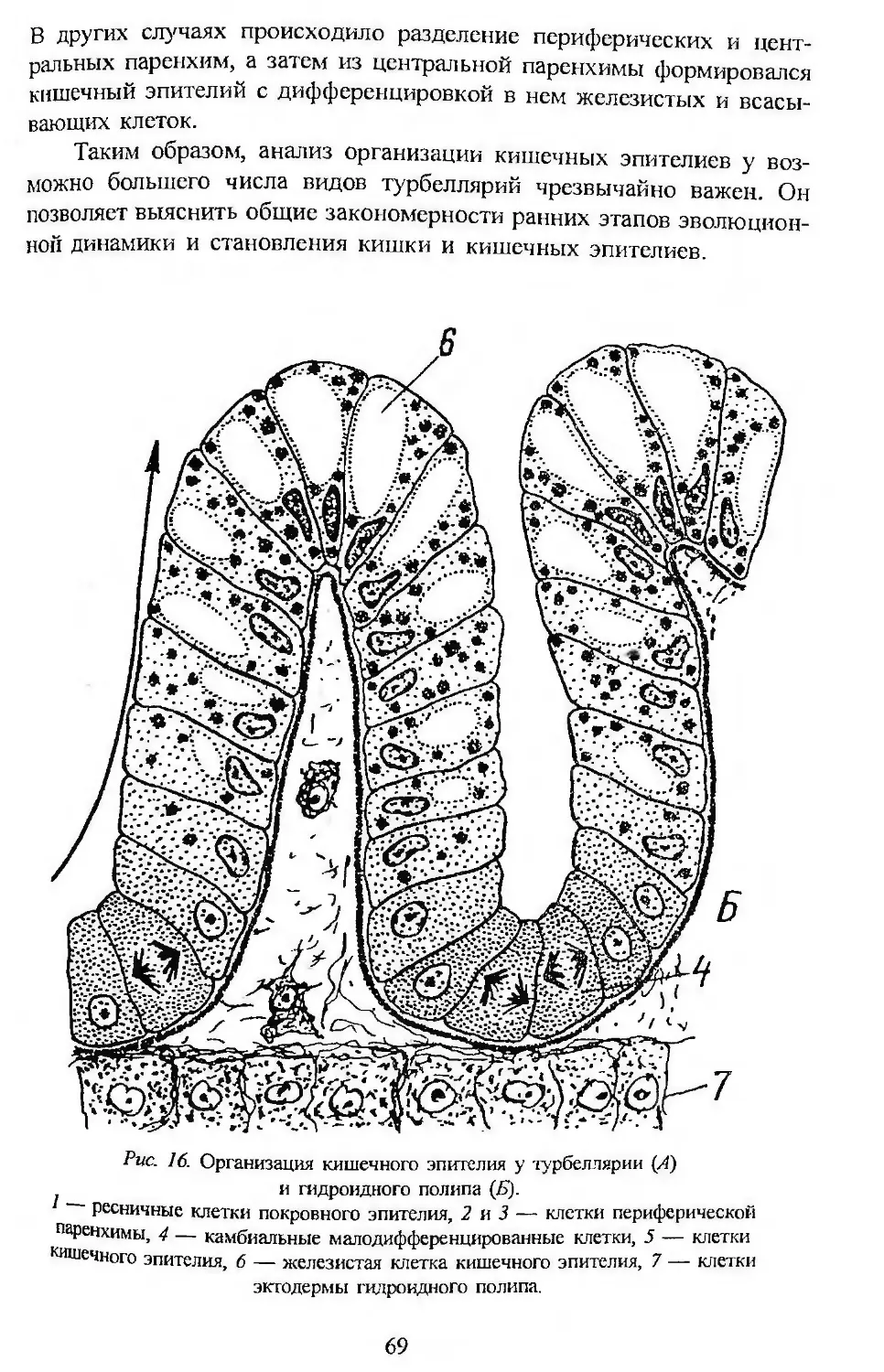
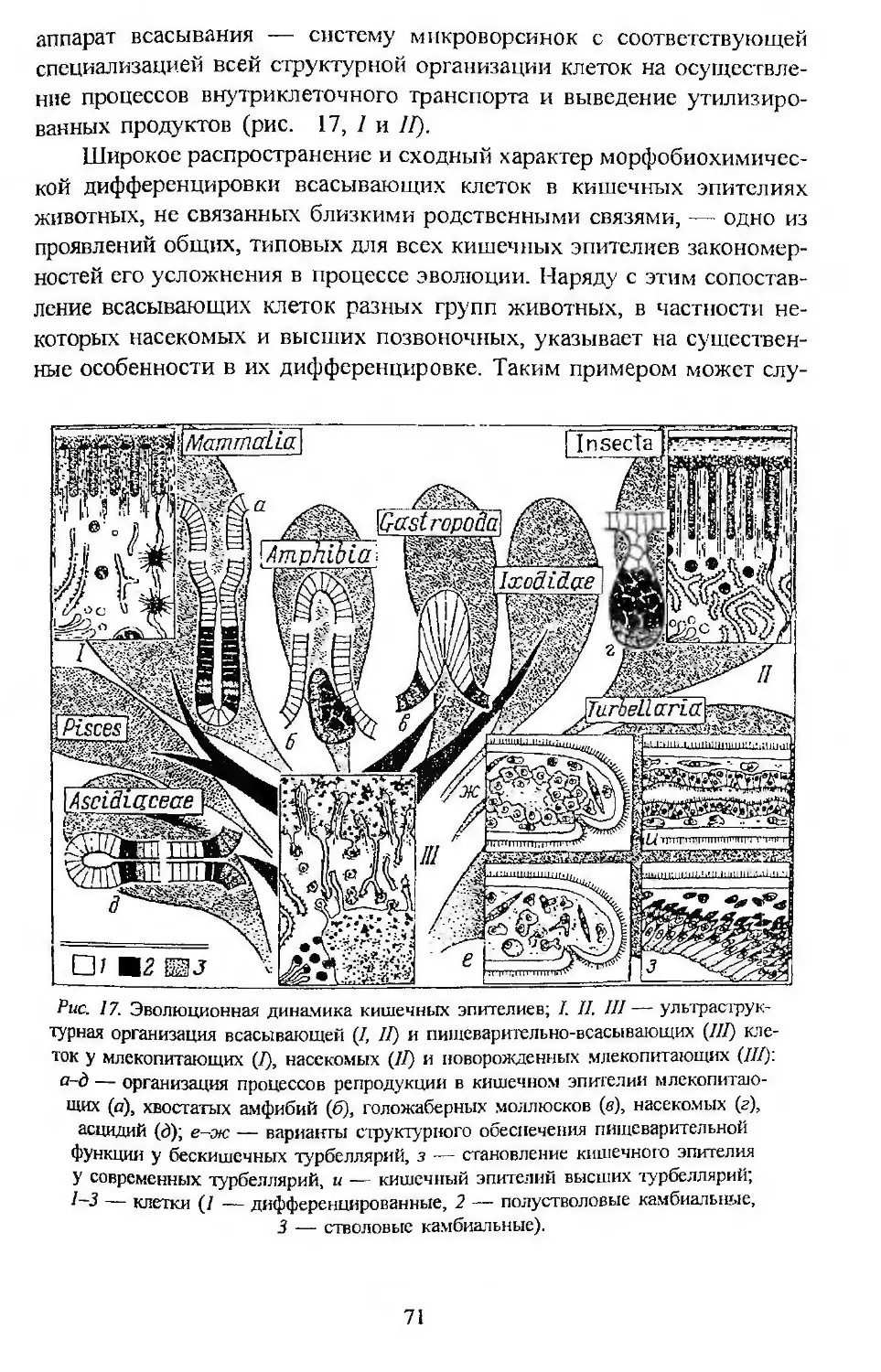
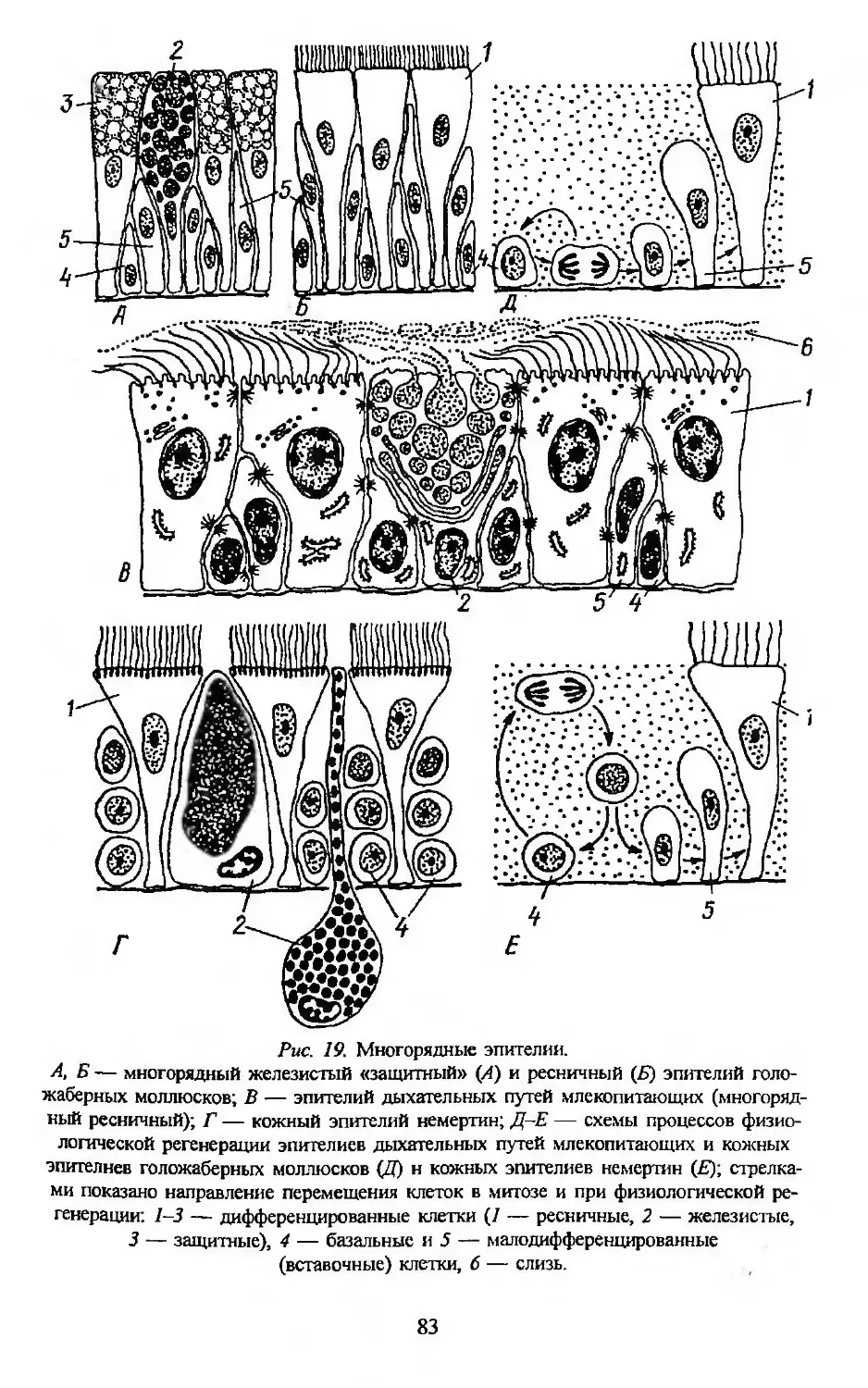
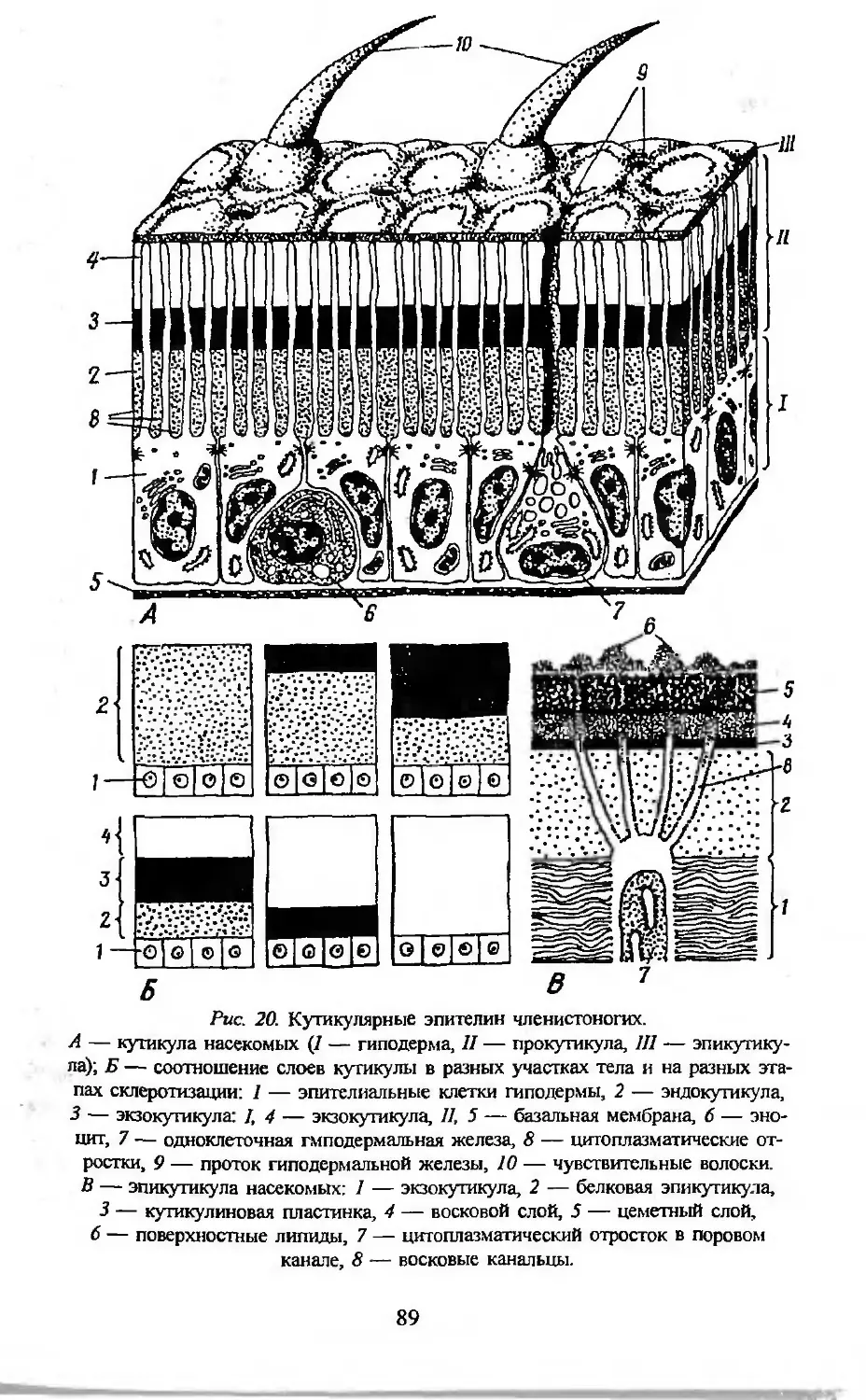
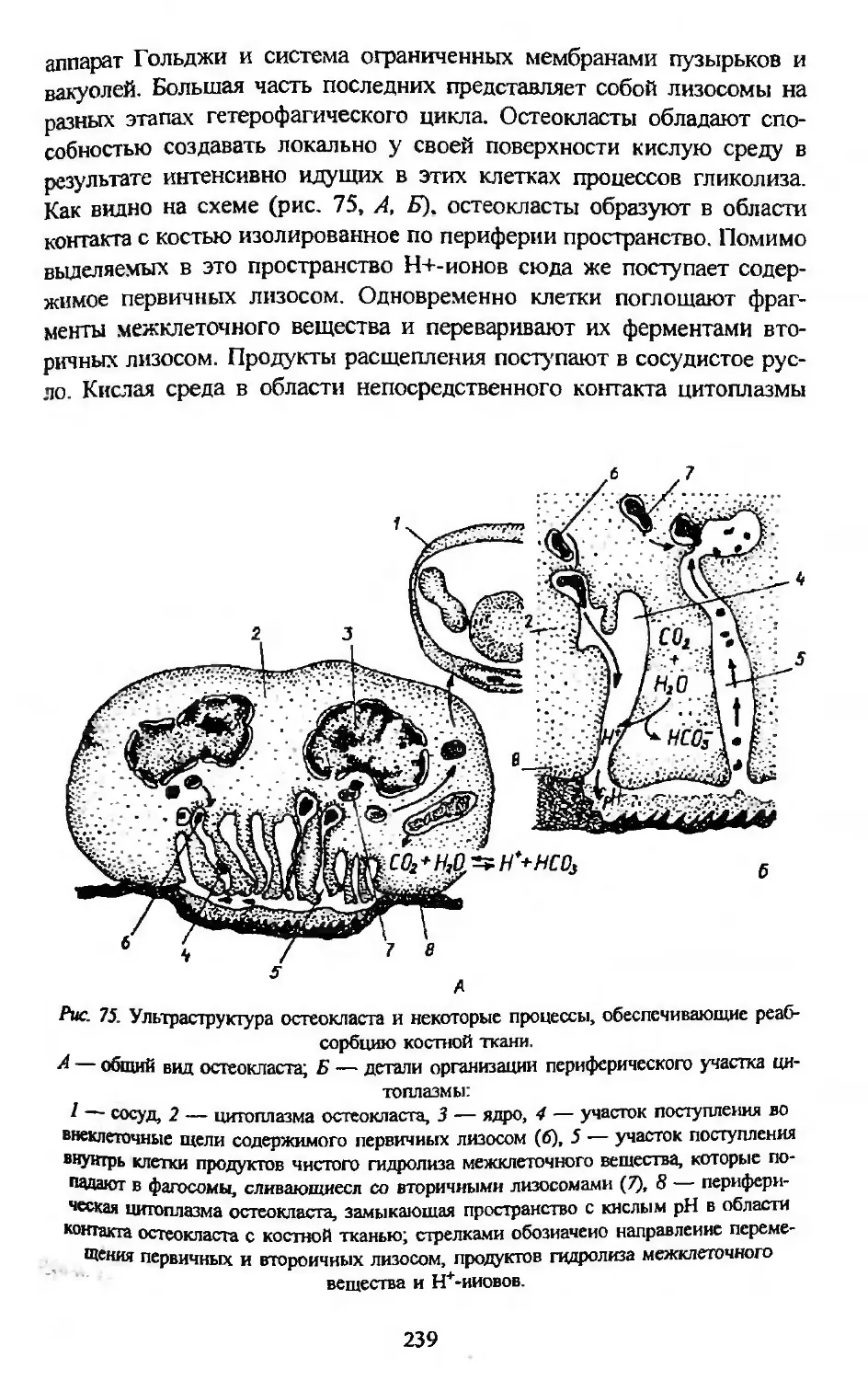
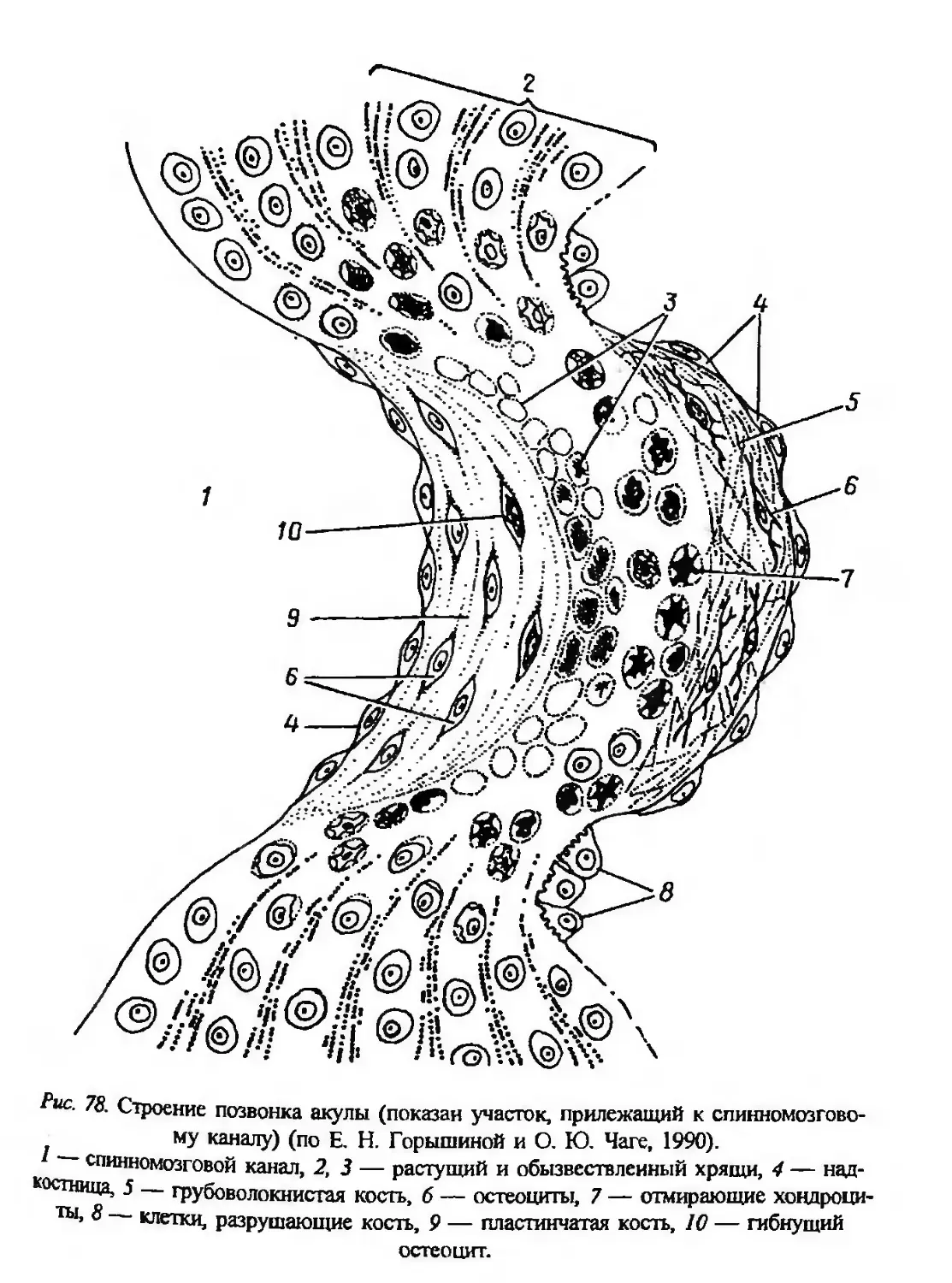
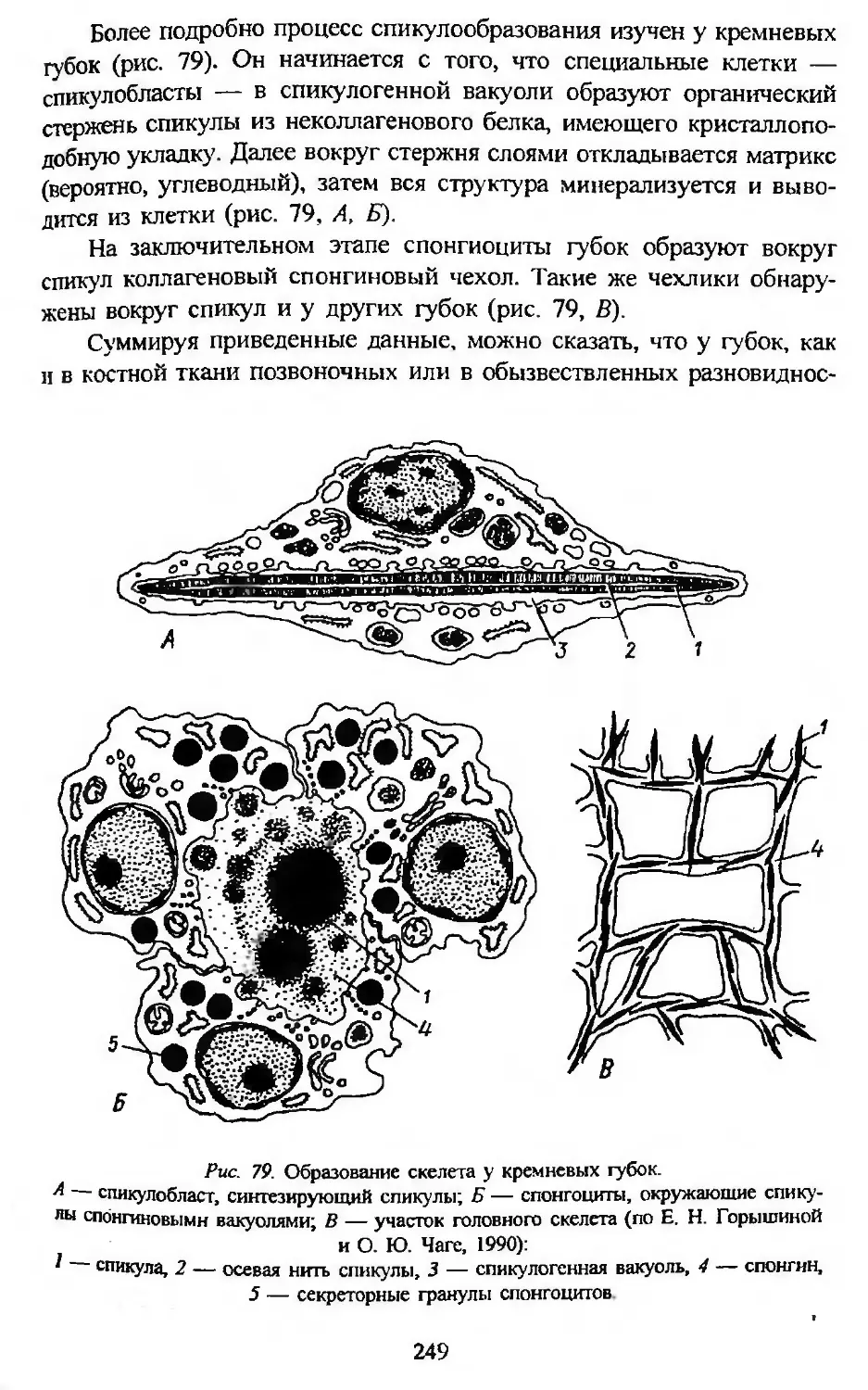
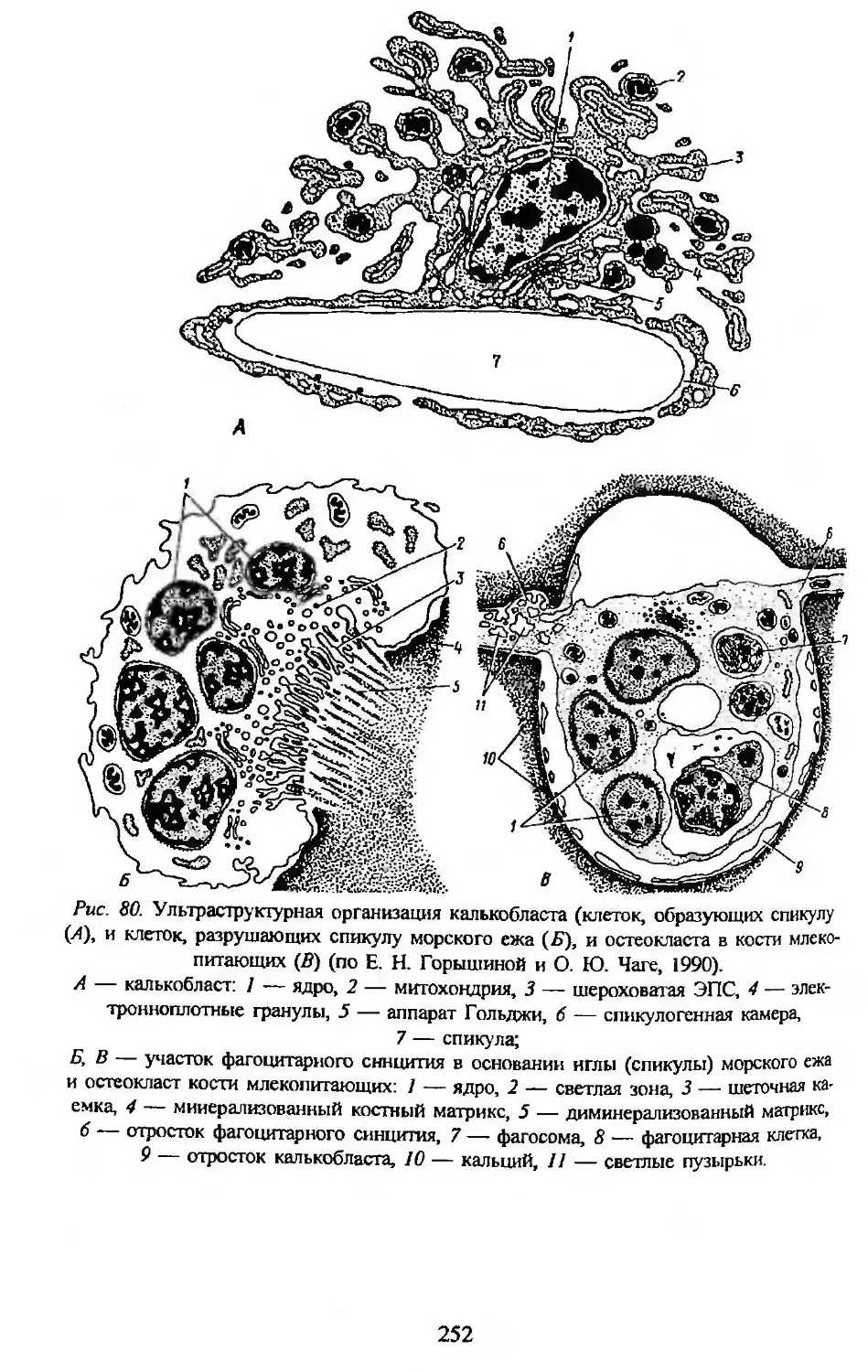
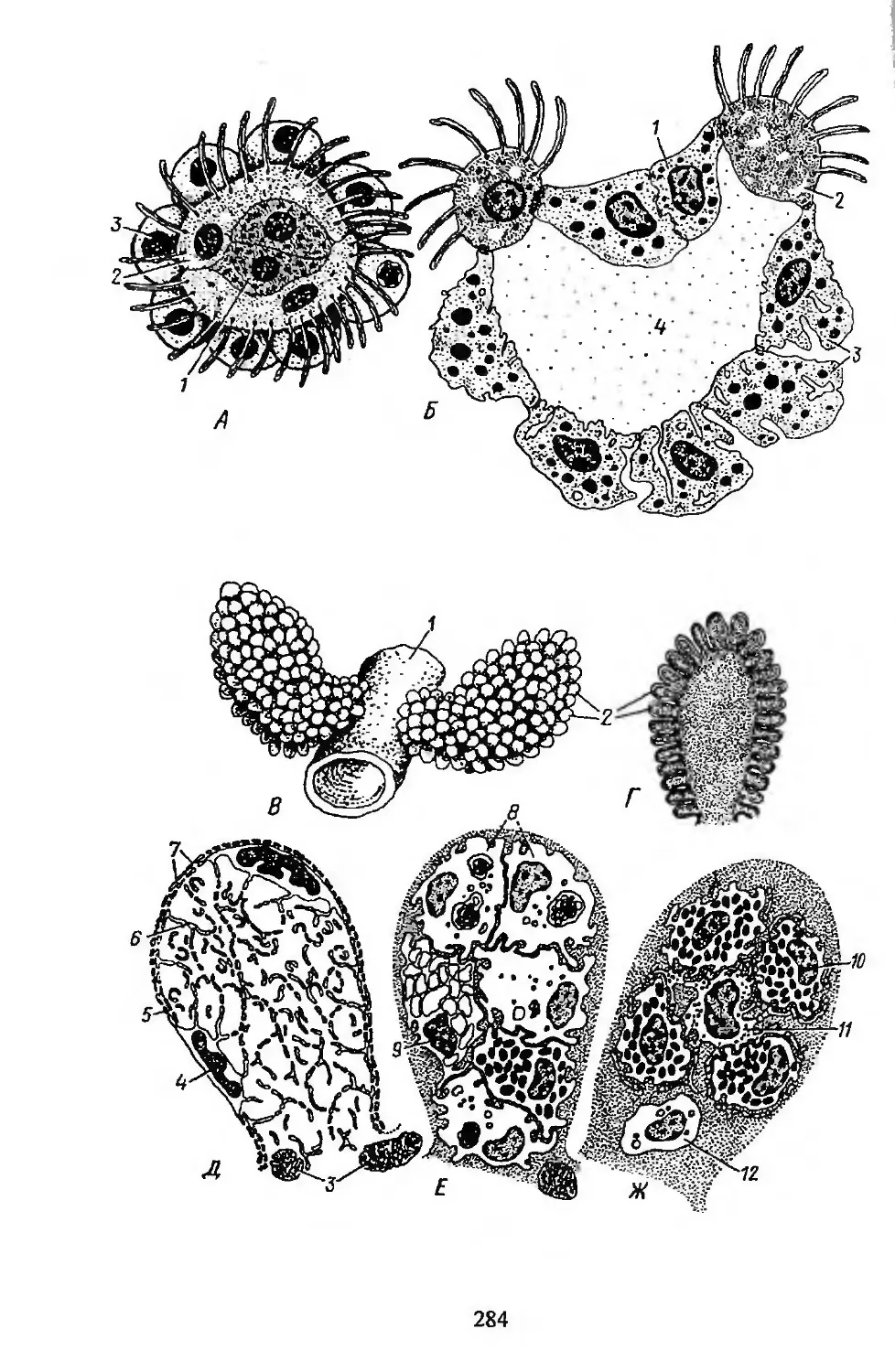
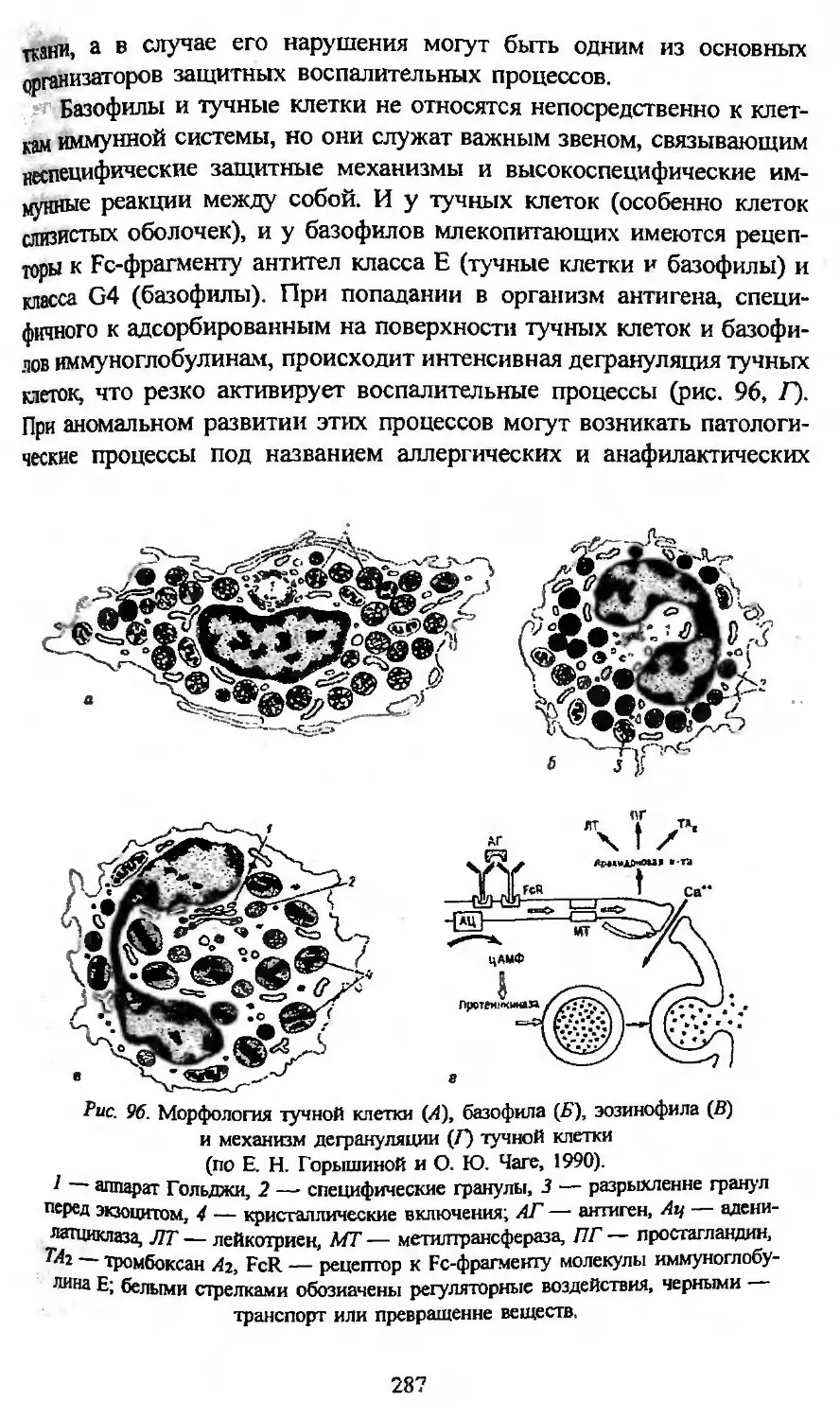
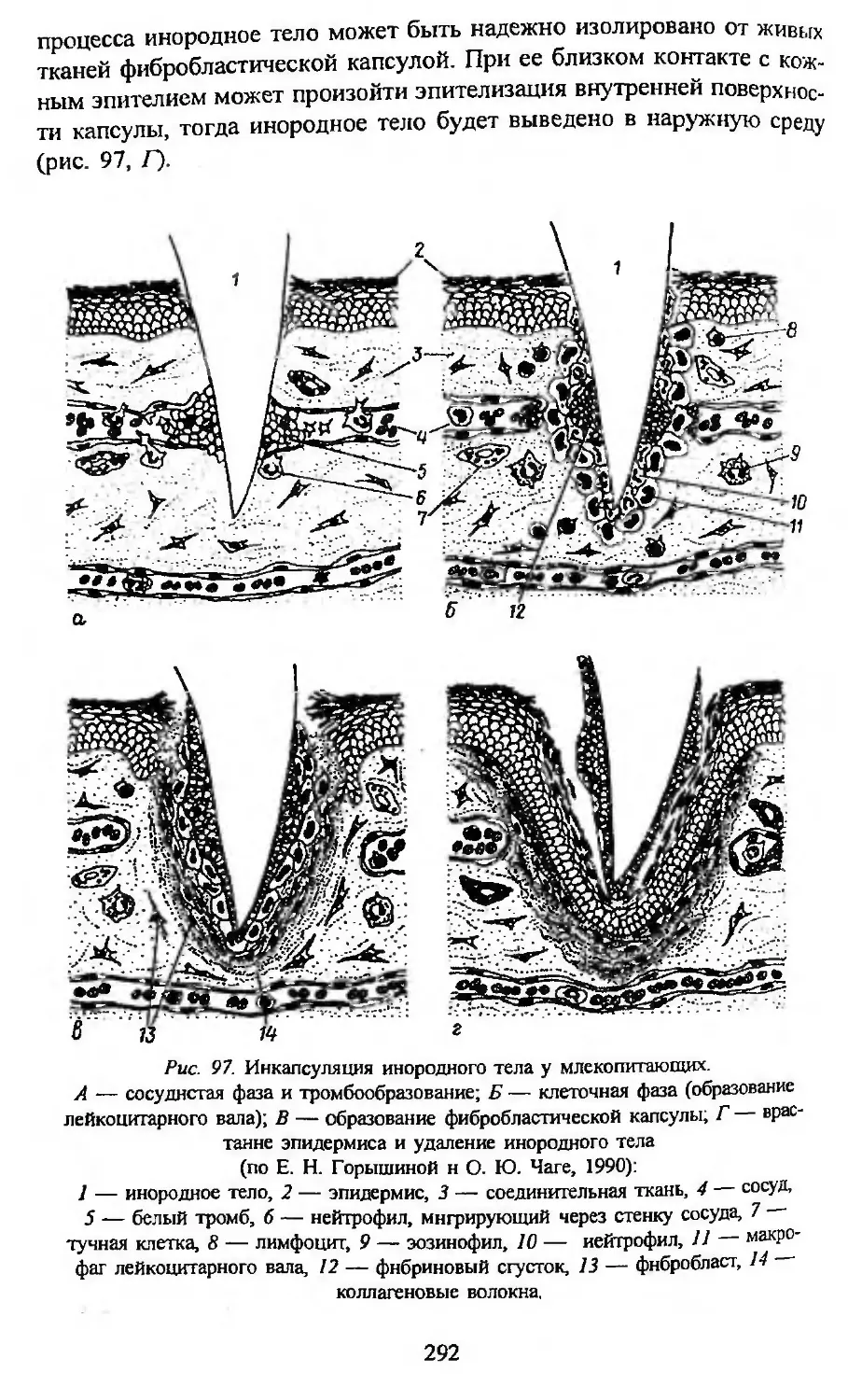
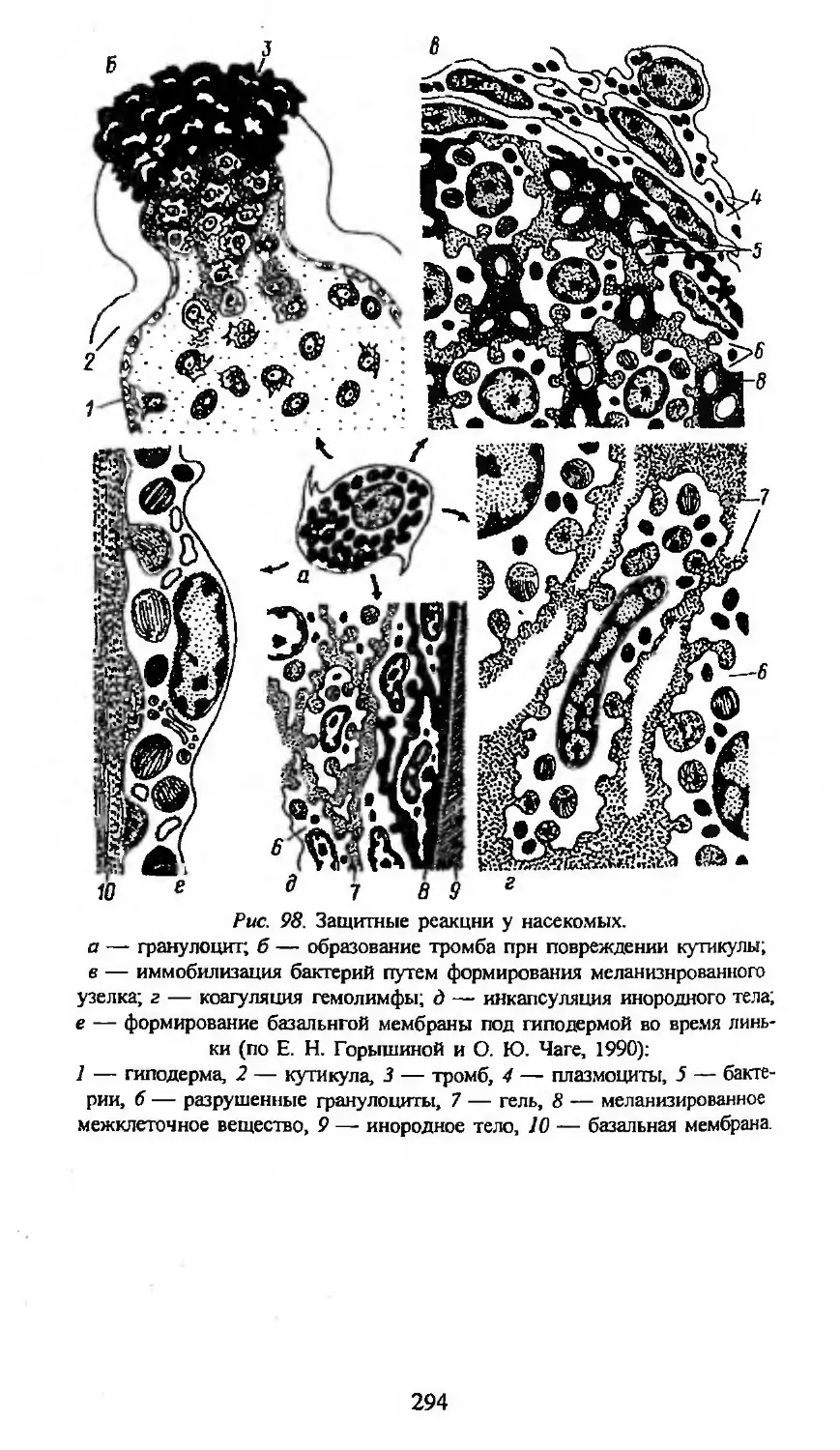
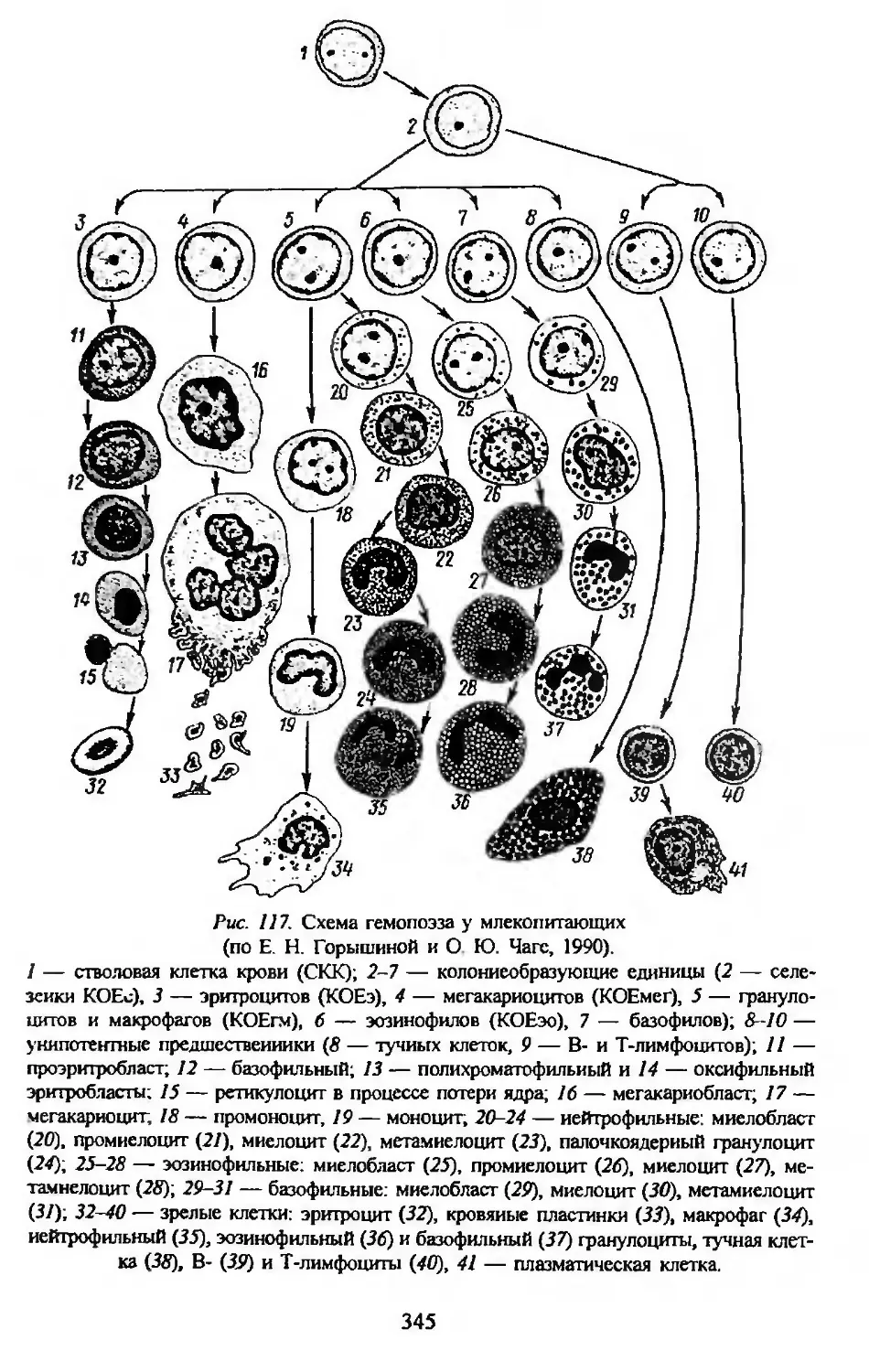
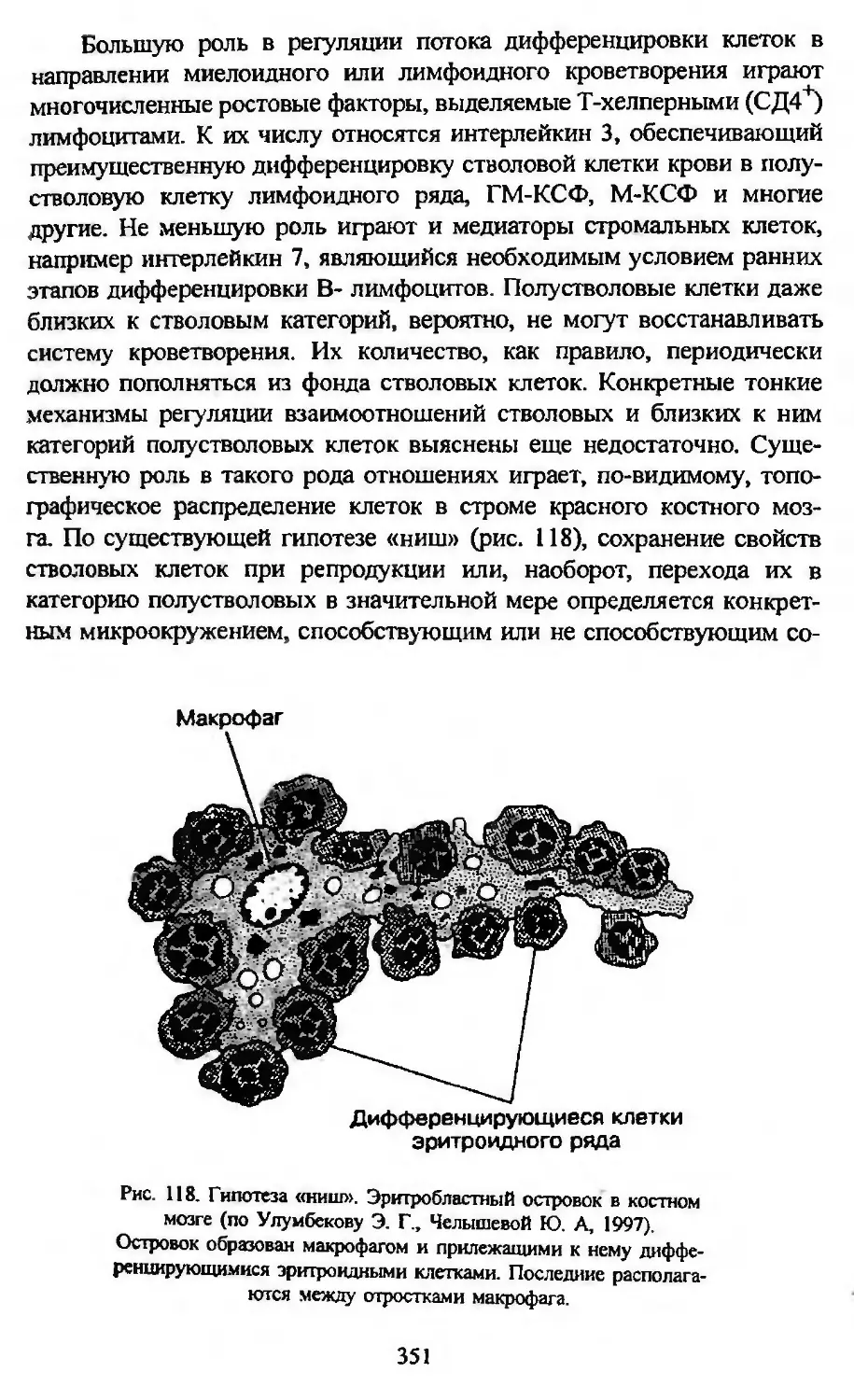
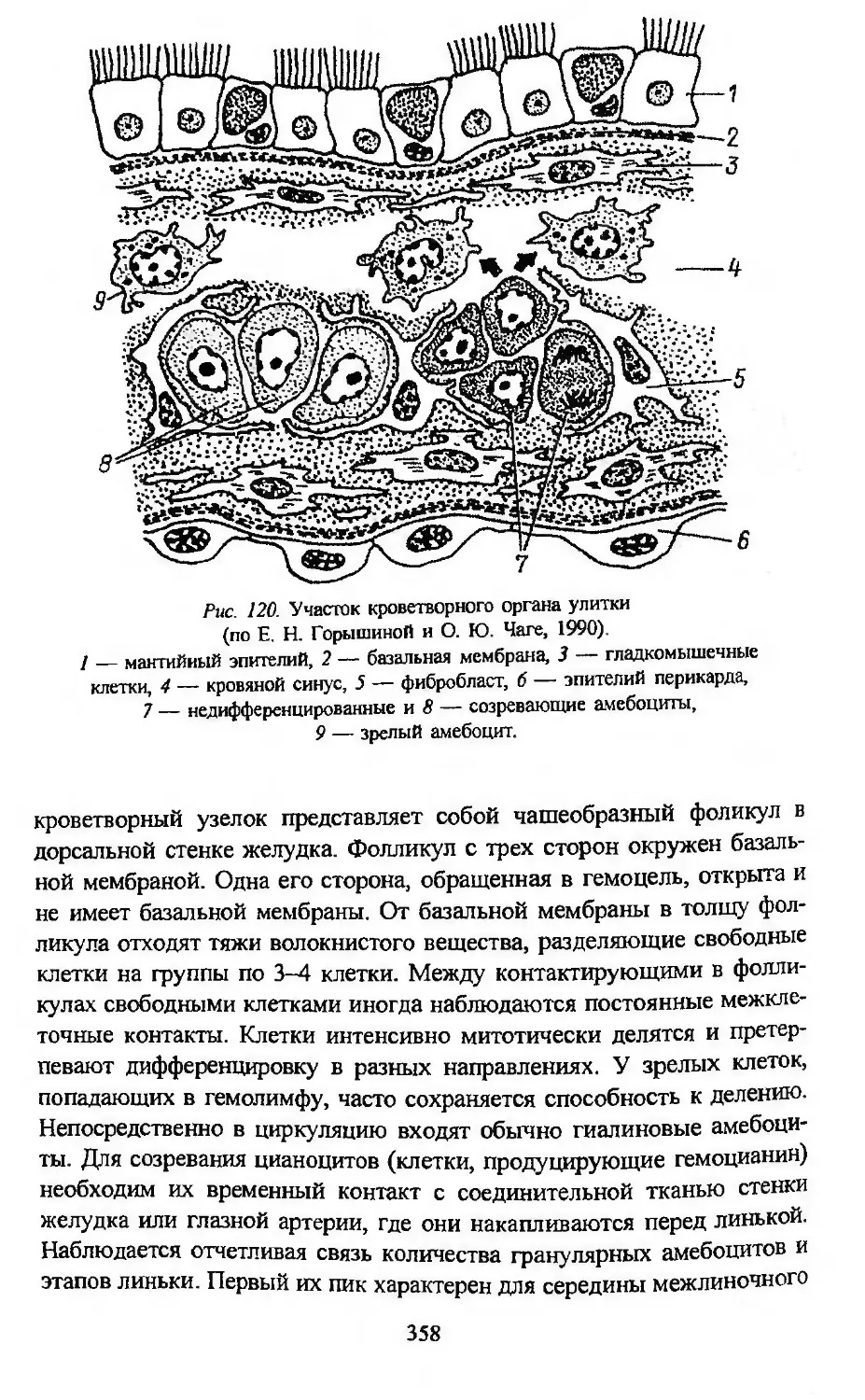
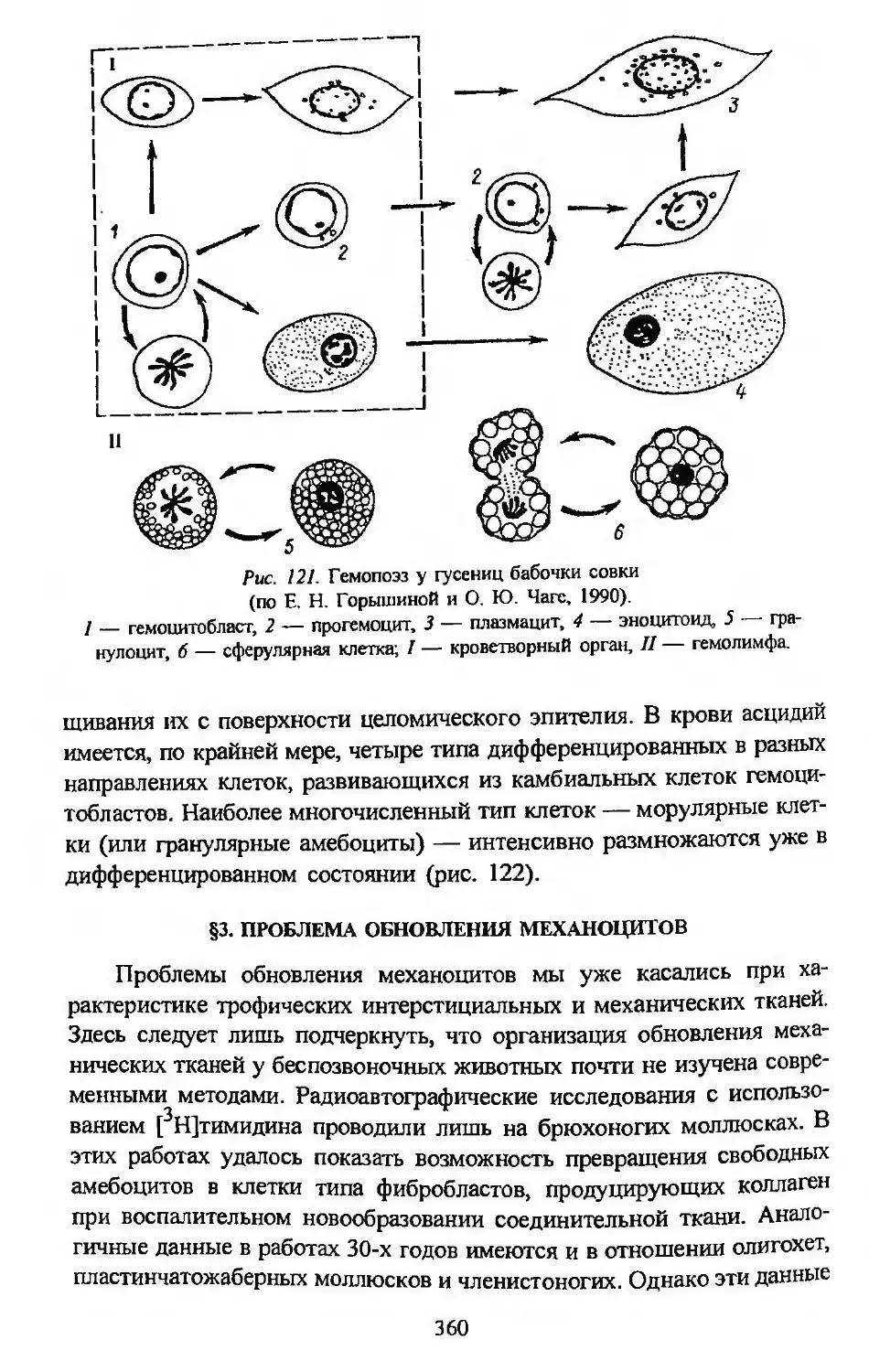
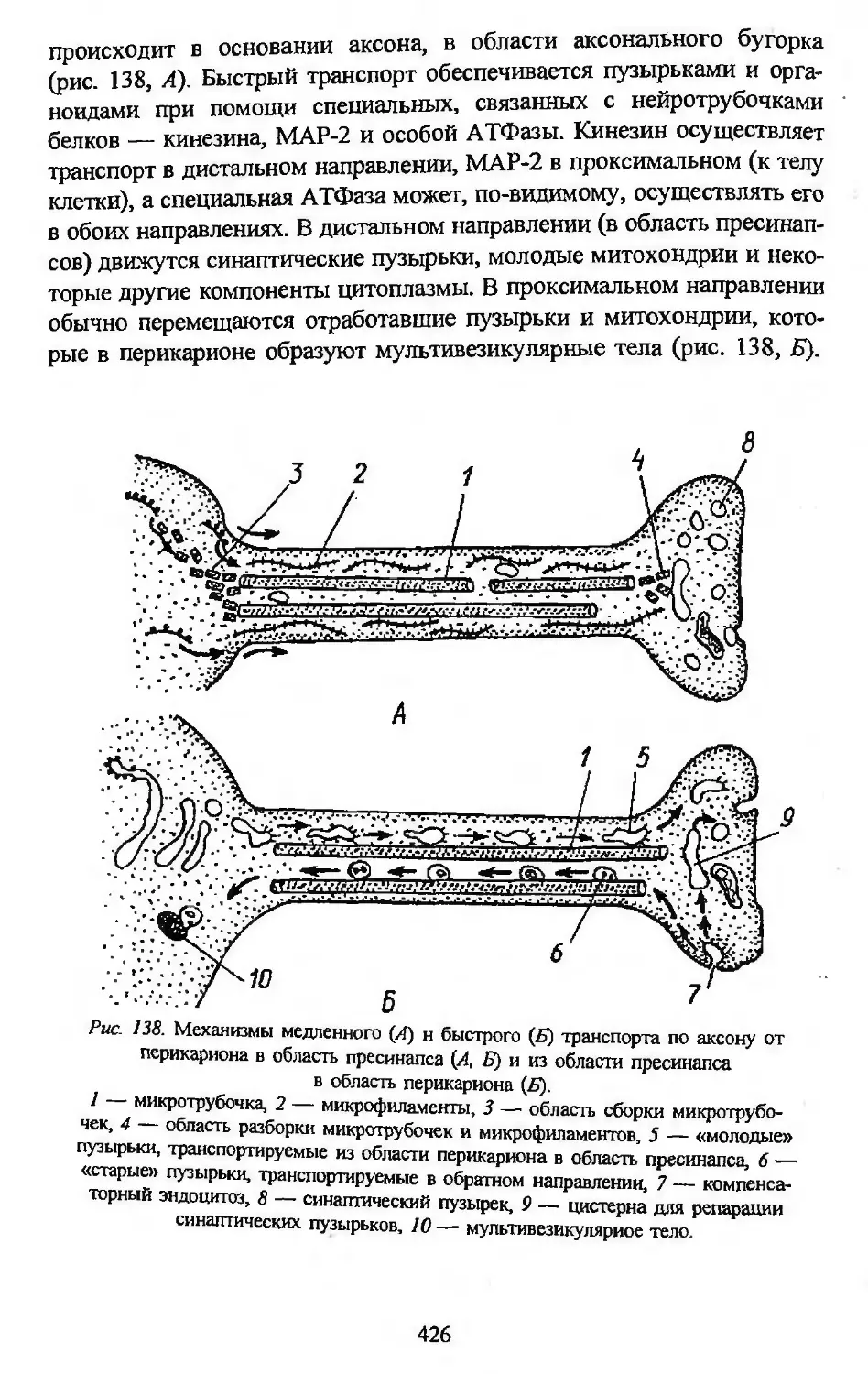
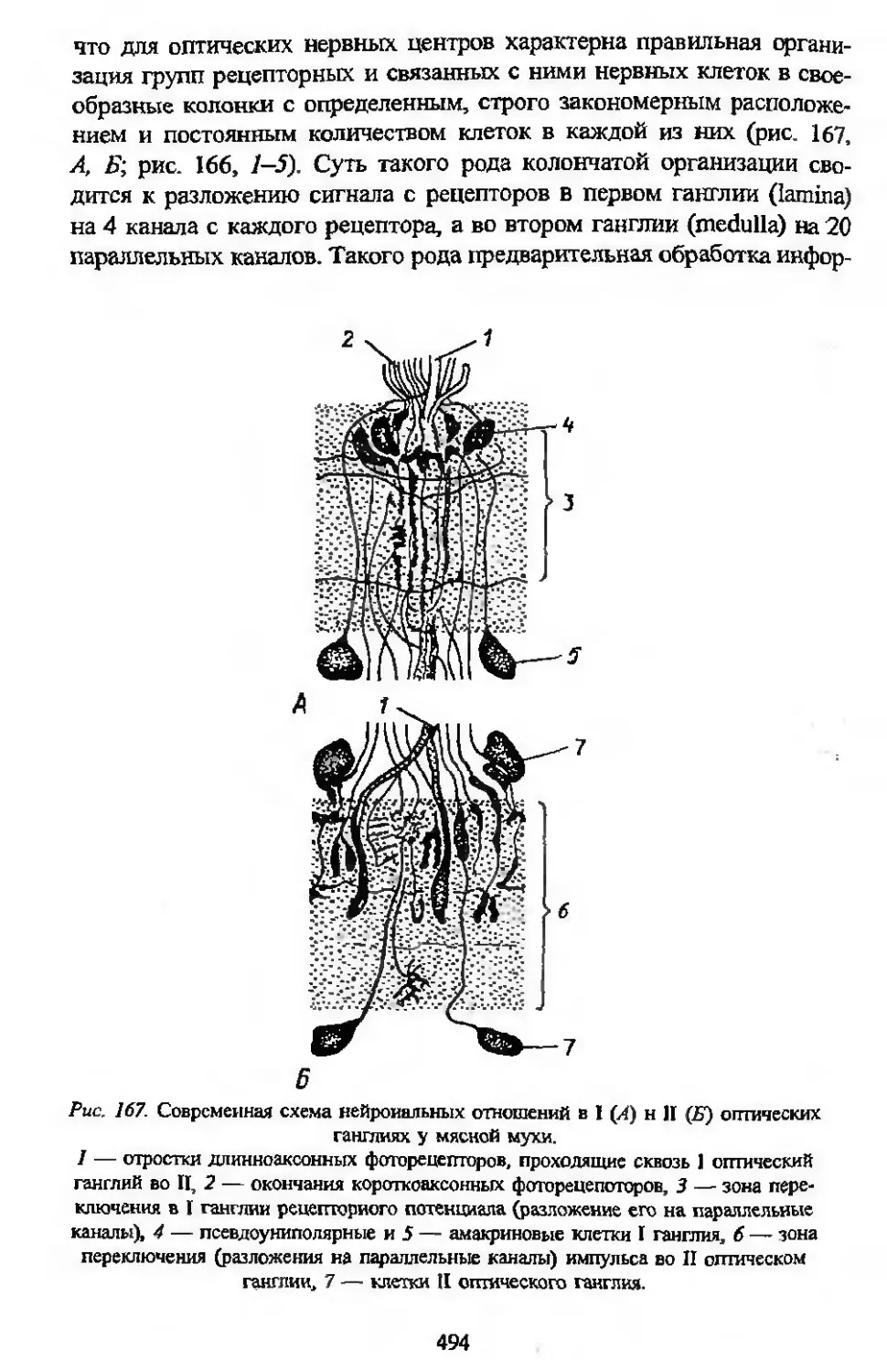
Автор: Заварзин А.А. Строева О.Г.
Теги: гистология животных биология клетки и субклеточных частиц цитология зоология медицина биология физиология учебник гистология регенерация
ISBN: 5-288-01776-Х
Год: 2000
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
А. А. Заварзин
СРАВНИТЕЛЬНАЯ ГИСТОЛОГИЯ
Учебник
Под редакцией д-ра биол. наук,
проф. О. Г. Строевой
Издательство С.-Петербургского университета
2000
УДК 591.8:576.3
ББК 28.66
3-13
Рецензенты: кафедра физиологии Новороссийского государственно-
го университета (зав. кафедрой чл.-кор. РАН Л. Н Иванова), д-р мед.
наук, проф. В. А. Отелин (Ин-т экспериментальной медицины РАМН)
Печатается по постановлению Редакционно-издательского совета
С.-Петербургского государственного университета
Заварзин А. А.
3-13 Сравнительная гистология: Учебник / Под ред. О. Г. Строе-
вой — СПб.: Изд-во С.-Петерб. ун-та, 2000. —- 520 с.
ISBN 5-288-01776-Х
В книге дается характеристика организации и эволюционной динамики
основных типов тканей многоклеточных животных (эпителиальных, тканей
внутренней среды, мышечных тканей и тканей нервной систем). Большое
внимание уделено также биологии лимфоидной ткани позвоночных (иммуно-
морфологии), нейробиологии и биологическим основам процессов физиологи-
ческой и репаративной регенерации обновляющихся и растущих тканей.
Учебник предназачен для студентов и преподавателей биологических
факультетов университетов и медицинских институтов.
Тем. план 1999 г., № 152
ББК 28.66
ISBN 5-288-01776-Х
© А. А. Заварзин, 2000
© Издательство С.-Петербургского
университета, 2000
Предисловие
Настоящий учебник по курсу гистологии для студентов биологи-
ческих факультетов университетов написан в соответствии с типовой
программой курса, в разработке которой автор принимал активное
участие. Учебник создан на основе более чем 20-летнего опыта пре-
подавания и совершенствования курса сравнительной гистологии на
кафедре цитологии и гистологии Ленинградского государственного
университета.
Большой материал по организации и функциональному значению
тканей и составляющих их элементов у представителей основных
типов многоклеточных животных излагается с эволюционных позиций.
Основы такого подхода были заложены в отечественной гистологии
еще в первой половине XX в. И одним из основных его достижений
стало создание теории параллелизма тканевых структур. Эта теория
объясняла многочисленные уже в тот период факты, свидетельствую-
щие о наличии общих закономерностей изменения функционально-
аналогичных тканей у неродственных животных.
Бурное развитие общей и частной цитологии во второй половине
XX в. и громадный сравнительно-гистологический материал, получен-
ный с помощью современных методов исследования, показали спра-
ведливость основных положений эволюционного, исторического под-
хода. Углубленный анализ организации тканей выявил направленный,
закономерный характер их преобразований в филогенезе. Это позво-
ляет осветить их эволюционную динамику, основываясь на современ-
ной интерпретации теории параллелизма. Такая попытка была сделана
нами в 1976 г. в монографии «Основы частной цитологии и сравни-
тельной гистологии многоклеточных животных» и в 1985 г. в учебном
пособии «Основы сравнительной гистологии». Естественно, что приве-
денные в этих книгах материалы и их теоретическое освещение нашли
отражение и в настоящем учебнике. При характеристике тканей внут-
ренней среды и особенно лимфоидной ткани широко использованы ил-
люстративный материал и некоторые идеи (с любезного согласия авто-
ров) учебного пособия Е. Н. Горышиной и О. Ю. Чаги «Сравнитель-
ная гистология тканей внутренней среды с основами иммунологии».
Наличие отечественной и зарубежной литературы по гистологии
не может восполнить остро ощущающийся пробел в учебной литера-
туре по курсу гистологии для студентов-биологов. По нашему глубо-
кому, проверенному практикой убеждению, курс гистологии на био-
логических факультетах университетов должен знакомить студентов с
3
общими закономерностями организации и изменений в эволюции тка-
ней всех многоклеточных животных, а не только млекопитающих и
человека, что характерно для медицинского курса гистологии. Эта
принципиальная особенность сближает наш курс с курсом зоологии.
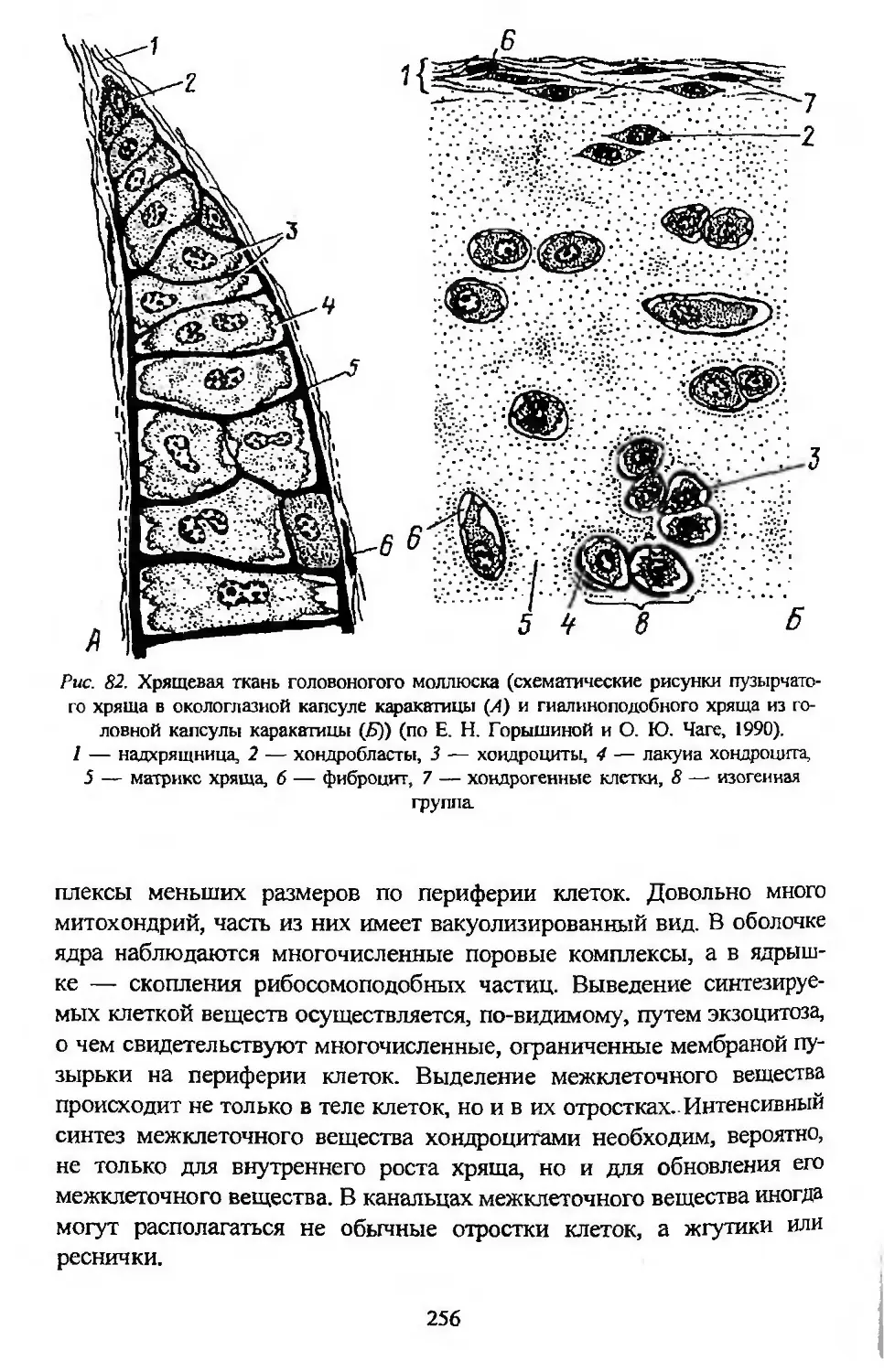
Кроме того, в методическом отношении и по глубине анализа тканевых
структур гистология сейчас все теснее оказывается связанной со струк-
турной биохимией и целым комплексом наук, объединяемых в новую
синтетическую науку — биологию клетки. Промежуточное положение
гистологии в системе биологического образования резко усиливает ее
значение: она обеспечивает одно из звеньев той неразрывной цепи,
которая должна существовать в современной биологии между зооло-
гией и науками физиолого-биохимического профиля, а также между
биологией и медициной*.
Автор сердечно благодарит всех сотрудников кафедры цитологии
и гистологии СПбГУ и студентов биолого-почвенного факультета,
способствовавших созданию учебника. Особую благодарность автор
выражает М. Ю. Пунину, О. Ю. Чаге и Е. Н. Горышиной за изготов-
ление или предоставление оригинальных иллюстраций, а также 3. А Зай-
ченко, Т. Г. Шапошниковой и Н. Ю. Павленко за техническое офор-
мление рукописи. Искренне благодарен автор также официальным ре-
цензентам: проф. В. А. Отеллину, проф. М. С. Виноградовой, чл.-кор.
РАН проф. Л. Н. Ивановой и всему коллективу кафедры физиологии
Новосибирского университета. Большая часть их ценных замечаний
учтена автором, и это помогло улучшить содержание учебника. Боль-
шую помощь оказали автору своими советами проф. Л. 3. Кайданов (в
области цитогенетики), проф. П. Г. Назаров (в области иммунологии)
и проф. О. Г. Строева, проф. В. А. Отеллин, доц. Д. К. Обухов (в об-
ласти нейробиологии). Особую благодарность выражает автор проф.
Ольге Георгиевне Строевой, без самоотверженной работы которой
выход учебника в свет был бы невозможен.
А. А. Заварзин
* Текст был подготовлен к печати при жизни А. А. Заварзина, однако после его кончины
в 1993 г. судьба рукописи складывалась непросто. Несколько лет она пролежала в изда-
тельстве «Высшая школа», после чего коллектив кафедры, ранее возглавлявшейся А. А. За-
варзиным, счел необходимым передать ее в издательство СПбГУ. Естественно, что за про-
шедшие годы многие положения книги если не устарели, то в какой-то части потеряли
новизну. В то же время многие идеи, высказанные автором в качестве предположений или
гипотез, в настоящее время получили блестящее подтверждение в экспериментальной нау-
ке. Осознавая все это, мы, сотрудники профессора А. А. Заварзина, проводившие окон-
чательную подготовку рукопис^т к изданию, сочли необходимым максимально сохранить
авторский текст и лишь отдельные главы, посвященные наиболее бурно развивающимся
областям биологии (иммунология и др.), были внесены некоторые уточнения и изменения.
Введение
§1 . СТАНОВЛЕНИЕ ЭВОЛЮЦИОННЫХ ИДЕЙ В ГИСТОЛОГИИ
Гистология — наука о тканях многоклеточных животных — за-
родилась в недрах анатомии человека еще до открытия клетки. В ее
основу легли результаты исследований анатомов, стремившихся вы-
явить тонкую структуру органов человека. Основоположником гисто-
логии считают французского анатома Биша, который, используя усо-
вершенствованные методы препаровки и мацерирования различных
органов человека, еще в 1801 г. предложил первую классификацию
тканей. Им было дано и первое определение тканей как общих систем
организма, входящих в состав разных органов.
Интенсивное развитие гистологии на научной основе началось
после открытия клетки и появления клеточной теории, устанавливаю-
щей и общность происхождения, и единство организации живых су-
ществ. В начале становления гистология интенсивно развивалась и в
рамках медицинских наук, и как часть зоологии, изучая микроскопи-
ческое строение органов различных групп многоклеточных животных.
Большой сравнительно-гистологический материал, накопленный зоо-
логами к концу XIX в., не мог не привлечь внимания морфологов-эво-
люционистов, разрабатывавших новую филогенетическую систематику
и создавших на основе учения Ч. Дарвина естественное филогенети-
ческое древо животного царства.
Первую попытку применить для анализа тканевого уровня орга-
низации методы и подходы эволюционной морфологии (сопоставление
тканей по принципу гомологии, использование биогенетического за-
кона) сделал известный немецкий зоолог-эволюционист Э. Геккель.
Ему принадлежит теория происхождения многоклеточных из гипоте-
тических примитивных двуслойных организмов — теория гастреи. В
онтогенезе современных многоклеточных животных этот этап фило-
генеза находит отражение, по его мнению, в стадии инвагинационной
гаструлы. Анализируя последующую дифференцировку таких гаструл,
Э. Геккель пришел к выводу, что происходящие при этом процессы
рекапитулируют дивергентную дифференцировку тканей в филогенезе
многоклеточных животных. Исходя из этого положения, он создал
первую гистогенетическую систему тканей, приняв за основу своей
классификации источник развития тканей в онтогенезе.
Таким образом, базируясь на упрощенной трактовке биогенети-
ческого закона (онтогенез повторяет филогенез), Геккель заключил,
что его гистогенетическая система отражает историю происхождения
тканей в филогенезе и является, следовательно, естественной филоге-
нетической системой тканей.
5
Построения Э. Геккеля не получили, однако, поддержки ни у
гистологов-зоологов, ни в медицинской гистологии. Специалисты-ме-
дики приняли систему тканей, предложенную немецкими гистологами
Ф. Лейдигом и А. Кёлликером. В основу ее были положены морфо-
функциональные признаки, по которым все ткани разделялись на че-
тыре основных типа: эпителиальные ткани, кровь и соединительная
ткань, мышечная и нервная ткани. Классификация оказалась более
удобной для характеристики микроскопического строения органов че-
ловека и патологических процессов в них.
Однако гистологи-зоологи не могли не обратить внимания на
большое сходство в строении тканей у животных, далеко отстоящих
в филогенетическом отношении, в частности у позвоночных и беспо-
звоночных животных. Сам факт сходства, по мнению зоологов-мик-
роскопистов начала XX в., указывал на неприменимость к тканевому
уровню организации традиционных методов и подходов эволюционной
морфологии.
Более биологичным оказался взгляд на происхождение много-
клеточных нашего выдающегося биолога И. И. Мечникова. На осно-
вании обширных сравнительно-эмбриологических исследований низ-
ших многоклеточных животных он пришел к выводу о том, что наи-
более примитивным способом гаструляции является миграция единич-
ных клеток внутрь формирующегося зародыша. И. И. Мечниковым
была сформулирована теория фагоцигеллы, согласно которой первич-
ные многоклеточные животные представляли собой колонию однокле-
точных организмов с лабильной дифференцировкой на поверхностные
жгутиковые и внутренние амебоидные клетки. Такая дифференцировка
в дальнейшем привела, по его мнению, к возникновению первичной
постоянной поверхностной ткани — кинобласта — и системы погру-
женных в глубь клеток — фагоцитобласта. В последнем по мере
прогрессивного развития животных дифференцировался эпителизиро-
ванный кишечник. Теория фагоцителлы более физиологична и более
всего соответствует сравнительно-зоологическим данным. Согласно
этой теории первичный способ усвоения пищи — внутриклеточное
пищеварение, что весьма вероятно в том случае, если многоклеточные
возникли из колоний одноклеточных организмов, у которых хорошо
развиты процессы фаго- и пиноцитоза. Кроме того, Мечников считал,
что некоторые признаки лабильной дифференцировки сохраняются и
у современных низших многоклеточных.
Теория фагоцителлы имеет принципиальное значение и для эво-
люционной гистологии, поскольку она обосновывает возникновение
первичных тканей с функциональной точки зрения.
6
Помимо теории фагоцителлы большое значение для развития срав-
нительной гистологии имело учение Мечникова о фагоцитах. По сути
дела, ему принадлежат первые исследования в сравнительном аспекте
эволюции этих специализированных клеток. И. И. Мечниковым было
показано, что исторической основой защитных фагоцитарных реакций
специализированных клеток высших животных является филогенети-
чески древний процесс — фагоцитоз, исходно связанный с питанием
и внутриклеточным пищеварением. Такой подход к анализу специа-
лизированных клеток, как будет показано при характеристике тканей
внутренней среды, не только не утрачивает своего значения, но и
приобретает все большую актуальность. И. И. Мечников в дальней-
шем, к сожалению, не разрабатывал общегистологические аспекты
этой проблемы.
В начале XX в. интерес к эволюционным вопросам в гистологии
несколько снизился. Причиной этого было преимущественное развитие
гистологии на медицинских факультетах. Немногочисленные гистоло-
ги-зоологи, хотя и продолжали накапливать сравнительно-гистологи-
ческий материал, не могли дать ему эволюционную трактовку. Такая
попытка с позиций классической эволюционной морфологии была
сделана в ЗО-е годы А. Н. Северцовым — известным советским мор-
фологом-эволюционистом — в отношении тканей позвоночных жи-
вотных. А. Н. Северцов считал, что установленные им закономерности
изменений органов и их систем в процессе эволюции свойственны и
тканям исследуемых животных. Он привел ряд примеров рекапитуля-
ций примитивных черт предков при эмбриональном гистогенезе неко-
торых тканей.
Однако зоолог Северцов не занимался специально проблемой эво-
люции тканей, эту задачу несколько позже пытался решить отечест-
венный гистолог А. В. Румянцев. Он рассмотрел с позиции теории
филэмбриогенеза Северцова преобразования в эволюции позвоночных
животных хрящевых и костных тканей и пришел к выводу, что в
отношении этих конкретных тканей оправдываются методы и подходы
классической эволюционной морфологии, разработанные А. Н. Север-
цовым. Однако для более широких сопоставлений и выяснения общих
закономерностей изменения тканей в эволюции многоклеточных жи-
вотных нужны, по мнению А. В. Румянцева, подходы и методы, учи-
тывающие специфику тканевого уровня организации.
К иному выводу в середине 40-х годов пришел Н. Г. Хлопин. В
своих работах, результаты которых нашли отражение в монографии
«Экспериментальные и биологические основы гистологии» (1946), по-
мимо традиционного для эволюционной морфологии анализа источ-
7
ников развития тканей в онтогенезе Н. Г. Хлопин широко использовал
метод культивирования тканей вне организма. Он показал, что во
многих случаях при определенных условиях характер роста ткани по
периферии культивируемого кусочка отражает ее биологические осо-
бенности и специфику происхождения из определенных эмбриональ-
ных зачатков. С помощью этого метода ему удалось уточнить клас-
сификацию эпителиальных и мышечных тканей. Н. Г. Хлопин выявил
относительно позднее в эволюции позвоночных происхождение так
называемых вторичных и третичных тканей. Примером вторичной
ткани может служить целомическая мышечная ткань, возникшая из
эпителиальной выстилки целома, а примером третичной — нейраль-
ные мышечные ткани, образующие у позвоночных сфинктер и пипя-
татор зрачка. По своим морфофункциональным свойствам эти мышеч-
ные ткани сходны с первичными соматическими и висцеральными
мышцами, однако отличаются некоторыми специфическими особен-
ностями.
Классификация тканей по источникам их развития в онтогенезе
имела значение для доказательства стойкой детерминированности тка-
ней в онтогенезе и невозможности их метаплазии — взаимопревраще-
ния во взрослом организме, а также для рациональной классификации
опухолей человека и выяснения источников их развития.
Н. Г. Хлопин, однако, не ограничился приведенными выше ре-
зультатами. Он повторил попытку Геккеля создать естественную сис-
тему тканей и выявить основные закономерности их изменений в
эволюции многоклеточных животных (рис. 1). Гистогенетическая сис-
тема Хлопина более точно, чем система Геккеля, отражает источники
развития тканей у позвоночных животных. Она основана на более
тщательном изучении процессов гистогенеза позвоночных животных,
при ее разработке использован большой экспериментальный и пато-
гистологический материал. Однако эта система применима лишь к
позвоночным животным и не может претендовать на естественную
систему тканей, которая отражала бы пути становления их в филоге-
незе многоклеточных животных. Кроме того, сам принцип разделения
тканей на типы лишь путем анализа процессов гистогенеза по отно-
сительно формальному критерию — местоположению клеток, дающих
начало той или иной ткани, — чреват серьезными ошибками и про-
тиворечиями. Так, эритроциты, сосудистый эндотелий и лейкоциты
оказались, по Хлопину, в составе разных тканей (рис. 1). В гистоге-
нетической системе тканей Хлопина недостаточно учитывался морфо-
функциональный аспект. Это не давало возможности проводить ши
рокие сравнительно-гистологические сопоставления, т. е. лишало гис
8
Эпителий Соединительная ткань и кробь Мышечная ткань Нердная ткань
&
5>
М Г
О
ga
SE
§ па
Энтодерма
с
5
к о
$ Е
L
Е > flj
'О
ip
§ OJ
Я S
с Б
H
'5 QJ
Es
g>-§
S »>
Зачаток
хорды
Рис. 1. Схема соотношения естественной (гистогенетической) системы гистологических структур с классификацией
тканей по морфофункциональному признаку на четыре типа (по Н. Г. Хпопину, 1946)
1
i
<8 2
§.с
е-к
8S
5 *
ев
Зачаток
целомической
быстилки
х
Б
Мезодерма
.Знто"
мезенхима
Первичная
энтодерма
Зачаток
мускулатуры
соматического
тила(миогпомы)
Кожная эктодер-
ма и прехордаль- Нейрэктодерма
пая пластинка
Первичная
эктодерма
тологию основного метода исследования, направленного на выявление
общих закономерностей изменения тканей в филогенезе. Основной
вывод Н. Г. Хлопина о том, что у многоклеточных животных в ходе
эволюции увеличивается разнообразие тканей и, следовательно, основ-
ной закономерностью их эволюционных преобразований является ди-
вергентная дифференцировка, справедлив лишь в самой общей форме.
В таком виде эта закономерность уже давно была известна гистологам
и не требовала специальных доказательств. Н. Г. Хлопин лишь фор-
мально учитывал в своих построениях ограниченность дивергентной
дифференцировки относительно жесткими рамками четырех морфо-
функциональных типов тканей. Так, развивающаяся из целомической
выстилки сократимая ткань не является особой тканью и по многим
важным признакам характеризуется как специфическая мышечная
ткань. Она вполне аналогична мышечной ткани древнего соматичес-
кого типа.
Таким образом, еще одна попытка применить классические при-
емы эволюционной морфологии к анализу общих закономерностей
эволюции тканей у всех многоклеточных животных столкнулась с
большими трудностями и ограничениями. Очевидно, что для внедре-
ния в гистологию исторического подхода необходимо было разрабо-
тать особый метод сравнительного анализа. Целенаправленное его
использование должно было бы объяснить закономерный, направлен-
ный и ограниченный характер эволюционных преобразований тканей.
Такой метод был разработан и с успехом использован основополож-
ником отечественной эволюционной гистологии академиком А. А. За-
варзиным.
А. А. Заварзин был учеником профессора А. С. Догеля, длитель-
ное время возглавлявшего кафедру гистологии Петербургского уни-
верситета. Эта кафедра воспитала многих первоклассных биологов-
гистологов и цитологов. Уже в своей магистерской диссертации в
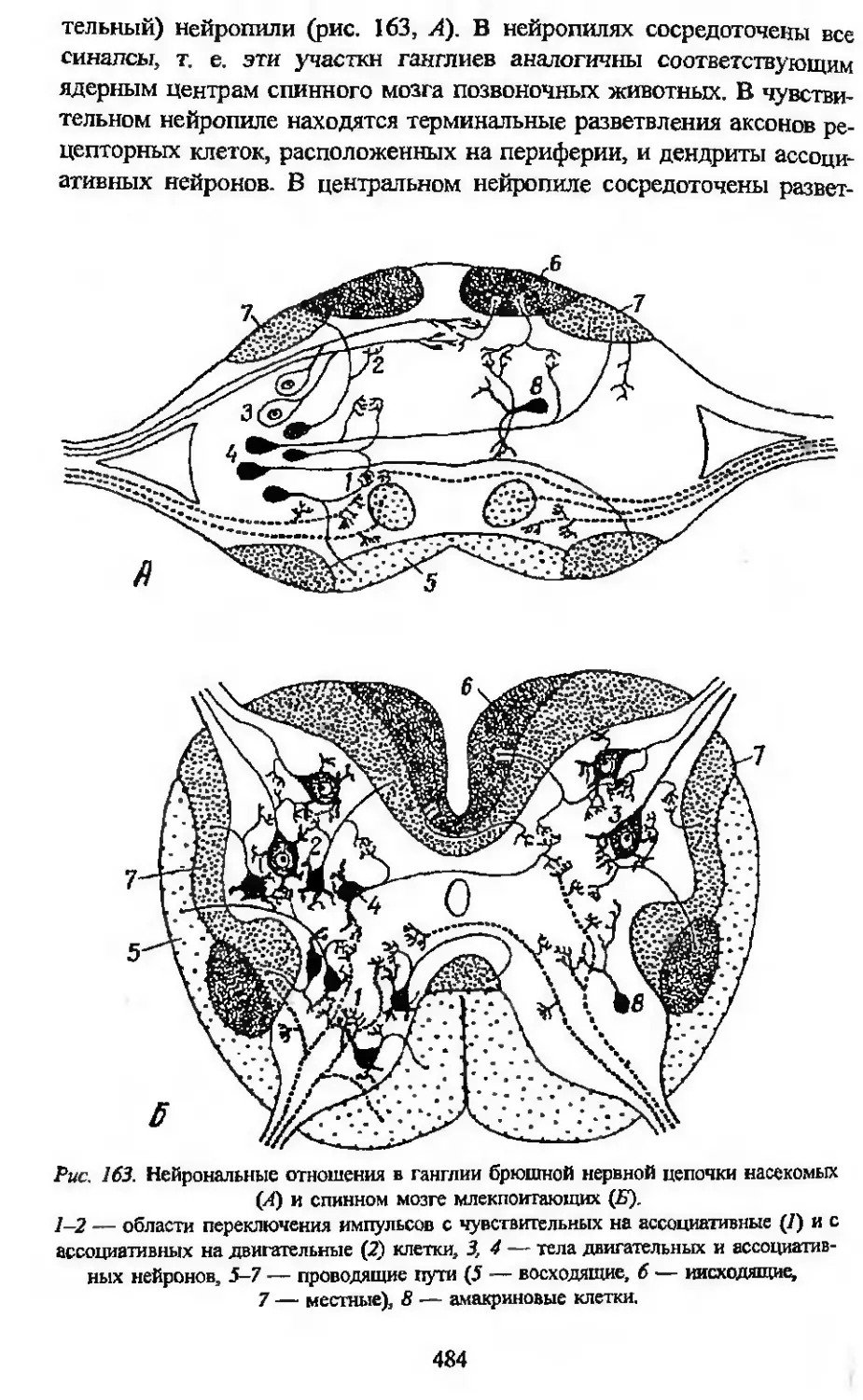
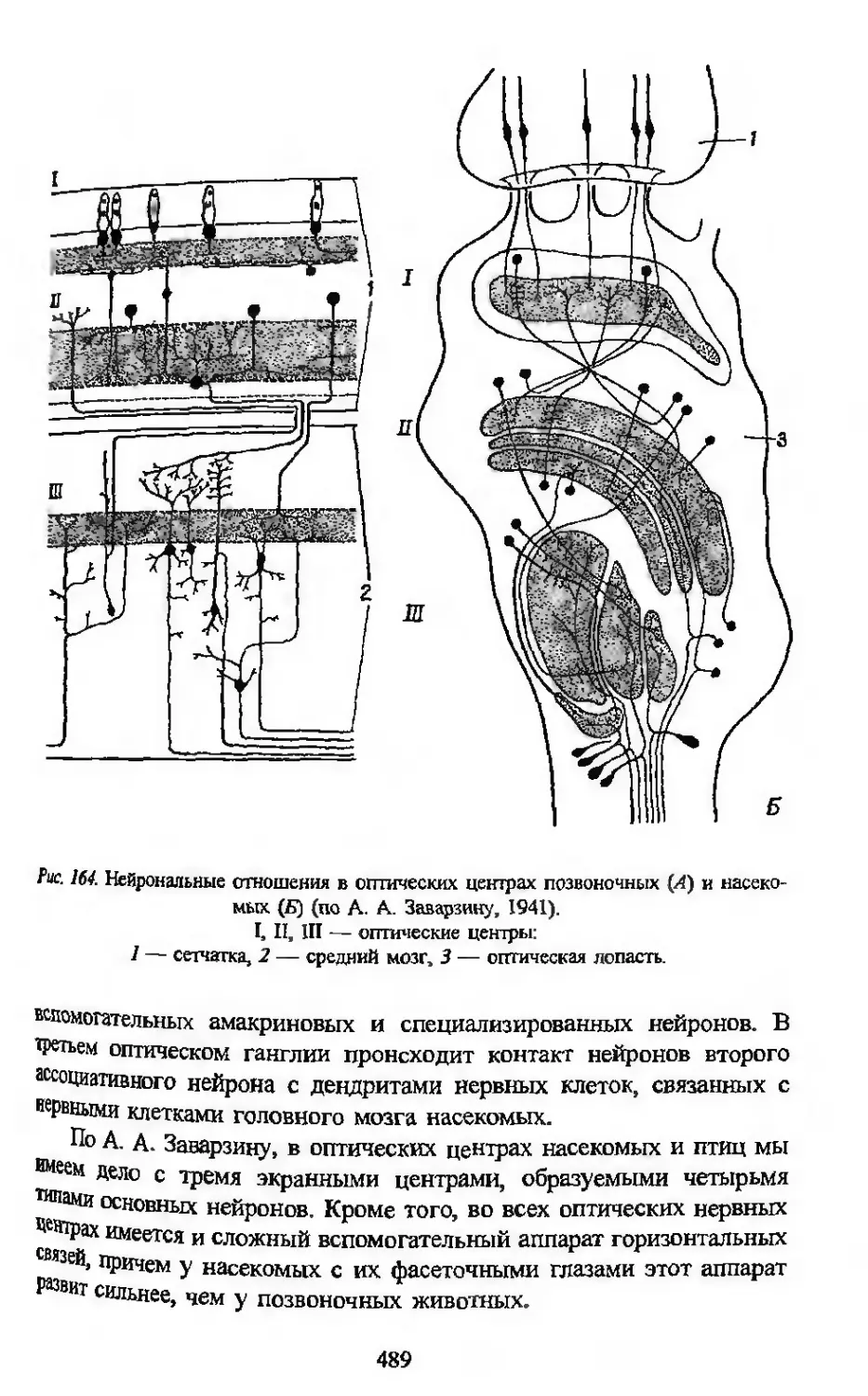
1913 г. А. А. Заварзин проводит сопоставление исследованных им
нейрональных отношений (топографических взаимоотношений нерв-
ных клеток и их отростков) в оптических центрах насекомых с изу-
ченными ранее нейрональными отношениями в оптических центрах
птиц и головоногих моллюсков, которое выявило принципиальное
сходство организации функционально-аналогичных структур у пред-
ставителей трех далеко отстоящих друг от друга типов животного
царства. В дальнейшем аналогичные сопоставления были проведены
А. А. Заварзиным между нейрональными отношениями в спинном
мозге позвоночных и брюшной цепочке насекомых и ряде дрУг1!Х
отделов нервной системы этих животных. Развивая исследования
10
И. И. Мечникова, А. А. Заварзин и его сотрудники провели исследо-
вания воспалительного новообразования соединительной ткани у пред-
ставителей ракообразных, насекомых, моллюсков и низших позвоноч-
ных. Эти работы также показали принципиальное сходство в развитии
процессов воспаления и регенерации у представителей весьма отда-
ленных групп животных, не связанных между собой близкородствен-
ными отношениями.
Сопоставление результатов сравнительно-гистологических иссле-
дований на относительно статичных тканях нервной системы и дина-
мичных тканях внутренней среды у разных групп животных привело
А. А. Заварзина к выводу о плодотворности предложенного им метода
сравнения по принципу функциональной аналогии. При таком сопо-
ставлении удалось обнаружить принципиальное структурное сходство
даже у далеко отстоящих форм. Оно свидетельствовало о том, что
эволюционные преобразования тканей у разных животных происходят
в принципе сходно, параллельно. Иными словами, при преобладающем
дивергентном развитии организмов изменения их функционально-ана-
логичных тканей происходят в основном в одном, общем для всех
групп животных направлении.
Основные положения теории параллельных рядов тканевой эво-
люции А. А. Заварзин иллюстрирует схемой тканевой эволюции
(рис. 2), в основу которой положено количество клеточных форм,
составляющих тканевую систему. Чем выше ступень развития ткани,
Рис. 2. Схема параллельных рядов тканевой эволюции
(по А. А. Заварзину).
II
тем большим количеством форм она располагает. Эволюция тканей в
разных типах животных идет параллельно, что позволяет наложить
ряды (горизонтальные стрелки на схеме) на эволюционное древо и
получить схему параллельных рядов тканевой эволюции. При этом
длина горизонтальных линий будет отражать степень расщепленности
ткани у данного типа животных, а начальные члены ряда (рис. 2, а) —
сходные, но не тождественные (разные значки) элементы ткани.
По Заварзину, причиной эволюционной направленности преобра-
зования тканей животных является общая для данного типа тканей
функциональная задача (сократимость, интегративная функция, функ-
ция обеспечения постоянства внутренней среды и др.). Кроме того,
направленность эволюционных преобразований функционально-анало-
гичных тканей обусловливается общими закономерностями организа-
ции эукариотных клеток. На основе этих общих свойств и происходит
у всех животных специализация клеток в направлении реализации той
или иной конкретной функции.
Закономерное преобразование тканей в сторону более совершен-
ного осуществления ими специфических функций не означает, однако,
что у всех организмов оно совершается абсолютно идентичными, тож-
дественными путями. Поэтому основной задачей сравнительного ме-
тода в гистологии является, по А. А. Заварзину, выяснение этих мо-
дификаций у разных групп животных и в первую очередь у далеко
отстоящих в филогенетическом отношении. Сопоставление у таких
животных функционально-аналогичных тканей позволяет выявить и
общие типовые признаки их структурной организации, и ее возможные
варианты. Последние, по мнению А. А. Заварзина, обусловлены осо-
бенностями общего плана строения организма и отражают известную
пластичность живой материи в реализации общих функциональных
задач.
Совокупность общих признаков организации данной ткани у раз-
ных животных и составляет эволюционную динамику этой ткани. Под
термином «эволюционная динамика» А. А. Заварзин понимал истори-
чески обусловленные свойства и потенции к совершенствованию в
определенном направлении функционально-аналогичных тканей у со-
временных многоклеточных животных.
Помимо работ А. А. Заварзина, А. В. Румянцева, Н. Г. Хлопина,
заложивших основы исторического подхода к анализу тканевого уров-
ня организации многоклеточных животных, в первой половине XX в.
в отечественной гистологии появились и работы, в которых сравни-
тельный метод использовался для решения более частных гистологи-
ческих проблем, имеющих прикладное значение. В качестве примера
12
можно привести серию сравнительных исследований эндокринных и
нейросекреторных систем рыб, положенных в основу технологии ис-
кусственного рыборазведения. Характерный для отечественной гисто-
логии общебиологический подход к анализу тканевого уровня органи-
зации приобретает особе значение в настоящее время. Появление боль-
шого количество принципиально новых методов исследования позво-
лило значительно углубить наши представления о структурно-хими-
ческой организации тканевых элементов и их взаимодействии в соста-
ве тканей. Было выявлено, что функционально-аналогичные тканевые
элементы и ткани разных животных характеризуются хотя и не тож-
дественными, но сходными закономерностями структурно-химической
организации на молекулярном и надмолекулярном уровнях.
В связи с этим сравнительные исследования и сопоставления в
гистологии и частной цитологии стали весьма актуальными не только
для выяснения закономерностей эволюции, но и как метод анализа
общих принципов структурно-химической организации функциональ-
но-аналогичных структур.
Естественно, что глубокие теоретические разработки наших пред-
шественников являются основой и для обобщения большого нового
сравнительного материала, и для целенаправленных сравнительно-гис-
тологических работ.
§2 . ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «ТКАНЬ», КЛАССИФИКАЦИЯ ТКАНЕЙ
У подавляющего большинства современных многоклеточных жи-
вотных клетки и межклеточные структуры объединены в особые сис-
темы — ткани. Следовательно, помимо клеточного и органного уров-
ней организации многоклеточных животных существует еще особый,
тканевой уровень. Ткани представляют собой более общие системы
организма, чем его органы, т. е. в состав различных органов входят
обычно одни и те же типы тканей.
Тканью в широком, типовом смысле этого понятия следует счи-
тать систему элементов (клеток и межклеточных структур), возникшую
или неоднократно возникавшую на основе общих структурно-биохи-
мичских закономерностей организации этих элементов для реализации
одной из функций многоклеточных животных. Так как таких общих
функций относительно немного (пограничность, создание постоянства
внутренней среды, восприятие и анализ раздражений и сократимость),
то и все многообразие тканей можно объединить в четыре основных
типа: пограничные (эпителиальные), ткани внутренней среды (кровь,
интерстициальные, скелетные), ткани нервной системы и мышечные
ткани.
13
общими закономерностями организации и изменений в эволюции тка-
ней всех многоклеточных животных, а не только млекопитающих и
человека, что характерно для медицинского курса гистологии. Эта
принципиальная особенность сближает наш курс с курсом зоологии.
Кроме того, в методическом отношении и по глубине анализа тканевых
структур гистология сейчас все теснее оказывается связанной со струк-
турной биохимией и целым комплексом наук, объединяемых в новую
синтетическую науку — биологию клетки. Промежуточное положение
гистологии в системе биологического образования резко усиливает ее
значение: она обеспечивает одно из звеньев той неразрывной цепи,
которая должна существовать в современной биологии между зооло-
гией и науками физиолого-биохимического профиля, а также между
биологией и медициной*.
Автор сердечно благодарит всех сотрудников кафедры цитологии
и гистологии СПбГУ и студентов биолого-почвенного факультета,
способствовавших созданию учебника. Особую благодарность автор
выражает М. Ю. Пунину, О. Ю. Чаге и Е. Н. Горышиной за изготов-
ление или предоставление оригинальных иллюстраций, а также 3. А Зай-
ченко, Т. Г. Шапошниковой и Н. Ю. Павленко за техническое офор-
мление рукописи. Искренне благодарен автор также официальным ре-
цензентам: проф. В. А. Отеллину, проф. М. С. Виноградовой, чл.-кор.
РАН проф. Л. Н. Ивановой и всему коллективу кафедры физиологии
Новосибирского университета. Большая часть их ценных замечаний
учтена автором, и это помогло улучшить содержание учебника. Боль-
шую помощь оказали автору своими советами проф. Л. 3. Кайданов (в
области цитогенетики), проф. П. Г. Назаров (в области иммунологии)
и проф. О. Г. Строева, проф. В. А. Отеллин, доц. Д. К. Обухов (в об-
ласти нейробиологии). Особую благодарность выражает автор проф.
Ольге Георгиевне Строевой, без самоотверженной работы которой
выход учебника в свет был бы невозможен.
А. А. Заварзин
* Текст был подготовлен к печати при жизни А. А. Заварзина, однако после его кончины
в 1993 г. судьба рукописи складывалась непросто. Несколько лет она пролежала в изда-
тельстве «Высшая школа», после чего коллектив кафедры, ранее возглавлявшейся А. А. За-
варзиным, счел необходимым передать ее в издательство СПбГУ. Естественно, что за про-
шедшие годы многие положения книги если не устарели, то в какой-то части потеряли
новизну. В то же время многие идеи, высказанные автором в качестве предположений или
гипотез, в настоящее время получили блестящее подтверждение в экспериментальной нау-
ке. Осознавая все это, мы, сотрудники профессора А. А. Заварзина, проводившие окон-
чательную подготовку рукописи к изданию, сочли необходимым максимально сохранить
авторский текст и лишь отдельные главы, посвященные наиболее бурно развивающимся
областям биологии (иммунология и др.), были внесены некоторые уточнения и изменения.
§3 . ФОРМИРОВАНИЕ ТКАНЕЙ В ОНТОГЕНЕЗЕ
При половом размножении развитие всех многоклеточных живот-
ных начинается с процесса слияния двух гаплоидных клеток — муж-
ской и женской. Они характеризуются высокой степенью цитологи-
ческой дифференциации. В то же время продукт их слияния — зиго-
та — дает начало всем разнообразным клеткам, из которых построены
все ткани многоклеточных животных.
Для процессов раннего эмбрионального развития особое значение
имеет строение женской половой клетки. Яйцеклетки могут достигать
гигантских размеров. Они характеризуются сложной структурной и
химической организацией цитоплазмы. В яйцеклетке помимо большо-
го количества запасных питательных веществ для пластического и
энергетического обменов сосредоточены как необходимые структуры
для последующего развития — белоксинтезирующий аппарат, так и
резервная энергетическая система в виде неработающих митохондрий.
Кроме того, в ооците синтезируются и накапливаются в цитоплазме
латентные формы мРНК и специфические белки, имеющие регулятор-
ное значение в последующем развитии. Запасные органоиды, а также
разнообразные рибонуклеопротеиды вместе с запасными питательны-
ми веществами закономерно распределяются по цитоплазме, образуя
гетерогенную структуру ооцита, определяющую первичную дифферен-
цировку клеточного материала зародыша. Дифференцировка реализу-
ется уже на первом этапе эмбриогенеза — дроблении, когда образую-
щиеся в ходе быстро протекающих митотических делений ядра попа-
дают в участки цитоплазмы, содержащие качественно различные типы
мРНК и регуляторных белков. Последние вместе с белками, синтези-
руемыми на основе латентных форм мРНК, оказывают влияние на
ядерный аппарат, активируя или блокируя отдельные участки генома:
в одних группах бластомеров активируются одни его участки, в дру-
гих — иные, благодаря чему дифференцируется клеточный материал
развивающегося зародыша. С этого периода начинается образование
эмбриональных зачатков — клеточных систем, разнородных по своим
потенциям к развитию. Клетки в зачатках характеризуются некоторы-
ми еще незначительными морфологическими особенностями и, что
самое главное, качественными различиями в синтетической активнос-
ти. У большинства многоклеточных в развитии имеется стадия, когда
зародыш представлен тремя слоями, или зародышевыми листками
(рис. 3, А). Образование трехслойного зародыша происходит разными
путями, однако в основе этих первичных морфогенетических процес-
сов лежит обычно сложная миграция клеток. На этой стадии эмбрио-
генеза осуществляется взаимодействие зародышевых листков — первич-
ная эмбриональная индукция. Ее процессы хорошо изучены у позво-
16
ночных животных. У зародышей позвоночных под влиянием среднего
зародышевого листка, или мезобласта, в наружном листке — эктоб-
ласте — возникает зачаток нервной системы (3). В дальнейшем он
преобразуется в нервную трубку — зачаток спинного и головного
мозга, а из мезобласта (у высших позвоночных) выделяется хорда (5),
и зародыш переходит в стадию закладки осевых органов.
Рис. 3. Поперечные разрезы на двух последовательных стадиях развития
зародыша позвоночных (птиц).
А — стадия формирования нервной трубки;
Б — закладка осевых органов:
1 — эктодерма, 2 — энтодерма, 3 — нервная пластинка, 4 — нервная
трубка. 5 — хорда, 6 — сомит, 7, 8 — париетальный и висцеральный листки
спланхнотома, 9 — дерматом, 10 — миотом, 11 — мезенхима, 12 — нефротом,
73 — сосуд.
17
На описываемой стадии дифференцировку претерпевает мезодер.
ма __ зачаток, образующийся из среднего зародышевого листка после
обособления из него хорды (рис. 3, Б). В мезодерме выделяется дор.
сальный участок, образующий сомиты (2, 10), и вентральный, состо-
ящий из дьух листков спланхнотома, дающих начало стенке вторичной
полости тела — целома. В месте соединения сомитов и листков
спланхнотома выделяется еще один зачаток — нефротом (12), из ко-
торого формируется мочеполовая система. В сомите выделяются мн-
огом (10) и дерматом (9), которые в последующем развитии дают
соответственно поперечнополосатую мускулатуру, соединительноткан-
ную основу кожи, мезенхиму, формирующую разновидности тканей
внутренней среды с механическими и трофическими функциями.
Скелетные ткани головного отдела формируются из особого за-
чатка, выделяющегося из наружного листка. Из эктодермы развивают-
ся кожный эпителий и его производные. Внутренний листок — энто-
дерма — дает начало кишечному эпителию, эпителию печени, желудка
и желез среднего отдела пищеварительного тракта. В энтодерме закла-
дываются и первичные половые клетки, которые затем мигрируют в
кровяное русло и оседают в определенных участках целомического
эпителия, где образуются половые железы. Сложную миграцию пре-
терпевают и клетки других зачатков, в частности пигментные клетки
и часть нервных клеток. Помимо зачатков дефинитивных тканей у
высших многоклеточных (первично- и вторичноротых) из всех трех
зародышевых листков дифференцируются провизорные ткани и орга-
ны, осуществляющие выделительную, всасывающую, респираторную
и другие необходимые для развития зародыша функции. Они сущест-
вуют относительно недолго и характеризуются высокой степенью спе-
циализации образующих их клеток. При дифференцировке последних
широко представлены явления полиплоидизации клеток.
Ведущую роль в прогрессирующей дифференцировке клеток эмо-
риональных зачатков в период гаструляции и закладки осевых органов
играет взаимодействие между клетками в одном зачатке и между
различными зачатками. В многочисленных экспериментах по пересад-
ке зачатков в развивающихся зародышах и их культивированию вне
организма удалось выявить некоторые общие закономерности таких
взаимосвязей. На примере кожного и других эпителиев оонаружена
необходимость временного или постоянного контакта эмбрионального
эпителия с развивающейся соединительной тканью. Для зачатков эпи
телия поджелудочной железы, миобластов позвоночных животных,
также других клеточных и тканевых систем при культивировании <
вне организма показано, что нормальная дифференцировка этих тк
18
невых элементов требует определенного количества клеток, т. е. не-
обходимо взаимодействие между одинаковыми клетками.
В процессах дифференциации весьма важную роль играют вне-
клеточные структуры типа базальных мембран и межклеточного ве-
щества. Они помимо выполнения специальной опорной и трофической
функции оказывают специфическое воздействие на рецепторы поверх-
ностного аппарата, обеспечивая таким образом дифференцировку кле-
ток эмбриональных зачатков.
В опытах на культивируемых клетках эмбриональных зачатков и
на зародышах высших позвоночных в условиях in vitro удалось пока-
зать, что такую информативную функцию выполняют мукополисаха-
риды и ряд белков, например фибронектины и коллагены — обяза-
тельные компоненты межклеточных структур в зачатках и тканях
эмбрионов позвоночных. В межклеточных взаимодействиях в онтоге-
незе исключительно важную роль играют временные и специфические
постоянные межклеточные контакты. Они определяют многие важные
процессы и, в частности, такие сложные явления, как оседание миг-
рирующих клеток лишь в определенных зачатках, причем в опреде-
ленном месте, что и происходит при развитии половых желез или при
миграции пигментных клеток.
Таким образом, множество фактов свидетельствует о том, что
дифференцировка зародыша определяется сложными взаимодействия-
ми клеточных и внеклеточных компонентов, образующихся в резуль-
тате первичной дифференцировки эмбриональных зачатков. По дости-
жении определенных стадий развития эмбриональные зачатки органов
и тканей могут в условиях изоляции продолжать нормальное развитие
и формировать тканевые и органные структуры, идентичные структу-
рам, развивающимся in vivo, т. е. способны к так называемой само-
дифференцировке. Возможность менять направление специализации
под влиянием внешних для эмбриональных зачатков факторов, как
правило, уменьшается по мере развития организма. Способность к
саморазвитию в определенном направлении у эмбриональных зачатков
и тканей в ходе развития зародыша увеличивается.
Ограничение потенций зачатков к различным дифференцировкам,
определение направления их дефинитивной специализации называется
Детерминацией. Проявление внутренних изменений в виде морфоло-
гических и функциональных особенностей носит название терминаль-
ной дифференцировки зачатков и тканей в широком смысле этого
понятия. В более узком смысле в гистологии под дифференциацией
или, точнее, цитодифференциацией обычно понимают возникновение
морфологических различий.
19
Явления детерминации и дифференциации развертываются на
уровне эмбриональных зачатков и тканей, т. е. на уровне интегриро
ванных клеточных систем. В основе механизмов, обеспечивающих
согласованный ход этих сложных процессов, лежат общие закономер-
ности, обеспечивающие специализацию клеток, в частности дифферен-
циальная активность их генетического аппарата.
В настоящее время есть достаточно убедительные данные о том
что, как правило (за исключением некоторых видов дифференцировок)
любая клетка данного многоклеточного организма обладает идентич-
ным набором хромосом, т. е. одинаковым запасом генетической ин-
формации. В связи с этим детерминация и последующая дифференци-
ровка клеточного материала связаны обычно не со структурными из-
менениями ДНК хромосом, а лишь со стойким изменением регуляции
работы генетического аппарата — деблокированием специфических
для данного направления дифференцировки генов и блокированием
других генов. Очевидно, что регуляция работы генетического аппарата
клеток осуществляется на уровне ДНК хромосом. Однако ее законо-
мерное течение во времени и конкретная реализация в нужный момент
обусловлены воздействиями химических системных факторов, т. е.
регулирующими воздействиями целостного организма.
Таким образом, процессы дифференциации, протекающие в ооге-
незе, определяют первичную дифференцировку яйцеклетки и в после-
дующем целостного зародыша. В ходе сложной многоэтапной эмбри-
ональной индукции, а позднее гормональной регуляции и нервной
интеграции обеспечивается развитие целостного и вместе с тем много-
образно дифференцированного организма.
К моменту формирования дефинитивных тканей генетический ап-
парат составляющих их клеток детерминирован уже достаточно стойко
и возможности изменения генетической программы в них, особенно у
высших животных, весьма ограничены. Обычно даже внешне мало-
дифференцированные клетки той или иной разновидности ткани спо-
собны дифференцироваться в небольшое число разновидностей специ-
ализированных клеток, характерных для данного типа тканей. Таким
образом, одна из фундаментальных характеристик тканевой систе-
мы — наличие в составляющих ее клеточных элементах стойкой де-
терминации генетического аппарата к определенным направлениям
дифференциации*.
* Такая стойкая детерминация даже малодифференцированных клеток передается по на
следству в ряду клеточных поколений в процессе их деления. Это свойство получило
ние эпигеномной наследственности, однако механизмы ее остаются неясными (В. М. 11
хайлов, Ю. Б. Вахтин, 1987).
20
Ограничение способности клеток одного типа тканей превращать-
ся в клетки другого типа представляет собой важную и пока еще
весьма загадочную закономерность тканевого уровня организации
многоклеточных животных. Принципиальная возможность изменения
детерминации генетического аппарата клеток и их дифференцировки
в любых направлениях, характерных для данного организма, показана
в опытах с пересадкой ядер соматических клеток эмбрионов в лишен-
ную ядра яйцеклетку амфибий. В опытах удалось получить полноцен-
ные организмы. Следовательно, ядерный аппарат соматической клетки
в цитоплазме яйцеклетки под непосредственным воздействием ее ре-
гуляторных молекул перестраивается и вновь способен реализовать
имеющиеся в геноме данного организма потенции. В экспериментах
на позвоночных животных и насекомых достоверно показана возмож-
ность ограниченной метаплазии, т. е. превращения клеток одного типа
тканей в клетки другого типа. Так, в эмбриогенезе хрусталик глаза
развивается из эктодермы (общий зачаток кожных эпителиев и его
производных). При регенерации же хрусталик глаза хвостатых амфи-
бий образуется за счет клеток радужины, т. е. клеток тканей, проис-
ходящих из нервного зачатка. Изменение детерминации — так назы-
ваемая трансдетерминация зачатков дефинитивных тканей и органов
(имагинальные диски) — наблюдается у личинок дрозофилы (до оп-
ределенного периода развития при пересадке зачатков). В клональных
культурах in vitro показана возможность трансдетерминации клеток
сетчатки в клетки хрусталика или пигментные клетки. В культурах in
vitro удалось также добиться превращения фибробластов в миобласты,
лающие симпластические мышечные волокна.
Весьма многочисленны примеры так называемой филогенетичес-
кой метаплазии. Суть ее заключается в том, что в процессе усложнения
многоклеточных животных могут появляться вторичные и третичные
(в зависимости от времени появления в филогенезе) ткани. Они воз-
никают на основе зачатков и тканей с основной функцией, а приоб-
ретают свойства тканей другого типа, выполняя соответственно и их
функцию. Примером тому могут служить уже упоминавшиеся мышеч-
ные ткани. Первичная разновидность тканей этого типа возникла у
примитивных многоклеточных на основе эпителиально-мышечных
клеток. В эволюции у всех многоклеточных наблюдается направленная
Дифференцировка первичных мышечных тканей с выделением особого
зачатка (многом у позвоночных). На более поздних этапах эволюции
на основе целомического эпителия (у первично- и вторичноротых
животных) возникают вторичные мышечные ткани. Наибольшего раз-
вития они достигают у членистоногих, обеспечивая сократимость их
21
внутренних органов (сердце, пищеварительный тракт). У позвоночных
животных — это мышечная ткань миокарда. Однако у них на основе
механоцитов рыхлой соединительной ткани возникают и третичные
сокоатимые ткани, образующие гладкие мышцы всех внутренних ор-
ганов. Наряду с гладкой мышечной тканью у позвоночных в глазу
позднее, уже на основе тканевых элементов нервной системы, возни-
кает еще одна разновидность третичных мышечных тканей — мышцы,
сужающие и расширяющие зрачок. Аналогичные явления, правда в
меньшей степени, характерны и для других типов тканей. Такая ме-
таплазия может приводить к формированию тканей, аналогичных пер-
вичной, или вовлечению в ее состав небольших клеточных популяций,
или, наконец, к использованию сходных структурно-биохимических
механизмов в разных по своим функциям и тканевой принадлежности
клетках.
Таким образом, несмотря на жесткость направлений дифференци-
ровки в дефинитивных тканях, они регулируются системными и меж-
тканевыми механизмами, что широко используется в естественных
условиях для наиболее рационального обеспечения функциональных
потребностей организмов на тканевом уровне организации.
Возникающие в эволюции вторичные и третичные ткани хотя и
отличаются от первичных, однако обычно приобретают основные при-
знаки данного типа тканей. Это позволяет в общебиологическом плане
рассматривать их уже как одну из разновидностей этого типа тканей.
Тем не менее более позднее происхождение в эволюции этих тканей
часто отражается на их развитии в онтогенезе. Так, древние сомати-
ческие мышечные ткани развиваются у позвоночных из миотомов,
сердечная мышечная ткань — из специальных зачатков в эпителиаль-
ной выстилке вторичной полости тела, а гладкая мышечная ткань —
из мезенхимы, зачатка, дающего все многочисленные разновидности
тканей внутренней среды. Мышцы, сужающие и расширяющие зрачок,
происходят из нейрального зачатка. При этом, несмотря на наличие
общих черт структурно-химической организации скелетной, сердечной
и гладкой мышечной тканей и мышц, происходящих из нервного
зачатка, они не могут превращаться друг в друга, т. е. являются строго
детерминированными разновидностями единого типа сократимых тка-
ней.
Явление филогенетической метаплазии — одно из проявлений
ограниченного, направленного изменения тканей в филогенезе. Есте-
ственно, что изучение механизмов этих процессов, имеющих весьма
широкое распространение у высших многоклеточных, — важная ха-
рактеристика эволюционной динамики вторичных и третичных тканей.
то
Знание таких механизмов приближает нас к пониманию внутренних
закономерностей процессов детерминации и дифференцировки при
адаптации животных в-ходе эволюции. Углубленное их изучение также
необходимо для выяснения особенностей развертывающихся в этих
тканях патологических процессов. Так, даже простое доказательство
факта происхождения мышечных и эпителиальных тканей из разных
зачатков у позвоночных животных, экспериментально обоснованное
Н. Г. Хлопиным, имело большое значение для рациональной класси-
фикации образуемых этими тканями опухолей. Такая классификация
объясняла с биологических позиций особенности малигнизированных
клеток, имеющих разные источники развития. Естественно, что еще
большее значение для анализа патологических процессов имеет изу-
чение всей исторически обусловленной совокупности свойств целоми-
ческих и соматических мышечных тканей, характеризующих особен-
ности их эволюционной динамики. Весьма ярко эти особенности про-
являются в процессах регенерации целомической и соматической мы-
шечных тканей у человека.
§4 . ПРОЛИФЕРАЦИЯ И ДИФФЕРЕНЦИРОВКА КЛЕТОК
ПРИ ФОРМИРОВАНИИ ТКАНЕЙ И В ИХ НОРМАЛЬНОЙ
ЖИЗНЕДЕЯТЕЛЬНОСТИ
Пролиферация (репродукция, размножение) и дифференцировка
клеток в тканях многоклеточных животных — две важнейшие стороны
жизнедеятельности клеток в составе тканевых систем. Размножение
клеток обусловливает увеличение их числа, а дифференцировка — их
разнообразную морфофункциональную специализацию. При делении
материнской клетки, как правило (за исключением специальных слу-
чаев), получаются две идентичные ей дочерние клетки. Дифференци-
ровка клеток обеспечивает появление у них специфических особен-
ностей. Между размножением и дифференцировкой клеток существу-
ют чаще антагонистические, а иногда и конкурентные отношения,
которые начали формироваться в момент появления многоклеточных.
В ходе эволюции по мере совершенствования интегративных механиз-
мов целостного организма в его тканях происходило усложнение вза-
имоотношений между репродукцией и дифференцировкой клеток.
В цитологическом плане репродукция клеток представляет собой
не только деление материнской клетки, или митоз. Важные процессы
синтеза ДНК и удвоения хромосом происходят обычно в середине
интерфазы. Они могут занимать половину, а иногда и большую часть
интерфазы.
Наличие в интерфазе важнейшего процесса клеточной репродук-
ции — репликации ДНК — позволяет разделить ее на три периода:
23
пресинтетический (период G1), синтетический (период S), постсинте-
тический (период G2). Вместе с митозом они составляют митотический
цикл клетки.
Таким образом, митотический цикл клеток — закономерная пос-
ледовательная цепь событий, состоящая из подготовки клеток к син-
тезу ДНК, удвоения хромосом, подготовки клеток к митозу и, наконец,
самого митоза.
Для пролиферации важнейшими периодами митотического цикла
являются синтез ДНК и митоз. Естественно поэтому, что при дробле-
нии в цикле делящихся клеток обычно отсутствуют периоды G1 и G2.
Их появление совпадает с началом гетеросинтетической активности
клеток эмбриональных зачатков, с началом синтеза в них специфичес-
ких макромолекул.
В процессах становления тканей в онтогенезе при ярко выражен-
ных антагонистических отношениях между гетеро- и автосинтетичес-
кой активностью клеток в тканевых системах имеется два способа
сочетания репродукции и дифференцировки. Первый способ — все
процессы репродукции клеток могут сосредоточиваться в периоде эмб-
риогенеза, когда и формируется основной запас клеток, необходимый
для построения данной ткани. Такого рода отношения наблюдаются
при развитии тканей нервной системы у высших животных. Второй
способ увеличения количества клеток при антагонизме между их реп-
родукцией и дифференцировкой — создание постоянного запаса мало-
дифференцированных пролиферирующих клеток, что и обеспечивает
непрерывный поток новых клеток, вступающих на путь специфической
дифференцировки.
При отсутствии антагонизма между гетеро- и автосинтетичес-
кой активностью клеток в тканевых системах увеличение их количе-
ства в онтогенезе идет параллельно с их дифференцировкой. Естест-
венно, что скорость пролиферации в таких тканевых системах умень-
шается в ходе развития и в дефинитивных тканях оказывается уже
на достаточно низком уровне, с весьма продолжительными периодами
G1 и S.
Такие ткани получили название растущие ткани. Весьма важной
системной характеристикой этого типа тканей является продолжитель-
ность жизни составляющих их элементов, т. е. интенсивность обнов-
ления внутриклеточных структур, клеток и образуемого ими межкле-
точного вещества. По этому признаку в разных тканях одних и тех
же животных и в одинаковых тканях у разных представителей много-
клеточных организмов удается выявить два основных типа системной
организации.
24
В тканях нервной системы высших многоклеточных животных
продолжительность жизни нейронов, как правило, соответствует про-
должительности жизни организма. Такие системы получили название
стационарных. Тем не менее образующие их клетки характеризуются
непрерывно идущими процессами внутриклеточного обновления ци-
топлазматических структур. Эти процессы характерны не только для
нейронов, но и клеток эпителия печени, мышечных волокон и ткане-
вых элементов некоторых других тканей.
Особую, весьма распространенную у многоклеточных животных
группу составляют ткани, жизнедеятельность которых основана на
непрерывном обновлении их клеточного состава. В этих, так называ-
емых камбиальных тканях, продолжительность жизни дифференциро-
ванных клеток относительно невелика. Численное постоянство клеточ-
ного состава в них достигается благодаря сбалансированному равно-
весию между количеством погибающих, закончивших свой жизненный
цикл клеток и количеством клеток, образующихся в результате деления
малодифференцированных камбиальных клеток. Естественно, что при
этом ярко выражены регуляторные системные механизмы и наглядно
выступают тесные взаимоотношения между репродукцией и диффе-
ренциацией клеток как в процессе становления таких тканей в эмбри-
огенезе, так и в их организации во взрослом состоянии.
Помимо основного способа репродукции клеток — митотического
деления — в специализированных тканях могут происходить процессы
амитотического, прямого, деления клеток. Иногда им предшествуют
синтез ДНК и частичное или полное удвоение хромосом. Однако у
многоклеточных животных прямое деление приводит к формированию
неспособных к митотическому делению клеток.
Весьма широко распространены при дифференцировке клеток
многоклеточных животных явления соматической полиплоидизации.
Они основаны на разобщении двух основных процессов клеточной
репродукции — синтеза ДНК и митоза. При соматической полиплои-
дизации клетка переходит на такой цикл репродукции (эндорепродук-
ция), в котором отсутствует митоз или его заключительные фазы, хотя
сохраняется период синтеза ДНК и происходит, следовательно, ее
удвоение. Клетки могут проходить несколько циклов эндорепродук-
Ции, т. е. степень полиплоидизации может быть различной; так, в
Дифференцированных клетках может содержаться количество ДНК,
соответствующее 1024 наборам хромосом.
В клетках многоклеточных животных известны два типа сомати-
ческой полиплоидизации: политения и эндомитоз. При политении из
Цикла репродукции выпадает митоз и происходит многократное уд-
25
воение молекул ДНК в составе хромосом диплоидных клеток. Благо-
даря этому хромосомы приобретают гигантские размеры (политенные
хромосомы) и становятся видимыми в интерфазном ядре, но число их
не увеличивается.
При эндомитозе обычно ядерная оболочка не разрушается, но
происходит кратное увеличение числа хромосом. В некоторых случаях
сохраняются начальные фазы митоза, но отсутствует анафаза и реп-
лицированные хромосомы оказываются в одном ядре.
Основной биологический смысл эндорепродукции заключается в
интенсификации метаболизма клетки без прекращения ее функции во
время митоза. При некоторых типах дифференцировки эндорепродук-
ция — необходимое условие специализации клеток. Именно так об-
стоит дело при дифференцировке слюнных желез у двукрылых насе-
комых, гигантских нейронов у голожаберных моллюсков и, наконец,
мегакариоцитов — гигантских клеток в кроветворной системе млеко-
питающих. Образование из цитоплазмы мегакариоцитов кровяных
пластинок начинается только при достижении клетками в результате
нескольких эндомитозов уровня плоидности не менее 16 С.
Одна из общих закономерностей организации эукариотных кле-
ток — отсутствие жестких причинно-следственных связей между эле-
ментарными процессами, из которых слагаются такие общие процессы,
как репродукция и специализация клеток. Ярким примером могут
служить только что рассмотренные явления соматической полиплои-
дизации, при которых в цикле репродукции разобщаются такие важные
его периоды, как синтез ДНК и митоз. Еще многочисленнее примеры
разобщения элементарных процессов при различной специализации
клеток в тканях многоклеточных животных. Лабильный характер ор-
ганизации процессов репродукции и дифференцировки клеток тканей
резко увеличивает их адаптивную пластичность, поскольку позволяет
путем комбинаторики сходных элементарных процессов создавать
сложные структуры для реализации разных или сходных функций.
Специализация клеток в составе тканей многоклеточных основана
обычно на гипертрофии и модификации (чаще путем комбинаторики)
общих для эукариотных клеток структурно-химических механизмов.
§5 . СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ В ГИСТОЛОГИИ
Одна из основных задач морфологических исследований в частной
цитологии и гистологии — выяснение функционального значения тка-
невых структур и тканей в целом. В настоящее время ведущая роль в
разработке методов анализа химической организации тканевой струк-
туры принадлежит новой синтетической науке — биологии клетки,
26
объединяющей общую цитологию, структурную биохимию, физиоло-
гию клетки и молекулярную генетику.
Характеристика тканевых элементов сейчас уже невозможна без
использования электронной микроскопии, особенно в сочетании с ме-
тодами цитохимии и радиоавтографии. Широко используются в гис-
тологии новые цитохимические подходы — цитохимия ферментов,
количественная цитоспектрофотометрия и, наконец, наиболее тонкий
метод качественного анализа макромолекул в тканевых структурах —•
иммуноцитохимия. Описание принципов и возможностей этих методов
имеются в любом современном руководстве и в учебниках по цито-
логии и гистологии (Ченцов Ю. С. Общая цитология, 1984; Хэм А.,
Кормак Д. Гистология, 1983. Т. 1; Альберте Б. и др. Молекулярная
биология клетки, 1987. Т. 1).
В краткой характеристике современных методов гистологического
анализа для иллюстрации качественных их особенностей остановимся
лишь на описании метода радиоавтографии и методов клонирования
стволовых клеток в качестве примеров описательного и эксперимен-
тального подходов к анализу тканевых структур.
Метод радиоавтографии — один из наиболее адекватных совре-
менных методов анализа структурно-биохимической организации тка-
невых структур. В основе его лежит использование радиоактивных
элементов, включаемых чаще всего в состав предшественников мак-
ромолекул — нуклеиновых кислот, белков, полисахаридов. Такими
предшественниками являются аминокислоты, азотистые основания или
моносахара. В качестве маркеров чаще всего используются изотопы
водорода — тритий [3Н] — и углерода [14С]. По сравнению с биохи-
мическими методами, в которых также используются радиоактивные
предшественники, метод радиоавтографии отличается особым спосо-
бом регистрации включения маркеров в макромолекулы. При биохи-
мических исследованиях специальными счетчиками регистрируется
интенсивность включения меченых предшественников в отдельных
фракциях, полученных путем дифференциального центрифугирования
предварительно измельченных и, следовательно, разрушенных ткане-
вых элементов.
Техника дифференциального центрифугирования в настоящее
время позволяет выделять отдельные клеточные органоиды и даже их
отдельные компоненты типа наружной и внутренней мембран мито-
хондрий, гладкой и шероховатой ЭПС и т. п. Однако для анализа
гетерогенных по составу тканевых систем биохимические методы ока-
зываются не всегда применимыми. Большим достоинством метода
радиоавтографии является возможность вести исследования без разру-
27
шейия тканевых структур. Регистрация включения меченых предше-
ственников производится при помощи специальных фотоэмульсий.
Срезы ткани покрывают «пленкой» такой эмульсии и экспонируют в
течение более или менее продолжительного времени (обычно 7-14
дней для световой микроскопии и более длительное время для элек-
тронной микроскопии). Электроны, испускаемые предшественником,
включенным в макромолекулы, возбуждают зерна AgBr эмульсии над
структурами, содержащими эти макромолекулы. При специальной об-
работке автографов над срезом остаются лишь возбужденные электро-
нами отдельные черные зерна восстановленного серебра (в случае
трития — с малой длиной пробега электронов) или цепочек зерен —
треков (в случае электронов углерода [1QC] — с большой энергией
излучения). Просматривая готовые автографы (при световой микро-
скопии — окрашенные срезы), исследователь видит и гистологические
структуры, как на обычном препарате, и черные зерна или цепочки
зерен восстановленного серебра над срезом в тех местах, где локали-
зованы молекулы с мечеными предшественниками. Количество зерен
или треков пропорционально количеству меченых макромолекул. Ме-
тод радиоавтографии позволяет, не нарушая тканевых структур, опре-
делить места синтеза макромолекул в клетках тканей многоклеточных
животных и дать относительную количественную характеристику ин-
тенсивности их синтеза. Кроме того, фиксируя материал через разные
сроки после введения предшественника, можно проследить динамику
перемещения меченых макромолекул внутри клетки или во внеклеточ-
ные структуры.
Метод радиоавтографии не менее широко применяется и для ана-
лиза закономерностей системной организации тканей, сочетающих ре-
продукцию и дифференцировку клеток. Для этих целей весьма аде-
кватным оказался метод радиоавтографии с использованием [3Н]тими-
дина — азотистого основания, включающегося в ДНК в период ее
синтеза в клетке. Особенности этого предшественника — весьма бы-
строе выведение экзогенного [3Н]тимидина из организма высших по-
звоночных и исключительная избирательность его включения в ДНК.
Отсутствие метаболизма ДНК обеспечивает стойкое маркирование
ядер определенной фракции клеток, особенно значительной в интен-
сивно обновляющихся тканях. Прослеживая на автографах судьбу кле-
ток, содержащих меченую ДНК, можно определить направление и
скорость перемещения клеток в ткани от момента прекращения их
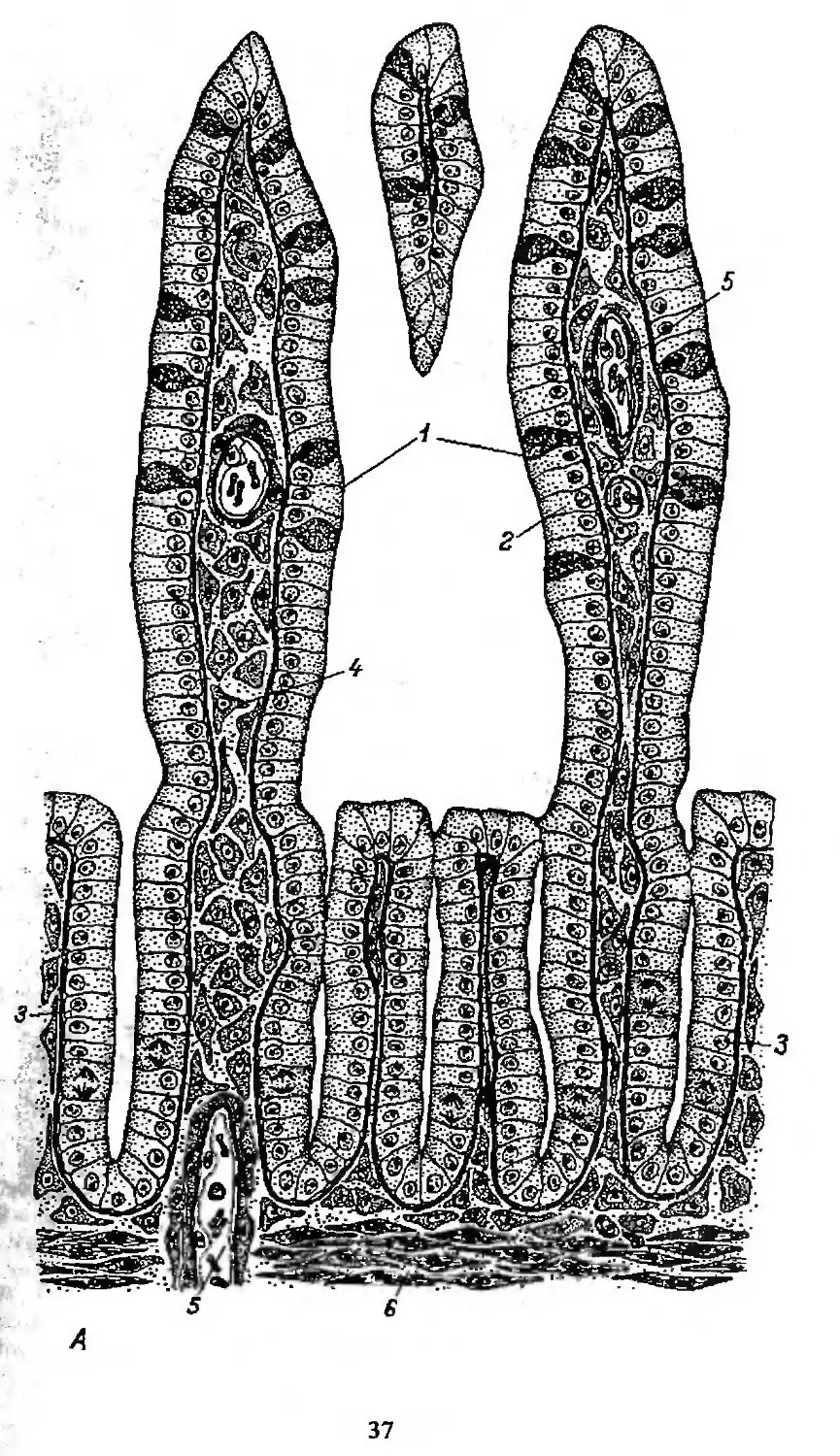
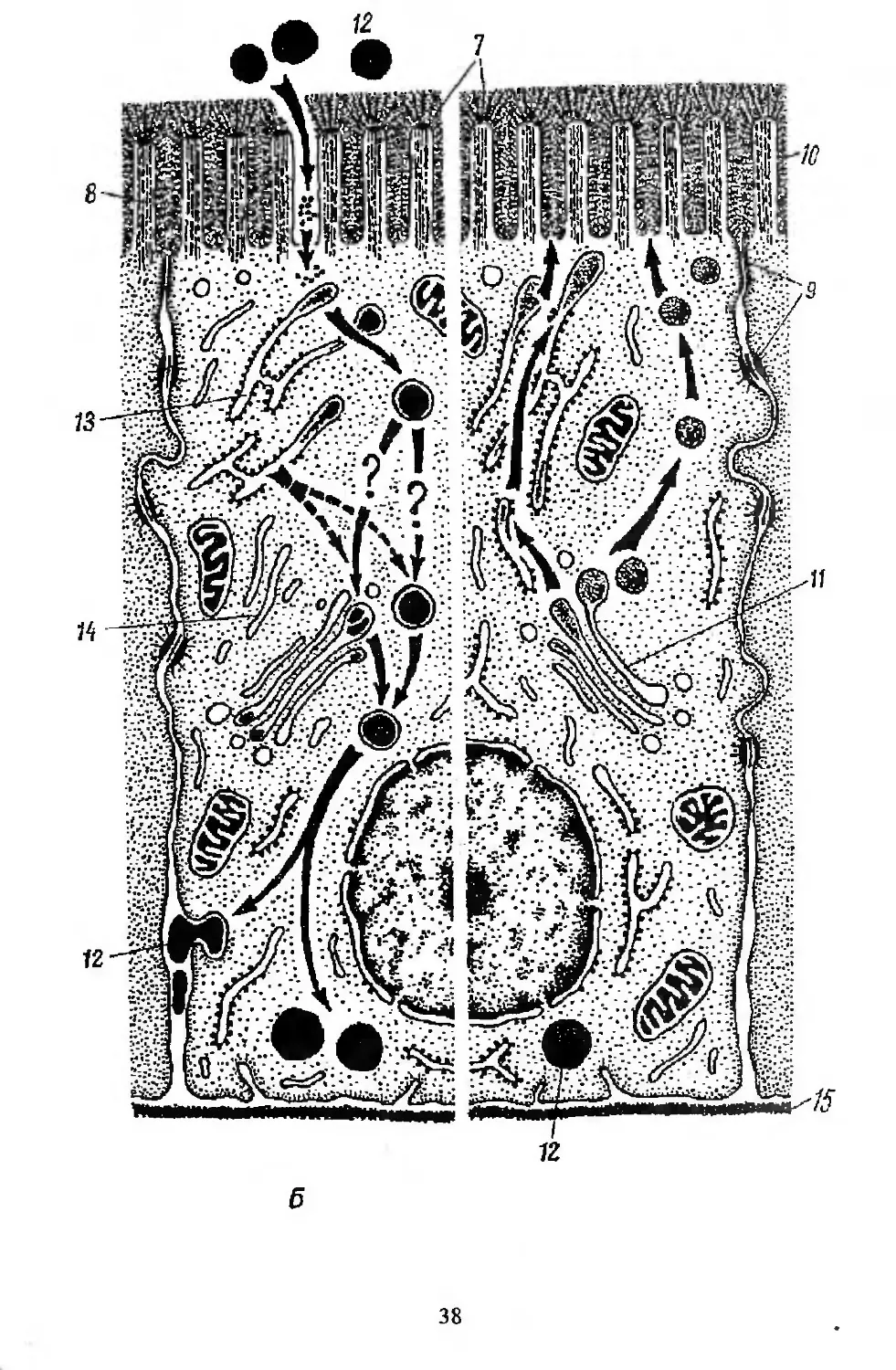
размножения до гибели. Это позволяет определить скорость физиоло-
гической регенерации — один из основных параметров кинетики ис-
следуемых камбиальных тканей.
28
q
Метод радиоавтографии с применением [ Н]тимидина позволя-
ет определить и скорость размножения клеток, общую длительность
митотического цикла (Т) и длительность его отдельных периодов (G2,
G1 и S).
Зная продолжительность митотического цикла и длительность пе-
риода синтеза ДНК, можно определить и относительное количество
пролиферирующих клеток в системе, так называемый пролифератив-
ный пул, или фонд размножающихся клеток. Это можно сделать, вводя
[3Н]тимидин в течение всего цикла с интервалами несколько меньши-
ми, чем средняя продолжительность периода S.
Таким образом, используя метод тимидиновой радиоавтографии,
можно получить такие важные количественные характеристики реп-
родукции и дифференцировки клеток в исследуемой ткани, как: а) ско-
рость выхода клеток в дифференцировку, продолжительность их су-
ществования в дифференцированном состоянии и локализация закон-
чивших свой жизненный цикл клеток; б) локализация, скорость раз-
множения и относительное количество размножающихся клеток. Со-
вокупность этих количественных показателей позволяет объективно
охарактеризовать кинетику клеточных популяций исследуемых тканей
и проследить ее изменение в гистогенезе, в патологических и экспе-
риментальных условиях и, наконец, выявить особенности кинетики
клеточных популяций в функционально-аналогичных тканях у разных
групп многоклеточных животных.
На основе метода тимидиновой радиоавтографии возникло целое
направление исследований закономерностей системной организации
клеточных популяций, представляющее собой новый этап в анализе
тканей, в жизнедеятельности которых совмещаются репродукция и
дифференциация клеток. Одним из важнейших достижений нового
направления было выяснение сложной организации процессов репро-
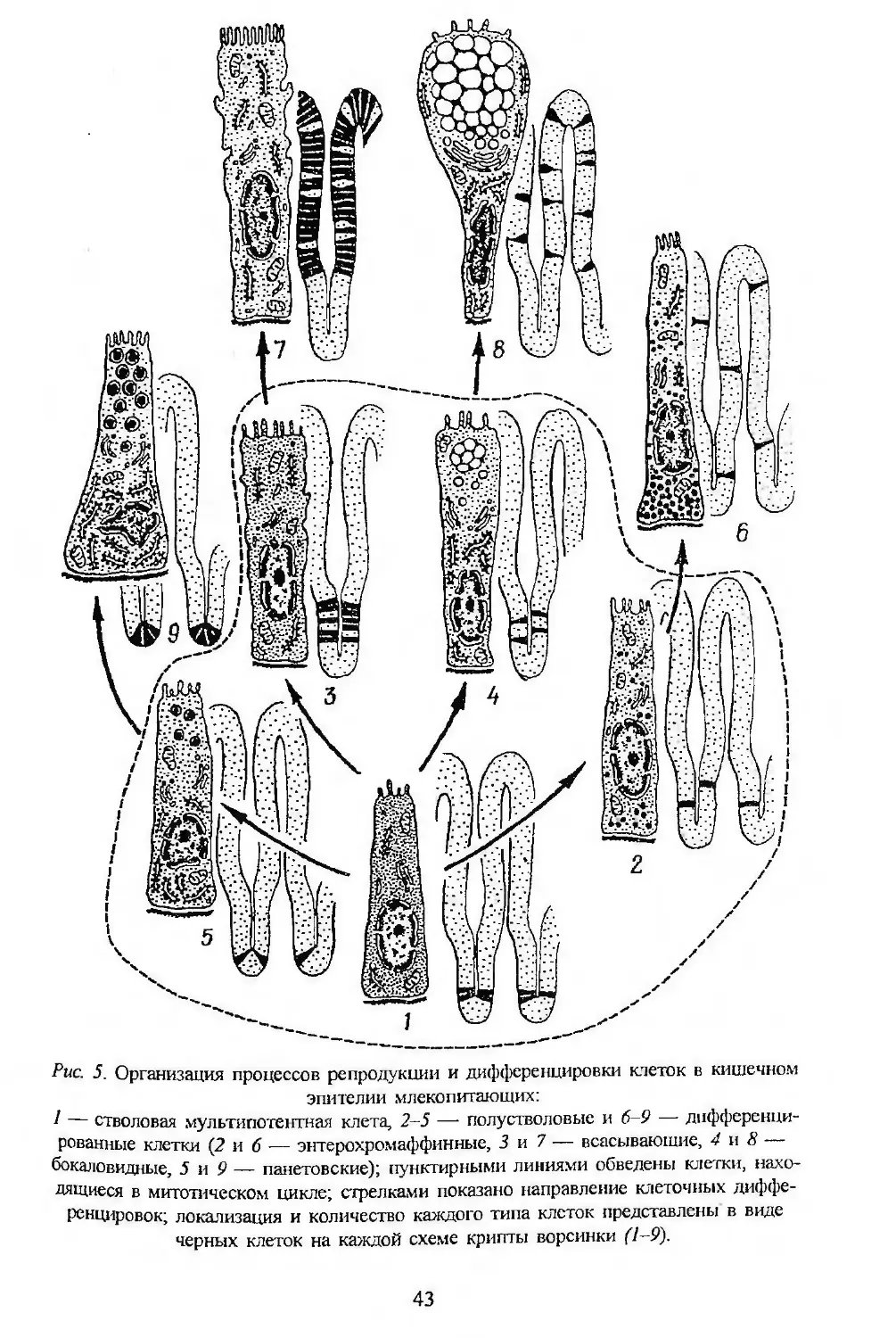
дукции в обновляющихся тканях высших многоклеточных. Оказалось,
что камбиальные клетки, как правило, представляют собой гетероген-
ную систему. В основе ее лежит наименее дифференцированная муль-
типотентная субпопуляция стволовых клеток. Кроме них в системе
имеется одна или обычно несколько субпопуляций полустволовых
клеток, пролиферирующих с большей скоростью, но имеющих огра-
ниченные потенции и к репродукции, и к различным дифференциров-
кам в составе данной ткани.
В изучении свойств стволовых и полустволовых клеток, характера
их взаимоотношений и общих системных закономерностей регуляции
репродукции большое значение имеют методы клонирования стволо-
вых клеток в организме и методы клонального культивирования ство-
29
ловых и особенно полустволовых клеток вне организма. Суть этих
методов заключается в создании искусственных (вне организма) или
естественных (в организме) условий для получения колоний или кло-
нов клеток, являющихся потомками одной, единственной родоначаль-
ной клетки и сохраняющих в своем составе клетки, способные давать
такие же клоны или колонии. Особенно детально эти методы разра-
ботаны для изучения кроветворной ткани млекопитающих. Имеются
определенные успехи и в разработке методов клонирования камбиаль-
ных клеток некоторых других тканей этих животных.
§6 . МЕСТО СРАВНИТЕЛЬНОЙ ГИСТОЛОГИИ В СИСТЕМЕ
БИОЛОГИЧЕСКИХ НАУК И ЕЕ ЗНАЧЕНИЕ
ДЛЯ МЕДИЦИНЫ И ВЕТЕРИНАРИИ
Как было сказано выше, в гистологии во второй половине XX в.
произошли существенные качественные сдвиги в методическом плане,
которые значительно углубили критерии анализа закономерностей тка-
невого уровня организации многоклеточных животных.
Использование новых методических подходов для анализа анало-
гичных тканей у разных групп многоклеточных животных показало
большую перспективность сравнительного исторического подхода и
выявило наличие типовых закономерностей структурно-химической
организации тканей одной функциональной специализации разных и
далеких в филогенетическом плане организмов.
Клетки и внеклеточные структуры одной функциональной специ-
ализации имеют общий план строения, проявляющийся в разных мо-
дификациях. Так, всасывающие клетки кишечного эпителия, сомати-
ческие мышцы, межклеточное вещество интерстициальных тканей у
млекопитающих и насекомых построены по одному плану. Однако это
не тождественные структуры, а модификации одного сходного типа,
направленные на решение сходных функциональных задач и возник-
шие или, во всяком случае, совершенствующиеся в процессе эволюции
первично- и вторичноротых независимо и параллельно. Их сходство,
затрагивающее как молекулярный и надмолекулярный, так и клеточ-
ный и надклеточный системный уровни организации, отражает именно
наличие общих для функционально-аналогичных тканей закономер-
ностей организации.
Естественно, что изучение общих закономерностей организации
в историческом плане возможно лишь на основе анализа основных
вариантов организации функционально-аналогичных тканей как у
близкородственных, различающихся в экологическом плане, так и у
далеко отстоящих, давно разошедшихся в филогенезе групп многокле-
точных животных.
30
Следовательно, в настоящее время основной задачей гистологии
как науки о тканевом уровне организации всех многоклеточных жи-
вотных является разработка проблемы эволюционной динамики тка-
ней. Исторический подход к анализу биологических закономерностей
тканевого уровня организации должен сочетаться с использованием
современных методов исследований.
Постановка проблемы эволюционной динамики тканей в качестве
центральной в гистологии выделяет основную задачу и общебиологи-
ческое значение гистологии. В то же время через частную цитологию
гистология теснейшим образом связана с общей цитологией, так как
использует разрабатываемые в ней новые методы исследования.
Сравнительный подход значительно шире, чем простое сопостав-
ление функционально-аналогичных и, в известном смысле, гомологич-
ных четырех типов первичных тканей и их разновидностей у близких
и далеко разошедшихся в филогенезе групп многоклеточных живот-
ных. Сравнительный метод широко применяется при исследовании
элементарных структурно-химических механизмов в одинаковых и раз-
ных в функциональном отношении тканевых дифференцировках у
одного и разных организмов. Такое применение сравнительного метода
характерно для общей цитологии и биологии клетки. При анализе
общих закономерностей организации клеток рассматривают многокле-
точных и одноклеточных животных и растительные организмы.
Сравнительный метод с большим успехом применяется и для
сопоставления первичных древних тканевых дифференцировок и ана-
логичных вторичных и третичных тканей и тканевых элементов, воз-
никающих в эволюции позднее и из других источников. Как отмеча-
лось выше, сам факт широкого распространения филогенетической
метаплазии — одно из наиболее глубоких доказательств закономер-
ных, направленных и ограниченных жесткими рамками четырех типов
изменений тканей в процессе эволюции многоклеточных животных.
Изучение тонких механизмов и факторов, обусловливающих филоге-
нетическую метаплазию, имеет непосредственное отношение и к раз-
работке проблемы дифференцировки и детерминации, и к выяснению
механизмов адаптации животных в процессе эволюции, т. е. наблюда-
ется тесная связь гистологии с зоологией и биологией развития. Кроме
того, выяснение особенностей эволюционной динамики вторичных и
третичных тканей позволяет не только объяснить с исторических по-
зиций сущность патологических процессов, но и в известной степени
прогнозировать их и биологически обосновывать мероприятия, направ-
ленные на их ликвидацию или восстановление пораженной области.
Так, изучение эволюционной динамики сердечной целомической мы-
31
шечной ткани показало принципиальное отличие ее регенераторных
механизмов от таковых соматической мышечной ткани. Естественно
поэтому, что мероприятия по восстановлению функциональной дея-
тельности сердца при инфарктах должны существенно отличаться от
мер, обеспечивающих полноценную регенерацию соматических мышц.
Биологической основой наблюдаемого при патологии глаз широ-
кого спектра метаплазий некоторых участков пигментного эпителия
сетчатки являются, по-видимому, мультифункциональный характер
дифференцировки этого эпителия и относительно низкий уровень де-
терминации дифференцировок в норме.
Приведенные примеры показывают, какое большое значение
имеет биологический анализ тканей для разработки медицинских про-
блем. Вместе с тем и наблюдаемые в патологических процессах пре-
вращения нормальных тканей дают богатый фактический материал для
характеристики свойств и потенций исследуемых гистологами нор-
мальных тканей.
В заключение необходимо подчеркнуть, что широкое распростра-
нение явлений параллелизма характерно не только для тканевого и
клеточного уровней организации живой материи. В последнее время
в сравнительной зоологии и палеонтологии накапливается все больше
фактов, свидетельствующих о широком распространении сходных, не-
зависимо возникающих признаков и на более высоких системных
уровнях организации животных.
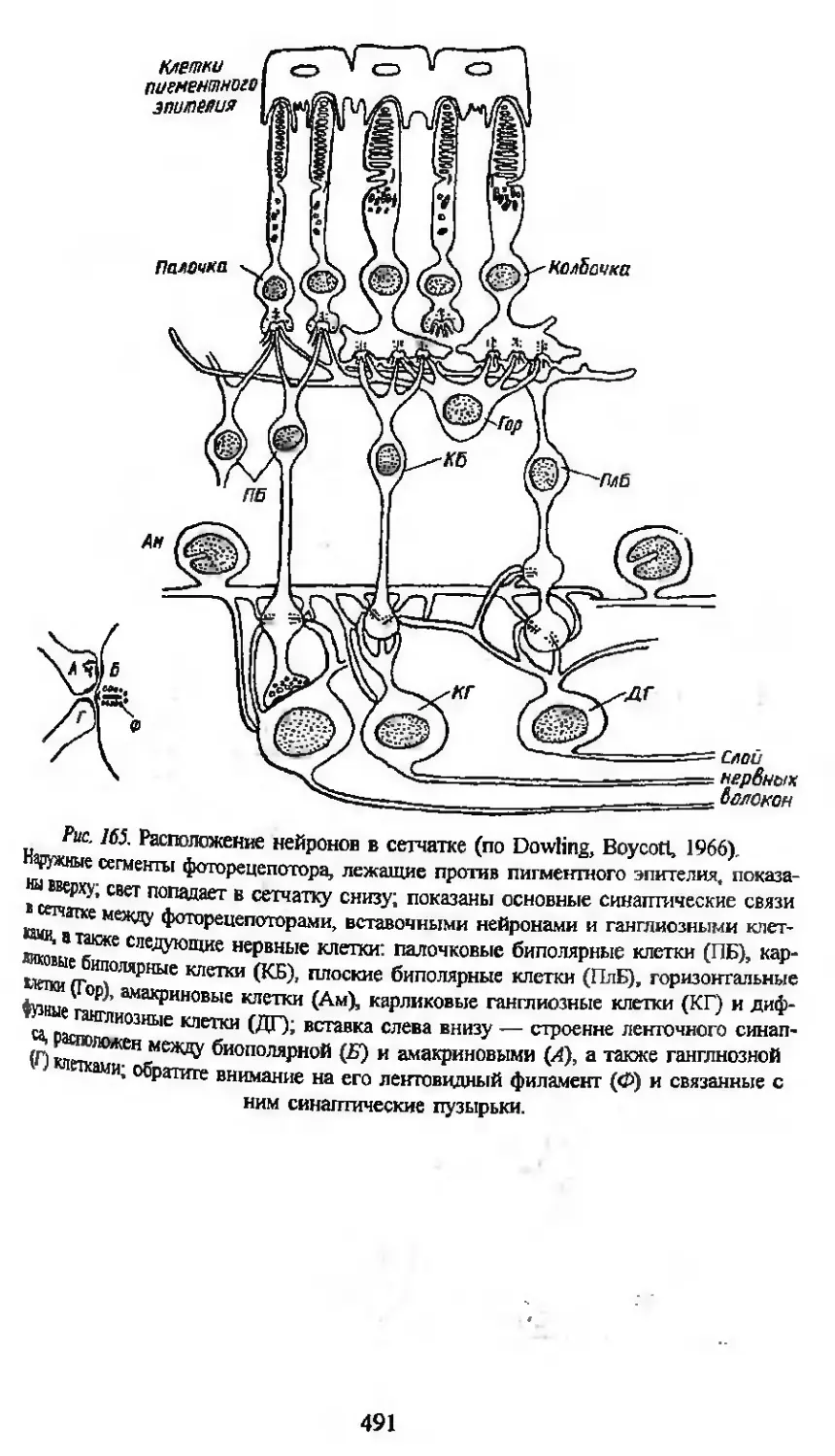
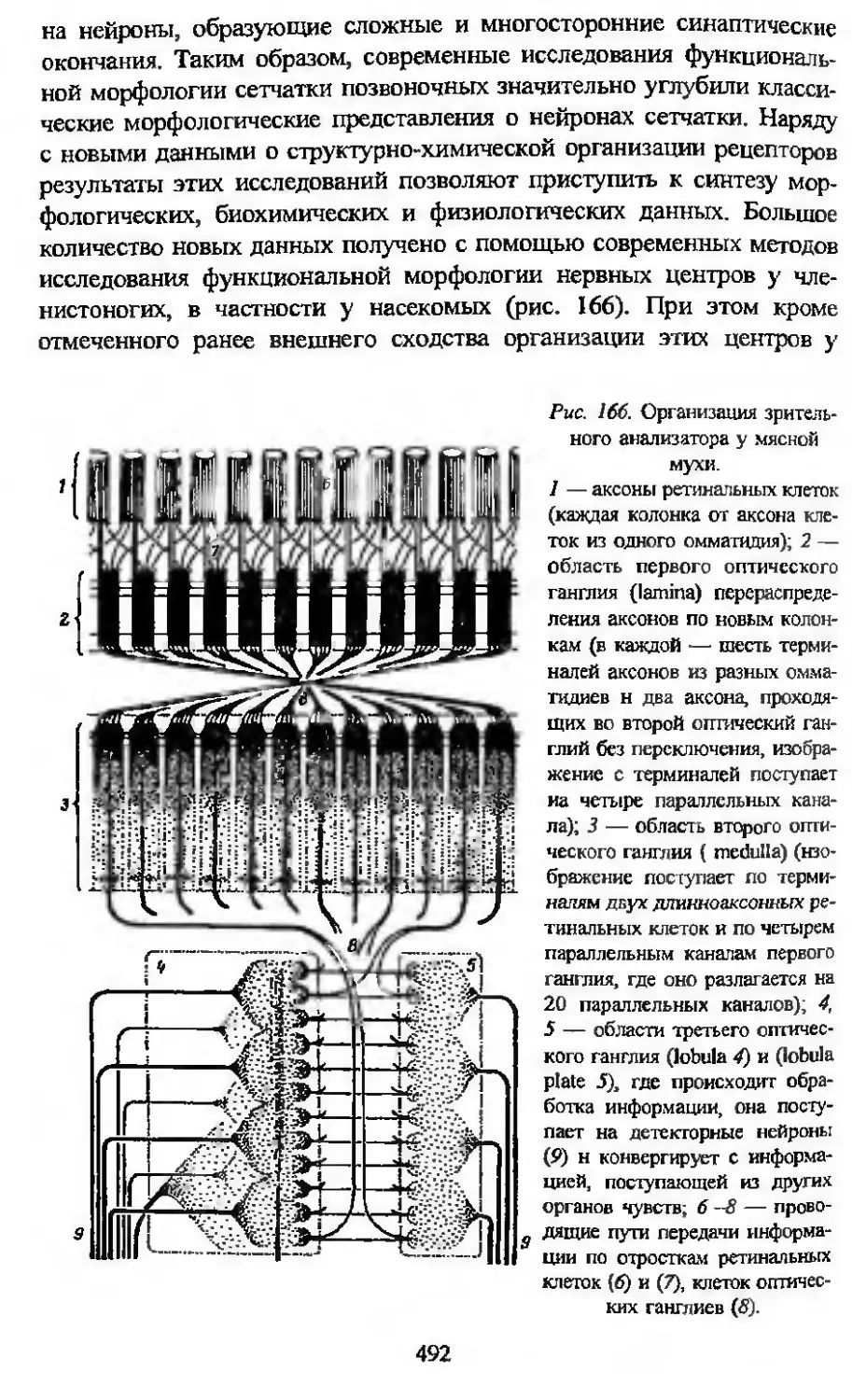
В гистологии особенно плодотворно используется сравнительный
метод для анализа интегративных систем организма и в первую оче-
редь исследования нервных центров. Общие для всех многоклеточных
принципы организации последних открывают весьма широкие пер-
спективы для исследования их функционального значения. Колоссаль-
ное количество нейронов в нервных центрах млекопитающих и чело-
века делает весьма сложной задачу выяснения тонких механизмов
структурной организации и работы этих центров. У высших первич-
норотых — головоногих моллюсков и, особенно, насекомых — име-
ется большое количество совершенных нервных центров, аналогичных
в функциональном отношении нервным центрам высших позвоночных.
Однако нервные центры у насекомых образованы значительно мень-
шим (на несколько порядков) количеством нервных клеток. Это об-
стоятельство обусловливает все возрастающее внимание нейрогисто-
логов к анализу организации этих центров у насекомых, и не столько
с целью изучения данных животных, сколько для понимания общих
принципов организации нервных центров у высших позвоночных и
человека.
32
Следовательно, сравнительный анализ приобретает роль непосред-
ственного рабочего метода для разработки весьма актуальной общей
нейрогистологической проблемы. Такое использование сравнительного
метода весьма характерно и для нейрофизиологии, особенно при вы-
яснении тонких механизмов анализаторской деятельности нервных
центров. Комплексные морфофункциональные исследования на нерв-
ных центрах насекомых и, в частности, зрительных центрах, играют
важную роль в анализе общих механизмов их работы у всех много-
клеточных животных.
Из всего сказанного следует, что современная сравнительная гис-
тология представляет собой самостоятельную науку, занимающуюся
выяснением функционального значения тканевых структур и тканей
во всем их многообразии у многоклеточных животных и человека.
Наряду с этим гистология благодаря использованию сравнительного
исторического подхода оказывается тесно связанной с зоологией и
оказывает влияние на такие бурно развивающиеся науки, как струк-
турная биохимия, общая цитология и биология развития. Кроме того,
все возрастающая роль принадлежит гистологии и в анализе актуаль-
нейших проблем медицины. При этом особенно велика роль сравни-
тельной гистологии для внедрения в разработку этих проблем истори-
ческого, эволюционного подхода. Значение последнего было показано
еще в конце прошлого века И. И. Мечниковым, а позднее нашими
гистологами, заложившими основу эволюционного подхода к анализу
тканевого уровня организации животных и человека.
ЛИТЕРАТУРА
Альберте Б., Брей Д, Льюис Дж. и др. Молекулярная биология клетки.
1987. Т. 1. С. 223. Т. 4. С. 197.
Епифанова О.И., Терских В.В. Радиоавтография. М., 1978.
Заварзин А. А. Очерки по эволюционной гистологии нервной системы:
Избр. труды. М.; Л., 1950. Т. 3.
Заварзин А. А. Очерки по эволюционной гистологии тканей внутренней
среды: Избр. труды. М.; Л., 1957.
Заварзин А. А. Труды по теории параллелизма и эволюционной динамике
тканей. Л., 1986.
Заварзин А. А. (мл.). История, состояние и перспективы разработки про-
блемы эволюционной динамики тканей И Цитология. 1983. Т. 26. № 3.
Заварзин А. А., Харазова А. Д., Молитвин М Н. Биология клетки. СПб.,
1992.
Михайлов В. П., Вахтин Ю. Б. Специфичность тканей и генетики сомати-
ческих клеток // Архив АГЭ. 1987. Т. 93. № 10.
33
Михайлов В. П., Катинас Г С. Об основных понятиях в гистологии //
Архив АГЭ. 1968. Т. 73. № 9.
Невмывака Г А. Алексей Алексеевич Заварзин. Л., 1971.
Румянцев А. В. Опыт исследования эволюции хрящевой и костной ткани
М., 1958.
Хлопин Н Г. Общебиологические и экспериментальные основы гистоло-
гии. М., 1946.
Хэм А., Кормак Д. Гистология. М., 1983. Т. 1.
Ченцов Ю. С. Общая цитология. М., 1984.
Часть 1. ЭПИТЕЛИАЛЬНЫЕ ТКАНИ
Эпителиальные ткани — разнородная по происхождению и по
функциональному значению группа тканей многоклеточных живот-
ных. Филогенетически наиболее древние разновидности эпителиаль-
ных тканей — кожные и кишечные эпителии — развиваются из раз-
ных эмбриональных зачатков (экто- и эндодермы) и у высших пред-
ставителей многоклеточных не обладают способностью к взаимным
превращениям. Кроме того, у большинства современных многоклеточ-
ных животных (как у первично-, так и у вторичноротых) имеется
особый подтип целомических эпителиальных тканей более позднего в
эволюции происхождения. У многих многоклеточных целесообразно
также выделить по структурно-функциональным признакам в отдель-
ный подтип железистые эпителии.
Многообразны функции отдельных разновидностей эпителиаль-
ных тканей. У высших животных они выполняют барьерную, всасы-
вающую, железистую, выделительную, осморегулирующую и ряд дру-
гих важных функций многоклеточного организма. Естественно, что
каждая из них требует особой специализации эпителиальных клеток
и продуцируемых ими межклеточных структур, а также особых сис-
темных закономерностей организации. В то же время для всех эпите-
лиальных тканей характерен ряд общих первичных признаков. Один
из них — структурное объединение клеток в целостные пласты или
тяжи клеточных элементов. Последние функционируют обычно как
целостные в структурном отношении системы.
Другой общий первичный признак эпителиальных тканей — по-
лярность, вытекающая из их пограничного положения в организме.
Полярность в эпителиальных тканях проявляется либо в закономерном
изменении по вертикали свойств клеток, образующих -эпителиальные
пласты (вертикальная анизоморфность многослойных эпителиев), либо
в возникновении асимметричных клеток с закономерным полярным
расположением общих и специальных органоидов и поляризованном
транспорте веществ через цитоплазму (однослойные эпителии). С по-
вышением уровня организации животных полярность в основных раз-
новидностях эпителиальных тканей (кожных, кишечных и выделитель-
ных) резко усиливается в связи с более совершенной реализацией ими
барьерной, всасывающей и реабсорбирующей функций. Однако при
погружении эпителиев во внутреннюю среду организма (эндокринные
железы, печень) свойство полярности может в большей или меньшей
степени утрачиваться.
35
ГЛАВА 1. Кишечные эпителии
Кишечные эпителии — одна из наиболее древних пограничных
тканей. Специализация основных клеток этой ткани шла в направлении
совершенствования механизмов либо трансмембранного транспорта
относительно простых соединений, образующихся в полости кишки,
либо транспорта в мембранной упаковке с последующим уже внутри-
клеточным расщеплением пищевых комочков при помощи лизосомаль-
ных ферментов. По первому пути специализация пошла у большинства
многоклеточных животных. В процессе совершенствования механиз-
мов трансмембранного транспорта развивалось и совершенствовалось
полостное пищеварение. В развитии по второму пути доминировало
так называемое внутриклеточное пищеварение. Необходимой предпо-
сылкой развития полостного пищеварения является формирование же-
лезистого аппарата либо непосредственно в составе эпителия, либо в
виде специальных желез по ходу пищеварительного тракта.
Предварительная сортировка и обработка пищи необходима и у
животных с внутриклеточным пищеварением, поэтому у многих мол-
люсков развиты сложный сортировочный и железистый аппараты. У
высших животных в пищеварительной системе имеются органы, обес-
печивающие детоксикацию и первичную обработку поглощенных ки-
шечным эпителием соединений. У позвоночных животных таким ор-
ганом является печень. Интересно, что у беспозвоночных животных
развиваются подобные же органы. Так, хорошо развитая печень как
орган первичной обработки поглощенных соединений имеется у голо-
воногих моллюсков.
Все вспомогательные дифференцировки мы лишь весьма кратко
рассматриваем в заключительном разделе настоящей главы. Основное
внимание уделяется сравнительной характеристике самого кишечного
эпителия, обеспечивающего поступление в организм необходимых ему
веществ.
§1 . КИШЕЧНЫЕ ЭПИТЕЛИИ позвоночных животных
Млекопитающие. Кишечный всасывающий эпителий млекопита-
ющих типичный однослойный цилиндрический эпителий с резко
выраженной полярностью образующих его клеточных элементов. Диф-
ференцированные, активно функционирующие клетки составляют эпи-
телиальный пласт, покрывающий наружную поверхность ворсинок —
основных структурных единиц слизистой оболочки тонкой кишки
(рис. 4, А). Оии представляют собой микроорганные структуры с соб-
ственными нервным, мышечным и сосудистым аппаратами. Слущива-
36
37
72
б
38
ние закончивших жизненный цикл дифференцированных клеток про-
исходит на вершине ворсинок. Постоянство клеточного состава эпи-
телиального пласта обеспечивается интенсивным делением камбиаль-
ных клеток крипт — пальцевидных впячиваний эпителия в слизистую
оболочку (5). Клетки эпителия крипт отличаются от дифференциро-
ванных меньшими размерами, большей базофилией цитоплазмы, от-
сутствием или слабым развитием морфологических признаков специ-
фической дифференцировки.
Морфологическим и цитохимическим различиям между камбиаль-
ными и дифференцированными клетками соответствуют и неодинако-
вые интенсивность и характер метаболических процессов. Они осо-
бенно отчетливо выявляются на автографах слизистой оболочки кишки
лабораторных грызунов в опытах с предшественниками синтеза белка
или РНК. На ранних сроках после инъекции меченых аминокислот
интенсивность их включения в белки клеток системы крипта-ворсинка
отчетливо преобладает в камбиальных клетках крипт по сравнению с
функционирующими клетками эпителия ворсинок. Интенсивность син-
теза белка в последних постепенно уменьшается от основания ворси-
нок к их вершинам. В опытах с предшественником синтеза РНК
[3Н]уридином включение его во вновь синтезируемую РНК происхо-
дит только в клетках крипт. Таким образом, результаты опытов пока-
зывают, что специфическая цитодифференциация в кишечном эпите-
лии приводит не только к полному блокированию автосинтетических
процессов и репродукции клеток, но и прекращению в дифференци-
рованных клетках считывания информации с ДНК ядерного аппарата,
т. е. блокирует транскрипцию. Необходимый для функционирования
клеток белковый синтез протекает с использованием различных типов
РНК, синтезированных в период деления клеток.
Следовательно, кишечный эпителий представляет собой сложную
гетерогенную систему. Однослойный эпителиальный пласт состоит из
Рис. 4. Строение слизистой оболочки (Я) и всасывающей клетки (£’)
тонкой кишки млекопитающих.
1 — ворсинки, 2 — эпителий, 3 — крипта, 4 — соединительная ткань, 5 — крове-
носный сосуд, 6 — мышечный слой слизистой оболочки, 7 — микроворсинки,
8 — цитоскелет микроворсинки, 9 — межклеточный соединительный комплекс
(зоны слияния и прилежания, десмосома), 10 — надмембранный комплекс,
II — аппарат Гольджи, 12 — капля жира, 13 — шероховатая ЭПС, 14 — гладкая
ЭПС, 15 — базальная мембрана; стрелками слева показаны направления процессов
всасывания и выведения жира, а также возможные пути его внутриклеточного транс-
порта, справа — локализация синтеза и пути внутриклеточного транспорта структур
для обновления поверхностного аппарата микроворсинок.
39
различающихся по своим свойствам и значению субпопуляций клеток
камбиальных, малодифференцированных, дифференцированных и за-
канчивающих жизненный цикл. Эти клеточные субпопуляции распре-
делены на боковых поверхностях крипт и ворсинок и на апикальных
концах последних. Несмотря на различия в метаболической активности
и топографическом положении все клетки представляют собой единую
систему, образованную клетками, находящимися на последовательных
этапах жизненного цикла. Темпы их размножения, длительность су-
ществования и интенсивность гибели строго координированы.
Основными дифференцированными клетками кишечного эпителия
в количественном (88% в тонкой кишке) и функциональном отноше-
нии являются всасывающие призматические клетки (рис. 4, Б). Они
относятся к так называемым асимметричным клеткам, особенностью
которых является ярко выраженная полярность, проявляющаяся в
структурных и функциональных различиях апикальных и базальных
частей клеток. Апикальная цитоплазма и плазматическая мембрана
образуют микроворсинки — относительно крупные образования (у
млекопитающих длиной 1,4 мкм и шириной 0,08 мкм), занимающие
всю обращенную в просвет кишки поверхность клетки. Снаружи каж-
дая микроворсинка имеет плазматическую мембрану, поэтому общая
всасывающая поверхность эпителиального пласта оказывается весьма
обширной (7).
В микроворсинках отчетливо проявляются продольные фибрил-
лярные актиновые структуры. В основании микроворсинок они пере-
ходят в фибриллярный слой, расположенный параллельно апикальной
поверхности клеток и содержащий помимо актиновых миозиновые
промежуточные и спектриновые (фодриновые) фибриллярные струк-
туры. Одно из свойств микроворсинок — способность их в результате
медленного сокращения и расслабления к изменению площади всасы-
вающей поверхности клеток и расстояния между соседними микро-
ворсинками. Весьма важной в функциональном отношении их струк-
турой является развитый мукополисахаридный надмембранный ком-
плекс (10), одевающий каждую микроворсинку. Он выделяется всасы-
вающими клетками. Интенсивное обновление надмембранного ком-
плекса было продемонстрировано методом электронной радиоавтогра-
фии с использованием [3Н]глюкозы (рис. 4, Б, стрелки справа).
Основная функция микроворсинок — обеспечение транспорта ве-
ществ из полости кишки в клетку. Плазматическая мембрана микро-
ворсинок обладает способностью к поляризованному одностороннему
активному и пассивному трансмембранному транспорту. Кроме того,
на поверхности микроворсинок располагаются ферменты, осущест-
40
вляющие гидролитическое расщепление сложных макромолекул, не
разрушенных до конца ферментами в полости кишки. Этот вспомога-
тельный механизм получил название пристеночного пищеварения. В
его работе участвуют мукополисахариды надмембранного комплекса
микроворсинок. Они образуют между соседними микроворсинками
сложную сеть, которая не пропускает крупные частицы пищи, а также
бактерии. Кроме того, она играет роль решетки, в которую могут
встраиваться ферменты из полости кишки. Эти ферменты вместе с
ферментами, синтезируемыми всасывающими клетками и встроенны-
ми в их мембрану, осуществляют заключительные этапы гидролиза
проходящих через ячейки сети молекул. Через базолатеральную по-
верхность клеток вещества выводятся из клетки. Это определяется
ориентировкой ионных насосов, противоположной той, которая харак-
терна для плазматической мембраны апикальной поверхности всасы-
вающей клетки. Перемещению и смешиванию ионных насосов апи-
кальной мембраны с насосами базолатеральной препятствуют особые
разновидности межклеточных контактов — так называемые зоны сли-
яния.
Ядра всасывающих клеток не обнаруживают признаков активного
синтеза РНК. Тем не менее эти клетки в течение всего жизненного
цикла синтезируют белки, мукополисахариды и ряд других соедине-
ний. Для всасывающих клеток характерно строго поляризованное рас-
положение органоидов, в частности аппарата Гольджи (рис. 4, Б, 11).
Последний находится всегда над ядром и представлен хорошо разви-
тыми цистернами с мелкими и крупными вакуолями. Многочисленные
митохондрии также обнаруживаются преимущественно в апикальной
части клетки. Всасывающие клетки обладают развитыми системами
гладкой и шероховатой эндоплазматичекой сети (ЭПС), функциональ-
ное единство которых отчетливо выявляется при всасывании жиров
(рис. 4, Б, 12, стрелки слева). Благодаря осмиофильным свойствам
последних удается проследить процессы их перемещения в клеточных
структурах. Оказалось, что основная масса жировых включений попа-
дает в полости шероховатой ЭПС, а также в цистерны аппарата Гольд-
жи. Проникновение жиров в каналы эндоплазматической сети всасы-
вающих клеток представляет собой активный многоэтапный процесс.
На первом его этапе происходит расщепление жиров до низкомолеку-
лярных продуктов ферментами, находящимися в надмембранном ком-
плексе и в плазматической мембране всасывающих клеток, после чего
низкомолекулярные соединения проходят через плазматическую мем-
брану. Далее в каналах ЭПС осуществляется ресинтез жиров. К ним
присоединяются липопротеины, и весь этот комплекс транспортирует-
41
ся к боковой поверхности всасывающих клеток, где жировые капли
выводятся в межклеточное пространство, ограниченное от полости
кишки особыми изолирующими контактами, расположенными в апи-
кальных частях клеток. Эти контакты препятствуют также перемеще-
нию ионных насосов из апикальной части плазматической мембраны
в базолатеральную, обеспечивая сохранение асимметричной дифферен-
цировки этих мембран.
Аминокислоты и углеводы проникают в клетки и выводятся из
них с помощью механизмов активного транспорта, т. е. с использова-
нием энергии АТФ. Высказано экспериментально обоснованное пред-
положение, что аминокислоты и углеводы, как и жиры, поступают в
каналы ЭПС и выводятся в межклеточное пространство. Одна всасы-
вающая клетка млекопитающих снабжает питательными веществами
около 100 000 клеток. При этом себя эти клетки обеспечивают пита-
тельными веществами не из потока всасываемых веществ, а из ткане-
вой жидкости.
Своеобразную структуру имеют всасывающие клетки новорож-
денных млекопитающих. В апикальной части клетки формируется по-
стоянный пиноцитозный комплекс. Он состоит из ограниченных мем-
браной и связанных с наружной средой системы канальцев и пузырь-
ков, а также крупной вакуоли. Эти клетки поглощают целые белковые
молекулы, в частности иммуноглобулины, которые, не гидролизуясь,
попадают в кровь. Они необходимы для обеспечения пассивной им-
мунизации новорожденных животных до развития у них собственной
системы иммунитета. Поступление молекул иммуноглобулинов в клет-
ку и обеспечение их сохранности при внутриклеточной транспорти-
ровке осуществляются с помощью так называемого опосредованного
рецепторами эндоцитоза. При этом поглощаемые клеткой молекулы
связываются со специфическими рецепторами плазматической мембра-
ны клетки. На месте задействованных рецепторов мембрана образует
опушенные специальными белками пузырьки — эндосомы, поступаю-
щие в особый распределительный органоид клетки. Отсюда поглощен-
ные вещества либо направляются в лизосомы, либо транспортируются
через клетку в неизменном состоянии.
Помимо основных всасывающих клеток в кишечном эпителии
млекопитающих имеются железистые элементы. Наиболее многочис-
ленные из них — слизистые бокаловидные клетки (рис. 5, 8). Это
одноклеточные железы, общее количество которых в тонкой кишке не
превышает 4,9%. Подробное их описание дано в гл. 3.
Второй тип секреторных образований — панетовские железистые
клетки (2). Они расположены на дне крипт, по нескольку клеток на
42
Рис. 5. Организация процессов репродукции и дифференцировки клеток в кишечном
эпителии млекопитающих:
I — стволовая мультипотентная клета, 2-5 — полустволовые и 6-9 — дифференци-
рованные клетки (2 и 6 — энтерохромаффинные, 3 и 7 — всасывающие, 4 и 8
бокаловидные, 5 и 9 — панеговские); пунктирными линиями обведены клетки, нахо-
дящиеся в митотическом цикле; стрелками показано направление клеточных диффе-
ренцировок; локализация и количество каждого типа клеток представлены в виде
черных клеток на каждой схеме крипты ворсинки (1-9).
43
каждую крипту, имеют конусовидную форму. Вся апикальная часть
клеток занята гранулами белкового секрета. Синтез его происходит на
рибосомах шероховатой эндоплазматической сети, занимающей всю
базальную часть клеток. Белковый секрет уже через 30-40 мин пере-
мещается в мелкие пузырьки хорошо развитого аппарата Гольджи,
расположенного в надъядерной области. Здесь образуются более круп-
ные конденсационные вакуоли и секреторные гранулы. Последние
смещаются к апикальной поверхности клеток, где их содержимое вы-
водится наружу. Весь секреторный цикл занимает около 1,5-2 ч.
Имеются данные о том, что панетовские клетки играют сущест-
венную роль в регуляции состава бактериальной флоры кишечника.
Они синтезируют и выделяют антибактериальный фактор лизоцим. В
их цитоплазме обнаружены микроорганизмы на ранних стадиях дег-
радации. На долю панетовских клеток в переднем отделе тонкой кишки
приходится 7,5% от общего числа клеток.
Третьим типом секреторных элементов в кишечном эпителии мле-
копитающих являются энтерохромаффинные клетки (рис. 5, б), кото-
рые также небольшими группами расположены на боковой поверхнос-
ти крипт среди основной массы камбиальных клеток. Секреторные
гранулы локализуются у базальных, граничащих с соединительной
тканью поверхностей клеток. Показано, что энтерохромаффинные
клетки выделяют в кровь серотонины и являются, следовательно, ти-
пичными железами внутренней секреции. Однако энтерохромаффин-
ные клетки, по-видимому, неоднородны. Помимо клеток, выделяющих
серотонин, существуют клетки, синтезирующие кишечные гормоны;
секретин и холецистокинин, а также соматостатин и эндорфин. Свой
жизненный цикл эти клетки заканчивают на вершине ворсинок, т. е.
они, как бокаловидные и всасывающие клетки, перемещаются от ос-
нования к вершине ворсинки. Количество их невелико — около 0,6%.
Более подробная их характеристика дана в гл. 3.
В кишечном эпителии в области лимфоидных скоплений (пейе-
ровых бляшек), помимо обычных клеток, имеется много особых М-
клеток; они лишены микроворсинок и обладают большей, чем обычные
клетки способностью поглощать из просвета кишки различные веще-
ства путем пиноцитоза и транспортировать их в район складок базаль-
ной мембраны, где обычно находятся лимфоидные клетки.
Для выяснения системных закономерностей организации кишеч-
ного эпителия позвоночных особое значение имеет детальная харак-
теристика процессов репродукции камбиальных клеток и физиологи-
ческой регенерации в эпителиальном пласте.
44
Методом радиоавтографии с использованием [ЗН]тимидина пока-
зано, что время полного обновления эпителиальной выстилки ворсинок
у мышевидных грызунов в среднем составляет около 48 ч. Удалось
выяснить также генерационное время у большинства пролиферирую-
щих клеток — порядка 12-15 ч.
Объективные количественные критерии, характеризующие интен-
сивность клеточной репродукции и физиологической регенерации в
кишечном эпителии, позволяют проводить уже не только качествен-
ные, но и строгие количественные сопоставления при анализе станов-
ления этой системы в онтогенезе, ее изменений при патологических
условиях и при сравнительно-гистологических исследованиях.
Используя такие критерии, удалось, в частности, показать, что
становление системы кишечного эпителия в онтогенезе происходит
при относительно постоянной скорости репродукции клеток. Абсолют-
ный прирост количества дифференцированных и камбиальных клеток
обеспечивается в результате резкого увеличения (в 3—4 раза) продол-
жительности жизни дифференцированных клеток, т. е. путем сниже-
ния интенсивности физиологической регенерации.
У взрослых животных обнаружена особая субпопуляция клеток,
характеризующихся меньшей скоростью репродукции по сравнению с
основной массой камбиальных клеток. Это, по-видимому, стволовые
клетки общей камбиальной системы, которые способны к дифферен-
цировке в четырех различных направлениях (всасывающие, бокало-
видные, панетовские и хромаффинные) (/). Ранние этапы дифферен-
цировки происходят в криптах (3, 4, Р). Вступившие на путь специа-
лизации клетки сохраняют еще некоторое время способность к деле-
нию и составляют субпопуляции так называемых полустволовых кле-
ток. Позже (у всасывающих, бокаловидных и хромаффинных клеток
при выходе на ворсинку, а у панетовских при накоплении в клетках
секреторных продуктов) способность клеток к синтезу ДНК и делению
утрачивается полностью. Соотношения процессов репродукции и диф-
ференцировки показаны на рис. 5.
Низшие позвоночные. У большинства представителей процве-
тающей группы костистых рыб всасывающие клетки кишечного эпи-
телия имеют хорошо развитый аппарат микроворсинок. В его ультра-
структурной организации не удается пока выявить существенных осо-
бенностей по сравнению с аппаратом микроворсинок высших позво-
ночных животных. Подобного рода сложная дифференцировка всасы-
вающих клеток характерна и для кишечных эпителиев рептилий и
амфибий. У некоторых рыб в среднем отделе кишечника обнаружены
всасывающие клетки с пиноцитозными каналами и большой вакуолью,
45
аналогичные в функциональном отношении всасывающим клеткам но-
ворожденных млекопитающих. Широко распространены у низших по-
звоночных бокаловидные клетки, строение, химические свойства и
функциональное значение которых сходны с бокаловидными клетками
высших позвоночных животных.
Следовательно, высокий уровень морфобиохимической дифферен-
цировки всасывающих и железистых клеточных элементов характерен
для кишечных эпителиев изученных представителей всех классов по-
звоночных животных.
В отношении топографического разграничения камбиальных и
специализированных клеток наиболее изучен кишечный эпителий двух
представителей амфибий — лягушки и аксолотля — и нескольких
видов костистых рыб (рис. 6, А-В).
У травяной лягушки в опытах с длительным насыщением [^ти-
мидином (в течение 8 сут) удалось выявить отчетливые различия меж-
ду количеством синтезирующих ДНК клеток в эпителии основания
кишечной складки и на ее вершине. К концу опыта в основании
кишечной складки больше половины клеток уже содержало меченые
ядра. Количество их постепенно нарастало в течении всего срока
ежедневных инъекций [3Н]тимидина. На вершине складки число кле-
ток с мечеными ядрами достигало к четвертым суткам после начала
опыта 20% и дальше уже практически не увеличивалось. Выравнива-
ние количества меченых ядер на вершине и в основании складок
происходило лишь через 24 дня после введения [3Н]тимидина.
Особенностью организации обновляющейся системы кишечного
эпителия лягушки является отсутствие хотя бы у части дифференци-
рованных клеток на вершине кишечной складки антагонистических
отношений между делением и дифференцировкой (рис. 6, Б). Вторая
особенность — крайне медленное его обновление. Репродуцирующие-
ся в основании кишечной складки клетки достигают ее вершины лишь
через 20-25 сут. Отсутствует у бесхвостых амфибий, по-видимому и
точно локализованный участок гибели клеток. В некоторых складках
гибель клеток может происходить не только на вершине, но и на
боковых поверхностях.
Кишечный эпителий бесхвостых амфибий претерпевает сущест-
венные сезонные изменения. Описанные выше отношения характерны
для «летних» и «осенних» лягушек. К весеннему пробуждению лягу-
шек высота складок слизистой оболочки уменьшается, а в эпителии
отчетливее, чем у «летних» лягушек, выявляются скопления менее
дифференцированных клеток.
Изучение в опытах с [3Н]тимидином кишечного эпителия аксо-
лотля представителя хвостатых амфибий — позволило выявить чет-
46
кое топографическое разграничение между камбиальными пролифери-
рующими, вступившими на путь дифференцировки и специализиро-
ванными клетками. Последние образуют эпителиальный пласт клеток,
не способных к синтезу ДНК и делению (рис. 6, А, 2). Камбиальные
пролиферирующие клетки располагаются в толще соединительной тка-
ни, в так называемых регенерационных гнездах (/), сосредоточенных
преимущественно в нижней части кишечной складки. Клетки с мече-
ными ядрами, вступающие на путь дифференцировки появляются в
составе эпителиального пласта лишь на восьмые сутки после начала
многократных введений [3Н]тимидина. Полное обновление всех диф-
ференцированных клеток происходит через 60-90 дней.
Таким образом, у хвостатых и бесхвостых амфибий при низкой
скорости физиологической регенерации кишечного эпителия имеются
существенные особенности в организации дифференцированной и кам-
биальной частей тканевой системы. При этом организация кишечного
эпителия аксолотля более сходна с таковой у млекопитающих, чем у
представителей более высокоорганизованных бесхвостых амфибий —
летних лягушек.
Рис. 6. Рисунки с микрофотографий кишечного эпителия аксо-
лотля (Я), травяной лягушки (5) и беломорской наваги (В).
I — регенерационные гнезда (Я) или участки малодифференци-
рованных камбиальных клеток (В), 2 — всасывающие клетки,
3 — соединительная ткань с сосудами, 4 — митозы; стрелками
показано направление смешения клеток в процессе физиологи-
ческой регенерации.
47
Анализ процессов репродукции и физиологической регенерации
методом тимидиновой радиоавтографии у некоторых костистых рыб
например вьюна — представителя весьма своеобразной по образу жю’
ни и морфологическим особенностям группы костистых рыб, свиде-
тельствует о том, что в его кишечном эпителии относительно слабо
выражена топографическая и морфологическая дифференциация про-
лиферирующих клеток. Тем не менее в кишечном эпителии вьюна (как
и бесхвостых амфибий) удается выявить зоны преимущественной реп-
родукции клеток. Они расположены обычно в основании складок и в
области формирования дополнительных складок на боковой поверх-
ности основных.
Степень выраженности топографического обособления камбиаль-
ных зон закономерно изменяется в разные сезоны года. У беломорской
наваги, трески и, по-видимому, у многих других костистых рыб в
кишечном эпителии топографически резко выделяются субпопуляции
камбиальных клеток, вполне аналогичные эпителию крипт млекопи-
тающих. У наваги митотический индекс в таких структурах может
достигать 5%, и примерно половина клеток содержит меченые ядра в
опытах с однократным введением [3Н]тимидина. Пролиферирующие
клетки характеризуются интенсивным синтезом РНК, меньшими раз-
мерами и высоким ядерно-плазменным отношением (рис. 6, В). Ана-
логичные показатели пролиферативной активности характерны для
эпителия крипт млекопитающих. Четкая топографическая дифферен-
цировка камбиальных клеток в виде их скоплений в составе эпители-
ального пласта, преимущественно в основании складок, наблюдается
в кишечном эпителии молоди осетра и у беломорских и дальневос-
точных бычков.
§2 . КИШЕЧНЫЕ ЭПИТЕЛИИ ПОЛУХОРДОВЫХ, НАСЕКОМЫХ,
МОЛЛЮСКОВ И ПОЛИХЕТ
Оболочники. Относительно хорошо изучен на ультраструктурном
уровне и методом тимидиновой радиоавтографии кишечный эпителии
асцидий. Эти сидячие организмы — вторичноизмененные низшие хор-
довые — имеют довольно сложный пищеварительный тракт. Его сред-
ние отделы дифференцированы на среднюю кишку и желудок. Пос-
ледний у видов асцидий, лишенных пищеварительных желез, имеет
сложный рельеф слизистой оболочки, образующей складки различных
размеров и формы.
У асцидий, в желудок которых открывается пищеварительная же-
леза (разветвленное впячивание кишечного эпителия в стенку желуд-
ка), слизистая оболочка имеет менее сложное строение. Пищеварение
и значительная часть процессов всасывания осуществляются в желуд-
ке. В тонкой кишке происходит всасывание и формирование каловых
масс. Клеточный состав эпителия, выстилающего желудок, пищева-
рительную железу и кишку, довольно сложен. Здесь можно выде-
лить пять типов дифференцированных клеток: пищеварительно-вса-
сывающие, белково-железистые, осморегулирующие и эндокринные
(рис. 7, а-е).
Наиболее многочисленные пищеварительно-всасывающие клетки
(рис. 7, а, б) сходны по принципу организации со всасывающими
клетками кишечного эпителия новорожденных млекопитающих. На их
апикальной поверхности хорошо развит аппарат микроворсинок, ор-
ганоиды поляризованы, в цитоплазме много мембранных структур.
Особенностью клеток является наличие в них пиноцитозных каналов,
мелких пузырьков и большой вакуоли в надъядерной области. Име-
ются экспериментальные данные о способности пищеварительно-вса-
сывающих клеток поглощать белковые макромолекулы путем «струк-
турированного» пиноцитоза (пиноцитоза, обусловленного рецептора-
ми).
Слизисто-ресничные клетки осуществляют синтез и выделение
мукопротеидного секрета и обеспечивают перемещение слизи реснич-
ным аппаратом в каудальном направлении. Белковые железистые клет-
ки имеют хорошо развитую шероховатую ЭПС и синтезируют гидро-
литические ферменты, необходимые для полостного пищеварения
(рис. 7, г). У видов асцидий, лишенных пищеварительных желез, они
находятся в эпителии желудка. Осморегулирующие клетки характе-
ризуются наличием глубоких впячиваний базальной плазматической
мембраны и обилием митохондрий между ними (рис. 7, д'). Наконец,
эндокринные железистые клетки содержат гранулы в базальной части,
а их апикальная часть доходит до поверхности эпителия и может
контактировать с пищей (клетки открытого типа диффузной эндокрин-
ной системы).
В эпителии кишки камбиальные клетки располагаются в зоне
желобка, идущего вдоль всей кишки. Методом радиоавтографии с
[3Н]тимидином показано, что клетки с мечеными ядрами из области
желобка смещаются в обе стороны навстречу друг другу. Полное
обновление эпителия занимает в летние месяцы около 30 дней.
Более сложны процессы клеточной репродукции в эпителии же-
лудка. Синтезирующие ДНК клетки и митозы в эпителии желудка
асцидий, обладающих пищеварительной железой, не образуют особых
камбиальных зон. В пищеварительной железе этих асцидий выделя-
ются две камбиальные зоны: первая — в концевых дистальных участ-
ках железы, вторая — в проксимальном участке, вблизи сообщения
железы с полостью желудка. Обновление эпителия железы происходит
49
в результате перемещения клеток из обеих зон навстречу друг другу
и занимает около 1,5 мес. В эпителии желудка асцидий, лишенных
пищеварительной железы, в основании складок выделяются отчетли-
вые камбиальные зоны.
Наиболее сложно организованы процессы обновления в эпителии
крупных продольных складок слизистой оболочки желудка. Помимо
зоны камбиальных клеток в базальной части складки имеется допол-
нительная камбиальная зона в основании вершины складки (рис. 7,
ж). Обновление клеток происходит из обеих зон в дистальном направ-
лении, т. е. за счет базальной камбиальной зоны обновляется боковая
поверхность складки, а за счет клеток дистальной зоны — эпителий
ее верхушки, образованный особыми реснично-слизистыми клетками
(стрелки на рис. 7). Время полного обновления эпителия складок —
около 25 сут.
Членистоногие. Среди животных этого типа наибольшее разно-
образие по характеру питания и используемой пищи наблюдается у
насекомых. Для них характерно большое анатомическое разнообразие
органов пищеварительной системы, в первую очередь ротового аппа-
рата и переднего отдела кишечника. Не однороден по строению так
же и центральный отдел пищеварительной системы — средняя кишка,
что выражается в разнообразии микроанатомической организации и
морфологической дифференцировки кишечного эпителия и его основ-
ных клеточных элементов.
Хорошо развитый аппарат микроворсинок всасывающих клеток
кишечного эпителия многих насекомых по функциональному значе-
нию и приципу организации аналогичен аппарату микроворсинок дру-
гих высших многоклеточных животных. В противоположность отно-
сительному однообразию строения аппарата микроворсинок в кишеч-
ном эпителии большинства позвоночных животных у насекомых, да-
же у сравнительно немногочисленных изученных к настоящему вре-
мени представителей, наблюдается сильное варьирование по размерам
и количеству специфических структур, приходящихся на клетку.
Несмотря на принципиально сходный характер организации апи-
кальных частей всасывающих клеток у насекомых с аналогичными
структурами кишечного эпителия позвоночных животных, между ними
имеется ряд глубоких различий. Если у позвоночных в процессе вса-
сывания происходит активный транспорт сахаров и аминокислот (про-
тив градиента их концентрации), то у насекомых осуществляется пас-
сивный транспорт веществ через плазматическую мембрану. Повышен-
ная концентрация веществ в полости кишки возникает в результате
ыстрого всасывания воды. Пассивный транспорт сахаров через мем-
50
Рис. 7. Ультраструктура различных типов дифференцированных клеток и организа-
ция больших складок в эпителии желудка асцидий.
а, б два типа пшцеварительно-всасывающих клеток с постоянными пиноцигозны-
ми комплексами в апикальной части клеток, в, г, е — железистые клетки (в — сли-
зистая, г — белковая, е — эндокринная), д — осморегулирующая клетка,
ж схема физиологической регенерации в складках желудка: 1 — базальная,
2 апикальная камбиальные зоны; стрелками показано направление перемещения
дифференцированных клеток.
51
браиу облегчается благодаря превращению их в клетке в соединения
не содержащиеся в полости кишки.
Для эпителия многих насекомых характерна мультифункциональ-
ная морфобиохимическая дифференциация всасывающих клеток. Так
у кровососущих насекомых, помимо всасывания низкомолекулярных
продуктов, образующихся при расщеплении белков форменных эле-
ментов и плазмы крови, всасывающие клетки осуществляют и интен-
сивный синтез белка — у них хорошо развитая шероховатая ЭПС
аппарат Гольджи, много митохондрий (рис. 8). В апикальных частях
клеток накапливается большое количество секреторных гранул, содер-
Рис. 8. Ультраструкгурная
организация железисто-вса-
сывающей клетки в кишеч-
ном эпителии кровососуще-
го насекомого.
1 — микроворсинки, 2 —
надмембранный комплекс,
3 — апикальные пузырьки,
4 — остаточное тело, 5 •—
аппарат Гольджи, б — ше-
роховатая ЭПС, 7 — мито-
хондрии, 8 — складка плаз-
матической мембраны.
52
жимое которых выделяется в просвет кишки, поставляя основные пи-
щеварительные ферменты в полость пищеварения. Таким образом, у
насекомых специфическая секреторная и всасывающая функции могут
осуществляться одними и теми же клеточными элементами. Наряду с
этим в кишечном эпителии чешуекрылых среди обычных всасываю-
щих клеток наблюдаются многочисленные бокаловидные клетки, вы-
деляющие слизь. Разнообразные железистые элементы имеются в ки-
шечном эпителии медоносной пчелы. Специфической структурой для
кишечного эпителия членистоногих является так называемая перитро-
фическая мембрана. Она представляет собой внеклеточное образование
в виде пластинки, расположенной на поверхности эпителиальных кле-
ток и изолирующей их от непосредственного контакта с пищевыми
частицами.
Функциональное значение перитрофической мембраны в какой-то
мере аналогично роли слоя секрета бокаловидных клеток позвоночных
животных. Она может служить для защиты микроворсинок всасыва-
ющих клеток от механического повреждения кусочками непереварен-
ной пищи. Перитрофическая мембрана отсутствует у некоторых видов
насекомых, питающихся жидкой пищей или имеющих хорошо разви-
тые бокаловидные клетки, Однако ее наличие у кровососущих насе-
комых свидетельствует и о возможном участии мембраны в процессах
транспорта гидролитических ферментов и низкомолекулярных продук-
тов гидролиза пищи. Перитрофические мембраны состоят из белка и
хитина и образуются либо всеми клетками эпителия средней кишки,
либо особыми клетками в области перехода переднего отдела кишеч-
ника в средний. В последнем случае образование структуры идет по
типу сложной апокриновой секреции (рис. 9).
При апокриновой секреции участки цитоплазмы клеток, отделяю-
щиеся вместе с секреторными гранулами, длительное время сохраня-
ются в составе перитрофической мембраны и играют важную роль в
процессах ее достройки и окончательного оформления, протекающих
за пределами клеток, образующих мембрану. При формировании пе-
ритрофической мембраны клетками эпителия средней кишки в ней
могут быть локализованы гидролитические пищеварительные фермен-
ты, по-видимому выделяемые клетками лишь при поступлении пищи
в полость кишки. Структура перитрофической мембраны варьирует в
широких пределах у разных видов насекомых. Она может быть пред-
ставлена тонкой однородной пластинкой или иметь сложную трехслой-
ную структуру. В последнем случае образование каждого слоя проис-
ходит благодаря интенсивной деятельности специфически дифферен-
цированных клеток переходного (от переднего к среднему) отдела
кишки.
53
2
1 5
Рис. 9. Один из сопосбов образования перитрофической мембраны у насекомых.
I — клетка кишечного эпителия, 2 — перигрофическая мембрана, 3 — секреторная
гранула, 4 — гликоген, 5 •— базальная мембрана.
Многообразию морфобиохимической дифференцировки клеток
кишечного эпителия у насекомых соответствует и многообразие орга-
низации этой тканевой системы. Так, у двукрылых кишечный эпителий
представляет собой растущую клеточную популяцию, образованную
однородными всасывающими клетками с весьма продолжительным
клеточным циклом. У прямокрылых же кишечный эпителий — типич-
ная обновляющаяся популяция с четким топографическим разделением
дифференцированных и камбиальных клеток (рис. 10, А). Последние
образуют скопления — «узелки» или гнезда, закономерно чередую-
щиеся с участками, где располагаются высокопризматические диффе-
ренцированные всасывающие клетки (2). Такие отношения наблюда-
ются, например, в строении кишечного эпителия саранчи или сверчка.
Имеются данные о том, что в кишечном эпителии саранчи полное
обновление его клеточного состава в активный период жизни живот-
ного происходит в течение нескольких суток. Очевидно, в данном
54
случае мы имеем дело с весьма динамичной обновляющейся системой,
вполне сопоставимой с кишечным эпителием позвоночных.
Аналогичные отношения между камбиальными и дифференциру-
ющимися клетками наблюдаются у многих видов тараканов. У тара-
канов эпителий средней кишки и ее придатков образует характерные
складки и углубления с закономерным расположением в них диффе-
ренцированных призматических всасывающих клеток и мелких кам-
биальных. Дифференцированные клетки образуют складки, а камби-
альные сосредоточены в желобкообразных углублениях — регенера-
ционных гнездах (рис. 10, Б, 1, 2). Методом тимидиновой радиоавто-
графии удалось показать, что синтез ДНК и деление клеток происходят
только в регенерационных гнездах. Отсюда клетки смещаются на бо-
ковые поверхности и вершину складок, превращаясь во всасывающие
высокопризматические клетки. Время полного обновления пласта око-
ло 10 сут. В кишечном эпителии таракана имеется и хорошо развитая
диффузная система эндокринных клеток.
Еще более сложную системную организацию имеет кишечный
эпителий жука-плавунца (рис. 10, В). Железистые и крупные всасы-
Рис. 10. Рисунки с микрофотографий кишечного эпителия сверчка (Я), таракана
(Б) и жука-плавунца (В).
I — участки скоплений малодифференцированных клеток (А, В} или регенераци-
онное гнездо (£), 2 — всасывающая клетка, 3 — мышцы стенки кишки, 4 — ми-
тозы; стрелками показано направление смещения клеток в процессе физиологичес-
кой регенерации.
55
вающие (по-видимому, частично полиплоидные) клетки образуют ров-
ный однослойный пласт, выстилающий внутреннюю поверхность киш-
ки этих животных (рис. 10, В, 2). Обновление клеток эпителиального
пласта происходит за счет размножающихся малодифференцировац-
ных клеток, расположенных, как показал анализ распределения мито-
зов и меченных [3Н]тимидином клеток, в дистальной части длинных
трубкообразных крипт, прободающих стенку кишки и находящихся в
гемоцеле (рис. 10, В, 1). Непосредственно над зоной митозов и клеток,
находящихся в фазе синтеза ДНК (меченных [3Н]тимидином на ранних
сроках после его введения), располагаются клетки с более крупными
ядрами. В этой зоне около трети клеток находится в фазе синтеза
ДНК, однако никогда не встречаются митозы. По-видимому, здесь
происходит процесс соматической полиплоидизации клеток, диффе-
ренцирующихся и смещающихся по направлению к эпителиальному
пласту, выстилающему внутреннюю поверхность кишки.
Моллюски. Широкое распространение у моллюсков внутрикле-
точного пищеварения с соответствующей специализацией пищевари-
тельных клеток на процессы пино- и фагоцитоза сочетается со сложной
тканевой организацией клеточных элементов. Так, у голожаберного
моллюска Coryphella rifibranchialis основные процессы поглощения
питательных веществ происходят в так называемых печеночных раз-
ветвлениях кишечника. Это тонкие трубчатые разветвленные выросты
кишечника, выстланные однослойным эпителием. На срезах желез
видно, что эпителий состоит из закономерно расположенных клеток
трех типов (рис. 11). Наиболее крупные клетки со светлой цитоплаз-
мой занимают вершину и боковые поверхности складок (/), мелкие
базофильные клетки расположены в их основании (3).
Опыты с [3Н]тимидином показывают, что крупные клетки пред-
ставляют собой дифференцированные, активно функционирующие
клеточные элементы, почти полностью утратившие способность к раз-
множению. Мелкие клетки являются камбиальной субпопуляцией тка-
невой системы. Большинство их находится в цикле репродукции. По-
мимо рассмотренных клеток в эпителии печеночных выростов имеются
еще и клетки с очень крупными ядрами и резко базофильной цито-
плазмой (2), в которой хорошо развита эндоплазматическая сеть с
многочисленными рибосомами. Эпителий печеночных выростов — об-
новляющаяся тканевая система, камбиальные клетки которой диффе-
ренцируются в двух направлениях: пищеварительные пиноцитирую-
щие клетки и специальные секреторные. Пищеварительные клетки
о новляются за 10-15 дней. Обновление имеет четко выраженный
поляризованный характер, поскольку наиболее старые клетки распо-
56
лягаются на вершине складок. Пищеварительные клетки в течение
этого периода претерпевают характерные циклические изменения, свя-
занные с поглощением и перевариванием пищи. Один пищеваритель-
ный цикл в клетках занимает около 5 сут (рис. 11). Он включает в
себя периоды интенсивного поглощения пищевых частиц (/, II), их
внутриклеточного переваривания (III, IV), периоды выделения непере-
варенных остатков вместе с цитоплазмой (V) и восстановления (I)
клеток до начала следующего цикла.
Рис. 1]. Морфологические изменения пищеварительных клеток кишечного
эпителия в папилле голожаберного .моллюска в процессе пищеварительного
цикла (по Е. В- Обуховой, 1979).
Римскими цифрами и стрелками показаны последовательные стадии пищева-
рительного цикла: I, II — стадии репарации и интенсивного пиноцитоза, III,
1У — стадии «переваривания» пищи, К — стадия частичной деструкции кле-
ток; 1 —- пищеварительные клетки, 2 — камбиальные клетки, 3 — железис-
тые клетки.
57
Сложность системной организации кишечного эпителия такого
типа проявляется и в наличии в нем еще одной весьма своеобразной
клеточной системы. Она располагается на вершине печеночных вырас-
тав и образует основную часть стрекательных мешков, или книдосаков.
Малодифференцированные камбиальные клетки этой системы проду-
цируют особые клеточные элементы, в которые из полости печеноч-
ного выроста попадают непереваренные стрекательные капсулы гид-
роидных полипов — пищи моллюсков (рис. 12). В дальнейшем стре-
кательные капсулы, располагаясь в специализированных клетках стре-
кательных мешков, выполняют защитную функцию (7, 3, 4). При
сокращении специальных мышц происходит выбрасывание клеток со
стрекательными капсулами в наружную среду, где освобождаются
стрекательные нити, предохраняющие моллюсков от преследующих
хищников.
В опытах с [3Н]тимидином показано, что пополнение клеток стре-
кательных мешков происходит благодаря размножению малодиффе-
ренцированных клеток, расположенных в их основании (4, 5). Отно-
сительно автономная система малодифференцированных клеток попол-
няется в результате размножения и миграции клеток из дистального
отдела пищеварительной железы.
Организация кишечного эпителия пластинчатожаберных моллюс-
ков в тех его отделах, где происходит поглощение пищевых комочков
пищеварительными клетками сходна с таковой у брюхоногих моллюс-
ков. Пищеварительные клетки (как и у брюхоногих моллюсков) вместе
с камбиальными и железистыми образуют трубчатые концевые отделы,
где и происходит поглощение пищи.
Полихеты. В весьма разнообразной и многочисленной в видовом
отношении группе подихет мы кратко остановимся на особенностях
организации кишечного эпителия у двух видов бродячих и одного вида
сидячих полихет. Относительно сложное строение и в гистологичес-
ком, и в микроанатомическом плане имеет средний отдел пищевари-
тельного тракта у бродячих полихет афродитид. В каждом сегменте
червя участок кишки образует два мешковидных, слегка разветвленных
железистых выроста, соединенных с полостью кишки специальными
протоками. Эпителий, выстилающий большую часть средней кишки,
образует характерные складки в основном из-за разной высоты состав-
ляющих его клеток. Кроме того, в кишке имеются и небольшие участки
со слабо выраженной складчатостью и даже лишенные ее. Складки
образованы длинными вытянутыми клетками с сигаровидными ядрами.
Между складками располагаются всасывающие клетки с округлыми
ядрами, светлой цитоплазмой и умеренно развитыми общими органо-
58
1
Рис. 12. Физиологическая регенерация в эпителиальной выстилке стрекательного
мешка и пищеварительной железы голожаберного моллюска
(по Е. В, Обуховой, 1979).
1 — стрекательная капсула, 2 — стрекательный мешок, 3 — эпителий стрека-
тельного мешка, 4 — камбиальная зона мешка, 5 — клетка, перемещающаяся
через канал в камбиальную зону мешка, 6 — камбиальные клетки дистального
участка эпителия пищеварительной железы, 7 — полость пищеварительной желе-
зы, 8 — пищеварительная, 9 — недифференцированная, 10 — известковая клет-
ки, II — покровный эпителий; стрелками показано направление перемещения
клеток в процессе физиологической регенерации.
59
идами. На апикальной поверхности клетки несут реснички и развитый
аппарат микроворсинок. По ультраструктурной организации они сход-
ны с клетками, расположенными между складками, однако их цито-
плазма темнее и содержит больше включений.
Ближе к вершине складок удается наблюдать дегенеративные из-
менения клеток и выведение их в просвет кишки. Опыты с [3Н]тими-
дином показали, что деление клеток происходит преимущественно
между складками и в их основании. Отсюда клетки медленно смеща-
ются к вершине складок. Такая топографическая дифференциация эпи-
телия особенно хорошо выражена у молодых животных. При попада-
нии в полость кишки крупных частиц пищи удается выявить пластинку
внеклеточного вещества, выделяемую, по-видимому, эпителием и вы-
полняющую функцию перитрофической мембраны. Помимо основных
выстилающих просвет кишки клеток в эпителии афродитид выявлена
система базальных клеток, отростки которых образуют субэпителиаль-
ное сплетение. Они относятся, по-видимому, к диффузной эндокрин-
ной системе (подробнее см. ниже). Выстилка протоков железистых
выростов образована типичным однослойным ресничным эпителием
состоящим из клеток с хорошо развитым ресничным аппаратом. По-
мимо обычных ресничек у части клеток удается наблюдать сложные
реснички. Они образуются путем объединения комплексов микротру-
бочек под одной плазматической мембраной. Эпителий протоков имеет
четко выраженный поляризованный характер. На границе с эпители-
ем, выстилающим мешковидные железистые придатки, находится зона
малодифференцированных ресничных клеток. В результате деления и
смещения этих клеток по направлению к кишке и происходит обнов-
ление ресничного эпителия протока. Эпителий железистых выростов
афродитид представляет собой динамичную эпителиальную систему
(рис. 13, А, Б). Этот пласт может быть образован либо плоскими
клетками (рис. 13, Б, е), либо высокопризматическими вакуолизиро-
ванными клетками с неровной апикальной поверхностью (рис. 13, Б,
а, б). Все изменения в структуре пласта определяются, по-видимому,
циклическими изменениями основных в количественном отношении
вакуолизированных клеток. По ультраструктуре эти клетки афродитид
сходны с пищеварительными клетками брахиопод и моллюсков. Это
делает весьма вероятным предположение об их пищеварительной
функции. Циклические изменения структуры этих клеток связаны,
очевидно, как и у моллюсков, с пищеварительным циклом, на заклю-
чительных этапах которого клетки могут отделять значительную часть
своей апикальной цитоплазмы с непереваренными остатками (рис. 13,
’ в)- роме вакуолизированных клеток в составе эпителия железистых
60
выростов имеются белковые железистые, малодифференцированные,
камбиальные и единичные эндокринные огросчатые базальные клетки
(рнс. 13, А). Камбиальные клетки обеспечивают физиологическую ре-
генерацию, которая имеет циклический характер.
Таким образом, у афродитид в эпителии кишки и придатков уда-
ется выявить, по крайней мере, три субсистемы: эпителий средней
кишки, протоков и железистых выростов. Каждая из них выполняет
различные функции: всасывание, транспорт, внутриклеточное пище-
варение — и характеризуется существенными особенностями специ-
ализации клеток и системными закономерностями организации эпи-
телия.
В микроанатомическом отношении наиболее просто устроен пи-
щеварительный тракт у широко распространенных бродячих полихет
рода Nereis. Средний отдел их пищеварительного тракта представляет
собой трубкообразный орган, имеющий мышечную оболочку. В из-
вестной мере он соответствует желудку сидячих полихет. Эпителий
образует складки благодаря различной высоте составляющих одно-
слойный пласт клеток (рис. 14).
Основным в количественном отношении клеточным типом явля-
ются всасывающие клетки с хорошо развитыми микроворсинками.
Клетки этого типа отличаются по высоте и интенсивности окраски
цитоплазмы. Однако различий в степени дифференцировки на ультра-
структурном уровне между высокими и образующими желобки низ-
кими клетками выявить не удается. Эти клетки делятся редко. Деля-
щиеся или вступившие в фазу синтеза ДНК клетки чаще располагаются
между складками, чем на складках. Таким образом, в кишечном эпи-
телии нереид относительно слабо выражена тенденция к топогра-
фическому выделению зон преимущественного размножения кле-
ток.Четко выделяются лишь секреторные клетки с хорошо развитой
шероховатой ЭПС и белковыми секреторными гранулами, имеются
многочисленные базальные клетки, обнаружены единичные рецептор-
ные клетки.
Более сложная микроанатомическая и гистологическая дифферен-
цировка характерна для кишечных эпителиев сидячих полихет. Их
пищеварительный тракт обычно дифференцирован на ряд отделов и
снабжен дополнительно железистыми придатками. Даже у таких си-
дячих полихет, как пескожил, с относительно просто устроенным пи-
щеварительным трактом, удается выделить: а) два железистых придат-
ка в виде так называемых слюнных желез; б) мощно развитый и за-
нимающий большую часть пищеварительной трубки железистый при-
даток; в) длинный кишечник. Процессы пищеварения происходят в
61
А: азэк — апикальная зона эпителиальных клеток с пузырьками и канальцами,
вэк вакуолизированные клетки, кгк — крупногранулярная клетка, мк — мы-
шечные клетки, ндк — недифференцированная клетка, отр — отросток крупно-
гранулярной клетки, ск — секреторная клетка, мит — митохондрии, бм — ба-
зальная мембрана, я — ядро, шэс — шероховатая ЭПС, аг — аппарат Гольджи,
сг секреторные гранулы, мв — микроворсинки, вк — включения;
62
г
Б
и циклических изменений этого эпителия (Б) у полихеты Harmothoc imbricata
М. Ю. Пунину, 1971).
Б', а-б — поглощение пищевых частиц и внутриклеточное переваривание, в
выведение неутилизированных продуктов путем фрагментации апикальной циго
плазмы, г — выведение неутилизированных продуктов путем разрушения
вакуолизированных клеток, д-ж — восстановление эпителиальной выстилки.
63
Рис. 14. Организация эпителия средней кишки полихеты
Nereis virens (по М. Ю. Пунину, 1991).
бк — базальные клетки, кс — кишечный синус, нк — апикаль-
ная часть нервной клетки, ск — секреторная клетка, век —- вса-
сывающие клетки, аг — аппарат Гольджи, шэе — шероховатая
ЭПС, мит — митохондрии, мв — микроворсинки, р — реснич-
ки, вак — вакуоли, бы — базальная мембрана.
64
основном в желудке и в передних
отделах кишечника. Эпителиальная
выстилка желудка пескожила пред-
ставлена однослойным железисто-
всасывающим эпителием (рис. 15).
Среди железистых клеток име-
ется несколько разновидностей бо-
каловидных клеток, которые выде-
ляют секрет, содержащий сульфати-
рованные мукополисахариды, и от-
личаются друг от друга характером
секреторного цикла. Вторым типом
железистых элементов, локализован-
ных в области желудка, являются
крупные клетки с резко базофиль-
ной цитоплазмой и хорошо развитой
эндоплазматической сетью с боль-
шим количеством рибосом на на-
ружной поверхности мембран. Апи-
кальные отделы этих клеток имеют
конусовидную форму и выходят на
поверхность пласта в виде узкого
цитоплазматического отростка. Ос-
новная масса эпителия желудка со-
стоит из крупных клеток с окси-
фильной цитоплазмой и отчетливо
выраженной щеточной каемкой, ко-
торая представляет собой хорошо
развитые микроворсинки, указываю-
щие на всасывающую функцию этих
клеток. Они имеют также многочис-
ленные лизосомы, шероховатую и
1
15. Участок пищеварительно-всасываю-
щей клетки эпителия желудка полихеты
Arenicola marina (по Э. А. Кагановской,
1983).
1 — микроворсинки, 2 — пиносомы, 8 —
пинолизосомы, 4 — пиноцитозный канал на
боковой поверхности клетки, 5 — шерохова-
тая ЭПС, б — остаточные тела, 7 — аппа-
рат Гольджи, 8 — митохондрии, 9 —ядро.
65
гладкую ЭПС, две разновидности аппарата Гольджи и несколько раз-
новидностей митохондрий. Все перечисленные морфологические при-
знаки указывают на сложный, мультифункциональный характер их
специфической дифференцировки.
В опытах с пероксидазой хрена удалось показать, что этот не
проникающий через мембрану белок попадает в клетки через систему
пиноцитозных каналов, расположенных в основном на боковой по-
верхности клеток (см. рис. 15).
Таким образом, всасывающие клетки эпителия желудка и перед-
них отделов кишки пескожила обладают способностью, с одной сторо-
ны, поглощать простые гидролизованные в полости пищеварительного
тракта соединения, используя механизмы трансмембранного транспор-
та через плазматическую мембрану микроворсинок. С другой стороны,
более крупные, не переваренные в полости частицы поступают в
межклеточные пространства. Отсюда они по пиноцитозным каналам,
открывающимся преимущественно на боковую поверхность всасыва-
ющих клеток, проникают внутрь этих клеток. Здесь от каналов отшну-
ровываются ограниченные мембраной пиносомы, которые сливаются
с лизосомами, где пищевые частицы подвергаются внутриклеточному
перевариванию.
§3. КИШЕЧНЫЕ ЭПИТЕЛИИ НИЗШИХ МНОГОКЛЕТОЧНЫХ
Губки, низшие турбеллярии. Из современных свободноживущих
многоклеточных эти животные имеют наиболее примитивную органи-
зацию кишечного эпителия. У губок поглощение питательных веществ
осуществляется группами сложнодифференцированных клеток. У од-
них губок они образуют выстилку внутренней полости животных, у
других — расположены в специальных каналах, пронизывающих тело
губки. Клетки имеют развитый жгутиковый аппарат и сложнодиффе-
ренцированную апикальную часть цитоплазмы в виде воротничка.
Сюда под действием силы тока жидкости, создаваемого жгутиком, и
поступают пищевые частицы. Последние фагоцитируются специализи-
рованными участками плазматической мембраны на поверхности кле-
ток в основании воротника. Фагоцитированные частицы у одних видов
губок перевариваются самими жгутиковыми клетками, у других —
передаются амебоцитам. Переваривание в обоих случаях идет по типу
внутриклеточного пищеварения. Примитивность тканевой организации
системы жгутиковых клеток проявляется как в функциональной авто-
номности каждой клетки, так и в отсутствии их структурной и гисто-
генетической интеграции. У некоторых губок описан обратимый про-
цесс превращения жгутиковых клеток в подвижные амебоциты тела
животного.
66
У разных представителей губок наблюдаются различные взаи-
моотношения между специализированными жгутиковыми клетками и
амебоцитами стенки тела. Так, у известковых губок жгутиковые клет-
ки — хоаноциты — и захватывают и переваривают питательные ве-
щества. У кремневых и кремнероговых губок пищу поглощают хоа-
ноциты, но затем передают ее амебоцитам, которые и осуществляют
внутриклеточное пищеварение. У некоторых губок хоаноциты играют
лишь гидрокинетическую роль. Поглощение и внутриклеточное пере-
варивание пищи осуществляют крупные специализированные амебо-
циты.
Многообразны отношения, наблюдаемые в организации пищева-
рительного аппарата у турбеллярий. У их низших представителей,
некоторых видов бескишечных турбеллярий, имеется только просто
устроенная глотка с ротовым отверстием, обеспечивающая захват пи-
щи. Переваривание пищи обеспечивается специальными пищевари-
тельными клетками, обладающими подвижностью фагоцитами.
Одним из направлений усложнения, по-видимому, первичных от-
ношений является обнаруженный у некоторых видов групповой фаго-
цитоз — способность фагоцитов образовывать вокруг крупных частиц
временные скопления. Часть фагоцитов в таких скоплениях гибнет,
выделяя гидролитические ферменты, обеспечивающие распад крупной
пищевой частицы на более мелкие, которые и поглощаются фагоци-
тами. Такое усложнение первичной фагоцитарной функции независимо
возникает в разных группах современных турбеллярий. Однако оно не
является прогрессивным приспособлением, поскольку уводит эти груп-
пы животных от создания настоящего кишечного эпителия. Более
прогрессивной тенденцией следует считать образование особой, так
называемой центральной паренхимы, из которой, по-видимому, и про-
исходит формирование кишечника. У современных бескишечных тур-
беллярий наблюдается более или менее отчетливая дифференцировка
паренхимы на периферическую и центральную. В опытах с [3Н]тими-
дином на одном из таких видов бескишечных турбеллярий показа-но,
что центральная паренхима представляет собой специализированную,
не размножающуюся клеточную или частично синцитиальную систе-
му.
Весьма вероятно, что при дальнейшей дифференцировке централь-
ной паренхимы — формировании в ней полости и стенки кишки,
выстланной кишечным эпителием, — и возникли те отношения, кото-
рые наблюдаются у многих современных турбеллярий и других плос-
ких червей. Они имеют хорошо развитый кишечник, а выстилающий
его эпителий обеспечивает процессы полостного пищеварения. В ки-
67
шечном эпителии животных могут дифференцироваться сложный же-
лезистый аппарат и специализированные всасывающие клетки.
Интересно, что в пределах класса турбеллярий сохранились виды,
не связанные между собой непосредственным родством, но находя-
щиеся на разных этапах выделения из центральной паренхимы специ-
ализированного кишечника. У одной из таких турбеллярий в парен-
химе уже имеется полость и формируется пласт специализированных
клеток (рис. 16, А). Однако они еще не отделены от периферической
паренхимы. В пределах класса турбеллярий в разных группах выделе-
ние эпителизированного кишечника из центральной паренхимы про-
исходило независимо; формирование кишки шло, по-видимому, раз-
ными путями, хотя конечный результат оказался сходным. В одних
случаях сначала образовывался просвет и происходило выделение же-
лезистых и всасывающих клеток, а затем формировалась стенка кишки.
68
в других случаях происходило разделение периферических и цент-
ральных паренхим, а затем из центральной паренхимы формировался
кишечный эпителий с дифференцировкой в нем железистых и всасы-
вающих клеток.
Таким образом, анализ организации кишечных эпителиев у воз-
можно большего числа видов турбеллярий чрезвычайно важен. Он
позволяет выяснить общие закономерности ранних этапов эволюцион-
ной динамики и становления кишки и кишечных эпителиев.
Рис. 16. Организация кишечного эпигелия у турбеллярии (А)
и гидроидного полипа (5).
1 ресничные клетки покровного эпителия, 2 и 5 — клетки периферическом
паренхимы, 4 — камбиальные малодифференцированные клетки, 5 — клетки
кишечного эпителия, 6 — железистая клетка кишечного эпителия, 7 — клетки
эктодермы гидроидного полипа.
69
Кишечнополостные. Возможно, что формирование кишечного
эпителия в этой группе животных происходило иначе, чем у турбел-
лярий. Тем не менее его организация у современных кишечнополост-
ных в принципе сходна с таковой высших турбеллярий и других
многоклеточных животных.
У представителей современных кишечнополостных внутриклеточ-
ное пищеварение уже не имеет доминирующего значения. Даже у
таких вторично упрощенных форм, как пресноводная гидра, кишечный
эпителий всегда представляет собой организованный пласт с диффе-
ренцировкой на железистые и всасывающие клетки. Последние часто
имеют реснички и обладают способностью (правда, в известных пре-
делах) к пино- и фагоцитозу. Дифференцировка железистых клеток у
высших представителей кишечнополостных может достигать большого
разнообразия. Они могут выделять помимо различного рода ферментов
еще и слизеподобные вещества, играющие вспомогательную роль в
процессах полостного пищеварения. У многих групп кишечнополост-
ных наблюдается концентрация железистых элементов в определенных
участках эпителиального пласта и закономерное их обновление в ре-
зультате размножения малодифференцированных клеток, расположен-
ных в основании складок кишечного эпителия (рис. 16, Б).
У других кишечнополостных, в частности у гидры, показано до-
вольно интенсивное обновление всасывающих клеток, хотя, по пос-
ледним данным, в их эпителии нет камбиальных зон — центров уси-
ленного размножения клеток.
Несмотря на в общем примитивные признаки организации кишеч-
ного эпителия кишечнополостных, у высших их представителей на-
блюдается весьма сложная дифференцировка и пищеварительного
тракта и выстилающего его эпителия (например, у актиний и сцифо-
медуз).
§4. ОБЩИЕ ЗАКОНОМЕРНОСТИ ЭВОЛЮЦИОННОЙ ДИНАМИКИ
КИШЕЧНЫХ ЭПИТЕЛИЕВ
Некоторые общие закономерности эволюционной динамики ки-
шечных эпителиев многоклеточных животных представлены на
рис. 17. Приведенный выше большой фактический сравнительно-ци-
тологический материал свидетельствует о наличии у разных животных
для трех основных типов специализированных клеток кишечного эпи-
телия (всасывающие, пищеварительные и пищеварительно-всасываю-
щие) общих признаков морфобиохимической дифференцировки.
сасывающие клетки кишечного эпителия представителей различ-
ных групп животных (первично- и вторичноротые) имеют сложный
70
аппарат всасывания — систему микроворсинок с соответствующей
специализацией всей структурной организации клеток на осуществле-
ние процессов внутриклеточного транспорта и выведение утилизиро-
ванных продуктов (рис. 17, 7 и 1Г).
Широкое распространение и сходный характер морфобиохимичес-
кой дифференцировки всасывающих клеток в кишечных эпителиях
животных, не связанных близкими родственными связями, — одно из
проявлений общих, типовых для всех кишечных эпителиев закономер-
ностей его усложнения в процессе эволюции. Наряду с этим сопостав-
ление всасывающих клеток разных групп животных, в частности не-
которых насекомых и высших позвоночных, указывает на существен-
ные особенности в их дифференцировке. Таким примером может слу-
Рис. 17. Эволюционная динамика кишечных эпителиев; I. II. III — ультраструк-
турная организация всасывающей (/, II) и пишеварительно-всасывающих (III) кле-
ток у млекопитающих (Г), насекомых (II) и новорожденных млекопитающих (III):
а-д — организация процессов репродукции в кишечном эпигелии млекопитаю-
щих (а), хвостатых амфибий (б), голожаберных моллюсков (в), насекомых (г),
асцидий (<3); е—ж — варианты структурного обеспечения пищеварительной
Функции у бескишечных турбеллярий, з — становление кишечного эпителия
У современных турбеллярий, и — кишечный эпителий высших турбеллярий;
7-3 — клетки (1 — дифференцированные, 2 — полустволовые камбиальные,
3 — стволовые камбиальные).
71
жить широко распространенное у насекомых сочетание секреторной и
всасывающей функций у одних и тех же клеток. Такого рода дуалис-
тическая дифференцировка лишь в небольшой степени свойственна
всасывающим клеткам высших позвоночных. У млекопитающих и
многих других позвоночных секреторные потенции всасывающих кле-
ток реализуются лишь в выделении мукопротеинового гликокаликса
или надмембранного комплекса, гипертрофированного на микровор-
синках и играющего вспомогательную роль в процессах пристеночного
пищеварения и активного мембранного транспорта. Всасывающие
клетки позвоночных синтезируют также и некоторые гидролитические
ферменты, необходимые для пристеночного пищеварения.
У некоторых насекомых и, по-видимому, у ряда других групп
животных, в частности у приапулид и нематод, всасывающие клетки
вырабатывают все гидролитические ферменты, т. е. берут на себя
функцию желез желудочно-кишечного тракта позвоночных. Кроме
того, у многих насекомых, у некоторых полихет и у приапулид они
обладают способностью периодически или постоянно выделять белки
и хитин, необходимые для построения перитрофических мембран.
У многоклеточных животных процессы полостного пищеварения
могут осуществлять клетки, не обладающие специальным аппаратом
микроворсинок. Наконец, весьма вероятно, что этот аппарат при более
детальном сравнительно-цитологическом исследовании у разных жи-
вотных окажется неодинаковым, особенно на молекулярном и надмо-
лекулярном уровнях его организации. В пользу такого заключения
говорят различия в механизмах транспорта аминокислот и углеводов
всасывающими клетками насекомых и млекопитающих. Эти более или
менее существенные частные особенности в дифференцировке всасы-
вающих клеток при полостном пищеварении отражают, очевидно, из-
вестное многообразие их эволюционных потенций. Еще в большей
мере такое многообразие характерно для дифференцировки пищевари-
тельных клеток и пищеварительно-всасывающих клеток в кишечных
эпителиях у животных с преобладающим внутриклеточным пищева-
рением. Клетки могут быть специализированы на реализацию обыч-
ного фаго- или пиноцитоза, как это наблюдается у низших многокле-
точных. У многих животных (моллюски, некоторые полихеты) наблю-
даются сложные пищеварительные циклы, в разных фазах которых
клетки имеют существенно различающуюся морфологию. Наконец, в
разных, группах животных, вероятно, независимо в апикальной части
пищеварительных клеток формируются временные или постоянные
пиноцитозные комплексы. Дифференцировка пищеварительных клеток
усложняется пока еще слабо изученными в сравнительном аспекте
72
специализациями для осуществления процесса так называемого опо-
средованного рецепторами пиноцитоза. Наличие такой специализации
доказано пока лишь для пищеварительно-всасывающих клеток новорож-
денных млекопитающих. Косвенные данные в пользу наличия свойств
такого рода у подобных клеток имеются и в отношении кишечного
эпителия пескожила и асцидий (клатриновые пиноцитозные пузырьки).
Сам факт' наличия и широкого распространения в кишечных эпителиях
неродственных животных пищеварительно-всасывающих клеток сти-
рает резкую грань между этими двумя типами специализации клеток
кишечного эпителия. В то же время эти факты свидетельствуют об
ограниченных возможностях эукариотных клеток в специализации на
поглощающую, всасывающую функцию. У многоклеточных животных
при специализации их кишечных эпителиев реализуются все три воз-
можности поглощения веществ — трансмембранный транспорт, транс-
порт в мембранной упаковке и сочетание обоих процессов.
Вспомогательные железистые клетки имеют более разнообразный
спектр эволюционных модификаций, чем рассмотренные выше основ-
ные типы клеток кишечного эпителия. Это определяется прежде всего
большим разнообразием пищи у разных многоклеточных и, следова-
тельно, разнообразием ферментов, необходимых для расщепления вы-
сокомолекулярных органических соединений в каждом конкретном
случае.
Общей прогрессивной тенденцией в эволюционной динамике спе-
циализированных железистых клеток является увеличение их разнооб-
разия. Более подробная характеристика эволюционной динамики же-
лезистых клеток дана в гл. 3, посвященной железистым эпителиям.
Кишечный эпителий и его производные у многих групп животных
обеспечивают не только расщепление и всасывание, но и вторичную
обработку и хранение запасных питательных веществ в виде гликогена
или жировых включений. Наибольшее развитие эта важная функция
внутреннего обмена получает в производных кишечного эпителия у
позвоночных животных. У них образуется специальный орган — пе-
чень. Эпителиальные клетки печени почти полностью утрачивают та-
кое характерное первичное свойство клеток кишечного эпителия, как
полярность, и по морфобиохимической дифференцировке представля-
ют собой редкий для кишечного эпителия позвоночных тип мульти-
функциональных клеточных элементов. Они характеризуются секре-
торной активностью и имеют в мембранах эндоплазматической сети
ферменты детоксикации вредных продуктов метаболизма. В печеноч-
ных клетках протекает и ряд узловых этапов углеводного, жирового
и белкового метаболизмов.
73
Некоторые функции печеночных клеток позвоночных реализуют-
ся в клетках кишечного эпителия или его железистых производных у
ряда групп первичноротых животных. Наиболее ярко они выражены
в пищеварительных клетках иксодовых клещей. На определенных ста-
диях пищеварительного цикла такие клетки становятся основными
резервуарами поглощенной пищи и, очевидно, обеспечивают ее вто-
ричную переработку перед выделением в гемолимфу. Выделение со-
единений, эмульгирующих жиры, образование гликогена и жировых
включений происходят в эпителиальных клетках пищеварительной же-
лезы ракообразных. Имеются данные о том, что у некоторых голово-
ногих моллюсков, как и у позвоночных животных, эпителии железис-
тых структур среднего отдела пищеварительного тракта становятся
аппаратом преимущественно вторичной обработки поглощенных пи-
щевых продуктов, причем поступление последних в клетки происходит
не из полости кишки, а из тканевой жидкости и транспортной сосу-
дистой системы.
В сравнительно-цитологическом плане весьма демонстративно
также независимое возникновение в кишечном эпителии некоторых
насекомых, представителей одного семейства морских звезд и брюхо-
ногих моллюсков полиплоидных всасывающих, ресничных всасываю-
щих и железистых клеток. Интересно также, что усиление сортирую-
щей транспортной функции во вспомогательных участках ресничного
кишечного эпителия может осуществляться тремя разными способами:
увеличением сложности организации и количества ресничек на клетку
(пластинчатожаберные моллюски, афродиты), полиплоидизацией кле-
ток с кратным увеличением количества ресничек (иглокожие) и, на-
конец, увеличением количества ресничных клеток (брахиоподы).
Таким образом, сравнительно-цитологический обзор специализи-
рованных клеток в кишечных эпителиях многоклеточных животных
указывает на совершенно определенные общие тенденции функцио-
нальной и морфобиохимической дифференцировки. Однако проявле-
ние последних может быть достаточно многообразным.
Еще более сложные отношения наблюдаются в эволюционных
преобразованиях внутрисистемных механизмов, обеспечивающих ин-
. еграцию кишечного эпителия как единой целостной системы клеточ-
ных элементов.
У некоторых низших многоклеточных как с внутриклеточным,
так и с полостным пищеварением мы встречаемся с относительно
низкой интегрированностью клеток в тканевой системе и даже с почти
полным ее отсутствием. Наиболее демонстративными примерами в
этом отношении среди животных с внутриклеточным пищеварением
являются губки и бескишечные турбеллярий.
74
Полостное пищеварение по своей сути требует уже определенной
степени целостности системы. Оно основано на «разделении труда»
между клетками и должно протекать в замкнутом тканевой системой
пространстве. Эти необходимые признаки структурной интеграции
имеются у кишечнополостных. Однако кишечным эпителиям рассмат-
риваемых животных свойственны и такие примитивные признаки, как
мультифункциональная дифференцировка эпителиально-мышечных
клеток и способность некоторых клеток к метаплазии в широких
пределах. Тем не менее на основании изложенных данных можно
констатировать, что у большинства животных кишечные эпителии
представлены интегрированными обновляющимися камбиальными
системами (рис. 17, a-д'). Ясно выраженная тенденция к топографи-
ческому выделению камбиальных клеток наблюдается в пределах каж-
дого класса позвоночных, как это было показано на примере амфибий
и костистых рыб. Отчетливо выявляется она и у некоторых групп
высших первичноротых, в частности у насекомых. Хорошо выражен-
ное поляризованное обновление системы имеет место у пластинчато-
жаберных и брюхоногих моллюсков с преобладающим внутриклеточ-
ным пищеварением.
Для изучения обновляющихся кишечных эпителиев весьма важно
выяснить внутренние закономерности организации камбиальных сис-
тем и конкретные механизмы их взаимоотношения с дифференциру-
ющимися в различных направлениях клетками. Совершенно очевидно,
что в основе стабильной и совершенной работы такой сложной тка-
невой системы, как кишечный эпителий млекопитающих, лежит меха-
низм обратных связей между дифференцирующимися в четырех на-
правлениях клеточными элементами и, по-видимому, единой камби-
альной системой. Взаимодействие осуществляется при помощи особых
веществ и соответствующих им адекватных рецепторов камбиальных
клеток. Показана также существенная роль в регуляции размножения
клеток непосредственных механических контактов между ними внутри
системы. Эти, а возможно, и ряд других механизмов лежат в основе
количественного и качественного постоянства клеточного состава во
всех камбиальных системах, в том числе и в камбиальных системах
кишечных эпителиев, у разных групп многоклеточных животных. Од-
нако регулятивные механизмы, как и любые другие биологические
механизмы, в каждом конкретном случае исторически обусловлены и
отнюдь не тождественно проявляются у разных животных.
Одной из наиболее интересных особенностей эволюционной ди-
намики кишечных эпителиев является тенденция к ускорению темпов
их физиологической регенерации, что связано с большими затратами
75
энергии и пластических материалов. Такая тенденция отчетливо вы-
ражена у высших позвоночных и некоторых насекомых. Весьма веро-
ятно, что она имеет место в эволюционной дифференцировке кишеч-
ных эпителиев и у многих групп многоклеточных животных.
По-видимому, быстрая и прогрессирующая в процессе эволюции
изнашиваемость всасывающих и других специализированных клеток
кишечного эпителия коррелирует с не ясным еще для нас совершен-
ствованием молекулярных и надмолекулярных механизмов, обуслов-
ливающих основные функции кишечного эпителия. Относительно не-
большой период активной функциональной деятельности дифферен-
цированных клеток (пищеварительные и всасывающие) обусловлива-
ется в равной мере процессами всасывания низкомолекулярных про-
дуктов и внутриклеточным пищеварением. Интенсивно обновляющие-
ся системы кишечного эпителия обнаружены у животных как с по-
лостным, так и с внутриклеточным пищеварением.
Помимо кишечных эпителиев, построенных по принципу обнов-
ляющихся клеточных популяций с выделением специальных малодиф-
ференцированных клеток, широко распространены в ряде групп много-
клеточных животных кишечные эпителии или отдельные их участки
с другим принципом организации процессов репродукции и физиоло-
гической регенерации. Обновление клеточного состава в таких эпите-
лиях обеспечивается благодаря сохранению способности к размноже-
нию у части дифференцированных функционирующих клеток, диф-
фузно распределенных в эпителии или образующих небольшие скоп-
ления. Примерами их могут служить кишечный эпителий летних ля-
гушек, приапулид, нереид, большая часть вспомогательных участков
ресничных эпителиев пластинчатожаберных моллюсков и брахиопод.
Такого рода кишечные эпителии отражают, по-видимому, первичные,
более простые отношения в их системной организации. Однако эти
эпителии характеризуются большей пластичностью, способностью в
широких пределах изменять интенсивность физиологической регене-
рации. Механизмами такого рада изменений могут быть и варьиро-
вание в цикличности размножения клеток, и своеобразный механизм
системной физиологической регенерации — слущивание больших
участков эпителия с последующим их восстановлением. Такая плас-
тичность кишечных эпителиев особенно важна при ярко выраженных
сезонных изменениях их внутренней организации.
Резкие различия во внутренней организации кишечных эпителиев
с выделенным камбием и без специальных недифференцированных
клеток выявляются лишь в типичных случаях. Наряду с различиями
ся и сходство, которое выражается в наличии эпителиев перс-
76
ходного типа, как, например, в средней кишке афродитид, и в наличии
у многих видов животных разновидностей обоих типов эпителиев, как,
например, у пластинчатожаберных моллюсков, афродитид и в желудке
разных видов асцидий. Особенно наглядно глубокая связь внутренней
организации кишечных эпителиев разного типа проявляется при их
сезонных изменениях. Так, некамбиальный эпителий летних лягушек
к началу весны приобретет черты сходства с эпителиями камбиального
типа.
Для понимания общих закономерностей эволюционной динамики
кишечных эпителиев большой интерес представляет их сопоставление
не только у неродственных групп животных, но и у представителей
животных в пределах одного класса или даже более мелких таксонов.
Примером могут быть отношения, которые наблюдаются у турбелля-
рий (рис. 17, з, ж): тенденция к формированию кишки проявляется
независимо в разных группах этих животных даже у современных
форм.
ЛИТЕРАТУРА
Заварзин А. А. Значение научного наследия А. А. Заварзина в работе ка-
федры цитологии Ленгосуниверситета // Эволюционные идеи в гистологии и
эмбриологии. 1987. Тр. ЛОЕ. Т. 86. Вып. 1.
Мамкаев Ю. В. О гистологической организации пищеварительной системы
турбеллярий И Эволюционная морфология беспозвоночных. Л., 1979.
Альберте Б., Брей Д„ Льюис Дж. и др. Молекулярная биология клетки.
1987. Т. 4. С. 151-158. Т. 2. С. 151-195.
Овсянников В. И. Пищеварительная система И Общий курс физиологии
человека и животных. Л., 1991. Т. 2.
Пунин М. Ю. Гистологическая организация кишечных эпителиев приапу-
лид, брахиопод, двустворчатых моллюсков и полихет. Л., 1991.
Уголев А. М., Иезуитова Н. Н., Цветкова В. А. Эволюционная физиоло-
гия пищеварения И Эволюционная физиология. 1983. Т. 2.
Хэм А., Кормак Д. Гистология. М., 1983. Т. 4. С. 49-158.
Loeffler М., Fatten С. S., Paulus V. Intestinal crypt proliferation. II Computer
modelling of mitotic index data provides further evidence for lateral and vertical
cell migration in the abcence of mitotic activity // Cell Tissue Kinet. 1988. Vol. 21.
N 4.
Potten C. S., Loeffler M. A comprehencive model of the crypts of small intes-
tine of the mouse provides insight into the mechanisms of cell migration and the
proliferation hierarchy H J. Theor. Biol. 1987. Vol. 127.
Weltzin C. Binding and transepithelial transport of immunoglobulins by intes-
tinal M cells: Demonstration using monoclonal IgA antibodies against enteric viral
proteins // J. Cell Biol. 1989. Vol. 108.
77
ГЛАВА 2. Кожные эпителии
Кожные эпителии — одна из наиболее древних тканевых систем,
возникшая на первых этапах эволюции многоклеточных. На ранних
этапах эволюции барьерная роль кожного эпителия сочеталась с по-
глощением питательных веществ и выделением вредных продуктов
метаболизма, а также локомоторной функцией и восприятием раздра-
жений из внешней среды. Позднее для осуществления этих функций
стали появляться специальные ткани, а кожный эпителий начал спе-
циализироваться на создании совершенного барьера, изолирующего
организм от внешней среды. Особенно большое значение барьерная
функция кожного эпителия приобретает при выходе многоклеточных
животных на сушу. У большой группы животных средних и высших
уровней организации барьерная функция кожного эпителия сочетается
со скелетной функцией.
Современные многоклеточные животные прошли длинный путь
адаптивной эволюции, которая касалась различных уровней их орга-
низации. На основании изучения кожных эпителиев животных невоз-
можно построить непрерывный ряд усложнения пограничных тканей
в процессе эволюции. Однако сравнительно-гистологические сопостав-
ления позволяют все же наметить основные тенденции их формиро-
вания у многоклеточных животных.
Среди кожных эпителиев можно выделить три основные разно-
видности: а) погруженные, однослойные и многорядные эпителии,
б) однослойные кутикулярные эпителии, в) многослойные неорогове-
вающие и ороговевающие эпителии. Такая классификация в известной
мере отражает последовательные этапы усложнения кожных эпителиев
в процессе эволюции. Первая разновидность наиболее характерна для
низших многоклеточных животных. Многослойные эпителии с тенден-
цией к образованию ороговевающих пластов характерны для всех
классов позвоночных. Развитие кожного эпителия, идущее по пути
совершенствования кутикулярных структур, — основная эволюцион-
ная тенденция кожных покровов многих групп беспозвоночных (коль-
чатые черви, членистоногие, оболочники и др.). В то же время разные
варианты кожных эпителиев могут встречаться и у одного и того же
животного. Это особенно характерно для однослойных и многорядных
эпителиев. Многорядные эпителии вторично возникают в специализи-
рованных участках многослойного кожного эпителия у позвоночных
животных. У моллюсков, относительно высоко организованных групп
беспозвоночных животных, кожные эпителии представлены как спе"
78
диализированными кутикулярными, так и однослойными и многоряд-
ными эпителиями.
§1. ПОГРУЖЕННЫЕ, ОДНОСЛОЙНЫЕ И МНОГОРЯДНЫЕ ЭПИТЕЛИИ
Однослойные и погруженные эпителии
Примером однослойных эпителиев, сохранивших, по-видимому,
некоторые черты первичных кожных эпителиев многоклеточных, яв-
ляется «примитивный» погруженный эпителий бескишечных турбел-
лярий (рис. 18, А). Характерная особенность эпителия заключается в
отсутствии четкой границы между ним и подлежащей паренхимой.
Ядросодержащие части эпителиальных клеток свободно распола-
гаются среди клеток паренхимы и как бы погружены в ее толщу.
Эпителиальный пласт образуют лишь расширенные апикальные части
клеток, формирующие межклеточные контакты. На апикальной по-
верхности эпителиальных клеток развивается мощный ресничный ап-
парат с хорошо развитыми корневыми нитями, который вместе с
мышечными клетками паренхимы образует локомоторный аппарат ко-
жи бескишечных турбеллярий.
У остальных турбеллярий (и большинства групп многоклеточных
животных) покровный эпителий обособлен от подлежащих тканей
базальной мембраной и имеет строение однослойного или многоряд-
ного эпителиального пласта (рис. 18, Б).
У двух классов паразитических плоских червей (цестоды и тре-
матоды) формируются специализированные псевдокутикулярные по-
груженные эпителии. Особенно хорошо особенности этого эпителия
выражены у цестод, лишенных пищеварительной системы. Их кожный
эпителий одновременно выполняет совершенную барьерную функцию
(защита от действия гидролитических ферментов полости кишки хо-
зяина) и функцию поглощения простых питательных веществ, главным
образом моносахаридов. Структурной основой для реализации этих
функций является тегумент, или псевдокутикулярная пластинка
(рис. 18, Г, Д). Она образована апикальными частями эпителиальных
клеток, которые сливаются боковыми поверхностями и формируют
целостный в структурном и функциональном отношении синцитий.
Он отделен от подлежащей паренхимы базальной мембраной, которая
прерывается только в местах связи ядросодержащих базальных частей
клеток с псевдокутикулярной пластинкой. Базальные части клеток с
ядрами, как и у бескишечных турбеллярий, располагаются среди кле-
ток паренхимы.
В прилегающих к базальной мембране участках тегумента содер-
жится много митохондрий и обнаруживаются цистерны и каналы эн-
79
доплазматической сети, тогда как его апикальная цитоплазма содержи!
большое количество ограниченных мембраной пузырьков и вакуолей
Кроме того, в апикальной части псевдокутикулярной пластинки не-
редко образуются уплотненные участки цитоплазмы, которые, вероят-
но, выполняют опорную функцию. Например, у некоторых трематод
они имеют форму выступающих на поверхности тегумента зубчиков,
ограниченных плазматической мембраной (рис. 18, Д). У цестод на-
ружная поверхность псевдокутикулярной пластинки образует различ-
ные варьирующие по своей форме структуры. Они могут иметь вид
длинных микроворсинок с шарообразными расширениями на концах
или массивных конусовидных образований, так называемых микрот-
рихий (рис. 18, Г). Предполагается, что микротрихии служат для за-
якоривания в слизистой кишечника хозяина и для усиления функции
всасывания питательных веществ.
Однослойный эпителий, имеющий синцитиальное строение, ха-
рактерен и для других групп животных: некоторых турбеллярий, ко-
ловраток, скребней и большинства нематод. У коловраток и скребней,
так же как у плоских паразитических червей, барьерная и скелетная
функции эпителия усиливаются благодаря формированию в апикаль-
ной зоне синцития уплотненной цитоплазмы — опорной пластинки,
которую иногда называют внутриклеточной кутикулой (рис. 18, В).
Примером другой разновидности кожных эпителиев, обнаружива-
ющих некоторые архаичные черты, могут служить однослойные по-
кровные эпителии губок и некоторых кишечнополостных, например
эпителий пресноводной гидры. У рассматриваемых животных этот
эпителий представлен однослойным или многорядным пластом клеток
уплощенной, кубической или призматической формы. Архаичность
эпителиев кишечнополостных проявляется в слабой детерминирован-
ности их тканевой организации. Например, у гидры наружный эпите-
лий может возникать из железистых клеток кишечного эпителия. Кро-
ме того, у кишечнополостных широко распространены эпителиально-
мышечные клетки. Ядросодержащие части последних образуют погра-
ничный пласт на поверхности тела, а вытянутые базальные части
имеют миофибриллы, осуществляющие сократительную функцию.
Подобного рода смешанные дифференцировки (барьерные и ло-
комоторные) появились на поздних этапах эволюции в специализиро-
ванных тканевых системах высших животных. Наиболее характерным
примером таких нерасчлененных структур могут служить эпителиаль-
но-мышечные клетки дилятатора зрачка глаза позвоночных животных
Ядросодержащие части клеток здесь образуют пигментный слой, вы-
стилающий внутреннюю поверхность радужины, а вытянутые базаль-
80
Рис. 18. Кожные эпителии турбеллярий, коловраток
и паразитических плоских червей.
А — погруженный ресничный эпителий бескишечных турбеллярий
(J — эпителиальные и 2 — паренхимные клетки, 5 — мышечная клетка); Б —
однослойный ресничный эпителий турбеллярий
(7 — ресничные и 2 — железистые клетки, 5 — базальная мембрана); В —
однослойный синцитиальный эпителий коловраток
(7 — уплотнение апикальной цитоплазмы синцития, 2 — базальная мембрана);
Г-Д — погруженный эпителий цестод (Г) и трематод (Д)
U — псевдокутикулярная пластинка, 2 — ядросодержащая часть синцития,
3 — базальная мембрана, 4 — продольные н кольцевые мышцы,
5 — паренхимные клетки, 6 — микротрнхии, 7 — шипик, 8 — гранулы).
81
ные части клеток содержат миофибриллы, обеспечивающие сокраще-
ние радужной оболочки, увеличивая тем самым диаметр зрачка. Все
эти структуры образуются из нервного зачатка, т. е. представляют
собой эпителиально-мышечную дифференцировку весьма позднего в
филогенезе происхождения.
Важную роль в усложнении кожных эпителиев сыграло появление
специальных железистых клеток, выделяющих на поверхность тела
различного рода секреторные продукты. Многочисленные железистые
клетки характерны для кожных эпителиев актиний, гребневиков, тур-
беллярий, немертин, моллюсков (рис. 18, В, 2; 19, А, Г). Выделяемый
ими секрет создает сплошной слизистый слой, играющий заметную
роль в осуществлении барьерной и локомоторной функций эпителия
этих животных. Характерная особенность эпителия гребневиков —
сложный локомоторный ресничный аппарат. Мощно развитые длинные
реснички эпителиальных клеток соединяются между собой боковыми
поверхностями и образуют гребные пластинки — структуры, обеспе-
чивающие перемещение животных в толще воды.
Многорядные ресничные эпителии
Типичным примером многорядных эпителиев может служить эпи-
телий, покрывающий большую часть тела голожаберных моллюсков
(рис. 19, а, б). Это интегрированная тканевая система с выделением в
ней камбиальных и функционирующих клеток, ядра которых лежат на
разных уровнях. Эпителий отделен от подлежащей соединительной
ткани базальной мембраной. Непосредственно на ней располагаются
камбиальные клетки, не доходящие до поверхности пласта и содержа-
щие относительно небольшое количество цитоплазмы. Количество ба-
зальных клеток и обусловленная их делением интенсивность физио-
логической регенерации варьируют в широких пределах в разных
участках тела животных. Деление клеток происходит у базальной
мембраны (рис. 19, Д). Замещение в опытах с [3Н]тимидином диффе-
ренцированных клеток клетками с мечеными ядрами происходит
через 10-12 сут. после начала опыта. Процесс дифференцировки кле-
ток, следовательно, довольно продолжительный.
Дифференцированные клетки составляют основную часть эпите-
лиального пласта, их высота и количество определяют толщину эпи-
телия, которая также варьирует в разных участках тела.
Ядра дифференцированных клеток располагаются в их средней
части, т. е. удалены от базальной мембраны, что и придает эпителию
отчетливо выраженный многорядный характер. В морфофункциональ-
82
Рис. 19. Многорядные эпителии.
А, Б — многорядный железистый «защитный» (Я) и ресничный (£) эпителий голо-
жаберных моллюсков; В — эпителий дыхательных путей млекопитающих (многоряд-
ный ресничный); Г — кожный эпителий немертин; Д-Е — схемы процессов физио-
логической регенерации эпителиев дыхательных путей млекопитающих и кожных
эпителиев голожаберных моллюсков (Д) н кожных эпителиев немертин (£); стрелка-
ми показано направление перемещения клеток в митозе и при физиологической ре-
генерации: 7-5 — дифференцированные клетки (7 — ресничные, 2 — железистые,
3 — защитные), 4 — базальные и 5 — малодифференцированные
(вставочные) клетки, 6 — слизь.
83
ном отношении клетки эпителия голожаберных моллюсков делятся на
две категории: железистые (белковые и слизистые) и призматические
или кубические кроющие клетки. Последние могут иметь реснички.
Тогда эпителий приобретает характер многорядного ресничного эпи-
телия (рис. 19, Б). В других участках тела реснички у призматических
клеток отсутствуют, а цитоплазма заполнена большим количеством
ограниченных мембраной пузырьков и вакуолей (рис. 19, А). В таких
участках эпителий непосредственно соприкасается с гидроидными по-
липами — пищей моллюсков — и имеет, следовательно,' четко выра-
женный защитный характер.
Многорядный ресничный эпителий в воздухоносных путях назем-
ных позвоночных обеспечивает наряду с барьерной функцией очистку
воздуха, поступающего в респираторные отделы дыхательной системы
от твердых частиц. Этот эпителий (рис. 19, В) по строению сходен с
многорядным ресничным эпителием моллюсков. Наружная поверх-
ность эпителиального пласта образована плотно расположенными апи-
кальными концами дифференцированных элементов дух типов: кону-
совидных ресничных и бокаловидных железистых клеток. Синхронная
работа ресничного аппарата обеспечивает непрерывное перемещение,
выделяемой бокаловидными клетками слизи, с приставшими к ней
инородными частицами в направлении, обратном движению поступа-
ющего из внешней среды воздуха.
Нижняя половина пласта заполнена базальными и вставочными
клетками, представляющими собой камбиальные и дифференцирую-
щиеся клеточные элементы. Особенностью этого эпителия у млекопи-
тающих животных и человека является относительно медленный темп
физиологической регенерации. Для многорядного эпителия, выстила-
ющего воздухоносные пути, характерно длительное существование
дифференцированных клеток и продолжительный митотический цикл
базальных камбиальных клеток. Благодаря этому рассматриваемая тка-
невая система обладает мощными пролиферативными потенциями, ко-
торые отчетливо выявляются при репаративной регенерации.
В многорядных ресничных эпителиях млекопитающих способ-
ностью к синтезу ДНК и делению обладают не только базальные, но
и вставочные клетки, интенсивность размножения которых выше, чем
базальных клеток. Такая гетерогенность пролиферирующих клеток по-
зволяет предположить тенденцию к разделению камбиальной системы
на две субпопуляции: непосредственно производящую клетки для об-
новления дифференцированных элементов и резервную субпопуляцию
стволовых клеток, обеспечивающую периодическое обновление «ра-
бочего» камбия. Возможно, что такой принцип организации камбиаль-
о л
ной системы в многорядных эпителиях свойствен и другим его раз-
новидностям.
Большие пролиферативные потенции многорядного призматичес-
кого эпителия млекопитающих обнаруживаются также при нарушении
нормальных взаимоотношений между размножением и дифференциа-
цией клеток при злокачественных перерождениях эпителия. Злокаче-
ственные новообразования, возникающие из эпителиальной выстилки
воздухоносных путей у человека, относятся к числу наиболее быстро
растущих опухолей.
Несмотря на сходные принципы организации ресничных эпители-
ев низших многоклеточных и позвоночных в последнем случае рес-
ничный эпителий представляет собой вторичную в эволюции позво-
ночных тканевую дифференцировку. Она возникает на основе харак-
терных для них многослойных кожных эпителиев. При различного
рода экстремальных воздействиях (пары формалина, ме-ханические
повреждения, специфические гормональные воздействия) ресничный
эпителий обнаруживает отчетливую способность к превращению в
типичные многослойные пласты.
Кожные многорядные ресничные эпителии широко распростране-
ны и у некоторых современных низших многоклеточных животных.
Они образуют покровы у высших турбеллярий и немертин. Их орга-
низация сходна с рассмотренной выше организацией многорядных
эпителиев моллюсков и позвоночных животных. У беломорской не-
мертины Linens rubrum эпителиальный пласт располагается на базаль-
ной мембране, ограничивающей его от паренхимы. Это типичный
многорядный эпителий с хорошо выраженной системой базальных
камбиальных клеток и дифференцированными ресничными и железис-
тыми клетками (рис. 19, Г). Особенность его состоит в том, что ми-
тотические деления наблюдаются преимущественно на верхних уров-
нях эпителиального пласта. Подготовка к делению, в частности синтез
ДНК, происходит в клетках, ядра которых располагаются у базальной
мембраны.
Таким образом, в многорядном ресничном эпителии немертин и,
по-видимому, высших турбеллярий имеет место характерная для одно-
слойных эпителиев миграция клеток при прохождении митотическо-
го цикла. Особенно наглядно такую миграцию удается проследить
с помощью метода тимидиновой радиоавтографии. На ранних сро-
ках после введения [3Н]тимидина меченые ядра располагаются в ба-
зальной части пласта. Затем в течение периода G2 клетки с мечены-
ми ядрами перемещаются к апикальной поверхности пласта, где в
результате деления и образуются две дочерние клетки. Последние
85
могут вступить в новый митотический цикл или дифференцироваться
в железистые или ресничные клетки. В обоих случаях дочерние клетки
вновь перемещаются к базальной мембране (рис. 19, Е). У некоторых
немертин наблюдается и значительно более сложная организация кож-
ных покровов. Однако рассмотрение этих случаев выходит за рамки
данного учебника.
§2. КУТИКУЛЯРНЫЕ ЭПИТЕЛИИ
Кутикулярные эпителии — наиболее широко распространенная у
современных многоклеточных разновидность кожных эпителиев. Они
имеются у оболочников, аннелид, приапулид, моллюсков, членистоно-
гих, нематод и других типов животных. Несмотря на большое разно-
образие, все они имеют три общие для любого кутикулярного эпителия
особенности. Во-первых, они построены из одного эпителия и выде-
ляемого им внеклеточного вещества — кутикулярной пластинки. Во-
вторых, кутикулярная пластинка состоит из фибриллярных структур
и цементирующего аморфного вещества — матрикса; наконец, третье
общее свойство кутикулярных эпителиев — постоянный или времен-
ный контроль за внеклеточными структурами со стороны образующих
их клеток.
В зависимости от конкретной структурно-химической организа-
ции можно выделить три основные разновидности кутикулярных эпи-
телиев: а) кутикулярные эпителии, в основе организации кутикулы
которых лежат полисахаридно-белковые фибриллярные структуры, —
артроподный тип; б) кутикулярные эпителии, основу кутикулы кото-
рых образует сеть коллагеновых волокон, — аннелидный тип; в) ку-
тикулярные эпителии с многослойной гетерогенной по своему составу
кутикулой — нематодный тип.
Кутикулярные эпителии артроподного типа
Кутикула в этих эпителиях построена на основе фибрилл, состо-
ящих из линейных молекул нейтральных полисахаридов — хитина или
целлюлозы в комплексе с белками. В качестве аморфного матрикса
обычно используются кислые полисахариды (глюкозаминогликаны),
которые в ряде случаев, например у наземных членистоногих, заме-
щаются белками и липидами. В большинстве таких эпителиев вся
кутикулярная пластинка или ее наружные слои стабилизируются за
счет ковалентных связей между белковыми молекулами. Такая стаби-
лизация белково-полисахаридного материала обеспечивается или пу-
т м о разования дисульфидных связей, или путем фенольного задуб-
ливания (склеротизация).
86
Нередко дополнительная механическая прочность достигается
благодаря биоминерализации — импрегнации кутикулярных структур
карбонатом или фосфатом кальция или соединениями кремния, железа,
цинка и других металлов.
Кутикулярные эпителии артроподного типа чрезвычайно широко
распространены у современных беспозвоночных. Они имеются у не-
которых кишечнополостных, в двух вариантах у моллюсков, аннелид,
приапулид и наибольшего развития достигают у членистоногих и обо-
лочников. Естественно, что у представителей каждого типа животных
этот эпителий характеризуется особенностями, связанными с незави-
симым развитием их кутикулярных структур. Эти различия касаются
конкретного проявления общих особенностей организации кутикуляр-
ных эпителиев. Например, у большинства беспозвоночных фибриллы
построены на основе хитина, а у оболочников используется целлюлоза.
Однако физико-химические свойства целлюлозных и хитиновых воло-
кон, механизмы их синтеза, способы укладки, характер связи с белками
и механизмы стабилизации полисахаридно-белковых структур оказы-
ваются сходными.
Для большинства кутикулярных эпителиев артроподного типа ха-
рактерен контроль за внеклеточным веществом, который осуществля-
ется эпителиальными клетками, а часто и специальными клетками
тканей внутренней среды — гранулярными амебоцитами. Однако в
перидерме гидроидных полипов, раковинной железе моллюсков и ще-
тинках полихет такой контроль либо носит периодический характер,
либо имеет место только в момент образования межклеточной струк-
туры.
Членистоногие. У членистоногих кутикулярный эпителий типич-
ного артроподного типа достигает наибольшей сложности и многооб-
разия. Для представителей этого типа животных и в гистологическом,
и в химическом отношении характерна сходная организация эпителия.
Одинакова и его биологическая роль как наружного скелета этих
животных. Однако в пределах общего плана строения кутикулярного
эпителия значительно варьируют частные признаки его организации у
представителей отдельных классов, родов и даже видов в связи с
особенностями среды обитания и степени филогенетического родства.
Большие различия в строении кутикулярного эпителия наблюдаются
в пределах одного организма.
Кутикула наземных членистоногих состоит из прокутикулы —
основной части — и покрывающей ее эпикутикулы (рис. 20, А). Про-
кутикула имеет слоистое строение и образована главным образом
хитином и белками, из которых формируются сложные фибрилляр-
87
ные и пластинчатые структуры. Хитина может быть в несколько раз
меньше, чем белков (около 20%), или его содержание несколько пре-
вышает'количество белков (до 60%), хотя обычно встречаются при-
мерно равные соотношения этих компонентов. В состав кутикулы
входят также гликопротеиды и липиды. Кроме того, в кутикуле водных
членистоногих и гибкой межсегментной мембране насекомых имеются
кислые полисахариды. Прокутикула обычно подразделяется на на-
ружный, бо-лее прочный слой — экзокутикулу — и внутренний элас-
тичный — эндокутикулу (рис. 20, А, 2-4). Такое расслоение проку-
тикулы обусловлено происходящей в ее наружном слое стабилиза-
цией полисахаридно-белкового материала. У большинства насекомых,
хилопод, паукообразных и высших ракообразных она обеспечивает-
ся фенольным задубливанием. У морских пауков — пантопод, низ-
ших насекомых и личинок двукрылых склеротизация кутикулы про-
исходит путем образования дисульфидных связей между белко-
выми молекулами. Дополнительная прочность кутикулы у многоно-
жек, некоторых насекомых и особенно высших раков обеспечивается
включением в экзо- и эндокутикулу углекислого и фосфорнокислого
кальция.
В свою очередь, и экзокутикула может быть склеротизирована в
разной степени. Слабо задубленная экзокутикула (экзокутикула I), или
мезокутикула, эластична и способна связывать гистологические кра-
сители (рис. 20, А, Б, 3). При дальнейшей склеротизации она утрачи-
вает эластичность, становиться химически инертной и приобретает
янтарно-желтый цвет (экзокутикула II). Соотношение слоев прокути-
кулы значительно варьирует у разных видов, в разных участках по-
кровов одного животного и на разных стадиях формирования кутику-
лы. Например, синтезируемая во время линьки прокутикула состоит
из эндокутикулы. Такое строение сохраняют после линьки и покровы
некоторых водных личинок насекомых (рис. 20, Б). Напротив, в участ-
ках покровов, несущих максимальную механическую нагрузку, — эли-
трах и мандибулах — вся кутикулярная пластинка может быть пред-
ставлена высоко склеротизированной экзокутикулой II (4).
У большинства современных членистоногих имеются структурные
механизмы взаимодействия внеклеточного вещества кутикулы и клеток
покровного эпителия — гиподермы. Прокутикула содержит так назы-
ваемые поровые каналы, в которые заходят отростки эпителиальных
клеток микроворсинки (рис. 20, А, 8). Поровые каналы пронизыва-
ют всю толщу прокутикулы и обычно заканчиваются на границе с
эпикутикулой системой восковых канальцев (рис. 20, В, 7, 8). Коли-
чество несущих клеточные отростки поровых каналов особенно велико
88
-----10
Рис. 20. Кутикулярные эпителии членистоногих.
Л — кутикула насекомых (7 — гиподерма, II — прокутикула, III — эпикутику-
па); Б — соотношение слоев кутикулы в разных участках тела и на разных эта-
пах склеротизации: 1 — эпителиальные клетки гиподермы, 2 — эндокутикула,
3 — экзокутикула: I, 4 — экзокутикула, II, 5 — базальная мембрана, б — эно-
цит, 7 — одноклеточная гмподермальная железа, 8 — цитоплазматические от-
ростки, 9 — проток гиподермальной железы, 10 — чувствительные волоски.
В — эпикутикула насекомых: I — экзокутикула, 2 — белковая эпикутикула,
5 — кутикулиновая пластинка, 4 — восковой слой, 5 — цеметный слой,
б — поверхностные липиды, 7 — цитоплазматический отросток в поровом
канале, 8 — восковые канальцы.
89
в кутикуле насекомых и может достигать одного миллиона на квад-
ратный миллиметр.
Эволюционная пластичность кутикулярных эпителиев членисто-
ногих наиболее ярко проявилась при формировании верхнего пласта
кутикулы — эпикутикулы {3—6). Несмотря на незначительную тол-
щину (0,5-2,0 мкм), он выполняет исключительно важную функцию.
Именно он делает возможным обитание членистоногих в воздушной
среде, предохраняя ткани животного от пересыхания. При электрон-
но-микроскопических исследованиях в эпикутикуле насекомых выяв-
лены четыре основных слоя: цементный, восковой, кутикулиновая
пластинка и внутренний, наиболее толстый — белковый (5—2). Осо-
бенностью химического состава эпикутикулы является отсутствие хи-
тина. Ее вещество представлено главным образом липидами и липо-
протеиновыми комплексами, которые осуществляют барьерную функ-
цию, а также белками. Внутренний белковый слой и кутикулиновая
пластинка формируются клетками гиподермы во время линьки. Це-
ментный слой эпикутикулы образуется благодаря секреторной деятель-
ности клеток специальных цементных желез. Липиды проникают в
эпикутикулу через систему специальных восковых канальцев, связан-
ных с поровыми каналами прокутикулы {8). Имеются веские основания
полагать, что за счет непрерывного поступления липидов над кутику-
линовой пластинкой формируется динамичный, постоянно обновляю-
щийся липопротеиновый восковой слой. Предполагается, что он играет
основную роль в предохранении тканей от пересыхания. Кроме того,
на поверхность эпикутикулы выделяются липидные вещества (б), ко-
торые, особенно у пустынных насекомых, также участвуют в предот-
вращении диффузии.воды из организма*.
Эпикутикула характерна для всех представителей членистоногих,
ведущих наземный образ жизни. Однако ее химический состав и струк-
тура отличаются у отдельных классов членистоногих рядом сущест-
венных особенностей. Так, у скорпионов в эпикутикуле используются
иные, чем у насекомых, липиды, а у пауков отсутствует кутикулиновая
пластинка. Тем не менее и по своей биологической роли, и по струк-
турной организации эпикутикула — это, несомненно, единое новооб-
разование в типе членистоногих, позволившее им расселиться в воз-
душной среде.
Как показывают палеонтологические данные, выход на сушу про-
—ходил независимо в разных классах членистоногих и, следовательно,
~ " данные 0 том> что липопротеиновый (восковой) слой эпику-
тикулы образуется в основном специальными восковыми железами.
90
водонепроницаемая эпикутикула возникала в кожных покровах чле-
нистоногих независимо, как проявление сходных потенций кутикуляр-
ных эпителиев общих предков.
Особенно наглядно эволюционная пластичность кутикулярных
эпителиев выступает у насекомых, среди которых есть виды, вторично
переходившие из воздушной среды к водному образу жизни и снова
возвращавшиеся к обитанию в воздушной среде. Для представителей
этих видов насекомых установлено, что переход к водному образу
жизни приводил к утрате эпикутикулы и, наоборот, возвращение в
воздушную среду — к ее вторичному новообразованию*.
Естественно, что сложная организация кутикулы у членистоногих
связана с высоким уровнем дифференцировки образующих ее клеток,
которые составляют основную часть клеточных элементов однослой-
ного кутикулярного эпителия (рис. 20, А, 7). Помимо них в составе
эпителиального пласта имеются железистые клетки, формирующие у
наземных членистоногих, в первую очередь у насекомых, особые ин-
терэпителиальные железы (7). Их секрет идет на построение цемент-
ного, а возможно и воскового, слоя эпикутикулы. Железы образованы
полиплоидными секреторными клетками. Кроме того, как и у высших
позвоночных, в кожных покровах насекомых формируются более круп-
ные железистые образования, выполняющие специальные функции
(железы, синтезирующие феромоны; «молочные» железы тлей и др.).
У многих насекомых в составе эпителиального пласта имеются
особые крупные полиплоидные клетки — эноциты (б). Их функцио-
нальное значение остается недостаточно ясным. Имеются данные об
участии этих клеток в синтезе липидов кутикулиновой пластинки. В
составе эпителия многих насекомых обнаружены так называемые мо-
чевые клетки — своеобразные почки накопления продуктов белкового
обмена. У личинок некоторых водных насекомых описаны клетки,
регулирующие солевой обмен. По функции и структурно-химической
организации они аналогичны солевым клеткам позвоночных.
Особенно ярко организменный контроль дифференцировки и фун-
кциональной активности клеток кутикулярного эпителия проявляется
в процессах линьки (рис. 21). Под воздействием гормона линьки эк-
дизона в клетках эпителия развертывается цепь последовательных про-
цессов, конечный результат которых — замена старой кутикулы на
новую. Активизации гетеросинтетических процессов в клетках часто
предшествует период усиленной пролиферации. Увеличение количе-
* У многих ракообразных, ведущих водный образ жизни, на поверхности прокутикулы
обнаружены структуры, сходные с нижними слоями эпикутикулы (кутикулиновая плас-
тинка).
91
Я 5
Рис. 21. Процесс, происходящий при линьке в кутикулярном эпигелии насекомых на ультраструкгурном (слева)
и тканевом (справа) уровнях организации.
А — кутикулярный эпителий в предлиночный период; Б-Д — стадии линьки (Б — формирование пылевидного
секрета, В — выделение грубозернистого секрета в неактивной форме, Г — активизация гидролитических ферментов,
Д — образование кушкулиновой пластинки).
ства клеток приводит к изменению их формы: они становятся куби-
ческими или даже высокопризматическими. Первым синтезируемым
соединением является мелкий, так называемый пылевидный секрет,
оттесняющий апикальную поверхность клеток от внутреннего слоя
эндокутикулы (рис. 21, Б). В образующееся пространство выделяют-
ся секреторные продукты второго типа, так называемый грубозер-
нистый секрет, состоящий из комплекса гидролитических ферментов
(рис. 21, В, Г). Последние существуют вначале в неактивной форме
благодаря, по-видимому, своеобразной конфигурации белковых моле-
кул. Вскоре после начала образования грубозернистого секрета разру-
шаются клеточные отростки, а на поверхность плазматической мем-
браны начинает выделяться липопротеидная кутикулиновая пластин-
ка — внутренняя часть новой эпикутикулы (рис. 21, Г, Д), По мере
образования кутикулиновой пластинки выделенный ранее грубозер-
нистый секрет переходит в активную форму, и начинается интенсивное
растворение старой кутикулы. Образующиеся в результате гидролиза
старого хитина и белков низкомолекулярные продукты всасываются
гиподермальными клетками и используются организмом для форми-
рования новых белков и хитина. На следующих этапах линьки эпите-
лиальные клетки последовательно выделяют вещества для формиро-
вания внутреннего белкового слоя эпикутикулы и хитино-белкового
материала прокутикулы.
Образование хитиновых фибрилл, подобно формированию целлю-
лозных фибрилл в клеточных стенках растений, происходит, по-види-
мому, при помощи мультиэнзимных комплексов хитинсинтетазы плаз-
матической мембраны клеток. Большую роль в сложной функциональ-
ной деятельности гиподермальных клеток (всасывание продуктов раз-
рушения старой кутикулы и выделение вновь синтезированных про-
дуктов) играют микроворсинки. Их образование начинается с момента
выделения клетками первых слоев экзокутикулы. На завершающих
этапах формирования новой кутикулы в верхние слои прокутикулы
при помощи клеточных отростков выделяются фенольные продукты и
фенолоксидаза. Фермент запускает процессы фенольного задублива-
ния, которые начинаются в белковом слое эпикутикулы и затем рас-
пространяются вглубь и на верхние слои прокутикулы. В результате
склеротизации прокутикула подразделяется на экзо- и эндокутикулу,
т. е. приобретает дефинитивную структуру. Морфологически это про-
является в утрате верхними пластами прокутикулы первичной слои-
сто структуры. К моменту завершения всех вышеописанных процес-
сов активизируется секреторная деятельность желез. Продукты их вы-
ления завершают формирование эпикутикулы, образуя ее верхние
94
ело». Одновременно образуются структурные липиды. Они выделяют-
ся отросткам» клеток кутикулярного эпителия и попадают в верхние
слои эпикутикулы через систем у поровых каналов и специальных
канальцев кутикулиновой пластинки.
Детали изменений в клетках эпителия в ходе линьки у предста-
вителей разных видов насекомых и других членистоногих могут ши-
роко варьировать. Однако суть процесса одинакова для всех членис-
тоногих. В период линьки в клетках кутикулярного эпителия проис-
ходит последовательная активация разных синтетических процессов.
Помимо всасывающей и гетерогенной синтетической деятельности в
клетках кутикулярного эпителия резко активизируются системы, обес-
печивающие поступление из гемолимфы ряда высокомолекулярных
соединений и фенольного субстрата, необходимых для построения
кутикулы. Весьма дифференцирован в клетках аппарат Гольджи, от-
дельные комплексы которого распределены в разных участках клетки
(базальной, центральной и апикальной) и выполняют, по-видимому,
различные функции.
Асцидии. Основную часть значительного по толщине кутикуляр-
ного эпителия асцидий составляет мощно развитая кутикула — туника.
Формирующий ее эпителий образован одним слоем клеток без клеточ-
ных отростков. В клетках эпителия удается выявить умеренно разви-
тую эндоплазматическую сеть, многочисленные комплексы Гольджи
и много митохондрий. В клетках постоянно идут синтетические про-
цессы и особенно интенсивно синтез полисахаридов.
Кутикула асцидий состоит из толстого внутреннего слоя — эн-
докутикулы — и относительно тонкого наружного — экзокутикулы
(рис. 22, А). Эндокутикула построена из целлюлозных волокон в ком-
плексе с белками, погруженных в аморфный матрикс из сульфатиро-
ванных гликозаминогликанов. Наружный слой туники — экзокутику-
ла — состоит из склеротизировэнных белков. На вершине шипов он
представлен сильно задубленной экзокутикулой II. Полисахаридные
структуры синтезируются эпителиальными клетками и отлагаются ап-
позиционным путем. Волокна целлюлозы формируются, вероятно, как
у насекомых и растений, ферментами, вмонтированными в плазмати-
ческую мембрану. Кроме того, эпителиальные клетки секретируют
сульфатированные гликозаминогликаны матрикса и часть белкового
материала эндокутикулы. В местах наиболее интенсивного синтеза
туники обнаружен и другой способ выведения межклеточного веще-
ства — макроапокриновая секреция (рис. 22, Б).
Как отмечалось выше, у членистоногих вещества, необходимые
Для фенольного задубливания, поступают в кутикулу из гемолимфы
95
по микроворсинкам эпителиальных клеток. У асцидий синтез и транс-
портировка этих веществ осуществляется морулярными клетками кро-
ви (рис. 22, А, Б). При дифференцировке в гранулах амебоцитов на-
капливаются фенолы, фенолоксидаза и мономерный белок с большим
количеством свободных аминогрупп. Зрелые гранулярные амебоциты
активно мигрируют в кутикулярную пластинку. Одни клетки выделяют
содержимое гранул в эндокутикуле, образуя сеть белковых волокон,
другие достраивают экзокутикулу, целиком трансформируясь в мате-
риал наружного слоя — задубленные фенолами белки (рис. 22, А, 3).
Последний процесс можно рассматривать как своеобразную голокри-
новую секрецию. Образование защитного белкового слоя в результате
массового разрушения морулярных клеток происходит и при повреж-
дении кутикулы в качестве первого этапа ее репарации.
Приапулиды. У приапулид покровный эпителий образован одним
слоем клеток призматической, кубической или уплощенной формы,
синтезирующих вещества кутикулы. Кутикула подразделяется на два
слоя — экзо- и эндокутикулу (рис. 22, Г). Обычно более толстая фи-
бриллярная эндокутикула состоит из хитина, незначительного количе-
ства белков и сульфатированных полисахаридов. Тонкая оксифильная
экзокутикула целиком образована задубленными белками. Соотноше-
ние двух слоев кутикулы приапулид варьирует в разных отделах те-
ла животных. Так, кутикула, покрывающая различные железистые и
чувствительные органы образована в основном экзокутикулой. Свое-
образную модификацию кутикулярного эпителия приапулид представ-
ляют собой участки, несущие большую механическую нагрузку, на-
пример так называемые «зубы», покрывающие поверхность подвиж-
ной глотки этих животных. Эпителий «зуба» образован сильно вы-
тянутыми призматическими клетками, выделяющими мощную кути-
кулу в виде заостренных шипов (рис. 22, В). Экзокутикула на верши-
не шипа подвергается дополнительному фенольному дублению, в ре-
зультате которого («на уже не окрашивается гистологическими краси-
телями и становится сходной с экзокутикулой II членистоногих и
асцидий.
Кутикула приапулид — структура, подверженная периодическому
обновлению — линькам. Интенсивность синтетической деятельности
клеток эпителия повышается в период, непосредственно предшествую-
щий линьке, когда под старой кутикулой образуется новая (рис. 22, Д)-
С помощью электронно-микроскопических исследований и мета-
болической радиоавтографии установлен сложный механизм форми-
рования кутикулярной пластинки во время линьки. Показано, что в
клетках предличиночного эпителия синтезируются, по крайней мере,
96
Рис. 22. Кутикулярный эпителий асцидий и приапулид.
А, Б — строение кутикулы (туники) асцидий (/1) и апокриновая секреция
материала эндокутикулы (£'), В — глоточный зуб приапулид; Г-Д — кутикула
приапулцд до начала линьки (Г) и во время линьки (Ду.
1 — эпителий, 2 — эндокутикула, 3 — экзокутикула, 1.4 — экзокутикула //,
5 — морулярные клетки.
два типа секрета: гранулярный и фибриллярный. Вначале синтезиру-
ется белковый гранулярный секрет, из которого строится наружный
слой кутикулы — экзокутикула. Затем образуется фибриллярный сек-
рет, который выделяется под новую экзокутикулу и формирует внут-
ренний слой — эндокутикулу. Эпителиальные клетки в это время
продолжают синтезировать гранулярный секрет, т. е. на протяжении
всего периода формирования новой кутикулы, как показано в радио-
автографических опытах, продолжается, хотя и с меньшей интенсив-
ностью, достройка новой экзокутикулы за счет белков, диффундиру-
ющих через формирующуюся эндокутикулу. Возможно, вместе с бел-
97
ками в экзокутикулу диффундируют также предшественники феноль-
ного дубления. Таким образом, при формировании новой кутикулы
имеют место два механизма ее роста: обьгчный аппозиционный, от
поверхности эпителиальных клеток, и диффузионный механизм до-
стройки, связанный с перемещением выделяемых клетками соединений
через образующуюся кутикулу в ее верхние слои.
Своеобразную разновидность кутикулярных эпителиев артропод-
ного типа представляют собой щетинки кольчатых червей, основные
химические компоненты щетинки — хитин и белки. Хитино-белковый
комплекс щетинок стабилизируется фенольным дублением и импрег-
нацией соединениями железа. Основания щетинок у полихет погруже-
ны в толщу стенки в области параподий, где кутикулярный эпителий
образует глубокие впячивания — так называемые щетинконосные
мешки (рис. 23, А). Основными клеточными элементами щетинконос-
ных мешков являются базальные клетки — хетобласты — и латераль-
ные клетки (рис. 23, Б). Каждая щетинка формируется одним хетоб-
ластом и несколькими латеральными клетками. Хетобласт отличается
большими размерами, на его апикальной поверхности имеется система
длинных микроворсинок, в плазматическую мембрану которых встро-
ены молекулы фермента хитинсинтетазы. В области каждой микро-
ворсинки происходит интенсивное выделение хитино-протеиновых
фибриллярных комплексов. Из них формируются трубчатые структу-
ры, составляющие основу щетинки. Совокупность трубчатых структур
спаяна с аморфным матриксом, который выделяется и базальной, и
латеральной клетками. Хетобласты секретируют и фенолоксидазу,
тогда как фенольный субстрат, по-видимому, выделяется и базальной,
и латеральными клетками. Латеральные клетки продуцируют также
поверхностные слои щетинки, которые и в структурном, и в химичес-
ком отношении отличаются от ее основной части.
В разных щетинках удельный вес синтетической деятельности
хетобластов и латеральных клеток, по-видимому, варьирует. Основные
щетинки — ацикулы — формируются главным образом базальными
клетками. В образовании вспомогательных мелких щетинок сущест-
венная роль принадлежит синтетической деятельности латеральных
клеток.
В сформированной щетинке базальная клетка дегенерирует. Ще-
тинки у многих животных функционируют относительно недолго и
заменяются новыми, непрерывно формирующимися в каждом щетин-
коносном мешке. В опытах с рН]тимидином показано, что щетинко-
носный мешок весьма динамичная поляризованная система, в ко-
торой процессы репродукции, последовательные этапы специфической
98
дифференцировки и гибели клеток топографически строго разграни-
чены (рис. 23, А).
Щетинки возникали в процессе эволюции, по-видимому, неодно-
кратно. Они и подобные им образования обнаружены у погонофор,
брахиопод и даже головоногих моллюсков.
Сложным в гистологическом и цитологическом плане примером
кутикулярных эпителиев артроподного типа является эпителий брю-
хоногих моллюсков, который выстилает передние отделы пищевари-
тельного тракта и формирует радулярный аппарат.
Кутикулярный эпителий ротовой полости — гетерогенная по
внешнему виду пограничная ткань. На внутренней стороне челюстей
у голожаберных моллюсков он представлен плоскими клетками, по-
Рис. 23. Строение щетинконосного мешка (Я) и отдельного фолликула
сформированной щетинки (Б) у полихет.
Зоны мешка — пролиферативная (/), роста щетииковых фолликулов (//), функциони-
рующих щетинок (III), дегенерации (IP): I — покровный эпителий, 2 — кутикула,
3 — Одноклеточные железы, 4 — базальные клетки (хетобласты), 5 — микроворсин-
ки хетобласта, 6 — латеральные клетки, 7 — щетинки, 8-9 — центральная часть
и корковое вещество щетинки.
99
крытыми толстой склеротизированной кутикулой. На наружной сто-
роне челюстей имеется слой высокопризматических клеток, выделяю-
щих эластичную, менее склеротизированную кутикулу. Методом ра-
диоавтографии показано, что эта кутикула непрерывно обновляется за
счет новых слоев внеклеточного вещества, выделяемого на апикальной
поверхности эпителиальных клеток. Органическую основу кутикулы,
независимо от ее топографических различий, составляют хитино-про-
теиновые фибриллы и пластинки, погруженные в гликопротеиновый
матрикс.
Наиболее сложно организован эпителий радулярного аппарата
(рис. 24). Его основу составляют две популяции малодифференциро-
ванных клеток (2), разделенные крупными полиплоидными клетками
(/).0ни располагаются в основании глубокой складки покровов —
радулярном мешке, из которого происходит рост и обновление раду-
лярного аппарата. Размножающиеся малодифференцированные клетки
обновляют две разновидности вспомогательного радулярного эпите-
лия — «верхний» (4), по отношению к формирующейся радуле, и
«нижний» (3) эпителиальные пласты. Предполагается, что часть мало-
дифференцированных клеток может идти по пути полиплоидизации и
обеспечивать обновление полиплоидных клеток.
Рис. 24. Куктикулярный эпителий радулы моллюсков.
1 базальные клетки (одонтобласты), 2 — камбиальные зоны, 3 — нижний
раодлярный эпителий, 4 — верхний радулярный эпителий, 5 — кутикуляр-
ны эпителий верхней губы, 6 — базальная пластинка радулы (эндокутику-
ла), 7 — формирующийся радулярный зубчик, 8-9 — молодой (экзокутику-
ла 7) и зрелый (экзокутикула II) радулярные зубчики.
100
Радула — это кутикула, верхняя часть которой образует радуляр-
Hbie зубчики. Главную роль в ее формировании играют полиплоидные
клетки — «одонтобласты». Они несут на своей поверхности мощно
развитый аппарат микроворсинок и выделяют хитино-белковые фиб-
риллярные структуры, составляющие основу радулы. Форма зубчиков
определяется, по-видимому, координированной деятельностью поли-
плоидных клеток «верхнего» эпителия. Радулярная пластинка посто-
янно смещается в краниальном направлении вместе с подстилающим
ее «нижним» эпителием. Смещение обусловлено постоянным обнов-
лением клеток «нижнего» и «верхнего» эпителиев за счет пролифери-
рующих малодифференцированных клеток радулярного мешка. По ме-
ре передвижения радулы происходит окончательная «достройка» зуб-
чиков в основном благодаря синтетической деятельности клеток «верх-
него» радулярного эпителия. Последние выделяют дополнительные
органические компоненты и осуществляют фенольное задубливание и
биоминерализацию вещества зубчиков. В результате этих процессов
кутикула подразделяется на базальную часть — эндокутикулу — и
радулярные зубчики, образованные прочной экзокутикулой.
Кутикулярные эпителии аннелидного типа
Эта разновидность эпителиев характеризуется наличием в кути-
куле большего или меньшего количества слоев коллагеновых волокон.
В соседних слоях волокна располагаются под углом 90°. Образующие
волокна коллагеновые фибриллы существенно отличаются от соеди-
нительнотканного коллагена и не имеют характерной для него попе-
речной исчерченности. Над слоями коллагеновых волокон и в проме-
жутках между ними располагаются аморфный и фиброзный матриксы,
образованные мукополисахаридами и неколлагеновыми белками
(рис. 25). У аннелид слой коллагеновых волокон в кутикуле пронизан
длинными микроворсинками, которые, имея на концах характерные
булавовидные расширения, выходят на поверхность кутикулы (рис. 25,
А). Они могут отшнуровываться и формировать на поверхности кути-
кулы слой сферосом — округлых телец, ограниченных плазматической
мембраной (б).
Непосредственный контакт апикальных концов микроворсинок с
наружной средой связывают с широко распространенным у кольчатых
червей явлением — поглощением органических веществ через кожные
покровы. Наличие такого питания было показано в опытах с мечеными
предшественниками. Анализ формирования кутикулы в онтогенезе и
при регенерации показал, что вначале образуется поверхностный фиб-
розный мукополисахаридный матрикс. Его образование — необходи-
101
мое условие для полимеризации предшественников коллагеновых во-
локон внутренних слоев кутикулы. Эти предшественники выделяются
клетками путем мерокриновой секреции.
При всем многообразии кольчатых червей общий план организа-
ции кутикулярных эпителиев сходен у подавляющего большинства их
представителей. Специфические особенности, наблюдаемые в стро-
ении кутикулярного эпителия различных представителей полихет, оли-
гохет и пиявок, касаются в основном количественных показателей
(число слоев коллагеновых волокон, соотношение толщины поверх-
ностной и основной частей кутикулярного эпителия, соотношение ко-
личества железистых и призматических клеток и т. д.).
Относительно мало известно о процессах физиологической реге-
нерации в кутикулярных эпителиях аннелид. Предварительные данные
показывают, что у такой широко распространенной полихеты, как
пескожил Arenicola marina, в эпителии наружных покровов и обо-
нятельной ямки удается обнаружить недифференцированные участки
эпителиального пласта. Здесь часто наблюдаются митозы: после вве-
дения [3Н]тимидина значительная часть клеток содержит меченые яд-
ра. Эти факты свидетельствуют о том, что у некоторых полихет в
кожных эпителиях постоянно обновляются их дифференцированные,
функционирующие клеточные элементы.
Значительный интерес представляет и система базальных клеток
в кутикулярных эпителиях некоторых олигохет, в частности дождевого
червя. Изучение репаративной регенерации кожных покровов у этих
животных показало некоторую автономность пролиферативных про-
цессов в этой клеточной системе. Возможно, что она аналогична сис-
теме базальных клеток в кишечных эпителиях некоторых полихет.
Кутикулярные эпителии аннелидного типа помимо кольчатых чер-
вей имеются у погонофор, сипункулид и волосатиков. У последних
двух групп животных они отличаются по плану строения от обычного
меньшим развитием (сипункулиды) или даже отсутствием (волосатики)
аппарата микроворсинок (рис. 25, Б, В).
Кутикулярные эпителии аннелидного типа неоднократно и неза-
висимо возникали в процессе эволюции, хотя и обнаруживают у со-
временных представителей разных типов большое сходство в своей
структурно-химической организации.
У низших полихет, мелких форм, а также на ранних стадиях
развития полихет кутикулярная пластинка не содержит крупных во-
локон и образована тонкими беспорядочно ориентированными кол-
лагеновыми фибриллами, заключенными в мукопротеидный матрикс
(рис. 25, Г). Предполагается, что подобное строение является первич-
ным, исходным в развитии рассматриваемой разновидности кутику-
102
лярных эпителиев. Существует мнение, что аннелидная кутикула могла
возникать на основе гипертрофии гликокаликса па поверхности мик-
роворсинок эпителиальных клеток (рис. 25, £). Действительно извест-
ны примеры кутикул промежуточного типа (у низших полихет, лоба-
тоцеребрид и иглокожих), представленные тонкой фиброзной муко-
протеидной пластинкой (рис. 25, Д).
Рис. 25. Кутикулярные эпителии аннелидного типа.
А — аннелиды и погонофоры; Б — сипункулиды; В — волосатики, Г — ли-
чинки полихет; Д — архианнелиды и лобатоцеребриды; Е — турбеллярий:
/ — эпителиальные клетки, 2 — микроворсинки эпителиальных клеток,
3 — коллагеновые волокна, V — гликопротеилиый матрикс,
5 — наружный слой кутикулы, б — сферические тельца,
7 — гликокаликс.
Кутикулярные эпителии нематодного типа
Эти эпителии образуют одну из наиболее сложных по своей
организации покровных структур беспозвоночных. Они выполняют как
опорную, так и совершенную барьерную функции, что позволяет не-
матодам осваивать самые разнообразные экологические ниши.
Покровные эпителий — гиподерма — у большинства нематод
синцитиального строения. Несмотря на значительные видовые вариа-
ции, кутикула этих животных имеет принципиально единый план
организации (рис. 26, А). На поверхности кутикулы расположен тон-
кий (6-30 нм) осмиофильный слой, который, как у насекомых, носит
название эпикутикулы (7). Под ним располагаются последовательно
три сравнительно толстые зоны кутикулярной пластинки: кортикаль-
ная, промежуточная и базальная (б, 5, 4). Строение зон варьирует
у разных видов. Так, у некоторых мелких нематод промежуточный
слой отсутствует, у некоторых животных он имеет фибриллярное стро-
ение или содержит обширные полости. Наконец, у крупных паразити-
ческих нематод, например у аскарид, кутикула максимально усложня-
ется в результате подразделения каждой зоны на несколько слоев
(рис. 26, Б).
Основным структурным компонентом кутикулы нематод являются
коллагеновые волокна (4), которые, как и в кутикулярных эпителиях
аннелидного типа, лишены поперечной исчерченности. По аминокис-
лотному составу они близки коллагенам соединительной ткани позво-
ночных животных и кутикулам аннелид, но резко отличаются от них
высоким содержанием цистеина. В этом отношении коллаген кутикулы
нематод оказывается сходным с проколлагенами и коллагеном IV типа,
образующим базальные мембраны у позвоночных. Сходство усилива-
ется тем, что в обоих случаях молекулы коллагена связаны между
собой дисульфидными мостиками. Из коллагена построены базальный
и промежуточный слои кутикулы. В промежуточном слое коллагено-
вые волокна обычно не имеют строгой ориентации (5). В базальном
слое они объединены в пластинки, окруженные осмиофильным мат-
риксом. Пластинки расположены строго упорядочено в два или не-
сколько слоев и ориентированы таким образом, что в соседних слоях
волокна коллагена лежат под углом 135° друг к другу.
Кортикальный слой кутикулы нематод представлен аморфным
электронно-плотным веществом, образованным структурным белком
неколлагеновой природы — «кутикулином» (б). Его характерной осо-
бенностью является наличие между белковыми молекулами большого
количества ковалентных связей, обеспечивающих высокую плотность
их упаковки. Предполагается, что по своим механическим свойствам
104
«кутикулин» сходен с эластином соединительной ткани позвоночных
животных.
Наружный слой кутикулы нематод — эпикутикула — состоит из
липидов и белков и на ультраструктурном уровне имеет вид трсхслой-
ной мембраны (7). На ее поверхности выявлена полисахаридная во-
локнистая зона, сходная с гликокаликсом плазматических мембран.
Предполагается, что, как и у наземных членистоногих, эпикутикула
нематод осуществляет барьерную функцию, в частности может предо-
хранять животных от потери воды.
Рис. 26. Кутикулярный эпителий нематод.
А — принципиальная схема организации;
Б — эпителий аскариды:
I — цитоплазма гиподермы, 2 — ядросодержащая
часть, 3 — базальная мембрана, 4 — базальный
слой кутикулы, 5 — промежуточный слой,
б — «кутикулин», 7 — эпикутикула,
8 — полости в промежуточном слое.
В ходе развития нематоды претерпевают обычно четыре линьки,
течение которых регулируется нейроэндокринной системой. Перед
линькой в клетках гиподермы гипертрофируется белоксинтезирующий
аппарат. В апикальной цитоплазме накапливаются мембранные пу-
зырьки, содержащие вещества, из которых происходит формирование
эпикутикулы и кортикальной зоны. Они выводятся под старую кути-
105
кулу путем экзоцитоза. Одновременно на рибосомах эндоплазматичес-
кой сети синтезируются предшественники коллагена, которые в форме
проколлагена накапливаются в ее цистернах. Окончательная сборка
коллагеновых волокон и их объединение в пластинки происходят уже
вне клеток. Таким образом, механизмы синтеза и секреции материала
внутренних слоев кутикулы нематод оказываются сходными с меха-
низмами образования коллагеновых волокон межклеточного вещества
соединительной, хрящевой и костной тканей у позвоночных животных.
Специализация кожных покровов у нематод в процессе эволюции
привела к созданию своеобразных и совершенных в функциональном
отношении структур. Они представлены большим количеством моди-
фикаций, что отражает их высокую эволюционную пластичность. На-
пример, кутикула у половозрелых самок некоторых картофельных не-
матод может подвергаться фенольному задубливанию. В результате
этого процесса стенка тела животного превращается в прочную цисту,
содержащую оплодотворенные яйца. В то же время у одного из видов
нематод, паразитирующего в гемолимфе насекомых, кутикулы вообще
нет. У этих животных пищеварительная система редуцирована, а их
питание осуществляется благодаря деятельности микроворсинок, об-
разуемых гиподермой.
§3. МНОГОСЛОЙНЫЕ ЭПИТЕЛИИ
Высшие позвоночные. Усовершенствование барьерной изолиру-
ющей функции на базе многослойных эпителиев является вторым
основным направлением филогенетической дифференцировки кожных
эпителиев. Естественно, что наиболее сложной организации много-
слойный кожный эпителий достигает у представителей высших клас-
сов позвоночных (млекопитающих, птиц, рептилий), обитающих пре-
имущественно в воздушной среде. Многослойный плоский орогове-
вающий эпителий этих животных представляет собой тканевую сис-
тему с закономерным направлением непрерывного или периодического
обновления клеточного состава. Процесс цитодифференцировки связан
с накоплением клетками специфических белков — кератинов — и
преобразованием их в сложные надмолекулярные структуры. На за-
ключительных этапах специализации в клетках происходит автолиз,
обеспечивающий разрушение основных органоидов цитоплазмы и
структур ядерного аппарата. Весь этот сложный комплекс морфобио-
химических процессов получил название кератинизации.
Кератины позвоночных представляют собой единую по происхож-
дению, но сильно дивергировавшую группу белков, широко распро-
страненных в эпителиальных тканях. Основная часть их относится к
106
фибриллярным белкам, формирующим так называемые промежуточ-
ные фибриллы внутриклеточного цитоскелета эукариотных клеток.
Особенностью многослойных кожных ороговевающих эпителиев яв-
ляется лишь значительно большее, чем в других эпителиальных клет-
ках, количество разновидностей этих белков и высокая их концентра-
ция в дифференцированных клетках. У млекопитающих в клетках
ороговевающих эпителиев работает около 20 разных генов, кодирую-
щих фибриллярные кератины молекулярной массой от 40 до 60 кДа.
В перьях и других производных кожного эпителия птиц, а также
в одной генерации эпителиальных клеток у чешуйчатых рептилий
ороговение обеспечивается фибриллярными кератинами молекулярной
массой от 10 до 15 кДа. Эти а- и p-кератины, хотя и обладают общими
свойствами, однако образуют разные надмолекулярные структуры. Вы-
сокомолекулярные фибриллярные а-кератины имеются в ороговеваю-
щих эпителиях всех высших позвоночных. Ороговение, обусловливае-
мое их накоплением в клетках, получило название а-кератинизации.
ct-Кератины представлены комплексом, состоящим из фибриллярного
компонента и матрикса. Фибриллярный компонент образован высоко-
молекулярным кератином (от 50 до 67 кДа), фибриллы которого со-
стоят из нескольких спирально закрученных полипептидов; матрикс
образован несколькими фракциями низкомолекулярных белков (фи-
лаггрин, лорикрин). Низкомолекулярные фибриллярные р-кератины
имеют меньшее распространение. Они участвуют в формировании
сложных многослойных пластов у чешуйчатых рептилий, специфичес-
ких роговых структур у птиц и крокодилов и перьев птиц. Образование
ороговевших структур путем накопления в клетках низкомолекуляр-
ных фибриллярных кератинов получило название p-кератинизации. В
отличие от а-кератинов фибриллярный компонент и матрикс р-кера-
тинов образованы одними и теми же белками, которые формируют
сложные комплексы из параллельно расположенных цепей полипеп-
тидов. Общим свойством а- и p-кератинов является обилие и разно-
образие поперечных связей внутри и между отдельными полипептид-
ными цепями. Широкое распространение имеют здесь дисульфидные
связи, возникающие на основе SH-групп остатков цистеина, а также
ряд других связей, в частности поперечные связи с использованием
лизиновых остатков, что и определяет химическую устойчивость и
механическую прочность ороговевающих структур.
В качестве классического примера организации ороговевающего
эпителия с использованием мягкой а-кератинизации может служить
эпителий кожи пальца человека (рис. 27, А). Он представляет собой
мощный многослойный эпителиальный пласт, состоящий из клеток,
107
находящихся на последовательных стадиях ороговения. Наиболее глу-
бокие слои образованы живыми клетками с базофильной цитоплазмой.
Здесь различают слой базальных клеток на границе с соединительной
тканью и несколько слоев шиповатых клеток. Граница с соединитель-
ной тканью неровная, что увеличивает общую площадь контакта тка-
ней. Верхние слои шиповатых клеток контактируют со слоем зернис-
тых клеток, содержащих в цитоплазме глыбки базофильного субстра-
та __зерна кератогиалина. Далее следует оксифильный блестящий
слой и, наконец, несколько десятков слоев роговых чешуек.
Сущность процессов специфической дифференцировки особенно
наглядно выступает при сопоставлении базальных, способных к про-
лиферации клеток, и дифференцированных, непосредственно осущест-
вляющих барьерную функцию роговых чешуек (рис. 27, Б, 1, 5).
Клетки базального слоя характеризуются наличием хорошо раз-
витых десмосом, связывающих клетки между собой и со слоем шипо-
ватых клеток, и многочисленных полудесмосом, которые обеспечива-
ют связь эпителиальных клеток с наружным светлым слоем базальной
мембраны. В цитоплазме относительно хорошо развиты мембранные
органоиды, имеются и многочисленные свободные рибосомы. Помимо
собственных фибриллярных структур десмосом они имеют пучки то-
нофибрилл, не связанных с десмосомами. Они образованы специаль-
ными фракциями высокомолекулярных кератинов (50 и 58 кДа). Их
появление в клетках базального слоя свидетельствует о начале про-
цесса а-кератинизации. Базальные клетки находятся в цикле репро-
дукции, синтезируют ДНК и делятся митозом.
Роговые чешуйки представляют собой крайне дифференцирован-
ные и сложно организованные структуры (5). Они имеют овальную
уплощенную форму и ориентированы параллельно поверхности плас-
та. Каждая чешуйка занимает площадь, соответствующую площади
апикальных поверхностей 9—10 клеток базального слоя. Связь между
чешуйками обеспечивается видоизмененными десмосомами. Межкле-
точные пространства заполнены нейтральными липидами, образующи-
ми гидроизолирующий слой, предохраняющий кожу от высыхания.
Роговые чешуйки снаружи имеют плазматическую мембрану, под
которой сосредоточен белковый слой с большим количеством попереч-
ных связей за счет лизиновых остатков особого белка (инволукрина).
Он отличается устойчивостью к механическим и химическим воздей-
ствиям. Вся внутренняя часть роговой чешуйки заполнена «-керати-
нами. Высокомолекулярные «-кератины образуют фибриллы диамет-
ром 8 нм, они спаяны аморфным матриксом. Кератиновые фибриллы
в роговых чешуйках наряду с деградировавшими в большей или меиь-
108
26
Рис. 27. Многослойный плоский ороговевающий эпителий кожи пальца человека.
А — рисунок с микрофотографии участка эпителия;
Б — ультраструктурная организация клеток отдельных слоев:
— слон эпителия (7 —базальный, 2 — шиповатый, 3 — зернистый, 4 — блестя-
5 — роговой), 6 — соединительная ткань, 7 — кератоцит, S — меланоцит,
0 десмосома, 10 — полудесмосома, II — базальная мембрана, 12 — митохонд-
рия, 13 — аппарат Гольджи, 14 — свободные рибосомы, 15 — шероховатая ЭПС,
16 — тоиофибриллы, 17 — пиноцитозные пузырьки, 18 — гранулы меланина,
ядро, 20 — кератосомы, 21-22 — гранулы кератогиалина с большим количест-
вом цистеина (21) и гистидина (22), 23 — прнмембранный слой белка с большим ко-
личеством S-S-связей в роговой чешуйке, 24 — гвдроизолирующий липидный слой,
25 — а-кератиновые фибриллы, 26 — аморфный матрикс.
109
шей степени молекулами кератинов базального слоя (50-58 кДа) со-
держат еще и кератины 56,5 кДа и от 65 до 67 кДа. Кератины 56,5 кДа
относятся к группе кислых кератинов, а кератины от 65 до 67 кДа —
к группе основных. Эти кератины являются специфическими именно
для кожного эпителия млекопитающих. Они составляют около 80%
всех белков роговых чешуй.
Таким образом, из характеристики базальных клеток и роговых
чешуек ясно, что процесс кератинизации — это цепь превращений
живой, пролиферирующей клетки в мертвую роговую чешуйку. Оче-
видно, что процесс такой своеобразной дифференцировки заключается
в синтезе, накоплении и перераспределении в клетках специфических
белков, деградации органоидов и ядерных структур и видоизменении
межклеточных контактов.
Прослеживая изменение клеток в ходе дифференцировки, мы ви-
дим, что уже в нижних клетках шиповатого слоя меняется функцио-
нальная активность ядерного аппарата: утрачивается способность к
репликации ДНК и делению и начинается синтез информационных
РНК для синтеза кислых кератинов молекулярной массой 56,5 кДа и
основных молекулярной массой от 65 до 67 кДа. В поверхностном
аппарате шиповатых клеток значительно увеличивается количество
десмосом, а в цитоплазме фибриллярные структуры имеют тенденцию
концентрироваться вокруг ядра. В клетках шиповатого слоя помимо
синтеза кератинов происходит интенсивный синтез и выведение из
клеток путем экзоцитоза так называемых кератосом (2, 20). Последние
представляют собой ограниченные мембраной скопления липидных
мембраноподобных структур. В их составе имеется и небольшое ко-
личество гидролитических ферментов, которые активизируются в верх-
них зонах рогового слоя, что может способствовать слущиванию верх-
них роговых чешуек. Выделяемые шиповатыми клетками кератосомы
вначале не образуют сплошных слоев и не препятствуют циркуляции
тканевой жидкости по межклеточному пространству. Кроме того, в
клетках верхних шиповатых слоев начинают синтезироваться и цемен-
тирующие белки матрикса роговых чешуек филаггрин и ларикрин.
Наиболее сложные и многообразные изменения в клетках происходят
на уровне зернистых и блестящих слоев (3, 4).
В клетках зернистого слоя появляются зерна кератогиалина (Я
21, 22) — не ограниченные мембраной участки электронно-плотного
базофильного вещества, расположенного в цитоплазме и ядерном ап-
парате. В структурном отношении они гетерогенны: имеются тонко-
фибриллярный и аморфный компоненты. Наряду со сложными грану-
лами, содержащими оба компонента, есть гранулы, образованные толь-
110
ко аморфным компонентом. Биохимический и радиоавтографический
анализы кератогиалиновых гранул показали, что они содержат в ос-
новном две фракции специфических белков — с повышенным содер-
жанием гистидина и цистеина. Гистидинсодержащие белки образуют
фибриллярный (филаггриновый), а цистеинсодержащие (лорикрино-
вые) — аморфный компонент гранул.
Таким образом, в клетках зернистого слоя в дополнение к уже
накопленным ранее кератинам заканчивается синтез и накопление до-
полнительных специфических белков, необходимых для формирования
дефинитивной структуры роговой чешуйки. Кроме того, в этих клетках
активизируются и процессы автолиза, приводящие к разрушению ядер-
ных структур и органоидов цитоплазмы (активизация особых транс-
глутаминаз и других гидролитических ферментов).
При переходе из зернистого в блестящий слой (3, 4) в клетках
происходит «дозревание» накопленных белков, их перераспределение,
формирование надмолекулярных структур, характерных для роговой
чешуйки. Эти процессы хорошо изучены на примере компонентов
кератогиалиновых гранул. Их аморфный компонент, образованный ци-
стеинбогатыми белками и белками с поперечными лизиновыми связя-
ми, формирует периферический субмембранный слой. Гистидинбога-
тые фибриллярные структуры (белок филаггрин) участвуют в образо-
вании дефинитивной, внутренней структуры роговой чешуйки, на их
основе формируется аморфный матрикс, им приписывают также роль
в преобразовании остатков РНК и ДНК при деградации ядерного и
белоксинтезирующего аппаратов клетки.
Помимо описанной мягкой а-кератинизации у млекопитающих
широко распространены процессы твердой а-кератинизации с длитель-
ным сохранением образующихся роговых структур. При твердой ке-
ратинизации в матриксе роговых чешуек увеличено количество цис-
теинсодержащих кератинов, а клеточные контакты между роговыми
чешуйками более устойчивы. На основе твердой а-кератинизации фор-
мируются такие структуры, как волосы, ногти, рога, копыта, когти.
Образование этих органных структур связано с усложнением органи-
зации базального камбиального слоя. Мощность его резко увеличива-
ется в результате увеличения поверхности контакта с соединительной
тканью путем образования глубоких впячиваний, сосочков или кожных
складок. Естественно, что в формировании и функционировании та-
кого рода структур велика роль сосудов и специализированных участ-
ков соединительной ткани, обеспечивающей трофическую регулирую-
щую, а часто и укрепляющую механическую функцию.
111
Характерным примером органных структур кожных покровов выс-
ших позвоночных может служить волос млекопитающих (рис. 28). Из
сопоставления волоса и щетинки полихет (см. рис. 23) видно, что
внешне эти образования сходны. Однако при более детальном изу-
чении становится ясным принципиальное различие этих структур: ще-
тинка — это неклеточное образование, а волос — механически проч-
ная структура, построенная из большого числа ороговевших клеток.
В основе организации волоса лежит погруженная в соединитель-
ную ткань система камбиальных клеток — волосяная луковица. Пе-
риферические клетки волосяной луковицы контактируют со специаль-
ными впячиваниями покровного эпителия в соединительную ткань —
наружным корневым влагалищем. В основании волосяной луковицы
находится углубление, в которое заходит соединительная ткань с со-
судами — волосяной сосочек (рис. 28, 2). Клетки волосяной луковицы
в фазе активного роста волоса энергично делятся и, замещаясь вверх,
кератинизируются. При этом несколько периферических слоев и цент-
ральные клетки ороговевают по типу мягкой а-кератинизации. Из
периферических слоев клеток формируется внутреннее корневое вла-
галище протоков сальных желез, а из центральных клеток — рыхлое
мозговое вещество стержня волоса (5). Основная часть стержня волоса
представлена корковым веществом (7), состоящим из клеток, образу-
ющихся в результате деления клеток волосяной луковицы. Эти клетки
ороговевают на относительно небольшом расстоянии от волосяной
луковицы, в так называемой кератогенной зоне. В них развиваются
процессы твердой а-кератинизации с образованием большого количе-
ства кератинов, богатых S—S-связями, и более стойким, чем при мягкой
кератинизации, объединением роговых чешуек в целостную систему
(кислые кератины, 44—46 кДа, и основные, 56-59 кДа).
У птиц наблюдается более разнообразный спектр модификаций
кератинизации. Помимо сходного с описанным выше у млекопитаю-
щих процесса мягкой а-кератинизации имеет распространение харак-
терная лишь для птиц и рептилий Р-кератинизация, в основе которой
лежит синтез относительно низкомолекулярных кератинов. В роговых
чешуйках перьев птиц эти кератины формируют фибриллярные над-
молекулярные структуры диаметром около 2 нм. При Р-кератинизации
отсутствует специальный матрикс, образованный особыми белками-
Объединение фибрилл в целостную систему осуществляется белками-
образующими поверхность фибрилл. У птиц в результате р-кератини-
зации образуются перья, роговые структуры клюва и чешуйки конеч
ностей. Сам покровный эпителий ороговевает, как и у млекопитаюших.
112
Рис. 28. Строение волоса млекопитающих.
1 — волосяная луковица, 2 — волосяной сосочек, 3, 4 — внутреннее (3) и наруж-
ное (#) корневые влагалища, 5 — мозговое вещество стержня волос, 6 — эпидер-
мис, 7 — корковое вещество стержня волос, 8 — сальная железа, 9 — мышцы.
113
на основе мягкой а-кератинизации. Особенностью этого процесса у
птиц является наличие помимо кератосом большого количества не.
структурированных липидов в клетках шиповатого слоя, занимающих
затем центральную область в сформированных роговых чешуйках. По
мере продвижения к поверхности пласта чешуйки уплощаются, стенки
их в конце концов разрываются и липиды выходят на поверхность
пласта и в межклеточные пространства, обеспечивая тем самым гид-
роизоляцию внутренней среды организма.
Многослойные пласты кожного эпителия млекопитающих и птиц
представляют собой непрерывно обновляющиеся системы. Особеннос-
тью камбиальных базальных клеток кожного эпителия млекопитающих
и птиц является различная скорость их пролиферации как в пределах
одного участка, так и в разных участках эпителия. В одном и том же
участке помимо обычного «рабочего» камбия, поставляющего клетки
для замены слущиваемых роговых чешуек в нормальных условиях,
имеются еще и резервные субпопуляции, используемые в случае вы-
хода системы из равновесия при травме или необычных воздействиях
на кожные покровы физических или химических факторов внешней
среды.
Среди клеток базального слоя эпидермиса имеются особые от-
ростчатые клетки — клетки Лангерганса, которые обладают способ-
ностью поглощать антигены и представлять их на своей поверхности
в иммуногенной форме, т. е. выполнять функцию А-клеток иммунной
системы.
Для анализа взаимоотношений между репродукцией и дифферен-
цировкой клеток большой интерес представляет выяснение природы
факторов, тормозящих процессы кератинизации на уровне базального
слоя. На эмбриональных зачатках кожного эпителия млекопитающих
и птиц удалось показать, что таким фактором является контакт эпи-
телия с высокомолекулярными белками, в частности с коллагеном
соединительной ткани. При замене последней на хрящевую ткань
происходит полное ороговение всего эпителиального пласта, включая
его базальный и шиповатый слои. При культивировании эмбриональ-
ного кожного эпителия с соединительной тканью легких кератиииза-
ции не происходит и образуется пласт многослойного неороговеваю-
щего эпителия. При замене кожной соединительной ткани соедини-
тельной тканью желудочно-кишечного тракта удается наблюдать ме-
таплазию кожного эпителия в железистый и ресничный эпителий-
Наконец, само существование зачатков кожного эпителия в культурах
in vitro возможно лишь при их взаимодействии с коллагеном. В от-
сутствие последнего через 24 ч происходит полная деструкция эпите-
лиальных пластов.
114
В регуляции процессов, лежащих в основе организации много-
слойных ороговевающих эпителиев — кератинизации и репродукции
клеток — большую роль играют взаимодействия между дифференци-
рованными и базальными клетками. Показано также существенное
влияние на эти процессы некоторых внешних для организма физичес-
ких и химических факторов (витамина А, механических воздействий
на поверхность эпидермиса, радиации). В опытах in vitro удалось
получить метаплазию эмбрионального эпидермиса при культивирова-
нии его в условиях избытка витамина А в многорядный ресничный
эпителий. Усиление пролиферации клеток и утолщение слоя роговых
чешуек наблюдаются при постоянных механических воздействиях на
поверхность кожного эпителия. При описанных метаплазиях эпидер-
миса часто происходят изменения экспрессии генов, кодирующих и
разновидности кератинов. Эти же механизмы лежат в основе топогра-
фических различий ороговевающих кожных эпителиев высших позво-
ночных. В настоящее время уже выделены многие гены, кодирующие
отдельные кератины и вспомогательные белки в клетках ороговеваю-
щего эпителия. Имеется и обоснованная точка зрения о существовании
особого регуляторного гена (подобного гену в соматических мышцах),
определяющего и координирующего экспрессию структурных «кера-
тиновых» генов.
Сложную, многоэтапную защитную реакцию кожного эпителия
вызывает регуляторное воздействие больших доз ультрафиолетовых
лучей (УФ). При умеренных дозах радиации изоляция клеток базаль-
ного слоя и их генетического аппарата осуществляется специальными
клетками — меланоцитами. Они возникают в ходе онтогенеза из нерв-
ного зачатка и заселяют эпителиальные пласты путем активной миг-
рации. Дифференцированные меланоциты представляют собой оваль-
ные клетки с отростками на апикальной поверхности. Они не связаны
десмосомами с соседними эпителиальными клетками, однако находят-
ся под общим системным контролем, обеспечивающим постоянство
их количества в эпителиальном пласте. При умеренных дозах УФ-об-
лучения бесцветный пигмент этих клеток переходит в окрашенную
форму. При более сильных дозах УФ-воздействие вызывает разруше-
ние лизосомных мембран. При этом выделяются вещества, стиму-
лирующие размножение резервных субпопуляций клеток базального
слоя, и значительно увеличивается толщина защитного слоя роговых
чешуек.
Сходство организации кожных эпителиев у высших позвоночных
особенно наглядно выступает при рассмотрении кожных эпителиев
рептилий. Как известно, ныне живущие рептилии принадлежат к трем
115
давно дивергировавшим ветвям и представляют собой, следовательно,
группы животных, прошедших длительную независимую эволюцию.
Наибольшие изменения при этом претерпели кожные покровы чешуй-
чатых рептилий (ящерицы, змеи).
Кожные эпителии чешуйчатых рептилий характеризуются нали-
чием периодичной физиологической регенерации, т. е. линьки. В пред-
личиночном состоянии кожный эпителий представляет собой гетеро-
генную тканевую систему (рис. 29). На поверхности относительно
тонкого росткового слоя имеются две генерации дифференцированных
роговых чешуек. Каждая из них неоднородна и состоит, по крайней
мере, из 3-4 разновидностей чешуек, расположенных одним или не-
сколькими слоями. Кроме того, между генерациями чешуек имеется
особый светлый слой ороговевающих клеток, разрушение которого в
момент линьки обусловливает сбрасывание поверхностной генерации
роговых чешуек.
Тщательный ультраструктурный анализ покровов одного из видов
ящериц показал, что поверхностный слой с шипами и лежащий под
ним довольно толстый В-слой образуют гомогенный пласт из р-кера-
тинов, представленных фибриллярным компонентом — электронно-
светлыми фибриллами диаметром 2 нм и электронно-плотным аморф-
ным матриксом. Под этим слоем располагается тонкая пластинка уп-
лощенных ороговевающих клеток, за которой следует относительно
толстый слой роговых чешуек, заполненных фибриллами а-кератина
с характерным для них диаметром — 8 нм (8, 10). Наконец, на границе
следующей генерации роговых чешуек располагается слой крупных
светлых клеток с ядрами и глыбками кератогиалина, напоминающих
клетки зернистого слоя при мягкой а-кератинизации (5). Однако био-
логическое значение этого слоя совсем иное. Он служит для разобще-
ния генераций роговых чешуек в момент линьки. Очевидно, что в
светлых клетках имеются особые взаимоотношения между катаболи-
ческими и анаболическими процессами. До определенного момента в
них происходит синтез кератинов и идут первые этапы катаболических
процессов. Однако вслед за этим клетки переходят в относительно
латентное состояние. Под воздействием гормонов линьки активизиру-
ются ферментативные системы, находящиеся до этого, по-видимому,
в лизосомах. Деятельность ферментов приводит к полному автолизу
цитоплазмы, что создает необходимые предпосылки для сбрасывания
поверхностной генерации роговых чешуек.
Следовательно, характерной особенностью покровного эпителия
чешуйчатых рептилий является гетерогенность его состава. В каждой
генерации рогового слоя имеются структуры, сходные и с роговыми
116
Рис. 29. Строение кожного эпителия чешуйчатых рептилий
в предлиночном состоянии.
I, II — генерации роговых чешуек: 1 — поверхностный слой чешуек с шипами.
2 — слой Р-кератиновых чешуек, 3 — промежуточный слой, 4 — слой «-керати-
новых роговых чешуек, 5 — слой светлых клеток, 6 — ростковый слой, 7 — ке-
ратиновые фибриллы (Р-кератин), 8 — аморфное вещество, 9 — электронно-плот-
ные участки, между которыми лежат фибриллы Р-кератина, 10 — фибриллы а-ке-
ратина, II — уплотненный слой по периферии роговых чешуек, 12 — остатки
десмосом, 13 — гранулы кератогиалина, 14 — пузырьки с гидролитическими фер-
чешуйками эпителия млекопитающих, и с ороговевающими клетками
перьев птиц.
Базальные клетки кожного эпителия рептилий, идентичные по
своим потенциям и происхождению, способны дифференцироваться
по нескольким, существенно отличающимся друг от друга программам.
В опытах по культивированию in vitro изолированного от соедини-
тельной ткани эпителия показано, что переключение программ не
зависит от внешних факторов, т. е. осуществляется на уровне внутри-
системной регуляции. Особенно наглядно удалось показать значение
последней при культивировании in vitro изолированного росткового
117
слоя. В этих условиях происходит нарушение координированной ра-
боты системы, и на поверхности жизнеспособного росткового слоя
формируется лишь небольшой слой атипически ороговевающих кле-
ток.
Результаты опытов показывают, что последовательная во времени
закономерная смена программ дифференцировки клеток осуществля-
ется в кожном 'пителии рептилий по принципу обратной связи. Оче-
видно, что при достижении определенной массы клеток, дифференци-
рующихся по одной программе, они выделяют достаточное количество
индуцирующего вещества, обусловливающего иную программу диф-
ференцировки у следующей генерации клеток. Обнаружено, что чем
толще слой клеток, ороговевающих по одной программе, тем меньшее
количество индуктора выделяет каждая клетка. Естественно, что по-
добный тип регуляции может осуществляться лишь при наличии у
клеток росткового слоя весьма чувствительных и достаточно разнооб-
разных рецепторов, позволяющих генетическому аппарату адекватно
реагировать на специфические стимулы дифференцирующихся клеток.
Низшие позвоночные. У большинства современных амфибий
кожный эпителий взрослых животных представлен, как и у рассмот-
ренных представителей высших позвоночных, многослойным плоским
ороговевающим эпителием. Особенностью кожных покровов амфибий
является обилие погруженных в соединительную ткань многоклеточ-
ных слизистых и белковых желез. Для их эпидермиса характерно
наличие на большей поверхности тела лишь одного слоя ороговевших
клеток. Эти особенности связаны с полуводным образом жизни жи-
вотных и их кожным дыханием.
Кожный эпителий амфибий образован относительно толстым (4-5
рядов) ростковым слоем и одним слоем сильно уплощенных орого-
вевших, тесно связанных между собой клеток (рис. 30, А, Б). В цито-
плазме клеток базального камбиального слоя имеются хорошо разви-
тые пучки тонофибрилл (рис. 30, Б, 5).
В вышележащих слоях ростковой зоны тонофибриллы меняют
сове расположение и образуют более плотно упакованные пучки. В
клетках шиповатого слоя накапливаются слизистые гранулы двух ти-
пов крупные и мелкие (рис. 30, Б, 6, 7). Последние выделяют сове
содержимое путем экзоцитоза в межклеточное пространство. Клетки
росткового слоя связаны между собой многочисленными десмосомами.
Верхние шиповатые клетки по ультраструктуре в период между линь-
ками не отличаются существенно от нижележащих клеток. Их особен-
ность заключается в наличии замыкающих, изолирующих контактов в
верхних латеральных частях клеток. Процесс превращения живых кле-
118
Рис. 30. Многослойный плоский ороговевающий эпителий кожи лягушки.
А — участок эпителия кожи спины; Б — схемы изменения улырасгруктурной
организации клеток при ороговении:
1 — слой ороговевших клеток, 2 — ростковый слой, 3 — соединительная ткань,
4 — железа, 5 — тонофибриллы, 6 — мукоидные гранулы, 7 — лизосомы,
8 — межклеточный цемент, 9 — остатки ядсрного аппарата и мембранных органои-
дов, 10— сс-кератиновые фибриллы, II — утолщение периферического слоя
цитоплазмы.
ток шиповатого слоя в роговые чешуйки происходит весьма быстро —
в течение 24 ч. Непосредственно перед этим превращением слущива-
ется поверхностный слой роговых чешуек, что связано, по-видимому,
с разрушением десмосом. Верхние клетки шиповатого слоя уплоща-
ются и уменьшаются в объеме. Ядра не исчезают, а лишь подвергаются
Деградации и сморщиваются (рис. 30, Б, 9). Цитоплазматические ор-
ганоиды, как и у высших позвоночных, исчезают полностью. По пе-
119
риферии клетки концентрируются особые белки, хотя их меньше, чем
в роговых чешуйках млекопитающих (рис. 30, Б, 1 /). Внутри клеток
в аморфном матриксе располагаются фибриллы диаметром 8 нм, т. е.
структуры, характерные для заключительных этапов а-кератинизации
(рис. 30, Б, 10). Особенностью а-кератинов амфибий является более
хаотичное расположение спиральных участков полипептидных цепей
в макромолекулах. Связь между формирующимися роговыми чешуй-
ками осуществляют сохраняющиеся зоны слияния. С нижележащими
клетками шиповатого слоя роговые чешуйки связываются при помощи
обычных точечных десмосом.
В отличие от ороговевающих эпителиев высших позвоночных у
амфибий не удается наблюдать последовательных стадий превращения
живой клетки в ороговевшую чешуйку, хотя сущность и химическая
основа процессов весьма сходна. Непосредственная причина особен-
ностей кератинизации у амфибий связана с периодичностью и большой
скоростью завершающих этапов этих процессов.
Таким образом, для кожного эпителия амфибий характерна из-
вестная незавершенность процессов вторичного преобразования спе-
цифических белков и деструкций высокомолекулярных соединений в
ороговевающих клетках. Однако эти особенности кератинизации вряд
ли можно рассматривать просто как признаки примитивной организа-
ции данного типа эпителия. Кожный эпителий амфибий обладает по-
тенциями к формированию мощных роговых структур типа роговых
зубов головастиков или специальных утолщений кожи на передних
лапах самцов лягушек.
У современных низших водных позвоночных — круглоротых и
многочисленных представителей класса рыб, несмотря на большое
разнообразие кожных эпителиев в их структурной организации удается
обнаружить ряд общих черт.
В типичном случае эпителий представляет собой многослойный
пласт с выраженной вертикальной анизоморфностью. На границе с
соединительной тканью располагается слой базальных камбиальных
клеток, обеспечивающих постоянное или периодическое обновление
эпителиального пласта. Процесс обновления совершается у разных
представителей рыб с большей или меньшей скоростью. Образующие-
ся в результате размножения клетки дифференцируются в двух основ-
ных направлениях: в направлении образования кроющих, часто упло-
щенных, поверхностных клеток и в направлении образования различ-
ного рода железистых элементов. Наличие в составе эпителиального
пласта белковых, слизистых и некоторых других специфических сек-
реторных клеток — весьма характерная особенность многослойных
120
эпителиев низших водных позвоночных. Железистые клетки, выделяя
секреты, способствуют обеспечению барьерной функции эпителиаль-
ного пласта.
При дифференцировке клеток в направлении кроющих элементов
происходит увеличение их размеров и развитие в цитоплазме волок-
нистых белковых структур — тонофибрилл, количество и плотность
расположения которых обычно увеличиваются по направлению к по-
верхности пласта. Тонофибриллы образованы особыми разновиднос-
тями кератинов и представляют собой, по сути дела, гипертрофиро-
ванную систему промежуточных филаментов. В типичных случаях
дифференцированные кроющие клетки уплощенной формы и имеют
слегка пикнотизированное ядро. На их апикальной поверхности обра-
зуются небольшие гребни, увеличивающие поверхность плазматичес-
кой мембраны. Сверху они покрыты секретом железистых клеток,
расположенным тонким электронно-плотным слоем. Хорошо развитые
десмосомы связывают клетки друг с другом. Полудесмосомы базаль-
ных клеток, кроме того, обеспечивают их крепление к внутренней
поверхности базальной мембраны.
Процессы физиологической регенерации и морфобиохимические
основы дифференцировки клеток в кожных эпителиях низших позво-
ночных животных еще недостаточно изучены. Имеющиеся данные
свидетельствуют о том, что у некоторых представителей костистых
рыб синтез ДНК и деление могут наблюдаться у вступивших на путь
дифференцировки клеток. Здесь, следовательно, нет еще резко вы-
раженных различий между камбиальными и дифференцирующимися
клетками.
Помимо описанных выше функций типичных для эпителиальных
пластов у некоторых видов рыб и круглоротых образование и выде-
ление слизистого секрета на поверхности тела может стать домини-
рующей его функцией. В этом случае дифференцировка всех клеток,
образующихся в результате деления клеток нижележащих слоев, идет
в направлении развития секреторных элементов, и поверхностный слой
клеток представляет собой сплошной слизеобразующий пласт (рис. 31,
А, 3). Продукты его выделения выполняют барьерную защитную функ-
цию.
Другая, более редкая, но наиболее интересная модификация мно-
гослойных пластов связана с прогрессивной дифференцировкой по-
верхностных кроющих клеток. У одного из представителей пресновод-
ных костистых рыб (Bagarius bagarius) поверхность эпителиального
пласта представлена сплошным слоем ороговевших клеток. По ульт-
раструктурной организации роговые клетки этого представителя кос-
121
тистых рыб сходны с клетками, образующимися при а-кератинизации
у амфибий. Участки ороговевающего эпителия обнаружены на брюш-
ных плавниках у двоякодышащих рыб и в виде отдельных «островков»
или «жемчужин» на голове карповых рыб.
Хорошо известны и изучены такие мощные образования, как ро-
говые зубы круглоротых, которые периодически обновляются у взрос-
лых животных. В период, предшествующий линьке, они представлены
двумя генерациями роговых пластинок, лежащих над ростковым слоем
и разделенных пластом электронно-плотных клеток, разрушение кото-
рого приводит к сбрасыванию поверхностной, первичной генерации
(рис. 31, Б, 7-9). Роговые пластинки обеих генераций образуются в
результате а-кератинизации и отличаются по степени завершенности
этого процесса. Первичная генерация представлена слоем роговых
чешуек, в которых полностью разрушены ядерный аппарат и другие
органоиды. При формировании роговых чешуек клетки проходят ста-
дию зернистых клеток, напоминающих по своей структуре клетки
зернистого слоя млекопитающих. Таким образом, у круглоротых на-
блюдается своеобразное сочетание а-кератинизации, сходной по неко-
торым признакам с а-кератинизацией у млекопитающих, с таким яв-
лением, как разрушение промежуточных клеток, характерное для кле-
ток зернистого слоя рептилий. И у клеток, вступивших на путь кера-
тинизации в области зубов миноги, имеются признаки, характерные
для ранних этапов кератинизации у амфибий (образование мелких и
крупных гранул, ограниченных мембраной). Естественно, что все эти
морфологические изменения и процессы независимо возникают у круг-
лоротых, амфибий, рептилий и млекопитающих и представляют собой
пример близкородственных параллелизмов.
§4. НЕКОТОРЫЕ ОБЩИЕ ЗАКОНОМЕРНОСТИ ЭВОЛЮЦИОННОЙ
ДИНАМИКИ КОЖНЫХ ЭПИТЕЛИЕВ
Обзор строения кожных эпителиев основных групп современных
многоклеточных животных показывает разнообразие принципов орга-
низации этой тканевой системы. Оно проявляется в различиях хими-
ческого состава структур, образуемых клетками кожных эпителиев,
принципов построения тканевых систем и в разнообразии механизмов
выработки специфических соединений, обусловливающих барьерную
защитную функцию.
Многообразие эпителиев кожных покровов у современных мно-
гоклеточных животных определяется разнообразием условий их оби-
тания и длительной адаптивной эволюцией в специфических услови-
ях внешней среды для каждой из рассмотренных групп животных.
Рис. 31. Кожный эпителий миноги.
А — участок многослойного железистого эпителия;
Б — роговой зуб в ротовой полости.
1 — соединительная ткань, 2-6 — клетки эпителия (2 — базальные, 3 — крою-
щие, 4 — железистые белковые, 5 — колбовидные, 6 — железистые слизистые),
7 — роговые чешуйки первой генерации, 8 — промежуточный слой, 9 — орого-
вевающие клетки зуба второй генерации, 10 — ростковый слой, II — хрящ.
Помимо внешних факторов разнообразие кожных эпителиев опреде-
ляется еще и внутренними причинами, которые обусловливают, по-ви-
димому, наличие у позвоночных многослойных эпителиев, а у беспо-
звоночных кутикулярных и большое разнообразие разновидностей пос-
ледних.
Весьма вероятно, что наиболее примитивными покровными струк-
турами являются погруженные эпителиальные пласты без четкой гра-
ницы с соединительной тканью, эпителиально-мышечные дифферен-
цировки кишечнополостных и разновидности ресничных эпителиев. У
современных низших многоклеточных животных эти ткани претерпели
большие изменения и существенно отличаются от того исходного типа,
который послужил основой для развития покровных эпителиев у про-
грессивно эволюционировавших групп животных.
123
Такие клетки, как нематоцисты кишечнополостных со специаль-
ной системой их воспроизводства, и мышечные отростки эпителиаль-
но-мышечных клеток медуз, образовались, очевидно, в результате вто-
ричного усложнения. Во многих случаях, например при построении
системы по принципу непрерывного обновления или дифференциров-
ки миофибриллярного аппарата в эпителиально-мышечных клетках,
вторичные свойства кожных эпителиев низших многоклеточных ока-
зываются в принципе сходными со свойствами систем, которые на-
блюдаются в аналогичных тканях более высокоорганизованных много-
клеточных животных.
В то же время у высших многоклеточных животных при возник-
новении вторичных пограничных тканей в составе других тканей ор-
ганизма выделяются специфические дифференцировки, сходные с эпи-
телиями низших многоклеточных (эпителиально-мышечные клетки ди-
лятатора зрачка, ресничный эпителий воздухоносных путей и гр.).
Из этих фактов уже можно сделать вывод об общих закономер-
ностях в филогенетической дифференцировке покровных структур,
которые отчетливо выступают при их сопоставлении у современных
животных.
Две наиболее распространенные у современных многоклеточных
животных разновидности кожных эпителиев — многослойные и кути-
кулярные эпителии — принципиально отличаются по своей организа-
ции, хотя и выполняют одинаковую барьерную, защитную, а у назем-
ных животных и очень специфическую гидроизолирующую функцию.
В отличие от других типов тканей и рассмотренной выше разновид-
ности кожных эпителиев многослойные кожные эпителии обычно не
характерны для беспозвоночных, а кутикулярные эпителии не свойст-
венны позвоночных животным. Существуют немногочисленные ис-
ключения из этого правила — покровы небольшой группы щетинко-
челюстных, представленные участками многослойного эпителия наря-
ду с кутикулярными участками, плакоидная чешуя хрящевых рыб и
адамантобласты эмалевых органов зубов позвоночных, выделяющие
на своей базальной поверхности межклеточное вещество. В кожных
эпителиях позвоночных клетки не обладают способностью к синтезу
и выведению хитина, а клетки кутикулярных эпителиев не синтезиру-
ют больших количеств и большого разнообразия кератинов.
Таким образом, многослойные эпителии, особенно ороговеваю-
щие эпителии позвоночных, а также кутикулярные эпителии, особенно
эпителии артроподного типа, представляют собой редкий на тканевом
уровне пример типичной дивергенции в филогенезе тканей многокле-
точных животных: решение сходной функциональной задачи при по-
124
мощи принципиально разной структурной и химической дифференци-
ровки клеток у животных, давно дивергировавших от общих предков.
Принципиальные различия многослойных и кутикулярных эпите-
лиев особенно ярко выявляются при сопоставлении таких специали-
зированных производных эпителиев, как волос и щетинки. Различны
по существу и имеющиеся у многослойных эпителиев высших позво-
ночных и в кутикулярных эпителиях артроподного типа взаимоотно-
шения с тканями внутренней среды. В многослойных эпителиях под-
лежащая соединительная ткань не только обеспечивает их трофику,
но и поддерживает существование базального слоя, а в гистогенезе в
известных пределах определяет характер дифференцировки эпители-
альных клеток. У оболочников и насекомых элементы крови — гра-
нулярные амебоциты — либо непосредственно участвуют в формиро-
вании кутикулы (оболочники), либо обеспечивают ее склеротизацию
(насекомые). Несмотря на то, что кожные эпителии — классический
пример дивергенции тканей в филогенезе позвоночных и высших бес-
позвоночных животных, в пределах каждой из этих групп животных
мы наблюдаем весьма яркие примеры параллельного направленного
развития эпителиальных тканей. Наиболее демонстративен в этом
плане кутикулярный эпителий вторичноротых — оболочников — и
высших первичноротых — насекомых. Сходство организации этих
эпителиев проявляется не только в химизме кутикулы, общем плане
ее строения и механизмах выведения основных компонентов клетками,
но и в характере взаимоотношений кутикулярного эпителия с клеточ-
ными элементами гемолимфы и крови — гранулярными амебоцитами
насекомых и морулярными клетками асцидий. Яркими примерами
параллельного развития в филогенезе являются взаимоотношения меж-
ду кутикулярным эпителием и гранулярными амебоцитами у мечехвос-
та и приапулид, сходное строение аннелидной кутикулы, щетинок и
щетинкоподобных структур у далеких в смысле филогенетического
родства групп беспозвоночных животных.
Как и для кишечного эпителия, для кожных эпителиев характерно
широкое распространение не только сходства в их организации у
неродственных животных, но и так называемых близкородственных
параллелизмов — независимого возникновения новых признаков ор-
-анизагии у родственных животных, признаков, отсутствовавших у
общих предков животных. Типичным примером этого является неза-
висимое друг от друга возникновение водонепроницаемой эпикутику-
,лы У различных классов наземных членистоногих и ороговевающих
. чгстков эпителия у круглоротых, костистых рыб и представителей
Других классов позвоночных.
125
Таким образом, несмотря на существенные специфические осо-
бенности эволюционной динамики кожных эпителиев, им, как и всем
тканям многоклеточных животных, свойственны отчетливо выражен-
ные явления направленной дифференцировки в филогенезе, проявляю-
щиеся в многочисленных отдаленных и близкородственных паралле-
лизмах.
ЛИТЕРАТУРА
Мамкаев Ю. В. Методы и закономерности эволюционной морфологии II
Современная эволюционная морфология. Л., 1991. С. 33-55.
Хэдли В. Кутикула членистоногих // В мире науки. 1986. С. 74-82
Хэм А., Кормак Д. Гистология. М., 1983. Т. 4. С. 49-92.
Чага О. Ю„ Соловей И. В. Кутикулярные эпителии и гранулярные амебо-
циты И Цитология. 1986. Т. 28. № 3.
Bereiter-Hahn J, Matoltsy A. G„ Richards К. S. Biology of integument II In-
vertebrates. Springer-Verlag, Berlin. 1984. Vol. 1.
Bereiter-Hahn J., Matoltsy A. G„ Richards K. S. Biology of integument //Ver-
tebrates. Springer-Verlag, Berlin. 1986. Vol. 2.
Fuchs E. Epidemal differentiation H J. Cell Biol. 1990. Vol. Ill.
Uchra K„ Migoshi S„ Hidestoshi T. Fine structure of the homy teeth of the
lamprey // Cell.Tissue Res. 1983. Vol. 231.
глава з. Железистые эпителии
Функция синтеза секреторных продуктов возникла и совершенст-
вовалась на основе способности клеток к выделению во внешнюю для
них среду продуктов внутриклеточного метаболизма. Это универсаль-
ное свойство живой протоплазмы широко и разнообразно реализуется
при образовании тканевых систем и, в частности, при развитии в них
внеклеточных структур типа кутикул кожного эпителия или межкле-
точного вещества и волокон соединительной ткани. Внутриклеточные
механизмы образования и выделения из клеток макромолекулярных
компонентов этих структур имеют много общего с типичными се-
креторными процессами. Однако все эти внеклеточные структуры
неотъемлемая составная часть тканевых систем и к ним неприло-
жим термин «секрет», который используется в настоящее время для
обозначения продуктов синтетической деятельности клеток, либо вы
полняющих специфическую для организма функцию (секрет под»6'
лудочной железы, обеспечивающий полостное пищеварение), либо иг
рающих вспомогательную роль в осуществлении основной функШЫ
126
Таким образом, несмотря на существенные специфические осо-
бенности эволюционной динамики кожных эпителиев, им, как и всем
тканям многоклеточных животных, свойственны отчетливо выражен-
ные явления направленной дифференцировки в филогенезе, проявляю-
щиеся в многочисленных отдаленных и близкородственных паралле-
лизмах.
ЛИТЕРАТУРА
Мамкаев Ю. В. Методы и закономерности эволюционной морфологии II
Современная эволюционная морфология. Л., 1991. С. 33-55.
Хэдли В. Кутикула членистоногих // В мире науки. 1986. С. 74-82.
Хэм А., Кормак Д. Гистология. М., 1983. Т. 4. С. 49-92.
Чага О. Ю., Соловей И. В. Кутикулярные эпителии и гранулярные амебо-
циты И Цитология. 1986. Т. 28. № 3.
Bereiter-Hahn J, Matoltsy A. G„ Richards К. S. Biology of integument // In-
vertebrates. Springer-Verlag, Berlin. 1984. Vol. 1.
Bereiter-Hahn J, Matoltsy A. G„ Richards K. S. Biology of integument //Ver-
tebrates. Springer-Verlag, Berlin. 1986. Vol. 2.
Fuchs E. Epidemal differentiation H J. Cell Biol. 1990. Vol. 111.
Uchra K„ Migoshi S„ Hidestoshi T. Fine structure of the homy teeth of the
lamprey // Cell.Tissue Res. 1983. Vol. 231.
глава з. Железистые эпителии
Функция синтеза секреторных продуктов возникла и совершенст-
вовалась на основе способности клеток к выделению во внешнюю для
них среду продуктов внутриклеточного метаболизма. Это универсаль-
ное свойство живой протоплазмы широко и разнообразно реализуется
при образовании тканевых систем и, в частности, при развитии в них
внеклеточных структур типа кутикул кожного эпителия или межкле-
точного вещества и волокон соединительной ткани. Внутриклеточные
механизмы образования и выделения из клеток макромолекулярных
компонентов этих структур имеют много общего с типичными се-
креторными процессами. Однако все эти внеклеточные структуры
неотъемлемая составная часть тканевых систем и к ним неприло-
жим термин «секрет», который используется в настоящее время для
обозначения продуктов синтетической деятельности клеток, либо вы
полняющих специфическую для организма функцию (секрет подже-
лудочной железы, обеспечивающий полостное пищеварение), либо иг
рающих вспомогательную роль в осуществлении основной функИ'Ы
126
данной тканевой системы (секрет бокаловидных железистых клеток
в кожном или кишечном эпителии). Особую группу секретов состав-
ляют специфические биологически активные вещества, регулирующие
различные процессы в тканях и в организме многоклеточных жи-
вотных. Эти вещества носят название гормонов. Таким образом, об-
щая особенность секреторных продуктов заключается в том, что они,
в отличие от межклеточных и внеклеточных структур, как правило,
не являются обязательными структурными компонентами тканевых
систем.
Типичные железистые дифференцировки — весьма характерное
направление специализации части клеток кожных и кишечных эпите-
лиев, а в некоторых случаях и отдельных участков целомической
выстилки.
Соответственно своему биологическому значению все железы де-
лятся на две большие группы — экзокринные и эндокринные. Экзо-
кринные железы — чаще всего производные кишечных и кожных
эпителиев. Они выделяют свой секрет во внешнюю среду. Эндокрин-
ные железы более разнообразны по своему происхождению. Продуци-
руемые ими секреты, или гормоны, выделяются в кровь или тканевую
жидкость. Многоклеточные экзокринные железы имеют систему вы-
водных протоков, в то время как у эндокринных желез их нет.
Помимо структурных и функциональных особенностей экзокрин-
ных и эндокринных желез между ними есть и глубокие биологические
различия. Секрет экзокринных желез обеспечивает такие процессы,
как полостное пищеварение и снабжение потомства пищей. Он может
также играть роль в осуществлении барьерной и других функций
пограничных эпителиальных тканей. Значение гормонов заключается
прежде всего в обеспечении гомеостаза многоклеточного организма.
Взаимосвязанная система эндокринных желез регулирует рост и диф-
ференцировку клеток, постоянство ионного состава, развитие вторич-
ных половых признаков и другие метаболические и морфогенетичес-
кие процессы.
§1. ЭКЗОКРИННЫЕ ЖЕЛЕЗЫ
Одноклеточные железы
Слизистые бокаловидные клетки представляют собой пример ти-
пичных одноклеточных желез, располагающихся обычно в кожных и
кишечных эпителиях. Они органически входят в состав пограничных
тканевых систем как одна из железистых дифференцировок эпители-
альных тканей. Слизистые клетки играют вспомогательную роль в
осуществлении основной функции эпителиального пласта. Так, в ки-
’27
щечном эпителии выделяемая бокаловидными клетками слизь образует
защитную оболочку. В эпителии толстой кишки слизистые клетки
становятся преобладающими клеточными элементами эпителиального
пласта. Слизь бокаловидных клеток в многорядном ресничном эпите-
лии воздухоносных путей служит тем субстратом, к которому прили-
пают твердые инородные частицы, попадающие в полость этих путей.
Наконец, в кожном эпителии немертин, моллюсков, низших позвоноч-
ных и многих других групп животных секрет слизистых клеток играет
вспомогательную, но важную роль в осуществлении барьерной функ-
ции эпителия.
Структурно-химическая организация слизистых железистых кле-
ток хорошо изучена на примере бокаловидных клеток кишечного эпи-
телия. Апикальная пузыревидная часть клетки в фазе накопления сек-
рета заполнена секреторными вакуолями, достигающими в зрелом со-
стоянии относительно крупных размеров (рис. 32, А). Ядро и основная
часть цитоплазмы с органоидами оказываются смещенными в базаль-
ную часть клетки — в область основания и ножки бокала. Особенно
большого развития достигает аппарат Гольджи (рис. 32, Б), представ-
ленный мощно развитой системой цистерн, располагающейся в надъ-
ядерной области (по периферии основания бокала и непосредственно
над ядром). Периферические цистерны сильно уплощены, ближе к
центру клетки они уже наполнены секретом и имеют овальную форму.
В средней части бокала наблюдаются скопления незрелых секреторных
гранул, занимающих основную часть цитоплазмы клеток. Шероховатая
эндоплазматическая сеть (ЭПС), митохондрии и другие органоиды рас-
положены в тонком периферическом слое цитоплазмы по стенке бо-
кала и в суженном основании клеток.
Исследования с меченными тритием глюкозой и галактозой пока-
зали, что меченые мукополисахариды обнаруживаются в мембранах
периферических уплощенных цистерн аппарата Гольджи уже через
5 мин после введения меченых предшественников. Через 20 мин ме-
ченый секрет обнаруживается в центральных расширенных цистернах
аппарата Гольджи и еще через 20 мин — в области секреторных
вакуолей. Через 4 ч меченые вакуоли находятся в апикальной части
клеток, откуда их содержимое выводится в полость кишки.
Таким образом, согласно радиоавтографическим данным, на мем-
ранах цистерн аппарата Гольджи синтезируются мукополисахариды,
составляющие основную часть слизистого секрета. Небольшое коли-
о елков, входящих в состав этого секрета, образуется на рибо-
плаз^е сосредоточенных преимущественно в периферической цито-
плазме и в стебельке или ножке клеток. Объединение белков и муко-
Рис. 32. Бокаловидные слизистые
клетки кишечного эпителия
позвоночных.
А — рисунок с микрофотографии бокало-
видной клетки кишечного эпителия аксо-
лотля; Б — схема строения бокаловидной
клетки кишечного эпителия млекопитаю-
щего: 1 — ядро, 2 — секреторные вакуо-
ли, 3 — шероховатая ЭПС, 4 — аппарат
Гольджи, 5 — митохондрии.
полисахаридов происходит в цистернах центральной части аппарата
Гольджи.
Описанный выше тип внутриклеточной морфобиохимической ор-
ганизации слизистой клетки характерен (с небольшими модификация-
ми) и для слизистых клеток других разновидностей эпителиальных
тканей позвоночных и беспозвоночных животных.
Помимо одноклеточных слизистых желез и в кожных, и в кишеч-
ных эпителиях, особенно у более низкоорганизованных и обитающих
в водной среде многоклеточных животных, имеются и другие одно-
клеточные железы, выделяющие белковый или смешанный секрет.
129
Принципы морфобиохимической организации их клеток рассмотрим
на примере малоклеточных и многоклеточных желез.
Малоклеточные железы
У высших первичноротых животных широко распространены ма-
локлеточные железы. Они состоят из собственно секреторных клеток
и клеток, выстилающих выводной проток железы.
Весьма сложно дифференцированы секреторные клетки слюнных
желез двукрылых насекомых. Интенсификация синтетической деятель-
ности достигается здесь в результате формирования высокополипло-
идных ядерных аппаратов с политенными хромосомами. В цитоплазме
таких клеток хорошо развит белоксинтезирующий аппарат (шерохова-
тая ЭПС). Многочисленные митохондрии локализованы главным об-
разом в области базальных складок плазматической мембраны. Аппа-
рат Гольджи представлен отдельными комплексами, рассредоточенны-
ми по всей цитоплазме.
Широкое распространение у беспозвоночных животных имеют
малоклеточные железы, продуцирующие смешанный мукопротеидный
секрет, составные компоненты которого синтезируются отдельными
узкоспециализированными клетками. Примером такой железы может
служить туловищная железа у приапулид (рис. 33). Секреторные эле-
менты представлены двумя типами клеток: темными с сильно базо-
фильной цитоплазмой и светлыми. Цитохимический и радиоавтогра-
фический анализ клеток показал, что темные клетки белоксинтези-
рующие. Светлые клетки характеризуются избирательным включением
предшественников синтеза кислых мукополисахаридов и относительно
низким уровнем белкового синтеза. Такие смешанные железы, состо-
ящие из клеток, специализированных на синтез различных компонен-
тов сложных секретов, характерны и для многоклеточных желез. К
ним относится, в частности, часть слюнных желез млекопитающих
(подчелюстная железа).
Многоклеточные железы
Эти железы особенно развиты у высших представителей вторич-
норотых животных, в частности у млекопитающих. Поэтому некоторые
щие закономерности дифференцировки клеток и системной органи-
зации железистой ткани удобно будет рассмотреть на примере трех
unn11110 ^eHHbIX желез: экзокринной части поджелудочной железы,
очной железы и сальных желез кожных покровов. Две первые
130
.“с 33. Строение многоклеточной железы в кутикулярном эпителии приапулиды.
Центральный проток железы, 2, 3 — мелкие клетки кутикулярного эпителия
в области протока, 4 — кутикулярный колпачок, 5 — полисахаридный
и б белковый слой кутикулы, 7 — слой слизи, 8 — гиподермальные клетки,
выстилающие железу, 9 — светлые слизистые и 10 — темные белковые
железистые клетки, II — клетки гиподер.мы, 12 — базальная мембрана.
131
железы относятся к так называемым сложным многоклеточным желе-
зам, обладающим целой системой разветвленных выводных протоков
Концевые разветвления заканчиваются секреторными отделами, имею-
щими вид альвеол или трубочек, стенки которых выстланы секретор-
ными клетками (рис. 34, В).
Концевые секреторные отделы поджелудочной железы имеют не-
большой просвет. Их стенка образована плотно примыкающими друг
к другу конусовидными клетками (рис. 34, А). Ядра расположены в
нижней трети клеток. Цитоплазма делится на две зоны — апикальную
зимогенную и базальную гомогенную. Апикальная часть клеток, со-
держащая гранулы секрета, окрашивается кислыми красителями, ба-
зальная гомогенная зона базофильна. В ней сосредоточена основная
часть гиалоплазмы и органоидов клетки; Особенно мощного разви-
тия достигает аппарат белкового синтеза (рис. 34, Б). Он представ-
лен плотно упакованными цистернами шероховатой ЭПС, занимаю-
щими всю базальную часть клеток. Многочисленные рибосомы об-
наруживаются и на наружной мембране ядерной оболочки. Хоро-
шо развит в секреторных клетках и аппарат Гольджи компактного
типа. Его цистерны и вакуолярная часть расположены в надъядерной
области. Многочисленны крупные митохондрии с хорошо развитыми
кристами.
Секреторная клетка поджелудочной железы благодаря интенсив-
ному белковому синтезу — удобная модель для анализа процессов
синтеза и транспорта белка. На поджелудочной железе морских свинок
методом электронно-микроскопической радиоавтографии удалось по-
казать, что сборка белков на рибосомах ЭПС относительно непродол-
жительна (около 3 мин). Перемещение синтезированного белка в мел-
кие транспортные пузырьки наблюдается уже через 10 мин после
начала синтеза и резко тормозится при нарушении метаболизма жир-
ных кислот (рис. 34, В). Слияние транспортных пузырьков с крупными
конденсационными вакуолями происходит через 20 мин после начала
синтеза белка на рибосомах ЭПС. Зрелые секреторные гранулы с
меченым белком в заметных количествах появляются через час после
введения меченого предшественника синтеза белка.
Возможность учета интенсивности синтеза белка, а также продол-
жительности внутриклеточного транспорта позволила перейти к экс-
периментальному анализу этих процессов. Удалось показать, что син-
тез белка и его транспорт через мембрану ЭПС, перемещение в цис-
тернах ЭПС, переход в транспортные пузырьки, а также их слияние
с конденсационными вакуолями — полуавтономные процессы, не свя
занные между собой причинно-следственными связями. Их синхронное
132
Рис. 34. Экзокриновая часть поджелудочной железы.
А — рисунок с микрофотографии концевого отдела железы; Б — ульграструктурная организация; В — строение участка железы:
1 — ядро, 2, 3 — зоны цитоплазмы (2 — гомогенная, 3 — зимогенная), 4 — шероховатая ЭПС, 5 — аппарат Гольджи, 6 — митохонд-
рии, 7 — конденсационные вакуоли аппарата Гольджи, 8 — мелкие транспортные пузырьки, 9 — лизосомы, 10 — поступление аминокис-
лот, 11 — концевой отдел, 12 — выводной проток; стрелками на рис. Б показано внутриклеточное перемещение секрета,
синтезированного на шероховатой ЭПС.
протекание в секреторном цикле клетки обусловлено наличием интег-
ративных механизмов, обеспечивающих нормальное развитие секре-
торного цикла клетки. Лабильная организация последнего придает
секреторным клеткам большую пластичность. Так, при действии не-
которых агентов образование секреторных гранул может происходить
не через конденсационные вакуоли, а через цистерны аппарата Гольд-
жи. Такой механизм формирования секреторных гранул характерен
для секреторных клеток большинства млекопитающих. В апикальной
части секреторных клеток поджелудочной железы морской свинки
обнаружены мелкие пузырьки, образующиеся путем компенсаторного
эндоцитоза. Они отшнуровываются от плазматической мембраны и
перемещаются к аппарату Гольджи, сливаясь с его цистернами и кон-
денсационными вакуолями. Таким образом обеспечивается удаление
избытка плазматической мембраны, возникающего при экзоцитозе сек-
реторных гранул. Повторное использование мембранных структур про-
исходит в секреторных клетках и при транспорте секрета от шерохо-
ватой ЭПС к конденсационным вакуолям. Транспортные пузырьки
после слияния с конденсационной вакуолью вновь отшнуровываются
от нее и возвращаются к цистернам ЭПС*.
На клетках экзокринной части поджелудочной железы млеко-
питающих показано наличие двух механизмов регуляции выведения
секрета. Экзоцитоз крупных зрелых гранул зимогенной зоны регули-
руется клеткой при воздействии на ее рецепторы внешних раздражи-
телей. Он обычно происходит через определенные промежутки време-
ни. Второй механизм выведения секрета осуществляется, по-видимому,
непрерывно мелкими пузырьками и гранулами, заполненными секре-
том. Механизмы регуляции процесса остаются в значительной мере
неясными.
Секреторные клетки поджелудочной железы выделяют свой сек-
рет по мерокриновому типу, т. е. путем экзоцитоза, без разрушения
апикальной части клетки и ее плазматической мембраны.
Своеобразие экзокринного отдела поджелудочной железы заклю-
чается в сохранении у части секреторных клеток способности к авто-
репродукции. Оно проявляется в способности некоторых клеток к
митозу или эндомитотическому удвоению генетического материала,
однако соматическая полиплоидизация захватывает лишь небольшую
часть клеток и они не достигают высокой плоидности. Несмотря на
,ш^5™ЬШИНСТВе “кРетоРных клеток транспортировка созревающего секрета от ЭПС к
нымиГтпянгГпиРаТа 0JIb®Kli’ цистернами аппарата Гольджи и между его конеч-
ных пузырьков СТеРНаМИ осУп1ествляется при помощи мелких рециклирующих транспорт-
134
медленное обновление секреторных клеток поджелудочной железы в
нормальных условиях, ее регенерационные потенции весьма велики.
Так, у белых крыс после отравления этионином и гибели около75%
секреторных клеток их восстановление происходит в течение недели
преимущественно благодаря интенсивному делению и специфической
дифференцировке клеток конечных отделов выводных протоков желе-
зы. Однако быстрая регенерация эпителия может происходить только
при сохранении целостности соединительно-тканной основы концевых
отделов и выводных протоков железы.
Железистые клетки молочной железы млекопитающих характери-
зуются разнообразной синтетической деятельностью. Эти клетки сек-
ретируют жир, белки (казеин, лактоальбумины и лактоглобулины),
специфический углевод лактозу, а также неорганические соединения.
Большая часть сложных органических секретов синтезируется непо-
средственно клеткой. В связи с мультифункциональной морфобиохи-
мической дифференцировкой в секреторных клетках молочной железы
сильно развит, хотя и в меньшей степени, чем в клетках поджелудоч-
ной железы, аппарат белкового синтеза. В надъядерной области рас-
полагается аппарат Гольджи. Имеется система цистерн и каналов глад-
кой ЭПС. Цитоплазма клеток в определенные периоды секреторного
цикла заполнена гранулами белкового секрета. Синтез жира начинается
в базальной части клеток (рис. 35). Жировые включения обнаружива-
ются вначале в виде небольшой капли, размеры которой по мере
продвижения к апикальной поверхности клетки сильно возрастают. К
моменту выделения она занимает большую часть апикальной цито-
плазмы. Выделение жира происходит по так называемому апокрино-
вому типу, т. е. с отрывом части цитоплазмы и плазматической мем-
браны апикальной поверхности. Белковые продукты выводятся пре-
имущественно путем экзоцитоза. Апикальная поверхность клеток об-
разует характерные пальцевидные выпячивания типа микроворсинок
в просвет концевого отдела железы. Они играют, по-видимому, суще-
ственную роль в процессах выведения воды, лактозы и ионов кальция.
Особенностью организации молочной железы является ее способ-
ность к периодическим разрастаниям и инволюциям. Эти морфогене-
тические процессы находятся под гормональным контролем организма,
определяющим скорость деления клеток в период разрастания конце-
вых отделов железы и процессы их дифференцировки.
На молочной железе грызунов удалось показать, что под гормо-
нальным контролем находится такой важный этап в подготовке клеток
к делению, как редупликация ДНК. В разрастающейся железе продол-
жительность его сокращается с 21,5 до 8,2 ч. Гормональное воздейст-
135
Рис. 35. Секреторный цикл в клетках молочной железы
I — эпителиально-мышечная клетка, 2 — капля жира, 3 — секреторная гранула
с белковым секретом, 4 — ядро секреторной клетки, 5 — шероховатая ЭПС, 6 —
аппарат Гольджи.
вие изменяет длительность этого периода митотического цикла. В
опытах с зачатками молочной железы в условиях in vitro выявлена
взаимообусловленность процессов специфического белкового синтеза
и деления клеток. Синтез специфического для секреторных клеток
белка казеина может происходить только после нескольких циклов
репродукции.
Помимо гормонального фактора большое значение в регуляции
функциональной активности железы и процессов ее инволюции име-
ют и внешние воздействия типа механического растяжения конце-
вых отделов железы выделяемым секретом. В лактирующей железе
при отсутствии оттока молока прекращается выработка секрета клет-
ками. Они дегенерируют, а секрет и продукты разрушения клеток
утилизируются организмом без резко выраженных воспалительных
процессов.
Примером железы, выделяющей свой секрет путем разрушения
клеток, может служить сальная железа млекопитающих. Выводные
протоки большинства сальных желез в коже млекопитающих связаны
с корневыми частями волос и развиваются в гистогенезе как часть
зачатка волоса. В сальных железах на границе с соединительной тка-
нью располагаются недифференцированные клетки, энергичное раз-
множение которых обеспечивает непрерывную замену дифференциро-
ванных клеток, разрушающихся в центральной области мешковидного
концевого отдела железы. Суть специфической дифференцировки кле-
ток этой железы заключается, следовательно, в непрерывном и про-
грессирующем накоплении в клетках жироподобных веществ, вплоть
до полного перерождения всей цитоплазмы и гибели клеток. За счет
продуктов распада перерожденных клеток образуется секрет, который
поступает в просвет выводного протока железы.
Этот не очень экономичный тип секреторного процесса — голо-
криновая секреция — довольно широко распространен у многоклеточ-
ных животных.
§2. ЭНДОКРИННЫЕ ЖЕЛЕЗЫ
Позвоночные животные. Эпителиальные эндокринные желе-
зы — сложная и гетерогенная по происхождению система желез внут-
ренней секреции — производные как кожного, так и кишечного эпи-
телиев. Имеются также железы, которые развиваются из целомической
выстилки и других производных мезодермального эпителия.
Эндокринная часть поджелудочной железы млекопитающих —
пример типичного железистого эпителия, специализированного на вы-
работку гормонов. Она состоит из тяжей железистых клеток, сосре-
доточенных в железистой ткани экзокринной части железы в виде
отдельных скоплений, получивших название островков Лангерганса.
Каждый островок состоит из взаимно переплетающихся тяжей эпите-
лиальных клеток с окружающей их разветвленной сетью многочислен-
ных капилляров (рис. 36). Последние выстланы эндотелием из упло-
щенных клеток. В эндотелии имеются многочисленные поры, которые
обеспечивают быстрое поступление гормонов в полость сосудов. Боль-
шинство эпителиальных клеток содержит в своей цитоплазме харак-
терные секреторные гранулы.
По окраске гранул и ряду физико-химических свойств популяцию
Дифференцированных секреторных клеток поджелудочной железы у
млекопитающих принято делить на три основных типа: А, В и D.
В-клетки выделяют гормон инсулин, снижающий уровень глюкозы в
крови благодаря превращению ее избытков в клетках печени и в
мышцах в гликоген. А-клетки выделяют гормон глюкагон, обеспечи-
вающий превращение гликогена в глюкозу при снижении ее уровня в
крови (7, 2). D-клетки (3) синтезируют гормон соматостатин, подав-
Рис. 36. Ультраструкзурная организация участка железистой ткани эндокринной
части поджелудочной железы (островок Лангерганса).
I — В-клетки с гранулами, 2 — D-клетки, 3 — /-клетки, 4 — сосуд, 5 — В-клетка
на стадии начала синтеза предшественника инсулина.
ляющий выход гормона роста из соматотропных клеток передней доли
гипофиза. Имеются также клетки, почти лишенные секреторных гра-
нул, на основании чего их считали камбиальными элементами, спо-
собными к делению и дифференцировке в различных направлениях
(С-клетки). По-видимому, это В-клетки в стадии синтеза предшествен-
ника инсулина до формирования зрелых секреторных гранул.
Изучение морфологии секреторных гранул с помощью электрон-
ной микроскопии и экспериментальных методов анализа в общем
подтвердило представление о гетерогенности клеточного состава же-
лезистого эпителия островков. Секреторные гранулы в разных типах
клеток существенно различаются по своим размерам, строению окру-
жающих мембран и соотношению электронно-плотной центральной
части гранулы и периферического субмембранного пространства. Уда-
лось также проследить и процессы выведения гранул из клеток в
138
нормальных условиях и при экспериментальной стимуляции секреции.
Показано, что при интенсивном выведении гранул, содержащих гор-
моны, увеличивается поверхность плазматической мембраны, образую-
щей своеобразные микроворсинки. В месте слияния мембран секре-
торной гранулы и клетки образуется отверстие, через которое гормон
выводится наружу.
Тонкие механизмы синтеза гормона, его внутриклеточного транс-
порта и созревания хорошо изучены в В-клетках (рис. 37). Оказалось,
что на рибосомах ЭПС синтезируется первый предшественник инсу-
лина, так называемый препроинсулин — полипептид молекулярной
массой 11 000 Да. Сразу после прохождения через мембрану ЭПС
внутрь ее каналов от полипептида отрезается сигнальный участок и
образуется проинсулин — полипептид 9100 Да. Уже после «созрева-
ния» секрета в цистернах аппарата Гольджи при образовании зрелых
секреторных гранул происходит вырезание из середины молекулы про-
инсулина фрагмента С и соединение двух ее краевых участков в
молекулу инсулина 5000 Да. Процессы осуществляются специальными
пептидазами, активизация которых происходит в результате изменения
pH в зрелых гранулах. Такого рода сложные превращения необходимы,
по-видимому, и для транспортировки молекул, и для более совершен-
ной регуляции выведения гормона в кровяное русло. Как уже отмеча-
лось выше, имеется определенная цикличность в синтезе, накоплении
и выведении гормона В-клетками. В стадии синтеза предшественников
гормона клетки содержат мало гранул. При накоплении большого
количества гранул синтез предшественников временно прекращается.
Среди А-клеток у млекопитающих выделяют три разновидности,
отличающиеся как по строению и размерам гранул, так и по отноше-
нию к некоторым экспериментальным воздействиям. У птиц обнару-
жено два типа А-клеток: вырабатывающие глюкагон и синтезирующие
панкреатический полипептидный гормон.
Гетерогенность состава А-клеток у млекопитающих позволяет вы-
сказывать предположение о том, что часть из них может выделять
гормоны, регулирующие метаболизм жиров, а также серотонин.
Система В-клеток у млекопитающих чувствительна к хронической
усиленной функциональной нагрузке. У В-клеток железистого эпите-
лия островков Лангерганса довольно ограничены потенции к гипер-
трофии, свойственные другим тканевым системам. Системы клеток,
продуцирующих инсулин, при усиленной функциональной нагрузке,
либо при неадекватном вмешательстве в регуляторные ее механизмы,
либо при эндогенных нарушениях этих механизмов подвергаются мас-
совой деструкции, приводящей к тяжелому и широко распространен-
139
Рис. 37. Синтез и изменения в процессе внутриклеточного транспорта
предшественника молекулы инсулина (препроинсулина); в квадрате —
синтез молекулы препроинсулина на прикрепленной рибосоме
шероховатой ЭПС.
А — ^-фрагмент, В —В-фрагмент, С — С-фрагмент молекулы препроин-
сулина; на дистальном конце молекулы светлый участок — сигнальная
последовательность (Си); ГТ — пептидазы, которые будут в зрелых грану-
лах вырезать фрагмент С', К — клатрин — белок, составляющий клэтрн-
новую оболочку («опушение») незрелых гранул со щелочной реакцией
среды: I — ядро, 2 — ЭПС, 3 — цистерны аппарата Гольджи, 4 — не-
зрелые «опушенные» секреторные гранулы, 5 — зрелые гранулы, 6 —
молекула инсулина; стрелками показано направление перемещения моле-
кул проинсулина и пептидаз.
140
ному заболеванию — диабету, суть которого заключается в утрате
способности организма регулировать уровень глюкозы в крови.
Щитовидная железа — пример железы, где запасание предшест-
венника для образования гормонов осуществляется внеклсточно в осо-
бых фолликулах. Стенки многочисленных фолликулов образованы же-
лезистым эпителием (рис. 38, Л). В полости фолликулов находится
коллоид тиреоглобулин, из которого образуются гормоны тироксин и
трннодтиронин. Молекулы тиреоглобулина 660 кДа состоят из четы-
рех мономеров протеогликанов. Их основу составляет центральная
белковая цепь, к которой
присоединены многочис-
ленные боковые полиса-
харидные цепи.
Как и во всех желе-
зах внутренней секре-
ции, в щитовидной желе-
зе имеется разветвленная
сеть капилляров, стенки
которых непосредствен-
но контактируют с ба-
зальной мембраной же-
лезистого эпителия фол-
Рис. 38. Фолликулы щитовид-
ной железы млекопитающего
(А) и ультраструктурная
организация секреторной
клетки (£).
/ — коллоид, 2 — секретор-
ные клетки, 3 — шероховатая
ЭПС, 4 — аппарат Гольджи,
5 — ядро, 6 — вакуоли с кол-
лоидом, синтезированным в
клетке, 7 — вакуоли с коллои-
дом, поглощаемым клеткой
путем фагоцитоза, 8 — лизосо-
ма; стрелками на левом рисун-
ке показано место синтеза кол-
лоида, путь его внутриклеточ-
ного транспорта и выделение
в просвет, на правом — погло-
щение коллоида путем фагоци-
тоза, расщепление его при по-
мощи ферментов лизосом и
выведения гормонов из клетки.
6
141
ликулов. В отличие от других эндокринных желез секреторные клетки
стенки фолликулов щитовидной железы характеризуются резко выра-
женной полярностью (рис. 38, Б). В базальной части клеток наблюда-
ются складчатость плазматической мембраны и большое количество
митохондрий. На апикальной поверхности, контактирующей с колло-
идом, образуются небольшие микроворсинки.
Синтез предшественника гормона — тиреоглобулина — начина-
ется на рибосомах расширенных цистерн ЭПС, расположенной в ба-
зальной и средней частях клеток. Отсюда синтезированные на рибо-
сомах белковые цепи протеогликанов с начальными участками поли-
сахаридных боковых цепей поступают в цистерны аппарата Гольджи,
где происходит синтез основных отрезков боковых углеводных цепей
и объединение мономеров протеогликанов в молекулы тиреоглобули-
на. Далее из цистерн аппарата Гольджи в мелких секреторных пузырь-
ках молекулы тиреоглобулинов транспортируются капикалыюй по-
верхности клеток, где коллоид путем экзоцитоза выделяется впросвет
фолликула. Иодирование молекул тиреоглобулина происходит либо в
апикальной части клеток, либо в момент экзоцитоза у клеточной по-
верхности. Обратное поступление коллоида в клетку осуществляется
путем пино- или фагоцитоза. Образующиеся пино- и фагосомы сли-
ваются с лизосомами, гидролитические ферменты которых разрушают
молекулы тиреоглобулина. При этом образуются два основных гормо-
на щитовидной железы — тироксин и трииодтиронин — небольшие
молекулы молекулярной массой около 6, 5 кДа, содержащие три или
четыре атома иода.
Сложный путь образования относительно простых соединений,
по-видимому, неслучаен. Он позволяет щитовидной железе иметь
большое количество «полупродукта» и тонко регулировать поступле-
ние гормонов в кровь. Вместе с тем этот принцип работы с внекле-
точным хранением высокомолекулярного предшественника гормонов
требует специальной организации клеток; они должны осуществлять
одновременно два разных по своей сути многоступенчатых процесса:
а) синтез тиреоглобулина; б) его поглощение, тонкий гидролиз с со-
хранением гормонов и их регулируемое выведение из клеток.
Помимо тиреоцитов в стенке фолликулов щитовидной железы
млекопитающих имеются еще и так называемые парафолликулярные
клетки. Они не доходят до просвета и синтезируют гормон кальцито-
нин небольшой полипептид, регулирующий кальциевый обмен. По
структурно-химической организации парафолликулярные клетки сход-
ны с и В-клетками поджелудочной железы и существенно отлича-
ются от тиреоцитов.
142
Гормоны железы, выделяемые тиреоцитами, тироксин и трииод-
тиронин, а также образующиеся из них в результате окислительного
дезаминирования конечные активные продукты действуют на фермен-
тативные системы, локализованные в митохондриях. В связи с этим
щитовидная железа регулирует общий энергетический обмен во мно-
гих тканях.
Эпителий щитовидной железы в отличие от эпителия островков
Лангерганса обладает большими потенциями к регенерации и гипер-
трофии. Эти процессы, как и функция железы в нормальных условиях,
регулируется гормонами, в частности тиреотропным гормоном адено-
гипофиза. У человека потенции эпителия щитовидной железы к уве-
личению количества железистой ткани в результате интенсивной реп-
родукции клеток особенно отчетливо проявляются в патологических
условиях. При недостатке в диете иода, естественно, падает и количе-
ство выделяемого щитовидной железой гормона. Это вызывает уси-
ленную продукцию тиреотропного гормона аденогипофизом, что обу-
словливает стимуляцию пролиферации клеток эпителия щитовидной
железы. В результате в несколько раз увеличивается объем железистой
ткани.
Корковое вещество надпочечника млекопитающих развивается из
целомической выстилки и может служить примером эндокринной же-
лезы мезодермального происхождения. Вся железа состоит из тяжей
эпителиальных железистых клеток, расположенных перпендикулярно
ограниченной соединительнотканной капсулой поверхности органа.
Соответственно ориентирована и сеть капилляров, которые со всех
сторон окружают тяжи железистых клеток. Расположение клеток в
тяжах и их морфобиохимическая дифференцировка не одинаковы в
разных зонах коркового вещества надпочечника (рис. 39). Клетки всех
зон выделяют стероидные гормоны, предшественником синтеза кото-
рых служит холестерин.
Под соединительнотканной капсулой располагаются начальные
участки тяжей, образованные относительно мелкими клетками с тем-
ными ядрами и умеренным количеством липидных включений в ци-
топлазме. Совокупность начальных участков тяжей образует так на-
зываемую клубочковую зону надпочечника (рис. 39, А, Б). Ее желе-
зистые клетки выделяют в основном гормон альдостерон, который
регулирует солевой обмен. Следующая, наибольшая по толщине зона
коркового вещества надпочечника образована средними участками
тяжей эпителиальных клеток и получила название пучковой зоны
(рис. 39, В, Г). Она состоит из более крупных клеток с относительно
светлой оксифильной цитоплазмой и более светлыми, чем у клеток
143
клубочковой зоны, ядрами. В состоянии умеренной функциональной
активности в цитоплазме клеток обнаруживаются в большом количе-
стве мелкие липидные гранулы, содержащие холестерин, из которого
образуется кортизон — основной гормон клеток этой зоны. Выделение
гормонов стимулируется особым аденокортикотропным гормоном аде-
ногипофиза. Гормоны пучковой зоны регулируют белковый и угле-
водный об-мен, а также тормозят размножение клеток и формирование
основного вещества в соединительной ткани, развитие воспалительной
реакции и процессы образования антител.
При умеренной продукции гормонов в цитоплазме клеток пучко-
вой зоны содержится много мелких липидных включений. При сти-
муляции железистой функции размеры клеток, ядер и ядрышек уве-
личиваются. Судьба липидных гранул при гипертрофии клеток может
быть различной. Они могут полностью исчезать, однако при более
сильной стимуляции количество их увеличивается по сравнению с
нормой, но размеры уменьшаются. Такие изменения липидных вклю-
чений свидетельствуют о том, что они, как и коллоид щитовидной
железы, содержат не готовый гормон, а лишь его предшественник.
Концевые участки эпителиальных тяжей коркового вещества об-
разуют так называемую сетчатую зону. Железистые клетки этой зоны
более мелкие, количество липидных включений в них минимально,
цитоплазма и ядра окрашиваются интенсивно (рис. 39, Д, Е). В цито-
плазме часто содержатся гранулы липофусцина. Предполагают, что
железистые клетки сетчатой зоны могут выделять андрогены и другие
половые гормоны.
Таким образом, корковое вещество надпочечника представляет
собой сложную железу внутренней секреции с отчетливой дифферен-
цировкой образующих ее клеточных элементов. В ней отчетливо вы-
ражено пространственное разграничение клеток разной функциональ-
ной специализации. Гистогенетические взаимоотношения между типа-
ми клеток, расположенных в разных зонах коркового вещества, оста-
ются неясными. Каждый эпителиальный тяж с его тремя зонами пред-
ставляет ^собой обновляющуюся субпопуляцию клеток. Митозы и ме-
ченные [ Н]тимидином ядра наблюдаются во всех зонах, их количество
максимально в клетках клубочковой зоны, минимально — в клетках
сетчатой зоны. Отчетливо выражен градиент распределения пролифе-
рирующих клеток и в пределах каждой зоны. Количество митозов и
меченных [ Н]тимидином ядер всегда больше в проксимальных и
еньше в лежащих глубже участках данной зоны. В длительных опы-
тах ]тимидином удается наблюдать в каждой зоне тяжа перемеще-
144
А Рис. 39. Корковое вещество надпочечника.
зоны: А, Б — клубочковая, В, Г — пучковая, Д, Е — сетчатая; А, В, Д —
рисунки с микрофотографии; Б, Г, Е — ультраструктурная организация клеток;
ядро, 2 — митохондрии, 3 — липидные капли, 4 — гранулы гликогена,
5 — полость капилляра, 6 — клетки эндотелия.
ние меченых клеток из проксимальных в дистально расположенные
участки.
Аденогипофиз занимает особое положение в системе желез внут-
ренней секреции у позвоночных животных, являясь центральной же-
лезой внутренней секреции. С одной стороны, железистые клетки
аденогипофиза выделяют гормоны, регулирующие деятельность дру-
гих желез внутренней секреции: кортикотропный, тиреотропный, го-
надотропный гормоны. С другой стороны, секреторная активность
клеток аденогипофиза регулируется (в основном через кровь и ткане-
вую жидкость) нейросекреторными клетками гипоталамуса. Часть кле-
ток аденогипофиза выделяет гормоны, непосредственно действующие
на клетки тканей-мишеней (например, гормон роста соматотропин,
лактогенный гормон, или маммотропин и, наконец, меланоцитстиму-
лирующий гормон).
Аденогипофиз в эмбриогенезе развивается из зачатка кожного
эпителия, выстилающего дорсальную стенку ротовой полости. В мор-
фологическом отношении основная его часть — дистальная зона —
имеет строение типичной железы внутренней секреции. Железистая
ткань представлена системой обильно васкуляризованных тяжей эпи-
телиальных клеток. Особенностью железистой ткани аденогипофиза
является большая гетерогенность клеточного состава. Она обусловлена
различной функциональной и в связи с этим морфобиохимической
дифференцировкой клеток.
В аденогипофизе удается выделить три главных типа клеток:
оксифильные, базофильные и хромофобные клетки. Оксифильные и
базофильные клетки — либо временно вышедшие из секреторного
цикла клетки, либо малодифференцированные камбиальные элементы,
способные превращаться в различные типы секреторных клеток. Они
характеризуются небольшими размерами и отсутствием признаков спе-
цифической дифференцировки. Оксифильные и базофильные клетки,
в свою очередь, подразделяются еще на ряд разновидностей, количе-
ство которых (по данным разных авторов) варьирует (от 7 до 9 типов
клеток). Функциональное значение некоторых типов клеток, выраба-
тывающих разные гормоны, установлено достаточно точно.
На ультраструктурном уровне клетки аденогипофиза различаются
главным образом размерами секреторных гранул (рис. 40). Установле-
но, что наиболее крупные гранулы (42—50 нм) характерны для про-
лактиновых клеток, наиболее мелкие — для кортикотропных и тире-
отропных клеток (10-20 нм). Последние отличаются между собой по
форме каналов эндоплазматической сети (более вытянутые у кортико-
тропных клеток) и количеством свободных рибосом (больше у тире-
146
S 4
Рис. 40. Улыраструктурная организация клеток
аденогипофиза млекопитающих.
I соматотропная, 2 — гонадотропная, 3 — тиреотропная,
4 — пролактиновые, 5 — эндотелиальные клетки.
•it'
147
отропных клеток). Для гонадотропных клеток характерны гранулы
размерами 20-25 нм, а для соматотропных — 35-40 нм.
Все рассмотренные выше примеры касались оформленных и часто
довольно сложно устроенных (надпочечник, щитовидная железа) эн-
докринных желез. Наряду с этими железами у высших позвоночных
существует и шрает большую роль в эндокринной регуляции и так
называемая диффузная эндокринная система (ДЭС). Ее образуют клет-
ки, диффузно распределенные в эпителиях по ходу пищеварительного,
мочеполового и дыхательного трактов. Найдены такие клетки и в
почке, особенно многочисленны они в кожном эпителии низших по-
звоночных, в частности у амфибий. Клетки диффузной эндокринной
системы весьма многообразны по морфологии содержащихся в них
гранул с предшественниками гормонов. В настоящее время у млеко-
питающих обнаружено уже 19 типов таких клеток, которые выделяют
специфический для каждого типа гормон или несколько гормонов.
Особенно хорошо изучены эти клетки по ходу пищеварительного
тракта и отчасти в легких (рис. 41). Основная масса гормонов, выде-
ляемых ДЭС, относится к биогенным аминам и пептидным гормонам.
В составе диффузной эндокринной системы обнаружены, в частности,
все клеточные типы, характерные для описанных выше тяжей эпите-
лиальных клеток в эндокринных участках поджелудочной железы. По
сути дела, островки Лангерганса — часть этой системы. Несмотря на
то что диффузная эндокринная система, как правило, представлена
отдельно расположенными единичными клетками в составе эпители-
альных пластов (например, энтерохромаффинные клетки кишечного
эпителия), общая масса клеток этой системы превышает массу всех
остальных, оформленных в виде органов эндокринных желез организ-
ма. Помимо упомянутых выше пептидных гормонов в составе ДЭС
имеются клетки, выделяющие гастрин, адренокортикотропный, сома-
тотропный и целый ряд других гормонов.
Есть в составе диффузной эндокринной системы клетки, выде-
ляющие гормоны, сходные с гормонами и медиаторами, выделяемыми
пептидэргическими нейронами (эндорфины, вещество Р, соматостатин
и др.).
Установлено, что клетки ДЭС могут выполнять как паракринную,
так и эндокринную функции. Под паракринной функцией понимают
местное влияние клеток ДЭС; выделяемые ими гормоны могут усили-
вать или прекращать секрецию рядом расположенных секреторных
клеток, усиливать или уменьшать барьерную функцию основных кле-
ток эпителиального пласта, обусловливать местное изменение прони-
Ц мости сосудов и т. д. Эндокринная функция клеток ДЭС аналогич-
148
Рис. 41. Структурная организация и функциональные связи диффузной
эндокринной системы (по В. В. Яглову, 1989).
1 — эндокринная клетка открытого типа, 2 — эндокринная клетка закрытого
типа, 3 — гладкая мышечная клетка, 4 — тучная клетка, 5 — капилляр,
6 — концевой отдел железы, 7 — фибробласт. 8 — нервная ктетка.
на эндокринной функции других желез внутренней секреции. Система
ДЭС, как и другие эндокринные железы, связана с нервной системой,
но особенно тесно с иммунной и древними защитными системами
организма. Это обусловлено расположением клеток ДЭС на границе
с внешней средой в составе пограничных эпителиальных пластов.
Клетки ДЭС по морфологии делятся на два типа: закрытые и открытые
клетки (7, 2). Последние выполняют наряду с эндокринной и пара-
кринной еще и рецепторную функцию. В их апикальной, контакти-
рующей с внешней средой плазматической мембране есть специфи-
ческие рецепторы, стимуляция которых внешними факторами вызыва-
149
ет выведение гормонов. Регуляция деятельности клеток ДЭС закрыто-
го типа (не контактирующих с внешней средой) осуществляется с
помощью сигналов, поступающих от нервных клеток, и рецепторов,
воспринимающих сигналы специфических молекул из тканевой жид-
кости.
Беспозвоночные животные. Эпителиальные эндокринные желе-
зы беспозвоночных представлены оптическими и перикардиальными
железами. Кроме того, гормональная активность обнаружена и у кле-
ток задней пары слюнных желез. Оптические железы — это шаровид-
ные образования, расположенные в дистальной части глазных стебель-
ков и состоящие из эпителиальных железистых и соединительноткан-
ных клеток. Эпителиальные клетки вырабатывают гонадотропный гор-
мон, стимулирующий рост половых желез и откладку яиц. Перикар-
диальные железы представляют собой систему каналов, выстланных
железистым эпителием. Удаление желез вызывает на четвертый день
гибель животных. Характер выделяемых этой железой гормонов и их
функциональное значение остаются пока неясными.
Слюнные железы головоногих моллюсков входят в состав желе-
зистого аппарата их пищеварительного тракта, т. е. выполняют роль
экзокринных желез. Однако, как и у млекопитающих, они не только
выделяют секрет в полость начальных отделов пищеварительного трак-
та, но и продуцируют гормоны в обильно разветвленную сеть капил-
ляров и лакун в прослойках соединительной ткани. Гормоны, выде-
ляемые железистыми клетками слюнных желез головоногих моллюс-
ков (норадреналин и серотонин), регулируют деятельность мышечных
клеток.
У ракообразных эндокринные железы представлены Y-органами
и андрогенными железами. Первые являются видоизмененными мета-
нефридиями головных сегментов. Они локализованы у низших раков
в первом сегменте. Y-орган может иметь листовидную, коническую
или чечевицевидную форму. Он состоит из эпителиальных железистых
клеток, цитоплазма которых богата РНК и щелочной фосфатазой и
бедна гликогеном и липидами. Гормон Y-органа регулирует обмен
веществ. По-видимому, он является разновидностью гормона линьки
членистоногих — экдизона. R связи с этим Y-органы предложено
называть экдизальными железами. Основная их функция — регуляция
линьки. Кроме того, гормон или гормоны экдизальных желез ракооб-
разных регулируют обмен веществ и стимулируют созревание гонад,
ндрогенные железы ракообразных, по-видимому, так же как и экди-
альные, мезодермального происхождения. Они развиваются из стенки
150
выводного протока половой железы и либо располагаются на его
поверхности, либо погружены в ткань половой железы. Гормоны этих
желез стимулируют развитие семенников и вторичных половых при-
знаков.
У насекомых хорошо изучены железы внутренней секреции эпи-
телиальной природы — прилежащие тела и экдизальные железы, из-
вестные под различными названиями (перикардиальные, проторакаль-
ные, вентральные, перитрахеальные и др.). Прилежащие тела насеко-
мых, как и аденогипофиз позвоночных, развиваются из эктодермы, а
экдизальные железы аналогичны корковому веществу надпочечников
и являются производными либо целомического эпителия, либо мезо-
дермальной части краниальных метанефридиев. Несмотря на общность
источников развития аденогипофиза и прилежащих тел, с одной сто-
роны, и коркового вещества надпочечников и экдизальных желез —
с другой, это негомологичные образования, так как возникают неза-
висимо у высших первично- и вторичноротых животных.
Эндокринные эпителиальные железы насекомых, несмотря на их
различное происхождение и функциональное значение, построены по
одному принципу — это скопления большего или меньшего числа
клеток, омываемых гемолимфой и обильно снабжаемых кислородом
за счет развитой в области этих желез трахейной системы. Прилежащие
тела и экдизальные железы насекомых связаны с нервной системой.
У многих насекомых среди эпителиальных железистых клеток обна-
ружены окончания нейросекреторных клеток. В ряде случаев показана
строгая корреляция между активностью клеток эндокринных желез и
появлением или исчезновением гранул нейросекрета в окончаниях
нейросекреторных клеток.
Для эндокринных эпителиальных желез насекомых характерны
циклические изменения железистой ткани, связанные с линькой. Они
проявляются, в частности, в периодическом росте интенсивности син-
теза РНК, определяемом по увеличению включения [3Н]уридина, что
коррелирует и с секреторной активностью железистых клеток.
Гормоны, выделяемые прилежащими телами, регулируют мета-
морфоз, линьку и связанные с ними процессы метаболизма в организме
и отдельных тканях и органах. Железистые клетки прилежащих тел
выделяют ювенильный гормон, тормозящий наступление половой зре-
лости. Экдизальная железа, по-видимому, вырабатывает гормон линьки
(экдизон), который сходен по химической природе со стероидными
гормонами надпочечника. В связи с этим в ультраструктурной орга-
низации секреторных клеток экдизальных желез удается выявить не-
которые сходные черты с организацией железистых клеток коры над-
155
почечников (рис. 42). Гормоны экдизальных желез растворяются в
липидах и выделяются вместе с липидными вакуолями. Возможно что
в синтезе гормонов принимают участием итохондрии. Однако клетки
насекомых не способны синтезировать холестерин — предшественник
стероидных гормонов, поэтому гладкая эндоплазматическая сеть в
клетках экдизальных желез не получает большого развития.
В экдизальных железах высших насекомых имеются специальные
приспособления для увеличения поверхности плазматической мембра-
ны клеток и транспортировки выделяемых клетками продуктов в ге-
молимфу. Многообразные отношения наблюдаются в эндокринных
железах насекомых между синтезом ДНК, репродукцией и гетеро-
синтетической активностью клеток. Широко распространены явления
соматической полиплоидизации. Репродукция и дегенерация клеток
эндокринных желез связаны не с физиологической регенерацией, а
с циклическими изменениями в функциональной активности желез.
Сильно изменяется ультраструктурная организация клеток эндокрин-
ных желез у насекомых в активном и неактивном состояниях, что
хорошо видно на примере клеток прилежащих тел (рис. 43, А, Б).
У многих групп беспозвоночных (моллюски, полихеты, насекомые
и др.) в кишечном эпителии обнаружены клетки, аналогичные элемен-
там диффузной эндокринной системы позвоночных. У беспозвоночных
это клетки, содержащие секреторные гранулы и часто имеющие от-
ростки. Расположены они в базальной части эпителиального пласта, и
нередко их апикальная часть не доходит до просвета. К сожалению,
прямые экспериментальные доказательства эндокринной природы этих
клеток имеются лишь в отношении насекомых.
Тонкие механизмы действия, химическая природа гормонов и
специфических рецепторов к ним у клеток-мишеней у беспозвоноч-
ных животных изучены значительно хуже, чем у позвоночных. Одна-
ко имеющиеся данные свидетельствуют о наличии у беспозвоноч-
ных глубоких аналогий или гомологий. Помимо сходства стероид-
ных гормонов (экдизона и кортизона) у многих беспозвоночш ix об-
наружен инсулиноподобный гормон, вырабатываемый часто клетка-
ми кишечного эпителия или особыми эндокринными клетками. Ве-
щество с подобным глюкагону действием выделено из кишечника
рака. Ряд полипептидных гормонов обнаружен у двустворчатых мол-
люсков и асцидий. Кроме того, соматостатин, панкреатический по-
липептид, гастрин, вазоактивный интестинальный полипептид и, на“
конец, энкефалин и секретин найдены в нервных или нейросекретор-
ных клетках различных беспозвоночных (аннелид, насекомых, мол-
люсков).
152
Рис. 42. Ультраструктурная организация клеток
экдизальной железы насекомых.
7 — оболочка железы, 2 — терминальное разветвление аксона нерв-
ной клетки, 3, 4 — терминальные разветвления аксонов нейросекре-
торных клеток (3 — с крупными гранулами, 4 — с мелкими гранула-
ми), 5 — гранулы гликогена, 6 — липидная капля, 7 — секреторная
вакуоль, 8 -— автофагическая вакуоль, 9 — лизосомы, 10 — межкле-
точная лакуна, II — периферическая лакуна, 12-14 — стадия транс-
формации митохондрий.
153
ис. 43. Ультраструктурная организация клеток прилежащего тела насекомого
при активном (Л) и неактивном (Ь) состоянии железы.
ядро, 2 шероховатая ЭПС, 3 — митохондрии, 4 — лизосома,
5 — десмосома.
154
Веским доводом в пользу несомненного сходства организации
эндокринных желез позвоночных и беспозвоночных животных явля-
ется обнаружение в кишечном эпителии насекомых и аннелид диф-
фузной эндокринной системы, аналогичной уже подробно изученной
системе диффузной эндокринной системы позвоночных (рис. 44).
Такие системы имеют, по-видимому, универсальное распространение
у многоклеточных животных. Они не утрачиваются у высших живот-
ных, а существуют и совершенствуются наряду с оформленными эн-
докринными железами у всех прогрессивно развивающихся групп жи-
вотных.
§3. НЕКОТОРЫЕ ОБЩИЕ ЗАКОНОМЕРНОСТИ ЭВОЛЮЦИОННОЙ
ДЕШАМИКИ ЖЕЛЕЗИСТЫХ ЭПИТЕЛИЕВ
Все многообразие специфической дифференцировки секреторных
клеток базируется на соответствующих модификациях общего для всех
клеток метаболического аппарата цитоплазмы. Естественно поэтому,
что изучение морфобиохимической организации железистых клеток
имеет не только специальное, но и общее значение. На примере спе-
циализированных клеток удается более четко выявить взаимоотноше-
ния органоидов цитоплазмы, источники и механизмы формирования
отдельных органоидов, полнее изучить процессы внутриклеточной ре-
гуляции и интеграции.
При разработке чисто цитологических аспектов дифференцировки
железистых эпителиев, связанных с детализацией функционального
значения отдельных желез, существенный прогресс наблюдается и в
понимании общих закономерностей клеточной организации. Из при-
веденных выше примеров следует, что характер структурно-химичес-
кой организации секреторных клеток определяется прежде всего клас-
сом соединений, образующих основную массу секрета. Когда преоб-
ладают белки, в секреторных клетках сильное развитие получает ше-
роховатая ЭПС. При синтезе стероидных гормонов сильнее развива-
ется гладкая ЭПС и появляется большое количество митохондрий,
наконец, в слизистых железах особенно большое развитие получает
мембранная система аппарата Гольджи. В связи с этим велико значение
систематического анализа сходных в биохимическом отношении желез
у далеко отстоящих в филогенетическом отношении групп животных.
Специальный анализ радиоавтографических и биохимических дан-
ных о динамике синтеза и внутриклеточного транспорта белка в сек-
реторных клетках поджелудочной железы млекопитающих и в белко-
вых железах у шелкопряда показал глубокое сходство основных зако-
номерностей этих процессов. Более того, несмотря на принципиальные
различия в организации растительных и животных клеток и длитель-
155
Рис. 44. Элементы диффузной эндокринной системы в кишечном эпителии полихеты нереис
(по М. Ю. Пунину, 1991).
г2 — гранулы мелкогранулярной клетки, г4 — гранулы амебоцита, кгк — крупногранулярная клетка,
кс — кишечный синус, мгк — мелкогранулярная клетка, окгк — отросток крупногранулярной клетки,
омгк — отростки мелкогранулярных клеток, пд — полудесмосомы, пор — поры в мембране, скк —
секреторные клетки эпителия, ац — цитоплазма амебоцита.
ный путь независимого эволюционного усложнения растительных сек-
реторных клеток, выделяющих терпеноиды, у них имеется много об-
щих черт в ультраструктурной организации с животными клетками,
синтезирующими стероиды. Сходство в организации рассматриваемых
клеток обусловливается сходством начальных этапов биосинтеза этих
специфических продуктов. Сходную ультраструктурную организацию
имеют такие далекие по происхождению специализированные клетки,
как клетки пучковой зоны надпочечника млекопитающих, клетки эк-
дизальных желез насекомых и, наконец, растительные клетки, синте-
зирующие терпены. Ярким примером может служить сходство в ульт-
раструктуре, динамике синтеза и перемещении белка в клетках, син-
тезирующих ферменты у насекомоядных растений, и клетках экзокрин-
ной части поджелудочной железы.
В основе отмеченного выше разнообразия железистых эпители-
альных тканей животных лежат, несомненно, глубокие исторические
причины. Возникновение процесса секреции базируется на одном из
фундаментальных и первичных свойств живой протоплазмы — непре-
рывном обмене веществ между окружающей средой и клеткой. В
пограничных тканях многоклеточных животных выделение продуктов
метаболизма происходило наружу и в подлежащую паренхиму. Соот-
ветственно этому и возникло два основных направления железистой
дифференцировки: формирование экзокринных и эндокринных желез.
Однако у низших многоклеточных с их относительно низким уровнем
организации нет необходимости в развитии специально оформленных
эндокринных желез. Гуморальная интеграция у них обеспечивается
специальной нейроэндокринной системой и, возможно, небольшим
количеством диффузно расположенных железистых клеток различного
происхождения. Лишь с повышением уровня организации животных
возникает необходимость формирования специальной системы эпите-
лиальных эндокринных желез в дополнение к более древним по про-
исхождению нервной и нейроэндокринной интеграционным системам
организма. Неожиданным является то обстоятельство, что наряду с
отчетливо выраженной тенденцией к выделению специальных органов
экзокринных и эндокринных желез и у позвоночных, и у беспозво-
ночных сохраняется и совершенствуется особая диффузионная эндо-
кринная система.
Весьма примечателен также тот факт, что возникновение систе-
мы эндокринных желез произошло независимо у трех групп живот-
ных: позвоночных, головоногих моллюсков и высших членистоногих.
Сложность организации системы таких желез и их вклад в регуляцию
важнейшей функций организма оказываются в прямой зависимости от
157
сложности организации животного. Наибольшего уровня филогенети-
ческой дифференцировки достигают эпителиальные эндокринные же-
лезы у высших позвоночных и у насекомых. Глубокая аналогия в
прогрессивном развитии системы эндокринных желез у позвоночных
и насекомых проявляется и в характере связей этих желез с нервной
системой. И у позвоночных, и у насекомых она обеспечивается через
систему нейросекреторных клеток.
У представителей различных классов позвоночных и близкород-
ственных им оболочников и ланцетника удается проследить ряд инте-
реснейших эволюционных модификаций некоторых желез внутренней
секреции. Так, гомологичными образованиями, по-видимому, являются
эндостиль ланцетника, оболочников и щитовидная железа позвоноч-
ных животных. Строение последней, а также способ формирования в
онтогенезе дают основание предполагать, что источником ее возник-
новения была железа, обладавшая выводным протоком и выделявшая
секрет в полость пищеварительного тракта. Прообразом такой железы
может служить щитовидная железа личинки миноги. Она имеет вы-
водной проток и выделяет синтезируемые в концевых отделах тире-
оглобулины в просвет пищеварительного тракта. В полости средней
кишки они подвергаются гидролизу, а иодированные аминокислоты
тироксин и трииодтиронин всасываются кишечным эпителием. Воз-
можно, однако, что наблюдаемые у личинки миноги особенности син-
теза предшественника и образования гормонов представляют собой
лишь одну из эволюционных модификаций этой железистой ткани и
не имеют отношения к возникновению у позвоночных сложной дина-
мики синтеза этих гормонов в клетках фолликулярного эпителия щи-
товидной железы.
Аналогичные отношения имели, по-видимому, место и в случае
инсулина. У предков позвоночных животных он выделялся в просвет
кишки в виде проинсулина и уже после частичного гидролиза погло-
щался клетками кишечного эпителия в виде готового гормона инсу-
лина.
Несмотря на более позднее в филогенезе появление эпителиаль-
ных эндокринных желез, они возникали, по-видимому, не только на
основе более древних по происхождению экзокринных желез. Так,
у низших позвоночных эндокринные железистые элементы эктодер-
мального происхождения выделяются из состава кишечного эпите-
лия раньше, чем экзокринная часть поджелудочной железы. Непосред-
ственно из целомического эпителия возникла в филогенезе позвоноч-
ных железистая ткань коркового вещества надпочечника. У высших
беспозвоночных большей части желез внутренней секреции дали на-
158
чало эпителиальные ткани, не специализированные на железистую
функцию.
У высших многоклеточных получила распространение и мульти-
функциональная дифференцировка клеток железистых эпителиев. На-
пример, в слюнных железах млекопитающих и человека, а также
головоногих моллюсков эти эпителии выполняют как экзокринную,
так и эндокринную функции.
ЛИТЕРАТУРА
Баранникова И. А. Гормональная регуляция функции // Общий курс фи-
зиологии человека и животных. Л., 1991. Т. 2. С. 72-122.
Баранникова И. А. Характеристика гуморальных механизмов регуляции //
Общий курс физиологии человека и животных. Л., 1991. Т. 1. С. 133-141.
Лейбсон Л. Г. Происхождение и эволюция эндокринной системы // Эво-
люционная физиология. Л., 1983. С. 3—52.
Пунин М. Ю. Эндокриноподобные элементы в кишечном эпителии беспо-
звоночных животных // Цитология. 1986. Т. 28, К® 10.
Уголев А. М. Энтериновая (кишечная гормональная) система. Л., 1978.
Хэм А., Кормак Д. Гистология. М., 1983. Т. 5. С. 5-125.
Шубникова Е. А., Коротько Г Ф. Секреция желез. М., 1936.
Fujita Y. Functional Mophology of Thyroid // Inter. Rev. Cytol. 1988. Vol. 113.
Motrueng L. M„ Barrenched M. et al. Ultrastructure and immunocytochemistry
of endocrine cells in the midgut of desert locust, Schisterera gregaria // Cell Tissue
Res. 1989. Vol. 258.
Orci L. A new type of coated vesicular carrier that appears not to contain
clathrin II Cell. 1986. Vol. 46, N 2.
Глава 4. Осморегулирующие и выделительные
эпителии
У многих многоклеточных животных (гомойосмотических орга-
низмов) функции осморегуляции (и ионорегуляции — поддержания
постоянства ионного состава внутренней среды организма) и экскре-
торная (выделение жидких продуктов обмена) осуществляются в ос-
новном формированием единых осморегулирующих и выделительных
органов.
Внешне они многообразны и могут развиваться из разных источ-
ников. Однако системные и тонкие цитологические механизмы их
Функционирования основаны на общих для всех животных принципах
организации.
159
чало эпителиальные ткани, не специализированные на железистую
функцию.
У высших многоклеточных получила распространение и мульти-
функциональная дифференцировка клеток железистых эпителиев. На-
пример, в слюнных железах млекопитающих и человека, а также
головоногих моллюсков эти эпителии выполняют как экзокринную,
так и эндокринную функции.
ЛИТЕРАТУРА
Баранникова И. А. Гормональная регуляция функции // Общий курс фи-
зиологии человека и животных. Л., 1991. Т. 2. С. 72-122.
Баранникова И. А. Характеристика гуморальных механизмов регуляции //
Общий курс физиологии человека и животных. Л., 1991. Т. 1. С. 133-141.
Лейбсон Л. Г. Происхождение и эволюция эндокринной системы И Эво-
люционная физиология. Л., 1983. С. 3—52.
Пунин М. Ю. Эндокриноподобные элементы в кишечном эпителии беспо-
звоночных животных // Цитология. 1986. Т. 28, К® 10.
Уголев А. М. Энтериновая (кишечная гормональная) система. Л., 1978.
Хэм А., Кормак Д. Гистология. М., 1983. Т. 5. С. 5-125.
Шубникова Е. А., Коротько Г Ф. Секреция желез. М., 1936.
Fujita Y. Functional Mophology of Thyroid // Inter. Rev. Cytol. 1988. Vol. 113.
Motrueng L. M., Barrenched M. et al. Ultrastructure and immunocytochemistry
of endocrine cells in the midgut of desert locust, Schisterera gregaria // Cell Tissue
Res. 1989. Vol. 258.
Orci L. A new type of coated vesicular carrier that appears not to contain
clathrin II Cell. 1986. Vol. 46, N 2.
Глава 4. Осморегулирующие и выделительные
эпителии
У многих многоклеточных животных (гомойосмотических орга-
низмов) функции осморегуляции (и ионорегуляции — поддержания
постоянства ионного состава внутренней среды организма) и экскре-
торная (выделение жидких продуктов обмена) осуществляются в ос-
новном формированием единых осморегулирующих и выделительных
органов.
Внешне они многообразны и могут развиваться из разных источ-
ников. Однако системные и тонкие цитологические механизмы их
Функционирования основаны на общих для всех животных принципах
организации.
159
§1. СМЕШАННЫЕ ОСМОРЕГУЛИРУЮЩИЕ
И ВЫДЕЛИТЕЛЬНЫЕ КАНАЛЬЦА
Осморегулирующие и выделительные органы обычно образуются
из эпителиальных канальцев, один конец которых либо слепо замкнут,
либо сообщается с вторичной полостью тела, а другой открывается
наружу или в полость кишки. Несмотря на большое разнообразие,
канальцы у разных групп животных работают по одному принципу.
В их полость поступает ультрафильтрат близких по составу раство-
ренных в нем компонентов тканевой жидкости организма. В процессе
прохождения жидкости по канальцу из нее извлекаются нужные для
организма вещества, а к формирующейся моче могут добавляться
конечные продукты азотистого обмена, подлежащие выведению, а
иногда и ионы. Сложные процессы реабсорбции (извлечение соедине-
ний из полости канальца) и секреции (выделение в полость канальца
органических и неорганических соединений) реализуются эпителиаль-
ными клетками стенки канальца. Реабсорбция и секреция осуществля-
ется в основном с помощью трансмембранного транспорта, при этом
часто создаются локальные области с повышенным осмотическим дав-
лением внутри клеток и в замкнутых или открытых межклеточных и
околоклеточных пространствах. Это требует специализации плазмати-
ческой мембраны (наличие асимметрично распределенных каналов и
насосов).
У эпителиальных клеток обычно гипертрофирована плазматичес-
кая мембрана и увеличено количество связанных с ней митохонд-
рий. Гипертрофия плазматической мембраны может достигаться раз-
ными путями: образованием глубоких впячиваний в базальной час-
ти клеток; формированием на их апикальной поверхности микровор-
синок и, наконец, образованием выростов цитоплазмы на боковой
поверхности клеток. Существенное значение в процессах транспорта
веществ имеет изменение проницаемости мембран и межклеточных
контактов для воды, а также транспорт веществ и ионов в мембранной
упаковке.
Как правило, в канальцах большинства животных удается выде-
лить четыре отдела: начальный, два основных (проксимальный и дис-
тальный) и конечный. В последнем моча накапливается перед ее вы-
ведением наружу. Начальный отдел служит для фильтрации первичной
мочи в полость канальца из тканевой жидкости, полости тела или
крови. Механизмы этого процесса различны. Существенную роль мо-
гут играть реснички и жгутики. Первичная моча может также фильт-
роваться из крови и гемолимфы или полостной жидкости благодаря
гидростатическому давлению.
160
В некоторых типах канальцев (агломеруллярные нефроны неко-
торых морских рыб, мальпигиевы сосуды насекомых) начальный отдел
отсутствует. Первичная моча попадает при этом в проксимальный
отдел канальца в основном путем осмотической фильтрации или изо-
осмотической секреции. Механизмы такой фильтрации сходны с ме-
ханизмами реабсорбции. Они основаны, по-видимому, на создании
локальных областей с повышенным осмотическим давлением и изме-
нением проницаемости мембран для воды. Однако направление фильт-
рации и реабсорбции противоположны. В проксимальные отделы неф-
ронов морских рыб и мальпигиевых сосудов насекомых поступает вода
с растворенными в ней органическими и .неорганическими компонен-
тами из крови и гемолимфы.
В типичных канальцах проксимальный отдел обеспечивает реаб-
сорбцию ионов и значительной части нужных организму веществ.
Процессы реабсорбции происходят в условиях, близких к изоосмоти-
ческим, т. е. при относительно небольшой разнице концентраций ве-
ществ в тканевой жидкости и в формирующейся моче*. Нужные для
организма соединения извлекаются из полости канальца с большим
количеством воды.
В дистальном отделе канальца количество реабсорбируемой воды
обычно минимальное. При этом избирательно реабсорбируются ионы
против градиента концентраций. В проксимальном и реже в дисталь-
ном отделах канальцев происходит наряду с реабсорбцией секреция
ионов и некоторых конечных продуктов азотистого обмена, а также
вредных для организма экзогенных веществ.
Проксимальный отдел канальцев меньше подвергается изменени-
ям в процессе эволюции. Дистальный отдел основной части канальца
более лабилен. Он может почти полностью редуцироваться или при-
обретать весьма сложное и дифференцированное строение. Это наблю-
дается, в частности, у птиц и млекопитающих и у высших первично-
ротых (насекомые). У животных, приспособленных к жизни в экстре-
мальных (в отношении водного баланса) условиях (недостаток воды,
необходимость использовать морскую воду, поглощение с пищей боль-
шого или недостаточного количества солей), независимо от их систе-
матического положения в дополнение к специальным осморегулиру-
ющим и выделительным органам в системах кожного, а иногда и
кишечного эпителиев развиваются вспомогательные осморегулирую-
Щие дифференцировки (солевые железы у рептилий и птиц, хлоридные
* Заметные различия в осмотическом давлении, необходимые для транспорта воды, соз-
даются лишь в небольших областях, непосредственно связанных с клеточными мембра-
нами.
161
клетки рыб, ректальные железы эласмобранхий, жабры пресноводных
личинок насекомых и личинок, обитающих в морской воде). Кроме
того, осморегулирующую, а частично и выделительную функции вы-
полняют и некоторые железистые клетки (бокаловидные), а также
специальные железы (потовые, слюнные) или участки кожного и ки-
шечного эпителиев (например, кожный эпителий амфибий, кишечный
эпителий насекомых и асцидий). Все вспомогательные осморегули-
рующие образования функционально (чаще через гормональную и
нервную регуляцию) связаны в единую систему с основными осморе-
гулирующими и выделительными органами*.
У низших многоклеточных из осморегулирующих и выделитель-
ных типов канальцев распространены протонефридии — органы экто-
дермального происхождения. Они характерны для немертин, турбел-
лярий, цестод, нематод, низших полихет и ряда других групп живот-
ных. Протонефридии представляют собой слепозамкнутые эпителиаль-
ные канальцы, начальный отдел которых располагается в паренхиме.
Он образован специальной терминальной клеткой — циртоцитом, или
системой таких клеток, несущих жгутики (рис. 45, А, Б). Цитоплазма
клеток образует вокруг жгутика своеобразный воротничковый, или
корзинчатый, аппарат. Стенка канала может быть сформирована ци-
топлазмой нескольких терминальных клеток (например, у приапулид
(рис. 45, В) или одной клеткой (у низших полихет). В обоих случаях
это аппараты, через которые в полость канала происходит ультра-
фильтрация тканевой жидкости. Она поступает внутрь благодаря раз-
режению пространства в полости канальца, обусловленному биением
жгутика. У приапулид тканевая жидкость поступает в канальца через
зигзагообразные межклеточные контакты. В протонефридиях у низших
полихет она фильтруется через щели или истонченные участки кор-
зинчатого аппарата терминальных клеток.
У животных с развитой сосудистой системой (ланцетник, некото-
рые немертины) терминальные клетки протонефридия вступают обыч-
но в контакт с ней (рис. 45, А, Г). У немертин это может приводить
к существенным изменениям в строении начального отдела канальца
и замене жгутиковых клеток на ресничные (рис. 45, А). У ланцетника
сохраняется структура корзинчатых терминальных клеток, которые
образуют лишь характерный дополнительный отросток, своим развет-
вленным концом контактирующий со стенкой кровеносного сосуда
(рис. 45, Г).
Наряду с этим сами выделительные канальцы, особенно у высших животных, помимо
выделительной и осморегулирующей функций выполняют еще и инкреторную и метабо-
лические функции (Ю. В. Наточнн, 1991).
162
Рис. 45. Протонефридии беспозво-
ночных и ланцетника.
А — немертины; Б — низшие поли-
хеты; В — приапулиды; Г — лан-
цетник: 1 — стенки кровеносной ла-
куны, 2—7 — отделы протонефриди-
ев (2 — начальный, 3 — средний,
4 — конечный), 5 — ядро корзинча-
той клетки (циртоцита), 6 — жгутик,
7 — корзинчатый аппарат, 8 —
клетки канала протонефридия, 9 —
сосуд, 10 — отросток корзинчатой
клетки на сосуде, II — клетки эпи-
телия канальца, 12, 13 — попере-
чные срезы через отростки корзин-
чатой клетки в среднем (72) и конеч-
ном (13) его участке.
163
Несмотря на разнообразие начальных отделов протонефридиев,
все они представляют собой специальные аппараты ультрафильтрации,
основными структурами которых являются образуемые клетками свое-
образные фильтры (внеклеточное вещество базальных мембран и це-
мент межклеточных контактов, надмембранные структуры в области
отверстий и щелей корзинчатого аппарата) и жгутики терминальных
клеток. Обработку ультрафильтрата, в частности реабсорбцию воды,
органических веществ и ионов, осуществляет эпителий проксималь-
ных и дистальных отделов канальцев протонефридиев. Изучены они
в структурно-функциональном отношении еще весьма слабо. У неко-
торых цестод показана реабсорбция глюкозы, лактата и мочевины из
ультрафильтрата*.
Относительно широко распространенным типом осморегулирую-
щих и выделительных эпителиальных канальцев являются метанефри-
дии. Первично они возникали, по-видимому, на основе целомодук-
тов — эпителиальных канальцев мезодермального происхождения,
обеспечивавших выведение половых продуктов из вторичной полости
тела в наружную среду. Наиболее близкая этим первичным отноше-
ниям структура наблюдается у большинства современных морских
полихет. Начальный отдел канальцев представлен у них воронкой,
которая открывается в полость тела и выстлана ресничным эпителием.
Биение ресничек обеспечивает поступление полостной жидкости в
полость канальца. У некоторых полихет вблизи отверстия воронки в
стенке полости тела обнаружены сосудистые сплетения, из которых
осуществляется фильтрация жидкой части крови в полость тела. Ос-
новной каналец метанефридиев морских полихет обычно не достигает
большой длины.
Более сложно устроены метанефридии у олигохет, в частности у
дождевого червя. Начальный отдел канальцев, так же как и у полихет,
образован воронкой, выстланной ресничным эпителием (рис. 46, А, Б)-
Основная часть канальца — проксимальный и дистальный отделы —
достигает большой длины. Тонкий проксимальный отдел, в свою оче-
редь, делится на 2-3 участка. Такая организация свидетельствует о
сложности процессов реабсорбции и секреции в этих отделах ка-
нальцев. Конечный отдел метанефридиев представлен ампулообразным
расширением, открывающимся нефридиальной порой. В метанефриди-
ях дождевого червя канальцы тесно связаны с кровеносными сосудами,
образующими по ходу канальца специальное сплетение. Такая связь
необходима, вероятно, для интенсификации реабсорбции и секреции.
* Имеются данные о том, что развитая система канальцев протонефридиев у крупных
цестод может выполнять и трофическую транспортную функцию.
164
Рис. 46. Меганефридии дождевого червя и зеленая железа ракообразных.
А — мстанефридии; Б — начальный отдел метапефридия; В — строение зеленой железы ракообразных:
7 — реснички, 2 — воронка, 3 — основной отдел канальца, 4 — конечный отдел, 5 — целомический мешочек — начальный отдел
канальца у ракообразных.
Видоизмененными метанефридиями являются зеленые железы ра-
кообразных, головные нефридии насекомых и, по-видимому, почки
моллюсков. Начальные отделы зеленых желез и головных нефридиев
представляют собой рудимент целома. Они расширены и имеют вид
мешочка, выстланного специализированными клетками целомического
эпителия (рис. 46, В). Из гемолимфы, омывающей мешочек, в его
полость поступает ультрафильтрат. В среднем отделе канальца, кото-
рый делится на проксимальную и дистальную части, идут процессы
реабсорбции и секреции. В каудальном отделе канальца, в его ампу-
лообразном расширении, накапливаются концентрированные жидкие
продукты обмена. Отсюда через выводные отверстия в стенке тела
животных они поступают в наружную среду.
У моллюсков развиты фильтрационные выделительные системы,
в основе функционирования которых лежат тесные структурные и
функциональные взаимосвязи сосудистой системы и выделительных
канальцев. У большинства моллюсков образование первичной мочи
происходит при сокращении сердца путем ультрафильтрации жидкой
части крови через стенку предсердия в рудимент целома — перикар-
диальную полость. Последняя связана с полостью почечного мешка
реноперикардиальным каналом, выстланным ресничным эпителием.
Реабсорбционный отдел почки моллюсков имеет большой диаметр. В
нем формируются многочисленные складки. Клетки эпителия почеч-
ного мешка обеспечивают реабсорбцию полезных веществ и воды и
секрецию конечных продуктов метаболизма. Последние часто накап-
ливаются в виде больших конкреций апикальной части клеток. Часть
клеток с большим количеством экскреторных включений может слу-
щиваться в просвет почечного мешка.
В почке некоторых моллюсков обнаружены и особые камбиаль-
ные участки, за счет делящихся клеток которых сохраняется относи-
тельное постоянство количества клеток эпителиальной выстилки по-
чечного мешка. Каудальный участок выделительной системы представ-
лен мочеточниками, эпителий которых у наземных моллюсков обла-
дает способностью к активному транспорту ионов.
Наиболее хорошо изучены в структурно-функциональном отно-
шении почки позвоночных животных и мальпигиевы сосуды насеко-
МЬ1Х основные выделительные и осморегулирующие органы.
Эпителиальные канальцы почки позвоночных в эмбриогенезе раз-
виваются из специального мезодермального зачатка — нефротома. Ис-
точник их развития в филогенезе неясен. Основной структурной еди-
ницей почки млекопитающих является нефрон — слепо замкнутый в
начальном отделе эпителиальный каналец, конечный отдел которого
166
открывается в собирательную трубку. Моча из собирательных трубок
постл пает в почечную лоханку, мочеточники и мочевой пузырь с
выводящими путями (рис. 47, Л). Последние четыре образования пред-
ставляют собой (по нашей классификации) дифференцированный ко-
нечный отдел осморегулирующей и выделительной системы. Его на-
значение — накопление и выведение готовой мочи, формирование
которой происходит в начальных отделах нефронов, в их основных
частях — проксимальных и дистальных отделах, и в системе собира-
тельных трубочек. Существенную роль в формировании мочи играют
также сосудистая система и соединительная ткань, основное вещество
которой способно удерживать ионы.
Начальный отдел нефрона вместе с капиллярным артериальным
клубочком образует сложный фильтрационный аппарат. Через него в
полость капсулы нефрона — слепо замкнутого начального отдела ка-
нала — фильтруется первичная моча (рис. 47, А). Из нее в канальце
нефрона реабсорбируются разнообразные ионы, глюкоза, аминокисло-
ты и некоторые другие вещества. У млекопитающих в таком аппарате
по функциональному признаку удается выделить два основных отде-
ла — проксимальный и дистальный. В состав проксимального отдела
входит начальный участок канальца до нисходящего тонкого отдела
пели Генле. Дистальный участок образован тонким (нисходящим и
восходящим) и толстым (восходящим) отделами петли Генле и дис-
тальным извитым канальцем. Последний открывается в собирательную
трубку, которую по функциональному значению следует отнести к
дистальному отделу канальцев.
В почке млекопитающих по функциональному значению и рас-
положению начальных отделов выделяют несколько популяций неф-
ронов. Наибольшее значение в образовании гипертонической мочи
играют нефроны, начальный отдел которых расположен на границе
коркового и мозгового вещества (юкстамедуллярные нефроны). Они
имеют наиболее длинные петли Генле. В области капиллярных клу-
бочков нефронов расположены эпителиоидные эндокринные клетки
(мышечного происхождения), юкстагломерулярный комплекс. Клетки
выделяют вещество ренин, которое регулирует клубочковую фильтра-
цию и другие процессы, связанные с образованием первичной мочи.
У морской свинки юкстамедуллярные нефроны составляют всего 5 %
всей популяции нефронов, а у обитающих в пустыне больших песчанок
все нефроны относятся к этому типу.
Мальпигиевы сосуды — осморегулирующие и выделительные
эпителиальные канальцы, образующиеся полифилетично у представи-
телей ряда классов наземных членистоногих, в частности у насекомых,
167
Рис. 41. Микроанатомическое строение нефрона почки млекопитающих и варианты
взаимоотношений мальпигиевых сосудов и кишки насекомых.
А — нефрон; Б — взаимоотношение конечных отделов мальпигиевых сосудов со
стенкой средней кишки; В — взаимоотношение начальных отделов мальпигиевых
сосудов со стенкой кишки в области ректальных утолщений: 1 — капсула нефрона,
2 — извитая, 3 — прямая часть проксимального отдела, 4 — нисходящая и 5
восходящая части петли нефрона, б — извитая часть дистального отдела, 7 — соби-
рательная трубка, 8 — мальпигиев сосуд, Р, 10 — полости средней и задней
кишки, 11 полость ампулообрвзного расширения, 12 — мышечный сфинктер,
периректальное пространство; стрелками на рис. В. показано направление
перемещения жидкости (тонкие) и ионов (толстые); плотность точек соответствует
величине осмотического давления.
168
на основе выростов каудального отдела средней кишки. Это слепо
замкнутые на проксимальных концах эпителиальные канальцы, дис-
тальными концами открывающиеся в просвет кишечника на границе
средней кишки с задней. Количество канальцев варьирует в широких
пределах (от 2 до 150 и более). У большинства насекомых эпители-
альные канальцы свободно лежат в гсмоцеле и омываются снаружи
гемолимфой. В отличие от канальцев других типов они лишены спе-
циального фильтрационного аппарата. Поступление первичной мочи
в полость канальца осуществляется на всем его протяжении через
основные эпителиальные клетки с их характерными структурами в
базальной и апикальной частях.
Процессы реабсорбции, по-видимому, частично осуществляются
специальными клетками в стенке канальца. Основную роль в избира-
тельной реабсорбции ионов и низкомолекулярных органических со-
единений играет, по-видимому, кишечный эпителий, выстилающий
ампулообразные расширения дистальных отделов мальпигиевых сосу-
дов (рис. 47, Б). В области соединения конечных участков мальпиги-
евых сосудов со стенкой кишки имеется мышечный аппарат. При его
сокращении первичная моча может задерживаться в этих участках. Это
позволяет выстилающим их клеткам обеспечить обратное всасывание
из мочи в гемолимфу углеводов, жиров и аминокислот.
Наконец, весьма существенную роль в процессах реабсорбции
играют участки кутикулярного эпителия в конечных отделах задней
кишки — ректальные утолщения. У некоторых насекомых мальпи-
гиевы сосуды вступают в непосредственную структурную связь с эти-
ми дифференцированными участками кутикулярного эпителия задней
кишки. Это обеспечивает создание весьма совершенной (в смысле
экономии воды) выделительной и осморегулирующей системы орга-
низма (рис. 47, В).
§2. ТОНКАЯ СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ФИЛЬТРАЦИОННЫХ
И РЕАБСОРБЦИОННЫХ ОТДЕЛОВ ОСМОРЕГУЛИРУЮЩИХ
И ВЫДЕЛИТЕЛЬНЫХ КАНАЛЬЦЕВ
Фильтрационные аппараты
В предыдущем разделе рассмотрена тонкая структурная органи-
зация фильтрационных аппаратов протонефридиев (см. рис. 45). В
данном параграфе анализируются характер и особенности организации
фильтрационных аппаратов в канальцах, структурно связанных с со-
судистой системой (нефроны позвоночных, почка моллюсков, зеленые
железы ракообразных). Основные особенности тонкой структурной
организации фильтрационных аппаратов разберем на примере началь-
ного отдела нефрона млекопитающих и человека. Начальный отдел
канальца нефрона образован капсулой, которая представляет собой
специализированный участок фильтрационного аппарата. Второй час-
тью аппарата является клубочек артериальных капилляров, находящих-
ся в тесном контакте с эпителиальными клетками внутреннего листка
капсулы нефрона. Эпителий наружного листка капсулы непосредст-
венно переходит в эпителиальную выстилку канальца нефрона. Между
внутренним и наружным листками капсулы образуется полость, в
которую и фильтруется первичная моча. Процессы фильтрации обу-
словлены в основном высоким гидростатическим давлением, возника-
ющим в капиллярах клубочка благодаря разнице диаметров принося-
щих и выносящих артерий. Развитию давления способствует и слабая
растяжимость базальной мембраны стенки капилляров, образованной
особым типом коллагена.
Первый фильтр в мальпигиевом тельце нефрона образован клет-
ками эндотелия стенки капилляров клубочка с многочисленными пора-
ми (рис. 48, А, 4). Второй фильтр представлен толстой базальной мем-
браной, расположенной между эндотелием и эпителиальными клетка-
ми внутреннего листка капсулы нефрона (3). Она сформирована из
фибрилл особого коллагена (коллаген IV типа), выделяемого эпите-
лиальными клетками капсулы, и состоит из двух рыхлых (наружный
и внутренний) слоев и более плотной центральной пластинки. Базаль-
ная мембрана по толщине в три раза превышает обычные базальные
мембраны. Она не пропускает крупные белковые молекулы, обладаю-
щие зарядом, и представляет собой динамическое образование — в
прилегающей к эндотелию части происходит деградация ее фибрилл,
а со стороны эпителия капсулы —- их новообразование. Наконец, тре-
тий фильтр на пути ультрафильтрата •— отростки подоцитов (2) —
специализированных эпителиальных клеток внутреннего листка кап-
сулы нефрона. Их строение весьма своеобразно. От ядросодержащих
частей клеток по направлению к базальной мембране отходят выросты
цитоплазмы, называемые главными отростками или цитотрабекулами.
Они идут параллельно длинной оси капилляра и по всей длине обра-
зуют короткие, расширяющиеся на концах отростки — цитоподии.
Последние непосредственно контактируют с базальной мембраной.
Образующиеся между соседними цитоподиями межклеточные про-
странства, или фильтрационные щели, затянуты диафрагмой. Диафраг-
ма гипертрофированные надмембранные комплексы концевых рас-
ширенных участков цитоподий с адсорбированными на них белками.
целом эти участки цитоподий подоцитов с фильтрационными ще-
лями и диафрагмой, как отмечалось выше, представляют собой третий
170
Рис. 48. Ультраструктурная организация подоцитов млекопитающих (Л) и членистоногих {Б).
1 — ядросодержащая часть клетки, 2 — огросток подоцита, 3 — базальная мембрана, ! — эндотелий с порами.
фильтр на пути образования ультрафильтрата. В нормальных условиях
он способен задерживать наиболее мелкие белковые молекулы плазмы
крови.
Типичные подоциты имеются и в ампулообразных расширениях
передних отделов видоизмененных мет'анефридиев ракообразных и
насекомых. Вся эпителиальная выстилка видоизмененных участков
целома образована отростчатыми клетками. Участки цитоплазмы кле-
ток, содержащие ядра, расположены на некотором расстоянии от ба-
зальной мембраны. Между прилегающими к базальной мембране от-
ростками имеются многочисленные щели, где полость мешочка и
окружающая его гемолимфа разделены лишь мембраной (рис. 48, £).
Диаметр ячеек в сети коллагеновых фибрилл базальной мембраны у
ракообразных меньше диаметра молекул гемоцианина — дыхательно-
го фермента, находящегося в гемолимфе этих животных.
Подоциты обнаружены у головоногих, а также у некоторых брю-
хоногих моллюсков. У головоногих моллюсков они находятся в пери-
кардиальных железах, или бронхиальных сердцах, в которых и проис-
ходит, по-видимому, ультрафильтрация. У брюхоногих моллюсков по-
доциты могут быть локализованы в стенке предсердия либо в стенке
желудочка сердца.
Типичные подоциты обнаружены у полихет в стенке целома, в
области специализированных разветвлений сосудов у воронок мета-
нефридиев.
Таким образом, имеющиеся сравнительно-цитологические данные
свидетельствуют о том, что подоциты весьма широко распространены
в осморегулирующих и выделительных канальцах многоклеточных
животных. Они имеются у таких неродственных групп животных, как
позвоночные, членистоногие, некоторые моллюски и полихеты. Подо-
циты — один из вариантов специфической дифференцировки эпите-
лиальных клеток для обеспечения клеточного контроля за процессами
фильтрации. Широкое распространение таких клеток в эпителиальных
канальцах животных далеко отстоящих групп свидетельствует и о
многократном независимом их возникновении в эволюции, и о весьма
важном функциональном значении.
Между подоцитами и корзинчатыми клетками протонефридиев
имеется, по-видимому, глубокая связь. О ее наличии свидетельствуют
описанные выше циртоподоциты ланцетника. Специфический отросток
таких клеток структурно и функционально аналогичен отросткам по-
доцитов других животных, а сами клетки имеют типичную структуру
корзинчатых клеток. Таким образом, у ланцетника представлены оба
механизма клеточного контроля за процессами фильтрации: и со сто-
172
роны разветвленного подоцитного отростка, и со стороны щелей кор-
зинчатого аппарата.
Основные отделы эпителиальных каналы!ев
У человека в результате деятельности эпителиальных клеток ос-
новных отделов выделительных канальцев происходит реабсорбция
около 99% образующейся за сутки (170-200 л) первичной мочи с
содержащимися в ней органическими и неорганическими соединения-
ми Об интенсивности работы клеток свидетельствует тот факт, что в
почках расходуется 10-12% всей энергии, получаемой организмом в
результате окислительного фосфорилирования.
Проксимальный отдел нефрона, представленный извитым началь-
ным канальцем и толстым прямым нисходящим участком, несет наи-
большую нагрузку, связанную с функцией реабсорбции. На его долю
приходится около 85% реабсорбируемой воды и ионов. В этом отделе
реабсорбируются практически все аминокислоты и глюкоза. Стенка
проксимальных отделов канальцев состоит из призматических клеток.
На их апикальной поверхности имеется щеточная каемка, образованная
многочисленными микроворсинками с хорошо развитым гликокалик-
сом (рис. 49, А), т. е. плазматическая мембрана резко гипертрофиро-
вана, благодаря чему общая площадь ее соприкосновения с ультра-
фильтратом в проксимальном отделе намного больше, чем в других
отделах нефрона. Кроме того, у рассматриваемых клеток значительно
гипертрофирована базальная плазматическая мембрана, образующая
глубокие щелевидные впячивания в базальной и нижней латеральной
частях клеток. Здесь же обычно наблюдаются скопления митохондрий.
Базальная часть клеток контактирует с разветвленной сетью капилля-
ров. В базальной и латеральной плазматических мембранах сосредо-
точено большое количество мембранных насосов, которые обеспечи-
вают непрерывное выведение ионов в межклеточные щелевидные про-
странства. Благодаря проницаемости клеточных мембран для воды и
большой поверхности их соприкосновения с ультрафильтратом вода в
силу осмотических условий устремляется в область повышенной кон-
центрации ионов. У высших позвоночных большой проницаемостью
Для ионов и воды обладают и межклеточные контакты в проксималь-
ных отделах нефрона. Хорошо развитая система капилляров обеспе-
чивает быстрое удаление избытка ионов и воды в кровеносное русло.
В почке существует также особая система для кругооборота мочевины:
50% ее реабсорбируется из ультрафильтрата в проксимальном отделе
нефрона. Однако в дистальном отделе большое количество воды обу-
173
A
174
Рис. 49. Ультраструктурная организация реабсорбирующих клеток у млекопитаю-
щих и основных клеток мальпигиевых сосудов насекомых.
Л — проксимальные, Б — дистальные отделы канальцев в нефроне млекопитаю-
щих; В — ультраструктурная организация клетки эпителия мальпигиевых
сосудов насекомых; Г — перемещение воды (толстые стрелки) и ионов
(тонкие стрелки) в клетках мальпигиевых сосудов:
I — микроворсинки, 2 — аппарат Гольджи, 3 — лизосомы, 4 — митохондрии,
5 — базальные впячивания плазматической мембраны
(плотность точек на фрагм. Г соответствует концентрации нонов).
г
словлено указанным выше механизмом ее кругооборота. В клетках
проксимальных отделов нефронов активны также биохимические ме-
ханизмы всасывания аминокислот, глюкозы и ряда других соединений.
Наряду с этим они способны секретировать экзогенные вредные со-
единения, которые могут попасть в кровяное русло при отравлении
организма.
Не менее важной функцией клеток проксимального отдела неф-
рона является их способность поглощать из ультрафильтрата путем
пиноцитоза высокомолекулярные соединения и переваривать их с по-
мощью лизосом. Эта функция особенно важна для утилизации орга-
низмом белков ультрафильтрата, которые всегда в небольшом коли-
честве содержатся в первичной моче.
Диаметр наиболее важных участков дистальных отделов нефро-
на — толстого восходящего отдела петли Генле и дистальных изви-
тых канальцев — меньше диаметра канальцев проксимального отдела
Клетки, образующие стенку канальцев, несколько меньше призмати-
ческих клеток проксимальных участков (рис. 49, Б). Для них харак-
терно отсутствие щеточной каемки на апикальной поверхности. Здесь
обнаруживаются лишь единичные неправильной формы микроворсин-
ки. В базальной части клеток имеется, как и в клетках проксимальных
отделов, система глубоких впячиваний плазматической мембраны с
большим количеством митохондрий. Наиболее важная функциональ-
ная особенность рассматриваемых клеток — низкая проницаемость
для воды их мембран и межклеточных контактов. Благодаря этому
реабсорбция ионов в результате деятельности мембранных ионных
насосов не сопровождается пассивным транспортом воды, как это
наблюдается в клетках проксимального отдела. В результате активного
транспорта ионов моча в конечных участках дистального отдела неф-
рона становится гипоосмотической, а в окружающей канальцы соеди-
нительной ткани локально повышается осмотическое давление, глав-
ным образом за счет реабсорбируемых ионов натрия. Часть последних
поступает через стенку тонкого нисходящего отдела петли Генле в
просвет канальца. Двусторонняя миграция между проксимальным и
дистальным отделами нефрона свойственна и мочевине. Эти особен-
ности процессов реабсорбции ионов в дистальных отделах нефрона
создают предпосылки для формирования системы, обеспечивающей
возможность регулировать концентрацию веществ в моче, в частности
формирование гипертонической мочи, — весьма важное приспособле-
ние для жизни в условиях засушливых районов. (Характеристика этих
систем дана ниже.)
176
Отмеченные структурные и функциональные особенности эпите-
лия проксимального и дистального отделов характерны для нефронов
всех позвоночных животных. Больше того, как показали ультраструк-
турные исследования проксимального и дистального участков каналь-
цев зеленой железы ракообразных, эпителиальные клетки этих отделов
отличаются теми же особенностями, что и клетки млекопитающих.
Клетки проксимального отдела имеют развитую щеточную каемку, а
у клеток дистального отдела ее нет. Оба типа клеток обладают хороню
выраженной складчатостью базальной мембраны, однако клетки дис-
тального отдела содержат большее количество митохондрий в базаль-
ной части, а их базальные мембраны образуют больше складок.
Ультраструктурная организация основных клеток мальпигиевых
канальцев насекомых (рис. 49, В) сходна с ультраструктурной клеток
проксимального отдела нефрона млекопитающих (рис. 49, А). Особен-
ностью эпителия мальпигиевых канальцев является лишь скопление
митохондрий в апикальной части клеток. Часть их заходит даже внутрь
хорошо развитых микроворсинок. При внешнем сходстве организации
клеток проксимального отдела нефрона млекопитающих и мальпиги-
евых сосудов насекомых между ними имеются глубокие функциональ-
ные различия. Клетки работают в противоположных направлениях.
Эпителий мальпигиевых сосудов обеспечивает в основном поступле-
ние первичной мочи из гемолимфы в полость канальца. По одной из
распространенных гипотез ионные насосы, расположенные в базальной
части плазматической мембраны, создают локальную повышенную
концентрацию ионов в цитоплазме базальных островков клеток. Сюда
из межклеточных щелей поступает вода с органическими веществами
и продуктами метаболизма. Вторая зона локального повышения кон-
центрации ионов создается в примембранных внеклеточных участках
на апикальной поверхности клеток. Естественно, что в эту область из
клеток устремляется вода с теми же компонентами, и они оказываются
в полости канальца (рис. 49, Г).
§3, ВСПОМОГАТЕЛЬНЫЕ ОСМОРЕГУЛИРУЮЩИЕ
ЭПИТЕЛИАЛЬНЫЕ СИСТЕМЫ
У рыб, рептилий, птиц и насекомых при поглощении большого
количества солей с пищей и водой или при поступлении их через
кожные покровы и кишечник при обитании животных в морской воде
или засоленных водоемах возникает повышенная солевая нагрузка. С
выведением избыточных ионов не в состоянии справиться основные
осморегулирующие системы организма. Необычные условия солевого
режима создаются и у пресноводных животных, теряющих большое
количество солей через кишечник и кожные покровы при обитании в
пресной воде. В этих условиях независимо (полифилетично) в каждом
классе животных (в пределах класса рептилий даже у представителей
разных групп) развиваются вспомогательные осморегуляторные систе-
мы, локализованные главным образом в кожном эпителии.
У рыб и водных личинок насекомых вспомогательные системы
представлены хлоридными клетками, а у рептилий и птиц — солевыми
железами.
У рыб хлоридные клетки представляют собой особую субпопуля-
цию, локализованную в эктодермальном эпителии основания жабр.
Подробно изучены их функциональная морфология, ультраструктура
и ее изменения под влиянием меняющихся осмотических условий
внешней среды. Такие изменения морфологии клеток показаны для
многих представителей рыб, обладающих способностью к периодичес-
ким миграциям из морской воды в пресную и обратно. Зрелая хло-
ридная клетка имеет весьма характерную структуру. Основная часть
ее цитоплазмы заполнена многочисленными митохондриями с хорошо
развитыми, плотно упакованными кристами и большим количеством
гранул в матриксе (рис. 50). Еще одна характерная особенность этих
клеток — гипертрофия мембранных структур гладкой эндоплазмати-
ческой сети, представленной системой канальцев. Гипертрофирована
также и плазматическая мембрана, которая в базальной части клеток
образует складки. В апикальной части активно функционирующей
хлоридной клетки формируется зона, свободная от митохондрий и
богатая пузырьками различных размеров и формы. Есть предположе-
ние, что именно в этих пузырьках накапливаются избыточные ионы
и выводятся в наружную среду путем экзоцитоза.
Таким образом, хлоридные клетки играют роль мощных опресни-
телей, обеспечивая выведение избытка ионов из организма, приобре-
тающего способность использовать для своих нужд морскую воду.
Наличие хлоридных клеток коррелирует у многих рыб с сокращением
расхода воды на процессы фильтрации в нефронах почки. У таких
рыб клубочковый аппарат нефронов обычно редуцируется, а первичная
моча образуется путем изоосмотической секреции, т. е. аналогично
процессам в мальпигиевых сосудах насекомых.
При помещении в пресную воду проходных рыб, адаптирован-
ных к морской воде, происходит существенная перестройка клеточной
ультраструктуры. В клетках резко уменьшается количество митохонд-
рий, а также крист в их внутренней мембране, исчезают гранулярные
включения в матриксе. В апикальной части клеток увеличиваются
размеры микроворсинок и редуцируются участки цитоплазмы с огра-
ниченными мембраной пузырьками и вакуолями. Заметной редукции
178
Рис. 50. Ультраструктурная организация солевой клетки у костистой рыбы,
обитающей в морской воде.
— десмосомы, 2 — пузырьки, ограниченные мембраной, 5 — микроворсинки,
4 — апикальная зона, свободная от митохондрий, 5 — митохондрия, 6 — ядро,
7 — впячнвание плазматической мембраны, 8 — гладкая ЭПС.
179
подвергаются также и мембранные структуры эндоплазматической се-
ти. Значительная часть (около 3/4) хлоридных клеток дегенерирует к
концу четвертой недели пребывания животных в пресной воде. Ос-
тающиеся в эпителии клетки представляют собой не просто резервный
аппарат осморегуляции, а функционирующую систему. Однако вместо
выведения избытка солей из организма они начинают активно погло-
щать соли, находящиеся в небольшом количестве в пресной воде.
У некоторых пресноводных личинок насекомых в определенных
участках кожных покровов (на конечностях и в трахейных жабрах)
среди обычных клеток кутикулярного эпителия обнаружены единич-
ные клетки или группы клеток с повышенной оксифилией цитоплазмы
и особым строением кутикулы над апикальной поверхностью этих
клеток. Их кутикула представляет собой истонченную, пронизанную
многочисленными порами структуру. На апикальной поверхности кле-
ток плазматическая мембрана образует глубокие впячивания. Благода-
ря этому здесь возникают щелевидные внеклеточные пространства,
которые контактируют с порами кутикулярной пластинки. Единичные
клетки сходны с хлоридными клетками рыб, обитающих в пресной
воде (на апикальной поверхности глубокие впячивания плазматической
мембраны, обилие митохондрий, в матриксе которых отсутствуют гра-
нулы). В расположении оксифильных клеток наблюдается определен-
ный порядок: одна центральная и две периферические клетки. У цент-
ральной клетки развиты впячивания апикальной плазматической мем-
браны, а у периферических — базальные впячивания плазматической
мембраны и многочисленные митохондрии. Основная функция всех
клеток заключается в активном поглощении из внешней среды ионов.
Хлоридные клетки могут развиваться и у личинок некоторых
насекомых, обитающих в засоленных водоемах и морской воде. В этом
случае они приобретают морфологическое сходство с хлоридными
клетками рыб, адаптированных к жизни в морской воде. У них гипе-
ртрофирована плазматическая мембрана в базальной части клеток и
резко увеличено количество митохондрий. Естественно, что основной
функцией их становится выведение избытка ионов во внешнюю среду.
Такие клетки чаще всего возникают в эпителии задней кишки, а у
некоторых насекомых и в системе кишечного всасывающего эпителия.
У рептилий и птиц, способных использовать богатую солями воду,
обычные железистые образования (слезные, носовые и некоторые дру-
гие железы) преобразуются в солевые железы. Основное их назначе-
ние выведение избытка солей из организма. Концевые отделы слож-
ных трубчатых желез образованы секреторными клетками, аналогич-
ными по своей функции хлоридным клеткам рыб. При переводе таких
180
животных на богатый солями пищевой режим в солевых железах
происходят двоякого рода процессы: с одной стороны, разрастается
железистая ткань и, следовательно, увеличивается количество клеток,
с другой — изменяются и сами клетки. Количество митохондрий в
них возрастает с 20% от общего объема цитоплазмы до 50%. Одно-
временно сильно увеличивается и общая поверхность плазматической
мембраны. На базальной и боковых поверхностях образуются много-
численные впячивания и выросты, придающие клетке характерный
звездчатый вид. У представителей разных групп рептилий таким пре-
вращениям (перестройка обычных желез в солевые железы) подверга-
ются негомологичные железы. Это свидетельствует о независимом
происхождении солевых желез даже в пределах одного класса.
§«. НЕКОТОРЫЕ ОБЩИЕ ЗАКОНОМЕРНОСТИ ЭВОЛЮЦИОННОЙ
ДИНАМИКИ ОСМОРЕГУЛИРУЮЩИХ И ВЫДЕЛИТЕЛЬНЫХ
ЭПИТЕЛИЕВ
Особенностью рассматриваемых эпителиев является их происхож-
дение из разных источников. Действительно, системы хлоридных кле-
ток, прото- и метанефридии, нефроны, мальпигиевы сосуды -— все это
негомологичные образования. Они имеют разные источники и пути
развития в филогенезе многоклеточных животных. Однако общность
функциональной задачи, а также универсальные клеточные механиз-
мы, на основе которых специализируются клетки, обусловливают чрез-
вычайно широкое распространение в этих структурах сходных морфо-
биохимических дифференцировок. В основе осморегулирующей и вы-
делительной функции лежат процессы активного ионного транспорта
и процессы эндо- и экзоцитоза. Сущность специализации клеток сво-
дится в основном к гипертрофии общих для всех клеток аппаратов
активного транспорта, что и наблюдается в тонкой структуре секре-
тирующих или поглощающих соли клеток кожного эпителия: в клетках
эпителия нефрона, в мальпигиевых сосудах, в краниальных метанеф-
ридиях насекомых и в зеленой железе ракообразных. Аналогичную
дифференцировку имеют эпителии хориальных сплетений, цилиарного
тела глаза, протоков слюнных желез млекопитающих, эпителии рек-
тальных желез у хрящевых рыб и даже эпидермис у растений, при-
способленных к обитанию на засоленных почвах.
Общие закономерности дифференцировки клеток выделительных
и осморегулирующих эпителиев проявляются в сходстве таких специ-
фических для этих эпителиев клеток, как подоциты внутреннего листка
капсулы нефронов позвоночных, подоциты членистоногих, моллюсков
и полихет и циртоподоциты ланцетника. Функциональное значение
181
этих клеток заключается в обеспечении регуляции процессов ультра-
фильтрации. Функциональная деятельность подоцитов выяснена недо-
статочно даже в наиболее изученном фильтрационном аппарате позво-
ночных животных. Тем не менее большое сходство в организации всех
разнородных по происхождению специализированных клеточных эле-
ментов не случайное совпадение.
Приведенные в предыдущих разделах главы факты показывают,
что общие принципы организации характерны не только для специа-
лизированных клеток, но и для осморегулирующих и выделительных
микроорганных систем, в частности для эпителиальных канальцев,
солевых желез, системы хлоридных клеток. Естественно, что струк-
турное обеспечение функциональных задач на этом уровне более мно-
гообразно, чем на уровне специализированных клеток. Так, имеется
по крайней мере три механизма поступления ультрафильтрата в по-
лость канальца: типичная ультрафильтрация, ультрафильтрация благо-
даря биению жгутиков или ресничек и, наконец, изоосмотическая
секреция. Многообразны, по-видимому, и механизмы реабсорбции и
дополнительной секреции, различия в которых обнаруживаются, на-
пример, при сопоставлении мальпигиевых сосудов насекомых и неф-
ронов позвоночных. Не одинаково в системном отношении (хотя и на
основе сходных клеточных механизмов) решаются в отдельных груп-
пах животных задачи адаптации к экстремальным условиям солевого
и водного режима.
Но имеется и ряд общих для большинства многоклеточных жи-
вотных системных принципов организации осморегулирующих и вы-
делительных органов. Один из наиболее важных общих принципов —
формирование замкнутых эпителиальных канальцев с выделением в
них проксимальных и дистальных отделов. Основная задача первого
отдела заключается в обеспечении максимальной реабсорбции необ-
ходимых веществ и воды при минимальной затрате энергии на едини-
цу объема реабсорбируемой жидкости*. Задача второго отдела более
сложна. Он должен обеспечивать регуляцию количества и концентра-
ции выделяемой мочи, т. е. конечную регуляцию водного и солевого
обменов организма. Обе задачи осуществляются путем создания и
совершенствования организации асимметричных клеток и межклеточ-
ных контактов между ними.
Для понимания общих закономерностей эволюционной динами-
ки осморегулирующих и выделительных эпителиев существенный ин-
* Общие затраты энергии на реабсорбцию в проксимальном отделе нефрона обычно не
меньше, чем в дистальном, поскольку в проксимальном отделе реабсорбируется основная
часть воды н органических веществ.
182
терес представляет выяснение механизмов такой регуляции водно-
солевого обмена в основных осморегулирующих системах у высших
первичноротых (насекомые) и вторичноротых (млекопитающие) жи-
вотных.
У млекопитающих важной предпосылкой для достижения совер-
шенной регуляции водно-солевого обмена является резкая интенсифи-
кация фильтрации, связанная с развитием активно работающей сосу-
дистой системы. В условиях интенсивного кровообращения и тока
жидкости по канальцам нефронов создается возможность использовать
механизмы избггрательной реабсорбции ионов в дистальных отделах
ка«альца в конечном счете — для формирования (при необходимости
экономить воду) гипертонической мочи. Как уже отмечалось, реаб-
сорбция ионов из дистальных канальцев происходит без извлечения
больших количеств воды. Прилегающая к канальцу соединительная
ткань и, в частности, ее основное вещество, обладают способностью
удерживать положительно заряженные ионы и создавать, следователь-
но, область повышенного осмотического давления. Кроме того, часть
ионов секретируется в нисходящие отделы петли Генле, увеличивая
концентрацию ионов в тонком отделе этого участка канальца. Следо-
вательно, создается постоянно поддерживаемая циркуляция ионов, еще
больше повышающая местное осмотическое давление.
Определенную роль в увеличении местного осмотического давле-
ния играют и отмеченные выше механизмы транспорта мочевины. В
то же время в собирательные трубочки поступает из дистального
отдела нефрона гипотоническая моча (поскольку из нее избирательно
в дистальном отделе были реабсорбированы ионы). При действии
антидиуретического гормона (АДГ) гипофиза активизируется синтез и
выведение гидролитических ферментов из эпителиальных клеток со-
бирательных трубочек. Ферменты действуют на межклеточные кон-
такты эпителия собирательных трубочек и резко увеличивают его
проницаемость для воды. Появились убедительные данные о том, что
для создания гипертонической мочи существенное значение имеет и
изменение проницаемости для воды плазматической мембраны клеток
эпителия собирательных трубочек при действии антидиуретического
гормона. Для этого гормона обнаружены специфические рецепторы,
активация которых вторичным посредником (циклической АМФ) вы-
зывает встраивание в апикальную мембрану клеток специальных бел-
ковых каналов для воды. Кроме того, у этих же клеток есть второй
тип рецепторов, на которые могут действовать другие вторичные по-
средники (инозитолтрифосфат и диацилглицерол). Посредники появ-
ляются в клетках эпителия собирательных трубочек при воздействии
183
15 1<t
I
9
I
того же антидиуретического гормона. Задействованные инозитолтри-
фосфатом или диацилглицеролом рецепторы могут уменьшать интен-
сивность встраивания в мембрану агрефоров, т. е. регулировать про-
ницаемость мембраны для воды. Гипотоническая моча иг дистального
отдела нефрона направляется в собирательные трубочки, нижняя часть
которых находится в области мозгового вещества почки с повышенным
осмотическим давлением в межклеточной соединительной ткани и в
участках нефронов с хорошо развитыми петлями Генле — отмечен-
ными выше юкстагломерулярными нефронами (рис. 51, А). Естествен-
но, что избыток воды из полости собирательных трубочек (при изме-
нении проницаемости для воды под действием антидиуретического
гормона апикальной мембраны клеток, а возможно, и межклеточных
контактов') будет устремляться в область повышенного осмотического
давления. Наличие сосудов с током крови в проксимальном направле-
нии, противоположном току мочи, обусловливает быстрое выведение
избытка воды из этой области и замещение новой порцией воды из
просвета собирательной трубочки. При достаточно большом количе-
стве крови и интенсивном кровообращении такого рода противоточная
осмотическая система работает весьма эффективно. Благодаря этому
в дистальных отделах собирательной трубки формируется уже гипер-
тоническая моча Следовательно, в формировании гипертонической
мочи деятельное участие принимает не только эпителий дистального
отдела канальцев (по нашей классификации, включая эпителий тонких
Рис. 51. Противоточная система в почке млекопитающих (А) и механизм поглоще-
ния воды в ректальных утолщениях насекомых (Б).
I — капсула нефрона, 2 — извитой проксимальный каналец, 3, 4 — нисходящий
и восходящий отделы петли Генле, 5 — дистальный извитой каналец, б — соби-
рательная трубка, 7 — сосуд, 8 — полость задней кишки, 9 — цитоплазма эпите-
лиальных клеток, 10 — межклеточное пространство, 77 — митохондрии, 12, 13 —
апикальные и базальные межклеточные контакты, 14 — периректальное простран-
ство и мембрана, 15 — гемолимфа; толстыми сплошными стрелками показан
транспорт воды, тонкими сплошными — ионов и мочевины (на фрагм. А между
дистальными и проксимальными отделами нефрона); плотность точек соответству-
ет концентрации ионов в .мочевых канальцах, гемолимфе, кровеносных сосудах,
межклеточных пространствах и межканальцевой соединительной ткани; прерывис-
тыми стрелками в сосудах на фрагм. А — обозначено удаление избытка воды и
частично ионов как конечный этап работы противоточной системы; слева на
фрагм. А представлены процессы реабсорбции воды и ионов из проксимальных
отделов, справа — процессы, происходящие при формировании гипертонической
мочи.
185
отделов петли Генле и собирательных трубочек), но и соединительная
ткань и сосудистая система. Все системы находятся под гормональ-
ным контролем. Особую роль в этом контроле играет действие гор-
мона АДГ на гетерогенные рецепторы клеток эпителия собирательных
трубочек.
Не менее сложная организация характерна и для основной выде-
лительной системы многих насекомых, особенно обитающих в засуш-
ливых районах. В дополнение к головным нефридиям и мальпигиевым
сосудам у них развивается очень важная часть общей с мальпигиевы-
ми сосудами осморегулирующей системы. Она представлена особыми
участками кутикулярного эпителия и вспомогательными структурами
в стенке задней кишки животных — ректальными утолщениями. Ор-
ганизация системы варьирует у разных групп насекомых. В основе ее
лежит специализированный участок кутикулярного эпителия, пред-
ставленный высокими призматическими клетками и тонкой, проницае-
мой для воды и ионов кутикулой (рис. 51, Б).
Клетки имеют хорошо выраженную щеточную каемку на апикаль-
ной поверхности, образованную крупными микроворсинками, содер-
жащими митохондрии. Между клетками расположена сложная система
узких и расширенных межклеточных пространств и лакун, в которые
заходят трахеи. Септальные десмосомы связывают между собой апи-
кальные и базальные области клеток. На латеральной поверхности кле-
ток имеются выросты, формирующие замковидные соединения между
соседними клетками, причем в каждом выросте цитоплазмы содержат-
ся митохондрии. По одной из наиболее распространенных гипотез,
обоснованной экспериментально, система работает следующим обра-
зом. Многочисленные ионные насосы плазматической мембраны со-
здают и поддерживают высокую концентрацию ионов в узких меж-
клеточных каналах. В них и устремляется из полости задней кишки
вода с растворенными в ней веществами. Отсюда вода поступает по
системе лакун и по специальным субэпителиальным щелям, снабжен-
ным иногда специальными клапанами, в гемолимфу. Транспортируе-
мые с водой ионы задерживаются ионными насосами мембран клеток
в их базальных и нижних латеральных отделах. Затем через цитоплаз-
му они возвращаются в апикальную часть клеток и снова выводятся
в межклеточные щели и лакуны. Таким образом, здесь, как и в почке
млекопитающих, создается и постоянно поддерживается циркуляция
ионов в локальной зоне*.
Имеются данные о том, что в создании локальных зон повышенного осмотического
давления принимают участие у насекомых н у позвоночных не только ноны, но и низко-
молекулярные органические соединения.
186
Интересно, что у птиц в процессе экономии воды принимает
участие также эпителий задней кишки. Поступающая по мочеточникам
моча может распространяться в краниальном направлении, где эпите-
лий задней кишки реабсорбирует часть воды и ионов. Как и у млеко-
питающих, работа всей осморегулирующей системы насекомых нахо-
дится под сложным гормональным контролем. Гормональное воздей-
ствие может изменить интенсивность ее работы очень быстро и в очень
широких пределах. Это позволяет насекомым экономно расходовать
вод}' на процессы экскреции и осморегуляции.
Особенно совершенная в структурном и функциональном отно-
шениях осморегулирующая система формируется у представителей
двух отрядов насекомых (Lepidoptera, Coleoptera). Мальпигиевы сосу-
ды у них непосредственно контактируют своими проксимальными
участками со стенкой задней кишки в области, где расположены спе-
циализированные для реабсорбции участки эпителия (см. рис. 47, В).
Перемещение первичной мочи в полости мальпигиева сосуда и содер-
жимого задней кишки происходит в противоположных направлениях,
т. е. также формируется своеобразная противоточная система. Такого
рода системы могут реабсорбировать не только значительное количе-
ство воды из экскретов задней кишки (непереваренные остатки пищи
и ультрафильтрат мальпигиевых сосудов), но и водяные пары из воз-
духа, который в виде пузырьков может располагаться у некоторых
видов насекомых в полости задней кишки.
Таким образом, в организации осморегулирующих и выделитель-
ных систем у млекопитающих и насекомых ярко проявляется еще одна
из общих закономерностей эволюционной динамики этих систем: уве-
личение у высших животных роли общих интеграционных механизмов
и межсистемных взаимодействий для более совершенного осуществле-
ния осморегуляции и экскреции.
ЛИТЕРАТУРА
Гинецинский А. Г. Физиологические механизмы водно-солевого равнове-
сия. М.; Л., 1963.
Наточин Ю. В. Физиологические детерминанты параллелизма (единства)
гистологических структур И Цитология, 1986. Т. 28. № 3.
Наточин Ю. В. Физиология жидкостей тела и функция почки И Общий
курс физиологии человека и животных. М., 1991. Ч. 2. С. 405-545.
Хэм Ф„ Кормак Д. Гистология. М., 1983. Т. 5. С. 5-125.
Kcmnick Н. Chloride cells and chloride epithelium in aquatic insects // Inter.
Rev. Cytol., 1976. Vol. 49.
187
Koushanpour E, Kris W. Renal Physiology Principles, Structure and Function.
N V. 1986. . . . . ...
Lencer И', Verkman A. et al. Endocytic vesicles from renal papilla which
retrieve the vasopressin-sensitie water channel do not contain a functional H ATPase
//J. Cell Biol., 1990. Vol. 1.
Rupper: E. Smith P. R. The functional organization of filtration nephridia П
Biol. Rev., 1988. Vol. 1.
Часть 2. ТКАНИ ВНУТРЕННЕЙ СРЕДЫ
Вопрос о происхождении тканей внутренней среды тесно связан
с проблемой происхождения многоклеточных животных и появлением
у них первичных исходных тканей
Согласно теории гастреи Геккеля, ткани внутренней среды имеют
вторичное происхождение. По этой теории, они берут начало от двух
первичных эпителиальных тканей — экто- и энтодермы, образовавших
вначале стенку тела первичного гипотетического двуслойного организ-
ма — гастреи.
По теории фагоцителлы Мечникова, ткани внутренней среды про-
изошли из одной из двух первичных тканей: из фагоцитобласта первич-
ного многоклеточного животного — фагоцителлы. По мнению Меч-
никова, внутренний клеточных слой фагоцителлы представлен клетка-
ми однородной паренхимы (клетки фагоцитобласта), а наружный —
ресничными жгутиковыми клетками (клетки кинобласта).
Теория фагоцителлы, по мнению зоологов (В. А. Догель,
А. В. Иванов и др.) и гистологов-эволюционистов (акад. А. А. Завар-
зин), лучше соответствует сравнительно анатомическим, эмбриологи-
ческим и гистологическим фактам.*
При оценке фактов нужно иметь в виду, что ныне живущие
низшие многоклеточные, а следовательно, и их ткани внутренней сре-
ды не являются прямыми предшественниками основных типов много-
клеточных и их тканей внутренней среды. В связи с этим анализ
организации последних у низших многоклеточных дает лишь косвен-
ные данные по интересующему нас вопросу. Анализируя организацию
тканей у низших многоклеточных, мы получаем представление лишь
о некоторых вариантах их строения, достигнутых в результате дли-
тельной эволюции.
Для эволюционных построений важно знать строение тканей внут-
ренней среды не только у отдельных представителей данного типа, но
и по возможности выявлять основные варианты строения исследуемой
ткани у разных его представителей, т. е. иметь представление об эво-
люционной динамике исследуемой ткани в пределах данного типа
животных.
* В настоящее время ие все зоологи разделяют данную точку зрения на происхождение
Metazoa; существуют и иные гипотезы, одиако А. А. Заварзин придерживался воззрений,
изложенных в настоящем тексте.
189
Для филогенетических сопоставлений у зоологов традиционно
принято рассматривать из низших многоклеточных типы губок и ки-
шечнополостных.
У губок выделяют два типа покровных тканей и функциональный
аналог тканей внутренней среды других многоклеточных — мезоглею.
Тело губок покрыто одним слоем плоских клеток пинакодермой
(рис. 52, А, 5). В водоносных каналах, пронизывающих все тело губок,
пинакодерма переходит в хоанодерму — слой цилиндрических клеток
хоаноцитов, имеющих (как у клеток простейших жгутиконосцев) жгу-
тики и воротничковый аппарат (рис. 52, Б, 9). Часть тела губки, между
пинакодермой и хоанодермой, образована мезоглеей. Ее основу со-
ставляет выделяемое отростчатыми клетками межклеточное вещество
(рис. 52, А, 4). В нем удается выявить типичные коллагеновые волокна
с характерной для коллагена позвоночных поперечной исчерченнос-
тью. В пределах типа губок наблюдается характерное и для рыб, и
для высших позвоночных варьирование коллагеновых волокон. У ро-
говых губок широко распространен и особый, аморфный коллаген,
получивший название спонгина.
Специфическая особенность мезоглеи губок — многообразие от-
ростчатых фибробластоподобных клеток, образующих коллагеновые и
другие межклеточные структуры. Помимо типичных аполярных фиб-
робластов, как и у других животных, по всей поверхности имеются по-
ляризованные фибробласты — лофоциты, синтезирующие параллель-
но уложенный пучок коллагеновых фибрилл лишь на половине, про-
тивоположной направлению движения этих клеток (рис. 53, А). У
роговых губок для синтеза аморфного коллагена дифференцируется
специальная разновидность фибробластов — спонгиобласты.
В мезоглее губок Haliciona обнаружено уникальное волокнистое
образование, формируемое внутриклеточными пучками параллельно
уложенных фибрилл неясной химической природы. В соседних клет-
ках, образующих непрерывную цепочку, фибриллы точно смыкаются
своими концами, формируя длинное растяжимое внутриклеточное сег-
ментированное волокно (рис. 53, Б). Необходимо, однако, подчерк-
нуть, что такое многообразие оседлых, продуцирующих коллаген кле-
ток характерно не для каждого вида губок. Разнообразно в мезоглее
губок представлена и система свободных клеточных элементов, в ней
найдено несколько вариантов амебоидных клеток со специфическими
включениями. К ним относятся гранулоциты, продуцирующие агглю-
тинины, серые клетки, запасающие гликоген, фагоциты и малодиффе-
ренцированные амебоциты (см. рис. 52, Б, 7, 8, 10). Особая субпопу-
ция подвижных клеток спикулобластов — специализирована для
нтеза спикульного скелета (см. рис. 52, Б, 11).
190
Рис. 52. Строение и гистологическая организация губок.
А — общая схема строения; Б — гистологическая организация (no Е. Н. Горыгаиной и О. Ю. Чаге, 1990):
/ — оскулюм, 2 — водоносный канал, 3 — жгутиковая камера, 4 — мезоглея, 5 — пинакодерма, 6 — пинакоцит, 7 — гранулоцит, 8 —
серая клетка, 9 — хоаноцит, 10 — археоцит, II — склероцит, 12 — спикула; стрелками на рис. Б показаны гистогенетичсские отношения.
Рис. 53. Лофоцит из мезоглеи
губки (Л) и сегментированное
волокно (5) губки
(no Е. Н. Горышиной
и О. Ю. Чаге, 1990).
А: 1 — митохондрии, 2 — ше-
роховатая ЭПС, 3 — аппарат
Гольджи, 4 — секреторные гра-
нулы, 5 — пучки коллагеновых
волокон; Б: 1 — границы кле-
ток, 2 — внутриклеточные фиб-
риллы неизвестной химической
природы.
192
Несмотря на цитологическую дифференцировку оседлых и по-
движных элементов мезоглеи, тканевая расчлененность губок относи-
тельна и поддерживается лишь в нормальных условиях. В «эпители-
альных тканях» губок — пинакодерме и хоанодерме — часть диффе-
ренцированных клеток сохраняет способность к делению и обеспечи-
вает тем самым рост клеточных систем и частичное их обновление.
Все разнообразные клеточные формы мезоглеи в нормальных условиях
возникают благодаря делению и дифференцировке в разных направ-
лениях малодифференцированных амебоцитов (см. рис. 52, Б, 10). В
экстремальных ситуациях последние могут давать эпителиальные клет-
ки, а хоаноциты могут утрачивать сложную специфическую диффе-
ренцировку и превращаться в амебоидные клетки.
Особенности, тканевой организации губок свидетельствуют о том,
что процесс выделения тканей как детерминированных и замкнутых
систем (не способны превращаться в клетки другой системы) не до-
ходит у взрослых губок до необратимого состояния, как у других
многоклеточных. При этом у губок в мезоглее встречаются разнооб-
разные и вьгсокоспециализированные свободные и оседлые элементы.
Больше того, по разнообразию типов фибробластов (продуцирующих
межклеточное вещество) и продуцируемых коллагенов губки сходны
(и даже превосходят по некоторым показателям) с такими животными,
как позвоночные и моллюски, у которых эти элементы достигают
наивысшего развития. При далеко зашедшей цитодифференциации тка-
невая организация губок находится еще на этапе становления.
Своеобразна эволюционная динамика тканей внутренней среды и
в пределах типов кишечнополостных и гребневиков. Низшие и вто-
рично измененные представители кишечнополостных (гидроидные по-
липы, гидра) практически не имеют четко выраженных аналогов тка-
ней внутренней среды (рис. 54, Б). Так, у пресноводной гидры «ме-
зоглея» представлена тонкой прослойкой коллагена, выделяемой ба-
зальными участками клеток экто- и энтодермы. В области прослойки
располагаются нервные клетки и особые малодифференцированные
интерстициальные клетки (2, 6). В щупальцах из них возникают стре-
кательные клетки — книдобласты, а в остальной части тела они пре-
вращаются в железистые клетки экто- и энтодермы. Однако наблю-
даемые у гидры и гидроидных полипов отношения вторичны. В эмб-
риогенезе (рис. 54, А) образование типичного двуслойного организма
(геккелевской гастреи) происходит не путем инвагинации, а в резуль-
тате мультиполярной миграции. Животное проходит в своем развитии
стадию, напоминающую фагоцителлу Мечникова.
Снаружи у личинок планулы имеется слой ресничных клеток —
аналог кинобласта фагоцителлы. У некоторых высших представителей
193
кишечнополостных (по-видимому, независимо в разных группах) и
близкого к ним типа гребневиков в большей или меньшей степени
развивается мезоглея (рис. 54, В, 2). Эта ткань, выполняющая преиму-
щественно опорную функцию, образована в типичных случаях меж-
клеточным веществом и заселяющими его оседлыми и подвижными
клетками. В состав межклеточного вещества входят коллаген и другие
соединения, характерные для межклеточных структур тканей внутрен-
ней среды (например, эластиноподобные волокна в мезоглее гребне-
виков). Клетки, заселяющие мезоглею, хотя и имеют эпителиальное
Рис. 54. Эмбриогенез и гистологическая организация кишечнополостных
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
А — варианты эмбрионального развития гидроидных (а-г) и коралловых \д-е) поли-
пов: а — яйцо, б — морула, в — паренхимула, г — планула, д — бластула, е —
инвагинационная гаструла, ж — полип, 1 — интерстициальные клетки;
Б — клеточный состав тела у гидры: 1 — эпителиально-мышечные и 2 — интерсти-
циальные клетки, 5 — книдобласты, 4 — стрекательная, 5 — железистая н б
нервная клетки, 7 — тонкая пластинка мезоглеи; стрелками показаны гисгогенетичес-
кие отношения;
В — срез через тело сцифоидной медузы: 1 — эпителий эскумбреллы, 2 — мезо-
глея, 3 — мезоглеальные клетки, 4 — фагоцитировавшие клетки, 5 — гастродерма,
б — гастральный канал, 7 — эпителий субумбреллы.
194
происхождение, однако способны к делению и, следовательно, к само-
поддержанпю, а возможно, и увеличению субпопуляции в процессе
роста животных. Особенно большой специализации достигают клетки
и межклеточные структуры в мезоглее известковых кораллов, где они
образуют сложный спикульный известковый скелет (аналог, в извест-
ном смысле, костной ткани позвоночных и спикульного скелета губок
и иглокожих).
На примере кишечнополостных видно, что эволюция (хотя и вто-
рично, о чем убедительно свидетельствуют эмбриологические данные)
пошла по пути, постулируемому теорией гастрси Геккеля. Первичные
кишечнополостные, редуцировавшие фагоцитобласт, при усложнении
своей организации вынуждены были снова создавать ткани внутренней
среды с отчетливо выраженной опорной функцией. Эти вторичные
ткани оказываются в общем сходными с первичными тканями, при-
мером которы является мезоглея губок. Сходные черты проявляются
не только в химическом составе межклеточного вещества, но и в
характере дифференцировки спикулобластов и механизмах образова-
ния ими спикульных скелетов губок и известковых полипов.
ГЛАВА 1. Оседлые трофические разновидности
тканей внутренней среды
§1 . РЫХЛАЯ СОЕДИНИТЕЛЬНАЯ ТКАНЬ
Рыхлая соединительная ткань позвоночных состоит из клеток и
межклеточных структур (рис. 55). Основными клетками являются уже
упоминавшиеся при характеристике мезоглеи губок оседлые клетки —
фибробласты (1). Они образуют разнообразные и в химическом, и
в структурном плане межклеточные структуры и осуществляют по-
стоянный контроль за работой и нормальной организацией межкле-
точных структур. Межклеточные структуры представлены основным
веществом и волокнами двух типов — коллагеновыми и эластически-
ми (4, 5).
Основное, или аморфное, вещество образовано пластинками и
тяжами гелеобразной консистенции. Основу геля составляют кислые
и нейтральные полисахариды обычно в комплексе с белками. Поли-
сахариды получили название гликозаминогликанов (нейтральные) и
сульфатированных гликозаминогликанов (кислые). В аморфном веще-
стве рыхлой соединительной ткани сульфатированных гликозаминог-
ликанов относительно немного. Главным компонентом гелеобразных
тяжей аморфного вещества является несульфатированный гликозами-
ногликан — гиалуроновая кислота. Длина каждой молекулы гиалуро-
195
Рис. 55. Рыхлая соединительная ткань кожи млекопитающих
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
1 — фибробласт, 2 — гистиоцит, 3 — тучная клетка, 4 — коллагеновые, 5 — элас-
тические волокна, 6 — жировая клетка, 7 — капилляр, 8 — эритроциты, 9 — пери-
цит, 10 — лимфоцит, 11 — лимфатический сосуд, 12 — плазматические клетки.
новой кислоты достигает 400 нм. Гиалуроновая кислота в геле аморф-
ного вещества может присутствовать в «чистом» виде и вместе с
белками, полисахаридами и другими гликозаминогликанами, образуя
мощные надмолекулярные комплексы (рис. 56). Их молекулярная мас-
са достигает нескольких миллионов дальтон (Да), занимая относитель-
но большой объем, сравнимый с объемом прокариотной клетки. По-
мимо гиалуроновой кислоты в состав надмолекулярных комплексов
входят молекулы протеогликанов (7, 3, 5), которые часто крепятся на
гиалуроновой кислоте при помощи специальных белков (2). Основу
молекулы протеогликанов составляют так называемые сердцевидные
белки (3), на которые навешаны многочисленные молекулы преиму-
щественно кислых (сульфатированных) глюкозаминогликанов. И про-
теогликаны, и их комплексы с гиалуроновой кислотой несут большое
количество отрицательно заряженных групп. Они создают основу
196
imiHHiHiHtiniiitHH minim
Рис. 56. Строение главных компонентов основного вещества рыхлой соединительной ткани — комплексов гиа-
луроновой кислоты с молекулами протеогликанов.
А — строение протеогликана; Б — общий вид участка молекулы гиалуроновой кислоты и связанных с ней
молекул протеогликанов:
1 — молекула гиалуроновой кислоты, 2 — связывающие белки, 3 —- белки сердцевины, 4, 5 — глюкозамин-
гликаны (4 — кератосульфат, 5 — хондроитин-сульфат).
аморфного вещества, придают ему консистенцию мягкого геля. Эти
молекулы окружены гидратными оболочками. Из-за обводненности
основное вещество рыхлой соединительной ткани оказывается средой,
в которой легко протекает диффузия. Кроме того, между гидратными
оболочками глюкозаминогликанов остается лабиринт канальцев, в ко-
торых в силу капиллярного эффекта циркулирует тканевая жидкость.
Таким образом, аморфное вещество рыхлой соединительной ткани
идеально приспособлено для реализации основной, проводящей тро-
фической функции — двустороннего транспорта веществ между рабо-
тающими органами и сосудистой системой.
В тесном контакте с аморфным матриксом находятся и механи-
ческие структуры рыхлой соединительной ткани — коллагеновые и
эластические волокна. Они связаны с молекулами основного вещества
боковыми углеводными цепями гликопротеидов и протеогликанов. Ос-
нову коллагеновых волокон составляет белок коллаген. В настоящее
время известно около 11 разновидностей белковых цепей, формирую-
щих путем различных комбинаций свыше семи типов сложных моле-
кул коллагена. Все молекулы построены по одному принципу и пред-
ставляют собой три полипептидные цепи, свернутые в спираль (рис. 57,
Б, 2). Каждая цепь состоит из повторяющихся последовательностей
трех аминокислот, первой из которых может быть любая аминокислота
(кроме пролина, лизина и глицина), второй — лизин либо пролин,
наконец, третьей — только глицин. Молекулы коллагена достигают в
длину 280 нм и имеют диаметр около 1,5 нм. Коллагеновые волокна
рыхлой соединительной ткани взрослых животных построены из мо-
лекул коллагена I типа, которые образованы двумя одинаковыми це-
пями и одной цепью, кодируемой другим геном. Коллагеновые волок-
на, образованные из коллагена I типа, характеризуются большой проч-
ностью на разрыв. Они могут объединяться в пучки разной толщины.
На обычных препаратах пучки волокон имеют извилистый вид. Изви-
листость волокон обеспечивает при механической нагрузке значитель-
ное растяжение соединительной, ткани.
Каждое коллагеновое волокно состоит из отдельных коллагеновых
фибрилл (4), которые, в свою очередь, образованы более тонкими
макрофибриллами (3). Толщина элементарной фибриллы 7 нм. Она
состоит из расположенных параллельно цепей молекул коллагена. В
такой элементарной фибрилле их пять. Молекулы коллагена, выделен-
ные из фибрилл, получили название тропоколлагена.
Под электронным микроскопом коллагеновые фибриллы некото-
рых типов обнаруживают характерную поперечную исчерченность.
При этом участки фибрилл длиной 660 нм имеют одинаковый и строго
повторяющийся рисунок такой исчерченности.
198
Рис. 57. Внутриклеточный синтез и «созревание» молекул коллагена (А)
и их внеклеточная сборка в поперечноисчерченные волокна (Б)
или решетки базальных мембран (В).
А: 1 — синтез молекулы коллагена на рибосомах шероховатой ЭПС, 2-4 — последо-
вательные стадии образования трехспиральных молекул коллагена в ЭПС и цистер-
нах аппарата Гольджи, их гидроксилирование (ОН) и гликозирование (значки), нали-
чие «лишних» концевых неспирализируюшихся участков;
Б: 1 -— молекула проколлагена в момент выделения, 2 — молекула тропоколлагена,
3 — сборка микрофибриллы из молекул тропоколлагена, 4 — сборка коллагеновых
фибрилл из микрофибрилл, 5 — образование коллагеновых волокон из коллагеновых
фибрилл с образованием пучков коллагеновых волокон;
В: 1—3 — последовательные стадии образования гексагональных решеток коллагена
базальных мембран из трехспиральных молекул коллагена IV типа.
Одним из наиболее распространенных объяснений явления исчер-
ченности коллагеновых фибрилл является представление о закономер-
ной укладке в фибрилле тропоколлагена; молекулы уложены правиль-
ными продольными цепочками (4, 5) по принципу «хвост к голове».
Между молекулами имеются значительные промежутки — «пустоты».
В соседних рядах они сдвинуты на 1/4 своей длины, так что в каждом
четвертом ряду промежутки между головкой и хвостом молекулы
будут совпадать по вертикали. За счет этого и образуются темные
полосы по длине коллагеновой фибриллы. Именно здесь в больших
количествах откладываются контрастирующие вещества при обработке
препаратов для ультраструктурного анализа.
Поперечную исчерченность имеют волокна наиболее распростра-
ненных типов коллагена (I, II, III). Коллагены III типа, из которых
199
образованы тонкие волокна, образованные относительно небольшим
количеством фибрилл из коллагена III типа, в отличие от коллагенов
I типа содержат в каждой из трех одинаковых полипептидных цепочек
по два остатка цистеина, образующих дисульфидные связи между
цепочками. Этот коллаген содержит также много остатков оксипроли-
на и гистидина и значительно больше гликозилирован, чем коллаген
I типа.
Весьма важной функциональной разновидностью межклеточных
структур рыхлой соединительной ткани, в состав которых входит кол-
лаген, являются базальные мембраны. Они образуются на границе с
тканями, выполняющими специфическую функцию: различного рода
эпителии, мышцы и другие системы. Базальные мембраны представ-
ляют собой уплотненные пластинки межклеточного вещества соеди-
нительной ткани. Часть базальной мембраны, которая прилегает к
другим тканям, выделяется их клетками, другая образуется фиброб-
ластами рыхлой соединительной ткани. Непосредственно контакти-
рующие с основным веществом рыхлой соединительной ткани базаль-
ные мембраны образованы преимущественно коллагенами нефибрил-
лярного типа (IV).
Вероятно, существенной особенностью коллагенов базальных
мембран является наличие у их молекул добавочных участков, которые
отрезаются пептидазами у фибриллярных тропоколлагенов.
Коллагены IV типа в базальных мембранах образуют не волокна,
а двух- или трехмерные решетки из четырех молекул, укрепленные
межмолекулярными S-S-связями (рис. 57, В).
Во внутренней части базальных мембран имеется и особый гли-
копротеин фибронектин. Его молекулы способны полимеризоваться в
волокнистые структуры как на поверхности оседлых клеток рыхлой
соединительной ткани, так и в соединительнотканных частях базаль-
ных мембран. Базальные мембраны играют весьма важную роль в
процессах обмена между основным веществом рыхлой соединительной
ткани и клетками других специализированных тканей. Кроме того, в
базальных мембранах и в особых утолщениях, образованных коллаге-
ном VII типа, возникают структуры, обеспечивающие крепление здесь
концов коллагеновых фибрилл I и III типов.
Эластические волокна на тотальных препаратах рыхлой соедини-
тельной ткани внешне отличаются от коллагеновых меньшим диа-
метром, прямолинейной направленностью и слабой окрашиваемостью
обычными красителями. По механическим свойствам они характери-
зуются (как следует из названия) эластичностью, т. е. способностью
после растяжения возвращаться в исходное состояние. Это свойство и
200
определяет функциональное значение эластических волокон в рыхлой
соединительной ткани: они стабилизируют ее структуру после различ-
ного рода механических воздействий.
Эластические волокна в отличие от коллагеновых состоят из двух
компонентов: аморфного эластина и нитевидных микрофибрилл
(рис. 58). Белок эластин сходен с коллагенами по аминокислотному
составу. Однако в нем значительно меньше полярных аминокислот и
почти нет гидрооксипролина и гидроксилизина. В отличие от колла-
гена поперечные сшивки между полипептидиыми цепями осуществля-
ются специфическими для эластина производными аминокислот —
десмознном и изодесмозином (рис. 58, J, Б). Микрофибриллярный
компонент эластических волокон образован трубчатыми структурами
диаметром 11 нм. Они окружают, а иногда и пронизывают аморфный
матрикс (рис. 58, В). Микрофибриллы состоят, по-видимому, из осо-
бого белка. Он отличается и от коллагена, и от эластина, богат поляр-
ными аминокислотами и лишен гидроксилизина и гидроксипролина.
Микрофибриллярные структуры содержат около 5% углеводов, что
указывает на их гликопротеидную природу.
Рис. 58. Сеть эластиновых молекул и структуры эластического волокна
А — сеть эластиновых молекул в сокращенном (а) и растянутом (б) состояниях;
Б — детали организации сети эластиновых молекул; В — общий вид коллагено-
вых (5) и эластических (3, 4) волокон:
1 — молекула мономерного эластина, 2 — десмозиновая связка, 3 — сердцевина во-
локна, 4 — гликопротеиновые микрофибриллы на поверхности волокна,
5 — коллагеновые волкна.
Принципиальной особенностью молекул эластина, определяющей
основные свойства эластических волокон и мембран, является «теку-
чая», не жестко закрепленная конформация этих молекул (рис. 58, А
а, б). Благодаря этому, а также наличию упомянутых выше сшивок
между молекулами (из десмозина и изодесмозина) образуемые ими
структуры приобретают свойства упругости, растяжимости и эластич-
ности.
Для рыхлой соединительной ткани характерна теснейшая взаимо-
связь между клетками и образуемыми ими межклеточными структу-
рами. Основные элементы рыхлой соединительной ткани представлены
клетками фибробластического ряда: периваскулярными камбиальными
клетками, фибробластами и фиброцитами. Среди них наибольшую
специфическую биосинтетическую активность проявляют фиброблас-
ты, которые способны синтезировать и разнообразные коллагены, и
белки эластических волокон, и сложные гликопротеиды, белки и гли-
козаминогликаны протеогликанов, гиалуроновую кислоту и еще ряд
полисахаридов и белков.Специализация фибробластов на синтез пре-
имущественно одного из перечисленных соединений наблюдается
лишь в плотных соединительных тканях. В рыхлой соединительной
ткани такой специализации наблюдать не удается.* Сложность функ-
циональной деятельности фибробластов определяется еще и способ-
ностью их поглощать путем пиноцитоза участки волокон и аморфного
вещества и обеспечивать переваривание их в лизосомах. Способны
фибробласты также путем опосредованного специальными рецептора-
ми пиноцитоза извлекать из крови и тканевой жидкости вещества,
необходимые для образования внутриклеточных структур (например,
некоторые липиды, необходимые для построения клеточных мембран).
Мультифункциональной деятельности фибробластов соответству-
ет и сложная структурно-химическая организация этих клеток (рис. 59,
А, Б). Внешне фибробласты представляют собой отростчатые, расплас-
танные по межклеточному веществу клетки, образующие местами спе-
циальные временные контакты через адгезивные гликопротеины меж-
клеточного вещества, например фибронектина. На специально при-
готовленных тотальных препаратах в фибробластах удается выявить
более темную перинуклеарную область и более светлую — перифе-
рическую. В ядре локализуется активно функционирующее ядрышко,
относительно много слабо конденсированного эухроматина, в ядерной
* Имеется лишь предположение, что самые молодые фибробласты синтезируют преиму-
щественно глюкозаминогликаны, а в более зрелых преобладает синтез механических бел-
ковых структур межклеточного вещества. Иногда удается наблюдать и фибробласты, ак-
тивно фагоцитирующие разрушающиеся коллагеновые структуры.
202
Гис 59. Общий вид (А) и детали (Б)
строения метаболического аппарата
фибробласта.
1 — шероховатая ЭПС, 2 — аппарат Гольд-
жи, 3 — секреторные гранулы, 4 — выведе-
ние содержимого гранул — экзоцитоз, 5 —
пучки коллагеновых волоки, 6 — каналы, со-
единяющие, по-видимому, цистерны шерохо-
ватой ЭПС с цистернами аппарата Гольджи,
7,8 — соответственно цис- и транс-цистер-
ны аппарата Гольджи, 9-13 — последова-
тельные стадии формирования секреторных
гранул с коллагеном на периферии цистерны
аппарата Гольджи, 14, 15 — последователь-
ные стадии формирования секреторных гра-
нул перед экзоцитозом.
оболочке много поровых комплексов. Перинуклеарная область цито-
плазмы в интенсивно функционирующих фибробластах насыщена ше-
роховатой ЭПС. Имеются рибосомы и на наружной мембране ядерной
оболочки. В цитоплазме повсеместно распределены митохондрии, хо-
рошо представлен динамичный микрофибриллярный (актиновый) и
микротрубочковый цитоскелет.
В центральной области цитоплазмы клеток вокруг центриоли и
редуцированной реснички располагаются комплексы Гольджи — свое-
образные центры биосинтетической деятельности клеток (рис. 59, Б).
Они принимают участие и в синтезе полисахаридов, и в посттрансля-
ционной обработке белков межклеточных структур.
Оказалось, что на рибосомах образуются цепи аминокислот зна-
чительно длиннее тех, что представлены в молекуле тропоколлагена.
Первая обработка происходит при прохождении молекул протоколла-
гена через мембрану эндоплазматической сети. Специальными фер-
ментами здесь удаляется часть добавочного участка цепей аминокис-
лот, и молекула протоколлагена превращается в молекулу проколла-
гена. После превращения молекул протоколлагена в молекулы прокол-
лагена происходит их перемещение в цистерны аппарата Гольджи. В
фибробластах транспорт молекул проколлагена осуществляется, по-ви-
димому, по особым, ограниченным мембранами канальцам, обеспечи-
вающим постоянную структурную связь полостей цистерн ЭПС с
полостями цистерн аппарата Гольджи.
В периферических зонах цис-цистерн аппарата Гольджи, в сфе-
рических выпячиваниях, происходит образование триплетов из моле-
кул коллагенов путем их взаимной спирализации. Далее, возможно,
путем слияния мембран этих выпячиваний в средних и транс-цистер-
нах аппарата Гольджи, происходит передача материала в цистерны
транс-зоны, где по периферии цистерн образуются цилиндрические
выпячивания (9—73). Здесь происходит гликозилирование сложной по-
липептидной молекулы. Полипептидная молекула перемещается в сек-
реторные гранулы, которые, вероятнее всего, образуются путем от-
шнуровывания цилиндрических выпячиваний от транс-части аппарата
Гольджи. До образования зрелой гранулы с компактно упакованными
полипептидными молекулами проколлагена наблюдается ряд промеж-
уточных стадий — стадий созревающих гранул. На начальной стадии
(цилиндрическое выпячивание транс-части аппарата Гольджи) агрега-
ты молекул проколлагена расположены линейно, в строгом порядке:
головка и хвостовые части агрегатов правильно чередуются друг с
другом. После отделения цилиндрического выпячивания от транс-цис-
терны аппарата Гольджи внутри гранулы происходит ряд закономер-
ных морфологических изменений, химическая сущность которых пока
204
не ясна. Зрелые гранулы подходят к плазматической мембране, их
содержимое выделяется на поверхность клетки путем экзоцитоза (Г4,
15). В это время специальные пептидазы отрезают лишние концы
молекул проколлагена, которые превращаются уже в молекулы тропо-
коллагена. т. е.. в свою очередь, закономерно полимеризуются, образуя
поперечно исчерченные коллагеновые фибриллы.
Не менее сложные превращения происходят в клетках в процессе
выделения ими эластина п соответствующих ему фибриллярных вспо-
могательных белков, а также разнообразны < гликопротеинов и поли-
сахаридов основного вещества. Однако изучены они менее детально,
чем описанные выше превращения коллагеновых структур.
В регуляции многосторонней синтетической и катаболической
деятельности фибробластов активную роль играют воздействия на их
рецепторы молекул межклеточного вещества. В частности, синтез и
выделение коллагена происходят в клетках лишь после воздействия
на их специфические рецепторы молекул фибронектина.
В настоящее время хорошо изучены и структура молекул фибро-
нектина, и структура рецепторов к фибронектину в плазматической
мембране фибробластов, и вся система белков, связывающих эти за-
действованные рецепторы с микрофибриллярным цитоскелетом фиб-
робласта (рис. 60, А-В).
Клетки фибробластического ряда представляют собой обновляю-
щуюся клеточную популяцию. В рыхлой соединительной ткани непре-
рывно происходит гибель старых, закончивших свой жизненный цикл
Рис. 60. Строение фибронектина, специфического к нему рецептора в мембране фиб-
робласта и связывающих его белков с микрофибриллярной системой цитоскелета.
А — общий вид молекулы фибронектина; Б — специфический рецептор к фибронек-
тину в мембране фибробласта; В — связывание молекулы фибронектина со специфи-
ческим рецептором и белками цитоскелета (4-7):
1 — фибронектин, 2 — мембрана, 3 — рецептор к фибронектину, 4 — талнн, 5 —
винкулин, 6 — тензин, 7 — актин.
205
фиброцитов — последних по степени дифференцировки клеток фиб-
робластического ряда. Они отличаются от фибробластов слабым раз-
витием мембранных органоидов в цитоплазме и более низким уровнем
метаболизма. Постоянство клеточного состава поддерживается благо-
даря митотическому делению начальных камбиальных элементов фиб-
робластического ряда. Последние характеризуются меньшим, чем у
фибробластов, объемом цитоплазмы и менее распластанной веретено-
видной формой. По скорости обновления популяции фибробластов
неоднородны. В подкожной соединительной ткани мышей существуют
две субпопуляции фибробластов: долгоживущие и быстро обновляю-
щиеся. В организме млекопитающих имеется, по-видимому, общий
фонд малодифференцированных стволовых клеток фибробластическо-
го ряда. Они могут циркулировать в крови, принимая вид лимфоци-
топодобных клеток, и оседать в разных участках соединительной
ткани, обеспечивая тем самым возможность стабильного обновления
фибробластических элементов. Соотношение межклеточных структур,
камбиальных элементов (фибробластов) и фиброцитов может варьи-
ровать в широких пределах и в разных участках соединительной ткани
у одного и того же животного. Такая вариабельность характерна и для
одних и тех же участков соединительной ткани у представителей
разных отрядов млекопитающих.
Имеющиеся сравнительно-биохимические данные свидетельству-
ют о большой консервативности в ряду позвоночных коллагеновых
генов. Что касается концевых неспирализованных участков молекул
коллагена, то здесь наблюдаются различия в первичной структуре даже
у разных видов животных. Особенно разнообразны видовые различия
в аминокислотном составе концевых участков молекул коллагена в
классе рыб.
§2 . РАЗНОВИДНОСТИ РЫХЛОЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Своеобразными разновидностями рыхлой соединительной ткани
являются ретикулярная ткань кроветворных и лимфоидных органов и
жировая ткань. Жировая ткань представлена у позвоночных несколь-
кими разновидностями (рис. 61, А, Б). Наиболее широко распростра-
нена обычная жировая ткань, образованная крупными клетками, в
центральной части которых располагается одна или несколько круп-
ных, заполненных жиром вакуолей (рис. 61, А). Вся активная цито-
плазма и ядра оттеснены в таких клетках к периферии. Жировые
включения в клетках жировой ткани обычно представляют собой не
пассивный, а непрерывный обновляемый материал. Более специфичес-
кой разновидностью жировой ткани является бурая жировая ткань
206
(рис. 61, Б). Она также состоит из крупных клеток, однако ядра в них
находятся, хак обычно, в центре клеток, а мелкие жировые включения
заполняют всю цитоплазму. В цитоплазме клеток велико количество
специфических митохондрий, которые содержат много ферментов для
окисления липидов и мало — для синтеза АТФ. В связи с этим
образующаяся при окислении жиров энергия переходит в основном в
тепловую энергию. Наличие такого регулируемого источника энергии
имеет существенное значение для разогревания крови при пробужде-
нии животных от зимней спячки и у новорожденных животных, ли-
шенных еще волосяного покрова.
Рис. 61. Жировые клетки млекопитающих.
А, Б — клетки белого и бурого жира (по Е. Н. Горышиной и О. Ю. Чаге):
I — гладкая ЭПС, 2 — липидные вакуоли.
Еще одна разновидность жировой ткани у млекопитающих —
жировая ткань костного мозга. Жировые клетки ее содержат особые
липиды, которые обычно не используются в липидном обмене, т. е. в
отличие от подкожной жировой ткани здесь нет интенсивного обнов-
ления запасенного субстрата.
К постоянным элементам рыхлой соединительной ткани следует
отнести и эндотелий капилляров, с которым эта ткань образует единую
трофическую систему (рис. 62). Эндотелий представляет собой эпите-
207
Рис. 62. Перициты млекопитающих.
А — поперечный срез; Б — вид сверху; В — ультраструкту-
ра (по Е. Н. Горышиной и О. Ю. Чаге):
1 — ядросодержащая часть, 2 — отростки перицита, 3 —
эндотелиальная клетка, 4 — базальная мембрана, 5 —
пучки коллагеновых волоки, б — пиноцитозные пузырьки.
леобразную разновидность тканей внутренней среды (3). У взрослых
животных в обычных капиллярах и кровеносных сосудах эндотелий
представлен одним слоем сильно уплощенных клеток, которые имеют
хорошо развитый надмембранный комплекс на поверхности, гранича-
щей с кровью. Клетки эндотелия обладают способностью к микропи-
ноцитозу образованию мелких пиноцитозных пузырьков на поверх-
ностях, обращенных к полости сосуда, и наружной поверхности, кон-
208
тактирующей с соединительной тканью. Пузырьки могут обеспечивать
транспорт веществ в мембранной упаковке из крови в соединительную
ткань и, наоборот, из соединительной ткани в кровь. В большей части
сосудистого кровеносного и лимфатического русла эндотелий образует
сплошную выстилку. В этих участках обмен между соединительной
тканью и кровью происходит либо путем двустороннего микропино-
цитоза, либо путем транс-мембранного транспорта через внешнюю и
внутреннюю мембраны эндотелиальных клеток. В некоторых специ-
альных отделах сосудистого русла (эндокринные железы, почечные
клубочки, венозные синусоиды кроветворных и лимфоидных органов)
в эндотелии имеются поры, обеспечивающие транспорт гормонов,
жи псих компонентов плазмы крови или, наконец, миграцию клеточных
элементов. Специфические особенности трофических взаимоотноше-
ний между кровью и работающими органами и тканями (эпителия,
легких, печени, нервных и глиальных клеток и т. д.) обеспечиваются,
по cj ти дела, в каждом органе позвоночных.
Эндотелий у взрослых млекопитающих относительно автономная,
самоподдерживающаяся разновидность тканей внутренней среды. От-
мирающие клетки в процессе жизнедеятельности заменяются преиму-
щественно за счет делящихся эндотелиальных клеток. Помимо эндо-
телия важную роль в трофических взаимоотношениях между сосудами
и рыхлой соединительной тканью играют особые, по-видимому, кон-
тролирующие эти взаимоотношения клетки — перициты. Они распо-
ложены на стенке мелких сосудов (артериал, венул и капилляров), на
наружной поверхности базальных мембран, отделяющих эндотелий от
межклеточного вещества рыхлой соединительной ткани (/, 2) По
строению они похожи на подоциты в фильтрующем аппарате мальпи-
гиевых клубочков почек и выполняют, по-видимому, сходную функ-
цию.
Кроме оседлых клеток в рыхлой соединительной ткани находятся
и специализированные клетки, относящиеся к системе свободных кле-
точных элементов крови. Наиболее постоянными и специфическими
подвижными клеточными элементами рыхлой соединительной ткани
являются гистиоциты (разновидности макрофагов) и тучные клетки
(см. рис. 55, 2, 3). Контролирующая и защитная функции гистоцитов
отчетливо обнаруживаются в экспериментальных условиях. При вве-
дении под кожу витальных красителей уже через несколько минут
Удается наблюдать их избирательное накопление в цитоплазме гисто-
цитов. Они играют в данном случае роль своеобразных, почек накоп-
ления нейтрализующих вредные продукты. Не менее очевидна защит-
ная функция гистоцитов и при различного рода воспалительных про-
209
цессах в рыхлой соединительной ткани. Ядра гистиоцитов значительно
темнее, чем у фибробластов. Цитоплазма содержит много вакуолей и
имеет на светооптическом уровне пенистую структуру. Границы кле-
ток четко очерчены. Клетки способны к амебоидному перемещению
и фагоцитозу. Количество их может увеличиваться как путем деления
клеток собственной популяции, так и за счет переселяющихся в со-
единительную ткань из сосудов моноцитов крови.
Зрелые тучные клетки заполнены крупными базофильными гра-
нулами вещества, стимулирующего воспалительные процессы. Более
подробное описание их, а также других свободных элементов рыхлой
соединительной ткани дано при характеристике функций клеток крови
и лимфоидной ткани.
§3 . ИНТЕРСТИЦИАЛЬНЫЕ ТРОФИЧЕСКИЕ ТКАНИ
БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Интерстициальные ткани типа рыхлой соединительной ткани до-
вольно широко распространены у представителей различных типов
беспозвоночных животных. Степень их развития определяется многи-
ми факторами, в первую очередь такими, как размеры животного и
степень доступности работающих органов для пищеварительной, вы-
делительной и транспортной систем организма, что обусловлено об-
щими закономерностями организации животных. Помимо характерной
для рыхлой соединительной ткани позвоночных транспортной тро-
фической функции по специальному межклеточному веществу воз-
можна реализация этой функции и путем создания обширных, запол-
ненных тканевой или полостной жидкостью полостей, омывающих
работающие органы. Возможна также реализация трофической транс-
портной функции по специализированным межклеточным щелям с
гипертрофированными у клеток надмембранными комплексами с боль-
шим количеством отрицательно заряженных анионных групп. Эти три
возможности в большей или меньшей степени реализуются у совре-
менных взрослых многоклеточных или в ходе их эмбрионального
развития.
Транспорт по специализированным межклеточным щелям харак-
терен для животных, ткани внутренней среды которых представлены
паренхимами, по сути дела еще не имеющими тканевой организации,
аиболее типичными представителями таких животных являются па-
разитические плоские черви и бескишечные турбеллярий. Тело у бес-
кишечных турбеллярий (рис. 63), состоит из двух тканей — покров-
ого эпителия и паренхимы, или фагоцитобласта. В фагоцитобласте
УД ыявить две части центральную пищеварительную и перИ'
210
Рис. 63. Гистологическая организация бескишечных турбеллярий
(по Е. Н. Горышиной и О. Ю. Чаге).
I — покровный эпителий, 2 — железистая клетка, 3 — необласт, 4 — пищевари-
тельная клетка, 5 — пищеварительная полость, 6 — центральная и 7 — перифери-
ческая паренхема, 8 — мышечные клетки; стрелками показаны гистогенетические
отношения.
ферическую, образованную скоплением различных дифференцирован-
ных клеток с системой узких межклеточных щелей и каналов между
ними. Очевидно, что питательные вещества, образующиеся в резуль-
тате деятельности клеток центральной пищеварительной паренхимы,
распространяются в периферическую паренхиму и к покровному эпи-
телию по этим щелям и каналам. Аналогичные транспортные меха-
низмы характерны для других животных, ткани внутренней среды
которых представлены клеточными скоплениями. Этот механизм ши-
211
роко используется в эмбриональных зачатках, в эпителиальных тканях
и в специальной трофической ткани нервной системы — глии.
Обеспечение проводящей функции путем развития обширных по-
лостей — характерная особенность животных с хорошо развитыми
полостями тела ( вторичной, первичной и смешанной). Это многие
аннелиды (полихеты и олигохеты), сипункулиды, приапулиды, отчасти
иглокожие и членистоногие. Полости независимо от механизмов их
развития в онтогенезе по своему происхождению и положению в
филогенезе (если принимать теорию фагоцителлы) являются, по сути
дела, производными первичной однородной паренхимы — общего ис-
точника развития тканей внутренней среды. С этой точки зрения мно-
гократное и, по-видимому, независимое в разных группах возникно-
вение целомов — еще одно выражение общих эволюционных тенден-
ций в развитии тканей внутренней среды.
Возникающие в ходе эволюции целомические полости, выстлан-
ные специфическим вторичным эпителием, вначале выполняли, веро-
ятно, трофическую функцию — транспорт в целомической жидкости
питательных веществ и продуктов обмена. Однако в дальнейшем у
ряда групп животных целомы приобрели и отчетливо выраженную
гидростатическую функцию, а также функцию обеспечения подвиж-
ности внутренних органов. Наряду с этим совершенствовалась и тро-
фическая функция благодаря специализации отдельных участков це-
ломического эпителия на реализацию функции запасания питательных
веществ, синтеза дыхательных пигментов и функцию детоксикации
вредных продуктов обмена (например, хлорагогенный эпителий анне-
лид и клетки жирового тела насекомых) (рис. 64, 65). По мере увели-
чения размеров тела животного, усложнения его внутренней органи-
зации, наконец, сегментации туловища, характерной для артикулят,
возникла необходимость и в усовершенствовании транспортных тро-
фических циркуляторных систем, а полости тела и наиболее распро-
страненная и совершенная из них целомическая полость в ее перво-
начальном виде не могли уже достаточно совершенно осуществлять
эту функцию. В связи с этим во многих группах животных, вероятно,
также многократно и независимо возникает специальная циркулятор-
ная система, представленная сетью сосудов с более или менее ор-
ганизованной стенкой и специальным пропульсаторным органом или
органами, обеспечивающими направленное перемещение жидкости
(крови или гемолимфы) по сосудам. Источниками развития сосудистой
системы могут быть либо непосредственно ткани внутренней среды,
либо ее производные — стенки целома. Широко распространено и
развитие сосудистой системы из обоих источников — крупные сосуды
212
Рис. 64. Хлорагогенный эпителий
кольчатых червей.
А — общий вид; Б — структура хлорагогенной
клетки (по Е. Н. Горышиной и О. Ю. Чаге, 1990):
1 — полость кровеносного сосуда, 2 — базаль-
ная мембрана, 3 — аутофагосома, 4 — хлорагосо-
ма, 5 — белковая гранула, 6 — отложения
гликогена.
и сердце развиваются преимущественно из видоизмененной стенки
делома, а мелкие сосуды — за счет большей или меньшей организации
стенки лакун и каналов в межклеточном веществе тканей внутренней
спелы. Такие отношения наиболее характерны для ракообразных. У
аннелид сосудистая система, по-видимому, является производным в
основном целомической стенки. Базальная мембрана клеток целоми-
ческого эпителия образует наружную стенку сосуда (рис. 66, А, Б). В
рупных сосудах из него образуются и специальные сократимые мы-
шечные или эпителиально-мышечные клетки.
213
5
Рис. 65. Клетки жирового тела личинок насекомых
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
а — жук, б — уратная клетка коллемболы, в — полиплоидная клетка жирового
тела дрозофилы: 1 — аутофагосома, 2 — отложение гликогена, 3 — вакуоль с крис-
таллами солей мочевой кислоты, 4 — липидная вакуоль, 5 — политеиныс
хромосомы.
Вопрос о наличии у аннелвд специальной сосудистой ткани эн-
дотелия в настоящее время является предметом дискуссии. Одни ав-
торы находят такую выстилку хотя бы в некоторых сосудах, другие
относят обнаруживаемые здесь клетки к видоизмененным гемамебо-
цитам, распластанным на коллагеновой базальной мембране сосуди-
стой стенки. Своеобразная модификация сосудистой системы обнару-
жена у наиболее специализированных пиявок. Здесь целом редуциру-
ется из-за гипертрофии тканей внутренней среды до системы каналов,
выстланных целомическим эпителием. Это чисто целомическое про-
214
Рис. 66. Кровеносные сосуды у аннелид и немертин
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
А — расположение сосудов у полихет: 1 — кутикула, 2 — покровный эпителий,
3 — интерэпителиальный капилляр 4 — базальная мембрана, 5 — целомический
эпителий, 6 — кожный сосуд, 7 — мезентерий, 8 — спинной сосуд, 9 — околоки-
шечный кровеносный синус, 10 — кишечный эпителий;
Б — специализированные клетки целомического эпителия в стенке сосуда у олигохе-
п>1: 1 — полость целома, 2 — подоцит, 3 — эпителиально-мышечная клетка, 4 — ба-
зальная мембрана, 5 — полость сосуда, 6 — ножки подоцита;
В — рисунок с микрофотографии участка интерстициальной ткани с сосудом у не-
мертины: 1 — полость сосуда, 2 — соединительная ткань, 3 — фибробласт,
4 — стенки сосуда, 5 — эндотелий.
изводное в значительной мере заменяет классическую сосудистую сис-
тему, характерную для других классов аннелид. Некоторые исследо-
ватели рассматривают сосудистую систему немертин как видоизменен-
ный редуцированный целом. Сосуды ряда немертин имеют хорошо
выраженную сплошную эндотелиальную выстилку, расположенную на
базальной мембране. Кроме того, в стенке сосудов имеются сократи-
мые мышечные клетки и механические эластиноподобные элементы.
Иными словами, стенки имеют типичный для сосудов позвоночных
план строения (рис. 66, В).
Сложная эволюционная динамика гистологического строения со-
судистой стенки особенно хорошо изучена на примере моллюсков
(рис. 67). у брюхоногих и лопатоногих моллюсков кровеносная сис-
215
тема организована по лакунарному типу — образована системой не
имеющих клеточной стенки лакун и каналов в межклеточном вещест-
ве. У двустворчатых и брюхоногих моллюсков (например, у морского
ангела) венозная часть системы не имеет собственной оформленной
стенки, т. е. сохраняет лакунарное строение (рис. 67, А, 3). Артери-
альные же сосуды имеют четко оформленную стенку, состоящую из
эндотелия, расположенного не на базальной мембране, а лишь на
выделяемом этими клетками межклеточном веществе (рис. 67, Б, 2).
Второй слой стенки образован крупными, циркулярно расположенны-
ми мышечными клетками (4). Наконец, снаружи имеется слой меж-
клеточного вещества, выделяемый типичными фибробластами (3, 5).
Клетки эндотелия хотя и не образуют типичных для позвоночных
межклеточных контактов, однако тесно прилежат друг к другу, фор-
мируя в местах контакта характерные краевые складки (2). В мелких
артериях у этих животных эндотелий прерывистый, а стенка капилля-
ров образована лишь одним слоем гладких мышечных клеток, одетых
собственной базальной мембраной.
Наибольшего развития сосудистая система достигает у головоно-
гих моллюсков. У высших их представителей она почти замкнутая и
имеет оформленное клеточное строение не только в артериальном, но
и в венозном и капиллярном отделах. Во всех отделах хорошо выра-
жена прослойка особого эластиноподобного вещества, у наружной
части которого находится слой циркулярно расположенных гладкомы-
шечных клеток, а внутренняя поверхность вещества выстлана эндоте-
лием, который местами не образует сплошного слоя (рис. 67, Д, Е).
Анализ имеющихся данных по эволюционной динамике сосуди-
стой системы показывает, что, как правило, эндотелиальная выстилка
многократно и независимо возникает в сосудах животных, относящих-
ся к эволюционно наиболее продвинутым группам: головоногие среди
моллюсков, голотурии среди иглокожих, форониды среди щупальце-
вых и позвоночные среди хордовых. По-видимому, основное назначе-
ние эндотелия это поддержание постоянных физико-химических
свойств циркулирующих по сосудам жидкостей и обеспечение peiy-
лирования процессов циркуляции. Наряду с этим эндотелий в замкну-
тых кровеносных системах становится барьером, избирательно регу-
лирующим транспорт веществ между плазмой крови и тканевой жид-
костью.
Несколько иные отношения наблюдаются у немертин — относи-
тельно низкоорганизованных животных с замкнутой кровеносной сис-
теме и хорошо развитой эндотелиальной выстилкой. Как отмечалось
, осо енности их сосудистой системы обусловлены либо тем, что
216
Рис. 67. Кровеносные сосуды моллюсков (морского ангела, осьминога).
А — венозные синусы; Б — артерия; В — эндотелий артерии; Г — контакт эндоте-
лиальных клеток; Д-Е — капилляры (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
1 — покровный эпителий, 2 — эндотелий, 3 — межклеточное вещество,
4 — гладкомышечная клетка, 5 — фибробласт, 6 -— базальная мембрана,
7 — эластииоподобиое вещество.
217
она развивается из редуцированного целома (как у пиявок), либо
специфическими особенностями эволюционной динамики их тканей
внутренней среды. Благодаря этому и на низших уровнях организации
проявляются их потенции к прогрессивному развитию. В пользу пос-
леднего предположения свидетельствуют хорошо развитые у немертин
интерстициальные ткани (см. ниже). Основными клеточными элемен-
тами интерстициальной паренхимы немертин являются типичные фиб-
робласты. Они образуют хорошо развитые прослойки межклеточного
вещества, состоящего из аморфного гелеобразного матрикса и волок-
нистых структур. К сожалению, данные о химическом составе этих
структур в литературе отсутствуют (см. рис. 66, В, 2, 3).
Интерстициальные трофические ткани, подобные рыхлой соеди-
нительной ткани позвоночных, мы находим у некоторых иглокожих
(голотурии) и у представителей всех классов моллюсков. В интерсти-
циальных тканях этих животных (как и у позвоночных) основным
клеточным элементом является фибробласт. В экспериментальных ус-
ловиях (воспалительное новообразование, регенерация) у моллюсков
возможно развитие фибробластов из подвижных мелких амебоцитов
гемолимфы. Они являются, по-видимому, камбиальным источником
развития оседлых элементов интерстициальных тканей моллюсков и
в нормальных условиях. К ограниченной пролиферации способны сами
фибробласты.
Функция и ультраструктурная организация фибробластов моллюс-
ков сходны с функцией и ультраструктурной организацией аналогич-
ных клеток у позвоночных животных. Это отростчатые клетки с хо-
рошо развитыми мембранными органоидами в цитоплазме. Они актив-
но синтезируют коллаген и разнообразные компоненты межклеточного
основного вещества.
Межклеточные структуры интерстициальных тканей моллюсков,
по-видимому, также аналогичны межклеточным структурам рыхлой
соединительной ткани позвоночных. У них выявляются типичные ис-
черченные коллагеновые волокна, эластические волокна представлены
в меньшем количестве. Химический состав основного вещества мол-
люсков изучен хуже, но в морфологическом отношении его структура
сходна с организацией основного вещества рыхлой соединительной
ткани позвоночных. В межклеточном веществе у моллюсков имеется
стема лакун и каналов, по которым циркулирует тканевая жидкость.
нки таких каналов могут быть ограничены системой закономерно
ПГТИРО“ №ллагеновьгх волокон и снабжены сократимым ап-
оазвитлй ослелн™ представлен обычно фибробластами с хорош0
развитой микрофибриллярной актин-миозиновой системой. Эта разн°-
218
вндность фибробластов, так называемые миофибробласты, обнаружена
н в соединительной грануляционной ткани позвоночных, образующей-
ся при заживлении обширных кожных ран.
В основном веществе интерстициальной соединительной ткани
кожи головоногих моллюсков обнаружены специфические для позво-
ночных сульфатированные гликозаминогликаны и небольшое количе-
ство целлюлозы.
Помимо фибробластов — основной клеточной формы интерсти-
циальных тканей — у моллюсков имеются и другие оседлые элементы:
пузырчатые, пигментные, зернистые и, наконец, своеобразные, так
называемые поровые клетки (рис. 68), выполняющие функцию почек
накопления. Вместе с тем они могут осуществлять синтез и разрушение
дыхательных пигментов в гемолимфе. Специфической особенностью
этих клеток помимо бурых включений в виде гранул в цитоплазме
является сложный рельеф поверхности. Плазматическая мембрана об-
разует лабиринт впячиваний, наружные отверстия которых закрыты
гипертрофированным надмембранным комплексом (рис. 68, Б).
Значительно меньшую роль в трофической проводящей функции
играют интерстициальные ткани у большинства аннелид и других
групп первичноротых животных с хорошо развитым целомом. У этих
животных в большинстве участков тела интерстициальные ткани пред-
ставлены лишь небольшими межсептальными и межмышечными про-
слойками, которые бедны фибробластами.
В связи с редукцией целома у пиявок и у некоторых полихет
(например, у афродитид) интерстициальные ткани получают большее
развитие и значительно возрастает их роль в трофической проводящей
функции. По своей организации интерстициальные ткани этих живот-
ных сходны с описанными выше интерстициальными тканями мол-
люсков.
Существенный интерес представляет организация интерстициаль-
ных трофических тканей высших первичноротых — членистоногих.
Степень развития и удельный вес этих тканей в осуществлении тро-
фической проводяшей функции варьируют как у представителей раз-
ных видов в пределах класса, так и у представителей отдельных
классов членистоногих. Так, среди насекомых у личинок жука-носо-
рога и у взрослых животных интерстициальные ткани представлены
пластинками аморфного вещества и волокнистыми структурами. Здесь
не удается обнаружить оседлых фибробластов и источники развития
этих структур остаются неясными. С другой стороны, у гусениц шел-
копрядов в межклеточном веществе имеется много фибробластов, тес-
но связанных с продуцируемыми ими межклеточными структурами.
219
Рис. 68. Клетки с обменно-трофической функцией в соединительной ткани моллюсков.
А, Б — поровая; В, Г — пузырчатая клетка (А, В — общий вид, Б, Г — участки поверхностного аппарата) (по Е. Н. Горышиной и
О. Ю. Чаге, 1990):
1 — впячивание плазматической мембраны, 2 — щелевые входы в лабиринты с надмембранным фильтрующим аппаратом, 3 — стп<же-
ние гликогена.
Особенностью последних является наличие помимо коллагеновых во-
локон особых волокон большего диаметра, образованных электронно-
плотными фибриллярными структурами. В отдельных участках меж-
клеточного вещества у некоторых насекомых обнаружены волокна,
удаляемые из срезов ферментом эластазой, т. е. аналогичные эласти-
ческим волокнам рыхлой соединительной ткани позвоночных. В ин-
терстициальных тканях насекомых обнаружены и разнообразные, ха-
рактерные для рыхлой соединительной ткани млекопитающих глико-
заминогликаны (гиалуроновая кислота, хондроитинсульфат).
У изученных представителей других классов членистоногих —
высших ракообразных, мечехвостов — интерстициальные трофичес-
кие ткани имеют сходное строение с аналогичными тканями гусениц
шелкопряда.
Фибробласты членистоногих похожи на фибробласты других
многоклеточных животных. У них хорошо развиты мембранные орга-
ноиды цитоплазмы, в первую очередь шероховатая ЭПС и аппарат
Гольджи (рис. 69). У фибробластов насекомых, как и у позвоночных
животных, прослеживается связь расширенных цистерн шероховатой
ЭПС с центральной частью небольших цистерн аппарата Гольджи. Она
осуществляется при помощи канальцев гладкой ЭПС Внутри цистерн
шероховатой ЭПС заметен материал умеренной электронной плотнос-
ти. Вопрос о механизмах выведения этого материала, а также о син-
тезируемых на мембранах аппарата Гольджи полисахаридах основного
вещества остается открытым. С одной стороны, в области аппарата
Гольджи имеются транспортные пузырьки и секреторные гранулы и
прослеживается постепенное перемещение последних к плазматичес-
кой мембране, где их содержимое выводится путем экзоцитоза. С
Другой стороны, в интенсивно функционирующих фибробластах часто
можно наблюдать тесный контакт участков цистерн шероховатой ЭПС
с плазматической мембраной. В местах такого контакта мембраны
цистерн ЭПС лишены рибосом. У насекомых, как и у позвоночных
животных, в фибробластах в ходе прогрессирующей дифференцировки
происходит редукция метаболического аппарата цитоплазмы. Она про-
является в резком уменьшении диаметра цистерн шероховатой ЭПС,
уменьшении области, занятой структурами аппарата Гольджи, и уп-
лотнении гиалоплазмы.
Межклеточное вещество соединительных интерстициальных тка-
ней у высших первичноротых, в частности у насекомых, состоит, как
И у позвоночных животных, из основного вещества и волокнистых
структур. Среди волокнистых структур четкую аналогию с позво-
221
Рис. 69. Ультраструктура фибробластов в интерстициальной ткани саран да.
1 — гиалоплазма, 2 — область выделения из клеток экзоцитозного пузырьк
„ у ^КЗОЦИЗОЗ
или поглощения вещества путем пиноцитоза, 3 — аппарат Гольджи, *
ный пузырек (или пиноцигозиый), 5 — шероховатая ЭПС, 6 — коллагеновое вол
но, 7 — основное вещество.
222
ночными обнаруживают коллагеновые волокна. Для них характерна
правильная нсчерченность, отражающая закономерное субъединичное
строение этих волокон. В каждой субъединице содержится два широ-
ких электронно-плотных диска по краям и два тонких — в середине.
Коллагены беспозвоночных варьируют по аминокислотному составу в
большей мере, чем у позвоночных животных, (за исключением про-
центного содержания глицина), а также по количеству связанных с
коллагеном углеводов, которое у беспозвоночных может достигать
20%. Большое разнообразие коллагеновых структур и образующих их
клеток обнаружено у представителей типа губок.
ЛИТЕРАТУРА
Альберте Б., Брей Б., Льюис Дж. и др. Молекулярная биология клетки.
М.. 1987 (1983). Т. 3.
Горышина Е. Н., Чага О. Ю. Сравнительная гистология тканей внутрен-
ней среды с основами иммунологии. Л., 1990. С. 20-33, 76-93.
Никитин В. Н, Перский Е Э., Утевская Л. А. Очерки о тройной спирали.
Киев, 1984.
Серов В. В., Шехтер А. В, Соединительная ткань. Функциональная мор-
фология и общая патология. М., 1981.
Хэм А., Кормак Д. Гистология. М., 1982. Т. 2. С. 36-105.
Ashurst D. Е. Connective tissues // Comprehensive Insect Physiol. Biochem.
Pharmacol. Oxford, 1985. Vol. 3.
Ruoslhti E. Structure and biology of proteoglycans // Ann. Rev. Cell Biol. 1988.
Ruppert E.. Carle K. Morphology of metazoan circulatory systems // Zoomor-
phology. 1983. Vol. 103, № 3.
Sims D. E. The pericyte-a review // Tissue a. Cell. 1986. Vol. 18, № 2.
глава 2. Скелетные ткани
§1. СКЕЛЕТНЫЕ ТКАНИ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Плотная соединительная ткань
Эта ткань у позвоночных животных состоит из тех же компонен-
тов, что и рыхлая соединительная ткань. Основными клеточными эле-
ментами плотной соединительной ткани являются клетки фиброблас-
тического ряда. Механическую опорную функцию выполняют межкле-
точные структуры, в первую очередь коллагеновые волокна. Эти во-
локна, образованные коллагеном I типа, собраны обычно в мощные
гулки, обеспечивающие большую прочность этой ткани. В зависимос-
ти от расположения пучков коллагеновых волокон и их соотношения
223
ночными обнаруживают коллагеновые волокна. Для них характерна
правильная нсчерченность, отражающая закономерное субъединичное
строение этих волокон. В каждой субъединице содержится два широ-
ких электронно-плотных диска по краям и два тонких — в середине.
Коллагены беспозвоночных варьируют по аминокислотному составу в
большей мере, чем у позвоночных животных, (за исключением про-
центного содержания глицина), а также по количеству связанных с
коллагеном углеводов, которое у беспозвоночных может достигать
20%. Большое разнообразие коллагеновых структур и образующих их
клеток обнаружено у представителей типа губок.
ЛИТЕРАТУРА
Альберте Б., Брей Б., Льюис Дж. и др. Молекулярная биология клетки.
М.. 1987 (1983). Т. 3.
Горышина Е. Н., Чага О. Ю. Сравнительная гистология тканей внутрен-
ней среды с основами иммунологии. Л., 1990. С. 20-33, 76-93.
Никитин В. Н, Перский Е Э., Утевская Л. А. Очерки о тройной спирали.
Киев, 1984.
Серов В. В., Шехтер А. В, Соединительная ткань. Функциональная мор-
фология и общая патология. М., 1981.
Хэм А., Кормак Д. Гистология. М., 1982. Т. 2. С. 36-105.
Ashurst D. Е. Connective tissues // Comprehensive Insect Physiol. Biochem.
Pharmacol. Oxford, 1985. Vol. 3.
Ruoslhti E. Structure and biology of proteoglycans // Ann. Rev. Cell Biol. 1988.
Ruppert E.. Carle K. Morphology of metazoan circulatory systems // Zoomor-
phology. 1983. Vol. 103, № 3.
Sims D. E. The pericyte-a review // Tissue a. Cell. 1986. Vol. 18, № 2.
глава 2. Скелетные ткани
§1. СКЕЛЕТНЫЕ ТКАНИ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Плотная соединительная ткань
Эта ткань у позвоночных животных состоит из тех же компонен-
тов, что и рыхлая соединительная ткань. Основными клеточными эле-
ментами плотной соединительной ткани являются клетки фиброблас-
тического ряда. Механическую опорную функцию выполняют межкле-
точные структуры, в первую очередь коллагеновые волокна. Эти во-
локна, образованные коллагеном I типа, собраны обычно в мощные
гулки, обеспечивающие большую прочность этой ткани. В зависимос-
ти от расположения пучков коллагеновых волокон и их соотношения
223
с прослойками рыхлой соединительной ткани различают две основные
разновидности плотной соединительной ткани: оформленную и не-
оформленную.
Плотная неоформленная соединительная ткань характеризуется
беспорядочным расположением пучков коллагеновых волокон в про-
странстве. Прослойки рыхлой соединительной ткани более или менее
равномерно распределены в этой сложной, взаимопереплетающеися
сети мощных коллагеновых структур. Вся система скреплена прослой-
ками межклеточного вещества, обычного для соединительной ткани
химического состава (гликозаминогликаны, протеогликаны, гликопро-
геидьи.
Кроме основной системы, образованной пучками коллагеновых
волокон, имеется аналогичная система, образованная эластическими
волокнами, которая придает всей структуре дополнительную проч
нос : ь и эластичность, в частности способность к растяжению и воз-
ращению в исходное состояние после прекращения действия внешнего
механического фактора.
Плотная неоформленная соединительная ткань широко распро-
странена в кожных покровах позвоночных животных. Она осущест-
вляет в них опорную функцию. Если кожные покровы подвергаются
менее разнообразным воздействиям (например, у водных животных, в
частности у рыб и круглоротых), то пучки коллагеновых волокон
приобретают более упорядоченное расположение.
Особенно отчетливо влияние функционального момента на про-
странственную организацию пучков коллагеновых волокон обнаружи-
вается в тех разновидностях плотной соединительной ткани, которые
получили название оформленных и представлены у позвоночных в
основном сухожилиями и связками. В сухожилиях пучки коллагеновых
волокон и клеточные элементы фибробластического ряда ориентиро-
ваны по направлению продольной оси сухожилия, т. е. соответствен-
но направлению действия механического натяжения при сокращении
мышц (рис. 70).
Закономерному в пространстве расположению коллагеновых во-
локон и дифференцированных клеток — фиброцитов — соответствует
и расположение прослоек рыхлой соединительной ткани, содержащей
кровеносные сосуды и малодифференцированные камбиальные эле-
менты фибробластического рядя.
Вторая разновидность оформленной соединительной ткани у по-
звоночных животных связки, образованные сетью эластических во-
локон и мембран, ориентированных преимущественно в продольном
равлении. В связках нет такого строгого пространственного разгра-
224
Рис. 70. Учалок сухожилия млекопитающего (по Е. 11. Горышиной
и О. Ю. Чаге, 1990).
1 — фибробласты-фиброциты, 2 — пучки катлгенпвых волоком пер-
вого порятка. 3 — пхчки коллагеновых волокон второго порядки.
4 — рыхлая соединительная ткань.
ничетшя дифференцированных и камбиальных клеток фибробластичес-
кого ряда, как в сухожилиях.
Приведенными примерами далеко не исчерпывается все разнооб-
разие плотных соединительных тканей у позвоночных животных. Они
могут парьировать не только по микроанатомическому строению, но
и ло составу основных макромолекулярных соединений, образующих
структурные компоненты этих тканей. Так, в плотной соединительной
т ани ооговицы млекопитающих вместо обычного для этих тканей
позвоночных сульфатированного гликозаминогликана имеются особые
-шкозаминогликаны. Кроме того, укладка коллагеновых волокон при-
г зретает правильный кристаллоподобный характер, что и обуслов-
ливает прозрачность этой структуры для световых лучей. Качествен-
ный состав и количественные соотношения мукополисахаридов основ-
ного вещества могут сильно отличаться у близких в систематическом
отношении групп и, наоборот, быть сходными у далеко отстоящих
I *' Аналогичная закономерность наблюдается и в отношении кол-
лагенов.
Весьма интересным фактом является наличие в плотной соедини-
’Нс ' ткаНИ кожи и эластической ткани стенки аорты млекопитаю-
225
щих целлюлозы, аналогичной по своим свойствам туницину оболоч-
ников. Своеобразная плотная соединительная ткань формируется в
окологубном аппарате личинки миноги — пескоройки. Здесь обнару-
жены и необычные фибробласты, имеющие гипертрофированный по-
верхностный аппарат за счет глубоких впячиваний плазматической
мембраны. Выявлены волокнистые структуры неизвестной химической
природы. Таких структур у других многоклеточных животных пока
обнаружить не удалось.
Хрящевая ткань
Эта разновидность скелетных тканей у позвоночных животных
также состоит из клеток и межклеточного вещества. Особенностью
последнего является его сложный химический состав. Основными хи-
мическими соединениями, образующими межклеточное вещество наи-
более распространенных гиалиновых хрящей, являются коллаген, суль-
фатированные гликозаминог шканы (хондроитинсульфаты А и С и
кератосу льфаты), нейтральные мукополисахариды и неколлагеновые
белки. Значительная часть белков и полисахаридов представлена в
межклеточном веществе хряща не в виде изолированных соединений,
а сложными надмолекулярными комплексами. Именно в хрящах по-
лучили широкое распространение соединения молекул гиалуроновой
кислоты с протеогликанами со специфическими сульфатированными
гликозаминогликана ии. Это обеспечивает особые его свойства — ме-
ханическую прочность и в то же время проницаемость для органичес-
ких соединений, воды и других веществ, необходимых для нормальной
жизнедеятельности клеточных элементов хрящевой ткани. Коллагено-
вые волокна составляют 40% межклеточного вещества хрящевой ткани
и состоят из особой разновидности коллагена (коллаген II типа с
одинаковыми полипептидными цепями в молекуле).
Наиболее специфичными, маркерными для межклеточного веще-
ства хряща соединениями являются кератосульфаты и определенные
разновидности хондроитинсульфатов. Они составляют до 1/3 сухой
массы хряща.
У высших позвоночных хрящевая ткань относительно рано закла-
дывается в онтогенезе и развивается из мезенхимы — общего источ-
ника для всех разновидностей тканей внутренней среды. На месте
будущей хрящевой ткани происходит концентрация клеток как за счет
их местной ускоренной пролиферации, так и за счет миграции клеток
из соседних участков мезенхимы. Вскоре после образования такого
скопления мезенхимных клеток они начинают вырабатывать межкле-
226
точное вещество и превращаются в специализированные клетки хря-
щевой ткани — хондробласты и хондроииты
Исходные клетки скелетогенной мезенхимы характеризуются вы-
сокими значениями ядерно-плазменных отношений (рис.71). Структу-
ры метаболического аппарата цитоплазмы представлены мелкими ком-
пактными митохондриями и относительно к^льшим количеством сво-
бодных рибосом, а также небольшими участками шероховатой ЭПС.
В цитоплазме много ограниченных мембранами пузырьков и вакуолей.
Аппарат Гольджи представлен рассредоточенными в цитоплазме не-
большими группами центральных цистерн со слабо развитыми пери-
ферическими вакуолями При превращении мезенхимных клеток в
активно фу нкниониру ющие хондробласты, которые синтезируют и вы-
деляют в окружающее межклеточное вещество основные макромоле-
кулярные соединения, происходит существенная перестройка всей ор-
ганизации клеток Она особенно четко проявляется в изменении ме-
таболического аппарата цитоплазмы (рис. 71, Б, В). Объем последней
постепенно увеличивается, что приводит к значительному уменьше-
нию ядерно-плазменных отношений. В клетках развивается белоксин-
тезигуюший аппарат в виде шероховатой ЭПС, занимающей все боль-
ший объем цитоплазмы Аппарат Гольджи концентрируется в около-
ядерной области и увеличивается в размерах. Сильно гипертрофиру-
ется его вакуолярная часть. Вместо небольших ipynn центральных
цистерн имеются уже развитые вакуолярные мембранные компоненты
этого органоида В митохондриях увеличивается объем матрикса. В
цитоплазме клеток появляются гранулы гликогена и липидные вклю-
чения. Одновременно увеличивается количество ограниченных мем-
бранами пу зырьков с содержимым умеренной электронной плотности.
Удается наблюдать и картины выведения содержимого вакуолей в
окружающее межклеточное вещество путем экзоцитоза. На периферии
цитоплазмы дифференпиру ющихся хрящевых клеток располагаются
уплотненные участки. В хондробластах, как и в фибробластах, имеет
место экзоцитоз с предварительным формированием окруженных мем-
бранами гранул в области аппарата Гольджи.
Дифференцированный хондробласт представляет собой клетку с
сильно развитым метаболическим аппаратом, специализированным на
синтез двух основных компонентов межклеточного вещества — спе-
цифических белков и мукополисахаридов (рис. 71, Г). Хондробласты
имеют мощно развитую эргастоплазму' и обширную околоядерную
территорию, занятую преимущественно вакуолярной системой аппара-
та Гольджи. В гиалоплазме таких клеток отмечены значительные скоп-
ления гликогена.
227
3
228
Дифференцированные хондробласты и клетки на описанных выше
начальных и средних стадиях дифференцировки обнаруживают высо-
кую метаболическую активность.
Об интенсивности метаболических процессов в хрящевых клет-
ках свидетельствуют опыты с предшественником синтеза коллагена
[ЗН]пролином. При введении этой аминокислоты меченый белок вна-
чале обнаруживается над свободными и прикрепленными рибосомами
эндоплазматической сети. Затем меченый белок почти одновременно
поступает в область аппарата Гольджи и в периферические участки
гиалоппазмы. Высказывается предположение, что в хондробластах про-
странственно разделен синтез коллагеновых и неколлагеновых белков.
Через 24 ч после введения радиоактивных аминокислот меченый белок
обнаруживается в межклеточном веществе. Таким образом, в активно
функционирующих хондробластах весь цикл синтеза и выведения ме-
ченых высокомолекулярных продуктов занимает меньше 24 ч. Вновь
образованные белки и мукополисахариды не располагаются непосред-
ственно около поверхности клеток, а распространяются диффузно (на
значительное расстояние от клетки) в образовавшемся ранее межкле-
точном веществе.
Активно функционирующие хондробласты в эмбриональных за-
чатках хрящевой ткани не утрачивают способности к синтезу ДНК и
делению. Рост хрящевого зачатка происходит как за счет прослоек
продуцируемого клетками межклеточного вещества, так и за счет де-
Рчс. 71. Последовательные изменения ультраструктурной организации клеток (А-Г)
при гистогенезе хрящевой ткани у млекопитающих.
7 — аппарат Гольджи, 2 — свободные рибосомы, 3 — шероховатая ЭПС, 4 — уп-
лотненный участок цитоплазмы в области контакта с коллагеновыми фибриллами
'Д 6 — область концентрации гликогена, 7 — митохондрии, 8 — вакуоли, 9 —
ядро, 10 — отросток.
229
лящихся клеток. Однако интенсивность их деления с момента начала
гетеросинтетической деятельности падает в основном вследствие силь-
ного увеличения продолжительности митотического цикла. Характер-
ным изменениям подвергается и ядерный аппарат хондробластов. Ядро
пикнотизируется, ядрышки сильно редуцируются. Зрелые хрящевые
клетки — хондроциты — в хряще располагаются обычно группами по
две, четыре или восемь клеток; эти так называемые изогенные груп-
пы окружены особыми участками межклеточного вещества, или кле-
точными территориями (рис. 72, А, 2, Б, 5). Каждая изогенная груп-
па образуется в результате деления одного хондробласта. Заверша-
ющие автосинтетические процессы происходят уже на поздних стади-
ях жизненного цикла хондробластов при снижении в них специфи-
ческой гетеросинтетической активности. В связи с этим образующие-
ся дочерние клетки не могут сформировать большого количества меж-
клеточного вещества и отойти друг от друга на значительное рас-
стояние.
В эмбриогенезе высших позвоночных и у низших взрослых по-
звоночных широко распространены так называемые пузырчатые хрящи
(рис. 72, Б). Их характерная особенность — большие размеры хонд-
роцитов и хондробластов и относительно небольшие прослойки меж-
клеточного вещества между ними.
У высших взрослых позвоночных наиболее широкое распростра-
нение имеют гиалиновые хрящи. В дефинитивной гиалиновой хряще-
вой ткани имеется строго поляризованное распределение клеток по
степени их дифференцировки (рис. 72, Б). На поверхности хряща вы-
деляется слой плотной соединительной ткани с хорошо развитой сетью
кровеносных сосудов, с запасом камбиальных малодифференцирован-
ных клеток — надхрящница (2). Она обеспечивает аппозиционный
рост хряща. Кроме того, через сосуды надхрящницы поступают в
хрящевую ткань вещества, необходимые для поддержания ее жизне-
деятельности, а также выводятся конечные продукты обмена. В гиа-
линовой хрящевой ткани трахеи клетки располагаются строго по уров-
ню их дифференцировки. Ближе к поверхности хряща находятся на-
именее дифференцированные одиночные хондробласты (5), имеющие
вид вытянутых параллельно надхрящнице клеток. Они энергично син-
тезируют межклеточное вещество и сохраняют способность к делению.
В центре хрящевой пластинки располагаются изогенные группы зре-
лых хондроцитов, имеющих округлую или овальную форму. Они зна-
чительно больше по размерам, чем хондробласты (4). Эти клетки уже
не способны к делению и синтезу межклеточного вещества в заметных
количествах. Клетки, расположенные между надхрящницей и центром
230
ГШПК)6)нф Л TlHKdx XHUdlEK 1U imodl.'lkJX VHVHl’l <> ’VI1
-ll<dl ИГННЛ1’И И c 'I'lUfTIC.drHlA / ‘iTLOCL-godrUOX f ’ИЧ.1.ШЧ Л1Ч11НЛкЧ1ГН<)\ ~ HllllimiKdXlA?ll
(И () И HOHiiniPido I и .] о»)
ИМНП’М H.iwd: !HEd\ МИННИНГЕ И 1 - </ ИЮНИ>\ V'lllliauru inh'dx HHlEhdl'H <n I’
\Г1НН»ИИ'И M'HlhOHOHLOlI HHE4J. MOU.'HlJKdX ИЧНЛ?И<| ..'HJ
хрящевой ткани, занимают промежуточное положение по уровню диф-
ференцировки.
Описанный выше гиалиновый хрящ высших позвоночных широко
распространенная, но далеко не единственная разновидность хрящевой
ткани. Даже у животных одного класса, в частности у млекопитающих,
имеются еще волокнистые и эластические хрящи. В межклеточном
веществе волокнистого хряща намного больше коллагеновых волокон,
чем в гиалиновом. По своей организации волокнистый хрящ занимает
промежуточное положение между плотной оформленной соединитель-
ной и хрящевой тканями. В известной мере это справедливо и в
отношении эластического хряща, где помимо основного аморфного
вещества и коллагеновых волокон имеется дополнительная система
эластических волокон, придающих такой хрящевой ткани особые ме-
ханические свойства.
Еще большее разнообразие хрящевых тканей удается обнаружить
у представителей разных классов позвоночных при сравнительно-гис-
тологическом анализе. Эти различия касаются соотношения клеток и
межклеточных структур, деталей внутренней организации клеточных
элементов и, наконец, химического состава межклеточного вещества.
Как правило, относительное количество межклеточного вещества
возрастает у представителей высших классов позвоночных. При этом
увеличивается и количество более сульфатированных хондроитинсуль-
фатов А. Однако у некоторых низших позвоночных, например у ска-
тов, имеются специальные механизмы гиперсульфатации более рас-
пространенного в хрящах низших позвоночных хондроитинсульфата
С. У взрослых миног в хрящевой ткани нейрокраниума и жаберных
дуг обнаружены необычные, округлой формы хондроциты со сложной
поверхностью (глубокие впячивания и каналы). Эти клетки секрети-
руют электронно-плотные глобулы, которые осаждаются на волокнах
и превращаются в сеть очень разветвленных фибрилл. Их вещество
ламприн составляет 44—51% сухой массы.
В хряще эмбрионов птиц обнаружен особый коллаген IX типа.
Он соединяет коллагеновые волокна II типа в единую систему.
Костная ткань
Для создания достаточно прочного внутреннего скелета в процес-
се эволюции у позвоночных животных появилась еще одна разновид-
ность скелетных тканей, а именно костная ткань. Время ее возникно-
вения у позвоночных животных или, скорее, порядок возникновения
в эволюции позвоночных хрящевой или костной тканей к настоящему
времени выяснены недостаточно. Возможно, что обе разновидности
232
скелетных тканей появились у предков позвоночных животных более
или менее одновременно.
Костная ткань, как и рассмотренные выше другие разновидности
скелетных тканей, состоит из клеток и межклеточного вещества. Пос-
леднее представлено двумя основными компонентами — органичес-
ким матриксом и солями кальция, преимущественно гидрооксиапати-
•гами. Неорганический компонент костной ткани и определяет специ-
фику ее как особой, наиболее совершенной в механическом отношении
ке летной ткани позвоночных.
Соли распределены в межклеточном веществе кости не хаотично,
а закономерно структурированы в ее органическом матриксе. Сам
процесс отложения солей — весьма сложное биологическое явление,
греоующее специальной организации органического матрикса межкле-
точного вещества. Хотя основные химические компоненты матрикса
те же, что и в межклеточном веществе хряща, однако их соотношение
и летали химического строения отличаются рядом особенностей.
Относительное количество коллагеновых волокон в межклеточ-
ном веществе костной ткани резко отличается от их количества в
кряшевой ткани (в хряще 40% коллагена II типа и 60% протеогликанов,
в кости 90% коллагена I типа и только 10% всех других компонентов).
В молекулах коллагена костной ткани много свободных боковых ами-
ногрупп лизиновых и оксилизиновых остатков. Эти боковые амино-
группы обладают способностью активно связывать пирофосфаты. Дру-
гой важной особенностью коллагена кости является высокое содержа-
ние органического фосфата при нормальной его концентрации в среде.
На один моль коллагена в костной ткани приходится два моля фосфата.
Для хондроитинсульфатов (сульфатированные гликозаминогликаны)
костной ткани характерна высокая степень их сульфатации и полиме-
ризации. В связи с этим они могут выступать как активные накопители
и переносчики необходимых для минерализации кости ионов кальция.
Из протеин-полисахаридных комплексов в костной ткани преобладает
фракция легких протеогликанов, содержащих лишь 15% белка и 85%
ховдроитинсульфатов. Особенностью этого комплекса является спо-
собность связывать, а при изменении конформации молекул отдавать
зн кальция в окружающую среду.
Ранние стадии развития костной ткани в онтогенезе высших по-
звоночных внешне напоминают развитие хрящевой ткани. Источником
соединительнотканных, или накладных, костей является скелетогенная
езенхи На месте формирования будущей кости в мезенхиме об-
Рззуются уплотненные участки. К моменту формирования межклеточ-
u 1 р Г'-ства в таких участках клетки располагаются рядами, прини-
233
мая эпителиоподобный вид. Их цитоплазма становится резкобазофиль-
ной в связи с развитием мощного белоксинтезирующего аппарата в
виде шероховатой ЭПС и аппарата Гольджи. В прилегающих друг к
другу рядах клеток в области их контактирующих поверхностей на-
чинается выработка межклеточного вещества кости. Здесь образуются
костные перекладины. Часть остеобластов замуровывается в толщу
межклеточного вещества, где они превращаются в дифференцирован-
ные клетки костной ткани — остеоциты. В отличие от хондроцитов
они имеют отростчатую форму. Тонкие отростки остеоцитов находятся
в особых костных канальцах, пронизывающих все межклеточное ве-
щество костной ткани. Этими канальцами тела остеоцитов, находя-
щиеся в костных полостях, связаны между собой и с кровеносными
сосудами, расположенными на поверхности кости в надкостнице или
в специальных каналах в толще костной ткани. Поскольку межклеточ-
ное вещество костной ткани непроницаемо для продуктов метаболиз-
ма, весь обмен веществ между телами остеоцитов и кровеносными
сосудами происходит через систему костных канальцев.
На рассматриваемой стадии происходит формирование уже доста-
точно сложной тканевой системы с основными признаками дефини-
тивной организации. В основе системы лежит надкостница, образован-
ная тремя основными типами клеточных элементов — камбиальными
полустволовыми клетками, функционирующим камбием — преостеоб-
ластами и утратившими способность к делению остеобластами. Завер-
шают этот последовательный ряд клеточных элементов костной ткани
остеоциты (рис. 73, 3, 5, 7, И).
Камбиальные полустволовые клетки представляют собой верете-
новидные клеточные элементы с небольшим объемом цитоплазмы и
умеренно развитым метаболическим аппаратом. Преостеобласты —
это особая субпопуляция клеток, которая характеризуется энергичной
пролиферативной активностью. Они обеспечивают увеличение коли-
чества клеток в системе. Наряду с этим у них достаточно хорошо
развит белоксинтезирующий аппарат, а также имеются и другие при-
знаки, свидетельствующие об относительно высоком уровне метабо-
лизма. По мнению некоторых авторов, эти морфологические особен-
ности обусловлены не только автосинтетическими процессами, связан-
ными с интенсивной репродукцией клеток. Высказывается предполо-
жение, что хотя бы часть клеток приступает и к специфическому
синтезу, в частности к синтезу мукополисахаридов. Выведение пос-
ледних из клеток совершается, согласно этим взглядам, после превра-
щения преостеобластов в остеобласты, которые специализируются пре-
имущественно на синтез коллагена. Как указывалось выше, остеоблас-
234
Рис 73. Строение развивающейся кости черепа млекопитающих.
I — сосуд. 2 — мезенхимма, 3 — камбиальные оседлые и, возможно, подвижные
клетки, 4 — клетки-предшественницы остеокластов (моноциты), 5 — преостеоблас-
ты, б — надкостница, 7 — остеобласт, 8 — остеобласт, замуровывающийся в меж-
клеточное вещество кости, 9 — выстилающие клетки (покоящийся камбий), 10 —
остеокласт. // — остеоцит, 12 — иеминсрализованиый участок межклеточного ве-
щества кости (остеоид), 13 — минерализованный участок межклеточного вещества
костной ткани.
ты в ультраструктурном отношении характеризуются прежде всего
мощным развитием белоксинтезирующего аппарата (шероховатая эн-
доплазматическая сеть) и других мембранных органоидов.
Механизмы внутриклеточного транспорта и выведения макромо-
лекул, а также внеклеточный фибриллогенез в костной ткани в прин-
ципе сходен с аналогичными процессами в хряшевой и соединительной
тканях. Возможно, однако, что при остеогенезе имеются и некоторые
особенности этих процессов. На разновидностях остеобластов — одон-
тобластах — дентаноидной кости впервые удалось показать выведение
тропоколлагена одонтобластами путем экзоцитоза гранул, образую-
| Щихся в области аппарата Гольджи.
Существенную роль играют остеобласты и на начальных этапах
процесса биоминерализации. Как уже отмечалось, организация орга-
нического матрикса межклеточного вещества кости специально при-
способлена для обеспечения процессов кальцификации. Минерализа-
235
ция может происходить только в нативных коллагеновых фибриллах,
образующих в естественном состоянии сложные надмолекулярные
комплексы с мукополисахаридами и протеинполисахаридными макро-
молекулами (протеогликаны)- Кристаллы гидроксида апатита отклады-
ваются не беспорядочно. Они начинают, по-видимому, образовываться
в линейно расположенных молекулах тропоколлагена — в промежут-
ках между головкой одной молекулы и хвостовым участком другой.
По мере роста кристаллы располагаются вдоль молекул тропоколла-
гена. Относительно конкретных механизмов начальных и последую-
щих этапов минерализации нет еще достаточной ясности.
Широко распространена и имеет фактическое морфологическое
обоснование теория первичной минерализации матриксными пузырь-
ками. Суть ее заключается в том, что остеобласты при минерализа-
ции костной ткани выделяют окруженные мембраной матриксные пу-
зырьки с повышенной концентрацией ионов кальция. Кроме того,
пузырьки содержат фермент — щелочную фосфатазу, которая раз-
рушает неорганический пирофосфат — ингибитор осаждения фосфа-
та кальция. Осаждение фосфата кальция начинается внутри пузырька
при достижении им зоны минерализации, а затем мембрана разруша-
ется и фосфат кальция оказывается в области коллагеновых фибрилл
(рис. 74, А. Б).
Среди органических компонентов, регулирующих процессы био-
минерализации вообще и минерализации костной ткани в частности,
выделяют два компонента: поверхностный и каркасный. Поверхност-
ный компонент имеет непосредственный контакт с минералом и обыч-
но представлен консервативными белками, богатыми кислыми груп-
пами. В костной ткани — это кальцийсвязывающие белки остеокаль-
цин и остеонектин, которые локализуются обычно в области контакта
концевых участков молекул тропоколлагена.
Каркасные компоненты более многообразны по своей химической
природе. В костной ткани они представлены коллагеном и регулируют
минерализацию путем воздействия на молекулы поверхностных ком-
понентов.
Остеоциты представляют собой неоднородную популяцию клеток,
что находит свое отражение и в их ультраструктурной организации.
Здесь имеются клетки как с относительно хорошо развитыми мембран-
ными органоидами (рис. 74, В), так и с относительно слабым разви-
тием этих структур. В настоящее время накапливается все больше
данных о том, что эти клетки принимают активное участие в метабо-
лических процессах, протекающих в межклеточном веществе кости.
Они участвуют в поддержании постоянства ионного баланса в орга-
236
Б
74. Ультраструктурная организация основных дифференцированных клеток кост-
ной ткани.
И — периферический участок остеобласта с межклеточным веществом; Б — участие
остеобластов (верхняя часть схемы) в биминерализации оссеиновых волоки (нижняя
часть схемы) по гипотезе матриксиых пузырьков; В — «молодой»
остеошп
— отростки клеток, 2 — шероховатая ЭПС, 3 — аппарат Гольджи, 4 матрикс-
ный пузырек, 5 — пучок коллагеновых волоки, 6 — центры вторичной минерализа-
ции, 7 — минерализация внутри коллагеновых фибрилл, 8 — ядро остеоцита.
237
низме. Достаточно сказать, что общая площадь соприкосновения тка-
невой жидкости с межклеточным веществом кости достигает у чело-
века 1500-5000 м2. Такая громадная поверхность соприкосновения
минерализованной костной ткани с жидкой средой создает сама по
себе необходимые предпосылки для поддержания ионного гомеостаза
организма. Этому способствует и активная роль клеточных элементов,
способных, по-видимому, осаждать или, наоборот, переводить в рас-
творенное состояние неорганические компоненты меж клеточного ве-
щества кости. Помимо основных типов клеток костной ткани — пре-
остеобластов. остеобластов и остеоцитов — в последнее время приня-
то выделять еще особые уплощенные клетки в тех участках поверх-
ности кости, где в данный момент не происходит ни образования, ни
разрушения кости. Эти клетки представляют собой покоящийся кам-
бий. Они. по-видимому, играют какую-то роль во взаимоотношениях
костной ткани и контактирующей с ней соединительной ткани (см.
рис. 73, 9).
Весьма характерная особенность костной ткани — постоянное
сосуществование в ней процессов новообразования и разрушения. Гар-
моничнос сочетание этих противоположных по своей сути процессов
является необходимым условием и механизмом роста формирующейся
кости. Уже с момента возникновения в ней выделяются участки, где
идет интенсивный аппозиционый рост костных перекладин, и зоны,
где происходит разрушение ранее образовавшейся костной ткани. В
накладных соединительнотканных костях участки интенсивного аппо-
зиционного роста обычно расположены на внешней, обращенной к
кожным покровам поверхности, а участки резорбции — на внутренней
поверхности формирующейся кости.
Разрушение межклеточного вещества кости — достаточно слож-
ный и не ясный еще во многих деталях системный процесс. В нем
принимают активное участие все типы клеток костной ткани и, по-ви-
димому, ряд гуморальных факторов. Особенно заметную и важную
роль играет в этом процессе особый тип клеток — остеокласты (см
рис. 73, /0; рис. 75). Это крупные многоядерные клетки с резкоокси-
фильной цитоплазмой. Остеокласты относятся к системе свободных
клеток тканей внутренней среды и представляют собой, по сути дела,
специальные макрофаги, образующие путем слияния многоядерные
клетки (рис. 73, /0). Их цитоплазма занимает относительно большой
объем и в центральной части, т. е. в области ядер она представлена
компактной массой, а на периферии, особенно в области контакта
с межклеточным веществом кости, образует сеть анастомозирующих
друг с другом отростков. В остеокластах особенно хорошо развиты
238
аппарат Гольджи и система ограниченных мембранами пузырьков и
вакуолей. Большая часть последних представляет собой лизосомы на
разных этапах гетерофагического цикла. Остеокласты обладают спо-
собностью создавать локально у своей поверхности кислую среду в
результате интенсивно идущих в этих клетках процессов гликолиза.
Как видно на схеме (рис. 75, А, Б), остеокласты образуют в области
контакта с костью изолированное по периферии пространство. Помимо
выделяемых в это пространство Н+-ионов сюда же поступает содер-
жимое первичных лизосом. Одновременно клетки поглощают фраг-
менты межклеточного вещества и переваривают их ферментами вто-
ричных лизосом. Продукты расщепления поступают в сосудистое рус-
ло. Кислая среда в области непосредственного контакта цитоплазмы
Рис. 75. Улыраструкгура остеокласта и некоторые процессы, обеспечивающие реаб-
сорбцию костной ткани.
Л — общий вид остеокласта; Б — детали организации периферического участка ци-
топлазмы:
7 —- сосуд, 2 — цитоплазма остеокласта, 3 — ядро, 4 — участок поступления во
внеклеточные щели содержимого первичных лизосом (6), 5 — участок поступления
внуитрь клетки продуктов чистого гидролиза межклеточного вещества, которые по-
надают в фагосомы, сливающиеся со вторичными лизосомами (7), 8 — перифери-
ческая цитоплазма остеокласта, замыкающая пространство с кислым pH в области
контакта остеокласта с костной тканью; стрелками обозначено направление переме-
щения первичных и второичных лизосом, продуктов гидролиза межклеточного
вещества и Н+-ииовов.
239
остеокластов и межклеточного вещества способствует растворению
минеральных солей и создает оптимальные условия для действия про-
теолитических и ряда других ферментов лизосом.
Костные ткани, как и хрящевые, у позвоночных животных пред-
ставлены большим числом разновидностей, которые могут быть све-
дены к трем основным типам: дентиноидные, грубоволокнистые и
пластинчатые. Характерной особенностью дентиноидной костной тка-
ни является отсутствие в толще ее межклеточного вещества костных
клеток. У высших позвоночных единственным примером такой кост-
ной ткани является дентин зуба, у низших (и особенно у ископаемых)
животных дентиноидная костная ткань имеет широкое распростране-
ние в наружных, так называемых накладных костях скелета. Для гру-
боволокнистой кости характерны относительно небольшое количество
и беспорядочное расположение коллагеновых волокон. Грубоволок-
нистая костная ткань широко представлена у низших позвоночных и
в эмбриональном, и в раннем постнатальном гистогенезе костей внут-
реннего скелета высших позвоночных.
Основным структурным компонентом пластинчатой костной тка-
ни является костная пластинка. Это участок костной ткани с парал-
лельно расположенными волокнами. В соседних пластинках волокна
располагаются обычно под углом 90°. Пластинчатая костная ткань
образует основные кости дефинитивного внутреннего скелета высших
позвоночных, а с некоторыми примитивными признаками организации
встречается и у низших позвоночных, и, что самое интересное, у их
вымерших ископаемых предков.
В наиболее сложной и совершенной пластинчатой костной тка-
ни костные пластинки закономерно ориентированы по отношению
друг к другу и к кровеносным сосудам, обеспечивающим трофику
этой ткани. Особенно наглядно такие взаимоотношения выражены в
пластинчатой ткани диафизов трубчатых костей у млекопитающих
(рис. 76). В этой костной ткани имеется три связанные между собой
разновидности костных каналов в межклеточном веществе и несколько
типов костных пластинок, определенным образом ориентированных
по отношению к продольным гаверсов каналам костной ткани. Все
межклеточное вещество кости пронизано анастомозирующими между
собой и связанными с наружной и внутренней поверхностью трубчатой
кости, а также с поверхностью гаверсовых каналов костными каналь-
цами. В них располагаются отростки костных клеток. В идущих па-
раллельно длинной оси трубчатой кости гаверсовых каналах находятся
рыхлая соединительная ткань, кровеносные сосуды, а по поверхности
стенки канала — малодифференцированные клеточные элементы кост-
240
Рис. 76. Пластинчатая костная ткань млекопитающих
1 — надкостница. 2, 3 — внутренние наружные генеральные
пластинки. 4 — остеоиы, 5 — гаверсов канал, 6 — вставоч-
ные пластинки, 7 — остеоцит.
ной ткани. Кровеносные сосуды в толще межклеточного вещества
кости связаны с сосудистыми сплетениями надкостницы системой ар-
терий и вен, расположенных в специальных фолькмановских каналах,
перпендикулярных длинной оси диафизов. Непосредственно под над-
костницей располагаются наружные генеральные костные пластинки
(/, 3). Они состоят из нескольких пластинок, охватывающих по внеш-
ней окружности весь диафиз трубчатой кости. На внутренней поверх-
ности трубчатой кости на границе с костномозговым каналом (2)
располагаются внутренние генеральные пластинки.
Наиболее распространенным типом костных пластинок, образую-
щих основную массу ткани, являются системы гаверсовых пластинок,
концентрически расположенных вокруг гаверсовых каналов. Каждая
система таких пластинок получила название остеона. Между соседни-
ми остеонами располагаются вставочные пластинки, которые в отличие
от остеонов не имеют гаверсова канала и концентрического распо-
ложения (б). Они представляют собой сохранившиеся в костной тка-
ни участки остеонов предшествующих генераций. Особенностью всей
системы пластинчатой кости являются непрерывно идущие в ней про-
цессы физиологической регенерации. Основную роль в них играет не
са*13 надкостница, а малодифференцированные полустволовые клетки
костной ткани, расположенные по ходу кровеносных сосудов в гавер-
совых каналах. При старении остеонов в гаверсовых каналах появля-
241
ются остеокласты, которые разрушают костные пластинки, образуя
обширную полость в межклеточном веществе кости. Затем из мало-
дифференцированных клеток формируются остеобласты, образующие
новую систему концентрически расположенных костных пластинок
новых остеонов. Поскольку процессы разрушения старых остеонов
могут проходить несколько эксцентрично, отдельные их участки ос-
таются в костной ткани, формируя системы вставочных пластинок.
Интенсивность такой своеобразной физиологической регенерации на-
столько велика, что у взрослого человека за 10 лет происходит полное
обновление костной ткани. Благодаря такой организации костная ткань
может обеспечить формирование механических структур, адекватных
меняющимся в ходе развития животных и человека физическим на-
грузкам.
Из приведенной краткой характеристики костной ткани позвоноч-
ных животных следует, что она представляет собой весьма совершен-
ную специализированную разновидность тканей внутренней среды. В
этой системе гармонично сочетаются такие противоположные свойства
и процессы, как механическая прочность и функциональная пластич-
ность, процессы новообразования и разрушения костной ткани.
Специализация приводит к утрате в костной ткани характерного
первичного признака тканей внутренней среды — первичной аполяр-
ности клеток и межклеточных структур. В клетках костной ткани резко
выражены конкурентные и даже антагонистические отношения между
процессами специфического синтеза и репродукцией, что обычно не
свойственно клеткам тканей внутренней среды.
Взаимоотношения разновидностей скелетных тканей
позвоночных животных
В основе организации таких различных на первый взгляд тканей,
как рыхлая и плотная соединительные, костная и хрящевая, лежит в
конечном счете единый процесс синтетической деятельности оседлых
клеток тканей внутренней среды позвоночных. Основными компонен-
тами этих тканей, несмотря на специфические особенности их разно-
видностей у позвоночных животных, являются коллагены и мукопо-
лисахариды, входящие в состав надмолекулярных комплексов. Обра-
зование макромолекул происходит с помощью сходных ферментов,
имеющихся в фибробластах, хрящевых и костных клетках. Очевидно,
что такие процессы, как внутриклеточный транспорт, выведение из
клеток высокомолекулярных органических соединений и сборка их в
надмолекулярные комплексы, требуют сходной внутренней организа-
ции рассматриваемых клеток.
242
Существование общего биохимического механизма в основе диф-
ференцировки опорных тканей заставляет предполагать сходство и
взаимосвязь их разновидностей в историческом и индивидуальном
развитии организмов. Весьма ярко проявляется взаимосвязь этих тка-
ней в процессах эмбрионального гистогенеза. Об этом свидетельствуют
даже чисто феноменологические характеристики наблюдаемых морфо-
генетических картин и процессов.
В раннем онтогенезе в период энергичного роста развивающегося
эмбриона у высших позвоночных большинство крупных костей внут-
реннего скелета закладывается в виде хрящевых «моделей». Темпы их
роста в этот период соответствуют темпам роста развивающегося ор-
ганизма. Затем, когда рост замедляется й возникает необходимость
формирования уже более прочного в механическом отношении скеле-
та. происходит замещение хряща костью. Процесс этот в трубчатых
костях начинается с того, что в области диафиза сформированной уже
хрящевой модели кости клетки надхрящницы перестают дифференци-
роваться в хондробласты (рис. 77, 11, 12). Они продуцируют остеоб-
ласты, которые формируют на поверхности хряща манжетку из пери-
хондральной костной ткани (10). Хрящевая ткань в области располо-
'кения такой костной манжетки постепенно разрушается. Процессы ее
разрушения усиливаются в результате деятельности специальных кле-
ток — хондрокластов (б). Затем на тонких прослойках сохранившегося
еще межклеточного вещества хряща оседают остеобласты, возникаю-
щие из периваскулярной мезенхимы (7). Они образуют участки эн-
хондральной кости (19). Когда процессы энхондрального и перихонд-
рального замещения хрящевой ткани костной в области диафиза захо-
дят уже достаточно далеко, начинается замещение костью хрящевой
ткани эпифизов. Наиболее продолжительное время (у человека до 20
лет) сохраняется хрящевая ткань в составе трубчатых костей на гра-
нице эпифиза и диафиза, где образуются характерные полоски, или
столбики, деления и роста хрящевых клеток (5). Их деятельность
обеспечивает рост кости в длину. Участки хрящевой ткани в области
зои роста представляют собой весьма своеобразную систему, где не-
прерывно делятся клетки. В направлении к диафизу клетки увеличи-
ваются в размерах и образуют прослойки межклеточного вещества.
Одновременно со стороны диафиза идет непрерывное разрушение хря-
щевой ткани и замещение ее костной благодаря деятельности остео-
генной соединительной ткани, находящейся в костномозговом канале
и надкостнице (3, 4, 5).
Терминальная дифференцировка хрящевых клеток в зоне «монет-
НЫх>> столбиков, или полосок роста, трубчатой кости существенно
243
Рис. 77. Замещение хряща костной тканью в ходе формирования трубчатой кости
млекопитающего (по Е. Н. Горышииой н О. Ю Чаге, 1990).
1 — надхрящница, 2—5 — зоны (2 — покояющегося гиалинового хряща, 3 — м0’
иетных столбиков, 4 — гипертрофированного хряща, 5 — разрушение хряша),
6 — хондрокласты, 7 — остеобласты, 5 — остеоциты, 9 — энхондральное и
70 — перихондральное окостенение, 11 — иадкосотница, 12 — остеогенные клет-
ки, 13 — кровеносные сосуды, 14 — хондроциты, 15 — хоидробласты, 16—~
хондрогеиные клетки.
244
отличается от обычной дифференцировки хондроцитов в гиалиновых
хрящах. Здесь хондроцит в конце своего жизненного цикла выделя-
ет особый нефибриллярный коллаген (XI тип), который способствует
обызвествлению хряща. Кроме того, клетки начинают образовывать
окруженные мембраной пузырьки — процесс, характерный для осте-
областов в ходе минерализации межклеточного вещества кости. Все
это приводит к обызвествлению межклеточного вещества хряща, ги-
бели хондроцитов и активному разрушению обызвествленного хряща
хондрокластами. Таким образом, в данном случае завершение клеточ-
ного цикла хондроцитов, начинающееся в зоне роста, «предусматри-
вает» целый комплекс процессов, приводящих к формированию здесь
костной ткани.
Длительное время размножение клеток и рост хряща идут сбалан-
сированно с процессами замещения хряща костной тканью, поэтому
толщина хрящевых пластинок остается без изменения. Расстояние же
между двумя хрящевыми пластинками, расположенными на границе
эпифизов трубчатой кости, непрерывно увеличивается, т. е. происхо-
дит рост диафиза в длину. При завершении процессов роста замещение
костной тканью хрящевых пластинок начинает преобладать над ростом
и юлением хрящевых клеток. К этому времени происходит и полное
замещение эмбриональной, энхондральной и перихондральной кост-
ных тканей дефинитивной пластинчатой костной тканью.
Процессы замещения хрящевой ткани костной в трубчатых костях
внутреннего скелета в тех или иных вариантах характерны для боль-
шинства классов позвоночных животных.
Помимо описанных выше изменений в скелетогенных зачатках
организма может наблюдаться и метаплазия остеогенной камбиальной
системы в хондробластическую. Наиболее простым примером может
служить развитие хрящевых мозолей при переломах кости. Хрящевая
ткань при этом формируется из камбиальных клеток надкостницы, в
работе их генетического аппарата происходят соответствующие сдви-
ги, необходимые для синтеза особого «хрящевого» коллагена и спе-
цифических хондроитинсульфатов. Непосредственным фактором, де-
лающим такое изменение клеточного метаболизма возможным, явля-
ется уровень кислородного обмена. Развитие хрящевой ткани в области
перелома кости происходит лишь при сильном нарушении сосудистой
системы. В случае сохранения капиллярной сети регенерация кости
идет без стадии хрящевой мозоли.
Примеры метаплазии опорных тканей удается получить и в экс-
периментальных условиях. В опытах по культивированию клеток над-
костницы куриного эмбриона по методу висячей капли в зависимости
245
Рис. 78. Строение позвонка акулы (показан участок, прилежащий к спинномозгово-
му каналу) (по Е Н. Горышиной и О. Ю. Чаге, 1990).
I — спинномозговой канал, 2, 3 — растущий и обызвествленный хрящи, 4 над-
костница, 5 — грубоволокнистая кость, 6 — остеоциты, 7 — отмирающие хондроци-
ты, 8 — клетки, разрушающие кость, 9 — пластинчатая кость, 10 — гибнущий
остеоцит.
ных клеток. По морфологическим признакам рассматриваемые клетки
существенно не различаются из-за отсутствия у них каких-либо при-
знаков специфической дифференцировки.
Различия между клетками появляются лишь в экспериментальных
или патологических условиях. Детерминированные остеогенные клет-
ки-предшественники не требуют особых условий для проявления сво-
их потенций к остеогенезу. Индуцибельные попустволовые клетки,
наоборот, могут превращаться в остеобласты лишь после воздействия
на них специфических индукторов, выделяемых основным веществом
кости, эпителием мочевого пузыря и неизвестными для нас эндоген-
ными естественными факторами. Указанные различия между двумя
типами полустволовых остеогенных клеток-предшественников опреде-
ляются, по-видимому, различными рецепторами на их наружной по-
верхности. Возможно, что эти две категории клеток отражают лишь
разные этапы их дифференцировки.
Помимо разновидностей полустволовых клеток в тканях внутрен-
ней среды взрослых млекопитающих имеются упоминавшиеся выше
стволовые стромальные клетки, способные, по-видимому, в зависимос-
ти от воздействия регулирующих местных или гуморальных факторов
в процессе дифференцировки давать любой тип оседлых клеток.
§2. ОПОРНЫЕ ТКАНИ БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Аналогичные костной ткани позвоночных животных скелетные
минерализованные системы беспозвоночных независимо друг от друга
развиваются в тканях внутренней среды или, скорее, в их аналогах у
представителей трех типов животных: губок, кишечнополостных и
иглокожих.
У кишечнополостных (класс Anthozoa) и губок (классы Calcarea
и Comacuspongida) минерализованные структуры представлены спи-
кульным скелетом, у иглокожих они образуют обычно субэпителиаль-
ный скелет из системы пластинок или аналогичных им структур.
У губок спикульный скелет разнообразен по химическому составу
и по характеру распределения органического и неорганического ком-
понентов. У известковых губок спикулы состоят в основном из каль-
цита (СаСО3), у кремневых губок — кремнезема (SiO2) или арагонита
(особой формой СаСО3).
Спикулы образуются специальными клетками — спикулобласта-
ми, которые выделяют как минеральные, так и органические компо-
ненты. В состав органического компонента входят волокнистые струк-
туры и аморфный матрикс.
248
Более подробно процесс спикулообразования изучен у кремневых
губок (рис. 79). Он начинается с того, что специальные клетки —
спикулобласты — в спикулогенной вакуоли образуют органический
стержень спикулы из неколлагенового белка, имеющего кристаллопо-
добную укладку. Далее вокруг стержня слоями откладывается матрикс
(вероятно, углеводный), затем вся структура минерализуется и выво-
дится из клетки (рис. 79, А, Б).
На заключительном этапе спонгиоциты губок образуют вокруг
спикул коллагеновый спонгиновый чехол. Такие же чехлики обнару-
жены вокруг спикул и у других губок (рис. 79, В).
Суммируя приведенные данные, можно сказать, что у губок, как
гг в костной ткани позвоночных или в обызвествленных разновиднос-
Рис. 79. Образование скелета у кремневых губок.
спикулобласт, синтезирующий спикулы; Б — спонгоциты, окружающие спику-
лы спбнгиновымн вакуолями; В — участок головного скелета (по Е. Н. Горышиной
и О. Ю. Чаге, 1990):
спикула, 2 — осевая нить спикулы, 3 — спикулогенная вакуоль, 4 — спонгин,
5 — секреторные гранулы снонгоцитов
249
тях кутикулярных эпителиев, отчетливо проявляется направляющая,
ограничивающая и организующая роль органического матрикса в про-
цессах минерализации. При этом конкретные ее механизмы у разных
губок, по-видимому, различны. Иными словами, в пределах типа губок
реализуются, вероятно, многие из возможных сочетаний органического
и минерального компонентов, наблюдаемых в минерализованных сис-
темах и у других многоклеточных животных. Аналогичная ситуация
наблюдается, по-видимому, в спикулах кишечнополостных, в част-
ности у наиболее изученных в этом отношении минерализованных
структур мезоглеальной природы у коралловых полипов. Как и у
губок, у них в спикулобластах или в симпластах, образуемых спонги-
опитами, формируется органический стержень, на который отклады-
вается СаСОз. Далее наблюдается периодическое чередование мине-
рального и органического компонентов, т. е. имеет место регулируемое
клеткой их взаимодействие.
Наиболее хорошо изучено соотношение процессов минерализации
и формирования органической основы в субэпителиальном скелете
иглокожих.
Минерализованные кальцитом пластинки занимают правильное
сетчатое расположение в плотном межклеточном веществе подкожной
соединительной ткани, где имеются и фибробластоподобные клетки.
В каждой пластинке содержится органический матрикс, основу кото-
рого образуют коллагеновые фибриллы. Процесс минерализации в
пластинках аналогичен минерализации костной ткани позвоночных.
Центрами кристаллизации являются свободные участки в местах кон-
такта «головою) и «хвостов» соседних молекул тропоколлагена. Таким
образом, кристаллы оказываются ориентированными строго по ходу
коллагеновых фибрилл. Такой принцип минерализации не нарушает
целостности последних, а лишь укрепляет их прочность.
Тканевой уровень организации описанных скелетных структур
существенно отличается от костной ткани позвоночных. В спикуль-
ных скелетах иглокожих и кишечнополостных практически отсутст-
вует тканевая организация минерализованных структур, хотя образо-
вание каждой спикулы — обычно результат интегрированной и слож-
ной деятельности группы клеток или симпластических структур, пред-
ставляющих часто клоны — результат деления исходного спикуло-
бласта.
У иглокожих минерализованные пластинки (иногда весьма при-
чудливой формы) и сложные игольчатые спикулы развиваются в ти-
пичной соединительной ткани. Однако характер формирования этих
структур и их взаимоотношения с клетками скорее сходен с отноше-
250
ниями, характерными для коралловых полипов и губок, чем с типичной
тканевой организацией костной ткани позвоночных (рис. 80, А~).
Интересная, хотя пока еще недостаточно хорошо изученная, функ-
циональная аналогия наблюдается между описанными выше остеоклас-
тами позвоночных и специальными клеточными симпластами, разру-
шающими спикульный скелет у морских ежей. Они образуются из
фагоцитов путем их слияния после завершения или в процессе их
фагоцитарной «очистительной» деятельности в области поврежденных
и требующих замены спикул. Внешне на ультраструктурном уровне
они сходны с остеокластами и явно принимают участие в резорбции
поврежденных спикул (рис. 80, Б, В).
В других группах беспозвоночных, в частности у высших первич-
норотых, минерализованные скелеты типичны лишь для некоторых
разновидностей кутикулярных эпителиев.
Потенции тканей внутренней среды к формированию хрящевой
ткани — скелетных механических структур на чисто органической
основе — проявляются у многих представителей первичноротых. Хря-
щевые ткани обнаружены у отдельных представителей почти всех
типов беспозвоночных животных, за исключением иглокожих и губок.
Хрящевая ткань довольно широко распространена в основании
щупалец сидячих полихет и обычно представлена тканью с тонкими
прослойками межклеточного вещества и крупными полигональными
клетками. Такая ткань напоминает клеточные или пузырчатые хрящи
низших позвоночных. Межклеточное вещество состоит из хондрои-
тинсульфатов и коллагеновых волокон.
Широко распространена субрадулярная хрящевая ткань у брюхо-
ногих моллюсков. У разных представителей моллюсков внутренний
скелет радулы может быть развит в различной степени, что определя-
ется приспособлением животных к разной пище. Так, у голожаберных
моллюсков хрящевая ткань практически отсутствует, опорные струк-
туры образованы плотной соединительной тканью с хорошо развитыми
коллагеновыми волокнами. У других брюхоногих моллюсков имеет
место диффузное распределение небольших групп хрящевых клеток и
мышечных волокон, образующих единую сократимую и опорную сис-
тему. Наконец, при максимальном развитии хрящевая ткань в субра-
Дулярном аппарате представлена большими участками преимуществен-
но клеточного хряща. По соотношению клеток и межклеточных струк-
тур он похож на пузырчатый хрящ низших позвоночных. Межкле-
точное вещество хряща у брюхоногих моллюсков дает положитель-
ную реакцию на кислые полисахариды. Крупные полигональные клет-
ки не обнаруживают закономерного распределения по степени их
251
Рис. 80. Ультраструктурная организация калькобласта (клеток, образующих спикулу
(Л), и клеток, разрушающих спикулу морского ежа (Я), и остеокласта в кости млеко-
питающих (В) (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
А — калькобласт: I — ядро, 2 — митохондрия, 3 — шероховатая ЭПС, 4 — элек-
тронноплотные гранулы, 5 — аппарат Гольджи, 6 — спикулогенная камера,
7 — спикула;
Б, В — участок фагоцитарного синцития в основании иглы (спикулы) морского ежа
и остеокласт кости млекопитающих: / — ядро, 2 — светлая зона, 3 — щеточная ка-
емка, 4 — минерализованный костный матрикс, 5 — диминерализованный матрикс,
6 — отросток фагоцитарного синцития, 7 — фагосома, 8 — фагоцитарная клетка,
9 — отросток калькобласта, 10 — кальций, 11 — светлые пузырьки.
252
зрелости. Интенсивность метаболизма сульфатированных полисахари-
дов во взрослом хряще невелика. При ультраструктурном исследова-
нии межклеточного вещества хряща у брюхоногого моллюска удалось
выявить наличие поперечнополосатых коллагеновых фибрилл с пери-
одичностью исчерченности 600-650 А. В отличие от хрящей позво-
ночных вместо характерных для них хондроитинсульфатов у этого
моллюска присутствует другой полисахарид — глюкансульфат.
У мечехвоста Limulus имеются две разновидности развивающейся
in мезодермы хрящевой ткани — хрящевая ткань в основании жабер-
ных выростов и хрящевая пластинка на брюшной стороне в передней
части головогруди. Детально исследован жаберный хрящ этих живот-
ных. У растущих животных прослойки межклеточного вещества край-
не незначительны и основная масса хряща представлена пузыревид-
ными клетками. У взрослых животных происходит увеличение и раз-
меров клеток, и прослоек межклеточного вещества. Как и у позвоноч-
ных животных, у мечехвостов имеют место два типа роста — с по-
верхности, за счет элементов окружающей соединительной ткани, и
изнутри, путем деления и роста клеток и выделения ими межклеточ-
ного вещества. При аппозиционном росте фибробласты окружающей
соединительной ткани обычным путем формируют тонкие волокна. В
участках этой ткани, прилегающих к межклеточному веществу хряще-
вой, волокна объединяются в более толстые пучки, которые постепен-
но переходят в межклеточное вещество хряща. В нем помимо волоки
истых пластинчатых электронно-плотных структур имеется аморфный
матрикс. Все эти сложные преобразования внеклеточных структур
происходят за счет выделяемых фибробластами высокомолекулярных
белков и полисахаридов. При этом в прилежащих к поверхности хряща
участках фибробласты синтезируют не только обычные полисахариды,
характерные для плотной соединительной ткани, но и специфические
хрящевые полисахариды. Таким образом, фибробласты постепенно
приобретают черты хрящевых клеток, что, в частности, выражается в
появлении в их цитоплазме больших количеств гликогена.
Типичные клетки хряща взрослых мечехвостов представляют со-
бой крупные пузыревидные клетки с вакуолизированной цитоплазмой
и эксцентрично расположенным ядром (рис. 81). В их цитоплазме
помимо крупных вакуолей имеются различные по величине окружен-
ные мембраной гранулы с каплями липидов, зернами гликогена и
Дегенерирующими рибосомами. Межклеточное вещество формируется
хрящевыми клетками двумя путями. В периферических участках ци-
топлазмы более молодых клеток наблюдается появление палочковид-
ных структур, сходных с ламеллярными структурами межклеточного
253
Рис. 81. Ультраструктурная организация хрящевой ткани мечехвоста.
/ — хрящевые клетки, 2 — ядро, 3 — уплотненные участки цитоплазмы, 4 — меж-
клеточное вещество, 5 — участок межклеточного вещества на месте хрящевой клет-
ки, 6 — коллагеновые волокна, 7 — фиброцит, 8 — место перехода плотной соеди-
нительной ткани в хрящевую ткань.
вещества. Затем, по-видимому, путем макроапокриновой секреции эти
структуры выводятся из клеток. Наблюдаются и факты, свидетель-
ствующие о другом механизме внутриклеточного образования боль-
шого количества межклеточного вещества, который приводит к пол-
ному перерождению хрящевых клеток. На месте таких клеток возни-
кают характерные участки межклеточного вещества. Их периферичес-
кая часть образована плотно расположенной системой концентричес-
ких пластинок. По направлению к бывшему центру клетки плотность
расположения пластинок уменьшается. Между пластинками находится
электронно-светлый матрикс, имеющий вид отдельных участков поли-
гональной формы. При окраске на мукополисахариды обнаруживается
254
резко положительная реакция в межклеточном веществе и цитоплазме
клеток центральных участков хрящевой ткани. В области надхрящни-
цы и периферических участках хряща окраска слабее или полностью
отсутствует.
Биохимический и рентгеноструктурный анализ хрящевой ткани
мечехвоста Limulus показал наличие в пей типичных хондроитинсуль-
фатов. Незначительным оказалось количество коллагена (10-12%).
Наибольшего развития и уровня гистологической дифференциров-
ки достигают хрящевые ткани у головоногих моллюсков. Они пред-
ставлены и хрящевой капсулой, обеспечивающей защиту головного
ганглия, и окологлазными хрящами, и другими хрящевыми структу-
рами в теле животных. Окологлазные хрящи головоногих моллюсков
по своем)' строению сходны с пузырчатым хрящом плавника миноги
(см. рис. 72). Они содержат мало межклеточного вещества и курные
пузырчатые клетки (рис. 82, А). Характерной особенностью хряща
капсулы, обеспечивающего защиту головного мозга, является большое
количество межклеточного вещества, а также строгая пространствен-
ная локализация клеток по степени их зрелости. На периферии хряща
располагаются молодые дифференцирующиеся клетки (1-3), а в цент-
ре — группы дифференцированных клеток (4). Благодаря этому хря-
щевая ткань головоногих моллюсков оказывается весьма сходной с
гиалиновым хрящом позвоночных и в структурном отношении, и по
характеру окраски межклеточного вещества при о бычных и специ-
альных гистохимических методиках (см. рис. 72).
У головоногих моллюсков обнаружены хондроитинсульфаты и
кератосульфаты, аналогичные, но не тождественные этим соединениям
в хряще позвоночных животных. Важной особенностью хрящевой тка-
ни головоногих моллюсков является отростчатая форма образующих
ее клеточных элементов. Благодаря этому все межклеточное вещество
хряща пронизано системой мелких каналов. Детальный анализ хряще-
вой ткани головоногих моллюсков показал, что ультраструктурная
организация межклеточного вещества их хряща сходна с аналогичны-
ми картинами, наблюдаемыми в хряще мечехвоста. В хряще голово-
ногих моллюсков, как и в матриксе хряща эмбрионов птиц, удалось
обнаружить специальные структуры, обеспечивающие связь коллаге-
новых волокон и образованные у птиц из особого коллагена (LX тип).
Существенные особенности характерны и для ультраструктурной
организации клеток хряща головоногих моллюсков. Они значитель-
но богаче, чем у мечехвоста, мембранными структурами, в частнос-
ти мембранами шероховатой ЭПС. Имеется развитый аппарат Гольд-
жи двух типов: обширные комплексы его элементов в центре и ком-
255
Рис. 82. Хрящевая ткань головоногого моллюска (схематические рисунки пузырчато-
го хряща в окологлазиой капсуле каракатицы (Л) и гиалиноподобного хряща из го-
ловной капсулы каракатицы (Я)) (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
1 — надхрящница, 2 — хондробласты, 3 — хондроциты, 4 — лакуна хондроцита,
5 — матрикс хряща, 6 — фиброцит, 7 — хонлрогенные клетки, 8 — изогенная
группа
плексы меньших размеров по периферии клеток. Довольно много
митохондрий, часть из них имеет вакуолизированный вид. В оболочке
ядра наблюдаются многочисленные поровые комплексы, а в ядрыш-
ке — скопления рибосомоподобных частиц. Выведение синтезируе-
мых клеткой веществ осуществляется, по-видимому, путем экзоцитоза,
о чем свидетельствуют многочисленные, ограниченные мембраной пу-
зырьки на периферии клеток. Выделение межклеточного вещества
происходит не только в теле клеток, но и в их отростках. Интенсивный
синтез межклеточного вещества хондроцитами необходим, вероятно,
не только для внутреннего роста хряща, но и для обновления его
межклеточного вещества. В канальцах межклеточного вещества иногда
могут располагаться не обычные отростки клеток, а жгутики или
реснички.
256
Как указывалось выше, помимо типичных хрящевых тканей у
беспозвоночных животных распространены и плотные соединительные
ткани.
Основным функционирующим структурным элементом в плотной
соединительной ткани беспозвоночных животных являются пучки кол-
лагеновых волокон, связанных с большим или меньшим количеством
мукопротеинов. В стенках сосудов и в некоторых участках переднего
отдела тела у многих животных большое развитие получают и элас-
ппюподобные волокнистые структуры.
Особый интерес представляет наличие типичной плотной колла-
геновой соединительной ткани у высших представителей первичноро-
тых насекомых. Одним из наиболее ярких и хорошо изученных при-
меров такой ткани служат опорные структуры в копулятивных органах
самцов саранчи Locusta migratoria. У взрослых животных эпителиаль-
ная выстилка канала этого органа окружена типичной плотной соеди-
нительной тканью с хорошо развитыми коллагеновыми волокнами и
межклеточным основным веществом. Обилие последнего, а также не-
которые цитохимические особенности дали основание отнести эту
ткань к разновидностям хрящевой ткани. Однако более тщательный
ультраструктурный анализ, а также анализ ее гистогенеза показали,
что это хорошо развитая плотная соединительная ткань, межклеточные
структуры которой формируются в результате активной синтетической
деятельности типичных фибробластов. Последние на ранних этапах
формирования плотной соединительной ткани характеризуются разви-
тым белоксинтезируюшим аппаратом и другими мембранными орга-
ноидами. Они активно включают специфические для коллагена ами-
нокислоты ([3Н]пролин) и достаточно энергично выделяют меченые
белки, идущие на формирование межклеточных структур соединитель-
ной ткани. Таким образом, данные отношения вполне сопоставимы с
аналогичными отношениями в соединительной ткани позвоночных жи-
вотных. Тем не менее формирующиеся межклеточные структуры в
плотной соединительной ткани копулятивного органа саранчи харак-
теризуются целым рядом как качественных, так и количественных
особенностей. Так, для этой соединительной ткани характерно боль-
шее, чем у позвоночных, развитие основного вещества, благодаря чему
она в известном смысле и занимает промежуточное положение между
хрящевой и плотной соединительной тканью.
ЛИТЕРАТУРА
г°Рышина Е. Н., Чага О. Ю. Сравнительная гистология тканей внутрен-
среды с основами иммунологии. Л., 1990. С. 34-75.
257
Каплан А. И. Хрящ // В мире науки. 1984. № 2.
Хэм А.. Кормак Д. Гистология. 1983. Т. 3. С. 5-135.
Biological mineralization and demineralization / Ed. Nancollas G. H. Berlin,
1982 J • к
Davies Y. The osteoclast. Functional antigen, implicated in the regulation of
the bone resorbtion, is biochemically related in vitro: nestis receptor // J. Cell Biol.
1989. Vol. 106, № 2.
Мдгке! К., Roser U. Et al. Ultrastructural investigation of matrix-mediated
biomineralization in echinoids // Zoomorphology. 1986. Vol. 106, № 2.
Person P„ Philpott D. E. The nature and significance of invertebrate carti-
lages // Bioi. Rev. 1969. Vol. 44.
Wilbur К. M. Many minerals, several phyla and a few consideration // Amer.
Zool 1984. Vol. 24, № 4.
ГЛАВА 3. Клеточные и гуморальные механизмы
реализации функций газообмена
и свертывания (коагуляции) крови,
гемолимфы и полостной жидкости
§1. ДЫХАТЕЛЬНЫЕ ПИГМЕНТЫ И КЛЕТКИ, РЕАЛИЗУЮЩИЕ
ФУНКЦИЮ ГАЗООБМЕНА
Позвоночные животные. Эритроциты млекопитающих представ-
ляют собой узкоспециализированные клеточные элементы, утрачиваю-
щие в зрелом состоянии ядро и основную массу органоидов метабо-
лического аппарата. Несмотря на это, они характеризуются довольно
длительным жизненным циклом и существуют в организме человека
свыше трех месяцев.
Эритроциты млекопитающих имеют форму двояковогнутых дис-
ков, величина которых у разных видов колеблется незначительно.
Диаметр эритроцитов у человека 7,4-7,6 мкм, а толщина 1,9-2,5 мкм,
т. е. они в несколько раз меньше, чем ядерные эритроциты других
позвоночных (рис. 83, А). Так 1Я форма и небольшие размеры обеспе-
чивают оптимальный газообмен в тканях и легких (связывание или
выход молекул кислорода и углекислого газа). Площадь одного эрит-
роцита человека 123 мкм2, а их общая площадь свыше 3500 м^. Спе-
цифически устроен поверхностный аппарат эритроцита. В его мембра-
не имеются особые интегральные гликопротеиды с большими угле-
водными компонентами (рис. 83, Б, 1, 2). Последние располагаются в
надмембранном комплексе и обусловливают отрицательный заряд по-
верхности эритроцита. В эритроцитах человека гликопротеиды над-
мембранного комплекса определяют групповую принадлежность эрит-
роцита.
258
Каплан А. И. Хрящ // В мире науки. 1984. № 2.
Хэм А.. Кормак Д. Гистология. 1983. Т. 3. С. 5-135.
Biological mineralization and demineralization / Ed. Nancollas G. H. Berlin,
1982 J • к
Davies Y. The osteoclast. Functional antigen, implicated in the regulation of
the bone resorbtion, is biochemically related in vitro: nestis receptor // J. Cell Biol.
1989. Vol. 106, № 2.
Мдгке! К., Roser U. Et al. Ultrastructural investigation of matrix-mediated
biomineralization in echinoids // Zoomorphology. 1986. Vol. 106, № 2.
Person P„ Philpott D. E. The nature and significance of invertebrate carti-
lages // Bioi. Rev. 1969. Vol. 44.
Wilbur К. M. Many minerals, several phyla and a few consideration // Amer.
Zool 1984. Vol. 24, № 4.
ГЛАВА 3. Клеточные и гуморальные механизмы
реализации функций газообмена
и свертывания (коагуляции) крови,
гемолимфы и полостной жидкости
§1. ДЫХАТЕЛЬНЫЕ ПИГМЕНТЫ И КЛЕТКИ, РЕАЛИЗУЮЩИЕ
ФУНКЦИЮ ГАЗООБМЕНА
Позвоночные животные. Эритроциты млекопитающих представ-
ляют собой узкоспециализированные клеточные элементы, утрачиваю-
щие в зрелом состоянии ядро и основную массу органоидов метабо-
лического аппарата. Несмотря на это, они характеризуются довольно
длительным жизненным циклом и существуют в организме человека
свыше трех месяцев.
Эритроциты млекопитающих имеют форму двояковогнутых дис-
ков, величина которых у разных видов колеблется незначительно.
Диаметр эритроцитов у человека 7,4-7,6 мкм, а толщина 1,9-2,5 мкм,
т. е. они в несколько раз меньше, чем ядерные эритроциты других
позвоночных (рис. 83, А). Так 1Я форма и небольшие размеры обеспе-
чивают оптимальный газообмен в тканях и легких (связывание или
выход молекул кислорода и углекислого газа). Площадь одного эрит-
роцита человека 123 мкм2, а их общая площадь свыше 3500 м^. Спе-
цифически устроен поверхностный аппарат эритроцита. В его мембра-
не имеются особые интегральные гликопротеиды с большими угле-
водными компонентами (рис. 83, Б, 1, 2). Последние располагаются в
надмембранном комплексе и обусловливают отрицательный заряд по-
верхности эритроцита. В эритроцитах человека гликопротеиды над-
мембранного комплекса определяют групповую принадлежность эрит-
роцита.
258
Рис. 83. Эритроциты млекопи-
тающих.
А — общий вид безъядерного
эритроцита; Б, В — строение
поверхностного аппарата на
вертикальном и тангенциаль-
ном срезах; Г, Д — стадии
развития эритроцита до н
посте удаления ядерного аппа-
рата; Е — эритроцит при сер-
повидноклеточной анемии
(мутации в гене, кодирующем
глобиновую цепь);
1. 2 — специфические интег-
ральные белки мембраны
<1 — Bdj, 2 — гликофорин),
3 — тетрамеры спектринов, 4,
3 — белки, крепящие сеть
субмембранных белков к мем-
бране, 6 — актин, 7 — ком-
плекс регуляторных белков,
регулирующих работу спект-
риновой субмембранной сис-
темы, 8 — ядро, 9 — полирн-
босомы.
г
t
259
В субмембранной системе поверхностного аппарата эритроцита
нет миозиновых структур, отсутствуют и микротрубочки. Основу фиб-
риллярной сети составляют связанные между собой тетрамерные ком-
плексы молекул высокомолекулярного белка спектрина (рис. 83, Б, 3,
В). Спектрин связан, с одной стороны, с интегральными белками мем-
браны, а с другой — с целой системой субмембранных белков « 5).
Система весьма пластична, подвержена сложной внутриклеточной ре-
гуляции. Она обеспечивает возможность изменений формы эритроци-
тов (7).
Поверхностный аппарат эритроцитов очень чувствителен к раз-
личного рода воздействиям. С поверхности эритроцитов относительно
легко снимается отрицательный заряд, в результате чего они слипа-
ются, образуя характерные скопления в виде монетных столбиков.
Поверхностный аппарат легко повреждается, что приводит к так
называемому гемолизу — выходу гемоглобина в окружающую среду.
Однако при этом не разрушается структурная целостность плазмати-
ческой мембраны. При изменении pH среды и других воздействиях
эритроциты либо легко сморщиваются, либо набухают. Они обладают
большой эластичностью и упругостью и могут временно (например,
продвигаясь по капиллярам) менять свою форму на сильно вытянутую.
Из органических соединений, составляющих массу эритроцита,
90% приходится на долю гемоглобина (33% от общей массы эритро-
цита). Молекула гемоглобина состоит из четырех мономеров. Каждый
мономер включает в себя простатическую группу в виде гема, в центре
которой находится атом железа. Гем в молекуле окружен цепью белка
глобина с закономерным трехмерным положением в пространстве. Все
четыре мономера связаны между собой и компактно упакованы в
молекуле. У взрослых млекопитающих и человека в одной молекуле
гемоглобина два мономера образованы а-глобиновыми цепями и
два — P-цепями. В эритроцитах эмбрионов вместо P-цепей имеются
специфические для их гемоглобинов цепи глобина.
Основное назначение гемоглобина — перенос кислорода от лег-
ких к работающим органам. Это осуществляется благодаря способнос-
ти атомов железа гемов в той внутримолекулярной ситуации, которая
создается белковыми цепями глобина, образовывать непрочные свя-
зи с молекулами кислорода. При высокой концентрации кислорода
в легких происходит присоединение четырех молекул кислорода к
четырем атомам железа. При низкой концентрации кислорода в тка-
нях работающих органов связи между кислородом и железом легко
нарушаются и кислород покидает молекулу гемоглобина. Показано,
что такая работа молекулы гемоглобина эффективнее осуществляется
260
целой тетрамерной системой, чем ее отдельными мономерами. Про-
слеживается тесная связь между структурой молекулы гемоглобина и
свойствами клетки. При замене в результате мутаций лишь одного
аминокислотного остатка в цепи глобина резко изменяется форма
эритроцита, и понижается его способность к связыванию и переносу
кислорода. Это и наблюдается при серповидной анемии (рис. 83, £).
Все изменения происходят в результате полимеризации молекул ге-
моглобина (в клетке) в длинные и жесткие тяжи. Помимо кислорода
эритроциты способны переносить и СОг. Для этого в их цитоплазме
имеется фермент угольная ангидраза, а в мембране — специальные
каналы, образуемые особым интегральным белком Вёз — гликопро-
теином.
Эритроциты других позвоночных отличаются у представителей
разных классов по размерам и форме (рис. 84, Л). Как правило, более
мелкие клетки свойственны животным с высоким уровнем тканевого
метаболизма Эритроциты всех позвоночных, за исключением млеко-
питающих, содержат ядра обычно небольших размеров, которые, од-
нако, имеют сильно конденсированный, почти неактивный хроматин.
У всех позвоночных начиная с рыб молекулы гемоглобина в
эритроцитах имеют тетрамерное строение. Для эритроцитов круглоро-
тых характерно димерное (минога) и даже мономерное (миксины)
строение молекул гемоглобина. Глобиновые цепи у низших позвоноч-
ных животных короче, чем у высших. Для ядерных эритроцитов ха-
рактерно также наличие хорошо выраженного цитоскелета, образован-
ного микротрубочками, формирующими опорное кольцо в субмем-
бранной области клетки.
Процесс удаления ядра при дифференцировке дефинитивных эри-
троцитов (см. рис. 83, Г, Д) может проявляться не только у млекопи-
тающих, но и у представителей других классов позвоночных. Так, у
рыб и амфибий эритроциты могут «отпочковывать» ядра и функцио-
нировать длительное время как безъядерные клетки. Они получили
название эритропластид. Существуют виды амфибий, у которых эри-
тропластиды составляют 85% всех эритроцитов (рис. 84, Б, В).
Значение эритроцитов для существования позвоночных возрастает
в процессе эволюции. Они абсолютно необходимы для высших позво-
ночных и человека. У хвостатых и бесхвостых амфибий показана
возможность длительного существования животных, лишенных эрит-
роцитов при экспериментально вызванной анемии. Известно также
несколько видов костистых рыб, обитающих в богатой кислородом
иоле, у которых в плазме крови нет ни эритроцитов, ни свободно
Циркулирующих молекул гемоглобина.
261
/)
2
&
6
Рис. 84. Эритроциты позвоночных и ультраструктура эритроцита и эритропластиды у саламандры (no Е. Н. Горышиной
и О. Ю. Чаге, 1990).
А — эритроциты позвоночных: 1 — протей, 2 — скат, 3 — минога, 4 — воробей, 5 — слон, 6 — мускусная крыса;
Б — эритроцит в момент образования эригропластиды;
В — эригропластиды: I — ядро, 2 — полисомы, 3 — кольцо микротрубочек.
Беспозвоночные животные. Транспортная дыхательная функция
у беспозвоночных животных реализуется более многообразными пу-
тями, чем у позвоночных. Помимо характерного для всех позвоночных
гемоглобина у беспозвоночных животных распространены еще не-
сколько дыхательных пигментов, в частности гемэритрин и гемоциа-
нин. В гемэритрине акцептором кислорода, как и в гемоглобине, яв-
ляется атом железа, а в гемоцианине — атом меди.
Принцип работы гемэритрина и гемоцианина несколько отлича-
ется от принципа работы гемоглобина и близкого к нему, имеющего
весьма ограниченное распространение дыхательного пигмента хлоро-
круорина. В основе работы последних двух пигментов лежит просте-
гическая группа, или гем, с двухвалентным железом, не меняющим
валентности при присоединении и отдаче кислорода. В молекулах
емэртприна и гемоцианина при присоединении кислорода происходит
переход Fe2+ в Fe3+ (гемэритрин), либо Си+ в Си2+ (гемоцианин).
Белковые цепи этих дыхательных пигментов не гомологичны белко-
вым цепям гемоглобина и хлорокруорина и имеют, по-видимому, не-
зависимое происхождение.
Гемоцианины характерны для моллюсков и ракообразных, гемэ-
ритрины — для сипункулид, приапулид и других близких к полихетам
групп беспозвоночных. Особенно широко распространены гемоглоби-
ны. Они характерны для низших ракообразных, встречаются у отдель-
ных представителей разных классов моллюсков, полихет, немертин,
иглокожих и ряда других беспозвоночных животных. Гемоглобины
имеются даже в гемолимфе водных личинок некоторых насекомых.
В основе организации молекул гемоглобина беспозвоночных, как
и у позвоночных животных, лежат мономеры молекулярной массой
16-17 кДа. Количество мономеров в молекулах гемоглобина может
варьировать от одного до нескольких десятков (например, у полихеты
пескожила молекулярная масса гемоглобина около 2000 кДа).
Дыхательные пигменты у беспозвоночных животных встречаются
в двух основных формах: в свободном виде и в специальных клетках —
эритроцитах. Последние у животных с хорошо развитым целомом
находятся в основном в целомической жидкости. Гемоглобины могут
иметь как внутриклеточную, так и внеклеточную локализацию. Гемэ-
ритрины содержатся только в клетках, а гемоцианины функционируют
Лишь внеклеточно. Внутриклеточные гемоглобины имеют обычно не-
большую молекулярную массу (состоят из небольшого количества
мономеров). Молекулы внеклеточных гемоглобинов достигают разме-
ров свыше 400 кДа. Они образованы большим количеством мономе-
№. Самый крупный внеклеточный гемоглобин обнаружен в гемолим-
263
позвоночных, обычно характерен микротрубочковый субмембранный
цитоскелет.
У некоторых беспозвоночных животных свободные клеточные
элементы, содержащие дыхательные пигменты, существенно отлича-
ются по своему строению от эритроцитов позвоночных. Примером
таких клеток могут служить циркулирующие в полостной жидкости
многих полихет элеоциты (рис. 85, А, 4). Эти клетки отличаются боль-
шими размерами и помимо дыхательных пигментов сод< ржат в цито-
плазме и другие включения, преимущественно трофического характе-
ра. Они полифункциональны, поскольку помимо транспортировки кис-
лорода выполняют и функцию трофоцитов, обеспечивая питательными
веществами развивающиеся в целоме половые клетки.
Рис. 85. Эритроциты беспозвоночных.
схематические рисунки эритроцитов; Б-Г— ультраструктурная организация
эритроцитов двух видов приапулид (Б, В — Priapulus caudatus, Г — Halicnptus
spinulosus')
__ (по Е. Н. Горышиной и О. Ю. Чаге, 1990):
по эритроциты (7 — немертины, 2 — приапулнды, 3 — полихеты), 4 — элеоцит
л1**61» 5 ядро, б — впячивание плазматической мембраны, 7 — дыхательный
пигмент, 8 — шероховатая ЭПС.
265
Мало еще изучен гистогенез эритроцитов у беспозвоночных. Дпя
многих их представителей не выяснен источник развития этих клеток.
Представляют ли они самоподдерживающуюся автономную систему
или имеют общий источник развития с гемамебоцитами как одна из
дифференцировок системы свободных элементов тканей внутренней
среды? У полихет (за исключением рода Magellona) и близких к ним
групп животных весьма вероятно происхождение такого рода клеток
из особых участков целомической выстилки.
По-видимому, вопрос о тканевой принадлежности эритроцитов
беспозвоночных животных имеет неоднозначное решение, и у разных
их представителей реализуется одна из трех указанных выше возмож-
ностей. Косвенным подтверждением этого являются данные об источ-
никах синтеза свободных дыхательных пигментов. У брюхоногих мол-
люсков, как указывалось выше, синтез дыхательных пигментов берут
на себя поровые клетки интерстициальной ткани. У мечехвоста гемо-
цианин продуцируется одной из разновидностей амебоцитов. У голо-
воногих моллюсков местом синтеза гемоцианина являются стенки жа-
берных сердец. Наконец, у полихеты пескожила высокомолекулярные
гемоглобины свободно циркулирующие в крови, синтезируются в пе-
риваскулярных клетках целомического эпителия. Аналогичные данные
имеются и в отношении гистогенеза эритроцитов. Помимо возможной
целомической их природы у ряда полихет и многих моллюсков пока-
зано их развитие из клеточных элементов тканей внутренней среды.
Соединительнотканную природу имеют, по-видимому, и клетки, про-
дуцирующие гемоцианин (поровые клетки моллюсков и цианоциты
членистоногих).
§2. ФОРМЕННЫЕ ЭЛЕМЕНТЫ КРОВИ И ПОЛОСТНОЙ ЖИДКОСТИ
И НЕКОТОРЫЕ ГУМОРАЛЬНЫЕ МЕХАНИЗМЫ,
ОБЕСПЕЧИВАЮЩИЕ ПРОЦЕССЫ КОАГУЛЯЦИИ
Позвоночные животные. Кровяные пластинки млекопитающих
и тромбоциты крови у всех остальных позвоночных представляют
собой специализированные форменные элементы крови, предназначен-
ные для обеспечения процессов коагуляции. Тромбоциты — это клет-
ки, а кровяные пластинки — участки цитоплазмы гигантских поли-
плоидных клеток красного костного мозга мегакариоцитов. Тем не
менее строение и функциональное значение тромбоцитов и кровяных
пластинок во многом сходно. Тромбоциты и форменные элементы
крови млекопитающих (кровяные пластинки) играют существенную
роль в организации тромбов — временных «заплаток» и пробок на
поврежденных сосудах. Основным субстратом этих образований яв-
266
ляется особый, вырабатываемый в основном клетками печени белок
фибрин. В нормальной плазме крови он циркулирует в виде фибри-
ногена. Для его полимеризации необходимо удаление у молекулы
лишних участков. Это позволяет им образовывать вначале полимер-
ный, а затем и нерастворимый фибрин (рис. 86, А, Б). Для реализа-
ции таких процессов в плазме имеется целая система ферментов,
последовательно активирующих друг друга и составляющих так на-
зываемый каскад коагуляции. Эта система находится под сложным
контролем разнообразных гуморальных и клеточных факторов. Она
может запускаться и внешними по отношению к сосудистому руслу,
.и внутренними стимулами. Процессы характеризуются большой плас-
тичностью и обратимостью. Наряду со стимулирующими коагуляцию
веществами существуют и соединения, тормозящие и даже блокирую-
щие ее, а также вещества, регулирующие разрушение образовавшихся
тромбов.
У позвоночных животных, как отмечено выше, в процессах коа-
гуляции и в ее регуляции существенную роль играют гуморальные
факторы. Однако в положительной и в отрицательной регуляции тром-
бообразования существенная роль принадлежит и клеткам, и их ана-
логам, специализированным на процессы свертывания (тромбоциты
или кровяные пластинки), а также клеткам эндотелия, образующим
Фибриноген
Нерастворимый
Иономерный
фибрин
Полимерный
фибрин
Рис В
ис- 86 Молекула фиброногена (Л) и последовательные стадии его полимеризации
(Ь) (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
267
выстилку сосудов. При этом тромбоциты и кровяные пластинки в
основном обеспечивают условия для формирования тромбов, а эн-
дотелий образует вещества, блокирующие процессы тромбообразо-
вания.
Организация форменных элементов крови наиболее хорошо изуче-
на на примере кровяных пластинок, которые хотя и не являются клет-
ками, но тем не менее достаточно долго существуют в нативном состо-
янии в крови (у человека около недели) и имеют весьма сложную диф-
ференцировку и поверхностного аппарата, и цитоплазмы (рис. 87, А, Б).
В пазматическую мембрану пластинок (очевидно, и тромбоцитов)
вмонтированы разнообразные рецепторы: к коллагенам, фибриногену,
факторам адгезии и др. Плазматическая мембрана образует глубокие
трубкообразные впячивания, которые контактируют с замкнутыми ка-
нальцами — видоизмененной гладкой ЭПС, так называемой плотной
тубулярной системой (2, 3). В целом получаются структуры, анало-
гичные Т- и L-системам мышечных волокон. При этом показано, что
плотная тубулярная система является резервуаром ионов кальция, т. е.,
как и L-система мышечных волокон, участвует в запуске взаимодей-
ствия актина и миозина, т. е. процессов сокращения.
Кровяные пластинки, как и тромбоциты, обладают хорошо разви-
тым периферическим цитоскелетом. Он состоит из опорного кольца,
образованного из микротрубочек (7) и актин-миозиновой системы мик-
рофиламентов, расположенной обычно между плазматической мембра-
ной и опорным микротрубочковым цитоскелетом. Специфическими
органоидами кровяных пластинок являются а- и Р-гранулы (4, 5). В
состав а-гранул (среди которых имеются, по-видимому, лизосомы и
пероксисомы) входит целый ряд веществ: один из факторов сверты-
вания каскада коагуляции — фибриноген, тромбоцитарный фактор
роста, и т. д. В составе Р-гранул содержатся серотонин, катехоламины,
поглошаемые пластинками из плазмы крови, а также нуклеотидтри-
фосфаты и ионы Са2+ и Mg2+.
Кроме того, в пластинках имеются и обычные органоиды: участки
шероховатой ЭПС, свободные рибосомы, митохондрии, включения
гликогена.
Структура поверхностного аппарата и цитоплазмы тромбоцитов
других классов позвоночных изучена хуже, но, по существу, она сход-
на со структурой кровяных пластинок (рис. 87, В).
В сосудах с ненарушенным эндотелием процессы тромбообразо-
вания обычно затруднены. Последовательная цепь событий в области
травмированного сосуда изображена на рис. 88. Кровяные пластинки,
как и тромбоциты у других позвоночных, обнаруживают положитель-
268
2
Рис. 87. Кровяная пластинка млекопитающих в норме (А),
при активации (5) и тромбоцит миноги (В)
(по Е. Н. Горышииой и О. Ю. Чаге, 1990).
1 — скелетное кольцо микротрубочек, 2 — система открытых
канальцев, 3 — плотная тубулярная система, 4, 5 — гранулы,
6 — скопление гликогена, 7 — клеточный центр.
269
ный хемотаксис к коллагену IV базальной мембраны (а особенно
сильный при более глубоких поражениях сосуда — к коллагенам Щ
и I соединительной ткани). Благодаря этому они накапливаются в месте
травмы, активируются и образуют здесь рыхлые многослойные агре-
гаты, так называемый белый тромб (рис. 88, А, В). При активации
пластинок происходит сокращение их субмембранной акто-миозино-
вой системы, благодаря чему все гранулы оказываются в центре плас-
тинок. Дальше имеет место их дегрануляция, при которой выделяются
некоторые факторы свертывания, особая фракция фибриногена, а на
поверхности пластинки образуется мультиферментный комплекс про-
тромбиназа, в формировании которого существенную роль играет уни-
кальный фосфометидный состав мембраны пластинок. Сборка про-
тромбиназы является одним из ключевых моментов в развитии каскада
процессов свертывания, обусловливающего полимеризацию фибрина.
Таким образом, одна из важнейших функций пластинок в тромбооб-
разовании — формообразовательная, организующая роль этого про-
Рис. 88. Стадии образования тромба у млекопитающих.
А — активация пластинок и их хемотаксис к месту повреждения сосуда; Б — адге-
зия пластинок к коллагену; В — образование многослойного белого тромба; Г
дегрануляция пластинок и осаждение фибрина (по Е. Н. Горышиной и О. Ю. Чаге,
1990):
1 — неактивная н 2 — активированная кровяные пластинки, 3 — эндотелиальная
клетка, 4 — базальная мембрана, 5 — коллаген, 6 — фибрин, 7 — эритроцит, меха-
нически включенный в сгусток.
270
цесса: они точно определяют место и объем тромба (область поражен-
ного участка сосудистого русла). На заключительных этапах процесса
тромбообразования, в ходе саморазрушения пластинок под влиянием
выделяющихся из их лизосом гидролитических ферментов происходит
сокращение их актин-миозиновых субмембранных систем. Благодаря
этому рыхлый вначале сгусток полимеризованного фибрина значитель-
но уплотняется, создавая более прочную структуру в области травмы
сосудистой стенки (ретракция сгустка).
Процессы тромбообразования у представителей других классов
позвоночных, по-видимому, сходны с этими процессами у млекопита-
ющих. Однако они исследованы менее подробно. Установлено лишь,
что у них либо отсутствует, либо действуют значительно слабее, чем у
млекопитающих, «внутренний» механизм инициации процессов тром-
бообразования.
Беспозвоночные животные. У первичноротых и вторичноротых
животных с циркуляторными распределительными системами, как и у
позвоночных, в тканях внутренней среды имеются специальные меха-
низмы, препятствующие потере тканевой жидкости и крови при по-
вреждении стенки тела или сосудистого русла. Например, у морских
звезд, некоторых голотурий и моллюсков, этот механизм заключается
в быстрой агрегации и агглютинации циркулирующих в крови, гемо-
лимфе ми полости тела клеток и образовании временных пробок типа
белого рыхлого тромба позвоночных животных.
У большинства других многоклеточных животных процесс коагу-
ляции приобретает более сложный характер, ибо при травмах репара-
ция дефекта обусловливается не только слипанием клеток, но и фор-
мированием внеклеточных структур. Предшественники последних, как
и у позвоночных, могут находиться в тканевой жидкости. Однако
У беспозвоночных животных они локализованы преимущественно в
клетках. Только у высших артикулят (насекомые и ракообразные)
существенную роль в процессах коагуляции принимают и внеклеточ-
ные белки гемолимфы. Для обеспечения коагуляции в тканях внутрен-
ней среды образуются (по-видимому, неоднократно и независимо в
разных типах животных) специальные гранулярные амебоциты, в гра-
нулах которых содержатся необходимые для этого компоненты.
В настоящее время гранулярные амебоциты и осуществляемые
ими вместе с гуморальными факторами процессы коагуляции в боль-
шей или меньшей мере изучены у представителей разных типов много-
клеточных (оболочники, ракообразные, насекомые, мечехвосты, при-
апулиды, некоторые иглокожие и даже кишечнополостные). Оказалось,
Что Функция коагуляции гемолимфы часто сочетается у них и с за-
271
Рис. 89. Гранулярные амебоциты мечехвоста на последовательных стадиях
активации и выведения гранул (А-Г).
щитной, и с формообразовательной, и строительной функциями, и
даже со своеобразной функцией отторжения чужеродных тканей.
Система гранулярных амебоцитов современными методами изу-
чается уже с конца 60-х годов. В экспериментальных и ультраструк-
турных исследованиях на гранулярных амебоцитах мечехвоста были
подробно изучены морфологические изменения гранул и ведущая роль
этих клеток в процессе свертывания гемолимфы. В этих работах под-
черкивалось сходство характера изменений при активации грануляр-
ных амебоцитов мечехвоста и при активации тромбоцитов и кровяных
пластинок (рис. 89, А-Г).
В дальнейшем на многих объектах (оболочники, иглокожие, при-
апулцды, членистоногие) гистохимическими методами было показано
наличие в гранулах белка, способного к полимеризации с ферментами,
осуществляющими этот процесс, а также фенолоксидазной системы
(рис. 90). При этом у мечехвоста и приапулид был обнаружен только
полимеризующийся белок (рис. 90, Г), а у всех остальных животных
272
Рис. 90. Состав гранул и функциональное значение системы гранулярных амебоци-
тов > асцидий (А), голотурий (Б), насекомых и ракообразных (В) и приапулид (Г).
Svkbij слева внизу характеризуют содержимое гранул: Me — фермент, Б — полиме-
ризующий бсток, ПФО — полифенолоксидаза, Ф — фенолы, КМПС — кислые му-
кополисахариды; стрелками показано, какие функции образующиеся белковые плен-
ки выполняют при активации содержимого гранул: 1 — образование пигмента, 2
формирование и склеротизация кутикулы, 3 — репаративные процессы в кутикуле,
4 — инкапсуляция инородных тел, 5 — трансплантационных иммунитет,
6 — фагоцитоз.
еще и фенолоксидазная система. У асцидий, иглокожих, приапулид и
членистоногих показано (отмеченное уже выше) многообразие функ-
циональной роли клеток, которые осуществляют не только коагуля-
Цию, но и защитную и строительно-формообразовательную функции.
Иногда эти дополнительные функции (например, строительная функ-
иия У оболочников или защитная функция у насекомых и ракообраз-
®«) становятся основными (рис. 90, А, В).
Наиболее детально морфологические изменения гранул при акти-
вации клеток перед дегрануляцией показаны на примере гранулярных
амебоцитов приапулид (рис. 91). Вначале появляются «микротрубоч-
коподобные» структуры, затем они исчезают и содержимое гранул
ириобретает, как и у мечехвоста, зернистый характер. После выведения
273
мт
Рис. 91. Активированный гранулярный амебоцит приапулид
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
гр — неактивированная гранула, мт, тм — «микротрубочкоподоб-
ные» структуры внутри гранул (в клетке) н в коагулировавшей ге-
молимфе (вне клеток), см — плазматическая мембрана, пх — элек-
тронноплотное содержимое гранул, ин — впячивание плазматичес-
кой мембраны, эк — экзоцитоз.
этого секрета в гемолимфу в ней вновь наблюдаются многочисленные
фибриллярные мнкротрубочкоподобные структуры.
Молекулярные механизмы процессов коагуляции изучены у ме-
чехвостов (рис. 92). Гранулярные амебоциты у них единственный по-
движный специализированный клеточный элемент тканей внутренней
среды. Они и обладают фагоцитарной активностью, и играют основ-
ную роль в процессах коагуляции гемолимфы. Очевидно, что у этих
клеток имеются по крайней мере две разные рецепторные системы,
задействование которых вызывает различную реакцию — либо поло-
жительный хемотаксис к объекту и процесс фагоцитоза, либо запуск
дегрануляции, выведение содержимого гранул и формирование геля.
Последняя реакция идет особенно активно под влиянием бактериаль-
274
Рис. 92. Коагуляция гемолимфы у меч^®°^а
(по Е. Н. Горышиной и О. Ю. гранулоцит,
1 — бактерии, 2 — молекулы липополисахаридов, □ и- э100цитоза гранул,
Дегранулирующая клетка, 5-8 — последователь коап,логеНа, запускаемый
5— волокна геля; справа — классический путь акгиваци агу емый
изменением ионного баланса, слева — альтернативны уть>
бактериальными протеазами.
275
ных липополисахаридов. Под воздействием этого фактора у клеток
образуются отростки и происходит концентрация гранул в околоядер-
ной области. Плотные гранулы разрыхляются и образуют микротру-
бочкоподобные структуры диаметром 15-17 нм (5, 6). Затем они ис-
чезают, и содержимое гранул в виде мелкозернистого субстрата вы-
водится наружу, где формируется гель (7, 8). Основной компонент
гранул — низкомолекулярный белок (17-24 кДа), богатый S-S-связя-
ми. В гранулах он представлен неактивной формой с лишним фраг-
ментом в молекуле и носит название коагулогена. В гранулах имеется
и последовательная система сериновых протеаз. Она состоит по край-
ней мере из трех ферментов (протеазы N, протеазы В и фактора свер-
тывания). Последние и представляют собой каскад коагуляции, анало-
гичный в принципе каскаду свертывания крови позвоночных. Протеаза
фактора свертывания у мечехвоста вырезает фрагмент из молекулы
коагулогена, и последний превращается в коагулин, который полиме-
ризуется, образуя гелеобразный сгусток.
По-видимому, аналогичная система коагуляции имеется у приапу-
лид, у которых (как и у мечехвоста) гранулярные амебоциты выпол-
няют и фагоцитарную функцию, и функцию свертывания.
У насекомых в гранулах амебоцитов (как и у мечехвоста) содер-
жится набор сериновых протеаз и низкомолекулярный белок коагуло-
ген. Эти системы активируются и бактериальными эндотоксинами и
гликанами клеточной стенки паразитических грибов. Кроме того, в
гемолимфе насекомых содержится высокомолекулярный белок фибри-
ноген (более 500 кДа). В норме он служит для переноса липидов к
ооцитам. Однако при формировании геля из молекул коагулина этот
белок оседает на нем, увеличивая массу сгустка. Кроме того, у насе-
комых имеется фенолоксидазная система, состоящая из профермента
фенолоксидазы и субстрата его действия — фенолов. При активации
молекул коагулогена активируется и эта система. При окислении фе-
нолов активной фенолоксидазой образуются хиноны, которые склеро-
тизируют белки сгустка и оказывают цитотоксическое действие на
бактерии. Таким образом, здесь функции коагуляции и репарации
стенки тела сочетаются уже и с мощной защитой от патогенных
микроорганизмов и грибов.
Еще в большей степени фенолоксидазная система рзвита у высших
ракообразных. Здесь имеется, по-видимому, несколько типов грануло-
цитов. Как и у насекомых, в коагуляции гемолимфы у ракообразных
принимает участие и фибриноген гемолимфы — высокомолекулярный
белок, второй по количеству в гемолимфе после гемоцианина.
Защитные механизмы, предотвращающие потерю жидкости при
повреждении стенки тела, характерны для иглокожих и оболочников.
276
у иглокожих отчетливо выявляется пластичность этой системы. Так,
морских ежей и многих видов голотурий коагуляция связана с
юрмированием сгустка в результате дегрануляции специализирован-
ных гранулярных амебоцитов. Однако у морских звезд или некоторых
тдов голотурий таких клеток либо нет, либо их очень мало и обра-
зование «пробок» при повреждении стенки тела происходит благодаря
агглютинации обычных фагоцитов. У тех видов голотурий, у которых
много гранулярных амебоцитов, последние участвуют не только в
коагуляции, но и в осуществлении нормальных функций тканей внут-
ренней среды. Особенно большое значение имеют гранулярные аме-
боциты у оболочников (морулярные клетки у асцидий). Помимо учас-
тия в коагуляции тканевой жидкости (побочная, преимущественно
защитная функция — инкапсуляция инородных тел) гранулярные аме-
боциты участвуют в построении верхнего слоя кутикулы, в склероти-
зации ее внутренних слоев и репарации при повреждении. Кроме того,
эта система обеспечивает отторжение особей при срастании несовмес-
тимых особей у колониальных асцидий.
Биохимические основы работы морулярных клеток у асцидий
пучены еще недостаточно, но уже обнаружены белки, способные к
полимеризации, и фенолоксидазная система. Можно предполагать, что
эти клетки «работают» в принципе сходно с гранулярными амебоци-
тами высших первичноротых, хотя возникла эта дифференцировка в
тканях внутренней среды у оболочников явно независимо от анало-
гичной дифференцировки у насекомых и ракообразных.
ЛИТЕРАТУРА
Алякринская И. О. Гемоглобины и гемоцианины беспозвоночных. М.,
1979.
Горышина Е. Н, Чага О. Ю. Сравнительная гистология тканей внутрен-
ней среды с основами иммунологии. Л., 1990. С. 94-111.
Мржак Л. И. Эволюция системы крови // Эволюционная физиология.
19й- С. 262-300.
Стародуб Я ф„ Назаренко В И. Гетерогенная система гемоглобина. Ки-
са, 1987.
Чага О. Ю., Соловей И. В. Кутикулярные эпителии и гранулярные амебо-
ЦИ1Ъ| И Цитология. 1986. Т. 28, № 3.
-4-, Кормак Д. Гистология. 1983. Т. 2. С. 106—127.
у°1 Р- Oxygen transport in invertebrates // Amer. J. Physiol. 1985.
Ratcl\ffe If A., Rowley A. F. Invertebrate immunity: basis cocepts and recent
Vances 11 biter. Rev. Cytol. 1985. Vol. 1, Xs 97.
277
Тигее В. C. The mollecular basis of blood coagulation // Cell. 1989. Vol. 53,
№ 4.
Van Bruggen E. F. Hemocyanin: the mystery of blue blood // Trends Biochem.
Sci. 1980. Vol. 5, № 1.
ГЛАВА 4. Древние клеточные и некоторые
гуморальные защитные механизмы
тканей внутренней среды
§1. КЛЕТОЧНЫЕ СИСТЕМЫ
Фагоциты
Позвоночные животные. Защитные системы позвоночных, в
частности у млекопитающих и человека, представлены фагоцитами.
Первый мультифункциональный тип фагоцитов циркулирует в крови
млекопитающих и человека в виде незрелой расселительной стадии —
моноцитов. Функционируют эти клетки в тканях и органах, приобретая
обычно специфические для каждой ткани и органа особенности. Это
гистиоциты рыхлой соединительной ткани, многоядерные остеокласты
и хондрокласты скелетных тканей, перитонеальные макрофаги, аль-
веолярные макрофаги легких, купферовские клетки печени, микро-
глия нервной системы, разнообразные отростчатые макрофаги костно-
го мозга и лимфоидных органов.
Каждая из перечисленных разновидностей макрофагов имеет свои
структурно-химические и функциональные особенности. Различия
между моноцитами и макрофагами можно показать хотя бы на примере
сопоставления моноцита (рис. 93, А) и наименее специализированного
перитонеального макрофага (рис. 93, Б). Моноцит по объему в два
раза меньше макрофага и имеет округлую форму, бобовидное ядро,
умеренно развитые общие органоиды и небольшое количество спе-
цифических гранул в цитоплазме. У макрофага резко увеличена по-
верхность клетки за счет временных отростков и глубоких впячива-
ний, развит поверхностный аппарат ядра, имеется активно функци-
онирующее ядрышко. В его цитоплазме значительно мощнее пред-
ставлены белоксинтезирующий аппарат (шероховатая ЭПС, свободные
полисомы) и аппарат Гольджи, больше митохондрий и специфических
гранул.
Еще более сложную структуру имеют специальные макрофаги
костной ткани — остеокласты. В альвеолярных макрофагах в окисли-
тельных процессах используется кислород. Остальные макрофаги свои
энергетические потребности покрывают обычно за счет гликолиза.
278
Сложно устроены и выполняют специфическую функцию отростчатые
ллфофаги костного мозга и лимфоидных органов.
Настоящим, исходно хорошо подготовленным является второй тип
фагоцитов — нейтрофильные лейкоциты, или так называемые мик-
рофаги (рис. 93, В). По размерам они меньше, чем моноциты, в зрелом
состоянии имеют слабо развитые общие органоиды, неактивное сег-
ментированное ядро. Цитоплазма нейтрофила у млекопитающих за-
полнена гранулами двух типов — азурофильными и специфическими
(рис. 93, А, В, 3, 7), а также очень мелкими С-частицами. Азурофиль-
ные гранулы — это специализированные лизосомы. Они содержат
кислые гидролазы. Кроме того, в гранулах имеются и бактерицидные
вещества — ферменты лизоцим и миелопероксидаза.
Лизоцим действует на оболочку бактерий — на муреиновый ком-
понент оболочки. Миелопероксидаза — специфический фермент фа-
гоцитов позвоночных. В присутствии галогенов он может расщеп-
лять пероксид водорода с образованием высокоактивных продуктов,
способных окислять практически любой субстрат. Миелопероксида-
за содержится в лизосомах и незрелых макрофагах. Благодаря этому
ферменту при фагоцитозе нейтрофилами и молодыми макрофагами
наблюдается метаболический взрыв — усиленное потребление клет-
ками кислорода, который используется для образования перекиси во-
з >рода
В специфических гранулах нейтрофилов содержатся фермент ли-
зоцим и лактоферрин, отнимающий железо у железосодержащих бак-
терий. С-частицы были обнаружены с помощью дифференциального
центрифугирования и, вероятно, являются собирательным понятием.
С ними связана вся желатиназная активность нейтрофила, в них об-
наружены катепсины В и D и некоторые другие ферменты. Нейтро-
филы обладают хорошо развитым микротрубочковым и актомиозино-
вым цитоскелетом и сложным рецепторным аппаратом, которые обес-
печивают их положительный хемотаксис по отношению к бактериям,
а также процессы внутриклеточного перемещения гранул, фагосом и
экзоцитоза гранул. При фагоцитозе с фагосомой сначала сливается
специфическая гранула, а затем азурофильная.
Зрелые нейтрофилы у человека циркулируют в крови несколько
часов после этого они выходят в ткани, где через 2-3 дня заканчивают
®ое существование. Роль нейтрофилов на этом последнем этапе диф-
ференцировки ничуть не уступает их роли в крови. Основными мес-
Тами гибели нейтрофилов являются полость кишечника, мочеполовые
и Дыхательные пути. В тонком кишечнике ферменты нейтрофилов
279
1
280
участвуют в расщеплении пищевых веществ. В толстом кишечнике
бактерицидные факторы нейтрофилов регулируют размножение сим-
биотической микрофлоры кишечника. В этом процессе значительная
роль принадлежит дефенсинам — пептидным антибиотикам, которые
у человека найдены не только в нейтрофилах, но и в клетках Панета
крипт кишечника. Мигрирующие в яйцеводы млекопитающих нейтро-
филы сдерживают развитие прокариотической микрофлоры, а также
фагоцитируют избыток сперматозоидов, поступивших в женские по-
ловые пути.
В воздухоносных путях нейтрофилы участвуют в уничтожении
патогенных микроорганизмов и удаляют частицы пыли. При поступ-
лении избытка пылевых частиц в течение длительного времени разви-
ваются некоторые формы хронических бронхитов и альвеолитов, на-
пример, у шахтеров и рабочих цементных производств, что связано с
Нис. 93. Ультраструктурная организация моноцита (Я), макрофага (В) и нейтро-
фила (В) млекопитающих (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
I — шероховатая ЭПС, 2 — полнрнбосомы, 3 — лизосомы, 4 — фаголизосо-
мы, 5 —ядро, б — гликоген, 7 — специфические гранулы
281
избыточной активностью нейтрофилов. Помимо осуществления фаго-
цитоза и выделения гидролитических ферментов нейтрофилы спо-
собны выделять вещества, действующие на нервные центры и клет-
ки иммунной системы. В целом нейтрофилы можно охарактеризовать
как высокоспециализированные, хорошо оснащенные микрофагоциты,
обеспечивающие главным образом борьбу организма с патогенными
микроорганизмами.
В противоположность нейтрофилам функциональная деятельность
макрофагов значительно более многообразна. Макрофаги не только
играют активную роль в фагоцитарной защитной деятельности, вместе
с нейтрофилами они являются основными клеточными элементами
неспецифических защитных реакций у позвоночных. Макрофаги на-
чинают развитие иммунной реакции на антигены и завершают ее,
активно фагоцитируя комплексы антиген—антитело. Макрофаги игра-
ют также роль мощных регуляторов процессов в тканях внутренней
среды, выделяя разнообразные ферменты, компоненты комплемента,
ингибиторы ферментов, биоактивные липиды, адгезивные белки, фак-
торы, стимулирующие размножение фибробластов и регулирующие
размножение лимфоцитов, опухолевых клеток, вирусов (всего около
50 различных факторов). Вещества-регуляторы, выделяемые макрофа-
гами, носят название монокинов.
Таким образом, моноциты — макрофаги позвоночных, в частнос-
ти млекопитающих и человека, представляют собой еще и полифунк-
циональные клетки — регуляторы внутритканевых и организменных
метаболических процессов. Специфичность эволюционной динамики
системы моноцитов—макрофагов заключалась во все большем ее ус-
ложнении при сохранении полнфункциональной природы этих клеток.
Зрелые формы макрофагов, расселяясь по разным органам и тканям в
эмбриональном и постнатальном гистогенезах, обнаруживают отчет-
ливую тенденцию к специализации — расщеплению на отдельные
дифференцировки. Альвеолярный макрофаг, остеокласты, купферов-
ские клетки, дендритические макрофаги лимфоузлов или макрофаги
селезенки — это уже разные клеточные элементы, обладающие спе-
цифической структурно-химической организацией и функциональны-
ми особенностями (рис. 94, А-Г)
Беспозвоночные животные. Что касается распространения фаго-
цитов, то еще из работ И. И. Мечникова известно, что фагоциты
универсальная дифференцировка тканей внутренней среды. Она сохра-
нилась в этих тканях от первичных многоклеточных, когда последние
образовали специальный кишечный эпителий. Действительно, почти у
282
Рис. 94. Специализированные макрофаги позвоночных животных
— меланомакрофагальный центр и Б — меланомакрофаг в селезенке камбалы;
S — гигантский макрофаг из белой пульпы селезенки амфибий; Г — дендрити-
ческая клетка из лимфоузла млекопитающего макрофагальной (?) природы
(по Е. Н. Горышиной и О. Ю. Чаге, 1990):
) — артериола, 2 — элипсоид, 3 — скопление лимфоцитов, 4 — барьер из фиб-
Робластов, 5 — меланомакрофаги, б — гранулы, 7 — фаголизосомы, 8 ваку-
оли с гемосидерином.
л
всех многоклеточных, имеющих развитые тка процессы фа-
нмеются клеточные элементы, специализирован ция сочетается
| гоцитоза. Иногда (у мечехвостов и приапулид) эт сВОйственна
со специализацией клеток на процессы коагуля мечехвоста послед-
фанулярным амебоцитам. Удалось показать, ч3° ем деГрануляции и
вис реагируют на грамотрицательных бактери бактерий —
сбразования белковых пленок, а на грамполож
I вродессами фагоцитоза.
283
284
Как правило, у большинства многоклеточных беспозвоночных фа-
сциты — это особая дифференцировка, представленная большими
базофильными амебоцитами в гемолимфе или полостной жидкости.
Тонкие механизмы процессов фагоцитоза и регуляции фагоцитарной
. -гивности изучены у беспозвоночных весьма слабо. Известно лишь,
что им не свойствен характерный для нейтрофилов и молодых макро-
фагоь метаболический «взрыв». В их лизосомах соответственно не
обнаружен и фермент миелопероксидаза.
Для беспозвоночных характерны так называемые фагоцитарные
органы — более или менее сложно устроенные образования, состо-
ящие из скопления фагоцитов и выполняющие фильтрующую защит-
ную функцию. Иногда это свойство приобретают специализированные
участки целомического эпителия. Уникальной структурой такого рода
являются урночки сипункулид — плавающие в целомической жидкос-
ти агрегаты из ресничных клеток и клеток, обладающих фагоцитарной
активностью (рис. 95, А, Б). Сложные и независимо возникающие у
представителей разных типов фагоцитарные органы характерны для
аннелид и иглокожих (рис. 95, В-Ж). У позвоночных животных сово-
\ гчость мигрирующих и оседлых клеточных элементов моноцитар-
ного ряда, локализованных во всех тканях и органах, образует систему
моионуклеарных фагоцитов.
Регуляторные клетки
Позвоночные животные. Помимо типичных унифункциональ-
ных (нейтрофилы) и полифункциональных (моноциты, макрофаги) фа-
гоцитов крови у позвоночных животных есть еще несколько клеточных
лиффет енциророк, имеющих непосредственное отношение к древним
; ишггныг системам тканей внутренней среды. Это эозинофильные и
базофильные гранулоциты. Кроме того, в соединительной ткани у
млекопитающих и человека имеются еще по крайней мере две разно-
95. Урночка сипункулиды (А, Б) и фагоцитарный орган земляного червя [В—Ж).
вцц < верху; Б — вертикальный разрез урночки снпуикулвды; В — общий вид,
продольный срез; Д—Ж — детали тонкого строения долек фагоцитарного органа
Че₽вя (Д — строма из отростков целомических клеток; Е, Ж — островки из макрофа-
1 гов (£) и гранулоцитов (Ж).
• °- I клетка купола, 2 — ресничная клетка, 3 — клетка лопастей, секретирую-
®их слизь, 4 — внутренняя полость урночки; В-Ж: 1 — кровеносный сосуд 2
,®лька органа, 3 — отростки мышечных клеток, 4 — ядро, 5 — тело, 6 отростки
'четок целомического эпителия, 7 — поры, 8 — макрофаги, 9-11 — гранулоциты
трех типов, 12 — малодифференцнрованные клетки.
285
видности тучных клеток: коротко- и долгоживущие (рис. 96, Л В)
Короткоживущая разновидность этих клеток располагается в слизис-
тых оболочках, тесно связана с иммунной системой и зависит от
Т-лимфоцитов. Долгоживущая разновидность располагается в соеди-
нительной ткани, не связана с Т-лимфоцитами и помимо защитной
выполняет регуляторную функцию в метаболических процессах в со-
единительной ткани. Несмотря на то, что коротко- и долгоживущие
тучные клетки, а также базофильные зернистые лейкоциты — незави-
симые клеточные линии, имеющие отдельные камбиальные (полу-
стволовые) источники развития, в структурно-химическом плане они
весьма сходны. Это высокодифференцированные специализированные
клетки. Базофилы полностью утрачивают способность к размножению,
а тучные клетки сохраняют ее в ограниченных пределах.
Дифференцировки в виде тучных клеток среди свободных эле-
ментов тканей внутренней среды появляются уже у круглоротых. Сре-
ди рыб лишь некоторые представители имеют базофилы в крови,
тучные клетки имеются у всех рыб. У амфибий нет типичных базо-
филов с сегментированным ядром, но имеются две разновидности
тучных клеток. Одна из них заселяет лимфоидные и кроветворные
органы и циркулирует в крови. Клетки этой популяции имеют округ-
лую форму. Вторая разновидность представлена клетками отростчатой
формы, которые располагаются в соединительной ткани.
Тучные клетки и базофилы имеют сходную химическую органи-
зацию, хотя по размерам, форме клеток и даже ультраструктуре спе-
цифических гранул могут существенно отличаться друг от друга. Гра-
нулы тучных клеток и базофилов представляют собой гетерогенный
полифункциональный лизосомный аппарат клеток, нацеленный на вне-
клеточную работу. Основу гранул составляет комплекс белка с гепа-
рином — сульфатированным полисахаридом, обладающим мощным
антикоагуляционным действием. Гепарин прочно связывается с белком
и освобождается от него только после дегрануляции и разрушения
гранул. В составе гранул имеются гидролитические ферменты. Менее
прочно с белками в гранулах связаны биогенные амины (гистамин и
др.), действующие на стенку сосудов и влияющие на подвижность
фагоцитов. Они могут постоянно выделяться из клеток в малых коли-
чествах независимо от дегрануляции.
Кроме того, в гранулах содержатся вещества, стимулирующие
положительный хемотаксис эозинофилов и нейтрофилов, а также фак-
тор, активирующий кровяные пластинки. Тучные клетки и базофи-
лы — это преимущественно секреторные регуляторные элементы тка-
ней внутренней среды. Они регулируют метаболизм соединительной
286
ткани, а в случае его нарушения могут быть одним из основных
организаторов защитных воспалительных процессов.
Базофилы и тучные клетки не относятся непосредственно к клет-
кам иммунной системы, но они служат важным звеном, связывающим
неспецифические защитные механизмы и высокоспецифические им-
мунные реакции между собой. И у тучных клеток (особенно клеток
слизистых оболочек), и у базофилов млекопитающих имеются рецеп-
торы к Fc-фрагменту антител класса Е (тучные клетки и базофилы) и
класса G4 (базофилы). При попадании в организм антигена, специ-
фичного к адсорбированным на поверхности тучных клеток и базофи-
лов иммуноглобулинам, происходит интенсивная дегрануляция тучных
клеток, что резко активирует воспалительные процессы (рис. 96, Г).
При аномальном развитии этих процессов могут возникать патологи-
ческие процессы под названием аллергических и анафилактических
Рис. 96. Морфология тучной клетки (А), базофила (£), эозинофила (В)
и механизм дегрануляции (Г) тучной клетки
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
I аппарат Гольджи, 2 — специфические гранулы, 3 — разрыхление гранул
перед экзоцитом, 4 — кристаллические включения; АГ — антиген, Ац адени-
лащиклаза, ЛТ — лейкотриен, МТ — метилтрансфераза, ПГ — простагландин,
' тромбоксан Лз, FcR — рецептор к Fc-фрагменту молекулы иммуноглобу-
лина Е; белыми стрелками обозначены регуляторные воздействия, черными
транспорт или превращение веществ.
287
реакций, которые в особенно тяжелых случаях могут вызвать у челове-
ка анафилактический шок с летальным исходом. Для ограничения и
регуляции функций базофилов крови и тучных клеток в тканях внут-
ренней среды появляется специальная клеточная дифференцировка, а
именно эозинофильные лейкоциты или эозинофилы (рис. 96, В). Эти
относительно короткоживущие клетки (у человека 3—5 дней) в крови
представлены уже дифференцированными формами. Клетки имеют
двулопастное слабоактивное ядро, а цитоплазма заполнена довольно
крупными гранулами, часто с кристаллоидными образованиями в ос-
новном белковой природы (рис. 96, В, 4, 5). Эозинофилы полифунк-
циональны. Им свойственны и ограниченная фагоцитарная активность,
и цитотоксическое действие (по отношению к паразитическим червям).
Основная роль эозинофилов у позвоночных, по-видимому, регу-
ляторная и состоит в локализации и сдерживании воспалительной ре-
акции, индуцированной биологически активными веществами из туч-
ных клеток и базофилов. Как отмечалось выше, эти клетки при акти-
вации выделяют вещества, привлекающие эозинофилы в очаг воспа-
ления. Вещества из гранул тучных клеток и базофилов растворяются
сравнительно медленно. Это позволяет эозинофилам передвигаться
против градиента концентрации этих веществ, фагоцитировать полу-
растворенные гранулы и инактивировать их с помощью своих лизо-
сомальных ферментов. Кроме того, эозинофилы оказывают еще ряд
ингибирующих воздействий, ограничивающих развитие воспалитель-
ных процессов.
§2. ДРЕВНИЕ ГУМОРАЛЬНЫЕ ЗАЩИТНЫЕ МЕХАНИЗМЫ
Помимо клеточных механизмов реализации защитной функции
тканей внутренней среды многоклеточные животные обладают и мощ-
ными гуморальными механизмами. У позвоночных животных в каче-
стве примера рассмотрим две наиболее древние системы — это так
называемый С-реактивный белок и систему ферментов комплемента.
Лишь часть последних образуется клетками тканей внутренней среды.
Тем не менее их защитная функция реализуется в крови и тканевой
жидкости, т. е. локализована в рассматриваемой тканевой системе.
Кроме того, в тканях внутренней среды беспозвоночных есть аналоги
или, скорее, гомологичные белки, представляющие большой сравни-
тельно-гистологический интерес.
С-реактивный белок (СРБ) обнаружен в плазме крови всех хор-
довых, начиная с асцидий. Свое название он получил за способность
связываться с С-полисахаридами клеточной стенки пневмококка. СРБ
является индуцибельным фактором и относится к группе острофазных
288
; ikob плазмы: при воспалении его количество увеличивается в сотни
раз. основное место синтеза этого белка — клетки печени, хотя часть
-нмфоцитов (вероятно, Т-лимфоцитов) также способна к синтезу СРБ.
количество синтезирующих СРБ лимфоцитов в ряду позвоночных
уменьшается от 25-30% у радужной форели Salnio gaidneri до 2-8%
у человека. Роль таких синтезирующих СРБ лимфоцитов остается
неясной, хотя наиболее вероятно, что они являются о1ень древней
популяцией естественных киллеров (NK-клеток), устраняющих му-
тантные и опухолевые клетки.
С-реактивный белок представляет собой пентамерный белок, со-
стоящий из пяти одинаковых субъединиц молекулярной массой
21 кДа. У рыб в составе пентамера обнаружены мономеры двух типов.
По аминокислотной последовательности субъединицы СРБ отдаленно
гомологичны иммуноглобулинам.
В каждой субъединице СРБ имеются активные центры для свя-
зывания с фосфорилхолнном, входящим в состав клеточных стенок
бактерий. СРБ, связанный с фосфорилхолнном, запускает каскад ком-
племента по классическому пути.
Неожиданным оказалось наличие в белковой цепи сложного ге-
магглютинина в гемолимфе мечехвоста — лнмулина — участков, го-
мологичных соответствующим участкам СРБ •— центрам связывания
с фосфорилхолнном и другими компонентами клеточной стенки бак-
терий. Более того, лимулин оказался главным белком гемолимфы этих
животных. В настоящее время гомологичные СРБ белки найдены в
гемолимфах многих моллюсков (тридакнины), и кольчатых червей.
Все эти пента- или гексамерные белки связывают фосфорилхолин
Са2+-зависимым образом и после связывания активируют литические
системы крови или гемолимфы. Вероятно, что эти древние молекулы,
напоминающие антитела с заданной специфичностью, возникли задол-
го до антител и развивались параллельно с ними, приобретая новые
функции в ходе эволюционного процесса.
Более мощная и также, по-видимому, весьма древняя гуморальная
защитная система, получившая название системы комплемента, нахо-
дится в плазме крови всех позвоночных животных. Она наиболее
развита и подробнее всего изучена у млекопитающих и человека. Эта
система состоит примерно из 20 белков плазмы крови. Ее основу
составляют белки-ферменты, образующие систему, подобную систе-
мам свертывания крови по принципу каскадной регуляции. Основная
масса ферментов — сериновые протеазы, образующие цепочку после-
довательной их активации путем вырезания фрагмента у неактивного
профермента.
289
Белки системы комплемента синтезируются клетками печени, а
также макрофагами и фибробластами. Активация системы начинается
с распознавания клетки-мишени и кончается ее лизосом. Имеется два
пути активации системы: классический и альтернативный. В первом
случае для активации системы необходимо, чтобы к клетке-мишени
присоединилась хотя бы одна молекула иммуноглобулина класса М,
или около 1000 молекул иммуноглобулина класса G.
Сигналом для активации комплемента по альтернативному пути
является стимуляция различными агентами •— липополисахаридами
бактерий, веществами вирусного или грибкового происхождения. Счи-
тается, что альтернативный путь активации более древний.
Система комплемента (хотя и не такая полная, как у млекопита-
ющих и человека) имеется у всех позвоночных. Различные белковые
литические системы, аналогичные (или гомологичные) комплемент}'
позвоночных, найдены в различных группах беспозвоночных. В част-
ности, у иглокожих найдены ферменты, взаимозаменяемые с белками
комплемента млекопитающих. Ферменты, подобные ферменту Сз ком-
племента позвоночных, обнаружены у сипункулид, мечехвоста и среди
насекомых — у бабочки (Galleria mellonella). У насекомых помимо
комплементоподобных цитотоксических белков удалось выявить еще
по крайней мере три типа белков цитотоксического действия в отно-
шении патогенных микроорганизмов. К ним относятся лизоцим (ко-
торый имеется и у позвоночных и играет важную роль в защитных
реакциях на слизистых оболочках), аттацины и цекропины. Особенно
интересна третья группа, в которой белки представлены по крайней
мере пятью разновидностями низкомолекулярных катионных белков,
каждый из них специфичен к определенным, причем разным группам
бактерий.
Механизм цитотоксического действия цекропинов сходен с ме-
ханизмом действия дефексинов позвоночных. За счет гидрофобных
участков молекулы цекропинов встраиваются в мембраны клеток-ми-
шеней, где образуют нерегулируемые ионные каналы.
§3. ВОСПАЛИТЕЛЬНЫЕ НОВООБРАЗОВАНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
(КЛЕТОЧНЫЕ МЕХАНИЗМЫ ПРОЦЕССОВ ВОСПАЛЕНИЯ)
Остановимся на краткой характеристике процессов воспалитель-
ного новообразования в тканях внутренней среды при проникновении
в организм чужеродных объектов. При этом коснемся лишь клеточных
механизмов развивающихся процессов.
Позвоночные животные. При попадании инородного тела в ор-
ганизм позвоночного развивается цепь последовательных закономер-
290
ных клеточных реакций, в которых несмотря на гистогенетическую
расщепленность отчетливо проявляется неразрывное единство всех
элементов тканей внутренней среды, ее оседлых и свободных элемен-
тов (рис. 97).
Сразу после повреждения сосуда и прилежащих тканей края раны
облепляются кровяными пластинками. Их богатые особыми фосфоли-
пидами мембраны необходимы для образования протромбиназы —
фермента, запускающего внутренний путь свертывания крови в сосуде.
При активации происходит дегрануляция пластинок и их агрегация. В
пораженный очаг поступают серотонин, гистамин, дофамин, адрена-
зин. факторы хемотаксиса лейкоцитов, а также ряд белковых факторов,
среди которых заметная роль принадлежит трансформирующему рос-
товому фактору-b (TGF-b). Травмирование сосуда, выброс факторов
из пластинок и запуск реакций свертывания крови вызывает деграну-
ляцию тучных клеток рыхлой соединительной ткани, окружающей
сосуд. Под действием факторов гранул тучных клеток и пластинок
происходит спазм сосудов, что уменьшает кровотечение. К этому вре-
мени тромбообразование в целом заканчивается, и через 5-7 мин после
травмы расширяются сосуды, несущие кровь к пораженному очагу.
Все это способствует развитию отека и притоку массы лейкоцитов в
очаг. За счет повышения проницаемости эндотелия сосудов лейкоциты
мигрируют в ткани. Первыми в формирующийся воспалительный очаг
устремляются нейтрофильные лейкоциты, которые в больших количе-
ствах выходят из кровеносных сосудов. За ними следуют моноциты
(макрофаги) и местные гистиоциты, которые образуют второй слой
вокруг инородного тела, фагоцитируя погибающие нейтрофилы, раз-
рушенные ткани и очищая пораженную область от некротизирующих-
ся остатков пораженных тканей (погибающих фибробластов, волокон,
основного вещества). Регуляция интенсивности всех этих процессов
осуществляется тучными клетками и приходящими сюда из сосудов
базофилами (стимулирующий эффект) и эозинофилами (тормозящий
эффект) (рис. 97, А, Б).
Второй этап воспалительных процессов начинается с активации
фибробластических элементов которые размножаясь, образуют вокруг
воспалительного очага фибробластическую капсулу (рис. 97, В). От-
носительно их происхождения у высших позвоночных существует
Двоякое мнение. Большинство авторов считают, что они в основном
развиваются за счет размножения местных малодифференцированных
Механоцитов, тогда как меньшая часть авторов высказывает мнение о
наличии особой популяции короткоживущих фибробластов гематоген-
ного происхождения. При благоприятном течении воспалительного
291
процесса инородное тело может быть надежно изолировано от живых
тканей фибробластической капсулой. При ее близком контакте с кож-
ным эпителием может произойти эпителизация внутренней поверхнос-
ти капсулы, тогда инородное тело будет выведено в наружную среду
(рис. 97, Г).
Рис. 97. Инкапсуляция инородного тела у млекопитающих.
А — сосудистая фаза и тромбообразоваиие; Б — клеточная фаза (образование
лейкоцитарного вала); В — образование фибробластической капсулы, Г — врас-
тание эпидермиса и удаление инородного тела
(no Е. Н. Горышиной н О. ГО. Чаге, 1990):
1 — инородное тело, 2 — эпидермис, 3 — соединительная ткань, 4 — сосун,
5 — белый тромб, 6 — нейтрофил, мигрирующий через стенку сосуда, 7
тучная клетка, 8 — лимфоцит, 9 — эозинофил, 10 — нейтрофил, И — макро-
фаг лейкоцитарного вала, 12 — фибриновый сгусток, 13 — фибробласт, 14 —
коллагеновые волокна.
292
Беспозвоночные животные. У некоторых беспозвоночных уда-
стся наблюдать последовательную цепь развития событий при попа-
дании инородных тел во внутреннюю среду организма, сходную с
таковой позвоночных . Типичный и наиболее хорошо изученный при-
мер этого могут дать брюхоногие моллюски. У них клеточные реакции
в тканях внутренней среды на инородное тело так же, как и у позво-
ночных, начинаются с реакции свободных элементов тканей внутрен-
ней среды, преимущественно амебоцитов, обладающих фагоцитарной
активностью. Амебоциты наряду с фагоцитозом осуществляют инкап-
суляцию инородного тела, при этом клетки наружных слоев капсулы
приобретают способность к выработке основного вещества и коллаге-
новых волокон, превращаясь в фибробласты.
Менее ясные представления об описанных выше процессах име-
ются относительно аннелид. У немногих представителей этого типа
щученных современными методами, показана инкапсуляция инород-
ных тел свободными амебоцитами с ярко выраженной фагоцитарной
активностью. Однако достоверных данных о превращении части из
них в фибробласты на поздних стадиях, как у моллюсков, в литературе
нет. Возможно, что фибробластическая реакция у аннелид, как и у
позвоночных, не связана с метаплазией свободных клеточных элемен-
тов тканей внутренней среды.
Несколько иначе развиваются процессы вокруг инородных тел у
животных, обладающих системой гранулярных амебоцитов, у которых
коагуляция в тканях внутренней среды имеет непосредственное отно-
шение к защитным реакциям (членистоногие, оболочники, приапули-
Ды). У этих животных при попадании инородных тел, особенно с
патогенными микроорганизмами, имеет место не столько фагоцитарная
реакция со стороны специальных фагоцитов, сколько дегрануляция
гранулярных амебоцитов (рис. 98), которая приводит к «пленочной»
инкапсуляции инородных тел и патогенных микроорганизмов (рис. 98,
В, Д). При этом образующиеся белковые пленки, особенно при их
склеротизации фенолоксидазной системой, обладают отчетливо выра-
женными цитотоксическими свойствами в отношении патогенных мик-
роорганизмов и грибов.
У насекомых в дополнение к пленочной инкапсуляции на заклю-
чительных этапах развития клеточных реакций может происходить и
инкапсуляция очага поражения специальными плазмоцитами, форми-
рующими капсулу вокруг инородных тел и часто вокруг миелинизи-
рованной пленки межклеточного вещества, образованного ранее гра-
нулярными амебоцитами. Эта капсула состоит из нескольких слоев
Уплощенных клеток, не выделяющих, однако, заметных количеств
межклеточного вещества (4).
293
Рис. 98. Защитные реакции у насекомых.
а — гранулоцит; б — образование тромба при повреждении кутикулы;
в — иммобилизация бактерий путем формирования меланизнрованного
узелка; г — коагуляция гемолимфы; д — инкапсуляция инородного тела;
е — формирование базальнгой мембраны под гиподермой во время линь-
ки (по Е. Н. Горышиной и О. Ю. Чаге, 1990):
7 — гиподерма, 2 — кутикула, 3 — тромб, 4 — плазмоциты, 5 — бакте-
рии, 6 — разрушенные гранулоциты, 7 — гель, 8 — меланизированное
межклеточное вещество, 9 —- инородное тело, 70 — базалг ная мембрана.
294
Таким образом, краткий обзор клеточных реакций при воспали-
тельных новообразованиях в тканях внутренней среды некоторых мно-
гоклеточных животных выявил и в них наличие общих механизмов у
животных, далеко отстоящих в филогенетическом отношении (позво-
ночные и моллюски, а возможно, и аннелиды). Кроме того, в этих
реакциях отчетливо выявляются и два других общих свойства системы
тканей внутренней среды: единство всех ее компонентов и большая
пластичность системы, что особенно ярко проявляется у млекопитаю-
щих и человека.
Процессы "оспалительного новообразования, или, точнее, клеточ-
ные защитные реакции, у высших беспозвоночных существенно отли-
чаются от таких реакций у других беспозвоночных (моллюски, анне-
лиды) и позвоночных животных.
ЛИТЕРАТУРА
Вашкинеяь В. К.. Петров М. И. Ультраструктура н функция тромооцитов
человека. Л., 1982.
Горышина Е И, Чага О. Ю. Сравнительная гистология тканей внутрен-
ней среды с основами иммунологии. Л., 1990. С. 168-251.
Капр Я. Макрофаги. М., 1978.
Маянский Л. Н. Маянский Д. Н. Очерки о нейтрофиле и макрофаге.
Новосибирск, 1989.
Появвщиков А. В.. Назаров П. Г. Иммуноцитотропные эффекты С-реактив-
ного белка // Иммунология. 1993. № 4.
Аэ.ч А.. Кормак Д. Гистология. М., 1983. Т. 2. С. 127-152.
Immunity in Invertebrates / Ed. Brchlein M. Berlin. 1986.
Invertebrate Immunity: Another Viewpoint // Scand.’.Immuno! 1992. Vol. 35.
P. 247-266.
Ratcliffe H. A., Rowley A. T. et al. Invertebrate immunity: basic concepts and
recent advances // Inter.Rev.Cytol. 1985. Vol. 97.
Stevens R., Austen F. Recent advances in the cellular and molecular biology of
Mast sells // Immunology Today. 1989. Vol. 10.
ГЛАВА 5. Лимфоидная ткань
§1 . ПРОИСХОЖДЕНИЕ И ОБЩАЯ ХАРАКТЕРИСТИКА
ЛИМФОИДНОЙ СИСТЕМЫ ПОЗВОНОЧНЫХ животных
Как было показано в предыдущей главе, в тканях внутренней
среды многоклеточных имеются сложные и многообразные гумораль-
ные и клеточные защитные механизмы. Вероятной эволюционной ос-
новой защитных реакций послужила способность к фагоцитозу у по-
295
Таким образом, краткий обзор клеточных реакций при воспали-
тельных новообразованиях в тканях внутренней среды некоторых мно-
гоклеточных животных выявил и в них наличие общих механизмов у
животных, далеко отстоящих в филогенетическом отношении (позво-
ночные и моллюски, а возможно, и аннелиды). Кроме того, в этих
реакциях отчетливо выявляются и два других общих свойства системы
тканей внутренней среды: единство всех ее компонентов и большая
пластичность системы, что особенно ярко проявляется у млекопитаю-
щих и человека.
Процессы "оспалительного новообразования, или, точнее, клеточ-
ные защитные реакции, у высших беспозвоночных существенно отли-
чаются от таких реакций у других беспозвоночных (моллюски, анне-
лиды) и позвоночных животных.
ЛИТЕРАТУРА
Вашкинеяь В. К.. Петров М. Н. Ультраструктура н функция тромооцитов
человека. Л., 1982.
Горышина Е И, Чага О. Ю. Сравнительная гистология тканей внутрен-
ней среды с основами иммунологии. Л., 1990. С. 168-251.
Капр Я. Макрофаги. М., 1978.
Маянский Л. Н. Маянский Д. Н. Очерки о нейтрофиле и макрофаге.
Новосибирск, 1989.
Появвщиков А. В.. Назаров П. Г. Иммуноцитотропные эффекты С-реактив-
ного белка // Иммунология. 1993. № 4.
Аэ.ч А.. Кормак Д. Гистология. М., 1983. Т. 2. С. 127-152.
Immunity in Invertebrates / Ed. Brehlein M. Berlin. 1986.
Invertebrate Immunity: Another Viewpoint // Scand.’.Immuno! 1992. Vol. 35.
P. 247-266.
Ratcliffe N. A., Rowley A. T. et al. Invertebrate immunity: basic concepts and
recent advances // Inter.Rev.Cytol. 1985. Vol. 97.
Stevens R., Austen F. Recent advances in the cellular and molecular biology of
Mast sells // Immunology Today. 1989. Vol. 10.
ГЛАВА 5. Лимфоидная ткань
§1 . ПРОИСХОЖДЕНИЕ И ОБЩАЯ ХАРАКТЕРИСТИКА
ЛИМФОИДНОЙ СИСТЕМЫ позвоночных животных
Как было показано в предыдущей главе, в тканях внутренней
среды многоклеточных имеются сложные и многообразные гумораль-
ные и клеточные защитные механизмы. Вероятной эволюционной ос-
новой защитных реакций послужила способность к фагоцитозу у по-
295
движных клеточных элементов фагоцитобласта. Часть его клеток после
возникновения специального кишечного эпителия не утратила способ-
ности к фагоцитозу и стала совершенствоваться как защитная система,
предохраняющая организм от патогенных микроорганизмов и от вы-
шедших из-под контроля собственных клеточных элементов. Именно
рост числа клеток в организме, становление и углубление тканевой
дифференцировки были двумя главными факторами, определившими
появление и совершенствование системы распознавания «свое—чу-
жое» и возникновение иммунных реакций. Следовательно, возникно-
вение иммунной системы позвоночных и аналогичных систем беспо-
звоночных стало естественным следствием, своеобразной платой за
повышение уровня организации и тонкую специализацию клеток и
тканей. У разных типов организмов эволюция этой защитной системы
шла различными путями. У всех высших многоклеточных имеется уже
весьма дифференцированная защитная система, обеспечивающая воз-
можность существования животных в современных условиях.
Особенно сложная задача по реализации защитной функции и
функции сохранения клеточного гомеостаза стояла перед позвоночны-
ми животными с их большими размерами, длительными сроками жиз-
ни, большим количеством камбиальных тканей и теплокровностью у
высших представителей. По-видимому, в связи с указанными особен-
ностями позвоночных, в их тканях внутренней среды дифференциров-
ка защитной субсистемы достигла максимальной сложности. Лимфо-
идная (иммунная) система позвоночных стала третьей важнейшей ин-
тегративной гомеостатической системой (вместе с нервной и эндокрин-
ной), главной задачей которой стало поддержание антигенного гоме-
остаза организма и контроль за однородностью клеточной популяции,
защита от мутантных и опухолевых клеток. Лимфоидная система также
может подключаться и к борьбе с паразитическими прокариотами и
грибами, хотя в большинстве случаев рассмотренные выше гумораль-
ные и клеточные факторы неспецифической защиты сами успешно
решают эту задачу. Лимфоидная система — наиболее сложная и со-
вершенная защитная регуляторная система многоклеточных животных.
Она подразделяется на центральные и периферические органы. В цент-
ральных органах происходит созревание и дифференцировка лимфо-
идных клеток. Этими центральными органами являются вилочковая
железа (тимус), красный костный мозг, фабрициева сумка (бурса) птиц,
эмбриональная печень и желточный мешок. В периферических органах
лимфоидной системы происходят заключительные этапы созревания
лимфоидных клеток, их активация и кооперация, размножение, миг-
рация и эффекторные реакции. Периферическими органами являются
лимфатические узлы (более 2000 у человека), белая пульпа селезенки,
296
лимфоидные скопления по ходу кишечника, дыхательных и мочепо-
ловых путей, окологлоточное лимфоидное кольцо, а также перифери-
ческая кровь. По месту созревания и структуре специфических распо-
знающих рецепторов большинство лимфоцитов подразделяется на два
класса: Т-лимфоциты, созревающие в тимусе (thymus) и В-лимфопиты,
созревающие в красном костном мозге (bone marrow) у млекопитаю-
щих или в фабрициевой сумке (bursa) у птиц.
Не определенное пока положение в защитных системах тканей
внутренней среды занимают так называемые натуральные киллеры
(рис. 99). Они не обладают антигенраспознающими рецепторами В
или Т-лимфоцитов. Наиболее вероятным местом их образования как
и В-клеток, является красный костный мозг,. Однако другой важной
особенностью натуральных (естественных) киллеров, или NK-клеток
(Natural Killer cells), является их способность к синтезу интерлейкина-2
и наличие рецепторов к нему, что сближает NK-клетки с лимфоцитами
Т-системы иммунитета. Долгое время морфология NK-клеток остава-
лась неясной. В последние годы NK-клеточные функции все чаще
связывают с большими гранулярными лимфоцитами (LGL — large
granular lymphocytes) (рис. 99). Именно эти лимфоциты синтезируют
СРБ и встраивают его в плазмалемму.
Уничтожение клеток-мишеней происходит путем формирования
в их плазматической мембране нерегулируемых клеткой каналов, стен-
ка которых образована особыми белками-перфоринами. Натуральные
1
Рис. 99. Естественный или натуральный «киллер».
1 =— азурофильные гранулы, 2 — аппарат Гольджи, 3 центриоль.
297
киллеры находят чужеродную или измененную собственную клетку,
вступают с ними в непосредственный контакт и выделяют из гранул
путем экзоцитоза сложный белковый комплекс. Деятельности этих
клеток часто приписывают важную роль в борьбе со злокачественными
новообразованиями.
По определению иммунологов, к иммунным реакциям относятся
защитные реакции, развивающиеся с латентным периодом и характе-
ризующиеся строгой специфичностью и памятью. При вторичном по-
падании агента реакция на него развивается быстрее и более интен-
сивно — организм помнит о встрече с этим агентом.
Важным критерием иммунных реакций считается участие в них
в качестве рецепторных, регуляторных и эффекторных молекул белков
суперсемейства иммуноглобулинов, возникших, вероятно, в результате
многократной дупликации и дивергенции одного исходного гена.
Условно различают реакции гуморального и клеточного иммуни-
тета. Однако Т- и В-системы теснейшим образом связаны между
собой — система В-лимфоцитов не может реагировать на большинство
антигенов без участия Т-системы и, наоборот, в реакциях клеточного
иммунитета часто принимает участие и система гуморального имму-
нитета своим эффекторным звеном.
Реакции гуморального и клеточного иммунитетов слагаются из
трех звеньев: рецепторного, регуляторного и эффекторного. Рецептор-
ное звено участвует в распознавании чужеродного объекта лимфоид-
ными клетками. Наиболее сложно организовано регуляторное звено.
Оно участвует в регулируемом размножении и дифференцировке ос-
новных реагирующих клеток, а также в подготовке к нейтрализации
объекта атаки. Последнее осуществляется либо путем агрегации и
преципитации чужеродных молекул, либо опсонизацией клеток, под-
лежащих уничтожению. Наконец, действие эффекторного звена реак-
ций иммунитета осуществляется либо фагоцитозом комплекса анти-
ген-антитело, либо цитотоксическим или гуморальным токсическим
действием на клетки-мишени.
§2 . РЕАКЦИИ ГУМОРАЛЬНОГО ИММУНИТЕТА
Общая характеристика реакции
Проявлением иммунной реакции, протекающей по гуморальному
пути, является повышение в крови уровня специфических антител (АТ,
иммуноглобулинов) в ответ на введение антигена (АГ). Гуморальные
иммунные реакции требуют кооперации макрофагов, Т- и В-лимфо-
цитов, и направлены главным образом против прокариотов.
298
Антигены — это вещества, несущие признаки генетической чу-
жеродности и способные вызывать иммунный ответ. Антигенами (АГ)
являются все белки и пептиды, состоящие из 8 или более аминокислот
(в том числе гормоны, ферменты, сывороточные, яичные и молочные
белки), углеводы, нуклеиновые кислоты, некоторые липиды (лецитин,
холестерин), а также разнообразные комплексы перечисленных ве-
ществ. Иногда в роли антигенов выступают низкомолекулярные син-
тетические вещества, например лекарственные препараты. Их антиген-
ные свойства значительно усиливаются при комплексировании с боль-
шими молекулами, например сывороточным альбумином или структу-
рами гликокаликса эритроцитов. По степени чужеродности различают
аутоантигены (АГ самого организма), изоантигены (АГ генетически
идентичной особи), аллоантигены (АГ другой особи своего вида) и
кселоантигены (АГ особей других видов).
Ответом организма на введение АГ является синтез антител (АТ),
специфичных к этому антигену, что является результатом первичного
гуморального иммунного ответа. Увеличение количества антител, спе-
цифичных к данному антигену, происходит не сразу, а через опреде-
ленный латентный период (несколько дней). При повторном введении
этого же антигена специфическая реакция на него развивается быстрее,
уровень образующихся антител выше и реакция продолжается дольше,
чем при первой встрече организма с антигеном. Такая усиленная ре-
акция называется вторичным иммунным ответом.
С антителом взаимодействует не вся молекула АГ, а лишь ее
небольшой участок, именуемый антигенной детерминантой. Одна мо-
лекула АГ может иметь десятки и сотни разных антигенных детер-
минант. Чем больше детерминант имеет АГ и чем они разнообразнее
по структуре, тем сильнее иммунный ответ. Поэтому попадание АГ в
организм вызывает активацию множества разных клонов В-лимфо-
Цитов и продукцию АТ, распознающих разные антигенные детер-
минанты.
Крупным успехом в развитии иммунологии и биологии лимфо-
идной ткани было выяснение, какие клетки образуют антитела (или
иммуноглобулины, 1g, они же у(гамма)-глобулины) и что собой пред-
етавляют эти белки. Иммуноглобулины продуцируются клонами плаз-
матических клеток, которые проявляются в организме в больших ко-
личествах на 3—5-е сутки после введения антигена и являются финаль-
ной стадией дифференцировки В-лимфоцитов. Эти клетки превышают
по размерам малые лимфоциты и содержат в цитоплазме мощно раз-
витый белоксинтезирующий аппарат (рис. 100). При этом клетки одно-
го клона выделяют иммуноглобулины одной и той же специфичности.
299
Все иммуноглобулины построены по одному принципу. Они со-
стоят из легких и тяжелых цепей, которые, в свою очередь, построены
Рис. 100. Плазматическая клетка.
I — ядрышко, 2 — шероховатая ЭПС, 3 — аппарат Гольджи, 4 — центриоль,
5 — митохондрия, 6 — глыбки хроматина.
из особых участков — доменов. Каждый домен представлен участком
белковой цепи длиной в 110—112 аминокислот, образующим характер-
ную глобулу. Легкая цепь состоит из двух доменов, а тяжелая — из
четырех или пяти (рис. 101, Л, 5). Краевые домены легкой и тяжелой
цепей на переднем конце молекулы образуют ее активный центр,
обеспечивающий специфическое взаимодействие с антигеном. Домены
тяжелой и легкой цепей образуют характерную щелевидную структуру,
в стенке которой в домене легкой цепи имеется три, а в домене
тяжелой цепи четыре легко мутирующих гипервариабельных участ-
ка (рис. 101, В, Г). Вариантов разной конфигурации щели в антиген-
связывающем центре молекулы у мыши около 108. Активные центры
узнают конфигурацию антигенных детерминант молекул антигенов.
300
Рис. 101. Строение молекул иммуноглобулинов.
а — мономерная форма иммуноглобулина М; б — функциональное членение мо-
лекулы иммуноглобулина; в — структура вариабельного домена; г — укладка ва-
риабельного домена по данным рентгеноструктурного анализа (по Е. Н. Горышн-
ной и О. Ю. Чаге, 1990):
FW|, FWi, FWj — фрагменты, обрамляющие HV], HVj, HVj гипервариабельные
участки; заштрихованы области контакта с вариабельным доменом легкой цепи.
Остальные домены молекулы иммуноглобулинов (один в легкой и три-
четыре в тяжелых цепях) характеризуются постоянством своей струк-
туры. У млекопитающих имеется два варианта легкой цепи — каппа-
и лямбда-цепи, и-5 вариантов тяжелой. Структура константной части
тяжелой цепи определяет класс молекулы иммуноглобулинов.
Для млекопитающих это классы М, D, G, Е и А Чаще всего они
представляют собой гетеродимеры и состоят из двух тяжелых и двух
легких цепей (D, G, Е). Иммуноглобулины классов М и А имеют более
сложную структуру (пять димеров и два-четыре димера соответствен-
но). Связь димеров в молекулах осуществляется специальными белка-
ми. В иммуноглобулинах классов D, G и Е связь цепей в молекуле
обеспечивается S—S-связями (рис. 102). В константной части молекул
иммуноглобулинов некоторых классов (М, G) имеется центр связи с
факторами комплемента. Однако этот центр открывается только в
комплексе антиген—антитело. Важную роль в функционировании ан-
301
тител играют концевые участки молекул, так называемые Fc-фрагмен-
ты К ним у всех лейкоцитов и некоторых других клеток имеются
специальные рецепторы.
Каждый из перечисленных классов иммуноглобулинов имеет свою
функциональную специализацию. Наиболее крупные и наиболее древ-
ние иммуноглобулины класса М (IgM) обладают хорошей преципити-
рующей и агглютинирующей активностью, поскольку каждая молекула
имеет 10 активных центров для связывания с антигеном (рис. 102).
1»М является мощнейшим фактором противомикробного действия. Оп-
сонизирующая роль иммуноглобулинов этого класса ме-нее значитель-
на, поскольку Fc-фрагменты сосредоточены внутри молекулы. Мем-
бранная форма IgM в виде димеров с гидрофобным участком в области
последнего домена тяжелой цепи играет роль антигенраспознающих
рецепторов В-лимфоцитов.
Рис. 102. Иммуноглобулины млекопитающих (по Е. Н. Горышиной и
О. Ю. Чаге, 1990).
Черными кружками обозначены вариабельные домены; белыми — константные
домены; SC — секреторный компонент.
IgA циркулирует в крови, где по концентрации занимает второе
место после IgG, однако основная активность иммуноглобулинов этого
класса связана с поверхностями эпителиев слизистых оболочек желу-
дочно кишечного, дыхательного и мочеполового трактов, где IgA при-
о ретает огромную противовирусную активность, блокирует антиген-
ные детерминанты и ингибирует адгезию прокариотов к эпителиям
изистых, а также рост и ферментативную активность микробов. IgA
302
в димерной (рис. 102) или тетрамерной форме захватывается эпители-
оцитами из плазмы, транспортируется через клетки и выводится на
поверхность для встречи и нейтрализации АГ еще до его попадания
в организм. При этом переносе к полимеризованным молекулам IgA
присоединяется секреторный компонент (SC, secretory componenet)
(рис. 102), который является остатком рецептора, переносящего IgA
из плазмы на поверхность эпителия. По современным представлениям
SC не имеет большой функциональной нагрузки.
Широко распространены «молодые » иммуноглобулины класса G,
представленные в геноме млекопитающих в виде четырех вариантов.
Они характеризуются повышенной прочностью связи с антигенными
детерминантами (усиливающимися в ходе иммунной реакции и при
вторичном ответе). Кроме того, это основные опсонины для фагоцитов
и системы комплемента, поскольку у нейтрофилов и макрофагов к
Fc-фрагменту этих иммуноглобулинов, связанных с антигеном, име-
ются многочисленные рецепторы.
Иммуноглобулины класса Е — это так называемые цитофильные
антитела. К их Fc-фрагменту у тучных клеток и базофилов есть спе-
циальные рецепторы. Клетки, вооруженные, или армированные, этими
иммуноглобул инами в случае функционирования активных антиген-
распознающих центров молекул, интенсивно дегранулируют, вызывая
развитие местных воспалительных реакций. Кроме IgE, с этими рецеп-
торами базофилов и тучных клеток могут связываться иммуноглобу-
ыны одного из подклассов IgG (IgG4 у человека).
Менее ясно функциональное значение иммуноглобулинов класса
D. Считается, что они служат для обеспечения сложных межклеточных
взаимодействий в иммунной системе, в частности при созревании
В-лимфоцитов. Вместе с мембранной формой иммуноглобулина класса
М IgD молекулы играют роль рецепторов В-лимфоцитов. Такая соэкс-
прессия генов, кодирующих иммуноглобулины разных классов в одной
и той же клетке, возможна потому, что гены, кодирующие константные
участки иммуноглобулинов класса М и D, расположены рядом. Пере-
ключение синтеза иммуноглобулинов с класса М на другие классы
происходит на уровне предшественников мРНК механизмами альтер-
нативного сплайсинга (рис. 103, Л) Сущность процесса такого сплай-
синга заключается в возможности получения из общего транскрипта,
содержащего информацию о доменах иммуноглобулинов класса М и
класса D, зрелые иРНК либо для IgM (отрезание хвостового участка
транскрипта), либо для IgD (вырезание участка, содержащего инфор-
мацию для константных доменов IgM). Переключение на синтез им-
муноглобулинов других классов происходит у млекопитающих на
303
уровне ДНК. Здесь образуется петля, и нетранскрибируемые участки
ДНК удаляются из генома в ходе утке антигензависимой дифференци-
ровки В-лимфоцитов (рис. 103, Б).
Антигеннезависимая дифференцировка В-лимфоцитов
Следующим важным этапом в изучении реакции гуморального
иммунитета было выяснение источников формирования плазматичес-
ких клеток и генетических механизмов возникновения колоссального
многообразия вариабельных доменов молекул иммуноглобулинов. Ис-
точником возникновения плазматических клеток оказались В-лимфо-
циты, количество клонов которых в организме оказалось равным ко-
личеству вариантов антигенсвязывающих центров молекул иммуног-
лобулинов, т. е. порядка 108.
Каждый клон В-лимфоцитов отличается от другого клона по
структуре вариабельных доменов, экспрессированных на поверхнос-
ти лимфоцитов и встроенных в мембрану иммуноглобулинов, играю-
щих роль антигенсвязывающих рецепторов. Сначала в ходе созревания
В-лимфоцитов, протекающем у млекопитающих в красном костном
мозге, на мембранах клеток появляются IgM-рецепторы. Это означает,
что лимфоцит встал на В-клеточный путь дифференцировки. Позднее
появляются IgD-рецепторы, что означает завершение реаранжировки
иммуноглобулиновых генов и установление антигенной специфичнос-
ти клона. Механизмы этой реаранжировки рассмотрены ниже. Кроме
этих рецепторов на поверхности В-лимфоцитов экспрессированы ре-
цепторы гистосовместимости II класса (характерные рецепторы, пред-
ставляющие антиген системе лимфоцит—Т-хелпер), а также различные
рецепторы к специфическим медиаторам, выделяемым макрофагами и
регуляторными Т-лимфоцитами.
В настоящее время уже известны генетические механизмы фор-
мирования удивительного многообразия вариабельных доменов у мле-
копитающих (мышь, кролик). Эти механизмы действуют в основном
в период так называемой антигеннезависимой дифференцировки В-
лимфоцитов.
В геноме полустволовой клетки лимфоидной системы (пре-В-лим-
фоцита предшественника В-лимфоцитов) информация о вариабель-
ном домене тяжелой цепи представлена у мыши 500 основными ва-
риантами гена, 15 вариантами, повышающими разнообразие (diversity)»
участками D и 4 вариантами связующих Y-участков.
ри формировании конкретного клона лимфоцитов из этих треХ
участков образуется путем свободной комбинации ген вариабельного
домена (рис. 103, А). При этом все участки ДНК, расположенные
304
4 V2 VJ Vn ^1-15 C|1 c8 Cy Ca ce
-I PEhO—П—МНННЗНЗНЗПЕН лнк
I
4 4V3B3 c^c^c,
-DTHTT—ПРГЬПП- дик
vsB3 Tcr ce
-ГТ1—QO~ иРНК
VjDJCj
-EO и phk
I —i & белок
=5= Ig-D
Puc. 103. Генетические механизмы кодирования синтеза тяжелой цепи иммуно-
глобулинов у мыши.
а — расположение генов у полусгволовой клетки (I), его изменение при форми-
ровании клона В-лимфоцита (И — реаранжировка генов), механизмы переключе-
ния синтеза иммуноглобулинов классов М н О G11 н IV) путем альтернативного
сплайсинга; б — механизмы переключения синтеза иммуноглобулинов класса
G, А и Е путем вылепливания ДНК (по Е. Н. Горышиной и О. Ю. Чаге, 1990):
VI—Vj — гены, кодирующие основную часть вариабельных доменов, Di-is
и J1-4 — варианты дополнительных участков ДНК, используемых при формиро-
вании геров вариабельных доменов; Сц, С«, Су, Со, Се — гены, кодирующие
константные домены тяжелой цепи соответственно классов М, D, G, А и Е;
SS — сигнальная последовательность нуклеотидов, распознаваемая ферментом
РР, вырезающим участок ДНК.
305
между выбранными участками, элиминируются из генома. Таким об-
разом, в данном случае при дифференцировке В-лимфоцитов (форми-
рование конкретных клонов) имеет место нарушение одной из основ-
ных генетических догм, объясняющих процессы цитодифференциров-
ки, по которой эти процессы связаны не со структурной перестройкой
ДНК а со стойким изменением механизмов, управляющих работой
генома.
Биологический смысл такого исключения понятен. При описанном
выше механизме, так называемой реаранжировке гена вариабельного
домена тяжелой цепи, создается возможность образования большого
разнообразия генов при использовании относительно небольшого ис-
ходного участка молекулы ДНК.
Аналогично организованы гены легких цепей иммуноглобулинов
мыши. Решающий вклад в изучение рекомбинации иммуноглобулино-
вых генов внесли работы С. Тонегавы в 1980-81 гг. Проще всего
устроен ген легкой цепи Л (лямбда). Вариабельный домен кодируется
двумя участками, J-участок также имеет 2 варианта, а константному
участку соответствует 5 разных копий, одна из которых экспрессиру-
ется только в эмбриональном состоянии. Для к (каппа) цепи характерно
не менее 200 вариантов У-участка, 5 вариантов J-участка (из которых
работоспособны 4) и лишь один вариант константного домена. Гены
легких цепей, в отличие от тяжелых, не имеют D-участков.
Увеличение многообразия образующихся генов усиливается еше
и возможностью неточной сшивки участков гена за счет соматических
мутаций в этой области и, наконец, использования лежащих рядом с
основными вариантами вариабельных доменов участков ДНК путем
так называемой конверсии. Часть этих процессов, по-видимому, может
иметь место и в зрелых В-лимфоцитах (соматические гипермутации).
Они играют существенную роль в обеспечении появления антител с
большим соответствием антигенным детерминантам. Особенно боль-
шой биологический смысл имеет эта пластичность вариабельных до-
менов у активированных В-лимфоцитов. Основные процессы генети-
ческих преобразований совершаются в геномах предшественников В-
лимфоцитов в эмбриогенезе. У млекопитающих эти процессы проис-
ходят в основном в печени и красном костном мозге эмбрионов. У
птиц и представителей других классов позвоночных для этой цели
имеются специальные центральные органы системы гуморального им-
мунитета, в частности у птиц так называемая фабрициева сумка в
о ласти клоаки. Окончательное созревание В-лимфоцитов происходит
уже в периферических органах лимфоидной системы.
306
Антигензависимая дифферецировка В-лимфоцитов
В настоящее время изучены в основных чертах механизмы акти-
вации В-лимфоцитов, приводящие к так называемой их антигензави-
симой дифференцировке. Эти процессы для небольшого количества
так называемых сильных или тимуснезависимых антигенов происходят
непосредственно после взаимодействия их с антигенраспознающими
рецепторами соответствующего клона В-лимфоцитов. Эти процессы
обычно и в данном случае происходят в периферических органах
иммунной системы, где и сильные антигены задерживаются специаль-
ными макрофагами (рис. 104). В структуре тимуснезависимых АГ оди-
наковые участки, многократно повторяются. Молекула АГ связывает
множество иммуноглобулиновых рецепторов, сшивает их между со-
бой, что приводит к образованию «шапочки», или кластера рецепторов,
что ведет к активации В-лимфоцита.
Рис. 104. Морфология лимфоидных клеток при ответе на сильные тимуснезавн-
симые антигены.
а — малый лимфоцит — исходная клетка, воспринимающая антигенраспозиаю-
щими рецепторами сильные антигены; б — бласт, в который превращается
лимфоцит после рецепции антигена; в — плазматическая клетка, образующая-
ся в результате деления и дифференцировки бластов (по Е. Н. Горышиной и
О. Ю. Чаге, 1990):
1 — ядро, 2 — цитоплазма, 3 — аппарат Гольджи, 4 — шероховатая ЭПС,
5 — ядрышко.
307
После задействования рецепторов соответствующими антигенны-
ми детерминантами В-лимфоциты начинают претерпевать бласт-транс-
формацию — усиление синтетических процессов, увеличение разме-
ров изменение проницаемости мембран (рис. 104, А, К). Клетка всту-
пает в митотический цикл и начинает энергично делиться. В результате
в течение 4-6 сут. из каждого претерпевшего бластотрансформацию
В-лимфоцита образуется клон из 256 или даже 512 клеток. При этом
все продукты деления превращаются в зрелые плазматические клетки,
синтезирующие антитела, идентичные по своим вариабельным до-
менам антигенраспознающим рецепторам исходного В-лимфоцита
(рис. 104, В). При реакции на тимуснезависимые антигены образуются
ан.тггела только класса М и не образуются клетки памяти. Такие
относительно простые отношения в иммунной системе, как отмечалось
выше, характерны лишь для немногих природных антигенов, облада-
ющих большим количеством одинаковых антигенных детерминант в
молекуле, способных активировать В- лимфоциты. Подавляющее боль-
шинство природных антигенов такой способностью не обладает и
является тимусзависимыми антигенами. Для активации соответствую-
щих им клонов В-лимфоцитов необходимо участие еще 2 клеток —
антигенпредставляющих, или А-клеток, и Т-хелперов, или CD4+ лим-
фоцитов.
В качестве антигенпредставляющих могут использоваться макро-
фаги, В-лимфоциты, некоторые эпителиальные и другие клетки, имею-
щие на своей поверхности рецепторы гистосовместимости типа П
антигена.
Как правило, роль А-клеток выполняют макрофаги. Они в уме-
ренных количествах поглощают путем фагоцитоза молекулы антигена,
частично расщепляют их при помощи своих лизосом и в такой имму-
ногенной форме представляют участки расщепленного антигена на
своих рецепторах гистосовместимости II класса на поверхности клетки
(рис. 105, А-кл, 1а, АГ). Частичное расщепление АГ в фагосомах
макрофага называется процессированием АГ Соединение фрагментов
АГ с молекулами антигенов II класса главного комплекса гистосов-
местимости (МНС II кл., major hystocompatibility coplex) происходит
на уровне аппарата Гольджи. Активированный макрофаг выделяет
целый спектр монокинов, среди которых важнейшими являются TGFb,
интерлейкины 1 и 6. К интерлейкинам (ИЛ) относятся медиаторные
полипептиды, регулирующие иммунный ответ и сопутствующие био-
логичекие реакции. Большинство интерлейкинов является либо-моно-
хожлМИ’ лимФ0Кинами (последние имеют лимфоцитарное проис-
ение). -1 один из самых полифункциональных медиаторов,
308
Рис 105. Взаимодействие клеток при индукции гуморального ответа на сла-
бые тимусзависимые антигены (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
А-кл — клетка, представляющая антиген Акл (макрофаг), АГ — антиген,
T-R — антигенраспознающнй рецептор Т-лимфоцитов; Тж-пре-Т-лнмфоцит —
преамплнфикатор, Т«-Т-лимфоцит — амплнфикатор, пре-Тх-Т-лнмфоцит —
нрсхелпер В, Тх—Т-лнмфоцит — хелпер В, 1g — иммуноглобулиновый антиген-
распознающий рецептор В-лимфоцита, АГ — антитела, ИЛ-1, ИЛ-2 и ФГ« —
лимфокины (интерлейкин-1 и интерлейкин-2 и фактор роста Т-хелперов В);
сплошными стрелками показана трансформация клеток, прерывистыми — дей-
ствие гуморальных факторов; бластотрансформация В-лимфоцитов, деление и
дифференцировка бластов и образование плазмоцитов, синтезирующих разные
классы иммуноглобулинов, а также образование клеток памяти на рисунке не
показаны.
рецепторы для которого имеются на большинстве клеток. Именно этот
медиатор, выделяясь с самого начала защитной реакции, вызывает
гипертермию и координирует работу иммунной и эндокринной систем.
На В-лимфоцитах ИЛ-1 вызывает экспрессию молекул антигена II
класса МНС, способствует повышению числа рецепторов для ИЛ-4 и
ИЛ-2, усиливает размножение предактивированных клеток.
Важнейшим событием гуморального ответа является передача сиг-
налов от активированного макрофага к CD4+ Т-лимфоциту (CD —
единая классификация поверхностных маркеров и рецепторов лейко-
цитов крови человека (англ, cluster of differentiation). Эта клетка по-
лучает от макрофага два сигнала: специфический и неспецифический.
Специфический сигнал состоит в презентации фрагментов АГ, ассо-
циированных с молекулами II класса МНС. При этом структуры II
класса МНС макрофага взаимодействуют с CD4-peuenropoM, этим под-
тверждается принадлежность макрофага и Т-клетки защитной системе
309
одного организма и возможность реакции на АГ путем гуморального
иммунного ответа. Сам фрагмент АГ распознается специфическим
рецептором Т-клетки, структура которого будет рассмотрена ниже
(рис 105, 109). Неспецифический сигнал заключается в рецепции Т-
лимфоцитом ИЛ-1. После получения этих двух сигналов Т-лимфоцит
возвращается из О°-периода в клеточный цикл, проходит бластотранс-
формацию, активно пролиферирует, продуцирует медиаторы и рецеп-
торы.
Для запуска бластотрансформации специфического клона В-лим-
фоцитов также требуются два сигнала. Специфический состоит в пре-
зентации АГ Т-клеткой В- лимфоциту. При этом также проверяется
совместимость клеток по антигенам II класса МНС. Неспецифический
сигнал (или сигналы) заключается в действии ИЛ-4 на В-клетки. Этот
медиатор имеет Т-клеточную природу и является главным фактором
пролиферации В-лимфоцитов. Меньшая, но все же значительная роль
принадлежит ИЛ-2, ИЛ-10 и некоторым другим Т-клеточным факто-
рам. Результатом их кооперативного воздействия становится бласто-
трансформация В-лимфоцитов соответствующего клона и их диффе-
ренцировка в плазматические клетки.
Для переключения синтеза на иммуноглобулины других классов
той же антигенной специфичности необходимы дополнительные воз-
действия со стороны гуморальных факторов, выделяемых Т-лимфоци-
тами, прежде всего ИН-4 и ИН-5. Интерлейкин-5 также необходим и
для образования клеток памяти в В-системе. После воздействия этих
факторов продукты размножения бластов не дифференцируются в
плазматические клетки, а сохраняют свой относительно слабо диффе-
ренцированный характер, превращаясь в клетки памяти. Благодаря
клеткам памяти вторичный ответ на попадание данного антигена ока-
зывается более эффективным. Таким образом, большинство реакций
гуморального иммунитета основывается на сложном кооперативном
взаимодействии разных категорий лимфоидных клеток.
Периферические органы лимфоидной системы
Для успешной реализации кооперативных взаимодействий клеток
необходима сложная структурная организация органов, обеспечиваю-
щих эти взаимодействия. У млекопитающих такие периферические
органы лимфоидной системы представлены тремя категориями: а) лим-
фоидными скоплениями под слизистыми оболочками пищеваритель-
ного и мочеполового трактов и дыхательных путей, лишенных соеди-
нительно тканной капсулы, б) лимфатическими узлами, покрытыми
капсулой, в) селезенкой. Нетрудно догадаться, что располагаются они
310
на возможных путях проникновения инфекции в организм: через сли-
зистые оболочки, из тканей с током лимфы и, наконец, из основной
транспортно- распределительной системы организма — кровеносной
системы.
Естественно, что каждая категория периферических органов имеет
свои специфические особенности, но все они построены по одному
принципу. Охарактеризуем его суть на примере лимфатического узла.
Любой периферический орган должен задержать и представить анти-
ген, обеспечить возможность взаимодействия всех категорий клеток,
участвующих в реакции, и обеспечить интенсивную репопуляцию,
обновление клеточного состава в органе. Одними из наиболее совер-
шенных органов лимфоидной системы, где успешно решаются эти
задачи, и являются лимфатические узлы (рис. 106). Эти органы рас-
положены по ходу лимфатических сосудов. В них открывается боль-
шое количество приносящих лимфатических сосудов (5), а лимфа
выносится по одному - двум выносящим (9). Это уже создает условия
для замедления тока лимфы в целой системе синусов, начиная с
краевого и кончая выносящими синусами в мозговом веществе (6, 7).
Синусы имеют выстилку, стенки синусов снабжены многочисленными
порами, строма узла образована ретикулярными клетками и волокнами
(10). Ретикулярные или аргирофильные волокна лимфатических узлов
в принципе являются обычными коллагеновыми волокнами, которые
покрыты густой «корой» из полисахаридов, связывающих серебро при
гистологической окраске. Появление этого полисахаридного слоя име-
ет свое объяснение. Коллагены в целом имеют сходный аминокислот-
ный состав (а следовательно, и общие антигенные детерминанты) у
представителей разных видов. Однако в лимфатическом узле, где идет
постоянный процесс распознавания «свое-чужое», наличие таких об-
щих детерминант может вызвать выработку АТ против аутоантигенов
коллагена. Поэтому такие чувствительные структуры должны быть
надежно защищены, экранированы от собственных иммунокомпетент-
ных клеток. В состав стромы в глубоких слоях коркового вещества (в
так называемой паракортикальной тимусзависимой зоне) входят ин-
тердигитирующие клетки — отростчатые макрофаги, а в состав основ-
ной части коркового вещества — дендритные клетки. Отростчатые
макрофаги наряду с обычными макрофагами, сосредоточенными и в
синусах, и в строме, являются в основном А-клетками, задерживаю-
щими и представляющими антиген. Дендритные клетки также задер-
живают антигены и комплексы антиген-антитело, что, по-видимому,
необходимо дл« развития вторичных реакций гуморального имму-
нитета
311
312
Снаружи J зел окружен капсулой из плотной соединительной тка-
ни (/), которая, проникая местами внутрь узла, делит его корковое
вещество на отсеки-дольки; каждая из них имеет собственную систему
кровоснабжения, состоящую из артерий, густой сети капилляров и
одной-двух собирающих венул. Стенки венул, расположенных в пара-
кортикальной зоне, построены из особого столбчатого эпителия (23),
способного привлекать из крови лимфоциты, которые в больших ко-
личествах покидают в этих местах кровяное русло и выходят в строму
узла (венулы с высоким эндотелием).
Вторым местом массового проникновения лимфоцитов в строму
коркового вещества являются стенки маргинального синуса, располо-
женного под соединительнотканной оболочкой. Обратное возращение
лимфоцитов в кровь происходит через грудной проток, который впа-
дает в вену, а лимфа в него поступает по лимфатическим сосудам, в
том числе и от многочисленных лимфатических узлов в разных об-
ластях тела.
Таким образом обеспечивается непрерывное обновление популя-
ций лимфоцитов в лимфоузле, или так называемая репопуляция лим-
фоидной ткани. В корковом веществе узла последняя представлена
двумя скоплениями — расположенными более поверхностно вторич-
ными узелками (У /), в центре которых расположены часто энергично
делящиеся бласты, так называемые центры размножения. Во вторич-
ных узелках расположены преимущественно В-лимфоциты и Т-хелпе-
ры. В следующей, глубже лежащей паракортикальной зоне сосредото-
чена основная масса Т-лимофцитов как CD4+ хелперных клеток, так
и CD8+ цитотоксических Т-лимфоцитов и супрессоров, а также Т-лим-
фоцитов, специализированных на реализацию реакций гиперчувстви-
тельности замедленного типа. Такие различия в зональном распреде-
лении разных категорий лимфоцитов в периферических органах лим-
Рис. 106. Лимфатический узел млекопитающих.
1 — соединительнотканная капсула, 2 — трабекула, 3 — приносящие лимфатические
сосуды, 4 — краевой синус, 5 — ретикулярно-эндотелиальные клетки, 6 — синус кор-
кового вещества, 7 — мозговое вещество, 8 — конечный и 9 — выносящий лимфати-
ческие сосуды, 10 — ретикулярные клетки, 11 — вторичные узелки, 12 — мякотные
шнуры, 13 — ретикулярные волокна, 14 — артерии лимфатического узла, 15 — сосуды,
окружающей соединительной ткани, 16 — трабекулярные артерии, 17 — артерии мя-
котных тяжей, 18 — поверхностные и глубокие гемокапиллярные сети, 19 — вены
мякотных тяжей, 20 — трабекулярная вена, 21 — макрофаги в синусах, 22 — лимфо-
циты и плазматические клетки, 23 — эндотелий, 24 — щели между эндотелиальными
клетками, 25 — лимфоцит, проникающий в щель, 26 — базальная мембрана.
313
Приносящие
Макрофаги
Пос’калиллярная
венула
Т-лымфоииты
В-лимфоциты
Посткалиллярная
венула
Фолликулярная
отростчатая клетка
Вена
Артерия
Рис. 107. Распределение Т- н В-лимфоцитов в лимфатическом узле
(по Улумбекову Э. Г., Челышевой Ю. А., 1997).
Светлым показана тимус-зависимая зона, заштрихована — тимус-независимая
зона Т-лимфоциты поступают в паренхиму узла из посткапиллярных венул и
вступают в контакт с фолликулярными отростчатыми клетками
лимфатические
сосуды
н В-лимфоцитами.
фоидной системы определяются, по- видимому, разными «информа-
тивными» свойствами стромы в разных областях органа (рис. 107).
В мозговом веществе также имеются скопления лимфоидных кле-
ток. Это так называемые мякотные шнуры (72), в активных узлах ко-
торых много дифференцированных базофильных плазматических кле-
ток.
У других хордовых животных обнаружены аналогичные законо-
мерности гуморального иммунного ответа. Это выражается не только
в общих генетических механизмах формирования многообразия анти-
генов, но и сходной структуре и общих механизмах функционирования
лимфатических узлов, что было показано на бесхвостных амфибиях.
По этим данным значительная часть антигенов, попадающих в краевой
синус узла поглощается макрофагами и частично используется в пер-
вичном ответе через реакцию гуморального иммунитета. Небольшая
часть антигенов утилизируется при этом по альтернативному пути.
Антигены захватываются особыми «транспортными» макрофагами, ко-
торые не фагоцитируют антиген, а передают его особым дендритичес-
314
КИМ клеткам, расположенным в корковой зоне узла. Эти клетки не
имеют многих характерных для макрофагов рецепторов, хотя основное
их назначение заключается в сохранении своеобразной консервации
антигена и периодической его выдаче Т-хелперам, либо В-лимфоци-
там, либо макрофагам. Консервация антигена производится дендрити-
ческими клетками путем окружения чужеродных частиц цитоплазмой
отростков с образованием характерных вздутий или так называемых
иккосом. Последние могут быть фагоцитированы специальными мак-
рофагами или В-лимфоцитами и представлены на поверхности этих
клеток в иммуногенной форме для Т-хелперов, которые обеспечивают
рецепцию этого антигена локализованными в строме узла клетками
памяти В-системы, образовавшимися еще в период первичного ответа
на этот антиген.
Таких! образом, из приведенного описания структуры лимфоузла
видно что он приспособлен и для задержания антигена, и для обес-
печения кооперативного взаимодействия между различными клетками
в реализации ими первичных и вторичных реакций гуморального им-
мунитета и, как будет видно ниже, реакций клеточного иммунитета.
Развитие системы В-лимфоцитов у позвоночных животных
В настоящее время имеются данные об организации реакций гу-
морального иммунитета у всех классов позвоночных на молекулярном,
:леточном, тканевом и органном уровнях. Однако изученность лим-
фоидной ткани у низших позвоночных в таком сравнительном аспекте
значительно ниже, чем у высших позвоночных, в частности у млеко-
питающих и человека.
Белки, отдаленно гомологичные m-цепи молекулы иммуноглобу-
лина класса М, найдены в целомической жидкости иглокожих. Это
коррелирует и с наличием у них системы ферментов, гомологичных
системе ферментов комплемента.* У круглоротых имеется лишь один
класс иммуноглобулинов — иммуноглобулины класса М.
У представителей других классов позвоночных появляются и дру-
гие классы иммуноглобулинов, однако строгой последовательности,
закономерности в их появлении не наблюдается. Так, в плазме хря-
щевых рыб имеется две разновидности иммуноглобулинов класса М —
чентаиерная и мономерная. Мономерная имеет свободный Fc-фраг-
мент и могла бы служить хорошим опсонином.
У двух неродственных представителей рыб — панцирной щуки и
гУперы — в плазме помимо обычной формы иммуноглобулина класса
* у асцидий можно говорить об обнаружении молекул, гомологичных одновременно
-цепям иммуноглобулинов позвоночных и С-реактивному белку.
315
М имеется и форма с четырьмя доменами тяжелой цепи. У двоякоды-
шаших рыб помимо иммуноглобулина класса М найден иммуногло-
булин класса N.
Пестрая картина наблюдается и у представителей других классов
позвоночных: у хвостатых имеются только иммуноглобулины класса
М, а у бесхвостых еще двух классов X и Y — мономерные сыворо-
точные иммуноглобулины. Они характеризуются более прочным свя-
зыванием с антигеном и оказывают опсонизирующий эффект.
Мономерные сывороточные иммуноглобулины есть у всех классов
позвоночных начиная с бесхвостых амфибий. Их появление коррели-
рует с возникновением иммунологической памяти. Часть их, например,
у рептилий и птиц, также обозначается как иммуноглобулины класса
Y. Однако они не гомологичны иммуноглобулинам класса Y бесхвос-
тых амфибий. Скорее это аналоги или гомологи иммуноглобулинов
класса А млекопитающих.
Анализ данных по разнообразию иммуноглобулинов у позвоноч-
ных животных позволяет сделать вывод о том, что общей тенденцией
в эволюции реакций гуморального иммунитета является увеличение
разнообразия классов иммуноглобулинов по мере повышения уровня
организации животных. Еще один, не менее важный вывод из имею-
щихся данных заключается в том, что в каждом классе позвоночных
животных общая тенденция проявляется, по-видимому, параллельно,
независимо от аналогичных процессов в пределах других классов
позвоночных животных.*
Справедливость второго вывода находит подтверждения и в уже
имеющихся сравнительных данных, полученных при анализе генети-
ческих механизмов формирования разнообразия вариабельных доме-
нов иммуноглобулинов у акуловых рыб, птиц, млекопитающих и бес-
хвостых амфибий. У акуловых рыб гены, кодирующие тяжелую цепь
иммуноглобулинов, собраны в кластеры. Каждый из них у полуство-
ловых клеток представлен четырьмя значащими участками Y, D, J и
С, разделенными незначащими. Три первых участка дают информацию
для участка мРНК, кодирующего вариабельный домен тяжелой цепи,
а четвертый для четырех константных доменов тяжелой цепи. При
формировании клонов В-лимфоцитов выбирается один из кластеров,
в котором происходит удаление незначащих участков на уровне ДНК.
шивка участков V, D, J (информация для вариабельного домена)
ала. ₽ьезный ВЫВ°Д> вытекающий из сравнительно-иммунологического матери
югся более пл7°М’470 В° ВС€Х гРУппах хордовых реакции гуморального иммунитета явля
иммунитету ДНИМЭВ°ЛЮиИОННЫМ пРи°бретеннем по сравнению с реакциями клеточного
316
может происходить неточно, что и определяет, по-видимому, разнооб-
разие конкретных клонов по вариабельному домену, получаемых из
одного кластера. Необходимо, однако, отметить, что у акуловых рыб
их разнообразие значительно меньше, чем у млекопитающих.
У птиц, по-видимому, наряду с использованием этого механизма
основное разнообразие вариабельного домена легкой цепи обеспечи-
вается другим способом. У полустволовой клетки всего один ген,
кодирующий часть мРНК для вариабельного домена легкой цепи, и
один — для связующего его участка ДНК (J), обеспечивающего связь
с участком ДНК, кодирующим часть мРНК для константного домена.
При формировании клона В-лимфоцитов здесь, так же как и у рыб,
может происходить неточная стыковка этих участков генома на уровне
ДНК. Однако основным источником разнообразия формирующихся
кнов В- лимфоцитов являются 25 вариантов псевдогенов. При фор-
мировании каждого клона В-лимфоцитов от одного или нескольких
из них (до 6) выбираются небольшие участки, которые путем конвер-
сии включаются в единственный ген (V). Это и создает возможность
на основе генома полустволовой клетки формировать колоссальное
разнообразие вариабельных доменов легких цепей.
Наконец, у млекопитающих мы имеем третий вариант организа-
ции генома для двух легких цепей и пяти вариантов тяжелых цепей
молекул иммуноглобулинов (см. рис. 103, А).
Следовательно, у млекопитающих основным источником много-
образия V-генов клонов В-лимфоцитов служит механизм реаранжи-
ровки генов. Дополнительный вклад в процессы антигеннезависимой
дифференцировки клонов В-лимфоцитов вносит и неточная сшивка
Y-, D-, J-участков, возможные соматические мутации в этих участках
ДНК, а также элементы конверсии участков ДНК полустволовых кле-
ток, расположенных рядом с вариантами V-генов (так называемые
мини-гены).
В настоящее время имеются данные и о генетических механизмах
формирования многообразия генов для вариабельных доменов у пред-
ставителей бесхвостых амфибий. Эти механизмы оказались сходными
с аналогичными механизмами у млекопитающих. Однако анализ по-
добных механизмов у кролика показал, что значительно большую роль
У них, как и у птиц, играют явления конверсии в формировании
участка гена для вариабельного домена.
Краткий обзор имеющихся сравнительных данных о механизмах
формирования разнообразия вариабельных доменов молекул иммуно-
глобулинов у представителей рыб, птиц, млекопитающих и бесхвостых
амфибий показывает, с одной стороны, общие принципы генетических
преобразований генома полустволовых клеток. С другой стороны, у
317
представителей разных классов преимущественное развитие получают
либо механизмы конверсии (птицы), либо механизмы реаранжировки
генов (млекопитающие, бесхвостые амфибии), либо, наконец, неточная
сшивка значащих участков при вырезании незначащих участков ДНК
(акуловые рыбы). Очевидно, что такое разнообразие механизмов от-
ражает разные пути эволюции системы гуморального иммунитета в
разных классах позвоночных, хотя все они имеют общую основу и
общую закономерность.
Что касается сравнительного анализа тканевого и органного уров-
ней организации реакций гуморального иммунитета, то на первом
плане по степени изученности в настоящее время стоит центральный
орган антигеннезависимой дифференцировки В-лимфоцитов у птиц —
фабрициева сумка. Она развивается в эмбриогенезе птиц в области
дорсальной стенки клоаки (рис. 108, а). Каждый фолликул состоит из
коркового и мозгового вещества; мозговое вещество составляют от-
ростчатые эпителиальные клетки, строму коркового — в основном
Рис. 108. Фабрициева сумка (бурса) птиц.
а складки бурсы; б строение отдельного фолликула (в левой части фоллику-
ла не показаны свободные клетки) (по Е. Н. Горышиной и О. Ю. Чаге, 1990):
мозговое вещество, 11 — кора: / — эпителий клоаки, 2 — фолликул, 3 — со-
единительная ткань, 4 — эпителиальная строма мозгового вещества, 5 — десмосо-
мы, соединяющие эпителиальные клетки, б — базальная мембрана, 7 — капилляр
корковой зоны. 8 — фибробласты, 9 — лимфоциты, 10 — макрофаги, 11 — плаз-
матические клетки.
318
ретикулярные клетки соединительной ткани (рис. 108, б). Отдельные
участки фолликула отделены друг от друга сплошным слоем эпители-
альных клеток (рис. 108, б, 4). На границе коркового и мозгового
вещества в каждом фолликуле имеется густая сеть капилляров. Моз-
говое вещество содержит в основном малые лимфоциты, в корковом
веществе имеются наряду с ними еще и бласты, и плазматические
клетки. Экспериментальными методами показано, что в фабрициевой
сумке (по-видимому, в строме мозгового вещества) создаются условия,
необходимые для реализации процессов генетических конверсий при
образовании генов вариабельного домена легкой цепи молекул им.лу
нсглобулинов при формировании из полустволовых клеток конкрет-
ных клонов В-лимфоцитов. Это обстоятельство является, вероятно,
основной причиной формирования такого своеобразного лимфоэпите-
лиального органа у птиц. Именно у них процессы конверсии занимают
ведущее положение в формировании разнообразия генов вариабельных
доменов.
У млекопитающих ангигеннезависимая дифференцировка В-лим-
фоцитов происходит в основном в строме образуемой соединительно-
тканными клетками эмбриональной печени, а позднее — в строме
красного костного мозга.
У рыб вопрос о месте созревания В-лимфоцитов (их антигенне-
зависимой дифференцировке) серьезно не исследован. У амфибий си-
туация, по-видимому, такая же, как у млекопитающих. Только вместо
печени у амфибий в эмбриогенезе в качестве кроветворного органа и,
следовательно, места созревания В- лимфоцитов функционирует почка.
Весьма примечательно, что у личинок некоторых видов лягушек
(Rana pipiens, Rana catesbiana) имеется особая лимфатическая железа.
Этот парный инкапсулированный орган лежит в области зачатков
передних конечностей и служит в основном местом созревания В-лим-
фоцитов (некоторое участие принимает он и в развитии Т-системы).
Приведенные выше единичные факты представляют собой боль-
шой теоретический интерес, поскольку показывают, что тенденция к
выделению специального центрального органа В-системы реализуется
не только в классе птиц. Неясным остается вопрос и в отношении
рептилий, у них эти процессы еще не исследованы.
Относительно периферических органов наиболее обширный срав-
нительный материал имеется о селезенке и лимфоидных скоплениях
слизистых оболочек. Общая тенденция развития — это усложнение
организации кровообращения в селезенке, увеличение количества и
разнообразия макрофагальных элементов и ее дифференциация по
локализации в строме преимущественно В- или Т- лимфоцитов. Ана-
логичная ситуация имеет место и в отношении лимфоидных скоплений
319
в слизистых оболочках. По мере повышения уровня организации жи-
вотных, особенно у птиц и млекопитающих (еще и благодаря их
теплокровности), усложняется и количественно увеличивается эта пе-
редняя линия обороны организма.
У птиц и млекопитающих здесь сосредоточена основная масса
клеток, способных вырабатывать секреторные иммуноглобулины, ко-
торые транспортируются эпителиальными клетками и выделяются на
их наружной поверхности. Здесь они, взаимодействуя с антигеном еще
вне организма, обеспечивают его нейтрализацию.
Примечательные данные имеются и в отношении лимфатических
узлов, для которых ситуация сходна с лимфатической железой некото-
рых амфибий. Лимфатические узлы имеются у всех млекопитающих. У
основной массы птиц наблюдается лишь тенденция к выделению этих
органов из лимфоидных скоплений. Однако у представителей лишь
одного отряда пластинчатоклювых имеются хорошо развитые немного-
численные узлы, сходные по своему строению с лимфоузлами млеко-
питающих. Тем не менее развитие лимфоузлов у отдельных представи-
телей класса птиц не зависит от аналогичного процесса у млекопита-
ющих. В нем проявляется лишь одна из общих тенденций совершен-
ствования лимфоидной системы на органном уровне ее организации.
§3. РЕАКЦИИ КЛЕТОЧНОГО ИММУНИТЕТА
Общая характеристика реакции
Проявлением иммунной реакции, протекающей по клеточному
типу, является накопление в крови и периферических лимфоидных
органах клона антиген-специфических цитотоксических Т-лимфоцитов
в ответ на введение АГ. Клеточный иммунитет требует кооперации
макрофагов, различных субпопуляций Т-клеток и направлен главным
образом против опухолевых, инфицированных вирусом, мутантных и
просто старых клеток организма, а также любых аллогенных и ксено-
генных клеток и тканей.
Популяция Т-лимфоцитов разнообразнее, чем В-лимфоцитов и
подразделяется на несколько субпопуляций (табл.1).
Тем не менее все категории Т-лимфоцитов имеют один тип анти-
генраспознающего рецептора и отличаются друг от друга не по этому
рецептору, а по вспомогательным рецепторам и маркерам, обозначае-
мым CD (табл.1). Стволовая клетка еще не имеет никаких маркеров,
указывающих на ее принадлежность к Т-ряду (см. рис. 112). В про-
цессе дифференцировки потомки стволовой клетки последовательно
приобретают маркеры CD2 (общий для всех Т-клеток, указывающий
на принадлежность к Т-ряду), CD3 (указывающий на завершение ре-
320
аранжировки генов в Т-клеточных рецепторах), CD4 и CD8 (свиде-
тельствующие о процессе обучения Т-клетки распознаванию структур
МНС II и I классов соответственно). Последние два маркера появля-
ются на Т-лимфоцитах одновременно, но в дальнейшем 65% клеток
остаются CD4+ CD8~, а 35% тимоцитов — CD4~ CD8+. К CD4+ клет-
кам относятся Т-хелперы, которые в настоящее время подразделяются
на две субпопуляции: Тх1 и Тх2, регулирующие разные формы им-
мунного ответа. К CD8+ лимфоцитам относятся цитотоксические Т-
лимфоциты, которые являются эффекторами в клеточном иммунном
ответе. По завершении процесса дифференцировки в тимусе, занима-
ющего 3 дня CD4+ и CD8+ лимфоциты мигрируют в периферические
лимфоидные органы, где в случае контакта с АГ переходят к антиген-
зависимой дифференцировке в Т-клеточные бласты, активно вступаю-
щие в межклеточные взаимодействия и секретирующие соответствую-
щие медиаторы.
Таблица 1. Субпопуляции Т-лимфоцитов
Субпопуляция Маркерные молекулы / распознаваемые структуры МНС Продуцируемые медиаторы Функция в иммунном ответе
Ствол м ктетка Т-ряда CD2“ CD3" CD4“ CD8~ He синтезирует Не имеет
Молодые укортикальныс тлмоцтгы) CD2+ CD3~ CD4~ CD8~ CD2* CD3+ CD4+ CD8" ИЛ-2. ИЛ-3 ИЛ-2, ИЛ-3 «
Т-хелперы 1 CD2* CD3+ CD4+ / МНС П ИЛ-2, ИЛ-3 у-ннтерферон, факторы некроза опухолей а н Р, ГМ —КСФ Обеспечивают запуск клеточного воспали- тельного ответа, фор- мируют Т-клетки па- мяти, активируют CD8* лимфоциты, участвуют в реакциях ГЗТ, тормозят работу Т-хелперов 2
Г-хслгсры 2 CD2+ CD3+ CD4+ / MHC II ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13 Направляют иммун- ный ответ по гумо- ральному пути, усиливают пролифера- цию В-лимфоцитов и синтез антител, тормозят активность Т-хелперов I
Т-цитоксические клетки CD2+ CD3+ CD84" / MHC 1 ИЛ-2, ИЛ-3 у-интерферои Лизируют чужерод- ные клетки мишенн
Структура основного антигенраспознающего рецептора Т-лимфо-
«итов и рецепторов гистосовместимости I и II классов (МНС I и
321
МНС П) была выяснена в 1984 г. Сейчас уже известны многие детали
организации Т-рецепторов, основные генетические механизмы форми-
рования вариабельных доменов, ряд тонких взаимодействий с антиге-
ном и представляющими его молекулами МНС — для CD8+ и МНС —
для CD4+.
Рецепторы Т-лимфоцитов и антигенпредставляющих клеток
Т-лимфоциты и иммуноглобулиновые рецепторы В-лимфоцитов
распознают разные участки. Если иммуноглобулиновые рецепторы В-
лимфоцитов распознают конфигурацию молекулы, то антигенраспоз-
наюшие рецепторы Т-лимфоцитов распознают последовательность
аминокислот в ней. При этом распознавание происходит только в том
случае, если одновременно часть маркеров Т-лимфоцитов вступает в
контакт с определенными участками рецепторов МНС I CD8+ или
МНС II CD4+ классов. Соответственно этому оба типа рецепторов
МНС имеют структуру, приспособленную, с одной стороны, для за-
хвата участка антигена, а с другой — для специфического контакта с
антигенраспознаюшим рецепторным комплексом Т-лимфоцитов, в со-
став которого, помимо собственно рецептора, входит ряд ассоцииро-
ванных трансмембранных белков, а также молекулы CD4 или CD8
(рис. 109, 6-10).
Рецептор МНС I класса состоит из тяжелой и легкой цепей.
Тяжелая цепь, в свою очередь состоит из трех доменов, трансмембран-
ного и цитоплазматического участков (рис. 109, 2). Два домена из трех
обладают полиморфизмом, а цепь кодируется у человека тремя раз-
ными генными локусами. По современным представлениям существует
не менее 8,3 млн вариантов тяжелой цепи МНС-I в человеческой
популяции. Легкая цепь образована одним доменом, не связана с
мембраной и отличается большим консерватизмом. Эта молекула на-
зывается Pj-микроглобулином {11). Считается, что его структура наи-
более близка к предковому гену, положившему начало иммуноглобу-
линовому суперсемейству.
Рецептор МНС II класса является гетеродимером, в котором каж-
дая цепь (а и Ь) включает два домена, трансмембранный участок
и цитоплазматический хвост. Первые домены имеют полиморфные
участки, а цепи кодируются четырьмя (по другим данным шестью)
различными генными локусами. Даже в случае 4 локусов за счет
множественного аллелизма молекулы МНС II класса образуют не
менее 1,2 млн вариантов организации структур. Тогда у человека об-
щее число вариантов организации МНС по антигенам I и П классов
составляет более 3,2х1012, что больше числа людей, населявших пла-
сту, с момента возникновения вида Homo sapiens.
322
Рис. 109. Структура антигенраспознающего рецептора Т-лимфоцита и
предполагаемый механизм его взаимодействия с антигеном на поверхнос-
ти клетки, представленным молекулой антигена главного комплекса гис-
тосовместимости I класса (ГКГ-/).
I — мембрана клетки-мишени, 2 — молекула ГКГ-/, 3 — антиген, 4 —
актигенраспознающий рецептор Т-лимфоцита, 5 — мембрана Т-лимфоци-
та, 6-9 — белки СДЗ-антигена (цг, 6, е. v), 10 — дополнительный рецеп-
тор CD-8 у Т-лимфоцитов-киллеров, 11 — Вг-мнкроглобулин; а и (3 —
обозначение цепей основной части антигенраспознаюшего рецептора;
S-S-связн показаны пунктиром.
Если молекулы МНС I класса распространены на всех клетках
индивидуума, то структуры МНС II класса характерны только для
клеток, вовлеченных в иммунологические реакции. Особенно много
их на В-лимфоцитах, макрофагах и дендритических клетках.
Антигены для представления их Т-лимфоцитам захватываются
А-клетками путем фагоцитоза, расщепляются на иммуногенные участ-
ки ферментами лизосом. В эндосомах или лизосомах соединяются с
рецепторами гистосовместимости I и II классов и в таком виде пред-
ставляются на поверхности клеток путем экзоцитоза.
Установлено, что А-клетки, а в отношении вирусных белков и
обычные клетки организма способны вылавливать образующиеся на
свободных рибосомах в гиалоплазме чужеродные белки, перемещать
их в особые вакуоли, где они соединяются с рецепторами МНС-I и
представляются на поверхность клетки путем экзоцитоза, где могут
быть рецептированы цитотоксическими CD8+ Т-лимфоцитами.
323
Основной антигенраспознающий рецептор Т-системы лимфоцитов
имеет также доменную структуру. Он гомологичен иммуноглобули-
нам, однако внешне основная надмембранная его часть устроена про-
ще, чем молекула типичных иммуноглобулиновых рецепторов (4). Она
сходна внешне с рецепторами главного комплекса гистосовместимости
П класса и представлена двумя двухдоменными цепями. Однако цепи
не одинаковы и кодируются разными генами. Домены, прилежащие к
мембране, относятся к константным участкам молекулы, они стабиль-
ны, но отличаются друг от друга в а- и P-цепях. В незрелых тимоцитах
обнаружены также образующие другую пару у- и 5-цепи. Их роль
остается неясной. Возможно, что эта форма рецептора характерна
только для одной из стадий дифференцировки. Верхние домены ва-
риабельны, здесь расположены специфические антигенраспознающие
участки. Они обеспечивают специфическое распознавание последова-
тельности аминокислот в небольших участках антигена только в том
случае, если рецептор участками своих константных доменов будет
связан со специальными участками молекул МНС-I и МНС-П. Помимо
надмембранной части антигенраспознающего рецептора Т-лимфоцитов
у него имеются еще и сложная мембранная и субмембранные части.
Они представлены: заякоренными в мембране гидрофобными участка-
ми а- и P-цепей (V) и четырьмя белками, расположенными в мембране
и в субмембранной части (6-9). Функциональное значение этих белков
интенсивно исследуется. Они, по-видимому, принимают непосредст-
венное участие в процессах созревания Т-лимфоцитов, трансляции
сигналов от антигенраспознающих центров на генетический аппарат
клеток и стабилизации Т-клеточного рецептора.
Механизмы генетических преобразований при антигеннезависи-
мом созревании клонов Т-лимфоцитов сходны с механизмами этих
преобразований при формировании генов вариабельных доменов мо-
лекул иммуноглобулинов. В случае Т-лимфоцитов также основным
механизмом формирования разнообразия генов вариабельных доменов
является механизм реаранжировки генов. Используются даже, по-ви-
димому, в большей мере механизмы неточной сшивки участков. Тем
не менее разнообразие вариабельных доменов в Т-рецепторах млеко-
питающих меньше, чем разнообразие иммуноглобулиновых рецепто-
ров В-лимфоцитов. Если общее число клонов В-лимфоцитов оценива-
ется как 108, то число комбинаций а-и P-цепей составляет около 2х106.
Последнее обстоятельство определяется более жестким отбором лим-
фоцитов Т-системы, поскольку они, в первую очередь, могут вызывать
аутоиммунные нарушения в организме.
324
Реакции трансплантационного иммунитета
Внешнее проявление развития реакций клеточного или трансплан-
тационного иммунитетов удобнее проследить на примере реакции от-
торжения кожных трансплантатов у генетически неродственных мы-
шей (рис. ПО).
Если одной из мышей с соблюдением правил асептики пересадить
участок кожи от другой мыши, то после восстановления кровообра-
щения за счет врастания сосудов организма хозяина участок кожи
"Л-5».
Рис. НО. Реакция клеточного иммунитета на трансплантированную
чужеродную ткань.
Темные клетки — ткань донора, светлые — ткань хозяина; АРС — антигенпре-
зентирующая клетка; I, И — молекулы МНС 1 и МНС II соответственно; Тх1 ~
р- CD4+ Т хелпер 1 (клетка ГЗТ), Тх2 — CD4+ Т хелпер 2; Тк — Т киллер (CD8+
Цитотоксический лимфоцит); МФ — макрофаг; В — В-клетка; (+) стимула-
ция, (-) — подавление, (х) — уничтожение.
325
приживается и будет нормально функционировать в течение 12-14
дней при первой пересадке. Однако к этому сроку неожиданно про-
исходит полный некроз пересаженной ткани и отторжение трансплан-
танта. При вторичной пересадке кожи от прежнего донора скорость
отторжения увеличивается примерно в два раза. Таким образом, в
реакциях клеточного иммунитета не менее отчетливо, чем в реакциях
гуморального, проявляются все характерные признаки иммунных ре-
акций: а) наличие латентного периода; б) наличие памяти; в) строгая
специфичность реакции.
Анализ клеточных механизмов отторжения трансплантанта пока-
зал, что процесс отторжения состоит по крайней мере из трех звеньев,
или этапов: а) сложного процесса рецепции; б) центрального звена
или (образно говоря) периода осмысливания полученной информации;
в) эффекторного звена — уничтожения чужеродной ткани путем ци-
тотоксического действия CD8+ Т-лимфоцитов и макрофагов, активи-
рованных Т-хелперами 1 (рис. 110).
Процесс рецепции осуществляется в основном двумя типами Т-
лимфоцитов в первый час после пересадки ткани. Это специфические
к данному рецептору МНС-I пересаженных клеток неактивные CD8+
Т-лимфоциты и МНС-П неактивные CD4+ Т-хелперы 1.
После контакта антигенраспознающих рецепторов с рецепторами
МНС-I и МНС- II пересаженных клеток активированные контактом
специфические CD8+ и CD4+ попадают в ближайший лимфатический
узел, где они локализуются в паракортикальной зоне, проходят акти-
вацию и бластотрансформацию и превращаются в высокоактивные
CD8+ и CD4+ клетки, вырабатывающие множество медиаторов и экс-
прессирующие соответствующие рецепторы к ним. Т- хелперы 1 вы-
рабатывают ИЛ-2 и у-интерферон, обеспечивающие развитие иммун-
ного ответа по клеточному пути, активирующие макрофаги, угнета-
ющие деятельность Т-хелперов 2 и стимулирующими размножение
CD8+ лимфоцитов. Цитотоксические CD8+ Т-лимфоциты в активиро-
ванном состоянии несут большое число рецепторов к ИЛ-2 и у-интер-
ферону. Под действием этих медиаторов клетки быстро проходят блас-
тотрансформацию и, непрерывно размножаясь, образуют клон цито-
токсических лимфоцитов (их часто называют Т-киллерами), направ-
ленных против чужеродных пересаженных клеток. Относительно ме-
ханизмов цитотоксического действия Т-киллеров, которые к 12-14-му
дню в массовом количестве устремляются в трансплантированную
ткань, существуют разные мнения. Наиболее распространена пока тео-
рия образования нерегулируемых каналов в мембране клетки-мишени,
описанная выше. Есть также данные о наличии воздействия Т-киллеров
326
на ДНК клеток-мишеней. Существует гипотеза о возможности вклю-
чения Т-киллерами особых рецепторов на самоуничтожение, имею-
щихся у каждой клетки.
CD8+ лимфоциты, по всей вероятности, не только играют роль
Т-киллеров, но и участвуют в супрессорных реакциях (см. табл. 1).
Не исключено, что их супрессорные функции связаны с большим
числом рецепторов к ИЛ-2 на этих клетках и большим сродством
самих рецепторов к МЛ-2. В результате размножения число CD8+
Т-лимфоцитов быстро возрастает, они перехватывают и утилизируют
вырабатывающийся в лимфатическом узле ИЛ-2 и останавливают раз-
множение всех Т-лимфоцитов (как CD4+, так и CD8+) и даже NK-кле-
ток, для которых ИЛ-2 является универсальным ростовым фактором.
В реакциях трансплантационного иммунитета CD4+ Т-хелперы I
принимают участие не только как хелперные клетки, но и как индук-
торы гиперчувствительности замедленного типа (ГЗТ) (рис. ПО). Они
перемещаются в трансплантированную ткань, где начинают выделять
гуморальные факторы, стимулирующие привлечение макрофагов и ну-
левых лимфоцитов, их фагоцитарную и цитотоксическую деятельность
и развитие хронической воспалительной реакции.
Естественно, что при трансплантации чужеродных тканей в орга-
низм наряду с живыми клетками попадает большое количество меж-
клеточных структур и продуктов метаболизма этих клеток, обладаю-
щих антигенной активностью. Часть антигенов попадет в лимфатичес-
кие узлы, где и воспринимается А-клетками, Т-хелперами 2 и в ко-
нечном счете В-лимфоцитами, т.е. запускается реакция гуморального
иммунитета.
Таким образом, на примере реакций трансплантационного имму-
нитета в искусственной экспериментальной обстановке проявляется
единство всей иммунной системы, хотя каждая из трех разнообразных
разновидностей реакций (клеточного и гуморального иммунитетов,
реакция ГЗТ) осуществляется особыми разновидностями клеток. Клю-
чевую связующую роль в этих реакциях играет хелперная система, в
частности CD4+ Т-хелперы 1 с продуцируемым ими лимфокином —
интерлейкином 2.
Как уже отмечалось, в естественных условиях Т-система специа-
лизирована в основном на борьбу с вирусной инфекцией и частично
с вышедшими из-под контроля в результате соматических мутаций
собственными клетками, изменения в которых отражаются на струк-
туре МНС-I и МНС-Il. Кроме трго, Т-система лимфоцитов через баланс
Т-хелперов 1 и 2 обеспечивает тонкую регуляцию иммуногенеза и
связь с процессами в организме.
327
Тимус- и антигеннезависимая дифференцировка Т-лимфоцитов
Для формирования разнообразного репертуара лимфоцитов Т-сис-
темы у млекопитающих (и у представителей всех классов позвоноч-
ных) имеется специальный центральный орган иммунитета — зобная
железа. Она относительно рано закладывается в эмбриогенезе и мак-
симальное развитие получает до периода половой зрелости. Зобная
железа — непарный дольчатый орган, расположенный у человека по-
зади грудины. В каждой дольке выделяют корковое и мозговое веще-
ство. Они различаются по количеству лимфоцитов: в корковом веще-
стве их значительно больше, около 90% (рис. 111, а, б, в). В наружной
части коркового вещества выделяют еще важную в функциональном
отношении субкапсулярную зону. Характерной особенностью крово-
снабжения коркового вещества тимуса является наличие гематотими-
ческого барьера. Этот барьер в структурном отношении образован
сплошным, не имеющим пор слоем эндотелия, выстилающим все со-
суды коркового вещества (рис. 111, д, 15). Кроме того, под эндотелием
имеется толстая сплошная коллагеновая мембрана (рис. 111, д, 5).
На некотором расстоянии от мембраны сосуды изолированы от
стромы еще и сплошным слоем эпителиальных клеток, связанных
десмосомами (б). В этом пространстве располагаются специальные
макрофаги, контролирующие вещества, поступающие из крови к лим-
фоцитам (8).
Строма зобной железы образована разными по степени зрелости
отростчатыми эпителиальными клетками. Особую роль играют денд-
ритные клетки, которые несут на своей поверхности рецепторы МНС-1
и МНС-П данного организма, представляя их для «знакомства» лим-
фоцитам. Наиболее молодые эпителиальные клетки расположены на
границе коркового и мозгового вещества. Кроме того, эпителиальные
клетки тимуса выделяют ряд гормонов (тимопоэтин, тимозин, тимулин
и др.), специфически влияющие на созревание Т-лимфоцитов.
Весьма характерны также и своеобразные эпителиальные клетки-
«няньки» (рис. 111, г). В углублениях их цитоплазмы лимфоциты
проводят несколько суток в полной изоляции от среды. Каждая клет-
ка-нянька обслуживает, таким образом, до 10 лимфоцитов одновре-
менно. Имеются в строме своеобразные миоидные клетки с актин-ми-
озиновыми фибриллами (рис. 111, в, 13). Функциональное значение
их неясно. По ходу сосудов в строме тимуса могут встречаться и
отдельные фибробласты. Особой структурой мозгового вещества яв-
ляются так называемые тельца Гассаля — участки ороговевающего
эпителия (14). Их функциональное значение также непонятно.
328
4
Рис. Ill. Тимус млекопитающего.
а — общий вид среза нескольких долек тимуса; б — кора; в — мозговое ве-
щество; г — клетка-нянька из наружной части коры; д — строение гематоти-
мического барьера (по Е. Н. Горышиной н О. Ю. Чаге, 1990):
1 — капсула, 2 — кора, 3 — мозговое вещество, 4 — фибробласт, 5 — ба-
зальная мембрана, б — эпителиальная строма, 7 — десмосомы между эпители-
альными клетками, 8 — макрофаг, 9 — лимфоцит, 10 — лимфобласт в мито-
зе, 11 — интердигитирующая клетка, 12 — просвет сосуда, 13 — миодная
клетка, 14 — центр ороговения тельца Гассаля, 75 — клетка эндотелия.
329
Под влиянием тимопоэтина, выделяемого клетками стромы кор-
кового вещества, в субкапсулярную зону устремляются полустволовые
клетки Т-системы. Они образуют запас недифференцированных CD2+
клеток в виде больших лимфоцитов или бластов. Часть их начинает
смещаться в глубжележащие зоны коркового вещества, энергично раз-
множаться и вступать в тесный контакт с клетками, несущими на своей
поверхности рецепторы к МНС-I и МНС-П (рис. 112). В этот момент
и происходят основные изменения в геноме клеток и, в частности,
описанная выше реаранжировка генов вариабельных доменов. Помимо
комбинаторики V-, D-, J-участков и неточной сшивки в образовании
большого разнообразия генов принимает, по-видимому, участие и фер-
мент TdT (терминальная дезоксинуклеотидтрансфераза), который при-
соединяет случайные основания в местах разрывов молекулы ДНК. По
завершении реаранжировки все тимоциты становятся CD3+. В этот
момент появляется небольшая группа Т-лимфоцитов, несущих 8-у, а
Рис. 112. Локализация клеток различных типов в тимусе
(по Улумбекову Э. Г., Челышевой Ю. А., 1997).
Пунктиром показана условная граница между корковым и мозговым слоями
дольки. Корковый слой содержит лимфобласты и малые тимоциты, взаимодейст-
вующие с дендритными эпителиальными клетками и макрофаги. Те же клетки
имеются в мозговом слое, ио здесь присутствуют более дифференцированные
тимоциты, готовые к выселению из тимуса.
330
не а-₽ антигенраспознающий рецептор. Дальнейшую судьбу этих кле-
гок пока проследить не удается. В процессе обучения распознаванию
МНС-I и -II своего организма все тимоциты на некоторое время ста-
новятся CD2+CD3+CD4+CD8+. Однако эта фаза продолжается недолго,
и после экспрессии а~Р Т-клеточных рецепторов и ориентировки на
распознавание МНС-П или МНС-I тимоциты разделяются на CD4+ и
CD8+ лимфоциты соответственно, которые выходят в мозговое веще-
ство. В корковом веществе погибает 90-95% образующихся в резуль-
тате интенсивных делений лимфоцитов, что свидетельствует об очень
жестком отборе формирующихся случайно клонов. Особенно строгий
отбор идет по их соответствию рецепторам МНС-П клеток своего
организма (рис. 113). Именно в период пребывания в тимусе лимфо-
цитов Т-системы и происходит формирование так называемой естест-
венной толерантности — обучение лимфоцитов Т-системы не реаги-
ровать на собственные клетки. Одним из элементов такого обучения
и является, по-видимому, элиминация агрессивных клонов.
Рис. 113. Позитивная и негативная селекция Т-лимфоцитов в тимусе
(по Фрейдлин И. С., 1998).
а — Т-лимфоцит, сопособный распознать собственные антигены тканевой со-
вместимости (/), экспрессированные на эпителиальных клетках тимуса (ЭКТ),
проходит позитивную селекцию и вступает в дальнейшее развитие; б — Т-лим-
фоцит, не способный распознать собственные антигены тканевой совместимости
(1), на поверхности ЭКТ, проходит позитивную селекцию и получает сигнал за-
программированной смерти (апоптоза); в — Т-лимфоцит, способный распознать
пептидные фрагменты аутоантигенов (3) на поверхности антиген-презентирую-
щих клеток (АПК) в комплексе с собственными антигенами тканевой совмести-
мости (/), на этапе негативной селекции получает сигнал запрограммирован-
ной смерти (апоптоза), РТК — рецептор Т-клеток.
331
Факторы и механизмы формирования различных разновидностей
лимфоцитов Т-системы пока неизвестны. Ясно лишь, что они разви-
ваются из общего источника, и происходит это в основном в глубоких
зонах коркового вещества.
Зобная железа, по-видимому, не единственный орган, где может
происходить антигеннезависимая дифференцировка Т-лимфоцитов. Та-
ким органом может быть и многослойный эпителий кожи, играющий
существенную роль в этих процессах у некоторых млекопитающих,
например у овец.
Эволюционная динамика реакций клеточного иммунитета
Сравнительный анализ реакций клеточного иммунитета у пред-
ставителей различных классов позвоночных, особенно низших, разра-
ботан слабо. Охарактеризуем кратко лишь систематические данные,
полученные в результате анализа характера отторжения кожных транс-
плантатов и данные по организации тимуса.
Известны два основных феномена отторжения трансплантатов: так
называемое острое отторжение и более слабое — хроническое. Острое
отторжение, характеризующее хорошо развитую и дифференцирован-
ную Т-систему, было описано при характеристике его у млекопитаю-
щих. Хроническое отторжение развивается позднее, после пересадки,
и сам процесс отторжения растянут на длительный срок. Очевидно,
что его реализуют менее дифференцированные системы Т-лимфоци-
тов.
Как следует из сравнительных данных, скорость реакции корре-
лирует с высотой организации животных. Острое отторжение харак-
терно для всех исследованных представителей птиц и млекопитающих.
Однако и у представителей низших позвоночных (амфибий, рыб), и у
наиболее продвинутых форм (бесхвостые амфибии, костистые рыбы)
также наблюдается острое отторжение. Следовательно, усиление реак-
ции есть общая тенденция эволюционной динамики системы Т-лим-
фоцитов. Пример с рыбами особенно интересен, поскольку как раз
костистые рыбы характеризуются весьма примитивным среди предста-
вителей класса рыб строением зобной железы — центрального органа
системы Т-лимфоцитов. Еще более примитивно устроена зобная же-
леза у круглоротых.
У остальных рыб, в частности у представителей хрящевых рыб,
зобная железа представляет собой хорошо оформленный орган, окру-
женный соединительнотканной капсулой. Строма образована в основ-
ном эпителиальными клетками. Имеется четкая дифференцировка на
корковое и мозговое вещество. К сожалению, детали организации
332
тимуса у хрящевых рыб и у представителей других классов позвоноч-
ных (рептилий, амфибий) изучены еще слабо, что не позволяет про-
водить более глубокие сопоставления.
По аналогии с млекопитающими и согласно косвенным экспери-
ментальным данным можно сделать вывод, что в лимфоидной системе
всех позвоночных и даже у круглоротых существует уже два типа
лимфоцитов (Т- и В-лимфоциты). У бесхвостых амфибий и птиц четко
показана необходимость кооперации Т- и В-лимфоцитов в рецепторной
фазе реакций иммунитета.
§4. НЕКОТОРЫЕ ОБЩИЕ ЗАКОНОМЕРНОСТИ ОРГАНИЗАЦИИ
ЛИМФОИДНОЙ ТКАНИ И РЕАКЦИЙ ИММУНИТЕТА
Иммуноморфология, составляющая основу современной иммуно-
логии, возникла в конце 60-х годов, когда стало ясно, что все реакции
иммунитета осуществляются лимфоидной тканью. Первым крупным
вкладом иммуноморфологии в теоретические основы иммунологии
было установление факта, что для каждой разновидности антигенов
существует свой клон лимфоцитов и образующихся из них плазмати-
ческих клеток. Это открытие утвердило наконец справедливость одно-
го из основных положений клонально-селекционной теории иммуни-
тета, хотя бы в отношении В-системы и реакций гуморального имму-
нитета. Значительно позднее этот факт был подтвержден и в отноше-
нии систем Т-лимфоцитов. Это подвело черту под многолетней дис-
куссией между сторонниками клонально-селекционной теории и так
называемыми инструктивистскими теориями иммунитета, в которых
антигену отводилась (в большей или меньшей степени) активная роль
в организации этой реакции.
Таким образом, оказалась справедливой парадоксальная концеп-
ция, объясняющая очень пластичную тонкую приспособительную ре-
акцию организма наличием жестко детерминированных узкоспециали-
зированных клонов лимфоцитов.
Второе положение клонально-селекционной теории, заключаю--
щееся в полной независимости клонов друг от друга, оказалось невер-
ным. Не подтвердилось также предположение о том, что причиной
естественной толерантности является полная элиминация в онтогенезе
всех клонов, способных реагировать на свои антигены.
Интенсивно развивающиеся иммуноморфология и биология лим-
фоидной ткани за истекшие десятилетия достигли колоссальных тео-
ретических достижений, и вышли в практическую медицину. В центре
внимания находится изучение тонких механизмов кооперативных вза-
имодействий клеток иммунной и неиммунной систем в процессах как
333
антигеннезависимой, так и антигензависимой дифференцировки. При
таком изучении интерес представляют и общий характер взаимодей-
ствий клеток, и конкретные контактные и гуморальные механизмы
межклеточных взаимодействий. Достижения в этой области уже нашли
применение в практической медицине. В скором времени удастся,
по-видимому, не прибегать к тотальному подавлению деятельности
всей лимфоидной ткани при трансплантациях органов у человека. В
настоящее время интенсивно разрабатываются методы, позволяющие
избирательно подавлять антигенспецифические клоны, активирован-
ные пересаженной тканью.
С другой стороны, получение в больших количествах интерлей-
кина-2 может стимулировать деятельность клонов лимфоцитов Т-сис-
темы, вступающих в борьбу со злокачественными клетками, тем более
что этот препарат стимулирует деятельность и натуральных киллеров.
Большие перспективы откроются пред медиками, когда иммуно-
логи научатся управлять деятельностью супрессорной системы. В на-
стоящее время ясно, что она играет существенную роль и в обучении
лимфоцитов на поздних этапах антигеннезависисмой дифференциров-
ки, и в наведении естественной и искусственной толерантности. Эти
свойства системы обусловливаются не только элиминацией агрессив-
ных клонов, как это утверждает клонально-селекционная теория.
Есть еще одна теория, объясняющая глубинные свойства лимфо-
идной ткани, — теория сети, сформулированная известным иммуно-
логом Н. К. Ерне еще в 70-е годы нашего столетия. В основе ее лежат
факты, свидетельствующие о том, что антитела сами обладают анти-
генной активностью, причем антигенные детерминанты локализованы
именно в вариабельном домене, иногда близко к антигенсвязываемому
центру. Вследствие этого на каждое новое антитело активируется клон
лимфоцитов, для которого антитело является антигеном. В результате
вся система находится не в покоящемся состоянии в ожидании по-
ступления антигена, а в состоянии активного равновесия противобор-
ствующих клонов в виде своеобразной сети. Введение антигена нару-
шает взаимодействие и приводит всю систему в движение для уста-
новления нового равновесия.
Эти сильно упрощенные сетевые взаимодействия в лимфоидной
системе интенсивно дебатируются в иммунологии в течение последних
20 лет. При этом речь идет не столько об отсутствии этих отношений,
сколько об удельном значении сетевых взаимоотношений в регуляции
деятельности иммунной системы.
Многие иммунологи, в частности, Н. К. Ерне, обратили внимание
еще на один интересный факт, а именно на то, что по характеру
334
организации, происхождению, эволюционной динамике лимфоидная
ткань и ткань нервной системы являются антиподами (подвижность и
^иегличность одной и стабильность и консервативность другой). В то
же время принципы их становления в онтогенезе (обучение), принципы
работы (рефлекторная реакция — рецепция, центральное звено, эф-
фекторное звено), регуляция на основе сочетания стимуляции и по-
давления торможения, интегрирующая роль в организации многокле-
точного организма и широкое представительство в органах и тканях —
далеко не полный перечень общих свойств этих систем.
Лимфоидная ткань, несмотря на всю свою специфику и своеоб-
разие, является лишь одной из разновидностей тканей внутренней
среды позвоночных и неразрывно связана и функционально, и гисто-
генетически, и исторически с системой ее свободных элементов. Поэ-
тому задачи иммунологов и гистологов, занимающихся изучением
организации и функции лимфоидной ткани, во многом совпадают. И
для иммунологов, достаточно глубоко интересующихся проблемой за-
щитных и других иммунологических реакций, и для гистологов-био-
логов даже при узкой (лишь в отношении лимфоидной ткани позво-
ночных) постановке проблемы одними из важных вопросов ее изуче-
ния являются вопросы об источниках развития этой системы факторов,
обусловивших ее возникновение, и, наконец, о ее связи с древними
защитными механизмами. Выше было показано, что во всех звеньях
иммунологических реакций (рецепторном, регуляторном и эффектор-
ном) прослеживается теснейшая связь лимфоидной ткани как с кле-
точными (прежде всего макрофагами), так и с гуморальными (системой
комплемента) защитными механизмами. Иными словами, и в органи-
зации этой системы также отчетливо проявляется характерная особен-
ность эволюционной динамики тканей внутренней среды — усиление
в ходе эволюции функциональной взаимосвязи дивергентно диффе-
ренцирующихся ее субсистем.
Сложнее ответить на вопрос об источниках и факторах, обусло-
вивших появление лимфоидной ткани и уникальных свойств отдель-
ных ее элементов и всей системы в целом. Существует несколько
гипотез, из которых выделим две. По первой гипотезе, менее распро-
страненной, способность к выработке иммуноглобулиноподобных мо-
лекул, нейтрализующих токсические молекулы, способные повредить
клетке, вырабатывались в эукариотных клетках еще до появления
многоклеточности — у одноклеточных простейших.
Согласно второй гипотезе (более распространенной и обоснован-
ной) основой для развития специфических рецепторных регуляторных
и эффекторных молекул лимфоцитов позвоночных послужили рецеп-
335
торные молекулы, построенные по доменному принципу, характери-
зующие принадлежность клетки к данному многоклеточному организ-
му. В пользу этой концепции в настоящее время свидетельствует много
косвенных аргументов. Одним из наиболее веских является наличие
значительной молекулярной гомологии в последовательности амино-
кислот между иммуноглобулинами и рецепторами межклеточных ком-
муникаций. В пользу этой концепции говорят также отмеченные выше
факты, свидетельствующие о наличии отдаленной гомологии между
молекулами иммуноглобулина, С-реактивного белка и некоторыми
белками у беспозвоночных и низших хордовых животных (например,
лимулином у мечехвоста и белками гемолимфы асцидий), а также
наличие такой гомологии между иммуноглобулинами и некоторыми
белками комплемента. С позиций этой гипотезы объяснение получает
и отмеченная выше параллельная независимая эволюция генов, коди-
рующих иммуноглобулины в разных классах позвоночных. На примере
генов надсемейства иммуноглобулинов показано, что после многократ-
ной дупликации и дивергенции исходных генов имеет место процесс
их коэволюции, обусловливающий их направленное параллельное раз-
витие в разных классах позвоночных животных.
* * *
Лимфоидная ткань позвоночных, осуществляющая реакции гумо-
рального и клеточного иммунитета, представлена в основном систе-
мами Т- и В-лимфоцитов. Они имеют общий источник развития и
подвержены сходной по своим механизмам антигеннезависимой и ан-
тигензависимой дифференцировке. Общим источником развития кло-
нов субсистем Т- и В-лимфоцитов являются стволовые клетки крови,
дающие полустволовые клетки лимфоидной системы (рис. 114). Пос-
ледние обеспечивают развитие полустволовых Т- и В-клеток, которые
образуют клоны в процессе антигеннезависимой дифференцировки в
центральных органах иммунитета (у птиц — фабрициева сумка, для
Т-системы у всех позвоночных — зобная железа). Во время диффе-
ренцировки в центральных органах лимфоидной системы образуются
многообразные (по вариабельному домену) клоны В- и Т-лимфоцитов,
происходит их функциональная специализация. Внешним выражением
дифференцировки является появление в плазматической мембране ан-
тигенраспознающих рецепторов. Для В-лимфоцитов такими рецепто-
рами являются мембранные формы иммуноглобулинов, для Т-лимфо-
цитов — особые рецепторы, состоящие из четырех белков и еще
одного вспомогательного рецептора (CD-4 или CD-8). Основная часть
рецепторов также относится к надсемейству иммуноглобулинов.
336
Рис. 114. Расположение лимфоидной ткани у птиц (И) и миграция клеток
при лимфопоэзе (Ь) (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
1 — костный мозг, 2 — тимус, 3 — добавочная и 4 — основная селезенка,
5 — фабрициева сумка, 6 — клоака; 1 — первичные, 11 — вторичные лим-
фоидные органы; СК — стволовые кроветворные клетки.
Рецепторы В-лимфоцитов распознают антигенные детерминанты
(конфигурацию чужеродных молекул). Рецепторы Т-лимфоцитов спе-
цифически реагируют: а) на чужие классы МНС-I и МНС-П (рецепторы
главного комплекса гистосовместимости), б) на измененные свои
МНС-I и МНС-П, в) на последовательность аминокислот в антигене,
обязательно представленном на МНС-I и МНС-П (соответственно
CD8+ и CD4+ Т-клеткам). Механизмы возникновения многообразия
клонов В- и Т-лимфоцитов по вариабельным доменам антигенраспоз-
наюгцих рецепторов сходны между собой. У млекопитающих и бес-
хвостых амфибий это в основном реаранжировка генов, у птиц —
генетическая конверсия, у акуловых рыб — неточная сшивка значащих
участков генов при формировании геномов соответствующих клонов
337
лимфоцитов из полустволовых В- и Т-клеток. В пределах позвоночных
увеличивается разнообразие классов иммуноглобулинов и усложняют-
ся периферические органы лимфоидной системы.
В периферических органах осуществляются реакции и гумораль-
ного, и клеточного иммунитета. У млекопитающих они представлены
лимфатическими узлами, белой пульпой селезенки и лимфоидными
скоплениями слизистых оболочек. Реакции гуморального иммунитета
заключаются в рецепции антигена антигенраспознающими рецептора-
ми соответствующих клонов В-лимфоцитов, их бластотрансформации,
многократном делении и формировании клонов антителопродуцирую-
щих клеток (вначале класса М, а затем G) и клеток памяти. Часть
антигенов консервируется особыми дендритическими клетками. В-
лимфоциты без помощи Т-системы (Т-хелперы 2) могут реагировать
лишь на тимуснезависимые антигены. Большинство тимусзависимых
антигенов вначале представляются А-клетками. Лишь после гумораль-
ного воздействия со стороны А-клеток и Т-хелперов 2 В-лимфоциты
способны эффективно отрецептировать тимусзависимый антиген. Ана-
логичная ситуация характерна и для Т-системы. CD8+ и CD4+ (ГЗТ)
могут рецептировать чужеродные клетки или антигены, представлен-
ные на МНС-I и МНС-П лишь при активации CD4+ Т-хелперов 1,
выделяющих интерлейкин 2 и у-интерферон. Центральное место в
реакциях гуморального клеточного иммунитета занимает хелперная
система Т-лимфоцитов, регуляция которой происходит через систему
взаимных влияний Т-хелперов 1 и 2.
Взаимодействие двух систем и обеспечивает тонкую и совершен-
ную регуляцию реакций клеточного и гуморального иммунитетов в
нормальных условиях.
ЛИТЕРАТУРА
Альберт Б., Брей Д., Льюис Дж., и др. Молекулярная биология клетки.
Т. 5. М., 1991. С. 6-70.
Гмактионов В. Г. Графические модели в иммунологии. М., 1986.
Галактионов В. Г. Эволюция суперсемейства иммуноглобулинов И Успехи
совр. биол. 1992. Т. 112. №1. С. 29-43.
Глупое В. В. Некоторые аспекты иммунитета насекомых // Успехи совр.
биол. 1992. Т. 112. № 1. С. 62-73.
Горышина Е. Н„ Чага О. Ю. Сравнительная гистология тканей внутренней
среды с основами иммунологии. Л., 1990. С. 319.
Ибрагимов А. Гены антител // Молекулярная биология. 1989. Т. 23. Вып. 1.
С. 5-32.
Иммунология / Под ред. У. Пола. В 3-х томах. М., 1987-88.
338
Кеннеди Р. С., Мельник Д Л., Дрисман Г. Р. Антиидиотипы и иммунитет
// В мире науки. 1986. Т. 9.
Кетлинский С. А., Симбирцев А. С., Воробьев А. А. Эндогенные иммуно-
модуляторы. СПб., 1992.
КоэнА. Свое, чужое и аутоиммунитет // В мире науки. 1988. № 6.
Купер Э. Сравнительная иммунология. М., 1980.
Малыгин А. М. Натуральные киллеры и их физиологическое значение //
Цитология. 1985. Т. 27. № 40.
Манько В. М, Хаитов Р. М. Иммунокомпетентные клетки // Итоги науки
и техники. Иммунология. 1989.
Маррак Ф., КаплерД Т-клетка и ее рецепторы // В мире науки. 1988. Кв 4.
Нестеренко В. Г. Сетевые взаимодействия в иммунной системе // Итоги
науки и техники. Иммунология. 1984.
Петров Р. М. Иммунология. М., 1987.
Родин С. Н, Ржецкий А. Ю. Коэволюционный подход к проблеме моле-
кулярно-генетических основ разнообразия антител // Успехи совр. биол. 1989.
Т. 107. Вып. 3.
Ройт А. Основы иммунологии. М., 1991.
Сидорова Е. В. Молекулярные механизмы генерации разнообразия имму-
ноглобулинов// Успехи совр. биол. 1988. Т. 106. Вып. 3(6).
Смит К. А. Интерлейкин 2 // В мире науки. 1990. Т. 5.
Флоренсов В. А., Пестова И. М. Очерки эволюционной иммуноморфоло-
гик. Иркутск, 1990.
Фонталин Л. М. Проблема происхождения иммунной системы позвоноч-
ных // Иммунология. 1988. № 3.
Хэм А., Кормак Д. Гистология. 1983. Т. 2. С. 191-252.
Чередеев А. И., Ковальчук Л. В. Клеточные и молекулярные аспекты им-
мунных процессов. (Новые данные об интерлейкинах и Т-системах) // Итоги
науки и техники. Иммунология. 1989. Т. 19.
Эдельсон Р. Л., Финк Д. М. Иммунологическая функция кожи // В мире
науки. 1985. № 8.
Юн Д„ Кон А. Как клетки убийцы убивают // В мире науки. 1988. Кв 3.
Barduy F., Gohnson Р., Gaughan G. Me, Viliams A. Immunoglobulin related
structures associated with vertebrate cell surface // The T-cell receptor. 1988.
P. 53-87.
Immunobiology of Natural Killer Cells. / Ed.Lotseva F., Heberman R. 1986.
Vol. 1, 2.
Invertebrate immunity: another viewpoint // Scand. J. Immunol. 1992. Vol. 35.
Loung G., Lia Ch. Multiple mechanism of Lymphocyte mediater killing //
Immunology Today. 1988. Vol. 9.
ГЛАВА 6. Организация процессов репродукции
в обновляющихся тканях внутренней среды
§1 . ОРГАНИЗАЦИЯ КРОВЕТВОРЕНИЯ У ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Сложность организации процессов размножения и дифференци-
ровки форменных элементов крови обусловлена большим количеством
функционально различных форменных элементов крови, относительно
небольшой продолжительностью жизненного цикла большинства диф-
ференцированных функционирующих в крови элементов. Специфичес-
кой особенностью камбиальной системы клеток крови (в отличие от
рассмотренных выше камбиальных систем эпителиальных обновляю-
щихся тканей) является топографическое разобщение специализиро-
ванных функционирующих в крови элементов от камбиальных и диф-
ференцирующихся клеток. Последние находятся в цикле репродукции
и претерпевают специфическую дифференцировку в разных направле-
ниях. Топографическое разобщение характерно и для мест гибели
закончивших свой жизненный цикл эритроцитов и нейтрофильных
лейкоцитов. Подлежащие разрушению эритроциты задерживаются и
деградируют в красной пульпе селезенки. Нейтрофилы гибнут преиму-
щественно в слизистой оболочке и просвете кишки.
Второй особенностью свободных элементов крови по сравнению
с клетками эпителиальных тканей является продолжительное сочета-
ние репродукции и дифференцировки, что резко увеличивает количе-
ство дифференцирующихся клеток и создает дополнительные возмож-
ности для регуляции их количества.
Третьей и наиболее важной особенностью кроветворения у выс-
ших позвоночных и человека является сложная организация системы
камбиальных клеток как в гистологическом отношении (наличие ие-
рархии полустволовых клеток с постепенно суживающимися потен-
циями), так и в отношении тонкого строения микроокружения, специ-
фического для каждой категории размножающихся камбиальных и
дифференцирующихся клеток. Такое микроокружение создается стро-
мальными фибробластами, отростчатыми макрофагами, жировыми
клетками, костной тканью, клетками, образующими стенку сосудов, и
периваскулярными фибробластами.
Всю систему свободных элементов тканей внутренней среды у
млекопитающих можно разделить на три отдела: отдел камбиальных
мультипотентных клеток (стволовой отдел); транзиторный и функци-
ональный.
В транзиторном следует выделить два подотдела: систему полу-
стволовых клеток разной степени зрелости, но не обнаруживающих
340
видимых признаков дифференцировки (табл. 2), и подотдел диффе-
ренцирующихся клеток, где изменения достаточно четко выявляются
цаже на светооптическом уровне анализа.
Таблица 2. Организация камбиальной системы крови
у млекопитающих
Отдел Вид клеток Свойства клеток и их функция
I Стволовой Стволовые н колониеобразующне Самоподдержание Комментирование
П-а Транзиторный Полустволовые Смешанные колониеобразующне Самоподдержание Коммети рован ие
П-б Унипотентные полустволовые Ограниченное самоподдержание
П-в Бласты и клетки видимого отдела дифференцировки Пролиферация и дифференцировка
П1 Функциональный Зрелые клетки крови всех рядов Функционирование
Центральным кроветворным органом, в котором реализуется ор-
ганизация репродукции и дифференцировки клеток крови у высших
позвоночных и человека, является красный костный мозг. Несмотря
на диффузное распределение красного костного мозга по костным
полостям, в гистологическом плане это закономерно распределенные
в пространстве системы клеточных элементов и межклеточных струк-
тур. Такую упорядоченность обеспечивает губчатое костное вещество
и специальная система сосудов, в частности особые венулы с системой
синусов, пронизывающих в радиальном направлении толщу кроветвор-
ной миелоидной ткани (рис. 115, А, Б). Через отверстия в стенке
синусов в кровяное русло попадают зрелые форменные элементы.
Кроме того, снаружи находятся слои периваскулярных фибробластов,
плотность распололожения которых может варьировать в широких
пределах. Строму миелоидной ткани составляет сеть дендритных,
имеющих макрофагальное происхождение клеток, тесно связанных с
сетью ретикулярных волокон. Последние располагаются вне клеток,
хотя могут быть погружены в особые углубления макрофагов и фиб-
робластов. Кроме этой своеобразной разновидности рыхлой соедини-
тельной ткани — ретикулярной (б) — в состав стромы входят особые
отростчатые макрофаги. В строме активной миелоидной ткани встре-
чаются отдельные жировые клетки (рис. 115, 5). Их количество может
увеличиваться вплоть до полного перерождения миелоидной ткани в
жировую или, наоборот, жировая ткань полостей трубчатых костей
341
может полностью или частично замещаться миелоидной тканью. В
ячейках ретикулярной ткани стромы располагаются гетерогенная сис-
тема морфологически неразличимых камбиальных клеток и дифферен-
цирующиеся в разных направлениях форменные элементы крови
(рис. 115, А). Это создает очень сложную и, на первый взгляд, хао-
тичную картину распределения весьма разнообразных по уровню и
Рис. 115. Красный костный мозг.
а — ход сосудов на поперечном срезе трубчатой кости;
б — строение стромы костного мозга:
1 — артерия, 2 — капилляры в толще кости, 3 — венозные синусоиды,
4 — вена, 5 — жировая, 6 — ретикулярная, 7 — адвентициальная клетки,
8 — базальная мембрана, 9 — эндотелий синусоида, 10 — коллагеновые
волокна, 11 — капилляр.
направлению дифференцировки клеточных элементов. Однако углуб-
ленное изучение отдельных категорий камбиальных и дифференциру-
ющихся клеток (и по характеру дифференцировки, и положению в
иерархии камбиальных клеток) показало закономерность в распреде-
лении клеток по степени их зрелости от периферии к центру органа.
На границе с костной тканью располагаются наименее дифференци-
рованные, мультипотентные клетки. Имеется и закономерная топогра-
фическая связь отдельных разновидностей дифференцирующихся кле-
ток с системой венозных синусов или отдельными элементами стромы
(рис. 116, А, Б).
Как уже отмечалось; в процессе кроветворения в красном костном
мозге можно выделить два этапа: начальный этап без видимых мор-
фологических изменений клеток и завершающий этап с хорошо выра-
женными изменениями клеток — от внешне недифференцированных
342
Рис. 116. Детали эритропоэза и тромбоцитопоэза в красном костном мозге
млекопитающих.
а — эритробластический отросток; б — почкование синусоида
(по Е. Н. Горышиной и О. Ю. Чаге, 1990):
1 — эритробласты, 2 — цитоплазма макрофага, 3 — ретикулоциты, 4 — кровя-
ные пластинки, 5 — эндотелий, 6 — базальная мембрана, 7 — адвентициальная
клетка, 8 — цитоплазма мегакариоцита
до зрелых специализированных в разных направлениях форменных
элементов крови. Завершающий этап кроветворения (гемопоэза) удоб-
нее рассмотреть на примере образования эритроцитов и кровяных
пластинок — эритропоэза и тромбоцитопоэза. Эти процессы у млеко-
питающих и человека характеризуются наибольшей сложностью, а в
эритропоэзе наиболее четко проявляются общие для всех типов клеток
крови закономерности рассматриваемого этапа кроветворения.
Исходной клеткой при эритропоэзе является особая полустволовая
эритропоэтинчуствительная клетка (ЭЧК) (рис. 117, 3). Эта клетка
была выявлена при культивировании in vitro суспензии клеток крас-
ного костного мозга. Она сохраняет свойства камбиальных унипотент-
ных (т. е. способных дифференцироваться лишь в одном направлении)
клеток и образует небольшие колонии при культивировании на твер-
дом агаре в присутствии эритропоэтина. Эритропоэтинчувствительные
клетки способны, следовательно, к ограниченному поддержанию своей
численности в популяции. Однако часть образующихся дочерних кле-
ток приступает к дальнейшей дифференцировке и система полуство-
ловых эритропоэтинчувствительных клеток должна подсеваться менее
дифференцированными полустволовыми клетками. По морфологичес-
кому строению ЭЧК имеют вид недифференцированных подвижных
клеток тканей внутренней среды — бластов, или, по старой термино-
логии, гемоцитобластов. Они довольно крупные, с базофильной цито-
плазмой, содержат ядро с распыленным хроматином и хорошо выра-
343
женным активным ядрышком. В цитоплазме бластов умеренно развиты
общие органоиды и полностью отсутствуют какие-либо признаки спе-
цифической дифференцировки.
У вступающих на путь эритропоэза клеток начинается активный
синтез рибосомных РНК и формируется большое количество свобод-
ных рибосом, на которых сразу же начинается синтез глобиновых
цепей на соответствующих информационных РНК. Рибосомы, связан-
ные с одной молекулой мРНК, образуют в цитоплазме характерные
скопления — полисомы. Клетки на этой стадии дифференцировки
получили название эритробластов (71-13). Они вступают в контакт с
отростчатыми макрофагами, образуя характерные эритробластические
островки (см. рис. 116, Б, 3). От макрофагов эритробласты получают
железо, необходимое для синтеза гемов. По мере накопления гемог-
лобина в эритробластах измененяется способность цитоплазмы вос-
принимать красители и резкая ее базофилия на начальных этапах
дифференцировки сменяется четко выраженной оксифилией. Последо-
вательные стадии дифференцировки эритробластов получили соответ-
ственно названия базофильных, полихроматофильных и эозинофиль-
ных (или оксифильных) эритробластов.
Несмотря на прогрессивно идущую дифференцировку все эрит-
робласты продолжают делиться и в результате из одной эритропоэ-
тинчувствительной клетки, вступившей на путь специализации, обра-
зуется целый клон дифференцирующихся клеток. Деление прекраща-
ется на стадии нормобласта (рис. 117, 14), следующей за стадией
оксифильного эритробласта. На этой стадии начинается подготовка к
удалению ядерного аппарата. Ядро с тонким слоем цитоплазмы сме-
щается к мембране клетки. Затем этот участок цитоплазмы с ядром
отшнуровывается и теряет связь с клеткой. При этом в поверхностном
аппарате эритробласта происходит характерное перераспределение
белков. Все молекулы спектрина и связанных с ним специфических
субмембранных белков остаются в безъядерной части. Поверхностный
аппарат ядросодержащего фрагмента обогащается рецепторами с боль-
шими углеводными компонентами, которые стимулируют активность
костно-мозговых макрофагов. Макрофаги фагоцитируют эти фрагмен-
ты, переваривают их, а продукты гидролиза ислользуются затем в
анаболических процессах.
Элиминация ядерных фрагментов нормобластов обычно совпадает
с выходом молодых эритроцитов, иначе ретикулоцитов, в просвет
сосуда, причем часто безъядерный ретикулоцит проходит через пору
в стенке синусов красного костного мозга, а ядросодержащий фрагмент
остается в его строме. Ретикулоциты начинают функционировать, со-
344
1
Рис. 117. Схема гемопоэза у млекопитающих
(по Е. Н. Горышиной и О Ю. Чаге, 1990).
1 — стволовая клетка крови (СКК); 2-7 — колониеобразующие единицы (2 — селе-
зенки КОЕс), 3 — эритроцитов (КОЕэ), 4 — мегакариоцитов (КОЕмег), 5 — грануло-
цитов и макрофагов (КОЕгм), б — эозинофилов (КОЕэо), 7 — базофилов); 8-10 —
унипотентные предшественники (8 — тучных клеток, 9 — В- и Т-лимфоцитов); 11 —
проэритробласт; 12 — базофильный; 13 — полихроматофильный и 14 — оксифильный
эритробласты; 15 — ретикулоцит в процессе потери ядра; 16 — мегакариобласт; 17 —
мегакариоцит, 18 — промоноцит, 19 — моноцит, 20-24 — нейтрофильные: миелобласт
(20), промиелоцит (21), миелоцит (22), метамиелоцит (23), палочкоядериый гранулоцит
(24); 25-28 — эозинофильные: миелобласт (25), промиелоцит (26), миелоцит (27), ме-
тамнелоцит (28); 29-31 — базофильные: миелобласт (29), миелоцит (30), мсгамиелоцит
(37); 32-40 — зрелые клетки: эритроцит (32), кровяные пластинки (33), макрофаг (34),
нейтрофильный (35), эозинофильный (36) и базофильный (37) гранулоциты, тучная клет-
ка (38), В- (39) и Т-лимфоциты (40), 41 — плазматическая клетка.
345
храняя еще некоторое время способность к синтезу гемоглобина. По-
степенно они утрачивают остатки органоидов и превращаются в зрелые'
эритроциты, которые циркулируют в крови более четырех месяцев, а
затем оседают в селезенке, где разрушаются. Сигналом для этого
служат возрастные изменения поверхностного аппарата. В старых
эритроцитах снижается плотность и заряд гликокаликса, происходит
обеднение клеточной поверхности остатками сиаловых кислот.
Еще более своеобразные и в известном смысле уникальные изме-
нения происходят при формировании кровяных' пластинок в красном
костном мозге млекопитающих и человека. Исходными недифферен-
цированными клетками являются полустволовые клетки особого типа,
так называемые колониеобразующие единицы тромбоцитарного ряда
(КОЕт), или тромбоцитарные полустволовые клетки. Их удалось вы-
делить при особых условиях культивирования суспензии клеток крас-
ного костного мозга in vitro. По своей морфологии они сходны с
эритропоэтинчувствительными клетками, т. е. имеют вид типичных
бластов, унипотентны, т. е. способны дифференцироваться лишь в
одном направлении. Выходящие в дифференцировку тромбоцитарные
полустволовые клетки сохраняют способность к репликации хромосом
и пытаются делиться. Однако митоз обычно не доходит до метафазы.
В результате образуются клетки с удвоенным количеством хромосом.
Цикл такой своеобразной эндомитотической репродукции неоднократ-
но повторяется, образуются гигантские клетки, содержащие 16, 32 и
даже 64 набора хромосом. Они получили, название мегакариоцитов и
имеют ядро неправильной формы, на порядок превышающее по раз-
мерам обычные диплоидные ядра (см. рис. 116, 117).
Сильно увеличен и объем цитоплазмы. Мегакариоциты распола-
гаются в красном костном мозге около стенки венозных синусов. По
мере увеличения плоидности клеток происходят специфические изме-
нения в их поверхностном аппарате и цитоплазме. Гипертрофируется
плазматическая мембрана, образующая глубокие впячивания в. цито-
плазму клеток. В мембране сосредоточиваются характерные для кро-
вяных пластинок рецепторы, а в субмембранной цитоплазме форми-
руется сократимая актин-миозиновая фибриллярная система и лежащая
глубже система микротрубочек — будущий «скелет» кровяных плас-
тинок. <
В цитоплазме мегакариоцитов начинает накапливаться гетероген-
ны , специфический для кровяных пластинок набор гранул и вакуолей,
а заключительных этапах дифференцировки мегакариоциты образуют
длинные похожие на бусы отростки, каждое расширение которых
р дставляет собой почти сформированную кровяную пластинку. От-
346
ростки обычно проникают через отверстия венозных синусов и распа-
даются в полости сосуда на кровяные пластинки. Помимо такого
механизма образования пластинок, наблюдаемого в опытах in vitro, в
естественных условиях более распространена фрагментация цитоплаз-
мы округлых мегакариоцитов на большое количество пластинок без
образования лентовидных отростков. Такая фрагментация осуществля-
ется путем слияния ограниченных мембраной пузырьков на границе с
образующимися пластинками. Активно перемещаясь, пластинки попа-
дают в просвет синусов. Ядра мегакариоцитов с остатками цитоплазмы
после ее фрагментации обычно фагоцитируются макрофагами.
Для нейтрофилов и моноцитов выделена методом культивирова-
ния in vitro общая полустволовая клетка, получившая название коло-
ниеобразующей единицы в культуре (КОЕк). Морфологически она не
отличается от рассмотренных выше полустволовых клеток и представ-
ляет собой недифференцированную бластную форму. Однако полу-
стволовые клетки — предшественники фагоцитов — обладают еще
большими потенциями к дифференцировке и могут специализировать-
ся по одной из двух программ: нейтрофильного гранулоцита и моно-
цита. Очевидно, что на пути дифференцировки этой категории полу-
стволовых клеток есть еще бластные формы предшественника для
каждого из направлений дифференцировки.
Что же касается самих грануло- и моноцитопоэзов, то они в
принципе сходны с процессами эритропоэза. Дифференцировка, как и
при эритропоэзе, сопровождается делением специализирующихся кле-
ток без утраты ими достигнутого уровня дифференцировки. Естест-
венно, что в каждом конкретном случае направление последователь-
ных этапов структурно-химических изменений в клетках соответствует
особенностям гранулоцитов или моноцитов. Процессы гранулоците- и
моноцитопоэза в красном костном мозге завершаются после форми-
рования в поверхностном аппарате специфических рецепторов и при-
обретения клетками способности к активному перемещению и поло-
жительному хемотаксису к стенке венозных синусов. В нормальных
условиях зрелые гранулоциты и моноциты задерживаются на 1-2 сут.
в красном костном мозге, функционирование стареющих гранулоцитов
и моноцитов происходит уже в кровяном русле и в прослойках сопро-
вождающей сосуды рыхлой соединительной ткани, куда эти подвиж-
ные форменные элементы постоянно проникают благодаря способнос-
ти мигрировать через стенки сосуда.
В настоящее время выделен ряд гуморальных факторов, стимули-
рующих дифференцировку как общего предшественника моноцитов и
гранулоцитов (ГМ-КСФ), так и отдельно моноцитов (М-КСФ) и гра-
347
нулоцитов (Г-КСФ). Особенностью моноцитов является сохранение
ими способности к делению и на стадии разнообразных разновиднос-
тей макрофагов, в которые они превращаются, выделяясь в специали-
зированные органы и ткани (легкие, целом, печень, лимфоидные ор-
ганы и др.) (см. рис. 117). Эта же способность свойственна всем
основным клеткам лимфоидной ткани, антигензависимая дифференци-
ровка которых обязательно сопровождается бластотрансформацией и
да пением дифференцирующихся клеток при образовании клонов В- и
Т- лимфоцитов. К ограниченному размножению способны и обе суб-
популяции тучных клеток {38-40. 42).
Крупным достижением современного периода изучения гемопоэза
у млекопитающих и человека стало выяснение организации его на-
чальных, морфологически не выраженных этапов. В начале 60-х годов
была разработана экспериментальная модель клонирования стволовых
клеток крови мышей in vitro. В радиобиологических экспериментах
после облучения мышей смертельной дозой рентгеновских лучей уда-
лось показать, что их гибель чаще всего сопровождается опустошением
кроветворных органов. Камбиальные клетки крови весьма чувствитель-
ны к действию рентгеновских лучей: при облучении происходит пол-
ная их гибель. Если облученным мышам ввести в кровь суспензию
клеток красного костного мозга от здоровых мышей, то наблюдается
расселение клеток и восстановление гемопоэза в строме костного мозга
облученной мыши. На 7-10-й день после пересадки в селезенке облу-
ченных мышей удалось обнаружить небольшие кроветворные очаги —
колонии. Каждая колония состояла из клеток, дифференцирующихся
либо в эритроцитном, либо в миелоидном направлении. При этом
эритроидных колоний было в два раза больше, чем грануло- и мега-
кариоцитных.
Тщательный анализ колоний показал, что источником каждой из
них является одна-единственная клетка из пересаженной суспензии
клеток красного костного мозга здоровой мыши. Иными словами,
каждая колония представляет собой клон клеток, развивающийся из
одной родоначальной клетки, которая в строме селезенки создала ми-
ниатюрную упрощенную кроветворную систему. В этой системе име-
ется самоподдерживающийся фонд камбиальных клеток и происходит
процесс дифференцировки клеток в одном из трех направлений гемо-
поэза.
В опытах с пересадкой облученным мышам колоний одного типа
вместо суспензии клеток красного костного мозга удалось показать,
что у таких мышей восстанавливаются все направления гемопоэза, а
селезенке снова развиваются колонии всех трех типов и в тех же
соотношениях, что и в исходном опыте.
348
Следовательно, родоначальные колониеобразующие клетки по
своей природе мультипотентны. Направление их дифференцировки
определяется не внутренними причинами, а внешними воздействиями
на клетки стромы кроветворного органа, в данном случае стромы
различных участков селезенки. При оседании родоначальной колоние-
образующей клетки в одном участке стромы селезенки будет форми-
роваться эритроидный росток, при оседании в других участках сфор-
мирзются гранулоцитныс или мегакариоцитные колонии.
Разработанный метод клонирования родоначальных колониеобра-
ззюших клеток крови в селезенке облученных мышей позволил изу-
чить их свойства. Оказалось, что эти клетки мультипотентны по своей
природе и могут давать начало клеткам, дифференцирующимся в
любом направлении в системе свободных элементов тканей внутрен-
ней среды данного организма (/). Второе важное свойство этих кле-
ток — способность поддерживать путем митотического деления опре-
деленное количество себе подобных клеток. Иными словами, они «чув-
ствуют» свое количество в системе и способны к неограниченному
делению. Клетки, обладающие такими свойствами, получили название
стволовых клеток крови.
Стволовые клетки крови несмотря на мультипотентность и на
способность к неограниченному делению в нормальных условиях де-
лятся редко, а их дочерние клетки чаще идентичны им по своим
свойствам, т. е. значительная часть клеток обычно не вступает на путь
дифференцировки.
Деятельность кроветворной системы в обычных условиях обеспе-
чивается в основном системой полустволовых клеток (3-10). Часть
категорий этих клеток удается выявить методом культивирования in
vitro. Рассмотренные нами полустволовые эритропоэтинчувствитель-
ные клетки и клетки, с которых начинается дифференциация по гра-
нулоцитному пути, представляют собой лишь одну конечную или
близкую к конечной категорию этих клеток. Между ними и стволо-
выми клетками имеется еще несколько категорий полустволовых кле-
ток, значительная часть которых пока точно не идентифицирована.
Первая категория клеток, наиболее близкая по своим свойствам к
стволовым, представляет собой полустволовые клетки миелоидного и
лимфоидного рядов (2, а, б).
Между полустволовой клеткой миелоидного ряда и эритропоэтин-
чувствительной клеткой имеется еще несколько унипотентных полу-
стволовых клеток эритроидного ряда. Условия, необходимые для их
выделения в культурах in vitro, чувствительность к эритропоэтину и
349
характер образуемых in vitro клонов различны. Промежуточные сис-
темы полустволовых клеток для гранулоцито-моноцитного и мегака-
рионитного рядов изучены в настоящее время еще слабо. Однако по
аналогии с эритропоэзом и здесь наличие нескольких категорий клеток
вполне вероятно.
Стволовые и все категории полустволовых клеток морфологичес-
ки неразличимы. Они имеют вид бластов. Общими особенностями
полустволовых клеток являются внутренние ограничения их потенций
к выбору направлений дифференцировки. Степень ограничения опре-
деляется категорией полустволовых клеток: она тем меньше, чем бли-
же клетка к стволовым клеткам. Второй особенностью системы полу-
стволовых клеток (по сравнению со стволовыми) является ограничение
их способности к самоподдержанию, т. е. пролиферации без видимой
дифференцировки. Степень такого ограничения, по-видимому, также
увеличивается по мере повышения уровня дифференцировки этих кле-
ток.* Полустволовые клетки (в отличие от стволовых), энергично раз-
множаясь, выходят в дифференцировку. Они подвержены прямому
действию специфических для каждого направления дифференциров-
ки гуморальных факторов. Для эритропоэза таким фактором служит
эритропоэтин, для КОЕк-клеток — колониестимулирующие факторы
(КСФ), для полустволовых клеток мегакариоцитного ряда — фактор,
получивший название тромбоцитопоэтина. Кроме этих факторов бел-
ковой или гликопротеидной природы (молекулярные массы от 15 до
160 кДа) на полустволовые клетки оказывают, по-видимому, влияние
и факторы, выделяемые зрелыми клетками. Стволовые клетки и на-
чальные категории полустволовых клеток менее чувствительны к дей-
ствию всех этих факторов. Регуляция интенсивности репродукции и
выхода в дифференцировку осуществляется их сложными взаимодей-
ствиями с клетками стромы и некоторыми специальными категориями
свободных клеточных элементов.
* В последнее время появились данные о возможности длительного самоподдержания
определенного количества полустволовых клеток. Например, в колониях in vitro полуство-
ловые клетки нейтрофильно- макрофагального ряда у мышей сохранялись в течение полу-
гола и даже дольше. В то же время способность к практически неограниченному делению
показана не только у стволовых клеток, но и у цитотоксических Т-лимфоцитов. В связи с
такого рода данными, количество которых непрерывно увеличивается, приводимая в этом
учебнике концепция стволовых клеток начинает подвергаться серьезной ревизии
(И. И. Чертков, А. А. Гуревич, 1984; И. И. Чертков, 1991). Этому способствует и обнару-
женная недавно лимфоидно-(В-система)-макрофагальная метаплазия, сильно усложняю-
щая классические представления о клональном принципе организации кроветворной систе-
мы. По нашему мнению, в концепции стволовых и полустволовых клеток чрезмерно персо-
нифицированы клетки и недостаточно учитываются внутрисистемные межклеточные взаи-
модействия.
350
Большую роль в регуляции потока дифференцировки клеток в
направлении миелоидного или лимфоидного кроветворения играют
многочисленные ростовые факторы, выделяемые Т-хелперными (СД4+)
лимфоцитами. К их числу относятся интерлейкин 3, обеспечивающий
преимущественную дифференцировку стволовой клетки крови в полу-
стволовую клетку лимфоидного ряда, ГМ-КСФ, М-КСФ и многие
другие. Не меньшую роль играют и медиаторы стромальных клеток,
например интерлейкин 7, являющийся необходимым условием ранних
этапов дифференцировки В- лимфоцитов. Полусгволовые клетки даже
близких к стволовым категорий, вероятно, не могут восстанавливать
си< тему кроветворения. Их количество, как правило, периодически
должно пополняться из фонда стволовых клеток. Конкретные тонкие
механизмы регуляции взаимоотношений стволовых и близких к ним
категорий полустволовых клеток выяснены еще недостаточно. Суще-
ственную роль в такого рода отношениях играет, по-видимому, топо-
графическое распределение клеток в строме красного костного моз-
га. По существующей гипотезе «ниш» (рис. 118), сохранение свойств
стволовых клеток при репродукции или, наоборот, перехода их в
категорию полустволовых в значительной мере определяется конкрет-
ным микроокружением, способствующим или не способствующим со-
Макрофаг
Дифференцирующиеся клетки
эритроидного ряда
Рис. 118. Гипотеза «ниш». Эритробластный островок в костном
мозге (по Улумбекову Э. Г., Челышевой Ю. А, 1997).
Островок образован макрофагом и прилежащими к нему диффе-
ренцирующимися эритроидными клетками. Последние располага-
ются между отростками макрофага.
351
хранению клетками малодифференцированного состояния. По гипотезе
«ниш», клетки, которые занимают прилегающие к костной ткани ниши
сохраняют или приобретают стволовые свойства, клетки же, находя-
щиеся в нишах около центральной вены имеют свойства полустволо-
вых клеток.
Таким образом, наиболее существенным отличием стволовых и
различных полустволовых клеток является наличие у клеток каждой
категории специфических рецепторов, определяющих способность кле-
ток занимать соответствующую нишу в строме красного костного
мозга и реагировать лишь на определенные воздействия. Биологичес-
кий смысл такого рода организации камбиальных кроветворных кле-
ток, способных к полному восстановлению системы кроветворения,
заключается в защите их от соматических мутаций.
Вероятность мутаций в стволовых клетках невелика из-за низкого
уровня их репродукции и нечувствительности к обычным регулирую-
щим гуморальным факторам. Стволовые и близкие к ним категории
полустволовых клеток обычно совсем не реагируют или слабо реаги-
руют на гормональные стимулирующие факторы типа эритропоэтина,
КСФ и др. Некоторый общий стимулирующий эффект в направлении
миелопоэза оказывает на рассматриваемые категории клеток лишь
продуцируемый лимфоцитами интерлейкин 3.
Сложная иерархия камбиальных клеток, включающая в себя ро-
доначальные стволовые и несколько категорий полустволовых клеток,
позволяет также обеспечить многоэтапную регуляцию. Это обуслов-
ливает в конечном счете большую пластичность и работоспособность
системы в разных условиях. Пластичность организации кроветворных
систем млекопитающих и человека определяется еще и способностью
стволовых родоначальных клеток к миграции и расселению по крове-
творным тканям организма.
Закономерные процессы миграции стволовых клеток крови весьма
характерны и для эмбрионального гистогенеза крови млекопитающих
и человека. Источником стволовых клеток крови является часть пер-
вичных клеток, которые появляются на весьма ранних этапах эмбри-
огенеза в кровяных островках провизорного органа — желточного
мешка. В дальнейшем наблюдается закономерное увеличение фонда
этих клеток и перемещение гемопоэза сначала в эмбриональную пе-
чень, а затем в костный мозг, а у некоторых млекопитающих частично
и в селезенку. Параллельно с изменением локализации гемопоэза в
ходе эмбрионального гистогенеза усложняются и процессы дифферен-
цировки клеток. Это проявляется в увеличении количества направле-
ний дифференцировки: на ранних стадиях эмбриогенеза в желточном
352
мешке у мыши образуются только эритроциты, дифференцировка гра-
нулоцитов и мегакариоцитов начинается у этих животных в период
печеночного гемопоэза. У других видов млекопитающих с более про-
должительным внутриутробным развитием процессы грануло- и мега-
кариоцитопоэза происходят уже в периоде желточного кроветворения.
Процессы эмбрионального гемопоэза по ходу развития непрерыв-
но удлиняются. В результате увеличивается количество промежуточ-
ных форм, формируются более специализированные функционирую-
щие клетки. Особенно хорошо изучены эти изменения дифференци-
ровки в эмбриогенезе на примере эритропоэза. Клетки первой, весьма
быстро формирующейся популяции функционирующих эритроцитов
значительно крупнее дефинитивных и содержат ядра; концентрация
гемоглобина в них намного меньше, чем в эритроцитах, образующихся
на более поздних этапах эмбрионального гистогенеза. Кроме того, в
основе их гемоглобина лежат особые хотя и гомологичные а- и Р-це-
пям дефинитивного гемоглобина глобиновые цепи. У животных с
более длительным этапом эмбрионального развития и у человека в
период печеночного кроветворения происходит переключение транс-
крипции с эмбриональных глобиновых генов на особые фетальные
гены из семейства Р-глобиновых. Наконец, на более поздних этапах
эмбриогенеза в эритропоэтическом ряду устанавливаются отношения,
характерные для дефинитивного эритропоэза: синтез глобинов проис-
ходит на основе мРНК, считываемых с дефинитивных а- и Р-глоби-
новых генов.
Важно подчеркнуть, что у млекопитающих все глубокие и зако-
номерные изменения процессов дифференцировки клеток крови в ходе
эмбриогенеза индуцируются изменением их микроокружения.
Что касается других позвоночных животных, то даже у миксин и
миног на всех этапах их онтогенеза клетки крови формируются в
кроветворных органах со специальной стромой из фибробластических
клеточных элементов, ретикулярных волокон, часто сопутствующих
им жировых клеток и специальных расширенных капилляров. Начиная
с рыб эритропоэз и тромбоцитопоэз происходят в специальном орга-
не — селезенке. Она формируется на основе околокишечной сое-
динительной ткани. Значение органа кроветворения селезенка сохра-
няет у современных амфибий и рептилий. Лишь у млекопитающих и
птиц процессы дефинитивного кроветворения перемещаются в крас-
ный костный мозг. Тенденция к формированию кроветворных органов
в контакте с костной тканью проявились у позвоночных и на более
низких уровнях организации. Так, у хрящевых ганоидов в кости черепа
над четвертым желудочком мозга имеются специальные полости, в
которых сосредоточена кроветворная миелоидная ткань. Что касается
353
гранулоцитопоэза, его локализация широко варьирует у позвоночных
животных. Формирование гранулярных лейкоцитов и, по-видимому,
моноцитов у низших позвоночных может происходить в почке, гона-
дах, в глазных орбитах, печени, эпикарде, в соединительной ткани
шейной области и ряде других органов. Однако везде обязательно
присутствует стромальная основа в функционирующей кроветворной
ткани. В связи с этим весьма обоснованным является предположение
о том, что у всех позвоночных есть сложная, аналогичная имеющейся
у млекопитающих животных система камбиальных клеток, включаю-
щая в себя и мультипотентные стволовые клетки, и более или менее
сложную иерархию полустволовых камбиальных клеток. Регуляция
работы этой системы осуществляется специальным, создаваемым стро-
мой и гуморальными факторами, микроокружением, регуляцией по
принципу обратной связи. Естественно, что этот общий принцип ор-
ганизации процессов миелопоэза у представителей отдельных классов,
а возможно, и в более мелких систематических группах имеет различ-
ные модификации. Внешним выражением такого рода модификаций
является отмеченное выше варьирование локализации процессов гра-
нулопоэза. Наличие мультипотентных стволовых клеток в кроветвор-
ных системах птиц доказано на экспериментальной модели, аналогич-
ной модели клонирования стволовых клеток млекопитающих.
Анализ имеющегося сравнительного материала позволяет сделать
вывод, что структурная организация процессов гемопоэза особенно
необходима для первого, морфологически не выраженного этапа. Что
касается второго, заключительного этапа, то процессы эритро- и тром-
боцитопоэза, как правило, совершаются вне стромы, интраваскулярно,
а завершающие этапы репродукции и дифференцировки этих клеток
часто происходят и в циркулирующей крови. Эта особенность завер-
шающих этапов образования эритроцитов и тромбоцитов частично
обусловлена слабой способностью этих клеток к активному переме-
щению.
Интересное приспособление для предотвращения массового попа-
дания в циркуляцию незрелых эритроцитов обнаружено у птиц. Рецеп-
торный аппарат дифференцирующихся эритробластов обладает срод-
ством к эндотелию венозных синусоидов, благодаря чему эритроблас-
ты образуют пристеночные скопления. Эти свойства поверхности эрит-
робластов при превращении их в эритроциты утрачиваются, и эрит-
роциты уносятся кровотоком.
Экстрав аскулярное созревание эритроцитов млекопитающих обу-
словливается, с одной стороны, контактом эритробластов с макрофа-
гами, обеспечивающим, по-видимому, их изоляцию от ингибирующего
влияния стромы на видимую фазу эритропоэза. С другой стороны, про-
354
цесс элиминации ядер и увеличение эластичности поверхностного ап-
парата эритроцитов в этот период делают возможным их активное про-
хождение через стенку венозных синусов. Экстраваскулярное форми-
рование кровяных пластинок обеспечивается у млекопитающих качест-
венными (по сравнению с другими позвоночными) изменениями самой
дифференцировки этих форменных элементов, утрачивающих, как мы
видели, клеточный характер своей организации. Последние примеры
показывают, каким существенным модификациям подвергаются сами
процессы дифференцировки кровяных клеток и характер межклеточ-
ных воздействий при гемопоэзе. Очевидно, что они свидетельствуют
о большой пластичности эволюционной динамики гемопоэза.
Весьма яр» им примером пластичности эволюционной динамики
гемопоэза у позвоночных животных является наличие в онтогенезе
птиц дву х популяций стволовых клеток крови. Первая популяция по-
является на ранних этапах онтогенеза и обеспечивает формирование
провизорной популяции эритроцитов, а затем элиминируется. Еще
одним примером в этом плане может служить особый способ диффе-
ренцировки эритроцитов птиц. Часть их может созревать быстро и без
делений в тетраплоидном состоянии.
Существенные изменения в характере экспрессии генов, кодиру-
ющих глобиновые цепи в онтогенезе, присущи не только млекопи-
тающим, но имеют место и у других позвоночных. Сложную мигра-
цию и, следовательно, смену макроокружения претерпевают стволовые
клетки в эмбриогенезе бесхвостых амфибий (рис. 119).
Мезодерма Интерсти- Колонизация
дорсальныхциальная зачатков
'латеральных миграция почки и аорты
пластинок 1 ' \
В-лимфопозз
Гоанулоцитопозз
Моноцитогозз
Селезенка
Гаст рула
Циркуляция
Тимус
Печень
Зритропозз
Вентральные-
кровяные -
островки
Желточные _ Эмбриональный
Вены *"зритропозз
Цирку-
ляция
Рис. 119. Пути миграции кроветворных клеток в эмбриогенезе бесхвостых амфи-
бий (по Е. Н. Горышиной и О. Ю. Чаге, 1990).
355
§2 . ОРГАНИЗАЦИЯ КРОВЕТ ВОРЕНИЯ У БЕСПОЗВОНОЧНЫХ
ЖИВОТНЫХ
Процессы кроветворения изучены в разных группах беспозвоноч-
ных животных очень неравномерно и значительно менее детально, чем
у позвоночных животных. Однако даже имеющиеся отрывочные дан-
ные позволяют сделать вывод, что в пределах отдельных классов бес-
позвоночных, а также от менее сложно организованных низших беспо-
звоночных к высшим первичноротым животным наблюдается тенден-
ция к усложнению организации процессов гемопоэза. Наиболее про-
стой формой проявления гемопоэза является наличие малодифферен-
цированного мультипотентного клеточного элемента в крови, благо-
даря делению которого происходит пополнение клеток разных направ-
лений дифференцировки. При этом процессы размножения и диффе-
ренцировки происходят непосредственно в крови или тканевой и по-
лостной жидкостях без формирования особых кроветворных органов.
Следующей ступенью организации гемопоэза является образова-
ние различного рода скоплений клеток, в которых наблюдаются от-
дельные этапы либо процессов репродукции, либо созревания клеток.
Такого рода зачаточные кроветворные органы описаны даже у немер-
тин, где в стенке сосудов, образующих прецеребральные сосудистые
лакуны, обнаружены скопления клеток, дифференцирующихся в эрит-
роциты. У аннелид удалось выявить в прослойках интерстициальной
соединительной ткани скопления дифференцирующихся лейкоцитов.
Однако деление этих клеток и присутствие малодифференцированных
бластов здесь не обнаружены.
У первичноротых животных с хорошо развитой вторичной полос-
тью тела анализ процессов гемопоэза затруднен тем, что целомический
эпителий и его производные берут на себя ряд функций тканей внут-
ренней среды. У аннелид часть свободных клеточных элементов, на-
ходящихся в полости тела, образуется из целомического эпителия.
Естественно, что организация их репродукции и дифференцировки
может отличаться от организации обновления свободных клеточных
элементов тканей внутренней среды, происходящих из первичной па-
ренхимы.
У аннелид, в частности, прямыми производными целомического
эпителия являются так называемые хлорагоциты, из которых могут
возникать специфические бифункциональные клетки — элеоциты. Не-
которые авторы считают, что и другие свободные элементы полости
тела и даже клетки, циркулирующие в кровеносных сосудах, имеют
целомическое происхождение. Однако прямых экспериментальных до-
казательств этого нет.
356
Сходная с существующей у позвоночных животных организация
процессов кроветворения у первичноротых животных наблюдается у
моллюсков, в частности у одного из подробно изученных в этом
отношении большого прудовика Lytnnaea stagnalis. Здесь методом ра-
диоавтографии с использованием [3Н]тимидина удалось показать ге-
мопоэтические островки в перикардиальной соединительной ткани. В
их состав входят клетки, имеющие вид бластов, промежуточные диф-
ференцирующиеся клетки и клетки, по своей морфологии сходные с
амебоцитами периферической крови. В непосредственном контакте с
островками находятся фибробласты, образующие их основу, т. е. сис-
тему, аналогичную строме кроветворных органов млекопитающих. Для
клеток гемопоэтических островков характерна наивысшая пролифера-
тивная активность как в нормальных условиях, так и при кровопотерях
и воспалительных процессах (в 10 раз выше, чем в периферической
крови). Повышение пролиферативной активности амебоцитов, образу-
ющих скопления в соединительной ткани в области мантии и пери-
карда, показано при экспериментальном заражении паразитами и у
другого вида брюхоногих моллюсков (рис. 120). Для брюхоногих и
пластинчатожаберных моллюсков характерно наличие общей камби-
альной клетки для оседлых и свободных клеточных элементов. Вместе
с тем у многих представителей других видов этих моллюсков не
удалось пока обнаружить специальных кроветворных органов. Обнов-
ление клеточных элементов их тканей внутренней среды происходит,
по-видимому, благодаря делению циркулирующих в крови недиффе-
ренцированных клеток. Кроме того, часть специализированных сво-
бодных клеток интерстициальных тканей типа описанных выше поро-
вых клеток имеет, возможно, и собственный источник развития.
Сложные кроветворные органы находятся в стенке глазных по-
лостей у головоногих моллюсков. Они имеют специальные синусы
кровеносных сосудов и отростчатые стромальные клетки. Для форми-
рующихся здесь клеток крови характерно полярное расположение:
наиболее зрелые элементы находятся в области кровяных синусов.
У членистоногих процессы гемопоэза изучены у единичных пред-
ставителей высших ракообразных и у представителей ряда отрядов
насекомых. У насекомых имеется, по-видимому, аналогично млекопи-
тающим, разделение камбиальности в дефинитивных системах для
оседлых клеток интерстициальных тканей и для свободных клеточных
элементов гемолимфы. Для многих изученных представителей членис-
тоногих также характерно наличие кроветворных органов, хотя их
локализация и структура варьируют в широких пределах. У высших
раков кроветворные органы представлены гемопоэтическими узелками,
расположенными в соединительной ткани стенки желудка. Каждый
357
Рис. 120. Участок кроветворного органа улитки
(no Е. Н. Горышиной и О. Ю. Чаге, 1990).
1 — мантийный эпителий, 2 — базальная мембрана, 3 — гладкомышечные
клетки, 4 — кровяной синус, 5 — фибробласт, 6 — эпителий перикарда,
7 — недифференцированные и 8 — созревающие амебоциты,
9 — зрелый амебоцит.
кроветворный узелок представляет собой чашеобразный фоликул в
дорсальной стенке желудка. Фолликул с трех сторон окружен базаль-
ной мембраной. Одна его сторона, обращенная в гемоцель, открыта и
не имеет базальной мембраны. От базальной мембраны в толщу фол-
ликула отходят тяжи волокнистого вещества, разделяющие свободные
клетки на группы по 3-4 клетки. Между контактирующими в фолли-
кулах свободными клетками иногда наблюдаются постоянные межкле-
точные контакты. Клетки интенсивно митотически делятся и претер-
певают дифференцировку в разных направлениях. У зрелых клеток,
попадающих в гемолимфу, часто сохраняется способность к делению.
Непосредственно в циркуляцию входят обычно гиалиновые амебоци-
ты. Для созревания цианоцитов (клетки, продуцирующие гемоцианин)
необходим их временный контакт с соединительной тканью стенки
желудка или глазной артерии, где они накапливаются перед линькой.
Наблюдается отчетливая связь количества гранулярных амебоцитов и
этапов линьки. Первый их пик характерен для середины межлиночного
358
периода, второй имеет место непосредственно перед линькой. У краба
Carcinus maenas в гемопоэтических узелках обнаружены оседлые клет-
ки типа фибробластов и волокнистые структуры неизвестного хими-
ческого состава. Авторы допускают возможность превращения осед-
лых клеток в недифференцированные свободные элементы, однако
строгих доказательств таких превращений пока нет.
У изученных представителей насекомых строение кроветворных
органов широко варьирует в связи с особенностями развития (полное
и неполное превращение) и многообразием форм в этом классе чле-
нистоногих.
Кроветворные органы изучены современными методами у саран-
чи, сверчка, пчелы, личинок шелкопряда, мясной мухи, дрозофилы и
представителей ряда других отрядов насекомых. У саранчи и сверчка
кроветворная ткань сосредоточена на диафрагме, отделяющей пери-
кард от гемоцеля. Как и у ракообразных, у них имеются группы клеток,
разделенные отростками базальной мембраны. Клетки в таких группах
часто связаны десмосомами. Они могут делиться митозом и превра-
щаться в прогемоциты. Имеются ретикулярные клетки, способные к
фагоцитозу и выделению бактерицидных веществ при попадании ин-
фекции. Допускается возможность превращения ретикулярных клеток
в свободные элементы.
У личинок мясной мухи кроветворные органы расположены в
задней части тела. Гемопоэтические узелки содержат отростчатые ре-
тикулярные клетки. Между их отростками располагаются округлые
недифференцированные клетки — предшественники фагоцитов и эно-
цитоилов. Последние лизируют базальные мембраны органов при ме-
таморфозе. Количество клеток, продуцируемых в кроветворном органе,
регулируется гормоном. Массовое появление фагоцитов и эноцитов в
циркуляции наблюдается перед метаморфозом. Очередные линьки так-
же требуют наличия гемоцитов. Показано специфическое влияние раз-
ных гормонов на репродукцию и дифференцировку клеток в гемопо-
этических островках.
У гусеницы бабочки совки своеобразная комбинация относитель-
но простой организации обновления гранулярных амебоцитов и сфе-
рулоцитов (в гемолимфе делятся дифференцированные клетки) соче-
тается с наличием кроветворных органов и постепенным созреванием
Двух других типов клеток: эноцитоидов и плазмоцитов (рис. 121).
Пластичность в организации системы свободных элементов и их
обновление наблюдается у представителей низших хордовых: ланцет-
ника и асцидий. У ланцетника имеется всего один тип клеток в цело-
мической жидкости. Эти клетки возникают, по-видимому, путем слу-
359
Рис. 121. Гемопоэз у гусениц бабочки совки
(по Е. Н. Горышиной и О Ю Чаге, 1990).
1 — гемоцитобласт, 2 — прогемоцит, 3 — плазмацит, 4 — эноцитоид 5 — гра-
нулоцит, б — сферулярная клетка; I — кроветворный орган, II — гемолимфа.
щивания их с поверхности целомического эпителия. В крови асцидий
имеется, по крайней мере, четыре типа дифференцированных в разных
направлениях клеток, развивающихся из камбиальных клеток гемоци-
тобластов. Наиболее многочисленный тип клеток — морулярные клет-
ки (или гранулярные амебоциты) — интенсивно размножаются уже в
дифференцированном состоянии (рис. 122).
§3 . ПРОБЛЕМА ОБНОВЛЕНИЯ МЕХАНОЦИТОВ
Проблемы обновления механоцитов мы уже касались при ха-
рактеристике трофических интерстициальных и механических тканей.
Здесь следует лишь подчеркнуть, что организация обновления меха-
нических тканей у беспозвоночных животных почти не изучена совре-
менными^ методами. Радиоавтографические исследования с использо-
ванием [ Н]тимидина проводили лишь на брюхоногих моллюсках. В
этих работах удалось показать возможность превращения свободных
амебоцитов в клетки типа фибробластов, продуцирующих коллаген
при воспалительном новообразовании соединительной ткани. Анало-
гичные данные в работах 30-х годов имеются и в отношении олигохет,
пластинчатожаберных моллюсков и членистоногих. Однако эти данные
360
Рис. 122. Гемопоэз у асцидии
(по Е. Н. Горышиной и О. Ю. Чаге, 1990).
1 — гемоцитобласт, 2 — гигантская клетка, 3 —
гранулоцит, 4 — гиалиновый амебоцит, 5 — фа-
гоцит, 6 — вакуолярные, 7 — перстневидные и
8 — отсековидные клетки, 9 — молодые и 70 —
зрелые морулярные клетки.
требуют проверки и пока не подтверждаются современными исследо-
ваниями.
Значительно менее подробно, чем процессы кроветворения, изу-
чена и организация обновления механопитов у позвоночных и даже у
их высших представителей — млекопитающих и человека. Изучение
этого вопроса осложняется тем, что дифференцировка механоцитов
обратима и поддерживается в основном не внутриклеточными меха-
низмами, а внешними факторами — синтезируемым ими межклеточ-
ным матриксом. Так, если изолировать хондробласты от их межкле-
361
точного вещества (коллаген И, протеогликаны), то через некоторое
время они превратятся в фибробласты, продуцирующие коллаген I
типа. Наиболее широким набором потенций к дифференцировке в
разновидности механоцитов обладает часть фибробластов стромы кост-
ного мозга. При так называемой гетеротопной пересадке (например,
под капсулу почки) стромы костного мозга эти клетки дают костные
клетки, ретикулярные клетки стромы и жировые клетки костного моз-
га, обеспечивая соответствующее микроокружение для формирования
свободных клеток крови. В связи с этим считается, что в костном
мозге содержатся не только стволовые клетки крови, но и стволовые
клетки системы оседлых элементов тканей внутренней среды.
В эмбриогенезе те и другие стволовые клетки происходят из
мезенхимы. Каковы взаимоотношения между этими двумя категориями
стволовых клеток у взрослых организмов, остается неясным. Помимо
оседлой отростчатой фибробластоподобной стромальной стволовой
клетки в организме должна быть и расселительная циркулирующая в
крови форма таких клеток, о чем свидетельствуют многочисленные
факты гетеротопного образования костной ткани и стромы костного
мозга в различных участках рыхлой соединительной ткани.
Имеются также данные о том, что в крови циркулируют и пред-
шественники особой популяции короткоживущих фибробластов, вы-
полняющих защитную функцию. Однако эти данные нуждаются в
дополнительных, более точных исследованиях. Для механоцитов и их
камбиальных предшественников, как и для полустволовых кроветвор-
ных клеток, характерна, по-видимому, разная степень зрелости полу-
стволовых клеток. Об этом, в частности, свидетельствуют упоминав-
шиеся выше данные о наличии двух категорий предшественников
костной ткани — детерминированных предшественников и предшест-
венников, требующих для проявления остеогенных потенций индук-
тивных влияний со стороны межклеточного вещества кости или эпи-
телия мочевого пузыря.
Большинство разновидностей тканей внутренней среды у предста-
вителей многих типов животных относится к обновляющимся камби-
альным тканям с четко выделенными малодифференцированными
клетками. Наиболее хорошо изучены такие системы, представленные
свободными элементами у высших позвоночных животных. Сложность
их организации проявляется в наличии целой иерархии стволовых и
полустволовых клеток. Конечные стадии последних, будучи уже уни-
потентными, сохраняют способность к пролиферации при наличии
морфологически выраженных изменений клеток. Кроме того, способ-
ность к пролиферации и существенным изменениям свойств реализу-
362
ется за пределами красного костного мозга у моноцитов-макрофагов,
тучных клеток и особенно у клеток лимфоидной системы. Признаком
сложности организации этой камбиальной системы является и не-
обходимость для ее работы специального микроокружения, создавае-
мого стромой центрального кроветворного органа — красного кост-
ного мозга.
Таким образом, камбиальная система, обеспечивающая существо-
вание и тонкую регуляцию работы свободных клеточных элементов
тканей внутренней среды, состоит по крайней мере из четырех отделов,
или субсистем: а) мультипотентных стволовых клеток, б) мультипо-
тентных полустволовых клеток, в) унипотентных полустволовых кле-
ток и, наконец, г) размножающихся клеток с видимыми признаками
дифференцировки. Регуляция процессов репродукции и направлений
дифференцировки в каждой из перечисленных систем имеет свои осо-
бенности. Она определяется и свойствами самих клеток, и тем гумо-
ральным и тканевым микроокружением, в котором они оказываются
в системе красного костного мозга. По-видимому, сходные принципы
организации и регуляции имеют камбиальные системы механоцитов в
тканях внутренней среды высших позвоночных. Однако у высших
позвоночных значительно большее значение в регуляции процессов
репродукции и самих свойств камбиальных клеток играют их взаимо-
отношения с продуцируемым механоцитами межклеточным вещест-
вом, т. е. с внеклеточным микроокружением.
У низших позвоночных обновление свободных клеток и механо-
цитов происходит менее сложным путем. Однако общие принципы
организации оказываются сходными с хорошо изученной организацией
камбиальных систем высших позвоночных.
Ни у одного представителя беспозвоночных камбиальные системы
тканей внутренней среды не достигают такой сложной организации,
как у млекопитающих и птиц. По сложности организации тканей
внутренней среды наблюдаются относительно большие различия у
родственных групп и, наоборот, сходство у отдаленных форм. Но, как
правило, чем выше организация, тем сложнее устроены камбиальные
кроветворные системы. Наибольшей сложности они достигают у го-
ловоногих моллюсков, ракообразных и насекомых. Здесь удается на-
блюдать наличие специальных стромальных клеток в кроветворных
органах и различные взаимоотношения между недифференцированны-
ми камбиальными и дифференцирующимися клетками. Степень слож-
ности организации этих систем, однако, не всегда соответствует уров-
ню организации. Так, у асцидий имеется довольно сложная кроветвор-
ная система, в то время как у ланцетника она практически отсутствует.
363
ЛИТЕРАТУРА
Голд Д Стволовая клетка // В мире науки. 1991. № 12.
Горышина Е. Н.. Чага О. Ю. Сравнительная гистология тканей внутренней
среды с основами иммунологии. Л., 1990. С. 253-308.
Моисеева О. И. Физиологические механизмы регуляции эритропоэза. Л,
1985.
Стрелин Г. С. Регенерационные процессы в развитии и ликвидации луче-
вого повреждения. М., 1978. С. 133-177.
фриденштейн А. Я.. Лурия Е. А. Клеточные основы кроветворного мик-
роокружения. М„ 1980.
Хрущев Н. Г. Иммунохимические подходы к исследованию онто- и фило-
гистогенеза кроветворной ткани // Цитология. 1986. Т. 28, № 3.
Хрущев И. Г. Стволовая клетка // Онтогенез. М.. 1991.
Аэ.м А., Кормак Д. Гистология. М., 1983. Т. 2. С. 153-190.
Чертков И. И. Стволовая кроветворная клетка и ее потенции // Успехи
совр. биол. 1991. Т. 3. Вып. 6.
Чертков И. И., Гуревич О. А. Стволовая кроветворная клетка и ее микро-
окружение. М., 1984.
Чертков И. И., Фриденштейн А. Я. Клеточные основы кроветворения. М.,
1977.
Hemler С. Adhesive protein receptors on haemopoetic cells // Immunology
Today. 1988. Vol. 9.
глава 7. Некоторые общие закономерности
эволюционной динамики тканей
внутренней среды
Ткани внутренней среды — наиболее разнообразный тип тканей
многоклеточных животных. Эволюционные потенции тканей этого ти-
па крайне неравномерно реализуются в разных группах многоклеточ-
ных животных. У позвоночных животных они достигают наивысшего
уровня развития, осуществляют множество разнообразных функций и
представлены наибольшим (по сравнению с другими животными) ко-
личеством разновидностей. Из первичноротых животных наибольший
удельный вес эти ткани имеют у моллюсков и особенно у их высших
представителей головоногих моллюсков. Значение тканей внутрен-
ней среды в ряду аннелиды — членистоногие меньше в связи с тем,
что часть функций этих тканей берут на себя целом и покровный
кутикулярный эпителий. В отношении характера структурно-химичес-
кой организации этих тканей и их значения у и представителей других
групп многоклеточных наблюдается весьма пестрая картина.
364
ЛИТЕРАТУРА
Голд Д Стволовая клетка // В мире науки. 1991. № 12.
Горышина Е. Н.. Чага О. Ю. Сравнительная гистология тканей внутренней
среды с основами иммунологии. Л., 1990. С. 253-308.
Моисеева О. И. Физиологические механизмы регуляции эритропоэза. Л,
1985.
Стрелин Г. С. Регенерационные процессы в развитии и ликвидации луче-
вого повреждения. М., 1978. С. 133-177.
фриденштейн А. Я.. Лурия Е. А. Клеточные основы кроветворного мик-
роокружения. М„ 1980.
Хрущев Н. Г. Иммунохимические подходы к исследованию онто- и фило-
гистогенеза кроветворной ткани // Цитология. 1986. Т. 28, № 3.
Хрущев И. Г. Стволовая клетка // Онтогенез. М.. 1991.
Аэ.м А., Кормак Д. Гистология. М., 1983. Т. 2. С. 153-190.
Чертков И. И. Стволовая кроветворная клетка и ее потенции // Успехи
совр. биол. 1991. Т. 3. Вып. 6.
Чертков И. И., Гуревич О. А. Стволовая кроветворная клетка и ее микро-
окружение. М., 1984.
Чертков И. И., Фриденштейн А. Я. Клеточные основы кроветворения. М.,
1977.
Hemler С. Adhesive protein receptors on haemopoetic cells // Immunology
Today. 1988. Vol. 9.
глава 7. Некоторые общие закономерности
эволюционной динамики тканей
внутренней среды
Ткани внутренней среды — наиболее разнообразный тип тканей
многоклеточных животных. Эволюционные потенции тканей этого ти-
па крайне неравномерно реализуются в разных группах многоклеточ-
ных животных. У позвоночных животных они достигают наивысшего
уровня развития, осуществляют множество разнообразных функций и
представлены наибольшим (по сравнению с другими животными) ко-
личеством разновидностей. Из первичноротых животных наибольший
удельный вес эти ткани имеют у моллюсков и особенно у их высших
представителей головоногих моллюсков. Значение тканей внутрен-
ней среды в ряду аннелиды — членистоногие меньше в связи с тем,
что часть функций этих тканей берут на себя целом и покровный
кутикулярный эпителий. В отношении характера структурно-химичес-
кой организации этих тканей и их значения у и представителей других
групп многоклеточных наблюдается весьма пестрая картина.
364
Разнообразие тканей внутренней среды определяется, с одной
стороны общей тенденцией эволюционной динамики этих тканей к
дивергентной дифференцировке. Их усложнение в ходе эволюции идет
по пути увеличения количества специализированных клеток и меж-
клеточных структур. Это приводит к появлению и большого количе-
ства разновидностей этих тканей, а в пределах каждой разновиднос-
ти _большого количества составляющих их элементов.
У позвоночных животных ткани внутренней среды представлены
двумя основными подтипами (система свободных элементов и стро-
мальные механические структуры) с дифференцировкой каждого из
них на ряд разновидностей. Разновидности первого подтипа, такие как
системы лимфоидной ткани, а также гранулоцитов и макрофагов в
пределах каждого класса позвоночных претерпевают отчетливую ди-
вергентную дифференцировку. Большим количеством разновидностей
представлен и второй подтип этих тканей: рыхлая соединительная,
жировая, ретикулярная ткани и система скелетных тканей.
С другой стороны, общей закономерностью эволюционной дина-
мики тканей внутренней среды является и то, что сходную функцио-
нальную задачу они могут решать несколькими механизмами. Так, в
частности, трофическая проводящая функция осуществляется путем
образования специального белково-полисахаридного основного веще-
ства в комбинации с лакунарной или сосудистой системой (основное
направление дифференцировки стромальных интерстициальных тка-
ней) или путем создания клеточных паренхим. У всех многоклеточных
животных защитную функцию берут на себя специальные более или
менее разнообразные фагоциты. Кроме того, на основе этих тканей
формируются еще по крайней мере две защитные системы — грану-
лярные амебоциты и лимфоидная система. В отличие от фагоцитоза
эти защитные механизмы реализуются либо только в одном типе
животных и имеют монофилетическое происхождение (лимфоидная
ткань позвоночных), либо мозаично распределяются по отдельным
типам беспозвоночных, имея полифилетическое независимое проис-
хождение (система гранулярных амебоцитов). Естественно, что много-
образие механизмов реализации сходных функций создает весьма пе-
струю и хаотичную картину их организации у представителей разных
групп многоклеточных животных. Эта кажущаяся хаотичность может
усиливаться и явлениями филогенетической метаплазии. Суть их за-
ключается в том, что функции, свойственные одному типу тканей,
рут на себя разновидности тканей другого типа. Типичный пример
такой положительной для тканей внутренней среды метаплазии пред-
ставляет формирование на основе фибробластов гладкой мышечной
365
ткани у позвоночных животных, а возможно, и у моллюсков. При этом
гладкие мышечные клетки сохраняют многие свойства оседлых фиб-
робластических элементов, хотя и представляют собой разновидность
морфофункционального типа сократимых тканей. В эволюционной
динамике тканей внутренней среды более многочисленны, однако,
примеры отрицательной метаплазии — выполнения ее функций раз-
новидностями тканей других типов. Особенно это характерно для
первичноротых, в частности для полихет, олигохет, а также насекомых
и других членистоногих.
Замещение функций может происходить двумя способами: без
утраты замещающей тканью характерных для типа особенностей ор-
ганизации и с утратой этих особенностей и приобретением черт стро-
ения, свойственных одной из разновидностей тканей внутренней сре-
ды. Примерами первого типа могут быть замещения, при которых
скелетную функцию и функцию газообмена берет на себя покровный
кутикулярный эпителий у насекомых и других групп наземных чле-
нистоногих. Примером второго рода может служить формирование
целомическим эпителием дыхательных пигментов и целомоцитов с
их специализацией на защитную функцию и функцию запасания кис-
лорода. При далеко зашедшей метаплазии второго типа и редук-
ции стенки целома у высших первичноротых животных не всегда
удается четко различить у взрослых животных собственно элементы
тканей внутренней среды — производные первичного фагоцитоблас-
та — и элементы более позднего целомического происхождения.
Именно такая ситуация складывается, как мы видели выше, в отно-
шении некоторых разновидностей и отдельных типов клеток тканей
внутренней среды членистоногих, моллюсков и ряда других групп
животных.
Несмотря на все сложности, кажущуюся пестроту и разнообразие
системной и структурно-химической организации элементов тканей
внутренней среды, преобразование этих тканей в эволюции многокле-
точных происходит закономерно, направленно и, как и в других тка-
нях, ограничено рамками типовых закономерностей.
Проявлением общих закономерностей являются факты независи-
мого многократного возникновения таких специфических дифферен-
цировок, как хрящевые ткани, эритроциты и гранулярные амебоциты
у отдельных групп первично- и вторичноротых животных. На моле-
кулярном и надмолекулярном уровнях организации выражением этих
общих закономерностей является параллельное, независимое увеличе-
ние разнообразия молекул и надмолекулярных комплексов коллагена
в ряду первично- и вторичноротых, сходные и независимо возникшие
366
механизмы кальцификации в кости позвоночных и спикульных скеле-
тов иглокожих и кишечнополостных.
Как было показано выше, закономерный направленный характер
преобразования тканей внутренней среды проявляется, однако, не толь-
ко в независимом появлении сходных дифференцировок у представи-
телей разных типов многоклеточных животных. Многочисленные глу-
бокие параллелизмы характерны для преобразования этих тканей в
пределах одного типа в ходе независимой эволюции его классов.
Особенно наглядно доминирующее значение таких близкородственных
параллелизмов в эволюционных преобразованиях тканей внутренней
среды можно наблюдать у позвоночных животных. Как было показано
на примере двух наиболее специализированных разновидностей этих
тканей — лимфоидной системы и скелетных тканей, их эволюционная
динамика в пределах типа характеризуется отчетливо выраженными
общими для всего типа закономерностями эволюционных преобразо-
ваний, которые могут проявляться по-разному у представителей каж-
дого класса.
Весьма характерной общей особенностью эволюционной динами-
ки тканей внутренней среды являются сохранение и даже, усиление и
усложнение взаимосвязей между отдельными клеточными элементами
внутри каждой дивергентно дифференцирующейся разновидности.
Усиление взаимосвязей происходит и между отдельными разновиднос-
тями внутри каждого из двух подтипов и, наконец, между разновид-
ностями каждого из этих подтипов. Наиболее полно изучены и дости-
гают наибольшей сложности эти взаимоотношения в тканях внутрен-
ней среды позвоночных. Они были продемонстрированы нами на при-
мере гистогенетических и кооперативных взаимодействий внутри лим-
фоидной системы между этой системой и системой гранулоцитов и
моноцитов и, наконец, между Т-лимфоцитами и стволовыми клетками
крови.
Не менее сложные отношения устанавливаются между клетками
и межклеточными структурами. А также между системами полуство-
ловых клеток в механических скелетных тканях, хотя изучены они
менее подробно. Наконец, с большой определенностью уже можно
говорить о существенном определяющем влиянии оседлых клеток и
межклеточных структур стромы соединительной и разновидностей ре-
тикулярной и костной тканей на процессы дифференцировки клеток
системы свободных элементов. Функциональное единство свободных
и оседлых элементов тканей внутренней среды проявляется в очаге
воспаления и воспалительном новообразовании соединительной ткани.
Реакция разнообразных клеточных элементов оказывается целостной,
367
хотя и весьма дифференцированной. В ней закономерно и последова-
тельно принимают участие сосуды, два типа фагоцитов и туЧНЫе
клетки со сдерживающими их эозинофилами. На заключительной ре-
генераторной фазе воспаления весьма активная реакция наблюдается
и со стороны оседлых фибробластических элементов. Активация син-
тетической деятельности фибробластов и их интенсивное деление
обеспечивают репаративные процессы.
Ткани внутренней среды, как и большинство рассмотренных выше
эпителиальных тканей, относятся к камбиальным, или обновляющим-
ся. Они состоят из двух основных отделов: отдела клеток, где обес-
печивается их деление, и отдела дифференцирующихся и функциони-
рующих клеток.
В простейших случаях (как, например, у приапулид или мечехвос-
та) четких различий между клетками двух отделов нет: часть их
сохраняет способность к делению, и за счет этих функционирующих
и делящихся клеток и происходит обновление всей популяции. Для
эритроцитов и для гранулярных амебоцитов у приапулид имеются свои
субпопуляции размножающихся клеток, темпы их деления не зависят
друг от друга.
В наиболее дифференцированных тканях внутренней среды отдел
размножающихся клеток представляет собой сложную многокомпо-
нентную систему. Она наиболее хорошо выражена и наиболее полно
изучена у высших позвоночных животных в отношении свободных
элементов крови и лимфоидной ткани. Поэтому мы и начинаем опи-
сание организации обновления тканей внутренней среды с характерис-
тики одной из наиболее сложных камбиальных систем — системы
свободных элементов крови млекопитающих и человека.
Гистогенетическое единство всех разновидностей тканей внутрен-
ней среды позвоночных весьма отчетливо проявляется в онтогенезе.
Все они развиваются из общего зачатка — мезенхимы. При этом
развитие клеток крови, стенок сосудов и рыхлой соединительной ткани
происходит на ранних стадиях из единых скоплений клеток мезенхи-
мы. Периферическая часть таких уплотнений превращается в рыхлую
соединительную ткань, из средней части образуется стенка сосуда, и,
наконец, центральная часть разрыхляется, клетки приобретают округ-
лую форму и превращаются в первичные кровяные клетки. Однако
это гистогенетическое единство оседлых и свободных элементов во
взрослом организме высших позвоночных утрачивается.
Гистогенетическое и функциональное единство клеток тканей
внутренней среды характерная общая особенность этих тканей. Она
сво ственна и тканям внутренней среды беспозвоночных животных-
368
Особенно хорошо показана такая целостность системы в эксперимен-
тах по воспалительному новообразованию соединительной ткани у
моллюсков. Удалось показать, что общим источником формирования
свободных и оседлых клеток, участвующих в воспалительном процес-
се, являются мелкие недифференцированные базофильные амебоциты.
Этот факт имеет принципиальное значение. Она показывает, что ха-
рактерное для млекопитающих разделение камбиальностей для осед-
лых и подвижных элементов не является отражением какого-то древ-
него исходного состояния первичных паренхим, как это постулируют
некоторые исследователи. Разделение камбиальностей, или, по-совре-
менному, выделение у млекопитающих стволовых клеток крови и
стволовых стромальных клеток, является лишь крайним выражением
разделения системы на два подтипа в результате прогрессирующей в
ходе эволюции дивергентной дифференцировки тканей внутренней
среды позвоночных. Интересно, что и у взрослых насекомых (в отли-
чие от моллюсков) также имеет место аналогичное явление. У поздних
личинок и взрослых насекомых не удается наблюдать ни превращения
свободных элементов гемолимфы в клетки стромы, ни превращения
клеток стромы в свободные клетки гемолимфы.
Наряду с процессами дивергентной дифференцировки или эволю-
ционного расщепления в эволюционной динамике тканей внутренней
среды распространено и явление усложнения в эволюции мультифунк-
циональных тканевых элементов. У позвоночных животных это моно-
циты — макрофаги и фибробласты с их многообразной синтетической
деятельностью. У беспозвоночных — система гранулярных амебоци-
тов у приапулид и мечехвоста, сочетающих функции тромбообразова-
ния и формирования белковых пленок с фагоцитарной функцией.
ЛИТЕРАТУРА
Горышина Е. Н.. Чага О. Ю. Сравнительная гистология тканей внутренней
среды с основами иммунологии. Л., 1990. С. 3-31.
Заварзин А. А. Очерки по эволюционной гистологии крови и соединитель-
ной ткани. М.; Л., 1953. Т. 4.
Хэм А., Кормак Д. Гистология. 1982. Т. 3, 1983. Т. 3.
Maximow F. Bindgewebe and blutbildende Gewebe Hand // Mikr. Anat. Men-
schen. Berlin, 1927. Bd 2.
Marchalonis J. J. Immunity in evolution. Cambridge, 1977.
Weiss L. The blood cells and hematopoetic tissues. New York, 1984.
Часть 3. МЫШЕЧНЫЕ ТКАНИ
Все разновидности мышечных тканей многоклеточных животных
специализированы на функцию сокращения. Они развиваются на од-
ной основе путем видоизменения и гипертрофии механохимической
актин-миозиновой сократимой системы, имеющейся во всех клетках
многоклеточных.
Мышечные ткани возникали в эволюции неоднократно и, по-ви-
димому, независимо в разных группах животных. Наиболее древние
соматические и висцеральные мышцы формировались из эпителиаль-
но-мышечных клеток кожного и кишечного эпителиев, подобных эпи-
телиально-мышечным клеткам современных кишечнополостных или
бескишечных турбеллярий. Возможно также их возникновение и из
оседлых элементов первичных паренхим примитивных многоклеточ-
ных.
У целомических животных часть сократимых тканей формирова-
лась на основе эпителия, выстилающего вторичную полость тела. Це-
ломические мышечные ткани у всех современных высших многокле-
точных животных представлены сердечной мышцей, а у насекомых —
и частью висцеральной мускулатуры.
Висцеральная мускулатура позвоночных формируется на основе
видоизмененных оседлых клеток тканей внутренней среды. При необ-
ходимости сократительные структуры могли возникнуть и на основе
других тканей. Примером являются мышцы, сужающие и расширяю-
щие зрачок у высших позвоночных, которые берут начало из нервного
зачатка. Разновидности мышечных тканей, развивающиеся в онтоге-
незе из разных зачатков, стойко детерминированы и не могут превра-
щаться друг в друга. Они различаются по механизмам формирования
в онтогенезе и при регенерации. Существенные различия между це-
ломическими и соматическими мышцами наблюдаются у животных на
тканевом уровне организации. В гладких мышцах позвоночных обна-
ружен ряд принципиальных отличий в организации сократительных
структур на молекулярном, надмолекулярном и органоидном уровнях
организации.
Тем не менее все мышечные ткани представляют собой единый
унифункциональный тип тканей. Несмотря на отмеченные выше раз-
личия между отдельными разновидностями мышечных тканей, коли-
чество вариантов прогрессивной специализации их сократительного
аппарата на молекулярном, надмолекулярном и органоидном уровнях
370
организации ограничено. Как правило, эти варианты использованы во
всех разновидностях мышечных тканей, что придает их эволюционной
динамике закономерный направленный характер. К сожалению, в на-
стоящее время не все разновидности мышечных тканей и далеко не
во всех группах животных детально изучены.
Если в основу классификации мышечных тканей положить струк-
турную организацию сократительного аппарата актин-миозиновой сис-
темы, обеспечивающей функцию сокращения, и источники развития
мышц в филогенезе, тогда все многообразие мышечных тканей много-
клеточных укладывается в четыре подтипа: а) соматические попере-
чнополосатые и косоисчерченные мышцы, б) целомические попере-
чнополосатые мышцы, в) гладкие мышцы беспозвоночных, г) гладкие
мышцы позвоночных животных.
Особенности организации актин-миозиновых сократимых струк-
тур в каждом выделенном подтипе могут коррелировать с характер-
ными особенностями на тканевом уровне организации. Такая корре-
ляция тем не менее обязательна, и более характерным является неза-
висимое изменение в ходе эволюции тканевого, органоидного и моле-
кулярного уровней организации.
Кроме того, как и в других тканях, в каждом подтипе мышечных
тканей реализация функции сокращения на принципиально одной и
той же механохимической основе отнюдь не выражается развитием
тождественных структур. Это характерно для отдельных разновиднос-
тей мышц данного подтипа у одного животного и тем более для мышц
каждого подтипа в разных группах многоклеточных. Наличие таких
вариантов свидетельствует об эволюционной пластичности мышечных
тканей и позволяет им обеспечить большое разнообразие конкретных
функциональных задач, несмотря на жесткие структурно-химические
ограничения, вытекающие из принципов организации актин-миозино-
вой системы.
ГЛАВА 1. Поперечнополосатые и косоисчерченные
соматические мышечные ткани
Наиболее характерной особенностью поперечнополосатых и ко-
соисчерченных соматических мышечных тканей является высокая упо-
рядоченность в расположении структур сократительного аппарата —
тонких (актиновых) и толстых (миозиновых) протофибрилл.
Косоисчерченные и поперечнополосатые мышечные ткани разли-
чаются между собой по характеру и степени упорядоченности взаим-
ного расположения структур и возникали в эволюции независимо друг
371
от друга как два варианта расположения толстых и тонких нитей в
пространстве.
Степень распространения поперечнополосатых и косоисчерчен-
ных мышц у современных животных различна. Поперечнополосатые
мышечные ткани найдены у представителей подавляющего большин-
ства многоклеточных высших, средних и даже низших уровней орга-
низации. Наибольший удельный вес они имеют в сократительных
системах высших вторичноротых и первичноротых животных. У по-
звоночных и членистоногих, по сути дела, все первичные соматические
мышечные ткани поперечнополосатые. Распространение косоисчерчен-
ных мышечных тканей более ограничено. Они обнаружены в основном
у беспозвоночных животных средних уровней организации — нема-
тод, аннелид, приапулид, сипункулид, а также у моллюсков и турбел-
лярий.
При классификации поперечнополосатых и косоисчерчённых со-
матических мышечных тканей за основу целесообразно принять прин-
ципы их тканевой организации. По этому принципу все многообразие
поперечнополосатых и косоисчерченных соматических мышечных тка-
ней можно разделить на четыре группы: а) мышечные ткани, образо-
ванные поперечнополосатыми симпластическими волокнами; б) по-
перечнополосатые мышечные ткани из мышечных клеток; в) мышеч-
ные ткани из эпителиально-мышечных клеток; г) косоисчерченные
мышечные ткани*.
§1 . МЫШЕЧНЫЕ ТКАНИ, ОБРАЗОВАННЫЕ
ПОПЕРЕЧНОПОЛОСАТЫМИ СИМПЛАСТИЧЕСКИМИ
ВОЛОКНАМИ
Позвоночные. Основным тканевым элементом поперечнополоса-
той мышечной ткани позвоночных является сложно организованный
симпласт — мышечное волокно. Оно может достигать 12 см в длину
и содержать большой объем цитоплазмы, контролируемой сотнями
ядер (рис. 123, А). Основу поверхностного аппарата мышечного во-
локна составляет плазматическая мембрана, или плазмалемма (1). В
типичном мышечном волокне плазмалемма формирует через одинако-
вые промежутки по его длине и перпендикулярно к длинной оси
систему пронизывающих волокно анастомозирующих друг с другом
поперечных, или Т-каналов (4). Над поверхностью плазмалеммы вы-
* Косоисчерченные мышцы выделяются в отдельную группу в силу своей морфологи-
ческой и филогенетической обособленности. Следует учитывать, что часть их по приз-
накам системной тканевой организации и происхождению может быть отнесена и к цело-
мическим мышечным тканям (сердечная мышечная ткань некоторых моллюсков).
372
Рис. 123. Ультраструктурная организация поперечнополосатого мышечного волокна
позвоночных животных.
А — общая схема организации участка волокна с клеткой сателлитом: 1 — плазмати-
ческая мембрана мышечного вс (окна, 2 — внешняя часть сарколеммы (базальная
мембрана + слой коллагеновых волокон), 3 — клетки сателлиты, 4 — Т-каналы, 5 —
L-каналы, б — саркомер, 7 — А-диск, 8 — 1-диск, 9 — Z-диск, 10 — миофибрилла,
11 — М-полоска, 12 — ядра мышечного волокна, 13 — митохондрия, 14 — тонкие
актиновые протофибриллы, 15 — толстые миозиновые протофибриллы;
Б — схема организации системы Т- и L-каналов: I — Т-канал, 2 — L-канал, 3 —
рианодиновые каналы-рецепторы (каналы для выведения Са2+ в гиалоплазму), 4 —
дигидропиридииовые рецепторы, 5 — кальцийсвязывающие белки, б — Mg-зависи-
мые кальциевые АТФазы (белки-насосы для быстрого удаления ионов кальция
из гиалоплазмы).
373
деляются базальная мембрана из белков и мукопротеидов и слой кол-
лагеновых волокон (2). Вместе с плазмалеммой они образуют сарко-
лемму. В каждом волокне между плазмалеммой и базальной мембра-
ной располагаются отдельные недифференцированные камбиальные
клетки, получившие название клеток-сателлитов (3).
Основная масса цитоплазмы и ядро обычно располагаются по
периферии, непосредственно под плазмалеммой. Здесь же обычно на-
ходятся и более или менее многочисленные «мышечные» митохондрии
с большим количеством крист (13). Мышечные волокна имеют хорошо
развитый цитоскелет, образованный преимущественно из так называ-
емых промежуточных фибрилл диаметром 10 нм, состоящих из белка
десмина. Десминовый цитоскелет связан с Z-дисками миофибрилл и
с мембраной специальными вспомогательными белками (а-актинин,
винкулин и др.). Кроме того, в миофибриллах развит специальный
цитоскелет, образованный фибриллами диаметром 2,5 нм из белка
титина. В саркоплазме некоторых мышечных волокон имеется большое
количество белка миоглобина, близкого по своим свойствам гемогло-
бину эритроцитов. По количеству миоглобина мышечные волокна де-
лятся на три типа: медленные, богатые миоглобином, — красные;
быстрые, бедные миоглобином, — белые; и промежуточные по этим
признакам. Красные волокна содержат наибольшее количество мито-
хондрий и способны к длительной непрерывной активности. В белых
волокнах количество митохондрий меньше, и хотя они могут сокра-
щаться быстрее красных, однако быстро устают и не способны к
длительной работе.
Количество свободных рибосом в дифференцированных мышеч-
ных волокнах всех типов невелико, элементы аппарата Гольджи раз-
виты слабо. Основную часть волокон составляют обычно специфичес-
кие органоиды — миофибриллы (10), однако количество их может
варьировать. Между миофибриллами в небольших прослойках цито-
плазмы располагается система продольных, или L-каналов (5). Они
представляют собой специализированную разновидность гладкой ЭПС.
В типичных мышечных волокнах млекопитающих L-каналы состоят
из закономерно расположенных цистерн и связывающих их развет-
вленных анастомозирующих каналов (5). Мембраны ЭПС, образующие
стенку каналов и цистерн саркоплазматической сети (L-системы), со-
держат на боковой поверхности большое количество сложных белко-
вых комплексов (Mg-зависимые Са-АТФазы) — специфических кать-
циевых насосов, обеспечивающих транспорт ионов кальция в полость
каналов ЭПС (рис. 123, Б). Вход последних в гиалоплазму осущест-
вляется другими насосами — рианодиновыми рецепторами (3). Они
374
расположены в области контакта мембран L-системы с мембранами
Т-каналов. Их выступающая наружу (за пределы мембраны L-цистерн)
часть контактирует с так называемыми дигидропиридиновыми рецеп-
торами мембран Т-каналов (4).
Каждая миофибрилла состоит из правильно чередующихся участ-
ков — темных анизотропных (А) и светлых изотропных (1) дисков.
Последние обычно в 1,5-2 раза длиннее темных анизотропных дисков
(например, в мышечных волокнах лягушки длина дисков А — 1,65,
дисков I — 2,05 мкм). Посередине светлых и темных дисков проходят
темные полоски: более заметный Z-диск — через изотропный, менее
выраженный М-диск — через анизотропный диск. Темные и светлые
диски в соседних миофибриллах располагаются на одном уровне, что
при большом количестве миофибрилл и создает впечатление попере-
чной нсчерченности на светооптическом уровне. Это и послужило
основанием для названия поперечнополосатых мышечных волокон.
При сильном сокращении мышцы светлые диски почти исчезают и
поперечная исчерченность становится менее выраженной. Конкретное
функциональное значение всех структур миофибриллы стало ясным
после детальных ультраструктурных, биохимических и цитохимичес-
ких исследований последних десятилетий. Оказалось, что основной
функциональной единицей миофибриллы является саркомер — учас-
ток между двумя Z-дисками. Саркомер включает в себя, следовательно,
темный диск и ограничивающие его с двух сторон половины светлых
дисков (рис. 123, А. 6). Каждый светлый полудиск состоит из тонких
нитей, или протофибрилл (5 нм), идущих параллельно длинной оси
миофибриллы (14). Темный диск образован толстыми нитями — про-
тофибриллами (15). В нем выделяется центральный более светлый
участок (Н-зона), где располагаются только толстые нити, и два кра-
евых более темных участка, где имеются и толстые, и тонкие нити. В
этой области наблюдаются так называемые поперечные мостики, сви-
детельствующие о структурном взаимодействии между тонкими и тол-
стыми нитями. В области Z-дисков тонкие нити одного саркомера
связаны с тонкими нитями соседних саркомеров с помощью белка
сс-актинина, М-диски представлены системой поперечных и продоль-
ных фибрилл, которые обеспечивают связь толстых нитей одного сар-
комера в целостную систему. На поперечных срезах саркомера в об-
ласти перекрытия толстых и тонких нитей видно, что их взаимное
расположение строго закономерно: одну толстую нить окружают шесть
тонких, а каждая тонкая находится в окружении трех толстых. Таким
образом, соотношение тонких и толстых нитей в саркомерах мышеч-
ных волокон позвоночных животных составляет 2:1. При сокращении
375
мышц увеличивается область перекрывания толстых и тонких нитей,
что может привести к полному исчезновению и светлых полудисков,
и зоны Н в центре темного диска. При этом, естественно, уменьшается
длина саркомера. Очевидно, что все изменения связаны с перемеще-
ниями тонких нитей двух светлых полудисков к центру саркомера.
Функциональное значение изменений саркомера при сокращении стало
понятным после выяснения локализации основных и вспомогательных
белков в его структурах.
Основу тонких нитей составляет относительно низкомолекуляр-
ный (42 кДа) белок актин. Он имеется во всех клетках. Даже в немы-
шечных клетках на его долю приходится до 12% всех их белков. Актин
существует либо в форме мономеров (глобулярный, или G-актин), либо
полимеризуется в филаменты — «двойные спирали» толщиной около
4-6 нм (F-актин; рис. 124, А).
Рис. 124. Структура и взаимодействие сократительных белков саркомера
модель тонкой актиновой протофибриллы; Б —- модель толстой миозиновой
протофи риллы, В строение молекулы миозина; Г, Д — регуляция взаимодейст-
вия головок миозина и активных центров глобул актина (Г — в отсутствие Са2+ в
среде, Д — в его присутствии):
мономер актина, 2 тропомиозин, 3 — тропониновый комплекс, 4 — голов-
ка, шейка, 6 хвост молекулы миозина, 7 — активный центр актина.
376
Актин кроме мышечного сокращения участвует в целом ряде
важных клеточных процессов. Это определяет его значительную эво-
люционную консервативность. Сравнительные исследования показали
исключительное сходство свойств и стабильность аминокислотной по-
следовательности актинов из разных источников. Замены аминокислот
возможны лишь в некоторых, строго ограниченных участках молеку-
лы. С такими заменами, в частности, связаны три основных варианта
строения концевых участков молекулы, определяющих характер поли-
меризации. Они соответствуют а-, ₽- и у-изоэлектрическим формам
актина. В немышечных сократительных аппаратах и в гладких мышцах
позвоночных используются менее стабильные в полимеризованном
состоянии Р- и у-формы. В поперечнополосатых мышцах они заменя-
ются значительно более стойкой в полимере a-формой, что коррели-
рует со строгой организацией сократительного аппарата.
Очень важным для понимания работы механохимической системы
свойством актина является полярность его отдельных молекул и поли-
меров. Так, рост актиновых фибрилл, т.е. добавление к полимеру
новых мономеров, происходит преимущественно с одного конца. По-
лярность обнаруживается и во взаимодействии с актиновой нитью
молекул миозина. Если обработать актиновую нить фракцией миози-
новых головок, образуются так называемые «оперенные стрелы», де-
монстрирующие пространственную детерминацию этого взаимодейст-
вия. «Наконечники стрел» имеют одну и ту же направленность по всей
длине отдельной актиновой нити.
В Z-дисках поперечнополосатых мышц сшиваются полимеры с
противоположной полярностью. В пределах саркомера, таким образом,
все тонкие нити, связанные с одним Z-диском, имеют одну полярность,
а связанные с другим Z-диском — противоположную. Полярность
актиновых нитей наряду с полярностью миозиновых агрегатов явля-
ется структурной основой генерации силы мышечного сокращения.
В желобках двунитчатой актиновой спирали располагаются моле-
кулы белка тропомиозина, составляющие единую нить (рис. 124, А).
Каждая молекула тропомиозина в нити имеет протяженность, равную
7-8 глобулами актиновой спирали (2). Тропомиозин участвует в ста-
билизации структуры актиновой протофибриллы. Основная же его
роль связана с регуляцией взаимодействия молекул актина и миозина.
Согласно распространенной гипотезе, в покоящейся мышце протропо-
миозин закрывает активные центры в молекулах актина, с которыми
могут взаимодействовать головки миозиновых молекул (рис. 124, Г).
Смещение молекул тропомиозина с этих центров происходит в резуль-
тате конформационных изменений в молекулах особого регуляторного
377
белка тропонина (рис. 124, А, Д 3). Каждая молекула тропонина со-
стоит из трех субъединиц. Одна из них связана с актином, другая —
с тропомиозином, третья обладает способностью связываться с ионами
кальция. Присоединение ионов кальция вызывает конформационные
изменения кальцийсвязывающей субъединицы тропонина и всего тро-
понин-тропомиозинового комплекса. В результате этих изменений
субъединицы тропонина, связанные с актином и тропомиозином, сме-
щаются, благодаря чему смещаются и молекулы тропомиозина, осво-
бождая активные центры в молекулах актина (рис. 124, Д).
Толстые нити образованы миозином и вспомогательными струк-
турными белками. Миозин — сложный высокомолекулярный белок
(500 кДа). В состав каждой молекулы мышечного миозина входят две
тяжелые и две пары легких цепей. Тяжелые цепи образуют ее «шейку»
и «хвостовой отдел» и вместе с легкими — две «головки» молекулы
(рис. 124, 5). Как видно на рисунке, в молекуле миозина имеется два
шарнирных участка. Один из них расположен в шейке молекулы и
обеспечивает возможность изменения положения в пространстве голо-
вок миозиновых молекул в относительно небольших пределах. Второй
шарнирный участок расположен на границе двух основных частей
молекулы — тяжелого и легкого меромиозинов — в проксимальной
части хвостового ее отдела. Этот участок обеспечивает более значи-
тельное смещение проксимального участка молекулы. В каждой го-
ловке расположены АТФазный центр и центр взаимодействия с акти-
ном. Известно несколько вариантов миозина, отличающихся по актив-
ности АТФазного центра. Более активные АТФазы входят в состав так
называемого быстрого миозина, характерного для тетанических (бы-
стрых) мышечных волокон, а менее активные АТФазы свойственны
головкам миозина тонических (медленных) мышечных волокон. АТ-
Фазная активность, по-видимому, связана с одной парой легких цепей,
которые получили название рабочих. Возможность взаимодействия
активных центров рабочих легких цепей с актином контролируется
регуляторными легкими цепями, также входящими в состав каждой
головки.
Конформационные изменения, приводящие к активации центров
взаимодействия с актином, происходят при фосфорилировании ре-
гуляторных цепей специальными протеинкиназами. В их состав вхо-
дит кальцийсвязывающий белок кальмодулин. Активация протеинки-
наз происходит при увеличении концентрации ионов Са2+, взаимодей-
ствующих с кальмодулином. Несмотря на возможную функциональ-
ную и химическую дифференцировку легких цепей миозиновых мо-
лекул, их функционирование возможно лишь при наличии всех ком-
378
понентов головок (концы тяжелых цепей и обе легкие), т. е. при
кооперативном взаимодействии всех цепей молекулы. Сборка молекул
миозина в целостную надмолекулярную структуру — толстую нить,
или протофибриллу — происходит при помощи особых структурных
белков. Здесь, в частности, имеется белок, расположенный вдоль тол-
стой протофибриллы.
В состав миозиновых протофибрилл входит около трехсот моле-
кул миозина. Половина их направлена своими головками в одну сто-
рону саркомера, а половина — в противоположную (рис. 124, В). В
центре толстой протофибриллы имеется участок, не содержащий го-
ловок молекул миозина. Таким образом, головки молекул одной по-
ловины толстой нити контактируют с актиновыми протофибриллами
одной полярности, а головки другой половины молекул взаимодейст-
вуют с тонкими протофибриллами другой. Головки миозиновых мо-
лекул располагаются на противоположных половинах миозиновой про-
тофибриллы шестью продольными рядами. Следовательно, каждый
ряд головок лежит точно против одной из шести актиновых прото-
фибрилл. Миозиновые протофибриллы в саркомере жестко связаны в
единую систему при помощи особого вспомогательного структурного
белка (М-белок). Этот белок образует пересекающуюся трехмерную
сеть фибрилл в центре саркомера. В промежутки этой сети могут
заходить концы тонких нитей при максимальном его сокращении.
В сложных молекулах миозина органически сочетаются стабиль-
ность и пластичность. Форма, размеры молекулы и ее основные свой-
ства относительно постоянны, несмотря на большое количество раз-
новидностей миозиновых молекул, отличающихся аминокислотной по-
следовательностью в отдельных цепях молекулы и активностью их
функциональных центров. Тонкие механизмы взаимодействия актина
и миозиновых головок при сокращении и расслаблении мышц выяс-
нены еще недостаточно полно. Внешним проявлением этого взаимо-
действия, как уже отмечалось, является смещение тонких нитей (в
промежутках между толстыми) к центру саркомера. Такое перемеще-
ние начинается после поступления нервного импульса и распростра-
нения его по мембранам Т-каналов в область мембран цистерн L-ка-
налов, где расположены рианодиновые рецепторы. Их активация обес-
печивает выброс ионов кальция, благодаря чему концентрация послед-
них в области перекрытия актиновых и миозиновых протофибрилл
резко возрастает. Ионы кальция, связываясь с тропонином и кальмо-
дулином, запускают механизмы взаимодействия актина и миозина.
Суть взаимодействия заключается, по-видимому, в том, что связывание
молекулы АТФ с головкой миозиновой молекулы инициирует рабочий
379
цикл актин-миозиновой системы. Этот цикл состоит из: а) отделения
головки от молекулы актина; б) перехода головки в другое крайнее
положение, допускаемое шарнирными участками молекулы; в) присо-
единения головки к другой молекуле актина, расположенной дисталь-
нее (по отношению к центру миозиновой протофибриллы) в соседней
тонкой протофибрилле; г) возращения головки в исходное положение
с одновременным расщеплением АТФ и использованием энергии на
перемещение тонкой протофибриллы. Прекращение работы, и расслаб-
ление мышцы происходит при удалении ионов кальция из области
миофибрилл в полость канальцев саркоплазматической сети. Такая
перекачка ионов осуществляется Mg-зависимой Са-АТФазой — спе-
циальными насосами, которые активируются при прекращении нерв-
ных импульсов. При обычных сокращениях саркомер укорачивается
на 20%. Возвращение актиновых протофибрилл в исходное состояние
и удлинение саркомера происходят, по-видимому, в значительной мере
благодаря работе упомянутого выше собственного цитоскелета сарко-
меров, образованного титановыми фибриллами. При сокращении
мышцы эти фибриллы сжимаются, а при расслаблении возвращаются
в исходное, естественное для них состояние.
Из взаимного скольжения актиновых и миозиновых протофибрилл
и возникающего напряжения при гидролизе АТФ и состоит работа
актин-миозиновой системы в саркомерах поперечнополосатых мышц.
При этом тропонин-тропомиозиновая регуляция обеспечивает в основ-
ном внутреннюю регуляцию работы в режиме сокращение — расслаб-
ление.
Миозиновая регуляторная система, возможно, обеспечивает сте-
пень сокращения, хотя ее конкретное назначение в поперечнополоса-
тых мышцах позвоночных еще недостаточно ясно. Таким образом,
внутренние регуляторные системы в саркомерах поперечнополосатых
мышц в совокупности делают возможной весьма совершенную и плас-
тичную регуляцию процессов сокращения.
Частота, степень и сила сокращений могут определяться и мно-
гими другими факторами. Существенную роль играет у позвоночных
активность мышечных АТФаз, обусловленная, вероятно, свойствами
рабочих легких цепей молекул миозина. В разных мышцах эта актив-
ность может варьировать в широких пределах за счет комбинации
легких цепей с разными свойствами. Частота и сила сокращений за-
висят также и от размеров саркомера: в коротких саркомерах скорость
сокращений больше, а развиваемое напряжение меньше, чем в мышцах
с длинными саркомерами. Однако у позвоночных последний механизм
р гуляции используется редко. Длина саркомера варьирует у них не-
380
значительно (от 1,8 до 2,8 мкм). Весьма стабильно в поперечнополо-
сатых мышечных тканях позвоночных также соотношение и взаимное
расположение в саркомерах тонких и толстых нитей: оно минимально
и равно 2:1. Более широкое применение находят у позвоночных внеш-
ние для актин-миозиновой системы регуляторные механизмы, в част-
ности скорость поступления и исчезновения ионов Са2+ в области
актин-миозиновых взаимодействий, а также скорость генерации и рас-
пространения нервных импульсов. Эти процессы определяются осо-
бенностями организации нервно-мышечных синапсов, степенью раз-
вития Т- и L-систем, активностью кальциевых насосов и свойствами
ионных каналов в мембранах мышечных волокон. Внешние для сис-
темы саркомеров регуляторные механизмы могут варьировать в ши-
роких пределах и в разных мышцах у одного животного, и у разных
представителей позвоночных, обеспечивая необходимое функциональ-
ное разнообразие работы скелетных мышц. Особенно большое значе-
ние для обеспечения функционального разнообразия, в частности в
силе сокращения, имеет у позвоночных объединение в мышце боль-
шего или меньшего количества волокон, а также волокон с разными
свойствами.
Членистоногие. В организации соматической мышечной ткани
членистоногих много общего с поперечнополосатыми мышцами по-
звоночных. Так, основной единицей этой ткани у членистоногих яв-
ляется симпласт — мышечное волокно (рис. 125). Оно возникает в
результате слияния клеток при становлении этой ткани в онтогенезе.
У ряда представителей членистоногих в мышечных волокнах обнару-
жены клетки-сателлиты, тоже имеющие значение своеобразных кам-
биальных элементов. Естественно, что в связи с меньшими размерами
тела и величина мышечных волокон у членистоногих в целом меньше,
чем у позвоночных. Однако эта особенность не носит принципиаль-
ного характера, поскольку, например, у крабов и у некоторых раков,
обнаружены мышечные волокна длиной до 6 см и диаметром около
3 мм. Более того, у насекомых с полным превращением, например у
тутового шелкопряда, в провизорных личиночных мышечных волокнах
помимо клеток-сателлитов обнаружено несколько категорий ядер, от-
личающихся уровнем плоидности. Следовательно, мы имеем дело с
надклеточной системой более сложного строения. В ходе дифферен-
цировки таких волокон часть ядер переходит на эндомитотическую
репродукцию.
В обычных соматических мышечных волокнах членистоногих и
сократительный аппарат (миофибриллы), и вспомогательные мембран-
ные структуры устроены и функционируют в принципе сходно с рас-
381
смотренными выше аналогичными структурами в соматических мы-
шечных волокнах позвоночных животных (см. рис. 123, 125). Стру-
ктуру сократительного аппарата образуют тонкие и толстые протофиб-
риллы организованные по длине миофибриллы в саркомеры (рис. 125,
1 2) Основу толстой протофибриллы составляют молекулы миозина.
Рис. 125. Поперечнополосатая соматическая
мышечная ткань членистоногих.
1 — актиновые и 2 — миозиновые прото-
фибриллы, 3 — Z-диск, 4 — L-каналы,
5 — Т-каналы, 6 — митохондрии, 7 —
сарколемма
Однако (в отличие от позвоночных) у членистоногих в миозино-
вых протофибриллах имеется особый вспомогательный структурный
белок парамиозин. Он широко распространен в мышечных тканях
первичноротых животных. У членистоногих количество его в толстых
нитях саркомера невелико — около 1%. Тонкие нити саркомеров чле-
нистоногих состоят из фибриллярного двухцепочечного актина и вспо-
могательных белков (а-актинин, тропонин, тропомиозин). У членис-
тоногих значительно чаще, чем у позвоночных, разнообразие функци-
ональных свойств мышцы достигается благодаря варьированию орга-
низации их миофибрилл на саркомерном уровне. Так, длина саркомера
даже у одного животного в различных мышцах может составлять от
0,5 до 15 мкм. В широких пределах изменяется соотношение тонких
и толстых протофибрилл. Соотношение тонких и толстых нитей в
наиболее быстрых мышцах членистоногих составляет 3:1 (почти как
у позвоночных). Однако оно может быть и 5:1, и даже 6:1, когда
382
каждая миозиновая протофибрилла оказывается окруженной 10-12 ак-
тиновыми протофибриллами. В таких мышцах обычно нарушается
правильное расположение тонких нитей вокруг толстых. Их может
быть больше или меньше 12 вокруг одной толстой нити.
В мышцах членистоногих большую вариабельность, чем у позво-
ночных животных, обнаруживает и строение Z-дисков. Они могут быть
сходными с Z-дисками миофибрилл позвоночных или резко отличаться
от них. Так, в некоторых мышцах Z-диск практически не выделяется,
несмотря на весьма правильную пространственную ориентацию тонких
и толстых нитей. В мышцах же голени саранчи Z-диски образованы
толстой пластинкой электронно-плотного вещества, имеющего волок-
нистое строение. Волокна расположены перпендикулярно длинной оси
миофибриллы. Сильно варьирует и структура М-полоски в центре
саркомера (аппарат поперечных связей между миозиновыми протофиб-
риллами).
Весьма своеобразным вариантом поперечнополосатых мышечных
тканей являются асинхронные летательные мышцы насекомых
(рис. 126, Б, Б). По интенсивности работы (использованное количество
молекул АТФ на механическую работу в единицу времени) они пред-
ставляют собой наиболее совершенную механохимическую сократи-
тельную систему. В ответ на один нервный импульс эти мышцы могут
давать до 300 сокращений в секунду. Летательные мышцы насекомых
характеризуются и другими функциональными особенностями — мак-
симальная сила их сокращений на порядок меньше максимальной силы
сокращений в обычных мышцах (соответственно 0,3 и 5,0 кг/см2).
Длина саркомера в этих мышцах при сокращении уменьшается лишь
на 2%, а не на 20%, как в обычных мышцах.
Особым функциональным свойствам соответствует и ряд сущест-
венных особенностей структурно-биохимической организации сарко-
меров. Соотношение актиновых и миозиновых протофибрилл 3:1, но
расположены они иначе, чем в поперечнополосатых мышцах у позво-
ночных. Кроме того, длина миозиновых протофибрилл и зоны их
контакта с актиновыми протофибриллами значительно больше, чем в
саркомерах обычных мышц, а размеры изотропных дисков намного
меньше обычных. Концы миозиновых протофибрилл связаны с Z-дис-
ками тонкими фибриллами (рис. 126, В). Для летательных асинхрон-
ных мышц насекомых характерен и необычный способ обеспечения
повторных сокращений после поступления одиночного нервного им-
пульса. Эти сокращения происходят уже с использованием не обыч-
ного кальциевого механизма, а в результате сложных механических
взаимодействий между мышечными волокнами при их асинхронной
383
384
Рис. 126. Организация саркомеров в синхронной тулувищной (А) и несинхронной летательной (5,
В) мышцах насекомых, взаимное расположение тониких актиновых и толстых миозиновых прото-
фибрилл на поперечном срезе саркомера мышцы млекопитающих (Г) и асинхронной мышцы насе-
комого (Д).
1 — актиновая и 2 — миозиновая протофибриллы, 3 — Z-диск, 4 — Т-канапы, 5 — L-каналы,
б — дополнительные нити, связывающие концы миозиновых протофибрилл с Z-диском.
о.............*...............-р. • о
работе. Большому количеству молекул АТФ, используемых при сокра-
щении летательных мышц, соответствует наличие многочисленных
гигантских митохондрий. Они заполняют все прослойки саркоплазмы
между миофибриллами и имеют много сложных крист, свидетельст-
вующих о гипертрофии внутренней мембраны митохондрий. Относи-
тельно слабо развиты в мышечных волокнах асинхронных мышц сис-
темы Т- и L-каналов.
Интересно, что сходные функциональные свойства могут дости-
гаться и при другой структурно-биохимической организации мышеч-
ных волокон — в так называемых быстрых синхронных мышцах на-
секомых и ракообразных. В этих мышечных волокнах с немногочис-
ленными периферическими миофибриллами обычного строения резко
гипертрофирована гладкая ЭПС. Ее цистерны и каналы составляют
основную массу цитоплазмы. Такая организация мышечных волокон
обеспечивает около 200 сокращений в секунду, т. е. частоту примерно
того же порядка, что и в асинхронных летательных мышцах насеко-
мых. В отличие от асинхронных в быстрых синхронных мышцах такие
частые сокращения возникают в ответ на нервные импульсы такой же
частоты и обеспечиваются обычным регуляторным кальциевым меха-
низмом.
Весьма своеобразную структурную модификацию поперечнополо-
сатой мышечной ткани членйстоногих представляют собой мышцы ме-
чехвоста. Длина саркомеров в миофибриллах достигает здесь 13 мкм.
Отсутствует М-система жесткой структурной взаимосвязи толстых
протофибрилл. Z-диски на границе саркомеров имеют отверстия, в
которые при сильном сокращении проходят концы толстых протофиб-
рилл. Благодаря этому саркомер при сокращениях может укорачивать-
ся на 70%.
Несмотря на отмеченное выше разнообразие в организации по-
перечнополосатой соматической мышечной ткани членистоногих в их
строении и функциональных свойствах удается выявить и большое
количество глубоких аналогий с соматическими поперечнополосатыми
мышцами позвоночных. Одним из таких примеров могут служить
мышцы-разгибатели голени у прыгающих насекомых. В этих мышцах
имеются тонические волокна, работающие при ходьбе животных и
осуществляющие медленные ритмические сокращения. Здесь же име-
ются и быстрые фазные волокна. По своей ультраструктурной орга-
низации фазные и тонические мышцы существенно отличаются у одно-
го и того же животного как у насекомых, так и у позвоночных, но
оказываются сходными у насекомых и позвоночных животных.
поперечнополосатых мышечных волокнах членистоногих ши-
роко используется весьма характерное для позвоночных варьирование
386
функциональных свойств мышц в результате изменения АТФазной
активности головок миозиновых молекул. Например, у одного из кра-
бов описаны три резко отличные в функциональном отношении мыш-
цы. Тем не менее существенных особенностей в структуре саркомеров
этих мышц обнаружить не удалось.
Увеличение функционального разнообразия соматических мышеч-
ных тканей достигается у насекомых благодаря полинейронной иннер-
вации, не характерной для мышечных волокон позвоночных. Волокна
насекомых имеют обычно терминальные окончания нескольких мотор-
ных нейронов с разными свойствами (тонических, промежуточных и
фазных нейронов). Такая полинейронная иннервация комбинируется
еше и с возможностью дифференцированного распространения им-
пульса лишь по некоторым участкам Т-системы и частичным включе-
нием актин-миозиновой системы отдельных саркомеров. Все эти осо-
бенности обусловливают возможность значительно более разнообраз-
ной регуляции работы мышечного аппарата даже на уровне отдельных
мышечных волокон. В регуляции работы мышц у членистоногих при-
нимают участие также нейросекреторные клетки, тормозные нейроны
и особые октопаминергические нейроны.
§2 . ПОПЕРЕЧНОПОЛОСАТЫЕ МЫШЕЧНЫЕ ТКАНИ,
ПРЕДСТАВЛЕННЫЕ СИСТЕМОЙ МЫШЕЧНЫХ
И ЭПИТЕЛИАЛЬНО-МЫШЕЧНЫХ КЛЕТОК
Как отмечалось выше, соматические поперечнополосатые мышцы
с правильным саркомерным строением миофибрилл распространены и
у многих беспозвоночных животных среднего и даже низшего уровня
организации. Они представлены обычно мышечными клетками, объ-
единенными между собой межклеточными структурами в пучки или
пласты. Таким образом, на тканевом и органном уровне организации
такие мышцы устроены аналогично гладким. Более подробную харак-
теристику этого тканевого уровня мы дадим ниже, при рассмотрении
гладких мышц беспозвоночных животных.
Поперечнополосатые мышечные ткани на основе мышечных кле-
ток образуют лишь единичные мышцы в органах, где нужны быстрые
и правильно организованные сокращения. Они изучены менее подроб-
но, чем мышцы высших первичноротых и вторичноротых животных,
особенно в биохимическом отношении. Тем не менее факт широкого
распространения саркомерной организации миофибрилл свидетельст-
вует о многократном и независимом происхождении в эволюции раз-
ных групп животных такого сократительного аппарата. Более того,
даже у некоторых кишечнополостных (медузы) в мышечных отростках
387
эпителиально-мышечных клеток обнаружены миофибриллы типично-
го саркомерного строения с хорошо выраженными Z-дисками и пра-
вильным расположением миозиновых и актиновых протофибрилл
(рис. 127). В организации их саркомеров наблюдаются признаки, свой-
ственные поперечнополосатым мышцам позвоночных и членистоно-
гих. Своеобразие мышечных пластов у медуз заключается в наличии
десмосом на боковых поверхностях мышечных отростков и межкле-
точных контактов на их концах, сходных со специфическими контак-
тами сердечной мышечной ткани (см. следующий параграф). Среди
поперечнополосатой мышечной ткани беспозвоночных животных сред-
него уровня организации обнаружены мышцы, сходные по строению
саркомеров с быстрыми синхронными мышцами насекомых. Так, у
пелагических животных Sagitta elegans (щетинкочелюстные) относи-
тельная длина миозиновых протофибрилл и размеры анизотропного
диска значительно больше, чем в миофибриллах обычных поперечно-
полосатых мышц.
Среди поперечнополосатых мышечных тканей, образованных мы-
шечными и эпителиально-мышечными клетками, особое место зани-
мают немногочисленные у некоторых моллюсков поперечнополосатые
мышцы, осуществляющие, например, быстрые перемещения некото-
рых двустворчатых моллюсков. Саркомеры миофибрилл мышечных
клеток, образующих такие мышцы, на ультраструктурном уровне сход-
Рис. 127. Ультраструктурная организация эпителиально-мышечных клеток медузы.
I ядросодержащие и 2 — сократительная части клеток, 3 — миофибриллы с ти-
пичной саркомерной организацией, 4 — саркомер, 5 — цитоплазма, 6 — место кон-
цов клеток, 7 — десмосомы, 8 — толстая миозиновая и 9 — тонкая актиновая про-
тофибриллы, 10 — Z- и 11 — М-диски.
388
ны с саркомерами типичных поперечнополосатых мышц. Однако в
тонких протофибриллах здесь отсутствует тропонин и регуляция вза-
имодействия актина и миозина осуществляется при помощи так назы-
ваемой прямой кальциевой регуляции. Суть ее заключается в том, что
взаимодействие актина и миозина оказывается возможным при присо-
единении ионов кальция к одной из легких цепей молекул миозина.
Во всех мышцах моллюсков (в том числе и быстрых поперечно-
полосатых) много парамиозина. Его наличие и отмеченные выше осо-
бенности регуляции взаимодействия актина и миозина связывают со
способностью мышц моллюсков длительное время находиться в со-
кращенном состоянии без дополнительной затраты энергии.
§3 . КОСОИСЧЕРЧЕННЫЕ МЫШЕЧНЫЕ ТКАНИ
Особую группу среди сократительных тканей с правильным про-
странственным расположением актиновых и миозиновых протофиб-
рилл представляют косоисчерченные мышцы. Они составляют основ-
ную часть туловищной мускулатуры у аннелид, приапулид, нематод.
Единичные косоисчерченные мышцы имеются у моллюсков, высших
турбеллярий и у ряда других групп первичноротых животных. Такие
мышцы образованы пучками косоисчерченных мышечных клеток.
Актиновые и миозиновые протофибриллы образуют в цитоплазме
мышечной клетки своеобразные системы (рис. 128, Б, В). Ограничи-
вающие их Z-диски, или, вернее, плотные тела в клетке, находящейся
в расслабленном состоянии, располагаются косо по отношению к ее
длинной оси. Они представляют собой не сплошную пластинку, как
в саркомерах многих поперечнополосатых мышц, а систему располо-
женных в ряд уплотненных фибриллярных участков, разделенных сво-
бодными промежутками. В косоисчерченных мышцах отсутствует и
жесткая структурная связь толстых миозиновых протофибрилл в цент-
ре саркомера. Таким образом, структурные взаимоотношения совокуп-
ности актиновых протофибрилл соседних, участков сократимых систем
(своеобразных саркомеров) и толстых миозиновых протофибрилл в
центре таких саркомеров более лабильны. При сокращении мышечных
клеток происходит не только движение, актиновых протофибрилл к
центрам саркомеров, но и смещение миозиновых протофибрилл друг
относительно друга. Благодаря этому изменяется и расположение плот-
ных тел (аналогов Z-дисков): угол их наклона уменьшается, и они
располагаются почти перпендикулярно длинной оси клетки, т.е. как в
саркомерах миофибрилл поперечнополосатой мышечной ткани.
Благодаря особенностям организации саркомеры в косоисчерчен-
ных мышечных клетках способны осуществлять более разнообразные
389
3
Рис. 128. Косоисчерчениая мышечная ткань аскариды.
Л схема взаимоотношений мышечных клеток с нервной системой; Б — участок
мышечного отростка; В, Г — схема сократительного аппарата в раслабленном (В) и
сокращенном (Г) состоянии:
ганглий нервной системы, 2 — проводящий отросток, 3 — ядросодержащая
часть клетки, 4 мышечный отросток, 5 — толстые миозиновые и б — тонкие ак-
тивные протофибриллы, 7 — плотные тела (аналоги Z-дисков).
390
по направлению натяжения сокращения, чем саркомеры жесткозакреп-
ленных миофибрилл поперечнополосатых мышц. Для осуществления
сложных червеобразных движений тела животных такая конструкция
саркомеров оказывается более приспособленной. В основе механохи-
мических процессов в косоисчерченных мышцах лежит, как и в по-
перечнополосатых мышцах, пространственно упорядоченное взаимо-
действие белков тонких и толстых протофибрилл саркомеров. Однако
возникали эти мышцы, по-видимому, независимо от поперечнополо-
сатых, хотя и на одной основе — из гладких мышечных тканей бес-
позвоночных животных — как один из вариантов упорядоченного
расположения в пространстве миозиновых и актиновых протофибрилл.
Для косоисчерченных мышечных тканей, как и для поперечнополоса-
тых мышц большинства животных, характерна двойная регуляция ак-
тин-миозиновых взаимодействий. Лишь в косоисчерченных мышцах
моллюсков найдена только прямая миозиновая кальциевая регуляция
этих взаимодействий.
В некоторых косоисчерченных и даже в поперечнополосатых
мышцах встречаются необычные взаимодействия мышечных клеток с
элементами нервной системы (рис. 128, А). Так, у аскариды не нервные
отростки подходят к мышечным клеткам, а мышечные клетки образу-
ют длинные отростки, направляющиеся к ганглиям брюшной нервной
цепочки. Интересно отметить, что аналогичные взаимоотношения на-
блюдаются в некоторых мышцах морского ежа (иглокожие) и ланцет-
ника (полухордовые).
ГЛАВА 2. Целомические поперечнополосатые
мышечные ткани
Целомические поперечнополосатые мышечные ткани представле-
ны у многоклеточных целомическими мышцами, возникавшими у вто-
ричноротых и первичноротых (у последних, по-видимому, многократ-
но) независимо. У хордовых и головоногих моллюсков такие мышцы
формируют сократительный аппарат стенки сердца. У членистоногих
помимо стенки трубчатых сердец целомическая мышечная ткань об-
разует еще и стенку кишки. Несмотря на независимое происхождение
целомической поперечнополосатой мышечной ткани у хордовых, го-
ловоногих моллюсков и членистоногих, она везде имеет принципиаль-
но сходное строение на тканевом уровне.
391
§1. СТРОЕНИЕ ЦЕЛОМИЧЕСКОЙ МЫШЕЧНОЙ ТКАНИ
ПОЗВОНОЧНЫХ И БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
У позвоночных, в частности у млекопитающих, целомическая
мышечная ткань сформирована анастомозирующими клеточными во-
локнами, создающими целостную в функциональном и структурном
отношениях сократительную систему. Образуются такие волокна не
путем слияния клеток, как скелетные симпластические мышечные во-
локна, а клетками-миоцитами. Волокно сердечной мышцы образуется
объединением клеток специализированными межклеточными контак-
тами. На границе прилегающих друг к другу миоцитов имеются так
называемые вставочные, или (по старой, более точной, терминологии)
спаивающие пластинки (рис. 129, В, 9). Они состоят из поверхностных
аппаратов дух контактирующих между собой клеток. Наиболее специ-
фическими структурами вставочных пластинок являются fascia adher-
ens (16) — участки контактирующих клеток в области расположения
миофибрилл. Основной функциональный смысл этих образований за-
ключается в структурном объединении миофибрилл контактирующих
миоцитов. Благодаря этим структурам концы миофибрилл, точнее их
концевые саркомеры, в контактирующих клетках связываются между
собой. В участках таких контактов надмембранные комплексы имеют
тонкофибриллярную структуру. Важную роль в соединении мембран
соседних клеток играют ионы Са2+, находящиеся в тонкофибрилляр-
ном матриксе. Последний, однако, проницаем для мелких частиц, т. е.
не представляет собой сплошной пластинки. Мембраны контактирую-
щих миоцитов млекопитающих и членистоногих в области fascia ad-
herens имеют извилистый характер, что увеличивает площадь сопри-
косновения краевых саркомеров. Участки тонких протофибрилл в об-
ласти мембраны характеризуются резко повышенной электронной плот-
ностью. Здесь в больших, чем обычно, количествах обнаруживается
вспомогательный структурный белок Z-дисков — а-актинин, а также
фибриллярный скелетный белок десмин. Выявлен и ряд других спе-
цифических белков, в частности белок, обеспечивающий связь акти-
новых протофибрилл с мембраной. Сложные по структурно-химичес-
кой организации поверхностного аппарата fascia adherens характерны,
по-видимому, не только для миоцитов целомической мышечной ткани.
Сходная организация наблюдается в краевых саркомерах соматической
мышечной ткани в области контактов мышечных волокон с сухожи-
лием (позвоночные) или кутикулярным эпителием (членистоногие).
Аналогичные структуры обнаружены и в области плотных тел, закреп-
ляющих краевые актиновые протофибриллы в сократительных едини-
цах гладких мышечных клеток. Помимо fascia adherens в спаивающих
392
в
Рис. 129. Сердечная мышечная ткань млекопитающих.
Д Б — миокард барана с обычными клеточными волокнами (Л) и кар-
диомиоцитами волокон Пуркяне — проводящей системы сердца (5);
В — ультраструктурная организация двух кардиомиоцитов в области
их контакта:
1 — сарколемма, 2 — плазмалемма, 3 — митохондрия, 4 — миофибрил-
лы, 5 — саркоплазма, б — L-каналы, 7 — тонкая актиновая протофиб-
рилла, 8 — М-полоска, 9 — вставочная пластинка, 10 — анизотропный
и П — изотропный диски, 12 — Z-диск, 13 — толстая миозиновая про-
тофибрилла, 14 — десмосома, 15 — нексус, 16 — гипертрофия белков
цитоскелета в области контакта саркомеров двух кардиомноцитов,
17 — Т-каналы.
393
пластинках в участках, не занятых миофибриллами, имеются еще и
специальные механические контакты — десмосомы, сходные по струк-
туре с десмосомами в других тканях (14).
С функциональной точки зрения весьма важное значение у мле-
копитающих и некоторых членистоногих имеют и так называемые
щелевые контакты, или нексусы (15). В области таких контактов мем-
браны соседних миоцитов разделены щелью шириной 2 нм. В мем-
бранах контактирующих миоцитов обнаружены правильно располо-
женные белковые комплексы. Доказано участие нексусов в распро-
странении возбуждения от клетки к клетке по миокарду. Предполага-
ют, что они служат для межклеточного обмена низкомолекулярными
соединениями и для укрепления механической связи между клетками.
Участки спаивающей, или вставочной, пластинки, содержащие fascia
adherens, и прилегающие к ним десмосомы и нексусы получили на-
звание интеркалярных дисков. У низших позвоночных животных вмес-
то типичных нексусов во вставочных пластинках обнаружены участки
с более тесным расположением мембран. Их считают функциональ-
ными аналогами нексусов — кардиомиоцитов млекопитающих. Таким
образом, с помощью вставочных пластинок в целомической мышечной
ткани обеспечивается структурное и функциональное объединение ми-
оцитов. Эта задача решается без нарушения клеточного принципа
организации. При этом создаются единые сократительные структуры,
как и в симпластических волокнах соматической поперечнополосатой
мышечной ткани. Что касается органоидного и молекулярного уровней
организации миоцитов, то они весьма сходны с соответствующими
уровнями организации поперечнополосатой мышечной ткани и у по-
звоночных, и у высших первичноротых животных. Так, у млекопита-
ющих ультраструктура миофибрилл кардиомиоцита и поперечнополо-
сатого симпластического мышечного волокна в принципе весьма сход-
на у одного и того же животного. Аналогичная ситуация наблюдается
у членистоногих. Некоторые особенности организации миозиновых
молекул (особые тяжелые, специфический набор легких цепей и т. п.)
или свойства молекул тропонина в тонкой протофибрилле, характер-
ные для кардиомиоцитов позвоночных и членистоногих, не выходят
за рамки варьирования молекулярной организации этих структур в
различных скелетных поперечнополосатых мышечных волокнах. Су-
щественной особенностью кардиомиоцитов позвоночных является не-
о ходимость для работы их сократительной системы не только внут-
риклеточных запасов ионов Са2+, как в скелетных мышцах, но и
неклеточного фонда этих ионов. В цитоплазму кардиомиоцитов они
ступают по кальциевым каналам, вмонтированным в плазматичес-
кую мембрану и мембраны Т-каналов.
394
Большое сходство в организации сократительного аппарата кар-
диомиоцитов и скелетных мышц как у первичноротых, так и у вторич-
норотых животных лишний раз и весьма наглядно иллюстрирует за-
кономерный характер изменения этих структур в эволюции многокле-
точных. И у членистоногих, и у позвоночных сократительные струк-
туры миоцитов изменяются сходно с аналогичными структурами в
древних первичных скелетных мышцах.
Как и в скелетных мышцах, строение мышечной ткани, образо-
ванной клеточными волокнами, варьирует у разных представителей
хордовых и первичноротых животных. Так, у асцидий она представ-
лена одним слоем своеобразных эпителиально-мышечных клеток, об-
разующих целостный однослойный пласт (рис. 130, А). Они развива-
ются на основе эпителиальной выстилки целома, и апикальные по-
верхности этих клеток обращены непосредственно в полость тела. В
базальной части клеток расположены миофибриллы, имеющие типич-
ное саркомерное строение с хорошо выраженными Z-дисками (4).
У позвоночных — от низших к высшим животным — наблюда-
ется прогрессирующее усложнение строения сократимой части стенки
сердца. У млекопитающих это уже мощная мышечная система —
миокард. Сложность ее организации подчеркивается еще и наличием
особой системы проводящих волокон. Она представлена пучками ви-
доизмененных кардиомиоцитов, пронизывающих всю толщу миокарда.
Эти кардиомиоциты специализированы на генерацию и распростране-
ние возбуждения и обеспечивают миогенный автоматизм сердечной
мышцы. Для них характерна частичная редукция сократительного ап-
парата, однако строение их сильно варьирует и в разных отделах
сердца, и у разных видов в пределах одного класса. Наиболее резкие
отличия от обычных кардиомиоцитов имеют клетки конечных отделов
проводящей системы в желудочках сердца копытных млекопитающих
(см. рис. 129, А, Б). Здесь они по размерам в несколько раз больше
обычных миоцитов, часто двухъядерны и содержат спирально закру-
ченные миофибриллы лишь на самой периферии клеток. Вся гиало-
плазма в центре клетки обычно свободна от органоидов и включений.
Клетки наряду с обычными мышечными митохондриями содержат и
митохондрии «нервного» типа — с небольшим количеством крист и
хорошо выраженным матриксом. Интересно, что своеобразные «ней-
роидные» свойства клеток проводящей системы очень рано детерми-
нируются в гистогенезе сердечной мышцы. Уже на ранних стадиях
онтогенеза часть клеток миокарда приобретает способность генериро-
вать и распространять возбуждение. Аналог или гомолог проводящей
системы имеется, по-видимому, уже в сердце асцидий, где показан
395
Рис. 130. Кардиомиоциты сердца
асцидий (Л) и высших ракообразных
(Б, В).
А, Б — ультраструктурная организа-
ция; В — рисунок с микрофотогра-
фии участка миокарда:
1 — ядро, 2, 3 — миофибриллы,
4 — вставочная пластинка, 5 —
гладкая ЭПС (аналоги L-каналов),
6 — Z-диски, 7 — митохондрии.
8
396
миогенный автоматизм и обнаружена в составе эпителиального пласта
система клеток, не имеющих развитых миофибрилл в базальной части.
Такой же как у хордовых, ряд усложнений в эволюции целоми-
ческой мышечной ткани наблюдается и у первичноротых животных.
Так, у низших раков стенка сердца представлена слоем эпителиопо-
добных миоцитов. У высших раков, крабов, паукообразных и мече-
хвостов это уже сложная система клеточных волокон, состоящих из
миоцитов, объединенных в единое целое вставочными пластинками с
десмосомами, fascia adherens, а у некоторых животных и щелевыми
соединениями (рис. 130, Б, В).
Таким образом, глубокий параллелизм между целомическими мы-
шечными тканями в ряду хордовых и в ряду высших первичноротых
проявляется не только в принципиальном сходстве тканевого уровня
организации, но и в самом процессе их преобразований в филогенезе.
На это указывает сходный характер организации целомических мы-
шечных тканей и у низших представителей этих рядов (сердце асцидии
и низших ракообразных), и у животных, занимающих вершину эво-
люционного древа, — у первичноротых (членистоногие, головоногие
моллюски) и вторичноротых (млекопитающие) животных.
§2. СОПОСТАВЛЕНИЕ ПРОЦЕССОВ ГИСТОГЕНЕЗА, БИОЛОГИЧЕСКИХ
СВОЙСТВ II РЕГЕНЕРАТОРНЫХ ВОЗМОЖНОСТЕЙ У СОМАТИЧЕСКИХ
И СЕРДЕЧНЫХ МЫШЕЧНЫХ ТКАНЕЙ
При сходстве строения миофибрилл в сердечной и соматической
мышечных тканях между ними имеются глубокие различия. Они про-
являются не только в разных принципах организации мышечных во-
локон (на симпластической и клеточной основах), но и в механизмах
гистогенеза, регенерации и гипертрофии. Скелетная соматическая мы-
шечная ткань развивается из миотома — центрального участка соми-
тов (рис.131, А). В ходе ее развития наблюдается антагонизм между
дифференцировкой и репродукцией клеток. Начало синтеза специфи-
ческих белков выключает репродукцию клеток. Вступившие на путь
дифференцировки миобласты сливаются друг с другом, образуя сим-
пластические тяжи — мышечные трубочки — зачатки будущих мы-
шечных волокон. Образование необходимого количества миобластов
происходит благодаря делению клеток в краевых дорсальных участках
миотомов. Часть малодифференцированных клеток мигрирует в об-
ласть формирования мышечных волокон и образует систему клеток-
сателлитов. В случае повреждения мышечных волокон ядра и цито-
плазма самого волокна претерпевают некротические изменения и гиб-
нут. Новые волокна на месте разрушенных при регенерации форми-
397
А Зрелое мышечное Волокно
Рис. 131. Соматический (Л) и сердечный (Б) миогеиез у млекопитающих
(по П. П. Румянцеву и И. Л. Ерохиной, 1981).
398
Прекордиальная мезодерма
Миоциты опенки сердечной трубки
Миоциты 8 позднем эмбриогенезе
Рис. 131. Окончание.
руются за счет делящихся клеток-сателлитов и в результате слияния
образующихся миобластов в новые симгшастические тяжи.
Сердечная мышечная ткань развивается в онтогенезе из особых
участков эпителия висцерального листка спланхнотома, так называе-
мых миоэпикардиальных пластинок (рис.131, Б).
Дифференцировка и функционирование клеток, формирующих си-
стему примитивных клеточных волокон зачатка моикарда, происходят
уже на ранних этапах онтогенеза. Начало синтеза специфических бел-
ков не выключает процессов репродукции, продолжающихся в течение
всего эмбрионального периода. Повышение уровня дифференцировки
кардиомиоцитов и накопление в цитоплазме миофибрилл приводят
лишь к увеличению длительности митотических циклов пролифериру-
399
Ющих клеток В дефинитивном миокарде млекопитающих нет недиф-
ференцированных камбиальных клеток. При повреждении миоциты
миокарда, оказавшиеся в травмированной области, гибнут. Репарация
миокарда осуществляется с использованием следующих механизмов:
а) формирования на месте повреждения плотной рубцовой соедини-
тельной ткани; б) гипертрофии сохранившихся миоцитов, которая со-
провождается у некоторых млекопитающих их полиплоидизацией;
в) частичной дедифференцировки специализированных миоцитов и их
однократного митотического деления не только в области травмы, но
и в других участках сердечной мышцы. При экспериментальном ин-
фаркте миокарда желудочков у крысы наблюдается массовое вступле-
ние в митотический цикл миоцитов предсердий, топографически не
связанных с зоной повреждения. Последний механизм более выражен
в сердечной мышечной ткани низших позвоночных животных. Отме-
ченные выше три механизма репаративных процессов при инфаркте
миокарда у млекопитающих имеют у разных видов млекопитающих
различный «удельный вес» в общем механизме репарации поврежде-
ния. Так, в частности, у обезьян, человека и некоторых копытных
большую роль в гипертрофии кардиомиоцитов играет полиплоидиза-
ция ядер или увеличение их количества в одной клетке. Приведенные
факты показывают, что сердечная мышечная ткань по соотношению
в ней процессов репродукции и дифференцировки клеток относится к
своеобразным растущим клеточным популяциям и резко отличается
по этому фундаментальному признаку тканевой организации от свое-
образной камбиальной ткани — симпластической соматической мы-
шечной ткани. Эти различия имеют исторические корни и, возможно,
обусловливается иным источником и более поздним развитием сер-
дечной мышечной ткани позвоночных в филогенезе. Глубокие разли-
чия между соматическими и целомическими мышечными тканями ярко
проявляются в опытах с культивированием смешанных зачатков этих
тканей у одного вида животных и одинаковых зачатков соматических
мышц у эмбрионов птиц и млекопитающих. В последнем случае при
благоприятных условиях культивирования образовывались смешанные
волокна, содержащие «куриные» и «мышиные» ядра. В первом случае
объединения «мышечных» клеток разных зачатков в одном волокне
никогда не наблюдалось.
Наряду с этими данными большой интерес представляют факты
наружения в сердечной мышечной ткани десятиногих раков клеток,
аналогичных по своей структуре и расположению сателлитам симплас-
тических соматических мышечных волокон. Если будет эксперимен-
ально показано участие этих клеток в регенерации, то мы будем иметь
400
интересный пример комбинаторики камбиального принципа организа-
ции с клеточным механизмом формирования мышечных волокон, что
не наблюдается у изученных представителей позвоночных животных.
Такого рода комбинации как исключения наблюдаются в эволюцион-
ной динамике мышечных тканей. К ним относится клеточное строение
соматических мышечных волокон в хвосте личинок асцидий при до-
минирующей у всех хордовых симпластической надклеточной органи-
зации соматических поперечнополосатых мышечных волокон.
ГЛАВА 3. Гладкие мышечные ткани
§1 . ГЛАДКАЯ МЫШЕЧНАЯ ТКАНЬ БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Гладкие мышцы распространены у беспозвоночных животных
средних и нижних уровней организации. Они образуют туловищную
и висцеральную мускулатуру. Это преобладающая разновидность мы-
шечных тканей у кишечнополостных, гребневиков, турбеллярий, боль-
шинства моллюсков и иглокожих. Вся висцеральная мускулатура ан-
нелид, приапулид, головоногих моллюсков и представителей многих
других классов и типов беспозвоночных образована гладкой мышечной
тканью. По своему происхождению она относится, по-видимому, к
древним первичным мышечным тканям, развившимся из эпителиаль-
но-мышечных клеток или оседлых клеточных элементов паренхимы
предков многоклеточных животных.
По характеру стабилизации тонких актиновых протофибрилл
гладкие мышцы беспозвоночных животных можно разделить на две
разновидности: а) гладкие мышцы с хорошо выраженными в цитоплаз-
ме клеток плотными телами — аналогами Z-дисков — структурами,
в которых закреплены тонкие протофибриллы; б) гладкие мышцы, в
цитоплазме клеток которых отсутствуют такие морфологически выра-
женные структуры, а также еще не выяснены механизмы стабилизации
и заякоривания концов тонких протофибрилл. Первая разновидность
мышц наиболее распространена и особенно хорошо изучена у мол-
люсков. Вторая характерна для низших многоклеточных и изучена у
немногих представителей, в частности в своеобразных гладкомышеч-
ных волокнах гребневиков.
Первая разновидность гладкой мышечной ткани у моллюсков со-
стоит из клеток чаще всего веретеновидной формы. На поверхности
плазмалеммы выделяется особая базальная мембрана, с которой клетки
связаны структурами типа полудесмосом. Клетки объединяются в пуч-
ки ила пласты прослойками межклеточного вещества, выделяемого
401
интересный пример комбинаторики камбиального принципа организа-
ции с клеточным механизмом формирования мышечных волокон, что
не наблюдается у изученных представителей позвоночных животных.
Такого рода комбинации как исключения наблюдаются в эволюцион-
ной динамике мышечных тканей. К ним относится клеточное строение
соматических мышечных волокон в хвосте личинок асцидий при до-
минирующей у всех хордовых симпластической надклеточной органи-
зации соматических поперечнополосатых мышечных волокон.
ГЛАВА 3. Гладкие мышечные ткани
§1 . ГЛАДКАЯ МЫШЕЧНАЯ ТКАНЬ БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Гладкие мышцы распространены у беспозвоночных животных
средних и нижних уровней организации. Они образуют туловищную
и висцеральную мускулатуру. Это преобладающая разновидность мы-
шечных тканей у кишечнополостных, гребневиков, турбеллярий, боль-
шинства моллюсков и иглокожих. Вся висцеральная мускулатура ан-
нелид, приапулид, головоногих моллюсков и представителей многих
других классов и типов беспозвоночных образована гладкой мышечной
тканью. По своему происхождению она относится, по-видимому, к
древним первичным мышечным тканям, развившимся из эпителиаль-
но-мышечных клеток или оседлых клеточных элементов паренхимы
предков многоклеточных животных.
По характеру стабилизации тонких актиновых протофибрилл
гладкие мышцы беспозвоночных животных можно разделить на две
разновидности: а) гладкие мышцы с хорошо выраженными в цитоплаз-
ме клеток плотными телами — аналогами Z-дисков — структурами,
в которых закреплены тонкие протофибриллы; б) гладкие мышцы, в
цитоплазме клеток которых отсутствуют такие морфологически выра-
женные структуры, а также еще не выяснены механизмы стабилизации
и заякоривания концов тонких протофибрилл. Первая разновидность
мышц наиболее распространена и особенно хорошо изучена у мол-
люсков. Вторая характерна для низших многоклеточных и изучена у
немногих представителей, в частности в своеобразных гладкомышеч-
ных волокнах гребневиков.
Первая разновидность гладкой мышечной ткани у моллюсков со-
стоит из клеток чаще всего веретеновидной формы. На поверхности
плазмалеммы выделяется особая базальная мембрана, с которой клетки
связаны структурами типа полудесмосом. Клетки объединяются в пуч-
ки ила пласты прослойками межклеточного вещества, выделяемого
401
самими клетками или фибробластами соединительной ткани. В туло-
вищных мышцах пучки гладких мышечных клеток могут быть связаны
со скелетными структурами при помощи эластических и коллагеновых
волокон, вплетающихся в прослойки межклеточного вещества. Места-
ми между соседними мышечными клетками образуются соединения
типа щелевых или плотных контактов за счет небольших отростков,
отходящих от боковой поверхности клетки. Особенно многочисленны
они в висцеральных мышцах и служат, по-видимому, для функцио-
нальной связи между клетками.
На боковых поверхностях клеток имеются трубкообразные впя-
чивания, возможные функциональные аналоги Т-каналов. Наблюдают-
ся иногда и контакты их с цистернами и канальцами ЭПС, играющими
роль резервуаров ионов кальция. В примембранном слое гиалоплазмы
и в непосредственной связи с мембраной часто наблюдаются пиноци-
тозные пузырьки. Ядро с несколькими ядрышками расположено обыч-
но в центре клетки. Здесь же находятся слабо развитие элементы
аппарата Гольджи и другие общие органоиды. Митохондрии рассре-
доточены по всей клетке. Основная же масса цитоплазмы занята со-
кратимыми элементами, представленными тонкими актиновыми и тол-
стыми миозиновыми протофибриллами. В состав толстой протофиб-
риллы входит белок парамиозин, и мышцы этого типа называют пара-
миозиновыми. Своеобразными структурами в цитоплазме являются
плотные тела. Они содержат а-актинин и либо связаны с внутренней
поверхностью мембраны, либо свободно лежат в гиалоплазме клеток.
Основной особенностью организации сократительного аппарата глад-
ких мышечных клеток у моллюсков является отсутствие правильно-
го взаимного расположения актиновых и миозиновых протофибрилл
(рис. 132, А, Б). Они не имеют миофибрилл и структур типа саркоме-
ров. Актиновые протофибриллы крепятся к плотным телам (2, 3),
миозиновые — свободно лежат в гиалоплазме (4). Соотношение коли-
чества актиновых и миозиновых протофибрилл, вычисленное в целом
на клетку, составляет приблизительно 10:1. На поперечных срезах
тонкие протофибриллы обычно не образуют правильных окружностей
вокруг толстых. Имеются участки, где тонкие нити лежат вне связи с
толстыми. Таким образом, взаимодействие актиновых и миозиновых
протофибрилл в гладких мышцах моллюсков носит не такой органи-
зованный характер, как в поперечнополосатых и косоисчерченных
волокнах. Миозиновые протофибриллы при сокращении могут взаи-
модействовать с большим или меньшим количеством актиновых про-
тофибрилл и располагаются под тем или иным углом к длинной оси
клетки.
402
Рис. 132. Строение гладкой мышечной клетки мол-
люска в раслабленном (А) и сокращенном (£)
состоянии.
1 — межклеточное вещество, 2, 3 — плотные тела
с актиновыми протофибриллами, связанные с мем-
браной 2 и не связанные с мембраной и располо-
женные в гиалоплазме 3. 4 — толстые миозиновые
протофибриллы, 5 — ядро, 6 — митохондрии.
На молекулярном уровне толстые протофибриллы имеют в прин-
ципе такое же строение, как в поперечнополосатых и косоисчерченных
мышцах первичноротых животных. Основу их составляет стержень из
парамиозина. Количество его у моллюсков значительно больше, чем
у членистоногих животных, и сильно варьирует в разных мышцах у
одного и того же животного и у разных животных, благодаря чему
толщина миозинсодержащих протофибрилл в мышцах у животных
одного вида может варьировать от 15 до 100 нм. Особенно много
парамиозина в гладких мышцах аддуктора раковины пластинчатожа-
берных моллюсков, где толстые нити имеют максимальный диаметр.
Что касается миозиновых молекул, то они построены по общему для
403
всех рассмотренных выше мышечных тканей принципу и состоят из
двух тяжелых и двух пар легких цепей с характерными головками на
переднем конце молекулы. Головки содержат те же центры, что и в
мышцах саркомерного типа: центр с АТФазной активностью и центр
связывания с актином. Собраны миозиновые молекулы на парамиози-
новом стержне в биполярный комплекс, т. е. на концах толстой про-
тофибриллы лежат головки молекул противоположной направленнос-
ти. В центре расположена зона, свободная от миозиновых головок.
Специальная система в молекулах миозина регулирует их взаимодей-
ствие с актином. Она образована легкими регуляторными цепями. В
отличие от таких цепей поперечнополосатых мышц позвоночных и
членистоногих аналогичные легкие цепи миозина гладких мышц мол-
люсков обладают способностью непосредственно связывать ионы каль-
ция. При этом они обеспечивают активацию центров рабочих цепей
головок миозиновых молекул. Таким образом, здесь имеется прямая
кальциевая регуляция процессов инициации мышечных сокращений,
однако сосредоточены ионы кальция в головке миозиновых молекул.
В основе тонких протофибрилл лежат две цепочки фибриллярного
актина с нитями из молекул тропомиозина, расположенных по всей
длине тонкой протофибриллы. В биохимических исследованиях не
удается обнаружить тропонин в актиновых протофибриллах в гладких
мышцах моллюсков и у ряда других животных. В некоторых мышцах
моллюсков наблюдается тенденция к объединению актиновых и мио-
зиновых протофибрилл в продольно или косо ориентированные сис-
темы.
Структурно-биохимическая организация и свойства гладких мышц
рассматриваемой разновидности могут варьировать в широких преде-
лах. Одним из крайних вариантов является мышца аддуктора раковины
пластинчатожаберных моллюсков, способная долгое время находиться
в сокращенном состоянии без большой затраты энергии и признаков
утомляемости. Широко варьирует также соотношение толстых и тон-
ких протофибрилл и их количество на единицу площади, а также
взаимное расположение. При более упорядоченной организации глад-
кие мышечные клетки иногда приобретают черты сходства с косо-
исчерченными мышцами. Такое упорядоченное расположение прото-
фибрилл может быть исходным свойством конкретной разновидности
гладкой мышечной ткани или приобретается некоторыми мышцами
при длительном их сокращении.
Что касается второй выделенной нами разновидности гладких
мышечных тканей беспозвоночных, то она изучена еще недостаточно.
Характерной ее особенностью, как уже отмечалось, является отсутст-
вие в цитоплазме плотных тел и других морфологически выраженных
404
структур, к которым крепятся концы тонких актиновых протофибрилл.
Такова организация сократительного аппарата, по-видимому, в отрост-
ках эпителиально-мышечных клеток кишечнополостных и, возможно,
в гладких мышечных клетках некоторых низших многоклеточных жи-
вотных. Такой же характер организации тонких протофибрилл отмечен
в весьма своеобразных симпластических мышечных волокнах, обна-
руженных недавно у гребневиков. Они по своей системной организа-
ции напоминают симпластические мышечные волокна позвоночных и
членистоногих. Однако пока остаются неясными как механизм обра-
зования этих волокон, так и тонкая структурно-биохимическая орга-
низация их сократительного аппарата. Тем не менее эти образования
являются примером комбинаторики у низших многоклеточных отно-
сительно простого надмолекулярного уровня организации сократитель-
ного аппарата с высшим уровнем тканевой организации.
§2 . ГЛАДКАЯ МЫШЕЧНАЯ ТКАНЬ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Гладкая мышечная ткань широко распространена у позвоночных
животных. Она образует сократимый аппарат всех внутренних органов.
Основной структурный элемент ее — гладкие мышечные клетки. По
морфологии они отчасти сходны с гладкими мышечными клетками
беспозвоночных животных (рис. 133). Для них характерна веретено-
видная форма, хотя в некоторых органах позвоночных они (например,
гладкие мышечные клетки мочевого пузыря) имеют отростчатую фор-
му. Размеры клеток варьируют от 60 до 200 мкм в длину и 4-8 мкм
в диаметре. В некоторых органах, например в матке млекопитающих,
их длина достигает 500 мкм. Функциональными единицами гладкой
мышечной ткани являются пучки гладких мышечных клеток. Ме-
ханизмы объединения клеток в пучки многообразны. На концах кле-
ток формируются пальцевидные впячивания, на боковых поверхностях
многочисленны десмосомы, имеется и значительное количество плот-
ных соединений — нексусов. Важную цементирующую роль играют
основное межклеточное вещество, а также коллагеновые и эластичес-
кие волокна. Все межклеточные структуры вырабатываются самими
гладкими мышечными клетками. Особенно ярко выражена функция
образования и обновления межклеточных структур у гладких мышеч-
ных клеток стенок сосудов.
Наружная поверхность клеток неровная. Здесь могут формиро-
ваться небольшие отростки, служащие для функционального взаимо-
действия с соседними клетками или усиления механической связи
клеток с межклеточным веществом. Более многочисленны различного
рода пузыревидные впячивания поверхностного аппарата. Часть их
405
Рис. 133. Гладкая мышечная клетка из стенки кишки млекопитающего.
А, Б — ультраструктурнвя организация; В — принципиальная схема
расположения молекул миозина в миозиновой протофибрилле.
1 — сократимые единицы, 2 — плотные тела на плазматической мем-
бране, к которым крепятся концы сократимых единиц (их расположе-
ние показано на схеме Б в виде спиральной линии), 3 — плотные тела
десминового цитоскелета, 4 — пиноцитозные пузырьки, 5 — коллаге-
новое волокно, 6 — ядро, 7 — молекулы миозина.
представляет собой, по-видимому, пиноцитозные пузырьки. Функцио-
нальное значение большей части этих образований пока не ясно.
В молодых гладких мышечных клетках хорошо развита шерохо-
ватая ЭПС, обеспечивающая синтез структурных компонентов меж-
клеточного вещества. С возрастом количество ее уменьшается. Ядро
овальной формы расположено в центре клетки. Оно может содержать
несколько (до 5-6) ядрышек и иметь заметную транскрипционную
активность, особенно у молодых клеток, активно выделяющих меж-
клеточное вещество.
Как и у моллюсков, в гладкомышечных клетках позвоночных
имеются многочисленные плотные тела, примембранные и цитоплаз-
матические. В них обнаружен а-актинин. Хорошо развит цитоскелет,
образованный фибриллами белка десмина диаметром 10 нм. Прикреп-
ляясь к плотным телам обоих типов, пучки десминовых фибрилл
формируют сложную трехмерную сеть (рис. 133, А, 3).
406
; Основная масса цитоплазмы занята тонкими актиновыми и тол-
стыми миозиновыми протофибриллами. Взаимодействуя между со-
бой, они образуют линейные структуры — сократительные единицы
(рис. 133, В, 7). Тонкие актиновые протофибриллы на концах сокра-
тимых единиц связаны с примембранными плотными телами, вслед-
ствие чего каждая сократимая единица закрепляется в двух точках
поверхностного аппарата клетки. Предполагают, что примембранные
плотные тела расположены в клетке по спирали, поэтому сократимые
единицы оказываются под некоторым углом к продольной оси клетки.
При сокращении гладкой мышечной клетки вся ее поверхность при-
обретает бугристый вид благодаря образованию глубоких впячиваний
в месте крепления сократительных единиц.
Каждая такая единица представляет собой структуру, аналогич-
ную миофибриллам поперечнополосатых мышц, однако в ней отсут-
ствует саркомерное расположение актиновых и миозиновых протофиб-
рилл. Хотя взаимодействие актиновых и миозиновых протофибрилл и
происходит по принципу скольжения, но осуществляется иначе, чем
в гладких мышечных клетках беспозвоночных и в поперечнополосатой
или косоисчерченной мышечных тканях. Иной характер взаимоотно-
шений актиновых и миозиновых протофибрилл обусловлен и принци-
пиальными особенностями их организации на молекулярном и надмо-
лекулярном уровнях. Основу толстой протофибриллы составляют хво-
сты молекул миозина в комплексе с дополнительными белками. Од-
нако располагаются они иначе, чем в толстых протофибриллах других
мышечных тканей (рис. 133, Б).
В толстых протофибриллах гладких мышечных клеток позвоноч-
ных головки миозиновых молекул распределяются спирально закру-
ченными рядами, причем в соседних рядах их полярность противопо-
ложна. Таким образом, здесь наблюдаются принципиальные отличия
и надмолекулярной организации миозиновых толстых протофибрилл
от всех рассмотренных выше разновидностей мышечных тканей. Тако-
го рода надмолекулярная организация является, по-видимому, первич-
ной, поскольку она характерна для миозиновых протофибрилл немы-
шечных клеток, не требует больших количеств специфических вспо-
могательных белков (белок С, парамиозин) и в значительной мере
является свойством собственно миозиновых молекул.
В сократительных единицах одна миозиновая протофибрилла ок-
ружена и может взаимодействовать с 16 актиновыми протофибриллами
противоположной полярности. Однако при сокращении такое взаимо-
действие осуществляется обычно с 10-15 актиновыми протофибрил-
лами, состоящими из актина ₽- и у-форм, т. е. немышечного актина.
407
Эти формы актина менее устойчивы в полимеризованном состоянии.
Очевидно, в тонких протофибриллах гладких мышц помимо актина
имеются тропомиозин и особые, пока еще не идентифицированные
вспомогательные белки. Возможно, они обеспечивают большую устой-
чивость актина в полимеризованном состоянии.
Тропонин в составе тонких нитей пока обнаружить не удалось,
хотя факт его отсутствия требует более точных доказательств. Имею-
щиеся факты свидетельствуют о том, что регуляция взаимодействия
актина и миозина осуществляется системой, локализованной в голов-
ках миозиновых молекул. Она аналогична описанной выше непрямой
регуляторной системе головок миозиновых молекул поперечнополоса-
той мышечной ткани. Ионы кальция взаимодействуют с кальмодули-
ном, входящим в состав киназы легкой регуляторной цепи молекулы
миозина. Это вызывает фосфорилирование регуляторной легкой цепи,
в результате чего «открываются» центры взаимодействия рабочих лег-
ких цепей с актином. Аналогичный механизм регуляции молекул ак-
тин-миозина характерен для большинства немышечных актин-миози-
новых механохимических систем эукариотных клеток.
Все особенности тонкой организации сократительного аппарата
гладких мышечных клеток сближают его с сократительным субмем-
бранным аппаратом соединительнотканных клеток фибробластов, в
частности с одной из наиболее стабильных его разновидностей, так
называемыми стресс-фибриллами. Последние состоят из продольно
ориентированных актиновых и миозиновых протофибрилл со вспо-
могательными белками. Стресс-фибриллы отличаются от сократимых
единиц гладких мышечных клеток меньшим диаметром. Кроме того,
их концы закрепляются на закономерно расположенных специальных
субмембранных опорных структурах. Имеются цитохимические дан-
ные о более закономерном, чем в сократимых единицах, взаимном
расположении в стресс-фибриллах актиновых и миозиновых прото-
фибрилл. Сходство гладких мышечных клеток позвоночных и меха-
ноцитов тканей внутренней среды, по-видимому, не случайно и обу-
словлено глубокими историческими причинами. Гладкие мышечные
клетки позвоночных можно рассматривать как специализированные на
сокращение оседлые элементы. Эти клетки, как уже отмечалось, всегда
сочетают функции сокращения и синтеза межклеточных структур (ос-
новного вещества, коллагеновых и эластических волокон). Кроме того,
в гистогенезе они развиваются из мезенхимы — общего зачатка для
всех тканей внутренней среды позвоночных.
Можно предположить по аналогии с эволюционной динамикой
рассмотренных выше разновидностей мышечных тканей, что распро-
408
странение специализированных сократимых клеток на основе немы-
шечных миозинов не ограничивается позвоночными животными.
По морфофункциональным признакам с гладкими мышечными
клетками сходны клетки, образующие стенку сосудов у головоногих
и брюхоногих моллюсков. Значительное количество актин-миозиновых
фибриллярных структур обнаружено и у некоторых фибробластов этих
животных.
Приведенная характеристика гладких мышечных клеток позвоноч-
ных дана преимущественно на материале исследований, проведенных
на висцеральной мускулатуре кишечника. Имеются уже данные, что
гладкие мышечные клетки кровеносных сосудов, матки и ряда других
внутренних органов характеризуются существенными особенностями.
Так, гладкие мышечные клетки сосудов имеют очень короткие мио-
зиновые протофибриллы (2 мкм), а актиновые протофибриллы крепят-
ся не только к субмембранным, но и к расположенным в цитоплазме
плотным телам. В гладких мышечных клетках матки соотношение
актиновых и миозиновых протофибрилл составляет не 24:1, как в
гладких мышцах кишечника, а всего 3:1, т. е. близко к их соотноше-
нию в скелетных мышцах позвоночных животных.
ГЛАВА 4. Общая характеристика эволюционной
динамики мышечных тканей
Суммируя вышеизложенное, можно сформулировать ряд положе-
ний, характеризующих современные представления об общих законо-
мерностях эволюционной динамики мышечных тканей. Изменения это-
го унифункционального типа тканей в процессе эволюции ограничены
относительно небольшим количеством вариантов системного (ткане-
вого) и органоидного (надмолекулярного и молекулярного) уровней
организации (рис. 134).
На тканевом уровне все многообразие мышечных тканей сводится
к четырем разновидностям: симпластические волокна, клеточные во-
локна, пучки мышечных клеток и пласты из клеток или отдельные
эпителиально-мышечные клетки (1—4). Разнообразие организации на
органоидно-надмолекулярном уровне достигается двумя основными
путями. Во-первых, сократительные специализированные органоиды
могут развиваться на основе гипертрофии' и видоизменения обычной
немышечной актин-миозиновой микрофибриллярной системы цитос-
келета эукариотных клеток. Во-вторых, в мышечных клетках проис-
ходит активация генов, кодируюших специальные мышечные миозины
и актины, которые могут образовывать в клетках либо внешне неор-
409
ганизованные надмолекулярные структуры — тонкие актиновые и тол-
стые миозиновые протофибриллы (гладкие мышцы беспозвоночных),
либо протофибриллы образуют саркомеры (поперечнополосатые и ко-
соисчерченные мышцы).
Таким образом, все известное многообразие мышечных тканей на
молекулярном и надмолекулярном уровнях организации их специаль-
ных сократительных органоидов сводится к трем основным типам:
а) саркомерная организация актиновых и миозиновых протофибрилл
из мышечного актина и миозина; б) внешне беспорядочная организа-
ция этих протофибрилл; в) организация сложных сократительных еди-
ниц из немышечного актина и миозина (рис. 134, А-В).
Естественно предположить, что исходным состоянием, основой
преобразования мышечных тканей в эволюции первичных многокле-
точных была немышечная форма организации актин-миозинового ап-
парата и первичная специализация их на клеточной основе. Если
принять эту точку зрения, то понятно, что высшие формы системной
организации сократительного аппарата — симпласты и клеточные во-
локна и саркомерная организация — наиболее широкое распростране-
ние получают у достаточно высокоорганизованных животных. В то же
время неупорядоченное, несаркомерное расположение актиновых и
миозиновых протофибрилл на клеточной основе (мышечные и эпите-
лиально-мышечные клетки) наиболее характерно для низкоорганизо-
ванных животных. Однако, как показано на схеме (рис. 134) и следует
из приведенных выше описаний, эта простая и логичная картина ус-
ложняется массой исключений. К ним относится наличие у некоторых
низкоорганизованных животных мышечных клеток с саркомерной ор-
ганизацией актиновых и миозиновых протофибрилл при относительно
примитивной системной организации или симпластических сложных
мышечных волокон с беспорядочным расположением тонких и толс-
тых протофибрилл. Исключениями противоположного характера явля-
ются вся висцеральная мускулатура и мышечный аппарат радужной
оболочки глаза позвоночных животных. Эти внешне относительно
просто организованные разновидности мышечных тканей характерны
для высших животных.
Причиной столь сложных преобразований мышечных тканей яв-
ляется уже отмечавшаяся в вводной части книги способность мно-
гоклеточных организмов в ходе эволюции многообразно регулиро-
вать на клеточном и системном уровнях организации работу генети-
ческого аппарата клеток. Именно эта способность обусловила неодно-
кратное возникновение мышечных тканей в филогенезе из. разных
источников появление помимо древних висцеральных и соматичес-
410
Рис- 134. Эволюционная динамика сократимых мышечных тканей
Основные варианты организации мышечной ткани на системном уровне:
1 — симпластические волокна с сателлитами, 2 — клеточные мышечные волокна со
специфическими межклеточными контактами (вставочными пластинками),
3 — пучки мышечных клеток, объединенных межклеточным веществом, 4 — пласты
эпителиально-мышечных клеток со специфическими межклеточными контактами.
Основные варианты организации миозиновых и актиновых протофибрилл:
а — мышечные актиновые и миозин-парамиозиновые протофибриллы, образующие
и б — не образующие саркомеры; в — немышечные актины и миозины в протофиб-
риллах сократимых единиц гладких мышц позвоночных.
411
ких мышц еще и целомических, мезенхимных и, наконец, нейральных
сократительных тканей.
Естественно, что различные источники происхождения и длитель-
ность эволюции находят свое отражение в свойствах мышечных тка-
ней. Это ясно видно на примере целомических и гладких мышечных
тканей позвоночных животных. Однако историческая обусловленность
свойств образующихся позднее тканей получает в этих двух примерах
принципиально разное проявление. В целомических тканях волокна
возникают на клеточной основе с весьма сходной с древними попере-
чнополосатыми мышцами организацией специфических органоидов —
миофибрилл. В гладких мышечных тканях позвоночных, наоборот, на
системном клеточном уровне организации не наблюдается принципи-
альных отличий от древних первичных гладких мышечных тканей
беспозвоночных животных. Принципиальная разница обнаруживается
в организации самого сократительного аппарата. Такой сложный не-
однозначный характер регуляции организмом процессов дифферен-
цировки вторичных и третичных тканей обусловлен одним из фун-
даментальных свойств эукариотных метазойных клеток — отсутстви-
ем жестких причинно-следственных связей между элементарными ме-
ханизмами, регулирующими процессы дифференцировки клеток. Эта
фундаментальная особенность эукариотных клеток определяет возмож-
ность комбинаторики признаков, связанных с разными уровнями их
организации. Другим ярким примером такой комбинаторики является
появление саркомерных миофибрилл в эпителиально-мышечных клет-
ках медуз и гладкомышечного симпласта у гребневика.
Приведенные факты весьма примечательны в двух аспектах. С
одной стороны, они показывают удивительную способность даже от-
носительно низкоорганизованных организмов регулировать и управ-
лять процессами дифференцировки составляющих их клеток в соот-
ветствии со стоящими перед организмом функциональными задачами.
С другой стороны, все эти исключения из общего правила еще раз
подчеркивают ограниченный направленный закономерный характер
преобразований мышечных тканей в филогенезе многоклеточных жи-
вотных.
В отличие от тканей других типов мышечные ткани очень редко
в процессе эволюции превращаются в ткани других типов. Пример
такого превращения дают электрические органы рыб, где мышечные
элементы специализируются не на сокращение, а на аккумуляцию
электрической энергии. Эта функция, однако, реализуется на основе
гипертрофии и видоизменения мембранных систем, специфических и
для типичных сократительных тканей. Интересно, что такого рода
412
специализации независимо и многократно возникают в процессе эво-
люции у разных видов рыб на основе как гладких, так и поперечно-
полосатых мышц, т. е. они носят и полифилетический, и направленный
характер.
При сходном характере преобразований одних и тех же разновид-
ностей мышечных тканей у разных групп животных эти ткани хотя и
похожи и видоизменяются в одинаковых направлениях, но далеко не
идентичны и представляют собой спектр модификаций со специфи-
ческими для каждой разновидности особенностями. Эти особенности
могут касаться весьма глубоких признаков и внутриклеточной, и сис-
темной организации К ним относятся, например, разные варианты
сборки протофибрилл в поперечнополосатых симпластических мышеч-
ных волокнах первичноротых и позвоночных животных, разные ме-
ханизмы миозиновой регуляции, наличие клеток-сателлитов в цело-
мической мышечной ткани сердца ракообразных и, наоборот, нали-
чие поперечнополосатой мышечной ткани, образованной миоцитами,
в хвостовой соматической мускулатуре личйнок асцидий.
Из последних примеров следует, что эти модификации в пределах
разновидности тканей настолько велики, что данная разновидность
вторичных (клеточные волокна ракообразных) или первичных (сома-
тические мышцы хвоста личинки асцидии) мышечных тканей при-
обретает характерные признаки, свойственные древней соматической
(клетки-сателлиты) и, наоборот, молодой целомической (клеточный
принцип организации волокон) мышечным тканям. Иными словами,
это еще одно яркое свидетельство большой пластичности мышечной
ткани — возможность преодоления исторически обусловленного кон-
серватизма в свойствах их отдельных разновидностей и комбинаторики
в крайних вариантах первичных и вторичных тканей древних и более
молодых признаков.
Пластичность эволюционной динамики мышечных тканей при
ограниченном, направленном ее характере проявляется и в многочис-
ленных функционально обусловленных, не выходящих за пределы
каждой из ее разновидностей, вариантах организации у разных групп
многоклеточных животных. Примерами таких модификаций могут слу-
жить асинхронные летательные мышцы насекомых, прямые синхрон-
ные мышцы членистоногих, клеточные волокна проводящей системы
сердца млекопитающих и другие, менее значительные функциональ-
ные модификации разновидностей мышечных тканей. Наличие моди-
фикаций еще более усиливает значение сравнительного метода и ис-
торического эволюционного подхода к анализу данной тканевой сис-
темы: очевидно, что без понимания общих закономерностей эволюци-
413
онной динамики мышечных тканей, без всестороннего анализа щ
основных модификаций, мозаичной комбинаторики признаков на раз-
ных уровнях организации невозможно ни выяснить функциональное
значение морфологических структур, ни приступить к каузальному
анализу регулятивных механизмов дифференцировки клеток. В кау-
зальном анализе этих механизмов большое значение имеют и послед-
ние молекулярно-генетические исследования механизмов дифференци-
ровки поперечнополосатых мышц в онтогенезе. Выделен ген, регули-
рующий дифференцировку эукариотных клеток в миобласты. Введение
такого активированного гена в геном фибробластов приводит к их
метаплазии в клетки, дающие типичные мышечные волокна сомати-
ческой поперечнополосатой мышечной ткани.
Сравнительно-исторический подход при анализе мышечных тка-
ней имеет исключительно важное значение и для разработки основных
проблем организации механохимических систем в живой природе. Он
необходим и для разработки вопросов, имеющих практическое значе-
ние, как это было показано нами на примере анализа регенераторных
потенций и механизмов их реализации в сердечных и соматических
мышечных тканях млекопитающих и человека.
Полученные сравнительно-историческим методом фактические
данные и выявленные на основе их анализа некоторые закономерности
эволюционной динамики мышечных тканей позволяют уже предска-
зывать возможные, но еще не выявленные их разновидности. Так, у
моллюсков, а возможно, и у других беспозвоночных животных должны
быть мышечные ткани, сократительный аппарат которых образован,
как и у позвоночных, немышечным миозином. В пользу такого пред-
положения говорит наличие в их тканях внутренней среды типичных
миофибробластов — клеток с гипертрофированной микрофибрилляр-
ной актин-миозиновой системой немышечного типа.
С другой стороны, весьма вероятно, что у позвоночных наряду
с типичными гладкими мышцами, сократительными единицами из не-
мышечного актина и миозина должны быть гладкие мышцы, обра-
зованные, как и у беспозвоночных животных, мышечным актином
и миозином. Весьма вероятно, что именно такими мышцами окажут-
ся мышцы нейрального происхождения, обеспечивающие расшире-
ние или сужение зрачка. В пользу такого предположения помимо
общих соображений свидетельствует то, что миофибриллы морских
свинок и птиц имеют саркомерное строение. Маловероятно, что эти
мышцы у отдельных видов млекопитающих и у птиц образуются на
другой основе, чем у представителей большинства других видов мле-
копитающих и человека. Саркомерный же принцип организации мио-
414
фибрилл возможен, по-видимому, лишь на основе мышечного актина
и миозина.
★ ★ ★
Анализ приведенного в предыдущих главах фактического мате-
риала показывает, что все многообразие мышц на тканевом уровне
организации можно свести к четырем их разновидностям: миосимплас-
там, клеточным волокнам, пучкам клеток и пластам эпителиально-мы-
шечных клеток.
На молекулярном и надмолекулярном уровнях организации выде-
ляются три группы мышц: а) с саркомерной организацией мышечных
актиновых и миозиновых структур; б) мышечные актиновые и миози-
новые протофибриллы без саркомерной организации; в) немышечные
актиновые и миозиновые протофибриллы, собранные в особые сокра-
тительные единицы.
Как правило, и у первичноротых, и у вторичноротых высшим
формам тканевой организации (симпласты и клеточные волокна) со-
ответствуют и высшие формы организации мышечных белков (сарко-
мерная организация мышечного актина и миозина). Однако имеются
и исключения — саркомеры в эпителиально-мышечных клетках медуз
и гладкомышечные симпласты у гребневиков.
Время и источник происхождения мышечных тканей в филогенезе
могут не влиять на структуру их сократительного аппарата (сердечная
и соматические мышцы позвоночных), однако существенно влияют на
их биологические свойства (различия в способности к регенерации
этих мышц).
Закономерный характер, свойственный эволюционной динамике
мышечных тканей, позволяет предсказывать наличие еще не выявлен-
ных их разновидностей (например, гладкие мышцы с мышечным ак-
тином и миозином у позвоночных и гладкие мышцы с немышечным
актином и миозином у моллюсков).
ЛИТЕРАТУРА
Альберте Б., Брей Д.. Льюис Дж. и др. Молекулярная биология клетки.
М„ 1987. Т. 4. С. 169-174. Т. 3. С. 75-87.
Заварзин А. А. (мл.) Состояние и перспектива разработки проблемы эволю-
ционной динамики тканей И Цитология. 1981. Т. 23. С. 971-990.
Кантон М., Жене Ж. Сердце как эндокринная железа // В мире науки.
1986. Т. 4.
Румянцев П. И. Кардиомиоциты в процессах репродукции, дифференци-
ровки и регенерации. Л., 1982. С. 298.
415
Румянцев П. П. Процессы репродукции и дифференцировки разных типов
мышечных клеток // Цитология. 1986. Т. 28, № 3. С. 241-291.
Хэм А., Кормак Д. Гистология. М., 1983. Т. 3. С. 241—291.
Cheng N„ Deatherage J. Three dimensional reconstruction of the Z-disk of
sectioned flight muscle // J. Cell Biol. 1989. Vol. 108. P. 1761—1783.
Furst D. Miogenesis in mouse embryo // J. Cell Biol. 1989. Vol. 109. P. 517-
527.
Horowits R Podoisky R The positional stability of thick filaments of inacti-
vated sceletal muscle depends on sarcomere length. Evidence for the role of titin
filaments // J. Cell Biol. 1987. Vol. 105. P. 2217.
Levine I.C., Chantier P. D., Kensler R. IV. Arrangement of myosin heads on
limulus thick filamenta // J. Cell Biol. 1988. Vol. 107.
Morris, Squire J., Fuller G. The 4 stranded helical arrangement of myosin
heads on insect (Lethourus) flight muscle thick filaments // J. Structural Biol. 1981.
Vol. 107. P. 237-249.
Schmacbruch D. Sceletal Muscle. New-York, 1985.
Squire J. The Structural Basis of muscle Contraction. New-York, 1982. P. 698.
Часть 4. ТКАНИ НЕРВНОЙ СИСТЕМЫ
Нервная система у всех наиболее высокоорганизованных вторич-
норотых (позвоночные) и первичноротых (головоногие моллюски, чле-
нистоногие) животных достигает высокого уровня дифференцировки.
Ткани нервной системы в процессе эволюции отдельных групп жи-
вотных обнаруживают закономерные усложнения на клеточном, тка-
невом и органном уровнях организации. Тенденции такого параллель-
ного, общего для всех многоклеточных животных усложнения функ-
ционально-аналогичных тканей на примере тканей нервной системы
выявляются особенно отчетливо. Это связано с ее особым и общим
для всех животных биологическим значением как основной интегри-
рующей системы.
При широких сравнительно-гистологических сопоставлениях ней-
рональных отношений в нервной системе высших многоклеточных
животных впервые удалось сформулировать представление об общих
закономерностях усложнения в процессе эволюции аналогичных в
функциональном отношении тканей. В настоящее время эта идея об-
щности морфофункциональной и биохимической организации нервной
системы позвоночных и беспозвоночных животных получает подтвер-
ждение не только в сравнительно-гистологических работах, но и в
многочисленных сравнительно-физиологических, биохимических и мо-
лекулярно-биологических исследованиях.
Нервная система у позвоночных и высших первичноротых живот-
ных имеет весьма сложное строение. Основными элементами ее явля-
ются нервные клетки, или нейроны. Кроме того, существенную роль
в жизнедеятельности нервных клеток играет вспомогательная ткань —
нейроглия, а также ее особая разновидность у позвоночных — эпен-
димная глия, или глиоэпителиальная ткань. Основу анализаторной и
интегративной функций нервной системы составляют рецепторы и
области переключения нервного импульса — межнейронные синапсы,
а также окончания отростков нервных клеток в иннервируемых тканях.
У низших многоклеточных функцию специфической гуморальной
интеграции осуществляют особые нейросекреторные клетки. У высших
животных нейросекреторные клетки контролируют работу желез внут-
ренней секреции.
Нервная система у всех многоклеточных осуществляет одну функ-
цию: интеграцию систем организма на основе восприятия и анализа
информации, поступающей от внутренних органов и из внешней сре-
ды. Тем не менее в основе ее эволюционной динамики лежит дивер-
417
рентная дифференцировка или эволюционное расщепление всех со-
ставляющих ее клеточных элементов: нейронов, клеток нейроглии,
глиоэпителиальной ткани и нейросекреторных клеток. Однако, в виде
исключения в нервной системе высших многоклеточных сохраняются
и усложняются в ходе эволюции мультифункциональные нейроны.
ГЛАВА 1. Нервные клетки и синапсы
Нервные клетки, или нейроны, многоклеточных животных ха-
рактеризуются большим разнообразием строения, формы, размеров и
ядерно-плазменных отношений. В то же время всем нервным клеткам
свойствен ряд общих признаков организации. Они определяются об-
щими функциональными задачами и сходными внутриклеточными ме-
ханизмами, лежащими в основе функциональной деятельности нейро-
нов. В нейроне выделяют тело клетки с ядром и окружающей его
цитоплазмой — перикарион, два типа отростков — дендриты, которые
служат обычно для восприятия раздражения, и нейрит, или аксон, по
которому нервный импульс распространяется от тела клетки. В функ-
циональном отношении все нервные клетки делятся на чувствитель-
ные, ассоциативные и эффекторные. Чувствительные клетки служат
для восприятия раздражения, а эффекторные передают нервные им-
пульс на работающие органы. В ассоциативных нейронах происходит
сложная переработка и анализ воспринятой чувствительными клетками
информации. Естественно, что именно система ассоциативных нейро-
нов достигает у высших животных наибольшей сложности и разнооб-
разия, образуя нервные центры.
§1 . НЕЙРОНЫ, ИЛИ НЕРВНЫЕ КЛЕТКИ
В зависимости от количества отростков нервные клетки делятся
на мультиполярные, биполярные, псевдоуниполярные и униполярные.
Наибольшее разнообразие формы, размеров и количества отростков
обнаруживается в группе мультиполярных клеток. У позвоночных
животных к ним относится большинство ассоциативных и эффектор-
ных нейронов соматической и все нейроны вегетативной нервной
системы. В эту группу попадают крупные нейроны типа двигательных
клеток спинного мозга, клетки Пуркине мозжечка и гигантские пира-
мидные клетки больших полушарий (рис. 135, Д Г). Их общей осо-
бенностью является большая длина аксона, достигающая у двигатель-
ных и пирамидных клеток человека 1 м и более. Количество, размеры
и форма ветвления дендритов при этом весьма разнообразны: наблю-
даются и относительно короткие и мало ветвящиеся дендриты двига-
418
Рис. 135. Псевдоуниполяриые (Л) и мультиполярные (Б~Г),
ассоциативные нервные клетки.
А — ассоциативный нейрон насекомых; Б — клетки Пуркинье; В — клетки-зерна
коры мозжечка, Г — пирамидная клетка коры больших полушарий:
1 — аксон, 2 — дендрит, 3 — тело клетки.
тельных клеток передних рогов спинного мозга, и дендриты с причуд-
ливыми весьма характерными ветвлениями у клеток Пуркине, и свое-
образные дендриты пирамидных клеток коры больших полушарий. К
мупьтиполярным клеткам относятся также клетки-зерна в коре моз-
жечка (рис. 135, В), корзинчатые, звездчатые клетки и целый ряд
других мелких ассоциативных клеточных элементов. Последние харак-
теризуются относительно небольшими размерами перикариона, корот-
419
КИМИ дендритами и аксонами значительно меньшей длины, чем у
двигательных нейронов спинного мозга. Таким образом, даже в пре-
делах одной группы мультиполярных нейронов у позвоночных наблю-
дается весьма широкий диапазон ядерно-плазменных отношений. В
мелких ассоциативных нейронах они мало отличаются от ядерно-плаз-
менных отношений в других соматических клетках. В крупных ней-
ронах с длинными аксонами или дендритами ядерно-плазменные от-
ношения оказываются резко сдвинутыми в сторону преобладания ней-
роплазмы.
Биполярные клетки представлены у позвоночных преимуществен-
но специализированными рецепторными клетками органов зрения и
обоняния и некоторыми ассоциативными нейронами. Более широко
они распространены у беспозвоночных животных, где большинство
чувствительных нервных клеток имеют один нейрит и один дендрит.
Близки по строению к биполярным клеткам псевдоуниполярные
нейроны позвоночных животных. Для них характерно наличие одного
длинного отростка, который затем, Т-образно разветвляясь, образует
длинный дендрит, уходящий на периферию, и более короткий аксон,
идущий в спинной мозг. В принципе это тоже биполярная клетка,
часть тела которой преобразована в длинный клеточный вырост.
Особую группу в функциональном и структурном отношениях
представляют собой широко распространенные у беспозвоночных уни-
полярные нейроны со сложной топографической дифференцировкой
рецептивных областей на отростке или его разветвлениях (рис. 135,
А). В отходящем от тела клетки отростке можно выделить три зоны:
проксимальный, или вставочный, сегмент, рецептивный сегмент и ак-
сон или аксоны с разветвлениями. Вставочный сегмент является свя-
зующим звеном между трофическим (перикарион) и рабочим (отрост-
ки) аппаратами клетки. Рецептивный сегмент (или сегменты) по своему
значению аналогичен дендритам мультиполярных, биполярных и псев-
доуниполярных клеток. Он может быть представлен одним или не-
сколькими (в основании каждого аксона) участками клеточного от-
ростка. В рецептивных областях расположены синапсы, регулирующие
деятельность аксона данного нейрона. У некоторых животных здесь
образуются выросты и отростки больших или меньших размеров. При
больших размерах и ветвлении они приобретают вид настоящих денд-
ритов. Последняя, наиболее значительная, часть отростка рассматри-
ваемого типа нейронов является аксоном (или аксонами), обеспечива-
ющими проведение импульса с рецептивной области на другую нерв-
ную клетку или рабочий орган.
Особую разновидность нейронов составляют относительно не-
многочисленные узкоспециализированные униполярные клетки. Они
420
представлены амакриновыми нервными клетками. Наибольшее распро-
странение амакриновые клетки получают в оптических нервных цент-
рах позвоночных животных, головоногих моллюсков и насекомых. Сам
факт широкого распространения таких клеток в нервной системе вы-
сокоорганизованных животных свидетельствует об их узкой специа-
лизации.
Помимо морфологической и функциональной классификации нер-
вных клеток была предложена классификация по типу медиаторов —
химических соединений для передачи импульсов. По химической при-
роде они весьма разнообразны: это ацетилхолин, биогенные амины,
некоторые аминокислоты, АТФ и его дериваты. Кроме того, роль
медиаторов и нейрогормонов играют и разнообразные полипептиды и
пептиды. Интересно, что нейроны разной медиаторной специфичности
в одинаковой мере распространены в нервных системах как позвоноч-
ных, так и беспозвоночных (первичноротых) животных*.
В нервной системе высших многоклеточных животных процессы
репродукции дифференцированных нервных клеток обычно оказыва-
ются стойко и необратимо блокированными. Однако у этих животных
в постнатальном гистогенезе нер! ной системы, а у более низкоорга-
низованных животных в течение всей жизни распространены иногда
и процессы соматической полиплоидизации. Благодаря этому у неко-
торых групп животных большинство нервных клеток в ганглиях ока-
зываются полиплоидными (рис. 136). Степень полиплоидии в нервных
клетках брюхоногих моллюсков может быть весьма высокой. Гигант-
Рис. 136. Полиплоидные нейроны
из висцерального ганглия брюхоно-
гого моллюска.
Л 2 — высокоплоидные и клетки
меныпей плоидности, 3 — дипло-
идные глиальные элементы.
* Создать биохимическую классификацию нейронов по типу медиаторов очень сложно,
поскольку есть уже много примеров, когда один нейрон выделяет несколько медиаторов.
Однако один из медиаторов является основным, а остальные играют обычно вспомога-
тельную модулирующую роль. Поэтому правомочна и биохимическая классификация, если
не придавать ей абсолютного значения.
421
ские полиплоидные нервные клетки имеются и в нервной системе
других первичноротых животных (аннелиды, ракообразные, насеко-
мые). Однако у большинства представителей беспозвоночных они не
стали преобладающим типом клеток.
Несмотря на наличие полиплоидных нейронов у первичноротых
животных такой путь интенсификации клеточного метаболизма не
играет ведущей роли в филогенетической дифференцировке нервной
системы. В центральной нервной системе и в периферических ее
отделах у насекомых, головоногих моллюсков и у позвоночных жи-
вотных преобладают обычно диплоидные клетки. В диплоидных нерв-
ных клетках с длинными аксонами и дендритами ядерный аппарат,
контролирует необычный для соматических клеток объем цитоплазмы.
Специфические особенности внутренней морфобиохимической
организации нейронов удобнее показать на примере двигательных кле-
ток передних рогов спинного мозга. Это клетки с крупными ядрами,
богатыми кариоплазмой, с резко выделяющимися на препаратах одним
или двумя ядрышками (рис. 137, 7). Ядерная оболочка имеет много-
численные поры. Хроматин сильно распылен и образует небольшие
скопления лишь в области ядерной оболочки. Такая структура интер-
фазного ядра характерна для весьма активных в метаболическом от-
ношении ядерных аппаратов.
Наиболее специфичной структурой цитоплазмы перикариона и
дендритов является так называемое тигроидное вещество (вещество
Ниеля). На светооптическом уровне оно выявляется в виде скоплений
или глыбок базофильного вещества (Р). На электронограммах видно,
что в таких базофильных участках цитоплазмы имеются хорошо раз-
витая сеть каналов шероховатой эндоплазматической сети и скопления
свободных рибосом, образующих характерные розетковидные струк-
туры.
Хорошо развит в нервных клетках и аппарат Гольджи своеобраз-
ного диффузного типа (70). Группы его центральных цистерн и пери-
ферических пузырьков образуют анастомозирующую сеть вокруг ядер-
ного аппарата нервной клетки. Довольно многочислены в цитоплазме
нервных клеток и лизосомы (1Г). У молодых животных они относи-
тельно однородны и по размерам, и по структуре. В нервных клетках
старых животных наблюдается увеличение в цитоплазме мультивези-
кулярных тел (76) и липофусциновых гранул, а также переходных
форм между лизосомами и этими структурами. В цитоплазме перика-
риона (7) и отростков имеются многочисленные митохондрии (72). Их
внутренняя мембрана обычно не образует большого количества крист.
Весьма характерными и специфическими структурами нервных
клеток являются нейрофиламенты (73) и специализированные микро-
422
Рис. 137. Ультраструктурная организация нейрона на примере двигатель-
ной клетки передних рогов спинного мозга позвоночных.
1 — перикарион, 2 — ядро, 3 — ядрышко, 4 — аксон, 5 — плазматичес-
кая мембрана, 6 — дендрит, 7 — пресинапс аксосоматического синапса,
8 — пресинапс аксодендритического синапса, 9 — субстанция Ниссля,
10 — аппарат Гольджи, 11 — лизосомы, 12 — митохондрии, 13 — ней-
рофиламенты, 14 — нейротрубочки, 15 — аксональный бугорок, 16 —
мультивезикулярное тело.
423
трубочки, которые хорошо развиты и в цитоплазме перикариона и
особенно в отростках. Нейрофиламенты это фибриллярные струк-
туры диаметром около 10 нм. Они образованы спирально закручен-
ными нитями, состоящими из специфических для нервных клеток
белков цитоскелета. Нейротрубочки (14) представляют собой цилинд-
рические образования диаметром 24 нм, толщина стенки цилиндра
10 нм. Они состоят из димеров тубулина, т. е. имеют строение типич-
ных микротрубочек эукариотных клеток.
В цитоплазме дендритов (б) содержатся те же органоиды, что и
в области перикариона. В аксоне (4) нет рибосом, однако имеются
митохондрии, элементы ЭПС и особенно хорошо развит аппарат ней-
рофиламентов и нейромикротрубочек.
У многих нервных клеток хорошо выражен участок перикариона,
от которого отходит аксон, он получил название аксонального холмика
(75). В области аксонального холмика в мембрану нейрона «вмонти-
ровано» около пяти разновидностей ионных каналов. Они предназна-
чены для перевода потенциала действия в нервный импульс.
В последнее время удалось обнаружить существенную структур-
но-химическую дифференцировку цитоскелета в дендритах и аксоне.
В аксоне все нейротрубочки имеют одну полярность — их минус-
конец направлен к телу нейрона. Здесь мало белка МАР-2 и много
белков молекулярной массой 210 кДа. В дендритах имеется две попу-
ляции микротрубочек с разной полярностью, обогащенных сопутству-
ющим белком МАР-2. Эти особенности цитоскелета дендритов связы-
вают с особенностями процессов транспорта по аксону и дендритам,
а также другими свойствами этих отростков. В частности, обилие в
дендритах сопутствующего нейротрубочкам белка МАР-2 лежит, по-
видимому, в основе их пластичности — способности образовывать
новые синапсы, с этими же свойствами дендритов связаны, вероятно,
и локальные субмембранные скопления рибосом, которых нет в аксоне.
Микротрубочки в аксоне или их отдельные участки характеризуются
разной стабильностью. Часть их подвержена интенсивно идущим про-
цессам полимеризации и деполимеризации.
Характерной особенностью нервных клеток всех многоклеточных
животных является высокая чувствительность к внешним воздействиям
как общего, так и местного значения. Чувствительность проявляется
и в быстром изменении интенсивности синтетических процессов, и в
структурных изменениях белоксинтезирующего и энергетического ап-
паратов клеток. Для многих нейронов характерен высокий уровень
синтетических процессов, в первую очередь синтеза белка и РНК.
елки сами по себе не являются медиаторами и играют лишь
спомогательную роль в транспорте, разрушении и ресинтезе медиа-
424
торов. Нейроны, использующие в качестве медиаторов полипептиды,
имеют ограниченное распространение у многоклеточных животных.
Поэтому весьма интенсивную синтетическую активность перикариона
нельзя объяснить только потребностью в белках для обеспечения хи-
мической передачи импульса и других процессов, непосредственно
связанных, с основной функцией нервных клеток. Очевидно, что ин-
тенсивный белковый синтез прежде всего необходим для обновления
структурных и метаболических белков цитоплазмы нейрона, а также
его отростков, в первую очередь аксона, лишенного собственного
белоксинтезирующего аппарата.
Предположение о наличии такого обновления было высказано еще
в 1925 г. и экспериментально обосновано в 40-х годах в опытах с
наложением лигатур на аксоны двигательных клеток передних рогов
спинного мозга. Через несколько дней после наложения таких лигатур
в проксимальной, прилегающей к лигатуре области аксона наблюдался
наплыв аксоплазмы, в дистальной области, наоборот, заметно умень-
шался диаметр аксона. При снятии лигатуры постепенно восстанавли-
валось исходное состояние.
Анализ результатов опытов и соответствующие расчеты показали,
что в аксонах имеется постоянный ток аксоплазмы в дистальном на-
правлении со скоростью 1 мм/сут. Опыты с мечеными аминокислота-
ми, проведенные на разных объектах, подтвердили эти выводы и
показали универсальное распространение медленного аксотока (0,5-
5 мм/сут) во всех исследованных нейронах. Кроме того, было обнару-
жено медленное перемещение меченого белка в дистальном направле-
нии не только в аксонах, но и в дендритах. Дифференцированный
анализ перемещения меченых белков по аксону показал, что помимо
медленного аксотока имеют место, по крайней мере, еще два типа
транспорта: промежуточный и быстрый аксотоки. Кроме того, давно
известно, что помимо перемещения синтезируемых в перикарионе
компонентов в дистальном направлении по аксону и, по-видимому, по
дендритам существует транспорт веществ с периферии к центру. Его
наличие было экспериментально показано в опытах с блокированием
транспорта сильным местным охлаждением в участках аксонов, выве-
денных под кожу. При этом в дистальных областях аксона на границе
с охлажденным участком накапливались ограниченные мембраной пу-
зырьки, которые, очевидно, в нормальных условиях перемещались в
проксимальном направлении.
Уже много известно и о конкретных механизмах медленного и
быстрого аксонального транспорта. Установлено, в частности, что
сборка цитоскелета и его главного компонента — нейротрубочек —
425
происходит в основании аксона, в области аксонального бугорка
(рис. 138, Л). Быстрый транспорт обеспечивается пузырьками и орга-
ноидами при помощи специальных, связанных с нейротрубочками
белков — кинезина, МАР-2 и особой АТФазы. Кинезин осуществляет
транспорт в дистальном направлении, МАР-2 в проксимальном (к телу
клетки), а специальная АТФаза может, по-видимому, осуществлять его
в обоих направлениях. В дистальном направлении (в область пресинап-
сов) движутся синаптические пузырьки, молодые митохондрии и неко-
торые другие компоненты цитоплазмы. В проксимальном направлении
обычно перемещаются отработавшие пузырьки и митохондрии, кото-
рые в перикарионе образуют мультивезикулярные тела (рис. 138, Б).
Рис. 138. Механизмы медленного (Л) н быстрого (£) транспорта по аксону от
перикариона в область пресинапса (Л, Б) и из области пресинапса
в область перикариона (Б).
1 — микротрубочка, 2 — микрофиламенты, 3 — область сборки микротрубо-
чек, 4 — область разборки микротрубочек и микрофиламентов, 5 — «молодые»
пузырьки, транспортируемые из области перикариона в область пресинапса, 6 —
«старые» пузырьки, транспортируемые в обратном направлении, 7 — компенса-
торный эндоцитоз, 8 — синаптический пузырек, 9 — цистерна для репарации
синаптических пузырьков, 10 — мультивезикуляриое тело.
426
§2 . МЕЖНЕЙРОННЫЕ И НЕРВНО-МЫШЕЧНЫЕ СИНАПСЫ
В анализирующей интегративной деятельности нервной системы
особое значение имеют специфические контакты между нервными
клетками — синапсы. Такие контакты и клеточный принцип органи-
зации нервной системы установлены в начале XX в., когда была сфор-
мулирована и получила всеобщее признание нейронная, клеточная,
теория строения нервной системы. В основе такой организации лежит
контактное взаимодействие нервных клеток. Естественно, что изучение
тонкой структурно-химической организации и функции этих контак-
тов, или синапсов, составляет самостоятельный раздел в комплексной
современной науке — нейробиологии. В настоящее время изучена
ультраструктурная и химическая организация синапсов в разных от-
делах нервной системы и у разных представителей многоклеточных
животных. Выявляется функциональное значение отдельных структур
и всего синаптического комплекса в целом. При этом удалось устано-
вить одну интересную общебиологическую закономерность. Оказа-
лось, что несмотря на большое разнообразие синапсов в нервной
системе одного животного, не существует больших различий между
синаптическими контактами в нервной системе низко- и высокоорга-
низованных многоклеточных животных. Этот факт свидетельствует,
очевидно, о том, что механизмы взаимодействия нервных клеток до-
статочно универсальны для всех многоклеточных животных независи-
мо от их филогенетических отношений. Они формируются и совер-
шенствуются в процессе эволюции в едином направлении и развива-
ются на основе специализации общих для всех эукариотных клеток
структур их поверхностного аппарата.
Все синапсы, несмотря на разнообразие их структурно-химичес-
кой организации, можно разделить на два типа: электротонические и
химические (рис. 139, А, Б). Электротонические синапсы обеспечивают
непосредственную передачу нервного импульса между контактирую-
щими клетками. Электротонические синапсы в зависимости от струк-
туры бывают двух вариантов. Более распространенная их разновид-
ность характеризуется наличием узкой щели между апикальными по-
верхностями плазматических мембран контактирующих клеток
(рис. 139, Б). Ширина щели около 2 нм. В месте контакта в мембранах
обеих клеток имеются интегральные белки, наружные части которых
выступают над головками липидов и непосредственно контактируют
Друг с другом. Считают, что передача импульсов осуществляется имен-
но в точках соприкосновения этих белков. Они получили название
коннексинов. Коннексины (рис. 139, В, 3) образуют встроенные в
мембрану комплексы из пяти одинаковых субъединиц, в центре кото-
427
рых и образуется ионный канал (рис. 139, В). Такой комплекс получил
название коннексона (4).
Во второй разновидности электротонических синапсов щель меж-
ду плазматическими мембранами двух контактирующих нервных кле-
z
А
428
ток отсутствует и они непосредственно соприкасаются своими наруж-
ными поверхностями. В электротонических синапсах импульс переда-
ется, как правило, в обоих направлениях. В некоторых специализиро-
ванных электротонических синапсах показано лишь одностороннее
проведение импульса, однако конкретные механизмы такой поляри-
зации еще не ясны. Как следует из вышеизложенного, электротони-
ческие синапсы не отличаются принципиально от аналогичных плот-
ных контактов, наблюдаемых в других тканях, например в эндоте-
лии, эпендиме, глии и в эпителиальных и мышечных тканях. В пос-
ледних они также используются для распространения возбуждения —
непосредственной передачи импульса с одной клетки на контактирую-
щую с ней. Вероятно, в эволюции электротонические синапсы послу-
жили основой для развития химических синапсов (рис. 139, А, 2),
принципиально отличающихся от электротонических (3) механизмом
передачи возбуждения или торможения. Тем не менее, электроничес-
кие синапсы, считающиеся более архаичными, сохраняются в нервной
системе высокоорганизованных животных. Электротонические синап-
Рис. 139. Строение синапсов.
А — общий вид химического и электротонического синапсов: 1 — электротони-
ческий синапс, 2 — химический синапс (синаптическая щель), 3 — синаптичес-
кие пузырьки, 4 — постсинаптическая мембрана, 5 — нейротрубочки, 6 — участ-
ки гладкой ЭПС, 7 — субмембранные утолщения пресинаптической мембраны,
8 — субмембранные утолщения постсинаптической мембраны;
Б — электротонический синапс с небольшой синаптической щелью: I, 2 — цито-
плазма контактирующих клеток, 3 — «синаптические» пузырьки,
4 — место контакта двух клеток;
8 — молекулярная организация электротонического синапса второго типа: 1, 2 —
мембраны контактирующих клеток, 3 — коннексины, 4 — коннексоны (группы
из 5 белков коннексинов).
429
сы стали использоваться для координации работы популяций одно-
значных в функциональном отношении клеток, что, естественно, об-
легчило и упростило создание сложных многоклеточных нервных ап-
паратов*.
Второй, наиболее характерный и специфичный для нервной сис-
темы тип синапсов — химические (рис. 139, Я). Они принципиально
отличаются от электротонических синапсов тем, что в них при помощи
медиатора происходит трансформация нервного импульса одной клет-
ки в нервный импульс другой, а не простая его передача между
клетками. Появление химических синапсов в гволюпии нервной сис-
темы многоклеточных животных создало предпосылки для развития
основного свойства нервной системы — не только реагировать на
внешние и внутренние раздражения рецепторов, но, анализируя их,
обеспечивать целесообразную работу эффекторных систем организма.
Иными словами, только с появлением химических синапсов стало
возможным развитие нервной системы как основной интегративной
системы многоклеточных животных.
Естественно, что в связи с принципиально иным механизмом
работы химических синапсов их тонкое строение существенно от-
личается от строения электротонических синапсов (рис. 139, А). Про-
цессы, обеспечивающие генерацию нервного импульса (деполяриза-
ция мембран в возбуждающих химических синапсах) или затрудня-
ющие ее (гиперполяризация мембраны клетки в тормозных хими-
ческих синапсах), начинаются с выделения в синапсах химических
веществ — медиаторов. Последние специфически действуют на плаз-
матическую мембрану нервной клетки в области синапса. Выделение
медиатора осуществляется отростками одной нервной клетки, а спе-
цифическое его восприятие — отростками или телом другой. В свя-
зи с этим химические синапсы, как правило, полярны и обеспечива-
ют лишь одностороннюю передачу сигнала. Взаимодействие между
клетками при работе химических синапсов происходит по принципу
«команда — исполнение», а не по принципу равноправного взаимо-
* В работах, выполненных на низших многоклеточных (кишечнополостные, архианне-
лиды и др.), показано наличие в нервной системе этих животных синцитиальных нервных
сплетений, где нервные клетки связаны между собой не межклеточными контактами, а
непосредственным слиянием отростков. Такие отношения могут быть и у более высоко-
организованных беспозвоночных животных, например, при образовании нейрохорды у ан-
нелцд и гигантских аксонов у некоторых ракообразных и моллюсков. Как следует из изло-
женного выше, нет принципиальных различий в проведении и распространении импульса
в таких синцитиальных образованиях и электротонических синапсах. Примеры синцити-
альных структур в нервной системе многоклеточных ни в коей мере не умаляют значения
ронно теории, поскольку' основным механизмом взаимодействия клеток являются гу-
моральные и синаптические взаимодействия индивидуальных нейронов.
430
действия, как в случае электротонических синапсов. В химическом
синапсе выделяются две различающиеся между собой части: преси-
наптическая, принадлежащая командующей нервной клетке, и постси-
наптическая — клетке-исполнительнице (4, 7). Кроме того, весьма
важную роль в его работе играет синаптическая щель — структура
шириной около 20 нм, образующаяся на основе специализированных
надмембранных комплексов контактирующих клеток, расположенная
между пре- и постсинаптическими частями синапса (рис. 139, А, 2;
рис. 140, А, 73).
Основное назначение пресинаптической части, или пресинапса,
заключается в регулируемом нервным импульсом выбросе медиатора
в синаптическую щель. В качестве медиатора в разных синапсах ис-
пользуется одно из большого количества преимущественно низкомо-
лекулярных соединений: ацетилхолин, холин, адреналин, норадрена-
лин, серотонин, различные полипептиды и аминокислоты, пурины и
даже АТФ.
Назначение структур синаптической щели состоит в направленном
перемещении медиатора к постсинаптической мембране, а часто и в
удалении его из области контакта после воздействия медиатора на
рецепторы постсинаптической мембраны.
Одна из главных задач постсинаптической части заключается в
специфической рецепции медиатора, а иногда и в его разрушении.
Другая задача состоит в обеспечении ответа на сигнал, полученный
через действие медиатора на рецептор. В возбуждающих синапсах этот
ответ предполагает изменение проницаемости мембраны и начало про-
цессов, приводящих к генерации нового нервного импульса. В тормоз-
ных синапсах происходит гиперполяризация мембраны и затрудняется
возбуждение нервной клетки при действии других синапсов. Естест-
венно, что конкретные детали химической организации рецепторных
и отчасти эффекторных компонентов постсинапса зависят, как и в
случае пресинапса, от химической природы медиатора.
В настоящее время детально изучена структурно-химическая ор-
ганизация холинергических синапсов, в частности тех, в которых ме-
диатором является ацетилхолин, а воспринимающими его рецепторами
в постсинаптической мембране холинрецептивные белки никотиновых
холинергических синапсов (рис. 140, А, Б).
В пресинаптической части холинергического синапса, как и в
других химических синапсах, наиболее характерные структуры — си-
наптические пузырьки (7). Они представляют собой круглые, ограни-
ченные мембраной образования, содержащие ацетилхолин. Форма, раз-
меры синаптических пузырьков и электронная плотность их содержи-
мого зависят от степени их зрелости.
431
01 и
432
Помимо синаптических пузырьков в пресинапсе имеются одиноч-
ные, ограниченные мембраной цистерны и многочисленные митохонд-
рии (5, 6). На внутренней стороне пресинаптической мембраны в
подлежащей гиалоплазме располагаются электронно-плотные образо-
вания конусовидной формы, так называемые dense projection (2). Их
размер от основания до вершины конуса примерно 160 нм, а диаметр
основания около 55 нм. Они расположены в шахматном порядке на
расстоянии 80 нм друг от друга. Каждый конус связан с пятью сосед-
ними при помощи тяжей таким образом, что на внутренней поверх-
ности пресинаптической мембраны, не занятой dense projection и свя-
зывающими их тяжами уплотненной цитоплазмы, образуются участки
треугольной формы. Предполагают, что именно в этих участках про-
исходит выход содержимого синаптических пузырьков в синаптичес-
кую шель.
Не ясен в деталях и механизм направленного перемещения си-
наптических пузырьков к мембране и их взаимоотношение с цитоске-
летом. По классической модели работы пресинаптической зоны синап-
са распространение нервного импульса меняет проницаемость мембран
для ионов кальция. Увеличение их количества в гиалоплазме преси-
напса вызывает активацию микрофибриллярной актин-миозиновой си-
стемы, которая и обеспечивает перемещение синаптических пузырьков
к мембране.
Недостаточно еще выяснены конкретные взаимоотношения мик-
рофибриллярной системы цитоскелета с синаптическими пузырьками
в покоящемся состоянии и при их активации. В мембранах синапти-
ческих пузырьков обнаружены белки-насосы для Са2+, Н+ и белки-
переносчики для ацетилхолина и АТФ (3). Выявлен также весьма
консервативный белок соматобревин (имеющий от 60 до 90% гомоло-
Рис. 140. Тонкая организация химического холинергического никотинового синапса.
А — классическая схема организации пресинапса; Б — альтернативная схема органи-
зации пресинапса с сохранением микротрубочек; В — детали строения синаптическо-
го пузырька:
1 — синаптические пузырьки, 2 — цитоскелетные структуры у пресинаптической
мембраны, 3 — белки-насосы и переносчики в мембране синаптического пузырька,
4 — протееогликаны, 5 — актин, 6 — митохондрия, 7 — соматобревин — специфи-
ческий белок мембраны синаптических пузырьков, 8 — компенсаторный эцдоцитоз,
9 — цистерна, обеспечивающая репарацию синаптических пузырьков, 10 — микрот-
рубочки, 11 — нейрофиламенты, 12 — гладкая ЭПС, 13 — синаптическая щель,
14 постсиналтическая мембрана с холинрецептивными белками, 15 — субмембран-
ный цитоскелет, стабилизирующий расположение холинрецептивных белков в постси-
наптической мембране.
433
гии у дрозофилы, млекопитающих и рыб) в трансмембранном и при-
легающем к мембране со стороны цитоплазмы участках (7). По-види-
мому, он играет важную роль в осуществлении основной функции
синаптических пузырьков. Наконец, в мембране синаптического пу-
зырька «вмонтированы» и молекулы протеогликанов, основная часть
которых обращена внутрь пузырька и оказывается в составе синапти-
ческой щели лишь после экзоцитоза пузырьков (4). Этим молекулам
приписывают существенную роль в стабилизации белков рецепторов
постсинаптической мембраны, хотя конкретные механизмы такой ста-
билизации еще не выявлены. Есть данные о том, что в неработающем
синапсе пузырьки находятся в составе сети из F-актина (5). По клас-
сической модели увеличение концентрации ионов кальция в гиало-
плазме активирует специальные ферменты, фрагментирующие нейро-
филаменты. Благодаря этим двум процессам цитоскелет в области
пресинапса представлен в основном микрофибриллярной актин-мио-
зиновой системой, под действием которой, по классической модели
работы пресинапса, и происходит направленное перемещение синап-
тических пузырьков к пресинаптической мембране.
В кальциевой регуляции работы актин-миозиновой системы пре-
синапса существенная роль отводится митохондриям, которые могут
депонировать или выделять в гиалоплазму ионы кальция.
В некоторых холинергических синапсах обнаружен своеобразный
компенсаторный механизм новообразования синаптических пузырьков.
Они формируются на боковой поверхности пресинапса путем компен-
саторного пиноцитоза. Образовавшиеся таким путем ограниченные
мембраной пузырьки сливаются с мембраной отмеченных выше еди-
ничных цистерн пресинаптической области. Из этих цистерн и обра-
зуются полноценные синаптические пузырьки (рис. 140, А).
Несмотря на многочисленные факты, свидетельствующие в пользу
рассмотренной выше гипотезы, имеются экспериментальные данные,
плохо объяснимые с ее позиций. Так, в опытах с мечеными предше-
ственниками ацетилхолина удалось показать, что при работе синапса
обменивается в основном ацетилхолин, сосредоточенный в гиалоплаз-
ме. Ацетилхолин, находящийся в синаптических пузырьках, согласно
экспериментальным данным, представляет собой как бы резервный,
слабо обменивающийся медиатор, используемый лишь в условиях
очень напряженной работы синапса, которая обычно вызывается ис-
кусственным раздражением нервных клеток.
На примере некоторых холинергических синапсов при особых ща-
дящих методах фиксации удалось показать наличие в пресинапсе изо-
гнутых микротрубочек с перемещающимися по ним синаптическими
пузырьками, доходящими до пресинаптической мембраны (рис. 140, Б).
434
Таким образом, тонкие механизмы работы даже холинергических
синапсов еще в значительной мере не известны. Еще менее ясен
механизм функционирования синапсов с другими медиаторами. Осно-
ву структур синаптической щели холинергических и других синапсов
составляют углеводные компоненты надмембранных комплексов, в
частности углеводные цепи ганглиозидов (липиды мембран с большой
углеводной головкой). Показано изменение состава последних при
увеличении скорости прохождения медиатора. Важную роль в такой
регуляции работы синапсов играют специфические белки, в частности
особый белок S-100 и, по-видимому, указанные выше молекулы про-
теогликанов синаптических пузырьков.
Довольно много известно о структурно-химической организации
наиболее важной, постсинаптической части холинергических синап-
сов и их постсинаптической мембраны. Специфическими структурами
этих мембран являются сложные комплексы холинрецептивного белка
(рис. 141). Холинрецептивные белки никотинового синапса — один
из видов наиболее хорошо изученных рецепторов. Они состоят из пяти
мономеров, образующихся, вероятно, в результате многократной дуп-
ликации одного гена. Два а-мономера идентичны, остальные — р-, у-,
Рис. 141. Организация холинрецептивных белков
в постсинаптической мембране никотинового (А,
Б В) и мускаринового (Г) синапса
А — схема взаимоотношения одного мономера
комплекса с мембраной; Б — срез через белко-
вый комплекс (удален один мономер), виден ион-
ный канал, образованный амфотерными участка-
ми молекул мономеров; В — общий вид двух
комплексов, состоящих из пяти мономеров; Г —
схема взаимоотношения рецепторных (7), про-
межуточных (2) белков и белков ионного канала
(3) в постсинаптическиой мембране мускарино-
вых и адренергических синапсов.
435
v___представлены каждый одним мономеров, различающимися меж-
ду собой последовательностью аминокислот в белковых цепях и мо-
лекулярной массой.
Каждый мономер имеет четыре гидрофобных и один амфотер-
ный участок, которыми белки связаны с плазматической мембраной
(рис. 141, Л). Имеются также и значительные гидрофильные концевые
цитоплазматический и особенно большой надмембранный участки. У
а-мономеров в последних расположены центры связывания ацетилхо-
лина, задействование которых вызывает активирование всего комплек-
са и перевод канала в открытое состояние. Стенка канала образована
амфотерными фрагментами мономеров, меняющих свою конфигура-
цию при задействовании активных центров в а-мономерах (рис. 141,
Б). Таким образом, холинрецептивные белки никотиновых синапсов
являются одновременно и рецепторами, и эффекторами, поскольку
именно они меняют проницаемость мембраны и обеспечивают гене-
рацию нового импульса. Третьим компонентом этой системы является
в большинстве никотиновых холинергических синапсов фермент аце-
тилхолинэстераза, деятельность которой обеспечивает быстрое разло-
жение медиатора и прекращение его действия. Холинрецептивные
белковые комплексы объединяются обычно по два, и цитоплазмати-
ческие их участки вступают в структурную связь с цитоскелетом,
расположенным под субсинаптической мембраной (рис. 141, В).
Холинергические никотиновые синапсы широко распространены
в нервной системе позвоночных и беспозвоночных животных. Срав-
нительные данные позволяют сделать вывод о том, что медиатор,
фермент ацетилхолинэстераза и холинрецептивные белковые комплек-
сы никотиновых синапсов произошли в филогенезе независимо друг
от друга. При этом позднее всего появились холинрецептивные белки
и объединение этих трех компонентов произошло лишь при форми-
ровании синапсов у многоклеточных животных.
Помимо никотиновых ацетилхолиновых синапсов широкое рас-
пространение в нервной системе имеют и так называемые мускарино-
вые ацетилхолиновые синапсы, медиаторами в которых являются так-
же ацетилхолины. Принцип действия этих синапсов иной и опреде-
лятся он различиями холинрецептивных белков никотиновых и мус-
кариновых синапсов. В постсинаптической мембране они представле-
ны мономерными белками молекулярной массой 80 кДа. Они не го-
мологичны холинрецептивным белкам никотиновых синапсов и коди-
руются генами другого надсемейства.
Холинрецептивные белки в мускариновых синапсах являются
лишь рецепторами. Они передают сигнал на систему ГТФ-зависимых
436
мембранных G-белков, которые связаны со специальными универсаль-
ными и для других рецепторов эффекторными системами эукариотных
клеток (рис. 141, Г). Такой принцип работы характерен для большин-
ства синапсов, использующих другие медиаторы, а также для боль-
шинства пептидных гормонов. Из других нервных синапсов, в которых
используется этот принцип работы, наиболее широкое распростране-
ние имеют, по-видимому, адренергические синапсы с медиаторами
адреналином и другими катехоламинами. Во всех синапсах широко
используются универсальные эффекторные мембранные системы, ха-
рактерные для эукариотных клеток (аденилатциклаза, специальные
кальциевые каналы, фосфоинозитоловая система), а воспринимающие
медиатор белки в постсинаптической мембране играют лишь роль
рецепторов, как и холинрецептивные белки мускариновых холинерги-
ческих синапсов.
Тот же принцип работы, как и в холинергических никотиновых
синапсах характерен для синапсов, использующих в качестве медиа-
тора у-аминомасляную кислоту. Рецептивные белки, тетрамеры из двух
а-субъединиц (50 кДа) и двух |3-субъединиц (55 к Да), образуют канал
для ионов хлора, который открывается при активации рецептивной
части молекулы. В отличие от никотиновых холинергических возбуж-
дающих синапсов этот синапс относится к типичным тормозным си-
напсам. Его возбуждение гиперполяризует мембрану нейрона и затруд-
няет работу возбуждающих синапсов.
Следует учесть, что у многоклеточных животных средних и выс-
ших уровней организации на дендритах и телах ассоциативных и
эффекторных нейронов имеются десятки или даже сотни возбуждаю-
щих и тормозных химических синапсов, что и обусловливает весьма
сложную анализаторскую деятельность нервных клеток (рис. 142). Она
усиливается еще и тем, что системы рецептивных белков в постсинап-
тической мембране находятся под контролем других рецептивных сис-
тем клетки. Кроме того, широко распространены в нервной системе
аксон-аксональные синапсы — нервные окончания на пресинапсах ак-
сонов, обеспечивающих контроль за деятельностью синапсов на уровне
их пресинаптической части.
Такой контроль может осуществляться двумя способами: образо-
ванием аксон-аксональных регулирующих синапсов или путем неси-
наптического модулирующего воздействия медиаторов на пресинапти-
ческую область синапсов. Последний механизм подробнее рассмотрен
ниже. Аксон-аксональные синапсы, как правило, тормозные синапсы.
Однако имеется уже много примеров, когда они оказывают сенсити-
зирующее, стимулирующее действие на основные возбуждающие си-
напсы.
437
Рис 142. Синаптические окончания на двигательной
нервной клетке передних рогов спинного мозга млеко-
питающих.
В качестве примера эффекторных синапсов нервных клеток мы
рассмотрим окончания двигательных нейронов на мышечных волокнах
поперечнополосатой мышечной ткани. У позвоночных животных эти
окончания имеют вид небольших утолщений или бугорков, располо-
женных на сарколемме мышечного волокна и получивших название
двигательных бляшек (рис. 143, А). Характерная особенность этих
образований — обилие ядер, которые принадлежат расположенному в
области двигательной бляшки скоплению вспомогательных глиальных
клеток.
Каждое терминальное разветвление аксона в области двигательной
бляшки заканчивается булавовидным расширением, которое представ-
ляет собой типичный пресинапс холинергического никотинового си-
напса, описанный выше (рис. 143, Б).
Особенность синаптической щели нервно-мышечного синапса яв-
ляются ее большие размеры (60—120 нм против 20 нм для нервных
синапсов) Кроме того, постсинаптическая мембрана, сформированная
438
А Б
Рис. 143. Нервно-мышечные синапсы позвоночных.
А — рисунок с микрофотографии двигательного нервного окончания поперечнополо-
сатых мышечных волокон лягушки; Б — ультраструктурная организация нервно-мы-
шечного синапса позвоночных:
/ — базальная мембрана, 2 — шванновская клетка, 3 — нейроплазма, 4 — сарко-
плазма мышечного волокна, 5 — пальцевидные отростки шваноновской клетки, 6 —
базальная мембрана мышечного волокна, 7 — синаптические пузырьки.
участком мембраны мышечного волокна, образует складки, что резко
увеличивает площадь ее поверхности, а следовательно, и количество
холинрецептивных никотиновых белковых комплексов. Их активация
ацетилхолином вызывает изменение проницаемости мышечной мем-
браны. Возникающий потенциал действия распространяется по мем-
бране и через специальные белки (пиримидиновые рецепторы) пере-
дается на рецепторы-каналы мембран видоизмененной эндоплазмати-
ческой сети, которые и обусловливают выход генерирующих сокра-
щение мышцы, ионов Са в гиалоплазму.
Еще одна особенность нервно-мышечных синапсов — это их
участие в формировании синаптической щели базальной мембраны
мышечного волокна (6). При этом она является не просто дополни-
тельной структурой гипертрофированных надмембранных комплексов
пре- и постсинаптических мембран. При разрушении и пресинапти-
ческой (денервация), и постсинаптической (разрушение мышечных во-
локон) мембран показано, что именно базальная мембрана мышечного
волокна, сохраняющаяся в обоих случаях, определяет место скопления
холинрецептивных белков (при регенерации мышечного волокна) или
локализацию синапса (при регенерации аксона). Эти данные находятся
в соответствии с представлениями о роли протеогликанов, вмонтиро-
ванных в мембрану синаптических пузырьков, в распределении холин-
рецептивных белков в постсинаптической мембране нервных синапсов.
439
На примере мышечных синапсов была особенно хорошо изучена
пресинаптическая система реутилизации ацетилхолина и повторного
использования мембран для формирования синаптических пузырьков.
Помимо ацетилхолиновых мышечных синапсов в некоторых мышеч-
ных тканях используются и синапсы с другими медиаторами (адрена-
лин, пурины). Однако в соматических мышечных волокнах у позво-
ночных, аннелид и некоторых других групп животных основным ме-
диатором в нервно-мышечных синапсах является ацетилхолин. При
этом у позвоночных каждое волокно имеет эффекторное окончание от
одного нейрона. Иные отношения наблюдаются у членистоногих. У
них медиатором в возбуждающих нервно-мышечных синапсах служит
глутаминовая кислота. Существенной особенностью нервно-мышеч-
ных синапсов является мультинейронная иннервация мышечных воло-
кон, причем нейронами разной специфичности (рис. 144). Здесь на
1 2 J 4 «
Рис. 144. Полинейронная иннервация мышечного
волокна насекомых.
7-5 — аксон быстрых (7) и медленных (2) мото-
нейронов, тормозных (3), октопаминергических
(4) нейронов и нейросекреторных клеток (5).
одном мышечном волокне находятся окончания быстрых и медленных
возбуждающих нейронов с глутаминовой кислотой в качестве медиа-
тора (7, 2). На возбуждающих синапсах могут быть и пресинаптические
тормозные синапсы (3). Кроме того, здесь же заканчиваются синапсы
тормозные и регуляторные (3-5). Последние выделяют либо октопамин
(4), либо нейросекреты (5), оказывающие влияние на работу других
синапсов. В отличие от позвоночных, где анализ информации проис-
ходит в нервных центрах, у членистоногих (в частности, у ракообраз-
ных) анализ информации, поступающей в нервную систему, происхо-
дит и на уровне нервно-мышечных синапсов. По образному выраже-
440
нию одного из физиологов, «рак думает клешней». Что же касается
смены медиаторов (замена ацетилхолина на глутамат) в нервно-мы-
шечных синапсах членистоногих, то здесь проявилась эволюционная
пластичность этих образований, связанная, по-видимому, с особеннос-
тями мультинейронной регуляции мышечной деятельности и необхо-
димостью частичной компенсации недостаточно развитой у членисто-
ногих гуморальной интеграции.
Эволюционная пластичность организации нервно-мышечных си-
напсов проявляется и в большом многообразии их у брюхоногих
моллюсков. Помимо ацетилхолина у них обнаружены серотонин, до-
фамин и несколько разновидностей полипептидов. Интересно, что у
позвоночных глутамат может играть роль гуморального регулятора
деятельности нервно-мышечных синапсов, в то время как у насекомых
такую роль выполняет ацетилхолин.
ГЛАВА 2. Рецепторные нервные окончания,
рецепторы
Организация рецепторных нервных аппаратов у многоклеточных
характеризуется большим разнообразием, чем организация синапсов.
Это определяется двумя основными биологическими особенностями
рецепторов. Во-первых, каждый тип рецепторов приспособлен к вос-
приятию одного специфического сигнала (раздражителя) из внешней
или внутренней среды. Во-вторых, в рецепторных нейронах и специ-
ализированных для этой цели рецепторных клетках других тканей
происходит преобразование энергии внешнего стимула в энергию нер-
вного импульса или рецепторного потенциала. Морфологически наи-
более простыми рецепторами являются свободные терминальные раз-
ветвления дендритов чувствительных нервных клеток в коже и других
органах позвоночных животных. Они называются свободными нерв-
ными окончаниями и обусловливают неспецифическую болевую чув-
ствительность, имеющую большое значение в эволюции позвоночных.
В сравнительно-гистологическом плане больший интерес представля-
ют более специфичные рецепторы.
По происхождению рецепторные клетки делятся на две группы:
первичночувствующие (видоизмененные нейроны) и вторичночувст-
вующие (видоизмененные глиальные или эпителиальные клетки). Вто-
ричночувствующие клетки более характерны для позвоночных живот-
ных, хотя они имеются и у гребневиков, и у головоногих моллюсков.
Первичночувствующие рецепторные клетки в ответ на специфическое
раздражение генерируют обычно нервный импульс, а вторичночувст-
441
нию одного из физиологов, «рак думает клешней». Что же касается
смены медиаторов (замена ацетилхолина на глутамат) в нервно-мы-
шечных синапсах членистоногих, то здесь проявилась эволюционная
пластичность этих образований, связанная, по-видимому, с особеннос-
тями мультинейронной регуляции мышечной деятельности и необхо-
димостью частичной компенсации недостаточно развитой у членисто-
ногих гуморальной интеграции.
Эволюционная пластичность организации нервно-мышечных си-
напсов проявляется и в большом многообразии их у брюхоногих
моллюсков. Помимо ацетилхолина у них обнаружены серотонин, до-
фамин и несколько разновидностей полипептидов. Интересно, что у
позвоночных глутамат может играть роль гуморального регулятора
деятельности нервно-мышечных синапсов, в то время как у насекомых
такую роль выполняет ацетилхолин.
ГЛАВА 2. Рецепторные нервные окончания,
рецепторы
Организация рецепторных нервных аппаратов у многоклеточных
характеризуется большим разнообразием, чем организация синапсов.
Это определяется двумя основными биологическими особенностями
рецепторов. Во-первых, каждый тип рецепторов приспособлен к вос-
приятию одного специфического сигнала (раздражителя) из внешней
или внутренней среды. Во-вторых, в рецепторных нейронах и специ-
ализированных для этой цели рецепторных клетках других тканей
происходит преобразование энергии внешнего стимула в энергию нер-
вного импульса или рецепторного потенциала. Морфологически наи-
более простыми рецепторами являются свободные терминальные раз-
ветвления дендритов чувствительных нервных клеток в коже и других
органах позвоночных животных. Они называются свободными нерв-
ными окончаниями и обусловливают неспецифическую болевую чув-
ствительность, имеющую большое значение в эволюции позвоночных.
В сравнительно-гистологическом плане больший интерес представля-
ют более специфичные рецепторы.
По происхождению рецепторные клетки делятся на две группы:
первичночувствующие (видоизмененные нейроны) и вторичночувст-
вующие (видоизмененные глиальные или эпителиальные клетки). Вто-
ричночувствующие клетки более характерны для позвоночных живот-
ных, хотя они имеются и у гребневиков, и у головоногих моллюсков.
Первичночувствующие рецепторные клетки в ответ на специфическое
раздражение генерируют обычно нервный импульс, а вторичночувст-
441
вуюгцие — рецепторный потенциал. Эти существенные особенности
свойств первично- и вторичночувствующих клеток не абсолютны. Фо-
торецепторные клетки, представленные у всех животных преимущест-
венно первичночувствующими клетками, генерируют в ответ на раз-
дражение светом рецепторный потенциал. Такая особенность харак-
терна и для некоторых механорецепторов беспозвоночных животных,
образованных видоизмененными нейронами.
Все рецепторы у многоклеточных животных можно разделить в
биологическом плане на две большие группы: интероцепторы и экс-
тероцепторы. Интероцепторы служат для восприятия специфических
раздражений из внутренней среды организма, от его клеточных эле-
ментов или межклеточных структур.
§1 . ИНТЕРОЦЕПТОРЫ
В качестве примера интероцепторов рассмотрим так называемое
тельце Фатер-Пачини у млекопитающих и рецепторы растяжения
мышц у ракообразных и позвоночных.
Фатерпачиниево тельце
В образовании фатерпачиниева тельца принимают участие терми-
нальные разветвления дендрита чувствительной нервной клетки, спе-
циализированные фиброциты, система коллагеновых волокон соеди-
нительной ткани и видоизмененные глиальные клетки (рис. 145). На-
ружная капсула образована продольно ориентированными фиброцита-
ми и системой коллагеновых волокон, спирально расположенных во-
круг продольной оси. Коллагеновые волокна фиксируются в основании
тельца, что обеспечивает лишь незначительные смещения капсулы
относительно внутренней части инкапсулированного окончания. Пос-
ледняя представлена разветвлениями дендритов чувствительных кле-
ток в студенистом аморфном веществе (внутрення колба) и системой
глиальных клеток.
В концевых разветвлениях дендритов удается обнаружить боль-
шое количество митохондрий. На концевом участке дендрита чувст-
вительной клетки (находящемся во внутренней колбе капсулы) обна-
ружены синаптические окончания терминалей аксонов. Природа этих
аксонов не ясна. Это могут быть окончания отростков вторичночув-
ствующих глиальных клеток, которые и воспринимают раздражение
своим ресничным аппаратом, как предполагают некоторые морфологи.
По мнению физиологов, терминальные разветвления принадлежат от-
росткам нервных клеток вегетативной нервной системы. Генерация
нервного импульса происходит в результате деформации концевого
442
Рис. 145. Строение инкапсулированного интеронеггтора — тельца Фатер-Пачини.
1 — слоистая капсула, 2 — внутренняя колба, 3 — дендрит чувствительной нервной клетки спи-
нального ганглия, 4 — спиральные коллагеновые волокна, 5 — фиброциты, 6 — глиальные клетки
с ресничками, 7 — возможные (?) синаптические окончания отростков вторичночувствующих (°)
глиальных клеток или окончания нейронов, регулирующих состояние рецептора.
участка дендрита чувствительной клетки. Сложная капсула, образован-
ная фибробластами, коллагеновыми волокнами и глиальными клетка-
ми, лишь усиливает эффект такой деформации и не принимает непо-
средственного участия в генерации нервного импульса.
Рецепторы растяжения мышц
Эти рецепторы представляют собой весьма наглядный пример
независимого параллельного развития в эволюции сходных интероцеп-
торов у позвоночных и ракообразных. Рецепторы растяжения в попе-
речнополосатой мышечной ткани у ракообразных представлены двумя
специальными типами волокон: медленными и быстрыми рецепторны-
ми мышечными волокнами (рис. 146, 3, 4). На каждом из них имеет-
ся три типа нервных окончаний: а) разветвление дендритов чувстви-
тельных клеток, б) нервно-мышечные синапсы аксонов возбуждающих
нейронов, в) нервно-мышечные тормозные синапсы (7, 5, 2).
Рис. 146. Строение рецепторов растяжения попере-
чнополосатых мышц у ракообразных (а)
н позвоночных (б).
1 — афферентные аксоны от мышц-рецепторов у
ракообразных, 2 — тормозной аксон ракообраз-
ных, 3. 4 — мышечные волокна = рецепторы мед-
ленные^) и быстрые (4) у ракообразных, 5 — ак-
соны возбуждающих нейронов у ракообразных н
позвоночных, 6, 7 — дендриты чувствительных
клеток первого (6) и второго (7) типов, образую-
щих окончания на мышечных волокнах-рецепто-
рах позвоночных, 8 — мышца, 9 — мышца-рецеп-
тор сумчатого типа, 10 — мышца-рецептор цент-
рального типа у млекопитающих.
444
У позвоночных животных, в частности у млекопитающих, рецеп-
торы растяжения в поперечнополосатых мышцах также представлены
двумя типами мышечных волокон: медленными и быстрыми (9, 10).
На каждом из них имеются два типа окончаний: окончания дендритов
чувствительных клеток (6) и нервно-мышечные синапсы возбуждаю-
щих нейронов (5, 7). В отличие от ракообразных у млекопитающих
отсутствуют тормозные нервно-мышечные синапсы.
Работа рецепторов и у ракообразных, и у млекопитающих проис-
ходит одинаково. При сокращении мышцы (8) расслабляются рецеп-
торные окончания дендритов чувствительных клеток, при сокращении
под влиянием импульсов возбуждающих синапсов самих рецепторных
волокон происходит растяжение сенсорных окончаний и соответст-
вующая информация поступает в нервные центры. Несмотря на боль-
шое сходство рассмотренных рецепторов растяжения млекопитающих
и ракообразных ясно, что они развивались независимо у этих живот-
ных и их сходные черты есть результат параллельного конвергентного
развития.
§2 . ЭКСТЕРОЦЕПТОРЫ
Экстероцепторы — это разнообразная группа рецепторов, обеспе-
чивающих поступление информации в нервную систему из внешней
среды.
Наиболее рациональной является классификация экстероцепторов,
в основу которой положен функциональный принцип. Он позволяет
выделить среди экстероцепторов три разновидности: механо-, хемо- и
фоторецепторы. К первой группе относятся концевые нервные аппа-
раты, генерация импульсов в которых основана на механическом воз-
действии раздражителей на рецепторные аппараты. Деятельность не
менее широко представленных хеморецепторов основана на химичес-
ком взаимодействии раздражителя с рецепторными аппаратами плаз-
матических мембран. Особую и очень важную разновидность эксте-
роцепторов составляют фоторецепторы, где раздражителем являются
фотоны световой энергии.
Помимо функциональной существует еще и общебиологическая
классификация экстероцепторов на контактные и дистантные рецеп-
торы. Последние позволяют животному ориентироваться в простран-
стве, не вступая в непосредственный контакт с источником раздра-
жения. Очевидно, что дистантные рецепторы, к которым относятся
органы зрения, обоняния, слуха и гравитации, представляют собой
в общебиологическом смысле чрезвычайно важную группу. Их орган-
ная и тонкая морфобиохимическая организация достигает у прогрес-
445
сивно эволюционирующих групп животных большой сложности и
совершенства.
Механорецепторы
Наиболее простым примером механорецепторов могут служить
чувствительные волоски насекомых. Они имеют вид кутикулярных
конусов, подвижно сочлененных с кутикулярной пластинкой кожного
покрова (рис. 147, 1, 2). Кутикула волоска и подвижных сочленений
образуется особыми, обычно немногочисленными клетками гиподер-
мы. Полость кутикулярного волоска заходит в специализированный
дендрит биполярной чувствительной клетки, тело которой располага-
ется обычно в самой гиподерме (4, 5. 6). При смещении гиподермаль-
ного аппарата чувствительных волосков происходит деформация денд-
рита чувствительной нервной клетки. В процессе такой деформации
и возникает нервный импульс или генерируется рецепторный потен-
циал.
Примерами более сложно устроенных механорецепторов много-
клеточных животных могут служить их органы «гравитации». Эти
органы в процессе эволюции независимо возникли у разных групп
многоклеточных животных и совершенствовались в пределах каждой
систематической группы. Несмотря на это рецепторы «гравитации» у
подавляющего большинства многоклеточных животных строятся по
одной и той же схеме. В любом органе равновесия обязательно есть
так называемая пробная масса — массивное внеклеточное образова-
ние, способное «перемещаться» при изменении положения организма
в гравитационном поле. Еще одним основным компонентом органа
«гравитации» является чувствительная антенна, представленная видо-
измененными жгутиками или микроворсинками. Они образуются нерв-
ными или особыми чувствительными клетками, генерирующими нерв-
ный импульс (нервная клетка) или рецепторный потенциал (чувстви-
тельная клетка). Органы «гравитации» в процессе эволюции претер-
певают большие усложнения, благодаря чему высшие многоклеточные
животные получают возможность не только ориентироваться в стати-
ческом гравитационном поле, но и анализировать угловые ускорения
при перемещении тела в пространстве. Способность к такого рода
рецепции достигается в результате усложнения у высших животных
всех основных компонентов органа «гравитации» и появления ряда
вспомогательных структур.
Особой сложности орган «гравитации» достигает у высших по-
звоночных, ракообразных и головоногих моллюсков. У млекопитаю-
щих орган равновесия входит в состав внутреннего уха. Он представ-
446
/
Рис. 147. Строение механорецепторов волоскового органа насекомых
(по Я. А. Винникову, 1979).
1 — кутикулярный волосок, 2 — кутикула, 3 — кутикулярная трубочка, фик-
сирующая ресничку, 4 — ресничка, 5 — периферический отросток, 6 — тело
нейрона, 7 — центральный отросток чувствительной клетки, 8 — базальная
мембрана.
447
лен частью перепончатого лабиринта, и состоит из двух связанных
между собой мешочков с тремя полукружными каналами, расположен-
ними в трех взаимно перпендикулярных плоскостях (рис. 148, А). Все
части перепончатого лабиринта залегают в костных полостях и окру-
жены перилимфой. Мешочки сообщаются между собой при помощи
узкого канала. Полукружные каналы в области соединения с одним
из мешочков имеют расширения, называемые ампулами. Внутри пере-
пончатого лабиринта находится эндолимфа. Стенка лабиринта изнутри
выстлана однослойным эпителием, в котором в определенных местах
расположены вторичночувствующие клетки. В мешочках это слуховые
пятна (5), а в основании полукружных каналов — слуховые гребешки
(4). В эпителии среди обычных цилиндрических или призматических
клеток имеются клетки, снабженные чувствительными антеннами в
виде одной длинной видоизмененной реснички и пучка из 60-80 мик-
роворсинок (рис. 148, Б, 9). Они погружены в пробную массу, имею-
щую в области слуховых пятен уплощенную, а в области слуховых
гребешков — конусовидную форму.
Чувствительные клетки слуховых пятен генерируют электроста-
тический сигнал (так называемый рецепторный потенциал) в резуль-
тате раздражения антенн при изменении положения тела в простран-
стве, а также при вибрационных воздействиях. Антенный аппарат
чувствительных клеток слуховых гребешков смещается в результате
инерционной задержки перемещения пробной массы при быстром по-
вороте головы или ускоренном угловом вращении тела в пространстве.
Аналогичное в принципе строение имеет и орган слуха млекопи-
тающих, вторичночувствующие клетки которого расположены в осо-
бой части перепончатого лабиринта — улитке (рис. 148, А, 6). Вместе
с системой вспомогательных эпителиальных клеток, коллагеновые во-
локна подлежащей ткани и особая мембрана, выполняющая роль проб-
ной массы, образуют Кортиев орган.
У некоторых головоногих моллюсков (осьминогов), так же как и
у позвоночных животных, видоизмененный, наполненный эндолимфой
статоцист находится в перилимфатической полости. У других голово-
ногих моллюсков (кальмаров) полости с перилимфой может не быть,
тогда в стенке органа «гравитации» развиваются многочисленные вы-
росты, обеспечивающие весьма сложные токи эндолимфы при пере-
мещении животного в пространстве. Как и у позвоночных животных,
рецепторными аппаратами у головоногих моллюсков являются слухо-
вые пятна и слуховые гребешки, или кристы. Последние располагаются
в трех взаимно перпендикулярных плоскостях.
У позвоночных две кристы расположены вертикально и одна
горизонтально, а у головоногих моллюсков — две горизонтально и
448
Б
Рис. 148. Органы равновесия млекопитающих.
А — схема перепончатого лабиринта млекопитающих; Б — участок выстилки
слухового пятна:
1-3 — полукружные каналы (/ — передний, 2 — задний, 3 — горизонтальный), 4,
5 — слуховые пятна, 6 — улитка, 7, 8 — два типа вторичночувствующих рецептор-
ных клеток, 9 — микроворсинки, 10 — ядро, 11 — аппарат Гольджи, 12 — мито-
хондрии, 13. 14 — чашевидные и бутонообразные нервные окончания, 15 — нерв-
ное волокно, 16 — шероховатая ЭПС.
одна вертикально. Часть чувствительных клеток у головоногих мол-
люсков, как и у других групп беспозвоночных животных, — это ви-
доизмененные нейроны (рис. 149, /). Однако морфобиохимическая
дифференцировка и антенного аппарата, и тела клетки весьма сходна
с дифференцировкой вторичночувствующих эпителиальных клеток у
позвоночных животных. Дендриты первичночувствующих клеток ор-
гана «гравитации» головоногих моллюсков представляют собой мик-
роворсинки и видоизмененные реснички. Количество ресничек у голо-
воногих моллюсков, однако, значительно больше, чем у позвоночных
животных. Для чувствительных нервных клеток головоногих моллюс-
ков характерно обилие эфферентной иннервации (4 а, б), что свиде-
тельствует о контроле за деятельностью чувствительных клеток со
449
стороны центральной нервной системы. Что касается взаимоотноше-
ний чувствительных клеток с пробной массой слуховых пятен и гре-
бешков, а также функционального значения этих структур, то они в
принципе аналогичны тем отношениям, которые наблюдаются в органе
равновесия у позвоночных животных. Слуховые пятна, как и у позво-
ночных животных, являются рецепторами гравитации, а кристы пред-
ставляют собой рецепторы угловых ускорений. Кроме того, те и другие
рецепторы весьма чувствительны к вибрации.
Как видно на схеме (рис. 149), около половины чувствительных
клеток в области слуховых пятен представлены у осьминога большими
и маленькими вторичночувствующими клетками (2 а, б). Они образуют
(как и у млекопитающих) пресинаптические контакты со специальны-
ми большими и обычными нейронами, тела которых расположены в
области рассматриваемых рецепторных аппаратов (3 а, б).
2а
Рис. 149. Участок выстилки перепончатого лабиринта головоногого моллюска.
1, 2 — первичночувствующие и вторичночувствующие клетки, 3 — большие (а) и
малые (б) нервные клетки, получающие информацию от больших (2 а), и малых
(2 б) вторичночувствующих клеток, 4 — эффекторная иннервация первнчночувству-
ющих (а) и вторичночувствующих (б) клеток, 5 — опорная клетка.
Таким образом, на примере органов «гравитации» головоногих
моллюсков и позвоночных животных мы видим, насколько глубоки
черты сходства аналогичных структур на субклеточном, тканевом и
даже органном уровнях организации у животных, весьма удаленных в
филогенетическом отношении. Вместе с тем в одних случаях (первич-
норотые животные) мы имеем дело и вторичночувствующими клетка-
ми, и с видоизмененными нейронами, а в других (позвоночные) — с
видоизмененными вторичночувствующими эпителиальными клетками.
Интересно отметить, что вторичночувствующие клетки обнаруже-
ны недавно в органах «гравитации» у таких относительно низкоорга-
450
низованных животных, как гребневики. Очевидно, что их возникнове-
ние в этом типе, как и у головоногих моллюсков, произошло незави-
симо и параллельно с их возникновением у позвоночных животных.
Широкое распространение аналогичных дифференцировок, осо-
бенно на субклеточном уровне организации органов равновесия, на-
блюдается и у других животных. Наряду с этим у некоторых групп
животных (например, у насекомых) универсальные для большинства
многоклеточных животных органы гравитации на основе более или
менее видоизмененного статоциста полностью утрачиваются и заме-
няются другими органами.
Существенные особенности в организации органа равновесия ха-
рактерны и для ракообразных. Смещение статоциста передается у
них на специальные кутикулярные волоски, образуемые специальными
клетками кутикулярного эпителия. Механическое смещение волосков
через кутикулярное внеклеточное образование воспринимается денд-
ритами чувствительных нервных клеток, которые и генерируют нерв-
ный импульс.
Весьма своеобразные органы «гравитации» имеются и у некото-
рых низших многоклеточных (кишечнополостные, немертины, турбел-
лярии и личинки асцидий). У всех животных, не связанных непосред-
ственным родством, формируются специальные клетки с внутрикле-
точной локализацией статолитов. С этими клетками у большинства
животных контактируют отростки или тела нервных клеток. Такие
органы «гравитации» хотя и функционируют, по-видимому, на едином
или сходном, не ясном еще для нас принципе, тем не менее имеют
явно независимое полифилетическое происхождение.
Хеморецепторы
К типичным хемоэкстероцепторам относятся органы вкуса и обо-
няния. У высших организмов они достигают сложной структурной
организации. В основе восприятия раздражения и его кодирования в
нервный импульс или рецепторный потенциал (в дистантном рецеп-
торе органа обоняния и контактном хеморецепторе органа вкуса) ле-
жит один и тот же механизм. Он заключается во взаимодействии
молекул различных веществ со специфическими белковыми молеку-
лами, вмонтированными в специализированные мембраны соответст-
вующих первично- или вторичночувствующих клеток. В качестве при-
меров хеморецепторов рассмотрим органы вкуса и обоняния высших
многоклеточных животных — позвоночных и насекомых.
Непосредственное восприятие раздражения специфическими мо-
лекулами в органах обоняния и вкуса осуществляется либо специали-
451
зированными дендритами видоизмененных чувствительных нейронов,
либо антенным аппаратом вторичночувствующих клеток. Последние у
млекопитающих сосредоточены в основном в многослойном эпителии
дорсальной стенки языка, в так называемых вкусовых луковицах
(рис. 150, Я). Каждая вкусовая луковица представляет собой органи-
зованную систему вторичночувствующих и вспомогательных опор-
ных эпителиальных клеток. Вкусовые луковицы расположены в толще
эпителиального пласта, на их периферии находятся преимущественно
опорные (светлые), а в центре — чувствительные (темные) клетки. На
вершине луковицы имеется пора, через которую апикальные отростки
чувствительных клеток контактируют с секретом желез ротовой по-
лости, с растворенными в нем специфическими молекулами (2). Апи-
кальные отростки вкусовых чувствительных клеток имеют вид свое-
образных кисточек. Они представляют собой специализированные ко-
нусовидные участки цитоплазмы, на конце которых сосредоточены
многочисленные и хорошо развитые микроворсинки (рис. 150, В, 4).
В апикальной части цитоплазмы и микроворсинках много микротру-
бочек и фибриллярных структур, которые связаны с клеточным цент-
ром. В цитоплазме клеток удается выявить многочисленные митохонд-
рии, элементы аппарата Гольджи, эндоплазматическую сеть и лизо-
сомный аппарат. В местах контакта темных вторичночувствующих
клеток с терминальными разветвлениями дендритов чувствительных
нервных клеток плазматическая мембрана и прилегающая цитоплазма
вкусовых клеток формируют характерные пресинаптические участки
Таким образом, воспринимающие вкусовые раздражения клетки
представляют собой специализированные вторичночувствующие клет-
ки. Еще одной интересной особенностью этих клеток является отно-
сительно непродолжительный жизненный цикл. Источником их попол-
нения являются, по-видимому, специальные участки общей камбиаль-
ной системы многослойного плоского эпителия. У других позвоночных
животных строение органов вкуса принципиально сходно с их стро-
ением у млекопитающих.
У беспозвоночных, в частности у хорошо изученных в этом от-
ношении насекомых, восприятие вкусового раздражения осуществля-
ется не вторичночувствующими клетками, а специализированными
дендритами чувствительных нервных клеток (7). Тела последних со-
средоточены обычно в виде небольших скоплений среди клеток кути-
кулярного эпителия (5). Дендрит чувствительной вкусовой клетки со-
стоит из двух частей. Нижняя часть, расположенная ближе к телу
клетки, так называемый проксимальный сегмент, представляет собой
участок цитоплазмы нервной клетки с рибосомами и митохондриями
452
2 f
Рис. 150. Вкусовые луковицы млекопитающих и вкусовой волосок насекомых.
Л, Б — вкусовая луковица (А — рисунок с микрофотографии, Б — ультраструктур-
ная организация апикальной части вторичночувствующей клетки);
В — вкусовой волосок:
1 — вкусовая луковица, 2 — пора на вершине вкусовой луковицы (место расположе-
ния .микроворсинок вторичночувствующих клеток), 3 — многослойный эпителий,
4 — микроворсинки вкусовой (вторичночувствующей) эпителиальной клетки, 5 — ре-
цепторная чувствительная клетка, 6 — аксоны этих клеток, 7, 8 — проксимальный и
дистальный сегменты периферического отростка чувствительной нервной клетки, 9 —
кутикулярный эпителий, 10 — базальная мембрана.
453
(7). Верхний, или дистальный, сегмент является видоизмененной рес-
ничкой (5). Он заходит в полость специального конусовидного выроста
кутикулярной пластинки, имеющего на вершине отверстие, где апи-
кальная часть дистального сегмента вступает в непосредственный кон-
такт с внешней средой (9).
Хеморецепторы органа обоняния у позвоночных и беспозвоноч-
ных представлены чувствительными нервными клетками, т. е. раздра-
жение, производимое пахучими молекулами, непосредственно воспри-
нимается специализированными дендритами этих клеток. У млекопи-
тающих и других позвоночных животных они имеют вид палочко-
или колбообразных структур, заканчивающихся на дистальном конце
специализированными подвижными утолщениями — обонятельными
булавами (рис. 151, А, 2). Последние могут выдвигаться над поверх-
ностью или, наоборот, втягиваться в толщу эпителиального пласта,
образованного опорными и секреторными вспомогательными клетка-
ми. Булавы на своей поверхности имеют чувствительные волоски, или
антенны, длиной до 200 мкм. Они представляют собой подвижные
образования, построенные по типу реснички или жгутика (5). Однако
характер движения этих структур резко отличается от движений обыч-
ных ресничек.
Имеющиеся данные показывают, что основным местом взаимо-
действия пахучих молекул с плазматической мембраной обонятельных
чувствительных клеток являются мембраны антенн — преобразован-
ных жгутиков, подвижность которых способствует более совершенно-
му контакту пахучих молекул с плазматической мембраной.
Тело обонятельной клетки содержит общие для всех клеток ор-
ганоиды. От ее базальной части отходит центральный отросток —
аксон, образующий характерные терминальные разветвления в виде
клубочков в обонятельных долях головного мозга (4). В опытах с
[3Н]тимидином удалось показать, что у позвоночных животных обо-
нятельные клетки, представляющие собой видоизмененные нейроны,
тем не менее имеют ограниченный жизненный цикл и обновляются
во взрослом организме. Источником их обновления являются базаль-
ные недифференцированные клетки. Анализ наблюдаемых отношений
показал, что в данном случае во взрослом организме сохраняются
отношения, имевшие место при гистогенезе нервной системы. Участки
респираторной эпителиальной выстилки, содержащие обонятельные
нейроны и специальные недифференцированные базальные и опорные
клетки, представляют собой вселившиеся в этот эпителий клеточные
элементы нервного зачатка, так называемые плакоды.
У насекомых, как и у позвоночных животных, чувствительные
обонятельные клетки представляют собой специализированные бипо-
454
j
Рис. 151. Ультраструктурная организация участка обонятельного эпителия млекопи-
тающих (А) и органа обоняния (£) у насекомых (по Я. А. Винникову, 1979).
А- 1 — первичночувствующая рецепторная клетка, 2 — обонятельная булава, 3
реснички, 4 — аксон, 5 — опорная клетка нейрального эпителия, 6 — базальная
мембрана, 7 — базальная клетка нейрального эпителия, обеспечивающая физиологи-
ческую регенрацию опорных и первичночувствующих клеток нейрального эпителия;
& б — базальная мембрана, 7 — первичночувствующая клетка, 8, 9 — проксималь-
ный и дистальный отделы отростка первичночувствующей клетки, 10 — ее цент-
ральный отросток, 11 — кутикулярная дисковидная пластинка с порами,
12 — кутикула.
455
лярные нейроны (рис. 151, Б). Цитоплазма этих клеток отличается
необыкновенным богатством органоидов: здесь и хорошо развитая
эндоплазматическая сеть, и элементы аппарата Гольджи, и мультиве-
зикулярные тельца, и лизосомы, и другие образования. Периферичес-
кий отросток имеет сложное строение и состоит из двух сегментов.
На границе между ними расположено базальное тельце, от которого
в наружный сегмент распространяется трубочковый аппарат жгутика,
а во внутренний — корневые поперечноисчерченные нити (<S). Наруж-
ный сегмент проникает в полость специализированного участка кути-
кулярной пластинки, где и дает терминальные разветвления (9). В этом
месте в специализированной кутикуле имеется система пор, с которы-
ми контактируют концевые разветвления апикального конца дисталь-
ного сегмента дендрита обонятельной нервной клетки (//).
Фоторецепторы
У всех многоклеточных животных фоторецепторы представляют
собой клетки со специализированными дендритами. У позвоночных
животных это так называемые палочки и колбочки (рис. 152, I, II).
Они состоят из наружного и внутреннего сегментов, разделенных
узкой перетяжкой, в которой располагаются сильно редуцированные
микротрубочки ресничек и базальное тельце. Во внутреннем сегменте
палочек находится плотное скопление большого количества митохонд-
рий (3). В колбочках имеется еще и маслянистая капля, которая у
некоторых позвоночных может быть окрашена каротиноидами в крас-
ный, желтый и желто-зеленый цвет (7). В базальной части внутреннего
сегмента дендрита палочек и колбочек на границе с телом клетки
иногда располагаются скопления структурированных гранул гликоге-
на — основного субстрата для энергетического метаболизма клеток.
В теле фоторецепторных клеток относительно хорошо развита
гранулярная эндоплазматическая сеть, имеются также и свободные
рибосомы. В надъядерной области сосредоточен компактный аппарат
Гольджи. Особенностью тела клеток является полное отсутствие ми-
тохондрий, поскольку весь энергетический аппарат сосредоточен во
внутреннем сегменте. Единичные митохондрии наблюдаются лишь в
пресинаптической области короткого аксона.
Наиболее характерной специфической структурой фоторецептор-
ных клеток позвоночных животных является мембранный аппарат на-
ружного сегмента (7), образованный плотноупакованными дисками,
представляющими собой погруженные в цитоплазму складки плаз-
матической мембраны. В палочках основная часть наружного сегмен-
та построена из таких мембранных дисков, утративших структурную
456
Рис. 152. Организация фоторецепторов
позвоночных животных.
1 — палочки; II — копбочки:
1 — наружный сегмент, 2 — внутренний сегмент,
3 — скопление митохондрий, 4 — отростки клеток
пигментного эпителия, 5 — ядро, 6 — синаптичес-
кая зона, 7 — масляная капля.
457
связь с плазматической мембраной. Лишь в базальной части наружного
сегмента эта связь сохраняется. В колбочках связь между плазмати-
ческой мембраной и дисками наружного сегмента наблюдается на всем
его протяжении. Система мембранных дисков палочек представляет
собой весьма динамично и полярно обновляющуюся структуру.
В радиоавтографических опытах с мечеными аминокислотами
удалось показать, что на рибосомном аппарате клеток-палочек идет
интенсивный белковый синтез. Значительная часть вновь синтезиро-
ванного белка поступает в основание наружного сегмента, где исполь-
зуется на построение новых дисков. Интенсивность таких процессов
даже у амфибий настолько велика, что за сутки образуется от 25 до
36 дисков. Такое же количество дисков за это время утрачивается
клетками на апикальной поверхности, по-видимому, путем фагоцитоза
вспомогательными пигментными клетками. В колбочках не обнаруже-
но такого поляризованного обновления мембранных структур. Вклю-
чение меченого белка происходит равномерно во все складки плазма-
тической мембраны наружного сегмента.
В мембранах дисков наружных сегментов фоторецепторных кле-
ток основную часть белкового компонента составляют специфические
белки опсины. Они могут образовывать слабые, легко разрушающиеся
на свету связи с ретиналем — производным каротинов, синтезируемых
растительными клетками и поступающих в животный организм с пи-
щей. Ретиналь является важнейшим структурным компонентом мем-
бран дисков. При отсутствии каротинов у позвоночных не формиру-
ются мембранные структуры дисков.
Процессы разложения родопсина на свету и ресинтез его в тем-
ноте, протекающие непрерывно в мембранных структурах дисков, ле-
жат в основе специфической фоторецепции чувствительных клеток
органов зрения.
Для всех фоторецепторов характерна уже отмеченная для позво-
ночных гипертрофия специализированного мембранного аппарата. Од-
нако для первичноротых и особенно их высших представителей —
насекомых и головоногих моллюсков — свойствен другой (по срав-
нению с позвоночными животными) механизм такой гипертрофии. На
боковой поверхности фоторецепторной клетки образуются длинные,
расположенные перпендикулярно ее телу и направлению света микро-
ворсинки, которые контактируют с аналогичной системой микровор-
синок соседних фоторецепторных клеток (рис. 153, А, 1). Таким об-
разом, в фоторецепторах насекомых воспринимающий антенный ап-
парат и метаболический центр клеток с хорошо развитым белоксин-
тезирующим и энергетическим аппаратами оказываются пространст-
венно менее разобщенными, чем у позвоночных животных. Тем не
458
Рис. 153. Организация фоторецепторов
блеспозвоночных животных.
А — насекомое; Б — головоногие моллюски:
1 — микроворсинки, 2 — ядро, 3 — митохондрии,
4 — аппарат Гольджи, 5 — эндоплазматическая
сеть, 6 — аксон, 7 — участок пигментной клетки,
8 — базальная мембрана, 9 — гранулы пигмента;
стрелками показано направление лучей света.
459
менее в радиоавтографических опытах показано, что у фоторецепторов
насекомых, как и в палочках позвоночных животных, имеет место
энергичное обновление аппарата микроворсинок.
У головоногих моллюсков фоторецепторы внешне больше похожи
на фоторецепторы позвоночных животных (рис. 153, Б). Их клетки-
палочки состоят из воспринимающего периферического отростка, тела
клетки и центрального отростка — аксона, т. е. имеют характерную
биполярную структуру. Однако в периферическом отростке нет жгу-
тиковых или ресничных структур, а гипертрофия мембран в палочко-
видном отростке достигается не врастанием плазматической мембраны
в цитоплазму отростков, а образованием (как у насекомых) сложной
системы многочисленных микроворсинок, расположенных перпенди-
кулярно длинной оси палочковидного отростка.
Универсальной закономерностью морфобиохимической организа-
ции фоторецепторов многоклеточных животных являются сходный
химический состав и сходная молекулярная организация гипертрофи-
рованного мембранного аппарата. У всех изученных представителей
многоклеточных животных основными белковыми компонентами мем-
бран дисков или системы микроворсинок являются белки опсины, а
рецепция света начинается с конформационных изменений молекул
родопсина.
Таким образом, использование каротиноидов растительного про-
исхождения в фоторецепции многоклеточных животных — необходи-
мое условие структурной и биохимической организации фоторецепто-
ров. Детали изменений родопсина могут варьировать у разных пред-
ставителей многоклеточных животных. Так, у членистоногих образу-
ющийся на свету метародопсин не подвергается гидролизу и представ-
ляет собой устойчивое соединение. Это позволяет членистоногим во-
зобновлять родопсин не за счет нового синтеза, а путем фотоизоме-
ризации метародопсина обратно в родопсин.
У головоногих моллюсков помимо родопсина есть еще и другой
зрительный пигмент — ретинохром, который участвует в ресинтезе
родопсина в темноте. Сильно варьируют также белки опсины и по
величине молекул, и по последовательности аминокислот в них. В
некоторых отношениях дифференцировка фоторецепторов у насеко-
мых оказывается более сложной, чем у высших позвоночных. Насеко-
мые способны различать плоскость поляризации света, они восприни-
мают часть светового излучения в ультрафиолетовой области, наконец,
у них отчетливо выражена способность к цветному зрению на клеточ-
ном уровне, в то время как у позвоночных животных такая диффе-
ренцировка имеет место лишь на молекулярном уровне организации
мембраны.
460
Фоторецепторы позвоночных и фоторецепторы насекомых для
передачи сигнала с родопсина на плазматическую мембрану клеток
используют внутриклеточный переносчик. Природа этого переносчика
и цепь событий, происходящих в фоторецепторной клетке, изучены
пока только у позвоночных (рис. 154, А-Г). После изомеризации под
действием кванта световой энергии -фотона, ретиналь родопсина из
состояния цис- переходит в состояние полностью транс-изомера. Ак-
тивированный родопсин вступает в контакт с мембранным белком
трансдуцином (рис. 154, Б). Затем одна из его субъединиц активирует
фермент фосфодиэстеразу (рис. 154, В, Г). При этом одна молекула
возбужденного светом родопсина может активировать несколько сотен
молекул трансдуцина. Активированный трансдуцином фермент фос-
фодиэстераза разлагает циклическую ГМФ, превращая ее в 5-ГМФ
Рис. 154. Молекулярные процессы в фоторецепторной мембране при действии
фотона света на молекулу родопсина.
А-Г — последовательные стадии конформационных изменений и метаболических
процессов в мембране после действия фотона света (извилистая стрелка на А) на мо-
лекулу родопсина:
1 молекула родопсина, 2 — молекула трансдуцина, 3 — активная субъединица мо-
лекулы трансдуцина, 4 — фосфодиэстераза из трех субъединиц в неактивном состоя-
нии, 5 — фрагмент фосфодиэстеразы, блокирующий ее работу, б — циклический гуа-
нозинмонофосфат, 7 — 5-гуанозинмоиофосфат, вызывающий закрытие ионных кана-
лов в мембране н ее гиперполяризацию.
461
(рис. 154, Г). Этот процесс происходит с большой скоростью — чя
одну секунду одна молекула фермента может разложить 4 200 молекул
циклической ГМФ. Уменьшение концентрации последней в гиалоплаз-
ме закрывает ионные каналы для Na+ в плазматической мембране
фоторецептора, в результате чего мембрана гиперполяризуется и эта
гиперполяризация воспринимается зрительным анализатором.
Биологический смысл такого разобщения событий в мембране
рецептора и восприятия фотонов зрительным пигментом заключается,
по-видимому, в том, что происходит резкое усиление сигнала при
активации трансдуцина и при работе активированного фермента. Ана-
логичные механизмы, вероятно, должны быть и в фоторецепторах
других животных, в частности в фоторецепторах членистоногих. Од-
нако они вряд ли могут быть идентичными механизмам, существую-
щим у позвоночных, поскольку у членистоногих восприятие фотона
кодируется не путем гиперполяризации плазматической мембраны фо-
торецептора, а в результате прекращения выхода ионов натрия. В
фоторецепторах членистоногих регистрация сигнала осуществляется,
наоборот, посредством открытия каналов для ионов натрия, в резуль-
тате чего происходит деполяризация плазматической мембраны клетки.
Остается совершенно непонятным, почему в фоторецепторах по-
звоночных и рабдомерных фоторецепторах членистоногих существуют
прямо противоположные способы кодирования информации об осве-
щенности.
глава 3. Нейроглия
Как уже было показано, нервные клетки и образуемые ими спе-
циализированные рецепторные, эффекторные и синаптические струк-
туры характеризуются целым рядом биологических особенностей. К
ним относятся необычные ядерно-плазменные отношения, высокий
уровень метаболической активности, большая функциональная подви-
жность специфических структур на молекулярном и надмолекулярном
уровнях их организации. Естественно поэтому ожидать, что такие
клеточные элементы, как нейроны, нуждаются для нормального функ-
ционирования в особой внутренней среде со специальными механи-
ческими (опорными), трофическими, защитными и изолирующими ме-
ханизмами. Такую задачу выполняет специальная вспомогательная
ткань — глия. Она возникает на ранних этапах эволюции нервной
системы и непрерывно совершенствуется во всех прогрессивно эво-
люционирующих группах многоклеточных животных, а также и в
пределах групп — от низших к высшим их представителям. Глия
имеется у представителей такой узловой группы, как черви, и в более
462
(рис. 154, Г). Этот процесс происходит с большой скоростью — чя
одну секунду одна молекула фермента может разложить 4 200 молекул
циклической ГМФ. Уменьшение концентрации последней в гиалоплаз-
ме закрывает ионные каналы для Na+ в плазматической мембране
фоторецептора, в результате чего мембрана гиперполяризуется и эта
гиперполяризация воспринимается зрительным анализатором.
Биологический смысл такого разобщения событий в мембране
рецептора и восприятия фотонов зрительным пигментом заключается,
по-видимому, в том, что происходит резкое усиление сигнала при
активации трансдуцина и при работе активированного фермента. Ана-
логичные механизмы, вероятно, должны быть и в фоторецепторах
других животных, в частности в фоторецепторах членистоногих. Од-
нако они вряд ли могут быть идентичными механизмам, существую-
щим у позвоночных, поскольку у членистоногих восприятие фотона
кодируется не путем гиперполяризации плазматической мембраны фо-
торецептора, а в результате прекращения выхода ионов натрия. В
фоторецепторах членистоногих регистрация сигнала осуществляется,
наоборот, посредством открытия каналов для ионов натрия, в резуль-
тате чего происходит деполяризация плазматической мембраны клетки.
Остается совершенно непонятным, почему в фоторецепторах по-
звоночных и рабдомерных фоторецепторах членистоногих существуют
прямо противоположные способы кодирования информации об осве-
щенности.
глава 3. Нейроглия
Как уже было показано, нервные клетки и образуемые ими спе-
циализированные рецепторные, эффекторные и синаптические струк-
туры характеризуются целым рядом биологических особенностей. К
ним относятся необычные ядерно-плазменные отношения, высокий
уровень метаболической активности, большая функциональная подви-
жность специфических структур на молекулярном и надмолекулярном
уровнях их организации. Естественно поэтому ожидать, что такие
клеточные элементы, как нейроны, нуждаются для нормального функ-
ционирования в особой внутренней среде со специальными механи-
ческими (опорными), трофическими, защитными и изолирующими ме-
ханизмами. Такую задачу выполняет специальная вспомогательная
ткань — глия. Она возникает на ранних этапах эволюции нервной
системы и непрерывно совершенствуется во всех прогрессивно эво-
люционирующих группах многоклеточных животных, а также и в
пределах групп — от низших к высшим их представителям. Глия
имеется у представителей такой узловой группы, как черви, и в более
462
продвинутой группе членистоногих. У высших представителей типа
червей — аннелид, а также у полихет и олигохет она хорошо развита
и разнообразна. Пиявки снабжены очень специализированной гиган-
токлеточной глией, обеспечивающей трофику нейронов при длитель-
ном голодании животных. В этой группе имеются животные, в нервной
системе которых еще только начинают появляться элементы глии. Не
обнаружена она в нервной системе кишечнополостных.
§1 . НЕЙРОГЛИЯ ПОЗВОНОЧНЫХ
Наиболее сложной и разнообразной дифференцировки достигает
нейроглия у высших позвоночных животных. Эта вспомогательная
ткань нервной системы имеет клеточное строение. По морфологичес-
ким особенностям все глиальные клетки у позвоночных можно с
известными оговорками разделить на три большие категории: наиболее
древнюю эпендимную глию, астроцитарную глию и олигодендроглию.
Помимо этих разновидностей собственно глиальной ткани, называемой
макроглией и происходящей из нервного зачатка, имеется еще особая
система фагоцитарных клеточных элементов. Она получила название
микроглии. Это особая разновидность макрофагов тканей внутренней
среды. В сером веществе органов центральной нервной системы по-
звоночных нейроглия представлена олигодендроглией и астроцитарной
глией. В астроцитарной глии удается выделить два типа клеток: фиб-
риллярные и плазматические астроциты (рис. 155, А, Б). Плазматичес-
кие астроциты имеют слабо ветвящиеся отростки. В их цитоплазме
относительно мало специализированных фибриллярных структур. Бо-
лее тонкие и сильно ветвящиеся отростки фибриллярных астроцитов,
наоборот, содержат большое количество фибрилл. Помимо типичных
астроцитов в некоторых участках нервной системы позвоночных жи-
вотных, например в сетчатке, имеются гигантские клеточные глиаль-
ные элементы — мюллеровы волокна, играющие существенную роль
в структурно-пространственной организации нервных центров сетчат-
ки (рис. 155, Г). Интересно, что аналогичные глиальные клетки, вы-
полняющие прежде всего опорную механическую функцию, обнару-
жены и в сетчатке головоногих моллюсков, и в зрительных анализа-
торах членистоногих (рис. 155, Д Е). Более разнообразна и широко
распространена в нервной системе позвоночных вторая разновидность
нейроглии — олигодендроглия. Элементы олигодендроглии в сером
веществе органов центральной нервной системы представлены обычно
относительно мелкими отростчатыми клетками, как правило, непосред-
ственно контактирующими с телами нервных клеток (рис. 155, В). У
молодых животных они неоднородны и представлены светлыми, про-
межуточными и темными клетками. Светлые в два раза больше по
463
Рис. 155. Клеточные элементы макроглии в сером веществе центральной нервой
системы млекопитающих и из зрительных анализаторов.
А — плазматический и Б — фибриллярный астроциты; В — две клетки олигоден-
дроглии у тела нервной клетки (Z — сосуд, 2 — отростки глиальных клеток, 3 —
тела глиальных клеток, 4 — тело нервной клетки); Г — мюллерово волокно, сет-
чатка глаза ящерицы; Д — астроцитарная глия из оптического ганглия слепня; Е —
астроцитарная глия из оптического ганглия сепии.
464
размерами, чем темные клетки. Однако во взрослом состоянии в сером
веществе центральной нервной системы все клетки олигодендроглии
превращаются в темные мелкие клеточные элементы.
Более многообразны клеточные элементы олигодендроглии в пе-
риферических отделах и в белом веществе центральных отделов нерв-
ной системы. В качестве примера элементов периферической олиго-
дендроглии можно привести мантийные клетки. Они образуют непре-
рывный слой на поверхности псевдоуниполярных чувствительных ней-
ронов спинальных ганглиев у позвоночных. Кроме того, элементы
олигодендроглии сопровождают отростки нервных клеток на всем их
протяжении как в белом веществе органов ЦНС, так и на периферии.
Эта разновидность глиальных клеток получила название шванновских.
В тонких безмякотных нервных волокнах взаимоотношения отростков
нейронов и шванновских клеток относительно простые (рис. 155, А).
Отросток, а иногда и несколько отростков нервных клеток (7) оказы-
ваются погруженными в цитоплазм}' одной шванновской клетки. В
толстых мякотных нервных волокнах наблюдаются более сложные
отношения (рис. 155, Б, В). Вокруг отростка нервной клетки образу-
ется многослойная мембранная структура, представляющая собой сло-
женную в несколько концентрических слоев плазматическую мембра-
ну шванновской клетки. В белом веществе органов ЦНС шванновские
клетки образуют пластинкообразные выросты, которые закручиваются
вокруг отростков нервных клеток. При этом одна шванновская клетка,
образовав несколько выростов, может обертывать участки аксонов или
дендритов нескольких нервных клеток. В местах контакта отдельных
шванновских клеток по длине отростка нервной клетки или в местах
контакта пластинкообразных выростов двух шванновских клеток име-
ются участки, свободные от миелиновой оболочки. Отросток нервной
клетки в таких участках изолирован от окружающих тканей лишь
тонким слоем цитоплазмы шванновской клетки и ее одинарными плаз-
матическими мембранами. Эти участки получили название перехватов
Ранвье (рис. 156, В, 5). Их наличие в мякотных волокнах обеспечивает
возможность более быстрого проведения нервного импульса.
Основное назначение вспомогательной системы глиальных эле-
ментов заключается в создании для нейронов и образуемых ими спе-
циализированных структур и нервных центров постоянной стабильной
внутренней среды. Оказалось, что одной из характерных особенностей
астроцитов является свойство их отростков образовывать своими тер-
минальными утолщенными участками характерные сплетения, «об-
кладку» вокруг кровеносных сосудов, тел и отростков нервных клеток,
а также на поверхности серого вещества нервных центров и под слоем
эпендимной глии, выстилающей полости спинномозгового канала и
465
Рис. 156. Клеточные элементы периферической глии позвоночных и их взаимоотно-
шения с отростками нервных клеток.
А — безмякотные; Б-В — мякотные нервные волокна на поперечном (Б) и продоль-
ном (В) срезе:
I — аксон, 2 — цитоплазма шванновских клеток, 3 — миелиновая оболочка, 4 —
участок истончения миелиновой оболочки в области ее перехода к перехвату Ранвье,
5 — перехват Ранвье, б — митохондрии, 7 — микротрубочки, 8 — микрофиламен-
ты, 9 — мезаксои, 10 — шероховатая ЭПС, II — коллагеновые волокна эндоневрия,
12 — базальная мембрана.
желудочков головного мозга (рис. 157, А). Благодаря этом}' в нервных
центрах формируется сложная разветвленная система межклеточных
щелей, образованных гликокалликсом плазматических мембран астро-
цитов, нервных клеток и субэндотелиальной, базальной мембраной
сосудистых капилляров. По системе межклеточных щелей и прос-
транств и осуществляется транспорт веществ, необходимых для жиз-
недеятельности нервных клеток. Сложность организации этой системы
обусловливается и наличием разнообразных межклеточных контактов
между глиальными клетками и клетками глии и нейронами. Вся эта
466
система вместе с сосудистым эндотелием образует структурную основу
так называемого гематоэнцефалического и ликвороэнцефалического
барьеров, обусловливающих строгий специфический контроль за по-
ступающими к нервным клеткам химическими соединениями. Показа-
но, что в гематоэнцефалическом барьере непосредственную барьерную
функцию осуществляют клетки эндотелия. Однако такие специфичес-
кие свойства (отличные от свойств эндотелия сосудов других органов)
клетки эндотелия мозговых сосудов приобретают лишь после воздей-
ствия на них терминальных разветвлений отростков астроцитов. По-
мимо этих хорошо уже установленных фактов относительно функци-
онального значения астроцитарной глии имеются данные о ее роли,
так же как и роли других разновидностей глии, в осуществлении
трофической функции для метаболизма и постоянства ионного баланса
нервных клеток. По-видимому, каждая разновидность глиальных кле-
ток осуществляет специфический контроль взаимоотношений между
нервными клетками и трофическими системами организма. Механизмы
такого контроля достаточно разнообразны как по биологическому зна-
чению, так и по конкретным путям реализации. Об этом свидетельст-
вуют факты быстрого появления вновь синтезированных белков РНК
в терминальных разветвлениях длинных аксонов.
Особенно убедительны в этом отношении результаты наблюде-
ний, проведенных на дистальных участках периферических ..нервов
тритона при их перерезке. В этих опытах удалось показать, что, если
сразу же после перерезки аксона ввести [3Н]гистидин, меченые высо-
комолекулярные соединения вначале появляются в цитоплазме шван-
новских клеток, а затем на периферии нейроплазмы аксонов. Анало-
гичные данные получены и в отношении [3Н]лейцина на этом объекте
и на других позвоночных животных. Большой фактический материал
имеется и об изменениях внутриклеточного метаболизма в системе
нейрон—глия в экспериментальных условиях. Показано, что после
различных воздействий восстановление нормального или синтез даже
повышенного количества РНК и белка в глиальных клетках предше-
ствует аналогичным восстановительным процессам в нейроне. Все эти
факты заставляют предполагать возможность контроля со стороны
глиальных элементов не только за транспортом низкомолекулярных
веществ, но и за синтезом и перемещением высокомолекулярных со-
единений типа РНК и белка.
Глиальные клетки играют, по-видимому, важную роль и в основ-
ной функции нервной системы, связанной с процессами возбуждения,
торможения и распространения импульсов по отросткам нервных кле-
ток и в области" синаптических контактов. Наряду с выполнением
изолирующей функции определенные разновидности клеток глии уча-
467
ствуют в перераспределении ионов для создания соответствующих
электростатических условий у поверхности плазматической мембраны
нейронов. Несмотря на весьма важное участие глии в деятельности
нервной системы, конкретное функциональное значение отдельных
разновидностей глии изучено еще слабо. В выяснении основных прин-
ципиальных вопросов биологического значения нейроглиальных взаи-
моотношений существенная роль принадлежит сравнительному методу
исследования.
§2 . НЕЙРОГЛИЯ ЦЕНТРАЛЬНЫХ ОРГАНОВ НЕРВНОЙ СИСТЕМЫ
БЕСПОЗВОНОЧНЫХ
В нервной системе брюхоногих и головоногих моллюсков общий
характер взаимоотношений между нейронами и глиальными клетками
оказался сходным с теми отношениями, которые наблюдаются у по-
звоночных животных. И в ганглиях, и в периферических отделах
нервной системы тела нервных клеток, их отростки и синаптические
контакты всюду сопровождаются глиальными клетками. Показано, что
в оптическом ганглии головоногого моллюска между телами нервных
клеток и синаптическими контактами в нейропиле, с одной стороны,
и кровеносными сосудами, а также организованными лакунами в меж-
клеточном веществе соединительной ткани — с другой, располагаются
астроцитоподобные глиальные клетки. Однако они в отличие от гли-
альных клеток позвоночных животных полностью не изолируют ней-
роны от контакта с межклеточными веществом соединительной ткани
(см. рис. 157, £)•
У насекомых все ганглии ЦНС отделены от гемолимфы специ-
альной периневральной глией, клетки которой образуют между собой
изолирующие межклеточные контакты (рис. 157, В). Помимо внешнего
гематоэнцефалического барьера у некоторых насекомых в ганглиях
имеется оболочка из ганглиальных клеток, окружающая нейропиль,
т. е. область, где сосредоточена основная масса синапсов. Таким об-
разом, у насекомых хорошо известная для ЦНС позвоночных обособ-
ленность синаптических зон от контакта с кровью морфологически
выражена значительно четче. У низших членистоногих, представите-
лями которых могут служить мечехвосты, рассмотренные выше сис-
темы глиальных клеток развиты несколько слабее (рис. 157, Г).
У членистоногих глия в организации гематоэнцефалического ба-
рьера играет, по-видимому, непосредственную роль. Показана, напри-
мер, способность нервной системы насекомых депонировать ионы на-
трия. Удалось также установить, что чем выше организация насеко-
мых, тем меньшую роль играют катионы и анионы в регуляции осмо-
тического давления гемолимфы.
468
469
У моллюсков и у других животных с периферическим располо-
жением в ганглиях тел псевдоуниполярных нейронов на поверхности
ганглиев обязательно находятся глиальные клетки-сателлиты, анало-
гичные по функциональному значению клеткам-сателлитам в спиналь-
ных ганглиях позвоночных животных. Их отростки у беспозвоночных
животных могут глубоко проникать в тела нервных клеток. Плазма-
тическая мембрана последних образует систему сложных впячиваний,
которые вместе с отростками клеток-сателлитов получили название
трофоспонгия. Между плазматическими мембранами отростков кле-
ток-сателлитов и телами нервных клеток формируются специфические
контакты. Через эти контакты могут, по-видимому, транспортировать-
ся и низкомолекулярные, и относительно высокомолекулярные соеди-
нения (рис. 158).
Наряду с общими признаками организации глиальных систем у
позвоночных и представителей отдельных типов беспозвоночных у
последних наблюдаются и специфические особенности. Так, у брюхо-
Рис. 157. Глноваскулярные отношения в нервной системе позвоночных и беспозво-
ночных животных.
млекопитающие; Б—Г беспозвоночные (Б — головоногие моллюски,
В — насекомые, Г — мечехвост):
1 астроцит, 2 отросток астроцита, образующий концевые ножки вокруг капил-
ляров, 3 просвет капилляров, 4 — ядро эндотелиальной клетки, 5 — контакты
между отростками астроцитов, б — базальная мембрана, 7 — коллагеновые волокна,
8 — отростки и тела нервных клеток, 9 — перициты, 10 — лакуны в межклеточном
веществе соединительной ткани, 11 — оболочки из межклеточного вещества,
12 — глиальные клетки наружного и 13 — внутреннего «барьеров».
470
Рис. 158. Глия, образующая трофоспонгий вокруг тел нейронов в ганглиях
брюхоногих моллюсков.
I — ядро нейрона, 2 — цитоплазма, 3 — глия, 4 — шероховатая ЭПС.
ногах моллюсков слабо развита астроцитарная глия, но сильно —
глиоинтерстициальная система (рис. 159). Основное назначение пос-
ледней, по-видимому, заключается в регуляции ионного баланса. Ха-
рактерная особенность глиоинтерстициальной системы — ее распро-
странение в периферических отделах за пределы терминальных раз-
ветвлений аксонов, особенно в некоторых мышцах.
Таким образом, здесь элементы глии, по-видимому, частично бе-
рут на себя функцию тканей внутренней среды. Такая интерстициаль-
ная глия имеется, возможно, и в вегетативной нервной системе позво-
ночных, а также в центральной нервной системе у некоторых других
групп первичноротых животных. У моллюсков, насекомых и ракооб-
разных глиальные клетки способны вырабатывать внеклеточный мат-
рикс. У ракообразных , он содержит коллагеноподобные фибриллы. У
насекомых в нем, как и в основном веществе соединительной ткани,
471
Рис. 159. Глноинтерстициальная система брюхоногих моллюсков.
А — общая схема строения; Б — глиомышечное соединение;
В — нервно-глиальное соединение:
1 — нервные клетки, 2 — глиальные клетки, 3 — мышцы, 4 — глиомышечное со-
единение, 5 —• нервно-мышечное соединение, б — нервное соединение, 7 — нервное
волокно, 8 — глиальная клетка, 9 — отросток глиальной клетки, внедряющейся в
мышцу, 10 — мышечное волокно, 11 — базальная мембрана,
12 — коллагеновые волокна.
обнаружено большое количество гиалуроновой кислоты. Последняя
играет, вероятно, роль своеобразного резервуара ионов.
§3 . РОЛЬ НЕЙРОГЛИИ В РЕГЕНЕРАЦИИ НЕРВОВ
И ПЕРИФЕРИЧЕСКАЯ ГЛИЯ БЕСПОЗВОНОЧНЫХ
Теснейшая системная связь между аксонами нервных клеток и
шванновскими клетками особенно ярко проявляется у позвоночных
животных при репаративной регенерации аксонов. После травматичес-
кого нарушения связи между периферической и центральной частями
аксона периферический участок распадается и дегенерирует (рис. 160).
472
4
Рис. 160. Дегенерация и регенерация нервных волокон у позвоночных
животных.
А-Т — последовательные стадии дегенерации и регенерации нервных
волокон после их перерезки:
Л 2 — проксимильный и дистальный участки волокна, 3 — распад мие-
линовых оболочек аксонов после их перерезки, 4 — усиленное размно-
жение шванновских клеток в месте травмы и образование тяжей, 5 —
макрофаги, б — образование регенераторных отростков на проксималь-
ном конце перерезанных аксонов, 7 — отрастание аксонов и образова-
ние оболочки.
473
Окружающие его шванновские клетки теряют значительную часть
своих мембранных структур. Затем они энергично размножаются ми-
тозом и образуют лентовидные структуры, которые растут в направ-
лении сохранившегося центрального участка аксона. В случае контакта
аксона с одним из таких лентовидных тяжей начинаются рост аксона
по футляру видоизмененных шванновских клеток и полное восстанов-
ление всей периферической части аксона вплоть до эффекторных при-
боров в области терминального разветвления.
При хорошо развитой у высших позвоночных способности нейро-
нов восстанавливать в благоприятных условиях периферические участ-
ки аксонов, расположенные за пределами органов ЦНС, они не спо-
собны к такому восстановлению в белом веществе органов ЦНС.
По-видимому, это связано с особенностями взаимоотношений между
шванновскими клетками белого вещества и находящимися здесь от-
ростками нервных клеток. Существенное значение глия имеет и в
гистогенезе нервной системы. Она не только осуществляет механичес-
кую функцию, но и регулирует рост отростков нервных клеток, а также
перемещение самих клеток в места их дефинитивной локализации,
например двигательных нейронов передних рогов спинного мозга.
У беспозвоночных мякотные волокна, столь характерные для по-
звоночных животных, встречаются реже. Однако в тех случаях, когда
имеется необходимость быстрого проведения нервного импульса, гли-
альные элементы могут формировать достаточно мощную изолирую-
щую оболочку. Такие отношения складываются в аксонах большого
диаметра, образующих длинные нисходящие пути. Гигантские аксоны
имеются у некоторых полихет и моллюсков. Особенно характерны они
для нервной системы ракообразных. Изолирующая обкладка у таких
аксонов формируется чаще не путем гипертрофии плазматической
мембраны одной глиальной клетки, как в мякотных волокнах позво-
ночных, а за счет многослойной капсулы, состоящей из сильно упло-
щенных, тесно связанных между собой клеток (рис. 161, 5). Иногда в
формировании оболочки могут принимать участие и межклеточные
структуры, образуемые шванновскими клетками. Последние распро-
странены в нервных системах почти всех многоклеточных животных
и имеют у них, по-видимому, сходное биологическое значение.
Межклеточные контакты в глии беспозвоночных многообразнее,
чем у позвоночных. У беспозвоночных между глиальными, а также
между глиальными и нервными клетками имеются разнообразные кон-
такты. Обнаружены даже своеобразные синапсоподобные контакты
между аксонами нервных клеток и глиальными клетками. В мембранах
некоторых глиальных клеток выявлены рецепторы к медиаторам, в
частности к ацетилхолину. На примере гигантских аксонов головоно-
474
Рис. 161. Различные типы глиаль-
ных оболочек, встречающихся в
нервной системе у членистоногих.
1 — аксон, не покрытый оболоч-
кой, 2 — однослойная глиальная
оболочка, 3 — слаборазвитая миели-
низированная оболочка, 4 — ком-
пактная сильно развитая миелинизи-
рованная оболочка, 5 — оболочки,
образованные несколькими шваннов-
скими клетками с многочисленны-
ми отростками, 6 — многослойная
оболочка, образованная глиальными
отростками, разделенными слоями
аморфного вещества, 7 — глиаль-
ная оболочка с толстой наружной
«аморфной» оболочкой.
гих моллюсков экспериментально показан переход белков и РНК из
цитоплазмы шванновских клеток в аксоплазму.
Сходные с позвоночными взаимоотношения глии с отростками
нервных клеток наблюдаются и в опытах с регенерацией нервов у
беспозвоночных. У насекомых и олигохет в таких опытах описана
быстрая дегенерация дистальных участков отростков, лишенных связи
с перикарионом. Эти процессы сопровождаются активацией глиальных
элементов, с которыми могут вступить в связь регенерирующие от-
ростки нервных клеток. Вместе с тем в некоторых случаях (гигантские
аксоны ракообразных, саранчи и головоногих моллюсков) имеет место
и длительное сохранение перерезанных отростков клеток.
ГЛАВА 4. Нейросекреторные системы,
регуляторные нейропептиды и соотношение
гуморальной и нервной интеграции
§1 . НЕЙРОСЕКРЕТОРНЫЕ СИСТЕМЫ
Позвоночные животные. Особой сложности системы нейросе-
креторных клеток достигают у позвоночных животных. Примером
типичной нейросекреторной клетки могут служить клетки гипофизар-
но-гипоталамической области у млекопитающих и человека (рис. 162).
По внешнему виду нейросекреторные клетки сходны с мультиполяр-
ным нейроном. Они имеют несколько коротких дендритов с много-
численными химическими синапсами и один длинный аксон, заканчи-
вающийся булавовидным расширением либо на сосудах задней доли
475
гипофиза, либо в железистой ткани аденогипофиза (7, 8). Аксоны
некоторых нейросекреторных клеток дают коллатерали, по которым
нейросекрет может транспортироваться к нейронам, иннервирующим
нейросекреторные клетки. Эти коллатерали образуют на телах и денд-
Рис. 162. Строение нейросекреторной клетки (по А. Л. Поленову, 1976).
1 — перикарион, 2 — ядро, 3 — дендрит, 4 — капилляр, 5 — гранулы нейро-
секрета, б — аксои, 7 — аксовазальный синапс, 8 — аксоаденарный синапс.
476
ритах нейронов аксосоматические и аксодендритические синапсы, в
которых нейрогормоны функционируют как типичные медиаторы хи-
мических синапсов.
Цитологической особенностью нейросекреторных клеток гипота-
ламуса является еще более сильное, чем в нейроне, развитие белок-
синтезирующего аппарата (особенно у нейросекреторных клеток, про-
дуцирующих пептидные нейрогормоны) и структур, ответственных за
транспорт гранул нейросекрета. В химическом отношении нейросекре-
торные клетки гипоталамической области делятся на две большие
группы: пептидергические и моноаминергические. Первые продуциру-
ют пептидные гормоны, вторые — моноаминовые (дофамин, норадре-
налин, серотонин).
Среди пептидергических нейросекреторных клеток гипоталами-
ческой области в биологическом плане можно выделить группу вис-
церотропных клеток, гормоны которых действуют на висцеральные
органы. Они выделяют вазопрессин (антидиуретический гормон), ок-
ситоцин и гомологи этих пептидов. Нейросекреторные клетки второй
подгруппы выделяют аденогипофизотропные гормоны, т. е. гормоны,
регулирующие деятельность железистых клеток аденогипофиза. Среди
выделяемых ими пептидных гормонов имеются как гормоны, стиму-
лирующие железистую функцию клеток аденогипофиза — либерины,
так и угнетающие ее гормоны — статины. Моноаминергические ней-
росекреторные клетки выделяют нейрогормоны в основном в сосудис-
тую систему задней доли гипофиза.
Таким образом, у млекопитающих гипоталамическая нейросекре-
торная система представляет собой дифференцированную и в цитоло-
гическом (обилие разновидностей клеток), и в гистологическом (раз-
нообразие и сложность связей) отношениях систему. Она является
частью общей интегрирующей системы (нейроэндокринная) организ-
ма и находится в тесной и многосторонней взаимосвязи и с нервной
системой (через химические синапсы нейронов высших отделов мозга),
и с эндокринной системой (через аденогипофиз и кровоток). Оконча-
ние аксонов этих клеток формирует особые нейрогемальные органы,
примером которых может служить задняя доля гипофиза. В нейроге-
мальных органах происходит депонирование нейросекрета и его регу-
лируемое выведение в кровоток.
Помимо нейросекреторных клеток гипоталамической области у
млекопитающих клетки с ярко выраженной секреторной специализа-
цией имеются и в других отделах головного мозга (пинеалоциты эпи-
физа, клетки эпендимы субкомиссурального и субфорникального ор-
ганов и др.). Развитая система специальных нейросекреторных клеток
477
есть и у представителей других классов позвоночных. При этом ко-
личество клеток с ярко выраженной секреторной специализацией в
нервной системе рыб даже в процентном отношении может быть
больше, чем в нервной системе высших позвоночных. У них помимо
хорошо развитой системы таких клеток в головном мозге имеется еще
специальная каудальная нейросекреторная система в спинном мозге.
Беспозвоночные животные. Развитые системы нейросекретор-
ных клеток имеются и у беспозвоночных животных. У полихет, плас-
тинчатожаберных и брюхоногих моллюсков нейросекреторные клетки
составляют относительно большой процент от всех нервных клеток,
образующих их нервную систему. Наблюдается, следовательно, ана-
логичная существующей у позвоночных закономерность: большее от-
носительное количество нейросекреторных клеток в нервной системе
у менее высокоорганизованных животных. У насекомых, ракообразных
и головоногих моллюсков при некотором уменьшении относительного
количества нейросекреторных клеток наблюдается и более совершен-
ная дифференцировка клеток и более выраженная система их ин-
теграции.
Достаточно хорошо изучены нейросекреторные системы брюш-
ных и головных ганглиев у насекомых. В цитологическом плане ней-
росекреторные клетки насекомых сходны с пептидергическими нейро-
секреторными клетками млекопитающих. Они имеют развитый белок-
синтезирующий аппарат и транспортную систему в аксонах. У нейро-
секреторных клеток обнаружены и дендриты с синаптическими окон-
чаниями на них аксонов нервных клеток. Тела нейросекреторных кле-
ток и дендритные разветвления их клеточного отростка сосредоточены
у насекомых в определенных участках головных ганглиев. Они обра-
зуют центральный нейросекреторный орган, аналогичный гипоталаму-
су позвоночных.
Аксоны нейросекреторных клеток заканчиваются в структурно-
организованном нейрогемальном органе — кардиальных телах. Они,
очевидно, функционально аналогичны задней доле гипофиза позвоноч-
ных. Есть у насекомых и железа внутренней секреции, аналогичная
аденогипофизу. Это так называемые прилежащие тела. Инкреторная
деятельность клеток этой железы контролируется нейрогормонами,
которые представляют собой регуляторные пептиды, аналогичные ней-
ропептидам позвоночных. И у насекомых, и у позвоночных имеются
еще и периферические эндокринные органы не нервного происхожде-
ния, а также диффузно расположенные в тканях отдельные секретор-
ные клетки, продуцирующие гормоны.
478
§2 . ВЗАИМООТНОШЕНИЯ ИНТЕГРАТИВНЫХ СИСТЕМ
В ОРГАНИЗМЕ МЛЕКОПИТАЮЩИХ И НАСЕКОМЫХ
Приведенные в предыдущем разделе данные показывают, что все
эндокринные железы у млекопитающих и насекомых оказываются
связанными в единую систем}' через нейросекреторные клетки и цент-
ральные эндокринные органы типа аденогипофиза млекопитающих и
прилежащих тел насекомых. Последние, с одной стороны, сами нахо-
дятся под контролем нейросекреторных клеток, а с другой стороны,
контролируют деятельность эндокринных желез не нервного проис-
хождения. Эти железы, в свою очередь, через кровь или гемолимфу
могут оказывать влияние на нервные клетки, которые оказывают воз-
действие на нейросекреторные клетки.
Таким образом, в организации двух основных интегрирующих
систем высших многоклеточных организмов — нервной и гумораль-
ной — благодаря наличию у высших первичноротых и у позвоночных
связующей их нейросекреторной системы наблюдается глубокая био-
логическая аналогия. Общие черты в организации основных интегри-
рующих систем и их взаимосвязей развились у насекомых и позво-
ночных явно независимо друг от друга. Глубокое сходство этих систем
проявляется не только в их структурной организации. Анализ реакций
млекопитающих и насекомых на стрессорные воздействия показал, что
основную роль в противостоянии таким воздействиям играют нейро-
секреторные системы этих животных, тесно связанные с системами
гуморальной и нервной интеграции.
§3 . РЕГУЛЯТОРНЫЕ НЕЙРОПЕПТИДЫ.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О СООТНОШЕНИЯХ
НЕРВНОЙ И ГУМОРАЛЬНОЙ ИНТЕГРАЦИИ
В 70-е годы нашего столетия физиологи обратили внимание на
большую роль в интегративной деятельности нервной системы (наряду
с модулирующим действием известных уже медиаторов и гормонов)
так называемых регуляторных нейропептидов. При этом было выска-
зано предположение о возможности несинаптического выведения этих
соединений и наличии рецепторов к ним, расположенных вне области
постсинаптической мембраны. Иными словами, возникли представле-
о том, что нейроны, как и нейросекреторные клетки, способны
выделять нейротрансмиттеры не только в области синапсов, но и в
РУШ участках своей плазматической мембраны.
Данны НаЧЭЛе 8О'Х годов были получены четкие морфологические
путем6 ° Наличии пР°йессов несинаптического выведения медиаторов
экзоцитоза в нервных системах моллюсков. Позднее эти мор-
479
фологические и иммуноцитохимические данные были получены уже
на многих объектах и, в частности, в отношении нейронов нервных
центров головного мозга млекопитающих животных. В настоящее
время наличие такого типа несинаптической регуляции деятельности
нервных центров не вызывает сомнений. Это открытие существенно
меняет наши представления о соотношении нервной, эндокринной и
нейросекреторной регуляции в интеграции многоклеточных организ-
мов. Оказалось, что большинство нейронов помимо синаптической
регуляции способны и к регуляции по типу нейросекреторных клеток.
Более того, тот же нейрон использует одни медиаторы для синапти-
ческой передачи, а другие — для несинаптической регуляции, выделяя
их вне области синаптических окончаний.
Таким образом, в настоящее время уже не приходится резко
противопоставлять по механизмам действия нервную, нейросекретор-
ную и эндокринную системы. Их следует рассматривать как единую
интегрирующую систему организма, состоящую из отдельных субсис-
тем, способную осуществлять эту функцию посредством трех меха-
низмов: проводникового локального, общего гуморального и гумораль-
ного путем диффузии в ограниченном пространстве определенных
нервных центров. Наличие последнего механизма, свойственного не
только нейросекреторным клеткам, но и большинству нейронов, сти-
рает резкую грань между нейросекреторными и нервными клетками.
Анализ этого последнего механизма начался в нейробиологии относи-
тельно недавно и уже существенно пополнил наши представления о
работе нервных центров. Уже можно сделать предаарительное заклю-
чение, что посредством диффузионного несинаптического гумораль-
ного механизма обеспечивается в основном модулирующее влияние
на деятельность нервных клеток и их синаптических приборов
ГЛАВА 5. Некоторые общие закономерности
эволюционной динамики тканей нервной системы
§1 . КЛАССИФИКАЦИЯ ОТДЕЛОВ НЕРВНОЙ СИСТЕМЫ
И НЕРВНЫХ ЦЕНТРОВ
Рассмотренные выше элементы тканей нервной системы и их
наиболее важные рабочие механизмы — синапсы и рецепторы — со-
здают основу для интегративной, анализаторской деятельности нерв-
ной системы. Эта основная функция нервной системы лишь на более
высоком системном уровне организации может быть реализована на
уровне объединения тканевых элементов и прежде всего нейронов в
480
фологические и иммуноцитохимические данные были получены уже
на многих объектах и, в частности, в отношении нейронов нервных
центров головного мозга млекопитающих животных. В настоящее
время наличие такого типа несинаптической регуляции деятельности
нервных центров не вызывает сомнений. Это открытие существенно
меняет наши представления о соотношении нервной, эндокринной и
нейросекреторной регуляции в интеграции многоклеточных организ-
мов. Оказалось, что большинство нейронов помимо синаптической
регуляции способны и к регуляции по типу нейросекреторных клеток.
Более того, тот же нейрон использует одни медиаторы для синапти-
ческой передачи, а другие — для несинаптической регуляции, выделяя
их вне области синаптических окончаний.
Таким образом, в настоящее время уже не приходится резко
противопоставлять по механизмам действия нервную, нейросекретор-
ную и эндокринную системы. Их следует рассматривать как единую
интегрирующую систему организма, состоящую из отдельных субсис-
тем, способную осуществлять эту функцию посредством трех меха-
низмов: проводникового локального, общего гуморального и гумораль-
ного путем диффузии в ограниченном пространстве определенных
нервных центров. Наличие последнего механизма, свойственного не
только нейросекреторным клеткам, но и большинству нейронов, сти-
рает резкую грань между нейросекреторными и нервными клетками.
Анализ этого последнего механизма начался в нейробиологии относи-
тельно недавно и уже существенно пополнил наши представления о
работе нервных центров. Уже можно сделать предаарительное заклю-
чение, что посредством диффузионного несинаптического гумораль-
ного механизма обеспечивается в основном модулирующее влияние
на деятельность нервных клеток и их синаптических приборов
ГЛАВА 5. Некоторые общие закономерности
эволюционной динамики тканей нервной системы
§1 . КЛАССИФИКАЦИЯ ОТДЕЛОВ НЕРВНОЙ СИСТЕМЫ
И НЕРВНЫХ ЦЕНТРОВ
Рассмотренные выше элементы тканей нервной системы и их
наиболее важные рабочие механизмы — синапсы и рецепторы — со-
здают основу для интегративной, анализаторской деятельности нерв-
ной системы. Эта основная функция нервной системы лишь на более
высоком системном уровне организации может быть реализована на
уровне объединения тканевых элементов и прежде всего нейронов в
480
многоклеточные системы разной степени сложности. Они находятся в
нервных системах высших животных в закономерной взаимосвязи друг
с другом. Изменение в организации нервной системы в процессе эво-
люции происходит обычно не столько в результате коренной пере-
стройки древних ее аппаратов, сколько путем усложнения и подчине-
ния новообразуюшимся центрам существовавших ранее нервных ап-
паратов.
В основе организации нервной системы у многоклеточных живот-
ных лежит обычно рефлекторная дуга, состоящая из чувствительного,
ассоциативного и эффекторного нейронов. В процессе эволюции на
основе рефлекторных дуг, расположенных в головном отделе живот-
ных, происходило формирование головного мозга, а в туловищной
нервной системе выделялись соматический и вегетативный отделы
нервной системы, рефлекторные дуги которых работают на основе
информации, поступающей из внешней среды и от внутренних орга-
нов. Для более совершенного анализа информации и координации
работы всей системы, а следовательно, организма в целом формиру-
ются высшие ассоциативные центры, которые берут под контроль
простейшие рефлекторные аппараты. Такая общая схема дифферен-
циации нервной системы в ходе эволюции характерна для всех много-
клеточных животных. Однако конкретная реализация этой схемы мо-
жет быть различной. Так, у позвоночных животных спинной и голов-
ной мозг и периферические отделы соматической и вегетативной сис-
темы длительное время эволюционировали независимо от брюшной
нервней цепочки, головных ганглиев и вегетативной системы высших
первичноротых животных. Нет гомологии и между органами чувств у
высших первичноротых и позвоночных животных. Более того, и в
микроанатомическом отношении эти органы могут (как, например,
органы зрения у насекомых и позвоночных) резко отличаться друг от
друга.
Многообразны и конкретные пути реализации отмеченных выше
общих для всех многоклеточных закономерностей эволюции нервных
центре®. Реализуются два крайних варианта и их различные комбина-
ции. Первый вариант, по-видимому, наиболее удачный и характерен
Для нервной системы позвоночных. В его основе лежит увеличение
количества нервных клеток в системе и в первую очередь проме-
жуточных ассоциативных нейронов. У высших позвоночных их коли-
чество достигает нескольких миллиардов, что позволяет им создать
сложнейшие и совершенные интегративные аппараты. Второй путь —
это увеличение размеров клеток, изменение ветвления их отростков
Цри относительно небольшом количестве клеток в системе. Наиболее
481
выражен такой путь усложнения нервной системы у брюхоногих мол-
люсков. Тенденция к использованию этого механизма отмечена у дру-
гих первичноротых животных. Она проявляется, в частности, в широ-
ком распространении в их нервных центрах мультифункциональных
ассоциативно-двигательных нейронов и эффекторных нейронов с не-
сколькими аксонами.
По организации нервной системы среди членистоногих резко вы-
деляются насекомые, а среди моллюсков — головоногие. Нервная сис-
тема как тех, так и других образована относительно большим для
первичноротых количеством диплоидных нейронов с выраженной уни-
функциональной организацией. Иными словами, у этих групп живот-
ных используется сходный с имеющимся у позвоночных принцип
усложнения нервной системы, хотя общее количество нервных клеток
в их центрах значительно меньше. Несмотря на это системные меха-
низмы организации нервных клеток у высших групп первичноротых
и позвоночных животных обнаруживают признаки аналогичного неза-
висимо приобретенного сходства.
§2 . ТУЛОВИЩНЫЕ (ЯДЕРНЫЕ) НЕРВНЫЕ ЦЕНТРЫ
Впервые сходство в организации нервных центров туловищного
мозга насекомых и позвоночных было показано при сопоставлении
нейрональных отношений в ганглии брюшной нервной цепочки ли-
чинки стрекозы и спинном мозге млекопитающих (рис. 163).
У позвоночных туловищные центры образуют собственный аппа-
рат спинного мозга. Он представляет собой систему чувствительных,
ассоциативных и моторных нейронов. Сами нервные центры, т. е.
места синаптических контактов между чувствительными, ассоциатив-
ными и моторными нейронами, располагаются в строго локализован-
ных участках серого вещества спинного мозга (рис. 163, Б). Аксон
чувствительной нервной клетки в белом веществе, окружающем задние
рога спинного мозга, дает восходящую (более короткую) и нисходя-
щую (более длинную) ветви. Они идут в составе проводящих пучков
собственного аппарата спинного мозга и дают в выше- и нижележащие
сегменты коллатерали, оканчивающиеся на дендритах и телах ассоци-
ативных (вставочных) нейронов.
При распространении нервного импульса по аксону чувствитель-
ной нервной клетки он передается, следовательно, на ассоциативные
клетки не только своего, но и выше- и нижележащих сегментов спин-
ного мозга. Аксоны ассоциативных нейронов, перед тем как дать
терминальное разветвление на дендритах и телах моторных нейронов
своей или противоположной стороны спинного мозга, также дают
482
•оллатерали в белое вещество пучков собственного аппарата спинного
В выше- и нижележащих сегментах они дают терминальные
^ветвления на дендритах и телах двигательных клеток соседних
сегментов.
Таким образом, на раздражение одной чувствительной клетки
могут отвечать несколько десятков мотонейронов. Помимо типичных
трехчленных рефлекторных дуг у высших позвоночных животных в
спинном мозге имеются и прямые контакты между чувствительными
и двигательными нейронами. Трехчленные и двучленные рефлектор-
иые дуги собственного аппарата спинного мозга имеют двусторонние
связи с вышележащими центрами головного мозга. Особенно сложный
контроль за деятельностью собственного аппарата спинного мозга осу-
ществляется на уровне двигательных нейронов. Анализ отношений в
собственном аппарате спинного мозга низших позвоночных показыва-
ет, что одной из основных закономерностей прогрессивной дифферен-
цировки ядерных нервных центров является усложнение промежу-
точного, ассоциативного звена — это касается как количества, так
и разнообразия ассоциативных нейронов. Вторая общая закономер-
ность прогрессивного развития ядерных центров — пространственная
и функциональная их дифференциация. Диффузное распределение си-
напсов в ядерных нервных центрах низших позвоночных сменяется у
высших позвоночных строго локализованным, т. е. они распределены
в определенных участках серого вещества спинного мозга. При этом
в двигательной области вместо одной диффузной зоны выделяется уже
около пяти четко локализованных ядерных центров. Наконец, третьей
очень важной закономерностью эволюции ядерных центров является
усложнение их восходящих и нисходящих связей с вышележащи-
ми, более поздними по происхождению центрами головного мозга. В
любом ядерном даигательном центре спинного мозга высших позво-
ночных на каждой эффекторной нервной клетке оканчиваются не толь-
ко аксоны ассоциативных клеток собственного аппарата, но и аксоны
клеток ядерных центров продолговатого мозга, мозжечка, среднего
мозга н аксоны пирамидных клеток коры больших полушарий (у
^екопитающих и человека).
Наиболее сложные и дифференцированные отношения в струк-
^Рной организации ядерных нервных центров у беспозвоночных на-
Но^ДНК)тся в ТУловищном мозге насекомых. Ганглии брюшной нерв-
Цепочки насекомых резко отличаются от спинного мозга позво-
ночных периферическим расположением тел клеток и центральным
Ный ( еНИем н* огРостков. Разветвления отростков образуют вентраль-
Сувствительный), центральный (основной) и дорсальный (двига-
483
тельный) нейропили (рис. 163, А). В нейропилях сосредоточены все
синапсы, т. е. эти участки ганглиев аналогичны соответствующим
ядерным центрам спинного мозга позвоночных животных. В чувстви-
тельном нейропиле находятся терминальные разветвления аксонов ре-
цепторных клеток, расположенных на периферии, и дендриты ассоци-
ативных нейронов. В центральном нейропиле сосредоточены развет-
Рис. 163. Нейрональные отношения в ганглии брюшной нервной цепочки насекомых
(Л) и спинном мозге млекпоитающих (Б).
1-2 — области переключения импульсов с чувствительных на ассоциативные (7) и с
ассоциативных на двигательные (2) клетки, 3, 4 — тела двигательных и ассоциатив-
ных нейронов, 5—7 — проводящие пути (5 — восходящие, 6 •— нисходящие,
7 — местные), 8 — амакриновые клетки.
484
вления дендритов разнообразных ассоциативных клеток. Наконец, в
двигательном нейропиле располагаются терминальные разветвления
аксонов ассоциативных клеток и дендриты моторных нейронов.
Таким образом, синаптические контакты между клетками локали-
зованы в строго определенном участке нейропиля, что аналогично
отношениям, наблюдаемым в ядерных центрах спинного мозга высших
позвоночных животных. Брюшная нервная цепочка насекомых имеет
собственный аппарат проводящих путей. В его основе, как у позво-
ночных, лежит трехчленная рефлекторная дуга, чувствительные и ас-
социативные клетки которой посылают аксонные коллатерали в сосед-
ние ганглии. Кроме того, собственный аппарат туловищного мозга
насекомых обладает сложной системой двусторонних связей с голов-
ным мозгом через специальные ассоциативные нейроны. Отростки
последних располагаются обычно по периферии нейропиля, преиму-
щественно на дорсальной и вентральной поверхностях ганглия.
Таким образом, несмотря на существенные анатомические разли-
чия брюшной нервной цепочки насекомых и спинного мозга позво-
ночных, в их нейрональных отношениях наблюдается принципиальное
сходство, причем это не случайное совпадение, а сходство, независимо
возникшее в результате усложнения нервной системы в сходном на-
правлении. Действительно, сопоставление организации туловищного
мозга насекомых и туловищного мозга аннелид свидетельствует о том,
что совершенствование этих центров в процессе эволюции происхо-
дило по тем же основным, отмеченным выше закономерностям, что и
в ряду позвоночных животных.
Сравнительно-морфологические и физиологические исследования
последних десятилетий в целом подтвердили этот принципиально важ-
ный вывод о наличии общих закономерностей в эволюционной дина-
мике центров туловищного мозга в рядах позвоночных и членистоно-
гих животных. Общие закономерности проявляются не только в сход-
ной микроанатомической организации и нейрональных отношениях в
ганглиях брюшной нервной цепочки и сегментах спинного мозга, но
и в тонких механизмах организации работы этих центров. В этих
механизмах удалось выявить и специфические для насекомых особен-
ности. Так, у них очень хорошо выражен автоматизм работы этих
Центров. Рефлекторные дуги и собственные ассоциативные нейроны
ганглиев брюшной нервной цепочки способны длительно обеспечивать
управление такими сложными актами, как ходьба или полет насекомых
при лишении их двусторонних связей с высшими центрами головного
мозга путем полной декапитации.
Способность автономно осуществлять координированную работу
большого количества нейронов обусловливается широким распростра-
485
нением в ганглиях нервной системы насекомых особых ассечиа ивных
командных интернейронов Их автоматическая деятельность запро-
граммирована генетически. Детальные физиологические исследования
последних лет, проведенные на спинном мозге позвоночных, показали,
однако, что и у этих животных в управлении их сложными двигатель-
ными актами используются аналогичные механизмы.
В настоящее время установлено, что управление локомоторными
актами у позвоночных и у насекомых определяется системными свя-
зями между отдельными группами интер- и мотонейронов. Сходство
в функциональной организации двигательных центров этих животных
проявляется в механизмах формирования нейронального «рисунка»
локомоторных актов. Удается провести глубокую аналогию между
командными нейронами, формирующими ритм ходьбы у кошки и
таракана. В большинстве локомоторных актов активность мотонейро-
нов определяется ритмической импульсацией генераторных интерней-
ронов, которые в свою очередь запускаются афферентной иннервацией.
Таким образом, генераторные и командные (интегративные) ин-
тернейроны являются обязательным, компонентом практически всех
рефлекторных дуг.
Большую роль в работе нервных центров играют особые группы
бесспайковых нейронов, обнаруженные в нервных центрах насекомых.
Эти интернейроны образуют синапсы с мотонейронами и в зависимос-
ти от афферентных сигналов выделяют различное количество медиа-
торов, регулируя уровень мембранного потенциала мотонейрона.
В свете приведенных данных предложенный и разработанный
академиком А. А. Заварзиным сравнительный метод сопоставления
функционально-аналогичных структур при изучении нервной системы
приобретает особое значение. Детальный анализ тонкой Структурно-
функциональной организации нервных систем высших первичноротых
животных необходим не только для выяснения общих закономерностей
эволюционной динамики иервной системы. Такой анализ нервных сис-
тем беспозвоночных животных, в первую очередь насекомых, является
одним из весьма эффективных методологических подходов к изучению
организации нервной системы высших позвоночных. Колоссальное
количество клеток, формирующих нервные центры у высших позво-
ночных животных, делает весьма сложным выяснение структурной
организации нервных центров в плане каузального анализа их анали-
заторской деятельности даже при всем богатом арсенале методов со-
временной физиологии и морфологии.
Нервная система насекомых, используя сходные системные меха-
низмы, осуществляет анализаторскую и координирующую деятель-
486
ность на основе систем и центров, образованных клетками, количество
которых на несколько порядков меньше, чем у высших позвоночных.
Естественно, что значительно проще начать каузальный анализ орга-
низации с более простых систем,
§3 . ЭКРАННЫЕ ЦЕНТРЫ НА ПРИМЕРЕ ЗРИТЕЛЬНОГО АНАЛИЗАТОРА
Отмеченный выше методологический подход к изучению основ-
ных механизмов организации нервной системы особенно актуален в
отношении анализаторской деятельности центров головного мозга, в
первую очередь центров, связанных с анализом информации, получае-
мой дистантными органами чувств — зрения, слуха и обоняния.
Как уже отмечалось, основа для такого подхода была заложена
А. А. Заварзиным еще в 1913 г. в его исследовании оптических нерв-
ных центров у личинки стрекозы и сопоставлении нейрональных от-
ношений в оптических нервных центрах у высших позвоночных, го-
ловоногих моллюсков и насекомых.
У позвоночных животных часть оптических нервных центров со-
средоточена в сетчатке, т. е. вынесена за пределы центральной нервной
системы. Сетчатка высших позвоночных имеет характерное для экран-
ных нервных центров плоскостное или слоистое строение. Описанные
в предыдущем разделе фоторецепторные клетки занимают наиболее
удаленное от поверхности глазного дна положение. Апикальными кон-
цами своих видоизмененных дендритов они обращены к слою пиг-
ментного эпителия, образующему отражательный экран, подстилаю-
щий сетчатку. Наружные сегменты палочек и колбочек формируют
первый спой сетчатки, так называемый слой палочек и колбочек
(рис. 164, А). Тела этих клеток составляют ее наружный ядеряый слой.
Далее по направлению к внутренней поверхности глазного дна следу-
ют наружный ретикулярный, внутренние ядерный и ретикулярный
слои, слой ганглиозных клеток и, наконец, слой нервных волокон. В
наружном ретикулярном слое аксоны палочек и колбочек образуют
синапсы на дендритах биполярных клеток (второй основной нейрон
оптического пути), т. е. здесь находится первый экранный оптический
центр сетчатки.
Во внутреннем ядерном слое располагаются перикарионы бипо-
лярных клеток, а во внутреннем ретикулярном слое — синапсы, где
происходит переключение импульса с аксонов биполярных клеток на
дендриты мультиполярных ганглиозных клеток — третьего основного
ассоциативного нейрона оптического пути. Следовательно, здесь рас-
положен второй экранный оптический центр. В слоях ганглиозных
487
клеток и нервных волокон располагаются соответственно тела гангли-
озных клеток и их аксоны, образующие оптический нерв. Ганглиозных
нервных клеток также значительно меньше, чем биполярных, т. е.
каждая ганглиозная клетка связана синаптическими аппаратами с не-
сколькими клетками. Небольшая часть ганглиозных клеток смещена
во внутренний ядерный слой. Во втором оптическом центре сущест-
венную роль играют и униполярные амакриновые нервные клетки. В
классических исследованиях конца ХГХ в. уже отмечалось большое
разнообразие этих клеток по характеру ветвления их отростков. Так,
Рамон Кахаль еще в 1822 г. отмечал наличие 14 типов амакриновых
клеток. Тела большинства амакриновых клеток расположены во внут-
реннем ядерном слое. Небольшая часть их имеется и в слое гангли-
озных клеток.
Третий оптический центр располагается в подкорковых центрах
головного мозга, в частности у птиц в коре среднего мозга (рис. 164,
А). Здесь оканчиваются аксоны ганглиозных клеток сетчатки. Кора
среднего мозга птиц имеет чрезвычайно сложное строение и состоит
более чем из 14 строго упорядоченных слоев нервных клеток.
У насекомых орган зрения построен по иному принципу, чем
камерные глаза позвоночных животных. Глаз насекомых состоит из
большого количества отдельных глазков — омматидиев. В каждом
глазке имеются вспомогательный диоптрический аппарат и система
фоторецепторных нейронов. В отличие от оптических центров позво-
ночных животных все переключательные звенья в оптическом пути,
Т. е. все оптические нервные центры, расположены у насекомых за
пределами органа зрения, в оптических лопастях (ганглиях) головного
мозга (рис. 164, 2>). Тонкий анализ нейрональных отношений в этих
структурах личинок стрекозы показал их сходство с нейрональными
отношениями в оптических центрах позвоночных животных.
В первом оптическом ганглии у личинок стрекозы, по данным
А. А. Заварзина (1913), расположен первый экранный зрительный
центр, где происходит переключение импульса с аксонов рецепторных
клеток на дендриты первого ассоциативного нейрона оптического
пути. Кроме того, здесь же расположены многочисленные синапсы,
образуемые терминальными разветвлениями отростков амакриновых и
других специализированных вспомогательных клеток. Во втором оп-
тическом ганглии расположен второй экранный центр, где сосредото-
чены синапсы между отростками первого и второго ассоциативных
нейронов зрительного пути. Особенностью этого центра является чрез-
вычайно мощное развитие вспомогательных горизонтальных связей.
Они образуются, как и в первом оптическом ганглии, отростками
488
Рис. 164. Нейрональные отношения в оптических центрах позвоночных (Л) и насеко-
мых (Б) (по А. А. Заварзину, 1941).
I, П, Ш — оптические центры:
1 — сетчатка, 2 — средний мозг, 3 — оптическая лопасть.
вспомогательных амакриновых и специализированных нейронов. В
третьем оптическом ганглии происходит контакт нейронов второго
ассоциативного нейрона с дендритами нервных клеток, связанных с
нервными клетками головного мозга насекомых.
По А. А. Заварзину, в оптических центрах насекомых и птиц мы
иыеем дело с тремя экранными центрами, образуемыми четырьмя
типами основных нейронов. Кроме того, во всех оптических нервных
Wipax имеется и сложный вспомогательный аппарат горизонтальных
связей, причем у насекомых с их фасеточными глазами этот аппарат
Р^вит сильнее, чем у позвоночных животных.
489
Таким образом, и в нейрональных отношениях в оптических цент-
рах головного мозга насекомых и высших позвоночных удалось вы-
явить глубокую функциональную аналогию. Она связана, как и в
случае ядерных центров туловищного мозга, с общими закономернос-
тями усложнения экранных центров.
Совершенствование оптического анализатора происходило, по
А. А. Заварзину, путем увеличения количества и плотности располо-
жения фоторецепторных клеток и, что самое важное, увеличения ко-
личества переключений импульса, т. е. увеличения количества экран-
ных центров по вертикали. И у позвоночных, и у насекомых форми-
руется три таких центра из четырех клеток основных типов, в то время
как у их предков и у современных животных с менее совершенной
деятельностью оптических анализаторов таких центров может быть
два или даже один, а нейронов — три или только два.
В своей монографии по нервной системе академик А. А. Заварзин
(1941) обратил внимание на сходство принципов организации опти-
ческих нервных центров и коры больших полушарий головного мозга
млекопитающих и человека. Он считал, что это сходство не случайно,
оно отражает общие закономерности эволюционной д инамики нервной
системы и связано с особенностями структурной организации анали-
заторской деятельности ее высших отделов.
Более поздние исследования оптических центров у позвоночных
и насекомых позволили значительно углубить изложенные выше пред-
ставления о тонком строении и механизмах работы оптических центров
(рис. 165). Так, удалось показать, что биполярные клетки (второй
нейрон оптического анализатора) у позвоночных животных передают
сигнал непосредственно на дендриты ганглиозных клеток (третий ней-
рон оптического пути) только от клеток-колбочек. Что касается сиг-
нала с рецепторов клеток палочек, то между ганглиозными клетками
и биполярными располагается еще один интернейрон — амакриновые
клетки (так называемые клетки П типа). Возникающий здесь допол-
нительный экранный центр обслуживается по крайней мере пятью
разновидностями амакриновых клеток, основным медиатором которых
является серотонин. Выявлена также большая в количественном отно-
шении группа холинергических амакриновых клеток (клетки I типа)
и показана их важная роль в анализаторской деятельности нейронов
сетчатки при регистрации движущихся предметов.
Установлено и участие горизонтальных клеток (клеток первого
экранного центра) в латеральном ингибировании. Выявлена группа
дофаминергических амакриновых клеток, обслуживающих второй эк-
ранный центр и оказывающих, по-видимому, модулирующее влияние
490
о
Рис. 165. Расположение нейронов в сетчатке (по Dowling, Boycott, 1966).
Наружные сегменты фоторецепотора, лежащие против пигментного эпителия, показа-
ны вверху; свет попадает в сетчатку снизу; показаны основные синаптические связи
в сетчатке между фоторецепоторами, вставочными нейронами и ганглиозными кпет-
Иад» а также следующие нервные клетки: палочковые биполярные клетки (ПБ), кар-
ликовые биполярные клетки (КБ), плоские биполярные клетки (ПлБ), горизонтальные
*^1КИ (Гор), амакриновые клетки (Ам), карликовые ганглиозные клетки (КГ) и диф-
♦узные ганглиозные клетки (ДГ); вставка слева внизу -— строение ленточного синап-
Ц расположен между биополярной (Б) и амакриновыми (Л), а также ганглиозной
) клетками; обратите внимание на его лентовидный филамент (Ф) и связанные с
ним синаптические пузырьки.
491
на нейроны, образующие сложные и многосторонние синаптические
окончания. Таким образом, современные исследования функциональ-
ной морфологии сетчатки позвоночных значительно углубили класси-
ческие морфологические представления о нейронах сетчатки. Наряду
с новыми данными о структурно-химической организации рецепторов
результаты этих исследований позволяют приступить к синтезу мор-
фологических, биохимических и физиологических данных. Большое
количество новых данных получено с помощью современных методов
исследования функциональной морфологии нервных центров у чле-
нистоногих, в частности у насекомых (рис. 166). При этом кроме
отмеченного ранее внешнего сходства организации этих центров у
Рис. 166. Организация зритель-
ного анализатора у мясной
мухи.
1 — аксоны ретинальных клеток
(каждая колонка от аксона кле-
ток из одного омматидия); 2 —
область первого оптического
ганглия (lamina) перераспреде-
ления аксонов по новым колон-
кам (в каждой — шесть терми-
налей аксонов из разных омма-
тидиев н два аксона, проходя-
щих во второй оптический ган-
глий без переключения, изобра-
жение с терминалей поступает
иа четыре параллельных кана-
ла); 3 — область второго опти-
ческого ганглия ( medulla) (изо-
бражение поступает по терми-
налям двух дтнноаксонных ре-
тинальных клеток и по четырем
параллельным каналам первого
ганглия, где оно разлагается на
20 параллельных каналов); 4,
5 — области третьего оптичес-
кого ганглия (lobula 4) и (lobula
plate 5), где происходит обра-
ботка информации, она посту-
пает на детекторные нейроны
(?) н конвергирует с информа-
цией, поступающей из других
органов чувств; 6-8 — прово-
дящие пути передачи информа-
ции по отросткам ретинальных
клеток (6) и (7), клеток оптичес-
ких ганглиев (8).
492
высших вторичноротых и первичноротых животных удалось обнару-
жить и глубокие функциональные аналогии. Так, в частности, в сет-
чатке позвоночных и в первом оптическом центре у насекомых широко
распространены процессы латерального ингибирования, которые обес-
печивают тонкое взаимодействие между группами фоторецепторов и
создают основу для анализа зрительной информации, в частности
выделения изображения точечных или сдвоенных объектов или боль-
ших объектов, перекрывающих у насекомых группу омматидиев. Уни-
версальное распространение в оптических анализаторах, в их дисталь-
ных по отношению к фоторецепторам центрах, имеют так называемые
детекторные интернейроны. В ряде случаев у насекомых их детектор-
ные свойства могут быть связаны с поведенческими стимулами.
Тонкими физиологическими методами удалось обнаружить детек-
торные интернейроны с большими рецептивными полями, суммирую-
щие с большого количества проекционных нейронов сигналы о ло-
кально направленных сдаигах наблюдаемого объекта. Выявлены также
сложные нейроны, которые способны суммировать сигналы от не-
скольких интернейронов с более ограниченными и, по-видимому, го-
могенными в функциональном отношении рецептивными полями.
Меньшее количество клеток и более четкая обособленность нерв-
ных центров у насекомых позволили в настоящее время изучить все
основные нейроны в первом оптическом ганглии у мясной мухи с их
синаптическими окончаниями и тонкими нейрональными отношения-
ми. Появилась возможность, используя современную микроэлектрод-
ную технику, приступить к конкретному каузальному анализу на уров-
не отдельных нейронов тонких процессов, происходящих в центрах
при возбуждении фоторецепторов,
У мясной мухи (как и у других насекомых) имеется три основных
оптических ганглия, или, по современной терминологии, lamina (пер-
вый ганглий), medulla (второй ганглий) и lobula + lobula plate (третий
ганглий (рис. 166, 2-5). В таких образованиях имеется весьма правиль-
иое закономерное плоскостное расположение синапсов фоторецептор-
ных клеток и основных — проекционных ассоциативных нейронов,
обеспечивающих передачу информации из одного оптического центра
в другой. Кроме того, такое же закономерное экранное расположение
в каждом центре имеют и многочисленные синапсы ассоциативных
нейронов (рис. 167, А, Б).
Таким образом, информация от фоторецепторов проецируется в
оптическом анализаторе не на три экрана, как предполагал А. А. За-
варзин, а на значительно большее их число (4—5 только в первом
ганглии, а всего — свыше 40 таких экранов). Больше того, оказалось,
493
что для оптических нервных центров характерна правильная органи-
зация групп рецепторных и связанных с ними нервных клеток в свое-
образные колонки с определенным, строго закономерным расположе-
нием и постоянным количеством клеток в каждой из них (рис. 167,
А, Б; рис. 166, 1-5). Суть такого рода колончатой организации сво-
дится к разложению сигнала с рецепторов в первом ганглии (lamina)
на 4 канала с каждого рецептора, а во втором ганглии (medulla) на 20
параллельных каналов. Такого рода предварительная обработка инфор-
6
Рис. 167. Современная схема нейрональных отношений в 1 (Л) н II (Б) оптических
ганглиях у мясной мухи.
1 — отростки длинноаксонных фоторецепторов, проходящие сквозь 1 оптический
ганглий во II, 2 — окончания короткоаксонных фоторецепоторов, 3 — зона пере-
ключения в I ганглии рецепторного потенциала (разложение его на параллельные
каналы), 4 — псевдоуниполярные и 5 — амакриновые клетки I ганглия, б — зона
переключения (разложения на параллельные каналы) импульса во II оптическом
ганглии, 7 — клетки II оптического ганглия.
494
мации — необходимая ступень для ее анализа, который осуществля-
ется уже специализированными нейронами оптического анализатора,
сосредоточенными в системе третьего оптического ганглия (lobula +
+ lobula plate, см. рис. 166, 4, 5) и в высших отделах центральной
нервной системы. Аналогичный, хотя и не так внешне четко выражен-
ный, колончатый принцип организации характерен и для оптических
нервных центров позвоночных.
Рассмотренные данные о функциональной организации экранных
центров сетчатки показывают условность принятого ранее разделения
нейронов на основные и вспомогательные. Как было показано выше,
с одной стороны, часть амакриновых клеток включается в «основной»
путь и передачи, и обработки сигнала. С другой стороны, и горизон-
тальные, и большая часть амакриновых клеток участвует в непосред-
ственной обработке и предварительном анализе поступающих с рецеп-
торов сигналов. Иными словами, они участвуют как полноправные
элементы в формировании экранных центров и вертикальных колонок,
или модулей, выраженных у позвоночных менее четко, чем у насеко-
мых. Тем не менее плоскостное расположение одноименных синапсов
и колончатый принцип объединения нейронных ансамблей пирамид-
ных клеток — характерный признак организации всех отделов коры
больших полушарий головного мозга млекопитающих и человека. В
связи с этим в нейробиологии широкое распространение получает
представление о том, что в данном случае мы имеем дело с выраже-
нием общих принципов организации высших нервных центров. Есте-
ственно, что для понимания этих принципов неоценимую помощь
могут оказать детальные исследования оптических центров насекомых,
где указанные выше признаки выражены особенно отчетливо, а обо-
собленность колонок и относительно небольшое количество нейронов
создают благоприятные предпосылки для использования всего ком-
плекса современных тонких нейрофизиологических и эксперименталь-
ных методов исследований.
ЛИТЕРАТУРА
Альберте Б. Брей Д, Льюис Дж. и др. Молекулярная биология клетки.
М., 1987. Т. 2. С. 181-183. Т. 4. С. 135-136. Т. 5. С. 71-154.
Винников Л. А. Факторы параллелизма органов чувств //Цитология. 1986.
Т. 28, № 3.
Голустейн Г., Лоррис А. Гематоэнцефалический барьер // В мире науки.
1986. №11.
Грибакин Ф. Г Функциональная эволюция фоторецепторов // Эволюцион-
ная физиология. М., 1983. Ч. 2. С. 211-226.
495
Грибакин Ф. Г Механизмы фоторецепторов насекомых. Л„ 1981. С. ЗОо.
Заварзин А. А (1941). Очерки по эволюционной гистологии нервной сис-
темы: Избр. Тр. М.; Л., 1950. Т. 3. С. 419.
Кимелберг Г. К, Норенберг М. Д Астроциты // В мире науки. 1989. № 6.
Кинд Т В., Карпунина Н Н., Тысячнюк М. С. Нейроэндокринная система
и методы изучения ее функциональной активности // Тр. Всесоюз. энтомол.
общества. 1983. Т. 64.
Мандельштам Ю. С. Нейрон и мышцы насекомого. Л., 1983. С. 169.
Стеллин В. А. Межклеточное пространство и несиналтические межнейрон-
ные связи головного мозга млекопитающих // Архив АГЭ. 1987. № 9.
Поленов А. Л. Эволюция гипоталамогипофизарного — эндокринного ком-
плекса // Эволюционная физиология. Л., 1983. С. 53-109.
Свидерский В. Л., Князева Н. И., Невмывака Г А. и др. Морфофункцио-
нальные исследования нервной системы беспозвоночных за последние 40 лет
// Эволюционные идеи в гистологии и эмбриологии. Тр. ЛОЕ. 1986. Т. 86.
Вып. 1.
Скок В. И. Нейрональные холинорецепторы. М., 1987,
Страйер Л. Молекулы зрительного возбуждения И В мире науки. 1987
№ 9.
Хэм К, Кормак Д Гистология. М.» 1983. Т. 4. С. 241-254, 263-271.
Шеперд Г Нейробиология. М., 1987.
Srausfeld N., Nassel D. R Neuroarchitectures Serving Compound Eyes of Crus-
tacea and Insecta. Gn. Comparative Physiology and Evolution of Vision in Inver-
tebrates. D. Invertebrate Visual Centers and Behavior. New York, 1981. P. 2-132.
Итак, в области частной цитологии и сравнительной гистологии
за последние десятилетия накоплено много новых фактов. Детальный
анализ морфобиохимической организации дифференцированных кле-
ток показал, что специализация тканевых элементов очень часто про-
исходит на основе специфической гипертрофии общих для всех клеток
структур и метаболических процессов. Именно так обстоит дело и при
дифференцировке сократимых тканей, и при формировании осморегу-
лирующих систем, нервных, железистых и многих других типов спе-
циализированных клеток и тканевых структур. Даже в тех случаях,
когда специализация связана с синтезом таких специфических поли-
меров или сложных соединений, как коллаген, родопсин, дыхательные
пигменты, удается с большой достоверностью показать, что эти со-
единения возникли на основе древних, характерных для первичных
многоклеточных общих для всех клеток метаболических процессов.
Жесткость клеточной организации многоклеточных организмов
усиливается еще и нахождением клеток в составе тканевых систем.
Значение регулирующих надклеточных факторов в ограничении воз-
можности клеток к эволюционным преобразованиям особенно нагляд-
но выступает при сопоставлении процессов репродукции клеток у
многоклеточных животных и простейших. В противоположность боль-
шем)' разнообразию этих процессов у простейших полноценное кле-
точное деление в тканях многоклеточных ограничивается типичным
метазойным митозом.
Таким образом, из всего сказанного выше неизбежно вытекает
вывод о том, что при сходных функциональных задачах их решение
на клеточном уровне чаще всего осуществляется сходным образом. В
справедливости такого вывода убеждает нас громадный сравнительно-
цитологический материал, полученный при изучении аналогичных в
функциональном отношении клеток или образуемых ими межклеточ-
ных структур.
Стихийное использование сравнительного метода по принципу
функциональной аналогии в настоящее время доминирует в сравни-
тельно-цитологических и гистологических работах. При детализации
наших представлений о тканевых структурах выявлены в пределах
каждого сходного по функции типа и даже каждой разновидности
тканей универсальные закономерности их организации. Иными слова-
ми, в большинстве случаев прогнозы сторонников дивергентной эво-
люции тканей, постулировавших наличие глубоких различий между
внешне сходными тканевыми структурами, оказались иесосгоятельны-
497
МИ В настоящее время определяющее значение функциональных па-
раллелизмов в организации тканевых структур у разных животных не
вызывает уже серьезно обоснованных возражений.
Наличие сходства в организации тканевых структур не означает
абсолютного их тождества. Как было показано на многочисленных
примерах параллелизмов (хрящевые ткани, рецепторы, фибробласты,
осморегулирующие, сократимые и многие другие тканевые элементы),
морфобиохимическое сходство организации этих структур проявляется
в разнообразных модификациях, затрагивающих существенные при-
знаки организации. Однако это варьирование структур не выходит
обычно за рамки общих признаков, характерных для данного типа
клеток или образуемых ими внеклеточных структур.
Приведенные в книге многочисленные факты свидетельствуют о
том, что теория параллелизма на уровне специализированных клеток
и внеклеточных структур получила сейчас более углубленное обосно-
вание, чем в период ее первоначальной формулировки. Оказались
справедливыми основные положения этой теории — наличие общих
закономерностей в филогенетической дифференцировке специализиро-
ванных структур, обусловленных и общностью функциональной зада-
чи, и общими свойствами или общими закономерностями организации
клеток.
В то же время в каждом типе и подтипе тканей имеются примеры
решения одной и той же функциональной задачи разными способами
(кутикулярные и многослойные эпителии, лимфоидная система и сис-
тема гранулярных амебоцитов, наконец, волокна соматической и сер-
дечных мышечных тканей).
Менее разработаны вопросы филогенетической дифференцировки
на тканевом уровне. Однако и здесь по мере накопления новых фак-
тических сравнительно-гистологических данных начинают выявляться
все более отчетливо специфические для каждого типа тканей и общие
для подавляющего большинства многоклеточных животных законо-
мерности филогенетической дифференцировки. Для тканей внутренней
среды такими закономерностями будут дивергентная дифференцировка
специализированных клеток н межклеточных структур, сохранение и
усиление функциональной целостности и интегрированности при боль-
шой эволюционной лабильности системы. Действительно, в противо-
положность относительно простым системам тканей внутренней среды
У низших животных в наиболее дифференцированных тканях высших
позвоночных имеются не менее 20 типов клеток и весьма многообраз-
ные межклеточные структуры. Единственными источниками развития
едлых, и подвижных клеток являются специальные стромальные
498
И Кроветворные стволовые мультипотентные клетки. Несмотря на глу-
бокую дифференцированность системы, доходящую до возможного
разделения ее камбиальностей, она представляет собой единую за-
щитную, трофическую и опорную тканевую систему. Все части сис-
темы находятся в неразрывном единстве. Наиболее яркими проявле-
ниями такого единства являются кооперативные взаимодействия раз-
личных типов клеток при воспалении, развитии скелетных тканей и в
реакциях адаптивного иммунитета. На некоторых объектах удалось
показать наличие в тканях внутренней среды насекомых тенденции к
разграничению систем оседлых и подвижных элементов аналогичной
таковой у позвоночных. Наоборот, у моллюсков отчетливо показано
гистогенетическое единство всех клеток рассматриваемой тканевой
системы. Таким образом, появление особых источников развития осед-
лых и подвижных элементов в тканях внутренней среды высших
первично- и вторичноротых животных не есть первичное свойство
этих систем.
Функциональная и филогенетическая лабильность тканей внутрен-
ней среды проявляется в варьировании их клеточного состава даже у
близкородственных животных. На фоне такой лабильности особенно
примечательны многочисленные примеры развития сходных тканевых
структур и специализированных клеток у неродственных животных
(эритроциты, хрящевые клетки и основное вещество хряща).
Наряду с многочисленными примерами независимого развития
сходных структур у неродственных животных имеются и примеры
противоположного характера: у позвоночных есть костная и лимфо-
идная ткани, которых нет у беспозвоночных; у беспозвоночных ши-
роко распространена система гранулярных амебоцитов, которой нет у
позвоночных.
В противоположность тканям внутренней среды специфической
закономерностью филогенетической дифференцировки сократимых
тканей, общей для всего типа этих тканей, является конвергентный
характер дифференцировки. При большом разнообразии сократимых
элементов их функциональная специализация основана на модифика-
циях единой акто-миозиновой системы. Степень упорядоченности в
пространстве, а также характер вспомогательных регуляторных меха-
низмов обусловливаются в значительной мере функциональными мо-
ментами. Это приводит, с одной стороны, к большому разнообразию
мышечных тканей у одного и того же животного, а с другой — к
наличию многочисленных параллелизмов в организации сократимых
аппаратов, причем не только у высших представителей первично- и
вторичноротых животных, ио и у животных средних и даже низших
уровней организации.
499
Обнаружены достаточно яркие примеры параллельного развития
и в отношении системного уровня организации сократимых тканей.
Например, мышечные волокна как насекомых, так и позвоночных,
имеют симпластическую структуру; у обеих групп животных выявля-
ются специальные камбиальные клетки-сатгелиты. Не менее ярким
примером системного параллелизма является организация сердечной
мышечной ткани позвоночных, моллюсков и членистоногих. Несмотря
на независимое возникновение этой ткани у первично- и вторичиоро-
тых. у всех животных она построена по принципу объединения одно-
ядерных клеток в единую в функциональном отношении многоклегоч-
ную структуру.
Наряду с известными разновидностями мышечных тканей имеет
все основания предположение о том, что нейральные мышцы позво-
ночных построены по типу гладких мышц беспозвоночных, а у мол-
люсков есть мышцы, сократимый аппарат которых сходен с таковым
гладких мышц позвоночных.
В отношении осморегулирующих и железистых эпителиев также
имеется много весьма ярких примеров цитологических параллелизмов.
Выявляются и общие тенденции системной организации. Так, мочевые
канальцы у разных животных функционируют на основе сочетания
фильтрации, реабсорбции и секреции с соответствующей дифферен-
цировкой эпителия отдельных участков канальцев.
Ткани нервной системы являются относительно однородной и по
происхождению, и по общем}' направлению филогенетической диффе-
ренцировки тканевой системой. В этом смысле они напоминают ткани
внутренней среды. Действительно, у предков современных многокле-
точных животных одной из первых дифференцировок их нервной
системы было выделение трех основных типов клеток — нервных,
глиальных и нейросекреторных, в дальнейшем развитии, как и в
случае тканей внутренней среды, идет дивергентная специализация
этих клеток, приводящая к тому большому разнообразию, которое мы
обнаруживаем у высщих представителей современных первично- и
вторичноротых животных.
Особенностью прогрессивной эволюции тканей нервной системы
по сравнению с тканями внутренней среды является филогенетическая
стабильность, консервативность этой системы. Это выражается в от-
сутствии больших различий в организации нервных тканей у близко-
р детве иных животных. Проявлением ее филогенетической стабиль-
осп! является и значительно более выраженная, чем при дифферен-
^^>вк^др'тих ^аней, тенденция к сохранению более древних аппа-
олюция нервной системы идет преимущественно путем со-
500
четания сохраняющихся и модифицирующихся древних аппаратов с
более молодыми, прогрессивно развивающимися высшими нервными
центрами.
Консервативность структурных и химических преобразований на
клеточном уровне показана на примере нервной системы брюхоногих
и пластинчатожаберных моллюсков. Несмотря на значительные анато-
мические различия в строении нервной системы разных отрядов и
подклассов этих животных, выявлены гомологичные нейроны, выпол-
няющие сходную функцию и характеризующиеся одинаковой медиа-
торной специфичностью.
Наиболее яркими примерами системных параллелизмов в диффе-
ренцировке нервной системы высших первично- и вторичноротых жи-
вотных по-прежнему являются подробно разобранные академиком
А. А. Заварзиным нейрональные отношения в системе их туловищного
мозга и оптических нервных центров. Последующие нейрогистологи-
ческие работы позволили детализировать и расширить количество при-
меров сходных принципов организации нервной системы первично- и
вторичноротых животных. Вместе с тем в этих работах показаны и
существенные модификации такой организации у некоторых групп
членистоногих. Весьма плодотворным оказался тесный контакт мор-
фологических и физиологических подходов при анализе общих прин-
ципов и механизмов организации нервной системы многоклеточных
животных. Комплексные исследования проводятся сейчас на большом
круге объектов, в первую очередь на высших первичноротых живот-
ных. Конечная их цель —• выяснить общие для каждой дифференци-
рованной нервной системы принципы ее организации.
Сравнительные исследования в современной нейробиологии осо-
бенно наглядно показывают изменение взаимоотношения между срав-
нительно-физиологическими, биохимическими и морфологическими
исследованиями. Если в середине XX в. они в значительной мере
развивались автономно, независимо, а результаты их часто противо-
речили друг другу, то в настоящее время наиболее плодотворные и
крупные обобщения делаются на стыке морфологического, биохими-
ческого и функционального подходов. Такое положение естественно,
Поскольку, по-видимому, нет особой функциональной, структурной и
хвмической эволюции: форма, функция и химическая организация —
Три стороны единой, сложно организованной живой материи, об-
вой ди* ВН^тРенними закономерностями организации и эволюцион-
которые общие черты наблюдаются в эволюционной динамике
И кишечных эпителиев. Эти ткани обеспечивают непосредст-
501
венно взаимоотношение организма с внешней средой и относятся к
наиболее древним тканевым системам со стабильной трофической
поглощающей (кишечные эпителии) или барьерно-изолирующей (кож-
ные эпителии) функциями. Одно из наиболее распространенных на-
правлений филогенетической дифференцировки кишечных эпителиев
на уровне специализированных клеток — совершенствование процес-
сов всасывания и внутриклеточного транспорта у основных всасыва-
ющих клеток. С этими процессами связана и дифференцировка разно-
образных железистых элементов с секреторной и инкреторной функ-
циями. Второе направление филогенетической дифференцировки ки-
шечного эпителия — специализация клеток на процессы внутрикле-
точного пищеварения.
Специализированный аппарат пино- и фагоцитоза может сочетать-
ся у некоторых животных с процессами всасывания в одних и тех же
бифункциональных пищеварительно-всасывающих клетках. Специфи-
ческую функцию выполняет этот видоизмененный универсальный ме-
ханизм взаимодействия клеток с внешней средой и во всасывающих
клетках кишечного эпителия новорожденных млекопитающих. Общий
для многих групп многоклеточных животных принцип системной ин-
теграции на основе энергичного обновления кишечного эпителия
имеет мозаичное распространение и характерен для животных как с
полостным, так и с внутриклеточным пищеварением. Поляризованные,
с топографически выделенным камбием эпителиальные пласты харак-
терны для представителей и низших, и высших позвоночных. Они
встречаются у насекомых, ракообразных н моллюсков.
Более сложные отношения наблюдаются при филогенетической
дифференцировке кожных эпителиев. Внешне эти сложные отношения
проявляются в наличии у животных нескольких существенно разли-
чающихся разновидностей кожного эпителия. В отличие от других
типов тканей сходная функциональная задача при выходе высших
вторично- и первичноротых животных на сушу «решалась» кожными
покровами принципиально различными способами и в химическом, и
в структурном отношениях, т. е. в данном случае в виде редкого
исключения имеет место дивергенция покровов: кутикулярные эпите-
лии наземных членистоногих и многослойные кожные ороговеваюшне
эпителии наземных позвоночных — принципиально различные ткане-
вые системы. Но и в случае кожных эпителиев мы имеем большое
количество примеров проявления общих тенденций их филогенетичес-
кой дифференцировки. К ним относятся наличие у высших вторично-
ротых животных и у моллюсков разновидностей кожных эпителиев,
свойственных низшим многоклеточным животным, и проявление по-
502
тенций к прогрессивной филогенетической дифференцировке (орого-
веваюшие многослойные эпителии) у более низко организованных
животных (костистые рыбы н круглоротые среди позвоночных). Весь-
ма ярким выражением процессов направленного развития в эволюци-
онной динамике кожных эпителиев является многократное возникно-
вение кутикулярных эпителиев артроподного типа. Они имеются у
таких не родственных артроподам животных, как оболочники и при-
апулиды. Тенденция к их возникновению проявляется и у других
животных (щетинки аннелид, перисарк кишечнополостных, раковина
моллюсков).
Таким образом, даже тканевые системы, непосредственно контак-
тирующие с внешней средой (кишечные и кожные эпителии) и в силу
этого подверженные наибольшей изменчивости, характеризуются чет-
ко выраженными тенденциями направленной, ограниченной опреде-
ленными рамками специализации у разных групп многоклеточных
животных, В связи с этим можно с достаточным основанием говорить
об универсальном характере и доминирующем значении принципа
параллелизма в филогенетической дифференцировке на тканевом и
клеточном уровнях организации многоклеточных животных.
Одной из важных предпосылок теории параллельных рядов тка-
невой эволюции было представление об исторической обусловленнос-
ти филогенетической гомологии основных типов тканей многоклеточ-
ных животных. Однако уже в период разработки теории параллелизма
были известны многочисленные примеры формирования в ходе эво-
люции на разных ее этапах так называемых вторичных и третичных
тканей, образованных тканевыми элементами другой функциональной
специализации, К настоящему времени резко увеличилось число таких
примеров. Удалось также более детально проследить характер изме-
нения системных и особенно субклеточных признаков морфобиохими-
ческой организации клеток во вторичных и третичных тканевых сис-
темах. При этом оказалось, что во многих случаях образуются специ-
ализированные клетки, весьма сходные со специализированными клет-
ками, имеющими более древнее в эволюции происхождение и другой
источник развития. Яркими примерами такой «филогенетической» ме-
таплазии могут служить сердечная мышечная ткань позвоночных, их
вторичночувствующие клетки, клетки осморегулирующих систем и
многие другие вторичные и третичные ткани или тканевые элементы.
В ряде случаев достоверно показана возможность сходной специ-
фической синтетической деятельности у клеток, специализированных
в разных направлениях. Так, синтез коллагена и специфических муко-
протеидов, характерный для механоцитов, могут осуществлять не толь-
503
ко различные разновидности сократимых тканей, но и базальные клет-
ки эпителия роговицы у млекопитающих или клетки мальпигиевых
сосудов у насекомых. Все эти факты, несмотря на их кажущуюся
парадоксальность, не являются неожиданными в свете современных
представлений о структурной идентичности ДНК в геноме всех спе-
циализированных клеток. Приходится скорее удивляться тому, что у
современных многоклеточных доминирует «тканевой» принцип орга-
низации на основе преимущественной гомологии тканевых типов*. Не
свойственные клеткам данного типа гетеросинтетическая активность
и филогенетические метаплазии являются лишь исключением из общей
закономерности. Очевидно, что такая ситуация обусловливается на-
личием регуляторных механизмов, которые специфически и в боль-
шинстве случаев стойко блокируют мультифункциональные потенции
ядерных аппаратов клеток. Степень такой блокировки при разных
типах специализации клеток различна. Наиболее легко, по-видимому,
деблокируются участки генома клеток, специализация которых осно-
вана исключительно на гипертрофии общих для всех клеток структур-
ных белков типа сократимых белков, коллагена, мембранных структур,
связанных с процессами активного транспорта, и других аналогичных
систем.
Несмотря на возможность передифференцировки клеток, в ходе
исторического развития биологические свойства возникающих в ре-
зультате таких процессов вторичных или тоетичных тканей могут
существенно отличаться от биологических свойств более древних, фун-
кционально аналогичных тканей. Это особенно ярко можно показать
на примере сердечных и соматических мышечных тканей при их ре-
генерации: регенеративные процессы у них имеют глубокие различия.
Одним из наиболее интересных и перспективных следствий тео-
рии параллелизма на современном этапе ее развития является то, что
аналогичные тканевые структуры и ткани в целом не идентичны как
в пределах гомологичных типов, так и при их филогенетической ме-
таплазии разной степени древности. Они представляют собой струк-
турные, химические и системные модификации, более или менее раз-
личные между собой. Эти различия являются в конечном счете ре-
зультатом проявления активности сходных участков генома или (ско-
рее) сходных тенденций его изменений, реализованных в различных
условиях внутриклеточной и системной интеграции.
* В последнее время в культурах in vitro методами генной инженерии удалось вызвать
путем введения в геном фибробластов активированного регуляторного гена передиффе-
ренцировку их в клетки, образующие волокна соматических мышц.
504
Следовательно, целенаправленное изучение аналогичных тканей
во всем их многообразии у разных групп животных дает весьма цен-
ный материал для понимания закономерностей филогенетической диф-
ференцировки и детерминации тканей в онтогенезе.
Повышенный интерес к сравнительной гистологии определяется
еще и тем обстоятельством, что общие закономерности организации
и тенденции развития обнаруживаются не только у функционально
аналогичных клеток и тканей. Можно привести много примеров общих
закономерностей организации и развития различных в функциональ-
ном отношении тканей. Например, определяющее значение для фило-
генетической и функциональной пластичности внеклеточных структур
имеет контактное и химическое взаимодействие их с соответствующи-
ми специализированными клетками и воздействия на эти клетки вы-
деляемых ими внеклеточных соединений. Такое взаимодействие ха-
рактерно н для рыхлой, и для плотной соединительной тканей, для
всех скелетных разновидностей тканей внутренней среды и для раз-
нообразных кутикулярных эпителиев, включая такие их разновиднос-
ти, как кутикулярные эпителии нематод.
Широкое распространение в различных модификациях имеет, по-
вилимому, и клональная организация камбиальных обновляющихся
тканей. Клональная организация камбиальных тканей достаточно убе-
дительно показана для тканей внутренней среды кишечного, кожного
и сперматогенного эпителиев млекопитающих и для корешков про-
ростков растении, т. е. весьма различных по происхождению и функ-
циям тканевых и клеточных систем. Большие биологические преиму-
щества этого принципа организации камбиальных тканей дают осно-
вания предполагать наличие его во всех камбиальных системах, ха-
рактеризующихся достаточно энергичным обновлением своего клеточ-
ного состава.
Классические варианты концепции стволовых клеток подвергают-
ся сейчас обоснованной критике. Неограниченным делением кроме
стволовых клеток обладают Т-лимфоциты. Доказано также, что это
свойство зависит от положения клеток в тканевой системе. Наконец,
в пределах лимфоидной системы позвоночных возможны, по-видимо-
му, более глубокие метаплазии.
Многообразие проявляется в организации и функциональной де-
ятельности различных тканей сочетание противоположных по своему
биологическому' значению процессов. Наиболее простыми примерами
такого сочетания могут быть соотношения процессов дифференциации
и репродукции клеток или процессов разрушения и образования кост-
ной ткани с ее единой системой костеообразующих и разрушающих
кость клеток.
505
Более сложные отношения наблюдаются в организации лимфоид-
ной ткани. Ее удивительная пластичность и строгая адекватность ре-
акции на антигенный стимул основаны на работе жестко и однозначно
детерминированных клеточных элементов. Лимфоидная ткань вместе
с тем является примером доведенного до высшей степени совершен-
ства эволюционного расщепления — одного из распространенных ме-
ханизмов усложнения тканей в филогенезе. Специфической особен-
ностью лимфоидной ткани является то, что здесь включаются в дело
особые механизмы перестройки генетического аппарата. При этом у
представителей разных классов позвоночных доминирующее значение
приобретают разные механизмы перестройки ДНК геномов при фор-
мировании клонов иммунокомпетентных клеток.
В других многочисленных примерах эволюционного расщепления,
особенно характерных для мультифункциональных тканей, различия
между клеточными линиями обеспечиваются не на уровне перестройки
ДНК, а на уровне регуляции функциональной активности генов.
Наряду с эволюционным расщеплением или дивергентной диф-
ференцировкой усложнение ткани может осуществляться и при сохра-
нении мультифункциональности клеточных элементов. Ярким приме-
ром этого для тканей внутренней среды могут служить моноциты —
макрофаги, а для нервной системы — командные интернейроны нерв-
ных центров.
Большой интерес представляет также глубокая биологическая ана-
логия, которая наблюдается между такими гистологически различными
системами, как нервная и лимфоидная системы высших позвоночных
животных. Обе системы осуществляют интегрирующую функцию на
основе рефлекторной реакции, они «обучаются» в онтогенезе и обла-
дают «памятью». Системы эти, хотя и на основе разных механизмов,
имеют универсальное распространение в организме и непрерывно по-
лучают и перерабатывают информацию из внутренней и внешней для
организма среды. При этом либо они претерпевают существенные
изменения в своем клеточном составе, либо происходят морфобиохи-
мические сдвиги в стабильных клеточных популяциях.
Среди общих закономерностей филогенетической дифференци-
ровки на системном уровне организации многоклеточных животных
особое значение имеет усиление у высших животных роли надсистем-
ных, межтканевых корреляций. Более совершенное функционирование
тканей высших животных по сравнению с функционированием анало-
гичных тканей низших животных обусловливается не столько услож-
нением морфобиохимической организации клеток и межклеточных
структур, сколько усложнением межтканевых корреляций и коопера-
тивного межклеточного взаимодействия.
506
Способность осморегулирующих и выделительных эпителиев выс-
ших позвоночных и насекомых вырабатывать гипертонические по от-
ношению к тканевой жидкости продукты выделения обусловливается
механизмами межтканевых корреляций, выходящих уже за рамки внут-
ритканевых взаимоотношений. Значение таких надсистемных механиз-
мов отчетливо прослеживается на железистых эпителиях. Особенно
наглядно это можно видеть на примере взаимоотношений эндокрин-
ной, нервной и нейросекреторной систем позвоночных и высших бес-
позвоночных животных.
Усиление значения межтканевых корреляций показано на кожных
зпителиях млекопитающих и птиц, где подлежащая соединительная
ткань в гистогенезе эпидермиса определяет и направление процессов
дифференцировки, и сам характер нормальных взаимоотношений меж-
ду репродукцией и дифференцировкой клеток в эпителиальном пласте.
Весьма демонстративно также включение в эпидермис высших позво-
ночных системы пигментных клеток — меланоцитов —- и образование
смешанных по происхождению клеток многослойных пластов со слож-
ными взаимоотношениями между этими разнородными субпопуляция-
ми.
Качественная особенность кишечных эпителиев высших позво-
ночных обусловливается в значительной мере образованием микроор-
ганных структур слизистой оболочки. Само же возникновение этих
структур связано с усилением и усложнением взаимодействия между
эпителием и подлежащей соединительной тканью и находящимися в
последней сосудами, нервными и мышечными клеточными элемента-
ми. В создании таких сложных систем, как лимфоидная ткань позво-
ночных, ведущая роль принадлежит межтканевым взаимодействиям,
поскольку свою иммунокомпетентность полустволовые клетки лимфо-
идной ткани приобретают в эпителиальной строме центральных орга-
нов иммунитета.
Еще одним примером большого значения межтканевых корреля-
ций могут служить взаимоотношения между кутикулярным эпителием
артроподного типа и системой гранулярных амебоцитов тканей внут-
ренней среды.
Таким образом, совокупность имеющихся в настоящее время фак-
в области сравнительной гистологии свидетельствует о том, что
выяснение закономерностей преобразования в филогенезе механизмов
УР0Вня организации многоклеточных животных, уровня,
ИМеетающего промежуточное положение между органным и тканевым,
принципиально важное значение для разработки общих проблем
Чионной гистологии. На этом уровне организации частично пре-
507
одолевается известное противоречие между относительной консерва-
тивностью и ограниченностью потенций специализированных клеток
и других тканевых элементов и прогрессивной эволюцией многокле-
точных животных.
Актуальным является вопрос о цитологических и молекулярно-
генетических основах явлений параллелизма.
Еще в 20-х годах нашего столетия наличие ограниченности, на-
правленности в наследственной изменчивости предвидел Н. И. Вави-
лов и сформулировал эту закономерность в виде закона гомологичных
рядов наследственной изменчивости. Суть этого закона заключалась в
том, что наследственная изменчивость не беспредельно многообразна
и случайна, а подчиняется определенным закономерностям. Новые
признаки, выявляемые у одних видов, как правило, будут обнаружи-
ваться у других видов. Фактический материал, на котором первона-
чально базировался этот закон, в значительной мере не соответствовал
его сущности в современном понимании описываемых в нем процес-
сов. Сходные признаки могли появляться у близких видов не в ре-
зультате мутаций гомологичных генов, а в результате мутаций в любом
из генов, обусловливающих развитие этого признака, что и было потом
показано в отношении ряда классических примеров, положенных в
основу закона Н. И. Вавилова.
Сходные взгляды высказывали и другие ученые, пытавшиеся вы-
яснить внутренние закономерности эволюционных процессов, не оп-
ределяемых всецело случайной наследственной изменчивостью и ес-
тественным отбором. В частности, Л. С. Берг в одном из основных
постулатов своей теории номогенеза об исходной целесообразности
живой материи под исходной целесообразностью, по сути дела, под-
разумевал наличие у живого вещества и клеток исходной организации,
изменения которой в ходе эволюции подчинены определенным внут-
ренним закономерностям и носят направленный характер. Несмотря
на ожесточенную критику этого положения ортодоксальными дарви-
нистами и философами за его якобы идеалистический характер, в свете
современных данных молекулярной генетики оно ближе к истине, чем
представления о безграничной дивергенции, случайных мутациях и
других основных положениях современного дарвинизма и синтетичес-
кой теории эволюции.
Аналогичный вывод можно сделать и в отношении представлений
акад. А. А. Заварзина об общих универсальных свойствах живого ве-
щества как об одной из основных предпосылок сходных, направленных
его изменений в ходе эволюции в аналогичных в функциональном
отношении гистологических структурах.
508
При весьма скудных сведениях о структурно-химической органи-
зации эукариотных клеток акад. А. А. Заварзин в первых эволюцион-
ных трактовках теории параллелизма наличие общих свойств живого
вещества усматривал в паранекротических изменениях его в ответ на
повреждающие воздействия. Лишь в конце своего творчества он при-
шел к выводу о том, что ведущая роль в будущих разработках эво-
люционных концепций, вскрывающих внутренние закономерности
эволюционной динамики живых организмов и его частных систем,
лежит в сравнительном анализе тонкой химической организации эу-
кариотных клеток.
Эти интуитивные предаидения выдающихся отечественных био-
логов первой половины 20 в. нашли подтверждение в наши дни в
развитии частной цитологии специализированных клеток и особенно
в широких молекулярно-генетических исследованиях. Удалось пока-
зать большую консервативность генов, кодирующих белки так назы-
ваемого «домашнего хозяйства» эукариотных клеток, обеспечивающих
их общий пластический и энергетический метаболизм. Эти гены сход-
ны по последовательности нуклеотидов у весьма отдаленных организ-
мов; сходство, очевидно, в значительной мере определяется отсутст-
вием возможности их изменений без ущерба для жизненно важных
функций организмов. Еще более интересным является другое свойство
генов, выявляемое в их больших родственных группах, образовавших-
ся в результате многократной дупликации и дивергенции одного ис-
ходного гена. Показано, что в этих семействах и надсемействах род-
ственных генов у одного организма и у разных, далеко отстоящих друг
от друга организмов в процессе эволюции наступает период, когда
прекращаются их дивергентные изменения, а эволюционные преобра-
зования приобретают направленный канонизированный характер.
В настоящее время появляется все больше и больше данных о
том, что процессы макроэволюции обусловливаются не точечными
случайными мутациями структурных генов, а закономерно направлен-
ными изменениями части регуляторных генов. Существенный вклад в
эволюционные процессы вносят и закономерные перераспределения в
геноме подвижных генетических элементов.
Очевидно, что закон гомологичных рядов наследственной измен-
чивости Н. И. Вавилова отражает в первую очередь описанные свой-
ства генетического материала, которые гениально предугадал Н. И. Ва-
вилов и интуитивно ощущали другие наши и зарубежные биологи-
эволюционисты.
Интересно, что нечто аналогичное отмеченной выше смене дивер-
генции генов на их параллельную эволюцию в мультигенных семей-
509
ствах характерно и для эволюции на органном и организменном уров-
нях. У зоологов и палеонтологов имеется уже много примеров о смене
периодов бурной дивергенции в эволюции длительными периодами
параллельного развития дивергировавших организмов. Поэтому не слу-
чайно наш выдающийся зоолог В. А. Догель еще в 1937 г. писал, что
золотой век сопоставлений по принципу гомологии в зоологии завер-
шился и имеется крайняя необходимость в сравнительно-зоологичес-
ких и палеонтологических работах учитывать многочисленные парал-
лелизмы, обусловленные внутренними факторами. Однако ясно и то,
что закономерно направленные изменения в эволюции живой материи,
определяемые внутренними закономерностями организации, по-разно-
му проявляются на разных уровнях организации материи: молекуляр-
но-генетическом, клеточном, тканевом, органном и организменном. Но
все они в конечном счете имеют, по-видимому, одну основу. Иссле-
дование взаимоотношений проявлений общей закономерности на раз-
ных уровнях организации живого представляется одной из наиболее
актуальных задач современной биологии.
Таким образом, обширный материал, приведенный в книге о спе-
циализированных клетках, надклеточных структурах и межклеточных
образованиях, свидетельствует о том, что в подавляющем большинст-
ве случаев мы можем говорить об этих тканевых структурах в типо-
вом смысле, применительно ко всем тканям основных типов много-
клеточных животных. Именно это относится и к фоторецепторам,
рецепторам растяжения мышц, рецепторам гравитации, вообще чувст-
вительным, ассоциативным и эффекторным нейронам, мышечным и
коллагеновым волокнам и многим другим специализированным клет-
кам и тканевым структурам. Принципиальное их сходство у разных
многоклеточных лишь частично обусловлено общностью происхожде-
ния соответствую-щих генов. В значительной мере сходные черты
определены сходным характером специализации аналогичных ткане-
вых элементов в разных группах животных. Это обусловлено сле-
дующими причинами: а) общими свойствами исходных эукариотных
клеток; б) специализацией на основе гипертрофии одной из общих
функций; в) общностью функциональных задач, стоящих перед этими
клетками у разных организмов.
Общность типовых признаков организации функционально анало-
гичных тканевых структур проявляется, однако, не в их тождестве, а
лишь в существенном ограничении варьирования этих структур. Это
обстоятельство обусловливает все возрастающее значение сравнитель-
ного метода исследования этих структур по принципу функциональной
аналогии как рабочего метода исследования типовых признаков.
510
Наиболее рациональным выявлением типов и основных подтипов
тканей является определение их как тканевых систем, возникших или
неоднократно возникавших в процессе эволюции для реализации об-
щих, аналогичных для всех многоклеточных животных функций. При
этом взаимоотношения более частных тканевых систем в рамках об-
щего подтипа или типа тканей определяются специфическими особен-
ностями эволюционной динамики данного типа или подтипа тканей.
Для кожных и в несколько меныпей степени кишечных эпителиев
характерна типичная дивергенция — реализация одной функциональ-
ной задачи принципиально разными способами (многослойные и ку-
тикулярные кожные эпителии, всасывающие и пищеварительные клет-
ки в кишечных эпителиях). Однако в эволюционной динамике этих
тканей в пределах каждой разновидности четко проявляются много-
численные примеры параллелизма (многослойные эпителии млекопи-
тающих, рептилий, миноги; кутикулярные эпителии асцидий, приапу-
лид, членистоногих; кишечные эпителии млекопитающих и насеко-
мых, новорожденных млекопитающих и пескожила).
Характерная особенность эволюционной динамики мышечных
тканей и осморегулирующих эпителиев — явления конвергенции и
параллелизма, многократного развития из разных источников функци-
онально аналогичтшгх структур, часто существенно отличающихся по
своим биологическим свойствам.
Эволюционная динамика тканей внутренней среды и тканей нерв-
ной системы характеризуется прежде всего дивергентной дифферен-
цировкой или эволюционным расщеплением образующих эти ткани
специализированных клеток. На этом общем фоне в обоих типах имеет
место и усложнение мультифункциональных элементов без расщепле-
ния. Вторая общая особенность — усиление интегративных механиз-
мов (сетевых и гуморальных), гистогенетического и функционального
единства.
Элементы указанных выше характерных особенностей эволюци-
онной динамики для отдельных типов и подтипов тканей, строго
говоря, характерны для всех рассмотренных в книге тканей. Однако
степень их проявления и удельный вес в эволюционной динамике
каждой ткани разные, что и позволяет сгруппировать их в три приве-
денные выше категории.
Помимо клеточного и тканевого уровней организации к компе-
тенции сравнительной гистологии относится и уровень межтканевых
отношений, приобретающих у высших животных существенную роль
в их эволюции. Приведенные в книге материалы свидетельствуют о
том, что и на этом уровне организации имеют место глубокие биоло-
гические аналогии. Наиболее наглядный пример таких аналогий —
511
сходные взаимоотношения между нервной, нейросекреторной и эндо-
кринной системами у первично- и вторичноротых животных.
В основе проявления закономерного, направленного и ограничен-
ного определенными рамками характера эволюционного процесса ле-
жат общие свойства живой материи, в частности свойства ее наслед-
ственной основы. Они проявляются в большой консервативности ге-
нов, кодирующих белки, обусловливающие общие функции эукариот-
ных клеток. Однако вряд ли справедливы утверждения сторонников
концепции универсализма о том, что вся эволюция на молекулярном
и надмолекулярном уровнях прошла уже у одноклеточных организмов,
а у многоклеточных имела место лишь комбинаторика приобретенных
ранее признаков.
В свете последних сравнительно-молекулярно-генетических дан-
ных и данных по пластичности генома представляется более вероятной
другая точка зрения. В ее основе лежит представление о том, что
наблюдаемые сходные признаки в генах, относящихся к семействам и
надсемействам гомологических генов, определяются не только об-
щностью их происхождения из одного исходного гена, но и направ-
ленной наследственной изменчивостью этих генов у филогенетчески
удаленных животных. Кроме того, процессы макроэволюции обуслов-
ливаются не столько точечными мутациями структурных генов, сколь-
ко закономерными наследственными изменениями в части регулятор-
ных генов. Существенную роль в процессах макроэволюции играют и
закономерные перемещения мобильных генетических элементов, су-
щественно изменяющих активность регуляторных и структурных ге-
нов.
Таким образом, хотя бы для генов в мультигенных семействах у
неродственных животных признается возможность параллельных из-
менений в эволюции. Нечто аналогичное обнаружено недавно палеон-
тологами. Они показали широкое распространение в эволюции парал-
лелизмов и на органном, и на организменном уровне. По мнению
специалистов, они определяются в конечном итоге общими внутрен-
ними свойствами живой материи. Именно эти внутренние закономер-
ности организации живой материи интуитивно почувствовали выдаю-
щиеся биологи в 20-е годы нашего столетия и постулировали ее в
законе гомологичных рядов наследственной изменчивости (Н. И. Ва-
вилов), теории номогенеза (Л. С. Берг) и теории тканевого паралле-
лизма (А. А. Заварзина).
512
ЛИТЕРАТУРА
Берг Л. С. Труды по теории эволюции. 1922-1930. Л., 1977. С. 387.
Борисов И. В., Дунаев П. В., Бежанов А Н. Филогенетические основы
тканей организации животных. Новосибирск, 1986.
Вавилов Н. И. (1920). Закон гомологических рядов наследственной измен-
чивости: Избр. тр., 1967.
Гиляров М. С. Общие направления эволюции насекомых и высших позво-
ночных // Зоол. журн. 1975. Т. 74, № 10.
Грибакин Ф. Г Зрительная система. Параллелизмы и функциональная эво-
люция //Тр. ЛОЕ. 1986. Т. 86. Вып. 1.
Заварзин А А Труды по теории параллелизма и эволюционной динамики
тканей. Л., 1986. С. 3-80.
Инге-Вечтомов С. Г. Генетика с основами селекции. М., 1989. С. 476-495.
Корочкин Л. И. Параллелизмы в молекулярной организации генома и про-
блемы эволюции / Молекулярные механизмы генетических процессов. М.,
1985. С. 132-145.
Мамкаев Ю. В. Проблема параллелизмов и морфологическая радиация //
Тр. ЛОЕ. 1986. Т. 86. Вып. 1.
Медников Б. М. Современное состояние н развитие закона гомологических
рядов в наследственной изменчивости // Проблемы новейшей истории эволю-
ционного учения. Л., 1981.
Назаров В. И. Учение о макроэволюции. М.» 1991. С. 216-260.
Светлов П. Г. Предисловие И Г. А. Невмывака. Алексей Алексеевич За-
варзин. Л., 1971.
Серовым Л. Н. О параллелизмах на субклеточном уровне организации
жи-вых систем И Вести. Леиингр. ун-та. 1987. Сер. 3. Вып. 1.
Татаринов Л. П. Очерки по теории эволюции. М., 1987.
Тыщенко В. П. Введение в теорию эволюции. Л., 1992. С. 214—235.
Уголев А М. Естественные технологии биологических систем. М., 1987
С. 3-311.
Эдельман Н. Топобиология Н В мире науки. 1987. № 7.
ОГЛАВЛЕНИЕ
Предисловие..........................................- - 3
Введение..... . . .... . -...... • ..... ......... 5
§1 . Становление эволюционных идей в гистологии......-
§2 . Определение понятия «ткань», классификация тканей... 13
§3 . Формирование тканей в онтогенезе...............16
§4 . Пролиферация и дифференцировка клеток при формиро-
вании тканей и в их нормальной жизнедеятельности.... 23
§5 . Современные методы исследования в гистологии...26
§6 . Место сравнительной гистологии в системе биологичес-
ких наук и ее значение для медицины и ветеринарии... 30
Часть 1. ЭПИТЕЛИАЛЬНЫЕ ТКАНИ ............................35
Глава 1. Кишечные эпителии............................36
§1 . Кишечные эпителии позвоночных животных.........-
§2 . Кишечные эпителии полухордовых, насекомых,
моллюсков и полихет .............................. 48
§3 . Кишечные эпителии низших многоклеточных........66
§4 . Общие закономерности эволюционной динамики кишеч-
ных эпителиев................................... 70
Глава 2. Кожные эпителии ........................... 78
§1 . Погруженные, однослойные и многорядные эпителии... 79
Однослойные и погруженные эпителии.................. —
Многорядные ресничные эпителии ................ 82
§2 . Кутикулярные эпителии........................ 86
Кутикулярные эпителии артроподного типа.......... —
Кутикулярные эпителии аннелидного типа...... ... 101
Кутикулярные эпителии нематодного типа........ 104
§3 . Многослойные эпителии....................... 106
§4 . Некоторые общие закономерности эволюционной
динамики кожных эпителиев..........................122
Глава 3. Железистые эпителии ........................126
§1 . Экзокринные железы.......................... 127
Одноклеточные железы ............................ —
Малоклеточные железы ................... .... 130
Многоклеточные железы .................................. —
§2 . Эндокринные железы........................... 137
514
§3 . Некоторые общие закономерности эволюционной дина-
мики железистых эпителиев...................... 155
Глава 4. Осморегулирующие и выделительные
эпителии .............................. 159
§1 . Смешанные осморегулирующие и выделительные
канальца................................... 160
§2 . Тонкая структурная организация фильтрационных и ре-
абсорбционных отделов осморетулирующих и выдели-
тельных канальцев..................................169
Фильтрационные аппараты............................—
Основные отделы эпителиальных канальцев......... 173
§3 . Вспомогательные осморегулирующие эпителиальные
системы............................................177
§4 . Некоторые общие закономерности эволюционной
динамики осморегулирующих и выделительных
эпителиев....................................... 181
Часть 2. ТКАНИ ВНУТРЕННЕЙ СРЕДЫ....................... 189
Глава 1. Оседлые трофические разновидности тканей
внутренней среды.................................. 195
§1 . Рыхлая соединительная ткань.....................—
§2 . Разновидности рыхлой соединительной ткани... 206
§3 . Интерстициальные трофические ткани беспозвоночных
животных...........................................210
Глава 2. Скелетные ткани..............................223
§1 . Скелетные ткани позвоночных животных___________ -
Плотная соединительная ткань ................. —
Хрящевая ткань ............................... 226
Костная ткань ...................................232
Взаимоотношения разновидностей скелетных тканей позво-
ночных животных........................ ........ 242
§2 . Опорные ткани беспозвоночных животных ........... 248
Глава 3. Клеточные и гуморальные механизмы
реализации функций газообмена
и свертывания (коагуляции) крови,
гемолимфы и полостной жидкости............. 258
§1 Дыхательные пигменты и клетки, реализующие функ-
цию газообмена.......................................-
515
§2 . Форменные элементы крови и полостной жидкости и
некоторые гуморальные механизмы, обеспечивающие
процессы коагуляции.....................................266
Глава 4. Древиие клеточные и некоторые гуморальные
защитные механизмы тканей внутренней
среды...........................................278
§1 . Клеточные системы...................................-
Фагоциты............................................. —
Регуляторные клетки........................-....... 285
§2 . Древние гуморальные защитные механизмы............288
§3- Воспалительные новообразования соединительной ткани
(клеточные механизмы процессов воспаления) .. .... 290
Глава 5. Лимфоидная ткань................................295
§1 . Происхождение и общая характеристика лимфоидной
системы позвоночных животных..............................-
§2 . Реакции гуморального иммунитета... ..... .. 298
Общая характеристика реакции........................ —
Антигеннезависимая дифференцировка В-лимфоцитов.... 304
Антигензависимая дифференцировка В-лимфоцитов ........ 307
Периферические органы лимфоидной системы.............ЗЮ
Развитие системы В-лимфоцитов у позвоночных живот-
ных.................................................... 315
§3 . Реакции клеточного иммунитета..... ...............320
Общая характеристика реакции......................... —
Рецепторы Т-лимфоцитов и антигенпредставляющих
клеток............................................. 322
Реакции трансплантационного иммунитета............. 325
Тимус- и антигеннезависимая дифференцировка
Т-лимфоцитов.......................................... 328
Эволюционная динамика реакций клеточного иммуни-
тета.................................................. 332
§4 . Некоторые общие закономерности организации
лимфоидной ткани и реакций иммунитета...................333
Глава 6. Организация процессов репродукции
в обновляющихся тканях внутренней
среды................................................. 340
§1 . Организация кроветворения у позвоночных живот-
ных ......... .......................................... -
§2 . Организация кроветворения у беспозвоночных
животных............................................ 356
516
§3 . Проблема обновления механоцитов.............360
Глава 7. Некоторые общие закономерности
эволюционной динамики тканей внутренней
среды.................................... ......... 364
Часть 3. МЫШЕЧНЫЕ ТКАНИ. .. ........................ 370
Глава 1. Поперечнополосатые и косоисчерченные
соматические мышечные ткани.........................371
§1 . Мышечные ткани, образованные поперечнополосатыми
симпластическими волокнами........................372
§2 . Поперечнополосатые мышечные ткани, представленные
системой мышечных и эпителиально-мышечных
клеток.......................................... 387
§3 . Косоисчерченные мышечные ткани -............389
Глава 2. Целомические поперечнополосатые
мышечные ткани......................................391
§1 . Строение целомической мышечной ткани позвоночных
и беспозвоночных животных........................ 392
§2 . Сопоставление процессов гистогенеза, биологических
свойств и регенераторных возможностей у соматичес-
ких и сердечных мышечных тканей................. 397
Глава 3. Гладкие мышечные ткани ...».............. 401
§1 . Гладкая мышечная ткань беспозвоночных животных.-
§2 . Гладкая мышечная ткань позвоночных животных...405
Глава 4. Общая характеристика эволюционной
динамики мышечных тканей - ....................... 409
Часть 4. ТКАНИ НЕРВНОЙ СИСТЕМЫ.............. ........ 417
Глава 1. Нервные клетки и синапсы................ 418
§1 . Нейроны, или нервные клетки....................~
§2 . Межнейронные и нервно-мышечные синапсы......427
Глава 2. Рецепторные нервные окончания,
рецепторы............................... ...... ... 441
§1 . Интероцепторы ............................. 442
Фатерпачиниеео тельце........................... ~
Рецепоторы растяжения мышц ................. . 444
§2 . Экстероцепторы ........................ 445
Механорецепторы.............................. 446
Хеморецепторы............................. .... 451
517
Фоторецепторы ..................................456
Глава 3. Нейроглия...................................462
§1 . Нейроглия позвоночных........................ 463
§2 . Нейроглия центральных органов нервной системы
беспозвоночных................................... 468
§3 . Роль нейроглии в регенерации нервов и перифери-
ческая глия беспозвоночных............. ......... 472
Глава 4. Нейросекреторные системы, регуляторные
нейропептиды и соотношение гуморальной
и нервной интеграции.................................475
§1 . Нейросекреторные системы ......................—
§2 . Взаимоотношения интегративных систем в организме
млекопитающих и насекомых ................... 479
§3, Регуляторные нейропептиды. Современные представле-
ния о соотношении нервной и гуморальной интегра-
ции ...............................................-
Глава 5. Некоторые общие закономерности
эволюционной динамики тканей нервной
системы ......................................... 480
§1 . Классификация отделов нервной системы и нервных
центров..........................................
§2 . Туловищные (ядерные) нервные центры..........482
§3, Экранные центры на примере зрительного анализа-
тора. ........................................ 487
Заключение. .........................................497