Автор: Заварзин А.А.
Теги: гистология животных биология клетки и субклеточных частиц цитология медицина гистология
Год: 1985
Текст
(X новы
CPAi НИТ17 J IЮЙ
ГИСТОЛОГИИ
ЛЕНИНГРАДСКИЙ ОРДЕНА ЛЕНИНА
И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ А. А. ЖДАНОВА
А. А. Заварзин
основы
СРАВНИТЕЛЬНОЙ
ГИСТОЛОГИИ
Допущено Министерством высшего и
среднего специального образования
СССР в, качестве учебного пособия для
студентов, обучающихся по специаль-
ности «Биология»
ЛЕНИНГРАД
ИЗДАТЕЛЬСТВО ЛЕНИНГРАДСКОГО УНИВЕРСИТЕТА
1985
Печатается по постановлению
Редакционно-издательского совета
Ленинградского университета -
УДК 591.8:576.3
Заварзин А. А. Основы сравнительной гистологии: Учеб, пособие. —
Л.: Изд-во Ленингр. ун-та, 1985. 400 с.
В учебном пособии с исторических1 позиций рассматривается эволюци-
онная динамика основных типов тканей: эпителиальных, .внутренней среды,
мышечных и нервных. Дается характеристика истории развития эволюцион-
ных идей в гистологии, современных методов исследования и общих зако-
номерностей формирования тканей в,онто- и филогенезе.
Наличие общей эволюционной идеи придает изложению необходимую
цельность, облегчает восприятие разнообразного сравнительного материала
по структурно-химической .организации однотипных в функциональном от-
ношении тканей у основных типов животных.
Предназначено для студентов биологических факультетов университе-
тов. Мб>кет служить краткой сводкой по частной цитологии и сравнительной
гистологии1 для’ специалистов гистологов и биологов смежных специально-
стей.'
Библиогр. 141 назв. Ил. 105.
Рецензенты: кафедра цитологии и гистологии Моск. гос. ун-та
(зав.— д-р биол. наук Ю. С. Ченцов),/д-р биол. наук. П. П. Румянцев (Ин-т
цитологии АН СССР).
2005000000—060
3 076(02)—85 90~ 85
© Издательство
Ленинградского
университета,
1985 г._
Столетию со дня рождения,
светлой памяти академика
Алексея Алексеевича Заварзина
свой труд посвящает автор
ПРЕДИСЛОВИЕ
Настоящая книга представляет собой пособие по курсу ги-
стологии для биологических факультетов университетов. Она
написана в соответствий с новой типовой программой этого
курса, в разработке которой автор принимал активное участие.
Учебник создан1 на основе более чем 15-летнего опыта препода-
вания и совершенствования курса сравнительной гистологии на
кафедре цитологии и гистологии Ленинградского государствен-
ного университета.
Большой сравнительный материал по организации и функ-
циональному значению тканей и составляющих их элементов
у представителей основных типов многоклеточных животных
излагается в учебнике с позиций исторического эволюционного
подхода, основы которого были заложены в отечественной ги-
стологии-еще в первой половине XX века. Одним из основных
достижений такого подхода было создание теории параллелиз-
ма тканевых структур. Эта теория объясняла многочисленные
уже в тот период факты, свидетельствующие о наличии общих
закономерностей изменения функционально-аналогичных тканей
у неродственных животных. Бурное развитие общей и частной
цитологии во второй половине XX века и громадный сравни-
тельно-гистологический материал, полученный с помощью со-
временных методов исследования, показал справедливость
основных положений такого эволюционного исторического
подхода. Углубленный анализ организации тканей выявил
направленный закономерный характер их преобразований
в филогенезе, что позволяет осветить их эволюционную дина-
мику с позиций современной интерпретации теории паралле-
лизма. Такая попытка уже была сделана нами в 1976 г. в мо-
нографии «Основы частной цитологии и сравнительной гисто-
логии . многоклеточных животных». Естественно, что приведен-
ные в ней материалы и их теоретическое освещение нашли
1*
3
отражение и в настоящей книге. Однако они существенно пере-
работаны и в силу необходимости сделать изложение более
доступным для студентов, и в связи с большим прогрессом на-
ших знаний за истекшее десятилетие.
Необходимость издания подобного учебника для биологов
не вызывает сомнений. Наличие отечественной и переводной
учебной литературы по гистологии для медиков не может вос-
полнить остро ощущающийся пробел в такой литературе по
курсу гистологии для студентов-биологов. По нашему глубо-
кому, проверенному практикой убеждению курс гистологии на
биологических факультетах университетов должен знакомить
студентов с общими закономерностями организации и измене-
ний в эволюции тканей всех многоклеточных животных, а не
только млекопитающих и человека, как это характерно для
медицинского курса гистологии. Эта принципиальная особен-
ность сближает наш курс с курсом зоологии. С другой стороны,
в методическом отношении и по глубине анализа тканевых
структур гистология сейчас все теснее оказывается связанной
со структурной биохимией и целым, комплексом наук, объеди-
няемых в новую синтетическую науку — биологию клетки. Та-
кое промежуточное положение гистологии в системе биологи-
ческого образования резко усиливает ее значение, поскольку
обеспечивает одну из цепочек неразрывной связи, которая
должна существовать в современной биологии между зоологией
и науками физиолого-биохимического профиля.
Помимо основной задачи учебного пособия — ориентиров-
ки его на студентов и преподавателей биологических специаль-
ностей университетов, книга может служить и краткой сводкой
современных представлений по общим и частным вопросам
эволюционной гистологии. С этой целью каждая часть снабже-
на кратким, но тщательно подобранным списком новой ли-
тературы (преимущественно за последние 5—10 лет). Более
полные литературные данные и основная литература до 1975 го-
да имеются в приведенных работах и обзорах, в частности в мо-
нографии «Основы частной щитологии и сравнительной гисто-
логии» и в переводном современном руководстве по гистологии
Хэма и Кормака.
Характеристика функционального значения тканевых струк-
тур на основе анализа их структурно-химической организации
сейчас весьма сложная задача, требующая знания большой
специальной литературы. В связи с этим при написании от-
дельных глав учебника мы пользовались консультациями специ-
алистов, работающих в данных областях. За эти консультации,
позволившие избежать ошибок и неточностей, автор при-
носит глубокую благодарность С. П; Гамбаряну, Ф. Г. Грибаки-
ну, А. К. Дондуа, Б. И. Иоффе, Ю. В. Мамкаеву, Ю. В. Нато-
чину, С. А. Кроленко, Г. П. Пинаеву, С. И. Плотниковой,
А. Л. Поленову, О. Г. Строевой.
4
Кроме того, существенную консультативную помощь оказали
автору по отдельным разделам сотрудники кафедры, ведущие
специальные курсы или работающие на отдельных тканевых
системах (Е. Н. Горышина, М. Н. Молитвин, Т. В. Серговская,
II. В. Соловей, О. Ю. Чага, Е. В. Обухова, Д. К. Обухов,
А. Д. Харазова).
Большое количество ценных замечаний высказали и офици-
альные рецензенты — директор Института цитологии АН СССР
нроф. П. П. Румянцев и коллектив кафедры гистологии Мос-
ковского Университета (заведующий проф. Ю. С. Ченцов).
Автор выражает им искреннюю благодарность и приносит изви-
нения в том, что по техническим причинам не все замечания
удалось учесть в настоящем издании книги.
В книге широко использованы результаты научно-исследо-
вательских работ сотрудников и студентов кафедры цитологии
п гистологии, особенно в разделах, посвященных эпителиаль-
ным тканям и тканям внутренней среды. Сердечно благодарит
автор М. Н. Молитвина, И. В. Соловей, М. Ю. Пунина за боль-
шую работу по творческому изготовлению большого количества
оригинальных рисунков, а также 3. А. Зайченко, Т. В. Сергов-
скую, Е. В. Обухову, Т. Г. Шапошникову и других сотрудников
кафедры за техническую работу по подготовке рукописи к пе-
чати.
Часть I
СРАВНИТЕЛЬНАЯ, ЭВОЛЮЦИОННАЯ
ГИСТОЛОГИЯ, СОВРЕМЕННОЕ СОСТОЯНИЕ
И ЕЕ ЗНАЧЕНИЕ В СИСТЕМЕ
БИОЛОГИЧЕСКИХ НАУК
Глава 1. ВОЗНИКНОВЕНИЕ ИСТОРИЧЕСКОГО
ПОДХОДА В ГИСТОЛОГИИ. ОБЩАЯ ХАРАКТЕРИСТИКА
ТКАНЕЙ МНОГОКЛЕТОЧНЫХ
§ 1. Разработка эволюционных идей в гистологии
Гистология — наука о тканях многоклеточных живот-
ных— зародилась в недрах анатомии человека еще до откры-
тия клеток. В ее основу легли результаты исследований анато-
мов, стремившихся выявить тонкую структуру органов челове-
ка. Основоположником гистологии считают французского
анатома Биша, который, используя усовершенствованные ме-
тоды анатомической препаровки и мацерирования различных
органов человека, еще в 1801 году предложил первую класси-
фикацию тканей. Им было дано и первое определение тканей
как общих систем организма, входящих в состав разных
органов.
Интенсивное развитие гистологии на научной основе нача-
лось после открытия клетки и формулирования клеточной тео-
рии, установившей единство организации и общность проис-
хождения живых существ. В начале своего становления гисто-
логия интенсивно развивалась и в рамках медицинских наук,
и как часть зоологии, характеризуя микроскопическое строение
органов различных групп многоклеточных животных. Большой
сравнительно-гистологической материал, накопленный зоолога-
ми к концу XIX века, естественно не мог не привлечь внимания
морфологов-эволюционистов, разрабатывавших новую филоге-
нетическую систематику и создавших на основе учения Дар-
вина естественное филогенетическое древо животного царства.
Первую попытку применить для анализа тканевого уровня организации
методы и подходы эволюционной морфологии (сопоставление ткане'й по
принципу гомологии, использование биогенетического закона) сделал изве-
стный немецкий зоолог-эволюционист Э. Геккель. Ему принадлежит теория
происхождения многоклеточных из гипотетических примитивных двуслойных
живых организмов — теория гастреи. В онтогенезе современных многокле-
6
точных животных этот этап филогенеза находит отражение, по его мнению,
в стадии инвагинационной гаструлы. Анализируя последующую дифферен-
цировку таких гаструл, Э. Геккель пришел к выводу, что происходящие при
этом процессы рекапитулируют дивергентную дифференцировку тканей в фи-
логенезе многоклеточных животных. Исходя из этого положения, он создал
первую гистогенетическую систему тканей, приняв за основу своей класси-
фикации источник развития ткани в онтогенезе.
Таким образом, базируясь иа упрощенной трактовке биогенетического
закона (онтогенез повторяет филогенез), Геккель заключил, что его гисто-
генетическая система отражает историю происхождения тканей в филоге-
незе и является следовательно естественной, филогенетической системой
тканей.
Эти построения Э. Геккеля не получили, однако, поддержки ни у гис-
тологов-зоологов, ни в медицинской гистологии. Специалисты-медики при-
няли систему тканей, предложенную немецкими гистологами Лейдигом
и Келликером. В основу ее были положены морфофункциональные при-
знаки, .согласно которым все ткани разделялись. на четыре основных типа:
эпителиальные ткани, кровь и соединительную ткаиь, мышечную и нервную
ткани. Эта классификация оказалась более удобной для характеристики мик-
роскопического строения органов человека и патологических процессов в них.
С другой стороны, гистологи-зоологи не могли ие обратить внимания
на большое сходство в строении тканей у животных, далеко отстоящих
в филогенетическом отношении, в частности, при сравнении. позвоночных
и беспозвоночных животных. Сам факт такого сходства, по мнению зооло-
гов-микроскопистов начала XX века, указывал на неприменимость к ткане-
вому уровню организации традиционных методов и подходов эволюционной
морфологии. .'
Более биологичным оказался подход к вопросу о происхож-
дении многоклеточных нашего выдающегося биолога И. И. Меч-
никова. На основании ’обширных сравнительно-эмбриологиче-
ских исследований низших многоклеточных животных он при-
шел к выводу о том, что наиболее примитивным способом
гае'труляции является миграция единичных клеток внутрь фор-
мирующегося зародыша. И. И. Мечниковым была сформулиро-
вана теория фагоцителлы, согласно .которой первичные
многоклеточные животные представляли собой колонию одно-
клеточных организмов с лабильной дифференцировкой на по-
верхностные жгутиковые и внутренние амебоидные клетки. Та-
кая дифференцировка в дальнейшем привела по его мнению,
к возникновению первичной постоянной поверхностной ткани —
кинобласта — и системы погруженных внутрь клеток — фагоци-
тобласта. В последнем по мере прогрессивного развития жи-
вотных дифференцировался эпителизированный кишечник. Тео-
рия фагоцителлы глубоко физиологична и более соответствует
сравнительно-зоолоЬическим данным. По этой теории первичный
способ усвоения пищи — внутриклеточное пищеварение, что не-
сомненно весьма вероятно при допущении происхождения мно-
гоклеточных из колоний одноклеточных организмов с их хоро-
шо развитыми процессами фаго- и пиноцитоза. Кроме того,
И. И. Мечников считал, что некоторые признаки лабильной
дифференцировки сохраняются и у современных низших много-
клеточных.
7
Теория фагоцителлы имеет принципиальное значение и для
эволюционной гистологии, поскольку она функционально обо-
сновывает возникновение первичных тканей.
Помимо теории фагоцителлы большое значение для срав-
нительной гистологии имело также учение И. И. Мечникова
о фагоцитах. По сути дела ему принадлежат первые иссле-
дования, анализирующие в сравнительном аспекте эволюцион-
ную динамику этих специализированных клеток. Й. И. Мечни-
ковым было показано, что исторической основой защитных
фагоцитарных реакций специализированных клеток высших жи-
вотных является филогенетически древний процесс— фагоцитоз,
исходно связанный с питанием и внутриклеточным пищеваре-
нием. Такой подход к анализу специализированных клеток, как
будет показано при характеристике тканей внутренней среды,
не только не утратил своего значения, но и приобретает все
большую актуальность И. И. Мечников, не будучи гистологом,
в дальнейшем, к сожалению, не разрабатывал общегистологи-
ческие аспекты этой проблемы.
В начале XX века интерес к эволюционным вопросам в ги-
стологии несколько снизился. Причиной этого было, с одной
стороны, преимущественное развитие гистологии на медицин-
ских факультетах университетов. С другой стороны, немного-
численные гистологи-зоологи хотя и продолжали накапливать
сравнительно-гистологический материал, не могли дать ему
эволюционную трактовку. Такая попытка в отношении тканей
позвоночных животных с позиций классической эволюционной
морфологии была сделана в 30-е годы А. Н. Северцовым —
известным советским морфологом-эволюционистом. А. Н. Се-
верцов считал, что установленные им закономерности измене-
ний органов и их систем, в процессе эволюции свойственны
и тканям исследуемых животных. Им приводился ряд приме-
ров рекапитуляций примитивных черт предков при эмбрио-
нальном гистогенезе некоторых тканей.
Однако будучи зоологом А. Н. Северцов не занимался спе-
циально проблемой эволюции тканей. Эту задачу несколько
позже пытался выполнить отечественный гистолог А. В. Ру-
мянцев. Он рассмотрел с позиции теории филэмбриоге-
неза Северцова преобразования в эволюции позвоночных жи-
вотных хрящевых и костных тканей и пришел к выводу, что
в отношении этих конкретных тканей оправдываются методы
и подходы классической эволюционной морфологии, разрабо-
танные А. Н. Северцовым. Однако для более широких сопостав-
лений и выяснения общих закономерностей изменения тканей
в эволюции всех многоклеточных животных нужны, по мнению
А. В. Румянцева, подходы и методы, учитывающие специфику
тканевого уровня организации. '
К иному выводу в середине 40-х годов пришел Н. Г. Хло-
пин. В своих работах, результаты которых нашли отражение
8
в монографии «Экспериментальные и биологические основы
гистологии» (1946), помимо традиционного для эволюционной
морфологии анализа источников развития тканей в онтогенезе
Н. Г. Хлопин широко использовал метод культивирования тка-
ней вне организма. Он показал, что во многих случаях при
определенных условиях характер роста ткани по периферии
культивируемого кусочка отражает ее биологические особенно-
сти и специфику происхождения из определенных эмбриональ-
ных зачатков. С помощью этого метода ему удалось уточнить
классификацию эпителиальных и мышечных тканей. Н. Г. Хло-
пин выявил относительно позднее в эволюции позвоночных про-
исхождение так называемых вторичных и третичных тканей.
Примером вторичных тканей может служить целомическая мы-
шечная ткань, возникшая из эпителиальной выстилки целома.
Еще более позднее —третичное — появление в эволюции харак-
терно для так называемых нейральных мышечных тканей, обра-
зующих у позвоночных животных сфинктер и дилятатор зрач-
ка. По своим морфофункциональным свойствам эти мышечные
ткани сходны с первичными соматическими и висцеральными
мышцами, однако отличаются некоторыми специфическими осо-
бенностями.
Классификация тканей по источникам их развития в онто-
генезе имела значение для доказательства стойкой детермини-
рованности тканей в онтогенезе и невозможности их мет а-
плазии — превращения друг в друга во взрослом организме,
а также для рациональной классификации опухолей человека
и выяснения источников их развития.
Н. Г. Хлопин, однако, не ограничился этими результатами.
Он повторил попытку Геккеля создать естественную си-
стему тканей и выявить основные закономерности их изме-
нений в эволюции многоклеточных животных (рис. 1). Гисто-
генетическая система Хлопина более точно отражает
источники развития тканей у позвоночных животных, чем си-
стема Геккеля. Она основана на более тщательном изучении
процессов гистогенеза позвоночных животных, и при ее разра-
ботке использован большой экспериментальный и патогистоло-
гический материал. Однако эта система применима лишь к по-
звоночным животным и не может претендовать на естествен-
ную систему тканей, которая отражала бы пути их становления
в филогенезе многоклеточных животных. Кроме того, сам
принцип разделения тканей на типы лишь, путем анализа про-
цессов гистогенеза по относительно формальному критерию —
местоположению клеток, дающих начало той" или иной ткани,
чреват серьезными ошибками и противоречиями. Так, эритроци-
ты, сосудистый эндотелий и лейкоциты оказались у Хлопина
в составе разных тканей (рис. 1). В гистогенетической системе
тканей Хлопина недостаточно учитывался морфофункциональ-
ный момент, что не давало возможности проводить широкие
9
Эпителий Соединительная ткань и кровь Мышечная ткань Нервная ткань
Рис. 1, Схема соотношения естественной (гнстогенетической) системы гистологических структур с классификацией
по морфофункдиональпому признаку на четыре типа [Н. Г. Хлопни, 1946].
10
сравнительно-гистологические сопоставления, т. е. лишало ги-
стологию основного метода исследования, направленного на
выяснение общих закономерностей измёнения тканей в филоге-
незе. Основной вывод Н. Г. Хлопина о том, что у многоклеточ-
ных животных в ходе эволюции увеличивается разнообразие
тканей и, следовательно, основной закономерностью их эволю-
ционных преобразований является дивергентная диф-
ференцировка, справедлив лишь в самой общей форме.
В таком виде эта закономерность уже давно была известна
гистологам и не требовала специальных доказательств.
Н. Г. Хлопин лишь формально учитывал в своих построениях
ограниченность дивергентной дифференцировки относительно
жесткими рамками четырех морфофункциональных типов тка-
ней. Так, например, развивающаяся из целомической выстилки
сократимая ткань не является особой новой тканью и по мно-
гим важным признакам характеризуется как специфическая
мышечная ткань. Она вполне аналогична мышечной ткани
древнего соматического типа.
Таким образом, еще одна попытка применить классические
приемы- эволюционной морфологии к анализу общих законо-
мерностей эволюции тканей у всех многоклеточных животных
столкнулась с большими трудностями и ограничениями. Оче-
видно, что для внедрения в гистологию исторического подхода
необходимо было разработать особый метод сравнительного
анализа. Целенаправленное его использование должно было бы
объяснить закономерный, направленный и ограниченный харак-
тер эволюционных преобразований тканей. Такой метод был
разработан и с успехом использован основоположником оте-
чественной эволюционной гистологии А. А. Завар-
зиным.'
А. А. Заварзин был учеником профессора А. С. Догеля, дли-
тельное время возглавлявшего кафедру гистологии Петербург-
ского университета. Эта кафедра воспитала многих первоклас-
сных биологов-гистологов и цитологов. Уже в своей магистерской
диссертации в 1913 г. А. А. Заварзин проводит сопостав-
ление исследованных им нейрональных отношений (топогра-
фических взаимоотношений нервных клеток и их отростков)
в оптических центрах насекомых с изученными ранее нейро-
нальными отношениями в оптических центрах птиц и головоно-
гих моллюсков. Такое сопоставление выявило принципиальное
сходство организации функционально аналогичных структур
у представителей трех далеко отстоящих друг от друга типов
животного царства. В дальнейшем аналогичные сопоставления
были проведены А. А. Заварзиным между нейрональными от-
ношениями в спинном мозге' позвоночных и брюшной цепочке
насекомых и ряде других отделов нервной системы этих жи-
вотных. Развивая исследования И. И. Мечникова, А. А. Завар-
зин и его сотрудники провели исследования по изучению вос-
11
палительного новообразования соединительной ткани у пред-
ставителей ракообразных, насекомых, моллюсков и низших по-
звоночных. Эти работы также показали наличие принципиаль-
ного сходства в развитии воспалительных и регенераторных
процессов у представителей весьма отдаленных групп живот-
ных, не связанных между собой близко родственными отноше-
ниями.
Сопоставление результатов сравнительно-гистологических
работ на относительно статичных тканях нервной системы и ди-
намичных тканях внутренней среды у разных групп животных
привело А. А. Заварзина к выводу о плодотворности предло-
женного им метода сравнения по принципу функ-
циональной аналогии. При таком сопоставлении уда-
лось обнаружить принципиальное структурное сходство даже
у далеко отстоящих форм. Оно свидетельствовало о том, что
эволюционные преобразования тканей у разных животных про-
исходят в принципе сходно, параллельно. Иными словами, при
преобладающем дивергентном развитии организмов изменения
их функционально-аналогичных тканей происходят в основном
в одном, общем для всех групп животных направлении.
Эти основные положения своей теории параллелиз-
ма тканевых структур А. А. Заварзин еще в 1925 году иллюст-
рировал схемой, представленной на рис. 2. Исходное недиффе-
ренцированное на ткани состояние первичных многоклеточных
изображено в виде круга. Расходящиеся от этого круга лучи
отражают направленное усложнение формирующихся функци-
онально-аналогичных тканей многоклеточных. Один из рас-
пространенных способов такого усложнения — увеличение в со-
ставе ткани специализированных клеток, что на схеме показано
увеличением количества линий в исходных лучах, отражающих
развитие одной ткани. При такой трактовке удовлетворитель-
ное объяснение получает и удивительное сходство аналогичных
тканей у неродственных животных, а также неравномерное
развитие тканей у одного животного — более высокий уровень
развития одних при относительно низких уровнях развития
других тканей..
По Заварзину, причиной направленности преобразования
тканей в ходе эволюции животных является,- во-первых, общая
для данного типа тканей функциональная задача (сократи-
мость, интегративная функция, функция обеспечения постоян-
ства внутренней среды и др.). Во-вторых, направленность эво-
люционных преобразований функционально-аналогичных тка-
ней обусловливается общими закономерностями организации
эукариотных клеток. На основе этих общих свойств и происхо-
дит у всех животных специализация клеток в направлении реа->
лизации той или иной конкретной функции.
Направленное, закономерное преобразование тканей в сто-
рону более совершенного осуществления ими специфических
12
функций не означает, однако, что у всех организмов оно
совершается абсолютно идентичными, тождественными пу-
тями.
В связи с этим основной задачей сравнительного метода
в гистологии является, по А. А. Заварзину, выяснение этих мо-
дификаций у разных групп животных и в первую очередь у да-
леко отстоящих в филогенетическом отношении. Сопоставление
функционально-аналогичных тканей и тканевых структур у этих
Рис. 2. Схема принципа параллелизма гистологических структур. [Завар-
зин А. А. 1925].
Окружность в центре обозначает примитивное, недифференцированное состояние пред-
ков многоклеточных животных. Лучи А, Б, В, Г, Д, Е показывают направленную
дифференцировку гистологических структур, выполняющих сходную функцию у всех
многоклеточных животных; А}, Л2, а2, аз и т. д.— степень дифференцировки систе-
мы, проявляющуюся в увеличении количества узкоспециализированных тканевых эле-
.ментов. Пунктирная линия — «формула» организма, сочетающего в своих структурах
высокий уровень дифференцированности по одной функции (например, Л) с низким
уровнем по другой функции (например, Б).
13
животных позволяет выявить и общие типовые признаки их
структурной организации и ее возможные варианты. Послед-
ние, по мнению А. А. Заварзина, обусловлены, с одной сторо-
ны, особенностями общего плана строения организма, а с дру-
гой— отражают известную пластичность живой материи в реа-
лизации общих функциональных задач.
Совокупность общих типовых признаков организации данной
ткани у разных животных и ее модификаций у представите-
лей отдельных групп животных и составляет эволюцион-
ную динамику этой ткани. Под этим термином А. А. За-
варзин понимал исторически обусловленные свойства и потен-
ции к совершенствованию в определенном направлении функ-
ционально-аналогичных тканей во всем многообразии их про-
явлений у современных многоклеточных животных.
Проблема эволюционной динамики тканей как основная
проблема эволюционной гистологии и сравнительный метод
для ее разработки были сформулированы А. А. Заварзиным
в 1934 году и обоснованы им в известных монографиях по
нервной системе (1941), крови и соединительной ткани (1945—
1947).
Помимо работ А. А. Заварзина, А. В. Румянцева, Н. Г. Хло-
пина, заложивших основы внедрения исторического подхода
для анализа тканевого уровня организации многоклеточных
животных, в первой половине XX века в отечественной гистоло-
гии наблюдалась тенденция ' к использованию сравнительного
метода и для решения более частных гистологических проблем,
имеющих прикладное значение. В качестве примера можно
привести широкую серию сравнительных .исследований по эндо-
кринным и нейросекреторным системам рыб, положенных в ос-
нову технологии искусственного рыборазведения.
Характерный для отечественной гистологии общебиологиче-
ский подход к анализу тканевогб уровня организации приобре-
тает особое значение в настоящее время. Появление большого
количества принципиально новых методов исследования позво-
лило значительно углубить наши представления о структурно-
химической организации ,тканевых элементов и их взаимодей-
ствии в составе тканей. При этом оказалось, что функциональ-
но-аналогичные тканевые элементы и ткани разных животных
характеризуются хотя и не тождественными, но сходными за-
кономерностями структурно-химической организации на моле-
кулярном и надмолекулярном уровнях.
В связи с этим сравнительные исследования и сопоставле-
ния в гистологии и частной цитологии стали весьма актуаль-
ными не только для выяснения закономерностей эволюции, но
и как метод анализа общих принципов структурно-химической'
организации функционально аналогичных структур.
Естественно, что для такого использования сравнительного
метода глубокие теоретические разработки наших предшест-
14
венников являются и основой для обобщения большого нового
сравнительного материала, и базой для постановки целенаправ-
ленных сравнительно-гистологических работ.
§ 2. Определение понятия ткани. Классификация тканей
У подавляющего большинства современных многоклеточных
животных клетки и межклеточные структуры объединены в осо-
бые системы — ткани. Следовательно помимо клеточного и ор-
ганного уровней организации многоклеточных животных сущест-
вует еще особый тканевый-уровень. Ткани представляют собой
более общие системы организма, чем его органы, т. е. в состав
различных органов входят обычно одни и те же типы тканей.
Тканью в широком смысле этого понятия следует считать
систему элементов (клеток и образуемых' ими межклеточных
структур), объединенных общей функцией и структурно-хими-.
ческой организацией: Поскольку таких общих -функций относи-
тельно немного (пограничность, создание постоянства, внутрен-
ней среды, сократимость, восприятие, передача, и анализ раз-
дражений), то и все многообразие тканей можно объединить
в четыре основных типа: пограничные ’(эпителиальные), ткани
внутренней среды (кровь, интерстициальные, скелетные), ткани
нервной системы и мышечные ткани. Эти четыре типа тканей
с большим или меньшим удельным значением в составе разно-
образных органов имеются у всех многоклеточных животных,
поскольку они обеспечивают самые общие стороны взаимоот-
ношения организма и окружающей его среды.
В каждом типе тканей, особенно у высших животных, вы-
деляется большее или меньшее количество частных систем —
подтипов и разновидностей данного типа тканей. Они специа-
лизированы на выполнение частных функций в пределах
общей типовой функции. Так, например, жидкая ткань — кровь
и лимфа позвоночных — осуществляет перенос продуктов обме-
на и питательных веществ по сосудам, а другая разновидность
тканей внутренней среды-—рыхлая соединительная ткань —
при помощи других механизмов транспортирует эти вещества
от стенок сосудов к работающим тканям. Аналогичные разно-
видности можно выделить в типе тканей нервной системы. Нерв-
ные клетки осуществляют основную функцию тканей этого ти-
па, однако они не могут полноценно работать без «обслужива-
ния» нейроглией — особой вспомогательной разновидностью
тканей нервной системы.
В составе разновидности ткани можно выделить и более ча-
стные категории — клеточные популяции. Они,, как правило,
объединены топографически или гистогенетически общими, ме-
ханизмами регуляции, репродукции и гибели клеток для со-
хранения постоянства их общего количества в популяции. Так,
в системе клеток крови млекопитающих можно выделить попу-
15
ляции эритроцитов, гранулоцитов, моноцитов, мегакариоцитов
и лимфоцитов. В кишечном эпителии естественно выделяется
популяция клеток в системе крипта-ворсинки, в кожном эпите-
лии — популяции клеток волос, ногтей, копыт и других образо-
ваний. В свою очередь при конкретных исследованиях тонких
механизмов регуляции количества клеток в популяциях целе-
сообразно выделять в них еще более частные системы — суб-
популяции, а в идеале и клоны, т. е. клетки, возникающие при
размножении и дифференцировке одной исходной клетки. Та-
ким образом, в ряде случаев удается составить в пределах
хотя бы одной группы животных сложную, но достаточно ло-
гичную иерархию данной тканевой системы, начиная от типа
и кончая клеточными клонами.
Однако для большинства тканевых типов, особенно если
проводить характеристику данного типа тканей применительно
ко всем многоклеточным животным, наблюдаются более слож-
ные отношения. Заложенная в биологическое определение типа
тканей А. А. Заварзиным общность принципов структурной
организации, функции и источников развития справедлива лишь
в смысле становления в эволюции многоклеточных тканевого
уровня организации. Конкретная же эволюционная динами-
ка каждого тканевого типа может быть весьма сложной в силу
разных причин. Одной из них является разделение единой об-
щей функции на ряд более конкретных, но также достаточно
общих функций. Так, например, пограничная функция очень
скоро дифференцируется на собственно барьерную, изолирую-
щую и функцию поглощения питательных веществ. Соответст-
венно этому в типе пограничных тканей естественно соединя-
ются два подтипа — кожные и кишечные эпителии. Несколько
позднее в эволюции многоклеточных выделяется и третий чет-
ко определяемый подтип пограничных тканей — целомические
эпителии.
Аналогичная, хотя и отличающаяся в системном отношении
ситуация наблюдается в типе тканей внутренней среды позво-
ночных животных. Этот тканевой тип у млекопитающих можно
подразделить на два или даже три подтипа, отчетливо разли-
чающихся в функциональном отношении,— трофические, ске-
летные и защитные ткани. Между элементами крови и костной
тканью не обнаруживается уже общности структурно-химиче-
ской организации тканевых элементов. Однако в отличие от
кишечных, кожных и целомических эпителиев функциональные
подтипы тканей внутренней среды обнаруживают значительно
более тесную функциональную и гистогенетическую взаимо-
связь и в онтогенезе — все эти ткани происходят в основном из
одного эмбрионального зачатка. Много общего имеют оних
и в закономерностях системной организации.
Еще сложнее обстоит дело с характеристикой типа мышеч-
ных тканей. В структурно-химическом и функциональном пла-
16 t
нах, за редким исключением (электрические органы рыб), мы-
шечные ткани хорошо характеризуются как единый тип, вы-
полняющий функцию сократимости на основе принципиально
общих структурных механизмов. Однако по источникам разви-
тия в онто- и филогенезе это весьма гетерогенный тип тканей.
Это касается как зачатков и источников, из которых развива-
ются сократимые ткани, так и времени их возникновения в фи-
логенезе. Так, наряду с древними соматическими и висцераль-
ными мышцами к этому типу относятся более «молодые» цело-
мические мышечные ткани, наконец, гладкие мышцы позво-
ночных, возникшие в филогенезе лишь у этой группы животных
на основе специализации оседлых элементов тканей внутрен-
ней среды.
Таким образом, мы видим, что к данному нами определе-
нию типа тканей и утвердившейся уже в науке морфофункцио-
нальной ид классификации нужно подходить диалектично, от-
давая себе отчет в том, что они не могут отразить всей слож-
ности наблюдаемых в действительности отношений.
Глава 2. НЕКОТОРЫЕ ОБЩИЕ ЗАКОНОМЕРНОСТИ
ФОРМИРОВАНИЯ ТКАНЕЙ В ОНТОГЕНЕЗЕ
И ВЗАИМООТНОШЕНИЯ ПРОЦЕССОВ РЕПРОДУКЦИИ
И ДИФФЕРЕНЦИРОВКИ ИХ КЛЕТОК
' § 1. Формирование тканей в онтогенезе
При половом размножении развитие всех многоклеточных
животных начинается с процесса слияния двух гаплоидных по-
ловых клеток — мужской и женской. Они характеризуются вы-
сокой степенью цитологической дифференциации, и вместе с тем
продукт их слияния — зигота — дает начало всем разнообраз-
ным клеткам, из которых построены ткани многоклеточных
животных.-
Для процессов раннего эмбрионального развития особое
значение имеет строение женской половой клетки. Яйцеклетки
могут достигать гигантских размеров и характеризуются весь-
ма сложной структурой и химической организацией цитоплаз-
мы. В ней помимо большого количества запасных питательных
веществ для пластического и энергетического обменов сосредо-.
точены как необходимые структуры для последующего развития
белоксинтезирующий аппарат и резервная энергетическая си-
стема в виде неработающих митохондрий. Кроме того, в ооците
синтезируются и накапливаются .в цитоплазме латентные формы
иРНК и специфические белки, имеющие регуляторное значение
в последующем развитии. Запасные органоиды, а также разно-
образные рибонуклеопротеиды вместе с запасными питатель-
ными веществами закономерно распределяются по цитоплазме,
17
образуя весьма сложную и гетерогенную структуру ооцита,
определяющую певричную дифференцировку клеточного мате-
риала зародыша. Она реализуется уже на первом этапе
эмбриогенеза—дроблении, когда образующиеся в ходе быстро
протекающих митотических делений ядра попадают в участки
цитоплазмы, содержащие качественно различные типы иРНК
и регуляторных белков. Последние вместе с белками, синтези-
руемыми на основе латентных форм иРНК, оказывают специ-
фическое влияние на ядерный аппарат, активируя или блоки-
руя отдельные участки генома. При этом в одних группах бла-
стомеров активируются одни его участки, в других — иные,
благодаря чему дифференцируется клеточный материал разви-
вающегося зародыша. С этого периода начинается образова-
ние эмбриональных зачатков—' клеточных систем, разнородных
по своим потенциям к развитию. Клетки в этих зачатках ха-
рактеризуются некоторыми еще незначительными морфологи-
ческими особенностями и, что самое главное, качественными
различиями в синтетической активности. У большинства много-
клеточных в развитии имеется стадия, когда зародыш пред-
ставлен тремя .слоями или'зародышевыми листками.*: наружным,
средним и внутренним. Образование трехсдойного зародыша
происходит разными путями,; однако в основе этих первичных
морфогенетических процессов лежит обычно сложная миграция
клеток. На ‘этой стадии эмбриогенеза, получившей название
гаструляции, осуществляется взаимодействие зародышевых ли-
стков— первичная’1 эмбриональная’ индукция. Ее
процессы хорошо изучены у позвоночных животных. У зароды-
шей позвоночных под влиянием’ среднего зародышевого листка
или мезобласта в наружном листке—эктобласте, возникает за-
чаток нервной системы. В дальнейшем он преобразуется в нерв-
ную трубку — зачаток спинного и головного мозга, а из мезоб-
ласта (у высших позвоночных) выделяется хорда, и зародыш
переходит в стадию закладки осевых органов.
На этой стадии весьма сложную дифференцировку претер-
певает мезодерма — зачаток, образующийся из среднего заро-
дышевого листка после обособления из него хорды (рис. 3).
В мезодерме выделяется дорсальный участок, образующий со-
миты, и вентральный, состоящий из двух листков спланхнотома,
дающих начало стенке вторичной полости тела — целома.
В месте соединения сомитов и листков спланхнотома выде-
ляется еще один зачаток — нефротом, из которого формирует-
ся мочеполовая система. Сомит подразделяется на централь-
ную часть — миотом, наружную — дерматом и внутреннюю —
склеротом, которые в последующем развитии дают соответст-.
венно: поперечно-полосатую мускулатуру, соединительноткан-
ную основу кожи, мезенхиму, формирующую разновидности
тканей внутренней среды с механическими (кость, хрящ) и тро-
фическими функциями.
18
Скелетные ткани головного отдела формируются из особого
зачатка, выделяющегося из наружного листка. Из эктодермы
развивается кожный эпителий и его производные. Внутренний
листок — энтодерма, дает начало кишечному эпителию, эпите-
лию печени, желудка и желез среднего отдела пищеваритель-
ного тракта. В энтодерме закладываются и первичные половые
клетки, которые затем мигрируют в кровяное русло и оседают
в определенных участках целомического эпителия, где обра-
зуются половые железы. Сложную миграцию претерпевают
и клетки других зачатков, в частности пигментные клетки
Рис. 3. Поперечные разрезы на двух последовательных стадиях развития
зародыша позвоночных (птиц).
а, б — стадии формирования нервной трубки (<?) и закладки осевых органов (б);
/ — эктодерма, 2— энтодерма, 3 — нервная пластинка, 4— нервная трубка, 5 — хорда,
6 —сомит, 7 — париентальный и 8 — висцеральный листки спланхнотома, £ —дерма-
том, 10— миотом, // — мезенхима, /2 — нефротом, 13 — сосуд.
19
и часть нервных клеток. Помимо зачатков дефинитивных тка-
ней у высших многоклеточных (и первично- и вторичноротых)
из всех трех зародышевых листков дифференцируются прови-
зорные ткани и органы, осуществляющие выделительную, вса-
сывающую, респираторную и другие необходимые для развития
зародыша функции. Они существуют относительно недолго
и характеризуются высокой степенью специализации образую-
щих их клеточных элементов. При дифференцировке последних
большое распространение имеют явления полиплоидизации.
клеток.
Ведущее значение в прогрессирующей дифференцировке
клеток эмбриональных зачатков в период гаструляции и за-
кладки осевых органов имеет взаимодействие между клетками
в одном зачатке и между различными зачатками. В многочис-
ленных экспериментах по пересадке зачатков в развивающихся
зародышах и их культивированию вне организма удалось вы-
явить некоторые общие закономерности таких взаимосвязей.
На примере кожного и других эпителиев обнаружена необходи-
мость временного или постоянного контакта эмбрионального
эпителия с развивающейся соединительной тканью. Для зачат-
ков эпителия поджелудочной железы, миобластов позвоночных
животных, а также других клеточных и тканевых систем при
культивировании их вне организма показано, что нормальная
дифференцировка этих тканевых элементов требует определен-
ного их числа, т. е. взаимодействия между одинаковыми
клетками.
В процессах дифференциации весьма важную роль играют
внеклеточные структуры типа базальных мембран и межклеточ-
ного вещества. Они являются производными надмембранного
комплекса клеток и помимо специальной опорной и трофиче-
ской функции' оказывают специфическое воздействие на рецеп-
торы поверхностного аппарата, обеспечивая таким образом диф-
ференцировку клеток эмбриональных зачатков.
В опытах на культивируемых in vitro клетках эмбриональ-
ных зачатков и на зародышах высших позвоночных в условиях
in vivo удалось показать, что такую информативную функцию
выполняют мукополисахариды и два типа белков — фибронек-
тины и коллагены — обязательные компоненты межклеточных
структур в зачатках и тканях эмбрионов позвоночных. В меж-
клеточных взаимодействиях в онтогенезе исключительно важ-
ную роль играют временные и специфические постоянные меж-
клеточные контакты. Они определяют многие важные процессы
и, в частности, такие сложные явления, как оседание мигриру-
ющих клеток лишь в определенных зачатках и в точно локали-
зованном месте, что и происходит при развитии половых желез
или при миграции пигментных клеток.
Таким образом, множество фактов свидетельствует о том,
что дифференцировка зародыша определяется сложными взаи-
20
модействиями клеточных и внеклеточных компонентов, образу-
ющихся в результате первичной дифференцировки эмбриональ-
ных зачатков. По достижении определенных стадий развития
эмбриональные зачатки органов и тканей могут в условиях
изоляции продолжать нормальное развитие и формировать тка-
невые и органные структуры, идентичные структурам, развива-
ющимся in vivo, т. е. способны к так называемой самодиф-
ференцировке. Возможность менять направление специа-
лизации под влиянием внешних для эмбриональных зачатков
факторов, как правило, уменьшается по мере развития орга-
низма. Способность же к саморазвитию в определенном напра-
влении у эмбриональных зачатков и тканей в ходе развития
зародыша увеличивается.
Ограничение потенций зачатков к различным дифференци-
ровкам,. определение направления их дефинитивной специали-
зации называется детерминацией. Проявление внутренних
изменений в виде морфологических и функциональных особен-
ностей носит название терминальной дифференцировки за-
чатков и тканей в широком смысле этого понятия. В более
узком смысле в гистологии под дифференциацией или, точнее,
цитодифференциацией обычно понимают возникновение
морфологических различий.
Явления детерминации и дифференциации развертываются
на уровне эмбриональных зачатков и тканей, т. е. на уровне
интегрированных клеточных систем. В основе механизмов, обе-
спечивающих согласованный ход этих сложных процессов, ле-
жат общие закономерности, обеспечивающие специализацию
клеток и, в частности, дифференциальная активность
их генетического аппарата.
В настоящее время есть достаточно убедительные данные
о том, что, как правило (за исключением некоторых видов диф-
ференцировок), любая клетка данного многоклеточного орга-
низма обладает идентичным набором хромосом, т. е. одинако-
вым запасом генетической информации. В связи с этим детер-
минация и последующая дифференцировка клеточного материа-
ла связаны обычно не со структурными изменениями ДНК
хромосом, как, например, у В-лимфоцитов, а лишь со стойким
изменением регуляции работы генетического аппарата — дебло-
кированием специфических для данного направления диффе-
ренцировки генов и блокированием других генов. Очевидно, что
регуляция работы генетического аппарата клеток осуществля-
ется на уровне ДНП хромосом. Однако ее закономерное тече-
ние во времени и конкретная реализация в нужный момент
обусловлены воздействиями химических системных факторов,
т. е. регулирующими воздействиями целостного организма.
Таким образом, процессы индивидуального развития пред-
ставляют собой прекрасный пример диалектического единства
целого и многообразия, заключенного в нем. Процессы диффе-
21
ренциации, протекающие в оогенезе, определяют первичную
дифференцировку яйцеклетки и в последующем целостного за-
родыша. Путем сложной многоэтапной системы эмбриональных
индукций, а позднее гормональных регуляций и нервной интег-
рации обеспечивается развитие целостного и вместе с тем мно-
гообразно дифференцированного организма.
К моменту формирования дефинитивных тканей генетиче-
ский аппарат составляющих их клеток детерминирован уже
достаточно стойко, и возможности изменения генетической про- <
граммы в них, особенно у высших животных, весьма ограниче-
ны. Обычно даже внешне мало дифференцированные клетки
той или иной разновидности ткани способны дифференциро-
ваться в небольшое число разновидностей специализированных
клеток, характерных для данного типа тканей. Таким образом,
одна из фундаментальных характеристик тканевой системы—•
наличие в составляющих ее клеточных элементах стойкой де-
терминации генетического аппарата к определенным направ-
лениям дифференцировки.
Эта ограниченность возможности превращений клеток одно-
го типа тканей в клетки другого типа представляет собой важ-
ную и пока еще весьма загадочную закономерность тканевого
уровня организации многоклеточных животных. Принципиаль-
ная возможность изменения детерминации генетического аппа-
рата клеток и их дифференцирдвка в любых направлениях, ха-
рактерных для данного организма, показана в опытах с пере-
садкой ядер' соматических клеток эмбрионов в лишенную ядра
яйцеклетку амфибий. В этих- опытах удалось получить полно-
ценные организмы. Таким образом оказалось, что ядерный
аппарат соматической клетки в цитоплазме яйцеклетки под не-
посредственным воздействием ее регуляторных молекул пере-
страивается и вновь'способен реализовать имеющиеся в геноме
данного организма потенции. В экспериментах на позвоночных
животных и насекомых достоверно показана возможность огра-
ниченной метаплазии, т. е. превращения клеток одного типа
тканей в клетки другого типа. Так, в эмбриогенезе хрусталик
глаза развивается из эктодермы (общий зачаток кожных эпи-
телиев и его производных). При регенерации же хрусталик
глаза хвостатых амфибий образуется за счет клеток радужины,
т. е. клеток тканей, происходящих из нервного зачатка. Изме-
нение детерминации, так называемая трансдетерминация
зачатков дефинитивных тканей и органов (имагинальные дис-
ки), наблюдается у личинок дрозофилы (до определенного пе-
риода развития при пересадке зачатков). В клональных куль-
турах in vitro показана возможность трансдетерминации кле-
ток сетчатки в клетки хрусталика или пигментные клетки.
Весьма многочисленны примеры так называемой филоге-
нетической метаплазии. Суть ее заключается в том, что
в процессе усложнения многоклеточных животных могут по-
22
являться вторичные и третичные (в зависимости от времени
появления в филогенезе) ткани..Они возникают на основе за-
чатков и тканей с одной основной функцией, а приобретают'-
свойство тканей другого типа, выполняя соответственно и их
функцию. Демонстративным примером в этом отношении мо-
гут служить уже упоминавшиеся мышечные сократительные
ткани. Первичная разновидность тканей этого типа возникла
у примитивных многоклеточных на основе эпителиально-мы-
шечных клеток. В дальнейшей эволюции у всех многоклеточ-
ных наблюдается направленная дифференцировка первичных
мышечных тканей с выделением особого зачатка (миотом у по-
звоночных). На.более поздних этапах.эволюции на основе це-
ломического эпителия (независимо у первично- и вторичноро-
тых животных), возникают вторичные мышечные сократимые
ткани. Наибольшего развития они достигают у членистоногих,
обеспечивая сократимость, их внутренних органов (сердце, пи-
щеварительный тракт). У позвоночных животных — это мышеч-
ная ткань миокарда. Однако у них на основе механоцитов рых--
лой соединительной ткани возникают и третичные сократимые
ткани, образующие гладкие мышцы всех внутренних органов.,
Наряду с гладкой мышечной, тканью у позвоночных в глазу
позднее, уже на основе тканевых элементов, нервной системы,
возникает еще одна разновидность третичных мышечных тка-
ней— мышцы, сужающие и расширяющие зрачки. Аналогич-
ные превращения,, правда в меньшей степени, наблюдаются
в эволюционной динамике и других типов тканей, Такая мета-
плазия может приводить к формированию тканей, аналогичных
первичной, или вовлечению в ее состав небольших клеточных
популяций или,, наконец, к использованию сходных структурно-:
биохимических механизмов в разных по своей функции и тка-
невой принадлежности клетках.
Таким образом, несмотря на жесткость направлений диф-
ференцировки в дефинитивных тканях, они, регулируются си-
стемными и межтканевыми механизмами, что широко исполь-
зуется в естественных условиях для наиболе рационального
обеспечения функциональных потребностей организмов на тка-
невом уровне организации.
Возникающие в эволюции вторичные и третичные ткани
хотя и отличаются от первичных, однако обычно приобретают
основные признаки данного .типа тканей. Это позволяет-в--об-
щебиологическом плане рассматривать их уже как одну- из
разновидностей этого типа тканей. Тем не менее более позднее
в эволюции происхождение этих тканей часто отражается на
их развитии в онтогенезе. Так, в частности, древние соматиче-
ские мышечные ткани развиваются у позвоночных из миотомов,
сердечная мышечная ткань—-из специальных зачатков в эпи-
телиальной выстилке вторичной полости тела, а гладкая мы-
шечная ткань — из мезенхимы — зачатка, дающего все много-
23
численные разновидности тканей внутренней среды. Мышцы,
сужающие и расширяющие зрачок, происходят из нейрального
зачатка. При этом, несмотря на наличие общих черт струк-
турно-биохимической организации скелетной, сердечной и глад-
кой мышечной тканей и мышц, происходящих из нервного за-
чатка, они не могут превращаться друг в друга, т. е. являются
строго детерминированными разновидностями единого типа со-
кратимых тканей.
Явление филогенетической метаплазии — одно из проявле-
ний в естественных условиях ограниченного, направленного из-
менения тканей в филогенезе, которое лежит в основе теории
параллелизма тканевых структур А. А. Заварзина. Естествен-
но, что изучение механизмов этих процессов, имеющих весьма
широкое распространение у высших многоклеточных, является
весьма важной характеристикой эволюционной динамики вто-
ричных и третичных тканей или отдельных тканевых элемен-
тов. Знание этих механизмов приблизит нас к пониманию внут-
ренних закономерностей процессов детерминации и дифферен-
цировки при адаптаций животных в ходе эволюции. Кроме то-
го, углубленное их изучение необходимо для выяснения осо-
бенностей развертывающихся в этих тканях патологических
процессов. Так, даже простое доказательство факта происхож-
дения мышечных и эпителиальных тканей из разных зачатков
у позвоночных животных, экспериментально обоснованное
Н. Г. Хлопиным, имело большое значение для рациональной
классификации образуемых этими тканями опухолей. Такая
классификация объясняла с биологических позиций особенно-
сти малигнизированных клеток, имеющих разные источники
развития. Естественно, что еще большее значение для анализа
патологических процессов имеет изучение всей исторически
обусловленной совокупности свойств целомических и соматиче-
ских мышечных тканей, характеризующих особенности их эво-
люционной динамики.
§ 2. Взаимоотношение пролиферации и дифференцировки
клеток при формировании тканей и в их нормальной
жизнедеятельности
Репродукция и дифференцировка клеток в тканях много-
клеточных животных представляют собой две важнейшие сто-
роны жизнедеятельности клеток в составе тканевых систем.
Размножение клеток обусловливает увеличение их количества,
а дифференцировка — их разнообразную морфофункциональ-
ную специализацию. При делении материнской клетки, как
правило (за исключением специальных случаев), получаются
две идентичные ей дочерние клетки. Дифференцировка клеток
обеспечивает появление у них специфических особенностей.
24
Между размножением и дифференцировкой клеток существуют
чаще антагонистические, а иногда и конкурентные отношения,
которые начали формироваться в момент появления многокле-
точных. В ходе эволюции по мере совершенствования интегра-.
тивных механизмов целостного организма в его тканях проис-
ходило усложнение взаимоотношений между репродукцией
и дифференцировкой клеток.
В цитологическом плане репродукция клеток представляет
собой не только деление материнской клетки или митоз. Важ-,
ные процессы синтеза ДНК и удвоения хромосом происходят
обычно в середине интерфазы. Они могут занимать половину,
а иногда и большую часть интерфазы.
Наличие в интерфазе важнейшего процесса клеточной ре-
продукции— репликации ДНК, позволяет разделить ее на
3 периода — пресинтетический (период Gi), синтетический (пе-
риод S), постсинтетический (период G2). Вместе с митозом
они составляют митотический цикл клетки. Таким обра-.
зом, митотический цикл клрток— закономерная последователь-,
ная цепь событий, состоящих из подготовки клеток к синтезу
ДНК, удвоению хромосом, подготовки клеток к митозу и, на-,
конец, самого митоза. С точки зрения пролиферации важней-
шими периодами митотического цикла являются синтез ДНК
и митоз. Естественно поэтому, что при дроблении в цикле
делящихся клеток обычно отсутствуют периоды Gi и G2. Их
появление совпадает с началом гетеросинтетической активно-
сти клеток эмбриональных зачатков, с началом синтеза в них
специфических макромолекул.
В процессах становления тканей в онтогенезе при ярко вы-,
раженных антагонистических отношениях между гетер о-.
и автосинтетической активностью клеток в тканевых
системах имеются два способа сочетания процессов репродук-.
ции и дифференцировки. Во-первых, все процессы репродукции-
клеток могут сосредоточиваться в. периоде эмбриогенеза,
когда и формируется основной запас клеток, необходимый
для построения данной ткани. Такого рода отношения на-
блюдаются при развитии нервной системы у высших животных.
Вторым способом увеличения количества клеток при антаго-
низме между их репродукцией и дифференцировкой является
создание постоянного запаса малодифференцированных проли-
ферирующих клеток, который и обеспечивает непрерывное-
вступление новых клеток на путь специфической дифференци-
ровки.
При отсутствии антагонизма между гетеросинтетической
и автосинтетической активностью клеток в тканевых системах-
увеличение их количества в онтогенезе идет параллельно с их-
дифференцировкой. Естественно, что темпы размножения кле-
ток в таких тканевых системах уменьшаются в ходе развития
и в дефинитивных тканях оказываются уже на достаточно
25,
низком уровне, с весьма продолжительными периодами Gj,
и иногда G2 и S. •
Такие ткани получили сейчас название растущих. Весьма
важной системной характеристикой такой ткани является про-
должительность жизни составляющих ее тканевых элементов,
т. е. интенсивность обновления внутриклеточных структур, кле-
ток и образуемого ими межклеточного вещества. По этому при-
знаку в разных тканях одних и тех же животных и в одинако-
вых тканях у разных представителей многоклеточных организ-
мов удается выявить два основных типа системной органи-
зации.
В тканях нервной системы высших многоклеточных живот-
ных продолжительность жизни нейронов соответствует продол-
жительности жизни организма. Такие системы получили назва-
ние стационарных. Тем не менее образующие их клетки харак-
теризуются непрерывно идущими процессами внутриклеточно-
го обновления цитоплазматических структур. Такие процессы
характерны для нейронов, клеток эпителия печени, мышечных
волокон и тканевых элементов других тканей.
Весьма многообразны также процессы замещения внекле-
точного вещества тканей внутренней среды и кутикул кожных
эпителиев. Они' могут быть цикличными, а могут происходить
непрерывно. Разрушение и особенно непрерывное или цикличе-
ское новообразование таких структур связано со сложными
физико-химическими процессами, существенную роль в кото-
рых играют контакты внеклеточных структур’ с плазматической
мембраной и разнообразные механизмы выведения веществ из
образующих их клеток. Большое значение в регуляции всех
этих процессов имеют не только постоянный клеточный конт-
роль за внеклеточными структурами, но и воздействие послед-
них на рецепторную систему образующих их клеток. '
Особую, весьма распространенную у Многоклеточных жи-
вотных группу составляют ткани, жизнедеятельность и систем-
ная организация которых основана на непрерывном обновле-
нии их клеточного состава. В этих так называемых камбиаль-
ных тканях продолжительность жизни дифференцированных
клеток относительно невелика. Численное постоянство клеточ-
ного состава в них достигается за счет сбалансированного
равновесия между количеством погибающих, закончивших
свой жизненный цикл клеток, и количеством клеток, образую-
щихся в результате'деления малодифференцированных камби-
альных клеток. Естественно, что при этом ярко выражены регу-
ляторные системные механизмы и наглядно выступают тесные
взаимоотношения между репродукцией и дифференциацией
клеток как в процессе становления этих тканей в эмбриогене-
зе, так и в их организации во взрослом организме.
Помимо основного способа репродукции клеток — митоти-
ческого деления — в специализированных тканях могут иметь
26
место процессы амитотического, прямого деления клеток. Иног-
да им предшествуют синтез ДНК и частичное или полное
удвоение хромосом. Однако у многоклеточных животных пря-
мое деление приводит к формированию неспособных к митоти-
ческому делению клеток.
Весьма широко распространены при дифференцировке кле-
ток многоклеточных животных явления соматической по-
ли пл о и д из а ц и и. Они основаны на разобщении двух основ-
ных процессов клеточной репродукции — синтеза ДНК и мито-
за. При соматической полиплоидизации клетки переходят на
эндомитотический цикл репродукции, в котором от-
сутствует митоз или его заключительные фазы, хотя и сохра-
няется период синтеза ДНК, и происходит, следовательно, ее
удвоение. Клетки могут проходить несколько циклов эндоре-
продукции, таким образом степень полиплоидизации может
быть различной. В крайних случаях в дифференцированных
клетках может содержаться количество ДНК, соответствующее
1024 наборам хромосом.
В клетках многоклеточных животных известны два типа со-
матической полиплоидизации — политения и эндомитоз.
При политении из цикла репродукции полностью выпадает ми-
тоз и происходит многократное удвоение молекул ДНК в со-
ставе хромосом диплоидных клеток. Благодаря этому хромосо-
мы приобретают гигантские размеры и становятся видимыми
в интерфазном ядре — политенные хромосомы.
При эндомитозе обычно ядерная оболочка не разрушается,
но происходит кратное увеличение количества хромосом. В не-
которых случаях сохраняются начальные фазы митоза, но от-
сутствует анафаза, и реплицированные хромосомы оказывают-
ся в одном ядре.
Основной биологический смысл эндорепродукции заключа-
ется в интенсификации метаболизма клетки без прекращения
ее функции во время митоза. При некоторых типах дифферен-
цировок эндорепродукция — необходимое условие специализа-
ции клеток. Именно так обстоит дело при дифференцировке
клеток слюнных желез у двукрылых насекомых, гигантских
нейронов у голожаберных моллюсков и, наконец,, гигантских
клеток мегакариоцитов в кроветворной системе млекопитаю-
щих. Образование из цитоплазмы мегакариоцитов кровяных
пластинок начинается только при достижении ими в результа-
те нескольких эндомитозов уровня плоидности не менее 16 С.
Одной из общих закономерностей организации эукариотных
клеток является отсутствие жестких причинно-следственных
связей между элементарными процессами, из которых слагаются
такие общие процессы, как репродукция и различные типы спе-
циализации клеток. Что касается репродукции, то ярким при-
мером этого могут служить только что разобранные явления
соматической полиплоидизации, при которых в цикле репро-
27
дукцйи разобщаются такие важные его периоды, как синтез
ДНК и митоз. Еще многочисленнее примеры разобщения эле-
ментарных процессов при различных специализациях клеток
в тканях многоклеточных животных. Такой лабильный харак-
тер организации процессов репродукции и дифференцировки
клеток тканей резко увеличивает их адаптивную пластичность,
поскольку позволяет путем комбинаторики сходных элементар-
ных процессов создавать сложные структуры для реализации
разных или сходных функций. Примером такого рода пластич-
ности процессов дифференцировки могут служить гранулярные
амебоциты у представителей разных типов беспозвоночных жи-
вотных и весьма распространенные у всех многоклеточных
пигментные клетки или меланоциты. Эти два разных по функ-
циональному значению типа специализированных клеток функ-
ционируют на основе единого по сути биохимического механиз-
ма— полимеризации белков и фенольного их задубливания.
Однако у представителей разных групп многоклеточных путем
комбинаторики лежащих в основе этого биохимического меха-
низма элементарных процессов создается большое количество
вариантов специализированных клеток. Естественно, что значе-
ние сравнительного метода в анализе такого рода специализи-
рованных клеток резко возрастает. Он может быть использо-
ван не только для изучения функционально-аналогичных кле-
ток, но и для выяснения модификаций единого биохимического
механизма, используемого на выполнение разных функций, как,
например, в гранулярных амебоцитах и пигментных клетках.
Такое использование сравнительного метода имеет принци-
пиальное и очень широкое значение, поскольку специализация
клеток в составе тканей многоклеточных основана обычно на
гипертрофии и модификации (чаще путем комбинаторики) об-
щих для всех эукариотных клеток структурно-химических ме-
ханизмов.
Глава 3. КРАТКАЯ ХАРАКТЕРИСТИКА
НЕКОТОРЫХ СОВРЕМЕННЫХ МЕТОДОВ
ГИСТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Одной из основных задач морфологических исследований
в частной цитологии и гистологии с момента их возникновения
и до настоящего времени является выяснение функционального
значения тканевых структур и тканей в целом. По мере совер-,
шенствования методов исследования глубина этой характери-'
стики непрерывно возрастала. В настоящее время большинство
качественно новых методов исследования в частной цитологии
направлено на выяснение функционального значения структур
путем анализа их химической организации. Ведущее значение
28
в разработке этих методов принадлежит новой синтетической
науке—биологии клетки, объединяющей общую цитоло-
гию, структурную биохимию, физиологию клетки и молекуляр-
ную генетику.
Естественно, что многие из этих методов, нацеленных на
характеристику химической организации тканевых структур,
а также экспериментальный анализ функционального значения
этих структур используется и в частной цитологии и гистоло-
гии. Характеристика тканевых элементов сейчас уже невоз-
можна без использования электронной микроскопии особенно
в сочетании с методами цитохимии и авторадиографии. Широ-
ко используются в гистологии новые цитохимические подхо-
ды —цитохимия ферментов, количественная цитоспектофото-
метрия и, наконец, наиболее тонкий метод качественного ана-
лиза макромолекул в тканевых структурах — иммуноцитохи-
мия. Принципы и возможности всех этих методов имеются
в любом современном руководстве и в учебниках по цитологии.
В краткой характеристике современных методов гистологиче-
ского анализа для иллюстрации качественных их особенностей
мы остановимся лишь на описании метода авторадиографии
и методов клонирования стволовых клеток как примеров опи-
сательного и экспериментального подхода к анализу тканевых
систем.
Метод авторадиографии — один из наиболее адекватных со-
временных методов анализа структурно-биохимической органи-
зации тканевых структур. В основе его лежит использование
радиоактивных элементов, включаемых чаще всего в состав
предшественников макромолекул — нуклеиновых кислот, бел-
ков, полисахаридов. Такими предшественниками служат амино-
кислоты, азотистые основания или моносахара. В качестве мар-
керов наиболее распространены изотопы водорода — тритий
(3Н), и углерода — (14С). Принципиальной особенностью авто-
радиографии по сравнению с биохимическими методами,
использующими радиоактивные предшественники, является
особый способ регистрации их включения в макромолекулы.
При биохимических исследованиях специальными Счетчиками
регистрируется интенсивность включения меченых предшест-
венников в отдельных фракциях, полученных путем дифферен-
циального центрифугирования предварительно измельченных и,
следовательно, разрушенных тканевых элементов.
Техника дифференциального центрифугирования в настоящее время по-
зволяет выделять отдельные клеточные органоиды и даже их отдельные
компоненты типа наружной и внутренней мембран митохондрий, гладкой
и шероховатой ЭПС и т. п. Тем не меиее для анализа гетерогенных по
составу тканевых систем биохимические методы оказываются ие всегда при-
менимыми. Большим достоинством метода авторадиографии является воз-
можность вести исследования без разрушения тканевых структур. Регист-
рация включения меченых предшественников производится здесь при помо-
щи специальных фотоэмульсий. Срезы ткаии покрывают «пленкой» такой
29
эмульсии и экспонируют в точечно Полон или менее продолжительного вре-
мени (обычно 7—14 дней ДЛИ стопой микроскопии и более длительное
время для электронной МИ1.|М»<1«»1ПШ). Электроны, испускаемые предшест-
венником включенным, И мнкромолекулы, возбуждают зерна AgBr эмуль-
сии над структурами, |'|)Держшцими эти макромолекулы. При специальной
обработке нитогрнфон инд срезом остаются лишь возбужденные- электронами
.черни HOCCTHIIulUloilIlot'O серебра в виде отдельных черных зерен (в случае
i'PHTIIH МИЛОЙ длиной пробега электронов) или цепочек зерен — треков
(И случи* нлоктропов углерода С14 —с большей энергией излучения). Про-
1'МЙipilMMll готовые автографы (при световой микроскопии — окрашенные
epiMhi), исследователь видит и гистологические структуры, как на обычном
Припарите, и черные зерна или цепочки зерен восстановленного серебра над
срезом в местах локализации молекул с мечеными предшественниками. При
.этом количество этих зерен или треков пропорционально количеству меченых
макромолекул. Метод авторадиографии позволяет, не разрушая тканевые
структуры, определить места синтеза макромолекул в клетках тканей мно-
гоклеточных животных и дать относительную количественную характеристику
интенсивности их синтеза, Кроме того, фиксируя материал через разные
сроки поело ппедопия iipofliiiocTiieiiiiiiKii, можно проследить динамику пере-
мощиппи моченых макромолекул внутри клетки или ио внеклеточные струк-
•I У1>1.1,
Помимо такого использования метод авторадиографии не
менее широко применяется и для анализа закономерностей си-
стемной организации тканей, сочетающих репродукцию и диф-
ференцировку клеток. Для этих целей весьма адекватным ока-
зался метод авторадиографии с использованием 3Н-тимиди-
на—-азотистого основания, включающегося в ДНК в период ее
синтеза в клетке. Особенность этого предшественника — весьма
быстрое выведение экзогенного 3Н-тимидина из организма выс-
ших позвоночных и исключительная избирательность его вклю-
чения в ДНК. Отсутствие метаболизма ДНК. обеспечивает
стойкое маркировние ядер определенной фракции клеток, осо-
бенно значительной в интенсивно обновляющихся тканях. Про-
слеживая на автографах судьбу клеток, содержащих меченую
ДНК, можно определить направление й скорость перемещения
клеток в ткани от момента прекращения их размножения до
гибели. Это позволяет определить скорость физиологической
регенерации — один из основных параметров кинетики иссле-
дуемых камбиальных тканей.
Кроме того, метод авторадиографии с применением 3Н —тимидина по-
зволяет определить и скорость размножения клеток, общую длительность
митотического цикла (Т) и длительность его отдельных периодов (tQ, ts
и*о2)-
Зная продолжительность митотического цикла и длительность периода
синтеза ДНК, можно определить и относительное количество пролифериру-
ющих клеток в системе — так называемый пролиферативный пул или фонд
размножающихся клеток. Это можно сделать, вводя 3Н-тимидин в течение
всего цикла с интервалами несколько меньшими, чем средняя продолжи-
тельность периода S.
Таким образом, используя метод тимидиновой авторадио-
графии, можно получить такие важные количественные харак-
30
теристики репродукций и Дифферейцировки клеток в исследуе-
мой ткани, как: а) скорость выхода'клеток в-дифференцировку,
продолжительность их ; существования в дифференцированном
состоянии и локализацию закончивших свой жизненный цикл
клеток; б) локализацию, скорость размножения и относитель-
ное количество размножающихся клеток. Совокупность этих ко-
личественных показателей позволяет объективно охарактеризо-
вать кинетику клеточных популяций исследуемых тканей
и проследить ее изменение в гистогенезе, в патологических и
экспериментальных условиях и, наконец, выявить особенности
кинетики клеточных популяций в функционально-аналогичных
тканях у разных групп многоклеточных животных. Таким об-
разом, на основе этого метода возникло целое направление
исследований закономерностей системной организации клеточ-
ных популяций, представляющее собой новый этап в анализе
тканей, в жизнедеятельности которых совмещаются репродук-
ция и дифференциация клеток. Одним из важных достижений
этого нового направления было выяснение сложной организа-
ции процессов репродукции в обновляющихся тканях высших
многоклеточных. Оказалось, что камбиальные клетки, как пра-
вило, представляют собой гетерогенную систему. В основе ее
лежит наименёе дифференцированная йультипотентная субпо-
пуляция стволовых клеток. Кроме них в'системе имеется одна
или обычно несколько субпопуляций полустволОвых клеток,
пролиферирующих с большей скоростью, но имеющих ограни-
ченные потенции и к репродукции, и к различным дифферен-
цировкам в составе данной ткани.
В.изучении свойств этих клеток, характера их взаимоотно-
шений и общих системных закономерностей регуляции репро-
дукции большое значение имеют сейчас методы 'клонирования
стволовых клеток в организме и методы клонального культи-
вирования стволовых и особенно полустволовых! клеток вне
организма. Суть' этих методов заключается в создании искус-
ственных (вне организма) или естественных (в организме)
условий для получения колоний или клонов клеток, являющих-
ся потомками одной единственной родоначальной клетки и со-
храняющих в своем составе клетки, способные давать такие
же клоны или колонии. Особенно детально эти методы раз-
работаны для изучения кроветворной ткани млекопитающих.
Имеются определенные успехи и в разработке методов клони-
рования камбиальных клеток некоторых других тканей этих
животных.
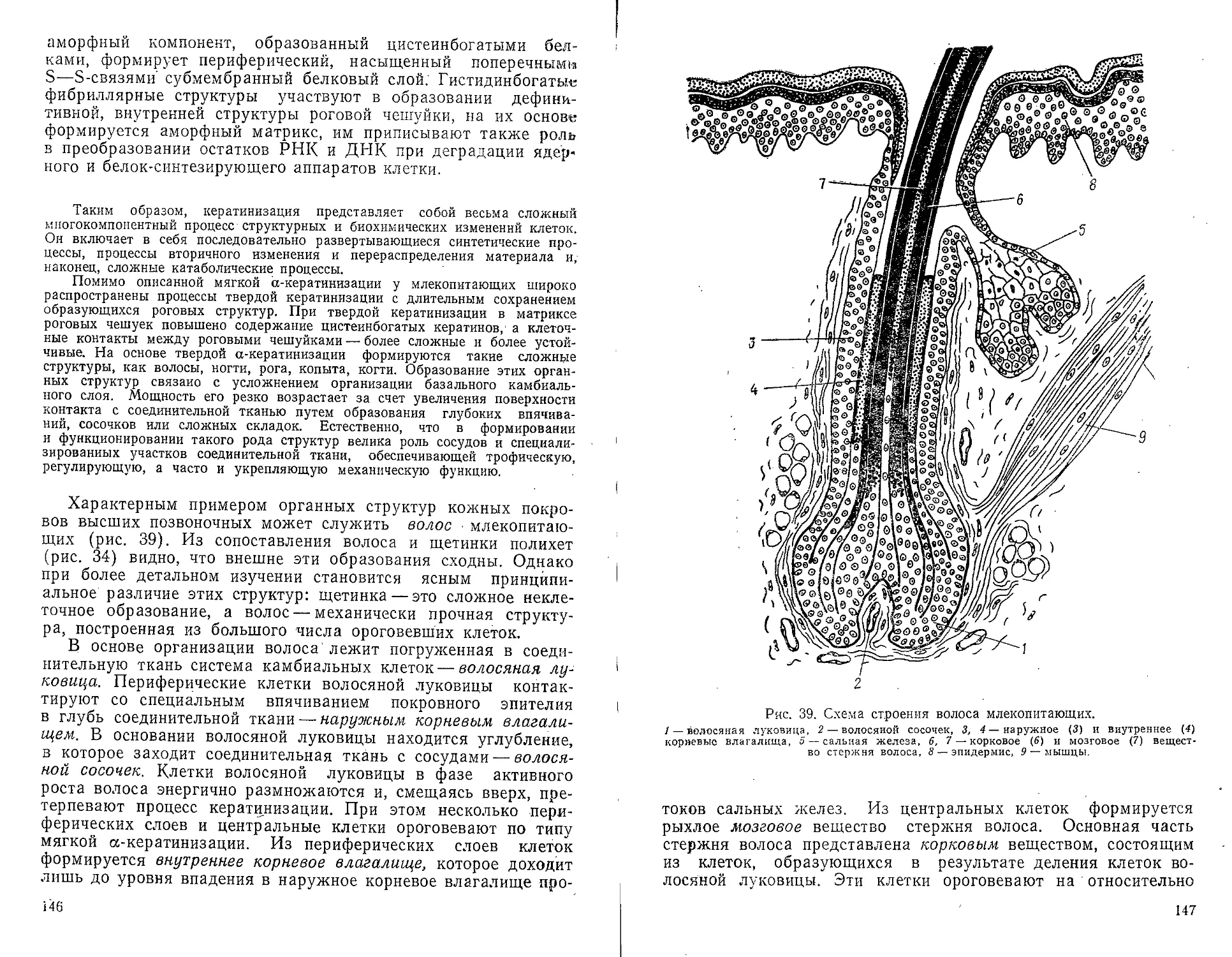
Глава 4. ЗНАЧЕНИЕ СРАВНИТЕЛЬНОГО ПОДХОДА
В СОВРЕМЕННОЙ ГИСТОЛОГИИ.
МЕСТО СРАВНИТЕЛЬНОЙ ГИСТОЛОГИИ
В СИСТЕМЕ БИОЛОГИЧЕСКИХ НАУК
Кик было показано в предыдущей главе, в гистологии во
второй половине двадцатого века произошли существенные
качественные сдвиги в методическом плане, что значительно
углубило критерии, по которым анализируются закономерно-
сти тканевого уровня организации многоклеточных животных
и функционального значения тканевых структур.
Использование этих новых методических подходов для ана-
лиза аналогичных тканей у разных групп многоклеточных жи-
вотных показало большую перспективность такого сравнитель-
ного исторического подхода. Наличие типовых закономерно-
стей структурно-химической организации и системных меха-
низмов у тканей одной функциональной специализации разных
и далеких в филогенетическом плане организмов в полной
мере проявилось при использовании углубленных критериев
в анализе этих закономерностей. При этом сходство в строе-
нии клеток и внеклеточных структур одной функциональной
специализации проявляется не только в тождестве этих струк-
тур у разных организмов, а в их модификациях в пределах
одного общего для этой функции плана организации. Так, на-
пример, всасывающие клетки кишечного эпителия, соматиче-
ские мышцы, межклеточное вещество интерстициальных тканей
у млекопитающих и насекомых построены по одному типу. Од-
нако это не тождественные структуры, а модификации одного
сходного типа, направленные на решение сходных функцио-
нальных задач и возникшие или во всяком случае совершен-
ствующиеся в процессе эволюции первично- и вторичноротых
независимо и параллельно. Их сходство, затрагивающее как
молекулярный и надмолекулярный, так и клеточный и надкле-
точный системный уровни организации отражает именно нали-
чие общих для функционально-аналогичных тканей закономер-
ностей организации.
. Естественно, что целенаправленное изучение этих общих
закономерностей организации в историческом плане возмож-
но лишь на основе детального анализа основных вариантов
организации функционально аналогичных тканей, как у близ-
кородственных, различающихся в экологическом плане, так
и у далеко отстоящих, давно разошедшихся в филогенезе групп
многоклеточных животных.
Таким образом, в настоящее время основной задачей гисто-
логии как науки о тканевом уровне организации всех много-
клеточных животных является разработка проблемы эволюци-
онной динамики тканей. Исторический подход к анализу био-
32
логических закономерностей тканевого уровня организации со?
четается при этом с использованием современных методов ис-
следований.
Постановка проблемы эволюционной динамики тканей как
центральной проблемы гистологии выделяет основную задачу
и общебиологическое значение гистологии. С другой стороны,
через частную цитологию гистология теснейшим образом свя-
зана с общей цитологией, так как использует разрабатываемые
в ней новые методы исследования.
Значение сравнительного подхода значительно шире, чем
простое сопоставление функционально-аналогичных и, в изве-
стном смысле, гомологичных четырех типов первичных тканей
и их разновидностей у близких и далеко разошедшихся в фи-
логенезе групп многоклеточных животных.
Сравнительный метод широко применяется при исследова-
нии элементарных структурно-химических механизмов в одина-
ковых и разных в функциональном отношении тканевых диф-
ференцировках у одного и разных организмов.
Такое применение сравнительного метода характерно сей-
час для общей цитологии и клеточной биологии. При анализе
общих закономерностей организации клеток используются
многоклеточные и одноклеточные животные и растительные
организмы. При использовании в качестве объектов тканевых
элементов многоклеточных животных интересы цитологов и гис-
тологов полностью совпадают. Сравнительный метод с большим
успехом применяется сейчас для сопоставления первичных
древних тканевых дифференцировок и аналогичных им вторич-
ных и третичных тканей и тканевых элементов, возникающих
в эволюции позднее и из других источников. Как уже раньше
отмечалось (см. стр. 22), сам факт широкого распространения
этого явления, названного нами филогенетической метапла-
зией, является одним из наиболее глубоких доказательств за-
кономерных, направленных и ограниченных жесткими рамка-
ми четырех типов изменений тканей в процессе эволюции мно-
гоклеточных животных. Изучение тонких механизмов и факто-
ров, обусловливающих такую метаплазию, имеет непосредст-
венное отношение и к разработке проблемы дифференцировки
и детерминации и к выяснению механизмов адаптации жи-
вотных в процессе эволюции. Таким образом, наблюдается
тесная идейная связь гистологии с зоологией и биологией раз-
вития. Кроме того, выяснение особенностей эволюционной дина-
мики вторичных и третичных тканей позволяет не только объяс-
нить с исторических позиций сущность патологических процессов,
но и в известной мере прогнозировать их и биологически обос-
новать мероприятия, направленные на ликвидацию или восста-
новление пораженной области. Так, в частности, знание эво-
люционной динамики сердечной целомической мышечной ткани
показало принципиальное отличие ее регенераторных меха-
2 672
33
пнзмов от таковых соматической мышечной ткани. Естествен-
но поэтому, что мероприятия по восстановлению функциональ-
ной деятельности сердца при инфарктах должны существенно
отличаться от мер, обеспечивающих полноценную регенерацию
соматических мышц.
Биологической основой наблюдаемого при патологии глаз'
широкого спектра метаплазий некоторых участков пигментного
эпителия сетчатки является, по-видимому, мультифункциональ-
ный характер дифференцировки этого эпителия и относительно
низкий уровень детерминации этих дифференцировок в норме.
Приведенные примеры показывают, какое большое значение
имеет биологический анализ тканей для разработки медицин-
ских проблем. Вместе с тем и наблюдаемые в патологических
процессах превращения нормальных тканей дают богатый
фактический материал для характеристики свойств и потенций
исследуемых гистологами нормальных тканей.
В заключение необходимо подчеркнуть, что широкое рас-
пространение явлений параллелизма характерно не только для
тканевого и клеточного уровней организации живой материи.
В последнее время в сравнительной зоологии и палеонтологии
накапливается все больше фактов, свидетельствующих о широ-
ком распространении сходных независимо возникающих при-
знаков и на более высоких системных уровнях организации
животных.
В гистологии особенно плодотворно используется сравни-
тельный метод для анализа интегративных систем организма
и в первую очередь исследования нервных центров. Общие для
всех многоклеточных принципы организации последних откры-
вают весьма широкие перспективы для исследования их функ-
ционального значения. Колоссальное количество нейронов
в нервных центрах млекопитающих и человека делает весьма
сложной задачу выяснения тонких механизмов структурной
организации и работы этих центров. У высших первичноро-
тых — головоногих моллюсков и особенно насекомых, имеется
большое количество достаточно сложных и совершенных нерв-
ных центров, аналогичных в функциональном отношении нерв-
ным центрам высших позвоночных. Однако эти центры у насе-
комых образованы значительно меньшим (на несколько по-
рядков) количеством нервных клеток. Это обстоятельство
обусловливает все возрастающее внимание нейрогистологов к
анализу организации этих центров у насекомых, и не столько
с целью изучения этих животных, сколько для понимания об-
щих принципов организации нервных центров у высших позво-
ночных и человека. Таким образом, сравнительный анализ при-
обретает роль непосредственного рабочего метода для разра-
ботки весьма актуальной общей нейрогистологической проблемы.
Такое использование сравнительного метода весьма харак-
терно и для нейрофизиологии, особенно при выяснении тонких
34 '
механизмов анализаторской деятельности нервных центров.
Комплексные морфологические и физиологические исследова-
ния на нервных центрах насекомых и, в частности, зрительных
центрах играют сейчас важную роль в анализе тонких общих
механизмов их работы у всех многоклеточных животных.
Из всего сказанного следует, что современная сравни-
тельная гистология представляет собой с одной стороны
самостоятельную биологическую науку, обладающую специфи-
ческими методами исследования, предназначенными для выяс-
нения функционального значения тканевых структур и тканей
во всем их многообразии у многоклеточных животных и чело-
века. Наряду с этим благодаря использованию сравнительного
исторического подхода в разработке центральной проблемы
сравнительной гистологии — эволюционной динамики тканей —
гистология оказывается теснейшим образом связанной и с зоо-
логией и с физиологией и, наконец, с такими бурно разви-
вающимися науками, как структурная биохимия, общая цито-
логия, молекулярная генетика и биология развития. Кроме того,
все возрастающая роль принадлежит гистологии и в анализе
актуальнейших проблем медицины. При этом особенно велика
роль сравнительной гистологии для внедрения в разработку
этих проблем исторического эволюционного подхода. Значение
последнего было показано еще в конце прошлого и в начале-
настоящего веков И. И. Мечниковым, а позднее, в первой по-
ловине XX века, отечественными гистологами, заложившими
основы исторического эволюционного подхода к анализу тка-
невого уровня организации многоклеточных животных и чело-
века.
УКАЗАТЕЛЬ ЛИТЕРАТУРЫ
Дэвидсон Э. Действие генов в раннем развитии. М., 1972. 342 с.
Заварзин А. А. (1941). Очерки по эволюционной гистологии нерв-
ной системы. Избр. тр. М.; Л. 1950, т. 3. 419 с.
Заварзин А. А. (1945, 1947). Очерки по эволюционной гистологии
крови и соединительной ткани. Избр. тр. М.; Л. 1957, т. 4. 717 с.
Заварзин А. А. Основы частной цитологии и сравнительной гистоло-
гии многоклеточных животных. Л., 1976, с. 377—387.
Заварзин А. А. Состояние и перспективы разработки проблемы эво-
люционной динамики тканей. — Цитология, 1981, с. 23, № 9, с. 971—990.
Кнорре А. Г. Эмбриональный гистогенез. М., 1971. 320 с.
Мамкаев Ю. В. О значении идей В. А. Догеля для эволюционной
морфологии. — В кн.: Эволюционная морфология беспозвоночных. Л., 1983,
с. 15—36 (Тр. ЗИН АН СССР, № 98).
Невмывако Г. А. Алексей Алексеевич Заварзин. Л., 1971. 208 с.
Румянцев А. В. Опыт исследования эволюции хрящевой и костной
тканей. М., 1958. 375 с.
X л о п и н Н. Г. Общебиологические и экспериментальные основы гисто-
логии. М., 1946. 491 с.
2*
35
Часть II
ЭПИТЕЛИАЛЬНЫЕ ТКАНИ
Эпителиальные ткани представляют собой разнородную по
происхождению и по функциональному значению группу тка-
ней многоклеточных животных. Филогенетически наиболее
древние разновидности эпителиальных тканей—кожные и ки-
шечные эпителии — развиваются из разных эмбриональных
зачатков (экто- и энтодерма) и у высших представителей мно-
гоклеточных не обладают способностью к взаимным превра-
щениям. Кроме того, у большинства современных многокле-
точных животных, как у первичноротых, так и у вторичноро-
тых, имеется особый подтип целомических эпителиальных
тканей более позднего в эволюции происхождения. У многих
многоклеточных целесообразно также выделить по структурно-
функциональным признакам в отдельный подтип железистые
эпителии.
Многообразно функциональное значение отдельных разно-
видностей эпителиальных тканей. У высших животных они
выполняют барьерную, всасывающую, железистую, выделитель-
ную, осморегулирующую и ряд других важных функций
многоклеточного организма. Естественно, что каждая из них
требует особой специализации эпителиальных клеток и проду-
цируемых ими межклеточных структур, а также особых систем-
ных закономерностей организации отдельных разновидностей
эпителиальных тканей. Для всех эпителиальных тканей тем не
менее характерен ряд общих первичных признаков системной
организации. Одним из них является структурное объединение
эпителиальных клеток в непрерывные пласты или тяжи кле-
точных элементов. Последние функционируют обычно как це-
лостные в структурном отношении системы.
Вторым общим первичным признаком эпителиальных тка-
ней является свойство полярности, вытекающее из их погра-
ничного положения в организме. Полярность в эпителиальных
тканях проявляется либо в закономерном изменении по вер-
тикали свойств клеток, образующих эпителиальные пласты
36
(многослойный эпителий), либо в закономерном полярном рас-
положении общих и специальных органоидов и поляризован-
ном транспорте веществ через цитоплазму клеток (разнооб-
разные однослойные эпителии). С повышением уровня орга-
низации животных это свойство в основных разновидностях
эпителиальных тканей резко усиливается в связи с более со-
вершенной реализацией ими специальных функций. Наряду
с этим при погружении отдельных разновидностей эпителиев
во внутреннюю среду организма свойство полярности может
в большей или меньшей степени вторично утрачиваться.
Глава 5. ЖЕЛЕЗИСТЫЕ ЭПИТЕЛИИ
Способность к выделению специфических секреторных про-
дуктов возникла и совершенствовалась на основе способности
клеток к выделению во внешнюю для них среду продуктов
внутриклеточного метаболизма. Это универсальное свойство
живой протоплазмы широко и разнообразно реализуется при
образовании тканевых систем и, в частности, при развитии в них
внеклеточных структур типа кутикул кожного эпителия или
межклеточного вещества и волокон соединительной ткани.
Внутриклеточные механизмы образования и выведения из кле-
ток макромолекулярных компонентов этих структур имеют
много общего с типичными секреторными процессами. Однако
все эти внеклеточные структуры являются неотъемлемой со-
ставной частью тканевых систем, и к ним неприложим термин
секрет, который используется в настоящее время для обозна-
чения продуктов синтетической деятельности клеток, выполня-
ющих либо специфическую для организма функцию (например,
секрет поджелудочной железы, обеспечивающий полостное пи-
щеварение), либо играющих вспомогательную роль в осуще-
ствлении основной функции данной тканевой системы (напри-
мер, секрет бокаловидных железистых клеток в кожном или
кишечном эпителиях). Особую группу секретов составляют
специфические биологически активные вещества, регулирующие
различные процессы в организме многоклеточных животных.
Эти вещества носят название гормонов. Таким образом, об-
щая особенность секреторных продуктов заключается в том,
что они в отличие от межклеточных структур не являются, как
правило, обязательными структурными компонентами ткане-
вых систем.
Типичные железистые дифференцировки — весьма харак-
терное направление специализации части клеток кожных и ки-
шечных эпителиев, а в некоторых случаях и отдельных участ-
ков целомической выстилки.
Общей закономерностью эволюционного усложнения желе-
зистых эпителиев является тенденция к обособлению их в от-
37
дельные органные структуры и частные тканевые системы. Они
выделяются из исходной ткани и преобретают специфические
особенности своей внутренней организации.
Соответственно своему биологическому значению все желе-
зы прежде всего делятся на две большие группы — экзокрино-
вые и эндокринные. Экзокриновые железы —чаще всего про-
изводные кишечных и кожных эпителиев —и выделяют свой
секрет во внешнюю среду. Эндокринные железы более разно-
образны по своему происхождению. Продуцируемые ими ин-
креты, или гормоны, выделяются в кровь или тканевую жид-
кость. Многоклеточные экзокриновые железы имеют систему
выводных протоков, в то время как у эндокринных желез они
отсутствуют.
Как указывалось выше, помимо этих структурных и функ-
циональных особенностей экзокриновых и эндокринных желез
между ними есть и глубокие биологические различия. Секрет
экзокриновых желез обеспечивает такие процессы, как полост-
ное пищеварение или снабжение потомства пищей. Он может
также играть вспомогательную роль в осуществлении барьер-
ной и других функций пограничных эпителиальных тканей.
Значение гормонов заключается прежде всего в обеспечении
гомеостаза многоклеточного*организма. Взаимосвязанная систе-
ма эндокринных желез регулирует рост и дифференцировку
клеток, постоянство ионного состава, развитиё вторичных по-
ловых признаков и другие метаболические и морфогенетические
процессы.
§ 1. Экзокриновые железы
Одноклеточные железы. Слизистые бокаловидные клетки
представляют собой типичный пример одноклеточных желез,
располагающихся обычно в кожных и кишечных эпителиях.
Они органически входят в состав этих пограничных тканевых
систем, представляя собой одну из железистых дифференциро-
вок эпителиальных тканей. Слизистые клетки играют важную
вспомогательную роль в осуществлении основной функции эпи-
телиального пласта. Так, в кишечном всасывающем эпителии
выделяемая бокаловидными клетками слизь образует защит-
ную оболочку. В эпителии толстой кишки и задних отделов
толстого кишечника слизистые клетки становятся преоблада-
ющими клеточными элементами эпителиального пласта. Слизь
бокаловидных клеток в многорядном ресничном эпителии воз-
духоносных путей служит тем субстратом, к которому прили-
пают твердые инородные частицы, попадающие в полость этих
путей. Наконец, в кожном эпителии немертин, моллюсков,
низших позвоночных и многих других групп животных секрет
слизистых клеток играет важную вспомогательную роль в осу-
38
ществлении барьерной функции
этого эпителия.
Структурно-химическая орга-
низация слизистых железистых
клеток хорошо изучена на при-
мере бокаловидных клеток ки-
шечного эпителия. Апикальная
пузыревидная часть клетки в
фазе накопления секрета запол-
нена секреторными вакуолями,
достигающими в зрелом состоя-
нии относительно крупных раз-
меров (рис. 4, а). Ядро и основ-
ная часть цитоплазмы с органо-
идами оказываются смещенными
в базальную часть клетки —
в область основания и ножки бо-
кала. Особенно большого разви-
тия достигает аппарат Гольджи
(рис. 4, .6), представленный мощ-
но развитой системой цистерн,
располагающейся в надъядер-
ной области (по периферии ос-
нования бокала и непосредствен-
но над ядром). Его перифериче-
ские цистерны резко уплощены,
по направлению же к центру
клетки они наполняются секре-
том и приобретают овальную
форму. В средней части бокала
наблюдается постепенный пере-
ход от расширенных цистерн
к округлым секреторным грану-
лам, занимающим основную
часть, цитоплазмы клеток. Ше-
роховатая эндоплазматическая
сеть, митохондрии и другие ор-
ганоиды расположены в тонком
периферическом слое цитоплазмы
по стенке бокала и в суженном
основании клеток.
Рис. 4. Бокаловидные клетки (б. к)
в кишечном эпителии позвоночных.
а — б. к. кишечного эпителия аксолотля;
б — схема строения б. к. кишечного эпите-
лия млекопитающих. 1 — ядро, 2 — секре-
торные вакуоли, 3 — шероховатая ЭПС,
4 — аппарат Гольджи, 5— митохондрия.
39
Исследования с меченными тритием глюкозой и галактозой
показали, что меченые мукополисахариды обнаруживаются
в мембранах периферических уплощенных цистерн аппарата
Гольджи уже через 5 мин после введения меченых предшест-
венников. Через 20 мин меченый секрет обнаруживается в цент-
ральных расширенных цистернах аппарата Гольджи и еще
через 20 мин — в области секреторных вакуолей. Через 4 ч
меченые вакуоли перемещаются в апикальную часть клеток,
откуда их содержимое выводится в полость кишки.
Рис. 5. Малоклеточные железы.
а. — полиплоидные клетки слюнной железы насекомого, б — схема строения сланной
железы двукрылых насекомых, в — железа в кутикулярном эпителии приапулид.
1 — секреторные клетки, 2, 3 — выводной проток железы насекомых (2) и приапулид
(3), 4 — кутикулярный колпачок, 5, 6 — слои кутикулы (5 — белковый, 6 — полисаха-
ридный), 7— слои слизи, 8—11 клетки (8 — гиподермальные, 9 — «светлые», /0 — ба-
зофильные, 11 — выстилающие железу), 12 — базальная мембрана.
40
Таким образом, авторадиографические данные показывают,
что на мембранах цистерн аппарата Гольджи синтезируются
мукополисахариды, составляющие основную часть слизистого
секрета. Небольшое количество белков, входящих в состав это-
го секрета, образуется на рибосомах, сосредоточенных преиму-
щественно в периферической цитоплазме и в стебельке или
ножке клеток. Объединение белков и мукополисахаридов сек-
рета происходит в вакуолях центральной части аппарата Голь-
джи. В бокаловидных клетках секреторный цикл от момента
начала синтеза секрета до оформления его в секреторные гра-
нулы занимает всего 20—30 мин.
Описанный выше тип внутриклеточной морфобиохимиче-
ской организации слизистой клетки характерен, по-видимому,
с небольшими модификациями и для слизистых клеток других
разновидностей эпителиальных тканей позвоночных и беспозво-
ночных животных.
Помимо одноклеточных слизистых желез и в кожных, и в
кишечных эпителиях особенно у более низкоорганизованных
и обитающих в водной среде многоклеточных животных име-
ются и другие одноклеточные железы, выделяющие белковый
или смешанный секрет. Принципы морфобиохимической орга-
низации их клеток рассмотрим на примере малоклеточных
и многоклеточных желез.
Малоклеточные железы. У многих высших первичноротых
животных широкое распространение имеют малоклеточные
железы. Они состоят из основных секреторных клеток и кле-
ток, выстилающих выводной проток железы. Весьма сложно
дифференцированы секреторные клетки слюнных желез дву-
крылых насекомых. Интенсификация синтетической деятельно-
сти достигается здесь путем многократйой эндорепродукции
и формирования высокополиплоидных ядерных аппаратов с по-
литенными хромосомами (рис. 5, а).
В цитоплазме клеток хорошо развит белоксинтезирующий
аппарат в виде цистерн шероховатой эндоплазматической сети,
многочисленны митохондрии, часть которых локализована в об-
ласти базальных складок плазматической мембраны. Аппарат
Гольджи представлен отдельными комплексами, рассредото-
ченными по всей цитоплазме.
На одном из представителей двукрылых (Sciara coprophila) выявлена
интересная дифференцировка этого аппарата, а возможно, и всей белоксии-
тезирующей системы клетки. В секреторных клетках слюнных желез у этих
животных обнаружено три типа резко различающихся между собой секре-
торных гранул: округлые гранулы с электроннопрозрачным содержимым,
такие же по размерам, но электроииоплотные гранулы и, наконец, крупные
эллипсоидные гранулы, содержащие фибриллярный матрикс. Формирование
каждбго из трех типов секреторных гранул происходит в отдельных комплек-
сах Гольджи, ответственных за формирование лишь. одного типа гранул.
В ходе развития личинки Sciara coprophila количество вырабатываемых свет-
лых и темных гранул закономерно изменяется. Наряду с ярко выраженными
41
мирф логическими признаками сложной дифференцировки метаболического
аппарата цитоплазмы выявлены и морфологические признаки активности
ядерных структур. В ядре происходит периодическое формирование выростов
наружной мембраны ядерной оболочки и наблюдаются изменения степе-
ни спирализации отдельных участков политенных хромосом.
Широкое распространение у беспозвоночных животных име-
ют малоклеточные железы, продуцирующие смешанный муко-
протеидный секрет, составные компоненты которого синтези-
руются отдельными узкоспециализированными клетками. При-
мером такой железы может служить туловищная железа
у приапулид (рис. 5, б). Секреторные элементы представлены
двумя типами клеток: темными с резко базофильной плотной
цитоплазмой и светлыми — с вакуолизованной цитоплазмой.
Цитохимический и авторадиографический анализ этих клеток
показал, что в первом случае мы имеем дело с белоксинтези-
рующими клетками. Светлые же клетки характеризуются из-
бирательным включением предшественников синтеза кислых
мукополисахаридов и относительно низким уровнем белкового
синтеза. Такие смешанные железы, состоящие из клеток, спе-
циализированных на синтез различных компонентов сложных
секретов, характерны и для многоклеточных желез. К ним от-
носится, в частности, часть слюнных желез . млекопитающих
(подчелюстная железа).
Многоклеточные железы. Эти железы особенно развиты
у высших представителей вторичноротых животных, и в част-
ности у млекопитающих. Поэтому некоторые общие закономер-
ности дифференцировки клеток и системной организации желе-
зистой ткани удобно будет разобрать на примере трех хорошо
изученных к настоящему времени желез: экзокриновой части
поджелудочной железы, молочной железы и сальных желез
кожных покровов. Две первые железы относятся к так назы-
ваемым сложным многоклеточным железам, обладающим це-
лой системой разветвленных выводных протоков. Их концевые
разветвления заканчиваются секреторными отделами. Послед-
ние имеют вид альвеол или трубочек, стенки которых выстланы
эпителиальными секреторными клетками.
Концевые секреторные отделы поджелудочной железы име-
ют небольшой просвет. Их стенка образована плотно примы-
кающими друг к другу конусовидными клетками (рис. 6, а).
Ядра расположены в нижней трети клеток. Цитоплазма де-
лится на две зоны — апикальную зимогенную и базальную го-
могенную зоны. Апикальная часть клеток, содержащая грану-
лы секрета, окрашивается кислыми красителями. Базальная
гомогенная зона, наоборот, резко базофильна. В ней сосредо-
точена основная часть гиалоплазмы и органоидов клетки. Осо-
бенно мощного развития достигает аппарат белкового синтеза
(рис. 6, б). Он представлен плотно упакованными цистернами
42
Рис 6 Секреторные клетки экзокриновой части поджелудочной железы
к млекопитающих.
л схрма чльтраструктурной организации секреторной
а — концевой отдел железы, б - «ема ул^^Хениая, 3 - зимогенная), 4 - шеро-
клеткн. -!-яДРор 2' 3 ТЛ°гНЬГоль^жв митохондрии, 7 - конденсационные вакуоли
ховатая ЭПС, !- аппарат Гоуджи 6 митоц р_лизосомы, /р-постунле-
аППаРние ам°нн?ислот. Стрелки показывают внутриклеточное перемещение секрета.
43
шероховатой эндоплазматической сети, занимающими всю ба-
зальную часть клеток. К наружной поверхности мембран, об-
разующих стенки каналов и цистерн, прикреплены многочис-
ленные рибосомы. В большом количестве обнаруживаются они
и на наружной мембране ядерной оболочки. Хорошо развит
также в секреторных клетках и аппарат Гольджи компактного
типа. Его цистерны и вакуолярная часть расположены в надъ-
ядерной области. В цитоплазме клеток имеются многочислен-
ные крупные митохондрии с хорошо развитыми кристами.
Секреторная клетка поджелудочной железы благодаря ин-
тенсивным процессам белкового синтеза представляет собою
удобную модель для анализа некоторых общих вопросов син-
теза и транспорта белка. На поджелудочной железе морских
свинок методом электронно-микроскопической авторадиографии
удалось показать, что сборка аминокислот, происходящая на
рибосомах эндоплазматической сети, занимает относительно
непродолжительную часть секреторного цикла (около 3 мин).
Перемещение синтезированного белка в мелкие транспортные
пузырьки наблюдается уже через 10 мин после начала синтеза
и резко тормозится при нарушении метаболизма жирных кис-
лот. Слияние транспортных пузырьков с крупными конденса-
ционными вакуолями происходит через 20 мин после начала
синтеза белка на рибосомах ЭПС. Зрелые секреторные грану-
лы с меченым белком начинают в заметных количествах по-
являться через 1 ч после введения меченого предшественника
синтеза белка.
Возможность количественного учета интенсивности процес-
сов синтеза белка, а также продолжительности отдельных эта-
пов внутриклеточного транспорта позволила перейти к экспери-
ментальному анализу этих процессов. При этом удалось пока-
зать, что синтез белка и транспорт его через мембрану ЭПС,
перемещение в цистернах ЭПС, переход в транспортные пузырь-
ки и их слияние с конденсационными вакуолями представляют
собой полуавтономные процессы, не связанные между собой
причинно-следственными связями. Их синхронное протекание
в секреторном цикле клетки обусловливается наличием у кле-
ток интегративных механизмов, обеспечивающих нормальное
развитие секреторного цикла. Такая лабильная организация
последнего придает секреторным клеткам большую пластич-
ность. Так, при действии некоторых агентов образование сек-
реторных гранул может происходить у морских свинок не че-
рез конденсационные вакуоли, а через цистерны аппарата
Гольджи. Такой механизм формирования секреторных гранул
характерен для секреторных клеток большинства млекопита-
ющих.
На секреторных клетках поджелудочной железы морской
свинки в апикальной части обнаружены мелкие пузырьки, об-
разующиеся путем компенсаторного эндоцитоза. Они отшнуро-
44
вываются от плазматической мембраны и перемещаются к ап-
парату Гольджи, сливаясь с его цистернами и конденсацион-
ными вакуолями. Таким образом обеспечивается удаление
избытка плазматической мембраны, возникающего при экзоци-
тозе секреторных гранул. Повторное использование мембран-
ных структур происходит в секреторных клетках и при транс-
порте секрета от шероховатой ЭПС к конденсационным вакуолям.
Транспортные пузырьки после слияния с конденсационной
вакуолью вновь отшнуровываются от нее и возвращаются
обратно к цистернам ЭПС.
Секреторные клетки поджелудочной железы выделяют свой
секрет по мерокриновому типу, т. е. экзоцитозом, без разру-
шения апикальной части клетки и ее плазматической мем-
браны.
Своеобразие экзокринового отдела поджелудочной железы заключа-
ется в сохранении у части секреторных клеток способности к авторепродук-
ции. Это проявляется, с одной стороны, в способности некоторых клеток
к митозу или эндомитотическому удвоению генетического материала. Одна-
ко соматическая полиплоидизация клеток захватывает лишь небольшую
часть клеток, и они не достигают высокой плоидиости.. Несмотря на мед-
ленное обновление секреторных клеток поджелудочной железы в нормаль-
ных условиях, ее регенеративные потенции весьма велики. У белых крыс
после отравления этионином и гибели около 75% секреторных клеток их
восстановление происходит в течение недели преимущественно за счет ин-
тенсивного размножения и специфической дифференцировки клеток конеч-
ных отделов выводных протоков железы. Однако такая быстрая регене-
рация этого эпителия может происходить только при сохранении целост-
ности соединительнотканной основы концевых отделов и выводных протоков
железы.
Железистые клетки молочной железы млекопитающих ха-
рактеризуются разнообразной синтетической деятельностью.
Эти’ клетки секретируют жир, белки (казеин, лактоальбумины
и лактоглобулины), специфический углевод лактозу, а также
неорганические соединения. Большая часть сложных органиче-
ских соединений синтезируется непосредственно клеткой.В свя-
зи с мультифункциональной морфобиохимической дифференци-
ровкой в секреторных клетках молочной железы сильно, хотя
и в меньшей степени, чем в клетках поджелудочной железы,
развит аппарат белкового синтеза в виде шероховатой эндо-
плазматической сети. В надъядерной области располагается
аппарат Гольджи. Имеется система цистерн и каналов глад-
кой эндоплазматической сети. Цитоплазма клеток в опреде-
ленные периоды секреторного цикла заполнена гранулами бел-
кового секрета. Синтез жира начинается в базальной части
клеток (рис. 7, а). Жировые включения обнаруживаются вна-
чале в виде небольшой капли, размеры которой по мере про-
движения к апикальной поверхности клетки сильно возрастают.
К моменту выделения она занимает большую часть апикаль-
ной цитоплазмы. Выделение жира происходит по так называ-
45
2 3
Рис. 7. Схема секреторного цикла в клетках молочной железы (а) [по: Ки-
росуми] и микрофотография сальной железы крысы (б).
1 — эпптелиалъио-мышсчпая клетка, 2 — капля жира, 3 — секреторная гранула с бел-
ковым секретом, 4 — ядро секреторной клетки, 5—шероховатая ЭПС, 6 — аппарат
Гольджи, 7 — камбиальные клетки, 8 — разрушающиеся клетки, 9 — выводной проток,
открывающийся в наружное волосяное влагалище.
емому апокриновому типу, т, е. с от-
рывом части цитоплазмы и плазма-
тической мембраны апикальной по-
верхности. Выведение белковых
продуктов осуществляется преиму-
щественно путем экзоцитоза. Апи-
кальная поверхность клеток обра-
зует характерные пальцевидные
выпячивания типа микроворсинок
в просвет концевого отдела желе-
зы. Они играют, по-видимому, су-
щественную роль в процессах вы-
ведения воды, лактозы и ионов
Са2+.
Особенностью организации мо-
лочной железы является ее способ-
ность к периодическим разрастани-
ям и инволюциям. Эти морфогене-
46
тические процессы находятся под гормональным контролем
организма, определяющим скорость размножения клеток
в период разрастания концевых отделов железы и процессы
их специфической дифференцировки.
- На молочной железе грызунов удалось показать, что под гормональным
контролем находится такой важный период в подготовке клеток к делению,
как редупликация ДНК. В разрастающейся железе продолжительность ее
сокращается с 21,5 до 8,2 ч. Кроме того, гормональное воздействие вы-
равнивает длительность этого периода митотического цикла. В опытах с за-
чатками молочной железы в условиях in vitro выявлена тесная связь и вза-
имообусловленность процессов специфического белкового синтеза и размно-
жения клеток. Синтез специфического для секреторных клеток белка казеина
может происходить только после того, как клетки проделают несколько
циклов репродукции.
Помимо гормонального фактора большое значение в регу-
ляции функциональной активности железы и процессов ее ин-
волюции имеют и внешние воздействия типа механического рас-
тяжения концевых отделов железы выделяемым секретом.
В лактирующей железе при отсутствии оттока молока прекра-
щается выработка секрета клетками. Они дегенерируют, а сек-
рет и продукты разрушения клеток утилизируются организмом
без резко выраженных воспалительных процессов.
Характерным примером железы, выделяющей свой секрет
путем разрушения клеток, может служить сальная железа
млекопитающих. Выводные протоки большинства сальных же-
лез в коже млекопитающих связаны с корневыми частями во-
лос и развиваются в гистогенезе как часть зачатка волоса.
В сальных железах на границе с соединительной тканью рас-
полагаются недифференцированные клетки, энергичное размно-
жение которых обеспечивает непрерывную замену дифференци-
рованных клеток, разрушающихся в центральной области
мешковидного концевого отдела железы (рис. 7, б). Суть
специфической дифференцировки клеток этой железы заклю-
чается, следовательно, в непрерывном и прогрессирующем
накоплении в клетках жироподобных веществ вплоть до полнога
перерождения всей цитоплазмы и гибели клеток. За счет продук-
тов распада таких перерожденных клеток образуется секрет,,
который поступает в просвет выводного протока железы.
Этот не очень экономичный тип секреторного процесса —
голокриновая секреция — довольно широко распространен сре-
ди многоклеточных животных.
§ 2. Эндокринные железы
Эпителиальные эндокринные железы позвоночных живот-
ных. Эти железы представляют собой сложную и гетерогенную
по происхождению систему желез внутренней секреции. Они —
производные как кожного, так и кишечного эпителиев. Име-
ются также железы, которые развиваются из целомиче-
47
ской выстилки и других производных мезодермального эпи-
телия.
Эндокринная часть поджелудочной железы млекопитаю-
щих— типичный пример железистого эпителия, специализиро-
ванного на выработку гормонов. Она состоит из тяжей желе-
зистых клеток, сосредоточенных в железистой ткани экзокри-
новой части железы в виде отдельных скоплений, получивших
название островков Лангерганса. Каждый островок состоит из
взаимно переплетающихся тяжей эпителиальных клеток с ок-
ружающей их сильно разветвленной сетью многочисленных ка-
пилляров (рис. 8). Последние выстланы эндотелием из силь-
но уплощенных клеток, имеющим многочисленные поры, которые
обеспечивают быстрое поступление гормонов в полость сосудов.
Большинство эпителиальных клеток содержит в своей цитоплаз-
ме характерные секреторные гранулы.
По окраске гранул и ряду физико-химических свойств по-
пуляцию дифференцированных секреторных клеток у млекопи-
тающих принято делить на три основных типа — А, В и D.
В-клетки выделяют гормон инсулин, снижающий уровень глю-
козы в крови за счет превращения ее избытков в клетках пе-
чени и мышцах в гликоген.. Клетки типа А выделяют гормон
глюкагон, обеспечивающий превращение гликогена в глюкозу
при снижении ее уровня в крови.
Клетки типа D синтезируют гормон соматостатин, подавля-
ющий выход гормона роста из соматотропных клеток передней
доли гипофиза. Имеются также клетки, почти лишенные сек-
реторных гранул, на основании чего их считали камбиальными
элементами, способными к делению и дифференцировке в раз-
личных направлениях (клетки типа С). Однако,, по-видимому,
это В-клетки в стадии синтеза предшественника инсулина до
формирования зрелых секреторных гранул.
Использование для изучения морфологии-секреторных гра-
нул электронной микроскопии в сочетании с эксперименталь-
ными методами анализа в общем подтвердило представление
о гетерогенности клеточного состава железистого эпителия
островков. Секреторные гранулы в разных типах клеток суще-
ственно различаются по своим размерам, строению окружаю-
щих их мембран и соотношению электронно-плотной цент-
ральной части гранулы и периферического субмембранного
пространства. Удалось также проследить и процессы выведения
гранул из клеток в нормальных условиях и при эксперимен-
тальной стимуляции секреции. Показано, что при интенсивнохм
выведении гранул, содержащих гормоны, увеличивается поверх-
ность плазматической мембраны,, образующей своеобразные
микроворсинки. В месте слияния мембран секреторной грану-
Рис. 8. Участок железистой клетки эндокринной части поджелудочной железы.
а— общий вид, б — схема ультраструктурной организации. 1 — В-клетки с гранулами
инсулина, 2 — А-клетки, 3 — Д-клетки, 4 — сосуд, 5 — В-клетки на стадии синтеза
предшественников инсулина.
48
49
лы и клетки образуется отверстие, через которое гормон вы-
водится наружу.
Тонкие механизмы синтеза гормона, его внутриклеточного
транспорта и созревания хорошо изучены в В-клетках. Оказа-
лось, что на рибосомах ЭПС синтезируется первый предшест-
венник инсулина, так называемый препроинсулин— полипеп-
тид с молекулярным весом 11000. В ходе транспортировки по
цистернам шероховатой ЭПС от полипептида «отрезается» уча-
сток цепи и образуется проинсулин— полипептид с молекуляр-
ным весом 9100. Из этих молекул в результате дальнейшего
гидролиза образуется уже инсулин с молекулярным весом
5000. Такого рода сложные превращения необходимы,
по-видимому, и для транспортировки молекулы, и для . бо-
лее совершенной регуляции выведения гормона в кровяное рус-
ло. Как уже отмечалось выше, имеется определенная циклич-
ность в синтезе, накоплении и выведении гормона В-клетками.
В стадии синтеза предшественников гормона клетки содержат
мало гранул, и, наоборот, при накоплении большого количе-
ства гранул синтез предшественников временно прекращается.
Среди А-клеток у млекопитающих выделяют три разновид-
ности, отличающиеся как по строению и размерам гранул, так
и по отношению к некоторым экспериментальным воздействи-
ям. У птиц обнаружено два типа А-клеток: Ai-клетки, выра-
батывающие глюкогон, и А2-клетки, синтезирующие панкреа-
тический полипептидный гормон.
Гетерогенность состава А-клеток у млекопитающих позво-
ляет высказывать предположения о том, что часть из них. мо-
жет выделять гормоны, регулирующие метаболизм жиров,
а также-серотонин.
Система В-клеток у млекопитающих чувствительна- к хронической уси-
ленной функциональной 'нагрузке. Свойственные другим тканевым системам
широкие потенции к клеточной и тканевой гипертрофии у В-клеток желе-
зистого эпителия островков Лангерганса довольно ограничены. Системы кле-
ток, продуцирующих инсулин, при усиленной функциональной нагрузке либо
при неадекватном вмешательстве в регуляторные ее механизмы, либо, нако-
нец, при эндогенных нарушениях этих механизмов подвергаются массовой
деструкции. Это приводит к тяжелому и широко распространенному заболе-
ванию — диабету, суть которого заключается в утрате способности организ-
ма регулировать уровень глюкозы в крови.
Щитовидная железа представляет собой пример железы,
имеющей некоторое внешнее сходство с экзокриновыми железа-
ми. Она состоит из многочисленных фолликулов, стенки кото-
рых образованы железистым эпителием (рис. 9, а). В полости
таких фолликулов .находится коллоид тиреоглобулин, из кото-
рого образуются гормоны тироксин и трииодтиронин. Молеку-
лы тиреоглобулина с молекулярным весом 660000 состоят из
четырех мономеров протеогликанов. Их основу составляет цент-
ральная белковая цепь, к которой присоединены многочислен-
ные боковые полисахаридные цепи.
50
Рис. 9. Фолликулы щитовидной железы млекопитающего (а) и схема уль-
траструктурпей организации секреторной клетки (б).
/ — коллоид, 2 — секреторные клетки, 3 — шероховатая ЭПС, 4 — аппарат Гольджи,
5 — ядро, 6 — пузырьки с синтезированным коллоидом, 7 — пузырьки с резорбирован-
ным коллоидом’, поступающим в клетку путем пнноцитоза, 8 — лизосомы. Стрелки:
слева показывают места синтеза и направление внутриклеточного перемещения кол-
лоида при его выделении в полость фолликула, справа — поступление (резорбцию)
и превращение коллоида в клетке при выделении гормонов.
51
Как и во всех железах внутренней секреции, в щитовидной
железе имеется разветвленная сеть капилляров, стенки кото-
рых непосредственно контактируют с базальной мембраной же-
лезистого эпителия фолликулов. В отличие от других эндокрин-
ных желез секреторные клетки стенки фолликулов щитовид-
ной железы характеризуются резко выраженной полярностью
(рис. 9, б). В базальной части клеток наблюдается складча-
тость плазматической мембраны и большое количество мито-
хондрий. На апикальной поверхности, контактирующей с кол-
лоидом, образуются небольшие микроворсинки.
Синтез предшественника гормона — тиреоглобулина начи-
нается на прикрепленных рибосомах расширенных цистерн эн-
доплазматической сети, расположенной в базальной и средней
частях клеток. Отсюда синтезированные на рибосомах белко-
вые цепи протеогликанов с начальными участками полисаха-
ридных боковых цепей поступают в цистерны аппарата Гольд-
жи. Здесь происходит синтез основных отрезков боковых угле-
водных цепей и объединение мономеров протеогликанов
в молекулы тиреоглобулина. Далее из цистерн аппарата Гольд-
жи при помощи мелких секреторных пузырьков происходит
транспортировка молекул тиреоглобулинов к апикальной по-
верхности клеток, где коллоид и выделяется в просвет фолли-
кула путем экзоцитоза. Иодирование молекул тиреоглобулина
имеет место либо в апикальной части клеток, либо в момент
экзоцитоза у клеточной поверхности. Обратное поступление
коллоида в клетку происходит путем пино- или фагоцитоза.
Образующиеся пино- и фагосомы сливаются с лизосомами,
гидролитические ферменты которых разрушают молекулы ти-
реоглобулина. При этом происходит образование двух основ-
ных гормонов щитовидной железы — тироксина и трииодтиро-
нина, представляющих собою небольшие молекулы с молеку-
лярным весом около 650 и содержащих 4 или 3 атома иода.
Такой сложный путь образования относительно простых
соединений, по-видимому, не случаен. Он позволяет щитовид-
ной железе иметь большое количество «полупродукта» и тон-
ко регулировать поступление гормонов в кровь. Вместе с тем
этот принцип работы с внеклеточным хранением высокомоле-
кулярного предшественника гормонов требует весьма сложной
организации клеток: они должны осуществлять одновременно
два разных по своей сути многоступенчатых процесса: а) син-
тез и выведение коллоида; б) его поглощение, тонкий гидро-
лиз с сохранением гормонов и их регулируемое выведение из
клеток.
Помимо тиреоцитов в стенке фолликулов щитовидной железы млекопи-
тающих имеются еще и так называемые парафолликулярные клетки. Они не
доходят до просвета и синтезируют гормон кальцитонин — небольшой поли-
пептид, регулирующий кальциевый обмен. По своей структурно-химической
организации парафолликулярные клетки сходны с А- и В-клетками подже-
лудочной железы и существенно отличаются от тиреоцита.
52
Гормоны железы, выделяемые тиреоцитами, тироксин
и трииодтиронин, а также образующиеся из них в результате
окислительного дезаминирования конечные активные продук-
ты действуют на ферментативные системы, локализованные в
митохондриях. В связи с этим щитовидная железа регулирует
общий энергетический обмен во многих тканях.
Эпителий щитовидной железы в отличие от эпителия островков Лангер-
ганса обладает большими потенциями к регенерации и гипертрофии. Эти
процессы, как и функция железы в нормальных условиях, регулируются гор-
монами и, в частности, тиреотропным' гормоном аденогипофиза. У человека
потенции эпителия щитовидной железы к увеличению количества желези-
стой ткани за счет интенсивной репродукции клеток особенно отчетливо
проявляются в патологических условиях. При отсутствии в диете доста-
точного количества йода естественно падает и количество выделяемого щи-
товидной железой гормона. Это вызывает усиленную продукцию тиреотроп-
ного гормона аденогипофизом, что обусловливает стимуляцию пролиферации
клеток эпителия щитовидной железы. В результате в несколько раз увели-
чивается объем железистой ткаии.
Корковое вещество надпочечника млекопитающих развивается из цело-
мической выстилки и может служить примером эндокринной железы мезо-
дермального происхождения. Вся железа состоит из тяжей эпителиальных
железистых клеток, расположенных перпендикулярно к ограниченной соеди-
нительнотканной капсулой поверхности органа. Соответственно этому ори-
ентирована и сеть капилляров, которые со всех сторон окружают тяжи же-
лезистых клеток. Расположение клеток в тяжах и их морфобиохимическая
дифференцировка неодинаковы в разных зонах коркового вещества надпо-
чечника (рис. 10). Клетки всех зон выделяют стероидные гормоны, предше-
ственником синтеза которых служит холестерин.
Под соединительнотканной капсулой располагаются начальные участки
тяжей, образованные относительно мелкими клетками с темными ядрами
и умеренным количеством липидных включений в цитоплазме. Совокупность
начальных участков тяжей образует так называемую клубочковую зону над-
почечника (рис. 10, а, б). Ее железистые клетки выделяют в основном гор-
мон альдостерон, который регулирует солевой обмен. Следующая, наиболь-
шая по толщине зона коркового вещества надпочечника образована сред-
ними участками тяжей эпителиальных клеток и получила название пучко-
вой зоны (рис. 10, в, е). Она состоит из более крупных клеток с относи-
тельно светлой оксифильной цитоплазмой и более светлыми, чем у клеток
клубочковой Зоны, ядрами. В состоянии умеренной функциональной актив-
ности в цитоплазме клеток обнаруживаются в большом количестве мелкие
липидные гранулы, содержащие холестерин, из которого образуется кортй-
зон — основной гормон клеток этой зоны. Выделение гормонов стимулиру-
ется особым адеиокортикотропным гормоном аденогипофиза. Гормоны пуч-
ковой зоны регулируют белковый и углеводный обмен, а также тормозят
размножение клеток и формирование основного вещества в соединитель-
ной ткани, развитие воспалительной реакции и процессы образования
антител.
При умереииой продукции гормонов в цитоплазме клеток пучковой зоны
содержится много мелких липидных включений. При стимуляции желези-
стой функции размеры клеток, ядер и ядрышек увеличиваются. Судьба ли-
пидных гранул при такой гипертрофии клеток может быть различной. Они
могут полностью исчезать, однако при более сильной стимуляции количе-
ство их увеличивается по сравнению о нормой, но размеры уменьшаются.
Такая динамика изменений липидных включений свидетельствует о том, что
они представляют собой, как и коллоид щитовидной железы, не готовый
гормон, а лишь его предшественник.
Конечные участки эпителиальных тяжей коркового вещества иадпочеч-
53
Рис, 10. Корковое вещество
Зоны коркового вещества надпочечника:
сетчатая. / — ядро, .2— митохондрия, 3~
полость капилляра,
надпочечников млекопитающих.
б — клубочковая, в, г — пучковая, д,
липидные капли, 4 — гранулы гликогена’,
6 — клетки эндотелия.
р
е —
5 —
54
ников, его так называемую сетчатую зону, образуют анастомозы между со-
седними тяжами. Железистые клетки этой зоны меньше по размерам, коли-
чество липидных включений в них минимально, цитоплазма и ядра окраши-
ваются интенсивно (рис. 10, д, ё). В цитоплазме часто содержатся гранулы
липофусцина. Предполагают, что железистые клетки сетчатой зоны могут
выделять андрогены и другие половые гормоны.
Таким образом, корковое вещество надпочечника представляет собой
сложную железу внутренней секреции с отчетливой дифференцировкой обра-
зующих ее клеточных элементов. В ней наблюдается четкое пространствен-
ное разграничение клеток разной функциональной специализации. Гистоге-
нетические взаимоотношения между типами клеток, расположенных в раз-
ных зонах коркового вещества, остаются неясными. Каждый эпителиальный
тяж с его тремя зонами представляет собой обновляющуюся субпопуляцию
клеток. Митозы и меченные 3Н-тимидином ядра наблюдаются во всех трех
зонах, максимальное их количество в клетках клубочковой зоны, а мини-
мальное-— в клетках сетчатой зоны. Отчетливо выражен градиент распре-
деления пролиферирующих клеток и в пределах каждой зоны. Количество
митозов и меченных 3Н-тимидииом ядер всегда больше в проксимальных
участках и меньше в глубже лежащих участках данной зоны. В длительных
опытах с 3Н-тимидином удается наблюдать в каждой зоне тяжа перемеще-
ние меченых клеток из проксимальных в дистально расположенные участки.
Аденогипофиз занимает особое положение в системе желез
внутренней секреции у позвоночных животных. С одной сторо-
ны, железистые клетки аденогипофиза выделяют гормоны, ре-
гулирующие деятельность других желез внутренней секреции:
кортикотропный, тиреотропный, гонадотропный гормоны. В свя-
зи с этим аденогипофиз является центральной железой внут-
ренней секреции. С другой стороны, секреторная активность
клеток аденогипофиза регулируется (в основном через кровь
и тканевую жидкость) нейросекреторными клетками гипотала-
мической области головного мозга. Часть клеток аденогипофи-
за выделяет гормоны, непосредственно действующие на клет-
ки тканей-мишеней (например, гормон роста соматотропин,
лактогенный гормон, или маммотропин и, наконец, меланоци-
тостимулирующий гормон).
Аденогипофиз в эмбриогенезе развивается из зачатка кож-
ного эпителия, выстилающего дорсальную стенку ротовой по-
лости. В морфологическом отношении основная его часть —
дистальная зона — имеет строение типичной железы внутренней
секреции. Железистая ткань представлена здесь системой
обильно васкуляризованных тяжей эпителиальных клеток. Осо-
бенностью железистой ткани аденогипофиза является боль-
шая гетерогенность клеточного состава. Она обусловлена раз-
личной функциональной и в связи с этим морфобиохимической
дифференцировкой клеток. В аденогипофизе удается выделить
три главных типа клеток: оксифильные, базофильные и хро-
мофобные клетки. Оксифильные и базофильные клетки — ак-
тивно функционирующие элементы. Хромофобные клетки пред-
ставляют собой либо временно вышедшие из секреторного цик-
ла клетки, либо запас малодифференцированных камбиальных
элементов, способных превращаться в различные типы секре-
55
торных клеток. Они характеризуются небольшими размерами
и отсутствием признаков специфической дифференцировки.
Оксифильные и базофильные клетки в свою очередь подраз-
деляются еще па ряд разновидностей, количество которых
варьирует (от 7 до 9 типов клеток), по данным разных авто-
ров. Функциональное значение некоторых типов клеток, выра-
батывающих разные гормоны, установлено достаточно точно.
На ультраструктурном уровне клетки аденогипофиза раз-
личаются главным образом размерами секреторных гранул
(рис. 11). Установлено, что наиболее крупные гранулы (42—
50 нм) характерны для пролактиновых клеток, наиболее мел-
кие— для кортикотропных и тиреотропных клеток (10—20 нм).
Последние отличаются между собой по форме каналов эндо-
плазматической сети (более вытянутые у кортикотропных кле-
ток) и количеством свободных рибосом (больше у тиреотроп-
ных клеток). Для гонадотропных клеток характерны гранулы
размером 20—25 нм, а для соматотропных — 35—40 нм.
Эпителиальные эндокринные железы беспозвоночных. Эти
железы, аналогичные по своему биологическому значению же-
лезам внутренней секреции позвоночных животных, обнару-
жены к настоящему времени в основном у высших первично-
ротых животных (насекомых, ракообразных, головоногих мол-
люсков) и у оболочников. Тем не менее специальные желези-
стые эпителиальные клетки, выделяющие гормоны, имеются,
по-видимому, и в тканях других беспозвоночных животных.
У оболочников своеобразными железами внутренней секре-
ции являются эндостиль и субневральная железа. Эндостиль —
это продольный желобок на брюшной стороне глотки, выстлан-
ный ресничным и железистым эпителием и служащий в основ-
ном для перемещения склеенных слизью пищевых комочков
к пищеводу. Однако авторадиографические исследования с1?1!
показали, что в эпителиальной выстилке эндостиля есть уча-
стки, образованные клетками, избирательно захватывающими
иод. Эти клетки образуют специфические гормоны тироксин
и трииодтиронин. Аналогичные клетки имеются в эндостиле
ланцетника. Гомологом аденогипофиза у оболочников многие
исследователи считают субневральную железу. Она вырабаты-
вает гормоны, близкие по своим свойствам меланоцитстимули-
рующему гормону аденогипофиза позвоночных, действующему
на пигментные клетки, и, по-видимому, своеобразные гонадо-
тропные гормоны.
Если у вторичнороты'х беспозвоночных, в частности у обо-
лочников, имеются эпителиальные эндокринные железы, в из-
вестной мере гомологичные соответствующим железам позво-
ночных, то у высших первичноротых животных в этом отно-
шении наблюдается лишь глубокая биологическая аналогия.
Эпителиальные эндокринные железы насекомых, ракообраз-
ных и головоногих моллюсков возникают в связи с общим
£6
Рис. 11. Схема ультраструктурной организации клеток аденогипофиза мле-
копитающих.
Клетки: /—соматотропная, 2 — гонадотропная, 3 — тиреотропная, 4 — пролактиновые,
5 — эндотелия.
57
усложнением их организации." У высших моллюсков и отдель-
ных классов членистоногих эндокринные железы относительно
разнообразны.
У головоногих моллюсков эпителиальные эндокринные же-
лезы представлены оптическими и перикардиальными железа-
ми. Кроме того, гормональная активность обнаружена и у
клеток задней пары слюнных желез. Оптические железы — это
шаровидные образования, расположенные в дистальной части
глазных стебельков и состоящие из эпителиальных железистых
и соединительнотканных клеток. Эпителиальные клетки выра-
батывают гонадотропный гормон, стимулирующий рост поло-
вых желез и откладку яиц. Перикардиальные железы пред-
ставляют собой систему каналов, выстланных железистым
эпителием. Удаление этих желез вызывает -на 4-й день гибель
животных. Характер выделяемых этой железой гормонов и их
функциональное значение остаются пока неясными.
Слюнные железы головоногих моллюсков входят в состав
железистого аппарата их пищеварительного тракта, т. е. вы-
полняют роль экзокриновых желез. Однако, как и у млекопи-
тающих, они не только выделяют секрет в полость начальных
отделов пищеварительного тракта, но и продуцируют гормоны
в обильно разветвленную сеть капилляров и лакун в прослой-
ках соединительной ткани. Гормоны, выделяемые железистыми
клетками слюнных желез головоногих моллюсков (норадрена-
лин и серотонин), регулируют деятельность мышечных клеток.
У ракообразных эндокринные железы представлены Т-орга-
нами и андрогенными железами. Первые являются видоизме-
ненными метанефридиями головных сегментов. Они локализо-
ваны у низших раков в первом антеннальном, а у высших ра-
ков— во втором максиллярном сегментах. Y-орган может иметь
листовидную, коническую или чечевицеобразную форму и со-
стоит из эпителиальных железистых клеток, цитоплазма кото-
рых богата РНК и щелочной фосфатазой и бедна гликогеном
и липидами. Гормон Y-органа регулирует обмен веществ. Он
представляет собой, по-видимому, разновидность гормона линь-
ки членистоногих — экдизона. В связи с этим Y-органы пред-
ложено называть экдизальными железами. Основной их функ-
цией является регуляция линьки, но, кроме того, гормон или
гормоны экдизальных желез ракообразных регулируют обмен
веществ и стимулируют созревание гонад. Андрогенные желе-
зы ракообразных, по-видимому, так же как и экдизальные,
мезодермального происхождения. Они развиваются из стенки
выводного протока половой железы и располагаются либо на
его поверхности, либо погружены в ткань половой железы^
Гормоны этих желез стимулируют развитие семенников и вто-
ричных мужских половых признаков.
У насекомых хорошо изучены и имеют наибольшее значе-
ние две железы внутренней секреции эпителиальной природы —
58
прилежащие тела и экдизальные железы, которые известны под
различными названиями (перикардиальные, проторакальные,
вентральные, перитрахеальные и др.). Прилежащие тела, как
и аденогипофиз позвоночных, развиваются из эктодермы,
а экдизальные железы аналогичны корковому веществу надпо-
чечников, поскольку являются производными либо целомиче-
ского эпителия, либо мезодермальной части краниальных ме-
танефридиев. При этом, несмотря на общность источников раз-
вития аденогипофиза и прилежащих тел, с одной стороны,
и коркового вещества надпочечников и экдизальных желез —
с другой, это не гомологичные образования, так как возникают
независимо у высших первично- и вторичноротых животных.
Рис. 12. Эпителиальные эндокринные железы насекомых. [Т. В. Кинд 1968].
а — прилежащие тела (Corpora allata), б — четыре полиплоидные клетки экднзиальной
(проторакальной) железы.
Эндокринные эпителиальные железы насекомых, несмотря
на их различное происхождение и функциональное значение,
построены по одному принципу (рис, 12). Они представляют
собой скопления большего или меньшего числа клеток, омывае-
мых гемолимфой и обильно снабжаемых кислородом за счет
развитой в области этих желез трахейной системы. Прилежа-
щие тела и экдизальные железы насекомых связаны с нервной
системой. У многих насекомых среди эпителиальных желези-
стых клеток обнаружены окончания нейросекреторных клеток.
В ряде случаев показана строгая корреляция между актив-
ностью клеток эндокринных желез и появлением или исчезно-
вением гранул нейросекрета в этих окончаниях.
Для эндокринных эпителиальных желез насекомых харак-
терны циклические изменения железистой ткани, связанные
59
J
Рис. 13. Схема ультраструктурной организации клеток экдизиальной железы
насекомых.
1 — оболочка железы, 2 — аксон нервной клетки, 3, 4 — аксоны нейросекреторных кле*
ток (3— с крупными и 4 — с мелкими секреторными гранулами), 5 — гранулы глико-
гена, 6 — липидная капля, 7 — секреторная вакуоль, 8 — аутофагическая вакуоль, 9—•
лизосома, 10 — межклеточная лакуна, 11 — периферическая лакуна, 12—14 — стадии
трансформации митохондрий.
ЪО
с линькой. Они проявляются, в частности, в периодическом
увеличении интенсивности синтеза РНК, выявляемом по уве-
личению включения 3Н-уридина, что коррелирует и с секретор-
ной активностью железистых клеток.
-Гормоны, выделяемые прилежащими телами, регулируют
метаморфоз, линьку и связанные с ними процессы метаболиз-
ма в организме и отдельных тканях и органах. Железистые
клетки прилежащих тел выделяют ювенильный гормон, тормо-
зящий наступление половой зрелости. Экдизальная железа, по-
видимому, вырабатывает гормон линьки (экдизон), который
сходен по своей химической природе со стероидными гормона-
ми надпочечника. В связи с этим в ультраструктурной орга-
низации секреторных клеток экдизальных желез удается вы-
явить некоторые сходные черты с организацией железистых-
клеток коры надпочечников (рис. 13). Гормоны экдизальных
желез растворяются в липидах и выделяются вместе с липид-
ными вакуолями. Возможно, что в синтезе гормонов прини-
мают участие митохондрии. Однако клетки насекомых не спо-
собны синтезировать холестерин — предшественник стероидных
гормонов, поэтому гладкая эндоплазматическая сеть в клетках
экдизальных желез не получает большого развития.
В экдизальных железах высших насекомых имеются спе-
циальные приспособления для увеличения поверхности плазма-
тической мембраны клеток и транспортировки выделяемых
клетками продуктов в гемолимфу (рис. 13). Многообразные
отношения наблюдаются в эндокринных железах насекомых
между синтезом ДНК, репродукцией и гетеросинтетической
активностью клеток. Здесь широко распространены явления со-
матической полиплоидизации. Репродукция и дегенерация кле-
ток эндокринных желез связаны не с процессами физиологиче-
ской регенерации, а с циклическими изменениями в функцио-
нальной активности желез.
§ 3. Некоторые общие закономерности эволюционной
динамики железистых эпителиев
Все многообразие специфической дифференцировки секре-
торных клеток базируется на соответствующих модификациях
общего для всех клеток метаболического аппарата цитоплазмы.
Естественно поэтому, что изучение морфобиохимической органи-
зации железистых клеток имеет не только специальное, но и
общее значение. На примере специализированных клеток уда-
ется более четко выявить взаимоотношения органоидов цито-
плазмы, источники и механизмы формирования отдельных
органоидов, полнее изучить процессы внутриклеточной регуля-
ции и интеграции.
При разработке чисто цитологических аспектов дифферен-
цировки железистых эпителиев, связанных с детализацией
61
фуНКЦИ(Я1ального значения отдельных желез, существенный
прогресс наблюдается и в понимании общих закономерностей
клеточной организации. Из приведенных выше примеров видно,
что характер структурно-химической организации секреторных
клеток определяется прежде всего классом соединений, образу-
ющих основную массу секрета. В тех случаях, когда преобла-
дают белки в секреторных клетках, сильное развитие получает
шероховатая ЭПС. При синтезе стероидных гормонов, наобо-
рот, сильно развивается гладкая ЭПС и появляется большое
количество митохондрий, наконец, в слизистых железах осо-
бенно большое развитие получает мембранная система аппара-
та Гольджи. В связи с этим велико значение систематического
анализа сходных в биохимическом отношении желез у далеко
отстоящих в филогенетическом отношении групп животных.
Специальный анализ авторадиографических и биохимиче-
ских данных по динамике синтеза и внутриклеточного тран-
спорта белка в секреторных клетках поджелудочной железы
млекопитающих и в белковых железах у шелкопряда показал
глубокое сходство основных закономерностей этих процессов.
Больше того, несмотря на принципиальные различия в ор-
ганизации растительных и животных клеток и длительный
путь независимого эволюционного усложения растительных
секреторных клеток, выделяющих терпеноиды, у них имеется
много общих черт в ультраструктурной организации с живот-
ными клетками, синтезирующими стероиды. Сходство в орга-
низации рассматриваемых клеток обусловливается сходством
. начальных этапов биосинтеза этих специфических продуктов.
Сходную ультраструктурную организацию имеют такие дале-
кие по происхождению специализированные клетки, как клетки
пучковой зоны надпочечника млекопитающих, клетки экдизаль-
ных желез насекомых и, наконец, растительные клетки, синте-
зирующие терпены. Ярким примером в этом отношении явля-
ется сходство в ультраструктуре, динамике синтеза и переме-
щении белка в клетках, синтезирующих ферменты у насекомо-
ядных растений, и клетках экзокриновой части поджелудочной
железы.
В основе отмеченного выше разнообразия железистых эпи-
телиальных тканей животных лежат, несомненно, глубокие
исторические причины. Возникновение процесса секреции бази-
руется на одном из фундаментальных и первичных свойств
живой протоплазмы — непрерывном обмене веществ между ок-
ружающей средой и клеткой. В пограничных тканях многокле-
точных животных выделение продуктов метаболизма происхо-
дило и наружу, и в подлежащую паренхиму. Соответственно
этому и возникло два основных направления железистой диф4-'
ференцировки: одно для формирования экзокриновых, дру-
гое— эндокринных желез. Однако у низших многоклеточных
с их относительно низким уровнем организации нет необходи-
62
мости в развитии специальных оформленных эндокринных же-
лез. Гуморальная интеграция у них обеспечивается специаль-
ной нейроэндокринной системой и, возможно, небольшим коли-
чеством диффузно расположенных железистых клеток различ-
ного происхождения. Лишь с повышением уровня организации
животных'возникает необходимость формирования специальной
системы эпителиальных эндокринных желез в дополнение к бо-
лее древним по происхождению нервной и нейроэндокринной
интеграционным системам организма.
Весьма примечательным является тот факт, что возникнове-
ние системы эндокринных желез произошло независимо у трех
групп животных: позвоночных, головоногих моллюсков и выс-
ших членистоногих. При этом сложность организации системы
таких желез и их удельное значение в регуляции важнейших
функций организма оказывается в прямой зависимости от
сложности организации животных. Наибольшего уровня фило-
генетической дифференцировки достигают эпителиальные эндо-
кринные железы у высших позвоночных и у насекомых. Глу-
бокая аналогия в прогрессивном развитии системы эндокрин-
ных желез у позвоночных и насекомых проявляется и в харак-
тере связей этих желез с нервной системой. И у позвоночных,
и у насекомых эта связь обеспечивается через систему нейро-
секреторных клеток. У представителей различных классов по-
звоночных и близкородственных им оболочников и ланцетника
удается проследить ряд интереснейших эволюционных модифи-
каций некоторых желез внутренней секреции. Так, гомологич-
ными образованиями являются, по-видимому, эндостиль лан-
цетника и оболочников и щитовидная железа позвоночных жи-
вотных. Строение последней, а также способ формирования
в отногенезе даЮт основание предполагать, что источником ее
возникновения была железа, обладавшая выводным протоком
и выделявшая секрет в полость пищеварительного тракта. Про-
образом такой железы может служить щитовидная железа ли-
чинки миноги. Она имеет выводной проток и выделяет синте-
зируемые в концевых отделах тиреоглобулины в просвет пище-
варительного тракта. В полости средней кишки они подверга-
ются гидролизу, а иодированные аминокислоты тироксин и три-
иодтиронин всасываются кишечным эпителием. Возможно,
однако, что наблюдаемые у личинки миноги особенности син-
теза предшественника и образования гормонов представляют
собой лишь одну из эволюционных модификаций этой желези-
стой ткани и не имеют отношения к возникновению у позво-
ночных сложной динамики синтеза этих гормонов в клетках
фолликулярного эпителия щитовидной железы.
Несмотря на более позднее в филогенезе появление эпите- ’
лиальных эндокринных желез, они возникали, по-видимому, не
только на оснбве более древних по происхождению экзокрино-
вых желез. Так, у низших позвоночных эндокринные желези-
63
стые элементы эктодермального происхождения выделяются из
состава кишечного эпителия раньше, чем экзокриновая часть
поджелудочной железы. Непосредственно из целомического
эпителия возникла в филогенезе позвоночных железистая ткань
коркового вещества надпочечника. У высших беспозвоночных
большей части желез внутренней секреции дали начало эпите-
лиальные ткани, не специализированные на железистую функ-
цию.
У высших многоклеточных получила распространение
и мультифункциональная дифференцировка клеток железистых
эпителиев как, например, в слюнных железах млекопитающих
и человека, а также головоногих моллюсков, т. е. эти эпителии
выполняют как экзокриновую, так и эндокринную функции.
Глава 6. КИШЕЧНЫЕ ЭПИТЕЛИИ
Кишечные эпителии представляют собой одну из наиболее
древних и универсальных тканевых систем многоклеточных
организмов. Специализация основных клеток этой ткани шла
в направлении совершенствования общих для всех клеток ме-
ханизмов трансмембранного поглощения веществ из внешней
среды, их внутриклеточного транспорта и выведения из клеток
в подлежащие ткани. Соответственно этому для большинства
современных многоклеточных животных характерно полостное
пищеварение. Однако у некоторых низших многоклеточных
(губки, бескишечные турбелярии), у большинства моллюсков,
брахиопод, у некоторых членистоногих преобладают процессы
внутриклеточного пищеварения. В качестве вспомогательного
механизма поглощение питательных веществ путем пиноци-
тоза используется кишечными эпителиями многих многокле-
точных с преимущественно полостным пищеварением.
Необходимой предпосылкой полостного пищеварения явля-
ется формирование железистого аппарата либо непосредствен-. >
но в составе эпителиального пласта, либо в виде специальных
желез, расположенных по ходу пищеварительного тракта. Фор-
мирование специального железистого аппарата параллельно
развивается в разных группах многоклеточных животных и у
высших представителей этих групп достигает большой слож-
ности и разнообразия. Кроме того, у позвоночных и некоторых
групп беспозвоночных (головоногие моллюски, отчасти ракооб-
разные) в пищеварительной системе выделяется специальный
орган — печень, обеспечивающий вторичную обработку, резерви-
рование и детоксикацию поступающих в организм соединений.
Эпителий печени образуется в онтогенезе из того же зачатка,
что и кишечный эпителий, и представляет собой особую его
разновидность.
64
§ 1. Кишечные эпителии позвоночных животных
Млекопитающие. Кишечный всасывающий эпителий млеко-
питающих— типичный однослойный цилиндрический эпителий
с резко выраженной полярностью образующих его клеточных
элементов. Дифференцированные, активно функционирующие
клетки составляют эпителиальный пласт, покрывающий наруж-
ную поверхность ворсинок —основных структурных единиц
слизистой оболочки тонкой кишки (рис. 14,о). Они представ-
ляют собой микроорганные структуры с собственным нервным,
мышечным и сосудистым аппаратами. Слущивание закончив-
ших жизненный цикл дифференцированных клеток происходит
на вершине ворсинок. Постоянство клеточного состава эпите-
лиального пласта обеспечивается за счет интенсивного размно-
жения камбиальных клеток крипт—пальцевидных впячиваний
эпителия в слизистую оболочку. Клетки эпителия крипт отли-
чаются от дифференцированных меньшими размерами, боль-
шей базофилией цитоплазмы, отсутствием или слабым разви-
тием морфологических признаков специфической дифференци-
ровки.
Морфологическим и цитохимическим различиям между камбиальными
и дифференцированными клетками соответствуют и неодинаковые интенсив-
ность и характер метаболических процессов. Они особенно отчетливо выявля-
ются на автографах слизистой оболочки кишки лабораторных грызунов
в опытах с предшественниками синтезов белка или РНК. На ранних сроках
после инъекции меченых аминокислот интенсивность их включения в белки
клеток системы крипта — ворсинка отчетливо преобладает в камбиальных
клетках крипт по сравнению с функционирующими клетками эпителия вор-
синок. Интенсивность синтеза белка в последних постепенно уменьшается от
основания ворсинок к их вершинам. В опытах с предшественником синтеза
РНК (3Н-уридином) включение его во вновь синтезируемую РНК происхо-
дит только в клетках крипт. Таким образом, эти опыты показывают, что
специфическая цитодиффереициация в кишечном эпителии приводит не
только к полному блокированию автосинтетических процессов и репродук-
ции клеток, но и прекращает в дифференцированных клетках считывание
информации с ДНК ядерного аппарата, т. е. блокирует транскрипцию. Не-
обходимый "для функционирования клеток белковый синтез протекает с ис-
пользованием различных типов РНК, синтезированных в период их размно-
жения.
Таким образом, кишечный эпителий представляет собой
сложную гетерогенную систему. Однослойный эпителиальный
пласт состоит из различающихся по своим свойствам и значе-
нию субпопуляций клеток: камбиальных, малодифференциро-
ванных, дифференцированных и заканчивающих жизненный
цикл. Эти клеточные субпопуляции распределены на боковых
поверхностях крипт и ворсинок и на апикальных концах по-
следних. Несмотря на различия в метаболической активности
и топографическом положении, все субпопуляции клеток пред-
ставляют собой единую систему. Она представлена клетками,
находящимися на последовательных этапах жизненного цикла.
3 672
65
Рис. 14. Схема строения слизистой оболочки (а) и всасывающей клётки
Фибриллярный аппЭарИаТтеЛыи'КроворсРиХ!’ Л'соеХХтьный* ко™™’ 5Г кровеиосный
12- капля жира, 13 - шероховатая ЭПС’/4-Гла дкая ЭПС К°Д™Т (зоны СЛ[1ЯН™
можные пути внутриклеточного транспорта, спраТаД-лок^изац™' синтТа^и во^ж!
обновления поверхностного
66
12
7
тонкой кишки млекопитающих (б).
сосуд, 6 — мышечный слой слизистой оболочки, 7 — микроворсинки, 8 — сократимый
и прилежания, десмосома), /0 — надмембранный комплекс, // — аппарат Гольджи,
на. Стрелки: слева показывают процесс всасывания и выведения жира, а также воз-
ные пути внутриклеточного транспорта мембранных и надмембранных структур для
аппарата микроворсинок.
3*
67
Темпы их размножения, длительность существования и интен-
сивность гибели строго координированы.
Основными дифференцированными клетками кишечного эпи-
телия в количественном (88% в тонкой кишке) и в функцио-
нальном отношениях являются всасывающие призматические
клетки. Их особенность — ярко выраженная полярность, про-
являющаяся в структурных и функциональных различиях апи-
кальных и базальных частей клеток. Апикальная цитоплазма
и наружная плазматическая мембрана образуют микроворсин-
ки— относительно крупные образования, у млекопитающих
длиной в 1,4 мкм и шириной в 0,08 мкм, занимающие всю об-
ращенную в просвет кишки поверхность клетки. Снаружи каж-
дая микроворсинка имеет плазматическую мембрану, благода-
ря чему общая всасывающая поверхность эпителиального пла-
ста оказывается весьма обширной (рис. 14,6).
В микроворсинках отчетливо выявляются продольные фиб-
риллярные актиновые структуры. В основании микроворсинок
они переходят в фибриллярный слой, расположенный парал-
лельно апикальной поверхности клеток и содержащий помимо
актиновых миозиновые и а-актининовые фибриллы. Одно из
важных свойств микроворсинок—-способность их в результате
медленного сокращения и расслабления к изменению всасыва-
ющей поверхности клеток и расстояния между соседними мик-
роворсинками. Весьма важной в функциональном отношении
их структурой является хорошо развитый мукополисахаридный
надмембранный комплекс, одевающий каждую микроворсинку
и выделяемый всасывающими клетками. Интенсивное обнов-
ление надмембранного комплекса было продемонстрировано ме-
тодом электронной авторадиографии с помощью 3Н-глюкозы.
Основная функция аппарата микроворсинок состоит в обе-
спечении активного транспорта—первого звена избирательного
поступления веществ в цитоплазму всасывающей клетки. Спе-
циализированная плазматическая мембрана обладает ярко вы-
раженной способностью к активному и пассивному транспорту.
Кроме того, на поверхности мембраны микроворсинок распола-
гаются ферменты, обеспечивающие гидролитическое расщепле-
ние макромолекул, не разрушенных действием ферментов же-
лудочного и кишечного соков. Этот вспомогательный механизм
получил название «пристеночного, или мембранного,
пищеварения». В его рабрте участвуют мукополисахариды
надмембранного комплекса микроворсинок. Они образуют
между соседними микроворсинками сложную сеть, которая не
пропускает крупные частицы пищи, а также бактерии. Кроме
того, она играет роль решетки, в которую могут встраиваться
ферменты из полости кишки. Эти ферменты вместе с фермен-
тами, синтезируемыми всасывающими клетками и встроенными
в их мембрану, осуществляют заключительные этапы гидро-
лиза проходящих через ячейки сети не очень крупных молекул.
68
Ядра всасывающих клеток не обнаруживают признаков
активного синтеза РНК. Тем не менее эти .клетки в течение
всего жизненного цикла синтезируют белки, мукополисахари-
ды и ряд других соединений. Для всасывающих клеток харак-
терно строго поляризованное расположение органоидов и, в ча-
стности, аппарата Гольджи. Последний находится всегда над
ядром и представлен хорошо развитыми цистернами с мелки-
ми и крупными вакуолями. Многочисленные митохондрии так-
же обнаруживаются преимущественно в апикальной части
клетки. Всасывающие клетки обладают развитыми системами
гладкой и шероховатой эндоплазматической сети, функцио-
нальное единство которых отчетливо выявляется при всасыва-
нии жиров (рис. 14, б). Благодаря осмиофильным свойствам
последних удается проследить процессы их перемещения в кле-
точных структурах. Оказалось, что основная масса жировых
включений попадает в полости шероховатой эндоплазматиче-
ской сети, а также в цистерны аппарата Гольджи. Проникно-
вение жиров в каналы эндоплазматической сети всасывающих
клеток представляет собой активный многоэтапный процесс.
На первом его этапе происходит расщепление жиров до низко-
молекулярных продуктов ферментами, находящимися в плаз-
матической мембране и в надмембранном комплексе всасыва-
ющих клеток, после чего низкомолекулярные соединения про-
ходят через плазматическую мембрану. Далее в каналах эндо-
плазматической сети осуществляется ресинтез жиров. К ним
присоединяются липопротеины, и весь этот сложный комплекс
транспортируется к боковой поверхности всасывающих клеток.
Здесь, по-видимому, путем экзоцитоза жировые капли выво-
дятся в межклеточное пространство, ограниченное от полости
кишки особыми изолирующими контактами, расположенными
в апикальных частях клеток. Кроме того, клетки в пласте свя-
заны механическими и химическими постоянными межклеточ-
ными контактами.
Аминокислоты и углеводы проникают в клетки с помощью
механизмов активного транспорта, т. е. с использованием энергии
АТФ. Высказано экспериментально обоснованное предположе-
• ние, что эти соединения, как и жиры, поступают в каналы
эндоплазматической сети и, не объединяясь с общим внутрикле-
точным фондом белков и углеводов гиалоплазмы, выводятся
в межклеточное пространство. Расчеты показывают, что
одна всасывающая клетка млекопитающих снабжает питатель-
ными веществами около 100 000 клеток. При этом себя эти
клетки обеспечивают питательными веществами не из потока
всасываемых ими веществ, а из тканевой жидкости, т. е. на
«общих» основаниях.
Своеобразную структуру имеют всасывающие клетки ново-
рожденных млекопитающих. В апикальной части клетки фор-
мируется постоянный пиноцитозный комплекс. Он состоит из
69
огрнинченинх мембраной и связанных с наружной средой си-
стемы канальцев и пузырьков, а также крупной вакуоли. Эти
клетки поглощают целые белковые молекулы и, в частности,
иммуноглобулины, которые, не гидролизуясь, попадают в кровь.
Они необходимы для обеспечения пассивной иммунизации но-
ворожденных животных до развития у них собственной систе-
мы иммунитета. .
Помимо основных всасывающих клеток в кишечном эпите-
лии млекопитающих имеются еще железистые клеточные эле-
менты. Наиболее многочисленные из них — слизистые бокало-
видные клетки. Они представляют собой одноклеточные желе-
зы и были подробно описаны в предыдущей главе. Их общее
количество в тонкой кишке не превышает 4,9%.
Второй тип секреторных клеток — панетовские железистые
клетки. Они расположены на дне крипт, по нескольку клеток
на каждую крипту, и имеют конусовидную форму. Вся апи-
кальная часть клеток занята гранулами белкового секрета.
Синтез его происходит на рибосомах шероховатой эндоплазма-
тической сети, занимающей всю базальную часть клеток. Бел-
ковый секрет уже через 30—40 мин перемещается в мелкие
пузырьки хорошо развитого аппарата Гольджи, расположенно-
го в надъядерной области. Здесь образуются более крупные
конденсационные вакуоли, которые постепенно превращаются
в секреторные гранулы. Последние смещаются к апикальной
поверхности клеток, где их содержимое выводится наружу.'
Весь секреторный цикл занимает около 1,5—2 ч.
Имеются данные о том, что панетовские клетки играют су-
щественную роль в регуляции бактериальной флоры кишечни-
ка. Они синтезируют и выделяют антибактериальный фактор
лизоцим. В их цитоплазме обнаружены микроорганизмы на
ранних стадиях деградации. Количество панетовских клеток
в переднем отделе тонкой кишки около 7,5%.
Третьим типом секреторных клеток в кишечном эпителии
млекопитающих являются энтерохромаффиновые клетки, кото-
рые также небольшими группами расположены на боковой по-
верхности крипт среди основной массы камбиальных клеток.
Секреторные гранулы локализуются у базальных, граничащих
с соединительной тканью поверхностей клеток. Показано, что
энтерохромаффиновые клетки выделяют в кровь серотонин
и являются, следовательно, типичными железами внутренней
секреции. Однако энтерохромаффиновые клетки, по-видимому,'
неоднородны. Помимо клеток, выделяющих серотонин, сущест-
вуют клетки, синтезирующие кишечные гормоны: секретин
и холецистокинин, а также соматостатин и эндорфин. Свой
жизненный цикл эти клетки заканчивают на вершине ворсинок,
т. е. они, как бокаловидные и всасывающие клетки, перемеща-
ются от основания к вершине ворсинки. Количество их невели-
ко— около 0,6%.
70
Для выяснения системных закономерностей организации ки-
шечного эпителия позвоночных особое значение имеет деталь-
ная характеристика процессов репродукции камбиальных кле-
ток и физиологической регенерации в эпителиальном пласте.
/Методом авторадиографии с использованием 3Н-тимидина
показано, что среднее время полного обновления эпителиаль-
ной выстилки ворсинок у мышевидных грызунов около 48 ч.
Удалось выяснить также и среднее генерационное время
у большинства пролиферирующих клеток. Оно оказалось по-
рядка 12—15 ч.
Объективные количественные критерии, характеризующие интенсивность
клеточной репродукции и физиологической регенерации в кишечном эпите-
лии, позволяют проводить уже ие только качественные, ио и строгие коли-
чественные сопоставления при анализе становления этой системы в онтоге-
незе, ее изменений при патологических условиях и при сравнительно-гисто-
логических исследованиях.
Используя эти критерии, удалось, в частности, показать что стаиовлеиие
системы кишечного эпителия в онтогенезе происходит при относительно по-
стоянной скорости репродукции клеток. Абсолютный прирост количества
дифференцированных и камбиальных клеток обеспечивается здесь за счет
резкого увеличения (в 3—4 раза) продолжительности жизни дифференци-
рованных' клеток, т. е,- путем снижения интенсивности физиологической реге-
нерации.
У взрослых животных обнаружена особая субпопуляция
клеток, характеризующихся меньшей скростью репродукции по
сравнению с основной массой камбиальных клеток. Это, по-види-
мому, стволовые клетки общей камбиальной системы, которые
способны к дифференцировке в четырех различных направле-
ниях (всасывающие, бокаловидные, панетовские и хромаффи-
новые). Ранние этапы дифференцировки происходят в криптах.
Вступившие на путь специализации клетки сохраняют еще не-
которое время способность к делению и составляют субпопуля-
ции так называемых полустволовых клеток. Лишь позднее
(всасывающие, бокаловидные и хромаффиновые клетки при
выходе на.ворсинку, а панетовские при накоплении в клетках
секреторных продуктов), способность клеток к синтезу ДНК
и делению утрачивается полностью. Эти соотношения процессов
репродукции и дифференцировки показаны на рис. 15.
Низшие позвоночные. У большинства представителей про-
цветающей группы костистых рыб всасывающие клетки ки-
шечного эпителия имеют хорошо развитый аппарат микровор-,
синок. В его ультраструктурной организации не удается пока
выявить существенных особенностей по сравнению с аппаратом
микроворсинок высших позвоночных животных. Подобного ро-
да сложная дифференцировка всасывающих клеток характер-
на и для кишечных эпителиев рептилий и амфибий. У некото-
рых рыб в среднем отделе кишечника обнаружены всасываю-
щие клетки с пиноцитозными каналами и большой вакуолью —
71
Рис. 15. Схема организации процессов репродукции и дифференцировки кле-
ток в кишечном эпителии млекопитающих.
1 — стволовая мультнпотентная клетка. 2—5 — полустполлпыв и л о
видные 5ЛиТКчИ_<5Я И 6~ энтеРохро.маффнновые, 3 и 7 всасывающие, Z и** Рбокало-
тотнчес’ком 1тикпрПагеТп^СКНе ’ ПунктиРн0Й линией обведены клетки, находящиеся в ми-
кализация1 X
в виде черных клеток на каждой схеме (/-5). рсинки показаны
72
Аналогичные в функциональном отношении энтероцитам ново-
рожденных млекопитающих. Широкое распространение у низ-
ших позвоночных имеют бокаловидные клетки, строение, хими-
ческие свойства и функциональное значение которых сходны
С бокаловидными клетками высших позвоночных животных.
Таким образом, высокий уровень морфобиохимической диф-
ференцировки всасывающих и железистых клеточных элемен-
тов характерен для кишечных эпителиев изученных представи-
телей всех классов позвоночных животных.
Сложнее обстоит дело с тенденцией кишечного эпителия
к топографической дифференцировке камбиальных и специали-
зированных клеточных элементов. Наиболее изучен в этом от-
ношении кишечный эпителий двух представителей амфибий —
лягушки и аксолотля — и нескольких видов костистых рыб.
У травяной лягушки в опытах с длительным насыщением 3Н-тимидином
(в течение 8 сут) удалось выявить отчетливые различия между количест-
вом синтезирующих ДНК клеток в эпителии основания кишечной складки
и иа ее вершине. К концу опыта в основании кишечной складки больше
половины клеток уже содержало меченые ядра. Количество их постепенно
нарастало в течение всего срока ежедневных инъекций' 3Н-тимидина. На
вершине складки число клеток с мечеными ядрами достигало к 4 сут после
начала опыта 20%-иого уровня и дальше уже практически не увеличива-
лось.
Особенностью организации обновляющейся системы кишеч-
ного эпителия у лягушки является отсутствие хотя бы у части
дифференцированных клеток на вершине кишечной складки
антагонистических отношений между размножением и диффе-
ренцировкой. Вторая особенность — крайне медленное его об-
новление. Репродуцирующиеся в основании кишечной складки
клетки достигают ее вершины лишь через 20—25 сут. Отсутст-
вует у бесхвостых амфибий и стойкая локализация гибели
клеток. В некоторых складках этот процесс может происходить
не только на вершине складки, но и на боковых ее поверхно-
стях.
Для кишечного эпителия бесхвостых амфибий характерны
существенные сезонные изменения его организации. Описанные
выше отношения характерны для летних и осенних лягушек.
К весеннему пробуждению лягушек высота складок слизистой
оболочки, уменьшается, а в эпителии отчетливее, чем" у летних
лягушек, выявляются скопления менее дифференцированных
клеток.
Изучение в опытах с 3Н-тимидином кишечного эпителия
аксолотля — представителя хвостатых амфибий — позволило
выявить четкое топографическое разграничение между кам-
биальными пролиферирующими, вступившими на путь диффе-
ренцировки и специализированными клетками. Последние обра-
зуют эпителиальный пласт клеток, не способных к синтезу
ДНК и делению. Камбиальные же пролиферирующие клетки
73
располагаются в толще соединительной ткани, в так называе-
мых регенерационных гнездах, сосредоточенных преимущест-
венно в нижней части кишечной складки. Клетки с мечеными
ядрами, вступающие на путь дифференцировки уже в течение
опыта, появляются в составе эпителиального пласта лишь на
восьмые сутки после начала инъекций 3Н-тимидина (рис. 16).
Однако полное обновление всех дифференцированных клеток
происходит через 60—90 дней.
Рис. 16. Автографы, иллюстрирующие включение 3Н-тимидина в клетки ки-
шечного эпителия аксолотля.
а — через 7 сут после ежедневных инъекций, б — через 18 сут после 7 инъекций
с интервалами в 24 ч, 1 — регенерационное гнездо, 2 — эпителиальный пласт.
Таким образом, у хвостатых и бесхвостых амфибий при
низкой скорости физиологической регенерации кишечного эпи-
телия имеются существенные особенности в организации диф-
ференцированной и камбиальной частей тканевой системы. При
этом у аксолотля наблюдаемые в кишечном эпителии отноше-
ния более сходны с таковыми у млекопитающих, чем у пред-
ставителя более высокоорганизованных бесхвостых амфибий —
летних лягушек. ’ . '
Анализ процессов репродукции и физиологической регенерации методом
тимидйиовой авторадиографии у отдельных представителей костистых рыб
свидетельствует о том, что в кишечном эпителии вьюиа — представителя
весьма своеобразной по образу жизни и морфологическим особенностям
группы костистых рыб — относительно слабо выражена топографическая
и морфологическая дифференциация пролиферирующих клеток. Тем ие ме-
нее, как и у бесхвостых амфибий, в кишечном эпителии вьюна удается вы-
явить зоны преимущественной репродукции клеток. Онн расположены обыч-
74
но в основании складок и в. области формирования дополнительных скла-
док — боковой поверхности основных. При этом степень выраженности то-
пографического обособления камбиальных зон закономерно изменяется в раз-
ные сезоны года. У беломорских навагн, трески и, по-видимому, у многих
других костистых рыб в кишечном эпителии топографически резко выделя-
ются субпопуляции камбиальных клеток, вполне аналогичные эпителию крипт
млекопитающих. У наваги митотический индекс в таких структурах может
достигать 5% и примерно половина клеток содержит меченные 3Н-тимиди-
ном ядра в опытах с однократной его инъекцией. Пролиферирующие клетки
характеризуются интенсивным синтезом РНК. Аналогичные показатели про-
лиферативной активности характерны и для эпителия крипт млекопитающих.
Четкая топографическая дифференцировка камбиальных клеток в виде их
скоплений в составе эпителиального пласта, преимущественно в основании
складок, наблюдается в кишечном эпителии молоди осетра и у беломор-
ских и дальневосточных бычков.
§ 2. Кишечные эпителии полухордовых, вторичноротых
и первичноротых беспозвоночных животных
Оболочники и иглокожие. Относительно хорошо изучен в на-
стоящее время и на ультраструктурном уровне, и методом ти-
мидиновой авторадиографии кишечный эпителий асцидий. Эти
сидячие организмы — вторичноизмененные низшие хордовые —
имеют довольно сложный' пищеварительный тракт. Его сред-
ние отделы дифференцированы на среднюю кишку и желудок.
Последний у видов асцидий, лишенных пищеварительных же-
лез, имеет сложный рельеф слизистой оболочки, образующей
складки различных размеров и формы.
У асцидий, в желудок которых открывается пищеваритель-
ная железа (разветвленное впячивание кишечного эпителия
в стенку желудка), слизистая оболочка имеет менее сложное
строение. Пищеварение и значительная часть процессов всасы-
вания осуществляется в желудке, в тонкой кишке происходит
всасывание и формирование каловых масс. Клеточный состав
эпителия, выстилающего желудок, пищеварительную железу
и кишку, довольно сложен. Здесь можно выделить 5 типов
дифференцированных клеток: абсорбищонно-всасывающие, сли-
зисто-ресничные, белково-железистые, осморегулирующие и
эндокринные (рис. 17, а—е).
Наиболее многочисленные абсорбционно-всасывающие клетки
сходны по принципу своей организации с всасывающими клет-
ками кишечного эпителия позвоночных, На их апикальной по-
верхности хорошо развит аппарат микроворсинок, органоиды
поляризованы, в цитоплазме много мембранных структур. Осо-
бенностью их является наличие у клеток пиноцитозных
каналов, мелких пузырьков и большой вакуоли в надъядерной
области. Имеются экспериментальные данные о способности
этих клеток поглощать белковые макромолекулы путем «стру-
ктурированного» пиноцитоза.
Слизисто-ресничные клетки представляют собой видоизме-
ненные слизистые клетки и сочетают в себе синтез и выделение
75
Л//'
vTv
г
д
Рис. 17. Схемы организации больших складок в эпителии желудка асцидий
и ультраструктуры различных типов дифференцированных клеток.
а, б — два типа пищеварительно-всасывающих клеток с постоянными пнноцитознцми
комплексами в верхней половине клеток; в, г, е — железистые клетки (в — слизистая,
г — белковая, е — эндокринная), д — осморегулирующая клетка, ж — схема физиологи-
ческой регенерации в складках желудка. 1 — базальная, 2— апикальная камбиальные
зоны. Стрелки показывают направление перемещения дифференцирующихся клеток.
76
мукопротеидного секрета с локомоторной функцией, обеспечи-
вая перемещение слизи ресничным аппаратом в каудальном
направлении. Белковые железистые клетки имеют хорошо разви-
тую шероховатую ЭПС и синтезируют гидролитические фер-
менты, необходимые для полостного пищеварения. У видов асци-
дий, лишенных пищеварительных желез, они находятся в эпи-
телии желудка. Осморегулирующие клетки характеризуются
наличием глубоких впячиваний базальной плазматической
мембраны и обилием митохондрий между ними. Эндокринные
клетки гетерогенны по своей морфологии. Они содержат гра-
нулы в базальной части, а их апикальная часть доходит до по-
верхности эпителия и может контактировать с пищей.
В эпителии пищеварительного тракта асцидий топографи-
чески обособлены камбиальные пролиферирующие и функцией
нирующие клетки.
В эпителии кишки камбиальные клетки располагаются
в зоне желобка, идущего вдоль всей кишки. Методом автора-
диографии 3Н-тимидином показано, что клетки с мечеными яд-
рами из области желобка смещаются в обе стороны навстре-
чу друг другу. Полное обновление эпителия занимает в летние
месяцы около 30 дней.
Более сложно и многообразно организованы процессы ре- '
продукции в эпителии желудка. Синтезирующие ДНК клетки
и митозы в эпителии желудка животных, обладающих пище-
варительной железой, распространены диффузно, не образуя
особых камбиальных зон. В пищеварительной железе этих
асцидий выделяются две камбиальные зоны: одна в концевых
дистальных участках железы и вторая — в проксимальном уча-
стке, вблизи сообщения железы с полостью желудка. При этом
обновление эпителия железы происходит из обеих зон навстре-
чу друг другу и занимает около 1,5 мес. В эпителии желудка
асцидий, лишенных пищеварительной железы, в основании
складок выделяются отчетливые камбиальные зоны.
Наиболее сложно организованы процессы обновления в эпи-
телии крупных продольных складок слизистой оболочки же-
лудка. Помимо зоны камбиальных клеток в основании склад-
ки имеется дополнительная камбиальная зона, расположенная
в основании вершины складки (рис. 17, ж). При этом обновле-
ние клеток происходит из обеих этих зон в дистальном напра-
влении, т. е. за счет базальной камбиальной зоны обновляется
боковая поверхность складки, а за счет дистальной зоны —
эпителий ее верхушки, образованный особыми реснично-слизи-
стыми клетками. Время полного обновления эпителия этих
складок около 25 сут.
У иглокожих наиболее изучен к настоящему времени кишечный эпи-
телий морских звезд. Особенно сложной и своеобразной дифференцировки
достигает ои у представителей дальневосточного семейства Asteriidae. Как
и у других морских звезд, основным органом полостного пищеварения слу-
77
жпт у них желудок. Особенностью морских звезд рассматриваемого семей-
ства является отсутствие тидемановских телец, обеспечивающих циркуляцию
жидкости внутри пищеварительной системы и доставку пищевых частиц
в пилорические придатки. Эту функцию берет иа себя эпителий желудка,
основную массу которого составляют жгутиковые клетки, имеющие от 1 до 8
и более жгутиков н систему микроворсинок. Помимо этих клеток в эпи-
телии имеются слизистые и белковые секреторные клетки. Слизистая обо-
лочка образует желобки и гребни, благодаря закономерному распределе-
нию в эпителиальном пласте жгутиковых клеток. При этом в желобках и ос-
новании гребней находятся типичные клетки с плоидностью 2—4 с и'обычно
с 1—2 жгутиками, а на вершине гребней — миогоядерные клетки с сигаро-
видными интенсивно окрашивающимися ядрами, жгутиковые клетки с пло-
идиостью от 16 до 32 с. Полиплоидные клетки имеют и большее количе-
ство жгутиков, обычно кратное 2. В авторадиографических опытах показано,
что полиплоидные клетки образуются за счет размножения «типичных» дипло-
идных. Помимо медленного обновления дифференцированных полиплоидных
клеток в конце зимы и начале весны происходит массовое отторжение суб-
популяции полиплоидных клеток гребней. К середине весны эта субпопу-
ляцпя восстанавливается и существует, медленно обновляясь, до конца зимы
следующего года.
Членистоногие. Среди животных этого типа наибольшее раз-
нообразие по характеру питания и используемой пищи наблю-
дается у насекомых. Для них характерно большое анатомиче-
ское разнообразие органов пищеварительной системы и в пер-
вую очередь ротового аппарата и переднего отдела кишечника.
Не однороден по строению также ш центральный отдел пище-
варительной системы — средняя кишка, что сказывается не
Только на микроанатомическом уровне организации этого от-
дела, но и на морфобиохимической дифференцировке кишеч-
ного эпителия и его основных клеточных элементов.
Хорошо развитый аппарат микроворсинок всасывающих кле-
ток кишечного эпителия многих насекомых по функционально-
му значению и принципу организации аналогичен аппарату
микроворсинок других высших многоклеточных животных.
В противоположность относительному однообразию строения
аппарата микроворсинок в кишечном эпителии большинства по-
звоночных животных у насекомых, даже у сравнительно не-
многочисленных изученных к настоящему времени представи-
телей, наблюдается сильное варьирование этих специфических
структур по их количеству на клетку, размерам и ультратон-
кому строению.
Несмотря на принципиально сходный характер организа-
ции апикальных частей всасывающих клеток у насекомых
с аналогичными структурами кишечного эпителия позвоночных
животных, между ними имеется ряд глубоких различий.' Если
у позвоночных в процессе всасывания происходит активный
транспорт сахаров и аминокислот против градиента их кон-
центрации, то у насекомых имеет место пассивный транспорт
этих веществ через плазматическую мембрану. Повышенная
концентрация этих веществ в полости кишки создается путем
быстрого всасывания воды. Пассивный транспорт моносахаров
78
через мембрану облегчается за счет превращения их в клетке
в соединения, не содержащиеся в полости кишки.
Для многих насекомых характерна мультифункциональная
морфобиохимическая дифференциация всасывающих клеток.
Так, например, у кровососущих, насекомых помимо всасывания
низкомолекулярных продуктов, образующихся при расщепле-
нии белков форменных элементов и плазмы крови, всасываю-
щие клетки обладают еще и мощным аппаратом белкового
синтеза. У них хорошо развита шероховатая эндоплазматиче-
ская сеть, аппарат Гольджи, много митохондрий (рис. 18, а).
В апикальных частях клеток накапливается большое количе-
ство секреторных гранул, которые выделяются в просвет киш-
ки и служат основными пищеварительными ферментами по-
лостного пищеварения. Таким образом, у насекомых весьма
специфическая секреторная и всасывающая функции могут
осуществляться одними и теми же клеточными элементами.
Наряду с этим в кишечном эпителии многих насекомых име-
ются и разнообразные секреторные клетки. Так, в кишечном
эпителии чешуекрылых среди обычных всасывающих клеток
наблюдаются многочисленные выделяющие слизь бокаловид-
ные клетки. Разнообразные железистые элементы имеются
в кишечном эпителии медоносной пчелы.
Специфической для кишечного эпителия членистоногих
структурой является так называемая перитрофическая мембра-
на. Она представляет собой внеклеточное образование в виде
пластинки, расположенной на поверхности эпителиальных кле-
ток и изолирующей их от непосредственного .контакта с пище-
выми частицами, находящимися в полости кишки. Функцио-
нальное значение перитрофической мембраны в какой-то мере
аналогично роли слоя секрета бокаловидных клеток позвоноч-
ных животных. Она может служить для защиты микроворси-
нок всасывающих клеток от механического повреждения ку-
сочками непереваренной пищи, находящейся в просвете кишки.
Перитрофическая мембрана отсутствует у некоторых видов на-
секомых, питающихся жидкой пищей или имеющих хорошо
развитые бокаловидные клетки. Однако ее наличие у кровосо-
сущих насекомых свидетельствует о ее возможной роли в про-
цессах транспорта гидролитических ферментов и низкомолеку-
лярных продуктов гидролиза пищи. Перитрофические мембраны
состоят из белка и хитина и образуются либо всеми клетками
эпителия средней кишки, либо особыми клетками в области
перехода переднего отдела кишечника в средний. В последнем
случае образование этой структуры идет по типу сложной
апокриновой секреции (рис. 18, б).
При апокриновой секреции участки цитоплазмы клеток, от-
деляемые вместе с секреторными гранулами, длительное время
сохраняются в составе перитрофической мембраны и играют
важную роль в процессах ее достройки и окончательного
79
Рис. 18. Схемы ультраструктурной организации железисто-всасывающей
телии
г^Л1Хр0В2рСИНКН’ 2~ надмембранный комплекс, 3 — шероховатая ЭПС, 4 — апикаль-
1 ольджи, 3 — остаточное тело, 9 — клетки кишечного эпителия, 10 — пернтрофическая
80
оформления, протекающих за пределами образующих мембра-
ну клеток. При формировании перитрофической мембраны
клетками эпителия средней кишки в ней могут быть локализо-
ваны гидролитические пищеварительные ферменты, по-видимо-
му, выделяемые клетками лишь при поступлении пищи в по-
лость кишки. Структура перитрофической мембраны варьирует
в широких пределах у разных видов насекомых. Она может
быть представлена тонкой однородной пластинкой или иметь
сложную трехслойную структуру. В последнем случае образо-
вание каждого ее слоя происходит за счет интенсивной дея-
тельности специфически дифференцированных клеток переход-
ного (от переднего к среднему) отдела кишки.
Многообразию морфобиохимической дифференцировки кле-
ток кишечного эпителия у насекомых соответствует и многооб-
разие организации этой тканевой системы. Так, например,
у двукрылых кишечный эпителий представляет собой растущую
клеточную популяцию, образованную однородными всасываю-
щими клетками с весьма продолжительным клеточным циклом.
У прямокрылых же кишечный эпителий — типичная обновляю-
щаяся популяция с четким топографическим разделением диф-
ференцированных и камбиальных клеток. Последние образуют
скопления — «узелки» или гнезда, закономерно чередующиеся
10
клетки (а) и образования перитрофической мембраны (б) в кишечном эпи-
насекомых.
ные пузырьки, 5 — митохондрии, 6 — складки плазматической мембраны, 7 —аппарат
мембрана, // — секреторная гранула, 12— гликоген, 13 — базальная мембрана.
81
с участками, где располагаются высокопризматические диффе-
ренцированные всасывающие клетки (рис. 19, а). Такие отно-
шения наблюдаются, например, в строении кишечного эпителия
саранчи и сверчка. Имеются данные о том, что в кишечном эпи-
телии саранчи полное обновление его клеточного состава
в активный период жизни животного происходит в течение не-
скольких суток. Очевидно, в данном случае мы имеем дело
с весьма динамичной обновляющейся системой, вполне сопо-
ставимой с кишечным эпителием позвоночных.
Рис. 19. Участки эпителия средней кишки насекомых.
а — эпителий кишки саранчи, б — автограф «крипты» кишечного эпителия жука пла-
вунца (3Н-тимидин введен за 3 ч до фиксации), / — дифференцированные клетки, 3 —
камбиальные клетки, 3 — зона дифференцирующихся клеток, синтезирующих ДНК, но
не делящихся митозом.
Аналогичные отношения между камбиальными и дифферен-
цирующимися клетками наблюдаются у многих видов тара-
канов. Здесь эпителий средней кишки и ее придатков образу-
ет характерные складки и углубления с закономерным распо-
ложением в них дифференцированных призматических всасы-
вающих клеток и мелких камбиальных. Дифференцированные
клетки образуют складки, а камбиальные сосредоточены в же-
лобкообразных углублениях — регенерационных гнездах. Мето-
дом тимидиновой авторадиографии удалось показать, что син-
тез ДНК и размножение клеток происходят только в регенера-
ционных гнездах. Отсюда клетки смещаются на боковые по-
верхности и вершину складок, превращаясь во всасывающие
высокопризматические клетки. Время полного обновления пла-
ста у одного из изученных видов тараканов около 10 сут. *
Еще более сложную системную организацию имеет кишеч-
ный эпителий жука-плавунца (рис. 19,б). Железистые и круп-
ные всасывающие, по-видимому, частично полиплоидные клет-
82
ки образуют ровный однослойный пласт, выстилающий внут-
реннюю поверхность кишки этих животных.’ Обновление кле-
ток эпителиального пласта происходит за счет размножения
малодифференцированных клеток, расположенных, как показал
анализ распределения митозов и меченных 3Н-тимидином кле-
ток, в дистальной части длинных трубкообразных крипт, про-
бодающих стенку кишки и находящихся в гемоцеле. Непосред-
ственно над зоной митозов и клеток, находящихся в фазе син-
теза ДНК (меченных 3Н-тимидином на ранних сроках после
его инъекции), располагаются клетки с более крупными ядра-
ми. В этой зоне около трети клеток находится в фазе синтеза
ДНК, однако никогда не встречается митозов. По-видимому,
здесь происходит процесс соматической полиплоидизации кле-
ток, дифференцирующихся и смещающихся по направлению
к эпителиальному пласту, выстилающему внутреннюю поверх-
ность кишки.
Менее варьирует строение кишечного эпителия у ракообразных. Сред-
ний отдел пищеварительного тракта представлен у них относительно корот-
кой средней кишкой с несколькими парами слепых трубкообразиых выростов.
Весь этот комплекс называется пищеварительной железой илн, по старой
терминологии, гепатопанкреасом. Здесь протекают основные процессы поло-
стного пищеварения н всасывания низкомолекулярных соединений. Всасы-
вающие и железистые клетки эпителия каждой трубочки пищеварительной
железы обновляются за счет малодифференцированных клеток двух камби-
альных зон: дистальной и проксимальной. Дифференцирующиеся клетки
смещаются к середине, трубки пищеварительной железы навстречу друг дру-
гу, однако клетки, выселяющиеся из дистальной зоны, движутся значитель-
но быстрее. Топографически выраженной зоны гибели и слущивания клеток
здесь нет. У некоторых ракообразных эктодермальный кишечный эпителий
выстилает и конечную часть переднего отдела пищеварительного тракта.
Иногда имеются и специальные камбиальные зоны для обновления эпителия
средней кишки.
Своеобразно построен кишечный эпителий у кровососущих
клещей. У этих специализированных представителей высших
первичноротых животных процессы питания и пищеварения
приурочены к определенным периодам жизненного цикла и по-
стнатального онтогенеза.
Такая цикличность функционирования эпителия особенно
ярко выражена в кишечном эпителии иксодовых клещей.
У взрослых голодных клещей кишечный эпителий • образован
преимущественно камбиальными клетками. Лишь изредка
в нем встречаются крупные пищеварительные клетки. Сразу пос-
ле прикрепления клеща к животному и еще до попадания пищи
в кишечник образуется первая генерация секреторных клеток.
С поступлением пищи в кишку происходит массовая гибель
и отторжение секреторных клеток. Продукты их разрушения
обеспечивают гемолиз эритроцитов. В это время начинают ин-
тенсивно размножаться камбиальные клетки. Образующиеся
при этом клетки дифференцируются в генерацию пищевари-
тельных.
83
Эти клетки энергично поглощают питательные вещества
и приобретают черты внешнего сходства с секреторными. Они
также могут выходить из состава пласта и располагаться сво-
бодно в полости кишки. В период максимального растяжения
стенки кишки, что соответствует переходу клеща к свободному
образу жизни, большинство клеток кишечного эпителия новой
генерации отторгается в просвет кишки и гибнет. Кишечный
эпителий представлен в этот момент лишь сильно уплощенны-
ми камбиальными клетками. По мере всасывания воды из по-
лости кишки в эпителии наступает новая вспышка митозов
с последующей дифференцировкой преимущественно пищева-
рительных клеток. В апикальных частях этих клеток имеются
хорошо выраженные пиноци-
тозные каналы, от которых
отшнуровываются пиноцитоз-
ные пузырьки. Пищеваритель-
ные клетки фагоцитируют про-
дукты разрушения кровяных
элементов, увеличиваются
в размерах, заполняют апи-
кальными концами просвет
кишки. Утилизация поглощен-
ных пищевых продуктов клет-
ками этой последней генерации
происходит постепенно. Иными
словами, пищеварительные
клетки клещей являются свое-
; б
а
<£»
г
Рис. 20. Схема строения канальцев пищеварительной железы пластинча
а — поперечный и продольный срезы канальца, б — схема ультраструктурной орга
разрез папиллы голожаберного моллюска Coryphella rufibranchialis. [Е. В. Обу
просвет канальца, 5 — вакуоль, 6 — гетерофагосомы, 7 — пнноцитозные пузырьки,
мешок (// — полость, 12— эпителий, 13— стрекательные капсулы, 14 — камбиальная
эпителий. Стрелки показывают направление перемещения клеток в процессе физио
84
образным резервуаром и выполняют функции клеток пече-
ни и жирового тела других высших многоклеточных животных.
Первичноротые беспозвоночные средних уровней организа-
ции (полихеты, приапулиды, брахиоподы, брюхоногие и плас-
тинчатожаберные моллюски). Кишечный эпителий первично-
ротых среднего уровня организации характеризуется относи-
тельно большим разнообразием своего строения, «внутренней
организации и специфической дифференцировкой образующих
тожаберных и голожаберных моллюсков.
низации пищеварительной клетки пластинчатожаберных моллюсков, в — продольный
хова, 1975] / — камбиальная, 2 — пищеварительная, 3 — железистая клетки, 4 —
8 —лизосомы, 9 — остаточные тела, 10 — липидные капли, 11—14 — стрекательный
зона), 15—клетка, мигрирующая через канал в камбиальную зону, 16— покровный
логической регенерации.
85
его клеток. У полихет и приапулид преобладает полостное пи-
щеварение. Однако у других животных, например, у брахиопод,
брюхоногих и пластинчатожаберных моллюсков, прогрессивное
развитие получают процессы внутриклеточного пищеварения.
Они происходят в железистых разветвлениях кишечной трубки
и могут сочетаться с предварительным ферментативным рас-
щеплением заглоченной пищи.
Широкое распространение у моллюсков внутриклеточного
пищеварения с соответствующей специализацией пищевари-
тельных клеток на процессы пино- и фагоцитоза сочетается со
сложной тканевой организацией клеточных элементов. В каче-
стве примера можно привести отношения, наблюдаемые у од-
ного из голожаберных моллюсков Coryphella rufibranchialis.
У этого моллюска основные процессы поглощения питательных
веществ происходят в так называемых печеночных разветвле-
ниях кишечника. Это тонкие трубчатые разветвленные выросты
кишечника, выстланные однослойным эпителием. На срезах
желез видно, что эпителий состоит из закономерно располо-
женных трех типов клеток (рис. 20, а). Наиболее крупные
клетки со светлой цитоплазмой занимают вершину и боковые
поверхности складок, мелкие базофильные клетки расположе-
ны в их основании.
Опыты с 3Н-тимидином показывают, что крупные клетки
представляют собой дифференцированные, активно функцио-
нирующие клеточные элементы, почти полностью утратившие
способность к размножению. Мелкие клетки являются камби-
альной субпопуляцией тканевой системы, и большинство их
находится в цикле репродукции. Помимо рассмотренных кле-
ток в эпителии печеночных выростов имеются еще и клетки
с очень крупными, полиплоидными ядрами и резко базофиль-
ной цитоплазмой, в которой хорошо развита эндоплазматиче-
ская сеть с многочисленными рибосомами. Эпителий печеноч-
ных выростов представляет собой обновляющуюся тканевую
систему, камбиальные клетки которой дифференцируются
в двух направлениях: на пищеварительные фагоцитирующие
клетки и специализированные секреторные. Обновление пище-
варительных клеток происходит за 10-—15 дней и имеет четко
выраженный поляризованный характер, поскольку наиболее
старые клетки располагаются на вершине складок. Пищевари-
тельные клетки в течение этого периода претерпевают харак-
терные циклические изменения, связанные с поглощением и пе-
ревариванием пищи. Один пищеварительный цикл в этих клет-
ках занимает около 5 сут. Он включает в себя периоды интен-
сивного поглощения пищевых частиц, их внутриклеточного Пе-
реваривания, периоды выделения непереваренных остатков
вместе с цитоплазмой и восстановления клеток для начала сле-
дующего цикла.
Сложность системной организации такого кишечного эпите-
86
лия проявляется и в наличии в нем еще одной весьма своеоб-
разной клеточной системы. Она располагается на вершине пе-
ченочных выростов и образует основную часть стрекательных
мешков, или книдосаков. Малодифференцированные камби-
альные клетки этой системы продуцируют особые клеточные
элементы, в которые из полости печеночного выроста попада-
ют непереваренные стрекательные капсулы гидроидных поли-
пов— пищи моллюсков. В дальнейшем эти" стрекательные кап-
сулы, располагаясь в специализированных клетках стрека-
тельных мешков, выполняют защитную функцию. При сокра-
щении специальных мышц происходит выбрасывание клеток
со стрекательными капсулами в наружную среду, где освобож-
даются стрекательные нити, предохраняющие моллюсков от
преследующих их хищников.
В- опытах с 3Н-тимидином показано, что пополнение клеток стрекатель-
ных мешков происходит за счет размножения малодифференцированных
клеток, расположенных в их основании. Эта относительно автономная сис-
тема малодифференцированных клеток подсевается, однако, за счет размно-
жения и миграции клеток из дистального отдела пищедарительной железы.
Общий принцип организации пищеварительной железы
пластинчато-жаберных моллюсков с гистологической точки
зрения сходен с описанным уже эпителием голожаберных мол-
люсков. В основе организации отдельных трубчатых концевых
отделов железы лежит система камбиальных малодифферен-
цированных клеток, образующих желобки по ходу трубочек
и занимающих слепозамкнутые терминали их дистальных кон-
цов (рис. 20, б,-в). У других групп двустворчатых моллюсков
малодифференцированные клетки в эпителии располагаются
небольшими скоплениями среди пищеварительных и секретор-
ных клеток. За счет размножения этих клеток формируются
дифференцированные, преимущественно пищеварительные клет-
ки. Они имеют хорошо развитый лизбсомный аппарат и, кро-
ме того, микроворсинки на апикальной поверхности клеток.
В клетках могут быть представлены постоянные пиноцитозные
комплексы — система ограниченных мембраной трубчатых
структур (рис. 20, б). Предполагают, что они участвуют в про-
цессах транспортировки пищевых частиц в пиноцитозные пу-
зырьки.
Данные опытов с 3Н-тимидином на беломорском пластинча-
тожаберном моллюске Муа arenaria свидетельствуют об отно-
сительно медленном обновлении эпителиального пласта. Диф-
ференцированные клетки с мечеными ядрами появляются в этих
опытах через 5—10 сут после инъекции 3Н-тимидина.
. В пищеварительной железе пластинчатожаберных моллюсков имеется
сложная система протоков. В состав их пищеварительного тракта входит
своеобразный желудок и относительно длинный тонкий кишечник. В этих
отделах происходит сортировка пищевых частиц, их направленный транспорт
£7
и мистичный полостной гидролиз ферментами, выделяемыми железистыми
клетками. Внутренняя выстилка всех этих отделов образована в основном
однослойным ресничным железистым эпителием. Для него характерно отсут-
ствие специальных камбиальных клеток. Медленное обновление эпителия
происходит за счет размножения ресничных клеток. Кроме того, имеет мес-
то и системное обновление пласта путем слущивания относительно больших
участков эпителия и последующей репарации дефекта за счет изменения
формы периферических клеток и их последующего размножения.
•
В качестве последнего примера кишечного эпителия у жи-
вотных с преобладающим внутриклеточным пищеварением мы
рассмотрим кишечный эпителий у замковой брахиоподы. Как
и у пластинчатожаберных моллюсков, основным органом
поглощения пищи у брахиопод является пищеварительная же-
леза. Она представлена совокупностью разветвленных слепозам-
кнутых впячиваний стенки желудка, выстланных специализи-
рованным эпителием. Обращенная в полость железы поверх-
ность эпителия неровная, что обусловлено различной высотой
- клеток. В ней закономерно чередуются складки и небольшие
бороздки. Складки образованы преимущественно дифференци-
рованными пищеварительными клетками. В бороздках и в ос-
новании складок располагаются менее дифференцированные
и железистые белковые клетки. Последние имеют хорошо раз-
витую шероховатую ЭПС, содержат в апикальной части сек-
реторные гранулы и реснички на поверхности. В количествен-
ном отношении секреторные клетки составляют около ’/5 всех
клеток пищеварительного эпителия. Ферменты, выделяемые
секреторными клетками, обеспечивают предварительный гидро-
лиз пищевых частиц, поглощаемых затем пищеварительными
клетками путем пиноцитоза. Зрелые функционирующие пище-
варительные клетки, составляющие основную массу клеток
эпителия, занимают боковую поверхность складок. Это узкие
вытянутые в длину клетки с умеренным развитием общих ор-
ганоидов и большим количеством вакуолярных образований
в апикальной части клеток. На апикальной поверхности име-
ются обычно одна ресничка и несколько микроворсинок. В ци-
топлазме развиты ограниченные мембраной системы пиноци-
тозных каналов. По направлению к вершине складки клетки
обнаруживают признаки старения. Опыты с 3Н-тимидином по-
казали, что репродукция клеток происходит в основном в об-
ласти основания складок. Размножаются преимущественно
малодифференцированные пищеварительные клетки, располо-
женные в этой зоне. Незначительная их часть может, по-види-
мому, превращаться в железистые клетки. Остальные пищева-
рительные клетки смещаются в область складки и- после пе-
риода активного функционирования гибнут главным образбм
на вершине складок. Интенсивность репродукции и физиоло-
гической регенерации относительно невелика и сильно варьи-
рует у отдельных животных.
$ •
Вспомогательные отделы пищеварительного тракта брахиопод выстланы
в основном однослойным ресничным эпителием. Для него характерен своеоб-
разный механизм усиления локомоторной транспортно-проводящей функции.
Интенсификация этой функции достигается не увеличением количества или
сложности строения ресничек (как и у пластинчатожаберных моллюсков),
а путем увеличения количества длинных узких клеток с одной ресничкой.
У первичноротых животных рассматриваемого уровня орга-
низации с преобладающим полостным пищеварением наиме-
нее сложный пищеварительный тракт свойствен приапулидам.
Он образован трубкообразной кишкой, слабо дифференциро-
ванной на отделы. Большая часть кишечника выстлана эпите-
лием, который представляет собой однослойный собранный
в складки пласт высокопризматических клеток, выполняющих
две функции (рис. 21, а). С одной стороны, эти клетки проду-
цируют пищеварительные ферменты, обеспечивающие процес-
сы пищеварения. С другой стороны, они же, очевидно, и по-
глощают образующиеся низкомолекулярные продукты. На
ультраструктурном уровне удается, однако, выявить два слабо
различающихся между собой морфофункциональных типа кле-
ток: железистые и всасывающие. На апикальной поверхности
клеток обоих типов имеются микроворсинки. Шероховатой ЭПС
и секреторных гранул, естественно, больше в железистых клет-
ках. Над микроворсинками иногда удается обнаружить тонкую
пластинку, по-видимому перитрофическую мембрану. Несмот-
ря на отсутствие четкой функциональной дифференцировки,
клетки и их ядра резко отличаются по форме в зависимости
от их расположения в складке: на вершине — клетки с темны-
ми вытянутыми сигаровидными ядрами, между складками —
с овальными более светлыми ядрами. Тем не менее в пласте
отсутствует топографическая дифференциация процессов про-
лиферации клеток. Более того, эти процессы имеют четко вы-
раженный ритмический характер. В хронических опытах с мно-
гократными инъекциями 3Н-тимидина удалось показать, что
у части животных в кишечном эпителии меченые ядра почти
полностью отсутствовали, в то время как у других животных
около половины всех клеток проходили в течение опыта пери-
од синтеза ДНК, причем меченые ядра имелись как на верши-
не, так и в основании складок.
В весьма разнообразной и многочисленной в видовом отно-
шении группе полихет мы кратко остановимся на особенностях
организации кишечного эпителия у двух видов бродячих и од-
ного вида сидячих полихет.
Значительно более, сложное строение и в гистологическом,
и в микроанатомическом плане имеет средний отдел пищева-
рительного тракта у бродячих полихет афродитид. В каждом
сегменте червя участок кишки образует два дорсальных и два
вентральных мешковидных, слегка разветвленных железистых
выроста, соединенных с полостью кишки специальными прото-
89
90
Рис. 21. Схема ультра-
структурной организации
эпителия средней кишки
приапулиды Priapulus
caudatus (а) и полихеты
Harmothoe imbricata (б).
1, 2 — клетки в основании
складки с преобладающей
секреторной (?) и всасываю-
щей (2) функциями, 3,4 —
^секреторные» (3) н «всасыва-
ющие» (4) клетки с видо-
измененной апикальной по-
верхностью иа вершине
складки, 5 — мнкроворсин-
кн, 6 — аналог пернтрофн-
ческой мембраны, 7 — стен-
ка кишки, 8, 9 — клетки
в основании (8) и в середи-
не складки (9), 10— рес-
нички, 11, 12 — два типа
отростчатых базальных кле-
ток, 13 — апикальная зона
призматических клеток, 14 —
отростки базальных клеток,
15 — мышцы, 16 — колла-
ген.
91
Рис. 22. Схема ультраструктурной организации эпителия железистых вы-
Harmothoe
А: 1 — малодифференцированные, 2 — железистые, 3 — базальные крупногранулярные
6 — базальная мембрана, 7 — ядро, 8 — ядрышко, 9 — шероховатая ЭПС, 10 — аппарат
тельиых клеток, 14 — митохондрии, 15 — десмосома, 16 — мнкроворсиики, £: а —«исход-
ненне клеток, в, г — варианты или последовательные стадии деструктивной фазы цнк-
сов в
ками. Эпителий, выстилающий большую часть средней кишки,
образует, как и у приапулид, характерные складки в ос-
новном за счет разной высоты составляющих его клеток (рйс.
21, б). Кроме того, в кишке имеются и небольшие участки со
слабо выраженной складчатостью и даже лишенные ее. Меж-
ду складками располагаются всасывающие клетки с округ-
92
ростов (Л) и циклических изменений этого эпителия (5) у полихеты
imbricata.
железистые, 4 — пищеварительные клетки, 5 — отросток базальной железистой клетки,
Гольджи, 11 — секреторные гранулы, 12 — вакуоли, 13 — апикальная зона пнщевари-
иое» состояние, начало накопления пниоцнтозных вакуолей, б — максимальное напол-
лических изменений эпителия, д—ою — последовательные фазы регенераторных процес-
эпителии.
лыми ядрами, светлой цитоплазмой и умеренно развитыми об-
щими органоидами. На апикальной поверхности клетки несут
реснички и развитый аппарат микроворсинок. Складки обра-
зованы длинными вытянутыми клетками с сигаровидными яд-
рами. По ультраструктурной организации они сходны с клет-
ками, расположенными между складками, однако их цитоплаз-
93
ма темнее и содержит больше включений. Ближе к вершине
складок удается наблюдать дегенеративные изменения клеток
и выведение их в просвет кишки. Опыты с 3Н-тимидином пока-
зали, что размножение клеток происходит преимущественно
между складками и в их основании. Отсюда клетки медленно
смещаются к вершине складок. Такая допографическая диффе-
ренциация эпителия особенно хорошо выражена у молодых
животных. При попадании в полость их кишки крупных час-
тиц пищи удается выявить пластинку внеклеточного вещества,
выделяемую, по-видимому, эпителием и выполняющую функ-
цию перитрофической мембраны. Помимо основных выстила-
ющих просвет кишки клеток в эпителии афродитид выявлена
система отростчатых базальных клеток, отростки которых об-
разуют субэпителиальное сплетение. Клетки и отростки содер-
жат гранулы, по размерам которых можно выявить два: типа
таких клеток. Система базальных клеток характеризуется из-
вестной гистогенетической автономностью: часть их способна
вступать в фазу синтеза ДНК и размножаться митозом.
Выстилка протоков железистых выростов образована ти-
пичным однослойным ресничным эпителием, состоящим из кле-
ток с хорошо развитым ресничным аппаратом. Помимо обыч-
ных ресничек здесь, как и в сортировочных отделах желудка
пластинчатожаберных моллюсков, у части клеток удается на-
блюдать сложные реснички. Они образуются путем объедине-
ния нескольких комплексов микротрубочек под одной плазма-
тической мембраной. Эпителий протоков имеет четко выражен-
ный поляризованный характер. На границе с эпителием, вы-
стилающим мешковидные железистые придатки, имеется зона
малодифференцированных ресничных клеток. За счет размно-
жения и смещения этих клеток по направлению к кишке и про-
исходит обновление ресничного эпителия протока. Эпителий
железистых выростов афродитид представляет собой динамич-
ную эпителиальную систему (рис: 22, а, б). Он может иметь
вид пласта, образованного одним слоем плоских клеток или,
наоборот, представлять собой толстый пласт из высокопризма-
тических вакуолизированных клеток с неровной апикальной по-
верхностью. Все эти изменения в структуре пласта определя-
ются, по-видимому, циклическими изменениями основных в ко-
личественном отношении вакуолизированных клеток. По своей
ультраструктуре эти клетки афродитид сходны с пищевари-
тельными клетками брахиопод и моллюсков, что делает весьма
вероятным предположение об их 'пищеварительной функции.
Циклические изменения структуры этих клеток связаны, оче-
видно, как и у моллюсков, с пищеварительным циклом, • на
заключительных этапах которого клетки могут отделять зна-
чительную часть своей апикальной цитоплазмы с неперева-
ренными остатками. Кроме вакуолизированных клеток в соста-
ве эпителия железистых выростов имеются белковые жедези-
94
стые, малодифференцированные, камбиальные и единичные
эндокринные отростчатые базальные клетки. Камбиальные
клетки обеспечивают физиологическую регенерацию, которая
имеет циклический характер.
Таким образом, у афродитид в эпителии кишки и придат-
ков удается выявить, по крайней мере, три субсистемы: эпите-
лий средней кишки, протоков и железистых выростов.. Каждая
из них специализирована на различные функции: всасывание,
транспорт, внутриклеточное пищеварение и характеризуется
существенными особенностями и в отношении специализации
клеток и системными закономерностями организации эпителия.
В микроанатомическом отношении наиболее просто устроен .пищевари-
тельный тракт у широкораспространенных бродячих полихет рода Nereis.
Как и у приапулид, средний отдел их пищеварительного тракта представ-
ляет собой трубкообразный орган, имеющий мышечную оболочку и выстлан-
ный изнутри однослойным. эпителием. Передний отдел средней кишки имеет
более широкий просвет и мощную мышечную оболочку и, в известной мере,
соответствует желудку сидячих полихет. Эпителий образует складки, обус-
ловленные, как и у приапулид, различной высотой составляющих однослой-
ный пласт клеток (рис. 23, а).
Основным в количественном отношении клеточным типом. являются вса-
сывающие клетки с хорошо развитыми микроворсинками. Клетки этого типа
отличаются по высоте и интенсивности окраски цитоплазмы, однако разли-
чий в степени дифференцировки иа ультраструктурном уровне между высо-
кими и образующими желобки низкими клетками выявить не удается. Ми-
тотическое деление и вступление в фазу синтеза ДНК встречаются у этих
клеток редко, однако чаще между складками, чем на складках. Таким обра-
зом, в кишечном эпителии нереид относительно слабо выражена тенденция
к топографическому выделению зон преимущественного размножения клеток.
В отличие от приапулид в кишечном эпителии нереид четко выделяются
крупные секреторные клетки с большим количеством шероховатой ЭПС
и белковыми секреторными гранулами.
У нереид имеется четко выраженная и довольно многочис-
ленная система базальных клеток (рис. 23, б). Они не дохо-
дят до просвета, содержат секреторные гранулы и умеренное
количество шероховатой ЭПС. Клетки имеют отростки, в ко-
торые заключены гранулы секрета. Базальные клетки пред-
ставляют собой, по-видимому, эндокринную систему, аналогич-
ную диффузной эндокринной системе в кишечном эпителии
млекопитающих. Единичные базальные секреторные клетки име-
ются и в кишечном эпителии брахиопод и приапулид. В ки-
шечном эпителии нереид обнаружены единичные рецепторные
нервные клетки.
Сложная дифференцировка характерна и для кишечных
эпителиев сидячих полихет. Их пищеварительный тракт обыч-
но дифференцирован на ряд отделов и снабжен дополнительно
железистыми придатками. Даже у таких сидячих полихет, как
пескожил с относительно просто устроенным пищеварительным
трактом, в нем удается выделить: а) два железистых придат-
ка в виде так называемых слюнных желез; б) мощно разви-
тый и занимающий большую часть пищеварительной трубки
95
96
б
Рис. 23. Схемы ультраструктурной организации основной части эпителия
средней кишки (а) и его взаимоотношений со стенкой сосуда (б) у полихеты
Nereis.
1— всасывающие и 2 — железистые клетки, 3— темные клетки на вершине складки,
4 — клетки с ресничкой, 5 — мнкроворсинкн, 6 — базальные клетки, 7 — отростки мелко-
гранулярных базальных клеток, 8— амебоциты в эпителии. 9 — базальная мембрана,
Ю _ стенка сосуда, // — амебоциты в просвете сосуда, 12 — крупногранулярные ба-
зальные клетки, 13— «поры» в базальной мембране, 14 — протофнбрнллы, 15 — гра-
нулы амебоцита, 16— отростки, крупногрануляряых клеток, 17 — гранулы мелкогра-
нулярных и 18 — крупногранулярных клеток, 19 — десмосомы, 20 — митохондрии, 21 —
шероховатая ЭПС, 22 — мышцы, 23 — коллаген, 24 — ядро, 25— ядрышко, 26 — аппарат
Гольджи, 27 — вакуоли, 28 — реснички, 29 — микротрубочки.
железистый желудок; в) длинный кишечник. Процессы пище-
варения и поглощения пищи ’ происходят в основном в желудке
и в передних отделах кишечника. Эпителий желудка песко-
жила представлен однослойным железисто-всасывающим эпи-
телием (рис. 24, а).
Среди железистых клеток имеется несколько разновидно-
стей бокаловидных клеток, которые выделяют секрет, содер-
жащий сульфатированные мукополисахариды, и отличаются
4 672
97
Piic. 24. Эпителий желудка полихеты Arenicola
marina [Э. А. Кагановская, 1973, 1983].
а — участок железисто-всасывающей зоны эпителия,
и— автограф ресничной зоны через 18 сут после 10
ежедневных инъекций 3Н-тнмидина, в — схема ульт-
раструктурной организации всасывающей клетки.
1—3 — клетки (/ — всасывающая, 2 — железистая,
3 — ресничная), 4 — микроворсиика, 5 — остаточные
тола, 6 — пиносомы, 7— пинолизосома, 8 — мито-
хондрии. 9 — пиноцитозный канал на боковой по-
верхности клетки, 10— аппарат Гольджи, 11— ше-
роховатая ЭПС, 12 — ядро.
друг от друга характером секреторно-
го цикла. Вторым типом железистых
элементов, локализованных в области
желудка, являются крупные клетки
с резко базофильной цитоплазмой и хо-
рошо развитой эндоплазматической
сетью, с большим количеством рибо-
сом на наружной поверхности мем-
бран. Апикальные отделы этих клеток
имеют конусовидную форму и выхо-
дят на поверхность пласта в виде уз-
кого цитоплазматического отростка.
Основная масса эпителия желудка
состоит из крупных клеток с оксифиль-
ной цитоплазмой и отчетливо выра-
женной щеточной каемкой, которая
представляет собой хорошо развитые
микроворсинки, что указывает на вса-
сывающую функцию этих клеток (рис.
24, б). Они щиеют также хорошо раз-
витые лизосомы, шероховатую и глад-
кую эндоплазматические сети, две
разновидности аппарата Гольджи и
98
четыре разновидности митохондрий. Все перечисленные морфо-
логические признаки указывают на сложный мультифункцио-
нальный характер специфической их дифференцировки.
В опытах с пероксидазой хрена удалось показать, что этот
не проникающий через мембрану белок попадает в клетки че-
рез систему пиноцитозных каналов, имеющихся в основном на
боковой поверхности клеток.
Таким образом, всасывающие клетки эпителия желудка
и передних отделов кишки пескожила обладают способностью,
с одной стороны, поглощать простые гидролизованные в полости
пищеварительного тракта соединения, используя механизмы
трансмембранного транспорта через плазматическую мембрану
микроворсинок. . С другой стороны, более крупные непе-
реваренные в полости частицы поступают в межклеточные про-
странства. Отсюда они по пиноцитозным каналам, открываю-
щимся преимущественно на боковую поверхность всасывающих
клеток, проникают внутрь этих клеток. Здесь от каналов отшну-
ровываются ограниченные мембраной пиносомы, которые сли-
ваются с лизосомами, где пищевые частицы подвергаются
внутриклеточному перевариванию.
Помимо железисто-всасывающего эпителия в области дорзального и вент-
рального кишечных сосудов и в латеральных участках кишки имеются бо-
роздки или крипты, выстланные ресничным эпителием (рис. 24, б). Площадь,
занятая таким ресничным эпителием, увеличивается в каудальном направ-
лении. В кишечном эпителии среднего и заднего отделов тела животного
он занимает .уже до половины всей- эпителиальной выстилки кишки. Взаи-
моотношения этого эпителия с железисто-всасывающлми участками не сов-
сем ясно. С одной стороны, на границе этих эпителиев удается обнаружить
клетки, переходные по своей ультраструктуре от ресничных к всасывающим.
С другой стороны, в опытах с 3Н-тимидином не наблюдали массового пере-
хода клеток с маркированными ядрами в область железнсто-всасывающсго
эпителия.
Длительные опыты с 3Н-тимидином (ежедневные инъекции в течение
6—10 сут) показали весьма слабую интенсивность обновления основной мас-
сы эпителиального пласта. В этих опытах удалось обнаружить лишь еди-
ничные меченые клетки. Их количество среди всасывающих клеток замет-
но увеличивалось лишь на 10-е, 20-е сут после инъекции 3Н-тимиднна. Отме-
ченные зоны ресничного эпителия обновляются интенсивнее. В упомянутых
выше опытах количество меченых клеток достигает здесь в результате на-
сыщения животных 3Н-тимидином в течение 6 сут 30, а через 8 сут,
после 10-кратной инъекции, даже 70%.
§ 3. Кишечные эпителии низших многоклеточных
Губки, кишечнополостные, турбеллярии. У современных сво-
бодноживущих многоклеточных животных наиболее примитив-
ную организацию имеют кишечные эпителии губок и низших
турбеллярий. У губок процессы поглощения питательных ве-
ществ -осуществляются группами весьма сложно дифференциро-
ванных клеток. У некоторых губок они образуют выстилку
4* 99
внутренней полости этих животных, у других — расположены
в специальных каналах, пронизывающих тело губки (рис. 25).
Клетки имеют развитый жгутиковый аппарат и сложно диф-
ференцированную апикальную часть цитоплазмы в виде ворот-
ничка. Сюда под действием тока жидкости, создаваемого жгу-
тиком, и поступают пищевые частицы. Последние фагоцитируются
специализированными участками плазматической мембраны
Рис. 25. Схема строения тела губки. [По: Андрю].
— парагастральная полость, 2 — хоаноциты, 3 — амебоциты, 4 ~ яйцеклетки, 5 — спи-
кулы, 6 — мезоглея.
в углублениях воротничка. Фагоцитированные частицы
у одних видов губок перевариваются самими жгутиковыми
клетками, у других передаются амебоцитам. Переваривание
в обоих случаях идет по типу внутриклеточного пищеварения.
Примитивность тканевой организации системы таких сложно-
дифференцированных жгутиковых клеток проявляется . как
в функциональной автономности каждой клетки, так и в отсут-
ствии их структурной и гистогенетической интеграции. У неко-
торых губок описана возможность обратимого превращения
жгутиковых клеток в подвижные амебоциты тела животного.
♦
Среди отдельных представителей губок наблюдаются различные взаимо-
отношения между специализированными жгутиковыми клетками и амебоци-
тами стенки тела. Так, у известковых губок жгутиковые клетки — хоаноци-
ты — и захватывают, и переваривают питательные вещества. У кремневых
100
и времнероговых губок пищу поглощают хоаноциты, но затем передают ее
амебоцитам, которые и осуществляют внутриклеточное пищеварение. Нако-
нец, у некоторых губок хоаноциты играют лишь гидрокинетическую роль.
Поглощение и внутриклеточное переваривание пищи осуществляют крупные
специализированные амебоциты.
Весьма многообразны отношения, наблюдаемые в органи-
зации пищеварительного аппарата у турбеллярий. У их низших
представителей — некоторых видов бескишечных турбеллярий,
имеется лишь довольно просто устроенная глотка с ротовым
отверстием, обеспечивающая захват пищи. Переваривание пи-
щи обеспечивается специальными пищеварительными клетка-
ми — обладающими подвижностью фагоцитами.
Одним из направлений усложнений этих, по-видимому, пер-
вичных отношений является обнаруживаемый у некоторых ви-
дов групповой фагоцитоз. Он заключается в способно-
сти фагоцитов образовывать вокруг крупных пищевых частиц
временные скопления. При этом часть фагоцитов в таких
скоплениях гибнет, выделяя гидролитические ферменты, обес-
печивающие распад крупной пищевой частицы на более мел-
кие, которые и поглощаются фагоцитами. Такое усложнение
первичной фагоцитарной функции независимо возникает в раз-
ных группах современных турбеллярий. Однако оно не явля-
ется прогрессивным приспособлением, поскольку уводит эти
группы животных от создания настоящего кишечного эпите-
лия. Более прогрессивной тенденцией следует считать образо-
вание особой так называемой. центральной паренхимы,
из которой, по-видимому, и происходит формирование кишеч-
ника. У современных бескишечных турбеллярий наблюдается
более или менее отчетливая дифференцировка паренхимы на
периферическую и ..центральную. В опытах с 3Н-тимидином на
одном -из таких видов бескишечных турбеллярий показано, что
центральная паренхима представляет собой специализирован-
ную, не размножающуюся клеточную или частично синцити-
альную систему.
Весьма вероятно, что. при дальнейшей дифференцировке та-
кой паренхимы — формировании в ней полости и стенки-' киш-
ки, выстланной кишечным эпителием, —- и возникли те отноше-
ния, которые наблюдаются у многих современных турбеллярий
и других плоских червей. Они имеют хорошо развитый кишеч-
ник, а выстилающий его эпителий обеспечивает процессы по-
лостного пищеварения. В кишечном эпителии этих животных
могут дифференцироваться сложный железистый аппарат и
специализированные всасывающие клетки. К сожалению,
системные отношения в таком эпителии не изучены еще
современными методами. Интересно, что в пределах класса
турбеллярий сохранились виды, не связанные между собой непо-
средственным родством, но находящиеся на разных этапах выде-
ления из центральной паренхимы специализированного кишеч-
101
102
ника. На примере одной из таких турбеллярий (рис, 2(1, п)
видно, что в паренхиме имеется уже полость и формируется
пласт специализированных клеток. Однако они еще не отделе-
ны от периферической паренхимы. Исследование этих видон
показывает, что в пределах класса турбеллярий, в разных
группах независимо происходило выделение эпителизирован-
ного кишечника из центральной паренхимы. При этом форми-
рование кишки шло, по-видимому, разными путями, хотя ко-
нечный результат оказался сходным. В одних случаях сначала
формировался просвет и происходило выделение железистых
п всасывающих клеток, а лишь, затем формировалась стенка
кишки. В других случаях, наоборот, происходило разделение
периферических и центральных паренхим, а лишь затем из цент-
ральной паренхимы формировался кишечный эпителий с диф-
ференцировкой в нем железистых и всасывающих клеток.
Таким образом, детальный анализ организации кишечных
эпителиев у возможно большего числа видов турбеллярий чрез-
вычайно важен. Он позволяет выяснить общие закономерности
ранних этапов эволюционной динамики кишечных эпите-
лиев.
Большой интерес представляют данные и по кишечным эпи-
телиям современных кишечнополостных. Возможно, что фор-
мирование кишечного эпителия в этой группе животных про-
исходило иначе, чем у турбеллярий. Тем не менее его органи-
зация у современных кишечнополостных в принципе сходна
п с таковой высших турбеллярий, и других многоклеточных
животных.
У представителей современных кишечнополостных внутри-
клеточное пищеварение уже не имеет доминирующего значе-
ния. Даже у наиболее примитивных или у таких вторично уп-
рощенных форм, как пресноводная' гидра, кишечный эпителий
всегда представляет собой организованный пласт с дифферен-
цировкой на железистые и всасывающие клетки. Последние
часто имеют реснички и обладают способностью, правда в из-
вестных пределах, к процессам пино- и фагоцитоза. Диффе-
ренцировка железистых клеток у высших представителей ки-
шечнополостных может достигать большого разнообразия. Они
могут выделять помимо различного рода ферментов еще и сли-
зеподобные вещества, играющие вспомогательную роль в про-
цессах полостного пищеварения. У многих групп кишечнополо-
стных наблюдается концентрация железистых элементов
в определенных участках эпителиального пласта. При этом
у гидроидных полипов с помощью 3Н-тимидина удалось пока-
зать закономерное и достаточно интенсивное обновление зрелых
железистых клеток, имеющих относительно непродолжитель-
ный жизненный цикл, исчисляемый несколькими сутками (рис.
26, б). При наличии в пласте определенных зон камбиальных
и зрелых железистых клеток у кишечнополостных наблюдаются
103
отношения, сходные с обновляющимися клеточными популя-
циями высших животных.
У многих кишечнополостных, в частности у гидры, показа-
но довольно интенсивное обновление всасывающих клеток,
хотя по последним данным в их эпителии нет камбиальных
зон — центров усиленного размножения клеток.
Несмотря на эти в общем примитивные признаки органи-
зации кишечного эпителия кишечнополостных, у высших их
представителей наблюдается весьма сложная дифференциров-
ка и пищеварительного тракта, и выстилающего его эпителия,
как, например, у актиний или сцифомедуз.
§ 4. Общие закономерности эволюционной динамики
кишечных эпителиев
Некоторые общие закономерности эволюционной динамики
кишечных эпителиев многоклеточных животных представлены
на схеме (рис. 27).
Приведенный выше большой фактический сравнительно-ци-
тологический материал свидетельствует о наличии у разных
животных для трех основных типов специализированных кле-
ток кишечного эпителия (всасывающие, пищеварительные
и секреторные) общих признаков морфобиохимической диффе-
ренцировки.
Всасывающие клетки кишечного эпителия представителей
различных групп животных (первично- и вторичноротые) име-
ют сложный аппарат всасывания — систему микроворсинок —
с соответствующей специализацией всей остальной структур-
ной организации клеток на процессы внутриклеточного транс-
порта и выведение утилизированных продуктов (рис. 27,1 и Я).
Широкое распространение и сходный характер морфобио-
химической дифференцировки всасывающих клеток в кишеч-
ных эпителиях животных, не связанных близкими родственны-
ми связями, — одно из проявлений общих, типовых для всех
кишечных эпителиев закономерностей его усложнения в процессе
эволюции. Наряду с этим сопоставление всасывающих клеток
разных групп животных, в частности некоторых насекомых
и высших позвоночных, указывает на существенные особенно-
сти и в их дифференцировке. К ним относится, например, ши-
роко распространенное у насекомых сочетание секреторной
и всасывающей функций у одних и тех же клеток. Такого рода
дуалистическая дифференцировка не свойственна всасывающим
клеткам высших позвоночных. У млекопитающих и многих
других позвоночных секреторные потенции всасывающих кле-
ток реализуются лишь в выделении мукопротеинового глико-
каликса или надмембранного комплекса, гипертрофированного
на микроворсинках и играющего вспомогательную роль в про-
цессах пристеночного пищеварения и активного мембранного
104
Рис. 27. Схема некоторых общих закономерностей эволюционной динамики
кишечных эпителиев.
I, Н, III — схемы ультраструктурной организации всасывающих (I, II) и пищевари-
тельной (III) клеток у млекопитающих (I), насекомых (II) и новорожденных млеко-
питающих, моллюсков и клещей (III) : а—д — схемы организации процессов репро-
дукции в кишечном эпителии млекопитающих (а)» хвостатых амфибий (б), голожа-
берных молллюсков (в), насекомых (а), асцидий (д); е—яс— варианты организации
пищеварительной функции у бескишечиых турбеллярий, з — становление кишечного
эпителия у современных турбеллярий, и — кишечный эпителий высших турбеллярий;
1—с — клетки (I — дифференцированные, 2 — полустволовые камбиальные, 3 — стволо-
вые камбиальные).
транспорта. Всасывающие клетки позвоночных синтезируют
и выделяют некоторые гидролитические ферменты, необходи-
мые для пристеночного пищеварения.
У некоторых насекомых и, по-видимому, у ряда других
групп животных, в частности у приапулид и нематод, всасы-
вающие клетки вырабатывают все гидролитические ферменты,
т. е. берут на себя функцию желез желудочно-кишечного трак-
та позвоночных. Кроме того, у многих насекомых, у некоторых
полихет и у приапулид они обладают способностью периодически
или постоянно выделять белки и хитин, необходимые для пост-
роения перитрофических мембран.
У многих многоклеточных животных процессы полостного
пищеварения и всасывания могут осуществляться клетками, не
обладающими специальным аппаратом микроворсинок. Нако-
105
нец, весьма вероятно, что этот аппарат при более детальном
сравнительно-цитологическом исследовании у разных живот-
ных окажется далеко не идентичным, особенно на молекуляр-
ном и надмолекулярном уровнях его организации. В пользу та-
кого заключения говорят глубокие различия в механизмах
транспорта аминокислот и углеводов всасывающими клетками
насекомых и млекопитающих. У насекомых преобладает пас-
сивный транспорт, а у млекопитающих ведущее значение име-
ет активный. Все эти более или менее существенные частные
особенности в дифференцировке всасывающих клеток при по-
лостном пищеварении отражают, очевидно, известное многооб-
разие их эволюционных потенций в рамках определенных об-
щих закономерностей.
Аналогичные отношения, очевидно, имеют место и в эволю-
ционной дифференцировке специализированных клеток, обес-
печивающих процессы внутриклеточного пищеварения. Исполь-
зование одного и того же универсального клеточного механиз-
ма— пино- и фагоцитоза — отнюдь не означает, что у амебы,
хоаноцита губок, в клетках железистых выростов моллюсков
и брахиопод и некоторых полихет и, наконец, в пищеваритель-
ных клетках кишечного эпителия иксодовых клещей этот ме-
ханизм, а также другие связанные с ним системы клеток ра-
ботают абсолютно идентично. Известны, например, различия
лизосомного аппарата даже у двух разновидностей лейкоци-
тов позвоночных — микро- и макрофагов. Не менее сущест-
венные особенности, по-видимому, имеются в самих механиз-
мах пино- и фагоцитоза у хоаноцитов и у амебоцитов губок
или в пищеварительных клетках моллюсков. Тем не менее для
всех этих клеток, специализированных на внутриклеточное пи-
щеварение, характерны и общие типовые признаки, и много-
численные примеры параллельной филогенетической диффе-
ренцировки.
Особенно яркими примерами цитологических параллелиз-
мов при внутриклеточном пищеварении являются постоянные
пиноцитозные комплексы, которые формируются в клетках
эпителия пищеварительной железы пластинчатожаберных
и брюхоногих моллюсков и брахиопод, а также в пищевари-
тельных клетках кишечного эпителия иксодовых клещей (рис.
27, III).
Степень его развития может быть различной. Чаще у пе-
речисленных выше животных он представлен системой пино-
цитозных каналов, от которых отшнуровываются пиноцитозные
пузырьки. В наиболее сложных случаях в дополнение к этой
апикальной системе каналов и пузырьков в надъядерной об-
ласти клетки формируется крупная ограниченная мембраной
вакуоль. Формирование постоянных пиноцитозных комплексов
может сочетаться с сохранением у клеток способности всасы-
вать низкомолекулярные продукты. Такие отношения харак-
106
терны для всасывающих клеток пескожила, новорожденных
млекопитающих, асцидий, некоторых рыб, ракообразных и, по-
видимому, многих других групп животных. Пиноцитозный комп-
лекс может формироваться и для транспортировки через цито-
плазму макромолекулярных соединений (без их гидролиза), как
это происходит у новорожденных млекопитающих или при
микропиноцитозе.
Третий тип специализированных клеток кишечных эпители-
ев — железистые клетки — имеет более разнообразный спектр
эволюционных модификаций, чем рассмотренные выше два типа
клеток кишечного эпителия. Это определяется прежде всего
большим разнообразием пищи у разных многоклеточных и,
следовательно, разнообразием ферментов, которые необходимы
для расщепления высокомолекулярных органических соедине-
ний в каждом конкретном случае.
Общей прогрессивной тенденцией в эволюционной динамике
специализированных железистых клеток является увеличение
их разнообразия. Так, например, в кишечном эпителии млеко-
питающих только в составе эпителиального пласта (помимо
особых железистых структур желудка, поджелудочной железы,
двенадцатиперстной кишки) имеется три типа узкоспециали-
зированных железистых клеток.
Аналогичное разнообразие имеется, по-видимому, у многих
насекомых, однако в составе их эпителия преобладают желе-
зистые клетки, связанные с обеспечением основной функции
секреторного аппарата — выделением ферментов для гидроли-
тического расщепления пищевых веществ. Наряду с этим у мно-
гих насекомых имеются и типичные бокаловидные клетки, ко-
торые весьма широко распространены и у других групп много-
клеточных животных. Количество разновидностей железистых
элементов может увеличиваться и у животных относительно
низких уровней организации, как, например, у кишечнополо-
стных и бескишечных турбеллярий.
Кишечный эпителий и его производные у многих групп жи-
вотных обеспечивают не только расщепление и всасывание, но
и вторичную обработку и хранение запасных питательных ве-
ществ в виде гликогена или жировых включений. Наибольшее
развитие эта важная функция внутреннего обмена получает
в производных кишечного эпителия у позвоночных животных.
У них образуется специальный орган — печень. Эпителиальные
клетки печени почти полностью утрачивают такое характерное
первичное свойство клеток кишечного эпителия, как поляр-
ность, и по своей морфобиохимической дифференцировке пред-
ставляют редкий для кишечного эпителия позвоночных тип
мультифункциональных клеточных элементов. Они характери-
зуются секреторной активностью и имеют в мембранах эндо-
плазматической сети ферменты детоксикации вредных продук-
тов метаболизма. В печеночных клетках протекает и ряд узло-
107
вых этапов углеводного, жирового и белкового метаболизмов.
Некоторые функции печеночных клеток позвоночных реа-
лизуются в клетках кишечного эпителия или его железистых
производных у ряда групп первичноротых животных. Наиболее
ярко они выражены в пищеварительных клетках иксодовых
клещей. Эти клетки на определенных стадиях пищеваритель-
ного цикла становятся основными резервуарами поглощенной
пищи и, очевидно, обеспечивают ее вторичную переработку
перед выделением в гемолимфу. Выделение соединений, эмуль-
гирующих жиры, образование гликогена и жировых включений
происходит в эпителиальных клетках пищеварительной железы
ракообразных. Имеются данные о том, что у некоторых голо-
воногих моллюсков, как и-у позвоночных животных, эпителии
железистых структур среднего отдела пищеварительного трак-
та становятся аппаратом преимущественно вторичной об-
работки поглощенных пищевых продуктов, причем поступ-
ление последних в клетки происходит не из полости
кишки, а из тканевой жидкости и транспортной сосудистой
системы.
В последнее время появились данные о том, что в кишеч-
ном эпителии многих групп беспозвоночных животных (игло-
кожие, оболочники, моллюски) имеются специализированные
клетки, вырабатывающие гормоны типа инсулина и гликагона
позвоночных для регуляции углеводного обмена. В этом плане
большой общий интерес представляет обнаруженная у бродя-
чих полихет и других беспозвоночных животных система ба-
зальных эндокринных отростчатых клеток. Они по своему
функциональному значению, по-видимому, аналогичны диффуз-
ной эндокринной системе кишечных эпителиев млекопитающих.
В сравнительно-цитологическом плане весьма демонстра-
тивно также независимое возникновение в кишечном эпителии
некоторых насекомых, у представителей одного семейства
морских звезд и брюхоногих моллюсков полиплоидных всасы-
вающих, ресничных всасывающих и железистых клеток. Инте-
ресно также, что усиление сортирующей транспортной функции
во вспомогательных участках ресничного кишечного эпителия
может осуществляться тремя разными способами: увеличением
сложности организации и количества ресничек на клетку
(пластинчатожаберные моллюски, афродитиды), полиплоиди-
зацией клеток с кратным увеличением количества ресничек
(иглокожие) и, наконец, увеличением количества клеток с
уменьшением их размеров (брахиоподы).
Таким образом, сравнительно-цитологический обзор специ-
ализированных клеток в кишечных эпителиях многоклеточных
животных указывает на совершенно определенные общие тен-
денции функциональной и морфобиохимической дифференци-
ровки. Однако проявление последних может быть весьма мно-
гообразным.
108
Еще более сложные отношения наблюдаются в эволюцион-
ных преобразованиях внутрисистемных механизмов, обеспечи-
вающих интеграцию кишечного эпителия как единой целостной
системы клеточных элементов. У некоторых низших многокле-
точных, как с внутриклеточным, так и с полостным пищева-
рением мы встречаемся с относительно низкой интегрирован-
ностью клеток в тканевой системе и даже с почти полным ее
отсутствием. Наиболее демонстративными примерами в этом
отношении среди животных с внутриклеточным пищеварением
являются губки и бескишечные турбеллярий.
Полостное пищеварение по своей сути требует уже опреде-
ленной степени целостности системы. Оно основано на «разде-
лении труда» между клетками и должно протекать в замкну-
том тканевой системой пространстве. Эти необходимые при-
знаки структурной интеграции имеются у кишечнополостных.
Однако кишечным эпителиям рассматриваемых животных свой-
ственны и такие примитивные признаки, как мультифункцио-
нальная дифференцировка эпителиально-мышечных клеток
и способность некоторых клеток к метаплазии в широких пре-
делах. На основании изложенных данных можно констатиро-
вать большое распространение интегрированных обновляющих-
ся камбиальных систем кишечных эпителиев (рис. 27, а—д).
Ясно выраженная тенденция к топографическому выделению
камбиальных клеток наблюдается в пределах каждого класса
позвоночных, как это было показано на примере амфибий
и костистых рыб. Отчетливо выявляется она и у некоторых
групп высших первичноротых, в частности, у насекомых. Хо-
рошо выраженное поляризованное обновление системы имеет
место у йластинчатожаберных и брюхоногих моллюсков с пре-
обладающим внутриклеточным пищеварением.
Для изучения обновляющихся кишечных эпителиев весьма
важно выяснить внутренние закономерности организации кам-
биальных систем и конкретные механизмы их взаимоотношения
с дифференцирующимися в различных направлениях клетками.
Совершенно очевидно, что в основе стабильной и совер-
шенной работы такой сложной тканевой системы, какой яв-
ляется кишечный эпителий млекопитающих, лежит механизм
обратных связей между дифференцирующимися в четырех на-
правлениях клеточными элементами и, по-видимому, единой
камбиальной системой. Это взаимодействие осуществляется при
помощи особых веществ и соответствующих им адекватных ре-
цепторов камбиальных клеток. Показана также существенная
роль в регуляции размножения клеток непосредственных меха-
нических контактов между ними внутри системы.
Эти, а возможно и ряд других механизмов, лежат в основе
количественного и качественного постоянства клеточного со-
става во всех камбиальных системах, в том числе и в камби-
альных системах кишечных эпителиев, у разных групп много-
109
клеточных животных. Однако эти регулятивные механизмы,
как и любые другие биологические механизмы, в каждом конк-
ретном случае исторически обусловлены и отнюдь не тождест-
венно проявляются у разных животных.
Одной из наиболее интересных особенностей эволюцион-
ной динамики кишечных эпителиев является тенденция к ус-
корению темпов их физиологической регенерации, что связано
с большими затратами энергии и пластических материалов.
Такая тенденция отчетливо выражена у высших позвоночных
и некоторых насекомых. Весьма вероятно, что она имеет место
в эволюционной дифференцировке кишечных эпителиев и у мно-
гих других групп многоклеточных животных.
По-видимому, быстрая и прогрессирующая в процессе эво-
люции изнашиваемость всасывающих и других специализиро-
ванных клеток кишечного эпителия коррелирует с неясным еще
для нас совершенствованием молекулярных и надмолекулярных
механизмов, обусловливающих основные функции кишечного
эпителия. При этом относительно небольшой период активной
функциональной деятельности дифференцированных клеток
(пищеварительные и всасывающие) обусловливается в равной
мере процессами всасывания низкомолекулярных продуктов
и внутриклеточным пищеварением. Интенсивно обновляющиеся
системы кишечного эпителия мы обнаруживаем у животных
как с полостным, так и внутриклеточным пищеварением.
Помимо кишечных эпителиев, построенных по принципу
обновляющихся клеточных популяций с выделением специаль-
ных малодифференцированных клеток, широко распространены
в ряде групп многоклеточных животных . кишечные. эпителии
или отдельные их участки с другим принципом организации
процессов репродукции и физиологической регенерации. Обнов-
ление клеточного состава в таких эпителиях обеспечивается за
счет сохранения способности к размножению у части диффе-
ренцированных функционирующих клеток, диффузно распре-
деленных в эпителии или образующих небольшие скопления.
Примерами их могут служить кишечный эпителий летних ля-
гушек, приапулид, нереид, большая часть вспомогательных
участков ресничных эпителиев пластинчатожаберных моллюс-
ков и брахиопод. Такого рода кишечные эпителии отражают,
по-видимому, первичные, более простые отношения в их сис-
темной организации. Однако эти эпителии характеризуются
большей пластичностью, способностью, в широких пределах
изменять интенсивность физиологической регенерации. Меха-
низмами такого рода изменений могут быть и варьирование,
и цикличность размножения клеток, и своеобразный мехайизм
системной физиологической регенерации — слущивание больших
участков эпителия с последующим их восстановлением. Такая
пластичность кишечных эпителиев особенно важна при ярко
выраженных сезонных изменениях их внутренней организации.
110
Резкие отличия внутренней организации между кишечными
эпителиями с выделенным камбием и без специальных недиф-
ференцированных клеток выявляются лишь в типичных случа-
ях. Наряду с такими различиями имеется и тесная связь,
которая выражается в наличии эпителиев переходного типа,
как, например, в средней кишке афродитид, и в наличии у мно-
гих видов животных разновидностей обоих типов эпителиев, как,
например, у пластинчатожаберных моллюсков, афродитид
и в желудке разных видов асцидий. Особенно же нагляд-
но глубокая связь внутренней организации кишечных эпители-
ев разного типа проявляется при их сезонных изменениях.
Так, некамбиальный эпителий летних лягушек к началу весны
приобретет черты сходства с эпителиями камбиального типа.
Для понимания общих закономерностей эволюционной дина-
мики кишечных эпителиев большой интерес представляет со-
поставление их организации не только у далеко отстоящих
в филогенетическом отношении групп многоклеточных живот-
ных, но и у разных представителей животных одного класса
или более мелких таксонов. Примером плодотворности такого
рода близкородственных сопоставлений является анализ тех
отношений, которые имеются в организации процессов пище-
варения у турбеллярий. В пределах класса турбеллярий у со-
временных их представителей выявляются разнообразные пути
становления кишечного эпителия в эволюции этой группы
многоклеточных животных. При этом обнаруживается общая
закономерность эволюционной динамики кишечных эпители-
ев— ярко выраженная направленность эволюционных преоб-
разований на формирование тканевой дифференцированной си-
стемы, способной обеспечить процессы совершенного полостно-
го пищеварения.
Тенденция к достижению этой цели независимо и по-разно-
му проявляется в разных группах турбеллярий, однако конеч-
ный результат всех этих преобразований — формирование обо-
собленного кишечника — оказывается весьма сходным в раз-
ных отрядах и семействах этого класса.
Глава 7. КОЖНЫЕ ЭПИТЕЛИИ
Кожные эпителии представляют собой одну из наиболее
древних тканевых систем, возникшую на первых этапах эво-
люции многоклеточных организмов. Первичной функцией этой
ткани была пограничная функция. На ранних этапах эволю-
ции многоклеточных животных барьерная роль кожного эпи-
телия сочеталась с поглощением из окружающей среды кис-
лорода и питательных веществ, выделением вредных продуктов
метаболизма, локомоторной функцией и восприятием раздра-
111
жсний. На более поздних этапах эволюции эти не основные
для кожного эпителия функции обычно выполняют другие
специализированные тканевые системы. Усложнение погранич-
ной ткани, расположенной на поверхности тела животных, шло
по пути специализации и усовершенствования ее барьерной
защитной роли, обеспечивающей изоляцию организма от внеш-
ней среды, приобретающей исключительное значение при вы-
ходе многоклеточных животных па сушу и расселении их в воз-
душной среде.
Современные многоклеточные животные прошли длинный
путь адаптивной эволюции, которая касалась различных уров-
ней их организации. На основании изучения кожных эпителиев
этих животных невозможно построить непрерывный ряд услож-
нения пограничных тканей в процессе эволюции. Однако срав-
нительно-гистологические сопоставления позволяют все же на-
метить основные тенденции их формирования у многоклеточ-
ных животных. Среди кожных эпителиев можно выделить три
основные разновидности: а) погруженные, однослойные и мно-
горядные эпителии, б) однослойные кутикулярные эпителии,
в) многослойные неороговевающие и ороговевающие эпителии.
Такая классификация в известной мере отражает последо-
вательные этапы усложнения кожных эпителиев в процессе
эволюции. Первая разновидность наиболее характерна для
низших многоклеточных животных. Многослойные эпителии
с тенденцией к образованию ороговевающих пластов характер-
ны для всех классов позвоночных. Развитие кожного эпителия
по пути совершенствования кутикулярных структур — основная
эволюционная тенденция кожных покровов многих групп бес-
позвоночных (кольчатые черви, членистоногие, оболочники
и др.).
В то же время разные варианты кожных эпителиев могут встречаться
и у одного и того же животного. Это особенно характерно для. однослой-
ных и многорядных эпителиев. Многорядные эпителии вторично возникают
в специализированных участках многослойного кожного эпителия, у позво-
ночных животных. У моллюсков — относительно высоко организованных групп
беспозвоночных животных — кожные эпителии представлены как специали-
зированными кутикулярными, так и однослойными и миогорядными эпите-
лиямп.
§ 1. Погруженные, однослойные и многорядные эпителии
Примером однослойных эпителиев, сохранивших, по-види-
мому, некоторые черты первичных кожных эпителиев многокле-
точных, является «примитивный» погруженный эпителий бес-
кишечных турбеллярий (рис. 28, а). Характерная особенность
этого эпителия заключается в отсутствии четкой границы меж-
ду ним и подлежащей паренхимой. Ядросодержащие части
эпителиальных клеток свободно располагаются среди клеток
паренхимы и как бы погружены в ее толщу. Эпителиальный
112
Рис. 28. Погруженные и однослойные эпителии.
а — погруженный ресничный эпителий бескншечных турбеллярий (/ — эпителиальные
и о — паренхимные клетки, 3— мышечная клетка), б — однослойный ресничный эпите-
лий турбеллярий (I — ресничные и 2.— железистые клетки, 3 — базальная мембрана),
в — однослойный синцитиальный эпителий коловраток (/—уплотнение апикальной ци-
топлазмы синцития, 2 — базальная мембрана), г, д — погруженный эпителий цестод
(г) и трематод (б) (/— псевдокутикулярная пластиика (тегумент), 2 — ядросодержа-
щис.части синцития, 3— базальная мембрана, 4— продольные и кольцевые мышечные
волокна, 5 — паренхимные клетки, 6 — микротрихии, 7 —«шнпяк», 3 — секреторные
гранулы).
пласт образуют лишь расширенные апикальные части клеток,
формируя межклеточные контакты. На апикальной поверхно-
сти эпителиальных клеток развивается мощный ресничный
аппарат с хорошо развитыми корневыми нитями, который вме-
сте с мышечными клетками паренхимы и ресничками образу-
ет Локомоторный аппарат кожи бескншечных турбеллярий.
113
У остальных турбеллярий (и большинства групп многоклс-
точных животных) покровный эпителий обособлен от подле-
жащих тканей базальной мембраной и приобретает строение
однослойного или многорядного эпителиального пласта (рис.
28,6).
У двух классов паразитических плоских червей (цестоды
и трематоды) формируются специализированные псевдокути-
кулярные погруженные эпителии. Особенно хорошо особенно-
сти этого эпителия выражены у цестод. Последние лишены
пищеварительной системы, и их кожный эпителий одновре-
менно выполняет совершенную барьерную функцию (защита
от действия гидролитических ферментов полости кишки хозяи-
на) и функцию поглощения простых питательных - веществ,
главным образом моносахаров. Структурной основой для реа-
лизации этих функций является тегумент или псевдокутику-
лярная пластинка (рис. 28, г, д). Она образована апикальны-
ми частями эпителиальных клеток, которые сливаются своими
боковыми поверхностями и формируют целостный в структур-
ном и функциональном отношениях синцитий. Он отделен от
подлежащей паренхимы базальной мембраной, которая пре-
рывается только в местах связи ядросодержащих базальных
частей клеток с псевдокутикулярной пластинкой. Базальные
части клеток с ядрами, как и у бескишечных турбеллярий,
располагаются среди клеток паренхимы.
В прилегающих к базальной мембране участках тегумента
содержится много митохондрий и обнаруживаются цистерны
и каналы эндоплазматической сети, тогда как его апикальная
цитоплазма содержит большое количество ограниченных мем-
браной пузырьков и вакуолей. Кроме того, в апикальной части
псевдокутикулярной пластинки нередко образуются уплотнен-
ные участки цитоплазмы, которые, вероятно, выполняют опор-
ную функцию. Например, у некоторых трематод они имеют
форму выступающих на поверхности тегумента зубчиков, по-
крытых цитоплазматической мембраной (рис. 28, д'). У цестод
наружная поверхность псевдокутикулярной пластинки образу-
ет различные варьирующие по своей форме структуры. Они
могут иметь вид длинных микроворсинок с шарообразными рас-
ширениями на концах или массивных конусовидных образова-
ний, так называемых микротрихий (рис. 28, г). Предполага-
ется, что микротрихии могут служить для заякоривания в сли-
зистой кишечника хозяина и для усиления функции всасыва-
ния питательных веществ.
Однослойный эпителий, имеющий синцитиальное строение,
характерен и для других групп животных: некоторых турбелля-
рий, коловраток, скребней и большинства нематод. У коловра-
ток и скребней так же, как у плоских паразитических червей,
барьерная и скелетная функции эпителия усиливаются благо-
даря формированию в апикальной зоне синцития уплотненной
114
цитоплазмы — опорной пластинки, которую иногда называют
«.'внутриклеточной кутикулой» (рис. 28, в).
Примером другой разновидности кожных эпителиев, обна-
руживающих некоторые архаичные черты, могут служить одно-
слойные покровные эпителии губок и некоторых кишечнополо-
стных (например, эпителий пресноводной гидры). У рассмат-
риваемых животных этот эпителий представле'н однослойным
или многорядным пластом клеток уплощенной, кубической или
призматической формы. Архаичность эпителиев кишечнополост-
ных проявляется в слабой детерминированности их тканевой
организации. Например, у гидры наружный эпителий может
возникать за счет дедифференцировок и железистых клеток ки-
шечного эпителия и последующей дифференцировки их в раз-
личных направлениях. Кроме того, у кишечнополостных ши-
роко распространены эпителиально-мышечные клетки. Ядросо-
держащие части последних образуют пограничный пласт на
поверхности тела, а вытянутые базальные части содержат
фибриллярные структуры, осуществляющие функцию сократи-
мости. Подобного рода смешанные дифференцировки (барьер-
ные и локомоторные) возникают на поздних этапах эволюции
и в специализированных тканевых системах высших животных.
Наиболее характерным примером таких еще нерасчленеиных структур
могут служить эпителиально-мышечные клетки дилятатора зрачка позвоноч-
ных животных. Ядросодержащие части клеток здесь образуют пигментный
слой, выстилающий внутреннюю поверхность радужины, а вытянутые ба-
зальные части клеток содержат мибфибриллы, обеспечивающие сокращение
радужной оболочки, увеличивая тем самым диаметр зрачка. Вее эти струк-
туры образуются из нервного зачатка, т. е. представляют собой эпителиаль-
но-мышечную дифференцировку весьма позднего в филогенезе происхожде-
ния.
Важную роль в усложнении кожных эпителиев сыграло по-
явление специальных железистых клеток, выделяющих на по-
верхность тела различного рода секреторные продукты. Много-
численные железистые клетки характерны для кожных эпите-
лиев актиний, гребневиков, турбеллярий, немертин, моллюсков
(рис. 28, н; 29, а, г). Выделяемый ими секрет создает сплошной
слизистый слой, играющий заметную роль в осуществлении
барьерной и локомоторной функции эпителия этих животных.
Характерная особенность эпителия гребневиков — сложный ло-
комоторный ресничный аппарат. Мощно развитые длинные рес-
нички эпителиальных клеток соединяются между собой боко-
выми поверхностями и образуют структуры — гребные плас-
тинки, обеспечивающие перемещение животных в толще воды.
Типичным примером многорядных эпителиев может слу-
жить эпителий, покрывающий большую часть тела голожабер-
ных моллюсков (рис. 29, а, б). Он представляет собой интегри-
рованную тканевую систему с выделением в ней камбиальных
115
и функционирующих клеток,' ядра которых лежат на разных
уровнях. Эпителий отделен от подлежащей соединительной
ткани базальной мембраной. Непосредственно на ней распола-
гаются камбиальные клетки, не доходящие до поверхности
пласта и содержащие относительно небольшое количество ци-
топлазмы. Количество базальных клеток и обусловленная их
делением интенсивность физиологической регенерации варьи-
руют в широких пределах в разных участках тела животных.
Деление клеток происходит у базальной мембраны (рис. 29, д').
Замещение дифференцированных клеток в опытах с 3Н-тими-
дином клетками с мечеными ядрами происходит через 10—
12 сут после начала опыта. Процесс дифференцировки клеток,
следовательно, довбльно продолжителен.
Дифференцированные клетки составляют основную часть
эпителиального пласта, их высота и количество определяют
толщину эпителия, которая также варьирует в разных участках
тела.
Ядра дифференцированных клеток располагаются в их средней части,
т. е. удалены от базальной мембраны, что и придает эпителию отчетливо
выраженный миогорядный характер. В морфофункциональном отношении
клетки эпителия голожаберных моллюсков делятся на две категории: же-
лезистые (белковые и слизистые) и призматические или кубические крою-
щие клетки. Последние могут иметь реснички, и эпителий приобретает ха-
рактер многорядного ресничного эпителия (рис. 29, б). В других участках
тела реснички у призматических клеток отсутствуют, а цитоплазма запол-
нена большим количеством ограниченных мембраной пузырьков и вакуолей
(рис. 29, а). В таких участках эпителий непосредственно соприкасается с гид-
роидными полипами — пищей моллюсков — и имеет, следовательно, четко
выраженный защитный характер.
Многорядный ресничный эпителий играет важную роль
в воздухоносных путях наземных позвоночных, обеспечивая
наряду с барьерной функцией очистку воздуха от твердых ча-
стиц, поступающих в респираторные отделы дыхательной
системы. Этот эпителий (рис. 29, в) по строению сходен с много-
рядным ресничным эпителием моллюсков. Наружная поверх-
ность эпителиального пласта образована плотно расположен-
ными апикальными концами дифференцированных элементов
двух типов: конусовидных ресничных и бокаловидных желези-
стых клеток. Синхронная работа ресничного аппарата обеспе-
чивает непрерывное перемещение слизи, выделяемой бокало-
видными клетками, с приставшими к ней инородными части-
цами в направлении, обратном движению поступающего из
внешней среды воздуха.
Нижняя половина пласта заполнена базальными и вста-
вочными клетками’, представляющими собой камбиальные
и дифференцирующиеся клеточные элементы. Особенностью это-
го эпителия у млекопитающих животных и человека является
относительно медленный темп физиологической регенерации.
116
Рис. 29. Многорядные эпителии.
а, б — кожный железистый (я) и ресничный (б) эпителий голожаберных моллюсков:
в — эпителий дыхательных путей млекопитающих; г — покровный эпителий немертнн;
д, е~ схемы физиологической регенерации кожных эпителиев голожаберных моллюс-
ков и дыхательных путей млекопитающих (д) и покровного эпителия немертин (е);
3 — дифференцированные клетки (/ — ресничные, 2 — железистые, <?--«защитные»},.
4 — базальные и 5 — малодифференцированные (вставочные) клетки, 6 — слизь.
117
Для многорядного эпителия, выстилающего воздухоносные пути,
характерно длительное существование дифференцированных
клеток и продолжительный митотический цикл базальных кам-
биальных клеток. Значительная часть последних находится,
по-видимому, в так называемой фазе покоя, вне обычного ми-
тотического цикла. Благодаря этому рассматриваемая ткане-
вая система обладает мощными пролиферативными потенция-
ми, которые отчетливо выявляются при репаративной регене-
рации.
В многорядных ресничных эпителиях млекопитающих спо-
собностью к синтезу ДНК и делению обладают не только ба-
зальные, но и вставочные клетки. При этом интенсивность
размножения последних выше, чем у базальных клеток. Та-
кая гетерогенность пролиферирующих клеток позволяет предпо-
ложить тенденцию к разделению камбиальной системы на две
субпопуляции: непосредственно производящую клетки для об-
новления дифференцированных элементов и резервную субпо-
пуляцию стволовых клеток, обеспечивающую периодическое
обновление «рабочего» камбия. Возможно, что такой принцип
организации камбиальной системы в многорядных эпителиях
свойствен и другим его разновидностям.
Большие пролиферативные потенции миогорядного призматического эпи-
телия млекопитающих обнаруживаются также при нарушении нормальных
взаимоотношений между размножением и дифференциацией клеток, что про-
исходит при его злокачественном перерождении. Злокачественные новообра-
зования, возникающие из эпителиальной выстилки воздухоносных путей
у человека, относятся к числу наиболее быстро растущих опухолей.
Несмотря на сходные с ресничными эпителиями низших многоклеточных
принципы организации эпителиального пласта и специфическую дифференци-
ровку образующих его клеток, ресничный эпителий позвоночных представ-
ляет вторичную в эволюции этих животных тканевую дифференцировку. Она
возникает на основе характерных для них многослойных кожных эпителиев.
При различного рода экстремальных воздействиях (пары формалина, меха-
нические повреждения, специфические гормональные воздействия) ресничный
эпителий обнаруживает отчетливо выраженную способность к превращению
в типичные многослойные пласты.
Кожные многорядные ресничные эпителии широко распро-
странены и у некоторых современных низших многоклеточных
животных. Они образуют покровы у высших турбеллярийине-
мертин. Их организация сходна с разобранной выше органи-
зацией многорядных эпителиев моллюсков и позвоночных жи-
вотных. У беломорской немертины Lineus rubrum эпителиаль-
ный пласт располагается на базальной мембране, отграничива-
ющей его от паренхимы. Это типичный многорядный эпителий
с хорошо выраженной системой базальных камбиалыйях
клеток и дифференцированными ресничными и железистыми
клетками (рис. 29, г). Особенность его заключается в том, что
митотические деления наблюдаются преимущественно на верх-
них уровнях эпителиального пласта. Подготовка к делению и,
118
в частности, синтез ДНК происходят в клетках, ядра которых
располагаются у базальной мембраны.
Таким образом, в миогорядном ресничном эпителии немертин и, по-ви-
димому, высших турбеллярий имеет место характерная для однослойных
эпителиев миграция клеток при прохождении ими митотического цикла.
Особенно наглядно такую миграцию удается проследить с помощью метода
тимидиновой авторадиографии. На ранних сроках после введения 3Н-тими-
дина меченые ядра располагаются в базальной части пласта. Затем в тече-
ние периода G2 клетки с мечеными ядрами перемещаются к апикальной по-
верхности пласта, где и образуются в результате деления две дочерние клет-
ки. Последние могут вступить в новый митотический цикл или дифферен-
цироваться в железистые или ресничные клетки. В обоих случаях дочерние
клетки вновь перемещаются к базальной мембране (рис. 29, е).
§ 2. Кутикулярные эпителии
Кутикулярные эпителии представляют собой наиболее ши-
роко распространенную у современных многоклеточных разно-
видность кожных эпителиев. Они имеются у оболочников, ан-
нелид, приапулид, моллюсков, членистоногих, нематод и дру-
гих типов животных.
Несмотря на большое разнообразие, всем им свойственны
три общих для любого кутикулярного эпителия принципа
структурно-химической организации. Во-первых, они построе-
ны из однослойного эпителия и выделяемого им внеклеточного
вещества — кутикулярной пластинки. Во-вторых, кутикулярная
пластинка состоит из фибриллярных структур и цементирую-
щего аморфного вещества — матрикса; наконец, третье общее
свойство кутикулярных эпителиев заключается в наличии
в них постоянного или временного контроля за внеклеточными
структурами со стороны образующих их клеток.
В зависимости от конкретной структурно-химической орга-
низации можно выделить три основных разновидности кутику-
лярных эпителиев: а) кутикулярные эпителии, в основе орга-
низации кутикулы которых лежат полисахаридно-белковые
фибриллярные структуры — артроподный тип; б) кутику-
лярные эпителии, основу кутикулы которых образует сеть кол-
лагеновых волокон, аннелидный тип; в) кутикулярные
эпителии с многослойной гетерогенной по своему составу ку-
тикулой — нематодный тип.
Кутикулярные эпителии с полисахаридно-белковой фибрил-
лярной основой (артроподный тип) построены на основе фиб-
рилл, состоящих из линейных молекул нейтральных полисаха-
ридов— хитина или целлюлозы — в комплексе с белками. В ка-
честве аморфного матрикса обычно используются кислые по-
лисахариды (гликозамингликаны), которые в ряде случаев,
например у наземных членистоногих, замещаются белками и ли-
пидами. В большинстве таких эпителиев вся кутикулярная
пластинка или ее наружные слои стабилизируются за счет об-
119
разования ковалентных связей между белковыми молекулами.
Такая стабилизация белково-полисахаридного материала обе-
спечивается или путем образования дисульфидных связей, или
путем фенольного задубливания (склеротизация).
Дисульфидные связи' возникают при взаимодействии (вос-
становлении) сульфгидрильных групп молекул цистеина, вхо-
дящих в состав соседних белковых цепей:
белок — SH+HS — белок —>белок — S—S — белок.
Сущность процессов склеротизации заключается в образо-
вании ковалентных связей между аминогруппами белковых мо-
лекул через бензольные кольца хинонов. Последние являются
продуктами окисления фенольных субстратов специальными
ферментами — фенолоксидазами:
он ОН
Хон Д/н
2 (белок-NHgJ + LI) фенолоксиВазд. белок - НН -1Д-НН - белел
Нередко дополнительная механическая прочность достигается
за счет б и о м и н е р а л из а ц и и: импрегнации кутикулярных
структур карбонатом или фосфатом кальция или соединениями
кремния, железа, цинка и других металлов.
Кутикулярные эпителии артроподного типа чрезвычайно
широко распространены у современных беспозвоночных. Они
имеются у некоторых кишечнополостных, в двух вариантах у
моллюсков, аннелид, приапулид и наибольшего развития дости-
гают у членистоногих и оболочников. Естественно, что у пред-
ставителей каждого типа животных этот эпителий характери-
зуется особенностями, связанными с независимым развитием
кутикулярных структур в каждом типе. Эти различия касают-
ся конкретного проявления общих особенностей организации
кутикулярных эпителиев. Например, у большинства беспозво-
ночных фибриллы построены на основе хитина, а у оболочни-
ков используется целлюлоза. Однако физико-химические свой-
ства целлюлозных и хитиновых волокон, механизмы их синте-
за, способы укладки, характер связи с белками и механизмы
стабилизации полисахаридно-белковых структур оказываются
сходными.
Для большинства кутикулярных эпителиев артроподного
типа характерен постоянный структурный и биохимический
контроль за внеклеточным веществом кутикулы, который осу-
ществляется эпителиальными клетками, а часто и специальны-
ми клетками тканей внутренней среды — граяг/лярнылш амебд-
цитами. Однако в перидерме гидроидных полипов, раковинной
железе моллюсков и щетинках полихет такой контроль либо
носит периодический характер, либо имеет место в момент
образования межклеточной структуры.
120
У членистоногих кутикулярный эпителий типичного артро-
подного типа достигает наибольшей сложности и многообра-
зия. Для представителей этого типа животных характерна и в
гистологическом, и в химическом отношениях сходная органи-
зация эпителия. Одинакова и его биологическая роль как на-
ружного скелета этих животных. Однако g пределах общего
плана строения значительно варьируют частные признаки ор-
ганизации у представителей отдельных классов, родов и даже
видов, в связи с особенностями среды обитания и степени
филогенетического родства. Большие различия в строении
кутикулярного эпителия наблюдаются и у одного орга-
низма.
Кутикула наземных членистоногих состоит из прокутику-
лы — основной части —• и покрывающей ее эпикутикулы
(рис. 30,а). Прокутикула имеет слоистое строение и образо-
вана главным образом хитином и белками, из которых форми-
руются сложные фибриллярные и пластинчатые структуры.
Хитина может быть в несколько раз меньше, чем белков (око-
ло 20%), или, наоборот, его содержание несколько превышает
количество белка (до 60%), хотя обычно встречаются пример-
но равные соотношения этих компонентов. В состав кутикулы
входят также гликопротеиды и липиды. Кроме того, в кутику-
ле водных членистоногих и гибкой межсегментной мембране
насекомых имеются кислые полисахариды. Прокутикула обыч-
но подразделяется на наружный более прочный слой — экзо-
кутикулу, и внутренний эластичный — эндокутикулу. Такое раз-
деление прокутикулы на слои обусловлено происходящей в ее
наружном слое стабилизацией полисахаридно-белкового мате-
риала. У большинства насекомых, хилопод, паукообразных
и высших ракообразных она обеспечивается фенольным задуб-
ливанием, у морских пауков — пантопод, низших насекомых,
и личинок двукрылых достигается путем образования дисуль-
фидных связей между белковыми молекулами. Дополнительная
механическая прочность кутикулы у многоножек, некоторых
насекомых и особенно высших раков обеспечивается включе-
нием в экзо- и эндокутикулу углекислого и фосфорнокислого
кальция. Особая механическая прочность режущего края
мандибул у насекомых, питающихся жесткой пищей, обус-
ловлена высоким содержанием в кутикуле цинка, образу-
ющего дополнительные связи между фенолами и бел-
ками.
В свою очередь, и экзокутикула может быть склеротизиро-
вана в разной степени. Слабо задубленная экзокутикула (экзо-
кутикула I), или «мезокутикула» эластична и способна связы-
вать гистологические красители. При дальнейшей склероти-
зации она утрачивает эластичность, становится химически
инертной и приобретает янтарно-желтый цвет (экзокутикула II).
Соотношение слоев прокутикулы значительно варьирует у раз-
121
Рис. 30. Кутикулярный эпителий членистоногих.
-а — кутикула насекомых (I — гиподерма, II — прокутикула, III — эпикутикула); б —
'соотношение слоев кутикулярной пластинки в разных участках тела и на разных
этапах склеротизации (/ — эпителиальные клетки гиподермы, 2— эндокутикула, 3 &-
экзокутикула I, 4— экзокутикула JJ, 5 ~ базальная мембрана, 6 — эноцит, / — одно-
клеточная гиподермальная железа, 8 — цитоплазматические отростки (микровор-
синки), 9 — протоки гиподермальных желез, 10— чувствительные волоски); в —эпику-
тикула насекомых (/ — экзокутикула, 2 — белковая (внутренняя) эпикутикула, 3 —
кутикулиновая пластинка, 4— восковой слой, 5 — цементный слой, 6 — поверхностные
липиды, 7 — цитоплазматический отросток в поровом канале, 8 — восковые канальцы).
.122
ных видов, в разных участках покровов одного животного и на
разных стадиях формирования кутикулы. Например, синтези-
руемая во время линьки прокутикула состоит из эндокутику-
лы. Такое строение сохраняют после линьки и покровы некото-
рых водных личинок насекомых (рис. 30,6). Напротив, в уча-
стках покровов, несущих максимальную механическую нагруз-
ку,— элитрах и мандибулах,—вся кутикулярная пластинка мо-
жет быть представлена высоко склеротизированной экзокути-
кулой II (рис. '30, б).
У большинства современных членистоногих имеются весьма
совершенные структурные механизмы взаимодействия внекле-
точного вещества кутикулы и цитоплазмы клеток покровного
эпителия — гиподермы. Прокутикула содержит так называемые
поровые каналы, в которые заходят отростки эпителиальных
клеток — микроворсинки (рис. 30,а). Эти каналы пронизыва-
ют всю толщу прокутикулы и обычно заканчиваются на гра-
нице с эпйкутикулой системой восковых канальцев. Количест-
во несущих клеточные отростки поровых каналов особенно ве-
лико в кутикуле насекомых и может достигать одного миллиона
на квадратный миллиметр.
Эволюционная пластичность кутикулярных эпителиев чле-
нистоногих наиболее ярко проявилась при формировании верх-
него слоя кутикулы — эпикутикулы. Несмотря на незначитель-
ную толщину (0,5—2,0 мкм), этот слой выполняет исключи-
тельно важную функцию. Именно он делает возможным
обитание членистоногих в воздушной среде, предохраняя ткани
животного от пересыхания. При электронно-микроскопических
исследованиях в эпикутикуле насекомых выявлены 4 основных
слоя: цементный, восковой, кутикулиновая пластинка и внут-
ренний, наиболее толстый — белковый (рис. 30, в ). Особенно-
стью химического состава эпикутикулы является отсутствие
хитина. Ее вещество представлено главным образом липидами
и липопротеиновыми комплексами, которые осуществляют
барьерную функцию. Внутренний белковый слой и кутикули-
новая пластинка формируются клетками гиподермы во время
линьки. Цементный слой эпикутикулы образуется за счет сек-
реторной деятельности клеток специальных цементных желез.
Липиды проникают в эпикутикулу через систему специальных
восковых канальцев, связанных с поровыми каналами проку-
тикулы (рис. 30, в). Имеются веские основания предполагать,
что за счет непрерывного поступления липидов над кутикули-
новой пластинкой формируется динамичный, постоянно обнов-
ляющийся липопротеиновый восковой слой. Предполагается,
что он играет основную роль в способности эпикутику-
лы предохранять ткани от пересыхания. Кроме того, на
поверхность эпикутикулы выделяются липидные вещества
(рис. 30, е), которые, особенно у пустынных насекомых, также
123
участвуют в предотвращении диффузии воды из орга-
низма.*
Эпикутикула характерна для всех представителей членисто-
ногих, ведущих наземный образ жизни. Однако ее химический
состав и структура отличаются у отдельных классов членисто-
ногих рядом существенных особенностей. Так, например, у скор-
пионов в эпикутикуле используются иные, чем у насекомых,
липиды, а у пауков отсутствует кутикулиновая пластинка. Тем
не менее и по своей биологической роли, и по структурной ор-
ганизации эпикутикула, несомненно, единое новообразование
в типе членистоногих, позволившее им расселиться в воздуш-
ной среде.
Как показывают палеонтологические данные, выход на су-
шу происходил независимо в разных классах членистоногих,
и, следовательно, у них водонепроницаемая эпикутикула воз-
никла в кожных покровах независимо — как проявление сход-
ных потенций кутикулярных эпителиев общих предков.
Особенно наглядно эволюционная пластичность кутикулярных эпителиев
выступает у насекомых, где известны виды, вторично переходившие из воз-
душной среды к водному образу жизни и снова возвращавшиеся к обита-
нию в воздушной среде. Для представителей этих видов насекомых установ-
лено, что переход к водному обр'азу жизни связан с утратой эпикутикулы
и, наоборот,, возвращение в воздушную среду —с ее вторичным новообразо-
ванием.** Подобные изменения в строении кутикулы наблюдаются и в ходе
развития у одного из видов тропических насекомых. На стадиях развития,
приходящихся па засушливый период, у них имеется хорошо развитая ти-
пичная эпикутикула, в период муссонов она отсутствует.
Существенные отклонения от общего плана строения кутикулярных эпи-
телиев наблюдаются лишь у отдельных групп членистоногих.. В качестве
примера можно привести относительно небольшую группу тихоходок, кож-
ные покровы которых хорошо изучены в последнее время, в связи с повы-
шенной способностью этих животных к криобиозу.
В прокутикуле тихоходок ие обнаружено поровых каналов. На поверх-
ности эпикутикулы отсутствует .цементный слой, но имеется слой слизи пз
кислых мукополисахаридов. Эпикутикула представлена кутикулиновой плас-
тинкой и белковым слоем. Между пего и прокутикулой лежит особый про-
межуточный слой и слой воска. Внутренняя часть промежуточного слоя со-
стоит из липопротеидов, а наружная — из тонких слоев склеротизированиого
белка.
Естественно, что сложная организация кутикулы у члени-
стоногих связана с высоким уровнем дифференцировки обра-
зующих ее клеток, которые составляют основную часть кле-
точных элементов однослойного кутикулярного эпителия
* В литературе имеются данные о том, что липопротеийовый (восковой)
слой эпикутикулы образуется в основном специальными восковыми желе-
зами. *
** Наряду с этими данными по эволюционной пластичности эпикутикулы
у насекомых, у многих ракообразных, ведущих водный образ жизни, на
поверхности прокутикулы обнаружены структуры, сходные с нижними сло-
ями эпикутикулы (кутикулиновая пластинка).
124
(рис. 30,а). Помимо них в составе эпителиального пласта име-
ются и железистые клетки, формирующие у наземных члени-
стоногих, и в первую очередь у насекомых, особые интраэпите-
лиальные железы. Их секрет идет на построение цементного,
а возможно и воскового слоев эпикутикулы. Эти железы обра-
зованы полиплоидными секреторными клетками. Кроме того, как
и у высших позвоночных, для кожных покровов насекомых ха-
рактерно формирование более крупных железистых образова-
ний, выполняющих специальные функции (железы, синтезиру-
ющие феромоны, «молочные» железы тлей и др.).
У многих насекомых в составе эпителиального пласта име-
ются особые крупные полиплоидные клетки — эноциты. Их
функциональное значение остается недостаточно ясным. Име-
ются данные об участии этих клеток в синтезе структурных
липидов кутикулиновой пластинки. В составе эпителия многих
насекомых обнаружены так называемые мочевые клетки, пред-
ставляющие собой своеобразные почки накопления продуктов
белкового обмена. У личинок некоторых водных насекомых
описаны клетки, регулирующие солевой обмен. По своей функ-
ции и структурно-химической организации они аналогичны со-
левым клеткам позвоночных (см. ниже стр. 179).
В составе кутикулярного эпителия у многих насекомых, наряду с диф-
ференцированными в различных направлениях клеточными элементами, об-
наружен запас диффузно распределенных камбиальных клеток. Показано
также, что перед началом лииьки может иметь место вспышка пролифера-
тивной активности, сменяемой дегенерацией части клеток. Таким своеобраз-
ным, путем происходит здесь и обновление клеточного состава популяций,
и регуляция ее численности в разные периоды функциональной активности
ткани. Для кутикулярных эпителиев насекомых характерна жесткая детер-
минация всех протекающих в системе процессов. Она проявляется не только
в сложной гетеросинтетической аткивности клеток, но и захватывает про-
цессы репродукции. Широкое распространение имеют здесь так называемые
дифференцирующие митозы, в результате которых образуются две неравно-
ценные по своим потенциям дочерние клетки. Такие митозы лежат в ос-
нове формирования железистых образований и разнообразных вспомогатель-
ных структур многочисленных рецепторных аппаратов. Очень часто диффе-
ренцирующие митозы сменяются процессами эндорепродукции, имеющими
широкое распространение у насекомых при развитии железистых и рецеп-
торных структур.
Особенно ярко системный и организменный контроль диф-
ференцировки и функциональной активности клеток кутикуляр-
ного эпителия проявляется в процессах линьки (рис.31).Под
воздействием гормона линьки экдизона в клетках кожного эпи-
телия развертывается цепь последовательных процессов, конеч-
ный результат которых — замена старой кутикулы новой. Акти-
визации гетеросинтетических процессов в клетках часто пред-
шествует период их усиленной пролиферации. Увеличение
количества клеток приводит к изменению их формы: они стано-
вятся кубическими или даже высокопризматическими. Первым
•синтезируемым соединением является мелкий так называемый
125
Рис. 31. Схема процессов, происходящих при линьке в кутикулярном эпителии насекомых на ультраструктурном (слева)
и тканевом (справа) уровнях организации.
а — кутикулярный эпителий в предлиночпый период; С—ci — стадии линьки (б — формирование пылевидного секрета, в — выделения гру-
бозернистого секрета в неактивной форме, г — активизация Тидролптических' ферментов, в — образование кутикулиновой пластинки). '
«г
пылевидный секрет, оттесняющий апикальную поверхность
клеток от внутреннего слоя эндокутикулы. В образующееся
пространство выделяются секреторные продукты второго типа,
так называемый грубозернистый секрет, состоящий из комп-
лекса гидролитических ферментов. Последние существуют вна-
чале в неактивной форме благодаря, по-видимому, своеобраз-
ной конфигурации белковых молекул. Вскоре после начала
образования грубозернистого секрета происходит разрушение
цитоплазматических отростков, а на поверхности плазматиче-
ской мембраны начинает выделяться липопротеидный кутику-
линовый слой — внутренняя часть новой эпикутикулы. По мере
образования кутикулиновой пластинки выделенный ранее гру-
бозернистый секрет переходит в активную форму, и начинается
интенсивное растворение старой кутикулы. Образующиеся в ре-
зультате гидролиза старого хитина и белков низкомолекуляр-
ные продукты всасываются гиподермальными клетками и ис-
пользуются организмом на образование новых белков и хити-
на. На следующих этапах линьки эпителиальные клетки
последовательно выделяют вещества для формирования внут-
реннего белкового слоя эпикутикулы и хитино-белкового мате-
риала прокутикулы. В авторадиографических опытах с исполь-
зованием 3Н-глюкозы выявлено аппозиционное отложение ме-
ченого хитина на поверхности эпителиальных клеток. При
использовании в качестве предшественников меченых амино-
кислот четкой картины послойного образования белковых ком-
понентов прокутикулы обнаружить не удалось.
Образование хитиновых фибрилл подобно образованию цел-
люлозных фибрилл в клеточных стенках растений происходит
и при помощи мультиэнзимных комплексов хитинсинтетазы
плазматической мембраны клеток. Большую роль в сложной
функциональной деятельности гиподермальных клеток (всасы-
вание продуктов разрушения старой кутикулы и выделение
вновь синтезированных продуктов) играют цитоплазматические
отростки. Их, образование начинается с момента выделения
клетками первых слоев экзокутикулы. На завершающих этапах
формирования новой кутикулы в верхние слои прокутикулы
при помощи клеточных отростков выделяются фенольные про-
дукты и фенолоксидаза. Этот фермент запускает процессы фе-
нольного задубливания, которые начинаются в белковом слое
эпикутикулы и затем распространяются в глубь кутикулярной
пластинки. В результате склеротизации прокутикула подраз-
деляется на экзо- и эндокутикулу, т. е. приобретает дефинитив-
ную структуру. Морфологически это проявляется в утрате
верхними участками прокутикулы первичной слоистой структу-
ры. К моменту завершения всех вышеописанных процессов
активизируется секреторная деятельность желез. Продукты их
выделения завершают формирование эпикутикулы, образуя ее
верхние слои, одновременно происходит образование структур-
128
ных липидов. Они выделяются отростками клеток кутикуляр-
ного эпителия и попадают в верхние слои эпикутикулы через
систему поровых каналов и специальных канальцев кутикуляр-
ной пластинки.
Детали изменений в ходе линьки в метаболическом аппарате продуциру-
ющих кутикулу клеток эпителия у представителей разных видов насекомых
и других членистоногих могут широко варьировать. Однако суть процесса
одинакова во всем типе членистоногих. В период линьки в клетках кутику-
лярного эпителия происходит последовательная активация разных синтетиче-
ских процессов. Помимо всасывающей и гетерогенной синтетической деятель-
ности, в клетках кутикулярного эпителия резко активизируются системы,
обеспечивающие поступление из гемолимфы ряда высокомолекулярных со-
единений и фенольного субстрата, необходимых для построения кутикулы.
В связи с этим для многих насекомых характерно образование складок
плазматической мембраны иа базальной поверхности клеток и увеличение
количества митохондрий в этой области. Весьма дифференцирован в этих
клетках аппарат Гольджи, отдельные комплексы которого распределены
в разных участках клетки (базальной, центральной и апикальной) и выпол-
няют, по-видимому, различные функции.
Основную часть значительного по толщине кутикулярного
эпителия асцидий составляет мощно развитая кутикула —• ту-
ника. Образующий ее эпителий состоит из одного слоя клеток
без клеточных отростков. В клетках эпителия удается выявить
умеренно развитую эндоплазматическую сеть, многочисленные
комплексы Гольджи и много митохондрий. В клетках постоян-
но идут синтетические, процессы и особенно интенсивно синтез
полисахаридов.
Кутикулярная пластинка асцидий состоит из толстого внут-
реннего слоя — эндокутикулы и относительно тонкого наруж-
ного— экзокутикулы (рис. 33, а). Эндокутикула построена из
целлюлозных волокон в комплексе с белками, погруженных
в амофный матрикс из сульфатированных гликозамингликанов.
Наружный слой туники — экзокутикула—-состоит из склероти-
зированных белков. На вершине шипов он представлен сильно
задубленной экзокутикулой. Полисахаридные структуры синте-
зируются эпителиальными клетками и отлагаются аппозицион-
ным путем. При этом волокна целлюлозы формируются, веро-
ятно, как у насекомых и растений, ферментами, вмонтирован-
ными в плазматическую мембрану. Кроме того, эпителиальные
клетки секретируют сульфатированные гликозамингликаны
матрикса и часть белкового материала эндокутикулы. В местах
наиболее интенсивного синтеза туники обнаружен и другой
способ выведения межклеточного вещества — макроапок-
риновой секреции (рис. 33, б).
Как отмечалось выше, у членистоногих вещества, необходи-
мые для фенольного задубливания, поступают в кутикулу из ге-
молимфы, по микроворсинкам эпителиальных клеток. У асцидий
синтез и транспортировка этих веществ осуществляется моруляр-
ными клетками крови. При дифференцировке в гранулах этих
5 672
129
Рис. 32. Кутикулярный эпителий приапулиды Priapulus caudatus в период,
предшествующий линьке. ‘
а— участок эпителия в области туловища; б, в — автографы аналогичных участков
через 3,5 (б) и 24 (в) ч после инкубации животных в растворе 3Н-гЛицина, г — через
10 сут после инъекции животным 3Н-глюкозы. / — однослойный кубический эпителий,
2 — новая кутикула, 3 — старая кутикула, 4 — хитияо-мукопротеидная эндокутикула.*
5—протеидная экзокутикула.
амебоцитов накапливаются фенолы, фенолоксидаза и мономер-
ный белок с высоким содержанием свободных аминогрупп.
Зрелые гранулярные амебоциты активно мигрируют в кутику-
лярную пластинку. Часть клеток выделяет содержимое гранул
в эндокутикуле, образуя сеть белковых волокон, другие — до-
страивают экзокутикулу, целиком трансформируясь в материал
наружного слоя — задубленные фенолами белки. Последний
процесс можно рассматривать как своеобразную голокриновую
секрецию. Такое образование защитного белкового слоя за счет
массового разрушения морулярных клеток происходит и при
повреждении кутикулы как первый этап ее репарации.
Следовательно, у асцидий наблюдаются весьма своеобразные взаимо-
отношения между кутикулярным эпителием и гранулярными амебоцитами
крови, которые, одиакО, не уникальны. Например, состоящая из хитина
130
и белков кутикула (перисарк) гидроидных полипов также подвергается
склеротизации при помощи особых гранулярных амебоцитов. Последние
дифференцируются в эндодерме, накапливая в своих гранулах фенольный
субстрат, феиолоксидазу и белки. Зрелые клетки мигрируют в эктодерму
и скапливаются в зонах активной секреции кутикулы. Здесь, выделяя ма-
териал гранул на поверхность эпителия, они осуществляют задубливаипе
перисарка. Еще одна особенность кутикулярного эпителия асцидий заклю-
чается в том, что у некоторых видов он служит основой для создания вы-
сокоинтегрированных колоний. В таких колониях все зооиды погружены
в общую мощно развитую тунику, которая становится своеобразной наруж-
ной «тканью внутренней среды», обеспечивая ие только механическую, но
и химическую связь отдельных особей, в том числе диффузию питательных
веществ для развивающихся зооидов.
У приапулид покровный эпителий образован одним слоем
клеток призматической, кубической или уплощенной формы,
синтезирующих вещества кутикулы, которая, как у членистоно-
гих и асцидий, подразделяется на два основных слоя: экзо-
и эндокутикулу (рис. 33, г). Обычно более толстая фибрил-
лярная эндокутикула состоит из хитина, незначительного коли-
чества белков и сульфатированных полисахаридов. Тонкая
оксифильная экзокутикула целиком образована задубленными
белками. Соотношение двух слоев кутикулы приапулид варьи-
рует в разных отделах тела животных. Так, кутикула, покры-
вающая различные железистые и чувствительные органы, об-
разована в основном экзокутикулой. Своеобразную модифика-
цию кутикулярного эпителия приапулид представляют собой
участки, несущие большую механическую нагрузку,— например
так называемые «зубы», покрывающие поверхность подвижной
глотки этих животных. Эпителий «зуба» образован сильно вы-
тянутыми призматическими клетками, выделяющими мощную
кутикулу в виде заостренных шипов (рис. 33, в). Экзокутикула
на вершине шипа подвергается дополнительному фенольному
дублению, в результате которого она перестает окрашиваться
гистологическими красителями и становится сходной с экзоку-
тикулой II членистоногих и асцидий.
Кутикула приапулид представляет собой структуру, под-
верженную периодическому обновлению—линькам. Интенсив-
ность синтетической деятельности клеток эпителия повышается
в период, непосредственно предшествующий линьке, когда под
старой кутикулой образуется новая (рис. 33, д), и сразу после
сбрасывания старой кутикулы.
С помощью электронно-микроскопических исследований -
и метаболической авторадиографии установлен сложный меха-
низм формирования кутикулярной пластинки во время линьки
(рис. 32,а—а). Показано, что в клетках предлиночного эпите-
лия синтезируются по крайней мере два типа секрета: грану-
лярный и фибриллярный. При этом вначале синтезируется бел-
ковый гранулярный секрет, из которого начинает строиться на-
ружный слой кутикулы — экзокутикула. Затем происходит
5*
13Е
образование фибриллярного секрета, который выделяется под
новую экзокутикулу и формирует внутренний слой — эндоку-
тикулу, Эпителиальные клетки в это время продолжают синте-
зировать и гранулярный секрет, т. е. на протяжении всего пе-
риода формирования новой кутикулы, как показано в автора-
диографических опытах, продолжается хотя и с меньшей
Рис. 33. Кутикулярный эпителий асцидий и приапулид.
я, б- схемы строения кутикулы (туники) (а) и апокриновой секреции материала эндо-
кутикулы (б) асцидий; в — глоточный «зуб» приапулид; г, д — кутикула приапулид до
(а) и во время линьки (д). 1 — покровный эпителий, 2 — эидокутикула, 3 — экзокути-
кула I, 4— экзокутикула 11, 5 — морулярные клетки.
интенсивностью достройка новой экзокутикулы за счет диффу-
зии белков через формирующуюся эндокутикулу. Возможно,
вместе с белками в экзокутикулу диффундируют также пред-
шественники фенольного дубления. Таким образом, при фор-
мировании новой кутикулы имеют место два механизма ее
роста: обычный аппозиционный, от поверхности эпителиаль-
А32
ных клеток, и диффузионный механизм достройки, связанный
с перемещением выделяемых клетками соединений через обра-
зующуюся кутикулу в ее верхние слои (рис. 32, б—г).
Своеобразную разновидность кутикулярных эпителиев арт-
роподного типа представляют щетинки кольчатых червей.
Основными химическими компонентами щетинки являются хи-
тин и белки. Хитино-белковый комплекс щетинок стабилизи-
Рис. 34. Строение щетииконосных мешка (а) и фолликула (б) полихет.
Зоны: щетинконосного мешка: I — пролиферации, II — роста щетииконосных фолликулов,
III — функционирующих щетинок, IV — дегенерации; / — покровный эпителий, 2 — ку-
тикула, 3 — одноклеточные железы, 4— базальные клетки (хетобласты), 5 — микровор-
синки хетобласта, 6 — латеральные клетки, 7 — щетинки, 8, 9 — центральная часть (8)
и корковое вещество (9) щетинки.
руется путем фенольного дубления и импрегнации соединения-
ми железа. Основания щетинок у полихет погружены в толщу
стенки тела в области параподий, где кутикулярный эпителий
образует глубокие впячивания — так называемые щетинконос-
ные мешки (рис. 34,а). Основными клеточными элементами
щетинконосных мешков являются базальные клетки — хето-
бласты— и латеральные клетки (рис. 34,6). Каждая щетинка
формируется одним хетобластом и несколькими латеральными
клетками. Хетобласт отличается большими размерами, и на его
133
апикальной поверхности имеется система длинных мнкроворси-
нок, в плазматическую мембрану которых встроены молекулы
фермента хитинсинтетазы. В области каждой микроворсинки
происходит интенсивное выделение хитино-протеиновых фиб-
риллярных комплексов. Из них формируются трубчатые струк-
туры, составляющие основу щетинки. Совокупность трубчатых
структур спаяна аморфным матриксом, который выделяется
и базальной, и латеральными клетками. Хетобласты секретиру-
ют и фенолоксидазу, тогда как фенольный субстрат, по-види-
мому, выделяется латеральными клетками. Латеральные
клетки продуцируют также поверхностные слои щетинки, кото-
рые и в структурном и в химическом отношении отличаются
от ее основной части.
В разных щетинках удельное значение синтетической дея-
тельности хетобластов и латеральных клеток, по-видимому,
варьирует. Основные щетинки (ацикулы) формируются глав-
ным образом базальными клетками. При образовании вспомо-
гательных мелких щетинок существенная роль принадлежит
синтетической деятельности латеральных клеток.
В сформированной щетинке базальная клетка дегенерирует.
Щетинки у многих животных функционируют относительно не-
долго и заменяются новыми, непрерывно формирующимися
в каждом щетинконосном мешке. В опытах с 3Н-тимидином
показано, что щетинконосный мешок представляет собой весь-
ма динамичную поляризованную систему, где процессы репро-
дукции, последовательные этапы специфической дифференци-
ровки и гибели клеток топографически строго разграничены
(рис. 34, а).
Щетинки возникали в эволюции, по-видимому, неоднократ-
но. Они и подобные им образования обнаружены у погонофор,
брахиопод и даже головоногих моллюсков.
Сложным в гистологическом и цитологическом планах примером кутику-
лярных эпителиев артроподиого типа является эпителий брюхоногих мол-
люсков, который выстилает передние отделы пищеварительного тракта
и формирует радулярный аппарат.
Кутикулярный эпителий ротовой полости — гетерогенная по внешнему
виду пограничная ткань. На внутренней стороне челюстей у голожаберных
моллюсков он представлен плоскими клетками, покрытыми толстой склеро-
тпзированной кутикулой. На наружной стороне челюстей имеется слой вы-
соко призматических клеток, выделяющих эластичную менее склеротизиро-
ванную кутикулу. Методом авторадиографии показано, что эта кутикула
непрерывно обновляется путем выделения на апикальной, поверхности эпи-
телиальных клеток новых слоев неклеточного вещества. Органическую осно-
ву кутикулы, независимо от ее топографических различий, составляют хи-
тино-протеиновые фибриллы и пластинки, погруженные в гликопротеиновый
матрикс.
Наибольшей сложности организации достигает эпителий радулярного
аппарата (рис. 35, а). Его основу составляют две популяции малодифферен-
цироваиных клеток, разделенные крупными полиплоидными клетками. Все
они располагаются в основании глубокой складки покровов — радулярном
мешке, из которого происходит рост и обновление радулярного аппарата.
134
Размножающиеся малодифференцированные клетки обновляют две разно-
видности ' вспомогательного радулярного эпителия — «верхний» (по отноше-
нию к формирующейся радуле) и «нижний» эпителиальные пласты. Пред-
полагается, что часть малодифференцированных клеток может идти по пути
полиплоидизации и обеспечивать обновление полиплоидных клеток.
Радула — это кутикулярная пластинка, верхняя часть которой образует
радулярные зубчики (рис. 35, а). Главную роль в ее формировании играют
полиплоидные клетки — «одонтобласты». Они несут на своей поверхности
__ Рис. 35. Кутикулярный эпителий моллюсков.
а — организация радулярного аппарата брюхоногих моллюсков: / — базальные клетки
(одонтобласты), 2— камбиальные зоны, 3— «нижиий» радулярный эпителий, 4— «верх-
ний» радулярный эпителий, 5 — кутикулярный эпителий верхней губы, 6 — базальная
пластинка радулы (эидокутикула), 7 — формирующийся радулярный зубчик, 8, 9 —
молодые (экзокутикула I) (8) и зрелые (9) (экзокутикула II) радулярные зубчики,
б — схема строения раковины двустворчатых моллюсков: /, 2— наружный эпителий
(/) (секреция эндокутикулы и ее биоминерализация) и внутренний ресничный эпите-
лий (2) мантии; 3— эпителий мантийной складки (секреция периостракума); 4 — пе-
риостракум (экзокутикула); 5, 6 — приематический (5) и перламутровый (6) слои (эндо-
кутикула).
135
мощно развитый аппарат мпкроворсинок и выделяют хитино-белковые фиб-
риллярные структуры, составляющие основу радулы. Форма зубчиков опре-
деляется, по-видимому, координированной деятельностью полиплоидных
клеток и «верхнего» эпителия. Радулярная пластинка постоянно смещается
в краниальном направлении вместе с подстилающим ее «нижним» эпите-
лием. Смещение обусловлено постоянным обновлением клеток «нижнего»
и «верхнего» эпителиев за счет пролиферации малодифференцированных
клеток радулярного мешка. По мере передвижения радулы происходит
окончательная «достройка» зубчиков в основном за счет синтетической дея-
тельности клеток «верхнего» радулярного эпителия. Последние выделяют
дополнительные органические компоненты и осуществляют фенольное задуб-
лнвание и биоминерализацию вещества зубчиков. В результате этих про-
цессов кутикулярная пластинка подразделяется на базальную часть — эндо-
кутикулу — н радулярные зубчики, целиком образованные прочной экзоку-
тикулой (рис. 35, а).
Минерализация радулы представляет собой активный биологический
процесс. Необходимые для этого минералы (соли кальция, кремний, магне-
тит) накапливаются в клетках «верхнего» эпителия и выделяются ими
в органический матрикс зубчика. В поверхностных слоях зубчиков содержа-
ние железа может .достигать 60% от сухого веса. Образование призматиче-
ских органических структур в толще органического матрикса сходно с про-
цессами образования призм эмали в зубе позвоночных.
Эпителий, формирующий раковину у пластинчатожаберных и брюхоно-
гих моллюсков, представляет собой еще одну сложную модификацию кути-
кулярного эпителия артроподного типа с преобладанием здесь процессов
биомииерализации (рис. 35,6). Наружный слой раковины — периостракум,
состоящий из склеротизированиых белков, формируется мантийной складкой.
Остальной эпителий мантии секретирует органическую основу внутренних
слоев раковины (хитин, белки и мукополисахариды) и осуществляет ее ми-
нерализацию. Некоторые общие закономерности этих процессов у многокле-
точных животных мы рассмотрим на примере минерализации межклеточных
структур в тканях внутренней среды (стр. 221).
Кутикулярные эпителии аннелидного типа характеризуются
наличием в кутикуле большего или меньшего количества сло-
ев коллагеновых волокон. В соседних слоях волокна распо-
лагаются под углом в 90°. Образующие волокна коллагеновые
фибриллы существенно отличаются от соединительнотканного
коллагена и не имеют характерной для него поперечной исчер-
ченности (см. ниже стр. 190). Над слоями коллагеновых воло-
кон и в промежутках между ними располагаются аморфный
и фиброзный матриксы, образованные мукополисахаридами
и неколлагеновыми белками (рис. 36). У аннелид слой колла-
геновых волокон в кутикуле пронизан длинными микроворсин-
ками, которые, образуя на концах характерные булавовидные
расширения, выходят на поверхность кутикулы (рис. 36, а).
Они могут отшнуровываться и формировать на поверхности
кутикулы слой сферосом — округлых телец, ограниченных
плазматической мембраной.
Непосредственный контакт апикальных концов микровор-
синок с наружной средой связывают с широко распространен-
ным у кольчатых червей вспомогательным поглощением орга-
нических веществ за счет их поступления через кожные покро-
вы. Наличие такого питания было показано в опытах с мече-
136
ними- предшественниками. Анализ формирования кутикулы
в онтогенезе и при регенерации показал, что вначале образу-
ется поверхностный фиброзный мукополисахаридный матрикс.
Его образование является необходимым условием для полиме-
ризации предшественников коллагеновых волокон внутренних
слоев, кутикулы. Эти предшественники выделяются клетками
путем мерокриновой секреции.
Рис. 36. Кутикулярный эпителий аннелидного типа.
а — аннелид и погонофор, б — сипункулид, в — волосатиков, г —личинок полихет,
д — архианнелид и лобатоцеребрид, е — турбеллярий, 1 — эпителиальные клетки, 2 —
микроворсинки эпителиальных клеток, 3 — коллагеновые волокна, 4— гликопротеидный
матрикс, 5 — наружный слой кутикулы, 6 — сферические тельца, 7 — гликокаликс.
Несмотря на большое разнообразие-кольчатых червей, об-
щий план организации кутикулярных эпителиев оказывается
сходным у подавляющего большинства их представителей. Спе-
цифические особенности, наблюдаемые в строении кутикуляр-
ного эпителия различных представителей полихет, олигохет
и пиявок, касаются в основном количественных показателей
(число слоев коллагеновых волокон, соотношение толщины по-
137
верхностной и основной частей кутикулярного эпителия, соот-
ношение количества железистых и призматических клеток
и т. д.).
Относительно мало известно в настоящее время о процес-
сах физиологической регенерации в кутикулярных эпителиях
аннелид. Предварительные данные показывают, что у такой
широко распространенной полихеты, как пескожил (Arenicola
marina), в эпителии наружных покровов и обонятельной ямки
удается обнаружить недифференцированные участки эпители-
ального пласта. Здесь часто наблюдаются митозы; после инъ-
екции 3Н-тимидина значительная часть клеток содержит мече-
ные ядра. Эти факты свидетельствуют о том, что у некоторых
полихет в кожных эпителиях постоянно обновляются их диф-
ференцированные, функционирующие клеточные элементы.
Значительный интерес представляет и система базальных
клеток в кутикулярных эпителиях некоторых олигохет и, в част-
ности, у дождевого червя. Изучение репаративной регенерации
кожных покровов у этих животных показало некоторую авто-
номность пролиферативных процессов в этой клеточной систе-
ме. Возможно, что она аналогична системе базальных клеток
в кишечных эпителиях некоторых полихет. Однако этот вопрос
требует еще специальных исследований.
Кутикулярные эпителии аниелидиого типа помимо кольчатых червей
имеются у погонофор, сипункулид и волосатиков. У. последних двух групп
животных они отличаются от обычного плана строения меньшим развитием
(сипункулиды) или даже отсутствием (волосатики) аппарата микроворси-
нок (рис. 36, б, в).
Кутикулярные эпителии аннелидного типа неоднократно и независимо воз-
никали в эволюции, хотя и обнаруживают у современных представителей
разных типов большое сходство в своей структурно-химической организации.
У низших полихет, мелких форм, а также на ранних стадиях развития
полихет кутикулярная пластинка не содержит крупных волокон и образова-
на тонкими беспорядочно ориентированными коллагеновыми фибриллами,
заключенными в мукопротеидный матрикс (рис. 36, г). Предполагается, что
подобное строение является первичным, исходным в развитии рассматривае-
мой разновидности кутикулярных эпителиев. Существует мнение, что аниелид-
ная кутикула могла возникать на основе гипертрофии гликокаликса на по-
верхности микроворсииок эпителиальных клеток (рис. 36, е), В настоящее
время действительно известны примеры кутикул промежуточного типа (у низ-
ших полихет, лобатоцеребрид и иглокожих), представленные тонкой фиб-
розной мукопротеидной пластинкой (рис. 36,5).
Кутикулярные эпителии нематодного типа — одна из наибо-
лее сложных по своей организации покровных структур бес-
позвоночных. Они выполняют как опорную, так и совершенную
барьерную функции, что позволяет нематодам осваивать самые1''
разнообразные экологические ниши.
Покровный эпителий — гиподерма — у большинства нематод
синцитиального строения. Несмотря на значительные видовые
вариации, кутикула этих животных имеет принципиально еди-
138
ный план организации (рис. 37, а). На поверхности кутикулы
расположен тонкий (6—30 нм) осмиофильный слой, который,
как и у насекомых, носит название эпикутикулы. Под ним рас-
полагаются последовательно три сравнительно толстых зоны
кутикулярной пластинки: кортикальная, промежуточная и ба-
зальная. Строение этих зон варьирует у разных видов. Так,
у некоторых мелких нематод промежуточный слой отсутствует.
У других животных он имеет фибриллярное строение или со-
держит обширные полости. Наконец, у крупных паразитических
Рис. 37. Кутикулярный эпителий нематод.
<з — принципиальная схема организации, б — кутикулярный эпителий аскариды. / —
цитоплазма гиподермы, 2 — ядросодержащая часть, 3 — базальная мембрана, -^ — ба-
зальный слой кутикулы, 5 — промежуточный слой, 6 — кортикальный слой, / — зпнку-
тикула, 8 — полости в промежуточном слое.
нематод, например у аскарид, достигается максимальное услож-
нение кутикулярной пластинки за счет подразделения каждой
зоны на несколько слоев (рис. 37, б).
Основным структурным компонентом кутикулы нематод яв-
ляются коллагеновые волокна. Эти волокна, как и в кутику-
лярных эпителиях аннелидного типа, лишены поперечной ис-
черченности. По своему аминокислотному составу они близки
коллагенам соединительной ткани позвоночных животных
н кутикулам аннелид, но резко отличаются от них высоким со-
держанием цистеина. В этом отношении коллаген кутикулы
нематод оказывается сходным с проколлагенами и коллагеном
IV типа, образующим базальные мембраны у позвоночных
139
животных. Сходство усиливается тем, что в обоих случаях мо-
лекулы коллагена связаны между собой дисульфидными мос-
тиками. Из коллагена построены базальный и промежуточный
слои кутикулярной пластинки. В промежуточном слое колла-
геновые волокна обычно не имеют строгой ориентации. В ба-
зальном слое они объединены в пластинки, окруженные осмио-
фильным матриксом. Пластинки расположены строго упо-
рядочено в два или несколько, как у аскариды, слоев
и ориентированы таким образом, что в соседних слоях волокна
коллагена лежат под углом 135°.
Кортикальный слой кутикулы нематод представлен амор-
фным электронно-плотным веществом, образованным структур-
ным белком неколлагеновой природы — «кутиклином». Его ха-
рактерной особенностью является большое количество кова-
лентных связей между белковыми молекулами, что обеспечи-
вает высокую плотность их упаковки. Предполагается, что по
своим механическим свойствам «кутиклин» сходен с эластином
соединительной ткани позвоночных животных.
Наружный слой кутикулы нематод — эпикутикула — состоит
из липидов и белков и на ультраструктурном уровне имеет
вид 3-слойной мембраны. На ее поверхности выявлена полиса-
харидная волокнистая зона, сходная с гликокаликсом плазма-
тических мембран. Предполагается, что, как и у наземных чле-
нистоногих, эпикутикула нематод осуществляет барьерную
функцию, в частности, может предохранять животных от по-
тери воды.
Кроме того, в состав кутикулы нематод входит небольшое
количество липидов, полисахаридов, ферментов и даже РНК.
У некоторых представителей этих животных обширные полости
в промежуточной зоне наполнены жидкостью, содержащей ге-
моглобин. Кутикула нематод представляет собой, следователь-
но, не просто инертный наружный скелет, но систему, в кото-
рой протекают биохимические реакции.
В ходе развития нематоды претерпевают обычно 4 линьки, течение ко-
торых регулируется нейроэндокринной системой. Перед линькой в клетках
гиподермы гипертрофируется белоксинтезирующий аппарат. В апикальной
цитоплазме накапливаются мембранные пузырьки, содержащие вещества, из
которых происходит формирование эпикутикулы и кортикальной зоны. Они
выводятся под старую кутикулу путем экзоцптоза. Одновременно на рибосо-
мах эндоплазматической сети синтезируются предшественники коллДгена,
которые в форме проколлагена накапливаются в ее цистернах. Затем рас-
ширенные цистерны ЭПС лишаются рибосом, подходят к плазматической
мембране и их содержимое выводится из гиподермы путем экзоцитоза.
Окончательная сборка коллагеновых волокон и их объединение в пластинки
происходят уже вне клеток. Таким образом, механизмы синтеза и секреций
материала внутренних слоев кутикулы нематод оказываются сходными
с процессами образования коллагеновых волокон межклеточного вещества
соединительной, хрящевой и костной тканей у позвоночных животных.
Специализация кожных покровов у нематод в процессе эволюции при-
вела к созданию весьма сложных, своеобразных и совершенных в функцио-
140
нальном отношении структур. Они представлены достаточно большим коли-
чеством модификаций, что отражает их высокую эволюционную пластичность.
Например, кутикула у половозрелых самок некоторых картофельных нематод
может подвергаться фенольному задубливанию. В результате этого процес-
са стенка тела животного превращается в прочную . цисту, содержащую
оплодотворенные яйца. С другой стороны, у одного вида нематод, парази-
тирующего в гемолимфе насекомых, кутикула вообще отсутствует. У этих
животных пищеварительная система сильно редуцирована, и их питание
осуществляется за счет всасывания питательных веществ с помощью много-
численных микроворсинок, образуемых гиподермой.
§ 3. Многослойные эпителии
Высшие позвоночные. Усовершенствование барьерной изоли-
рующей функции на базе многослойных эпителиев является
вторым основным направлением филогенетической дифферен-
цировки кожных эпителиев. Естественно, что наиболее слож-
ной организации многослойный кожный эпителий достигает
у представителей высших классов позвоночных (млекопитаю-
щих, птиц, рептилий), обитающих преимущественно в воздуш-
ной среде. Многослойный плоский ороговевающий эпителий
этих животных представляет собой тканевую систему с законо-
мерным направлением специализации клеток. Она построена
по принципу непрерывного или периодического обновления
клеточного состава. Процесс цитодифференцировки связан с на-
коплением клетками специфических белков — кератинов —
и преобразованием их в сложные надмолекулярные структу-
ры. На заключительных этапах специализации в клетках про-
исходит автолиз, обеспечивающий разрушение основных орга-
ноидов цитоплазмы и структур ядерного аппарата. Весь этот
сложный комплекс морфобиохимических процессов получил
название к е р а т и н и з а ц и и.
Кератины позвоночных представляют собой, по-видимому,
единую по происхождению, но сильно дивергировавшую груп-
пу белков, широко распространенных среди эпителиальных тка-
ней. Основная их часть относится к фибриллярным белкам,
формирующим так называемые промежуточные фибриллы ци-
тоскелета. Особенностью многослойных кожных ороговевающих
эпителиев является значительно большее, чем в других эпите-
лиальных клетках, количество разновидностей этих белков
и высокая их концентрация в дифференцированных клетках.
У млекопитающих в клетках ороговевающих эпителиев рабо-
тает.около 20 разных генов, кодирующих фибриллярные кера-
тины с молекулярным весом от 40 до 60 тысяч. В перьях
и других производных кожного эпителия птиц, а также в од-
ной генерации клеток у чешуйчатых рептилий ороговение обес-
печивается фибриллярными кератинами с молекулярными ве-
сами от 10 до 15 тысяч. Эти а- и p-кератины, хотя и обладают
общими свойствами, однако образуют разные надмолекуляр-
ные структуры. Высокомолекулярные фибриллярные кератины
141
имеются в ороговевающих эпителиях
всех высших позвоночных. Ороговение,
обусловливаемое их .накоплением в
клетках, получило название а-керати-
низации. а-кератины представлены
комплексом, состоящим из фибрилляр-
ного компонента и матрикса. Фибрил-
лярный компонент образован высоко-
молекулярным кератином, фибриллы
которого состоят из нескольких спи-
рально закрученных полипептидов;
матрикс образован несколькими фрак-
циями низкомолекулярных белков
(6—20 000). Низкомолекулярные фиб-
риллярные p-кератины имеют меньшее
распространение. Они участвуют в
формировании сложных многослойных
пластов у чешуйчатых рептилий и спе-
цифических роговых структур у птиц
и крокодилов. Образование ороговев-
ших структур путем накопления в
клетках низкомолекулярных фибрил-
лярных кератинов получило название
р-кер атинизации. В отличие от
а-кератинов фибриллярный компонент
и матрикс p-кератинов образованы одними и теми же белками,
которые формируют сложные комплексы из параллельно рас-
положенных цепей полипептидов. Общим свойством а- и р-ке-
ратинов является обилие и разнообразие поперечных связей
внутри и между отдельными полипептидными цепями. Широ-
кое распространение имеют здесь дисульфидные связи, возни-
кающие на основе SH-групп остатков цистеина, а также ряд
других связей и, в частности, поперечные связи с использова-
нием лизиновых остатков. Наличие и разнообразие этих связей
при большом количестве кератинов в клетках и определяет
химическую устойчивость и механическую прочность орогове-
вающих структур. В качестве классического примера органи-
зации ороговевающего кожного эпителия с использованием
мягкой а-кератинизации может служить эпителий кожи паль-
ца человека (рис. 38, а).
Он представляет собой мощный многослойный эпителиаль-
ный пласт, состоящий из клеток, находящихся на последова-
тельных стадиях ороговения. Наиболее глубокие слои образо-
ваны живыми клетками с базофильной цитоплазмой. Здесь
различают слой базальных, клеток на границе с соединитель-
ной тканью и несколько слоев шиповатых клеток. Граница
с соединительной тканью неровная, что увеличивает общую
площадь контакта этих тканей. Верхние слои шиповатых кле-
142
Рис. 38. Многослойный плоский ороговевающий эпителий кожи пальца че-
ловека.
а — участок эпителия, б — схема ультраструктурной организации отдельных слоев: J —
5 — слои (/ — базальный, 2 — шиповатый, 3 — зернистый, 4 — блестящий, .5 — роговой);
6— соединительная ткань, 7— кератоцйт, 8—меланоцит, 9— десмосомы, 10— полу-
десмосомы, 11 — базальная мембрана, 12 — митохондрии, 13 — аппарат Гольджи, 14 —
свободные рибосомы, 15 — шероховатая ЭПС, 16 — тонофибриллы, 17 — пиноцитозиые
пузырьки, 18 — гранулы меланина, 19 — ядро, 20 — кератосомы, 21, 22 гранулы керато-
гиалина с большими количествами цистеина (21) и гистидина (22), 23 — примембран-
ный слой с большим количеством S—S -связей, 24 — гидроизолирующий липидный
слой, 25 — а-кератиновые .фибриллы, 26 — аморфный матрикс.
143
ток контактируют со слоем зернистых клеток, содержащих
в цитоплазме глыбки базофильного уплотненного субстрата —
зерна кератогиалина. Далее следует оксифильный блестящий
слой и, наконец, несколько десятков слоев роговых чешуек.
Сущность процессов специфической дифференцировки осо-
бенно наглядно выступает при сопоставлении базальных, спо-
собных к пролиферации клеток и дифференцированных, непо-
средственно осуществляющих барьерную функцию роговых че-
шуек (рис. 38, б, 1,5).
Клетки базального слоя характеризуются наличием хоро-
шо развитых десмосом, связывающих их между собой и со сло-
ем шиповатых клеток и многочисленных полудесмосом, кото-
рые обеспечивают связь эпителиальных клеток с наружным
светлым слоем базальной мембраны. В цитоплазме относитель-
но хорошо развиты мембранные органоиды, имеются и много-
численные свободные рибосомы. Помимо собственных фибрил-
лярных структур десмосом имеются пучки тонофибрилл, не
связанных с десмосомами. Они образованы специальными
фракциями высокомолекулярных кератинов (45—46000). Их
появление в клетках базального слоя свидетельствует о начале
процесса а-кератинизации. Базальные клетки находятся в цик-
ле репродукции, синтезируют ДНК и делятся митозом.
Роговые чешуйки представляют собой крайне дифферен-
цированные и сложно организованные структуры. Они имеют
овальную уплощенную форму и ориентированы параллельно
поверхности пласта. Каждая чешуйка занимает площадь, соот-
ветствующую площади, занимаемой апикальными поверхностя-
ми 9—10 клеток базального слоя. Связь между чешуйками
обеспечивается видоизмененными десмосомами. Межклеточ-
ные пространства заполнены нейтральными липидами, образу-
ющими гидроизолирующий слой, предохраняющий кожу от вы-
сыхания.
Роговые чешуйки снаружи имеют плазматическую мембра-
ну, под которой сосредоточен белковый слой с большим коли-
чеством SS-связей. Он отличается устойчивостью к механиче-
ским и химическим воздействиям. Вся внутренняя часть рого-
вой чешуйки заполнена а-кератинами. Высокомолекулярные
а-кератины образуют фибриллы диаметром 8 нм. Они спаяны
аморфным матриксом, состоящим из низкомолекулярных а-ке-
ратинов с высоким содержанием гистидина.
Таким образом, из приведенной характеристики базальных
клеток и роговых чешуек ясно, что процесс кератинизации
представляет собой весьма сложную цепь превращений живой,
пролиферирующей клетки в роговую чешуйку. Последняя име-
ет сложное строение, однако представляет собой мертвую, не
обладающую способностью к метаболизму клетку на конечной
стадии дифференцировки. Очевидно, что процесс такой своеоб-
разной дифференцировки заключается в синтезе, накоплении
144
и перераспределении в клетках специфических белков, дегра-
дации органоидов и ядерных структур и видоизменении меж-
клеточных контактов.
Прослеживая изменение клеток в ходе дифференцировки,
мы видим, что уже в нижних клетках шиповатого слоя меня-
ется функциональная активность ядерного аппарата: утрачи-
вается способность к репликации ДНК и делению и начина-
ется синтез информационных РНК для синтеза кератинов с мо-
лекулярным весом 55000. В поверхностном аппарате шипова-
тых клеток значительно увеличивается количество десмосом,
а в цитоплазме фибриллярные структуры имеют тенденцию
концентрироваться вокруг ядра. В клетках шиповатого слоя
помимо синтеза кератинов происходит интенсивный синтез
и выведение из клеток путем экзоцитоза так называемых кера-
тосдм. Последние представляют собой ограниченные мембраной
скопления липидных мембрано-подобных структур. В их соста-
ве имеется и небольшое количество гидролитических фермен-
тов, которые активизируются в верхних зонах рогового слоя,
что может способствовать слущиванию верхних роговых че-
шуек. Выделяемые шиповатыми клетками кератосомы вначале
не образуют сплошных слоев и не препятствуют циркуляции
тканевой жидкости по межклеточному пространству.
Наиболее сложные и многообразные изменения в клетках
происходят на уровне зернистых и блестящих слоев.
В клетках зернистого слоя появляются зерна кератогиали-
на — не ограниченные мембраной участки электронноплотного
базофильного вещества, расположенного в цитоплазме и ядер-
ном аппарате. В структурном отношении они гетерогенны:
имеются тонкофибриллярный и аморфный компоненты. Наря-
ду со сложными гранулами, содержащими оба компонента, есть
гранулы, образованные только аморфным компонентом. Био-
химический и авторадиографический анализы кератогиалино-
вых гранул показали, что они содержат в основном две фрак-
ции специфических белков — гистидин- и цистеинбогатые
фракции. При этом гистидинбогатые фракции образуют фиб-
риллярный, а цистеинбогатые — аморфный компонент гранул.
Таким образом, в клетках зернистого слоя в дополнение
к уже накопленным ранее кератинам синтезируются еще до-
полнительные специфические белки, необходимые для форми-
рования дефинитивной структуры роговой чешуйки. .Кроме
того, в этих клетках активизируются и автолитические процес-
сы,. приводящие к разрушению ядерных структур и органоидов
цитоплазмы.
..При переходе из зернистого в блестящий слой- в клетках
происходит «дозревание» накопленных белков, их перераспре-
деление в клетке и формирование надмолекулярных структур,
характерных для роговой чешуйки. Эти процессы хорошо изу-
чены. на примере компонентов кератогиалиновых гранул. Их
145
аморфный компонент, образованный цистеинбогатыми бел-
ками, формирует периферический, насыщенный поперечными
S—S-связями субмембранный белковый слой. Гистидинбогатые
фибриллярные структуры участвуют в образовании дефини-
тивной, внутренней структуры роговой чешуйки, на их основе
формируется аморфный матрикс, им приписывают также роль
в преобразовании остатков РНК и ДНК при деградации ядер»
ного и белок-синтезирующего аппаратов клетки.
Таким образом, кератинизация представляет собой весьма сложный
многокомпонентный процесс структурных и биохимических изменений клеток.
Он включает в себя последовательно развертывающиеся синтетические про-
цессы, процессы вторичного изменения и перераспределения материала и,
наконец, сложные катаболические процессы.
Помимо описанной мягкой d-кератинизации у млекопитающих широко
распространены процессы твердой кератинизации с длительным сохранением
образующихся роговых структур. При твердой кератинизации в матриксе
роговых чешуек повышено содержание цистеинбогатых кератинов, а клеточ-
ные контакты между роговыми чешуйками — более сложные и более устой-
чивые. На основе твердой а-кератинизации формируются такие сложные
структуры, как волосы, ногти, рога, копыта, когти. Образование этих орган-
ных структур связано с усложнением организации базального камбиаль-
ного слоя. Мощность его резко возрастает за счет увеличения поверхности
контакта с соединительной тканью путем образования глубоких впячива-
ний, сосочков или сложных складок. Естественно, что в формировании
и функционировании такого рода структур велика роль сосудов и специали-
зированных участков соединительной ткани, обеспечивающей трофическую,
регулирующую, а часто и укрепляющую механическую функцию.
Характерным примером органных структур кожных покро-
вов высших позвоночных может служить волос млекопитаю-
щих (рис. 39). Из сопоставления волоса и щетинки полихет
(рис. 34) видно, что внешне эти образования сходны. Однако
при более детальном изучении становится ясным принцйпи-
альное различие этих структур: щетинка — это сложное некле-
точное образование, а волос — механически прочная структу-
ра, построенная из большого числа ороговевших клеток.
В основе организации волоса лежит погруженная в соеди-
нительную ткань система камбиальных клеток — волосяная лу-
ковица. Периферические клетки волосяной луковицы контак-
тируют со специальным впячиванием покровного эпителия
в глубь соединительной ткани—-наружным корневым влагали-
щем. В основании волосяной луковицы находится углубление,
в которое заходит соединительная ткань с сосудами — волося-
ной сосочек. Клетки волосяной луковицы в фазе активного
роста волоса энергично размножаются и, смещаясь вверх, пре-
терпевают процесс кератинизации. При этом несколько пери-
ферических слоев и центральные клетки ороговевают по типу
мягкой а-кератинизации. Из периферических слоев клеток
формируется внутреннее корневое влагалище, которое доходит
лишь до уровня впадения в наружное корневое влагалище про-
146
Рис. 39. Схема строения волоса млекопитающих.
/_ волосяная луковица, 2 — волосяной сосочек, 3, -4—наружное (3) и внутреннее (4)
корневые влагалища, 5 — сальная железа, 6, 7— корковое (£) и мозговое (7) вещест-
во стержня волоса, 8 — эпидермис, 9 — мышцы.
токов сальных желез. Из центральных клеток формируется
рыхлое мозговое вещество стержня волоса. Основная часть
стержня волоса представлена корковым веществом, состоящим
из клеток, образующихся в результате деления клеток во-
лосяной луковицы. Эти клетки ороговевают на относительно
147
небольшом расстоянии от волосяной луковицы, в так называемой
кератогенной зоне. В них развиваются процессы твердой а-ке-
ратинизации с образованием большого количества кератинов,
богатых S—S-связями, и более стойким, чем при мягкой ке-
ратинизации, объединением роговых чешуек в целостную- сис-
тему. Таким образом, хотя основу организации волоса и со-
ставляет пространственная комбинация мягкой и твердой
а-кератинизаций многослойного эпителия, в целом- это уже мик-
роорганная структура, находящаяся под контролем гормональ-
ных регуляций организма и в формировании и функциониро-
вании которой существенную роль играют соединительная
ткань, сосуды и специальные мышечные элементы.
У птиц наблюдается более разнообразный спектр модифи-
каций кератинизации. Помимо сходного с происходящим у мле-
копитающих процесса мягкой а-кератинизации имеет распро-
странение. характерная лишь для птиц и рептилий р-кератини-
зация, в основе которой лежит синтез относительно низкомо-
лекулярных кератинов. В роговых чешуйках перьев птиц эти
кератины формируют фибриллярные надмолекулярные струк-
туры с диаметром около 2 нм. При p-кератинизации отсутст-
вует специальный матрикс, образованный особыми белками.
Объединение фибрилл в целостную систему осуществляется
белками, образующими поверхность фибрилл. У птиц за счет
[i-кератинизации образуются перья, роговые структуры клюва
и чешуйки конечностей. Сам покровный эпителий ороговевает,
как и у млекопитающих, на основе мягкой а-кератинизации.
Особенностью этого процесса у птиц является наличие помимо
кератосом большого количества неструктурированных липидов
в клетках шиповатого слоя, занимающих затем центральную
область в сформированных роговых чешуйках. По мере про-
движения чешуек к поверхности пласта они уплощаются, и в
конце концов липиды выводятся через разрывы стенки рого-
вой чешуйки на поверхность пласта и в межклеточные проме-
жутки, обеспечивая тем самым гидроизоляцию внутренней
среды организма.
Таким образом, на примере а-кератинизации видно, что
одна и та же задача гидроизоляции у птиц и млекопитающих
решается несколькими различными механизмами.
Многослойные пласты кожного эпителия млекопитающих
и птиц представляют непрерывно обновляющиеся системы,
т. е., как и другие камбиальные системы, построены по прин-
ципу динамического равновесия. Особенностью камбиальных
базальных клеток кожного эпителия млекопитающих и птиц
является неодинаковая скорость их размножения как в преде-
лах одного участка, так и в разных участках эпителия. В од-
ном и том же участке помимо обычного «рабочего» камбия,
поставляющего клетки для замены слущиваемых роговых че-
шуек в нормальных условиях, имеются еще и резервные суб-
148
популяции, используемые в случае выхода системы из равно-
весия при травме или необычных воздействиях на кожные по-
кровы физических или химических факторов внешней среды.
Для анализа взаимоотношений между репродукцией и дифференциров-
кой клеток большой интерес представляет выяснение факторов, тормозящих
процессы кератинизацни на уровне базального слоя. На эмбриональных за-
чатках кожного эпителия млекопитающих и птиц удалось показать, что та-
ким фактором является контакт эпителия с высокомолекулярными белками,
и в частности с коллагеном соединительной ткани. При замене последней
на хрящевую ткань (in vitro) происходит полное ороговение всего эпители-
ального пласта, включая его базальный и шиповатый слои. При культиви-
ровании эмбрионального кожного эпителия с соединительной тканью легкого
кератинизацни не происходит и образуется пласт многослойного неорогове-
вающего эпителия. При замене кожной соединительной ткани соединитель-
ной тканью желудочно-кишечного тракта удается наблюдать метаплазию
кожного эпителия в железистый и ресничный эпителий. Наконец, само су-
ществование зачатков кожного эпителия в культурах in vitro возможно
лишь при их взаимодействии с коллагеном. В отсутствие последнего через
24 ч происходит полная деструкция эпителиальных пластов.
В регуляции взаимоотношений двух процессов, лежащих в основе орга-
низации многослойных ороговевающих эпителиев — кератинизацни и репро-
дукции клеток, большую роль играют и взаимодействия между дифференци-
рованными и базальными клетками. Показано также существенное влияние
на эти взаимоотношения некоторых внешних для организма физических
и химических факторов (витамина А, механических воздействий на поверх-
ность эпидермиса, радиации). В опытах in vitro удалось получить метапла-
зию эмбрионального эпидермиса при культивировании его в условиях избыт-
ка витамина А в многорядный ресничный эпителий. Усиление пролиферации
клеток и утолщение слоя роговых чешуек постоянно наблюдается при хро-
нических механических воздействиях на поверхность кожного эпителия.
Сложную, многоэтапную защитную реакцию вызывает регу-
лярное воздействие больших доз ультрафиолетовых лучей
(УФ). При умеренных дозах радиации изоляция клеток ба-
зального слоя и их генетического аппарата осуществляется
специальными клетками — меланоцитами. Они возникают в ходе
онтогенеза из нервного зачатка и заселяют эпителиальные пла-
сты путем активной миграции. Дифференцированные мелано-
циты представляют собой овальные клетки с отростками на
апикальной поверхности. Они не связаны десмосомами с со-
седними эпителиальными клетками,, однако находятся под об-
щим системным контролем, обеспечивающим постоянство их
количества в эпителиальном пласте. При умеренных дозах УФ-
облучения . имеющийся в этих клетках бесцветный пигмент пе-
реходит в окрашенную форму. При более сильных дозах УФ-
облучения усиливается синтез этого пигмента. Чрезмерное
УФ-воздействие вызывает разрушение лизосомных мембран.
При этом выделяются вещества, стимулирующие размножение
резервных субпопуляций клеток базального слоя, что приводит
к рёзкому утолщению эпителиального пласта и, в частности,
его рогового слоя.
149
Сходство организации кожных эпителиев у высших позво-
ночных особенно наглядно выступает при рассмотрении кож-
ных эпителиев рептилий. Как известно, ныне живущие репти-
лии принадлежат к трем давно дивергировавшнм ветвям и пред-
ставляют собой, следовательно, группы животных, прошедших
длительную независимую эволюцию. Наибольшие изменения
при этом претерпели кожные покровы чешуйчатых рептилий
(ящерицы и змеи).
Рис. 40. Схема строения кожного эпителия чешуйчатых рептилий в предли-
ночном состоянии.
I, II — генерации роговых чешуек; 1— поверхностный слой чешуек с шипами, 2 —
слой p-кератиновых роговых чешуек, 3 — промежуточный слой, 4 — слой а-кёратино-
вых роговых чешуек, 5 — слой светлых клеток, 6 — ростковый слой, 7 — волокна р-кера-
тина, 8 — аморфное вещество, 9 — электронноплотные участки, между которыми лежат
волокна р-кератина. 10— волокна а — кератина, // — уплотненный слой на периферии
роговых чешуек, 12 — остатки десмосом, 13— гранулы кератогналина, 14 — пузырьки
с гидролитическим ферментом, 15 — шипы роговых чешуек поверхностного слоя пер-
вой генерации.
Для кожного эпителия чешуйчатых рептилий характерца
периодичность физиологической регенерации, т. е. процессы
линьки. В предлиночном состоянии кожный эпителий пред-
ставляет собой сложную тканевую систему (рис. 40). На по-
верхности относительно тонкого росткового слоя имеются две
150
генерации дифференцированных роговых чешуек. Каждая из
них неоднородна и состоит, по крайней мере, из 3—4 разно-
видностей чешуек, расположенных’одним или несколькими сло-
ями. Кроме того, между этими генерациями имеется особый
светлый слой ороговевающих клеток, разрушение которого
в момент линьки и обусловливает сбрасывание поверхностной
генерации роговых чешуек.
Тщательный ультраструктурный анализ покровов одной из
ящериц показал, что поверхностный слой с шипами и лежа-
щий под ним довольно толстый p-слой образуют гомогенный
пласт из' p-кератинов, в котором отсутствуют границы клеток
и межклеточные промежутки, p-кератины представлены фиб-
риллярным компонентом—электронно-светлыми фибриллами
диаметром 2 нм и электронно-плотным аморфным матриксом.
Под этим слоем располагается тонкая пластинка уплощенных
ороговевающих клеток, за которой следует относительно тол-
стый слой роговых чешуек, заполненных фибриллами «-кера-
тина с характерным для них диаметром — 8 нм. Наконец, на
границе следующей генерации роговых чешуек располагается
слой крупных светлых клеток с ядрами и глыбками кератогиа-
лина, напоминающих клетки зернистого слоя при мягкой
а-кератинизации. Однако биологическое значение этого слоя
совсем иное. Он служит для разобщения генераций роговых че-
шуек в момент линьки. Очевидно, что в светлых клетках име-
ются особые взаимоотношения между катаболическими и ана-
болическими процессами. До определенного момента в них
происходит синтез кератинов и идут первые этапы катаболиче-
ских процессов. Однако вслед за этим клетки переходят в от-
носительно латентное состояние. Под воздействием гормонов
линьки активизируются ферментативные системы, находящие-
ся до этого, по-видимому, в лизосомах. Деятельность фермен-
тов приводит к полному автолизу цитоплазмы, что создает
необходимые предпосылки для сбрасывания поверхностной ге-
нерации роговых чешуек.
. Следовательно, характерной особенностью покровного эпи-
телия чешуйчатых рептилий является гетерогенность его соста-
ва. В каждой генерации рогового слоя имеются структуры,
сходные и с роговыми чешуйками эпителия млекопитающих,
и с ороговевающими клетками перьев птиц.
У базальных клеток кожного эпителия рептилий, идентич-
ных по своим потенциям и происхождению, имеется способ-
ность дифференцироваться по нескольким, существенно отли-
чающимся друг от друга программам. В опытах по культиви-
рованию in vitro изолированного от соединительной ткани эпи-
телия показано, что переключение программ не зависит от
внешних факторов, т. е. обусловлено внутрисистемными регу-
ляциями. Особенно наглядно удалось показать значение послед-
них при культивировании in vitro изолированного росткового
151
слоя. В этих условиях происходит нарушение координирован-
ной работы системы, и на поверхности жизнеспособного рост-
кового слоя формируется лишь небольшой слой атипически оро-
говевающих клеток.
Результаты этих опытов показывают, что последовательная во времени
закономерная смена программ дифференцировки клеток осуществляется
в кожном эпителии рептилий по принципу обратной связи. Очевидно, что при
достижении определенной массы клеток, дифференцирующихся по одной про-
грамме, они выделяют достаточное количество индуцирующего вещества,
обусловливающего иную программу дифференцировки у следующей генера-
ции клеток. При этом обнаружено, что чем толще слой клеток, ороговеваю-
щих по одной программе, тем меньше индуктора выделяет каждая клетка:
Естественно, что подобный тип регуляции может иметь место лишь при на-
личии у клеток росткового слоя весьма чувствительных и достаточно разно-
образных рецепторов, позволяющих генетическому аппарату адекватно реа-
гировать на специфические стимулы дифференцйрующихся клеток.
У рассматриваемых представителей чешуйчатых рептилий такая слож-
ная организация кожных эпителиев возникла спустя много времени после
их отделения от общего с млекопитающими ископаемого предка.. В связи
с этим наличие у чешуйчатых рептилий специализированных клеток с а-
и Р-кератинами свидетельствует о существовании общих тенденций филоге-
нетической дифференцировки в кожных ороговевающих эпителиях всех выс-
ших позвоночных. Однако их конкретная реализация у каждой группы жи-
вотных имеет свои особенности, которые характерны и для двух других
групп рептилий: наиболее древних их представителей — черепах и более близ-
ких к птицам — крокодилов. У этих животных отсутствует характерная для
чешуйчатых рептилий периодическая смена целой генерации роговых чешуек.
Здесь преобладает свойственное млекопитающим и птицам постепенное слу-
щивание поверхностных ороговевших клеток.
В эпидермисе панциря многих черепах долго сохраняется роговой сдой.
Это требует сложной организации и регуляции процессов клеточной репро-
дукции, обеспечивающих синхронный рост роговой пластинки в соответствии
с увеличением размеров тела и костного скелета панциря.
Низшие позвоночные. У большинства современных амфибий
кожный эпителий взрослых животных представлен, как и у рас-
смотренных представителей высших позвоночных, многослой-
ным плоским ороговевающим эпителием. Особенностью кож-
ных покровов амфибий является обилие погруженных в соеди-
нительную ткань многоклеточных слизистых и белковых же-
лез. Для их эпидермиса характерно наличие на большей по-
верхности тела лишь одного слоя ороговевших клеток. Эти
особенности связаны с полуводным образом жизни животных
и их кожным дыханием.
Кожный эпителий амфибий образован относительно толс-
тым (4—5 слоев) ростковым слоем и одним слоем сильно уп-
лощенных ороговевших, тесно связанных между собой клеток
(рис. 41). В цитоплазме клеток базального камбиального слЪя
имеются хорошо развитые пучки тонофибрилл.
В вышележащих слоях ростковой зоны тонофибриллы ме-
няют свое расположение и образуют более плотно упакован-
ные пучки. В клетках шиповатого слоя накапливаются грану-
152
лы двух типов — крупные и мелкие. Последние выделяют свое
содержимое путем экзоцитоза в межклеточное пространство.
Клетки росткового слоя связаны между собой многочислен-
ными десмосомами. Верхние шиповатые клетки по своей ульт-
раструктуре в период между линьками не отличаются сущест-
венно от нижележащих клеток. Их особенность заключается
в наличии замыкающих изолирующих контактов в верхних ла-
Рис. 41. Многослойный плас- '
кий ороговевающий эпите-
лий кожи лягушки.
а — участок эпителия кожи
спины, б — схемы изменения
ультраструктурной организа-
ции клеток при ороговении.
1 — слой ороговевших кле-
ток, 2 .— ростковый слой, 3 —
соединительная ткань, 4 — же-
леза, 5 — тонофибриллы, 6 —
мукоидные гранулы. 7 — ли-
зосомы, 8 — остатки ядерного
аппарата и мембранных ор-
ганоидов, 9 —- а-кератиновые
волокна, 10 — межклеточный
цемент, 11 — утолщение пе-
риферического слоя цитоплаз-
мы.
теральных частях клеток. Процесс превращения живых клеток
шиповатого слоя в роговые чешуйки происходит весьма быст-
ро, в течение 24 ч. Непосредственно перед этим превращением
слущивается поверхностный слой роговых чешуек, что связано,
по-видимому, с разрушением десмосом. Верхние клетки шипо-
.153
ватого слоя уплощаются и уменьшаются в объеме. Ядра не ис-
чезают, а лишь подвергаются деградации и сморщиванию. Ци-
топлазматические органоиды, как и у высших позвоночных, ис-
чезают полностью. По периферии клетки концентрируются бел-
ки, богатые S—S-связями, хотя их количество меньше, чем
в роговых чешуйках млекопитающих. Внутри клеток в аморф-
ном матриксе располагаются фибриллы диаметром 8 нм, т. е.
структуры, характерные для заключительных этапов сх-керати-
низации. Особенностью сх-кератинов амфибий является более
хаотичное расположение спиральных участков полипептидных
цепей в макромолекулах. Связь между формирующимися ро-
говыми чешуйками осуществляют сохраняющиеся зоны слия-
ния. С нижележащими клетками шиповатого слоя роговые че-
шуйки связываются при помощи обычных точечных десмО-
сом.
В отличие от ороговевающих эпителиев высших позвоночных у амфи-
бий не удается наблюдать последовательных стадий превращений живой
клетки в ороговевшую чешуйку, хотя сущность и химическая основа про-
цессов весьма сходна. Непосредственной причиной этих особенностей кера-
тинизации у амфибий является периодичность и большая скорость заверша-
ющих этапов этих процессов.
Таким образом, для кожного эпителия амфибий характерна известная
незавершенность процессов вторичного преобразования специфических бел-
ков и деструкций высокомолекулярных соединений в ороговевающих клетках.
Однако данные особенности кератинизацни вряд ли можно рассматривать
просто как признаки примитивной организации этого эпителия. Кожный
эпителий амфибий обладает потенциями к формированию мощных роговых
структур типа роговых зубов головастиков или специальных утолщений ко-
жи на передних лапах самцов лягушек.
У современных низших водных позвоночных — круглоротых
и многочисленных представителей класса рыб, несмотря на
большое разнообразие кожных эпителиев, в их структурной ор-
ганизации удается обнаружить ряд общих закономерностей.
В типичном случае эпителий представляет собой много-
слойный пласт с выраженной вертикальной анизоморфностью.
На границе с соединительной тканью располагается слой ба-
зальных камбиальных клеток, обеспечивающих постоянное или
периодическое обновление эпителиального пласта. Этот про-
цесс совершается у разных представителей рыб с большей
или меньшей скоростью. Образующиеся в результате размно-
жения клетки дифференцируются в двух основных направле-
ниях: в направлении образования кроющих, часто уплощенных,
поверхностных клеток и в направлении образования различно-
го рода железистых элементов. Наличие в составе эпителиаль-
ного пласта белковых, слизистых и некоторых других специфи-
ческих секреторных клеток — весьма характерная особенность
многослойных эпителиев низших водных позвоночных. Желези-
154
стые клетки, выделяя секреты, способствуют обеспечению барь-
ерной функции эпителиального пласта.
При дифференцировке клеток в направлении кроющих эле-
ментов происходит увеличение их размеров и развитие в цито-
плазме волокнистых белковых структур — тонофибрилл, коли-
чество и плотность расположения которых обычно увеличива-
ются по направлению к поверхности пласта. В типичных
случаях дифференцированные кроющие клетки имеют уплощен-
ную форму и слегка пикнотизированное ядро. На их апикаль-
ной поверхности образуются небольшие гребни, увеличивающие
поверхность плазматической мембраны. Сверху они покрыты
секретом железистых клеток, расположенным в виде тонкого
Рис. 42. Кожный эпителий миноги.
а — участок многослойного железистого эпителия, б — роговой зуб ротовой полости;
/ — соединительная ткань, 2—6 — клетки (2— базальные, 3 — кроющие ослизненные, 4—^
железистые белковые, 5 — колбовидные, 6 — железистые слизистые), 7 — роговые че-
шуйки зуба первой генерации, 8 — промежуточный слой, 9 — ороговевающие клетки
зуба второй генерации, 10 —* ростковый слой.
электронноплотного слоя на поверхности плазматической мем-
браны. Хорошо развитые десмосомы связывают клетки друг
с другом. Полудесмосомы базальных клеток, кроме того, обес-
печивают их крепление к внутренней поверхности базальной
мембраны.
Процессы физиологической регенерации и морфобиохимиче-
ские основы дифференцировки клеток в кожных эпителиях
низших позвоночных животных еще недостаточно изучены.
Имеющиеся данные свидетельствуют о том, что у некоторых
представителей костистых рыб процессы синтеза ДНК и раз-
155
множения могут наблюдаться у вступивших на путь диффе-
ренцировки клеток. Здесь, следовательно, нет еще резко вы-
раженных различий между камбиальными и дифференцирую-
щимися клетками.
Помимо описанных выше типичных эпителиальных пластов
у некоторых видов рыб и круглоротых образование слизистого
секрета на поверхности тела может стать доминирующей функ-
цией эпителиального пласта. В этом случае дифференцировка
всех клеток, образующихся в результате размножения клеток
нижележащих слоев, идет в направлении развития секретор-
ных элементов, и поверхностный слой клеток представляет со-
бой сплошной слизеобразующий пласт (рис. 42, а). Продукты
его выделения выполняют барьерную защитную функцию.
Другая, более редкая, но наиболее интересная модификация
многослойных эпителиальных пластов связана с прогрессивной
дифференцировкой поверхностных кроющих клеток. У одного
из представителей пресноводных костистых рыб (Bagarius
bagarius) на поверхности эпителиального пласта имеется сплош-
ной слой ороговевших клеток. Белки этих клеток богатйг SH-
группами, а цитоплазма шиповатых клеток обладает базофиль-
ной зернистостью. По. своей ультраструктурной организации
роговые чешуйки этого представителя костистых рыб сходны
с чешуйками, образующимися при а-кератинизации у амфи-
бий. Участки ороговевающего эпителия обнаружены на брюш-
ных плавниках у двоякодышащих рыб и в виде отдельных
«островков» или «жемчужин» на голове карповых рыб.
Хорошо известны и изучены такие мощные образования,
как роговые зубы круглоротых, которые периодически обнов-
ляются у взрослых животных. В период, предшествующий .линь-
ке, они представлены двумя генерациями роговых пластинок,'
лежащих над ростковым, слоем и разделенных пластом элект-
ронноплотных клеток, разрушение которого приводит к сбра-
сыванию поверхностной, первичной генерации (рис. 42,6). Ро-
говые пластинки обеих генераций образуются в результате а-
кератинизации и отличаются по степени завершенности этого
процесса. Первичная генерация представлена слоем роговых
чешуек, в которых полностью разрушены ядерный аппарат
и другие органоиды, а межклеточные пространства заполнены
электронноплотным матриксом. При формировании роговых
чешуек клетки проходят стадию зернистых клеток, напомина-
ющих по своей структуре клетки зернистого слоя млекопитаю-
щих. Таким образом, у круглоротых наблюдается своеобраз-
ное сочетание а-кератинизации, сходной по некоторым призна-
кам с а-кератинизацией млекопитающих, с таким явление^,
как разрушение промежуточных клеток, что характерно для
клеток зернистого слоя рептилий. Естественно, что все эти про-
цессы независимо возникают у круглоротых, рептилий и мле-
копитающих и представляют собой пример так называемых
156
родственных параллелизмов в организации кожных покровов
и их производных.
'Рассмотренные примеры далеко заходящей кератинизации
в эпителии- рыб и круглоротых позволяют предположить, что
в филогенезе уже на первых этапах формирования многослой-
ных кожных эпителиев в клеточном геноме были заложены
потенции к формированию ороговевающих эпителиев и синтезу
специфических белков—кератинов. Эти потенции максималь-
но проявились в процессе прогрессивной эволюции при рассе-
лении позвоночных на суше. Однако они же выявляются при
адаптивной эволюции у низших позвоночных животных при
формировании на ограниченных участках тела слабо орогове-
вающих многослойных пластов, роговых зубов у миноги и ро-
говых «жемчужин» в коже некоторых костистых рыб.
Хорошо известным образованием в коже низших позвоночных живот-
ных, получившим прогрессивное развитие и у других позвоночных, является
плакоидная чешуя хрящевых рыб. В ее формировании принимает участие
не только соединительная ткань, но и эпителий. Часть базальных клеток
последнего .в области образования таких структур выделяет на своей ба-
зальной поверхности плотное межклеточное вещество, которое вместе с меж-
клеточным обызвествленным веществом соединительнотканного происхожде-
ния создает комплексную, двойственную по происхождению структуру. В об-
ласти- чешуек нарушается целостность эпителиального пласта, и покрытый
эмалью (продуктом секреторной деятельности эпителиальных клеток) участок
вступает в непосредственный контакт с внешней средой. Образование такого
рода структур в кожных покровах современных рыб не получило, однако,
большого развития. У большинства костистых рыб усиление механической
функции кожных покровов происходит за счет формирования костных пла-
стинок соединительнотканной природы.
§ 4. Некоторые закономерности эволюционной динамики
кожных эпителиев
Обзор строения кожных эпителиев основных групп совре-
менных многоклеточных животных показывает разнообразие
принципов организации этой тканевой системы. Оно проявля-
ется в различиях химического состава структур, образуемых
клетками кожных эпителиев, в принципах построения ткане-
вых систем и в разнообразии механизмов выработки специфи-
ческих соединений, обусловливающих барьерную защитную
функцию.
Такое многообразие эпителиев кожных покровов у совре-
менных многоклеточных животных определяется разнообрази-
ем, условий их обитания, уровнем организации животных и дли-
тельной адаптивной эволюцией в специфических -условиях внеш-
ней среды для каждой из рассмотренных групп животных.
Однако на фоне дивергентной филогенетической дифференци-
ровки кожного эпителия удается особенно отчетливо выявить
ряд общих эволюционных тенденций, общих закономерностей
157
усложнения этой тканевой системы по мере повышения уровня
организации животных.
Весьма вероятно, что наиболее примитивными покровными
структурами являются погружные эпителиальные пласты без
четкой границы с соединительной тканью, эпителиально-мышеч-
ные дифференцировки кишечнополостных и разновидности рес-
ничных эпителиев. У современных низших многоклеточных жи-
вотных эти ткани претерпели большие изменения и существен-
но отличаются от того исходного типа, который послужил
основой для развития покровных эпителиев у прогрессивно эво-
люционировавших групп животных.
Примерами вторичного усложнения являются, очевидно, та-
кие сложные клетки, как нематоцисты кишечнополостных со
специальной системой их воспроизведения, сложные мышеч-
ные отростки эпителиально-мышечных клеток медуз, а также
высокая скорость обновления клеток в ресничном эпителии
немертин и моллюсков и сложная гетерогенная организация их
камбиальных систем. Во многих случаях (например, построе-
ние системы по принципу непрерывного обновления или слож-
ные дифференцировки миофибриллярного аппарата в эпители-
ально-мышечных клетках) эти вторичные свойства кожных
эпителиев низших многоклеточных, приобретенные в процессе
адаптивной эволюции, оказываются в принципе сходными со
свойствами тканевых систем, которые наблюдаются в анало-
гичных тканях более высокоорганизованных многоклеточных
животных.
С другой стороны, у высших многоклеточных животных при
возникновении вторичных пограничных тканей в составе других
тканей организма выделяются специфические дифференцировки,
сходные с эпителиями низших многоклеточных (эпителиально-
мышечные клетки дилататора зрачка, ресничный эпителий
воздухоносных путей и др.). Из этих фактов уже можно
сделать вывод об общих закономерностях в филогенетической
дифференцировке покровных структур, которые отчетливо вы-
ступают при их сопоставлении у современных животных.
Две наиболее распространенные у современных многокле-
точных животных разновидности кожных эпителиев—- много-
слойные и кутикулярные эпителии — принципиально отличают-
ся по своей структурной организации, хотя и выполняют оди-
наковую барьерную, защитную, а у наземных животных и очень
специфическую—гидроизолирующую функцию. В отличие от дру-
гих типов тканей и рассмотренной выше разновидности кожных
эпителиев, многослойные кожные эпителии обычно отсутствуют
у беспозвоночных, и, наоборот, кутикулярные эпителии не
свойственны позвоночным животным. Единственным исключе-
нием из этой общей закономерности для многослойных эпите-
лиев являются покровы небольшой группы щетинкочелюстных,
представленные наряду с кутикулярными участками мнбго-
158
слойного эпителия. Для кутикулярных эпителиев такими, тоже
единственными исключениями, являются плакоидная чешуя
хрящевых рыб и адамантобласты эмалевых органов зубов по-
звоночных, выделяющие на своей базальной поверхности меж-
клеточное вещество, структурно аналогичное кутикуле одно- ,
слойных эпителиев беспозвоночных. В кожных эпителиях бес-
позвоночных животных нет белков, подобных или гомологич-
ных кератинам, а ,у позвоночных -нед .такого специфического
полисахарида, как хитин. Таким образом, многослойные эпи-
, телии и особенно ороговевающие эпителии позвоночных, а так-
же кутикулярные эпителии и особенно эпителии артроподного
типа представляют собой редкий на тканевом уровне классиче-
ский пример типичной дивергенции в филогенезе много-
клеточных животных: решение сходной функциональной задачи
при помощи принципиально разной структурной и химической
дифференцировки клеток у животных, давно дивергировавших
от общих предков.
Эти принципиальные различия многослойных и кутикуляр-
ных эпителиев особенно демонстративно выявляются при сопо-
ставлении таких специализированных производных этих эпи-
телиев, как щетинка полихет и волос млекопитающих (см. выше
стр. 146). Различны по существу и имеющиеся у многослойных
эпителиев высших позвоночных и в кутикулярных эпителиях
К) артроподного типа взаимоотношения с тканями внутренней
среды. В многослойных эпителиях подлежащая соединитель-
ная ткань не только обеспечивает их трофику, но и поддержи-
вает существование базального, слоя, а в гистогенезе в извест-
ных пределах определяет характер дифференцировки эпители-
альных клеток. У оболочников и насекомых элементы крови —
гранулярные амебоциты — либо непосредственно участвуют
в формировании кутикулы (оболочники), либо обеспечивают
ее склеротизацию (насекомые). Дивергентное развитие кож-
ных покровов у позвоночных и беспозвоночных животных от-
ражает существование особенности общей организации этих
животных.
Несмотря на то, что кожные эпителии являются классиче- ,
ским примером дивергенции тканей в филогенезе позвоночных
и высших беспозвоночных животных, в пределах каждой из
этих групп животных мы наблюдаем весьма яркие примеры
параллельного направленного развития эпителиальных тканей.
Наиболее демонстративен в этом плане кутикулярный эпителий
вторичноротых — оболочников, и высших первичноротых — на-
секомых. Сходство организации этих эпителиев проявляется не
только в химизме кутикулы, общем плане ее строения и меха-
низмах выведения основных компонентов клетками, но и в ха-
рактере взаимоотношений кутикулярного эпителия , с клеточны-
ми элементами гемолимфы и крови — гранулярными амебоци-
тами насекомых и морулярными клетками асцидий. Яркими
159
примерами параллельного, направленного развития в филоге-
незе являются взаимоотношения, имеющиеся между кутикуля-
рным эпителием и гранулярными амебоцитами у мечехвоста
и приапулид, сходное строение аннелидной кутикулы, щетинок
и щетинкоподобных структур у далеких в смысле филогене-
тического родства групп беспозвоночных животных. Как и в
случае кишечного эпителия, для кожных эпителиев характер-
но широкое распространение не только параллелизмов в их
организации у неродственных животных, но и так называемых
«близкородственных» параллелизмов — незави-
симое возникновение новых признаков организации у родствен-
ных животных, признаков, отсутствовавших у общих предков
этих животных. Типичным примером в этом плане является
независимое друг от друга возникновение водонепроницаемой
эпикутикулы у различных классов наземных членистоногих
и ороговевающих участков эпителия у круглоротых, костистых
рыб и представителей других классов позвоночных.
Таким образом, можно сделать общий вывод о том, что,
несмотря на существенные специфические особенности эволю-
ционной динамики кожных эпителиев, им, как и кишечным
эпителиям, а также и другим тканям многоклеточных живот-
ных свойственны отчетливо выраженные явления направлен-
ной дифференцировки в филогенезе, проявляющиеся в много-
численных отдаленных и «близкородственных» параллелизмах.
Глава 8. ОСМОРЕГУЛИРУЮЩИЕ
И ВЫДЕЛИТЕЛЬНЫЕ ЭПИТЕЛИИ
§ 1. Общая характеристика смешанных осморегулирующих
и выделительных эпителиальных канальцев
У многоклеточных животных функция осморегуляции (под-
держание количественного и качественного постоянства ионно-
го состава внутренней среды) и экскреторная функция (выде-
ление жидких продуктов обмена) осуществляются в основном
путем формирования специальных смешанных осморегулирую-
щих и выделительных органов. У разных групп животных
внешне они весьма многообразны и могут развиваться из раз-
личных источников. Однако системные и тонкие цитологические
механизмы их функционирования основаны на общих для всех
животных принципах организации.
Осморегулирующие и выделительные органы обычно обра-
зуются из эпителиальных канальцев, один конец которых либо-
слепо замкнут, либо сообщается со вторичной полостью тела,
а другой открывается наружу или в полость кишки. Все эти
канальцы, несмотря на большое разнообразие их у разных
160
групп животных, работают по одному принципу. В их полость
поступает ультрафильтрат, близкий по составу растворенных
в нем компонентов тканевой жидкости организма. В процессе
прохождения жидкости по канальцу из нее извлекаются нуж-
ные для организма вещества, а к формирующейся моче могут
добавляться конечные продукты азотистого обмена, подлежа-
щие выведению, а иногда и ионы. Эти сложные процессы р е-
абсорбции (извлечение соединений из полости канальца)
и секреции (выделение в полость канальца органических
и неорганических соединений) реализуются эпителиальными
клетками стенки канальца. Процессы реабсорбции и секреции
в основном осуществляются с помощью трансмембранного
транспорта, при этом часто создаются локальные области
с повышенным осмотическим давлением внутри клеток и в-
замкнутых или. открытых межклеточных и околоклеточных про-
странствах. Это требует наличия у эпителиальных клеток ка-
нальцев плазматической мембраны, специализированной на
процессы активного транспорта, и источников энергии. У эпи-
телиальных клеток обычно гипертрофирована плазматическая
мембрана и увеличено количество связанных с ней митохонд-
рий. Гипертрофия плазматической мембраны может достигать-
ся разными путями: образованием глубоких впячиванийв ба-
зальной части клеток, формированием на их апикальной по-
верхности микроворсинок и, наконец, образованием выростов
цитоплазмы на боковой поверхности клеток. Существенное
вспомогательное значение в процессах транспорта веществ
имеет изменение проницаемости мембран и межклеточных кон-
тактов для воды, а также транспорт веществ и ионов, в мем-
бранной упаковке. Как правило, в канальцах большинства
животных удается выделить 4 отдела: начальный, 2 основных
(проксимальный и дистальный) и конечный. В последнем моча
накапливается перед ее выведением наружу. Начальный от-
дел служит для фильтрации первичной мочи в полость каналь-
ца из тканевой жидкости, полости тела или крови, Механизмы
этого процесса’ различны. Основную роль здесь играют рес-
нички или жгутики. Первичная моча может также фильтро-
ваться за счет гидростатического давления из крови и гемо-
лимфы или полостной жидкости.
В некоторых типах канальцев — агломерулярные нефроны
некоторых морских рыб, мальпигиевы сосуды насекомых — на-
чальный отдел отсутствует. Первичная моча попадает при этом
в проксимальный отдел канальца-в основном путем так назы-
ваемой осмотической фильтрации или изоосмотиче-
ской секреции. Механизмы такой фильтрации сходны с меха-
низмами реабсорбции. Они основаны, по-видимому, на создании
локальных областей с повышенным осмотическим . давле-
нием. Однако направления работы этих механизмов при осмо-
тической фильтрации и при реабсорбции противоположны:
6 672 ' 161
в проксимальные отделы нефронов морских рыб и мальпиги-
евых сосудов насекомых поступает вода с растворенными в ней
органическими и неорганическими компонентами из крови и ге-
молимфы.
В типичных канальцах проксимальный отдел обеспечивает
•реабсорбцию воды и значительной части содержащихся в ней
нужных организму веществ. Процессы реабсорбции могут про-
исходить в условиях, близких изоосмотическим, т. е. при отно-
сительно небольшой разнице концентраций веществ в тканевой
жидкости и в формирующейся моче*. При этом нужные для
-организма соединения извлекаются из полости канальца с боль-
шим количеством воды.
В дистальном отделе канальца, наоборот, количество реаб-
сорбируемой воды обычно минимально. При этом избиратель-
но реабсорбируются ионы против градиента концентрации.
В проксимальном и реже в дистальном отделах канальцев
происходит наряду с реабсорбцией секреция ионов и некото-
рых конечных органических продуктов азотистого обмена,
а также вредных для организма экзогенных веществ.
Проксимальный отдел канальцев меньше подвергается изменениям
в процессе эволюции. Дистальный отдел основной части канальца более ла-
билен. Он может почти полностью редуцироваться или, наоборот, приобре-
тать весьма сложное и дифференцированное строение, что наблюдается,
в частности, у птиц и млекопитающих и у высших первнчноротых (насеко-
мые). У животных, приспособленных к жизни в экстремальных в отноше-
нии водного баланса условиях (недостаток воды, необходимость использо-
вать морскую воду, поглощение с пищей большого или, наоборот, недоста-
точного количества солей) независимо от их систематического положения
в дополнение к специальным осморегулирующим и выделительным органам
в системах кожного, а иногда и кишечного эпителиев развиваются вспомо-
тательные осморегулирующие дифференцировки (солевые железы у рептилий
:и птиц, хлоридные клетки рыб, ректальные железы элязмобранхий, пресно-
водных личинок насекомых и личинок, обитающих в морской воде). Кроме
того, осморегулирующую, а частично и выделительную функции выполняют
и некоторые железистые клетки (бокаловидные), а также специальные же-
.лезы (потовые и слюнные) или участки кожного и кишечного эпителиев (на-
пример, кожный эпителий амфибий, кишечный эпителий насекомых и асци-
дий). Все эти воспомогательные осморегулирующие образования функцио-
нально (чаще через гормональную и нервную регуляцию) связаны в единую
•систему с основными осморегулирующими и выделительными органами.
Одним из распространенных среди низших многоклеточных
типов осморегулирующих и выделительных канальцев являют-
ся протонефридии — органы эктодермального происхождения.
'Они характерны для немертин, турбеллярий, цестод, нематод,
низших полихет и ряда других групп животных. Протонефри-
дии представляют собой слепозамкнутые эпителиальные «а-
* Заметные различия в осмотическом давлении, необходимые для транс-
порта воды, создаются лишь в небольших областях, непосредственно связан-
ных с клеточными мембранами.
162
нальцы, начальный отдел которых располагается в паренхиме.
Он образован специальной терминальной клеткой — циртоци-
том, или системой таких клеток, несущих жгутики (рис. 43,
а, б). Цитоплазма этих клеток образует вокруг жгутика свое-
образный воротничковый, или корзинчатый аппарат. Стенка
канала может быть сформирована цитоплазмой нескольких
терминальных клеток (например, у приапулид) или одной клет-
кой (у низших полихет). В обоих случаях—-это аппараты, че-
рез которые в полость канала происходит ультрафильтрация
тканевой жидкости. Она поступает внутрь благодаря разреже-
нию пространства в полости канальца, что обусловлено бие-
нием жгутика. У приапулид жидкость поступает внутрь каналь-
ца через зигзагообразные межклеточные контакты. В протоне-
фридиях у низших полихет' жидкость фильтруется через щели
или истонченные участки корзинчатого аппарата терминальных
клеток.
У животных с развитой сосудистой системой (ланцетник,
некоторые немертины) терминальные клетки протонефридия
вступают обычно в контакт с ней (рис. 43, в, а). У немертин,
это может приводить к существенным изменениям в строении
начального отдела канальца и замене жгутиковых клеток на
ресничные (рис. 43, в). У ланцетника сохраняется структура
корзинчатых терминальных клеток, которые образуют лишь
характерный дополнительный отросток, своим разветвленным
концом контактирующий со стенкой кровеносного сосуда (рис.
43, г).
Несмотря на разнообразие начальных отделов протонефри-
диев все они представляют собой специальные аппараты уль-
трафильтрации, основными структурами которых являются об-
разуемые клетками своеобразные фильтры (внеклеточное веще-
ство базальных мембран и цемент межклеточных контактов,
надмембранные структуры в области отверстий и щелей кор-
зинчатого аппарата) и жгутики терминальных клеток. Обра-
ботку ультрафильтрата, в частности реабсорбцию воды орга-
нических веществ и ионов, осуществляет эпителий проксималь-
ных и дистальных отделов канальцев протонефридиев.
ОднаКо изучены они в структурно-функциональном отношении
еще весьма слабо. У некоторых цестод показана реабсорбция
глюкозы, лактата и мочевины из ультрафильтрата*. В эпите-
лии канальцев протонефридиев у изученных представителей
турбеллярий и немертин обнаружена фосфатазная активность.
Вторым относительно широко распространенным типом ос-
морегулирующих и выделительных эпителиальных канальцев
являются метанефридии. Первично они возникали, по-видимо-
* Имеются данные о том, что развитая система канальцев протонефри-
диев у крупных цестод может выполнять и трофическую транспортную
функцию.
164
му, на основе целомодуктов— эпителиальных канальцев мезо-
дермального происхождения, обеспечивавших выведение поло-
вых продуктов из вторичной полости тела в наружную среду.
Наиболее близкая этим первичным отношениям структура
наблюдается у большинства современных морских полихет.
Начальный отдел канальцев представлен у них воронкой, кото-
рая открывается в полость тела и выстлана ресничным эпите-
Рис. 44. Метанефридий дождевого чер-
вя и зеленая железа ракообразных.
а — метанефридий [по: Андрю], б —началь-
ный отдел метанефрндия, в — схема строения
зеленой железы ракообразных (по:
В. Н. Беклемишев, 1964). / — реснички, 2 —
воронка, 3 — основной отдел метанефридня,
4 — конечный отдел, 5 — целомический мешо-
чек — начальный отдел зеленой железы.
165
лием. Биение ресничек обеспечивает поступление полостной
жидкости в полость канальца. У некоторых полихет вблизи от-
верстия воронки, в стейке полости тела обнаружены сосуди-
стые сплетения, из которых происходит фильтрация жидкой
части крови в полость тела. Основной каналец метанефридиев
морских полихет обычно не достигает большой длины.
Более сложно устроены метанефридии у олигохет, в част-
ности у дождевого червя. Начальный отдел канальцев так же,
как и у полихет, образован воронкой, выстланной ресничным
эпителием (рис. 44, а, б). Основная часть канальца — его прок-
симальный и дистальный отделы — достигают большой длины.
Тонкий в диаметре проксимальный и относительно толстый
дистальный отделы в свою очередь делятся на 2—3 участка.
Это свидетельствует о сложности процессов реабсорбции
и секреции в этих отделах канальцев. Конечный отдел метане-
фридиев представлен ампулообразным расширением, открываю-
щимся нефридиальной порой. В метанефридиях дождевого
червя канальцы тесно связаны с кровеносными сосудами, об-
разующими по ходу канальца специальное сплетение. Такая
связь необходима, вероятно, для интенсификации реабсорбции
и секреции.
Видоизмененными метанефридиями являются зеленые же-
лезы ракообразных и головные нефридии насекомых, а также,
по-видимому, почки моллюсков. Начальные отделы зеленых же-
лез и головных нефридиев представляют собой рудимент це-
лома. Они расширены и имеют вид мешочка, выстланного спе-
циализированными клетками целомического эпителия (рис. 44,
в). Из гемолимфы, омывающей такой мешочек, в его полость
поступает ультрафильтрат. В среднем отделе канальца, кото-
рый делится на проксимальную и дистальную части, происхо-
дят процессы реабсорбции и секреции. В каудальном отделе
канальца, в его ампулообразном расширении, накапливаются
концентрированные жидкие продукты обмена. Отсюда они по-
ступают в наружную среду через выводные отверстия в стен-
ке тела животных.
Большого развития достигают фильтрационные выделительные си-
стемы, основанные на тесных структурных и функциональных взаимо-
связях сосудистой системы с выделительными канальцами у моллюсков,
У большинства моллюсков образование первичной мочи происходит при со-
кращении сердца путем ультрафильтрации жидкой части крови через стенку
предсердия в рудимент целома — перикардиальную полость. Последняя свя-
зана реиоперикардиальным каналом, выстланным ресничным эпителием, с по-
лостью почечного мешка. Реабсорбционный отдел почки моллюсков имеет
большой диаметр. В нем формируются ^многочисленные складки. Клетки
эпителия почечного мешка обеспечивают реабсорбцию, полезных веществ
и воды и секрецию конечных продуктов метаболизма. Последние часто на-
капливаются в виде больших конкреций в апикальной части клеток. Часть
клеток с большим количеством экскреторных включений может слущиваться
в просвет почечного мешка. В почке некоторых моллюсков обнаружены и осо-
166
бые камбиальные участки, за счет размножения клеток которых сохраняется
динамическое постоянство количества клеток эпителиальной выстилки почеч-
ного мешка. Каудальный участок выделительной системы представлен моче-
точниками, эпителий которых у наземных моллюсков обладает способностью
к активному транспорту ионов.
Наиболее хорошо изучены в структурно-функциональном
отношении почки позвоночных животных и мальпигиевы сосу-
ды насекомых — основные выделительные и осморегулирующие
органы.
Эпителиальные канальцы почки позвоночных в эмбриогене-
зе развиваются из специального мезодермального зачатка —
нефротома. Источник их развития в филогенезе неясен. Основ-
ной структурной единицей почки млекопитающих является
нефрон — слепозамкнутый в начальном отделе эпителиальный
каналец, конечный отдел которого открывается в собиратель-
ную трубку. Моча из собирательных трубок поступает в почеч-
z ную лоханку, мочеточники и мочевой пузырь с выводящими
путями. Последние четыре образования представляют собой по
нашей классификации дифференцированный конечный отдел
осморегулирующей и выделительной системы. Его назначение
заключается в накоплении и выведении готовой мочи. Форми-
рование происходит в начальных отделах нефронов, в их основ-
ных частях — проксимальных и дистальных отделах и в систе-
ме собирательных трубочек. Существенную роль в формирова-
нии мочи играют также сосудистая система и соединительная
ткань, основное вещество которой способно удерживать ионы.
Начальный отдел нефрона -вместе с капиллярным артери-
альным клубочком образует сложный фильтрационный аппа-
рат. Через него в полость капсулы нефрона — слепо замкну-
того начального отдела канала — фильтруется первичная моча
(рис. 45,а). Из нее в канальце нефрона реабсорбируются вода,
глюкоза, аминокислоты и некоторые другие вещества. У млеко-
питающих в нем по функциональному признаку удается выде-
лить два основных отдела — проксимальный и дистальный.
В состав проксимального отдела входит начальный участок
канальца до нисходящего тонкого отдела петли Генле. Ди-
стальный участок образован тонким (нисходящим и восходя-
. щим) и толстым восходящим отделами петли Генле и дисталь-
ным извитым канальцем. Последний открывается в собиратель-
ную трубку, которую в функциональном отношении следует
отнести к дистальному отделу' канальцев.
Мальпигиевы сосуды представляют собой осморегулирую-
щие и выделительные эпителиальные канальцы, образующиеся
полифилетично у представителей ряда классов наземных чле-
нистоногих, в частности у насекомых, на основе выростов кау-
дального отдела средней кишки. Это — слепозамкнутые на
проксимальных концах эпителиальные канальцы, открываю-
щиеся дистальными концами на границе средней и задней
167
Рис. 45. Микроанатомическая схема строения нефрона почки млекопитающих
[В. Г. Елисеев и др., 1972] и варианты взаимоотношений мальпигиевых со-
судов и кишки насекомых (по: Wall, 1979).
Схемы: а — иефрона, б — взаимоотношения конечных отделов мальпигиевых сосудов
со стенкой средней кишки, в — периректального нефридиального комплекса. 1 — капсула
нефрона, 2, 3 — извитая (2) и прямая (3) части проксимального отдела, 4, 5 — нисхо-
дящая (4) и восходящая (5) части петли нефрона, 6 — извитая часть дистального от-
дела, 7— собирательная трубка, 8— мальпигиев сосуд, 9, 10 — полость средней (9)
и задней (10) кишки, 11 — полость ампулообразного расширения, 12 — периректальное
пространство, 13 — мышечный сфинктер. Стрелки показывают направление перемеще-
ния жидкости (тонкие) и ионов К“Ь (толстые), плотность точек соответствует величи-
не осмотического давления.
168
кишки в просвет кишечника. Количество канальцев варьирует
в широких пределах (от 2 до 150 и больше). У большинства
насекомых эпителиальные канальцы свободно лежат в гемо-
целе и омываются снаружи гемолимфой. В отличие от других
типов канальцев они лишены специального фильтрационного
аппарата. Поступление первичной мочи в его полость осущест-
вляется на протяжении всего канальца через основные эпите-
лиальные клетки с их характерными структурами в базальной
и апикальной частях.
Процессы реабсорбции, по-видимому, частично осуществля-
ются специальными клетками в стенке канальца. Существен-
ную роль в избирательной реабсорбции ионов и низкомолеку-
лярных органических соединений играет, по-видимому, кишеч-
ный эпителий, выстилающий ампулообразные расширения
дистальных отделов мальпигиевых сосудов (рис. 45,6). В обла-
сти соединения конечных участков мальпигиевых сосудов со
стенкой кишки имеется мышечный аппарат, при сокращении
которого первичная моча может задерживаться в этих участ-
ках, что позволяет выстилающим их клеткам обеспечить обрат-
ное всасывание из мочи в гемолимфу углеводов, жиров и ами-
нокислот.
Наконец, весьма существенную роль в процессах реабсорб-
ции играют участки кутикулярного эпителия в конечных
отделах задней кишки, так называемые ректальные утолщения.
У некоторых насекомых мальпигиевы сосуды вступают в непо-
средственную структурную связь с этими дифференцированны-
ми участками кутикулярного эпителия задней кишки, что обе-
спечивает создание весьма совершенной (в смысле экономии
воды) осморегулирующей системы организма (рис. 45,в).
§ 2. Тонкая структурная организация фильтрационных
и реабсорбционных отделов
осморегулирующих эпителиальных канальцев
Фильтрационные аппараты. В предыдущем разделе уже рас-
сматривалась тонкая структурная организация фильтрацион-
ных аппаратов протонефридиев (см. рис. 43). Не менее харак-
терны и особенности организации фильтрационных аппаратов
в канальцах, структурно связанных с сосудистой системой
(нефроны позвоночных, почка моллюсков, зеленые железы ра-
кообразных) .
Основные особенности тонкой структурной организации этих
аппаратов мы разберем на примере начального отдела нефро-
на млекопитающих и человека. Начальный отдел канальца
образован здесь капсулой, которая . представляет собой спе-
циализированный участок его фильтрационного аппарата. Вто-
рой частью этого аппарата является клубочек артериальных
капилляров, находящихся в тесном контакте с эпителиальными
169
Рис. 46. Схема ультраструктурной организации подоцитов млекопитающих (а), членистоногих (5).
( — ядросодержащая часть клетки. 2 - отростки подоцитов. Л — базальная мембрана.-/ — ашилслий с пирами.
170
клетками внутреннего листка капсулы нефрона. Эпителий на-
ружного листка капсулы непосредственно переходит в эпите-
лиальную выстилку канальца нефрона. Между внутренним
и наружным листками капсулы образуется полость, в которую
и происходит фильтрация первичной мочи. Процессы фильтра-
ции обусловлены в основном высоким гидростатическим давле-,
нием, возникающим в капиллярах клубочка за счет разницы
диаметров приносящих и выносящих артерий. Развитию давле-
ния способствует и слабая растяжимость базальной мем-
браны стенки капилляров, образованной особым типом кол-
лагена.
Первый фильтр на пути ультрафильтрата в мальпигиевом
тельце нефрона образован клетками эндотелия стенки капил-
ляров клубочка с многочисленными порами (рис. 46, а). Вто-
рой фильтр представлен толстой базальной мембраной, распо-
ложенной между эндотелием и . эпителиальными клетками
внутреннего листка капсулы нефрона.* Она сформирована из
фибрилл особого коллагена (коллаген 4-го типа), выделяемого
эпителиальными клетками капсулы и состоит из двух рыхлых
(наружный и внутренний) слоев и более плотной центральной
пластинки. Базальная мембрана по толщине в три раза пре-
вышает обычные базальные мембраны. Она не пропускает
крупные белковые молекулы и представляет собой динамичное
образование — в прилегающей к эндотелию части происходит
деградация ее фибрилл, а со стороны эпителия капсулы — их
новообразование. Наконец, третьим фильтром на пути ультра-
фильтрата являются отростки подоцитов — специализирован-
ных эпителиальных клеток внутреннего листка капсулы неф-
рона. Их строение весьма своеобразно. От ядросодержащих
частей клеток по направлению к базальной мембране отходят
выросты цитоплазмы, называемые главными отростками или
цитотрабекулами. Они идут параллельно длинной оси капил-
ляра и по всей своей длине образуют короткие расширяющиеся
на концах отростки — цитоподии. Последние непосредственно
контактируют с базальной мембраной. Образующиеся между
соседними цитоподиями межклеточные пространства, или филь-
трационные щели, затянуты диафрагмой. Она представляет
собой гипертрофированные надмембранные комплексы конце-
вых расширенных участков цитоподий с адсорбированными на
них белками. В целом эти участки цитоподий подоцитов с филь-
трационными щелями и диафрагмой, как отмечалось выше,
представляют собой третий фильтр на пути ультрафильтрата.
В нормальных условиях он способен задерживать наиболее
мелкие белковые молекулы плазмы крови.
Типичные подоциты имеются и в ампулообразных расшире-
ниях передних отделов видоизмененных метанефридиёв рако-
образных и насекомых. Вся эпителиальная выстилка этих видо-
измененных участков целома образована отростчатыми клет-
171
Рис. 47. Схема ультраструктурной организации реабсорбирующих клеток
у млекопитающих и основных клеток мальпигиевых сосудов насекомых,
а — проксимальные, б —дистальные отделы канальцев в нефроне млекопитающих,
в — схема ультраструктурной организации клетки эпителия мальпигиевых сосудов на-
секомых, г — схема перемещения ионов (толстые стрелки) и воды (тонкие стрелки)
в клетках мальпигиевых сосудов. 1 — микроворсинки, 2 — аппарат Гольджи, 3 — лизо-
сомы, 4 — базальные впячивания плазматической мембраны с митохондриями. Плот-
ность точек соответствует величине осмотического давления.
9
172
ками. Содержащие ядра участки цитоплазмы этих клеток
расположены на некотором расстоянии от базальной мембра-
ны. Между прилегающими, к базальной мембране отростками
имеются многочисленные щели, где полость мешочка и окру-
жающая его гемолимфа разделены лишь мембраной
(рис. 46, б). Размеры ячеек в сети коллагеновых фибрилл ба-
зальной мембраны у ракообразных меньше диаметра молекул
гемоцианина — дыхательного фермента, находящегося в гемо-
лимфе этих животных.
Подоциты обнаружены у головоногих, а также у некоторых
брюхоногих моллюсков. У головоногих моллюсков они
находятся в так называемых перикардиальных железах, или
бронхиальных сердцах, где и происходит, по-видимому, ультра-
фильтрация. У брюхоногих моллюсков местом локализации
подоцитов может быть либо стенка предсердия, либо стенка
желудочка сердца.
Типичные подоциты обнаружены у полихет в стенке целома,
в области специализированных разветвлений сосудов у воронок
метанефридиев.
Таким образом, имеющиеся сравнительно-цитологические
данные свидетельствуют о том, что подоциты весьма широко
распространены в осморегулирующих и выделительных ка-
173
нальцах многоклеточных животных. Они имеются у таких не-
родственных групп животных, как позвоночные, членистоногие,
некоторые моллюски и полихеты. Подоциты представляют со-
бой один из вариантов специфической дифференцировки эпи-
телиальных клеток для обеспечения клеточного контроля за
процессами фильтрации. Широкое распространение таких кле-
ток в эпителиальных канальцах далеко .отстоящих групп жи-
вотных свидетельствует и о многократном независимом их
возникновении в эволюции и о весьма важном функциональном
значении. Между подоцитами и корзинчатыми клетками про-
тонефридиев имеется, по-видимому, глубокая связь. О ее нали-
чии свидетельствуют описанные выше циртоподоциты ланцет-
ника. Специфический отросток таких клеток структурно
и функционально аналогичен отросткам подоцитов других жи-
вотных, а сами клетки имеют типичную структуру корзинчатых
клеток. Таким образом, у ланцетника присутствуют оба меха-
низма клеточного контроля за процессами фильтрации: и со
стороны разветвленного подоцитного отростка, и со стороны
щелей корзинчатого, аппарата.
Основные отделы эпителиальных канальцев. У человека из
образующихся за сутки 170—200 литров первичной мочи в ре-
зультате деятельности эпителиальных клеток основных отделов
выделительных канальцев происходит реабсорбция около 99%
этой жидкости с содержащимися в ней органическими и неор-
ганическими соединениями. Об интенсивности работы этих кле-
ток свидетельствует тот факт, что в почках расходуется 10—
12% всей энергии, получаемой организмом в процессах окисли-
тельного фосфорилирования.
Проксимальный отдел нефрона, представленный извитым
начальным канальцем и толстым прямым нисходящим участ-
ком петли Генле, выполняет наибольшую по объему реабсор-
бирующую функцию. На его долю приходится около 85% ре-
абсорбируемой воды и ионов. Здесь же реабсорбируются прак-
тически все аминокислоты и глюкоза. Стенка проксимальных
отделов канальцев' состоит из призматических клеток. На их
апикальной поверхности имеется щеточная каемка, образован-
ная многочисленными микроворсинками с хорошо развитым
гликокаликсом (рис. 47, а), т. е. резко гипертрофирована плаз-
матическая мембрана, благодаря чему общая площадь ее со-
прикосновения с ультрафильтратом в проксимальном отделе
резко возрастает по сравнению с другими отделами нефрона.
Кроме того, у рассматриваемых клеток значительно гипертро-
фирована базальная плазматическая мембрана, образующая
глубокие щелевидные впячивания в базальной и нижней лате4
ральной частях клеток. Здесь же обычно наблюдаются скопле-
ния митохондрий. Базальная часть клеток контактирует с раз-
ветвленной сетью капилляров. В базальной и латеральной
плазматических мембранах сосредоточено большое количество
174
мембранных насосов, которые обеспечивают непрерывное вы-
ведение ионов в межклеточные щелевидные пространства.
Благодаря проницаемости клеточных мембран для воды
и большой поверхности их соприкосновения с ультрафильтра-
том вода в силу осмотических условий устремляется в область
повышенной концентрации ионов. Хорошо развитая система
капилляров обеспечивает быстрое удаление избытка ионов
и воды в кровеносное русло. Клетки проксимальных отделов
нефроно’в обладают также биохимическими механизмами для
всасывания аминокислот, глюкозы и ряда других соединений.
Наряду с этим они способны секретировать в просвет канальца
ряд конечных органических продуктов обмена, а также экзо-
генные вредные соединения, которые могут попасть в кровя-
ное русло при отравлении организма.
Не менее важной функцией клеток проксимального отдела
нефрона является их способность поглощать из ультрафильт-
рата путем пиноцитоза высокомолекулярные соединения и пе-
реваривать их с помощью лизосом. Эта функция особенно важ-
на для утилизации организмом белков ультрафильтрата, кото-
рые всегда в небольшом количестве содержатся в первичной
моче.
Диаметр наиболее важных участков дистальных отделов
нефрона — толстого восходящего отдела петли Генле и ди-
стальных извитых канальцев несколько меньше диаметра ка-
нальцев проксимального отдела. Клетки, образующие стенку
канальцев, несколько меньше призматических клеток прокси-
мальных участков (рис. 47,6). Для них характерно отсутствие
щеточной каемки на апикальной поверхности. Здесь обнару-
живаются лишь единичные неправильной формы микроворсин-
ки. В базальной части клеток имеется, как и в клетках прок-
симальных отделов, система глубоких впячиваний плазматиче-
ской мембраны с большим количеством митохондрий. Наибо-
лее важная функциональная особенность рассматриваемых
клеток — слабая проницаемость их мембран и межклеточных
контактов для воды. Благодаря этому реабсорбция ионов за
счет деятельности мембранных ионных насосов не сопровожда-
ется пассивным транспортом воды, как это наблюдается в клет-
ках проксимального отдела. В результате такого активного тран-
спорта ионов моча в конечных участках дистального отдела
нефрона становится гипоосмотичной, а в окружающей каналь-
цы соединительной ткани локально повышается осмотическое
давление главным образом за счет реабсорбируемых ионов
Na+. Кроме того, часть последних поступает через стенку тон-
кого нисходящего отдела петли Генле в просвет канальца. Эти
особенности процессов реабсорбции ионов в дистальных отде-
лах нефрона создают предпосылки для формирования системы,
обеспечивающей возможность регулировать концентрацию ве-
ществ в моче, в частности формирование гипертонической
175
мочи — весьма важное приспособление для жизни в условиях за-
сушливых районов. На характеристике этих систем мы остано-
вимся в заключительном разделе настоящей главы (см. стр. 183).
Отмеченные структурные и функциональные особенности эпителия прок-
симального и дистального отделов характерны для нефронов всех позвоноч-
ных животных. Больше того, как показали ультраструктурные исследования
проксимального и дистального участков канальцев зеленой железы ракооб-
разных, эпителиальные клетки этих отделов отличаются теми же особенно-
стями, что и у млекопитающих. Клетки проксимального отдела имеют раз-
витую щеточную каемку, а у клеток дистального отдела она отсутствует.
Оба типа клеток обладают хорошо выраженной складчатостью базальной
мембраны, однако клетки дистального отдела содержат большее количество
митохондрий в базальной части, а их базальные мембраны образуют больше
складок.
Ультраструктурная организация основных клеток мальпи-
гиевых канальцев насекомых (рис. 47, в) сходна с ультраструк-
турой клеток проксимального отдела нефрона млекопитающих
(рис. 47, а). Особенностью эпителия мальпигиевых канальцев
является лишь скопление митохондрий и в апикальной части
клеток. Часть их заходит даже внутрь хорошо развитых микро-
ворсинок. При внешнем сходстве организации клеток прокси-
мального отдела нефрона млекопитающих и мальпигиевого
сосуда насекомых между ними имеются глубокие функцио-
нальные различия. Эти клетки работают в противоположных
направлениях. Эпителий мальпигиевых сосудов обеспечивает
в основном поступление первичной мочи из гемолимфы в по-
лость канальца. По одной из распространённых гипотез ион-
ные насосы, расположенные в базальной части плазматиче-
ской мембраны, создают локальную повышенную концентра-
цию ионов в цитоплазме базальных отростков клеток. Сюда
из межклеточных щелей начинает поступать вода с растворен-
ными в ней веществами. Вторая зона локального повышения
концентрации ионов создается в примембранных внеклеточных
участках на апикальной поверхности клеток. Естественно, что
и в эту область из клеток устремляется вода с растворенными
в ней веществами, которые оказываются таким образом в по-
лости канальца (рис. 47,а).
§ 3. Вспомогательные осморегулирующие
эпителиальные системы
Повышенная солевая нагрузка возникает у рыб, рептилий,
птиц и насекомых при поглощении большого количества солей
с пищей и водой или при поступлении их через кожные покро-
вы и кишечник при обитании животных в морской воде или за-
соленных водоемах. С выведением этих избыточных количеств
ионов не в состоянии справиться основные осморегулирующие
системы организма. Необычные условия солевого режима со-
176
здаются и у пресноводных животных, теряющих большое ко-
личество солей через кишечник и кожные покровы при обита-
нии в пресной воде. В этих условиях у перечисленных животных
независимо полифилетично в каждом классе животных (в пре-
делах класса рептилий даже у представителей разных групп)
развиваются вспомогательные осморегуляторные системы, ло-
кализованные главным образом в кожном эпителии.
У рыб и водных личинок насекомых они представлены хло-
ридными клетками, а у рептилий и птиц — солевыми железами.
У рыб хлоридные клетки представляют собой особую суб-
популяцию, локализованную в эктодермальном эпителии осно-
вания жабр. Сейчас уже подробно изучена их функциональная
морфология, ультра структур а и ее изменения под влиянием
меняющихся осмотических условий внешней среды. Такие из-
менения морфологии клеток показаны для многих представите-
лей рыб, обладающих способностью к периодическим мигра-
циям из морской воды в пресную и обратно.
У одного из таких представителей — японского угря (Anguilla japoni-
са) — в многослойном эпителии основания жабр среди обычных эпителиаль-
ных клеток имеются крупные клетки с резко оксифильной цитоплазмой
(клетки первого типа) и клетки меньших размеров, цитоплазма которых
окрашивается эозином в бледно-розовый цвет (клетки второго типа). При
специальных окрасках удается обнаружить, что одной из наиболее харак-
терных особенностей этих клеток является обилие в них митохондрий, коли-
чество которых особенно велико в клетках первого типа.
При перенесении животных в морскую воду на протяжении первых трех
суток в два раза увеличивается количество оксифильных клеток обоих ти-
пов. На протяжении последующих недель количество клеток с резко окси-
фильной цитоплазмой продолжает нарастать. К концу этого срока их в 8 раз
больше, чем у животных, обитающих в пресной воде. Клетки же со слабо
оксифильной цитоплазмой к концу второй недели пребывания животных
в морской воде исчезают совсем. При перенесении этих животных в прес-
ную воду происходит постепенное уменьшение в эпителии числа клеток
с резко оксифильной цитоплазмой. Все эти изменения в кожном эпителии
основания жабр обусловлены гормональной регуляцией, связанной с измене-
нием концентрации ионов в крови.
Таким образом, очевидно, что у рыб в основании жабр располагается
важная осморегулирующая система, способная к существенной гипертрофии
при изменении ионного состава тканевых жидкостей организма. Основным
механизмом такой гипертрофии является увеличение количества хлоридных
клеток за счет быстрого дозревания клеток со слабо оксифильной цитоплаз-
мой. При этом, однако, количество последних не только не уменьшается
в течение первых трех суток после начала опытов, но, наоборот, увеличи-
вается к концу этого срока почти в два раза. Такая сложная динамика чис-
ленности дифференцированных и вступающих на путь дифференцировки кле-
ток при адаптации к морской воде свидетельствует о наличии системной ре-
акции многослойного эпителиального пласта. При повышении концентрации
ионов в тканевых жидкостях происходит дозревание клеточных элементов
при одновременной вспышке размножения камбиальных клеток и быстрой
дифференцировке образующихся клеток в направлении хлоридных клеток.
Интенсивность пролиферации и дифференцировки на ранних сроках адапта-
ции животных к морской воде оказывается выше, чем процессов дозревания
хлоридных клеток. Благодаря этому увеличивается количество как зрелых
дифференцированных клеток, так и клеток, находящихся в процессе диффе-
177
ренцировки. По мере увеличения количества дифференцированных клеток
уменьшается концентрация ионов в тканевой жидкости. Одновременно снижа-
ется темп размножения камбиальных клеток и начинают преобладать процессы
дозревания вступивших на путь дифференцировки клеток. В результате это-
го количество клеток со слабо оксифильной цитоплазмой постепенно умень-
шается.
Зрелая хлоридная клетка имеет.весьма характерную струк-
туру. Основная часть ее цитоплазмы заполнена многочислен-
ными митохондриями с хорошо развитыми, плотно упакован-
ными кристами и большим количеством гранул в матриксе
(рис. 48). Вторая характерная особенность этих клеток — ги-
пертрофия мембранных структур гладкой эндоплазматической
сети, представленной разветвленной системой канальцев. Ги-
пертрофирована также и плазматическая мембрана, которая
в базальной части клеток образует глубокие складки. В апи-
кальной части активно функционирующей хлоридный клетки
формируется зона, свободная от митохондрий и богатая пу-
зырьками различных размеров и формы. Есть предположение,
что именно эти пузырьки накапливают избыточные ионы и вы-
водят их в наружную среду путем экзоцитоза. Таким образом,
хлоридные клетки играют роль мощных опреснителей, обеспе-
чивая выведение избытка ионов из организма, приобретающе-
го способность использовать для своих нужд морскую воду.
Наличие таких клеток коррелирует у многих рыб с сокраще-
нием расхода воды на процессы фильтрации в нефронах почки.
У этих рыб клубочковый аппарат нефронов обычно редуци-
руется, а первичная моча образуется путем изоосмотической
секреции, т. е. аналогично этим процессам в мальпигиевых
сосудах насекомых.
При помещении проходных рыб, адаптированных к морской
воде, в пресную воду происходит существенная перестройка
клеточной ультраструктуры. В клетках резко уменьшается ко-
личество митохондрий, сильно редуцируется количество крист
в их внутренней мембране, исчезают гранулярные включения
в матриксе. В апикальной части клеток увеличиваются разме-
ры микроворсинок и редуцируются участки цитоплазмы с огра-
ниченными мембраной пузырьками и вакуолями. Заметной ре-
дукции подвергаются также и мембранные структуры эндоплаз-
матической сети. Значительная часть (около 3/4) хлоридных
клеток дегенерирует к концу четвертой недели пребывания
животных в пресной воде. Остающиеся в эпителии клетки пред-
ставляют собой не просто резервный аппарат осморегуляции,
а функционирующую систему. Однако направление работы
этой системы меняется. Вместо выведения избытка солей иэ
организма они начинают активно поглощать соли, находящие-
ся в небольшом количестве в пресной воде.
У некоторых пресноводных личинок насекомых в опреде-
ленных участках кожных покровов (на конечностях и в тра-
178
рнс 48 Схема ультраструктурной организации солевой клетки у костистой
* ' рыбы.
I - межклеточные контакты, 2’- "Узырьки, °^охондрий! 5М-Ммитохондрия, 6 — ядро,
синти, 4 - «»= плазматической Spa^ 8 С гладкая ЭПС.
179
хейных жабрах) среди обычных клеток кутикулярного эпите-
лия обнаружены одиночные клетки или группы клеток с по-
вышенной оксифилией цитоплазмы и особым строением кути-
кулы над апикальной поверхностью этих клеток. Их кутикула
представляет собой истонченную, пронизанную многочисленны-
ми порами структуру. На апикальной поверхности клеток
плазматическая мембрана образует глубокие впячивания. Бла-
годаря этому здесь возникают щелевидные внеклеточные про-
странства, которые контактируют с порами кутикулярной пла-
стинки. Одиночные клетки сходны с хлоридными клетками рыб,
обитающих в пресной воде (на апикальной поверхности глубо-
кие впячивания плазматической мембраны, обилие митохонд-
рий, в матриксе которых отсутствуют гранулы). При групповом
расположении оксифильных клеток имеется одна центральная
и две периферические клетки. У центральной клетки развиты
впячивания апикальной плазматической мембраны, а у пери-
ферических—'базальные впячивания плазматической мембра-
ны и многочисленные митохондрии. Основная функция всех этих
клеток заключается в активном поглощении из внешней среды
ионов.
Хлоридные клетки могут развиваться и у личинок некото-
рых насекомых, обитающих в засоленных водоемах и морской
воде. В этом случае они приобретают морфологическое сход-
ство с хлоридными клетками рыб, адаптированными к жизни
в морской воде. У них гипертрофирована плазматическая мем-
брана в базальной части клеток и резко увеличено количество
митохондрий. Естественно, что основной функцией таких кле-
ток становится выведение избытков ионов во внешнюю среду.
Такие клетки чаще всего возникают в эпителии задней кишки,
а у некоторых насекомых и в системе кишечного всасывающе-
го эпителия.
У рептилий и птиц, обладающих способностью использо-
вать богатую солями воду, обычные железистые образования
(слезные, носовые и некоторые другие железы) преобразуются
в так называемые солевые железы. Основное их назначение
заключается в выведении избытка солей из организма. Конце-
вые отделы этих сложных трубчатых желез образованы секре-
торными клетками, аналогичными по своей функции хлоридны-
ми клетками рыб. При переводе таких животных на богатый
солями пищевой и водный режим в солевых железах имеют
место двоякого рода процессы: с одной стороны, разрастается
железистая ткань, и, следовательно, увеличивается количество
клеток, с другой — изменяются и сами клетки. Количество ми-
тохондрий в них возрастает с 20% от общего объема цитоплаз-
мы до 50%. Одновременно сильно увеличивается и общая по-
верхность плазматической мембраны. На базальной и боковых
поверхностях клеток образуются многочисленные впячивания
и выросты, придающее клетке характерный звездчатый вид.
180
У представителей разных групп рептилий таким превращениям
(перестройка обычных желез в солевые железы) подвергаются
негомологичные железы. Это свидетельствует о независимом
полифилитичном происхождении солевых желез даже в преде-
лах одного класса.
§ 4. Некоторые общие закономерности эволюционной динамики
осморегулирующих и выделительных эпителиев
Особенностью рассматриваемых эпителиев является их про-
исхождение из разных источников. Действительно, системы
хлоридных клеток, прото- и метанефридии, нефроны, мальпи-
гиевы сосуды — все это негомологичные образования. Они име-
ют разные источники и пути развития в филогенезе многокле-
точных животных. Тем не менее общность функциональной за-
дачи, а также универсальных клеточных механизмов, на основе
которых специализируются эти клетки, и обусловливает чрезвы-
чайно широкое распространение в этих структурах сходных
морфобиохимических дифференцировок. В основе осморегули-
рующей и выделительной функции лежат процессы активного
ионного транспорта и процессы эндо- и экзоцитоза. Сущность
специализации клеток сводится в основном к гипертрофии об-
щих для всех клеток аппаратов активного транспорта, что мы
и наблюдаем в тонкой структуре секретирующих или поглоща-
ющих соли клеток кожного эпителия: в клетках эпителия неф-
рона, в мальпигиевых сосудах, в краниальных метанефридиях
насекомых и в зеленой железе ракообразных. Аналогичную
дифференцировку имеют эпителии хориальных сплетений, ци-
лиарного тела, глаза, протоков слюнных желез у млекопита-
ющих, эпителии ректальных желез у хрящевых рыб и даже
эпидермис у растений, приспособленных к обитанию на засо-
ленных почвах.
Общие закономерности эволюционной дифференцировки
клеток выделительных и осморегулирующих эпителиев прояв-
ляются в сходстве таких специфических для этих эпителиев
клеток, как подоциты внутреннего листка капсулы нефронов
позвоночных, подоциты членистоногих, моллюсков и полихет
и циртоподоциты ланцетника. Функциональное значение этих
клеток заключается в обеспечении регуляции процессов ультра-
фильтрации. Эти стороны функциональной деятельности подо-
цитов выяснены недостаточно даже в наиболее изученном
фильтрационном аппарате позвоночных животных. Тем не ме-
нее. большое сходство в организации всех этих разнородных по
происхождению специализированных клеточных элементов
представляет собой не случайное совпадение. Возможно, что
здесь проявляются еще более глубокие закономерности цито-
логических параллелизмов, поскольку обнаруживается сходст-
во в крайне специализированных, специфических лишь для
181
выделительных эпителиев высших животных признаках клеточ-
ной организации.
Приведенные в предыдущих разделах главы факты показы-
вают, что общие принципы организации характерны не только
для специализированных клеток, но и для осморегулирующих
и выделительных микроорганных систем, в частности для эпи-
телиальных канальцев, солевых желез, системы хлоридных
клеток. Естественно, что структурное обеспечение функцио-
нальных задач на этом уровне более многообразно, чем на
уровне специализированных клеток. Так, имеется, по крайней
мере, три механизма поступления ультрафильтрата в полость
канальца: типичная ультрафильтрация, ультрафильтрация за
счет биения жгутиков или ресничек и, наконец, нзоосмотиче-
ская секреция. Многообразны, по-видимому, и механизмы ре-
абсорбции и дополнительной секреции, различия в которых
обнаруживаются, например, при сопоставлении мальпигиевых
сосудов насекомых и нефронов позвоночных."Неодинаково в си-
стемном отношении (хотя и на основе сходных клеточных ме-
ханизмов) решаются в отдельных группах животных задачи
адаптации к экстремальным условиям солевого и водного режи-
ма. Тем не менее имеется и ряд общих для большинства мно-
гоклеточных животных системных принципов организации
осморегулирующих и выделительных органов. Одним из наи-
более важных общих принципов является формирование замк-
нутых эпителиальных канальцев с выделением в них прокси-
мальных и дистальных отделов. При этом основная задача
первого отдела заключается в обеспечении максимальной ре-
абсорбции необходимых веществ и воды при минимальной за-
трате энергии на единицу объема реабсорбируемой жидкости.*
Задача дистального отдела более сложна. Он должен обеспе-
чивать регуляцию количества и концентрации выделяемой мо-
чи, т. е. конечную регуляцию водного и солевого обменов орга-
низма.
Для понимания общих закономерностей эволюционной ди-
намики осморегулирующих и выделительных эпителиев суще-
ственный интерес представляет выяснение механизмов такой
регуляции водно-солевого обмена в основных осморегулирую-
щих системах у высших первичноротых (насекомых) и вторич-
норотых (млекопитающие) животных.
У млекопитающих важной предпосылкой для достижения
совершенной регуляции водно-солевого обмена является резкая
интенсификация фильтрации, связанная с развитием активно ра-
ботающей сосудистой системы. В условиях интенсивного кро-4 •*
•* Общие затраты энергии на реабсорбцию в проксимальном отделе неф-
рона обычно не меньше, чем в дистальном, поскольку в проксимальном отделе
реабсорбируется основная часть воды и органических и неорганических ве-
ществ.
182
вообращения и тока жидкости по канальцам нефрона создает-
ся возможность использовать механизмы избирательной реаб-
сорбции ионов в дистальных отделах канальца, в конечном
счете — для формирования (при необходимости экономить во-
ду) гипертонической мочи. Как уже отмечалось, реабсорбция
ионов из дистальных канальцев происходит без извлечения
больших количеств воды. Прилегающая к канальцу соедини-
тельная ткань и, в частности, ее основное вещество обладают
способностью удерживать положительно заряженные ионы
и создавать, следовательно, область повышенного осмотическо-
го давления. Кроме того, часть этих ионов секретируется в ни-
сходящие отделы петли Генле, увеличивая концентрацию ионов
в тонком отделе этого участка канальца. Здесь, следовательно,
создается постоянно поддерживаемый круговорот ионов, что
еще больше увеличивает местное осмотическое давление.
С другой стороны, в собирательные трубки поступает из ди-
стального отдела нефрона гипотоническая моча (поскольку из
нее избирательно в дистальном отделе были реабсорбированы
ионы). При действии антидиуретического гормона (АДГ) ги-
пофиза активизируется синтез и выведение гидролитических
ферментов из эпителиальных клеток собирательных трубочек.
Ферменты действуют на межклеточные контакты эпителия со-
бирательных трубочек и резко увеличивают его проницаемость
для воды. Гипотоническая моча из извитого дистального ка-
нальца направляется в собирательные трубки, которые нахо-
дятся в области почки, где в окружающих ее прослойках сое-
динительной ткани имеется зона повышенного осмотического
давления (рис. 49, а). Естественно, что вода из полости соби-
рательной трубочки перейдет через ее стенку в область повы-
шенного осмотического давления. Благодаря наличию здесь
сосудов с током крови в проксимальном направлении, проти-
воположным току мочи, избыток воды быстро выводится из
этой области и замещается новой порцией воды из просвета
собирательной трубочки. При достаточно большом количестве
крови и интенсивном кровообращении такого рода противоточ-
ная осмотическая система работает весьма эффективно. Бла-
годаря этому в дистальных отделах собирательной трубки фор-
мируется уже гипертоническая моча. Таким образом, в ее фор-
мировании деятельное участие принимает не только эпителий
дистального отдела канальцев (по нашей классификации,
включая эпителий тонких отделов петли Генле и собиратель-
ных трубочек), но и соединительная ткань, сосудистая система
и гормональная регуляция.
Не менее сложная организация характерна и для основной
выделительной системы многих насекомых, и особенно насеко-
мых, обитающих в засушливых районах. В дополнение к го-
ловным нефридиям и мальпигиевым сосудам у них развивается
очень важная часть общей с мальпигиевыми сосудами осморе-
183
Рис. 49. Схемы противоточных систем в почке млекопитающих (а) и в эпи-
телии ректального утолщения у насекомых (5).
капсула нефрона, 2 — извитой проксимальный каналец, 3, 4 — нисходящий (3)
и восходящий (4) отделы петли Генле, 5 — дистальный извитой каналец, 6 — собира-
тельная трубка, 7 — сосуд, 8—полость задней кишки, 9 — цитоплазма эпителиальных
клеток, 10 — межклеточные пространства, 11 — митохондрии, 12, 13 — апикальные (12)
и базальные (13) межклеточные контакты, 14 — периректальное пространство и мем-
брана, 15— гемолимфа. Тонкие стрелки показывают перемещение ионов, толстые —
воды; плотность точек соответствует величине осмотического давления.
гулирующей системы. Она представлена особыми участками
кутикулярного, эпителия и вспомогательными структурами
в стенке задней кишки животных — так называемыми ректаль-
ными утолщениями. Организация этой системы варьирует
у разных групп насекомых, однако принцип работы универса-
лен для всех насекомых. В основе ее лежит специализирован-
ный участок кутикулярного эпителия, представленный высоки-
ми призматическими клетками и тонкой проницаемой для воды
и ионов кутикулой (рис. 49, б).
Клетки имеют хорошо выраженную щеточную каемку на
апикальной поверхности. Она образована крупными, содержа-
щими митохондрии микроворсинками. Между клетками имеется
сложная система узких и расширенных межклеточных про-
странств и лакун, в которые заходят трахеи. Септальные дес-
мосомы связывают между собой апикальные и базальные об-
ласти клеток. На латеральной поверхности клеток образуются
выросты, формирующие замковидные соединения между сосед-
184
ними клетками, причем в каждом выросте цитоплазмы содер-
жатся митохондрии. По одной из наиболее распространенных
гипотез, обоснованных экспериментально, работа этой системы
происходит следующим образом. Многочисленные ионные на-
сосы плазматической мембраны создают и поддерживают вы-
сокую концентрацию ионов в узких межклеточных каналах,
куда и устремляется из полости задней кишки вода с раство-
ренными в ней веществами. Отсюда вода поступает по системе
лакун и по специальным субэпителиальным щелям, снабжен-
ным иногда специальными клапанами, в гемолимфу. Транспор-
тируемые с водой ионы задерживаются ионными насосами
мембран клеток в их базальных и нижних латеральных отде-
лах. Затем они через цитоплазму клеток возвращаются в апи-
кальную часть клеток и снова выводятся в межклеточные ще-
ли и лакуны. Таким образом, здесь, как и в почке млекопита-
ющих, создается и постоянно поддерживается кругооборот
ионов в локальной зоне.* Как и у млекопитающих, работа всей
осморегулирующей системы находится под сложным гормо-
нальным контролем. При этом гормональные воздействия мо-
гут изменить интенсивность ее работы очень быстро и в.очень
широких пределах, что позволяет насекомым экономно расхо-
довать воду на процессы экскреции и осморегуляции. Особен-
но совершенная в структурном и функциональном отношениях
осморегулирующая система формируется у представителей
двух отрядов насекомых (Lepidoptera, Coleoptera). Мальпигие-
вы сосуды у этих насекомых непосредственно контактируют
своими проксимальными участками со стенкой задней кишки
в области, где расположены специализированные на реабсорб-
цию участки эпителия (рис. 47, а).. Перемещение первичной мо-
чи в полости мальпигиева сосуда и содержимого задней кишки
происходит в противоположных направлениях, т. е. формиру-
ется своеобразная противоточная система. Такого рода систе-
мы могут реабсорбировать не только значительное количество
воды из экскретов задней кишки (непереваренные остатки пи-
щи и ультрафильтрат мальпигиевых сосудов), но и водяные-
пары из воздуха, который в виде пузырьков может распола-
гаться у некоторых видов насекомых в полости задней кишки.
Таким образом, в разобранных выше примерах организа-
ции осморегулирующих и выделительных систем у млекопита-
ющих и насекомых ярко проявляется еще одна из общих зако-
номерностей эволюционной динамики этих систем: увеличение
у высших животных удельного веса общих интеграционных
механизмов и межсистемных взаимодействий для более совер-
шенного осуществления осморегуляции и экскреции.
* Имеются данные о том, что в создании локальных зон повышенного
осмотического давления принимают участие у насекомых и у позвоночных
не только ионы, но и низкомолекулярные органические соединения. -
185.
УКАЗАТЕЛЬ ЛИТЕРАТУРЫ
Герловин Е. Ш. Секреторная клетка. — В кн.: Физиология пищева-
рения. Л., 1974, с. 26—76.i
Лейбсон Л. Г. Происхождение и эволюция эндокринной системы. —
В кн.: Эволюционная физиология. Л., 1983, с. 3—52.
Мамкаев Ю. В. О гистологической организации пищеварительной си-
стемы турбеллярий. — В кн.: Эволюционная морфология беспозвоночных. Л.,
1979, с. 13—24. (Тр. ЗИН АН СССР; №’84).
Наточин Ю. В. Эволюция водно-солевого обмена и почки.'—В кн.:
Эволюционная физиология. Л., 1983, с. 371—426.
Тыщенко В. П. Физиология эндокринных органов. — В кн.: Физиоло-
гия насекомых. Л., 1977, с. 190—217.
У г о л е в А. М., Иезуитова Н. Н., Цветкова В. А. Эволюцион-
ная физиология пищеварения.— В кн.: Эволюционная физиология Л., 1983,
с. 301—370.
Хэм А., Кормак Д. Гистология, М., 1983, т. 4, с. 49—158. т. 5
с. 5—125.
Andersen S. О. Biochemistry of insect cuticle.— Ann. Rev. Ento-
mology, 1979, vol. 24, p. 26—61.
Delecluse C. Keratohyaline synthesis.— In: Frontiers of matrix bio-
logy. Basel, 1981, vol. 9, p. 102—111.
Gardner M. L. G. Intestinal assimilation of intact peptides and pro-
teins.— Biol. Rev., 1984, vol. 59, 3, p. 289—331.
Gi eb is ch G. Principles of ion transport in kidney tubules.— In: Com-
parative physiology of osmoregulation in animals. New York, 1979, vol. 1,
p. 2—82.
Green H., Fuchs E., Watt T. Differentiated structural components
of the keratinocyte.— Cold Spring Harbor Symp. Quant. Biol. New York,
1982, vol. 46, p. 293—301.
Hadley N. F. Cuticular lipids of terrestrial plants and arthropods:
a comparison of their structure, composition and waterproofing function.—
Biol. Rev., 1981, vol. 56, p. 23—47.
Kollar E. J. Epithelial-mesenchymal interactions in the mammalian
integument.— In: Epithelial-mesenchymal interactions in development. New
York, 1983, p. 27—50.
Ko m nick H. Chloride cells and chloride epithelia of aquatic insects.—
Intern. Rev. Cytol., 1976, vol. 49, p. 134—162.
Krampitz G. P. Structure of the. organic matrix in mollusc shells
and avian eggshells.— Life, Sci. Res. Rep., 1982, vol. 23, p. 219—232.
Leblond С. P. The life history of cells in renewing systems.—Amer.
J. Anat, 1981, vol. 160, p. 114—158.
Lucas A. M. Lipoid secretion by the body epidermis in avian skin.—
Linn. Soc. Symp. Ser. London, 1980, N 9, p. 33—45.
M i s c h о г В., M a r k e 1 K. Histology and regeneration of the radula
•of Pomacea bridgesi Gastropoda, Prosobranchia.— Zoomorphol., 1984, vol. 104,
p. 42—57.
Mittal A. K-, Banerjee T. K. Keratinization versus mucus secretion
in fish epidermis.— Linn. Soc. Symp. Ser. London, 1980, N 9, p. It—12.
Morton B. Feeding and digestion on Bivalvia.— In: Mollusca. Lon-
don; New York, 1983, vol. 4, p. 65—149.
Quazana R. Structure et composition chimique de tegument cuticu-
laire des Nematodes.— Bull. Soc. Zool. france., 1982, vol. 107, p. 419—426.
Wall B. J., О s c h m a n J. L. Insect.— In: Comparative physiology oj
osmoregulation in animals. New York, 1979, vol. 1, p. 219—260.
Yasuhisa E., Hiroyuki S., Setsuya F., Junko N. Kinetics of
columnar and endocrine cells in the cockroach midgut.— Biomed.. Res., 1983,
vol. 4, p. 51—60.
186
Часть III
ТКАНИ ВНУТРЕННЕЙ СРЕДЫ
Ткани внутренней среды развивались в филогенезе из фа-
гоцитобласта — одной из двух первичных клеточных систем
фагоцителлы •— гипотетического предка многоклеточных живот-
ных. Как отмечалось выше (стр. 7); ее внутренняя часть со-
стояла из амебоидных клеток, способных к перемещению
и активному фагоцитозу. В ходе дальнейшей эволюции фаго-
цитобласт превратился в первичную паренхиму. В последней
часть клеток сохранила способность к амебоидной подвижно-
сти и фагоцитозу. Они специализировались в дальнейшем на
защитную функцию, из них сформировалась система подвиж-
ных элементов тканей внутренней среды. Межклеточные струк-
туры первичных паренхим и образующие их оседлые клетки
дали начало другим разновидностям тканей внутренней сре-
ды— с трофической, проводящей и скелетной функциями.
У высших позвоночных система фагоцитов достигает большей
дифференцированности: нейтрофильные лейкоциты — микрофа-
ги и гетерогенные в отношении функциональной специализации
моноциты — макрофаги. Как показал еще И. И. Мечников, за-
щитные фагоциты имеются у всех многоклеточных животных.
Кроме того, на основе первичного свойства многоклеточных жи-
вотных различать свои и чужие клетки в тканях внутренней
среды развивается специальная система подвижных клеток для
поддержания клеточного гомеостаза. Наибольшей сложности
достигает она у позвоночных животных, которые обладают
лимфоидной системой, обеспечивающей сложные реакции им-
мунитета. Механизмы контроля клеточного гомеостаза у бес-
позвоночных животных более многообразны. Эту функцию
могут выполнять фагоциты и специальные гранулярные амебо-
циты. Часть клеток системы свободных элементов тканей внут-
ренней среды независимо у представителей разных групп жи-
вотных специализируется на обеспечении функции газообмена,
187
а иногда и других трофических функций. Таким образом, для
эволюционной динамики свободных клеточных элементов тка-
ней внутренней среды характерна дивергентная дифференциров-
ка-увеличение в ходе эволюции количества специализирован-
ных клеточных форм.
Вторая основная система тканей внутренней среды много-
клеточных животных представлена оседлыми клетками и обра-
зуемыми ими межклеточными структурами. Одной из первич-
ных функций этой системы была проводящая трофическая
функция. Она в большей или меньшей степени выражена в тка-
нях внутренней среды большинства современных многоклеточ-
ных. У высших первичноротых и вторичноротых животных эту
проводящую трофическую функцию выполняют соответственно
интерстициальные ткани и рыхлая соединительная ткань. Спе-
циальные трофические разновидности этих тканей представле,-
ны жировой и ретикулярной тканями кроветворных и лимфо-
идных органов. Последняя кроме осуществления трофической
функции регулирует процессы созревания и дифференцировки
системы свободных клеточных элементов тканей внутренней
среды. На основе межклеточных структур первичных парен-
хим у многоклеточных животных развилась целая система
опорных скелетных тканей (плотная соединительная ткань,
хрящевые и костные ткани). Наибольшего развития эта общая
для всех многоклеточных животных потенция тканей внутрен-
ней среды достигла у позвоночных животных.
Положив в основу классификации рассматриваемого типа
тканей функциональный критерий, можно выделить следующие
разновидности тканей внутренней среды:
1. Рыхлую соединительную ткань и ее разновидности у по-
звоночных животных и интерстициальные трофические ткани,
паренхимы и мезоглею беспозвоночных животных. 2. Скелет-
ные опорные ткани внутренней среды позвоночных и беспозво-
ночных животных. 3. Кровь, миелоидная и лимфоидная ткани
позвоночных и их функциональные аналоги у беспозвоночных
животных."’
____________ *
* У многих групп беспозвоночных животных часть функций (чаще спе-
циальные трофические, газообмен, экскреторная) могут выполнять свобод-
ные и оседлые клеточные элементы вторичного происхождения (производные
выстилки целома).
188
Глава 9. ОСЕДЛЫЕ ТРОФИЧЕСКИЕ РАЗНОВИДНОСТИ
ТКАНЕЙ ВНУТРЕННЕЙ СРЕДЫ
§ 1. Рыхлая соединительная ткань и ее разновидности
у позвоночных животных
Рыхлая соединительная ткань позвоночных состоит из кле-
ток и межклеточных структур. Основными ее клеточными эле-
ментами являются оседлые клетки — фибробласты. Они обра-
зуют разнообразные межклеточные структуры и осуществляют
постоянный контроль за функциональной деятельностью и нор-
мальной организацией межклеточных структур. Последние
представлены основным веществом и двумя типами волокон—•
коллагеновыми и эластическими. Основное или аморфное ве-
щество образовано пластинками и тяжами гелеобразной кон-
систенции.
Основу геля составляют кислые и нейтральные полисаха-
риды обычно в комплексе с белками. Эти полисахариды полу-
чили название глюкозамингликанов (нейтральные) и сульфати-
рованных глюкозамингликанов (кислые). В аморфном веществе
рыхлой соединительной ткани сульфатированных, глюкоза-
мингликанов относительно немного. Основу гелеобразных тяжей
аморфного вещества составляют разветвленные сети несульфа-
тированного глюкозамингликана гиалуроновой кислоты. Сово-
купность ее молекул занимает большую площадь ' (протяжен-
ность каждой молекулы до 400 нм). Отдельные молекулы свя-
заны между собой и образуют сложную мелкоячеистую сеть,
пронизанную каналами, в которых циркулирует тканевая жид-
кость, составляющая жидкую фазу геля. Кроме гиалуроновой
кислоты в состав этой сети входит варьирующее в разновидно-
стях рыхлой ткани небольшое количество сульфатированных
глюкозамингликанов. Они связаны обычно с белками и обра-
зуют надмолекулярные комплексы — протеогликаны. Кроме
того, и молекулы гиалуроновой кислоты также обычно связаны
с белками. Кроме глюкозамингликанов и их комплексов с бел-
ками в составе основного вещества имеются и гликопротеи-
ды— комплексы белков и углеводов.
Жидкая часть основного вещества представлена тканевой
жидкостью, которая весьма динамична: она непрерывно посту-
пает из начальных отделов артериальных капилляров и заби-
рается венозными капиллярами и лимфатическими сосудами.
Кроме того, в этой жидкости могут свободно диффунди-
ровать ионы и другие низкомолекулярные вещества. Это
делает возможным проведение веществ между кровью
и работающими тканями через аморфный матрикс. Такому
обмену способствует и обилие анионных групп у основ-
ного компонента аморфного матрикса — гиалуроновой кис-
лоты.
189
В тесном контакте с аморфным матриксом находятся и ме-
ханические структуры рыхлой соединительной ткани — колла-
геновые и эластические волокна. Они связаны с молекулами
основного вещества боковыми углеводными цепями гликопро-
теидов и протеогликанов. Основу коллагеновых волокон со-
ставляет белок коллаген. У позвоночных животных он коди-
руется семейством родственных генов. В настоящее время из-
вестно около И разновидностей белковых цепей, образующих
путем различных комбинаций свыше 7 типов сложных молекул
коллагена. У позвоночных животных все они построены по од-
ному принципу и представляют собой три полипептидные цепи,
свернутые в спираль. Каждая цепь состоит из повторяющихся
последовательностей трех аминокислот. Первая может быть
любой аминокислотой (кроме пролина, лизина и глицина),
вторая — лизин либо пролин и, наконец, третья — обязательно
глицин. Молекулы коллагена достигают длины 280 нм и имеют
диаметр около 1,5 нм. Коллагеновые волокна рыхлой соеди-
нительной ткани взрослых животных построены из моле-
кул коллагена 1-го типа, которые образованы двумя
одинаковыми цепями и одной цепью, кодируемой другим
геном.
Коллагеновые волокна характеризуются большой механиче-
ской прочностью на разрыв. Они могут объединяться в пучки
разной толщины. На обычных препаратах пучки волокон име-
ют извилистый вид, что обеспечивает при механической
нагрузке значительное растяжение соединительной ткани
(рис. 50, а, б).
Каждое коллагеновое волокно состоит из отдельных колла-
геновых фибрилл, которые в свою очередь образованы более
тонкими фибриллами. Элементарная фибрилла имет толщину
7 нм. Она состоит из расположенных параллельно цепей моле-
кул коллагена. В такой элементарной фибрилле их около 12.
Молекулы коллагена, выделенные из фибрилл, получили назва-
ние тропоколлагена.
Под электронным микроскопом коллагеновые фибриллы
обнаруживают характерную поперечную исчерченность. Она
проявляется в правильном чередовании темных и светлых дис-
ков разной толщины. При этом участки фибрилл длиной
660 нм имеют одинаковый и строго повторяющийся рисунок
такой исчерченности.
Одним из наиболее распространенных объяснений исчерчен-
ности коллагеновых фибрилл является представление о законо-
мерной укладке в фибрилле тропоколлагена: молекулы лежат
правильными продольными цепочками (рис. 50, д), располагаясь
по принципу — хвост к голове. При этом между молекуламй
имеются значительные промежутки — «пустоты». В сосед-
них рядах, они сдвинуты на 1/4 своей длины, так что в каж-
дом 4-м ряду промежутки между головкой и хвостом молеку-
190
Рис. 50. Рыхлая соединительная ткань млекопитающих.
«—в — межклеточное вещество с фибробластом (а), тучной клеткой (б) и гистио-
цитами, заполненными коллоидным красителем (в); а —схема ультра структурной
организации фибробласта, д — схема молекулярной организации коллагеновой фиб-
риллы. 1 — пучки коллагеновых, волокон, 2 — эластические волокна, 3—аморфное ве-
щество; на поверхности фибробласта схематически показаны молекулы: тропоколлагена
(.-/), . эластина (5), нефибриллярных белков (6) и мукополисахаридов (7); в—форми-
рующиеся коллагеновое и 9 — эластические волокна, 10— области аппарата Гольджи,
// — цистерны шероховатой ЭПС, 12— лизосома. Стрелками показаны: места синте-
за и возможные пути внутриклеточного перемещения молекул преколлагена, преэла-
стииа и нефибриллярных белков (темные стрелки), синтез и перемещение мукопо-
лисахаридов (светлые стрелки), перемещение лизосом в ходе внутри- и внеклеточ-
ных катаболических процессов (стрелки с точками).
19J
лы будут совпадать по вертикали. За счет этого и образуются
светлые полосы по длине коллагеновой фибриллы.*
Поперечную исчерченность имеют волокна наиболее распространенных
типов коллагена (I, II, III). Тонкие волокна, образованные относительно не-
большим количеством фибрилл из- коллагена III типа, получили название
ретикулярных или аргентофильных волокон. Коллагены III типа в отличие от
коллагенов I типа содержат в каждой из трех одинаковых полипептидных
цепочек по 2 остатка цистеина, образующих дисульфидные связи между це-
почками. Этот коллаген содержит также много остатков оксипролина и ги-
стидина и значительно более гликозилирован, чем коллаген I типа.
Весьма важной функциональной разновидностью межклеточных струк-
тур рыхлой соединительной ткани, в состав которых входит коллаген, явля-
ются базальные мембраны. Они образуются на границе с тканями, выпол-
няющими специфическую функцию (различного рода эпителии, мышцы
и другие системы), и эндотелием кровеносных сосудов,- Эти образования
представляют собой уплотненные пластинки межклеточного вещества и имеют
чаще всего двойственное происхождение: наружная по отношению к соеди-
нительной ткани часть базальных мембран, прилегающая к другим тканям,
выделяется их клетками, вторая, глубже лежащая, образуется фибробла-
стами рыхлой соединительной ткани. Непосредственно контактирующая
с основным веществом рыхлой соединительной ткани часть базальных мем-
бран образована преимущественно коллагенами, причем в разных базальных
мембранах обнаружено, по крайней мере, четыре их разновидности (колла-
гены IV—VII типов). Они отличаются по характеру полипептидных цепей
(наличие или отсутствие цистеина, количество оксилизина и оксипролина),
степенью их гетерогенности, количеством углеводов и по своим свойствам
(степень иммуногенности, стойкость к коллагеназе и др.).
Во внутренней части базальных мембран, имеется и особый белок фибро-
нектин. Это гликопротейд с небольшой углеводной частью. Его молекулы
представляют собой связанные двумя SS-связями дипептиды. Они способны
полимеризоваться в волокнистые структуры на поверхности как оседлых
клеток рыхлой соединительной ткани, так и в соединительнотканных частях
базальных мембран. Базальные мембраны играют весьма важную роль в про-
цессах обмена между основным веществом рыхлой соединительной ткани
и клетками других специализированных тканей. Они являются структурами
межклеточного вещества, с которых начинаются или которыми заканчива-
ются процессы такого обмена.
Эластические волокна на тотальных препаратах рыхлой
соединительной ткани внешне отличаются от коллагеновых
меньшим диаметром, прямолинейной направленностью и сла-
бой окрашиваемостью обычными красителями (рис. 50, а). По
своим' механическим свойствам, как следует из названия, они
характеризуются эластичностью, т. е. способностью после рас-
тяжения возвращаться в исходное состояние. Это свойство
и определяет функциональное значение эластических волокон
в рыхлой соединительной ткани. Они стабилизуют ее структуру
после различного рода механических воздействий.
Эластические волокна в отличие от коллагеновых состоят
из двух компонентов: аморфного эластина и нитевидных мик-
рофибрилл (рис. 50,г). Белок эластин сходен с коллагенами
* Описанная модель организации коллагеновой фибриллы не объясняет
всех имеющихся в настоящее время фактов о надмолекулярной организа-
ции этой структуры.
192
по аминокислотному составу. Однако в нем значительно мень-
ше полярных аминокислот и почти нет гидрооксипролина
и гидрооксилизина. В отличие от коллагена поперечные сшив-
ки между полипептидными цепями осуществляются здесь спе-
цифическими для эластина производными аминокислот — дес-
мозином и изодесмозином.
Микрофибриллярный компонент эластических волокон об-
разован трубчатыми структурами диаметром 11 нм. Они окру-
жают, а иногда и пронизывают аморфный матрикс. Микрофиб-
риллы состоят, по-видимому, из особого белка. Он отличается
и от коллагена, и от эластина, богат полярными ами-
нокислотами и лишен гидроксилизина и гидрооксипро-
лина. Микрофибриллярные структуры содержат около 5%
углеводов, что указывает на их гликопротеидную при-
роду.
Для рыхлой соединительной ткани характерна теснейшая
взаимосвязь между клетками и межклеточными структурами.
Основные ее клеточные элементы представлены клетками фиб-
робластического ряда: периваскулярными камбиальными клет-
ками, фибробластами и фиброцитами. Среди них наиболее
активными в функциональном отношении являются фиброблас-
ты. Это уплощенные отростчатые клетки, распластанные
в межклеточном веществе. На специально приготовленных то-
тальных препаратах соединительной ткани в фибробластах
выявляется более темная базофильная перинуклеарная зона
и светлая периферическая, где не всегда удается различить
границу между клетками и межклеточным веществом
(рис. 50, а). Под электронным микроскопом такая граница Вы-
является достаточно отчетливо (рис. 50,а). Для фибробластов
характерны хорошо развитые шехороватая эндоплазматическая
сеть и мембранные системы аппарата Гольджи. В ядерном
аппарате имеются активные ядрышки, много деспирализован-
ного хроматина, ядерная оболочка богата поровыми комплекса-
. ми. Современные представления о сложной структурно-хими-
ческой организации фибробластов суммированы на схеме
(рис. 50,а), из которой следует, что фибробласты одновремен-
но могут синтезировать, транспортировать и выделять разно-
образные белки и полисахариды межклеточного вещества.
Синтезированные вещества в процессе их транспортировки
подвергаются сложной вторичной обработке. Наиболее хорошо
изучены эти процессы при синтезе коллагена. Оказалось, что на
рибосомах образуются цепи аминокислот значительно длиннее
тех, что представлены в молекуле тропоколлагена. Первая обра-
ботка происходит при прохождении молекул протоколлагена
через мембрану эндоплазматической сети.. Специальными фер-
ментами здесь удаляется часть добавочного участка цепей
аминокислот, и молекула протоколлагена превращается в мо-
лекулу проколлагена. В это же время происходит и гидроок-
7 672
193
силирование пролиновых и лизиновых остатков. Механизмы
транспорта и выведения молекул проколлагена из клетки оста-
ются неясными.
На родственных фибробластам клетках костной ткани — одонтобластах
и остеобластах (см. стр. 214) —методами электронной авторадиографии уда-
лось показать перемещение белков, меченых 8Н-пролином, в цистерны аппа-
рата Гольджи и формирование в области аппарата характерных гранул,
содержащих меченые нитевидные структуры. Эти гранулы выводят свое со-
держимое путем типичного экзоцитоза. Авторы предполагают, что эти ни-
тевидные структуры представляют собой комплексы из молекул проколла-
гена. Такие картины удается иногда наблюдать в типичных активных фиб-
робластах рыхлой соединительной ткани. Здесь часто можно видеть участки
шероховатой ЭПС, вступающие в тесный контакт с плазматической мембра-
ной. При этом на стороне мембран, обращенной к поверхности клеток, от-
сутствуют рибосомы. На основании таких картин многие авторы высказы-
вают предположение о том, что мы имеем здесь дело со специфическим, не
исследованным еще в деталях механизмом выведения высокомолекулярных
белков через две мембраны без видимого нарушения их целостности. В мо-
мент выведения или через короткое время после попадания проколлагена на
поверхность клетки специальными пептидазами от молекул отщепляются лиш-
ние хвостовые участки, и проколлаген превращается в молекулы тропокол-
лагена. Последние уже вне клетки подвергаются закономерной сборке или
вернее самосборке с образованием поперечно-исчерченных коллагеновых фиб-
рилл.
Сложность взаимоотношений между фибробластами и межклеточными
структурами обусловлена еще и способностью этих клеток не только к синтезу
разнообразных компонентов межклеточного вещества. Фибробласты’ имеют
развитый лизосомный аппарат. При этом лизосомы могут переваривать не
только фагоцитируемые клеткой компоненты межклеточных структур, но
и выводить содержащиеся в них ферменты путем экзоцитоза наружу, обес-
печивая, таким образом, гидролиз части межклеточных структур вне
клетки.
В регуляции гетерогенной синтетической деятельности фибробластов ак-
тивную роль играют воздействия на рецепторы их поверхностного аппарата
молекул межклеточного вещества. Экспериментально показано влияние фиб-.
ронектина на синтез и выведение коллагена.
Для синтеза эластических волокон также удалось показать
наличие предшественника — проэластина. Однако до формирова-
ния эластических волокон и выведения проэластина из клеток
фибробласты должны выделить каркас из микрофиламентов.
В этот каркас и начинают выделяться молекулы тропоэласти-
на. Они образуются, как и молекулы тропоколлагена, из пред-
шественника (в данном случае проэластина).
Заключительным этапом созревания эластических волокон,
протекающим уже вне клеток, является соединение лизиновых
групп четырех тропоэластиновых молекул специальным фер-
ментом лизилоксидазой с образованием десмозина и изодес-
мозина, сшивающим четыре эластиновых молекулы в единое
целое.
Синтез полисахаридов основного вещества рыхлой соедини-
тельной ткани происходит на мембранах цистерн аппарата
Гольджи, а выводятся они из клетки путем типичного экзоци-
тоза при помощи специальных транспортных вакуолей, обра-
зующихся в вакуолярных отделах аппарата Гольджи.
194
Клетки фибробластического ряда представляют собой об-
новляющуюся клеточную популяцию. В рыхлой соединитель-
ной ткани непрерывно происходит гибель старых закончивших
свой жизненный цикл фиброцитов — последних по степени диф-
ференцировки клеток фибробластического ряда. Они отличаются
от фибробластов слабым развитием мембранных органоидов
в цитоплазме и меньшим уровнем метаболизма. Постоянство
клеточного состава поддерживается за счет митотического
размножения начальных камбиальных элементов фибробла-
стического ряда. Последние характеризуются меньшим, чем
у фибробластов, объемом цитоплазмы и менее распластанной,
веретеновидной формой. Имеются данные, что по скорости об-
новления популяция фибробластов неоднородна. В подкожной
соединительной ткани мышей показаны две субпопуляции фиб-
робластов: длительно существующие и быстро обновляющиеся.
В организме млекопитающих имеется, по-видимому, общий
фонд малодифференцированных стволовых клеток фибробла-
стического ряда. Они могут циркулировать в крови, принимая
вид лимфоцитоподобных клеток, и оседать в разных участках
соединительной ткани, обеспечивая тем самым возможность
стабильного обновления фибробластических элементов. Соот-
ношение межклеточных структур камбиальных элементов —
фибробластов и фиброцитов — может варьировать в широких
пределах и в разных участках соединительной ткани у одного
и того же животного. Такая вариабельность характерна и для
одних и тех же участков соединительной ткани у представите-
лей разных отрядов млекопитающих. В настоящее время име-
ются уже и некоторые сравнительно-биохимические данные от-
носительно коллагена в ряду позвоночных. В целом эти данные
свидетельствуют о большой консервативности коллагеновых
генов.
Что касается концевых неспирализованных участков молекул коллагена,
то здесь удается наблюдать различия в первичной структуре даже у разных
видов животных. Особенно разнообразны видовые различия в аминокислот-
ном составе концевых участков молекул коллагена в классе рыб с характер-
ным для них варьированием общего количества ДНК в геноме.
Своеобразной разновидностью рыхлой соединительной ткани являются
ретикулярная ткань кроветворных и лимфоидных органов и жировая ткань.
Жировая ткань представлена у позвоночных несколькими разновидностями.
Более широко распространена обычная жировая ткань, образованная крупными
клетками, в центральной части которых располагается одна или несколько
крупных заполненных жиром вакуолей. Вся активная цитоплазма и ядра
оттеснены в таких клетках к периферии. Жировые включения в клетках
жировой ткани обычно представляют собой не пассивный, а непрерывно об-
новляемый субстрат. Более специфической разновидностью жировой ткани
является бурая жировая ткань. Она также состоит из крупных клеток, од-
нако ядра в них находятся, как обычно, в центре клеток, а жировые вклю-
чения в виде мелких вакуолей заполняют всю цитоплазму. В цитоплазме
клеток содержится большое количество специфических митохондрий, в кото-
рых много ферментов для окисления липидов и мало — для синтеза АТФ.
В связи с этим образующаяся при окислении жиров энергия переходит в ос-
7*
195
новном в теплую энергию. Наличие такого регулируемого источника этой
энергии имеет существенное значение для разогревания крови при пробуж-
дении животных от зимней спячки и у новорожденных животных, лишен-
ных еще волосяного покрова.*
К постоянным элементам рыхлой соединительной ткани следует отнести
л эндотелий капилляров, с которыми эта ткань образует единую трофиче-
скую систему. Эндотелий представляет собой эпителеобразную разновид-
ность тканей внутренней среды, возникшую из клеточных элементов парен-
химы предков позвоночных. У взрослых животных в обычных капиллярах
эндотелий образован одним слоем сильно уплощенных клеток. Последние
имеют хорошо развитый надмембранный комплекс на свободной поверхно-
сти. Клетки обладают специфической способностью к микропиноцнтозу — об-
разованию мелких пнноцитозных пузырьков на внутренней и наружной (кон-
тактирующая с базальной мембраной) поверхностях клеток и транспортиров-
ке содержимого пиносом путем экзоцитоза в полость сосуда и в окружаю-
щую соединительную ткань. Эндотелий у взрослых организмов представляет
собой, по-видимому, относительно автономную, самоподдерживающуюся раз-
новидность тканей внутренней среды. Отмирающие в процессе жизнедеятель-
ности клетки заменяются преимущественно за счет размножения эндотели-
альных клеток.
Помимо оседлых клеток рыхлой соединительной ткани
в ней находятся и специализированные клетки, относящиеся
к системе свободных клеточных элементов крови. Наиболее
постоянными и специально предназначенными для рыхлой сое-
динительной ткани подвижными клеточными элементами явля-
ются гистиоциты (разновидность макрофагов) и тучные
клетки (рис. 50, б, в). Контролирующая и защитная функция
гистиоцитов отчетливо обнаруживается в экспериментальных
условиях. При введении под кожу витальных красителей уже
через несколько минут удается наблюдать избирательное на-
копление краски в цитоплазме этих клеток. Они играют в дан-
ном случае роль своеобразных, нейтрализующих вредные
продукты почек накопления. Не менее очевидна защитная
функция гистиоцитов и при различного рода воспалительных
процессах, развертывающихся в рыхлой соединительной ткани
(см. ниже стр. 240). Ядра гистиоцитов значительно темнее, чем
у фибробластов, благодаря большему количеству конденсиро-
ванного гетерохроматина. Цитоплазма содержит много вакуо-
лей и имеет пенистую структуру. Границы клеток четко очер-
чиваются даже на светооптическом уровне. Клетки способны
к амебоидному перемещению и фагоцитозу. Количество их мо-
жет увеличиваться как за счет размножения местной популя-
ции гистиоцитов, так и благодаря превращению выселяющихся
из сосудов моноцитов крови. Зрелые тучные клетки заполнены
крупными базофильными гранулами, содержащими биологиче-
ски активные вещества, стимулирующие воспалительные про-
---------- *
* Третьей разновидностью жировой ткани у млекопитающих является
жировая ткань костного мозга. Жировые клетки содержат особые липиды,
которые обычно не используются в липидном обмене, т. е., в отличие от под-
кожной жировой ткани, здесь не происходит интенсивного обновления за-
пасенного субстрата.
196
цессы. Более подробную их характеристику, как и других сво-
бодных элементов, находящихся в рыхлой соединительной тка-
ни, мы рассмотрим при характеристике функции клеток крови
и лимфоидной ткани (см. стр. 278).
§ 2. Интерстициальные трофические ткани, паренхима
и мезоглея беспозвоночных животных
Степень развития и характер организации интерстициаль-
ных трофических тканей варьируют у представителей различ-
ных типов беспозвоночных животных в значительно больших
пределах, чем у позвоночных. Несмотря на существенные осо-
бенности организации трофических интерстициальных тканей
в некоторых типах беспозвоночных животных, у многих их
представителей наблюдаются весьма сходные с позвоночными
тенденции к усложнению первичных паренхим. Интерстициаль-
ные трофические ткани типа рыхлой соединительной ткани по-
звоночных мы находим у некоторых иглокожих (голотурии)
и у представителей всех классов моллюсков. Как и у позво-
ночных, в интерстициальных тканях этих животных основным
клеточным элементом является фибробласт. В эксперименталь-
ных условиях (воспалительное новообразование, регенерация)
у моллюсков показана возможность развития фибробластов из
подвижных мелких амебоцитов гемолимфы. Они являются, по-
видимому, камбиальным источником развития оседлых элемен-
тов интерстициальных тканей моллюсков и в нормальных ус-
ловиях. к ограниченному размножению способны сами фибро-
бласты.
Функция и ультраструктурная организация фибробластов
моллюсков сходны с функцией и ультраструктурной организа-
цией аналогичных клеток у позвоночных животных. Это рас-
пластанные отростчатые клетки с хорошо развитыми мембран-
ными органоидами в цитоплазме. Они активно синтезируют
коллаген и разнообразные компоненты межклеточного основ-
ного вещества. Межклеточные структуры интерстициальных
тканей моллюсков, по-видимому, также аналогичны межкле-
точным структурам рыхлой соединительной ткани позвоночных.
У них выявляются типичные поперечно-исчерченные коллаге-
новые волокна, эластические волокна представлены в меньшем
количестве. Химический состав основного вещества у моллюс-
ков изучен хуже, но в морфологическом отношении его струк-
тура сходна с организацией основного вещества рыхлой соеди-
нительной' ткани позвоночных. В межклеточном веществе
у моллюсков имеется система лакун и каналов, по которой
циркулирует тканевая жидкость. Стенки таких каналов могут
быть ограничены системой закономерно ориентированных кол-
лагеновых волокон и снабжены сократимым аппаратом. По-
следний представлен обычно фибробластами с хорошо разви-
197
той микрофибриллярной актин-миозиновой системой. Эта раз-
новидность фибробластов—так называемые миофибробла-
сты— обнаружена и в соединительной грануляционной ткани
позвоночных, образующейся при заживлении обширных кож-
ных ран.
Особенно большого совершенства и сложности организации
достигает трофическая транспортная система в интерстициаль-
ных тканях головоногих моллюсков. Стенка сосудов у них об-
разована специальными, концентрически расположенными по
наружной поверхности сосуда клетками — перицитами. По-ви-
димому, это специализированные миофибробласты. Они имеют
хорошо развитые актин-миозиновые сократимые фибриллы и на
своей внутренней, обращенной к просвету сосуда поверхности
выделяют коллагеновую мембрану. Со стороны просвета сосу-
дов эта Мембрана выстлана уплощенным эндотелием. Клетки
эндотелия по своей ультраструктурной организации сходны
с клетками эндотелия позвоночных животных. Сосуды голово-
ногих моллюсков не имеют сплошной эндотелиальной выстил-
ки. В этих участках мембрана, образованная коллагеновыми
волокнами, граничит непосредственно с полостью сосудов.
В других участках интерстициальной ткани имеются капилля-
ры, стенки которых образованы перицитами, коллагеновой мем-
браной и эндотелием. В стенке крупных сосудов, как и у по-
звоночных животных, содержится довольно много эластических
волокон. В основном веществе интерстициальной соединитель-
ной ткани кожи головоногих моллюсков обнаружены специ-
фичный для позвоночных сульфатированный глюкозаминогли-
кан и небольшое количество целлюлозы.
Помимо фибробластов — основной клеточной формы интер-
стициальных тканей моллюсков —здесь имеются и другие осед-
лые элементы: пузырчатые, пигментные, зернистые и, наконец,
своеобразные, так называемые поровые клетки. Последние спе-
циализированы на синтез дыхательных пигментов и имеют на
своей поверхности систему глубоких впячиваний плазматиче-
ской мембраны.
Значительно меньший удельный вес в трофической проводящей функции
имеют интерстициальные ткани у большинства аннелид и других групп пер-
вичноротых животных с хорошо развитым целомом. У этих животных
в большинстве участков тела интерстициальные ткани представлены лишь
небольшими септальными и межмышечными прослойками, которые .бедны
клеточными элементами фибробластического ряда. Стенки большинства со-
судов образованы лишь более или менее правильно ориентированными кол-
лагеновыми мембранами. Последние образуются в основном клетками цело-
мического, кожного и кишечного эпителиев, т. е. тех тканей, где распола-
гаются отдельные участки сосудистой системы. В связи с редукцией целоца
у пиявок и у некоторых полихет (например у афродитид) интерстициаль-
ные ткани получают большее развитие и имеют значительно больший удель-
ный вес в трофической проводящей функции. По своей организации интер-
стициальные ткани этих животных оказываются сходными с описанными
выше интерстициальными тканями моллюсков.
198
Существенный интерес представляет организация интер-
стициальных трофических тканей высших первичноротых — чле-'
нистоногих. Степень развития и удельное значение этих тканей
в трофической проводящей функции варьируют, как у предста-
вителей разных видов в пределах класса, так и у представи-
телей отдельных классов членистоногих. Так, например, среди
насекомых у личинок жука-носорога и у взрослых животных
интерстициальные ткани представлены пластинками аморфного
вещества и волокнистыми структурами (рис. 51, а). Здесь не
удается обнаружить оседлых фибробластов, и источники раз-
вития этих структур остаются неясными. С другой стороны,
у гусениц шелкопрядов в межклеточном веществе имеется от-
носительно много фибробластов, тесно связанных с продуцируе-
мыми ими межклеточными структурами. Особенностью послед-
них является наличие здесь помимо коллагеновых волокон
особых волокон большого диаметра, образованных электронно-
плотными фибриллярными структурами (рис. 51, б). В отдель-
ных участках межклеточного вещества у некоторых насекомых
обнаружены волокна, удаляемые из срезов ферментом эласта-
зой, т. е. аналогичные эластическим волокнам рыхлой соеди-
нительной ткани позвоночных. Кроме того, у насекомых обна-
ружены особые резелиновые волокна. По аминокислотному со-
ставу белок резелин существенно отличается от эластина, что
и определяет особые механические свойства рассматриваемых
волокон.
У изученных представителей других классов членистоно-
гих— высших ракообразных, мечехвостов — интерстициальные
трофические ткани имеют сходное строение с аналогичными
тканями гусениц шелкопряда.
Фибробласты членистоногих имеют сходную структурно-
биохимическую организацию с фибробластами других много-
клеточных животных. У них хорошо развиты мембранные ор-
ганоиды цитоплазмы и, в первую очередь, шероховатая ЭПС
и аппарат Гольджи (рис. 51, г). У фибробластов насекомых,
как и у позвоночных животных, прослеживается связь расши-
ренных цистерн шероховатой ЭПС с центральной частью не-
больших цистерн аппарата Гольджи. Она осуществляется при
помощи канальцев гладкой ЭПС. Внутри цистерн шерохова-
той ЭПС заметен материал умеренной электронной плотности.
Вопрос о механизмах выведения этого материала, а также о
синтезируемых на мембранах аппарата Гольджи полисахари-
дах основного вещества остается открытым. С одной стороны,
в области аппарата Гольджи имеются окаймленные пузырьки
и прослеживается их постепенное перемещение к плазматиче-
ской мембране, где их содержимое путем экзоцитоза выводится
в межклеточное вещество. С другой стороны, в интенсивно
функционирующих фибробластах часто можно наблюдать близ-
кий контакт участков цистерн шероховатой ЭПС с плазматиче-
199
Рис. 51. Интерстициальные соединительные ткани насекомых.
а — фибробласт с окружающим межклеточным веществом у саранчи, 0. в — участок соединительной ткани у шелкопряда (б) и у личи
ки жука носорога (в); / — гиалоплазма, 2 — аппарат Гольджи, 3 —область выведения из клетки тропоколлагена, 4 — экзоцитозяый п
зырек 5 — шероховатая ЭПС, 6 — коллагеновые Волокна, 7 — волокно неизвестной химической природы, 8 — основное вещество.
200
ской мембраной. В местах такого контакта мембраны цистерн
ЭПС лишены рибосом. Таким образом, организация и функ-
ция фибробластов насекомых сходна с организацией их у по-
звоночных животных (см. стр. 193). Более того, у насекомых,
как и у позвоночных животных, в фибробластах в ходе про-
грессирующей дифференцировки удается наблюдать редукцию
метаболического аппарата цитоплазмы. Она проявляется в рез-
ком уменьшении диаметра цистерн шероховатой ЭПС, умень-
шении области, занятой структурами аппарата Гольджи и уп-
лотнении гиалоплазмы, т. е. здесь удается выявить ряд фибро-
бласт-фиброцит, отражающий этапы старения клеток.
Межклеточное вещество соединительных интерстициальных
тканей у высших первичноротых, в частности у насекомых, со-
стоит, как и у позвоночных животных, из основного вещества
и волокнистых структур. Среди последних четкую аналогию
с позвоночными обнаруживают коллагеновые волокна. Для
них характерна правильная исчерченность, отражающая зако-
номерное субъединичное строение этих волокон. В каждой
субъединице содержится по краям два широких электронно-
плотных диска и два тонких, расположенных в середине.
Коллагены беспозвоночных варьируют в значительно боль-
шей мере по аминокислотному составу, чем у позвоночных жи-
вотных (за исключением процентного содержания глицина),
а также по количеству связанных с коллагеном углеводов, ко-
торое у беспозвоночных может достигать 20%.
Специальный интерес представляют интерстициальные тка-
ни низших многоклеточных — губок, кишечнополостных, греб-
невиков и червей, не имеющих вторичной полости тела. У них
интерстициальные ткани, по-видимому, почти нс сохранили тех
первичных черт организации, которые были характерны фаго-
цителлоподобным предкам первичных многоклеточных живот-
ных. Так, у не обладающих тканевой организацией губок
обнаружены типичные коллагеновые волокна с характерной
поперечной исчерченностью и субъединичным строением, с раз-
мерами субъединиц 66 нм, т. е. сходными с размерами их у по-
звоночных и высших первичноротых животных. Для губок ха-
рактерно и наблюдаемое в коллагенах рыб варьирование у раз-
ных видов молекулярной организации в концевых участках
полипептидных цепей. С другой стороны, у кишечнополостных
и гребневиков интерстициальные ткани представлены так на-
зываемой мезоглеей — прослойками межклеточного вещества,
выделяемого базальными поверхностями клеток покровного
и кишечного эпителиев. Степень развития и строение мезоглеи
сильно и закономерно варьируют в пределах типа кишечно-
полостных и у гребневиков.
Так, у вторичноизмененной и упрощенной в своей организации пресно-
водной гидры под эпителием имеется слой продольно-ориентированных фиб-
рилл диаметром 0,3 нм, состоящих из коллагена и эластино-подобных белков.
201
Пространство между этими волокнами заполнено мукопротеидамн. У акти-
ний н сцифомедуз мезоглея представлена студенистой тканью, занимающей
большое пространство в теле животных. Ее основу составляют волокнистые
и пластинчатые белковые структуры в комплексе с разнообразными муко-
полисахаридами. У взрослых животных эта ткань заселена свободными под-
вижными гранулярными амебоцитами. Возможно, что в ней имеются и осед-
лые элементы. Высказывается предположение, что рассматриваемая ткань
имеет двойственное происхождение. Ее основу, как и у гидроидных полипов,
составляют межклеточные структуры, выделяемые покровным и кишечным
эпителием. В дальнейшем по мере развития животных из состава покровного
или кишечного эпителиев в эти межклеточные структуры выселяются свобод-
ные, а возможно, н оседлые клетки. Они принимают, по-видимому, участие
в прогрессирующем усложнении межклеточных структур мезоглеи.
Сходные отношения наблюдаются, по-видимому, и в организации мезоглеи
у гребневиков. Биохимический и диффракционный анализ показал наличие
в мезоглее коллагеноподобных белков. Однако эти белки не образуют харак-
терных поперечнополосатых фибрилл, т. е. имеют иную надмолекулярную
организацию, чем коллагеновые фибриллы позвоночных и высших первич-
норотых животных.*
У гребневиков помимо мембран, гладких волокон и пластинок в мезо-
глее располагаются спирально закрученные волокна. Они образуют тесную
связь с мышечными клетками и так же в стенке сосудов позвоночных жи-
вотных, по-видимому, механически препятствуют сокращению мышечных
клеток. Весьма вероятно, что этн волокна построены из эластиноподобных
белков. Морфологическими и биохимическими методами такие белки и эла-
стические волокна, образующие сеть за счет поперечных связей, обнаружены
в мезоглее сцифомедуз. Эластические структуры мезоглеи этих животных
лишены, однако, аморфного матрикса.
В противоположность мезоглее кишечнополостных и гребневиков, где
наблюдается известная редукция оседлого клеточного компонента первичных
паренхим предков многоклеточных, у низших и паразитических червей мы
наблюдаем редукцию межклеточных структур. Основным компонентом парен-
хим турбеллярий, нематод, плоских червей являются оседлые клеточные эле-
менты. У наиболее примитивных из этих животных — бескишечных турбелля-
рий — периферическая паренхима представлена сетью отростчатых клеток.
В петлях такой сети, включающей помимо оседлых клеток паренхимы мы-
шечные, железистые, нервные, половые и малодифференцированные камби-
альные клетки, не удается обнаружить большого количества волокнистых
и пластинчатых структур. Трофическая транспортная функция в такого рода
гетерогенных клеточных паренхимах осуществляется по-видимому, по кана-
лам и щелям паренхимы, не имеющих организованной стенки. Большую роль
в этих транспортных процессах играют надмембранные комплексы паренхи-
матозных клеток. Крайне узко и своеобразно специализированную форму
такого рода клеточной организации интерстициальных тканей представляют
собой, возможно, паренхимы паразитических плоских червей.
Наиболее «типична» в плане гармоничного сочетания кле-
точного и межклеточного компонентов, а также развития замк-
нутой кровеносной сосудистой системы паренхима немертин (рис.
52). Здесь имеются многочисленные фибробласты и сложная
система межклеточного вещества, представленная и волокни-
* В условиях in vitro выделенные из мезоглеи гребневиков коллагены
способны образовывать типичные поперечно-исчерченные коллагеновые фиб-
риллы, т. е. в условиях in vivo у гребневиков в мезоглее имеются факторы,
препятствующие нормальной самосборке молекул тропоколлагена.
202
Рис. 52. Участок соединительной ткани немертины.
/ — сосуд, 2— фибробласты, 3 — волокнистые структуры, 4 — основное вещество,
5 — мышца.
стыми, и пластинчатыми мукопротеидными структурами. Сле-
довательно, организация паренхимы немертин сходна с орга-
низацией рыхлой соединительной ткани позвоночных животных.
Глава 10. СКЕЛЕТНЫЕ ТКАНИ
§ 1. Скелетные ткани позвоночных животных
Плотная соединительная ткань позвоночных животных со-
стоит из тех же компонентов, что и рыхлая соединительная
ткань. Основными клеточными элементами плотной соедини-
тельной ткани являются клетки фибробластического ряда. Ос-
новную и главным образом механическую опорную функцию
играют здесь межклеточные структуры и в первую очередь кол-
лагеновые волокна, образованные коллагеном 1-го типа. Они
собраны обычно в мощные пучки и обеспечивают большую
прочность этой ткани. В зависимости от расположения пучков
коллагеновых волокон и их соотношения с прослойками рых-
лой соединительной ткани различают две основные разновид-
203
кости плотной соединительной ткани: оформленную и неоформ-
ленную.
Неоформленная плотная соединительная ткань характеризуется беспоря-
дочным расположением пучков коллагеновых волокон в пространстве. Про-
слойки рыхлой соединительной ткани более или менее равномерно распре-
делены в этой сложной взаимопереплетающейся сети мощных коллагеновых
структур. Вся система скреплена прослойками межклеточного вещества,
обычного для соединительной ткани химического состава (глюкозаминглика-
ны, сульфатированные гликозамингликаны, гликопротеиды).
Кроме основной системы, образованной пучками коллагеновых волокон,
имеется аналогичная система, образованная эластическими волокнами. По-
следняя придает всей структуре дополнительную прочность и эластичность,
в частности способность к растяжению и возвращению в исходное состояние
после прекращения действия внешнего механического фактора.
Широкое распространение плотная неоформленная соединительная ткань
имеет в кожных покровах позвоночных животных, осуществляя в них опор-
ную функцию. В тех случаях, когда кожные покровы подвергаются менее
разнообразным воздействиям, как это наблюдается, например, у водных жи-
вотных, в частности у рыб и круглоротых, пучки коллагеновых волокон при-
обретают более упорядоченное расположение.
Особенно отчетливо влияние функционального момента на
пространственную организацию пучков коллагеновых волокон
обнаруживается в тех разновидностях плотной соединительной
ткани, которые получили название оформленных и представле-
ны у позвоночных в основном сухожилиями и связками. В су-
хожилиях пучки коллагеновых волокон и клеточные элементы
фибробластического ряда ориентированы строго в направлении
продольной оси сухожилия, т. е. соответственно действию ме-
ханического натяжения при сокращении мышц.
Закономерному в пространстве расположению коллагеновых
волокон и дифференцированных клеток — фиброцитов соответ-
ствует и расположение прослоек рыхлой соединительной ткани,
содержащей кровеносные сосуды и малодифференцированные
камбиальные элементы фибробластического ряда.
Второй разновидностью оформленной соединительной ткани
у позвоночных животных являются связки. Они образованы
сетью эластических волокон и мембран, ориентированных пре-
имущественно в продольном направлении. В связках нет тако-
го строгого пространственного разграничения дифференциро-
ванных и камбиальных клеток фибробластического ряда, как
в сухожилиях.
Приведенными примерами далеко не исчерпывается все разнообразие
плотных соединительных тканей у позвоночных животных. Они могут варь-
ировать не только по своему микроанатомическому строению, но и по со- .
ставу основных макромолекулярных соединений, образующих структурные *
компоненты этих тканей. Так, например, в плотной соединительной ткани
роговицы млекопитающих вместо обычного для плотных соединительных
тканей позвоночных сульфатированного глюкозамингликана имеются особые
глюкозамингликаны. Качественный состав и количественные соотношения му-
кополисахаридов основного вещества могут сильно отличаться у близких
204
в систематическом отношении групп и, наоборот, быть сходными у далеко
отстоящих форм. Аналогичная закономерность наблюдается и в отношении
коллагенов. Весьма интересным фактом является наличие в плотной соеди-
нительной ткани кожи и эластической ткани стенки аорты млекопитающих
целлюлозы, аналогичной по своим свойствам туницину оболочников.
Хрящевая ткань позвоночных животных состоит из клеток
и межклеточного вещества. Особенностью последнего является
его сложный химический состав. Основными химическими сое-
динениями, образующими межклеточное вещество наиболее
распространенных гиалиновых хрящей, являются: коллаген
в форме надмолекулярных фибриллярных комплексов, сульфа-
тированные гликозамингликаны (хондроитинсульфаты А и С
и кератосульфаты), нейтральные мукополисахариды и некол-
лагеновые белки. Значительная часть белков и полисахаридов
представлена в межклеточном веществе хряща не в виде изо-
лированных соединений, а сложными надмолекулярными комп-
лексами. Это обеспечивает особые его свойства — механиче-
скую прочность и в то же время проницаемость для органи-
ческих соединений, воды и других веществ, необходимых для
нормальной жизнедеятельности клеточных элементов хрящевой
ткани. Коллагеновые волокна хрящевой ткани состоят из осо-
бой разновидности коллагена (коллаген П-го типа с одинако-
выми полипептидными цепями в молекуле).
Наиболее специфичными, маркерными, для межклеточного
вещества хряща соединениями являются кератосульфаты и оп-
ределенные разновидности хондроитинсульфатов. Они состав-
ляют до 7з сухого веса хряща и вступают в соединения, как
с коллагеном, так и с другими белками его межклеточного
вещества. Лучше изучены в настоящее время комплексы муко-
полисахаридов с неколлагеновыми белками. Эти мукопротеины
состоят из двух фракций — легкие, богатые мукополисахарида-
ми, и тяжелые протеин-полисахариды со значительно меньшим
содержанием полисахаридов в комплексе. Первая фракция
представлена преимущественно протеогликанами, а во второй
очевидно преобладают гликопротеиды.
У высших позвоночных хрящевая ткань относительно ранет
закладывается в онтогенезе и развивается из мезенхимы — об-
щего источника для всех разновидностей тканей внутренней
среды. На месте будущей хрящевой ткани происходит концент-
рация клеток как за счет их местной ускоренной пролифера-
ции, так и за счет миграции клеток из соседних участков мезен-
химы. Вскоре после образования такого скопления мезенхимных
клеток они начинают вырабатывать межклеточное вещество
и превращаются в специализированные клетки хрящевой тка-
ни — хондробласты и хондроциты.
Исходные клетки скелетогенной мезенхимы характеризуют-
ся высокими значениями ядерно-плазменных отношений (рис.
53). Структуры метаболического аппарата цитоплазмы: мел-
205
кие компактные митохондрии, относительно большое количест-
во свободных рибосом и небольшие участки гранулярной эн-
доплазматической сети. В цитоплазме много ограниченных мем-
бранами пузырьков и вакуолей. Аппарат Гольджи представлен
рассредоточенными в цитоплазме небольшими группами цент-
ральных цистерн со слабо развитыми периферическими вакуо-
лями. При превращении мезенхимных клеток в активно функ-
Рис. 53. Схема последовательных изменений ультраструктурной организации
клеток (а, б) при гистогенезе хрящевой ткани млекопитающих. [По: Кодман,
Портер].
7 —аппарат Гольджи, 2 — свободные рибосомы, 3 — шероховатая ЭПС, 4 —уплотнен-
ные участки цитоплазмы в области выведения макромолекул. 5 — коллагеновые фиб-
риллы, 6 — область концентрации гликогена, 7—митохондрия.
ч«
ционирующие хондробласты, которые синтезируют и выделяют
в окружающее межклеточное вещество основные макромоле-
кулярные соединения, происходит существенная перестройка
всей организации клеток. Она особенно четко проявляется в
изменении метаболического аппарата цитоплазмы (рис. 53, а, б).
Объем последней постепенно увеличивается, что приводит к зна-
чительному уменьшению ядерно-плазменных отношений. В клет-*
ках развивается белоксинтезирующий аппарат в виде шерохо-
ватой эндоплазматической сети, занимающей все больший
объем цитоплазмы. Аппарат Гольджи концентрируется в око-
206
.|ояде|>п<)й области и увеличивается в размерах. Сильно гипер-
I рофпруется его вакуолярная часть. Вместо небольших групп
нейтральных цистерн имеются уже активно функционирующие
мембранные системы этого органоида. В митохондриях увели-
чивается объем матрикса; их размеры в несколько раз пре-
вышают размеры митохондрий недифференцированных мезен-
химных клеток. В цитоплазме клеток появляются гранулы гли-
i-.orrnii и липидные включения. Одновременно увеличивается
l.(Mlичccтвo ограниченных мембранами пузырьков с содержи-
мым умеренной электронной плотности. Удается наблюдать
и картины выведения содержимого вакуолей в окружающее
межклеточное вещество путем своеобразного экзоцитоза или
апокриновой секреции. На периферии цитоплазмы дифферен-
цирующихся хрящевых клеток имеются уплотненные участки,
где, возможно, происходит выведение тропоколлагена и фор-
мирование коллагеновых фибрилл. Тонкие молекулярные меха-
низмы этого процесса, как и в случае фибриллогенеза в рыхлой
соединительной ткани, остаются неясными. Помимо упомяну-
того способа выведения синтезируемых клеткой высокомолеку-
лярных соединений имеет место, по-видимому, и экзоцитоз
г ирод||ирптелы1ым формированием окруженных. мембранами
। ранул и области аппарата Гольджи. Предполагают, что таким
путем происходит выделение неколлагеновых белков и муко-
полисахаридов.
Дифференцированный хондробласт представляет собой
клетку с сильно развитым метаболическим аппаратом, специа-
лизированным /га синтез двух основных компонентов межкле-
10411010 вещества — специфических белков и мукополисахари-
дов (рис, 53, б). Хопдробласты имеют мощно развитую эрга-
сгоилаэму и обширную околоядерпую территорию, занятую
преимущественно вакуолярвой системой аппарата Гольджи.
В гпалоплазме таких клеток имеются и значительные скопле-
ния гликогена.
Дифференцированные хондробласты и клетки иа описанных выше на-
чальных и средних стадиях дифференцировки обнаруживают высокую ме-
таболическую активность. Особенно наглядно ее удается показать, применяя
метод авторадиографии с использованием предшественников белкового, муко-
полисахаридного и сульфомукополисахаридного синтезов (3Н-пролин, 3Н-
глюкоза и Na23SSO4). Уже в ранних светооптических авторадиографических
работах было показано избирательное включение экзогенного меченного по
’’S сульфата натрия в цитоплазму хрящевых клеток с последующим выве-
дением меченого продукта в окружающее межклеточное вещество. В даль-
нейшем, при использовании электронной авторадиографии удалось уточнить,
что местом первичного включения меченой серы являются цистерны аппа-
рата Гольджи. Аналогичные данные получены и в отношении локализации
меченых моносахаров. На основании этих наблюдений был сделан вывод
о том, что местом синтеза мукополисахаридов, а также их сульфатирования
являются мембраны аппарата Гольджи.
Об интенсивности метаболических процессов в хрящевых клетках свиде-
тельствуют опыты с предшественником синтеза коллагена 3Н-пролином. При
207
введении этой аминокислоты меченый белок вначале обнаруживается над
свободными и прикрепленными рибосомами эндоплазматической сети. За-
тем меченый белок почти одновременно поступает в область аппарата Гольд-
жи и в периферические участки гиалоплазмы. Высказывается предположе-
ние, что в хондробластах пространственно разделен синтез коллагеновых
и неколлагеновых белков. Через 24 ч после инъекции радиоактивных аминокис-
лот меченый белок обнаруживается в межклеточном веществе. Таким образом,
в активно функционирующих хондробластах весь цикл синтеза и выведения
меченых высокомолекулярных продуктов занимает меньше 24 ч. Вновь образо-
ванные белки и мукополисахариды не располагаются непосредственно около по-
верхности клеток, а распространяются диффузно (на значительное расстоя-
ние от клетки) в образовавшемся ранее межклеточном веществе. Последний
факт указывает на весьма сложный и неясный еще в деталях механизм
внеклеточной сборки и формирования дефинитивных коллагеновых волокон
и мукопротеиновых комплексов хрящевой ткани.
Активно функционирующие хондробласты в эмбриональных
зачатках хрящевой ткани не утрачивают способности к синтезу
ДНК и делению. Рост хрящевого зачатка происходит как за
счет увеличения прослоек продуцируемого клетками межкле-
точного вещества, так и за счет деления клеток. Однако интен-
сивность размножения с момента начала гетеросинтетической
деятельности клеток падает в основном за счет сильного увели-
чения продолжительности митотического цикла. Характерным
изменениям подвергается и ядерный аппарат хондробластов.
Ядро пикнотазируется, ядрышковый аппарат сильно редуци-
руется. Зрелые хрящевые клетки — хондроциты в хряще распо-
лагаются обычно группами по 2, 4 или 8 клеток; эти так назы-
ваемые изогенные группы окружены особыми участками меж-
клеточного вещества, или клеточными территориями. Каждая
изогенная группа образуется в результате деления одного хонд-
робласта. Завершающие автосинтетические процессы происхо-
дят уже на поздних стадиях жизненного цикла хондробластов
при снижении в них специфической гетеросинтетической ак-
тивности. В связи с этим образующиеся дочерние клетки не
могут сформировать большого количества межклеточного веще-
ства и отойти друг от друга на значительное расстояние.
В дефинитивной гиалиновой хрящевой ткани имеется стро-
го поляризованное распределение клеток по уровню их диффе-
ренцировки (рис. 54). На поверхности хряща выделяется слой
плотной соединительной ткани с хорошо развитой сетью крове-
носных сосудов, с запасом камбиальных малодифференциро-
ванных клеток — надхрящница. Она обеспечивает так называ-
емый аппозиционный рост хряща. Кроме того, через сосуды
надхрящницы поступают в хрящевую ткань вещества, необхо-
димые для поддержания ее жизнедеятельности, а также выво-
дятся конечные продукты обмена. В гиалиновой хрящевой тканц,
трахеи клетки располагаются строго по уровню их дифферен-
цировки. Ближе к поверхности хряща располагаются наименее
дифференцированные одиночные хондробласты, имеющие вид
вытянутых параллельно надхрящнице клеток. Они энергич-
208
но синтезируют межклеточное вещество и сохраняют способ-
ность к делению. В центре хрящевой пластинки располагаются
изогенные группы зрелых хондроцитов, имеющих округлую
или овальную форму и значительно больших, чем хондробла-
сты, размеров. Эти клетки уже не способны к делению и к
синтезу межклеточного вещества в заметных количествах.
Клетки, расположенные между надхрящницей и центром хря-
щевой ткани, занимают промежуточное положение по уровню
своей дифференцировки.
Рис. 54. Участок гиалинового хряща трахеи кошки.
/ — надхрящница, 2— молодая хрящевая ткань, 3—зрелая хрящевая ткань, 4 — изо-
генные группы клеток.
Описанный выше гиалиновый хрящ высших позвоночных яв-
ляется широко распространенной, но далеко не единственной
разновидностью хрящевой ткани. Даже у животных одного
класса, в частности у млекопитающих, имеются еще волокни-
стые и эластические хрящи. В межклеточном веществе волок-
нистого хряща намного больше коллагеновых волокон, чем
в гиалиновом. По своей организации волокнистый хрящ зани-
мает промежуточное положение между плотной оформленной
соединительной и хрящевой тканями. В известной мере это
справедливо и в отношении эластического хряща, где помимо
основного аморфного вещества и коллагеновых волокон име-
ется дополнительная система эластических волокон, придаю-
щих такой хрящевой ткани особые механические свойства.
209
Еще большее разнообразие хрящевых тканей удается об-
наружить при сравнительно-гистологическом анализе у пред-
ставителей разных классов позвоночных. Эти различия каса-
ются соотношения клеток и межклеточных структур, деталей
внутренней организации клеточных элементов и, наконец, хи-
мического состава межклеточного вещества. Как правило, от-
носительное количество последнего возрастает у представите-
лей высших классов позвоночных. При этом увеличивается
и количество более сульфатированных хондроитинсульфатов А.
Однако у некоторых низших позвоночных, например у скатов,
имеются специальные механизмы гиперсульфатации более рас-
пространенного в хрящах низших позвоночных хондроитинсуль-
фата С.
Несмотря на известные тенденции эволюционного усложне-
ния химического состава и системной организации хрящевых
тканей, имеющиеся в настоящее время сравнительно-биохими-
ческие и сравнительно-гистологические данные свидетельствуют
о том, что в основе строения всех хрящевых тканей позвоноч-
ных животных лежит единый принцип их биохимической орга-
низации. Наиболее важной закономерностью такой организа-
ции является формирование межклеточных структур на основе
крупных надмолекулярных комплексов, образованных за счет
объединения молекул сульфатированных полисахаридов с бел-
ками и определенного структурного взаимодействия этих му-
копротеиновых комплексов с коллагеновыми фибриллами.
Костная ткань. Для создания достаточно прочного внутрен-
него скелета в процессе эволюции у позвоночных животных
появилась еще одна разновидность скелетных тканей, а имен-
но костная ткань. Время ее возникновения у позвоночных жи-
вотных или, скорее, порядок возникновения в эволюции позво-
ночных хрящевой и костной тканей к настоящему времени вы-
яснены недостаточно. Возможно, что обе эти разновидности
скелетных тканей появились у предков позвоночных животных
более или менее одновременно.
Костная ткань, как и рассмотренные выше другие разно-
видности скелетных тканей, состоит из клеток и межклеточного
вещества. Последнее представлено двумя основными компо-
нентами— органическим матриксом и солями кальция, пре-
имущественно гидрооксиапатитами. Неорганический компонент
костной ткани и определяет специфику ее как особой, наибо-
лее совершенной в механическом отношении скелетной ткани
позвоночных животных.
Соли распределены в межклеточном веществе кости не хао-
тично, а закономерно структурированы в ее органическом мат-
риксе. Сам процесс отложения этих солей представляет собой
весьма сложное биологическое явление, требующее специаль-
ной организации органического матрикса межклеточного веще-
ства. Хотя основные химические компоненты этого матрикса те
210
же, что и в межклеточном веществе хряща, однако их соотно-
шение и детали химического строения отличаются рядом осо-
бенностей!.
Относительное количество коллагеновых волокон в межкле-
точном веществе костной ткани близко к их количеству в хря-
щевой ткани и составляет в среднем около 30% его сухого
веса. В отличие от хрящевой ткани коллагеновые волокна кост-
ной ткани образованы коллагеном I типа. В молекулах колла-
гена много свободных боковых аминогрупп лизиновых и окси-
лизиновых остатков. Эти боковые аминогруппы обладают спо-
собностью активно связывать пирофосфаты. Другой важной
особенностью коллагена кости является высокое содержание
органического фосфата при нормальной его концентрации в сре-
де. На-один моль коллагена в костной ткани приходится два
моля фосфатов. Для хондроитинсульфатов (сульфатированные
гликозамингликаны) костной ткани характерна высокая сте-
пень их сульфатации и полимеризации. В связи с этим они мо-
гут выступать как активные накопители и переносчики необхо-
димых для минерализации кости ионов кальция. Из протеин-
полисахаридных комплексов в костной ткани преобладает
фракция легких протеин-полисахаридов (протеогликаны), со-
держащих лишь 15% белка и 85% хондроитинсульфатов. Осо-
бенностью этого комплекса является способность связывать,
а при изменении конформации молекул отдавать ионы кальция
в окружающую среду. Организация органического матрикса
межклеточного вещества кости специально приспособлена для
обеспечения процессов кальцификации. Минерализация может
происходить только в нативных коллагеновых фибриллах, об-
разующих в естественном состоянии сложные надмолекуляр-
ные комплексы с мукополисахаридами и протеинполисахарид-
ными макромолекулами (протеогликаны). Кристаллы гидро-
окиси аппатита откладываются не беспорядочно. Они занимают
имеющиеся в расположенных линейно молекулах тропоколла-
гена промежутки между головкой одной и хвостовым участком
другой молекулы.
Костные ткани, как и хрящевые, у позвоночных животных
представлены большим количеством разновидностей, которые
могут быть сведены к трем основным типам: дентиноидные,
грубоволокнистые и пластинчатые. Характерной особенностью
дентиноидной костной ткани является отсутствие в толще ее
межклеточного вещества тел костных клеток. У высших позво-
ночных единственным примером такой костной ткани является
дентин зуба, у низших (и особенно у ископаемых) животных
дентиноидная костная ткань имеет и имела более широкое рас-
пространение в наружных, так называемых накладных костях
скелета. Для грубоволокнистой кости характерно относительно
небольшое количество и беспорядочное расположение коллаге-
новых волокон. Грубоволокнистая костная ткань широко пред-
211
ставлена у низших позвоночных и в эмбриональном и раннем
постнатальном гистогенезе костей внутреннего скелета высших
позвоночных.
Основным структурным компонентом пластинчатой костной
ткани является костная пластинка. Последняя представляет со-
бой участок костной ткани с параллельно расположенными во-
локнами. В соседних пластинках волокна располагаются обыч-
но под углом в 90°. Пластинчатая костная ткань образует ос-
новные кости дефинитивного внутреннего скелета высших по-
звоночных, а с некоторыми примитивными признаками органи-
зации встречается и у низших позвоночных и, что самое инте-
ресное, у их вымерших ископаемых предков.
Ранние стадии развития костной ткани в онтогенезе высших
позвоночных внешне напоминают развитие хрящевой ткани.
Источником так называемых соединительнотканных или на-
кладных костей является скелетогенная мезенхима. На месте
формирования будущей кости в мезенхиме образуются уплот-
ненные участки. К моменту формирования межклеточного ве-
щества в таких участках клетки располагаются рядами, при-
обретая эпителиоподобный вид (рис. 55, а). Их цитоплазма
становится резко базофильной в связи с развитием мощного
белоксинтезирующего аппарата в виде шероховатой эндоплаз-
матической сети и аппарата Гольджи. В прилегающих Друг
к другу рядах клеток в области их контактирующих поверх-
ностей начинается выработка межклеточного вещества кости.
Здесь образуются костные перекладины. Часть остеобластов
замуровывается в толщу межклеточного вещества, где они пре-
вращаются в дифференцированные клетки костной ткани —
остеоциты (рис. 55, б, в). В отличие от хондроцитов они имеют
отростчатую форму. Тонкие отростки остеоцитов находятся
в особых костных канальцах, пронизывающих все межклеточ-
ное вещество костной ткани. При помощи этих канальцев тела
остеоцитов, находящиеся в костных полостях, связаны между
собой и с кровеносными сосудами, расположенными на поверх-
ности кости в надкостнице или в специальных каналах в тол-
ще костной ткани. Поскольку межклеточное вещество костной
ткани непроницаемо для продуктов метаболизма, весь обмен
веществ между телами остеоцитов и кровеносными сосудами
происходит через систему костных канальцев.
На рассматриваемой стадии происходит формирование уже
достаточно сложной тканевой системы с основными признака-
ми дефинитивной организации. В основе такой системы лежит
надкостница, образованная тремя основными типами клеточ-
ных элементов — камбиальными полустволовыми клетками,
функционирующим камбием — преостеобластами и утративши-
ми способность к размножению остеобластами. Завершают
этот последовательный ряд клеточных элементов костной тка-
ни остеоциты.
212
Рис. 55. Участок развивающейся кости и схемы ультраструктурной органи-
зации клеток костной ткани.
а — участок костной ткани, б — остеобласт, в — остеоцнт, г — остеокласт, 1 — оссеи-
новые фибриллы, 2 — шероховатая ЭПС, 3 — уплотненные участки цитоплазмы, 4 —
лизосомы, 5 — митохондрии, 6 — аппарат Гольджи, 7 — межклеточное вещество кости,
8 — ядро, 9—10 — участки образующейся (3) н разрушающейся (10) кости.
213-
Камбиальные полустволовые клетки представляют собой
веретеновидные клеточные элементы с небольшим объемом
цитоплазмы и умеренно развитым метаболическим аппаратом.
Преостеобласты — это особая субпопуляция клеток, которая
характеризуется энергичной пролиферативной активностью. Они
обеспечивают увеличение количества клеток в системе. Наряду
с этим у них достаточно хорошо развит белоксинтезирующий
аппарат, а также имеются и другие признаки, свидетельству-
ющие об относительно высоком уровне метаболизма. По мне-
нию некоторых авторов, эти морфологические особенности
обусловлены не только автосинтетическими процессами, связан-
ными с интенсивной репродукцией клеток. Высказывается пред-
положение, что хотя бы часть этих клеток приступает и к про-
цессам специфического синтеза, в частности, к синтезу муко-
полисахаридов. Выведение последних из клеток совершается,
согласно этим взглядам, после превращения преостеобластов
в остеобласты, которые специализируются преимущественно на
синтез коллагена. Как указывалось выше, остеобласты в уль-
траструктурном отношении характеризуются прежде всего мощ-
ным развитием белоксинтезирующего аппарата (шероховатая
эндоплазматическая сеть) и других мембранных органоидов.
Высокая белоксинтезирующая активность рассматриваемых
клеток отчетливо выявляется в авторадиографических опытах
с 3Н-пролином.
Механизмы внутриклеточного транспорта и выведения мак-
ромолекул, а также внеклеточный фибриллогенез в костной
ткани в принципе могут быть сходными с аналогичными про-
цессами в хрящевой и соединительной тканях. Возможно, од-
нако, что при остеогенезе имеются и некоторые особенности
этих процессов. Так, в частности, удалось показать выведение
тропоколлагена одонтобластами путем экзоцитоза гранул, об-
разующихся в области аппарата Гольджи.
Остеоциты представляют собой неоднородную популяцию
клеток. Это находит свое отражение и в их ультраструктурной
организации. Здесь имеются клетки с относительно хорошо
развитыми мембранными органоидами и, наоборот, с от-
носительно слабым развитием этих структур (рис. 55, в).
В настоящее время накапливается все больше данных
о том, что эти клетки принимают активное участие в метабо-
лических процессах, протекающих в межклеточном веществе
кости. Они участвуют в поддержании постоянства ионного
баланса в организме. Достаточно сказать, что общая площадь
-соприкосновения тканевой жидкости с межклеточньпм вещест-
вом кости достигает у человека 1500—5000 м2. Такая громад-
ная поверхность соприкосновения минерализованной костной
ткани с жидкой средой создает сама по себе необходимые пред-
посылки для поддержания ионного гомеостаза организма.
Этому способствует и активная роль клеточных элементов,
214
обладающих, по-видимому, свойством осаждать или, наоборот,,
переводить в растворенное состояние неорганические компо-
ненты межклеточного вещества кости.
Весьма характерная особенность костной ткани — постоян-
ное сосуществование в ней процессов новообразования и раз-
рушения. Больше того, гармоничное сочетание этих двух про-
тивоположных по своей сути процессов является необходимым
условием и механизмом роста формирующейся кости. Уже
с самого момента возникновения в ней выделяются участки,,
где идет интенсивный аппозиционный рост костных перекладин,,
и зоны', где происходит разрушение образовавшейся ранее кост-
ной ткани. В накладных соединительнотканных костях участки
интенсивного аппозиционного роста обычно расположены на
внешней, обращенной к кожным покровам поверхности, а уча-
стки резорбции — на внутренней поверхности формирующейся
кости.
Процесс разрушения межклеточного вещества кости—до-
статочно сложный и неясный еще во многих деталях систем-
ный процесс. В нем принимают активное участие все типы
клеток костной ткани и, по-видимому, ряд гуморальных фак-
торов. Особенно заметную и важную с гистологической точки
зрения роль играет в этом процессе особый тип клеток — осте-
окласты (рис. 55, а, а). Они представляют собой крупные мно-
гоядерные клетки с резко оксифильной цитоплазмой. Остео-
класты относятся к системе свободных клеток тканей внутрен-
ней среды и представляют собой, по сути дела, специальные
макрофаги, образующие путем слияния многоядерные клетки,,
специально предназначенные для разрушения костной ткани.
Их цитоплазма занимает относительно большой объем и в
центральной части, т. е. в области ядер представлена ком-
пактной массой, а на периферии, особенно в области контакта
с межклеточным веществом кости, образует сеть анастомози-
рующих друг с другом отростков. В остеокластах особенно-
хорошо развит аппарат Гольджи и система ограниченных мем-
бранами пузырьков и вакуолей. Большая часть последних
представляет собой лизосомы на разных этапах гетерофагиче-
ского цикла. Остеокласты обладают способностью создавать
локально у своей поверхности кислую среду за счет интенсив-
но идущих в этих клетках процессов гликолиза. Кислая среда
в области непосредственного контакта цитоплазмы остеоклас-
тов и межклеточного вещества способствует растворению ми-
неральных солей, создает также оптимальные условия для дей-
ствия протеолитических и ряда других ферментов лизосом,,
содержимое которых выделяется остеокластами путем экзоци-
тоза.
В наиболее сложной и совершенной пластинчатой костной
ткани костные пластинки закономерно ориентированы по отно-
шению друг к другу и к кровеносным сосудам, обеспечиваю-
215.
щим трофику этой ткани. Особенно наглядно такие взаимоот-
ношения выражены в пластинчатой ткани диафизов трубчатых
костей у млекопитающих (рис. 56, а, б). В этой костной ткани
имеется три связанных между собой разновидности костных
каналов в межклеточном веществе и несколько типов костный
пластинок, определенным образом ориентированных по отно-
шению к продольным так называемым гаверсовым каналам
Рис. 56. Пластинчатая костная ткань млекопитающих.
а— остеон, б — схема строения трубчатой кости1. /— система наружных н внутренних
генеральных пластинок, 2 — гаверсовы пластинки, 3 —полость гаверсового канала,
4 — вставочные пластинки, 5 — полости костных клеток и анастомозирующая сеть
костных канальцев, 6 — надкостница, 7—кровеносный сосуд кости, 8— кровеносные
сосуды костного мозга, 9 — фолькмановский канал, 10—граница остеона, 11— остео-
генная соединительная ткань.
костной ткани. Все межклеточное вещество кости пронизано
анастомозирующими между собой и связанными с наружной
и внутренней поверхностью трубчатой кости, а также с поло-
стью гаверсовых каналов, костными канальцами. В них рас-
полагаются отростки костных клеток. В идущих параллельно
длинной оси трубчатой кости гаверсовых каналах находятся
рыхлая соединительная ткань, кровеносные сосуды, а по по-
верхности стенки канала — малодифференцированные клеточ-
ные элементы костной ткани. Кровеносные сосуды в толще
216
межклеточного вещества кости связаны с сосудистыми силетс-
ниями надкостницы системой артерий и вен, расположенных
в специальных так называемых фолькмановских каналах, пер-
пендикулярных к длинной оси диафизов. Непосредственно под
надкостницей располагаются наружные генеральные костные
пластинки. Они состоят из нескольких пластинок, охватываю-
щих по внешней окружности весь диафиз трубчатой кости.
В соседних костных пластинках коллагеновые волокна распо-
лагаются под углом 90° друг к другу. Такая организация ос-
новного органического компонента межклеточного вещества
костной ткани в механическом отношении является наиболее
прочной. Второй разновидностью костных пластинок являются
внутренние генеральные пластинки, которые, располагаются на
внутренней поверхности трубчатой кости на границе с костно-
мозговым каналом.
Наиболее распространенным типом костных пластинок, об-
разующих основную массу ткани, являются системы гаверсо-
вых пластинок, концентрически расположенных вокруг гавер-
совых каналов. Каждая система таких пластинок получила
название остеона. Между соседними остеонами располагаются
вставочные пластинки, которые в отличие от остеонов не имеют
гаверсова канала и концентрического расположения. Они пред-
ставляют собой по сути дела сохранившиеся в костной ткани
участки остеонов предшествующих генераций. Особенностью
всей системы пластинчатой кости является то, что в ней не-
прерывно идут процессы физиологической регенерации. При
этом основную роль в этих процессах играет не сама надкост-
ница, а малодифференцированные полустволовые клетки кост-
ной ткани, расположенные по ходу кровеносных сосудов в га-
версовых каналах. При старении остеонов в гаверсовых кана-
лах появляются остеокласты, которые разрушают костные
пластинки, образуя обширную полость в межклеточном веще-
стве кости. Затем из малодифференцированных клеток форми-
руются остеобласты, которые образуют новую систему кон-
центрически расположенных костных пластинок новых остео-
нов. Поскольку процессы разрушения старых остеонов могут
проходить несколько эксцентрично, отдельные их участки оста-
ются в костной ткани, образуя системы вставочных пластинок.
Интенсивность такой своеобразной физиологической регенера-
ции настолько велика, что у взрослого человека за 10 лет про-
исходит полное обновление костной ткани. Благодаря такой
организации костная ткань может обеспечить формирование ме-
ханических структур, адекватных меняющимся в ходе развития
животных и человека физическим нагрузкам.
Из приведенной краткой характеристики костной ткани по-
звоночных животных следует, что она представляет собой
весьма совершенную специализированную разновидность тка-
ней . внутренней среды. В этой системе гармонично сочетаются
217
такие противоположные свойства и процессы, как механическая
прочность и функциональная пластичность, процессы новооб-
разования и разрушения костной ткани.
Специализация приводит к утрате в костной ткани такого
характерного первичного признака тканей внутренней среды,
как первичная аполярность клеток и межклеточных структур.
В клетках костной ткани резко выражены конкурентные и даже
антагонистические отношения между процессами специфиче-
ского синтеза и репродукцией, что обычно не свойственно клет-
кам тканей внутренней среды.
Взаимоотношения разновидностей скелетных тканей позво-
ночных животных. В основе организации таких различных на
первый взгляд тканей, как рыхлая и плотная соединительные,
костная и хрящевая, лежит в конечном счете единый процесс
-сложной комплексной синтетической деятельности оседлых кле-
ток тканей внутренней среды позвоночных. Основными компо-
нентами этих тканей, несмотря на специфические особенности
их разновидностей у позвоночных животных, являются колла-
гены и мукополисахариды, входящие в состав надмолекуляр-
ных комплексов. Образование этих макромолекул происходит
с помощью сходных ферментов, имеющихся у фибробластов,
хрящевых и костных клеток. Очевидно, что такие процессы,
как внутриклеточный транспорт, выведение из клеток высоко-
молекулярных органических соединений и сборка их в надмо-
лекулярные комплексы требуют сходной внутренней организа-
ции рассматриваемых клеток.
Существование общего биохимического механизма в осно-
ве дифференцировки опорных тканей заставляет предполагать
глубокое сходство и взаимосвязь, их разновидностей в истори-
ческом и индивидуальном развитии организмов. Весьма ярко
проявляется взаимосвязь этих тканей в процессах эмбриональ-
ного гистогенеза. Об этом свидетельствуют даже чисто фено-
менологические характеристики наблюдаемых морфологиче-
ских картин и процессов.
В раннем онтогенезе, в период энергичного роста развива-
ющегося эмбриона у высших позвоночных большинство круп-
ных костей внутреннего скелета закладывается в виде хряще-
вых «моделей». Темпы их роста в этот период соответствуют
темпам роста развивающегося организма. Затем, когда рост
замедляется и возникает необходимость формирования уже
более прочного в механическом отношении скелета, происхо-
дит замещение хряща костью. Процесс этот в трубчатых костях
начинается с того, что в области диафиза сформированной уже
хрящевой модели кости клетки надхрящницы перестают диф-*1
-ференцироваться в хондробласты (рис. 57, ц). Они начинают
продуцировать остеобласты, которые формируют на поверхно-
сти хряща манжетку из так называемой перихондральной
костной ткани. Хрящевая ткань в области расположения такой
218
костной манжетки начинает разрушаться. Процессы рпзру-
шения усиливаются за счет деятельности специальных клеток
хондрокластов. Затем на тонких прослойках сохранившегося
еще межклеточного вещества хряща оседают остеобласты,
возникающие из периваскулярной мезенхимы. Они образуют
участки так называемой энхондральной кости. Когда процессы
энхондрального и перихондрального замещения хрящевой тка-
ни костной в области диафиза зацдут уже достаточно далеко,.
Рис. 57. Взаимоотношения хрящевой и костной тканей при развитии труб-
чатой кости.
а —продольный срез трубчатой кости в области перехода диафиза в эпифиз, б —
в —автографы этой же области у двухдневных мышей через 1 ч (б) и 4 сут (в)
после трехкратной инъекции 3Н-тнмидина с иитервалдм в 6 ч; 1 — перихондральная-
кость, 2 — энхондральная кость, 3 — надкостница, 4 — формирующаяся миелоидная ткань,,
о — зона уплощенных пролиферирующих хрящевых клеток, 6 — зона пузырчатого хряща..
начинается замещение костью хрящевой ткани эпифизов. Наи-
более продолжительное время (у человека до 20 лет) сохра-
няется хрящевая ткань в составе трубчатых костей на границе'
эпифиза и диафиза, где образуются характерные полоски, или
столбики, размножения и роста хрящевых клеток. Их деятель-
ность обеспечивает рост кости в длину. Участки хрящевой тка-
ни в области этих зон роста представляют собой весьма свое-
образную систему. Здесь происходит непрерывное размноже-
ние клеток. По направлению к диафизу клетки увеличиваются
в размерах и образуют прослойки межклеточного вещества.
Одновременно со стороны диафиза идет непрерывное разруше-
219»
ние хрящевой ткани и замещение ее костной за счет деятель-
ности остеогенной соединительной ткани, находящейся в кост-
номозговом канале и надкостнице.
Динамика размножения клеток в эпифизарной части хрящевой пластин-
ки и их перемещения в область гипертрофированных и разрушающихся хря-
щевых клеток на границе с диафизом хорошо прослеживаются в опытах с 3Н-
тимидином. На ранних сроках после инъекции 3Н-тимидина маркированные
ядра у хондроцитов наблюдаются лишь в области их размножения (рис. 57,
б). К более поздним срокам хондроциты с меченой ДНК смещаются уже
на границу с диафизом (рис. 57, в). Длительное время размножение клеток
и рост хряща сбалансированы с процессами его замещения костной тканью,
и толщина хрящевых пластинок остается без изменения. Расстояние же
между двумя хрящевыми пластинками, расположенными на границе эпифи-
зов трубчатой кости, непрерывно увеличивается, т. е. происходит рост диа-
физа в длину. При завершении процессов роста замещение костной тканью
хрящевых пластинок начинает преобладать над ростом и размножением хря-
щевых клеток. К этому времени происходит и полное замещение эмбриональ-
ной, эихондральной и перихондральной костных ткаиёй дефинитивной плас-
тинчатой костной тканью.
Процессы замещения хрящевой ткани костной в трубчатых костях внут-
реннего скелета с теми или иными вариантами характерны для большинства
классов позвоночных животных.
Помимо описанных выше изменений в скелетогеиных зачатках организ-
ма может наблюдаться и метаплазия остеогенной камбиальной системы
в хондробластическую. Наиболее простым примером является развитие
хрящевых мозолей при переломах кости. Хрящевая ткань при переломах
формируется из камбиальных клеток надкостницы. В них происходят соот-
ветствующие сдвиги в работе генетического аппарата, необходимые для син-
теза особого «хрящевого» коллагена и специфических хондроитинсульфатов.
Непосредственным фактором, делающим такое изменение клеточного метабо-
лизма возможным, является уровень кислородного обмена. Развитие хря-
щевой ткани в области перелома кости происходит лишь при сильном нару-
шении сосудистой системы. В случае сохранения капиллярной сети регене-
рация кости идет без стадии хрящевой мозоли.
Еще более многообразные и сложные примеры метаплазии опорных тка-
ней удается получить в экспериментальных условиях. В опытах по культи-
вированию клеток надкостницы куриного эмбриона по методу висячей кап-
ли автором в зависимости от окружающих условий (степень насыщения кис-
лородом, плотность расположения клеток в системе, механическое натяже-
ние) удавалось получить из одних и тех же клеток либо костную ткань,
либо хрящевую, либо, наконец, плотную фиброзную ткаиь.
Естественно, что возможность относительно легкой взаимной метапла-
зии тканей широко реализуется при их филогенетической дифференцировке
у представителей разных классов позвоночных животных, о чем свидетель-
ствуют разобранные выше процессы нормального замещения хрящевой тка-
ни костной. Еще одним примером может служить обратный процесс — мета-
плазия остеобластов в хоидробласты хряща суставных поверхностей при
развитии некоторых костей черепа у птиц. Такой метаплазии предшествует
усиленная пролиферация клеток надкостницы. После накопления достаточ-
ной клеточной массы часть клеток идет по пути остеогенеза, а часть усили-
вает синтез хондроитинсульфатов и превращается в хрящ.
Пластичность скелетных тканей позвоночных животных со-
четается в организме со сложной системной организацией этих
тканей. Последняя особенно интенсивно изучается в настоящее
время на примере костной ткани высших позвоночных живот-
ных.
220
Помимо работающего камбия, представленного иреостеоб-
ластами в костной ткани, как -и в других разновидностях тка-
ней внутренней среды, имеется еще и система полустволовых
недифференцированных камбиальных клеток. Она также, по-
видимому, гетерогенна по своим биологическим свойствам и со-
стоит из детерминированных и так называемых индуцибельных
клеток. По морфологическим признакам рассматриваемые
клетки существенно не различаются из-за отсутствия у них ка-
ких-либо признаков специфической дифференцировки.
Различия между этими клетками проявляются лишь в эк-
спериментальных или патологических условиях. Детерминиро-
ванные остеогенные клетки-предшественники не требуют особых
условий для проявления своих потенций к остеогенезу. Инду-
цибельные полустволовые клетки, наоборот, могут превращать-
ся в остеобласты лишь после воздействия на них специфи-
ческих индукторов, выделяемых основным веществом кости,
эпителием мочевого пузыря и неизвестными для нас эндоген-
ными естественными факторами. Указанные различия между
двумя типами полустволовых остеогенных клеток-предшествен-
ников определяются, по-видимому, различными рецепторами
на их наружной поверхности. Возможно, что эти две категории
клеток отражают лишь разные этапы их дифференцировки.
Помимо этих разновидностей полустволовых клеток в тканях
внутренней среды взрослых млекопитающих имеются упоми-
навшиеся уже выше стволовые стромальные клетки, способ-
ные, по-видимому, в зависимости от воздействия регулирующих
местных или гуморальных факторов дифференцироваться в на-
правлении любого типа оседлых клеток.
§ 2. Скелетные опорные ткани беспозвоночных животных
Аналогичные костной ткани позвоночных животных скелет-
ные минерализованные системы беспозвоночных независимо
друг от друга развиваются в тканях внутренней среды или, ско-
рее, в их аналогах у представителей трех типов животных:
губок, кишечнополостных и иглокожих.
У кишечнополостных (класс Anthozoa) и губок (классы
Calcarea и Cornacuspongida) минерализованные структуры
представлены спикульным скелетом, у иглокожих они образуют
обычно субэпителиальный скелет из системы пластинок или
аналогичных им структур.
У губок спикульный скелет разнообразен по своему хими-
ческому составу и по характеру распределения органического
и неорганического компонентов. У известковых губок спикулы
образованы в основном кальцитом (СаСО3), у кремневых гу-
бок— кремнеземом (SiO2) или арагонитом (особой формой
СаСОз).
Спикулы образуются специальными клетками — спикуло-
221
бластами, которые выделяют как минеральные, так и органи-
ческие компоненты. В состав органического компонента входят
волокнистые структуры и аморфный матрикс. Химический со-
став волокнистых структур и аморфного матрикса изучен пока
слабо. Предполагают, что здесь имеются и типичные коллаге-
новые волокна, и поперечно-исчерченные коллагеноподобные
волокна, и мукопротеиды. В спикулах кремневых губок пока-
зано наличие осевого органического волокнистого матрикса, оп-
ределяющего направление кристаллизации; в спикулах, обра-
зованных кальцитом, имеются чехлики из эластиноподобных
белков и коллагеновых волокон, ограничивающих и направ-
ляющих процессы кристаллизации. Такие же чехлики имеются
и у кремневых спикул.
Суммируя все эти данные, можно сказать, что у губок, как
и в костной ткдни позвоночных или в обезызвествленных раз-
новидностях кутикулярных эпителиев, отчетливо проявляется
направляющая, ограничивающая и организующая роль орга-
нического матрикса в процессах минерализации. При этом
конкретные ее механизмы у разных губок, по-видимому, раз-
личны. Иными словами, в пределах типа губок реализуются,
вероятно, многие из возможных сочетаний органического и ми-
нерального компонентов, наблюдаемых в минерализованных
системах и у других многоклеточных животных. Аналогичная
ситуация наблюдается, по-видимому, в спикулах кишечнополо-
стных, в частности у наиболее изученных в этом отношении
минерализованных структур мезоглеальной природы у корал-
ловых полипов. Как и у губок, внутриклеточно в спикулоб-
ластах или в симпластах, образуемых этими клетками, фор-
мируется органический стержень, на который откладывается
СаСО3. Далее наблюдается периодическое чередование мине-
рального и органического компонентов, т. е. имеет место регу-
лируемое клеткой их взаимодействие.
Наиболее хорошо изучено соотношение минерализации
и формирование органической основы в субэпителиальном ске-
лете иглокожих.
Минерализованные кальцитом пластинки занимают пра-
вильное сетчатое расположение в плотном межклеточном веще-
стве подкожной соединительной ткани, где имеются и фиброб-
ластоподобные клетки. В каждой пластинке содержится орга-
нический матрикс, основу которого образуют коллагеновые
фибриллы. Процесс минерализации в пластинках аналогичен
минерализации костной ткани позвоночных. Центрами кристал-
лизации являются свободные участки в местах контакта «го-
ловок» и «хвостов» соседних молекул тропоколлагена. ТаКивд
образом, кристаллы оказываются строго ориентированными
по ходу коллагеновых фибрилл. Такой принцип минерализации
не нарушает целостности последних, а лишь укрепляет их проч-
ность.
222
Что касается тканевого уровня организации этих скелетных
структур, то он существенно отличается от костной ткани по-
звоночных. В спикульных скелетах иглокожих и кишечнополо-
стных практически отсутствует тканевая организация минера-
лизованных структур, хотя образование каждой спикулы есть
обычно результат интегрированной и сложной деятельности
группы клеток или симпластических структур, представляющих
часто клоны — результат размножения исходного спикуло-
бласта.
У иглокожих минерализованные пластинки иногда весьма
причудливой формы, а сложные игольчатые спикулы развива-
ются в типичной соединительной ткани. Однако характер фор-
мирования этих структур и их взаимоотношения с клетками
скорее сходен с отношениями, характерными для коралловых
полипов и губок, чем с типичной тканевой организацией кост-
ной ткани позвоночных.
В других группах беспозвоночных, в частности, у высших
первичноротых животных, минерализованные скелеты типичны
лишь для некоторых разновидностей кутикулярных эпителиев.
Однако потенции тканей внутренней среды к формированию
хрящевой ткани — скелетных механических структур на чисто
органической основе, проявляются у многих представителей пер-
вичноротых. Хрящевые ткани были обнаружены у отдельных
представителей почти всех типов беспозвоночных животных, за
исключением иглокожих и губок.
Хрящевая ткань довольно широко распространена в основа- -
нии щупалец сидячих полихет и обычно представлена тканью
с тонкими прослойками межклеточного вещества и крупными
полигональными клетками. Такая ткань напоминает клеточные
хрящи низших позвоночных. Межклеточное вещество состоит
из хондроитинсульфатов и коллагеновых волокон.
Широкое распространение имеет субрадулярная хрящевая
ткань у брюхоногих моллюсков. У разных представителей мол-
люсков внутренний скелет радулы может быть развит в различ-
ной степени, что определяется приспособлением животных
к разной пище. Так, например, у голожаберных моллюсков
хрящевая ткань практически отсутствует, и опорные структуры
образованы плотной соединительной тканью с хорошо разви-
тыми коллагеновыми волокнами. У других брюхоногих мол-
люсков имеет место диффузное распределение небольших групп
хрящевых клеток и мышечных волокон, образующих единую
сократимую и опорную систему. Наконец, при своем макси-
мальном развитии хрящевая ткань в субрадулярном аппарате
представлена большими участками преимущественно клеточ-
ного хряща. По соотношению клеток и межклеточных структур
он похож на пузырчатый хрящ низших позвоночных (рис. 58, а,
б). Межклеточное вещество хряща у брюхоногих моллюсков
дает положительную реакцию на кислые полисахариды. Круп-
223
ные полигональные клетки не обнаруживают закономерного
распределения по степени их зрелости. Интенсивность метабо-
лизма сульфатированных полисахаридов во взрослом хряще
невелика. При ультраструктурном исследовании межклеточного
вещества хряща у Busycon canaliculatum удалось выявить на-
личие поперечнополосатых коллагеновых фибрилл с периодич-
ностью исчерченности 600—650 А. В отличие от хрящей позво-
ночных вместо характерных для них хондроитинсульфатов
у этого моллюска присутствует другой полисахарид — глюкан-
сульфат.
Рис. 58. Участок пузырчатого хряща в плавнике миноги (а) и хрящевая
ткань из субрадулярного хряща брюхоногого моллюска (б).
У мечехвоста Limulus имеются две разновидности развива-
ющейся из мезедермы хрящевой ткани — хрящевая ткань в ос-
новании жаберных выростов и хрящевая пластинка на брюш-
ной стороне в передней части головогруди. Детально исследо-
ван в настоящее время жаберный хрящ этих животных (рис.
59). У растущих животных прослойки межклеточного вещества
крайне незначительны, и основная масса хряща представлена
пузыревидными клетками. У взрослых животных происходит
увеличение и размеров клеток, и прослоек межклеточного ве-
щества. Как и у позвоночных животных, у мечехвостов имефт
место два типа роста — с поверхности, за счет элементов окру-
жающей соединительной ткани, и изнутри, путем размножения
и роста клеток и выделения ими межклеточного вещества. При
аппозиционном росте фибробласты окружающей соединитель-
224
ной ткани обычным путем формируют тонкие волокна. В уча-
стках этой ткани, прилегающих к межклеточному веществу
хрящевой, волокна объединяются в более толстые пучки, ко-
торые постепенно переходят в межклеточное вещество хряща.
В нем помимо волокнистых пластинчатых электронноплотных
структур имеется аморфный матрикс. Все эти сложные пре-
Рис. 59. Схема ультраструктуриой организации хрящевой ткани мечехвоста.
I — хрящевая клетка, 2 — межклеточное вещество, 3 — коллагеновые волокна, 4— ядро,
5 — участок межклеточного вещества на месте хрящевой клетки, 6—уплотненные
участки цитоплазмы в области апокриновой секреции, 7 — фиброцит, 8 — область пе-
рехода плотной соединительной ткани в хрящевую ткань.
образования внеклеточных структур происходят за счет выде-
ляемых фибробластами высокомолекулярных белков и полиса-
харидов. При этом в прилежащих к поверхности хряща участ-
ках фибробласты синтезируют не только обычные полисахариды,
характерные для плотной соединительной ткани, но и спе-
цифические хрящевые полисахариды. Таким образом, фибро-
бласты постепенно приобретают черты хрящевых клеток, что,
8 672 225
в частности, выражается в появлении в их цитоплазме больших
количеств гликогена.
Типичные клетки хряща взрослых мечехвостов представля-
ют собой крупные пузыревидные клетки с вакуолизированной
цитоплазмой и эксцентрично расположенным ядром. В их цито-
плазме помимо крупных вакуолей имеются различные по вели-
чине окруженные мембраной гранулы, с каплями липидов, зер-
нами гликогена и дегенерирующими рибосомами. Межклеточное
вещество формируется хрящевыми клетками двумя путями.
С одной стороны, в периферических участках цитоплазмы
более молодых клеток наблюдается появление палочковидных
структур, сходных с ламеллярными структурами межклеточ-
ного вещества. Затем, по-видимому, путем микроапокриновой
секреции эти структуры выводятся из клеток. Кроме того, на-
блюдаются картины, которые свидетельствуют о другом меха-
низме внутриклеточного образования большого количества
межклеточного вещества, который приводит к полному пере-
рождению хрящевых клеток. На месте таких клеток возникают
характерные участки межклеточного вещества. Их перифери-
ческая часть образована плотно расположенной системой кон-
центрических пластинок. По направлению к бывшему центру
клетки плотность расположения пластинок уменьшается. Между
пластинками находится электронносветлый матрикс, имеющий
вид отдельных участков полигональной формы. При окраске
на мукополисахариды обнаруживается резко положительная
реакция в межклеточном веществе и цитоплазме клеток цент-
ральных участков хрящевой ткани. В области надхрящницы
и периферических участках хряща окраска слабее или полно-
стью отсутствует.
Биохимический и рентгеноструктурный анализ хрящевой
ткани мечехвоста Limulus показал наличие в ней типичных
хондроитинсульфатов. Незначительным оказалось количество
коллагена (10—12%).
Наибольшего развития и уровня гистологической диффе-
ренцировки достигают хрящевые ткани у головоногих моллюс-
ков. Они представлены и хрящевой капсулой, обеспечивающей
защиту головного ганглия, и глазными хрящами, и другими
хрящевыми структурами в теле животных. Характерной осо-
бенностью хрящевой ткани головоногих моллюсков является
большое количество межклеточного вещества и строгая про-
странственная локализация клеток по степени их зрелости. На
периферии хряща располагаются молодые дифференцирую-
щиеся клетки, а в центре — группы дифференцированных кле-
ток. Благодаря этому хрящевая ткань головоногих моллюсков
оказывается весьма сходной с гиалиновым хрящом позвоноч-
ных и в структурном отношении, и по характеру окраски меж-
клеточного вещества при обычных и специальных гистохими-
ческих методиках (рис. 60, а, б).
220
У головоногих моллюсков обнаружены хондроитинсульфаты
и кератосульфаты, аналогичные, но не тождественные этим
соединениям в хряще позвоночных животных. Важной особен-
ностью хрящевой ткани головоногих моллюсков является от-
ростчатая форма образующих ее клеточных элементов. Благо-
даря этому все межклеточное вещество хряща пронизано си-
стемой мелких каналов. Детальный анализ хрящевой ткани
головоногих моллюсков показал, что ультраструктурная орга-
низация межклеточного вещества их хряща сходна с анало-
гичными картинами, наблюдаемыми в хряще мечехвоста,
(рис. 59).
Рис. 60. Хрящевая ткаиь лягушки (а) и головоногого моллюска (б).
1 — зона молодого хряща, 2 — зрелая хрящевая ткань.
Существенные особенности характерны и для ультраструк-
турной организации клеток. Они значительно богаче, чем у ме-
чехвоста, мембранными структурами, в частности мебранами
шероховатой эндоплазматической сети. Имеется развитый аппа-
рат Гольджи двух типов: обширные комплексы его элементов
в центре и меньших размеров комплексы по периферии клеток.
Довольно много митохондрий, часть которых имеет вакуолизи-
рованный вид. В оболочке ядра наблюдаются многочисленные
поры, а в ядрышке — скопления рибосомоподобных частиц. Вы-
ведение синтезируемых клетками веществ осуществляется, по-
8*
227
видимому, путем экзоцитоза, о чем свидетельствуют многочис-
ленные, ограниченные мембраной пузырьки на периферии кле-
ток. Выделение межклеточного вещества имеет место не толь-
ко в теле клеток, но и в их отростках. Интенсивный синтез меж-
клеточного вещества хондроцитами необходим, по-видимому,
не только для осуществления внутреннего роста хряща, но
и для обновления его межклеточного вещества. В канальцах
межклеточного вещества иногда могут располагаться не обыч-
ные отростки клеток, а жгутики или реснички. Функциональное
значение этих образований остается неясным.
Как указывалось выше, помимо типичных хрящевых тканей
у безпозвоночных животных распространены и плотные соеди-
нительные ткани.
Основным функционирующим структурным элементом в
плотной соединительной ткани беспозвоночных животных явля-
ются пучки коллагеновых волокон, связанных с большим или
меньшим количеством мукопротеинов. В стенках сосудов и в
некоторых участках переднего отдела тела у многих животных
большое развитие получают и эластиноподобные волокнистые
структуры.
Особый интерес представляет наличие типичной плотной
коллагеновой соединительной ткани у высших представителей
первичноротых насекомых. Одним из наиболее ярких и хорошо
изученных примеров такой ткани являются опорные структуры
в копулятивных органах самцов саранчи Locusta migratoria.
У взрослых животных эпителиальная выстилка канала этого
органа окружена типичной плотной соединительной тканью
с хорошо различимыми в ней коллагеновыми волокнами и меж-
клеточным основным веществом. Обилие последнего, а также
некоторые цитохимические особенности дали основание отнести
эту ткань к разновидностям хрящевой ткани. Однако более
тщательный ее ультраструктурный анализ, а также анализ ее
гистогенеза показали, что это хорошо развитая плотная соеди-
нительная ткань, межклеточные структуры которой формиру-
ются за счет активной синтетической деятельности типичных
фибробластов. Последние на ранних этапах формирования плот-
ной соединительной ткани характеризуются развитым белоксин-
тезирующим аппаратом и другими мембранными органоидами.
Они активно включают специфические для коллагена амино-
кислоты (3Н-пролин) и достаточно энергично выделяют мече-
ные белки, идущие на формирование межклеточных структур
соединительной ткани. Таким образом, данные отношения
вполне сопоставимы с аналогичными отношениями в соедини-
тельной ткани позвоночных животных. Тем не менее формиру-
ющиеся межклеточные структуры в плотной соединительной*
ткани копулятивного органа саранчи характеризуются целым
рядом как качественных, так и количественных особенностей.
Так, например, для этой соединительной ткани характерно
228
большее, чем у позвоночных, развитие основного вещества,
благодаря чему она в известном смысле занимает промежуточ-
ное положение между хрящевой и плотной соединительной
тканью.
Глава 11. КРОВЬ. МИЕЛОИДНАЯ И ЛИМФОИДНАЯ
ТКАНИ ПОЗВОНОЧНЫХ И ИХ ФУНКЦИОНАЛЬНЫЕ
АНАЛОГИ У БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
§ 1. Система свободных элементов тканей
внутренней среды
Как уже отмечалось, прообразом системы свободных эле-
ментов тканей внутренней среды были амебоидно-подвижные
клетки первичных паренхим. Они сменили свою функцию вну-
триклеточного пищеварения на защитную, сохранив при этом
способность к положительному хемотаксису в отношении чуже-
родных частиц, фагоцитозу и их внутриклеточному перевари-
ванию. Это основное и первичное свойство амебоцитов стало
использоваться многоклеточными организмами и для борьбы
с инфекциями, и для осуществления эффективного контроля за
постоянством клеточного состава организма.
У позвоночных животных при значительных размерах тела
и большом количестве обновляющихся камбиальных тканей
особую актуальность приобретают эффективные системы над-
зора за генетической однородностью клеточного состава и борь-
бы с соматическими мутациями. У высших позвоночных (мле-
копитающие, птицы) одной из необходимых предпосылок
развития теплокровности стала имевшаяся у них действенная
вистема борьбы с патогенными микроорганизмами.
Обе задачи в эволюции позвоночных животных были реше-
ны в основном путем прогрессивного усложнения системы сво-
бодных фагоцитарных элементов и развития на ее основе осо-
бой лимфоидной ткани, обеспечивающей весьма совершенные
реакции клеточного и инфекционного иммунитетов.
У беспозвочных животных задачи борьбы с соматическими
мутациями при значительно меньшем количестве клеток и ин-
тенсивности репродукции их стоит не так остро, как у позво-
ночных. По-видимому, это обстоятельство, а также меньшая
в принципе подверженность атаке со стороны патогенных мик-
роорганизмов позволили им ограничиться совершенствованием
фагоцитарной неспецифической реакции и рядом дополнитель-
ных защитных механизмов.
Помимо защитной функции система свободных клеток тка-
ней внутренней среды берет на себя и ряд других важных
229
функций, в частности функции газообмена, свертывания крови
и гемолимфы и специальные запасные трофические функции.
Наиболее хорошо изучены специальные клетки и формен-
ные элементы крови, реализующие эти вторичные функции
у позвоночных животных. У беспозвоночных животных также
удается выявить аналогичные независимо возникающие спе-
циализированные тканевые элементы. Факт их появления у от-
дельных видов в разных группах филогенетически непосредст-
венно несвязанных животных свидетельствует о закономерном
Рис. 61. Эритроциты позвоночных.
а — схематические рисунки эритроцитов позвоночных, б — объемная схема эритроцита
человека, в — схема молекулярной организации поверхностного аппарата эритроцита';
1—6 — эритроциты (/— протея, 2 —ската, 3 — миноги, 4— лягушки, 5 — человека»
6 — мускусной кабарги); 7—1] — белки поверхностного аппарата (7—гликофорин, 8 —
Bd-З гликопротеин, 9 —анкирин, 10 — спектрин, // — актин).
возникновении этих дифференцировок в системе тканей внут-
ренней среды, о наличии у них общих для всех животных по-
тенций к формированию сходных специализированных клеток.
Весьма большой сложности достигают у высших позвоночных
специальные органы, обеспечивающие репродукцию и созрева-
ние клеток крови и многоступенчатую регуляцию этих процес-
сов, а в случае лимфоидной ткани — возможность кооперации
клеток и реализации самих реакций иммунитета.
В основу характеристики общих закономерностей организа-
ции системы свободных клеток тканей внутренней среды целе-
сообразно положить организацию ее у позвоночных животных.
По ходу описания отдельных направлений функциональной
230
специализации этой системы мы приведем и сравнительно-ги-
стологические данные по аналогичным дифференцировкам этой
системы у беспозвоночных животных.
Все форменные элементы крови позвоночных за исключе-
нием лимфоцитов (см. стр. 266) можно разделить на три кате-
гории: а) эритроциты, б) кровяные пластинки (млекопитающие)
или тромбоциты (другие позвоночные); в) зернистые лейкоци-
ты (три типа у высших позвоночных) и моноциты.
Эритроциты и дыхательные пигменты. Эритроциты млекопи-
тающих представляют собой весьма узкоспециализированные
клеточные элементы, утрачивающие в зрелом состоянии ядро
и основную массу органоидов метаболического аппарата. Не-
смотря на это, они характеризуются довольно длительным жиз-
ненным циклом и существуют в организме человека свыше трех
месяцев.
Эритроциты млекопитающих имеют форму двояковогнутых
дисков, величина их у разных видов колеблется незначительно.
У человека диаметр эритроцитов 7,4—7,6 мкм, а толщина 1,9—
2,5 мкм, т. е. они в несколько раз меньше, чем ядерные эри-
троциты других позвоночных (рис. 61,а). Такая форма и не-
большие размеры обеспечивают оптимальный газообмен в тка-
нях и в легких (связывание или выход молекул кислорода
и углекислого газа). Площадь одного эритроцита 125 мкм2,
а их общая площадь у человека свыше 3500 м2. Специфически
и своеобразно устроен поверхностный аппарат эритроцита.
В его мембране имеются особые интегральные гликопротеины
с большими углеводными компонентами (рис. 61,в). Послед-
ние располагаются в надмембранном комплексе и обусловли-
вают отрицательный заряд поверхности эритроцита. В эритро-
цитах человека мукополисахариды надмембранного комплекса
определяют групповую принадлежность эритроцита.
В субмембранной системе поверхностного аппарата нет миозиновых
структур, отсутствуют и микротрубочки. Основу фибриллярной сети состав-
ляют преимущественно связанные между собой тетрамерные комплексы мо-
лекул спектрина — высокомолекулярного белка, обладающего АТФазной ак-
тивностью. Спектрин связан, с одной стороны, с интегральными белками
мембраны, а с другой — с целой системой субмембраиных белков (актин,
Bd4, анкирин).
Поверхностный аппарат очень чувствителен к различного
рода воздействиям. Относительно легко-рнимается отрицатель-
ный заряд с поверхности эритроцитов, и они слипаются свои-
ми боковыми поверхностями, образуя характерные скопления
в виде монетных столбиков.
Поверхностный аппарат легко повреждается, что приводит
к так называемому гемолизу — выходу гемоглобина в окру-
жающую среду. Однако при этом не нарушается структурная
целостность плазматической мембраны. При изменении pH
231
среды и других воздействиях эритроциты либо легко сморщи-
ваются, либо набухают. Они обладают большой эластичностью
и упругостью и могут временно (например, продвигаясь по
капиллярам) менять свою форму, сильно вытягиваясь в длину.
90% органических соединений, составляющих массу эритро-
цита, приходится на долю гемоглобина (33% от общей массы
эритроцита). Молекула гемоглобина состоит из четырех моно-
меров. Каждый мономер включает простетическую группу
в виде гема, в центре которой находится атом железа. Гем
в молекуле окружен цепью белка глобина с закономерным
трехмерным положением в пространстве. Все четыре мономера
связаны между собой и компактно упакованы в молекуле.
У взрослых млекопитающих и человека в одной молекуле ге-
моглобина имеются два мономера, образованные «-глобиновы-
ми цепями, и два — 0-цепями. В эритроцитах эмбрионов вмес-
то 0-цепей имеются специфические для их гемоглобинов цепи
глобина.
Основное назначение гемоглобина — перенос кислорода от легких к ра-
ботающим органам. Это осуществляется благодаря способности атомов же-
леза гемов в той внутримолекулярной ситуации, которая создается белковыми
цепями глобина, образовывать непрочные связи с молекулами кислорода.
При высокой концентрации последнего в легких происходит присоединение
4 молекул кислорода к 4 атамам железа. При низкой концентрации кисло-
рода в тканях работающих органов связи между кислородом и железом
легко нарушаются, и кислород покидает молекулу гемоглобина. Показано,
что такая работа молекулы гемоглобина эффективнее осуществляется целой
тетрамерной системой, чем ее отдельными мономерами. Помимо кислорода
эритроциты способны переносить н СОг. Для этого в их цитоплазме имеется
фермент угольная ангидраза, а в мембране—специальные каналы, образу-
емые особым интегральным белком Bd3 — гликопротеином. Имеется тесная
связь между структурой молекулы гемоглобина и формой эритроцитов. При
замене в результате мутаций лишь одного аминокислотного остатка в важ-
ном участке цепи глобина резко изменяется форма эритроцитов и понижа-
ется его способность к связыванию и переносу кислорода, что и наблюда-
ется при серповидной анемии.
Эритроциты других позвоночных отличаются у представите-
лей разных классов по размерам и форме (рис. 61, а). Как пра-
вило, более мелкие клетки свойственны животным с высоким
уровнем тканевого метаболизма. Эритроциты всех позвоноч-
ных, за исключением млекопитающих, содержат ядра, обычно
небольших размеров, которые однако имеют сильно конденси-
рованный почти неактивный хроматин.
У всех позвоночных, начиная с рыб, молекулы гемоглобина в эритро-
цитах имеют тетрамерное строение. Для эритроцитов круглоротых характер-,,
но димерное (минога) и даже мономерное (миксины) строение молекул
гемоглобина. Глобиновые цепи у низших позвоночных животных короче, чем
у высших. Для ядериых эритроцитов характерно также, наличие хорошо
выраженного цитоскелета, образованного микротрубочками, формирующими
характерное кольцо в субмембранной области клетки.
232
Значение эритроцитов для существования позвоночных возрастает в про-
цессе эволюции. Они абсолютно необходимы для высших позвоночных и че-
лове!<а. У хвостатых и бесхвостатых амфибий показана возможность длитель-
ного существования животных, лишенных эритроцитов при эксперименталь-
но вызванной анемии. Известно также несколько видов костистых рыб, оби-
тающих в богатой кислородом воде, лишенных эритроцитов и не содержащих
в плазме крови свободно циркулирующих молекул гемоглобина.
Транспортная дыхательная функция у беспозвочных живот-
ных реализуется более многообразными путями, чем у позво-
ночных. Помимо характерного для всех позвоночных гемогло-
бина у беспозвоночных животных распространены еще несколько
дыхательных пигментов, и в частности гемэритрин к гемоцианин..
В гемэритрине акцептором кислорода, как и в гемоглобине,
является атом железа, а в гемоцианине — атом меди.
Принцип работы всех дыхательных пигментов сходен —их бел-
ковые цепи создают условия для образования легко диссоци-
ирующих связей молекулы кислорода с атомом металла.
Распространены они среди разных групп беспозвоночных
неравномерно. Так, гемоцианины характерны для моллюсков
и ракообразных, гемэритрины — для сипункулид, приапулид
и других близких к полихетам групп беспозвоночных. Особенно
широко распространены гемоглобины. Они характерны для
низших ракообразных, встречаются у отдельных представителей
разных классов моллюсков, полихет, немертин, иглокожих и ря-
да других беспозвоночных животных. Они имеются даже в ге-
молимфе водных личинок некоторых насекомых.
В основе организации молекул гемоглобина беспозвочных,
как и у позвоночных животных, лежат мономеры с молекуляр-
ным весом 16—17000. Количество таких мономеров в молеку-
ках гемоглобина может варьировать от одного до нескольких
десятков (например, у полихеты пескожила молекулярный вес
гемоглобина около 2 000 000).
Дыхательные пигменты у беспозвоночных животных встре-
чаются в двух основных формах: в свободном виде и в спе-
циальных клетках-эритроцитах. Последние у животных с хоро-
шо развитым целомом находятся в основном в целомической
жидкости. Гемоглобины могут иметь как внутриклеточную, так
и внеклеточную локализацию. Гемэритрины содержатся только
в клетках, а гемоцианины функционируют лишь внеклеточно.
Внутриклеточные гемоглобины имеют обычно небольшой моле-
кулярный вес (состоят из небольшого количества мономеров).
Молекулы внеклеточных гемоглобинов достигают максималь-
ных размеров и образованы большим количеством мономеров.
Эритроциты имеются у представителей многих типов беспо-
звоночных животных, Они обнаружены у немертин, иглокожих,
пластинчатожаберных моллюсков, полихет и близких к ним
групп животных с хорошо развитой полостью тела (рис. 62, а).
У большинства беспозвоночных эритроциты содержат гемо-
233
глобин. Лишь у сипункулид, приапулид, некоторых брахиопод
и в крови одного рода полихет (Magellona) эритроциты содер-
жат гемэритрин.
Несмотря на такое широкое распространение эритроцитов,
они имеются у большинства (за исключением приапулид) пе-
речисленных групп животных лишь у отдельных видов. У пред-
ставителей близкородственных видов эритроциты могут отсут-
ствовать, и дыхательная функция крови и полостной жидкости
Рис, 62. Эритроциты беспозвоночных.
а — схематические рисунки эритроцитов, б — г — схемы ультраструктуриой организа-
ции эритроцитов двух видов приапулид: Priapulus caudatus (о, в) и Halicriptus
spinulosus (г): /—3 — эритроциты (/— немертины, 2 — приапулиды, 3 — полихет
р. Magellona), 4 — элеоцит полихет, 5 — ядро, 6 — впячнваиие плазматической мембра-
ны, 7 — дыхательный пигмент, 8 — шероховатая ЭПС.
осуществляется за счет растворенных в них дыхательных пиг-
ментов.
Наконец, у некоторых видов отсутствуют и дыхательные
пигменты, и эритроциты, а у других, наоборот, имеются дыха-
тельные пигменты в крови и эритроциты в полостной жид-
кости.
По своему строению эритроциты некоторых беспозвоночных
животных обладают известными чертами сходства с эритроци-
тами позвоночных. Это обычно узкоспециализированные клетки,
цитоплазма которых заполнена дыхательным пигментом. Такую
234
организацию имеют, например, эритроциты приапулид. При этом
у представителей двух разных видов обнаруживаются сущест-
венные различия в структурно-химической организации по-
верхностного аппарата: у представителей одного вида поверх-
ность клетки увеличена за счет веретеновидной формы клетки;
у представителей другого вида эта же задача решается путем
образования глубоких и многочисленных впячиваний поверхно-
стного аппарата эритроцита (рис. 62, г, в). У некоторых беспо-
звоночных, как и у млекопитающих, зрелые эритроциты лише-
ны ядер. Такие безъядерные эритроциты обнаружены в поло-
стной жидкости у одной из офиур и в крови полихеты Magellona
papilllcornis (рис. 62, а). Безъядерные эритроциты этой
полихеты характеризуются, кроме того, весьма мелкими разме-
рами и способностью к гемолизу, т. е. аналогичны по многим
признакам наиболее совершенным с функциональной точки
зрения безъядерным эритроцитам млекопитающих. Для эри-
троцитов беспозвочных, как и ядерных эритроцитов позвоноч-
ных, характерно обычно наличие микротрубочкого субмембран-
ного цитоскелета.
У некоторых беспозвоночных животных свободные клеточные элементы,
содержащие дыхательные пигменты, существенно отличаются по своему стро-
ению от эритроцитов позвоночных. Примером таких клеток могут служить
циркулирующие в полостной жидкости многих полихет элеоциты. Эти клет-
ки отличаются большими размерами и помимо дыхательных пигментов со-
держат в цитоплазме и другие включения преимущественно трофического
характера. Они полифункциональны, поскольку помимо транспортировки
кислорода выполняют и функцию трофоцитов, обеспечивая питательными
веществами развивающиеся в целоме половые клетки.
Мало изучен еще вопрос о гистогенезе эритроцитов у беспозвоночных.
Для многих их представителей ие выяснен источник развития этих клеток.
Представляют ли оии самоподдерживающуюся автономную систему или
имеют общий источник развития с гемамебоцитами, как одна из дифферен-
цировок системы свободных элементов тканей внутренней среды. У полихет
(за исключением рода Magellona) и близких к ним групп животных весьма
вероятно происхождение такого рода клеток из особых участков целоми-
ческой выстилки.
По-видимому, вопрос о тканевой принадлежности эритроцитов беспозво-
ночных животных имеет неоднозначное решение, и у разных их представи-
телей реализуется одна из трех указанных выше возможностей.
Косвенным подтверждением этого являются данные о источниках син-
теза свободных дыхательных пигментов. У брюхоногих моллюсков, как ука-
зывалось выше, синтез дыхательных пигментов берут на себя поровые клет-
ки интерстициальной ткани. У мечехвоста гемоцианин продуцируется одной
из разновидностей амебоцитов. У головоногих моллюсков местом синтеза
гемоцианина являются стенки жаберных сердец. Наконец, у полихеты пес-
кожила высокомолекулярные гемоглобины, свободно циркулирующие в плаз-
ме крови, синтезируются в периваскулярных клетках целомического эпите-
лия.
Кровяные пластинки и проблемы свертывания плазмы кро-
ви и гемолимфы. Весьма своеобразным и узкоспециализирован-
ным форменным элементом крови млекопитающих являются
235
кровяные пластинки. Они представляют собой специфически
дифференцированные участки цитоплазмы особых гигантских
полиплоидных клеток — мегакариоцитов. Последние располо-
жены в основном в центральном кроветворном органе взрослых
млекопитающих — красном костном Мозге (см. стр. 249).
Несмотря на небольшие размеры, кровяные пластинки мле-
копитающих и человека имеют сложную структурно-химиче-
скую организацию. В их поверхностном аппарате, в частности
в плазматической мембране, сосредоточена гетерогенная систе-
ма рецепторов и гликопротеидов, способных специфически реа-
гировать и соединяться с молекулами, находящимися в окру-
Рис. 63. Схема ультраструктуриой организации кровяной пластинки млеко-
питающих.
/ — открытая и 2 —плотная тубулярные системы, 3 — скелетное кольцо из микротру-
бочек, 4 — актиновые микрофиламенты,- 5 — специфические гранулы, 6 — плотные гра-
нулы, 7 — лизосомы, 8 — митохондрии, 9— элементы аппарата Гольджи, 10 — глико-
ген.
жающей пластинки среде. Например, кровяные пластинки спе-
цифически реагируют на контакт с коллагеном и могут присое-
динять молекулы фибриногена и тромбина и, наконец, слипать-
ся друг с другом, образуя так называемые белые тромбы. Обу-
словливающие эти изменения поведения и свойств кровяных
пластинок рецепторы и специфические гликопротеиды поверх-
ностного аппарата представляют собой единую систему: акти-
вация компонентов поверхностного аппарата, обеспечивающих
слипание пластинок и присоединение чужеродных молекул, про-,,
исходит в естественных условиях лишь после задействования
рецепторов к коллагену. Весьма сложно устроена и субмембран-
ная часть поверхностного аппарата. Здесь имеется своеобраз-
ная кольцевидная скелетно-направляющая система микротрубо-
236
чек (рис. 63). На ее наружной поверхности располагаются
актин-миозиновые микрофибриллы, обеспечивающие образова-
ние непостоянных сократимых микроворсинок и конусовидных
выростов поверхностного аппарата. Кроме того, на поверхности
пластинок открываются трубкообразные каналы, ограничен-
ные плазматической мембраной и уходящие в глубь цитоплаз-
мы пластинок. Последняя делится на периферическую и цент-
ральную части. В центральной части сосредоточены а-гранулы,
плотные тела и элементы так называемой плотной трубчатой
системы. Все эти образования ограничены мембраной и имеют
содержимое различной электронной плотности. Установлено,
что а-гранулы содержат ряд гидролитических ферментов, элек-
тронноплотные тела — серотонин, кальций, АТФ и АДФ и ряд
других соединений. Плотная трубчатая система является ана-
логом системы L-каналов мышечных волокон и играет роль
резервуаров для ионов Са2+.
В цитоплазме или ограниченных мембраной структурах кро-
вяных пластинок содержится помимо отмеченных выше еще
целый ряд важных для функционирования пластинок химиче-
ских компонентов (особая фракция фибриногена, некоторые
белковые факторы системы свертывания крови и др). Кровя-
ные пластинки млекопитающих и человека представляют собой
структуры, обеспечивающие остановку кровотечения из сосудов
и свертывание крови. Участие их в этих процессах многосто-
ронне благодаря сложным взаимодействиям между рецептор-
ной системой, аппаратом выведения специфических соединений,
содержащихся в цитоплазме, и опорно-сократимой системой
поверхностного аппарата. Одной из функций пластинок явля-
ется образование временной заплатки («пробки») в местах по-
вреждения сосудистой стенки в результате их агглютинации.
Агглютинация стимулируется контактом пластинок с коллаге-
ном и выделяемыми из гранул компонентами, в частности иона-
ми кальция и АДФ. Кроме того, активизированные пластинки
могут адсорбировать на своей поверхности фибриноген и тром-
бин плазмы, обеспечивая тем самым структурированное взаи-
модействие этих двух основных компонентов системы сверты-
вания, крови. Наконец, при полной дегрануляции агглютиниро-
ванных пластинок они выделяют в плазму особую фракцию
фибриногена и белковый фактор, необходимый для развития
процесса свертывания крови и образования фибриновых фиб-
рилл из фибриногена плазмы. На заключительных этапах свер-
тывания кровяные пластинки разрушаются, а фибриллярный
актин-миозиновый компонент их субмембранного аппарата
используется для уплотнения рыхло расположенных фибрино-
вых волокон в плотный сгусток, обеспечивающий более совер-
шенную закупорку поврежденного сосуда.
У всех остальных классов позвоночных (даже у птиц) функ-
цию кровяных пластинок выполняют специально дифференци-
237
рованные клетки — тромбоциты. Они имеют ядро и внешне ча-
сто похожи на ядерные эритроциты, отличаясь от них несколь-
ко меньшими размерами и полным отсутствием гемоглобина.
Процессы свертывания гемолимфы и крови и участие в них
специальных свободных клеток тканей внутренней среды у бес-
позвоночных животных более многообразны.
Рис. 64. Моноцит и нейтрофильный лейкоцит млекопитающих.
а, б — моноцит (п) и нейтрофил (б), в, г — схемы ультраструктурной организации
моноцита (в) и нейтрофила (г): 1—эритроцит, 2 — моноцнт, 3 — нейтрофил, 4.—
лизосомы, 5 — фаголизосомы, 6 — аппарат Гольджи, 7 — шероховатая ЭПС, 8 — клеточ-
ный центр, 9— ядро, 10— центриоль, 11 — гликоген, 12 — полирибосомы, 13 — мито-
хондрии, 14 — специфические гранулы.
У высших раков и у многих насекомых в гемолимфе содер-
жится белок, способный к полимеризации при определенных
условиях, в создании которых, как и у млекопитающих, боль-
шую роль приписывают специфическим соединениям, выделяе-
мым клетками при повреждении стенки тела животных. Инте*
ресно, что морфологические изменения в гранулярных амебо-
цитах, предшествующие процессу свертывания гемолимфы,
сходны с процессами, наблюдаемыми в кровяных пластинках
при их активизации.
238
У мечехвоста, некоторых насекомых, иглокожих и у пред-
ставителей ряда других типов животных клеточным элементам
гемолимфы принадлежит, по-видимому, значительно большая,
чем у позвоночных, роль в процессе свертывания крови и гемо-
лимфы. Гранулярные амебоциты многих беспозвочных обеспе-
чивают синтез основной массы полимеризующихся при этих
процессах белков (см. стр. 242).
У некоторых насекомых, например у личинки мясной мухи,
в гемолимфе имеются особые гигантские полиплоидные клетки.
При повреждении стенки тела личинки эти клетки отделяют
небольшие участки цитоплазмы, которые способны к агглюти-
нации и могут препятствовать вытеканию гемолимфы через
поврежденный участок покровов. Таким образом, у насекомых
могут возникать системы, функции которых, по-видимому, ана-
логичны одной из функций кровяных пластинок млекопитаю-
щих— образованию белого тромба.
Моноциты и гранулярные лейкоциты позвоночных, фагоциты
и гранулярные амебоциты беспозвоночных. Нейтрофильные
лейкоциты млекопитающих представляют собой наиболее мно-
гочисленную группу зернистых лейкоцитов. Зрелые нейтрофи-
лы имеют 10—12 мкм в диаметре. Наиболее характерными их
морфологическими особенностями являются наличие в цито-
плазме двух типов окруженных мембраной гранул и дольчатое,
сегментовидное ядро (рис. 64,б,а). В крови нейтрофилы суще-
ствуют 8—12 ч, а затем выходят в соединительную ткань, где
и существуют в течение 3 сут. Молодые нейтрофилы имеют ме-
нее сегментированное ядро, хотя и содержат два типа гранул.
Более крупные, но имеющиеся у зрелых нейтрофилов в мень-
шем количестве (20%) азурофильные гранулы представляют
собой типичные лизосомы. Они содержат свыше 6 различных
лизосомных гидролитических ферментов. Более мелкие специ-
фические гранулы нейтрофилов содержат щелочную фосфата-
зу и бактерицидные вещества. У нейтрофильных лейкоцитов
хорошо выражен хемотаксис по отношению к бактериям, осо-
бенно к бактериям с прикрепленными к их стенке гумораль-
ными белковыми защитными факторами (опсины). Они весьма
активно фагоцитируют такие бактерии. С фагосомами первы-
ми сливаются мелкие специфические гранулы, содержимое ко-
торых убивает бактерии. Позднее к стенке фагосомы подходят
азурофильные гранулы с ферментами для переваривания по-
глощенных бактерий.
Помимо такой внутриклеточной защитной реакции нейтрофилы способны
бороться с инфекционными агентами путем выделения содержащихся в них
бактерицидных веществ и ферментов в окружающую среду. Так, в очаге
воспаления наблюдается массовая гибель нейтрофилов, что приводит к уве-
личению концентрации -этих веществ в местах скопления инфекции. Кроме
того, нейтрофилы способны выделять гранулы путем экзоцитоза или свое-
образного отшнуровывания участка цитоплазмы с гранулой. Естественно,
239
что для направленного перемещения клетки и внутриклеточного перемеще-
ния гранул в ходе развития процессов фагоцитоза , и внутриклеточного пи-
щеварения необходимы и разнообразные рецепторы, и сложный субмембран-
ный опорно-сократимый актии-миозиновый аппарат, и динамичный цитоске-
лет. из тубулиновых микротрубочек. Что касается других органоидов, то
в зрелых нейтрофилах они развиты слабо, поскольку клетки представляют
собой конечную стадию узкой специализации.
Моноциты крови млекопитающих и человека — относительно
крупные клетки диаметром 12—15 нм (рис. 64, а, в). Их коли-
чество в крови невелико, на порядок меньше, чем нейтрофиль-
ных лейкоцитов. Однако производные этих клеток широко рас-
пространены в различных тканях и органах. Видоизмененными
моноцитами являются гистиоциты рыхлой соединительной тка-
ни. Специальные птростчатые макрофаги входят в состав стро-
мы костного мозга, периферических и центральных органов
лимфоидной системы (см. стр. 250, 272). Имеются они и
в тканях печени (купферовские клетки), легких (альвео-
лярные макрофаги), во вторичной полости тела (перитонеаль-
ные макрофаги) и в тканях нервной системы (микроглия).
Как уже отмечалось, своеобразными макрофагами являют-
ся и многоядерные остеокласты, участвующие в резорбции
межклеточного вещества костной и хрящевой тканей. Естест-
венно, что каждая из перечисленных разновидностей макрофа-
гов отличается специфическими морфобиохимическими и функ-
циональными особенностями. Следовательно, моноциты крови
представляют собой клеточную форму, способную к широкому
спектру модификаций своей структурно-химической организа-
ции. Их основной функцией в крови является пополнение много-
численных субпопуляций макрофагов, сосредоточенных и функ-
ционирующих в разных тканях организма. Моноциты крови
имеют базофильную цитоплазму и крупное бобовидное ядро.
У них хорошо развит аппарат Гольджи и в отличие от нейтро-
филов относительно мало лизосом. Однако при активизации
этих клеток, что наблюдается в очаге воспаления, они увели-
чиваются в размерах, начинают синтезировать большое коли-
чество лизосом и приобретают способность к направленному
перемещению в очаги деструктивных изменений. Здесь они ста-
новятся макрофагами и начинают фагоцитировать и перевари-
вать погибшие нейтрофилы и обломки разрушенных тканей,
очищая очаг воспаления от детрита. Таким образом, в отличие
от нейтрофильных лейкоцитов, являющихся дифференцирован-
ными готовыми к фагоцитарной деятельности клетками, моно-
циты для проявления фагоцитарной активности должны еще
созреть, проделать дополнительную конечную дифференци-
ровку. *
Помимо рассмотренных выше функций моноциты и образующиеся из
них макрофаги принимают разностороннее и важное вспомогательное уча-
стие в реакциях иммунитета (см. стр. 271). Моноциты или вернее развиваю-
240
щиеся из них гистиоциты в соединительной ткани находятси и'
взаимоотношениях с фибробластами и межклеточными структурами и в
первую очередь с коллагеном и фибронектином. С одной стороны, они, как
и нейтрофилы, могут выделять лизосомные ферменты, разрушающие поли
сахариды, связанные с колагеиовыми волокнами, и ферменты, работающие
при нейтральных pH, разрушающие коллаген, эластин и фибронектин. С дру-
гой стороны, коллаген и продукты его гидролиза могут оказывать стиму-
лирующее действие на секреторную активность макрофагов. Последние
в свою очередь выделяют белковые факторы, стимулирующие синтетическую
деятельность фибробластов и рост кровеносных сосудов.
. Моноциты крови и макрофаги способны также секретиро-
вать антибактериальный белок лизоцим, ряд факторов компле-
мента и еще много других биологически активных соединений.
Б крови человека содержание базофильных лейкоцитов от-
носительно невелико (меньше 0,5% от всех лейкоцитов). Это
клетки средних размеров от 8 до 10 мкм в диаметре. Ядра ба-
зофилов имеют дольчатую или бобовидную форму. Цитоплазма
характеризуется базофильной зернистостью — содержит круп-
ные ограниченные мембраной базофильные гранулы. Поверхно-
стный аппарат, его рецепторы и содержимое гранул сходны
с .аналогичными структурами тучных клеток. Возможно, что
между базофильными лейкоцитами и тучными клетками име-
ются те же отношения, что и между моноцитами крови и суб-
популяциями макрофагов в различных тканях.
Однако для тучных клеток и базофильных лейкоцитов-, че-
ловека и млекопитающих нет пока строгих экспериментальных
доказательств прямых гистогенетических связей. Тем не менее
в гранулах базофилов найдены гистамин и гепарин, а на по-
верхности— рецепторы к константной части иммуноглобули-
нов, т. е. те же рецепторы, что и у тучных клеток (см, ниже).
Имеются, по-видимому, в гранулах базофилов и вещества, сти-
мулирующие защитную реакцию нейтрофилов и макрофагов,
в частности их накопление в очаге воспаления. Таким образом,
функциональное значение этих клеток сходно с функцией туч-
ных клеток — они стимулируют воспалительную реакцию, влия-
ют на проницаемость стенки сосудов и на степень сокращения
ее мышечного аппарата.
.. У человека эозинофильные лейкоциты в норме составляют
2,5% от общего количества лейкоцитов. Это относительно круп-
ные клетки, 10—12 мкм в диаметре. Ядра у них двулопастные,
цитоплазма слабо базофильна и заполнена оксифильными гра-
нулами с основными белками. В специфических гранулах эози-
нофилов обнаружены ряд гидролитических ферментов, фосфор
и железо. Некоторые гранулы содержат цилиндрические кри-
сталлоподобные включения слоистого характера. Наряду с гра-
нулами, бедными гидролитическими ферментами, имеются
и Типичные первичные лизосомы с высоким содержанием этих
ферментов. Количество эозинофильных лейкоцитов значитель-
но возрастает при воспалительных процессах, глистных инва-
241
зиях, раке и аллергических состояниях. Есть мнение, что они
принимают участие в обезвреживании токсинов и могут фаго-
цитировать комплексы антиген-антител о, выпадающие в осадок.
Тем нс мопсе основная функция эозинофилов, по-видимому,
регулирующая и сдерживающая. В их гранулах содержатся
ферменты, разрушающие биологически активные соединения,
выделяемые тучными клетками и базофилами. Эозинофилы, об-
ладают положительным хемотаксисом к этим соединениям
и активно фагоцитируют и переваривают гранулы, выделяемые
тучными клетками, тормозя и ограничивая тем самым развитие
местных и общих аллергических реакций (см. стр. 279).
Естественно, что у беспозвоночных количество и функциональ-
ное значение амебоцитов крови, гемолимфы и полостной жид-
кости варьирует значительно больше, чем у позвоночных жи-
вотных.*
Наиболее распространенной формой фагоцитов, имеющихся
у представителей многих типов беспозвоночных, являются
крупные базофильные незернистые амебоциты. Характерной
их функциональной особенностью являются амебоидная': по-
движность, положительный хемотаксис по отношению к чуже-
родным поверхностям и, наконец, способность к фагоцитозу
и внутриклеточному перевариванию инородных компонентов,
попадающих во внутреннюю среду организма. Широкий сравни-
тельно-гистологический анализ этих клеток был проведен в свое
время еще И. И. Мечниковым и составил основу его учения
о фагоцитах. Последующие исследования подтвердили факт
существования фагоцитов в тканях внутренней среды у пред-
ставителей почти всех типов беспозвоночных и наличия у них
общих «типовых» признаков структурно-химический органи-
зации.
Второй широко распространенной разновидностью подвиж-
ных клеток является система гранулярных амебоцитов беспо-
звоночных и полухордовых животных. Эти клетки имеют сход-
ную структурно-химическую организацию у представителей та-
ких отдаленных в филогенетическом плане типов животных,
как оболочники, иглокожие, членистоногие, кишечнополостные,
приапулиды. Основные их особенности проявляются в специ-
фических рецепторах поверхностного аппарата и структурно-
химической организации содержимого многочисленных гранул,
заполняющих цитоплазму клеток (рис. 65). Характерный мор-
фологической особенностью этих гранул являются микротру-
бочкоподобные структуры диаметром 15—20 мкм. По химиче-
* У отдельных представителей оболочников, насекомых, полихет и неко-(
торых других типов животных в тканях внутренней среды описано свыше
4—5 различных в функциональном отношении разновидностей подвижных
клеток. Характеристика каждой из этих разновидностей выходит за пределы
задачи нашего учебного пособия. Поэтому мы остановимся лишь на двух
наиболее распространенных разновидностях этих клеток.
242
скому составу можно выделить два варианта гранул. Первый,
более широко распространенный вариант характерен для гра-.
нулярных амебоцитов асцидий, насекомых, ракообразных, ки-
шечнополостных и, по-видимому, иглокожих.
В таких гранулах специализированных амебоцитов содер-
жатся следующие химические компоненты: а) мономерная фор-
ма способного к полимеризации белка и неактивный фермент,
способствующий активации полимеризации этого белка; б) фе-
нолы и окисляющая их, неактивная в гранулах фенолоксидаза;
в} мукополисахаридный матрикс, обеспечивающий, по-видимо-
0 7 А 2 ъЗ • 4
Рис. 65. Схема организации и превращения содержимого гранул гранулярно-
го амебоцита беспозвоночных.
« — структурная организация гранулярного амебоцита, 6 — выведение содержимого
гранул, в — полимеризация белка, г — задубливание его хинонами; / — мономеры бел-
ка, способного к полимеризации, 2 — фермент, полимеризующий этот белок; 3 — поли-
фенолоксидаза, 4 — фенольный субстрат.
му,: неактивное состояние в гранулах двух указанных выше бел-
ковых систем.
При активации этих систем, что происходит обычно в мо-
мент выделения содержимого гранул путем экзоцитоза или
микроапокриновой секреции, формируется белковая пленка из
полимеризующегося мономерного белка, которая задубливается
хинонами, образующимися при окислении фенолов активиро-
ванной фенолоксидазой. Такой механизм работы гранулярных
амебоцитов, по-видимому, универсален для этих клеток у всех
перечисленных выше представителей многоклеточных живот-
ных. Биологическое значение использования его у каждого кон-
кретного организма может существенно различаться соответст-
венно функциональным задачам и особенностям тканевой
243
и органной организаций этих животных (рис. 66). Конкретная
функция этих клеток у каждого организма определяется, оче-
видно, разными рецепторными системами их поверхностного
аппарата, запускающими процессы дегрануляции и активации
высвобождающихся из гранул ферментов. -
Так, у некоторых асцидий (рис. 66, а) зрелые гранулярные
амебоциты, представленные морулярными клетками, обладают
в нормальных условиях положительным хемотаксисом по отно-
шению к внеклеточному веществу туники. Значительная часть
мигрирующих во внеклеточное вещество туники морулярных
клеток остается в его толще, образуя длинные нитевидные от-
ростки. Выделяемые такими отростчатыми морулярными клет-
ками гранулы обеспечивают уплотнение и склеротизацию вне-
клеточного вещества туники.
Другая часть морулярных клеток мигрирует на поверхность
туники, разрушается там и образует поверхностный плотный
склеротизированный хинонами слой туники. Особенно интен-
сивная миграция морулярных клеток на поверхность туники
происходит при ее повреждении. Здесь они быстро образуют
первичную временную «заплатку» из склеротизованного белка,
под защитой которой происходит уже более медленное обра-
зование нового участка туники за счет синтетической деятель-
ности клеток эпителиального пласта.
Гранулярные амебоциты или морулярные клетки асцидий
способны «чувствовать» инородные поверхности и во внутрен-
ней среде организма. Они окружают внедрившихся паразитов
или инородные тела и изолируют их путем инкапсуляции плен-
кой склеротизованного задубленного хинонами белка. Наконец,
на колониальных асцидиях показана способность этих клеток
распознавать генетически чуждые колонии и препятствовать их
срастанию.
Гранулярные амебоциты насекомых сходны с морулярными
клетками асцидий по химическому составу гранул и способно-
сти выделять их с образованием плотных прослоек полимери-
зованного белка (рис. 66, в). Однако у насекомых они не при-
нимают непосредственного участия в процессах склеротизации
кутикулы. Тем не менее у многих насекомых непосредственно
перед этими процессами наблюдается резкое уменьшение коли-
чества этих клеток в гемолимфе. Этот факт позволяет предпо-
лагать, что при их массовой гибели высвобождаются необходи-
мые для задубливания кутикулы компоненты.
Весьма важную защитную функцию выполняют грануляр-
ные амебоциты насекомых при закупорке различных отверстий
в наружных покровах, в частности при наиболее частых в есте-
ственных условиях поломках конечностей или других придат-
ков. Гранулярные амебоциты быстро накапливаются в области
такого рода дефектов и образуют прочную белковую «пробку».
Несмотря на внешнее сходство этих процесов с аналогичными
244
Рис. 66. Схема эволюционной динамики гранулярных амебоцитов и клеток,
использующих сходные структурно-химические механизмы.
а — ж — представители разных типов и классов животных- (а — асцидии, б — голоту-
рии, в — насекомые и ракообразные, г — приапулиды, д — кишечнополостные, е — плос-
кие черви (цестоды), ж— млекопитающие); содержимое гранул: Me — фермент, Б —
полимеризующийся белок, ПФО— полифенолоксидаза, Ф — фенолы, КМПС — кислые
ьгукополисахариды. Функции полимеризованных пленок или структурно-химических из-
менений внутри гранул: 1 — образование пигмента, 2 — формирование и склеротизация
кутикулы, 3 — репаративные процессы в кутнкуле, 4 — инкапсуляция инородных тел,
5 — трансплантационный иммунитет, 6 — фагоцитоз.
245
явлениями у асцидий, у насекомых они возникли, естествен-
но, независимо и отличаются иными механизмами реализации
аналогичной функции. Рассматриваемая функция гранулярных
амебоцитов у насекомых направлена не столько на репарацию
кутикулы (как у асцидий), как на. предотвращение вытекания
гемолимфы. Весьма вероятно, что она связана теснейшим об-
разом и с процессом свертывания гемолимфы. По сути дела
полимеризация белков гемолимфы и содержимого гранул аме-
боцитов представляет собой весьма сходные, а у некоторых на-
секомых и ракообразных возможно и идентичные процессы.
Еще одной функцией гранулярных амебоцитов у насекомых
является, по-видимому, образование бесклеточных белковых
мембран вокруг желез, а возможно и других органов живот-
ных. Наконец, у насекомых, как и у асцидий, гранулярные
амебоциты инкапсулируют выделяемыми ими белковыми плен-
ками паразитов и другие инородные компоненты, попадающие
во внутреннюю среду организма.
Особенно наглядно защитная функция гранулярных амебо-
цитов выступает при инкапсуляции ими гифов паразитических
грибов у ракообразных. Образующиеся здесь вокруг пророс-
ших гифов защитные пленки подвергаются меланизации, ста-
новятся темными и препятствуют разрастанию паразита.
Общей особенностью гранулярных амебоцитов приапулид
и мечехвостов является отсутствие в их гранулах фенолов и фе-
нолоксидазы, т. е. системы задубливания полимеризующихся
белков. Тем не менее ультраструктурная организация гранул
сходна с их организацией у асцидий и насекомых: в основном
матриксе сосредоточены микротрубочкоподобные структуры.
Сходно с гранулярными амебоцитами других членистоногих
и функциональное значение этих клеток у мечехвоста. Как от-
мечалось выше, они обеспечивают, по-видимому, свертывание
гемолимфы и участвуют в защитных реакциях против чуже-
родных агентов. Весьма своеобразно функциональное, значение
гранулярных амебоцитов приапулид (рис. 66, г). Система по-
движных элементов этих животных представлена всего двумя
типами клеток: эритроцитами и гранулярными амебоцитами.
В связи с этим амебоциты помимо функций, связанных с нали-
чием у них специфических гранул, осуществляют еще и функ-
цию фагоцитоза и защитного внутриклеточного пищеварения.
Иными словами, они умеют весьма тонко различать, в каких
случаях нужно мобилизовать лизосомный аппарат и проявить
фагоцитарную активность, а когда необходимо «включить» ме-
ханизм дегрануляции и образовывать защитные пленки. Благо-
даря более однородному в химическом отношении составу гра-
нул амебоцитов приапулид, удалось на их примере детально
проследить морфологические изменения компонентов гранул
и структур образующихся внеклеточных пленок при экзоцито-
зе. Оказалось, что эти пленки состоят в основном из весьма
246
плотно расположенных трубчатых структур диаметром 1П—
20 нм, склеенных небольшим количеством аморфного мат-
рикса.
У приапулид выявлена также интересная модификация
взаимоотношений кутикулярного эпителия с гранулярными аме-
боцитами. При поверхностном нарушении целостности кутику-
лярной пластинки гранулярные амебоциты активно мигрируют
через неповрежденный слой эпителия в область дефекта, где
начинают образовывать белковый защитный слой, обеспечива-
ющий временно барьерную функцию в поврежденном участке
покровов. По периферии дефекта этот слой сливается с белко-
во-хитиновой экзокутикулой кутикулярной пластинки. В дан-
ном случае в отличие от членистоногих более выражена
«строительная» регенераторная функция гранулярных амебоци-
тов, аналогичная функции их у асцидий.
Рассмотренный выше биохимический механизм гранулярных
амебоцитов беспозвоночных животных используется и специа-
лизированными клетками других тканей многоклеточных. Так,
в происходящих из нервного зачатка пигментных клетках по-
звоночных животных в основе образования меланина лежат
процессы фенольного задубливания, т. е. субстраты и ферменты
сходны с этими компонентами гранул амебоцитов (рис. 66,ж).
Еще более полная аналогия наблюдается в гранулярных клет-
ках, возникающих из полового зачатка паразитических ленточ-
ных червей. В их гранулах содержатся все компоненты, имею-
щиеся в гранулах амебоцитов оболочников и насекомых. При
разрушении этих клеток у цестод формируется плотная белко-
вая пленка, предохраняющая оплодотворенную яйцеклетку от
действия гидролитических ферментов полости пищеварительно-
го тракта организма хозяина (рис. 66, е).
§ 2. Кроветворение
Позвоночные животные и человек. Наибольшей сложности
организация процессов размножения и дифференцировки фор-
менных элементов крови достигает у высших позвоночных жи-
вотных и человека. Она обусловлена большим количеством
функционально различных форменных элементов крови, относи-
тельно небольшой продолжительностью жизненного цикла
большинства дифференцированных функционирующих в крови
элементов. Специфической особенностью камбиальной системы
клеток крови, в отличие от рассмотренных выше камбиальных
систем эпителиальных обновляющихся тканей, является топо-
графическое разобщение специализированных функционирую-
щих в крови элементов от камбиальных и дифференцирующих-
ся клеток. Последние находятся в цикле репродукции и пре-
терпевают специфическую дифференцировку в разных направ-
лениях. Топографическое разобщение характерно и для лока-
247
Рис. 67. Красный костный мозг.
а — участок костной и миелоидной ткани, б — общая схема организации; /—кост-
ная ткань, 2 — строма с форменными элементами кровн, 3 — венозный синусоид,
4—6 — области расположения клеток крови (4 — стволовых, 5 — полустволовых, 6~
дифференцирующихся), 7 — мегакариоциты, 8 — отростчатый макрофаг с окружаю-
щими его эритробластами, 9— артерия, /0 — жировая клетка, 11 — стромальные фиб-
робласты, 12 — ретикулярные волокна, 13 — периваскулярные клетки, 14— эндотелий.
лизацин гибели закончивших свой жизненный цикл эритроци-
тов и нейтрофильных лейкоцитов. Подлежащие разрушению
эритроциты задерживаются и деградируют в красной пульпе
селезенки. Местом гибели нейтрофилов является преимущест-
венно слизистая оболочка кишки.
Второй особенностью свободных элементов крови по срав-
нению с клетками эпителиальных тканей является более про-
должительное сочетание процессов репродукции и дифферен-
цировки. Это резко увеличивает количество дифференцирую-
щихся клеток и создает дополнительные возможности для ре-
гуляции их количества.
Наконец, последней и наиболее важной особенностью, кро-
ветворения у высших позвоночных и человека является слож-
ная организация системы камбиальных клеток как в гистоге-
нетическом отношении (наличие иерархии полустволовых кле-
ток с постепенно суживающимися потенциями), так и по тон-
кому строению микроокружения, специфического для каждой
категории размножающихся камбиальных и дифференцирую-
щихся клеток. Такое микроокружение создается стромальными
фибробластами, отростчатыми макрофагами, жировыми клет-
ками, костной тканью и клетками, образующими стенку со-
судов.
248
Центральным кроветворным органом, в котором реализует-
ся такая организация репродукции и дифференцировки клеток
крови у высших позвоночных и человека, является красный
костный мозг. Несмотря на диффузное распределение красного
костного мозга по костным полостям, в организме, в гистологи-
ческом плане это сложно устроенные и закономерно распреде-
249
ленные в пространстве системы клеточных элементов и меж-
клеточных структур. В основе такой упорядоченности лежит
специальная система сосудов, в частности особые венулы с си-
стемой венозных синусоидов, пронизывающих в радиальном
направлении толщу кроветворной миелоидной ткани (рис. 67,
а, б). В стенке синусоидов имеются отверстия, через которые
в кровяное русло попадают зрелые форменные элементы. Кро-
ме того, снаружи находятся слои периваскулярных фибробла-
стов, плотность расположения которых может варьировать
в широких пределах. Строму миелоидной ткани составляет сеть
отростчатых фибробластов, тесно связанных с сетью ретику-
лярных волокон. Последние располагаются вне клеток, хотя
могут быть погружены в особые углубления фибробластов.
Кроме этой своеобразной разновидности рыхлой соединитель-
ной ткани — так называемой ретикулярной — в состав стромы
входят особые отростчатые макрофаги. В строме активной мие-
лоидной ткани встречаются отдельные жировые клетки. Их ко-
личество может увеличиваться вплоть до полного перерожде-
ния миелоидной ткани в жировую или, наоборот, жировая
ткань полостей трубчатых костей может полностью или частич-
но замещаться миелоидной тканью. В имеющихся в ретику-
лярной ткани стромы ячейках располагаются гетерогенная си-
стема морфологически неразличимых камбиальных клеток
и дифференцирующиеся в разных направлениях форменные
элементы крови (рис. 67, а). Это создает очень сложную и на
первый взгляд хаотичную картину распределения весьма раз-
нообразных по уровню и по направлению дифференцировки
клеточных элементов. Однако углубленное изучение отдельных
категорий камбиальных и дифференцирующихся клеток (и по
характеру дифференцировки, и по местоположению в иерархии
камбиальных клеток) показало закономерность распределения
клеток по степени их зрелости от периферии к центру органа.
На границе с костной тканью располагаются наименее диффе-
ренцированные, мультипотентные клетки. Имеется и законо-
мерная топографическая связь отдельных разновидностей диф-
ференцирующихся клеток с системой венозных синусов или от-
дельными элементами стромы (рис. 67, б).
В процессе кроветворения в красном костном мозге можно
выделить два этапа: а) начальный этап без видимых морфо-
логических изменений в клетках;' б) завершающий этап с хо-
рошо выраженными изменениями клеток, от внешне недиффе-
ренцированных до зрелых специализированных в разных на-
правлениях форменных элементов крови. Этот завершающий
этап кроветворения или гемопоэза удобнее рассмотреть на
примере образования эритроцитов и кровяных пластинок —
эритропоэза и тромбоцитопоэза. Эти процессы у мле-
копитающих и человека характеризуются наибольшей сложно-
стыо, а в эритропоэзе наиболее четко проявляются общие для
250
всех типов клеток крови закономерности рассматриваемого эта-
па кроветворения. Исходной клеткой при эритропоэзе является
особая полустволовая эритропоэтинчувствительная клетка
(ЭЧК). Эти клетки удалось выявить при культивировании in
vitro суспензии клеток красного костного мозга. Они сохра-
няют свои свойства камбиальных унипотентных (т. е. способ-
ных дифференцироваться лишь в одном направлении) клеток
и образуют небольшие колонии при культивировании на твер-
дом агаре в присутствии эритропоэтина. Они способны, следо-
вательно, к ограниченному поддержанию своей численности
в популяции. Однако часть образующихся дочерних клеток
приступает к дальнейшей дифференцировке, и система полу-
стволовых эритропоэтинчувствительных клеток должна подсе-
ваться-менее дифференцированными полустволовыми клетками.
По своему морфологическому строению эритропоэтинчувстви-
тельные клетки имеют вид недифференцированных подвижных
клеток тканей внутренней среды, так называемых бластов, или
по старой терминологии — гемоцитобластов. Они довольно
крупные, с базофильной цитоплазмой и содержат ядро с рас-
пыленным хроматином и хорошо выраженным активным яд-
рышком. В цитоплазме бластов умеренно развиты общие орга-
ноиды и полностью отсутствуют какие-либо признаки специфи-
ческой дифференцировки.
У вступающих на путь эритропоэза клеток начинается ак-
тивный синтез рибосомальных РНК и формируется большое
количество свободных рибосом, которые сразу же начинают
синтезировать глобиновые цепи на соответствующих информа-
ционных РНК. Рибосомы, связанные с одной молекулой иРНК,
образуют в цитоплазме характерные скопления — полисомы.
Клетки на этой стадии дифференцировки получили название
эритробластов. Они вступают в контакт с отростчатыми макро-
фагами, образуя характерные эритробластические островки. От
макрофагов эритробласты получают железо, необходимое для
синтеза гемов. По мере накопления гемоглобина в эритробла-
стах происходит изменение способности цитоплазмы восприни-
мать красители, и резкая ее базофилия на начальных этапах
дифференцировки сменяется четко выраженной оксифилией.
Соответственно этому последовательные стадии дифференци-
ровки эритробластов получили название базофильных, поли-
хроматофильных и эозинофильных или оксифильных эритроб-
ластов. Несмотря на прогрессивно идущую дифференцировку,
все эритробласты продолжают делиться, и в результате из од-
ной эритропоэтинчувствительной клетки, вступившей на путь
специализации, образуется целый клон дифференцирующих-
ся клеток. Прекращение деления происходит на стадии нормо-
бласта, следующей за стадией оксифильного эритробласта. На
этой стадии начинается сложный процесс подготовки к удале-
нию ядерного аппарата. Ядро с тонким слоем цитоплазмы
251
и субмембранной частью поверхностного аппарата смещается
к краю клетки, и затем этот участок цитоплазмы с ядром от-
шнуровывается и теряет связь с клеткой. При этом в поверх-
ностном аппарате эритробласта происходит характерное пере-
распределение белков. Все молекулы спектрина и связанных
с ним специфических субмембранных белков остаются в безъ-
ядерной части. Поверхностный же аппарат ядросодержащего
фрагмента обогащается рецепторами с большими углеводными
компонентами, которые стимулируют активность костномозго-
вых макрофагов. Макрофаги фагоцитируют эти фрагменты, пе-
реваривают их, а продукты гидролиза используются затем
в анаболических процессах. Элиминация ядерных фрагментов
нормобластов обычно совпадает с выходом молодых эритроци-
тов, или, как их называют, ретикулоцитов в просвет сосуда,
причем часто безъядерный ретикулоцит проходит через пору
в стенке синусоидов красного костного мозга, а ядросодержа-
щий фрагмент остается в его строме. Ретикулоциты начинают
функционировать, сохраняя еще некоторое время способность
к синтезу гемоглобина. Постепенно они утрачивают остатки
органоидов и превращаются в зрелые эритроциты. Они цирку-
лируют в крови свыше 4 мес., а затем оседают в селезенке, где
подвергаются разрушению. Сигналом для их задержки и ги-
бели являются возрастные изменения поверхностного ап-
парата. В старых эритроцитах происходит обеднение угле-
водных рецепторов клеточной поверхности остатками сиаловых
кислот.
Еще более своеобразные и в известном смысле уникальные
изменения происходят при формировании кровяных пластинок
в красном костном мозге млекопитающих и человека. Исход-
ными недифференцированными клетками являются здесь полу-
стволовые клетки особого типа, так называемые колониеобра-
зующие единицы тромбоцитарного ряда (КОЕТ), или тромбо-
цитарные полустволовые клетки. Их удалось выделить недав-
но при особых условиях культивирования суспензии клеток
красного костного мозга in vitro. По своей морфологии они
сходны с эритропоэтинчувствительными клетками, т. е. имеют
вид типичных бластов. Они также унипотентны, т. е. способны
дифференцироваться лишь в одном направлении. Выходящие
в дифференцировку тромбоцитарные полустволовые клетки со-
храняют способность к синтезу ДНК, репликации хромосом
и пытаются делиться. Однако митоз обычно не доходит до ме-
тафазы, и в результате образуются клетки с удвоенным коли-
чеством хромосом. Цикл такой своеобразной эндомитотической
репродукции неоднократно повторяется, таким образом, рбразу-
ются гигантские клетки, содержащие 16, 32 и даже 64 набора
Рис. 68. Мегакариоциты млекопитающих.
а — участок миелоидной ткани с мегакариоцитом, б — образование кровяных пласти-
нок из цитоплазмы мегакариоцита в просвете венозного синуса красного костного
мозга; 1—эритроцит, 2 — кровяные пластинки, 3 — клетки эндотелия, 4 — ядро мега-
кариоцита, 5 — миелоидная ткань.
252
253
хромосом. Они получили название мегакариоцитов и имеют
ядро неправильной формы, на порядок превышающее по раз-
мерам обычные диплоидные ядра (рис. 68, а).
Сильно увеличен и объем цитоплазмы. Мегакариоциты рас-
полагаются в красном костном мозге около стенки венозных
синусоидов. По мере увеличения плоидности клеток происходят
специфические изменения в их поверхностном аппарате и ци-
топлазме. Гипертрофируется плазматическая мембрана, обра-
зующая глубокие впячивания в цитоплазму клеток. В мембра-
не сосредоточиваются характерные для кровяных пластинок
рецепторы, а в субмембранной цитоплазме формируется сокра-
тимая актин-миозиновая фибриллярная система и лежащая
глубже система микротрубочек — будущий «скелет» кровяных
пластинок.
В цитоплазме мегакариоцитов начинает накапливаться ге-
терогенный специфический для кровяных пластинок набор гра-
нул и вакуолей. На заключительных этапах дифференцировки
мегакариоциты образуют длинные четковидные отростки, каж-
дое расширение которых представляет собой почти сформиро-
ванную кровяную пластинку. Отростки обычно проникают че-
рез отверстия венозных синусов и распадаются в полости со-
суда на кровяные пластинки. Помимо такого механизма обра-
зования пластинок, как правило, наблюдаемого в опытах in
vitro, в естественных условиях более распространена, по-види-
мому, фрагментация цитоплазмы округлых мегакариоцитов на
большое количество пластинок без образования лентовидных
отростков. Такая фрагментация осуществляется путем слияния
ограниченных мембраной пузырьков на границе с образующи-
мися пластинками. Активно перемещаясь, пластинки попадают
в просвет синусоидов. Ядра мегакариоцитов с остатками цито-
плазмы после ее фрагментации обычно фагоцитируются макро-
фагами.
Для всех гранулоцитов и моноцитов в настоящее время
выделена методом культивирования in vitro общая полуство-
ловая клетка, получившая название колониеобразующей еди-
ницы в культуре (КОЕк). Морфологически она не отличима от
рассмотренных выше полустволовых клеток и представляет
собой недифференцированную бластную форму. Однако полу-
стволовые клетки — предшественники фагоцитов — обладают
еще большими потенциями к дифференцировке и могут спе-
циализироваться по одной из четырех программ: нейтрофиль-
ного, эозинофильного, базофильного гранулоцитов и мо-
ноцита. Очевидно, что на пути дифференцировки этой ка-
тегории полустволовых клеток есть еще бластные формы пред-
шественника для каждого из направлений дифференци-
ровки.
Что же касается самих грануло- и моноцитопоэзов, то они
в принципе сходны с процессами эритропоэза. Дифференци-
254
ровка, как и при эритропоэзе, сопровождается делением специа-
лизирующихся клеток без утраты ими достигнутого уровня
дифференцировки. Естественно при этом, что в каждом конк-
ретном случае направление последовательных этапов структур-
но-биохимических изменений в клетках соответствует особен-
ностям каждого типа гранулоцитов или моноцитам. Процессы
гранулоцитопоэза и моноцитопоэза в красном костном мозге
завершаются после формирования в поверхностном аппарате
специфических рецепторов и приобретения клетками способно-
сти к активному перемещению и положительному хемотаксису
к стенке венозных синусоидов. В нормальных условиях зрелые
гранулоциты и моноциты задерживаются 1—2 сут. в красном
костном мозге, и функционирование стареющих гранулоцитов
и моноцитов происходит уже в кровяном русле и в про-
слойках сопровождающей сосуды рыхлой соединительной тка-
ни, куда эти подвижные форменные элементы постоянно прони-
кают, обладая способностью мигрировать через стенку со-
суда.
Крупным достижением современного периода изучения гемопоэза у мле-
копитающих и человека было выяснение организации его начальных морфоло-
гически не выраженных этапов. В начале 60-х годов разработана экспери-
ментальная модель клоиирования стволовых клеток крови мышей in vivo.
В радиобиологических экспериментах после облучения мышей смертельной
дозой рентгеновских лучей удалось показать, что их гибель чаще всего про-
исходит в результате опустошения кроветворных органов. Камбиальные
клетки крови весьма чувствительны к действию рентгеновских лучей, и при
облучении происходит полная их гибель. Если облученным мышам ввести
в кровь суспензию клеток красного костного мозга от здоровых, то наблю-
дается расселение их и восстановление гемопоэза в строме костного мозга
облученной мыши. В таких опытах на 7—10-й день после пересадки в се-
лезенке облученных мышей удалось обнаружить небольшие кроветворные
очаги — колонии. Каждая из таких колоний состояла из клеток, дифферен-
цирующихся либо в эритроидном, либо в мегакариоцитном, либо, наконец,
гранулоцитном направлениях. При этом эритроидных колоний было в два
раза больше, чем гранулоцитных и мегакариоцитных.
Тщательный анализ этих колоний показал, что источником каждой из
них является одна единственная клетка из пересаженной суспензии клеток
красного костного мозга здоровой мыши. Иными словами, каждая колония
представляет собой клон клеток, развившийся из одной родоначальной клет-
ки, которая в строме селезенки создала миниатюрную упрощенную крове-
творную систему. В этой системе имеется самоподдерживающийся фонд кам-
биальных клеток, и происходит процесс дифференцировки клеток в одном
из трех направлений гемопоэза. В опытах с пересадкой облученным мышам
колоний одного типа вместо суспензии клеток красного костного мозга, уда-
лось показать, что у таких мышей восстанавливаются все направления ге-
мопоэза, а в селезенке снова развиваются колонии всех трех типов и в тех
же соотношениях, что и в исходном опыте.
Следовательно, родоначальиые колонеобразующие клетки по своей при-
роде мультипотентны. Направление их дифференцировки определяется не
внутренними причинами, а внешними воздействиями на клетку стромы кро-
ветворного органа, а в данном случае стромы различных участков селезен-
ки. При оседании родоиачальной колонеобразующей клетки в одном участке
стромы селезенки будет формироваться кроветворная система, направленная
на эритропоэз, при оседании в других участках сформируются гранулоци-
тарные или мегакариоцитные колонии.
255
Разработанный метод клонирования родоначальных коло-
ниеобразующих клеток крови в селезенке облученных мышей
позволил изучить их свойства.
Оказалось, что эти клетки мультипотентны по своей приро-
де и могут давать начало клеткам, дифференцирующимся в лю-
бом направлении в системе свободных элементов тканей внут-
ренней среды данного организма.
Вторым важным свойством этих клеток является способность
их поддерживать путем митотического деления определенное
количество себе подобных клеток. Иными словами, они способ-
ны «чувствовать» свое количество в системе и способны к не-
ограниченному размножению. Клетки, обладающие такими
свойствами, получили название стволовых клеток крови.
Несмотря на свою мультипотентность и на способность к не-
ограниченному размножению, стволовые клетки крови в нор-
мальных условиях редко делятся, и их дочерние клетки чаще
идентичны им по своим свойствам, т. е. значительная их часть
обычно не вступает на путь дифференцировки.
Деятельность кроветворной системы в обычных условиях
обеспечивается в основном системой полустволовых клеток.
В настоящее время, как уже отмечалось, часть категорий этих
клеток удается выявить методом культивирования in vitro.
Рассмотренные нами полустволовые эритропоэтинчувствитель-
ные клетки и клетки, дающие начало мегакариоцитному игра-
нулоцито-моноцитному направлениям дифференцировки пред-
ставляют собой лишь одну из категорий, а именно конечную
или близкую к конечной категорию этих клеток. Между ними
и стволовыми клетками имеется еще несколько категорий по-
лустволовых клеток, значительная часть которых пока точно
не идентифицирована (рис. 69). Первая категория клеток, наи-
более близкая по своим свойствам к стволовым, представляет
собой полустволовые клетки миелоидного и лимфоидного ря-
дов. Причем существование полустволовой клетки миелоидного
ряда экспериментально доказано. Наличие полустволовой клет-
ки лимфоидного ряда имеет пока еще лишь косвенные дока-
зательства. Систему полустволовых клеток лимфоидной систе-
мы мы рассмотрим в разделе, специально посвященном ее ха-
рактеристике (см. стр. 281).
Между полустволовой клеткой миелоидного ряда и эритропоэтинчувст-
вительной клеткой имеется еще 4—5 категорий унипотентных полустволо-
вых клеток эритроидного ряда. Они отличаются по характеру условии, не-
обходимых для выделения их в культурах in vitro, чувствительностью к эрит-
ропоэтину и характеру образуемых in vitro клонов. Промежуточные систе-
мы полустволовых клеток для гранулоцито-моноцитного и мегакариоцитного
рядов изучены в настоящее время еще слабо. Однако по аналогии с эрит-
ропоэзом наличие и здесь нескольких категорий клеток вполне вероятно.
Стволовые и все категории полустволовых клеток морфоло-
гически неразличимы. Они имеют вид бластов и отличаются
друг от друга уровнем дифференцировки.
256
СгтЛолобая кррбетйорная клетка
Рис. 69. Схема кроветворения у млекопитающих (по: Е А Шубникова
1982).
1—4 ~ субсистемы клеток, различающиеся по уровню дифференцировки (/ — стволовые,
2 — полустволовые, 3 v Дифференцирующиеся, 4— дифференцированные).
9 672
257
дифференци-
подвержены
направления
эритропоэза
клеток — это
Общими особенностями полустволовых клеток являются
внутренние ограничения их потенций к выбору направлений
дифференцировки. Степень такого ограничения определяется
категорией полустволовых клеток; она тем меньше, чем ближе
клетка к стволовым клеткам.
Второй особенностью системы полустволовых клеток по
сравнению со стволовыми является ограничение их способно-
сти к самоподдержанию, т. е. пролиферации без видимой диф-
ференцировки. При этом степень такого ограничения, по-види-
мому, также увеличивается по мере повышения уровня диф-
ференцировки этих клеток.* Полустволовые клетки, в отличие
от стволовых, энергично размножаясь, выходят в
ровку. Они и особенно их конечные категории
прямому действию специфических для каждого
дифференцировки гуморальных факторов. Для
таким фактором является эритропоэтин, для КОЕк
колониестимулирующий фактор (КСФ) и для полустволовых
клеток мегакариоцитного ряда — фактор, получивший название
тромбоцитопоэтина. Помимо этих факторов типа гормонов бел-
ковой или гликопротеидной природы (с молекулярными весами
от 15 до 160 000) на полустволовые клетки оказывают, по-ви-
димому, влияние и факторы, выделяемые зрелыми клетками,
так называемые кейлоны. Последние регулируют процессы ге-
мопоэза по принципу обратной связи. Стволовые клетки и на-
чальные категории полустволовых клеток менее чувствительны
к действию всех этих факторов. Регуляция интенсивности их
репродукции и выхода в дифференцировку осуществляется их
сложными взаимодействиями с клетками стромы и некоторы-
ми специальными категориями свободных клеточных элемен-
тов (см. стр. 277).
Полустволовые клетки даже близких к стволовым катего-
рий не могут восстанавливать систему кроветворения. Их ко-
личество должно пополняться периодически из фонда стволовых
клеток. Конкретные тонкие механизмы регуляции взаимоотно-
шений стволовых и близких к ним категорий полустволовых
клеток выяснены еще недостаточно. Существенную роль
в такого рода регуляциях играет, по-видимому, топографиче-
ское распределение этих клеток в строме красного костного
мозга. Сохранение свойств стволовых клеток при репродукции
или, наоборот, переход их в категорию полустволовых клеток
* В последнее время появились данные о возможности длительного само-
поддержаиия определенного количества полустволовых клеток: например,
в колониях in vitro, полустволовые клетки нейтрофильно-макрофагального
ряда сохранялись в течение полугода и даже дольше. С другой сторрны
отсутствуют и строгие экспериментальные доказательства неограниченной
возможности к самовоспроизведению в естественных условиях стволовых
клеток. В связи с этим приводимая в учебном пособии концепция стволовых
клеток начинает подвергаться серьезной ревизии (см. Чертков и Гуревич,
1984).
258
в значительной мере определяется и конкретным микроокру-
жением, способствующим или неспособствующим сохранению
дочерними клетками недифференцированного состояния. Из
всего сказанного ясно, что конкретным отличием стволовых
и разных категорий полустволовых клеток является наличие
у каждой категорий клеток специфических рецепторов. Они
определяют способность клеток занимать соответствующую
нишу в строме красного костного мозга и отвечать лишь на
определенные воздействия. Биологический смысл такого рода
сложной организации камбиальных кроветворных клеток за-
ключается в защите основных родоначальных клеток, способ-
ных к полному восстановлению системы кроветворения от со-
матических мутаций. Вероятность таких мутаций в стволовых
клетках невелика из-за низкого уровня их репродукции и нечув-
ствительности к обычным регулирующим гуморальным факто-
рам. Сложная иерархия камбиальных клеток, включающая
в себя родоначальные стволовые и несколько категорий полу-
стволовых клеток, позволяет также обеспечить многоэтапную
регуляцию, что обусловливает в конечном счете большую плас-
тичность и работоспособность системы в разных условиях.
Сложность организации кроветворных систем млекопитаю-
щих и человека определяется еще и способностью стволовых ро-
доначальных клеток к миграции и расселению по кроветвор-
ным тканям организма.
Закономерные процессы миграции стволовых клеток крови весьма ха-
рактерны и для эмбрионального гистогенеза крови млекопитающих и чело-
века. Источником стволовых клеток крови является часть первичных кле-
ток, которые появляются на весьма ранних этапах эмбриогенеза в кровя-
ных островках провизорного органа — желточного мешка.
В дальнейшем наблюдается закономерное увеличение фонда этих кле-
ток и перемещение гемопоэза сначала в эмбриональную печень, а затем
в костный мозг, а у некоторых млекопитающих частично и в селезенку. Па-
раллельно с изменением локализации гемопоэза в ходе эмбрионального
гистогенеза усложняются и! процессы дифференцировки клеток. Это прояв-
ляется в увеличении направлений дифференцировки: на ранних стадиях
эмбриогенеза в желточном мешке у мышей образуются только эритроциты,
дифференцировка гранулоцитов и мегакариоцитов начинается у этих жи-
вотных в период печеночного гемопоэза. У других видов млекопитающих,
с более продолжительным периодом внутриутробного развития, процессы
граиуло- и мегакариоцитопоэза имеют место уже в периоде желточного
кроветворения.
Процессы эмбрионального гемопоэза по ходу развития непрерывно уд-
линяются,. в результате увеличивается количество промежуточных форм
и происходит формирование более специализированных функционирующих
клеток. Особенно хорошо изучены эти изменения дифференцировки в эмбри-
огенезе на примере эритропоэза. Клетки первой весьма быстро формирую-
щейся популяции функционирующих эритроцитов значительно крупнее дефи-
нитивных, содержат ядра, а концентрация гемоглобина в них намного
меньше, чем в эритроцитах, образующихся на более поздних этапах
эмбрионального гистогенеза. Кроме того, в основе их гемоглобина лежат
особые глобиновые цепи, хотя и гомологичные а- и p-цепям дефинитивного
гемоглобина. У животных с более длительным этапом эмбрионального развития
и у человека в период печеночного кроветворения происходит переключение
9* 259
транскрипции с эмбриональных глобиновых генов на особые фетальные гены
из семейства р-глобиновых. Наконец, на более поздних этапах эмбриогенеза
в эритропоэтическом ряду устанавливаются отношения, характерные для де-
финитивного эритропоэза: синтез глобинов происходит на основе иРНК, счи-
тываемых с дефинитивных а- и Р-глобиновых генов.
Важно подчеркнуть, что все эти глубокие и закономерные изменения
процессов дифференцировки стволовых клеток крови в ходе эмбриогенеза
индуцируются у млекопитающих изменением их микроокружения.
Что касается других позвоночных животных, то даже у мик-
син и миног на всех этапах их онтогенеза клетки крови фор-
мируются в кроветворных органах со специальной стромой из
фибробластических клеточных элементов ретикулярных воло-
кон и часто сопутствующих им жировых клеток и специальных
расширенных капилляров. Начиная с рыб, эритропоэз и тро.м-
боцитопоэз происходят в специальном органе — селезенке. Она
формируется на основе околокишечной соединительной ткани.
Значение органа кроветворения селезенка сохраняет у совре-
менных амфибий и рептилий, и лишь у млекопитающих и птиц
эти процессы перемещаются в красный костный мозг. Однако
тенденция к формированию кроветворных органов в контакте
с костной тканью проявилась у позвоночных и на более низ-
ких уровнях организации. Так, например, у хрящевых ганои-
дов в кости черепа над четвертым желудочком мозга имеются
специальные полости, в которых сосредоточена кроветворная
миелоидная ткань. Что касается гранулоцитопоэза, то его ло-
кализация широко варьирует у позвоночных животных. Фор-
мирование гранулярных лейкоцитов и, по-видимому, моноцитов
у низших позвоночных может происходить в почке, в гонадах,
в глазных орбитах, в печени, в- эпикарде, в соединительной
ткани шейной -области и ряде других органов. Однако везде
обязательно присутствует стромальная основа в функционирую-
щей кроветворной ткани. В связи с этим весьма обоснованным
является предположение о том, что у всех позвоночных есть
сложная аналогичная имеющейся у млекопитающих животных
система камбиальных клеток, включающая в себя и мультипо-
тентные стволовые клетки и более или менее сложную иерар-
хию полустволовых камбиальных клеток. Регуляция работы
этой системы осуществляется специальным микроокружением,
создаваемым стромой, и гуморальными факторами по принци-
пу обратной связи. Естественно, что этот общий принцип орга-
низации процессов миелопоэза у представителей отдельных
классов, а возможно, и в более мелких систематических
группах, имеет различные модификации. Внешним выраже-
нием такого рода модификаций является отмеченное выше
варьирование локализации процессов гранулопоэза. Наличие
мультипотентных стволовых клеток в кроветворных системах
птиц доказано на экспериментальной модели, аналогичной
модели по клонированию стволовых клеток млекопита-
ющих.
260
Анализ имеющегося сравнительного материала позволяет
сделать вывод, что структурная организация процессов гемопо-
эза особенно необходима для первого морфологически не вы-
раженного этапа. Что касается второго конечного этапа, то
процессы эритро- и тромбоцитопоэза, как правило, соверша-
ются вне стромы, интраваскулярно, а завершающие этапы ре-
продукции и дифференцировки этих клеток часто происходят
и в циркулирующей крови. Эта особенность завершающих эта-
пов образования эритроцитов и тромбоцитов частично обус-
ловлена слабой способностью этих клеток к активному пере-
мещению.
Интересное приспособление обнаружено у птиц для предот-
вращения массового попадания в циркуляцию незрелых эрит-
роцитов. Рецепторный аппарат дифференцирующихся эритро
бластов обладает сродством к эндотелию венозных синусоидов,
благодаря чему эритробласты образуют пристеночные скопле-
ния. Эти свойства поверхности эритробластов при превраще-
нии их в эритроциты утрачиваются, и эритроциты уносятся кро-
вотоком.
Экстраваскулярное созревание эритроцитов млекопитающих
обусловливается, с одной стороны, контактом эритробластов
с макрофагами, обеспечивающим, по-видимому, их изоляцию
от ингибирующего влияния стромы на видимую фазу эритро-
поэза. С другой стороны, процесс элиминации ядер и увели-
чение эластичности поверхностного аппарата эритроцитов
в этот период дел.ают возможным их активное прохождение
через стенку венозных синусоидов. Экстраваскулярное форми-
рование кровяных пластинок обеспечивается у млекопитающих
качественными (по сравнению с другими позвоночными) изме-
нениями самой дифференцировки этих форменных элементов,
утрачивающих, как мы видели, клеточный характер своей ор-
ганизации. Последние примеры показывают, каким существен-
ным модификациям подвергаются сами процессы дифференци-
ровки кровяных клеток и характер межклеточных воздействий
при гемопоэзе. Очевидно, что они свидетельствуют о большой
пластичности эволюционной динамики гемопоэза при наличии
общих для кроветворных систем всех позвоночных закономер-
ностей организации процессов кроветворения.
Весьма ярким примером пластичности эволюционной дина-
мики гемопоэза у позвоночных животных является наличие
в онтогенезе птиц двух популяций стволовых клеток крови.
Первая популяция появляется на ранних этапах онтогенеза
и обеспечивает формирование провизорной популяции эритро-
цитов, а затем элиминируется. Еще одним примером в этом
плане может служить обнаруженный недавно особый способ
дифференцировки эритроцитов птиц. Часть их может созревать
быстро и без делений в тетраплоидном состоянии. Количество
их удваивается путем деления лишь на стадии оксифильных
261
эритробластов, которые у птиц обычно уже утрачивают- спо-
собность к делению.
Беспозвоночные животные. Процессы кроветворения изуче-
ны в разных группах беспозвоночных животных очень неравно-
мерно и значительно менее детально, чем у позвоночных жи-
вотных. Тем не менее даже имеющиеся отрывочные данные
позволяют сделать вывод, что в пределах отдельных классов
беспозвоночных и от менее сложно организованных низших
беспозвоночных к высшим первичноротым животным наблюда-
ется тенденция к усложнению организации процессов гемопоэ-
за. Наиболее простой формой их организации является нали-
чие малодифференцированного мультипотентного клеточного
элемента в крови, за счет деления которого происходит попол-
нение клеток разных направлений дифференцировки. При этом
процессы размножения и дифференцировки происходят непо-
средственно в крови или тканевой и полостной жидкостях без
формирования особых кроветворных органов.
Следующей ступенью организации гемопоэза является обра-
зование различного рода скоплений клеток, где происходят от-
дельные этапы либо процессов репродукции, либо созревания
клеток. Такого рода зачаточные кроветворные органы описаны
даже у немертин, где в стенке сосудов, образующих прецере-
бральные сосудистые лакуны, обнаружены скопления клеток,
дифференцирующихся в эритроциты. Скопления малодиффе-
ренцированных бластов в лакунах без четко выраженных сте-
нок— характерная особенность процессов гемопоэза у асцидий.
У голотурий описаны очаги гемопоэза в соединительной тка-
ни стенки сосудов. У аннелид удалось выявить в прослойках
интерстициальной соединительной ткани скопления дифферен-
цирующихся фагоцитов и гранулоцитов. Однако размножение
этих клеток и малодифференцированные бласты здесь обнару-
жены не были.
У первичноротых животных с хорошо развитой вторичной по-
лостью тела анализ процессов гемопоэза затруднен тем, что
здесь ряд функций тканей внутренней среды берут на себя
целомический эпителий и его производные. У аннелид, по край-
ней мере, часть свободных клеточных элементов, находящихся
в полости тела, происходит из целомического эпителия. Есте-
ственно, что организация их репродукции и дифференцировки
может отличаться от организации обновления свободных кле-
точных элементов тканей внутренней среды, происходящих из
первичной паренхимы.
У аннелид, в частности, прямыми производными целомиче-
ского эпителия являются так называемые хлорагоциты, из ко-,
торых могут возникать специфические бифункциональные клет;
ки-элеоциты. Некоторые авторы считают, что и другие свобод-
ные элементы полости тела, и даже клетки, циркулирующие
в кровеносных сосудах, имеют целомическое происхождение.
'262
Однако прямые экспериментальные доказательства этого от-
сутствуют.
Наиболее близкая к существующей у позвоночных живот-
ных организация процессов кроветворения у первичноротых
животных наблюдается у моллюсков, в частности у одного из
подробно изученных в этом отношении большого прудовика
Lymnea stagnalis. Здесь методом авторадиографии с использова-
нием 3Н-тимидина удалось показать гемопоэтические островки
в перикардиальной соединительной ткани. В их состав входят
клетки, имеющие вид недифференцированных бластов, проме-
жуточные дифференцирующиеся клетки и клетки, по своей мор-
фологии сходные с амебоцитами периферической крови. В не-
посредственном контакте с узелками находятся фибробласты,
образующие их основу, т. е. систему, аналогичную строме кро-
ветворных органов млекопитающих. Для клеток гемопоэтиче-
ских островков характерна наивысшая пролиферативная ак-
тивность как в нормальных условиях, так и при кровопотерях
и воспалительных процессах (в 10 раз выше, чем в перифе-
рической крови). Повышение пролиферативной активности
скоплений амебоцитов в соединительной ткани в области ман-
тии и перикарда показано при экспериментальном заражении
паразитами и у другого вида брюхоногих моллюсков. Для
брюхоногих и пластинчатожаберных моллюсков характерно
наличие общей камбиальной клетки для оседлых и свободных
клеточных элементов. Вместе с тем у многих представителей
других видов этих моллюсков не удалось пока обнаружить спе-
циальных кроветворных органов, и обновление клеточных эле-
ментов их тканей внутренней среды происходит, по-видимому,
за счет размножения циркулирующих в крови недифференци-
рованных клеток. Кроме того, часть специализированных сво-
бодных клеток интерстициальных тканей типа описанных выше
поровых клеток имеет, возможно, и собственный источник раз-
вития. Эти клетки образуют на своей поверхности своеобраз-
ный фильтр из надмембранных структур, аналогичный образу-
емому надмембранными структурами отростков подоцитов —
типичных производных целомического эпителия у позвоночных
и беспозвоночных животных.
Весьма сложные кроветворные органы находятся в стенке
глазных полостей у головоногих моллюсков.- Они имеют спе-
циальные синусы кровеносных сосудов и отростчатые стро-
мальные клетки. Для формирующихся здесь клеток крови ха-
рактерно полярное расположение: наиболее зрелые элементы
находятся в области кровяных синусов.
У членистоногих процессы гемопоэза изучены у единичных
представителей высших ракообразных и у представителей ряда
отрядов насекомых. У насекомых имеется, по-видимому, ана-
логично млекопитающим разделение камбиальное™ в дефини-
тивных системах для оседлых клеток интерстициальных тканей
263
и для свободных клеточных элементов гемолимфы. Для многих
изученных представителей членистоногих характерно также
наличие кроветворных органов, хотя их локализация и струк-
тура варьируют в широких пределах. У высших раков кровет-
ворные органы представлены гемопоэтическими узелками, рас-
положенными в соединительной ткани стенки желудка. Каж-
дый кроветворный узелок представляет собой чашеобразный
фолликул в дорзальной стенке желудка. Фолликул с трех сто-
рон окружен базальной мембраной. Одна его сторона,, обра-
щенная в гемоцель, открыта и не имеет базальной мембраны.
От базальной мембраны в толщу фолликула отходят тяжи во-
локнистого вещества, разделяющие свободные клетки на груп-
пы в 3—4 клетки. Между контактирующими в фолликулах
свободными клетками иногда наблюдаются постоянные меж-
клеточные контакты. Клетки интенсивно делятся митозом
и претерпевают дифференцировку в разных направлениях. У зре-
лых клеток, попадающих в гемолимфу, часто сохраняется спо-
собность к делению. Непосредственно в циркуляцию выходят
обычно гиалиновые амебоциты. Для созревания цианоцитов
(клетки, продуцирующие гемоцианин) необходим их времен-
ный контакт с соединительной тканью стенки желудка или глаз-
ной артерии, где они накапливаются перед линькой. Наблю-
дается отчетливая связь количества гранулярных амебоцитов
и этапов линьки. Первый их пик характерен для середины
!иежлиночного периода, второй — имеет место непосредственно
перед линькой. У десятиногого рака Carcinus rnaenus в гемо-
поэтических узелках обнаружены оседлые клетки типа фибро-
бластов и волокнистые структуры неизвестного химического
состава. Авторы допускают возможность превращения оседлых
клеток в недифференцированные свободные элементы, однако
строгих доказательств таких превращений пока нет.
У изученных представителей насекомых строение кроветвор-
ных органов широко варьирует в связи с особенностями раз-
вития (полное и неполное превращение) и многообразием форм
в этом классе членистоногих.
Кроветворные органы изучены современными методами уса-
ранчи, сверчка, пчелы, личинок шелкопряда, мясной мухи, дро-
зофилы и представителей ряда других отрядов насекомых.
У саранчи и сверчка кроветворная ткань сосредоточена на
диафрагме, отделяющей перикард от гемоцеля. Как и у рако-
образных, у них имеются группы клеток, разделенные отрост-
ками базальной мембраны. Клетки в таких группах часто связаны
десмосомами. Они могут делиться митозом и превращаться
в прогемоциты. Имеются ретикулярные клетки, способные
к фагоцитозу и выделению бактерицидных веществ при
попадании инфекции. Допускается возможность превращения
ретикулярных клеток в свободные элементы. У личинок мясной
мухи кроветворные органы расположены в задней части тела.
264
Гемопоэтические узелки содержат отростчатые ретикулярные
клетки. Между их отростками располагаются округлые недиф-
ференцированные клетки — предшественники фагоцитов и эле-
оцитоидов. Последние лизируют базальные мембраны органов
при метаморфозе. Количество клеток, продуцируемых в кровет-
ворном органе, регулируется гормонами. Массовое появление
фагоцитов и эноцитов в циркуляции наблюдается перед мета-
морфозом. Очередные линьки также требуют наличия гемоци-
тов. Показано специфическое влияние разных гормонов на ре-
продукцию и дифференцировку клеток в гемопоэтических ост-
ровках.
Особенности организации процессов гемопоэза у изученных представи-
телей членистоногих (локализация гемопоэтических островков в области стен-
ки целома, наличие у клеток постоянных' контактов) дает основание неко-
торым авторам высказывать предположение о происхождении части или
даже всех свободных элементов гемолимфы из целомического эпителия.
Однако для такой крайней точки зрения вряд ли есть пока достаточные
основания. Специфические особенности организации гемопоэза у ракообраз-
ных и особенно у насекомых представляют собой, по-видимому, лишь одну
из своеобразных модификаций этой системы, обусловленую особенностями
общего плана строения этих животных.
§ 3. Лимфоидная ткань
Лимфоидная ткань позвоночных осуществляет реакции им-
мунитета, а также, по-видимому, и ряд других функций, в част-
ности принимает участие в регуляции процессов репродукции
и дифференцировки клеток на поздних этапах онтогенеза. Лим-
фоидная ткань у высших позвоночных состоит из системы цент-
ральных (красный костный мозг, зобная железа, фабрициева
сумка) и периферических (лимфатические узлы, селезенка,
лимфоэпителиальные скопления) органов. В ее состав входит
также циркулирующая в крови, лимфе и тканевой жидкости
обширная и гетерогенная популяция лимфоцитов.
Центральное место в лимфоидной ткани принадлежит лим-
фоцитам. Однако становление лимфоидной ткани в онтогенезе
и реализация свойственных им функций невозможны без струк-
турной организации репродукции и дифференцировки лимфоци-
тов, а также без взаимодействия их с оседлыми элементами
стромы лимфоидных органов, макрофагами и другими свобод-
ными клеточными элементами тканей внутренней среды.
В функциональном и структурном отношениях в лимфоид-
ной системе позвоночных выделяются две тесно связанные
и имеющие, по-видимому, единое происхождение субсистемы.
Одна из них осуществляет реакции клеточного или транспланта-
ционного иммунитета. В нормальных условиях именно эта суб-
система в основном обеспечивает реакции иммунологического
надзора, направленные на борьбу с соматическими мутациями.
Эти реакции осуществляются особой субпопуляцией лимфоци-
265
тов — 1-лимфоцитами, которые созревают в зобной железе,
или тимусе. Вторая субсистема лимфоидной ткани специализи-
рована на борьбу с инфекционными началами. Она осуществля-
ет реакции гуморального иммунитета, имеющие особое значе-
ние у теплокровных позвоночных. Эти реакции обеспечивают
В-лимфоциты. У млекопитающих В-лимфоциты образуются
в строме эмбриональной печени и красном костном мозге.
У птиц они созревают в особом центральном органе иммуните-
та — фабрициевой сумке.
Функциональная взаимосвязь двух основных субсистем лимфоцитов име-
ет, по-видимому, глубокие исторические корни. По одной из распространен-
ных и предложенных иммуногенетиками гипотез обе разновидности лимфо-
цитов произошли из одного источника. Исходные для обеих субсистем клетки
по этой гипотезе обеспечивали сохранность индивидуальности многоклеточного
организма. Для этой целину всех клеток организма имелись, очевидно,
одинаковые кодируемые одним геном белковые рецепторы. Одновременно
среди подвижных клеток тканей внутренней среды выделилась специальная
система клеток, специализированная на элиминацию клеточных элементов.
На последующих этапах эволюции при усложнении организации животных
и увеличении их размеров такой контроль за генетической однородностью
клеточного состава различных тканей приобретал все большее значе-
ние. У предков позвоночных при общем усложнении генетического аппа-
рата произошла многократная дубликация первичных генов, кодирующих
белковые рецепторы взаимного узнавания клеток одного организма. В даль-
нейшем имели место значительная дивергенция генов, транслокация их в раз-
ные хромосомы. В результате этого в геноме позвоночных сформировалась
гетерогенная система генов, обеспечившая создание сложного аппарата для
борьбы с соматическими мутациями — лимфоидной ткани.
Поскольку она развивалась в эволюции для элиминации «чужих» (изме-
ненные свои) клеток, естественно было, что этот аппарат стал использо-
ваться и для борьбы с прокариотными клетками и паразитическими орга-
низмами. Так как эта дополнительная функция с усложнением организмов
приобретала специфические особенности, то в первично единой лимфо-
идной ткани произошло разделение труда. Часть этой системы продолжала
совершенствоваться в направлении первичной функции, т. е. как аппарат им-
мунологического надзора (против внутреннего «чужого» — вирусов, изменен-
ных своих клеток). Другая, часть системы специализировалась на реализа-
цию защитной функции против внешних чужеродных агентов, кооперируясь
с древней защитной фагоцитарной системой организма.*
Млекопитающие и человек. Завершающее эффекторное зве-
но в реакции гуморального иммунитета у позвоночных осуще-
ствляется особыми белками •— иммуноглобулинами. У млекопи-
тающих и человека известно пять основных классов таких
* Несмотря на логичность изложенной гипотезы о происхождении и со-
отношении у современных позвоночных систем Т- и В-лимфоцитов, имеется
уже много данных, плохо согласующихся с этими представлениями. Одних^
из веских аргументов против признания первичности . Т-системы являются
иные принципы ее организации по сравнению с принципом организации за-
щитных систем большинства многоклеточных животных. Организация этих
систем основана обычно иа распознавании одного белкового маркера при-
надлежности клетки к данному организму.
266
4
Рис. 70. Схемы строения молекул иммуноглобулина класса G (а) и ультра-
структурной организации плазматической клетки (б).
У, 2 — цепи молекулы (У —легкая, 2 — тяжелая), 3—4 — вариабельные участки легкой
13) и тяжелой (4) цепей, 5, 6 — константные участки тяжелой (5) и легкой (6) цепей,
7— S—S-связи, 8 — центр связывания молекулы с антигеном, 9— концевой участок
молекулы (Рс-фрагмент), 10 — ядро, УУ —ядрышко, У2 — шероховатая ЭПС, УЗ —аппа-
рат Гольджи, 14— клеточный центр, 15— митохондрия.
267
белков. Все они построены по одному принципу и представляют
собой сложные белки, составленные из нескольких субъединиц
(чаще две). В состав каждой субъединицы входит легкая (L)
и тяжелая (Н) цепи. Легкая цепь состоит из двух доменов
(петли из 110 аминокислотных остатков, связанные в основа-
нии петли SS-связями). Тяжелая цепь построена из 4 или 5
доменов. В иммуноглобулинах класса G, Е, D и А целая моле-
кула образуется путем объединения двух субъединиц таким
образом, что две тяжелые цепи связываются между собой SS-
связями, а легкие цепи присоединяются дисульфидными мости-
ками сбоку от 1-го и 2-го доменов тяжелых цепей, образуя ха-
рактерную V-образную структуру (рис. 70, а). В иммуноглобу-
линах класса М молекулы состоят из десяти субъединиц. В их
объединении участвует и мукополисахаридный компонент. Бо-
лее сложная, чем обычно, организация молекул может быть
характерна и для части иммуноглобулинов класса А (4 субъ-
единицы). У млекопитающих наиболее распространены и пре-
обладают в количественном отношении иммуноглобулины клас-
са М, G и А. Иммуноглобулины класса Е и D представлены
обычно в плазме крови и тканевой жидкости в очень неболь-
ших количествах.
В субъединицах молекул иммуноглобулинов выделяют две
основные части, вариабельную и константную. Вариабельная
часть образована первыми доменами легкой и тяжелой цепей.
Краевыми участками этих доменов формируется активный
центр молекулы. Его конфигурация соответствует так называ-
емым антигенным детерминантам. Последние располагаются
на поверхности молекул, вызывающих реакцию иммунитета —
антигенов. Конфигурация активных центров молекул иммуно-
глобулинов специфична для каждого клона синтезирующих их
клеток. При этом такая специфичная конфигурация запрограм-
мирована генетически. Таким образом, в процессе дифферен-
цировки формируется большое количество генов, специфичных
для каждого клона клеток, продуцирующих антитела. Осталь-
ная часть субъединиц молекулы иммуноглобулина (один домен
легкой цепи и 3 или 4 домена тяжелой) составляет их констан-
тные участки. В легких цепях для всех классов иммуноглобу-
линов известно лишь два варианта константных доменов по
последовательности аминокислот в них. В константных участ-
ках тяжелых цепей одинаковая последовательность аминокис-
лотных остатков имеется в иммуноглобулинах каждого из 5 вы-
деленных классов. Иными словами, принадлежность иммуно-
глобулинов к тому или иному классу определяется аминокис-
лотной последовательностью в константной части тяжелой цепи
молекул. При этом одинаковые вариабельные участки могут
объединяться с разными константными, и, наоборот, одни
и те же константные участки имеют разные вариабельные
участки.
268
Для иммуноглобулинов классов М и G показаны две разновидности
тяжелых цепей. Они отличаются по аминокислотным последовательностям
концевого участка молекулы. В первой разновидности иммуноглобулинов
класса М на конце тяжелой цепи имеется 28 гидрофильных, а ВО' второй —
41 гидрофобная аминокислота. Эти небольшие различия имеют большое
функциональное значение. Первая разновидность представляет собой так на-
зываемую секретируемую форму этих молекул и используется для нейтра-
лизации чужеродных молекул—антигенов. Вторая разновидность — мем-
бранная форма; ее концевой гидрофобный участок встраивается в мембрану
клетки, и молекула играет роль специфического рецептора. Мембранная раз-
новидность молекулы имеется, по-видимому, и в других классах иммуногло-
булинов, в частности в классе D. В константных участках тяжелых цепей
иммуноглобулинов классов М и G находится центр связывания с одним из
факторов комплемента плазмы крови (комплемент — взаимосвязанная систе-
ма гидролитических ферментов плазмы крови). Концевые участки тяжелых
цепей молекул иммуноглобулинов—Fc-фрагменты, могут связываться со
специальными белками рецепторами на поверхности ряда свободных клеток
тканей внутренней среды (макрофаги, Т-лимфоциты, тучные клетки).
В основе нейтрализации чужеродных молекул лежит их
специфическое связывание вариабельными концами молекул
иммуноглобулина и образование стойких комплексов антиген —
антитело. Образующиеся комплексы часто выпадают в осадок
и подвергаются усиленной атаке со стороны макро- и микро-
фагов, что уже само по себе нейтрализует токсическое дейст-
вие антигенов. Кроме того, если в составе комплекса имеются
антитела классов G и М, то в константной части их тяжелых
цепей активизируется центр связывания с комплементом, что,
в свою очередь, приводит к гидролитическому расщеплению
и чужеродной молекулы, и иммуноглобулина.
Специфические особенности типичной реакции гуморального
иммунитета отчетливо выступают при анализе изменения коли-
чества и скорости синтеза специфических антител в плазме
крови при первичном и вторичном введении одних и тех же
чужеродных молекул лабораторным животным.
Весьма характерной особенностью этих изменений является
наличие латентного периода в нарастании количества антител
в течение 1—2 сут после введения антигена. Максимальное
количество антител наблюдается обычно к 5 сут после введе-
ния антигенов, оно на несколько порядков превышает коли-
чество этих антител в крови интактного животного. При вто-
ричном введении того же антигена сокращается латентный
период реакции и, кроме того, резко возрастает абсолютный
прирост антител по сравнению с уровнем, наблюдаемым до вве-
дения антигена.
В этих фактах отчетливо выявляется строгая специфичность
реакции и наличие в ней феномена памяти. Причины всех этих
особенностей реакции стали ясны после того, как удалось
установить источник и механизмы образования антител,
т. е. выяснить клеточные основы этой строго специфической
реакции.
Оказалось, что непосредственным продуцентом специфиче-
269
ских антител являются специальные плазматические клетки,
или плазмоциты (рис. 70).
Это крупные клетки с деформированным, слегка бобовид-
ным и пикнотизированным ядром. Цитоплазма их насыщена
мощным белок-синтезирующим аппаратом в виде цистерн ше-
роховатой ЭПС и хорошо развитыми комплексами Гольджи.
Цистерны ЭПС зрелых плазмоцитов наполнены белками. Все
они представляют собой иммуноглобулины одной специфично-
сти, т. е. иммуноглобулины, предназначенные для нейтрализа-
ции антигена, вызвавшего развитие этой реакции. Выведение
антител такими клетками осуществляется, как правило, путем
голокриновой секреции, т. е. путем их разрушения и гибели.
Естественно, что до введения антигена эти клетки в орга-
низме отсутствовали, и их появление составляет одно из звень-
ев, а именно конечное эффекторное звено реакции гуморального
иммунитета. Его начальное и центральное звенья связаны с на-
личием в организме клеток-предшественников, способных рас-
познать появление антигена.
Обнаружение таких клеток-предшественников и легло в ос-
нову современных представлений о клеточных основах иммун-
ных реакций. Для субсистемы гуморального иммунитета ими
оказалась весьма многочисленная гетерогеннная по специфи-
ческим иммуноглобулиновым рецепторам субпопуляция' В-лим-
фоцитов. По своей морфологии они схожи с типичными лимфо-
цитами периферической крови. Детальный анализ, проведенный
специально разработанными цитохимическими и иммуноцито-
химическими методами, показал, что В-лимфоциты имеют на
своей поверхности специфические рецепторы. Они образованы
мембранными формами иммуноглобулинов и чаще всего уже
упоминавшимися . мономерами (из 2 субъединиц) класса М
с гидрофобным Fc-концом. Рецепторами В-лимфоцитов могут
быть и иммуноглобулины класса D, а также, по-видимому,
и других классов. Характерной особенностью рецепторов явля-
ется то, что у каждого В-лимфоцита имеется лишь одна их
разновидность по вариабельной части молекулы, т. е. каждый
конкретный лимфоцит может реагировать лишь на один специ-
фический антиген, а вся их совокупность представляет собой
гетерогенную систему относительно небольших по количеству
клеток клонов, отличающихся друг от друга своими специфи-
ческими иммуноглобулиновыми рецепторами..
Количество одинаковых иммуноглобулиновых рецепторов на
мембране В-лимфоцитов относительно велико (около 24000).
Для них характерна высокая скорость обновления (за 12 ч
обновляется половина рецепторов). Таким образом, часть per
цепторов все время попадает в плазму крови, создавая тем
естественный фонд иммуноглобулинов разной специфичности.
При задействовании рецепторов В-лимфоцита соответствующим
чужеродным антигеном с ним происходит цепь последователь-
270
ных событий, получивших название бластотрансформ а-;
ции. Клетка начинает увеличиваться в размерах, в ней активи-
зируются синтетические процессы. В результате В-лимфоциты
превращаются в лимфобласты, точнее в плазмобласты, которые
начинают делиться с интервалом в 12 ч, образуя к 5 сут клон
порядка 256—512 клеток. При этом подавляющая часть этих
клеток постепенно, не утрачивая способности делиться, превра-
щается в зрелые плазматические клетки. Они синтезируют
иммуноглобулины (секреторную форму) с вариабельной частью,
идентичной вариабельной части иммуноглобулинов-рецепторов.
Часть клеток не вступает на путь специализации, а, сохраняя
недифференцированный вид, превращается в В-лимфоциты па-
мяти. Они содержат в своем поверхностном аппарате рецеп-
торы, идентичные по вариабельной части рецепторам В-лимфо-
цита—.родоначальника сформированного клона эффекторных
клеток. При вторичном попадании антигена количество клеток,
способных специфически реагировать на его присутствие, есте-
ственно увеличивается, и реактивные процессы протекают быст-
рее и с большей интенсивностью.
Таким образом, очень пластичная и строго специфичная по
своим внешним проявлениям реакция гуморального иммунитета
основана на детерминированной реакции специализированных
клонов В-лимфоцитов. При этом каждому антигену может
соответствовать несколько клонов В-лимфоцитов, рецепторы
которых отличаются степенью связывания с антигенной детер-
минантой. С другой стороны, один и тот же клон может реаги-
ровать с близкими по своей конфигурации детерминантами
разных антигенов. Возможность задействования рецепторов
В-лимфоцитов антигеном и развертывание цепи событий, обес-
печивающих развитие плазмоцитов при гуморальном иммуни-
тете, требует обычно еще ряда условий. В большинстве случа-
ев для эффективной рецепции необходимо кооперативное взаи-
модействие между В-лимфоцитами, особыми разновидностями
Т-лимфоцитов (Т-хелперы или помощники) и макрофагами.
Эти взаимодействия осуществляются и путем непосредственного
контакта клеточных поверхностей перечисленных выше трех ка-
тегорий клеток, и за счет выделения некоторыми клетками (Т-
лимфоциты) быстро распадающихся гуморальных факторов.*
Периферические органы лимфоидной системы должны обе-
спечить и возможность встречи антигена с В-лимфоцитами со-
* Конкретные механизмы и последовательность взаимодействия рассмат-
риваемых категорий клеток между собой и антигеном при их рецепции ин-
тенсивно исследуются, однако экспериментально доказанные и общепринятые
схемы такого взаимодействия еще отсутствуют. Доказаны лишь факты выде-
ления Т-хелперами гуморального фактора, необходимость его контакта с В-
лимфоцитом и обработки антигенов макрофагами (Р. Петров, 1982).
271
ответствующих ему клонов, и возможность структурного взаи-
модействия трех категорий клеток в процессе рецепции,
У млекопитающих имеется три разновидности перифериче-
ских органов лимфоидной системы: 1) лимфоидные скопления
по ходу пищеварительного, дыхательного и мочеполового трак-
тов; 2) система лимфатических узлов по ходу лимфатических
сосудов; 3) селезенка. Из простого перечисления не трудно за-
метить, что такая система органов обеспечивает улавливание
антигенов, могущих попасть в тканевую жидкость с поверхно-
стей слизистых оболочек (лимфоидные скопления), лимфу (лим-
фатические узлы) и кровь (селезенка). Все эти органы пост-
роены аналогично и предназначены для задержания антигена
и для обеспечения его рецепции клетками субсистемы гумо-
рального иммунитета лимфоидной ткани. Общие принципы
организации таких органов мы рассмотрим на примере лимфа-
тических узлов (рис. 71). Они варьируют по своей форме, но
чаще бывают бобовидными. Лимфатические узлы всегда рас-
полагаются по ходу лимфатических сосудов. При этом со всех
сторон к узлу подходят приносящие лимфатические сосуды. Из
узла лимфа выносится по одному крупному лимфатическому
сосуду, расположенному в центре бобовидного впячивания.
Здесь же располагаются и магистральные кровеносные сосуды:
одна приносящая артерия и две выносящих вены.
На поверхности лимфатического узла образуется капсула,
состоящая из плотной соединительной ткани с толстыми пуч-
ками коллагеновых волокон( рис. 71, а). От капсулы в толщу
узла отходят трабекулы из коллагеновых волокон, формирую-
щие его механический каркас. Строму лимфоузла составляет
ретикулярная ткань, в состав которой входят отростчатые фиб-
робласты и синтезируемые ими ретикулярные волокна (рис. 71,
а, б). Последние тесно связаны с поверхностью фибробластов,
располагаясь обычно в желобкообразных углублениях их по-
верхности. С другой стороны, концы ретикулярных волокон
крепятся на трабекулах и капсуле, что обеспечивает механи-
ческую прочность всей этой сетевидной ретикулярной стромы
узла. Помимо фибробластов в петлях сети находятся особые
отростчатые макрофаги. Их особенно много в периферической,
так называемой корковой зоне узла. Эта разновидность макро-
фагов обладает способностью длительно удерживать на своей
поверхности молекулы антигена. Помимо отростчатых имеется
и большое количество обычных макрофагов.
В* строме лимфатического узла находится система синусов,
выстланных эндотелием; Она начинается краевым синусом, рас-
положенным под капсулой. В краевой синус открываются при-
носящие лимфатические сосуды. Из него лифма попадает
в корковый и промежуточный корковый синусы, а далее в моз-
говые, из которых уже собирается в выносящий сосуд. Ха-
рактерной особенностью эндотелиальной выстилки синусов
272
Рис. 71. Лимфатический узел млекопитающих [по: В. Г. Елисеев и др. 1972].
а— общая схема узла, б — участок ретикулярной ткани; /—соединительная капсула,
2 — трабекула, 3 — приносящие лимфатические сосуды, 4 — краевой синус, 5 — ретику-
лоэндотелиальные клетки (береговые клетки), 6 — синус коркового вещества, 7 —си-
нус мозгового вещества, 8— конечный и 9 — выносящий лимфатические сосуды, 10—
ретикулярные клетки, //—вторичные узелки, 12 — мякотные тяжн, 13— ретикулярные
волокна, /“/ — артерия лимфатического узла, 15— сосуды окружающей соединительной
ткани. 16— трабекулярная артерия, 17 — артерии мякотных тяжей, 18— поверхностные
и глубокие гемокапиллярные сети, 19 — вены мякотных тяжей, 20— трабекулярная
вена, 2/— макрофаги в синусах, 22 — лимфоциты и плазматические клетки, 23 — эн-
дотелий, 24 —щели между эндотелиальными клетками, 25 —лимфоцит, проникающий
в щель, 26— базальная мембрана.
273
является отсутствие базальной мембраны и наличие щелевид-
ных пространств между эндотелиальными клетками. Благодаря
этому в узле создаются условия для свободного перехода кле-
ток из стромы в полость синуса и обратно. Кроме того, через
щели в полость синуса могут проникать и отростки особых
макрофагов. Весь лимфатический узел заполнен лимфоцитами.
По периферии в его корковом веществе образуются плотные
скопления, преимущественно В-лимфоцитов. Они формируют
характерные узелки, в центре которых часто наблюдаются оча-
ги размножения клеток. Непосредственно под узелками корко-
вой зоны располагаются лентовидные скопления Т-лимфоци-
тов. Эта зона получила название тимус-зависимой или пара-
кортикальной зоны.
В мозговом веществе лимфоидные элементы образуют тяжи,
направленные перпендикулярно поверхности узла, — мякотные
шнуры. В их составе кроме лимфоцитов обычно имеется много
клеток, находящихся на разных стадиях превращения в плаз-
матические.
Кровеносные сосуды распространяются в узле по трабуке-'
лам. Особенно богатая сеть каппиляров образуется в области
скоплений В-лимфоцитов в корковой зоне узла. Отсюда капил-
ляры собираются в венулы, эндотелий которых имеет необыч-
ный вид (рис. 71). Полость сосуда выстлана не плоскими, а ку-
бическими и даже призматическими клетками. Венулы подоб-
ного типа располагаются преимущественно в паракортикаль-
ной тимусзависимой зоне узла. Кубический и призматический
эндотелий венул через области межклеточных контактов изби-
рательно пропускает из крови в строму узла лимфоциты пе-
риферической крови, и в первую очередь Т-лимфоциты. Боль-
ше того, здесь наблюдается массовый выход лимфоцитов пе-
риферической крови в строму узла в связи с наличием у, них
положительного хематаксиса к этому эндотелию. Очевидно,
что это один из ключевых механизмов, обеспечивающих актив-
ную рециркуляцию клеточного состава лимфатического узла.
Часть лимфоцитов через стенку венул активно переходит в стро-
му узла. Другая их часть с током лимфы постоянно выносится
в магистральные лимфатические сосуды и оттуда снова попа-
дает в периферическую кровь.
Из приведенного описания следует, что структурная орга-
низация лимфатического узла хорошо приспособлена к реали-
зации тех задач, которые стоят перед клетками, осуществля-
ющими реакции гуморального иммунитета. Условия лимфото-
ка, организация синусов и стромы, свойства особых макрофа-
гов— все это направлено на задержку и фиксацию антигена
в узле. С другой стороны, наличие рециркуляции лимфоцитов,
а также непосредственный контакт В-, Т-лимфоцитов и макро-
фагов создают все условия для успешной рецепции этих анти-
генов соответствующими клонами В-лимфоцитов. Более того,
274
в специальных исследованиях удалось показать, что образую-
щиеся при первичном ответе клетки памяти, представленные
долгоживущими В-лимфоцитами, обычно остаются в узле про-
должительное врейя в области первичного контакта В-лимфо-
цитов с антигеном, что, естественно, облегчает и ускоряет про-
цесс рецепции при вторичном попадании данного антигена.
Аналогичная ситуация наблюдается и в отношении других пе-
риферических органов лимфоидной системы.
Периферические скопления лимфоидной ткани в различных слизистых
оболочках играют роль первого барьера на пути проникновения инфекции
с поверхности слизистых оболочек в тканевую жидкость. Эффекторными мо-
лекулами этих скоплений являются у млекопитающих в основном иммуно-
глобулины класса А, в образовании которых помимо плазматических кле-
ток принимают участие и мукополисахариды секрета эпителиальных клеток.
Между этой частично автономной периферической субсистемой гуморального
иммунитета и ее основной частью существуют тесные взаимосвязи. В тех
случаях, когда периферическая часть системы гуморального иммунитета
не в силах справиться с атакой чужеродных антигенов, в реакцию вступает
основная часть лимфоидной системы, локализованная в лимфатических уз-
лах и селезенке.
В периферических органах лимфоидной системы разверты-
ваются не только основные звенья реакции гуморального им-
мунитета, но и реакции первичного клеточного или трансплан-
тационного иммунитета.
Характеристику этой субсистемы лимфоидной ткани, как
и системы В-лимфоцитов, удобнее начать с описания эффек-
торного звена реакции трансплантационного иммунитета. Дей-
ствующим агентом этой реакции в отличие от реакций гумо-
рального иммунитета являются не молекулы, вырабатываемые
специальными клетками, а сами клетки, которые появляются
в ответ на пересадку чужеродных тканей. Они получили назва-
ние Т-киллеров или Т-убийц. Специфические особенности этих
клеток, имеющих вид средних лимфоцитов, заключаются в тон-
кой структуре поверхностного аппарата: наличие специальных
рецепторов для распознавания чужеродных клеток и неясного для
нас механизма повреждения мембраны клеток-мишеней. Внеш-
не заключительный этап реакции трансплантационного иммуни-
тета проявляется в том, что Т-киллеры, обладая, по-видимому,
положительным хемотаксисом к чужеродным клеткам, образу-
ют с ними временную связь при помощи выростов своего по-
верхностного аппарата. После непродолжительного контакта,
образно называемого «поцелуем смерти», Т-киллер устремля-
ется к следующей клетке-мишени. Гибель чужеродной клетки
происходит из-за прогрессирующего нарушения проницаемости
мембраны.*
* Относительно механизмов действия Т-киллеров имеется интересная
гипотеза о том, что они включают имеющиеся у любой клетки многоклеточ-
ного организма рецепторы, специфическое задействование которых включает
механизмы самоуничтожения клеток. Эти механизмы и рецепторы возникли
в эволюции как приспособления для удаления избыточного количества кле-
ток.
275
Как уже отмечалось, клоны специфически нацеленных на
определенную чужеродную ткань Т-киллеров появляются в ор-
ганизме лишь после пересадки ему этой ткани. Очевидно, что,
как и в случае инфекционного иммунитета, появлению клонов
Т-киллеров должны предшествовать рецепция чужеродной тка-
ни, переработка полученной информации и развитие клонов
эффекторных клеток из клеток-предшественников, циркулирую-
щих в организме и заполняющих его лимфоидные органы. Дей-
ствительно, многочисленные эксперименты с трансплантацией
кожи у лабораторных животных показывают, что после первич-
ной трансплантации между генетически неродственными живот-
ными отторжение трансплантата происходит обычно на 10—
12-й день после операции. После вторичной трансплантации
длительность его существования сокращается почти вдвое,
т. е. и здесь мы встречаемся с тем же феноменом памяти, ко-
торый характерен для реакций инфекционного иммунитета. Ана-
лиз клеточных механизмов, лежащих в основе начальных эта-
пов реакций трансплантационного иммунитета, показал, что
для развития этой реакции необходимо попадание в транс-
плантированную ткань специфически детерминированных (по
своим рецепторам) к этой ткани лимфоцитов двух категорий:
а) 1-прекиллеров; б) 1-антигенреактивных клеток (АРК). Каж-
дая из двух цепей, образующих белковую молекулу рецептора,
состоит из двух доменов, гомологичных доменам вариабельной
и константной частей молекул иммуноглобулинов. Рецепторы
кодируются генами одного из локусов главного комплекса тка-
невой совместимости. Рецепторы этих клеток специфически свя-
зываются с гликопротеидными маркерными белками, рас-
положенными на поверхности чужеродных клеток. Они,
естественно, отличаются от соответствующих маркерных
белков, имеющихся у всех клеток данного организма, и полу-
чили название антигенов тканевой совместимости.
У млекопитающих рецепторы тканевой гистосовместимости
представляют собой крупные и сложные молекулы, расположен-
ные в плазматической мембране большинства клеток дан-
ного организма. Они состоят из тяжелой гликопротеидной цепи
и легкой, весьма консервативной, называемой Вг-микроглобу-
лином. Система иммунологического надзора лимфоидной тка-
ни, или система лимфоцитов, осуществляющая реакции транс-
плантационного иммунитета, реагирует, по-видимому, и на свои
клетки с измененными маркерными рецепторами гистосовмести-
мости. Естественно, что они весьма активно будут реагировать
на чужие клетки, имеющие специфические для другого орга-
низма маркерные белки. Что касается самого принципа узна-
вания измененных своих или чужих рецепторов, то, как и в слу-
чае В-лимфоцитов, во взрослом организме имеется большое
количество прекиллеров и антигенреактивных клеток, уже де-
терминированных на возможные изменения и варианты этих
276
маркерных рецепторов. К сожалению, в отличие от системы
В-лимфоцитов, мы не знаем точно свойств специфических ре-
цепторов этих клеток, хотя вопрос этот интенсивно исследует-
ся. После специфического задействования рецепторов Т-пре-
киллеров и антигенреактивных клеток они уходят в ближайший
лимфатический узел, где задерживаются и претерпевают даль-
нейшие изменения. Антигенреактивные клетки превращаются
в Т-хелперы и начинают секретировать гуморальный фактор,
на который реагируют лишь активированные Т-прекиллеры.
Эти клетки претерпевают бластотрансформацию и переходят
к делению и дифференцировке, образуя в конце концов клон
Т-киллеров, специфически детерминированных к антигенам тка-
невой совместимости клеток трансплантированной ткани. Часть
клеток, как и в случае образования клона плазматических кле-
ток в системе В-лимфоцитов, не вступает на путь дифферен-
цировки, а превращается в клетки памяти. По мере созрева-
ния Т-киллеры выходят из лимфатического узла и в конце
концов достигают трансплантированной ткани, где задержива-
ются, накапливаются и вызывают ее отторжение. Естественно,
что при повторной пересадке такой же ткани реакция оттор-
жения разовьется быстрее благодаря наличию в организме
большого количества Т-лимфоцитов, детерминированных на
специфическую рецепцию данного антигена тканевой совмести-'
мости.
Иммунологическим надзором и контролирующей вспомога-
тельной ролью в реакциях гуморального иммунитета не исчер-
пывается многосторонняя деятельность системы Т-лимфоцитов
у высших позвоночных. Недавно удалось показать, что в
Т-системе имеется особая субпопуляция клеток, способных ре-
гулировать направление дифференцировки стволовых и первых
уровней полустволовых клеток при гемопоэзе. Они получили
название дифференцированных лимфоцитов (Td). Такого рода
клеткам некоторые авторы приписывают важную роль и в ре-
гуляции размножения и дифференцировки клеток в поздних
морфогенезах других тканей.
В системе лимфоцитов помимо основных ее частей, деятель-
ность которых отчетливо проявляется при пересадке чужерод-
ных тканей и в реакции гуморального иммунитета, имеется
еще небольшая по объему, но, по-видимому, весьма важная
субпопуляция лимфоцитов, называемая естественными киллера-
ми. Последние обладают способностью находить вышедшие из-
под контроля клетки (очевидно, клетки с измененными антиге-
нами тканевой совместимости) и вызывать их гибель. Таким
образом, естественные киллеры принимают непосредственное
участие в основной функции Т-системы — функции в иммуноло-
гическом надзоре. Полагают, что такого рода механизм играет
весьма важную, если не основную, роль в поддержании клеточ-
ного гомеостаза у высших позвоночных животных.
277
В иммунологическом надзоре может участвовать и система В-лимфоци-
тов. В большинстве случаев при попадании в организм чужеродных клеток
или прн выходе из-под контроля организма собственных клеток разверты-
ваются реакции и гуморального, и клеточного иммунитетов, поскольку чуже-
родные клетки обладают антигенными свойствами. В ответ на появление мо-
лекул с антигенными детерминантами, расположенных на поверхности этих
клеток, происходит формирование клонов плазмоцитов, выделяющих специ-
фические для антигенных детерминант иммуноглобулины, обычно классов
G и М. Естественно, что эти антитела специфически связываются с анти-
генными детерминантами поверхностных антигенов чужеродных клеток.
Само присоединение антител к поверхности этих клеток может и не оказы-
вать на них губительного влияния. Однако при таком присоединении у мо-
лекул иммуноглобулинов открываются центры связывания с некоторыми
факторами комплемента. Присоединение последних к иммуноглобулину ак-
тивирует обычно всю систему комплемента. Последовательная активизация
и присоединение ее специфических компонентов к поверхностному аппарату
чужеродной клетки в конце концов нарушает проницаемость плазматиче-
ской мембраны этих клеток, что и приводит их к гибели. Кроме такого ме-
ханизма элиминации из организма маркированных специфическими антите-
лами чужеродных клеток, они могут быть уничтожены макрофагами или
специальной субпопуляцией В-лимфоцитов (К-клетки). Последние образу-
ются в красном костном мозге. Общим свойством всех категорий перечислен-
ных выше клеток является наличие у них рецепторов к константному концу
тяжелой цепи иммуноглобулинов (Fc-фрагмент). Поскольку у присоединив-
шихся к чужеродным клеткам молекул иммуноглобулинов именно эти кон-
цы оказываются свободными, то К-клетки или макрофаги подходят к таким
маркированным антителами клеткам и могут их уничтожить либо путем
фагоцитоза, либо путем выделения каких-то факторов, повреждающих их
плазматическую мембрану.
Еще одна функция системы В-лимфоцитов связана с воз-
можностью их взаимодействия с популяциями тучных клеток
соединительной ткани и базофильными лейкоцитами. Тучные
клетки и базофилы имеют, как отмечалось выше, встроенные
в плазматическую мембрану специфические рецепторы, спо-
собные присоединять Ес-фрагмент тяжелой цепи молекул им-
муноглобулинов класса Е. Присоединение молекул иммуногло-
булина к поверхности тучных клеток не вызывает еще их от-
ветной реакции. Активация антигенсвязывающей части мо-
лекулы иммуноглобулина Е, находящейся на поверхности кле-
ток, со специфическим антигеном вызывает уже дегрануляцию
тучных клеток и базофилов. Если эта реакция носит массовый
характер (когда в нее вовлекается большое количество тучных
клеток и базофилов крови), то может произойти одномомент-
ное выделение в кровь и тканевую жидкость биологически
активных веществ, в частности гистамина. Последний в боль-
ших количествах оказывает сильный стимулирующий эффект
на гладкие мышечные клетки стенки бронхиол и сосудов, а так-
же резко увеличивает проницаемость эндотелия кровеносных
сосудов. Появление большого количества гистамина в крови
и в рыхлой соединительной ткани в местах скопления тучных
клеток (в частности в тканях легких) может вызывать тяже-
лые нарушения жизнедеятельности организма человека вплоть
до летального' исхода. Такие нарушения носят названия а н а-
278
филаксии и анафилаксического шока. При бо-
лее медленной дегрануляции тучных клеток под влиянием ряда
факторов, выделяемых ими помимо гистамина (особый липо-
протеид и кислый полипептид), в области их скоплений (под-
кожная соединительная ткань, соединительная ткань слизистых
оболочек) развиваются местные воспалительные реакции с при-
влечением большого количества эозинофильных лейкоцитов.
В целом эти процессы у человека получили название аллер-
гических реакций, или аллергии, а вещества, их вызы-
вающие (антигены, реагирующие с антителами класса Е, рас-
положенными на поверхности тучных клеток),— аллергенов. На
примере анафилаксии и аллергии мы видим, как адаптивное
приспособление для реализации защитной функции в тканях
внутренней среды может при чрезмерном развитии реакции
приобретать отрицательное значение.
Необходимость для организма механизмов торможения иммунных реак-
ций и наличия у лимфоидной системы потенций к известной автономности
особенно отчетливо выявляется при пересадке облученным смертельными до-
зами рентгеновских лучей мышам костного мозга от здоровых взрослых мы-
шей. В этих условиях из стволовых клеток здоровой мыши наряду с дру-
гими ростками кроветворения развивается и система лимфоцитов. Несмотря
на то, что развитие этой системы происходит в условиях микроокружения
стромы хозяина, развивающиеся зрелые лимфоциты начинают воспринимать
ткани организма хозяина как чужеродные. В связи с этим возникает тяже-
лое заболевание, называемое реакцией трансплантат против хозяина, закан-
чивающееся обычно гибелью животного.
Серьезные нарушения в жизнедеятельности организма на-
блюдаются и у человека при так называемых аутоиммун-
ных заболеваниях, когда система иммунитета начинает
реагировать на нормальные клетки некоторых тканей или соб-
ственные антигены. Очевидно, что в лимфоидной системе нор-
мального организма должны быть весьма совершенные систе-
мы внутренней регуляции, направленные, прежде всего, на
ограничение и торможение реактивного эффекторного звена
этой в известном смысле полуавтономной надорганизменной
и одновременно определяющей его интеграцию системы. С та-
кими частными тормозными механизмами саморегуляции мы
уже знакомы. К ним относится субпопуляция эозинофильных
лейкоцитов, в гранулах которых содержатся ферменты для раз-
рушения белковых факторов, стимулирующих развитие аллер-
гических реакций. Эозинофилы, привлекаемые к очагам массо-
вой дегрануляции тучных клеток, способны фагоцитировать
и переваривать гранулы тучных клеток, снижая тем самым из-
быточное количество биологически активных веществ, выде-
ляемых в окружающие ткани. Саморегулирующее, в известном
смысле ограничивающее значение имеет разобранная выше не-
обходимость участия в рецепции большинства антигенов трех
типов клеток, а при трансплантационном иммунитете двух раз-
279
новидностей Т-лимфоцитов. Весьма существенная роль в раз-
витии так называемой естественной толерантности —
невосприимчивости лимфоидной ткани к своим тканям и анти-
генам— придавалась в 60-х годах удалению части клонов лим-
фоцитов, способных реагировать на свои ткани и антигены.
Предполагалось, что элиминация этих клонов происходит в пе-
риод становления системы лимфоидной ткани в онтогенезе
в центральных органах иммунитета (стр. 281). Однако анализ
организации лимфоидной ткани показал, что большинство
клонов лимфоцитов, способных реагировать на поверхностные
рецепторы собственных клеток и циркулирующие в организме
собственные антигены, не элиминируются из организма. Более
того, само формирование разнообразия клонов — предшествен-
ников В-системы в онтогенезе, основано, по-видимому, на спо-
собности формирующихся В-лимфоцитов ' распознавать боль-
шое разнообразие «своих» антигенов. Оказалось, что а реак-
тивность лимфоидной системы взрослого организма обеспе-
чивается в основном наличием в ней особой супрессорной си-
стемы— мощного аппарата внутренней саморегуляции лимфо-
идной ткани. Она представлена главным образом субпопуля-
цией Т-лимфоцитов-супрессоров. Механизмы и точка приложе-
ния их тормозящего действия изучены еще слабо. Для В-систе-
мы предполагают, что они могут действовать и на Т-хелперы
в период рецепции антигена и на сам процесс формирования
плазматических клеток.
Наконец, весьма сложная и, по-видимому, эффективная са-
морегуляция реакций иммунитета осуществляется за счет тес-
нейшей взаимосвязи всех ее клеточных элементов. Эти взаимо-
связи основаны на способности лимфоцитов реагировать на
антитела, выделяемые плазмоцитами. Благодаря этому свойст-
ву вся чрезвычайно гетерогенная по составу и топографически
разобщенная система В-лимфоцитов представляет собой в
функциональном отношении целостную сеть, находящуюся
в каждый данный момент в уравновешенном активном состоя-
нии. Введение инородных антигенов выводит всю систему из
равновесного состояния и вызывает перестройку значительных
участков сети, и в конце концов вся система снова переходит
в равновесное состояние. На каждый конкретный антиген или
чужеродную клетку реагируют непосредственно лишь специ-
фичные клоны В-лимфоцитов. Однако в ходе развития эффек-
торного звена реакций происходит активизация клонов лимфо-
цитов, реагирующих на продуцируемые антитела. В свою оче-
редь активизация этйх клонов 2-го порядка вызывает активи-
зацию клонов, реагирующих уже на факторы, выделяемые кло-
нами 2-го порядка. В результате всех этих процессов система
взаимосвязанных элементов перейдет в равновесное состояние
путем постепенного затухания активации большого количества
клонов лимфоцитов.
280
Одной из центральных проблем организации лимфоидной
ткани является выяснение системных, клеточных и генетиче-
ских механизмов возникновения удивительного генетически
обусловленного разнообразия клонов лимфоцитов — специфич-
ного у высших позвоночных для каждого организма даже
в пределах одного вида.
Разработка этой проблемы ведется в следующих основных
направлениях: а) выяснения периода онтогенеза, в котором
происходит формирование этого разнообразия, б) локализации
и системной организации процессов размножения и специфи-
ческой антигеннезависимой дифференцировки клонов
однозначно детерминированных клеток, в) анализа генетиче-
ских и клеточных механизмов, обусловливающих возможность
такой дифференцировки.
Формирование разнообразия клонов лимфоцитов и обуче-
ние лимфоидной системы распознаванию своего и чужого кор-
релирует с закладкой и заселением лимфоцитами дефинитив-
ных или провизорных центральных органов лимфоидной систе-
мы. У млекопитающих и человека такими органами являются
зобная железа, красный костный мозг и, по-видимому, эмбрио-
нальная печень. У разных видов млекопитающих этот процесс
может быть либо целиком приурочен к внутриутробному пе-
риоду (животные с длительным периодом внутриутробного раз-
вития), либо может захватывать и начало постнатального онто-
генеза (например, у грызунов с коротким периодом внутриут-
робного развития). Значение его в становлении лимфоидной
ткани особенно наглядно было показано у млекопитающих на
примере неидентичных в генетическом отношении близнецов
телят, имевших общую плаценту в период внутриутробной
жизни. Лимфоидные системы таких телят не реагируют на
антигены и ткани друг друга при взаимной трансплантации ко-
жи. Иными словами, смешение крови и лимфоцитов во время
внутриутробного развития обусловило стойкую ареактивность
или толерантность лимфоидных систем этих телят по отноше-
нию к клеткам и антигенам друг друга. Таким образом, стано-
вление естественной толерантности и возникновение детерми-
нированных клонов клеток происходит именно в этот период
онтогенеза.
Что касается системных механизмов этих процессов, то
в настоящее время достаточно точно установлено, что и у эмб-
рионов и во взрослом организме источником развития клонов
лимфоцитов является стволовая клетка крови (см. рис. 69). Весь-
ма вероятно, что первым этапом их превращения в элементы
лимфоидной системы является общая полустволовая клетка
этой системы. В красном костном мозге удалось выявить полу-
стволовые клетки для Т- и В-систем (так называемые пре- В-
н пре-Т-клетки). Дальнейшие этапы антигеннезависимой диф-
ференцировки гетерогенной Т-системы происходят в зобной же-
281
лезе. Дифференцировка клонов В-лимфоцитов у млекопитаю-
щих и человека происходит, по-видимому, в основном в эмбрио-
нальной печени, а частично и в особых участках красного кост-
ного мозга.*
Естественно, то в настоящее время системные аспекты анти-
геннезависимой дифференцировки у млекопитающих лучше
Рис. 72. Участки лимфоидной ткани зобной железы млекопитающих.
а — общий вид дольки железы, б — схема взаимоотношений между кровеносным со-
судом, эпителиальной стромой и лимфоцитами зобной железы яа ультраструктурной
уровне организации: 1 — корковое, 2 — мозговое вещество, 3 — тельце Гассаля, 4 — про-
слойки соединительной ткани, 5 —эндотелий, 6 — базальная мембрана, 7 — цитоплаз-
ма эпителиальной клетки, 8 — лимфоцит, 9 — соединительнотканное пространство.
* Локализация антигеннезависимой дифференцировки основной массы
исходных клонов В-лимфоцитов у позвоночных животных широко варьирует
в разных классах в противоположность локализации формирования клонов
лимфоцитов Т-системы, которые образуются у представителей всех классов
позвоночных в зобной железе или в ее гомологах '(круглоротые). Эти раз-
личия периодов антигеннезависимой дифференцировки Т- и В-систем лим-
фоцитов, по-видимому, не случайны. Они отражают существенные биологи-
ческие особенности этих систем. Для Т-системы в этот период происходит
«обучение» лимфоцитов различать свое и чужое. В-система не обладает
этим свойством, и толерантность к своим антигенам обеспечивается за счет
наличия теснейшей ее взаимосвязи с Т-системой.
282
изучены в отношении системы Т-лимфоцитов, поскольку точно
известно место локализации этих процессов.
Тимус, или зобная железа млекопитающих, внешне похож
на лимфатический узел гигантских размеров. Снаружи тимус
имеет соединительнотканную капсулу, которая образует через
примерно одинаковые промежутки глубокие впячивания, раз-
деляя орган на отдельные дольки. Каждая долька, как и лим-
фатический узел, состоит из коркового и мозгового вещества.
Краевые, прилегающие к капсуле участки лимфоидной ткани,,
характеризуются плотным расположением лимфоцитов, а глуб-
же лежащие участки — более рыхлым их расположением-
(рис. 72,а). Однако при этом внешнем микроанатомическом
сходстве периферического и центрального органов лимфоидной
системы между ними имеются глубокие принципиальные отли-
чия. Как уже отмечалось, вся структура стромы и синусов лим-
фатических узлов предназначена для обеспечения контакта В-и
Т-лимфоцитов с антигеном. В тимусе, наоборот, организация
его стромы преследует цель изолировать Т-лимфоциты от кон-
такта с антигеном. В тимусе слабо развиты лимфатические со-
суды, а система капилляров коркового вещества отграничена
от скоплений Т-лимфоцитов сложным барьером (рис. 72, б).,
Строма тимуса помимо фибробластов и ретикулярных волокон
содержит сеть отростчатых эпителиальных клеток, которые
в мозговом веществе образуют характерные структуры — тель-
ца Гассаля, группы связанных между собой и плотно располо-
женных клеток, в центре которых образуются типичные рого-
вые чешуйки. В корковое вещество проникают лишь капилля-
ры от артериол и венул, проходящих по границе коркового-
н мозгового вещества. Стенка капилляров коркового вещества
образована эндотелием, снаружи от которого находится так
называемое соединительнотканное пространство. В нем имеют-
ся структуры типа базальных мембран, перициты и макрофаги.
Соединительнотканное пространство. в свою очередь снаружи-
окружено слоем эпителиальных клеток. Таким образом, содер-
жащиеся в плазме крови антигены для достижения скоплений
лимфоцитов должны пройти через эндотелий капилляров, сое-
динительнотканное пространство и слой эпителия, т. е., по край-
ней мере, через три активных барьера. При этом в соедини-
тельнотканном пространстве они будут активно поглощаться-
макрофагами и, возможно, с направленным оттоком тканевой
жидкости распространяться по этому пространству в область,
мозгового вещества.
Изоляция дифференцирующихся Т-лимфоцитов от контакта
с антигеном имеет очень важное значение, поскольку прежде-
временное воздействие антигенов на незрелые клетки может,,
по-видимому, привести их к гибели.
Показано, что именно корковое вещество заселяется пре-
Т-лимфоцитами костного мозга. Они имеют (благодаря нали-
28а
чию на поверхности специфических для этой стадии дифферен-
цировки рецепторов) отчетливо выраженный положительный
хемотаксис в отношении периферической стромы коркового
вещества. Оседая в этой области стромы под влиянием сти-
мулов с ее стороны и особых гуморальных факторов, выделяе-
мых эпителиальными отростчатыми клетками стромы (в частно-
сти пептидного гормона тимозина), пре-Т-лимфоциты присту-
пают к интенсивной пролиферации и дифференцировке. При
этом дифференцирующиеся клетки смещаются в глубже лежа-
щие зоны коркового вещества. При таком смещении происхо-
дит закономерное изменение маркерных поверхностных рецеп-
торов, отражающее прогрессирующие изменения свойств кле-
ток в ходе их дифференцировки. Наряду с интенсивным раз-
множением клеток в корковом веществе тимуса происходит
и массовая их гибель. По некоторым, возможно, несколько за-
вышенным расчетам здесь погибает до 95% вновь образую-
щихся в результате деления клеток. Массовая гибель лимфо^
цитов дает основание предположить, что в данном случае имеет
место отбор формирующихся клонов лимфоцитов, т. е. проис-
ходит массовая гибель предшественников клонов Т-лимфоци-
тов. Элиминации подвергаются и нежизнеспособные предшест-
венники клонов, возникающие в результате соматических му-
таций (стр. 285). Показано, что в корковом веществе тимуса
образуются все субпопуляции Т-лимфоцитов (за исключением
естественных киллеров) и большое количество их отдельных
специфических клонов в пределах каждой функциональной
субпопуляции. Гистогенетические взаимоотношения Т-прекилле-
ров, Т-антигенреактивных клеток с Т-хелперами, В-, Т-супрес-
сорами и Td-лимфоцитами не ясны. Весьма вероятно, что каж-
дая из этих субпопуляций представляет собой отдельные ли-
нии дифференцировки Т-лимфоцитов, как это, в частности,
установлено для Т-прекиллеров, антигенреактивных клеток,
и Т-хелперов.
Закончившие этап антигеннезависимой дифференцировки
Т-лимфоциты попадают в корковое вещество тимуса, по-види-
мому, минуя мозговое вещество, через капилляры коркового
вещества и сосуды, расположенные на границе коркового
и мозгового вещества. Последнее репопулируется лимфоцитами,
мигрирующими из крови через стенку венул, выстланных столб-
чатым призматическим эндотелием, аналогичным эндотелию
венул лимфатических узлов. Конкретное функциональное зна-
чение мозгового вещества тимуса пока не очень ясно.
Особенно большие успехи достигнуты в последнее время
в изучении генетических основ возникновения разнообразия
клонов В-лимфоцитов. По современным представлениям, осно-
ванным на изучении организации генов, непосредственно коди-
рующих иммуноглобулины, а также изменения структуры, этих
генов в процессе дифференцировки клеток методами генной
284
инженерии удалось выявить ряд принципиально важных поло-
жений. Оказалось, что количество генов, кодирующих констант-
ные участки молекул иммуноглобулинов, на гаплоидный геном
не превышает для тяжелых цепей 1—3 для каждого класса
этих цепей (всего около 10 генов). В,се специфичное разнооб-
разие антител определяется специальными генами, кодирую-
щими вариабельные участки молекул. Однако количество этих
генов в эмбриональном геноме не превышает нескольких сотен.
Естественно, что они даже при учете возможных комбинаций
вариабельных участков легких и тяжелых цепей не в состоянии
обеспечить информацию о различиях в специфических антиген-
связывающих центрах молекул иммуноглобулинов, порядка
2-Ю7, характерных для лимфоидной системы взрослых млеко-
питающих. Исследования последних лет показали, что в геноме
имеются дополнительные механизмы увеличения этого разно-
образия. Разнообразие клонов и соответственно антител опре-
деляется тремя факторами: наличием большого количества га-
метных генов, кодирующих вариабельные участки (как для L,
так и для Н цепей); происходящими в этих генах в ходе диф-
ференцировки клеток соматическими мутациями, сборкой генов
из нескольких сегментов.1"
К сожалению, в настоящее время отсутствуют еще точные
данные по генетическим основам дифференцировки Т-лимфоци-
тов. Однако очевидно, что в основе формирования их разнооб-
разия должны лежать сходные генетические механизмы.
Круглоротые, рыбы, амфибии, рептилии и птицы. В послед-
нее время в иммунологии вопросу об исторических основах ре-
акций иммунитета и эволюционной динамике лимфоидной тка-
ни стали уделять все большее внимание. Накоплен уже боль-
шой сравнительный материал об организации лимфоидной ткани,
строении молекул иммуноглобулинов и реакциях клеточного
и гуморального иммунитетов у представителей разных классов
позвоночных, начиная от круглоротых и кончая высшими
млекопитающими и птицами. Имеются попытки найти у бли-
жайших родственников позвоночных— полухордовых, в част-
ности асцидий, систему свободных элементов, послужившую
источником развития лимфоидной ткани позвоночных. Эта
попытка пока не увенчалась успехом. Лимфоцитоподобные
клетки асцидий не обнаруживают способности к синтезу мо-
лекул, гомологичных иммуноглобулинам позвоночных, и за-
щитные реакции свободных клеточных элементов крови огра-
* Сборка дефинитивных генов для каждого клона В-лимфоцитов при
их дифференцировке происходит путем вырезания неиспользуемых участков
молекулы ДНК, т. е. связана со структурной ее перестройкой. В формиро-
вании дефинитивного гена принимают участие не только гены константных
и вариабельных участков цепи, но и два промежуточных участка молекулы
ДНК, представленных в геноме полустволовой клетки в нескольких вари-
антах (3—5).
285
ничиваются у них фагоцитарной реакцией и реакцией инкап-
суляции, осуществляемой своеобразной системой гранулярных
амебоцитов (см. стр. 249). Анализ причин и механизмов оттор-
жения чужеродных тканей и особей у колониальных асцидий
показал генетическую природу тканевой несовместимости. Од-
нако механизмы этой реакции иные, чем при клеточном имму-
нитете.*
Проведенный к настоящему времени анализ организации
лимфоидной ткани у представителей разных классов позвоноч-
ных животных показал, что от низших (круглоротые, акуловые
рыбы) и до высших позвоночных (рептилии, птицы, млекопита-
ющие) наблюдается усложнение ее организации. У всех пред-
ставителей позвоночных в крови, лимфе и тканевой жидкости
имеется система циркулирующих лимфоцитов. Однако плазма-
тические клетки не обнаружены ни у круглоротых, ни у низ-
ших акуловых рыб, хотя эти животные содержат в плазме имму-
ноглобулины и способны осуществлять реакцию гуморального
иммунитета. У круглоротых зачатки организованной лимфоидной
ткани обнаружены лишь в области жаберных щелей, у личинок,
миноги — в виде скоплений лимфоцитов, контактирующих с эпи-
телием жаберных карманов (гомолог тимуса позвоночных)
и в кроветворной ткани в стенке. передней кишки взрослых
животных (гомолог селезенки). У миксин организованных уча-
стков лимфоидной ткани обнаружить пока не удалось. У аку-
ловых рыб уже имеются хорошо развитые тимус и селезенка.
У представителей других классов позвоночных помимо этих
органов развиваются и другие периферические и центральные
органы лимфоидной системы (скопления лимфоидной ткани
в почке и в стенке кишки у рыб, лимфомиелоидные и лимфо-
идные железы у бесхвостых амфибий, фабрициева сумка
у птиц). Представители современных позвоночных животных
являются по сути дела боковыми ветвями давно дивергировав-
ших групп позвоночных, и прямолинейные сопоставления орга-
низации их лимфоидных систем требуют существенных огово-
рок. Очевидно, что тот или иной уровень организации этой си-
стемы в группе является в значительной мере результатом не-
зависимых от других групп изменений лимфоидной системы
в ходе эволюции данной группы животных. Иными словами,
наблюдаемое в пределах каждой группы усложнение лимфо-
идной системы можно рассматривать как параллельное, не
тождественное проявление общей тенденции системы к более
* По мнению некоторых исследователей, основной причиной отсутствия
у предков позвоночных примитивной лимфоидной ткани является неустой*
чивое состояние первых этапов ее становления. Она не могла сохраниться
в таком состоянии, поскольку сам принцип организации этой системы не-
избежно требует и возникновения большого количества клеток, и прогрес-
сивного развития взаимосвязи между ними, как в «надорганизменной» по-
луавтономной саморегулирующейся системе.
286
дифференцированной организации. В каждом классе позвоноч-
ных эта общая тенденция проявляется по-разному. Так, в пре-
делах млекопитающих весьма четко выступает тенденция к ус-
ложнению и совершенствованию организации лимфатических
узлов (у низших млекопитающих — ехидны — они представле-
ны скоплением небольших лимфоидных фолликулов внутри
лимфатических сосудов). С другой стороны, возникающая
независимо от млекопитающих фабрициева сумка птиц пред-
ставляет собой в известном смысле вершину эволюционной
дифференцировки центральных органов лимфоидной системы,
поскольку в данном случае имеет место топографическое и орган-
ное обособление части системы, ответственной за дифференци-
ровку В-лимфоцитов.
Фабрициева сумка внешне напоминает зобную железу. Она
расположена в стенке клоаки. Ее строму образуют отростча-
тые фибробласты с ретикулярными волокнами и сеть отростча-
тых эпителиальных клеток.
В отличие .от зобной железы в строму фабрициевой сумки
проникают антигены. Таким образом, формирование и отбор
предшественников клонов В-лимфоцитов происходит здесь
в присутствии антигенов. Очевидно, что, несмотря на сходный
характер происходящих в зобной железе и фабрициевой сумке
событий (формирование и отбор разнообразных предшествен-
ников клонов Т- и В-лимфоцитов), механизмы этих процессов
в отношении систем Т- и В-лимфоцитов характеризуются су-
щественными неясными еще пока в деталях особенностями.
Лимфатические узлы у птиц возникают независимо от мле-
копитающих и имеют иное строение. В пределах класса амфи-
бий образуются сложные лимфомиелоидные и лимфоидные
органы, какими являются лимфатические железы взрослых
бесхвостых амфибий или провизорная лимфатическая железа
головастиков. К сожалению, функциональное значение и тон-
кая структурная организация этих органов изучены еще весь-
ма слабо.
Аналогичная общая закономерность отчетливо прослежи-
вается и на молекулярном уровне организации, в частности
в строении и дивергентной дифференцировке молекул иммуно-
глобулинов.
Так, у круглоротых имеется лишь один тип молекул анти-
тел — иммуноглобулины класса М. У млекопитающих и чело-
века, как было отмечено выше, имеются уже 5 классов имму-
ноглобулинов (М, G, А, Е и D) и субклассы в пределах каж-
дого класса. При этом помимо увеличения количества и функ-
циональной специализации молекул антител возрастает и их
способность связываться с антигеном. Так, в частности, имму-
ноглобулины класса G (более «молодые», характерные для
млекопитающих) связывают антигены эффективнее, чем более
древние иммуноглобулины класса М.
287
Эта тенденция к увеличению разнообразия молекул антител
и совершенствованию их антигенсвязывающих свойств незави-
симо и не тождественно проявляется в разных классах позво-
ночных. Так, уже у двоякодышащих рыб помимо иммуногло-
булинов класса М появляются иммуноглобулины, состоящие из
двух мономеров (комплексы с легкой и тяжелой цепями) с мо-
лекулярным весом 38000, обозначаемые как иммуноглобулины
класса N. В пределах класса амфибий, независимо от млеко-
питающих, возникают димерные иммуноглобулины, подобные'по
своим свойствам иммуноглобулинам класса G млекопитающих, но
не гомологичные им по аминокислотной последовательности тя-
желых цепей. Они имеются у бесхвостых амфибий и отсутст-
вуют у хвостатых. У птиц независимо от млекопитающих по-
являются два новых класса низкомолекулярных иммуноглобу-
линов, подобных по своим свойствам иммуноглобулинам клас-
сов G и А млекопитающих.
Изучение организации наиболее древнего и консервативного
М-класса иммуноглобулинов показало, что надмолекулярная
организация этих сложных высокомолекулярных белков моза-
ично варьирует у представителей разных классов позвоночных.
Так, у человека и акуловых рыб он представлен пентамерны-
ми формами. При этом в плазме акуловых рыб имеется еще
и мономерная форма, а у млекопитающих мембранная разно-
видность его димерной формы играет роль рецептора В-лим-
фоцитов. Для тритона характерна гексамерная форма иммуно-
глобулинов М, а для костистых рыб—-тетрамерная. Такое
хаотичное распространение рассматриваемого признака у
представителей разных классов свидетельствует о том, что
в ходе эволюции каждого класса позвоночных используются все
возможные варианты организации даже надмолекулярных комп-
лексов молекул наиболее древнего и консервативного класса
иммуноглобулинов.
Таким образом, можно заключить, что на молекулярном,
надмолекулярном и органном уровнях организации лимфоид-
ной системы у позвоночных имеет место нетождественное
в каждом классе проявление ряда универсальных для всей
лимфоидной системы закономерностей ее эволюционной дина-
мики.
Сравнительный анализ функциональной деятельности лим-
фоидной системы показал, что всем позвоночным, включая
круглоротых, свойственны реакции гуморального и клеточного
иммунитетов с характерной для них высокой специфичностью
реакции и феноменом памяти. Эти данные свидетельствуют
о том, что в основе реакции иммунитета лежит прежде всёго-
система свободно циркулирующих в организме лимфоцитов.
Усложнение структурной организации этой системы необходи-
мо для более совершенной реализации свойственных ей разно-
сторонних функций.
288
По аналогии с млекопитающими и из косвенных экспери-
ментальных данных следует, что в лимфоидной системе низ-
ших позвоночных и даже у круглоротых имеется уже два типа
лимфоцитов (Т- и В-лимфоциты). Как уже отмечалось, у круг-
лоротых и низших акуловых рыб активизированные антигеном
В-лимфоциты не образуют морфологически выраженных плаз-
матических клеток. Однако они дают начало клонам клеток,
способных выделять в плазму секреторную форму иммуногло-
булинов класса М. У представителей всех других классов по-
звоночных имеются типичные плазматические клетки, образо-
вание которых, по-видимому, сходно с подобными процессами
у млекопитающих. Такая же ситуация имеется, вероятно, и в
отношении реакций клеточного иммунитета. При благоприят-
ных условиях и соответствующей температуре наблюдаются
весьма энергичные первичная и вторичная реакции на чуже-
родные ткани у акуловых, двоякодышащих и костистых рыб.
У ряда представителей позвоночных (бесхвостые амфибии,
птицы) показана также необходимость кооперации Т- и В-лим-
фоцитов в рецепторной фазе реакций гуморального иммуните-
та на тимусзависимые антигены.
Глава 12. НЕКОТОРЫЕ ОБЩИЕ ЗАКОНОМЕРНОСТИ
ЭВОЛЮЦИОННОЙ ДИНАМИКИ ТКАНЕЙ
ВНУТРЕННЕЙ СРЕДЫ
Ткани внутренней среды представляют собой наиболее раз-
нообразный тип тканей многоклеточных животных. Эволюци-
онные потенции тканей этого типа крайне неравномерно реа-
лизуются в разных группах многоклеточных животных.
У позвоночных животных они достигают наивысшего уровня
развития, осуществляют максимальное количество функций
и представлены наибольшим по сравнению с другими живот-
ными количеством разновидностей. Из первичноротых живот-
ных наибольший удельный вес эти ткани имеют у моллюсков
и особенно у их высших представителей — головоногих мол-
люсков.
Удельное значение тканей внутренней среды в ряду аннели-
ды—-членистоногие меньше в связи с тем, что ряд функций
этих тканей берут на себя целом и покровный кутикулярный
эпителий.
В отношении удельного веса и характера структурно-хими-
ческой организации этих тканей у представителей других групп
многоклеточных наблюдается весьма пестрая картина.
Это разнообразие определяется, с одной стороны,, общей
тенденцией эволюционной динамики этих тканей к дивергент-
ной дифференцировке. Усложнение этого тканевого типа в хо-
10 672
289
де эволюции идет по пути увеличения количества видов тканей
и тканевых элементов — специализированных клеток и межкле-
точных структур, что приводит к появлению и большого коли-
чества разновидностей этих тканей, и в пределах каждой раз-
новидности —" большого количества составляющих их эле-
ментов.
У позвоночных животных ткани внутренней среды представ-
лены двумя основными подтипами (система свободных элемен-
тов и стромальные механические структуры) с дифференцировкой
каждого из них еще на ряд разновидностей. Такие разновидности
первого подтипа, как системы лимфоидной ткани, а также гра-
нулоцитов и макрофагов в пределах каждого класса позвоноч-
ных, претерпевают отчетливую дивергентную дифференциров-
ку. Большим количеством разновидностей представлен и вто-
рой подтип этих тканей: рыхлая соединительная, жировая,
ретикулярная ткани и система скелетных тканей.
Второй общей закономерностью эволюционной динамики
тканей внутренней среды является то, что сходную функцио-
нальную задачу они могут решать с помощью нескольких ме-
ханизмов. Так, в частности, трофическая проводящая функция
осуществляется и путем образования специального белково-
полисахаридного основного вещества в комбинации с лакунар-
ной или сосудистой системой (основное направление дифферен-
цировки стромальных интерстициальных тканей) или путем со-
здания клеточных паренхим. В последнем случае проводящая
функция обеспечивается, по-видимому, надмембранными ком-
плексами пузыревидных клеток и системой узких межклеточных
щелей (низшие турбеллярий, ряд паразитических червей и не-
которые другие группы животных). У всех многоклеточных
животных защитную функцию берут на себя специальные бо-
лее или менее разнообразные фагоциты. Кроме того, на основе
этих тканей формируются еще по крайней мере две защит-
ные системы — гранулярные амебоциты и лимфоидная сис-
тема.
В отличие от фагоцитоза эти защитные механизмы реали-
зуются либо только в одном типе животных и имеют монофи-
летическое происхождение (лимфоидная ткань позвоночных),
либо, наоборот, мозаично распределяются по отдельным типам
беспозвоночных, имея очевидно полифилетическое независимое
происхождение (система гранулярных амебоцитов). Естествен-
но, что такое многообразие механизмов реализации сходных
функций создает весьма пеструю и кажущуюся хаотичной кар-
тину их организации у представителей разных групп многокле-
точных животных. Эта кажущаяся хаотичность может усили-
ваться еще и явлениями филогенетической метаплазии. Суть
их заключается в том, что функции, свойственные одному типу
тканей, берут на себя разновидности тканей другого типа. Ти-
пичный пример такой положительной для тканей внутренней
290
среды метаплазии представляет формирование на основе фиб-
робластов гладкой мышечной ткани, что наблюдается у позво-
ночных животных, а возможно и у моллюсков (см. стр. 332).
При этом гладкие мышечные клетки сохраняют многие свойства
оседлых фибробластических элементов, хотя и представляют
собой разновидность морфофункционального типа сократимых
тканей. В эволюционной динамике тканей внутренней среды
более многочисленны, однако, примеры отрицательной метапла-
зии— выполнения ее функций разновидностями тканей других
типов. Особенно характерно это для первичноротых, в част-
ности для полихет, олигохет, насекомых и других членисто-
ногих.
Такое замещение функций может происходить двумя спосо-
бами: без утраты замещающей тканью своих типовых особен-
ностей организации и, наоборот, с утратой этих особенностей
и приобретением черт строения, свойственных одной из разно-
видностей внутренней среды.
Примерами первого типа могут быть замещения, при ко-
торых скелетную функцию и функцию газообмена берет на се-
бя покровный кутикулярный эпителий у насекомых и других
групп наземных членистоногих.
Примером второго рода может служить формирование це-
ломическим. эпителием дыхательных пигментов и целомоцитов
с их специализацией на защитную функцию и функцию запа-
сания кислорода. При далеко зашедшей метаплазии второго
типа и редукции стенки целома у высших первичноротых жи-
вотных не всегда удается четко различить у взрослых живот-
ных собственно элементы тканей внутренней среды — произ-
водные первичного фагоцитобласта — от элементов более по-
зднего целомического происхождения. Именно такая ситуация
складывается, как мы видели выше, в отношении некоторых
разновидностей и отдельных типов клеток тканей внутренней
среды членистоногих, моллюсков и ряда других групп жи-
вотных.
Несмотря на все эти сложности, кажущуюся пестроту
и разнообразие системной и структурно-химической организа-
ции тканевых элементов тканей внутренней среды, преобразо-
вание этих тканей в эволюции многоклеточных происходит за-
кономерно, направленно и, как и в других тканях, ограничено
рамками типовых закономерностей.
Проявлением общих закономерностей в широком плане эво-
люционных преобразований являются факты независимого мно-
гократного возникновения таких специфических дифференциро-
вок, как хрящевые ткани, эритроциты и гранулярные амебоци-
ты у отдельных групп первично- и вторичноротых животных.
На молекулярном и надмолекулярном уровнях организации
выражением этих общих закономерностей является параллель-
ное, независимое увеличение разнообразия молекул и надмоле-
10*
291
кулярных комплексов коллагена в ряду первично- и вторично-
ротых, сходные и независимо возникшие механизмы кальцифи-
кации в кости позвоночных и спикульных скелетов иглокожих
и кишечнополостных.
Как было показано выше, закономерный направленный ха-
рактер преобразования тканей внутренней среды проявляется,
однако, не только в независимом появлении сходных диффе-
ренцировок у представителей разных типов многоклеточных
животных. Многочисленные глубокие параллелизмы характер-
ны для преобразования этих тканей в пределах одного типа
в ходе независимой эволюции отдельных его классов. Особен-
но наглядно доминирующее значение таких близкородствен-
ных параллелизмов в эволюционных преобразованиях тканей
внутренней среды выступает у позвоночных животных. Как
было показано на примере двух наиболее специализированных
разновидностей этих тканей — лимфоидной системы и скелет-
ных тканей — их эволюционная динамика в пределах типа ха-
рактеризуется отчетливо выраженными, нетождественно прояв-
ляющимися у представителей каждого класса, но общими для
всего типа закономерностями эволюционных преобразова-
ний.
Весьма характерной общей особенностью эволюционной ди-
намики тканей внутренней среды являются сохранение и, более
того, усиление и усложнение взаимосвязей между отдельными
клеточными элементами внутри каждой дивергентно дифферен-
цирующейся разновидности. Усиление взаимосвязей происхо-
дит и между отдельными разновидностями внутри каждого из
двух подтипов и, наконец, между разновидностями каждого из
этих подтипов. Наиболее полно изучены и, по-видимому, до-
стигают наибольшей сложности эти взаимоотношения в тканях
внутренней среды позвоночных. Они были продемонстрирова-
ны нами на примере гистогенетических и кооперативных взаи-
модействий внутри лимфоидной системы и между этой систе-
мой и системой гранулоцитов и моноцитов и, наконец, между
Td-лимфоцитами и стволовыми клетками миелоидной ткани.
Не менее сложные отношения устанавливаются между
клетками и межклеточными структурами, а также между си-
стемами полустволовых клеток в механических скелетных тка-
нях, хотя изучены они менее подробно. Наконец, с большой
определенностью уже сейчас можно говорить о существенном
и в известном смысле определяющем влиянии оседлых клеток
и межклеточных структур стромы соединительной и различных
разновидностей ретикулярной и костной тканей на процессы
дифференцировки клеток системы свободных элементов. Функ»
циональное единство свободных и оседлых элементов тканей
внутренней среды проявляется в очаге воспаления и воспали-
тельном новообразовании соединительной ткани. Реакция раз-
нообразных клеточных элементов оказывается здесь целостной,
292
хотя и весьма дифференцированной. В ней закономерно и по-
следовательно принимают участие сосуды, два типа фагоци-
тов и тучные клетки со сдерживающими их эозинофилами. На
заключительной регенераторной фазе воспаления весьма актив-
ная реакция наблюдается и со стороны оседлых фибробласти-
ческих элементов. Активизация синтетической деятельности
фибробластов и их интенсивное деление обеспечивают форми-
рование фибробластической капсулы.
Гистогенетическое единство всех разновидностей тканей
внутренней среды позвоночных весьма отчетливо проявляется
в онтогенезе. Все они развиваются из общего зачатка — мезен-
химы. При этом развитие клеток крови, стенок сосудов и рых-
лой соединительной ткани происходит на ранних стадиях из
единых скоплений клеток мезенхимы. Периферическая часть
таких уплотнений превращается в рыхлую соединительную
ткань, из средней части образуется стенка сосуда и, наконец,
центральная часть разрыхляется, клетки приобретают округ-
лую форму и превращаются в первичные кровяные клетки.
Однако это гистогенетическое единство оседлых и свободных
элементов во взрослом организме высших позвоночных утрачи-
вается.
Гистогенетическое и функциональное единство клеток тка-
ней внутренней среды — характерная общая особенность этих
тканей. Она свойственна и тканям внутренней среды беспозво-
ночных животных. Особенно хорошо показана такая целост-
ность системы в экспериментах по воспалительному новообра-
зованию соединительной ткани у моллюсков. Здесь удалось
показать, что общим источником формирования свободных
и оседлых клеток, участвующих в воспалительном процессе,
являются мелкие недифференцированные базофильные амебо-
циты. Этот факт имеет принципиальное значение. Он показы-
вает, что характерное для млекопитающих разделение камби-
альностей для оседлых и подвижных элементов является не
отражением какого-то древнего исходного состояния первич-
ных паренхим, как это постулируют некоторые исследователи.
Разделение камбиальностей, или, по-современному, выделение
у млекопитающих стволовых клеток крови и стволовых стро-
мальных клеток, является лишь крайним выражением разде-
ления системы на два подтипа в результате прогрессирующей
в ходе эволюции дивергентной дифференцировки тканей внут-
ренней среды позвоночных. Интересно, что и у взрослых насе-
комых в отличие от моллюсков также имеет место аналогич-
ное явление. У поздних личинок и взрослых насекомых не
удается наблюдать ни превращения свободных элементов ге-
молимфы в клетки стромы, ни превращения клеток стромы
в свободные клетки гемолимфы.
293
АриповУ. А., Хаитов Р. М., Галактионов В. Г. Очерки совре-
менной иммунологии. Ташкент, 1981. 255 с.
Вашкинель В. К., Петров М. Н. Ультраструктура и функция тром-
боцитов человека. Л., 1982. 87 с.
Жарикова Н. А. Периферические органы системы иммунитета: раз-
витие, строение и функция. Минск, 1979. 206 с.
Иржа к Л. И. Эволюция системы крови. — В кн.: Эволюционная фи-
зиология. Л., 1983, с. 262—300.
Карр Я. Макрофаги. М., 1978. 188 с.
Кинетические аспекты гемопоэза. Томск, 1982. 306 с.
Никитин В. Н., Перскнй Е. Э., Утевская Л. А. Возрастная
и эволюционная биохимия коллагеновых структур. Киев, 1977. 279 с.
Петров Р. В. Иммунология. М., 1982. 368 с.
Пнгаревский В. Е. Зернистые лейкоциты и их свойства. М., 1978.
127 с.
Серов В. В., Ш е х т е р А. Б. Соединительная ткань. Функциональная
морфология и общая патология. М., 1981. 312 с.
Сидорова Е. В. Гены иммуноглобулинов. — Усп. совр. биол., 1982,
т. 94, № 1 (4), с. 38—50.
Фермнлен Ж., Ферстрате М. Гемостаз. М., 1984. 192 с.
Фриденштейн А. Я., Лурия Е. А. Клеточные основы кроветвор-
ного микроокружения. М, 1980. 215 с.
Хрущов Н. Г. Гистогенез соединительной ткани: Экспериментальное
исследование происхождения фибробластов. М., 1976. 117 с.
Хэм А., Кормак Д. Гистология. М., 1983, т. 2, с. 35—252; т. 3,
с. 15—135.
Чертков И. Л„ Гуревич О. А. Стволовая кроветворная клетка
и ее микроокружение. М., 1984. 320 с.
Чертков И. Л., Фриденштейн А. Я. Клеточные основы кровет-
ворения, М., 1977, 272 с.
Шубникова Е. А. Функциональная морфология тканей. М., 1981.
с. 122—237.
A s h h и г s t D. E. The structure and development of insect connective tis-
sue.— In: Insect Ultrastructure, V. 1. New York — London, 1982, p. 313—350.
Cohn M. Conversations with Jerne on immuneregulation.— Cell. Immu-
nol., 1981, vol. 61, N 2, p. 425—430.
Coutinho A. The self-nonself discrimination and the nature and
acquisition of the antibody repertoire.— Ann. Immunol., 1980. vol. D 131, N 3,
p. 233—253.
Fie is ch H. Mechanisms of normal mineralization in bone and carti-
lage.— In: Biological mineralization and demineralization. Berlin e. a., 1982.
p. 233—241.
Garrone R. Phylogenesis of connective tissue: Morphological aspects
and biosynthesis of sponge intercellular matrix. Basel, 1978. 250 p.
Marchalonis J. J. Immunity in evolution. Cambridge, 1977. 316 p.
Phylogeny of immunological memory.— In: Proc. Int. Symp., Tampa-
Fla, 28—30 Dec. 1979. Amsterdam e. a. 1980, 318 p.
Ravindranath M. H. Haemocytes in haemolymph coagulation of
arthropods.— Biol. Rev., 1980. vol. 55, p. 139—170.
Silverstein A. M. History of immunology. Development of the con-
cept of immunological specificity, I, II, III.—Cell. Immunol., 1982, vol. 67,
N 2, p. 396—409; 1982. vol. 71, N 1, p. 183—195; 1983. vol. 78, N 1,
p. 177—190; vol. 80, N 2, p, 416—425.
Terwilliger R. ' C. Structure of invertebrate hemoglobins.— Amer.
Zool., 1980. vol. 20, N 1, p. 53—67. , ,
Travis D. F. The comparative ultrastructure and organization of five
calcified tissues.— In: Biological calcification: Cellular and molecular aspects.
New York, 1970, p. 203—312.
Williams A. F. The T-lymphocyte antigen receptor — elusion on
more.— Nature, 1984, vol. 308 (5955), p. 108—109.
294
Часть IV
МЫШЕЧНЫЕ ТКАНИ И ТКАНИ НЕРВНОЙ
СИСТЕМЫ
Глава 13. МЫШЕЧНЫЕ ТКАНИ
§ 1. Классификация и общая характеристика
мышечных тканей
Все разновидности мышечных тканей многоклеточных жи-
вотных специализированы на функцию сокращения. Они раз-
виваются на одной основе путем видоизменения и гипертрофии
механохимической актин-миозиновой сократимой системы, име-
ющейся во всех клетках многоклеточных.
Мышечные ткани возникали в эволюции неоднократно и,
по-видимому, независимо в разных группах животных. Наибо-
лее древние соматические и висцеральные мышцы формирова-
лись вначале из эпителиально-мышечных клеток кожного'
и кишечного эпителиев, подобных эпителиально-мышечным
клеткам современных кишечнополостных или бескншечных
турбеллярий. Возможно также их возникновение и из оседлых
элементов первичных паренхим примитивных многоклеточ-
ных.
У целомических животных часть сократимых тканей фор-
мировалась на основе эпителия, выстилающего вторичную по-
лость тела. Целомические мышечные ткани у всех современ-
ных высших многоклеточных животных представлены сердеч-
ной мышцей, а у насекомых — и частью висцеральной муску-
латуры.
Висцеральная мускулатура позвоночных формируется на
основе видоизмененных оседлых клеток тканей внутренней сре-
ды. При необходимости сократимые структуры могли возникать
и на основе других тканей. Примером являются мышцы, сужа-
ющие и расширяющие зрачок у высших позвоночных. Они раз-
виваются из нервного зачатка и представляют собой специа-
лизированные на сократимую функцию клеточные элементы
тканей нервной системы. Разновидности мышечных тканей,
295
развивающиеся в онтогенезе из разных зачатков, стойко детер-
минированы и не могут превращаться друг в друга. Они отлича-
ются и по механизмам формирования в онтогенезе и при реге-
нерации. Существенные различия между целомическими и со-
матическими мышцами наблюдаются у животных на тканевом
уровне их организации. В гладких мышцах позвоночных об-
наружен ряд принципиальных отличий в организации сокра-
тимых структур на молекулярном, надмолекулярном и органо-
идном уровнях организации.
Тем не менее все мышечные ткани представляют собой еди-
ный унифункциональный тип тканей. Несмотря на отмеченные
выше различия между отдельными разновидностями мышеч-
ных тканей, количество вариантов прогрессивной специализа-
ции их сократимого аппарата на молекулярном, надмолеку-
лярном и органоидном уровнях организации ограничено. Как
правило, эти варианты используются всеми разновидностями
мышечных тканей, что придает эволюционной динамике мы-
шечных тканей закономерный направленный характер. К со-
жалению, в настоящее время не все разновидности мышечных
тканей и далеко не во всех группах животных изучены доста-
точно детально.
Представляется удобным в основу классификации мышеч-
ных тканей положить' структурную организацию сократимого
аппарата — актин-миозиновой системы, обеспечивающей функ-
цию сокращения. Тогда все многообразие мышечных тканей
многоклеточных укладывается в три подтипа: а) поперечнопо-
лосатые и косоисчерченные мышцы; б) гладкие мышцы
беспозвоночных;' в) гладкие мышцы позвоночных живот-
ных.
Особенности организации актин-миозиновых сократимых
структур в каждом выделенном нами подтипе могут коррели-
ровать с характерными особенностями на тканевом уровне
организации. Такая корреляция тем не менее не обязательна,
и более характерным является независимое изменение в ходе
эволюции тканевого, органоидного и молекулярного уровней
организации.
Кроме того, как и в других тканях, в каждом подтипе мы-
шечных тканей реализация функции сокращения на принци-
пиально одной и той же механохимической основе, отнюдь не
выражается развитием тождественных структур. Это характер-
но для отдельных разновидностей мышц данного подтипа у од-
ного животного и тем более для мышц каждого подтипа в раз-
ных группах многоклеточных. Наличие таких вариантов свиде-
тельствует об эволюционной пластичности мышечных тканей
и позволяет им обеспечить большое разнообразие конкретных
функциональных задач, несмотря на жесткие структурно-хими-
ческие ограничения, вытекающие из принципов организации
актин-миозиновой системы.
-296
§ 2. Поперечнополосатые и косоисчерченные
мышечные ткани
Общая характеристика, распространение, классификация.
Наиболее характерной особенностью этого подтипа мышечных
тканей является высокая упорядоченность в расположении
структур сократимого аппарата — тонких (актиновых) и толс-
тых (миозиновых) нитей.
Косоисчерченные и поперечнополосатые мышечные ткани
отличаются между собой по характеру и степени упорядоченно-
сти взаимного расположения этих структур и возникали в эво-
люции независимо друг от друга как два варианта закономер-
ного расположения толстых и тонких нитей в пространстве.
Широта распространения поперечнополосатых и косоисчер-
ченных мышц у современных животных различна. Поперечно-
полосатые мышечные ткани найдены у представителей подав-
ляющего большинства типов многоклеточных высших, средних
и даже низших уровней организации. Наибольший удельный
вес они имеют в сократимых системах высших вторичноротых
и первичноротых животных. У позвоночных и членистоногих
по сути дела все первичные соматические и вторичные целоми-
ческие мышечные ткани являются поперечнополосатыми. Рас-
пространение косоисчерченных мышечных тканей более огра-
ничено. Они обнаружены в основном у беспозвоночных живот-
ных средних уровней организации — нематод, аннелид, приапу-
лид, сипункулид, а также у моллюсков и турбеллярий.
При классификации поперечнополосатых и косоисчерченных
мышечных тканей за основу целесообразно взять принципы их
тканевой организации. Исходя из этого, все многообразие по-
перечнополосатых и косоисчерченных мышечных тканей можно
разделить на четыре группы: а) мышечные .ткани, образованные
поперечнополосатыми симпластическими волокнами; б) попе-
речнополосатые мышечные ткани из мышечных и эпителиаль-
но-мышечных клеток; в) поперечнополосатые целомические
мышечные ткани из клеточных волокон; г) косоисчерченные мы-
шечные ткани.*
Мышечные ткани, образованные поперечнополосатыми сим-
пластическими волокнами. Основным тканевым элементом по-
перечнополосатой мышечной ткани позвоночных является слож-
но организованный симпласт— мышечное волокно. Оно может
достигать 12 см в длину и содержать большой объем цитоплаз-
мы, контролируемой сотнями ядер (рис. 73, а, б). Основу по-
верхностного аппарата мышечного волокна составляет плаз-
* Косоисчерченные мышцы выделяются в отдельную группу в силу своей
морфологической и филогенетической обособленности. При этом следует
учитывать, что они по признакам системной тканевой организации могут
находиться в составе группы «б» (нематоды) и «в» (сердечные мышцы мол-
люсков) .
297
Рис. 73. Поперечнополосатые мышечные волокна
позвоночных животных.
лчшогп’’3/ °Рга,,пза"-"‘:- в - мышечные волокна туловищных мышц
ч,г 7 \ - -сарколемма, 3 - клетка-сателлит, 4-Т-каналы 5-Ька-
то'ег-1 6/9 —anPn'n.i'IC?,L 7 А-ДИСК, 8 — 1-диск, !) — Z-диск, 10 — миофибрилла, /’/— М-по-
' ’ “ -ЛРа ннечною волокна, 13 митохондрии, 14 — тонкие актиновые нити,
15 -- толстые миозиновые нити.
298
магическая мембрана, или плазмолемма. В типичном мышеч-
ном волокне плазмолемма через одинаковые промежутки по его
длине формирует перпендикулярно к длинной оси систему про-
низывающих волокно, анастомозирующих друг с другом попе-
речных или Т-каналов (рис. 73, б). Над поверхностью плаз-
молеммы выделяются базальная мембрана из белков и муко-
протеидов и слой коллагеновых волокон. Вместе они состав-
ляют сарколемму — своеобразное производное надмембранного
комплекса мышечного волокна. В каждом волокне между
плазмолеммой и сарколеммой располагаются отдельные недиф-
ференцированные камбиальные клетки, получившие название
клеток-сателлита в.
Основная масса цитоплазмы и ядра обычно располагается
по периферии, непосредственно под плазмолеммой. Здесь
же обычно находятся и более или менее многочисленные «мы-
шечные» митохондрии с большим количеством крист. Мышечные
волокна имеют хорошо развитый цитоскелет, образованный
преимущественно из так называемых промежуточных фибрилл
диаметром 10 нм, состоящих из белка десмина. В саркоплазме
некоторых мышечных волокон имеется большое количество
пигментного белка миоглобина, близкого по своим свойствам
гемоглобину эритроцитов. По количеству миоглобина мышеч-
ные волокна делятся на три типа: медленные, богатые мио-
глобином, — красные; быстрые, бедные миоглобином, — бе-
лые и промежуточные по этим признакам. Красные волокна
содержат наибольшее количество митохондрий и способны к
длительной непрерывной активности. В белых волокнах коли-
чество митохондрий меньше, и хотя они могут сокращаться
быстрее красных, однако быстро устают и не способны к дли-
тельной работе.
Количество свободных рибосом в дифференцированных мы-
шечных волокнах всех типов невелико, элементы аппарата
Гольджи развиты слабо. Основную часть волокна составляют
обычно специфические органоиды — миофибриллы, однако ко-
личество их может варьировать. Между миофибриллами в не-
больших прослойках цитоплазмы располагается система про-
дольных или L-каналов. Они представляют собой специализи-
рованную разновидность гладкой эндоплазматической сети.
В типичных мышечных волокнах млекопитающих L-каналы
состоят из закономерно расположенных цистерн и связывающих
их разветвленных анастомозирующих каналов (рис. 73, б).
Мембраны эндоплазматической сети, образующие стенку ка-
налов и цистерн саркоплазматической сети (L-системы), со-
держат большое количество сложных белковых комплексов
(Mg-зависимые Са-АТФазы)—специфических кальциевых на-
сосов.
Каждая миофибрилла состоит из правильно чередующихся
участков — темных анизотропных (А) и светлых изотропных
299
(I) дисков. Последние обычно в полтора-два раза длиннее тем-
ных анизотропных дисков. (Например, в мышечных волокнах
лягушки А—1,65, I — 2,05 мкм). Посередине светлых и темных
дисков проходят темные полоски: более заметный Z-диск—
через изотропный, и менее выраженный М-диск— через анизо-
тропный диски. Темные и светлые диски в соседних миофиб-
риллах располагаются на одном уровне, что при большом ко-
личестве миофибрилл и создает впечатление поперечной исчер-
ченности при наблюдениях на светооптическом уровне (рис.
73, а). Это и послужило основанием для названия поперечно-
полосатых мышечных волокон. При сильном сокращении мыш-
цы светлые диски почти исчезают, и поперечная исчерченность
волокон становится менее выраженной. Конкретное функцио-
нальное значение всех структур миофибриллы стало ясным пос-
ле детальных ультраструктурных, биохимических и цитохими-
ческих исследований последних десятилетий. Оказалось, что
основной функциональной единицей миофибриллы является
саркомер — участок между двумя Z-дисками. Саркомер вклю-
чает в себя, следовательно, темный диск и ограничивающие
его с двух сторон половины светлых дисков (рис. 75, б). Каж-
дый светлый полудиск состоит из тонких нитей (5 нм), идущих
параллельно длинной оси миофибриллы. Темный диск образо-
ван толстыми нитями (10 нм). В нем выделяется центральный
более светлый участок (Н-зона), где располагаются только
толстые нити, и два краевых более темных участка, где име-
ются и толстые, и тонкие нити. В этой области наблюдаются
так называемые «поперечные мостики», свидетельствующие
о структурном взаимодействии между тонкими и толстыми
нитями. В области Z-дисков тонкие нити одного саркомера свя-
заны с тонкими нитями соседних саркомеров с помощью белка
а-актинина. M-диск, будучи системой поперечных и продоль-
ных фибрилл, обеспечивает связь толстых нитей одного сарко-
мера в целостную систему. На поперечных срезах саркомера
в области перекрытия тонких и толстых нитей видно, что их
взаимное расположение строго закономерно; одну толстую нить
окружают шесть тонких, а каждая тонкая находится в окру-
жении трех толстых. Таким образом, соотношение 'тонких
и толстых нитей в саркомерах мышечных волокон позвоночных
2:1. При сокращении мышц увеличивается область перекрыва-
ния толстых и тонких нитей, что может привести к полному
исчезновению и светлых полудисков, и зоны Н в центре тем-
ного диска. При этом, естественно, происходит уменьшение
длины саркомера. Очевидно, что все эти изменения связаны
с перемещением тонких нитей двух светлых полудисков к цент-,
ру саркомера. Функциональное значение этих изменений сар-
комера при сокращении стало понятным после выяснения ло-
кализации основных и\вспомогательных белков в его структу-
рах.
300
Основу тонких нитей составляет относительно низкомолеку-
лярный (42000) белок актин. Он имеется во всех клетках, со-
ставляя даже в немышечных клетках до 12% всех их белков.
Актин существует либо в форме мономеров (глобулярный или
G-актин), либо полимеризуется в филаменты — «двойные спи-
рали» толщиной около 4—6 нм (F-актин).
Актин кроме мышечного сокращения участвует в целом ряде
важных клеточных процессов, что определяет его значительную
эволюционную консервативность. Сравнительные исследования
показали исключительное сходство свойств и стабильность ами-
нокислотной последовательности актинов из разных источни-
ков. Замены аминокислот возможны лишь в нескольких строго
ограниченных участках молекулы; с такими заменами, в част-
ности, связаны три основных варианта концевых участков
молекулы, определяющих характер полимеризации. Они соот-
ветствуют а-, |3-и у-изоэлектрическим формам актина. В немы-
шечных сократимых аппаратах и в гладких мышцах позвоно-
чных используются менее стабильные в полимеризованном со-
стоянии р- и у-формы. В поперечнополосатых мышцах они за-
меняются значительно более стойкой в полимере a-формой, что
коррелирует со строгой организацией сократимого аппарата.
Очень важным для понимания работы механохимической
системы свойством актина является полярность его отдельных
молекул и полимеров. Так, рост актиновых фибрилл, т. е. до-
бавление к полимеру новых мономеров, происходит преимуще-
ственно с одного конца. Полярность обнаруживается и во вза-
имодействии с актиновой нитью молекул миозина. Если- обра-
ботать актиновую нить фракцией миозиновых головок, образу-
ются так называемые «оперенные стрелы», демонстрирующие
пространственную детерминацию этого взаимодействия. «На-
конечники стрел» имеют одну и ту же направленность по всей
длине отдельной актиновой нити.
В Z-дисках поперечнополосатых мышц сшиваются полимеры
с противоположной полярностью. В пределах саркомера, та-
ким образом, все тонкие нити, связанные с одним Z-диском,
имеют одну полярность, а связанные с другим Z-диском — про-
тивоположную. Полярность актиновых нитей, наряду с поляр-
ностью миозиновых агрегатов, является структурной основой
генерации силы мышечного сокращения.
В желобках двунитчатой актиновой спирали располагаются
молекулы белка тропомиозина, составляющие единую нить
(рис. 74 а). Каждая молекула тропомиозина в этой нити име-
ет протяженность, равную 7—8 глобулам актиновой спирали.
Тропомиозин частично участвует в стабилизации структуры
актиновой протофибриллы. Основную же его роль связывают
с регуляцией взаимодействия молекул актина и миозина. Со-
гласно распространенной гипотезе, в покоящейся мышце тро-
помиозин закрывает активные центры в молекулах актина,
301
с которыми могут взаимодействовать головки миозиновых мо-
лекул (рис. 74, г). Смещение молекул тропомиозина с этих
центров происходит в результате конформационных изменений
в молекулах особого регуляторного белка — тропонина. Каждая
молекула тропонина состоит из 3 субъединиц. Одна из них
связана с актином, другая — с тропомиозином, и, наконец,
третья обладает способностью связываться с ионами кальция.
Рис. 74. Структура и схема взаимодействия сократительных белков сарко-
мера.
а — модель тонкой актиновой нити, б — строение молекулы миозина, в — модель тол-
стой миозиновой нити, г, д — схемы регуляции взаимодействия головок миозиновых
молекул и активных центров глобул актина (г— состояние системы без ионов Са2+
в среде, <5 —в присутствии ионов СаЧ-); / — мономер актина, 2 — тропомиозин, 3 —
комплекс тропонина, 4 — головка, 5 — шейка, 6 — хвост молекулы миозина, / — актив-
ный центр молекулы актина.
Присоединение последних вызывает конформационные измене-
ния кальций-связывающей субъединицы тропонина и всего
тропонин-тропомиозинового комплекса. В результате этих
изменений субъединицы тропонина, связанные с актином и тро-
помиозином, смещаются, благодаря чему смещаются и молеку-
лы тропомиозина, освобождая активные центры в молекулах
актина (рис. 74, д).* *
" i
* Как показывают последние исследования, конкретные молекулярные
механизмы работы регуляторной тропонин-тропомиозиновой системы акти-
новых протофибрилл на самом деле значительно сложнее. Однако более
глубокое освещение вопроса выходит за рамки задач настоящего учебного
пособия.
302
Толстые нити образованы белком миозином и вспомогатель-
ными структурными белками. Миозин — сложный высокомоле-
кулярный (500000) белок. В состав каждой молекулы мышеч-
ного миозина входят две тяжелые и 2 пары легких цепей.
Тяжелые цепи образуют ее «шейку» и «хвостовой отдел»
и вместе с легкими — две «головки» молекулы (рис. 74, б). Как
видно на рисунке, в молекуле миозина имеются два шарнирных
участка. Один из них расположен в шейке молекулы и обес-
печивает возможность изменения положения в пространстве
головок миозиновых молекул в относительно небольших пре-
делах. Второй шарнирный участок расположен на границе
двух основных частей молекулы — тяжелого и легкого
меромиозинов — в проксимальной части хвостового ее от-
дела. Этот участок обеспечивает более значительное смещение
проксимального участка молекулы. В каждой головке располо-
жены АТФазный центр и центр взаимодействия с актином.
Известно несколько вариантов миозина, отличающихся по ак-
тивности АТФазного центра. Более активные АТФазы входят
в состав головок молекул так называемого «быстрого» миози-
на, характерного для тетанических (быстрых) мышечных во-
локон, и менее активные АТФазы свойственны головкам мио-
зина тонических (медленных) мышечных волокон. АТФазная
активность, по-видимому, связана с одной парой легких цепей,
которые получили название рабочих.'* Возможность взаимодей-
ствия активных центров рабочих легких цепей с актином конт-
ролируется регуляторными легкими цепями, также входящими
в состав каждой головки.
Конформационные изменения, приводящие к активации
центров взаимодействия с актином, происходят при фосфори-
лировании регуляторных цепей специальными протеинкиназа-
ми. В их состав входит кальций-связывающий белок кальмоду-
лин. Активация протеинкиназ происходит при увеличении кон-
центрации ионов Са2+, взамодействующих с кальмодулином.
Несмотря на возможную функциональную и химическую диф-
ференцировку легких цепей миозиновых молекул, их функцио-
нирование возможно лишь при наличии всех компонентов головок
(концы тяжелых цепей и обе легкие), т. е. при кооперативном
взаимодействии всех цепей молекулы. Сборка молекул
миозина в целостную надмолекулярную структуру — толстую
нить или протофибриллу, — происходит при помощи особых
структурных белков. Здесь, в частности, имеется белок, распо-
ложенный вдоль толстой протофибриллы.
В состав миозиновых протофибрилл входит около трехсот
молекул миозина. Половина их направлена своими головками
* Распространено также мнение, что АТФазный центр находится в тя-
желой цепи молекулы миозина, а рабочие легкие цепи имеют лишь вспомо-
гательное значение.
303
в одну сторону £аркомера, а половина — в противоположную
(рис. 74, в). В цёнтре толстой протофибриллы имеется участок,
не содержащий головок молекул миозина. Таким образом, го-
ловки миозина одной половины толстой нити контактируют
с актиновыми протофибриллами одной полярности, а головки
другой половины молекул взаимодействуют с тонкими прото-
фибриллами другой. Головки миозиновых молекул располага-
ются на противоположных половинах миозиновой протофиб-
риллы шестью продольными рядами (рис. 74, в). Следователь-
но, каждый ряд головок лежит точно против одной из шести
тонких актиновых протофибрилл. Миозиновые, протофибриллы
в саркомере жестко связаны в единую систему при помощи
особого вспомогательного структурного белка (М-белок). Этот
белок образует пересекающуюся трехмерную сеть фибрилл
в центре саркомера. В промежутки этой сети могут заходить
концы тонких нитей при максимальном его сокращении.
В сложных молекулах миозина органически сочетаются ста-
бильность и пластичность. Форма, размеры молекулы и ее ос-
_ новные свойства относительно постоянны, несмотря на большое
количество разновидностей миозиновых молекул, отличающих-
ся аминокислотной последовательностью в отдельных цепях
молекулы и активностью их функциональных центров. Тонкие
механизмы взаимодействия актина и миозиновых головок при
сокращении и расслаблении мышц выяснены еще недостаточ-
но полно. Внешним проявлением этого взаимодействия, как
уже отмечалось, является смещение тонких нитей в промежут-
ках между толстыми к центру саркомера. Такое перемещение
начинается после поступления нервного импульса и распрост-
ранения его по мембранам Т-каналов в область мембран цис-
терн L-каналов. В них происходит изменение проницаемости
для ионов кальция, благодаря чему концентрация последних
в области перекрытия актиновых и миозиновых протофибрилл
резко возрастает. Ионы кальция, связываясь с тропонином
и кальмодулином, запускают механизмы взаимодействия акти-
на и миозина. Суть этого взаимодействия заключается, по-ви-
димому, в том, что связывание молекулы АТФ с головкой мио-
зиновой молекулы инициирует рабочий цикл актин-мио-
зиновой системы. Этот цикл состоит: а) из отделения головки
от молекулы актина, б) перехода головки в другое крайнее
положение, допускаемое шарнирными участками молекулы,
в) присоединения головки к другой молекуле актина, распо-
ложенной дистальнее (по отношению к центру миозиновой
протофибриллы) в соседней тонкой протофибрилле, г) возвра-
щения головки в исходное положение с одновременным рас-
щеплением АТФ и использованием энергии на перемещение
тонкой протофибриллы. Прекращение работы и расслабление
мышцы происходит при удалении ионов кальция из области
миофибрилл в полость канальцев саркоплазматической сети.
304
Такая перекачка ионов осуществляется Mg-зависимой
азой — специальными насосами, которые активизируются”фр,,
прекращении нервных импульсов. При обычных сокращениях
саркомер укорачивается на 20%.
Из взаимного скольжения актиновых и миозиновых прото-
фибрилл и возникающего напряжения при гидролизе АТФ
и состоит работа актин-миозиновой системы в саркомерах по-
перечнополосатых мышц. При этом тропонин-тропомиозиновая
регуляторная система обеспечивает в основном внутреннюю ре-
гуляцию работы в режиме сокращение—расслабление.
Что касается миозиновой регуляторной системы, то она,
возможно, обеспечивает степенр сокращения, хотя ее конкрет-
ное назначение в поперечнополосатых мышцах позвоночных
еще недостаточно ясно. Таким образом, внутренние регулятор-
ные системы в саркомерах поперечнополосатых мышц в сово-
купности делают возможной весьма совершенную и пластич-
ную регуляцию процессов сокращения.
Частота, степень и сила сокращений могут определяться
и многими другими факторами. Существенную роль играет
у позвоночных активность мышечных АТФаз, обусловленная,
вероятно, свойствами рабочих легких цепей молекул миозина.
В разных мышцах эта активность может варьировать в широ-
ких пределах за счет комбинации легких цепей с разными свой-
ствами. Частота и сила сокращений зависит также и от раз-
меров саркомера: в коротких саркомерах скорость сокраще-
ний больше, а развиваемое напряжение меньше, чем в мышцах
с длинными саркомерами. Однако у позвоночных последний
механизм регуляции используется слабо. Длина саркомера
варьирует у них незначительно (от 1,8 до 2,8 мкм). Весьма ста-
бильно в поперечнополосатых мышечных тканях позвоночных
также соотношение и взаимное расположение в саркомерах
тонких и толстых нитей; оно минимально и равно 2:1. Более ши-
рокое применение находят у позвоночных внешние для актин-
миозиновой системы регуляторные механизмы, в частности ско-
рость поступления и исчезновения ионов Са2+ в областях актин-
миозиновых взаимодействий, а также скорость генерации и рас-
пространения нервных импульсов. Эти процессы определяются
особенностями организации нервно-мышечных синапсов, сте-
пенью развития Т- и L-систем, активностью кальциевых насо-
сов и свойствами ионных каналов, в мембранах мышечных во-
локон. Внешние для системы саркомеров регуляторные меха-
низмы могут варьировать в широких пределах и в разных мыш-
цах у одного животного и у разных представителей позвоночных,
обеспечивая необходимое функциональное разнообразие рабо-
ты скелетных мышц. Особенно же большое значение для обеспе-
чения функционального разнообразия, в частности, в силе со-
кращения, имеет у позвоночных объединение в мышце большего
305
о
306
7
Рис.- 75. Поперечнополосатая соматическая мышечная ткань членистоногих.
а — мышечные волокна личинки жука носорога, б — г— объемные схемы организации
саркомеров в асинхронной летательной мышце насекомых (б, в) и участки мышечного
волокна ракообразных (г); 1 — актиновые и 2 — миозиновые нити, 3 — Z-диск, 4 —
L-каналы, 5 —Т-каналы, 6 — фибриллы неизвестной химической природы, 7 — сарко-
лемма, 8 — митохондрия.
и меньшего количества волокон, а также волокон с разными
свойствами. Эти различия отдельных волокон могут опреде-
ляться помимо перечисленных выше факторов еще и количе-
ством миоглобина, разными системами генерации молекул
АТФ и другими факторами.
Как уже отмечалось, соматические поперечно-полосатые
мышечные ткани изменялись в процессе эволюции высших пер-
вичноротых— членистоногих — независимо от соматических мы-
шечных тканей позвоночных. Тем не менее в организации со-
матической мышечной ткани членистоногих много общего с по-
307
перечнополосатыми мышцами позвоночных. Так, основной еди-
ницей этой ткани у членистоногих является высокоорганизован-
ный симпласт — мышечное волокно (рис. 75, а). Последнее
возникает в результате слияния клеток при становлении этой
ткани в онтогенезе. У ряда представителей членистоногих
в мышечных волокнах обнаружены клетки-сателлиты, тоже
имеющие значение своеобразных камбиальных элементов. Ес-
тественно, что в связи с меньшими размерами тела и величина
мышечных волокон в целом меньше, чем у позвоночных. Одна-
ко эта особенность не носит принципиального характера, по-
скольку у членистоногих, например у крабов и у некоторых
раков, обнаружены мышечные волокна длиною до 6 см и диа-
метром около 3 мм. Более того, у насекомых-с полным пре-
вращением, например у тутового шелкопряда, в провизорных
личиночных мышечных волокнах помимо клеток-сателлитов об-
наружено несколько категорий ядер, отличающихся по уровню
плоидности. Здесь, следовательно, мы имеем дело с надклеточ-
ной системой еще более сложного строения. В ходе дифферен-
цировки таких волокон часть ядер переходит на эндомитоти-
ческий цикл репродукции.
В обычных соматических мышечных волокнах членистоно-
гих и сам сократимый аппарат — миофибриллы, и вспомога-
тельные мембранные структуры устроены и функционируют
в принципе сходно с разобранными выше аналогичными струк-
турами в соматических мышечных волокнах позвоночных жи-
вотных (рис. 75, г). В основе сократимого аппарата лежат
тонкие и толстые нити, организованные по длине миофибрил-
лы в саркомеры. Основу толстых нитей составляют молекулы
миозина. Однако в отличие от позвоночных у членистоногих
в миозиновых протофибриллах имеется особый вспомогатель-
ный структурный белок — парамиозин. Он широко распростра-
нен в мышечных тканях первичноротых животных. У членисто-
ногих количество его в толстых нитях саркомера невелико—•
около одного процента. Тонкие нити саркомеров членистоногих
состоят из фибриллярного двухцепочечного актина и вспомо-
гательных белков (а-актинин, тропонин, тропомиозин). У чле-
нистоногих значительно чаще, чем у позвоночных, разнообра-
зие функциональных свойств мышц достигается за счет варьиро-
вания организации их миофибрилл на саркомерном уровне.
Так, длина саркомера даже у одного животного в различных
мышцах может составлять от 0,5 до 15 мкм. В широких пре-
делах изменяется соотношение и взаимное расположение тон-
ких и толстых протофибрилл. Близкое к позвоночным соотно-
шение тонких и толстых нитей наблюдается в наиболее быст-
рых мышцах членистоногих (3:1). Однако оно может быть
и 5:1 и даже 6:1, когда каждая миозиновая протофибрилла
оказывается окруженной 10—12 актиновыми протофибрилла-
ми. В таких мышцах обычно нарушается правильное распо-
308
ложение тонких нитей вокруг толстых. Их может быть больше
или меньше 12 вокруг одной толстой нити.
В мышцах членистоногих большую вариабельность, чем
у позвоночных животных, обнаруживает и строение Z-дисков.
Они могут быть сходными с Z-дисками миофибрилл позвоноч-
ных или резко отличаться от них. Так, у личинок Copepoda
Z-диск практически отсутствует, несмотря на весьма правиль-
ную пространственную ориентацию тонких и толстых нитей.
В мышцах же голени саранчи Z-диски образованы толстой
пластинкой электронноплотного вещества, имеющего волокни-
стое строение, с расположением волокон перпендикулярно
к длинной оси миофибриллы. Сильно варьирует и структура
М-полоски в центре саркомера (аппарат поперечных связей
между миозиновыми протофибриллами).
Весьма своеобразным вариантом поперечнополосатых мы-
шечных тканей являются асинхронные летательные мышцы на-
секомых (рис. 75, б, в). С точки зрения интенсивности работы
(использование максимального количества молекул АТФ на
механическую работу в единицу времени) они представляют
собой наиболее совершенную механохимическую сократимую
систему. В ответ на один нервный импульс эти мышцы могут
давать до 300 сокращений в одну секунду. Летательные мыш-
цы насекомых характеризуются и другими функциональными
особенностями — максимальная сила их сокращений на поря-
док меньше максимальной силы сокращений в обычных мыш-
цах (соответственно 0,3 и 5,0 кг на см2). Длина саркомера
в этих мышцах при сокращении уменьшается лишь на 2%,
а не на 20%, как в обычных мышцах.
Этим особым функциональным свойствам соответствует
и ряд существенных особенностей структурно-биохимической
организации саркомеров. Соотношение актиновых и миозино-
вых протофибрилл 3:1, и расположены они иначе, чем в попе-
речнополосатых мышцах у позвоночных. Кроме того, длина
миозиновых протофибрилл и зоны их контакта с актиновыми
протофибриллами значительно больше, чем в саркомерах обыч-
ных мышц, а размеры изотропных дисков намного меньше
обычных. Концы миозиновых протофибрилл связаны с Z-дис-
ками при помощи тонких волокон, химическая природа кото-
рых пока неизвестна (рис. 75, б, в). Для летательных асинхрон-
ных мышц характерен и необычный способ обеспечения повтор-
ных сокращений после поступления одиночного нервного
импульса. Эти сокращения происходят уже с использованием не
обычного кальциевого механизма, а за счет сложных механи-
ческих взаимодействий между мышечными волокнами при их
асинхронной работе. Большому количеству молекул АТФ, ис-
пользуемых при сокращении летательных мышц, соответствует
наличие многочисленных гигантских митохондрий. Они запол-
няют все прослойки саркоплазмы между миофибриллами и име-
309-
ют много сложных крист, свидетельствующих о гипертрофии
внутренней мембраны митохондрий. Относительно слабо раз-
виты в мышечных волокнах асинхронных мышц системы Т-
и L-каналов.
Интересно, что сходные функциональные свойства могут дос-
тигаться и при другой структурно-биохимической организации
мышечных волокон — в так называемых быстрых синхронных
мышцах насекомых и ракообразных. В их мышечных волок-
нах с немногочисленными, периферически расположенными
миофибриллами обычного строения резко гипертрофирована
гладкая эндоплазматическая сеть. Ее цистерны и каналы за-
полняют основную массу цитоплазмы. Такая организация мы-,
шечных волокон обеспечивает их сокращения с частотой около
200 сокращений в секунду, т. е. примерно того же порядка,
что и в асинхронных летательных мышцах насекомых. В отли-
чие от асинхронных в быстрых синхронных мышцах такие
частые сокращения возникают в ответ на нервные импульсы
такой же частоты и обеспечиваются обычным 'регуляторным
кальциевым механизмом.
Весьма своеобразную структурную модификацию поперечно-
полосатой мышечной ткани членистоногих представляют собой
мышцы мечехвоста. Длина саркомеров в миофибриллах дости-
гает здесь 13 мкм. Отсутствует М-система жесткой структурной
взаимосвязи толстых протофибрилл. Z-диски на границе
саркомеров имеют отверстия, в которые при сильном сокра-
щений могут проходить концы толстых протофибрилл. Благо-
даря этому саркомер при сокращениях может укорачиваться
на 70%.
Несмотря на отмеченное выше разнообразие в организации
поперечнополосатой соматической мышечной ткани членисто-
ногих, в их строении и функциональных свойствах удается
выявить и большое количество глубоких аналогий с соматиче-
скими поперечнополосатыми мышцами позвоночных. Одним из
таких примеров могут служить мышцы-разгибатели голени
у прыгающих насекомых. В этих мышцах имеются тонические
волокна, работающие при ходьбе животных и осуществляющие
медленные ритмические сокращения. Здесь же имеются и быст-
рые фазные волокна. По своей ультраструктурной организации
фазные и тонические мышцы существенно отличаются у одно-
го и того же животного как у насекомых, так и у позвоночных,
но оказываются сходными у насекомых и позвоночных жи-
вотных.
В поперечнополосатых мышечных волокнах членистоногих
широко используется весьма характерное для позвоночных
варьирование функциональных свойств мышц за счет изменения
АТФазной активности головок миозиновых молекул. Напри-
мер, у одного из крабов описаны три резко отличные в функ-
циональном отношении мышцы. Тем не менее существенных
310
особенностей в структуре саркомеров этих мышц обнаружить
не удалось.
Увеличение функционального разнообразия соматических
мышечных тканей достигается у насекомых их полинейронной
иннервацией, не характерной для мышечных волокон позвоноч-
ных. Волокна насекомых имеют обычно терминальные окончания
нескольких моторных нейронов с разными свойствами (тониче-
ских, промежуточных и фазных нейронов). Такая полинейрон-
ная иннервация комбинируется еще и с возможностью диффе-
ренцированного распространения импульса лишь по ограничен-
ным участкам Т-системы и частичным включением актин-миози-
новой системы отдельных саркомеров. Все эти особенности
обусловливают возможность значительно более разнооб-
разной регуляции работы мышечного аппарата даже на уровне
отдельных мышечных волокон. В регуляции работы мышц
у членистоногих принимают участие нейросекреторные клетки,
тормозные нейроны, а также особые октопаминэргические ней-
роны.
Поперечнополосатые мышечные ткани, представленные сис-
темой мышечных клеток. Как отмечалось выше, соматические
поперечнополосатые мышцы с правильным саркомерным строе-
нием миофибрилл распространены и у многих беспозвоночных
животных среднего и даже низшего уровней организации. Здесь
они представлены обычно мышечными клетками, объединенны-
ми между собой межклеточными структурами в пучки или пла-
сты. Таким образом, на тканевом и органном уровнях органи-
зации такие мышцы устроены аналогично гладким. Более под-
робную характеристику этого тканевого уровня мы дадим в
разделе, посвященном гладким мышцам беспозвоночных жи-
вотных (см. стр. 323).
Поперечнополосатые мышечные ткани на основе мышечных
клеток образуют лишь единичные мышцы в органах, где нуж-
ны быстрые и правильно организованные сокращения. Они изу-
чены сейчас менее подробно, чем мышцы высших первично-
ротых и вторичноротых животных, особенно в биохимическом
отношении. Тем не менее сам факт широкого распространения
саркомерной организации миофибрилл свидетельствует о мно-
гократном и независимом происхождении в эволюции разных
групп животных такого варианта сократимого аппарата. Бо-
лее того, даже у некоторых кишечнополостных (медузы) в мы-
шечных отростках эпителиально-мышечных клеток обнаружены
миофибриллы типичного саркомерного строения с хорошо вы-
раженными Z-дисками и правильным расположением миозино-
вых и актиновых протофибрилл (рис. 76). В организации их
саркомеров наблюдаются признаки, свойственные поперечно-
полосатым мышцам и позвоночных, и членистоногих. Своеоб-
разие мышечных пластов у медуз заключается в наличии дес-
мосом на боковых поверхностях мышечных отростков и меж-
311
клеточных контактов на их концах, сходных со специфическими
контактами сердечной мышечной ткани (см. следующий раз-
дел). Среди поперечнополосатой мышечной ткани беспозвоноч-
ных животных среднего уровня организации обнаружены мыш-
цы, сходные по строению саркомеров с быстрыми синхронными
мышцами насекомых. Так, у пелагических животных Sagitta
elegans (щетинкочелюстные) относительная длина миозиновых
протофибрилл и размеры анизотропного диска значительно
больше, чем в миофибриллах обычных поперечнополосатых
мышц.
Рис. 76. Объемная схема ультраструктурной организации эпителиально-мы-
шечных клеток медузы (вид сверху).
/ — ядросодержащая и 2 — сократительная части клеток, 3 — миофибриллы е типич-
ной саркомерной организацией, 4— саркомер, 5 — цитоплазма, 6 — место контактов
концов клеток, 7 — десмосомы, 8 —• толстая миозиновая и 9 — тонкая актиновая про-
тофибриллы, 10— Z- и 11— М-диски.
Мышечные ткани, состоящие из поперечнополосатых клеточ-
ных волокон. Эта разновидность мышечных тканей представле-
на у многоклеточных целомическими мышцами, возникшими
из целомического эпителия независимо у первично- и вторич-
норотых животных. У хордовых и головоногих моллюсков та-
кие мышцы формируют сократимый аппарат стенки сердца —
центрального органа распределительной сосудистой системы.
У членистоногих помимо стенки их трубчатых сердец целоми-
ческая мышечная ткань образует еще и висцеральную муску*
латуру средней кишки. Несмотря на независимое происхожде-
ние целомической поперечнополосатой мышечной ткани у хор-
довых, головоногих моллюсков и членистоногих, она везде
имеет принципиально сходное строение на тканевом уровне
312
Рис. 77. Сердечная мышечная ткань млекопитающих.
а, б — миокард барана с обычными клеточными волокнами (а) и с миоцитами про-
водящей системы сердца (волокнами Пуркинье) (б), в — схема ультраструктурной
организации области контакта двух миоцитов (В. Г. Елисеев и др., 1972); / — сарко-
лемма, 2— плазмолемма, 3 — митохондрия, 4— миофнбрилла, 5 — саркоплазма, 6 —
L-каналы, 7 — тонкая актиновая нить, 3 — М-полоски, 9 — граница между мноцнтами
(вставочная пластинка), 10 — анизотропный и 11— изотропный диски, 12 — Z-диск, 13 —
толстая (миозиновая) нить, 14— десмосома, 15 — нексус, 16 — уплотненные участки
краевых саркомеров в области контакта миофибрилл соседних клеток (интеркалярные
диски), 17 — Т-каналы.
3ia
организации. Эта ткань сформирована анастомозирующим^!
клеточными волокнами, создающими целостную в функцио-
нальном и структурном отношениях сократимую систему. Обра-
зуются такие волокна не слиянием клеток, как скелетные сим-
пластические мышечные волокна, а клетками-миоцитами. Созда-
ние волокна сердечной мышцы происходит объединением кле-
ток специализированными межклеточными контактами. На
границе прилегающих друг к другу миоцитов имеются так на-
зываемые вставочные, или, по старой более точной термино-
логии, спаивающие пластинки (рис. 77). Они состоят из поверх-
ностных аппаратов двух контактирующих между собой клеток.
Наиболее специфическими-структурами вставочных пластинок
являются fascia adherens — участки контактирующих клеток
в области расположения миофибрилл. Основной функциональ-
ный смысл этих образований заключается в структурном объ-
единении. миофибрилл контактирующих миоцитов. Благодаря
этим структурам концы миофибрилл, точнее их концевые сар-
комеры, в контактирующих клетках связываются между собой.
В участках таких контактов надмембранные комплексы харак-
теризуются тонкофибриллярной структурой, по-видимому, бел-
ковой природы. Важную роль в соединении мембран соседних
клеток играют ионы Са2+, находящиеся в тонкофибриллярном
матриксе. Последний, однако, проницаем для мелких частиц,
т. е. не представляет собой сплошной п-ластинки. Мембраны
контактирующих миоцитов млекопитающих и членистоногих
в области fascia adherens имеют извилистый характер, что
увеличивает площадь соприкосновения краевых саркомеров.
Участки тонких протофибрилл в области мембраны характе-
ризуются резко повышенной электронной плотностью. Здесь
в больших количествах, чем обычно, обнаруживается вспомо-
гательный структурный белок Z-дисков а-актинин, а также
фибриллярный скелетный белок десмин. Выявлен и ряд других
специфических белков, в частности белок, обеспечивающий
связь актиновых протофибрилл с мембраной. Сложные по
структурно-химической организации поверхностного аппарата
fascia adherens характерны, по-видимому, не только для мио-
цитов целомической мышечной ткани. Сходная химическая
и структурная организация наблюдается в краевых саркоме-
рах соматической мышечной ткани в области контакта мышеч-
ных волокон с сухожилием (позвоночные) или кутикулярным
эпителием (членистоногие). Аналогичные структуры обнаруже-
ны недавно и в области плотных тел, закрепляющих краевые
актиновые протофибриллы в сократимых единицах (см. ниже
стр. 328) гладких мышечных клеток. Помимо fascia adherens
в спаивающих пластинках, в участках, не занятых миофибрил-
лами, имеются еще и специальные механические контакты —
десмосомы, сходные по структуре с десмосомами в других тка-
нях.
314
С функциональной точки зрения весьма важное значение
у млекопитающих и некоторых членистоногих имеют и так на-
зываемые щелевые контакты, или нексусы. В области таких
контактов мембраны соседних миоцитов разделены щелью ши-
риной 2 нм. В них обнаружены правильно расположенные бел-
ковые комплексы. Доказано участие нексусов в распростране-
нии возбуждения от клетки к клетке по миокарду. Предпола-
гаютг что они служат для межклеточного обмена низкомоле-
кулярными соединениями и для укрепления механической свя-
зи между клетками. У низших позвоночных животных вместо
типичных нексусов во вставочных пластинках обнаружены уча-
стки с более тесным расположением мембран. Их считают
функциональными аналогами нексусов кардиомиоцитов млеко-
питающих. Таким образом, с помощью вставочных пластинок
в целомической мышечной ткани обеспечивается структурное
и функциональное объединение миоцитов. Решение этой задачи
происходит без нарушения клеточного принципа организации.
При этом создаются единые длинные сократимые структу-
ры, как и в симпластических волокнах соматической поперечно-
полосатой мышечной ткани. Что касается оганоидного и мо-
лекулярного уровней организации миоцитов, то они весьма
сходны с соответствующими уровнями организации поперечно-
полосатой мышечной ткани и у позвоночных, и у высших пер-
вичноротых животных. Так, например, у млекопитающих уль-
траструктура миофибрилл кардиомиоцита и поперечнополоса-
того симпластического мышечного волокна в принципе весьма
сходна у одного и того же животного. Аналогичная ситуация
наблюдается у членистоногих. Некоторые особенности органи-
зации миозиновых молекул (особые тяжелые, специфический
набор легких цепей и т. п.) или свойств молекул тропонина
в тонкой протофибрилле, характерные для кардирмиоцитов
позвоночных и членистоногих, не выходят за рамки молекуляр-
ной организации этих структур в различных скелетных попе-
речнополосатых мышечных волокнах. Существенной особенно-
стью кардиомиоцитов позвоночных является необходимость для
работы их сократимой системы не только внутриклеточных за-
пасов ионов Са, как в скелетных мышцах, но и внеклеточного
фонда этих ионов. В цитоплазму кардиомиоцитов они посту-
пают по кальциевым каналам, вмонтированным в плазматиче-
скую мембрану и мембраны Т-каналов.
Большое сходство в организации сократимого аппарата кар-
диомиоцитов и скелетных мышц как у первичноротых, так и у
вторичноротых животных лишний раз и весьма наглядно иллю-
стрирует закономерный характер изменения этих структур
в эволюции многоклеточных. И у членистоногих, и у позвоноч-
ных сократимые структуры миоцитов изменяются сходно с ана-
логичными структурами в древних первичных скелетных мыш-
цах.
315
Рис. 78. Клетки мышечной ткани сердца асцидии (а) и ракообразных (б, в).
схемы ультраструктурной организации, в — участок ткани; 1—ядро, 2—3 миофибриллы, 4 — место контакта двух клеток (вставоч-
ная пластинка), 5 — гладкая ЭПС (аналоги L-каналов), 6 — Z-диски, 7 — митохондрия.
316
Как и в скелетных мышцах, строение мышечной ткани, об-
разованной клеточными волокнами, варьирует у разных пред-
ставителей хордовых и первичноротых животных. Так, у асци-
дий она представлена одним слоем своеобразных эпители-
ально-мышечных клеток, образующих целостный однослойный
пласт (рис. 78, а). Они развиваются на основе эпителиальной
выстилки целома, и апикальные поверхности этих клеток обра-
щены непосредственно в полость тела. В базальной части кле-
ток расположены миофибриллы, имеющие типичное саркомер-
ное строение с хорошо выраженными Z-дисками.
У позвоночных — от низших к высшим животным — наблю-
дается прогрессирующее усложнение строения сократимой час-
ти стенки сердца миокарда. У млекопитающих это уже мощ-
ная мышечная система — миокард. Сложность ее организации
подчеркивается еще и наличием особой системы проводящих
волокон. Она представлена пучками видоизменных кардио-
миоцитов, пронизывающих всю толщу миокарда. Эти кардио-
миоциты специализированы на генерацию и распространение
возбуждения и обеспечивают миогенный автоматизм сердечной
мышцы. Для них характерна частичная редукция сократимого
аппарата, однако строение их сильно варьирует и в разных
отделах сердца, и у разных видов в пределах одного класса.
Наиболее резкие отличия от обычных кардиомиоцитов имеют
клетки конечных отделов проводящей системы в Желудочках
копытных млекопитающих (рис. 77, б). Здесь они в несколько
раз больше по размерам обычных миоцитов, часто двуядерны
и содержат спирально закрученные миофибриллы лишь на
самой периферии клеток. Вся гиалоплазма в центре клетки
обычно свободна от органоидов и включений. Клетки наряду
с обычными мышечными митохондриями содержат и митохонд-
рии «нервного» типа — с небольшим количеством крист и хоро-
шо выраженным матриксом. Интересно, что своеобразные так
называемые «нейроидные» свойства клеток проводящей системы
очень рано детерминируются в гистогенезе сердечной мышцы.
Уже на ранних стадиях онтогенеза часть клеток миокарда при-
обретает способность генерировать и распространять возбуж-
дение. Аналог или гомолог проводящей системы имеется, по-ви-
димому, уже в сердце асцидий. Здесь показан миогенный авто-
матизм и обнаружена в составе эпителиального пласта система
клеток, не имеющих развитых миофибрилл в базальной
части.
Аналогичный хордовым ряд усложнений в эволюции цело-
мической мышечной ткани наблюдается и у первичноротых \
животных. Так, j низших раков стенка сердца, как и у асци-
дий, представлена одним слоем эпителиоподобных миоцитов.
У высших раков, крабов, паукообразных и мечехвостов — это
уже сложная система клеточных волокон, состоящих из мио-
цитов, объединенных в единое целое вставочными пластинками
317
Рис. 79. Схемы соматического (а) и сердечного (б) миогёнезов у млеко
с десмосомами, fascia adherens, а у некоторых животных и ще-
левыми соединениями (рис. 78, б, в).
Таким образом, глубокий параллелизм между целомиче-
скими мышечными тканями в ряду хордовых и в ряду высших
первичноротых проявляется не только в принципиальном сход-
318
Прекордиальная мезодерма
4
Миоциты стенки сердечной трубки I
Миоциты в позднем эмбриогенезе
Миоциты b постнатальном периоде
питающих (П. П, Румянцев и И. Л. Ерохина, 1981).
стве тканевого уровня их организации, но и в самом процессе
их преобразований в филогенезе. На это указывает сходный
характер организации целомических мышечных тканей и у низ-
ших представителей этих рядов (сердце асцидии и низших ра-
кообразных), и у животных, занимающих вершину эволюцион-
319
ного древа — у первичноротых (членистоногие, головоногие
моллюски) и у вторичноротых (млекопитающие) животных.
При сходстве строения миофибрилл в сердечной и сомати-
ческой мышечных тканях между ними имеются глубокие раз-
личия. Они проявляются не только в разных принципах орга-
низации мышечных волокон (на симпластической и клеточной
основах), но и в механизмах гистогенеза, регенерации и ги-
пертрофии. Скелетная соматическая мышечная ткань развива-
ется из миотома — центрального участка сомитов (рис. 79,- а).
В ходе ее развития наблюдается антагонизм между диффе-
ренцировкой и репродукцией клеток. Начало синтеза специфи-
ческих белков выключает репродукцию клеток. Прекратившие
размножение и вступившие на путь дифференцировки миобла-
сты сливаются друг с другом, образуя симпластические тяжи —
мышечные трубочки — зачатки будущих мышечных волокон.
Образование необходимого количества миобластов происходит
за счет размножения клеток в краевых дорсальных участках
миотомов. Часть малодифференцированных клеток мигрирует
в область формирования мышечных волокон и образует систе-
му клеток сателлитов. В случае повреждения мышечных во-
локон ядра и цитоплазма самого волокна подвергаются некро-
тическим изменениям и гибнут. Новые волокна формируются
при регенерации на месте разрушенных за счет размножения
клеток-сателлитов и слияния образующихся миобластов в но-
вые симпластические тяжи.
Сердечная мышечная ткань развивается в онтогенезе из
особых участков эпителия висцерального листка спланхнотома
(рис. 79, б). Дифференцировка и функционирование клеток,
формирующих систему примитивных клеточных волокон зачат-
ка миокарда, происходят уже на ранних этапах онтогенеза.
Начало синтеза специфических белков не выключает здесь
процессов репродукции, продолжающихся в течение всего эмб-
рионального периода. Повышение уровня дифференцировки
кардиомиоцитов и накопление в цитоплазме миофибрилл при-
водят лишь к увеличению длительности митотических циклов
пролиферирующих клеток. . В дефинитивном миокарде млеко-
питающих нет недифференцированных камбиальных клеток.
При повреждении миоциты миокарда, оказавшиеся в травми-
рованной области, гибнут. Репарация миокарда осуществля-
ется следующими механизмами: а) формированием на месте
повреждения плотной рубцовой соединительной ткани; б) ги-
пертрофией сохранившихся миоцитов, которая сопровождается
у некоторых млекопитающих их полиплоидизацией; в) частич-
ной дедифференцировкой специализированных миоцитов и их
однократным митотическим делением, и не только в области
травмы, но и в других участках сердечной, мышцы. При экспе-
риментальном инфаркте миокарда желудочков крысы наблю-
дается массовое вступление в митотический цикл миоцитов
320
предсердий, топографически не связанных с зоной поврежде-
ния.
Последний механизм более выражен в сердечной мышечной
ткани низших позвоночных животных. Приведенные факты по-
казывают, что сердечная мышечная ткань по соотношению
в ней процессов репродукции и дифференцировки клеток от-
носится к своеобразным растущим клеточным популяциям и рез-
ко отличается по этому фундаментальному признаку тканевой
организации от своеобразной камбиальной ткани — симпласти-
ческой соматической мышечной ткани. Причина этих различий
имеет глубокие исторические корни и, возможно, обусловлива-
ется иным источником и более поздним развитием сердечной
мышечной ткани позвоночных в филогенезе.
В этом плане большой интерес представляют обнаружен-
ные в сердечной мышечной ткани десятиногих раков клетки,
аналогичные по своей структуре и расположению сателлитам
симпластических соматических мышечных волокон. Если будет
экспериментально показано участие этих клеток в регенерации,
то мы будем иметь интересный пример комбинаторики камби-
ального принципа организации с клеточным механизмом фор-
мирования мышечных волокон, что не наблюдается у изучен-
ных представителей позвоночных животных. Такого рода ком-
бинации как исключения наблюдаются в эволюционной дина-
мике мышечных тканей. К ним относится клеточное строение
соматических мышечных волокон в хвосте личинок асцидий при
доминирующей у всех хордовых симпластической надклеточной
организации соматических поперечнополосатых мышечных во-
локон.
Косоисчерченные мышечные ткани. Особую группу среди
сократимых тканей с правильным пространственным располо-
жением актиновых и миозиновых протофибрилл представляют
косоисчерченные мышцы. Они составляют основную часть туло-
вищной мускулатуры у аннелид, приапулид, нематод. Единич-
ные косоисчерченные мышцы имеются у моллюсков, высших
турбеллярий и у ряда других групп первичноротых животных.
Такие мышцы образованы пучками косоисчерченных мышечных
клеток.
Актиновые и миозиновые протофибриллы образуют в цито-
плазме мышечной клетки своеобразные «косые» саркомеры
(рис. 80, б, в). Ограничивающе их Z-диски в клетке, находящей-
ся в расслабленном состоянии, расположены косо по отношению
к ее длинной оси. Они представляют собой не сплошные плас-
тинки, как в большинстве поперечнополосатых мышц, а систему
расположенных в ряд уплотненных фибриллярных участков,
разделенных свободными промежутками. В косоисчерченных
мышцах отсутствует и жесткая структурная связь толстых
миозиновых протофибрилл в центре саркомера. Таким обра-
зом, структурные взаимоотношения и системы актиновых про-
11 672
321
3
Рис. 80 Косонсчерчеиная мышечная ткань аскариды.
а — схема взаимоотношения мышечных клеток с нервной системой, б— участок мы-
шечного отростка, в, г — схемы сократимого аппарата в расслабленном (а) и сокра-
щенном (г) состояниях; 1 — ганглнй нервной ..системы, 2 — проводящий отросток,
3 — ядросодержащая часть клетки, 4—мышечный отросток, 5 — толстые миозиновые
и 6 — тонкие актиновые нити, 7— плотные тела (аналоги Z-дисков).
322
тофибрилл соседних саркомеров и толстых миозиновых прото-
фибрилл в центре саркомера более лабильны. При сокраще-
нии мышечной клетки происходит не только движение актино-
вых протофибрилл к центрам саркомеров, но и смещение мио-
зиновых протофибрилл относительно друг друга. Благодаря
этому изменяется и расположение Z-дисков — угол их наклона
изменяется, и они располагаются почти перпендикулярно
к длинной оси клетки, как и в саркомерах поперечнополосатой
мышечной ткани.
Благодаря этим особенностям организации саркомеров в ко-
соисчерченных мышечных клетках они способны генерировать
более мощное напряжение и осуществлять разнообразные по
направлению сокращения для обеспечения червеобразных дви-
жений тела животных. В основе механохимических процессов
в косоисчерченных мышцах лежит, как и в поперечнополоса-
тых мышцах, пространственно упорядоченное взаимодействие
белков тонких и толстых нитей саркомеров. Однако возникают
эти мышцы, по-видимому, независимо от поперечнополосатых,
как один из возможных вариантов упорядоченности располо-
жения протофибрилл. В некоторых косоисчерченных и даже
в поперечнополосатых мышцах встречаются необычные взаимо-
отношения мышечных клеток с нервной системой (рис. 80, а).
У нематод, иглокожих и ланцетника имеются мышечные клет-
ки, образующие более или менее длинные отростки. Они на-
правляются в центральную нервную систему, где и образуются
нервно-мышечные синапсы. Таким образом, здесь не нервы
подходят к мышцам, а, наоборот, сами мышечные клетки сво-
ими специализированными отростками обеспечивают связь
с ЦНС.
§ 3. Гладкие мышцы беспозвоночных животных
Гладкие мышцы широко распространены у беспозвоночных
животных средних и низших уровней организации. Они обра-
зуют туловищную и висцеральную мускулатуру. Это — преобла-
дающая разновидность мышечных тканей у кишечнополостных,
гребневиков, турбеллярий, большинства классов моллюсков;
п иглокожих. Вся висцеральная мускулатура аннелид, приапу-
лид, головоногих моллюсков и представителей многих других
классов и типов беспозвоночных образована гладкой мышеч-
ной тканью. По своему происхождению она относится, по-ви-
димому, к древним первичным мышечным тканям, развившим-
ся из эпителиально-мышечных клеток или оседлых клеточных
элементов первичных паренхим предков многоклеточных жи-
вотных.
По характеру стабилизации тонких актиновых протофиб-
рилл гладкие мышцы беспозвоночных животных, можно разде-
лить на две разновидности: а.) гладкие’мышцы с хорошо вы-
11* 323
раженнымив цитоплазме клеток плотными телами — аналогами
Z-дисков — структурами, в которых закреплены тонкие прото-
фибриллы; б) гладкие мышцы, в цитоплазме клеток которых
отсутствуют такие морфологически выраженные структуры,
а также еще не выяснены механизмы стабилизации и заяко-
ривания концов тонких протофибрилл. Первая разновидность
мышц наиболее распространена и особенно хорошо изучена
у моллюсков. Вторая разновидность характерна для низших
многоклеточных и изучена у немногих представителей, в част-
ности в своеобразных гладкомышечных волокнах гребневиков.
Первая разновидность гладкой мышечной ткани у моллюс-
ков состоит из клеток. Они имеют чаще всего веретеновидную
форму. На поверхности плазмолеммы выделяется особая ба-
зальная мембрана, с которой клетки связаны структурами типа
полудесмосом. Клетки объединяются в пучки или пласты про-
слойками межклеточного вещества, выделяемого самими клет-
ками или фибробластами соединительной ткани. В туловищ-
ных мышцах пучки гладких мышечных клеток могут быть свя-
заны со скелетными структурами при помощи эластических
и коллагеновых волокон, вплетающихся в прослойки межкле-
точного вещества. Местами между соседними мышечными
клетками образуются соединения типа щелевых или плотных
контактов за счет небольших отростков, отходящих от боковой
поверхности. Особенно многочисленны они в висцеральных
мышцах и служат, по-видимому, для функциональной связи
между клетками.
На боковых поверхностях клеток имеются трубкообразные
впячивания, возможные функциональные аналоги Т-каналов.
Наблюдаются иногда и контакты их с цистернами и каналь-
цами эндоплазматической сети, играющими роль резервуаров
ионов кальция. В примембранном слое гиалоплазмы и в непо-
средственной связи с мембраной часто наблюдаются пиноци-
тозные пузырьки. Ядро с несколькими ядрышками расположе-
но обычно в центре клетки. Здесь же имеются слабо развитые
элементы аппарата Гольджи и другие общие органоиды,- Ми-
тохондрии рассредоточены по всей клетке. Основная же масса
цитоплазмы занята сократимыми элементами, представленными
тонкими актиновыми и толстыми миозиновыми протофибрилла-
ми. В состав толстой протофибриллы в значительных количе-
ствах входит белок парамиозин, и мышцы этого типа называют
парамиозиновыми. Своеобразными структурами в цитоплазме
являются плотные тела. Они содержат а-актинин и либо свя-
заны с внутренней поверхностью плазматической мембраны,
либо свободно лежат в гиалоплазме клеток. Основной особен-
ностью организации сократимого аппарата гладких мышечных
клеток у моллюсков является отсутствие правильного взаим-
ного расположения актиновых и миозиновых протофибрилл
(рис. 81, а). Они не имеют миофибрилл и структур типа сар-
324
Рис. 81. Схема строения гладкой мышечной клетки моллюсков в расслаблен-
ном (а) и сокращенном (б) состояниях.
/ — межклеточное вещество, 2, 3 - плотные тела с актиновыми нитя-
ми, связанные с мембраной (2) и в цитоплазме (3), “-миозиновые
нити, 5 — ядро, 6 — митохондрия.
325
комеров. Актиновые протофибриллы крепятся к плотным те-
лам, миозиновые — свободно лежат в гиалоплазме. Суммар-
ное соотношение актиновых и миозиновых протофибрилл, вы-
численное в целом на клетку, составляет приблизительно 10:1.
На поперечных срезах тонкие протофибриллы обычно не обра-
зуют правильных окружностей вокруг толстых. Имеются уча-
стки, где тонкие нити лежат вне связи с толстыми. Таким об-
разом, взаимодействие актиновых и миозиновых протофибрилл
в гладких мышцах моллюсков носит не такой организованный
характер, как в поперечнополосатых и косоисчерченных мыш-
цах. Миозиновые протофибриллы при сокращении могут вза-
имодействовать с большим или меньшим количеством актино-
вых протофибрилл и располагаться под тем или иным углом
к длинной оси клетки.
На молекулярном уровне толстые протофибриллы имеют
в принципе такое же строение, как в поперечнополосатых и ко-
соисчерченных мышцах первичноротых животных. Основу их
составляет стержень из парамиозина. Количество его у мол-
люсков значительно больше, чем у членистоногих животных,
и сильно варьирует в разных мышцах у одного и того же жи-
вотного и у разных животных, благодаря чему толщина мио-
зинсодержащих протофибрилл в мышцах у животных одного
вида может варьировать от 15 до 100 нм. Особенно большое
количество парамиозина имеется в гладких мышцах аддуктора
раковины пластинчатожаберных моллюсков, где имеются тол-
стые нити максимального диаметра. Что касается миозиновых
молекул, то они построены по общему для всех рассмотренных
выше мышечных тканей принципу и состоят из двух тяжелых
и двух пар легких цепей с характерными головками на пе-
реднем конце молекулы. Головки содержат те же центры, что
и в мышцах саркомерного типа: АТФазный ферментативный
центр и центр связывания с актином. Собраны миозиновые
молекулы на парамиозиновом стержне в биполярный комплекс,
т. е. на концах толстой протофибриллы лежат головки моле-
кул противоположной направленности. В центре имеется зона,
свободная от миозиновых головок. В миозиновых молекулах
имеется специальная система, регулирующая взаимодействие
с актиновыми. Она образована легкими регуляторными цепями.
В отличие от таких цепей поперечнополосатых мышц позво-
ночных и членистоногих аналогичные легкие цепи миозина
гладких мышц моллюсков обладают способностью непосредст-
венно связывать ионы кальция. При этом они обеспечивают
активацию центров рабочих цепей головок миозиновых мо-
лекул. Таким образом, здесь имеется прямая кальциевая*ре-
гуляция, как в тропонин-тропомиозиновой регуляторной систе-
ме тонкой актиновой протофибриллы.
В основе тонких протофибрилл лежат две цепочки фибрил-
лярного актина с нитями из молекул тропомиозина, располо-
326
женных по всей длине тонкой протофибриллы. Вопрос о на-
личии в тонких протофибриллах гладких мышц моллюсков
молекул тропонина и соответственно тропонин-тропомиозино-
вого механизма регуляции взаимодействия миозиновых и ак-
тиновых молекул остается открытым. В биохимических иссле-
дованиях 70-х годов не удавалось обнаружить этого механиз-
ма в гладких мышцах моллюсков и у ряда других животных.
В последнее время появились сообщения о том, что негатив-
ные результаты обусловлены особыми свойствами тропонина
у этих животных. Он подвергается протеолизу при стандарт-
ных методах выделения исследуемых фракций.
В некоторых мышцах моллюсков наблюдается тенденция
к объединению актиновых и миозиновых Протофибрилл в про-
дольно или косо ориентированные системы — сократительные
единицы.
Структурно-биохимическая организация и свойства гладких
мышц рассматриваемой разновидности могут варьировать в ши-
роких пределах. Одним из крайних вариантов является мышца
аддуктора раковины пластинчатожаберных моллюсков, спо-
собная находиться в сокращенном состоянии длительное вре-
мя без большой затраты энергии и признаков утомляемости.
Широко варьировать может и соотношение толстых и тонких
протофибрилл и их количество на единицу площади, а также
их взаимное расположение. При более упорядоченной их ор-
ганизации гладкие мышечные клетки могут приобретать черты
сходства с косоисчерченными мышцами. Такое более упорядо-
ченное расположение протофибрилл может быть исходным
свойством конкретной разновидности гладкой мышечной ткани
или приобретается некоторыми мышцами при длительном их
сокращении.
Что касается второй выделенной нами разновидности глад-
ких мышечных тканей беспозвоночных, то она изучена сейчас
еще весьма слабо. Характерной ее особенностью, как уже от-
мечалось, является отсутствие в цитоплазме плотных тел и дру-
гих морфологически выраженных структур, закрепляющих
концы тонких актиновых протофибрилл. Такая организация
сократимого аппарата имеется, по-видимому, в отростках эпи-
телиально-мышечных клеток кишечнополостных и, возможно,
в гладких мышечных клетках некоторых низших многоклеточ-
ных животных. Такой же характер носит организация тонких
протофибрилл-в весьма своеобразных симпластических мышеч-
ных волокнах, обнаруженных недавно у гребневиков. Они по
своей системной организации напоминают симпластические
мышечные волокна позвоночных и членистоногих.
Однако пока остаются неясными как механизм образования
этих волокон, так и тонкая структурно-биохимическая органи-
зация их сократимого аппарата. Тем не менее эти образования
являются примером комбинаторики у низших многоклеточных
327
относительно простого надмолекулярного уровня организации
сократимого аппарата с высшим тканевым уровнем органи-
зации.
§ 4. Гладкие мышцы позвоночных животных
Гладкая мышечная ткань имеет широкое распространение
у позвоночных животных, образуя сократимый аппарат всех
внутренних органов. Основным структурным элементом ее явля-
ются гладкие мышечные клетки. По своей морфологии они от-
части сходны с гладкими мышечными клетками беспозвоноч-
ных животных (рис. 82, а, б). Для них характерна веретено-
видная форма, хотя в некоторых органах позвоночных они име-
ют отростчатую (например гладкие мышечные клетки мочево-
го пузыря). Размеры клеток варьируют от 60 до 200 мкм
в длину и составляют 4—8 мкм в диаметре. В некоторых
органах, например в матке млекопитающих, они достигают
длины 500 мкм. Функциональными единицами гладкой мышеч-
ной ткани являются пучки гладких мышечных клеток. Меха-
низмы объединения клеток в пучки многообразны. На концах
клеток формируются пальцевидные впячивания, на боковых
поверхностях клеток многочисленны бывают и десмосомы, име-
ется и значительное количество плотных соединений — нексу-
сов. Основную же цементирующую роль играют основное гли-
копротеиновое межклеточное вещество и коллагеновые и эла-
стические волокна. Все эти межклеточные структуры выраба-
тываются самими гладкими мышечными клетками. Особенно
ярко выражена функция образования и обновления межкле-
точных структур у гладких мышечных клеток стенок сосудов.
Наружная поверхность клеток неровная. Здесь могут форми-
роваться небольшие отростки, служащие для функционального
взаимодействия с соседними клетками или усиления механиче-
ской связи клеток с межклеточным веществом. Более много-
численны различного рода пузыревидные впячивания поверх-
ностного аппарата. Часть их представляет собой, по-видимому,
пиноцитозные пузырьки. Функциональное значение большей
части этих образований остается пока не ясным.
В молодых гладких мышечных клетках хорошо развита ше-
роховатая ЭПС, что связано с синтезом и секрецией клеткой
структурных компонентов межклеточного вещества. С возрас-
том количество ее уменьшается. Ядро овальной формы распо-
ложено в центре клетки. Оно может содержать несколько (до
5—6) ядрышек и проявляет заметную транскрипционную ак-
тивность, особенно у молодых активно выделяющих межкле-
точное вещество клеток.
Как и в гладкомышечных клетках моллюсков, у позвоноч-
ных имеются многочисленные плотные тела, примембранные
и цитоплазматические. В них обнаруживается а-актинин. Хоро-
328
329
шо развит цитоскелет, образованный фибриллами белка дес-
мина диаметром 10 нм. Прикрепляясь к плотным телам обоих
типов, пучки десминовых фибрилл формируют сложную трех-
мерную сеть (рис. 82, б).
Основная масса цитоплазмы занята тонкими актиновыми
и толстыми миозиновыми ' протофибриллами. Взаимодействуя
между собой, они образуют линейные структуры, так называе-
мые сократимые единицы (рис. 82, б). Тонкие актиновые про-
тофибриллы на концах сократимых единиц связаны с примем-
бранными плотными телами, вследствие чего каждая сократи-
мая единица закрепляется в двух точках поверхностного аппа-
рата клетки. Предполагают, что примембранные плотные тела
расположены в клетке по спирали, поэтому сократимые едини-
цы оказываются под некоторым углом к длинной оси клетки.
При сокращении гладкой мышечной клетки вся ее поверх-
ность приобретает бугристый вид благодаря образованию
глубоких впячиваний в местах крепления сократимых
единиц.
Каждая сократимая единица представляет собой структуру,
аналогичную миофибриллам поперечнополосатых мышц, одна-
ко в ней отсутствует правильное саркомерное расположение
актиновых и миозиновых протофибрилл. Они лежат параллель-
но, но их расположение не закономерно в поперечном направ-
лении. Хотя взаимодействие актиновых и миозиновых прото-
фибрилл и происходит по принципу скольжения, но осуществля-
ется иначе, чем в гладких мышечных клетках беспозвоночных
и в поперечнополосатой или косоисчерченной мышечных тка-
нях. Иной характер взаимоотношений актиновых и миозиновых
протофибрилл обусловлен и принципиальными особенностями
их организации на молекулярном и надмолекулярном уровнях.
Основу толстой протофибриллы составляют хвосты молекул
миозина в комплексе с дополнительными белками. Однако рас-
полагаются они иначе, чем в толстых протофибриллах других
мышечных тканей (рис. 82, в).
В толстых протофибриллах гладких мышечных клеток
позвоночных головки миозиновых молекул распределяются
спирально закрученными рядами, причем в соседних рядах
они противоположной полярности, т. е. взаимодействуют
с актиновыми протофибриллами в разных направлениях.
Таким образом, здесь наблюдаются принципиальные отли-
чия и надмолекулярной организации миозиновых толстых
протофибрилл от всех рассмотренных выше разновидностей
мышечных тканей. Такого рода надмолекулярная организация
является, по-видимому, первичной, поскольку она характерна
для миозиновых протофибрилл в немышечных клетках. Она не
требует больших количеств специфических вспомогательных
белков (белок С, парамиозин) и в значительной мере являет-
ся свойством самих миозиновых молекул.
330
В сократимых единицах одна миозиновая протофибрилла
окружена и может взаимодействовать с 16 актиновыми прото-
фибриллами противоположной полярности. Однако при сокра-
щении такое взаимодействие осуществляется обычно с 10—15
актиновыми протофибриллами. Последние состоят из актина
у- и p-изоформ, т. е. немышечного актина. Они относятся
к актинам, менее устойчивым в полимеризованном состоянии.
Очевидно, в гладких мышцах в тонких нитях помимо актина
имеются тропомиозин и особые, пока еще не идентифицирован-
ные вспомогательные белки. Возможно, они обеспечивают боль-
шую устойчивость актина в полимеризованном состоянии.
Тропонин в составе тонких нитей пока обнаружить не уда-
лось, хотя факт его отсутствия требует более точных доказа-
тельств. Имеющиеся в настоящее время факты свидетельст-
вуют о том, что регуляция взаимодействия актина и миозина
осуществляется системой, локализованной в головках миозино-
йых молекул. Она аналогична описанной выше (см. стр. 303)
непрямой регуляторной системе головок миозиновых молекул
поперечнополосатой мышечной ткани. Ионы кальция взаимо-
действуют с кальмодулином, входящим в состав киназы лег-
кой регуляторной цепи молекулы миозина. Это вызывает фос-
форилирование регуляторной легкой цепи, в результате чего
«открываются» центры взаимодействия рабочих легких цепей
с актином. Аналогичный механизм регуляции взаимодействия
актин-миозиновых молекул характерен для большинства немы-
шечных актин-миозиновых механохимических систем эукариот-
ньщ: клеток.
Все эти особенности в тонкой организации сократимого ап-
парата гладких мышечных клеток сближают его с сократимым
субмембранным аппаратом соединительнотканных клеток фиб-
робластов, в частности с одной из наиболее стабильных его
разновидностей, так называемыми стресс-фибриллами. Послед-
ние- состоят из продольно ориентированных актиновых и мио-
зиновых протофибрилл со вспомогательными белками. Стресс-
фибриллы отличаются от сократимых единиц гладких мышеч-
ных клеток меньшим диаметром, отсутствием правильного рас-
положения по отношению к длинной оси клетки и закрепле-
нием своих концов на закономерно расположенных специаль-
ных субмембранных опорных структурах. Имеются цитохими-
ческие данные о более закономерном в стресс-фибриллах, чем
в сократимых единицах, взаимном расположении актиновых
и миозиновых протофибрилл. Сходство гладких мышечных кле-
ток позвоночных и механоцитов тканей внутренней среды, по-
видимому, не случайно и обусловлено глубокими исторически-
ми-причинами. Гладкие мышечные клетки позвоночных можно
рассматривать как специализированные на функцию сокраще-
ния оседлые элементы. Эти клетки, как уже отмечалось, всегда
сочетают функции сокращения и синтеза межклеточных струк-
, 331
тур (основного вещества, коллагеновых и эластических воло-
кон). Кроме того, в гистогенезе они развиваются из мезенхи-
мы— общего зачатка для всех тканей внутренней среды по-
звоночных.
Весьма вероятно предположить по аналогии с эволюцион-
ной динамикой рассмотренных выше разновидностей мышечных
тканей, что распространение специализированных сократимых
клеток на основе немышечных миозинов не ограничивается по-
звоночными животными.
По морфофункциональным признакам с гладкими мышеч-
ными клетками сходны клетки, образующие стенку сосудов
у головоногих и брюхоногих моллюсков. Значительное количе-
ство актин-миозиновых фабриллярных структур обнаружено
и в некоторых фибробластах этих животных.
Приведенная выше характеристика гладких мышечных кле-
ток позвоночных дана преимущественно на материале исследо-
ваний, проведенных на висцеральной мускулатуре кишечника.
Имеются уже данные, что гладкие мышечные клетки кровенос-
ных сосудов, матки и ряда других внутренних органов харак-
теризуются существенными особенностями. Так, гладкие мы-
шечные клетки сосудов имеют очень короткие миозиновые про-
тофибриллы (2 мкм), а актиновые протофибриллы крепятся не
только к субмембранным плотным телам, но и к плотным те-
лам, расположенным в цитоплазме клеток. В гладких мышеч-
ных клетках матки соотношение актиновых и миозиновых про-
тофибрилл не 24:1, как в гладких мышцах кишечника, а все-
го 3:1, т. е. близко к их соотношению в скелетных мышцах
позвоночных животных.
§ 5. Общая характеристика эволюционной динамики
мышечных тканей
Суммируя изложенное, можно сформулировать ряд положе-
ний, характеризующих современные представления об общих
закономерностях эволюционной динамики мышечных тканей.
Изменения этого унифункционального типа тканей в процессе
эволюции многоклеточных животных ограничены относительно
небольшим количеством вариантов системного, органоидного,
надмолекулярного и молекулярного уровней организации
(рис. 83).
На системном уровне все их многообразие укладывается
в четыре разновидности: симпластические и клеточные волок-
на, пучки клеток и пласты эпителиально-мышечных клеток
(рис. 83, 1—4). Разнообразие организации на органоидно!й
и молекулярном уровнях достигается двумя путями. Во-первых,
специализированные сократимые аппараты развиваются на ос-
нове видоизменения на молекулярном уровне исходной актин-ми-
озиновой системы. Возникают мышечный актин и специфическая
332
поляризованная сборка миозиновых протофибрилл (рис. 83, а, б).
Во-вторых, используется гипертрофия и пространственная ста-
билизация немышечных актинов и миозинов (рис. 83, в). Пер-
вый вариант, в свою очередь, реализуется двояко: актин-миози-
новая сократимая мышечная система достигает правильной
пространственной саркомерной организации (а) или саркомер-
ная организация отсутствует (б).
При этом естественно предположить, что исходным состоя-
нием, основой преобразования мышечных тканей в эволюции
первичных многоклеточных была немышечная форма органи-
Рис. 83. Схема эволюционной динамики мышечных тканей.
/—4 — основные варианты организации мышечной тканн: 1 — симпластические волок-
на- с сателлитами, 2 — клеточные мышечные волокна со специфическими межклеточ-
ными контактами типа вставочных пластинок (миоциты сердечных мышц), 3 — пучки
мышечных клеток, объединенных межклеточным веществом, 4 — эпителиально-мышеч-
ные клетки; а—в — основные варианты надмолекулярной организации миозиновых
нитей: а— саркомерная организация поляризованных миозиновых и миозин-парамио-
знневых нитей в поперечнополосатых и косоисчерченных мышечных тканях, 6 — «бес-
порядочное» распределение поляризованных миозии-парамнозиновых нитей, в — сборка
миозиновых молекул в направлении, поперечном длинной оси нити (немышечный
миозин).
333
зации актин-миозинового аппарата и первичная специализация
их на клеточной основе. С этой точки зрения понятно, что выс-
шие формы системной организации — симпласты и мышечные
клеточные волокна и саркомерная организация сократимого
аппарата — наиболее широкое распространение получают у до-
статочно высокоорганизованных животных. С другой стороны,
строго неупорядоченное, несаркомерное расположение актино-
вых и миозиновых протофибрилл на клеточной основе (мышеч-
ные и эпителиально-мышечные клетки) наиболее характерно
для низкоорганизованных животных. Однако, как видно на
схеме (рис. 83) и следует из приведенных выше описаний, эта
простая и логичная картина усложняется массой исключений.
К ним относится наличие у некоторых низкоорганизованных
животных мышечных клеток с правильной саркомерной орга-
низацией актиновых и миозиновых протофибрилл на относи-
тельно примитивной системной организации или, наоборот, сим-
пластических сложных мышечных волокон с беспорядочным
расположением тонких и толстых протофибрилл. Исключения-
ми противоположного характера являются вся висцеральная:
мускулатура и мышечный аппарат радужной оболочки глаза
позвоночных животных. Эти внешне относительно просто орга-
низованные разновидности мышечных тканей характерны для
высших животных.
Причиной столь сложного характера преобразования мы-
шечных тканей является уже отмечавшаяся в вводной части
книги (см. стр. 22) способность многоклеточных организмов в
ходе эволюции многообразно регулировать на клеточном и на
системных уровнях организации работу генетического аппара-
та клеток. Именно эта способность обусловила неоднократное
возникновение мышечных тканей в филогенезе из разных
источников — появление помимо древних висцеральных и сома-
тических мышц еще и целомических, мезенхимных и, наконец,
нейральных сократимых тканей.
Естественно при этом, что различные источники происхожде-
ния и длительность эволюции находят свое отражение в свойст-
вах мышечных тканей. Это ясно видно на примере целомических
и гладких мышечных тканей позвоночных животных. Однако
историческая обусловленность свойств образующихся позднее
тканей получает в этих двух примерах принципиально разное
проявление. В целомических тканях волокна возникают на кле-
точной основе с весьма сходной с древними поперечнополоса-
тыми мышцами организацией специфических органоидов — мио-
фибрилл. В гладких мышечных тканях позвоночных, наоборот,
на системном клеточном уровне организации не наблюдается
принципиальных отличий от древних первичных гладких мы-
шечных тканей беспозвоночных животных. Принципиальная
разница здесь обнаруживается в организации самого сократи-
мого аппарата. Такой сложный неоднозначный характер регу-
334
ляции организмом процессов дифференцировки вторичных
и третичных тканей обусловлен одним из фундаментальных
свойств эукариотных метазойных клеток — отсутствием жест-
ких причинно-следственных связей между элементарными меха-
низмами, регулирующими процессы дифференцировки клеток.
Эта фундаментальная особенность эукариотных клеток опре-
деляет возможность комбинаторики признаков, связанных
с разными уровнями их организации. Другим ярким примером
такой комбинаторики являются: появление саркомерных мио-
фибрилл в эпителиально-мышечных клетках медуз и, наоборот,
гладкомышечного симпласта у гребневика.
Все эти факты весьма примечательны в двух аспектах.
С одной стороны, они показывают удивительную способность
даже относительно низко организованных организмов регули-
ровать и управлять процессами дифференцировки составляю-
щих их клеток в соответствии со стоящими перед организмом
функциональными задачами. С другой стороны, все эти
исключения из общего правила еще раз подчеркивают огра-
ниченный направленный закономерный характер преобразо-
вания мышечных тканей в филогенезе многоклеточных жи-
вотных.
В отличие от других типов тканей мышечные ткани очень
редко в эволюции превращаются в другие типы тканей. Одним
из примеров в этом отношении могут служить электрические
органы рыб, где мышечные элементы специализируются не на
сокращение, а на аккумуляцию электрической энергии. Эта
функция, однако, реализуется на основе гипертрофии и видо-
изменения мембранных систем, специфических и для типичных
сократимых тканей. Интересно, что такого рода специализа-
ции независимо и многократно возникают в процессе эволюции
у разных видов рыб на основе как гладких, так и поперечно-
полосатых мышц, т. е. они носят и полифилетический, и на-
правленный характер.
При сходном характере, преобразований одних и тех же
разновидностей мышечных тканей у разных групп животных
и в первую очередь у далеко отстоящих друг от друга первич-
но- и вторичноротых животных эти ткани хотя и похожи и ви-
доизменяются в одинаковых направлениях, однако они далеко
не идентичны и представляют собой спектр модификаций со
специфическими для каждой разновидности в пределах иссле-
дуемых групп особенностями. Эти особенности могут касаться
весьма глубоких признаков и внутриклеточной, и системной
организации. К ним относятся, например, разные варианты
сборки тонких нитей в поперечнополосатых симпластических
мышечных волокнах первичноротых и позвоночных животных,
разные механизмы миозиновой регуляции, наличие клеток-са-
теллитов в целомической мышечной ткани сердца ракообраз-
ных и, наоборот, наличие поперечнополосатой мышечной ткани,
335
образованной миоцитами, в хвостовой соматической мускула-
туре личинок асцидий.
В последних примерах мы видим, что эти модификации
в пределах разновидности тканей настолько велики, что данная
разновидность вторичных (клеточные волокна ракообразных)
или первичных (соматические мышцы хвоста личинки асци-
дии) мышечных тканей приобретает характерные признаки,
свойственные древней соматической (клетки сателлиты) или,
наоборот, более молодой целомической (клеточный принцип
организации волокон) мышечным тканям. Иными словами,
это еще один яркий пример большой пластичности мышечной
ткани — возможность преодоления исторически обусловленного
консерватизма в свойствах их отдельных разновидностей и ком-
бинаторики в крайних вариантах первичных и вторичных тка-
ней «древних» и более «молодых» признаков.
Пластичность эволюционной динамики мышечных тканей
при ограниченном направленном ее характере проявляется и в
многочисленных функционально обусловленных вариантах
организации, не выходящих за пределы каждой из ее разновид-
ностей, у разных групп многоклеточных животных. Примерами
таких модификаций могут служить асинхронные летательные
мышцы насекомых, прямые синхронные мышцы членистоно-
гих, клеточные волокна проводящей системы сердца млекопи-
тающих и другие менее значительные функциональные моди-
фикации разновидностей мышечных тканей. Наличие модифи-
каций еще более усиливает значение сравнительного метода
и исторического эволюционного подхода к анализу данной тка-
невой системы.
Сейчас уже становится очевидным, что без понимания об-
щих закономерностей эволюционной динамики мышечных тка-
ней, без всестороннего анализа их основных модификаций,-мо-
заичной комбинаторики признаков на разных уровнях органи-
зации невозможно ни выяснить функциональное значение мор-
фологических структур, ни приступить к каузальному анализу
регулятивных механизмов дифференцировки клеток.
Сравнительный исторический подход при анализе мышеч-
ных тканей имеет исключительно важное значение и для раз-
работки основных проблем организации механохимических си-
стем в живой природе. Он необходим и для разработки вопро-
сов, имеющих практическое значение, как это было показано
нами на примере анализа регенераторных потенций и меха-
низмов их реализации в сердечных и соматических мышечных
тканях млекопитающих и человека.
Глава 14. ТКАНИ НЕРВНОЙ СИСТЕМЫ
Нервная система у всех наиболее высокоорганизованных
вторичноротых (позвоночные) и первичноротых ^головоногие
моллюски и членистоногие) животных достигает высокого уров-
ня дифференцировки. Ткани нервной системы в процессе эво-
люции отдельных групп животных обнаруживают закономер-
ные усложнения на клеточном, тканевом и даже органном уров-
нях организации. Тенденции такого параллельного, общего для
всех многоклеточных животных усложнения специализирован-
ных клеточных систем на примере тканей нервной системы вы-
являются особенно отчетливо в связи с ее особым и общим для
всех животных биологическим значением как основной интегри-
рующей системы. Не случайно поэтому, что при широких срав-
нительно-гистологических сопоставлениях нейрональных отно-
шений в нервных системах высших многоклеточных животных
именно на их примере впервые удалось сформулировать пред-
ставление об общих закономерностях усложнения в процессе
эволюции аналогичных в функциональном отношении тканей
многоклеточных животных. В настоящее время эта идея общ-
ности морфофункциональной и биохимической организации
нервных систем позвоночных и беспозвоночных животных по-
лучает подтверждение не только в сравнительно-гистологиче-
ских работах, но и в многочисленных сравнительно-физиологи-
ческих исследованиях.
Нервные системы у позвоночных и высших первичноротых
животных имеют весьма сложное строение. Основными элемен-
тами их являются нервные клетки, или нейроны. Кроме того,
весьма существенную роль в жизнедеятельности клеток играет
специальная вспомогательная ткань — нейроглия. Основу ана-
лизаторской и интегративной функций нервной системы состав-
ляют рецепторы и области переключения нервного импульса.—
межнейронные синапсы и окончания отростков нервных клеток
в иннервируемых тканях.
У низших многоклеточных функцию специфической гумо-
ральной интеграции организма осуществляют особые нейросек-
реторные клетки. У высших животных системы нейросекретор-
ных клеток обеспечивают еще и связь между нервной системой
и системой желез внутренней секреции.
§ 1. Нервные клетки
Нервные клетки многоклеточных животных характеризуют-
ся большим разнообразием строения, формы, размеров и ядер-
но-плазменных отношений. Тем не менее всем нервным клет-
кам свойствен ряд общих признаков организации. Они опре-
деляются общими функциональными задачами и сходными
внутриклеточными механизмами,, лежащими в основе функцио-
12 672 337
нальной деятельности нейронов. В нейроне выделяют тело
клетки с ядром и окружающей его цитоплазмой — перикарион
и два типа отростков — дендриты, которые служат обычно для
восприятия 'раздражения, и нейрит, или аксон, по которому
импульс распространяется от тела клетки. В функциональном
отношении все нервные клетки делятся на чувствительные,
ассоциативные и эффекторные. Чувствительные клетки служат
для восприятия раздражения, а эффекторные передают нерв-
ный импульс на работающие органы. В ассоциативных нейро-
нах происходит сложная переработка и анализ воспринятой
Рис. .84. Псевдоуниполярные и мультиполярные нейроны беспозвоночных и по-
звоночных животных.
й — двигательная клетка грудного гаиглия личинки стрекозы, б — клетка Пуркинье,.
в — клетка-зерио, г — пирамидная клетка; 1 — аксон, 2 — дендриты, 3 —тело клетки.
338
чувствительными клетками информации. Естественно, что имен-
но система ассоциативных нейронов достигает у высших жи-
вотных наибольшей сложности и разнообразия, образуя их
нервные центры. В зависимости от количества отростков нерв-
ные клетки делятся на мультиполярные, биполярные, псевдо-
униполярные и униполярные.
Наибольшее разнообразие пб форме, размерам и количест-
ву отростков обнаруживается в группе мультиполярных клеток
(рис. 84). У позвоночных животных к ним относится большин-
ство ассоциативных и эффекторных нейронов соматической
и все нейроны вегетативной нервных систем. В эту группу по-
падают крупные нейроны типа двигательных клеток спинного
мозга, клетки Пуркинье мозжечка и гигантские пирамидные
клетки коры больших полушарий. Их общей особенностью яв-
ляется большая длина аксона, достигающая у двигательных
и пирамидных клеток человека более метра. Количество, раз-
меры и форма ветвления дендритов при этом весьма разнооб-
разны. Здесь наблюдаются и относительно короткие и мало
ветвящиеся дендриты двигательных клеток передних рогов
спинного мозга, и дендриты с причудливым весьма характер-
ным ветвлением у клеток Пуркинье, и своеобразные дендриты
пирамидных клеток коры больших полушарий. К мультиполяр-
ным клеткам относятся также клетки-зерна в коре мозжечка,
корзинчатые, звездчатые клетки и целый ряд других мелких
ассоциативных клеточных элементов. Последние характеризу-
ются относительно небольшими размерами перикариона, ко-
роткими дендритами и аксонами значительно меньшей длины,
чем у двигательных нейронов спинного мозга. Таким образом,
даже в пределах одной группы мультиполярных нейронов у по-
звоночных наблюдается весьма широкий диапазон ядерно-плаз-
менных отношений. В мелких ассоциативных нейронах они ма-
ло отличаются от ядерно-плазменных отношений в других со-
матических клетках. В крупных нейронах с длинными аксона-
ми или дендритами ядерно-плазменные отношения оказывают-
ся резко сдвинутыми в сторону преобладания нейроплазмы
и площади поверхностного аппарата.
Биполярные нейроны представлены у позвоночных преиму-
щественно специализированными рецепторами — нервными клет-
ками органов зрения и обоняния — и некоторыми ассоциатив-
ными нейронами. Более широко они распространены у беспо-
звоночных. животных, где большинство чувствительных нерв-
ных клеток имеют один нейрит и один дендрит.
Близки к чувствительным биполярным клеточным элемен-
там псевдоуниполярные нейроны позвоночных животных. Для
них характерно наличие одного длинного отростка, который за-
тем Т-образно разветвляется, образуя длинный дендрит, ухо-
дящий на периферию, и более короткий аксон, идущий в спин-
ной мозг. В принципе мы имеем здесь дело с биполярной клет-
12*
339
кой, часть тела которой преобразована в длинный клеточный’
вырост.
Особую группу в функциональном и структурном отноше-
ниях представляют широко распространенные у беспозвоноч-
ных униполярные нейроны со сложной топографической диффе-
ренцировкой рецептивных областей на отростке или его раз-
ветвлениях (рис. 84,а). В отходящем от тела клетки отростке
можно выделить три зоны — проксимальный или вставочный
сегмент, рецептивный сегмент и. аксон или аксоны с разветвле-
ниями. Вставочный сегмент является связующим звеном меж-
ду трофическим (перикарион) и рабочим (отростки) аппарата-
ми клетки. Рецептивный сегмент (или сегменты) по своему зна-
чению аналогичен дендритам мультиполярных, биполярных
и псевдоуниполярных клеток. Он может быть" представлен од-
ним или несколькими (в основании каждого аксона) участками
клеточного отростка. В рецептивных областях расположены
синапсы, регулирующие деятельность аксона данного нейрона.
У некоторых животных здесь образуются больших или мень-
ших размеров выросты и отростки. При больших размерах
и ветвлении они приобретают вид настоящих дендритов. По-
следняя, наиболее значительная часть отростка рассматривае-
мого типа нейронов является аксоном (или аксонами), обеспе-
чивающим проведение импульса с рецептивной области на дру-
гую нервную клетку или рабочий орган.
Особую разновидность нейронов составляют относительно
немногочисленные узкоспециализированные униполярные клет-
ки. Они представлены амакриновыми нервными клетками. Наи-
большее распространение амакриновые клетки получают в оп-
тических нервных центрах позвоночных животных, головоногих
моллюсков и насекомых. Сам факт широкого распространения
таких клеток’ в нервных системах высокоорганизованных жи-
вотных свидетельствует об их узкой специализации.
Помимо морфологической и функциональной классифика-
ции нервных клеток в последнее время предложена классифи-
кация по типу медиаторов.— химических соединений для пере-
дачи импульсов. По химической природе они весьма разнооб-
разны: это ацетилхолин, биогенные амины, некоторые амино-
кислоты, АТФ и его дериваты. Кроме того, роль медиаторов
и нейрогормонов играют и разнообразные полипептиды. Инте-
ресно, что нейроны разной медиаторной специфичности в оди-
наковой мере распространены как в нервных системах позво-
ночных, так и беспозвоночных (первичноротых) животных.
В нервных системах высших многоклеточных животных про-
цессы репродукции дифференцированных нервных клеток обыч-
но оказываются стойко и необратимо блокированными. Одна-
ко у этих животных в постнатальном гистогенезе нервной си-
стемы, а у более низкоорганизованных животных в течение
всей жизни широко распространены процессы соматической по-
340
липлоидизации. Благодаря этому у некоторых групп животных
(брюхоногие моллюски) большинство нервных клеток в ганг-
лиях оказываются полиплоидными (рис. 85). Степень полипло-
идии в нервных клетках брюхоногих моллюсков . может быть
весьма высокой. Гигантские полиплоидные нервные клетки
имеются и в нервной системе других первичноротых животных
(аннелиды, ракообразные, насекомые). Однако у большинства
представителей беспозвоночных они не являются преобладаю-
щим типом клеток.
Рис. 85. Полиплоидные нервные клетки из висцерального ганглия брюхоно-
гого моллюска.
/ — высокоплоидные и 2— клетки меньшей плоидности, 3 — диплоидные глиальные
элементы.
Несмотря на широкое распространение полиплоидных ней-
ронов у первичноротых животных такой путь интенсификации
клеточного метаболизма не является ведущим в филогенетиче-
ской дифференцировке нервной системы. В центральной нерв-
ной системе и в периферических ее отделах у насекомых, голо-
воногих моллюсков и у позвоночных животных преобладают
обычно диплоидные клетки. В таких диплоидных нервных клет-
ках с длинными аксонами и дендритами ядерный аппарат конт-
ролирует необычные для соматических клеток объем цитоплаз-
мы и площадь поверхностного аппарата.
341
Специфические особенности внутренней морфобиохимиче-
ской организации нейронов удобнее показать на примере дви-
гательных клеток передних рогов спинного мозга. Это клетки
с крупными ядрами, богатыми кариоплазмой, с резко выделя-
ющимися на препаратах одним или двумя ядрышками (рис. 86).
Ядерная оболочка имеет многочисленные поры. Хроматин
сильно распылен и образует небольшие скопления лишь в об-
ласти ядерной оболочки. Такая структура интерфазного ядра
характерна для весьма активных в метаболическом отношении
ядерных аппаратов.
Наиболее специфичной структурой цитоплазмы перикарио-
на и дендритов является так называемое тигроидное вещество
(вещество Ниссля). На светооптическом уровне оно выявляет-
ся в виде скоплений или глыбок базофильного вещества. На
электронограммах видно, что в таких базофильных участках
цитоплазмы имеются хорошо развитая сеть, каналов шерохова-
той эндоплазматической сети и скопления свободных рибосом,
образующих характерные розетковидные структуры (рис. 86, в).
Хорошо развит в нервных клетках и аппарат Гольджи свое-
образного .диффузного типа. Группы его центральных цистерн
и периферических пузырьков образуют анастомозирующую
сеть вокруг ядерного аппарата нервной клетки. Довольно мно-
гочисленны в цитоплазме нервных клеток и лизосомы. У моло-
дых животных они относительно однородны и по размерам,
и по структуре. В нервных клетках старых животных наблю-
дается увеличение в цитоплазме мультивезикулярных тел и ли-
пофусциновых гранул, а также переходных форм между лизо-
сомами и этими структурами. В цитоплазме перикариона и от-
ростков имеются многочисленные митохондрии. Их внутренняя
мембрана обычно не образует большого количества крист.
Весьма характерными и специфическими структурами нерв-
ных клеток являются нейрофиламенты и специализированные
микротрубочки, которые хорошо развиты и в цитоплазме пери-
кариона, и особенно в отростках. Нейрофиламенты — это фиб-
риллярные структуры, диаметром около 10 нм. Они образова-
ны спирально закрученными нитями, состоящими из специфи-
ческих для нервных клеток белков цитоскелета. Нейротрубочки
представляют собой цилиндрические образования диаметром
24 нм с толщиной стенки цилиндра 10 нм, состоящие из диме-
ров тубулина, т. е. имеют строение типичных микротрубочек
эукариотных клеток.
В цитоплазме дендритов содержатся те же органоиды, что
и в области перикариона. В аксоне отсутствуют рибосомы, одно-
ко имеются митохондрии, элементы эндоплазматического рети-
кулума, и особенно хорошо развит аппарат нейрофиламентов
и нейротрубочек.
У многих нервных клеток хорошо выражен участок перика-
риона, от которого отходит аксон. Он получил название аксо-
342
Рве. 86. Двигательные клетки передних рогов спинного мозга позвоночных,
а, б — автографы спинного мозга лягушки через 1 ч после введения 3Н-уридина (а)
и ^З-метиоиииа (6); в — схема ультраструктуриой организации клеток, /—ядрышко,
2 — ядро, 3 — цитоплазм, 4 — клетка глии, 5 — плазматическая мембрана, 6 — денд-
рит, 7— аксосоматический синапс, 8 — аксодендритический синапс, 9 — участки шеро-
ховатой ЭПС и свободные рибосомы (субстанция Ниссля), 10 — аппарат Гольд-
жи, 11—лизосомы, 12 •— митохондрии, 13 — нейрофиламенты, 14—нейротрубочки.
343
нального холмика. В этом участке мало рибосой, и ему припи-
сывают большую роль в генерации нервного импульса.
Эффекторные и крайне разнообразные ассоциативные нерв-
ные клетки у разных животных обнаруживают в основном
лишь количественные различия в интенсивности обмена ве-
ществ отдельных компонентов метаболического аппарата.
Характерной особенностью нервных клеток всех многокле-
точных животных является высокая чувствительность их
к внешним воздействиям как общего, так и местного значения.
Эта чувствительность отчетливо проявляется и в быстрой из-
менении интенсивности синтетических процессов, и в структур-
ных изменениях белоксинтезирующего и энергетического аппа-
ратов клеток.
Для многих нейронов характерен высокий уровень синтети-
ческих процессов и в первую очередь синтеза белка и РНК
(рис. 86, а, б).
Белки сами не являются медиаторами и играют лишь вспо-
могательную роль в транспорте, разрушении и ресинтезе
медиаторов. Нейроны, использующие в качестве медиаторов по-
липептиды, имеют весьма ограниченное распространение у мно-
гоклеточных животных. Поэтому весьма интенсивную синтетиче-
скую активность перикариона нельзя объяснить только потреб-
ностью в белках для обеспечения химической передачи импульса
и других процессов, непосредственно связанных с основной
функцией нервных клеток. Очевидно, что интенсивный белко-
вый синтез прежде всего необходим для обновления струк-
турных и метаболических белков цитоплазмы нейрона, а также
его отростков, и в первую очередь аксона, лишенного собствен-
ного белоксинтезирующего аппарата.
Предположение о наличии такого обновления было выска-
зано еще 1925 году и экспериментально обосновано в 40-х го-
дах в опытах с наложением лигатур на аксоны двигательных
клеток передних рогов спинного мозга. Через несколько дней
после наложения таких лигатур в проксимальной прилегающей
к лигатуре области аксона наблюдался наплыв эксоплазмы,
в дистальной области, наоборот, происходило заметное умень-
шение диаметра аксона. При снятии лигатуры постепенно вос-
станавливались нормальные отношения. Анализ результатов
этих опытов и соответствующие расчеты показали, что в аксо-
нах имеет место постоянный ток аксоплазмы в дистальном на-
правлении со скоростью 1 мм в сут. Опыты с мечеными амино-
кислотами, проведенные на разных объектах, подтвердили эти
выводы и показали универсальное распространение медленно-
го аксотока (0,5—5 мм в сут) во всех исследованных нейронах.
Кроме того, в опытах с инъекцией меченых аминокислот в ин-
дивидуальные нейроны обнаружено медленное перемещение
меченого белка в дистальном направлении не только в аксонах,
но и дендритах. Дифференцированный анализ перемещения
344
меченых белков по аксону показал, что помимо медленного
аксотока имеют место, по крайней мере, еще два типа тран-
спорта — промежуточный и быстрый аксотоки. Кроме того,
давно известно, что помимо перемещения синтезируемых в пе-
рикарионе компонентов в дистальном направлении по аксону
и, по-видимому, по дендритам существует транспорт веществ
с периферии к центру. Его наличие было недавно показано
в опытах с блокированием транспорта сильным местным охла-
ждением в участках аксонов, выведенных под кожу. При этом
в дистальных областях аксона на границе с охлажденным уча-
стком накапливались ограниченные мембраной пузырьки, ко-
торые, очевидно, в нормальных условиях перемещались в прок-
симальном направлении. Из всех приведенных выше данных
ясно, что отростки нервных клеток представляют собой весьма
сложные транспортные системы. Тонкие механизмы транспор-
та веществ по отросткам весьма разнообразны. Имеются экспе-
риментальные данные о том, что в нем принимают участие
эндоплазматическая сеть, ограниченные мембраной пузырьки
и гранулы, микротрубочки и нейрофиламенты, а также актин-
миозиновая система клеточного цитоскелета. За отдельные ви-
ды транспорта отвечают, по-видимому, разные из перечислен-
ных выше клеточных структур.
§ 2. Синапсы
В анализирующей интегративной деятельности нервной си-
стемы особое значение имеют специфические контакты между
нервными клетками — синапсы. Такие контакты и клеточный
принцип организации нервной системы были установлены в на-
чале XX века. Естественно, что изучение тонкой структурно-
химической организации и функции синапсов составляет це-
лый самостоятельный раздел в комплексной современной науке
нейробиологии. В настоящее время изучена ультраструктурная
и химическая организация синапсов в разных отделах нервной
системы и у разных представителей многоклеточных животных.
Делаются успешные попытки выявить функциональное значение
отдельных структур и всего синаптического комплекса в це-
лом. При этом удалось установить одну интересную общебио-
логическую закономерность. Оказалось, что, несмотря на боль-
шое разнообразие синапсов в нервной системе одного, живот-
ного, не существует больших различий между синаптическими
приборами в нервной системе низко- и высокоорганизованных
многоклеточных животных. Этот факт свидетельствует, очевид-
но, о том, что механизмы взаимодействия нервных клеток до-
статочно универсальны для всех многоклеточных животных
независимо от их филогенетических отношений. Они формиру-
ются и совершенствуются в процессе эволюции в едином на-
правлении и развиваются на основе специализации общих для
345
всех эукариотных клеток структур их поверхностного ап-
парата.
Все синапсы, несмотря на разнообразие их структурно-хи-
мической организации, можно разделить на два типа: электро-
тонические и химические синапсы. Электротоническпе синапсы
имеют вспомогательное значение в нервной системе и обеспечи-
вают непосредственную передачу нервного импульса между
контактирующими клетками. Электротонические синапсы по
Рис. 87. Схемы ультраструктурной Организации синапсов.
1 — электротоиический, 2 — химический синапсы, 3 — синаптические пузырьки, 4 — пост-
сииаптическое уплотнение, 5 — иейротрубочки, 6 — цистерны гладкой ЭПС, 7 — субмем-
бранные уплотнения цитоплазмы в пресинапсе (dense projection), 8 — синаптическая
щель.
своей структуре бывают двух вариантов. Более распространен-
ная их разновидность характеризуется наличием узкой щели
между апикальными поверхностями плазматических мембран
контактирующих клеток (рис. 87). Ширина щели около 2 нм.
В месте контакта в мембранах обеих клеток имеются интег-
ральные белки, наружные части которых выступают над голов-
ками липидов и непосредственно контактируют друг с другом.
Считают, что передача импульсов осуществляется именно
в точках соприкосновения этих белков. Во второй разновидно-
сти электротонических синапсов щель между плазматическими
мембранами двух контактирующих нервных клеток отсутст-
вует, и они непосредственно соприкасаются своими наружными
346
поверхностями. В электротонических синапсах импульс может
передаваться, как правило, в обоих направлениях. В некото-
рых специализированных электротонических синапсах показано
лишь одностороннее проведение импульса, однако конкретные
механизмы такой поляризации в настоящее время не ясны. Как
следует из вышеизложенного, электротонические синапсы не
отличаются принципиально от аналогичных плотных контак-
тов, наблюдаемых в других тканях, например в эпителиальных
и мышечных. В последних, как было показано выше, они так-
же используются для распространения возбуждения — непо-
средственной передачи импульса с одной клетки на контактиру-
ющую с ней. Вероятно, в эволюции электротонические синапсы
послужили той основой, на которой развились химические си-
напсы, принципиально отличающиеся от электротонических по
механизму передачи возбуждения или торможения. Первичный
и более «примитивный», на первый взгляд, характер электро-
тонических синапсов не привел к их исчезновению в нервных
системах высокоорганизованных животных. В этих системах
электротонические синапсы стали использоваться для коор-
динации работы популяций однозначных в функцио-
нальном отношении клеток, что, естественно, облегчило и упро-
стило создание сложных многоклеточных нервных аппа-
ратов.
Второй, наиболее характерный и специфичный для нервной
системы тип синапсов — химические. Они принципиально отли-
чаются от электротонических синапсов тем, что в них при по-
моши медиатора происходит трансформация нервного импуль-
са в одной клетке в нервный импульс другой, а не простая его
передача между клетками. Появление химических синапсов
в эволюции нервных систем многоклеточных животных создало
предпосылки для развития основного свойства нервной систе-
мы—не только реагировать на внешние и внутренние раздра-
жения рецепторов, но, анализируя их, обеспечивать целесооб-
разную работу эффекторных систем организма. Иными слова-
ми, только с появлением химических синапсов стало возмож-
ным развитие нервной системы как основной интегративной
системы многоклеточных животных.
Естественно, что в связи с принципиально иным механиз-
мом работы химических синапсов их тонкое строение сущест-
венно отличается от строения электротонических синапсов. На-
чало процессов, обеспечивающих новообразование нервного
импульса (возбуждающие химические синапсы) или гиперполя-
ризацию мембраны клетки, затрудняющую такое новообразо-
вание (тормозные химические синапсы), происходит в этих си-
напсах путем выделения химических веществ — медиаторов.
Они специфически действуют на плазматическую мембрану
нервной клетки в области синапса. Выделение медиатора осу-
ществляется отростками одной клетки, а специфическое его
347
восприятие — отростками или телом другой нервной клетки.
В связи с этим химические синапсы, как правило, полярны
и обеспечивают лишь одностороннюю передачу сигнала. Взаи-
моотношение между клетками при работе химических синапсов
происходит по принципу «команда — исполнение», а не по прин-
ципу «товарищеского» взаимодействия, как в случае электрото-
нических синапсов. В химическом синапсе выделяются две рез-
ко отличающиеся между собой части: пресинаптическая часть,
принадлежащая командующей нервной клетке, и постсинапти-
ческая — клетке-исполнительнице (рис. 87). Кроме того, весь-
ма важную роль в его работе играет синаптическая щель —•
структура толщиной около 20 нм, образующаяся на основе
специализированных надмембранных комплексов контактирую-
щих клеток, расположенная между пре- и постсинаптическими
частями синапса.
Основное назначение пресинаптической части, или пресинап-
са, заключается в регулируемом нервным импульсом выбросе
медиатора,в синаптическую щель. В качестве медиатора в раз-
ных синапсах используется одно из большого количества пре-
имущественно низкомолекулярных соединений: ацетилхолин,
холин, адреналин, норадреналин, серотонин, различные поли-
пептиды и аминокислоты, пурины и даже АТФ. Соответственно
этому имеется сложная биохимическая классификация синап-
сов и даже нервных клеток, поскольку обычно нервные клетки
синтезируют и выделяют лишь медиаторы одного типа. В по-
следнее время появилось, однако, много данных, противореча-
щих этому правилу. Естественно, что детали структурно-хими-
ческой организации пресинапсов определяются химической при-
родой медиатора конкретного синапса.
Назначение структур синаптической щели заключается
в направленном перемещении медиатора к постсинаптической
мембране, а часто и в удалении его из области контакта после
воздействия медиатора на рецепторы постсинаптической мем-
браны. Тонкая регуляция количества и скорости проведения по
структурам синаптической щели лежит, по-видимому, в основе
таких процессов, как облегчение генерации импульса и в ко-
нечном счете определяет или участвует в определении такого
сложного свойства нервной системы, как долговременная па-
мять.
Одна из главных задач постсинаптической части заключа-
ется в специфической рецепции медиатора, а иногда и в его
разрушении. Вторая задача состоит в обеспечении специфиче-
ского ответа на сигнал, полученный через действие медиатора
на рецептор. В возбуждающих синапсах этот ответ заключа-
ется в изменении проницаемости мембраны и начале процес-
сов, приводящих к генерации нового нервного импульса. В тор-
мозных синапсах происходит гиперполяризация мембраны
и затрудняется возбуждение нервной клетки при действии дру-
348
гих синапсов. Естественно, что конкретные детали химической
организации рецепторных и отчасти эффекторных компонентов
постсинапса зависят, как и в случае пресинапса, от химической
природы медиатора.
В настоящее время детально изучена структурно-химиче-
ская организация холинэргических синапсов, в частности тех,
в которых медиатором является ацетилхолин.
В пресинаптической части холинэргического синапса, как и в
других химических синапсах, наиболее характерные структу-
ры —• синаптические пузырьки. Они представляют собой
круглые ограниченные мембраной образования, содержащие
ацетилхолин. Форма, размеры синаптических пузырьков и элек-
тронная плотность их содержимого зависят от степени их зре-
лости и химической природы медиатора.
Помимо синаптических пузырьков в пресинапсе имеются
одиночные ограниченные мембраной цистерны и многочислен-
ные митохондрии. При особых методах фиксации, можно обна-
ружить и нейротрубочки, доходящие до пресинаптической мем-
браны. На внутренней стороне пресинаптической мембраны
в подлежащей гиалоплазме располагаются электронноплотные
образования конусовидной формы, так называемые dense pro-
jection. Их размер от основания до вершины конуса примерно
160 нм, а диаметр основания около 55 нм. Они расположены
в шахматном порядке на расстоянии друг от друга, равном
80 нм. Каждый конус связан с 5 соседними при помощи тяжей
таким образом, что на внутренней поверхности пресинаптиче-
ской мембраны, не занятой dense projection и связывающими
их тяжами уплотненной цитоплазмы, образуются участки тре-
угольной формы. Предполагают, что именно в этих участках
происходит выход содержимого синаптических пузырьков в си-
наптическую щель.
Центральным в работе пресинаптической части является во-
прос о механизмах выделения медиатора. По классической схе-
ме выделение медиатора происходит путем направленного пе-
ремещения синаптических пузырьков в область субмембранных
структур пресинаптической мембраны и выведения их содержи-
мого в синаптическую щель путем экзоцитоза. Сигналом для
такого перемещения является распространение нервного им-
пульса в область терминального разветвления нейрона, т. е.
в пресинаптическую область синапса. Изменение проницаемости
мембраны, в частности для ионов Са2+, вызывает повышение
их концентрации в гиалоплазме пресинапса. Их избыток, как
и в сократимых мышечных тканях, делает возможным специ-
фическое взаимодействие актина и миозина, что и перемещает
синаптические пузырьки к пресинаптической мембране. Хоро-
шим подтверждением этой схемы работы пресинапса являются
биохимические данные о наличии актина в гиалоплазме преси-
напса и особенно в области плотных тел у пресинаптической
349
мембраны. Кроме того, в прилегающей к мембране синаптиче-
ских пузырьков гиалоплазме обнаружен миозиноподобный бе-
лок нейростенин.
В кальциевой регуляции работы актин-миозиновой системы пресинапса
существенная роль принадлежит митохондриям, которые могут депонировать
или выделять в гиалоплазму ионы кальция. Кроме того митохондрии уча-
ствуют в некоторых химических синапсах и в синтезе медиаторов.
В некоторых холинэргических синапсах обнаружен своеобразный компен-
саторный механизм новообразования синаптических пузырьков. Они форми-
руются на боковой поверхности пресинапса путем своеобразного пииоцитоза.
Образовавшиеся таким путем органичеиные мембраной пузырьки сливаются
с мембраной отмеченных выше единичных цистерн пресинаптической обла-
сти. Из этих цистерн и происходит образование полноценных синаптических
пузырьков.
Несмотря на многочисленные факты, свидетельствующие в пользу ра-
зобранной выше гипотезы, имеются экспериментальные данные, плохо объ-
яснимые с ее позиций. Так, в опытах с мечеными предшественниками ацетил-
холина удалось показать, что при работе синапса обменивается в основном
ацетилхолин, сосредоточенный в гиалоплазме. Ацетилхолин, находящийся
в синаптических пузырьках, согласно этим экспериментальным данным, пред-
ставляет собой как бы резервный слабо обменивающийся медиатор, исполь-
зуемый лишь в условиях очень напряжённой работы синапса, которая обыч-
но вызывается искусственным раздражением нервных клеток.
На примере некоторых холинэргических синапсов при особых щадящих
методах фиксации удалось показать наличие в пресинапсе микротрубочек
с перемещающимися по ним синаптическими пузырьками, доходящими до
пресинаптической мембраны.
Таким образом, в отношении даже холинэргических синапсов вопрос
о тонких механизмах их работы остается еще в значительной мере откры-
тым. Еще менее ясен этот вопрос в отношении синапсов с другими медиа-
торами.
Что касается синаптической щели холинэргических и других
синапсов, то в настоящее время ясно, что основу ее структур
составляют углеводные компоненты надмембранных комплек-
сов, в частности углеводные, цепи ганглиозидов (липиды мем-
бран с большой углеводной головкой). Показано изменение
состава последних при увеличении скорости прохождения ме-
диатора. Выяснено, что важное участие в такой регуляции ра-
боты синапсов играют специфические белки, в частности осо-
бый белок S-100.
Довольно много известно уже сейчас о структурно-химиче-
ской организации наиболее важной, постсинаптической части
холинэргических синапсов и их постсинаптической мембраны.
Специфическими структурами этих мембран являются слож-
ные комплексы так называемого холинрецептивного белка. Эти
комплексы состоят из нескольких мономеров, расположение
которых в мембране остается не совсем ясным. »
По данным первых работ с выделением этих комплексов каждый моно-
мер представляет собой интегральный белок, выходящий на обе поверхности
мембраны: т. е. белковый комплекс холинрецептивного белка представляет
собой одновременно и рецепторную, и эффекторную систему. При задейство-
350
вании ацетилхолином рецепторной части мономеров в них происходят кон-
формационные изменения, приводящие к изменению проницаемости мембра-
ны и генерации нервного импульса в нейроне. Биохимиками уже изучена
аминокислотная последовательность каждого из 5 мономеров пентамерпого
комплекса, образующего сложную молекулу холинрецептивных белков в пост-
синаптической мембране электрических органов у рыб. Известны точная
локализация участков молекулы, воспринимающих сигнал от медиатора,
и основные мономеры (а и Р), ответственные за конформационные изме-
нения молекулы при ее специфическом задействовании медиатором.
Вероятно, имеется несколько модификаций организации
постсинаптической части холинэргических синапсов в пределах
нервной системы одного животного и у разных многоклеточных
животных. О наличии таких модификаций свидетельствуют
особенности механизмов удаления избытка медиатора из пост-
синаптической области. В большинстве холинэргических синап-
сов у многоклеточных животных для этой цели служит фер-
мент ацетилхолинэстераза. Молекулы этого фермента распола-
гаются на внешней поверхности постсинаптической мембраны
и тесно связаны с рецепторной частью холинрецептивных бел-
ковых комплексов. В некоторых холинэргических синапсах
у брюхоногих моллюсков для этой цели используются другие
механизмы. Существенные особенности наблюдаются и в орга-
низации субмембранной цитоплазмы в постсинаптической об-
ласти. Здесь часто обнаруживаются субмембранные электрон-
ноплотные участки гиалоплазмы различных размеров и фор-
мы. В некоторых синапсах имеются субмембранные единичные
цистерны гладкой эндоплазматической сети, расположенные
в непосредственной близости от постсинаптической мембраны.
Функциональное значение всех этих структур остается неяс-
ным. Несмотря на принципиальное сходство в организации всех
химических синапсов, конкретная реализация этого общего
принципа отличается в разных синапсах существенными осо-
бенностями. Больше того, разобранная выше химическая
организация постсинаптической’ мембраны холинэргического
синапса представляет, в известном смысле, исключение из обще-
го правила. Более общей закономерностью является простран-
ственное разобщение рецептивных белковых комплексов и ком-
плексов, ответственных за регуляцию проницаемости постсинап-
тической мембраны. Функциональная связь между этими бел-
ками, расположенными в разных участках постсинаптической
мембраны, осуществляется при помощи циклического АМФ
и связанными с ним ферментными системами (аденилатцикла-
за, протеинкиназа и др.).
Помимо электротонических и химических синапсов в нерв-
ных системах многоклеточных животных распространены сме-
шанные, одна часть которых построена по принципу электро-
тонического, а другая — химического синапсов.
Количество синапсов, приходящихся на одну нервную клет-
ку, а точнее их концентрация на поверхности ассоциативных
351
и эффекторных нейронов, естественно возрастает по мере ус-
ложнения нервной системы и увеличения количества в ней
нервных клеток. У высших позвоночных, в частности у млеко-
питающих, в нервных центрах имеются весьма сложные отно-
шения. Даже в относительно древних нервных центрах, кото-
рыми являются двигательные центры передних рогов спинного
мозга, на каждой двигательной клетке имеется (рис. 88) не-
Рис. 88. Синаптические окончания на двигательной нервной клетке передних
рогов спинного мозга млекопитающих [по: Б. Катц].
сколько сотен синаптических окончаний. Если при этом учесть,
что часть их тормозные, а часть возбуждающие, становится
ясным, какая сложная анализаторская работа должна быть
проделана клеткой, прежде чем совершится простейший реф-
лекторный акт — возбуждение двигательного нейрона.
Помимо аксодендрических (синапсы, образованные аксоном
одной и дендритом другой нервных клеток) и аксосоматиче-
ских (аксон — тело нейрона) имеются еще весьма специфиче-
ские аксо-аксональные химические синапсы. Внешне они состо-
ят как бы из двух пресинапсов, однако, по-видимому, в обецх
мембранах имеются рецепторные и эффекторные системы,
обеспечивающие специфическое восприятие медиатора, выделя-
емого в синаптическую щель одним из нейронов. Аксо-аксо-
нальные синапсы способны, вероятно, обеспечивать двустороннее
352
новообразование или торможение нервного импульса, т. е. мо-
гут изменять полярность синаптической его передачи.
Помимо межнейронных синапсов большое значение в дея-
тельности нервно?! системы имеют нервно-мышечные контакты
и другие нервные окончания эффекторных нейронов. Терминаль-
ные разветвления аксонов эффекторных нейронов располага-
ются на специализированных тканевых элементах во всех об-
ластях тела многоклеточных животных. Особенно многочислен-
ны они в различных сократимых тканях.
В качестве примера особенностей морфобиохимической ор-
ганизации подобного рода структур мы рассмотрим эффектор-
ное нервное окончание на соматических мышечных волокнах
позвоночных животных. Эти окончания имеют вид небольших
утолщений или бугорков, расположенных на сарколемме мы-
шечного волокна, и получили название двигательных бляшек.
Их характерная особенность — обилие ядер, которые принад-
лежат расположенному в области двигательной .бляшки скоп-
лению вспомогательных глиальных клеток.
Каждое терминальное разветвление аксона в области
бляшки заканчивается булавовидным расширением, в котором
обнаруживаются структуры, свойственные пресинаптической
части межнейронного синапса (скопление синаптических пу-
зырьков и митохондрий, специфическая организация плазмати-
ческой мембраны с характерными уплотненными участками
цитоплазмы). Особенностью синаптической щели нервно-мы-
шечного синапса являются ее большие размеры (60—120 нм).
Плазматическая мембрана мышечного волокна, за счет кото-
рой формируется постсинаптическая часть синапса, образует
многочисленные складки.
Таким образом, за исключением чисто количественных различий (раз-
меры синаптической щели и гипертрофия мембран постсииаптической части)
общий принцип структурной организации нервно-мышечных синапсов оказы-
вается сходным с химическими синапсами нервных клеток. У позвоночных,
кольчатых червей и у некоторых других групп животных медиатором
в нервно-мышечных синапсах является ацетилхолин. У насекомых в анало-
гичных по ультраструктурной организации нервно-мышечных синапсах роль
медиатора выполняет, по-видимому, глутамат. Помимо холинэргических си-
напсов в мышечных тканях позвоночных имеются еще адренэргические и пу-
ринэргические синапсы, медиаторами в которых являются соответственно
адреналин и пурины. Особенно большое разнообразие в эффекторных нерв-
но-мышечных синапсах наблюдается у гастропод. Медиаторами здесь могут
быть помимо ацетилхолина серотонин, дофамин и несколько разновидностей
полипептидов. Эти примеры наглядно показывают эволюционную пластич-
ность специализированных терминальных аппаратов нервных клеток.
§ 3. Рецепторные нервные окончания
Организация рецепторных нервных аппаратов у современ-
ных многоклеточных животных характеризуется значительно
353
большим разнообразием, чем организация синапсов. Это опре-
деляется двумя основными биологическими особенностями ре-
цепторных нервных приборов. Во-первых, каждый тип рецеп-
торов приспособлен к восприятию одного специфического сигна-
ла (раздражителя) из внешней или внутренней среды. Во-вторых,
в рецепторных нейронах и специализированных для.этой цели ре-
цепторных клетках других тканей происходит преобразование
энергии внешнего стимула в энергию нервного импульса, или
рецепторного потенциала..
По происхождению рецепторные клетки делятся на две
группы: первичночувствующие (видоизмененные нейроны)
и вторичночувствующие (видоизмененные глиальные или эпите-
лиальные клетки). Вторичночувствующие клетки более харак-
терны для позвоночных животных, однако они имеются и у
гребневиков, а возможно и у головоногих моллюсков. Первично-
чувствующие рецепторные клетки в ответ на специфическое
раздражение генерируют обычно нервный импульс, а вторично-
чувствующие — рецепторный потенциал.
Эти существенные особенности свойств первично- и вторнч-
ночувствующих клеток однако не абсолютны. Фоторецепторные
клетки, представленные у всех животных первичночувствую-
щими клетками, генерируют в ответ на раздражение светом
рецепторный потенциал. Эта особенность характерна и для не-
которых механорецепторов беспозвоночных животных, образо-
ванных видоизмененными нейронами.
Все рецепторы у многоклеточных животных можно разде-
лить в биологическом плане на две большие группы: интеро-
рецепторы и экстерорецепторы. Интерорецепторы служат для
восприятия специфических раздражений из внутренней среды
организма, с его клеточных элементов или межклеточных
структур. В качестве примера интерорецепторов рассмотрим
лишь одну из разновидностей инкапсулированных окончаний,
так называемое фатер-пачиниево тельце млекопитающих (рис.
89).
В образовании фатер-пачиниевого тельца принимают уча-
стие терминальные разветвления дендрита чувствительной
нервной клетки, специализированные фиброциты, система кол-
лагеновых волокон соединительной ткани и видоизмененные
глиальные клетки. Наружная капсула образована продольно
ориентированными фиброцитами и системой коллагеновых во-
локон, спирально расположенных вокруг длинной ее оси. Кол-
лагеновые волокна фиксируются в основании тельца, что обес-
печивает лишь незначительные смещения капсулы относитель-
но внутренней части инкапсулированного окончания. Последняя
представлена разветвлениями дендритов чувствительных кле-
ток в студенистом аморфном веществе (внутренняя колба)
и системой глиальных клеток.
В концевых разветвлениях дендритов удается обнаружить
354
большое количество митохондрий. На дендритах чувствитель-
ной клетки спинального ганглия находятся синаптические кон-
такты с терминалями аксонов либо эффекторных клеток веге-
тативной нервной системы, либо вторично-чувствующих клеток
глиального происхождения. В пользу последнего предположе-
ния говорит наличие у клеточных элементов, расположенных
на границе наружной капсулы и внутренней колбы, антенных
Рис. 89. Схема строения инкапсулированного интерорецептора — тельца Фа-
тер-Пачиии [по: Отелнн и др.].
1 — слоистая капсула, 2 — виутреиияя колба, 3 — дендрит чувствительной нервной клет*
ки, —спиральные коллагеновые волокна, 5 — фиброциты, 6 — глиальные клетки
с ресничками, 7 — возможные синаптические контакты аксонов вторичночувствующих
клеток.
структур в виде видоизмененных ресничек и микроворсинок. Воз-
можно, что восприятие механического раздражения и преоб-
разование его в рецепторный потенциал происходят в этих
клетках при смещении наружной капсулы относительно внут-
ренней колбы. Эти глиальные клетки могут выполнять и иную
функцию, а генерация нервного импульса в таком случае про-
исходит в результате непосредственной деформации дендритных
разветвлений рецепторной клетки спинальных ганглиев.
Экстерорецепторы — это разнообразная группа рецепторов,
обеспечивающих поступление информации в нервную систему
из внешней для организма среды.
Наиболее рациональной классификацией экстерорецепто-
ров является классификация, в основу которой положен функ-
циональный принцип, позволяющий выделить среди экстероре-
цепторов три разновидности — механорецепторы, хеморецепто-
ры и фоторецепторы. К первой группе относятся концевые нерв-
355
ные аппараты, генерация импульсов в которых основана на меха-
ническом воздействии раздражителей на рецепторные приборы.
Деятельность не менее широко представленных хеморецепторов
основана на химическом взаимодействии раздражителя с рецеп-
торными аппаратами плазматических мембран. Особую и очень
важную разновидность экстерорецепторов составляют фоторе-
цепторы, где раздражителем являются фотоны световой энер-
гии.
Помимо такой функциональной классификации существует
еще и общебиологическая классификация экстерорецепторов на
контактные и дистантные рецепторы. Последние позволяют
животному ориентироваться в пространстве, не вступая в не-
посредственный контакт с источником раздражения. Очевидно,
что дистантные рецепторы, к которым относятся органы зре-
ния, обоняния, слуха и гравитации, представляют собой в об-
щебиологическом смысле чрезвычайно важную группу. Их ор-
ганная и тонкая морфобиохимическая организация достигает
у прогрессивно эволюционирующих групп животных большой
сложности и совершенства.
Наиболее простым примером механорецепторов могут слу-
жить чувствительные волоски насекомых. Они имеют вид ку-
тикулярных конусов, подвижно сочлененных с кутикулярной
пластинкой кожного покрова. Кутикула волоска и подвижных
сочленений образуется особыми, обычно немногочисленными
клетками гиподермы. Внутрь полости кутикулярного волоска
заходит специализированный дендрит биполярной чувствитель-
ной клетки, тело которой располагается обычно в самой гипо-
дерме. При смещении гиподермального аппарата чувствитель-
ных волосков происходит деформация дендрита чувствительной
нервной клетки. В процессе такой деформации и возникает
нервный импульс или генерируется рецепторный потенциал,
т. е. механическая энергия смещения волоска трансформиру-
ется в электрическую энергию нервного импульса.
Примерами более сложно устроенных механорецепторов
многоклеточных животных могут служить их органы «грави-
тации». Эти органы в процессе эволюции независимо возникли
у разных групп многоклеточных животных и совершенствова-
лись в пределах каждой систематической группы. Несмотря на
это, рецепторы «гравитации» у подавляющего большинства
многоклеточных животных строятся по одной и той же схеме.
В любом органе равновесия обязательно есть так называемая
«пробная масса», массивное внеклеточное образование, спо-
собное перемещаться при изменении положения организма
в гравитационном поле. Вторым основным компонентом органа
«гравитации» является чувствительная антенна, представлен-
ная видоизмененными жгутиками или микроворсинками. Эти
структуры образуются нервной или особой чувствительной
клеткой, генерирующими нервный импульс (нервная клетка)
356
или рецепторный потенциал (чувствительная клетка). Органы
«гравитации» в процессе эволюции претерпевают большие ус-
ложнения, благодаря чему высшие многоклеточные животные
получают возможность не только ориентироваться в статиче-
ском гравитационном поле, но и анализировать угловые уско-
рения при перемещении тела в пространстве. Способность к та-
кого рода рецепции достигается за счет усложнения у высших
животных всех основных компонентов органа «гравитации»
и появления ряда вспомогательных структур.
, Особой сложности орган «гравитации» достигает у высших
позвоночных, ракообразных и головоногих моллюсков. У мле-
копитающих орган равновесия входит в состав внутреннего
уха и представлен частью перепончатого лабиринта, которая
состоит из двух связанных между собой мешочков с тремя по-
лукружными каналами, расположенными в трех взаимно пер-
пендикулярных плоскостях (рис. 90, а). Все эти части перепон-
чатого лабиринта залегают в костных полостях и окружены
перилимфой. Мешочки сообщаются между собой при помощи
Рис. 90. Перепончатый лабиринт млекопитающих (а) и участок его эпители-
альной выстилки с вторичночувствующими клетками (б).
1—3 — полукружные каналы (/ — передний, 2 — задний, 3 — горизонтальный), 4, 5 —
слуховые пятна, 6 — улитка, 7, 8— два типа вторичночувствующнх рецепторных клеток,
9 — микроворсинки, 10 — ядро, // — аппарат Гольджи, 12 — митохондрии, 13— чаше-
видные и 14 — бутонообразные нервные окончания, 15 — миелинизированное нервное
волокно, 16 — шероховатая ЭПС.
357
узкого канала. Полукружные каналы в области соединения
с одним из мешочков имеют расширения, так называемые ам-
пулы. Внутри перепончатого лабиринта находится эндолимфа.
Стенка лабиринта изнутри выстлана .однослойным эпителием,
в котором в определенных местах расположены вторично-чув-
ствующие клетки. В мешочках это так называемые слуховые
пятна, а в основании полукружных каналов — слуховые гре-
бешки. В эпителии среди обычных цилиндрических или призма-
тических клеток имеются клетки, снабженные чувствительными
антеннами в виде одной длинной видоизмененной реснички
и пучка (60—80) микроворсинок (рис. 90, б). Они погружены
в «пробную массу», имеющую в области слуховых пятен упло-
щенную, а в области слуховых гребешков конусовидную
форму.
Чувствительные клетки слуховых пятен генерируют элект-
рический сигнал, так называемый рецепторный потенциал, в ре-
зультате раздражения антенн при изменении положения тела
в пространстве, а также при вибрационных воздействиях. Ан-
тенный аппарат чувствительных клеток слуховых гребешков
смещается в результате инерционной задержки перемещения
пробной массы при быстром повороте головы или ускоренном
угловом вращении тела в пространстве.
Аналогичное в принципе строение имеет и орган слуха мле-
копитающих, вторичночувствующие клетки которого расположе-
ны в особой части перепончатого лабиринта — улитке. Вместе
со сложной системой вспомогательных эпителиальных клеток,
коллагеновых волокон подлежащей ткани и особой мембраной
(выполняющей роль «пробной массы») здесь образуется слож-
ный, так называемый кортиев орган.
У некоторых головоногих моллюсков (осьминог), так же
как и у позвоночных животных, видоизмененный и сложно
устроенный, наполненный эндолимфой статоцист находится
в перилимфатической полости. У других головоногих -моллюс-
ков (кальмары) полость с перелимфой может отсутствовать,
тогда в стенке органа «гравитации» развиваются многочислен-
ные выросты, обеспечивающие весьма сложные токи эндолим-
фы при перемещении животного в пространстве. Как и у позво-
ночных животных, рецепторными аппаратами у головоногих
моллюсков являются слуховые пятна и слуховые гребешки, или
кристы. Последние также располагаются в трех взаимно пер-
пендикулярных плоскостях.
У позвоночных две кристы имеют вертикальное и одна гори-
зонтальное положение, а у головоногих моллюсков— две го-
ризонтальные кристы и одна вертикальная. Чувствительный
клетки у головоногих моллюсков, как и у многих других групп
беспозвоночных животных, являются ' видоизмененными нейро-
нами. Однако морфобиохимическая дифференцировка и антен-
ного аппарата, и тела клетки весьма сходна с дифференциров-
358
кой вторичночувствующих эпителиальных клеток у позвоноч-
ных животных. Дендриты первичночувствующих клеток органа
«гравитации» головоногих моллюсков представляют собой мик-
роворсинки и видоизмененные реснички. Количество последних,
однако, значительно больше, чем у позвоночных животных.
Для чувствительных нервных клеток головоногих моллюсков
характерно обилие эфферентной их иннервации, что свидетель-
ствует о контроле за их деятельностью со стороны централь-
ной нервной системы. Что касается взаимоотношений чувстви-
тельных клеток с «пробной массой» слуховых пятен и гребеш-
ков, а также функционального значения этих структур, то они
в принципе аналогичны тем отношениям, которые наблюдаются
в органе равновесия у позвоночных животных. Слуховые пятна,
как и у позвоночных животных, являются рецепторами грави-
тации, а кристы представляют собой рецепторы угловых уско-
рений. Кроме того, и те и другие рецепторы весьма чувстви-
тельны к вибрации. Имеются данные о том, что у некоторых
головоногих моллюсков часть чувствительных клеток является
вторичночувствующими.
Таким образом, на примере органов «гравитации» голово-
ногих моллюсков и позвоночных животных мы видим, насколь-
ко глубоки черты сходства аналогичных структур на субкле-
точном, тканевом и даже органном уровнях организации у жи-
вотных, весьма. удаленных в филогенетическом отношении.
Вместе с тем в одних случаях (первичноротые животные) мы
имеем дело в основном с видоизмененными нейронами, а в
других (позвоночные) — с видоизмененными вторичночувствую-
щими эпителиальными клетками. Интересно отметить, что вто-
ричночувствующие клетки обнаружены недавно в органах «гра-
витации» у таких относительно низкоорганизованных живот-
ных, как гребневики. Очевидно, что их возникновение в этом
типе произошло независимо параллельно с их возникновением
у позвоночных животных.
Широкое распространение аналогичных дифференцировок,
особенно на субклеточном уровне организации органов равно-
весия, наблюдается и у других животных. Наряду с этим у не-
которых групп животных, как, например, у насекомых, уни-
версальные для большинства многоклеточных животных орга-
ны «гравитации» на основе более или менее видоизмененного
статоциста полностью утрачиваются и заменяются другими ор-
ганами.
Хеморецепторы составляют вторую группу экстерорецепто-.
ров многоклеточных организмов. Несмотря на то, что молеку-
лярные механизмы хеморецепции достаточно универсальны,
строение основных воспринимающих клеток и вспомогательных
элементов весьма разнообразно как у одного и того же орга-
низма, так и у представителей различных групп многоклеточ-
ных животных.
359
К типичным хемоэкстерорецепторам относятся органы вкуса
и обоняния. Они у высших организмов достигают весьма слож-
ной структурной организации. В основе восприятия раздраже-
ния и кодирования его в нервный импульс или рецепторный
потенциал jb контактном хеморецепторе органа вкуса и дистант-
ном рецепторе органа обоняния лежит один и тот же меха-
низм. Он в конечном счете заключается во взаимодействии мо-
лекул различных веществ со специфическими белковыми моле-
кулами, вмонтированными в специализированные мембраны
соответствующих первично- или вторичночувствующих клеток.
В качестве примеров хеморецепторов мы рассмотрим органы
вкуса и обоняния высших многоклеточных животных —позво-
ночных и насекомых.
Непосредственное восприятие раздражения специфическими
молекулами в органах вкуса и обоняния осуществляется либо
специализированными дендритами видоизмененных чувстви-
тельных нейронов, либо антенным аппаратом вторичночувст-
вующих клеток. Последние у млекопитающих сосредоточены
в основном в многослойном эпителии дорсальной стенки языка,
в так называемых вкусовых луковицах (рис. 91, а). Каждая
..вкусовая луковица представляет собой сложно организованную
систему вторичночувствующих и вспомогательных опорных
эпителиальных клеток. Вкусовые луковицы расположены в тол-
ще эпителиального пласта, при этом на их периферии нахо-
дятся преимущественно опорные (светлые), а в центре — чув-
ствительные (темные) клетки. На вершине луковицы имеется
пора, через которую апикальные отростки чувствительных кле-
ток контактируют с секретом желез ротовой полости, с раст-
воренными в нем специфическими молекулами. Апикальные
отростки вкусовых чувствительных клеток имеют вид своеоб-
разных кисточек. Они представляют собой специализи-
рованные конусовидные участки цитоплазмы, на конце
которых сосредоточены многочисленные и хорошо развитые мик-
роворсинки. В апикальной части цитоплазмы и микроворсин-
ках много микротрубочек и фибриллярных структур, которые
связаны с клеточным центром. В цитоплазме клеток удается
выявить многочисленные митохондрии, элементы аппарата
Гольджи, эндоплазматическую сеть и лизосомный аппарат.
В местах контакта темных вторичночувствующих клеток с тер-
минальными разветвлениями дендритов чувствительных нерв-
ных клеток плазматическая мембрана и прилегающая цито-
плазма вкусовых клеток формируют характерные пресинапти-
ческие участки.
Рис. 91. Вкусовые луковицы млекопитающих и вкусовой волосок насекомых,
а —вкусовые луковицы, б — вкусовой волосок насекомых; Z — вкусовая луковица, 2 —
пора на вершине вкусовой луковицы (место расположения микроворсииок), 3 — много-
слойный эпителий, 4 — вкусовая клетка с микроворсинками, 5 — рецепторная клетка,
6 — центральные отростки, 7 — проксимальный и 8 — дистальный сегменты перифери-
ческого отростка, 9 — кутикулярный эпителий, 10 — базальная мембрана.
360
361
Таким образом, воспринимающие вкусовые раздражения
клетки представляют собой весьма сложные по своей морфо-
биохимической организации специализированные клеточные
элементы. Еще одной интересной особенностью этих клеток
является их относительно непродолжительный жизненный цикл.
При этом источником их пополнения являются, по-видимому,
специальные участки общей камбиальной системы многослой-
ного плоского эпителия. У других позвоночных животных строе-
ние органов вкуса принципиально сходно с их строением у мле-
копитающих.
У беспозвоночных, в частности у хорошо изученных в этом
отношении насекомых, восприятие вкусового раздражения осу-
ществляется не вторичночувствующими клетками, а специали-
зированными дендритами чувствительных нервных клеток (рис.
91, б). Тела последних сосредоточены обычно в виде неболь-
ших скоплений среди клеток кутикулярного эпителия. Дендрит
чувствительной вкусовой клетки состоит из двух частей. Ниж-
няя часть, расположенная ближе к телу клетки, так называ-
емый проксимальный сегмент, представляет собой участок ци-
топлазмы нервной клетки с рибосомами и митохондриями.
Верхний или дистальный сегмент является видоизмененной
ресничкой. Он заходит в полость специального конусо-
видного выроста кутикулярной пластинки, имеющего на
вершине отверстие, где апикальная часть дистального сег-
мента вступает в непосредственный контакт с внешней
средой.
Хеморецепторы органа обоняния у позвоночных и у беспоз-
воночных представлены чувствительными нервными клетками,
т. е. раздражение, производимое пахучими молекулами, не-
посредственно воспринимается специализированными дендри-
тами этих клеток. У млекопитающих и других .позвоночных жи-
вотных они имеют вид палочко- или колбообразных структур,
заканчивающихся на дистальном конце специализирован-
ными подвижными утолщениями — обонятельными булавами
(рис. 92, а). Последние могут выдвигаться над поверхностью или,
наоборот, втягиваться в толщу эпителиального пласта, обра-
зованного опорными и секреторными вспомогательными клет-
ками. Булавы на своей поверхности имеют чувствительные во-
лоски, или антенны, длиной до 200 мк. Они в свою очередь
представляют собой подвижные образования, построенные до
типу реснички или жгутика. Однако характер движения этих
структур резко отличается от движения обычных ресничек.
Имеющиеся данные показывают, что основным местом вза-
-имодействия пахучих молекул с плазматической мембраной*
обонятельных чувствительных клеток являются мембраны ан-
тенн— преобразованных жгутиков, подвижность которых спо-
собствует более совершенному контакту пахучих молекул
с плазматической мембраной.
362
Рис. 92. Схемы ультраструктурной организации участка обонятельного эпи-
телия млекопитающих (а) и органа обоняния у насекомых (б).
1 — первнчночувствующая рецепторная клетка, 2 — обонятельная булава, 3 — обоня-
тельные волоски, 4 — аксон, 5 — опорная клетка, 6 — базальная мембрана, 7 — рецеп-
торная клетка, 8 — проксимальный и 9 — дистальный сегменты периферического от-
ростка, 10 — центральный отросток, 11 — кутикулярная дисковидная пластинка с по-
рами, 12 — кутикула.
363
1
Тело обонятельной
клетки содержит общие
для всех клеток органои-
ды. От ее базальной час-
ти отходит центральный
отросток — аксон, обра-
зующий характерные тер-
минальные разветвления з
виде клубочков в обоня-
тельных долях головного
мозга.
У насекомых, как и
у позвоночных животных,
чувствительные обоня-
тельные клетки представ^
ляют собой специализи-
рованные биполярные
нейроны (рис. 92, б). Ци-
топлазма этих клеток от-
личается необыкновен-
ным богатством органои-
дов. Здесь имеются хо-
рошо развитая эндоплаз-
матическая сеть, элемен-
ты аппарата Гольд-
жи, мультивезикулярные
тельца, лизосомы и дру-
гие образования. Пери-
ферический отросток име-
ет сложное строение и
состоит из двух сегмен-
тов. На границе между
ними расположено ба-
зальное тельце, от кото-
рого в наружный сегмент
распространяется трубоч-
ковый аппарат жгутика,
а во внутренний — кор-
невые поперечно-исчер-
ченные нити. Наружный
сегмент проникает в по-
Рис. 93. Схема организации
фоторецепторов позвоночных
животных. «•
I — палочки, II — колбочки; 1. —
наружный сегмент, 2— внутренний
сегмент, 3 — скопление митохонд-
рий, 4 —отростки клеток пигмент-
ного эпителия, 5 — ядро, 6 синап-
тическая зона, 7 — масляная капля.
364
лость специализированного участка кутикулярной пластинки,
где и дает терминальные разветвления. В этом месте в специа-
лизированной кутикуле имеется сложно устроенная система
пор,' с которыми контактируют концевые разветвления апикаль-
ного конца дистального сегмента дендрита обонятельной нерв-
ной клетки.
Фоторецепторы у всех многоклеточных животных представ-
ляют собой первичночувствующие нервные клетки с весьма
сложно устроенными специализированными дендритами. У по-
звоночных животных это так называемые палочки и колбочки
(рис. 93). Они состоят из наружного и внутреннего сегментов,
разделенных узкой перетяжкой, в которой располагаются силь-
но редуцированные микротрубочки ресничек и базальное тель-
це. Во внутреннем сегменте у палочек находится плотное скоп-
ление большого количества митохондрий. В колбочках, кроме
того, имеется еще и маслянистая капля, которая у некоторых
позвоночных может быть окрашена каратиноидами в красный,
желтый и желто-зеленый цвет. В базальной части внутреннего
сегмента дендрита палочек и колбочек на границе с телом
клетки иногда располагаются скопления структурированных
гранул гликогена — основного субстрата для энергетического
метаболизма клеток.
В теле фоторецепторных клеток относительно хорошо раз-
вита гранулярная эндоплазматическая сеть, имеются также
и свободные рибосомы. В надъядерной области сосредоточен
компактный, но хорошо развитый аппарат Гольджи. Особен-
ностью тела клеток является полное отсутствие здесь мито-
хондрий, поскольку весь энергетический аппарат сосредоточен
во внутреннем сегменте. Единичные митохондрии наблюдаются
лишь в пресинаптической области короткого аксона.
Наиболее характерной специфической структурой фоторе-
цепторных клеток позвоночных животных является мембранный
аппарат наружного сегмента. Последний заполнен плотно упа-
кованными дисками, представляющими собой погруженные
внутрь цитоплазмы складки плазматической мембраны. В па-
лочдах основная часть наружного сегмента построена из таких
мембранных дисков, утративших структурную связь с плазма-
тической мембраной. Лишь в базальной части наружного сег-
мента эта связь сохраняется. В колбочках связь между плаз-
матической мембраной и дисками наружного сегмента наблю-
дается на всем его протяжении. Система мембранных дисков
палочек представляет собой весьма динамично и полярно об-
новляющуюся структуру.
В авторадиографических опытах с мечеными аминокислотами удалось
показать, что на рибосомном аппарате клеток-палочек идет интенсивный бел-
ковый синтез. Значительная часть вновь синтезированного белка поступает
в основание наружного сегмента, где используется на построение новых
дисков. Интенсивность таких процессов даже у амфибий настолько велика,
что за сутки образуется от 25 до 36 дисков. Такое же количество дисков
365
за это время утрачивается клетками на апикальной поверхности по-ввдпмо-
му, путем фагоцитоза вспомогательными пигментными клетками. В колбоч-
ках не обнаружено такого поляризованного обновления мембранных структур.
Включение меченого белка здесь происходит равномерно во все складки
плазматической мембраны наружного сегмента.
В мембранах дисков наружных сегментов фоторецепторных
клеток основную часть белкового компонента составляют спе-
цифические белки опсины. Они могут образовывать слабые
легко разрушающиеся на свету связи с ретиналем — производ-
ным каротинов, синтезируемых растительными клетками и по-
ступающих в животный организм с пищей. Ретиналь является
важнейшим структурным компонентом мембран дисков. При
отсутствии каротинов у позвоночных не формируются мембран-
ные структуры дисков.
Процессы разложения родопсина на свету и ресинтез его
в темноте, протекающие непрерывно в мембранных структурах
дисков, и лежат в основе специфической фоторецепции чув-
ствительных клеток органов зрения. Непосредственной причи-
ной генерации рецепторного потенциала при воздействии фото-
нов является изменение проницаемости мембраны, обусловлен-
ное конформационными изменениями молекул родопсина.
Для всех фоторецепторов характерна уже отмеченная для
позвоночных гипертрофия специализированного мембранного,
аппарата. Однако для первичноротых и особенно их высших
представителей — насекомых и головоногих моллюсков, свой-
ствен другой по сравнению с позвоночными животными меха-
низм такой гипертрофии. На боковой поверхности фоторецеп-
торной клетки образуются длинные, расположенные перпен-
дикулярно к ее телу и направлению света микроворсинки,
которые контактируют с аналогичной системой микроворсинок
соседних фоторецепторных клеток (рис. 94, а). Таким образом,
в фоторецепторах насекомых воспринимающий антенный аппа-
рат и метаболический центр клеток с хорошо развитым белок-
синтезирующим и энергетическим аппаратами оказываются
пространственно менее разобщенными, чем у позвоночных жи-
вотных. Тем не менее в авторадиографических опытах пока-
зано, что у насекомых, как и в палочках позвоночных живот-
ных, имеет место поляризованное обновление аппарата микро-
ворсинок.
У головоногих моллюсков фоторецепторы внешне больше
похожи на фоторецепторы позвоночных животных (рис. 94, б).
Их клетки-палочки состоят из воспринимающего перифериче-
ского отростка, тела клетки и центрального отростка аксона,
т. е. имеют характерную биполярную структуру. Однако в пе-
риферическом отростке нет остатков жгутиковых или реснич-
ных структур, а гипертрофия мембран в палочковидном отро-
стке достигается не врастанием плазматической мембраны в ци-
топлазму отростков, а, как у насекомых, образованием слож-
Збб
Рис. 94. Схема ультраструктуриой организации фоторецепторов беспозвоноч-
ных животных.
а — насекомые, б — головоногие моллюски; i — микроворсники,
хондрин, 4 —аппарат Гольджи, 5 — эндоплазматическая сеть,
ток пигментной клетки, 8 — базальная мембрана, 9— гранулы
называет направление лучей света.
2 — ядро, 3 — мито-
6 — аксон, 7 — учас-
пнгмента. Стрелка по-
367
ной системы многочисленных микроворсинок, расположенных
перпендикулярно длинной оси палочковидного отростка.
Универсальной закономерностью морфобиохимической орга-
низации фоторецепторов многоклеточных животных являются
сходный химический состав и сходная молекулярная организа-
ция гипертрофированного мембранного аппарата. У всех изу-
ченных представителей многоклеточных животных основными
белковыми компонентами мембран дисков или системы ми-
кроворсинок. являются белки опсины, а в основе рецепции
света лежит фотолиз и последующее восстановление родо-
псина.
Таким образом, использование каротиноидов растительного
происхождения в фоторецепции у многоклеточных животных—
необходимое условие структурной и биохимической организации
фоторецепторов. Детали фотолиза и ресинтеза родопсина могут
варьировать у разных представителей многоклеточных живот-
ных. Так, у головоногих моллюсков, помимо родопсина есть
еще и другой зрительный пигмент — ретинохром, который уча-
ствует в ресинтезе родопсина в темноте. Сильно варьируют
также белки опсины и по величине молекул, и по последо-
вательности аминокислот в них. В некоторых отношениях диф-
ференцировка фоторецепторов у насекомых оказывается более
сложной, чем у высших позвоночных. Насекомые способны
различать плоскость поляризации света, они воспринимают
часть светового излучения в ультрафиолетовой области, нако-
нец, у них отчетливо выражена способность к цветному зрению
на клеточном уровне, в то время как у позвоночных животных
такая дифференцировка имеет место лишь на молекулярном
уровне организации мембраны.
§ 4. Нейроглия
Как было уже показано, нервные клетки и образуемые ими
специализированные рецепторные, эффекторные и синаптиче-
ские структуры характеризуются целым рядом биологических
особенностей. К ним прежде всего относятся: необычные ядер-
но-плазменные отношения, высокий уровень метаболической
активности, большая функциональная подвижность специфи-
ческих структур на молекулярном и надмолекулярном уровне
их организации. Естественно поэтому ожидать, что такие спе-
циализированные клеточные элементы, какими являются ней-
роны, нуждаются для своего нормального функционирования
в особой внутренней среде со специальными трофическими,,
защитными и изолирующими механизмами. Такую задачу и вы-
полняет специальная вспомогательная ткань — глия. Она воз-
никает уже на ранних этапах эволюции нервной системы и не-
прерывно совершенствуется во всех прогрессивно эволюциони-
рующих группах многоклеточных животных.
368
Наиболее сложной и разнообразной дифференцировки дос-
тигает нейроглия у высших позвоночных животных. Эта вспо-
могательная ткань нервной системы имеет клеточное строение.
По морфологическим особенностям все глиальные клетки у по-
звоночных можно с известными оговорками разделить на три
большие категории: наиболее древнюю эпендимную глию,
астроцитарную глию и олигодендроглию. Помимо этих разно-
видностей собственно глиальной ткани, называемой макрогли-
ей и происходящей из нервного зачатка, имеется еще особая
Рис. 95. Клеточные элементы макроглии в сером веществе центральной нерв-
ной системы млекопитающих.
а — плазматический и б — фибриллярный астроциты, в — две клетки олигодендроглии
у тела нервной клетки; 1 — сосуд, 2 — отростки глиальных клеток, 3 — тела глналь-
иых клеток, 4 —тело нервной клетки.
система фагоцитарных клеточных элементов. Она получила
название микроглии и представляет собой особую разновид-
ность макрофагов ткайей внутренней среды. В сером веществе
органов центральной нервной системы позвоночных основную
массу нейроглии составляют клетки астроцитарной глии. В ней
удается выделить два типа клеток: фибриллярные и плазмати-
ческие астроциты (рис, 95, а, 6). Плазматические астроциты
имеют слабо ветвящиеся отростки. В их цитоплазме относи-
тельно мало специализированных фибриллярных структур. Бо-
лее тонкие и сильно ветвящиеся отростки-фибриллярных астро-
13 672 369
цитов, наоборот, содержат большое количество фибрилл. По-
мимо типичных астроцитов в некоторых участках нервной сис-
темы позвоночных животных, например в сетчатке, имеются
гигантские клеточные глиальные элементы — мюллеровские
волокна, играющие существенную роль в структурно-простран-
ственной организации нервных центров сетчатки. Более разно-
образна и широко распространена в нервной системе позво-
ночных вторая разновидность нейроглии — олигодендроглия.
Элементы олигодендроглии в сером веществе органов централь-
ной нервной системы представлены обычно относительно мел-
кими отростчатыми клетками, как правило, непосредственно
контактирующими с телами нервных клеток (рис. 95, в).
'Рис. 96. Клеточные элементы периферической олигодендроглии позвоночных
и их взаимоотношения с отростками нервных клеток.
а — безмякотиые, б, в — мякотные иервийе волокна на поперечном (б) и продольном
(в) срезах; 1— аксон, 2—.цитоплазма шванновских , клеток, 3— миелиновая оболочка,
4 — участок истончения миелиновой оболочки в области ее перехода к перехвату
Раивье, 5 — перехват Ранвье, 6 — митохондрия, 7 — микротрубочки, 8 — микрофиламен-
ты,. 9 —мезаксои, 10 — шероховатая ЭПС, 11 — коллагеновые волокна эидоневрия,
12— базальная мембрана.
370
Более многообразны клеточные элементы олигодендроглии
в периферических отделах и в белом веществе центральных
отделов нервной системы. В качестве примера элементов пери-
ферической олигодендроглии можно привести мантийные клет-
ки. Они образуют непрерывный слой на поверхности псевдо-
униполярных чувствительных нейронов спинальных ганглиев
у позвоночных. Кроме того, элементы олигодендроглии сопро-
вождают отростки нервных клеток на всем их протяжении как
в белом веществе органов ЦНС, так и на периферии. Эта раз-
новидность глиальных клеток получила название шванновских.
В тонких безмякотных нервных волокнах взаимоотношения от-
ростков нейронов и шванновских клеток относительно простые
(рис. 96, а). Отросток, а иногда и несколько отростков нервных
клеток оказываются погруженными в цитоплазму одной шван-
новской клетки. В толстых мякотных нервных волокнах на-
блюдаются более сложные отношения (рис. 96, б, в). Вокруг
отростка нервной клетки образуется многослойная мембран-
ная структура, представляющая собой сложенную в несколько
концентрических слоев плазматическую мембрану шванновской
клетки. В белом веществе органов ЦНС шванновские клетки
образуют пластинкообразные выросты, которые закручивают-
ся вокруг отростков нервных клеток. При этом одна шваннов-
ская клетка, образовав несколько выростов, может обертывать
участки аксонов или дендритов нескольких нервных клеток.
В местах контакта отдельных шванновских клеток по длине
отростка нервной клетки или в местах контакта пластинкооб-
разных выростов двух шванновских клеток имеются участки,
свободные от миелиновой оболочки. Отросток нервной клетки
в таких участках изолирован от окружающих тканей лишь
тонким слоем цитоплазмы шванновской клетки и ее одинар-
ными плазматическими мембранами. Эти участки получили
название перехватов Ранвье (рис. 96, в). Их наличие в мякот-
ных волокнах обеспечивает возможность более быстрого про-
ведения нервного импульса.
Основное назначение вспомогательной системы глиальных
элементов заключается в создании для нейронов и образуемых
ими специализированных структур и нервных центров- посто-
янной стабильной внутренней среды. Особенно ярко своеобраз-
ная трофическая в широком смысле этого слова функция гли-
альных клеток проявляется при анализе характера взаимоот-
ношений нервных клеток со стенкой сосудистых капилляров.
Оказалось, что ни в одном участке центральной и перифери-
ческой нервной системы нет непосредственного контакта плазма-
тических мембран нервных клеток ни с капиллярами, ни с эле-
ментами рыхлой соединительной ткани (рис. 97, а). В связи
с этим широкое распространение получили представления о том,
что трофические взаимоотношения между тканями внутренней
среды и нервными клетками у позвоночных животных осуще-
13:
37Г
Рис. 97. Глиоваскулярные отношения в нервной системе позвоночных и бес-
позвоночных животных.
а т- млекопитающие, б—г — беспозвоночные (6 — головоногие моллюски, в — насеко-
мые, г — мечехвост), 1 — астроцит, 2 — отростки астроцита, образующие концевые
ножки вокруг капилляров, 3 — просвет капилляров, 4 — ядро эндотелиальной клетки,
5 — контакты между отростками астроцитов, 6—базальная мембрана, 7 — коллагено-
вые волокна, -8— отростки ~и'.тела нервных клеток, 9 — перициты, 10— лакуны в меж-
клеточном веществе соединительной ткани, // — оболочка из межклеточного вещества,
12, '.1'3 — глиЬльйые'клетки- наружного (12) и'внутреннего (13) «барьеров».
372
ствляются через цитоплазму глиальных клеток. Прямая экспе-
риментальная проверка этого предположения с помощью мар-
керных веществ показала, однако, что они могут распростра-
няться по межклеточным пространствам, минуя глиальные клет-
ки. Характер функционального и биохимического взаимодействия
между тканями внутренней среды, глией и нейронами, по-
видимому, значительно сложнее. Каждая разновидность гли-
альных клеток осуществляет специфический контроль взаимо-
отношений между нервными клетками и трофическими систе-
мами организма. Механизмы такого контроля достаточно
разнообразны как по биологическому значению, так и по конк-
ретным путям реализации. Об этом свидетельствуют факты
быстрого появления вновь синтезированных белков и РНК
в терминальных разветвлениях длинных аксонов.
Особенно убедительны в этом отношении наблюдения, проведенные на
дистальных участках периферических нервов тритона при их перерезке.
В этих опытах удалось показать, что если сразу же после перерезки аксона
инъецировать 3Н-гистидин, то меченые высокомолекулярные соединения вна-
чале появляются в цитоплазме швановских клеток, а затем на периферии
нейроплазмы аксонов. Аналогичные данные получены и в отношении ЭН-
лейцина на этом объекте и на других позвоночных животных. Большой фак-
тический материал имеется и об изменениях внутриклеточного метаболизма
в системе нейрон — глия при различных воздействиях. Показано, что после
различных воздействий восстановление нормального или даже повышенного ко-
личества РНК и белка в глиальных клетках предшествует аналогичным вос-
становительным процессам в нейроне. Все эти факты заставляют предпола-
гать возможность контроля со стороны глиальных элементов ие только за
транспортировкой низкомолекулярных веществ, но и за синтезом и переме-
щением высокомолекулярных соединений типа РНК и белка.
Глиальные клетки играют, по-видимому, важную роль и в
осуществляемой нервной системой основной функции, связан-
ной с процессами возбуждения, торможения и распростране-
ния импульсов по отросткам нервных клеток и в области
синаптических контактов. Наряду с изолирующей функцией
определенные разновидности клеток глии участвуют в перерас-
пределении ионов для создания соответствующих электростати-
ческих условий у поверхности плазматической мембраны нейро-
нов. Несмотря на весьма важную роль глии в деятельности нерв-
ной системы, конкретное функциональное значение отдельных
разновидностей глии изучено еще слабо. В выяснении ос-
новных принципиальных вопросов биологического значения ней-
роглиальных взаимоотношений существенная роль принадле-
жит сравнительному методу исследования.
Так, в нервной системе брюхоногих и головоногих моллю-
сков общий характер взаимоотношений между нейронами
и глиальными клетками оказался сходным с теми отношени-
ями, которые наблюдаются у позвоночных животных. И в ганг-
лиях, и в периферических отделах нервной системы тела нерв-
373
ных клеток их отростки и синаптические контакты всюду со-
провождаются глиальными клетками. Показано, что в оптиче-
ском ганглии головоногого моллюска между телами нервных
клеток и синаптическими контактами в нейропиле, с одной сто-
роны, и кровеносными сосудами, а также организованными ла-
кунами в межклеточном веществе соединительной ткани — с дру-
гой, располагаются астроцитоподобные глиальные клетки. Они,
однако, в отличие от позвоночных животных полностью не изо-
лируют нейроны от, контакта с межклеточным веществом сое-
динительной ткани (рис. 97, б).
У насекомых все ганглии ЦНС отделены от гемолимфы спе-
циальной периневральной глией, клетки которой образуют меж-
ду собой изолирующие межклеточные контакты (рис.97в). По-
мимо этого внешнего гемоэнцефалического барьера у некото-
рых насекомых в ганглиях имеется оболочка из. глиальных
клеток, окружающая нейропиль, т. е. область, где сосредото-
чена основная масса синапсов. Таким образом, у насекомых
хорошо известная для ЦНС позвоночных обособленность си-
наптических зон от контакта с кровью морфологически выра-
жена значительно четче. У более низкоорганизованных члени-
стоногих, представителем которых могут служить мечехвосты,
рассмотренные выше системы глиальных клеток развиты не-
сколько слабее (рис. 97, г).
У моллюсков и у других животных с периферическим рас-
положением в ганглиях тел псевдоуниполярных нейронов на их
поверхности обязательно находятся глиальные к летки-с ат ел ли-
ты, аналогичные по своему функциональному значению клет-
кам-сателлитам в спинальных ганглиях позвоночных животных.
Их отростки у беспозвоночных животных могут глубоко про-
никать в тела нервных клеток. Плазматическая мембрана по-
следних образует систему сложных впячиваний, которые вмес-
те с отростками клеток-сателлитов получили название трофо-
спонгия. Между плазматическими мембранами отростков кле-
ток-сателлитов и телами нервных клеток формируются специ-
фические контакты. Через эти контакты могут, по-видимому,
транспортироваться и низкомолекулярные и относительно вы-
сокомолекулярные соединения.
Наряду с общими признаками организации глиальных сис-
тем у позвоночных и представителей отдельных типов беспо-
звоночных у последних наблюдаются и специфические особен-
ности. Так, например, у брюхоногих моллюсков слабо развита
астроцитарная глия, в то время как сильное развитие получает
глиоинтерстициальная система. Основное назначение послед-
ней, по-видимому, заключается в регуляции ионного баланса.
Характерная особенность глиоинтерстициальной системы — ее
распространение в периферических отделах за пределы тер-
минальных разветвлений аксонов, особенно в некоторых
мышцах.
374
Таким образом, здесь элементы глии, по-видимому, частич-
но берут на себя выполнение функций тканей внутренней сре-
ды. Такая интерстициальная глия имеется, возможно, и в веге-
тативной нервной системе позвоночных животных, а также
в центральной нервной системе у некоторых других групп пер-
вичноротых животных. У моллюсков, насекомых и ракообраз-
ных глиальные клетки способны вырабатывать внеклеточный
матрикс. У ракообразных он содержит коллагеноподобные фиб-
риллы. У насекомых в нем обнаружено, как и в основном ве-
ществе соединительной ткани, большое количество гиалуроно-
вой кислоты. Последняя играет, вероятно, роль своеобразного
резервуара ионов.
Теснейшая системная связь между аксонами нервных кле-
ток и шванновскими клетками особенно ярко проявляется
у позвоночных животных при репаративной регенера-
ции аксонов. После травматического нарушения связи между
периферической и центральной частями аксона перифериче-
ский участок распадается и дегенерирует (рис. 98). Окружа-
ющие его шванновские клетки теряют значительную часть
своих мембранных структур. Затем они энергично размножа-
ются митозом и образуют лентовидные структуры. Последние
растут в направлении сохранившегося центрального участка
аксона. В случае контакта последнего с одним из таких лен-
товидных тяжей' начинается рост аксона по футляру видоизме-
ненных шванновских клеток и полное восстановление всей
периферической части аксона вплоть до эффекторных прибо-
ров в области терминального разветвления.
При хорошо развитой способности нейронов у высших по-
звоночных восстанавливать в благоприятных условиях перифе-
рические участки аксонов, расположенные за пределами орга-
нов ЦНС, они не способны к такому восстановлению в белом
веществе органов ЦНС. По-видимому, это связано с особен-
ностями взаимоотношений между шванновскими клетками бе-
лого вещества и расположенными здесь отростками нервных
клеток. Существенное значение глия имеет и в гистогенезе
нервной системы, не только осуществляя механическую функ-
цию, но и регулируя рост отростков нервных клеток.
У беспозвоночных мякотные волокна, столь характерные
для позвоночных животных, встречаются реже. Однако в тех
случаях, когда имеется необходимость быстрого проведения
нервного импульса, глиальные элементы могут формировать
достаточно мощную изолирующую оболочку. Такие отношения
складываются в аксонах большого диаметра, образующих длин-
ные нисходящие пути. Гигантские аксоны имеются у некото-
рых полихет и моллюсков. Особенно характерны они для нерв-
ной системы ракообразных. Изолирующая обкладка у таких
аксонов формируется чаще не путем . гипертрофии плазмати-
ческой мембраны одной глиальной клетки, как в мякотных
37&-
Рис. 98. Схемы дегенерации и регенерации нервных волокон у позвоночных
животных [по: Хэм]. ' 4
а—г — последовательные стадии . дегенерации и регенерации нервных волокон; 1 —
проксимальный и 2 — дистальный участки волокна, 3 — распад миелиновых оболочек
аксонов после перерезки, 4 — усиленное размножение шванновских клеток в месте
травмы и образование тяжей, 5 — макрофаги, 6 — образование регенераторных отрост-
ков на проксимальном конце перерезанных аксонов, 7 — отрастание аксонов и образо-
вание оболочки.
376
волокнах позвоночных, а за счет многослойной капсулы, со-
стоящей из сильно уплощенных тесно связанных между собой
нескольких глиальных клеток. Иногда в формировании обо-
лочки могут принимать участие и межклеточные структуры,
образуемые шванновскими клетками. Что же касается
обычных шванновских клеток, то они распространены и,
по-видимому, имеют сходное биологическое значение в пери-
ферической и центральной нервных системах почти у всех
многоклеточных животных.
Значительно многообразнее, чем у позвоночных, межклеточ-
ные контакты в глие беспозвоночных животных. Здесь между
глиальными клетками, а также глиальными и нервными клет-
ками имеются разнообразные механические, химические и изо-
лирующие контакты. Обнаружены даже своеобразные синапсо-
подобные контакты между аксонами нервных клеток и гли-
альными клетками. В мембранах некоторых глиальных клеток
выявлены рецепторы к медиаторам, в частности, к ацетилхо-
лину.
На примере гигантских аксонов головоногих моллюсков
экспериментально показан переход белков и РНК из цитоплаз-
мы шванновских клеток в аксоплазму, хотя механизмы такого
транспорта остаются еще неясными.
Общие и специфические закономерности взаимоотношений
между нейронами и глией у позвоночных и беспозвоночных
животных обнаруживаются в опытах по регенерации перифе-
рических нервов и нервных волокон в центральной нервной
системе.
Наблюдается принципиальное сходство дегенеративных
и регенераторных процессов у всех многоклеточных животных.
У представителей высшей группы членистоногих — насекомых
и у олигохет описана относительно быстрая дегенерация дис-
тальных частей отростков, изолированных от тела клетки, ко-
торая сопровождается активацией глиальных элементов. При
репаративной регенерации отростков нервных клеток имеет
место, как и у позвоночных животных, тесное взаимодействие
регенерирующих участков с видоизмененными шванновскими
клетками.
Наряду с этой общностью восстановительных процессов
в ряде случаев, преимущественно при перерезке аксонов эф-
фекторных клеток, обнаружены факты длительного существо-
вания и нормального функционирования дистального отдела
аксона без связи с телом нервной клетки. Впервые этот фе-
номен был описан на примере гигантских аксонов у ракооб-
разных. Аналогичное явление показано и на аксонах моторных
нейронов саранчи и аксонах гигантских нейронов головоногих
моллюсков.
377
§ 5. Нейросекреторные клетки
Нейросекреторные клетки представляют собой универсаль-
ную для нервных систем многоклеточных животных разновид-
ность клеточных элементов тканей нервной системы. Особой
сложности системы таких клеток достигают среди позвоночных
у млекопитающих и у высших представителей первичноротых
животных. Широко представлены они и у представителей боль-
шинства классов других типов многоклеточных животных. При-
мером типичной нейросекреторной клетки могут служить клет-
ки гипофизарно-гипоталамической области у млекопитающих
и человека (рис. 101). По внешнему виду нейросекреторные
клетки сходны с мультиполярным нейроном. Они имеют не-
сколько коротких дендритов с многочисленными химическими
синаптическими окончаниями аксонов нервных клеток и один
длинный аксон, заканчивающийся булавовидным расширением,
либо на сосудах задней доли гипофиза, либо в железистой
ткани аденогипофиза (рис. 99). Аксоны некоторых нейросек-
реторных клеток дают коллатерали, по которым нейросекрет
может транспортироваться к нейронам, иннервирующим' нейро-
секреторные клетки. Эти коллатерали образуют на телах и ден-
дритах нейронов аксосоматические и аксодендрические синап-
сы, в которых нейрогормоны функционируют как типичные
медиаторы химических синапсов.
Цитологической особенностью нейросекреторных клеток ги-
поталамуса является еще более сильное, чем в нейроне, разви-
тие белок-синтезирующего аппарата (особенно у нейросекре-
торных клеток, продуцирующих пептидные нейрогормоны)
и структур, ответственных за транспорт гранул нейросекрета.
В химическом отношении нейросекреторные клетки гипотала-
мической области делятся на две большие группы — пептидэр-
гические и монаминэргические. Первые продуцируют пептид-
ные гормоны, вторые — монаминовые (дофамин, норадреналин,
серотонин).
Среди пептидэргических нейросекреторных клеток гипота-
ламической области в биологическом плане можно выделить
группу висцеротропных клеток, гормоны которых действуют на
висцеральные органы. Они выделяют вазопрессин (антидиуре-
тический гормон), окситоцин и гомологи этих пептидов. Вто-
рая подгруппа нейросекреторных клеток выделяет аденогипо-
физтропные гормоны, т. е. гормоны, регулирующие деятель-
ность железистых клеток аденогипофиза. Среди выделяемых
ими пептидных гормонов имеются и гормоны, стимулирующие
железистую функцию клеток аденогипофиза — либерины, либо,
наоборот, угнетающие гормоны — статины. Монаминэргические
нейросекреторные клетки выделяют нейрогормоны в основном
в портальную сосудистую систему задней доли гипофиза.
378
Рис. 99. Схема строения нейросекреторной клетки (А. Л. Поленов, 1968).
1 — перикарион, 2 — ядро, 3 — дендрит, 4 — капилляр, 5 —гранулы иейросекрета, 6 —
аксон, 7— аксовазальиый синапс, 8 — аксоаденариый синапс.
Таким образом, у млекопитающих гипоталамическая ней-
росекреторная система представляет собой весьма сложно диф-
ференцированную и в цитологическом (обилие разновидностей
клеток), и в гистологическом (разнообразие и сложность свя-
зей) отношениях систему. Она является частью общей инте-
грирующей системы (нейроэндокринная) организма и нахо-
дится в тесной и многосторонней взаимосвязи и с нервной сис-
темой (через химические синапсы нейронов высших отделов
379
мозга), и с эндокринной системой (через аденогипофиз и кро-
воток). Окончание аксонов этих клеток формирует особые
нейрогемальные органы, примером которых может служить
задняя доля гипофиза. В нейрогемальных органах происходит
депонирование нейросекрета и его регулируемое выведение
в кровоток. Помимо нейросекреторных клеток гипоталамиче-
ской области у млекопитающих клетки с ярко выраженной сек-
реторной специалйзацией имеются и в других отделах голов-
ного мозга (пинеалоциты эпифиза, клетки эпендимы субкомис-
сурального и субфорникального органов и др.). Сложно разви-
тая система специальных нейросекреторных клеток имеется
и у представителей других классов позвоночных. При этом
количество клеток с ярко выраженной секреторной специали-
зацией в нервных системах рыб даже в процентном отношении
может быть больше, чем в нервной системе высших позвоноч-
ных. У них помимо хорошо развитой системы таких клеток
в головном мозге имеется еще специальная каудальная нейро-
секреторная система в спинном мозге.
Кроме того, к настоящему времени накоплено большое ко-
личество фактов, свидетельствующих о том, что в интегратив-
ной деятельности нервной системы очень большую роль игра-
ют регуляторные пептиды, выделяемые типичными нейронами.
Эти вещества распространяются по трофической системе глии
и оказывают специфические регуляторные влияния на нервные
клетки и их синаптические аппараты. Все эти факты дают
основание некоторым исследователям не противопоставлять
резко нервную, нейросекреторную и эндокринную системы,
а рассматривать их как единую интегрирующую систему орга-
низма, состоящую из отдельнх субсистем, способных осуще-
ствлять эту функцию посредством двух механизмов: секретор-
ного нейроэндокринного и проводникового нервного. В пользу
такого рода представлений свидетельствуют отношения, наблю-
даемые у беспозвоночных животных. У полихет, пластинчато-
жаберных и брюхоногих моллюсков нейросекреторные клетки
составляют относительно большой процент от всех нервных
клеток, образующих их нервные системы. Здесь, следователь-
но, наблюдается аналогичная существующей у позвоночных
закономерность: большее относительное количество нейросек-
реторных клеток в нервных системах у менее высокоорганизо-
ванных животных. У насекомых, ракообразных и головоногих
моллюсков при некотором уменьшении относительного количе-
ства нейросекреторных клеток наблюдается и более совершен-
ная дифференцировка клеток и более выраженная система их
интеграции. Достаточно хорошо изучены сейчас нейросекретрр-
ные системы брюшных и головных ганглиев у насекомых. В ци-
тологическом плане нейросекреторные клетки насекомых сход-
ны с пептидэргическими нейросекреторными клетками млеко-
питающих. Они имеют хорошо развитый белоксинтезирующий
380
аппарат и транспортную систему в аксонах. У нейросекретор-
ных клеток обнаружены и дендриты с синаптическими оконча-
ниями аксонов нервных клеток. Тела и, очевидно, дендритные
разветвления сосредоточены :В определенных участках голов-
ных ганглиев, образующих центральный нейросекреторный ор-
ган, аналогичный гипоталамусу позвоночных. Аксоны нейросек-
реторных клеток заканчиваются в структурно-организованном
нейрогемальном органе, аналогичном задней доле гипофиза по-
звоночных— кардиальных телах. Подобно аденогипофизу по-
звоночных у насекомых имеются прилежащие тела, деятельность
которых контролируется нейрогормонами. Последние представ-
ляют собой пептиды или специфические белки, т. е. также ана-
логичны пептидным гормонам позвоночных. Как уже отмеча-
лось и у насекомых, и у позвоночных имеются еще эндокрин- -
ные органы и диффузно распределенные в тканях эндокринные
клетки не. нервного происхождения. Однако вся эта система
эндокринных желез теснейшим образом связана с нервной сис-
темой и через нейросекреторные клетки, центральные эндокрин-
ные железы типа аденогипофиза и прилежащих тел и, нако-
нец, путем воздействия гормонов на нервные клетки через ге-
молимфу, тканевую жидкость, и кровь. Таким образом, в ор-
ганизации общей интегративной системы и характере взаимо-
6 действия ее нервной, нейросекреторной и эндокринной субсис-
тем у высших позвоночных и членистоногих наблюдается глу-
бокая биологическая аналогия. При этом сходные черты в этих
взаимоотношениях и организации всей системы в целом приоб-
ретаются в ряду позвоночных и у первичноротых независимо,
параллельно.
§ 6. Некоторые общие закономерности эволюционной
динамики тканей нервной системы
Рассмотренные выше тканевые элементы и их наиболее важ-
ные рабочие механизмы — синапсы и рецепторы тканей нерв-
ной системы — создают основу для ее интегративной, анализа-
! . торской деятельности. Эта основная ее функция возможна лишь
на более высоком системном уровне организации, на уровне
объединения тканевых элементов и прежде всего нейронов
в сложные многоклеточные системы разной степени сложности.
Они находятся в нервных системах высших животных в опре-
деленной закономерной взаимосвязи и соподчинении друг с дру-
гом. Изменение в организации нервных систем в эволюции про-
исходит обычно не столько за счет коренной перестройки пер-
, вичных древних ее аппаратов, сколько путем их надстройки
и усложнения и подчинения новообразующимся центрам суще-
ствовавших ранее нервных аппаратов. В связи с этим в основе
организации нервной системы у многоклеточных животных ле-
жит обычно рефлекторная дуга, состоящая из чувствительного,
381
ассоциативного и двигательного эффекторного нейронов. В про-
цессе эволюции на основе рефлекторных- дуг, расположенных
в головном отделе животных, происходило формирование го-
ловного мозга, а в туловищной нервной системе выделялась
соматическая и вегетативная нервные системы, рефлекторные
дуги которых работают на основе информации, поступающей
из внешней среды и от внутренних органов. Для более совер-
шенного анализа всей этой информации и координации работы
всей системы, а следовательно и организма в целом, формиру-
ются высшие ассоциативные центры, которые берут под конт-
роль простейшие рефлекторные аппараты. Такая общая схема
дифференциации нервной системы в ходе эволюции характер-
на для всех многоклеточных животных. Однако конкретная
структурно-функциональная реализация этой общей схемы мо-
жет быть различной. Так, у позвоночных животных спинной
и головной мозг и периферические отделы соматической веге-
тативной систем длительное время эволюционировали явно не-
зависимо от брюшной нервной цепочки, головных ганглиев
и вегетативной системы высших первичноротых животных. Воз-
можно даже, что источник развития большой части нервной
системы у предков позвоночных иной, чем у других групп пер-
вцчноротых животных. Нет гомологии и между органами чувств
у высших первичноротых и позвоночных животных. Более то-
го, и в микроанатомическом отношении эти органы иногда, как,
например, органы зрения у насекомых и позвоночных, могут
резко отличаться друг от друга.
Многообразны и конкретные пути реализации отмеченных
выше общих для всех многоклеточных закономерностей эволю-
ции нервных центров. Здесь реализуются два крайних вариан- ~
та и их различные комбинации. Первый вариант, по-видимому,
наиболее удачный, характерен для нервных систем позвоноч-
ных. В основе его лежит увеличение количества нервных кле-
ток в системе и в первую очередь промежуточных ассоциатив-
ных нейронов. У высших позвоночных их количество достигает
нескольких миллиардов, что позволяет им создать сложней-
шие и совершенные интегративные аппараты. Второй путь за-
ключается в увеличении размеров клеток, характера ветвления
их отростков при сохранении относительно небольшого коли-
чества клеток в системе. Наиболее резко такой путь усложне-
ния нервной системы выражен у брюхоногих моллюсков. Тен-
денция к использованию этого механизма характерна и для
других первичноротых животных. Она, в частности, проявля-
ется в широком распространении в их нервных центрах муль-
тифункциональных ассоциативно-двигательных нейронов №
эффекторных нейронов с несколькими аксонами. Среди членисто-
ногих резко выделяются насекомые, а среди моллюсков — голо-
воногие. Их нервные системы образованы относительно боль-
шим для первичноротых количеством диплоидных нейронов
382
с выраженной унифункциональной организацией. Иными сло-
вами, у этих групп животных используется сходный с имеющим-
ся у позвоночных принцип усложнения нервной системы, хотя об-
щее количество нервных клеток в их центрах значительно мень-
ше. Несмотря на это, системные механизмы организации нерв-
ных клеток у высших групп первичноротых и позвоночных
животных обнаруживают признаки аналогичного (независимо
приобретенного) сходства.
Впервые это сходство в организации нервных центров туло-
вищного мозга насекомых и позвоночных было показано при
сопоставлении нейрональных отношений в ганглии брюшной
нервной цепочки личинки стрекозы и спинном мозге млекопи-
тающих (рис. 100). У позвоночных туловищные центры обра-
зуют собственный аппарат спинного мозга.
Он представляет собой систему чувствительных, ассоциа-
тивных и двигательных нейронов. При этом сами нервные цент-
ры, т. е. места синаптических контактов между чувствительны-
ми, ассоциативными и двигательными нейронами, располагают-
ся в строго локализованных участках серого вещества спинно-
го мозга (рис. 100, б). Аксон чувствительной нервной клетки
в белом веществе, окружающем задние рога спинного мозга,
дает восходящую (более короткую) и нисходящую (более
длинную) ветви. Они идут в составе проводящих пучков собст-
венного аппарата спинного мозга и дают в выше и ниже лежа-
щие сегменты коллатерали, оканчивающиеся на дендритах
и телах ассоциативных (вставочных) нейронов.
При распространении нервного импульса по аксону чувст-
вительной нервной клетки он передается, следовательно, на
ассоциативные клетки не только своего, но и выше и ниже ле-
жащих сегментов спинного мозга. Аксоны ассоциативных ней-
ронов, перед тем как дать терминальное разветвление на ден-
дритах и телах двигательных эффекторных нейронов своей или
противоположной стороны спинного мозга, также дают колла-
терали в белое вещество, идущие вверх и вниз в составе пуч-
ков собственного аппарата спинного мозга. В выше- и нижеле-
жащих сегментах они дают терминальные разветвления на
дендритах и телах двигательных клеток соседних сегментов.
Таким образом, на раздражение одной чувствительной клет-
ки могут отвечать несколько десятков двигательных нейронов.
Помимо типичных трехчленных рефлекторных дуг у высших
позвоночных животных в спинном мозге имеются и прямые —
двучленные — контакты между чувствительными и двигатель-
ными нейронами. Трехчленные и двучленные рефлекторные ду-
ги собственного аппарата спинного мозга имеют двусторонние
связи с вышележащими центрами головного мозга. Особенно
сложный контроль за деятельностью собственного аппарата
спинного мозга осуществляется на уровне двигательных ней-
ронов. Анализ отношений в собственном аппарате спинного
383
мозга низших позвоночных показывает, что одной из основных
закономерностей прогрессивной филогенетической дифференци-
ровки ядерных нервных центров спинного мозга является
усложнение промежуточного, ассоциативного звена как в отно-
шении количества, так и разнообразия ассоциативных нейро-
нов. Вторая общая закономерность прогрессивного развития
Рис. 100. Схемы нейрональных отношений в ганглии брюшной нервной це-,
почки насекомых (а) и спинном мозге млекопитающих (б). [По: А. А. За-
варзин, 1941].
1—2 — области переключения импульсов с чувствительных на ассоциативные (/) и с
ассоциативных на двигательные клетки (2), 3— тела двигательных' и 4— тела ассо-
циативных нейронов, 5—7 — проводящие пути: (5 — восходящие, 6—нисходящие, 7 —
местные), 8 — амакриновые клетки.
384
ядерных центров — их пространственная и функциональная
диффренциация. Диффузное распределение синапсов в ядер-
ных нервных центрах низших позвоночных сменяется у высших
позвоночных строго локализованным — они распределены в оп-
ределенных участках серого вещества спинного мозга. При
этом в двигательной области вместо одной диффузной зоны
выделяется уже около 5 четко локализованных ядерных цент-
ров. Наконец, третьей и очень важной закономерностью услож-
нения ядерных центров является усиление их восходящих
и нисходящих связей с вышележащими, более поздними по
происхождению центрами головного мозга. В любом ядерном
двигательном центре спинного мозга высших позвоночных на
каждой эффекторной нервной клетке оканчиваются не только
аксоны ассоциативных клеток собственного аппарата, но и ак-
соны клеток ядерных центров продолговатого мозга, мозжечка,
среднего мозга и аксоны пирамидных клеток коры больших
полушарий (у млекопитающих и человека).
Наиболее сложные и дифференцированные отношения
в структурной организации ядерных нервных центров у беспо-
звоночных наблюдаются в туловищном мозге насекомых. По
своей внешней микроанатомической организации ганглии брюш-
ной нервной цепочки насекомых резко отличаются от спинного
мозга позвоночных периферическим расположением тел кле-
ток и центральным положением их отростков. Разветвления по-
следних образуют вентральный (чувствительный), централь-
ный (основной) и дорсальный (двигательный) нейропили
(рис. 100, а). В нейропилях сосредоточены все синапсы, т. е. эти
участки ганглиев аналогичны соответствующим ядерным цент-
рам спинного мозга позвоночных животных. В чувствительном
нейропиле находятся терминальные разветвления аксонов ре-
цепторных клеток, расположенных на периферии, и дендриты
ассоциативных нейронов. В центральном нейропиле сосредото-
чены разветвления дендритов разнообразных ассоциативных
клеток. Наконец, в двигательном нейропиле располагаются
терминальные разветвления аксонов ассоциативных клеток
и дендриты моторных нейронов.
Таким образом, синаптические контакты между клетками
локализованы в строго определенном участке нейропиля, что
аналогично отношениям, наблюдаемым в ядерных центрах
спинного мозга высших позвоночных животных. Брюшная нерв-
ная цепочка насекомых имеет собственный аппарат проводя-
щих путей. В его основе, как и у позвоночных, лежит трехчлен-
ная рефлекторная дуга, чувствительные и ассоциативные клетки
которой посылают аксонные коллатерали в соседние ганглии.
Кроме того, собственный аппарат туловищного мозга насеко-
мых обладает сложной системой двухсторонних связей с го-
ловным мозгом через специальные ассоциативные нейроны. От-
ростки последних располагаются обычно по периферии нейро-
385
пиля, преимущественно на дорсальной и вентральной поверх-
ностях ганглия.
Таким образом, несмотря на существенные анатомические
различия брюшной нервной цепочки насекомых и спинного моз-
га позвоночных в их нейрональных отношениях наблюдается
принципиальное сходство. Причем это не случайное совпаде-
ние, а сходство, независимо возникшее в результате усложне-
ния нервной системы и ее центров туловищного мозга в сход-
ном направлении. Действительно, сопоставление организации
туловищного мозга насекомых с туловищным мозгом аннелид
свидетельствует о том, что совершенствование этих центров
в процессе эволюции происходило по тем же основным отме-
ченным выше закономерностям, что и в ряду позвоночных жи-
вотных.
Сравнительно-морфологические и физиологические исследо-
вания последних десятилетий в целом подтвердили этот прин-
ципиально важный вывод о наличии общих закономерностей
Рис. 101. Строение сетчатки позвоночных животных [по: Доулинг, Бойкот].
а — участок сетчатки, б — схема нейрональных отношений; 1—10 — слои сетчатки
(1 — пигментный эпителий, 2— слои палочек и колбочек, 3 — наружная пограничная
мембрана, 4 — наружный зернистый, 5 — наружный ретикулярный, 6 — внутренний зер-
нистый, 7 — внутренний ретикулярный, 8 — ганглиозных клеток, 9 — нервных волокон,
10 — внутренняя пограничная мембрана), 11— палочки, 12 — колбочки, 13 — карлико-
вый бнполяр, 14 — палочковый биполяр, 15 — плоский биполяр, 16 — горизонтальная
клетка, 17 — амакриновая клетка, 18 — карликовая и 19 — «диффузная» ганглиозные
клетки.
386
в эволюционной динамике центров туловищного мозга в рядах
позвоночных и членистоногих животных. Общие закономерно-
сти проявляются не только в сходной микроанатомической
организации и нейрональных отношениях в ганглиях брюшной
нервной цепочки и сегментах спинного мозга, но и в тонких
механизмах организации работы этих центров. В этих меха-
низмах удалось выявить и специфические для насекомых осо-
бенности. Так, например, у них значительно лучше выражен
автоматизм работы этих центров. Рефлекторные дуги и собст-
венные ассоциативные нейроны ганглиев брюшной нервной це-
почки способны длительно обеспечивать управление такими
сложными актами, как ходьба или полет насекомых при лише-
нии их двусторонних связей с высшими центрами головного
мозга путем полной декапитации.
Способность автономно осуществлять координированную ра-
боту большого количества нейронов обусловливается широким
распространением в ганглиях нервной системы насекомых осо-
бых ассоциативных командных интернейронов. Их автоматиче-
ская деятельность запрограммирована генетически. Детальные
физиологические исследования последних лет, проведен-
ные на спинном мозге позвоночных, показали, однако,
что и у этих животных в управлении их сложными
двигательными актами используются аналогичные меха-
низмы.
В настоящее время установлено, что управление сложными
локомоторными актами и у позвоночных, и у насекомых опреде-
ляется системными связями между отдельными группами интер-
и мотонейронов. Сходство в функциональной организации дви-
гательных центров этих животных проявляется в механизмах
формирования нейронального «рисунка» локомоторных актов.
Удается провести глубокую аналогию между командными нейро-
нами, формирующими ритм ходьбы у кошки и таракана. В боль-
шинстве локомоторных актов активность мотонейронов опреде-
ляется ритмической импульсацией генераторных интернейронов,
которые в свою очередь запускаются афферентной иннерваци-
ей. Таким образом, генераторные и командные (интегратив-
ные) интернейроны являются обязательным компонентом прак-
тически всех рефлекторных дуг. Большую роль в работе нерв-
ных центров играют особые группы бесспайковых нейронов,
обнаруженные в нервных центрах насекомых. Эти интернейро-
ны образуют синапсы с мотонейронами и в зависимости от аф-
ферентных сигналов выделяют различное количество медиато-
ров, регулируя уровень мембранного потенциала мотонейрона;
В свете этих данных предложенный и разработанный А. А. За-
варзиным сравнительный метод по сопоставлению функцио-
нально-аналогичных структур при изучении нервной системы
приобретает особое значение. Детальный анализ тонкой струк-
турно-функциональной организации нервных систем высших
387
первичноротых животных необходим не только для выяснения
общих закономерностей эволюционной динамики нервной систе-
мы в многообразии их проявлений у разных животных. Такой
анализ нервных систем беспозвоночных животных, и в первую
очередь насекомых, является одним из весьма эффективных ме-
тодологических подходов в изучении организации нервной си-
стемы высших позвоночных. Колоссальное количество клеток,
формирующих нервные центры у этих животных, делает весьма
сложным выяснение структурной организации этих центров
в плане каузального анализа их анализаторской деятельности
даже при всем богатом арсенале методов современной физио-
логии и морфологии. Нервные системы насекомых, используя,
очевидно, сходные системные механизмы, осуществляют анали-
заторскую и координирующую деятельность на основе систем
и центров, образованных на несколько порядков меньшим ко-
личеством клеток. Естественно, что значительно проще начать
каузальный анализ организации более простых систем. Такой
методологический подход к изучению основных механизмов
организации нервной системы особенно актуален в отношении
анализаторской деятельности центров головного мозга и в пер-
вую очередь центров, связанных с анализом информации, полу-
чаемой дистантными органами чувств: зрения, слуха и обо-
няния.
Как отмечалось выше, основа для такого подхода в отноше-
нии зрительного анализатора была заложена А. А. Заварзи-
ным еще в 1913 году в его исследовании оптических нервных
центров у личинки стрекозы и сопоставлении нейрональных от-
ношений в оптических нервных центрах у высших позвоночных,
головоногих моллюсков и насекомых.
У позвоночных животных часть оптических нервных центров
сосредоточена в сетчатке, т.,е. вынесена за пределы центральной
нервной системы. Сетчатка высших позвоночных имеет харак-
терное для экранных нервных центров плоскостное или слоис-
тое строение. Описанные в предыдущем разделе фоторецептор-
ные клетки занимают наиболее удаленное от поверхности глаз-
ного дна положение. Апикальными концами своих видоизмен-
ных дендритов они обращены к слою пигментного эпителия,
образующему отражательный экран, подстилающий сетчатку.
Наружные сегменты палочек и колбочек формируют первый
слой сетчатки, так называемый слой палочек и колбочек
(рис. 101). Тела этих клеток составляют ее наружныйядерный
слой. Далее по направлению к внутренней поверхности глаз-
ного дна следуют наружный ретикулярный,'внутренние ядерный
и ретикулярный слои, слой ганглиозных клеток и, наконец, слой
нервных волокон. В наружном ретикулярном слое аксоны па-
лочек и колбочек образуют синапсы на дендритах биполярных
клеток (второй основной нейрон оптического пути), т. е. здесь
располагается первый экранный оптический центр сетчатки.
388
Особенностью центра является то, что каждая биполярная
клетка связана не с одной, а с несколькими палочками и кол-
бочками. Таким образом, общее количество вставочных бипо-
лярных клеток меньше, чем палочек и колбочек. Второй особен-
ностью этого центра являются вспомогательные горизонталь-
ные связи, образуемые вспомогательными мультиполярными
нейронами. Во внутреннем ядерном слое располагаются пери-
карионы биполярных клеток, а во внутреннем ретикулярном
слое — синапсы, где происходит переключение импульса с аксо-
нов биполярных клеток на дендриты мультиполярных гангли-
озных клеток — третьего основного ассоциативного нейрона оп-
тического пути. Следовательно здесь расположен второй экран-
ный оптический центр. В слоях ганглиозных клеток и нервных
волокон располагаются сответственно тела ганглиозных клеток
и их аксоны, образующие оптический нерв. Количество гангли-
озных нервных клеток также значительно меньше количества
биполярных, т. е. каждая ганглиозная клетка связана синапти-
ческими аппаратами с несколькими биполярными клетками.
Небольшая часть ганглиозных клеток смещена во внутренний
ядерный - слой. Во втором оптическом центре существенную
роль играют и вспомогательные униполярные амакриновые
нервные клетки. Тела большей части амакриновых клеток рас-
положены во внутреннем ядерном слое. Небольшая часть их
имеется и в слое ганглиозных клеток. Все амакриновые клетки
обеспечивают горизонтальные связи во втором оптическом нерв-
ном центре.
Третий оптический центр располагается в подкорковых цент-
рах головного мозга, в частности у птиц, в коре среднего мозга
(рис. 102, а). Здесь оканчиваются аксоны ганглиозных клеток
сетчатки. Кора среднего мозга птиц имеет чрезвычайно слож-
ное строение и состоит более чем из 14 слоев строго упорядо-
ченных нервных клеток.
У насекомых орган зрения построен по иному принципу, чем
камерные глаза позвоночных животных. Глаз насекомых со-
стоит из большого количества отдельных глазков—оммати-
диев. В каждом таком глазке имеется вспомогательный диоп-
трический аппарат и система фоторецепторных нейронов. В от-
личие от позвоночных животных все переключательные звенья
в оптическом пути, т. е. все оптические нервные центры, распо-
ложены у насекомых за пределами органа зрения, в оптических
лопастях (ганглии) головного мозга (рис. 102, б). Тонкий ана-
лиз нейрональных отношений в этих структурах личинок стре-
козы, проведенный А. А. Заварзиным, показал их сходство
с нейрональными отношениями в оптических центрах позвоноч-
ных животных.
В первом оптическом ганглии у личинки стрекозы располо-
жен первый экранный зрительный центр. Здесь происходит
переключение импульса с аксонов рецепторных клеток на денд-
389
риты первого ассоциативного нейрона оптического пути. Кроме
того, здесь же расположены многочисленные синапсы, образуе-
мые терминальными разветвлениями отростков амакриновых
и других специализированных вспомогательных клеток. Во вто-
ром оптическом ганглии расположен в,торой экранный центр.
Здесь сосредоточены синапсы между отростками первого и вто-
рого ассоциативных нейронов зрительного пути. Особенностью
этого центра является чрезвычайно мощное развитие вспомо-
гательных горизонтальных связей. Они образуются, как и в
первом оптическом ганглии, отростками, вспомогательных амак-
риновых и специализированных нейронов. В третьем оптиче-
ском ганглии происходит контакт нейронов второго ассоциатив-
ного нейрона с дендритами нервных клеток, связанных с нерв-
ными клетками головного мозга насекомых.
Рис. 102. Схемы нейрональных отношений в оптических центрах позвоноч-
ных (а) и насекомых (б) (по: А. А. Заварзин, 1941).
'I, II, III, — первый, второй, третий оптические центры; / — сетчатка, 2 — средний мозг,
3 — оптическая лопасть.
390
В оптических центрах насекомых и птиц мы имеем дело,
следовательно, с тремя экранными центрами, образуемыми че-
тырьмя типами основных нейронов. Кроме того, во всех опти-
ческих нервных центрах имеется и сложный вспомогательный
аппарат горизонтальных связей, причем у насекомых с их фа-
сеточными глазами этот аппарат развит сильнее, чем у позво-
ночных животных.
Таким образом, и в нейрональных отношениях в оптических
центрах головного мозга насекомых и высших позвоночных
А. А. Заварзину удалось выявить глубокую функциональную
аналогию. Она связана, по его мнению, как и в случае ядер-
ных центров туловищного мозга, с общими закономерностями
усложнения экранных центров.
Совершенствование оптического анализатора происходит, по
А. А. Заварзину, путем увеличения количества и плотности рас-
положения фоторецепторных клеток и, что самое важное, уве-
личения количества переключений импульса, т. е. увеличения
количества экранных центров по вертикали. И у позвоночных,
и у насекомых формируется 3 таких центра из четырех основ-
ных типов клеток, в то время как у их предков и у современ-
ных животных с менее совершенной деятельностью оптических
анализаторов количество таких центров может быть 2 или даже
1, а количество типов нейронов 3 или только 2.
В своей монографии по нервной системе (1941 г.) А. А. За-
варзин обратил внимание на сходство принципов организации
оптических нервных центров и коры больших полушарий го-
ловного мозга млекопитающих и человека. Он считал, что это
сходство не случайно, оно отражает общие закономерности
эволюционной динамики нервной системы и связано с особен-
ностями структурной организации анализаторской деятельности
ее высших отделов.
Современные исследования оптических центров у позвоноч-
ных и насекомых позволили значительно углубить наши пред-
ставления о тонком 'строении и механизмах работы оптических
центров. Кроме отмеченного ранее внешнего сходства органи-
зации этих центров у высших вторичноротых и первичноротых
животных удалось обнаружить и глубокие функциональные
аналогии. Так, в частности, в сетчатке позвоночных и в первом
оптическом центре у насекомых широко распространены про-
цессы латерального ингибирования, осуществляе-
мого коллатералями аксонов фоторецепторных клеток. Эти про-
цессы обеспечивают тонкое взаимодействие между группами
фоторецепторов и создают основу для анализа зрительной ин-
формации, в частности выделения изображения точечных или
сдвоенных объектов или больших объектов, перекрывающих
у насекомых группу омматидиев. Универсальное распростране-
ние в оптических анализаторах в их дистальных по отношению
к фоторецепторам центрах имеют так называемые детекторные
391
интернейроны. В ряде
случаев у насекомых их
детекторные свойства мо-
гут быть связаны с по-
веденческими стимулами.
Тонкими физиологиче-
скими методами удалось
обнаружить детекторные
интернейроны с больши-
ми рецептивными поля-
ми, суммирующими сиг-
налы с большего количе-
ства проекционных ней-
ронов о локально напра-
вленных сдвигов наблю-
даемого объекта. Выяв-
лены также сложные
нейроны, которые способ-
ны суммировать сигналы
от нескольких интерней-
ронов с более ограничен-
ными^, по-видимому, го-
могеийыми в функцио-
нальном отношении ре-
цептивными полями.
Меньшее количество
клеток и более четкая
обособленность нервных
центров у насекомых по-
зволили в настоящее
время изучить все ос-
новные нейроны в пер-
вом оптическом ганглии
у мясной мухи с их си-
наптическими окончания-
Рис. 103. Строение ретиното-
пнческой колонки на уровне
I (а) и части II (б) одиче-
ских ганглиев.
/ — отростки длинноаксонных фо-
торецепторов, проходящие сквозь
I оптический ганглий во II, 2 —
окончания короткоаксонных фото-
рецепторов, 3 — зона переключе-
ния рецепторного потенциала, 4*—
униполярные и 5 — амакриновые
клетки, 6 — зона переключения им-
пульсов, 7 — клетки II оптического
ганглия.
392
ми и тонкими нейрональными отношениями. На этом объекте
появилась возможность, используя современную микроэлект-
родную технику, приступить к конкретному каузальному ана-
лизу на уровне отдельных нейронов тонких процессов, проис-
ходящих в центрах при возбуждении фоторецепторов.
У мясной мухи, как и у других1 насекомых, имеется три
основных оптических ганглия или по современной терминоло-
гии Lamina (первый ганглий), lobula (второй ганглий) и lobu-
la-j-lobula plate (третий ганглий). В этих образованиях имеет-
ся весьма правильное закономерное плоскостное расположение
синапсов фоторецепторных клеток и основных, так называемых
проекционных ассоциативных нейронов, обеспечивающих пере-
дачу информации из одного оптического центра в другой
Кроме того, такое же закономерное экранное расположение
в каждом центре имеют и многочисленные синапсы вспомо-
гательных ассоциативных нейронов.
Таким образом, информация от- фоторецепторов проециру-
ется в оптическом анализаторе не на 3, как предполагал
А. А. Заварзин, экрана, а на значительно большее их количе-
ство (4—5 только в первом ганглии, а всего — свыше 40 таких
специфических по типам синапсов экранов). Больше того, ока-
залось, что для оптических нервных центров характерна пра-
вильная организация групп рецепторных и связанных с ними
нервных клеток в своеобразные колонки с определенным стро-
го закономерным расположением и постоянным количеством
клеток в каждой из них (рис. 103а). Суть такого рода колон-
чатой организации сводится к разложению сигнала с рецепто-
ров в первом ганглии (lamina) на 4 канала с каждого рецеп-
тора, а во втором ганглии (medulla) на 20 параллельных ка-
налов.-Такого рода предварительная обработка информации —
необходимая ступень для ее анализа, который осуществляется
уже специализированными нейронами оптического анализато-
ра, сосредоточенными в системе третьего оптического ганглия
(lobula lobula plate) и в высших отделах центральной нерв-
ной системы. Аналогичный, хотя и не так внешне четко выра-
женный, колончатый принцип организации характерен
и для оптических нервных центров позвоночных.
Плоскостное расположение одноименных синапсов и колон-
чатый принцип объединения нейронных ансамблей пирамидных
клеток — характерный признак организации всех отделов коры-
больших полушарий головного мозга млекопитающих и чело-
века. В связи с этим в нейробиологии широкое распростране-
ние получают представления о том, что в данном случае мы
имеем дело с выражением общих принципов организации выс-
ших нервных центров. Естественно, что для понимания этих
принципов неоценимую помощь могут оказать детальные иссле-
дования оптических центров насекомых, где указанные выше
признаки выражены особенно отчетливо, а обособленность ко?
393:
лонок и относительно небольшое количество нейронов создают
благоприятные предпосылки для использования всего комплек-
са современных тонких нейрофизиологических и эксперимен-
тальных методов исследований.
УКАЗАТЕЛЬ ЛИТЕРАТУРЫ
Винников Я. А. Эволюция репепторов. Л., 1979. 139 е.
Грибакин Ф. Г. Механизмы фоторецепции насекомых. Л., 1981.300с.
Заварзин А. А. (1941). Очерки по эволюционной гистологии нерв-
ной системы. Избр. тр. М.; Л, 1950. т. 3. 419 с.
Кинд Т. В., Карпунина Н. Н., Тысяч ню к М. С. Нейроэндокрин-
ная система и методы изучения ее функциональной активности. — Тр. Все-
союз. энтомологического о-ва, 1983, т. 64, с. 5—28.
Кэн де л Э. Малые системы нейронов. — В кн.: Мозг. М., 1982, с.
59—81.
Лагутенко Ю. П. Структурная организация туловищного мозга ан-
нелид. Л., 1981. 127 с.
Мандельштам Ю. С. Нейрон и мышцы насекомого. Л., 1983. 169 с.
Поглазов Б. Ф., Левицкий Д. И. Миозин и биологическая под-
вижность. М„ 1982, с. 3—160.
Поленов А. Л. Эволюция гипоталамо-гипофизарного нейроэндокрин-
ного комплекса. — В кн.: Эволюционная физиология. Л., 1983, с. 53—109.
Румянцев П. П. Кардиомноциты в процессах репродукции, диффе-
ренцировки и регенерации. Л., 1982. 288 с.
Свидерский В. Л. Основы нейрофизиологии насекомых. Л., 1980.
280 с. -
X э м А., К о р м а к Д. Гистология. М., 1983, т. 3, с. 163—291.
Blanquet R. S., Riordan G. An ultrastructural study of the
subumbrellar musculature and desmosomal complexes of Cassiopea xamachana
(Cnidaria: Scyphozoa).— Trans. Amer. Microsc. Soc., 1981, vol. 100, N 2,
p. 409—119. ;
Eakin R. Evolutionary significance of Photoreceptors: In retrospect.—
Amer. Zook, 1979, vol. 19, p. 647—653.
Haynes L. W. Peptide neuroregulations in invertebrates.— In: Progress
in Neurobiology, 1980, vol. 15, N 3, p. 205—247.
Hernandez-Nicaise M. L., Amsellem J. Ultrastructure of
the giant smooth muscle fiber, of Ctenophore Beroe ovata.— J. Ultrastruct.
Res., 1980, vol. 72, p. 151—168.
Jones D. G. Some current concepts of synaptic organization. Berlin,
1978, p. 1—69.
Kato T. Biochemical characteristics of individual neurons.— Adv. in
Cell. Neurobiol., 1980, vol. 1, p. 119—176.
Lane N. I., Treherne J. Functional organization of arthropod neuro-
glia.— In: Insect biology in the future "VBW 80”. New York, 1980.
p. 765—796.
Lanzavecchia G. Morphological modulation in helical muscles
(Aschelminthes and Annelida).— Intern. Rev. Cytol., 1977. vol. 51,
p. 133—186.
M i n о z i M. The structure and distribution of satellite sells of cardiac
muscles in decapod crustaceas.— Cell Tiss. Res., 1981, vol. 219, N 1,
p. 69—83.
Small J. V., Sobieszek A. The contractil apparatus of smooth
muscle,— Intern. Rev. Cytol., 1980, vol. 64, p. 241—302.
394
Squire J. The structural basis of muscular contraction^ New York, 1982.
698 p.
Strausfeld N. J., Nassel D. R. Neuroarchitectures serving compound
eyes of Crustacea and insecta.— In: Comparative physiology and evolution oi
vision in invertebrates. B. Invertebrate visual centers and behavior. 1. New
York, 1981, p. 2—132.
T a u c L. Nonvesicular release of neurotransmitter.— Physiological Review,
1982, voi. 62, N 3, p. 857—893.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автосинтетическая активность — 25,
208, 214, 320
Аксон — 338, 378, 383
Аксональный холмик — 342
Аксоток — 344
Актин — 301, 331
Актин миозиновая сократительная
система — 295, 332
Аллерген — 279
Аллергическая реакция — 279
Амёбоцит:
— гранулярный— 130, 159, 242,
286, 290
— незернистый — 242
Анафилаксия —• 279
Антиген — 268
Антигеннезависимая дифференциров-
ка—281, 287
Антитела — 267, 287
Астроцит — 369, 374
АТФазный центр — 303, 305, 326
Аутоимунное заболевание — 279
Биоминерализация— 120, 221, 222
Бластотрансформация — 271, 277
Близкородственные параллелизмы —
160, 292
Венозный синусоид — 250, 261
Вещество Ниссля — 342
Вкусовая луковица — 359
Внутриклеточная кутикула—115
Волокно:
клеточное — 297, 312, 317, 320
— коллагеновое— 136, 139, 189
190, 204, 211
— симпластнческое — 297, 308, 327
— проводящее — 317, 323
— резелиновое— 199
— эластическое— 189, 192, 204
Волос— 146
Ворсинка — 65
Восковой каналец— 123
Вставочная спаивающая пластинка —
314, 317
Гемоглобин — 231, 233, 251
Гемоцианин — 233, 264
Гемоэритрин — 233
Гемопоэз'—255, 261
Гемоцитобласт — 251
Гетеросинтетическая активность —
25, 208, 320
Гиалуроновая кислота—189
Гидроксиапатит — 210
Гистиоцит— 196, 240
Гиподерма—-138, 140
Главный комплекс тканевой совмести-
мости — 276
Глиоинтерстициальная система — 374
Глия:
— олигодендроглия — 369
— периневральная — 374
Глюкансульфат — 224
Глюкозамингликаны —189, 211
Гормон:
— антидиуритический —183
— глюкагон — 48
— инсулин — 48
— Либерии — 378
— соматостатин — 48, 70
— статин — 378
— трийодтиронин — 50, 53
— тимозин — 284
— тироксин — 50, 53
— экдизон — 58, 61
— эритропоэтин — 251
Двигательная бляшка 353
Дендрнт 338, 354, 359, 362, 365, 378
Десмин 299, 330
Детерминация 21
Дивергентная дифференцировка 11,
157, 188, 289, 293
Дивергенция 10, 159, 290
Диск:
— анизотропный 299
— изотропный 299
— М 300, 304, 310
— Z 300, 309, 310, 311, 314, 32Г,-
324
Дистальный отдел 161, 162, 167,175,
183
Дистантный рецептор 356
Домен 268, 276
395
Естественный киллер 277
Зерна кератогиалина 144, 145, 151
Железы:
— аденогипофиз 55, 378
— андрогенная 58
— кардиальная 379
— зобная 283
— молочная 42, 45
— оптическая 58
— перикардиальная 58
— поджелудочная 42, 48
— прилежащая 59, 61, 379
— сальная 42, 47, 147
— слюнная 41, 58, 64, 181
— субневральная 56
— щитовидная 50
— экдизальная 59
Иммуноглобулин:
— классы 268, 287
-— рецепторы 270, 276, 284
— центры 268
— цепи 268, 284
Кальмодулин 303
Каналы:
— L 299, 305, 310
— Т 299, 305, 310, 311, 324
Кейлон 258
Кератин 141
Кератинизация:
— а 142, 143, 146, 148, 151, 154,
156
— 0 142, 148, 151
— мягкая 144, 145
— твердая 146
Кератосома 145
Кератосульфат 205
Кинетика клеточных популяций 31,
71, 73, 74, 77, 86
Клетка:
— всасывающая призматическая 68,
71, 75, 78, 104
— вторичночувствующая 354, 358,
359
— колбочка 365
— мантийная 371
— морулярная 120, 159, 244
— отросчатая эпителиальная 283,
287
— палочка 365
— памяти 275, 277
— пищеварительная 86, 87, 88, 94,
106
— плазматическая 267, 270, 289
— полустволовая 31, 71, 212, 214,
217, 221, 252, 254, 256
— родоначальная колонеобразующая
256
— сателлиты:
— мышечный 299, 320, 321, 336
— нервный 374
— стволовая 31, 71, 195, 221, 256,
257, 258
— стромальная 195, 221, 248, 260,
263, 272, 283, 287, 292
— тучная 196, 241, 278
— хлоридная 177
— шванновская 371, 375
— энтерохромаффиновая 70, 77, 95
• — эпителиально-мышечная 115, 158,
311, 317, 332
— эритропоэтинчувствительная 251
Клон 16, 251, 255, 271
Коллаген 190, 192, 195
Колонки 393
Комплекс антиген-антитело 269
Конденсационная вакуоль 44
Корзинчатый аппарат 164, 174
Костная пластинка 212, 217
Красный костный мозг 236, 249
Крипта 65, 72
Кровяная пластинка 231, 236
Кутикула 119, 121, 129, 131, 136,139
Кутикулиновая пластинка 123, 140
Лейкоциты:
— базофильные 241, 278
— нейтрофильные 187, 239
— моноциты 231, 240, 241, 254
— эозинофильные 241, 279
Лимфатический узел 272, 273, 274,
287
В-лимфоциты 270, 271, 274, 278, 280,
284, 287
Т-лимфоциты:
— дифференцировочные 277
— антигеиреактивные и хелперы Т
276
— киллеры и прекиллеры 275, 276
— супрессоры 280
— хелперы В 271
Линька 125, 129, 131, 150, 151, 156
Макроглия 369
Макрофаг:
— обычный 188, 240, 271, 283
— отросчатый 240, 250, 272
Мальпигиевы сосуды 161, 167, 176,
186
Mg-зависимая Са-АТФаза 299, 306 ’
Мегакариоцит 236, 252
Мезоглея 188, 201
Мезодерма 18
Меланоцит 149, 247
396
Меромиозин 303
Метод:
— авторадиографии:
----метаболической 29, 40, 44,
131, 344
----тимидиновый 29, 31, 74, 77, 86
— имунноцитохимии 29
— клонального культивирования:
------- в организме 31, 255
•---вне организма 31, 149, 152, 256
— сравнения по принципу функцио-
нальной аналогии 12„ 33, 289, 386
Механорецептор 355, 357
Микроворсинки 68, 75, 78, 95, 98,
105
Микротрубочкоподобные структуры
242
Миобласт 320
Миоглобин 299
Миозин 303, 326, 330, 333
Миозиновая регуляторная система
303, 305, 326
Миотом 18, 320
Миофибрилла 299, 214
Миофибробласт 198, 332
Митотический цикл 25
Моча: '
— первичная 161
— гипотоничная 183
— гипертоничная 183
Мышца:
— асинхронная летательная 309, 336
— синхронная 310, 336
— висцеральная 295, 328
— соматическая 295, 297, 307, 311
-— целомическая 295, 312
Надхрящница 208, 225, 226
Нейрон:
— ассоциативный 338, 380, 381
— ассоциативно-двигательный 381
— чувствительный 338, 339, 380, 381
— эффекторный 338, 339, 342, 380,
381
Нейрональные отношения 11, 381
Нейропиль:
— двигательный 384
— основной 384
— чувствительный 384
Нейросекреторная клетка:
— моноаминэргическая 378
— пептидэргическая:
---- аденогипофизотропная 378
---- висцеротропная 378
Нейротрубочка 342
Нейрофиламент 342
Нексус (щелевидный контакт) 315,
324
Нервные центры:
— оптические 11, 387
— экранные 387, 389, 392
— ядерные И, 383
Нефрон 161, 167, 168, 183
Нефротом 18
Нити:
— толстые миозиновые 300, 303
— тонкие актиновые 300, 301, 302
Нормобласт 251
Омматидий 389
Осмотическая фильтрация 161, 176
Остеобласт 212
Остеокласт 215
Остеон 217
Остеоцит 212
Паракортикальная зона 274
Парамиозин 308, 326
Перехват Ранвье 371
Перикарион 338
Перитрофическая мембрана 81, 89
Петля Генле 167, 183
Пиноцитоз 64, 69, 106, 175
Плазмобласт 271
Плотные тела 324, 330, 332
Подоцит 171, 181
Политенная хромосома 27, 41
Постоянный пиноцитозный комплекс
69, 75, 106
Преостеобласт 212
Препроинсулин 50
Пристеночное пищеварение 68
Пробная масса 355, 357, 368
Проинсулин 50
Проколлаген 193
Проксимальный отдел 161, 162, 174
Прокутикула 121
Протеогликан 50, 189, 211
Противоточная осмотическая система
183
Протонефридий 162, 163, 164
Проэластин 194
Рабочий цикл мышечного сокраще-
ния 304
Реабсорбция 161, 183
Регенерационное гнездо 74, 81
Ректальное утолщение 169, 185
Репаративная регенерация:
— мышц 320
— нервов 375, 377
Рефлекторная дуга 381
Роговые чешуйки 144
Сарколемма 299
Саркомер 300, 305, 308, 309, 310
Секреция:
— апокриновая 46
— голокриновая 47
— изоосмотическая 161
397
— мерокриновая 45
Синапс:
— химический 347, 348, 349, 350
— электротонический 346
Скелетогенная мезенхима 212
Слуховой гребешок 357
Собирательная трубочка 167, 183
Собственный аппарат спинного мозга
383
Соединительнотканное пространст-
во 283
Соматическая полиплоидизация 27,
41, 108, 236, 308, 340
Сомит 18, 320
Спикулобласт 221
Спланхнотом 18, 320
Статоцист 359
Субпопуляция 16
Тегумент 114
Тельце Гассаля 283
Теории:
— дивергентной эволюции 10, 11
— дифференциальной активности ге-
нов 21
— параллелизма 12, 385, 387
— фагоцителлы 7
— филэмбриогенеза 8
Ткань:
— - вторичная 9
— жировая 195
— интерстициальная 118
— камбиальная 26, 31, 71, 77, 86,
195, 221, 247
— костная 210
— миелоидная 250
— первичная 8
— плотная соединительная 203
— растущая 26
— ретикулярная 188, 272, 249, 283
— рыхлая соединительная 177
— третичная 9
Толерантность 280, 281
Тромбоцит 238
Тромбоцитопоэз 250, 252
Тромбоцитопоэтин 258
Тропоколлаген 190
Тропонин 302
Тропонин тропомиозиновая регуля-
торная система 302, 305
Тропоэластин 194
Трофоспонгий 374
Туника 129, 244
Фабрициева сумка 266, 287
Фагоцнтобласт 7, 187
Фатер-пачиниевое тельце 354
Фенольное задубливание 120
Фибриноген 236
Фибробласт 189, 195, 197, 199, 248,
250, 263, 272
Фибронектин 194
Филогенетическая:
— метаплазия 22, 33, 290, 334, 362
Фоторецепторы 355, 365
Хеморецепторы 355, 359
Хетобласт 133, 134
Хинон 120
Хитин 119
Хлорагоцит 262 ‘
Хондробласт 205, 207
Хондроцит 205
Хондроитинсульфат А и С 205, 211
Цементный слой 123
Цианоцит 264
Циртоцит 164
Щетинка 133, 134
Щетинконосный мешок 134
Экзокутикула 121
Эндокутикула 121
Эндомитотический цикл репродукции
27 ’
Эноцит 125
Энтодерма 19
Экстерорецепторы 354, 356
Эпикутикула 121, 140
Эпителий:
— аннелидного типа 119, 136, 138
— артроподного типа 119, 120, 129,
131, 135, 139
— многослойный:
----неороговевающий 112, 154, 158
------ ороговевающий 112, 141, 142,
150, 152, 156, 158
— нематодного типа 119, 138, 139,
140
— псевдокутикулярный 114
Эритробласт 251
Эритробластический островок 251
Эритропоэз 250
Эритропоэтин 251
Эритроцит 231, 233, 234, 235
ОГЛАВЛЕНИЕ
Предисловие .......................................................... 3
ЧАСТЬ I. СРАВНИТЕЛЬНАЯ, ЭВОЛЮЦИОННАЯ ГИСТОЛОГИЯ,
СОВРЕМЕННОЕ СОСТОЯНИЕ И ЕЕ ЗНАЧЕНИЕ В СИСТЕМЕ
БИОЛОГИЧЕСКИХ НАУК
Глава 1. Возникновение исторического подхода в гистологии. Об-
щая характеристика тканей многоклеточных.......................... 6
§ 1. Разработка эмолюционных идей в гистологии...................—
§ 2. Определение понятия ткани. Классификация тканей ... 15
Глава 2. Некоторые общие закономерности формирования тканей в
онтогенезе и взаимоотношения процессов репродукции и
дифференцировки их клеток . .................................... 17
§ 1. Формирование тканей в онтогенезе....................., —
§ 2. Взаимоотношение пролиферации и дифференцировки клеток
прн формировании тканей и в их нормальной жизнедеятель-
ности ......................................................24
Глава 3. Краткая характеристика некоторых современных методов
гистологических исследований . . . ;..............................28
Глава 4. Значение сравнительного подхода в современной гистоло-
гии. Место сравнительной гистологии в системе биологиче-
ских наук........................................................ 32
ЧАСТЬ II.
ЭПИТЕЛИАЛЬНЫЕ ТКАНИ
Глава 5. Железистые эпителии.................................. . 37
§ 1. Экзокриновые железы . ...............................; 38
§ 2. Эндокринные железы........................... ... . 47
§ 3. Некоторые общие закономерности эволюционной динамики
железистых эпителиев.................................. 61
Глава 6. Кишечные эпителии.......................................64
§ 1. Кишечные эпителии позвоночных животных............... 65
§ 2. Кишечные эпителии полухордовых, вторичноротых и первич-
норотых беспозвоночных животных..........................75
§ 3. Кишечные эпителии низших многоклеточных....................99
§ 4. Общие закономерности эволюционной динамики кишечных
эпителиев..................................................104
Глава 7. Кожные эпителии...........................................111
§ 1. Погруженные, однослойные и многорядные эпителии ... 112
§ 2. Кутикулярные эпителии.....................................119
§ 3. Многослойные эпителии.....................................141
§ 4. Некоторые закономерности эволюционной динамики кожных
эпителиев..................................................157
Глава 8. Осморегулирующие и выделительные эпителии...................160
§ 1. Общая характеристика смешанных осморегулнрующих и вы-
делительных эпителиальных канальцев..........................—
' § 2. Тонкая структурная организация фильтрационных и реаб-
сорбциониых отделов осморегулирующнх эпителиальных ка-
нальцев .......................................................,169
§ 3. Вспомогательные осморегулирующие эпителиальные системы
у животных............................................... 176
§ 4. Некоторые общие закономерности эволюционной динамики
осморегулирующих и выделительных эпителиев.................181
ЧАСТЬ III. ТКАНИ ВНУТРЕННЕЙ СРЕДЫ
Глава 9. Оседлые трофические разновидности ткаией внутренней
среды . . ........................................................189
§ 1. Рыхлая соединительная ткань и ее разновидности у позво-
ночных животных...............................................—
§ 2. Интерстициальные трофические ткани, паренхима и мезоглея
беспозвоночных животных...................................197
Глава 10. Скелетные ткани..........................’..............203
§ 1. Скелетные ткани позвоночных животных.............’ . —
§ 2. Скелетные опорные ткани беспозвоночных животных ... 221
Глава 11. Кровь, миелоидная и лимфоидная ткани позвоночных и их
функциональные аналоги у беспозвоночных животных . . 229
§ 1.' Система свободных' элементов тканей внутренней среды . —
§ 2. Кроветворение........................................ 247
§ 3. Лимфоидная ткань . .'..................................265
Глава 12. Некоторые общие закономерности эволюционной динамики
тканей внутренней среды . .......................................289
ЧАСТЬ IV. МЫШЕЧНЫЕ ТКАНИ И ТКАНИ НЕРВНОЙ СИСТЕМЫ
Глава 13. Мышечные ткани...................................... 295
§ 1. Классификация и общая характеристика мышечных ткаией —
§ 2. Поперечнополосатые и косоисчерченные мышечные ткани . 297
§ 3. Гладкие мышцы беспозвоночных животных..................323
§ 4. Гладкие мышцы позвоночных животных...................328
§ 5. Общая характеристика эволюционной динамики мышечных.
тканей.................................................... 332
Глава 14. Ткани нервной системы................................337
§ 1. Нервные клетки...................................: ; . —
§ 2. Синапсы...............................................345
§ 3. Рецепторные нервные окончания.........................353
§ 4. Нейроглия............................................ 368
§ 5. Нейросекреторные клетки................................378
§ 6. Некоторые общие закономерности эволюционной динамики
тканей нервной системы.....................................381
ИБ № 2169
Алексей Алексеевич. Заварзин
Основы сравнительной гистологии
Учебное пособие
Редактор Т. Н. Пескова.
Художник А. Н. Гришин
Художественный редактор- О. Н. Советникова
Технический редактор Е. Г. Учаева
Корректоры К. Я- Бенина, Л4. В. Унковская
Сдано в набор 27.07.84. Подписано в печать 19.03.85. М-27793. Формат бумаги 60X901/t«. Бу-
мага тип. №2. Гарнитура литературная. Печать высокая. Усл. печ. л. 25. Усл. кр.-отт.
25,12. Уч. изд. л. 27,£8. Тираж 5000 экз. Заказ 672. Цена 1 р. 20 к.
Издательство ЛГУ имени А. А. Жданова. 199164, Ленинград, Университетская наб., 7/9.
Сортавальская книжная типография Государственного комитета КАССР по делам изда-
тельств, полиграфии и книжной торговли. Сортавала, ул. Карельская, 42.