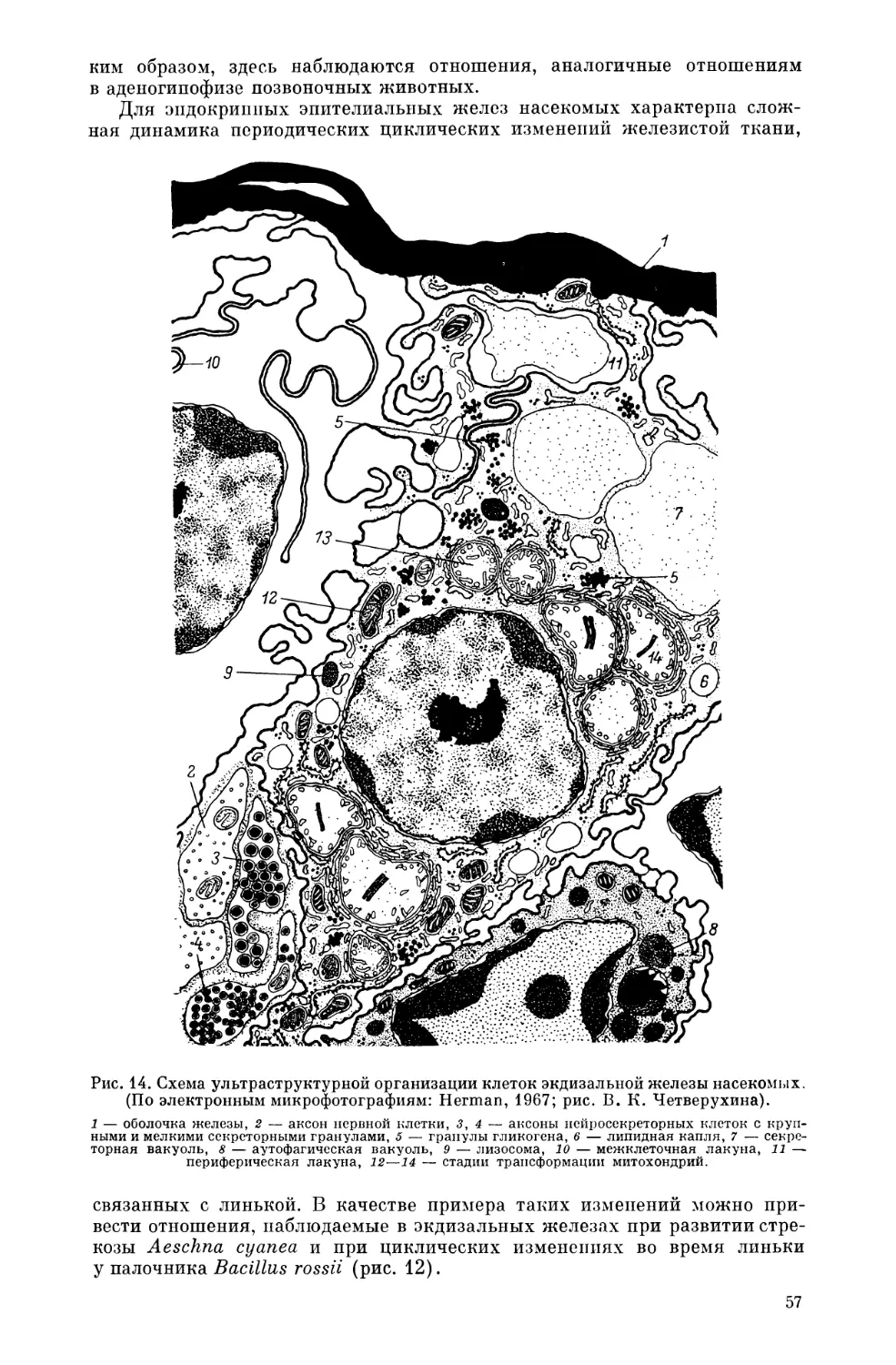
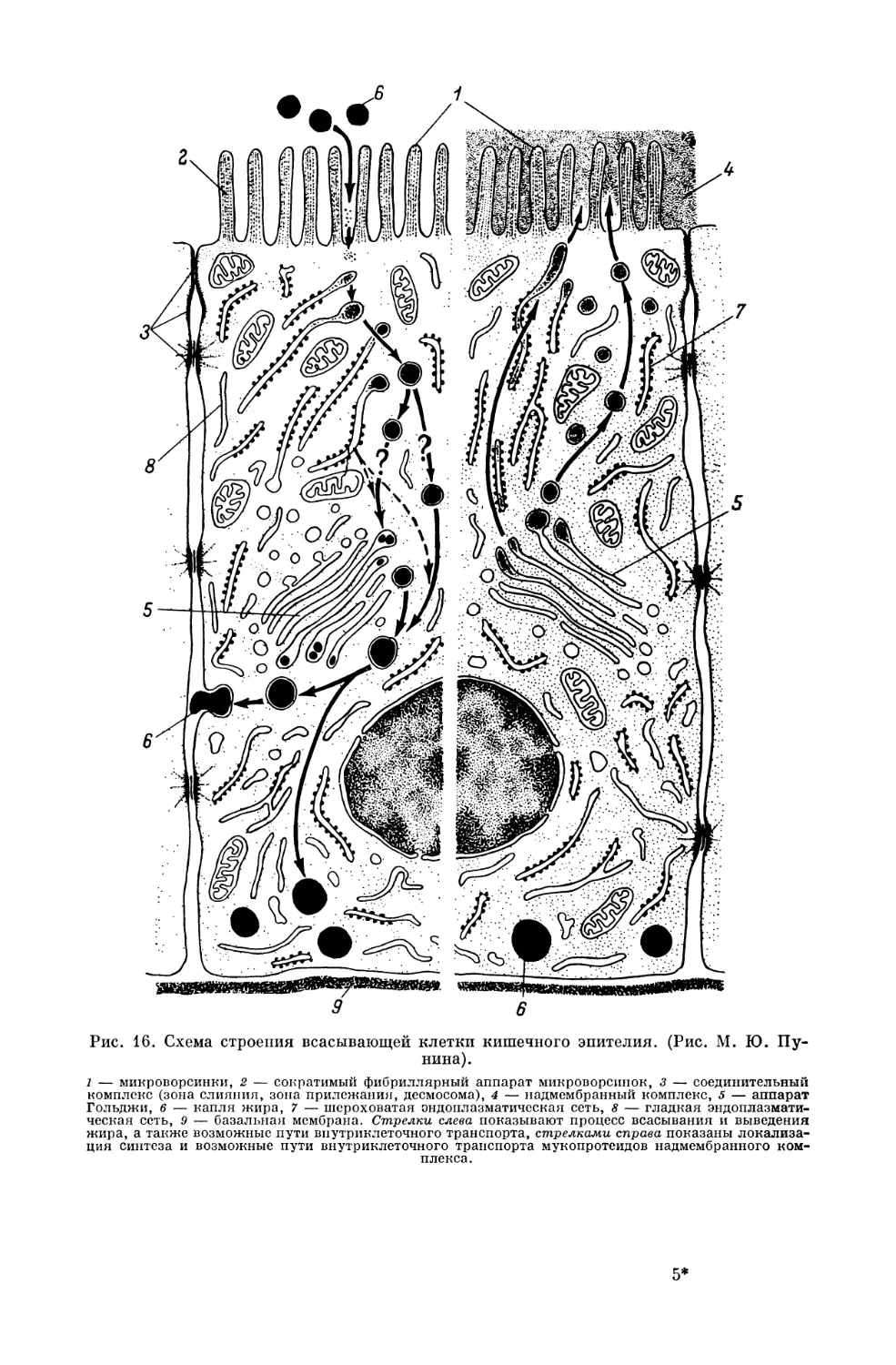
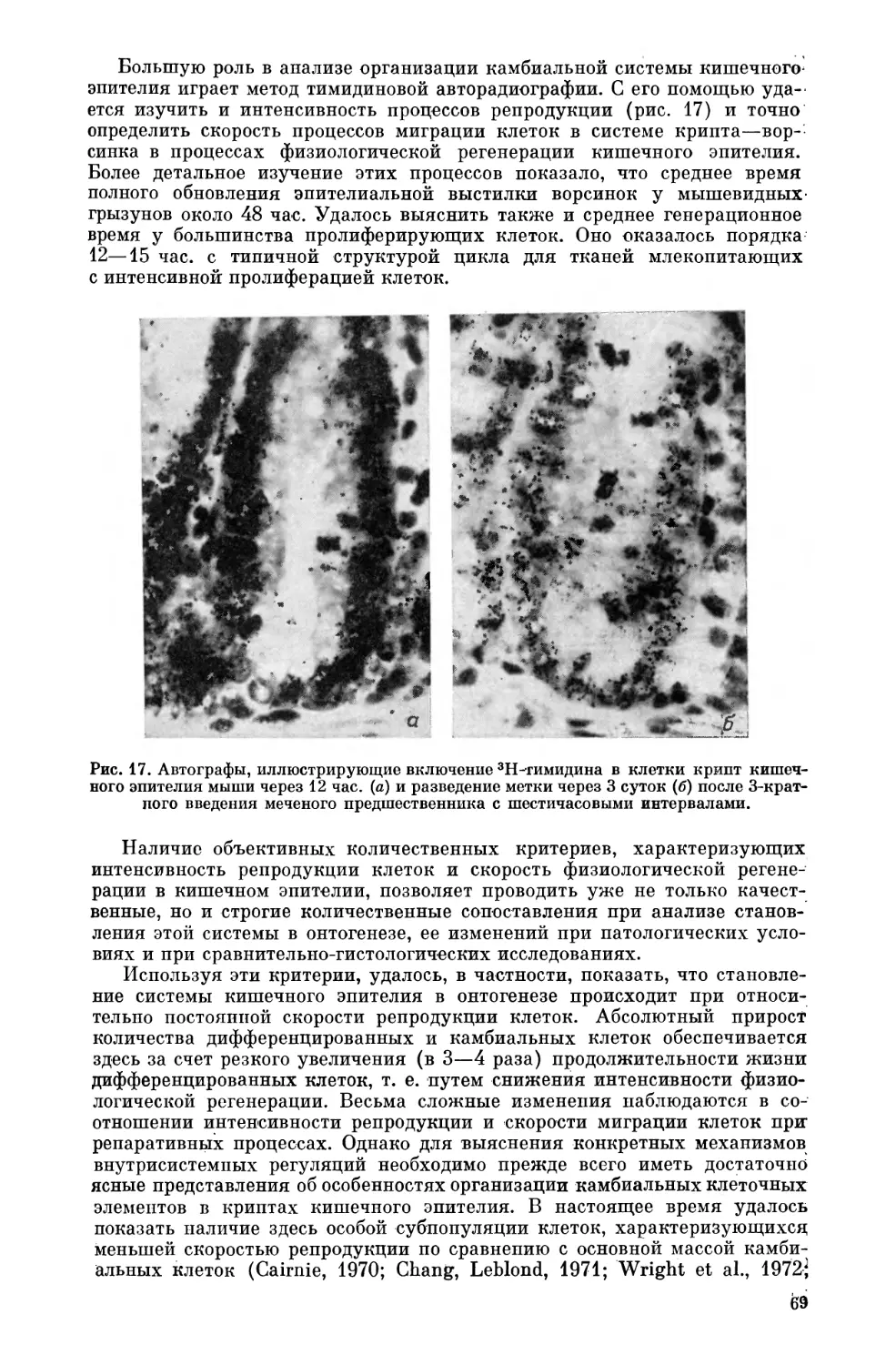
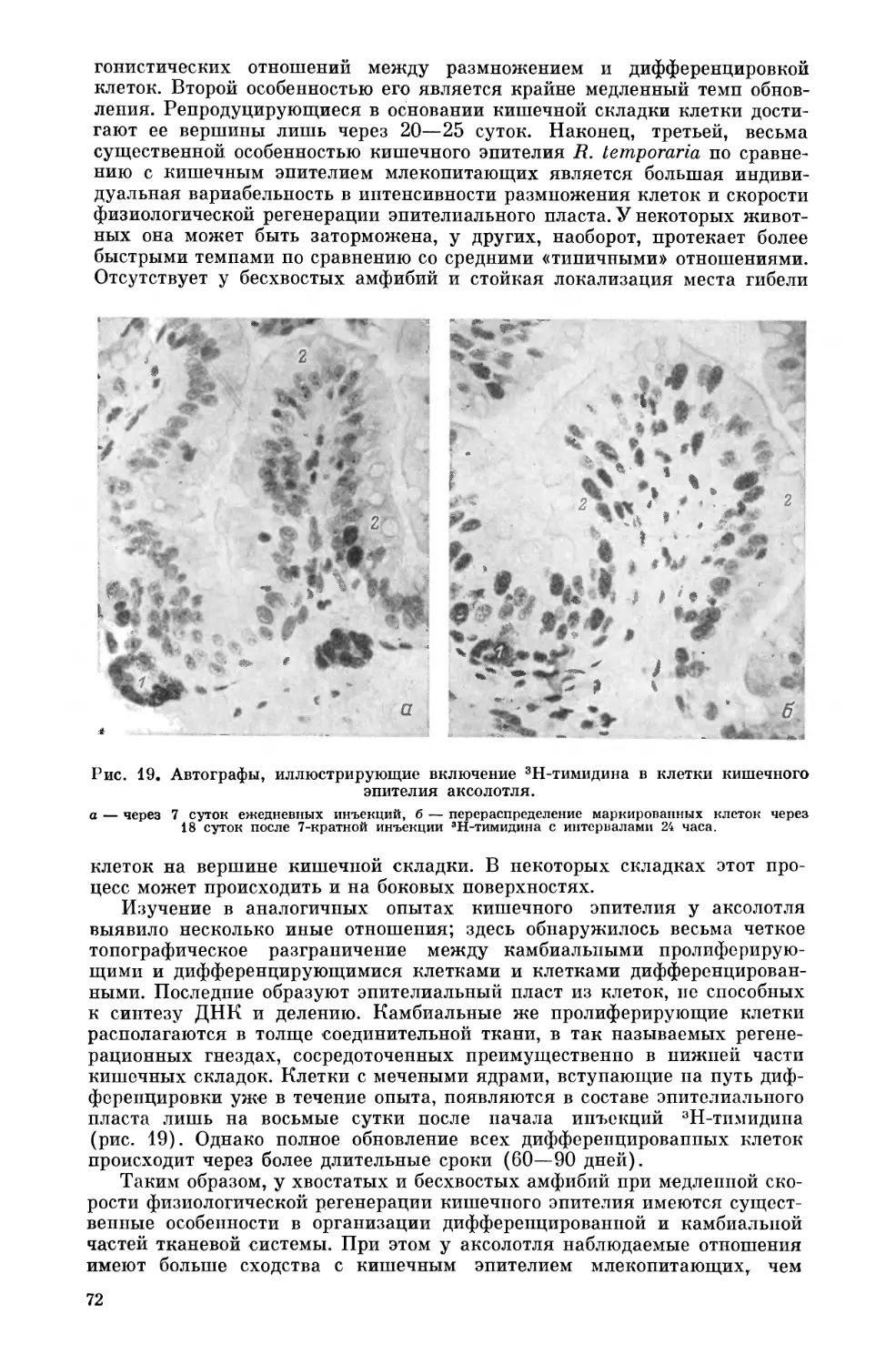
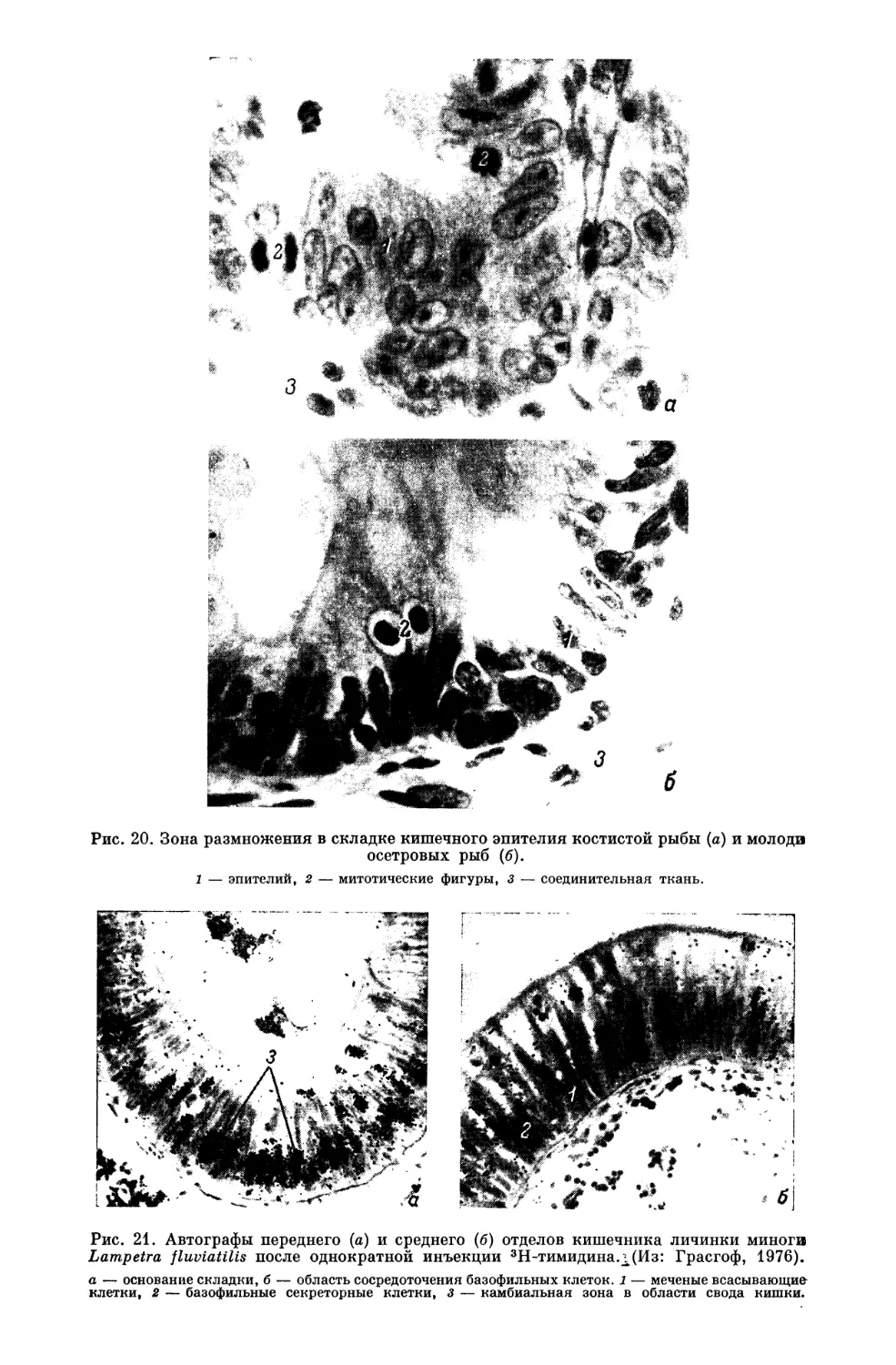
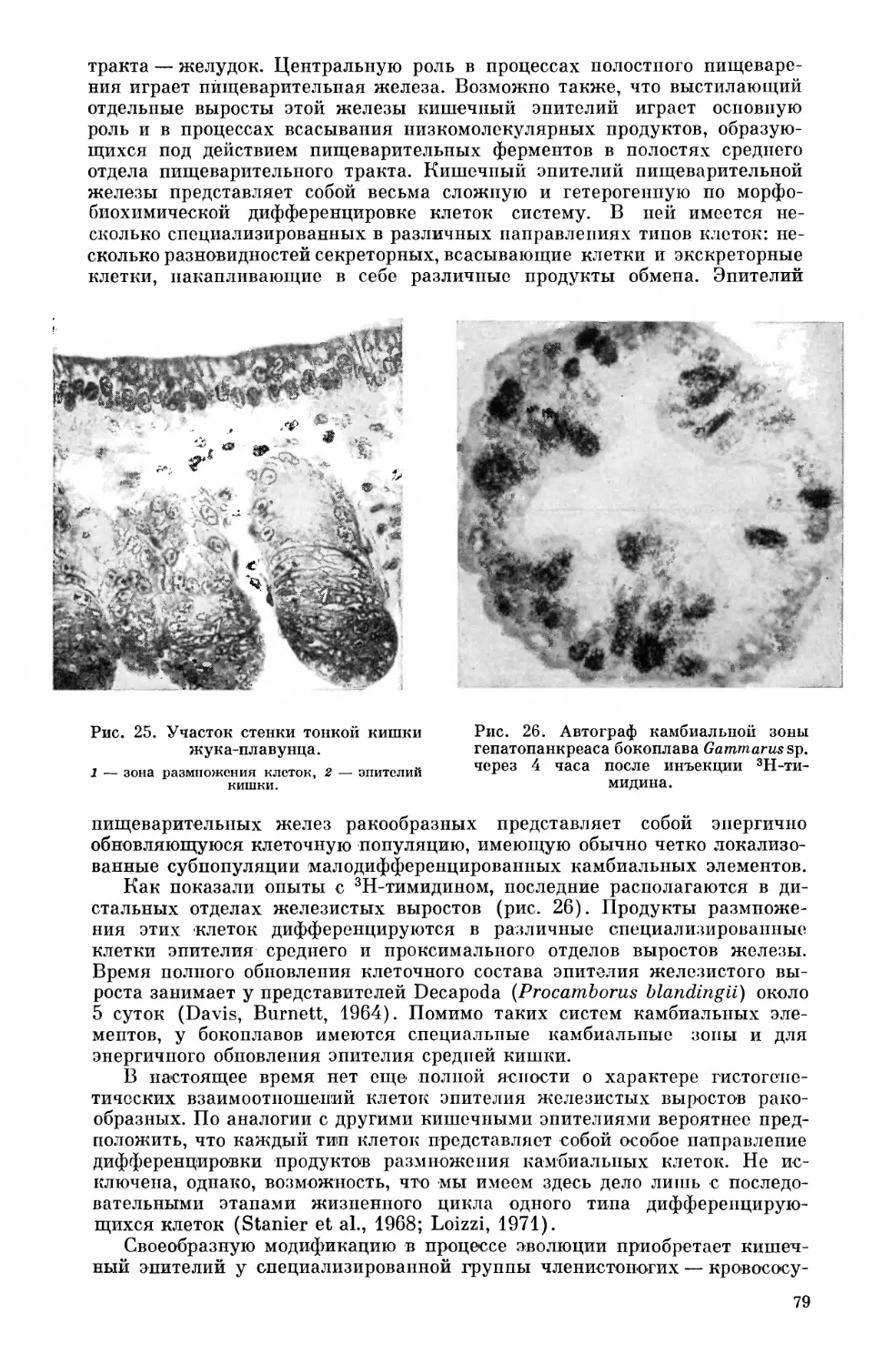
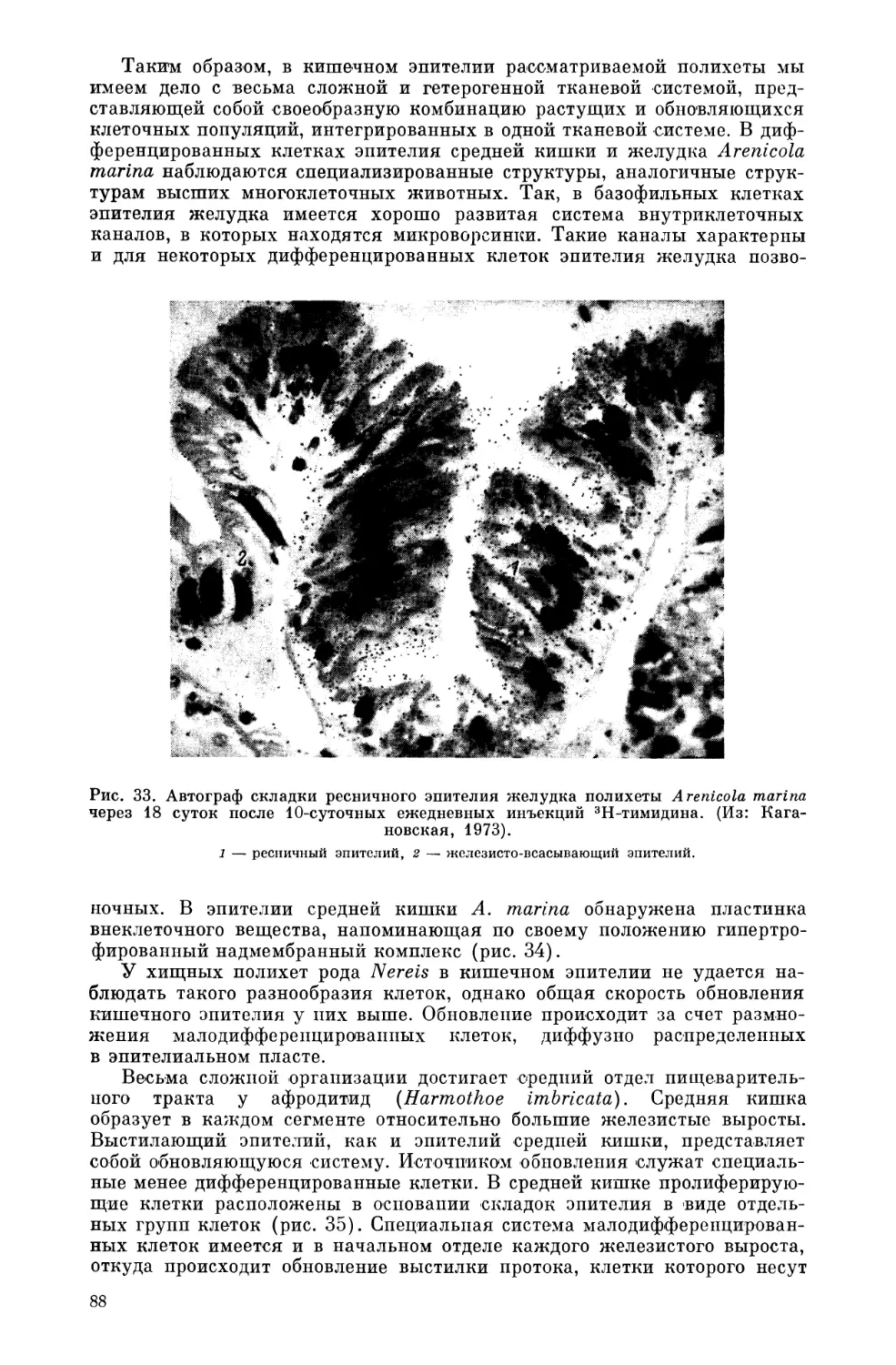
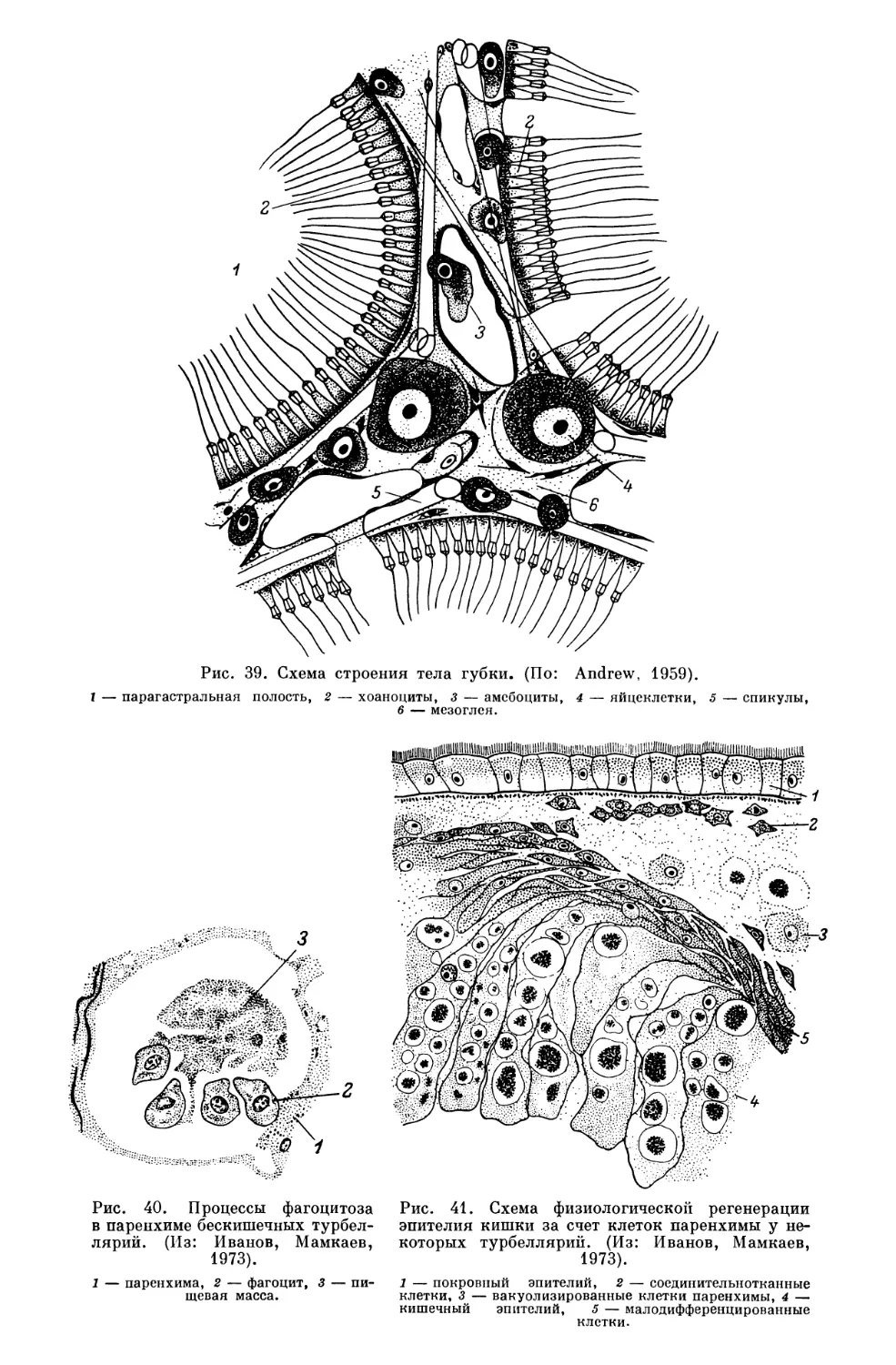
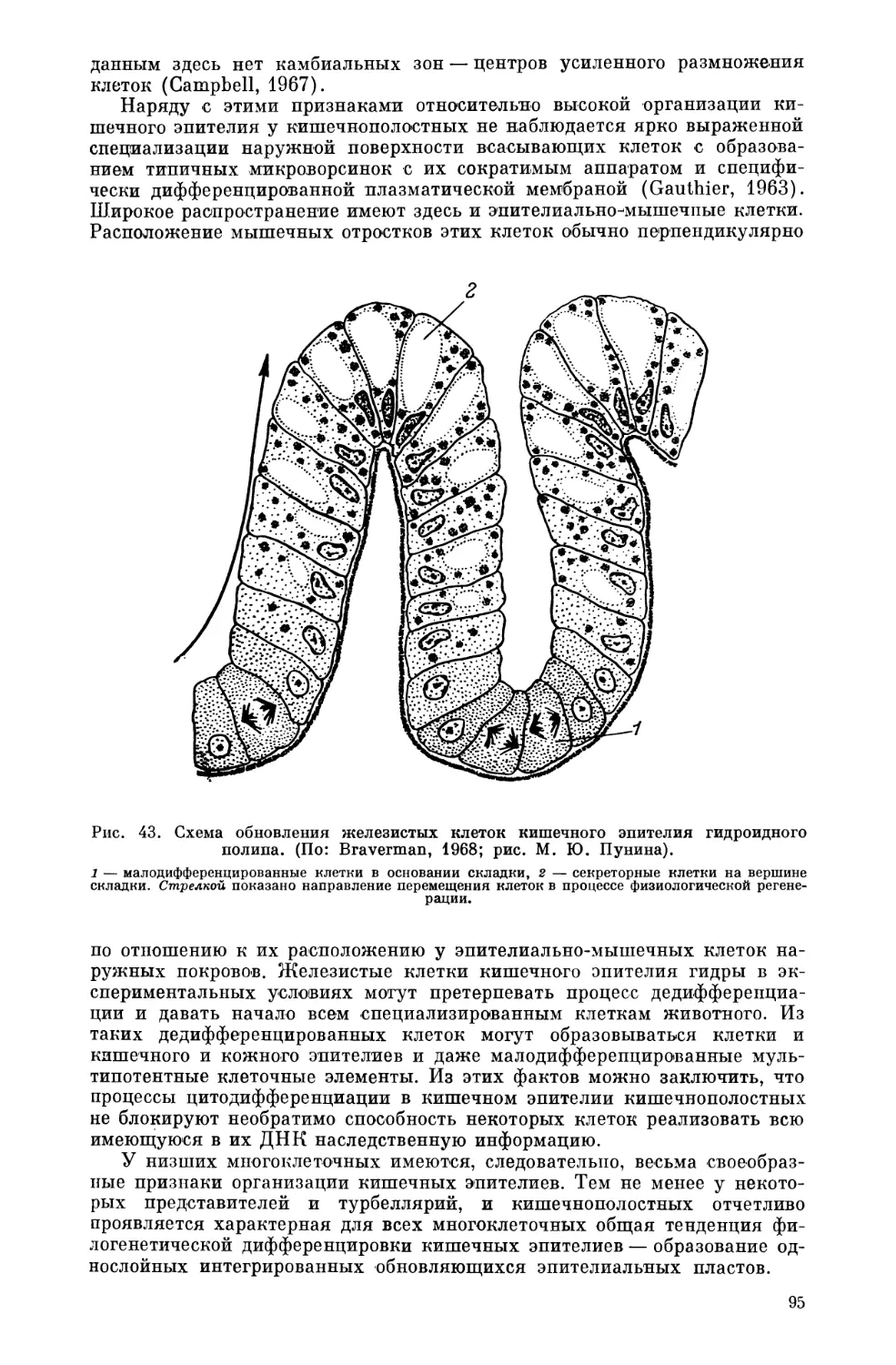
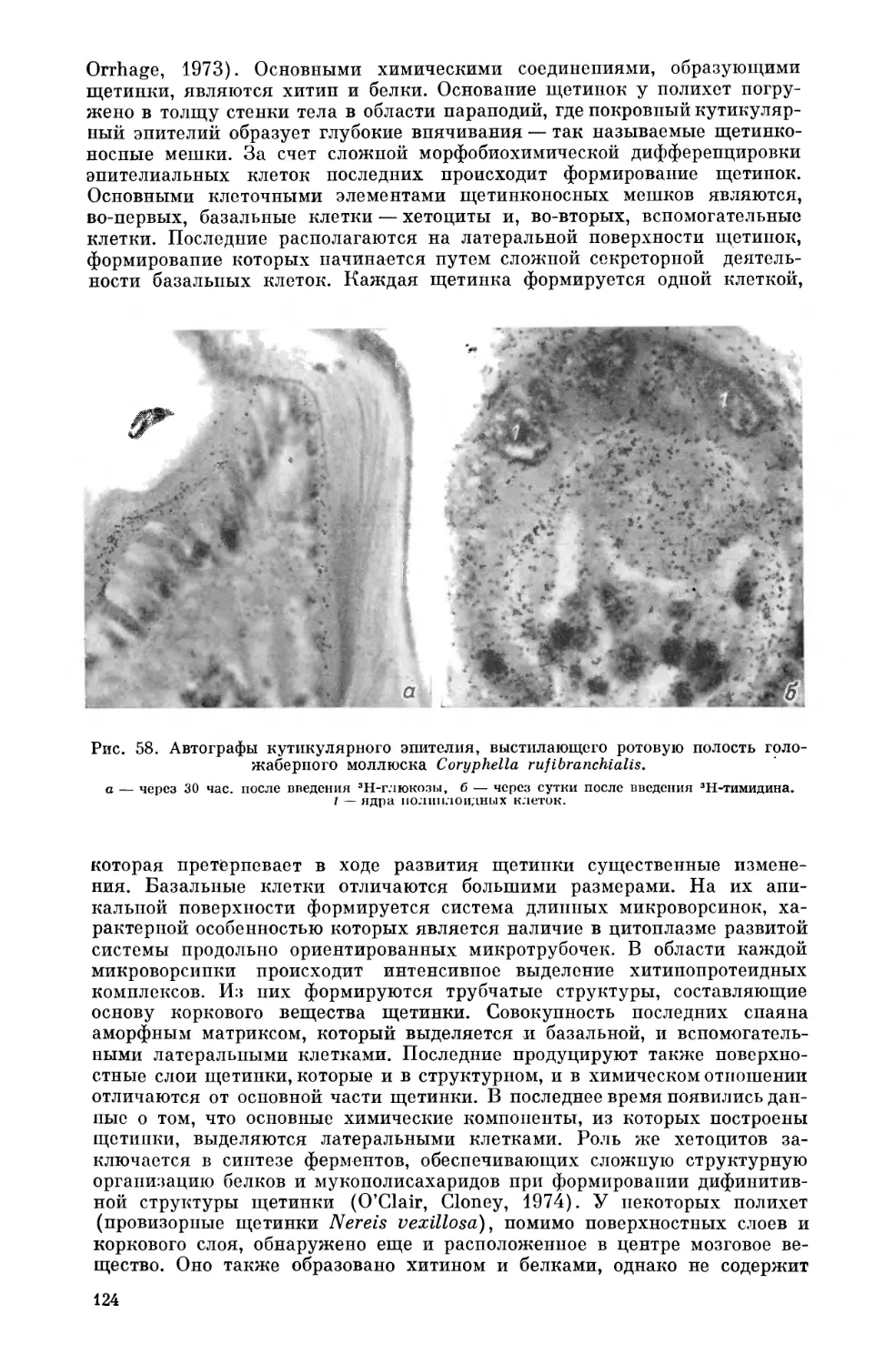
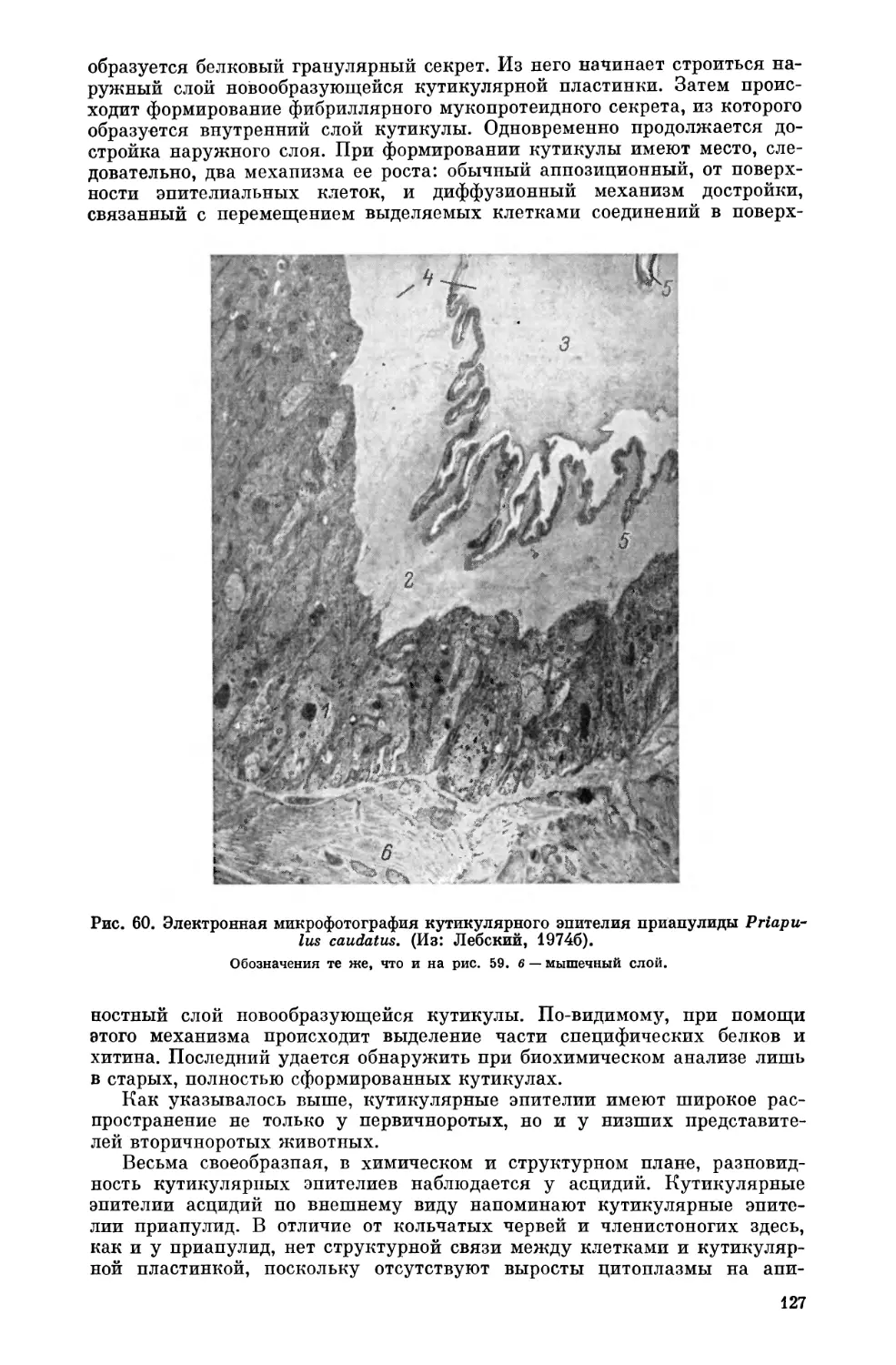
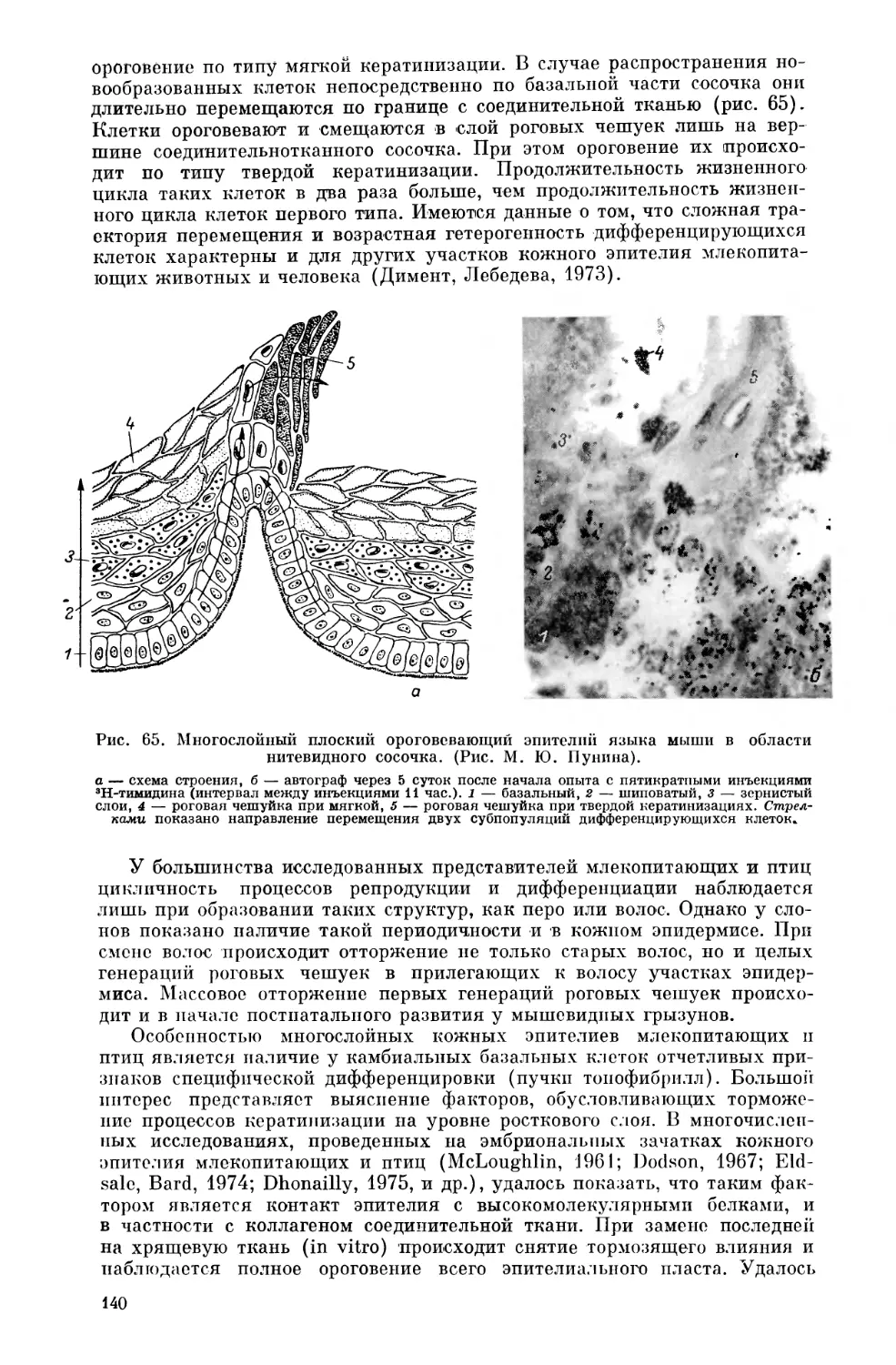
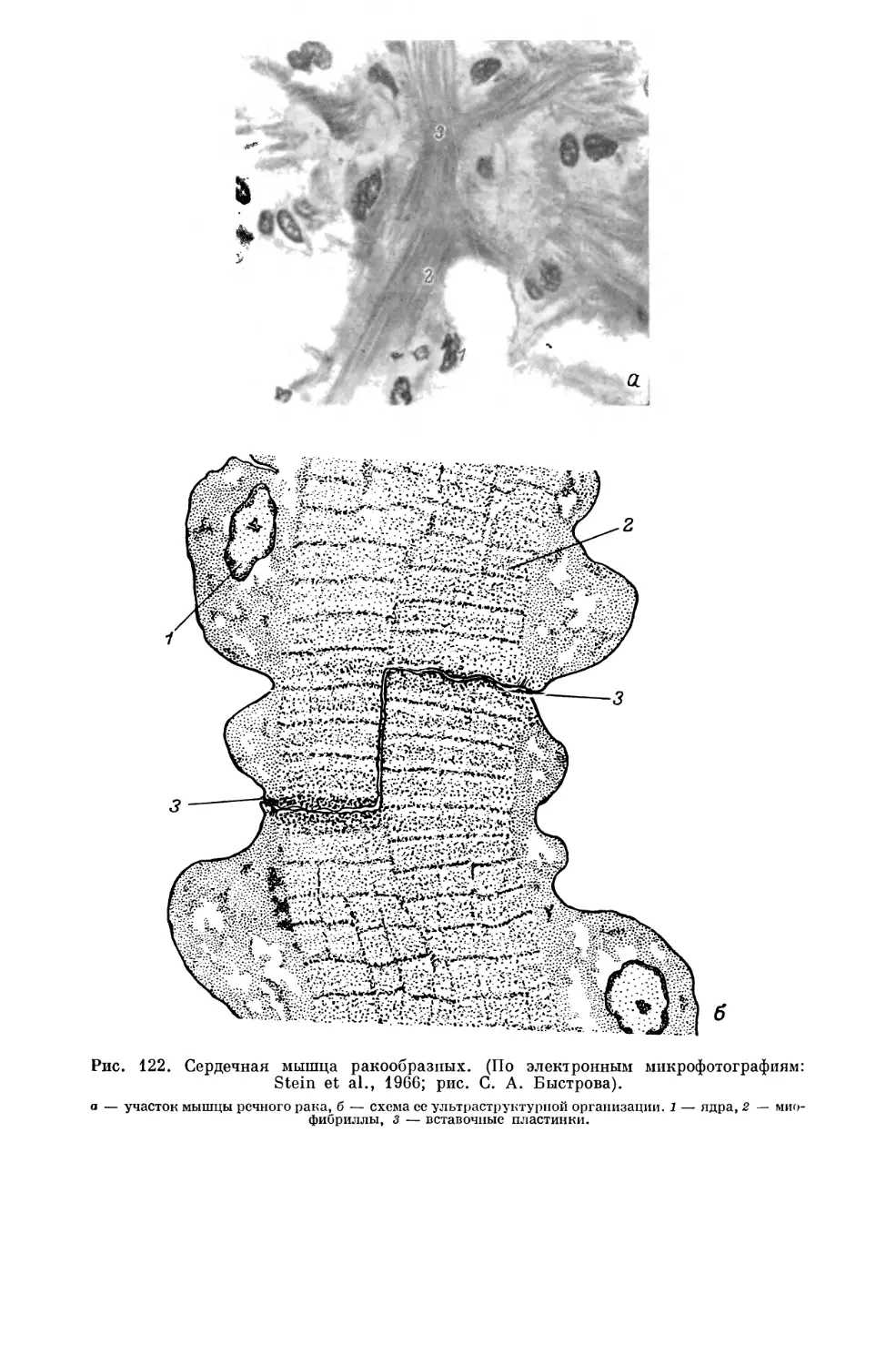
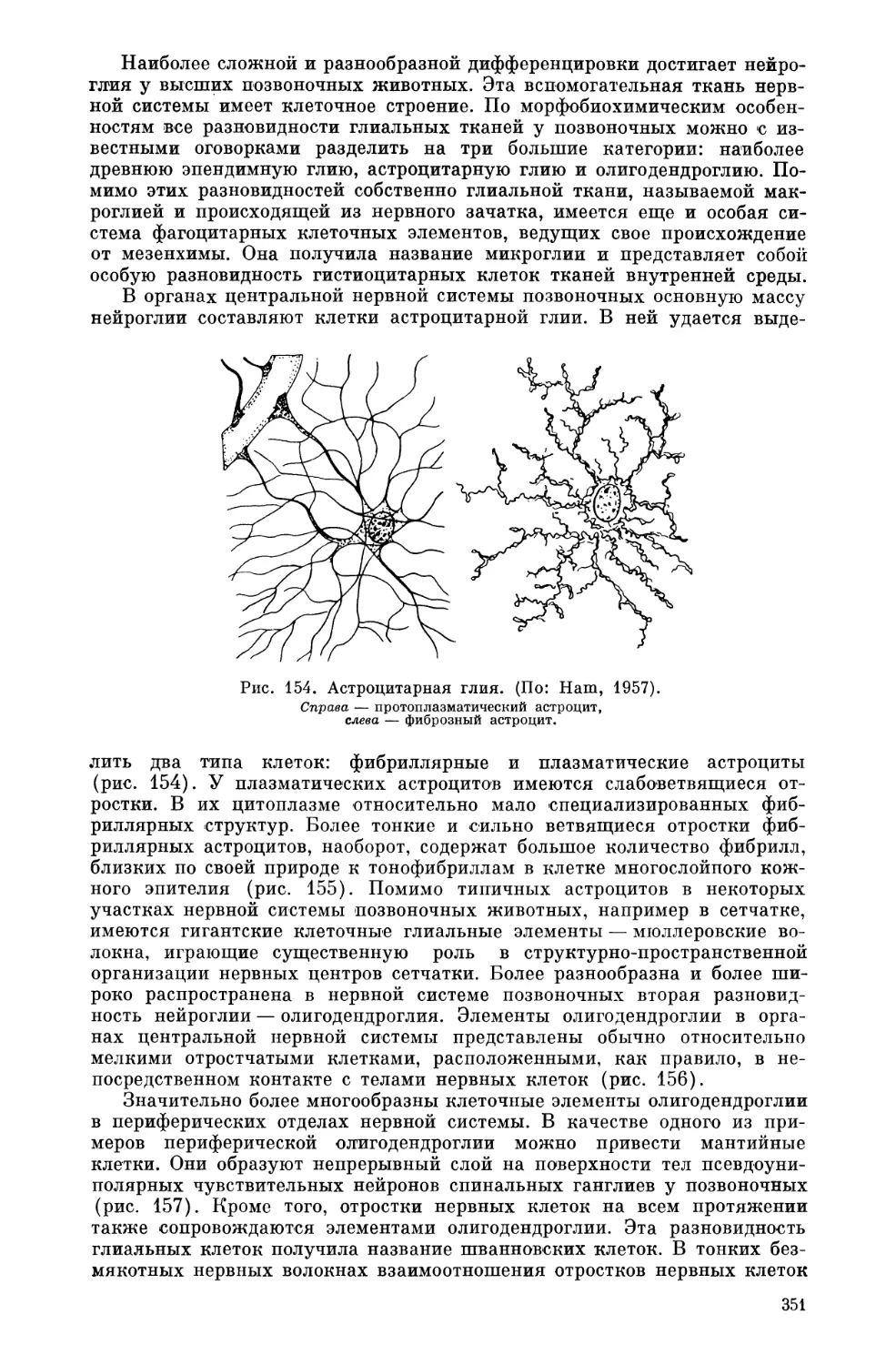
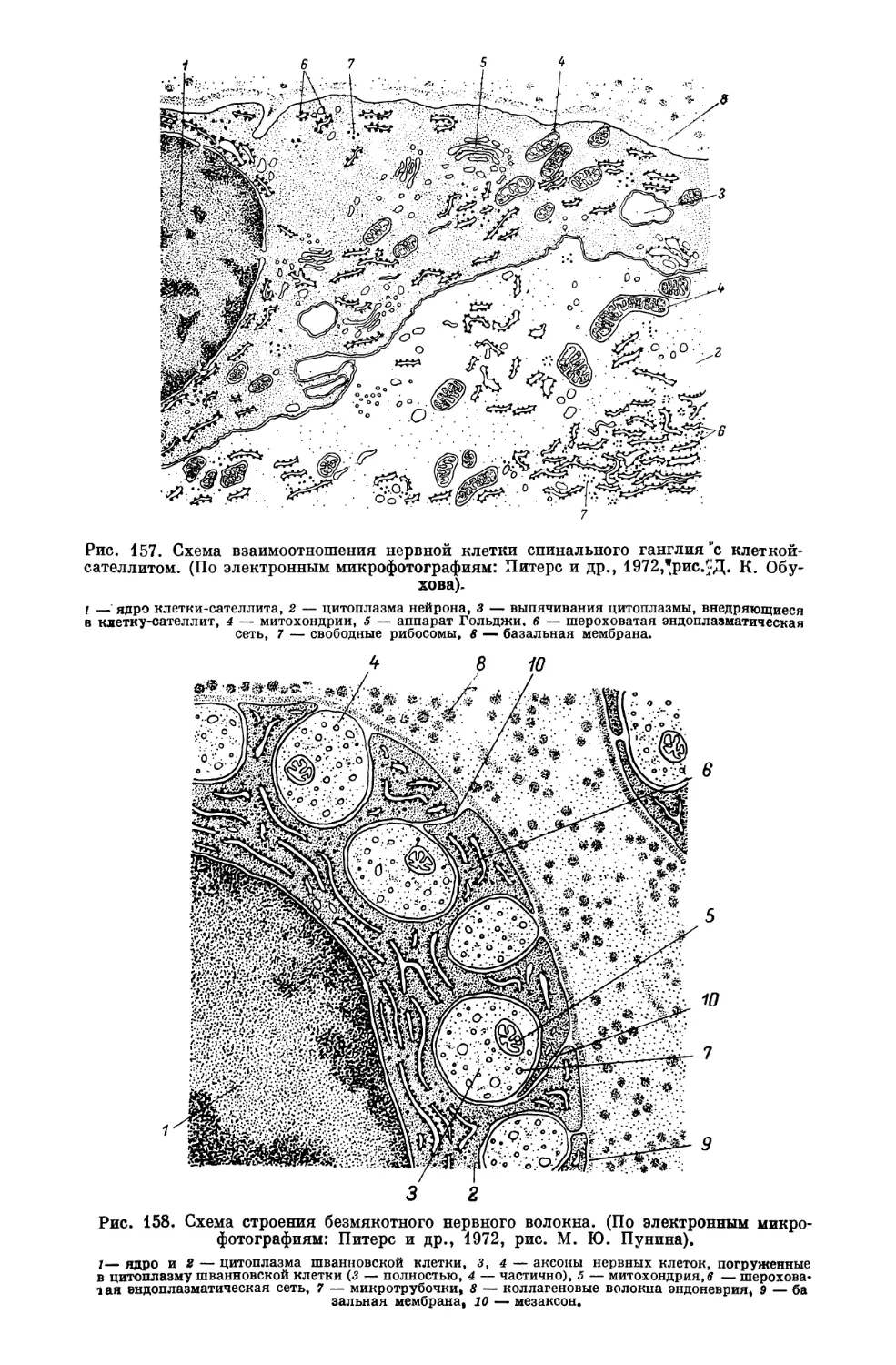
Текст
АКАДЕМИЯ ПАУК СССР
НАУЧНЫЙ СОВЫ' ПО ПРОБЛЕМАМ ЦИТОЛОГИИ
А.А.ЗАВАРЗИ Н
основы
ЧАСТНОЙ цитологии
И СРАВНИТЕЛЬНОЙ
гистологии
МНОГОКЛЕТОЧНЫХ
животных
в
113 ДАТ Е Л Ь СТВО «II А у К А»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
ЛЕНИНГРАД • 1976
УДК 591.8 : 576.3
Основы частной цитологии и сравнительной гистологии многоклеточных животных.
Заварзин А. А. 1976. Изд-во «Наука», Ленинградск. отд., Л., 1—411.
В книге с эволюционных, исторических позиций анализируется большой факти-
ческий материал по сравнительной гистологии четырех типов тканей как позво-
ночных, так и беспозвоночных животных. Соответственно этой задаче она состоит
из трех основных частей. В них на многочисленных примерах разбираются законо-
мерности филогенетической дифференцировки эпителиальных тканей (часть II),
тканей внутренней среды (часть III), мышечных тканей и тканей нервной системы
(часть IV). Кроме того, в книге имеется краткий очерк современных представлений
сб общих закономерностях организации клеток, происхождении и развитии тканей
в онтогенезе (часть I). В заключительных разделах каждой главы и в общем за-
ключении делается попытка теоретической оценки имеющегося сейчас фактиче-
ского материала и его значения для разработки проблемы дифференцировки. Та-
ким образом, книга имеет двоякое значение. С одной стороны, она может служить
учебным пособием для биологов широкого профиля. С другой стороны, в ней обоб-
щен большой сравнительно-гистологический и цитологический материал п в этом
отношении она представляет интерес как для специалистов цитологов и гистологов,
так и для биологов смежных специальностей. Илл. —173, библ. — 644 назв.
21003-655
О 1 547 “76
055 (02)-76
© Издательство «Наука», 1976
ПРЕДИСЛОВИЕ
В основу настоящей книги положен курс лекций по частной цитологии
и общей сравнительной гистологии, в течение ряда лет читаемый для сту-
дентов биолого-почвенного факультета Ленинградского государственного
университета. Этот курс по своей научной основе и фактическому мате-
риалу отличается от курсов гистологии и цитологии, читаемых в меди-
цинских и ветеринарных высших учебных заведениях. Программа и фак-
тическое содержание последних нашли достаточно широкое освещение
в современных отечественных и зарубежных учебниках и учебных посо-
биях по гистологии. Общие разделы этих курсов преследуют цель подго-
товить студентов к усвоению функциональной микроскопической анато-
мии млекопитающих и человека, т. е. имеют практическую направлен-
ность. Описание закономерностей организации основных типов ткапей
у млекопитающих и человека проводится в медицинских учебных посо-
биях с большим или меньшим учетом современных достижений цитоло-
гии и гистологии. Однако это описание не отражает современного состоя-
ния гистологии и частной цитологии как паук о специализированных
клетках и тканях всех многоклеточных животных.
Отсутствие в учебниках гистологии характеристики общих закономер-
ностей организации ткапей в широком сравнительно-гистологическом ас-
пекте, особенно в учебной литературе последних лет, представляет собой
существенный недостаток. Такое положение тем более трудно объяснимо,
что за последнее время накоплен громадный фактический материал по
сравнительному изучению специализированных клеток и тканей много-
клеточных животных.
Как хорошо известно, одним из основных достижений эволюционного
направления в гистологии 30—40-х годов было создание теории парал-
лельных рядов тканевой эволюции. Эта теория объяснила факты, свиде-
тельствующие о наличии общих универсальных для всех многоклеточных
животных закономерностей филогенетической дифференцировки аналогич-
ных в функциональном отношении ткапей.
Широкое использование принципиально новых, преимущественно мор-
фобиохимическпх методов исследования позволило резко углубить морфо-
логические и биохимические критерии, по которым можно проводить
сопоставление сходных в функциональном отношении тканевых структур.
Имеющиеся в мировой литературе попытки такого сопоставления по от-
дельным типам тканей или тканевым элементам (хрящевые ткани, сокра-
тимые структуры, синаптические контакты, рецепторные клетки) пока-
зали широкое распространение явлений параллельной филогенетической
дифференцировки этих структур у разных групп многоклеточных орга-
низмов. При этом общие закономерности усложнения в эволюции анало-
гичных структур выявлены и на тканевом, и на клеточном, и па молеку-
лярном, и па надмолекулярном уровнях организации.
Проявление же этих общих закономерностей структурной п химиче-
ской организации выражается не в абсолютном тождестве аналогичных
структур и тканей, а в глубоком сходстве по ряду основных показа-
телей при наличии в каждом конкретном случае существенных струк-
турных и химических отличий. Иными словами, при тщательном анализе
1 *
3
аналогичных структур у животных разных ветвей филогенетического
древа обнаруживается целый спектр структурных и химических модифи-
каций в обеспечении данной конкретной сходной элементарной функции.
Однако этот спектр не бесконечно разнообразен, а ограничен определен-
ными жесткими рамками общих для данного типа функциональной спе-
циализации типовых закономерностей организации. Анализируя этот
спектр, мы выясняем и эти общие закономерности и потенции живой ма-
терии к модификациям в их пределах.
Эволюционной гистологии и частной цитологии принадлежит важная
роль в разработке одной из центральных общебиологических проблем —
проблемы дифференциации специализированных тканевых структур.
Основным методом этих наук является исторический сравнительный
метод, базирующийся на принципе сопоставления сходных в функцио-
нальном отношении структур и частных систем организма. Подчиненный
характер этих систем в составе многоклеточных организмов и структурная
идентичность геномов у разных специализированных клеток одного орга-
низма обусловливают относительность понятий гомологии и аналогии на
клеточном и тканевом уровнях организации. Это обстоятельство еще бо-
лее расширяет возможности сравнительного метода для изучения законо-
мерностей дифференцировки ткапей в филогенезе. Имеющийся фактичес-
кий сравнительный материал можно использовать не только для анализа
эволюционной динамики отдельных гомологичных у всех многоклеточных
ткапей. Сравнительный метод по принципу функциональных и биологи-
ческих аналогий позволяет анализировать и негомологичпые специализи-
рованные структуры, и ряд общих принципов их организации.
В предлагаемой читателю книге рассматривается большой фактиче-
ский сравнительный материал по основным типам тканей в плане анализа
общих и специфических закономерностей филогенетической дифференци-
ровки на тканевом и клеточном уровнях организации многоклеточных жи-
вотных. Книга может служить также и учебным пособием по курсам срав-
нительной гистологии и частной цитологии. В связи с этим она содержит
и краткое изложение классических данных, известных цитологам и гисто-
логам.
Такой двойственный характер книги создает известные трудности
в подборе материала и в его изложении, особенно в связи с ограничен-
ным ее объемом. При сравнительно-гистологической характеристике ос-
новных типов тканей мы стремились тем не менее избежать схематизации
и освещать современное состояние вопросов как в отношении малоизу-
ченных объектов, так и объектов длительно и детально изучаемых в ги-
стологии. Естественно, что при этом не удалось подробно осветить состоя-
ние многочисленных конкретных вопросов во всех деталях и тонкостях их
изучения разносторонними современными методами исследования. По наи-
более важным объектам и проблемам в основных частях книги приво-
дятся ссылки на оригинальные работы и обзоры последних лет, в которых
содержится подробная библиография.
Большая работа по редактированию, изготовлению иллюстраций и
подготовке рукописи к печати является результатом коллективных усилий
сотрудников кафедры цитологии и гистологии ЛГУ. Особенно большую
работу по редактированию отдельных глав книги выполнили Е. Р. Га-
гинская, В. М. Грасгоф, В. В. Исаева, Е. В. Обухова, Д. К. Обухов,
Т. В. Серговская, В. Ф. Синицына, Е. В. Петелина, А. Д. Харазова. В тех-
ническом оформлении рукописи и изготовлении иллюстраций активно
участвовали В. П. Афанасьева, М. В. Гаврилова, 3. А. Зайченко, С. А. Бы-
стров, М. Ю. Пунин, В. К. Четверухин. Весьма признателен автор также
А. К. Допдуа, Г. А. Заварзину, О. Г. Строевой и Н. Г. Хрущову за ценные
советы и замечания, сделанные при знакомстве с отдельными главами
рукописи.
Часть I
ВВЕДЕНИЕ. КЛЕТКИ И ТКАНИ
Глава 1
КРАТКИЙ ОЧЕРК СОВРЕМЕННЫХ ПРЕДСТАВЛЕНИЙ
ОБ ОБЩИХ ЗАКОНОМЕРНОСТЯХ ОРГАНИЗАЦИИ
КЛЕТОК МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
ВВЕДЕНИЕ
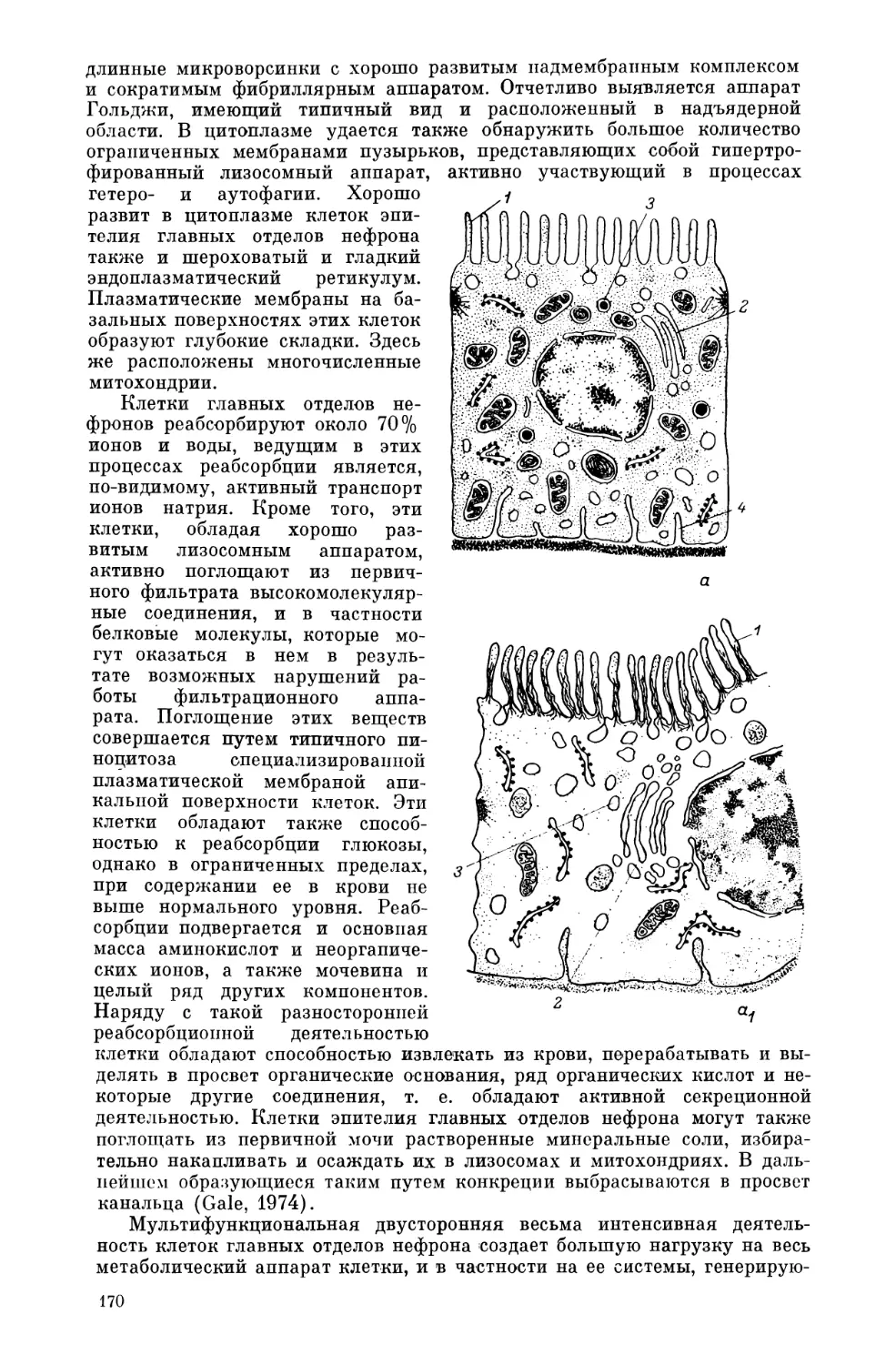
Клетки многоклеточных животных состоят из трех основных частей:
плазматической мембраны, цитоплазмы с органоидами и ядерного аппа-
рата (рис. 1). Плазматическая мембрана представляет собой структуру,
обеспечивающую физическое и химическое взаимодействие клетки с внеш-
ней для нее средой, а у многоклеточных организмов и структурные и хи-
мические связи с соседними клетками.
Цитоплазма с органоидами является основным метаболическим аппа-
ратом клетки, обеспечивающим и возможность существования целостной
клеточной системы и ее специфическую функцию в тканях многоклеточ-
ного организма.
Ядерный аппарат осуществляет функции хранения и выработки гене-
тической информации, а также передачи этой информации в ряду клеточ-
ных поколений в процессе деления клеток.
Несмотря на возможность выделить эти три основные части, имеющие
различное биологическое и функциональное значение, клетка представ-
ляет собой единую целостную систему. Только в составе этой системы мо-
гут полноценно работать и метаболический аппарат, и плазматическая
мембрана, и ядерпые структуры.
ПЛАЗМАТИЧЕСКАЯ МЕМБРАНА
При обычных методах обработки, принятых в электропномикроскопи-
ческпх исследованиях, плазматическая мембрана па препаратах имеет вид
трехслойной структуры толщиной около 90—100 А. Она состоит из на-
ружного и внутреннего электронноплотпых слоев и среднего относительно
светлого слоя. В химическом отношении основными компонентами плаз-
матической мембраны являются разнообразные белки п липиды. Среди
белков имеется большое количество ферментов.
В молекулярной организации плазматической мембраны и других кле-
точных мембран большую роль играют не только гидрофильные связи
белковых и липидных молекул, но и связи белков с гидрофобными кон-
цами липидных молекул. В противоположность распространенной ранее
трехслойной билипидной модели мембраны в настоящее время преобла-
дают представления о мембране как о липопротеиновом комплексе, в ко-
тором гидрофильные группировки липидов и белков образуют поверх-
ностные слои мембраны, а гидрофобные — внутренние.
5
В качестве примера современных гипотетических моделей молекуляр-
ной организации плазматической мембраны может служить жидкостно-
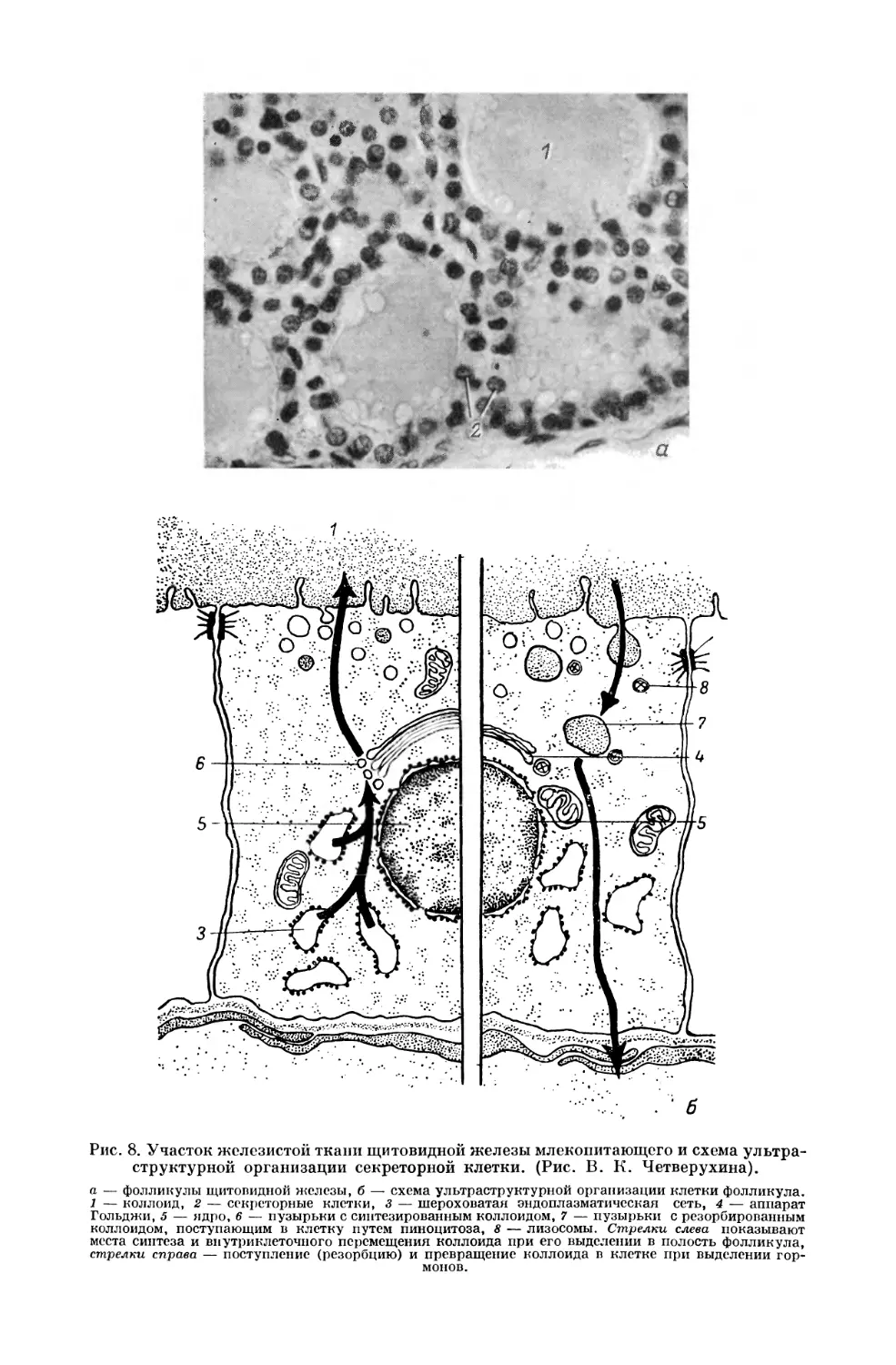
Рис. 1. Схема ультраструктурной организации клетки многоклеточных животных.
(Рис. М. 10. Пунина).
1 — хроматин, 2 — перихроматиновые гранулы, 3 — околоядрышковый хроматин, 4 — фибрилляр-
ный компонент ядрышка, 5 — гранулярный компонент ядрышка, 6 — поры в ядерпой оболочке,
7 — перинуклеарное пространство, 8 — центриоль, .9 — шероховатая эндоплазматическая сеть,
10 — свободные рибосомы, 11 — гладкая эндоплазматическая сеть, 12 — аппарат Гольджи, 13 —
секреторные гранулы, 14 — .лизосомы, 15 — гетерофагосома, 16 — гетсрофаголизосома, 17 — тело-
сома, 18 — аутофагосома, 19 — митохондрии, 20 — липидные включения. Стрелками показано
внутриклеточное перемещение фагосом, лизосом, фаголизосом и секреторных гранул.
мозаичная модель ее организации. Согласно этой гипотезе мембрана пред-
ставляет собой не жестко структурированную систему, а динамичное об-
разование из жидкой липидной фазы и свободно перемещающихся в пей
белковых глобул разных размеров. Наличие перемещения белковых ком-
6
понептов меморап паглядпо удается показать в опытах по гиоридизации
клеток.
Большую роль в функциональной деятельности плазматической мемб-
раны играет особый надмембранпый комплекс. Он расположен па поверх-
ности мембраны и представляет собой непрерывно и достаточно интен-
сивно обновляющийся гликопротеиновый слой. Степень его развития и
функциональное значение определяются специализацией клеток. Воз-
можно, что способность плазматической мембраны клетки к формирова-
нию особого внеклеточного субстрата явилась той общей основой в эволю-
ции, которая привела к возникновению структур типа оболочки расти-
тельных клеток или межклеточного вещества во всем его сложном много-
образии у современных многоклеточных животных.
Для плазматической мембраны весьма характерно образование различ-
ного рода временных и постоянных структурных контактов между сосед-
ними клетками. В простейших случаях в местах таких контактов обра-
зуются более или менее глубокие взаимопроникающие пальцевидные вы-
росты цитоплазмы. Они обусловливают механическое объединение клеток
и резко увеличивают поверхность их соприкосновения.
Примером более сложных межклеточных контактов могут служить так
называемые десмосомы. В этих участках происходит гипертрофия и видо-
изменение падмембранпых комплексов контактирующих клеток. Они об-
разуют общую спаивающую пластинку. В пей иногда наблюдаются труб-
чатые структуры, контактирующие с наружной поверхностью мембран.
В участках цитоплазмы, прилегающих к местам такого контакта, обра-
зуются электронноплотные пластинки. В более глубоких участках диф-
ференцируются фибриллярные структуры.
Помимо обычных десмосом, осуществляющих механические контакты
между клетками, в тканях многоклеточных животных широкое распрост-
ранение имеют контакты, обеспечивающие: а) изоляцию межклеточных
полостей (зоны слияния); б) обмен ионами и низкомолекулярными сое-
динениями между контактирующими клетками (плотные соединения и
некоторые разновидности септальных десмосом). Десмосомы, зоны слия-
ния и другие типы контактов между клетками варьируют в деталях своей
организации в клетках разных тканей у одного животного и в сходных
тканях у разных животных. Помимо перечисленных выше типов межкле-
точных контактов общего характера, имеются еще и специализированные
контакты типа синапсов.
Характерным свойством плазматических мембран многих клеток яв-
ляется их способность к процессам эндо- и экзоцитоза. При помощи эндо-
цитоза происходит поступление жидких и твердых частиц внутрь клетки.
Экзоцитоз представляет собой обратный процесс — выведение в наружную
среду продуктов клеточного метаболизма. Оба процесса основаны на спо-
собности плазматической мембраны к самосборке или саморазборке. Та-
кая возможность определяется, по-видимому, наличием готовых блоков
для построения мембраны. Известны две разновидности эпдоцитоза: пипо-
и фагоцитоз. Процесс пиноцитоза заключается в локальном впячивании
мембраны в области контакта с адекватным субстратом. Он отличается
определенной избирательностью. На поверхности мембраны имеется, оче-
видно, рецепторный аппарат, позволяющий клетке распознавать нуж-
ные для нее продукты. Считается, что существенную роль в механизме
рецепции играет надмембранный комплекс. Процесс пиноцитоза завер-
шается формировапием пипоцитозного пузырька в толще цитоплазмы.
Вначале он связан с поверхностью клетки при помощи пиноцитозного
канала, а затем отшнуровывается и утрачивает связь с наружной
средой.
При фагоцитозе происходит аналогичный процесс поглощения частиц
плазматической мембраной. Однако в отличие от пиноцитоза процесс
фагоцитоза совершается не только путем впячивания мембраны, но и
обрастанием, обволакиванием фагоцитируемых частиц с периферии за
счет активного движения поверхностных участков цитоплазмы.
Процесс экзоцитоза основан на способности ряда мембранных струк-
тур клетки сливаться с плазматической мембраной. При экзоцитозе мемб-
раны секреторных гранул, или телолизосом (см. ниже), сливаются с плаз-
матической мембраной, а гранулы секрета или непереваренные остатки
выводятся во внешнюю для клетки среду. Помимо процессов экзо- и эндо-
цитоза поступление веществ в клетку и выведение в окружающую среду
осуществляется путем пассивного транспорта, облегченной диффузии и
активного транспорта веществ против электрохимического градиента с за-
тратой энергии. Последний тип транспорта веществ имеет особое значение
в морфологической организации клеток. Он обусловлен особыми свойст-
вами плазматической мембраны.
Плазматическим мембранам клеток многоклеточных животных, неза-
висимо от вида животных и функциональной специализации клеток, свой-
ствен ряд общих универсальных черт морфобиохимической организации.
Наряду с этим для каждого типа клеток, в рамках этих общих черт, имеет
место и большое разнообразие модификаций их организации. Подробное
их описание будет дано при характеристике клеток отдельных тканей.
В основе таких модификаций лежит возможность гипертрофии одной из
многочисленных функций плазматической мембраны. Плазматические
мембраны разных клеток различаются по химическому составу, особенно
в отношении конкретных белков и в первую очередь ферментов, сокра-
тимых белков и, по-видимому, особых рецепторных белковых молекул.
Существенные модификации возможны и в отношении качественного со-
става липидов. Варьирование на уровне химического состава сопровожда-
ется структурными модификациями и па более высоком, надмолекулярном
уровне.
В животных клетках имеются мембраны с резко гипертрофированной
барьерной функцией. Такими клетками являются, например, шванновские
клетки в нервной системе позвоночных. Эти клетки образуют своей гипер-
трофированной плазматической мембраной мощную многослойную изоли-
рующую оболочку. Характерной особенностью миелиновой оболочки явля-
ется относительная бедность ее мембран белками. С другой стороны,
в клетках, специализированных на осморегулирующую функцию, плазма-
тическая мембрана характеризуется, наоборот, обилием ферментов актив-
ности ионного транспорта и большой подвижностью своей внутренней ор-
ганизации. Своеобразную структуру имеют плазматические мембраны
рецепторных клеток, специфической функцией которых является трансля-
ция энергии внешнего раздражителя в энергию нервного возбуждения.
Ведущую роль в этом, как и во многих других случаях, играют особые
рецепторные белки и ряд других химических соединений, входящих в со-
став плазматической мембраны. Весьма динамичные плазматические мем-
браны присущи секреторным клеткам, лимфоцитам, нервным клеткам,
особенно в области синапсов, и многим другим разновидностям специали-
зированных клеток.
В последнее время большие успехи достигнуты в изучении глюкопро-
теидпых рецепторов плазматической мембраны и субмембрапного опорно-
сократимого аппарата. Показано, в частности, что в плазматической мемб-
ране клеток животных имеются многочисленные глюкопротепды, олиго-
сахаридные части которых расположены в надмембранпом комплексе и
обладают способностью связывать белки растительного происхождения —
лектины, оказывающие специфические воздействия па жизнедеятельность
клеток. С другой стороны, удалось выявить универсальное распростране-
ние в клетках животных опорно-сократимой системы микротрубочек и
микрофиламентов, находящихся в непосредственном контакте с белко-
выми глобулами плазматической мембраны. В состав этого аппарата вхо-
дят сократимые белки, и он играет большую роль в процессах эндо- и эк-
8
зоцитоза, изменении конфигурации клеточной поверхности и внутримемб-
ранных перемещениях функциональных комплексов глобул белков в са-
мой мембране. В связи с этими данными поверхностную часть клеток
рассматривают как единую систему, включающую в себя наряду
с плазматической мембраной и надмембранный комплекс и непосредст-
венно связанный с мембраной поверхностный опорно-сократимый аппа-
рат гиалоплазмы.
ЦИТОПЛАЗМА И ОРГАНОИДЫ
Одним из свойств живой протоплазмы является структурированность
в пей биохимических процессов. Благодаря этому они осуществляются не
на основе случайных столкновений молекул, как в коллоидных растворах,
а имеют строго упорядоченный, организованный, векторный характер.
Структурная организация биохимических процессов характерна не только
для органоидов цитоплазмы, но и для основной цитоплазмы, или гиало-
плазмы. Возможно, что не несущие ферментативной функции белковые
молекулы гиалоплазмы имеют участки, с которыми соединяются посту-
пающие в клетку или образующиеся в результате катаболических процес-
сов в ней молекулы низкомолекулярных веществ. Отсюда эти вещества
поступают уже к белкам-ферментам. Последние образуют сложные упо-
рядоченные ферментативные комплексы либо в самой гиалоплазме, либо
на различных мембранных структурах цитоплазмы. Большую роль в обра-
зовании упорядоченной структуры и диссоциации ферментативных си-
стем, локализованных в гиалоплазме, играют и молекулы воды, обладаю-
щие способностью к переходу из структурированного состояния в жидкое
и обратно. Особенно ярко пространственная организация биохимических
процессов в клетке проявляется в структуре и функции органоидов цито-
плазмы. Среди них особое место занимают органоиды, ответственные за
сборку, вторичные видоизменения и транспортировку белковых молекул
в клетке.
Основную роль в этих важнейших анаболических процессах играют
рибосомы и эндоплазматическая сеть — ограниченная мембранами внутри-
клеточная сеть каналов и цистерн. Рибосомы и мембранные структуры
эндоплазматической сети могут быть структурно не связаны между собой.
В этих случаях в клетках имеется лишь гладкая эндоплазматическая сеть.
Такие отношения наблюдаются в малодифферепцировапных клетках и
в клетках, специализация которых не связана с выработкой большого ко-
личества белка па «экспорт», т. е. с выведением его из клеток. Тем не ме-
нее и в этих клетках синтез и внутриклеточный транспорт белков играют
большую роль в их морфобиохимической организации, так как в основе
любого метаболического процесса лежат структурно организованные и
непрерывно обновляющиеся системы белков-ферментов. В клетках, синте-
зирующих большое количество специфического белка (белковые железы,
нервные клетки, клетки, синтезирующие межклеточное вещество), боль-
шое развитие получает шероховатая эндоплазматическая сеть. В пей между
рибосомами и мембранами каналов сети имеется непосредственная струк-
турная связь. Рибосомы располагаются здесь па наружной поверхности
мембран. Показано, что эффективность работы прикрепленных к мембра-
нам рибосом на порядок выше, чем свободных рибосом. В большинстве
клеток имеются обе разновидности эндоплазматической сети, а также сво-
бодные и прикрепленные рибосомы. Соотношение и степень развития
шероховатой и гладкой эндоплазматической сети варьируют в широких
пределах в клетках различной функциональной специализации.
Рибосомы представляют собой универсальные для всей живой мате-
рии структуры, обеспечивающие синтез белков. Информация о последова-
тельности аминокислот синтезируемых белков поступает в рибосомы из
9
ядра посредством информационных РНК (иРНК). Аминокислоты транс-
портируются в рибосому при помощи специфических для каждой амино-
кислоты транспортных РНК (тРНК).
Рибосомы состоят из двух субъединиц. Каждая субъединица рибосомы
представляет собой сложный рибопуклеопротеид. В его основе лежит одна
высокополимерная молекула РНК (рРНК), обеспечивающая закономер-
ную пространственную ориентировку связанных с пей белковых молекул.
Последние, образуя особые активные центры рибосом, обеспечивают креп-
ление па них молекул иРНК, их смещение после образования очередной
пептидной связи, удержание и перемещение амипоацилтрапспортных
РНК. Имеется два типа рибосом — 80 S и 70 S рибосомы. Первые харак-
терны для Eukaryota, вторые для Prokaryota и митохондрий клеток Ен-
karyota.
Относительно мало известно о локализации в клетке топких механиз-
мов вторичных преобразований синтезированных па рибосомах белковых
молекул и их внутриклеточной транспортировке.
На примере секреторных клеток показано большое значение мембран
эндоплазматической сети в транспортировке специфических секреторных
белков. Однако процессами внутриклеточного транспорта белков далеко
не исчерпывается значение эндоплазматической сети. Последняя играет
роль и в процессах внутриклеточного транспорта других соединений.
В ней, особенно в мембранах гладкой эндоплазматической сети, сосредо-
точены ферменты, обеспечивающие синтез липидов. В мембранах эндо-
плазматической сети имеются ферменты активного ионного транспорта,
системы ферментов, обеспечивающих детоксикацию вредных продуктов
обмена, ферменты, связанные с энергетическим обменом клетки. Таким
образом, эндоплазматическая сеть представляет собой важную мульти-
функциональную структуру, обеспечивающую направленный и структурно
организованный ход ряда важных биохимических процессов. На примере
эндоплазматической сети, как и плазматической мембраны, отчетливо про-
является функциональная и филогенетическая пластичность этой струк-
туры. В секреторных клетках она осуществляет транспорт белков. В мы-
шечных клетках — это мощный резервуар ионов. В клетках эпителия
печени большое развитие получают ферментативные системы, обеспе-
чивающие детоксикацию вредных продуктов метаболизма.
Важным мембранным органоидом клетки являются лизосомы. Они
представляют собой пузырьки, содержащие наборы гидролитических фер-
ментов. Мембраны лизосом по толщине и свойствам близки к плазмати-
ческой мембране, однако отличаются от нее ферментативным составом.
Мембраны лизосом способны сливаться с мембранами пипоцитозпых пу-
зырьков и фагосом, секреторных гранул и с плазматической мембраной.
В лизосомах может содержаться набор гидролитических ферментов, не-
обходимых для расщепления сложных органических соединений. Мемб-
раны лизосом образуются из мембран мелких пузырьков аппарата
Гольджи, а ферменты синтезируются на рибосомах эндоплазматической
сети. В некоторых случаях удается наблюдать картины, свидетельствую-
щие о возможности образования лизосом непосредственно из эндоплазма-
тической сети. Весьма важную роль играет лизосомпый аппарат в про-
цессах разрушения и переваривания деградирующих клеточных структур,
в реутилизации секреторных продуктов и в регуляции работы клеточных
органоидов. Описано также выделение ферментов лизосом путем экзоци-
тоза и гидролитическое расщепление ими межклеточных структур. Нере-
шенным остается вопрос о состоянии и структуре ферментов в первичных
неработающих лизосомах. Высказывается предположение о том, что инак-
тивация ферментов, расщепляющих белки, достигается здесь либо за счет
их связи с мембранами, либо за счет образования комплексов с особыми
мукополисахаридами, которые блокируют деятельность их активных
центров.
10
Совокупность имеющихся данных показывает, что, несмотря па кажу-
щуюся автономность, лизосомы представляют собой лишь структурное
выражение одной из сторон деятельности всего метаболического аппарата
клеток. Они, играя важную роль в катаболических процессах в клетке,
сами неразрывно связаны и по своему происхождению, и по всей много-
образной деятельности в клетке с ее основными метаболическими си-
стемами.
Еще в большей мере функциональная взаимосвязь мембранных орга-
ноидов цитоплазмы проявляется в деятельности аппарата Гольджи. Аппа-
рат Гольджи состоит из образованных мембранами уплощенных цистерн,
па периферии которых располагаются обычно пузырьки двух или более
типов, различающиеся размерами и формой. Между относительно плотно
упакованными цистернами имеются топкие прослойки видоизмененной
гиалоплазмы, содержащей фибриллярные структуры. Степень развития
аппарата Гольджи, количество и взаимное расположение его элементов,
очертания цистерн сильно варьируют в клетках различной функциональ-
ной специализации. Известны два типа компактных аппаратов Гольджи,
когда все его элементы локализованы в одном участке цитоплазмы,
обычно в околоядерпой области. Для первого типа характерны относи-
тельно хорошо развитые центральные цистерны. Они больших размеров
и па периферии имеют относительно ровные края. У второго типа цен-
тральные цистерны сильно редуцированы, и их периферическая часть
занята разветвленной, связанной с цистернами системой трубочек и ка-
нальцев. Кроме аппаратов Гольджи компактного типа широко распро-
странено в клетках многоклеточных организмов диффузное распределение
его элементов в цитоплазме. В этих случаях каждый отдельный комплекс
элементов аппарата Гольджи представлен цистерпамп и периферическими
пузырьками. Наибольшего развития аппарат Гольджи достигает в клет-
ках, характеризующихся высоким уровнем метаболизма.
В мембранах центральных цистерн аппарата Гольджи локализованы
ферменты, обеспечивающие синтез углеводов, в частности специфических
мукополисахаридов. Существенную роль играет аппарат Гольджи в тран-
спортировке и вторичной обработке синтезируемых па рибосомах эндо-
плазматической сети клеточных белков. Синтезированные па рибосомах
белковые молекулы поступают в элементы аппарата Гольджи. В области
аппарата Гольджи происходит формирование первичных лизосом. Здесь
в них накапливаются ферменты и они приобретают способность участво-
вать в процессах авто- и гетерофагии. При некоторых типах дифферен-
цировки, например в процессе формирования сперматозоидов, происходит
преобразование цистерн аппарата Гольджи в своеобразную гигантскую
лпзосому — акросому. Наличие гидролитических ферментов в полости
цистерн аппарата Гольджи па промежуточых этапах формирования лизо-
сом показано и при других типах дифференцировки. Элементы аппарата
Гольджи существенную роль игрют и в формировании секреторных гра-
нул. Чаще всего секреторные гранулы формируются из крупных пузырь-
ков аппарата Гольджи. Одпако в некоторых клетках имеет место форми-
рование крупных гранул секрета и непосредственно путем наполнения
секретом самих центральных цистерн. В этих клетках особенно четко
выражена поляризация структур аппарата Гольджи. Его периферически
расположенные цистерны преобразуются в крупные секреторные гранулы,
а в прилегающей к ядру области имеет место непрерывное формирование
новых цистерн.
Весьма важную роль аппарат Гольджи играет при образовании микро-
ворсинок и других ограниченных мембранами структур специализирован-
ных клеток.
Исключительная роль принадлежит, по-видимому, аппарату Гольджи
и в образовании мембранных структур. Он является основным местом
в цитоплазме, где происходит преобразование мембран эпдоплазматиче-
11
ского типа с толщиной 50—60 А в мембраны экзоплазматического типа
90—100 А толщины, способных объединяться с плазматической мембра-
ной клетки.
Эта весьма важная роль аппарата Гольджи в динамике и взаимосвязи
мембранных структур в клетке проявляется, в частности, в двойственном
характере мембран, образующих его основные элементы. Мембраны пери-
ферических пузырьков аппарата Гольджи чаще имеют толщину порядка
90—100 А, а мембраны центральных цистерн, из которых формируются
периферические пузырьки, оказываются по своей толщине ближе к мем-
бранам эндоплазматического типа. Аппарат Гольджи является, по-види-
мому, не только важным центром в клетке, где происходит преобразова-
ние одного типа мембран в другой, но и одним из основных мест их
новообразования или, во всяком случае, сборки из предсуществующих
в гиалоплазме блоков мембранных структур.
В последнее время аппарат Гольджи, эндоплазматическую сеть, или
эндоплазматический ретикулум, и лизосомы объединяют в единую систему
(система ГЭРЛ). Действительно, все эти органоиды, хотя и осуществляют
различные стороны внутриклеточного метаболизма, находятся между
собой в неразрывном единстве. Эта система связана также через про-
цессы эпдо- и экзоцитоза с плазматической мембраной и ее производными.
Система мембранных органоидов клетки и по своему происхождению
и в функциональном отношении находится в тесной взаимосвязи с рибо-
сомами, что особенно отчетливо проявляется на примере шероховатой
эндоплазматической сети в секреторных клетках и в процессах формиро-
вания лизосом.
Таким образом, п плазматическая мембрана с ее производными, и все
разобранные выше органоиды цитоплазмы вместе с окружающей их
гиалоплазмой представляют собой единую целостную систему, все части
которой неразрывно связаны в процессах общего и специфического мета-
болизма клетки.
Наряду с этим мембранные органоиды цитоплазмы разделяют ее по
крайней мере па три фазы: а) основную цитоплазму, пли гиалоплазму,
б) структурированную фазу (система сложно дифференцированных мем-
бран и рпбопуклеопротеиды рибосом), в) содержимое каналов, цистерн
и пузырьков мембранных органоидов. Такая дифференцировка цито-
плазмы создает условия для обеспечения направленного течения биохи-
мических процессов, а также их регуляции интегрирующими системами
клетки.
В клетках гетеротрофных животных основным источником энергии яв-
ляются макроэргическпе связи адепозпптрифосфорной кислоты (АТФ).
Образование АТФ в животных клетках происходит двумя основными пу-
тями — в результате мепее экономичных анаэробных реакций гликолиза
и путем окислительного фосфорилирования адепозипдифосфорной кислоты
(АДФ). Ферментативные системы гликолиза сосредоточены в гиало-
плазме. В последнее время получены данные о том, что часть наиболее
важных ферментов этой системы структурирована па мембранах эндо-
плазматической сети. Системы ферментов, обеспечивающие образование
АТФ за счет окислительного фосфорилирования сосредоточены в мембра-
нах митохондрий. Эти органоиды и обеспечивают наиболее экономичный
синтез АТФ в животных клетках.
Основными структурными компонентами митохондрий являются их
наружная и внутренняя мембраны. Последняя образует более или мепее
многочисленные складки — кристы. Они имеют вид либо неполных попе-
речных или продольных перегородок, либо трубчатых выростов, вдаю-
щихся внутрь центральной аморфной массы — матрикса митохондрий.
Между наружной и внутренней мембранами митохондрий имеется обычно
щелевидпое пространство. Толщина наружной мембраны около 60 А,
внутренней — 90 А. Мембраны отличаются по набору локализованных
12
в пих дыхательных ферментов. Все ферменты, осуществляющие перенос
электронов по дыхательной цепи, локализованы во внутренней мембране
митохондрий и могут работать только как структурированные комплексы.
Помимо жестко структурно закрепленных ферментов, в дыхательной цепи
имеются и подвижные переносчики электронов.
Перепое электронов по дыхательной цепи сопряжен с фосфорилиро-
ванием АДФ и образованием АТФ. Источником электронов являются раз-
личные окисляемые субстраты, гидролиз которых происходит при помощи
нескольких ферментативных систем. Ферменты этих окислительных цик-
лов располагаются в матриксе митохондрий. Они могут образовывать
также и лабильные связи с ее мембранами. Молекулярные механизмы
сложного процесса окислительного фосфорилирования выяснены еще не-
достаточно полно. Показано сопряжение этой основной функции мито-
хондрий с мехапохимическими и электрохимическими процессами,
обусловленными изменениями в процессах активного ионного транспорта
и в конформации сократительных белков, локализованных в мембранах.
Митохондрии обладают способностью к регуляции ионного баланса
в гиалоплазме. В их матриксе могут откладываться соли в виде гранул
различных размеров и формы.
В матриксе митохондрий имеется кольцевидная молекула ДНК и 70 S
рибосомы бактериального типа. Показана возможность синтеза белка
митохондриальными рибосомами па основе информации, содержащейся
в кольцевидной молекуле ДНК. Однако этой информации достаточно
лишь для синтеза небольшой части белков митохондрий. Все остальные
белки и, в частности, ферменты дыхательной цепи внутренней мембраны
синтезируются рибосомами цитоплазмы с помощью иРНК, образующейся
па ДНК ядра. Кроме того, процессы транскрипции РНК на митохондри-
альной ДНК, а также ее репликация происходят с помощью ферментов,
синтезируемых па цитоплазматических рибосомах. ДНК бактериального
типа обнаружена также в хлоропластах растительных клеток, в клеточном
центре и базальных тельцах ресничек. Высказывается предположение
о происхождении митохондрий и всех содержащих ДНК органоидов путем
симбиоза примитивных клеток Eukaryota с бактериями или синезелеными
водорослями.
Если митохондрии действительно имеют бактериальное происхождение,
то они в процессе эволюции в составе эукариотных клеток в значитель-
ной мере, как показано выше, утрачивают биосинтетическую автоном-
ность. С другой стороны, можно рассматривать появление белоксинтези-
рующих систем в митохондриях и других органоидах как выражение
далеко заходящей дифференциации этих систем внутри исходной клетки.
Более специальное значение имеет органоид животных клеток, играю-
щий важную роль в процессах клеточного деления, так называемый кле-
точный центр, или центросома. Основными его структурными компонен-
тами у Metazoa являются два расположенных перпендикулярно друг
к другу цилиндра — центриоли. Стенка каждой центриоли образована
девятью группами микротрубочек. В каждой группе имеется по три микро-
трубочки диаметром в 200 А. Стенки микротрубочек центриоли образо-
ваны 13 фибриллярными нитями, которые представляют собой законо-
мерно расположенные глобулярные белковые структуры.
Помимо микротрубочек, в стенке и в полости цилиндров имеются
участки электропноплотного и светлого вещества, придающие этим образо-
ваниям весьма характерный рисунок. На наружной поверхности цилин-
дров расположены глобулярные структуры. Они содержат много РНК и
носят название сателлитов. Интересной особенностью центриолей явля-
ется их способность к удвоению. Механизм этого процесса не ясен. Суть
его заключается в том, что рядом с предсуществующей центриолью под
прямым углом к ней в цитоплазме происходит новообразование дочерней
цилиндрической структуры, которая, увеличиваясь в размерах, приобре-
13
тает все характерные структурные особенности типичной центриоли.
Предполагается, что в центриолях имеется особая ДНК, обусловливающая
способность этих органоидов к саморепродукции.
Использование тонких щадящих методов фиксации и заливки позво-
лило обнаружить в животных и растительных клетках широкое распро-
странение микротрубочек. Они имеют структуру, идентичную структуре
микротрубочек центриолей, отличаясь от них значительно большей чувст-
вительностью к действию различных повреждающих агентов. Микротру-
бочки образуют нити митотического аппарата. В иптерфазпых клетках они
играют, по-видимому, существенную роль в транспортировке веществ и
обеспечении взаимосвязи отдельных участков цитоплазмы..
При дифференцировке клеток происходит формирование специализи-
рованных структур, которые часто образуются путем гипертрофий общих,
для всех клеток органоидов или метаболических систем. Так, па основе
способности клеточной цитоплазмы к функции сократимости и наличия
в ее структурах актипомиозипоподобпых белков в клетках мышечных
ткапей формируются сложные сократимые органоиды — миофибрпллы.
На этой же, по-видимому, основе с использованием аппарата микротрубо-
чек развивается одна из наиболее древних и широко распространенных
дифференцировок в тканях многоклеточных животных — респичка. Спе-
циализированные микротрубочки — характерный органоид нервных кле-
ток. Широкое распространение имеют и различные специализированные
волокнистые структуры, выполняющие скелетную механическую функ-
цию. Подробно структуру и функцию этих специализированных образова-
ний во всем разнообразии их эволюционных модификаций мы рассмотрим
в соответствующих главах книги.
ИНТЕРФАЗНОЕ ЯДРО
Основным структурным компонентом ядерпого аппарата являются
иптерфазпые хромосомы, которые образованы питями ДНП. При хими-
ческом анализе выделенных из ядер нитей ДНП показано, что около 40%
в них приходится па долю ДНК и 60% составляют белки. Последние
представлены двумя типами белков — 85% их составляют гистоны и около
15% —кислые белки. В составе нитей ДНП имеется и небольшое коли-
чество (около 1%) особой низкомолекулярной РНК.
По своему химическому составу и принципам молекулярной организа-
ции тяжи ДНП представляют собой сложные высокомолекулярные
нуклеопротеиды, в которых основное функциональное значение имеет ги-
гантская молекула ДНК. На ней происходит считывание информации
путем матричного синтеза различных типов РНК. Другим свойством ДНК
является способность к удвоению комплементарных нитей при подго-
товке клеток к делению.
Что касается белковых компонентов питей ДНП, то им, очевидно, при-
надлежит лишь вспомогательная роль в реализации этих двух основных
функций ДНК. При этом гистоны выполняют важную роль в структурной
пространственной организации питей ДНП.
В настоящее время показано, что в структурном отношении хроматин
представляет собой линейно организованные глобулярные субъединицы,
так называемые нуклеосомы, диаметром 70—80 А, каждая из которых
содержит участок ДНК в 170—200 пар оснований, и все пять фракций
гистонов, определенным образом упакованных в нуклеосоме. Такая эле-
ментарная четкообразная нить ДНП претерпевает более сложную упа-
ковку в гетерохроматиновых участках.
В специализированных клетках многоклеточных животных использу-
ется обычно пе больше 5—7% генетической информации, содержащейся
в ядерпой ДНК. При этом имеются общие для всех клеток данного орга-
14
низма функционирующие гены, например гены, кодирующие рибосо-
мальную РНК или информационные РНК, необходимые для синтеза фер-
ментов дыхательной цепи и ряда других ферментов энергетического об-
мена. Вместе с тем в каждой специализированной клетке работают также
особые участки генома, которые выдают информацию о синтезе специфи-
ческих для данного типа клеток соединений. Таким образом, у много-
клеточных организмов в ядерпом аппарате и, по-видимому, в самих иптер-
фазиых хромосомах или нитях ДНП должны быть механизмы, обеспечи-
вающие и блокирование основной части генома, и топкую регуляцию
специфического деблокирования отдельных генов при дифференциации
клеток в специализированных тканях и эмбриональных зачатках. Имеются
достаточно обоснованные предположения о том, что хотя бы частично эти
функции осуществляют белки ДНП. Большинством авторов основным
белкам — гистонам приписывается существенная роль в неспецифическом
блокировании больших участков нитей ДНП, в то время как кислые
белки имеют, по-видимому, важное значение в регуляции специфической
транскрипции.
Нити ДНП в иптерфазпых ядрах распределены обычно по всей карио-
плазме, однако плотность их расположения и концентрация в отдельных
участках ядра может сильно варьировать в разных типах клеток и па
разных стадиях их специфической дифференциации.
Важным структурным компонентом иптерфазпого ядра является
ядрышко. Оно формируется па хромосоме в области так называемого
ядрышкового организатора, представляющего собой группу генов, ответст-
венных за синтез высокомолекулярных рибосомных РНК. Ядрышковых
организаторов может быть один или несколько па гаплоидный набор хро-
мосом. Соответственно этому в ядре может быть одно или несколько
ядрышек. Помимо функционирующих ядрышек в геноме клеток могут
быть другие участки ДНП, содержащие информацию о синтезе рибосом-
ных РНК. В нормальных условиях они не синтезируют рибосомных РНК
и вокруг них пе происходит формирования ядрышек. Однако в экспери-
ментальных условиях при разрушении работающего ядрышкового аппа-
рата может происходить активизация этих резервных участков хромосом.
Весьма своеобразный механизм интенсификации синтеза рибосомных РНК
имеется у овоцитов некоторых многоклеточных животных. В период, пред-
шествующий интенсивному формированию рибосом, в овоцптах происхо-
дит множественная репликация ядрышковых организаторов и формирова-
ние дополнительных ядрышек па реплицированных участках ДНК. Коли-
чество ядрышек при этом может достигать нескольких сотен, а количество
такой экстрахромосомпой ДНК в несколько раз превышает количество
ДНК в хромосомах. Помимо ядрышкового организатора, обязательным
компонентом функционирующих ядрышек являются гранулярные и
фибриллярные компоненты, образованные гранулами РНП диаметром
150—200 А и фибриллами РНП диаметром 50 А.
Интенсивные биохимические и цитологические исследования с исполь-
зованием электроппомикроскопической авторадиографии и цитохимии
в последние годы позволили попять функциональную морфологию яд-
рышка и идентифицировать отдельные его компоненты. Фибриллярный
компонент ядрышка содержит новообразованную высокомолекулярную
(45 S) РНК, гранулярный компонент— продукты ее созревания, т. е. 35 S
и 28 S РНК.
Размеры фибрилл и гранулярного компонента, а также взаимное их
расположение в ядрышке определяются его функциональным состоянием.
Неактивное ядрышко содержит только фибриллярный компонент, с на-
чалом синтеза рРНК в нем появляется и гранулярный компонент. При
подавлении синтеза рРНК, но сохранении транспорта ее происходит так
называемая сегрегация ядрышка, выражающаяся в перераспределении
обоих ультраструктурных компонентов относительно друг друга.
J5
На ряде объектов удалось показать, что меченая РНК сразу после
поступления меченых предшественников в клетку располагается на гра-
нице фибриллярного компонента и ДНП ядрышкового организатора.
На более поздпих сроках происходит перемещение меченой РНК в гра-
нулярный компонент п в цитоплазму. Удалось получить препараты
ядрышковых организаторов, где па нитях ДНП можно выявить под элек-
тронным микроскопом гранулы фермента — РНК-полимеразы с прикреп-
ленными к ним нитями транскрибируемой РНК. Этот фермент одновре-
менно осуществляет два процесса. Он разрывает водородные связи ком-
плементарных оснований молекул ДНК, раскручивая двойную спираль,
и обеспечивает соединение нуклеотидов в предшественнике рибосомаль-
ных РНК соответственно расположению их в одной из нитей ДНК ядрыш-
кового организатора.
Биохимический анализ позволил установить, что транскрипция рРНК
осуществляется полицистронно, т. е. вначале считывается большой уча-
сток молекулы ДНК и образуется высокомолекулярная 45 S РНК пред-
шественника, в составе которой находятся и 28 S и 18 S РНК и небольшие
участки, которые пе входят в состав рРНК. Удалось также показать, что
основные преобразования этого предшественника, приводящие к появ-
лению высокомолекулярных дефинитивных рРНК, происходят па струк-
турах ядрышка. При этом на всех этапах последовательных превращений
предшественники рРНК связаны с белками. В ядрышке начинается и
формирование рибопуклеопротеидов рибосом. Однако готовых рибосом и
даже их субчастиц в ядрышках обнаружить не удалось. Заключительные
этапы формирования субчастиц рибосом происходят в других структурах
ядерпого аппарата, а возможно и в цитоплазме. Таким образом, совокуп-
ность имеющихся данных показывает, что рибопуклеопротеидпые струк-
туры ядрышка представляют собой очень важную часть ядерпого аппа-
рата. Здесь, с одной стороны, сосредоточены предшественники рРНК и
субчастиц рибосом и, с другой стороны, имеется, по-видимому, рибопуклео-
протеидная сеть, обеспечивающая организованный, структурированный,
многоэтапный процесс биосинтеза рибосом. Конкретные механизмы этого
процесса остаются в значительной мере неясными. Очень мало известно
также и о значении дополнительных белковых, а иногда и мембранных
компонентов, которые обнаруживаются в ядрышках некоторых типов
клеток.
Помимо хроматина и ядрышек в интерфазных ядрах клеток различ-
ных типов, описаны ультрамикроскопические структуры, содержащие
РНК и белки. Это так называемые интерхроматиновые гранулы, имею-
щие диаметр около 200 А и располагающиеся между участками хрома-
тина, а также перихроматиновые фибриллы (диаметром 30—50 А) и гра-
нулы (диаметром 400—600 А). Функциональное значение этих структур
не всегда понятно. Электронномикроскопическая авторадиография пока-
зала, что 3Н-уридип помимо ядрышка включается в первую очередь
в РНК, расположенную по периферии хроматина (в зоны, содержащие
перихроматиновые фибриллы). Можно думать, что помимо предшествен-
ников иРНК, по периферии нитей ДНП сосредоточены особые рибопу-
клеопротеидные структуры, обеспечивающие структурную организацию
процессов созревания, отбора и первичной транспортировки транскриби-
руемых нерибосомных РНК.
Очень важной структурой интерфазного ядра, структурой, обеспечива-
ющей прежде всего непосредственное взаимодействие ядерпого аппарата
с метаболической системой цитоплазмы и многие стороны топкой регуля-
ции этого взаимодействия, является ядерная оболочка. Она образована
двумя близко расположенными друг к другу мембранами, между кото-
рыми имеется так называемое перинуклеарное пространство. Мембраны
по своей толщине и внутренней структуре сходны с мембранами эндо-
плазматической сети. Наружная мембрана ядерной оболочки может непо-
16
средственно переходить в мембраны каналов и цистерн эндоплазматиче-
ской сети, и в этих случаях перинуклеарное пространство оказывается
непосредственно связанным с содержимым эндоплазматической системы
каналов. Контакт основной цитоплазмы и кариоплазмы наблюдается в об-
ласти расположения особых структур ядерной оболочки, получивших на-
звание ядерных пор. В этих участках наружная мембрана ядерной обо-
лочки переходит во внутреннюю, и в оболочке образуется отверстие круг-
лой формы диаметром около 600—700 А. По краям этого отверстия, как
со стороны цито-, так и со стороны кариоплазмы, в непосредственной
связи с наружной и внутренней мембранами ядерной оболочки, располо-
жено по восемь гранул с каждой стороны. Предполагают, что эти гранулы
представляют собой рибонуклеопротеидные тяжи, которые находятся
в структурной и функциональной связи с РНП ядрышка и перихромати-
новых гранул. Количество ядерных пор варьирует в различных типах
клеток в широких пределах. Обычно их тем больше, чем выше уровень
метаболизма клеток.
Таким образом, на границе ядра и цитоплазмы имеются специализиро-
ванные структуры, обеспечивающие весьма сложные ядерно-цитоплазма-
тические взаимодействия, благодаря которым из цитоплазмы в ядро по-
ступают вещества, необходимые для пластического и энергетического об-
менов в ядерном аппарате, а из ядра в цитоплазму транспортируются
различные РНК, рибосомы или их предшественники.
Помимо этих относительно хорошо изученных процессов, имеют место
непрерывные химические регулятивные воздействия на ядерный аппарат
со стороны цитоплазмы и плазматической мембраны и, наоборот, воздей-
ствия ядерного аппарата на метаболический аппарат цитоплазмы. Моле-
кулярные механизмы этих тонких регуляторных процессов изучены еще
недостаточно. Возможно, что существенную роль в этих процессах играют
обнаруженные недавно особые ядерные белки, характерным свойством
которых является миграция из ядра в цитоплазму и обратно.
Краткая характеристика организации отдельных структурных компо-
нентов ядерного аппарата интерфазных клеток показывает, что мы имеем
здесь дело с высокодифференцированной системой клетки. Она обеспечи-
вает не только элементарные акты матричного синтеза РНК на ДНК,
но и весьма сложную регуляцию этих процессов, которые заключаются
и в явлениях блокирования и специфического деблокирования участков
генома, вторичных преобразованиях образующихся первичных продуктов,
формировании рибонуклеопротеидных комплексов и целом ряде других
процессов. Естественно, что синхронное течение всех этих процессов воз-
можно лишь при условии глубокого единства всего ядерного аппарата,
проявлением которого может служить тонкое взаимодействие всех его
структурных компонентов.
ДЕЛЕНИЕ КЛЕТОК И ЯВЛЕНИЯ СОМАТИЧЕСКОЙ
ПОЛИПЛОИДИЗАЦИИ
Важнейшие процессы, связанные с наблюдаемым при митозе равнона-
следственным распределением генетического материала между дочерними
клетками, совершаются не только в митозе, но и на протяжении интер-
фазы. Оказалось, что репликация ДНК и образование двойного набора
интерфазных хромосом или нитей ДНП приурочены обычно к середине
интерфазы и могут занимать относительно большие промежутки времени
(до половины, а в некоторых случаях и больше интерфазного периода).
В связи с этим интерфазные периоды у пролиферирующих клеток и
интерфазные состояния ядер в клетках, прекративших размножение, не-
однозначны по своему значению. В последнем случае имеет место стойкое
2 А. А. Заварзин
17
блокирование процессов репродукции клеток, по в них происходят про-
цессы транскрипции и сложная работа метаболического аппарата. Такое
состояние получило название гетеросинтетической интерфазы. В клетках
пролиферирующих тканей, помимо процессов, характерных для клеток,
находящихся в гетеросинтетической иптерфазе, имеют место еще и про-
цессы подготовки к делению. В связи с этим период иптерфазы в размно-
жающихся клетках получил название аутосинтетической иптерфазы. Пе-
реход от аутосинтетического к гетеросиптетическому состоянию связан
со специфической дифференциацией клеток в тканевых системах и имеет
важное значение в регуляции клеточного размножения. Соотношение гете-
росинтетических процессов и репликации ДНК и других синтетических
процессов, связанных с репродукцией клеток, весьма многообразно в клет-
ках разных ткапей — от длительного сосуществования их в дифференци-
рующихся клетках до ярко выраженного антагонизма.
В случае длительного сосуществования процессов специфического
синтеза и репродукции клеток их интерфазы принято называть амфисин-
тетическими интерфазами.
Наличие в аутосиптетических и амфисинтетических интерфазах оп-
ределенного периода, когда происходит важнейший процесс клеточной ре-
продукции — удвоение иптерфазпых хромосом — позволяет разделить всю
интерфазу на 3 периода — пресинтетический (период Gi), синтетический
(период S) и постсинтетический (период G2). Вместе с митозом они со-
ставляют митотический цикл клетки, в котором ведущее значение для
ее репродукции имеют периоды S и митоза.
Репликация ДНК в интерфазных хромосомах совершается по мульти-
репликонному типу, т. е. происходит асинхронно в разных участках нити
ДНК. Каждый автономно реплицирующийся участок ДНК получил на-
звание репликона. Он имеет длину до 30 мкм, т. е. в хромосоме может
содержаться до 1000 репликонов. Асинхронность репликации больше
в функционирующих генах, чем в блокированных участках генома. На-
чинается же репликация обычно в эухроматиновых (мепее спирализован-
пых) участках хромосомы. Помимо асинхронной репликации ДНК в реп-
ликонах одной хромосомы имеет место и асинхронность репликации ДНК
в разных хромосомах. Наиболее поздно реплицируются, в частности, ДНК
неактивных половых хромосом. Помимо репликации ДНК в периоде S
происходит и интенсивный синтез хромосомных белков и синхронное по-
ступление их в ядро. Показано, в частности, что все гистоны новообразую-
щихся нитей ДНП собираются на рибосомах цитоплазмы и связываются
с нитями ДНК по мере их формирования. Значительно хуже изучены
в настоящее время процессы, происходящие в пресинтетическом и пост-
сиптетическом периодах.
Детально изучен заключительный период митотического цикла — ми-
тоз. В митозе можно выделить четыре последовательные по времени фазы:
профазу, метафазу, анафазу и телофазу.
Профаза и телофаза представляют собой периоды, когда происходит
соответственно спирализация и деспирализация хромосом. В мета- и ана-
фазах осуществляются сложные процессы перемещения хромосом к эква-
тору и расхождения дочерних хромосом к полюсам делящейся клетки.
При спирализации хромосом происходит компактная укладка нитей
ДНП, или интерфазных хромосом. Помимо нитей ДНП в хромосомах
«упаковывается» и часть рибопуклеопротеидов ядрышек и хромосом. Био-
логический смысл спирализации хромосом заключается в более компакт-
ной транспортабельной упаковке генетического материала ядерного ап-
парата. В профазе в большинстве клеток многоклеточных животных про-
исходит также исчезновение ядрышка и разрушение ядерпой оболочки.
Имеются данные о том, что часть ее мембран оказывается связанной
с хромосомами. Возможно, однако, что имеет место и полпая разборка
мембранных структур на блоки, из которых в телофазе происходит быстрое
18
восстановление ядерных оболочек дочерних клеток. Наиболее заметным
процессом, происходящим в цитоплазме вступающих в митоз клеток, яв-
ляется формирование митотического аппарата. Важную роль в этом про-
цессе у многоклеточных животных выполняют центросомы. Центриоли
центросом обычно удваиваются еще в телофазе предыдущего деления.
В профазе они расходятся к полюсам клетки, и в цитоплазме формируется
сложная гетерогенная система микротрубочек. Увеличиваются в длину
микротрубочки, образующие так называемые нити сияния, связывающие
центриоли с поверхностью клетки в области ее полюсов. Кроме того,
формируются микротрубочки, образующие центральное веретено — струк-
туру, расположенную обычно в центре и связывающую между собой оба
клеточных центра. Часть микротрубочек веретена заканчивается в его
центральной области. В области клеточных центров большинство микро-
трубочек пе доходит до центриолей и заканчивается на их сателлитах, —
богатых РНК, уплотненных структурах, расположенных на наружной
поверхности центриолей.
В копце профазы при переходе к метафазе происходит формирование
кинетохорных микротрубочек, которые связывают особые участки сфор-
мированной хромосомы — центромеры, или кинетохоры, с клеточным
центром.
На следующих стадиях митоза происходит перемещение хромосом
в экваториальную плоскость клетки, продольное расщепление двойных
материнских хромосом (метафаза) и расхождение дочерних хромосом
к клеточным центрам (анафаза). Относительно механизмов метафазного
и анафазпого перемещения хромосом нет единого мнения. По мнению
многих авторов, в основе этого процесса лежит сборка (удлинение) и
разборка (укорочение) кинетохорных микротрубочек и микротрубочек
центрального веретена. Имеются также данные о том, что анафазное дви-
жение хромосом определяется в основном процессами взаимодействия
коротких нитей центрального веретена. Здесь удалось обнаружить нали-
чие фибрилл, образованных сократимыми белками. Некоторые исследова-
тели считают, что возникновение аппарата микротрубочек — лишь
внешнее проявление более сложных, неясных еще для нас процессов,
происходящих в цитоплазме клеток. В пользу таких представлений гово-
рят факты, свидетельствующие о наличии в анафазе направленных пере-
мещений гиалоплазмы с органоидами.
В телофазе происходит деспирализация хромосом, формирование яд-
рышка и ядерпой оболочки. В это же время происходит и цитотомия,
т. е. деление цитоплазмы материнской клетки. В этом процессе прини-
мают участие и поверхностный слой цитоплазмы, и аппарат централь-
ного веретена, и, наконец, по-видимому, микротрубочки нитей сияния-
В поверхностной цитоплазме дифференцируются фибриллярные струк-
туры из сократительных белков. Их сокращение происходит под влия-
нием физиологически активных веществ. Последние поступают в пери-
ферические слои цитоплазмы из области центрального веретена. Сокраще-
ние фибриллярных структур поверхностного слоя в области экватора и
формирование перетяжки, или борозды деления, облегчаются уменьше-
нием поверхпостпого натяжения на полюсах клетки благодаря поступле-
нию туда, по-видимому, по аппарату микротрубочек нитей сияния со-
ответствующих химических компонентов, обеспечивающих изменения
физико-химических свойств цитоплазмы. На заключительных этапах цито-
томии в области центрального веретепа происходит образование двух
плазматических мембран, приводящее к окончательному разделению до-
черних клеток.
Таким образом, митотическое деление клеток представляет собой
весьма сложную цепь взаимообусловленных и последовательно совершаю-
щихся процессов в целостной системе клетки. Несмотря на строгую по-
следовательность совершающихся в митозе и в интерфазе процессов,
S*
19
между ними ие всегда имеется жесткая прпчинио-следствениая связь.
Об этом свидетельствуют многочисленные экспериментальные данные, по-
казывающие, что нарушение или выключение одного из звеньев процесса
клеточного деления может не остановить следующий за ним частный
процесс в общей цепи последовательных событий, составляющих суть кле-
точной репродукции. Так, в частности, можно остановить процессы рас-
хождения хромосом, разрушив аппарат микротрубочек. Тем не менее хро-
мосомы будут проходить характерную для телофазы деспирализацию и
будут образовывать типичное интерфазное ядро, содержащее, однако,
удвоенный набор хромосом.
Эта общая закономерность организации процессов репродукции клеток
определяет, по-видпмому, филогенетическую лабильность этих процессов.
Особенно ярко проявляется опа в модификациях митотического размно-
жения у некоторых одноклеточных организмов. В процессах равнона-
следствепиого распределения хромосом здесь может принимать сущест-
венную, а иногда ведущую роль ядерная оболочка, которая при этом
пе разрушается, и все процессы деления клетки совершаются при сохра-
нении ядра. При этом аппарат микротрубочек может возникать в карио-
плазме, прикрепляться к ядерной оболочке или вообще полностью реду-
цироваться. Весьма многообразна также и структура клеточного центра.
В нем, как например у клеток высших растений, могут отсутствовать
центриоли. Они могут иметь также и необычную структурную орга-
низацию.
Помимо основного способа репродукции клеток — их митотического
деления, в специализированных тканях могут иметь место процессы ами-
тотического, прямого деления клеток. Иногда им могут предшествовать
и процессы синтеза ДНК и репликации хромосом. Однако у многоклеточ-
ных животных при дифференцировке клеток процессы прямого деления
приводят к формированию неполноценных, не способных к митотическому
делению клеток.
Весьма широко распространены при дифференцировке соматических
клеток многоклеточных животных явления соматической полиплоидиза-
ции. Они основаны на разобщении двух основных процессов клеточной
репродукции — синтеза ДНК и митоза. При соматической полиплоидиза-
ции клетки переходят на эндомитотический цикл репродукции, при кото-
ром в цикле отсутствует митоз, хотя и сохраняется период синтеза ДНК
и происходит удвоение интерфазных хромосом. При полиплоидизации
клетки могут проходить не один, а несколько и даже много циклов эндо-
репродукции, благодаря чему степень полиплоидизации бывает различ-
ной. В крайних случаях в клетках может содержаться свыше 1000 набо-
ров хромосом или соответствующее количество ДНП.
В клетках многоклеточных животных известны два типа соматиче-
ской полиплоидизации — политения и эндомптоз. При политении из
цикла репродукции полностью выпадает митоз и происходит многократ-
ное удвоение нитей ДНП в составе исходных материнских хромосом.
Благодаря этому они приобретают гигантские размеры и становятся ви-
димыми в иитерфазном ядре. Такие хромосомы называются политенными.
Политения особенно широко распространена у высших первичноротьк’
и, в частности, насекомых. Однако она имеет, по-видимому, место и
в клетках некоторых провизорных тканей у млекопитающих.
При эндомитозе могут сохраняться начальные фазы митоза. Здесь
отсутствует лишь анафаза, и реплицированные хромосомы оказываются
в одном ядре. При каждом эндомитотическом цикле происходит, как
правило, кратное удвоение числа интерфазных хромосом.
Основной биологический смысл эндорепродукции в клетках тканей
многоклеточных животных заключается в том, что при этом происходит
интенсификация специфического метаболизма без затраты энергии па
митоз и без прекращения функциональной деятельности клеток во
20
время деления. При некоторых типах дифференцировок эндорепродук-
ция является необходимым условием специализации клеток на выпол-
нение определенной специфической функции.
ЗАКЛЮЧЕНИЕ
В настоящее время в цитологии достигнуты значительные успехи
в анализе общих закономерностей организации и репродукции клеток.
Имевшие несколько десятилетий назад широкое распространение пред-
ставления об отсутствии структурной организации живой протоплазмы
оказались ошибочными. Удалось показать, что особенностью химиче-
ских реакций в клетке является их упорядоченный, направленный ха-
рактер, причем структурная организация биохимических процессов
наблюдается как на молекулярном, так и на надмолекулярном и органо-
идном уровнях. Наиболее иллюстративными примерами в этом отноше-
нии могут быть матричный синтез ДНК и РНК, процессы окислитель-
ного фосфорилирования в мембранах митохондрий, активный ионный
транспорт через мембраны, сборка белков на рибонуклеопротеидах ри-
босом. Однако строгая структурная упорядоченность биохимических
процессов в клетке не ограничивается, по-видимому, организацией этих
важнейших реакций пластического и энергетического обменов на отно-
сительно хорошо уже изученных мембранах и нуклеопротеидных струк-
турах клетки.
Весьма прогрессивными, на наш взгляд, являются представления
о том, что вообще все реакции в живой протоплазме основываются на
структурно организованном транспорте и взаимодействии низкомолеку-
лярных веществ, механизмы которых, однако, остаются еще в значи-
тельной мере неясными.
В клеточных системах сочетается большая степень дифференциро-
ванности метаболического и других аппаратов клетки с интеграцией
клетки как целостной элементарной системы организации живой мате-
рии. Упрощенные представления о роли ядерногб аппарата в такой
интеграции клеточного метаболизма лишь как источника информации
сменяются в настоящее время более сложным и углубленным понима-
нием этого вопроса. Единство клетки определяется не только матрич-
ным синтезом РНК на ДНК. Не менее сложные, хотя и менее изучен-
ные, регулирующие влияния оказывают на ядерный аппарат химиче-
ские соединения, поступающие из внешней для клетки среды и из
цитоплазмы в ядро.
Иными словами, речь идет о наличии сложных взаимодействий ос-
новных структурных компонентов клетки — ядра, плазматической мем-
браны и цитоплазмы как основы такой интеграции. В последнее время
накапливается все больше и больше фактов, свидетельствующих о том,
что и в интерфазе и при делении клетки между ее специализирован-
ными мембранными, нуклеопротеидными и другими структурными эле-
ментами происходит непрерывное взаимодействие, которое определяет
и единство клеточной организации, и структурную организацию биохи-
мических процессов. Воспроизведение отдельных звеньев этих процес-
сов на изолированных структурах клетки никогда не отражает пол-
ностью их ход и регуляцию в целостной клеточной системе из-за нару-
шения такого взаимодействия — одного из основных свойств целостных
клеточных систем.
Совокупность имеющихся в настоящее время данных показывает,
что в основе организации очень разнообразных по своей специализации
клеток многоклеточных животных лежит ряд общих универсальных для
всех клеток закономерностей. Они проявляются и в структуре, и в хи-
мическом составе отдельных органоидов, в их взаимодействии, в меха-
21
низмах интеграции клеточной системы, и, наконец, в процессах клеточ-
ной репродукции. Универсальность этих закономерностей исторически
обусловлена общим источником развития и первыми этапами эволюци-
онного усложнения клеточных систем. Существенное значение имеют,
по-видимому, и ограниченные потенции живой материи на клеточном
и тканевом уровнях к изменениям в различных направлениях при фи-
логенезе многоклеточных животных. Эти ограничения вытекают из пер-
вичных свойств живого вещества. В связи с такими ограничениями
сходные черты в морфобиохимической организации клетки и ее отдель-
ных структур могут появиться и независимо в процессе эволюционного
усложнения разных групп многоклеточных и одноклеточных животных.
Особенно широкое распространение такие цитологические паралле-
лизмы имеют при формировании специализированных клеток современ-
ных многоклеточных животных.
Наряду с известной исторически обусловленной консервативностью
организации клеточных систем, одним из выражений которой является
как раз наличие общих для всех клеток закономерностей их организа-
ции, мы наблюдаем также и лабильность, пластичность такой органи-
зации. Она проявляется в варьировании до определенных пределов об-
щих для всех клеток признаков структурной и химической организации.
Степень и характер таких модификаций в рамках общих типовых для
данной клеточной структуры или процесса закономерностей могут быть
различными. Как правило, амплитуда этих модификаций тем больше, чем
выше уровень организации. Само проявление их также будет различ-
ным на макромолекулярном, надмолекулярном, органоидном и систем-
ном клеточном уровнях организации. Кроме того, и степень изучен-
ности возможных вариантов организации клеточных структур и инте-
гративных механизмов в клетках также весьма неоднозначна.
Относительно хорошо известны закономерные изменения таких кле-
точных структур, как плазматическая мембрана, эндоплазматическая
сеть, аппарат Гольджи и других мультифункциональных органоидов
цитоплазмы и структур ядерного аппарата. Большой фактический ма-
териал накоплен и по сравнительному изучению аналогичных в функ-
циональном отношении специальных органоидов и внеклеточных струк-
тур, особенно на макромолекулярном и надмолекулярном уровнях их
организации. Значительно хуже обстоит дело в отношении изучения
интегрирующих механизмов, обеспечивающих функционирование кле-
ток как целостных элементарных систем, как в общецитологическом
плане, так и в плане сравнительного изучения специфики этих меха-
низмов у дифференцированных в различных направлениях клеток мно-
гоклеточных животных. Тем не менее имеющийся фактический мате-
риал позволяет уже в настоящее время проводить достаточно широкие
сравнительно-цитологические сопоставления специализированных кле-
ток у разных животных.
Глава 2
КЛАССИФИКАЦИЯ ТКАНЕЙ И НЕКОТОРЫЕ ОБЩИЕ
ЗАКОНОМЕРНОСТИ ИХ ФОРМИРОВАНИЯ В ОНТО-
И ФИЛОГЕНЕЗЕ
ВВЕДЕНИЕ
У подавляющего большинства современных многоклеточных живот-
ных клетки и межклеточные структуры объединены в особые системы —
ткани. Следовательно, помимо клеточного уровня организации много-
22
клеточных животных, существует еще и особый тканевой уровень их
организации. Интегрированные тканевые системы образуют отдельные
органы или их системы. В состав различных органов могут входить одни
п те же ткани, т. е. число тканей значительно меньше, чем количество
и разнообразие органных структур.
Ткани специализированы на выполнении частных функций много-
клеточных организмов. Под тканью в широком смысле понимают си-
стему элементов (клеток и межклеточных структур), имеющих общие
признаки морфобиохимической и системной организации и выполняю-
щих общую функцию. Поскольку таких общих функций, характеризую-
щих основные стороны взаимоотношений организма с внешней средой,
относительно немного и они характерны для всех животных, одни и
те же типы тканей имеются у подавляющего большинства многоклеточ-
ных животных. В каждом типе тканей, особенно у достаточно высоко
организованных животных, удается выявить большее или меньшее число
конкретных частных систем — разновидностей данного типа тканей. Они
специализированы на осуществлении отдельных сторон общей для дан-
ного типа основной, универсальной функции. В пределах разновидно-
стей тканей целесообразно выделить еще более частные клеточные си-
стемы, так называемые клеточные популяции. В составе разновидности
ткани клеточные популяции объединены пространственно в виде част-
ных систем с собственными механизмами регуляции численного состава
клеток в данной системе. Таким образом, каждый тип тканей состоит
из большого числа разновидностей, каждая из которых в свою очередь
подразделяется на частные системы — клеточные популяции, объединен-
ные в составе этой ткани в целостную систему. Некоторые типы тканей
целесообразно разделить не только на разновидности, но выделить в них
еще и более крупные категории. Так, в частности, в типе пограничных
эпителиальных тканей можно выделить кожные, кишечные и мезодер-
мальные эпителии в качестве отдельных подтипов.
На тканевом уровне организации многоклеточных животных мы
имеем дело, следовательно, с целой иерархией систем, характеризую-
щихся известной автономией и спецификой своей системной организации
и вместе с тем составляющих единый тканевой тип с общими для дан-
ного типа признаками системной интеграции и общими закономерно-
стями филогенетической дифференцировки.
Для тканевого уровня организации характерны специфические си-
стемные закономерности интеграции клеток и межклеточных структур.
Поскольку основными компонентами тканей и клеточных популяций яв-
ляются клетки, естественно, что отмеченные в предыдущем разделе за-
кономерности морфофункциональной организации клеток и их репродук-
ции и лежат в основе системных механизмов объединения любой клеточ-
ной системы. Ткани осуществляют свои функции не изолированно,
а в составе комплексных систем, находящихся в сложных отношениях
между собой и с интегрирующими системами организма.
Возникновение тканевого уровня организации явилось важным про-
грессивным моментом в эволюции многоклеточных животных, обусловив-
шим значительную интенсификацию общих организменных функций и
создавшим основу для развития и прогрессивного усложнения органных
структур. Лишь у немногих групп низших многоклеточных — губок и
бескишечных турбелярий — отсутствует или слабо выражена тканевая
организация специализированных клеток и межклеточных структур.
23
РАЗВИТИЕ ТКАНЕЙ В ОНТОГЕНЕЗЕ. ДИФФЕРЕНЦИРОВКА
И ДЕТЕРМИНАЦИЯ КЛЕТОЧНЫХ СИСТЕМ И ИХ ЦИТОГЕНЕТИЧЕСКАЯ
ОСНОВА
При половом размножении развитие у всех многоклеточных живот-
ных начинается с процесса слияния двух гаплоидных, мужской и жен-
ской, половых клеток. Они характеризуются высокой степенью цитологи-
ческой дифференциации и вместе с тем продукт их слияния — зигота —
дает начало всем разнообразным клеткам, из которых построены ткани
многоклеточных животных.
Для процессов раннего эмбрионального развития особое значение
имеет дифференцировка женской половой клетки — ооцита. Ооциты мо-
гут достигать гигантских размеров и характеризуются весьма сложной
структурной и химической организацией цитоплазмы. В ней, помимо
большого количества запасных питательных веществ для пластического
и энергетического обменов, сосредоточены и необходимый для последую-
щего развития белоксинтезирующий аппарат и резервная энергетическая
система в виде неработающих митохондрий. Кроме того, в цитоплазме
находятся латентные формы иРНК и специфические белки, имеющие
регуляторное значение в последующем развитии. Запасные органоиды и
многочисленные и разнообразные по своему значению рибонуклеопроте-
иды вместе с запасными питательными веществами закономерно распре-
деляются по цитоплазме, образуя ее весьма сложную и гетерогенную
в химическом плане структуру, определяющую первичную дифференци-
ровку клеточного материала зародыша. Она реализуется уже на первом
этапе эмбрионального развития — дроблении, когда в ходе быстро проте-
кающих митотических делений образующиеся ядра попадают в разные
участки цитоплазмы бывшего ооцита, участки, содержащие качест-
венно различные типы иРНК и регуляторных белков. Последние вместе
с белками, синтезируемыми на основе латентных форм иРНК, оказывают
специфическое влияние на, ядерный аппарат, активируя или блокируя
отдельные участки генома. При этом в одних группах бластомеров ак-
тивируются одни участки, в других — иные, благодаря чему происходит
дифференцировка клеточного материала развивающегося зародыша.
С этого периода начинается образование эмбриональных зачатков — раз-
нородных по своим потенциям к развитию клеточных систем. Клетки
в этих системах характеризуются некоторыми, незначительными еще,
морфологическими особенностями и, что самое главное, различиями в ге-
теросинтетической активности. На ранних стадиях развития количество
зачатков относительно невелико. У большинства многоклеточных живот-
ных в развитии есть стадия, когда они представлены тремя клеточными
системами: наружными, граничащими с внешней для зародыша средой
(эктобластом и энтобластом) и расположенным между ними средним
слоем (мезобластом). Такое расположение зародышевых слоев в разных
группах многоклеточных животных достигается различными путями.
Оно осуществляется либо активными морфогенетическими перемеще-
ниями клеточного материала, либо неравномерным ростом отдельных
частей зародыша. Чаще имеет место, комбинация этих двух механизмов.
Процессы сложного перераспределения клеточного материала составляют
основное содержание второго периода эмбриогенеза — периода гастру-
ляции.
На следующем, третьем этапе развития, в период закладки основных
органов, происходит дальнейшее передвижение клеточного материала и
дифференцировка первичных эмбриональных зачатков на более частные
системы. У высших позвоночных в эктобласте выделяется эктодерма и
нервный зачаток, происходит разделение энтобласта на хорду и зароды-
шевую и внезародышевую части энтодермы. Весьма сложную дифферен-
цировку претерпевает мезодерма. В ней выделяются участки, дающие
24
начало поперечнополосатой мышечной ткани, скелетным тканям и
стенке вторичной полости тела. Из мезодермы образуется основная часть
первичной эмбриональной ткани — мезенхимы. Ее отличие от обычных
эмбриональных зачатков заключается в том, что в момент своего выделе-
ния она начинает выполнять трофическую функцию, обеспечивая транс-
портировку питательных веществ и продуктов метаболизма. Помимо
мезенхимы, у многих высших многоклеточных дифференцируются прови-
зорные клеточные системы, осуществляющие выделительную, всасываю-
щую, респираторную и другие, необходимые для развития зародыша
функции. В отличие от мезенхимы провизорные ткани не являются ис-
точником развития дефинитивных тканей. Они характеризуются относи-
тельно коротким периодом существования в зародыше, высокой степенью
специализации образующих их клеточных элементов. При дифференци-
ровке последних большое распространение имеют явления эндорепро-
дукции.
Ведущее значение в прогрессирующей дифференцировке клеток
эмбриональных зачатков в период гаструляции и закладки основных орга-
нов животных имеет взаимодействие между клетками различных зачатков
и одинаковыми клетками в одном зачатке. В многочисленных экспе-
риментах с пересадкой зачатков в развивающихся зародышах и культи-
вированием зачатков вне организма в различных комбинациях удалось
выявить некоторые общие закономерности таких взаимосвязей. У позво-
ночных животных показано организующее значение отдельных областей
зародыша для формирования основного осевого комплекса органов. На
примере зачатков кожного эпителия и других эпителиев выявлена необ-
ходимость временного или постоянного контакта эмбрионального эпите-
лия с развивающейся соединительной ткапью не только для нормального
развития этих зачатков, но и для их существования в условиях in vitro.
На примере зачатков эпителия поджелудочной железы, миобластов позво-
ночных животных, а также других клеточных и тканевых систем в усло-
виях культивирования их вне организма показано, что для нормальной
специализации и дифференцировки этих тканевых элементов необходимо
определенное критическое их число, или их общая масса, т. е. необходимо
взаимодействие между одинаковыми клетками.
Таким образом, имеется множество фактов, свидетельствующих о том,
что прогрессирующая дифференцировка зародыша определяется слож-
ными взаимодействиями образующихся в результате первичной диффе-
ренцировки эмбриональных зачатков. Наиболее яркой иллюстрацией яв-
лений такого зависимого развития являются классические эксперименты
по изменению направления дифференцировки зачатков при пересадке
одного и того же зачатка в разные участки зародыша.
С другой стороны, имеются данные, свидетельствующие о том, что
определенные комплексы зачатков и эмбриональных тканей могут в усло-
виях изоляции их от организма продолжать нормальное развитие и фор-
мировать тканевые и органные структуры, подобные структурам, разви-
вающимся in vivo, т. е. они способны к самодифференцировке как частные,
в известной мере автономные, системы. Возможность менять направ-
ление дифференцировки под влиянием внешних для эмбриональных за-
чатков факторов, как правило, уменьшается по мере развития организма.
Известная автономность и способность к саморазвитию в определенном
направлении у эмбриональных зачатков и тканей, наоборот, увеличива-
ется в ходе развития зародыша.
Ограничение потенций зачатков к различным направлениям диффе-
ренцировки, определение направления их дефинитивной дифференци-
ровки называется детерминацией. Проявление этих внутренних измене-
ний в виде различий в морфологии, поведении, функциональных осо-
бенностях клеточных элементов различных зачатков носит название
дифференцировки зачатков и ткапей в широком смысле этого понятия.
25
В более узком смысле в гистологии под дифференциацией или, точнее,
цитодифференциацией обычно понимают возникновение качественных
видимых различий между клетками.
Явления детерминации и дифференциации развертываются на уровне
эмбриональных зачатков и тканей, т. е. на уровне интегрированных кле-
точных систем. В основе механизмов, обеспечивающих согласованный
ход этих сложных процессов, лежат общие закономерности морфобиохи-
мической организации клеток и, в частности, сложная деятельность их
генетического аппарата. В настоящее время имеются достаточно убеди-
тельные данные о том, что, как правило, любая клетка данного многокле-
точного организма обладает идентичным набором хромосом, т. е. одина-
ковым запасом генетической информации. В связи с этим процессы
детерминации и последующей дифференцировки клеточного материала
связаны обычно пе со структурными изменениями ДНК хромосом, а лишь
со стойким изменением регуляции работы генетического аппарата — де-
блокированием специфических для данного вида дифференцировки генов
и стойким блокированием других генов. Конкретные молекулярные ме-
ханизмы этих процессов в настоящее время остаются в значительной
мере неясными. Очевидно, что все эти процессы регуляции работы гене-
тического аппарата клеток осуществляются на уровне ДНП хромосом.
Однако их закономерное течение во времени и конкретная реализация
в нужный момент опосредованы или прямыми воздействиями химиче-
ских системных и организменных регулирующих факторов, или их влия-
нием через метаболический аппарат данной клетки. В основе некоторых
цитодифференцировок в виде исключения могут лежать количественные
(генная амплификация) или даже качественные изменения отдельных
участков ДНК.
К моменту формирования дефинитивных тканей генетический аппа-
рат составляющих их клеток детерминирован уже достаточно стойко, и
возможности изменения генетической программы в них, особенно у выс-
ших животных, весьма ограничены. Обычно даже наименее внешне диф-
ференцированные клетки той или иной разновидности тканей способны
дифференцироваться в небольшое число специализированных клеток
в пределах направлений цитодифференциации, характерных для данной
разновидности или данного типа тканей. Таким образом, одной из фунда-
ментальных характеристик тканевой системы является наличие в со-
ставляющих ее клеточных элементах стойкой детерминации генетического
аппарата к определенным типам дифференцировки, что обусловлено воз-
можностью активизации в них лишь определенных участков генома.
ВЗАИМООТНОШЕНИЯ МЕЖДУ РЕПРОДУКЦИЕЙ
И ДИФФЕРЕНЦИРОВКОЙ КЛЕТОК В ТКАНЕВЫХ СИСТЕМАХ
В процессах становления тканевых систем в онтогенезе и во многих
разновидностях дефинитивных тканей взрослого организма ведущими
факторами формирования и жизнедеятельности тканевых систем явля-
ются процессы репродукции клеток и их специфической цитодифферен-
циации. Как было уже отмечено, в основе этих процессов лежат разные
по своей сути программы работы метаболического аппарата клеток, их
аутосинтетическая и гетеросинтетическая активность. В первом случае
деятельность метаболического аппарата клеток направлена на процессы
репродукции — увеличение количества клеток в системе. При гетеросин-
тетической активности в клетках происходит формирование специфиче-
ских структур или синтез и выделение специфических продуктов. Взаи-
моотношения между гетеро- и аутосинтетической активностью сложны
и многообразны даже в пределах отдельных разновидностей специализи-
26
рованных клеток. Естественно, что в тканевых системах эти взаимоотно-
шения приобретают особое значение для организации системы.
При цитодифференциации, связанной с ярко выраженными антагони-
стическими отношениями между гетеро- и аутосинтетической актив-
ностью клеток в тканевых системах, имеются два способа сочетания
процессов репродукции и дифференциации клеток. Все процессы репро-
дукции клеток могут сосредоточиваться в периоде эмбриогенеза, когда
и формируется основной запас клеток, необходимый для построения
данной ткани. Такого рода отношения наблюдаются при развитии нервной
системы у высших животных. Вторым способом увеличения количества
клеток при антагонизме между их репродукцией и дифференцировкой яв-
ляется создание постоянного запаса малодифференцированных проли-
ферирующих клеток, который и обеспечивает непрерывное возникнове-
ние новых клеток, вступающих на путь специфической дифференци-
ровки.
При отсутствии антагонизма между гетеросинтетической и аутосин-
тетической активностью в тканевых системах увеличение коли-
чества клеток в онтогенезе идет параллельно с их дифференцировкой.
Естественно, что темпы размножения клеток в таких тканевых системах
уменьшаются в ходе развития и в дефинитивных тканях оказываются уже
на достаточно низком уровне.
Помимо трех основных типов тканей по рассматриваемому признаку:
стационарных, обновляющихся и так называемых растущих тканей, име-
ется и много разновидностей, занимающих промежуточное положение
между ними. Взаимоотношения между репродукцией и дифференциров-
кой в некоторых разновидностях тканей и клеточных популяций могут
быть значительно сложнее простого антагонизма или конкуренции. На не-
которых хорошо изученных модельных системах удалось показать на-
личие тесной связи между размножением клеток и их специфической
гетеросинтетической активностью. Возможно, что такие взаимоотноше-
ния этих процессов имеют более широкое распространение, чем принято
считать в настоящее время.
Весьма важной системной характеристикой ткани является продолжи-
тельность жизни составляющих ее тканевых элементов, т. е. интенсивность
обновления внутриклеточных структур, клеток и образуемых ими меж-
клеточных структурных элементов. По этому признаку в разных тканях
одних и тех же животных и в одинаковых тканях у разных представи-
телей многоклеточных организмов удается выявить несколько характер-
ных типов системной организации.
В тканях нервной системы высших многоклеточных животных про-
должительность жизни нейронов соответствует продолжительности жизни
организма. Такие системы получили название стационарных систем. Тем
не менее образующие их нервные клетки характеризуются непрерывно
идущими процессами обновления структурных элементов, причем в от-
ростках нейронов процессы обновления клеточных структур часто при-
обретают направленный полярный характер. Непрерывное обновление
внутриклеточных структур при весьма продолжительном существовании
клеток и надклеточных образований, симпластов, характерно у позвоноч-
ных животных для клеток эпителия печени, мышечных волокон и тка-
невых элементов многих других разновидностей тканей.
Весьма многообразны также процессы обновления продуцируемого
клетками межклеточного вещества соединительной ткани позвоночных
животных и кутикул кожных эпителиев многих беспозвоночных жи-
вотных. Эти процессы могут носить цикличный характер, могут быть
строго поляризованы или равномерно рассредоточены в толще межкле-
точного вещества. Разрушение и особенно непрерывное или циклическое
новообразование таких структур связаны со сложными физико-химиче-
скими процессами их вторичных изменений. В этих процессах сущест-
27
венную роль играют контакты межклеточных структур с плазматической
мембраной и разнообразные механизмы выведения веществ из образую-
щих их клеток.
Особую, весьма распространенную у многоклеточных животных
группу составляют ткани, жизнедеятельность и системная организация
которых основана на непрерывном обновлении их клеточного состава.
В этих так называемых камбиальных тканях продолжительность жизни
дифференцированных клеток относительно невелика. Численное посто-
янство клеточного состава в таких тканях достигается за счет сбаланси-
рованного равновесия между количеством погибающих, закончивших
свой жизненный цикл клеток и количеством образующихся в результате
деления малодифференцированных камбиальных клеток. Естественно,
что здесь особенно ярко выражены регулятивные системные механизмы
и особенно наглядно выступают тесные взаимоотношения между репро-
дукцией и дифференциацией клеток.
В точной количественной характеристике этих взаимоотношений, осо-
бенно на уровне клеточных популяций камбиальных тканей, существен-
ная роль принадлежит методу тимидиновой авторадиографии. С помощью
этого метода для многих клеточных популяций различных тканей уда-
лось определить среднюю продолжительность митотического цикла у ма-
лодифференцированных камбиальных клеток, их относительное количе-
ство в системе — так называемый пролиферативный фонд клеточной
популяции и скорость обновления дифференцированных клеток. При на-
личии таких характеристик процессов репродукции и физиологической
регенерации появились реальные предпосылки для выяснения конкрет-
ных системных механизмов, лежащих в основе регуляции репродукции,
дифференцировки и гибели специализированных клеток в отдельных кле-
точных популяциях.
Большое значение в успешной реализации этих предпосылок имеют
и другие, преимущественно экспериментальные методы исследования.
Среди них особенно важную роль в анализе внутренних закономерно-
стей организации таких сложных камбиальных систем, как системы тка-
ней внутренней среды высших позвоночных животных, играет методика
трансплантаций в комбинации с действием ионизирующей радиации, ис-
пользование генетических маркеров и клонирование камбиальных ство-
ловых клеток в условиях in vivo. Подробный анализ методических прие-
мов и достигнутых с их помощью успехов в изучении камбиальных и дру-
гих тканей будет дан при характеристике этих тканей.
ЗАКЛЮЧЕНИЕ
Особенностью живой материи является ее способность передавать по
наследству происходящие в процессе эволюции изменения ее внутрен-
ней организации. Это свойство у современных организмов обеспечивается
весьма совершенным генетическим аппаратом клеток. Он возник в про-
цессе естественного отбора на основе первичных комплексов макромо-
лекул, образовавшихся при зарождении жизни. Их способность с той или
иной степенью совершенства передавать информацию о своей структуре
другим новообразующимся комплексам макромолекул и послужила, оче-
видно, основой для исторической обусловленности структур и процессов
в живой материи. Современные организмы прошли длительный путь исто-
рического развития, т. е. все сложные коррелятивные связи между ча-
стями многоклеточного организма имеют историческую обусловленность.
В связи с этим достаточно глубокое понимание основных биологических
закономерностей возможно лишь при выяснении закономерностей эво-
люционных преобразований на всех уровнях организации многоклеточ-
ных животных.
28
К сожалению, прямые экспериментальные подходы к анализу эволю-
ционного процесса возможны сейчас лишь в отношении самых ранних,
доклеточных, этапов формирования живой материи. Что касается кле-
точного и тканевого уровней организации, то здесь основным и ведущим
методом остается косвенный — сравнительный исторический метод. Бла-
годаря большому прогрессу в методических подходах и углублению на-
ших знаний об общих и специфических закономерностях организации
клеток и тканей значительно шире, глубже и разнообразнее стали кри-
терии, по которым можно проводить сопоставление тканевых элементов
и признаков системной организации у современных многоклеточных жи-
вотных.
В основе эволюции тканей лежат общие закономерности морфобио-
химической организации клеток. Однако конкретная реализация имею-
щихся у клеток данной системы потенций к специализации происходит
в результате опосредованных через системный тканевой уровень воздей-
ствий физических и химических факторов на генетический и метаболи-
ческий аппараты клеток. Конкретные механизмы действия таких физи-
ческих и химических системных факторов аналогичны, по-видимому,
интенсивно изучаемому в настоящее время действию факторов, обеспечи-
вающих взаимодействие эмбриональных зачатков и тканей в ходе инди-
видуального развития организма.
Закономерности филогенетической дифференцировки тканей как част-
ных систем многоклеточного организма отличаются от закономерностей
филогенетических преобразований на органном и организменном уровнях
организации рядом специфических особенностей. Наряду с этим ткани
как более сложные, чем клетки, системы характеризуются значительно
большим разнообразием модификаций своей системной и морфобиохи-
мической организации. Ткани осуществляют самые общие, универсаль-
ные для любого организма функции, поэтому разнообразие типов тканей
относительно невелико. Такими общими функциями являются барьер-
ная функция, функция обеспечения относительного постоянства внутрен-
ней среды, функция восприятия раздражения и проведения возбуждения
и, наконец, локомоторная функция. Соответственно этому у подавляющего
большинства современных многоклеточных животных имеются эпите-
лиальные ткани, ткани внутренней среды, ткани нервной системы и мы-
шечные ткани. Последовательность возникновения этих тканей у первич-
ных многоклеточных животных обусловливается, очевидно, прежде всего
функциональными моментами.
В связи с этим естественно предположить, что первыми в процессе
эволюции появились пограничные ткани и ткани внутренней среды, по-
скольку они осуществляют более общие стороны взаимодействия орга-
низма с внешней средой. Для осуществления более специальных функ-
ций уже несколько позднее выделились нервные и мышечные ткани.
У всех организмов функции, осуществляемые этими тканями, в принципе
оказываются одинаковыми, а основным тканевым элементом является
клетка с ее относительно консервативной организацией и ограниченными
потенциями к эволюционным преобразованиям. Эти два обстоятельства
и определяют основную особенность тканевой дифференцировки в фило-
генезе, ее направленный закономерный характер. Эта общая закономер-
ность проявляется в широком распространении на тканевом уровне ор-
ганизации явлений параллелизма и конвергенций, т. е. наличии сходных
структур и принципов системной организации у неродственных, давно
разошедшихся в эволюции групп многоклеточных животных.
Таким образом, в противоположность большому разнообразию живот-
ных на организменном уровне организации на тканевом уровне сходство
аналогичных в функциональном отношении тканей становится домини-
рующей закономерностью их усложнения в процессе эволюции. Такая
направленность и универсальность для всех многоклеточных основных
29
путей усложнения типов тканей не является, правда, исключительной
особенностью тканевого уровня организации. Еще в большей мере эти
тенденции свойственны клеточному, субклеточному и молекулярному
уровням организации. Более широкое, чем думали раньше, распростра-
нение имеют явления параллелизма и на более высоком уровне органи-
зации многоклеточных животных.
Ведущая роль явлений параллелизма и конвергенций в эволюцион-
ном усложнении аналогичных в функциональном отношении тканей
разных групп многоклеточных животных обусловливает исключительное
значение для анализа эволюционной динамики тканей их сравнительного
исследования по признаку функциональной аналогии. Накопленный
большой сравнительно-гистологический и сравнительно-цитологический
материал в отношении отдельных разновидностей аналогичных по функ-
ции тканей и специализированных клеток показывает, что сходные черты
в организации клеток и тканей у разных животных проявляются не
в абсолютном тождестве организации тканей и морфобиохимических диф-
ференцировок клеток и межклеточных структур. В пределах каждой
функциональной разновидности тканей как у разных и далеко отстоя-
щих групп, так и в пределах одной систематической группы имеется
целый спектр существенных модификаций данного типа тканевых
структур. Это обстоятельство обусловливает настоятельную необходимость
на данном этапе развития гистологии и частной сравнительной цитологии
обеспечить систематическое целенаправленное изучение этих модифика-
ций каждой универсальной для многоклеточных животных функциональ-
ной разновидности тканей.
Часть II
ЭПИТЕЛИАЛЬНЫЕ ТКАНИ
Эпителиальные ткани представляют собой разнородную по происхож-
дению и по функциональному значению группу ткапей многоклеточных
животных. Филогенетически наиболее древние разновидности эпителиаль-
ных тканей — кожные и кишечные эпителии — развиваются из разных
эмбриональных зачатков (экто- и энтодермы) и у высших представителей
многоклеточных не обладают способностью к взаимным превращениям.
Кроме того, у большинства современных многоклеточных животных,
и у первичпоротых, и у вторичноротых, имеется особая разновидность
эпителиальных ткапей вторичного мезодермального происхождения. Не
менее многообразно и функциональное значение отдельных разновид-
ностей эпителиальных тканей. У высших животных они выполняют барь-
ерную, всасывающую, железистую, выделительную, осморегулирующую
и ряд других важных функций многоклеточного организма. Естественно,
что каждая из них требует особой специализации эпителиальных клеток
и продуцируемых ими межклеточных структур. Это приводит к резким
морфобиохимическим различиям в структуре специализированных клеток
и в общих системных закономерностях организации эпителиальных тка-
ней. Несмотря на это, для всех эпителиальных тканей характерен ряд
общих первичных признаков системной организации. Одним из них яв-
ляется структурное объединение эпителиальных клеток в целостные не-
прерывные пласты или тяжи клеточных элементов. Последние функцио-
нируют обычно как целостные в структурном отношении системы.
Вторым общим первичным признаком эпителиальных тканей является
свойство полярности, вытекающее из их пограничного положения в орга-
низме. Оно проявляется либо в закономерном изменении по вертикали
свойств клеток, образующих эпителиальные пласты (многослойный эпите-
лий) , либо в закономерном полярном расположении общих и специальных
органоидов и поляризованном транспорте веществ через цитоплазму кле-
ток (разнообразные однослойные эпителии). С повышением уровня орга-
низации животных это свойство в основных разновидностях эпителиаль-
ных тканей резко усиливается в связи с более совершенной реализацией
ими специальных функций. Наряду с этим при погружении отдельных
разновидностей эпителиев во внутреннюю среду организма свойство по-
лярности может в большей или меньшей степени вторично утрачи-
ваться.
Анализ основных закономерностей организации эпителиальных ткапей
во всем многообразии их модификаций у современных многоклеточных
животных будет проведен отдельно для каждой из трех основных раз-
новидностей — кожных, кишечных и выделительно-осморегулирующих
эпителиев.
Кроме того, в первой главе будет дана краткая характеристика желе-
зистых эпителиев. На примере этой разнородной по происхождению,
но сходной в функциональном отношении группы эпителиальных тканей
особенно наглядно проявляется значение общих клеточных механизмов
для формирования специализированных клеток.
31
Глава 1
ЖЕЛЕЗИСТЫЕ ЭПИТЕЛИИ
ВВЕДЕНИЕ
Способность к выделению специфических секреторных продуктов
возникла и совершенствовалась на основе способности клеток к выделе-
нию во внешнюю для них среду продуктов внутриклеточного метаболизма.
Это универсальное свойство живой протоплазмы широко и разнообразно
реализуется при образовании тканевых систем и, в частности, при разви-
тии в них внеклеточных структур типа кутикул, кожного эпителия или
межклеточного вещества и волокон соединительной ткани. Внутриклеточ-
ные механизмы образования и выведения из клеток макромолекулярных
компонентов этих структур имеют много общего с типичными секретор-
ными процессами. Однако все эти внеклеточные структуры являются не-
отъемлемой составной частью тканевых систем и к ним неприложимо по-
нятие секрета. Этот термин используется в настоящее время для обозна-
чения продуктов синтетической деятельности клеток, выполняющих либо
специфическую для организма функцию (например, секрет поджелудоч-
ной железы, обеспечивающий полостное пищеварение), либо играющих
вспомогательную роль в осуществлении основной функции данной ткане-
вой системы (например, секрет бокаловидных железистых клеток в кож-
ном или кишечном эпителиях). Особую группу секретов составляют спе-
цифические биологически активные вещества, обеспечивающие регуляцию
различных процессов в организме многоклеточных животных. Эти ве-
щества носят название гормонов, или инкретов. Таким образом, общей
особенностью секреторных продуктов является то, что они в отличие от
межклеточных структур не являются, как правило, обязательными струк-
турными компонентами тканевых систем.
Типичные железистые дифференцировки — весьма характерное на-
правление специализации части клеток покровных кожных и кишечных
эпителиев, а в некоторых случаях и отдельных участков целомической
выстилки.
Общей закономерностью эволюционного усложнения железистых эпи-
телиев является тенденция к обособлению их в отдельные органные струк-
туры и частные тканевые системы. Они выделяются из исходной ткани и
приобретают специфические особенности своей внутренней организации.
У высших животных обычно мы имеем дело уже с целым комплексом
разнообразных желез, обособленных от основной ткани в самостоятельные
органные структуры. Особенно отчетливо тенденция к обособлению в от-
дельные системы проявляется в кожных эпителиях позвоночных. Доста-
точно хорошо выражена она также и в дифференцировке железистого
аппарата пищеварительного тракта в разных группах многоклеточных
животных. Эту тенденцию удается наблюдать и при развитии в процессе
эволюции системы желез внутренней секреции.
Поскольку секреция специфических продуктов базируется на общих
метаболических свойствах протоплазмы, внутриклеточная дифференци-
ровка секреторных клеток связана с гипертрофией и специализацией их
анаболических систем. В зависимости от характера выделяемого секрета
и его количества в железистых клетках происходит большая или меньшая
гипертрофия либо белоксинтезирующего аппарата, либо аппарата, связан-
ного с синтезом липидов, либо, наконец, структур, ответственных за син-
тез мукополисахаридов. При выработке сложных секретов гармоничное
развитие получают структуры, ответственные за синтез всех компонентов
этих секретов.
В секреторных клетках обычно хорошо развит аппарат Гольджи, име-
32
ющий важное значение в синтезе некоторых компонентов секрета, в его
транспортировке, дегидратации, преобразовании мембран, ограничиваю-
щих секреторные гранулы и вакуоли.
Особенностью железистых клеток является также наличие большого
количества митохондрий и развитой системы внутриклеточного тран-
спорта. В ряде случаев, особенно в случае малоклеточных желез у некото-
рых групп беспозвоночных животных, интенсификация синтетической
деятельности секреторных клеток сопровождается увеличением наборов
или размеров хромосом, т. е. путем соматической полиплоидизации клеток.
Соответственно своему биологическому значению все железы прежде
всего делятся на две большие группы — экзокриновые и эндокринные же-
лезы. Экзокриновые железы представляют собой чаще всего производные
кишечных и кожных эпителиев и выделяют свой секрет во внешнюю для
организма среду. Эндокринные железы более разнообразны по своему про-
исхождению. Продуцируемые ими инкреты, или гормоны, выделяются
в кровь или тканевую жидкость. Экзокриновые железы имеют более или
менее развитую систему выводных протоков, в то время как у эндокрин-
ных желез они отсутствуют.
Как указывалось выше, помимо этих структурных и функциональных
особенностей экзокриновых и эндокринных желез, между ними есть и
глубокие биологические различия. Секрет экзокриновых желез обеспечи-
вает такие процессы, как полостное пищеварение или снабжение потом-
ства пищей. Он может также играть вспомогательную роль в осуществле-
нии барьерной функции и других функций пограничных эпителиальных
тканей. В противоположность этому значение гормонов заключается
прежде всего в обеспечении гомеостаза многоклеточного организма.
Взаимосвязанная система эндокринных желез регулирует такие про-
цессы, как рост и дифференцировка клеток, постоянство ионного со-
става, развитие вторичных половых признаков и другие метаболические
и морфогенетические процессы. Железы внутренней секреции представ-
ляют собой важнейшую гуморальную интегрирующую систему. Они обес-
печивают вместе с нервной системой непрерывно прогрессирующую в ходе
эволюции интеграцию многоклеточных организмов.
Естественно, что и экзокриновые и эндокринные железы у многокле-
точных животных весьма разнообразны и по характеру дифференцировки
клеток и по их интеграции ib органных и тканевых системах. В кратком
обзоре невозможно дать исчерпывающей характеристики всего многооб-
разия секреторных клеток и их системной организации у разных живот-
ных. Мы ограничимся лишь самой общей характеристикой основных за-
кономерностей морфобпохимической дифференцировки этих клеток на
примере отдельных экзокриновых и эндокринных желез у различных жи-
вотных. На этих же примерах будут освещены и некоторые особенности
системной организации железистых структур, преимущественно у выс-
ших многоклеточных животных.
ЭКЗОКРИНОВЫЕ ЖЕЛЕЗЫ
Одноклеточные и малоклеточные железы
Слизистые бокаловидные клетки. Слизистые бокаловидные клетки
представляют собой одноклеточные железы, располагающиеся обычно
в составе кожных и кишечных эпителиев. Они органически входят в со-
став этих пограничных тканевых систем, представляя собой одну из
весьма широко распространенных железистых дифференцировок эпите-
лиальных тканей. Слизистые клетки играют важную вспомогательную
роль в осуществлении основной функции эпителиального пласта. Так,
в кишечпом всасывающем эпителии выделяемая бокаловидными клетками
3 А. А. Заварзин 33
слизь образует защитную оболочку для тонкого и сложного дифференци-
рованного аппарата микроворсинок всасывающих клеток. В эпителии тол-
стой кишки и задних отделов топкого кишечника слизистые клетки ста-
новятся преобладающим дифференцированным клеточным элементом.
Слизь бокаловидных клеток в многорядном ресничном эпителии воздухо-
носных путей служит тем субстратом, к которому прилипают твердые
инородные частицы, попадающие в полость воздухоносных путей. Нако-
нец, в кожном эпителии немертин, моллюсков, низших позвоночных и мно-
гих других групп животных секрет слизистых клеток играет важную вспо-
могательную роль в осуществлении барьерной функции этого эпителия.
Такое широкое распространение слизистых одноклеточных желез и
среди различных групп многоклеточных животных, и в разных типах
эпителиальных тканей у одного вида животного свидетельствует об отно-
сительно древней природе этого типа дифференцировки клеточных эле-
ментов и относительно лабильном блокировании в эпителиальных клетках
участков геномов, ответственных за дифференцировку клеток в этом на-
правлении. Даже в экспериментальных условиях при воздействии избытка
витамина А или при контакте с чужеродной соединительной тканью в де-
терминированных зачатках кожного эпителия млекопитающих и птиц
происходит развитие слизистых бокаловидных клеток, которые отсутст-
вуют при нормальном онтогенезе этих зачатков.
Морфобиохимическая организация слизистых железистых клеток хо-
рошо изучена на примере бокаловидных клеток кишечного эпителия
(Neutra, Leblond, 1966). Апикальная пузыревидная часть клетки в фазе
накопления клеткой секрета заполнена секреторными вакуолями, дости-
гающими в зрелом состоянии относительно крупных размеров (рис. 2, а).
Ядро и основная часть цитоплазмы с органоидами оказываются смещен-
ными в базальную часть клетки в область основания и ножки бокала.
Особенно большого развития достигает аппарат Гольджи (рис. 2, б).
Он представлен мощно развитой системой цистерн, располагающейся
в надъядерной области (по периферии основания бокала и непосредст-
венно над ядром). Его периферические цистерны резко уплощены, по на-
правлению к центру цистерны наполняются содержимым и приобретают
овальную форму. Далее к центру бокала наблюдается постепенный пере-
ход от этих цистерн к округлым секреторным гранулам. Последние за-
нимают основную часть цитоплазмы клеток. Шероховатая эндоплазмати-
ческая сеть, митохондрии и другие органоиды расположены в топком
периферическом слое цитоплазмы по стенке бокала и в суженном основа-
нии клеток.
Исследования с меченными тритием глюкозой и галактозой показали,
что появление меченых мукополисахаридов обнаруживается уже через
5 мин. после введения меченых предшественников в мембранах перифери-
ческих уплощенных цистерн аппарата Гольджи. Через 20 мин. наблюда-
ется перемещение этих цистерн с меченым секретом в область расположе-
ния центральных расширенных цистерн аппарата Гольджи и далее
(40 мин. — 1.5 часа) в область расположения секреторных вакуолей.
Через 4 часа меченые вакуоли перемещаются в апикальную часть клеток,
откуда их содержимое выводится в полость кишки.
Таким образом, авторадиографические данные показывают, что мемб-
раны аппарата Гольджи являются, по-видимому, теми структурами
клетки, где осуществляется синтез мукополисахаридов, составляющих ос-
новную часть слизистого секрета. Небольшое количество белков, входя-
щих в состав этого секрета, синтезируется на рибосомах, сосредоточенных
преимущественно в периферической цитоплазме и в стебельке или ножке
клеток (рис. 2, б, в). Объединение белков и мукополисахаридов секрета
происходит в вакуолях центральной части аппарата Гольджи. Здесь же
имеет место и присоединение неорганических соединений серы — проис-
ходит сульфатирование мукополисахаридов. В бокаловидных клетках
34
имеет место прямое превращение цистерн аппарата Гольджи в секретор-
ные гранулы. При этом в активно секретирующих клетках весь секретор-
ный цикл от момента начала синтеза секрета до оформления его в секре-
торные гранулы занимает всего 20—30 мин.
Рис. 2. Бокаловидные клетки в кишечном эпителии позвоночных. (Схема ультраструк-
турной организации из: Neutra, Leblond, 1966).
а — бокаловидные клетки кишечного эпителия аксолотля; б — схема строения бокаловидной клетки
кишечного эпителия млекопитающих; в — схема синтеза и внутриклеточного перемещения мукополи-
сахаридов и белков. Стрелками показано перемещение белков (тонкие) и мукопротеидов (жирная).
1 — ядро, 2 — секреторные вакуоли, 3 — шероховатая эндоплазматическая сеть, 4 — аппарат
Гольджи, 5 — митохондрия.
Описанный выше тип внутриклеточной морфобиохимической организа-
ции слизистой клетки характерен, по-видимому, с небольшими модифи-
кациями и для слизистых клеток других разновидностей эпителиальных
тканей у позвоночных и беспозвоночных животных. Детальный ультра-
структурный анализ бокаловидных слизистых клеток у планарий показал
3*
35
Рис. 3. Секреторная клетка
слюнной железы насекомого (а)
и схема ее ультраструктурной
организации (б). (По элек-
тронным фотографиям: Phil-
lips, Swift, 1965; рис. В. К. Чет-
верухина).
1 — микроворсинки, 2—4 — области
аппарата Гольджи и прилегающих
участков шероховатой эндоплазма-
тической сети, где происходит син-
тез и формирование электронно-
плотных (2), светлых (3) и фибрил-
лярных (эллипсоидных) (4) секре-
торных гранул. Стрелками пока-
зано внутриклеточное перемещение
трех синтезируемых клеткой разно-
видностей_секрета.
принципиальное сходство их внутренней организации с бокаловидными
слизистыми клетками позвоночных животных (Best et al., 1968).
Помимо одноклеточных слизистых желез, и в кожных, и в кишечных
эпителиях, особенно у более низкоорганизованпых и обитающих в водной
среде многоклеточных животных, имеются и другие одноклеточные же-
лезы, выделяющие белковый или сложный смешанный секрет. Принципы
морфобиохимической организации клеток таких желез рассмотрим па при-
мере малоклеточных и многоклеточных желез.
Малоклеточные железы. У многих высших первичноротых животных
широкое распространение имеют малоклеточные железы. Они пред-
ставляют собой уже систему, популяцию клеток, находящихся в струк-
турной и химической взаимосвязи и специализированных в разных
направлениях. Здесь имеются основные секреторные клетки и один или
несколько типов вспомогательных клеток, в частности клетки, выстилаю-
щие выводной проток железы. Весьма сложную дифференцировку имеют
секреторные клетки слюнных желез двукрылых насекомых. Интенсифи-
кация синтетической деятельности и увеличение необходимого для этого
запаса генетической информации достигается здесь путем многократной
эндорепродукции и формирования высокополиплоидных ядерпых аппа-
ратов с политенными хромосомами (рис. 3, а).
В цитоплазме клеток имеется хорошо развитый белоксинтезирующий
аппарат в виде цистерн шероховатой эндоплазматической сети. Здесь
обнаруживаются и многочисленные митохондрии, часть которых локали-
зована в области базальных складок плазматической мембраны. Аппарат
Гольджи представлен отдельными комплексами, рассредоточенными по
всей цитоплазме. На одном из представителей двукрылых (Sciara copro-
phila) выявлена интересная дифференцировка этого аппарата, а возможно,
и всей белоксинтезирующей системы клетки (Phillips, Swift, 1965). В се-
креторных клетках слюнных желез у этих животных удается обнаружить
три типа резко различающихся между собой секреторных гранул: округ-
лые гранулы с электроннопрозрачным содержимым; такие же по разме-
рам гранулы, но электронноплотные и, наконец, крупные эллипсоидные
гранулы, содержащие фибриллярный матрикс (рис. 3, б). Формирование
каждого из трех типов секреторных гранул происходит в области разных
комплексов Гольджи таким образом, что отдельные диктиосомы ответст-
венны за формирование лишь одного типа гранул. При этом в ходе раз-
вития личинки рассматриваемого насекомого количество вырабатываемых
светлых и темных грапул закономерно изменяется. Наряду с такими ярко
выраженными морфологическими признаками сложной дифференцировки
метаболического аппарата цитоплазмы удается выявить и морфологичес-
кие признаки активности структур ядерпого аппарата. Признаки такой
активности проявляются и в периодическом формировании выростов на-
ружной мембраны ядерной оболочки и в изменении степени спирализации
отдельных участков политенных хромосом. Секреторные клетки слюнных
желез насекомых обладают способностью к избирательному транспорту
через плазматическую мембрану разнообразных веществ из гемолимфы.
Широкое распространение у беспозвоночных животных имеют мало-
клеточные железы, продуцирующие смешанный мукопротеидпый секрет,
составные компоненты которого синтезируются отдельными узкоспециали-
зированными клетками. В качестве примера такой железы можно при-
вести туловищную железу у приапулид (рис. 4). Секреторные элементы
представлены двумя типами клеток — темными с резко базофильной плот-
ной цитоплазмой и светлыми с вакуолизованпой цитоплазмой (рис. 4, а).
Цитохимический и авторадиографический анализ этих клеток показал, что
в первом случае мы имеем дело с белоксинтезирующими клетками. Свет-
лые клетки, наоборот, характеризуются избирательным включением пред-
шественников синтеза кислых мукополисахаридов и относительно низким
уровнем белкового синтеза (рис. 4, б, в).
37
3
Рис. 4. Малоклеточная железа кутикулярного эпителия приапулиды Halicryptus spi-
nulosus. (Рис. О. В. Зайцевой).
а — схема строения железы, б, в — автографы через 24 часа после введения 3Н-глицина (б) и 358-суль-
фата натрия (в). 1 — центральный канал железы, 2 — мелкие клетки «пульпарного пространства»,
3 — отростки клеток пульпы, 4 — кутикулярный колпачок, 5 — полисахаридный и 6 — белковый
слои кутикулы, 7 — слой слизи, 8 — гиподермальные клетки, выстилающие железу, 9 — «светлые»
клетки, 10 — базофильные клетки, 11 — клетки гиподермы, 12 — базальная пластинка.
Многоклеточные железы
Многоклеточные железы особенно большое развитие получают у выс-
ших представителей вторичноротых животных, и в частности у млеко-
питающих. Поэтому некоторые общие закономерности дифференцировки
клеток и системной организации железистой ткани удобно будет разо-
брать на примере трех достаточно хорошо изученных в настоящее время
многоклеточных экзокриновых желез у млекопитающих животных: экзо-
криновой части поджелудочной железы, молочной железы и сальных же-
лез кожных покровов. Две первые железы относятся к так называемым
сложным многоклеточным железам, обладающим целой системой раз-
ветвленных выводных протоков. Их концевые разветвления заканчива-
ются секреторными отделами. Последние имеют вид альвеол или трубо-
чек, стенка которых выстлана эпителиальными секреторными клетками.
Поджелудочная железа. Концевые секреторные отделы поджелудоч-
ной железы имеют небольшой просвет. Их стенка образована плотно при-
мыкающими друг к другу конусовидными клетками (рис. 5, а). Ядра
клеток расположены в их нижней трети. Цитоплазма делится четко на
две зоны — апикальную зимогенную и базальную гомогенную зоны. Апи-
кальная часть клеток, содержащая гранулы секрета, окрашивается кис-
лыми красителями. Базальная гомогенная зона, наоборот, резко базо-
фильна. В ней сосредоточена основная часть гиалоплазмы и органоидов
клетки. Особенно мощного развития достигает здесь аппарат белкового
синтеза (рис. 5, б). Он представлен плотно упакованными цистернами
шероховатой эндоплазматической сети, занимающими всю базальную
часть клеток. К наружной поверхности мембран, образующих стенки ка-
налов и цистерн эндоплазматической сети, прикреплены многочисленные
рибосомы. В большом количестве обнаруживаются они и на наружной
мембране ядерной оболочки. Хорошо развит также в секреторных клетках
и аппарат Гольджи компактного типа. Его цистерны и вакуолярная
часть расположены в надъядерной области. В цитоплазме клеток имеются
многочисленные крупные митохондрии с хорошо развитыми кристами
(Пермяков и др., 1973; Герловип, 1974; Шубникова, 1974).
Секреторная клетка поджелудочной железы благодаря большой интен-
сивности процессов белкового синтеза представляет собою удобную модель
для анализа некоторых общих вопросов белкового синтеза и транспорта
белка. На этих клетках удалось показать наличие синтеза нескольких
разновидностей белков с резко различными скоростями их выведения из
клеток или скоростями обновления в клеточных структурах. Наряду со
специфическими секреторными белками, синтез и выведение из клетки
которых занимает около 1.5 час., здесь обнаруживается также быстро
метаболирующий белок, по-видимому, собственных ферментативных си-
стем и белок структурный, характеризующийся малой скоростью обнов-
ления. Проведено также комплексное исследование методами дифферен-
циального центрифугирования и электронномикроскопической авторадио-
графии синтеза и транспортировки секреторного белка в клетках па куль-
тивируемых in vitro срезах (Jamieson, Palade, 1967, 1971; Palade, 1975).
В этих работах показано, что сборка аминокислот, происходящая на рибо-
сомах эндоплазматической сети, занимает относительно непродолжитель-
ную часть секреторного цикла (около 3 мин.). Перемещение синтезиро-
ванного продукта в мелкие пузырьки аппарата Гольджи наблюдается уже
через 10 мин. после начала синтеза и резко затормаживается при наруше-
нии метаболизма жирных кислот. Последнее обстоятельство свидетельст-
вует, по-видимому, об активном участии в процессе внутриклеточного
транспорта секретируемого белка мембранных структур эндоплазмати-
ческой сети. Последующее превращение синтезируемого продукта и обра-
зование крупных конденсационных вакуолей занимает около 20 мин. Зре-
лые секреторные гранулы с меченым белком начинают в заметных коли-
39
Рис. 5. Секреторные клетки экзокриновой части поджелудочной железы млеко-
питающих.
а — концевой отдел железы, б — схема ультраструктурной организации секреторной клетки, в —
схема возможных путей синтеза, внутриклеточного перемещения и реутилизации секрета. 1 — ядро,
2 — гомогенная и 3 — зимогенная зоны цитоплазмы, 4 — шероховатая эндоплазматическая сеть,
5 — аппарат Гольджи, 6 — митохондрии, 7 — конденсационные вакуоли, 8 — мелкие пузырьки
аппарата Гольджи, 9 — лизосомы, 10 — поступление аминокислот, 11 — обычный, «мембранный»
путь выведения секрета, 12 — возможный путь выведения секрета — через гиалоплазму, 13 — воз-
можная аутофагия гранул секрета лизосомами.
чествах появляться через 1 час после введения меченого предшественника
белкового синтеза (рис. 5, в).
Методом дифференциального центрифугирования и последующим хи-
мическим анализом выделяемых фракций мембранных органоидов и мемб-
ран, окружающих секреторные гранулы, удалось показать резкие разли-
чия по белковому и липидному составу мембран эндо- и экзоплазматиче-
ского типа. Однако конкретные молекулярные механизмы структурного
и химического преобразования мембран в области аппарата Гольджи оста-
ются неясными. Показана известная автономность процессов синтеза
белка, начальных этапов его внутриклеточного транспорта и завершаю-
щих этапов выведения секрета из клеток. Последние процессы стимули-
руются при действии некоторых специфических химических агентов, ско-
рость синтеза и перемещения белка в область аппарата Гольджи остаются
при этом без существенных изменений. В составе секрета обнаружены и
сульфатированные мукополисахариды. Их синтез и сульфатация происхо-
дят па мембранах аппарата Гольджи (Berg, Young, 1971).
Синхронное развертывание всех этих процессов, не связанных между
собой жесткими причинно-следственными отношениями, возможно лишь
при наличии в клетке совершенных интегративных механизмов. В усло-
виях in vivo действие их, по-видимому, еще более сложное, так как име-
ются данные о наличии в клетках второго пути транспортировки секрета
без оформления его в секреторные гранулы, а также об участии лизосом-
пого аппарата в реутилизации избытка секреторных продуктов. Показано
также, что при длительной стимуляции процессов экскреции в поджелу-
дочной железе крыс происходит значительное ускорение внутриклеточ-
ного транспорта секрета (Bieger et al., 1976).
Секреторные клетки поджелудочной железы выделяют свой секрет по
мерокриновому типу, т. е. без разрушения апикальной части клетки и ее
плазматической мембраны. Процесс этот в рассматриваемых железах про-
исходит преимущественно путем экзоцитоза.
Своеобразие экзокринового отдела поджелудочной железы заключается
в сохранении у части секреторных клеток способности к авторепродукции.
Это проявляется, с одной стороны, в способности некоторых клеток
делиться митозом или переходить на эндомитотический путь удво-
ения генетического материала. Однако соматическая полиплоидизация
клеток захватывает лишь небольшую часть клеток и они не достигают
высоких степеней плоидности. Несмотря па малую скорость обновления
секреторных клеток в поджелудочной железе в нормальных условиях, ее
регенеративные потенции весьма велики. У белых крыс показано, что
после отравления этионином и гибели около 75% секреторных клеток их
восстановление происходит в течение недели, преимущественно за счет
интенсивного размножения и специфической дифференцировки клеток ко-
нечных отделов выводных протоков железы. Однако такая быстрая реге-
нерация этого эпителия может происходить только при сохранении це-
лостности соединительнотканной основы концевых отделов и выводных
протоков железы (Fitzgerald et al., 1966).
Молочная железа. Весьма характерной особенностью железистых
клеток молочной железы является мультифункциональный характер их
синтетической деятельности. Эти клетки секретируют и жир, и белки (ка-
зеин, лактоальбумины и лактоглобулины), и специфический углевод лак-
тозу, а также неорганические соединения. Большая часть сложных орга-
нических соединений синтезируется непосредственно клеткой. В связи
с такой мультифункциональной морфобиохимической дифференцировкой
в секреторных клетках сильно, хотя и в меньшей степени, чем в клетках
поджелудочной железы, развит аппарат белкового синтеза в виде шерохо-
ватой эндоплазматической сети (Kurosumi et al., 1968). В надъядерной
области располагается аппарат Гольджи. Имеется также и система цистерн
и каналов гладкой эндоплазматической сети. Цитоплазма клеток в опре-
41
деленные периоды секреторного цикла заполнена гранулами белкового
секрета. Синтез жира начинается в базальной части клеток (рис. 6). Жи-
ровые включения обнаруживаются вначале в виде небольшой капли.
В дальнейшем, по мере продвижения этой капли к апикальной поверх-
ности клетки, размеры ее сильно возрастают. К моменту выделения из
клетки она занимает большую часть апикальной зоны клетки. Выделение
жира происходит по так называемому апокриновому типу с отрывом части
цитоплазмы и плазматической мембраны апикальной поверхности клетки.
Выведение белковых продуктов осуществляется преимущественно путем
экзоцитоза. Апикальная поверхность клеток образует характерные паль-
цевидные выпячивания в просвет концевого отдела типа микроворсинок.
Рис. 6. Схема секреторного цикла в клетках молочной железы крысы. (Из: Киго-
sumi et al., 1968).
1 — эпителиально-мышечная клетка, 2 — капля жира, 3 — секреторная гранула с белковым секре-
том, 4 — ядро секреторной клетки, 5 —шероховатая эндоплазматическая сеть, 6 — аппарат Гольджи.
Они играют, по-видимому, существенную роль в процессах выведения
воды, лактозы и ионов Са.
Особенностью организации молочной железы является ее способность
к периодическим разрастаниям и инволюциям. Эти морфогенетические
процессы находятся под гормональным контролем организма, определяю-
щим скорость размножения клеток в период разрастания концевых отде-
лов железы и процессы их специфической дифференцировки. На молочной
железе грызунов удалось показать, что под гормональным контролем нахо-
дится такой важный период в подготовке клеток к делению, как период ре-
дупликации ДНК. В разрастающейся железе продолжительность его сокра-
щается с 21.5 до 8.2 часа. Кроме того, в условиях гормонального воздейст-
вия выравнивается гетерогенность популяции пролиферирующих клеток по
длительности этого периода цикла. В модельных опытах с зачатками молоч-
ной железы (в условиях in vitro) выявлена тесная связь и взаимообуслов-
ленность процессов специфического белкового синтеза и размножения кле-
ток (Stockdale, Topper, 1966). Синтез специфического для секреторных
клеток белка казеина может происходить только после того, как клетки
проделают несколько циклов репродукции. Помимо гормонального фак-
тора, большое значение в регуляции функциональной активности железы
и процессов ее инволюции имеют и внешние воздействия типа механи-
ческого растяжения концевых отделов железы выделяемым секретом.
В лактирующей железе при отсутствии оттока молока происходит пре-
кращение выработки секрета клетками. Они дегенерируют, а секрет и
42
продукты разрушения клеток утилизируются организмом без резко вы-
раженных воспалительных процессов.
Сальная железа. Сальная железа представляет собой железу с голо-
криновым типом секреции. Выводные протоки большинства сальных же-
лез в коже млекопитающих связаны с корневыми частями волос и разви-
ваются в гистогенезе как часть зачатка волоса. В сальных железах па
границе с соединительной тканью располагаются недифференцированные
клетки. Энергичное размножение этих клеток обеспечивает непрерывную
замену дифференцированных клеток, подвергающихся разрушению в цент-
ральной области мешковидного концевого отдела железы. Суть специфи-
ческой дифференцировки клеток заключается здесь, следовательно, в не-
прерывном и прогрессирующем накоплении в клетках жироподобпых
веществ вплоть до полного перерождения всей цитоплазмы и гибели кле-
ток. За счет продуктов распада таких перерожденных клеток образуется
секрет, который выводится в просвет выводного протока железы.
Этот не очень экономичный тип секреторного процесса имеет относи-
тельно широкое распространение среди многоклеточных животных. Голо-
криновый тип секреции характерен, в частности, для железистых клеток
кишечного эпителия отдельных представителей кишечнополостных и
насекомых.
ЭНДОКРИННЫЕ ЖЕЛЕЗЫ
Эпителиальные эндокринные железы позвоночных животных
Эпителиальные эндокринные железы позвоночных животных пред-
ставляют собой сложную и гетерогенную по происхождению систему же-
лез внутренней секреции. Они являются производными как кожного, так
и кишечного эпителиев. Имеются также железы, которые развиваются из
целомической выстилки и других производных мезодермального эпителия.
Характеристику эпителиальных эндокринных желез позвоночных жи-
вотных мы проведем на четырех различных по своему происхождению
железах внутренней секреции млекопитающих: эндокринной части под-
желудочной железы, щитовидной железе, корковом веществе надпочеч-
ников и аденогипофизе.
Эндокринная часть поджелудочной железы. Эта железа млекопитаю-
щих представляет собой типичный пример железистого эпителия, специа-
лизированного на выработку гормонов. Она состоит из тяжей железистых
клеток рассредоточенных в железистой ткани экзокриповой части железы
в виде отдельных островков, получивших название островков Лангер-
ганса. Каждый островок представляет собой взаимно переплетающиеся
тяжи эпителиальных клеток с окружающей их сильно разветвленной
сетью многочисленных капилляров (рис. 7). Последние выстланы эндо-
телием из резко уплощенных клеток с многочисленными порами, обеспе-
чивающими достаточно эффективное поступление гормонов в полость со-
судов. Большинство эпителиальных клеток содержит в своей цитоплазме
характерные секреторные гранулы.
По окраске гранул и ряду физико-химических свойств популяцию диф-
ференцированных секреторных клеток у млекопитающих принято делить
на три основных типа — А, В и D. При окраске азаном в клетках типа D
гранулы окрашиваются в голубой цвет, в то время как А-клетки имеют
красную цитоплазму, а В-клетки — оранжевую. Кроме того, секреторные
гранулы А-клеток не растворяются в 70°-м спирту, а все гранулы в цито-
плазме В-клеток вымываются спиртом. Что касается функционального
значения этих типов клеток, то до последнего времени имелись веские
морфологические и экспериментальные данные о том, что В-клетки вы-
деляют гормон инсулин, обеспечивающий снижение уровня глюкозы
43
в крови за счет превращения ее избытков в гликоген, что происходит
в клетках печени и мышцах. Клетки типа А выделяют гормон глюкагон,,
обеспечивающий превращение гликогена в глюкозу при снижении ее
уровня в крови.
Клетки типа D большинство исследователей считали старыми дегра-
дирующими формами клеток либо А-, либо В-типов. Помимо клеток, со-
держащих секреторные гранулы, были описаны клетки, лишенные этих
гранул, на основании чего их считали камбиальными элементами, способ-
ными к делению и дифференцировке в различных направлениях
(клетки типа С). Эти клетки обеспечивают медленное обновление
всей системы и поддержание ее в состоянии динамического равновесия.
Рис. 7. Участок железистой ткани эндокринной части поджелудочной железы обезьяны..
1 — В-клетки, 2 — А-клетки, 3 — D-клетки, 4 — сосуды.
Эти достаточно стройные и логичные дуалистические представления
о функциональном значении железистых клеток островков Лангерганса
оформились к концу 30-х — началу 40-х годов и удовлетворительно объяс-
няли многие факты по функциональной морфологии островкового аппа-
рата и его роли в норме и при патологических процессах.
Использование тонкого метода изучения морфологии секреторных гра-
нул — электронной микроскопии в сочетании с экспериментальными мето-
дами анализа в общем подтвердило представление о гетерогенности кле-
точного состава железистого эпителия островков (см. обзор: Fawcett et
al., 1969). Секреторные гранулы в разных типах клеток обнаруживают
существенные различия по своим размерам, строению окружающих их
мембран и соотношению электронноплотной центральной части гранулы
и светлого пространства между этой частью и окружающей секреторную
гранулу мембраной. Удалось также проследить и процессы выведения,
этих гранул из клеток в нормальных условиях и в условиях эксперимен-
тальной стимуляции секреции. Показано, что выведению гранул, содер-
жащих гормоны, предшествует увеличение поверхности плазматической
мембраны, образующей своеобразные микроворсинки. Окружающая гра-
нулу мембрана сливается с плазматической мембраной и в месте слияния
образуется отверстие, через которое содержимое гранулы выходит на-
ружу.
44
Более сложным представляется в настоящее время вопрос о класси-
фикации клеточных элементов железистого эпителия. Качественный и
количественный анализ ультраструктурной организации секреторных гра-
нул в порме и при экспериментальных воздействиях показал значительно
большую гетерогенность клеточного состава рассматриваемого железис-
того эпителия. Если В-клетки действительно представляют собой относи-
тельно однородную группу клеток, то среди А-клеток отчетливо выделя-
ются три разновидности, отличающиеся как по строению и размерам
гранул, так и по отношению к некоторым экспериментальным воздейст-
виям. Серьезные возражения вызывает также отнесение D-клеток к группе
деградирующих клеточных элементов. Наконец, у некоторых млеко-
питающих обнаружены еще два типа клеток, каждый из которых харак-
теризуется определенными особенностями ультраструктуры гранул.
Такая гетерогенность клеточного состава островков Лангерганса за-
трудняет дуалистическую трактовку гормональной активности железы.
В связи с этим делаются попытки показать более сложный спектр гормо-
нальных продуктов, выделяемых железистыми клетками. В частности,
есть данные о том, что они выделяют гормоны, регулирующие метаболизм
жиров, а также серотонин.
Несмотря па эти затруднения в анализе функционального значения
того или иного направления дифференцировки клеток, ясно, что эндо-
кринная часть поджелудочной железы представляет собой сложную муль-
тифупкциональную систему, источником развития различных клеток кото-
рой являются агранулярные клетки С. Последние способны к делению и
к дифференцировке в различные морфофункциональные типы клеток, со-
ставляющие железистую ткань островков Лангерганса.
Особенностью очень еще неясных регулятивных механизмов этой си-
стемы является ее отношение к усиленной функциональной нагрузке.
Свойственные другим тканевым системам широкие потенции к клеточной
и тканевой гипертрофии в системе железистого эпителия островков Лан-
герганса проявляются лишь в ограниченных пределах. При очень резких и
продолжительных воздействиях система исчерпывает эти потенции и под-
вергается деструктивным изменениям. Такие отношения особенно харак-
терны для В-клеток, которые при усиленной функциональной нагрузке
либо при неадекватном вмешательстве в регуляторные механизмы этой
системы, либо, наконец, при эндогенных нарушениях этих механизмов
подвергаются массовой деструкции. Это приводит к тяжелому и широко
распространенному заболеванию — диабету, суть которого заключается
в утрате способности организма регулировать уровень глюкозы в крови.
Щитовидная железа. Щитовидная железа по своему строению имеет
некоторое сходство с экзокриновыми железами. Она представляет собой
систему фолликулов, стенки которых образованы железистым эпите-
лием (рис. 8, а). В полости таких фолликулов находится коллоид, из
которого образуются гормоны тироксин и трииодтиронин. Основную часть
коллоида составляют полимеризованные молекулы тиреоглобулина. Они со-
стоят из сложных глюкопротеидов с большим молекулярным весом. Кроме
иодированных и обычных аминокислот, в состав молекулы входят глюк-
озамин, глюкоза, фукоза и манноза. Между фолликулами располагаются
тяжи эпителиальных клеток, не содержащих коллоида. Они носят назва-
ние интерфолликулярных островков.
Как и во всех железах внутренней секреции, в щитовидной железе
имеется разветвленная сеть капилляров, стенки которых непосредственно
контактируют с базальной мембраной железистого эпителия фолликулов.
В отличие от других желез внутренней секреции секреторные клетки
стенки фолликулов характеризуются резко выраженной полярностью
(рис. 8, б). В базальной части клеток наблюдаются выпячивания плазма-
тической мембраны и увеличенное количество митохондрий. На апикальной
поверхности, контактирующей с коллоидом, развиваются микроворсинки.
45
В апикальной цитоплазме сосредоточены многочисленные пузырьки, за-
полненные электронноплотным содержимым. Удается проследить связь
этих пузырьков с вакуолярной частью аппарата Гольджи, расположенного
в падъядерной области. Хорошо развита в клетках и эндоплазматическая
сеть, и в частности ее шероховатая разновидность. Имеются также и сво-
бодные рибосомы.
Синтез тиреоглобулина и формирование из него гормонов тироксина и
трииодтиронина представляют собой сложные многоступенчатые про-
цессы, основные звенья которых происходят в цитоплазме клеток фолли-
кулов и связаны с интенсивной работой анаболического и катаболического
аппаратов клеток. В клетках эпителия фолликулов происходит накопле-
ние иода, который относительно быстро выделяется в просвет фолликула
и включается в состав коллоида. Локализацию синтетических процессов и
внутриклеточный транспорт образующихся продуктов удается проследить
при использовании меченых предшественников (1321, 3Н-лейцин, 3Н-фу-
коза) и метода авторадиографии. Все эти процессы занимают несколько
часов и связаны с активной работой рибосом, эндоплазматической сети,
мембран аппарата Гольджи и апикальной цитоплазмы (Haddad et al.,
1971). Формирование сложного гликопротеидного комплекса, в состав
которого входят иодированные аминокислоты и различные мопосахара,
завершается в апикальных ограниченных мембранами пузырьках. Отсюда
коллоид путем экзоцитоза выводится в просвет фолликула.
Менее изучены цитологические механизмы резорбции коллоида, обра-
зования гормонов и транспортировки их в капиллярную сеть. Биохими-
ческая сущность этих процессов заключается в гидролизе тиреоглобулина.
Процессы эти происходят, по-видимому, также в цитоплазме клеток. По-
ступление коллоида в клетку происходит при помощи механизма пино-
и фагоцитоза. Существенную роль в процессах гидролиза белковой части
коллоида играет, по-видимому, лизосомный аппарат клеток (рис. 8, б).
Клетки эпителия фолликулов щитовидной железы представляют собой
весьма сложные системы, обеспечивающие и синтез макромолекул тирео-
глобулина, и их последующее специфическое расщепление. Более подроб-
ные сведения о морфобиохимической организации этих клеток и варьиро-
вании их структуры у позвоночных животных содержатся в специальных
обзорах (Fujita, 1974; Pantic, 1974).
Гормоны щитовидной железы тироксин и трииодтиронин, а также об-
разующиеся из них в результате окислительного дезаминирования конеч-
ные активные продукты действуют на ферментативные системы, локали-
зованные в митохондриях. В связи с этим щитовидная железа регулирует
общий энергетический обмен во многих тканях.
Эпителий щитовидной железы в отличие от эпителия островков Лангер-
ганса обладает большими потенциями к регенерации и гипертрофии. Эти
процессы находятся под прямым гормональным контролем и прежде всего
под влиянием тиреотропного гормона аденогипофиза. У человека потен-
ции эпителия щитовидной железы к увеличению количества железистой
ткани за счет интенсивной репродукции клеток особенно отчетливо
проявляются в патологических условиях. При отсутствии в диете достаточ-
ного количества иода естественно падает и количество выделяемого щито-
видной железой ипкрета. Это вызывает усиленную продукцию тиреотроп-
ного гормона аденогипофизом, что обусловливает стимуляцию как выве-
дения гормона, так и пролиферации клеток эпителия щитовидной железы.
В результате происходит увеличение в несколько раз объема железистой
ткани.
Железистый эпителий щитовидной железы часто образует доброка-
чественные и злокачественные разрастания. Их возникновение связано,
с одной стороны, с наличием больших потенций железистой ткани
к усиленной репродукции клеток, а с другой — с возможностью наруше-
ния гормонального баланса и системных механизмов, регулирующих нор-
46
Рис. 8. Участок железистой ткани щитовидной железы млекопитающего и схема ультра-
структурной организации секреторной клетки. (Рис. В. К. Четверухина).
а — фолликулы щитовидной железы, б — схема ультраструктурной организации клетки фолликула.
1 — коллоид, 2 — секреторные клетки, 3 — шероховатая эндоплазматическая сеть, 4 — аппарат
Гольджи, 5 — ядро, 6 — пузырьки с синтезированным коллоидом, 7 — пузырьки с резорбированным
коллоидом, поступающим в клетку путем пиноцитоза, 8 — лизосомы. Стрелки слева показывают
места синтеза и внутриклеточного перемещения коллоида при его выделении в полость фолликула,
стрелки справа — поступление (резорбцию) и превращение коллоида в клетке при выделении гор-
монов.
мальные взаимоотношения между процессами репродукции и дифферен-
цировки клеток.
Корковое вещество надпочечника. Корковое вещество надпочечника
млекопитающих может служить примером эндокринной железы мезодер-
мального происхождения. Эта железистая ткань является производной
целомической выстилки, и для нее характерно наличие структурной про-
странственной организации основных компонентов — тяжей эпителиальных
железистых клеток. Все корковое вещество надпочечника состоит из та-
ких эпителиальных тяжей, расположенных перпендикулярно к ограничен-
ной соединительнотканной капсулой поверхности органа. Соответственно
этому ориентирована сеть капилляров, которые со всех сторон окружают
тяжи железистых клеток. Расположение клеток в тяжах и их морфобио-
химическая дифференцировка неодинаковы в разных зонах коркового ве-
щества надпочечника (рис. 9). Под капсулой располагаются начальные
участки тяжей, образованные относительно мелкими клетками с темными
ядрами и умеренным количеством липидных включений в цитоплазме.
Совокупность начальных участков тяжей образует так называемую клу-
бочковую зону надпочечника (рис. 9, а, б). Ее железистые клетки выде-
ляют в основном гормон альдостерон, который регулирует солевой обмен.
Следующая наибольшая по толщине зона коркового вещества надпочеч-
ника образована средними участками тяжей эпителиальных клеток и полу-
чила название пучковой зоны (рис. 9, в, г). Она состоит из более крупных
клеток с относительно светлой оксифильной цитоплазмой и более светлыми,
чем у клеток клубочковой зоны, ядрами. В состоянии умеренной функцио-
нальной активности в цитоплазме клеток обнаруживаются в большом ко-
личестве мелкие липидные гранулы, содержащие холестерин, из которого
образуется кортизон — основной гормон клеток этой зоны. Выделение
гормонов стимулируется особым аденокортикотропным гормоном адено-
гипофиза. Гормоны пучковой зоны регулируют белковый и углеводный
обмены, а также тормозят размножение клеток и формирование основного
вещества в соединительной ткани, развитие воспалительной реакции и
процессы образования антител.
Железистые клетки пучковой зоны представляют собой лабильные
клеточные системы. При умеренной продукции гормонов в цитоплазме,
как указывалось выше, содержится много мелких липидных включений.
При стимуляции железистой функции размеры клеток, ядер и ядрышек
увеличиваются. Судьба липидных гранул при такой гипертрофии клеток
может быть различной. Они могут полностью исчезать. При более сильной
стимуляции количество их увеличивается по сравнению с нормой, но раз-
меры становятся меньшими. Такая динамика изменений липидных вклю-
чений свидетельствует о том, что они представляют собой, как и коллоид
щитовидной железы, не готовый гормон, а лишь резервный полупродукт,
из которого образуются уже гормоны. Локализация отдельных этапов син-
теза гормонов в клетках выяснена еще недостаточно полно. Показаны
лишь локализация ряда ферментов в мембранах эндоплазматической сети
и митохондрий и тесное взаимодействие этих органоидов и липидных ва-
куолей в синтезирующих гормоны клетках. Нет полной ясности в меха-
низмах выведения гормонов из клеток. Одним из последних предположе-
ний по этому поводу является представление о том, что липидные вакуоли
представляют собой не только место сосредоточения предшественников
кортикостероидов, но и принимают непосредственное участие в процессах
выведения гормонов из клеток.
Особенностью конечных участков эпителиальных тяжей коркового ве-
щества надпочечников, его так называемой сетчатой зоны, является нали-
чие анастомозов между соседними тяжами. Железистые клетки этой зоны
меньше по размерам, количество липидных включений в них минимально,
цитоплазма и ядра окрашиваются наиболее интенсивно (рис. 9, д, е). В ци-
топлазме часто содержатся гранулы липофусцина. Предполагают, что же-
48
Рис. 9. Корковое вещество надпочечников млекопитающих. (По электронным микро-
фотографиям: Rhodin, 1971; рис. В. К. Четверухина).
In
а, б — клубочковая, в, г — пучковая, д, е — се чатая зоны коркового вещества надпочечника. 1 —
ядро, 2 — митохондрия, з — липидные капли, 4 — гранулы гликогена, 5 — полость капилляра,
G — клетка эндотелия.
4 А. А. Заварзин
лезистые клетки сетчатой зоны могут выделять андрогены и другие поло-
вые гормоны.
Таким образом, корковое вещество надпочечника представляет собой
в функциональном отношении сложную железу внутренней секреции с от-
четливой функциональной и морфобиохимической дифференцировкой об-
разующих ее клеточных элементов. В пей наблюдается четкое пространст-
венное разграничение расположения клеток разной функциональной
специализации. Тем не менее гистогенетические взаимоотношения между
различными типами клеток, расположенными в разных зонах коркового ве-
щества, остаются неясными. Каждый эпителиальный тяж с его тремя зо-
нами представляет собой обновляющуюся субпопуляцию клеток. Митозы
и меченные 3Н-тимидином ядра наблюдаются во всех трех зонах, макси-
мальное их количество в клетках клубочковой зоны, а минимальное —
в клетках сетчатой. Отчетливый градиент распределения пролиферирую-
щих клеток обнаруживается и в пределах каждой зоны. Количество мито-
зов и меченных 3Н-тимидином ядер всегда больше в проксимальных
участках и меньше в глубже лежащих участках данной зоны. В длитель-
ных опытах с 3Н-тимидином удается наблюдать в каждой зоне тяжа пере-
мещение меченых клеток из проксимальных участков в дистально распо-
ложенные участки.
На основании этих опытов, а также приведенных выше данных по
функциональному значению отдельных зон коркового вещества надпочеч-
ника можно высказать предположение, что каждый тяж состоит из трех
относительно автономных самоподдерживающихся обновляющихся субпо-
пуляций клеток. Различия в пролиферативной активности между клетками
каждой зоны обусловливаются с этой точки зрения разной скоростью об-
новления.
С другой стороны, не исключена возможность и более сложной органи-
зации железистой ткани коркового вещества надпочечника. Можно пред-
положить, что в течение своего жизненного цикла клетки тяжей проходят
три последовательных этапа функциональной морфобиохимической диф-
ференцировки. На первом этапе клетки, находясь в начальных участках тя-
жей, выделяют альдостерон, на втором этапе, перемещаясь в пучковую
зону, они начинают вырабатывать кортизон и, наконец, в конце жизненного
цикла клетки перемещаются в сетчатую зону, где начинают вырабаты-
вать третий тип гормонов. С этой точки зрения в клубочковой зоне должен
находиться запас малодифференцированных камбиальных стволовых кле-
ток, размножение которых обеспечивает возможность существования всей
системы на основе динамического равновесия между количеством отми-
рающих и количеством образующихся в результате деления новых клеток.
Характеристика современного состояния вопроса о закономерностях си-
стемной организации и морфобиохимической дифференцировки клеток
коркового вещества надпочечника содержится в специальных работах и
обзорах (Idelman, 1970; Rhodin, 1971; Fujita, 1972).
Аденогипофиз. Аденогипофиз занимает особое положение в системе
желез внутренней секреции у позвоночных животных. С одной стороны,
железистые клетки аденогипофиза выделяют гормоны, регулирующие
деятельность других желез внутренней секреции: кортикотропный,
тиреотропный, гонадотропный гормоны. В связи с этим аденогипофиз яв-
ляется как бы центральной железой внутренней секреции, деятельность
которой обеспечивает гуморальную регуляцию всей системы желез внут-
ренней секреции. С другой стороны, аденогипофиз связан с нейрогипо-
физом, представляющим собой скопление терминальных разветвлений ак-
сонов специальных нейросекреторных клеток.
Аденогипофиз в эмбриогенезе развивается из зачатка кожного эпи-
телия, выстилающего дорсальную стенку ротовой полости. В морфологи-
ческом отношении основная его часть — дистальная зона — имеет строе-
ние типичной железы внутренней секреции. Железистая ткань представ-
50
Рис. 10. Аденогипофиз млекопитающих. (По электронным микрофотографиям: Foster,
1971; рис. В. К. Четверухина).
а — участок железистой ткани, б — схема ультраструктурной организации клеток различной
функциональной специализации. 1 — соматотропная, 2 — гонадотропная, 3 — тиреотропные,
4 — пролактиновая клетки, 5 — клетки эндотелия.
лепа здесь системой обилыю васкуляризованных тяжей эпителиальных
клеток (рис. 10, а). Особенностью железистой ткани аденогипофиза яв-
ляется большая гетерогенность клеточного состава. Опа обусловлена раз-
личной функциональной специализацией клеток и в связи с этим осо-
бенностями их морфобиохимической дифференцировки. Эти особенности
отчетливо выявляются при цитохимическом и ультраструктурном анализе
клеток. Удается выделить три главных типа клеток: оксифильные, базо-
фильные и хромофобные клетки. Каждый из этих типов клеток в свою
очередь подразделяется еще на ряд разновидностей, количество которых
варьирует (от 7 до 9 типов клеток, по данным разных авторов). Функцио-
нальное значение некоторых типов клеток, вырабатывающих разные
гормоны, установлено достаточно точно (Foster, 1971).
На ультраструктурном уровне клетки аденогипофиза различаются
главным образом по размерам секреторных гранул (рис. 10, б). Установ-
лено, что наиболее крупные гранулы (4200—5000 А) характерны для про-
лактиновых клеток, наиболее мелкие — для кортикотропных и тиреотроп-
ных клеток (1000—2000 А). Последние отличаются между собой по форме
каналов эндоплазматической сети (более вытянутые — у кортикотроп-
ных клеток) и количеством свободных рибосом (большим у тиреотропных
клеток). Для гонадотропных клеток характерны размеры гранул в 2000—
2500 А, а для соматотропных — 3500—4000 А.
Камбиальными клеточными элементами в аденогипофизе являются, по-
видимому, малодифференцированные хромофобные клетки. Однако кон-
кретные механизмы регуляции численного состава отдельных субпопуля-
ций железистой ткани, а также сдвигов соотношения этих клеток при
изменениях функционального состояния организма остаются еще в зна-
чительной мере неясными.
Эпителиальные эндокринные железы
беспозвоночных животных
Эпителиальные эндокринные железы, аналогичные по своему биологи-
ческому значению железам внутренней секреции позвоночных животных,
обнаружены в настоящее время лишь у высших первичноротых живот-
ных (насекомых, ракообразных, головоногих моллюсков) и у оболочников
(Gersch, 1964; Tombes, 1970; Киршенблат, 1971). Тем не менее нельзя
исключить возможность существования специальных железистых эпите-
лиальных клеток, выделяющих гормоны, в тканях других беспозвоночных
животных. Возможно, что отсутствие сведений о таких клетках обуслов-
лено лишь их диффузным распределением в тканях и отсутствием адек-
ватных цитохимических и биохимических методов для выявления их ло-
кализации и путей распространения выделяемых этими клетками биоло-
гически активных соединений. Гормональная регуляция углеводного
обмена у ряда групп беспозвоночных животных показана в последнее
время биохимическими методами.
У оболочников своеобразными железами внутренней секреции явля-
ются эндостиль и субневральная железа. Эндостиль представляет собой
продольный желобок на брюшной стороне глотки. Он выстлан ресничным
и железистым эпителием и служит в основном для перемещения склеен-
ных слизью пищевых комочков по направлению к пищеводу. Однако ав-
торадиографические исследования с 1311 показали, что в эпителиальной
выстилке эндостиля имеются участки, образованные клетками, избира-
тельно захватывающими иод и связывающими его с аминокислотами. Эти
клетки образуют специфические гормоны — тироксин и трииодтиропин.
Аналогичные клетки имеются в эндостиле ланцетника. Гомологом адено-
гипофиза у оболочников является, по мнению многих исследователей,
так называемая субневральная железа. Она вырабатывает вещество, близ-
52
кое по своим свойствам гормону аденогипофиза позвоночных, действую-
щему на пигментные клетки. Клетки субневральной железы синтези-
руют и выделяют своеобразные гонадотропные гормоны в ответ на непо-
средственную химическую стимуляцию их половыми продуктами данного
вида.
Если у вторичноротых беспозвоночных животных, в частности у обо-
лочников, имеются эпителиальные эндокринные железы, в известной мере
гомологичные соответствующим железам позвоночных животных, то у выс-
ших первичноротых животных в этом отношении наблюдается лишь
глубокая биологическая аналогия. Эпителиальные эндокринные железы
насекомых, ракообразных и головоногих моллюсков возникают в связи
с общим усложнением организации этих животных и необходимостью
обеспечения более совершенной гуморальной их интеграции. У высших
моллюсков и отдельных классов членистоногих эндокринные железы отно-
сительно разнообразны.
У головоногих моллюсков эпителиальные эндокринные железы пред-
ставлены оптическими и перикардиальными железами. Кроме того,
гормональная активность обнаружена и у клеток задней пары слюнных
желез. Оптические железы — это шаровидные образования, расположен-
ные в дистальной части глазных стебельков. Они состоят из эпителиаль-
ных железистых и соединительнотканных клеток. Эпителиальные клетки
вырабатывают гонадотропный гормон, стимулирующий рост половых
желез и откладку яиц. Перикардиальные железы представляют собой
систему выстланных железистым эпителием каналов. Удаление этих же-
лез вызывает на 4-й день гибель животных. Характер выделяемых этой
железой гормонов и их функциональное значение остаются пока не-
ясными.
Слюнные железы у головоногих моллюсков представляют собой типич-
ные экзокриновые железы. Однако, как и у млекопитающих, они не только
выделяют секрет в полость начальных отделов пищеварительного тракта,
но и продуцируют гормоны в обильно разветвленную сеть капилляров и
лакун в прослойках соединительной ткани. Гормоны, выделяемые желе-
зистыми клетками слюнных желез у головоногих моллюсков (норадрена-
лин и серотонин), регулируют деятельность пигментных клеток и, в част-
ности, оказывают влияние на сокращение мышечных клеток, обеспечи-
вающих изменение размеров меланофоров.
У ракообразных эндокринные железы представлены Y-органами и ан-
дрогенными железами. Y-органы являются видоизмененными метанефри-
диями головных сегментов. Они локализованы у низших раков в первом
антеннальном, а у высших раков — во втором максиллярном сегментах.
Y-орган может иметь листовидную, коническую или чечевицеобразную
форму и состоит из эпителиальных железистых клеток, цитоплазма кото-
рых богата РНК и щелочной фосфатазой и бедна гликогеном и липидами.
Гормон Y-органа регулирует обмен веществ. Он представляет собой, по-
видимому, разновидность гормона линьки членистоногих — экдизона.
В связи с этим Y-органы предложено называть экдизальными железами;
основной их функцией является регуляция процессов линьки (Herman,
1967). Кроме того, гормон или гормоны экдизальных желез ракообразных
регулируют обмен веществ и стимулируют созревание гонад. Андрогенные
железы ракообразных имеют, по-видимому, так же как и экдизальпые
железы, мезодермальное происхождение. Они развиваются из стенки вы-
водного протока половой железы и располагаются либо на его поверх-
ности, либо погружены в ткань половой железы. Гормоны этих желез
стимулируют развитие семенников и мужских вторичных половых при-
знаков.
У насекомых наиболее хорошо изучены и имеют наибольшее значение
две железы внутренней секреции эпителиальной природы — прилежащие
тела и экдизальные железы, которые известны под различными назва-
53
пиями (перикардиальные, проторакальные, вентральные, перитрахеаль-
ные и др.). Прилежащие тела, как и аденогипофиз позвоночных, имеют
эктодермальное происхождение, а экдизальные железы аналогичны кор-
ковому веществу надпочечников, поскольку они являются производными
либо целомического эпителия, либо мезодермальной части краниальных
метанефридиев. При этом, несмотря на общность источников развития
Рис. 11. Эпителиальные эндокринные железы насекомых. (Из: Кинд, 1968).
а — прилежащие тела (Corpora allata) справа и околосердечное тело (Corpora cardiaca) слева;
б—четыре полиплоидные клетки экдизальной (проторакальной) железы.
аденогипофиза и прилежащих тел, с одной стороны, и коркового вещества
надпочечника и экдизальных желез — с другой, это не гомологичные
образования, поскольку они возникают независимо у высших первично-
и вторичноротых животных.
Эндокринные эпителиальные железы насекомых, несмотря на их раз-
личное происхождение и функциональное значение, построены по одному
принципу (рис. 11). Это скопления большего или меньшего количества
клеток, омываемых гемолимфой и обильно снабжаемых кислородом за
54
Рис. 12. Морфологические изменения железистой ткани прилежащего тела (Corpora allata) в ходе развития насекомых. £(Из:;Негтап, 1967).’
а — у стрекозы Aeschna суапеа, б — на 4 стадиях личиночного цикла у палочника Bacillus rossii. 1 — неактивное, 2 — активное и 3 — деструктивное состояния
железы у поздних личинок (7, 2) и взрослых стрекоз (з); 4 — два дня, 5 — шесть дней, 6 — одиннадцать дней после линьки и 7 — два дпя перед линькой у личинки
палочника.
счет развитой в области этих желез трахейной системы. Прилежащие
тела и экдизальные железы насекомых связаны с нервной системой.
У многих насекомых среди эпителиальных железистых клеток обнару-
Рис. 13. Схема ультраструктурной организации клеток прилежащего тела насекомых
при активном (а) и неактивном (б) состояниях железы. (По электронным микрофото-
графиям: Scharrer, 1965; рис. В. К. Четверухина).
1 — ядро, 2 — шероховатая эндоплазматическая сеть, 3 — митохондрия, 4 — лизосома, 5 — десмо-
сома.
жены окончания нейросекреторных клеток. В ряде случаев показана
строгая корреляция между активностью клеток эндокринных желез и по-
явлением и исчезновением гранул нейросекрета в этих окончаниях. Та-
56
ким образом, здесь наблюдаются отношения, аналогичные отношениям
в аденогипофизе позвоночных животных.
Для эндокринных эпителиальных желез насекомых характерна слож-
ная динамика периодических циклических изменений железистой ткани,
Рис. 14. Схема ультраструктурной организации клеток экдизальной железы насекомых.
(По электронным микрофотографиям: Herman, 1967; рис. В. К. Четверухина).
1 — оболочка железы, 2 — аксон нервной клетки, 3, 4 — аксоны нейросекреторных клеток с круп-
ными и мелкими секреторными гранулами, 5 — гранулы гликогена, 6 — липидная капля, 7 — секре-
торная вакуоль, 8 — аутофагическая вакуоль, 9 — лизосома, 10 — межклеточная лакуна, 11 —
периферическая лакуна, 12—14 — стадии трансформации митохондрий.
связанных с линькой. В качестве примера таких изменений можно при-
вести отношения, наблюдаемые в экдизальных железах при развитии стре-
козы Aeschna суапеа и при циклических изменениях во время линьки
у палочника Bacillus rossii (рис. 12).
57
В экдизальных железах развивающегося Antherea polyphemus (Lepi-
doptera) период слабого включения 3Н-уридина сменяется периодом его
интенсивного включения в ядерную РНК, который продолжается в тече-
ние двух суток. В дальнейшем интенсивность включения 3Н-уридина
в ядра снова резко падает. Такая динамика изменений интенсивности син-
теза РНК коррелирует с секреторной активностью железистых клеток.
Примером резких различий в ультраструктурной организации железистых
клеток эндокринных желез в активные периоды и в периоды покоя могут
служить железистые клетки прилежащих тел у перепончатокрылых
(рис. 13). В клетках покоящейся железы уменьшается количество цито-
плазмы, а также абсолютное и относительное количество в ней мембран-
ных органоидов.
Гормоны, выделяемые прилежащими телами, регулируют такие важ-
ные процессы, как метаморфоз, линька и связанные с ними существенные
изменения процессов метаболизма в организме и отдельных тканях и ор-
ганах. Железистые клетки прилежащих тел выделяют так называемый
ювенильный гормон, тормозящий наступление половой зрелости и регу-
лирующий метаморфоз. Экдизальная железа, по-видимому, вырабатывает
гормон линьки экдизон, который сходен по своей химической природе со
стероидными гормонами надпочечника. В связи с этим в ультраструктур-
ной организации секреторных клеток экдизальных желез удается выя-
вить некоторые сходные черты с организацией железистых клеток коры
надпочечника (рис. 14). Гормоны экдизальных желез растворяются в ли-
пидах и выделяются вместе с липидными вакуолями. Возможно, что в син-
тезе гормонов принимают участие митохондрии. Однако клетки насеко-
мых не способны синтезировать холестерин — предшественник стероидных
гормонов. Поэтому гладкая эндоплазматическая сеть в клетках экдизаль-
ных желез не получает большого развития. В связи с ярко выраженной
цикличностью в секреторной активности железистых клеток в опре-
деленные периоды жизненного цикла в клетках формируются многочис-
ленные лизосомы. Большого развития может в определенные периоды до-
стигать и шероховатая эндоплазматическая сеть.
В экдизальных железах высших насекомых имеются специальные
приспособления для увеличения поверхности плазматической мембраны
клеток и транспортировки выделяемых клетками продуктов в гемолимфу.
Весьма сложные и многообразные отношения наблюдаются в эндокрин-
ных железах насекомых между синтезом ДНК, репродукцией клеток и
гетеросинтетической активностью. Здесь широко распространены явле-
ния соматической полиплоидизации. Репродукция и дегенерация клеток
эндокринных желез связаны не с процессами физиологической регенера-
ции, а обусловливаются циклическими изменениями в функциональной
активности желез.
Химическая природа гормонов и механизм действия последних у насе-
комых, а также взаимоотношения желез друг с другом, с органами-мише-
нями и с нервной системой изучены менее детально, чем у позвоночных
животных. Весьма вероятно, что в настоящее время известны далеко не
все железы внутренней секреции насекомых, а секреторная активность
известных эпителиальных желез значительно более сложна и многооб-
разна. Тем не менее даже имеющиеся сейчас данные свидетельствуют
о наличии у насекомых сложной дифференцированной системы желез
внутренней секреции, имеющей большое значение в гуморальной инте-
грации процессов метаболизма у высших первичноротых животных.
ЗАКЛЮЧЕНИЕ
По мере углубления наших знаний относительно железистых эпите-
лиев становится ясным, что все многообразие специфической дифферен-
цировки секреторных клеток базируется на соответствующих модифика-
58
циях общего для всех клеток метаболического аппарата цитоплазмы.
Естественно поэтому, что изучение морфобиохимической организации же-
лезистых клеток имеет не только специальное, но и общее значение. На
примере специализированных железистых клеток удается более четко
выявить взаимоотношения органоидов цитоплазмы, источники и меха-
низмы формирования отдельных органоидов, полнее изучить процесс
внутриклеточной регуляции и интеграции.
Особенно наглядно значение таких исследований в аспекте разработки
общецитологических проблем выступает на примере анализа секреторных
клеток экзокриновой части поджелудочной железы, слизистых бокаловид-
ных клеток, клеток фолликулов щитовидной железы и коркового вещества
надпочечников. Во всех этих секреторных клетках мы не обнаруживаем
каких-либо специальных органоидов. Однако в одном случае имеет место
резкая гипертрофия белоксинтезирующего аппарата (поджелудочная же-
леза), в другом — аппарата синтеза мукополисахаридов (слизистые клет-
ки). Для клеток щитовидной железы и коркового вещества надпочечни-
ков характерен единый принцип многоступенчатого накопления полупро-
дукта во внутриклеточной или внеклеточной модификациях. Детальный
анализ развертывающихся в клеточных структурах биохимических про-
цессов показывает сложный характер их регуляции и позволяет присту-
пить уже к анализу элементарных механизмов внутриклеточной регуля-
ции. В этом отношении большой интерес представляет обнаруженная на
клетках поджелудочной железы относительная автономность процессов
синтеза, транспортировки и выведения секрета. Возможность разобщения
этих процессов и отсутствие жесткой причинно-следственной зависимости
свидетельствуют, с одной стороны, о пластичности организации биохими-
ческих процессов, а с другой — о наличии совершенных интегративных
механизмов. Значение внутриклеточной интеграции весьма наглядно вы-
ступает и па примере клеток щитовидной железы, сложная многоступен-
чатая двусторонняя анаболическая и катаболическая деятельность кото-
рых невозможна без таких механизмов. Большое общее значение для
понимания пластичности и функционально-биохимической взаимосвязи
органоидов имеют данные по быстрому обновлению цистерн аппарата
Гольджи в бокаловидных клетках и данные по морфобиохимическому
взаимодействию митохондрий, мембран гладкой эндоплазматической сети
и липидных включений в клетках коры надпочечника. Весьма удобным
объектом для анализа общего вопроса об источниках и механизмах фор-
мирования лизосом могут служить экдизальные железы некоторых на-
секомых.
Таким образом, можно заключить, что по мере разработки чисто ци-
тологических аспектов дифференцировки железистых эпителиев, связан-
ных с детализацией функционального значения отдельных желез, сущест-
венный прогресс наблюдается и в понимании общих закономерностей
клеточной организации. Не меньшее значение для общей цитологии дол-
жен иметь и систематический анализ сходных в функциональном или
биохимическом отношениях желез у далеко отстоящих в филогенетиче-
ском отношении групп животных. К сожалению, это направление срав-
нительно-цитологических исследований железистых эпителиев развива-
ется недостаточно интенсивно. Даже такая универсальная дифференци-
ровка, как бокаловидные слизистые клетки, наиболее детально изучена
у млекопитающих и почти не исследована морфобиохимическими мето-
дами у других групп многоклеточных животных.
Несколько лучше обстоит дело с изучением белоксинтезирующих же-
лез. Специальный анализ авторадиографических и биохимических данных
по динамике синтеза и внутриклеточного транспорта белка в секреторных
клетках поджелудочной железы и в белковых железах членистоногих по-
казал глубокое сходство основных закономерностей этих процессов (Kafa-
tos, Kiortsis, 1971; Tobe, Davey, 1974).
59
Перспективность такого рода широкого сравнительно-цитологического
подхода проявляется и при сопоставлении ультраструктурной организа-
ции и процессов метаболизма в секреторных клетках растительных и
животных организмов (Васильев, 1970). Несмотря на принципиальные
различия в организации растительных и животных клеток и длительный
путь независимого эволюционного усложнения в растительных секретор-
ных клетках, секретирующих терпеноиды, имеется много общих черт
ультраструктурной организации с животными клетками, синтезирующими
стероиды. Сходство в организации рассматриваемых клеток обусловлива-
ется сходством начальных этапов биосинтеза этих специфических продук-
тов. Еще более ярким примером в этом отношении является сходство
в ультраструктуре, динамике синтеза и перемещении белка в клетках, син-
тезирующих ферменты у насекомоядных растений и экзокриновой части
поджелудочной железы (Schwab et al., 1969). С другой стороны, у насе-
комых имеются железы, образующие гормоны, близкие в химическом от-
ношении к растительным терпенам. По своей ультраструктурной орга-
низации секреторные клетки этих желез сходны с клетками растений,
синтезирующими терпены (Нарр et al., 1966).
Очевидно, что в основе этих глубоких биологических аналогий
лежит и сходство биохимических процессов, протекающих в клеточных
системах. Во всех перечисленных выше работах основное внимание уде-
ляется признакам сходства рассматриваемых систем. Однако не меньший
интерес представляют и специфические особенности проявления этих об-
щих признаков в клетках отдаленных в филогенетическом отношении ор-
ганизмов. Для выявления этой специфики необходимы детальные разно-
сторонние исследования аналогичных клеток. В настоящее время в боль-
шинстве случаев такие исследования еще отсутствуют.
В основе отмеченного выше разнообразия железистых эпителиальных
тканей животных лежат несомненно глубокие исторические причины. Воз-
никновение процесса секреции базируется на одном из фундаментальных
и первичных свойств живой протоплазмы — необходимости непрерывного
обмена веществ между окружающей средой и клеткой. В пограничных
тканях многоклеточных животных выделение продуктов метаболизма про-
исходило и во внешнюю для организма среду, и в подлежащую парен-
химу. Соответственно этому и возникло два основных направления желе-
зистой дифференцировки — экзокриновые и эндокринные железы. Однако
у низших многоклеточных с их относительно простым уровнем организа-
ции нет необходимости развития специальных оформленных эпителиаль-
ных эндокринных желез. Для гуморальной интеграции организма здесь
достаточным является наличие специальной нейроэндокринной системы и,
возможно, небольшого количества диффузно расположенных железистых
клеток различного происхождения. Лишь с повышением уровня организа-
ции животных возникает необходимость формирования специальной си-
стемы эпителиальных эндокринных желез в дополнение к более древним
по происхождению нервной и нейроэндокринной интегрирующим систе-
мам организма.
Весьма примечательным является тот факт, что возникновение такой
системы эпителиальных эндокринных желез произошло независимо у трех
групп животных: позвоночных, головоногих моллюсков и высших члени-
стоногих. При этом сложность организации системы таких желез и их
удельное значение в регуляции важнейших функций организма оказы-
вается в прямой зависимости от сложности и высоты организации живот-
ных. Наибольшей степени филогенетической дифференцировки достигают
эпителиальные эндокринные железы у высших позвоночных и у насе-
комых. В пределах позвоночных и близкородственных им оболочников и
ланцетника удается проследить ряд интереснейших эволюционных моди-
фикаций некоторых желез внутренней секреции. Так, гомологичными об-
разованиями являются, по-видимому, эндостиль ланцетника и оболочни-
60
ков и щитовидная железа позвоночных животных. Строение последней
у позвоночных, а также способ формирования в онтогенезе дают основание
предполагать, что источником ее возникновения была железа, обладавшая
выводным протоком и выделявшая секрет в полость пищеварительного
тракта. Прообразом такой железы может служить щитовидная железа ли-
чинки миноги. Эта железа имеет выводной проток и выделяет синтези-
руемые в концевых отделах тиреоглобулины в просвет пищеварительного
тракта. В полости средней кишки они подвергаются гидролизу, а иодиро-
ванные аминокислоты — тироксин и трииодтиронин — всасываются кишеч-
ным эпителием. Возможно, однако, что наблюдаемые у личинки миноги
своеобразные отношения представляют собой лишь одну из эволюционных
модификаций щитовидной железы и не имеют отношения к формирова-
нию сложной динамики синтеза этих гормонов в клетках фолликулярного
эпителия щитовидной железы позвоночных животных.
Несмотря на более позднее в филогенезе появление эпителиальных
эндокринных желез, они возникали, по-видимому, не только на основе бо-
лее древних по происхождению экзокриновых желез. Так, у низших поз-
воночных эндокринные железистые элементы эктодермального происхож-
дения выделяются раньше из состава кишечного эпителия, чем экзокрино-
вая часть поджелудочной железы. Непосредственно из целомического
эпителия возникла в филогенезе позвоночных железистая ткань коркового
вещества надпочечника. У высших беспозвоночных большая часть желез
внутренней секреции возникла из эпителиальных тканей, не специализи-
рованных па железистую функцию.
Широкое распространение имеет у высших многоклеточных и мульти-
функциональная дифференцировка как экзокриновых, так и эндокрин-
ных железистых клеток. Хорошо изученными в этом отношении приме-
рами могут быть слюнные железы млекопитающих и человека и слюнные
железы головоногих моллюсков. Все эти факты лишний раз свидетельст-
вуют о том, что возникновение специальных эпителиальных желез внут-
ренней секреции представляет собой проявление одной из общих универ-
сальных для всех многоклеточных животных тенденций филогенетической
дифференцировки железистых эпителиев.
Глава 2
КИШЕЧНЫЕ ЭПИТЕЛИИ
ВВЕДЕНИЕ
Кишечные эпителии представляют собой одну из наиболее древних
и универсальных тканевых систем многоклеточных организмов. Специа-
лизация основных клеток этой ткани шла в направлении совершенство-
вания общих для всех клеток механизмов поглощения веществ из внеш-
ней среды, их внутриклеточного транспорта и выведения из клеток
в подлежащие ткани. Соответственно этому для большинства современ-
ных многоклеточных животных характерно полостное пищеварение и
лишь у некоторых низших многоклеточных (губок, бескишечных тур-
беллярий) и отдельных групп первичноротых животных (пластинчато-
жаберные и брюхоногие моллюски, некоторые паукообразные) получили
развитие процессы внутриклеточного пищеварения, как основного или
вспомогательного механизма поглощения питательных веществ.
Необходимой предпосылкой полостного пищеварения является фор-
мирование железистого аппарата либо непосредственно в составе эпи-
телиального пласта, либо в виде специальных желез, расположенных по
ходу пищеварительного тракта. У позвоночных и некоторых групп бес-
позвоночных (головоногие моллюски, отчасти ракообразные) в системе
пищеварительного тракта выделяется специальный орган — печень, обе-
61
спечивающий вторичную обработку, резервирование и детоксикацию по-
ступающих в организм соединений. Эпителий печени образуется в он-
тогенезе из общего с кишечным эпителием зачатка и представляет со-
бой особую разновидность этого эпителия. В нашем обзоре мы вынуж-
дены ограничиться рассмотрением лишь собственно кишечного эпите-
лия, выполняющего основную функцию этой ткани — непосредственного
поглощения питательных веществ из полости кишки.
Современная литература по частной цитологии и системным законо-
мерностям организации кишечных эпителиев многоклеточных животных
неоднородна. Многочисленные исследования и обзоры посвящены ки-
шечному эпителию млекопитающих. Относительно много новых данных
содержится в работах по изучению кишечного эпителия у отдельных
представителей членистоногих, и в частности у насекомых. Значительно
менее изучены с помощью современных методов исследования кишеч-
ные эпителии низших позвоночных и первичноротых животных.
Обзор имеющегося фактического материала удобнее начать с ки-
шечных эпителиев высших вторичноротых (позвоночные) и первично-
ротых (членистоногие) животных, где основные потенции филогенети-
ческой дифференцировки рассматриваемой ткани проявляются наиболее
отчетливо. Далее мы рассмотрим модификации организации кишечных
эпителиев у животных средних и низших уровней организации. В крат-
ком заключении будет сделана попытка обобщить приведенный фактиче-
ский материал по сравнительной гистологии и цитологии кишечных эпи-
телиев.
КИШЕЧНЫЕ ВСАСЫВАЮЩИЕ ЭПИТЕЛИИ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Млекопитающие
У млекопитающих основные тенденции прогрессивной дифференци-
ровки кишечного эпителия достигают весьма высокой степени
реализации. Здесь имеется уже и сложная система железистых органов,
обеспечивающих первичную обработку и ферментативное расщепление
пищи, и специальный аппарат промежуточного обмена для вторичной
ее переработки. Кишечный всасывающий эпителий представляет собой
детерминированную динамичную тканевую систему, построенную по
принципу энергичного самообновления с четкой локализацией как об-
ласти гибели клеток, так и области их интенсивного размножения.
Кишечный всасывающий эпителий млекопитающих — типичный од-
нослойный цилиндрический эпителий с резко выраженной полярностью
образующих его клеточных элементов. Дифференцированные, активно
функционирующие клетки этого эпителия сосредоточены в эпителиаль-
ном пласте, покрывающем наружную поверхность ворсинок — основных
структурных единиц слизистой оболочки тонкой кишки. Они представ-
ляют собой микрооргапные структуры с собственным нервным, мышеч-
ным и сосудистым аппаратами (рис. 15). Местом гибели клеток в ки-
шечном эпителии являются вершины ворсинок. Постоянство количества
клеток обеспечивается за счет их интенсивного размножения в крип-
тах — пальцевидных впячиваниях в слизистую оболочку, образованных
камбиальными и малодифференцированными клетками. Эти клетки от-
личаются от дифференцированных меньшими размерами, большей
базофилией цитоплазмы, отсутствием или еще относительно слабым
развитием морфологических признаков специфической дифференцировки.
Морфологическим и цитохимическим различиям между камбиаль-
ными и дифференцированными клетками соответствуют и существенные
различия в интенсивности и характере метаболических процессов. Они
особенно отчетливо выявляются па автографах слизистой оболочки
кишки у лабораторных грызунов в опытах с предшественниками синте-
62
зов белка или РНК. На ранних сроках после инъекции меченых амино-
кислот интенсивность их включения в белки клеток в системе крипта—
ворсинка характеризуется отчетливым преобладанием включения в кам-
биальные клетки крипт по сравнению с функционирующими клетками
эпителия ворсинок. Интенсивность синтеза белка в клетках эпителия
ворсинок постепенно уменьшается от основания ворсинок к их верши-
нам. В опытах с предшественником синтеза РНК (3Н-уридином) вклю-
чение его во вновь синтезируемую РНК происходит только в клетках
крипт. Таким образом, эти опыты показывают, что специфическая ци-
тодифферепциация в кишечном эпителии приводит не только к полному
блокированию аутосинтетических процессов и репродукции клеток, но
и прекращает в дифференцированных клетках считывание информации
с ДНК ядерного аппарата, т. е. блокирует транскрипцию. Необходимый
для функционирования клеток белковый синтез протекает с исполь-
зованием различных типов РНК, синтезированных в период актив-
ной деятельности клеток, сочетающейся с процессами их размножения.
Таким образом, кишечный эпителий представляет собой весьма слож-
ную гетерогенную систему. Однослойный эпителиальный пласт состоит
из существенно различающихся по своим свойствам и значению субпо-
пуляций клеток: камбиальных, малодифференцированных, дифференци-
рованных и заканчивающих жизненный цикл. Эти субпопуляции клеток
в эпителиальной выстилке кишки распределены на боковых поверхно-
стях крипт, ворсинок и апикальных концах последних. Несмотря на раз-
личия в метаболической активности и топографическом распределении,
все субпопуляции клеток представляют собой единую систему. Такое их
системное единство определяется прежде всего гистогенетической
общностью рассматриваемых субпопуляций, представляющих собою
клетки, находящиеся на последовательных этапах жизненного цикла.
Кроме того, темпы размножения клеток, длительность их существования и
интенсивность гибели строго координированы в системе неясными еще
для нас надклеточными системными механизмами. Возможно, что точкой
приложения химических и физических факторов такой регуляции явля-
ется генетический аппарат клеток. С помощью сканирующего электрон-
ного микроскопа показано, что гибель клеток на вершине ворсинок про-
исходит еще до вычленения их из состава эпителиального пласта, т. е.
она, по-видимому, запрограммирована в их генетическом аппарате
(Pfeifer, 1970).
Основными и по количеству и в функциональном отношении диффе-
ренцированными клетками кишечного эпителия являются всасывающие
призматические клетки. Наиболее характерной особенностью всасыва-
ющих клеток является их ярко выраженная полярность. Они характе-
ризуются резко выраженными структурными и функциональными раз-
личиями своих апикальных и базальных частей. Апикальная цитоплазма
и наружная плазматическая мембрана образуют микроворсинки: это от-
носительно крупные образования, достигающие у млекопитающих
1.4 мкм длины и 0.08 мкм ширины, занимающие всю наружную, обра-
щенную в просвет кишки поверхность клетки. Снаружи каждая микро-
ворсинка покрыта плазматической мембраной, общая поверхность кото-
рой благодаря этому оказывается весьма обширной (рис. 16).
Внутри микроворсинок отчетливо выявляются продольные фибрил-
лярные структуры. В основании микроворсинок они переходят в фиб-
риллярный слой, расположенный параллельно апикальной поверхности
клеток. Одним из важных свойств микроворсинок является способность
их в результате медленного сокращения и расслабления к увеличению
и уменьшению своей длины, а следовательно, и к изменению общей
всасывающей поверхности клеток и расстояния между соседними микро-
ворсинками. Весьма важной в функциональном отношении структурой
является здесь также хорошо развитый мукополисахаридный надмем-
63
5 6 a
Рис. 15. Схема строения слизистой оболочки и эпителия тонкого кишечника млекопи-
тающих. (Рис. М. 10. Пунина).
а — схема строения слизистой оболочки, б — гистогенетические отношения между эпителиальными
клетками. 1 — ворсинки, 2 — эпителий, 3 — крипта, 4 — соединительная ткань, 5 — кровеносный
сосуд, 6—мышечный слой слизистой оболочки, 7 — стволовая родоначальная клетка, 8—11 — мало-
дифференцированныг клетки крипт (панетовские, энтерохромаффиновые, олигослизистые, всасываю-
щие), 12—15 — дифференцированные клетки в эпителии крипт (12) и ворсинок (13—15).
12 ” 7
Рис. 15 (продолжение).
5 А. А. Заварзин
бранный комплекс, одевающий каждую микроворсинку и являющийся
продуктом выделения всасывающих клеток (Boyd, Parsons, 1969; Dob-
bins, 1969; Mukherjee, Staehelin, 1971). Высокая интенсивность обнов-
ления падмембрапного комплекса была недавно продемонстрирована
методом электронной авторадиографии с помощью 3Н-глюкозы (Ben-
nett, Leblond, 1970). Показано также и активное участие аппарата
Гольджи в формировании и мембранных и фибриллярных структур мик-
роворсипок при дифференцировке всасывающих клеток в онтогенезе
(Vollrath, 1971).
Основное функциональное значение аппарата микроворсинок заклю-
чается в обеспечении активного мембранного транспорта — первого
звена избирательного поступления веществ в цитоплазму всасывающей
клетки. Этой задаче и служит резкое увеличение всасывающей поверх-
ности клеток. Специализированная плазматическая мембрана обладает
ярко выраженной способностью к активному и пассивному транспорту.
Кроме того, установлено, что на поверхности мембраны микроворсинок
располагаются ферменты, обеспечивающие гидролитическое расщепле-
ние макромолекул, не разрушенных действием ферментов желудочного
и кишечного соков. Этот важный вспомогательный механизм получил
название «пристеночного, или мембранного пищеварения» (см. обзор:
Уголев, 1972).
Ядра всасывающих клеток не обнаруживают признаков активного
синтеза иРНК и рРНК (Газарян и др., 1967). Тем не менее всасыва-
ющие клетки в течение всего своего жизненного цикла синтезируют
белки, мукополисахариды и ряд других соединений. Для всасывающих
клеток характерным является строго поляризованное расположение ор-
ганоидов и, в частности, аппарата Гольджи. Последний находится всегда
над ядром и представлен хорошо развитыми цистернами с мелкими и
крупными вакуолями. Многочисленные митохондрии также обнаружи-
ваются преимущественно в апикальной части клеток. Всасывающие
клетки обладают развитой системой гладкой и шероховатой эндоплазма-
тической сети, функциональное единство которых отчетливо выявляется
при всасывании жиров (рис. 16). Благодаря осмиофильным свойствам
последних удается проследить процессы их перемещения в клеточных
структурах. При этом показано, что основная масса жировых включений
оказывается заключенной в полости шероховатой эндоплазматической
сети, а также в цистернах аппарата Гольджи. Проникновение жиров в по-
лости каналов эндоплазматической сети всасывающих клеток представ-
ляет собой активный весьма сложный многоэтапный процесс. На первом
этапе этого процесса происходит расщепление жиров до низкомолекуляр-
ных продуктов ферментами, находящимися в плазматической мембране
всасывающих клеток, затем эти низкомолекулярные продукты проходят
через плазматическую мембрану. Далее в гиалоплазме или точнее внутри
каналов эндоплазматической сети и цистерн аппарата Гольджи происхо-
дит ресинтез жиров. К ним присоединяются еще и липопротеины, и весь
этот сложный комплекс транспортируется к боковой поверхности вса-
сывающих клеток. Здесь, по-видимому, путем экзоцитоза происходит вы-
ведение жировых капель в межклеточное пространство. Показано также,
что для внутриклеточного транспорта жиров необходим активный синтез
белка, что связано с новообразованием мембран при внутриклеточном
транспорте белка (Friedman, Cardell, 1972).
Меньше известно о механизмах поступления в клетки углеводов и
аминокислот. Расщепление сохранившихся участков полипептидных
и полисахаридных цепей происходит под действием гидролитических
ферментов, локализованных в плазматической мембране микроворсинок.
Аминокислоты и углеводы проникают в клетку с помощью механизмов
активного транспорта, т. е. с использованием энергии АТФ. Высказыва-
ется экспериментально обоснованное предположение, что эти соединения,
66
.6
1
Рис. 16. Схема строения всасывающей клетки кишечного эпителия. (Рис. М. Ю. Пу-
нина).
1 — микроворсинки, 2 — сократимый фибриллярный аппарат микроворсинок, 3 — соединительный
комплекс (зона слияния, зона прилежания, десмосома), 4 — надмембранный комплекс, 5 — аппарат
Гольджи, 6 — капля жира, 7 — шероховатая эндоплазматическая сеть, 8 — гладкая эндоплазмати-
ческая сеть, 9 — базальная мембрана. Стрелки слева показывают процесс всасывания и выведения
жира, а также возможные пути внутриклеточного транспорта, стрелками справа показаны локализа-
ция синтеза и возможные пути внутриклеточного транспорта мукопротеидов надмембранного ком-
плекса.
5*
как и жиры, поступают в полости каналов эндоплазматической сети и,
не объединяясь с общим внутриклеточным фондом белков и углеводов
гиалоплазмы, выводятся в межклеточные пространства (Bronk, Leese,
1974).
Весьма своеобразную структуру имеют всасывающие клетки ново-
рожденных млекопитающих. В апикальной части клетки формируется
постоянный пиноцитозный комплекс. Он 'состоит из ограниченных мемб-
раной и связанных с наружной средой систем канальцев и крупной ва-
куоли (Krachenbuhl, Campiche, 1969; Knutton et al., 1974).
Более подробно современное состояние вопроса о функциональной
морфологии всасывающих клеток освещено в специальных обзорах (To-
ner, 1968; Уголев, 1972; Parsons, Boyd, 1972; Isselbacher, 1975).
Помимо основных всасывающих клеток, в кишечном эпителии млеко-
питающих имеются еще и дифференцированные железистые клеточные
элементы. Наиболее многочисленные из них — это слизистые бокаловид-
ные клетки. Они представляют собой одноклеточные железы и были под-
робно описаны в предыдущей главе.
Второй тип секреторных клеток — это панетовские железистые клетки.
Они расположены в дне крипт, по нескольку клеток на каждую крипту.
Клетки имеют конусовидную форму. Вся апикальная часть клеток занята
гранулами белкового секрета. Синтез его происходит на рибосомах ше-
роховатой эндоплазматической сети, занимающей всю базальную часть
клеток. Синтезированный секрет уже через 30—40 мин. перемещается
в мелкие пузырьки хорошо развитого аппарата Гольджи, расположенного
в надъядерной области. Здесь образуются более крупные конденсацион-
ные вакуоли, которые постепенно превращаются в секреторные гранулы.
Они смещаются к апикальной поверхности клеток, где содержимое гранул
выводится наружу. Весь секреторный цикл занимает около 1.5—2 час.
Функциональное значение образующегося секрета неясно. Высказы-
вается предположение о том, что он создает особо благоприятную среду
для размножения камбиальных элементов крипт. Имеются данные о том,
что панетовские клетки играют существенную роль в регуляции бактери-
альной флоры кишечника. В их цитоплазме обнаружены микроорганизмы
на разных стадиях деградации (Erlandsen, Chase, 1972).
Третьим типом секреторных клеток в кишечном эпителии млекопи-
тающих являются энтерохромаффиновые клетки, которые также неболь-
шими группами расположены на боковой поверхности крипт среди основ-
ной массы камбиальных клеток. Секреторные гранулы локализуются
в этих клетках у их базальных, граничащих с соединительной тканью по-
верхностей. Показано, что эти клетки выделяют в кровь серотонин и
являются, следовательно, типичными железами внутренней секреции.
Местом гибели закончивших жизненный цикл энтерохромаффиновых кле-
ток является вершина ворсинок, т. е. они, как бокаловидные и всасываю-
щие клетки, претерпевают закономерное перемещение от основания к вер-
шине ворсинки (Cheng, Leblond, 1974).
В последнее время в эпителии кишки и желудка описан еще один
вспомогательный тип клеток. Эти клетки характеризуются глубокими ин-
вагинациями апикальной мембраны, образующими внутриклеточные ка-
налы, длинными микроворсинками с сильно развитыми фибриллами, до-
ходящими до глубоких слоев цитоплазмы. Функция этих клеток пока не
выяснена (Nabeyama, Leblond, 1974).
Для выяснения системных закономерностей организации кишечного
эпителия позвоночных особое значение имеет детальная характеристика
процессов репродукции камбиальных клеток и физиологической регене-
рации в эпителиальном пласте. За последние 15—20 лет в изучении этого
вопроса достигнуты большие успехи и накоплен новый фактический мате-
риал, обобщенный в ряде специальных обзоров и сводок (Заварзин, 1967,
1972; Schultze et al., 1972; Cheng, Leblond, 1974).
68
Большую роль в анализе организации камбиальной системы кишечного^
эпителия играет метод тимидиновой авторадиографии. С его помощью уда-
ется изучить и интенсивность процессов репродукции (рис. 17) и точно
определить скорость процессов миграции клеток в системе крипта—вор-
синка в процессах физиологической регенерации кишечного эпителия.
Более детальное изучение этих процессов показало, что среднее время
полного обновления эпителиальной выстилки ворсинок у мышевидных-
грызунов около 48 час. Удалось выяснить также и среднее генерационное
время у большинства пролиферирующих клеток. Оно оказалось порядка
12—15 час. с типичной структурой цикла для тканей млекопитающих
с интенсивной пролиферацией клеток.
Рис. 17. Автографы, иллюстрирующие включение 3Н-тимидина в клетки крипт кишеч-
ного эпителия мыши через 12 час. (а) и разведение метки через 3 суток (б) после 3-крат-
пого введения меченого предшественника с шестичасовыми интервалами.
Наличие объективных количественных критериев, характеризующих
интенсивность репродукции клеток и скорость физиологической регене-
рации в кишечном эпителии, позволяет проводить уже не только качест-
венные, но и строгие количественные сопоставления при анализе станов-
ления этой системы в онтогенезе, ее изменений при патологических усло-
виях и при сравнительно-гистологических исследованиях.
Используя эти критерии, удалось, в частности, показать, что становле-
ние системы кишечного эпителия в онтогенезе происходит при относи-
тельно постоянной скорости репродукции клеток. Абсолютный прирост
количества дифференцированных и камбиальных клеток обеспечивается
здесь за счет резкого увеличения (в 3—4 раза) продолжительности жизни
дифференцированных клеток, т. е. путем снижения интенсивности физио-
логической регенерации. Весьма сложные изменения наблюдаются в со-
отношении интенсивности репродукции и скорости миграции клеток при
репаративных процессах. Однако для выяснения конкретных механизмов
внутрисистемных регуляций необходимо прежде всего иметь достаточно
ясные представления об особенностях организации камбиальных клеточных
элементов в криптах кишечного эпителия. В настоящее время удалось
показать наличие здесь особой субпопуляции клеток, характеризующихся
меньшей скоростью репродукции по сравнению с основной массой камби-
альных клеток (Cairnie, 1970; Chang, Leblond, 1971; Wright et al., 1972;
69
Kovacs, Potten, 1973). Биологическое значение этой субпопуляции мед-
ленно размножающихся клеток неясно. Возможно, что они представляют
собой частную камбиальную систему для обновления папетовских или
хромаффиновых клеток. Возможно, однако, что такие частные камбиаль-
ные системы в криптах отсутствуют, а медленно размножающиеся клетки
представляют собой стволовые клетки общей камбиальной системы, ана-
логичные стволовым клеткам кроветворной и некоторых других камбиаль-
ных тканей млекопитающих. Именно такую точку зрения па системную
организацию кишечного эпителия развивают в серии последних работ
Ченг и Леблон (Cheng, Leblond, 1974) на основании тщательных элек-
тронноавторадиографических исследований (рис. 15, б). По мнению этих
авторов, основу всей системы кишечного эпителия составляют мульти-
потентные стволовые клетки, способные к дифференцировке по крайней
мере в четырех различных направлениях (всасывающие, бокаловидные,
панетовские и хромаффиновые). Ранние этапы дифференцировки в одном
из этих направлений происходят в криптах. При этом вступившие на
путь специализации клетки сохраняют еще некоторое время способность
к делению. Лишь позднее (всасывающие, бокаловидные и хромаффиновые
клетки при выходе на ворсинку, а панетовские при накоплении в клетках
секреторных продуктов) способность клеток к синтезу ДНК и размноже-
нию утрачивается полностью.
Приведенные данные показывают, что кишечные эпителии млекопи-
тающих представляют собой весьма динамичную, сложно организован-
ную систему. Сложность ее организации проявляется в резких различиях
в метаболической активности камбиальных, малодифференцированных и
дифференцированных клеток, в наличии разных направлений их диффе-
ренцировки, в весьма напряженной работе гетерогенных, мозаично рас-
пределенных в пласте субпопуляций камбиальных клеток.
Такая высокая степень дифференциации системы является вместе
с тем лишь внешним выражением ее глубокого внутреннего единства.
Оно обусловливается и гистогенетической общностью всех клеток в си-
стеме, и сложными неясными еще для нас взаимодействиями камбиаль-
ных и дифференцированных в разных направлениях клеточных субпо-
пуляций.
Низшие позвоночные
Кишечный эпителий низших позвоночных животных с помощью со-
временных методов исследования изучен еще недостаточно полно и систе-
матически. Имеющиеся, однако, хотя и отрывочные данные свидетельст-
вуют о том, что в пределах каждого класса низших позвоночных живот-
ных удается выявить тенденцию к сложной морфобиохимической
дифференцировке всасывающих клеток и к организации эпителиального
пласта по принципу поляризованной обновляющейся системы.
У большинства представителей процветающей группы костистых рыб
всасывающие клетки кишечного эпителия имеют хорошо развитый аппа-
рат микроворсинок. В его ультраструктурной организации не удается пока
выявить существенных особенностей по сравнению с аппаратом микровор-
синок высших позвоночных животных. Подобного рода сложная дифферен-
цировка всасывающих клеток характерна и для кишечных эпителиев репти-
лий и амфибий. Широкое распространение у низших позвоночных живот-
ных имеют и бокаловидные клетки, строение, химические свойства и
функциональное значение которых сходны с бокаловидными клетками
высших позвоночных животных. У некоторых костистых и у осетровых
рыб бокаловидные клетки гетерогенпы и представлены несколькими
разновидностями, различающимися по характеру синтезируемого секрета.
Таким образом, можно сделать вывод о том, что высокий уровень мор-
фобиохимической дифференцировки всасывающих и железистых клеточ-
,70
ных элементов характерен для кишечных эпителиев изученных предста-
вителей всех классов позвоночных животных.
Сложнее обстоит дело с тенденцией кишечных эпителиев к топогра-
фической дифференцировке камбиальных и дифференцированных клеточ-
ных элементов. Более подробно изучен в настоящее время этот вопрос
в отношении двух представителей амфибий — лягушки (Ланская, 1974)
и аксолотля. У Rana temporaria в опытах с длительным насыщением
Рис. 18. Автографы, иллюстрирующие включение 3Н-тимидина в клетки кишечного
эпителия Rana temporaria. (Из: Ланская, 1974).
а, б — через 4 суток после ежедневных инъекций меченого предшественника в основании (а) и на
вершине (б) складки слизистой оболочки кишки, в — перераспределение клеток с мечеными ядрами
через 20 суток после 4-кратного введения 3Н-тимидина с интервалами 24 часа.
3Н-тимидином (в течение 8 суток) удается выявить отчетливые различия
между количеством синтезирующих ДНК клеток в эпителии основания
кишечной складки и на ее вершине. К концу опыта в основании кишеч-
ной складки больше половины клеток содержат уже меченые ядра
и количество их нарастало в течение всего срока ежедневных инъекций
3Н-тимидина. На вершине складки число клеток с мечеными ядрами до-
стигало к 4-м суткам после начала опыта 20 %-го уровня и дальше уже
количество их практически не увеличивалось (рис. 18). Как можно судить
по результатам этих опытов, особенностью организации обновляющейся
системы кишечного эпителия у R. temporaria является отсутствие хотя бы
у части дифференцированных клеток на вершине кишечной складки анта-
71
гонистических отношений между размножением и дифференцировкой
клеток. Второй особенностью его является крайне медленный темп обнов-
ления. Репродуцирующиеся в основании кишечной складки клетки дости-
гают ее вершины лишь через 20—25 суток. Наконец, третьей, весьма
существенной особенностью кишечного эпителия R. temporaries по сравне-
нию с кишечным эпителием млекопитающих является большая индиви-
дуальная вариабельность в интенсивности размножения клеток и скорости
физиологической регенерации эпителиального пласта. У некоторых живот-
ных она может быть заторможена, у других, наоборот, протекает более
быстрыми темпами по сравнению со средними «типичными» отношениями.
Отсутствует у бесхвостых амфибий и стойкая локализация места гибели
Рис. 19. Автографы, иллюстрирующие включение 3Н-тимидина в клетки кишечного
эпителия аксолотля.
а — через 7 суток ежедневных инъекций, б — перераспределение маркированных клеток через
18 суток после 7-кратной инъекции 3Н-тимидина с интервалами 24 часа.
клеток на вершине кишечной складки. В некоторых складках этот про-
цесс может происходить и на боковых поверхностях.
Изучение в аналогичных опытах кишечного эпителия у аксолотля
выявило несколько иные отношения; здесь обнаружилось весьма четкое
топографическое разграничение между камбиальными пролиферирую-
щими и дифференцирующимися клетками и клетками дифференцирован-
ными. Последние образуют эпителиальный пласт из клеток, не способных
к синтезу ДНК и делению. Камбиальные же пролиферирующие клетки
располагаются в толще соединительной ткани, в так называемых регене-
рационных гнездах, сосредоточенных преимущественно в нижней части
кишечных складок. Клетки с мечеными ядрами, вступающие па путь диф-
ференцировки уже в течение опыта, появляются в составе эпителиального
пласта лишь на восьмые сутки после начала инъекций 3Н-тимидипа
(рис. 19). Однако полное обновление всех дифференцированных клеток
происходит через более длительные сроки (60—90 дней).
Таким образом, у хвостатых и бесхвостых амфибий при медленной ско-
рости физиологической регенерации кишечного эпителия имеются сущест-
венные особенности в организации дифференцированной и камбиальной
частей тканевой системы. При этом у аксолотля наблюдаемые отношения
имеют больше сходства с кишечным эпителием млекопитающих, чем
72
Рис. 20. Зона размножения в складке кишечного эпителия костистой рыбы (а) и молоди
осетровых рыб (б).
1 — эпителий, 2 — митотические фигуры, з — соединительная ткань.
Рис. 21. Автографы переднего (а) и среднего (б) отделов кишечника личинки миноги
Lampetra fluviattlis после однократной инъекции 3Н-тимидинал (Из: Грасгоф, 1976).
а — основание складки, б — область сосредоточения базофильных клеток. 1 — меченые всасывающие
клетки, 2 — базофильные секреторные клетки, 3 — камбиальная зона в области свода кишки.
у представителя более высокоорганизованных бесхвостых амфибий. Од-
нако скорость обновления дифференцированных клеток здесь в 2—3 раза
меньше, чем у лягушек.
Немногочисленные еще данные по анализу процессов репродукции и
физиологической регенерации методом тимидиновой авторадиографии
у отдельных представителей процветающего в настоящее время класса
костистых рыб свидетельствуют о наличии у них сходных с амфибиями
закономерностей. С одной стороны, в кишечном эпителии вьюна, предста-
вителя весьма своеобразной по образу жизни и морфологическим особен-
ностям группы костистых рыб, относительно слабо выражена топографи-
ческая дифференциация малодифференцировапных субпопуляций клеток
(Кульминская и др., 1968). С другой стороны, у беломорской наваги,
трески и, по-видимому, многих других групп костистых рыб имеется чет-
кое выделение в системе кишечного эпителия организованных субпопу-
ляций камбиальных клеток, вполне аналогичных эпителию крипт млеко-
питающих животных (рис. 20, а). У наваги митотический индекс в таких
скоплениях может достигать 5% и примерно половина клеток содержит
меченные 3Н-тимидином ядра в опытах с однократной его инъекцией.
Пролиферирующие клетки характеризуются большой интенсивностью
синтеза РНК. Аналогичные показатели пролиферативной активности ха-
рактерны и для эпителия крипт кишечника млекопитающих. Четкая топо-
графическая дифференцировка камбиальных клеток в виде их скоплений
в составе эпителиального пласта, преимущественно в основании складок,
наблюдается в кишечном эпителии молоди осетра (рис. 20, б).
Весьма интересные отношения наблюдаются в топографическом рас-
пределении камбиальных и дифференцированных клеток в кишечном эпи-
телии личинки миноги — пескоройки (Грасгоф, 1976). В переднем отделе
кишки, где в эпителии локализованы выделяющие пищеварительные фер-
менты клетки, пет топографического разграничения пролиферирующих и
дифференцированных клеток. В среднем и заднем отделах кишечника,
где эти секреторные пиронинофильпые клетки отсутствуют, имеется чет-
кое разграничение камбиальных и дифференцированных участков пласта
(рис. 21). Все пролиферирующие клетки сосредоточены здесь в области
основания складки.
Таким образом, даже эти отрывочные и весьма неполные данные по-
казывают, что такой признак организации кишечных эпителиев, как лока-
лизация камбиальных клеток, варьирует в широких пределах и- у отдель-
ных видов в пределах одного класса позвоночных и даже у одного живот-
ного в различных отделах желудочно-кишечного тракта.
Тем пе менее этот признак отражает глубокие внутренние закономер-
ности взаимоотношения дифференцированных и пролиферирующих кле-
ток, поскольку локализация камбиальных клеток и большая или меньшая
топографическая интеграция их в отдельные субпопуляции определяет
в конечном счете всю внутреннюю динамику этой обновляющейся си-
стемы. Наличие сходных тенденций к усложнению системной организации
кишечного эпителия в разных классах позвоночных животных свидетель-
ствует о том, что мы имеем здесь дело с проявлением одной из общих
закономерностей филогенетической дифференцировки этой тканевой
системы.
КИШЕЧНЫЙ ЭПИТЕЛИЙ БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Членистоногие
Среди членистоногих наибольшее разнообразие по характеру питания и
используемой пищи наблюдается у насекомых. Для насекомых характерно
большое анатомическое разнообразие органов пищеварительной системы
и в первую очередь ротового аппарата и переднего отдела кишечника.
74
Большое разнообразие строения обнаруживается также и в центральном
отделе пищеварительной системы, в ее средней кишке, что сказывается не
только па микроапатомическом уровне организации этого отдела, по и на
морфобиохимической дифференцировке кишечного эпителия и его основ-
ных клеточных элементов.
Всасывающие клетки кишечного эпителия у многих насекомых несут
хорошо развитый аппарат микроворсипок, функциональное значение и
принцип организации которых аналогичны функциональному значению
и организации их у других высших многоклеточных животных. Сходными
являются и механизмы формирования этих структур при дифференци-
ровке всасывающих клеток в онтогенезе. Как и у позвоночных животных,
непосредственное участие в формировании и мембранных и фибрилляр-
ных структур принимает аппарат Гольджи. При этом у отдельных видов
насекомых процесс формирования микроворсипок па апикальной поверх-
ности клеток занимает около 3 часов (Starre-Molen, Priester, 1972). В про-
тивоположность относительному однообразию строения аппарата микро-
ворсипок в кишечном эпителии большинства позвоночных животных
у насекомых, даже у сравнительно немногочисленных еще представите-
лей, изученных с помощью электронного микроскопа, наблюдается силь-
ное варьирование этих специфических структур по их количеству на
клетку, размерам и ультратонкому строению.
Несмотря па сходный в принципе характер организации апикальных
частей всасывающих клеток у насекомых с аналогичными структурами
в кишечном эпителии позвоночных животных, между ними имеется ряд
глубоких различий. В отличие от кишечного эпителия позвоночных, где
в процессе всасывания происходит активный транспорт сахаров и амино-
кислот против градиента их концентрации, у насекомых имеет место пас-
сивный транспорт этих веществ через плазматическую мембрану. Повы-
шенная концентрация этих веществ в полости кишки создается и путем
быстрого всасывания воды. Процессы пассивного транспорта мопосахаров
через мембрану облегчаются за счет быстрого превращения их в клетке
в соединения, не содержащиеся в полости кишки (см. обзор: Dadd, 1970).
Для многих насекомых характерна мультифункциональная морфобио-
химическая дифференциация всасывающих клеток. Так, например, у кро-
вососущих насекомых, помимо всасывания низкомолекулярных продуктов
(образующихся при расщеплении белков форменных элементов и плазмы
крови), всасывающие клетки обладают еще и мощпым аппаратом белко-
вого синтеза (Staubli et al., 1966; Gooding, 1972, 1973). Здесь имеется
хорошо развитая шероховатая эндоплазматическая сеть, аппарат Гольджи
и много митохондрий (рис. 22). В апикальных частях клеток накаплива-
ется большое количество секреторных гранул, которые выделяются в про-
свет кишки. Они представляют собой пищеварительные ферменты, играю-
щие важную роль в процессах полостного пищеварения. Таким образом,
у некоторых насекомых весьма специфические секреторная и всасываю-
щая функции осуществляются одними и теми же клеточными элементами.
Наряду с этим у многих насекомых в кишечном эпителии имеются разно-
образные секреторные клетки. Так, в кишечном эпителии чешуекрылых
среди обычных всасывающих клеток наблюдаются многочисленные выде-
ляющие слизь бокаловидные клетки. Разнообразные железистые элементы,
как по характеру выделяемого секрета, так и по способам его выделения,
имеются в кишечном эпителии медоносной пчелы.
Весьма специфической для кишечного эпителия членистоногих струк-
турой является так называемая перитрофическая мембрана (Georgi, 1969;
Peters, 1969; Platzer-Schultz, Welsch, 1970; Richards, Richards, 1971). Она
представляет собой относительно топкое внеклеточное образование, распо-
ложенное на поверхности эпителиальных клеток и изолирующее их от не-
посредственного контакта с пищевыми частицами, находящимися в по-
лости кишки. Функциональное значение перитрофической мембраны в ка-
75
кой-то мере аналогично слою слизистого секрета бокаловидных клеток
позвоночных животных. Это внеклеточное образование может служить
для защиты микроворсипок всасывающих клеток от механического по-
вреждения кусочками непереваренной пищи, находящейся в просвете
кишки. Перитрофическая мембрана отсутствует у некоторых видов насе-
Рис. 22. Схема строения клетки, осуществляющей всасывающую и секреторную функ-
ции в кишечном эпителии кровососущего насекомого. (По электронным микрофотогра-
фиям: Staubli et al., 1966; рис. М. 10. Пунина).
1 — микроворсинки, 2 — плотный гранулярный материал (продукт секреции), з — шероховатая
эндоплазматическая сеть, 4 — апикальные пузырьки, 5 — митохондрии, 6 — складки плазматиче-
ской мембраны, 7 — аппарат Гольджи, 8 — остаточное тело.
комых, питающихся жидкой пищей или имеющих хорошо развитые бока-
ловидные клетки. Наличие перитрофической мембраны у кровососущих
насекомых свидетельствует и о ее, возможно, иной функции. Опа может
служить барьером, обеспечивающим одностороннюю миграцию ферментов
от клеток к непереваренной пище, и, наоборот, к поверхности клеток
пропускать лишь низкомолекулярные продукты, образующиеся под дей-
ствием пищеварительных ферментов. Перитрофические мембраны состоят
из белка и хитина и образуются либо всеми клетками эпителия средней
кишки, либо особыми клетками в области перехода переднего отдела
76
в средний отдел кишечника. В последнем случае удалось показать, что
образование этой структуры идет по типу сложной апокриновой секреции
(рис. 23). При этом участки цитоплазмы клеток, отделяемые вместе
с секреторными гранулами, длительное время сохраняются в составе
перитрофической мембраны и играют важную роль в процессах ее до-
стройки и окончательного оформления, протекающих за пределами обра-
зующих ее клеток. При формировании перитрофической мембраны клет-
ками эпителия средней кишки в пей могут быть локализованы гидроли-
тические пищеварительные ферменты. Это имеет место, по-видимому,
Рис. 23. Схема’образования перитрофической мембраны у насекомых. (По: Platzer-
Shultz, Welsch, 1970; рис. М. Ю. Пунина).
1 — клетки кишечного эпителия, 2 — перитрофическая мембрана, з — секреторная гранула,
4 — гликоген, 5 — базальная мембрана.
в тех случаях, когда выделение ферментов клетками и формирование
перитрофической мембраны происходит лишь при поступлении пищи
в полость кишки.
Многообразию морфобиохимической дифференцировки клеток кишеч-
ного эпителия у насекомых соответствует и многообразие организации
тканевой системы. Так, например, у двукрылых этот эпителий представ-
ляет собой растущую клеточную популяцию, образованную однородными
всасывающими клетками, с весьма продолжительным клеточным циклом.
У прямокрылых, наоборот, мы имеем дело с типичной обновляющейся
популяцией с четким топографическим разделением дифференцированных
и камбиальных клеток. Последние образуют скопления — «узелки», или
гнезда, которые закономерно чередуются с участками, где располагаются
высокопризматические дифференцированные всасывающие клетки
(рис. 24). Такие отношения наблюдаются, например, в строении кишеч-
ного эпителия саранчи. Имеются данные о том, что в кишечном эпителии
саранчи полное обновление клеточного состава кишечного эпителия в ак-
тивный период жизни животного происходит в течение двух суток. Та-
ким образом, в данном случае мы, очевидно, имеем дело с весьма динамич-
77
ной обновляющейся системой, вполне сопоставимой с кишечным эпите-
лием высших позвоночных.
Наряду с этими крайними в смысле организации тканевых систем
отношениями среди насекомых можно найти большое количество пред-
ставителей, занимающих по скорости обновления кишечного эпителия
промежуточное положение между прямокрылыми и двукрылыми насе-
комыми.
Процессы энергичного обновления кишечного эпителия насекомых
могут обусловливаться не только небольшой длительностью существова-
ния дифференцированных всасывающих клеток. Они могут быть связаны
с секреторной активностью железистых клеток. Так, например, у жука-
плавупца пищеварительные ферменты в средней кишке выделяются путем
Рис. 24. Эпителий средней кишки саранчи.
1 — всасывающие клетки, 2 — камбиальные «узелки».
разрушения железистых клеток, что сопровождается их пополнением за
счет митотического размножения камбиальных клеток, расположенных
в особых трубкообразных выростах кишечного эпителия в стенке кишки
(рис. 25).
Аналогичные процессы обнаруживаются и в кишечном эпителии медо-
носной пчелы. Здесь непрерывно происходит образование мелких базо-
фильных секреторных клеток, выделяющих пищеварительные ферменты
в полость кишки по голокриновому типу секреции, т. е. путем разруше-
ния клеток.
Весьма своеобразные отношения наблюдаются также в строении ки-
шечного эпителия гусениц. Этот эпителий может представлять собой,
как например у шелкопряда, сложную систему. Ее крупные дифферен-
цированные всасывающие клетки образуются в результате сомати-
ческой полиплоидизации малодифференцированных камбиальных клеток.
Последние имеют строго запрограммированное количество делений, необ-
ходимое для обеспечения замены отработавших дифференцированных
полиплоидных клеток.
Мепее варьирует строение кишечного эпителия у ракообразных (см.
обзор: Weel, 1970). Средний отдел пищеварительного тракта представлен
здесь относительно короткой средней кишкой, снабженной несколькими
парами слепых трубкообразпых выростов. Весь этот комплекс носит на-
звание пищеварительной железы, или, по старой терминологии, гепато-
панкреаса. У некоторых ракообразных эктодермальный кишечный эпи-
телий выстилает и конечную часть переднего отдела пищеварительного
78
тракта — желудок. Центральную роль в процессах полостного пищеваре-
ния играет пищеварительная железа. Возможно также, что выстилающий
отдельные выросты этой железы кишечный эпителий играет основную
роль и в процессах всасывания низкомолекулярных продуктов, образую-
щихся под действием пищеварительных ферментов в полостях среднего
отдела пищеварительного тракта. Кишечный эпителий пищеварительной
железы представляет собой весьма сложную и гетерогенную по морфо-
биохимической дифференцировке клеток систему. В ней имеется не-
сколько специализированных в различных направлениях типов клеток: не-
сколько разновидностей секреторных, всасывающие клетки и экскреторные
клетки, накапливающие в себе различные продукты обмена. Эпителий
Рис. 25. Участок стенки тонкой кишки
жука-плавунца.
1 — зона размножения клеток, 2 — эпителий
кишки.
Рис. 26. Автограф камбиальной зоны
гепатопанкреаса бокоплава Gammarus sp.
через 4 часа после инъекции 3Н-ти-
мидина.
пищеварительных желез ракообразных представляет собой энергично
обновляющуюся клеточную популяцию, имеющую обычно четко локализо-
ванные субпопуляции малодифференцированных камбиальных элементов.
Как показали опыты с 3Н-тимидином, последние располагаются в ди-
стальных отделах железистых выростов (рис. 26). Продукты размноже-
ния этих клеток дифференцируются в различные специализированные
клетки эпителия среднего и проксимального отделов выростов железы.
Время полного обновления клеточного состава эпителия железистого вы-
роста занимает у представителей Decapoda (Procamborus blandingii) около
5 суток (Davis, Burnett, 1964). Помимо таких систем камбиальных эле-
ментов, у бокоплавов имеются специальные камбиальные зоны и для
энергичного обновления эпителия средней кишки.
В настоящее время нет еще полной ясности о характере гистогепе-
тических взаимоотношений клеток эпителия железистых выростов рако-
образных. По аналогии с другими кишечными эпителиями вероятнее пред-
положить, что каждый тип клеток представляет собой особое направление
дифференцировки продуктов размножения камбиальных клеток. Не ис-
ключена, однако, возможность, что мы имеем здесь дело лишь с последо-
вательными этапами жизненного цикла одного типа дифференцирую-
щихся клеток (Stanier et al., 1968; Loizzi, 1971).
Своеобразную модификацию в процессе эволюции приобретает кишеч-
ный эпителий у специализированной группы членистоногих — кровососу-
79
щих клещей (Балашов, 1967; Райхель, 1975). Строение и свойства эпи-
телия средней кишки и желудка этих животных, а также динамика его
морфофункциональпых изменений в процессе поглощения крови и ее
переваривания представляют большой интерес в плане изучения эволюци-
онной динамики кишечных эпителиев многоклеточных животных. У рас-
сматриваемых специализированных высших представителей первичноро-
тых животных процессы питания и пищеварения приурочены к опреде-
ленным периодам жизненного цикла и постнатального онтогенеза. При
этом по характеру питания и длительности переваривания пищи, а также
клеточным механизмам поглощения и переваривания крови наблюдаются
отличия в двух основных группах кровососущих клещей — аргасовых и
иксодовых клещей.
У аргасовых клещей процессы пищеварения и поглощения питательных
веществ рассредоточены па продолжительный период, и различия между
строением и свойствами кишечного эпителия в период «покоя» (у голо-
дающих животных) и в период активной фазы пищеварения выражены
менее резко, чем у иксодовых клещей с их одноразовым питанием на
определенной стадии жизненного цикла. У аргасовых и иксодовых клещей
в основе системы кишечного эпителия лежат так называемые резервные,
или камбиальные, клетки. У длительно голодающих особей они состав-
ляют большую часть клеток эпителиального пласта, имеют кубическую
форму с плохо выраженными на обычных препаратах границами клеток.
Помимо этих клеток у аргасовых клещей имеется небольшое количество
секреторных и пищеварительных клеток — двух направлений диффенци-
ровки камбиальных клеток. Секреторные клетки выделяются крупными
размерами, достигая 60—120 мкм высоты и 20—30 мкм ширины и вы-
даются в просвет своими апикальными концами. Они содержат в апи-
кальных концах вакуоли, наполненные мукополисахаридами, а также
гранулы гликогена. Пищеварительные клетки имеют булавовидную
форму. В их цитоплазме содержатся различные включения, в основном
белкового характера. Кроме того, здесь же обнаруживаются гранулы
гликогена и многочисленные жировые включения. Часть пищеваритель-
ных клеток, перегруженных включениями и особенно гематином, оттор-
гаются в просвет, где некоторое время существуют, а затем разрушаются
и гибнут. При попадании в кишечник свежей крови прежде всего имеет
место массовое разрушение секреторных клеток. Оно сопровождается
интенсивным делением камбиальных клеток и ускоренной дифференци-
ровкой их в новые секреторные и пищеварительные клетки. Часть диф-
ференцированных клеток, и секреторных и пищеварительных, слущи-
вается в полость кишки. В дальнейшем в пищеварительных клетках, как
свободно плавающих в крови, так и входящих в состав эпителиального
пласта, происходит активное накопление включений. Основным механиз-
мом его является поглощение продуктов разрушения крови путем пино- и
фагоцитоза. Наряду с этим имеет, по-видимому, место и поглощение путем
всасывания. На это указывает наличие у многих пищеварительных кле-
ток структур, напоминающих щеточную каемку кишечного эпителия, т. е.
аппарата микроворсинок. Таким образом, у аргасовых клещей имеет ме-
сто своеобразная комбинация внутриклеточного пищеварения с поло-
стным пищеварением и всасыванием, при высоком темпе обновления
кишечного эпителия в период активной фазы пищеварения.
Еще в большей степени выражена сложная динамика циклических из-
менений в кишечном эпителии иксодовых клещей. У голодных взрослых
клещей кишечный эпителий образован преимущественно камбиальными
клетками. Лишь изредка здесь встречаются крупные пищеварительные
клетки. Сразу после прикрепления клеща к животному, еще до попада-
ния пищи в кишечник, происходит образование первой генерации секре-
торных клеток. С поступлением пищи в кишку происходит массовая ги-
бель и отторжение секреторных клеток. Продукты их разрушения обеспе-
80
чпвают гемолиз эритроцитов. В это время начинают интенсивно размно-
жаться камбиальные клетки. Образующиеся в результате их размножения
клетки дифференцируются в генерацию пищеварительных клеток.
Эти клетки энергично поглощают питательные вещества и по внеш-
нему виду приобретают черты сходства с секреторными. Они также мо-
гут выходить из состава пласта и располагаться свободно в полости
кишки. В период максимального растяжения стенки кишки, что соответ-
ствует моменту перехода клеща к свободному образу жизни, большинство
клеток кишечного эпителия повой геперации отторгается в просвет кишки
и гибнет. Кишечный эпителий представлен в этот момент лишь сильно
уплощенными камбиальными клетками. По мере всасывания воды из по-
лости кишки в кишечном эпителии наступает новая вспышка митозов
с последующей дифференцировкой преимущественно пищеварительных
клеток. Они фагоцитируют продукты разрушения кровяных элементов,
увеличиваются в размерах, заполняют апикальными концами просвет
кишки. Особенностью процессов пищеварения в клетках этой последней
геперации являются весьма медленно идущие процессы расщепления и
утилизации пищевых продуктов. Иными словами, пищеварительные
клетки здесь являются своеобразным резервуаром, выполняя функцию
клеток печени, жировой ткани или жирового тела других высших мно-
гоклеточных животных. Таким образом, у иксодовых клещей высокий
уровень интеграции кишечного эпителия проявляется в последовательном
во времени образовании нескольких генераций дифференцированных сек-
реторных и пищеварительных клеток. При этом каждая их генерация ха-
рактеризуется существенными особенностями соответственно времени ее
появления в процессе поглощения пищи. Очевидно, что такая мульти-
функциональная дифференцировка клеток, образующихся в результате
размножения камбиальных клеточных элементов, возможна лишь при
условии очень совершенной организации тканевой системы. При этом
основным механизмом поглощения питательных веществ является древ-
ний механизм внутриклеточного пищеварения, специально приспособлен-
ный к постепенному использованию больших запасов пищи. Интересно
отметить, что у одной разновидности пищеварительных клеток форми-
руется постоянный пиноцитозный комплекс, аналогичный такому же
комплексу у всасывающих клеток новорожденных млекопитающих.
Беспозвоночные животные средних уровней
организации (полихеты, приапулиды, моллюски,
оболочники и иглокожие)
Кишечный эпителий вторичноротых (морские звезды, голотурии, ас-
цидии) и ряда групп первичноротых среднего уровня организации (поли-
хеты, приапулиды, пластинчатожаберные и брюхоногие моллюски) харак-
теризуется относительно большим разнообразием своего строения, внут-
ренней организации и специфической дифференцировкой образующих его
клеток. У большинства этих групп животных преобладает полостное пи-
щеварение. Однако у ряда форм, например у брюхоногих и пластинчато-
жаберных моллюсков, прогрессивное развитие получают, наоборот,
процессы внутриклеточного пищеварения. Эти процессы происходят
в железистых разветвлениях кишечной трубки. Они могут сочетаться
с предварительным ферментативным расщеплением заглоченной пищи.
Широкое распространение у моллюсков процессов внутриклеточного
пищеварения с соответствующей специализацией пищеварительных клеток
на процессы пино- и фагоцитоза сочетается со сложной системной, ткане-
вой организацией клеточных элементов. В качестве примера можно
привести отношения, наблюдаемые у одного из голожаберных моллюсков
Coryphella rufibranchialis (Обухова, 1975). У этого моллюска основные
процессы поглощения питательных веществ происходят в так называемых
6 А. А. Заварзин
81
печеночных разветвлениях кишечника. Они представляют собой тонкие
разветвленные трубчатые выросты кишечника, выстланные однослойным
сложнодифференцированным эпителием. На поперечных разрезах таких
трубчатых структур видно, что эпителий состоит из закономерно располо-
женных трех типов клеток (рис. 27). Наиболее крупные клетки со свет-
лой цитоплазмой занимают вершину и боковые поверхности складок. Мел-
кие клетки с базофильной цитоплазмой расположены, наоборот, в основа-
нии складок.
Опыты с 3Н-тимидином показывают, что крупные клетки представляют
собой дифференцированные, активно функционирующие клеточные эле-
Рис. 27. Поперечный срез папиллы голожаберного моллюска Coryphella rufibranchialis
на уровне пищеварительной железы. (Из: Обухова, 1975).
1 — пищеварительные клетки, 2 — известковые клетки, 3 — недифференцированные клетки,
4 — покровный эпителий.
менты, почти полностью утратившие способность к размножению. Мелкие
клетки, наоборот, являются пролиферативным резервом тканевой си-
стемы, и относительно большой процент их находится в цикле репродук-
ции. Помимо этих клеток в эпителии печеночных выростов имеются еще
и клетки с очень крупными, по-видимому, полиплоидными ядрами и резко
базофильной цитоплазмой, в которой хорошо развита шероховатая эндо-
плазматическая сеть с многочисленными рибосомами. Эпителий печеноч-
ных выростов представляет собой обновляющуюся тканевую систему,
камбиальные клетки которой дифференцируются в двух направлениях:
в направлении пищеварительных фагоцитирующих клеток и в направле-
нии специализированных секреторных клеточных элементов. Обновление
пищеварительных клеток происходит за 10—15 дней и имеет четко выра-
женный поляризованный характер, поскольку наиболее старые клетки
располагаются на вершине складок. Пищеварительные клетки в течение
этого периода претерпевают характерные циклические изменения, связан-
ные с поглощением и перевариванием пищи. Сложность системной орга-
низации такого кишечного эпителия проявляется и в наличии в нем еще
одной весьма своеобразной клеточной системы. Она располагается на вер-
шине печеночных выростов и образует основную часть стрекательных
мешков, или книдосаков. Малодифференцированные камбиальные клетки
этой системы продуцируют особые клеточные элементы, в которые попа-
82
дают из полости печеночного выроста непереваренные стрекательные кап-
сулы гидроидных полипов, служащих пищей моллюскам. В дальнейшем
эти стрекательные капсулы, располагаясь в специализированных клетках
стрекательных мешков, выполняют защитную функцию. При сокращении
специальных мышц происходит выбрасывание клеток со стрекательными
капсулами в наружную среду, где освобождаются стрекательные нити,
предохраняющие моллюсков от преследующих их хищных животных.
3
Рис. 28. Схема процессов физиологической регенерации в эпителиальной выстилке
стрекательного мешка и пищеварительной железы у голожаберного моллюска Со-
ryphella rufibranchialis. (Из: Обухова, 1975).
1 — стрекательный мешок, 2 — эпителий стрекательного мешка, з — стрекательные капсулы, 4 —
камбиальная зона мешка, 5 — клетка, мигрирующая через канал в камбиальную зону мешка, 6 —
камбиальные клетки дистального участка пищеварительной железы, 7 — полость пищеварительной
железы, 8 — пищеварительная, 9 — известковая, 10 — недифференцированная клетки, 11 — по-
кровный эпителий. Стрелки показывают направление перемещения клеток в процессе физиологиче-
ской регенерации.
В опытах с 3Н-тимидином удалось показать, что пополнение убыли
клеток происходит за счет размножения малодиффенцированных кле-
ток, расположенных в основании стрекательных мешков. Эта относительно
автономная система подсевается, однако, малодифференцированными
клетками за счет размножения и миграции клеток из дистального отдела
пищеварительной железы (рис. 28).
Большое количество исследований выполнено и на эпителии пищева-
рительной железы пластинчатожаберных моллюсков. Общий принцип его
организации с гистологической точки зрения сходен с описанным уже выше
6*
83
Рис. 30. Схема взаимосвязи приливно-отливного ритма с цикличной работой пищеварительной железы у некоторых
пластинчатожаберных моллюсков. (По: Morton, 1970; рис. М. Ю. Пунина).
Рис. 29. Схема строения пищеварительной клетки пластинчатожаберных моллюсков. (По: Owen, 1972; рис.
М. Ю. Пунина).
1 — микроворсинка, 2 — пиносома, 3 — митохондрия, 4 — гетерофагосома, 5 — гетеролизосома, 6 — остаточные тела, 7 — липид-
ная капля.
эпителием голожаберных моллюсков. В основе организации отдельных
трубчатых концевых отделов железы лежит система камбиальных мало-
дифференцированных клеток, располагающихся в дистальном конце сле-
позамкнутого канала выростов. За счет размножения этих клеток форми-
руются дифференцированные, преимущественно пищеварительные клетки.
Они имеют хорошо развитый лизосомный аппарат, кроме того, па апи-
кальной поверхности клеток имеются микроворсипки. Хорошо развиты
здесь и сложно ориентированные системы микротрубочек (рис. 29). Пред-
полагают, что они участвуют в процессах транспортировки пиноцитозных
пузырьков. Пищеварительные клетки претерпевают существенные изме-
Рис. 31. Схема строения эпителия пищеварительной железы пластинчатожаберного
моллюска Муа arenaria, (Из: Пунин, 1975).
7—3 — пищеварительные трубки на поперечном (1, 2) и продольном (3) разрезах, 4 — пищеваритель-
ные клетки, 5 — базофильные клетки, 6 — недифференцированные клетки, 7 — камбиальная зона
слепозамкнутого конца трубки, 8 — проток железы.
нения в процессе поглощения и переваривания пищи (рис. 30). Имеются
морфологические данные об относительно небольшой продолжительности
их жизненного цикла и наличии непрерывного массового обновления вы-
стилки желез по завершении одного пищеварительного цикла (McQuiston,
1969; Morton, 1970; Owen, 1972). Регенерация эпителия пищеварительных
выростов из малодифферепцированных базофильных клеток показана и
в опытах с действием ионизирующего излучения (Mix, Sparks, 1971).
Предварительные данные опытов с 3Н-тимидином па беломорском пла-
стинчатожаберном моллюске Муа arenaria свидетельствуют, однако, об
относительно медленном обновлении эпителиального пласта. Дифференци-
роваппые клетки с мечеными ядрами появляются в этих опытах через
5—10 суток после инъекции 3Н-тимидина (рис. 31). Наряду с этим
у другого исследованного с помощью 3Н-тимидина пластинчатожаберного
моллюска Масота calcarea удается наблюдать резкое усиление пролифе-
ративной активности и скорости дифференцировки пищеварительных кле-
ток в течение суток на протяжении двух приливно-отливных циклов (Пу-
нин, 1975).
Сложность системной организации кишечного эпителия у моллюсков
проявляется также и в весьма высокой дифференцированности вспомо-
85
гательного ресничного аппарата, особенно ярко выраженной у пластинча-
тожаберных моллюсков. Здесь он играет основную роль в сортировке и
перемещении пищевых частиц к участкам эпителия, где происходит ути-
лизация этих продуктов.
Не менее сложная системная организация кишечных эпителиев на-
блюдается у животных рассматриваемого уровня организации, у которых
преобладает полостное пищеварение. В качестве примера здесь удобнее
рассмотреть кишечный эпителий у одной из широко распространенных
полихет Arenicola marina (Вагановская, 1973). Основная масса желези-
стых клеток, обеспечивающих выработку секретов, необходимых для по-
лостного пищеварения, локализована здесь в составе однослойного эпите-
лиального пласта. В средних отделах пищеварительного тракта выделя-
ется расширенный желудок и более длинная суженная часть — средняя
кишка.
Среди железистых клеток имеется несколько разновидностей бокало-
видных клеток, выделяющих секрет, содержащий сульфатированные му-
кополисахариды, и отличающихся друг от друга характером секретор-
ного цикла. Вторым типом железистых элементов, локализованных
в области желудка, являются крупные клетки с резко базофильной
цитоплазмой и хорошо развитой шероховатой эндоплазматической сетью
с большим количеством рибосом на наружной поверхности мембран, огра-
ничивающих просветы каналов и цистерн эндоплазматической сети.
Апикальные отделы этих клеток имеют конусовидную форму и выходят
на поверхность пласта в виде узкого цитоплазматического отростка
(рис. 32).
Основная масса эпителия желудка состоит из крупных клеток с окси-
фильной цитоплазмой и отчетливо выраженной щеточной каемкой, кото-
рая представляет собой хорошо развитые микроворсинки, что указывает
на всасывающую функцию этих клеток. Они имеют также хорошо разви-
тые лизосомы, шероховатую и гладкую эндоплазматическую сеть, две
разновидности аппаратов Гольджи и четыре разновидности митохондрий.
Помимо микроворсинок на апикальной поверхности клеток, микро-вор-
синки имеются также и в верхней части боковых поверхностей клеток и
в области впячивания апикальной поверхности плазматической мембраны
внутрь клетки. Все эти морфологические признаки указывают на слож-
ный мультифункциональный характер специфической дифференцировки
этих клеток. Помимо процессов всасывания они обладают, по-видимому,
способностью поглощать пищевые частицы путем пино- и фагоцитоза. Воз-
можно также, что они способны в ограниченных пределах к активной спе-
цифической секреторной деятельности. В эпителии желудка изредка
встречаются и клетки с большим количеством митохондрий. Функцио-
нальное значение их остается неясным.
Длительные опыты с 3Н-тимидином (ежедневные инъекции в тече-
нпе 6—10 суток) показали весьма слабую интенсивность обновления ос-
новной массы эпителиального пласта. В этих опытах удалось обнаружить
лишь единичные меченые клетки. Количество последних среди всасываю-
щих клеток заметно увеличивалось лишь к 10-м, 20-м суткам после
инъекции 3Н-тимидина. Наряду с этим на вентральной стороне пищевари-
тельной трубки, а также по медиальной линии дорсальной стороны, а ме-
стами и на боковых стенках имеются участки эпителия, резко отличаю-
щиеся от основной массы пласта размерами клеток и характером их диф-
ференцировки. Эти участки состоят из вытянутых цилиндрических клеток
с хорошо развитым ресничным аппаратом. Среди основной массы встре-
чаются и бокаловидные слизистые клетки. Характерной особенностью
этих участков эпителия является их интенсивное обновление. В упомя-
нутых выше опытах количество меченых клеток достигает здесь в течение
6 суток насыщения животных 3Н-тимидином 30, а через 8 суток после
десятикратных инъекций — даже 70 процентов (рис. 33).
86
3
Рис. 32. Эпителий желудка полихеты Arenicola marina. (Из: Кагановская, 1973).
а — участок эпителия, б, в — схема строения всасывающей (б) и белковой (в) клеток. 1 — всасываю-
щие клетки, 2 — белковые клетки, 3 — внутриклеточный канал с микроворсинками, 4 — межклеточ-
ный канал с микроворсинками, 5 — остаточное тело, 6 — гранулы зимогена, 7 — фаголизосомы на
разных стадиях переваривания, 8 — фибриллярная митохондрия, 9 — липидные капли, 10 — ап-
парат Гольджи, 11 — шероховатая эндоплазматическая сеть.
Таким образом, в кишечном эпителии рассматриваемой полихеты мы
имеем дело с весьма сложной и гетерогенной тканевой системой, пред-
ставляющей собой своеобразную комбинацию растущих и обновляющихся
клеточных популяций, интегрированных в одной тканевой системе. В диф-
ференцированных клетках эпителия средней кишки и желудка Arenicola
marina наблюдаются специализированные структуры, аналогичные струк-
турам высших многоклеточных животных. Так, в базофильных клетках
эпителия желудка имеется хорошо развитая система внутриклеточных
каналов, в которых находятся микроворсинки. Такие каналы характерны
и для некоторых дифференцированных клеток эпителия желудка позво-
Рис. 33. Автограф складки ресничного эпителия желудка полихеты Arenicola marina
через 18 суток после 10-суточных ежедневных инъекций 3Н-тимидина. (Из: Вага-
новская, 1973).
1 — ресничный эпителий, 2 — железисто-всасывающий эпителий.
ночных. В эпителии средней кишки A. marina обнаружена пластинка
внеклеточного вещества, напоминающая по своему положению гипертро-
фированный надмембранный комплекс (рис. 34).
У хищных полихет рода Nereis в кишечном эпителии не удается на-
блюдать такого разнообразия клеток, однако общая скорость обновления
кишечного эпителия у пих выше. Обновление происходит за счет размно-
жения малодифферепциронаппых клеток, диффузно распределенных
в эпителиальном пласте.
Весьма сложной организации достигает средний отдел пищеваритель-
ного тракта у афродитид (Harmothoe imbricata). Средняя кишка
образует в каждом сегменте относительно большие железистые выросты.
Выстилающий эпителий, как и эпителий средней кишки, представляет
собой обновляющуюся систему. Источником обновления служат специаль-
ные менее дифференцированные клетки. В средней кишке пролиферирую-
щие клетки расположены в основании складок эпителия в виде отдель-
ных групп клеток (рис. 35). Специальная система малодифферепцирован-
ных клеток имеется и в начальном отделе каждого железистого выроста,
откуда происходит обновление выстилки протока, клетки которого несут
88
Рис. 34. Всасывающая клетка средней кишки полихеты Arenicola marina. (Из: Вага-
новская, 1973).
1 — микроворсинки, 2 — терминальная сеть протофибрилл, 3 — соединительный комплекс,
4 — тонофибриллы, 5 — остаточное тело, 6 — надмембранный комплекс.
на своей апикальной поверхности хорошо развитые реснички. Особая
диффузно рассредоточенная система камбиальных клеток имеется и в каж-
дом железистом выросте.
У близкой в систематическом отношении к полихетам небольшой
группы приапулид кишечный эпителий имеет своеобразное строение. Он
представляет собой однослойный собранный в складки пласт высокоприз-
матических клеток, характеризующихся мультифункциональной актив-
ностью. С одной стороны, эти клетки продуцируют пищеварительные фер-
менты, обеспечивающие процессы полостного пищеварения. С другой
стороны, они же, очевидно, и поглощают образующиеся низкомолекуляр-
ные продукты. Несмотря на отсутствие четкой функциональной диффе-
ренцировки, клетки и их
ядра резко отличаются по
форме в зависимости от их
расположения на вершине
или в основании складок
(рис. 36). Тем не менее
здесь отсутствует топо-
графическая дифферен-
циация в локализации
в пласте процессов проли-
ферации клеток. Более
того, эти процессы имеют
четко выраженный . рит-
мический характер. В хро-
нических опытах с мно-
Рис. 35. Автограф кишечного
эпителия полихеты Harmothoe
imbricate, через 3 суток после
ежедневных инъекций 3Н-ти-
мидина.
z — зона размножения клеток,
2 — всасывающие клетки.
гократными инъекциями 3Н-тимидина удалось показать, что у части жи-
вотных в кишечном эпителии меченые ядра почти полностью отсутство-
вали, в то время как у других животных около половины всех клеток
проходили в течение опыта период синтеза ДНК, причем меченые ядра
имелись как на вершине, так и в основании складок (рис. 37).
Весьма интересные данные* получены в последнее время относительно
системной организации кишечного эпителия у аскариды — представителя
своеобразной узкоспециализированной группы паразитических нематод
(Анисимов и др., 1974). У этих животных, характеризующихся постоян-
ством клеточного состава во многих тканях, в кишечном эпителии обна-
ружены картины гибели клеток и их митотического размножения. Нали-
чие процессов физиологической регенерации в кишечном эпителии этих
весьма своеобразных животных свидетельствует, очевидно, о том, что про-
цессы клеточного обновления являются стойким типовым признаком ор-
ганизации кишечных эпителиев и сохраняются у животных, несмотря на
то что в других тканях они уже полностью утрачены.
Широкое распространение в кишечном эпителии различных групп
беспозвоночных животных имеет сочетание процессов репродукции клеток
и соматической полиплоидизации всасывающих или секреторных клеток.
Такие отношения описаны в эпителии желудка морской звезды (Воробьев,
Лейбсон, 1974). Они имеют, по-видимому, место и у других беспозвоноч-
ных животных. Так, в частности, характерные для полиплоидных клеток
эпителия желудка морской звезды сигаровидные вытянутые ядра обнару-
90
живаются в клетках кишечного эпителия хищных полихет, приапулид
и других беспозвоночных животных.
Четко топографически выделенные камбиальные системы обнаружены
в эпителии кишки и желудка у асцидий (Мовчан и др., 1971; Кучко,
Рис. 36. Эпителий кишки Priapulus caudatus.
а — вершина, б — основание складки.
Рис. 37. Автограф кишечного эпителия
Priapulus caudatus через 5 суток после
ежедневных инъекций 3Н-тимидина
{стрелками указаны маркированные
ядра).
Рис. 38. Автограф камбиальной зоны
кишки асцидии на 3-и сутки после
ежедневных инъекций 3Н-тимидина.
(Из: Кучко, 1975).
1975; Ermak, 1975). В кишечном эпителии асцидий такой системой яв-
ляется участок эпителия, выстилающий желобкообразное впячивание на
вентральной поверхности кишки (рис. 38). Здесь сосредоточены все про-
лиферирующие клетки. В опытах с 3Н-тим!Идином удается показать, что
за 7 суток ежедневных инъекций индекс меченых ядер достигает в этом
участке 70%. Скорость распространения образующихся в результате раз-
91
мпожения клеток по эпителиальному пласту и их специфической диф-
ференцировки варьирует у отдельных животных. Однако к 30-м суткам
после начала опыта клетки с мечеными ядрами у некоторых животных
обнаруживаются во всех участках эпителиальной выстилки кишки. В эпи-
телии желудка асцидий имеются две зоны пролиферации клеток — в осно-
вании складок и в основании расширенных вершин складок. Участки
эпителия основания складок сходны по морфологии образующих их кле-
ток с участками эпителия в камбиальной зоне кишки. Однако скорость
миграции и дифференцировки клеток, а также интенсивность их проли-
ферации здесь в 2—3 раза ниже, чем в эпителии кишки. Зоны пролифе-
рирующих клеток в основании вершин складок представлены слизистыми
клетками. Их пролиферация обеспечивает обновление слизистых клеток
на вершине складок.
КИШЕЧНЫЕ ЭПИТЕЛИИ НИЗШИХ МНОГОКЛЕТОЧНЫХ
(ГУБКИ, КИШЕЧНОПОЛОСТНЫЕ, ТУРБЕЛЛЯРИИ)
У современных свободноживущих многоклеточных животных наиболее
примитивные отношения в организации кишечных эпителиев обнаружи-
ваются у губок и низших турбеллярий (Беклемишев, 1964; Иванов, Мам-
каев, 1973). У губок процессы поглощения питательных веществ осуще-
ствляются группами весьма сложно дифференцированных клеток.
У некоторых губок они образуют выстилку внутренней полости этих живот-
ных, у других расположены в специальных каналах, пронизывающих тело
губки (рис. 39). Клетки имеют развитый жгутиковый аппарат и сложно
дифференцированную апикальную часть цитоплазмы в виде воротничка.
Сюда под действием тока жидкости, создаваемого жгугиком, и поступают
пищевые частицы. Последние поглощаются специализированными участ-
ками плазматической мембраны в углублениях воротничка путем фагоци-
тоза. Фагоцитированные частицы у одних видов губок перевариваются
самими жгутиковыми клетками, у других видов они передаются амебоци-
там. Переваривание в обоих случаях идет по типу внутриклеточного пище-
варения. Примитивность тканевой организации системы таких сложнодиф-
ференцированных жгутиковых клеток проявляется и в функциональной
автономности каждой клетки, и в отсутствии структурной и гистоге-
нетической интеграции их в единую систему. У некоторых губок описана
возможность обратимого превращения жгутиковых клеток в подвижные
амебоциты тела животного и, наоборот, дифференцировка их из этих аме-
боцитов. Способность определенной субпопуляции последних к превра-
щению во все остальные клеточные элементы тела губки была показана
недавпо в опытах с культивированием комплексов амебоцитов (Ефремова,
Никитин, 1973).
Среди отдельных представителей губок наблюдаются различные взаи-
моотношения между специализированными жгутиковыми клетками и
амебоцитами стенки тела. Так, у известковых губок жгутиковые клетки —
хоаноциты и захватывают и переваривают питательные вещества. У крем-
невых и кремнероговых губок пищу улавливают хоаноциты, но затем пе-
редают ее амебоцитам, которые и осуществляют процессы внутриклеточ-
ного пищеварения. Накопец, у некоторых губок хоаноциты осуществляют
лишь гидрокинетическую роль. Процессы же поглощения и внутриклеточ-
ного переваривания пищи берут на себя крупные специализированные
амебоциты.
Весьма своеобразные отношения в организации процессов поглощения
питательных веществ наблюдаются у низших турбеллярий (Иванов, Мам-
каев, 1973). Здесь эти процессы в простейших случаях осуществляются
сцециальными пищеварительными клетками, представленными разроз-
ненными фагоцитами, блуждающими в паренхиме (рис. 40).
92
•]
Рис. 39. Схема строения тела губки. (По: Andrew, 1959).
I — парагастральная полость, 2 — хоаноциты, з — амебоциты, 4 — яйцеклетки, 5 — спикулы,
6 — мезоглея.
Рис. 40. Процессы фагоцитоза
в паренхиме бескишечных турбел-
лярий. (Из: Иванов, Мамкаев,
1973).
1 — паренхима, 2 — фагоцит, 3 — пи-
щевая масса.
Рис. 41. Схема физиологической регенерации
эпителия кишки за счет клеток паренхимы у не-
которых турбеллярий. (Из: Иванов, Мамкаев,
1973).
1 — покровный эпителий, 2 — соединительнотканные
клетки, 3— вакуолизированные клетки паренхимы, 4 —
кишечный эпителий, 5 — малодифференцированные
клетки.
У более высокоразвитых бескишечных турбеллярий эти разрозненные
фагоциты собираются в общий пищеварительный синцитий. Проглочен-
ная пища переваривается в вакуолях такого синцития по принципу внут-
риклеточного пищеварения. Однако у некоторых видов бескишечных тур-
беллярий имеет место тенденция к использованию и полостного пищева-
рения, в связи с чем в их паренхиме имеются железистые клетки. Полную
реализацию эта потенция получает у кишечных турбеллярий, у которых
кишечник выстлан однослойным железистым или однослойным реснич-
ным эпителием. Такой эпителий уже обладает способностью всасывать
низкомолекулярные продукты расщепления пищевых частиц, образую-
щиеся под действием секрета пищеварительных желез переднего отдела
пищеварительного тракта. У некоторых турбеллярий имеет место
процесс своеобразной физиологической регенерации кишечного эпителия.
Рис. 42. Схема строения гастродермального эпителия гидры. (Рис. М. Ю. Пунина).
1 — абсорбционные клетки (эпителиально-мышечные), 2 — перерезанные мышечные фибриллы эпи-
телиально-мышечных клеток, 3 — секреторные слизистые клетки, 4 — зимогенные клетки, 5 —
недифференцированные интерстициальные клетки, 6 — мезоглея.
Клетки эпителия, осуществившие акт пищеварения, гибнут, а восстанов-
ление нового эпителия идет за счет размножения камбиальных элементов
(рис. 41).
У представителей кишечнополостных процессы внутриклеточного пи-
щеварения уже не имеют доминирующего значения. Даже у наиболее
примитивных или у таких вторично упрощенных форм, как пресновод-
ная гидра, кишечный эпителий представляет собой всегда организованный
пласт с дифференцировкой на железистые и всасывающие клетки
(рис. 42). Последние часто имеют реснички и обладают способностью,
правда в ограниченных пределах, к процессам пино- и фагоцитоза. Диф-
ференцировка железистых клеток у высших представителей кишечнопо-
лостных может достигать большого разнообразия. Они могут выделять,
помимо различного рода ферментов, еще и слизеподобные вещества, иг-
рающие вспомогательную роль в процессах полостного пищеварения.
У многих групп кишечнополостных наблюдается концентрация желези-
стых элементов в определенных участках эпителиального пласта. При
этом у гидроидных полипов с помощью 3Н-тимидина удалось показать
закономерное и достаточно интенсивное обновление зрелых железистых
клеток, имеющих относительно непродолжительный жизненный цикл, ис-
числяемый несколькими сутками (рис. 43). При наличии определенных
зон камбиальных клеток и зрелых железистых клеток в пласте здесь
наблюдаются отношения, сходные с отношениями, наблюдаемыми в об-
новляющихся клеточных популяциях высших животных (Braverman.
1968).
У многих кишечнополостных, и в частности у гидры, показано до-
вольно интенсивное обновление всасывающих клеток, хотя по последним
94
данным здесь нет камбиальных зон — центров усиленного размножения
клеток (Campbell, 1967).
Наряду с этими признаками относительно высокой организации ки-
шечного эпителия у кишечнополостных не наблюдается ярко выраженной
специализации наружной поверхности всасывающих клеток с образова-
нием типичных микроворсинок с их сократимым аппаратом и специфи-
чески дифференцированной плазматической мембраной (Gauthier, 1963).
Широкое распространение имеют здесь и эпителиально-мышечные клетки.
Расположение мышечных отростков этих клеток обычно перпендикулярно
Рис. 43. Схема обновления железистых клеток кишечного эпителия гидроидного
полипа. (По: Braverman, 1968; рис. М. Ю. Пунина).
1 — малодифференцированные клетки в основании складки, 2 — секреторные клетки на вершине
складки. Стрелкой показано направление перемещения клеток в процессе физиологической регене-
рации.
по отношению к их расположению у эпителиально-мышечных клеток на-
ружных покровов. Железистые клетки кишечного эпителия гидры в эк-
спериментальных условиях могут претерпевать процесс дедифференциа-
ции и давать начало всем специализированным клеткам животного. Из
таких дедифференцированных клеток могут образовываться клетки и
кишечного и кожного эпителиев и даже малодифферепцированные муль-
типотентные клеточные элементы. Из этих фактов можно заключить, что
процессы цитодифференциации в кишечном эпителии кишечнополостных
не блокируют необратимо способность некоторых клеток реализовать всю
имеющуюся в их ДНК наследственную информацию.
У низших многоклеточных имеются, следовательно, весьма своеобраз-
ные признаки организации кишечных эпителиев. Тем не менее у некото-
рых представителей и турбеллярий, и кишечнополостных отчетливо
проявляется характерная для всех многоклеточных общая тенденция фи-
логенетической дифференцировки кишечных эпителиев — образование од-
нослойных интегрированных обновляющихся эпителиальных пластов.
95
ЗАКЛЮЧЕНИЕ
Сопоставление разобранных выше фактов, характеризующих эволюци-
онную динамику кишечных эпителиев у разных групп многоклеточных
животных, целесообразно провести в двух основных аспектах.
Сначала мы подведем некоторые итоги по сравнительной цитологии
специализированных клеток и лишь затем рассмотрим проявление эволю-
ционных тенденций на уровне системных, тканевых механизмов.
Приведенный выше большой фактический сравнительно-цитологиче-
ский материал свидетельствует о наличии у трех основных типов специа-
лизированных клеток кишечного эпителия (всасывающих, пищеваритель-
ных и секреторных) общих признаков морфобиохимической дифферен-
цировки у разных животных.
У всасывающих клеток кишечного эпителия представителей различных
групп животных (первично- и вторичноротых) имеется сложный аппа-
рат всасывания — система микроворсинок с соответствующей специали-
зацией всей остальной структурной организации клеток на процессы
внутриклеточного транспорта и выведение утилизированных продуктов.
Широкое распространение и сходный характер морфобиохимической диф-
ференцировки всасывающих клеток в кишечных эпителиях животных, не
связанных близкими родственными связями, являются одним из проявле-
ний общих, типовых для всех кишечных эпителиев закономерностей его
усложнения в процессе эволюции. Наряду с этим сопоставление всасы-
вающих клеток у разных групп животных, и в частности у некоторых на-
секомых и высших позвоночных, указывает на наличие существенных осо-
бенностей и в их дифференцировке. К ним относится, например, широко
распространенное у насекомых сочетание секреторной и всасывающей
функций у одних и тех же клеток. Такого рода дуалистическая диффе-
ренцировка не свойственна в такой степени всасывающим клеткам выс-
ших позвоночных. У млекопитающих и многих других позвоночных сек-
реторные потенции всасывающих клеток реализуются лишь в выделении
мукопротеинового гликокаликса, или надмембранного комплекса, гипер-
трофированного на микроворсинках и играющего вспомогательную роль
в процессах пристеночного пищеварения и активного мембранного тран-
спорта. Всасывающие клетки позвоночных синтезируют и выделяют не-
которые гидролитические ферменты, необходимые для пристеночного пи-
щеварения.
У некоторых насекомых и, по-видимому, у ряда других групп живот-
ных, в частности у ириапулид и нематод, всасывающие клетки вырабаты-
вают все гидролитические ферменты, т. е. берут на себя функцию секре-
торных клеток поджелудочной железы и желудка позвоночных. Кроме
того, у многих насекомых они обладают способностью периодически или
постоянно выделять белки и хитин, необходимые для построения пери-
трофической мембраны.
У многих многоклеточных животных процессы полостного пищеваре-
ния и всасывания могут осуществляться клетками, не обладающими спе-
циальным аппаратом микроворсинок. Наконец, весьма вероятно, что этот
аппарат при более детальном сравнительно-цитологическом исследовании
у разных животных окажется далеко не идентичным, особенно на мо-
лекулярном и надмолекулярном уровнях его организации. В пользу та-
кого заключения говорят глубокие различия в механизмах транспорта
аминокислот и углеводов всасывающими клетками насекомых и млекопи-
тающих. У насекомых преобладает пассивный транспорт, а у млекопи-
тающих ведущее значение имеет их активный транспорт с помощью
«вмонтированных» в мембраны переносчиков, использующих энергию
АТФ. Все эти более или менее существенные частные особенности в диф-
ференцировке всасывающих клеток при полостном пищеварении отра-
жают, очевидно, известное многообразие их эволюционных потенций
96
в рамках определенных общих закономерностей. Последние в дифференци-
ровке всасывающих клеток обусловлены и общей функциональной зада-
чей и общими для всех клеток первичными механизмами активного
и пассивного мембранного транспорта.
Аналогичные отношения, очевидно, имеют место и в эволюционной
дифференцировке специализированных клеток, обеспечивающих процессы
внутриклеточного пищеварения. Использование одного и того же универ-
сального клеточного механизма пино-и фагоцитоза отнюдь не означает,
что у амебы, хоаноцита губок, в клетках печеночных выростов моллюсков
и, наконец, в пищеварительных клетках кишечного эпителия иксодовых
клещей этот механизм, а также другие связанные с ним системы клеток
работают абсолютно идентично. Известны, например, глубокие различия
лизосомного аппарата даже у двух разновидностей лейкоцитов позвоноч-
ных — микро- и макрофагов. Не менее существенные особенности, по-
видимому, имеются в самих механизмах пино- и фагоцитоза у хоаноци-
тов губок и у амебоцитов этих животных или в пищеварительных клетках
моллюсков. Тем не менее и здесь для всех клеток, специализированных
на процессах внутриклеточного пищеварения, будут характерны и общие
типовые признаки и многочисленные примеры параллельной филогенети-
ческой дифференцировки. Они обусловлены теми же причинами, что и
аналогичные явления при дифференцировке всасывающих клеток при
полостном пищеварении.
Особенно яркими примерами цитологических параллелизмов при вну-
триклеточном пищеварении являются постоянные пиноцитозные комп-
лексы, формирование которых имеет место у клеток эпителия кишки но-
ворожденных млекопитающих, в клетках пищеварительной железы пла-
стинчатожаберных моллюсков и в пищеварительных клетках кишечного
эпителия иксодовых клещей. Несмотря на некоторые особенности этих
структур у рассматриваемых животных, пиноцитозные комплексы пред-
ставляют собой сложный аппарат поверхностной части клеток. Он фор-
мируется плазматической мембраной и опорно-сократимыми структурами
гиалоплазмы для наиболее совершенной реализации функции поглоще-
ния пищи из полости пищеварительного тракта.
Третий тип специализированных клеток кишечных эпителиев — же-
лезистые клетки — имеет более разнообразный спектр эволюционных мо-
дификаций, чем у рассмотренных выше двух типов клеток кишечного
эпителия. Это определяется прежде всего большим разнообразием пищи
у разных многоклеточных и, следовательно, разнообразием набора фер-
ментов, который необходим для расщепления высокомолекулярных орга-
нических соединений в каждом конкретном случае.
Общей прогрессивной тенденцией в эволюционной динамике специали-
зированных железистых клеток является увеличение их разнообразия.
Так, например, в кишечном эпителии млекопитающих только в составе
эпителиального пласта (помимо особых железистых структур желудка,
поджелудочной железы, двенадцатиперстной кишки) имеется три типа
узкоспециализированных железистых клеток. Эти клетки выполняют и
защитную роль, и роль желез внутренней секреции, и, возможно, роль
трофического аппарата камбиальных клеток, т. е. частные, специальные,
вспомогательные функции этой высокодифференцированной тканевой
системы.
Аналогичные отношения имеются, по-видимому, у многих насекомых.
Здесь, однако, в составе эпителия преобладают железистые клетки, свя-
занные с обеспечением основной функции секреторного аппарата — вы-
делением ферментов для гидролитического расщепления пищевых ве-
ществ. Наряду с этим у многих насекомых имеются и типичные бокало-
видные клетки со сходной с млекопитающими функцией. Бокаловидные
слизистые клетки имеют весьма широкое распространение и у других
групп многоклеточных животных. Количество разновидностей железистых
7 А. А. Заварзин
97
элементов может сильно увеличиваться в кишечных эпителиях животных
с относительно низким уровнем организации. Примерами в этом отноше-
нии будут кишечные эпителии некоторых полихет и кишечнополостных.
В эпителии желудка полихет имеются клетки, сходные по наличию
внутриклеточных каналов с клетками эпителия желудка у млекопитаю-
щих.
Особенно большое значение в процессах полостного пищеварения
имеют разнообразные железистые клетки в дивертикулах пищеваритель-
ного тракта хищных полихет. Однако для сравнительных сопоставле-
ний необходим более детальный анализ их морфобиохимической органи-
зации и конкретного функционального значения. Весьма актуальным
в сравнительно-цитологическом плане является также вопрос о гипер-
трофированных надмембранных структурах апикальной поверхности
кишечного эпителия полихет. Эти структуры обнаруживают некоторые
сходные черты организации с перитрофической мембраной членисто-
ногих.
Кишечный эпителий и его производные у многих групп животных
обеспечивают не только функции расщепления и всасывания, но и вто-
ричную обработку и хранение запасных питательных веществ в виде гли-
когена или жировых включений. Наибольшее развитие эта важная функ-
ция внутреннего обмена получает в производных кишечного эпителия
у позвоночных животных. У них образуется массивный орган — печень.
Клетки эпителия печени почти полностью утрачивают такие характерные
первичные свойства клеток кишечного эпителия, как полярность, и по
своей морфобиохимической дифференцировке представляют редкий для
кишечного эпителия позвоночных тип мультифупкциопальпых клеточных
элементов. Они характеризуются и секреторной активностью, и имеют
в мембранах эндоплазматической сети мощный ферментативный аппарат
детоксикации вредных продуктов метаболизма. В печеночных клетках
протекает и ряд узловых этапов углеводного, жирового и белкового мета-
болизмов.
Реализация некоторых функций печепочпых клеток позвоночных
имеет место и в клетках кишечного эпителия или его железистых про-
изводных у ряда групп первичноротых животных. Наиболее ярко выра-
жена она в пищеварительных клетках иксодовых клещей. Эти клетки на
определенных стадиях пищеварительного цикла становятся основными
резервуарами поглощенной пищи и, очевидно, обеспечивают ее вторичную
переработку перед выделением в гемолимфу. Выделение соединений,
эмульгирующих жиры, образование гликогена и жировых включений про-
исходит в эпителиальных клетках пищеварительной железы ракообразных.
Имеются указания о том, что у некоторых головоногих моллюсков, как и
у позвоночных животпых, эпителии железистых структур среднего отдела
пищеварительного тракта становятся преимущественно аппаратом вто-
ричной обработки поглощенных пищевых продуктов, причем поступле-
ние последних в клетки происходит не из полости кишки, а из тканевой
жидкости и транспортной сосудистой системы.
В последнее время появились данные о том, что в кишечном эпителии
многих групп беспозвоночных животпых (иглокожие, оболочники, мол-
люски) имеются специализированные клетки, вырабатывающие гормоны
для регуляции углеводного обмена типа инсулина и глюкагона позвоноч-
ных (Dawson, 1970; Falkmer, 1972; Frietsch et al., 1976). Если это дейст-
вительно так, то мы будем иметь еще один весьма яркий пример систем-
ного параллелизма. Особый интерес эти данные представляют в связи
с тем, что здесь речь идет уже о глубокой функциональной и биологиче-
ской аналогии па уровне гуморальной эндокринной регуляции.
Таким образом, сравнительно-цитологический обзор специализирован-
ных клеток в кишечных эпителиях многоклеточных животпых указывает
на наличие совершенно определенных общих тенденций функциональной
98
и морфобиохимпческой дифференцировки. Однако проявление последних
может быть достаточно сложным и многообразным.
Еще более сложные и менее ясные для нас отпошепия наблюдаются
в эволюционных преобразованиях внутрисистемных регулятивных меха-
низмов, обеспечивающих интеграцию кишечного эпителия как единой
целостной системы клеточных элемецтов. Непосредственное изучение этих
механизмов началось лишь в последнее время и то преимущественно в от-
ношении высших позвоночных животных. В связи с этим в настоящее
время мы располагаем фактическим материалом, позволяющим проводить
сопоставление лишь в самом общем виде. Анализируя в таком плане имею-
щийся материал, можно прежде всего отметить, что у современных мно-
гоклеточных животных имеется достаточно разнообразный спектр раз-
личного рода модификаций интегративных системных механизмов. У не-
которых низших многоклеточных и с внутриклеточным и с полостным
пищеварением мы встречаемся с относительно низкой степенью интегри-
рованности клеток в тканевой системе или даже с почти полным отсутст-
вием системной интеграции. Наиболее демонстративными примерами
в этом отношении среди животных с внутриклеточным пищеварением
являются губки и бескишечпые турбеллярий.
Полостное пищеварение по своей сути требует уже определенной сте-
пени целостности системы. Оно основано на «разделении труда» между
клетками и должно протекать в замкнутом тканевой системой простран-
стве. Эти необходимые признаки структурной интеграции имеются уже
у кишечнополостных. Однако кишечным эпителиям рассматриваемых жи-
вотных свойственны и такие примитивные признаки, как мультифунк-
циональная дифференцировка эпителиально-мышечных клеток и способ-
ность некоторых клеток к метаплазии в широких пределах. В экспери-
ментальных условиях показана, например, способность железистых
клеток превращаться не только во всасывающие клетки кишечного
эпителия, но и в клетки наружного эпителия.
Наибольший интерес представляет выяснение сущности интегрирую-
щих механизмов, а также их особенностей в разных группах многокле-
точных животных. Сейчас можно лишь констатировать большое распро-
странение организации кишечных эпителиев как обновляющихся камби-
альных систем. Ясно выраженная тенденция к сокращению длительности
жизни дифференцированных клеток и усложнению интегрирующих меха-
низмов наблюдается в ряду позвоночных животных. Отчетливо выявля-
ется она и у некоторых групп высших первичноротых, в частности у не-
которых насекомых. Хорошо выраженное поляризованное обновление
системы имеет место у пластинчатожаберных и брюхоногих мол-
люсков с преобладающим внутриклеточным пищеварением. Наконец, на-
личие процессов обновления клеточного состава — характерный признак
кишечных эпителиев приапулид, полихет, асцидий, личинок круглоротых
и, по-видимому, многих других групп животных. Наряду с этим в кишеч-
ном эпителии, а особенно часто в его производных, специализированные
клетки имеют продолжительный жизненный цикл. В крайпих случаях,
как например в случае эпителия печени высших позвоночных животных,
это приводит к возникновению типичной растущей клеточной популяции.
Сложность внутренней организации кишечного эпителия может обус-
ловливаться еще и тем, что входящие в его состав разнородные специали-
зированные элементы обновляются с различной скоростью. Такого рода
отношения особенно хорошо изучены в настоящее время в кишечном
эпителии млекопитающих. Они имеют, по-видимому, весьма широкое рас-
пространение в кишечных эпителиях и других животных, в частности об-
наружены уже у полихет.
Для понимания обновляющихся популяций весьма важно выяснить
внутренние закономерности организации камбиальных систем и конкрет-
ные механизмы их взаимоотношения с дифференцирующимися в различ-
7*
99
ных направлениях специализированными клетками. Такая работа еще
только начинается и то преимущественно лишь в отношении кишечных
эпителиев высших позвоночных. Совершенно очевидно, что в основе воз-
можности стабильной и совершенной работы такой сложной тканевой си-
стемы, какой является кишечный эпителий млекопитающих, лежит меха-
низм обратных связей между дифференцирующимися в четырех направле-
ниях клеточными элементами и, по-видимому, единой камбиальной
системой. Этот механизм осуществляется химическим путем при помощи
особых веществ и соответствующими адекватными им рецепторными
аппаратами камбиальных клеток. Показана также существенная роль
в регуляции размножения клеток непосредственных механических контак-
тов между ними внутри системы.
Эти, а возможно, и ряд других механизмов лежат в основе количест-
венного и качественного постоянства клеточного состава во всех камби-
альных системах, в том числе и в камбиальных системах кишечных эпи-
телием у разных групп многоклеточных животных. Однако эти регулятив-
ные механизмы, как и любые другие биологические механизмы, в каждом
конкретном случае исторически обусловлены и отнюдь не тождественно
проявляются у разных животных.
Внешним выражением такого разнообразия являются хотя бы боль-
шие различия в чисто топографическом распределении камбиальных и
дифференцированных клеток. Оно может быть диффузным, или камби-
альные элементы могут быть более или менее выделенными в топогра-
фически обособленную в эпителиальном пласте систему. Такое обособле-
ние этой системы является, по-видим’ому, прогрессивной эволюционной
тенденцией, поскольку наибольшего развития достигает оно в наиболее
высокодифференцировапных системах кишечного эпителия как у высших
первичноротых, так и у позвоночных животных. Такой же тенденцией
является и усиление антагонизма между специфической дифференциров-
кой клеток и их репродукцией. Полное блокирование способности диффе-
ренцированных клеток к репродукции является также весьма характер-
ным признаком кишечных эпителиев у высших животных с хорошо диф-
ференцированным кишечником и совершенными пищеварительной и
всасывающей функциями.
Следует при этом подчеркнуть, что проявление этих тенденций имеет
место не только у высших первичноротых и вторичноротых животных.
Они могут быть в большей или меньшей степени выражены и у разных
представителей одной систематической группы животных. Так, у пред-
ставителей класса амфибий наблюдаются большие различия в топографи-
ческой дифференциации камбиальных клеток и взаимоотношениях между
репродукцией и дифференциацией клеток. Аналогичные отношения ха-
рактерны и для отдельных представителей костистых рыб.
Одной из наиболее интересных особенностей эволюционной динамики
кишечных эпителиев является тенденция к ускорению темпов их физиоло-
гической регенерации, что связано с большими затратами энергии и пла-
стических материалов на непрерывное воспроизводство клеток. Такая тен-
денция отчетливо обнаруживается у высших позвоночных и некоторых
насекомых. Весьма вероятно, что она имеет место в эволюционной диффе-
ренцировке кишечных эпителиев и у многих других групп многоклеточ-
ных животных.
В настоящее время большинством исследователей оставлена попытка
объяснить необходимость массовой гибели клеток на небольших отрез-
ках времени непосредственным участием продуктов их разрушения
в акте полостного пищеварения, т. е. своеобразной голокриновой секре-
цией. Голокриновая секреция при полостном пищеварении — достаточно
широко распространенное явление. Однако она не является первичным
механизмом, на основе которого возникли универсальные механизмы об-
новления клеточного состава тканевых систем. Даже у низших многокле-
100
точных помимо типичной голокриновой секреции имеет место непрерыв-
ное обновление всей системы специализированных клеток кишечного эпи-
телия. Кроме того, показано, что ферменты, освобождающиеся при раз-
рушении отмирающих всасывающих клеток в кишечном эпителии млеко-
питающих не имеют существенного значения в общем балансе ферментов,
выделяемых специализированными железистыми клетками поджелудоч-
ной железы и других железистых образований.
По-видимому, быстрая и прогрессирующая в процессе эволюции изна-
шиваемость всасывающих и других специализированных клеток кишечного
эпителия коррелирована с неясным для нас еще совершенствованием ка-
ких-то молекулярных и надмолекулярных механизмов, обусловливающих
основные функции кишечного эпителия. При этом относительно неболь-
шой период активной функциональной деятельности дифференцирован-
ных (пищеварительных и всасывающих) клеток обусловливается в рав-
ной мере и процессами всасывания низкомолекулярных продуктов и про-
цессами -внутриклеточного пищеварения. Интенсивно обновляющиеся
системы кишечного эпителия мы обнаруживаем как у животных с по-
лостным, так и внутриклеточным пищеварением.
Рассмотренный в данной главе сравнительно-гистологический мате-
риал показывает, что на уровне морфобиохимической дифференцировки
отдельных специализированных клеток и па уровне системной организа-
ции этих кишечных эпителиев у разпых животных проявляются общие
тенденции прогрессивного усложнения этой ткани.
Эти тенденции имеют тем не менее не тождественное проявление
у отдельных групп животных. Большое разнообразие отношений, наблю-
даемых у систематически отдаленных групп животных, обусловливается
рядом причин. Прежде всего, имеющиеся и у клетки и у системы потен-
ции, несмотря на их исходную ограниченность, шире их конкретной реа-
лизации у отдельных групп животных. Кроме того, в силу тех или иных
причин степень реализации потенций клеток и особенно внутрисистемной
интеграции может не достигать у многих групп современных животных
максимального проявления. Наконец, в эволюции кишечного эпителия, как
сложной многокомпонентной системы, могут комбинироваться у разных
животных разные характерные вообще для всей этой системы признаки.
Одним из ярких примеров возможности таких комбинаций может слу-
жить кишечный эпителий клещей. Здесь самым причудливым образом
переплетаются и механизмы внутриклеточного пищеварения, и, вероятно,
механизмы активного мембранного транспорта, а также* вторичная пере-
работка и храпение утилизированных продуктов. Все эти сложные пре-
вращения клеток происходят на основе весьма интегрированной обновляю-
щейся системы, камбиальные элементы которой обладают способностью
образовывать последовательно во времени несколько дифференцирован-
ных в различных направлениях генераций специализированных клеток.
В связи с имеющимися уже данными можно прийти к заключению, что
для углубленного анализа закономерностей филогенетической дифферен-
цировки кишечных эпителиев сравнительным методом необходимы целе-
направленные исследования не па представителях отдельных видов, а на
специально подобранных по экологическим признакам рядах форм в пре-
делах основных групп многоклеточных животных. Большой интерес
представляет также анализ кишечных эпителиев вторично измененных
и тупиковых форм. Значение такого направления исследований наглядно
демонстрируют уже имеющиеся данные по кишечным эпителиям парази-
тических нематод, приапулид, асцидий и иглокожих. При наличии такого
материала удается выявить и пределы возможного варьирования систем-
ных механизмов, и основные закономерности изменений кишечных эпите-
лпев в филогенезе многоклеточных животных.
101
Глава 3
КОЖНЫЕ ЭПИТЕЛИИ
ВВЕДЕНИЕ
Кожные эпителии представляют собой одну из наиболее древних тка-
невых систем, возникшую на первых этапах эволюции многоклеточных
организмов. Первичной функцией этой ткани была пограничная функция.
На ранних этапах эволюции многоклеточных животпых барьерная роль
кожпого эпителия сочеталась с поглощением из окружающей среды кис-
лорода и питательных веществ, выделением вредных продуктов метабо-
лизма, локомоторной функцией и восприятием раздражений. На более
поздних этапах эволюции эти не основные для кожпого эпителия функции
выполняют уже другие специализированные тканевые системы. Усложне-
ние пограничной ткани, расположенной на поверхности тела животных,
шло по пути специализации и усовершенствования ее барьерной защит-
ной роли, обеспечивающей изоляцию организма от внешней среды. Барь-
ерная роль кожных эпителиев приобрела исключительное значение при
выходе многоклеточных животпых па сушу и расселении их в воздушной
среде.
Современные многоклеточные животные прошли длинный путь адап-
тивной эволюции в пределах различных уровней их организации. На ос-
новании изучения кожных эпителиев этих животпых у нас нет возмож-
ности построить непрерывный ряд усложнения пограничных ткапей
в процессе эволюции. Однако сравнительно-гистологические сопоставле-
ния позволяют все же наметить основные тенденции формирования кож-
ных эпителиев у многоклеточных животпых. Среди эпителиальных ткапей
кожного типа можно выделить пять основных разновидностей: однослой-
ные и многорядные ресничные эпителии, однослойные железистые эпите-
лии, однослойные кутикулярные эпителии, многослойные неороговеваю-
щие и ороговевающие эпителии.
Такая классификация в известной мере отражает последовательные
этапы усложнения кожных эпителиев в процессе эволюции. Первые две
разновидности характерны для низших многоклеточных животных. Мно-
гослойные эпителии с тенденцией к образованию ороговевающих пластов
характерны для прогрессивно эволюционирующих классов позвоночных.
Развитие кожпого эпителия по пути совершенствования кутикулярных
структур — основная эволюционная тенденция кожных покровов многих
групп беспозвоночных (кольчатые черви, членистоногие, оболочники
и др.).
При характеристике разновидностей кожных эпителиев вначале будет
приведен обзор имеющихся данных по строению кожных эпителиев
у низших многоклеточных животпых (однослойные и многорядные рес-
ничные, однослойные покровные железистые эпителии). В этих разде-
лах мы сочли целесообразным кратко рассмотреть и некоторые модифи-
кации этих разновидностей эпителиальных тканей у высших позвоночных
животных. Далее будут рассмотрены кутикулярные кожные эпителии
у высших первичпоротых животных и варианты филогенетической диф-
ференцировки кутикулярных эпителиев у других многоклеточных живот-
ных. В последнем разделе главы будет дана характеристика многослойных
кожных эпителиев позвоночных.
ОДНОСЛОЙНЫЕ И МНОГОРЯДНЫЕ РЕСНИЧНЫЕ ЭПИТЕЛИИ
Из современных низших многоклеточных животных наиболее просто
устроен кожный эпителий у низших бескишечных турбеллярий (рис. 44).
Части эпителиальных клеток, содержащие ядра, оказываются погружен-
102
ними в паренхиму и не образуют сплошного эпителиального пласта. Не-
прерывный слой формируют лишь апикальные безъядерные участки эпи-
телиальных клеток с хорошо развитым ресничным аппаратом. Помимо рес-
ничек в цитоплазме эпителиальных клеток дифференцируются фибриллы,
образованные сократимыми белками. Совокупность последних наряду
с ресничками и сократимыми клетками паренхимы обеспечивает локомо-
Рис. 44. Схема строения погруженного эпителия бескишечной турбеллярии OUgochoe-
rus erythrophalmus. (Из: Иванов, Мамкаев, 1973).
1 — эпителиально-мышечные клетки, 2 — миофибриллы, 3 — клетки паренхимы, 4 — корневые
нити ресничек.
торную функцию животных (Беклемишев, 1964). У высших турбелля-
рий образуются «уже покровные эпителиальные пласты, оформленные
в структурном и функциональном отношениях. Примером таких струк-
тур может служить так называемый пемертинный тип покровных эпите-
лиев (рис. 45). Он получил широкое распространение у многоклеточных
животных и весьма характерен для высших турбеллярпй и немертин.
Рис. 45. Схема строения многорядного ресничного эпителия низших червей. (Из: Ива-
нов, Мамкаев, 1973).
1 — базальный аппарат ресничек, 2 — базальные клетки, з — ресничные клетки, 4 — скопление
секрета, 5 — миофибриллы.
На границе между эпителием и соединительной тканью здесь имеется
хорошо выраженная базальная мембрана. Ядра клеток располагаются на
разных уровнях эпителиального пласта, в котором помимо ресничных со-
держатся также железистые и рецепторные нервные клетки. Эпителиаль-
ный пласт представляет собой интегрированную обновляющуюся систему
с разделением на камбиальные и дифференцирующиеся клетки. Фигуры
103
митотического деления наблюдаются преимущественно на верхних уров-
нях эпителиального пласта. Подготовка к делению, и в частности синтез
ДНК, происходит в клетках, ядра которых располагаются у базальной
мембраны. Таким образом, в многорядном ресничном эпителии немертин
и, по-видимому, высших турбеллярий имеет место характерная для од-
нослойных и многорядных эпителиев миграция клеток в процессе про-
хождения ими митотического цикла. Особенно наглядно такую миграцию
удается проследить с помощью метода тимидиновой авторадиографии.
На ранних сроках после введения 3Н-тимидина меченые ядра распола-
гаются в базальной части пласта. Затем в течение периода G2 клетки
с мечеными ядрами перемещаются к апикальной поверхности пласта,
где и образуются в результате деления две дочерние клетки. Последние
могут вступить в новый митотический цикл или дифференцироваться
Рис. 46. Автограф покровного эпителия немертины через 5 суток после трехкратного
введения 3Н-тимидина.
в железистые или ресничные клетки. В обоих случаях дочерние клетки
вновь перемещаются по направлению к базальной мембране.
Интенсивность пролиферативных процессов в периоды активной
жизни животных может быть весьма высокой. В митотическом цикле
может находиться одновременно значительное количество камбиальных
клеток. В опытах с повторными инъекциями 3Н-тимидина в течение
3—5 суток больше половины базальных клеток, а также часть диффе-
ренцирующихся и уже дифференцированных клеток содержат меченые
ядра (рис. 46). Для кожного эпителия немертин характерен, следова-
тельно, относительно высокий уровень физиологической регенерации.
Многорядные и однослойные ресничные эпителии имеются не только
у немертин и высших турбеллярий, но и у более высокоорганизованных
многоклеточных животных. Особенно распространены они у моллюсков
в различных участках кожного покрова (Schmekel, Wechsler, 1967; Zyl-
stra, 1972).
Многорядные кожные эпителии достигают большой сложности и раз-
нообразия у брюхоногих моллюсков, в частности у лишенных раковины
голожаберных моллюсков. В основе организации эпителиального пласта
у одного из изученных представителей этой группы (Coryphella rufibran-
chialis') лежат, как и в кожном эпителии немертин, базальные камбиаль-
ные клетки. Они характеризуются не только способностью к синтезу
ДНК и активному делению, но и более высокой интенсивностью транскрип-
ции. В опытах с 3Н-уридином удалось показать резкое преобладание вклю-
чения в ядра базальных клеток по сравнению с ядрами дифференциро-
ванных клеток (на ранних сроках инкубации животных в растворе
104
меченого предшественника). Однако интенсивность процессов физиологиче-
ской регенерации в данном случае относительно невелика и сильно варь-
ирует в различных участках тела животных. Максимальная интенсив-
ность обновления клеточного состава обнаружена в эпителиальной вы-
стилке наружных отделов ротового аппарата и щупалец. В опытах
с 3Н-тимидином замещение дифференцированных клеток клетками с ме-
чеными ядрами происходит на 10—12-е сутки. В отличие от немертин
базальные клетки при делении не смещаются к апикальной поверхности
пласта.
В жаберном аппарате многих беспозвоночных ресничный эпителий
выполняет гидрокинетическую функцию, необходимую для более совер-
шенного газообмена. Формирование ресничного аппарата покровными
эпителиальными клетками — важное приспособление у многих групп
морских беспозвоночных, позволяющее им активно перемещаться в вод-
ной среде. Ресничный аппарат достигает мощного развития в некоторых
участках кожного покрова гребневиков.
Многорядный ресничный эпителий играет важную роль в воздухонос-
ных путях наземных позвоночных. Здесь наряду с барьерной функцией
он выполняет роль аппарата, обеспечивающего очистку от твердых час-
тиц воздуха, поступающего в респираторные отделы дыхательной си-
стемы. Строение этого эпителия (рис. 47) сходно со строением покров-
ного эпителия немертин (рис. 45). Наружная поверхность эпителиаль-
ного пласта образована плотно расположенными апикальными концами
дифференцированных элементов двух типов: конусовидных ресничных
и бокаловидных железистых клеток. В отличие от эпителия немертин,
где на средних и особенно на нижних уровнях эпителиального пласта
имеются свободные промежутки, заполненные тканевой жидкостью, здесь
обнаруживаются лишь небольшие межклеточные пространства. Основная
часть нижней половины пласта заполнена базальными и вставочными
клетками, представляющими собой камбиальные и дифференцирующиеся
клеточные элементы. Особенностью этого эпителия у млекопитающих
животных и человека является относительно медленный темп физиоло-
гической регенерации. Для многорядного эпителия, выстилающего воздухо-
носные пути, характерно длительное существование дифференцирован-
ных клеток и продолжительный митотический цикл базальных камби-
альных клеток. Значительная часть последних находится, по-видпмому,
в так называемой фазе покоя, вне обычного митотического цикла. Бла-
годаря этому рассматриваемая тканевая система обладает мощными про-
лиферативными потенциями, которые отчетливо выявляются при репа-
ративной регенерации.
В многорядных ресничных эпителиях млекопитающих способностью
к синтезу ДНК и делению обладают не только базальные, но и вставоч-
ные клетки. При этом интенсивность размножения последних выше, чем
у базальных клеток (Bindreiter et al., 1968). Такая гетерогенность про-
лиферирующих клеток позволяет предположить наличие тенденции
к разделению камбиальной системы на две субпопуляции: непосредст-
венно производящую клетки для обновления дифференцированных эле-
ментов и резервную субпопуляцию стволовых клеток, обеспечивающую
периодическое обновление «рабочего» камбия. Возможно, что такой
принцип организации камбиальной системы в многорядных эпителиях
свойствен и другим его разновидностям.
Большие пролиферативные потенции многорядного призматического
эпителия млекопитающих обнаруживаются также при нарушении нор-
мальных взаимоотношений между размножением и дифференциацией
клеток, что происходит при его злокачественном перерождении. Злока-
чественные новообразования, возникающие из эпителиальной выстилки
воздухоносных путей у человека, относятся к числу наиболее быстро ра-
стущих опухолей.
105
Несмотря на сходные с ресничными эпителиями низших многокле-
точных принципы организации эпителиального пласта и специфическую
дифференцировку образующих его клеток, ресничный эпителий позво-
ночных представляет вторичную в эволюции этих животных тканевую
дифференцировку. Она возникает на основе характерных для этих жи-
вотных многослойных кожных эпителиев. При различного рода экстре-
Рис. 47. Многорядный ресничный эпителий трахеи кошки. (Из: Greep, 1966).
<z — участок эпителия, б — схема строения. 1 — соединительная ткань, 2 — ресничная клетка,
3 — бокаловидная слизистая клетка, 4 — базальная клетка, 5 — клетка с микроворсинками.
мальных воздействиях (пары формалина, механические повреждения,
ряд специфических гормональных воздействий) ресничный эпителий об-
наруживает отчетливо выраженную способность к превращению в типич-
ные многослойные ороговевающие пласты. С другой стороны, зачатки
кожного эпителия способны образовывать железистые и ресничные
клетки, более или менее правильно ориентированные в многорядные или
двуслойные структуры, что наблюдается при воздействии избытка вита-
мина А или при подсадке к таким зачаткам чуждой им соединительной
ткани желудочно-кишечного тракта (Dodson, 1967). В ресничном эпите-
106
лии млекопитающих четко выражено функциональное единство пласта.
Деятельность его ресничного аппарата строго упорядочена, и все рес-
ничные клетки связаны в единую функциональную систему. Синхронная
работа ресничного аппарата обеспечивает непрерывное перемещение вы-
деляемой бокаловидными клетками слизи с приставшими к ней инород-
ными частицами. Движение этих частиц происходит в направлении, об-
ратном по отношению к направлению движения поступающего из внеш-
ней среды воздуха.
Известны варианты строения ресничного аппарата клеток ресничного
эпителия, выполняющего различные частные функции у отдельных
представителей многоклеточных животных. Однако общий принцип
ультраструктурной организации ресничек оказывается достаточно уни-
версальным (Du Praw, 1970; Satir, 1974). Реснички представляют собой
специализированные выросты цитоплазмы клеток, ограниченные с по-
верхности плазматической мембраной. Основным структурным компонен-
том реснички и жгутика является система микротрубочек, состоящая из
9 косо расположенных пар и двух центральных трубочек. Трубочки
в симметрично расположенных парах на периферии реснички или жгу-
тика отличаются друг от друга тем, что рядом с одной из пих, распо-
ложенной несколько ближе к центру, имеются особые уплотненные
участки цитоплазмы в виде двух пальцевидных выростов, способных кон-
тактировать с наружной трубочкой соседней пары.
Анализ химического состава ресничек, проведенный на ресничках ин-
фузорий, показал, что основную массу их составляют белки (70—80%).
Здесь имеется также некоторое количество липидов (13—23%) и углеводов
(1—6%). Среди белков удается выделить две основные фракции — раст-
воримую и нерастворимую в ЭДТА. Белковый компонент двух централь-
ных трубочек входит в состав растворимой фракции, поскольку при дей-
ствии ЭДТА они исчезают. Второй структурой, построенной преимущест-
венно из белков растворимой фракции, являются пальцевидные выросты
уплотненной цитоплазмы у периферических трубочек. Анализ АТФ-аз-
ной активности белковой фракции показал, что почти весь белок, обла-
дающий способностью расщеплять АТФ, находится во фракции, раство-
римой в ЭДТА. Более того, из нее удалось выделить субфракцию, кото-
рая обладала способностью восстанавливать в присутствии ионов магния
уплотненные участки цитоплазмы у периферических трубочек при до-
бавлении ее к обработанным ЭДТА ресничкам. Материал пальцевидных
выростов, очевидно, входит в состав этой субфракции. На основании
имеющихся данных был сделан вывод о том, что мы имеем здесь дело
со специфическим, обладающим АТФ-азной активностью белком, способ-
ным взаимодействовать с белками микротрубочек ресничек. Этот белок
составляет около 8% общего количества белка ресничек, и ему придают
большое значение в работе ресничек и жгутиков (Satir, 1974).
Показано также, что обработанные глицерином реснички и жгутики,
в которых сохраняется только система центральных и периферических
трубочек, способны ритмично сокращаться при добавлении АТФ. Эти
данные свидетельствуют, таким образом, в пользу предположения о том,
что основные молекулярные механизмы механохимических реакций свя-
заны с трубчатыми структурами. Процесс сокращения осуществляется по
принципу скольжения одних трубочек по отношению к другим за счет
временного взаимодействия образованных особым белком динеином
пальцевидных выростов цитоплазмы с белками соседних периферических
трубочек.
Рассмотренный выше общий план ультраструктурного строения рес-
ничек и жгутиков универсален для самых различных клеток. Однако мо-
гут наблюдаться и более или менее существенные модификации их
строения. Сильно варьируют размеры ресничек. Иногда, хотя и довольно
редко, имеет место отступление от обычной закономерности в организа-
107
ции ресничек и жгутиков — девять пар периферических и две централь-
ные трубочки: периферических трубочек может быть и меньше (до семи
пар) и больше (до одиннадцати пар). В последнем случае добавочные
пары периферических трубочек могут располагаться вне периферического
кольца, обычно снаружи от него. Значительно чаще наблюдается редук-
ция двух центральных трубчатых структур. Такого рода явления отме-
чены при многочисленных эволюционных модификациях ресничных кле-
ток, которые могут специализироваться и как рецепторные элементы, и
как железистые клетки со своеобразным аппаратом выведения секрета,
формирующимся на основе ресничек. В этих случаях, помимо редукции
некоторых структур ресничного аппарата, в цитоплазме клеток возни-
кают другие специализированные структуры, как например системы
параллельных мембран и мицелл в фоторецепторных элементах сетчатки
позвоночных (Винников, 1971).
Обязательной составной частью ресничек и жгутиков являются ба-
зальные тельца, расположенные в основании ресничек. По своему строе-
нию базальные тельца весьма сходны с центриолями и представляют со-
бой цилиндры, образованные девятью триплетами трубочек, аналогичных
по своему строению периферическим трубочкам ресничек. При этом пе-
риферически расположенная пара трубочек в каждом триплете контак-
тирует с периферическими трубочками ресничек. Третья трубочка ба-
зального тельца в каждом триплете слепо заканчивается в пластинке
электронноплотного вещества толщиною 300 А, расположенной в области
контакта микротрубочек реснички и базального тельца. С внешней сто-
роны этой пластинки в ней также слепо заканчиваются две централь-
ные трубочки реснички. Базальные тельца играют основную роль в про-
цессах формирования и регенерации ресничек. Однако конкретные мо-
лекулярные механизмы этих процессов в настоящее время не выяснены.
Возможно также их участие в координации работы ресничного аппарата.
Такую же функцию, вероятно, имеет фибриллярный аппарат в виде во-
локон, иногда имеющих поперечную исчерченность. Это — корневые
нити, которые могут располагаться либо в поверхностных участках цито-
плазмы, либо.проникать внутрь цитоплазмы до наружной мембраны ядер-
ной оболочки.
Реснички в клетках Eukaryota представляют собой, несомненно, один
из наиболее древних специальных органоидов. У многоклеточных живот-
ных потенции к формированию ресничек сохраняются в клетках различ-
ных тканей. Благодаря этому при соответствующих функциональных
потребностях в процессе эволюции наблюдаются многократные повтор-
ные возникновения ресничного аппарата у клеток с различной специа-
лизацией. Реснички образуются в клетках производных кожного эпителия
высших позвоночных, кишечных и мезодермальных эпителиев и эпите-
лиев, вторично возникающих из нервного зачатка. В последнее время
ресничные дифференцировки обнаружены также у некоторых клеточных
элементах тканей внутренней среды у млекопитающих и головоногих
моллюсков.
ОДНОСЛОЙНЫЕ ЖЕЛЕЗИСТЫЕ ЭПИТЕЛИИ
Эта разновидность эпителиальных тканей занимает в известной мере4
промежуточное положение между ресничными эпителиями и кутикуляр-
ными однослойными эпителиями многих групп беспозвоночных. В наи-
более простом, «типичном» виде они встречаются в некоторых участках
тела отдельных представителей кишечнополостных, губок и многих мол-
люсков.
Промежуточное положение этого эпителия особенно отчетливо про-
является в кожном эпителии брюхоногих моллюсков. Так, например,
у голожаберного моллюска в эпителиях, выстилающих наружную по-
108
верхность тела и передний отдел пищеварительного тракта, удается на-
блюдать постепенный переход однослойного железистого эпителия в ти-
пичный многорядный ресничный эпителий и далее в эпителиальный
пласт с мощной кутикулярной пластинкой, образующий радулярный ап-
парат этих животных (рис. 48). При этом общий план организации
нересничного защитного и ресничного эпителиев принципиально сходен.
И в том и в другом случае это обновляющиеся ткани, в основе организа-
ции которых лежит система базальных клеток. Рассматриваемые разно-
Рис. 48. Кожные эпителии голожаберного моллюска Coryphella rufibranchialis.
а — однослойный железистый, б — многорядный ресничный, в — кутикулярный эпителии.
видности эпителиев отличаются друг от друга лишь в плане морфобиохи-
мической дифференцировки специализированных клеток. Последние
в нересничном эпителии представлены в основном призматическими клет-
ками, цитоплазма которых заполнена многочисленными вакуолями, огра-
ниченными мембранами.
Более просто организован однослойный кожный эпителий у губок и
кишечнополостных. Он представляет собой однослойный пласт клеток либо
уплощенной, либо кубической, либо, наконец, призматической формы.
Архаичность таких пластов у низших многоклеточных сказывается
в слабой детерминированности их тканевой организации. Например,
у гидры наружный эпителий может возникать за счет дедифференци-
ровки железистых клеток кишечного эпителия и последующей диффе-
ренцировки их в различных направлениях. У губок исходным материалом
для формирования наружных клеток могут быть подвижные амебо-
109
циты. У кишечнополостных широко распространены эпителиально-мы-
шечные клетки (рис. 49). Ядросодержащие части последних образуют
пограничный пласт па поверхности тела, а вытянутые базальные части
содержат фибриллярные структуры, осуществляющие функцию сократи-
мости (Bouillon, 1968; Davis, 1973). Подобного рода смешанные диф-
ференцировки (барьерные и локомоторные) возникают па поздних этапах
эволюции и в специализированных тканевых системах высших живот-
ных. Наиболее характерным примером такого рода структур могут слу-
жить эпителиально-мышечные клетки дилятатора зрачка. Ядросодер-
жащие части клеток здесь образуют пигментный слой, выстилающий
внутреннюю поверхность радужины, а вытянутые базальные части
Рис. 49. Схема строения эпителиально-мышечной (а) и железисто-мышечной (6) клеток
покровного эпителия гидры. (Из: Davis, 1973).
1 — миофибриллы, 2 — вакуоли, 3 — цитоплазматические включения, 4 — гранулы секрета, 5 —
десмосомы, 6 — секрет, выделенный на поверхность клетки.
клеток содержат миофибриллы и обеспечивают сокращения радужной обо-
лочки, увеличивая тем самым диаметр зрачка. Все эти структуры обра-
зуются из нервного зачатка, т. е. представляют собой эпителиально-мы-
шечную дифференцировку весьма позднего происхождения в филогенезе
многоклеточных животных.
В эпителиально-мышечных клетках кишечнополостных сократимые
элементы в цитоплазме могут достигать высокого уровня организации.
Так, например, у некоторых гидромедуз в определенных участках тела
клетки могут иметь несколько цитоплазматических отростков, содержа-
щих большое количество поперечно исчерченных миофибрилл. Таким
образом, здесь мы имеем пример далеко зашедшей цитоплазматической
дифференцировки при относительно примитивной организации тканевой
системы. Вторым примером такого рода являются книдобласты, широко
распространенные в кожных покровах гидроидных полипов. В результате
сложной синтетической деятельности эти крайне специализированные
клетки образуют стрекательные пити — основные орудия нападения и за-
щиты гидроидов (рис. 50). Признаком примитивности системной организа-
ции клеточных элементов является автономность их функционирования.
Стрекательные нити выбрасываются образующими их клетками — немато-
цитами, не в результате каких-либо эндогенных стимулов со стороны
системы кожных покровов или под влиянием нервных импульсов, а в ре-
110
зультате непосредственного механического раздражения нематоцитов. Не-
смотря па функциональную автономность, совокупность последних в ги-
стогенетическом отношении представляет собой типичную обновляю-
щуюся популяцию. Имеются специальные камбиальные клетки,
интенсивность размножения которых такова, что компенсирует гибель
нематоцитов в процессе функционирования.
В наружном эпителии у гидроидных полипов происходит непрерыв-
ная миграция дифференцирующихся клеток от основания щупалец к их
вершине. Дифференцированные клетки других участков эпителия
гидроидных полипов также имеют ограниченный жизненный цикл и по-
стоянно обновляются за счет размножения клеток. Наиболее детально
эти процессы изучены у пресноводной
1967а, 1967b; Clarkson, 1969).
Установлено, что гибель старею-
щих клеток происходит в опреде-
ленных участках: на концах щу-
палец и па подошве. В области
подошвы стареющие эпителиаль-
но-мышечные клетки перед эли-
минацией из пласта превращаются
в секреторные клетки базального
диска (Davis, 1973). Наличие
локальных областей гибели кле-
ток обусловливает процессы миг-
рации клеточных масс в строго
закономерном направлении. Раз-
множение клеток происходит на
Рис. 50. Схема строения книдобласта
в покоящемся (а) и в выстреленном (б)
состояниях. (Из: Догель, 1959).
1 — стрекательная нить, 2 — стрекательная
капсула, <3 — осязательный волосок, 4 —
ядро.
гидры (Burnett, 1966; Campbell,
всем протяжении тела гидры. Тем не мепее в области гипостома удается
выделить зону с повышенной метаболической активностью клеток и отно-
сительно небольшой скоростью их миграции.
Примитивные признаки цитологической организации кожных эпите-
лиев обнаружены у губок (Bagby, 1970). В данном случае в области
контактов соседних клеток отсутствуют десмосомы, слабо выражены
зоны слияния. На апикальной поверхности уплощенных клеток кожного
эпителия резко гипертрофирован надмембранный комплекс. Последний
представлен толстой пластинкой аморфного внеклеточного вещества. По
всем этим признакам ультраструктурной организации, а также по выра-
женной пиноцитозной активности кожный эпителий губок напоминает
эндотелий, выстилающий сосуды у позвоночных.
Важную роль в усложнении кожных эпителиев имело появление спе-
циальных железистых клеток, выделяющих различного рода органические
и неорганические секреторные продукты. Последние играют основную или
вспомогательную роль в обеспечении барьерной и даже скелетной функ-
ции наружного эпителия. Многочисленные железистые клетки харак-
терны для кожных эпителиев таких своеобразных животных, как греб-
невики. Выделяемый клетками секрет создает сплошной слизистый слой,
играющий заметную роль в осуществлении барьерной функции этого
эпителия. Мощный железистый аппарат развивается в кожных эпите-
лиях моллюсков, особенно у таких форм, как голожаберные моллюски,
вторично утратившие раковину. Разнообразные железистые клетки го-
111
ложаберпых моллюсков располагаются не только в эпителиальном пласте,
но и образуют пакеты многоклеточных и одноклеточных желез, погру-
женных в нижележащую соединительную ткань. У некоторых гидроид-
ных полипов в наружном эпителии обнаружены железистые клетки,
принимающие участие в процессах пищеварения.
Своеобразное строение имеет так называемая перидерма, осуществляю-
щая барьерную и отчасти скелетную функцию у морских гидроидных
полипов. Эта структура, однако, приближается по сути своей дифферен-
цировки к кутикулярным эпителиям. Образующаяся на поверхности
гидроидных полипов перидерма не является продуктом секреторной дея-
тельности специализированных секреторных клеток. Она выделяется обыч-
ными клетками эпителиального пласта, сохраняющими связь с перидермой.
У некоторых гидроидов при электронномикроскопическом исследовании
покровного эпителия удается обнаружить микроворсинки, внедряющиеся
в перидерму. Микроворсинки обеспечивают лучшие условия газообмена.
Среди химических соединений, образующих перидерму, обнаружен хи-
тин — важный компонент кутикул у многих беспозвоночных (Bouillon,
1968; Wilfert, Peters, 1969). Эпителиальные клетки наружного покрова
кишечнополостных выделяют значительную часть основного вещества ме-
зоглеи — промежуточной пластинки между кожным и кишечным эпи-
тел иями. В составе мезоглеи обнаружены склеропротеины (коллаген,
эластин и др.), а также различные мукополисахариды. Таким образом,
клетки наружного эпителия кишечнополостных представляют собой муль-
тифункциональные системы, обладающие способностью к синтезу
(правда, в небольших количествах) целого ряда специфических белков
и мукополисахаридов. Во многих случаях, однако, перидерма может и
не быть связана с наружной поверхностью эпителиального пласта
у взрослых животных. В этих случаях она представляет собой защитную
и скелетную структуру, аналогичную в известном смысле «домикам»
сидячих полихет или раковинам моллюсков.
Резко выраженную опорную и защитную функцию могут осуще-
ствлять скелетные образования из органических или неорганических сек-
реторных продуктов. Такая структура кожных покровов характерна для
шестилучевых полипов и многих моллюсков. Раковины последних по-
строены из секреторных выделений специальных раковинных желез, ко-
торые являются производными однослойного кожного эпителия (см. об-
зоры: Gregoire, 1972; Wilbar, 1972). Распространение данной разновид-
ности однослойных эпителиев ограничивается, однако, лишь немногими
группами многоклеточных животных. Образование покровных тканей из
двух резко отграниченных частей без постоянной структурной связи
между ними оказалось не лучшим решением задачи создания наружного
скелета и осуществления барьерной изолирующей функции наружных
покровов. Такой тип наружного скелета ограничивает подвижность жи-
вотных, что является существенным препятствием для прогрессивной их
эволюции. Кроме того, в гистологическом плане резкое разобщение сек-
ретирующих клеток и продуцируемых ими скелетных образований огра-
ничивает функциональную пластичность этих структур и, следовательно,
их адаптацию к изменяющимся условиям внешней среды.
КУТИКУЛЯРНЫЕ ЭПИТЕЛИИ
Членистоногие
Наибольшей сложности и разнообразия строения кутикулярные эпите-
лии достигают у членистоногих. Тем не менее для всего этого типа живот-
ных характерен принципиально сходный в морфологическом и химическом
отношениях план организации кутикулярного эпителия. Одинакова и его
112
биологическая роль, как наружного скелета этих животных. Однако
в пределах общего плана строения имеет место значительное варьирование
частных признаков организации этого эпителия у представителей отдель-
ных классов, родов и даже видов в связи с особенностями среды обитания
и степени филогенетического родства. Большие различия в строении
кутикулярного эпителия наблюдаются и у одного организма.
Сравнительно-гистологический анализ закономерностей морфобиохи-
мической организации кутикулярных эпителиев членистоногих представ-
ляет собой интенсивно разрабатываемую область исследований. Много-
численная литература по этому вопросу приводится в систематически
публикуемых обзорах и сводках (Locke, 1964; Гиляров, 1970; Hackman,
1971). Кутикула у подавляющего большинства современных членисто-
ногих состоит из полисахарида — хитина и белков. Хитин и белки обра-
зуют морфологически неотделимые пластинчатые структуры. Кроме
того, в состав кутикулы членистоногих входят гликопротеиды, амино-
кислоты, липиды. Постоянным компонентом кутикулы является также
вода, на долю которой приходится около 30—40% общего веса. Механи-
ческая прочность кутикулы может достигаться двумя путями: либо со-
единением хитина с белками, задубленными фенолами (у большинства
насекомых, хилопод, паукообразных), либо включением в толщу кути-
кулы углекислого и фосфорнокислого кальция (ракообразные, много-
ножки и некоторые насекомые).
Относительное количество основных химических компонентов в ку-
тикуле членистоногих варьирует в широких пределах как у разных
представителей этого типа, так и в различных участках покровов у од-
ного животного.
В морфологическом отношении кутикулы в разных группах членисто-
ногих представлены как относительно тонкими однородными структу-
рами, одновременно выполняющими и скелетно-барьерную функцию и
играющими роль дыхательных поверхностей, так и более толстыми ге-
терогенными структурами. У предков современных членистоногих, оби-
тавших в морских водоемах, наружные покровы наряду с барьерной
функцией несли и функцию наружного скелета. В отличие от моллюсков
характерной особенностью организации такого наружного скелета с ги-
стологической точки зрения является построение опорной ткани на ос-
нове тесного структурного, биохимического и функционального объедине-
ния клеток и продуцируемой ими кутикулярной пластинки. Такой принцип
организации наружного скелета оказался, очевидно, весьма перспектив-
ным, поскольку обеспечил большую пластичность наружных покровов
в филогенезе рассматриваемой группы животных. Одним из проявлений
этой пластичности и является отмеченное выше разнообразие кутику-
лярных эпителиев в разных классах членистоногих, у представителей
одного класса в пределах более мелких систематических групп и, нако-
нец, в наружных покровах у одного и того же животного. Тем не менее
у всех членистоногих имеется так называемая прокутикула, основная часть
кутикулярной пластинки (рис. 51). В глубоких, прилегающих к апи-
кальной поверхности клеток слоях прокутикула содержит систему перпен-
дикулярных к ее поверхности канальцев. Слоистость прокутикулы
насекомых обусловливается закономерной ориентацией хитинопротеидных
пластинок. Их параллельное по отношению к апикальной поверх-
ности клеток расположение чередуется со спирально закрученным
положением. Предполагают, что первое определяется воздействием на
волокна со стороны цитоплазмы, а второе обусловлено чисто физико-
химическими закономерностями (Neville et al., 1969). В прокутикуле
насекомых принято выделять три слоя — эндо-, мезо- и экзокути-
кулу. Максимальную механическую прочность у насекомых имеет
обычно экзокутикула. В ней наиболее резко выражены процессы скле-
ротизации белков, благодаря чему она утрачивает слоистое строение.
8 А. А. Заварзин
ИЗ
Последнее отчетливо выявляется в относительно мягкой эндокутикуле.
Мезокутикула занимает в этом отношении промежуточное положение.
Хитина может быть в несколько раз меньше, чем белка (всего около
20%), или наоборот, его количество несколько превышает количество
белка (до 64%). Чаще встречаются, правда, примерно равные соотноше-
ния этих компонентов. В прокутикуле располагаются тонкие отростки
эпителиальных клеток. Количество последних особенно велико в кутикуле
насекомых (до одного миллиона на один квадратный миллиметр). Кле-
Рис. 51. Схема строения кутикулярного эпителия членистоногих. (Рис. М. Ю. Пунина).
Z — эпи-, 2 — прокутикулы, 3 — экзо-, 4 — мезо-, 5 — эндокутикулы, 6 — эпителиальная клетка»
7 — ее отростки, 8 — железистая клетка, 9 — выводной проток железы, 10 — секрет железистой
клетки, 11 — эноцит, 12, 13 — чувствительный волосок и формирующая его клетка, 14 — клетки,
накапливающие ураты, 13 — базальная мембрана, 16 — клетки гемолимфы, 17 — клетка жирового
тела.
точные отростки заканчиваются в среднем слое прокутикулы и не захо-
дят в ее поверхностный слой.
Таким образом, у современных высших представителей членистоно-
гих имеются весьма совершенные структурные механизмы взаимодей-
ствия внеклеточного вещества кутикулы и цитоплазмы эпителиальных
клеток. Значение такого взаимодействия в сформированной кутикуле вы-
яснено в настоящее время недостаточно полно. В опытах с мечеными
предшественниками удалось показать наличие слабого обновления и
роста внутренних слоев прокутикулы. Однако контакт цитоплазмы клеток
с внеклеточными структурами кутикулярной пластинки имеет, по-види-
мому, и более существенный, неясный еще для нас биологический
смысл.
У насекомых и других членистоногих данный общий план строения
прокутикулы варьирует в широких пределах. Ее дифференцировка на три
114
слоя может быть слабо выражена, как например у некоторых личинок
водных насекомых (Noble-Nesbitt, 1963а), или, наоборот, каждый из
перечисленных выше слоев дифференцируется на несколько четко раз-
личающихся подслоев. Особенно большой толщины и сложности дости-
гает прокутикула у высших ракообразных и многих насекомых (Barth,
1969; Green, Neff, 1972; Mary, Krishnan, 1974; Ravindranath, 1974).
Эволюционная пластичность кутикулярных эпителиев членистоногих
наиболее ярко проявилась при формировании верхнего слоя кутикулярной
пластинки, так называемой эпикутикулы. Несмотря на незначительную
толщину, этот слой выполняет исключительно важную функцию. Он
обеспечивает возможность обитания членистоногих в воздушной среде,
так как предохраняет ткани
животного от потери воды за
счет испарения. Несмотря на
многочисленные исследова-
ния эпикутикулы, ее тонкая
молекулярная организация
остается в значительной ме-
ре неясной (Locke, 1966;
Noble-Nesbitt, 1969; Filshie,
1970; Wigglesworth, 1970).
В типичных случаях эпику-
тикула состоит из четырех
основных слоев: самого по-
верхностного слоя — цемента,
Рис. 52. Схема строения эпикути-
кулы насекомых. (Рис. М. Ю. Пу-
нина).
I — эпикутикула, 2 — слой воска, 3 —
кутикулиновая пластинка, 4 — белко-
вый слой, 5 — экзокутикула, 6 — по-
ровый канал, 7 — отросток эпителиаль-
ной клетки, 8 — восковые каналы,
9 — эпикутикулиновые тяжи.
воскового слоя, кутикулиновой пластинки и наиболее толстого внутрен-
него белкового слоя (рис. 52). В отношении химического состава особен-
ностью эпикутикулы является отсутствие в ней хитина. Основную роль
в барьерной функции эпикутикулы играют липиды и липопротеиновые
комплексы. Внутренний белковый слой и кутикулиновая пластинка фор-
мируются клетками гиподермы. Поверхностные слои эпикутикулы обра-
зуются в основном за счет секреторной деятельности клеток специальных
восковых и цементных желез. Весьма существенную роль в организации
эпикутикулы играют липиды, проникающие через систему специальных
каналов в верхних частях прокутикулы и нижних слоях эпикутикулы.
Эти кналы связаны с поровыми каналами прокутикулы (Bruck, Stockem,
1972). Имеются веские основания предполагать, что за счет непрерывного
поступления липидов через эти каналы в один из верхних слоев эпикути-
кулы здесь формируется динамичный непрерывно обновляющийся моно-
молекулярный слой липидов. Последний играет, по-видимому, основную
роль в способности эпикутикулы предохранять подлежащие ткани of
пересыхания. Точная локализация этого слоя липидов, а также детали
его конкретной молекулярной организации требуют дальнейших исследо-
ваний.
Эпикутикула характерна для всех представителей членистоногих, веду-
щих наземный образ жизни. Однако ее химический состав и структура
отличаются у отдельных классов членистоногих рядом существенных
особенностей. Так например, у скорпионов вместо воскового слоя в эпи-
8* 115
кутикуле имеется слой, образованный парафинами. Тем не менее и по
своей биологической роли, и по структурной организации это, несо-
мненно, единое новообразование в типе членистоногих, позволившее им
расселиться в воздушной среде.
Как показывают палеонтологические данные, выход на сушу происхо-
дил независимо у разных классов членистоногих, и, следовательно, у них
эпикутикула возникала в кожных покровах независимо, как проявление
сходных потенций кутикулярных эпителиев общих предков. Особенно на-
глядно эволюционная пластичность кутикулярных эпителиев выступает
у насекомых, где известны представители, переходившие от жизни в воз-
душной среде вторично к водному образу жизни и снова возвращавшиеся
к обитанию в воздушной среде. В этих случаях установлено, что переход
к водному образу жизни связан с утратой эпикутикулы и, наоборот, воз-
вращение в воздушную среду — с ее вторичным новообразованием. По-
добные изменения в строении кутикулы наблюдаются и в ходе развития
у одного из видов тропических насекомых. На стадиях развития, приходя-
щихся на засушливый период, у них имеется хорошо развитая типичная
эпикутикула. В период муссонов при обильной насыщенности атмосферы
влагой эпикутикула отсутствует.
Несмотря па большую изменчивость кутикулярных эпителиев чле-
нистоногих, общий план их организации у представителей большинства
классов оказывается сходным. Имеющиеся топографические и видовые
различия связаны обычно либо с отсутствием или наличием эпикутикулы
и отдельных ее слоев, либо с количественными модификациями в струк-
туре и химическом составе прокутикулы.
Более существенные отклонения от общего плана строения кутикуляр-
ных эпителиев наблюдаются лишь у отдельных групп членистоногих.
В качестве примера можно привести относительно небольшую группу тихо-
ходок, кожные покровы которых хорошо изучены в последнее время,
в связи с повышенной способностью этих животных к криобиозу (Baccetti,
Rosati, 1971).
В прокутикуле тихоходок не обнаружено поровых каналов (рис. 53).
На поверхности эпикутикулы отсутствует цементный слой, но имеется
слой слизи, состоящий из кислых мукополисахаридов. Эпикутикула пред-
ставлена кутикулиновой пластинкой и белковым слоем. Между нею и про-
кутикулой лежит особый промежуточный слой и слой воска. Внутренняя
часть промежуточного слоя состоит из липопротеидов, а наружные части
представлены тонкими слоями склеротизированного белка. Прокутикула
тихоходок по своему химическому составу напоминает эндокутикулу дру-
гих членистоногих. Кутикулярные эпителии тихоходок имеют общие при-
знаки морфобиохимической организации с полихетами, нематодами и чле-
нистоногими, отличаясь тем не менее от кутикулярных эпителиев каждой
из перечисленных групп животных. Наряду с наличием у тихоходок су-
щественных отклонений от общего для членистоногих плана организации
кутикулярных эпителиев, у другого своеобразного класса членистоногих
(Pentastomidae), даже у представителей ведущих паразитический образ
жизни, кутикулярный эпителий имеет типичное строение (Riley, Banaja,
1975).
Естественно, что сложная организация кутикулярной пластинки на-
ружных покровов у членистоногих связана с достаточно сложной диф-
ференцировкой образующих ее клеток, составляющих основную часть
клеточных элементов однослойного кутикулярного эпителия (рис. 51).
Помимо них в составе эпителиального пласта имеются и железистые
клетки, образующие у наземных членистоногих, и в первую очередь у на-
секомых, особые интраэпителиальные малоклеточные железы. Их секрет
идет на построение верхней части эпикутикулы. Эти железы образованы
полиплоидными секреторными клетками. Кроме того, как и у высших
позвоночных, для кожных покровов насекомых характерным является
116
формирование более крупных железистых образований, выполняющих
специальную функцию.
У многих насекомых в составе эпителиального пласта имеются особые
крупные полиплоидные клетки — эноциты. Их функциональное значение
остается недостаточно ясным. Имеются данные об участии этих клеток
в синтезе структурных липидов кутикулиновой пластинки (Wigglesworth,
1970).
В составе эпителия многих насекомых обнаружены так называемые
мочевые клетки, представляющие собой своеобразные почки накопления
Рис. 53. Схема строения кутикулярного эпителия тихоходок. (Рис. М. Ю. Пунина).
1 — слой слизи, 2 — эпикутикула, 3 — кутикулиновая пластинка, 4 — белковая часть эпикутикулы,
5 — промежуточный слой, 6 — слой воска, 7 — прокутикула, 8 — область контакта эпите-
лиальных клеток.
продуктов белкового обмена. В последнее время у личинок некоторых вод-
ных насекомых описаны клетки, основное назначение которых заклю-
чается в регуляции солевого обмена, т. е. они имеют отчетливо выражен-
ную осмотрегуляторную специализацию.
Кутикулярный эпителий членистоногих, и особенно насекомых, пред-
ставляет собой, следовательно, высокодифферепцироваппую тканевую
систему. Одним из проявлений высокого уровня дифференцировки явля-
ется весьма гетерогенный клеточный состав эпителиального пласта.
Не менее сложны и совершенны механизмы тканевой и организменной
интеграции в кутикулярных эпителиях членистоногих, и прежде всего
у наиболее изученных в этом отношении насекомых. Они также имеют
весьма разнообразные проявления. В составе кутикулярного эпителия
у многих насекомых, наряду с дифференцированными в различных на-
правлениях клеточными элементами, обнаружен запас диффузно распре-
117
деленных камбиальных клеток. Показано также, что перед началом линьки
может иметь место вспышка пролиферативной активности, сменяемая
дегенерацией части клеток. Таким своеобразным путем происходит здесь
и обновление клеточного состава популяций, и регуляция численности
клеток в разные периоды функциональной активности ткани. Для кути-
кулярных эпителиев насекомых характерна жесткая детерминация* всех
протекающих в системе процессов. Она проявляется не только в сложной
гетеросинтетической активности клеток, но и захватывает процессы ре-
продукции. Широкое распространение имеют здесь так называемые диф-
ференцирующие митозы, в результате которых образуются две неравно-
ценные по своим потенциям дочерние клетки. Такие митозы лежат
в основе формирования железистых образований и разнообразных вспомо-
гательных структур многочисленных рецепторных аппаратов. Очень часто
дифференцирующие митозы сменяются процессами эндорепродукции,
имеющими широкое распространение у насекомых при развитии желе-
зистых и рецепторных структур.
Особенно ярко системный и организменный контроль дифференци-
ровки и функциональной активности клеток кутикулярного эпителия
проявляется в процессах линьки. Под воздействием гормона линьки
в клетках кожного эпителия развертывается цепь последовательных про-
цессов, конечным результатом которых является замена старой кутикулы
новой. Детальное изучение процессов линьки в классических работах и
в работах последних лет, проведенных на ультраструктурном уровне
(Noble-Nesbitt, 1963b; Locke, 1964; Noirot, Noirot-Timothee, 1966, 1971;
Kunkel, 1975), позволяет характеризовать их достаточно подробно. Акти-
визации гетеросинтетических процессов в клетках часто предшествует
период их усиленной пролиферации. Увеличение количества клеток при-
водит к изменению их формы: они становятся кубическими или даже
высокопризматическими. У некоторых насекомых при этом образуются
многорядные пласты. Изменение динамики синтетических процессов
в клетках гиподермы во время линьки удобнее проследить на конкретном
примере (рис. 54). Первыми синтезируемыми соединениями является так
называемый мелкий пылевидный секрет, оттесняющий апикальную по-
верхность клеток от внутренней поверхности эндокутикулы. В образую-
щееся пространство выделяются секреторные продукты второго типа, так
называемый грубозернистый секрет. Он образуется на рибосомах шерохо-
ватой эндоплазматической сети. Цистерны последней находятся у плазма-
тической мембраны в апикальной части клеток. Этот секрет представляет
собой комплекс гидролитических ферментов. Последние существуют вна-
чале в неактивной форме благодаря, по-видимому, своеобразной конфигу-
рации белковых молекул. Вскоре после начала образования грубозерни-
стого секрета происходит разрушение цитоплазматических отростков, а на
поверхности плазматической мембраны начинает выделяться липопроте-
идный кутикулиновый слой — внутренняя часть новой эпикутикулы. Осо-
бенно детально процессы ее формирования описаны в работе Лока (Locke,
1969). По мере образования кутикулиновой пластинки выделенный ранее
грубозернистый секрет переходит в активную форму, и начинается интен-
сивное растворение старой кутикулы. Образующиеся в результате гидро-
лиза старого хитина и белков низкомолекулярные продукты всасываются
гиподермальпыми клетками и используются организмом на образование
новых белков и хитина. На следующих этапах линьки эпителиальные
клетки последовательно выделяют вещества для формирования новых
экзо-, мезо- и эндокутикул, т. е. всех слоев прокутикулы. В настоящее
время остается неясным, происходит ли объединение хитина и белков
в органоидах клеток и, в частности, в аппарате Гольджи, или же образо-
вание комплекса белка и хитина — вторичное физико-химическое явление,
происходящее уже вне клеток. В авторадиографических опытах с исполь-
зованием 3Н-глюкозы показано послойное, аппозиционное отложение ме-
118
ченого хитина на поверхности эпителиальных клеток (Condoulis, Locke,
1966). При использовании в качестве предшественников меченых амино-
кислот такой четкой картины послойного образования белковых компо-
нентов прокутикулы обнаружить не удалось. Большую роль в сложной
фунциональной деятельности гиподермальных клеток (всасывание про-
дуктов разрушения старой кутикулы и выделение вновь синтезированных
Рис. 54. Схема процессов, происходящих при линьке в кутикулярном эпителии на-
секомых на ультраструктурном (слева) и тканевом (справа) уровнях организации.
(Рис. М. Ю. Пунина).
а — кутикулярный эпителий в предлиночный период, б — стадия формирования пылевидного се-
крета, в — стадия выделения грубозернистого секрета в неактивной форме, г — стадия активизации
гидролитических ферментов, д — стадия образования кутикулиновой пластинки.
продуктов) играют цитоплазматические отростки. Они начинают образо-
вываться с момента выделения клетками первых слоев экзокутикулы.
На завершающих этапах формирования новой кутикулы при помощи от-
ростков клеток в толщу экзо- и частично мезокутикулы выделяются фе-
нольные продукты, вызывающие склеротизацию этих слоев прокутикулы.
В результате происходящих при участии этих продуктов химических про-
цессов экзо- и мезокутикулы приобретают дефинитивную структуру. Мор-
фологически это проявляется в утрате верхними участками прокутикулы
первичной слоистой пластинчатой структуры. К моменту завершения всех
выше описанных процессов активизируется секреторная деятельность
119
желез. Продукты их выделения завершают формирование эпикутикулы,
образуя ее верхний слой. В этот же период происходит образование струк-
турных липидов. Они выделяются отростками клеток кутикулярного эпи-
телия и попадают в верхние слои эпикутикулы через систему поровых
капалов и специальных канальцев в верхних слоях кутикулярной пла-
стинки. Предполагают, что синтез этих липидов происходит в эноцитах
(Wigglesworth, 1970).
Рис. 55. Схема строения эпидермальной клетки насекомых во время образования
белковой эпикутикулы и поглощения линочной жидкости. (Из: Locke, 1969).
1 — линочная жидкость, 2 — кутикулиновая пластинка, 3 — белковый слой эпикутикулы, 4 —
эпикутикулиновые тяжи, 5 — апикальный аппарат Гольджи, 6 — фагосомы, 7 — микротрубочки,
8 — микрофибриллы, 9 — центральный и базальный аппараты Гольджи, 10 — базальная мембрана,
11 — полудесмосомы, 12 — плазматическая мембрана, 13 — лизосомы, 14 — вакуоли. Стрелками
показано внутриклеточное перемещение фагосом и лизосом.
Детали изменений в метаболическом аппарате продуцирующих кути-
кулу клеток эпителия в ходе линьки у представителей разных видов насе-
комых и других членистоногих могут широко варьировать. Однако суть
процесса остается постоянной во всем типе членистоногих. В период
линьки происходит последовательно во времени активация разной синте-
тической деятельности в клетках. Помимо всасывающей и гетерогенной
синтетической деятельности, в клетках кутикулярного эпителия резко
активизируются системы, обеспечивающие поступление ряда высокомоле-
кулярных соединений, необходимых для построения кутикулы, из гемо-
120
лимфы. Для многих насекомых характерно в связи с этим образование
складок плазматической мембраны па базальной поверхности клеток и
увеличение количества митохондрий в этой области. Весьма дифферен-
цирован в этих клетках аппарат Гольджи, отдельные комплексы которого
распределены в разных участках клетки (базальной, центральной и апи-
кальной) и выполняют, по-видимому, различные функции (рис. 55).
Кольчатые черви, приапулиды, моллюски, голотурии и асцидии
Кутикулярные эпителии широко распространены у разных групп со-
временных многоклеточных животных. Они образуют кожные покровы,
передний и задний отделы пищеварительного тракта у кольчатых червей,
нематод, приапулид и ряда других первичноротых (пиявки, коловратки,
сипункулиды и др.). Типичные и весьма сложно организованные кутику-
лярные эпителии характерны для переднего отдела пищеварительного
тракта брюхоногих моллюсков. Тенденция к формированию кутикулы,
как указывалось выше, наблюдается и у морских гидроидных полипов.
Среди вторичноротых своеобразные кутикулярные эпителии имеются
у иглокожих и таких вторично измененных форм, как оболочники и,
в частности, асцидии.
Несмотря на большое структурное и химическое разнообразие кути-
кулярных эпителиев у перечисленных выше представителей многоклеточ-
ных животных, все они характеризуются одной общей особенностью орга-
низации. Как и в кутикулярных эпителиях членистоногих, общим при-
знаком этих эпителиев является наличие постоянной связи между
специализированными внеклеточными структурами кутикулярной пла-
стинки и продуцирующими их клетками. Эта связь по-разному проявля-
ется в кутикулярных эпителиях различных систематических групп. Крат-
кий обзор некоторых механизмов такой взаимосвязи целесообразно дать
на примере кутикулярных эпителиев, характерных для представителей
разных групп многоклеточных животных.
Особенности ультраструктурной организации кутикулярных эпителиев
кольчатых червей изучены в настоящее время у многих олигохет (Gog-
geshall, 1966; Goodman, Parrish, 1971; Postwald, 1971; Richards, 1975) и
полихет • (Hess, Menzel, 1967; Storch, Welsch, 1970; Bantz, Michel, 1971;
Burke, 1974; Burke, Ross, 1975).
Типичным примером кутикулярных эпителиев кольчатых червей яв-
ляется кожный эпителий дождевого червя Lumbricus terrestris (Gogge-
shall, 1966). Однослойный эпителиальный пласт состоит из клеток 3 ти-
пов — призматических, слизистых и так называемых базальных. Призма-
тические и слизистые клетки занимают всю толщу пласта, базальные
находятся в его нижней части. Основная часть кутикулы образована
слоями коллагеновых волокон, расположенных во взаимно перпендику-
лярных направлениях и заключенных в аморфный липопротеидный мат-
рикс. Поверхностная часть кутикулы образована мукопротеидным слоем,
не содержащим коллагеновых волокон. На внешней стороне этого слоя
располагаются окруженные плазматической мембраной эллипсоидные тела
с электронпоплотпым содержимым. Снаружи они покрыты тонкими фи-
бриллами, перпендикулярными поверхности, напоминающими хорошо
развитый падмембрапный комплекс — гликокаликс. Многие авторы пред-
полагают, что эти эллипсоидные тела возникают путем отшпуровывапия
их от апикальной части микроворсипок, пронизывающих кутикулярную
пластинку и выходящих на наружную поверхность кутикулы. Имеются
также данные о том, что эллипсоидные тела представляют собой дина-
мичную, непрерывно обновляющуюся систему (Hess, Menzel, 1967). По-
мимо эллипсоидных тел, конкретное функциональное значение которых
остается неясным, на поверхность кутикулы выходят расширенные
апикальные концы длинных микроворсинок. У некоторых полихет в кути-
121
кулярном эпителии глотки наблюдаются резкие морфологические измене-
ния в поверхностных структурах, связанные с поглощением пищи живот-
ными (Boilly, 1967). Непосредственный контакт апикальных концов микро-
ворсинок с наружной средой связывают с широким распространением
у кольчатых червей осмотического питания за счет поступления веществ
через кожные покровы. Наличие такого питания было показано в опытах
с мечеными предшественниками (Chien et al., 1972).
Рис. 56. Схема строения кутикулярного эпителия полихет. (Рис. М. Ю. Пунина).
1 — базальная мембрана, 2 — тонофибриллы, 3 — гранулы пигмента, 4 — кутикула, 5 — колла-
геновые волокна, 6 — мукопротеидный матрикс, 7 — расширенные концы микроворсинок, 8—10 —
апикальная часть кутикулы, не содержащая коллагеновых волокон и ее исчерченный (9) и пластин-
чатый (10) слои, 11 — эллипсоидные тела, 12 — волокнистый мукопротеиновый слой.
Несмотря на большое разнообразие кольчатых червей общий план
организации кутикулярных эпителиев оказывается сходным у подавляю-
щего большинства их представителей (рис. 56). Даже у недавно изучен-
ных наземных полихет пет принципиальных отличий в строении кути-
кулы по сравнению с морскими видами (Storch, Welsch, 1972). Специфи-
ческие особенности, наблюдаемые в строении кутикулярного эпителия
различных представителей полихет и олигохет, касаются в основном ко-
личественных показателей (число слоев коллагеновых волокон, соотно-
шение толщины поверхностной и основной частей кутикулярного эпите-
лия, соотношение количества железистых и призматических клеток и
т. д.). У некоторых морских полихет (Harmothoe imbricata, Lepidonotus
squamatus) кутикулярная пластинка может достигать значительной тол-
щины. Кроме того, у этих полихет наблюдается образование своеобразных
122
чешуек, состоящих, как и кутикулярная пластинка, из коллагеновых во-
локон и мукопротеидного матрикса.
Относительно мало выяснен в настоящее время вопрос о процессах
физиологической регенерации в кутикулярных эпителиях аннелид. Пред-
варительные данные показывают, что у такой широко распространен-
ной полихеты, как пескожил (Arenicola marina), в эпителии наружных
покровов, а также в эпителии обонятельной ямки удается обнаружить
недифференцированные участки эпителиального пласта (Серговская,
1973). Здесь часто наблюдаются митозы; при инъекции 3Н-тимидина об-
наруживается, что значительная часть клеток содержит меченые ядра
(рис. 57). Эти факты свидетельствуют, по-видимому, о том, что по край-
Рис. 57. Автографы кожного эпителия и эпителия обонятельной ямки полихет после
многократных инъекций 3Н-тимидина. (Из: Серговская, 1973).
с — кожный эпителий, б — эпителий обонятельной ямки Arenicola marina, в — кожный эпителий
полихеты Harmothoe imbricata.
ней мере у некоторых полихет в кожных эпителиях имеет место постоян-
ное обновление клеточного состава.
Большой сложности в структурном и биохимическом отношениях до-
стигают кутикулярные эпителии хищных полихет в области ротового ап-
парата. Помимо коллагеновых волокон, в составе кутикулярной пластинки
важную роль играет хитин и ряд других соединений, обеспечивающих
механическую прочность ротового аппарата. Хитиновые кутикуляр-
ные эпителии наблюдаются в ротовой полости брюхоногих моллюсков
(рис. 58, а). Здесь путем сложной дифференцировки эпителиальной вы-
стилки формируются структуры, необходимые для измельчения раститель-
ной и животной пищи. Эти специализированные участки кутикулярных
эпителиев представляют собой систему закономерно обновляющихся кле-
точных элементов (Runcham, 1963). У некоторых моллюсков конечные
этапы дифференцировки клеток в такой системе сопровождаются процес-
сами их полиплоидизации (рис. 58, б). Непрерывно обновляющийся кле-
точный пласт продуцирует мощную кутикулу, приобретающую сложную
конфигурацию наружной поверхности. Кутикула имеет, по-видимому,
гетерогенный химический состав в разных частях радулярного аппарата.
Весьма своеобразные структуры представляют собой щетинки и об-
разующие их клеточные системы у кольчатых червей, погонофор и неко-
торых других групп животных (Bouligand, 1967; Gustus, Cloney, 1973;
123
Orrhage, 1973). Основными химическими соединениями, образующими
щетинки, являются хитин и белки. Основание щетинок у полихет погру-
жено в толщу стенки тела в области параподий, где покровный кутикуляр-
ный эпителий образует глубокие впячивания — так называемые щетинко-
носпые мешки. За счет сложной морфобиохимической дифференцировки
эпителиальных клеток последних происходит формирование щетинок.
Основными клеточными элементами щетинконосных мешков являются,
во-первых, базальные клетки — хетоциты и, во-вторых, вспомогательные
клетки. Последние располагаются на латеральной поверхности щетинок,
формирование которых начинается путем сложной секреторной деятель-
ности базальпых клеток. Каждая щетинка формируется одной клеткой,
Рис. 58. Автографы кутикулярного эпителия, выстилающего ротовую полость голо-
жаберного моллюска Coryphella rujibranchialts.
а — через 30 час. после введения 3Н-глюкозы, б — через сутки после введения 3Н-тимидина.
I — ядра полиплоидных клеток.
которая претерпевает в ходе развития щетинки существенные измене-
ния. Базальные клетки отличаются большими размерами. На их апи-
кальной поверхности формируется система длинных микроворсинок, ха-
рактерной особенностью которых является наличие в цитоплазме развитой
системы продольно ориентированных микротрубочек. В области каждой
микроворсипки происходит интенсивное выделение хитииопротеидных
комплексов. Из них формируются трубчатые структуры, составляющие
основу коркового вещества щетинки. Совокупность последних спаяна
аморфным матриксом, который выделяется и базальной, и вспомогатель-
ными латеральными клетками. Последние продуцируют также поверхно-
стные слои щетинки, которые и в структурном, и в химическом отношении
отличаются от основной части щетинки. В последнее время появились дан-
ные о том, что основные химические компоненты, из которых построены
щетинки, выделяются латеральными клетками. Роль же хетоцитов за-
ключается в синтезе ферментов, обеспечивающих сложную структурную
организацию белков и мукополисахаридов при формировании дифинитив-
ной структуры щетинки (O’Clair, Cloney, 1974). У некоторых полихет
(провизорные щетинки Nereis vexillosa), помимо поверхностных слоев и
коркового слоя, обнаружено еще и расположенное в центре мозговое ве-
щество. Оно также образовано хитином и белками, однако не содержит
124
трубчатые структуры и характеризуется относительно рыхлым располо-
жением волокон (Gustus, Cloney, 1973).
В сформированной щетинке базальная клетка дегенерирует. Щетинки
у многих животных функционируют относительно недолго и заменяются
новыми, непрерывно формирующимися в каждом щетипкопоспом мешке.
В опытах с 3Н-тимидином удается показать интенсивно протекающие
пролиферативные процессы. Таким образом, каждый щетипконоспый ме-
шок представляет собой весьма динамичную поляризованную систему,
где процессы репродукции и последовательные этапы специфической диф-
ференцировки и гибели клеток топографически строго разграничены
в пространстве.
Приведенные примеры специфических производных кутикулярных
эпителиев кольчатых червей и других животных представляют большой
сравнительно-гистологический интерес. Наличие в составе кутикулы рото-
вого аппарата и щетинок хитина в качестве основного полисахаридного
компонента свидетельствует о том, что информация для синтеза фермен-
тов, необходимых для его образования, имеется в ядерпом аппарате клеток
кутикулярного эпителия у представителей различных групп животных.
Реализация потенций к синтезу этих ферментов наблюдается не только
у членистоногих; это, по-видимому, универсальное свойство специализи-
рованных клеток рассматриваемой разновидности эпителиальных тканей.
Достаточно отчетливо и весьма своеобразно эти потенции проявляются
в кутикулярных эпителиях приапулид — группы, в систематическом отно-
шении близкой к полихетам. Кутикулярные эпителии этих животных изу-
чены в настоящее время с помощью разнообразных методов преиму-
щественно у Priapulus caudatus (Shapeero, 1962; Moritz, 1972; Заварзин,
1973; Лебский, 1974а).
У приапулид эпителиальный пласт образован одним слоем клеток приз-
матической, кубической или слегка уплощенной формы. На апикальной
поверхности пласта имеется мощпая кутикула, состоящая из двух частей:
более толстой гомогенной внутренней мукопротеидной части и уплощен-
пой тонкой оксифильной, преимущественно белковой поверхпостпой части.
Кутикула приапулид представляет собой динамичную структуру, под-
верженную периодически процессам обновления. Интенсивная синтети-
ческая деятельность клеток обнаруживается в период, непосредственно
предшествующий линькам, когда под старой кутикулярной пластинкой
образуется новая. В опытах с мечеными предшественниками белков и
сульфатированных мукополисахаридов показано интенсивное включение
их в новообразующуюся кутикулу (рис. 59). При этом наблюдается отчет-
ливый краниально-каудальный градиент синтетических процессов, свиде-
тельствующий о наличии тканевой и организменной интеграции синте-
тической деятельности клеток в пласте.
У одного из представителей приапулид Halicryptus spinulosus желе-
зистые клетки — белковые и слизистые — сосредоточены в особых участ-
ках эпителия туловища, образуя смешанные железы (см. стр. 37). У Pri-
apulus caudatus имеются большие скопления слизистых клеток в каудаль-
ной области тела. Характерную дифференцировку наружного покрова
представляют собой так называемые зубчики, в большом количестве со-
средоточенные в подвижной глотке этих животных. На месте образования
таких зубчиков, в их основании, наблюдается скоплепие эпителиальных
клеток, имеющих высокопризматическую форму. Кутикулярная пластипка
в области расположения зубчиков имеет вид заостренных шипов и резко
отличается, судя по окраске, от прилежащих частей кутикулы.
Таким образом, кутикулярный эпителий приапулид представляет со-
бой весьма своеобразную модификацию кутикулярных эпителиев. По хи-
мическому составу кутикулы и характеру ее взаимоотношений с клетками
он резко отличается от кутикулярного эпителия полихет. Показано, что
в сформированной кутикуле имеется около 50% хитина, сходного с хити-
125
ном членистоногих (Carlisle, 1959). Наряду с этим избирательное вклю-
чение 3Н-глюкозы и 35в-сульфата натрия в новообразующуюся кутикуляр-
ную пластинку, а также резко положительная окраска внутреннего слоя
кутикулы на кислые мукополисахариды свидетельствуют о наличии
в кутикуле приапулид кислых сульфатированных мукополисахаридов
(Заварзин, 1973). Эти соединения относительно редко обнаруживаются
в кутикулах первичноротых. Под электронным микроскопом в кутикуле
приапулид не удается выявить ни отростков клеток, ни столь характерных
Рис. 59. Кутикулярный'эпителий приапулиды Priapulus caudatus в период, пред-
шествующий линьке. (Из: Заварзин, 1973).
а — участок эпителия в области туловища, б, в — автографы аналогичных участков через 3.5 (б)
и 24 (в) часа после инкубации животных в растворе 8Н-глицина, г — автограф эпителия в области
туловища через 10 суток после инъекции животным 8Н-глюкозы. 1 — однослойный кубический эпи-
телий, 2 — новая кутикула, 3 — старая кутикула, 4 — мукопротеидная часть кутикулы, 5 —
белковая часть кутикулы.
для полихет коллагеновых волокон. Наружный слой кутикулы относи-
тельно гомогенен, внутренний имеет фибриллярное строение. В цито-
плазме эпителиальных клеток содержится большое количество мито-
хондрий и наблюдается заметная гипертрофия поверхности плазматической
мембраны, образующей взаимопроникающие выросты между соседними
клетками (рис. 60). Взаимодействие клеток с кутикулой осуществляется,
по-видимому, двумя путями: интенсивной секреторной деятельностью
клеток в предлиночный период и относительно медленным поступлением
пластических материалов из клеток в кутикулу после формирования ее
внутреннего и наружного слоев. При этом образование дефинитивной
структуры последнего завершается лишь к моменту линьки.
Показано также, что в клетках синтезируется по крайней мере два
типа секретов — гранулярный и фибриллярный. Их формирование и выве-
дение из клеток происходит в определенной последовательности. Вначале
126
образуется белковый гранулярный секрет. Из него начинает строиться на-
ружный слой новообразующейся кутикулярной пластинки. Затем проис-
ходит формирование фибриллярного мукопротеидного секрета, из которого
образуется внутренний слой кутикулы. Одновременно продолжается до-
стройка наружного слоя. При формировании кутикулы имеют место, сле-
довательно, два механизма ее роста: обычный аппозиционный, от поверх-
ности эпителиальных клеток, и диффузионный механизм достройки,
связанный с перемещением выделяемых клетками соединений в поверх-
Рис. 60. Электронная микрофотография кутикулярного эпителия приапулиды Priapu-
lus caudatus. (Из: Лебский, 19746).
Обозначения те же, что и на рис. 59. 6 — мышечный слой.
постный слой новообразующейся кутикулы. По-видимому, при помощи
этого механизма происходит выделение части специфических белков и
хитина. Последний удается обнаружить при биохимическом анализе лишь
в старых, полностью сформированных кутикулах.
Как указывалось выше, кутикулярные эпителии имеют широкое рас-
пространение не только у первичноротых, но и у низших представите-
лей вторичноротых животных.
Весьма своеобразная, в химическом и структурном плане, разновид-
ность кутикулярных эпителиев наблюдается у асцидий. Кутикулярные
эпителии асцидий по внешнему виду напоминают кутикулярные эпите-
лии приапулид. В отличие от кольчатых червей и членистоногих здесь,
как и у приапулид, нет структурной связи между клетками и кутикуляр-
ной пластинкой, поскольку отсутствуют выросты цитоплазмы на апи-
127
кальной поверхности клеток. Связь кутикулярной пластинки с клетками
поддерживается за счет синтетических процессов. Однако в отличие от
приапулид у асцидий не наблюдается периодических линек, а происходит
непрерывное обновление кутикулярной пластинки. При исследовании кож-
ных покровов асцидии Holocynthia aurantium под электронным микроско-
пом (Smith, 1970) в клетках эпителия удается обнаружить хорошо разви-
тые аппараты Гольджи, эндоплазматическую сеть и многочисленные мито-
хондрии. Активная синтетическая деятельность эпителиальных клеток
выявляется также в опытах с введением меченой глюкозы. В этих опытах
метка обнаруживается вначале над цитоплазмой эпителиальных клеток,
где происходит синтез мукополисахарида туницина, близкого к целлю-
лозе растительных клеток. Примерно за 5 суток происходит распростране-
ние метки по всей толщине кутикулы, что свидетельствует о довольно ин-
тенсивном обновлении структуры, обеспечиваемом непрерывно идущими
синтетическими процессами. Помимо специфического для асцидий ту-
пицина, здесь обнаружены также и кислые сульфатированные мукополи-
сахариды. В кутикулу проникают амебоциты из соединительной ткани.
Однако в их ультраструктурной организации не удалось обнаружить при-
знаков активной синтетической деятельности.
У асцидии Perophora viridis в толще кутикулярной пластинки наблю-
дается закономерное расположение двух типов специализированных аме-
боцитов (Deck et al., 1966). В поверхностном слое кутикулярной пла-
стинки сосредоточиваются так называемые пузыревидные амебоциты, об-
наруживающие признаки белковой секреции по голокриновому типу, т. е.
путем разрушения клеток. По-видимому, секрет этих клеток образует са-
мую поверхностную часть кутикулярной пластинки и, в частности, располо-
женные здесь зубчики или спикулы чисто белковой природы. Основная же
масса кутикулы образована у этой асцидии пластинками межклеточного
вещества, представляющими собой сложноорганизованный комплекс бел-
ков и мукополисахаридов. Эта структура образуется в основном за счет
интенсивной синтетической деятельности эпителиальных клеток. Послед-
ние выделяют белки и мукополисахариды вначале в виде тонкого фибрил-
лярного компонента. Окончательная организация дефинитивных пластин-
чатых структур происходит, по-видимому, при участии белков, образую-
щихся при разрушении особой разновидности амебоцитов. Они в виде
сплошного слоя накапливаются в кутикуле над апикальной поверхностью
эпителиальных клеток. Относительное постоянство количества обоих ви-
дов амебоцитов в кутикуле поддерживается за счет непрерывного поступ-
ления их в толщу кутикулярной пластинки из субэпителиальных крове-
носных синусов. Возможно, что наряду с участием в формообразователь-
ных процессах кровяные амебоциты у некоторых видов асцидий несут и
экскреторную функцию.
Кутикулярные эпителии голотурий представляют особый интерес
в связи с тем, что основная механическая функция кожных покровов при-
надлежит не кутикуле, а подлежащей соединительной ткани. Последняя
образует 3 четко отграниченных слоя: поверхностный слой, образованный
преимущественно основным веществом, средний, пластинчатый — из кол-
лагеновых волокон и гиподермальный — из основного вещества и тонких
ретикулиновых волокон. Кутикула голотурий — это относительно тонкая
пластипка на поверхности однослойного эпителия. Она имеет фибрилляр-
пое строение, но фибриллы по своей ультраструктуре не похожи на кол-
лаген. На поверхности пластинки находится относительпо толстый слой
аморфного электроннонлотного вещества. Кутикулярная пластинка, как и
у полихет, пронизана каналами, в которых лежат отростки эпителиальных
клеток. Однако лишь небольшая часть этих отростков достигает электрон-
ноплотпого поверхностного слоя кутикулярной пластинки. Помимо верти-
кальных отростков, клетки дают местами широкие плоские отростки, рас-
полагающиеся непосредственно под кутикулярной пластинкой. В области
128
таких уплощенных лопастей наблюдается интересное структурное объе-
динение плазматической мембраны эпителиальных клеток и нижележа-
щей соединительной ткани. Последняя на всем протяжении эпителиаль-
ного пласта отделена от него базальной мембраной. В области уплощенных
горизонтальных отростков эпителиальных клеток образуются полу-
десмосомы. В соединительной ткани в местах расположения полудесмосом
имеются пучки вертикально ориентированных аргирофильных волокон.
Второй особенностью организации кожного эпителия голотурий является
факультативное структурное объединение эпителиальных и соединительно-
тканных клеток. В толщу эпителиального пласта могут проникать два
типа последних. Зернистые, или гранулярные, клетки, ядросодержащие
тела которых расположены в соединительной ткани, посылают свои от-
ростки через базальную мембрану и межклеточные пространства в эпите-
лии в кутикулу, обеспечивая таким образом поступление гранулярного
материала на ее поверхность. Между эпителиальными клетками и отрост-
ками гранулярных амебоцитов образуются типичные десмосомы. С другой
стороны, такого же типа структурное объединение с эпителиальными
клетками при помощи десмосом наблюдается в случае попадания в состав
эпителиального пласта блуждающих целомоцитов, которые содержат спе-
цифические гранулы и обычно встречаются в соединительной ткани.
Паразитические черви
Уникальные в морфологическом и функциональном отношениях струк-
туры образуются в кожном эпителии паразитических червей, и в част-
ности у цестод. У этих животных полностью редуцируется пищевари-
тельная система и кожные покровы выполняют функцию всасывания, по-
мимо защитной барьерной функции.
При изучении кожного эпителия взрослых цестод под световым ми-
кроскопом удается выявить сплошную кутикулярную пластинку с не-
ровным апикальным краем. Ядросодержащие части клеток в таком
эпителии не образуют сплошного эпителиального пласта, отграниченного
от паренхимы базальной мембраной. Они, как и у бескишечных турбел-
лярий, погружены в паренхиму и расположены на большем или меньшем
удалении от кутикулярной пластинки. Базальная мембрана формируется
на границе последней с паренхимой, прерываясь в области соединения
цитоплазматических отростков с кутикулой.
Электронномикроскопические и цитохимические исследования пока-
зали, что кутикулярная пластинка представляет собой участок цито-
плазмы клеток с митохондриями и многочисленными вакуолями. Она не
является, следовательно, внеклеточным образованием (Тимофеев, 1964;
Lee, 1966, Rifkin et al., 1970; Muthukrishnan, 1974, 1975). Апикальная
поверхность такой псевдокутикулы образует покрытые плазмати-
ческой мембраной нитевидные выросты — микротрихии и более слож-
ные пальцевидные выросты. Структура псевдокутикулярной пластинки
резко отличается от структуры цитоплазмы. Ее основу составляет элек-
тронпоплотный гранулярный компонент, в котором находится большое ко-
личество светлых пузырьков и вакуолей. Функциональное значение этих
образований выяснено еще недостаточно. В настоящее время ясно, что
такая специализированная структура выполняет и барьерно-механическую
функцию и одновременно осуществляет поглощение соединений типа
аминокислот и мопосахаров. Особенно важную роль в процессах всасыва-
ния у цестод играют, по-видимому, микротрихии, принцип работы которых
резко отличается от принципа работы микроворсинок клеток кишечного
эпителия. У некоторых цестод вместо микротрихий на апикальной поверх-
ности псевдокутикулы обнаружены сложные микроворсинки (рис. 61).
Принципиально сходную организацию имеет и погружной кожный эпи-
телий у некоторых трематод, и в частности у подробно изученной в на-
9 А. А. Заварзин
129
стоящее время печеночной двуустки {Fasciola hepatica). У этого живот-
ного в отличие от цестод сохраняется пищеварительная система. Однако
и здесь кожный эпителий играет существенную роль в поступлении ве-
ществ из внешней среды. Псевдокутикулярная пластинка печеночной дву-
устки также представляет собой специализированную часть цитоплазмы
клеток. На ее поверхности постоянно наблюдаются многочисленные пино-
цитозные пузырьки. Здесь микротрихии отсутствуют, однако имеются
своеобразные выросты и многочисленные углубления наружной плазма-
тической мембраны. В толще псевдокутикулы содержится много мито-
Рис. 61. Схема строения покровного эпителия цестоды Tylocephalum sp. (Из: Rifkin
et al., 1970).
1 — микроворсинки, 2 — кутикулярная пластинка, 3 — базальная мембрана 4 — мышечный слой,
5 — тела эпителиальных клеток. 6 — клетки паренхимы»
хондрий, система каналов эндоплазматической сети и большое количество
вакуолей.
Наблюдаемые у паразитических червей структуры обнаруживают
лишь внешнее сходство с рассмотренными выше кутикулами кольчатых
червей и некоторых других животных. Неясность филогенетических свя-
зей этих групп паразитических животных, обусловленная длительной эво-
люцией в своеобразных условиях существования, крайне затрудняет ре-
шение вопроса об источнике развития такого рода структур в филогенезе.
В жизненном цикле цестод имеются стадии, наружные покровы которых
образованы типичным ресничным эпителием. Можно предположить, что
специализация апикальной поверхности эпителиальных клеток в направ-
лении развития кутикулярных барьерно-всасывающих структур происхо-
дила па основе первичного ресничного покрова.
Однако специальное исследование показало, что ресничный покров
личинок у цестод представляет собой провизорную дифференцировку и
полностью редуцируется па определенной стадии жизненного цикла (Ти-
130
мофеев, Куперман, 1972). В то же время развитие псевдокутикулярных
барьерпо-всасывающих структур, специфичных для кожных покровов це-
стод, происходит путем сложных преобразований поверхностного слоя
недифференцированных клеток зародыша. Формированию псевдокути-
кулы с микротрихиями предшествует стадия развития личинки, у которой
па поверхности клеток имеются относительно хорошо развитые и доста-
точно дифференцированные микроворсипки.
Имеются данные о том, что у таких паразитических червей, как не-
матоды, обладающих очень сложно устроенной кутикулой, не всегда уда-
ется обнаружить границу между внутренней ее частью и цитоплазмой
эпителиальных клеток. Специальное исследование, проведенное недавно
па личинках различных стадий развития паразитической нематоды Nema~
tospiroides dubius, показало, что здесь имеет место своеобразный процесс
внутриклеточного образования кутикулярной пластинки (Bonner et al.,
1970). На ранпих стадиях развития этого паразитического червя наруж-
ная поверхность кутикулярной пластинки образована плазматической
мембраной, под которой происходит постепенное накопление фибрилляр-
ных и гранулярных компонентов будущей кутикулы. По мере накопления
в апикальной части клеток этих специфических структур и химических
соединений в цитоплазме начинает формироваться новая плазмати-
ческая мембрана. Вначале она не является непрерывной и участки цито-
плазмы непосредственно контактируют с формирующейся наружной
частью кутикулы. Через эти «окна» в новообразованной плазматической
мембране продолжают поступать компоненты для построения нижележа-
щих слоев кутикулы. Здесь происходит, следовательно, своеобразное пере-
рождение цитоплазмы эпителиальных клеток. На ранних этапах этот про-
цесс коррелирует с гипертрофией центров активного белкового синтеза —
шероховатой эндоплазматической сети — и появлением большого коли-
чества митохондрий в базальных, свободных от метаплазматических вклю-
чений участках цитоплазмы. Наряду с этим своеобразным механизмом
образования межклеточного вещества кутикулы имеет место и характер-
ный для синтеза склеропротеинов механизм, а именно выделение их во
внутриклеточные вакуоли с последующим поступлением вакуолярного со-
держимого за пределы формирующейся плазматической мембраны второй
генерации. Особенно большое удельное значение этот механизм приобре-
тает после завершения формирования плазматической мембраны второй
генерации. Здесь, в непосредственном контакте с ее внутренней поверх-
ностью, происходит образование волокнистых слоев внутренней части ку-
тикулы. В это время в нижележащих участках цитоплазмы начинается
формирование плазматической мембраны третьей генерации.
Эти наблюдения над процессами гистогенеза кутикулы нематод на
ультраструктурном уровне представляют большой общебиологический ин-
терес. Здесь имеет место комбинация обычного секреторного механизма
образования межклеточных структур со своеобразным процессом экто-
плазматического перерождения цитоплазмы эпителиальных клеток. В бо-
лее поздних публикациях по этому вопросу (Bonner, Weinstein, 1972; Mi-
nier, Bonner, 1975) авторы приходят к выводу о том, что кутикулы
у изученных нематод выделяются путем обычной секреции химических
компонентов клетками. Однако этот вывод, па наш взгляд, требует более
убедительных доказательств.
Существенный интерес представляют также данные о структуре,
ультраструктуре и химическом составе кутикул взрослых нематод, и в ча-
стности одного из наиболее изученных представителей — Ascaris luntbri-
coides (Watson, 1965; Anya, 1966a). Поверхностный слой мощной кути-
кулы этих животпых образован осмиофилыюй пластинкой толщиной
около 100 А. Этот слой имеется у многих других видов нематод и обна-
ружен также па личппочпых стадиях развития аскариды. Он представ-
ляет собой, вероятно, видоизмененную плазматическую мембрану Гипо-
O’
131
дермы, отделяемую в начале формирования поверхностного слоя кути-
кулы (рис. 62).
Следующий за ним наружный слой представлен у аскариды аморфным
электроппоплотным веществом. Поперечные борозды, имеющиеся па по-
верхности кутикулы, заходят в этот слой и делят его па ряд колец. Под
наружным кортикальным слоем лежит внутренний, состоящий из сети
фибрилл. Ниже лежит слой кутикулы, образованный гомогенной или
слегка исчерченной в вертикальном направлении пластинкой, занимаю-
щей по толщине около 7 s всей кутикулы. Далее следуют три волокни-
стых слоя, каждый из которых состоит из пучков коллагеновых фибрилл,
не обнаруживающих характерной для позвоночных поперечной печерчеп-
Рис. 62. Схема строения кутикулярного эпителия нематоды Ascaris lu mbricoides.
(Из: Bird, Bird, 1969).
1 — поперечные борозды в наружном кортикальном слое, 2 — наружный кортикальный, 3 — вну-
тренний кортикальный, 4 — фибриллярный, 5 — промежуточный, 6 — пограничный, 7 — волокни-
стый слои, 8 — плазматическая мембрана, 9 — цитоплазма гиподермы, 10 — сократимая часть
мышечной клетки, 11 — ядро мышечной клетки.
ности. Пучки коллагеновых фибрилл в каждом слое располагаются строго
закономерно под углом 135° друг к другу. Внутренний слой кутикулы
аскариды носит название базальной пластинки и располагается между
гиподермой и внутренним фибриллярным слоем. Его структура сходна со
структурой волокнистых слоев, пучки коллагеновых фибрилл отличаются
лишь несколько меньшей толщиной. Относительно наличия плазматиче-
ской мембраны на апикальной поверхности гиподермы нет единого мне-
ния. Некоторые авторы отрицают ее существование, другие, наоборот,
описывают отчетливо выраженную мембрану. Противоречия относительно
этой очень важной для понимания организации кутикулярных эпителиев
структуры могут получить объяснение в свете рассмотренных выше дан-
ных по динамике образования кутикулы у Nematospiroides dubius. Воз-
можно, что в случае аскариды разные авторы имели дело с животными,
находящимися на различных стадиях заключительного этапа формирова-
ния кутикулы.
Говоря о химическом составе выше рассмотренной сложной многослой-
ной структуры, можно отметить, что основным компонентом ее являются
различные белки. В последние годы в ее составе обнаружено незначитель-
ное количество углеводов и липидов. Анализ аминокислотного состава
132
белков наружного кортикального слоя показал большое сходство их с ке-
ратинами в ороговевающих эпителиях высших позвоночных. Вместе с тем
отсутствие гидрооксипролипа, а также результаты дифракционного ана-
лиза показывают, что кератины аскариды по ряду свойств существенно
отличаются от кератинов позвоночных. Среди прочих белков кутикулы
аскариды основную массу составляют разновидности коллагена, который
обнаруживает ряд существенных особенностей по сравнению с коллагеном
позвоночных животных. В кутикуле аскариды и других нематод содер-
жатся соединения, способные осуществлять перенос электронов, и,
следовательно, здесь могут протекать реакции биологического окисления.
Некоторые авторы обнаруживали в кутикуле небольшое количество
РНК и ферментов (Anya, 1966b). Кутикула аскариды представляет со-
бой, следовательно, не просто инертный наружный скелет, по систему,
в которой протекают биохимические процессы.
В кутикулярных эпителиях других представителей пематод, изучен-
ных в настоящее время па ультраструктурпом уровне, наблюдаются более
или менее существенные отклонения от вышеописанной организации ку-
тикулы аскариды. Так, например, у Nippostrongylus brasiliensis — лишь
один кортикальный слой, в котором не выявляются никакие структуры.
Кроме того, у этой нематоды имеются всего два волокнистых слоя, а вместо
промежуточной пластинки обнаруживается полость между кортикальным
п фибриллярными слоями. Она заполнена жидкостью, содержащей гемо-
глобин. Здесь встречаются также различные поддерживающие структуры
коллагеновой природы. Существенные особенности в строении отдельных
слоев кутикулы наблюдаются и у других представителей нематод. Особый
интерес представляют обнаруженные в средних слоях кутикул многих не-
матод вертикальные каналы. Предполагают, что они обусловливают воз-
можность внутреннего роста кутикулы, характерного для многих нематод.
Нематодам свойствен процесс линьки, цитологические механизмы
которого имеют ряд общих черт с таковыми у высших первичноротых
животных, в частности у насекомых. В ходе развития нематоды претер-
певают обычно четыре линьки, течение которых регулируется нейроэн-
докринной системой. В настоящее время этот процесс подробно изучен
у нескольких представителей нематод (Bird, Rogers, 1965; Davey, 1965;
Bird, Bird, 1969; Bonner et al., 1970; Lee, 1970). У животных перед линь-
кой происходит гипертрофия белоксинтезирующего аппарата и ядер.
Последовательные по времени процессы своеобразного эктоплазматиче-
ского перерождения апикальных участков цитоплазмы, а также выделе-
ние тропоколлагена при формировании кутикулы были описаны выше
на примере нематоды Nematospiroides dubius. С теми или иными вари-
антами они характерны и для всех прочих нематод. У нематоды Pho с ci-
nema decipiens отмечено участие мышечных элементов в синтезе липид-
ных компонентов кутикулы (Davey, 1965). У некоторых нематод имеют
место аналогичные членистоногим процессы растворения глубоких слоев
старой кутикулы, за исключением кортикального слоя, и реутилизация
продуктов гидролиза через плазматическую мембрану клеток. Эти про-
цессы описаны у Meloidogyne javanica (Bird, Rogers, 1965). У других
представителей нематод гидролиз и реутилизацию компонентов старой
кутикулы наблюдать не удается (Lee, 1970).
Таким образом, специализация кожных покровов у нематод в про-
цессе эволюции привела к созданию весьма сложных, своеобразных и
совершенных в функциональном отношении структур. Они представлены
достаточно большим количеством модификаций единого типа строения,
что отражает их эволюционную пластичность.
Весьма примечательно, что по ряду признаков организации кутикула
нематод сходна с кутикулой членистоногих, хотя в химическом отноше-
нии между кутикулярными структурами этих животных имеются глубо-
кие принципиальные различия. Некоторые общие черты обнаруживаются
133
у нематод и с кожным эпителием позвоночных, а именно внутриклеточ-
ное образование кутикулы и наличие в составе кутикулы аскариды бел-
ков, сходных по свойствам с кератинами рогового слоя эпителиев позво-
ночных животных. Наконец, наличие в кутикуле нематод коллагеновых
волокон сближает ее с кутикулой апнелид.
МНОГОСЛОЙНЫЕ ЭПИТЕЛИИ
Высшие позвоночные (млекопитающие, птицы, рептилии)
Усовершенствование барьерной изолирующей функции на базе много-
слойных эпителиев является вторым основным направлением филогене-
тической дифференцировки кожных эпителиев. Естественно, что наибо-
лее сложной организации многослойный кожный эпителий достигает
у представителей высших классов позвоночных, ведущих наземный об-
раз жизни, — рептилий, а также птиц и млекопитающих. Многослойный
плоский ороговевающий эпителий этих животпых представляет собой
тканевую систему с закономерно ориентированным в пространстве на-
правлением специализации клеток. Она построена на принципе непре-
рывного или периодического обновления клеточного состава. Процесс
специализации или цитодифференцировки связан с накоплением клет-
ками специфических фибриллярных белков — кератинов и вторичным
преобразованием этих белков в сложные надмолекулярные структуры.
На заключительных этапах цитодифференцировки в клетках происходят
автолитические процессы, обеспечивающие разрушение основных орга-
ноидов цитоплазмы и структур ядерного аппарата. Весь этот сложный
комплекс морфобиохимических процессов получил название кератиниза-
ции. Его изучению посвящена большая литература, обобщенная в много-
численных сводках и обзорах (Spearman, 1966; Parakkal, Alexander,
1972; Elias, Friend, 1975, и др.).
Кератины представляют собой гетерогенную по последовательности
аминокислот и аминокислотному составу группу белков. Их характерной
особенностью является относительно большое количество серусодержа-
щих аминокислот. По своей надмолекулярной организации кератины от-
личаются большим разнообразием. Выделяют две основные их разно-
видности с характерным расположением трех полипептидных цепей
в пространстве — а- и p-кератины. Для p-кератинов характерно линейное,
а для а-кератинов — спиральное расположение этих цепей. Р-кератипы
содержат большее количество серусодержащих аминокислот. Третья
разновидность кератинов, также весьма богатая серусодержащими
аминокислотами, так называемые у-кератины, характеризуется мепее
правильной укладкой полипептидных цепей в молекуле сложного
белка.
Общим свойством а- и p-кератипов является обилие и разнообразие по-
перечных связей между соседними полипептидными цепями и в преде-
лах одной цепи. Важнейшее значение имеют здесь дисульфидные мо-
стики, возникающие на основе SH-групп остатков цистеина. Существен-
ную роль играют водородные, ионные, а также гидрофобные связи.
Наличие и разнообразие всех этих связей и определяет химическую
устойчивость и механическую прочность кератинов, а также возмож-
ность формирования ими сложных надмолекулярных фибриллярных
комплексов.
Сущность процессов, происходящих в кожных эпителиях при орого-
вении. наглядно выступает при использовании для их изучения совре-
менных морфобпохимичсских методов исследований (электронной микро-
скопии, авторадиографии, цитохимии). Особенно многочисленны иссле-
дования, проведенные в последнее время па многослойных эпителиях и
134
их производных млекопитающих животных и человека (Lavker, Matoltsy,
1970; Chapman, Gemmell, 1971; Wolff, Schreiner, 1971; Jessen et al., 1974;
Fukuyama, Epstein, 1975; Meyer, Schreder, 1975).
Одним из примеров в этом отношении может служить эпител ей кожи
пальца человека (Brody, 1970; Mazzuca, Agache, 1970). Он представляет
собой мощный многослойный эпителиальный пласт, состоящий из не-
скольких слоев клеток, находящихся на последовательных стадиях
ороговения (рис. 63). Наиболее глубокие слои образованы живыми
клетками с базофильной цитоплазмой. Здесь различают базальный слой на
границе с соединительной тканью и несколько слоев шиповатых, или кры-
латых, клеток. Граница
с соединительной тканью
неровная, что увеличивает
общую площадь контакта
этих тканей. Верхние слои
шиповатых клеток контак-
тируют со слоем зерни-
стых клеток, содержащих
в цитоплазме глыбки базо-
фильного уплотненного
субстрата (зерна керато-
гиалина). Далее следует
оксифильный блестящий
слой и, наконец, несколь-
ко десятков слоев роговых
чешуек.
Сущность процессов
специфической дифферен-
цировки особенно нагляд-
но выступает при сопо-
ставлении базальных, не-
дифференцированных, спо-
Рис. 63. Многослойный пло-
ский ороговевающий эпителий
кожи пальца человека.
1 — базальный слой, 2 — слой ши-
поватых клеток, 3 — слой зерни-
стых клеток, 4 — блестящий слой,
£ — слой роговых чешуек, 6 —
соединительная ткань.
собных к пролиферации клеток и дифференцированных, непосредственно
осуществляющих барьерную функцию, роговых чешуек (рис. 64).
Клетки базального слоя характеризуются наличием хорошо разви-
тых десмосом, связывающих их между собой и со слоем шиповатых кле-
ток. На их нижней поверхности имеются многочисленные полудесмо-
сомы, обеспечивающие связь эпителиальных клеток с наружным свет-
лым слоем базальной мембраны. В цитоплазме относительно хорошо
развиты мембранные органоиды, имеются и многочисленные свободные
рибосомы. Помимо фибриллярных структур десмосом имеются пучки тоно-
фибрилл, не связанных с десмосомами. Они образованы фибриллярными
белками и появляются в рассматриваемых клетках в результате синтеза
специфических белков.
Активное состояние метаболического аппарата клеток базального слоя
отчетливо проявляется в строении ядра. В нем имеются обширные об-
ласти деспирализовапиого хроматина, а в его оболочке — большое коли-
чество ядерпых пор. В опытах с предшественниками синтеза белка и
Рис. 64. Схема организации клеток отдельных слоев многослойного плоского орого-
вевающего эпителия кожи пальца человека. (Рис. В. К. Четверухина).
а — базальный, б — шиповатый, в — зернистый, г — блестящий, д — роговой слои. 1 — кератоцит»
2 — меланоцит, з — десмосомы, 4 — полудесмосомы, 5 — базальная мембрана, 6 — митохондрии,
7 — аппарат Гольджи, 8 — свободные рибосомы, 9 — шероховатая эндоплазматическая сеть, 10 —
тонофибриллы, 11 — пиноцитозные пузырьки, 12 — гранулы меланина, 13 — ядро, 14 — муко-
протеидные гранулы, 15 — межклеточные пространства, 16 — кератогиалин, 17 — лизосомы, 18 —
фибриллярный белок, 19 — цементирующее вещество, 20 — липидные гранулы, 21 — остатки десмо-
сом, 22 — а-кератиновые волокна, 23 — аморфное вещество.
РНК (Н3-лейцин, 535-метионин и некоторые другие аминокислоты,
а также Na2HP32O4 или Н3-уридин) максимальное включение происходит
в белки и РНК базальных и шиповатых клеток (Жинкин, 1959;
Fukuyama et al., 1965). Последние характеризуются большим развитием
десмосомпого аппарата, более плотным расположением и концентриче-
ской ориентировкой вокруг ядра пучков тонофибрилл. Кроме того, в верх-
них шиповатых клетках появляются ограниченные мембранами гранулы
с мукопротеидами (Matoltsy, 1966). Между клетками базального и шипо-
ватого слоев в естественном состоянии имеются пространства, заполнен-
ные тканевой жидкостью.
Дифференцированные клетки (роговые чешуйки) представляют собой
овальные структуры с четко выраженными границами. В межклеточных
промежутках видны видоизмененные десмосомы, и все пространство
между клетками заполнено цементирующим веществом. Для роговых че-
шуек характерно резкое утолщение клеточной оболочки. Однако это свя-
зано не с изменением плазматической мембраны, имеющей обычную
трехслойную структуру, а с уплотнением периферической цитоплазмы.
Показано, что здесь накапливаются белки, содержащие особенно большое
количество серусодержащих аминокислот (Fukuyama, Epstein, 1969).
Основная часть роговой чешуйки заполнена плотно упакованными кера-
тиновыми фибриллами диаметром 80 А. Они образованы а-кератином.
Между электроннопрозрачпыми, светлыми па фотографиях, фибриллами
а-кератина имеется электронноплотное аморфное вещество из у-кера-
тина. В центре клетки удается обнаружить относительно низкомолеку-
лярные продукты гидролиза, не имеющие видимой структурной органи-
зации. При гистологической обработке они обычно извлекаются из
роговых чешуек. Естественно, что никаких признаков активного метабо-
лизма в роговых чешуйках обнаружить не удается.
Сопоставление структуры клеток базального и шиповатого слоев и
роговых чешуек показывает, что в рассматриваемой тканевой системе на
протяжении относительно небольшого отрезка времени происходят ко-
ренные преобразования клеточной организации. Они заключаются в ут-
рате клеткой ее основных органоидов, накоплении и вторичном преобра-
зовании больших масс специфического белка и некоторых других соеди-
нений. Все эти процессы происходят в клетках зернистого и блестящего
слоев. В клетках верхнего шиповатого и зернистых слоев удается наблю-
дать процессы экзоцитоза. Ограниченные мембранами гранулы подходят
к плазматической мембране, сливаются с ней и выделяют свое содержи-
мое в межклеточное пространство. В цитоплазме клеток зернистых слоев
появляются базофильные электронноплотные гранулы сложного химиче-
ского состава (Matoltsy, Matoltsy, 1972). На рибосомах шероховатой
эндоплазматической сети начинается синтез фибриллярного белка, кото-
рый накапливается в каналах эндоплазматической сети.
В работе, выполненной на ороговевающем эпителии рубца жвачных
млекопитающих (Lavker, Matoltsy, 1970), показано, что в клетках бле-
стящего слоя происходит объединение электронноплотных гранул вокруг
ядра, пучки тонофибрилл перемещаются па периферию. Цистерны эндо-
плазматической сети расширяются, заполняясь фибриллярным белком,
предшественником кератина. Одновременно из лизосом высвобождаются
гидролитические ферменты, действующие специфически. Постепенно ре-
дуцируются ядерпый аппарат, рибосомы и мембранные органоиды
клетки. Продукты гидролиза выходят из клетки и скапливаются в меж-
клеточных промежутках в виде плотных масс. Содержимое электронно-
плотных гранул рассеивается и смешивается с фибриллярным белком,
а па периферии под плазматической мембраной появляются светлые
кератиновые фибриллы, спаянные электронноплотным матриксом.
Одновременно здесь происходит утолщение периферического слоя цито-
плазмы.
137
В настоящее время неясно, в какой мере наблюдаемые в клетках зер-
нистого и блестящего слоев структурные изменения отражают активные
метаболические процессы и в какой мере они связаны с катаболическими
явлениями и вторичными преобразованиями новообразованных белков и
других соединений. Показано, в частности, избирательное накопление не-
которых аминокислот в клетках зернистого слоя (3Н-аргинин, 3Н-гисти-
дпн, 3Н-глицип, 3Н-серин, 3Н-тирозин). При этом обнаружено, что разные
аминокислоты включаются в белки разных структурных компонентов
клеток (Fukuyama et al., 1965). Обнаружена также повышенная актив-
ность некоторых ферментов в клетках зернистого слоя (кислая фосфа-
таза). Эти данные свидетельствуют о наличии здесь активных метаболи-
ческих процессов. С другой стороны, значительная часть специфических
белков синтезируется, несомненно, клетками росткового слоя и в выше-
лежащих слоях подвергается лишь вторичным изменениям.
Таким образом, имеющиеся данные свидетельствуют о том, что резкие
структурные преобразования в клетках ороговевающих эпителиев на за-
ключительных этапах их дифференциации отражают сложный комплекс
анаболических и катаболических процессов. Они сопровождаются объеди-
нением синтезированных ранее специфических белков в надмолекуляр-
ные структуры. В настоящее время неясно, в какой мере эти процессы
связаны с деятельностью специфических ферментов, а в какой мере
являются результатом простой полимеризации.
Рассмотренный тип организации многослойных ороговевающих эпите-
лиев имеет широкое распространение в кожных покровах млекопита-
ющих и птиц. Его характерной особенностью является быстрое прохож-
дение клетками заключительных этапов цитодифференциации и весьма
существенное преобразование их на этих этапах. Роговые слои, возника-
ющие при таком типе кератинизации, характеризуются непрерывным
естественным слущиванием поверхностных слоев роговых чешуек. Дан-
ный тип ороговения получил название мягкой кератинизации.
Второй тип кератинизации носит название твердой кератинизации.
Роговые чешуйки, формирующиеся при этом типе кератинизации, внешне
сходны с только что рассмотренными роговыми чешуйками. В основе
организации чешуек, составляющих роговые слои при твердой кератини-
зации, находятся спаянные аморфным у-кератином пучки фибрилл диа-
метром 80 А, имеющие структуру типичного а-кератина. Здесь также
наблюдается уплотнение периферического слоя цитоплазмы, и особенно
большое развитие получает межклеточный спаивающий цемент (Gemmell,
Chapman, 1971). Особенностью твердой кератинизации является более по-
степенное развитие процесса в клетках. Здесь отсутствуют зернистые и
блестящие клетки. Клеточные элементы, вступающие па путь специфиче-
ской дифференцировки, начинают постепенно накапливать пучки про-
кератииовых фибрилл при одновременном или несколько более позднем
появлении межфибриллярного матрикса. Данный тип кератинизации ха-
рактеризуется образованием более твердых структур. Его особенностью
является отсутствие слущивания и распада роговых чешуек. Такой тип
кератинизации характерен для коркового вещества стержня волоса, ног-
тей, рогов и ряда других образований. Детальная ультраструктурная ха-
рактеристика изменений клеток при твердой кератинизации приводится
в ряде работ (Chapman, Gemmell, 1971; Hashimoto, 1971, и др.). В химиче-
ском отношении твердый кератин отличается большим процентным содер-
жанием серусодержащих аминокислот.
Кроме этих наиболее характерных разновидностей кератинизации,
у млекопитающих существует и ряд других модификаций данного про-
цесса. При гистогенезе эпителия пищевода имеются стадии с большим
количеством мукоида в ороговевающих клетках. Зернистый слой отсут-
ствует при ороговении эпидермиса па хвосте грызунов и при так называ-
емом патологическом ороговении — паракератозе. Характерной особеп-
138
ностыо этой разновидности ороговения является длительное сохранение
ядерных структур, т. е. здесь имеет место остановка катаболических про-
цессов на более ранних, чем в разобранных выше примерах, этапах.
Весьма существенно отличаются в структурном отношении роговые
чешуйки, образующие перо птиц, в которых кератин представлен не
фибриллами а-кератина с диаметром 80 А, а фибриллами значительно
большего диаметра (200 А), образованными Р-кератином. Они состоят из
протофибрилл диаметром 30 А. Количество цистина в фибриллярном
Р- и аморфном у-кератине одинаково в отличие от роговых чешуек мле-
копитающих, где цистеина больше в аморфном у-кератине (Matoltsy,
1969; Brush, 1974; Kemp et al., 1974).
Многослойные пласты кожного эпителия млекопитающих и птиц пред-
ставляют непрерывно обновляющиеся системы, т. е., как и другие кам-
биальные системы, построены по принципу динамического равновесия.
Особенностью камбиальных базальных клеток кожного эпителия млеко-
питающих и птиц является большая гетерогенность системы по ско-
рости размножения как в пределах одного участка, так и в разных уча-
стках эпителия. В одном и том же участке, помимо обычного «рабочего»
камбия, обеспечивающего увеличение количества клеток, необходимого
для замены слущиваемых роговых чешуек в нормальных условиях, име-
ются еще и резервные субпопуляции, используемые в случае выхода си-
стемы из равновесия при травме или сильных, выходящих за пределы
нормы, воздействиях на кожные покровы физических или химических
факторов внешней среды.
В последнее время появились данные о наличии сложной организации
системы камбиальных базальных клеток кожного эпителия (Allen, Pot-
ten, 1974; Potten, 1974). Эта система в эпителии спины у мышей состоит
из отдельных клопов клеток, в среднем по 10 клеток в одном клоне. Цен-
тральная клетка в каждом клоне характеризуется отсутствием десмосом
и полудесмосом, а также более медленным темпом пролиферации. Выска-
зывается предположение о том, что эта клетка является родоначальни-
цей клона пролиферирующих клеток. Таким образом, можно предполо-
жить, что в кожном эпителии имеет место клопальпый принцип орга-
низации камбиальной системы с выделением в каждом клопе стволовой
родоначалыгой клетки и периодически обновляющихся рабочих камбиаль-
ных клеток.
В разных участках кожного эпителия млекопитающих средняя про-
должительность митотического цикла базальных клеток может варьиро-
вать от 20 час. до 100 час. Такая гетерогенность системы камбиальных
элементов в комбинации с различной скоростью физиологической регене-
рации и различной длительностью существования роговых чешуек при
мягкой кератинизации создает предпосылки для большой эволюционной
пластичности кожных эпителиев па основе сходного (в химическом отно-
шении) процесса специфической дифференцировки клеток. В качестве
примера такой пластичности можно привести три топографически раз-
личных участка кожпого эпителия у одного и того же животного — эпи-
телий губы, эпителий подошвы п эпителий хвоста крысы или мыши. При
приблизительно одинаковой толщине росткового слоя во всех трех уча-
стках эпителий губы резко выделяется меньшей толщиной рогового слоя.
При этом скорость физиологической регенерации и перемещения клеток
в пласте примерно одинакова в эпителии подошвы и губы и на порядок
меньше в эпителии хвоста.
Еще более сложные отношения наблюдаются в нитевидных сосочках
языка (Cameron, 1966). Здесь, в основании сосочка, расположены одно-
родные камбиальные клетки, однако судьба и характер кератинизации
продуктов их размножения определяются теми микроусловиями, в кото-
рые попадают клетки после митоза. В случае смещения их перпендику-
лярно к поверхности базального слоя в течение 3—4 суток происходит
139
ороговение по типу мягкой кератинизации. В случае распространения но-
вообразованных клеток непосредственно по базальной части сосочка они
длительно перемещаются по границе с соединительной тканью (рис. 65).
Клетки ороговевают и смещаются в слой роговых чешуек лишь на вер-
шине соединительнотканного сосочка. При этом ороговение их происхо-
дит по типу твердой кератинизации. Продолжительность жизненного
цикла таких клеток в два раза больше, чем продолжительность жизнен-
ного цикла клеток первого типа. Имеются данные о том, что сложная тра-
ектория перемещения и возрастная гетерогенность дифференцирующихся
клеток характерны и для других участков кожного эпителия млекопита-
ющих животных и человека (Димент, Лебедева, 1973).
Рис. 65. Многослойный плоский ороговсвающий эпителий языка мыши в области
нитевидного сосочка. (Рис. М. Ю. Пунина).
а — схема строения, б — автограф через 5 суток после начала опыта с пятикратными инъекциями
3Н-тимидина (интервал между инъекциями 11 час.). 1 — базальный, 2 — шиповатый, 3 — зернистый
слои, 4 — роговая чешуйка при мягкой, 5 — роговая чешуйка при твердой кератинизациях. Стрел-
ками показано направление перемещения двух субпопуляций дифференцирующихся клеток.
У большинства исследованных представителей млекопитающих и птиц
цикличность процессов репродукции и дифференциации наблюдается
лишь при образовании таких структур, как перо или волос. Однако у сло-
нов показано наличие такой периодичности и в кожном эпидермисе. При
смене волос происходит отторжение не только старых волос, но и целых
генераций роговых чешуек в прилегающих к волосу участках эпидер-
миса. Массовое отторжение первых генераций роговых чешуек происхо-
дит и в начале постпатальпого развития у мышевидных грызунов.
Особенностью многослойных кожных эпителиев млекопитающих п
птиц является наличие у камбиальных базальных клеток отчетливых при-
знаков специфической дифференцировки (пучки топофибрилл). Большой
интерес представляет выяснение факторов, обусловливающих торможе-
ние процессов кератинизации на уровне росткового слоя. В многочислен-
ных исследованиях, проведенных на эмбриональных зачатках кожного
эпителия млекопитающих и птиц (McLoughlin, 1961; Dodson, 1967; Eld-
sale, Bard, 1974; Dhonailly, 1975, и др.), удалось показать, что таким фак-
тором является контакт эпителия с высокомолекулярными белками, и
в частности с коллагеном соединительной ткани. При замене последней
на хрящевую ткань (in vitro) происходит снятие тормозящего влияния и
наблюдается полное ороговение всего эпителиального пласта. Удалось
140
наблюдать метаплазию кожного эпителия в железистый и ресничный
эпителии при замене кожной соединительной ткани соединительной
тканью желудочно-кишечного тракта. Наконец, само существование за-
чатков кожпого эпителия в культурах in vitro возможно лишь при усло-
вии их взаимодействия с коллагеном. В отсутствие последнего через
24 часа происходит полная деструкция эпителиальных пластов.
Большой интерес представляют также факты, свидетельствующие
о возможности синтеза коллагена и некоторых мукопротеидов соедини-
тельной ткани клетками базального слоя эпителия при гистогенезе рого-
вицы глаза млекопитающих (Trelstad et al., 1974).
В регуляции нормального взаимоотношения двух процессов, лежащих
в оспове организации многослойных ороговевающих эпителиев — керати-
пизации и репродукции клеток, большую роль играют взаимодействия
между дифференцированными и базальными клетками. Показано суще-
ственное влияние па эти взаимоотношения некоторых физических и хи-
мических, внешних для организма, факторов (витамина А, механических
воздействий на поверхность эпидермиса, радиации). В опытах in vitro
удалось получить метаплазию эмбрионального эпидермиса при культи-
вировании его в условиях избытка витамина А. Усилепие пролифера-
ции клеток и утолщение слоя роговых чешуек постоянно наблюдается
при хронических механических воздействиях на поверхность кожного
эпителия.
Сложную, многоэтапную защитную реакцию вызывает регулярное воз-
действие больших доз ультрафиолетовых лучей (УФ). При умеренных
дозах радиации изоляция клеток базального слоя и их генетического ап-
парата от этих воздействий осуществляется специальными клетками —
меланоцитами. Они мозаично распределены в базальном слое, а в ходе он-
тогенеза возникают из нервного зачатка (Rawless, 1947). Меланоциты
заселяют эпителиальные пласты путем активной миграции в процессе
эмбриогенеза. В дефинитивном эпителии они представляют собой оваль-
ные клетки с отростками на апикальной поверхности. Они не связаны
десмосомами с соседними эпителиальными клетками, однако находятся
под общим системным контролем, обеспечивающим постоянство их ко-
личества в эпителиальном пласте. При умеренных дозах УФ-облучения
имеющиеся в этих клетках бесцветные формы пигмента переходят в ок-
рашенную форму. При более сильных дозах УФ-облучения происходит
усиление синтеза этого пигмента-. Очень сильные воздействия вызывают
разрушение лизосомных мембран. При этом выделяются вещества, сти-
мулирующие размножение резервных субпопуляций клеток базального
слоя, что обусловливает резкое утолщение эпителиального пласта и, в ча-
стности, его рогового слоя.
Помимо внутрисистемных и непосредственных межтканевых регуля-
ций, процессы репродукции и дифференцировки клеток в многослойных
кожных эпителиях млекопитающих и птиц находятся, как и в других
тканях, под контролем общих нейрогуморальных систем организма. Спе-
цпфикой кожпого эпителия в этом отношении является лишь более высо-
кая пластичность системы. Она обусловлена сложной организацией кам-
биальной системы и возможностью варьирования в широких пределах и
скорости физиологической регенерации и абсолютного количества клеток
в многослойном эпителиальпом пласте. Такая пластичность клеточных
популяций в филогенезе высших позвоночных коррелирует с отмеченной
выше пластичностью самого процесса кератинизации на молекулярном и
надмолекулярном уровнях формирования роговых чешуек. За счет подоб-
ной корреляции в кожных покровах высших позвоночных формируются
весьма разнообразные структуры (ногти, рога, копыта, волосы и др.).
В основе их образования лежат, тем не менее, единый для всех высших
позвоночных тип специализации клеток и общие системные закономер-
ности внутренней организации многослойных ороговевающих эпителиев.
141
Сходство организации кожных эпителиев у высших позвоночных осо-
бенно- наглядно выступает при рассмотрении кожных эпителиев репти-
лий. Как известно, ныне живущие рептилии принадлежат к трем давно
дивергировавшим ветвям предков наземных позвоночных. Они представ-
ляют собой, следовательно, группы животных, прошедших длительную
независимую дивергентную эволюцию. Наибольшие изменения при этом
9
Рис. 66. Схема строения кожного эпителия чешуйчатых рептилий в предлин очном
состоянии. (Рис. В. К. Четверухина).
2, II — первая и вторая генерации роговых чешуек. 1 — поверхностный слой чешуек с шипами, 2 —
слой p-кератиновых роговых чешуек, 3 — промежуточный слой, 4 — слой а-кератиновых роговых
чешуек, 5 — слой светлых клеток, 6 — ростковый слой, 7 — волокна р-кератина, 8 — аморфное
вещество, 9 — электронноплотные участки, между которыми лежат волокна р-кератина, 10 — во-
локна а-кератина, 11 — уплотненный периферический слой роговых чешуек, 12 — остатки десмосом,
13 — гранулы кератогиалина, 14 — пузырьки, появляющиеся в цитоплазме светлых клеток перед
линькой, 15 — шипы роговых чешуек поверхностного слоя первой генерации.
претерпели кожные покровы чешуйчатых рептилий (ящериц и змей).
У некоторых представителей они изучены в настоящее время весьма об-
стоятельно с применением современных методов исследования (Roth,
Boden, 1967; Flaxman et al., 1968; Alexander, Parakkal, 1969; Alexander,
1970; Maderson et al., 1972; Flaxman, Maderson, 1973).
Для чешуйчатых рептилий характерна периодичность процессов фи-
зиологической регенерации кожного эпителия, т. е. процессы линьки.
В предлиночпом состоянии кожный эпителий представляет собой слож-
ную тканевую систему (рис. 66). На поверхности относительно тонкого
росткового слоя расположены две генерации дифференцированных роговых
чешуек. Каждая из них неоднородна и состоит по крайней мере из 3—
142
4 разновидностей чешуек, расположенных одним или несколькими слоями.
Кроме того, между двумя генерациями роговых чешуек имеется особый
светлый слой ороговевающих клеток, разрушение которого в момент
линьки и обусловливает сбрасывание поверхностной генерации роговых
чешуек.
Тщательный ультраструктурный анализ, проведенный на покровах
одной из ящериц (Alexander, Parakkal, 1969; Maderson et al., 1972), по-
казал, что самый поверхностный, граничащий с внешней средой слой ро-
говых чешуек представляет собой генерацию клеток, ороговевающих с об-
разованием (3-кератинов. Далее следует относительно толстый гомоген-
ный пласт (до 10 слоев) роговых чешуек, в котором не сохраняются
границы клеток. В клетках этого слоя находятся фибриллы (3-кератина,
имеющие диаметр 20 А. Под этим слоем располагается тонкая пластинка
уплощенных ороговевающих клеток, за которой следует относительно тол-
стый слой роговых чешуек, заполненных фибриллами а-кератина с харак-
терным для них диаметром 80 А. Наконец, на границе следующей генера-
ции роговых чешуек располагается слой крупных светлых клеток с яд-
рами и глыбками кератогиалина, напоминающих клетки зернистого слоя
в случае мягкой «-кератинизации. Однако биологическое значение этого
слоя совсем иное. Он служит для разобщения второй и первой, располо-
женной под ней, генерации роговых чешуек, что происходит в момент
линьки. Очевидно, что в этих клетках имеются особые взаимоотношения
между катаболическими и анаболическими процессами. До определенного
момента в клетках этого слоя происходит синтез кератинов и проходят
первые этапы катаболических процессов. Однако вслед за этим клетки пе-
реходят в относительно латентное состояние. При воздействии гормонов
линьки в достаточной концентрации происходит включение фермента-
тивных систем, находящихся до этого в неактивном состоянии (по-видп-
мому, в лизосомах). Деятельность ферментов приводит к полному авто-
лизу цитоплазмы, что создает необходимые предпосылки для сбрасывания
поверхностной генерации роговых чешуек.
Как следует из вышеприведенного описания, характерной особен-
ностью покровного эпителия чешуйчатых рептилий является гетероген-
ность его состава. В каждой генерации рогового слоя имеются структуры,
сходные и с роговыми чешуйками эпителия млекопитающих, и с орого-
вевающими клетками, из которых построены перья птиц. Несмотря на
сходство в строении роговых чешуек, процессы их формирования у реп-
тилий существенно отличаются от этих процессов у птиц и млекопитаю-
щих. Наиболее отчетливо это проявляется при (3-кератипизации (рис. 67),
где образованию роговых чешуек, заполненных В-кератипом, предшест-
вует стадия, на которой в клетках имеются обширные вакуоли, напол-
ненные гомогенным содержимым. На следующей стадии происходит
формирование толстых кератиновых фибрилл диаметром 100—150 А.
Наконец, на заключительных этапах кератинизации из этих тол-
стых фибрилл образуются тонкие дефинитивные фибриллы диаметром
20 А. Формирование гетерогенных слоев роговых чешуек происходит из
одного и того же слоя базальных клеток, которые периодически вступают
в фазы усиленной пролиферации.
Замечательной и весьма своеобразной особенностью кожного эпителия
рептилий является наличие у клеток, идентичных по своим потенциям п
происхождению, способности дифференцироваться по нескольким, суще-
ственно отличающимся друг от друга программам. В опытах с изоляцией
эпителия от соединительной ткани и культивированием его in vitro пока-
зано, что переключение программ не зависит от внешних факторов,
т. е. обусловливается внутрисистемными регуляциями (Flaxman et
al., 1968). Особенно наглядно удалось показать значение последних при
культивировании in vitro изолированного росткового слоя. В этих усло-
виях происходит нарушение координированной работы системы, и на по-
143
верхности жизнеспособного росткового слоя формируется лишь неболь-
шой слой атипически ороговевающих клеток. Результаты этих опытов
показывают, что последо-
вательная во времени, за-
кономерная смена про-
грамм дифференцировки
клеток осуществляется в
кожном эпителии репти-
лий по принципу обратной
связи. Очевидно, что при
достижении определенной
массы клеток, дифферен-
цирующихся по одной про-
грамме, они выделяют
достаточное количество
индуцирующего вещества,
обусловливающего пере-
ключение программы диф-
ференцировки у следую-
щей генерации клеток.
При этом обнаруживается,
что чем толще слой кле-
ток, ороговевающих по од-
ной программе, тем мень-
ше индуктора выделяет
каждая клетка. Наоборот,
чем тоньше слой клеток,
ороговевающих по дан-
ному типу, тем больше
биологически активного
вещества выделяет каж-
дая клетка данного на-
правления цитодифферен-
циации. Естественно, что
подобный тип регуляции
может иметь место лишь
при наличии у клеток
росткового слоя весьма
тонких и достаточно раз-
нообразных рецепторов,
Рис. 67. Схема образования
P-кератина в кожном эпителии
у рептилий. (Рис. С. А. Бы-
строва).
а — клетка росткового слоя, б —
клетка на стадии образования ваку-
олей, в — клетка на стадии форми-
рования толстых кератиновых
фибрилл, г — роговая чешуйка, за-
полненная p-кератином, д — клетка
поверхностного слоя с шипами.
1 — вакуоли с гомогенным содер-
жимым, 2 — вакуоли, заполненные
провизорными толстыми волокнами
кератина, 3 — гранулы гликогена,
4 — свободные рибосомы, 5 — де-
финитивные волокна р-кератина,
6 —^шипы поверхностного слоя ро-
говых чешуек.
позволяющих их генетическому аппарату адекватно реагировать на спе-
цифические стимулы дифференцирующихся клеток.
144
В последнее время в специальном авторадиографическом исследова-
нии удалось показать, что детерминация клеток на конкретный тип оро-
говения происходит уже в базальном слое (Flaxman, Maderson, 1973).
В связи с этим данный слой в определенные периоды жизнедеятельности
представляет собой гетерогенную субполяцию клеток. В ней имеются и
прекратившие размножение, детерминированные на определенную про-
грамму ороговения клетки и клетки, синтезирующие ДНК и делящиеся
митотически.
У рассматриваемых представителей чешуйчатых рептилий такая слож-
ная организация кожных эпителиев возникла спустя большой период
времени после их отделения от общего с млекопитающими и птицами ис-
копаемого предка. В связи с этим наличие у чешуйчатых рептилий спе-
циализированных клеток с а- и p-кератинами свидетельствует о сущест-
вовании общих тенденций филогенетической дифференцировки в кожных
ороговевающих эпителиях всех высших позвоночных. Однако конкретная
реализация этих тенденций у каждой группы животных имеет свои осо-
бенности. Такие особенности характерны и для двух других групп репти-
лий: наиболее древних их представителей — черепах и более близких
к птицам — крокодилов. У этих животных отсутствует характерная для
чешуйчатых рептилий периодическая смена целой генерации роговых че-
шуек. Здесь преобладает свойственное млекопитающим и птицам посте-
пенное слущивание поверхностных ороговевших клеток.
Для эпидермиса панциря многих черепах характерно длительное со-
хранение рогового слоя. Это требует сложной организации и регуляции
процессов клеточной репродукции, направленных на обеспечение син-
хронного роста роговой пластинки в соответствии с увеличением разме-
ров тела и костного скелета панциря. Детальный ультраструктурный ана-
лиз процессов кератинизации в кожных покровах черепах проведен в спе-
циальном исследовании (Matoltsy, Huszar, 1972).
Низшие позвоночные (амфибии, рыбы, круглоротые)
У большинства современных амфибий кожный эпителий взрослых жи-
вотных представлен, как и у рассмотренных представителей высших поз-
воночных, многослойным плоским ороговевающим эпителием. Особен-
ностью кожных покровов амфибий является обилие погруженных в соеди-
нительную ткань многоклеточных слизистых и белковых желез. Для их
эпидермиса характерно наличие па большей поверхности тела лишь од-
ного слоя ороговевших клеток. Эти особенности связаны с полуводным
образом жизни животных и большим значением у них кожпого дыхания.
В последнее время строение кожного эпителия некоторых представителей
амфибий было подробно изучено с помощью современных методов (Spear-
man, 1968; Lavker, 1972, 1974; Wright, 1973; Budtz, Larsen, 1975).
Кожный эпителий амфибий образован относительно толстым (4—
5 слоев) ростковым слоем и одним слоем сильно уплощенных ороговев-
ших клеток, тесно связанных между собой (рис. 68). Между последним
и верхними клетками росткового слоя отсутствует постепенный переход,
что связано с цикличностью заключительных этапов кератинизации. Тем
не менее, как и у других позвоночных, в цитоплазме клеток базального
камбиального слоя имеются хорошо развитые пучки тонофибрилл. Их
количество несколько возрастает в шиповатых клетках. У некоторых ам-
фибий в нижних шиповатых клетках появляется большое количество му-
коидных гранул, которые, как правило, частично или полностью исчезают
в верхних клетках росткового слоя. В этих клетках удается наблюдать
активизацию катаболических процессов. В них обнаруживается кислая
фосфатаза, а под электронным микроскопом наблюдается увеличение ко-
личества первичных лизосом. Особенностью ороговевших клеток является
10 А. А. Заварзин J45
неполное разрушение органоидов цитоплазмы и ядерного аппарата. Тем
не менее в периферических участках цитоплазмы клетки содержат боль-
шое количество кератиновых фибрилл. Здесь происходит утолщение пе-
риферического слоя цитоплазмы, а также выделение спаивающего меж-
клеточного цемента. Особенностью а-кератинов эпителия амфибий явля-
ется их меньшая прочность, что связано с относительно более низким по
сравнению с высшими позвоночными количеством SH- и S = S-rpynn.
Рис. 68. Многослойный плоский орого-
вевающий эпителий кожи лягушки.
(Рис. В. К. Четверухина).
а — участок^эпителия кожи спины, б — схема
изменения ультраструктурной организации
клеток при ороговении. 1 — слой ороговевших
клеток, 2 — ростковый слой, 3 — соедини-
тельная У ткань, 4 — железа, 5 — тонофи-
бриллы, 6 — мукоидные гранулы, 7 — лизо-
сомы, 8 — остатки ядерного аппарата и мем-
бранных органоидов, 9 — а-кератиновые во-
локна, 10 — межклеточный цемент, 11 —
утолщение периферического слоя цитоплазмы.
В организации роговых чешуек большую роль играют свободные фосфо-
липиды, препятствующие потере нижележащими тканями воды за счет
испарения.
Таким образом, для кожного эпителия амфибий характерна известная
незавершенность процессов вторичного преобразования специфических
белков и процессов деструкции высокомолекулярных соединений в орого-
вевающих клетках. Однако эти особенности кератинизации вряд ли можно
рассматривать просто как признаки примитивной организации этого эпи-
телия. Кожный эпителий амфибий обладает потенциями к формированию
мощных роговых структур типа роговых зубов головастиков или специаль-
ных утолщений кожи на передних лапах самцов лягушек. К сожалению,
авторадиографический анализ процессов кератинизации в этих производ-
ных кожного эпителия проведен лишь на светооптическом уровне. Для
кожного эпителия амфибий характерна периодичность процессов репро-
дукции и завершающих этапов кератинизации. Это связано с циклич-
ностью процессов обновления поверхностного рогового слоя, который, как
и у чешуйчатых рептилий, слущивается обычно с месячным интервалом.
146
Тонкие механизмы этого процесса исследованы в специальной работе
(Budtz, Larsen, 1975).
У современных низших водных позвоночных — круглоротых и много-
численных представителей класса рыб, несмотря на большое разнообразие
кожных эпителиев, в их структурной организации удается обнаружить
ряд общих закономерностей. Эти закономерности изучены у некоторых
костистых рыб с помощью электронной микроскопии (Henrikson, Matoltsy,
1968; Brown, Wellings, 1970; Hawkes, 1974; Mittal, Banerjee, 1974; Harris.
Hunt, 1975).
В типичном случае эпителий представляет собой многослойный
пласт с выраженной вертикальной анизоморфностью. На границе
с соединительной тканью
располагается слой ба-
зальных камбиальных кле-
ток, обеспечивающих по-
стоянное или периодиче-
ское обновление эпите-
лиального пласта. Этот
процесс может совер-
шаться у разных предста-
вителей рыб с большей
или меньшей скоростью.
Образующиеся в резуль-
тате размножения клетки
дифференцируются в двух
основных направлениях: в
направлении образования
кроющих, часто уплощен-
ных, поверхностных кле-
Рис. 69. Многослойный желе-
зистый эпителий кожи миноги.
1 — плотная соединительная
ткань, 2 —»базальные, 3 — крою-
щие (железистые), 4 — белковые,
5 — колбовидные, 6 — слизистые
клетки.
ток и в направлении образования различного рода железистых элементов.
Наличие в составе эпителиального пласта белковых, слизистых и некото-
рых других специфических секреторных клеток — весьма характерная осо-
бенность многослойных эпителиев низших водных позвоночных. За счет
выделяемых ими секретов железистые клетки играют существенную вспо-
могательную роль в обеспечении барьерной функции эпителиального
пласта.
При дифференцировке клеток в направлении кроющих элементов про-
исходит увеличение их размеров и развитие в цитоплазме волокнистых
белковых структур — тонофибрилл, количество и плотность расположе-
ния которых обычно увеличиваются по направлению к поверхности
пласта. В типичных случаях дифференцированные кроющие клетки имеют
уплощенную форму и слегка пикнотизированное ядро. На их апикальной
поверхности иногда образуются небольшие микроворсинки, увеличиваю-
щие поверхность плазматической мембраны. Сверху они покрыты секре-
том, выделяемым железистыми клетками. Секрет располагается в виде
тонкого электронноплотного слоя на поверхности плазматической мем-
браны. Структурная целостность эпителиального пласта обеспечивается
за счет хорошо развитых десмосом, связывающих клетки друг с другом и
весь пласт в единое целое. У базальных клеток, кроме того, имеются полу-
10:
147.
десмосомы, обеспечивающие их крепление к эпителиальной части базаль-
ной мембраны.
В настоящее время относительно плохо изучены процессы физиологи-
ческой регенерации и морфобиохимические основы дифференцировки
клеток в кожных эпителиях низших позвоночных животных. Немного-
численные данные свидетельствуют о том, что у некоторых представите-
лей костистых рыб процессы синтеза ДНК и размножения клеток могут
наблюдаться у вступивших уже на путь дифференцировки клеток. Здесь,
следовательно, пет еще резко выраженных различий между камбиальными
и дифференцирующимися клетками. Введение меченых аминокислот круг-
лоротым и некоторым рыбам показывает, что наиболее интенсивное вклю-
чение на ранних сроках после введения наблюдается в верхней половине
пласта, что является косвенным доказательством низкой интенсивности
процессов физиологической регенерации.
Помимо описанных выше типичных эпителиальных пластов, у некото-
рых видов рыб и круглоротых наблюдаются и другие отношения (рис. 69).
Образование слизистого секрета на поверхности тела может стать основ-
ной, доминирующей функцией эпителиального пласта. В этом случае диф-
ференцировка всех клеток, образующихся в результате размножения
клеток нижележащих слоев, идет в направлении развития секреторных
элементов, и поверхностный слой клеток представляет собой сплошной
слизеобразующий пласт. Продукты его выделения выполняют барьерную
и защитную функции.
Другая, значительно более редкая, но наиболее интересная крайняя
модификация многослойных эпителиальных пластов связана с прогрессив-
ной дифференцировкой поверхностных кроющих клеток. У одного из пред-
ставителей пресноводных костистых рыб [Bagarius bagarius) описано на-
личие на поверхности эпителиального пласта сплошного слоя ороговевших
клеток (Mittal, Munshi, 1970). Белки этих клеток богаты SH-группами,
а цитоплазма шиповатых клеток обладает базофильной зернистостью.
К сожалению, данные по ультраструктурной организации этого эпителия
в настоящее время отсутствуют. Участки ороговевающего эпителия обна-
ружены на брюшных плавниках у двоякодышащих рыб. Хорошо известны
и изучены на уровне световой микроскопии такие мощные образования,
как роговые зубы у круглоротых (Dawson, 1963). Наконец, у некоторых
костистых рыб (Carassius auratus, Morulius chrysophakedion и др.) па го-
лове имеются небольшие участки ороговевающего эпителия (Sasse et aL,
1970). В последней работе проведен подробный цитохимический и ульт-
раструктурный анализ одного из таких ороговевающих участков. При этом
оказалось, что он представляет собой достаточно сложную и гетерогенную
систему (рис. 70), в которой удается выделить по крайней мере три типа
ороговевающих клеток: а) наружные, контактирующие с соединительной
тканью и кровеносными сосудами; б) внутренние, удаленные от кровенос-
ных сосудов, и в) безъядерные роговые чешуйки. Границы между этими
тремя участками эпителиального пласта достаточно резкие, что
свидетельствует о наличии цикличности в репродукции клеток и прохож-
дении ими отдельных этапов кератинизации. По своим цитохимическим
и ультраструктурным особенностям эти типы клеток сходны с дифферен-
цирующимися клетками в многослойных ороговевающих эпителиях выс-
ших позвоночных.
Рассмотренные примеры далеко заходящей кератинизации в эпителии
рыб и круглоротых позволяют предположить, что в филогенезе уже на
первых этапах формирования многослойных кожных эпителиев в клеточ-
ном геноме были заложены потенции к формированию ороговевающих
эпителиев и синтезу специфических белков — кератинов. Эти потенции
получили максимальное проявление в процессе прогрессивной эволюции
при расселении позвоночных на суше. Однако они же выявляются и при
адаптивной эволюции низших позвоночных животных — на ограниченных
148
Рис. 70. Схема строения «жемчужины» костистой рыбы Morulius chrysophakedion.
(Из: Sasse et al., 1970).
I — поверхностные роговые чешуйки, II — внутренняя область «жемчужины», III — наружная
область «жемчужины», IV — соединительная ткань, а — область контакта роговых чешуек с неоро-
говевающим покровным эпителием, б — клетка из апикальной части внутренней области, в —
клетка из базальной части внутренней области, г — апикальная часть соединительнотканного со-
сочка, д — соединительнотканный сосочек, е — область контакта базальных клеток наружной об-
ласти с соединительной тканью. 1 — роговые чешуйки, 2 — кроющая клетка, 3 — клетка, дифферен-
цирующаяся в направлении кроющей.
участках тела в виде слабо ороговевающих многослойных пластов, рого-
вых зубов у миноги и роговых «жемчужин» в коже некоторых кости-
стых рыб.
Хорошо известным образованием в коже низших позвоночных
животных, получившим прогрессивное развитие и у других позвоноч-
ных, является плакоидная чешуя хрящевых гапопдов. В ее форми-
ровании принимает участие не только соединительная ткань, но и эпи-
телий. Часть базальных клеток последнего в области образования таких
структур выделяет на своей базальной поверхности плотное межклеточ-
ное вещество, которое вместе с межклеточным обызвествленным веще-
ством соединительнотканного происхождения создает комплексную
двойственную по происхождению структуру. В области чешуек нару-
шается целостность эпителиального пласта, и покрытый эмалью (про-
дуктом секреторной деятельности эпителиальных клеток) участок всту-
пает в непосредственный контакт с внешней средой. Образование такого
рода структур в кожных покровах рыб не получило, однако, большого
развития и ограничивается лишь хрящевыми ганоидамп. У большин-
ства костистых рыб усиление механической функции кожных покровов
происходит за счет формирования костных пластинок чисто соедини-
тельнотканной природы.
ЗАКЛЮЧЕНИЕ
Проведенный обзор строения кожных эпителиев наиболее важных
групп современных многоклеточных животных показывает разнообразие
принципов организации этой тканевой системы. Оно отражает дивергент-
ную эволюцию живых существ как в процессе их адаптации к опреде-
ленным условиям существования, так и в процессе прогрессивной эволю-
ции. Это разнообразие проявляется в различиях химического состава
структур, образуемых клетками кожных эпителиев, в принципах построения
тканевых систем и в разнообразии самих механизмов выработки специ-
фических соединений, обусловливающих барьерную защитную функцию.
Действительно, среди химических компонентов мы встречаем различ-
ные белковые соединения (коллаген, артропоедин, кератин и др.), разнооб-
разные мукополисахариды (хитин, туницип, сульфомукополиса^аридьГ),
разнообразные продукты секреторной деятельности клеток и, наконец,
различные неорганические соли. Не меньшие различия мы обнаруживаем
в принципах организации кожного эпителия как барьерной защитной
ткани. Среди однослойных эпителиев имеются и погружные эпите-
лии, не имеющие четкой границы с нижележащей тканью, и эпителии,
где сократимая и барьерная функции сочетаются у одной ткани. Свое-
образную группу эпителиальных тканей представляет собой группа ку-
тикулярных эпителиев и по химическому составу образуемых ими
кутикул, и по механизму связи между клетками и выделяемыми ими
внеклеточными структурами. Наконец, псевдокутикулярные, ресничные
и многослойные эпителии являются принципиально различными ткане-
выми системами, каждая из которых характеризуется особыми призна-
ками специфической дифференциации клеточных элементов и особыми
внутрисистемными механизмами объединения клеток в единую ткане-
вую систему. Разнообразие кожных эпителиев усугубляется еще и ди-
вергентной дифференцировкой специализированных железистых элемен-
тов, которые могут играть важную роль в осуществлении барьерной
функции пласта.
Не менее многообразны тонкие цитологические механизмы синтеза
и выделения специфических химических соединений, образуемых клет-
ками покровного эпителия. Наряду с обычными для секреторных клеток
механизмами мы встречаемся здесь с мультифункциональной синтети-
ческой деятельностью клеток по нескольким последовательным во вре-
150
мепи программам, как например в кутикулярных эпителиях насекомых.
Некоторым разновидностям кожных эпителиев свойственны процесс после-
довательного накопления и перестройка ранее синтезированных продук-
тов внутри клеток, как это характерно для роговых чешуек позвоноч-
ных. Наблюдается в кожных эпителиях и своеобразное внутриклеточное
образование псевдокутикулы (эпителий цестод).
Такое многообразие эпителиев кожных покровов у современных много-
клеточных животных определяется разнообразием условий их обитания,
уровнем организации животных и длительной адаптивной эволюцией
в специфических условиях внешней среды для каждой из рассмотрен-
ных групп животных. Однако на фоне дивергентной филогенетической
дифференцировки кожного эпителия удается особенно отчетливо выявить
ряд общих эволюционных тенденций, общих закономерностей усложне-
ния этой тканевой системы по мере повышения уровня организации жи-
вотных.
Весьма вероятно, что наиболее примитивными тканевыми покровными
структурами являются погружные эпителиальные пласты без четкой
границы с соединительной тканью, эпителиально-мышечные дифферен-
цировки кишечнополостных и различные разновидности ресничных эпи-
телиев. У современных низших многоклеточных животных эти ткани
претерпели большие изменения и существенно отличаются от того исход-
ного типа, который послужил основой для развития покровных эпителиев
у прогрессивно эволюционировавших групп животных. Признаками вто-
ричного усложнения являются, очевидно, такие сложные клетки, как не-
матоциты кишечнополостных со специальной системой их воспроизведе-
ния, сложные мышечные отростки в эпителиально-мышечных клетках
медуз, а также высокая скорость обновления в ресничном эпителии не-
мертин и моллюсков и сложная гетерогенная организация их комбиаль-
пых систем. Во многих случаях (например, построение системы по прин-
ципу непрерывного обновления или сложные дифференцировки миофиб-
риллярного аппарата в эпителиально-мышечных клетках) эти вторичные
свойства кожных эпителиев низших многоклеточных, приобретенные в про-
цессе адаптивной эволюции, оказываются в принципе сходными со свой-
ствами тканевых систем, которые наблюдаются в аналогичных тканях
более высокоорганизованных многоклеточных животных.
С другой стороны, у высших многоклеточных животных при возник-
новении вторичных пограничных тканей в составе других тканей орга-
низма выделяются специфические дифференцировки, сходные с эпите-
лиями низших многоклеточных (эпителиально-мышечные клетки диля-
татора зрачка, ресничный эпителий воздухоносных путей и др.). Из этих
фактов уже можно сделать вывод о наличии общих закономерностей
в филогенетической дифференцировке покровных структур, которые от-
четливо выступают при сопоставлении покровных структур у современ-
ных животных.
Наибольшее разнообразие и в химическом, и в структурном отноше-
нии обнаруживают кожные эпителии животных средних уровней органи-
зации (кольчатые черви, приапулиды, моллюски, оболочники и некото-
рые другие группы беспозвоночных животных). Создается впечатление,
что на этих уровнях организации природа как бы «пробует» различные
варианты химической и структурной организации, доводя их до совер-
шенства в процессе адаптивной эволюции каждой из ныне живущих
форм. Действительно, здесь, как указывалось выше, используются и
различные склеропротеины типа коллагена, кератинов и артропоединов,
разнообразные мукополисахариды (хитины, туницины, сульфатирован-
ные мукопротеиды) и целый ряд других химических компонентов в со-
ставе внеклеточных выделений кутикулярных эпителиев. Принцип пост-
роения последних варьирует от псевдокутикул цестод до настоящих
хитиновых кутикулярных эпителиев в ротовом аппарате полихет и мол-
151
люсков. Широкое распространение имеет также принцип построения ку-
тикулярного эпителия на основе его непрерывного химического обновле-
ния (асцидии) или комбинация этого механизма с периодическими линь-
ками (приапулиды).
Рассмотренными выше примерами далеко не ограничивается разно-
образие структурной и химической организации кутикулярных эпите-
лиев. Существенные особенности наблюдаются в строении кутикулы
у представителей отдельных даже небольших групп червей (см. обзор:
Eakin, Brandenburger, 1974). Наиболее сложное строение имеют кути-
кулярные эпителии цестод и нематод.
В настоящее время трудно сказать, в какой мере наблюдаемые прин-
ципы химической и структурной организации отражают те отношения,
которые имелись у прямых предков современных многоклеточных жи-
вотных. Весьма вероятно, что в большинстве случаев кожные покровы
современных животных представляют собой модификации нескольких
основных типов кожных эпителиев. Благодаря этому при филогенетиче-
ской дифференцировке кожных эпителиев проявляются и общие законо-
мерности, общие потенции дифференцировки живой материи в определен-
ных направлениях. Особенно ярким примером в этом отношении явля-
ется та удивительная аналогия, которая имеет место в процессах линьки
у насекомых и нематод — животпых, крайне удаленных друг от друга
в филогенетическом отношении.
Вторым, более частным примером может служить сходный механизм
склеротизации белковых компонентов кутикулы у некоторых нематод,
тихоходок и клещей на основе окисления SH-групп хинонами.
У двух наиболее высокоорганизованных и наиболее прогрессивно эво-
люционирующих групп животных — членистоногих и позвоночных, при
выходе па сушу решение задачи максимальной изоляции от внешней
среды кожными покровами осуществлялось различными путями. У выс-
ших позвоночных эта задача решалась путем формирования многослой-
ных пластов с выделением железистых структур в самостоятельные част-
ные системы и передачей механической функции кожных покровов
соединительной ткани. Изолирующая, барьерная функция кожпого эпите-
лия, достигающая максимального развития у высших позвоночных, осу-
ществляется на основе единого процесса кератинизации. Последний
представляет собой один из примеров крайней морфобиохимиче-
ской специализации клеточных элементов, приводящей к их гибели и
функционированию в виде омертвевших роговых чешуек. Необходимая
пластичность такой системы крайне специализированных элементов до-
стигается за счет ее построения по принципу динамического равновесия.
Оно основано па непрерывной или периодической смене функционирую-
щих генераций роговых чешуек новыми генерациями, возникающими за
счет размножения клеток базального камбиального слоя.
Исключительный интерес в сравнительно-гистологическом плане пред-
ставляет то, что потенции к развитию совершенных структур, которые
мы наблюдаем у высших позвоночных, были заложены уже в момент
возникновения примитивных многослойных пластов у общего предка сов-
ременных позвоночных животных. В этом нас убеждают факты появле-
ния участков многослойных ороговевающих эпителиев у низших позво-
ночных — круглоротых и рыб. Здесь они возникают, несомненно, как вто-
ричные приспособления в процессе длительной адаптивной эволюции.
Большое сходство этих структур в морфологическом и химическом
плане с типичными ороговевающими эпителиями высших позвоночных
является одним из наиболее ярких примеров проявления в эволюции кож-
ных эпителиев общих закономерностей филогенетической дифферен-
циации.
При большом разнообразии многослойных эпителиев в структурном
и химическом отношениях пи у одного из представителей позвоночных
152
животных в составе эпителиальных структур не удается обнаружить ха-
рактерные для беспозвоночных животных мукополисахариды, и в част-
ности хитин. Между тем хитин имеется не только в кутикулярных эпи-
телиях членистоногих, но и достаточно широко распространен в кожных
покровах других беспозвоночных животных. Весьма вероятно, что прин-
цип многослойной организации эпителиального пласта оказывается не-
совместимым с функционированием локусов генома, ответственных за
синтез ферментов, осуществляющих синтез этих мукополисахаридов.
Возможно однако, что в процессе эволюции эти гены были утрачены ге-
номом позвоночных в результате мутаций.
У членистоногих задача создания совершенного наружного покрова
решается на базе однослойного кутикулярного эпителия. При этом из
всего разнообразия кутикулярных эпителиев сохраняется один его тип,
а именно эпителий, выделяющий кутикулу, состоящую из мукополисаха-
рида хитина и белка артропоедина. По-видимому, такая химическая ор-
ганизация кутикул оказалась наиболее совершенной основой для осуще-
ствления комбинированной функции наружного покрова и наружного
скелета. Необходимость в развитии последнего обусловливалась редук-
цией целома и резкой активизацией перемещения животных в прост-
ранстве. Хитиновая кутикула оказалась также и наиболее совершенной
изолирующей структурой при выходе членистоногих в воздушную среду
обитания. В комбинации с выделением специализированных железистых
элементов и приобретением специальных механизмов удержания воды
в теле животных она обеспечивает достаточную стабильность водного ба-
ланса у наземных членистоногих и, в частности, у наиболее высокоорга-
низованной их группы — насекомых.
Совершенство кутикулярных эпителиев насекомых проявляется
в весьма сложной деятельности их клеточных элементов. Они обладают
способностью синтезировать различные ферментативные белки, муко-
протеиды и ряд других химических соединений, входящих в состав кути-
кулы. Эта многоплановая синтетическая деятельность сочетается со
способностью клеток поглощать продукты разрушения старых кутикул с по-
следующей утилизацией этих продуктов. Таким образом, общей законо-
мерностью цитологической дифференцировки кожных эпителиев в фило-
генезе многоклеточных является сочетание крайней специализации кле-
ток с возможностью их работы по мультифункциональным программам.
Эта особенность может проявляться в виде последовательной во времени
смены программ синтетической деятельности, подобно тому как это про-
исходит в кутикулярных эпителиях насекомых. С другой стороны, у реп-
тилий она проявляется в наличии у дифференцирующихся клеток потен-
ций к разным типам дифференцировки, реализация которых осуще-
ствляется внутритканевыми механизмами обратной связи.
Второй общей закономерностью эволюции кожных эпителиев у выс-
ших многоклеточных является резкое ограничение химического многооб-
разия и принципов структурной организации кожных покровов.
В противоположность отмеченному выше многообразию кожных эпп-
телиев у животных, находящихся на средних уровнях организация,
у высших многоклеточных — высших позвоночных и насекомых, все раз-
нообразные структуры их кожных эпителиев, за исключением желе-
зистых дифференцировок, строятся либо на основе процессов кератинп-
зации с небольшими химическими вариациями, либо па базе развития
кутикулярных покровов определенного химического состава.
Эта закономерность отчетливо проявляется не только при самом об-
щем анализе имеющегося фактического материала по кожным покровам
высших наземных позвоночных и беспозвоночных животных, но и в пре-
делах каждой из этих групп животных. У высших позвоночных живот-
ных весьма демонстративным в этом отношении примером является ком-
бинация а- и В-кератинов в кожном эпителии рептилий, соответствующая
153
доминирующим направлениям специфического белкового синтеза у млеко-
питающих (кератинизации по a-типу) и у птиц (p-тип кератинизации).
Еще более наглядно проявляется эта закономерность у членистоногих.
Несмотря на далеко заходящую дивергентную эволюцию представителей
этого типа в пределах каждого класса и возможное полифилетическое
происхождение отдельных классов членистоногих, их кожные покровы
в химическом и структурном плане характеризуются целым рядом общих
признаков. Более того, при резких изменениях условий существования,
например при переходе к наземному образу жизни, что, несомненно, не-
зависимо происходило в разных классах членистоногих, кожные покровы
обнаруживают весьма сходную тенденцию к морфобиохимическим изме-
нениям. Особенно демонстративным является в этом отношении незави-
симое образование сходных по химпзму, структуре и биологическому
значению эпикутикул у насекомых, пауков, скорпионов, клещей и ряда
других более мелких систематических групп членистоногих.
Приведенные выше факты, количество которых непрерывно возра-
стает, позволяют сделать вывод о том, что у высших животных адаптив-
ная пластичность кожных эпителиев осуществляется уже не столько за
счет использования нового строительного материала, столько за счет
усложнения внутрисистемных и межсистемных регуляторных механиз-
мов на весьма ограниченной химической основе. Значение и прогрессив-
ное развитие этих механизмов особенно хорошо изучено в настоящее
время у высших позвоночных. Сущность этой общей закономерности за-
ключается, очевидно, в том, что на высших этапах эволюции известная
внутрисистемная автономность кожных эпителиев оказывается в подчи-
ненном положении по отношению к .межтканевым коррелятивным свя-
зям, которые обеспечивают уже не только трофические взаимоотноше-
ния эпителия и соединительной ткани, но и определяют всю внутреннюю
организацию эпителиальных пластов — существование базального кам-
биального слоя и даже качественный характер процессов сцецифического
синтеза и дифференцировки клеток. При этом в отличие от кожных эпи-
телиев низших многоклеточных, где отсутствие системной автономности
кожных эпителиев определяется слабым морфофункциональным обособ-
лением их от нижележащих тканей, у млекопитающих и птиц имеются
межтканевые коррелятивные отношения между высокодифференциро-
ванными и резко отграниченными друг от друга (в структурном и биохи-
мическом отношениях) специализированными тканевыми системами —
эпителием и нижележащей соединительной тканью.
Глава 4
ОСМОРЕГУЛИРУЮЩИЕ И ВЫДЕЛИТЕЛЬНЫЕ ЭПИТЕЛИИ
ВВЕДЕНИЕ
Постоянство ионного состава внутренней среды организмов является
одним из важных условий для прогрессивной эволюции многоклеточных
животных. В связи с этим у большинства современных животных име-
ются специализированные системы, осуществляющие регуляцию осмоти-
ческого режима. Особое значение приобрели эти системы у животных,
обитающих в пресной воде и воздушной среде.
Осморегуляция может осуществляться двумя путями — выведением
пли поглощением воды и активным избирательным транспортом ионов.
Первый механизм реализуется у пресноводных одноклеточных и низших
многоклеточных животных. Характерными примерами в этом отношении
являются пульсирующие, сократительные вакуоли в клетках пресновод-
154
ных губок и простейших и эктодермальные впячивания и канальцы, об-
разованные ресничным эпителием турбеллярий, обитающих в пресной
воде. Большее распространение, однако, получил более экономичный и
более совершенный механизм осморегуляции, основанный на универсаль-
ной способности клеточных систем к активному ионному транспорту че-
рез клеточные мембраны.
Экскреторная, или выделительная, функция представляет собой ко-
нечный этап непрерывно протекающих в клетках многоклеточного орга-
низма процессов метаболизма. Суть ее сводится к удалению из организма
тех конечных продуктов метаболизма, которые не могут уже утилизи-
роваться в энергетическом или пластическом обменах и часто обладают
токсическими свойствами. Процессы экскреции у современных многокле-
точных животных осуществляются двумя основными путями: переводом
экскретов в нерастворимое состояние или выведением их из организма во
внешнюю среду. Естественно, что второй механизм более совершенный
и имеет значительно большее распространение. Тем не менее у низших
многоклеточных и даже у высших первичноротых животных образование
экскретов в виде конкреций в цитоплазме клеток может иметь сущест-
венное вспомогательное значение в реализации экскреторной функции
организма. Экскреты могут накапливаться в клетках целомического или
кожного эпителиев или в специализированных амебоцитах тканей внут-
ренней среды.
Примером чисто экскреторных систем, основанных на прямом выве-
дении конечных продуктов метаболизма во внешнюю среду, являются
универсальные для всех многоклеточных животных системы, обеспе-
чивающие выведение СО2 — конечного продукта энергетического обмена.
Несмотря па разнообразие органов дыхания у высших многоклеточных
животных, цитологические механизмы реализации экскреции СО2 ока-
зываются сходными. Основаны они на создании наиболее благоприятных
условий для диффузии СО2 во внешнюю среду и, наоборот, Ог во
внутреннюю среду организма. У высших позвоночных животных такие
условия достигаются за счет тесного контакта между клетками эндотелия
капилляров и сильно уплощенными эпителиальными клетками в конеч-
ных отделах дыхательных систем — легочных альвеолах. У современных
многоклеточных животных имеются, следовательно, и чисто осморегуля-
торные, и чисто экскреторные системы.
Однако основную роль в процессах экскреции продуктов азотистого
обмена и в процессах осморегуляции и регуляции водного баланса орга-
низма играют эпителиальные ткани, осуществляющие одновременно и
осморегулирующую и экскреторную функции. Эти разновидности эпите-
лиальных тканей могут быть различного происхождения. Тем не менее
для них характерен ряд общих признаков организации.
Обзор имеющихся в настоящее время данных по осморегулирующим
п экскреторным выделительным эпителиям удобнее начать с характе-
ристики чисто осморегуляторных систем кожного эпителия, имеющих
распространение и у высших первичноротых, и у вторичноротых жи-
вотных.
Далее мы рассмотрим общие признаки организации эпителиальных
канальцев, осуществляющих осморегулирующую и экскреторную функ-
ции, и дадим краткую характеристику основных типов таких канальцев.
Будут рассмотрены протонефридии низших многоклеточных, типичные
метанефридии и их модификации у позвоночных, моллюсков и членисто-
ногих и наконец мальпигиевые сосуды членистоногих.
Более подробно следует остановиться на характеристике цитологиче-
ских основ организации фильтрационного и реабсорбциоппого аппаратов
выделительных и осморегулирующих канальцев у многоклеточных жи-
вотных. Это даст возможность сопоставить строение специализирован-
155
ных клеток в нефронах позвоночных с аналогичными в функциональном
отношении клетками других типов осморегулирующих и выделительных
канальцев, чему и посвящен заключительный раздел главы.
СПЕЦИАЛИЗИРОВАННЫЕ ОСМОРЕГУЛИРУЮЩИЕ СИСТЕМЫ
КОЖНОГО ЭПИТЕЛИЯ
Солевые клетки рыб и солевые железы рептилий и птиц
Солевые клетки рыб представляют собой особую субпопуляцию кле-
ток, локализованную в эктодермальном эпителии основания жабр
(рис. 71, а). В последнее время подробно изучена их функциональная
морфология, ультраструктура и ее изменения под влиянием меняющихся
осмотических условий внешней среды. Такие изменения морфологии кле-
ток показаны для многих представителей рыб, обладающих способностью
к периодическим миграциям из морской воды в пресную и обратно
(Shirai, Utida, 1970). У одного из таких представителей — японского угря
(Anguilla japonica) в многослойном эпителии основания жабр среди
обычных эпителиальных клеток имеются крупные клетки с резко окси-
фильной цитоплазмой (клетки первого типа) и клетки меньших разме-
ров, цитоплазма которых окрашивается эозином в бледно-розовый цвет
(клетки второго типа). При специальных окрасках удается обнаружить,
что одной из наиболее характерных особенностей этих клеток является
обилие в них митохондрий, количество которых особенно велико в резко
оксифильных клетках первого типа.
При перенесении животных в морскую воду на протяжении первых
трех суток происходит увеличение в два раза количества оксифильных
клеток и первого и второго типов. Затем на протяжении последующих
двух недель количество клеток с резко оксифильной цитоплазмой про-
должает нарастать. К концу срока их в 8 раз больше, чем у животных,
обитающих в пресной воде. Клетки же со слабо оксифильной цитоплаз-
мой к концу второй недели пребывания животных в морской воде исче-
зают совсем. При перенесении этих животных в пресную воду имеет
место постепенное уменьшение в эпителии клеток с резко оксифильной
цитоплазмой. В специальных биохимических исследованиях удалось по-
казать, что непосредственной причиной нарастания количества солевых
клеток в пласте является увеличение концентрации солей в крови и тка-
невой жидкости при перенесении животных в морскую воду. Таким
образом, очевидно, что у рыб в основании жабр располагается важная
осморегулирующая система, способная к весьма существенной гипертро-
фии при изменении ионного состава в тканевых жидкостях организма.
Основным механизмом такой гипертрофии является увеличение количе-
ства солевых клеток за счет быстрого дозревания клеток со слабо окси-
фильной цитоплазмой. При этом, однако, количество последних не только
не уменьшается в течение первых трех суток после начала опытов, но,
наоборот, увеличивается к концу этого срока почти в два раза. Такая
сложная динамика изменения численпости дифференцированных и всту-
пающих па путь дифференцировки клеток при адаптации к морской
воде свидетельствует о наличии системной реакции многослойного
эпителиального пласта. При повышении концентрации ионов в тка-
невых жидкостях имеет место дозревание клеточных элементов при
одновременной вспышке размножения камбиальных клеток и быстрой
дифференцировке образующихся клеток в направлении солевых клеток.
Интенсивность процессов пролиферации и дифференцировки на ранних
сроках адаптации животных к морской воде оказывается выше, чем
процессов дозревания солевых клеток. Благодаря этому происходит уве-
личение количества и зрелых дифференцированных клеток п клеток, па-
156
Рис. 71. Кожный эпителий в основании жабр у костистой рыбы Oncorhynchus gorbuscha.
(Рис. В. К. Лебского).
а — участок эпителия в основании жабр с солевыми клетками, б —схема ультраструктурной органи-
зации солевой клетки. 1 — оксифильные солесекретирующие клетки, 2 — кровеносные капилляры,
<— микроворсинки, 4 — апикальная зона, свободная от митохондрий, 5 — митохондрия, 6 — ядро,
7 — впячивания плазматической мембраны, 8 — гладкая эндоплазматическая сеть.
ходящихся еще в процессе дифференцировки. По мере увеличения коли-
чества дифференцированных солевых клеток происходит уменьшение
концентрации ионов в тканевой жидкости. Одновременно снижается
темп размножения камбиальных клеток и начинают преобладать лишь
процессы дозревания вступивших на путь дифференцировки клеток.
В результате этого количество клеток со -слабо оксифильной цитоплазмой
постепенно уменьшается.
Зрелая солевая клетка имеет весьма характерную структуру. Основ-
ная часть ее цитоплазмы заполнена многочисленными митохондриями
с хорошо развитыми, плотно упакованными кристами и большим коли-
чеством гранул в матриксе (рис. 71, б). Второй характерной особенностью
этих клеток является гипертрофия мембранных структур гладкой эндо-
плазматической сети, представленных разветвленной системой канальцев.
Гипертрофирована также и плазматическая мембрана, которая в базаль-
ной части клеток образует глубокие складки. Весьма характерным при-
знаком активно функционирующей солевой клетки является формиро-
вание в ее апикальной части зоны, свободной от митохондрий и богатой
вакуолями, пузырьками различных размеров и формы. Здесь же имеются
небольшие микроворсинки.
Функциональная обусловленность всех этих структурных особен-
ностей солевых клеток отчетливо проявляется при помещении животных,
адаптированных к морской воде, в пресную воду. В этих условиях про-
исходит существенная перестройка ультраструктурной организации кле-
ток. В них резко уменьшается количество митохондрий п изменяется их
внутренняя структура. Сильно редуцируется количество крист, исчезают
гранулярные включения в матриксе. На наружной поверхности клеток
увеличиваются размеры микроворсинок и редуцируются вакуолизиро-
ванные, не содержащие митохондрий участки цитоплазмы в апикальных
частях клеток. Заметной редукции подвергаются также и мембранные
структуры эндоплазматической сети. Значительная часть, около со-
левых клеток дегенерирует к концу четвертой недели пребывания живот-
ных в пресной воде. Остающиеся в эпителии солевые клетки представ-
ляют собой, по-видимому не просто резервный аппарат осморегуляции,
а функционирующую систему. Однако направление работы этой системы
меняется. Вместо выведения избытков солей из организма солевые
клетки начинают активно поглощать соли, находящиеся в небольшом
количестве в пресной воде, и передавать их во внутреннюю среду орга-
низма. Имеются также данные и о возможной экскреторной функции со-
левых клеток рыб (Masoni, Garcia-Romen, 1972).
Таким образом, система солевых клеток рыб обладает способностью
к резкой интенсификации работы как за счет увеличения количества
отдельных функционирующих элементов, так и путем существенной
перестройки энергетического и мембранного аппаратов клетки, направ-
ленных на резкую интенсификацию своеобразной секреторной деятель-
ности солевых клеток. Все эти изменения и на клеточном, и на тканевом
уровнях организации происходят под прямым воздействием изменения
концентрации ионов в крови и тканевой жидкости.
Аналогичная закономерность наблюдается и в организации осморегу-
лирующих систем у некоторых рептилий и птиц, обладающих способ-
ностью использовать богатую солями воду (Ernst, Ellis, 1969; Komnick,
Kniprath, 1970; Martin. Philpott, 1973). У этих животных обычные же-
лезистые образования (слезные, слюнные и другие железы) преобра-
зуются в так называемые солевые железы, основное назначение которых
заключается в выведении избытка солей из организма. Концевые отделы
этих сложных трубчатых желез образованы секреторными клетками,
аналогичными по своей функции солевым клеткам рыб. При переводе
таких животных на богатый солями пищевой и водный режим в солевых
железах имеют место двоякого рода процессы. В этих условиях, с одной
158
стороны, происходит разрастание железистой ткани и, следовательно, уве-
личение количества солеобразующих клеток. С другой стороны, изме-
няются и сами клетки. Количество митохондрий в них возрастает с 20%
общего объема цитоплазмы до 50%. Одновременно сильно увеличивается
и общая поверхность плазматической мембраны. На базальной и боковых
поверхностях клеток образуются многочисленные впячивания и выросты,
придающие клетке весьма характерный звездчатый вид.
Таким образом, и в этом случае мы имеем дело с резко выраженными
адаптивными изменениями солевых желез в ответ на повышение кон-
центрации ионов в крови и на тканевом, и на клеточном уровнях орга-
низации осморегулирующей системы. Здесь, как и в случае солевых
клеток рыб, имеют место увеличение количества солесекретирующих кле-
ток и резкая гипертрофия энергетического аппарата клеток и их мемб-
ранных структур.
Осморегулирующие системы кожного эпителия насекомых
У некоторых пресноводных личинок насекомых в определенных участ-
ках кожных покровов (на конечностях и в трахейных жабрах) среди
обычных клеток кутикулярного эпителия обнаружены одиночные клетки
или группы клеток, характеризующиеся повышенной оксифилией цито-
плазмы и особым строением кутикулы над апикальной поверхностью этих
клеток (Wichard et al., 1972). Анализ ультраструктурных особенностей
кутикулы показал, что она представляет собой здесь истонченную, про-
низанную многочисленными порами структуру (рис. 72).
На апикальной поверхности клеток плазматическая мембрана обра-
зует глубокие впячивания. Благодаря этому здесь возникают щелевид-
ные внеклеточные пространства, которые контактируют с порами кути-
кулярной пластинки. Помимо контакта оксифильных клеток с наружной
Средой при помощи поровой пластинки имеются и другие типы струк-
тур.
Существенные модификации обнаружены и в ультраструктурной
организации клеток. В случае одиночных клеток они сходны с солевыми
клетками рыб, обитающих в пресной воде (на апикальной поверхности
глубокие впячивания плазматической мембраны, обилие митохондрий,
в матриксе которых отсутствуют гранулы).
При групповом расположении оксифильных клеток имеется одна цен-
тральная и две периферические клетки. У центральной клетки развиты
впячивания апикальной плазматической мембраны, а у перифериче-
ских — базальные впячивания плазматической мембраны с многочислен-
ными митохондриями (рис. 72).
В специальных цитохимических и авторадиографических исследова-
ниях удалось показать, что основная функция всех этих клеток заклю-
чается в поглощении из внешней среды ионов и активной транспорти-
ровке их во внутреннюю среду организма. Системность в функциониро-
вании этого эпителия выражается в своеобразном «разделении труда»:
одни клетки реабсорбируют ионы, а другие транспортируют ионы в ге-
молимфу.
Несколько другой биологический смысл имеет гипертрофия плазма-
тической мембраны и митохондриального аппарата в клетках гиподермы
в определенных участках задней кишки насекомых — так называемых
ректальных утолщениях, или ректальных бугорках (Oschman, Wall, 1969;
Wessing, Eichelberg, 1973). В этой области в кутикулярной пластинке со-
держится меньше белка, в связи с чем она обладает способностью про-
пускать воду и ионы. У некоторых насекомых на апикальной поверх-
ности гиподермальных клеток имеются многочисленные микроворсинки,
внутрь которых заходят крупные митохондрии. Аналогичные структуры
имеются и на их боковых поверхностях. В средних и нижних участках
159
эпителиального пласта наблюдается сложная система межклеточных
щелей (синусов), в которых расположены конечные разветвления тра-
хейных трубочек. Основная функция гиподермальных клеток в области
ректальных утолщений заключается в активном транспорте ионов Na из
полости задней кишки и создании высокого осмотического давления
в межклеточных пространствах эпителиального пласта. В связи с хоро-
шей проницаемостью кутикулы для воды она устремляется в область вы-
сокой концентрации ионов. В дальнейшем вода и некоторое количество
ионов переводятся во внутреннюю среду организма — в гемолимфу, а ос-
новная масса ионов вновь поглощается клетками путем активного ион-
ного транспорта с затратой больших количеств энергии. В данном случае
структурные компоненты активного ионного транспорта (гипертрофиро-
Рис. 72. Схемы ультраструктурной организации солевых клеток водных личинок
насекомых. (По: Wichard et al., 1972, с изменениями).
а — единичная клетка, б — клеточный комплекс. 1 — поровая пластинка в кутикуле, 2 — клетка,
контактирующая с внешней средой, 3 — промежуточные клетки.
ванная плазматическая мембрана и кристы митохондрий) используются
для обратного всасывания воды путем поглощения ее из полости задней
кишки. Аналогичная дифференцировка клеток имеет место и в других
отделах задней кишки (Marshall, Wright, 1974).
КРАТКАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ
СМЕШАННЫХ ОСМОРЕГУЛИРУЮЩИХ И ВЫДЕЛИТЕЛЬНЫХ СИСТЕМ
МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
Как уже отмечалось, основным направлением в реализации осморегу-
лирующей и выделительной функций у многоклеточных животных яв-
ляется формирование специализированных эпителиальных канальцев,
обеспечивающих и осморегуляцию, и выделение экскреторных продуктов.
Несмотря на большое разнообразие таких систем у разных групп много-
клеточных животных, подавляющее большинство их построены по одному
принципу. Они представляют собой более или менее сложную систему
эпителиальных канальцев. Количество последних варьирует от одной или
нескольких пар до сотен тысяч. Источником развития таких канальцев
может быть и мезодермальный эпителий, выстилающий вторичную по-
лость тела, и кожный, и даже кишечный эпителий. У многих животных
(причем независимо в разных группах) формируются смешанные мезо-
дермально-эктодермальные канальцы. Такие выделительные канальцы
характерны для полихет, наземных моллюсков, позвоночных.
160
Несмотря на различное происхождение и локализацию в теле живот-
ных, в осморегулирующих и выделительных канальцах удается обычно
выделить три основных отдела — начальный, средний и каудальный. Со-
отношение и функциональное значение этих отделов канальца удобнее
рассмотреть на примере видоизмененных метанефридиев членистоногих
животных (рис. 73). Эти органы расположены в головных сегментах
животных. Начальный отдел канальца расширен и имеет вид мешочка,
выстланного специализированными клетками целомического эпителия.
Мешочек представляет собой рудимент целомической полости. Из омываю-
щей такой мешочек гемолимфы внутрь поступает фильтрат с растворен-
ными в нем веществами. В среднем отделе канальца, который делится на
проксимальную и дистальную части, происходит реабсорбция воды, по-
лезных веществ и, возможно, экскреция конечных продуктов метаболизма.
В каудальном участке канальца, в его ампуло-
образном расширении, накапливаются жидкие
продукты обмена в концентрированном виде. От- /у \А
сюда они поступают в наружную среду через г/ f А \\
выводные отверстия в стенке тела животных \ д
(Fain-Maurel, Cassier, 1971; Francois, 1972). ц Va vA
Аналогичное в принципе строение имеют и V А у A VX v
типичные метанефридии аннелид. Более сложно уД v d А2 Г
устроены эти канальцы у дождевого червя у А Ц| | к
(Graszynski, 1963). Начальный отдел канальцев М Н
образован воронкой, выстланной ресничным эпи- /( .у \ \
Рис. 73. Схема строения «зеленой железы» ракообраз- Д fl
ных. (Из: Беклемишев, 1964).
1 — целомический мешочек (рудимент целома), 2 — извитой
каналец, 3 — конечный участок канальца.
телием (рис. 74). В воронку непрерывно поступает целомическая жидкость,
являющаяся по существу ультрафильтратом крови. В средней части сильно
извитого, достигающего большой длины, метанефридия происходит слож-
ная обработка содержимого канальца. Сущность такой обработки заклю-
чается в реабсорбции ионов, питательных веществ и в экскреции вредных
продуктов метаболизма. Соответственно сложной функциональной задаче
канал метанефридия делится по крайней мере на 5 участков, каждый из ко-
торых образован эпителиальными клетками различной функциональной
специализации. Конечный отдел метанефридия образован расширенным
участком канала, открывающимся наружу нефридиальной порой. В метане-
фридиях дождевого червя обнаруживается тесная связь канальцев с крове-
носными сосудами, образующими по ходу канальца специальное сплетение.
Такая связь необходима для интенсификации процессов реабсорбции и эк-
скреции. Возможно также, что в некоторых участках канальцев может
иметь место и ультрафильтрация жидких и низкомолекулярных продуктов
из крови. Наличие тесной связи специального сосудистого сплетения и
стенки целома в области, контактирующей с воронкой метанефридия, по-
казано у одной из полихет (Koechlin, 1966, 1972).
У пиявок, которые характеризуются редукцией целома, по сравне-
нию с полихетами связь выделительных канальцев с сосудистой системой
выражена еще более четко (Boroffka, 1970; Haupt, 1974).
Особенно же большого развития достигают фильтрационные выдели-
тельные системы, основанные на тесных структурных и функцио-
нальных взаимосвязях сосудистой системы с выделительными каналь-
цами у моллюсков и позвоночных животных. У большинства моллюсков
образование первичной мочи происходит путем ультрафильтрации жид-
11 А. А. Заварзин 161
кой части крови через стенку предсердия в рудимент целома — перикар-
диальную полость. Последняя связана при помощи реноперикардиаль-
ного канала, выстланного ресничным эпителием, с полостью почечного
мешка. Почка моллюсков характеризуется большим диаметром реабсорб-
ционного отдела. Здесь формируются многочисленные складки. Клетки
эпителия почечного мешка обеспечивают реабсорбцию полезных веществ
и экскрецию конечных продуктов метаболизма. Последние часто накап-
ливаются в виде больших конкреций в апикальной части клеток. Клетки
с большим количеством экскреторных включений гибнут и слущиваются
в просвет почечного мешка. У некоторых моллюсков обнаружены и осо-
бые камбиальные участки, за счет размножения клеток которых сохра-
Рис. 74. Метанефридии кольчатых червей. (Из: Andrew, 1959).
а — микроанатомическая схема метанефридия, б — участок воронки метанефридия дождевого червя.
1 — реснички, 2 — воронка, 3 — средний и 4 — конечный участки канальца.
няется динамическое постоянство количества клеток в эпителиальной
выстилке почечного мешка (Bonga, Boer, 1969). Здесь имеются также
и участки уплощенных эпителиальных клеток, где можно предположить
наличие фильтрации жидкой части крови непосредственно из сосудов
в полость мешка. Каудальный участок выделительной системы у мол-
люсков представлен мочеточниками, эпителий которых у наземных мол-
люсков обладает способностью к активному транспорту ионов.
Аналогичную по сути функцию осуществляют выделительные ка-
нальцы позвоночных животных. У большинства представителей началь-
ный отдел основной структурной единицы почки — нефрона вместе с ка-
пиллярным артериальным клубочком образует сложный фильтрационный
аппарат. Через него в полость капсулы нефрона — слепо замкнутого
начального отдела канала — фильтруется первичная моча. Из нее реабсор-
бируются вода, глюкоза, аминокислоты и другие полезные вещества. Все
эти процессы совершаются в длинном среднем отделе канальца
нефрона. У млекопитающих в нем удается выделить три участка: прокси-
мальный, в состав которого входят извилистая и прямая части главного
отдела; тонкий отдел петли Генле, включающий нисходящую и тонкую
восходящую части петли; дистальный участок, образованный толстым
восходящим отделом петли Генле и дистальным извилистым канальцем.
Последний открывается в сложнодифференцированную систему прото-
162
ков каудального отдела, состоящую из собирательных трубок, почечной
лоханки, мочеточников и мочевого пузыря (рис. 75).
Таким образом, у высших позвоночных животных метанефридиаль-
ные выделительные канальцы фильтрационного типа получают наивыс-
шее развитие. Они полностью утрачивают связь с полостью тела, и их
функциональная деятельность основана на теснейших взаимоотношениях
между эпителием почечных канальцев и стенкой капилляров, как в об-
ласти фильтрационного аппарата, так и в других участках, где проис-
ходят процессы реабсорбции и экскреции. Величина нефронов и мор-
фофункциональная дифференцировка их по длине канальца варьируют
у представителей разных классов позвоночных животных. У низших по-
звоночных часть нефронов может сохранять связь с полостью тела. У не-
которых видов костистых рыб нефроны ли-
шены фильтрационного аппарата и почка рабо-
тает по секреционному типу (Dobbs, De Vries,
1975). Наконец, весьма важные участки не-
фрона — нисходящие и восходящие каналы
петли Генле — лишь у птиц и млекопитающих
приобретают способность формировать гиперто-
ническую мочу и в широких пределах регулиро-
вать концентрацию последней.
Особое направление филогенетической диф-
ференцировки осморегулирующих и выделитель-
ных канальцев представляют протонефридии —
органы эктодермального происхождения, харак-
терные для низших червей, пемертин и некото-
Рис. 75. Микроанатомическая схема строения нефрона
почки млекопитающих. (Из: Елисеев и др., 1972).
I — капсула нефрона, 2 — извитая и 3 — прямая части прокси-
мального отдела, 4 — нисходящая и 5 — восходящая части
петли нефрона, 6 — извитая часть дистального отдела, 7 — соби-
рательная трубка.
рых других групп многоклеточных животных. Их общей особенностью яв-
ляется наличие специальной терминальной клетки или системы клеток
эктодермальной природы в слепозамкнутом переднем отделе канальцев.
Таким образом, в отличие от метанефридиев или смешанных по происхож-
дению целомодуктов все отделы канальцев протонефридиев являются про-
изводными кожного эпителия. Начальные отделы слепозамкнутых каналь-
цев протонефридиев у целомических и псевдоцеломических животных мо-
гут контактировать с выстилкой целома или ее аналогами, однако эта связь
носит вторичный характер. Концевые отделы протонефридиев у животных
с хорошо развитой сосудистой системой (немертины, ланцетник) обнару-
живают тенденцию к образованию тесной структурной и функциональной
связи с кровеносными сосудами.
Концевые клетки и клеточные системы протонефридиев изучены
в настоящее время весьма детально и у многих представителей много-
клеточных животных (см. обзоры: Brandenburg, 1966; Wilson, Webster,
1974). Они могут быть представлены типичными корзинчатыми клет-
ками, или циртоцитами, с апикально расположенным ядром, жгутиком
и сложным воротничковым, или корзинчатым, аппаратом (рис. 76, б).
Жгутиковые терминальные клетки могут образовывать экстрацеллюляр-
ный канал. В стенке канала имеются извилистые, взаимопроникаю-
щие контакты соседних клеток (рис. 76, в). Такого рода специализиро-
ванные щелевидные контакты могут возникать между терминальной
клеткой и начальной клеткой отводящего канальца, как это наблюдается
11*
163
в протонефридиях трематод. Наконец, у некоторых немертин в слепо-
замкнутой части канальцев протонефридиев концевые клетки контакти-
руют со стенкой сосудистой лакуны (рис. 76, а). К сожалению, сейчас
еще отсутствуют работы по тонкому строению такого рода концевых от-
Рис. 76. Протонефридии беспозвоночных.
а — немертин (из: Willmer, 1970), б — приапулид (из:
Brandenburg, 1966), в — низших полихет (из: Лебский, 1974а).
1 — стенка кровеносной лакуны, 2 — начальные отделы
протонефридия, 3 — средний и 4 — конечный отделы прото-
нефридиев, 5 — ядро корзинчатой клетки (циртоцита), 6 —
жгутик, 7 — корзинчатый аппарат, 8 — клетки канала про-
тонефридия.
делов, являющихся аналогами капсулы нефрона позвоночных животных.
Несмотря на разнообразие концевых аппаратов протонефридиев и их
возможное полифилетическое происхождение, все они представляют со-
бой, по-видимому, своеобразные аппараты ультрафильтрации. При этом
основными структурами являются здесь выделяемые или образуемые
клетками своеобразные фильтры (внеклеточное вещество базальных мем-
бран и цемент межклеточных контактов, видоизмененные мембраны
164
в области отверстий и щелей корзинчатого аппарата) и большей или
меньшей сложности и мощности жгутиковый аппарат терминальных кле-
ток. Существенное значение в реализации осморегулирующей и выдели-
тельной функций протонефридиев может иметь у некоторых низших мно-
гоклеточных и эпителий канальцев протонефридиев. У некоторых цестод
показано наличие реабсорбции глюкозы, лактата и мочевины из ультра-
фильтрата, причем реабсорбция глюкозы происходит значительно более
интенсивно. В эпителии канальцев протонефридиев у изученных пред-
ставителей турбеллярий и немертин обнаружена фосфатазная активность.
Однако морфобиохимическая организация эпителиев канальцев протоне-
фридиев изучена еще недостаточно полно.
Рис. 77. Схема секреционного механизма формирования мочи в начальных отделах
мальпигиевых сосудов насекомых. (По: Welsch, Storch, 1973, с изменениями).
а — образование ограниченных мембраной пузырьков в области аппарата Гольджи, б — формирова-
ние глубоких пиноцитозных каналов в базальной части клеток, в — формирование пиноцитозпых
пузырьков, г — дегидратация и выведение содержимого пузырьков в просвет канальца.
Значительно лучше изучены своеобразные выделительные канальцы
членистоногих — мальпигиевы сосуды (Berridge, Oschman, 1969; Taylor,
1971; Marshall, Cheung, 1974; Wall et al., 1975). В этих слепозамкнутых
канальцах, количество которых варьирует в больших пределах (от 2 до
150 и больше), выделяют несколько отделов. Выделительные канальцы
представляют собой экскреционные секреторные системы. Выделение экс-
креторных продуктов происходит преимущественно в начальном слепо-
замкнутом конце выделительного канальца. В нижней части клеток пе-
риодически формируются пиноцитозные пузырьки с гемолимфой. В пе-
риоды формирования пиноцитозных пузырьков происходит набухание
базальной мембраны. Мембранные структуры для процесса пино-
цитоза образуются в области аппарата Гольджи (рис. 77). Формирую-
щиеся пиноцитозные пузырьки перемещаются к апикальной поверх-
ности клеток, и их содержимое выводится в просвет канальцев. В про-
цессе перемещения пузырьков в гиалоплазме происходит дегидратация
их содержимого. Избытки воды из просвета канальца реабсорбируются
и в переходном отделе мальпигиева сосуда.
Реабсорбция содержащихся в просвете канальцев белков, аминокислот
и других полезных для организма веществ происходит в главном отделе
мальпигиева сосуда. В настоящее время преобладает, однако, представле-
ние о том, что именно эти средние отделы имеют основное значение
в процессах экскреции.
Конечный, связанный с полостью кишки, отдел мальпигиевых сосу-
дов осуществляет контроль за транспортировкой веществ в полость
кишки. Его стенка снабжена специальным мышечным сократимым ап-
165
паратом. В тесной функциональной связи с деятельностью мальпигиевых
сосудов находятся и описанные в предыдущем разделе ректальные утол-
щения задней кишки насекомых, обеспечивающие реабсорбцию физио-
логически важных ионов и воды.
Краткая характеристика основных типов выделительных канальцев
многоклеточных животных свидетельствует об их относительно большом
разнообразии в отношении источников развития в онто- и филогенезе.
Тем не менее тщательный анализ тонкой структуры и морфобиохимиче-
ской дифференцировки выделительных эпителиев дает весьма яркие при-
меры цитологических и системных параллелизмов в организации эпите-
лия негомологичных по происхождению, но аналогичных в функциональ-
ном отношении отделов выделительных канальцев.
СТРУКТУРНЫЕ МОДИФИКАЦИИ И ЯВЛЕНИЯ ЦИТОЛОГИЧЕСКОГО
И СИСТЕМНОГО ПАРАЛЛЕЛИЗМА ОСМОРЕГУЛИРУЮЩИХ
И ВЫДЕЛИТЕЛЬНЫХ КАНАЛЬЦЕВ МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
Как следует из приведенного выше обзора микроанатомического
строения выделительных систем, их можно разделить на системы филь-
трационного и секреционного типов. К типичным фильтрационным выде-
лительным канальцам относятся подавляющее большинство нефронов
позвоночных, выделительные системы моллюсков и видоизмененные ме-
танефридии ракообразных и насекомых. Типичными секреторными выде-
лительными канальцами являются мальпигиевы сосуды насекомых и
агломерулярные нефроны рыб. Что касается мета- и протонефридиев
низших многоклеточных, то физиологические механизмы их работы изу-
чены еще недостаточно полно. Тем не менее есть веские основания пред-
полагать, что и в этом случае мы имеем дело со своеобразными выде-
лительными канальцами фильтрационного типа. Тем не менее такое под-
разделение несколько условно, поскольку в фильтрационных канальцах
имеют место процессы секреции и, наоборот, в секреционпых канальцах
типа мальпигиевых сосудов происходят и процессы осмотической филь-
трации.
Наибольшей сложности организации достигают фильтрационные ап-
параты нефронов высших позвоночных, и в частности млекопитающих
и человека (см. обзоры: Welsch, Storch, 1973; Наточин, 1974).
В дефинитивной почке высших позвоночных нефроны обнаруживают
тесную связь с сосудистой системой. Их передний отдел преобразуется
в капсулу нефрона, представляющую собой специализированный уча-
сток фильтрационного аппарата почки. Второй частью этого аппарата
является клубочек артериальных капилляров, находящихся в тесном кон-
такте с эпителиальными клетками внутреннего листка капсулы нефрона.
Эпителий наружного листка капсулы нефрона непосредственно перехо-
дит в эпителиальную выстилку канальца нефрона. Между внутренним
и наружным листком капсулы нефрона образуется полость, в которую и
происходит фильтрация первичной мочи.
Особенностью ультраструктурной организации эндотелия, образую-
щего стенку капилляров в капсуле нефрона, является наличие здесь
отверстий — пор. В области пор кровь непосредственно контактирует с пла-
стинкой межклеточного вещества — базальной мембраной стенки капил-
ляра. Эпителиальные клетки внутреннего листка капсулы нефрона пре-
образуются в подоциты, имеющие весьма своеобразное строение
(рис. 78, а). Ядросодержащая часть их цитоплазмы расположена на некото-
ром расстоянии от базальной мембраны. От этого центрального участка
клетки по направлению к базальной мембране отходят многочисленные
разветвленные отростки. Опи вступают в тесный контакт с базальной мем-
браной. Таким образом, создаются отношения, при которых полость со-
166
суда и полость канальца нефрона оказываются разграниченными лишь
базальными мембранами эндотелия сосудов и эпителия внутреннего ли-
стка капсулы нефрона. Такие отношения имеют место в области пор
Рис. 78. Схема ультраструктурной организации подоцитов.
а — млекопитающих и б — членистоногих (по: Kiimmel, 1967), в — моллюсков (по электронным
микрофотографиям: Witmer, Martin, 1973; рис. В. К. Лебского). 1 — ядросодержащая часть клет-
ки, 2 — отростки подоцитов, 3 — базальная мембрана, 4 — эндотелий с порами.
эндотелиальных клеток капилляров и промежутков между отростками
подоцитов.
Естественно, что такая ультраструктурная организация фильтрацион-
ного аппарата нефрона создает хорошие условия для прохождения внутрь
канальца жидкой части крови и растворенных в ней низкомолекуляр-
167
ных продуктов. Фильтрации этих компонентов крови способствует еще
и высокое онкотическое давление, которое развивается в капиллярах
благодаря разнице диаметров приносящей и выносящей артерий. Рас-
смотренная структура фильтрационного аппарата, где фильтром явля-
ются базальные мембраны, не создает условий для избирательной филь-
трации. Основным ограничителем этих фильтров являются размеры
молекул. Базальные мембраны оказываются непроницаемыми лишь для
форменных элементов крови и крупных белковых молекул.
Однако имеются данные о том, что подоциты не только образуют
поры своими отростками, но и осуществляют активную контролирующую
роль за процессом фильтрации. Эта функция подоцитов особенно четко
проявляется в патологических условиях (Seiler et al., 1976).
Неожиданным и в функциональном отношении далеко еще не ясным
оказалось наличие типичных подоцитов в ампулообразных расширениях
передних отделов видоизмененных метанефридиев (лабиальные и максил-
лярные «железы») ракообразных и насекомых (Altner, 1968; Stragways-
Dixon, Smith, 1970). Вся эпителиальная выстилка этих видоизмененных
участков целома образована отростчатыми клетками, ядросодержащие части
которых расположены на некотором расстоянии от базальной мембраны.
Между прилегающими к базальной мембране отростками имеются многочис-
ленные участки, где полость мешочка и окружающая гемолимфа разде-
лены лишь базальной мембраной и более или менее толстой прослойкой
межклеточного вещества соединительнотканной природы (рис. 78, б).
Подоциты обнаружены и у головоногих (Schipp et al., 1971; Witmer,
Martin, 1973), и у некоторых брюхоногих (Boer et al., 1973) моллюсков.
У головоногих моллюсков (рис. 78, в) они находятся в так называемых
перикардиальных железах, или в бронхиальных сердцах, где и происхо-
дит, по-видимому, ультрафильтрация. У брюхоногих моллюсков местом
локализации подоцитов может быть либо стенка предсердия, либо стенка
желудочка сердца. Эти данные свидетельствуют о варьировании локализа-
ции процесса ультрафильтрации у моллюсков. У ряда брюхоногих моллю-
сков не удалось еще пока выявить этих клеток ни в стенке сердца, ни
в начальном отделе их выделительной системы.
Типичные подоциды обнаружены у полихет в стенке целома, в об-
ласти специализированных разветвлений сосудов у воронок метанефри-
диев (Koechlin, 1966). Имеются они, по-видимому, и у некоторых пред-
ставителей немертин.
Таким образом, имеющийся сравнительно-цитологический материал
по фильтрационным выделительным системам свидетельствует о том,
что подоцитный тип их организации широко распространен у современ-
ных многоклеточных животных. Он имеется у таких неродственных групп
животных, как позвоночные, членистоногие и некоторые моллюски, по-
лихеты и немертины. Особенно ярким свидетельством наличия общих
тенденций в формировании фильтрационных аппаратов подоцитного типа
в выделительных системах являются те отношения, которые наблюда-
ются у ланцетника. У этих животных выделение и осморегуляция осуще-
ствляются своеобразными протонефридиями. Однако их корзинчатые
клетки — циртоциты имеют две характерные особенности. В их корзин-
чатом аппарате отсутствует мембрана, замыкающая продольные щели, и
полость воротничкового канала циртоцита непосредственно сообщается
с тканевой жидкостью. Второй особенностью циртоцитов является нали-
чие у них подоцитообразных отростков, которые контактируют со стенкой
кровеносного сосуда (рис. 79). Здесь имеет, по-видимому, место уль-
трафильтрация жидкости из крови в окружающие ткани. Образующийся
ультрафильтрат благодаря биению жгутиков и наличию открытых щелей
в воротничковом аппарате поступает преимущественно в полость ка-
нальца протонефридия.
Второй важнейшей функцией смешанных осморегулирующих и выде-
168
лительных систем является обработка первичной мочи, выделяемой
в полость канальцев. Наиболее интенсивно эти процессы протекают
в нефронах высших позвоночных животных.
У человека из образующихся за сутки 170—200 литров первичной
мочи в результате деятельности эпителиальных клеток выделительных
канальцев происходит реабсорбция свыше 90% этой жидкости с содержа-
Рис. 79. Циртоподоцит протонефридия ланцетника. (Из: Brandenburg, 1966).
1 — сосуд, 2 — отростки циртоподоцита на сосуде, 3 — тело клетки, 4 — жгутик, 5 — отростки
циртоподоцита вокруг жгутика, в — клетки эпителия канальца протонефридия. Справа вверху — по-
перечные разрезы через отросток циртоподоцита в среднем (вверху) и конечном (внизу) его участках
щимися в ней полезными для организма органическими и неорганическими
соединениями. Об интенсивности работы этих клеток свидетельствует тот
факт, что в почках расходуется 10—12% всей энергии, полу-
чаемой организмом в процессах окислительного фосфорилирования. Есте-
ственно, что функциональная деятельность этих клеток обусловливает
их весьма сложную морфобиохимическую организацию (Rostgaard, Thu-
neberg, 1972; Наточин, 1974).
Сложное строение имеют клетки эпителия главного отдела нефрона —
извитых канальцев первого порядка (рис. 80, а). Их выстилка образована
здесь крупными клетками с оксифильной цитоплазмой и характерной,
заметной на уровне светового микроскопа, исчерченностью в базальной
и апикальной частях клеток. На апикальной поверхности клеток имеются
169
длинные микроворсинки с хорошо развитым надмембрапным комплексом
и сократимым фибриллярным аппаратом. Отчетливо выявляется аппарат
Гольджи, имеющий типичный вид и расположенный в надъядерной
области. В цитоплазме удается также обнаружить большое количество
ограниченных мембранами пузырьков, представляющих собой гипертро-
фированный лизосомный аппарат,
гетеро- и аутофагии. Хорошо
развит в цитоплазме клеток эпи-
телия главных отделов нефрона
также и шероховатый и гладкий
эндоплазматический ретикулум.
Плазматические мембраны на ба-
зальных поверхностях этих клеток
образуют глубокие складки. Здесь
же расположены многочисленные
митохондрии.
Клетки главных отделов не-
фронов реабсорбируют около 70%
ионов и воды, ведущим в этих
процессах реабсорбции является,
по-видимому, активный транспорт
ионов натрия. Кроме того, эти
клетки, обладая хорошо раз-
витым лизосомным аппаратом,
активно участвующий в процессах
3
активно поглощают из первич-
ного фильтрата высокомолекуляр-
ные соединения, и в частности
белковые молекулы, которые мо-
гут оказаться в нем в резуль-
тате возможных нарушений ра-
боты фильтрационного аппа-
рата. Поглощение этих веществ
совершается путем типичного пи-
ноцитоза специализированной
плазматической мембраной апи-
кальной поверхности клеток. Эти
клетки обладают также способ-
ностью к реабсорбции глюкозы,
однако в ограниченных пределах,
при содержании ее в крови не
выше нормального уровня. Реаб-
сорбции подвергается и основная
масса аминокислот и неорганиче-
ских ионов, а также мочевина и
целый ряд других компонентов.
Наряду с такой разносторонней
реабсорбциопной деятельностью
клетки обладают способностью извлекать из крови, перерабатывать и вы-
делять в просвет органические основания, ряд органических кислот и не-
которые другие соединения, т. е. обладают активной секреционной
деятельностью. Клетки эпителия главных отделов нефрона могут также
поглощать из первичной мочи растворенные минеральные соли, избира-
тельно накапливать и осаждать их в лизосомах и митохондриях. В даль-
нейшем образующиеся таким путем конкреции выбрасываются в просвет
канальца (Gale, 1974).
Мультифункциональная двусторонняя весьма интенсивная деятель-
ность клеток главных отделов нефрона создает большую нагрузку на весь
метаболический аппарат клетки, и в частности на ее системы, генерирую-
170
щие энергию. Митохондрии почечных клеток имеют относительно непро-
должительный жизненный цикл и непрерывно обновляются. Большую
роль в таком непрерывном обновлении этого аппарата играют процессы
аутофагии. Они имеют, по-видимому, существенное значение в обновле-
нии и других мембранных структур клеток. Естественно, что клетки
должны обладать высокой синтетической активностью, направленной на
Рис. 80. Схема ультраструктурной организации реабсорбирующих клеток у млеко-
питающих и ракообразных. (Рис. В. К. Лебского и С. А. Быстрова).
at — проксимальные, б, бх — дистальные отделы канальцев в нефроне млекопитающих (а, б) и
«зеленой железе» ракообразных (аг, 6J. 1 — микроворсипки, 2 — аппарат Гольджи, 3 — лизосомы,
4 — впячивания базальной мембраны с митохондриями.
образование большого количества собственных липидов, белков и других
соединений, необходимых для построения новых мембранных структур.
Таким образом, клетки эпителия главных отделов нефрона позвоноч-
ных животных представляют собой одну из наиболее сложнодифферен-
цированных клеточных систем, специализированных на осморегулирую-
щей и выделительной функциях. Однако в этих клетках не формиру-
ются особые специфические структуры. В них наблюдается только
гипертрофия и усложнение общих для всех клеток систем их метаболи-
ческого аппарата. Это обстоятельство, а также общность функций реаб-
сорбции и дополнительной секреции обусловливают большое сходство
171
в ультраструктуре клеток реабсорбционного отдела канальца у позво-
ночных, членистоногих и моллюсков. Сходные признаки строения прояв-
ляются не только на клеточном уровне, но и в характере дифференци-
ровки реабсорбционных отделов канальцев. Так, в зеленой железе рако-
образных и гомологичных ей видоизмененных метанефридиях головных
сегментов у некоторых насекомых имеется четкое подразделение
центрального отдела нефридия на проксимальный и дистальный отделы.
На апикальной поверхности эпителиальных клеток проксимального отдела
хорошо развит аппарат микроворсинок (рис. 80, ai). Клетки содержат
многочисленные лизосомы и вакуоли различных размеров и формы.
Однако в рассматриваемом проксимальном отделе канальца зеленой же-
лезы у эпителиальных клеток отсутствуют складки плазматической
мембраны в базальной части клетки с характерными пакетами мито-
хондрий между ними. Эти структуры имеются у клеток, выстилающих
дистальный отдел канальца (рис. 80, 6j). Вместе с тем у них отсутствуют
микроворсинки и относительно слабо развит лизосомный аппарат.
Сходная морфофункциональная топографическая дифференцировка
эпителиальной выстилки канальцев наблюдается, хотя и в меньшей сте-
пени, и в нефронах позвоночных (рис. 80, а, б).
Весьма сложная топографическая дифференцировка среднего отдела
канальца метанефридия наблюдается у дождевого червя. Для метанефри-
диев дождевых червей характерно, как и для членистоногих, наличие
участков с гипертрофированным аппаратом микроворсинок и, наоборот,
с базальной складчатостью плазматической мембраны.
В эпителии почечного мешка моллюсков клетки имеют более гармо-
ничное развитие. У них есть и аппарат микроворсинок, и базальная
складчатость плазматической мембраны с пакетами митохондрий. Специ-
фической особенностью этого эпителия является наличие в клетках
экскреторных конкреций и поляризованного обновления клеток эпите-
лиальной выстилки мешка.
Своеобразную, но сходную организацию имеют клетки центрального
отдела мальпигиевых сосудов членистоногих (паукообразных и насеко-
мых). Основные клетки этого эпителия характеризуются и наличием
базальной складчатости с обилием митохондрий, и хорошим развитием
микроворсинок с расположенными в них митохондриями (Marshall,
Cheung, 1974). Существенную роль в активном ионном транспорте иг-
рают здесь и особые вспомогательные клетки, которые значительно от-
личаются по характеру своей морфобиохимической организации от ос-
новных клеток, образующих стенку канальца (Berridge, Oschman, 1969).
ЗАКЛЮЧЕНИЕ
Как следует из приведенного фактического материала, в специализа-
ции клеток выделительных и осморегулирующих эпителиев не менее
ярко, чем на примере кожных и кишечных эпителиев, проявляется ряд
общих универсальных для всего этого функционального типа эпителиаль-
ных структур закономерностей филогенетической дифференцировки.
Особенностью этой группы тканей является их происхождение из
разных источников. Действительно, системы солевых клеток позвоноч-
ных и насекомых, прото- и метанефридии, мальпигиевые сосуды — все
это не гомологичные образования. Они имеют разные источники и разные
пути развития в филогенезе многоклеточных животных. Тем не менее
общность функциональной задачи, а также общность тех универсальных
клеточных механизмов, на основе которых специализируются эти клетки,
и обусловливает то чрезвычайно широкое распространение сходных
морфобиохимических дифференцировок клеток, которые мы наблюдаем
в эпителиях этих разнородных структур. Таким образом, на примере ос-
172
морегулирующих и выделительных эпителиев особенно ярко выявля-
ется и функциональная обусловленность специализации клеток, и огра-
ниченные возможности к разнообразным модификациям такой специали-
зации клеток у многоклеточных животных. В основе осморегулирующей
и выделительной функций лежат процессы активного ионного транспорта
и в качестве вспомогательного реабсорбционного механизма — процессы
эндо- и экзоцитоза. Сущность специализации клеток эпителиальных ка-
нальцев и сводится в основном к гипертрофии общих для всех клеток
аппаратов активного ионного транспорта и в ряде случаев механизмов
пино- и фагоцитоза.
В этой связи естественным является, что и в секретирующих или
поглощающих соли клетках кожного эпителия, и в клетках эпителия
главных отделов нефрона, и в мальпигиевых сосудах, и в метанефридиях
насекомых мы наблюдаем гипертрофию плазматической мембраны и
энергетического аппарата клеток, несмотря на существенные различия
конкретных функциональных задач, реализуемых этими клетками. К при-
веденным выше фактам можно добавить, что аналогичную дифференци-
ровку на ультраструктурном уровне организации имеют клетки таких
эпителиев, как эпителии хориальных сплетений, эпителий цилиарного
тела глаза, слюнных желез у млекопитающих, эпителии ректальных утол-
щений у акуловых рыб и даже эпидермис у растений, приспособленных
к обитанию на засоленных почвах.
Весьма возможно, однако, что в каждом конкретном случае помимо
чисто количественных различий в степени развития этих структур, могут
быть обнаружены и существенные качественные особенности. Однако
они, очевидно, будут наиболее отчетливо проявляться на молекулярном
и надмолекулярном уровнях организации ферментативных систем и вспо-
могательных структур, пока еще почти недоступных для систематиче-
ского анализа.
Наличие общих закономерностей эволюционной дифференцировки
специализированных клеток выделительных и осморегулирующих эпи-
телиев проявляется и в сходстве строения таких специфических для этих
эпителиев клеток, как подоциты внутреннего листка капсулы нефро-
нов позвоночных, подоциты членистоногих, моллюсков и полихет и цир-
топодоциты ланцетника. Функциональное значение этих клеток заклю-
чается в создании более тесных контактов между полостью выделитель-
ных канальцев и тканевой жидкостью или плазмой крови. При этом
они выполняют еще, по-видимому, и регулирующую и контролирующую
функции. Эти стороны функциональной деятельности подоцитов выяс-
нены недостаточно даже в наиболее хорошо изученном фильтрационном
аппарате позвоночных животных. Тем не менее большое сходство в ор-
ганизации всех этих разнородных по происхождению специализирован-
ных клеточных элементов представляет собой не случайное совпадение.
Возможно, что здесь мы имеем дело с проявлением еще более глубоких
закономерностей цитологических параллелизмов, поскольку обнаружи-
вается сходство в крайне специализированных специфических лишь для
выделительных эпителиев высших животных признаках клеточной ор-
ганизации. Оно тем более удивительно, что в функциональном отноше-
нии фильтрационные аппараты нефрона, метанефридиев членистоногих,
почек моллюсков и протонефридиев ланцетника далеко не аналогичные
образования.
На примере осморегулирующих и выделительных эпителиев отчетливо
проявляются и некоторые общие закономерности организации тканевых си-
стем. Осморегулирующие системы эктодермальных эпителиев (солевые
клетки рыб и солевые железы рептилий и птиц) представляют собой весьма
яркие примеры функциональной обусловленности регуляции процессов
репродукции и дифференцировки со стороны внешних для системы фак-
торов (концентрации ионов в плазме крови и тканевой жидкости).
173
Особенно отчетливо значение системных механизмов обнаружи-
вается в организации осморегулирующих эпителиев выделительных
канальцев высших животных. Это прежде всего проявляется
в топографической дифференцировке средних отделов канальцев
на участки, что обеспечивает все большее и большее «разделение
труда» между отдельными участками канальца. Такая дифференцировка
канальцев оказывается возможной лишь при непрерывном усилении
общих интегративных механизмов всей системы канальцев. Дифферен-
циация среднего и конечного отделов выделительных канальцев на
участки является, следовательно, лишь внешним выражением тканевой
и микроорганной интеграции и достаточно хорошо выражена и в нефро-
нах позвоночных, и в типичных метанефридиях полихет, и в видоизме-
ненных метанефридиях, и в мальпигиевых сосудах членистоногих. Больше
того, процессы дифференциации почечных канальцев на отделы различ-
ного микрофункционального значения являются одним из механизмов
приспособительных изменений выделительной и осморегулирующей
систем в связи с экологическими особенностями отдельных групп жи-
вотных.
Эта закономерность достаточно хорошо выражена у позвоночных
животных, нефроны почек которых обнаруживают весьма разнообраз-
ный спектр структур, отличающихся как по общей длине почечных ка-
нальцев, так и по количеству их специфически дифференцированных от-
делов. Однако, несмотря на это разнообразие, различия в морфобиохи-
мической дифференцировке клеток в разных отделах канальцев носят
в основном количественный характер.
Дальнейшее усложнение и функциональное совершенствование выде-
лительных и осморегулирующих органных структур происходит уже за
счет усложнения системных механизмов и межтканевых взаимодействий.
Эта закономерность отчетливо проявляется в организации нефронов
млекопитающих и птиц и выделительных органов у насекомых, обладаю-
щих способностью выделять гипертоническую мочу.
У насекомых выработка гипертонических экскретов происходит за счет
деятельности специальной осморегулирующей системы в ректальных
утолщениях задней кишки. У млекопитающих увеличение концентрации
экскретов происходит в среднем и каудальном отделах эпителиальных
канальцев. Возможность выработки гипертонической мочи обеспечива-
ется здесь путем создания противоточной системы по всей длине не-
фрона и местным усилением осмотического давления в межклеточном
веществе соединительной ткани мозгового вещества почки. При этом
эпителиальная выстилка собирательных трубок может изменять свою
пропицаемость для воды под влиянием антидиуретического гормона ги-
пофиза. Действие гормона стимулирует, по-видимому, выделение эпите-
лиальными клетками ферментов, расщепляющих мукопротеиды межкле-
точных контактов. Благодаря этому облегчается выход воды из полости
собирательных трубок в область межуточной соединительной ткани, где
имеется повышенное осмотическое давление. Оно создается здесь за
счет активного транспорта ионов эпителиальными клетками каудальных
участков средних отделов выделительных канальцев.
Таким образом, в данном случае проявляется общая, характерная и
для других эпителиальных тканей закономерность: резкое усиление
у высших животных удельного значения системных интегрирующих ме-
ханизмов и механизмов межтканевого взаимодействия. Как следует из
анализа морфобиохимической организации специализированных эпите-
лиальных клеток разных отделов выделительных канальцев у разных
групп многоклеточных животных, их разнообразие и сложность органи-
зации ограничены определенными пределами. Эти ограничения обуслов-
лены тем, что специализация в направлении реализации фильтрацион-
ной, секреторной и реабсорбционной функций происходит на клеточном
174
уровне на основе гипертрофии общих для всех клеток метаболических
систем. В связи с этим естественно, что усовершенствование и интенси-
фикация выделительной и осморегулирующей функций у высших живот-
ных происходят уже преимущественно путем усовершенствования ми-
кроорганных уровней организации выделительных и осморегулирующих
систем организма.
Для понимания закономерностей филогенетической дифференцировки
осморегулирующих и выделительных систем, в еще большей мере чем
для других частных систем многоклеточных животных, необходимо нали-
чие фактического сравнительного материала по варьированию морфобио-
химической организации этих систем в пределах каждого класса живот-
ных в связи с особенностями экологии отдельных видов. Такой материал
особенно необходим в отношении нефронов позвоночных, нефридиев и
мальпигиевых сосудов членистоногих и осморегулирующих и выделитель-
ных канальцев других групп животных. К сожалению, целенаправленное
накопление такого материала началось лишь в последнее время. Более
подробно состояние вопроса по сравнительному анализу осморегулирую-
щих систем у отдельных групп животных освещено в специальных об-
зорах и сводках (Гинецинский, 1966; Kirschner, 1967; Potts, Рагу, 1968;
Oglesbly, 1969; Berridge, Oschman, 1972; Oschman et al., 1974, и др).
Часть III
ТКАНИ ВНУТРЕННЕЙ СРЕДЫ
Ткани внутренней среды представляют собой весьма разнообразную
по составу группу тканей, отдельные разновидности которых резко отлича-
ются по характеру морфобиохимической дифференцировки клеток и меж-
клеточных структур.
У многоклеточных животных общим источником развития всех тканей
внутренней среды были, по-видимому, примитивные паренхимы, образован-
ные клетками и межклеточным веществом. В оформленном состоянии
такие паренхимы осуществляли функцию проведения питательных ве-
ществ за счет развития в них основного, аморфного вещества. Для фор-
мирования межклеточного вещества в паренхиме имелись особые осед-
лые отростчатые клетки. Важную роль в осуществлении трофической
функции играли здесь и подвижные амебоциты, которые в дальнейшем
взяли на себя у многих животных еще и роль защитного и контролирую-
щего аппарата. Из современных низших многоклеточных относительно
просто устроенные ткани внутренней среды наблюдаются у таких живот-
ных, как немертины. У них эти ткани представлены паренхимой, среди
клеток которой имеются и оседлые, образующие межклеточные струк-
туры, клетки и подвижные амебоциты, осуществляющие защитную и
своеобразную выделительную функции.
У низших многоклеточных в тканях внутренней среды или, скорее,
в тканевых и клеточных структурах, выполняющих аналогичную рассмот-
ренным выше паренхимам функцию, могут наблюдаться и другие отно-
шения. Так, например, у кишечнополостных широкое распространение
имеет мезоглея, основу которой составляет межклеточное вещество, про-
дуцируемое преимущественно эпителиальными клетками.
У высших представителей кишечнополостных и у гребневиков эти
межклеточные структуры заселяются клетками в постэмбриональном раз-
витии животных. Среди них могут быть клетки, которые и сами проду-
цируют межклеточные структуры. Способностью к синтезу межклеточных
структур в ограниченных пределах обладают и некоторые эпителии,
а также сократимые ткани у высших позвоночных животных. Широкое
распространение у многих групп беспозвоночных животных имеет суб-
ституция ряда конкретных трофических и защитных функций специали-
зированными системами клеток эпителиального происхождения, и в ча-
стности выстилкой вторичной полости тела. Тем не менее ткани внут-
ренней среды у большинства современных многоклеточных животных
представляют собой трофические, защитные и в большей или меньшей
степени опорные скелетные тканевые системы, образованные разнооб-
разными клетками и сложными межклеточными структурами.
Имевшиеся потенции к прогрессивной филогенетической дифференци-
ровке у оформленных в виде самостоятельной тканевой системы парен-
химы первичных многоклеточных получили неодинаковое развитие в раз-
ных группах многоклеточных. Максимальное развитие этих потенций
наблюдается у высших представителей вторичноротых животных. У по-
звоночных животных непосредственным преемником примитивных парен-
хим первичных многоклеточных животных является рыхлая соединитель-
ная ткань. Она построена из клеток и межклеточного вещества, выполпяю-
176
щего трофическую и опорную функции. В составе тканей внутренней
среды у позвоночных животных имеются узкоспециализированные трофи-
ческие и защитные разновидности. К ним в первую очередь относятся
кровь и лимфоидная ткань. С другой стороны, в системе тканей внутрен-
ней среды позвоночных выделяются и специализированные опорные
ткани. Они представлены плотной соединительной тканью, хрящевой и
костной тканями.
Аналогичная классификация, основанная на историческом и функ-
циональном принципах, правомочна и для тканей внутренней среды
других многоклеточных животных. У них отсутствуют лишь костные и
лимфоидные ткани, а другие функциональные разновидности тканей
внутренней среды не достигают в большинстве случаев характерной для
позвоночных высокой степени дифференцированности и сложности орга-
низации.
Учитывая эти особенности филогенетической дифференцировки тка-
ней внутренней среды у многоклеточных животных, в настоящем раз-
деле книги специальная глава посвящена рассмотрению общих законо-
мерностей организации трофических и защитных разновидностей тка-
ней внутренней среды позвоночных животных.
Во второй главе рассмотрены эти же вопросы в отношении беспозво-
ночных животных. Третья глава посвящена характеристике скелетных
опорных разновидностей тканей внутренней среды.
Обстоятельный анализ имевшихся к середине XX века сравнительно-
гистологических данных в отношении тканей внутренней среды много-
клеточных животных с позиций эволюционной гистологии был сделан
акад. А. А. Заварзиным (Заварзин, 1945, 1947). В связи с этим в нашем
кратком обзоре будет уделено внимание преимущественно современному
состоянию общих вопросов эволюционной динамики тканей внутренней
среды многоклеточных животных.
Глава 1
ТРОФИЧЕСКИЕ И ЗАЩИТНЫЕ РАЗНОВИДНОСТИ ТКАНЕЙ
ВНУТРЕННЕЙ СРЕДЫ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
РЫХЛАЯ СОЕДИНИТЕЛЬНАЯ ТКАНЬ
Рыхлая соединительная ткань высших позвоночных, и в частности
млекопитающих и человека, состоит из клеток и межклеточных структур.
Основными клетками рыхлой соединительной ткани являются оседлые
клетки фибробластического ряда, гистиоциты, тучные и жировые клетки.
Трофическую и механическую функции рыхлой соединительной ткани
выполняют весьма сложные в морфологическом и химическом отноше-
ниях межклеточные структуры (рис. 81, а, б, в).
Межклеточное вещество рыхлой соединительной ткани состоит из двух
компонентов — аморфного, или основного, вещества и волокнистых фиб-
риллярных структур (коллагеновые, ретикулиновые, эластические и окси-
таланные волокна). Аморфное вещество в структурном отношении пред-
ставляет собой гелеобразную массу полужидкой консистенции, способную
в широких пределах менять степень своего обводнения и физические
свойства. В химическом отношении основу такого геля составляет глю-
куроновая кислота. Кроме того, в состав аморфного вещества входят
хондроитинсульфаты (преимущественно хондроитинсульфат В), неболь-
шое количество нейтральных мукополисахаридов и неколлагеновые белки.
Белки и мукополисахариды образуют крупные надмолекулярные муко-
протеиновые комплексы. Сложный химический состав и надмолекуляр-
12 А. А. Заварзин
177
ная организация аморфного межклеточного вещества обеспечивают весьма
совершенный транспорт продуктов метаболизма между кровью и клет-
ками различных тканей (Laurent, 1966).
Коллагеновые и ретикулиновые, или аргирофильные, волокна обра-
зованы белком коллагеном. Пучки коллагеновых волокон сильно варьи-
руют по своему диаметру в зависимости от количества коллагеновых
волокон, объединенных в одном пучке. Каждое коллагеновое волокна
состоит из отдельных фибрилл. Последние в одной и той же разновид-
ности соединительной ткани имеют обычно один и тот же диаметр, од-
нако в разных участках соединительной ткани он может варьировать от
30 до 200 А. Эти различия определяются количеством молекул тропокол-
лагена, составляющих такую фибриллу. Каждая молекула тропоколла-
гена состоит из 3 спирально закрученных полипептидных цепей. Дан-
ные по аминокислотному составу показывают, что специфичным для тро-
поколлагена является наличие большого количества глицина, которого
никогда не бывает меньше 30% (см. обзоры: Мазуров, 1974; Gross, 1974).
Под электронным микроскопом коллагеновые фибриллы обнаружи-
вают правильную поперечную исчерченность. Она обусловлена правильным
чередованием темных и светлых участков. Природа этой исчерченности
остается еще до конца неясной. Наибольшее распространение получило
представление о том, что такая исчерченность обусловлена асим-
метричностью молекул тропоколлагена и их закономерным расположением
в коллагеновой фибрилле. Последняя состоит из расположенных парал-
лельно цепей — соединенных концами молекул тропоколлагена, причем
соседние цепи сдвинуты одна относительно другой на 74 длины молекулы
тропоколлагена. Помимо таких представлений о надмолекулярной струк-
туре коллагеновых протофибрилл, предлагаются и другие. Однако все
они основаны на данных об асимметричной структуре макромолекулы
тропоколлагена, в составе которой имеется три полипептидных цепочки
со сложными и разнообразными поперечными связями между ними.
Коллагеновые фибриллы обладают способностью образовывать ком-
плексы с мукополисахаридами и мукопротеидами аморфного вещества.
Кроме того, в них у позвоночных животных содержится до 1 % углеводов.
Последние играют важную роль и в транспортировке, и в агрегации
молекул тропоколлагена.
Самые тонкие коллагеновые волокна, образованные относительно не-
большим количеством фибрилл, характеризуются способностью избира-
тельно осаждать соли серебра и получили название аргирофильных, или
ретикулиновых, волокон. Они могут быть лишь начальной стадией фор-
мирования более толстых дефинитивных коллагеновых волокон. В не-
которых участках рыхлой соединительной ткани ретикулиновые волокна
составляют часть общей системы коллагеновых и эластических волокон.
Ретикулиновые волокна являются также основной межклеточной струк-
турой ретикулярной ткани.
Эластические волокна внешне отличаются относительно небольшим
диаметром (от 0.2 до 1.0 мкм) и способностью анастомозировать друг
с другом, образуя сети с более или менее крупными ячейками. Одной
из наиболее характерных особенностей эластических волокон является
их невосприимчивость ко многим гистологическим красителям в связи
с отсутствием активных химических групп в составе образующих эла-
стические волокна белковых молекул,
В отличие от коллагеновых волокон эластические волокна состоят
из двух компонентов (Ross, Bronstein, 1969; Bodley, Wood, 1972). Цент-
ральную часть эластического волокна составляет пучок фибрилл. Послед-
ние не имеют поперечной исчерченности. Их средний диаметр около
20 А. Пучок фибрилл спаян в единое целое и окружен с периферии
аморфным веществом. Оба компонента эластического волокна состоят
из сходного по аминокислотному составу белка — эластина. Образование
178
Рис. 81. Рыхлая соединительная ткань млекопитающих. (Рис. 3. А. Зайченко).
а — межклеточные структуры и фибробласты, б — тучные клетки, в — гистиоциты, заполненные
коллоидным красителем, г — схема ультраструктурной организации фибробласта. 1 — пучки колла-
геновых волокон, 2 — ретикулиновые волокна, 3 — аморфное вещество. На поверхности фибробласта
схематически показаны молекулы тропоколлагена (4), эластина (5), нефибриллярных белков (б) и
мукополисахаридов (7). 8 — формирующееся коллагеновое волокно, 9 — эластическое волокно,
10 — области аппарата Гольджи, 11 — цистерны шероховатой эндоплазматической сети, 12 — лизо-
сома. Темными стрелками показаны места синтеза и возможные пути внутриклеточного перемещения
молекул преколлагена, преэластина и нефибриллярных белков. Светлой стрелкой показан синтез
и перемещение мукополисахаридов, темной (с точками} стрелкой показано перемещение лизосом
в ходе внутри- и внеклеточных катаболических процессов.
эластических волокон происходит в два этапа — вначале формируется
пучок центральных фибрилл, который затем одевается аморфным матрик-
сом (рис. 81, г). Эластин представляет собой белок, весьма устойчивый
и к кислотному и щелочному гидролизу. По такой химической инерт-
ности и устойчивости он близок к кератину. По аминокислотному со-
ставу эластины напоминают коллагены высоким относительным содер-
жанием глицина и почти полным отсутствием серусодержащих амино-
кислот. Молекулярная и надмолекулярная организация эластических
волокон изучена в настоящее время значительно меньше, чем коллагено-
вых волокон. Помимо зрелых эластических волокон в рыхлой соедини-
тельной ткани могут быть незрелые преэластические, или окситаланные,
волокна, состоящие только из фибриллярных компонентов.
Межклеточное вещество рыхлой соединительной ткани млекопитаю-
щих представляет собой целостную и вместе с тем гетерогенную и
в структурном, и в химическом отношении систему. Сложность ее орга-
низации определяется не только высокой степенью химической и струк-
турной дифференциации, но и большой функциональной подвижностью.
Такие процессы, как самосборка коллагеновых фибрилл, образование раз-
личных гомогенных и гетерогенных надмолекулярных комплексов, изме-
нение степени обводнения аморфного вещества, обусловливаются фи-
зико-химическими свойствами сложных макромолекул. Особенностью на-
тивного межклеточного вещества является и большая функциональная
и морфогенетическая пластичность, определяемая активными фермента-
тивными процессами.
В соединительной ткани имеются разносторонние связи между раз-
личными компонентами межклеточных структур и клеточными элемен-
тами. Среди различных типов ее клеток ведущая роль в этом отношении
принадлежит клеткам фибробластического ряда. Последние представ-
лены периваскулярными камбиальными клетками, фибробластами и
фиброцитами. Наиболее активными в функциональном отношении яв-
ляются фибробласты. Они представляют собой уплощенные отростчатые
клетки, распластанные в межклеточном веществе (рис. 81, а, в). На спе-
циально приготовленных тотальных препаратах соединительной ткани
в фибробластах, под световым микроскопом, выявляется более темная
базофильная перинуклеарная зона и светлая периферическая, где не
всегда удается различить границу между клетками и межклеточным
веществом. Под электронным микроскопом такая граница выявляется
достаточно отчетливо (рис. 81, а). Характерной особенностью фибробла-
стов является хорошее развитие у них шероховатой эндоплазматической
сети и мембранных систем аппарата Гольджи. Осповная фупкция этих
клеток заключается в синтезе и выведении высокомолекулярных соеди-
нений — белков и полисахаридов, идущих на формирование межклеточ-
ных структур соединительной ткани.
Процессы синтеза, внутриклеточного транспорта и выведения макро-
молекул фибробластами изучаются и биохимическими, и авторадиогра-
фическими методами. При введении меченых аминокислот (3Н-пролина,
3Н-глицина и др.) меченые белки через 10—15 мин. обнаруживаются
над цистернами шероховатой эндоплазматической сети в перинуклеар-
ной области фибробластов. Позднее меченые белки перемещаются в об-
ласть аппарата Гольджи и в периферические участки цитоплазмы. Таким
образом, часть синтезируемых белков «дозревает» в структурах аппа-
рата Гольджи. Имеется, однако, мнение, что значительная часть бел-
ков (около половины), в частности тропоколлаген, минует аппарат
Гольджи и поступает непосредственно в периферическую часть цито-
плазмы фибробластов. Вопрос этот, однако, требует дальнейшей детализа-
ции. В синтезирующих коллаген клетках скелетных тканей показано
его накопление в вакуолях аппарата Гольджи (Weinstock, Leblond, 1974).
Через несколько часов после инъекции меченых аминокислот меченые
180
белки обнаруживаются в межклеточных структурах вначале в перицел-
люлярной области, а затем и в более отдаленных от клетки участках.
Меченые аминокислоты включаются при этом не только в коллаген, но
и в другие неколлагеновые белки межклеточного вещества соединитель-
ной ткани. Соотношение интенсивности синтеза белков основного веще-
ства соединительной ткани и тропоколлагена зависит, по-видимому, и от
функционального состояния, и от топографических особенностей данного
участка рыхлой соединительной ткани.
Первичная локализация меченых мукополисахаридов (3Н-глюкоза,
35S сульфат натрия) в фибробластах наблюдается над мембранами ап-
парата Гольджи. Скорость выведения синтезированных мукополисаха-
ридов несколько выше, чем скорость выведения новообразующихся
белков.
Таким образом, фибробласты представляют собой весьма специализи-
рованные и сложные в биохимическом отношении клеточные элементы.
Они одновременно синтезируют несколько типов специфических белков
и разнообразные мукополисахариды. Имеются также данные о том, что
фибробласты могут выделять не только структурные белки и мукополи-
сахариды, но и гидролитические ферменты лизосом, т. е. обеспечивать
возможность локального разрушения межклеточных структур (Dingle,
1967). Вся эта сложная синтетическая деятельность фибробластов на-
правлена на обеспечение нормальной жизнедеятельности межклеточного
вещества путем непрерывного обновления его структурных и химиче-
ских компонентов, активной регуляции биохимических процессов и пере-
стройки этих структур при нарушении целостности межклеточных
структур.
В связи с этим фибробласты должны обладать и сложными рецептор-
ными приборами, и разнообразными механизмами выведения веществ
из клетки, и, наконец, возможностью одновременно и синхронно осу-
ществлять синтез нескольких разновидностей белков и мукополисахари-
дов. Сложность морфобиохимической организации фибробластов отчет-
ливо выступает на схеме, где суммированы современные представления
по этому вопросу (рис. 81, а).
Наиболее интенсивно обновляющимся компонентом межклеточного
вещества рыхлой соединительной ткани является ее аморфное вещество.
Как уже указывалось, белковые и мукополисахаридные компоненты
этого вещества синтезируются на рибосомах и в аппарате Гольджи и
выводятся из клеток путем неясных еще для нас в деталях механизмов
(Merker, Struwe, 1971).
Большую роль в начальных этапах перицеллюлярного формирования
фибриллярных структур приписывают мукополисахаридам. В многочи-
сленных исследованиях удалось установить, что формированию коллаге-
новых фибрилл при нормальных или репаративных гистогенезах соеди-
нительной ткани предшествует усиленное образование фибробластами
мукополисахаридов (Слуцкий, 1972). Предполагается, что эти соедине-
ния создают условия для концентрации молекул тропоколлагена, выде-
ляемых фибробластами около плазматической мембраны последних. Вы-
сокая концентрация молекул тропоколлагена у клеточной поверхности и
обеспечивает условия для объединения их в надмолекулярные струк-
туры — коллагеновые фибриллы. Возможно, что для нормального течения
первых этапов фибриллогенеза необходимо наличие выделяемых клет-
кой особых веществ или особой организации ее плазматической мем-
браны.
В последнее время удалось показать, что молекулы проколлагена пе-
ред выведением их из клетки имеют больший молекулярный вес, чем
нормальные внеклеточные молекулы тропоколлагена. Показано также, что
эти дополнительцые компоненты выполняют двоякую роль: обеспечивают
транспортировку молекул через мембрану фибробластов и препятст-
181
вуют самосборке молекул тропоколлагена в коллагеновые фибриллы
внутри клетки (см. обзоры: Grant, Prackop, 1972; Gross, 1974).
Клетки фибробластического ряда представляют собой обновляю-
щуюся клеточную популяцию. В рыхлой соединительной ткани непре-
рывно происходит гибель старых, закончивших свой жизненный цикл
фиброцитов. Постоянство клеточного состава популяции поддерживается
за счет митотического размножения камбиальных периваскулярных кле-
ток и молодых фибробластов. Имеются данные о том, что в отношении
скорости обновления популяция фибробластов неоднородна.
В подкожной соединительной ткани мышей в опытах с 3Н-тимидином
удалось показать наличие двух субпопуляций фибробластов: длительно
существующих и быстро обновляющихся (Ланге, Хрущов, 1973). Однако
только местных источников для пополнения фабробластов при их фи-
зиологической дегенерации недостаточно. В организме млекопитающих
имеется, по-видимому, и общий фонд стромальных стволовых клеток,
обеспечивающих постоянный подсев малодифференцированных способных
к делению фибробластических элементов. Эти стволовые клетки или об-
разующиеся в результате их деления клеточные элементы циркулируют,
по-видимому, в крови и имеют вид лимфоидных клеток (Лурия, 1972;
Фриденштейн, Лалыкина, 1973; Хрущов, 1974).
Вторым функциональным типом клеток рыхлой соединительной ткани
являются гистиоциты. Их активная контролирующая и защитная функ-
ции отчетливо обнаруживаются в экспериментальных условиях. При вве-
дении в подкожную соединительную ткань витальных красителей уже
через несколько минут удается наблюдать избирательное накопление
краски в цитоплазме этих клеток. Они играют в данном случае роль
своеобразных, нейтрализующих вредные продукты почек накопления.
Ядра гистиоцитов значительно темнее благодаря большей, чем у фибро-
бластов, конденсации хроматина (рис. 81, в). Цитоплазма содержит мно-
гочисленные вакуоли и имеет пенистую структуру. Помимо накопления
коллоидных красителей, гистиоциты при их стимуляции способны
к весьма активному фагоцитозу. В этих условиях происходит активиза-
ция их метаболического аппарата и в цитоплазме формируется большое
количество лизосом. Количество гистиоцитов может возрастать за счет
их способности к митотическому делению. Кроме того, количество актив-
ных макрофагов в соединительной ткани может увеличиваться и за счет
превращения в них моноцитов и даже лимфоцитов крови. Гистиоциты
характеризуются относительно высоким уровнем белкового и нуклеино-
вого обменов. Скорость обновления этой популяции клеток выше, чем
скорость обновления фибробластов в два-три раза.
Весьма своеобразным типом дифференцированных клеток рыхлой со-
единительной ткани позвоночных животных являются так называемые
тучные клетки. Эти клетки у млекопитающих достаточно четко выде-
ляются даже на уровне светового микроскопа благодаря тому, что их
цитоплазма заполнена крупными базофильными гранулами (рис. 81, б).
Детальный морфологический и цитохимический анализ тучных клеток
показал, что гранулы в цитоплазме неоднородны. Наряду с гранулами
с гомогенным содержимым имеются гранулы со сложной внутренней
структурой. В цитоплазме зрелых тучных клеток слабо развиты орга-
ноиды и мембранные структуры. Общий объем межгранулярных про-
слоек цитоплазмы незначителен. В ядре отсутствует ядрышко, что яв-
ляется прямым морфологическим показателем низкой метаболической
активности этих клеток. По авторадиографическим и биохимическим
данным, тучные клетки характеризуются весьма низким уровнем обмена
РНК и белка (Хрущов, 1969). В состав гранул входят сульфатированные
мукополисахариды, гепарин и основные белки. Кроме того, здесь име-
ются гистамин, а, возможно, также и небольшое количество хондроитин-
сульфатов (А и С) и глюкуроновой кислоты. Несмотря на такой сложный
182
химический состав имеющихся в клетке включений, большинство их
в зрелой клетке почти не обновляется. Резко избирательное включение
меченых соединений обнаруживается только в отношении 35S сульфата
натрия и предшественников синтеза гистамина. Однако и это включение
связано, по-видимому, не с синтезом гистамина или гепарина, а отра-
жает скорее своеобразную химическую адсорбцию.
Тучные клетки участвуют в трофической и защитной функции рых-
лой соединительной ткани, однако их конкретное функциональное
значение требует дальнейшего анализа. Сложный химический состав гра-
нул, а также реактивные изменения системы тучных клеток при воспа-
лительных, иммунных, аллергических и других процессах свидетельст-
вуют об их полифункциональности. Большое распространение в послед-
нее время получило представление о том, что регуляция обмена в рыхлой
соединительной ткани тучными клетками осуществляется путем связы-
вания и выведения соединений, синтезируемых в других клетках. В ча-
стности, показано, что таким путем осуществляется регуляция синтеза
мукополисахаридов и их сульфатации. Несомненно, существенную роль
в развертывающихся в рыхлой соединительной ткани процессах играют
содержащиеся в гранулах вещества, освобождающиеся при разрушении
или дегрануляции тучных клеток. Помимо накопления соединений, син-
тезируемых другими клетками, часть специфических включений тучных
клеток синтезируется метаболическим аппаратом этих клеток, однако не
в зрелом дифференцированном их состоянии, а на ранних этапах цито-
дифференциации.
Дифференцированные тучные клетки размножаются крайне редко.
Это проявляется и в очень низком митотическом индексе и индексе ме-
ченных 3Н-тимидином ядер на ранних сроках после его инъекции. На
основании этих фактов некоторые авторы (Blenkinsopp, 1967) приходят
к выводу о крайне медленном обновлении популяции тучных клеток.
Полное их обновление у мышей по расчетам должно занимать 9—18 ме-
сяцев. Однако эти расчеты справедливы лишь при условии гистогене-
тической автономии популяции тучных клеток, т. е. если считать ее
самоподдерживающейся медленно обновляющейся частной клеточной си-
стемой.
Предполагают, что основным источником увеличения количества туч-
ных клеток является не их размножение, а развитие из недифференциро-
ванных клеток. Особенно же убедительными опытами, подтверждаю-
щими эту точку зрения, являются опыты с культивированием суспен-
зий клеток из различных источников на фибробластическом слое.
В этих условиях удалось наблюдать дифференцировку тучных клеток
в суспензиях лимфоцитов тимуса и клеток селезенки. Таким образом,
одним из основных источников формирования тучных клеток являются,
по-видимому, лимфоидные элементы. Более подробная характеристика
этой весьма своеобразной разновидности клеток рыхлой соединительной
ткани содержится в специальных обзорах (см., например: Виноградов,
Воробьева, 1973).
Широкое распространение в рыхлой соединительной ткани имеют
также жировые клетки. Во многих местах, особенно под кожей, они
являются преобладающим клеточным элементом и образуют жировую
ткань. Последняя у млекопитающих представлена двумя разновидно-
стями — бурой и обычной жировой тканью. Первая разновидность со-
стоит из клеток с жировыми включениями в виде мелких вакуолей, за-
полняющих всю цитоплазму клеток. Ядра в таких клетках занимают
центральное положение. В обычной, более широко распространенной
жировой ткани ядра и вся активная цитоплазма занимают перифериче-
ское положение. В центральной части клетки располагается одна или
несколько крупных, заполненных жиром вакуолей. Жировые включения
в клетках жировой ткани представляют собой не пассивный запасной
183
материал, а непрерывно обменивающийся субстрат. В нормальных усло-
виях процессы утилизации жировых включений и их синтеза находятся
в динамическом равновесии. Жировые клетки являются, по-видимому,
относительно малодифференцированными элементами. При патологиче-
ских условиях они способны быстро освобождаться от заполняющих их
жировых включений и претерпевать прогрессивные изменения, превра-
щаясь в фибробластические клеточные элементы.
Помимо этих основных и вспомогательных клеточных элементов
в рыхлой соединительной ткани постоянно присутствуют мигрирующие
из крови различные разновидности зернистых и незернистых лейкоцитов,
что связано с тесным структурным и функциональным взаимодействием
между кровью и рыхлой соединительной тканью. Весьма важную роль
в защитной функции рыхлой соединительной ткани играют и плазматиче-
ские клетки, и эффекторные клетки трансплантационного иммунитета.
Однако они органически входят в состав лимфоидной ткани, на характе-
ристике которой мы остановимся в специальном разделе настоящей главы.
У разных позвоночных рыхлая соединительная ткань имеет в прин-
ципе сходное строение. В ней всегда обнаруживаются основные типы кле-
ток: клетки фибробластического ряда и гистиоциты. Межклеточное веще-
ство представлено волокнистыми структурами и основным аморфным ве-
ществом. Тем не менее у представителей различных классов и в пределах
одного класса и более мелких систематических групп наблюдаются спе-
цифические особенности. Они касаются прежде всего соотношения клеток
и межклеточного вещества. У млекопитающих, птиц и акуловых рыб рых-
лая соединительная ткань богата клеточными элементами, наоборот, у ко-
стистых рыб и амфибий количество их значительно меньше. Существен-
ные различия, даже в пределах класса, могут наблюдаться в соотноше-
нии недифференцированных, интенсивно функционирующих и зрелых
клеток фибробластического ряда. Так, например, у грызунов различия
между клеточными элементами этого ряда незначительны, в то время как
у хищников удается четко разграничить камбиальные клетки, фибробла-
сты и фиброциты и по их морфологическим особенностям, и по топогра-
фическому распределению в соединительной ткани. Сильно варьирует
у различных представителей позвоночных и количество тучных клеток.
Они могут полностью отсутствовать или, наоборот, наблюдаются в отно-
сительно большом количестве. Кроме того, тучные клетки млекопитаю-
щих, по-видимому, не идентичны тучным клеткам других позвоночных,
и в частности амфибий. У последних не наблюдается характерных для
млекопитающих существенных отличий между тучными клетками соеди-
нительной ткани и базофильными зернистыми лейкоцитами крови.
Однако все эти сравнительно-гистологические данные в отношении
рыхлой соединительной ткани позвоночных животных получены в основ-
ном старыми классическими методами. Имеющиеся единичные современ-
ные работы по изучению рыхлой соединительной ткани низших позво-
ночных носят отрывочный, частный характер. Это не позволяет в настоя-
щее время дать достаточно полную характеристику модификаций рыхлой
соединительной ткани в пределах различных классов позвоночных живот-
ных. Такая характеристика усложняется еще и большим разнообразием
рыхлой соединительной ткани в различных органах даже у одного и
того же животного.
КРОВЬ
Кровь позвоночных животных состоит из плазмы и форменных эле-
ментов. В плазме крови у млекопитающих и человека содержится 90—
93% воды и лишь 7—10% минеральных и органических соединений. Из
них около 7% приходится на долю белков, а 3% на другие органические
и минеральные соединения. Белковые вещества представлены сывороточ-
184
ным альбумином (4%), сывороточным глобулином (2.8%) и фибриноге-
ном (0.4%). Кроме белков в плазме постоянно содержатся аминокислоты,
жиры, глюкоза, минеральные соли и различные продукты обмена. Часть
характерных белковых компонентов плазмы крови синтезируется пече-
ночными клетками. Поэтому плазму крови можно рассматривать как меж-
клеточное вещество крови в значительной мере условно, поскольку опа
резко отличается по своему происхождению от обычных межклеточных
структур тканей внутренней среды.
Форменные элементы крови у позвоночных животных представлены
разнообразными клеточными элементами. Степень разнообразия варьирует
в пределах отдельных классов и даже более мелких систематических
групп.
Наиболее сложным и дифференцированным составом форменных эле-
ментов крови обладают млекопитающие. Форменные элементы крови
Рис. 82. Эритроциты позвоночных.
1 — протей, 2 — скат, 3 — минога, 4 — саламандра, 5 — лягушка, 6 — черепаха, 7 — воробей»
8 — слон, 9 — человек, 10 — коза, 11 — мускусная крыса, 12 — лама.
у них можно прежде всего разделить на две большие группы: а) узкоспе-
циализированные, не способные к каким-либо видоизменениям, формен-
ные элементы и б) клеточные элементы в большей или меньшей степени
способные к изменениям своей морфобиохимической организации. К пер-
вой группе относятся эритроциты, кровяные пластинки и зернистые лей-
коциты. Вторую группу составляют незернистые лейкоциты (большие,
средние и малые лимфоциты и моноциты). Следует, однако, отметить,
что в настоящеее время мы еще недостаточно ясно представляем себе
биологическое значение весьма интересной группы малых лимфоцитов.
Возможно, что значительную часть этой гетерогенной популяции клеточ-
ных элементов следует также отнести в группу узкоспециализированных
клеток крови.
Другая более распространенная и общепринятая классификация фор-
менных элементов крови млекопитающих подразделяет их на эритроциты,
кровяные пластинки и лейкоциты. Последние делятся уже на зернистые
и незернистые лейкоциты.
Эритроциты млекопитающих представляют собой узкоспециализиро-
ванные элементы, утрачивающие в процессе своей специализации такой
важный компонент клеточной организации, как ядро. Они имеют форму
двояковогнутых дисков, размеры которых колеблются в относительно не-
больших пределах (рис. 82). Такая форма эритроцитов обеспечивает зна-
чительное увеличение их поверхности. 60% содержимого эритроцита при-
ходится на долю воды. Основным же органическим соединением (90%)
является гемоглобин. Молекула гемоглобина человека состоит из че-
тырех мономеров. Каждый мономер включает в себя простетическую
185
группу в виде гема, в центре которой находится атом железа. Каждый
гем в молекуле окружен цепью белка глобина с закономерным трехмер-
ным распределением ее в пространстве вокруг гема. Все четыре мономера
связаны между собой и компактно упакованы в молекуле. В эритроцитах
взрослого человека в молекулах гемоглобина имеется два типа глобинов,
отличающихся друг от друга и по аминокислотному составу, и по после-
довательности расположения аминокислот в полипептидной цепи. В каж-
дой молекуле два мономера образованы так называемыми a-цепями, а два —
p-цепями глобинов. В эритроцитах эмбрионов вместо P-цепей имеются
у-цепи глобинов.
Основное значение гемоглобина заключается в переносе кислорода
от легких к тканям. Это оказывается возможным благодаря способности
железа в той внутримолекулярной ситуации, которая создается белковыми
цепями глобинов в молекуле гемоглобина, образовывать особые непроч-
ные связи с молекулой кислорода. При высокой концентрации последнего,
что имеет место в тканях легких, происходит присоединение 4 молекул
кислорода к 4 атомам железа в молекуле гемоглобина. При низкой кон-
центрации кислорода в окружающих тканях связи между железом и
кислородом легко нарушаются и кислород покидает молекулу гемоглобина.
Показано, что такая работа молекулы гемоглобина значительно лучше
осуществляется целой 4-мономерной системой, чем ее отдельными моно-
мерами. Помимо переноса кислорода молекула гемоглобина обладает спо-
собностью к переносу СО2.
Имеется тесная связь между структурой молекул гемоглобина и фор-
мой эритроцитов. При замене в результате мутаций лишь одного амино-
кислотного остатка в цепи глобинов, что наблюдается, например, при сер-
повидной анемии, резко меняется нормальная форма эритроцитов.
Эритроциты млекопитающих и особенно других классов позвоночных
животных изучены в настоящее время значительно менее подробно, чем
у человека. Безъядерные эритроциты имеются только у взрослых млеко-
питающих. У представителей всех остальных классов позвоночных в зре-
лых эритроцитах, как правило, имеются ядра, однако они содержат сильно
конденсированный хроматин и, по-видимому, полностью инактивированы
в функциональном отношении. Однако эти изменения в ядерном
аппарате обратимы, поскольку в экспериментальных условиях при пере-
садке таких ядер в другие клетки в них появляется ядрышко и обнару-
живается синтез рибонуклеиновой кислоты.
Наряду с этим у таких весьма древних реликтовых форм, как минога,
в крови среди обычных эритроцитов удается обнаружить и безъядерные
клетки. Значительный процент безъядерных эритроцитов можно наблю-
дать у бесхвостых амфибий в условиях хронических опытов с кислород-
ным голоданием. Таким образом, тенденция к утрате ядер является, по-ви-
димому, общей эволюционной тенденцией данного типа клеточной диф-
ференцировки.
Эритроциты позвоночных животных отличаются и по размерам, и по
форме. Как правило, более мелкие клетки свойственны животным с высо-
ким уровнем тканевого метаболизма. В молекулах гемоглобина постоян-
ной для всех позвоночных является простетическая группа гема. Амино-
кислотный состав и последовательность аминокислот в глобинах, коли-
чество мономеров в молекуле гемоглобина, а также их молекулярный вес
варьируют в широких пределах у представителей разных систематических
групп позвоночных животных.
Кровяные пластинки млекопитающих и тромбоциты других позвоноч-
ных представляют собой второй тип узкоспециализированных форменных
элементов крови. Они отсутствуют лишь у круглоротых. По своему внеш-
нему виду, размерам и форме тромбоциты позвоночных напоминают ядер-
ные эритроциты, принципиально отличаясь от них лишь полным отсут-
ствием гемоглобина. Они имеют, по-видимому, и общий с эритроцитами
186
источник развития в филогенезе, поскольку образуются в тех же участ-
ках кроветворной ткани, где и эритроциты. Первичным и основным свой-
ством тромбоцитов является у всех позвоночных способность их к агглю-
тинации. Они играют существенную роль в процессах свертывания крови.
Биологическое значение этого процесса, в котором принимают участие
белок плазмы крови — фибриноген и целый ряд ферментативных систем
и белковых факторов, заключается в предотвращении больших кровопо-
терь при повреждениях сосудистой системы. Процессы свертывания крови
в настоящее время изучены особенно детально у млекопитающих и че-
ловека. В них принимают непосредственное участие кровяные пластинки,
аналогичные по своему функциональному значению и происхождению
тромбоцитам остальных позвоночных животных. Кровяные пластинки
представляют собой весьма мелкие, варьи-
рующие по своей форме и размерам, сво-
бодно циркулирующие в крови участки цито-
плазмы особых гигантских полиплоидных
клеток мегакариоцитов. Диаметр кровяной
пластинки обычно в четыре раза меньше
диаметра эритроцита. В цитоплазме кровя-
ных пластинок имеются ограниченные мем-
гранулы, заполненные электронно-
плотным содержимым, и светлые вакуоли
(рис. 83). Иногда здесь обнаруживаются
Рис. 83. Схема ультраструктурной организации
кровяной пластинки (По электронной микрофото-
графии: Rodman et al., 1963; рис. М. Ю. Пунина).
J— а-гранулы, 2 — [3-гранулы, 3 — т-гранулы,
4 — 5-гранулы.
единичные митохондрии и рибосомы. Непосредственно под плазматиче-
ской мембраной в кровяных пластинках располагается система микротру-
бочек и микрофиламентов — опорно-сократимого аппарата примембранной
части гиалоплазмы. Кровяные пластинки имеют относительно непродол-
жительный жизненный цикл, не превышающий 4—10 дней. В зависи-
мости от стадии жизненного цикла различают юные, зрелые, старые и
дегенеративные формы кровяных пластинок. Каждая из разновидностей
характеризуется структурными и цитохимическими особенностями. В па-
тологических условиях появляется особая форма гигантских кровяных
пластинок, в два-три раза превышающих их нормальные размеры.
Кровяные пластинки обладают ярко выраженной способностью при
нарушениях сосудистой стенки к слипанию, агглютинации — образованию
временных, не очень прочных закупорок сосудов, так называемых белых
тромбов. Их участие в процессах свертывания крови заключается в том,
что они содержат ряд белковых факторов, освобождение которых необхо-
димо для развертывания сложной многоступенчатой реакции превраще-
ния фибриногена в фибрин. После образования рыхлого фибринового
сгустка его дальнейшее уплотнение и организация происходят лишь при
непосредственном контакте фибриновых нитей с кровяными пластинками.
В последнее время удалось показать, что помимо белковых факторов свер-
тывания крови в кровяных пластинках имеется две разновидности фиб-
риногена: адсорбированный на поверхности пластинок плазменный фиб-
риноген и фибриноген, заключенный в гранулах (см. обзор: Билуди, Ши-
ряев, 1974).
Ультраструктурный анализ изменений кровяных пластинок при обра-
зовании тромбов показал, что на первых этапах этого процесса происхо-
дит их агглютинация,, при этом наблюдается концентрация гранул и ва-
187
куолей в центре пластинок (Rodman et al., 1963). Далее кровяные пла-
стинки начинают образовывать отростки и содержимое гранул выходит
в окружающую среду. Наконец, на заключительных этапах тромбогенеза
после образования фибринового сгустка, имеет место разрушение и рас-
Рис. 84. Схема изменения кровяных пластинок при свертываниия крови. (По элек-
тронным микрофотографиям: Rodman et al., 1963; рис. М. Ю. Пунина).
а—г — последовательные стадии изменения кровяных пластинок, ф —фибрин. Остальные обозна-
чения те же, что и на рис. 83.
пад кровяных пластинок (рис. 84). Считается, что именно в этот момент
они выделяют особый сократимый белок тромбостепип, который и обус-
ловливает уплотнепие фибринового сгустка. В настоящее время получены
данные о том, что тромбостепип обладает сходными свойствами с актином
и миозином — универсальными сократимыми белками.
Зернистые лейкоциты, или гранулоциты, представляют собой третью
разновидность узкоспециализированных клеток крови. Они гетерогепны
и в морфологическом и в функциональном отношении, у человека явля-
188
ются наиболее многочисленной группой лейкоцитов крови (80% всех лей-
коцитов). Гранулоциты у позвоночных животных — пластичная, изменчи-
вая в филогенезе группа клеточных элементов крови. Даже в пределах
высших позвоночных, млекопитающих и птиц, количество их разновид-
ностей может варьировать у отдельных видов животных. Сходные по сво-
ему функциональному значению клетки могут существенно отличаться по
своей морфологической характеристике. Еще в большей степени такая
вариабельность характерна для низших позвоночных. Так, среди кости-
стых рыб известны виды, у которых вообще нет зернистых лейкоцитов,
с другой стороны, у близкородственных видов они могут быть представ-
лены несколькими клеточными формами.
У человека имеются три типа зернистых лейкоцитов: нейтрофильные,
эозинофильные и базофильные лейкоциты. Общей их особенностью явля-
Рис. 85. Гранулоциты млекопитающих. (Рис. М. 10. Пунина).
а — нейротрофильный лейкоцит человека, б — эозинофильный лейкоцит крысы, в — базофильный
лейкоцит морской свинки.
ется наличие зернистости в цитоплазме и сегментовидных или лопастных
ядер у зрелых форм (рис. 85). Последняя особенность связана со спо-
собностью их активно мигрировать через стенку сосудов.
Наиболее многочисленной группой зернистых лейкоцитов являются
нейтрофильные лейкоциты. Они у человека составляют 60—70% от об-
щего количества лейкоцитов крови. Нейтрофилы имеют 10—12 мкм в диа-
метре, ядра у зрелых дифференцированных клеток состоят из 4—5 лопа-
стей или сегментов. Ядрышки отсутствуют и ядра, по-видимому, обладают
очень слабой синтетической и информационной активностью. В цито-
плазме зрелых циркулирующих в крови нейтрофилов содержится неболь-
шое количество митохондрий, элементы аппарата Гольджи и эндоплаз-
матической сети везикулярного типа. Наиболее характерной структурой
цитоплазмы являются многочисленные, варьирующие по своим разме-
рам, окруженные мембраной гранулы, наполненные электронпоплотпым
содержимым. Анализ динамики формирования этих гранул при созрева-
нии гранулоцитов показывает, что их белковый компонент формируется
на рибосомах эндоплазматической сети, а окончательное оформление
структур происходит в области аппарата Гольджи (Bainton, Farquhar.
1966). Часть гранул содержит протеолитические ферменты. Опи представ-
ляют собой типичные лизосомы. Гипертрофия лизосомного аппарата ней-
трофилов обусловливается их функциональным значением в тканях внут-
ренней среды как весьма активных бактериальных микрофагов. Размеры
и отношение к красителям гранул нейтрофилов варьируют у разных видов
животных. Так, у кролика в отличие от человека они имеют резко выра-
женное сродство к кислым красителям. Аналогичные нейтрофилы с окси-
189
фильными гранулами имеются у многих птиц и у некоторых предста-
вителей других классов позвоночных животных. При активном поглоще-
нии микрофагами путем фагоцитоза бактерий, как правило, наблюдается
образование пищеварительных вакуолей, активизация латентных форм
ферментов, заключенных в гранулах, и переваривание чужеродных орга-
низмов. Активизация гидролитических ферментов может происходить и
при разрушении клеток, что часто наблюдается на ранних этапах разви-
тия воспалительной реакции в пораженных участках соединительной
ткани.
Вторая разновидность гранулоцитов в крови человека представлена
эозинофилами, составляющими в количественном отношении всего 3%
от всех лейкоцитов. Они значительно крупнее нейтрофилов и имеют диа-
метр около 15 мкм и двулопастные ядра. Наиболее характерным компо-
нентом цитоплазмы являются относительно крупные эозинофильные гра-
нулы. У некоторых млекопитающих в центре гранулы имеется палочко-
видная электронноплотная масса, окруженная по периферии более
светлым содержимым. От цитоплазмы гранула отделена мембраной (Bain-
ton, Farquhar, 1970).
Функциональное значение эозинофилов даже у человека выяснено
еще недостаточно полно. Показана корреляция между количеством эози-
нофилов и аллергией, повышенной чувствительностью к некоторым анти-
генам у отдельных индивидуумов. Такую корреляцию связывают с обна-
руженными в эозинофилах гистамином и гистаминоподобными вещест-
вами. С другой стороны, в последнее время установлено, что эозинофилы
содержат вещества, необходимые для стимуляции фагоцитарной деятель-
ности макрофагов и формирования у них лизосом.
Третий тип гранулоцитов крови человека — базофильные лейкоциты —
составляет всего 0.5% от общего количества лейкоцитов. У других млеко-
питающих, например у мышей и кроликов, количество их может дости-
гать 8—10%. Обнаружена обратно пропорциональная зависимость между
количеством базофильных лейкоцитов в крови и тучных клеток в соеди-
нительной ткани. Возможно, что такая зависимость имеет функциональ-
ные причины и отражает сходное биологическое значение этих типов кле-
ток в системе тканей внутренней среды. На это же указывает и сходная
ультраструктурная организация гранул в тучных клетках и базофильных
лейкоцитах, а также сходное отношение к некоторым красителям. Наряду
с этим и в деталях ультраструктурной организации и по химическому
составу гранулы тучных клеток и базофильных лейкоцитов обнару-
живают ряд существенных различий. Это отражает, очевидно, неиден-
тичность рассматриваемых типов клеток. У бесхвостых амфибий наблю-
даются другие отношения. Их базофильные лейкоциты, мигрируя в со-
единительную ткань, могут прямо превращаться в оседлые тучные клетки,
и резких различий между этими клеточными формами обнаружить не
удается. У рыб базофильные лейкоциты, за редким исключением, как пра-
вило, отсутствуют. У птиц и рептилий они, возможно, имеют другое, чем
у амфибий и млекопитающих, биологическое значение.
Конкретное функциональное значение базофильных лейкоцитов даже
у млекопитающих и человека в значительной мере неясно. Отмечено их
активное участие в аллергических реакциях, что связывают с возможным
наличием в гранулах гистамина.
Лимфоциты у человека и млекопитающих представляют собой вторую
по количеству группу лейкоцитов после нейтрофильных лейкоцитов.
В крови человека их содержится 20—25% от общего количества лейко-
цитов. В тканях внутренней среды млекопитающих выделяют большие,
средние и малые лимфоциты. Наиболее многочисленные малые лимфо-
циты имеют диаметр около 7—7.5 мкм и характеризуются сильно пикно-
тизированным округлым ядром с небольшим ободком цитоплазмы, от-
носительно бедной органоидами.
190
Большие лимфоциты имеют диаметр порядка 10—12 мкм. Ядра часто
слегка бобовидной формы, хорошо заметны ядрышки; хроматин менее
конденсирован, чем у малых лимфоцитов. Относительное количество ци-
топлазмы и органоидов в ней больше, чем у малых лимфоцитов. Средние
лимфоциты занимают промежуточное положение по своим размерам и
другим признакам между большими и малыми лимфоцитами.
Лимфоциты имеются в крови всех позвоночных животных, функцио-
нальное значение этой разновидности клеточных элементов весьма много-
образно.
Такое разнообразие функций лимфоцитов обусловливается далеко захо-
дящей у высших позвоночных и человека дивергентной дифференциров-
кой этой разновидности клеток крови, хотя она и не сопровождается
морфологическими признаками. Значительная часть лимфоцитов крови
Рис. 86. Кровь человека.
(Рис. М. Ю. Пунина).
а — окрашенный мазок крови, б — схема ультраструктурной организации моноцита. 1 — эритроцит,
2 — моноцит, 3 — лизосомы, 4 — аппарат Гольджи.
относится к лимфоидной системе. Иммунокомпетентные лимфоциты лим-
фоидной системы гетерогенны, поскольку здесь имеются и костномозго-
вые лимфоциты (К-лимфоциты), и тимические лимфоциты (Т-лимфо-
циты), и так называемые антигенреактивные клетки памяти. Каждая из
этих разновидностей лимфоцитов характеризуется особыми биологичес-
кими свойствами, и в частности специфической морфобиохимической ор-
ганизацией плазматической мембраны. Более подробная их характери-
стика будет дана ниже.
Другие субпопуляции лимфоидных клеток являются, по-видимому,
циркулирующими в крови малодифференцированными элементами, спо-
собными превращаться в макрофаги и тучные клетки рыхлой соединитель-
ной ткани. Возможно, что среди этих циркулирующих лимфоидных кле-
ток имеется особая субпопуляции клеток, способных давать скелетоген-
ные и фибробластические клеточные элементы. Часть малых лимфоцитов
представляет собой, по-видимому, и узкоспециализированные клетки с ко-
ротким жизненным циклом. Они являются своеобразными трофоцитами,
так как продукты их разрушения используются для синтеза белков и ну-
клеиновых кислот в тканях, характеризующихся интенсивной репродук-
цией клеток.
В настоящее время пет еще ясности, в какой мере все эти разнообраз-
ные функции осуществляются разными субпопуляциями лимфоцитов и
в какой мере направление их дифференцировки определяется местными
факторами. Известно лишь, что около 95% циркулирующих в крови лим-
фоцитов представлено короткоживущими лимфоцитами, продолжитель-
ность жизни которых не превышает нескольких суток. Среди немногочис-
191
лепных длительно существующих лимфоцитов имеется, по-видимому,
крайне незначительное количество клеток, обладающих свойствами по-
липотентных камбиальных клеток.
Последнюю разновидность форменных элементов крови составляют мо-
ноциты (Nichols et al., 1971). В крови человека это относительно крупные
клетки, имеющие диаметр от 12 до 15 мкм с относительно большим коли-
чеством слабооксифильной цитоплазмы и варьирующим по своей форме
ядром (рис. 86). Основная часть цитоплазмы моноцитов свободна от огра-
ниченных мембраной гранул. Однако в области аппарата Гольджи зрелых
дифференцированных моноцитов содержатся небольшие скопления пер-
вичных лизосом.
Моноциты относятся по своей функции к системе макрофагов тканей
внутренней среды. Они являются активными фагоцитами и способны фор-
мировать при фагоцитозе мощный лизосомный аппарат. Кроме того, им
приписывают также роль в синтезе некоторых белковых компонентов
плазмы крови (см. обзор: Cohn, 1968).
КРОВЕТВОРЕНИЕ
Форменные элементы крови у взрослых млекопитающих и человека
в нормальных условиях развиваются в специальном рассредоточенном по
всему организму кроветворном органе — красном костном мозге. Послед-
ний находится в костях, преимущественно в их губчатом веществе. Ос-
Рис. 87. Схема взаимоотношений ретикулярных клеток и ретикулиновых волокон.
(Из: Елисеев и др., 1972).
1 — ядро, 2 — клеточные отростки, 3 — ретикулиновые волокна, 4 — митохондрии, 5 — шерохова-
тая эндоплазматическая сеть.
нову красного костного мозга составляет ретикулярная ткань. Она обра-
зована отростчатыми контактирующими между собой ретикулярными
клетками и ретикулиновыми волокнами, имеющими сходную с коллаге-
новыми волокнами молекулярную организацию. В нормальных условиях
между клетками и ретикулиновыми волокнами имеются весьма теспые
взаимоотношения. Волокна оказываются как бы «погруженными» внутрь
цитоплазмы клеток (рис. 87). Часть ретикулярных клеток представляет
собой относительно мало дифференцированные клеточные элементы. Они
способны терять связь с ретикулиновыми волокнами и превращаться в ок-
руглые подвижные малодифференцированные клетки, так называемые
бласты, или гемоцитобласты. Кроме того, они могут проявлять активную
фагоцитарную способность. За счет синтеза ретикулярными клетками
коллагеновых белков образуются ретикулиновые волокна. Возможно, что
192
клетки способны синтезировать и особое межклеточное студенистое ве-
щество преимущественно мукополисахаридной природы, которое запол-
няет все промежутки ретикулярной ткани.
Вторым не менее важным компонентом красного костного мозга яв-
ляется -система кровеносных сосудов, и в частности синусоиды, представ-
ляющие собой специализированные капилляры. Основное их отличие от
обычных капилляров заключается в относительно большом диаметре и
наличии многочисленных пор, обеспечивающих проникновение зрелых
форменных элементов крови в сосудистое русло.
Наконец, третьим компонентом красного костного мозга являются кам-
биальные, так называемые стволовые и полустволовые клеточные эле-
менты и форменные элементы крови на разных стадиях их созревания.
Рис. 88. ^Красный костный мозг кролика.
1 — кость, 2 — миелоидная ткань, 3 — жировые клетки.
Эти клетки обусловливают весьма сложную и гетерогенную в смысле
клеточного состава картину миелоидной кроветворной ткани (рис. 88).
В красном костном мозге постоянно встречаются отдельные жировые
клетки. Кроме того, с возрастом может происходить метаплазия части
миелоидной ткани в жировую ткань. При хронических кровопотерях, на-
оборот, жировая ткань костного мозга может замещаться миелоидной кро-
ветворной тканью.
В миелоидной ткани красного костного мозга образуются эритроциты,
кровяные пластинки, все гранулоциты и, по-видимому, все моноциты
крови. Стволовые клетки красного костного мозга дают начало и всем
разновидностям лимфоцитов. Об интенсивности процессов формирования
эритроцитов, кровяных пластинок и гранулоцитов свидетельствуют дан-
ные по продолжительности их жизни в крови и по количеству в 1 мл.
Так, продолжительность жизни эритроцитов 140 дней, а их количество
4.5—5 млн на миллилитр. Нейтрофилы и кровяные пластинки циркули-
руют в крови у человека около недели, а количество их соответственно
6—8 тыс. и 200—300 тыс. в 1 мл.
Естественно, что для поддержания относительного постоянства коли-
чественного состава форменных элементов крови необходимо их непре-
рывное воспроизводство. Таким образом, миелоидная ткань представляет
13 А. А. Заварзин
193
собой весьма энергично работающую и сложно организованную камбиаль-
ную систему крови.
Внешним проявлением сложности организации этой системы является
обилие в ней клеток, находящихся на разных стадиях специфической
дифференциации в различных направлениях. При этом характерной осо-
бенностью процессов миелоидного кроветворения является длительное
сосуществование специфической дифференциации клеток и их репродук-
ции. Благодаря этому при вступлении на путь специфической дифферен-
цировки одной камбиальной клетки образуется не одна дифференциро-
ванная клетка, а целый клон клеток — порядка нескольких сотен клеточ-
ных элементов. В процессе прохождения митотического цикла и митоза
вступившие на путь диференцировки клеточные элементы крови не утра-
чивают, как это обычно происходит с делящимися клетками, достигнутого
ими уровня дифференцировки.
Общим источником развития различных форменных элементов крови
является система малодифференцированных клеток. Она, как будет по-
казано ниже, неоднородна по свойствам составляющих ее клеток. Однако
они не имеют морфологических различий и носят название гемоцитобла-
стов. По внешнему виду гемоцитобласты представляют собой крупные
клетки с относительно слабо конденсированным хроматином в ядре и хо-
рошо выраженным ядрышковым аппаратом. Гемоцитобласты характери-
зуются отсутствием в цитоплазме каких-либо специальных органоидов и
включений, а также умеренным развитием общих клеточных орга-
ноидов.
Из таких клеток в результате активизации специфических локусов
их генома, путем постепенно прогрессирующей специализации в сочета-
нии с энергичным их размножением образуются и безъядерные эритро-
циты и три типа узкоспециализированных гранулоцитов крови, а также
лимфоциты и моноциты.
Естественно, что в случае развития продуктов размножения камбиаль-
ных клеток в направлении эритроцитов наиболее характерным процессом
является синтез клеткой глобина и гема и формирование из них сложных
тетрамерных у млекопитающих молекул гемоглобина.
Синтез глобинов происходит па свободных рибосомах клеток эритро-
идного ряда. По мере прогрессирующего в ходе дифференцировки накоп-
ления гемоглобина меняется морфология и размеры клеток. По этому
признаку в гематологии различают ряд характерных последовательных
стадий эритропоэза: стадии проэритробласта, базофильного, полихромато-
фильного и эозинофильного эритробластов, нормобласта и ретикулоцита.
Все промежуточные стадии до нормобласта пе утрачивают способности
к делению, и количество клеток возрастает в геометрической прогрес-
сии. Тем не менее прогрессирующее накопление гемоглобина кор-
релирует с постепенной инактивацией ядерного аппарата. Внешним вы-
ражением этого процесса является конденсация хроматина в интерфазных
ядрах. Этот процесс приводит в конце концов к пикнотизации ядра и
элиминации его из клеток путем сложного и неясного еще в деталях ак-
тивного процесса. После элиминации из клеток ядер образуются уже мо-
лодые эритроциты, так называемые ретикулоциты, которые поступают
в кровяное русло. Они еще способны примерно в течение недели синте-
зировать в ограниченных пределах молекулы гемоглобина за счет остат-
ков белоксинтезирующего аппарата и длительно живущих информацион-
ных РНК.
Серьезную и не разрешенную до конца проблему представляет вопрос
о механизмах поступления зрелых эритроцитов в кровяное русло. Одним
из наиболее остроумных предположений является представление о том,
что при переходе нормобластов в ретикулоциты плазматическая мемб-
рана последних приобретает способность разжижать или гидролизовать
гипотетическое аморфное вещество, составляющее основу миелоидной
194
ткани. При растворении этого вещества зрелые ретикулоциты проникают
через поры синусоидов в сосудистое русло (Weiss, 1966).
Сходные по существу изменения происходят при дифференцировке
продуктов размножения гемоцитобластов в направлении нейтрофильных,
эозинофильных и базофильных лейкоцитов. Для каждого из этих направ-
лений дифференцировки также известен ряд переходных последовательных
стадий, обозначаемых специальными терминами: промиелобласт, метамие-
лобласт, миелобласт, миелоцит (соответственно эозинофильный, базофиль-
ный или нейтрофильный). Естественно, что в случае развития нейтро-
фильных лейкоцитов наиболее важным специфическим процессом является
синтез гидролитических ферментов и формирование мощного лизосомного
аппарата. В формировании его наиболее активное участие принимают
шероховатая эндоплазматическая сеть и аппарат Гольджи. При развитии
эозинофильных и базофильных лейкоцитов активизируются, очевидно,
другие локусы генома, ответственные за информацию о синтезе веществ,
составляющих основу соответствующих гранул в цитоплазме этих клеток.
Параллельно с накоплением специфических продуктов в цитоплазме гра-
нулоцитов происходит изменение формы и прогрессирующая инактивация
ядерного аппарата. Однако, так же как и при эритропоэзе, клетки сохра-
няют способность к делению до конечных этапов их превращения в зре-
лые гранулоциты. Избирательное поступление последних в сосудистое
русло обеспечивается, по-видимому, строгой корреляцией между степенью
дифференцировки клеток и способностью их к активному направленному
перемещению. Такую способность приобретают лишь клетки, достигшие
конечных этапов дифференцировки.
Весьма специфическим, возникшим сравнительно недавно и характер-
ным только для кроветворных систем млекопитающих и человека явля-
ется процесс образования кровяных пластинок. Эти форменные элементы
крови развиваются в миелоидной ткани млекопитающих из особых кле-
ток — мегакариоцитов. Последние представляют собой гигантские поли-
плоидные клетки, достигающие плоидности 64с. Они образуются из
обычных гемоцитобластов путем перехода их на митотический цикл с ре-
дуцированными конечными фазами митоза. Благодаря этому клетки и
ядра по завершении каждого цикла не расходятся в виде дочерних
клеток, а образуют одну полиплоидную клетку. При этом ядра у зре-
лых мегакариоцитов могут приобретать весьма причудливую неправиль-
ную лопастную форму. При достижении в результате таких видоизменен-
ных процессов авторепродукции определенной величины плоидности (по-
видимому, порядка 16 или 32с) в цитоплазме мегакариоцитов начинают
обнаруживаться проявления процессов цитодифференциации (Behnke,
1968; Paulus, 1970). Она расчленяется впячиваниями плазматической
мембраны на отдельные участки, каждый из которых соответствует буду-
щей кровяной пластинке. После этого такой созревший округлый мегака-
риоцит резко меняет свою форму, превращаясь в сильно отростчатую
клетку с небольшим перинуклеарным ободком цитоплазмы. Отростки че-
рез поры в синусоидах проникают внутрь кровеносных сосудов и рас-
падаются там на отдельные кровяные пластинки (рис. 89). В настоящее
время остается неясным, способны ли мегакариоциты к нескольким цик-
лам таких изменений или после образования одной генерации кровяных
пластинок они дегенерируют.
Относительно источников и механизмов формирования в миелоидной
ткани красного костного мозга моноцитов и особой популяции костно-
мозговых лимфоцитов в настоящее время имеется еще относительно мало
конкретных обстоятельных исследований. Очевидно, что общие законо-
мерности такого лимфо- и моноцитопоэзов аналогичны закономерностям
грянуло- и эритропоэза. Спецификой этих процессов является лишь менее
богатая картина видимых морфологических проявлений цитодифферен-
циации рассматриваемых типов клеток (Furth, Disselhoffden, 1970).
13*
195.
Рассмотренные выше изменения в клетках эритроидного и миелоид-
ного рядов и своеобразный процесс формирования кровяных пластинок
в миелоидной ткани костного мозга млекопитающих и человека представ-
ляют собой лишь внешние проявления деятельности кроветворной си-
стемы. В основе ее организации лежит весьма совершенная камбиальная
система с тонкой регуляцией в ней процессов репродукции клеток и диф-
ференциации их в нескольких направлениях (см. обзоры: Фриденштейн,
Рис. 89, Мегакариоциты млекопитающих. (Рис. С. А. Быстрова).
а — участок миелоидной ткани с мегакариоцитом, б — рисунок, иллюстрирующий образование
кровяных пластинок из цитоплазмы мегакариоцита в просвете кровеносных синусов красного кост-
ного мозга. 1 — эритроцит, 2 — кровяные пластинки, 3 — клетки эндотелия сосуда, 4 — ядро
мегакариоцита.
Чертков, 1968, 1969). Для понимания внутренних закономерностей орга-
низации этой системы большое значение имеет метод клонирования ство-
ловых камбиальных клеток в условиях in vivo. Оказалось, что при
пересадке костного мозга от здоровых мышей животным, облученным
смертельными дозами ионизирующей радиации, у них происходит не
только восстановление «опустошенной» в результате действия ионизирую-
щей радиации кроветворной системы красного костного мозга, но и в се-
лезенке развиваются дискретные очажки кроветворения, так называемые
кроветворные колонии. К седьмому — десятому дню после трансплантации
костного мозга эти колонии достигают относительно больших размеров и
видимы уже даже невооруженным глазом (рис. 90).
196
Гистологический анализ таких колоний показал, что большинство их
состоит только из одного типа клеточных элементов. При этом максималь-
ное количество, около 40%, составляют эритроидные колонии. Свыше
20% образовано миелоидными (гранулоцитными) и примерно такое же
количество мегакариоцитными колониями. Однотипный клеточный состав
колоний, а также динамика увеличения размеров колоний в селезенке
дали возможность предположить, что каждая колония представляет собой
клон, начало которому дает лишь одна пересаженная стволовая клетка.
Это предположение было подтверждено опытами с пересадкой облученным
животным не нормального костного мозга, а кроветворной ткани, облучен-
Рис. 90. Участки мегакариоцитной (а) и миелоидной (6) колоний в селезенке мышей,
облученных смертельной дозой рентгеновских лучей с последующей трансплантацией
им красного костного мозга здоровых мышей.
ной небольшими дозами рентгеновских лучей. При таком облучении ство-
ловые клетки сохраняли способность к митотическому делению, одпако
у них возникали характерные для каждой клетки нарушения структуры
хромосом, так называемые хромосомные аберрации. Хромосомный анализ
митотически делящихся клеток колоний в селезенке, образующихся при
пересадке такого облученного костного мозга, показал, что все клетки
в одной колонии имеют одну и ту же хромосомную аберрацию, т. е. дей-
ствительно образуются в результате размножения одной исходной родона-
чальпой стволовой клетки. Происхождение колоний из одной клеткп
было подтверждено и в опытах с использованием естественных хромосом-
ных маркеров. Одновременно было показано, что при некоторых условиях
из одной стволовой клетки могут образоваться несколько колоний разного
типа.
Появление у исследователей такой исключительно важной для ана-
лиза процессов кроветворения экспериментальной модели позволило ре-
шить и вопрос о потенциях стволовых камбиальных клеток, и целый ряд
принципиальных вопросов организации всей кроветворной системы у мле-
копитающих и человека. Для решения вопроса о потенциях стволовых
клеток достаточным оказалось произвести пересадку животным, облучен-
197
ным смертельными дозами рентгеновских лучей, одинаковых клонов (ко-
лоний) из селезенки другого животного. Очевидно, что в случае наличия
трех изолированных типов стволовых клеток для каждого из основных
направлений дифференцировки кроветворных клеток у животных в селе-
зенке были бы обнаружены колонии одного типа клеток, идентичных тем
[Рис. 91. Схема кроветворения у млекопитающих. (Рис. 3. А. Зайченко).
А — схема морфологических изменений клеток при дифференцировке, Б — схема репродукции кле-
ток и взаимоотношения фондов стволовых и полустволовых клеток. 1 — гемоцитобласты, 2 — диф-
ференцирующиеся лейкоциты (а — нейтрофильные, б — эозинофильные, в — базофильные), 3 —
мегакариоциты, 4 — эритроидный ряд, 5 — ряды незернистых лейкоцитов (а — лимфоциты, б —
моноциты). ФСКК — фонд стволовых клеток крови, ФПСЗЛ — фонд полустволовых клеток зерни-
стых лейкоцитов, ФПСМег — фонд полустволовых клеток мегакариоцитов, ФПСЭ— фонд полуство-
ловых клеток эритроидного ряда, ФПСЛ — фонд полустволовых клеток лимфоидного ряда,
ФПСМ — фонд полустволовых клеток мопоцитного ряда.
клонам, которые были взяты для трансплантации. Однако результаты
экспериментов оказались иными. Независимо от типа взятых для транс-
плантации клонов в селезенке реципиента по-прежнему развивались три
типа колоний, причем примерно в таких же соотношениях, что и при
пересадке обычного костного мозга. Таким образом, в этих опытах уда-
лось показать, что в основе всей кроветворной миелоидной ткани лежит
система стволовых или родопачальных мультипотептных камбиальных
клеток, способных дифференцироваться и в эритроидные, и в миелоидные,
и в мегакариоцитные клеточные элементы. Каждая кроветворная колония
в селезенке представляет собой миниатюрную упрощенную кроветворную
198
систему, в организации которой, очевидно, должны проявляться законо-
мерности организации и всей миелоидной кроветворной ткани.
В связи с этим в настоящее время проведено тщательное изучение ди-
намики формирования колоний в селезенке, соотношения различных по
уровню дифференциации категорий клеток и в первую очередь динамики
роста численности стволовых, образующих колонии клеток. Изучено
также влияние местных и общих факторов на направление диффе-
ренцировки и ее развертывание в колониях — клонах кроветворных кле-
Б
Рис. 91 (продолжение).
ток. Совокупность нового фактического материала, полученного этим и
другими экспериментальными методами, дала возможность некоторым
исследователям предложить ряд новых более совершенных схем организа-
ции системы кроветворных элементов миелоидной ткани.
В основе организации кроветворной миелоидной ткани, согласно одной
из таких схем (рис. 91), лежит система, или фонд, стволовых камбиальных
мультипотентных клеток крови (ФСКК). Замечательной особенностью
этих клеток является их способность к неограниченному самоподдержа-
нию определенного, относительно постоянного по объему, фонда стволовых
клеток. При уменьшении такого фонда при экспериментальных или пато~
логических условиях происходит энергичное размножение сохранившихся
клеток и восстановление нормального характерного для кроветворной си-
стемы данного организма количества этих клеток в системе. О величине
репаративных потенций системы стволовых клеток свидетельствуют хотя
бы опыты с трансплантацией их относительно небольшого количества
199
в опустошенные кроветворные системы облученных животных и быстрое
восстановление фонда этих клеток после трансплантации. Однако в здо-
ровых функционирующих кроветворных системах нормальным состоянием
стволовых клеток является не энергичное размножение, а, наоборот, со-
стояние временного покоя — нахождение их вне митотического цикла,
в так называемой фазе временного выхода из цикла репродукции. Есте-
ственно при этом, что в функционирующих кроветворных системах имеет
место непрерывный подсев стволовыми клетками системы работающих
камбиальных элементов. Энергичное размножение этого камбия обеспе-
чивает продукцию клеточного материала, необходимого для интенсивного
новообразования различных типов форменных элементов крови. Однако ин-
тенсивность его подсева стволовыми клетками в нормальных условиях
не особенно велика, поскольку работающие камбиальные элементы, или
фонды полустволовых клеток (ФПСЗЛ, -Мег, -Э, -Л, -М), сами способны
в течение ограниченного, правда, отрезка времени поддерживать свой чис-
ленный состав за счет равнонаследственного деления и сохранения у до-
черних клеток свойств камбиальных элементов. В настоящее время не-
ясны факторы, обеспечивающие превращение стволовых клеток в полу-
стволовые работающие камбиальные элементы. Известно лишь, что
этот процесс, так же как и восстановление фонда стволовых родона-
чальных клеток, может происходить лишь при наличии сложной структур-
ной организации миелоидной ткани и его лишь с большим трудом и в те-
чение небольших сроков удается воспроизвести в условиях in vitro (Лу-
рия, 1972).
В отличие от системы мультипотентных стволовых клеток система ра-
ботающего камбия полустволовых клеток гетерогенна и состоит из не-
скольких типов полустволовых клеток. Три типа таких клеток — эритро-
идные, миелоидные и мегакариоцитные — выявляются в опытах с клониро-
ванием in vivo в соответствующих колониях в селезенке. Весьма вероятно
также и существование фондов полустволовых клеток в двух линиях диф-
ференцировки незернистых лейкоцитов — лимфоцитов и моноцитов
(ФПСЛ, ФПСМ). Полустволовые клетки обладают ограниченными
потенциями к дифференцировке и могут давать лишь один из пяти типов
клеточных элементов крови. Кроме того, как уже отмечалось выше, полу-
стволовые клетки могут делиться, сохраняя свойства камбиальных полу-
стволовых клеток, лишь ограниченное число раз. Интенсивность их раз-
множения и перехода, образующегося в результате репродукции клеточ-
ного материала к дифференцировке может регулироваться действием
специфических биологически активных, вырабатываемых организмом
соединений. Так, в случае эритропоэза таким соединением является вы-
рабатываемый в тканях почки эритропоэтин.
Эффективность работы кроветворной системы резко повышается отме-
ченным уже выше длительным сохранением у клеток, вступивших на
путь видимой специфической дифференциации, способности к делению.
Благодаря этому в результате перехода к дифференцировке продуктов
размножения одной камбиальной полустволовой клетки образуется це-
лый клон родственных дифференцированных клеток. Такой клональный
принцип организации кроветворной системы с общим резервным фондом
стволовых клеток и частными камбиальными системами полустволовых
клеток является, по-видимому, наиболее совершенным принципом органи-
зации интенсивно обновляющихся тканевых систем. При клональном
принципе организации системы ее основные стволовые клетки не нахо-
дятся в чувствительных для различного рода воздействий периодах мито-
тического цикла, что придает системе повышенную прочность и обеспе-
чивает большие потенции к репарации.
Сложность организации кроветворных систем млекопитающих и чело-
века обусловливается, по-видимому, еще и способностью стволовых родо-
начальных клеток к миграции и расселению по кроветворным тканям ор-
200
ганизма. Об этом свидетельствуют, в частности, опыты с экранированием
отдельных участков кроветворной ткани при воздействии на животных
смертельными дозами рентгеновских лучей. В этих опытах удалось пока-
зать, что у некоторых видов млекопитающих (мыши, крысы) значи-
тельный процент животных с экранированными участками костного мозга
будет выживать и восстанавливать свою кроветворную систему, даже
если через небольшой промежуток времени после облучения у них
удалить экранированные, не подвергнутые облучению участки костного
мозга.
Косвенным свидетельством в пользу наличия в системе кровяных эле-
ментов особой подвижной формы родоначальных стволовых клеток явля-
ются успешные ^пыты с восстановлением кроветворной системы у облу-
ченных животных при инъекции им не здорового костного мозга, а фор-
менных элементов крови. Естественно, что кандидатами на роль такой
подвижной родоначальной стволовой клетки являются не узкоспециализи-
рованные клетки, а клетки типа лимфоцитов или моноцитов. В свете дан-
ных такого рода опытов весьма вероятным является предположение о том,
что стволовые клетки могут иметь в системе кровяных элементов различ-
ную морфологию: оседлой ретикулярной клетки, гемоцитобласта и лимфо-
идной клетки. Возможно, что они на разных этапах своего жизненного
цикла могут приобретать различные морфологические модификации, со-
храняя при этом общие свойства и потенции, характерные для типичной
стволовой родоначальной клетки. В последнее время удалось получить
фракции кроветворных тканей с повышенным (в 50 раз) содержанием
стволовых клеток. Особенностью этих фракций является увеличение в них
относительного количества больших лимфоцитов.
Несмотря на большие успехи в изучении кроветворных систем некото-
рых млекопитающих и человека и стройность предлагаемых схем гемо-
поэза, следует подчеркнуть, что это лишь начало точного эксперименталь-
ного анализа внутренней организации этих систем. В настоящее время
не идентифицированы еще стволовые и полустволовые клетки, нет дан-
ных относительно полустволовых клеток, формирующих моноциты и лим-
фоциты в миелоидной ткани. Несмотря на большие достоинства метода
клонирования стволовых клеток in vivo, резкие изменения условий их
функционирования изменяют их свойства и клетки, образующие колонии,
не совсем идентичны нормальным стволовым клеткам. Мало известно
и о значении структурной организации миелоидной ткани и взаимо-
действии ее клеточных элементов в нормальной жизнедеятельности этой
весьма сложно организованной тканевой системы.
Процессы кроветворения у других позвоночных животных в настоящее
время изучены, к сожалению, значительно менее полно, чем у млекопи-
тающих и человека.
Наши сведения об общих закономерностях организации кроветворных
систем других классов позвоночных базируются в основном на старой
классической литературе. Новые исследования с помощью современных
методик имеются лишь преимущественно в отношении характеристики
морфобиохимических особенностей процессов эритропоэза у рыб и амфи-
бий (Hollgfield, 1966; Iorio, 1969; Maniatis, Ingram, 1971; Nesta, Maclean,
1974). Из современных сравнительно-цитологических работ по анализу
процессов цитодифференцировки выделяется серия исследований Грассо
с соавторами на хвостатых амфибиях (Grasso, Woodard, 1966; Grasso,
Shephard, 1968; Grasso, 1973). В этих работах авторам удалось избира-
тельно элиминировать все клетки эритроидного ряда, за исключением ге-
моцитобластов. На такой модели оказалось удобным анализировать кине-
тику эритропоэза с использованием современных методических подходов.
Авторам удалось, в частности, показать возможность развертывания про-
цессов репродукции и дифференцировки клеток прямо в сосудистой крови,
начиная с самых ранних этапов эритропоэза.
201
На основании данных этой серии работ, сведений, полученных в ста-
рых обстоятельных морфологических исследованиях, и тех углубленных
в настоящее время представлений об общих закономерностях организа-
ции кроветворных систем млекопитающих можно предположить, что обна-
руженный у последних принцип организации этих систем является уни-
версальной закономерностью для кроветворных систем всех позвоночных
животных. Особенностью низших позвоночных животных, и в частности
круглоротых и различных представителей обширного класса рыб, является
лишь менее выраженная структурная организация миелоидной, или кро-
ветворной, ткани. У круглоротых все процессы гемопоэза сосредоточены
в сосудах и околососудистой соединительной ткани спиральной складки
кишки, которая, по мнению многих авторов, является образованием,
аналогичным селезенке других позвоночных.
У акуловых рыб и скатов эритропоэз и тромбоцитопоэз осуществля-
ются в селезенке, где сосредоточены, по-видимому, и стволовые и полу-
стволовые клетки эритроидного и тромбоцитоидного рядов. Лейкоциты об-
разуются в специальных, так называемых лимфомиелоидных органах —
участках кроветворной ткани в области пищевода, слизистой оболочки
кишки, в тканях почки и ряда других органов. Такое же разделе-
ние миелопоэза и эритропоэза наблюдается и у современных представите-
лей другой группы рыб — хрящевых ганоидов.
У костистых рыб топографическое разграничение грануло- и эритро-
поэза выражено, по-видимому, менее резко. Образование лейкоцитов мо-
жет происходить и в селезенке, и в других участках кроветворной ткани.
Резкие различия в топографической дифференциации грануло-, эритро-
и тромбоцитопоэзов имеют место у хвостатых и бесхвостых амфибий.
У бесхвостых амфибий весь миелопоэз, включая и эритро- и тромбоцито-
поэзы, происходит в красном костном мозге. Наряду с этим гранулоциты
могут образовываться и в других участках кроветворной ткани. Однако
селезенка у многих видов полностью утрачивает кроветворную функцию,
и в ней происходит в основном лишь селекция и гибель завершивших
свой жизненный цикл эритроцитов.
Наоборот, у хвостатых амфибий, как и у представителей древних групп
рыб, имеет место четкое разделение гранулопоэза и эритро- и тромбоцито-
поэзов. Последние происходят исключительно в селезенке, в то время
как гранулопоэз происходит в лимфоидной ткани печени, почек и слизи-
стых оболочек пищеварительной системы. У изученных представителей
рептилий и птиц основным местом эритроидного, тромбоцитарного и гра-
нулоцитарного кроветворений является красный костный мозг, хотя гемо-
поэтическую функцию может нести и селезенка, а также отдельные диф-
фузно расположенные участки лимфомиелоидной ткани.
У предков позвоночных не было, по-видимому, четкого топографиче-
ского разграничения процессов гемопоэза по отдельным типам кровяных
элементов, а возможно, также и особых кроветворных органов. В процессе
прогрессивной эволюции, а также приспособительной адаптивной эволю-
ции, не связанной с существенным повышением уровня организации жи-
вотных, в разных группах позвоночных происходил общий процесс фило-
генетической дифференциации и усложнения кроветворных систем. У да-
леко отстоящих в филогенетическом отношении групп животных, как
акуловые рыбы, хрящевые ганоиды, хвостатые амфибии, этот процесс
дифференциации приводит к топографическому разделению миелоидного
и эритроидного кроветворений в связи с локализацией эритропоэза в се-
лезенке. Наряду с этим спецификой процесса филогенетической диффе-
ренциации и усложнения системы кровяных элементов является также и
усиление интеграционных механизмов внутри системы, и сложности
взаимоотношений системы стволовых и полустволовыхжлеток при кло-
нальном принципе организации всей системы. В связи с этим оказалось
целесообразным вторичное топографическое объединение эритро- и гра-
202
нулопоэза, что и наблюдается у всех высших позвоночных. Такое объеди-
нение эритро- и гранулопоэзов происходит на основе нового кроветвор-
ного органа — красного костного мозга. При этом исторически обусловлен-
ная дифференциация процессов гемопоэза сохраняется здесь путем
выделения особых систем унипотентных полустволовых клеток. Способ-
ность селезенки млекопитающих создавать необходимую структурную ор-
ганизацию для выявления потенций стволовых клеток к организации кро-
ветворных систем имеет, по-видимому, также глубокую историческую
обусловленность. Особенно интересна в этом отношении наблюдаемая
у некоторых млекопитающих тенденция к формированию дискретных
однозначных колоний именно в древней по происхождению ретикулярной
ткани селезенки.
Не менее сложные отношения наблюдаются у различных представите-
лей позвоночных и в плане взаимоотношения лимфоидного и миелоидного
кроветворений, экстра- и интраваскулярного кроветворений, локализации
стволовых, полустволовых и пролиферирующих дифференцирующихся
клеток и, наконец, более тонких закономерностей внутренней организации
кроветворных систем.
К сожалению, сравнительно-гистологический анализ последнего наи-
более интересующего нас вопроса в настоящее время затруднен в связи
с почти полным отсутствием необходимого для такого сопоставления фак-
тического экспериментального гистологического материала по кроветвор-
ным системам представителей различных классов позвоночных животных.
Тем не менее по аналогии с данными по организации кроветворной си-
стемы млекопитающих и на основании имеющегося преимущественно опи-
сательного сравнительно-гистологического материала можно высказать
ряд более или менее гипотетических представлений об общих закономер-
ностях организации кроветворной системы позвоночных. У всех позвоноч-
ных, кроме млекопитающих, по-видимому, отсутствует сложный механизм
обеспечения избирательного поступления зрелых эритроцитов в сосудистое
русло. В связи с этим эритропоэз, а также тромбоцитопоэз происходят
интраваскулярно. Остается неясным, все ли этапы этих процессов
действительно происходят в сосудистом русле или начальные стадии,
например стадии подсева стволовыми клетками полустволовых, а также
сам переход продуктов размножения последних к специфической диффе-
ренцировке, совершаются и вне сосудистого русла в контакте с ретику-
лярной стромой кроветворных органов. Учитывая исключительную роль
ретикулярной ткани в организации и регуляции работы кроветворных си-
стем млекопитающих, естественно предположить ее существенное значе-
ние и в кроветворных системах современных представителей других клас-
сов позвоночных животных. Справедливость такого предположения тем
более вероятна, что у всех высших позвоночных основные этапы грануло-
поэза происходят экстраваскулярно. По-видимому, структурная организа-
ция камбиальных систем кроветворных тканей обеспечивает и максималь-
ную эффективность, и точную внутрисистемную регуляцию процессов ге-
мопоэза. Особенно важное значение такая структурная организация имеет
для начальных этапов этого процесса. Что же касается заключительных
этапов формирования зрелых кровяных элементов, то они могут осу-
ществляться, хотя возможно и с меньшей скоростью, и в циркулирующей
крови. Об этом свидетельствует широкое распространение митотического
деления и процессов дозревания клеток в циркулирующей крови за пре-
делами кроветворных органов у разных позвоночных животных. Особенно
наглядно эта особенность процессов гемопоэза у низших позвоночных
животных выявляется в экспериментальных условиях, как в упомянутой
уже выше серии работ на хвостатых амфибиях.
В совершенствовании, дифференциации и усложнении интеграции кро-
ветворных систем позвоночных животных широкое распространение имели
:и явления тканевого системного параллелизма. Внешним проявлением та-
203
ких параллелизмов в пределах позвоночных животных является хотя бы
сходный характер дифференциации миелоидного и эритроидного кроветво-
рений у акуловых рыб, скатов и хвостатых амфибий. Особенно же ярким
в этом отношении примером могут служить бесхвостые амфибии, которые
по ряду признаков организации своей кроветворной системы оказываются
ближе к млекопитающим, чем рептилии и птицы.
Наряду с этими сходными закономерностями эволюционной дифферен-
цировки системы клеточных элементов крови у всех позвоночных живот-
ных мы имеем и большое количество примеров, свидетельствующих
о большой эволюционной пластичности системы. Помимо разнообразия
в локализации миелоидного и эритроидного кроветворения (их различ-
ной комбинации в разных органах и участках тела у разных представи-
телей позвоночных) весьма убедительным в этом отношении примером
является дифференцировка кровяных пластинок у млекопитающих.
Своеобразный процесс их тромбоцитопоэза является, несомненно, резуль-
татом существенного изменения обычной, характерной для других позво-
ночных, дифференцировки клеток. При этом такое сложное видоизменение
этого типа дифференцировки произошло на относительно непродолжи-
тельном этапе эволюционного развития позвоночных животных.
Все эти рассуждения не могут, однако, заменить целенаправленных
сравнительно-гистологических исследований ряда принципиальных вопро-
сов организации кроветворных систем у представителей различных клас-
сов позвоночных.
Учитывая несомненное наличие общих принципов такой организации
у всех позвоночных и неоднозначное проявление их у представителей каж-
дого класса, такой сравнительно-гистологический материал, помимо обще-
биологического значения, совершенно необходим и для выяснения целого
ряда неясных для нас вопросов организации и регуляции работы миелоид-
ных систем высших позвоночных и человека.
ЛИМФОИДНАЯ ТКАНЬ
Лимфоидная ткань, как и миелоидная ткань красного костного мозга,
представляет собой широко распространенную в организме, топографи-
чески разобщенную, но единую в функциональном отношении разновид-
ность тканей внутренней среды позвоночных животных.
В отличие от миелоидной ткани, которая в принципе имеет сходное
строение, лимфоидная ткань гетерогенна по характеру своей организации
в пределах одного организма. У млекопитающих и человека можно выде-
лить несколько разновидностей лимфоидной ткани. Внешне наиболее
простое строение имеет лимфоидная ткань солитарных фолликулов
(рис. 92). Основу ее составляет ретикулярная ткань, в петлях которой
располагаются свободные лимфоидные клетки. Особой закономерной связи
таких участков лимфоидной ткани с кровеносными и лимфатическими со-
судами обнаружить не удается. Расположение свободных клеток в фолли-
кулах может варьировать, однако чаще в центре фолликула находятся бо-
лее крупные элементы типа больших лимфоцитов. По периферии обычно
расположены в значительно больших количествах клетки типа малых лим-
фоцитов. Благодаря неравномерному распределению разных типов клеток
в фолликулах они имеют на окрашенных препаратах вид неоднородных
образований. Основная масса солитарных фолликулов сосредоточена
в слизистых оболочках переднего и заднего отделов пищеварительного
тракта, в системе дыхательных путей и ряде других систем организма,
граничащих с внешней средой.
Солитарные фолликулы встречаются обычно не в виде одиночных об-
разований; из них формируются комплексы больших или меньших разме-
ров. В области таких комплексов, состоящих из группы солитарных
204
фолликулов, имеют место тесные взаимоотношения лимфоидной ткани
с эпителиальной тканью благодаря богатой инфильтрации эпителиальных
пластов лимфоцитами. Такие отношения наблюдаются у млекопитающих
в области нёбной миндалины и в слизистой оболочке подвздошной кишки
и червеобразного отростка.
Более сложно организованные системы представляет собой лимфоид-
ная ткань лимфатических узлов и селезенки. В лимфатическом узле лим-
фоидная ткань является основным компонентом этого органа, для кото-
рого характерны сложные связи с системой лимфатических и кровеносных
сосудов (рис. 93). Снаружи лимфатические узлы, имеющие слегка бобо-
видную форму, ограничены капсулой из плотной соединительной ткани,
которая вдается внутрь узла в виде
трабекул, разграничивая внутрен-
нюю полость узла на отдельные со-
общающиеся между собой отсеки
или камеры. Эти отсеки заполнены
ретикулярной тканью и ретикуло-
эндотелием. Последний образует вы-
стилку лимфоидных синусов, пред-
ставляющих собой целую систему
своеобразно измененных лимфатиче-
ских капилляров. Под капсулой рас-
положена общая система краевых
синусов. Синусы этой зоны перехо-
дят в синусы коркового вещества,
идущие вдоль трабекул, и далее в си-
стему синусов мозгового вещества,
собирающих лимфу в один вынося-
Рис. 92. Участок инфильтрированного лим-
фоцитами многослойного эпителия в
области нёбной миндалины.
1 — поверхностные слои эпителия, 2 — лимфо-
циты.
щий лимфатический сосуд. В лимфатический узел лимфа поступает из
нескольких приносящих лимфатических сосудов, которые Открываются
в систему краевых синусов.
Все элементы ретикулярной стромы лимфатического узла являются
активными фагоцитами. Лимфатический узел в связи с этим представляет
собой прежде всего мощную дренажную систему. Она обладает большими
потенциями к обезвреживанию инородных частиц и патогенных микроор-
ганизмов, которые могут попадать в лимфатические сосуды.
В петлях ретикулярной ткани в лимфатических узлах располагаются
скопления лимфоидных клеточных элементов. В корковом веществе они
образуют так называемые вторичные узелки, по своему виду аналогичные
рассмотренным выше солитарным фолликулам. В мозговом веществе скоп-
ления лимфоидных клеток образуют систему анастомозирующих лентовид-
ных тяжей, состоящую преимущественно из малых лимфоцитов. Свобод-
ные лимфоидные элементы в несколько меньших количествах сосредото-
чены в синусах и в прилегающих к ним участках коркового и мозгового
вещества.
Лимфоидная ткань лимфатических узлов сильно васкуляризована кро-
веносными сосудами. В ворота узла входит артерия, которая дает раз-
ветвленную трабекулярную артериальную сеть, переходящую в сеть ка-
пилляров. Последняя особенно богата в корковом веществе лимфатических
узлов. Эндотелиальная выстилка трабекулярных вен обладает способ-
ностью обеспечивать выход лимфоцитов из сосудистого русла в лимфоид-
205
Рис. 93. Лимфатический узел млекопитающих. (Из: Елисеев и др., 1972).
а — общая схема узла, б — участок ретикулярной ткани. 1 — соединительнотканная капсула, 2 —
трабекула, з — приносящие лимфатические сосуды, 4 — краевой синус, 5 — ретикулоэндотелиаль-
ные клетки (береговые клетки), 6 — синус коркового вещества, 7 — синус мозгового вещества, 8 —
конечный синус, 9 — выносящий лимфатический сосуд, 10 — ретикулярные клетки, 11 — вторичные
узелки, 12 — мякотные тяжи, 13 — ретикулярные волокна, 14 — артерия лимфатического узла,
15 — сосуды окружающей соединительной ткани, 16 — трабекулярная артерия, 17 — артерии
мякотных тяжей, 18 — поверхностные и глубокие гемокапиллярные сети, 19 — вены мякотных тя-
жей, 20 — трабекулярная вена, 21 — макрофаги в синусах, 22 — лимфоциты и плазматические клетки,.
23 — эндотелий, 24 — щели между эндотелиальными клетками, 25 — лимфоцит, проникающий
в щель, 26 — базальная мембрана.
ную ткань лимфатического узла. Благодаря этому в организме имеет
место непрерывная репопудяция лимфатических узлов лимфоцитами
крови.
Рис. 94. Участки лимфоидной ткани зобной железы млекопитающих. (Рис. В. К. Чет-
верухина).
а — общий вид дольки железы, б — тельце Гассаля в мозговом веществе, в — схема взаимоотношений
между кровеносным сосудом, эпителиальной стромой и лимфоцитами зобной железы на ультраструк-
турном уровне организации. 1 — корковое, 2 — мозговое вещество, 3 — наружные, 4 — внутренние
эпителиальные клетки тельца Гассаля, 5 — эндотелий капилляра, 6 — базальная мембрана, 7 —
цитоплазма эпителиальной клетки стромы, 8 — лимфоциты зобной железы.
Тесная связь с клетками сосудистой крови характерна и для лимфоид-
ной ткани селезенки. Эта ткань расположена здесь в стенке центральных
артерий, образуя так называемую белую пульпу селезенки. По периферии
каждый участок лимфоидной ткани, расположенный по ходу центральных
артерий, находится в непосредственном контакте с красной пульпой селе-
207
венки. Красная пульпа образована синусоидами и ретикулярной тканью,
в которых сосредоточены различные форменные элементы крови.
Еще более сложное строение имеет лимфоидная ткань зобной железы
(тимуса) птиц и млекопитающих и фабрициевой сумки птиц. Характерной
особенностью этой разновидности лимфоидной ткани является наличие
в ней, помимо обычной ретикулярной ткани мезенхимного происхождения,
ретикулярной ткани, или, вернее, весьма специализированной сетчатой
эпителиальной стромы, образованной отростчатыми эпителиальными
клетками. Таким образом, здесь мы имеем дело фактически с лимфо-эпи-
телиальными органами.
Для зобной железы характерно дольчатое строение с четкой диффе-
ренцировкой каждой дольки на корковое и мозговое вещество (рис. 94, а).
Основные различия между ними заключаются в структуре ретикулярной
стромы и в биологических свойствах свободных лимфоидных элементов.
Плотность расположения клеток в корковом веществе значительно больше,
чем в мозговом. Эпителиальные клетки стромы в мозговом веществе обра-
зуют характерные слоистые структуры, так называемые тельца Гассаля.
Второй характерной структурой, образуемой этими клетками, являются
эпителиальные футляры, изолирующие стенки мелких кровеносных сосу-
дов и капилляров от непосредственного контакта с лимфоидными элемен-
тами тимуса (рис. 94, б, в).
Среди эпителиальных клеток тимуса у птиц удается выявить недиф-
ференцированные клетки. Они располагаются обычно на границе коркового
и мозгового вещества. Дифференцированные эпителиальные клетки пред-
ставлены клеточными элементами с сильно развитым фибриллярным ап-
паратом, клетками с ограниченными мембранами гранулами и, наконец,
клетками с большим количеством мелких вакуолей (Trazier, 1973). В ти-
мусе птиц обнаружено три типа пузырьков, стенки которых образованы
эпителиальными клетками с признаками секреторной активности (Isler,
1976). Предполагают, что одна из разновидностей таких пузырьков проду-
цирует фактор, ответственный за наведение иммунокомпетентности на
лимфоциты. Более подробно состояние этого вопроса в отношении зобной
железы высших позвоночных рассмотрено в специальных обзорах (Mandi,
Giant, 1973; Trainin, 1974).
Характерной особенностью всех рассмотренных выше разновидностей
лимфоидной ткани является морфологическая и функциональная подвиж-
ность. В лимфоидной ткани непрерывно происходит размножение клеток,
перемещение и перераспределение клеточного материала. Размножение
части клеток сочетается с гибелью и разрушением других клеточных эле-
ментов. Интенсивность этих процессов неодинакова в различных разно-
водностях лимфоидной ткани. Наиболее энергично они протекают в лим-
фоидной ткани зобной железы. При этом интенсивно делятся не только
клетки типа больших и средних лимфоцитов, но и малые лимфоциты.
Последние после своего возникновения в тканях зобной железы из сред-
них лимфоцитов могут пройти еще один или даже два митотических
цикла. В других разновидностях лимфоидной ткани размножения малых
лимфоцитов обычно не происходит. Митотические фигуры встречаются
здесь лишь среди больших и средних лимфоцитов и в клетках, обеспечи-
вающих реализацию конечных этапов иммунологических реакций.
Сложная динамика морфологических изменений лимфоидной ткани
является, очевидно, внешним, видимым выражением неясной еще нам по
ряду принципиальных вопросов функциональной деятельности лимфоид-
ной ткани как целостной интегрированной защитной системы организма.
Высокая степень дифференцированности и сложность организации этой си-
стемы проявляются прежде всего в наличии рассмотренных выше много-
численных разновидностей лимфоидной ткани. Непосредственное отноше-
ние к ее работе имеет и вся система макрофагов крови и соединительной
ткани, циркулирующие в крови лимфоциты, а также стволовые клетки
208
миелоидной ткани, являющиеся источником всех подвижных элементов
лимфоидной ткани.
Разобранные выше основные разновидности лимфоидной ткани пред-
ставляют собой единую защитную систему, несмотря на их топографи-
ческую разобщенность в организме. Благодаря непрерывной циркуляции
лимфоидных клеток, их постоянной репопуляции в лимфоидных органах и
рыхлой соединительной ткани лимфоидная тйань оказывается неразрывно
связанной со всеми трофическими и защитными системами тканей внут-
ренней среды.
Функциональное значение лимфоидной ткани, помимо защитной, дре-
нажной роли лимфатических узлов, длительное время оставалось неясным.
Лишь во второй половине XX века удалось выяснить, что она играет ос-
новную роль в одной из наиболее совершенных защитных реакций много-
клеточных животных — реакциях адаптивного иммунитета.
Различают две основные разновидности реакций иммунитета — гумо-
ральный, или инфекционный, и клеточный, или трансплантационный,
иммунитеты. Сущность этих реакций заключается в том, что через не-
которое время после попадания в организм высокомолекулярных соедине-
ний, несущих в своей структуре признаки чужеродной генетической ин-
формации — антигенов (белки, нуклеиновые кислоты, некоторые полиса-
хариды), или после приживления чужеродных тканей, в лимфоидной
ткани организма формируются клоны специализированных клеток. При
гуморальном иммунитете это — плазматические клетки, которые выделяют
нейтрализующие антигены иммуноглобулины (антитела гуморального
иммунитета). При трансплантационном иммунитете образуются специаль-
ные лимфоциты, контакт которых с чужеродными тканями вызывает дест-
рукцию этих тканей. При повторном попадании антигена в организм или
вторичном приживлении тканей от того же животного, что и при первой
трансплантации, формирование клонов клеток, вырабатывающих антитела
или отторгающих чужеродные ткани, происходит быстрее.
Как и в любой рефлекторной реакции организма, в реакции иммуни-
тета можно выделить три звена — рецепторное, центральное и эффектор-
ное. Каждое из них характеризуется сложными процессами на клеточном
и системном уровнях организации лимфоидной ткани. Изучение сущности
этих процессов и составляет содержание специальной биологической дис-
циплины — иммуноморфологии, являющейся одновременно важным раз-
делом и иммунологии, и гистологии лимфоидной ткани. Иммуноморфоло-
гия представляет собой в настоящее время один из наиболее бурно разви-
вающихся разделов биологических наук. Естественно поэтому, что мы нс
в состоянии осветить все разрабатываемые ею проблемы. Для наших целей
достаточно остановиться лишь на основных твердо установленных фактах
и принятых большинством исследователей представлениях о клеточных и
тканевых основах иммунных реакций. Более подробные сведения по этим
вопросам можно получить в публикуемых ежегодно обзорах (Петров,
1970, 1976; Незлин, 1972; Miller, 1972; Feldman, Nossal, 1974; Сидорова,
1974; Уилсон, 1974; Ашмарин, 1975).
По современным данным, центральная роль в реакции адаптивного
иммунитета принадлежит двум основным разновидностям лимфоцитов:
лимфоцитам тимуса (Т-лимфоциты) и костномозговым лимфоцитам
(К-лимфоциты). Обе разновидности лимфоцитов происходят из одного
источника — общих стволовых родоначальных клеток. Формирование
Т-лимфоцитов происходит в тимусе. Попадающие сюда малодифференци-
рованные лимфоциты (образующиеся в результате деления полустволовых
клеток миелоидной ткани) проходят несколько циклов репродукции под
индуцирующим влиянием стромы тимуса. При этом происходят опреде-
ленные сдвиги в их генетическом аппарате, благодаря чему они стано-
вятся уже иммунокомпетентными клетками. Внешним выражением этих
14 А. А. Заварзин
209
сдвигов служит появление в плазматической мембране лимфоцитов спе-
цифических маркерных белков. Из тимуса благодаря непрерывной репо-
пуляции лимфоцитов Т-лимфоциты попадают в различные участки лим-
фоидной ткани. Они в относительно больших количествах встречаются
во всех разновидностях лимфоидной ткани, за исключением красного кост-
ного мозга и циркулирующей крови (от 30 до 100%). Наиболее характер-
ным местом постоянного нахождения этих клеток служат так называемые
тимусзависимые поля селезенки и лимфатических узлов. Опустошение
этих участков лимфоидной ткани происходит при удалении тимуса в пер-
вую очередь. Имеются данные о неоднородном составе популяции тимиче-
ских лимфоцитов. Среди них некоторые авторы выделяют антигенреактив-
ные клетки, клетки, формирующие эффекторные элементы при транспланта-
ционном иммунитете, и, наконец, клетки памяти (Брондз, 1972). По другим
данным, популяция Т-лимфоцитов состоит из двух основных субпопуля-
ций — незрелых долгоживущих камбиальных клеток и зрелых относи-
тельно короткоживущих клеток, которые в данный момент и принимают
непосредственное участие в реакциях адаптивного иммунитета (Cantor,
1972). Эти функционирующие клетки и, по-видимому, формирующие их
камбиальные (менее дифференцированные) клетки в свою очередь делятся
на большое количество различающихся по конкретному функциональному
значению разновидностей Т-лимфоцитов. Однако их изучение затруднено
отсутствием еще достаточно детальных представлений о специфических
белках, образуемых Т-лимфоцитами. Помимо специфических маркерных
белков, имеющихся в плазматической мембране Т-лимфоцитов, они при
дифференцировке в эффекторные клетки вырабатывают крупные белко-
вые молекулы, которые специфически реагируют с белками чужеродных
тканей. Кроме того, особые субпопуляции Т-лимфоцитов обладают способ-
ностью выделять белковые факторы, либо способствующие специфиче-
скому взаимодействию рецепторных белков К-лимфоцитов и антигенов,
либо, наоборот, препятствующие такому взаимодействию (клетки-супрес-
соры). Т-лимфоциты выделяют также факторы, способствующие актива-
ции макрофагов. Однако детальный анализ этих специфических белков
еще находится в стадии методических разработок (см. обзор: Галактио-
нов, 1975а).
Значительно более полные данные имеются относительно молекуляр-
ной организации и биологических свойств антител — специфических бел-
ков системы инфекционного иммунитета. Эти данные позволили весьма
детально изучить клеточную систему, ответственную за формирование
антител. Основными клетками этой системы является субпопуляция им-
мунокомпетентных клеток — К-лимфоцитов. Особенностью морфобиохими-
ческой организации К-лимфоцитов является наличие в их мембране спе-
цифических рецепторов. Функцию таких рецепторов выполняют иммуно-
глобулины, или антитела.
Каждая молекула антитела образована легкими и тяжелыми полипеп-
тидными цепями. И легкие и тяжелые цепи состоят из постоянных и
варьирующих по последовательности аминокислот участков. В легких це-
пях варьирующий участок занимает половину полипептидной цепи,
а в тяжелых — !/4 часть. Активный взаимодействующий с антигеном
участок молекулы антитела расположен в концевой части варьирующих
участков легких и тяжелых цепей.
Кроме колоссального разнообразия молекул антител, а следовательно,
и разнообразия разновидностей К-лимфоцитов, определяемых различиями
в варьирующих участках молекул антител, существует 5 классов иммуно-
глобулинов, различающихся по постоянной части тяжелой полипептидной
цепи. Из них наиболее хорошо изучены М-, G- и А-глобулины. Пока-
зана закономерная последовательность возникновения субпопуляций
К-лимфоцитов в онтогенезе, обладающих способностью продуцировать
плазматические клетки, образующие либо М-, либо G-. либо А-антитела.
210
При этом активные варьирующие участки молекул у них идентичны и
все они, следовательно, специфичны к одному антигену. Первыми в онто-
генезе появляются субпопуляции К-лимфоцитов, продуцирующие М-гло-
булины, затем G-глобулины, и, наконец, самая последняя субпопуляция об-
ладает способностью к образованию плазматических клеток, продуцирую-
щих А-глобулины. Эти факты позволяют высказать предположение, что
в данном случае мы имеем дело с изменениями в геноме дифференцирую-
щихся клеток. Весьма вероятно, что гены, ответственные за синтез посто-
янных участков тяжелых цепей молекул антител, расположены рядом и
в такой же последовательности, в какой возникают соответствующие суб-
популяции К-лимфоцитов. При этом с генами, кодирующими вариабель-
ные участки цепи антитела, контактирует ген, кодирующий постоянный
участок полипептидной цепи М-иммуноглобулинов. Смена субпопуляций
лимфоцитов, по имеющимся сейчас представлениям, происходит в резуль-
тате образования петель в транскрибируемом участке молекулы ДНК. Бла-
годаря этому на втором этапе дифференцировки камбиальных К-лимфо-
цитов транскрибироваться будут те же гены варьирующего участка, но
вместо гена, кодирующего М-глобулины, считывание информации будет
происходить с гена, ответственного за синтез G-глобулинов.
Значительно сложнее объяснить генетические основы разнообразия
варьирующих участков молекул антител. По представлениям одних авто-
ров, количество генов, кодирующих варьирующие участки в молекулах
антител в каждой клетке, соответствует количеству возможных вариантов
антител. По этой гипотезе разнообразие разновидностей К-лимфоцитов,
как и при других типах дифференцировки, определяется лишь актива-
цией одних генов и репрессией других при помощи обычных или специ-
фических для иммунных систем механизмов регуляции работы генетиче-
ского аппарата.
По другим представлениям, в основе разнообразия антител лежат более
существенные изменения генетического аппарата К-лимфоцитов —
а именно соматические мутации в участках ДНК, кодирующих варьирую-
щие участки полипептидных цепей антител. Клетки с измененным в ре-
зультате этих соматических мутаций геномом подвергаются жесткому от-
бору в лимфоидной системе организма.
, Все указанные выше изменения в генетическом аппарате К-лимфоци-
тов относительно автономны. Они происходят и при отсутствии контакта
с антигенами. Однако для успешного развертывания этих сложных изме-
нений в генетическом аппарате формирующихся иммунокомпетентных
клеток необходимы индуцирующие (контактные или химические) воздей-
ствия других клеточных элементов лимфоидной системы или других тка-
ней организма. При дифференцировке К-лимфоцитов у птиц эту функцию
выполняет эпителий фабрициевой сумки. У млекопитающих формирование
иммунокомпетентных клеток в эмбриональный период происходит в мие-
лоидной ткани печени и селезенке. В печени индуцирующее влияние ока-
зывают эпителиальные клетки — гепатоциты. Источники и механизмы
индуцирующего влияния на дифференцировку К-лимфоцитов в селезенке
остаются еще неясными. Возможно также, что дифференцировка иммуно-
компетентных К-лимфоцитов происходит и в миелоидной ткани красного
костного мозга. Общие принципы и механизмы становления системы им-
мунокомпетентных клеток инфекционного (К-лимфоциты) и трансплан-
тационного (Т-лимфоциты) иммунитетов, по-видимому, весьма сходны.
Однако они лучше изучены в отношении системы инфекционного иммуни-
тета. Вопрос о генетической основе дифференцировки иммунокомпетент-
ных клеток освещен в специальных обзорах ( Mood, 1972; Jerne, 1973;
Cooper, Lawton, 1974; Ашмарин, 1975).
Популяции Т-лимфоцитов и К-лимфоцитов различаются и по средней
продолжительности жизни клеток, и по интенсивности репопуляции обра-
зуемых ими скоплений в лимфатических узлах. Продолжительность
14*
211
жизни Т-лимфоцитов у мышей — 4—6 месяцев, а К-лимфоцитов — 5—
7 недель, интенсивность репопуляции Т-лимфоцитов в несколько раз
выше, чем К-лимфоцитов (Sprent, Basten, 1973; Sprent, 1973).
Рис. 95. Схема формирования клона плазматических клеток. (Рис. 3. А. Зайченко).
1 — иммунокомпетентный К-лимфоцит в первые сутки после введения антигена, 2—5 — последова-
тельные этапы изменения морфологии клеток соответственно на 2-й, 3-й, 4-й и 5-й дни после введения
►антигена. Слева — схема репродукции клеток в процессе формирования клона плазматических
клеток.
Из трех звеньев реакций адаптивного инфекционного и транспланта-
ционного иммунитетов в настоящее время наиболее изученным является
последнее эффекторное звено. Сущность происходящих здесь процессов
заключается в том, что после восприятия клетками лимфоидной ткани ин-
формации о попадании в организм антигена или чужеродной ткани оп-
ределенная часть иммунокомпетентных клеток приступает к формирова-
нию клонов специфических клеток. При этом происходит увеличение ко-
личества дифференцирующихся клеток в геометрической прогрессии за
212
счет их усиленного деления с продолжительностью генерационного цикла
порядка 12 час. Благодаря такому энергичному делению количество клеток
в каждом клоне достигает к пятым суткам 256—512. Одновременно с про-
цессами деления, как и в случае миелопоэза, происходит специфическая
дифференцировка клеток, прогрессирующая с каждым делением (рис. 95) •
У дифференцирующихся клеток при инфекционном иммунитете фор-
мируется мощный белоксинтезирующий аппарат. Он представлен разви-
той шероховатой эндоплазматической сетью с многочисленными рибосо-
мами. Каждый клон клеток вырабатывает лишь одну разновидность ан-
тител, специфичных для антигена, который вызвал развитие иммунной
реакции. Формирование клонов плазматических клеток можно относи-
тельно легко воспроизвести в условиях вне организма, т. е. этот заключи-
тельный этап реакции иммунитета — процесс уже достаточно автоном-
ный. Иммунокомпетентными клетками при инфекционном иммунитете
являются К-лимфоциты. Формирование клонов плазматических клеток
у млекопитающих происходит главным образом в лимфатических узлах и
селезенке. Отсюда они могут с током лимфы и крови распространяться
по организму. Выведение антител осуществляется путем секреции. Ос-
новная же их масса накапливается в цистернах эндоплазматической сети
и выводится из клеток при их разрушении. Продолжительность жизни
зрелой плазматической клетки в организме не превышает нескольких
дней. Вне организма продолжительность существования этих клеток мо-
жет быть значительно более длительной. Незначительная часть плазма-
тических клеток длительно существует в условиях in vivo. Замечено, что
отдельные зрелые плазматические клетки могут появляться за несколько
дней до созревания основной их массы. Показано тормозящее влияние
продуцируемых антител на размножение и дифференцировку клонов
плазматических клеток. Кроме того, имеется предположение о наличии
специальных субпопуляций Т-лимфоцитов, выделяющих факторы, пре-
пятствующие чрезмерной продукции плазматических клеток. \
По мнению некоторых авторов, при развитии клона не все сестринские
клетки, образующиеся при размножении иммунокомпетентных клеток,
вступают на путь специфической дифференцировки. Часть их сохраняет
индифферентный недифференцированный вид. Эти клетки превращаются
в так называемые клетки памяти и сохраняются в лимфоидной системе.
При вторичном попадании данного антигена в организм каждая из таких
клеток переходит к энергичному размножению и дифференцировке, да-
вая клон специфических к этому антигену зрелых плазматических кле-
ток. Имеются, однако, данные о том, что клетки памяти представляют
собой особую субпопуляцию лимфоцитов, не связанную гистогенетически
с развитием клонов плазматических клеток (Брондз, 1972).
Аналогичные в принципе процессы происходят и на заключительных
этапах трансплантационного иммунитета. Иммунокомпетентными клет-
ками в этом случае является особая разновидность Т-лимфоцитов. Они
так же, как и в случае инфекционного иммунитета, при получении ин-
формации о чужеродных тканях переходят к формированию клонов спе-
циализированных клеток. Сущность дифференцировки клеток и их морфо-
логические особенности иные, чем у плазматических клеток. В отличие от
последних, зрелые клетки трансплантационного иммунитета характери-
зуются слабым развитием эндоплазматической сети при большом коли-
честве свободных рибосом. Синтезируемые на рибосомах специфические
белки не выводятся в кровь, а встраиваются в плазматическую мембрану.
Клетки приобретают способность к положительному хемотаксису по от-
ношению к чужеродным тканям, а их контактное взаимодействие с эле-
ментами этих тканей оказывается губительным для обоих взаимодейст-
вующих компонентов. Эффекторное звено реакции трансплантационного
иммунитета можно воспроизвести в условиях вне организма. Если, на-
пример, к культивируемым in vitro фибробластам мышей СзН добавить
213
лимфоциты от иммунизированных к тканям этой линии мышей другой
линии, то уже через 48 час. начинается гибель и фибробластов, и лимфо-
цитов в результате их непосредственного контакта.
Значительно хуже представляем мы в настоящее время клеточные ос-
Цовы рецепторного и центрального звеньев реакций адаптивного инфек-
ционного иммунитета. Эти этапы иммунной реакции при первичной имму-
низации удается с большим трудом и атипично воспроизвести в органных
и суспензионных культурах при особых условиях культивирования (Лу-
рия, 1972). Очевидно, что для нормального протекания этих процессов не-
обходима структурно организованная лимфоидная ткань.
При попадании антигена в организм часть его может нейтрализоваться
и разрушаться неспецифическими детоксицирующими системами орга-
низма. Значительная часть антигена поглощается системой макрофагов и
претерпевает изменения внутри этих клеток под влиянием их лизосом-
ного аппарата. Однако, по мнению некоторых авторов, дело здесь сво-
дится не к простому гидролизу молекул антигена под влиянием пищева-
рительных ферментов лизосомного аппарата. Часть молекул или их участ-
ков, несущих в своей структуре специфическую информацию, сохраняется
в клетках благодаря их связи с молекулами РНК или иммуноглобулинов.
Последние могут располагаться на мембране макрофагов или в тканевой
жидкости и после связывания с антигеном соединяться со специфиче-
скими рецепторами мембран. В дальнейшем такие комплексные специфи-
ческие соединения, по мнению авторов этих моделей, играют основную
роль в передаче информации об антигене на иммунокомпетентные клетки.
По мнению других исследователей, основное значение поглощения анти-
гена макрофагами заключается в удалении избытков антигена из орга-
низма. Часть молекул антигена может длительно находиться в неизменен-
ном состоянии на поверхности ретикулярных клеток. Однако все эти
способы удержания или поглощения антигена имеют, по-видимому, не
основное, а вспомогательное значение. Более важное значение в рецепции
антигенного стимула при инфекционном иммунитете имеет непосредствен-
ное специфическое соединение молекул антигенов с рецептивными имму-
ноглобулинами плазматической мембраны соответствующих данному
антигену К-лимфоцитов.
При развитии реакций трансплантационного иммунитета обнаружено,
что на ранних сроках после трансплантации чужеродной ткани она ин-
фильтрируется лимфоцитами реципиента. Затем они покидают трансплан-
тированные ткани и попадают в ближайшие лимфатические узлы или се-
лезенку. В данном случае активная роль принадлежит Т-лимфоцитам,
хотя мы не знаем деталей, происходящих на молекулярном и субклеточ-
ном уровнях процессов.
Одной из очень важных, но еще не решенных иммуноморфологических
проблем является проблема интимных внутриклеточных механизмов ак-
тивизации генетического аппарата клеток. Неясно, в частности, как вос-
принимаемая плазматической мембраной иммунокомпетентных клеток ин-
формация вызывает адекватные сдвиги в их генетическом аппарате.
Имеются данные, что в случае поливалентных антигенов они соединя-
ются с несколькими молекулами антител плазматической мембраны К-
лимфоцитов. В дальнейшем такие комплексы молекул смещаются к од-
ному из полюсов клетки, где путем пиноцитоза попадают внутрь
лимфоцита (Raff, Petris, 1973). Судьба антигена в таких пиноцитозных
пузырьках остается неясной.
Как уже указывалось выше, большинство имеющихся в настоящее
время данных свидетельствует, по-видимому, о том, что в основе реакций
адаптивного инфекционного иммунитета лежит соответствие количества
разновидностей иммунокомпетентных клеток количеству антигенов. Иными
словами, эта удивительно пластичная по своей сути реакция базируется
на многоклеточной системе, каждый элемент которой характеризуется
214
стабильной и строго однозначной детерминацией своего генетического
аппарата (Nossal, 1972). Основной особенностью реактивных процессов
лимфоидной ткани при реализации реакций иммунитета является строго
адекватный раздражителю характер ответа генетического аппарата
иммунокомпетентных клеток.
Из всего изложенного выше следует, что в лимфоидной ткани сущест-
вует две, в известной мере автономные, системы, каждая из которых
обеспечивает либо реакцию адаптивного инфекционного иммунитета, либо
реакцию трансплантационного иммунитета. Принцип работы этих систем
в общем аналогичен принципу работы миелоидной ткани с ее разнообраз-
ными направлениями дифференцировки специализирующихся клеток. От-
личие дифференцировки клеток при лимфопоэзе от эритро- и миелопоэзов
заключается в том, что последние происходят в организме непрерывно,
а эффекторные клетки инфекционного и трансплантационного иммуните-
тов образуются лишь при попадании в организм антигенов или чужерод-
ных тканей. Характер же формирования клонов дифференцированных
клеток с длительным сочетанием процессов их репродукции и специализа-
ции идентичен в лимфоидной и миелоидной тканях высших позво-
ночных.
Несмотря на отмеченную выше дифференцированность лимфоидной
ткани на две относительно автономные системы, оказывается, что между
ними имеются глубокая взаимосвязь и органическое единство.
В опытах на животных, облученных смертельной дозой рентгеновских
лучей, с полностью инактивированной собственной лимфоидной системой
удалось показать, что во многих случаях изолированная инъекция костно-
мозговых или тимических лимфоцитов не вызывает восстановления реак-
ций инфекционного или трансплантационного иммунитетов. Лишь сов-
местная инъекция этих двух основных разновидностей лимфоцитов обус-
ловливает восстановление обоих типов иммунной реакции. Тщательный
экспериментальный анализ этого вопроса показал, что для многих анти-
генов необходимо взаимодействие Т- и К-лимфоцитов, причем К-лимфо-
циты являются непосредственным источником формирования специфи-
ческих плазматических клеток, а Т-лимфоциты играют роль в первых
этапах рецепции антигена. Относительно механизмов участия Т-лимфо-
цитов в рецепции антигенов нет единого мнения. Есть предположение,
что для инициации иммунного ответа необходимо одновременное кон-
тактное взаимодействие между антигенами и К- и Т-лимфоцитами. При
этом Т-лимфоциты обладают, по-видимому, способностью сорбировать
на своей поверхности мелкие молекулы унивалентных антигенов. По-
следние могут быть восприняты рецептивными белками плазматической
мембраны К-лимфоцитов лишь при таком агрегированном их состоянии
на поверхности Т-лимфоцитов.
Имеется также мнение о том, что Т-лимфоциты при попадании анти-
гена выделяют специфические гуморальные факторы. Наличие послед-
них является необходимым условием для специфического связывания ан-
тигенов рецептивными белками соответствующих иммунокомпетентных
К-лимфоцитов. Удалось выделить белковый фактор, продуцируемый Т-
лимфоцитами и стимулирующий развитие иммунной реакции.
Наряду с установленным в настоящее время для ряда антигенов фак-
том взаимодействия двух основных типов иммунокомпетентных клеток
в реакциях инфекционного иммунитета имеется ряд данных и о наличии
такого взаимодействия в ходе реализации реакций трансплантационного
иммунитета. Наконец, большой фактический материал накоплен и в от-
ношении участия в иммунных реакциях макрофагов и стромальных эле-
ментов ретикулярной ткани. О большом значении последних говорит
хотя бы то обстоятельство, что основные наиболее важные этапы иммун-
ного ответа осуществляются в пространственно организованной строме
лимфоидных органов.
215
Современные представления о характере гистогенетических и коопе-
ративных взаимодействий различных типов клеток в лимфоидной ткани
иллюстрирует схема, приведенная на рис. 96.
Весьма ярко единство системной организации лимфоидной ткани вы-
ражено также в так называемой реакции «трансплантат против хозя-
ина». Эта реакция развивается при пересадках кроветворной и лимфоид-
ной систем животным с деградировавшей в результате облучения соб-
ственной кроветворной системой. Восстанавливающаяся при пересадке
лимфоидная ткань образована клетками донора и воспринимает окру-
жающие ее ткани реципиента как чужеродные ткани. Естественно, что
в этих условиях она начинает образовывать клоны клеток, возникнове-
ние которых вызывает тяжелое заболевание организма, приводящее его
в подавляющем большинстве случаев к гибели. Выживание небольшого
процента животных в подобных опытах может быть обусловлено элими-
нацией подсаженной кроветворной ткани и восстановлением собственной
миелоидной и лимфоидной тканей из сохранившихся в организме родо-
начальных стволовых клеток. В очень редких случаях может происхо-
дить и «привыкание» пересаженной кроветворной ткани к тканям нового
организма-хозяина. 'Клеточные механизмы такого привыкания остаются
неясными.
Для выяснения принципов организации лимфоидной ткани и характера
взаимодействия ее клеток большое значение имеют опыты по искусствен-
ному торможению или предотвращению иммунных реакций, опыты по
выяснению механизмов так называемой искусственной толерантности или
невосприимчивости лимфоидной ткани к антигенным стимулам. Естест-
венно, что в весьма сложно развертывающейся, строго закономерной и
последовательной во времени иммунной реакции предотвращение иммун-
ного ответа можно вызвать на различных этапах рецепторного и цен-
трального звеньев этой реакции путем исключения или блокирования дея-
тельности тех или иных клеточных элементов, участвующих в этих
процессах. Наибольший интерес для понимания механизмов реакций им-
мунитета представляют опыты по индукции толерантности путем пе-
риодических инъекций малых подпороговых доз антигена. Тщательный
анализ результатов этих опытов в сопоставлении с данными других
экспериментов показывает, что непосредственной причиной блокирования
иммунного ответа являются обычно изменения в популяции тимических
лимфоцитов.
Явления толерантности имеют большое значение при формировании
организма в онтогенезе. На их основе, очевидно, происходит «обучение»
лимфоидной системы, т. е. приобретение ею способности различать «свои»
и чужеродные или дефектные клеточные и тканевые элементы. Одним
из основных механизмов такого обучения является элиминация из си-
стемы клеток, чувствительных к собственным антигенам.
В последнее время появились, однако, данные, что механизмы толе-
рантности во многих случаях нельзя свести к простой элиминации клонов
антигенреактивпых клеток. Высказывается предположение, что эти меха-
низмы заключаются в избирательном подавлении реактивности этих кло-
нов за счет активизации внутрисистемных блокирующих факторов. Воз-
можно, что такое блокирующее действие оказывают особые субпопуляции
Т-лимфоцитов.
Краткий обзор имеющихся уже данных о клеточных основах реакции
адаптивного иммунитета в современной иммуноморфологии показывает,
что в случае лимфоидной ткани мы имеем дело с весьма дифференциро-
ванными частными системами и вместе с тем с единой, весьма совер-
шенно интегрированной разновидностью тканей внутренней среды. Такая
системная интеграция лимфоидной ткани проявляется и в происхождении
ее элементов из одного источника, и в непрерывной репопуляции лимфо-
цитами топографически разобщенных участков лимфоидной ткани в ор-
216
Il
Рис. 96. Схема взаимоотношения клеток в лимфоидной
системе. (Рис. 3. А. Зайченко).
1 — красный костный мозг: а — фонд стволовых клеток крови,
б — фонд полустволовых клеток миелоидной системы, в — фонд
полустволовых клеток лимфоидной ткани; II — лимфоэпите-
лиальные органы: а — зобная железа, б — фабрициева сумка
у птиц или ее аналог у млекопитающих; 111 — периферические
органы лимфоидной системы (лимфатические узлы, селезенка).
1 — стволовая клетка крови, 2 — полустволовые клетки лимфоид-
ной системы, 3 — К-лимфоцит, 4 — Т-лимфоцит, 5 — эпителиаль-
ные клетки лимфоэпителиальных органов, 6 — ретикулярная
клетка, 7 — макрофаг, 8 — клетки памяти (а — транспланта-
ционного и б — инфекционного иммунитетов), 9 — эффекторные
клетки (а — трансплантационного и б — инфекционного имму-
нитетов). Темными стрелками показаны гистогенетические отно-
шения между основными клетками лимфоидной системы. Свет-
лые стрелки указывают на кооперативное взаимодействие между
вспомогательными н основными клетками.
ганизме, и, наконец, в наличии глубокого кооперативного взаимодействия
между основными составляющими ее разновидностями специализирован-
ных клеточных элементов.
Единство и сложность организации лимфоидной иммунной системы
обусловливается еще и тем обстоятельством, что помимо основных
активно реагирующих с антигеном участков в молекуле антител имеются
многочисленные и разнообразные активные участки, обеспечивающие
взаимодействие антител с другими антителами внеклеточной и внутри-
клеточной локализации. Наличие таких участков обусловливает и инди-
видуальность каждой системы лимфоидных элементов у отдельных орга-
низмов, и целостность и единство ее у данного организма. Иммуноком-
петентные клетки представляют собой как бы единую взаимосвязанную
и взаимообусловленную систему, находящуюся в динамическом равнове-
сии и непрерывно изменяющуюся по составу образующих ее клеток.
Необходимо, однако, подчеркнуть, что, несмотря на большие успехи,
достигнутые в изучении клеточных основ реакций иммунитета, в этой
области еще много противоречивых суждений, фактов, гипотез и о меха-
низмах рецепции антигена, и относительно механизмов индукции гене-
тического аппарата иммунокомпетентных клеток и характера взаимо-
действия антигена с клеточными и гуморальными антителами.
В настоящее время все еще дискутируются вопросы об уни- или поли-
потентности лимфоцитов к различным антигенам и о специфической или
неспецифической роли макрофагов. Не ясны также гистогенетические
отношения между иммунокомпетентными клетками первичной иммунной
реакции и клетками памяти и целый ряд других важных цитологических
вопросов. Относительно мало известно и о роли структурной организации
лимфоидной ткани в осуществлении кооперативного взаимодействия между
основными и вспомогательными клетками и, в частности, ее стромаль-
ными элементами.
Для углубленного изучения гистологии лимфоидной ткани выявление
конкретных механизмов взаимодействия ее компонентов имеет особое
значение. Такое взаимодействие включает в себя, несомненно, и гумораль-
ное химическое взаимовлияние продуктов специфической синтетической
деятельности клеток и тесное структурное контактное взаимодействие.
По справедливому замечанию некоторых авторов (Чертков, Фриденштейн,
1972), мы имеем в данном случае лишь проявление общебиологических
закономерностей взаимодействия клеток и тканей, лежащих в основе
интеграции частных систем организма. В связи с этим исключительно
большой интерес для общей гистологии представляет дальнейшее изуче-
ние этих механизмов на такой удобной и уже хорошо изученной модели,
какой является лимфоидная ткань позвоночных животных.
В настоящее время имеется тенденция сосредоточить основные усилия
в анализе клеточных основ реакций иммунитета на изучении упрощен-
ных модельных систем в условиях in vitro (Брондз, 1972). Не отрицая
достоинств такого аналитического подхода, необходимо все же отметить,
что имеющиеся сейчас данные свидетельствуют о большом значении
в функции лимфоидной ткани системного уровня ее организации (Фри-
денштейн, Чертков, 1969; Чертков, Фриденштейн, 1972; Лурия, 1972).
В изучении клеточных основ и системного уровня организации,
и в частности в выяснении принципиального вопроса о значении кон-
тактных и гуморальных взаимодействий в организации и функционирова-
нии лимфоидной системы, важное значение должен иметь сравнительный,
исторический метод исследования.
Клеточные основы реакций иммунитета у низших позвоночных изу-
чены в значительно меньшей степени, чем у высших позвоночных. Име-
ется обширная классическая литература по морфологической характери-
стике лимфоидной ткани, частично обобщенная в свое время в обзорах
и сводках (Заварзин, 1945, 1947). С другой стороны, имеются отдельные
218
иммунологические работы по выяснению особенностей реакций адаптив-
ного инфекционного и трансплантационного иммунитетов у отдельных
представителей низших позвоночных, главным образом костистых рыб
и хвостатых и бесхвостых амфибий (Auerbach, Ruben, 1970; Cushing,
1970; Ruben, 1970; Kraft, Shortman, 1972).
Целенаправленные систематические сравнительно-иммунологические
исследования ведутся сейчас лишь в немногих лабораториях. Результаты
исследований, проведенных на крутлоротых и различных представителях
хрящевых и костистых рыб, а также имеющиеся данные по другим
представителям низших позвоночных обобщены в специальных обзорах
(Good, Papermaster, 1964; Good, 1968; Catti et al., 1970; Галактионов,
19756).
Установлено, что лимфоидная ткань как относительно автопомпая и
специализированная защитная система тканей внутренней среды пред-
ставлена у большинства классов позвоночных животных. При этом обна-
ружена отчетливая корреляция между степенью развития и сложностью
организации лимфоидной ткани, и в частности зобной железы или ее
аналогов, и степенью выраженности реакций адаптивного инфекционного
и трансплантационного иммунитетов.
У круглоротых весьма примитивный аналог тимуса имеется лишь
у миног. Соответственно этому миноги обладают очень слабой способ-
ностью к синтезу антител, образуя их лишь на некоторые антигены.
Образующиеся у миноги антитела относятся к двум классам иммуногло-
булинов (М и G). Однако в отличие от других позвоночных в них не обна-
руживают структурных различий в тяжелых цепях мономерных (G)
и полимерных (М) молекул. У миног и миксин описано также специ-
фическое отторжение гомотрансплантатов, сроки которого резко сокра-
щаются при вторичных пересадках (у миксин с 72 до 28 дней).
У других низших позвоночных — хрящевых и костистых рыб, хвоста-
тых и бесхвостых амфибий имеется хорошо развитый тимус и система
лимфоидных элементов в крови и других тканях. Имеются и лока-
лизованные очаги лимфопоэза в кроветворной ткани. Обнаружены также
и плазматические клетки. Все это коррелирует у них с достаточно хорошо
выраженной способностью вырабатывать специфические антитела при
антигенной стимуляции и отторгать гомотрансплантаты. При этом срок
отторжения последних у бесхвостых амфибий вполне сопоставим с их
отторжением у высших животных.
В специальной серии исследований на бесхвостых амфибиях показано
наличие у них сложной и дифференцированной лимфоидной системы
(Cooper, Hildemann, 1963; Baculi, Cooper, 1967, 1973; Norton, 1969).
В состав лимфоидной системы у этих животных входят тимус, селезенка
и лимфоидная железа. Особенностью этой системы является относительно
ранняя ее функциональная зрелость. Выработка антител на первичное
введение антигена и отторжение гомотрансплантата наблюдаются уже
у головастиков. Показано также разделение функций в этой системе. Так,
тимус, как и у высших позвоночных, ответствен в основном за реакции
трансплантационного иммунитета. Наряду с этим он стимулирует и про-
дукцию антител при инфекционном иммунитете другими разновидно-
стями лимфоидной ткани. Основными источниками антителообразующих
клеток при инфекционном иммунитете являются селезенка и лимфоидная
железа. Показано и изменение лимфоидной системы у этих представите-
лей бесхвостых амфибий в ходе онтогенеза.
Такого рода исследования свидетельствуют о наличии у низших позво-
ночных достаточно сложной и диффенцированной системы, ответствен-
ной за реакции адаптивного иммунитета. В связи с этим их детальное
изучение весьма перспективно для выяснения ряда принципиальных во-
просов организации лимфоидной ткани и ее эволюционной динамики
у позвоночных животных.
219
Основным недостатком имеющихся сравнительно-иммунологических
данных является отсутствие адекватного им анализа тонких клеточных
взаимодействий в иммунном ответе и особенностей организации лимфоид-
ных систем. При наличии этих данных наши возможности каузального
анализа роли структурной организации лимфоидной системы могли быть
значительно расширены и углублены. В связи с этим не случайно, что
один из крупнейших иммуноморфологов Г. И. Носсаль (Nossal, 1972)
считает, что анализ филогении адаптивного иммунитета является одной
из важнейших задач иммунологии на ближайшее десятилетие. Естест-
венно, что неразрывно связанный с этой проблемой сравнительно-гисто-
логический анализ лимфоидной ткани представляется весьма актуальным
для выяснения общих принципов ее организации и усложнения в про-
цессе эволюции позвоночных животных.
ФУНКЦИОНАЛЬНОЕ ЕДИНСТВО ТРОФИЧЕСКИХ
И ЗАЩИТНЫХ РАЗНОВИДНОСТЕЙ ТКАНЕЙ ВНУТРЕННЕЙ СРЕДЫ
В предыдущих разделах настоящей главы было показано, что у выс-
ших представителей позвоночных трофические и защитные разновидности
тканей внутренней среды характеризуются большой степенью филогене-
тической дифференцированности. Последняя проявляется и в большом
разнообразии клеток и межклеточных структур в пределах каждой разно-
видности тканей внутренней среды, и в известной системной автономии
отдельных частных систем или популяций специализированных клеток.
Наиболее ярко такая автономность обнаруживается в реакциях «транс-
плантат против хозяина» при пересадке облученным животным костного
мозга. Достаточно отчетливо выражена она и в патологических условиях,
например при поражении отдельных ростков гемопоэза у человека,
а также при тех или иных экспериментальных воздействиях.
В настоящее время ясно, что расчлененность единой системы тканей
внутренней среды позвоночных является результатом прогрессивного раз-
вития и непрерывного совершенствования первичных трофических и за-
щитных тканей, имевших у предков позвоночных менее дифференциро-
ванный характер.
Выделение отдельных относительно автономных частных систем со-
провождается усилением общих интегративных механизмов. В связи
с этим у высших представителей позвоночных трофические и защитные
разновидности тканей внутренней среды представляют собой единую це-
лостную систему. Это ее единство отражает, с одной стороны, общность
происхождения в эволюции всех разновидностей тканей внутренней
среды. С другой стороны, оно определяется и тесной функциональной
взаимосвязью трофических и защитных разновидностей тканей внутрен-
ней среды на протяжении всего исторического развития позвоночных
животных.
Достаточно хорошо известным внешним проявлением единства тканей
внутренней среды является факт развития всех защитных и трофических
их разновидностей из общего источника, первичной трофической ткани —
мезенхимы. При этом у млекопитающих и птиц в ходе онтогенеза проис-
ходит закономерное перемещение процессов гемопоэза из сосудов жел-
точного мешка в эмбриональную соединительную ткань печени, а в на-
чале постнатального развития — в красный костный мозг.
Такое перемещение процессов гемопоэза происходит путем метаста-
зирования соответствующих кроветворных органов циркулирующими
в крови стволовыми родоначальными клетками, появляющимися в мо-
мент выделения первичных кроветворных клеток. Методом клонирования
стволовых клеток in vivo показано, например, что их появлению к 11-му
220
дню развития в печени у мышей предшествует появление их в крови
10-дневного эмбриона (Niewisch et al., 1970; Johnson, Moore, 1975). Коли-
чество этих клеток нарастает в эмбриональной печени с 11-го до
18-го дней беременности. При переходе к постнатальной жизни коли-
чество их падает, и вскоре они полностью исчезают из печени.' Во второй
половине эмбрионального развития количество стволовых клеток в крови
у эмбрионов в десятки раз выше, чем у взрослых животных. Максималь-
ный их уровень наблюдается в конце эмбрионального и начале постна-
тального развития, т. е. тогда, когда начинается формирование дефини-
тивных миелоидных и лимфоидных систем. В это же время наблюдается
появление и резкое увеличение количества стволовых клеток в селезенке.
Эти факты свидетельствуют в пользу предположения о раннем выделении
в формирующихся зачатках тканей внутренней среды популяции стволо-
вых клеток. У мышей эта популяция возникает на 9—10-е сутки одно-
временно с появлением первичных кровяных клеток. Можно предпола-
гать, что в дальнейшем развитии организма происходит лишь увеличение
количества стволовых клеток и их закономерное расселение по разным
отделам формирующихся кроветворных и лимфоидных систем. При этом,
однако, под влиянием местных факторов и общих организменных регуля-
ций имеют место существенные качественные изменения в свойствах
стволовых клеток. Конкретные внутриклеточные механизмы этих онто-
генетических изменений свойств стволовых клеток изучены пока лишь
на примере полустволовых клеток лимфоидной системы (Cooper, Lawton,
1974). Внешним проявлением существенных сдвигов в генетическом ап-
парате клеток является увеличение направлений дифференцировки про-
дуктов их размножения и некоторые изменения характера дифферен-
цировки в количественном и даже качественном отношениях. Такие из-
менения особенно хорошо показаны на примере эритропоэза (см. обзоры:
Marks, Kovach, 1966; Rifkind et al., 1969).
Показано, в частности, что в ходе развития организма увеличивается
количество эритроцитов, образующихся из одной вступившей на путь
дифференцировки камбиальной клетки. Менее совершенные ядерные
эритроциты желточного эритропоэза уже к 15-му дню развития у мышей
начинают замещаться безъядерными эритроцитами. К началу постна-
тальной жизни в эритробластах красного костного мозга появляются но-
вые иРНК, обеспечивающие синтез 0-цепей глобинов, которых нет в ге-
моглобине эритроцитов эмбрионов.
Аналогичные изменения в ходе развития организма происходят при
других направлениях дифференцировки продуктов размножения стволо-
вых клеток при миело- и лимфопоэзе. Определяющая роль в этих измене-
ниях свойств стволовых клеток внешних для них факторов особенно от-
четливо показана в опытах с клонированием in vivo стволовых клеток
10—11-дневных эмбрионов мыши. В селезенке взрослой мыши, облучен-
ной смертельными дозами рентгеновских лучей, эти стволовые эмбрио-
нальные клетки формируют колонии не эмбрионального, а дефинитивного
гемопоэза.
Таким образом, полученные в последнее время данные по становле-
нию в онтогенезе кроветворных и лимфоидных систем свидетельствуют
о глубоком единстве этих систем. Основу такого единства составляет на-
личие в них общего фонда мультипотентных родоначальных стволовых
клеток. Их мультипотентность проявляется не только в разнообразии на-
правлений дифференцировки в дефинитивных системах. Они способны
существенно менять программу дифференцировки в ходе развития и при
однозначной специализации клеток, как это было показано выше на при-
мере эритропоэза.
Необходимо, однако, подчеркнуть, что, несмотря на большие успехи
в изучении гистогенеза кроветворных и лимфоидных систем, целый ряд
принципиальных вопросов становления и усиления интегративных меха-
221
низмов в онтогенезе требует еще специальных систематических иссле-
дований.
Значительно лучше обстоит дело с выяснением тонких механизмов,
обусловливающих интеграцию дефинитивных трофических и защитных
разновидностей тканей внутренней среды. По самой сути функциональ-
ной специализации рыхлая соединительная ткань, кровь и лимфоидная
ткань представляют собой лишь специализированные разновидности еди-
ной трофической и защитной системы организма. Этот общий достаточно
тривиальный вывод получает все большее и большее подтверждение
по мере углубления наших знаний о морфобиохимической организации
клеток и межклеточных структур и их конкретном функциональном зна-
чении в реализации трофической и защитной функций тканей внутрен-
ней среды. Действительно, все разнообразные специализированные клетки
рыхлой соединительной ткани представляют собой по сути дела единый
трофический и контролирующий аппарат, диффузно рассредоточенный
в организме. Он находится в неразрывной функциональной связи с за-
щитной и трофической системами крови, лимфы и лимфоидных органов.
Особенно ярко функциональное единство трех этих частных систем
проявляется в патологических условиях, и в частности при реализации
древней и универсальной для всех многоклеточных животных воспали-
тельной реакции. Как хорошо известно еще со времен Мечникова, воспа-
лительную реакцию можно расчленить на несколько последовательных
этапов. Естественно, что у высших позвоночных животных с их весьма'
дифференцированными защитными системами каждый из этих этапов
характеризуется сложными биохимическими процессами в очаге вос-
паления.
В первой деструктивно-эксудативной фазе воспалительной реакции
существенные изменения в очаге воспаления начинаются сразу же после
травмы. Они проявляются в развитии деструктивных процессов в меж-
клеточных структурах рыхлой соединительной ткани и в реакции со сто-
роны сосудистой стенки. Эти изменения в очаге воспаления представ-
ляют собой последовательно развертывающийся во времени комплекс
биохимических процессов. На самых ранних этапах развития воспали-
тельной реакции в межклеточном веществе происходит диссоциация
мукопротеидных комплексов, что вызывает резкий сдвиг pH в кислую-
сторону. Одновременно в связи с увеличением проницаемости сосудистой
стенки наблюдается усиленный выход в пораженные ткани воды и дру-
гих компонентов плазмы крови и лимфы. Это приводит к резкому обвод-
нению, отеку участка пораженных тканей, который усиливается еще и
благодаря закупорке мелких сосудов образующимся фибрином. Вос-
палительный очаг, таким образом, оказывается в известной мере изоли-
рованным от организма в биохимическом отношении. В травмированной
области начинается набухание и деструкция коллагеновых волокон, бла-
годаря изменению pH среды и активации гидролитических ферментов.
Последние появляются в межклеточном веществе при разрушении пора-
женных клеток, а также из лизосом активизирующихся фибробластов.
На фоне развития этого сложного комплекса физико-химических и
биохимических процессов, составляющих основу деструктивно-эксудатив-
ной фазы воспалительной реакции, начинает развертываться и ее сле-
дующий защитно-фагоцитарный этап. Ведущее значение в нем у млеко-
питающих принадлежит клеточным элементам крови, которые в больших
количествах выселяются из сосудов. В этой фазе реакции принимают
участие нейтрофильные лейкоциты, моноциты, лимфоциты и отчасти
эозинофилы. Первыми в очаге воспаления оказываются нейтрофилы,
которые являются весьма активными микрофагами. Они поглощают попа-
дающие в очаг воспаления микроорганизмы и переваривают их при по-
мощи лизосом. Кроме того, имеет место массовая гибель нейтрофилов.
Количество гидролитических ферментов в межклеточном веществе резко
222
возрастает, что обусловливает усиление деструктивных процессов в трав-
мированных волокнах соединительной ткани. К этому времени в очаге
воспаления начинают уже накапливаться макрофаги, которые гетерогенны
по своему происхождению. Часть их развивается из гистиоцитов соедини-
тельной ткани. Основным же источником формирования макрофагов слу-
жат моноциты и лимфоциты, выселяющиеся к этому времени из окру-
жающих сосудов. Трансформация этих клеток в макрофаги происходит
путем активизации в них метаболических систем, обусловливающих син-
тез гидролитических ферментов и формирование лизосом. Активизация
лизосомного аппарата, как и стимуляция фагоцитарной активности, про-
исходит под влиянием веществ, выделяемых эозинофильными лейкоци-
тами. Активные макрофаги в очаге воспаления интенсивно фагоцитируют
и переваривают остатки погибших клеток и полуразрушенные структуры
межклеточного вещества. Они создают, таким образом, необходимые
предпосылки для завершающей регенераторной фазы воспалительной
реакции, где основную роль играют фибробласты, количество которых
увеличивается за счет их размножения и размножения периваскулярных
камбиальных клеток. Имеется предположение, что источником развития
фибробластов могут быть циркулирующие в крови стволовые стромаль-
ные клетки, имеющие вид лимфоцитов. Они трансформируются в направ-
лении специализированных оседлых элементов соединительной ткани.
Одновременно происходит также и увеличение количества тучных клеток.
На ранних сроках развития регенераторной фазы воспалительной ре-
акции клетки соединительной ткани вырабатывают преимущественно
мукополисахариды и лишь через некоторое время приступают к фибрилло-
генезу. Он протекает весьма интенсивно, благодаря чему вокруг трав-
мированного участка вскоре формируется соединительнотканная капсула.
Из краткой характеристики процессов, происходящих при воспали-
тельной реакции у млекопитающих, четко выявляется весьма совершен-
ная координация деятельности различных клеточных элементов крови
и соединительной ткани. Очевидно, что такая координация отражает
единство всей рассматриваемой тканевой системы, имеющее глубокие
исторические корни.
Единство трофических и защитных разновидностей тканей внутрен-
ней среды не менее отчетливо проявляется и в организации дефинитив-
ных кроветворных систем. Как следует из приведенных в предыдущих
разделах фактов, общим источником всех специализированных клеток
крови и лимфоидной ткани являются мультипотентные камбиальные
стволовые клетки (Фриденштейн, Чертков, 1969, и др.). За счет размно-
жения и первичной дифференцировки этих клеток формируется система
рабочего камбия, состоящая из полустволовых, более узко детерминиро-
ванных клеток.
Продукты их размножения дифференцируются в направлении эритро-
цитов, зернистых лейкоцитов, мегакариоцитов, лимфоцитов и моноцитов.
Процесс дифференцировки может быть ограничен одним определенным
направлением, как в случае развития эритроцитов или мегакариоцитов.
Могут наблюдаться и более сложные отношения, как например
при развитии лимфоидных элементов, когда образуются и две резко
различающиеся по своим биологическим свойствам популяции костно-
мозговых и тимических лимфоцитов и лимфоциты, выполняющие другие
функции. Из этого источника формируются и все гистиоциты соединитель-
ной ткани и близкие к ним моноциты крови. Среди незернистых лейко-
цитов имеются и клетки, способные к глубокой дедифференцировке и
превращению в общие стволовые клетки миелоидной ткани. Возможно,
что для каждой из разновидностей незернистых лейкоцитов существует
свой особый фонд полустволовых клеток, аналогичный таким фондам
для эритроидного ряда или мегакариоцитов. Несмотря на такую сложную
и неясную еще в деталях (особенно в отношении полустволовых клеток)
223
дифференцировку миелоидной и лимфоидной тканей, в настоящее время
достаточно убедительно показано гистогенетическое единство всех сво-
бодных и подвижных клеток крови, лимфоидной и соединительной
тканей.
Сложнее обстоит дело с оседлыми, или так называемыми стромаль-
ными, клетками. В рассматриваемых тканях к ним относятся клетки
фибробластического ряда и часть клеток ретикулярной ткани.
Детальный анализ динамики изменений численного и качественного
состава клеточных популяций при культивировании костного мозга в ус-
ловиях in vitro выявил существенные различия в поведении камбиальных
клеток, оседлых и свободных клеточных элементов (Лурия, 1972, и др.).
На ранних сроках культивирования преобладают процессы репродукции
и специфической дифференцировки свободных клеток. В дальнейшем
наблюдается трансформация свободных недифференцированных клеток
в макрофаги. Одновременно происходит истощение фонда полустволовых
и стволовых клеток и ликвидация всей системы свободных клеточных
элементов. Этот процесс завершается при обычных методах культивиро-
вания к 7—9-м суткам. Отсутствие стволовых кроветворных клеток в си-
стеме к этому сроку может быть хорошо продемонстрировано опытами
с подсадкой суспензий из такого рода культур животным, облученным
смертельной дозой рентгеновских лучей. В этих опытах не удавалось
наблюдать восстановления кроветворной системы и развития кроветвор-
ных колоний в селезенке.
Несмотря на истощение системы свободных элементов к 7—9-м сут-
кам культивирования миелоидной ткани, культуры не погибают. В них
.формируются группы отростчатых фибробластоподобных клеток, источ-
ником развития которых являются отдельные ретикулярные клетки, ко-
торые в условиях in vitro сохраняют способность к репродукции и форми-
рованию клонов оседлых стромальных клеток. Эти факты, а также целый
ряд других наблюдений позволяют предположить, что в тканях внутрен-
ней среды высших позвоночных, помимо стволовых клеток, образующих
разнообразные подвижные элементы крови, лимфоидной ткани и соеди-
нительной ткани, имеется и специальная система стволовых клеток для
оседлых клеток, образующих строму кроветворных и лимфоидных орга-
нов и являющихся основными клетками рыхлой соединительной ткани.
Весьма возможно, что эти стромальные стволовые клетки могут нахо-
диться в двух различных состояниях — в виде отростчатых оседлых кле-
ток и в виде подвижных циркулирующих в крови свободных клеток.
Однако по своим биологическим свойствам они сходны между собой и
принципиально отличны от обычных незернистых лейкоцитов. Продукты
размножения этих клеток могут дифференцироваться лишь в направле-
нии оседлых стромальных клеточных элементов.
В свете э^их фактов и представлений вновь приобретает большую
актуальность поднятый акад. А. А. Заварзиным (Заварзин, 1945, 1947)
вопрос о расчленении или расщеплении единого камбия в тканях внут-
ренней среды как проявлении прогрессивной филогенетической диффе-
ренцировки этих тканей у высших позвоночных животных. Для решения
этого вопроса большую роль должны сыграть сравнительно-гистологи-
ческие исследования тканей внутренней среды у низших позвоночных
на том методическом и экспериментальном уровнях, которые достигнуты
сейчас в отношении лабораторных млекопитающих. Такие исследования
в настоящее время, к сожалению, почти полностью отсутствуют.
Наряду с представлением о том, что выделение двух относительно
автономных камбиальных систем в тканях внутренней среды у позво-
ночных представляет собой эволюционное расщепление первично единой
системы, в последнее время развиваются и иные взгляды (Willmer,
1970). Высказывается мнение о том, что различия между стромальными
оседлыми и подвижными клетками имеют глубокие исторические корни.
224
Системы подвижных и оседлых клеток, по этим представлениям, явля-
ются отражением двух первичных основных состояний клеток предков
всех многоклеточных организмов. С этой точки зрения наличие гисто-
гепетической расчлененности системы ткапей внутренней среды у со-
временных многоклеточных животных отражает отношения, имевшие
место па ранних этапах эволюции многоклеточных животпых.
Несмотря па возможное расчленение и даже, больше того, благодаря
этому «эволюционному расщеплению» единого камбия у млекопитающих,
функциональное единство и интеграция этих ткапей оказываются зна-
чительно усиленными.
Отсутствие гистогенетического единства системы компенсируется
сложнейшими и весьма совершенными физическими и химическими
кооперативными взаимодействиями между стромальными и свободными
клетками. К сожалению, во многих случаях, и в частности в лимфоидной
и миелоидной тканях, сущность этих взаимодействий и их конкретные
механизмы остаются для пас неясными. Однако в настоящее время уже
не вызывает сомнений их громадное значение в сложной функции мие-
лоидной и лимфоидной ткапей (в регуляции процессов миелопоэза и кле-
точных дифференцировок, связанных с реакциями адаптивного имму-
нитета) .
Глава 2
ТРОФИЧЕСКИЕ И ЗАЩИТНЫЕ РАЗНОВИДНОСТИ
ТКАНЕЙ ВНУТРЕННЕЙ СРЕДЫ БЕСПОЗВОНОЧНЫХ
ЖИВОТНЫХ
МЕЖУТОЧНЫЕ ИНТЕРСТИЦИАЛЬНЫЕ ТКАНИ
Интерстициальные ткани, заполняющие пространства между основ-
ными системами органов, у подавляющего большинства современных бес-
позвоночных животных построены принципиально сходно. Основными
компонентами этих тканей являются оседлые отростчатые клетки и меж-
клеточные структуры. Интерстициальные ткани, как и все другие разно-
видности тканей внутренней среды, развились из примитивной паренхимы
первичных многоклеточных животных. Такие паренхимы были образо-
ваны системой клеточных элементов и межклеточным студенистым ве-
ществом.
В многочисленных сравнительно-гистологических работах конца
XIX и первой половины XX века накоплен большой фактический мате-
риал, свидетельствующий о разнообразии строения рассматриваемых тка-
ней у представителей различных систематических групп и в пределах
каждой группы. Это разнообразие проявляется и в степени развития интер-
стициальных тканей, и в различном соотношении клеток и межклеточ-
ных структур, и, наконец, в количественных и качественных особенно-
стях дифференцировки клеток и межклеточных структур.
Подробный разбор данных по соединительным тканям всех групп
беспозвоночных животных выходит за рамки задач книги. Поэтому мы
остановимся лишь на краткой характеристике некоторых общих законо-
мерностей их морфобиохимической организации преимущественно па
основании современных цитологических исследований соединительных
тканей у представителей основных групп низших многоклеточных и пер-
вичноротых животных.
С эволюционной точки зрения весьма интересной представляется ор-
ганизация интерстициальной ткани у низших многоклеточных, а именно
у кишечнополостных и гребневиков. Эта ткань, получившая название
15 А. А. Заварзин
225
мезоглеи, сильно отличается по своему строению и степени развития
у разных представителей этих животных. У таких вторично упрощенных
животных, как пресноводная гидра, она представлена тонкими, не содер-
жащими клеток, прослойками межклеточного вещества. Наоборот, у акти-
ний и у сцифомедуз это весьма мощная студенистая ткань с большим
количеством пластинчатых и волокнистых структур с амебоидными и,
возможно, оседлыми отростчатыми клетками (рис. 97). На основании
разнообразия строения этой межуточной ткани акад. А. А. Заварзин (За-
варзин, 1945, 1947) высказал предположение о том, что в пределах типа
кишечнополостных имеет место тенденция к формированию своеобразной
разновидности тканей внутренней среды. Ее особенностью у высших
представителей кишечнополостных, согласно этому предположению, явля-
ется двойственное происхождение этой ткани. Одну из составных ее ча-
стей образуют межклеточные структуры, возникающие в результате син-
тетической деятельности эпителиальных клеток. Вторым компонентом
развитых мезоглей кишечнополостных являются межклеточные струк-
туры, выделяемые уже собственно мезоглиальными клетками, хотя по-
следние мигрируют в мезоглею из эпителия уже в постнатальном разви-
тии животных.
Биохимическому и морфологическому анализу мезоглеи у кишечно-
полостных и гребневиков посвящена обширная современная литература
(см. обзор: Elder, 1973). Биохимический и дифракционный апализ пока-
зал наличие в мезоглее коллагеноподобных белков. Однако эти белки
в мезоглее изученных представителей кишечнополостных не образуют
характерных поперечноисчерченных фибрилл, т. е. они имеют иную
надмолекулярную организацию, чем у позвоночных животных. Морфо-
логическими и биохимическими методами показано наличие у многих
кишечнополостных эластиноподобных структур. Они отсутствуют лишь
в классе Anthozoa, а наивысшего развития достигают у сцифомедуз.
У этих животных эластиноподобные волокна образованы тонкими прото-
фибриллами с небольшой поперечной исчерченностью и поперечными
мостиками между соседними протофибриллами. В отличие от эласти-
ческих волокон позвоночных здесь полностью отсутствует аморфный
матрикс.
В морфологических работах, выполненных на гидре (Hausman, Burnett,
1969) и гребневике (Bargmann, 1972), удалось вскрыть ряд тонких дета-
лей организации межклеточных структур. У гидры под эпителием име-
ется слой продольно ориентированных фибрилл диаметром 0.3 мкм,
образованных, по мнению авторов, коллагено- и эластиноподобными бел-
ками. Пространство между ними заполнено мукопротеидами. Основу
мезоглиальной пластинки составляет аморфная гелеобразная масса из
коллагеноподобных белков.
У гребневика Pleurobranchia pileus с более развитой мезоглеей она
образована системой мембран и пластинок разной толщины, непосредст-
венно связанных с базальными подэпителиальпыми мембранами. Между
этими пластинками располагаются спиральные волокна без характерной
для коллагена поперечной исчерченности. Межклеточные структуры мезо-
глеи, и в частности спиральные волокна, обнаруживают тесную связь
с сократимыми элементами. Здесь наблюдаются взаимоотношения, сход-
ные с взаимоотношениями гладких мышечных клеток и эластических во-
локон в стенках сосудов позвоночных животных. К сожалению, данные
по ультраструктурной организации клеточных элементов мезоглеи у ки-
шечнополостных и гребневиков в настоящее время отсутствуют. В связи
с этим вопрос о возможности формирования ее межклеточных структур
за счет синтетической деятельности клеток, находящихся в мезоглее,
остается открытым. Весьма слабо изучены также и мукопротеиды аморф-
ного вещества, заполняющего промежутки между фибриллярными струк-
турами.
226
Проведенное недавно подробное изучение строения и морфобиохими-
ческой организации коллагеновых волокон и основного вещества интер-
стициальной ткани морской губки Chondrosia reniformis показало наличие
у волокон поперечной исчерченности с периодичностью 660 А и выявило
глюкопротеидную природу основного вещества, находящегося в тесной
структурной связи с волокнами (Carrone et al., 1975). У иглокожих наи-
более изучены современными методами интерстициальные соединитель-
ные ткани кожи голотурий. Стенку тела животных образует здесь мощ-
ная сеть коллагеновых волокон, имеющих типичную для коллагеновых
волокон позвоночных ультраструктурную организацию. Обнаружены
здесь и типичные фибробласты, которые, очевидно, и продуцируют
основную массу межклеточ-
ных структур. В соедини-
тельной ткани голотурий вы-
являются также и фибриллы,
не имеющие характерной для
коллагена поперечной исчер-
ченности. На светооптическом
уровне удается выявить тон-
кие волоконца, окрашиваю-
щиеся некоторыми специфиче-
скими для эластических во-
локон красителями (Elder,
1973).
Рис. 97. Участок мезоглеи сцифо-
медузы.
I — базальная мембрана, 2 — волокна и
пластинки межклеточного вещества.
Из первичноротых животных наибольшего развития, как по общему
удельному значению в организме, так и по обилию разнообразных кле-
точных элементов, интерстициальная соединительная ткань достигает
у моллюсков. Она относительно хорошо изучена у брюхоногих и пластин-
чатожаберных моллюсков. Для всех представителей этих классов харак-
терным является наличие прослоек межклеточного вещества с типичными
коллагеновыми волокнами и пластинками аморфного, по-видимому муко-
протеидного, матрикса. Межклеточные структуры образуют стенку лакун
и каналов, в которых циркулирует тканевая жидкость. Стенки таких
каналов могут быть ограничены системой закономерно ориентированных
коллагеновых фибрилл и снабжены мышечным аппаратом. Особенно
большого совершенства и сложности организации достигает эта внекле-
точная трофическая транспортная система в центральной нервной си-
стеме головоногих моллюсков (Gray, 1969). В стенках крупных сосудов
у головоногих и пластинчатожаберных моллюсков имеется хорошо разви-
тая концентрическая сеть эластиноподобных волокон. В составе муко-
полисахаридов кожи головоногих моллюсков обнаружены хондроитин-
сульфат и целлюлоза (Hunt, 1972).
Для всех изученных представителей разных классов моллюсков ха-
рактерно также наличие большего или меньшего количества типичных
фибробластов. Ультраструктурный анализ этих клеток проведен в настоя-
щее время у ряда представителей брюхоногих моллюсков (Plummer, 1966;
Wondrak, 1969; Sminia 1972). У некоторых моллюсков удалось выявить
ряд интересных особенностей в организации клеток и характере их
взаимоотношения с межклеточными структурами.
Так, в частности, у брюхоногого моллюска Arion rufus фибробласты
имеют весьма развитую систему уплощенных цистерн аппарата Гольджи,
занимающих значительную часть цитоплазмы клетки (рис. 98). На гра-
15*
227
нице с межклеточным веществом периферическая часть цитоплазмы об-
разует многочисленные конусовидные выросты, внедряющиеся в меж-
клеточное вещество. Кроме того, в основании выростов имеются глубо-
кие трубкообразпые впячивапия, в дистальную часть которых происходит
выделение синтезируемых клеткой белков и мукополисахаридов. Оформ-
леппые коллагеновые фибриллы с характерной испорченностью обнару-
живаются несколько отступя от вершины цитоплазматических выростов.
Пространство между ними и поверхностью клеток занято волокнистыми
структурами, находящимися, по-видимому, на последовательных этапах
полимеризации. У других видов брюхопогих моллюсков имеются фибро-
Рис. 98. Схема ультраструктурной организации фибробласта интерстициальной
соединительной ткани брюхоногого моллюска Arion rufus. (По электронной микро-
фотографии: Wondrak, 1969, рис. В. К. Четверухина).
1 — аппарат Гольджи, 2 — складки плазматической мембраны, 3 — коллагеновые волокна.
бласты с внутриклеточной локализацией коллагеновых фибрилл (Smi-
nia, 1972). Помимо типичных фибробластов, у разных представителей
описаны и другие типы оседлых клеточных элементов: пузырчатые, пиг-
ментные, зерпистые и, наконец, своеобразные, так называемые поровые
клетки. Что касается первых трех типов, то они представляют собой
либо резервные депо гликогепа (пузырчатые клетки), либо своеобразные
экскреторные элементы (зернистые, а возможно, и пигментные клетки).
Особенностью поровых клеток является наличие у них глубоких щеле-
видных впячивапий плазматической мембраны и системы образованных
ею каналов и цистерн в периферических участках цитоплазмы (рис. 99).
Кроме того, клетки обладают хорошо развитой гранулярной эндоплазма-
тической сетью и могут содержать значительные запасы гликогепа. По
поводу функционального значения этих клеток в современной литературе
ведется оживленная дискуссия. Им приписывали еще недавно роль фиб-
робластов (Plummer, 1966; Nicaise et al., 1966), фагоцитов (Buchholz et al.,
1971), резервных клеток—накопителей гликогена (Wondrak, 1969;
Ruddell, Welligs, 1971). В последнее время появились, однако, убедитель-
ные данные о том, что по крайней мере у некоторых представителей
брюхоногих моллюсков основной функцией этих клеток является синтез
и выведение в тканевую жидкость дыхательных пигментов. При этом
228
у животных, содержащих гемоцианины (Lymnaea stagnalis), они продуци-
руют гемоцианин, а у моллюсков, использующих в качестве дыхатель-
ного пигмента гемоглобин, поровые клетки синтезируют этот сильно от-
личающийся по своей химической структуре от гемоцианина дыхатель-
ный пигмент (Sminia, 1972; Sminia et al., 1972). Возможно, однако, что
приведенные противоречивые данные в отношении роли поровых клеток
у разных представителей моллюсков отражают лишь филогенетическую
пластичность этой мультипотептной в функциональном отношении разно-
видности клеток.
Значительно меньший удельный вес имеет интерстициальная соеди-
нительная ткань у кольчатых червей и близких к ним групп мпогокле-
Рис. 99. Схема ультраструктурной организации поровой клетки из интерстициальной
ткани брюхоногого моллюска. (Из: Plummer, 1966).
1 — впячивания плазматической мембраны, 2 — шероховатая эндоплазматическая сеть.
точных животных с хорошо развитой вторичной полостью тела. У этих
животных соединительная ткань представлена лишь небольшими интер-
септальпыми и межмышечными прослойками, относительно бедными кле-
точными элементами. Межклеточное вещество образовано типичными
коллагеновыми волокнами и мукополисахаридами, дающими положитель-
ную окраску па кислые полисахариды. Подробной ультраструктурной
характеристики фибробластов и их взаимоотношений с межклеточными
структурами в литературе обнаружить не удалось. Имеются данные, что
часть межклеточных структур может синтезироваться элементами мы-
шечных тканей. Высказываются также предположения и об эпителиаль-
ном происхождении коллагеновых волокон (Boilly, 1970). При этом спо-
собностью к синтезу коллагена и сопутствующих ему мукопротеидов
обладают и кожный, и кишечный, и целомический эпителии (Nakao,
1974).
У некоторых полихет обнаружена хорошо развитая система волокон
неколлагеновой природы, играющая роль аппарата антагонистичного мы-
шечной системе кожпо-мускулыюго мешка (Elder, 1972). Эластштопо-
добпые структуры описаны и у других представителей полихет, а также
у сипункулид, приапулид и пиявок.
Особый интерес с эволюционной точки зрения представляют данные
о строении интерстициальной соединительной ткани у высших пред-
229
ставителей первичноротых животных — насекомых и ракообразных.
У насекомых в связи с небольшими размерами тела, наличием наружного
скелета и трахейной системы ткани внутренней среды имеют значи-
тельно меньшее значение, чем у позвоночных животных. У разных пред-
ставителей насекомых соединительная ткань имеет различное строение.
Так, например, у личинки жука-носорога и у взрослых животных она
представлена пластинками аморфного вещества и волокнистыми струк-
турами; здесь не обнаружены оседлые фибробластические элементы
(рис. 100, а). С другой стороны, у шелкопрядов в межклеточном ве-
ществе имеется относительно большое количество оседлых фибробластов,
структурно тесно связанных с продуцируемыми межклеточными струк-
Рис. 100. Интерстициальная соединительная ткань насекомых.
а — участок бесклеточной соединительной ткани личинки жука-носорога (из: Лазаренко, 1925);
б — схема ультраструктурной организации периневральной соединительной ткани у шелкопряда
по: Locke, Huie, 1972; рис. С. А. Быстрова). 1 — коллагеновые фибриллы, 2 — фибриллы неизвест-
ной химической природы, з — аморфный матрикс.
турами (см. обзор: Заварзин, 1945, 1947). Особенностью последних яв-
ляется наличие здесь, помимо типичных коллагеновых волокон, особых
фибриллярных структур, значительно большего диаметра (рис. 100, б).
В бесклеточной соединительной ткани внутренней выстилки сердца од-
ного из представителей прямокрылых, помимо коллагеновых волокон и
мукополисахаридного матрикса, описаны волокна, полностью удаляемые
из срезов при действии специфического для эластина фермента — эла-
стазы (Baccetti, Bigliardi, 1969). У насекомых широкое распространение
получили и аналоги эластических волокон — резилиновые волокна, обра-
зованные особым белком — резилином. В стенке крупных сосудов высших
раков и крабов имеются пластинки межклеточного вещества, дающего
положительную окраску на эластические структуры.
Анализ ультраструктурной организации образующих межклеточные
структуры клеток у некоторых насекомых показал наличие сходных
признаков с фибробластами позвоночных животных (Ashhurst, 1968).
Так, у многих насекомых клетки, образующие межклеточные структуры
периневральной пластинки, обладают развитым белоксинтезирующим ап-
паратом в виде шероховатой эндоплазматической сети. Ее цистерны свя-
230
заны с вакуолями, содержащими волокнистые структуры. Однако взаимо-
отношения фибробластов с межклеточным веществом, а также выведе-
ние синтезируемых в клетках белков и мукополисахаридов у насекомых
отличаются, по-видимому, рядом существенных особенностей. Здесь уда-
ется иногда наблюдать внутриклеточную локализацию коллагеновых
фибрилл и картины, свидетельствующие о наличии своеобразной апо-
криновой секреции. Особенно отчетливо внутриклеточную локализацию
оформленных коллагеновых структур удается наблюдать в вакуолях кле-
ток эпителия мальпигиевых сосудов, обладающих способностью к синтезу
и выделению коллагена.
Наряду с известным уменьшением у насекомых по сравнению с дру-
гими многоклеточными животными удельного значения в трофической
функции собственно соединительной ткани, для большинства насекомых
характерно развитие на основе тканей внутренней среды аппарата про-
межуточного обмена, так называемого жирового тела (Locke, Collins, 1965;
Locke, McMahon, 1971).
Жировое тело насекомых является функциональным аналогом пе-
чени позвоночных. В клетках жирового тела большого развития дости-
гает гранулярная эндоплазматическая сеть. Наряду с этим имеется и
агранулярный ретикулум. В цитоплазме обнаруживается большое коли-
чество митохондрий и структуры, свидетельствующие о мощном разви-
тии лизосомного аппарата. Ядерные структуры характеризуются при-
знаками, специфичными для активно метаболирующих клеток. Весьма
характерной особенностью клеток жирового тела насекомых является на-
личие у них полиплоидных ядер, при этом степень полиплоидизации
значительно выше, чем в клетках печени у позвоночных животных
(Wigglesworth, 1967).
В функциональном отношении клетки жирового тела характеризу-
ются, как и клетки печени позвоночных, разносторонней деятельностью.
Они синтезируют, накапливают и выделяют в кровь липиды и играют
центральную роль в углеводном обмене. Клетки жирового тела могут по-
глощать готовые белки из гемолимфы и откладывать их в виде запасных
гранул, а также способны и к интенсивному синтезу белков своим белок-
синтезирующим аппаратом. Мощно развитая система внутриклеточного
пищеварения этих клеток обеспечивает расщепление запасенных высоко-
молекулярных соединений и выведение продуктов гидролиза в гемолимфу.
Специфической особенностью клеток жирового тела является их функ-
циональная пластичность на различных этапах жизненного цикла насе-
комых. В этих клетках могут преобладать либо синтетические процессы,
либо процессы накопления органических соединений, либо, наконец, ка-
таболические процессы, связанные с необходимостью реализации высоко-
молекулярных органических соединений, накопленных в цитоплазме
клеток.
Таким образом, краткий обзор современных данных о морфобиохимиче-
ской организации интерстициальных соединительных тканей беспозвоноч-
ных животных показывает их большее разнообразие по сравнению с соеди-
нительной тканью позвоночных животных. Наряду с типичными для
этих тканей клеточными элементами и межклеточными структурами
(фибробластами, коллагеновыми и эластиноподобными волокнами),
имеющими универсальное распространение в соединительных тканях
представителей всех типов животных, обнаруживаются и своеобразные
специфические только для тканей этих животных специализированные
элементы. К ним относятся и клетки жирового тела насекомых, и
продуцирующие дыхательные пигменты поровые клетки моллюсков, и,
по-видимому, целый ряд клеточных элементов и межклеточных структур
у представителей других групп животных. Такое разнообразие дифферен-
цировок в рассматриваемой разновидности тканей внутренней среды от-
ражает, очевидно, отмеченную выше их филогенетическую пластичность.
231
Филогенетическая пластичность межуточных тканей у многоклеточ-
ных животных проявляется и в модификациях морфобиохимической ор-
ганизации их межклеточных структур и синтезирующих их клеточных
элементов.
К сожалению, сравнительно-гистологические и сравнительно-цитоло-
гические данные по этому вопросу еще далеко не достаточны для широ-
ких сопоставлений на уровне современных методических возможностей.
Наиболее подробно изучены в настоящее время в сравнительном аспекте
коллагеновые структуры соединительной ткани (см. обзоры: Mathews,
1967; Hunt, 1970). В многочисленных сравнительно-биохимических,
а в последнее время и ультраструктурных исследованиях показано универ-
сальное распространение коллагена и коллагеноподобных белков у отдель-
ных представителей разных типов многоклеточных, а также сходный ха-
рактер их надмолекулярной организации (позвоночные, иглокожие, мол-
люски, кольчатые черви и членистоногие). Наряду с этим обнаружен и
ряд специфических особенностей коллагена и образуемых им структур
у беспозвоночных животных. Особенностью коллагенов беспозвоночных
животпых является, в частности, относительно большее, чем у позвоноч-
ных животных, варьирование аминокислотного состава, за исключением
глицина. Относительное количество этой наиболее характерной для кол-
лагенов аминокислоты не бывает меньше 30 и больше 34%. Второй
особенностью коллагеновых структур беспозвоночных является большой
процент углеводов, участвующих в формировании надмолекулярных
структур. Если у позвоночных животных их не больше 2%, то известны
коллагены беспозвоночных, содержание углеводов в которых дости-
гает 20 %.
Естественно, что большому разнообразию беспозвоночных животных
соответствует и большее разнообразие образуемых их коллагенами меж-
клеточных структур. Наряду с коллагеновыми фибриллами с поперечной
исчерченностью у беспозвоночных имеются фибриллы с другой перио-
дичностью расположения молекул тропоколлагена или вообще не обна-
руживающие поперечной исчерченности.
Особенно характерна такого рода своеобразная надмолекулярная ор-
ганизация коллагена для кишечнополостных. При этом у изученных
представителей кишечнополостных степень развития и дифференциро-
ванности коллагеновых структур весьма разнообразна. Широкое распро-
странение у беспозвоночных животных имеют коллагеновые структуры
эпителиального и мышечного происхождения.
Мепее изучены биохимические особенности организации у беспозво-
ночных других компонентов межклеточного вещества — аморфного мат-
рикса и волокон неколлагеновой природы. Последние отличаются еще
большим разнообразием модификаций единого структурно-функциональ-
ного и, по-видимому, химического типа организации. Прежде всего не-
обходимо отметить, что по своей ультраструктурной организации эла-
стипоподобпые волокна беспозвоночных животных сходны не со зрелыми
эластическими волокнами позвоночных, а с волокнами па их начальной
стадии формирования, когда у них отсутствует аморфный матрикс. На
основании единичных сравнительно-биохимических работ можно предпо-
лагать, что по крайней мере у некоторых представителей беспозвоночных
рассматриваемые волокна образованы функциональным аналогом эла-
стина, особым белком, резилином. Его аминокислотный состав сущест-
венно отличается от эластина (Hunt, 1970). Эластипоподобпые волокна
у беспозвоночных отличаются по своей ультраструктурной организации
и у представителей отдельных типов животпых. При этом кишечнополост-
ные и членистоногие имеют один тип ультраструктурной организации,
а моллюски и кольчатые черви другой, существенно отличающийся тип
ультраструктурной организации эластиноподобных волокон (Elder, 1973).
Все эти даже отрывочные и единичные наблюдения свидетельствуют,
232
очевидно, о том, что сходная функция у представителей разных групп
многоклеточных животных осуществляется на основе сходной, по далеко
не идентичной морфобиохимической организации. Аналогичная законо-
мерность проявляется весьма наглядно (как это будет показано ниже па
примере хрящевых тканей) и в химической и в структурной организации
основного межклеточного вещества. К сожалению, в отношении этого
компонента соединительной ткани беспозвоночных современные сравни-
тельно-биохимические данные почти полностью отсутствуют.
Естественно, что многообразию модификаций сходных межклеточных
структур соответствуют и модификации морфобиохимической организа-
ции образующих их оседлых клеточных элементов соединительных тка-
ней. Фибробласты позвоночных, моллюсков, насекомых и других живот-
ных — явно не идентичные клеточные элементы. Однако детальный срав-
нительно-цитологический анализ фибробластов представляет собой весьма
актуальную задачу дальнейших исследований.
СВОБОДНЫЕ КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ КРОВИ,
ПОЛОСТНОЙ И ТКАНЕВОЙ ЖИДКОСТЕЙ
И ИХ ФУНКЦИОНАЛЬНОЕ ЗНАЧЕНИЕ
Исключительно важная роль у беспозвоночных принадлежит системе
свободных подвижных клеточных элементов тканей внутренней среды,
а также той жидкой среде, в которой сосредоточены и функционируют
различные типы таких клеток. Последняя представлена кровью и ткане-
вой жидкостью при замкнутой кровеносной системе или общей для всего
организма тканевой жидкостью типа гемолимфы членистоногих. У жи-
вотных с развитым целомом к рассматриваемой системе следует отнести
и полостную жидкость с находящимися в пей свободными клеточными
элементами. Функциональная специализация клеток, как и химический
состав крови, полостной и тканевой жидкостей, варьирует в широких
пределах у разных групп беспозвоночных.
Несмотря па разнообразие дифференцированных подвижных клеток и
химического состава тканевых жидкостей беспозвоночных, это разнообра-
зие не беспредельно. Так, в частности, у высших первичпоротых живот-
ных (насекомых и других членистоногих), перешедших к жизни в воз-
душной среде, наблюдается ряд общих тенденций изменения химического
состава тканевых жидкостей и гемолимфы (Jeuniaux, 1971). Такими тен-
денциями являются утрата ими роли переносчика кислорода, и соответст-
венно дыхательных пигментов, резкое увеличение в гемолимфе удельного
веса и относительного количества небольших органических молекул. Все
эти тенденции полифилетические по своей природе, они независимо про-
являются в различных группах членистоногих, перешедших к жизни
в воздушной среде.
Весьма демонстративным примером общих тенденций филогенетичес-
кой дифференцировки тканей внутренней среды, при этом не только для
первичпоротых животных, являются механизмы свертывания гемолимфы
у членистоногих (см. обзор: Gregoire, 1971). К сожалению, биохимичес-
кие основы механизмов этой приспособительной реакции, обеспечиваю-
щей предотвращение потери гемолимфы при травмах, изучены еще
весьма слабо. Однако в ряде случаев даже простой феноменологический
анализ рассматриваемого процесса обнаруживает большое сходство с про-
цессами, наблюдаемыми при свертывании крови у позвоночных живот-
ных. Так, у краба Limulus па первом этапе развития процесса коагуля-
ции гемолимфы имеет место агрегация зернистых амебоцитов гемолимфы.
Далее происходит последовательно концентрация гранул в околоядерной
области, формирование клетками псевдоподий и, наконец, выведение
содержимого гранул в окружающую гемолимфу. Процесс завершается
233
разрушением клеток и формированием коагулированного сгустка
гемолимфы (рис. 101). Интересно, что аналогичные изменения
наблюдаются при свертывании крови у млекопитающих (Rodman et al.,
1963). Кажущееся существенное отличие этих процессов по месту лока-
лизации фибриногена (у краба в клетках, у млекопитающих в плазме) —
Рис. 101. Схема изменений ультраструктурной организации амебоцитов краба Limulus
polyphemus при свертывании гемолимфы. (По электронным микрофотографиям: Du-
mont et al., 1966; рис. М. Ю. Пунина).
а—д — последовательные стадии изменений расположения и структуры гранул перед выходом их
содержимого из клеток.
относительно. Одна из фракций фибриногена у млекопитающих нахо-
дится в гранулах кровяных пластинок. Для членистоногих характерным
является весьма большое разнообразие модификаций механизмов сверты-
вания гемолимфы — от их практически полного отсутствия до весьма со-
вершенных механизмов, напоминающих или даже идентичных тем или
иным звеньям этого сложного многоступенчатого процесса у высших
позвоночных животных. Так, в частности, у высших раков и у многих на-
секомых в гемолимфе содержится белок, аналогичный по своим свойст-
вам фибриногену позвоночных животных, а амебоциты, как и кровяные
234
пластинки позвоночных животных, выделяют в основном лишь факторы,
определяющие его превращение в фибрин.
Весьма яркий пример цитологического параллелизма обнаружен не-
давно у одного из представителей двукрылых насекомых Calliphora егу-
throcephala (Zachary, Hoffmann, 1973). У этих животных среди трех типов
амебоцитов имеются клетки, специализированные на образовании свобод-
ных окруженных плазматической мембраной участков цитоплазмы. Эти
плазматические тельца обладают ярко выраженной способностью к аг-
глютинации и осуществляют функцию тромбоза при повреждении тела
животного. Процесс их образования аналогичен процессу образования
кровяных пластинок мегакариоцитами млекопитающих. Перед началом
этого процесса плазматическая мембрана образует глубокие впячивания
Рис. 102. Схема ультраструктурной организации тромбоцитоида мухи Calliphora
erythrocephala при образовании аналогов кровяных пластинок — участков цито-
плазмы, способных к агглютинации. (По электронной микрофотографии из: Zachary,
Hoffman, 1973; рис. С. А. Быстрова).
1 — ядро тромбоцитоида, 2 — организованный участок цитоплазмы («кровяная пластинка»),
3 — агглютинирующие «кровяные пластинки».
внутрь цитоплазмы. Затем происходит массовое отшнуровывание плаз-
матических телец, которые попадают в гемолимфу. На заключительных
этапах процесса амебоцит представлен ядром, окруженным тонким обод-
ком цитоплазмы (рис. 102).
В отличие от мегакариоцитов млекопитающих рассматриваемые амебо-
циты принимают активное участие в изоляции инородного тела, образуя
путем слияния многоядерные симпласты (Zachary et al., 1975).
Весьма интересные данные имеются по распространению и локализа-
ции дыхательных пигментов у многоклеточных беспозвоночных живот-
ных (см. обзоры: Проссер, Браун, 1967; Florkin, 1969; Redmond, 1972;
Bonaventura et al., 1975).
Перенос и резервирование кислорода обеспечивается 4 типами дыха-
тельных пигментов — гемоглобинами, гемоэритринами, хлоропорфиринами
и гемоцианинами. В трех первых акцепторами кислорода являются атомы
железа, в последнем — атомы меди. Принцип работы всех дыхательных
пигментов сходен и разобран уже выше, при анализе гемоглобинов по-
звоночных животных (стр. 186). Белковая часть молекулы дыхательного
пигмента создает такую молекулярную ситуацию, при которой атом ме-
талла приобретает способность образовывать легко диссоциирующие связи
с кислородом. Распространение дыхательных пигментов среди разных
групп беспозвоночных неравномерно. Так, гемоцианины характерны для
моллюсков и ракообразных, гемоэритрины распространены у сипункулид,
приапулид и других близких к полихетам беспозвоночных. Ограниченное
распространение имеют хлоропорфирины, и, наоборот, весьма широко
распространены гемоглобины. Они характерны для низших ракообразных,
235
встречаются у отдельных представителен разных классов моллюсков, по-
лихет и у других беспозвоночных животных. Они имеются даже в гемо-
лимфе водных личинок некоторых насекомых, у которых в большинстве
случаев дыхательные пигменты в гемолимфе отсутствуют.
Известная хаотичность в распространении дыхательных пигментов
проявляется пе только в наличии разных пигментов у представителей од-
ной систематической группы, но и в том, что у некоторых животпых (по-
лихет) в крови имеются сразу два пигмента, причем у молодых форм
преобладает гемоглобин, а у более старых — хлорокруорин.
Детальная химическая характеристика дыхательных пигментов бес-
позвоночных представляет большой интерес для выяснения закономер-
ностей молекулярной эволюции. Одпако в настоящее время еще только
начинаются систематические исследования этого вопроса и то преиму-
щественно в отношении гемоглобинов и гемоэритринов па ограниченном
круге объектов.
В основе организации молекул гемоглобинов лежат мономеры с моле-
кулярным весом 16—17 тыс. Количество таких мономеров в молекуле
может варьировать у беспозвоночных от одного до нескольких десятков
(например, в молекуле гемоглобина Arenicola marina с молекулярным
весом 2 000 000). Изученный у некоторых беспозвоночных аминокислот-
ный состав глобинов отличается от аминокислотного состава глобипов
позвоночных. Так, у аппелид глобины богаче аргипипом и беднее гисти-
дином. У членистоногих, и в частности хирономид, в гемолимфе содер-
жится гемоглобин с относительно небольшим молекулярным весом
(31 000 или даже около 16 000, т. е. димеры и мономеры). Установлено
также, что полипептидпые цепи глобинов у хирономид короче, чем у по-
звоночных, и вместо валина на концах молекул находится глицин. Весьма
интересно, что у этих животных имеется от 8 до 12 различных гемогло-
бинов, белковые цепи которых синтезируются, по-видимому, с помощью
иРНК, считываемых с разных гепов.
Дыхательные пигменты у беспозвоночных животпых в тканях внут-
ренней среды встречаются в двух основных формах: в свободном виде и
в цитоплазме специальных клеток — эритроцитов. Последние у животпых
с хорошо развитым целомом находятся в основном в целомической жид-
кости. Гемоглобины могут иметь как внутриклеточную, так и внеклеточ-
ную локализацию. Гемоэритрины содержатся только в клетках, а гемо-
циапипы и хлорокруорины, наоборот, функционируют лишь впеклеточпо.
Эритроциты имеются у представителей многих типов беспозвоночных
животпых. Опи обнаружены у некоторых видов пемертип, иглокожих,
пластинчатожаберных моллюсков, полихет и близких к пим групп жи-
вотных с хорошо развитой полостью тела. У большинства беспозвоночных
эритроциты содержат гемоглобин. Лишь у сипупкулид, приапулид, не-
которых брахиопод и в крови одпого рода полихет (Magelona} эритро-
циты содержат гемэритрин. Несмотря на такое широкое распростране-
ние эритроцитов, они имеются у перечисленных групп животпых лишь
у отдельных видов. У представителей близкородственных видов эритро-
циты могут отсутствовать, и дыхательная функция крови и полостпой
жидкости осуществляется за счет раствореппых в пих дыхательпых пиг-
мептов. Наконец, у некоторых видов могут отсутствовать и дыхательные
пигменты и эритроциты пли, наоборот, одновременно имеются дыхатель-
ные пигменты в плазме крови и эритроциты в полостной жидкости.
Одной из характерных общих тенденций в дифференцировке этих
клеток является редукция ядериого аппарата. В крайних случаях эта
тенденция приводит к полной утрате ядра клетками. Такие безъядерные
эритроциты обнаружены в полостпой жидкости у одпой из офпур и
в крови Magelona papillicornis (рис. 103).
Безъядерные эритроциты Magelona характеризуются, кроме того,
весьма мелкими размерами и способностью к гемолизу, т. е. аналогичны
236
по многим признакам наиболее совершенным с функциональной точки
зрения безъядерным эритроцитам млекопитающих (Boilly, 1974). Боль-
шое сходство в ультраструктурной организации обнаружено и между
эритроцитами Pnapulus caudatus и эритроцитами низших позвоночных.
Рис. 103. Эритроциты полихет
и приапулид.
а, б — эритроциты приапулиды Priapulus
caudatus (по электронным микрофотогра-
фиям: Mattison, Funge, 1973, рис. С. А. Бы-
строва); в — эритроцит полихеты Mage Iona
papillicornis (по электронным микрофото-
графиям: Boilly, 1974: рис. С. А. Быстрова).
1 — ядро, 2 — шероховатая эндоплазма-
тическая сеть, з — вакуоль с кристалли-
ческими включениями, 4 — дыхательный
пигмент, 5 — впячивание и 6 — разрыв
плазматической мембраны.
В цитоплазме эритроцитов большинства беспозвоночных животных
наблюдаются многочисленные гранулы. Однако конкретная форма струк-
турной организации дыхательных пигментов остается невыясненной. Из-
вестно лишь, что заключенные в клетках гемоглобины имеют меньший
молекулярный вес, чем гемоглобины, функционирующие в растворах.
Мало изучен еще вопрос о гистогенезе эритроцитов у беспозвоночных.
Остаются невыясненными источники развития широко распространенных
полостных эритроцитов. Представляют ли они собой самоподдерживаю-
237
щуюся автономную систему или имеют общий источник развития с гем-
амебоцитами. У полихет и близких к ним групп многоклеточных живот-
ных весьма вероятно происхождение эритроцитов из особых участков
целомического эпителия.
Несколько лучше обстоит дело с анализом процессов биосинтеза сво-
бодных дыхательных пигментов. У брюхоногих моллюсков, как указыва-
лось выше, функцию синтеза дыхательных пигментов берут на себя осо-
бые оседлые элементы соединительной ткани — поровые клетки (Sminia
et al., 1972). При этом у представителей одних видов они продуцируют
гемоцианины, а у других — гемоглобины. У крабов гемоцианин продуци-
руется, по-видимому, в одной из разновидностей амебоцитов (Fahren-
bach, 1968). В противоположность этому у головоногих моллюсков основ-
ным местом синтеза гемоцианина являются клетки бронхиальной же-
лезы, развивающиеся из эктодермы (Dilly, Messenger, 1972). У полихет
растворенные в плазме крови высокомолекулярные гемоглобины син-
тезируются в периваскулярных клетках целомического эпителия
(рис. 104).
Серьезное внимание уже давно уделяется изучению гуморальных и
клеточных защитных механизмов тканей внутренней среды беспозвоноч-
ных животных (Bang, 1967; Cushing, 1967; Salt, 1967).
Много усилий было затрачено на поиски в крови и тканевой жидкости
беспозвоночных животных, особенно у высших представителей — члени-
стоногих, иммуноглобулинов, аналогичных специфическим антителам
позвоночных животных. Однако попытки обнаружить такие белки по край-
ней мере у изученных представителей беспозвоночных животных (насе-
комые, крабы, мечехвосты, сипункулиды, оболочники) не дали положи-
тельных результатов. В тканевых жидкостях этих животных обычно не
содержится патогенных микроорганизмов, что связано с наличием у них
защитных неспецифических бактерицидных веществ широкого спектра
действия. Установлена также возможность предварительной иммуниза-
ции животных к некоторым патогенным микроорганизмам и паразитиче-
ским простейшим. Однако выделяемые при этом защитные вещества не
имеют, по-видимому, ничего общего с антителами. В ряде случаев по-
казано, что это относительно низкомолекулярные термостабильные и
устойчивые к трипсину соединения. Они сразу же появляются в актив-
ной форме и, очевидно, либо находятся в латентном состоянии в ткане-
вой жидкости, либо уже предсуществуют в специальных клетках. Второй
механизм более вероятен. Наряду с этими данными в последнее время
у крабов удалось обнаружить в гемолимфе и особый белок, с бактерицид-
ными свойствами. Он обладает некоторыми общими характеристиками
с иммуноглобулинами круглоротых. Последние по своей структуре су-
щественно отличаются от иммуноглобулинов других позвоночных (см.
обзор: Незлип, 1972).
Еще менее ясен вопрос о трансплантационном иммунитете у беспозво-
ночных животных.
По мнению Солта (Salt, 1961, 1967), способность распознавать
«свое» и «чужое» у высших членистоногих—насекомых осуществляется
путем реакции обволакивания, инкапсуляции инородных компонентов.
Она основана на способности амебоцитов тканей внутренней среды реа-
гировать на чужеродные неадекватные данному организму поверхности
трансплантируемых тканей других организмов. Многие исследователи
считают, что реакции клеточного трансплантационного иммунитета у бес-
позвоночных отсутствуют. Однако более тщательный анализ этого воп-
роса на примере аннелид и иглокожих позволил выявить у них оттор-
жение гомотрансплантатов через длительные сроки после их приживле-
ния (200 дней для аннелид и 155 дней для иглокожих). При вторичной
пересадке гомотрансплантатов эти сроки сокращались соответственно
до 80 и 60 дней (Галактионов, 19756).
238
Рис/ 104. Схема ультраструктурной организации участка целомического эпителия,
продуцирующего гемоглобин, и его взаимоотношений с сосудистой стенкой у полихеты
Arenicola marina. (Из: Dalles, Poill, 1970).
J — клетки целомического эпителия, продуцирующие гемоглобин, 2 — перициты, 3 — мембрана
стенки сосуда, 4 — амебоциты крови, 5 — молекулы гемоглобина.
Универсальной для всех многоклеточных животных защитной реак-
цией тканей внутренней среды является фагоцитарная реакция. Ее
обычно осуществляет специальная система крупных базофильных незер-
нистых амебоцитов, имеющаяся как обязательный компонент ткапей
внутренней среды почти у всех многоклеточных животных. Кроме этого
типа клеток, имеющего универсальное распространение, широко распро-
странены у беспозвоночных животных и различного рода гранулярные
амебоциты. Это менее постоянная разновидность специализированных
клеточных элементов рассматриваемой системы как в смысле возмож-
ности их наличия или отсутствия у близкородственных видов, так и
в смысле различного функционального значения их в разных группах
животных.
Как мы видели выше, у крабов и многих насекомых гранулярные аме-
боциты выполняют важную роль в процессах свертывания гемолимфы.
У моллюсков имеются амебоциты, гранулы которых содержат ферменты
в латентном состоянии и представляют собой, следовательно, готовый ли-
зосомный аппарат, как и у нейтрофилов позвоночных. Широко распрост-
ранены у пластинчатожаберных моллюсков и ряда других групп беспоз-
воночных амебоциты с включениями трофического характера, а также
гранулоциты, играющие роль своеобразных подвижных почек накопления
(Feng et al., 1971).
В онтогенезе насекомых с полным превращением (Calliphora erythro-
cephala) убедительно показано резкое увеличение относительного и абсо-
лютного количества гранулярных амебоцитов в период, непосредственно
предшествующий метаморфозу. Эти клетки играют весьма важную роль
в утилизации жидких и твердых продуктов разрушения личиночных тка-
ней (Zachary, Hoffmann, 1973).
У некоторых групп животных, особенно тупиковых или вторично из-
мененных форм, зернистые амебоциты играют существенную роль в по-
строении кутикулярной пластинки наружных покровов, например у не-
которых асцидий и у голотурий (Endean, 1960; Smith, 1970).
Весьма интересные соображения высказываются в последнее время
и относительно базальных клеток в кутикулярном эпителии олигохет
(Burke, 1974). Эти клетки представляют собой, по мнению этого автора,
вынесенную в состав эпителия субпопуляцию фагоцитарных защитных
амебоцитов.
Многообразие направлений функциональной специализации амебоцитов
беспозвоночных животных обусловливается еще и возможностью сохране-
ния у ряда групп животных весьма древней первичной их трофической
функции — захвата, переноса и частичного переваривания заглоченной
пищи. Как указывалось выше, этот древний механизм весьма харак-
терен для некоторых губок. Однако в видоизмененной форме он наблю-
дается и у многих пластинчатожаберных моллюсков. У некоторых насе-
комых амебоциты принимают активное участие в утилизации высоко-
молекулярных соединений, накопленных клетками жирового тела.
ГИСТОГЕНЕТИЧЕСКИЕ ОТНОШЕНИЯ МЕЖДУ КЛЕТКАМИ
В ТРОФИЧЕСКИХ РАЗНОВИДНОСТЯХ ТКАНЕЙ
ВНУТРЕННЕЙ СРЕДЫ БЕСПОЗВОНОЧНЫХ
Анализ большой сравнительно-гистологической литературы и резуль-
таты специальной серии экспериментальных работ па представителях на-
секомых, ракообразных, пластинчатожаберных моллюсков и аппелид по-
зволили акад. А. А. Заварзину в конце 30-х годов сформулировать пред-
ставление о наличии единого плана строения ткапей внутренней среды
у беспозвоночных животных (Заварзин, 1934). В основе этого представ-
ления лежали факты наличия в тканях внутренней среды изученных
240
представителей беспозвоночных животных малодифференцированпых ба-
зофильных амебоцитов и переходных форм к различного рода специали-
зированным дифференцированным клеточным элементам. С другой сто-
роны, удалось показать, что у весьма разнообразных и далеко отстоящих
друг от друга в систематическом отношении представителей многоклеточ-
ных процесс асептического воспалительного новообразования соедини-
тельной ткани протекает сходно. Он включает в себя, как и у позвоноч-
ных животных, три последовательно развертывающихся во времени
этапа — деструктивный, защитно-фагоцитарный и регенераторный. В связи
с меньшим развитием межклеточных структур у большинства беспозво-
ночных животных деструктивная фаза менее выражена, чем у позвоноч-
ных животных. На ранних стадиях защитно-фагоцитарной реакции во-
круг инородного тела происходит концентрация крупных незернистых
базофильных амебоцитов, возникающих из мелких камбиальных клеток,
в результате их энергичного митотического деления и последующей уско-
ренной дифференцировки. У животных с дифференцированной системой
свободных элементов (аннелиды, моллюски) некоторое участие в фор-
мировании прилегающих к инородному телу слоев клеточных элементов
принимает одна из разновидностей зернистых амебоцитов. Ярко выражен-
ной фагоцитарной активностью обладают лишь незернистые амебоциты.
На более поздних сроках, после образования сплошного клеточного слоя,
на его наружную поверхность продолжают оседать базофильные незер-
нистые амебоциты. Однако теперь они уже становятся на иной путь диф-
ференцировки: клетки приобретают веретеновидную форму и начинают
вырабатывать межклеточное вещество. В результате этого вокруг ино-
родного тела образуется капсула из новообразованной соединительной
ткани.
Поскольку единственными камбиальными клетками в тканях внутрен-
ней среды изученных представителей беспозвоночных, по мнению
акад. А. А. Заварзина, были мелкие базофильные амебоциты, он считал,
что этими опытами доказана тесная гистогенетическая связь и единство
у беспозвоночных животных между основными компонентами их тканей
внутренней среды — соединительными межуточными тканями и системой
свободных элементов крови и полостной жидкости.
Относительно структурной организации этой общей камбиальной си-
стемы, а также факторов, обусловливающих то или иное направление
дифференцировки продуктов размножения камбиальных клеток, в старой
классической литературе имелись весьма ограниченные сведения. У раз-
ных групп животных (аннелиды, моллюски, насекомые) в разных участ-
ках тела описаны скопления мелких базофильных амебоцитов, преиму-
щественно по ходу кровеносных сосудов. Им приписывалась кроветворная
функция. В отдельных случаях удалось показать стимуляцию процес-
сов размножения клеток в таких скоплениях при значительных искус-
ственно вызванных кровопотерях. С другой стороны, имелись не менее
многочисленные данные об отсутствии у многих представителей беспо-
звоночных структурной организации камбиальной системы и диффузном
распределении процессов репродукции клеток во всей системе тканей
внутренней среды.
Несмотря на стройность изложенной выше унитарной концепции ор-
ганизации и филогенетической дифференцировки тканей внутренней
среды как единой целостной системы, она требует в настоящее время бо-
лее точных и детальных обоснований. Для этого необходим тщательный
анализ кинетики репродукции и дифференцировки клеток, гистогенети-
ческих отношений между различными типами клеточных элементов и,
наконец, тонких механизмов регуляции репродукции и дифференцировки.
Такой фактический материал необходим для достаточно глубоких сравни-
тельно-гистологических сопоставлений тканей внутренней среды позво-
ночных и беспозвоночных животных.
46 А. Л. Заварзин
241
Приведенный выше краткий обзор состояния вопроса по изучению ос-
новных трофических и защитных разновидностей ткапей внутренней
среды беспозвоночных животных свидетельствует о существенном про-
грессе наших знаний в отношении тонких механизмов морфобиохимичес-
кой дифференцировки специализированных клеток и межклеточных
структур, а также некоторых биохимических процессов, осуществляемых
отдельными разновидностями рассматриваемых тканей.
Значительно хуже обстоит дело с анализом системных принципов ор-
ганизации тканей внутренней среды. В современной литературе имеются
лишь единичные целенаправленные исследования в этом направлении.
В качестве примера таких работ можно привести исследование Лай
Фук на гемоцитах Calpodes ethlius (Lai Fook, 1973). У этого представи-
теля чешуекрылых на основании параллельного светооптического и ульт-
раструктурного анализа удается выявить пять типов клеток. По мнению
автора, лишь три из них являются четко различающимися по своей
морфобиохимической дифференцировке зрелыми функционирующими ти-
пами клеток — гранулярные гемамебоциты, сферические клетки и эно-
цитоиды. Гранулярные амебоциты содержат в цитоплазме ограниченные
мембраной гранулы. Последние варьируют как в количественном, так и
в качественном отношении. Электронноплотные гранулы имеют аморфное
гомогенное содержимое. В более светлых гранулах обнаруживаются не-
большие трубчатые структуры диаметром 150 А. Часть гранул дает
положительную окраску на кислые полисахариды. Гранулярные амебо-
циты обладают способностью к активному фагоцитозу, а также способны
к накоплению неограниченных мембранами капель жира.
Эноцитоиды представляют собой самые крупные клетки гемолимфы.
В их гиалоплазме имеется фиброзный матрикс, вокруг которого распола-
гаются рибосомы. Мембранные органоиды в зрелых клетках развиты
слабо.
Сферические клетки характеризуются наличием в цитоплазме круп-
ных гранул диаметром 3.5 мкм, с электронносветлым содержимым. Ядро
располагается эксцентрично и имеет пикнотизированный вид.
Кроме специализированных клеток, в гемолимфе Calpodes имеются
прогемоциты и гемоциты, которые представляют собой камбиальные и
дифференцирующиеся клетки. Прогемоциты характеризуются обилием
свободных рибосом и слабым развитием мембранного метаболического
аппарата. Гемоциты более крупных размеров и имеют более развитую
мембранную систему.
На основании детальной морфологической характеристики амебоцитов
гемолимфы логично предположить, что общим источником развития диф-
ференцированных в различных направлениях клеток являются здесь про-
гемоциты. Эти клетки способны к энергичному размножению и, по-види-
мому, к дифференцировке в трех различных направлениях, причем эта
дифференцировка, как и при гемопоэзе у позвоночных животных, совер-
шается не сразу, а через ряд промежуточных форм, которые и наблю-
даются в гемолимфе рассматриваемого представителя насекомых.
Еще более интересные результаты получены в серии работ француз-
ских авторов на различных насекомых и особенно на мухе Calliphora
erythrocephala (Zachary, Hoffmann, 1973). Достоинством этих работ яв-
ляется сочетание в них экспериментальных и количественных методов
анализа с учетом онтогенетических изменений в форменных элементах
гемолимфы. Такой комплексный подход позволил авторам не только дать
характеристику отдельных клеток гемолимфы, но и показать их функ-
циональное значение и, что особенно важно, выявить гистогенетические
отношения между ними.
В гемолимфе С. erythrocephala обнаружены три различных морфо-
функциональных типа амебоцитов: плазмоциты, тромбоцитоиды и эноци-
тоиды. Первый наиболее многочисленный тип амебоцитов составляет
242
в количественном отношении от 80 до 95% всех амебоцитов. Их абсолют-
ное количество увеличивается в 10—11 раз к началу метаморфоза. При
этом вместо агранулярных плазмоцитов ранних личинок преобладающей
формой (свыше 80%) становятся гранулярные амебоциты, которые
в гемолимфе первых четырех дней личиночной жизни составляют лишь
около 5% всех амебоцитов. Детальный ультраструктурный анализ зер-
нистых плазмоцитов позволил выделить среди них 4 морфологические
категории клеток. Однако все они представляют собой лишь клетки,,
находящиеся на последовательных этапах жизненного цикла, и отлича-
ются в основном лишь количеством ограниченных мембранами пузырь-
ков и гранул. В цитоплазме более зрелых гранулярных амебоцитов пре-
обладают остаточные тела и липидные включения. У молодых клеток
липидные включения отсутствуют. Амебоциты с липидными включениями
появляются лишь в момент метаморфоза и достигают максимального от-
носительного количества к моменту его завершения. Наоборот, более мо-
лодые гранулярные амебоциты преобладают в гемолимфе в конце личи-
ночной жизни. Сопоставление ультраструктурной организации клеток и
характерной количественной и качественной динамики клеточного со-
става гемолимфы у личинок и при метаморфозе позволило авторам сде-
лать вывод о том, что плазмоциты представляют собой специализирован-
ную клеточную линию; они осуществляют процессы резорбции и реути-
лизации продуктов разрушения личиночных ткапей. Источником развития
гранулярных плазмоцитов, активно осуществляющих эту функцию, явля-
ются агранулярные плазмоциты, относительное количество которых в ге-
молимфе ранних личинок (до 6-го дня) достигает 60—70%, а в конце
личиночной жизни падает до 10—20%. Однако это падение не абсолют-
ное, так как в это же время происходит резкое увеличение общего ко-
личества клеток в гемолимфе. Оно отражает лишь ускорение процессов
специализации агранулярных плазмоцитов и превращения их в зрелые
функционирующие клеточные элементы (гранулярные плазмоциты).
10-кратное увеличение количества плазмоцитов в гемолимфе к началу
метаморфоза (с преобладающими темпами прироста количества клеток
в течение последних 2—3 дней) осуществляется в специальных крове-
творных органах, расположенных в области дорсального сосуда в послед-
них брюшных сегментах личинки. Эта кроветворная ткань образована
недифференцированными округлыми амебоцитами типа гемоцитобластов
позвоночных и отростчатыми, связанными десмосомами «ретикулярными»
клетками. Она, следовательно, в принципе напоминает по своему строе-
нию миелоидную ткань позвоночных животных. Ведущее значение этой
ткани в обеспечении быстрого увеличения количества плазмоцитов, по-
мимо обилия здесь фигур митотического деления, показано прямыми
опытами с перевязкой заднего конца тела животного и облучением кро-
ветворной ткани рентгеновскими лучами. У опытных животных в этих
условиях не наблюдалось характерного прироста количества клеток в по-
следние дни личиночной жизни. Эти данные о наличии у насекомых спе-
циальной кроветворной ткани весьма интересны в связи с тем, что у дру-
гих беспозвоночных, и в частности у детально изученного методом ти-
мидиновой авторадиографии брюхоногого моллюска Lymnaea stagnalis,
не удалось выявить каких-либо признаков структурной организации про-
цессов амебоцитопоэза (Sminia, 1974).
Два других морфо-функциональных типа клеточных элементов у мухи
Calliphora erythrocephala — тромбоцитоиды и эноцитоиды — представ-
ляют собой субпопуляции клеток характеризующихся относительным по-
стоянством абсолютного количества в гемолимфе в ходе постнатального
онтогенеза. Их относительное количество в связи с увеличением абсо-
лютного количества гранулярных амебоцитов падает от 16% у ранних
личинок до 2% к началу метаморфоза. Тромбоцитоиды представляют со-
бой клетки, которые, как указывалось выше, аналогичны мегакариоцитам
16*
243
млекопитающих. Эноцитоиды имеют некоторые признаки ультраструк-
турной организации, сходные с эритроцитами позвоночных: пикнотиче-
ские ядра, свободные рибосомы и электронноплотный матрикс. Источни-
ком развития трех типов амебоцитов мухи являются, по-видимому, общие
для всей системы малодифференцированные амебоциты кроветворной
ткани. Современные сведения о гемопоэзе у других насекомых имеются
в специальной литературе (см. обзор: Jones, 1970).
Большой интерес представляет вопрос о гистогенетических отношениях
в тканях насекомых между оседлыми и подвижными клеточными эле-
ментами. У насекомых методом тимидиновой авторадиографии удалось
убедительно доказать происхождение из гемамебоцитов клеток жирового
тела. С другой стороны, в современных ультраструктурных работах не
удалось получить ясных картин, свидетельствующих о возможности
прямого превращения гемамебоцитов в продуцирующие коллаген фиб-
робласты ни в нормальном развитии (см. обзор: Ashhurst, 1968), ни при
развитии защитной капсулы вокруг инородного тела (Salt, 1967). Воз-
можно, однако, что в последнем случае способность к проявлению фибро-
бластических потенций у гемамебоцитов была подавлена из-за специфи-
ческого влияния используемых инородных тел.
В работах последних лет (Sutherland, 1971; Vey, 1971; Vinson, 1971)
по изучению инкапсуляции амебоцитами насекомых естественных для
изученных видов паразитов показано наличие небольших прослоек аморф-
ного внеклеточного вещества, выделяемого уплощенными клетками, фор-
мирующими капсулу. Однако в этом веществе не обнаружены оформлен-
ные коллагеновые волокна. Полное отсутствие таких прослоек межкле-
точного вещества отмечено при изучении реакции амебоцитов у Locusta
inigratoria и Melontha melontha (Brehelin et al., 1975) на инородные тела
и чужеродные ткани. У этих насекомых в реакции инкапсуляции при-
нимают участие только гранулярные амебоциты, не обладающие фагоци-
тарной активностью. По мнению авторов, морфологические изменения
в цитоплазме гранулярных амебоцитов при формировании ими капсулы
аналогичны изменениям в цитоплазме глиальных клеток позвоночных при
попадании инородных тел в ткань нервной системы (концентрация и
уплотнение по периферии клеток фибриллярных структур).
Факт отсутствия или ограниченного проявления у изученных насе-
комых гистогенетического единства между оседлыми и подвижными эле-
ментами весьма интересен. В нем можно усматривать аналогию с отно-
шениями между оседлыми и подвижными клеточными элементами в тка-
нях внутренней среды позвоночных.
При этом гистогенетическое разграничение оседлых и подвижных
клеток является не отражением первичных отношений, а признаком про-
грессивной филогенетической дифференцировки. В справедливости по-
добного заключения убеждают нас экспериментальные исследования на
тканях внутренней среды моллюсков, где гистогенетическое единство
свободных амебоцитов и оседлых, продуцирующих коллаген клеток по-
казано не только старыми классическими методами (Заварзин, 1945,
1947), но и современными методами ультраструктурного и авторадиогра-
фического анализа (Sminia et al., 1974).
Глава 3
ОПОРНЫЕ И СКЕЛЕТНЫЕ РАЗНОВИДНОСТИ ТКАНЕЙ
ВНУТРЕННЕЙ СРЕДЫ
ПЛОТНАЯ СОЕДИНИТЕЛЬНАЯ ТКАНЬ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Плотная соединительная ткань позвоночных животных состоит из
тех же тканевых компонентов, что и рыхлая соединительная ткань. Ос-
новными клеточными элементами плотной соединительной ткани явля-
ются клетки фибробластического ряда. Гистиоциты и другие разновид-
ности клеток рыхлой соединительной ткани находятся преимущественно
в ее прослойках по ходу кровеносных сосудов, и в самой плотной соеди-
нительной ткани встречаются крайне редко. Основную и главным образом
механическую опорную функцию играют в плотной соединительной ткани
межклеточные структуры и в первую очередь в большинстве ее разновид-
ностей коллагеновые волокна. Они собраны обычно в мощные пучки
и обеспечивают большую прочность этой ткани. В зависимости от взаим-
ного расположения пучков коллагеновых волокон и их соотношения
с прослойками рыхлой соединительной ткани различают две основные
разновидности плотной соединительной ткани: оформленную и неоформ-
ленную.
Неоформленная плотная соединительная ткань характеризуется бес-
порядочным ходом пучков коллагеновых волокон в пространстве. Про-
слойки рыхлой соединительной ткани более или менее равномерно рас-
пределены в этой сложной взаимопереплетающейся сети мощных колла-
геновых структур. Вся система скреплена прослойками межклеточного
вещества, обычного для соединительной ткани химического состава
(хондроитинсульфат В, глюкуроновая кислота и их комплексы с бел-
ками) .
В дополнение к основной системе, образованной пучками коллагеновых
волокон, имеется и аналогичная система, образованная эластическими
волокнами. Последняя придает всей структуре дополнительную прочность
и эластичность, в частности способность к растяжению и возвращению
в исходное состояние после прекращения действия внешнего механиче-
ского фактора.
Тщательное изучение механических свойств неоформленной плотной
соединительной ткани в сопоставлении с характером действия внешних
механических факторов на данный ее конкретный участок показывает,
что термин «неоформленная» является крайне неудачным для характе-
ристики этой весьма совершенной и пластичной структуры. Неоформлен-
ность и беспорядочное на первый взгляд расположение пучков коллаге-
новых и эластических волокон на самом деле отражает лишь сложность
механических воздействий на данный участок плотной соединительной
ткани, соответственно которым и располагаются эти волокна, обеспечи-
вая максимальную прочность всей системы.
Широкое распространение плотная неоформленная соединительная
ткань имеет в кожных покровах позвоночных животных. Здесь она осу-
ществляет опорную функцию. В тех случаях, когда кожные покровы
подвергаются менее разнообразным воздействиям, как это наблюдается,
например, у животных, ведущих водный образ жизни, и в частности
у рыб и круглоротых, пучки коллагеновых волокон приобретают значи-
тельно более упорядоченное и правильное расположение.
Помимо чисто механической функции, плотная соединительная ткань
кожи у наземных низших позвоночных, в частности у бесхвостых амфибии,
может выполнять и другие функции. В соединительной ткани кожи этих
животных обнаружено большее, чем обычно, количество мукополисаха-
245
ридов и ионов Са (см. обзор: Mathews, 1967). Наряду с этими особен-
ностями организации плотной соединительной ткани кожи у отдельных
классов позвоночных, химический состав основного вещества и морфобио-
химическая организация коллагеновых волокон оказываются сходными
у таких отдаленных в систематическом отношении групп животных, как
например млекопитающие, круглоротые и костистые рыбы.
Особенно отчетливо влияние функционального момента на простран-
ственную организацию пучков коллагеновых волокон обнаруживается в тех
разновидностях плотной соединительной ткани, которые получили на-
звание оформленных соединительных тканей и представлены у позвоноч-
ных в основном сухожилиями и связками. В сухожилиях пучки колла-
геновых волокон и клеточные элементы фибробластического ряда ориен-
тированы строго в направлении продольной оси сухожилия соответственно
действию механического натяжения при сокращении мышц.
Закономерному в пространстве расположению коллагеновых волокон
и дифференцированных клеток — фиброцитов соответствует и закономер-
ное расположение прослоек рыхлой соединительной ткани, содержащей
кровеносные сосуды и малодифференцироваппые камбиальные эле-
менты фибробластического ряда. Наиболее тонкие прослойки окружают
несколько параллельно идущих пучков коллагеновых волокон, разделен-
ных рядами продольно ориентированных фиброцитов. Каждый такой пу-
чок носит название пучка 1-го порядка. Их совокупность, окруженная
общей прослойкой рыхлой соединительной ткани, называется пучком
2-го порядка. Несколько пучков 2-го порядка объединяются более тол-
стыми прослойками рыхлой соединительной ткани в пучки 3-го порядка
и т. д., в зависимости от общего диаметра сухожилия.
Второй разновидностью оформленной соединительной ткани у позво-
ночных животных являются связки. Они образованы сетью эластических
волокон и мембран, ориентированных преимущественно в продольном на-
правлении. В связках нет такого строгого пространственного разграниче-
ния дифференцированных и камбиальных клеток фибробластического
ряда, как в сухожилиях.
Весьма сложную организацию имеет плотная эластическая соедини-
тельная ткань стенок крупных сосудов. Здесь она представлена системой
циркулярно расположенных эластических мембран и находится в тес-
нейших пространственных и функциональных связях с кольцевым слоем
гладких мышечных клеток средней оболочки сосуда. В настоящее время
имеются убедительные данные о том, что существенное участие в фор-
мировании этой опорной системы принимают гладкие мышечные
клетки.
Приведенными примерами далеко не исчерпывается все разнообразие
плотных соединительных тканей у позвоночных животных. Они могут
варьировать не только по своему микроанатомическому строению, но и по
конкретному составу основных макромолекулярных соединений, образую-
щих структурные компоненты этих тканей. Так, например, в плотной
соединительной ткани роговицы млекопитающих вместо обычного для
плотных соединительных тканей позвоночных хондроитинсульфата В име-
ются несульфатированные хондроитины А и С. У некоторых амфибий и
рыб помимо хондроитинсульфата В в плотной соединительной ткани
кожи имеется и достаточно большое количество хондроитинсульфата А
или С. Качественный состав и количественные соотношения мукополи-
сахаридов основного вещества могут сильно отличаться у близких в си-
стематическом отношении групп и, наоборот, быть сходными у далеко
отстоящих форм. Аналогичная закономерность наблюдается и в отноше-
нии коллагенов (см. обзор: Mathews, 1967). Весьма интересным фактом
является наличие в плотной соединительной ткани кожи и эластической
ткани стенки аорты млекопитающих целлюлозы, аналогичной по своим
свойствам туницину оболочников.
246
Значение подобного рода сравнительно-биохимических данных в на-
стоящее время еще трудно оценить, хотя некоторые соображения эволю-
ционного характера и высказываются отдельными авторами (см. обзор:
Hunt, 1970).
ХРЯЩЕВЫЕ ТКАНИ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Хрящевая ткань позвоночных животных состоит из клеток и межкле-
точного вещества. Особенностью межклеточного вещества хрящевой ткани
является его сложный химический состав. Основными химическими со-
единениями, образующими межклеточное вещество наиболее распростра-
ненных гиалиновых хрящей, являются: коллаген в форме надмолекуляр-
ных фибриллярных комплексов, кислые мукополисахариды (хондроитин-
сульфаты А и С и кератосульфаты), нейтральные мукополисахариды и
неколлагеновые белки. Значительная часть белков и полисахаридов пред-
ставлена в межклеточном веществе хряща не в виде изолированных сое-
динений, а в виде сложных надмолекулярных комплексов. Это обеспечи-
вает особые его свойства — механическую прочность и в то же время
проницаемость для органических соединений, воды и других веществ,
необходимых для нормальной жизнедеятельности клеточных элементов
хрящевой ткани.
Наиболее специфичными, маркерными, для межклеточного вещества
хряща соединениями являются кератосульфаты и определенные разно-
видности хондроитинсульфатов. Они составляют до Уз сухого веса хряща
и вступают в соединения, как с коллагеном, так и с другими белками его
межклеточного вещества. Более изучены в настоящее время комплексы
мукополисахаридов с неколлагеповыми белками. Эти мукопротеины состоят
из двух фракций — богатые мукополисахаридами легкие протеин-поли-
сахариды и тяжелые протеин-полисахариды со значительно меньшим со-
держанием полисахаридов в комплексе (Mathews, 1967; Kobayashi, 1971).
У высших позвоночных хрящевая ткань относительно рано заклады-
вается в онтогенезе и развивается из мезенхимы — общего источника для
всех разновидностей тканей внутренней среды. На месте будущей хря-
щевой ткани происходит сгущение клеток, как за счет их местной уско-
ренной пролиферации, так и за счет миграции клеток из соседних уча-
стков мезенхимы. Вскоре после образования такого сгущения мезенхим-
ных клеток они начинают вырабатывать межклеточное вещество и
превращаются в специализированные клетки хрящевой ткани — хондро-
бласты и хондроциты.
Подробная характеристика изменений ультраструктурной организации
клеток при нормальном хондрогенезе у млекопитающих дана в обстоя-
тельной работе Годмана и Портера (Godman, Porter, 1960) и последующих
работах (Черкасов, 1975, и др.).
Исходные клетки скелетогенной мезенхимы характеризуются высо-
кими значениями ядерно-плазменпых отношений (рис. 105, а). Они имеют
умеренно развитые структуры метаболического аппарата цитоплазмы: мел-
кие компактные митохондрии, относительно большое количество свобод-
ных рибосом и небольшие участки гранулярной эндоплазматической сети.
В цитоплазме много ограниченных мембранами пузырьков и вакуолей.
Аппарат Гольджи представлен рассредоточенными в цитоплазме не-
большими группами центральных цистерн со слабо развитыми перифе-
рическими вакуолями. При превращении мезенхимных клеток в активно
функционирующие хондробласты, синтезирующие и выделяющие в окру-
жающее межклеточное вещество основные макромолекулярные соеди-
нения, происходит существенная перестройка всей организации клеток.
Она особенно четко проявляется в изменении метаболического аппарата
цитоплазмы (рис. 105, б, в). Объем последней постепенно увеличивается,
247
что приводит к Значительному уменьшению ядерно-плазменных отноше-
ний. В клетках развивается белоксинтезирующий аппарат в виде шеро-
ховатой эндоплазматической сети, занимающей все больший объем цито-
плазмы.
Аппарат Гольджи концентрируется в околоядерной области и увеличи-
вается в размерах. Сильно гипертрофируется его вакуолярная часть.
Вместо небольших групп центральных цистерн здесь имеется уже зна-
чительная область клеточной территории, занятая активно функционирую-
щими мембранными системами этого органоида. В митохондриях увели-
чивается объем митохондриального матрикса; их размеры в несколько
раз превышают размеры митохондрий недифференцированных мезенхим-
ных клеток. В цитоплазме клеток появляются гранулы гликогена и ли-
пидные включения. Одновременно происходит увеличение количества
ограниченных мембранами пузырьков с содержимым умеренной электрон-
ной плотности. Помимо пузырьков, ограниченных одинарной мембраной,
на некоторых этапах дифференцировки происходит формирование круп-
ных вакуолярных структур, ограниченных двойной мембраной. Они на-
поминают по своему виду и содержимому аутофагические вакуоли. Уда-
ется наблюдать и картины выведения содержимого таких вакуолей
в окружающее межклеточное вещество путем своеобразного экзоцитоза
или апокриновой секреции. На периферии цитоплазмы дифференцирую-
щихся хрящевых клеток имеются уплотненные участки, где, по мнению
Годмана и Портера, происходит выведение торопоколлагена и формирова-
ние коллагеновых фибрилл. Тонкие молекулярные механизмы этого про-
цесса, как и в случае фибриллогенеза в рыхлой соединительной ткани,
остаются неясными. Помимо таких механизмов выведения синтезируемых
клеткой высокомолекулярных соединений, имеет место, по-видимому, и
экзоцитоз с предварительным формированием окруженных мембранами
гранул в области аппарата Гольджи. Предполагают, что таким путем
происходит выделение неколлагеновых белков и мукополисахаридов.
Дифференцированный хондробласт представляет собой клетку с хо-
рошо и гармонично развитым метаболическим аппаратом, специализиро-
ванным на синтез двух основных компонентов межклеточного вещества —
специфических белков и мукополисахаридов (рис. 105, г). Хондробласты
имеют мощно развитую эргастоплазму и обширную околоядерную терри-
торию, занятую преимущественно вакуолярной системой аппарата
Гольджи. В гиалоплазме таких клеток имеются и значительные скопления
гликогена.
Дифференцированные хондробласты и клетки на описанных выше на-
чальных и средних стадиях дифференцировки обнаруживают высокую ме-
таболическую активность. Особенно наглядно ее удается показать, приме-
няя метод авторадиографии с использованием предшественников белкового,
мукополисахаридного и сульфомукополисахаридного синтезов (3Н-пролин,
3Н-глюкоза и Na235SO4). Уже в ранпих светооптических авторадиографи-
ческих работах было показано резко избирательное включение экзоген-
ного меченного по 35S сульфата натрия в цитоплазму хрящевых клеток
с последующим выведением меченого продукта в окружающее межкле-
точное вещество. В дальнейшем, при использовании электронной автора-
диографии, удалось уточнить, что местом первичного включения мече-
ной серы являются цистерны аппарата Гольджи. Аналогичные данные
получены и в отношении локализации меченых моносахаров. На основа-
нии этих наблюдений был сделан вывод о том, что местом синтеза муко-
полисахаридов, а также их сульфатирования являются мембраны аппа-
рата Гольджи. Однако этот вывод находится в некотором противоречии
с данными биохимических работ. В этих работах показано, что присое-
динение молекул полисахаридов к полипептидным цепочкам при образо-
вании мукопротеинов происходит еще до завершения формирования их
белковых компонентов (Herwitz, Dorfman, 1968). Наряду с этим при ра-
248
7
Рис. 105. Схема изменений ультраструктурной организации клеток при гистогенезе
хрящевой ткани млекопитающих. (По: Codman, Porter, 1960; рис. С. А. Быстрова).
а—г — последовательные изменения структур клеток. 1 — аппарат Гольджи, 2 — свободные рибо-
сомы, 3 — шероховатая эндоплазматическая сеть, 4 — уплотненные участки цитоплазмы в области
выведения макромолекул, 5 — коллагеновые фибриллы, 6 — область концентрации гликогена,
7 — митохондрии, 8 — вакуоли.
боте с ингибиторами белкового и мукополисахаридного синтезов удается
избирательно подавлять эти две стороны гетеросинтетической активности
хрящевых клеток.
Об интенсивности метаболических процессов в хрящевых клетках сви-
детельствуют опыты с предшественником синтеза коллагена 3Н-пролином
(Житников, 1975, и др.). При использовании этой аминокислоты меченый
белок вначале обнаруживается над свободными и прикрепленными ри-
босомами эндоплазматической сети. Затем меченый белок почти одно-
временно поступает в область аппарата Гольджи и в периферические
участки гиалоплазмы. Высказывается предположение, что в хондро-
бластах имеется пространственное разделение синтеза коллагеновых
и неколлагеповых белков. При этом предполагают, что синтез тропокол-
лагена происходит на свободных полисомах и на более ранних этапах
дифференцировки хондробластов. Неколлагеновые белки по этим пред-
ставлениям синтезируются на более поздних этапах дифференцировки
уже на рибосомах эндоплазматической сети (Керкис, Христолюбова,
1974). Через 24 часа после инъекции радиоактивных аминокислот мече-
ный белок обнаруживается в межклеточном веществе. Таким образом,
в активно функционирующих хондробластах весь цикл синтеза и выведе-
ния меченых высокомолекулярных продуктов занимает меньше 24 час.
Вновь образованные белки и мукополисахариды располагаются не не-
посредственно около поверхности клеток, а распространяются диффузно
на значительном расстоянии в образовавшемся ранее межклеточном ве-
ществе. Последний факт указывает на весьма сложный и неясный еще
в деталях механизм внеклеточной сборки и формирования дефинитивных
коллагеновых волокон и мукопротеиновых комплексов хрящевой ткани.
Активно функционирующие хондробласты в эмбриональных зачатках
хрящевой ткани не утрачивают способности к синтезу ДНК и делению.
Рост хрящевого зачатка происходит, как за счет увеличения прослоек
продуцируемого клетками межклеточного вещества, так и за счет раз-
множения клеток путем деления. Однако интенсивность размножения
с момента начала гетеросинтетической деятельности клеток падает
в основном за счет сильного увеличения продолжительности митотиче-
ского цикла. Сложность взаимоотношений между ауто- и гетеросинтети-
ческой активностью хондробластов удается выявить при культивировании
их в условиях in vitro. При этом наблюдается известный антагонизм
этих двух процессов: усиление специфической синтетической деятель-
ности при замедлении интенсивности их размножения и, наоборот, рез-
кое угнетение избирательного включения сульфата натрия при создании
благоприятных условий для интенсивной пролиферации клеток. С другой
стороны, при некоторых условиях культивирования можно стимулиро-
вать и пролиферацию и специфическую гетеросинтетическую активность.
Еще более сложные отношения между этими процессами имеют место
в условиях in vivo. Как правило, с увеличением массы межклеточного
вещества уменьшается и гетеросинтетическая активность клеток и бло-
кируется их способность к синтезу ДНК. Это находит морфологическое
выражение в редукции белоксинтезирующего аппарата клеток, цитоплазма
которых часто заполняется жировыми включениями и скоплениями гра-
нул гликогена. Характерным изменениям подвергается и ядерный ап-
парат хондробластов. Ядро пикнотизируется, ядрышковый аппарат сильно
редуцируется. Зрелые хрящевые клетки — хондроциты в хряще распола-
гаются обычно группами по 2, 4 или 8 клеток. Они окружены особыми
участками межклеточного вещества, получившего название клеточных
территорий, а группы клеток — изогенных групп (рис. 106). Каждая та-
кая группа образуется в результате деления одного хондробласта. Завер-
шающие аутосинтетические процессы происходят уже на поздних
стадиях жизненного цикла хондробластов при снижении в них специфи-
ческой гетеросинтетической активности. В связи с этим образующиеся
250
дочерние клетки не могут сформировать большого количества межкле-
точного вещества и отойти друг от друга на значительное расстояние.
Помимо такого рода закономерных прогрессивных изменений на ранних
стадиях формирования хрящевой ткани могут иметь место процессы фи-
зиологической гибели еще недифференцированных хрящевых клеток. Это
связано, по-видимому, с системными регуляциями численного состава
клеток в зачатках хрящевой ткани.
Весьма сложные отношения между репродукцией и дифференциров-
кой клеток наблюдаются в участках их интенсивного роста при формиро-
вании дефинитивного хряща, а также в участках хрящевой ткани, обес-
печивающих процессы роста трубчатых костей.
Рис. 106. Участок гиалинового хряща трахеи кошки.
I — надхрящница, 2 — молодая хрящевая ткань, з — зрелая хрящевая ткань, 4 — изогенные
группы клеток.
В дефинитивной гиалиновой хрящевой ткани имеется строго поляризо-
ванное в пространстве распределение клеток по уровню их диф-
ференцировки (рис. 106). На поверхности хряща выделяется слой плот-
ной соединительной ткани с хорошо развитой сетью кровеносных сосу-
дов. Здесь сосредоточен запас камбиальных малодифференцированных
клеток. Этот слой получил название надхрящницы. Он обеспечивает так
называемый аппозиционный рост хряща. Кроме того, через сосуды над-
хрящницы осуществляется поступление в хрящевую ткань веществ, не-
обходимых для поддержания ее жизнедеятельности, а также выводятся
конечные продукты обмена. В гиалиновой хрящевой ткани трахеи
клетки располагаются строго по градиенту, соответствующему уровню
их дифференцировки. Ближе к поверхности хряща располагаются наи-
менее дифференцированные одиночные хондробласты, имеющие вид вы-
тянутых параллельно надхрящнице клеток. Они энергично синтезируют
межклеточное вещество и сохраняют способность к делению. В центре
хрящевой пластинки, наоборот, располагаются изогенные группы зрелых
хондроцитов, имеющих округлую или овальную форму и значительно
большие, чем у хондробластов, размеры. Эти клетки уже утрачивают
способность к делению и к синтезу межклеточного вещества в заметных
251
количествах. Клетки, расположенные между надхрящницей и центром'
хрящевой ткани, занимают промежуточное положение по уровню своей
дифференцировки.
Описанный выше гиалиновый хрящ высших позвоночных является
широко распространенной, но далеко не единственной разновидностью
хрящевой ткани. Даже у животных одного класса, и в частности у мле-
копитающих, помимо этой разновидности, имеются еще и так называе-
мые волокнистые и эластические хрящи. Особенностью волокнистых хря-
щей является значительно большее количество, чем в гиалиновом хряще,
коллагеновых волокон в межклеточном веществе. По своей организации
волокнистый хрящ занимает промежуточное положение между плотной
оформленной соединительной и хрящевой тканями. В известной мере
это справедливо и в отношении эластического хряща, где, помимо основ-
ного аморфного вещества и коллагеновых волокон, имеется и дополни-
тельная система эластических волокон, придающих такой хрящевой
ткани особые механические свойства.
Существенные изменения претерпевает межклеточное вещество хря-
щевой ткани в ходе развития. Эти изменения касаются пе только чисто
количественного увеличения межклеточного вещества в результате спе-
цифической синтетической деятельности клеток. В ходе развития проис-
ходят качественные изменения его химического состава. Так, на ранних
этапах гистогенеза в межклеточном веществе хряща преобладают несуль-
фатированные полисахариды. На более поздних стадиях появляются
хондроитинсульфаты. Вначале в большем количестве содержится хондро-
итинсульфат С, который сменяется затем более сульфатированным хонд-
роитинсульфатом А. Наконец, в постнатальном гистогенезе появляются
и прогрессивно нарастают кератосульфаты.
Весьма сложные изменения внутриклеточных регулятивных механиз-
мов происходят на заключительных этапах дифференцировки хрящевых
клеток в провизорных, замещающихся костью хрящах. В этом случае
в клетках, с одной стороны, происходит накопление резервных низко-
молекулярных веществ, используемых при остеогенезе, с другой стороны,
в цитоплазме клеток образуются в большом количестве специфические
макромолекулы, которые, по-видимому, также могут использоваться
остеобластами для построения основного вещества кости.
Еще большее разнообразие хрящевых тканей удается обнаружить при
сравнительно-гистологическом анализе их у представителей различных
классов позвоночных (Schaffer, 1930; Румянцев, 1958). Различия этих
разновидностей касаются соотношения клеток и межклеточных структур,
деталей внутренней организации клеточных элементов и, наконец, хими-
ческого состава межклеточного вещества. Как правило, относительное
количество последнего возрастает у представителей высших классов по-
звоночных. При этом увеличивается и относительное количество более
сульфатированных хондроитинсульфатов А. Однако у некоторых низших
позвоночных, например у скатов, имеются специальные механизмы ги-
персульфатации более распространенного в хрящах низших позвоночных
хондроитинсульфата С.
Несмотря на наличие известных тенденций эволюционного усложне-
ния и химического состава и системной организации хрящевых тканей,
имеющиеся в настоящее время сравнительно-биохимические и сравни-
тельно-гистологические данные свидетельствуют о том, что в основе стро-
ения всех хрящевых тканей позвоночных животных лежит единый
принцип их биохимической организации. Наиболее важной закономер-
ностью такой организации является формирование межклеточных струк-
тур на основе образования крупных надмолекулярных комплексов за
счет объединения молекул сульфатированных полисахаридов с белками и
определенного структурного взаимодействия этих мукопротеиновых комп-
лексов с коллагеновыми фибриллами. Такой принцип организации харак-
252
терен, по-видимому, для всех разновидностей хрящевой ткани позвоноч-
ных. Весьма веским аргументом в пользу такого заключения являются
сходные физико-химические характеристики мукопротеидных комплек-
сов межклеточного вещества хряща у таких отдаленных групп животных,
как круглоротые и млекопитающие (см. обзор: Mathews, 1967).
КОСТНЫЕ ТКАНИ
Несмотря на весьма совершенные механические свойства хрящевой
ткани, создание на ее основе достаточно мощного и прочного внутрен-
него скелета оказалось невозможным из-за отсутствия твердости меж-
клеточного вещества этой ткани. В связи с этим в процессе эволюции
у позвоночных животных появилась еще одна разновидность скелетных
тканей, а именно костная ткань. Время ее возникновения у позвоночных
животных или, скорее, порядок возникновения в эволюции позвоночных
хрящевой и костной тканей в настоящее время выяснены недостаточно
полно. Возможно, что обе эти разновидности скелетных тканей появились
у предков позвоночных животных более или менее одновременно (см. об-
зоры: Румянцев, 1958; Moss, 1964; Воробьева, 1975).
Все разновидности костной ткани, как и рассмотренные выше другие
разновидности скелетных и опорных тканей, состоят из клеток и меж-
клеточного вещества. Последнее представлено двумя основными компо-
нентами — органическим матриксом и солями кальция, преимущественно
гидрооксиапатитами. Неорганический компонент костной ткани и опре-
деляет специфику ее как особой, наиболее совершенной в механическом
отношении скелетной ткани позвоночных животных.
Соли распределены в межклеточном веществе кости не хаотично,
а закономерно структурированы в ее органическом матриксе. Сам процесс
отложения этих солей представляет собой весьма сложное биологическое
явление, требующее специальной организации органического матрикса
межклеточного вещества. Хотя основные химические компоненты этого
матрикса те же, что и в межклеточном веществе хряща, однако их соотно-
шение и детали химического строения отличаются рядом особенностей.
Относительное количество коллагеновых волокон в межклеточном ве-
ществе костной ткани близко к их количеству в хрящевой ткани и со-
ставляет в среднем около 30% его сухого веса. Одним из наиболее ха-
рактерных свойств образующего оссеиновые волокна коллагена является
обилие здесь свободных боковых аминогрупп лизиновых и оксилизино-
вых остатков (Barnes, 1973). Эти боковые группы обладают способностью
активно связывать пирофосфаты. Другой важной особенностью оссеино-
вых волокон является высокое содержание органического фосфата при
нормальной концентрации фосфатов в среде. На моль коллагена в кост-
ной ткани приходится два моля фосфатов. Особенностью хондроитин-
сульфатов костной ткани является высокая степень их сульфатации и
полимеризации. В связи с этим они могут выступать как активные на-
копители и переносчики необходимых для минерализации кости ионов
кальция. Из протеин-полисахаридных комплексов в костной ткани пре-
обладает фракция легких протеин-полисахаридов, содержащих лишь
15% белка и 85% хондроитинсульфатов. Особенностью этого комплекса
является способность связывать, а при изменении конформации молекул
отдавать ионы кальция в окружающую среду. Организация органического
матрикса межклеточного вещества кости специально приспособлена для
обеспечения процессов кальцификации. Достаточно отметить, что про-
цесс минерализации может происходить только в нативных коллагеновых
фибриллах, образующих в естественном состоянии сложные надмолеку-
лярные комплексы с мукополисахаридами и легкими протеин-полисаха-
ридными макромолекулами (Kobayashi, 1971; Слуцкий, 1972).
253
Костные ткани, как и хрящевые ткатш у позвоночных животпых, пред-
ставлены большим количеством разновидностей, которые могут быть све-
дены к трем основным типам: дентиноидные, грубоволокнистые и пла-
стинчатые (Румянцев, 1958). Характерной особенностью дентиноидпой
костной ткани является отсутствие в толще ее межклеточного вещества
тел костных клеток. У высших позвоночных единственным примером
такой костной ткани является дентин зуба, у низших и особенно ископа-
емых животпых дентинопдная костная ткань имеет и имела широкое рас-
пространение в поверхностных кожных костях скелета. Для грубоволок-
нистой кости характерным является относительно меньшее количество
и беспорядочное расположение оссеиновых волокон.
Основным структурным компонентом пластинчатой костной ткани
является костная пластинка. Последняя представляет собой участок кост-
ной ткани с параллельным расположением оссеиновых волокон. В соседних
пластинках волокна располагаются обычно под углом в 90°. Грубоволок-
нистая костная ткань характерна для низших позвоночных и эмбриональ-
ного и раннего постнатального гистогенеза костей внутреннего скелета
высших позвоночных. Пластинчатая костная ткань образует основные
кости дефинитивного внутреннего скелета высших позвоночных. Пластин-
чатая костная ткань в ограниченных пределах п с некоторыми прими-
тивными признаками в своей организации встречается и у низших по-
звоночных и, что самое интересное, у их вымерших ископаемых предков.
Ранние стадии развития костной ткани в онтогенезе высших позвоноч-
ных внешне напоминают ранние стадии развития хрящевой ткани. Источ-
ником развития так называемых соединительнотканных, или накладных,
костей является скелетогенная мезенхима. На месте формирования буду-
щей кости в мезенхиме образуются уплотненные участки. К моменту
формирования межклеточного вещества кости в таких участках клетки
располагаются рядами, приобретая эпителиоподобный вид (рис. 107, а).
Цитоплазма таких клеток становится резко безофильной в связи с раз-
витием у них мощного белоксиптезирующего аппарата в виде шерохова-
той эндоплазматической сети и аппарата Гольджи. В прилегающих друг
к другу рядах клеток в области их контактирующих поверхностей на-
чинается выработка межклеточного вещества кости. Здесь образуются
костные перекладины. Часть остеобластов замуровывается в толщу меж-
клеточного вещества кости; здесь они превращаются в дифференцирован-
ные клетки костной ткани — остеоциты. Они в отличие от хондроцитов
имеют отростчатую форму (рис. 107, б). Тонкие отростки остеоцитов
находятся в особых костных канальцах, пронизывающих все межклеточ-
ное вещество костной ткани. При помощи этих канальцев тела остеоцитов,
находящиеся в костных полостях, связаны между собой и с крове-
носными сосудами, расположенными на поверхности кости в надкост-
нице или в специальных каналах в толще костной ткани. Поскольку меж-
клеточное вещество костной ткани непроницаемо для продуктов метабо-
лизма, весь обмен веществ между телами костных клеток и кровеносными
сосудами происходит через систему костных канальцев.
На рассматриваемой стадии происходит уже формирование доста-
точно сложной тканевой системы с основными признаками ее организа-
ции в дефинитивной костной ткани. В основе такой системы лежит над-
костница, образованная тремя основными типами клеточных элементов —
камбиальными полустволовыми клетками, функционирующим камбием —
преостеобластами и утратившими способность к размножению остеобла-
стами (Luck et al., 1974). Завершают этот последовательный ряд клеточ-
ных элементов костной ткани замурованные в межклеточное вещество
кости отростчатые клетки — остеоциты.
Камбиальные полустволовые клетки представляют собой веретеновид-
пые клеточные элементы с относительно небольшим объемом цитоплазмы
и умеренно развитым метаболическим аппаратом. Преостеобласты — это
254
особая субпопуляция клеток, которая характеризуется энергичной про-
лиферативной активностью. Они обеспечивают увеличение количества
клеток в системе. Наряду с этим у них достаточно хорошо развит белок-
Рис. 107. Схемы ультраструктурной организации клеток костной ткани. (Рис. М. Ю. Пу-
пина).
а — остеобласт, б — остеоцит, в — остеокласт. 1 — оссеиновые фибриллы, 2 — шероховатая эндо-
плазматическая сеть, з — уплотненные участки цитоплазмы (места предполагаемого выхода прокол-
лагена), 4 — лизосомы, 5 — митохондрии, 6 — аппарат Гольджи, 7 — межклеточное вещество кости,
8 — ядро.
синтезирующий аппарат, а также имеются и другие признаки, свидетель-
ствующие об относительно высоком уровне метаболизма. По мнению неко-
торых авторов (Knese, 1967), эти их морфологические особенности об-
условлены не только аутосинтетическими процессами, связанными с ин-
255
тенсивной репродукцией клеток. Высказывается предположение, что
хотя бы часть этих клеток приступает уже и к процессам специфического
синтеза и, в частности, синтеза специфических мукополисахаридов. Вы-
ведение последних из клеток совершается, согласно этим взглядам, после
превращения преостеобластов в остеобласты, которые специализируются
уже преимущественно на синтез коллагена. Эти интересные представле-
ния о функциональной дифференцировке клеток, находящихся на двух
последовательных этапах гистогенеза основываются, однако, преимуще-
ственно на электронномикроскопических данных и требуют дополнитель-
ных доказательств.
Как указывалось выше, остеобласты в ультраструктурном отношении
характеризуются прежде всего мощным развитием эргастоплазмы
(рис. 107, а). Плотность расположения мембран шероховатой эндоплаз-
матической сети приближается здесь к плотности их расположения в та-
ких специализированных белоксинтезирующих клетках, как клетки экзо-
криновых отделов поджелудочной железы. Достаточно большое развитие
в цитоплазме остеобластов получают и другие мембранные органоиды.
Высокая белоксинтезирующая активность рассматриваемых клеток от-
четливо выявляется в авторадиографических опытах с 3Н-пролином
(Frank, Frank, 1969; Домашевская, Медвецкий, 1975). Интенсивное вклю-
чение этой аминокислоты в синтезируемые в цитоплазме остеобластов
белки значительно превышает ее включение в белки, синтезируемые пре-
остеобластами и остеоцитами.
Механизмы внутриклеточного транспорта и выведения макромоле-
кул, а также процессы внеклеточного фибриллогенеза в костной ткани
в принципе могут быть сходными с аналогичными процессами в хряще-
вой и соединительной тканях. Возможно, однако, что при остеогенезе
имеются и некоторые особенности этих процессов. Так, в частности уда-
лось показать наличие синтеза тропоколлагена на шероховатой эндо-
плазматической сети в одонтобластах зуба, образующих дентин. Весьма
отчетливо и методом электронной авторадиографии и морфологическими
наблюдениями прослежено перемещение молекул проколлагена в пу-
зырьки аппарата Гольджи и выведение содержимого пузырьков путем эк-
зоцитоза (Weinstock, Leblond, 1974). Предполагают, что такой механизм
внутриклеточного транспорта и выведения коллагена характерен для всех
клеток тканей внутренней среды, синтезирующих коллаген.
Особенностью фибриллогенеза в пластинчатой костной ткани является
наличие здесь дополнительных механизмов, обусловливающих параллель-
ную ориентировку волокон в каждой костной пластинке и изменение та-
кой ориентировки при формировании следующей костной пластинки.
Остеоциты представляют собой неоднородную популяцию клеток. Это
находит свое отражение и в их ультраструктурной организации. Здесь
имеются клетки с относительно хорошо развитыми мембранными орга-
ноидами и, наоборот, с относительно слабым развитием этих структур.
В настоящее время накапливается все больше данных о том, что эти
клетки принимают активное участие в метаболических процессах, проте-
кающих в межклеточном веществе кости (Черкасова, 1975). Они обеспе-
чивают, во-первых, локальное обновление межклеточных структур и, во-
вторых, поддерживают постоянство ионного баланса в организме. Доста-
точно сказать, что общая поверхность соприкосновения тканевой жид-
кости с межклеточным веществом кости достигает у человека 1500—
5000 м2. Такая громадная поверхность соприкосновения минерализован-
ной костной ткани с жидкой средой создает сама по себе необходимые
предпосылки для поддержания ионного гомеостаза организма. Они уси-
ливаются еще и активной ролью клеточных элементов, обладающих, не-
видимому, свойством способствовать осаждению или, наоборот, перево-
дить в растворенное состояние неорганические компоненты межклеточ-
ного вещества кости.
256
Весьма характерной особенностью костной ткани является постоянное
сосуществование в ней процессов ее новообразования и разрушения.
Больше того, гармоничное сочетание этих двух противоположных по
своей сути процессов является необходимым условием и механизмом
роста формирующейся кости. Уже с самого момента ее возникновения
в ней выделяются участки, где идет интенсивный аппозиционный рост
костных перекладин, и зоны, где, наоборот, происходит разрушение обра-
зовавшейся ранее костной ткани. В накладных соединительнотканных
костях участки интенсивного аппозиционного роста обычно расположены
на внешней, обращенной к кожным покровам, поверхности кости,
а участки резорбции — на внутренней поверхности формирующейся
кости.
Процесс разрушения межклеточного вещества кости достаточно слож-
ный и неясный еще во многих деталях системный процесс. В нем прини-
мают активное участие все типы клеток костной ткани и, по-видимому,
ряд гуморальных факторов. Особенно заметную и важную с гисто-
логической точки зрения роль играет в этом процессе особый тип кле-
ток— остеокласты (рис. 107, в). Они представляют собой крупные мно-
гоядерные клетки с резко оксифильной цитоплазмой. Остеокласты обра-
зуются путем слияния малодифференцированных клеток надкостницы.
Эти симпластические надклеточные структуры имеют относительно боль-
шой объем цитоплазмы, которая в центральной части, в области ядер
представлена компактной массой, а на периферии, особенно в области
контакта с межклеточным веществом кости, образует сеть анастомози-
рующих друг с другом отростков. В остеокластах особенно хорошо развит
аппарат Гольджи и система ограниченных мембранами пузырьков и ва-
куолей. Большая часть последних представляет собой лизосомы па раз-
ных этапах гетерофагического цикла. Остеокласты обладают способ-
ностью создавать локально у своей поверхности кислую среду за счет
интенсивно идущих в этих клетках процессов гликолиза. Эта кислая
среда в области непосредственного контакта цитоплазмы остеокластов и
межклеточного вещества способствует растворению минеральных солей,
создает также оптимальные условия для действия протеолитических и
ряда других ферментов лизосом, содержимое которых выделяется осте-
окластами путем экзоцитоза. Таким образом, остеокласты представляют
собой специализированные симпластические структуры, где очень ярко
проявляется «внеклеточная работа» лизосомного аппарата (см. обзор:
Vaes, 1969).
Есть обоснованное предположение, что эта функция, хотя и в мень-
шей мере, свойственна лизосомному аппарату других оседлых клеток
ткапей внутренней среды и, в частности, у позвоночных животных клет-
кам фибробластического ряда, хондроцитам и остеоцитам.
В последнее время появились данные и об участии лизосомного ап-
парата скелетогенных клеток в процессах минерализации (Matthews et
al., 1973). Остеоциты костной ткани и хондроциты обызвествляющихся
хрящей обладают повышенной способностью к накоплению Са-4- и отло-
жению в виде гранул солей кальция в матриксе митохондрий. Отсюда
Са++ выводятся в межклеточное вещество. Одним из механизмов их вы-
ведения является образование ограниченных мембраной пузырьков,
в состав которых входят ферменты АТФаза и пирофосфатаза и фосфо-
липиды в комплексе с ионами кальция. Эти пузырьки попадают в меж-
клеточное вещество, где под действием пирофосфатазы происходит гидро-
лиз неорганического пирофосфата или других фосфатных эфиров и со-
здается локальное увеличение концентрации ортофосфата. В результате
начинается формирование кристалла. Последний разрывает мембрану
пузырька и переходит в межклеточное вещество.
Как указывалось выше, в хрящевой ткани процессы роста осуществ-
ляются как с поверхности, аппозиционным путем, за счет непрерывного
17 А. А. Заварзин
257
размножения и специфической дифференцировки клеток надхрящницы,
так и за счет размножения клеток и формирования межклеточного ве-
щества, погруженными уже в его толщу дифференцирующимися хряще-
выми клетками. Для костной ткани возможен только аппозиционный
тип роста. Процессы роста находятся в нормальной кости в систем-
ной корреляции с процессами разрушения ранее образованных участ-
ков костной ткани. В наиболее сложной и совершенной пластинчатой
костной ткани костные пластинки закономерно ориентированы между со-
бой и с кровеносными сосудами, обеспечивающими трофику пластинча-
той костной ткани. Особенно наглядно все эти взаимоотношения высту-
пают в пластинчатой ткани диафизов трубчатых костей у млекопитаю-
щих (рис. 108). В этой костной ткани имеется три связанных между
собой разновидности костных каналов в межклеточном веществе и не-
сколько типов костных пластинок, определенным образом ориентирован-
ных по отношению к продольным так называемым гаверсовым каналам
костной ткани. Все межклеточное вещество кости пронизано анастомо-
зирующими между собой и связанными с наружной и внутренней по-
верхностью трубчатой кости, а также с полостью гаверсовых каналов,
костными канальцами. В них располагаются отростки костных клеток.
В идущих параллельно длинной оси трубчатой кости гаверсовых кана-
лах находится рыхлая соединительная ткань, кровеносные сосуды и по
стенке канала малодифференцированные клеточные элементы костной
ткани, способные превращаться в остеобласты или остеокласты в зави-
симости от действия гуморальных химических или системных физиче-
ских факторов. Кровеносные сосуды в толще межклеточного вещества
кости связаны с сосудистыми сплетениями надкостницы системой ар-
терий и вен, расположенных в каналах, перпендикулярных к длинной
оси диафизов. Непосредственно под надкостницей располагаются наруж-
ные генеральные костные пластинки. Они состоят из нескольких пласти-
нок, охватывающих по внешней окружности весь диафиз трубчатой
кости. В соседних костных пластинках коллагеновые волокна распола-
гаются под углом 90° друг к другу. Такая организация основного органи-
ческого компонента межклеточного вещества костной ткани с механи-
ческой точки зрения является наиболее прочной. Второй разновидностью
костных пластинок являются внутренние генеральные пластинки, кото-
рые располагаются на внутренней поверхности трубчатой кости на гра-
нице с костно-мозговым каналом.
Наиболее распространенным типом костных пластинок, образующих
основную массу костной ткани, являются системы гаверсовых пласти-
нок, концентрически расположенных вокруг гаверсовых каналов. Каждая
система таких пластинок получила название остеона. Между соседними
остеонами располагаются вставочные пластинки, которые отличаются
от остеонов отсутствием гаверсова канала и концентрического располо-
жения. Они представляют собой по сути дела сохранившиеся в костной
ткани участки остеонов предшествующих генераций. Особенностью всей
системы пластинчатой кости является то, что в ней непрерывно идут
процессы физиологической регенерации и обновления. При этом основ-
ную роль в этих процессах играет не сама надкостница, а малодиф-
ференцированные полустволовые клетки костной ткани, расположен-
ные по ходу кровеносных сосудов в гаверсовых каналах. Из этих
клеток при старении остеонов развиваются остеокласты, которые разру-
шают костные пластинки, образуя обширную полость в межклеточном
веществе кости. Затем из малодифференцированных клеток формиру-
ются остеобласты, которые образуют новую систему концентрически рас-
положенных костных пластинок новых остеонов. Поскольку процессы
разрушения старых остеонов могут проходить несколько эксцентрично,
отдельные участки старых остеонов остаются в костной ткани, образуя
системы вставочных пластинок. Интенсивность процессов такой свое-
258
образпой физиологической регенерации настолько велика, что у взрос-
лого человека за 10 лет происходит полное обновление костной ткани.
Лежащие в основе организации костной ткани процессы своеобраз-
ной физиологической регенерации имеют большое биологическое зпаче-
Рис. 108. Пластинчатая костная ткань млекопитающих. (Из: Ham, 1957).
а — остеон, б — схема строения трубчатой кости. 1 — система наружных и внутренних генеральных
пластинок, 2 — гаверсовы пластинки, <3 — полость гаверсовых каналов, 4 — вставочные пластинки,
5 — полости костных клеток и анастомозирующая сеть костных канальцев, где располагаются остео-
циты, 6 — надкостница, 7 — кровеносный сосуд кости, 8 — кровеносные сосуды костного мозга,
9 — фолькмановский канал, 10 — граница остеона, 11 — остеогенная соединительная ткань.
ние, поскольку они обусловливают функциональную пластичность этой
системы в онто- и филогенезе. Благодаря такой организации костная ткань
может обеспечить формирование механических структур адекватных ме-
няющимся в ходе развития животных и человека физических нагрузок.
17*
259
Эта способность костной ткани к адекватной реакции на действие физи-
ческих факторов была известна еще в конце XIX века. Однако конкрет-
ные механизмы этих процессов, и особенно механизмы рецепции
меняющихся физических нагрузок на дефинитивную костную ткань, дли-
тельное время оставались неясными. В настоящее время делаются ус-
пешные попытки связать эти механизмы рецепции с ярко выраженным
пьезо-эффектом, характерным для межклеточного вещества костной ткани
(Digby, 1966). При сгибании вырезанных даже из мертвой кости пласти-
нок на их поверхностях наводится положительный и отрицательный
заряды. В связи с этим есть основание предполагать, что такой пьезо-
эффект и является тем первичным сигналом, который приводит в действие
систему малодифференцированных клеток. Положительный заряд вызывает
дифференцировку остеокластов, а отрицательный — остеобластов. Проти-
воположная по своему значению деятельность этих клеток приводит к пе-
рестройке костной ткани соответственно действию механических сил.
Из приведенной краткой характеристики костной ткани позвоночных
животных следует, что она представляет собой весьма совершенную спе-
циализированную разновидность тканей внутренней среды. В этой си-
стеме гармонично сочетаются такие противоположные свойства и про-
цессы, как механическая прочность и функциональная пластичность,
процессы новообразования и разрушения костной ткани.
Специализация приводит к утрате в костной ткани такого характер-
ного первичного признака тканей внутренней среды, как первичная апо-
лярность клеток и межклеточных структур. В клетках костной ткани
резко выражены конкурентные или даже антагонистические отношения
между процессами специфического синтеза и репродукцией, что обычно
не свойственно разновидностям тканей внутренней среды.
ОБЩИЕ ЗАКОНОМЕРНОСТИ СИСТЕМНОЙ ОРГАНИЗАЦИИ
И МОРФОБИОХИМИЧЕСКОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК
ОПОРНЫХ И СКЕЛЕТНЫХ ТКАНЕЙ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
В основе организации таких различных на первый взгляд тканей,
как рыхлая и плотная соединительные ткани, костная и хрящевая ткани,
лежит в конечном счете единый процесс сложной комплексной синтети-
ческой деятельности оседлых клеток тканей внутренней среды позвоноч-
ных. Чем больше мы узнаем о химическом составе этих тканей и общих
закономерностях морфобиохимической организации образующих их кле-
ток, тем яснее становится тот факт, что различия между этими тканями
на клеточном и субклеточном уровнях организации носят в основном
количественный, а не качественный характер. Действительно, основными
компонентами этих тканей, если даже учесть все разнообразие их от-
дельных разновидностей у позвоночных животных, являются коллагены
и мукополисахариды, входящие в состав надмолекулярных комплексов.
Образование этих макромолекул происходит с помощью одинаковых на-
боров ферментов, характерных и для фибробластов, и для хрящевых, и
для костных клеток. Очевидно, что сами процессы внутриклеточного
транспорта, выведения из клеток высокомолекулярных органических со-
единений и сборки их в надмолекулярные комплексы требуют сходной
внутренней организации рассматриваемых клеток.
Различия в дефинитивной функциональной деятельности этих клеток
заключаются в основном в разных соотношениях продуцируемых клет-
ками веществ и, в конечном счете, с биохимической точки зрения эти
различия обусловливаются количественным варьированием в клетках од-
них и тех же ферментативных систем или их усложнением путем добав-
ления новых ферментов к уже существующим. Мысль о наличии единого
общего биохимического механизма в процессах синтеза межклеточных
260
структур во всех разновидностях тканей внутренней среды последова-
тельно проводится в ряде последних обзоров крупными специалистами
по сравнительному биохимическому и цитологическому анализу опорных
тканей (Mathews, 1967; Hall, 1970; Owen, 1970).
По сути дела в отношении опорных тканей позвоночных животных
справедливы те же соображения, которые были высказаны ранее в от-
ношении кожных эпителиев позвоночных или членистоногих. Все много-
образие поверхностных структур в этих тканях создается на основе
единого для каждого типа животных биохимического механизма — керати-
низации у позвоночных и синтеза хитина и специфических склеропротеи-
нов у членистоногих животных. Особенностью опорных тканей внутренней
среды являются лишь большие потенции к формированию более много-
образных, чем у кожных эпителиев, структур. Это определяется более
сложным в своей первичной основе химическим составом опорных тка-
ней у предков позвоночных животных и более сложным и многообраз-
ным системным уровнем их организации.
Существование общего биохимического механизма в основе диффе-
ренцировки опорных тканей заставляет предполагать и наличие глубо-
кого единства их разновидностей в историческом и индивидуальном раз-
витии организмов. Весьма ярко проявляется единство этих тканей в он-
тогенезе позвоночных животных. Об этом свидетельствуют даже чисто
феноменологические характеристики наблюдаемых морфологических кар-
тин и процессов.
В раннем онтогенезе в период энергичного роста развивающегося эм-
бриона у высших позвоночных большинство крупных костей внутрен-
него скелета закладывается вначале в виде хрящевых «моделей». Их
темпы роста в этот период соответствуют темпам роста развивающегося
организма. Затем, когда интенсивность процессов роста замедляется и
возникает необходимость формирования уже более прочного в механиче-
ском отношении скелета, происходит замещение хряща костью. Процесс
этот в трубчатых костях начинается с того, что в области диафиза сфор-
мированной уже хрящевой модели кости клетки надхрящницы пере-
стают образовывать хондробласты (рис. 109, а). Они начинают продуци-
ровать остеобласты, которые образуют на поверхности хряща манжетку
из так называемой перихондральной костной ткани. Хрящевая ткань
в области расположения такой костной манжетки начинает разрушаться.
Процессы ее разрушения усиливаются за счет деятельности специальных
клеток хондрокластов. Последние возникают из периваскулярной мезен-
химы сосудов, врастающих в область разрушающейся хрящевой ткани.
Затем на тонких перекладинах и прослойках сохранившегося еще меж-
клеточного вещества хряща оседают остеобласты, возникающие из этой
же периваскулярной мезенхимы. Они образуют участки так называемой
энхондральной кости. Когда процессы энхондрального и перихондраль-
ного замещения хрящевой ткани костной в области диафиза зайдут уже
достаточно далеко, начинается замещение костью хрящевой ткани эпи-
физов. Наиболее продолжительное время (у человека до 20 лет) сохра-
няется хрящевая ткань в составе трубчатых костей на границе эпифиза
и диафиза, где образуются характерные полоски, или столбики роста и
размножения хрящевых клеток. Их деятельность обеспечивает рост ко-
сти в длину. Участки хрящевой ткани в области этих зон роста представ-
ляют собой весьма своеобразную систему. Здесь происходит непрерывное
размножение клеток. По направлению к диафизу клетки увеличиваются
в размерах и образуют прослойки межклеточного вещества. Одновре-
менно со стороны диафиза идет непрерывное разрушение хрящевой
ткани и замещение ее костной за счет деятельности остеогенной соеди-
нительной ткани, находящейся в костномозговом канале и надкостнице.
Динамика размножения клеток в эпифизарной части хрящевой пла-
стинки и их перемещения в область гипертрофированных и разрушаю-
261
щихся хрящевых клеток на границе с диафизом хорошо прослеживается
в опытах с 3Н-тимидином. На ранних сроках после инъекции 3Н-тими-
дина маркированные ядра у хондроцитов наблюдаются лишь в области
их размножения (рис. 109, б). К более поздним срокам хондроциты
с меченой ДНК смещаются уже на границу с диафизом (рис. 109, в).
Длительное время процессы размножения клеток и роста хрящевой
ткани сбалансированы с процессами ее замещения костной тканью и
толщина хрящевых пластинок остается без изменения. Расстояние же
Рис. 109. Взаимоотношения хрящевой и костной тканей при развитии трубчатой кости.
а — участок продольного среза трубчатой кости в области перехода диафиза в эпифиз, б, в — авто-
графы этой области трубчатой кости двухдневных мышей через 1 час (б) и 4 суток (в) после трехкратной
инъекции 3Н-тимидина с интервалом в 6 час. 1 — перихондральная кость, 2 — эпхондральная
кость, 3 — надкостница, 4 — формирующаяся миелоидная ткань, 5 — зона уплощенных пролифери-
рующих хрящевых клеток, 6 — зона пузырчатого хряща.
между двумя хрящевыми пластинками, расположенными на границе
эпифизов трубчатой кости, непрерывно увеличивается, т. е. происходит
рост диафиза кости в длину. При завершении процессов роста замеще-
ние костной тканью хрящевых пластинок начинает преобладать над
процессами роста и размножения хрящевых клеток. К этому времени
происходит и полное замещение эмбриональной, энхондральной и пери-
хондральной костных тканей дефинитивной пластинчатой костной
тканью со сложной системой каналов и костных пластинок.
В последнее время появились данные о том, что при замещении хря-
щевой ткани костной в области хрящевых пластинок, остеобласты ис-
пользуют не только имеющиеся в гипертрофированных хрящевых клет-
ках запасы гликогена, но и часть макромолекулярных соединений, необ-
ходимых для построения межклеточного вещества кости (Knese, 1967).
Процессы замещения хрящевой ткани костной в трубчатых костях
внутреннего скелета с теми или иными вариантами характерны для
большинства классов позвоночных животных (Румянцев, 1958).
262
Краткая характеристика некоторых аспектов взаимоотношения кост-
ной и хрящевой тканей при формировании трубчатых костей скелета
высших позвоночных животных в нормальных условиях показывает, на-
сколько тесно связаны между собой эти две разновидности опорных тка-
ней на системном уровне их организации. Очевидно, что возможность
смены хондробластической потенции камбиальных клеток на остеогенную
связана с наличием у хондробластов и остеобластов сходной морфо-
биохимической организации. Помимо описанных выше изменений, в ске-
летогенных зачатках в условиях организма может наблюдаться и мета-
плазия остеогенной камбиальной системы в хондробластическую. Наи-
более простым примером является развитие хрящевых мозолей при
переломах кости. Формирование хрящевой ткани при таких переломах
происходит из камбиальных клеток надкостницы. Образующиеся в ре-
зультате размножения этих клеток клеточные элементы меняют харак-
терную для них естественную программу усиленного коллагеногенеза
на стимуляцию синтеза хондроитинсульфатов. Непосредственным фак-
тором, обусловливающим возможность такого изменения клеточного ме-
таболизма, является уровень кислородного обмена. Развитие хрящевой
ткани в области перелома кости происходит лишь при сильном наруше-
нии сосудистой системы. В случае сохранения капиллярной сети реге-
нерация кости происходит без стадии хрящевой мозоли (Ham, Harris,
1956).
Еще более многообразные и сложные примеры метаплазии опорных
тканей удается получить в экспериментальных условиях (см. обзор:
Hall, 1970). В опытах по культивированию клеток надкостницы кури-
ного эмбриона при разных условиях по методу висячей капли авторам
в зависимости от окружающих условий (степени насыщения кислородом,
плотности расположения клеток в системе, механического натяжения)
удавалось получить из одних и тех же клеток либо костную ткань, либо
хрящевую, либо, наконец, плотную фиброзную ткань.
В опытах in vitro, по мнению некоторых авторов, удается наблюдать
не только изменение направления дифференцировки камбиальных кле-
ток путем реализации их остеобластических или хондробластических
потенций, по и прямое превращение хрящевых клеток в остеобласты
или, наоборот, последних в хондроциты. Это происходит, например, при
удалении гипертрофированных хондроцитов из матрикса (Crelin, Koch,
1967). Еще раньше Фелл (Fell, 1933) удалось показать возможность
трансформации остеобластов в клетки гипертрофированного хряща. Од-
нако эти данные требуют дополнительной проверки.
Естественно, что возможность относительно легкой взаимной мета-
плазии тканей широко реализуется при их филогенетической диффе-
ренцировке у представителей разных классов позвоночных животных,
о чем свидетельствуют разобранные выше процессы нормального заме-
щения хрящевой ткани костной. Еще одним примером может служить
обратный процесс метаплазии остеобластов в хондробласты хряща су-
ставных поверхностей при развитии некоторых костей черепа у птиц.
Такой метаплазии предшествует усиленная пролиферация клеток над-
костницы. После накопления достаточной клеточной массы часть кле-
ток идет по пути остеогенеза, а часть усиливает синтез хондроитинсуль-
фатов и превращается в хрящ (Murray, 1963; Hall, Shorey, 1968).
Пластичность скелетных тканей позвоночных животных сочетается
в условиях in vivo со сложной системной организацией этих тканей. По-
следняя особенно интенсивно изучается в настоящее время на примере
костной ткани высших позвоночных животных (см. обзор: Owen, 1970).
Как следует из приведенной в предыдущем разделе характеристики кост-
ной ткани, одной из ее особенностей является закономерное распределе-
ние клеток по степени их дифференцированности. В костной ткани име-
ется топографически выделенная и сложно организованная неоднородная
263
камбиальная система. Она представлена работающим камбием — пре-
остеобластами, расположенными снаружи от слоя дифференцированных,
прекративших репродукцию остеобластов. Преостеобласты, по определению
Оуэн, представляют собой фонд пролиферирующих клеток-предшествен-
ников и по сути дела аналогичны сохраняющим способность к размно-
жению дифференцирующимся клеткам в других разновидностях тканей
внутренней среды. Сложность организации костной ткани заключается
в том, что в ней, помимо системы преостеобластов, имеется еще и спе-
циальная система пролиферирующих предшественников для остеокла-
стов. Эта система может быть топографически отделена от пролифери-
рующих предшественников остеобластов, однако чаще они располагаются
в одних и тех же участках надкостницы или скелетогенной мезен-
химы. Такая дуалистическая дифференцировка на уровне пролифери-
рующих клеток-предшественников отчетливо выявляется при действии
паратиреоидного гормона. Последний стимулирует синтез РНК и раз-
множение преостеобластов и, наоборот, угнетает эти процессы в пре-
остеокластах.
Помимо работающего камбия, представленного преостеобластами
и преостеокластами, в костной ткани, как и в других разновидностях
тканей внутренней среды, имеется еще и система полустволовых недиф-
ференцированных камбиальных клеток. Она также, по-видимому, гетеро-
генна по своим биологическим свойствам и состоит из детерминирован-
ных и так называемых индуцибельных клеток. По морфологическим
признакам рассматриваемые клетки не обнаруживают существенных раз-
личий в связи с отсутствием у них каких-либо признаков специфиче-
ской дифференцировки. Представление о гетерогенности остеобластиче-
ского камбия было сформулировано А. Я. Фриденштейном на основании
результатов опытов с культивированием различных клеток тканей внут-
ренней среды в диффузионных камерах (Фриденштейн, 1973; Фриден-
штейн, Лалыкина, 1973). В этих опытах удалось показать, что при опре-
деленной концентрации клеток костного мозга происходит образование
костной ткани. При культивировании в диффузионных камерах взвеси
клеток селезенки, лейкоцитов периферической крови, клеток перито-
неального эксудата аналогичные результаты получаются лишь при усло-
вии добавления к взвеси этих клеток кусочков переходного эпителия
мочевого пузыря. Анализируя результаты этих опытов, автор приходит
к выводу, что в костном мозге имеются камбиальные клетки, способные
давать костную ткань без дополнительных химических воздействий (де-
терминированные клетки-предшественники). Среди клеток,взятых из дру-
гих источников, такие клетки отсутствуют, однако имеются камбиальные
клетки, способные проявлять остеобластические потенции при наличии
специального индуктора (индуцибельные клетки-предшественники).
На основании этих и других данных Оуэн считает, что в нормальной
костной ткани имеются обе эти разновидности камбиальных клеток.
По ее мнению, при регенерации костной ткани первые этапы репаратив-
ных процессов осуществляются за счет размножения индуцибельных
клеток-предшественников. Завершающие этапы репаративных процессов
и все сложные процессы перестройки хрящевой и костной мозолей про-
исходят уже за счет деятельности продуктов размножения основных
камбиальных клеток костной ткани — детерминированных клеток-пред-
шественников.
Таким образом, современные представления о камбиальной системе
костной ткани свидетельствуют о том, что в настоящее время мы уже
подходим к пониманию сложного гетерогенного характера ее организа-
ции. Результаты опытов Фриденштейна, а также многочисленные данные
по эктопическому образованию костной ткани (см. обзоры: Hall, 1970;
Owen, 1970) свидетельствуют и о глубоком единстве всех тканей внут-
ренней среды. Образование костной ткани в любом участке соединитель-
264
ной ткани возможно лишь при наличии в соединительной ткани или
в циркулирующей крови клеток, обладающих способностью проявлять
остеобластические потенции. Можно, следовательно, с большой вероят-
ностью предполагать, что в основе всех разновидностей тканей внутрен-
ней среды, помимо стволовых мультипотентных клеток кроветворных
и лимфоидных систем, имеются и стволовые мультипотентные стромаль-
ные клетки, продукты размножения которых способны дифференциро-
ваться и в направлении фибробластов рыхлой и плотной соединительных
тканей, и в направлении хондробластов, ретикулярных клеток и остео-
бластов.
ХРЯЩЕВЫЕ И ПЛОТНЫЕ СОЕДИНИТЕЛЬНЫЕ ТКАНИ
БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Как правило, у большинства беспозвоночных животных опорная ске-
летная функция осуществляется по иному принципу, чем у позвоночных
животных.
У многих беспозвоночных основную роль в реализации этой функции
берут на себя наружные скелеты — производные кожного эпителия. При
этом большее распространение и прогрессивное развитие в эволюции
имеют наружные скелеты, образованные различными разновидностями
кутикулярных эпителиев. У некоторых кишечнополостных, у губок и
у иглокожих, по-видимому, независимо в каждом из этих типов живот-
ных, формируются внутренние спикульные скелеты преимущественно
из неорганических солей. Их образуют особые, своеобразно интегриро-
ванные системы клеток спикулобластов. У кольчатых червей и других
близких к ним беспозвоночных с хорошо развитым целомом и кожно-
мускульным мешком необходимая механическая прочность тела живот-
ных обеспечивается в значительной мере этими органами.
Несмотря на такое разнообразие скелетных опорных образований
у беспозвоночных животных, у них получают развитие и имеющиеся
в тканях внутренней среды потенции к формированию опорных механи-
ческих структур. Однако эти потенции проявляются лишь у некоторых
групп животных и в ограниченных участках тела в связи с особыми
функциональными задачами органных структур, требующих специаль-
ного усиления механической функции межуточных интерстициальных
тканей или стенки данного органа.
Впервые наличие опорных тканей, образованных межклеточным ве-
ществом соединительнотканной природы, было обнаружено в XIX веке
в период интенсивного сравнительно-гистологического анализа микро-
скопического строения тканей многоклеточных животных. В многочис-
ленных сравнительно-гистологических работах у разных животных и
в разных органах были описаны структуры, аналогичные плотной соеди-
нительной ткани позвоночных животных, и даже ткани, сходные с типич-
ной хрящевой тканью (см. обзоры: Schaffer, 1930; Заварзин, 1945, 1947).
Хрящевые ткани были обнаружены у отдельных представителей почти
всех типов беспозвоночных животных, за исключением иглокожих и
губок. Однако отсутствие точных биохимических и гистохимических мето-
дов анализа межклеточного вещества и отсутствие у межклеточного ве-
щества хряща беспозвоночных способности образовывать желатину, дало
основание многим авторитетным гистологам возражать против иденти-
фикации хрящевой ткапи позвоночных и беспозвоночных животных.
По их мнению, у беспозвоночных животных мы имеем дело с тканями,
лишь внешне напоминающими хрящевую ткань позвоночных животных.
Наряду с этим имелись и альтернативные представления по этому во-
просу.
Оживленная дискуссия между сторонниками и противниками при-
знания принципиального сходства хрящевых тканей у многоклеточных
265
животных велась в течение первой половины XX в. Общебиологическое
значение этого вопроса было подчеркнуто акад. А. А. Заварзиным в его
очерках по эволюционной гистологии тканей внутренней среды. По его
мнению, факт наличия такой специализированной ткани у представите-
лей разных типов давно дивергировавших от общего предка, не имев-
шего хрящевой ткани, является одним из наиболее ярких примеров па-
раллельной эволюции на тканевом уровне организации многоклеточных
животных. К сожалению, эти идеи не получили распространения в миро-
вой литературе и лишь в последнее время независимо развиваются груп-
пой американских и английских авторов на основании систематических
морфологических и биохимических исследований хрящевых и других
опорных тканей беспозвоночных животных (см. обзоры: Mathews, 1967;
Ashhurst, 1968; Person, Philpott, 1969b; Hunt, 1970). Необходимой пред-
посылкой этих исследований было выяснение химической природы меж-
клеточного вещества хрящевой ткани позвоночных. После того, как уда-
лось показать, что помимо коллагена в его состав входят две разновид-
ности хондроитинсульфатов (А и С) и кератосульфаты в комплексе
с особыми белками, стали возможны аналогичные исследования на хря-
щевой ткани беспозвоночных животных; появились точные критерии для
сопоставления ее у разных животных. Первое биохимическое исследова-
ние такого рода на хрящевой ткани беспозвоночных было проведено
в 1959 г. Лашем (Lash, 1959). В качестве объекта он использовал суб-
радулярный хрящ брюхоногого моллюска Busycon canaltculatum. В этом
и более детальном последующем исследовании (Lash, Whitehouse, 1960),
авторам удалось показать, что специфическими мукополисахаридами
являются здесь не хондроитинсульфаты, а глюкансульфаты, мукополиса-
хариды, в основе молекулы которых лежит глюкоза, а не галактоза.
Аналогичные последующие исследования, проведенные на хрящевых
тканях головоногих моллюсков, крабов, полихет показали, что у этих
животных в межклеточном веществе соединительной ткани специфиче-
скими мукополисахаридами являются хондроитинсульфаты А и С, а воз-
можно, и кератосульфат. Таким образом, химическая аналогия хрящевых
тканей представителей разных, далеко отстоящих в филогенетическом
отношении типов многоклеточных животных этими исследованиями была
доказана весьма убедительно. В свете полученных биохимических дан-
ных большой общебиологический интерес представляло выяснение осо-
бенностей тонкой структурной и химической организации хрящевых
тканей в разных группах беспозвоночных животных. Такие морфобиохи-
иические исследования и были проведены в последние десять лет на хря-
щевых тканях представителей полихет, брюхоногих и головоногих мол-
люсков и членистоногих.
Хрящевая ткань довольно широко распространена у сидячих полихет.
Наиболее подробно она изучена в настоящее время у полихеты Eudisty-
lia polymorpha (Person, Mathews, 1967). Скелетная опорная ткань в ос-
новании щупалец образована двумя ее разновидностями. Одна из них
представляет собой хрящевую ткань с тонкими прослойками межклеточ-
ного вещества и крупными полигональными клетками с ядрами, распо-
ложенными в центре клеток. Такая ткапь весьма напоминает «клеточные»
хрящи низших позвоночных. Как указывалось выше биохимический
анализ хрящевой ткани рассматриваемой полихеты показал наличие
здесь хондроитинсульфатов и коллагена. Особенностью мукополисахари-
дов является высокая степень их сульфатации, что вообще характерно
для морских животных, обитающих в соленой воде.
Широкое распространение имеет субрадулярная хрящевая ткань
у брюхоногих моллюсков в их ротовом аппарате. У разных представите-
лей этих животных опорный внутренний скелет радулы может быть
развит в различной степени, что определяется приспособлением животных
к разному типу пищи. Так, у некоторых брюхоногих моллюсков (на-
266
пример, у голожаберных) хрящевая ткань практически отсутствует и
опорные структуры образованы плотной соединительной тканью с хо-
рошо развитыми коллагеновыми волокнами. У других брюхоногих (Ар-
lysia, Lymnaea, Helix и др.) имеет место диффузное распределение не-
больших групп хрящевых клеток и мышечных волокон, образующих
единую сократимую и опорную систему. При этом обе разновидности
клеток в этой системе происходят из одного источника и тесно связаны
между собой не только структурно и функционально, но и гистогенети-
чески. Наконец, при максимальном развитии хрящевой ткани в суб-
радулярном аппарате она представлена большими участками преиму-
щественно клеточной хрящевой ткани (Busycon canaliculatum, Buccinum.
Рис. 110. Участок пузырчатого хряща в плавнике миноги (а) и хрящевая ткань из суб-
радул яркого хряща брюхоногого моллюска (б).
undatum). По соотношению клеток и межклеточных структур этот хрящ
похож па пузырчатый хрящ низших позвоночных (рис. 110, а, б). Меж-
клеточное вещество хряща у брюхоногих моллюсков дает положительную
окраску на кислые полисахариды. Крупные полигональные клетки не об-
наруживают четко выраженного закономерного распределения по сте-
пени их зрелости. Интенсивность метаболизма сульфатированных поли-
сахаридов во взрослом хряще невелика. Слабое включение меченой серы
удавалось наблюдать при инъекции Na235SO4 у Buccinum undatum лишь
в хряще молодых животных, в то время как в слизистых железистых
эпителиальных клетках даже у взрослых животных наблюдается весьма
интенсивное ее избирательное включение. При ультраструктурном ис-
следовании межклеточного вещества хряща у Busycon canaliculatum уда-
лось выявить наличие коллагеновых фибрилл с типичной поперечной
исчерчепностыо с периодичностью 600—650 А. Как указывалось выше,
вместо хондроитиисульфатов у этого моллюска имеется другой полисаха-
рид — глюкапсульфат. Особенностью хрящевой ткани брюхоногих мол-
люсков является также наличие здесь дыхательных пигментов — миогло-
бинов и особой цитохромоксидазы, содержащей как медь, так и железо
в активной части молекулы.
Обстоятельно исследована комплексным морфобиохимическим мето-
дом хрящевая ткань у краба Limulus (Person, Philpott, 1969а). У этого
животного имеются две разновидности развивающейся из мезенхимы хря-
щевой ткани — хрящевая ткань в основании жаберных выростов и хря-
щевая пластинка на брюшной стороне в передней части головогруди.
267
Более детально исследован в настоящее время жаберный хрящ этих жи-
вотных (рис. 112, а). У растущих животных прослойки межклеточного
вещества крайне незначительны и основная масса хряща представлена
пузыревидными клетками. У взрослых животных происходит увеличение
и размеров клеток и прослоек межклеточного вещества. Как и у позво-
ночных животных, у краба имеют место два типа роста — с поверхности,
за счет элементов окружающей соединительной ткани, и изнутри, путем
размножения и роста клеток и выделения ими межклеточного вещества.
При аппозиционном росте фибробласты окружающей соединительной
ткани обычным путем формируют тонкие волокна. В участках этой ткани,
прилегающих к межклеточному веществу хрящевой ткани, эти волокна
объединяются в более толстые пучки, которые постепенно переходят
в межклеточное вещество хряща. В нем помимо волокнистых пластин-
чатых электронноплотных структур имеется аморфный матрикс. Все эти
сложные преобразования внеклеточных структур происходят за счет вы-
деляемых фибробластами высокомолекулярных белков и полисахаридов.
При этом в прилежащих к поверхности хряща участках фибробласты
синтезируют не только полисахариды обычной соединительной ткани,
но и специфические хрящевые полисахариды. Таким образом, фибро-
бласты постепенно приобретают черты хрящевых клеток, что, в част-
ности, выражается в появлении в их цитоплазме больших количеств
гликогена.
Типичные хрящевые клетки в хряще взрослых животных представ-
ляют собой крупные пузыревидные клетки с вакуолизированной цито-
плазмой и эксцентрично расположенными ядрами. В их цитоплазме по-
мимо крупных вакуолей имеются различные по величине гранулы, окру-
женные мембраной. В этих гранулах обнаруживаются капли липидов,
зерна гликогена и дегенерирующие рибосомы. Межклеточное вещество
формируется этими клетками двумя путями. С одной стороны, в более
молодых клетках в периферических участках цитоплазмы наблюдается
появление палочковидных структур, сходных с ламеллярными структу-
рами межклеточного вещества. Затем, по-видимому, путем макроапокри-
новой секреции эти структуры выводятся из клеток. Помимо такого ме-
ханизма, наблюдаются картины, которые, по мнению Персона и Фил-
пота, свидетельствуют о возможности внутриклеточного образования
большого количества межклеточного вещества. В конце концов это при-
водит к полному перерождению хрящевых клеток. На месте таких клеток
возникают характерные участки межклеточного вещества. Их перифери-
ческая часть образована плотно расположенной системой концентриче-
ских пластинок. По направлению к бывшему центру клетки плотность
расположения пластинок уменьшается. Между пластинками располагается
электронносветлый матрикс, имеющий вид отдельных участков полиго-
нальной формы. Помимо основного матрикса, заполняющего промежутки
между системой тяжей и пластинок, в наиболее удаленных от клеток
участках имеются еще и прослойки электронноплотного аморфного ве-
щества. Они обычно остаются не окрашенными при любых методах
окраски. При окраске на мукополисахариды обнаруживается резко поло-
жительная реакция в межклеточном веществе и цитоплазме клеток цент-
ральных участков хрящевой ткани. В области надхрящницы и перифери-
ческих участков хряща окраска слабее или полностью отсутствует.
Биохимический и рентгеноструктурный анализ хрящевой ткани краба
Limulus показал наличие здесь типичных хондроитинсульфатов. Не-
значительным оказалось относительное количество коллагена (10—12%).
Возможно, что это связано с небольшим удельным весом межклеточного
вещества в гомогенатах, приготовленных из хрящевой ткани крабов.
Эта же причина обусловливает, по-видимому, и отсутствие типичных для
коллагена рентгенограмм при рентгеноструктурном анализе таких гомо-
генатов.
268
Наибольшего развития и степени гистологической дифференцировки
достигают хрящевые ткани у головоногих моллюсков. Они представ-
лены, во-первых, хрящевой капсулой, обеспечивающей защиту высших
отделов головного мозга, и, во-вторых, глазными хрящами. Характерной
особенностью хрящевой ткани головоногих моллюсков является большое
количество межклеточного вещества и наличие строгой пространствен-
ной локализации клеток по степени их зрелости. На периферии распо-
лагаются молодые дифференцирующиеся клетки, а в центре — группы
дифференцированных клеток. Благодаря этому хрящевая ткань голово-
ногих моллюсков оказывается весьма сходной с гиалиновым хрящом
низших позвоночных (рис. 111). При общих и специальных гистохими-
Рис. 111. Хрящевая ткань лягушки (а) и головоногого моллюска (б).
1 — зона молодого хряща, 2 — зрелая хрящевая ткань.
ческих окрасках также наблюдается сходное с хрящом позвоночных жи-
вотных отношение межклеточных структур к красителям.
На протяжении последних лет, начиная с 1960 года, проведен био-
химический анализ хрящевой ткани у разных представителей головоногих
моллюсков. Основным результатом этих работ было доказательство на-
личия в хряще хондроитинсульфатов и кератосульфатов, аналогичных,
но не тождественных этим соединениям в хряще позвоночных живот-
ных. Важной особенностью хрящевой ткани головоногих моллюсков яв-
ляется отростчатая форма образующих ее клеточных элементов. Благодаря
этому все межклеточное вещество хряща пронизано системой мелких
каналов. Детальный ультраструктурный анализ хрящевой ткани голово-
ногих моллюсков проведен Филпотом и Персоном (Philpott, Person, 1970).
При этом оказалось, что электронномикроскопическая картина межкле-
точного вещества хряща головоногих моллюсков сходна с аналогичными
картинами, наблюдаемыми в хряще краба (рис. 112). Основу его состав-
ляют тяжи или пластинки межклеточного вещества, образующие сеть
с полигональными ячейками. Однако у головоногих моллюсков тяжи эти
тоньше, а объем электронносветлого матрикса, наоборот, значительно
больше. Кроме тяжей и матрикса, в межклеточном веществе обнаружи-
ваются и электронноплотные гранулы.
Существенные особенности характерны и для ультраструктурной ор-
ганизации клеток. Они значительно богаче мембранными структурами и,
269
в частности, мембранами шероховатой эндоплазматической сети. В них
имеется хорошо развитый аппарат Гольджи двух типов: обширные комп-
лексы его элементов в центре и мепьших размеров комплексы по пери-
ферии клеток. Относительно много митохондрий, часть которых имеет
вакуолизированный вид. В оболочке ядра наблюдаются многочисленные
поры, а в ядрышке — скопления рибосомоподобных частиц.
Рис. 112. Схемы ультраструктурной организации хрящевой ткани краба (по элек-
тронным микрофотографиям: Person, Philpott, 1969а) и головоногого моллюска
(по электронным микрофотографиям: Philpott, Person, 1970) и плотной соедини-
тельной ткани саранчи (по электронным микрофотографиям: Ashhurst, Costin, 1974;
Martoja, Bassot, 1965).
a — хрящевая ткань краба, б — хрящевая ткань головоногого моллюска, в, г — плотная соедини-
тельная ткань саранчи (в — формирующаяся, г — дифференцированная). 1 — хрящевые клетки,
2 — межклеточное вещество хряща, 3 — коллагеновые волокна, 4 — ядро, 5 — участок межклеточ-
ного вещества хряща на месте хрящевой клетки, 6 — уплотненные участки цитоплазмы на месте
апокриновой секреции, 7 — фиброцит, 8 — область перехода плотной соединительной ткани в хряще-
вую ткань, 9 — отросток клетки в канале межклеточного вещества, 10 — ресничка, 11 — шерохова-
тая эндоплазматическая сеть, 12 — аппарат Гольджи, 13 — фибробласт, 14 — межклеточное ве-
щество соединительной ткани, 15 — видоизмененные коллагеновые волокна в зрелой соединительной
ткани, 16 — область выведения из клетки тропоколлагена, 17 — экзоцитозный пузырек.
Наблюдаемые картины со всей очевидностью свидетельствуют о том,
что хондроциты хрящевой ткани головоногих моллюсков обладают спо-
собностью вырабатывать большие количества межклеточного вещества
мукопротеидной природы. Выведение синтезируемых клетками веществ
осуществляется, по-видимому, путем экзоцитоза, о чем свидетельствуют
многочисленные, ограниченные мембраной пузырьки на периферии кле-
ток. Выделение межклеточного вещества имеет место не только в теле
клеток, но и в их отростках. Интенсивный синтез межклеточного ве-
щества хондроцитами необходим, по-видимому, не только для осуществле-
270
4
Рис. 112 (продолжение),
ния внутреннего роста хряща, но и для обновления его межклеточного
вещества. В канальцах межклеточного вещества иногда могут распола-
гаться не обычные отростки клеток, а жгутики или реснички. Функцио-
нальное значение этих образований остается неясным.
Таким образом, краткий обзор результатов основных современных
работ по хрящевой ткани беспозвоночных животных показывает, на наш
взгляд, большую перспективность целенаправленных сравнительно-ги-
стологических и биохимических исследований. Действительно, в них уда-
Рис. 112 (продолжение).
лось отчетливо показать наличие общих закономерностей филогенетиче-
ской дифференцировки этой весьма специфической разновидности тканей
внутренней среды. Глубокое сходство в структурном и особенно в хими-
ческом отношении хрящевой ткани головоногих моллюсков, членисто-
ногих и низших позвоночных животных может служить весьма ярким
примером возможности независимого проявления общих потенций к весьма
специфической дифференцировке тканей внутренней среды многоклеточ-
ных животных. Наряду с этим у каждого из разобранных представителей
многоклеточных животных хрящевая ткань имеет весьма существенные
особенности. Наиболее далеко заходящие различия химического состава
наблюдаются в хрящевой ткани брюхоногих моллюсков, а в отношении
характера взаимоотношения клеток и межклеточных структур у краба
Limulus. Существенные особенности морфобиохимической организации
272
межклеточного вещества хряща характерны также и для хрящевой ткани
полихет.
Как указывалось выше, помимо типичных хрящевых тканей у беспоз-
воночных животных достаточно широко распространены плотные соеди-
нительные ткани. Они имеют либо самостоятельное значение, как напри-
мер в стенке тела у голотурий и оболочников, либо образуют сложные
опорно-сократимые системы ротового аппарата или крупных сосудов.
В таких системах, развивающихся обычно из общего источника, имеется
не только тесная функциональная связь сократимых и опорных структур,
но и отсутствует топографическое разделение мышечной и соединитель-
ной тканей.
Основным функционирующим структурным элементом в плотной сое-
динительной ткани беспозвоночных животных являются пучки коллаге-
новых волокон, связанных с большим или меньшим количеством муко-
протеинов. В стенках сосудов и в некоторых участках переднего отдела
тела у многих животных большое развитие получают и эластиноподобные
волокнистые структуры (Elder, 1973).
Особый интерес представляет факт наличия типичной плотной кол-
лагеновой соединительной ткани у высших представителей первичноро-
тых — насекомых. Как уже отмечалось, у этих животных реализация по-
тенций тканей внутренней среды к созданию скелетных механических
структур выражена относительно слабо, поскольку скелетная функция
осуществляется в основном кутикулярным эпителием и его производ-
ными. Тем не менее у некоторых представителей насекомых в силу не-
ясных для нас причин эта опорная скелетная функция при формирова-
нии специальных органов может осуществляться и опорными структурами
соединительнотканной природы.
Одним из наиболее ярких примеров таких структур являются опор-
ные структуры в копулятивных органах самцов саранчи Locusta migrates
ria. У взрослых животных эпителиальная выстилка канала этого органа
окружена типичной плотной соединительной тканью с хорошо различи-
мыми в ней коллагеновыми волокнами и межклеточным основным веще-
ством (рис. 112, г). Обилие последнего, а также некоторые цитохимиче-
ские особенности дали основание отнести эту ткань к разновидностям
хрящевой ткани (Martoja, Bassot, 1965). Однако более тщательный уль-
траструктурный анализ этой ткани, а также анализ ее гистогенеза пока-
зал, что мы имеем здесь дело с типичной хорошо развитой плотной сое-
динительной тканью, межклеточные структуры которой формируются за
счет активной синтетической деятельности типичных фибробластов
(Ashhurst, Costin, 1974). Последние на ранних этапах формирования
плотной соединительной ткани характеризуются наличием хорошо раз-
витого белоксинтезирующего аппарата и других мембранных органоидов
(рис. 112, в). Они активно включают специфические для коллагена ами-
нокислоты (3Н-пролин) и достаточно энергично выделяют меченые
белки, идущие на формирование межклеточных структур соединительной
ткани. Таким образом, в данном случае имеются отношения, вполне со-
поставимые с аналогичными отношениями в соединительной ткани по-
звоночных животных. Тем не менее формирующиеся межклеточные струк-
туры в плотной соединительной ткани копулятивного органа саранчи
характеризуются и целым рядом особенностей как в качественном, так
и в количественном отношениях. Так, в частности, для этой соединитель-
ной ткани характерно большее, чем у позвоночных, развитие основного
вещества, благодаря чему она в известном смысле занимает промежуточ-
ное положение между хрящевой и плотной соединительной тканью.
Кроме того, химический состав этого основного вещества, по-видимому,
не идентичен полностью химическому составу основного вещества плот-
ной соединительной ткани позвоночных. Наконец, наблюдаются и неко-
торые различия в надмолекулярной структуре коллагеновых волокон. Ха-
18 А. А. Заварзин
273
рактерная для них поперечная исчерченность имеет у насекомых не-
сколько иной рисунок, чем у позвоночных животных.
Таким образом, в данном примере достаточно отчетливо выявляется
уже неоднократно отмеченная выше закономерность филогенетической
дифференцировки специализированных структур — наличие глубокого
сходства в их морфобиохимической организации и не тождественное его
проявление у филогенетически весьма отдаленных групп высших пер-
вичноротых животных. Этот пример особенно демонстративен в связи
с тем, что у насекомых механическая опорная функция тканей внутрен-^
ней среды в значительной мере редуцирована и проявляется лишь в иск-
лючительных случаях.
ЗАКЛЮЧЕНИЕ
Как следует из приведенного обзора современного состояния вопроса
по сравнительной гистологии тканей внутренней среды у многоклеточ-
ных животных, они изучены, особенно с помощью современных методов,
крайне неравномерно. Значительно углубились наши представления
о морфологической организации специализированных клеток и межкле-
точных структур крови, соединительной и скелетных тканей высших по-
звоночных. Еще большие успехи достигнуты в изучении системных зако-
номерностей организации их отдельных разновидностей, что особенно на-
глядно было показано на примерах лимфоидной и миелоидной тканей.
Хуже обстоит дело с анализом морфобиохимической и системной органи-
зации рассматриваемых тканей у низших позвоночных, как в отношении
опорных, механических, так и трофических защитных их разновидностей.
Особенно же недостаточно изучены и изучаются гистогенетические от-
ношения и общие системные закономерности организации тканей внут-
ренней среды беспозвоночных животных.
Такое несоответствие в глубине анализа рассматриваемых тканей
у позвоночных и беспозвоночных животных затрудняет в настоящее
время возможность широких сравнительно-гистологических и сравни-
тельно-цитологических сопоставлений. Тем не менее большой новый фак-
тический материал, накопленный при изучении отдельных аналогичных
в функциональном отношении специализированных клеток и межклеточ-
ных структур, уже создает предпосылки для некоторых общих выводов.
Такие выводы ^ожно сделать хотя бы в отношении отдельных, частных
разновидностей тканей внутренней среды многоклеточных животных.
Сравнительные цитологические и биохимические сопоставления
делаются в настоящее время многими исследователями, работающими
в области сравнительной биохимии, гистологии и цитологии. В качестве
примера можно привести обзорные работы по фибробластам и опорным
механическим структурам соединительной ткани (Willmer, 1965; Mathews,
1967; Hunt, 1970; Elder, 1973; Carrone et al., 1975), дыхательной функции
крови и полостной жидкости (Проссер, Браун, 1967; Florkin, 1969; Red-
mond, 1972), процессам свертывания гемолимфы (Gregoire, 1971), ткане-
вым системам, осуществляющим защитную функцию (Good, Papermaster,
1964; Bang, 1967), и хрящевым тканям (Mathews, 1967; Hall, 1970;
Person, Philpott, 1969b).
Центральное место в этих работах занимает констатация фактов, сви-
детельствующих о наличии глубокого сходства в морфобиохимической
организации функционально аналогичных клеток и межклеточных струк-
тур у весьма отдаленных в систематическом отношении групп многокле-
точных животных.
Как было отмечено в соответствующих главах, универсальное распро-
странение в тканях внутренней среды многоклеточных животных имеют
фибробластические клеточные элементы с их сложной гетеросинтетиче-
ской деятельностью и своеобразными, далеко еще не ясными для нас
274
в деталях механизмами выведения тропоколлагена, других специфических
неколлагеновых белков и разнообразных мукополисахаридов. Широко
распространены в соединительных тканях и сложные надмолекулярные
структуры — коллагеновые фибриллы, мукопротеиновые комплексы и. по-
видимому, эластические и эластипоподобпые 'волокна.
Вторым основным специализированным клеточным элементом интер-
стициальных тканей, крови, тканевой и полостпой жидкостей являются
дифференцированные амебоциты, обладающие ярко выраженной фагоци-
тарной способностью. Они обнаружены в тканях внутренней среды по-
давляющего большинства современных многоклеточных животпых. Весьма
характерно также широкое распространение у представителей разных
групп многоклеточных животных крайне специализированных клеток,
осуществляющих дыхательную функцию (транспорта и резервирования
кислорода). В отличие от фибробластических элементов и фагоцитов,
имеющих универсальное распространение, эритроциты обнаруживаются
лишь у отдельных представителей многих типов беспозвоночных живот-
ных. Такое широкое и вместе с тем эпизодическое появление в тканях
внутренней среды беспозвоночных животных крайне специализирован-
ной разновидности клеток является доказательством полифилетического
происхождения их в эволюции и следовательно ярким проявлением общих
тенденций филогенетической дифференцировки тканей внутренней
среды.
Сходные тенденции филогенетической дифференцировки тканей внут-
ренней среды не менее отчетливо выступают и в распределении специа-
лизированных хрящевых тканей у беспозвоночных животных. Как отме-
чалось выше, они обнаружены у отдельных представителей таких непо-
средственно не связанных между собой групп животпых, как полихеты,
моллюски и ракообразные. Сравнительный анализ хрящевых тканей осо-
бенно интересен в связи с тем, что здесь специфическая дифференци-
ровка специализированных клеток связана с синтезом не только специ-
фических белков, но и весьма своеобразных мукополисахаридов типа
глюкан-, хондроитин- и кератосульфатов.
Аналогичная закономерность проявляется и в формировании эласти-
новых и эластиноподобных структур, процессах свертывания крови и ге-
молимфы, морфобиохимической организации гранулярных амебоцитов.
Таким образом, проведенный в последнее время па современном ме-
тодическом уровне сравнительно-цитологический анализ специализиро-
ванных клеток и межклеточных структур показал широкое распростра-
нение в тканях внутренней среды многоклеточных цитологических и мо-
лекулярно-биологических параллелизмов, отражающих общие тенденции
филогенетической дифференцировки ткапей внутренней среды у много-
клеточных животных.
Классические сравнительно-гистологические исследования системных
закономерностей организации ткапей внутренней среды многоклеточных
животпых также свидетельствуют о наличии здесь сходных принципов
такой организации. У подавляющего большинства животных они по-
строены по принципу обновляющих ткапей с более или мепее сложно ор-
ганизованной камбиальной системой, обеспечивающей возможность со-
вершенной физиологической регенерации и динамического равновесия
клеточного состава этих тканей. Детальное изучение организации таких
камбиальных систем проводится в настоящее время преимущественно'
лишь в отношении некоторых представителей высших позвоночных жи-
вотных. Однако есть все основания предполагать, что обнаруженный
у позвоночных клональный принцип организации таких систем с их по-
пуляцией мультипотептпых самоподдерживающихся стволовых клеток и
рабочим камбием из детерминированных полустволовых клеток является
общим для всех многоклеточных принципом системной организации тка-
пей внутренней среды.
18*
275
Имеющийся в настоящее время сравнительный материал по тканям
внутренней среды многоклеточных животных показывает, что в них, как
и в других тканях, наблюдаются сходные дифференцировки у отдаленных
в филогенетическом отношении представителей и на молекулярном, и на
клеточном, и, по-видимому, на тканевом уровнях организации.
В отношении системного тканевого уровня организации значение срав-
нительного метода особенно ярко выступает на примере выяснения прин-
ципиального вопроса о характере взаимоотношения между оседлыми,
продуцирующими межклеточные структуры клетками и подвижными
клетками тканей внутренней среды. Доказанный в настоящее время факт
гистогенетического единства системы подвижных и оседлых элементов
в дефинитивных тканях внутренней среды у моллюсков имеет принци-
пиальное значение. Этот факт свидетельствует о том, что наблюдаемое
у позвоночных расчленение и тенденция к такому расчленению у насе-
комых систем свободных и оседлых элементов — явление вторичное, вы-
ражение общих потенций в прогрессивной филогенетической дифферен-
цировке тканей внутренней среды.
Наличие аналогичных дифференцировок в тканях внутренней среды
имеет значение в плане развиваемых в книге представлений в связи
с тем, что эти ткани характеризуются большой эволюционной пластично-
стью. У позвоночных животных и в пределах млекопитающих, и в преде-
лах других классов позвоночных сильно варьирует клеточный состав
крови и в количественном, и даже в качественном отношениях. Суще-
ственные отличия имеются и в локализации кроветворных систем, сте-
пени дифференцировки соединительной ткани, организации лимфоидной
ткани. Ярким проявлением пластичности тканей внутренней среды явля-
ется своеобразный процесс тромбоцитопоэза у млекопитающих. Весьма
демонстративно также отсутствие эритроцитов у некоторых антарктиче-
ских костистых рыб.
В еще большей мере эта пластичность тканей внутренней среды про-
является у беспозвоночных животных. Здесь прежде всего следует под-
черкнуть разнообразие функциональных дифференцировок оседлых и
особенно свободных клеточных элементов. Они, помимо типичных для
рассматриваемых тканей функций (трофической, защитной и опорной),
могут играть важную роль и в формировании кутикулярных структур
(оболочники, иглокожие), и в функции промежуточного обмена (насеко-
мые), в выделительной экскреторной функции (многие полихеты), и, на-
конец, по-видимому, даже в пищеварительной функции (пластинчатожа-
берные моллюски).
Наряду с этим в разных группах беспозвоночных функции, характер-
ные для тканей внутренней среды позвоночных животных и первичных
многоклеточных, могут осуществляться тканевыми элементами других
тканей. Такая филогенетическая метаплазия может приводить к почти
полному замещению одной из основных функций тканей внутренней
среды, как это имеет место с механической скелетной функцией у члени-
стоногих или транспортной дыхательной функцией у наземных насекомых
и некоторых других членистоногих. При таких тотальных функциональ-
ных метаплазиях замещение функций происходит обычно на основе
специфической для замещающей ткани дифференцировки, резко отлича-
ющейся по существу от дифференцировок, характерных для соответству-
ющих разновидностей тканей внутренней среды. Именно такие отноше-
ния наблюдаются в кутикулярных эпителиях членистоногих. Здесь функ-
ция наружного скелета, осуществляется за счет синтеза и выделения
эпителиальными клетками особых склеропротеинов и мукополисахаридов.
Они резко отличаются от коллагена и мукополисахаридов скелетных
тканей позвоночных.
Тем не менее даже в этих условиях обнаруживаются некоторые об-
щие для всех механических тканей закономерности системной и биохими-
276
ческой организации. К ним в первую очередь относится сам принцип
построения этих структур на основе тесного топографического и метабо-
лического контакта между клетками и межклеточными структурами. Та-
кие контакты обеспечивают необходимую функциональную и филогене-
тическую пластичность этих структур. Много общего имеется, по-види-
мому, здесь и в механизмах выведения макромолекулярных соединений
из клеток, в формировании надмолекулярных структур вне клеток, зако-
номерной ориентировке волокон в кутикуле и пластинчатой кости и
в механизмах их минерализации. К сожалению, все эти интимные меха-
низмы взаимоотношения клеток и межклеточных структур в скелетных
тканях эктодермального происхождения изучены еще весьма слабо. Это
затрудняет проведение более глубоких сопоставлений.
Резкие различия в химической организации кутикулярных эпителиев
и опорных разновидностей тканей внутренней среды характерны лишь
для членистоногих и некоторых других групп животных. У многих бес-
позвоночных животных кутикулярная пластинка наружного скелета мо-
жет формироваться и за счет макромолекулярных соединений, характер-
ных для опорных тканей внутренней среды (коллагеновые волокна кути-
кулы полихет и некоторых других групп животных, сульфатированные
мукополисахариды кутикулы приапулид).
Замещение скелетной функции тканей внутренней среды у высших
первичноротых животных наряду с другими факторами, обусловившими
специфические особенности эволюции этих животных, оказало, по-види-
мому, ограничивающее влияние на проявление потенций филогенетиче-
ской дифференцировки их тканей внутренней среды. Оно находит,
в частности, выражение в отсутствии у первичноротых животных такой
сложной и совершенной защитной системы, а также системы внутреннего
гомеостаза, какой является лимфоидная ткань позвоночных животных.
Второй тип функциональных субституций носит обычно более ограни-
ченный характер. Одним из наиболее демонстративных примеров такого
рода замещения частных функций может быть синтез дыхательных пиг-
ментов целомическим эпителием полихет или эктодермальным эпителием
бронхиальных желез у головоногих моллюсков. К этому же типу функ-
циональных субституций относится и формирование коллагеновых воло-
кон соматическими мышцами у полихет или возможное образование
у них эритроцитов из целомического эпителия. Такого рода субституции
или своеобразные филогенетические метаплазии имеют, по-видимому, ши-
рокое распространение у многоклеточных животных.
В ограниченных пределах они наблюдаются и у позвоночных живот-
ных. Так, в частности, можно считать доказанной способность гладких
мышечных клеток формировать эластические и коллагеновые волокна,
а также связанные с ними мукопротеиновые комплексы межклеточного
вещества. Имеются убедительные данные о наличии такой способности
и у клеток целомической сердечной мышечной ткани позвоночных.
Весьма вероятно, что способность к синтезу межклеточных структур
характерна для целомической мышечной ткани всех высших многокле-
точных животных. Наряду с этим, как указывалось выше, клеточные эле-
менты тканей внутренней среды могут брать на себя функции, реализу-
емые у других животных производными иных тканей, как это, в част-
ности, имеет место в случае жирового тела насекомых.
Характерной особенностью всех этих филогенетических метаплазий
является сходный характер морфобиохимической организации клеток,
выполняющих аналогичную функцию.
Эволюционная пластичность тканей внутренней среды многоклеточ-
ных животных проявляется не только в разнообразии дифференцировок
тканевых элементов и разного рода филогенетических метаплазиях. Одно
из наиболее интересных для нас ее проявлений представляют структур-
ные и химические модификации аналогичных в функциональном отно-
277
шенпи тканей у представителей разных групп многоклеточных. Совокуп-
ность имеющихся сравнительно-цитологических и биохимических данных
показывает, что структурные и химические параллелизмы, как правило,
проявляются не в тождественных структурах и макромолекулярных сое-
динениях, а в ограниченных определенными общими рамками их вариан-
тах, при этом такие структурные и химические модификации могут до-
статочно сильно отличаться друг от друга и в пределах одной системати-
ческой группы животных и у отдаленных в филогенетическом отношении
их представителей.
Именно так обстоит дело и с дыхательными пигментами, эритроци-
тами, хрящевыми тканями и другими аналогичными дифференцировками
тканей внутренней среды. Иными словами, в тканях внутренней среды,
как и в эпителиальных тканях, достаточно отчетливо проявляется общая
закономерность процесса дифференцировки у многоклеточных живот-
ных — нетождественный характер аналогичных структур и процессов.
Есть все основания предполагать, что эта закономерность проявляется
и па системном тканевом уровне, что делает весьма актуальной задачу
сравнительно-гистологического анализа принципов системной организа-
ции тканей внутренней среды не только в общебиологическом, но и более
узком практическом плане. Фактический материал такого анализа может
оказаться весьма ценным для выяснения многих неясных еще вопросов
системной организации тканей внутренней среды высших позвоночных и
человека.
Часть IV
МЫШЕЧНЫЕ СОКРАТИМЫЕ ТКАНИ И ТКАНИ
НЕРВНОЙ СИСТЕМЫ
Глава 1
МЫШЕЧНЫЕ ТКАНИ
ВВЕДЕНИЕ
Функция сократимости в той или иной степени свойственна всем клет-
кам многоклеточных животных, поскольку способность использовать
энергию химических связей для механической работы является одним из
основных свойств живой протоплазмы. В клетках Eukaryota эту функцию
выполняют особые сократимые белки, которые имеются в гиалоплазме
всех клеток, а при специализации клеток образуют более или менее
сложные надмолекулярные комплексы. Естественно, что последние особой
сложности достигают в тканевых элементах сократимых тканей, где их
специализация идет в направлении реализации локомоторной функции
организма или его внутренних органов.
Имеющийся в настоящее время материал по разностороннему изуче-
нию мышечных ткапей показывает, что специализация тканевых элемен-
тов сократимых мышечных тканей происходила в процессе эволюции на
основе первичных механизмов, универсальных для всех клеток много-
клеточных организмов. По-видимому, в связи с этим специализированные
мышечные ткани возникали в процессе эволюции из различных источни-
ков, что и нашло свое отражение в многообразии разновидностей мышеч-
ных тканей у высших многоклеточных животных. Наиболее древними
сократимыми тканями являются соматические мышечные ткани, источ-
ником развития которых были эпителиальные пограничные ткани. На бо-
лее поздних этапах эволюции и у первичпоротых, и у вторичноротых жи-
вотных из стенки целомической полости возникла мышечная ткань
сердца. Сократимые ткани формировались также и на основе тканей
внутренней среды. Такое происхождение имеют все висцеральные мышцы
позвоночных. Специализированные сократимые элементы могут разви-
ваться и из некоторых участков нервной системы, а в железах из эпите-
лиальных клеток. Помимо таких чисто мышечных клеток, относительно
позднего в эволюции происхождения, дифференцировка специальных со-
кратимых органоидов обнаружена в последнее время и в специализиро-
ванных клетках других тканей.
Несмотря на различное происхождение мышечных тканей и обуслов-
ленные этим обстоятельством существенные особенности в свойствах от-
дельных их разновидностей, общий принцип филогенетической дифферен-
цировки контрактильных систем в тканевых элементах всех типов мы-
шечных тканей оказывается сходным. Во всех мышечных тканях мы
имеем дело с сократимыми белками, организованными в сложные надмо-
лекулярные комплексы и способными к прямому превращению химиче-
ской энергии АТФ в механическую энергию мышечных сокращений.
Эволюция структурной организации сократимых белков происходила, по-
видимому, в рамках определенных общих закономерностей. Об этом сви-
детельствует наличие большого количества сходных признаков организа-
279
ции сократимых структур в различных типах мышечных тканей у одного
организма, и в однотипных мышцах разных, даже далеко отстоящих
в филогенетическом отношении, современных многоклеточных животных
(Komnick et al., 1973). Наряду со сходством специализированных сокра-
тимых структур молекулярные механизмы регуляции процессов сокраще-
ния и принципы системной организации в отдельных разновидностях
мышечных тканей обнаруживают существенные различия.
По мышечным тканям имеется обширная литература, которая ча-
стично будет приведена по ходу характеристики отдельных разновидно-
стей. Такую характеристику удобнее начать с наиболее изученных сома-
тических мышечных тканей высших позвоночных животных. Далее мы
рассмотрим соматические мышечные ткани у высших первичноротых жи-
вотных — насекомых и ракообразных. Особое внимание будет уделено
различным модификациям сократимых мышечных тканей у беспозвоноч-
ных животных среднего и относительно низкого уровней организации
(аннелиды, моллюски, кишечнополостные и др.).
Отдельные разделы посвящены характеристике сердечных мышечных
тканей преимущественно у высших первичноротых и вторичноротых жи-
вотных, а также висцеральной и некоторым другим разновидностям глад-
кой мышечной ткани позвоночных животных. В заключение будет дана
характеристика общих закономерностей дифференцировки мышечных
тканей в филогенезе многоклеточных животных.
СОМАТИЧЕСКАЯ МЫШЕЧНАЯ ТКАНЬ ПОЗВОНОЧНЫХ
Многочисленные данные по морфобиохимической организации и мор-
фофункциональным особенностям мышечных тканей позвоночных сум-
мированы в ряде обзоров (Бендолл, 1970; Sandow, 1970; Smith, 1972;
Ebashi, Nonomura, 1973; Franzini-Armstrong, 1973; Korneliassen, Niolyson,
1973; Fuchs, 1974; Ленинджер, 1974).
Структурным элементом соматической мышечной ткани позвоночных
является мышечное волокно, представляющее собой сложную надклеточ-
ную или симпластическую структуру (рис. ИЗ). Волокно может дости-
гать 12 см в длину и содержать большой объем цитоплазмы и сотни
ядер.
Мышечное волокно ограничено плазматической мембраной, или плаз-
молеммой. Снаружи, на поверхности последней, выделяется базальная
мембрана и слой тонких коллагеновых волокон. Эти внеклеточные струк-
туры получили название сарколеммы. Сарколемма может ограничивать
одно или несколько волокон. Основная масса цитоплазмы (саркоплазмы)
мышечных волокон сосредоточена обычно в периферической части во-
локна под плазмолеммой. Здесь находятся и ядра, равномерно распреде-
ленные по длине мышечного волокна. В периферическом слое распола-
гаются многочисленные митохондрии. Центральная часть мышечного во-
локна занята миофибриллами. Количество последних в одном волокне
колеблется от 1000 до 2000 в соматических мышцах млекопитающих.
Между миофибриллами имеются продольно расположенные системы ци-
стерн и каналов эндоплазматической сети, так называемая система L-ка-
налов, или каналов саркоплазматической сети. Они обычно дифференци-
рованы на две части — систему краевых цистерн и центральную часть,
образованную продольными ветвящимися и анастомозирующими друг
с другом каналами с относительно узким просветом (рис. 114). В ци-
стернах происходит выход ионов кальция в саркоплазму, а в каналах
их возвращение в полость системы.
Каждая миофибрилла состоит из правильно чередующихся темных и
светлых участков анизотропных (А) и изотропных (I) дисков. В сере-
дине каждого светлого диска имеется уплотненный участок, получивший
280
s
Рис. 113. Поперечнополосатая мышечная ткань позвоночных. (Из: Du Praw, 1970)
а — мышечные волокна из туловищной мускулатуры миноги, б — схема строения мышечного во-
локна. 1 — ядро, 2 — миофибриллы, 3 — сарколемма, 4 — система каналов (саркоплазматическая
сеть), 5 — толстые протофибриллы, 6 — Z-диски, 7 — прослойки соединительной ткани.
название Z-диска, или телофрагмы. Во многих мышцах млекопитающих
и у других позвоночных на уровне Z-дисков миофибрилл происходит
ветвление поперечных впячиваний плазмолеммы — система Т-каналов
мышечного волокна. Система Т-капалов может располагаться и по обе
стороны от Z-дисков миофибрилл, в области непосредственного контакта
актиновых и миозиновых протофибрилл. В обоих случаях Т-каналы
образуют здесь специализированные контакты с цистернами L-каналов
(см. обзор: Кроленко, 1975).
Участки миофибрилл, расположенные между двумя соседними тело-
фрагмами, получили название саркомеров. Каждый саркомер состоит из
Рис. 114. Схема взаимоотношений системы Т- и L-каналов, их расположения по отно-
шению к миофибриллам, организации саркомера миофибрилл в мышечном волокне
лягушки. (Из: Кроленко, 1975).
с — сарколемма, мф — миофибриллы, Z—Z-диск, А—A-диск, I—1-диск, тп — каналы Т-системы,
пт — продольно ориентированные каналы Т-системы, тц — терминальные цистерны саркоплазма-
тической сети, пк — продольные каналы саркоплазматической сети, пв — центральный участок про-
дольных каналов саркоплазматической сети, тр — триада, пп — пиноцитозные пузырьки, м —
митохондрии.
тонких и толстых протофибрилл и межфибриллярного матрикса. Основ-
ными химическими компонентами этих структур являются специфические
сократимые белки — актин и миозин, а также вспомогательные и регу-
ляторные белки — тропомиозин, тропонин и др.
Толстые протофибриллы занимают центральную часть саркомера. Их
концы не достигают в несокращенном мышечном волокне Z-дисков и
как бы вдвинуты в промежутки между тонкими протофибриллами. На
поперечных разрезах саркомеров, проходящих в области контакта толстых
протофибрилл с тонкими, видно, что взаимное их расположение строго
закономерно. Три толстые протофибриллы окружают одну тонкую, а шесть
тонких — одну толстую. Таким образом, в саркомерах миофибрилл по-
звоночных животных на каждую толстую протофибриллу приходится
две топкие. При больших разрешениях электронного микроскопа удается
видеть поперечные спайки — мостики между толстыми и тонкими прото-
фибриллами.
282
Тонкие протофибриллы образованы глобулярным белком актином, со-
стоящим из одной полипептидной цепочки. В состав одной топкой прото-
фибриллы входит несколько сотен молекул актина, которые формируют
двухцепочечную суперспираль. В одной из бороздок этой спирали нахо-
дится молекула тропомиозина В, образующая в свою очередь комплекс
с глобулярным белком тропонином (рис. 115). Тропонин обладает спо-
собностью связывать ионы кальция и тем самым регулировать взаимо-
отношение актина и миозина в процессе сокращения и расслабления
мышц. Подробная характеристика этой регулирующей тропонин-тропо-
миозиновой системы, локализованной в тонкой протофибрилле и имеющей
универсальное распространение в мышцах позвоночных, содержится в спе-
циальных обзорах (Weber, Murray, 1973; Cohen, 1975). Характер струк-
турных взаимоотношений тонких протофибрилл соседних саркомеров
в настоящее время окончательно не выяснен. По данным одних авторов,
здесь имеет место их непрерывная химическая связь. По более обоснован-
ным данным других авторов эта связь осуществляется особыми вспомо-
гательными белками. Построенные из них конечные участки тонких про-
тофибрилл соседних саркомеров образуют петлеобразный взаимопере-
крещивающийся контакт в области Z-дисков.
Образующие толстые протофибриллы молекулы миозина имеют ха-
рактерную форму и состоят из двух головок, шейки, тела и хвостика. Две
головки каждой молекулы расположены в области контакта толстой про-
тофибриллы с тонкими протофибриллами, а хвостики молекул собраны
в центре толстой протофибриллы. В состав толстой протофибриллы вхо-
дит свыше 300 таких молекул. При ферментативном гидролизе молекулы
миозина закономерно распадаются на две части, так называемую фрак-
цию легкого меромиозина, образованную хвостиками и частью тела мо-
лекулы миозина с молекулярным весом 150 000, и фракцию тяжелого
меромиозина с молекулярным весом 180 000. Последнюю фракцию удается
легко разделить на фракцию головок миозина (молекулярный вес
120 000), способную взаимодействовать с актином и обладающую АТФаз-
ной ферментативной активностью, и фракцию с молекулярным весом
60 000. В центре саркомеров имеется утолщение — так называемая М-по-
лоска. Предполагается, что она образована особым белком, М-протеи-
ном. Показано, что в области М-полосок формируется сложный аппарат
структурной связи между толстыми протофибриллами. Он состоит из за-
кономерно ориентированных в пространстве и связанных в единое це-
лое продольных и поперечных фибрилл (Knappeis, Carlsen, 1968).
Современные представления о морфобиохимической организации сар-
комера и протофибрилл суммированы на схеме (рис. 115).
Несмотря на большие успехи в изучении тонкой структуры миофиб-
рилл, молекулярные механизмы процессов сокращения остаются еще
в значительной мере неясными. Достаточно сказать, что за последние
годы предложено несколько десятков гипотез мышечного сокращения.
После выяснения ультраструктурной организации миофибрилл и об-
наружения АТФазной активности меромиозина была предложена гипотеза
скольжения. Ее суть заключается в предположении о том, что в основе
мышечных сокращений лежит взаимодействие актиновых и миозиновых
протофибрилл, приводящее к перемещению актиновых протофибрилл
к центру саркомеров и укорочению саркомеров и всего мышечного во-
локна. Основным достоинством гипотезы скольжения является соответ-
ствие ее реальным морфологическим картинам, наблюдаемым в электрон-
ном микроскопе. В сокращенной мышце действительно наблюдается зна-
чительное уменьшение расстояния между свободными концами топких
актиновых протофибрилл. Скольжение актиновых протофибрилл проис-
ходит в результате того, что меромиозиновые головки молекул миозина
в присутствии АТФ обладают способностью закономерно менять в про-
цессе сокращения точки своего крепления к молекулам актина.
283
Основным недостатком первых интерпретаций гипотезы скользящих
нитей было полное игнорирование в них многочисленных биохимических
данных, полученных в модельных опытах. Данные этих опытов свиде-
тельствовали о наличии сложных процессов внутримолекулярных пере-
строек в процессе сокращения мышечных белков.
В последующих гипотезах мышечных сокращений наблюдалась от-
четливая тенденция к синтезу положительных моментов теорий скольже-
ния и биохимических данных о конформационных изменениях мышеч-
Рис. 115. Схема морфобиохимической организации саркомера. (По: Ebashi, Nonomura,
1973, с изменениями; рис. С. А. Быстрова).
а — схема расположения участков саркомера с различной электронной плотностью; б — схема
взаимоотношений Z-дисков, актиновых и миозиновых протофибрилл и их молекулярной организации,
в — распределение специфических белков в саркомере, г — детальная схема организации актиновой
протофибриллы. 1 — Z-диск, 2 — изотропный полудиск, 3 — анизотропный диск, 4 — М-полоска,
5 — область расположения центральных участков миозиновых протофибрилл, 6 — Н-зона (область
контакта актиновых и миозиновых протофибрилл), 7—12 — области локализации специфических
белков (7 — миозина, 8 — актина, 9 — тропомиозина, 10 — тропонина, 11 — актинина, 12 —
М-белка), 13 — актиновые, 14 — миозиновые протофибриллы.
пых белков в процессе сокращения. Этими достоинствами обладает ги-
потеза Девиса, которая уже больше десяти лет является одной из наи-
более популярных гипотез (Davies, 1963). В основе представлений Девиса
лежат хорошо известные факты о том, что при возбуждении мышцы про-
исходит освобождение ионов кальция, сосредоточенных в системе L-кана-
лов саркоплазматической сети. Ионы кальция диффундируют в миофиб-
риллы и образуют комплексные связи между АТФ, связанной с актином,
и АТФ, сорбированной в концевой части головки тяжелого меро-
миозина. В покоящейся мышце головки миозиновых молекул находятся
в растянутом состоянии благодаря взаимному отталкиванию отрицательно
заряженных АТФ и внутренних частей головок меромиозиновых молекул.
Последние обладают АТФазной активностью. Положительно заряженные
ионы Са нейтрализуют отрицательный заряд связанной молекулы АТФ,
что и вызывает резкое укорочение, благодаря свертыванию в спираль
284
полипептидной цепочки головки меромиозина. Поскольку при этом со-
храняется структурная связь головок меромиозина через ионы Са с мо-
лекулой актина, укорочение головки меромиозина и обусловливает пере-
мещение актиновых протофибрилл к центру саркомера. В определенный
момент укорочения головок миозиновых молекул сорбированная на их
конечных участках АТФ приходит в контакт с центром АТФазной актив-
ности молекул миозина. В этот момент происходит отщепление остатка
фосфорной кислоты от молекулы АТФ. Образующаяся свободная энергия
используется на разрыв связи полипептидной цепочки головки тяжелого
меромиозина и актина тонкой протофибриллы. Вследствие взаимного от-
талкивания новой молекулы АТФ, сорбируемой в области разрыва на
конечной части полипептидной цепочки головок меромиозина и внутрен-
них отрицательно заряженных ее участков, головка вновь удлиняется
благодаря «плавлению» а-спиральной структуры полипептидной цепи го-
ловки тяжелого меромиозина. Рассмотренный цикл молекулярных изме-
нений повторяется до тех пор, пока в мышцах имеется избыток ионов
кальция.
Некоторые авторы высказывают предположения о том, что в основе
процесса сокращения может лежать не переход от неупорядоченной кон-
формации белковой цепи головки миозина к а-спиральной, как это по-
стулирует теория Девиса, а, наоборот, разрушение спирального участка
и образование более беспорядочной и сильно свернутой белковой цепи
(Бендолл, 1970).
В последнее время получено много новых данных относительно тон-
кой структуры и функциональных свойств молекул сократимых и вспомо-
гательных белков саркомеров и образуемых ими временных и постоян-
ных надмолекулярных комплексов. Эти новые факты позволили зна-
чительно углубить наши представления о молекулярных механизмах
процессов сокращения. Однако подробный анализ этих вопросов выходит за
рамки задачи краткого сравнительного анализа сократимых тканей много-
клеточных животных. Подробная характеристика современного состоя-
ния вопроса о тонких механизмах процессов сокращения имеется в спе-
циальных обзорах (Huxley, 1972; Fuchs, 1974; Ленинджер, 1974; Cohen,
1975).
Для соматических мышечных тканей позвоночных характерна отно-
сительная стабильность организации саркомеров. Их длина варьирует от
1.8 до 2.8 мкм, а соотношение тонких и толстых протофибрилл всегда
постоянно и равно 2 : 1. Тем не менее в тонкой организации саркомеров
в соматических мышцах могут наблюдаться существенные особенности.
Так, в частности, в медленных мышцах лягушки в миофибриллах отсут-
ствуют М-полоски, а Z-диски более широкие, чем в быстрых мышцах.
Показана также на разных представителях позвоночных животных
большая активность миозиновой АТФазы в быстрых мышцах по сравне-
нию с более медленными мышцами.
Более широкая изменчивость организации мышечных волокон у по-
звоночных наблюдается в отношении мембранной системы (Franzini-
Armstrong, 1973). В медленных мышцах обычно слабее развита система
Т-каналов и каналов саркоплазматической сети. Впячивание плазмолеммы
происходит обычно на уровне Z-дисков. У медленных мышц миофибриллы
толще, саркомеры длиннее, митохондрий меньше. В быстрых мышцах, на-
оборот, имеется две мембранные системы Т-капалов на каждый саркомер.
Они располагаются в области контактов толстых и тонких протофибрилл.
Значительно лучше выражены здесь и уплотненные участки саркоплазмы
в области контактов Т-каналов и цистерн саркоплазматической сети. Все
эти особенности строения имеют четкую функциональную обусловлен-
ность. При этом одинаковые функциональные свойства мышц могут опре-
деляться, по-видимому, разными механизмами. Так, например, увеличение
скорости сокращения может достигаться либо увеличением активности
285
ферментативных систем, либо гипертрофией вспомогательного мембран-
ного аппарата. Сложность морфофункциональной организации сокра-
тимых мышечных тканей обусловливается еще и наличием переходных
по своим функциональным свойствам промежуточных волокон, а также
комбинаций в одной мышце мышечных волокон с различными свой-
ствами. Все эти особенности соматической мышечной ткани независимо
проявляются у представителей разных классов позвоночных животных.
Они в основном определяются функциональным моментом и в значи-
тельно меньшей мере высотой организации животных.
СОМАТИЧЕСКАЯ МЫШЕЧНАЯ ТКАНЬ ЧЛЕНИСТОНОГИХ
Соматические поперечнополосатые мышечные ткани у членистоногих
(в основном у насекомых и ракообразных) изучены относительно под-
робно и разносторонне (см. обзоры: Hoyle, 1969; Armitage et al., 1972;
Pringle, 1972; Мандельштам, Свидерский, 1974). Интерес к этим тканям
определяется их высоким уровнем дифференцировки как в отношении
совершенства механохимических контрактильных систем, так и разно-
образия морфобиохимической организации всех основных функциональ-
ных аппаратов мышечных волокон.
У насекомых и ракообразных, как и у позвоночных животных, основной
структурной единицей мышечной ткани является мышечное волокно
(рис. 116). В связи с меньшими размерами тела животных мышечные
волокна членистоногих в большинстве случаев меньше, чем у позвоноч-
ных, однако это не имеет принципиального значения. У некоторых рако-
образных (у крабов Maja squindo и Paralithoides kamchatka, а также
у некоторых видов балянусов) обнаружены гигантские мышечные во-
локна — до 6 см длины и 3 мм в диаметре. Независимо от размеров мы-
шечные волокна членистоногих, как и у позвоночных, представляют со-
бой симпластичеокие надклеточные образования. Их организация сходна
с организацией мышечных волокон позвоночных. Контрактильной си-
стемой здесь также являются миофибриллы, образованные саркомерами,
имеются системы Т- и L-каналов, гипертрофированный аппарат генерации
энергии, большое количество ядер и значительный объем саркоплазмы.
Саркомеры миофибрилл состоят из толстых и тонких протофибрилл, обра-
зованных теми же сократимыми белками. Таким образом, системная и
молекулярная организации соматических мышечных волокон у членисто-
ногих оказываются в принципе сходными с организацией мышечных во-
локон у позвоночных животных.
На фоне этого глубокого сходства поперечнополосатых мышечных во-
локон позвоночных и членистоногих соматическая мышечная ткань выс-
ших первичноротых обнаруживает ряд существенных особенностей, ха-
рактерных для всех уровней организации мышечных волокон. Для попе-
речнополосатой мышечной ткани членистоногих характерным является
значительно большее, чем у позвоночных, структурное и функциональное
разнообразие мышечных волокон и образующих их компонентов как
у одного организма, так и у разных видов этих животных.
У некоторых отрядов насекомых имеются особые весьма своеобразные
летательные асинхронные мышцы, волокна которых обладают способ-
ностью давать в ответ на одиночные импульсы несколько сотен раздельных
сокращений в секунду. Эти мышечные волокна характеризуются и дру-
гими функциональными особенностями — максимальная сила их сокра-
щения относительно невелика (около 0.3 кг/см2) по сравнению с сомати-
ческими мышцами (5 кг/см2), а максимальное укорочение составляет
1—2%, что па порядок меньше, чем укорочение длины саркомеров обыч-
ных соматических мышечных волокон. Эти функциональные особенности
коррелируют со своеобразной организацией их саркомеров. Здесь относн-
286
Рис. 116. Соматическая поперечнополосатая мышечная ткань членистоногих.
(Рис. М. 10. Пунина).
а — мышечные волокна личинки жука-носорога, б — схема ультраструктурной организации мышеч-
ной ткани у ракообразных. 1 — миозиновые и 2 — актиновые протофибриллы, 3 z-диск, «
саркоплазматическая сеть каналов (L-каналы), 5 — поперечные, 6 — продольные впячивания плаз-
матической мембраны, 7 — митохондрия.
тельная длина толстых миозиновых протофибрилл значительно больше, чем
в саркомерах миофибрилл обычных соматических мышц (рис. 117, а, б).
Детальный анализ молекулярной организации этих протофибрилл сви-
детельствует о том, что упаковка молекул миозина в толстых протофиб-
риллах летательных мышц отличается от их расположения в толстых
протофибриллах соматических мышц млекопитающих (Reedy, 1968).
Рис. 117. Схемы организации саркомеров в синхронной туловищной и в летательной
асинхронной мышцах насекомых, деталей строения саркомеров асинхронной мышцы
(по: Auber, 1967) и морфологических изменений при сокращении летательных мышц
(по: Reedy, 1968).
а, б — схема саркомеров синхронной (а) и асинхроннойКб) мышцы, в — детали строения концевой
части саркомера асинхронной мышцы, г, д — участок! саркомера^асинхронной летательной мышцы
в состоянии напряжения (г) и покоящемся (д) состоянии, е, ж — поперечный разрез саркомеров
мышцы млекопитающих (е) и летательной асинхронной мышцы насекомых (ж). 1 — Z-диск, 2 — мио-
зиновая протофибрилла, 3 — актиновая протофибрилла, 4 — Т-каналы, 5 — L-каналы (каналы
саркоплазматической сети), 6 — дополнительные нити, связывающие концы миозиновых прото-
фибрилл с Z-диском.
В летательных мышцах насекомых отчетливо удается наблюдать, по-
мимо актиновых и миозиновых протофибрилл, еще и третий тип тонких
фибрилл, которые, по мнению некоторых авторов, связывают концы мио-
зиновых протофибрилл с Z-дисками (рис. 117, в).
Несмотря на эти и другие особенности организации контрактильного
аппарата миофибрилл в летательных мышцах, основной принцип их ра-
боты оказывается сходным с обычными соматическими мышцами. Вы-
сказывается лишь предположение о том, что в основе скольжения лежит
здесь не тянущий, а толкающий механизм взаимодействия в области
актомиозиновых мостиков (рис. 117, г, д).
288
Для асинхронных летательных мышц насекомых характерным явля-
ется также относительное постоянство длины саркомеров и минимальное
для членистоногих соотношение толстых и тонких протофпбрилл: па одну
толстую миозиновую протофибриллу здесь приходится три тонкие акти-
нотропомиозпновые протофибриллы. Взаимное расположение тонких и
толстых протофибрилл в асинхронных летательных машцах отличается
от расположения их в саркомерах миофибрилл позвоночных (рис. 117,
е, ж). Весьма существенной качественной особенностью летательных
асинхронных мышц насекомых является особый механизм инициации
повторных сокращений после одиночного нервного импульса. В основе
асинхронной работы сократимого аппарата лежит, по-видимому, десин-
хронизация процессов расслабления и сокращения в двух группах мышеч-
ных волокон, что и обеспечивает поддержание высокого ритма их работы
в ответ на одиночное раздражение.
Интересно, что у ракообразных обнаружены мышцы, дающие до
100 сокращений в секунду, т. е. в некотором отношении аналогичные ле*
тательпым мышцам насекомых. Однако в структурном отношении они
обнаруживают ряд характерных отличий. Основной особенностью этих
мышц является резкая гипертрофия саркоплазматической сети, которая
в виде густой сети ограниченных мембранами трубчатых структур зани-
мает всю центральную часть мышечных волокон (Rosenblath, 1969). Мио-
фибриллы расположены по периферии волокна относительно топким
слоем и занимают всего V4 часть мышечного волокна. Соотпошепие тон-
ких и толстых протофибрилл такое же, как и в асинхронных летательных
мышцах насекомых. Однако относительная длина миозиновых протофиб-
рилл не превышает заметно обычных для саркомеров соматических мышц
беспозвоночных величин.
Аналогичные отношения наблюдаются и в синхронных (прямых) ле-
тательных мышцах насекомых, также обладающих способностью давать
большое число сокращений в секунду, однако не на один нервный им-
пульс, а на соответствующее количество нервных импульсов. Таким об-
разом, можно сделать предположение о том, что в асинхронных мышцах
регуляция высокого ритма сокращения обеспечивается механизмами, не
связанными непосредственно с нервными импульсами. В синхронных ле-
тательных мышцах насекомых и в других быстрых мышцах такая регу-
ляция осуществляется мембранными системами и, в частности, быстрым
поступлением и обратным поглощением ионов Са (Smith, 1972). Этому
предположению хорошо соответствует отсутствие в асинхронных лета*
тельных мышцах насекомых развитой системы L-каналов и, наоборот,
сильное развитие этих систем в прямых летательных и других быстрых
мышцах членистоногих (Auber, 1967; McNeill et al., 1972).
Большая степень морфобиохимической и функциональной диверген-
ции у соматической мышечной ткани членистоногих проявляется и в чет-
кой топографической дифференциации туловищных мышц, в которых мо-
гут отдельными группами располагаться мышечные волокна, резко от-
личающиеся по своим функциональным свойствам (типичные быстрые
тетанические волокна и медленные мышечные волокна, способные к то-
ническим сокращениям). Очень часто такие резкие функциональные раз-
личия коррелируют и со степенью развития саркоплазматической сети,
длиной саркомеров и относительным количеством в них тонких прото-
фибрилл. В быстрых тетанических мышцах саркомеры короче, саркоплаз-
матическая сеть развита сильнее, а относительное количество тонких
протофибрилл значительно меньше (Jahromi, Atwood, 1969). Однако
у краба Portanus sanguinolentus описаны недавно три резко отличные
в функциональном отношении группы мышечных волокон, единственным
морфологическим отличием которых является количество митохондрий:
последних в быстрых мышечных волокнах значительно больше, чем в мед-
ленных. Существенных различий в тонкой структуре саркомеров и сте-
19 А. А. Заварзин
289
пени развития мембранных структур обнаружить при этом не удалось
(Hoyle, 1973). Таким образом, и на этих примерах мы видим, что сход-
ная функциональная задача в соматической мышечной ткани членисто-
ногих, как и у позвоночных, может решаться на разной морфобиохими-
ческой основе.
Для миофибрилл соматической мышечной ткани членистоногих весьма
характерным является значительно большее, чем у позвоночных живот-
ных, варьирование длины саркомеров (Hoyle, 1967; Franzini-Armstrong,
1970, 1973). Даже у одного животного размеры саркомеров сильно
варьируют, а у разных видов животных они могут быть от 0.5 до 15 мкм.
В широких пределах варьирует в мышцах членистоногих и соотношение
тонких и толстых протофибрилл, а также их взаимное расположение.
Как указывалось выше, наиболее сходное с млекопитающими соотно-
шение тонких и толстых протофибрилл наблюдается в асинхронных и
синхронных летательных мышцах насекомых с высоким ритмом сокра-
щения. Однако прямой зависимости между скоростью сокращений и ко-
личеством протофибрилл нет.
Соотношение тонких и толстых протофибрилл в обычных туловищных
мышцах может достигать 6 : 1 и даже 7 : 1, так что каждая толстая про-
тофибрилла оказывается окруженной 12 актиновыми протофибриллами.
В таких мышцах обычно нарушается правильное расположение тонких
протофибрилл вокруг толстых. Их может быть и больше и меньше 12.
Местами встречаются группы тонких протофибрилл, не связанных с тол-
стой протофибриллой.
В мышцах членистоногих большую вариабельность обнаруживает и
структура Z-дисков. Они могут быть сходны с Z-дисками позвоночных или
резко отличаться от них. Так, у личинок Copepoda Z-диски практически
отсутствуют, при хорошо выраженном саркомерном строении миофиб-
рилл. Наоборот, в мышце голени у саранчи Z-диски образованы толстой
пластинкой электронноплотного вещества, имеющего волокнистое строе-
ние с поперечным к продольной оси миофибрилл расположением фибрил-
лярных структур. Сильно варьирует и структура М-полоски в центре
саркомера (аппарат поперечных связей между миозиновыми протофиб-
риллами) . Здесь может быть не 3, как у млекопитающих, а 7 поперечных
фибрилл. У саранчи в туловищных мышцах связь между миозиновыми
протофибриллами имеет место на протяжении участка саркомера, заня-
того миозиновыми протофибриллами. У некоторых ракообразных вместо
одной группы поперечных фибрилл в центре саркомеров имеются две
симметричные группы фибрилл, смещенные в обе стороны от центра
саркомера (Hoyle, 1967).
В соматической поперечнополосатой мышечной ткани высших первич-
норотых животных наблюдается, следовательно, большее варьирование
всех структур мышечных волокон. Тем не менее среди широкого спектра
модификаций в функциональных свойствах и морфобиохимической орга-
низации мышечных волокон у высших первичноротых животных удается
выявить большое количество примеров аналогии с позвоночными живот-
ными именно в таких вариантах, модификациях основного типа строения
соматических волокон. Одним из таких примеров могут служить мышцы
разгибатели голени у прыгающих насекомых. Здесь имеются тонические
волокна, способные осуществлять медленные тонические ритмичные
сокращения, связанные с ходьбой животных, и, наоборот, быстрые фазные
волокпа, по мощности развиваемых усилий на единицу площади в 100 раз
превышающие усилия, развиваемые фазными мышечными волокнами
человека. Интересно, что по своей ультраструктурной организации фаз-
ные и тонические волокна существенно отличаются и у насекомых, и
у позвоночных у одного и того же организма и оказываются сходными
между собой у насекомых и у позвоночных животпых (см. обзор: Ман-
дельштам, Свидерский, 1974).
290
СОМАТИЧЕСКИЕ МЫШЕЧНЫЕ ТКАНИ
ДРУГИХ БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Естественно, что у беспозвоночных животных средних и низших уров-
ней организации, варьирование системной и морфобиохимической орга-
низации мышечных тканей и их элементов выражено в еще большей мере,
чем у рассмотренных выше групп высших первичноротых животных. Раз-
меры тканевых элементов здесь обычно меньше. Широкое распростране-
ние имеет клеточный принцип организации мышечных тканей. Однако
симпластические волокна встречаются у представителей разных типов
многоклеточных. У низших многоклеточных, а также в отдельных мыш-
цах у животных средних уровней организации имеются эпителиально-
мышечные клетки.
По характеру дифференцировки сократимого аппарата и надмолеку-
лярной организации сократимых белков мышечные ткани можно раз-
делить на поперечнополосатые, косоисчерченные и гладкие. Поперечно-
полосатые мышечные ткани с саркомерной организацией протофибрилл
и перпендикулярным по отношению к длинной оси волокна или клетки
расположением Z-дисков или их аналогов имеют меньшее в количествен-
ном отношении распространение, чем у позвоночных и членистоногих.
Однако в отдельных мышцах у отдельных представителей их удается об-
наружить и у аннелид (Наследов, Скоробовичук, 1974), и у моллюсков
(Скоробовичук, 1974), и у других, близких полихетам, групп первичноро-
тых животных. Они имеются и у щетинкочелюстных, и у турбелярий,
и, наконец, даже в эпителиально-мышечных клетках медуз (Chapman
et al., 1962; Kawaguti, Hamakoshi, 1963). Последний факт особенно
интересен, поскольку он свидетельствует о том, что упорядочение орга-
низации сократимого аппарата может достигаться у животных относи-
тельно низких уровней организации. Интересно также, что даже
в миоцитах некоторых губок (Microciona prolifera) наблюдается довольно
правильная ориентировка тонких протофибрилл вокруг толстых, хотя
границы саркомеров и выражены недостаточно (Bagby, 1966).
Весьма своеобразна поперечнополосатая мышечная ткань и у пред-
ставителя щетинкочелюстных — Sagitta elegans. У этого планктонного
хищника ультраструктурная организация саркомера оказывается сходной
с его организацией в летательных мышцах насекомых. Относительная
длина толстых протофибрилл здесь больше, чем в обычных мышцах, а со-
отношение толстых и тонких протофибрилл, как и в летательных мышцах
членистоногих, — 1:3. В области Z-дисков имеются дополнительные по-
перечные фибриллярные структуры. Количество митохондрий невелико,
и они имеют типичную ультраструктурную организацию.
Из других разновидностей мышечных тканей следует подробнее оста-
новиться на характеристике косоисчерченных и одной из разновидностей
гладких мышечных тканей моллюсков. Косоисчерченные мышечные ткани
наиболее широко распространены у аннелид и близких к них групп пер-
вичноротых животных, где косоисчерченная мышечная ткань является
основной разновидностью мышечных тканей. В настоящее время ультра-
структурная организация косоисчерченных мышц подробно изучена уже
у многих представителей аннелид (Rosenblath, 1967, 1968; Heumann, Zebe,
1967; Mill, Knapp, 1970; Wissocq, 1974) и моллюсков (Millman, 1967; см.
также обзор: Rosenblath, 1972 b).
Основной особенностью косоисчерченных мышц является диагональ-
ное расположение миозиновых и актиновых протофибрилл в саркомерах
и, следовательно, косая ориентация Z-дисков или их аналогов по отноше-
нию к продольной оси мышечного волокна (рис. 118). При сокращении
таких мышц происходит не только скольжение тонких протофпбрилл по
толстым, но и перемещение миозиновых протофибрилл по отношению
друг к другу, благодаря чему Z-диски приобретают постепенно перпенди-
19*
291
кулярпое положение по отношению к длинной оси волокна. Особенностью
косоисчерченных мышц является способность отдельных саркомеров к не-
зависимому сокращению, что увеличивает функциональную пластичность
этого типа мышц.
Как и поперечнополосатые мышцы, косоисчерчепные мышечные во-
локна варьируют по деталям своей ультраструктурной организации. Осо-
Рис. 118. Косоисчерчепные мышечные волокна. (Из: Heumann, Zebe, 1967).
а — косоисчерченная мышечная ткань приапулиды Priapulus caudatus в состоянии максимального
сокращения; б, в — схема организации актиновых и миозиновых протофибрилл и их соотношения
с системО1Тканалов эндоплазматической сети {светлые кружки) и со структурными аналогами Z-дисков
(темные' кружки) в расслабленном (б) и сокращенном (в) состояниях косоисчерченных мышц.
бенно большое варьирование в структуре косоисчерченных мышечных
элементов наблюдается у моллюсков. Относительное количество тонких
протофибрилл обычно большое — на одну миозиновую протофибриллу
приходится 5—6 актиновых. Система Т-каналов развита слабо и функция
их в значительной мере компенсируется развитой системой саркоплазма-
тической сети, образующей не только продольные, но и поперечные ка-
налы, контактирующие с плазматической мембраной.
Особую группу косоисчерченных мышц составляют мышцы с непра-
вильной исчерченностыо (Millman, 1967). Они особенно хорошо изучены
у пластинчатожаберных моллюсков. В этих мышцах нарушается пра-
вильный порядок расположения протофибрилл в центральных участках
мышечных клеток. В косоисчерченных мышечных клетках и волокнах
сильно варьирует структура Z-дисков, а также степень выраженности
миофибриллярной организации саркомеров.
922
Вариантом косоисчерчепных мышц являются мышцы аскариды. В них
имеется топографическое разделение проводящей части, трофического
центра клетки с ядерным аппаратом и непосредственно сократимой части
(рис. 119). При этом в отличие от обычных отношений проводящий мы-
шечный отросток идет к брюшной нервной цепочке, где и образуется
нервно-мышечный синапс. Интересно, что подобные же отношения наблю-
даются в некоторых мышцах и ланцетника (см. обзор: Итина, 1974),
и у представителя иглокожих — морского ежа. Сократимая часть мышеч-
ной клетки аскариды построена из саркомеров, имеющих типичное для
косоисчерчепных мышц расположение актиновых и миозиновых прото-
фибрилл. В ядросодержащей части клетки имеются большие запасы
гликогена.
Рис. 119. Схема взаимоотношения мышечных клеток и нервной системы у аскариды.
(Из: Rosenblath, 1967).
1 — нервный ствол, 2 — проводящий отросток мышечной клетки, 3 — ядросодержащая часть и
4 — сократимая часть мышечной клетки.
Весьма своеобразную модификацию мышечных тканей представляет
собой парамиозиновая гладкая мышечная ткань аддукторов пластинчато-
жаберных моллюсков (см. обзор: Скоробовичук, 1974; Morrison, Odense,
1974; Elliot, 1974). Ее наиболее характерной функциональной особен-
ностью является способность находиться в сокращенном состоянии в те-
чение многих часов и даже дней. В гладких мышечных клетках нет
правильной саркомерной организации тонких и толстых протофибрилл.
Последние, помимо миозина, содержат парамиозин (тропомиозин А).
Количество последнего в два раза больше, чем актина и миозина. Пред-
полагают, что парамиозин занимает центральную часть толстых прото-
фибрилл, диаметр которых достигает 0.1 мкм. Некоторые авторы припи-
сывали парамиозину основную роль в способности мышцы длительное
время находиться в сокращенном состоянии, не требуя больших затрат
энергии. Авторы этих гипотез считали, что при сокращении происходила
конформация — своеобразная кристаллизация молекул парамиозина. Од-
293
нако парамиозин имеется во всех мышцах у моллюсков, хотя относитель-
ное его количество наибольшее в мышцах, способных к длительному со-
кращению. Кроме того, тщательное изучение последних в сокращенном
состоянии показало, что в процессе сокращения не происходит конфор-
мации молекул парамиозина. В основе сокращения этих мышц лежит
скольжение толстых и тонких протофибрилл относительно друг друга
без изменения их внутренней молекулярной организации. В связи с этим
ряд авторов предполагает, что способность к длительному сокращению
определяется особым крайне специализированным механизмом регуляции
сокращенного и расслабленного состояний, не связанным с перестройкой
парамиозиновых участков толстых протофибрилл.
В сравнительно-гистологическом отношении большой интерес пред-
ставляет тот факт, что парамиозиновые протофибриллы обнаружены не
только у пластинчатожаберных моллюсков, но и в весьма своеобразных
эпителиально-мышечных клетках желудка полихет (Del Castillo et al.,
1972), а также у краба Limulus (Levine et al., 1973) и погонофор (Jensen,
Myklebast, 1975). Биохимическими методами парамиозин выделен
в мышцах сипункулид.
В заключение следует подчеркнуть, что животным низших и средних
уровней организации еще в большей степени, чем высшим животным,
свойственно варьирование структурной организации сократимого аппа-
рата. Здесь у одного организма сократимый аппарат может быть образован
и гладкими, и поперечнополосатыми, и косоисчерченными мышечными
элементами с варьированием еще и структуры в пределах каждого из этих
типов мышечных тканей. Эта закономерность особенно хорошо показана
на примере полихет (Wissocq, 1974) и моллюсков (Скоробовичук, 1974).
ЦЕЛОМИЧЕСКИЕ МЫШЕЧНЫЕ ТКАНИ
Целомическая поперечнополосатая мышечная ткань позвоночных и
высших первичноротых животных образует у них основную часть стенки
сердца, т. е. выполняет аналогичную функцию, хотя и развивалась неза-
висимо из одного и того же источника (стенки целома) в ряду первично-
ротых и вторичноротых животных.
В связи с этим анализ организации этой ткани представляет большой
сравнительно-гистологический интерес, как в плане сопоставления сер-
дечной мышечной ткани у высших представителей первично- и вторично-
ротых животных, так и в плане сопоставления соматической и целоми-
ческой мышечной ткани у одних и тех же животных.
Позвоночные животные и оболочники. Современные гистологические
и цитологические исследования сердечной мышечной ткани весьма много-
численны. Имеется обширная литература и по сердечной мышечной
ткани высших позвоночных и по отдельным представителям других клас-
сов позвоночных.
Мышечная ткань сердца млекопитающих похожа па поперечнополоса-
тую соматическую мышечную ткань (Sperelakis et al., 1970). Здесь
удается обнаружить мышечные волокна, которые внешне сходны с во-
локнами соматической мускулатуры (рис. 120, а). Особенно большое
сходство наблюдается в структуре миофибрилл, обнаруживающих пра-
вильную периодичность в своей организации на основе типичного для
мпофибрилл соматической мышечной ткани саркомерного строения
(рис. 120, в). Наряду с этими сходными чертами удается наблюдать и
ряд характерных отличий. Бросается в глаза различие в расположении
ядер. Они сосредоточены не на периферии волокон, а в их центральной
части. Весьма характерным для сердечной мышцы является также ее
сетчатое строение: мышечные волокна связаны между собой поперечными
и косыми перемычками, образуя общую сетевидную структуру. Мышеч-
294
ные волокна сердечной мышцы содержат значительно большее количе-
ство митохондрий.
Для этой ткани весьма характерны также особые структуры, так на-
зываемые вставочные пластинки, узкие темные поперечные полоски, раз-
Рис. 120. Сердечная мышечная ткань млекопитающих. (Из: Елисеев и др., 1972).
а — участок сердечной мышечной ткани, б — волокна Пуркинье, в — схема ультраструктурной
организации сердечной мышечной ткани в области вставочной пластинки. 1 — базальная мембрана,
2 — плазматическая мембрана, 3 — митохондрии, 4 — миофибриллы, 5 — саркоплазма, 6 — эндо-
плазматическая сеть, 7 — тонкая (актиновая) протофибрилла, 8 — толстая (миозиновая) протофи-
брилла, 9 — вставочная пластинка, 10 — светлый диск, 11 — темный диск, 12 — Z-диск, 13 — М-по-
лоска, 14 — дссмосома, 15 — зона прилежания, 16 — волокнистые электроппоплотные участки на
концах саркомеров в области вставочной пластинки.
бивающие волокно на отдельные участки. Эти структуры особенно хорошо
выявляются при импрегнации препаратов AgNOs или при окраске желез-
ным гематоксилином. Их функциональное значение было выяснено при
изучении сердечной мышечной ткани под электронным микроскопом.
Оказалось, что в данном случае мы имеем дело со специализированными
плазматическими мембранами двух соседних клеток. Иными словами,
295
принципиальной особенностью сердечной мышечной ткани является ее
клеточное строение. Для обеспечения функционального и структурного
единства волокна при сохранении его клеточного строения оказалось не-
обходимым создать очень прочные и совершенные в функциональном от-
ношении аппараты крепления двух соседних клеток в продольном на-
правлении. Именно такой структурой и являются рассматриваемые вста-
вочные пластинки. Характерная особенность этих структур заключается
в том, что миофибриллы двух контактирующих клеток топографически
точно соответствуют друг другу. В контактирующих с плазматической
мембраной вставочной пластинки саркомерах миофибрилл наблюдается
волокнистое электроппоплотное вещество, а между контактирующими
мембранами особый межклеточный «цемент». Весь этот аппарат крепления
обусловливает, по-видимому, с одной стороны, достаточно прочную связь
между клетками, а с другой стороны, функциональное единство спе-
циальных сократимых органоидов — миофибрилл, несмотря на их струк-
турную разобщенность в отдельных клетках. Прочность контакта между
плазматическими мембранами соседних клеток обеспечивается в области
вставочных пластинок и многочисленными десмосомами, расположенными
в цитоплазматических зонах волокна, не занятых миофибриллами
(рис. 120, в). Особое функциональное значение имеют во вставочных
пластинках сердечной мышцы млекопитающих участки с весьма близким
расположением наружных поверхностей мембран соседних клеток.
В плазматической мембране клеток сердечной мышцы сильно развит
надмембранпый комплекс. Что касается других деталей ультраструктур-
ной организации мышечных клеток сердечной мышцы, то здесь мы не
обнаруживаем у высших позвоночных принципиальных особенностей их
дифференцировки по сравнению со структурами поперечнополосатого
соматического мышечного волокна. Саркомеры миофибрилл имеют типич-
ное строение со всеми деталями их ультраструктуры, характерной и для
миофибрилл соматических мышц. Имеется хорошо развитая продольная
саркоплазматическая сеть, которая находится в тесном контакте с много-
численными митохондриями, расположенными между миофибриллами.
Особенностью митохондрий сердечной мышцы является сильное разви-
тие их внутренних мембран, образующих многочисленные кристы. На-
ружная плазматическая мембрана мышечных клеток в области Z-дисков
образует хорошо развитую систему Т-капалов. Здесь же имеются харак-
терные для сократимых тканей контакты Т-каналов с системой цистерн
саркоплазматической сети.
Таким образом совокупность имеющихся в настоящее время данных
о структурной организации сердечной мышечной ткани млекопитающих
показывает, что в данном случае мы имеем дело с примером сократимой
ткани, которая принципиально отличается своим клеточным строением
от симпластической структуры соматического мышечного волокна. Наряду
с этим и в том и в другом случае в мышечных тканях имеются сходные
или даже идентичные специфические дифференцировки и основного кон-
трактильного аппарата миофибрилл и вспомогательной проводящей мем-
бранной системы. Различие в структуре этих аппаратов, а также аппа-
рате генерации энергии носит в основном количественный характер и
определяется функциональными особенностями сердечной мышцы. Суть
последних заключается в необходимости обеспечения непрерывности ее
работы и строго закономерной последовательности сокращения отдельных
частей единой сетевидной структуры сердца. Для успешного решения
этой задачи у млекопитающих па основе обычной сердечной мышечной
ткани образуется особая проводящая система мышечных волокон, обес-
печивающая и автоматизм работы сердечной мышцы и закономерную
последовательность работы ее отдельных частей. Эта система состоит из
синусного узла, расположенного в эпикарде в области впадения вены
в предсердие, атриовентрикулярного узла в области поперечной пере
296
городки сердца, пучков Гиса и волокон Пуркинье (рис. 120, б). Все эти
образования представляют собой единую в функциональном и в струк-
турном отношениях систему, специализированную па инициацию и про-
ведение импульса в мышечной ткани миокарда. Строение мышечной
ткани в различных участках этой системы весьма различно (Viragh,
Porte, 1973а, 1973b). Так, мышечная ткань атрио-вептрикулярного узла
характеризуется небольшим диаметром и тесным расположением воло-
кон, а также большим количеством ядер. Волокна Пуркинье, наоборот,
отличаются, особенно у некоторых млекопитающих, относительно боль-
шим диаметром, превышающим диаметр обычного мышечного волокна
сердечной мышцы в 2—3 раза (рис. 120, б). Весьма характерным для
них является также парное расположение ядер, обилие саркоплазмы и
слабое развитие миофибриллярпого аппарата. Миофибриллы занимают
лишь самую периферическую часть мышечных волокон. Черты своеоб-
разной специализации таких волокон отчетливо проявляются и в ультра-
структурной их организации. Здесь пет системы Т-капалов, имеются
лишь небольшие продольные складки наружной плазматической мем-
браны. В сердце кролика в проводящей системе в области атрио-вентри-
кулярного узла веретеновидпые клетки располагаются в виде пучков кле-
ток, связанных своими боковыми поверхностями. Снаружи пучка имеется
общая для всей группы клеток базальпая мембрана. У обезьян (Масаса
mullata) в составе проводящей системы в области атрио-вентрикулярпого
узла и дистальных ее участках имеются особые клетки овальной формы
со светлой цитоплазмой.
Весьма характерным для волокон Пуркинье является наличие двух
популяций митохондрий. Здесь наблюдаются обычные мышечные мито-
хондрии с хорошо развитыми кристами и митохондрии «нервного» типа,
характерные для аксонов нервных клеток симпатической нервной си-
стемы, с одной кристой. На примере волокон Пуркинье отчетливо видно,
что своеобразная функциональная специализация в сердечной мышечной
ткани может обусловливать весьма существенные перестройки во внут-
ренней структурной организации мышечной ткани. Наиболее характер-
ным, общим для всех отделов проводящей системы миокарда свойством
является способность мышечных клеток к автоматическому сокращению.
Эту способность клетки проводящей системы приобретают уже па pan-
них этапах дифференцировки миокарда в онтогенезе еще до структурного
оформления миофибриллярпого аппарата. Молекулярные механизмы
такого автоматизма сокращений остаются в настоящее время еще в зна-
чительной мере неясными.
У всех изученных представителей разных классов позвоночных, как
и у млекопитающих животных, сердечная мышечная ткапь имеет клеточ-
ное строение. Объединение клеток в единую морфофункциональпую си-
стему обеспечивается универсальным для всех позвоночных аппаратом
вставочных пластинок. Их особенностью у низших позвоночных являются
отсутствие зон близкого контакта плазматических мембран соседних кле-
ток и менее сложная ультраструктурная организация вставочных пласти-
нок (Sommer, Johnson, 1969). Достаточно стабильна в ряду позвоноч-
ных животпых и дифференцировка сократимого аппарата миофибрилл,
имеющих саркомерпое строение. Размеры и ультраструктурная органи-
зация саркомеров обычно идентичны саркомерам миофибрилл соматиче-
ских мышц данного вида животпых.
Большая вариабельность обнаруживается у позвоночных животных
во вспомогательном мембранном аппарате.
У представителей некоторых классов могут отсутствовать Т-капалы,
и их отсутствие компенсируется наличием контакта элементов саркоплаз-
матической сети непосредственно с плазматической мембраной мышеч-
ных клеток. При этом наличие или отсутствие Т-каналов прямо не кор-
релирует с высотой организации животпых. Так, Т-каналы отсутствуют
297
у амфибий, рептилий и птиц (Forbes, Sperelakis, 1971) и имеются в сер-
дечной мышце круглоротых и акуловых рыб. Очевидно, что сложность
организации сердечной мышечной ткани определяется такими структур-
ными особенностями, как размеры клеток или периферическое или цент-
ральное расположение миофибрилл.
Особый сравнительно-гистологический интерес представляют данные
по ультраструктурной организации сердечной мышечной ткани у оболоч-
Рис. 121. Схема ультраструктурной организации эпителиальномышечной клетки
асцидий. (По электронным микрофотографиям: Oliphant, Cloney, 1972;
рис. С. А. Быстрова).
1 — полость сердца, 2 — перикардиальная полость, з — миофибриллы.
пиков и, в частности, у асцидий (Kalk, 1970; Oliphant, Cloney, 1972).
У этих животных сократимая часть сердечной трубки образована базаль-
ными участками клеток, апикальные части которых непосредственно об-
ращены в перикардиальную полость (рис. 121). Здесь, следовательно, мы
имеем дело с эпителиально-мышечными клетками, развившимися па ос-
нове эпителиальной выстилки целома. В базальных частях клеток акти-
новые и миозиновые протофибриллы формируют типичные саркомеры
с хорошо выраженными Z-дисками. Между базальными частями сосед-
них клеток имеется тесная связь, однако здесь еще отсутствуют типичные
десмосомы и другие структуры, характерные для вставочных пла-
стинок. Не обнаружено и системы Т-каналов. Элементы эпдоплазматиче-
298
ской сети образуют контакты непосредственно с плазматической мем-
браной.
Высшие первичноротые (головоногие моллюски и членистоногие).
Наиболее изучена в настоящее время сердечная мышечная ткань рако-
образных (Howse et al., 1971; Sperelakis, 1971). Как хорошо известно,
трубчатое сердце у этих животных разливается, как и камерное сердце
позвоночных, из стенки целома. Однако строение органа существенно
отличается от структуры камерных сердец. Сердце десятиногого рака
представляет собой трубчатое образование с несколькими входными от-
верстиями, через которые в полость сердца поступает гемолимфа из
перикарда при расслаблении сердечной мышцы. В качестве выводных
отверстий служат крупные артериальные стволы, куда проталкивается
гемолимфа из полости сердца при сокращении сердечной мышцы. По-
следняя у ракообразных не обладает способностью к автоматическим со-
кращениям. Правильная периодичность ее работы обусловливается спе-
циальными нервными клетками за счет автоматической генерации
импульсов через определенные промежутки времени.
Таким образом, и в структурно-анатомической организации, и по не-
которым важным функциональным механизмам сердце ракообразных
весьма существенно отличается от камерных сердец с миогепным авто-
матизмом позвоночных животпых. Несмотря на эти принципиальные осо-
бенности и несомненный независимый путь филогенетической диффе-
ренцировки сократимых тканей из стенки целома у предков ракообраз-
ных и позвоночных животных, структурная организация этих тканей
оказывается весьма сходной (рис. 122, а, б).
Весьма детально изучена ультраструктурная организация сердечной
мышцы у краба Limulus polyphemus (Leyton, Sonnenblick, 1971). Как и
у позвоночных животных, в сердечной мышце краба основными струк-
турными единицами являются специализированные мышечные клетки,
объединенные в мышечные волокна. Последние образуют сетевидные
структуры благодаря наличию поперечных связей, клетки в волокнах
объединяются при помощи вставочных пластинок. В области фиксиро-
ванных па плазматических мембранах концов миофибрилл контактирую-
щих клеток имеются характерные волокнистые структуры. В участках,
не занятых миофибриллами, широкое распространение имеет десмосом-
ный тип соединения клеток. У краба, как и у низших позвоночных, от-
сутствуют характерные для вставочных пластинок сердечной мышечной
ткани млекопитающих участки близкого контакта мембран соседних
клеток.
Миофибриллы, занимающие центральную часть мышечной клетки,
имеют типичное саркомерное строение с хорошо развитыми Z-дисками.
Длина саркомеров значительно превышает длину саркомеров туловищных
соматических мышц. Одпу толстую миозиновую протофибриллу окружает
12 тонких актиновых. Аппарат связи миозиновых протофибрилл в центре
саркомера четко не выявляется. Миозиновые протофибриллы в центре
имеют мепее плотную структуру, чем ® периферических участках.
Характерной особенностью мышечных клеток краба является наличие
глубоких впячивапий плазматической мембраны с прилегающим к ней
внеклеточным веществом внутрь клетки. От этих впячивапий отходят
каналы Т-системы. Их дистальные участки Т-образпо разветвляются,
распространяясь продольно вдоль миофибрилл, закапчиваются слепо,
образуя контакты с элементами эндоплазматической сети. Таким образом,
вспомогательный мембранный аппарат в клетках сердечной мышцы краба
получает большое развитие. При этом гипертрофируются участки его,
образованные плазматической мембраной..
Аналогичная сложная система Т-капалов имеется и в сердечной мы-
шечной ткани у одного из представителей паукообразных (Sherman, 1972).
Для пего характерно также и более сложное строение вставочных пла-
299
Рис. 122. Сердечная мышца ракообразных. (По электронным микрофотографиям:
Stein et al., 1966; рис. С. А. Быстрова).
а — участок мышцы речного рака, б — схема се ультраструктурной организации. 1 — ядра, 2 — мио-
фибриллы, 3 — вставочные пластинки.
стпнок. Здесь, как и у млекопитающих, помимо десмосом и структурного
объединения клеток в области концов миофибрилл имеются еще участки
тесного прилегания наружных поверхностей плазматических мембран
соседних клеток. С другой стороны, у низших раков (папример, у даф-
нии) миоциты сердечной мышцы имеют менее сложное строение. Здесь
практически отсутствует система Т-капалов, имеется всего один слой
мышечных клеток с небольшим количеством миофибрилл и относительно
мощно развитыми митохондриями (Stein et al., 1966).
У других ракообразных (Copepoda, Isopoda) сердечная мышечная
ткань имеет сложное строение с развитой системой Т- и L-каналов и ти-
пичной структурой вставочных пластинок (Howse et al., 1975;
Tjpnneland et al., 1975).
Сердечная мышечная ткань насекомых и головоногих моллюсков
изучена менее детально. Однако имеющиеся данпые показывают, что
общей ее особенностью является клеточный тип строения с соответствую-
щей сложной организацией межклеточных контактов. Во всяком случае,
у изученных в настоящее время представителей насекомых и головоно-
гих моллюсков в сердечной мышце обнаружены типичные вставочные
пластинки с характерным аппаратом десмосом и структурно-фупкцио-
нальйым объединением миофибрилл соседних клеток в области вставоч-
ных пластинок.
У высших первичпоротых животных значительная вариабельность
структурной организации сердечпой мышечной ткани характерна не
только для вспомогательных мембранных структур, но и для самого со-
кратимого аппарата. Однако, как и в случае соматических мышц, эта
вариабельность не выходит за рамки общих закономерностей организа-
ции сократимых структур, характерных для поперечнополосатой мышеч-
ной ткани.
ВИСЦЕРАЛЬНАЯ ГЛАДКАЯ МЫШЕЧНАЯ ТКАНЬ ПОЗВОНОЧНЫХ
И ДРУГИЕ РАЗНОВИДНОСТИ ГЛАДКОЙ МЫШЕЧНОЙ ТКАНИ
Висцеральная гладкая мышечная ткань обеспечивает у позвоночных
животных функцию сокращения в стенках большинства внутренних
органов (большей части кишечника, сосудов и органов мочеполовой си-
стемы). Она представляет собой достаточно четко характеризуемую
у этих животных разновидность сократимых тканей.
Гладкая мышечная ткань развивается в онтогенезе из мезенхимы —
общего зачатка всех разновидностей ткапей внутренней среды и в гисто-
генетическом отношении является, по-видимому, одной из дифференци-
ровок этой группы тканей у позвоночных животных.
Основным структурным компонентом гладкой мышечной ткани яв-
ляется гладкая мышечная клетка (рис. 123). Опа чаще всего имеет
веретеновидную форму. Размеры ее колеблются от 15 до 500 мкм в длину,
диаметр от 2 до 20 мкм. Наибольшей величины гладкие мышечные клетки
достигают у млекопитающих в стенке матки беременных животных.
Помимо веретеновидных клеток, в аорте, эндокарде, мочевом пузыре
встречаются клетки неправильной отростчатой формы.
В подавляющем большинстве случаев гладкие мышечные клетки
функционируют не как отдельные изолированные единицы, а как целые
системы таких клеток —слои или пучки гладких мышечных клеток.
Объединение клеток в пучок происходит за счет межклеточного вещества
мукопротеидной природы. В некоторых случаях и в условиях in vivo
(стенка артерий) и в культурах гладких мышечных клеток in vitro
удается показать способность этих клеток к синтезу пе только основного
аморфного межклеточного вещества, но и коллагеновых и эластических
волокон (Ross, Klebanoff, 1971). В цитоплазме клеток обнаружены уча-
301
стки эндоплазматической сети с рибосомами, т. е. аппарат белкового син-
теза, характерный для клеток, «продуцирующих основное вещество. Таким
образом, в настоящее время можно считать доказанной способность глад-
ких мышечных клеток к синтезу межклеточного вещества сходного
с межклеточным веществом рыхлой соединительной ткани. Плазматиче-
ские мембраны соседних мышечных клеток одного пучка местами обра-
зуют тесные контакты, играющие, по-видимому, роль в передаче им-
пульса между клетками (Iwayama, 1971). На поверхности гладких мы-
шечных клеток имеются многочисленные впячивапия правильной овальной
формы. Некоторые авторы считают их аналогами Т-каналов в соматиче-
ских мышцах (Devine, Somlyo, 1972; Bussow, Wullfhekel, 1972). Однако
высказывается предположение о преимущественно трофическом значении
этих образований (см. обзор: Prosser, 1974).
В цитоплазме гладких мышечных клеток удается выявить лишь один
тип неорганизованных в саркомеры протофибрилл — аналогичных тон-
ким актиповым протофибриллам соматической мышечной ткани. В цито-
плазме гладких мышечных клеток обнаруживаются также участки элек-
тронноплотного фибриллярного вещества. Некоторые авторы предпола-
гают, что эти участки электронноплотного вещества аналогичны веществу
Z-дисков соматической мышечной ткани. Биохимическими методами
удается выделить из гладкой мышечпой ткапи белок миозин и получить
в условиях in vitro агрегаты молекул миозина — искусственные миози-
новые протофибриллы. Однако в гладких мышечных клетках их не уда-
валось обнаружить длительное время даже с помощью высоких разреше-
ний электронного микроскопа.
Лишь в последнее время при применении особых методов обработки
материала, а также при фиксации мышцы в сокращенном состоянии и па
глицеринизированных или трипсипизированных моделях (см. обзоры:
Komnick et al., 1973; Богач, 1974) удалось показать наличие в цито-
плазме гладких мышечных клеток толстых, по-видимому миозиновых,
протофибрилл. Остается, однако, неясным, в какой мере наблюдаемые
картины отражают реальность существования миозиновых протофибрилл
в гладких мышечных клетках в условиях организма.
Имеются предположения о том, что миозиновые фибриллы в покоя-
щейся мышце находятся в дезинтегрированном состоянии и организуются
лишь в момент сокращения. Для такого предположения имеются опреде-
ленные экспериментальные данные (Rice et al., 1970; Rosenblath, 1972a).
Возможно также, что характерное для процессов сокращения поперечно-
полосатой мышечной ткани скольжение молекул миозина и актина может
осуществляться и без образования надмолекулярных комплексов — мио-
зиновых протофибрилл. В модельных опытах с сократимыми белками из
соматической мышечной ткани удалось показать возможность формиро-
вания актомиозиновых комплексов, обладающих способностью к сокра-
щению без оформленных миозиновых протофибрилл (Haese, Komnick,
1972). В связи с этими даппыми не исключена возможность, что в раз-
ных типах гладкой мышечной ткани имеет место неодинаковая степень
структурной организации молекул миозина.
Таким образом, основной особенностью проводящего мембранного и
контрактильного аппаратов гладкой мышечпой клетки является лишь
менее правильная организация их в пространстве. Тем не мепее п в
гладких мышцах в основе сокращений лежит характерный для других
сократимых тканей механизм взаимодействия сложных надмолекуляр-
ных белковых комплексов.
Отсутствие жесткой структурной организации этих комплексов
в миозиновых протофибриллах при мепее упорядоченном расположении
актиновых протофибрилл создает предпосылки для большей функцио-
нальной пластичности системы висцеральных мышц. Во всяком случае,
у позвоночных такой же принцип морфобиохимической организации па-
302
Рис. 123. Гладкая висцеральная мышечная ткань позвоночных. (Из: Devine, Somlyo,
1972).
а — мышечная ткань стенки кишки аксолотля, б, в — объемные схемы ультраструктурной органи-
зации гладких мышечных клеток млекопитающих. 1 — ядро, 2 — места близкого контакта плазма-
тических мембран соседних клеток, 3 — впячивания плазматической мембраны — возможные ана-
логи Т-каналов, 4 — участки гладкой эндоплазматической сети — возможные аналоги системы
L-каналов (саркоплазматической сети), 5 — сократимые протофибриллы, 6 — участки электронно-
плотного вещества, предполагаемые аналоги Z-дисков, 7 — участки шероховатой эндоплазматиче-
ской сети.
блюдается и в эпителиально-мышечных клетках желез (Cutler, Chaudry,
1973), и в сократимых клетках радужины, развивающихся из нервного
зачатка, и, наконец, в сократимых структурах клеток эпителия нефронов
(Pease, 1968; Rostgaard et al., 1972).
По-видимому, благодаря функциональной пластичностп гладкая мы-
шечная ткань имеет широкое распространение у многоклеточных живот-
ных (моллюсков, кишечнополостных, иглокожих и др.). У этих животных
опа изучена значительно менее полно и разносторонне, чем гладкая
мышечная ткань позвоночных. Характерной особенностью гладкой мы-
шечной ткани многих беспозвоночных животных является большая
структурированность молекул миозина, что проявляется в наличии у них
миозиновых протофибрилл в несокращенных мышечных клетках (Кош-
nick et al., 1973; Cavey, Cloney, 1974).
ЗАКЛЮЧЕНИЕ
Краткий сравнительный очерк морфобиохимической организации
сократимых тканей многоклеточных животных показывает, что, несмотря
на большое разнообразие их отдельных разновидностей, и в сократимом
аппарате, и во вспомогательных мембранных структурах имеются общие
закономерности, общие принципы такой организации. Они проявляются
прежде всего в сходной биохимической основе механохимических сокра-
тимых систем во всех мышечных тканях. В отдельных разновидностях
гладких, косоисчерченных и поперечнополосатых мышечных тканей у раз-
ных групп многоклеточных животных мы имеем дело с однотипными
основными сократимыми белками: актином и миозином (Komnick et al.,
1973). При этом между крайними модификациями структурной органи-
зации этих белков в надмолекулярные комплексы (например, в гладких и
поперечнополосатых мышцах) на самом деле нет глубоких принципиаль-
ных различий (рис. 124).
Как хорошо видно на схеме, все эти разновидности мышечных тканей
работают по принципу скольжения, основанному на взаимодействии
актина и миозина. Основной особенностью поперечнополосатых, гладких,
косоисчерченных мышечных тканей и их многочисленных модификаций
у животных разных систематических групп является лишь различная
степень упорядоченности пространственного расположения и размеров
надмолекулярных комплексов, образованных сократимыми белками. Имею-
щиеся сравнительно-гистологические данные показывают, что эти при-
знаки, характеризующие ту или иную разновидность мышечных тканей,
в значительной мере определяются функциональными моментами и не
связаны с высотой организации животных. Поперечнополосатые и косо-
исчерченные мышечные ткани с их наиболее правильной и сложной
организацией сократимого аппарата распространены практически у пред-
ставителей всех типов многоклеточных животных. Эти разновидности
мышечных тканей представлены не только наиболее древними, преем-
ственно развивающимися у многоклеточных соматическими мышцами,
но и висцеральной мускулатурой высших первичпоротых (Smith et al.,
1966; Toshio et at., 1974) и целомической сердечной мышечной тканью
более позднего в эволюции многоклеточных происхождения. Саркомерное
строение миофибрилл могут иметь такие специфические сократимые эле-
менты, как эпителиальпо-мышечные клетки радужной оболочки глаза
у некоторых птиц (Gabella, 1974). Наличие саркомерной организации
мпофибрилл показано также в мышечных клетках в глазу головоногих
моллюсков и в весьма своеобразных мышечных элементах в тимусе
млекопитающих (Raviola, Raviola, 1967; Toro et al., 1968). Больше того,
в настоящее время развиваются взгляды, что и в клетках, где функция
сокращения не является ведущей, сокращение отдельных клеточных
304
структур происходит по тому же принципу, что и в специализированных
мышечных тканях (Durham, 1974). В пользу этого заключения свиде-
тельствуют упоминавшиеся уже выше экспериментальные данные, по-
казавшие возможность в условиях in vitro создать модельные системы,
способные к сокращению, из актомиозиновых белков, выделенных из по-
перечнополосатых и гладких мышц позвоночных животных и даже из
цитоплазмы миксомицета Physaruin polycephalum (Haese, Komnick, 1972).
Общей особенностью всех этих модельных систем являются отсутствие
в них организованных миозиновых протофибрилл и появление их при
длительной стимуляции к сокращению. Нечто аналогичное наблюдается,
6
1
Рис. 124. Схема ультраструктурной организации и изменений в процессе сокращения
сократимых структур в мышечных тканях многоклеточных животных. (Из: Komnick
et al., 1973).
а — поперечнополосатые мышечные ткани позвоночных, б — косоисчерчепные мышечные ткани,
в — гладкие мышечные ткани беспозвоночных с оформленными миозиновыми и актиновыми прото-
фибриллами, г — гладкие мышечные Ткани позвоночных животных. 1 — сократимые структуры в по-
коящемся, 2 — сокращенном состояниях. Толстые продольные линии — миозиновые, тонкие —акти-
новые протофибриллы, Вертикальные линии и точки — Z-диски или их аналоги.
по-видимому, и в гладких мышечных клетках позвоночных при сокраще-
нии в условиях in vivo. Особенно же наглядно общность гладкой и попе-
речнополосатой или косоисчерченной мышечной ткани удалось выявить
при длительной стимуляции радулярных мышц брюхоногого моллюска
Bucctnum undatum. В конце опыта миозиновые и актиновые протофиб-
риллы в гладких мышечных клетках приобретали некоторое подобие
саркомерной организации.
В пользу отсутствия резких различий между миозином гладких и по-
перечнополосатых мышечных тканей свидетельствует уже давно извест-
ный факт возможности образования миозиновых протофибрилл из
миозина, выделенного из гладкой мышечной ткани.
Несмотря на несомненное наличие общего плана дифференцировки и
сократимого аппарата и вспомогательного мембранного аппарата мышеч-
ных тканей, вряд ли справедливо считать идентичными молекулярные и
надмолекулярные механизмы процессов сокращения во всех разновид-
ностях или даже в пределах отдельных разновидностей мышечных тка-
ней у многоклеточных животных. К сожалению, в настоящее время убе-
дительные доказательства в пользу наличия модификаций этого процесса
20 А. А. Заварзин
305
еще не многочисленны. Это связано в основном с еще относительно не-
большим кругом объектов, на которых проводятся достаточно разносто-
ронние и детальные морфобиохимические исследования процессов сокра-
щения. Тем не менее уже имеющиеся данные по соматическим мышцам
позвоночных и высших членистоногих, летательным асинхронным мыш-
цам насекомых, парамиозиновым мышцам пластинчатожаберных моллю-
сков и другим разновидностям мышечных тканей свидетельствуют о на-
личии определенной специфичности и процесса сокращения и его морфо-
биохимических основ, проявляющихся, в частности, в особенностях
организации контрактильных и мембранных систем.
Весьма существенные особенности наблюдаются также и в динамике
формирования миофибрилл в гистогенезе соматических мышц у позво-
ночных и насекомых (Auber, 1969; Sandow, 1970). У позвоночных тол-
щина и длина миозиновых и актиновых протофибрилл в формирующихся
саркомерах не изменяется в ходе гистогенеза мышечных волокон. У насе-
комых длина саркомеров и составляющих их протофибрилл на ранних
этапах гистогенеза меньше, чем в дефинитивных мышцах.
Существенные модификации, особенно разнообразные у беспозвоноч-
ных животных, наблюдаются в структуре Z-дисков, количественном со-
отношении толстых и тонких протофибрилл, характере взаимосвязи по-
следних и других структурных элементов сократимых систем даже в пре-
делах одной разновидности поперечнополосатых мышечных тканей.
В связи с этим, очевидно, что формулируемые теории сокращения еще
очень далеки от объективного отражения этого процесса во всем много-
образии его проявления в сократимых тканях многоклеточных животных.
Одним из наглядных примеров необходимости сравнительных иссле-
дований могут служить биохимические исследования регуляторных бел-
ков миофибрилл и молекулярных механизмов регуляции взаимодействия
протофибрилл саркомера (см. обзоры: Weber, Murray, 1973; Lehman, 1976).
В этих работах удалось показать наличие в мышцах многоклеточных
животных по крайней мере двух механизмов такой регуляции — тропо-
пин-тропомиозиновой системы тонких протофибрилл и специальной вспо-
могательной системы в толстых миозиновых протофибриллах. При этом
у позвоночных и ракообразных имеется только тропонин-тропомиозино-
вая система, у моллюсков, брахиопод, немертин и иглокожих только си-
стема, действующая на уровне миозиновых протофибрилл, у нематод,
полихет, членистоногих имеются и та и другая системы регуляции про-
цесса сокращения. Наличие этих двух регулятивных механизмов само по
себе свидетельствует об отсутствии полной идентичности в тонких меха-
низмах взаимодействия сократимых белков. Мозаичное распространение
этих механизмов в мышечных тканях у животных, весьма отдаленных
друг от друга в филогенетическом отношении, является вместе с тем
одним из ярких примеров биохимических параллелизмов на уровне вза-
имодействия специфических белковых молекул.
Имеющийся в настоящее время сравнительно-цитологический мате-
риал показывает, что ведущими моментами в возникновении тех или
иных разновидностей сократимых структур и вспомогательных аппаратов
на клеточном и субклеточном уровнях организации мышечных тканей
являются функциональный момент и относительная консервативность
биохимических механизмов, на основе которых происходит специализа-
ция мышечных клеток (Josephson, 1975).
Однако вряд ли можно согласиться с распространенными у физиоло-
гов и биохимиков представлениями о том, что у многоклеточных живот-
ных практически отсутствовали в эволюции существенные изменения
в элементарных механизмах мышечных сокращений на молекулярнобио-
логическом уровне их организации. В качестве аргумента в пользу такого
предположения приводится факт наличия у кишечнополостных и других
относительно низкоорганизованных животных мышечных систем с разно-
306
образными и сложноорганизованными в пространстве надмолекулярными
комплексами сократимых белков.
Нам, однако, представляется, что все эти факты свидетельствуют не
об остановке эволюционного процесса на этих уровнях организации живой
материи, а лишь о его параллельном сходном у разных животных ха-
рактере. Благодаря этому и создается возможность формирования слож-
ных специализированных систем при относительно низком общем уровне
организации животного. Не следует при этом забывать, что современные
низшие многоклеточные животные не являются непосредственными пред-
ками высших животных.
Против указанной выше точки зрения говорят также многочисленные
факты, свидетельствующие о наличии существенных структурных моди-
фикаций в организации контрактильных систем даже в пределах одной
разновидности мышечных тканей. Очевидно, что они связаны с более
или менее существенными модификациями и в конкретных биохимиче-
ских механизмах, которые, к сожалению, изучены еще в разных мышцах
и у разных животных далеко не достаточно. Сам факт широкого распро-
странения таких структурных модификаций свидетельствует об измене-
ниях сократимого аппарата в ходе эволюции животных, протекающих,
однако, в ограниченных пределах.
Приведенный выше сравнительный материал по сократимым тканям
показывает, что на уровне организации сократимого аппарата относи-
тельно слабо проявляется значение исторически обусловленной преем-
ственности развития данной ткани из определенного общего источника
в филогенезе. Сходные сократимые аппараты, хотя и имеют в основном
преемственное развитие в соматических и висцеральных мышцах,
однако могут возникать и в клетках других и весьма разнообразных тка-
ней и на разных этапах эволюции животных. Основной причиной широ-
кого распространения такого рода «филогенетических метаплазий» в об-
разовании сократимых ткапей является идентичность геномов клеток
одного организма и относительно слабое блокирование в них генов, от-
ветственных за синтез сократимых белков и белков вспомогательного
мембранного аппарата мышечных клеток.
Иные отношения наблюдаются на клеточном или скорее системном
тканевом уровне организации. Весьма существенное значение на этом
уровне организации мышечных тканей источника и длительности их раз-
вития в филогенезе многоклеточных животных особенно наглядно высту-
пает при сопоставлении биологических свойств соматической и целоми-
ческой мышечных тканей высших первично- и вторичноротых животных.
Как уже неоднократно указывалось выше, целомическая и соматиче-
ская мышечные ткани в филогенезе многоклеточных животных развива-
лись из разных источников. Источником развития более древней сомати-
ческой мышечной ткани была, очевидно, первичная пограничная ткань,
из которой через стадию эпителиально-мышечных клеток в процессе ди-
вергентной дифференцировки образовалась соматическая мышечная
ткань. Сердечная мускулатура возникла в филогенезе значительно позд-
нее у целомических животных с хорошо развитой транспортной функ-
цией целома. В силу каких-то обстоятельств при образовании пульсирую-
щих сердец-насосов в таких транспортных системах оказалось удобнее
дифференцировать новую разновидность сократимых тканей на основе
тканей стенки целомической полости. Во всяком случае у всех современ-
ных высших многоклеточных животных сократимая часть центральных
пропульсаторных органов кровеносной системы построена из мускула-
туры целомического происхождения.
Глубокие, исторически обусловленные различия в источниках разви-
тия целомической и соматической мышечных тканей у современных
многоклеточных животных находят свое отражение в различных источ-
никах развития этих тканей в онтогенезе. У позвоночных животных
20*
307
основным источником развития соматической мышечной ткани является
особая часть мезодермы — миотом. Сердечная же мышца развивается из
так называемых миоэпикардиальных пластинок — особых участков вис-
церальных листков спланхнотома. Аналогичные различия в источниках
развития сердечной и соматической мышечных тканей имеются у пер-
вичноротых животных. Интересно, однако, что эти разновидности мышеч-
ных тканей отличаются не только по источникам развития, но и по не-
которым признакам самого механизма дифференцировки и, в частности,
взаимоотношениям на определенных этапах миогенеза между гетеросин-
тетической активностью, т. е. синтезом ДНК и репродукцией клеток
(Румянцев, 1964; Заварзин, 1967; Жинкин, Румянцев, 1970).
У высших позвоночных животных начало специфического синтеза
этих белков в соматических мышцах практически выключает способность
ядерного аппарата к репликации ДНК. В сердечной мускулатуре у этих
животных синтез тех же сократимых белков длительно сосуществует
с процессами размножения клеток. При этом в миокарде в ходе гистоге-
неза происходит постепенное увеличение длительности митотического
цикла в пролиферирующих клетках, и в частности длительности такого
консервативного периода, как период синтеза ДНК. В размножающихся
камбиальных клетках миотомов в ходе гистогенеза не наблюдается таких
резких изменений продолжительности митотического цикла. Весьма суще-
ственно отличаются соматическая и целомическая мышечные ткани у выс-
ших позвоночных животных по своим регенеративным потенциям, а также
по самому механизму регенеративных процессов. Наиболее харак-
терными посттравматическими изменениями соматических мышечных
волокон являются на первых этапах процессы деструкции сократимого
миофибриллярпого аппарата на большом протяжении мышечного волокна.
Следующий этап заключается в активизации сохранившейся саркоплазмы
и ядер. Внешним проявлением такой активизации является увеличение
базофилии околоядерных участков цитоплазмы и резкое усиление про-
цессов синтеза РНК в ядрах и белков в цитоплазме (Жинкин, Ду-
бипко, 1964).
Механизм дальнейших активных регенеративных процессов остается
в настоящее время не совсем ясным. В травмированной области, с одной
стороны, наблюдаются на определенной стадии регенеративных измене-
ний большие наплывы саркоплазмы со скоплением ядер в концевых
участках таких мышечных почек. Считалось, что эти структуры отражают
определенные этапы своеобразного миосимпластического процесса реге-
нерации волокон — процесса, при котором волокно не утрачивает своего
целостного симпластического строения и регенерирует как единое целое.
Однако ннаблюдения в культурах тканей, а также использование метода
авторадиографии показали, что образование таких почек происходит не
в результате активной пролиферации клеток и новообразования живой
цитоплазмы, а является в значительной мере результатом активного
перемещения ядер и цитоплазмы. Новообразование мышечных волокон и
полноценное восстановление мышечной ткани в травмированном участке
происходят, по-видимому, преимущественно за счет возникновения
в травмированном волокне одноядерных миобластов, их энергичного раз-
множения и перемещения в травмированную область. На последующих
стадиях регенерации, путем слияния этих миобластов, происходит обра-
зование мышечных трубочек, представляющих собой начальную стадию
формирования мышечных волокон.
Относительно источников происхождения миобластов в настоящее
время нет единой точки зрения. По мнению одних исследователей,
миобласты возникают за счет дедифференцировки ядер и окружающих
их участков саркоплазмы мышечного волокна. Более распространено,
однако, представление о том, что миобласты происходят из особых кам-
биальных элементов мышечного волокна, так называемых клеток-сател-
308
литов (Mauro, 1961; Mair et al., 1965; см. также обзор: Mair, 1970).
Сателлиты являются малодифференцированными клетками, отделенными
от волокна плазматической мембраной, а от окружающих тканей базаль-
ной мембраной и периферическим слоем коллагеновых волокон сарко-
леммы. Наличие сателлитов показано в мышцах амфибий и млекопитаю-
щих. Методом электронной авторадиографии удалось доказать преиму-
щественное размножение этих клеток на ранних этапах регенерации
мышечных волокон (Moss, 1969; Reznick, 1969). Клетки-сателлиты обна-
ружены и в провизорных мышечных волокнах у гусениц шелкопряда
(Жинкин и др., 1975) и у рептилий (Kahn, Simpson, 1974). У насекомых
они особенно четко выявляются в связи с характерной для провизорных
мышечных тканей насекомых полиплоидизацией функционирующих ядер.
Если имеющиеся сейчас данные в отношении универсального распростра-
нения в соматической мышечной ткани особых малодифференцирован-
ных клеток получат дальнейшее подтверждение, то это будет означать,
что соматические мышечные волокна, по крайней мере у высших живот-
ных, представляют собой своеобразные камбиальные системы с четким
разделением на функционирующие дифференцированные участки, со-
ставляющие основную массу волокон, и особые резервные камбиальные
элементы, обеспечивающие способность волокон к регенеративным про-
цессам.
В целомической мышечной ткани желудочков миокарда млекопитаю-
щих не удалось обнаружить особых камбиальных элементов. В условиях
обычных экспериментальных травм или нарушений кровообращения не-
кротические изменения мышечной ткани репарируются обычно лишь за
счет разрастания межмышечной соединительной ткани. В сохранившихся
участках мышечных волокон миокарда наблюдается лишь незначитель-
ное повышение уровня белкового синтеза и синтеза РНК, что, как правило,»
не приводит к деблокированию ядерного аппарата и началу в клетках
процессов подготовки к делению.
В менее дифференцированной мышечной ткани предсердий при
экспериментальной травме или искусственно вызванной гипертрофии
удается наблюдать в значительном проценте клеток переход к аутосин-
тетическим процессам, и в частности важнейшему процессу подготовки
клеток к делению — редупликации ДНК (Румянцев, 1970, 1972, 1973).
Переход к четко выраженной аутосинтетической активности наблюдается
при гипертрофии миокарда и в особых менее дифференцированных уча-
стках мышечной ткани желудочков.
Активные пролиферативные процессы наблюдаются также при экспе-
риментальных травмах в мышечной ткани сердца у низших позвоночных,
например у амфибий. Весьма своеобразные изменения в целомической
сердечной мышечной ткани обнаружены у людей с гипертрофированным
миокардом в результате врожденных пороков сердца. Среди обычных
диплоидных ядер здесь удалось обнаружить полиплоидные ядра относи-
тельно высоких степеней плоидности (до 32с). Однако во всех этих
проявлениях пролиферативных потенций в миокарде имеет место не
активизация особых камбиальных клеток, как в соматических мышцах,
а дедифференцировка уже функционирующих специализированных
клеток.
Таким образом, краткая характеристика регенеративных процессов
в целомической п соматической мышечных тканях показывает, что в дан-
ном случае мы имеем дело с резко различными по своим биологическим
свойствам гистологическими системами, особенно у высших позвопочных
и, по-видимому, у первичпоротых животных. К сожалению, в настоящее
время почти полностью отсутствуют экспериментальные гистологические
данные по целомической мышечной ткани у беспозвоночных животных.
Глубокие различия в биологических свойствах соматической и цело-
мической мышечных тканей не менее отчетливо проявляются и в харак-
309
тере их разрастания в условиях культивирования вне организма кусоч-
ков скелетной мышечной ткани и миокарда.
Соматическая мышечная ткань, начиная с определенных этапов
эмбрионального развития, у млекопитающих и птиц растет в таких усло-
виях в виде своеобразных миосимпластов. Участки же миокарда до тех
пор, пока они сохраняют способность к экстенсивному росту вне орга-
низма, превращаются в пролиферирующие недифференцированные ми-
областы.
В диссоциированных клеточных культурах при смешивании миобла-
стов из миотомов разных животных, например птиц и млекопитающих,
удается получить гибридные мышечные волокна из клеточных элементов
эмбрионов различных классов позвоночных животных. Такие гибридные
структуры никогда не возникают в смешанных культурах миобластов
целомической и соматической мышечной ткани. Последний пример осо-
бенно убедительно свидетельствует, с одной стороны, о глубоком сходстве
соматической мышечной ткани у всех позвоночных животных и, с дру-
гой — о глубоких исторически обусловленных различиях между соматиче-
ской и целомической мышечными тканями у одного и того же организма.
Такие же исторически обусловленные различия в биологических свой-
ствах мышечных тканей имеются, по-видимому, и между другими их
разновидностями. И висцеральной гладкой мышечной ткани позвоночных,
и мионейральным элементам позвоночных и головоногих моллюсков, и
миоэпителиальным клеткам железистого эпителия и зобной железы, и,
по-видимому, многочисленным другим разновидностям мышечных тканей
у беспозвоночных животных свойственны специфические особенности на
тканевом уровне их организации. Они обусловлены, как и в случае цело-
мической мышечной ткани, различиями во времени и источниках возник-
новения каждой такой разновидности сократимых тканей. Несмотря на
существенные различия биологических свойств отдельных разновидно-
стей мышечных тканей у многоклеточных животных, явления тканевого
параллелизма широко распространены и на этом уровне их организации.
В этом отношении наиболее яркими примерами являются сходные черты
системной организации поперечнополосатых соматических мышечных
волокон у насекомых и позвоночных животных, а также независимое
возникновение и у первичноротых, и у вторичноротых животных клеточ-
ного строения сердечной мышечной ткани с формированием аналогичных
аппаратов объединения миоцитов в сетевидные целостные в функцио-
нальном отношении структуры.
Глава 2
ТКАНИ НЕРВНОЙ СИСТЕМЫ
ВВЕДЕНИЕ
Нервная система у многоклеточных животных является основной ин-
тегрирующей системой. В связи с этим у всех наиболее высокоорганизо-
ванных вторичноротых (позвоночные) и первичноротых (головоногие мол-
люски и членистоногие) животных опа достигает высокого уровня фи-
логенетической дифференцировки. При этом, как и в случае других рас-
смотренных выше тканевых систем, ткани нервной системы в процессе
эволюции отдельных групп животных обнаруживают сходные закономер-
ности усложнения па клеточном, тканевом и даже органном уровнях их
организации. Тенденции такого параллельного, общего для всех много-
клеточных животных усложнения специализированных клеточных систем
па примере тканей нервной системы выявляются особенно отчетливо
ЗЮ
в связи с ее особым и общим для всех многочисленных животных биоло-
гическим значением. Не случайно поэтому, что при широких сравнитель-
но-гистологических сопоставлениях организации нервных систем высших
многоклеточных животных именно на их примере впервые удалось сфор-
мулировать представление о наличии общих закономерностей усложнения
в процессе эволюции аналогичных в функциональном отношении тканей
многоклеточных животных (Заварзин, 1925, 1941). В настоящее время
эта идея общности морфофункциональной и биохимической организации
нервных систем и позвоночных и беспозвоночных животных получает
подтверждение не только в сравнительно-гистологических работах (Нев-
мывака, 1966; Цвиленева, 1970; Плотникова, 1975), по и в многочислен-
ных сравнительно-физиологических исследованиях (см обзоры- Kandell,
Kupferman, 1970; Krebs, 1975; Hoyle, 1975). Больше того, нервные си-
стемы беспозвоночных становятся в последнее десятилетие одним из ос-
новных объектов для изучения как общих закономерностей организации
специализированных нервных клеток так и их структурного и функцио-
нального взаимодействия в нервных центрах и в нервной системе в целом
(Bullock, 1975; Kennedy, 1975).
Большое значение в понимании молекулярных и клеточных основ
рецепции имеют широкие и целенаправленные сравнительно-цитологиче-
ские исследования, интенсивно проводимые в лаборатории Я. А. Винни-
кова (Винников, 1971). Большой сравнительно-гистологический материал
накоплен и в отношении морфобиохимической организации синапсов,
глиальных и нейросекреторных клеток (Таис, 1967; Поленов, 1968, 1974;
Nicaise, 1973; Паллас, Ваксман, 1973; Сахаров, 1974). Все это облегчает
нашу задачу дать краткий очерк современных достижений в области
сравнительной цитологии и гистологии тканей нервной системы. Такую
характеристику удобнее начать с рассмотрения особенностей морфобиохи-
мической организации основных структурных единиц этих тканей — нерв-
ных клеток, или нейронов. Далее разбирается состояние вопроса по срав-
нительно-цитологическому анализу специализированных межнейронных
контактов — синапсов, а также разнообразных и сложных по своей струк-
туре рецепторных клеток в важнейших органах чувств. Специальный раз-
дел посвящен характеристике глиальной ткани и состоянию вопроса о ее
взаимодействии с нервными клетками. В заключительном разделе мы
остановимся па некоторых аспектах эволюционного подхода к анализу
системного уровня организации нервной системы.
МОРФОБИОХИМИЧЕСКАЯ ОРГАНИЗАЦИЯ НЕЙРОНОВ
Нервные клетки многоклеточных животных характеризуются большим
разнообразием своего строения, формы, размеров и ядерно-плазменных от-
ношений (см. обзор: Питерс и др., 1972). Тем не менее всем нервным
клеткам свойствен ряд общих типовых признаков организации. Они опре-
деляются общими функциональными задачами и сходными внутриклеточ-
ными механизмами, лежащими в основе функциональной деятельности
нервных клеток. Одним из характерных внешних признаков нервных
клеток является наличие у них отростков. В связи с этим в нейроне выде-
ляют тело клетки с ядром и окружающей его цитоплазмой, так называемый
перикариоп, и отростки. У большинства нервных клеток отростки двух
типов — дендриты, по которым нервный импульс обычно распространяется
к телу клеток, и нейрит, или аксон, по которому импульс распростра-
няется от тела клетки. В зависимости от количества отростков нервные
клетки делятся на мультиполярные, биполярные, псевдоуниполярные и
униполярные. Наибольшее разнообразие по форме, размерам и количе-
ству отростков обнаруживается в группе мультиполярных клеток
(рис. 125). У позвоночных животпых к ним относится большинство ас-
311
a
Рис. 125. Мультиполярные клетки из различных отделов нервной системы позвоночных
животных. (Рис. Е. В. Петелиной).
а — двигательная клетка передних рогов спинного мозга, б — корзинчатая клетка, в — клетка
Пуркинье, г — зернистая клетка коры мозжечка, б, е — звездчатая и пирамидная клетки из коры
больших полушарий. 1 — аксоны (центральные отростки), 2 — дендриты (периферические отростки).
социативных и эффекторных нейронов соматической и все нейроны веге-
тативной нервных систем. В эту группу попадают крупные нейроны типа
двигательных клеток спинного мозга, клетки Пуркинье мозжечка и ги-
гантские пирамидные клетки коры больших полушарий. Их общей осо-
бенностью является большая длина аксона, достигающего у двигательных
и пирамидных клеток человека размеров более метра. Количество, раз-
меры и форма ветвления дендритов при этом весьма разнообразны. Здесь
наблюдаются и относительно короткие и мало ветвящиеся дендриты дви-
гательных клеток передних рогов спин-
ного мозга, и дендриты с причудливым
весьма характерным ветвлением клеток
Пуркинье, и весьма своеобразные денд-
риты пирамидных клеток коры больших
полушарий. К мультиполярным клеткам
относятся также клетки-зерна в коре моз-
жечка, корзинчатые и звездчатые клетки
и целый ряд других мелких ассоциатив-
ных клеточных элементов (рис. 125).
Последние характеризуются относительно
небольшими размерами перикариона, ко-
роткими дендритами и аксонами значи-
Рис. 127. Двигательная клетка из
грудного ганглия личинки стрекозы.
(По: Заварзин, 1941, рис. Е. В. Пе-
телиной).
1 — аксон, 2 — дендриты, 3 — тело
клетки.
Рис. 126. Биполярная клетка из сет-
чатки черепахи. (По: Догель, 1888).
тельно меньшей длины по сравнению с двигательными нейронами спин-
ного мозга. Таким образом, даже в пределах одной группы мультиполяр-
ных нейронов у позвоночных наблюдается весьма широкий диапазон
ядерно-плазменных отношений. В мелких ассоциативных нейронах они
мало отличаются от обычных ядерно-плазменных отношений в других
соматических клетках. В крупных нейронах с длинными аксонами или
дендритами ядерно-плазменные отношения оказываются резко сдвину-
тыми в сторону преобладания в клетках нейроплазмы.
Кроме позвоночных животных мультиполярные нервные клетки ши-
рокое распространение имеют только в нервных системах низших много-
клеточных. У первичноротых животных они имеются лишь у отдельных
групп (у ракообразных и головоногих моллюсков) в немногих отделах
нервной системы (Заварзин, 1941; Bullock, Horridge, 1965).
Биполярные нейроны представлены у позвоночных преимущественно
специализированными рецепторными нервными клетками органа зрения
(рис. 126) и обоняния и некоторыми ассоциативными нейронами. Более
313
широкое распространение они имеют у беспозвоночных животных, где
большинство чувствительных нервных клеток имеет один нейрит и один
дендрит.
Близки к чувствительным биполярным клеточным элементам псевдо-
униполярные нервные клетки позвоночных животных. Для них харак-
терно наличие одного длинного клеточного отростка, который затем
Т-образно разветвляется, образуя длинный дендрит, уходящий на пери-
ферию, и относительно более короткий аксон, идущий в спинной мозг.
В принципе мы имеем здесь дело с биполярной клеткой, часть тела кото-
рой преобразована в длинный клеточный вырост.
Особую группу в функциональном и структурном отношениях пред-
ставляют широко распространенные у беспозвоночных униполярные ней-
роны со сложной топографической дифференцировкой рецептивных обла-
стей па отростке или его разветвлениях (рис. 127). В отходящем от тела
клетки отростке можно выделить три зоны — проксимальный, или вста-
вочный, сегмент, рецептивный сегмент и аксон или аксоны с разветвле-
ниями. Вставочный сегмент является связующим звеном между трофиче-
ским (перикарион) и рабочим (отростки) аппаратом клетки. Рецептив-
ный сегмент, или сегменты, по своему значению аналогичен дендритам
мультиполярных, биполярных и псевдоуниполярпых клеток. Он может
быть представлен одним или несколькими (в основании каждого аксона)
участками клеточного отростка. В рецептивных областях расположены
синапсы, регулирующие деятельность данного аксона. У некоторых жи-
вотпых здесь образуются больших или меньших размеров выросты и от-
ростки. В случае достаточно больших размеров и ветвления они приобре-
тают вид настоящих дендритов. Последняя, наиболее значительная часть
отростка рассматриваемого типа нейронов является аксоном или аксонами,
обеспечивающими проведение импульса с рецептивной области на другую
нервную клетку или рабочий орган.
Особую разновидность нейронов составляют относительно немногочис-
ленные узкоспециализированные униполярные клетки. Они представлены
амакриновыми нервными клетками. Амакриновые клетки имеются в раз-
ных отделах центральной нервной системы. Наибольшее распространение
получают они в оптических нервных центрах позвоночных животных,
головоногих моллюсков и насекомых. Сам факт широкого распростране-
ния таких клеток в нервных системах высокоорганизованных животных
свидетельствует об их узкой специализации. Независимое возникновение
таких клеток в оптических центрах разных групп животных представляет
собой весьма яркий пример цитологического и гистологического паралле-
лизма в эволюции нервной системы (Заварзин, 1941).
Помимо морфологической и функциональной классификации нервных
клеток, в последнее время предложена их классификация по типу хими-
ческой специализации в отношении выделяемых ими веществ — медиато-
ров для химической передачи импульсов (Baldessurini, 1973; Сахаров,
1974). Эти вещества в химическом отношении весьма разнообразны. К ним
относятся: ацетилхолин, биогенные амины, некоторые аминокислоты,
АТФ и его дериваты. Кроме того, роль медиаторов и нейрогормонов
играют и разнообразные полипептиды. Интересно, что нейроны разной
медиаторной специфичности в одинаковой мере распространены как в
нервных системах позвоночных, так и беспозвоночных (первичноротых)
животпых. При этом одни и те же медиаторы, как правило, имеются
у далеко отстоящих друг от друга в филогенетическом отношении первич-
норотых и вторичноротых животных.
В нервных системах высших многоклеточных животных процессы
репродукции дифференцированных нервных клеток оказываются обычно
стойко и необратимо блокированными. Однако у этих животных в про-
цессе постнатального гистогенеза нервной системы, а у более низко орга-
низованных животных в течение всей жизни широкое распространение
314
имеют процессы соматической полиплоидизации. Благодаря этому у не-
которых групп животных (брюхоногие моллюски) большинство нервных
клеток в ганглиях ц. н. с. оказываются полиплоидными (рис. 128). Сте-
пень полиплоидии в нервных клетках брюхоногих моллюсков может до-
стигать весьма больших значений (Боровягин, Сахаров, 1968). Гигант-
ские полиплоидные нервпые клетки имеются и в нервной системе других
первичноротых животных (аннелиды, ракообразные, насекомые). Однако
у большинства представителей они не являются преобладающим типом
клеток. Соматическая полиплоидизация до 4—8с имеет место в некоторых
типах нервных клеток и у позвоночных животных.
Несмотря на широкое распространение полиплоидных нейронов, осо-
бенно у первичноротых животных, такой путь интенсификации метабо-
лизма клеток не является ведущим в филогенетической дифференцировке
нервной системы. В центральной нервной системе и в периферических ее
отделах и у насекомых, и у головоногих моллюсков, и у позвоночных жи-
вотных преобладают обычно диплоидные клетки. Естественно, что на-
грузка на функционирующие матрицы ДНК в таких диплоидных нерв-
ных клетках оказывается весьма напряженной. Особенно велика она
в диплоидных ттервпых клетках с длинными аксонами или дендритами,
т. е. в клетках, где ядерный аппарат контролирует необычный для сома-
тических клеток объем цитоплазмы.
Специфические особенности внутренней морфобиохимической органи-
зации нейронов удобнее показать на примере двигательных клеток перед-
них рогов спиппого мозга. У этих клеток имеются крупные ядра, богатые
кариолимфой, с резко выделяющимися на препаратах одним или двумя
ядрышками (рис. 129). Ядерная оболочка характеризуется наличием мно-
гочисленных пор. Хроматин сильно распылен и образует небольшие
скопления лишь в области ядерной оболочки. Такая структура интерфаз-
ного ядра характерна для весьма активных в метаболическом отношении
ядетшых аппаратов.
Наиболее специфичной для нервных клеток структурой цитоплазмы
перикариона и дендритов является так называемое тигроидное вещество
(вещество Ниссля). На уровне светового микроскопа оно выявляется
ъ виде скоплений или глыбок базофильного вещеста. На электронных фо-
тографиях видно, что в таких базофильных участках цитоплазмы имеется
хорошо развитая сеть каналов шероховатой эндоплазматической сети и
скопления свободных рибосом, образующих характерные розетковидные
структуры (рис. 130).
Хорошо развит в нервных клетках и аппарат Гольджи своеобразного
диффузного типа. Группы его центральных цистерн и периферических
пузырьков образуют анастомозирующую сеть вокруг ядерного аппарата
нервной клетки. Достаточно многочисленны в цитоплазме нервных кле-
ток и лизосомы. У молодых животных они относительно однородны и по
размерам и по своей структуре. В нервных клетках более старых живот-
ных наблюдается увеличение в цитоплазме мультивезикулярных тел и ли-
пофусциновых гранул, а также переходных форм между лизосомами и
этими структурами. В цитоплазме перикариона и отростков имеются
многочисленные митохондрии. Их внутренняя мембрана не образует
обычно большого количества крист.
Весьма характерными и специфическими структурами нервных кле-
ток являются пейрофиламенты и специализированные микротрубочки, ко-
торые хорошо развиты и в цитоплазме перикариона и особенно в отростках
нейронов. Нейрофиламенты — это фибриллярные структуры диаметром
от 40 до 100 А. Отти состоят из спирально закрученных нитей, состоящих
из белковых глобул с молекулярным весом 80 000. Глобулы образованы
кислыми белками. Нейротрубочки представляют собой цилиндрические
образования диаметром 240 А с толщиной стенки цилиндра 100 А
(рис. 131). Стенка образована 13 спирально закрученными нитями, со-
315
Рис. 128. Висцеральный ганглий брюхоногого моллюска (а) и схема строения поли-
плоидной клетки ганглия (б). (По: Боровягин, Сахаров, 1968; рис. Е. В. Петелиной).
1 — крупные клетки, 2 — средние и мелкие клетки, 3 — ядро, 4 — клеточный отросток, 5 — трофо-
спонгий, 6 — эндоплазматическая сеть.
стоящими из белковых мономеров с молекулярным весом 60 000 (см. об-
зор: Wuerker, Kirkpatrick, 1972).
В цитоплазме дендритов содержатся те же органоиды, что и в области
перикариона. В аксоне и участке перикариоиа, от которого он отходит —
аксональном холмике, отсутствуют рибосомы. Здесь имеются митохонд-
рии, элементы эндоплазматического ретикулума, и особенно хорошо раз-
вит аппарат нейрофиламентов и нейротрубочек.
Эффекторные и крайне разнообразные ассоциативные нервные клетки
у разных животных обнаруживают в основном лишь количественные раз-
личия в интенсивности метаболизма и степени развития отдельных ком-
понентов метаболического аппарата клеток.
Рис. 129. Двигательная клетка передних рогов спинного мозга кошки.
1 — ядро, 2 — ядрышко, 3 — глыбки тигроида.
Характерной особенностью нервных клеток всех многоклеточных жи-
вотных является высокая чувствительность их к внешним воздействиям
как общего, так и местного значения. Эта чувствительность отчетливо
проявляется и в быстром изменении интенсивности синтетических про-
цессов и в структурных изменениях белоксинтезирующего и энергетиче-
ского аппаратов клеток.
Для нервных клеток характерен высокий уровень синтетических про-
цессов, и в первую очередь процессов синтеза белка и РНК. Применение
меченых предшественников синтеза РНК и белка показывает, что в ней-
ронах интенсивность синтеза этих важнейших макромолекул находится
на очень высоком уровне (рис. 132).
Белки сами не являются медиаторами и играют лишь вспомогательную
роль в транспорте, разрушении и ресинтезе медиаторов. Нейроны, исполь-
зующие в качестве медиаторов полипептиды, имеют весьма ограниченное
распространение у многоклеточных животных. В количественном отноше-
нии небольшую часть синтезируемых нервными клетками белков состав-
ляют белки, участвующие в формировании долговременной нейрологиче-
ской памяти. Поэтому весьма интенсивную синтетическую активность
перикариона нельзя объяснить только потребностью в белках для обеспече-
ния химической передачи импульса и других процессов, непосредственно
317
связанных с основной функцией нервных клеток. Очевидно, что интен-
сивный белковый синтез прежде всего необходим для обновления струк-
турных и метаболических белков цитоплазмы нейрона, а также его от-
ростков, и в первую очередь аксона, лишенного собственного белоксинте-
зирующего аппарата.
Предположение о существовании такого обновления было высказано
и экспериментально обосновано еще в сороковых годах настоящего столе-
2
Рис. 130. Схема ультраструктурной организации двигательной нервной клетки пе-
редних рогов спинного мозга позвоночных. (Рис. М. Ю. Пунина).
1 — плазматическая мембрана, 2 — ядро, 3 — дендрит, 4 — аксосоматические окончания, 5 —
аксодендритические окончания, 6 — шероховатая эндоплазматическая сеть, 7 — цистерны аппарата
Гольджи, 8 — лизосомы, 9 — митохондрии, 10 — нейрофиламенты, 11 — нейротрубочки.
тия Вейсом (см. обзор: Weiss, 1969). В своих первых опытах Вейс накла-
дывал на живой нерв лигатуры из тканей кровеносных сосудов, что обу-
словливало резкое уменьшение диаметра аксона в области такой лига-
туры. Рассматривая изменения в аксонах через различные промежутки
времени, он обнаружил наличие характерных наплывов аксоплазмы со
стороны участка аксона, связанного с перикарионом. При снятии лига-
тур наплывы аксоплазмы постепенно исчезали, перемещаясь по направ-
лению к периферии. Сделанный на основании этих опытов вывод о нали-
чии тока аксоплазмы в дистальном направлении получал подтверждение
в опытах с мечеными аминокислотами (см. обзоры: Грачева, 1968; La-
sek, 1970; Мезенцев, Мессинова, 1971). В многочисленных современных
исследованиях удалось показать универсальное распространение про-
цесса непрерывного смещения аксоплазмы от перикариона к терминаль-
318
ным разветвлениям аксонов. Процесс этот удалось наблюдать и у млеко-
питающих, и у костистых рыб, и у ракообразных. Скорость смещения
аксоплазмы варьирует в довольно узких пределах. Она не превышает
10 мм в день, однако чаще ток аксоплазмы происходит со скоростью
1—5 мм в день. Это перемещение аксоплазмы в нейронах представляет
собой специфическое проявление общей
закономерности их клеточной организа-
ции — непрерывного обновления структур-
ных белков цитоплазмы. Для нервных
клеток высших многоклеточных животных
этот процесс приобретает особое значение,
поскольку здесь не происходит смены кле-
точного состава в стабильной клеточной
популяции нейронов. Таким образом, ин-
тенсивное обновление белка в нервных
клетках представляет собой, по-видимому,
Рис. 131. Модель элементарной организации мик-
ротрубочек и нейрофиламентов. (По: Schmitt,
1969).
1 — микротрубочка, 2 — нейрофиламент.
своеобразную модифидацию процессов физиологической регенерации, при
которой длительное существование клеток обеспечивается непрерывным
обновлением их цитоплазмы. Процессы непрерывного обновления харак-
терны для всей нейроплазмы, однако в аксоне они приобретают резко вы-
Рис. 132. Автографы нервных клеток спинномозгового ганглия лягушки через 1 час
после инъекции меченых предшественников.
а — 3Н-уридин, б — 358-метионин.
раженный направленный характер в связи с отсутствием здесь собствен-
ного белоксинтезирующего аппарата.
Вопрос о полном отсутствии процессов белкового синтеза в аксоне не
имеет еще однозначного отрицательного решения. На ряде объектов
(маутнеровские нейроны костистых рыб, гигантские полиплоидные ней-
роны брюхоногих моллюсков) получены данные, свидетельствующие
319
о наличии здесь особых форм немитохондриальной РНК и высказыва-
ются предположения о возможности, правда в весьма ограниченных пре-
делах, местного белкового синтеза (см. обзоры: Edstrom, 1969; Глебов,
1970; Мезенцев, Мессинова, 1971; Ашмарин, 1975).
Весьма своеобразные отношения удалось обнаружить в перифериче-
ских отростках некоторых нервных клеток у ракообразных. Эти отростки,
будучи искусственно отделенными от тела клетки путем перерезки, дли-
тельное время не дегенерируют. Возможно, однако, что в этом случае
процессы метаболизма в дистальном, лишенном связи с перикарионом, уча-
стке отростка поддерживаются за счет вспомогательных глиальных кле-
ток (см. ниже). Независимо от наличия или отсутствия местного белко-
вого синтеза в аксонах ясно, что основная масса белка в нервных клетках
синтезируется в области перикариона.
Помимо относительно медленного перемещения нейроплазмы в про-
цессе ее обновления, в последнее время обнаружен' также и механизм
быстрого перемещения белков и других компонентов по отросткам нерв-
ных клеток (см. обзоры: Samson, 1971; Ochs, 1972). Скорость этого бы-
строго транспорта варьирует в широких пределах (от 50 до 2000 мм
в день), он имеет универсальное распространение, как в нейронах позво-
ночных, так и беспозвоночных животных. Быстрый транспорт веществ
зависит от процессов окислительного фосфорилирования, наличия ионов
Са и нарушается при разрушении микротрубочек и нейрофиламентов.
В связи с этим предполагают, что эти специфические для нервных кле-
ток органоиды представляют собой структурную основу для специальной
морфобиохимической системы, обеспечивающей быстрый транспорт ве-
ществ по отросткам. Этот транспорт, по-видимому, осуществляется благо-
даря взаимодействию белков типа актина и миозина, находящихся на
поверхности микротрубочек, и переносимого вещества — транспортно-фи-
ламентная гипотеза (рис. 133). Такие актомиозиноподобные белки выде-
лены из нейроплазмы.
Согласно другой гипотезе — гипотезе «скользящего пузырька», движе-
ние частиц по аксону происходит вследствие механохимического взаимо-
действия между глобулярными белками микротрубочек и переносимой
частицей. Высказывается предположение, что система быстрого тран-
спорта веществ может работать не только в проксимально-дистальном, но
и в обратном направлениях, что обеспечивает возможность непосредствен-
ной связи между периферическими разветвлениями отростков нервных
клеток и их трофическим центром. Наличие такой связи показано в мно-
гочисленных экспериментальных работах. Более подробная характери-
стика современного состояния вопроса о механизмах и значении быстрого
транспорта веществ по аксонам содержится в специальных работах и об-
зорах (Fernandez et al., 1971; Dahltsrom et al., 1974; Heslop, 1974; Howes
et al., 1974).
На основе полученных данных о большом своеобразии морфобиохи-
мической организации нейронов в последнее время делаются успешные
попытки связать высокую метаболическую активность нервных клеток
с их способностью сохранять и передавать следовые реакции, лежащие
в основе условнорефлекторной нервной деятельности (Hyden, Lange,
1969). При этом удалось обнаружить появление у обученных животных
особых форм РНК с необычной последовательностью оснований и специ-
фических ядерных белков. Однако вряд ли следует ожидать, что такие
сложные процессы, как память и условнорефлекторная деятельность по-
лучат свое объяснение лишь на молекулярном и клеточном уровнях орга-
низации нервной системы. Имеющийся в настоящее время большой срав-
нительно-гистологический и сравнительно-физиологический материал сви-
детельствует о том, что в основе сложной деятельности нервной системы
должны лежать общие для всех многоклеточных системные механизмы ее
организации. Современное состояние вопроса о цитологических и систем-
320
ных механизмах нейрологической памяти освящено в монографии
И. П. Ашмарина (Ашмарин, 1975). Автор убедительно показывает, что
в настоящее время более вероятными представляются гипотезы, объясня-
ющие долговременную память за счет изменения механизмов межней-
ронных взаимодействий. В процессах изменения проводимости межней-
ронных контактов — синапсов, большая, но вспомогательная роль принад-
Рис. 133. Схемы, иллюстрирующие возможные механизмы «быстрого» транспорта
веществ по аксону согласно модели скользящего пузырька (Schmitt, 1969) и транс-
портно-филаментной гипотезе (Ochs, 1972).
а, б — модель скользящего пузырька (механическое взаимодействие между глобулами — молеку-
лами нейротрубочки и глобулярными структурами в мембранах пузырька), в — схема перемещения
веществ по транспортно-филаментной гипотезе. 1 — пузырек, 2 — растворимый белок, 3 — вещество
неопределенной природы, 4 — микротрубочка, 5 — нейрофиламент, 6 — транспортная нить (воз-
можный аналог миозиновой протофибриллы).
лежит и синтезу макромолекул и, в частности, специфических белков.
Имеются предположения, что в процессах макромолекулярных синтезов,
обеспечивающих стойкое повышение проводимости синапсов, использу-
ются механизмы регуляции, аналогичные механизмам памяти в реакциях
адаптивного иммунитета.
СИНАПСЫ
Одним из основных аппаратов, обеспечивающих деятельность нервной
системы, являются аппараты передачи нервного импульса с одной нерв-
ной клетки на другую и с нервных клеток на работающие органы. Изу-
чение морфобиохимических основ процессов возникновения и проведения
нервных импульсов необходимо для выяснения одного из основных меха-
низмов интегрирующей и анализирующей функций нервной системы и
привлекает все большее и большее внимание (см. обзоры: Таис, 1967;
Akert, Pfenninger, 1969; Gray, 1971; Питерс и др., 1972; Паллас, Вакс-
ман, 1973; Сахаров, 1974). Еще в конце XIX и начале XX в. места спе-
циализированных контактов нервных клеток получили название синапсов
(рис. 134). В настоящее время уже изучена ультраструктурная и частично
21 А. А. Заварзин 321
биохимическая организация различных модификаций таких контактов.
Делаются успешные попытки выявить функциональное значение отдель-
ных структур и всего синаптического комплекса в целом. При этом уда-
лось установить прежде всего одну интересную общебиологическую зако-
номерность. Оказалось, что, несмотря на большое разнообразие синапсов
в нервной системе одного животного, не существует больших различий
между синаптическими приборами в нервной системе низко- и высоко-
организованных многоклеточных животных (Таис, 1967; Gray, 1971).
Этот факт свидетельствует, очевидно, о том, что механизмы взаимодей-
Рис. 134. Синаптические окончания на двигательной нервной клетке передних рогов
спинного мозга млекопитающих. (Из: Катц, 1966).
ствия нервных клеток достаточно универсальны для всех многоклеточных
животных независимо от их филогенетических отношений. Они форми-
руются и совершенствуются в процессе эволюции в едином направлении.
Все многообразие специализированных контактов между нервными
клетками можно разделить на 3 основных типа — синапсы с химической
передачей, электротонические и смешанные синапсы.
Наибольшее распространение имеют синапсы с химической переда-
чей нервного импульса. Принцип работы таких синапсов заключается
в том, что в области контакта нервных клеток под влиянием специфиче-
ских химических веществ, выделяемых клеткой, приносящей нервный
импульс, происходит местная деполяризация или гиперполяризация плаз-
матической мембраны. В результате этого имеет место либо образова-
ние нового нервного импульса, либо затруднение для его возникновения
под влиянием импульсов со стороны других нервных клеток. Вся слож-
ная цепь биохимических процессов, которая лежит в основе химической
трансформации нервного импульса, и изменения мембранного потен-
циала в области контактирующих нервных клеток развертываются в обла-
сти синапсов.
322
Типичный нейрохимический -синапс состоит из пресинаптической и
постсинаптической частей и синаптической щели (рис. 135).
Пресинаптическая часть образована концевыми расширениями ак-
сона, утратившего миелиновую оболочку. Одним из специфических струк-
турных компонентов этой области синапса являются синаптические
пузырьки. Они представляют собой ограниченные мембраной структуры
преимущественно округлой формы. Помимо простых относительно мел-
ких синаптических пузырьков, в некоторых синапсах обнаружены более
крупные синаптические пузырьки с электронноплотными ячеистыми
структурами на их наружной поверхности (Gray, 1971). Все эти пузырьки
имеют светлое содержимое и называются агранулярными. Наряду с этим
типом пузырьков в синапсах встречаются пузырьки с электронпоплотным
содержимым, их принято называть гранулярными пузырьками.
Рис. 135. Схема строения аксодендритического химического синапса. (Рис. М. Ю. Пу-
нина).
1 — аксональная терминаль, 2 — дендрит, 3 — агранулярные пузырьки, 4 — гранулярные
пузырьки, 5 — уплотнения аксоплазмы на пресинаптической мембране, 6 — субсинаптические тела.
При биохимических исследованиях методами дифференциального
центрифугирования в синаптических пузырьках холинэргических синап-
сов обнаружено наличие ацетилхолина и ферментативных систем, необхо-
димых для его синтеза и транспорта (Marchbanks, 1969). Эти фермента-
тивные системы и ацетилхолин обнаруживаются, кроме того, в аксоплазме
пресинаптической области.
В типичных синапсах очень сложную структуру имеет пресинаптиче-
ская мембрана к прилегающая к пей цитоплазма аксона (Akert, Pfennin-
ger, 1969). На внутренней стороне пресинаптической мембрапы располо-
жены электронноплотные образования конусовидной формы, так на-
зываемые dense projection. Их размер от основания до вершины
конуса примерно 1 600А, а диаметр основания около 550А. Они располо-
жены в шахматном порядке на расстоянии друг от друга, равном 800 А.
Каждый конус связан с 5 соседними при помощи тяжей таким образом,
что на внутренней поверхности пресинаптической мембраны, не занятой
dense projection и связывающими их тяжами уплотненной цитоплазмы,
образуются участки треугольной формы. Предполагают, что именно
в этих участках происходит выход содержимого синаптических пузырь-
ков в синаптическую щель. Перед выделением содержимого пузырька оно
21*
323
обогащается за счет поступления сюда дополнительных веществ. Отно-
сительно конкретных молекулярных механизмов работы пресинаптиче-
ской части, функциональной взаимосвязи отдельных ее специфических
структур, а также источников обновления и синтеза химических компо-
нентов синаптических пузырьков (медиаторов и ферментативных белков)
в настоящее время нет единого мнения. Многие вопросы еще далеки от
их однозначного, строго доказанного решения. Неясен конкретный меха-
низм выведения содержимого пузырька. Наиболее вероятно, что здесь
имеет место своеобразный специализированный экзоцитоз. Высказывается
также мнение, что в некоторых случаях в области пресинаптической мем-
браны может происходить образование пузырьков путем пиноцитоза.
Процессы пиноцитоза убедительно показаны методом замораживания и
скалывания в боковых участках терминального расширения аксона
(Akert et al., 1969). Широкое распространение имеет представление о том,
что синаптические пузырьки образуются из эндоплазматической сети
аналогично секреторным гранулам. Ряд авторов, однако, производит эти
структуры из микротрубочек (De Robertis, 1969). Еще большее количе-
ство гипотез имеется относительно источников формирования содержи-
мого синаптических пузырьков, т. е. медиаторов, ферментов и других
веществ, необходимых для регулируемого транспорта медиаторов через
мембраны в область синаптической щели.
Все эти гипотезы базируются, с одной стороны, на фактах, свидетель-
ствующих о наличии в аксонах наряду с медленным центростремитель-
ным смещением аксоплазмы, описанным выше, быстрой транспортировки
низко- и высокомолекулярных соединений из перикариона в область тер-
минальных разветвлений аксона. С другой стороны, имеются данные и
об активных синтетических процессах в области самих терминальных
разветвлений аксона. В частности, довольно убедительно показано нали-
чие здесь синтеза низкомолекулярных соединений, а также вторичных
изменений белковых молекул.
В работе синапса, в биохимических процессах, развертывающихся
в его пресинаптической части, важное значение имеют локализованные
здесь части энергетического аппарата клеток, и в частности митохондрии.
Последние могут иногда вступать в тесный контакт с пресинаптической
мембраной. Второй особенностью синаптических митохондрий является
их непродолжительный жизненный цикл. В многочисленных исследова-
ниях показано, что пресинаптические области являются местами преиму-
щественной гибели и разрушения митохондрий, а относительное постоян-
ство их количества обеспечивается непрерывным поступлением их из
перикариона. Возможно, что такая недолговечность митохондрий обуслов-
лена весьма интенсивной специфической работой, связанной с необходи-
мостью продукции большого количества АТФ.
В настоящее время еще относительно мало известно о морфобиохи-
мической организации и конкретном функциональном значении двух
других частей химических синапсов — синаптической щели и постсинап-
тического участка, образуемого главным образом дендритами нервных
клеток. Относительно синаптической щели ясно, что это не просто про-
странство между контактирующими мембранами двух соседних клеток,
а внеклеточная система, где развертываются определенные звенья био-
химических процессов, лежащих в основе химической передачи нервного
импульса. Синаптическая щель заполнена, по-видимому, в основном спе-
циализированными надмембранными комплексами двух контактирующих
между собой нервных клеток. Ширина синаптической щели обычно около
200 А. В щели обнаружено вещество средней электронной плотности,
в котором удается наблюдать трубчатые структуры, связывающие наруж-
ные слои плазматических мембран контактирующих клеток. Внеклеточ-
ное вещество, заполняющее синаптическую щель, представляет собой
весьма динамичное образование и по скорости его обновления, и по спо-
324
собности к различным перестройкам в процессе генерации и проведения
импульса.
Постсинаптическая мембрана в некоторых синапсах характеризуется
наличием на внутренней поверхности уплотненного слоя цитоплазмы,
который также подвержен видимым морфологическим изменениям в раз-
ных типах сипапсов. Часто он может почти полностью отсутствовать.
В постсинаптической области также имеются митохондрии, а в неко-
торых типах синапсов уплощенные, ограниченные мембранами структуры,
функциональное значение которых неясно. Весьма важными химическими
компонентами постсинаптической мембраны в холинэргических синапсах
являются холинрецептивный белок и структурноорганизованный фер-
мент — ацетилхолинэстераза. Эти соединения играют, по-видимому, одну
из центральных ролей в химической передаче импульса. Наличие холин-
рецептивного белка создает, с одной стороны, предпосылки для специфиче-
ского и весьма точного воздействия на мембрану, индуцируя цепь биохими-
ческих процессов, приводящих либо к генерации потенциала действия,
либо к более стойкой ее поляризации. С другой стороны, быстрое разру-
шение медиатора холинэстеразой препятствует его непрерывному дей-
ствию па рецепторные аппараты постсинаптической мембраны. Холинэр-
гические синапсы, в которых медиатором является ацетилхолин, изучены
подробно у позвоночных и некоторых беспозвоночных животных. Однако
у последних, как например у брюхоногих моллюсков, имеет место и
другой механизм инактивации медиатора, не связанный с действием струк-
турно организованного в постсинаптической мембране гидролитического
фермента ацетилхолинэстеразы.
Помимо холинэргических нейронов и синапсов, имеются еще адрен-
эргические нейроны, где роль медиаторов выполняют моноаминные
соединения (адреналин, норадреналин, серотонин и др.). Широкое рас-
пространение у многоклеточных имеют нейроны, в синапсах которых
роль медиаторов играют аминокислоты (у-аминомасляная кислота, глута-
мат, глицин). Некоторые из этих медиаторов, как например у-аминомас-
ляная кислота и глутамат, впервые были описаны у беспозвоночных
животных, а затем их удалось обнаружить и в нервной системе позво-
ночных (Глебов, 1970; Сахаров, 1974).
Каждая разновидность синапсов имеет существенные особенности
морфобиохимической организации. Эти особенности определяются специ-
фикой синаптических и транспортных процессов в пресипаптической
части, особенностями рецепторов в постсинаптической мембране и спе-
цификой процессов деградации и ресинтеза данного медиатора. В частно-
сти, инактивация таких простых медиаторов, как глицин, происходит не
путем разрушения этой аминокислоты, а быстрым избирательным удале-
нием ее из синаптической щели.
В функциональном отношении все синапсы с химической передачей
импульса делятся прежде всего на две большие противоположные по
своему значению группы — тормозные и возбуждающие. Очевидно, что
различный эффект их действия на постсипаптическую область синапса
определяется различиями в молекулярной, химической, а возможно, и
морфологической организациях таких синапсов. Эти различия не могут
определяться самим медиатором, хотя некоторые медиаторы, как напри-
мер т-аминомасляная кислота, характерны для тормозных синапсов,
а глутамат — для возбуждающих. Однако на одиночных нейронах у мол-
люсков удалось показать, что нейрон, синтезирующий ацетилхолин,
может вызывать в различных областях терминальных разветвлений ак-
сона либо возбуждение, либо торможение, либо оказывать возбуждающее
и тормозное воздействие на постсинаптические нейроны. Очевидно, что
в данном случае специфика ответа определяется рецепторами постсинап-
тической мембраны, каждый из которых вызывает изменение проницае-
325
мости мембраны для разных ионов и этим обусловливает дифференциро-
ванный ответ при действии одного и того же медиатора.
Представление о сложности и разнообразии синаптических аппаратов
в нервной системе многоклеточных животных дают примеры, приводимые
Греем (Gray, 1971) в одном из последних обзоров. На рис. 136, а пока-
заны синаптические контакты на пирамидной клетке больших полушарий.
Здесь имеются типичные аксодендритические синапсы с шипиками ден-
Рис. 136. Схема строения синапсов в различных отделах нервной системы позвоноч-
ных. (По: Gray, 1971, рис. Е. В. Петелиной).
а — синапсы на пирамидной клетке головного мозга, б — аксоаксональпый синапс, в — синапти-
ческий комплекс в латеральном коленчатом теле, г — схема нейронных окончаний в обонятельной
луковице млекопитающих, д — синапс на дендрите маутнеровской клетки. 1 — синапсы на дендрите,
2 — синапсы на дендритном шипике, <3 — окончание оптического волокна, 4 — терминаль иного
происхождения, 5 — дендрит, 6 — терминали аксонов чувствительных клеток, 7 — митральная
клетка, 8 — зернистая клетка.
дритов (2) и поверхностью дендрита (7), являющиеся, по-видимому,
возбуждающими синапсами. Их пресипаптические части содержат сфе-
рические пузырьки, а в постсипаптических участках наблюдается типич-
ное уплотнение цитоплазмы. На теле клетки имеется так называемый
аксосоматический синапс, содержащий в пресинаптической области
уплощенные синаптические пузырьки, в постсипаптической части такого
синапса пет уплотненных участков цитоплазмы. По всей вероятности, это
типичный тормозной синапс.
На рис. 136, б показан своеобразный аксоаксональпый синапс, встре-
чающийся в ц. п. с. позвоночных и у беспозвоночных животных. В дан-
ном случае можно предполагать, что выделение медиатора в одном пре-
синапсе вызывает торможение выделения медиатора во втором пресинапсе,
т. е. имеет место эффект так называемого пресинаптического торможе-
326
яия. Еще более сложные отношения наблюдаются в аксодепдритических
синапсах в оптических центрах среднего мозга млекопитающих
(рис. 136, в). Одно из терминальных разветвлений аксона образует пре-
синапс одновременно с дендритом и другим аксональным окончанием,
которое само является пресинапсом к этому же дендриту и, по всей ви-
димости, относится к тормозным аксодепдритическим синапсам (упло-
щенные пузырьки, отсутствие в постсинаптической части уплотнения
цитоплазмы).
На рис. 136, г представлена схема нейронных взаимоотношений, на-
блюдаемых в обонятельной луковице млекопитающих. Здесь имеются ти-
2
Рис. 137. Схема электротонического синапса. (По электронным микрофотографиям:
Питерс и др., 1972, рис. М. Ю. Пунина).
7 — аксональное окончание, 2 — дендрит, 3 — синаптические пузырьки, 4 — синаптическая щель
(видна поперечная исчерченностъ).
пичные акоодендритические синапсы между терминалями аксонов чув-
ствительных обонятельных клеток и дендритом митральной клетки.
На латеральных дендритах митральных клеток имеются своеобразные так
называемые реципрокные синапсы с отростком зернистой клетки. Одна
часть этого синапса является тормозной по отношению к митральной
клетке и имеет в пресинапсе уплощенные пузырьки, а другая — возбуж-
дающей по отношению к зернистой клетке и имеет сферические пузырьки.
Приведенные примеры, естественно, далеко не исчерпывают всей слож-
ности и многообразия синаптических контактов между нервными клет-
ками с химической передачей импульса.
Помимо химических сипапсов, в нервной системе многоклеточных
животных распространены еще и так называемые электротонические и
смешанные синапсы. Они встречаются в различных участках нервной
системы и образуют в основном дендродендритические и соматосомати-
ческие контакты.
На рис. 136, д представлен электротонический синапс на дендрите
маутнеровской клетки из спинного мозга рыб.
По своей морфобиохимической организации электротонические си-
напсы, по-видимому, имеют много общего с тесными контактами типа зоны
слияния, часто наблюдаемыми в эпителиальных тканях (рис. 137). По мор-
327
фологическим особенностям можно выделить два типа синапсов: с плотным
соприкосновением мембран (tight junction) и с наличием небольшой щели
или системы каналов диаметром 20 A (gap junction). В электротонических
синапсах иногда удается выявить наличие в нейроплазме синаптических
пузырьков, функциональное значение которых абсолютно неясно.
Имеются достаточно обоснованные предположения о том, что электро-
тонические синапсы обладают определенной специфичностью — они
могут пропускать или не пропускать импульс, а также могут, по-видимому,
способствовать распространению импульса в определенном направлении
(Bennet, 1968). Биологический смысл
таких электротонических синапсов
очевиден, поскольку они обеспечи-
вают синхронную работу однознач-
ных клеток. Относительно редко и
у позвоночных, и у беспозвоночных
животных удается наблюдать сме-
шанные синапсы.
Помимо межнейронных синапсов
большое значение в деятельности
нервной системы имеют нервномы-
шечные контакты и другие нервные
окончания эффекторных нейронов.
Терминальные разветвления аксонов
эффекторных нейронов располага-
ются на специализированных ткане-
вых элементах во всех областях тела
многоклеточных животных. Особенно
многочисленны они в различных со-
кратимых тканях.
Рис. 138. Двигательные нервные окончания
на поперечнополосатых мышечных волок-
нах лягушки.
В качестве примера особенностей морфобиохимической организации
подобного рода структур мы разберем подробнее эффекторное нервное
окончание на соматических мышечных волокнах позвоночных животных
(Coers, 1967). Эти окончания имеют вид небольших утолщений или бу-
горков, расположенных на сарколемме мышечного волокна. Они получили
название двигательных бляшек (рис. 138). Характерной особенностью
этих структур является обилие здесь ядер, которые принадлежат распо-
ложенному в области двигательной бляшки скоплению вспомогательных
глиальных клеток.
Каждое терминальное разветвление в области бляшки заканчивается
булавовидным расширением аксона, в котором обнаруживаются струк-
туры, свойственные и пресинаптической части межнейронного синапса
(скопление синаптических пузырьков и митохондрий, специфическая
организация плазматической мембраны с характерными уплотненными
участками цитоплазмы). Особенностью синаптической щелио нервно-мы-
шечного синапса являются ее большие размеры (600—1200 А). Плазма-
тическая мембрана мышечного волокна, за счет которого формируется
постсинаптическая часть синапса, образует многочисленные складки
(рис. 139).
Таким образом, за исключением чисто количественных различий (раз-
меры синаптической щели и гипертрофия мембран 1постсинаптической
части) общий принцип структурной организации нервно-мышечных
328
синапсов оказывается сходным с химическими синапсами нервных кле-
ток. На примере нервно-мышечных синапсов особенно четко удалось про-
следить динамику экзоцитоза синаптических пузырьков и компенсатор-
ного пиноцитоза на латеральной поверхности пресинапса (Heuser, Reese,
1973). При длительном раздражении нейрона удается получить массо-
вый экзоцитоз синаптических пузырьков в области пресинаптической
мембраны. На латеральной поверхности в этих условиях наблюдается
интенсивное образование пиноцитозных пузырьков, которые, сливаясь
в центре пресинапса, образуют ограниченные мембраной цистерны. Пос-
ледние служат источником развития новых синаптических пузырьков.
У позвоночных, кольчатых червей и у некоторых других групп животных
Рис. 139. Схема ультраструктурной организации нервно-мышечного контакта.
(Рис. М. Ю. Пунина).
1 — базальная мембрана, 2 — шванновская клетка, 3 —терминаль нервного волокна, 4 — сарко-
плазма мышечного волокна, 5 — пальцевидные отростки шванновской клетки.
медиатором в нервно-мышечных синапсах является ацетилхолин. У на-
секомых в аналогичных по ультраструктурной организации нервно-мы-
шечных синапсах роль медиаторов выполняет, по-видимому, глутамат
(Usherwood, 1967; Salpeter, Faeder. 1971). Помимо холинэргических си-
напсов, в мышечных тканях позвоночных имеются еще и адренэргические,
и пуринэргические нервно-мышечные синапсы, медиаторами в которых
являются соответственно адреналин и пурины. Особенно большое разно-
образие в эффекторных нервно-мышечных синапсах наблюдается у га-
стропод. Медиаторами здесь могут быть помимо ацетилхолина серотонин,
дофамин и несколько разновидностей полипептидов. Эти примеры на-
глядно показывают эволюционную пластичность специализированных
терминальных аппаратов нервных клеток.
РЕЦЕПТОРНЫЕ НЕРВНЫЕ ОКОНЧАНИЯ
Организация рецепторных нервных аппаратов у современных много-
клеточных животных характеризуется значительно большим разнообра-
зием, чем организация синапсов. Это определяется двумя основными био-
логическими особенностями рецепторных нервных приборов. Во-первых,
каждый тип рецепторов приспособлен к восприятию одного специфиче-
ского сигнала (раздражителя) внешней или внутренней среды. Во-вто-
рых, в рецепторных нейронах и специализированных для этой цели ре-
329
цепторных клетках других тканей имеет место первичная генерация
нервного импульса — происходит трансляция энергии внешнего стимула
в энергию нервного импульса. Естественно, что в нашем кратком очерке
рецепторных аппаратов мы не сможем сколько-нибудь подробно охарак-
теризовать все их многообразие и остановимся лишь па описании некото-
рых наиболее распространенных у многоклеточных типов рецепторных
аппаратов. Более полная характеристика рецепторов в широком сравни-
тельном аспекте дана в монографии Я. А. Винникова (Винников, 1971).
В этой книге подробно освещена и основная современная литература.
Все концевые нервные чувствительные аппараты можно разделить на
две большие группы — свободные нервные окончания (терминальные
разветвления дендритов) и специальные рецепторные приборы, или ре-
цепторы. Принципиальное различие между этими двумя типами чув-
ствительных аппаратов заключается в отсутствии специализации чув-
ствительных терминальных разветвлений на восприятие определенного
химического или физического факторов и, наоборот, в наличии строгой
специфичности в этом отношении рецепторных приборов и рецепторов.
Все рецепторы у многоклеточных животпых можно разделить в био-
логическом плане па две большие группы: иптерорецепторы и экстеро-
рецепторы. Последняя более многочисленная и разнообразная группа
рецепторов обеспечивает поступление информации в нервную систему из
внешней для организма среды путем непосредственного воздействия на
рецепторные приборы факторов внешней среды.
Интерорецепторы служат для восприятия специфических раздраже-
ний из внутренней среды организма, с его клеточных элементов или меж-
клеточных структур. В качестве примера иптерорецепторов рассмотрим
лишь одну из разновидностей инкапсулированных окончаний, так назы-
ваемое фатер-пачиниево тельце млекопитающих (рис. 140).
Структура фатер-пачиниевого тельца и функциональное значение его
отдельных компонентов изучены в настоящее время весьма обстоятельно
(см. обзор: Отелин и др., 1976).
В образовании фатер-пачиниевого тельца принимают участие терми-
нальные разветвления дендрита чувствительной нервной клетки, специа-
лизированные фиброциты, система коллагеновых волокон и видоизменен-
ные глиальные клетки. Наружная часть капсулы образована продольно
ориентированными фиброцитами и системой коллагеновых волокон спи-
рально расположенных вокруг длинной оси капсулы. Коллагеновые во-
локна фиксируются в основании тельца, что обеспечивает определенные
смещения наружной капсулы по отношению к внутренней части инкап-
сулированного окончания. Последняя представлена разветвлениями ден-
дритов чувствительных клеток в студенистом аморфном веществе (так
называемая внутренняя колба) и системой глиальных клеток.
В концевых разветвлениях дендритов удается обнаружить большое
количество митохондрий. На дендритах чувствительной клетки спиналь-
ного ганглия обнаружены синаптические контакты с терминалями аксо-
нов, либо эффекторных клеток вегетативной нервной системы, либо
вторичночувствующих клеток глиального происхождения. В пользу послед-
него предположения говорит наличие у клеточных элементов, располо-
женных па границе наружной капсулы и внутренней колбы, антенных
структур в виде видоизмененных респичек и микроворсипок. Возможно,
что восприятие механического раздражения и трансляция его в нервный
импульс происходят в этих клетках при смещении наружной капсулы
по отношению к внутренней колбе. Эти клетки, однако, могут выполнять
и иную функцию, а генерация нервного импульса в таком случае проис-
ходит в результате непосредственной деформации дендритных разветв-
лений рецепторной клетки спинальных ганглиев.
Наиболее рациональной классификацией экстерорецепторов является
классификация, в основу которой положен функциональный принцип, по-
330
зволяющий отнести большую часть экстерорецепторов к двум большим
группам — мехапорецепторам и хеморецепторам. К первой группе отно-
сятся концевые нервные аппараты, генерация импульсов в которых осно-
вана на механическом воздействии раздражителей па рецепторные при-
боры. Деятельность второй, не менее широко представленной группы —
хеморецепторов — основана на химическом взаимодействии раздражителя
с рецепторными аппаратами плазматических мембран. Особую и очень
важную разновидность экстерорецепторов составляют фоторецепторы,
где раздражителем являются фотоны световой энергии.
Помимо такой функциональной классификации, существует еще и
общебиологическая классификация экстерорецепторов на контактные
Рис. 140. Схема строения инкапсулированного интерорецептора — тельца Фатер—
Пачини. (По: Отелин и др., 1976).
1 — слоистая капсула, 2 — внутренняя колба, 3 — дендрит чувствительной нервной клетки, 4 —
спиральные коллагеновые волокна, 5 — фиброциты, 6 — вторичночувствующие клетки с реснич-
ками, 7 — синаптические контакты аксонов вторичночувствующих клеток с дендритами чувствитель-
ной нервной клетки.
п дистантные рецепторы. Последние позволяют животному ориентиро-
ваться в пространстве, не вступая в непосредственный контакт с источ-
ником раздражения. Очевидно, что дистантные рецепторы, к которым
относятся органы зрения, обоняния, слуха и гравитации, представляют
собой в общебиологическом смысле чрезвычайно важную группу рецеп-
торов. Их морфобиохимическая организация достигает у прогрессивно
эволюционирующих групп животных наибольшей сложности и совер-
шенства.
Наиболее простым примером механорецепторов могут служить чув-
ствительные волоски насекомых (рис. 141). Они имеют вид кутикуляр-
ных конусов, подвижно сочлененных с кутикулярной пластинкой кож-
ного покрова. Кутикула волоска и кутикула подвижных сочленений обра-
зуется особыми обычпо немногочисленными клетками гиподермы. Внутрь
полости кутикулярного волоска заходит специализированный дендрит
биполярной чувствительной клетки. Ее тело располагается обычпо в са-
мой гиподерме. При смещении гиподермального аппарата чувствитель-
ных волосков происходит деформация дендрита чувствительной нервной
клетки. В процессе такой деформации и возникает нервный импульс,
т. е. механическая энергия смещения волоска трансформируется в элек-
трическую энергию нервного импульса.
331
Примерами более сложно устроенных мехапорецепторов многоклеточ-
ных животных могут служить их органы гравитации. Эти органы в про-
цессе эволюции независимо возникли у разных групп многоклеточных
животных и совершенствовались в пределах каждой систематической
группы.
Рис. 141. Схема механорецепторного волоскового органа насекомых. (В. П. Иванов,
ориг.).
1 — кутикулярный волосок, 2 — кутикула, 3 — кутикулярная трубочка, фиксирующая ресничку,
4 — ресничка, 5 — периферический отросток, 6 — тело и 7 — центральный отросток чувствительной
клетки, 8 — базальная мембрана.
Несмотря на это, рецепторы гравитации у подавляющего большин-
ства многоклеточных животпых строятся по одной и той же схеме. В лю-
бом органе гравитации обязательно имеется так называемая «пробная
масса», массивное внеклеточное образование, способное перемещаться
при изменении положения организма в гравитационном поле. Вторым
основным компонентом органа гравитации является чувствительная ан-
тенна, представленная видоизмененными жгутиками или микроворсин-
ками. И наконец, третий элемент — генерирующая нервный импульс
нервная или особая чувствительная клетка. Эта система в процессе эво-
люции претерпевает большие усложнения, благодаря чему высшие мно-
332
гоклеточные животные получают возможность не только ориентироваться
в отношении статического гравитационного поля, но и анализировать
угловые ускорения при перемещении тела в пространстве. Способность
к такого рода рецепции достигается за счет усложнения у высших жи-
вотных всех трех основных компонентов органа гравитации и появления
ряда вспомогательных структур.
Особой сложности орган гравитации достигает у высших позвоночных,
ракообразных и головоногих моллюсков. У млекопитающих орган равно-
весия входит в состав вну-
треннего уха и представлен
частью перепончатого лаби-
ринта. Это часть лабиринта
состоит из двух связанных
между собой мешочков с
тремя полукружными кана-
лами, расположенными в
трех взаимно перпендикуляр-
ных плоскостях (рис. 142).
Все эти части перепончатого
лабиринта залегают в кост-
ных полостях и окружены
перилимфой. Мешочки сооб-
Рис. 142. Общий вид перепонча-
того лабиринта млекопитающих.
1—3 — передний, задний и горизон-
тальный (латеральный) полукружные
каналы, 4, 5 — слуховые пятна (4 —
утрикулярная макула, 5 — саккуляр-
ная макула), 6 — улитка.
Рис. 143. Схематическое изображение клеток I
и II типов в рецепторных структурах лабиринта
позвоночных (из: Винников, 1971).
I — рецепторная клетка первого типа, II — рецептор-
ная клетка второго типа. 1 — чувствительные волоски,
2 — ядро, 3 — аппарат Гольджи, 4 — митохондрии,
5 — чашевидные и 6 — бутонообразные нервные оконча-
ния, 7 — миелинизированные нервные волокна, 8 —
шероховатая эндоплазматическая сеть.
щаются между собой при помощи узкого канала. Полукружные каналы
в области соединения с одним из мешочков имеют расширения, так назы-
ваемые ампулы. Внутри перепончатого лабиринта находится эндолимфа.
Стенка лабиринта изнутри выстлана однослойным эпителием, в котором
в определенных местах расположены вторичночувствующие клетки. В ме-
шочках это так называемые слуховые пятна, а в основании полукружных
каналов — слуховые гребешки. Здесь среди обычных цилиндрических или
призматических эпителиальных клеток имеются клетки, снабженные
чувствительными антеннами в виде одной длинной видоизмененной
реснички и пучка (60—80) микроворсинок. Они погружены в пробную
массу, имеющую в области слуховых пятен уплощенную, а в области
слуховых гребешков конусовидную форму (рис. 143). Чувствительные
клетки и в слуховых пятнах и в слуховых гребешках бывают двух типов.
333
Клетки первого типа погружены в особое чашевидное расширение конце-
вого разветвления дендрита чувствительной нервной клетки. У филогене-
тически более древних клеток второго типа связь с дендритами чувстви-
тельных нервных клеток менее специализирована. Оба типа клеток харак-
теризуются наличием мембран шероховатой эндоплазматической сети,
обилием митохондрий и развитым аппаратом Гольджи. Опи обнаруживают
высокую метаболическую активность. В области волосковых чувствитель-
ных клеток при цитохимических исследованиях удается выявить высокую
активность ацетилхолинэстеразы, т. е. здесь имеются химические синапсы,
пресинаптической частью которых являются определенные участки тела
чувствительной клетки.
Чувствительные клетки слуховых пятен генерируют импульс в ре-
зультате раздражения антенного аппарата при изменении положения тела
в пространстве, а также при вибрационных воздействиях. Антенный ап-
парат чувствительных клеток слуховых гребешков раздражается в резуль-
тате инерционного запаздывания смещения пробной массы при быстром
повороте головы или ускоренном угловом вращении тела в пространстве.
У некоторых головоногих моллюсков (осьминога), так же как и
у позвоночных животных, видоизмененный и сложно устроенный напол-
ненный эндолимфой статоцист находится в полости, заполненной пери-
лимфой. У других головоногих моллюсков (кальмары) перилимфатиче-
ское пространство может отсутствовать — в стенке органа гравитации
имеются многочисленные выросты, обеспечивающие весьма сложные токи
эндолимфы при перемещении животного в пространстве. Как и у позво-
ночных животных, рецепторными аппаратами у головоногих моллюсков
являются слуховые пятна и слуховые гребешки, или кристы. Последние
также располагаются в трех взаимно перпендикулярных направлениях.
У позвоночных две кристы имеют вертикальное и одна горизонтальное
положение, а у головоногих моллюсков две горизонтальные и одна вер-
тикальная кристы. Чувствительные клетки, как и у многих других групп
беспозвоночных животных, у головоногих моллюсков являются видоиз-
мененными нейронами. Однако морфобиохимическая дифференцировка
и антенного аппарата и тела клетки весьма сходна с дифференцировкой
вторичночувствующих эпителиальных клеток у позвоночных животных
(рис. 144). Дендриты первичночувствующих клеток органа гравитации
головоногих моллюсков представляют собой микроворсинки и видоизме-
ненные реснички. Количество последних, однако, значительно большее,
чем у позвоночных животных. Характерным для чувствительных нерв-
ных клеток головоногих моллюсков является обилие эфферентной их
иннервации, что свидетельствует о наличии контроля за их деятельностью
со стороны центральной нервной системы. Что касается взаимоотношений
чувствительных клеток с пробной массой слуховых пятен и гребешков,
а также функционального значения этих структур, то они в принципе
аналогичны тем отношениям, которые наблюдаются в органе равнове-
сия у позвоночных животных. Слуховые пятна, как и у позвоночных жи-
вотных, являются органами гравитации, а кристы представляют собой
рецепторы угловых ускорений. Кроме того, и те и другие рецепторы
весьма чувствительны к вибрации.
Таким образом, на примере органа гравитации головоногих моллюсков
и позвоночных животных мы видим, как далеко могут заходить черты
сходства аналогичных структур на субклеточном, тканевом и даже ор-
ганном уровнях организации у животных, весьма удаленных в филогене-
тическом отношении. Вместе с тем в одних случаях (первичноротые жи-
вотные) мы имеем дело с видоизмененными нейронами, а в других
случаях (позвоночные) с видоизмененными вторичночувствующими эпите-
лиальными клетками. Интересно отметить, что вторичночувствующие эпи-
телиальные клетки обнаружены недавно в органах гравитации у таких
относительно низкоорганизованных животных, как гребневики.
334
Широкое распространение аналогичных дифференцировок, особенно
на субклеточном уровне организации органов равновесия, наблюдается и
у других животных. Наряду с этим у некоторых групп животных, как па-
пример у насекомых, универсальный для большинства многоклеточных
животных принцип организации органа гравитации па основе более или
менее видоизмененного статоциста полностью утрачивается и заменяется
другими механизмами.
Относительно конкретных молекулярных механизмов, лежащих
в основе одной из основных функций механорецепторов — преобразова-
ния механических раздражений концевых аппаратов в нервный импульс,
в настоящее время нет единого мнения.
Широко распространено представление о том, что такое преобразова-
ние совершается путем деполяризации специализированных мембран
в области антенного аппарата первично- или вторичночувствующих кле-
ток и не требует больших затрат энергии чувствительной клеткой. Однако
для передачи нервного импульса необходимо значительное усиление этого
процесса, на что рецепторной клеткой и затрачивается большое количе-
ство энергии. Действительно, во всех исследованных плазматических
мембранах специализированных механорецепторов установлено резкое
увеличение АТФазной активности по сравнению с АТФазной активностью
обычных клеток. Как указывалось выше, одной из характерных особен-
ностей чувствительных клеток является обилие митохондрий — основного
и наиболее экономичного поставщика запасов АТФ в клетке. В связи
с этим имеется весьма обоснованное предположение о том, что наиболее
важным механизмом, лежащим в основе сложной цепи процессов, об-
условливающих генерацию нервного импульса в рецепторе, является ме-
ханизм взаимодействия между вмонтированным в мембрану высокомоле-
кулярным белком, обладающим АТФазной активностью и молекулой АТФ.
Некоторые авторы (Dunkan, 1967) предполагают даже, что сама депо-
ляризация мембран происходит на основе этого механизма. По мнению
этого автора, при механическом воздействии на мембрану происходит
сближение АТФ и АТФазного центра такой молекулы, в результате чего
освобождается энергия, обеспечивающая деполяризацию мембраны.
Иными словами, здесь имеет место тот же в принципе молекулярный ме-
ханизм, который лежит в основе взаимодействия миозина и актина в про-
цессах мышечного сокращения.
Другие исследователи (Винников, 1971), не отрицая в принципе важ-
ную роль этих молекулярных механизмов в процессах генерации и рас-
пространения импульса, считают тем не менее, что сама рецепция осуще-
ствляется при помощи прежде всего особых специфических для каждого
типа рецепторов белковых молекул, вмонтированных в мембрану. Эти
белки не обладают ферментативной активностью, но способны менять свою
структуру при действии специфического раздражителя. Как мы увидим
ниже, существование таких молекул доказано в мембранах хеморецепто-
ров. Они имеются также и в постсинаптической мембране в нервных и
нервно-мышечных синапсах.
Хеморецепторы составляют вторую основную группу экстерорецепто-
ров многоклеточных организмов. Несмотря на то что молекулярные меха-
низмы хеморецепции достаточно универсальны, строение основных вос-
принимающих клеток и вспомогательных элементов весьма разнообразно
и у одного организма, и у представителей различных групп многоклеточ-
ных животных.
К типичным хемоэкстерорецепторам относятся органы вкуса и обоня-
ния. Они у высших организмов достигают весьма сложной структурной
организации. В основе восприятия раздражения и кодирования его
в нервный импульс в контактном хеморецепторе органа вкуса и дистант-
ном рецепторе органов обоняния лежит один и тот же механизм. Он в ко-
нечном счете заключается во взаимодействии молекул различных веществ
335
a
Рис. 144. Схема организации органа гравитации головоногих моллюсков. (Из: Вин-
ников, 1971).
а — слуховые пятна (макула), б — слуховые гребешки. 1 — оттолитовая мембрана, 2 — киноцилии
(реснички), 3 — микроворсинки, 4 — рецепторные клетки, 5 — афферентные нервные окончания,
6 — опорные клетки, 7 — униполярные нервные клетки, 8 — аксон, 9 — базальная мембрана, 10 —
слой нервных волокон, 11 — купула кристы («пробная масса»).
со специфическими белковыми молекулами, вмонтированными в специа-
лизированные мембраны соответствующих первично- или вторичночувст-
вующих клеток. В качестве примеров хеморецепторов мы дадим краткую
характеристику органов вкуса и обоняния высших многоклеточных жи-
вотных — позвоночных и насекомых.
Рис. 144 (продолжение).
Непосредственное восприятие раздражения специфическими молеку-
лами в органах вкуса и обоняния осуществляется либо специализирован-
ными дендритами видоизмененных чувствительных нейронов, либо ан-
тенным аппаратом вторичночувствующих клеток. Последние у млекопи-
тающих сосредоточены в основном в многослойном эпителии дорсальной
стенки языка, в так называемых вкусовых луковицах (рис. 145). Каждая
22 А. Л. Заварзин 337
Рис. 145. Схема вкусовой луковицы млекопитающих. (По электронным микрофотогра-
фиям: Murray, Murray, 1967, рис. С. А. Быстрова).
1 — вкусовая пора, 2 — вкусовая ямка, 3 — светлая клетка, 4 — темная клетка, 5 —нервное окон-
чание, 6 — пограничная мембрана между вкусовой луковицей и эпителием, 7 — эпителиальные
клетки. Внизу слева — схема синапса в области основания темной клетки вкусовой луковицы.
вкусовая луковица представляет собой сложно организованную систему
вторичночувствующих и вспомогательных опорных эпителиальных кле-
ток. Последние расположены в толще эпителиального пласта, при этом
на периферии луковицы находятся преимущественно опорные (светлые),
а в центре чувствительные (темные) клетки. На вершине луковицы име-
ется пора, через которую апикальные отростки чувствительных клеток
контактируют с секретом желез ротовой полости, с растворенными в нем
Рис. 146. Схема вершины вкусовой луковицы млекопитающих. (Рис. М. 10. Пунина).
1 — рецепторные клетки, 2 — вкусовая кисточка с микроворсинками, 3 — олсктроннонлотное ве-
щество между кисточками.
специфическими молекулами. Апикальные отростки вкусовых чувстви-
тельных клеток имеют вид своеобразных кисточек (рис. 146). Они пред-
ставляют собой специализированные конусовидные участки цитоплазмы,
на конце которых сосредоточены многочисленные и хорошо развитые мпкро-
ворсинки. В апикальной части цитоплазмы и микроворсинках обнару-
живается большое количество микротрубочек и фибриллярных структур,
которые оказываются связанными с клеточным центром. В цитоплазме
клеток удается выявить многочисленные митохондрии, элементы аппарата
Гольджи, эндоплазматическую сеть и лизосомный аппарат. В местах кон-
такта темных клеток с терминальными разветвлениями дендритов чув-
ствительных нервных клеток плазматическая мембрана и прилегающая
цитоплазма вкусовых клеток формируют характерные пресипаптпческие
участки.
22*
339
Таким образом, воспринимающие вкусовые раздражения клетки пред-
ставляют собой весьма сложные по своей морфобиохимической организа-
ции специализированные клеточные элементы. Еще одной интересной
особенностью этих клеток является их относительно непродолжительный
жизненный цикл. По данным Бейдлера и Смолмена (Beidler, Smallman,
1965), вкусовая клетка функционирует всего 3—5 суток, т. е. система
вкусовых и опорных клеток органов вкуса построена по принципу энер-
гично обновляющихся клеточных популяций. При этом источником по-
полнения являются специальные участки общей камбиальной системы
многослойного плоского эпителия. У других позвоночных животных
органы вкуса построены принципиально сходно с их строением у млеко-
питающих.
У беспозвоночных, и в частности хорошо изученных в этом отноше-
нии насекомых, восприятие вкусового раздражения осуществляется не
вторичночувствующими клетками, а специализированными дендритами
чувствительных нервных клеток (рис. 147). Тела последних сосредото-
чены обычно в виде небольших скоплений среди клеток кутикулярного
эпителия. Дендрит чувствительной вкусовой клетки состоит из двух ча-
стей. Нижняя часть (сегмент), расположенная ближе к телу клетки, так
называемый проксимальный сегмент, представляет собой участок цито-
плазмы нервной клетки с рибосомами и митохондриями. Верхний, или ди-
стальный, сегмент является видоизмененной ресничкой. Дистальный сег-
мент заходит в полость специального конусовидного выроста кутикуляр-
ной пластинки, имеющего на вершине отверстие, где апикальная часть
дистального сегмента вступает в непосредственный контакт с внешней
средой.
Крупным достижением в изучении молекулярных механизмов хемо-
рецепторов органа вкуса было открытие специфических белковых молекул,
способных менять свою структуру при воздействиях веществ, вызы-
вающих обычно ощущение горького и сладкого вкуса. Местом локализа-
ции таких белков являются, по-видимому, плазматические мембраны мик-
роворсинок вторичночувствующих клеток и апикальной части дисталь-
ных сегментов дендритов чувствительных нервных клеток у насекомых.
Хеморецепторы органа обоняния и у позвоночных и у беспозвоночных
животных представлены чувствительными нервными клетками, т. е. не-
посредственное восприятие раздражения пахучих молекул производится
специализированными дендритами этих клеток. У млекопитающих и дру-
гих позвоночных животных они имеют вид палочко- или колбообразных
структур, заканчивающихся на дистальном конце специализированными
подвижными утолщениями — обонятельными булавами (рис. 148). По-
следние могут выдвигаться над поверхностью или, наоборот, втягиваться
в толщу эпителиального пласта, образованного опорными и секреторными
вспомогательными клетками. Булавы на своей поверхности имеют чув-
ствительные волоски, или антенны, длиной до 200 мкм. Они, в свою
очередь, представляют собой подвижные образования, построенные по ти-
пичному плану строения реснички или жгутика. Однако характер движе-
ния этих структур резко отличается от характера движения обычных рес-
ничек.
Совокупность имеющихся данных показывает, что основным местом
взаимодействия пахучих молекул с плазаматической мембраной обоня-
тельных чувствительных клеток являются мембраны антенн — преобра-
зованных жгутиков, подвижность которых способствует более совершен-
ному контакту пахучих молекул с плазматической мембраной.
Тело обонятельной клетки содержит обычные общие для всех клеток
органоиды. От ее базальной части отходит центральный отросток — аксон,
образующий характерные терминальные разветвления в виде клубочков
в обонятельных долях головного мозга. Интересные данные получены не-
давно относительно возможности возникновения и обновления рецептор-
340
Рис. 147. Схема строения вкусовой сенсиллы насекомых. (Из: Иванов, 1969).
1 — рецепторная клетка, 2 — центральный отросток, з — проксимальный и 4 — дистальный сег-
менты периферического отростка, 5 — кутикулярный конус, 6 — базальная мембрана.
ных клеток за счет размножения базальных клеток обонятельного эпите-
лия у взрослых лягушек (Graziadei, 1973).
У насекомых, как и у позвоночных животных, чувствительные обоня-
тельные клетки представляют собой специализированные биполярные
Рис. 148. Схема строения обонятельного эпителия млекопитающих. (Из: Бронштейн,
1972).
1 — рецепторная клетка, 2 — обонятельная булава, 3 — обонятельные волоски, 4 — аксон, 5 —
опорная клетка, 6 — базальная мембрана.
нейроны (рис. 149). Цитоплазма этих клеток отличается необыкновенным
богатством органоидов. Здесь имеется хорошо развитая эндоплазматиче-
ская сеть, элементы аппарата Гольджи, мультивезикулярные тельца, ли-
зосомы и другие образования. Периферический отросток имеет сложное
342
строение. On состоит из двух сегментов. На границе между ними распо-
ложено базальное тельце, от которого в наружный сегмент распространя-
ется трубочковый аппарат жгутика, а во внутренний корневые поперечно-
Рис. 149. Схема строения обонятельной сенсиллы насекомых. (Из: Иванов, 1966).
Z — рецепторная клетка, 2 — проксимальный сегмент, 3 — дистальный сегмент периферического
отростка, 4 — центральный отросток, 5 — кутикулярная дисковидная пластинка с порами, 6 —’
базальная мембрана, 7 — кутикула.
исчерченные нити. Наружный сегмент проникает в полость специализи-
рованного участка кутикулярной пластинки, где и дает терминальные
разветвления. В этом месте в специализированной кутикуле имеется
сложно устроенная система пор, с которыми контактируют концевые раз-
343
ветвления апикального конца дистального сегмента дендрита обонятель-
ной нервной клетки.
Относительно молекулярных механизмов рецепции в органах обоня-
ния дело обстоит сложнее, чем с органами вкуса. В настоящее время
ясно, особенно при сопоставлении всего сравнительно-цитологического ма-
териала, что первый этап взаимодействия молекул пахучих веществ
с плазматической мембраной обонятельных клеток происходит в области
плазматической мембраны антенного аппарата, т. е. в микроворсинках
у позвоночных и на терминальных резветвлениях дендритов в области
пор у насекомых. Есть мнение, что сущность этого взаимодействия за-
ключается в специфическом влиянии энергии внутримолекулярной вибра-
ции на каратиноиды или другие пигменты, вмонтированные в плазмати-
ческую мембрану этих структур.
Получила распространение гипотеза о том, что принцип взаимодей-
ствия здесь аналогичен взаимодействию в хеморецепторах органа вкуса,
т. е. осуществляется путем действия молекул веществ на специфические
обонятельные белки, закономерно расположенные в определенных уча-
стках плазматической мембраны. Независимо от решения этого вопроса
ясно, что суть генерации нервного импульса в обонятельных клетках за-
ключается в первичной деполяризации специализированных мембран
в результате их взаимодействия с пахучими молекулами. Громадное зна-
чение имеет здесь, как и в других рецепторных клетках, сложная цепь
внутриклеточных биохимических процессов с затратой большого количе-
ства энергии, для непрерывного пополнения запасов которой все рецеп-
торные клетки обладают мощно развитым энергетическим аппаратом.
Фоторецепторы у всех многоклеточных животных представляют собой
первичночувствующие нервные клетки с весьма сложно устроенными
специализированными дендритами. У позвоночных животных это так на-
зываемые палочки и колбочки (рис. 150). Они состоят из наружного и
внутреннего сегментов, разделенных узкой перетяжкой, в которой распо-
лагается сильно редуцированный аппарат микротрубочек ресничек и ба-
зальное тельце. Во внутреннем сегменте у палочек сосредоточено боль-
шое количество митохондрий в виде плотного скопления. В колбоч-
ках, кроме того, имеется еще и маслянистая капля, которая у некоторых
позвоночных может быть окрашена каратиноидами в красный, желтый и
желто-зеленый цвет. В базальной части внутреннего сегмента дендрита
палочек и колбочек на границе с телом клетки иногда располагаются
скопления структурированных гранул гликогена — основного субстрата
для энергетического метаболизма клеток.
В теле фоторецепторных клеток относительно хорошо развита грану-
лярная эндоплазматическая сеть, имеются также и свободные рибосомы.
В надъядерной области сосредоточен компактный, но хорошо развитый
аппарат Гольджи. Особенностью тела клеток является полное отсутствие
здесь митохондрий, поскольку весь энергетический аппарат сосредоточен
во внутреннем сегменте. Единичные митохондрии наблюдаются лишь
в пресинаптической области короткого аксона.
Наиболее характерной специфической структурой фоторецепторных
клеток позвоночных животных является мембранный аппарат наружного
сегмента. Последний заполнен плотно упакованными дисками, представ-
ляющими собой погруженные внутрь цитоплазмы клетки складки плазма-
тической мембраны. В палочках основная часть наружного сегмента по-
строена из таких мембранных дисков, утративших структурную связь
с плазматической мембраной. Лишь в базальной части наружного сег-
мента эта связь сохраняется и диски образованы складками плазматиче-
ской мембраны. В колбочках связь между плазматической мембраной и
дисками наружного сегмента наблюдается на всем его протяжении. Си-
стема мембранных дисков палочек представляет собой весьма динамично
и полярно обновляющуюся структуру (Young, Droz, 1968). В авторадио-
344
Рис. 150. Схема организации фоторецепторов позвоночных животных. (Из: Nilsson
1964).
I — палочки, II — колбочки. 1 — наружный сегмент, 2 — внутренний сегмент, 3 — скопление
митохондрий (эллипсоид), 4 — отросток клетки пигментного эпителия, 5 — ядро, 6 — синаптиче-
ская зона, 7 — масляная капля.
графических опытах с мечеными аминокислотами удалось показать, что
в клетках-палочках на их рибосомном аппарате имеет место интенсивный
белковый синтез. Значительная часть вновь синтезируемого белка посту-
пает в основание наружного сегмента, где используется на построение но-
вых дисков (рис. 151). Интенсивность таких процессов даже у амфибий
настолько велика, что за сутки образуется от 25 до 36 дисков. Такое же
количество дисков за это время утрачивается клетками на апикальной
поверхности наружного сегмента, по-видимому, путем фагоцитоза вспомо-
гательными пигментными клетками. В колбочках не обнаружено такого
поляризованного обновления мембранных структур. Включение меченого
Рис. 151. Схема синтеза белка в клетке-палочке лягушки. (Из: Young, Droz, 1968).
а — схема организации клетки-палочки, б — распределение меченого белка через 10 мин. после
инъекции 8Н-лейцина (преимущественное распределение метки над эндоплазматической сетью),
в — внутриклеточное перемещение белков, синтезированных на рибосомах эндоплазматической сети
(светлые стрелки показывают перемещение белков в аппарат Гольджи, темные — в базальные диски,
ядро и аксон), г — распределение меченого белка через 8 часов после инъекции (в базальных дисках
меченого белка в 20 раз больше, чем в эргастоплазме). 1 — наружный сегмент, 2 — митохондрии,
3 — эргастоплазма, 4 — аппарат Гольджи, 5 — ядро, 6 — синаптическая зона.
белка здесь происходит равномерно во все складки плазматической
мембраны наружного сегмента. Мембраны дисков наружных сегмен-
тов фоторецепторных клеток имеют глобулярную структуру. Основную
часть белкового компонента этих мембран составляют специфические
белки опсины, которые могут образовывать слабые легко разрушаемые
на свету связи с ретиненом — производным каротинов, синтезируемых
растительными клетками и поступающих в животный организм с пищей.
Ретинен является важнейшим структурным компонентом мембран дисков.
При отсутствии каротинов у позвоночных не происходит формирование
мембранных структур дисков.
Процесс разложения родопсина на свету и ресинтеза его в темноте,
протекающий непрерывно в мембранных структурах дисков, и лежит
в основе специфической фоторецепции чувствительными клетками орга-
нов зрения.
Относительно конкретных молекулярных механизмов генерации нерв-
ного импульса фоторецепторной клеткой на основе реакции разложения
зрительного пигмента родопсина нет единого мнения. Имеется представ-
ление о том, что родопсин является проферментом и его активация осу-
346
ществляется взаимодействием с фотонами световой энергии. Механизм
усиления нервной активности связан с АТФазной активностью самого
родопсина или находящимся с ним в комплексной связи особым белком,
обладающим АТФазной активностью (Островский и др., 1967; Dunkan,
1967).
Вторая, физико-химическая гипотеза исходит из предположения о том,
что наружный сегмент имеет кристаллический характер своих мембран-
ных структур. Распространение возбужденного фотоном состояния моле-
кулы родопсина в таких структурах может передаваться на соседние мо-
лекулы без дальнейших воздействий света. Третья ионная гипотеза фото-
рецепции предполагает, что в основе генерации нервного импульса лежит
изменение проницаемости мембран. Последняя определяется либо реак-
циями между фосфолипидами мембран и освобождающимся на свету ре-
тиненом, либо специфическими изменениями при реакции фотолиза ро-
допсина четвертичной структуры опсина, составляющего значительную
часть структурного белка мембран.
Независимо от справедливости всех этих точек зрения, в той или иной
мере имеющих фактическое обоснование, в настоящее время ясно, что,
как и в других рецепторах, этот процесс нельзя свести к одним измене-
ниям в специализированных мембранах. В нем несомненно принимает
участие вся клетка, представляющая собой весьма сложную и специфиче-
скую по своей морфобиохимической организации целостную систему.
В справедливости такого рода заключения убеждают нас приведенные
уже выше факты относительно морфобиохимической организации рецеп-
торных клеток. Весьма убедительными аргументами являются также мно-
гочисленные цитофизиологические данные. Они показали наличие суще-
ственных структурных изменений в мембранах дисков возбужденных и
покоящихся фоторецепторов. Обнаружены также характерные механохи-
мические процессы, связанные с укорочением или удлинением наружных
сегментов фоторецепторов в различных их функциональных состояниях.
Существенные сдвиги удается обнаружить в концентрации ионов, ак-
тивности ферментов трансмембранного транспорта и синтеза РНК и
белка в условиях различной функциональной нагрузки на фоторецептор-
ные клетки. Более подробно современное состояние проблемы освещено
в специальном обзоре (Goldsmith, 1975).
Сравнительно-цитологический анализ морфобиохимической организа-
ции фоторецепторных клеток современных многоклеточных животпых по-
казывает многообразие конкретных структурных механизмов реализации
этой функции у разных групп животных. Наряду с этим обнаруживаются
и общие типовые закономерности морфобиохимической организации, за
пределы которых живая материя не выходит, несмотря на длительный и
многообразный путь филогенетической дифференцировки фоторецепторов
у отдельных групп многоклеточных животных.
Одной из таких типовых закономерностей является отмеченное уже
выше происхождение фоторецепторных элементов из нервных клеток.
У подавляющего большинства многоклеточных животных фоторецептор-
ные клетки имеют специализированный дендрит и типичный аксон. Лишь
у высших ракообразных фоторецепция осуществляется непосредственно
лишенными аксонов ретинальными клетками, возбуждение которых пу-
тем электротонической передачи переходит на одну эксцентричную
клетку с типичным аксоном (Smith, Baumann, 1969).
Видоизмененные дендриты фоторецепторных клеток могут формиро-
ваться либо на основе жгутикового трубчатого аппарата, как у позвоноч-
ных животных, либо на основе обычного дендрита, не содержащего орга-
низованных трубчатых структур. Такие не жгутиковые фоторецепторные
антенны характерны для высших первичноротых, и в частности для на-
секомых и головоногих моллюсков. Однако и среди первичноротых есть
группы животных (некоторые полихеты, пластинчатожаберные мол-
347
люски), в основе организации фоторецепторов которых лежит редуциро-
ванный жгутиковый аппарат.
Для всех фоторецепторов характерной является отмеченная уже выше
для позвоночных гипертрофия специали-
зированного мембранного аппарата. Од-
нако для первичноротых и особенно их
высших представителей, насекомых и го-
ловоногих моллюсков, характерен другой
по сравнению с позвоночными животными
механизм такой гипертрофии. У насеко-
мых на боковой поверхности фоторецеп-
торной клетки образуется система длин-
ных, расположенных перпендикулярно
к телу фоторецепторной клетки и направ-
Рис. 152. Схема организации рети-
нальной клетки насекомых. (По:
Грибакин, 1969, с изменениями).
1 — микроворсинки, 2 — ядро, 3 — мито-
хондрии, 4 — аппарат Гольджи, 5 — эндо-
плазматическая сеть, 6 —аксон, 7 — уча-
сток пигментной клетки, 8 — базальная
мембрана. Стрелкой указано направление
света.
Рис. 153. Схема организации фото-
рецепторной клетки головоногих
моллюсков. (Рис. М. Ю. Пунина).
1 — периферический отросток, 2 — тело
клетки, 3 — центральный отросток, 4 —
микроворсинки, 5 — гранулы пигмента.
лению света, микроворсинок, контактирующих с аналогичной системой
микроворсинок соседних фоторецепторных клеток (рис. 152). Таким обра-
зом, в фоторецепторах насекомых воспринимающий антенный аппарат и
348
метаболический центр клеток с хорошо развитым белоксинтезирующим и
энергетическими аппаратами оказываются пространственно менее разоб-
щенными, чем у позвоночных животных. Тем не менее в авторадиогра-
фических опытах удалось показать, что у насекомых, как и в палочках
позвоночных животных, имеет место поляризованное обновление аппарата
микроворсипок (Perrelet, 1972).
У головоногих моллюсков фоторецепторы внешне больше похожи на
фоторецепторы позвоночных животных (рис. 153). Их клетки-палочки со-
стоят из палочковидного воспринимающего периферического отростка,
тела клетки и центрального отростка аксона, т. е. имеют характерную би-
полярную структуру. Однако в периферическом отростке нет остатков
жгутиковых или ресничных структур, а гипертрофия мембран в палочко-
видном отростке достигается не путем врастания плазматической
мембраны внутрь цитоплазмы отростка, а, наоборот, как у насекомых,
образованием сложной системы многочисленных выростов цитоплазмы —
микроворсинок, расположенных перпендикулярно длинной оси палочко-
видного отростка.
Универсальной закономерностью морфобиохимической организации
фоторецепторов многоклеточных животных является сходный химиче-
ский состав и сходная молекулярная организация гипертрофированного
мембранного аппарата. У всех изученных представителей многоклеточ-
ных животных основными белковыми компонентами мембран дисков или
системы микроворсипок являются белки опсины, а в основе рецепции
света лежит фотолиз и обратное восстановление родопсина.
Таким образом, использование каротинов растительного происхожде-
ния в фоторецепции у многоклеточных животных является необходимым
условием структурной и биохимической организации фоторецепторов. Де-
тали фотолиза и ресинтеза родопсина могут варьировать у разных пред-
ставителей многоклеточных животных. Так, у головоногих моллюсков,
помимо родопсина, имеется еще и второй зрительный пигмент — ретино-
хром, который принимает участие в процессах ресинтеза родопсина в тем-
ноте. Сильно варьируют также и белки опсины и по величине молекул и
по последовательности аминокислот в них. У насекомых, например, мо-
лекулярный вес родопсина почти в 10 раз меньше, чем у позвоночных.
Соответствующие различия имеются и в диаметре молекул. В некоторых
отношениях филогенетическая дифференцировка фоторецепторов у насе-
комых оказывается более сложной, чем у высших позвоночных. Насеко-
мые способны различать плоскость поляризации света, они воспринимают
часть светового излучения в ультрафиолетовой области, наконец, у них
имеется отчетливая дифференцировка цветного зрения на клеточном
уровне, в то время как у позвоночных животных такая дифференцировка
имеет место лишь на молекулярном уровне организации мембраны.
Все эти непрерывно накапливающиеся сравнительнощитологические
и цитофизиологические данные показывают, что в организации фоторецеп-
торов, как и в случаях других специализированных структур, мы наблю-
даем глубокую аналогию, проявляющуюся в широком спектре структур-
ных и химических модификаций.
Краткая характеристика некоторых рецепторов многоклеточных жи-
вотных показывает, что, несмотря на все разнообразие их организации,
имеются общие, универсальные для всех рецепторов принципы такой
организации. Основной функциональной единицей любого рецептора, спе-
циализированного на адекватном восприятии и трансляции определен-
ного физического или химического фактора, является первичная или
вторичная чувствительная клетка. Несмотря на различные источники
развития этих клеток в онто- и филогенезе многоклеточных животных,
несмотря на их различную функциональную специализацию, все чув-
ствительные клетки имеют ряд общих признаков морфобиохимической
•организации. Их основной транслирующий и воспринимающий аппарат
349
формируется на основе двух широко распространенных клеточных струк-
тур — микроворсинок и ресничек. Много общего имеется, по-видимому, и
в организации энергетических и других метаболических систем клеток,
связанных с трансляцией и усилением траслируемого сигнала, а также
систем, обеспечивающих динамическое постоянство клеточной организа-
ции этих высокоспециализированных клеток.
Эти общие закономерности организации чувствительных клеток про-
являются в большом количестве модификаций, не выходящих, однако,
за рамки, характерные для всего типа чувствительных клеток, струк-
турных и биохимических ограничений. Определяющим моментом для
той или иной модификации является прежде всего функциональная
специализация клеток. Однако существенную роль играют здесь и такие
факторы, как особенности пограничных тканей, где расположены рецеп-
торы, история развития и происхождения последних, наконец, воздей-
ствие интегрирующих организменных факторов. Тем не менее в случае
рецепторных клеток и рецепторных аппаратов в целом мы имеем боль-
шое количество примеров удивительного параллелизма, сходных тенден-
ций филогенетической дифференцировки у далеко разошедшихся в фило-
генезе групп многоклеточных животных. Эти параллелизмы проявляются
на всех уровнях организации рецепторов, начиная с тонкой структуры
специализированных мембран антенного аппарата клеток и кончая сис-
темным уровнем организации органов гравитации и зрения у некоторых
первичиоротых беспозвоночных и позвоночных животных. Весьма ярким
примером проявления сходных тенденций к филогенетической дифферен-
цировке на системном уровне организации является также независимое
появление вторичночувствующих клеток в органе гравитации гребневи-
ков и позвоночных животных.
НЕЙРОГЛИЯ
Как было показано в предыдущих разделах, нервные клетки и обра-
зуемые ими специализированные рецепторные, эффекторные и синапти-
ческие структуры характеризуются целым рядом биологических особен-
ностей. К ним прежде всего относятся: необычные ядерно-плазменные
отношения, высокий уровень метаболической активности, большая функ-
циональная подвижность специфических структур на молекулярном п
надмолекулярном уровнях их организации. Естественно поэтому ожи-
дать, что такие специализированные клеточные элементы, какими явля-
ются нейроны, нуждаются для своего нормального функционирования
в особой внутренней среде, обладающей определенным постоянством со-
става и мощными трофическими, защитными и изолирующими механиз-
мами. Такую задачу и выполняет специальная вспомогательная ткань —
глия. Она возникает уже на ранних этапах эволюции нервной системы
и непрерывно совершенствуется во всех прогрессивно эволюционирую-
щих группах многоклеточных животных.
К сожалению, в настоящее время морфобиохимическая организация,
функциональное значение и степень филогенетической дифференцирован-
ности нейроглии в различных группах многоклеточных .животных изу-
чены крайне неравномерно. Наиболее полные данные имеются в отно-
шении нейроглии позвоночных (преимущественно млекопитающих) жи-
вотных (см. обзоры: Hyden, 1967; Певзнер, 1972; Питерс и др., 1972).
У беспозвоночных животных наиболее полно изучена система глиальных
клеточных элементов у брюхоногих и головоногих моллюсков (см. об-
зоры: Gray, 1969; Nicaise, 1973). Единичные современные исследования
имеются и по другим группам беспозвоночных животных (см. обзор:
Bullock, Horridge, 1965; Coggeshall, Fawcett, 1964; Kuffler, Nickoils, 1966;
Cohen, 1969; Holtzmann et al., 1970; Baskin, 1971, и др.).
350
Наиболее сложной и разнообразной дифференцировки достигает нейро-
глия у высших позвоночных животных. Эта вспомогательная ткань нерв-
ной системы имеет клеточное строение. По морфобиохимическим особен-
ностям все разновидности глиальных тканей у позвоночных можно с из-
вестными оговорками разделить на три большие категории: наиболее
древнюю эпендимную глию, астроцитарную глию и олигодендроглию. По-
мимо этих разновидностей собственно глиальной ткани, называемой мак-
роглией и происходящей из нервного зачатка, имеется еще и особая си-
стема фагоцитарных клеточных элементов, ведущих свое происхождение
от мезенхимы. Она получила название микроглии и представляет собой
особую разновидность гистиоцитарных клеток тканей внутренней среды.
В органах центральной нервной системы позвоночных основную массу
нейроглии составляют клетки астроцитарной глии. В ней удается выде-
Рис. 154. Астроцитарная глия. (По: Ham, 1957).
Справа — протоплазматический астроцит,
слева — фиброзный астроцит.
лить два типа клеток: фибриллярные и плазматические астроциты
(рис. 154). У плазматических астроцитов имеются слабоветвящиеся от-
ростки. В их цитоплазме относительно мало специализированных фиб-
риллярных структур. Более тонкие и сильно ветвящиеся отростки фиб-
риллярных астроцитов, наоборот, содержат большое количество фибрилл,
близких по своей природе к тонофибриллам в клетке многослойного кож-
ного эпителия (рис. 155). Помимо типичных астроцитов в некоторых
участках нервной системы позвоночных животных, например в сетчатке,
имеются гигантские клеточные глиальные элементы — мюллеровские во-
локна, играющие существенную роль в структурно-пространственной
организации нервных центров сетчатки. Более разнообразна и более ши-
роко распространена в нервной системе позвоночных вторая разновид-
ность нейроглии — олигодендроглия. Элементы олигодендроглии в орга-
нах центральной нервной системы представлены обычно относительно
мелкими отростчатыми клетками, расположенными, как правило, в не-
посредственном контакте с телами нервных клеток (рис. 156).
Значительно более многообразны клеточные элементы олигодендроглии
в периферических отделах нервной системы. В качестве одного из при-
меров периферической олигодендроглии можно привести мантийные
клетки. Они образуют непрерывный слой на поверхности тел псевдоуни-
полярных чувствительных нейронов спинальных ганглиев у позвоночных
(рис. 157). Кроме того, отростки нервных клеток на всем протяжении
также сопровождаются элементами олигодендроглии. Эта разновидность
глиальных клеток получила название шванновских клеток. В тонких без-
мякотных нервных волокнах взаимоотношения отростков нервных клеток
351
и швановских клеток относительно простые (рис. 158). Отросток нерв-
ной клетки оказывается погруженным в цитоплазму шванновской клетки.
Часто в цитоплазму одной шванновской клетки оказываются погружен-
Рис. 155. Схема ультраструктурного строения протоплазматического (а) и фиброз-
ного (б) астроцитов. (Рис. Д. К. Обухова).
I — ядро, 2 — пучки фибрилл, 3 — митохондрии, 4 — аппарат Гольджи, 5 — шероховатая эндо-
плазматическая сеть.
ными несколько отростков нервных клеток. В толстых мякотных нерв-
ных волокнах наблюдаются более сложные отношения (рис. 159). Во-
круг отростка нервной клетки образуется многослойная мембранная
структура, представляющая собой сложенную в несколько концентриче-
ских слоев плазматическую мембрану шванновской клетки. В некоторых
352
случаях одна шванновская клетка также может образовывать сложные
многослойные мембранные структуры вокруг нескольких отростков. В мес-
тах контакта отдельных шванновских клеток по длине отростка нервной
клетки имеются участки, свободные от миелиновой оболочки. Отросток
нервной клетки в таких участках изолирован от окружающих тканей
лишь цитоплазмой шванновской клетки и ее одинарными плазматиче-
скими мембранами. Эти участки получили название перехватов Ранвье
(рис. 160).
Как уже указывалось, основное назначение вспомогательной системы
глиальных элементов заключается в создании для нейронов и образуе-
мых ими специализированных структур и нервных центров постоянной
стабильной внутренней среды. Особенно ярко эта своеобразная трофиче-
ская в широком смысле этого слова функция глиальных клеток прояв-
Рис. 156. Олигодендроглия. (По: Наш, 1957; рис. Д. К. Обухова).
1 — олигодендроцит, 2 — отростки олигодендроцита, 3 — тело нервной клетки»
ляется при анализе характера взаимоотношений нервных клеток со стен-
кой сосудистых капилляров. Оказалось, что ни в одном участке централь-
ной и периферической нервной системы нет непосредственного контакта
плазматических мембран нервных клеток ни с капиллярами, ни с элемен-
тами рыхлой соединительной ткани (рис. 161). В связи с этим широкое
распространение получили представления о том, что трофические взаимо-
отношения между тканями внутренней среды и нервными клетками
у позвоночных животных осуществляются через цитоплазму глиальных
клеток. Прямая экспериментальная проверка этого предположения с по-
мощью маркерных веществ показала, однако, что эти вещества могут
распространяться по межклеточным пространствам, минуя цитоплазму
глиальных клеток. Характер функционального и биохимического взаимо-
действия между тканями внутренней среды, глией и нейронами, по-
видимому, значительно сложнее. Каждая разновидность глиальных кле-
ток осуществляет, вероятно, специфический, но разносторонний биоло-
гический контроль взаимоотношений между нервными клетками и
трофическими системами организма. Механизмы такого контроля доста-
точно разнообразны как по биологическому значению, так и по конкрет-
ным путям реализации.
В пользу наличия весьма сложных отношений между глиальными
и нервными клетками свидетельствуют упоминавшиеся уже выше дан-
ные Хидена и Ланга (Hyden, Lange, 1969) о присутствии в цитоплазме
глиальных клеток и ядрах нервных клеток особых фракций кислого белка
у животных, подвергавшихся длительному обучению. К этим же фактам
23 А. Л. Заварзин 353
Рис. 157. Схема взаимоотношения нервной клетки спинального ганглия с клеткой-
сателлитом. (По электронным микрофотографиям: Литерс и др., 1972,’рис.£Д. К. Обу-
хова)-
I — ядро клетки-сателлита, 2 — цитоплазма нейрона, 3 — выпячивания цитоплазмы, внедряющиеся
в клетку-сателлит, 4 — митохондрии, 5 — аппарат Гольджи. 6 — шероховатая эндоплазматическая
сеть, 7 — свободные рибосомы, 8 — базальная мембрана.
Рис. 158. Схема строения безмякотного нервного волокна. (По электронным микро-
фотографиям: Питерс и др., 1972, рис. М. Ю. Пунина).
Z— ядро и 2 — цитоплазма шванновской клетки, 3, 4 — аксоны нервных клеток, погруженные
в цитоплазму шванновской клетки (3 — полностью, 4 — частично), 5 — митохондрия, s — шерохова-
тая эндоплазматическая сеть, 7 — микротрубочки, 8 — коллагеновые волокна эндоневрия, 9 — ба
зальная мембрана, 10 — мезаксон.
II
Рис. 159. Схема строения и образования мякотных нервных волокон. (По электронным
микрофотографиям: Питерс и др., 1972; рис. М. Ю. Пунина).
I — ранняя стадия образования мякотной оболочки, II — более поздняя стадия, III — сформирован-
ная мякотная оболочка. 1 — аксон нервной клетки, 2 — ядро и 3 — цитоплазма шванновской клетки,
4 — мезаксон, 5 — миелиновая оболочка, 6 — митохондрия, 7 — базальная мембрана, 8 — колла-
геновые волокна эндоневрия.
Рис. 160. Схема ультраструктурной организации перехвата'Ранвье. (Рис. Д. К. Обу-
хова).
1 — аксон, 2 — цитоплазма отростков двух смежных шванновских клеток, 3 — миелиновая оболочка,
4 — участок истончения миелиновой оболочки, 5 — карманы, образованные истонченными и расши-
ренными пластинками миелина и заполненные цитоплазмой шванновской клетки, 6 — митохондрия,
7 — микротрубочки, 8 — нейрофиламенты.
относятся данные о быстром появлении вновь синтезированных белков
и РНК в терминальных разветвлениях длинных аксонов. Особенно убе-
дительны в этом отношении наблюдения, проведенные на дистальных
участках периферических нервов тритона при перерезке последних (Sin-
1
6 2
Рис. 161. Глио-васкулярные взаимоотношения в нервной системе позвоночных.
(По электронным микрофотографиям: Питерс и др., 1972; рис. М. Ю. Пунина).
1 — фиброзный астроцит, 2 — отростки астроцита, образующие концевые «ножки» вокруг капилляра,
3 — просвет капилляра, 4 — ядро эндотелиальной клетки, 5 — контакты между отростками астро-
цитов, в — базальные мембраны, 7 — коллагеновые волокна, 8 — отростки и тела нервных клеток.
ger, Salpeter, 1966). В этих опытах удалось показать, что если сразу же
после перерезки аксона произвести инъекцию 3Н-гистидина, то меченые
высокомолекулярные соединения вначале появляются в цитоплазме шван-
новских клеток, а затем на периферии нейроплазмы аксонов. Аналогич-
ные данные получены и в отношении 3Н-лейцина на этом объекте и на
других позвоночных животных. Большой фактический материал имеется
356
и по изучению изменений процессов внутриклеточного метаболизма в си-
стеме нейрон—глия при различных воздействиях (Певзнер, 1972). Пока-
зано, что после различных воздействий восстановление нормального или
даже повышенного количества РНК и белка в глиальных клетках пред-
Рис. 162. Схема дегенерации и регенерации нервных волокон у позвоночных живот-
ных. (По: Ham, 1957).
1 — проксимальный участок волокна, 2 — дистальный участок, 3 — распад миелиновых оболочек
и аксонов после перерезки, 4 — усиленное размножение шванновских клеток в месте травмы и обра-
зование тяжей, 5 — многочисленные макрофаги, уничтожающие остатки разрушенных аксонов и
миелиновых оболочек, 6 — образование в проксимальном участке волокна множества аксонных вето*
чек, проникающих между шванновскими клетками, 7 — отдельные тонкие аксоны, достигающие
дистального участка волокна, 8 — образование и развитие новой миелиновой оболочки вокруг моло-
дого аксона.
шествует аналогичным восстановительным процессам в нейроне. Все эти
факты заставляют предполагать возможность контроля со стороны гли-
альных элементов не только за транспортировкой низкомолекулярных
веществ, но и за синтезом и перемещением высокомолекулярных соеди-
нений типа РНК и белка.
357
Рис. 163. Ультраструктурные схемы дегенерации и регенерации проксимального
участка нервного волокна. (По: Morris et al., 1972; рис. М. Ю. Пунина).
а, б 7- распад миелиновой оболочки и аксона, в — макрофаг, пожирающий остатки миелина, г —.
образование пучка регенерирующих аксонов, д — молодой аксон с развивающейся миелиновой обо-
лочкой. 1 — аксон, 2 — ядро шванновской клетки, 3 — распадающаяся миелиновая оболочка, 4 —
ядро макрофага, 5 — митохондрия, 6 — шероховатая эндоплазматическая сеть, 7 — аппарат
Гольджи, 8 — вакуоли с различными включениями, 9 — гранулы в цитоплазме, 10 — мембрана
(базальная), 11 — коллагеновые волокна эндоневрия.
Рис. 163 (продолжение),
Теснейшая системная связь между аксонами нервных клеток и шван-
новскими клетками особенно ярко проявляется у позвоночных живот-
ных в условиях репаративной регенерации аксонов (Morris et al., 1972).
После травматического нарушения связи между периферической и цент-
ральной частями аксона периферический участок распадается и дегене-
рирует (рис. 162, 163). Окружающие его шванновские клетки теряют
значительную часть своих мембранных структур. После этого, особенно
в области травмы, имеет место энергичное митотическое размножение
шванновских клеток и образование из них лентовидных структур. По-
следние растут в направлении сохранившегося центрального участка ак-
сона. В случае контакта последнего с одним из таких лентовидных
Рис. 163 (продолжение)*
тяжей начинается рост аксона по сохранившемуся футляру видоизменен-
ных шванновских клеток и полное восстановление всей периферической
части аксона вплоть до эффекторных приборов в области терминального
разветвления аксона.
Глиальные клетки играют, по-видимому, весьма существенную роль
и в основной функции нервной системы, связанной с процессами возбуж-
дения, торможения и распространения импульсов по отросткам нервных
клеток и в области синаптических контактов. При этом наряду с изоли-
рующей функцией определенные разновидности клеток глии принимают
участие в перераспределении ионов и создании соответствующих электро-
статических условий у поверхности плазматической мембраны нейронов.
Несмотря на весьма важную роль глии в деятельности нервной системы,
конкретное функциональное значение отдельных разновидностей глии
остается еще весьма слабо изученным.
В выяснении основных принципиальных вопросов биологического
значения нейроглиальных взаимоотношений существенная роль принад-
лежит сравнительному методу исследования.
В плане такого сравнительного анализа нейроглии особый интерес
представляет ее сопоставление у первичноротых беспозвоночных и по-
звоночных животных. Даже весьма краткие и отрывочные сведения по
строению нейроглии первичноротых беспозвоночных животных свидетель-
360
ствуют о наличии общих признаков ее организации с нейроглией позво-
ночных.
Так, в наиболее хорошо изученной нервной системе брюхоногих и
головоногих моллюсков общий характер взаимоотношений между нейро-
нами и глиальными клетками оказался сходным с теми отношениями,
которые наблюдаются у позвоночных животных. И в ганглиях, и в пери-
ферических отделах нервной системы тела нервных клеток, отростки кле-
ток и синаптические контакты всюду сопровождаются глиальными клет-
ками (Stephens, Young, 1969). Показано (Gray, 1969), что в оптическом
ганглии головоногого моллюска между телами нервных клеток и синап-
тическими контактами в пейропиле, с одной стороны, и кровеносными
Рис. 164. Гл ио-васкулярные взаимоотношения в нервной системе головоногих мол-
люсков. (По: Gray, 1969а; рис. Д. К. Обухова).
7 — капилляр, 2 — лакуна в межклеточном веществе соединительной ткани, 3 — астроцитоподоб-
ные глиальные клетки, 4 — перициты, 5 — отростки нервных клеток, 6 — мембрана сосуда, 7 —
коллагеновые волокна.
сосудами, а также организованными лакунами в межклеточном веществе
соединительной ткани — с другой, располагаются астроцитоподобные гли-
альные клетки (рис. 164). Они, однако, в отличие от позвоночных живот-
ных не обеспечивают полной изоляции нейронов от контакта с межкле-
точным веществом соединительной ткани. Этот факт свидетельствует,
очевидно, в пользу предположения об отсутствии необходимости межкле-
точных взаимодействий между цитоплазмой глиальных и нервных клеток
для обеспечения трофики нервных клеток.
С другой стороны, и у моллюсков и у других животных с перифери-
ческим расположением в ганглиях тел псевдоуниполярных нейронов сна-
ружи обязательно находятся глиальные клетки-сателлиты, аналогичные
по своему функциональному значению клеткам-сателлитам в ганглиях
позвоночных животных.
У беспозвоночных животных обычно отсутствуют мякотные волокна,
столь характерные для позвоночных животных и обеспечивающие быст-
рое проведение нервного импульса. Однако в тех случаях, когда имеется
необходимость такого проведения, глиальные элементы могут формиро-
вать достаточно мощную изолирующую оболочку. Такие отношения скла-
дываются в аксонах большого диаметра, образующих длинные нисходя-
щие пути. Гигантские аксоны имеются у некоторых полихет и мол-
люсков. Особенно характерны они для нервной системы ракообразных.
361
Изолирующая обкладка у таких аксонов формируется не путем гипер-
трофии плазматической мембраны одной клетки, как в мякотцых волок-
нах позвоночных, а за счет многослойной капсулы, состоящей из сильно
уплощенных тесно связанных между собой глиальных клеток (рис. 165).
Что же касается обычных шванновских клеток, то они имеют универ-
сальное распространение и, по-видимому, сходное биологическое значе-
ние в периферической и центральной нервных системах почти у всех
многоклеточных животных.
Наряду с общими признаками организации глиальных систем всех
многоклеточных животных имеющиеся сравнительно-гистологические
данные свидетельствуют и о большой филогенетической лабильности ней-
роглии. Такая лабильность проявляется в разнообразии форм клеточных
элементов даже в пределах одной группы животных. Так, например,
у брюхоногих моллюсков отсутст-
вует типичная астроцитарная глия,
в то время как сильное развитие
получает глиоинтерстициальная
Рис. 165. Различные типы глиальных
оболочек, встречающиеся в нервной
системе 'V членистоногих. (По: Bullock,
Horridge, 1965).
1 — аксон, не'покрытый оболочкой, 2 — одно-
слойная глиальная оболочка, з — слабораз-
витая*миелинизированная оболочка, 4 — ком-
пактная, сильно развитая миелинизированная
оболочка, 5 — оболочка, образованная * не-
сколькими шванновскими клетками с много-
численными отростками, 6 — многослойная
оболочка, образованная глиальными отрост-
ками, разделенными слоями «аморфного» ве-
щества, 7 — глиальная оболочка с толстой
наружной «аморфной» оболочкой.
система. Основное назначение последней, по мнению некоторых авторов,
заключается в регуляции ионного баланса (Nicaise et aL, 1968; Amsellem,
Nicaise, 1976). Характерной особенностью глиоинтерстициальной системы
является то, что она распространяется в периферических отделах за пре-
делы терминальных разветвлений аксонов, особенно в некоторых мышцах
(рис. 166). Таким образом, здесь происходит, по-видимому, частичная
субституция функций тканей внутренней среды элементами глии. Такая
интерстициальная глия имеется, возможно, и в вегетативной нервной
системе позвоночных животных, а также в центральной нервной системе
у некоторых других групп первичноротых животных. С другой стороны,
у головоногих моллюсков интерстициальная глия утрачивается, однако
имеется хорошо развитая астроцитарная глия (Gray, 1969). Высокодиф-
ференцированная астроцитарная глия обнаружена и в ганглиях централь-
ной нервной системы у дождевого червя (Zimmermann, 1967). Здесь по
морфологическим критериям удается выделить до 7 типов клеточных эле-
ментов этой разновидности глии.
Существенные особенности могут наблюдаться и в тонкой струк-
туре глиальных клеток. Так, у некоторых моллюсков в одних и тех же
глиальных клетках имеются в относительно больших количествах гра-
нулы гликогена, гранулы, окруженные мембраной, и фибриллярные
структуры. У других моллюсков в нервной системе выделяются три раз-
новидности глиальных клеток, каждая из которых содержит только один
из перечисленных выше компонентов в своей цитоплазме.
В глиальных элементах насекомых отсутствуют кератиновые фиб-
риллы, однако хорошо развит аппарат микротрубочек. У головоногих
моллюсков среди глиальных клеток имеется особая разновидность кле-
ток, в цитоплазме которых обнаруживается большое количество рибосом.
362
Особенно отчетливо общие и специфические закономерности взаимо-
отношений между нейронами и глией у позвоночных и беспозвоночных
животных обнаруживаются в опытах с регенерацией периферических нер-
вов и нервных волокон в центральной нервной системе. В настоящее
время по этому вопросу имеются сравнительно-гистологические и фи-
зиологические данные по разным группам беспозвоночных животных
Рис. 166. Общий вид (а) и схемы строения отдельных компонентов (б, в) глиоинтерсти-
циальной системы у брюхоногих моллюсков. (По: Nicaise et al., 1968, рис. Д. К. Обу-
хова).
1 — нервные клетки, 2 — глиальные клетки, 3 — мышца, 4 — глио-мышечное соединение, 5 —
нервно-мышечное соединение, 6 — нервное соединение, 7 — нервное окончание, 8 — отростки гли-
альных клеток, 9 — отросток глиальной клетки, внедряющийся в мышцу, 10 — мышечное волокно,
11 — базальная мембрана, 12 — коллагеновые волокна.
(Zimmermann, 1967; Boulton, 1969; Hoy, 1970; Rees, Usherwood, 1972;
Nordlander, Singer, 1973; Wine, 1973).
Из этих работ можно сделать вывод о принципиальном сходстве де-
генеративных и регенеративных процессов у всех многоклеточных жи-
вотных. У представителей высшей группы членистоногих — насекомых,
и у олигохет описана относительно быстрая дегенерация дистальных час-
тей отростков, изолированных от тела клетки, сопровождаемая, кроме
того, активизацией глиальных элементов. При репаративной регенерации
отростков нервных клеток имеет место, как и у позвоночных животных,
тесное взаимодействие регенерирующих участков с видоизмененными
шванновскими клетками.
363
4 5
Рис. 167. Схема дегенерации и регенерации нервного волокна у саранчи после его
перерезки. (По: Boulton, 1969; рис. Д. К. Обухова).
о — норма, б — через 5—10 дней, в — через 19 дней после перерезки. 1 — неизмененный аксон, 2 —
«реактивный» аксон, 3 — дегенерирующий аксон, 4 — отростки глиальных клеток, 5 — дегенери-
рующие отростки глиальных клеток, 6 — межклеточные пространства, 7 — митохондрии, 8 — «тем-
ные» гранулы в дегенерирующих отростках, 9 — вакуоли, 10 — ламеллярные тела.
Наряду с этой общностью регенерационных процессов в ряде случаев,
преимущественно при перерезке аксонов эффекторных клеток обнару-
жены факты длительного существования и нормального функционирова-
ния дистального отдела аксона без связи с телом нервной клетки. Впер-
вые этот феномен был описан на примере гигантских аксонов у рако-
образных (Wiersma, Hunhes, 1961; Hoy, 1970). Аналогичное явление
показано и на аксонах моторных нейронов саранчи и гигантских аксонах
нейронов головоногих моллюсков (рис. 167).
Тщательный анализ ультраструктурных изменений в области дисталь-
ных отделов перерезанных аксонов у ракообразных, проведенный в по-
следнее время (Nordlander, Singer, 1972, 1973), показал, что в данном
случае действительно имеет место длительное сохранение относительно
нормальной морфобиохимической организации аксоплазмы в отростках,
лишенных связи с телом клетки. Наиболее лриемлемым объяснением
возможности существования и функционирования таких аксонов в те-
чение нескольких месяцев является предположение о том, что отсут-
ствие трофической и структурной связи с телом клетки компенсируется
здесь активизацией трофических взаимосвязей аксоплазмы и окружаю-
щих перерезанные аксоны шванновских клеток. В пользу такого пред-
положения говорят также четкие картины активизации метаболического
аппарата шванновских клеток в области дистального отрезка нервного
волокна.
Тем не менее и в данном случае не происходит, как предполагалось
ранее, срастания проксимального и дистального концов перерезанных ак-
сонов. Восстановление нормальных отношений и здесь происходит за счет
роста проксимального участка аксона и деструкции его участка, утра-
тившего связь с телом клетки.
Таким образом, на разобранном примере отчетливо видно, что при
наличии общих типовых признаков взаимодействия между глией и ней-
ронами некоторые признаки такого взаимодействия могут быть резко
усилены у отдельных представителей беспозвоночных животных.
ЗАКЛЮЧЕНИЕ’
В предыдущих разделах в сравнительном. аспекте были рассмотрены
общие закономерности морфобиохимической организации нервных клеток,
их специализированных структур в области синапсов, эффекторных и ре-
цепторных аппаратов, вспомогательных глиальных клеточных элементов.
Еще большую актуальность приобретает в настоящее время такой
сравнительный, исторический подход к изучению наиболее сложного ор-
ганного уровня организации нервной системы. Особая актуальность срав-
нительного подхода в данном случае определяется большой сложностью
организации нервной системы позвоночных животных, которая состоит
у них из колоссального количества разнообразных клеточных элементов,
находящихся между собой в весьма сложных структурных и функцио-
нальных взаимодействиях.
В методическом отношении нервная система высших беспозвоночных
животных имеет ряд принципиальных преимуществ для изучения ее ор-
ганного уровня организации и благодаря крупным размерам нервных
клеток и их периферическому расположению, и, наконец, главным обра-
зом в связи со значительно меньшим количеством их в системе.
Не случайно поэтому нервная система беспозвоночных животпых, и
в частности кольчатых червей, моллюсков, ракообразных и насекомых,
в последние 10—15 лет становится излюбленным объектом не только для
анализа клеточного и субклеточного уровней организации системы, по
и для выяснения общих фундаментальных механизмов, лежащих в ос-
нове системного уровня ее организации (см. обзоры: Kandell, Kupferman,
365
1970; Kennedy, 1975). Помимо перечисленных выше достоинств этих
объектов, их преимущество заключается еще п в разнообразии видов
животных (особенно у насекомых), нервные системы которых обнару-
живают существенные видовые особенности. Это позволяет подобрать
для решения той или иной конкретной задачи при анализе системных
механизмов наиболее адекватную модельную систему. /
Особенно большое значение это обстоятельство имеет для физиоло-
гического анализа системных механизмов. В связи с этим, а также благо-
даря разработке новых тонких физиологических методов анализа
в последнее время достигнуты большие успехи в изучении системных ме-
ханизмов организации нервных систем беспозвоночных животных, глав-
ным образом в их функциональном проявлении. Эти новые данные сравни-
тельно-физиологических исследований последних лет показали наличие
глубоких аналогий с известными уже механизмами в сходных в функ-
циональном отношении отделах нервной системы позвоночных животных.
Наличие таких аналогий делает весьма перспективным комплексный
анализ системного уровня организации нервной системы многоклеточных
животных не столько для выяснения ее особенностей у отдельных групп
животных, сколько для выяснения общих универсальных закономерно-
стей ее организации. Такой методологический подход становится сейчас
доминирующим в области сравнительной физиологии. Однако идея о на-
личии общих закономерностей организации нервной системы и ее эво-
люционного усложнения в ряду первичноротых и вторичноротых живот-
ных была высказана акад. А. А. Заварзиным еще в середине 20-х годов
и обоснована им в 40-х годах в его известной монографии «Очерки эво-
люционной гистологии нервной системы» (Заварзин, 1925, 1941). В ос-
нову представлений о наличии глубоких аналогий в структурной орга-
низации многоклеточных животных легли его собственные исследования
по анализу нейрональных отношений в оптических нервных центрах
и брюшной нервной цепочке личинки стрекозы Aeschna, проведенные на
тотальных препаратах с прижизненным окрашиванием нервных клеток
метиленовой синью. При этом удалось наблюдать не только расположе-
ние тел нервных клеток, но и ход их отростков, а также локализацию
синаптических контактов, т. е. представить достаточно полно картину
нейрональных отношений в исследуемых нервных центрах.
На основании собственных данных и обобщения обширной лите*
ратуры по анализу нейрональных отношений в нервных системах позво-
ночных и беспозвоночных животных Заварзиным были обнаружены не*
которые общие закономерности структурной организации нервной си-
стемы и основные принципы ее эволюционного усложнения. Эти пред-
ставления в своей основе не только не утратили значения в настоящее
время, но и получают все большее и большее развитие как в морфоло-
гических (Невмывака, 1966; Цвиленева, 1970; Плотникова, 1975), так и
сравнительно-физиологических исследованиях (см. обзоры: Таис, 1967;
Свидерский, 1973; Kandell, Kupferman, 1970; Krebs, 1975).
В основе организации нервной системы многоклеточных животных
лежит система взаимосвязанных нервных центров. Под нервными цент-
рами в нейрогистологии понимают пространственно организованные
участки, где происходит переключение нервных импульсов с одной нервной
клетки на другую, т. е. область расположения синаптических контактов.
Все разнообразие нервных центров у многоклеточных животных
можно разделить на две разновидности: ядерные и экранные нервные
центры.
Типичным примером ядерных нервных центров могут быть нервные
центры туловищного мозга многоклеточных животных. Наиболее ярко
общие закономерности их организации и филогенетической дифферен-
цировки проявляются у высших позвоночных животных и у насекомых.
У высших позвоночных животных эти центры представлены так паЗы-
366
ваемым собственным аппаратом спинного мозга. Собственный аппарат
спинного мозга представляет собой систему взаимосвязанных афферентных,,
ассоциативных и эфферентных нейронов. При этом сами нервные центры,
т. е. места синаптических контактов между чувствительными, ассоциатив-
ными и двигательными нейронами, располагаются в строго локализован-
ных участках серого вещества спинного мозга (рис. 168). Аксон чувст-
вительной нервной клетки в белом веществе, окружающем задние рога
спинного мозга, дает восходящую (более короткую) и нисходящую (бо-
лее длинную) ветви. Они идут в составе проводящих пучков собствен-
ного аппарата спинного мозга и дают в выше и ниже лежащих сегмен-
тах коллатерали, оканчивающиеся на
дендритах и телах ассоциативных (вста-
вочных) нейронов.
При распространении нервного им-
пульса по аксону чувствительной нервной
клетки импульс передается, следова-
тельно, на ассоциативные клетки не
только своего, но и выше и ниже лежа-
щих сегментов спинного мозга.
Ассоциативные клетки собственного
аппарата спинного мозга высших позво-
ночных представляют собой сложную си-
стему разнообразных клеток. Здесь име-
ются нейроны амакринового типа, клетки,
посылающие аксоны на свою и в проти-
воположную сторону спинного мозга, и
целый ряд других клеточных элементов.
Аксоны ассоциативных нейронов, перед
тем как дать терминальное разветвление
Рис. 168. Схема строения «собственного» аппарата
спинного мозга позвоночных. (Рис. Е. В. Петели-
ной).
1 — чувствительный нейрон (клетка спинального ганг-
лия), 2 — пучковая клетка (ассоциативный нейрон),
3 — двигательная клетка (эффекторный нейрон).
на дендритах и телах двигательных эффекторных нейронов своей или
противоположной стороны спинного мозга, дают коллатерали в белое ве-
щество, идущие вверх и вниз в составе пучков собственного аппарата
спинного мозга. В выше- и нижележащих сегментах они дают терминаль-
ные разветвления на дендритах и телах двигательных клеток соседних
сегментов.
Таким образом на раздражение одной чувствительной клетки могут
отвечать несколько десятков двигательных нейронов. Это явление полу-
чило название лавинообразного нарастания импульса. Помимо типичных
трехчленных рефлекторных дуг, у высших позвоночных животных
в спинном мозге имеются и прямые двучленные контакты между чув-
ствительными и двигательными нейронами. Трехчленные и двучленные
рефлекторные дуги собственного аппарата спинного мозга имеют двусто-
ронние связи с вышележащими центрами головного мозга. Особенно слож-
ный контроль за деятельностью собственного аппарата спинного мозга
осуществляется на уровне двигательных нейронов. Анализ отношений в соб-
ственном аппарате спинного мозга низших позвоночных показывает, что
одной из основных закономерностей прогрессивной филогенетической диф-
ференцировки ядерных нервных центров спинного мозга является услож-
нение промежуточного, ассоциативного звена, как в смысле количества, так
и разнообразия ассоциативных нейронов. Второй общей закономерностью
прогрессивного развития ядерных центров является их пространственная
367
и функциональная дифференциация. Диффузное распределение синапсов
в ядерных нервных центрах низших позвоночных сменяется у высших
позвоночных строго локализованным их распределением в определенных
участках серого вещества спинного мозга. При этом в двигательной об-
ласти вместо одной диффузной зоны выделяется уже около 5 четко лока-
лизованных ядерных центров. Наконец, третьей и очень важной законо-
мерностью усложнения ядерных центров является усиление их восходя-
щих и нисходящих связей с вышележащими более поздними по проис-
хождению центрами головного мозга. В любом ядерном двигательном
центре спинного мозга высших позвоночных на каждой эффекторной
нервной клетке оканчиваются не только аксоны промежуточных и чув-
ствительных клеток собственного аппарата, но и аксоны клеток ядерных
Рис. 169. Схема строения ганглия брюшной нервной цепочки насекомого. (Из: Завар-
зин, 1941; рис. Е. В. Петелиной).
1 — вентральный нейропиль, 2 — центральный нейропиль, з — дорзальный нейропиль, 4 — двига-
тельная клетка, 5 — комиссуральные клетки двигательной области, 6 — комиссуральные клетки
чувствительной области, 7 — входящие в ганглий чувствительные волокна, 8 — нисходящие двига-
тельные волокна.
центров продолговатого мозга, мозжечка, среднего мозга и аксоны пира-
мидных клеток коры больших полушарий (у млекопитающих и человека).
К настоящему времени благодаря .старым работам, выполненным ме-
тодом прижизненного окрашивания метиленовой синью (Retzius, 1890,
1891; Заварзин, 1924; Hanstrom, 1928), и аналогичным современным ра-
ботам (Smith, 1957; Невмывака, 1966; Цвиленева, 1970; Плотникова,
1975, и др.) накоплен обширный сравнительный материал по характе-
ристике нейрональных отношений в туловищном мозге представителей
некоторых групп беспозвоночных животных (червей, ракообразных и на-
секомых) .
Наиболее сложпые и дифференцированные отношения в структурной
организации ядерных нервных центров у беспозвоночных наблюдаются
в туловищном мозге насекомых. По своей внешпей микроанатомической
организации ганглии брюшной нервной цепочки насекомых резко отли-
чаются от спинного мозга позвоночных периферическим расположением
тел клеток и центральным положением их отростков. Разветвления
последних образуют вентральный (чувствительный), центральный
(основной) и дорсальный (двигательный) нейропили (рис. 169). В нейро-
пилях сосредоточены все синапсы, т. е. эти участки ганглиев анало-
гичны соответствующим ядерным центрам спинного мозга позвоночных
животных. В чувствительном нейропиле располагаются терминальные
разветвления аксонов рецепторных клеток, расположенных на периферии,
и дендриты ассоциативных нейронов. В центральном нейропиле распо-
ложены разветвления дендритов разнообразных ассоциативных клеток.
Наконец, в двигательном нейропиле располагаются терминальные развет-
вления аксонов ассоциативных клеток и дендриты моторных нейронов.
368
Таким образом, синаптические контакты между клетками локализо-
ваны в строго определенном участке нейропиля, что аналогично отноше-
ниям, наблюдаемым в ядерных центрах спинного мозга высших позво-
ночных животных. В морфологических и физиологических исследованиях
удалось показать, что брюшная нервная цепочка насекомых имеет собст-
венный аппарат проводящих путей. В его основе, как и у позвоночных,
лежит трехчленная рефлекторная дуга, чувствительные и ассоциативные
клетки которой посылают аксонные коллатерали в соседние ганглии.
Кроме того, собственный аппарат туловищного мозга насекомых обладает
сложной системой двусторонних связей с головным мозгом через специ-
альные ассоциативные нейроны. Отростки последних располагаются
обычно по периферии нейропиля, преимущественно на дорсальной и вен-
тральной поверхностях ганглия.
Среди этих ассоциативных нейронов в последнее время в специальных
физиологических экспериментах удалось выявить особые командные ин-
тернейроны, которые обеспечивают синхронную работу моторных нейро-
нов в таких сложных поведенческих актах, как полет насекомых (Сви-
дерский, 1973). В морфологических исследованиях удалось проследить
ход нейритов командных нейронов в туловищном мозге насекомых
(Плотникова, 1975). Командные интернейроны, управляющие работой
большой совокупности нервных эффекторных клеток, имеют широкое рас-
пространение в нервной системе беспозвоночных животных (см. обзор:
Kandell, Kupferman, 1970). Они хорошо изучены и в морфологическом
и в функциональном . отношениях у высших ракообразных (Wiersma,
Hunhes, 1961; Atwood, Wiersma, 1967; Цвиленева, 1970), а также описаны
у моллюсков и кольчатых червей (Smith, 1957; Coggeshall, 1965). Име-
ются указания па наличие аналогичных механизмов в нервных системах
позвоночных животных.
Большие надежды возлагаются в настоящее время па использование
новых методов выявления нервных клеток, их отростков и даже синап-
тических приборов с помощью прижизненного введения проционовых кра-
сителей или солей кобальта в индивидуальные нервные клетки (Nichol-
son, Kater, 1973). Достоинством этого метода является возможность одно-
временного анализа морфологии клетки со сложным ветвлением ее
отростков и выяснения биоэлектрических свойств, т. е. основных функ-
циональных параметров нейронов. Эта методика оказывается наиболее
адекватной для постановки комплексных морфофункциональных иссле-
дований в изучении нейрональных отношений и системного уровня орга-
низации нервной системы в целом. Особенно много новых данных полу-
чено этой методикой при изучении нервных систем беспозвоночных
животных и в силу чисто методических возможностей и благодаря нали-
чию в нервных системах этих животных относительно небольшого коли-
чества нервных клеток. За несколько лет после внедрения в практику
исследований этих методик получены уже интересные, принципиально
важные факты. Удалось показать строгую индивидуальность и слабую
изменчивость положения тел клеток и ветвления отростков в туловищном
мозге ракообразных. Идентифицированы тела нервных клеток, образую-
щих гигантские аксоны у ракообразных и аннелид. Выявлены нейро-
нальные отношения и функциональные взаимосвязи в системе мотоней-
ронов у ракообразных.
Современные морфофункциопальные исследования туловищной нерв-
ной системы беспозвоночных животных со всей очевидностью свидетель-
ствуют, что деятельность этих систем основана не па простых рефлек-
торных актах, а связана со сложнейшей переработкой поступающих
в нервные центры сигналов. В основе такой переработки, кроме регу-
лирующего влияния высших центров, лежат и сложнейшие взаимодейст-
вия собственных интернейронов. В организации и функциональной дея-
тельности системы этих интернейронов у высших беспозвоночных и поз-
24 А. А. Заварзин
369
воночных имеется много общих аналогичных морфологических и функ-
циональных признаков.
По мере углубления наших знаний о тонких механизмах структурной
и функциональной организации ядерных нервных центров у позвоночных
и высших первичноротых, становится ясным, что наблюдаемая здесь ана-
логия, не случайное совпадение. Наличие сходных механизмов является,
очевидно, отражением общих принципов организации нервных систем
многоклеточных животных. Наряду с этим туловищный мозг каждой
группы животных имеет и свои специфические особенности. Так, напри-
мер, специфической особенностью туловищного мозга насекомых и других
членистоногих является наличие относительно большого количества поли-
валентных ассоциативно-двигательных нейронов и нейронов с несколь-
кими аксонами (рис. 170).
Рис. 170. Поливалентная ассоциативно-двигательная
клетка краба. (По: Заварзин, 1941; рис. Д. К. Обухова).
Не менее четко наличие общих принципов филогенетической диф-
ференцировки выступает и при сравнительном анализе нейрональных
отношений в экранных, плоскостных, нервных центрах. Типичным при-
мером экранных нервных центров являются оптические нервные центры,
весьма развитые у всех высших представителей многоклеточных живот-
ных (позвоночных, головоногих моллюсков и насекомых). У позвоночных
животных часть оптических нервных центров сосредоточена в сетчатке,
т. е. вынесена за пределы центральной нервной системы. Сетчатка
высших позвоночных имеет характерное для экранных нервных центров
слоистое строение. Описанные уже в предыдущем разделе фоторецеп-
торные клетки занимают наиболее удаленное от поверхности глазного
дна положение. Апикальными концами своих видоизмененных дендритов
они обращены к слою пигментного эпителия, образующему отражатель-
ный экран, подстилающий сетчатку. Наружные сегменты палочек и кол-
бочек образуют первый слой сетчатки, так называемый слой палочек и
колбочек (рис. 171). Тела этих клеток с ядрами составляют ее наружный
ядерный слой. Далее по направлению к внутренней поверхности глазного
дна следуют наружный ретикулярный, внутренний ядерный, внутренний
ретикулярный слои, слой ганглиозных клеток и, наконец, слой нервных
волокон. В наружном ретикулярном слое аксоны клеток палочек и кол-
бочек образуют синапсы на дендритах биполярных клеток (второго ос-
новного нейрона оптического пути), т. е. здесь располагается первый
экранный оптический центр сетчатки. Особенностью центра является то,
что каждая биполярная клетка связана не с одной, а с несколькими
палочками и колбочками. Таким образом, общее количество вставочных
биполярных клеток меньше, чем палочек и колбочек. Второй особен-
ностью этого центра является наличие в нем вспомогательных горизон-
тальных связей, образуемых вспомогательными мультиполярными нейро-
нами. Во внутреннем ядерном слое располагаются перикарионы биполяр-
370
пых клеток, а во внутреннем ретикулярном слое — синапсы, где
происходит переключение импульса с аксонов биполярных клеток на
дендриты мультиполярных ганглиозных клеток — третьего основного ас-
социативного нейрона оптического пути. Следовательно, здесь расположен
второй экранный оптический центр. В слое ганглиозных клеток и в слое
нервных волокон располагаются соответственно тела ганглиозных клеток
и их аксоны, образующие оптический нерв. Количество ганглиозных
нервных клеток также значительно меньше количества биполярных,
т. е. каждая ганглиозная клетка связана синаптическими аппаратами
Э.***
10^ ---
Рис. 171. Строение сетчатки позвоночных животных. (Из: Dowling, Boycott, 1966).
а — участок сетчатки, б — схема нейрональных отношений. 1 — пигментный эпителий, 2 — слой
палочек и колбочек, 3 — наружная пограничная мембрана, 4 — наружный зернистый слой, 5 —
наружный ретикулярный слой, 6 — внутренний зернистый слой, 7 — внутренний ретикулярный
слой, 8 — слой ганглиозных клеток, 9 — слой нервных волокон, 10 — внутренняя пограничная
мембрана, 11 — палочка, 12 — колбочка, 13 — карликовый биполяр, 14 — палочковый биполяр,
15 — плоский биполяр, 16 — горизонтальная клетка, 17 — амакриновая клетка, 18 — карликовая
ганглиозная клетка, 19 — «диффузная» ганглиозная клетка.
с несколькими биполярными клетками. Небольшая часть ганглиозных
клеток смещена во внутренний ядерный слой. Во втором оптическом
центре существенную роль играют и вспомогательные униполярные ама-
криновые нервные клетки. Тела большей части амакриновых клеток рас-
положены во внутреннем ядерном слое. Небольшая часть их имеется и
в слое ганглиозных клеток. Все амакриновые клетки обеспечивают гори-
зонтальные связи во втором оптическом нервном центре.
Третий оптический центр располагается в подкорковых центрах го-
ловного мозга и, в частности, у птиц в коре среднего мозга (рис. 172, а).
Здесь оканчиваются аксоны ганглиозных клеток сетчатки. Кора среднего
мозга птиц имеет чрезвычайно сложное строение и состоит более чем
из 14 слоев строго упорядоченно расположенных нервных клеток.
У насекомых орган зрения построен по иному принципу, чем камер-
ные глаза позвоночных животных. Глаз насекомых состоит из большого
количества отдельных глазков — омматидиев. В каждом таком глазке
имеется вспомогательный диоптрический аппарат и система фоторецептор-
ных нейронов. В отличие от позвоночных животных все переключатель-
24*
371.
ные звенья в оптическом пути, т. е. все оптические нервные центры,
расположены у насекомых за пределами органа зрения, в оптических
лопастях (ганглиях) головного мозга (рис. 172, в). Тонкий анализ ней-
рональных отношений в этих структурах, проведенный у личинок стре-
козы, показал их сходство с нейрональными отношениями в оптических
центрах позвоночных животных (Заварзин, 1913).
В первом оптическом ганглии у личипки стрекозы расположен первый
экранный зрительный центр. Здесь происходит переключение импульса
с аксонов рецепторных клеток на дендриты первого ассоциативного ней-
рона оптического пути. Кроме того, здесь же расположены многочислен-
ные синапсы, образуемые терминальными разветвлениями отростков
амакриновых и других специализированных вспомогательных клеток.
Во втором оптическом ганглии расположен второй экранный центр. Здесь
сосредоточены сипапсы между отростками первого и второго ассоциатив-
ных нейронов зрительного пути. Особенностью этого центра является
чрезвычайно мощное развитие вспомогательных горизонтальных связей.
Эти горизонтальные связи образуются, как и в первом оптическом ганг-
лии, отростками вспомогательных амакриновых и специализированных
нейронов. В третьем оптическом ганглии происходит контакт нейронов
второго ассоциативного нейрона с дендритами нервных клеток, связанных
с нервными клетками головного мозга насекомых.
В оптических центрах насекомых, позвоночных и птиц мы имеем
дело, следовательно, с тремя экранными центрами, образуемыми че-
тырьмя типами основных нейронов. Кроме того, во всех оптических нерв-
ных центрах имеется и сложный вспомогательный аппарат горизонталь-
ных связей, причем у насекомых с их фасеточными глазами этот аппарат
развит сильнее, чем у позвоночных животных.
У головоногих моллюсков, как и у позвоночных, глаза камерного, од-
нако в отличие от них, не инвертированного типа. Кроме того, у них,
как и у насекомых, все переключения в оптическом пути происходят
в органах центральной нервной системы. В отличие от насекомых и
позвоночных у головоногих моллюсков только два таких переключения,
они образованы тремя типами основных нейронов (рис. 172, б). Особен-
ностью оптических нервных центров головоногих моллюсков является их
несколько менее дифференцированный характер, чем у позвоночных и на-
секомых, особенно в отношении второго оптического центра. Внешне это
проявляется в отсутствии здесь слоистости в расположении тел и отростков
нервных клеток. Вспомогательный аппарат горизонтальных связей выра-
жен достаточно хорошо и представлен в основном амакриновыми клетками
различных размеров. Однако он развит все же слабее, чем у насекомых.
Таким образом, сопоставление оптических экранных центров у пред-
ставителей трех высших групп , многоклеточных животных указывает па
наличие глубокой аналогии в их общей системной организации. Очевидно,
что сходство структурной организации оптических центров обусловли-
вается общими закономерностями прогрессивной филогенетической диф-
ференцировки этих структур у членистоногих, головоногих моллюсков
и позвоночных животных. Сопоставление организации оптических цент-
ров у этих высших представителей с организацией их у менее высоко-
организованных первично- и вторичноротых позволяет выявить две ос-
новные закономерности их эволюционного усложнения. Первая из них
заключается в увеличении количества рецепторных элементов и пра-
вильно ориентированном в пространстве расположении клеток и синап-
тических контактов. Второй закономерностью прогрессивной филогене-
тической дифференцировки экранных центров является увеличение ко-
личества переключений, т. е. количества центров в оптическом пути.
Проведенные в последнее время многочисленные экспериментальные
физиологические исследования показали, что отмеченная выше структур-
ная аналогия в организации оптических центров у представителей раз-
372
ных групп многоклеточных животных коррелирует с глубокой аналогией
в тонких физиологических механизмах. Так, в частности, удалось пока-
зать универсальное распространение в оптических системах, так назы-
ваемого латерального ингибирования, осуществляемого синаптическими
окончаниями коллатералей аксонов одних рецепторных клеток па других
соседних рецепторных клетках. В сетчатке позвоночных и в фасеточных
глазах членистоногих обнаружено также наличие сложной и сходной
373
в обеих группах функциональной дифференцировки морфологически одно-
родных рецепторных элементов (см. обзоры: Kandell, Kupferman, 1970;
Boycott, 1974). Такую функциональную гетерогенность однозначных
по своим морфологическим признакам нейронов особенно детально
удается изучить с помощью прижизненного введения проционового жел-
того (Kaneko, 1973). Эти и многие другие факты свидетельствуют, с од-
ной стороны, о наличии анализаторной деятельности не только в высших
отделах ц. н. с., по и на уровне отдельных нервных центров. С другой
стороны, общность этих функциональных механизмов у столь отдаленных
групп животных обусловлена, очевидно,, универсальными признаками
организации их нервных систем.
Комплексный морфофункциопальпый анализ общих свойств экранных
центров в сравнительном аспекте представляет собой особый интерес.
Это связано с широким распространением экранных центров, а также
ведущим значением в эволюции нервной системы млекопитающих и чело-
века коры больших полушарий, являющейся высшим ассоциативным
нервным центром экранного типа.
В качестве третьего, последнего, примера, показавшего значение срав-
нительного подхода к анализу общих морфофункциопальных закономер-
ностей организации интегрирующих систем организма следует привести
некоторые данные по нейросекреторным системам и их взаимосвязи
с нервной и эндокринной системами организма.
В настоящее время хорошо известно, что одной из важнейших обще-
биологических функций нервной системы является функция интеграции
специализированных в различных направлениях тканевых и органных
систем многоклеточного организма. Наряду с нервной системой сущест-
венная роль в такой интеграции принадлежит и гуморальной интеграции
за счет непрерывного обмена веществами между отдельными частями
многоклеточного организма через его трофическую распределительную
систему. У высших многоклеточных животных весьма важную роль в си-
стеме гуморальной интеграции приобретают железы внутренней секреции,
выделяющие биологически активные вещества — гормоны. Железы внут-
ренней секреции развиваются преимущественно из эпителиальных тканей,
однако часть их, как например, мозговое вещество надпочечников и раз-
бросанные по организму участки хромаффиновой ткани, происходят из
нервного зачатка. Больше того, тщательное изучение различных отде-
лов ц. н. с. у позвоночных, а также у отдельных представителей бес-
позвоночных животных показало наличие в нервных системах многокле-
точных животных специализированных железистых клеточных элементов,
представляющих собою видоизмененные нейроны и выделяющих синте-
зируемые ими нейросекреторные продукты в кровь или тканевую жид-
кость. Оказалось, что эти нейросекреторные клетки имеют большее рас-
пространение, чем эндокринные железы. Они обнаружены не только
у высших многоклеточных, обладающих хорошо выраженной системой
желез внутренней секреции, но и у животных с относительно пизкпм
уровнем организации типа плоских червей, полихет, иглокожих, у кото-
рых еще не найдено специальных эндокринных органов. Тем не менее
в процессе эволюции у вторично- и у первичноротых животных системы
нейросекреторных клеток претерпевают прогрессивную филогенетическую
дифференцировку. Это проявляется в усовершенствовании их функции
как своеобразных желез внутренней секреции, выделяющих биологически
активные вещества, так и в усилении структурных и функциональных
связей между нервной системой и формирующейся позднее системой
желез внутренней секреции.
У высших позвоночных имеется хорошо развитая система клеток, со-
средоточенных в гипофизарно-гипоталамической области (см. обзоры: По-
ленов, 1968, 1974). Основной структурной и функциональной единицей
такой системы является нейросекреторная клетка. По внешнему виду
374
нейросекреторные клетки сходны с мультиполярными нейронами. Опп
имеют несколько коротких дендритов и один длинный аксон (рис. 173),
заканчивающийся булавовидным расширением либо па сосудах задней
Рис. 173. Схема строения нейросекреторной клетки. (Из: Поленов, 1968).
7 — перикарион, 2 — ядро, 3 — дендрит, 4 — капилляр, 5 — гранулы нейросекрета, 6 — аксон,
7 — аксовазальный синапс, 8 — аксоаденарный синапс.
доли гипофиза, либо на железистых клетках передней доли гипофиза.
Цитологической особенностью нейросекреторных клеток гипоталамуса
является еще более сильное, чем в нейроне развитие белоксиптезирую-
щего аппарата и других мембранных органоидов метаболического
аппарата цитоплазмы. Вырабатываемые нейросекреторными клетками
375
продукты поступают по их аксонам в сосудистую систему задней доли
гипофиза, которая связана с аденогипофизом. Кроме того, часть аксонов
нейросекреторных клеток у млекопитающих заканчивается непосред-
ственно в железистой ткани аденогипофиза.
Для системы нейросекреторных клеток характерна большая функ-
циональная подвижность их структурной организации, а также наличие
сложных и еще неясных в деталях механизмов транспортировки и вы-
ведения биологически активных веществ в кровь, тканевую жидкость или
на поверхность плазматической мембраны железистых клеток. На ден-
дритах и телах нейросекреторных клеток имеются многочисленные си-
напсы, образованные разветвлениями специальных нейронов, располо-
женных в ядерных центрах головного мозга. Нейросекреторная система
позвоночных животных, помимо инкреторной функции, берет па себя и
функцию обеспечения связи между ц. н. с. и центральной железой внут-
ренней секреции — аденогипофизом. Таким образом, у позвоночных жи-
вотных в процессе их эволюции происходит структурное и функциональ-
ное объединение гуморальной и нервной интегрирующих систем особой
нейроэндокринной системой.
Аналогичные отношения наблюдаем мы и в развитии интегрирующих
систем первичноротых животных (см. обзоры: Scharrer, Scharrer, 1963;
Поленов, 1968; Tombes, 1970; Киршенблат, 1971). Так, у высших пер-
вичпоротых — насекомых имеют место теснейшие взаимоотношения
между аксонами нейросекреторных клеток и основной железой вну-
тренней секреции — corpora allata. Железистые элементы этой железы
имеют также эктодермальное происхождение. Широко распространены
у высших первичноротых (головоногих моллюсков и высших раков) так
называемые нейрогемальные органы. Здесь в области специальных резер-
вуаров гемолимфы заканчиваются разветвления аксонов нейросекретор-
ных клеток. Эти нейрогемальные органы аналогичны по своему значению
задней доле гипофиза позвоночных. В данном случае мы имеем дело
с глубокой биологической аналогией в филогенетической дифференци-
ровке этих важных интегрирующих систем организма, причем не только
на клеточном уровне, по и на системном уровпе, включающем связь
нервной, нейросекреторной и эндокринной систем организма. Очевидно,
что такая аналогия не случайность. Она отражает наличие общих законо-
мерностей в эволюционной дифференцировке интегрирующих систем
многоклеточных животных.
ОБЩЕЕ ЗАКЛЮЧЕНИЕ
Обсуждение фактического материала было проведено в заключитель-
ных разделах, посвященных каждой из рассмотренных тканевых систем.
В этих частных заключениях сделана попытка оценить полученный
современными методами сравнительный материал с позиций характер-
ного для отечественной гистологии эволюционного, исторического под-
хода.
В общем заключении целесообразно кратко осветить основные этапы
разработки эволюционного направления в гистологии и частной цитоло-
гии. Основное же внимание будет уделено характеристике современного
состояния некоторых общих проблем филогенетической дифференцировки
специализированных тканевых элементов, тканей и других частных си-
стем организма.
Поразительное относительное однообразие типов тканей и специали-
зированных клеток, противоречащее, казалось бы, разнообразию организ-
мов и органов, было установлено еще в конце прошлого и в начале на-
стоящего веков. Такое кажущееся несоответствие между разнообразием
животных и большим сходством у них однозначных в функциональном
отношении ткапей долгое время было серьезным препятствием для ис-
пользования в частной цитологии и сравнительной гистологии эволюцион-
ного, исторического подхода. Тем не менее в конце XIX в. Геккель
(Haeckel, 1885), а позднее А. Н. Северцов (Северцов, 1934) и Н. Г. Хло-
пни (Хлопип, 1946) пришли к заключению, что на тканевом уровне
организации многоклеточных животных вполне применимы методы срав-
нительной морфологии по принципу гомологии тканевых структур. При
этом считалось, что эволюционный процесс па всех уровнях организации
многоклеточных животных протекает дивергентно. Основной задачей эво-
люционной гистологии, по мнению этих исследователей, являлось пост-
роение естественной системы тканей, аналогичной системе филогенетиче-
ского древа животных. Попытки построения такой системы, базировав-
шейся главным образом на происхождении тканей в онтогенезе, были
сделаны Геккелем и Хлопиным для тканей позвоночных животных. Факт
относительно небольшого разнообразия тканей многоклеточных животных
авторы объясняли большей консервативностью тканей и отсутствием еще
достаточных критериев для определения имеющихся в однотипных тка-
нях глубоких различий у разных групп животных.
Иной подход к проблеме филогенетической дифференцировки ткапей
был памечеп в теории параллельных рядов тканевой эволюции
акад. А. А. Заварзина (Заварзин, 1925, 1934). В окончательном виде эта
теория была сформулирована в сороковых годах в его известных моно-
графиях по нервной системе и тканям внутренней среды (Заварзин, 1941,
1945, 1947). Согласно теории параллелизма, в прогрессивном усложне-
нии тканевых систем доминирует параллельное развитие однотипных
в функциональном отношении тканей у разных и даже далеких в фило-
генетическом отношении групп многоклеточных животных. Причины та-
кой направленности или ограниченности эволюционного процесса на тка-
невом уровне организации акад. Заварзин усматривал, во-первых, в на-
личии общих свойств живой протоплазмы и, во-вторых, в общности у всех
377
многоклеточных животных функциональных задач, осуществляемых тка-
нями как частными системами организма.
Теория параллелизма была основана на анализе большого фактиче-
ского сравнительно-гистологического материала по тканям первичпоротых
и вторичноротых животных. Особенно детально эта теория была разра-
ботана в отношении тканей нервной системы и ткапей внутренней среды.
Исходя из отчетливо выраженной тенденции к усложнению в сходном
направлении функционально аналогичных тканей у первичноротых и вто-
ричпоротых животных, акад. Заварзин придавал большое значение
сравнительному методу по принципу морфофункциопальных аналогий.
Основной задачей эволюционной гистологии он считал не построение
естественной системы тканей, а выяснение общих закономерностей фило-
генетической дифференцировки каждого морфофункционального типа
тканей.
Сформулированные и разработанные у нас в стране эволюционные
идеи в области гистологии и частной цитологии в силу ряда объективных
причин не получили большого распространения в мировой литературе.
В отечественной гистологии до середины 50-х годов продолжалась
длительная и не очень плодотворная дискуссия о ведущем значении ди-
вергенции или параллелизма в эволюции тканей. Она завершилась
внешне компромиссной точкой зрения о том, что и дивергенция и парал-
лелизм играют существенную роль в сложном процессе филогенетической
дифференцировки тканей. По мнению А. В. Румянцева (Румянцев, 1958),
для анализа общих принципиальных проблем усложнения структур и
систем на тканевом уровне организации большее значение имеет предло-
женное акад. Заварзиным сопоставление по принципу функциональной
аналогии в пределах крупных далеко отстоящих групп многоклеточных
животных. Для анализа же более частных вопросов микроэволюционных
преобразований на тканевом уровне организации в пределах отдельных
типов животных и более мелких систематических групп с успехом могут
быть использованы и подходы, учитывающие родство организмов и осо-
бенности развития тканей в ходе онтогенеза, т. е. принципы опто- и фи-
логенетической гомологии.
Существенный вклад в разработку теории параллелизма был сделан
работами П. Г. Светлова (Светлов, 1957, 1959, 1962, 1967). Он обратил
внимание на ограниченность и ненадежность использования гистогене-
тических данных для построения системы тканей на основе принципа
гомологии даже в пределах позвоночных животных. С другой стороны,
им на ряде ярких примеров было показано, что сходные тенденции в ус-
ложнении многоклеточных организмов характерны не только для ткане-
вого и клеточного уровней организации, но имеют широкое распростра-
нение и на более высоких уровнях.
По мнению П. Г. Светлова, примерами системных параллелизмов из
области эмбриологии могут служить особенности формирования передних
сегментов тела у первичноротых и вторичноротых животных, сложные
и однотипные изменения процессов гаструляции у насекомых и высших
позвоночных и аналогичные изменения положения оси тела в ходе раз-
вития у высших представителей двух основных ветвей животных.
Многочисленные параллелизмы, не связанные непосредственно с общ-
ностью происхождения, наблюдаются в развитии далеко отстоящих
групп животных и в отношении более частных признаков. Все эти факты
привели Светлова к заключению о том, что принцип параллелизма явля-
ется более общим, чем это постулировал акад. Заварзин, принципом эво-
люционного усложнения многоклеточных животных.
За последние десятилетия в области частной цитологии и сравнитель-
ной гистологии накоплено много новых фактов. Наряду с этим сущест-
венно конкретизировались и наши представления об общих закономер-
ностях морфобиохимической организации клеток. Одним из наиболее важ-
378
ных выводов из этих представлений является вывод о наличии сложной
структурной организации основных клеточных метаболических систем
и в связи с этим существенных ограничений возможностей коренных пре-
образований клеточной организации при специализации клеток.
Больше того, детальный анализ морфобиохимической организации
специализированных клеток показал, что специализация тканевых эле-
ментов очень часто происходит на основе специфической гипертрофии об-
щих для всех клеток структур и метаболических процессов. Именно так
обстоит дело и при дифференцировке сократимых тканей, и при форми-
ровании осморегулирующих систем, и при формировании нервных, же-
лезистых и многих других типов специализированных клеток и тканевых
структур. Даже в тех случаях, когда специализация связана с синтезом
таких специфических полимеров или сложных соединений, как коллаген,
родопсин, дыхательные пигменты, удается с большой достоверностью по-
казать, что эти соединения возникли на основе древних характерных для
первичных многоклеточных общих для всех клеток метаболических про-
цессов (Willmer, 1970).
Жесткость клеточной организации у многоклеточных организмов уси-
ливается еще и нахождением клеток в составе тканевых систем. Значе-
ние регулирующих надклеточных факторов в ограничении возможности
клеток к эволюционным преобразованиям особенно наглядно выступает
при сопоставлении процессов репродукции клеток у многоклеточных жи-
вотных и простейших. В противоположность большому разнообразию
-И1ВИЮЭ я эинэкой ООПЬОЮЕМ эоннэйонгоп хишиохэойп Л HODOdilodn ХИ1С
ческих тканях многоклеточных животных ограничивается типичным ми-
тозом.
Таким образом, из всего сказанного выше неизбежно вытекает вывод
о том, что при сходных функциональных задачах их решение на кле-
точном уровне организации многоклеточных животных чаще всего осу-
ществляется сходным образом. В справедливости такого вывода убеж-
дает нас громадный современный материал по сравнительно-цитологиче-
скому анализу аналогичных в функциональном отношении клеток или
образуемых ими межклеточных структур.
Стихийное использование сравнительного метода по принципу функ-
циональной аналогии в настоящее время доминирует в сравнительно-цито-
логических и гистологических работах. При детализации наших представ-
лений о морфобиохимической организации специализированных клеток
и межклеточных структур выявилось наличие в пределах каждого
сходного по функции типа и даже каждой разновидности тканей общих
универсальных для разных животных закономерностей такой организа-
ции. Иными словами, в подавляющем большинстве случаев прогнозы сто-
ронников дивергентной дифференцировки тканей и специализированных
клеток о наличии глубоких различий между внешне сходными тканевыми
структурами оказались несостоятельными. В настоящее время определя-
ющее значение функциональных параллелизмов в организации специали-
зированных тканевых структур у разных животных не вызывает уже
серьезно обоснованных возражений.
Наличие сходства не означает тем не менее абсолютного их тожде-
ства. Как было показано на многочисленных примерах параллелизмов
(хрящевые ткани, рецепторы, фибробласты, осморегулирующие, сокра-
тимые и многие другие тканевые элементы), морфобиохимическое
сходство организации этих структур проявляется в разнообразных моди-
фикациях, затрагивающих существенные признаки такой организации.
Однако эти изменения и варьирование структур не выходят обычно за
рамки общих признаков организации характерных для данного функцио-
нального типа клеток или образуемых ими внеклеточных структур.
Из приведенных в книге многочисленных фактов можно сделать вы-
вод о том, что теория параллелизма на уровне специализированных клеток
379
и внеклеточных структур получила сейчас значительно более углублен-
ное обоснование. Оказались справедливыми основные положения этой
теории — наличие общих закономерностей в филогенетической дифферен-
цировке специализированных структур, обусловленных и общностью
функциональной задачи, и общими свойствами, или общими закономер-
ностями, морфобиохимической организации клеток.
Менее разработаны к настоящему времени вопросы филогенетической
дифференцировки на тканевом уровне организации многоклеточных жи-
вотных. Однако и в отношении этого уровня организации по мере накоп-
ления новых фактических сравнительно-гистологических данных начи-
нают выявляться все более отчетливо специфические для каждого типа
тканей и общие для подавляющего большинства многоклеточных живот-
ных закономерности филогенетической дифференцировки.
Для тканей внутренней среды такими закономерностями будут ди-
вергентная дифференцировка специализированных клеток и межклеточ-
ных структур, сохранение и усиление функциональной целостности и ин-
тегрированности и большая эволюционная лабильность системы. Действи-
тельно, в противоположность относительно простым системам тканей
внутренней среды, представленным всего двумя типами клеточных эле-
ментов, в наиболее дифференцированных системах тканей внутренней
среды высших позвоночных имеется не менее двух десятков различных
узкоспециализированных типов клеток и сложная система межклеточных
структур. При этом единственными источниками развития и оседлых и
подвижных клеток являются специальные стромальные и кроветворные
стволовые мультипотентные клетки. Несмотря на такую глубокую диф-
ференцированность системы, доходящую до возможного разделения ее
камбиальностей, она представляет собой тем не менее единую защитную,
трофическую и опорную тканевую систему. Все части этой системы на-
ходятся в неразрывном единстве. Наиболее яркими примерами такого
единства являются кооперативные взаимодействия различных типов кле-
ток при воспалении, развитии скелетных тканей и в реакциях адаптив-
ного иммунитета. В последние годы удалось показать наличие в тканях
внутренней среды насекомых аналогичной позвоночным животным тен-
денции к разграничению системы оседлых и подвижных элементов, тогда
как у моллюсков отчетливо показано гистогенетическое единство всех
клеток рассматриваемой тканевой системы. Таким образом, появление
особых источников развития оседлых и подвижных элементов в тканях
внутренней среды высших первичноротых и вторичноротых животных не
есть первичное свойство этих систем.
Функциональная и филогенетическая лабильность тканей внутренней
среды проявляется в варьировании их клеточного состава даже у близко-
родственных животных. На фоне такой лабильности особенно примеча-
тельны многочисленные примеры развития сходных тканевых структур
и специализированных клеток у неродственных животных.
В противоположность тканям внутренней среды специфической зако-
номерностью филогенетической дифференцировки сократимых тканей, об-
щей для всего типа этих тканей, является монофункциональный конвер-
гентный характер такой дифференцировки. При большом разнообразии
сократимых элементов их функциональная специализация основана на
структурных и биохимических модификациях единой актомиозиновой си-
стемы. Степень упорядоченности в пространстве, а также характер вспо-
могательных регулятивных механизмов обусловливаются в значительной
мере функциональными моментами. Это приводит, с одной стороны,
к большому разнообразию мышечных ткапей у одного и того же живот-
ного, а с другой — к наличию многочисленных параллелизмов в организа-
ции сократимых аппаратов, причем не только у высших представителей
первичноротых и вторичноротых животных, но и у животных средних и
даже низших уровней организации.
380
В последнее время обнаружены достаточно яркие примеры парал-
лельного развития и в отношении системного уровня организации сокра-
тимых тканей. К ним относятся, в частности, симпластическая структура
мышечных волокон насекомых и позвоночных, с наличием у обеих групп
животных специальных камбиальных клеток-сателлитов. Не менее ярким
примером системного параллелизма является структурная организация
сердечной мышечной ткани позвоночных, моллюсков и членистоногих.
Несмотря на независимое возникновение этой ткани у первично- и вто-
ричноротых, у всех животных она построена по принципу объединения
одноядерных клеток в единую в функциональном отношении многокле-
точную структуру.
В выделенных нами по функциональному критерию железистых и
осморегулирующих эпителиях также достаточно отчетливо выступает зна-
чение функционального момента в филогенетической дифференцировке
клеточных элементов этих ткапей. В отношении этих ткапей в настоящее
время имеется уже большое число весьма ярких примеров цитологиче-
ских параллелизмов, функциональный смысл которых нам ясен еще да-
леко не в полной мере. Сложнее обстоит дело с системным уровнем орга-
низации рассматриваемых тканей. Частично это обусловлено недостаточ-
ным вниманием к тканевому уровню их организации у беспозвоночных
животных. Тем не менее в отношении осморегулирующих систем здесь
четко выявляются на примере фильтрационных выделительных и осморе-
гулирующих канальцев общие тенденции их системной организации. Все
они у разных животных функционируют на основе сочетания фильтрации,
реабсорбции и секреции с соответствующей морфофункциональной диф-
ференцировкой эпителия отдельных участков канальцев. Универсальное
распространение имеет, по-видимому, и большая морфофункциональная
подвижность осморегулирующих тканей, системные аспекты которой в на-
стоящее время хорошо изучены лишь в отношении солевых клеток и со-
левых желез позвоночных животных. Наряду с этим в организации желе-
зистых образований, происходящих из кожпого эпителия у высших
первично- и вторичноротых животных, могут обнаруживаться и существен-
ные особенности. Частично они обусловлены принципиальными разли-
чиями в организации кутикулярных эпителиев членистоногих и много-
слойных эпителиев позвоночных животных.
Ткани нервной системы являются относительно однородной и по про-
исхождению и по общему направлению филогенетической дифференци-
ровки тканевой системой. В этом отношении они напоминают ткани внут-
ренней среды. Действительно, у предков современных многоклеточных
животных одной из первых дифференцировок их нервных систем было вы-
деление здесь уже трех основных типов клеток — нервных, глиальных и
нейросекреторных. В дальнейшем развитии и у первичпоротых и у вто-
ричпоротых животных, как и в случае ткапей внутренней среды, идет
дивергентная специализация клеток, которая приводит к тому большому
их структурному, функциональному и химическому разнообразию, которое
мы обнаруживаем у высших представителей современных первично- и
вторичноротых животных.
Особенностью прогрессивной эволюции тканей нервной системы по
сравнению с тканями внутренней среды является филогенетическая ста-
бильность, консервативность этой системы, что выражается, в частности,
в отсутствии больших различий в организации этих тканей у близко
родственных животпых. Проявлением филогенетической стабильности яв-
ляется и значительно более выраженная, чем при филогенетической диф-
ференцировке других тканей, тенденция к сохранению более древних
аппаратов. Как известно, эволюция нервной системы идет преимуще-
ственно путем надстройки и подчинения сохраняющихся и модифицирую-
щихся древних аппаратов филогенетически более молодыми прогрессивно
развивающимися высшими нервными центрами (Заварзин, 1941; Кара-
381
мян, 1976). Консервативность структурных и химических преобразова-
ний на клеточном уровне организации убедительно показана на при-
мере нервной системы брюхоногих и пластинчатожаберных моллюсков
(Сахаров, 1974). Несмотря на значительные анатомические различия
в строении нервной системы разных отрядов и подклассов этих живот-
ных, здесь удается выявить гомологичные нейроны, выполняющие
сходную функцию и характеризующиеся одинаковой медиаторной специ-
фичностью.
Наиболее яркими морфологическими примерами системных парал-
лелизмов в филогенетической дифференцировке нервных систем по-преж-
нему являются подробно разобранные акад. Заварзиным нейрональные
отношения в системе туловищного мозга и оптических нервных центров
высших первично- и вторичноротых животных (Заварзин, 1941). По-
следующие нейрогистологические работы позволили детализировать и
расширить количество примеров сходных принципов организации нервных
систем первичноротых и вторичноротых животных (Невмывака, 1966;
Цвиленева, 1970; Плотникова, 1975). Вместе с тем в этих работах пока-
заны и существенные модификации такой организации у некоторых групп
членистоногих (Цвиленева, 1970). Весьма плодотворным оказался тесный
контакт морфологических и физиологических работ в анализе общих
принципов и механизмов организации нервных систем многоклеточных
животных. Такие комплексные морфофункциональные исследования про-
водятся сейчас на большом круге объектов, в первую очередь на высших
первичноротых животных. Конечной целью этих исследований является
выяснение общих для всех дифференцированных нервных систем прин-
ципов их организации. Таким образом, и в этих исследованиях непосред-
ственное развитие получают основные идеи, заложенные в теории парал-
лелизма.
Иные взгляды на процессы филогенетической дифференцировки нерв-
ной системы развивает Д. А. Сахаров в своей гипотезе полигенеза (Саха-
ров, 1974). По его мнению, причиной разнообразия медиаторной специфич-
ности нейронов является химическая разнородность нейронов предков
современных многоклеточных животных. Одной из причин такой первич-
ной разнородности нейронов является, по Сахарову, их полифилетическое
происхождение из разных источников. В процессе эволюции, по его мне-
нию, происходит лишь усовершенствование механизмов химической пере-
дачи импульсов и появляются модификации медиаторов, не связанные
с коренной перестройкой их химической структуры. Основными аргумен-
тами в пользу своей гипотезы Сахаров считает упомянутые уже выше от-
ношения у моллюсков, наличие разнородных нейронов в нервных системах
низших многоклеточных и отдельные факты о происхождении нервных
клеток из разных эмбриональных зачатков. Несмотря на известную остро-
умность этой гипотезы, она базируется в основном лишь на фактах, сви-
детельствующих о большей, чем в других тканевых системах, стабильности
и консервативности нервных клеток. Вряд ли, однако, это свойство обус-
ловливает принципиальное отличие процессов филогенетической диф-
ференцировки в тканях нервной системы по сравнению с другими тканями
организма. Слабым местом гипотезы полигенеза является ее основ-
ное положение о исходном многообразии нейронов. Большого многообра-
зия нет даже у низших современных многоклеточных, которые не явля-
ются предками первичноротых и вторичноротых животных. Тем более
его трудно ожидать в примитивных нервных системах, из которых про-
изошло развитие нервных систем современных позвоночных животных.
Доминирующим общим принципом усложнения нервной системы, как
и системы тканей внутренней среды, является все же принцип дивер-
гентной специализации клеток и увеличение их структурного, химиче-
ского и функционального разнообразия. Наличие же общих медиаторов п
сходной химической специализации нейронов у первичпоротых и вторично-
382
ротых животных представляет собой явление, аналогичное наличию гемо-
глобинов, коллагенов, хондроитинсульфатов, т. е. яркие примеры паралле-
лизмов на цитологическом и молекулярно-биологическом уровнях
организации специализированных систем. Факты неоднозначного функцио-
нального значения нейронов одинаковой медиаторной специфичности
у первичноротых и вторичноротых животных логично рассматривать как
нетождественное проявление этих параллелизмов, тем более что тонкие
механизмы работы синапсов остаются еще для нас в значительной мере
неясными.
В ходе эволюции кишечного эпителия происходит совершенствование
процессов всасывания и внутриклеточного транспорта, возникает сложная
дифференцировка железистого аппарата и, наконец, возрастает интеграция
системы на основе ее непрерывного обновления. Вторым направлением
филогенетической дифференцировки кишечного эпителия является специа-
лизация клеток на процессы внутриклеточного пищеварения. Специализи-
рованный аппарат пино- и фагоцитоза сочетается у некоторых высших
первичноротых с процессами полостного пищеварения. Специфическую
функцию выполняет этот видоизмененный универсальный механизм вза-
имодействия клеток с внешней средой и во всасывающих клетках кишеч-
ного эпителия млекопитающих. Общий для многих групп многоклеточных
животных принцип системной интеграции на основе энергичного обнов-
ления кишечного эпителия имеет весьма мозаичное распространение и
характерен как для животных с полостным, так и с внутренним пищева-
рением. Поляризованные, с топографически выделенным камбием, эпи-
телиальные пласты характерны для представителей и низших и высших
позвоночных. Они встречаются у насекомых, ракообразных, моллюсков
и даже круглых червей. В случае кишечного эпителия наряду с доста-
точно четко выраженными общими для всех многоклеточных животных
тенденциями филогенетической дифференцировки их проявление слож-
нее и многообразнее, чем в некоторых других тканях многоклеточных
животных.
Еще более сложные отношения наблюдаются при филогенетической
дифференцировке кожных эпителиев. Внешне эти сложные отношения
проявляются в наличии у современных многоклеточных животных не-
скольких существенно различающихся разновидностей кожного эпителия.
В отличие от других типов тканей сходная функциональная задача при
выходе высших вторичноротых и первичноротых животных на сушу
«решалась» кожными покровами принципиально различными способами
п в химическом и в структурном отношениях. Таким образом, здесь
в виде редкого исключения имеет место дивергентная дифференцировка
покровов, поскольку кутикулярные эпителии наземных членистоногих
и многослойные кожные ороговевающие эпителии наземных позвоноч-
ных — принципиально различные тканевые системы. Тем не менее и
в случае кожных эпителиев мы имеем большое количество примеров про-
явлений общих тенденций их филогенетической дифференцировки. К ним
относятся: наличие у высших вторичноротых животных и у моллюсков
разновидностей кожных эпителиев, свойственных низшим многоклеточным
животным; проявление потенций к прогрессивной филогенетической диф-
ференцировке (ороговевающие многослойные эпителии и хитинопротеи-
новые кутикулярные эпителии) у более низко организованных животных
(костистые рыбы и круглоротые у позвоночных и полихеты и моллюски
у беспозвоночных). Весьма яркими примерами в этом отношении явля-
ются также независимое формирование эпикутикулы у представителей
различных классов членистоногих и комбинации сходных кератинов у мле-
копитающих, рептилий и птиц.
Таким образом, даже тканевые системы, непосредственно контакти-
рующие с внешней средой (кишечные и кожные эпителии) и в силу
этого подверженные наибольшей изменчивости, тем не менее характери-
383
зуются достаточно четко выраженными тенденциями направленной, огра-
ниченной определенными рамками специализации у разных групп мно-
гоклеточных животных.
В связи с этим можно с достаточным основанием говорить об универ-
сальном характере и доминирующем значении принципа параллелизма
в филогенетической дифференцировке на тканевом и клеточном уровнях
организации многоклеточных животных.
Одной из важных предпосылок теории параллельных рядов тканевой
эволюции было представление об исторической обусловленности филоге-
нетической гомологии основных типов тканей многоклеточных животных.
Однако уже в период разработки теории параллелизма были известны
многочисленные примеры формирования в ходе эволюции на разных ее
этапах так называемых вторичных и третичных тканей, образованных
тканевыми элементами другой функциональной специализации.
К настоящему времени резко увеличилось число примеров такой
смены функции отдельными популяциями клеток тканевой системы, ис-
ходно выполнявшей другую функцию. Удалось также значительно более
детально проследить характер изменения системных и особенно суб-
клеточных признаков морфобиохимической организации клеток во вторич-
ных и третичных тканевых системах. При этом оказалось, что во многих
случаях образуются специализированные клетки, идентичные или весьма
сходные со специализированными клетками, имеющими более древнее
в эволюции происхождение и другой источник развития. Особенно яркими
примерами такой «филогенетической метаплазии» могут служить сердеч-
ная мышечная ткань позвоночных, их вторичночувствующие клетки,
клетки осморегулирующих систем и многие другие вторичные и третич-
ные ткани или тканевые элементы.
Кроме того, в ряде случаев достоверно показана возможность сходной
специфической синтетической деятельности у клеток, специализирован-
ных в разных направлениях. Так, например, синтез коллагена и специ-
фических мукопротеидов могут осуществлять не только различные раз-
новидности сократимых тканей, но и базальные клетки эпителия роговицы
у млекопитающих или клетки мальпигиевых сосудов насекомых. Все эти
факты, несмотря на их кажущуюся парадоксальность, не являются не-
ожиданными в свете современных представлений о структурной иден-
тичности ДНК в геноме всех специализированных клеток. Приходится
скорее удивляться тому, что у современных многоклеточных доминирует
«тканевой принцип» организации на основе преимущественной гомологии
тканевых типов и несвойственная клеткам данного типа гетеросинтети-
ческая активность и филогенетические метаплазии являются лишь исклю-
чением из этой общей закономерности. Очевидно, что такая ситуация
обусловливается наличием каких-то еще совершенно неясных для нас ре-
гулятивных надклеточных механизмов, которые специфически блокируют
мультифункциональные потенции ядерных аппаратов клеток. Степень та-
кой блокировки при разных типах специализации клеток различна. Наи-
более легко, по-видимому, деблокируются участки генома клеток, специа-
лизация которых основана исключительно на гипертрофии общих для всех
клеток морфобиохимических систем типа сократимых белков, мембранных
структур, связанных с процессами активного транспорта, и других анало-
гичных систем. Несмотря на возможность передифференцировки клеток
в ходе исторического развития, биологические свойства возникающих
в результате таких процессов вторичных или третичных тканей могут
существенно отличаться от биологических свойств более древпих функ-
ционально аналогичных тканей. Это особенно ярко можно показать на
примере сердечных и соматических мышечных тканей. Очевидно, что
такие глубокие различия отражают в данном случае значение историче-
ского момента, т. е. сдвига в ходе развития взаимоотношений регулятив-
ных надклеточных механизмов с генетическим аппаратом клеток.
384
Одним из наиболее интересных и перспективных следствий теории па-
раллелизма на современном этапе ее развития является то, что аналогич-
ные тканевые структуры и ткани в целом, как в пределах гомологичных
типов, так и при их филогенетической метаплазии разной степени древ-
ности, не идентичны. Они представляют собой структурные, химические
и системные модификации, более или менее различные между собой. Эти
различия являются в конечном счете результатом проявления активности
сходных участков генома или, скорее, сходных тенденций его изменений,
реализованных в различных условиях внутриклеточной и системной ин-
теграции.
Отсюда следует, что целенаправленное комплексное изучение прояв-
лений общих тенденций филогенетической дифференцировки во всем их
многообразии у разных групп животных дает весьма ценный материал
для глубоких обобщений в понимании закономерностей филогенетиче-
ской дифференцировки на суборганизменных уровнях организации.
Такие обобщения в отношении отдельных функциональных типов
клеток и разновидностей тканей уже делаются в настоящее время пре-
имущественно, однако, на клеточном и субклеточном уровнях организа-
ции. Особенно убедительными и глубокими оказываются они при нали-
чии планомерной целенаправленной разработки отдельных частных
систем на основе сравнительного метода по принципу функциональной ана-
логии. Примерами таких исследований и обобщений являются работы по
рецепторным приборам (Винников, 1971) или работы по хрящевым
тканям первичноротых животных (Person, Philpott, 1969а, 1969b).
Из всего сказанного выше со всей очевидностью следует, что специали-
зация клеток и выделяемых ими межклеточных структур, а также услож-
нение тканевых систем в целом в ходе эволюции происходит не беско-
нечно разнообразными путями у разных животных: все эти процессы
подчинены определенному общему для разных групп животных порядку,
причем определяющим моментом в процессах филогенетической дифферен-
цировки на этих уровнях организации является функциональный момент.
В настоящее время речь идет уже не только о констатации этой об-
щей закономерности или выявлении новых примеров цитологических и
гистологических параллелизмов. Углубленный анализ внутриклеточных
и системных механизмов реализации сходной функциональной специали-
зации клетками и тканями разных групп животных оказывается весьма
плодотворным в разработке общих проблем дифференцировки клеток
и тканей многоклеточных животных. Такой подход существенно допол-
няет весьма тонкие, но в известной мере односторонние молекулярно-био-
логические работы по этой проблеме, проводимые лишь на ограничен-
ном круге объектов.
Повышенный интерес к сравнительной частной цитологии и гистоло-
гии в этом плане определяется еще и тем обстоятельством, что общие за-
кономерности организации и тенденции филогенетической дифференци-
ровки обнаруживаются не только у функционально аналогичных клеток
и тканей. Сейчас уже можно привести большое число примеров общих
закономерностей организации и филогенетической дифференцировки
структур в различных в функциональном отношении тканях. Одним из
примеров может служить определяющее значение для филогенетической
и функциональной пластичности внеклеточных структур контактного
и химического взаимодействия с соответствующими специализированными
клетками. Такое взаимодействие характерно и для рыхлой, и для плотной
соединительной ткани, для всех скелетных разновидностей тканей внут-
ренней среды и для разнообразных кутикулярных эпителиев, включая
такие их разновидности, как кутикулярные эпителии паразитических
червей. При этом можно предполагать, что дело здесь заключается в на-
личии каких-то общих универсальных закономерностей в тонких меха-
низмах такого взаимодействия на молекулярном и надмолекулярном
*/4 25 А. А. Заварзин
385
уровнях организации межклеточного вещества, несмотря на оолыпое его
химическое разнообразие в приведенных выше объектах. О правомоч-
ности поиска таких механизмов свидетельствуют данные о существенном
влиянии клеток на ориентировку оссеиновых волокон в пластинчатой
костной ткани и на ориентировку хитинопротеиновых пластин в кути-
куле насекомых.
Широкое распространение в различных модификациях имеет, по-ви-
димому, и принцип системной клональной организации камбиальных об-
новляющихся тканей. Этот принцип организации камбиальных тканей
достаточно убедительно показан в отношении тканей внутренней среды
и в отношении сперматогенного эпителия млекопитающих, и в отноше-
нии корешков проростков растений, т. е. весьма различных по происхож-
дению и функции тканевых и клеточных систем. Большие биологические
преимущества такого принципа организации камбиальных тканей дают
веские основания предполагать наличие широкого распространения этого
принципа организации в тех или иных модификациях во всех камбиаль-
ных системах, характеризующихся достаточно энергичным обновлением
своего клеточного состава.
Достаточно ярко и многообразно проявляется в организации и функ-
циональной деятельности различных тканей сочетание противоположных
по своему биологическому значению процессов.
Наиболее простыми и тривиальными примерами в этом отношении
будут соотношение процессов дифференциации и репродукции клеток или
процессов разрушения и образования костной ткани с ее единой системой
костеобразующих и разрушающих кость клеток.
Более сложные отношения наблюдаются между анаболическими и
катаболическими процессами в кутикулярных эпителиях насекомых и
некоторых нематод при линьке, между процессами транспортировки и ре-
абсорбции веществ в разных отделах осморегулирующих и выделитель-
ных канальцев. Еще более сложным и весьма иллюстративным примером
в этом отношении может служить лимфоидная ткань. Ее удивительная
пластичность и строгая адекватность реакции па антигенный стимул
основаны на работе жестко однозначно детерминированных клеточных
элементов. Если справедливы представления некоторых авторов о сома-
тических мутациях (см. обзор: Ашмарин, 1975) как основном источнике
многообразия иммунокомпетентных клеток, то создается весьма пара-
доксальная ситуация. Основная гомеостатическая регулятивная система
для борьбы с соматическими мутациями у позвоночных, оказывается, сама
создается на основе соматических мутаций.
Весьма демонстративным примером наличия общих принципов функ-
циональной организации на уровне интегрирующих систем организма
является та глубокая биологическая аналогия, которая наблюдается
между такими различными с гистологической точки зрения системами
как нервная и лимфоидная системы высших позвоночных животных
(Jerne, 1973). Обе системы осуществляют интегрирующую функцию на
основе рефлекторной реакции, они обучаются в онтогенезе и обладают
свойством «памяти». Системы эти, хотя и на основе разных механизмов,
имеют универсальное распространение в организме и непрерывно полу-
чают и перерабатывают информацию из внутренней и внешней для ор-
ганизма среды. Они претерпевают при этом существенные изменения
либо в своем клеточном составе, либо в морфобиохимических сдвигах
в стабильных клеточных популяциях.
Среди общих закономерностей филогенетической дифференцировки на
системном уровне организации многоклеточных животных особое значе-
ние имеет усиление у высших животных роли надсистемных, межткане-
вых корреляций. Более севершенное и дифференцированное в количе-
ственном и даже в качественном отношении функционирование тканей
высших животных по сравнению с аналогичными тканями низших жи-
386
вотных обусловливается не столько усложнением морфобиохимической
организаций клеток и межклеточных структур, сколько путем усложне-
ния межтканевых корреляций.
Способность осморегулирующих и выделительных эпителиев высших
позвоночных и насекомых вырабатывать гипертонические по отношению
к тканевой жидкости продукты выделения обусловливается механизмами
межтканевых корреляций, выходящих уже за рамки внутритканевых
взаимоотношений. Значение таких надсистемных механизмов отчетливо
прослеживается на железистых эпителиях. Особенно наглядно это можно
видеть на примере щитовидной железы, надпочечника и аденогипофиза
в ряду позвоночных. Аналогичные отношения в прегрессивном усложне-
нии эндокринных желез имеют место и в ряду первичноротых.
Усиление значения межтканевых корреляций показано на кожных
эпителиях млекопитающих и птиц, где подлежащая соединительная ткань
в гистогенезе эпидермиса определяет и направление процессов дифферен-
цировки, и сам характер нормальных взаимоотношений между репродук-
цией и дифференцировкой клеток в эпителиальном пласте. Весьма
демонстративно также включение в эпидермис высших позвоночных
системы пигментных клеток — меланоцитов и образование смешанных по
происхождению клеток многослойных пласт.ов со сложными взаимоотно-
шениями между этими разнородными субпопуляциями. Качественная
особенность кишечных эпителиев высших позвоночных обусловливается
в значительной мере образованием микроорганных структур слизистой
оболочки. Само же возникновение этих структур связано с усилением и
усложнением взаимодействия между эпителием и подлежащей соедини-
тельной тканью и находящимися в последней сосудами, нервными и
мышечными клеточными элементами. В создании таких сложных систем,
как лимфоидная ткань позвоночных, ведущая роль принадлежит меж-
ткапевым взаимодействиям, поскольку наведение иммунокомпетентности
па полустволовые клетки лимфоидной ткани обеспечивается эпителиаль-
ной стромой центральных органов иммунитета.
Таким образом, совокупность имеющихся в настоящее время фактов
в области сравнительной гистологии свидетельствует о том, что выясне-
ние закономерностей преобразования в филогенезе механизмов надтка-
невого уровня организации многоклеточных животных, уровня, занимаю-
щего промежуточное положение между органпым и тканевым уровнем
организации, имеет принципиально важное значение для разработки об-
щих проблем эволюционной гистологии. Именно преимущественно на
этом уровне организации преодолевается известное противоречие между
относительной консервативностью и ограниченностью потенций специали-
зированных клеток и других тканевых элементов и прогрессивной эво-
люцией многоклеточных животных. При этом имеющиеся в настоящее
время факты (к сожалению, весьма ограниченные, особенно в отношении
первичноротых животных) позволяют прийти к выводу, что и на уровне
надсистемных межтканевых корреляций широко распространен принцип
параллельного усложнения их в филогенезе многоклеточных животных.
Проявление этих общих закономерностей на рассматриваемом уровне,
естественно, еще более сложное и многообразное, чем на клеточном и
чисто тканевом уровнях организации.
*/2 25 А- А- Заварзин
ЛИТЕРАТУРА
Анисимов A. IL, Н. П. Токмакова, Л. Н. У ш е в а. 1974. Пролиферация и
рост кишечного эпителия Ascaris suum. III. — Онтогенез, 5:43—52.
Ашмарин И. П. 1975. Загадки и откровения биохимии памяти. Изд. ЛГУ.
Балашов Ю. С. 1967. Кровососущие клещи (Ixodoidea) — переносчики болезней
человека и животных. «Наука», Л.
Беклемишев В. Н. 1964. Основы сравнительной анатомии беспозвоночных, т. IL
«Наука», М.
Б е н д о л л Дж. Р. 1970. Мышцы, молекулы и движение. «Мир», М.
Бернет Ф. 1972. Клеточная иммунология. «Мир», М.
Би л у ди В. П., В. В. Ширяев. 1974. Белки тромбоцитов. — Усп. совр. биол., 78:
371—384.
Богач П. Г. 1974. Гладкомышечная клетка. — В кн.: Физиология пищеварения.
«Наука», Л.: 91—119.
Б о р о в я г и н В. А., Д. А. Сахаров. 1968. Тонкая структура гигантских нейронов
у тритонии. «Наука», М.
Б р о н д з Б. Д. 1972. Иммунологическое распознавание и механизмы тканевой не-
совместимости. — В кн.: Клеточные основы иммунитета. «Медицина», М.:
45-58.
Бронштейн А. А. 1972. Структурная организация периферических отделов обо-
нятельного анализатора и обонятельной луковицы. — В кн.: Физиология сен-
сорных систем. «Наука», Л.: 515—529.
Васильев А. Е. 1970. О локализации синтеза терпеноидов в растительной
клетке.— Растительные ресурсы, 5:29—41.
Винников Я. А. 1971. Цитологические и молекулярные основы рецепции.
«Наука», Л.
Виноградов В. В., Н. Ф. Воробьева. 1973. Тучные клетки. «Наука», Новоси-
бирск.
Воробьев В. А., Н. Л. Л е й б с о н. 1974. Цитофотометрическое исследование
эпителия кардиального желудка морской звезды. — Цитология, 16: 1222—
1227.
Воробьева Э. И. 1975. К вопросу о соотношении хряща п кости в филогенезе
древнейших низших позвоночных. — Журн. общ. биол., 36 : 361—372.
Газарян К. Г., Ю. С. Ченцов, А. С. К у л ь м п н с к а я. 1967. Изменения в об-
мене РНК, белка и в ультраструктуре клеток системы «крипта—ворсинка»
(эпителий тонкой кишки). — Журн. общ. бпол., 28 : 198—207.
Галактионов В. Г. 1975а. Клеточные рецепторы иммунной системы. — Усп. совр.
биол., 80 : 84—101.
Галактионов В. Г. 19756. Естественная история иммунитета. — Природа, 12:
20—29.
Герловин Е. Ш. 1974. Секреторная клетка. — В кн.: Физиология пищеварения.
«Наука», Л.: 26—75.
Гиляров М. С. 1970. Закономерности приспособлений членистоногих к жизни
на суше. «Наука», М.
Гинецинский А. Г. 1966. Физиологические механизмы водно-солевого равнове-
сия. «Наука», М.—Л.
Глебов Р. Н. 1970. Биохимия синапсов. — Усп. совр. биол., 70 : 26—40.
Грасгоф В. М. 1976. Авторадиографическое и гистологическое исследование ки-
шечного эпителия балтийской миноги. — Арх. анат., гистол. и эмбпиол. 70:
20—26.
Грачева Н. Д. 1968. Авторадиография синтеза нуклеиновых кислот и белков
в нервной системе. «Наука», Л.
Грибакин Ф. Г. 1969. Ультраструктурная организация фоторецепторов насеко-
мых. — Труды Всесоюзн. энтомол. общества, 53 : 238—273.
Димент А. В., Г. С. Лебедева. 1973. Особенности обновления клеток эпителия
роговицы у крыс.— Арх. анат., гистол. и эмбриол., 65:51—54.
Догель А. С. 1888. К вопросу об отношении нервных элементов в сетчатой обо-
лочке глаза осетровых рыб, рептилий, птиц и млекопитающих животных. —
Врач, 26 :1—18.
Догель В. А. 1959. Зоология беспозвоночных. «Сов. наука», М.
388
Домашевская Е. И., Е. В. Медвецкий. 1975. Авторадиографический анализ
синтеза сульфатированных глюкозаминогликанов и белков коллагенового
типа клетками надкостницы растущей кости и костного регенерата. —
В кн.: Дифференцировка клеток в гисто- и органогенезах. «Наукова думка»,
Киев : 107—112.
Елисеев В. Г., Н. А. Юрина, Ю. И. Афанасьев. 1972. Гистология. «Меди-
цина», М.
Ефремова С. М., Н. С. Никитин. 1973. Формообразовательные потенции раз-
личного размера конгломератов соматических клеток пресноводной губки Ephy-
datia jluviatilis (L.). — В кн.: Морфологические процессы при бесполом раз-
множении, соматическом эмбриогенезе и регенерации. Изд. ЛГУ : 97.
Жинкин Л. Н. 1959. Белковый и нуклеиновый обмен в процессе физиологической
регенерации многослойного плоского эпителия языка. — В кн.: Радиоактивные
индикаторы в гистологии (Труды ИЭМ АМН СССР). Л.: 68—81.
Ж и н к и н Л. Н., Г. А. Д у б и н к о. 1964. Синтез РНК и белка при регенерации
скелетной мускулатуры. — Матер. IV конф, по вопросам регенерации и кле-
точного размножения. М.: 50.
Жинкин Л. Н., В. К. Нилова, С. А. Комаров. 1975. Синтез ДНК в ядрах
личиночных межсегментных мышц тутового шелкопряда. — В кн.: Диф-
ференцировка клеток в гисто- и органогенезах. «Наукова думка», Киев : 155—
160.
(Жинкин Л. Н., П. П. Румянцев) Zhinkin L. N., Р. Р. Rumyantzev. 1970.
La synthese de 1’ADN et 1’ARN au course du developpement de la muscula-
ture somatique tissu et du muscle cardiaque. — In: Recent adv. in anat.- res.
in USSR. Moscou : 178—191.
Житников А. Я. 1975. Некоторые особенности пролиферации и метаболизма
хондроцитов метафизов скелета конечностей растущих животных. —
В кн.: Дифференцировка клеток в гисто- и органогенезах. «Наукова думка»,
Киев : 116—123.
Заварзин А. А. 1913. Гистологические исследования чувствительной нервной си-
стемы и оптических ганглиев насекомых. С.-Петербург.
(Заварзин A. A.) Z a w а г z i n А. А. 1924. Zur Morphologie der Nervenzentren. —
Z. wiss. Zool, 122 : 322—434.
(Заварзин A. A.) Zawarzin A. A. 1925. Der Parallelismus der Strukturen als
ein Grundprinzip der Morphologie. — Z. wiss. Zool., 124: 118—130.
Заварзин A. A. 1934. Об эволюционной динамике тканей. — Арх. биол. наук, 36:
118—130.
Заварзин А. А. 1941. Очерки эволюционной гистологии нервной системы. — Из-
бранные труды, т. 3. Изд. АН СССР, М.—Л., 1950.
Заварзин А. А. 1945, 1947. Очерки эволюционной гистологии крови и соедини-
тельной ткани. — Избранные труды, т. 4. Изд. АН СССР, М.—Л., 1953.
Заварзин А. А. 1967. Синтез ДНК и кинетика клеточных популяций в онтоге-
незе млекопитающих. «Наука», Л.
Заварзин А. А. 1972. Некоторые итоги и перспективы исследования кинетики
клеточных популяций в гистогенезе эпителиальных тканей млекопитающих. —
В кн.: Механизмы регуляторных процессов. Изд. ЛГУ: 90—116.
Заварзин А. А. 1973. Исследование кутикулярного эпителия приапулид при цик-
лических изменениях, связанных с линькой. — Арх. анат., гистол. и эмбриол.,
65 : 30—37.
Иванов А. В., Ю. В. Мамкаев. 1973. Ресничные черви, их происхождение и
эволюция. «Наука», Л.
Иванов В. П. 1966. Ультраструктурная организация хеморецепторных сенсилл
антенн жука-плавунца Acilius sulcatus. — Журн. эвол. биохим. и физиол.,
2 :464—472.
Иванов В. П. 1969. Ультраструктурная организация хеморецепторов насекомых. —
Труды Всесоюзн. энтомол. общества, 53 : 301—333.
И т и н а Н. А. 1974. Нервно-мышечный аппарат иглокожих и хордовых. — В кн.: Раз-
витие сократительных функций мышц двигательного аппарата. «Наука», Л.:
229—290.
Каганове кая Э. А. 1973. Исследование кишечного эпителия полихеты Areni-
cola marina. — В кн.: Механизмы биологических процессов. Изд. ЛГУ: 57.
Карамян А. И. 1976. Эволюция конечного мозга позвоночных. «Наука», Л.
Катц Б. 1966. Как клетки общаются друг с другом. —В кн.: Живая клетка. «Мир»,
М.: 164—181.
К е р к и с А. Ю., Н. Б. Христолюбова. 1974. О временном и пространственном
разобщении синтезов в процессе хондрогенеза. — Онтогенез, 5 : 303—306.
Кинд Т. В. 1968. Функциональная морфология нейросекреторных систем
насекомых при активном развитии и при различных типах диапаузы. —
В кн.: Фотопериодическая адаптация у насекомых и клещей. Изд. ЛГУ:
153—191.
Киршенблат Я. Д. 1971. Общая эндокринология. «Высшая школа», М.
Кроленко С. А. 1975. Т-система мышечных волокон. «Наука», Л.
25*
389
Кульминская А. С., С. М. Безручко, К. Г. Газарян. 1968. Синтез ДНК,
РНК и белка при дифференцировке кишечного эпителия некоторых предста-
вителей позвоночных животных. — Цитология, 10 : 1257—1268.
Кучко В. В. 1975. Морфология и кинетика клеточной репродукции эпителия пи-
щеварительного тракта асцидий. — Тез. конфер. молодых ученых морфоло-
гов г. Ленинграда 28 апреля 1975 г. «Медицина», Л.: 37—38.
(Лазаренко Ф. М.) Lazarenko F. М. 1925. Beitrage zur vergleichenden Histo-
logie des Blutes und des Bindegewebes. — Z. mikr.-anat. Forschung, 3:409—499.
Ланге M. A., H. Г. Хрущев. 1973. О существовании двух популяций фибробла-
стов рыхлой соединительной ткани. — Журн. общ. биол., 34 : 752—757.
Ланская А. Б. 1974. Авторадиографическое исследование кинетики клеточных
популяций в эпителии тонкой кишки и печени травяной лягушки. — Цитоло-
гия, 16 : 329—334.
Лебский В. К. 1974а. Тонкое строение протонефромиксий полихеты Eulalia vi-
ridis. I. Материалы к вопросу о функции протонефридиев. — Цитология, 16:
685—689.
Лебский В. К. 19746. Тонкое строение кутикулярного эпителия Priapulus cau-
datus в процессе линьки. — Цитология, 16 : 903—907.
Ленинджер А. 1974. Биохимия. «Мир», М.
Лурия Е. А. 1972. Кроветворная и лимфоидная ткани в культурах. «Медицина», М.
Мазуров В. И. 1974. Биохимия коллагеновых белков. «Медицина», М.
Мандельштам Ю. Е., В. Л. Свидерский. 1974. Мышечный аппарат члени-
стоногих. — В кн.: Развитие сократительной функции мышц двигательного
аппарата. «Наука», Л.: 193—228.
Мезенцев А. Н., О. В. Мессинова. 1971. Транспорт аксоплазмы и биосинте-
тические процессы в аксоне. — Усп. совр. биол., 72 : 62—75.
Мовчан О. Т., Н. Л. Л е й б с о н, Л. Т. Фролова. 1971. О локализации проли-
феративного процесса в кишке нескольких видов беспозвоночных. — Научп.
сообщ. Инет, биологии моря ДВНЦ АН СССР, 2. Владивосток: 152—157.
Мовчан О. Т., Н. Л. Л е й б с о н. 1973. Клеточное размножение в жабрах моллю-
сков разных классов. — Журн. общ. биол., 34 : 425—434.
Наследов Г. А., Н. Ф. Скоробовичук. 1974. Нервно-мышечный аппарат чер-
вей. — В кн.: Развитие сократительной функции мышц двигательного аппа-
рата. «Наука», Л.: 136—155.
Наточин Ю. В. 1974. Физиология почки. «Наука», Л.
Н е в м ы в а к а Г. А. 1966. Нервная система дождевого червя. «Наука», М.—Л.
Н е з л и н Р. С. 1972. Строение и биосинтез антител. «Медицина», М.
Носсаль Г. 1974. Антитела и иммунитет. «Мир», М.
Обухова Е. В. 1975. Авторадиографическое исследование динамики клеточных
популяций эпителия пищеварительной железы и его некоторых производ-
ных у голожаберного моллюска Coryphella rufibranchialis. — Цитология, 17:
917—923.
Островский М. А., И. Б. Федорович, И. Н. Голубев. 1967. Некоторые
аспекты биофизики фоторецепции. — Биофизика, 12 : 877—892.
Оте лин А. А., В. Ф. Маш ан с кий, А. С. Миркин. 1976. Тельца Фатер—Пачини.
«Наука», Л.
Паллас Д., С. Ваксман. 1973. Ультраструктура синапсов. — В кн.: Физиоло-
гия и фармакология синаптической передачи. «Наука», М.: 7—30.
Певзнер Л. 3. 1972. Функциональная биохимия нейроглии. «Наука», Л.
Пермяков Н. К., А. Е. Подольский, Г. П. Титова, 1973. Ультраструктурный
анализ секреторного цикла поджелудочной железы. «Медицина», М.
Петров Р. В. 1970. Формы взаимодействия генетически различающихся клеток
лимфоидных тканей (трехклеточная система иммуногенеза). — Усп. совр.
биол., 69:261—271.
Петров Р. В. 1976. Т- и В-лимфоциты. — В кн.: Итоги науки и техники по био-
логии. Серия «Общие вопросы патологии», 4. ВИНИТИ, М.
Питерс А., С. Палей, Г. Уэбстер. 1972. Ультраструктура нервной системы.
«Мир», М.
Плотникова С. И. 1975. О чувствительном нейропиле ганглиев брюшной цепочки
саранчи. — Труды Ленинградск. общ. энтомологов, 65 : 5—21.
Поленов А. Л. 1968. Гипоталамическая нейросекреция. «Наука», Л.
Поленов А. Л. 1974. О жизненном пути и секреторном цикле нервно-секретор-
ных клеток гипоталамуса. — Арх. анат., гистол. и эмбриол., 67 : 5—19.
Проссер А. П., Ф. Браун. 1967. Сравнительная физиология животных. «Мир», М.
Пунин М. Ю. 1975. Авторадиографическое и цитохимическое исследование орга-
низации эпителия трубочки пищеварительной железы моллюска Муа аге-
naria. Матер. XVII конфер. студентов и аспирантов морфологических кафедр
и лабораторий ленинградских вузов и научно-исследовательских институтов.
«Медицина», Л. : 26—27.
Райхель А. С. 1975. Электронномикроскопическое изучение внутриклеточного пи-
щеварения в кишечных клетках иксодового клеща Hyalomma asiaticum. —
Цитология, 17 : 748—751.
390
Румянцев А. В. 1958. Опыт исследования эволюции хрящевой и костной тканей.
«Медицина», М.
Румянцев П. П. 1964. Авторадиографическое исследование синтеза ДНК и де-
ления ядер в эмбриональном и постнатальном гистогенезе мышцы сердца.—
Арх. анат., гистол. и эмбриол., 47 : 59—65.
(Румянцев П. П.) Rumyantsev Р. Р. 1970. DNA synthesis and mitosis in atrial
myocytes of rats with aortal stenosis. — Experientia, 26 : 773—774.
Румянцев П. П. 1972. Электронномикроскоппческий анализ дедифференцировки
и митотического деления миоцитов предсердия при массивном инфаркте мио-
карда левого желудочка. — Арх. анат., гистол. и эмбриол., 62 : 115—121.
(Румянцев П. П.) Rumyantsev Р. Р. 1973. Post injury DNA synthesis, mitosis
and ultrastructural reorganization of adult frog cardiac myocytes. — Z. Zellforsch.,
139 :431—450.
Сахаров Д. A. 1974. Генеалогия нейронов. «Наука», M.
Светлов П. Г. 1957. О первичной гетерономии состава тела позвоночных. — Арх.
анат., гистол. и эмбриол., 34 : 3—22.
Светлов П. Г. 1959. Субституции при образовании зародышевых листков.—
Труды Инет, морфол. животных АН СССР, 27 :26—40.
Светлов П. Г. 1962. К анализу понятий параллелизма и дивергенции. —
В кн.: Вопросы общей экологии и медицинской паразитологии. «Медгиз»,
М.: 215—228.
Светлов П. Г. 1967. Соотношение морфологических осей в онто- и филогенезе
разных групп животных. — Журн. общ. биол., 28 : 567—579.
Свидерский В. Л. 1973. Нейрофизиология полета саранчи. «Наука», Л.
Северцов А. Н. 1934. Главные направления эволюционного процесса. «Биомед-
гиз», М.
Серговская Т. В. 1973. Клеточный состав и кинетика репродукции клеток
в кожном эпителии полихеты Arenicola marina. — В кн.: Механизмы биологи-
ческих процессов. Изд. ЛГУ : 76.
Сидорова Е. В. 1974. Механизмы синтеза и секреции иммуноглобулинов. — Усп.
совр. бпол., 78 : 234—254.
Скоробовичук Н. Ф. 1974. Нервно-мышечный аппарат моллюсков. — В кн.: Раз-
витие сократительной функции мышц двигательного аппарата. «Наука», Л.:
156—192.
Слуцкий А. И. 1972. Биохимия регенерата кости как специфической разновид-
ности грануляционно-фиброзной ткани. — В кн.: Механизмы регенерации кост-
ной ткани. «Медицина», М.
Тимофеев В. А. 1964. Строение кутикулы Schistocephalus pungitii на разных
фазах его развития в связи с особенностями питания цестод. — В кн.: Элек-
тронная и флуоресцентная микроскопия клетки. «Наука», М.: 50—60.
Тимофеев В. А., Б. И. К у п е р м а н. 1972. Возникновение и формирование ми-
тохондрий у цестод на примере Triaenophorus nodulosus. — ДАН СССР, 207:
757—759.
У г о л е в А. М. 1972. Мембранное пищеварение. Полисубстратные процессы, орга-
низация и регуляция. «Наука», Л.
Уилсон Д. 1974. Тело и антитело. «Мир», М.
(Фриденштейн А. Я.) Friedenstein A. J. 1973. Determined and in-
ducible osteogenic precursor cells. Ciba Foundat. Sympos. (new series), 11 :
169—181.
Фри д енштейн А. Я., К. С. Лалыкина. 1973. Индукция костной ткани и остео-
генные клетки предшественники. «Медицина», М.
Фриденштейн А. Я., И. Л. Чертков. 1968. Стволовая лимфоидная клетка п
ее дифференцировка. — Усп. совр. биол., 66:87—101.
Фриденштейн А. Я., И. Л. Чертков. 1969. Клеточные основы иммунитета.
«Медицина», М.
X л о п и н Н. Г. 1946. Общебиологические и экспериментальные основы гистологии.
Изд. АН СССР, М.
X р у щ о в Н. Г. 1969. Функциональная цитохимия рыхлой соединительной ткани.
«Наука», М.
X р у щ о в Н. Г. 1974. Проблема происхождения фибробластов в постнатальном
онтогенезе млекопитающих. — Онтогенез, 5 : 3—12.
Цвиленева В. А. 1970. К эволюции туловищного мозга членистоногих. «Наука», Л.
Черкасов В. В. 1975. О видовых различиях в дифференцирующихся хондроци-
тах. — В кн.: Дифференцировка клеток в гисто- и органогенезах. «Наукова
думка», Киев : 137—141.
Черкасова И. Б. 1975. О способности остеоцитов растущей кости к биосинтезу
белков коллагенового типа. — В кн.: Дифференцировка клеток в гисто- и орга-
ногенезах. «Наукова думка», Киев : 142—145.
Чертков И. Л., А. Я. Фриденштейн. 1972. Кооперативное взаимодействие
клеток при иммунном ответе. — Усп. совр. биол., 74 : 292—307.
Шубникова Е. А. 1974. Лекции по гистологии. Изд. МГУ.
391
А к е г t К., II. Moor, К. Pfenninger, С. S a n d г i. 1969. Contribution of new im-
pregnation methods and freeze- etching to the problems of synaptic fine struc-
ture. — Progr. Brain Res., 31 : 223—240.
Akert К., K. Pfenninger. 1969. Synaptic fine structure and neural dynamic.
In: Cellular dynamics of the neuron, 8. N. Y.—London : 245—263.
Alexander N. J. 1970. Comparison of a- and P-keratin in reptiles. — Z. Zellforsch.,
110: 153—165.
Alexander N. J., P. F. Parakkal. 1969. Formation of a- and fl-type keratin
in lizard epidermis during the molting cycle. — Z. Zellforsch., 101 : 72—87.
Allen T. D., C. S. P otten. 1974. Fine-structural identification and organization of
the epidermal proliferative unit. — J. Cell Sci., 15:291—319.
A It n er H. 1968. Die Ultrastruktur der Labialnephridien von Onychiurus quadriocel-
latus (Collembola). — J. Ultrastruct. Res., 24 : 349—366.
Amsellem I., G. Nicaise. 1976. Distribution of the glio-interstitial system in Mol-
luscs. — Cell and Tissue Res., 165 :174—184.
Andrew W. 1959. Textbook of comparative histology. N. Y.
Anya A. 0. 1966a. The structure and chemical composition of the nematode cuticle.
Observation on some Oxyurids and Ascaris. — Parasitol., 56: 179—198.
Anya A. O. 1966b. Localization of ribonucleic acid in the cuticle of Nematodes.—
Nature, 209: 827—828.
Armitage P., A. Miller, C. D. Roger, R. T. Frege ar. 1972. The structure
and function of insect muscle. — Cold Spring Harbor Sympos. Quant. Biol., 37 :
379—387.
Ashhurst D. E. 1968. The connective tissues of insects. — Ann. Rev. Entomol.,
13 :45—74.
A s h h u r s t D. E., N. M. С о s t i n. 1974. The development of a collagenous connec-
tive tissue in the locust Locusta migratoria. — Tissue and Cell, 6 : 279—301.
Atwood H. L., C. A. Wiersma. 1967. Command interneurons in the crayfish cen-
tral nervous system. — J. Exper. Biol., 46:246—261.
Auber I. 1967. Distribution of two kinds of myofilaments in insect muscle. — Amer.
Zoologist, 7 : 451—456.
Auber I. 1969. La myofibrillogenese du muscle strie. II. Vertebres. — J. Microscopie,
8 : 367—390.
Auerbach R., L. N. Ruben. 1970. Studies in antibody formation in Xenopus lae-
vis. — J. Immunol., 104 : 1242—1246.
Baccetti В., E. Bigliardi. 1969. Studies of the fine structure of the dorsal
vessel of Arthropod. — Z. Zellforsch., 99 : 13—36.
Baccetti B., F. Rosati. 1971. Electron microscopy on tardigrades. III. The inte-
gument. — J. Ultrastruct. Res., 34 : 214—243.
Baculi B. S., E. L. Cooper. 1967. Lymphomyeloid organs of Amphibia. II. — J. Mor-
phol, 123 :463—479.
Baculi B. S., E. L. Cooper. 1973. Lymphoid changes during antibody synthesis
in larval Rana catesbeiana. — J. Exper. Zool., 183: 185—192.
Bagby R. M. 1966. The fine structure of myocytes in the sponges. — J. Morphol.,
И8 : 167—181.
Bagby R. M. 1970. The fine structure of pinacocytes in the marine sponge Micro-
ciona prolifera. — Z. Zellforsch., 105 : 579—594.
В ain t on D. F., M. G. Farquhar. 1966. Origin of granules in polymorphonuclear
leucocytes. — J. Cell Biol., 28 : 277—285.
В a i n t о n D. F., M. G. Farquhar. 1970. Segregation and packaging of enzymes
granules in eosinophilic leucocytes. — J. Cell Biol., 45 : 54—67.
Baldessurini K. J. 1973. Biochemical physiology of central synapses. — Ann. Rev.
Physiol., 35 : 273—304.
Bang F. B. 1967. Defense reactions in invertebrate. Summary. — Feder. Proc., 26:
1713—1715.
Bantz M., C. Michel. 1971. Revetement cuticulaire de la gaine de la trompe chez
Glycera convoluta Keferstein (Annelides, Polychetes).— Z. Zellforsch., 118:
221—242.
Bargmann W. 1972. Zur Architektur der Mesoglea. Untersuchungen an der Rippen-
qualle Pleurobranchia pileus. — T. Zellforsch., 123:66—81.
Barnes M. I. 1973. Biochemistry of collagens from mineralized tissues. — In: Ciba
Foundat. Sympos. (new series), 11:247—261.
Barth F. G. 1969. Die Feinstruktur des Spinneninteguments. I. Die Cuticula des Lauf-
beins adulter hautungsferner Tiere (Cupiennius salei Keys). —Z. Zellforsch.,
97 : 137—159.
Baskin D. G. 1971. The fine structure of neuroglia in the central nervous system
of Nereid (Polychaetes). — Z. Zellforsch., 119:295—307.
Behnke O. 1968. An electron microscope study of the megacaryocyte of the rat bone
marrow. I. The development of the demarcation membran system and the pla-
telet surface coat. — J. Ultrastruct. Res., 24 : 412—433.
392
В eidler L. M., R. Small man. 1965. Renewal of cells within taste buds. — J. Cell
Biol., 27:263—272. i л1
Bennet M. V. 1968. Similarities between chemically and electrically mediated trans-
missions. — In: Physiological and biochemical aspects of nervous integration. New
Jersey: 73—128. c к ъ ,
Bennett G., С. P. L e b 1 о n d. 1970. Formation of cell coat material tor the whole
surface ’of columnar cells in the rat small intestine, as visualized by radioauto-
graphy with l-fucose-3H. — J. Cell Biol., 46:409—416.
Berg N В RW Young. 1971. Sulphate metabolism in pancreatic acinar cells. —
J. Cell Biol., 50:469-483. „ „ ,
В e r r i d g e M. J., J. L. О s c h m a n. 1969. A structural basis for fluid secretion of
malpighian tubules. — Tissue and Cell, 1 : 247—272.
В e r r i d g e M. J., J. L. О s c h m a n. 1972. Transporting epithelia. London—N. Y.
Best J. В., M. Morita, J. Noel. 1968. Fine structure and function of Planarium
goblet cells. — J. Ultrastruct. Res., 24 : 385—397.
BiegerW. A., Martin-Achard, M. Basslei, H. F. Kernt. 1976. Studies on in-
tracellular transport of secretory proteins in the rat exocrine pancreas. — Cell
and Tissue Res., 165 : 435—453.
Bindreiter M., J. Schuppler, L. Stockinger. 1968. Zellproliferation und
Differenzierung im Trachealepithel der Ratte. — Exper. Cell Res., 50 : 377—382.
Bird A. F., I. Bird. 1969. Skeletal structures and integument of Acanthocephala and
Nematoda. — Chem. Zool., 3 : 253—288.
Bird A. F., A. E. Rogers. 1965. Ultrastructure of the cuticle and its formation
in Meloidogyne javanica.— Nematologica, 11:224—230.
Blenkinsopp W. K. 1967. Mast cell proliferation in adult rats.— J. Cell Sci., 2:
33—37.
В о d 1 e у H. D., K. L. Wood. 1972. Ultrastructural studies on elastic fibres using
enzymatic digestion of thin sections. — Anat. Rec., 172 : 71—88.
Boer H. H., H. A. Noor, A. W. L о m m e r s e. 1973. Ultrastructure of possible sites
of ultrafiltration in some Gastropoda, with particular reference to the auricle
of the freshwater Prosobranch Viviparus viviparus L. — Z. Zellforsch., 153:
329—341.
В о i 11 у В. 1967. Contribution a I’etude ultrastructurale de la cuticule epidermique
et pharyngienne chez une annelide polychete Syllis arnica (Quatrefages).—
J. Microscopie, 6 : 469—484.
В о illy В. 1970. Presence de collagene dans le proventricule des Syllidiens (Anneli-
des, Polychetes). — Z. Zellforsch., 103 : 265—281.
В о illy В. 1974. Ultrastructure des hematies anuclees de Magelona papillicornis.—
J. Microscopie, 19 : 47—58.
Bonaventura J., C. Bonaventura, B. Sullivan. 1975. Hemoglobins and he-
mocyanins comparative aspects of structure and functions. — J. Exper. Zool.»
194 : 155—174.
В о n g a S. E., H. H. Boer. 1969. Ultrastructure of the reno-pericardial system in the
pond snail Lymnaea stagnalis (L.) — Z. Zellforsch., 94 : 513—529.
Bonner T. P., M. G. Menefee, F. J. E t g e s. 1970. Ultrastructure of cuticle forma-
tion in a parasitic nematode, Nematospirotdes dubius.— Z. Zellforsch., 104;
193—204.
В о n n er T. P., P. P. Weinstein. 1972. Ultrastructure of cuticle formation in the
nematodes Nippostrongylus brasiliensis and Nematospirotdes dubius. — J. Ultra-
struct. Res., 40 :261—271.
Boroffka I., Al tn er H., F. Haupt. 1970. Function und Ultrastruktur des Nephri-
diums von Hirudo medicinalis.— Z. vergl. Physiol., 66:421—438.
Bouillon J. 1968. Introduction to Coelenterates. — Chem. Zool., 2 : 81—147.
Bouligand Y. 1967. Les soies et les cellules associees chcz deux annelides poly-
chetes. — Z. Zellforsch., 79 : 332—363.
Boulton R. S. 1969. Degeneration and regeneration in the insect central nervous
system. — Z. Zellforsch., 101 : 98—134.
Boycott В. B. 1974. Aspects of the comparative anatomy and physiology of the ver-
tebrate retina. In: Essays on the nervous system, 1. Oxford : 223—257.
Boyd C. A., D. S. Parsons. 1969. The fine structure of the microvilli of isolated
brush borders of intestinal epithelial cells. — J. Cell Biol., 41 :646—651.
Brandenburg J. 1966. Die Reusenformen der Cyrtocyten. Eine Beschriebung von
fiinf weiteren. Reusengeibelzellen und eine vergleichende Betrachtung. — Zool.
Beitr. (N. F.), 12:345—417.
Braverman M. 1968. Studies on hydroid differentiation. Ш. The replacement of
hypostomal gland cells of Podocoryne carnea. — J. MorphoL, 126:95—106.
Brehelin M., J. A. Hoffmann, G. Matz, A. Porte. 1975. Encapsulation of im-
planted foreign bodies by hemocytes in Locusta migratoria and Melontha me-
lontha. — Cell and Tissue Res., 160 : 283—290.
Brody I. 1970. Variations in the differentiation of the fibrils in the normal human
stratum corneum as revealed by electron microscopy. — J. Ultrastruct. Res., 30 :
601—614.
393.
в г о п к J. R., Н. Leese. 1974. Accumulation of amino acids and glucose by the
mammalian small intestine. — Sympos. Soc. Exper. Biol., 28 : 382—410.
Brown G. A., S. R. Wellings. 1970. Electron microscopy of the skin of the te-
leost, Hippoglossoides elassodon.— Z. Zellforsch., 103: 149—169.
Bruck E., W. Stockem. 1972. Morphologische Untersuchungen an der Cuticula
von Insecten. — Z. Zellforsch., 132 : 403—430.
Brush A. H. 1974. Feather keratin analysis of subunit heterogeneity. — Comp. Bio-
chem. Physiol. B, 48 : 661—670.
Buchholz K., D. Kuhlmann, A. Nolte. 1971. Aufnahme von Trypanblau und
Ferritin in die Blasenzellen des Bindgewebes von Helix pomatia. — Z. Zellforsch.,
113:203—215.
В u d t z P., L. O. Larsen. 1975. Structure of the toad epidermis during the moulting
cycle. — Cell and Tissue Res., 159 : 459—483.
Bullock T. H. 1975. Are we learning what actually goes on when the brain recog-
nizes and controls. — J. Exper. Zool., 194 : 13—34.
Bullock T. H., G. A. H о r r i d g e. 1965. Structure and function in the nervous sys-
tem of invertebrates, 1, 2. San Francisco, California.
Burke J. M. 1974. An ultrastructural analysis of the cuticle, epidermis and esopha-
geal epithelium of Eisenia joetida (Oligochaeta). — J. MorphoL, 142:301—320.
Burke J. M., R. A. Ross. 1975. A radioautographic study of collagen synthesis by
earthworm epidermis. — Tissue and Cell, 7 : 631—651.
Burnett A. L. 1966. A model of growth and cell differentiation in Hydra. — Amer.
Naturalist, 100:165—189.
Biissow II., U. W u 1 1 f h e к e 1. 1972. Die Feinstructur der glatten Muskelzellen
in den grohen muskularen Arterie der Vogel — Z. Zellforsch., 125 : 339—352.
C a i rn i e A. B. 1970. Renewal of goblet and Paneth cells in the small intestine. —
Cell and Tissue Kinetics, 3 : 35—45.
Cameron J. L. 1966. Cell proliferation, migration and specialization in the epi-
thelium of mouse tongue. — J. Exper. Zool., 163:271—284.
Campbell R. D. 1967a. Tissue dynamics of steady state growth in Hydra littoralis.
I. Patterns of cell division. — Develop. Biol., 15 : 487—502.
Campbell R. D. 1967b. Tissue dynamics of steady state growth in Hydra littoralis.
II. Patterns of tissue movement. — J. MorphoL, 121 : 19—28.
Cantor H. 1972. T-cells and immune response. — Progr. Biophys. and Molec. Biol.,
25 : 71—82.
Carlisle D. B. 1959. On the exuvia of Priapulus caudatus L. — Arch. Zool., 12:
79—81.
Car rone R., A. Hue, S. J u n g u a. 1975. Fine structure and physico-chemical stu-
dies on the collagen of the marine sponge Chondrosia renijormis.— J. Ultra-
struct. Res., 52 : 261—275.
C a 11 i R. A., O. S t u t m a n, R. A. Good. 1970. The lymphoid system. — Ann. Rev.
Physiol., 32 : 529—546.
C a v e у M. J., R. Л. С 1 о n e y. 1974. Fine structur and differentiation of ascidian
muscle. — J. MorphoL, 144 : 23—70.
Chang W. W., С. P. Leblond. 1971. Renewal of the epithelium in the descending
colon of the mouse. — Amer. J. Anat., 131:73—120.
Chapman D. M., C. F. P a n t i n, E. A. Robson. 1962. Muscle in coelenterates. —
Rev. Canad. Biol., 21 : 267—277.
Chapman R. E., R. T. Gemmell. 1971. Stages in the formation and keratiniza-
tion of the cortex of the wool fiber. — J. Ultrastruct. Res., 36 : 342—354.
Cheng H., С. P. Leblond. 1974. Origin, differentiation and renewal of the four
main epithelial cell types in the mouse small intestine. — Amer. J. Anat., 141 :
461—562.
Chien P. K., G. C. Stephens, P. L. Healey. 1972. The role of ultrastructure and
physiological differentiation of epithelia in amino acid uptake by the bloodworm
Glycera. — Biol. Bull., 142 : 219—235.
Clarkson S. G. 1969. Nucleic acid and protein synthesis and pattern regulation
in Hydra. — J. Embryol. Exper. MorphoL, 21 : 33—70.
C 6 e r s C. 1967. Structure and organization of the myoneural junction. — Internal.
Rev. CytoL, 22 : 239—268.
Coggeshall R. E. 1965. A fine structure analysis of the ventral nerve cord and
associated sheath of Lumbricus terrestris L. — J. Compar. Neurol., 125:394—438.
Coggeshall R. E. 1966. A fine structural analysis of the epidermis of the earth-
worm Lumbricus terrestris L. — J. Cell Biol., 28 : 95—108.
Coggeshall R. E., D. W. Fawcett. 1964. The fine structure of the central ner-
vous system of the leech, Hirudo medicinalis. — J. NeurophysioL, 27 : 229—
289.
Cohen C. 1975. The protein switch of muscle contraction. — Scient. Amer., 223:
. 36—45.
Cohen M. I. 1969. Neuronal change in the regenerating and developing insect ner-
vous system. — In: Cellular dynamics of the neuron, 8, N. Y.—London : 263—275.
394
Cohn Z. Л. 1968. The structure and function of monocytes and macrophages. — Adv.
Immunol., 9 : 163.
Condoloulis W. V., M. Locke. 1966. The deposition of endocuticle in an insect,
Calpodes ethlius Stoll (Lepidoptera, Hesperiidae). — J. Insect. Physiol.,
12 : 311—323.
Cooper E. L., W. H. Hildemann. 1963. The immune response of larval bullfrogs
(Rana catesbeiana) to diverse antigens. — Ann. N. Y. Acad. Sci., 126:647—661
Cooper M. D., A. R. Lawton. 1974. The development of the immune system. —
Scient. Amer., 231: 58—78.
С г e 1 i n E. S., W. E. Koch. 1967. An autoradiographic study of chondrocyte trans-
formation into chondroclasts and osteocytes during bone formation in vitro. —
Anat. Rec., 158 : 473.
Cushing J. 1967. Invertebrates immunology and evolution.— Fed. Proc., 26 : 1666—1670.
Cushing J. E. 1970. Immunology of fish. In: Fish physiology, 4. N. Y.—London :
465—500.
Cutler L. S., L. R. C h a u d r y. 1973. Differentiation of the myoepithelial cells of
the rat submandibular gland in vivo and in vitro. — J. Morphol., 140:343—354.
Dadd В. H. 1970. Digestion in insects. — Chem. Zool., 5: 117—145.
Dahlstrom A., I. Haggendal, P. O. Heiwall, P. A. Larsson, N. R. Saun-
ders. 1974. Intra-axonal transport of neurotransmitters in mammalian neu-
rons. — Sympos. Soc. Exper. Biol., 28 : 229—247.
Dalles R. Ph., J. S. Poill. 1970. Cytological aspects of hemoglobin and chloro-
cruorin synthesis in polychaete annelids.— Z. Zellforsch., 109 : 20—32.
Davey K. G. 1965. Molting in a parasitic nematode, Phocanema decipiens. I. Cytolo-
gical events. — Canad. J. Zool., 43 : 997—1003.
Davies R. E. 1963. A molecular theory of muscle contraction. — Nature, 199;
1068—1074.
Davis L. E. 1973. Histological and ultrastructural studies of the basal disk of hydra. —
Z. Zellforsch., 139: 1—27.
Davis L. E., A. L. Burnett. 1964. A study of growth and cell differentiation
in the hepatopancreas of the crayfish. — Develop. Biol., 10: 122—153.
Dawson A. 1963. The oral cavity: the jaws and the horny teeth of Myxine.
In: The biology of Myxine. Oslo : 231—255.
Dawson I. 1970. The endocrine cells of the gastrointestinal tract. — Histochem. J.,
2:527-549.
Deck J. D., E. D. Hay, J. P. Revel. 1966. Fine structure and origin of the tunic
of Perophora viridis. — J. Morphol., 120 : 267—280.
Del Castillo L, M. Anderson, D. S. Smith. 1972. Proventriculus of a marine
annelid: muscle preparation with the longest recorded sarcomere. — Proc. Nat.
Acad. Sci. USA, 69:1669—1672.
De RobertisE. D. 1969. Structure and chemical studies on storage and receptor
sites for biogenic amines in the central nervous system. In: Cellular dynamics
of the neuron, 8. N. Y.—London : 191—211.
D e v i ne C., A. S о m 1 у o. 1972. Sarcoplasmic reticulum and excitation contracting
coupling in mammalian smooth muscle. — J. Cell Biol., 52:690—718.
Dhonailly D. D. 1975. Formation of cutaneous appendages in dermoepidermal re-
combinations between reptiles, birds and mammals. — Wilhelm Roux’s Arch. De-
velop. Biol., 177 : 323.
Digby P. 1966. Mechanism of calcification in mammalian bone. — Nature, 212:
1250—1252.
Dilly P. N., J. B. Messenger. 1972. The branchial gland: a site of haemocyanin
synthesis of Octopus. — Z. Zellforsch., 132 :193—201.
Dingle J. T. 1967. The extracellular secretion of lysosomal enzymes. — In: Lysoso-
mes in biology and pathology, 2. Amsterdam—London.
Dobbins W. O. 1969. Morphological and functional correlates of intestinal brush
borders. — Amer. J. Med. Sci., 258: 150—171.
Dobbs G. H., De Vries A. 1975. The aglomerular nephron of antarctic teleosts. —
Tissue and Cell, 7 :159—170.
Dodson J. W. 1967. The differentiation of epidermis. — J. Embryol. Exper. Morphol.,
17:83—117.
Dowling J. E., В. B. Boycott. 1966. Organization of the primate retina: electron
microscopy. — Proc. Roy. Soc. B, 166:80—111.
Dumont J. N., E. Anderson, G. Winner. 1966. Some cytologic characteristics
of the haemocytes of Limulus during doting. — J. Morphol., 119:181—208.
Dunkan С. I. 1967. The molecular properties and evolution of excitable cells.
London.
Du Praw E. J. 1970. Cell and molecular biology. N. Y.—London.
Durham A. C. 1974. A unified theory of the control of actin and myosin in non-
muscular movements. — Cell, 2 : 123—136.
During M., К. H. Andres. 1976. The ultrastructure of taste and touch receptors
of the frog’s taste organ. — Cell and Tissue Res., 165: 185—198.
395
Eakin R. M., I. L. Brandenburger. 1974. Ultrastructural features of a gordean
worm (Nematomorpha).— J. Ultrastruct. Res., 46:351—374.
Ebashi S., Y. Nonomura. 1973. Proteins of the myofibril. — In: The structure
and function of muscle, 3. N. Y.—London : 283—362.
Edstrom A. 1969. RNA and protein synthesis in Mautthner nerve fiber components
of fish. — In: Cellular dynamics of the neuron, 8. N. Y.—London : 51—72.
Elder H. I. 1972. Connective tissue and body wall structure in the polychaete Po-
lyphysta crassa and their significance. — J. Marine Biol. Assoc. U. K., 52:
747—764.
Elder H. I. 1973. Distribution and function of elastic fibres in the invertebrates.—
Biol. Bull., 144 : 43—63.
Elias P. M., D. S. Friend. 1975. The permeability barrier in mammalian epider-
mis. — J. Cell Biol., 65 : 180—191.
Elliot A. 1974. The arrangement of myosin on the surface of paramyosin filament
in the white adductor muscle of Crassostrea augulata. — Proc. Roy. Soc. B, 186 :
53—66.
E1 s d a 1 e T., J. Bard. 1974. CeUular interactions in morphogenesis of epithelial
mesenchymal systems. — J. Cell Biol., 63 : 343—346.
E n d e a n R. 1960. The blood cells of the Ascidian. — Quart. J. Microscop. Sci., 101 :
177—197.
E r 1 a n d s e n S. L., D. G. Chase. 1972. Paneth cell function: phagocytosis and in-
tracellular digestion intestinal microorganisms. I. Hexamita marts. — J. Ultra-
struct. Res., 41 : 291—333.
E r m а к T. H. 1975. Cell proliferation in the digestive tract of Stylla clava (Urochor-
data, Ascidiacea) as revealed by autoradiography with tritiated thymidine. —
J. Exper. Zool., 194 :449—534.
Ernst S., R. Ellis. 1969. The development of surface specialization in the secre-
tory epithelium of the avian salt gland in response to osmotic stress. — J. Cell
Biol., 40 : 305—321.
Fahrenbach W. H. 1968. The cyanoblast: hemocyanin formation in Limulus po-
lyphemus. — J. Cell Biol., 39 : 43a.
Fain - M a u r e 1 M. A., P. Gassier. 1971. Differentiations cytoplasmiques en rela-
tion avec la function excretice dans les reins cephaliques dePetrobius martimus
Leach (Insecte, Apterygote). — J. Microscopie, 10:163—178.
F a 1 к m e r S. 1972. Insulin production in vertebrates and invertebrates. — Gen. Com-
par. Endocrinol., Suppl. 3 : 184—191.
Farquhar M. G., G. E. Palade. 1965. Cell junctions in amphibian skin. — J. Cell
Biol., 26 : 263—291.
Fawcett D. W., G. A. L о n y, A. L. Jones. 1969. The ultrastructure of endocrine
glands. — Progr. Hormone Res., 25 : 315—380.
Feldman M., G. Nossal. 1974. Cellular basis of antibody production. — Quart.
Rev. Biol., 47 : 269—286.
Fell H. B. 1933. Chondrogenesis in culture of endosteum. — Proc. Roy Soc. B, 112:
417—427.
Feng S. Y., I. S. Feng, C. N. Burke, L. H. Kh air alia h. 1971. Light and elec-
tron microscopy of the leucocytes of Crassostrea virginica (Mollusca, Pelecy-
poda). — Z. Zellforsch., 120 : 222—245.
Fernandez H. L., P. R. Burton, F. E. Samson. 1971. Axoplasmic transport
in the crayfish nerve cord. The role of fibrillar constituents of neurons. —
J. Cell Biol., 51 : 176—192.
Filshie В. K. 1970. The resistance of epicuticular components of an insect to ex-
traction with lipid solvents. — Tissue and Cell, 2 : 181—190.
Fitzgerald P. J., В. M. Carol, L. Rosenstock. 1966. Pancreatic acinar cell
regeneration. — Nature, 212 : 594—596.
Flaxman В. A., P. F. Manderson. 1973. Relationship between pattern of cell
migration from the germinal layer and changing patterns of differentiation
in the lizard epidermis. — J. Exper. Zool., 183 : 209—216.
F1 a x m a n В. A., P. F. Manderson, G. Szabo, S. I. Roth. 1968. Control of cell
differentiation in lizard epidermis in vitro. — Develop. Biol., 18 : 354—375.
F1 о г к i n M. 1969. Respiratory protein and oxygen transport. — Chem. Zool., 4 :
111—132.
Forbes M. S., N. Sperelakis. 1971. Ultrastructure of lizard ventricular musle.—
J. Ultrastruct. Res., 34 : 439—451.
Foster C. L. 1971. Relationship between ultrastructure and function in the adeno-
hypophysis of the rabbit. — In: Subcellular organization and function in endo-
crine tissue. Cambridge : 125—146.
Francois J. 1972. Ultrastructure du rein ladial cephalique de Cainpodea chardardi
Conde (Diplura. Insecta). —Z. Zellforsch., 127:34—49.
Frank R. M., P. Frank. 1969. Autoradiographie quantitative de Fosteogenese
en microscopie electronique a 1’aide de la proline tritiee. — Z. Zellforsch.. 99:
121—133.
396
Franzini-Armstrong С. 1970. Natural variability in the length of thin and
thick filaments in single fibres from a crab Portunus deparator. — J. Cell. Sci.,
6 :559—592. q e ъ
Franzini-Armstrong C. 1973. Membranous system in muscle fibers.—
In: The structure and function of muscle, 2. N. Y.—London : 532—620.
Friedman H. I., R. R. Car de 11. 1972. Effects of puromycin on the structure
of rat intestinal epithelial cells during fat absorbtion. — J. Cell Biol., 52:
15—40.
Fritsch H. A., S. Van Noorden, A. G. Pearse. 1976. Cytochemical and immu-
nofluorescence investigations on insulin-like producing cells in the intestine
of Mytilus edulis. — Cell and Tissue Res., 165 : 365—370.
Fuchs F. 1974. Striated muscle. — Ann. Rev. Physiol., 36:461—502.
Fujita H. 1972. On the fine structure of alteration on the adrenal cortex in hypo-
physectomized rats. — Z. Zellforsch., 125 : 480—496.
Fujita H. 1974. Fine structure of thyroid gland. — Internal. Rev. CytoL, 40: 197—271.
Fukuyama K., W. L. E p s t e i n. 1969. Sulphur-containing proteins and epidermal
keratinization. — J. Cell Biol., 40 : 830—838.
Fukuyama K., W. L. Epstein. 1975. A comparative autoradiographic study of ke-
ratohyalin granules containing cystine and histidine. — J. Ultrastruct. Res., 51 :
314-325.
Fukuyama К., T. Nakamura, I. A. Bernstein. 1965. Differentially localized
incorporation of amino acid in relation to epidermal keratinization in the new-
born rat. — Anat. Rec., 152 : 525—536.
Furth R. V., M. M. Diesselhoffden. 1970. The kinetics of promonocytes and mo-
nocytes in the bone marrow. — J. Exper. Med., 132 : 813—825.
Gabella G. 1974. Striated muscle cells in the guinea-pig iris. — Cell and Tissue
Res., 154: 181—189.
G a 11 e P. 1974. Role des lysosomes et des mitochondries de concentration et d’elimi-
nation d’elements mineraux par le rein. — J. Microscopie, 19 :17—24.
Gauthier G. F. 1963. Cytological studies on the gastroderm of Hydra. — J. Exper.
Zool., 152: 13—39.
Gemmell R. T., R. E. Chapman. 1971. Formation and breakdown of the inner
root sheath and features of the pilary canal epithelium in the wool follicle.—
J. Ultrastruct. Res., 36 : 355—366.
G e о r g i R. 1969. Bildung peritrophischer Membranen von Decapoden. — Z. Zellforsch.,
99:570—607.
Gers ch M. 1964. Vergleichende Endocrinologie der Wirbellosentiere. Leipzig.
G о d m a n G. С., K. R. Porter. 1960. Chondrogenesis studied with the electron mic-
roscope. — Biophys. Biochem. CytoL, 8 : 719—760.
Goldsmith T. H. 1975. Photoreceptor processes. Some problems and perspectives.—
J. Exper. Zool., 194 : 89—102.
Good R. A. 1968. Phylogenetic development of the lymphoid tissue and immunologic
capacity among the lower vertebrates. — In: Symposium on regulation of the an-
tibody response. N. Y—London : 212—231.
Good R. A., B. W. P a p e r m a s t e r. 1964. Ontogeny and phylogeny of adaptive im-
munity. — Adv. Immunol., 4 : 1—115.
Gooding R. H. 1972. Digestive processes of haematophagus insects. 1. A literature
review. — Questions entomol., 8 : 5—60.
Gooding R. H. 1973. The digestive processes of haematophagus insect. — Canad.
Entomologist, 105:599—603.
Goodman D., W. B. Parrish. 1971. Ultrastructure of the epidermis in the ice
worm, Mesenchytraeus solijugus.— J.-MorphoL, 135:71—86.
Grant M. E., D. J. P г а с к о p. 1972. The biosynthesis of collagen. — New England
J. Med., 286 : 194—202.
Grasso J. A. 1973. Erythropoesis in the newt, T. cristatus. — J. Cell Sci., 12:
463—523.
Grasso J. A., D. C. Shephard. 1968. Experimental production of totally anaemic
newts. — Nature, 218 :1274—1276.
Grasso J. A., J. W. Woodard. 1966. The relationship between RNA synthesis and
haemoglobin synthesis in amphibian erythropoesis. — J. Cell Biol., 31 : 279—289.
Grasso J. A., J. W. Woodard. 1967. DNA synthesis and mitosis in erythropoetic
cells. — J. Cell Biol., 33 : 645—655.
Graszynski K. 1963. Die Feinstructur des Nephridialkanals von Lumbricus terre-
stris L. — Zool. Beitr., 8 :189—296.
Gray E. C. 1969. Electronmicroscopy of the gliovascular organization of the brain
of Octopus. — Philos. Trans. Roy. Soc. London B, 255: 13—32.
Gray E. C. 1971. The fine structural characterization of different types of synapse.—
Progr. Brain Res., 34: 149—160.
Graziadei P. P. 1973. Cell dynamics in the olfactory mucosa. — Tissue and Cell,
5:113—132.
Green J. P., M. R. Neff. 1972. A survey of the fine structure of the integument
of the fiddler crab. — Tissue and Cell, 4:137—171.
26 А. А. Заварзин 39-7
G г e e p R. О. 1966. Histology. N. Y.
Gregoire С. 1971. Haemolymph coagulation in Arthropoda. — Chem. Zool., 6:
145—186.*
Gregoire C. 1972. Structure of the molluscan shell. — Chem. Zool., 7:45—102.
Gross J. 1974. Collagen. Biology, structure, degradation and disease. — Harvey Lec-
tures, 68 : 351—432.
G u s t u s R. M., R. A. Cloney. 1973. Ultra structure of the larval compound setae
of the polychaete Nereis vexillosa Grube. — J. Morphol., 140:355—366.
Hackman R. H. 1971. The integument of Arthropoda. — Chem. Zool., 6:1—63.
Haddad A., M. D. Smith, A. Herscowics, N. I. Nadler, С. P. Leblond.
1971. Radioautographic study of in vivo and in vitro incorporation of fucose 3H
into thyreoglobulin by rat thyreoid follicular cells. — J. Cell. Biol., 49:856—
882.
Haeckel E. 1885. Ursprung und Entwicklung der tierischen Gewebe. Ein histogene-
tischer Beitrag zur Gastraea-Theorie. — Jena. Z. Naturwiss. (N. F.), 18:11.
Цит. по: H. Г. Хлопин, 1946.
Haese J. D., H. К о m n i c k. 1972. Fine structure and contraction of isolated muscle
actomyosin. — Z. Zellforsch., 134 : 411—434.
Hall В. K. 1970. Cellular differentiation in skeletal tissues. — Biol. Rev., 45:455—484.
Hall В. К., C. D. S h о r e y. 1968. Ultrastructural aspects of cartilage and membrane
bone differentiation from common germinal cells. — Austral. J. Zool., 16:
821—840.
H a m A. W. 1957. Histology. Philadelphia.
H a m A. W., W. R. Harris. 1956. Repair and transplantation of bone. — In: Bioche-
mistry and physiology of bone. N. Y.: 475—505.
Hanstrom B. 1928. Vergleichende Anatomie des Nervensystem der wirbellosen
Tiere unter besonderer Beriicksichtigung seiner Funktion. Berlin.
H a p p G. M., J. D. S t r a n d b e r g, Ch. M. H a p p. 1966. The terpene-producing glands
of a phasmid insect. — J. Morphol., 119: 143—160.
Harris J. E., S. Hunt. 1975. The fine structure of the epidermis of two species
of salmonid fish, the atlantic salmon (Salmo salar L.) and the brown tront
(Salmo trutta L.). I. General organization and filament-containing cells. — Cell
and Tissue Res., 157 : 553—565.
Hashimoto K. 1971. Ultrastructure of the human toe-nail. II. Keratinization and
formation of the marginal band. — J. Ultrastruct. Res., 36:391—410.
Haupt J. 1974. Function and ultrastructure of the nephridium of Hirudo medicina-
lis L. — Cell and Tissue Res., 152 : 385—401.
Hausman R. E., A. L. Burnett. 1969. The mesoglea of Hydra. I. Physical and
histochemical properties. — J. Exper. Zool., 171 : 15—24.
Hawkes J. H. 1974. The structure of fish skin. I. General organization. — Cell and
Tissue Res., 149 : 147—158.
H e n г i к s о n R. C., A. G. M a t о 11 s y. 1968. The fine structure of teleost epider-
mis. — J. Ultrastruct. Res., 21 : 194—232.
Herman N. S. 1967. The ecdysial glands of Arthropods. — Internal. Rev. Cytol., 22:
269—367.
H e r w i t z A. L., A. Dorfman. 1968. Subcellular sites for synthesis of chondromuco-
protein of cartilage. — J. Cell Biol., 38 : 358—369.
H e s 1 о p J. P. 1974. Fast transport along nerves. — Sympos. Soc. Exper. Biol., 28:
209—227.
Hess R. T., D. В. M e n z e 1. 1967. The fine structure of the epicuticular particles
of Enchytraesus fragmentosus. — J. Ultrastruct. Res., 19 : 487—497.
Heumann H. G., E. Z e b e. 1967. Uber Feinbau und Funktionsweise der Fasern aus
dem Hautmuskelschlauch des Regenwurms, Lumbricus terrestris. — Z. Zellforsch.,
78: 131—150.
.Heuser J. E., T. S. Reese. 1973. Evidence for recycling of synaptic vesicle mem-
brane during transmitter release at the frog neuromuscular junction. — J. Cell
Biol., 57 :315—344.
Hollgfield J. G. 1966. The origin of erythroblast in Rana pipiens tadpoles. — De-
velop. Biol., 14:461—471.
Holtzmann E., A. R. Freeman, G. A. Kashner. 1970. A cytochemical and elec-
tron microscopy study of channels in the Schwann cell, surrounding lobster
giant axons. — J. Cell Biol., 44 : 438—445.
Howes E. A., B. J. Melo ugh in, J. P. Neslop. 1974. The autoradiographical as-
sociation of fast transported material with dense core vesicles in the central
nervous system of Anodonta cygnea. — Cell and Tissue Res., 153 : 545—558.
Howse H. D., V. I. Ferrans, R. G. Hibbs. 1971. A light and electrone microsco-
pic study of the heart of crayfish Procambarus clarkii. — J. Morphol., 133:
353-374.
Howse H. D., R. A. Woodmansee, W. E. H a w к i n s, H. M. Perry. 1975. Ul-
trastructure of the heart of the copepod Anomalocera ornata. — Trans. Amer.
Microscop. Soc., 94 : 1—23.
398
Hoy R. R. 1970. Degeneration and regeneration in abdominal flexor motor neurones
in the crayfish. — J. Exper. Zool., 172 : 219—232.
Hoyle G. 1967. Diversity of striated muscle. — Amer. Zoologist, 7:435—449.
Hoyle G. 1969. Comparative aspects of muscles. — Ann. Rev. Physiol., 31 :43—81.
Hoyle G. 1973. Correlated physiological and ultrastructural studies on specialized
muscle. III. — J. Exper. Zool., 185:97—110.
Hoyle G. 1975. Identified neurons and the future of neuroethology. — J. Exper.
Zool., 194:51—74.
Hunt S. 1970. Polysaccharide-protein complexes in invertebrate. N. Y.—London.
Huxley H. E. 1972. Molecular basis oi contraction in cross-striated muscle. —
In: The structure and function of muscle, 1. N. Y.—London : 302—384.
Hyden II. 1967. Dynamic aspects of the neuron-glia relationship. In: Neuron. Am-
sterdam :179—217.
Hyden H., P. W. Lange. 1969. Synthesis of acidic proteins in nerve cells during
establishment of new behavior. In: Cellular dynamics of the neuron, 8. N. Y.—
London : 335—350.
I d e 1 m a n S. 1970. Ultrastructure of the mammalian adrenal cortex. — Internal. Rev.
CytoL, 27 : 181—281.
Iorio J. N. 1969. Some morphological and kinetic studies of the developing erytroid
cells of the common goldfish Carassius auratus. — Cell and Tissue Kinetic,
2 : 319—331.
Isler H. 1976. Fine structure of the chicken thymic epithelial vesicles. — J. Cell Sci^
20 : 135—147.
Isselbacher K. J. 1975. The intestinal cell surface: properties of normal, undifferen-
tiated and malignant cells. — Harvey Lectures, 69 : 197—221.
Iwayama T. 1971. Nexuses between areas of the surface membrane of the some
arterial smooth muscle cell. — J. Cell Biol., 49 : 521—525.
Jahromi S. S., H. L. Atwood. 1969. Correlation of structure, speed of contraction
and total tension in fast and slow abdominal muscle fibers of the lobster
(Homarus americanus). — J. Exper. Zool., 171:25—38.
Jamieson J. D., G. E. Palade. 1967. Intracellular transport of secretory protein
in the pancreatic exocrine cell. — J. Cell Biol., 34 : 577—615.
Jamieson J. D., G. E. Palade. 1971. Synthesis, intracellular transport and dis-
charge of secretory proteins in stimulated pancreatic exocrine cells. — J. Cell
Biol., 50: 135—158.
Jensen H., R. Myklebast. 1975.Ultrastructure of muscle cells mSiboglinum fior-
dicum (Pogonophora). — Cell and Tissue Res., 163: 185—197.
Jerne N. K. 1973. The immune system. — Scient. Amer., 229 : 52—60.
Jessen H., P. D. Peters, T. A. Hall. 1974. Sulphur in different types of kera-
tohyalin granules: a quantitative assay by X-ray microanalysis. — J. Cell Sci.,
15 :359—378.
J e uni aux Ch. 1971. Hemolymph — Arthropoda. — Chem. Zool., 6:64—118.
Johnson G. R., M. A. Moore. 1975. Role of stem cell migration in initiation
of mouse foetal liver haemopoesis. — Nature, 258 : 726—728.
Jones I. G. 1970. Haemocytopoesis in Insects. — In: Regulation of haemotopoesis.
N. Y.: 7—65.
Josephson R. K. 1975. Extensive and intensive factors determining the perfor-
mance of striated muscle. — J. Exper. Zool., 194 : 135—154.
Kafatos F. С., V. Kiortsis. 1971. The packaging of a secretory protein: kine-
tics of cocoonase zymogen transport into a storage vacuole. — J. Cell Biol., 48:
426—431.
Kahn E. B., S. S. Simpson. 1974. Satellite cells in mature uninjured skeletal
muscle of the lizard tail. — Develop. Biol., 37 : 219—225.
Kai к M. 1970. The organization of tunicate heart. Tissue and Cell, 2:99—118.
Kandell E., I. Kupferman. 1970. The functional organization of invertebrate
ganglia. — Ann. Rev. Physiol., 32 : 193—258.
Kane ко A. 1973. Morphological identification of single cells in the fish retina
by? intracellular dye injection. In: Intracellular staining in neurobiology, N. Yj
К a w a g u t i S., T. II a m а к о s h i. 1963. Electron microscopic studies of the striated
and smooth muscles of an anthomedusa, Spirocodon saltatrix. — Biol. J. Okagama
Univ., 9 : 127—139.
Kemp D. В., P. Y. Dyer, G. E. Rogers. 1974. Keratin synthesis during develop-
ment of the embryonic chick feathers. — J. Cell Biol., 62: 114—131.
Kennedy D. 1975. Comparative strategies in the investigation of neural networks.—
J. Exper. Zool., 194 : 35—50.
Knapp e is G. G., F. Carlsen. 1968. The ultra structure of the M line in skeletal
muscle. — J. Cell Biol., 38 : 202—211.
26*
393
К и е s е К. Н. 1967. Topographic and temporal correlation of processes of osteogenesis
discussed according to electron-microscopic findings. In: Callus formation. Buda-
pest : 165—177.
Knut ton S., A. R. Limb rick, I. D. Robertson. 1974. Regular structures in mem-
branes. 1. Membranes in the endocytic complex of ileal epithelial cells.— J. Cell
Biol., 62:679—694.
Kobayashi S. 1971. Acid mucopolysaccharides in calcified tissues. — Internal. Rev.
CytoL, 30:257—371.
К о ec hlin N. 1966. Ultra structure du plexus sanguin preoesophagien, ses relation-
avec la nephridie de Sabella pavonina Savigny. — C. r. Acad, sci., 262:1266—
1296.
Koechlin N. 1972. Etude histochimique et ultrastructurale des pigments nephridiens
et coelomiques d’une Annelide Polychete (Sabelle). — Ann. Histochim., 17:
27—54.
Komnick H., E. Kniprath. 1970. Morphometrische Untersuchungen an der Saltz-
driise von Silbermoven. — Cytobiologie, 1 : 228—247.
Komnick H., W. Stockem, К. E. Wohlfarth-Bottermann. 1973. Cell mo-
tility: mechanism in protoplasmic streaming and ameboid movement. — Internal.
Rev. CytoL, 34 : 169—242.
Korneliassen H., K. Niolyson. 1973. Ultrastructure of four types of striated
muscle fibers in the atlantic hagfish (Myxine glutinosa L.). — Z. Zellforsch.,
143 :273—290.
Kovacs L., C. S. P otten. 1973. An estimation of proliferative population size
in stomach, jejunum and colon of DBA mice. — Cell Tissue Kinetic, 6: 125—135.
Krachenbuhl J. P., M. A. Campiche. 1969. Early stages of intestinal absorp-
tion of specific antibodies in the newborn. An ultrastructural cytochemical and
immunological study in the pig, rat and rabbit. — J. Cell Biol., 42:345—365.
Kraft N., K. Shortman. 1972. Differentiation of antibody-forming cells in toad
spleen. — J. Cell Biol., 52 : 438—452.
Krebs H. A. 1975. The August Krogh principle: «For many problems there is an ani-
mal on which it can be most conveniently studied». — J. Exper. Zool., 194:
221—226.
Krischner L. B. 1967. Comparative physiology of invertebrate excretory organs.—
Ann. Rev. Physiol., 29 : 169—196.
Kuffler S. W., I. G. Nickо 11 s. 1966. The physiology of neuroglial cells. — Ergebn.
Physiol., 57 : 1—90.
Kiimmel G. 1967. Die Podocyten. — Zool. Beitr., N. F., 13 : 245—263.
Kumm el G. 1973. Filtration structure in excretory systems. A. Comparison. Compara-
tive Physiology. Amsterdam : 221—240.
Kunkel J. G. 1975. Cockroach molting. I. Temporal organization of events during
molting cycle of Blattella germanica (L.). — Biol. Bull., 148 : 259—273.
Kurosumi K., Y. Kobayashi, N. Baba. 1968. The fine structure of mammary
glands of lactating rats with special reference to the apocrine secretion. — Exper.
Cell Res., 50: 177—192.
Lai FookJ. 1973. The structure of the haemocytes of Calpodes ethlius (Lepido-
ptera). — J. MorphoL, 139: 79—104.
L a s e k P. J. 1970. Protein transport in neuron. — Internal. Rev. NeurobioL, 13:
285—324.
Lash J. W. 1959. The presence of myoglobine in the cartilage of marine snail Busy-
con. — Science, 130 : 334.
Lash J. W., M. W. W h i t e h о u s e. 1960. An unusual polysaccharide in chondroid
tissue of the snail Busycon : polyglucose sulphate. — Biochem. J., 74 : 351—355.
Laurent T. C. 1966. In vitro studies on the transport macromolecules through con-
nective tissue. — Fed. Proc., 25 : 1128—1134.
L a v k e r R. M. 1972. Fine structure of the newt epidermis. — Tissue and Cell, 4:
663—675.
Lavker R. M. 1974. Horny cell formation in the epidermis of Rana pipiens.—
J. MorphoL, 142 : 365—378.
Lavker R. M., A. G. Matoltsy. 1970. Formation of horny cells. The fate of cell
organelles and differentiation products in ruminal epithelium. — J. Cell Biol.,
44:501—512.
Lee D. L. 1970. Moulting in nematodes: the formation of the adult cuticle during
the final moult of Nippostrongylus brasiliensis. — Tissue and Cell, 2:139—153.
Lehman W. 1976. Phylogenetic diversity of the proteins regulating muscular con-
tracting. — Internal. Rev. CytoL, 44 : 55—92.
Levine R. I., M. M. Dewey, D. E. Colflesh. 1973. Unusual striated thick fila-
ments in Limulus skeletal muscle. — J. Cell Biol., 57 : 591—593.
Leyton R. A., E. H. Sonnenblick. 1971. Cardiac muscle of the horse shoe crab
Limulus polyphemus. — J. Cell Biol., 48:101—119.
Locke M. 1964. The structure and function of the integument in insect. — In: Phy-
siology of insecta, 3. N. Y.: 379—470.
400
Locke M. 1966. The structure and formation of the cuticulin layer in the epicuticle
of an Insect, Calpodes ethlius (Lepidoptera, Hesperiidae). — J. Morphol., 118:
461________494.
Locke M. 1969. The structure of an epidermal cell during the development of the
protein epicuticle and the uptake of molting fluid in an Insect. — J. Morphol.,
127 : 7—40.
Locke M., J. Collins. 1965. The structure and formation of protein granules
in the fat body of an Insect. — J. Cell Biol., 26 : 857—884.
Locke M, P. Huie. 1972. The fiber components of insect connective tissue. — Tissue
and Cell, 4:601-612. . . , ,
Locke M., J. T. McMahon. 1971. The origin and fate of microbodies in the fat
body of an Insect. — J. Cell Biol., 48 : 61—78.
Loizzi R. F. 1971. Interpretation of crayfish hepato-pancreatic function based
on fine structural analysis of epithelial cell lines and muscle networks. —
Z. Zellforsch., 113 : 420—440.
Luck S. С., C. Napa j aroonsri, G. T. Simon. 1974. The ultrastructure of endo-
steum. A topographic study in young adult Rabbits. — J. Ultrastruct. Res., 46:
165—205.
Maderson P. F., B. A. Flaxman, S. I. Roth, G. Szabo. 1972. Ultrastructural
contributions to the identification of cell types in the lizard epidermal genera-
tion. — J. Morphol., 136 :191—210.
Mair A. R. 1970. The structure and distribution of satellite cells. — In: Regeneration
of striated muscle and miogenesis. N. Y.: 91—100.
Mair A. R., A. H. Kanii, D. Allbrock. 1965. The structure of the satellite cells
in skeletal muscle. — J. Anat., 99 : 435—444.
Mandi В. T., B. Giant. 1973. Thymosin-producing cells of the thymus. — Nature
New Biol., 246 : 25—28.
M a n i a t i s G. M., V. M. Ingram. 1971. Erythropoiesis during amphibian metamorpho-
sis. — J. Cell Biol., 49 : 372—404.
Marchbanks R. M. 1969. Biochemical organisation of cholinergic nerve terminals
in the cerebral cortex. — In: Cellular dynamics of the neuron, 8. N. Y.—London :
115—135.
Marks M. H., K. Kovach. 1966. Development of mammalian erythroid cell.
In: Current topics in developmental biology, 1. N. Y.—London: 173—206.
Marshall A. T., W. W. Cheung. 1974. Studies on water and ion transport in ho-
mopteran insects: ultrastructure and cytochemistry of the cicadoid and cerpopoid
Malpighian tubule in filter chamber. — Tissue and Cell, 6:153—171.
Marshall A. T., A. Wright. 1974. Ultrastructure changes associated with osmo-
regulation in the hindgut cells of saltwater insect. — Tissue and Cell, 6 : 301—318.
Martin B. J., Ch. W. Philpott. 1973. The adaptive response of the salt glands
of adult mallard ducks of salt water regime.— J. Exper. Zool., 186:111—122..
Martoja R., J. M. Bassot. 1965. Existence d’un tissue conjonctif de type cartila-
genoux chez certains insects Orthopterus. — C. r. Acad, sci., 261 :2954—.
2960.
Mary R. F., G. Krishnan. 1974. On the nature and role of protein constituents
of the cuticle of crustaceans in relation to permeability of the cuticle. — Marine
Biol., 25 :299—309.
Masoni A., F. Garcia-Romen. 1972. Accumulation et excretion de substance
organiques par les cellules a chlorure de la branchie & Anguilla anguillaL. abap-
tee a 1’eau de mer. — Z. Zellforsch., 133 : 389—398.
Mathews M. B. 1967. Macromolecular evolution of connective tissues. — Biol. Rev.,
42 :499—551.
Matoltsy A. G. 1966. Membrane-coating granules of the epidermis. — J. Ultra-
struct. Res., 15 : 510—515.
Matoltsy A. G. 1969. Keratinization of the avian epidermis. An ultrastructural study
of the newborn chick skin. — J. Ultrastruct. Res., 29 :438—458.
Matoltsy A. G., T. H u s z a r. 1972. Keratinization of the reptilian epidermis:
an ultrastructural study of the turtle skin. — J. Ultrastruct. Res., 38:87—101.
Matoltsy A. G., M. N. Matoltsy. 1972. The amorphous component of keratohy-
alin granules. — J. Ultrastruct. Res., 41 : 550—560.
Matthews I. L., I. H. Martin, I. W. Kennedy, E. I. Collins. 1973. An ultra-
structural study of calcium and phosphate deposition and exchange in tissues. —
Ciba Foundat. Sympos. (new series), 11:187—211.
Mattison A., R. F u n g e. 1973. Ultrastructure of erythrocytes and leicocytes of Pri-
apulus caudatus. — J. Morphol., 140:367—371.
Mauro A. 1961. Satellite cell of skeletal muscle fibers. — J. Biophys. Biochem. Cy-
tol., 9:493—495.
Mazzuca M., P. Aga ch e. 1970. Structure fine de I’epiderme plantaire humain.—
J. Microscopie, 9 : 75—88.
McLoughlin С. B. 1961. The importance of mesenchymal factors in the differen-
tiation of chick epidermis. — J. Embryol. Exper. Morphol., 9:370—409.
401
McNeill P., M. Narrow, G. Hoyle. 1972. Fine structure of muscles controlling
the strike mechanism of the mantis shrimp Hemisquill. — J. Exper. Zool., 179:
395—416. , ,
McQuiston R. W. 1969. Cyclic activity in the digestive diverticula of Lasaea rubra
(Montagu) (Bivalvia: Lamellibranchia).— Proc. Malacol. Soc. London, 38:483—
492.
Merk er H. G., K. Struwe. 1971. Electronmikroskopische Untersuch ungen zum
Problem der Secretion der bindgewebigen Interzellular Substance. — Z. Zell-
forsch, 115:212—225.
Meyer M, H. E. S c h r a e d e r. 1975. A quantitative electron microscopic analysis
of the keratinizing epithelium of normal human hard palate. — Cell and Tissue
Res, 158 : 177—203.
Mill P. I., M. T. Knapp. 1970. The fine structure of obliquely striated body wall
muscles in the earthworm Lumbricus terrestris (L.)—J. Cell Sci, 7:233—
261.
Miller J. F. 1972. Lymphocyte interactions in antibody responses. — Internet. Rev.
CytoL, 33: 77—130.
Millman В. M. 1967. Mechanism of contraction in molluscan muscle. — Amer. Zoolo-
gist, 7 : 583—591.
Minier L. N, T. P. Bonner. 1975. Cuticle formation in parasitic nematodes: ultra-
structure of molting and the effects of actinomycin D. — J. Ultrastruct. Res,
53 : 77—86.
Mittal А. К, T. K. Banerjee. 1974. Structure and keratinization of the skin
of a freshwater teleost Notopterus notopterus (Notopteridae: Pisces). — Proc.
Zool. Soc. London, 174 : 341—355.
Mittal А. К, J. S. Munshi. 1970. Structure of the integument of a freshwater te-
leost, Bagarius bagarius (Ham.) (Sisoridae, Pisces). — J. MorphoL, 130:3—10.
Mix M. С, A. K. Sparks. 1971. Repair of digestive tubule of the pacific oyster
Crassostrea gigas, damaged by ionizing radiation. — J. Invertebrat. Pathol,
17 : 172—177.
Mood L. E. 1972. Two genes, one polypeptide chain-fact or fiction? — Fed. Proc,
31 :177—185.
Moritz K. 1972. Zur Feinstruktur integumentaler Bildungen bei Priapuliden (Hali-
cryptus spinulosus und Priapulus caudatus).— Z. MorphoL und Okol. Tiere,
72: 203—230.
Morris J. H, A. R. Hudson, G. W e d e 11. 1972. A .study of degeneration and re-
generation in the divided rat sciatic nerve based on electron microscope.—
Z. Zellforsch, 124:74—164.
Morrison С. M, В. H. Odense. 1974. Ultra structure of some pelecypoda adductor
muscles. — J. Ultrastruct. Res, 49 : 228—251.
Morton B. 1970. The tidal rhythm and rhythm of feeding and digestion in Cardium
edule. — J. Marine Biol. Assoc. U. K, 50 : 499—512.
Moss F. P. 1969. Nature of dividing nuclei in skeletal muscle of growing rats. —
Anat. Rec, 169 : 233—240.
Moss M. L. 1964. The phylogeny of mineralized tissues. — Internet. Rev. gen. ex-
per. Zool, 1 : 297—332.
Mukherjee T. M, L. A. Staehelin. 1971. The fine structural organization of
the brush border of intestinal epithelial cells. — J. Cell Sci, 8 : 573—599.
Murray P. D. 1963. Adventitous (secondary) cartilage in the chick embryo and the
development of certain bones and articulations in the chick skull. — Austral.
J. Zool, 11 : 368—430.
Murray R. I, A. Murray. 1967. Fine structure of taste buds of rabbit foliate pa-
pillae. — J. Ultrastruct. Res, 13 : 327—353.
Muthukrishnan S. 1974. Studies on the integument of Cestodes. — Acta histo-
chem, 50 : 174—180.
Muthukrishnan S. 1975. Studies on the integument of Cestodes. — Acta histo-
chem, 53 : 175—181.
N a b e у a m a A, С. P. Leblond. 1974. «Caveolated cell» characterized by deep sur-
face invaginations and abundant filaments in mouse gastro-intestinal epithelia.—
Amer. J. Anat, 140 : 147—153.
Nakao T. 1974. An elektron microscopic study of the circulatory system in Nereis
japonica. — J. MorphoL, 144 : 217—236.
Nest a T, N. Maclean. 1974. The blood as an erythropoetic organ in anaemic
Xenopus. — Experientia, 30 : 1083—1085.
Neutra M, С. P. Leblond. 1966. Synthesis of the carbohydrate of mucus in the
Golgi complex as shown by electron microscope radioautography of goblet cells
from rats injected with glucose-3H. — J. Cell Biol, 30: 119—137.
Neville A. С, M. G. Thomas, B. Zelazny. 1969. Pore canal shape related
to molecular architecture of arthropod cuticle. — Tissue and Cell, 1 : 183—200.
N i c a i s e G. 1973. The glio-interstitial system of Mollusces.— Internal. Rev. CytoL,
34 : 251—332.
402
Nicaise G., R. Garrone, M. Pavans de Ceccaty. 1966. Aspects membranai-
res du fibroblaste au cour se de la genese du collagene chez Glossodoris. —
G. r, Acad, sci., 262 : 2248—2250.
Nicaise G., M. Pavans de Geccatty, A. Balydier. 1968. Ultrastructures des con-
nexions entre cellules nerveuses, musculaires et glio-interstitielles chez Glosso-
doris. — Z. Zellforsch., 88 : 470—486.
Nichols B. A., D. T. В a in ton, M. G. Farquhar. 1971. Differentiation of mono-
cytes. Origin, nature and fate of their azurophil granules. — J. Cell. Biol., 50:
498—515.
Nicholson Ch., S. Kat er. 1973. The development of intracellular staining.—
In: Intracellular staining in neurobiology. N. Y.: 3—19.
Niewisch H., J. Hajdik, J. Sultanin, H. Vogel, G. Matioli. 1970. Haemo-
poetic stem sell distribution in tissues of fetal and newborn mice. — J. Cell
Physiol., 76 : 107—116.
Nilsson S. E. 1964. An electron microscopic classification of the retinal receptors
of the leopard frog (Rana pipiens). — J. Ultrastruct. Res., 10:390—416.
Noble-Nesbitt J. 1963. The cuticle and associated structure of Podura aquatica
at the moult. — Quart. J. Microscop. Sci., 104:369—391.
Noble-Nesbitt J. 1969. Water balance in the firebrat, Thermobia domestica
(Packard). Exchanges of water with the atmosphere. — J. Exper. Biol., 50:
745—769.
Noirot С., C. Noirot-Timothee. 1971. La cuticule proctodeale des insectes.
II. Formation durant la mue. — Z. Zellforsch., 113:361—387.
N о r d 1 a n d e r R. H., M. Singer. 1972. Electron microscopy of severed motor fibers
in the crayfish. — Z. Zellforsch., 126 : 157—181.
Nordlander R. H., M. Singer. 1973. Degeneration and regeneration of severed
crayfish sensory fibers: an ultrastructural study. — J. Gompar. Neurol., 125:
175—192.
Norton! D. 1969. Ontogeny of the immune response to skin allografts in relation
to lymphoid organ development in the amphibian Xenopus laevis.— J. Exper.
Zool., 170:449—466.
Nos sal G. I. 1972. Immunology as an independent discipline. — Cell Immunol.,
4: 109—115.
Ochs S. 1972. Fast transport of materials in mammalian nerve fibers. — Science, 176:
252—260.
O’C lair R. M., R. A. С1 o n ey. 1974. Patterns of morphogenesis mediated by dyna-
mic microvilli: chaetogenesis in Nereis vexillosa. — Cell and Tissue Res., 151 :
141—157.
Oglesbly L. C. 1969. Ionic and osmotic regulation. — Chem. Zool., 4:211—301.
Oliphant L. W., R. Gloney. 1972. The ascidian myokardium. — Z. Zellforsch.,
129: 395—412.
Orrhage L. 1973. Light and electron microscope studies of some brachiopod and
pogonophoran setae. — Z. Morphol. und Okol. Tiere, 74 : 253—270.
Os ch man J. L., B. J. Wall. 1969. The structure of the rectal pads of Periplaneta
americana.-L Morphol., 127:475—509.
Os ch man J. L., B. J. Wall, B. L. Gupta. 1974. Cellular basis of water transport.—
Sympos. Soc. Exper. Biol., 28 :305—350.
Owen G. 1972. Lysosomes, peroxisomes and bivalves. — Sci. Prog., 60:299—318.
Owen M. 1970. The origin of bone cells.— Internet. Rev. CytoL, 28:213—238.
Palade G. 1975. Intracellular aspects of the process of protein synthesis. — Science,
189 : 347—358.
P a n t i с V. R. 1974. The cytophysiology of thyroid cells. — Internet. Rev. CytoL, 38:
153—243.
P а г а к к a 1 P. F., N. J. Alexander. 1972. Keratinization. London—N. Y.
Parsons D. S., C. A. Boyd. 1972. Transport across the intestinal mucosal cell. —
Internal. Rev. CytoL, 32 : 209—255.
Paulus J. M. 1970. Gy topho tome trie measurement of DNA in thrombopoetic mega-
caryocytes. — Exper. Cell Res., 53 : 310—312.
Pease D. C. 1968. Myoid features of renal corpuscles and tubules.— J. Ultrastruct.
Res., 23:304—320.
Perrelet A. 1972. Protein synthesis in the visual cells of the honeybee drone as
studied with electron microscope radioautography. — J. Cell Biol., 55 : 595—
605.
Person P., M. B. Mathews. 1967. Endoskeletal cartilage of marine polychaete.
Eudistylia polymorpha. — Biol. Bull., 132 : 244—252.
Person Ph., D. Ё. Philpott. 1969a. The biology of cartilage. I. —J. Morphol.,
128 : 67—93.
Person Ph., D. E. Philpott. 1969b. The nature and significance of invertebrate
cartilages. — Biol. Rev., 44 : 1—16.
403
Peters W. 1969. Vergleichende Untersuchungen der Feinstruktur peritrophischer
Membranen von Insekten. — Z. Morphol. und Okol. Tiere, 64 : 21—58.
Pfeifer С. I. 1970. Gastric surface morfology in man, monkey and ferret: evidence
for in situ surface cell degeneration. — J. Exper. Molec. Pathol., 3:319—328.
Phillips D. M., H. Swift. 1965. Cytoplasmic fine structure of Sciara salivary
glands. — J. Cell Biol., 27 : 395—409.
Philpott D. E., Ph. Person. 1970. The biology of cartilage. II. —J. Morphol.,
131 :417—430.
Platzer-Schultz J., U. Welsch. 1970. Apocrine Sekretion der peritrophischen
Membran von Chironomus thummi piger Str. (Diptera). — Z. Zellforsch., 104:
530—540.
P1 u m m er L. M. 1966. Collagen formation in Acnatinidae associated with a specific
cell type.— Proc. Roy. Soc. B, 37 : 189—198.
Postwald H. E. 1971. A fine structural analysis of the epidermis and cuticle
of the oligochaete Aeolosoma bengalense Stephenson. — J. Morphol., 135:
185—212.
P otten C. S. 1974. The epidermal proliferative unit: the possible role of the central
basal cell. — Cell and Tissue Kinetics, 7 : 77—89.
Potts W. T., G. Рагу. 1968. Osmotic and ionic regulation in animals. N. Y.
Priester W. 1971. Ultrastructure of the midgut epithelial cells in fly Calliphora
erythrocephala. — J. Ultrastruct. Res., 36 : 783—805.
Pringle J. W. 1972. Arthropod muscle. — In: The structure and function of muscle,
1. N. Y.—London : 491—542.
Prosser C. L. 1974. Smooth muscle. — Ann. Rev. Physiol., 36 : 503—537.
Raff M. C., S. Petris. 1973. Antibody antigen reaction of the lymphocyte surface. —
In: Cell interaction. Amsterdam—London : 237—243.
Ravindranath M. H. 1974. An inquiry into the histochemistry of insect cuticle. —
Acta histochem., 51: 188—199.
R a v i о 1 a E., G. R a v i о 1 a. 1967. Striated muscle cells in the thymus of reptilies
and birds. An electron microscopy study. — Amer. J. Anat., 121:623—646.
Rawless M. E. 1947. Origin of pigment cells from the neural crest in the mouse
embryo. — Physiol. Zool., 20 : 248—266.
Redmond J. R. 1972. Blood respiratory pigments. — Chem. Zool., 6 : 129—140.
Reedy M. K. 1968. Ultrastructure of insect flight muscle. — J. Mol. Biol., 31:155—
176.
Rees D., P. N. U s h e r w о о d. 1972. Fine structure of normal and degenerating mo-
tor axons and nerve-muscle synapses in the locust Schtstocerca gregaria. —
J. Compt. Biochem. Physiol., 43 : 83—101.
Retzius G. 1890. Zur Kenntnis der Nervensystems der Crustacean. — Biol. Unter-
suchung, 1 :1—50.
Retzius G. 1891. Zur Kenntnis der Nervensystems der Wiirmer. — Biol. Untersu-
chung, 2 : 1—28.
Reznick M. 1969. Thymidine 3H uptake by satellite cells of regenerating skeletal
muscle. — J. Cell Biol., 40 : 568—570.
Rhodin I. A. 1971. The ultrastructure of the adrenal cortex of the rat under normal
and experimental conditions. — J. Ultrastruct. Res., 34:23—71.
Rice R. V., I. A. Moses, D. M. McManus, A. C. Brady, L. M. Blasik. 1970.
The organization of contractile filaments in a mammalian smooth muscle. —
J. Cell Biol., 47:183—196.
Richards A. D., P. A. Richards. 1971. Origin and composition of the peritro-
phic membrane of the mosquito Aedes aegypti. — J. Insect. Physiol., 17:2253—
2275.
Richards K. S. 1975. The histochemistry of the cuticle of some lumbricids (Anne-
lida: Oligochaeta). — Ann. Histochim., 20: 133—143.
Rifkin E., T. С. C e h n g, H. R. Hohl. 1970. The fine structure of the tegument
of Tylocephalum metacestodes: with emphasis on a new type of microvilli. —
J. Morphol., 130 :11—24.
Rifkind R., D. Chui, H. Epl er. 1969. An ultrastructural study of early morpho-
genetic events during the establishment of fetal hepatic erythropoiesis. — J. Cell
Biol., 40:343—365.
Riley J., A. A. В a n a j a. 1975. Some ultrastructural observations on the integument
of a pentastomid. — Tissue and Cell., 7 : 33—50.
R о d m a n N. F., J. C. Pai n t er, N. B. McDevitt. 1963. Platelet desintegration du-
ring clotting. — J. Cell Biol., 16 : 225—242.
Rosenblath J. 1967. Obliquely striated muscle. I, II. Contraction mechanism
of Ascaris body muscle. — J. Cell Biol., 34 : 15—33.
Rosenblath J. 1968. Obliquely striated muscle. IV. Sarcoplasmic reticulum con-
tractile apparatus and endomysium of the body muscle of a polychaeta Glycera
in relation to its speed. — J. Cell Biol., 36 : 245—259.
Rosenblath J. 1969. Sarcoplasmic reticulum of on unusually fast acting crusta-
cean muscle. — J. Cell Biol., 42 : 534—547.
404
Rosenblath J. 1972a. Myosin like aggregates in trypsin treated smooth muscle
cells. — J. Cell Biol., 48 : 174—188.
Rosenblath J. 1972b. Obliquely striated muscle. — In: The structure and function
of muscle, 1. N. Y.—London : 389—419.
Ross R., P. В г о n s t e i n. 1969. The elastic fiber. — J. Cell Biol., 40 : 366—381.
Ross R., S. Klebanoff. 1971. The smooth muscle cell. — J. Cell Biol., 50:159—186.
Rostgaard J., В. I. Kristenen,, L. E. Nelsen. 1972. Electron microscopy of fi-
laments in the basal part of rat kidney tubule cells, and their in situ interac-
tion with heavy meromyosin. — Z. Zellforsch., 132 : 497—522.
Rostgaard J., L. Thuneberg. 1972. Electron microscopical observations on the
brush border of proximal tubule cells of mammalian kidney. — Z. Zellforsch.,
132:473—496.
Roth S. I., H. P. Baden. 1967. An autoradiographic study of the sites of protein
synthesis in the epidermis of the indigo snake (Drymarchon corais couperi). —
J. Exper. Zool., 165 : 345—354.
Ruben L. N. 1970. Lymphoreticular neoplasia and immunity in Amphibia. — De-
velop. Biol., 22 :43—58.
Rudd ell C. L., S. R. Welligs. 1971. The ultrastructure of the oyster brown cell,
a cell with a fenestrated plasma membrane. — Z. Zellforsch., 120: 17—28.
R u n h a m N. W. 1963. A study of the replacement mechanism of the pulmonate ra-
dula.—Quart. J. Microscop. Sci., 104:271—277.
Salpeter M. M. 1968. 3H-protein incorporation into cartilage. Electron microscopic
autoradiographic observation. — J. Morphol., 124 : 387—422.
Salpeter M. M., I. R. Fa e der. 1971. The role of sheath cells in glutamate uptake
by insect nerve muscle preparation. — Progr. Brain Res., 34 :103—114.
Salt G. 1961. The haemocytic reaction of insects to foreign bodies. — In: The cell
and the organism. Cambridge : 175—182.
Salt G. 1967. Cellular defence mechanisms in insects. — Fed. Proc., 26:1671—1673.
Samson T. E. 1971. Mechanism of axoplasmic transport. — J. Neurobiol., 2:347—
360.
S a n d о w A. 1970. Skeletal muscle. — Ann. Rev. Physiol., 32 : 87—138.
Sasse D., W. Pfeiffer, M. Arnold. 1970. Epidermale Organe am Kopf von Mo-
rulius chrysophakedion (Cyprinidae, Ostariophysi, Pisces).— Z. Zellforsch., 103:
218—231.
S a t i r P. 1974. How cilia move. — Scient. Amer., 231: 45—63.
Schaffer J. 1930. Die Stutzgewebe. — In: Handbuch d. mikr. Anat. des Menschen,
2. Berlin: 1—390.
Scharrer B. 1965. Hemocytes within prothoracic glands of insects. — Amer. Zoolo-
gist, 5 : 235—238.
Scharrer E., B. Scharrer. 1963. Neuroendocrinology. N. Y.—London.
Schipp R., P. Hohn, A. Schafer. 1971. Elektronenmikroskopische und histoche-
mische Untersuchungen zur Funktion des Kiemenherzanhanges (Pericardialdriise)
von Sepia officinalis. — Z. Zellforsch., 117:252—274.
Schmekel L., W. Wechsler. 1967. Elektronenmikroskopische Untersuchungen fiber
Structur und Entwicklung der Epidermis von Trichesia granosa (Gastropoda,
Opistobranchia). — Z. Zellforsch., 77 : 95—114.
Schmitt F. O. 1969. Fibrous proteins and neuronal dynamics. In: Cellular dynamics
of neuron, 8. N. Y.—London : 95—111.
Schultze В., V. Haack, A. C. Schmeer, W. Maurer. 1972. Autoradiographic
investigation on the cell kinetics of crypt epithelia in the jejunum of the
mouse. — Cell and Tissue Kinetics, 5: 131—145.
Schwab D. W., E. Simmons, J. Scala. 1969. Fine structure changes during func-
tion of the digestive gland of Venus flytrap. — Amer. J. Bot., 56:88—100.
Seiler M. W., M. A. Van Katachalan, R. S. Cortan. 1976. Glomerular epithe-
lium. Structural alteration induced by polycations. — Science, 189:390—393.
Shapeero W. L. 1962. The epidermis and cuticle of Priapulus caudatus Lamarck.—
Trans. Amer. Microscop. Soc., 81:352—355.
Sherman R. G. 1972. Ultrastructural features of cardiac muscle cells in a Tarantula
spider. — J. Morphol.. 140 : 215—241.
S h i г a i N., S. U t i d a. 1970. Development and degeneration of the chloride cell
during seawater and freshwater adaptation of the Japanese eel, Anguilla fapo-
nica. — Z. Zellforsch., 103 : 247—264.
Singer M., M. M. Salpeter. 1966. The transport of 3H-l-histidine through the
schwann and myelin sheath into axon, including a reevaluation of myelin func-
tion. — J. Morphol., 120 : 281—316.
S m i n i a T. 1972. Structure and function of blood and connective tissue cells of the
freshwater pulmonata, Lymnaea stagnalis. — Z. Zellforsch., 130 : 497—526.
S mini a T. 1974. Haematopoesis in the freshwater snail Lymnaea stagnalis studied by
electron microscopy and autoradiography. — Cell and Tissue Res., 150:443—454.
Sminia T., H. H. Boer, A. Niemantsverdriet. 1972. Haemoglobin producing
cells in freshwater snails. — Z. Zellforsch., 135 : 563—568.
405
Sminia T., E. Borhat-Reinders A. N. L i n d e van der. 1974. Encapsulation
of foreign matriials experimentally introduced into the freshwater snail Lym-
naea stagnalis. — Cell and Tissue Res., 153 : 307—326.
Smith D. S. 1972. Muscle. N. Y.—London.
Smith D. S., B. L. Cup th, U. Smith. 1966. The organization and myofilament
array of insect visceral muscles. — J. Cell Sci., 1:49—57.
S m i t h J. E. 1957. The nervous anatomy of the body segments of nereid polychaetes. —
Philos. Trans. Roy. Soc. London B, 240: 135—196.
Smith M. J. 1970. The blood cells and tunica of ascidian Halocynthia aurantium
Pallas. — Biol. Bull., 132 : 354—388.
Smith T. G., T. Baumann. 1969. The functional organization within the omma-
tidium of the lateral eye of Limulus. — Prog. Brain Res., 31: 313—349.
Sommer J. R., E. A. Johnson. 1969. Cardiac muscle. A comparative study with
special reference to frog and chicken hearts. — Z. Zellforsch., 98 : 437—468.
Spearman R. I. 1966. The keratinization of epidermal scales, feathers and hairs. —
Biol. Rev., 41 : 59—96.
Spearman R. I. 1968. Epidermal keratinization in the salamander and a comparison
with other amphibia. — J. MorphoL, 125 : 129—144.
Sperelakis N. 1971. Ultrastructure of the neurogenic heart of Limulus polyphe-
mus. — Z. Zellforsch., 116 : 443—463.
Sperelakis N., R. Rubio, J. Redick. 1970. Sharp discontinuity in sarcomere
lengths across intercalated discs of fibrillating cat hearts. — J. Ultrastruct. Res.,
30:503—532.
Sprent J. 1973. Circulating T- and B-lymphocytes of the mouse. I. Migratory proper-
ties. — Cell Immunol., 7 : 10—39.
Sprent J., A. Basten. 1973. Circulating T- and B-lumphocytes of the mouse. II Life
span. — Cell Immunol., 7 :40—59.
S t a n i e r J. E., M. A. W о о d h о u s e, R. L. Griffin. 1968. The fine structure of
the hepatopancreas of Carcinus maenas (L.) (Decapoda, Brachyura). — Crusta-
ceana, 14 : 56—66.
Starre-Molen van der L. G., N. P r i e s t e r. 1972. Brush-border formation in the
midgut of insect Calliphora erythrocephala. — Z. Zellforsch., 125 : 295—305.
Staubli W., T. A. Freyvogel, J. Suter. 1966. Structural modification of the
endoplasmic reticulum of midgut epithelial cells of mosquitoes in relation to
blood intake. — J. Microscopie, 5 : 189—204.
Stein R. L, W. R. Richter, R. A. Zussman, G. В о г у n j о 1 f s о n. 1966. Ultra-
structural characterization of Daphnia heart muscle. — J. Cell Biol., 29: 168—170.
Stephens P. R., I. Z. Young. 1969. The glio-vascular system of Cephalopods.—
Philos. Trans. Roy. Soc. London B, 255:1—12.
Stockdale F. E., Y. J. Topper. 1966. The role of DNA synthesis and mitosis in hor-
mone dependent differentiation. — Proc. Nat. Acad. Sci. USA, 56:1283—1289.
Storch V., U. Welsch. 1970. Uber die Feinstruktur der polychaeten Epidermis
(Annelida). — Z. MorphoL Tiere, 66:310—322.
Storch V., U. Welsch. 1972. Ultrastructural and histochemistry of the integument
of air-breathing polychaetes from mangrove swamps of Sumatra. — Marine Biol.,
17:137—144.
Stragways-Dixon J., D. S. Smith. 1970. The fine structure of gill «podocytes»
in Planulirus argus (Crustacea). — Tissue and Cell, 2:611—624.
Sutherland D. I. 1971. A hemocytic disorder of the american cockroach Peripla-
neta americana. — J. Invertebrat. Pathol., 17 : 369—374.
T a u c L. 1967. Transmission in invertebrate and vertebrate ganglia. — Physiol. Rev.,
47 : 521—593.
Taylor R. H. 1971. Water and solute transport by the Malpighian tubules of the
stick insect, Carausius morosus. — Z. Zellforsch., 118:333—368.
Terne de z H. L., P. R. Burton, F. E. Samson. 1971. Axoplasmic transport
in the crayfish nerve cord. — J. Cell Biol., 51 : 172—176.
Tj0nneland A., R. Myklebust, H. Jensen. 1975. The membrane systems of
the cardiac muscle cell of Cirolana borealis. — Cell and Tissue Res., 163 : 175—
184.
Tobe S. S., K. G. D a v e y. 1974. Autoradiographic study of protein synthesis in ab-
dominal tissues of Glossina austeni. — Tissue and Cell, 6 : 255—268.
T о m b e s A. S. 1970. An introduction to invertebrate endocrinology. N. Y.
Toner P. G. 1968. Cytology of intestinal epithelial cells. — Internet. Rev. CytoL, 24:
233—343.
Toro I. L., R. G u z s о, O. Tor ok, I. О 1 a n. 1968. Myogenese in Gewebkulturen des
Thymus. — Z. Zellforsch., 89 : 241—249.
Tosh io N., W. Gordon, G. Grach am. 1974. Insect visceral muscle: fine struc-
ture of the proctodeal muscle fibres. — J. Insect Physiol., 20 : 1999—2013.
T r a i n i n N. 1974. Thymic hormones and the immune response. — Physiol. Rev., 54 :
272-315.
T r a z i e r I. A. 1973. Ultrastructure of the chick thymus. — Z. Zellforsch., 136 : 191—205.
406
Trelstad R. L., K. Hagashi, В. P. Toole. 1974. Epithelial collagens and glu-
cosaminoglycans in the embryonic cornea. — J. Cell Biol., 60 : 815—830.
Usherwood P. N. 1967. Insect neuromuscular mechanisms. — Amer. Zoologist, 7:
553—582.
V a e s G. 1969. Lysosomes and the cellular physiology of bone resorption. — In: Lysoso-
mes in biology and pathology. Amsterdam—London : 217—253.
Vey A. 1971. Etudes des reactions cellulaires anti cryptogamiques chez Galleria mello-
nella. — Ann. Zool. Ecol. Anim., 3 : 17—30.
Vinson S. B. 1971. Defence reaction and hemocyte changes in Heliothes virescens
in response to its habitual parasitoid Cardiochiles nigriceps. — J. Invertebrat.
Pathol., 18:94—100.
Viragh S., A. Porte. 1973a. The fine structure of the conducting system of monkey
heart. I. The sino-atrial node and the internodal connections. — Z. Zellforsch.,
145: 191—211.
Viragh S., A. Porte. 1973b. On the impulse conducting system of the monkey
heart (Macaca mullatta).— Z. Zellforsch., 145:363—388.
Vollrath L. 1971. Uber die Mikrovillibildung im fetalen Rattendiindarm. — Z. Zell-
forsch., 114:546—556.
Wall B. J., J. L. О s c h m a n, B. A. Schmidt. 1975. Morphology and function of
Malpighian tubules and associated structures in the cockroach, Periplaneta ame-
ricana. — J. Morphol., 146 : 265—306.
Watson B. D. 1965. The fine structure of the body wall and the growth of the cu-
ticle in the adult nematode Ascaris lumbricoides. — Quart. J. Microscop. Sci.,
106 : 83-91.
Weber A., I. M. Murray. 1973. Molecular control mechanisms in muscle contrac-
tion. — Physiol. Rev., 53 : 612—673.
We el P. B. 1970. Digestion in Crustacea. — Ghem. Zool., 5:117—145.
Weinstock M., С. P. L e b 1 о n d. 1974. Synthesis, migration and release of precur-
sor collagen by odontoblasts as visualized by radioautography after 3H proline
administration. — J. Cell Biol., 60 : 92—127.
Weiss L. 1966. Bone marrow. In: Histology. N. Y. : 344—354.
Weiss P. 1969. Neuronal dynamics and neuroplasmic («axonal») flow. In: Cellular
dynamics of the neuron, 8. N. Y.—London : 3—34.
Welsch U., V. Storch. 1973. Einfiihrung in Cytologie und Histologie der Tiere.
Leipzig. (Русск. пер.: Велш У., Ф. Ш тор х. 1976. Введение в цитологию и
гистологию животных. «Мир», М.).
W е s s i n g A., D. Eichelberg. 1973. Elektronenmikroskopie Untersuchungen zur
Struktur und Funktion der Rectalpapillen von Drosophila. — Z. Zellforsch., 136 :
415-432.
W i c h a r d W., J. H. Abel. 1972. Typology of ephemerid chloride cells. — Z. Zell-
forsch., 132:533—551.
Wiers ma C. A., G. M. Hunh e s. 1961. On the functional anatomy of neuronal units
in the abdominal cord of crayfish, Procambarus clarkii. — J. Compar. Neurol.,
116:209—220.
Wigglesworth V. B. 1967. Polyploidy and nuclear fusion in fat body of Rhodnius
(Hemiptera). — J. Cell Sci., 2 : 603—616.
Wigglesworth V. B. 1970. Structural lipid's in the insect cuticle and the func-
tion of the oenocytes. — Tissue and Cell, 2 :155—179.
Wilbur K. 1972. Shell formation in Molluscs. — Chem. ZooL, 7 : 103—142.
W i 1 f e r t M., W. Peters. 1969. Vorkommen von Chitin bei Coelenteraten. — Z. Mor-
phol. und Okol. Tiere, 64 : 77—84.
Willmer E. N. 1965. The origin of collagen. In: Structure and function of connec-
tive and skeletal tissue. London : 196—206.
Willmer E. N. 1970. Cytology and evolution. N. Y.—London.
Wilson R. A., L. A. Webster. 1974. Protonephridia. — Biol. Rev., 49:127—160.
Wine I. 1973. Invertebrate central neurones: orthograde degeneration and retrograde
changes after axotomy. — J. Exper. Neurol., 38:157—169.
W i n e e г a J. S. 1974. Fine structure of the investing layer on the gymnoblastic hy-
droid Syncoryne tenella. — J. Morphol., 144:131—142.
Wissocq J. C. 1974. Etude ultrastructurale d’un organe musculaire constitue de fib-
res possedant les plus longs sarcomeres du regne animal. — J. Microscopie, 19:
285-306.
Witmer A., A. W. Martin. 1973. The fine structure of the branchial heart appen-
dage of the cephalopod Octopus dofleini Martini. — Z. Zellforsch., 136:545—568.
Wolff К., E. Schreiner. 1971. Differential enzymatic digestion of cytoplasmic
components of keratinocytes: electron microscopic observations. — J. Ultrastruct.
Res., 36 :437—454.
W о n d г a к G. 1969. Die Ultrastruktur der Zellen aus dem interstitielen Bindgewebe
von Arion rufus (Pulmonata, Gastropoda). — Z. Zellforsch., 95:249—262.
407
Wright N, A. Morley, D. A p p 1 e t о n. 1972. Variation in the duration of mitosis
in the crypts of lieberkiihn of the Rat. — Cell Tissue Kinetic, 5:351—364.
Wright S. M. 1973. DNA synthesis during differentiation of tadpole shank epider-
mis. — J. Exper. Zool., 186 : 237—256.
Wuerker R. B., J. B. Kirkpatrick. 1972. Neuronal microtubules, neurofilaments
and microfilaments. — Internal. Rev. Cytol., 33 : 45—75.
Young R. W, B. Droz. 4968. The renewal of protein in retinal rods and cones. —
J. Cell Biol., 39: 169—184.
Zachary D., M. Brechlin, J. A. Hoffmann. 1975. Role of the «trombocytoids»
in capsule formation in the dipteran Calliphora erytrocephala. — Cell and Tissue
Res., 162:343—348.
Zachary D., J. A. Hoffmann. 1973. The haemocytes of Calliphora erythrocephala
(Meig.). — Z. Zellforsch, 141: 55—73.
Zimmermann P. 1967. Fluoreszenzmikroskopische Studien fiber die Verteilung
und Regeneration der Faserglia bei Lumbricus terrestris L. — Z. Zellforsch,
81 : 190—220.
Zylstra U. 1972. Histochemistry and ultrastructure of the epidermis and subepider-
mal gland cells of the freshwater snails Lymnaea stagnalis and Biomphalaria
pjeifferi. — Z. Zellforsch, 130 : 93—134.
ОГЛАВЛЕНИЕ
Стр.
Предисловие 3
Часть I. ВВЕДЕНИЕ. КЛЕТКИ И ТКАНИ ............................. 5
Глава 1. Краткий очерк современных представлений об общих закономер-
ностях организации клеток многоклеточных животных...................... 5
Введение.............................................................. 3
Плазматическая мембрана............................................... 3
Цитоплазма и органоиды ... .............. .... 9
Интерфазное ядро..................................................... 14
Деление клеток и явления соматической полиплоидизации . . ... 17
Заключение........................................................... 21
Глава 2. Классификация тканей и некоторые общие закономерности их
формирования в онто- и филогенезе..................................... 22
Введение............................................................. 22
Развитие тканей в онтогенезе. Дифференцировка и детерминация клеточных
систем и их цитогенетическая основа.............................. 24
Взаимоотношения между репродукцией и дифференцировкой клеток в ткане-
вых системах..................................................... 26
Заключение................................................. . . 28
Ч а с т ь II. ЭПИТЕЛИАЛЬНЫЕ ТКАНИ ................................... 31
Глава 1. Железистые эпителии......................................... 32
Введение............................................................. 32
Экзокриновые железы.................................................. 33
Одноклеточные и малоклеточные железы............................ 33
Многоклеточные железы........................................... 39
Эндокринные железы................................................... 43
Эпителиальные эндокринные железы позвоночных животных .... 43
Эпителиальные эндокринные железы беспозвоночных животных . . 52
Заключение........................................................... 58
Глава 2. Кишечные эпителии......................................... 61
Введение............................................................ 61
Кишечные всасывающие эпителии позвоночных животных................... 62
Млекопитающие...................................... ........... 62
Низшие позвоночные..................... . . 70
Кишечный эпителий беспозвоночных животных .... 74
Членистоногие................................................... 74
Беспозвоночные животные средних уровней организации (полихеты,
приапулиды, моллюски, оболочники и иглокожие)............... 81
Кишечные эпителии низших многоклеточных (губки, кишечнополостные,
турбеллярии)..................................................... 92
Заключение........................................................... 96
Глава 3. Кожные эпителии.............................................. 102
Введение........................................... ... . . 102
Однослойные и многорядные ресничные эпителии 102
409
Однослойные железистые эпителии . . . . . ..............
Кутикулярные эпителии................................................... И2
Членистоногие.......................................................И2
Кольчатые черви, приапулиды, моллюски, голотурии и асцидии . . . 121
Паразитические черви...............................................129
Многослойные эпителии...................................................134
Высшие позвоночные (млекопитающие, птицы, рептилии)............... 134
Низшие позвоночные (амфибии, рыбы, круглоротые)....................145
Заключение..............................................................130
Глава 4. Осморегулирующие и выделительные эпителии..................... 154
Введение................................................................154
Специализированные осморегулирующие системы кожного эпителия ... 156
Солевые клетки рыб и солевые железы рептилий и птиц................156
Осморегулирующие системы кожного эпителия насекомых................159
Краткая характеристика и классификация смешанных осморегулирующих
и выделительных систем многоклеточных животных....................160
Структурные модификации и явления цитологического и системного паралле-
лизма осморегулирующих и выделительных канальцев многоклеточных
животных..........................................................166
Заключение............................................................. 172
Часть III. ТКАНИ ВНУТРЕННЕЙ СРЕДЫ.............................. 176
Глава 1. Трофические и защитные разновидности тканей внутренней среды
позвоночных животных..................................................177
Рыхлая соединительная ткань............................................ 177
Кровь.................................................................. 184
Кроветворение...........................................................192
Лимфоидная ткань........................................................204
Функциональное единство трофических и защитных разновидностей тканей
внутренней среды..................................................220
Глава 2. Трофические и защитные разновидности тканей внутренней среды
беспозвоночных животных . ................................225
Межуточные интерстициальные ткани...................................... 225
Свободные клеточные элементы крови, полостной и тканевой жидкостей
и их функциональное значение......................................233
Гистогенетические отношения между клетками в трофических разновидностях
тканей внутренней среды беспозвоночных......................240
Глава 3. Опорные и скелетные разновидности тканей внутренней среды 245
Плотная соединительная ткань позвоночных животных.......................245
Хрящевые ткани позвоночных животных...................................247
Костные ткани...........................................................253
Общие закономерности системной организации и морфобиохимической диф-
ференцировки клеток опорных и скелетных тканей позвоночных жи-
вотных ...........................................................260
Хрящевые и плотные соединительные ткани беспозвоночных животных . . 265
Заключение . 274
Часть IV. МЫШЕЧНЫЕ СОКРАТИМЫЕ ТКАНИ И ТКАНИ НЕРВНОЙ
СИСТЕМЫ............................................................... 279
Глава 1. Мышечные ткапн...........................................279
Введение..........................................................279
Соматическая мышечная ткань позвоночных...........................280
Соматическая мышечная ткань членистоногих.........................286
Соматические мышечные ткани других беспозвоночных животных .... 291
410
Целомические мышечные ткани........................................294
Висцеральная гладкая мышечная ткань позвоночных и другие разновидности
гладкой мышечной ткани........................................ 301
Заключение....................................................... 304
Глава 2. Ткани нервной системы 310
Введение...........................................................310
Морфобиохимическая организация нейронов............................311
Синапсы........................................................... 321
Рецепторные нервные окончания..................................... 329
Нейроглия..........................................................350
Заключение........................................................ 365
ОБЩЕЕ ЗАКЛЮЧЕНИЕ...................................................377
Литература.........................................................388
Алексей Алексеевич Заварзин
Основы частной цитологии
и сравнительной гистологии
многоклеточных животных
Утверждено к печати
Научным советом по проблемам цитологии
Академии наук СССР
Редактор издательства В. В. Тарнягина
Художник Д. С. Данилов
Технический редактор М. Н. Кондратьева
Корректоры А. И. Кац, Э, Н. Липпа, Г. А. Мошкина
Сдано в набор 18/VI 1976 г. Подписано к^печати
19/XI 1976 г. Формат 70Х1081/1в. Бумага № 2.
Печ. л. 253/4=36.05 усл. печ. л. Уч.-изд. л. 38.94.
Изд. № 6138. Тип. зак. М 696. М-44632. Тираж 3500.
Цена 2 р. 69 к.
Ленинградское отделение издательства «Наука»
199164, Ленинград, В-164, Менделеевская линия, д. 1
1-я тип. издательства «Наука»
199034, Ленинград, В-34, 9 линия, д. 12