Текст
ТИББИЁТ ОПИЙ БИЛИМГОКЛАРИ ТАЛАБАЛАРИ УЧУН
УЦУВ АДАБИЁТИ
Х.Х.КАНИМО8АЗ.ТАТАРСКАЯНТОЛИМХУЖАЕВА
у мумий КИМЁДАН АМАЛИЙ МАНИУЛОТЛАР ♦
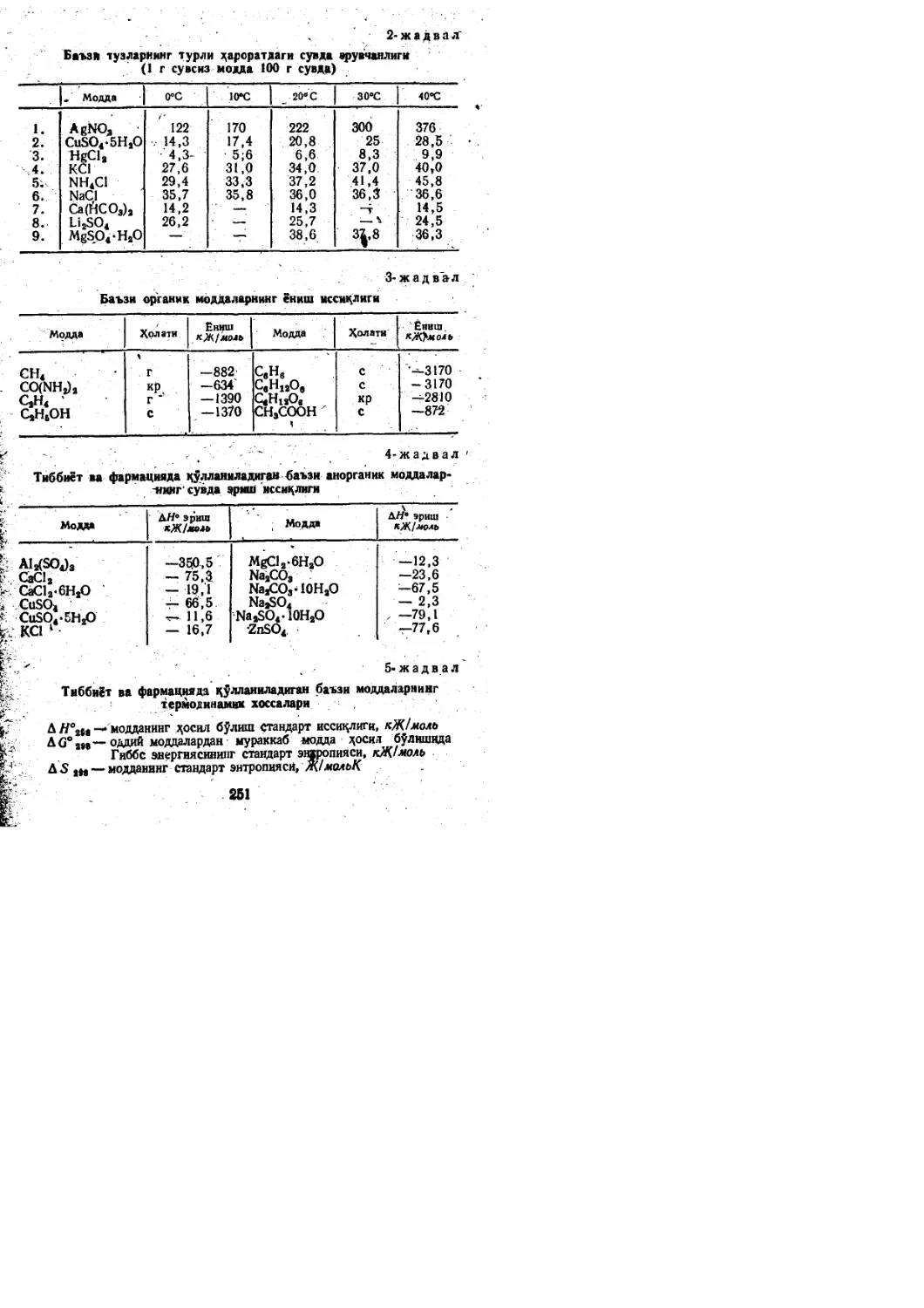
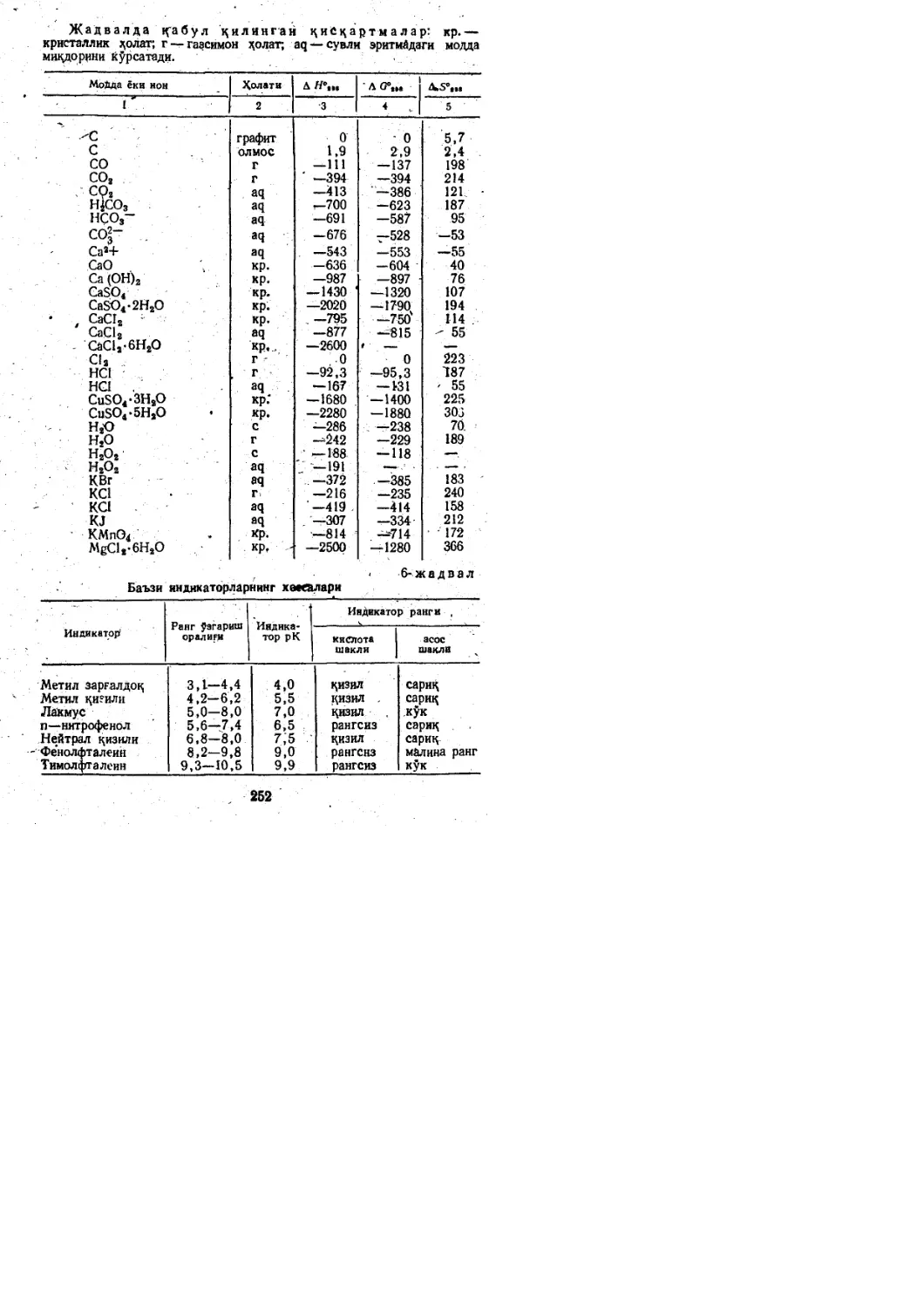
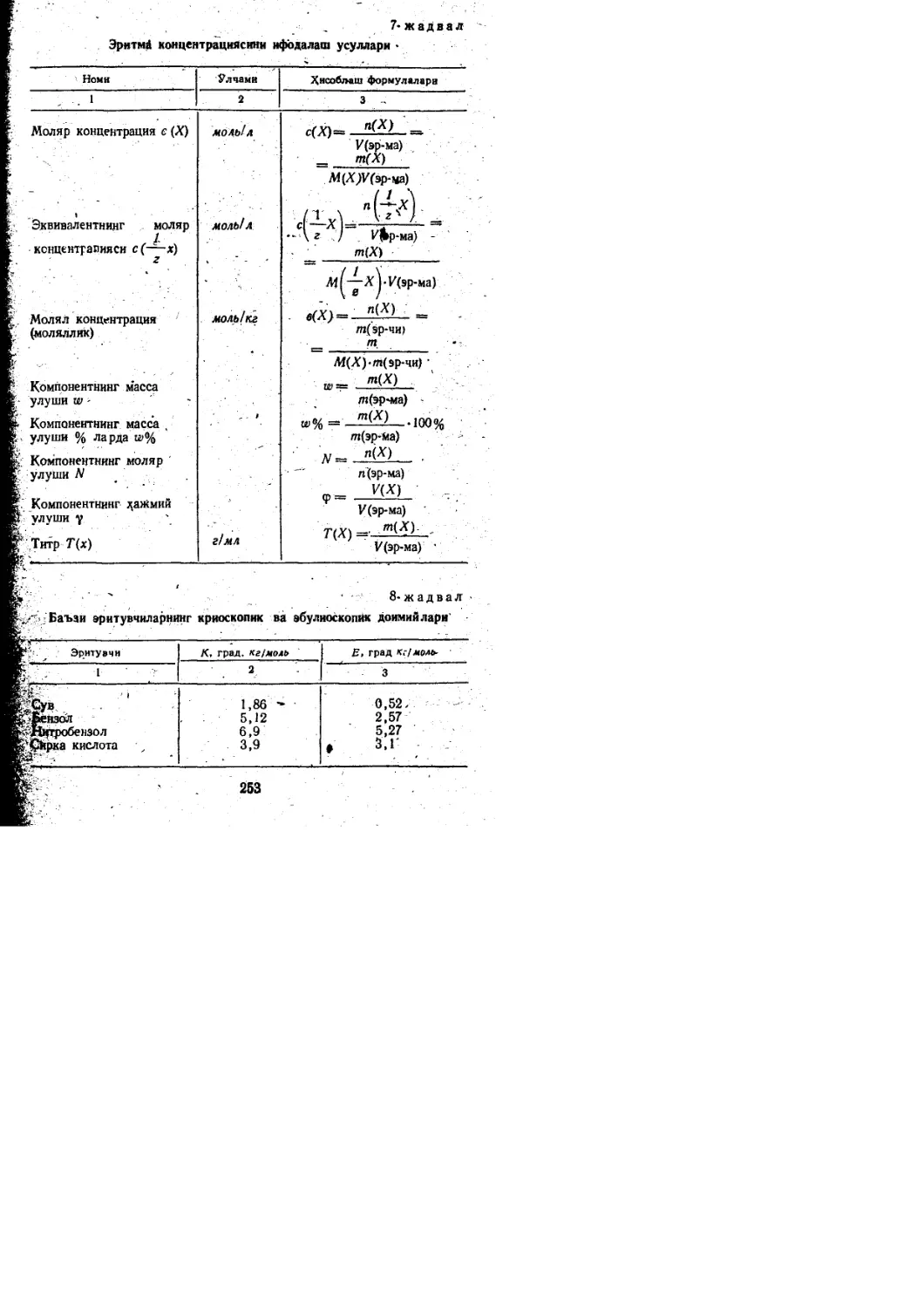
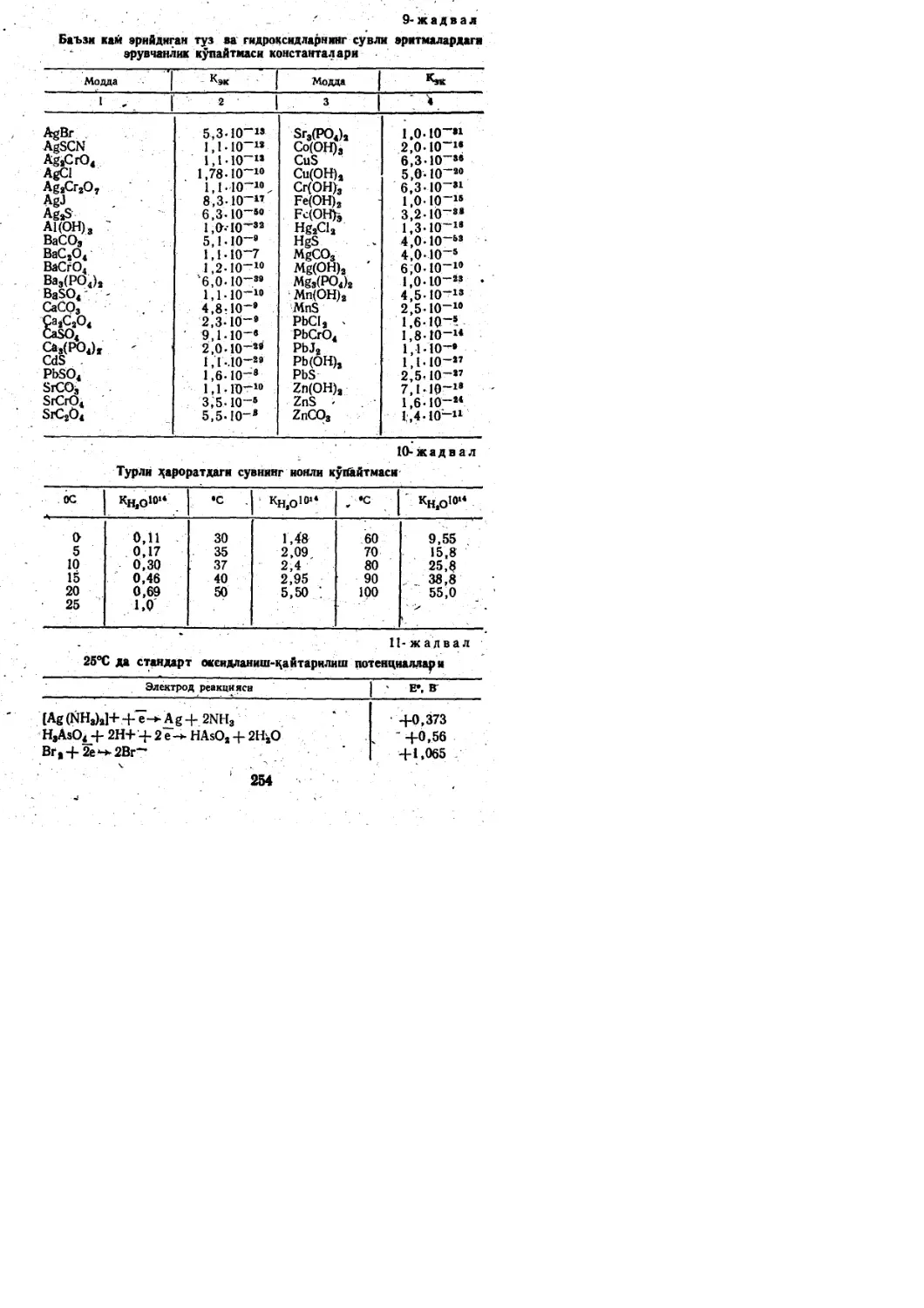
o.6Z K.s.ci.Na.Mg.FB
0.4Z
24.1
Тад-ризчилар:
Тошкент Давлат тиббиёт олий билимго\и умумий ва • « биоорганик кимё кафедраси мудири A. F. Максумов, шу кафедра? доценти А. Ж. Хамроев.
Хакимов X. X- ва боищ.
X 20 Умумий кимёдан амалий мащрулотлар: Тиб-,' биёт олий билимго^лари талабалари учун |^ув ' цултк/Х. X- Хакимов, А. 3. Татарская, Н. Т. Олим- -хужаева.— Т.: Ибн Сино номидаги нашриёт-матбаа бирлашмаси, 1993.— б:—(Тиббиёт олий
билимго^лари талабалари учун. Уцув. адабиёТи)
I. 1,2 Автордош.
Хакимов X. X. и др. Пособие по лабораторным занятиям по общей химии. .
Кимё мудим умумназарий фанлар даторига кириб. унииг асосий" вазифаси— еалабалариинг махсус- фаяларнн муваффадиягли узлашгириши учун назарий вамин яратиш. уларнинг дунёдарашини шакчлантириш, долаверса талабалар. нинг илмий фикрлаш добилиягнни такомиллашгиришдир. Шу билан биргд ушбу дарсликда муаллифлар тиббий билимларни эгаллашда кимёнинг мудим Урии тутишини уцтириб йтганлар. к . —
Дарслик тиббиет олий билимгодлари Кабул килган Удув дастурига мувофид тузилган ва ана шу олийгодларда таълим олаётгаи талабаларга йУл-жалланган. *
ББК 24.1я73
1703000000—045
' М354(04)—93 75’93
ISBN 5-638-00793-8
© X. X- Хакимов, А. 3. Татарская, Н. Т. Олимхужаева, 1993.
СУЗ БОШИ ;
г
ч Кимё фундаментал умумназарий фрнлар цаторига майсуб. Унинг асосий вазифаси ^уйидагилардан иборат: биринчидан ^цувчиларнинг махсус фанларни муваффа-^иятли узлаштириши учун назарий замин яратиш, иккинчидан талабаларда илмий дунёцарашни шакллан-тириш, учинчддан ^цитиш жараёнида талабаларда замонавий назарий фикрлашни ривожлантириш гоятда му^имдир, чунки ^озирги замон мутахассйсига цуйила-диган талаблар ррасида урганилаётган объект'ёки ^ода-сага назарий цараш зарурати, муста^ил фикрлаш цоби-' лияти, фан ну^таи назаридан фикр юритиш, узининг тор мутахассислик доирасидан чи^иб, комплекс муам-моларни ^ал кила олиш цобилияти биринчи уринга чикади. .
Тиббий билимларни эгаллашда кимёнинг роли кат-тадир. Модданинг тузилиш назарияси ва кимёвий 6of-лар ^осил булиши, кимёвий термодинамика, кимёвий жараёнларнинг бориш механизми ва бонща йуналиш-ларни билмай туриб, тиббиётдаги му^им йуналишлар-дан б^лган молекуляр биология, генетика, фармакология, квант биокимёси ва бошкаларни урганиб б^лмайди.
Тиббиёт олий у^ув юртлари учун программага муво-фи^ тузилган умумий кимёнинг бир б^лими бионорга-ник-кимедир, у ноорганйк кимё, биокимё, биология, био-геокимё асосида ташкил топган.
Бионоорганик кимё Металл ионларини сацловчи био-молекулалар таркибини, тузилишйни, ^згаришини ^рга-нади ва уларни моделлаштиради. Бу фан ноорганйк ионларни биокимёвий жараёнлар боришида ^атнашиш механизмларини ^рганади. Системаларда кимёвий эле-ментларнинг цандай бирикма ^олида булиши ва цайси биологик жараёнларда цатнашишиуи тушунтириб бериш мумкин.
Буюк рус олими М. В. Ломоносовнинг «Шифокор кимёни етарлича чуцур билмай туриб етук б^ла олмай-
ди»,—деган ^авдоний с^злари ^озирги кунда ^ам $з а^амиятини й^отгани йуц.
Китобни рус тилидаги матнини ^збекчага таржима цилган кимё фанларй номзоди У. Э. Алиевга муаллиф-лар ^з миннатдорчиликларини билдирадилар ва ^ув-чиларнинг китоб ^а^идаги фикр-муло^азаларини ба-жону дил дабул циладилар.
кириш
«ь •
Бионоорганик кимё фанини тиббиёт олий ^ув юрти талабалари биринчи уцув Йили давомида урганадилар. Бу фан цуйидаги асосий б^лимларни уз ичига оладиз 1) Бионоорганик кимёни биологик системаларга зфглашнинг назарий асослари;
2) биоген элементлар кимёси;
3) биологик объектлар, дори препаратлари сифат ва мицдорий анализ асослари.
Бу уцув ^улланма бионоорганик кимёни Урганадиган тиббиёт олий уцув юрти талабаларига ёрдам тарицасида тузилган. Бу тавсиянома талабаларнинг лаборатория-амалий маютулотларга мустацил тайёрланиши учун за-РУРДИр.
Бионоорганик кимё курсинннг мадсади: талабаларда типик кимёвий жараёнларни урганиш асосида тирик организмда кечадйган модда узгариши ма^сулотларини олдиндан сифат ва мицдоран белгилаш куникмаларини фаннинг ^озирги замон ютуцлари асосида шакллантй-риш.
Бионоорганик кимё курсини ^злаштириш натижа-сида
ТАЛАБА КУИИДАГИЛАРНИ БИЛИШИ КЕРАК:
I) Биокимёвий жараёнлар кечишининг йуналиши ва чу^урлигини белгилайдиган кимёвий жараёнлар термо-динамикасига тааллуцли. асосий тушунча ва цонун’ ларни;
2) кймёвий кинетика асосий ^онунларини биологик системаларга татбиц цила олиши;
3) эритмалар ^а^ида таълимот, унйнг асосида электролит ва ноэлектролитлар хоссалйрини ба^олаш ва бу-ни биокимёвий жараёнлар боришига таъсирини аввал-дан белгилаш; эритма таркибини ифодалаш усуллари; кислота ва асос протеолитик назариясинй 1$ллаган ^ол-
да, тирик'организмда кечадиган кислота-асос муноса-батларини к^риб чи^иш;
4) ексидланипг-^айтарилиш ва чукиш жараёнлари боришининг асосий ^онуниятлари, уларни биокимёвий системаларда ва доривор моддаларнинг тиббиётда и№ латилишида ^осил б^ладиган моддаларни башорат ци-лишДа 1$ллаш;
х 5) биомолекулалар ^осил булиши ва тузилишини ур-ганишда атом тузилиш квант-механика назарияси асос-лари, кимёвий бог ^осил б^лишининг ^озирги замон на^ зариясидан фойдаланиш;
б) тирик организмда металл ионлйри ва биолиганД'* лар орасида ^осил булиш эугимоли купро^ булган моддаларни башорат этишда комплекс бирйкмаларни реак-цйяга киришиш ^обилияти ^амда тузилиш назарияёи асосларини тадби^ цилиш ва уларни тиббиётда ^улла-. нилиши; "
7) Д. И. Менделеев элементлар даврий системасида жойлашган ^рнига ^араб s-, р-, d-, f-, элемент бирикма-ларининг типик.хоссаларини, кимёвий элементларнинг биологик системаларда ^згариш э^тимолини башорат цилиш;
Бионоорганик кимё курсини узлаштириш натйжа-сида
ТАЛАБА К.УЙИДАГИЛАРНИ'БАЖАРА О ЛИШИ КЕРАК:
1) Муста^ил равишда уцув ва билдиргич адабиёт-лардан фойдаланиш ^амда улардаги маълумотларни намунавий масалаларни ечишга ва биологик система-ларга татбиц ^илиш;
2) муайян-бирикмаГблиш реакцияси ^тказиш учун шароит танлаш;
3) утказиш мумкин булган кимёвий жараёнларни башорат цилиш ва борадиган жараёнлар тенгламасини тузиш; 7
4) тиббий препаратлар. ва биологик объектларни сй-фат ва микдор жи^атдан анализ ^илишда кимёвий лаборатория ишларини замонавий усулда бажариш;
5) бажарилаётган анализга рефератлар тузиш ва тиббий амалиётга тадбиц цилиш учун олинган натижа-ларни илмий асослаб берищ.
КУлланмада ургатувчи масалалар ва уларнинг ечим-ларидан намуналар келтирилган, бу эса ашщ масалаларни ечишда назарий асосларни тадби^ этишга й^л-ланма булади. Уларни тал^инидан с^нг саволларга жа-
роб бериш, маииулотлар му^окамаси, масалалар ечиш ва таклиф этйлган лаборатория ишларини баждришга Jh'HHi тавсия этилади.
Л Мазкур к$лланмага цатор йиллар мобайнида Урта Осиё тиббиёт олий билимго^ида- у^ув жараёнйда бионо-.органик кимёни ^рганиш учуй цулланилган ишлар асос цилиб олинган. Уцув ^лланма тиббиёт олий билимго^и талабаларини «Бионоорганик кимё» кур£и б^йича ^ци-тилиш программной асосида тузилган. J
Кулланмани тузишда ноорганик кнменй тиббйётга мойил килиб тузишга ало^ида эътибор^берилган.
I БОБ
КИМЁВИЙ ЛАБОРАТОРИЯЛАРДА ИШЛАШ ТАРТИБИ
Замонавий кимёвий текшириш усуллари мураккабва турлй-туман. Уларнинг дастлабки босцичи бионоорганик кимё буйича бажариладиган лаборатория-амалий машгулотларидир. Унда у^увчида лаборатория асбоб-анжомлари, идишдар билан ишлашда дастлабки куник-малар ^осил б^лади ^амда унча мураккаб б^лмаган тажрибалар ^тказилади;
Кимёвий лабораторияда ишлаётган ^ар бир талаба Куйидаги коидаларга цатъий риоя цилиши керак:
1. Лабораториядаги ^ар бир ишловчига ало^ида иш жойи тайинланади, уни кераксиз нарсалар билан уюб ташлаш, столга папка, китоблар ва бошца орти^ча нарсалар ^уйиш мумкин эмас. Иш жойида тартиб ва тоза-ликни сацлаш керак. ~
2. КаР бир^ лаборатория ишидан олдин унга тааллук-ли назарий матерйалларни Урганиш керак хамда й^риц-нома билан чу^ур танишиб, ноани^ саволларнй ^ал Кйлгандан с^нг тажрибани бошлаш лозим. ХаР бир лаборатория иши ало^ида бажарилади.
3. Электр цуввати^газ, сув, реактивлар тежамкврлик билан ишлатилиши лозим. Тажрибалар учун энг кам мивдорХа модда олинг. Ишлатилмай долган ёки ортиц-ча олинган реактивларни цайта идишга солиш мумкин эмас. Кам учрайдиган, ^имматба^о ва за^арли модда цолдицларини лаборантда сацланХдигай махсус идишга т^киш лозим.
4. Ишлатилгандан с^нг барча реактив ва эритмалар са^ланадиган идиш цопцорини ёпиб ^йинг, шу'билан
бирга цопцоцларни алмаштириб юборманг. Умумий ншлатиладиган реактивларни уз иш жойига олиб кетиш ман цилинади. Реактивларни идиши билан китоб ва дафтарлар устига цуйиш мумкин эмас.
5. Лабораторияда халат кийиб ишланади, у .ерда оМ-- цат ейиш, чекиш ва баланд овозда гаплашиш цатъиян ман этилади.
' б. Ишни тугатгандан сунг фойдаланилган идищларни ювиб ц^йиш, иш жойини тозалаш, газ, сув, электр ас-бобларини ^чириб цуйиш зарур.
Камма утказилган лаборатория ишларининг натижа-лари лаборатория журналига ёзилади. Унда ана щу ишни бажариш учун зарур булган назарий маълумот-лар ёзилади, кузатишлар, реакция тенгламалари, цисоб-лар, саволларга жавоблар, масалалар ечйми, анализ4 нинг илмий асосланган натижалари цайд этилади. Журналдаги ёзув тартибли булиши ва аниц ёзилиши керак-ки, бу иш билан таниш булмаган кимёгар цам уни ^циб тажриба цандай бажарилранлиги, унда йималар кузатилганлиги, бажарувчи цандай хулосага келганлиги цацида аниц маълумотлар булиши керак. Лаборатория журналини анализ олиб бориш мобайнида т^лдириб бориш лозим. ХаР цандай цораламалардан фойдала-нишга рухсат этилмайди. Тажриба баёнида рацамларни ^згартириш лозйм булса, устига чизиб ёнига Хайта ёзиш лозим. '
КИМЁВИЙ ЛАБОРДТОРИЯЛАРДА ИШЛАШДА ТЕХНИКА ХАВФСИЗЛИГИ КОИДАЛАРИ
Тажриба ни цоидада ёзилиши буйича олиб . бориш лозим/
Киздирилаётган колба ва пробирка орзини узингиз ва ёнингизда ишлаётган одамга царатманг, жараён (реакция) бораётган идиш огзига энгашиб цараш мумкий эмас.
>Гез аланга олувчи моддалар билан ишлаётганда оловдан узоцда б^лиш керак.
Уювчи, зацарли ва циди уткир моддалар билан ба-жариладиган ишни тортувчи жавон ичида бажариш керак. Концентрланган кислота ва ишцорлар цам шу ерда цуйилади. Уларнинг цолдигини чиганоцца т^кманг, балки махсус ажратилган идишга цуйинг. Зацарли газ ёки бур ажралиб чициши билан боглиц барча ишлар тортма жовон ичида бажарилади.
Иссид идиш ва асбоблар махсус тагликка дуйилади.
Юз ва д^лларга кислота текканда аввал кучли сув -одимида, суигра ичимлик содасининг кучсиз эритмасида ювилади; терига ишдор текканда аввал сув билан, сунг-ра суюлтирилган сирка кислотаси эритмаси билан ювй-лади.
Иссид нарсалардан куйганда куйган жойга калий перманганатнинг кучсиз эритмаси шимдирилган дока ёпилади. Шиша кесганда донни калий перманганатнинг кучсиз эритмаси ёки спирт билан ювилади, ярага йод суртиб боглаб дуйилади. »' •
Таркибида симоб, мишьяк (маргимуш), барий, дур-рошин садловчи тузлар задарли эканинЛ эсда тутиш ло- зим, улар билан ишлагандан сунг дулингизни яхшилаб ювинг.
Газларни дидига дараб текшираётганда пробиркани чап дулга олиб, бурундан пастродда ушланади ва унг дул билан бурун томон елпилади.
'Шуни эсда тутиш керакки, кимёвий лаборатория-ларда ишлаш алодида эътибор, тартиб ва ишчанЛикни талаб этади. Бу ишдаги ютудлар мезонидир.
^ар бир талаба фадат кимёвий лабсфаторияларда ишлаш техника хавфсизлиги доидаларини ^рганганидан с^нггина лаборатория ишларинй бажаришга дуйилади.
Халдаро СИ системасида-эритма концентрациясини . ифодалаш усуллари
: Машгулотнинг мадсади. Доривор модда ва биологик объектиларни текшириш учун зарур булган турли кон-центрациядаги эритмалар тайёрлашда миддорий дисоб-ларни Урганиш.
Урганилаётган мавзунинг а^амияти. Сую^ эритмалар, биринчи навбатда сувли эритмаларнинг табиатда а^амияти катта. Улар тирик организм учун, айни^са 5аётий зарур жараёдлар, биринчи навбатда моддалар алмашинуви учун зарур омил ^исобланади. Биологик суюцликлар: дон плазмаси, лимфа, меъда шираси, сий-дик ва бошцалар одсил, углевод, ё₽ дамда тузларнинг сувда эриган мураккаб аралашмаларидир. Доривор моддаларни ишлатищда уларнинг сувда эрувчанлиги дисобга олинади. Доривор модда эритмалари тиббиётда ншлатилганда уни дабул дилиш мйддори анид Kjrpca-тилган б^лиши керак. Шунинг уч/н шифокор миддорни ифодаловЧи бирликларни билиши керак. '
Бошлангич билим даражаси
1. Модданинг сувда эрувчанлиги.
2. Эриган модда, эритувчи, эритма тушунчалари.
3. Д. И. Менделеевнинг эритмалар досил б^лиш кимёвий назарияси.
4. Эритмалар концентрацияси.
5. Туйинган, туйинмаган, ута туйинган, концёнтрлан-ган, суюлтирилган эритмалар.
Муста^йл тайёрланиш учун 9кув материаллари
1. Л. Н. Глинка. «Умумий химия». Т. 1968. 254--бет.
2. X. Рустамов. «Умумий химия». Т. 1969. 99-бет.
3. J\. Р. Рахимов. «Анорганик химия». Т. 1974. 108-бет.
. 4. А. В. Бабков. Г. Н. Горшкова. А. М. Кононов «Практикум по общей химии с элементами количественного анализа». М. 1978. 532- бет.
5. А. С. Ленский». Введение в бйонеорганическую и биофизическую химию», М., 1989. 94-бет. '
МАЪЛУМОТЛАР БЛОКИ
Халдаро СИ системасида эритма концентрациясининг улчов бирликлари ва асосий терминлари СИ системадаги эритма концентрацияси
Маълумки, бу системада массанинг асосий бирли-ги Килограмм (кг), грамм (г), дажм бирлиги — литр (л), миллилитр (мл); модданинг миддорий бирлиги — моль деб кабул дилинган.
п(Х) системасидаги модда миддори— улча мл и физик катталик булиб, системадаги заррачалар — атом, молекула,-ион,, электрон ва бошкалар еони билан ифо-даланади. Бу модда мицдори— 0,12 кг 12С изотбпида неча атом б^лса, шунча анид ёки шартли заррачалар садлайди.
Масалан: n (НО) = 2 моль; п(Н+) = 10~3 моль;
n(Mg2+) = 3 моль.
моляр масса — М(Х) системадаги бир моль модда массаси. Модда массаси унинг миддорига нисбатини к^рсатади. Улчов бирликлари — кг/моль; г!моль
М. (X) — г, г]моль п(Х) •
М (X) — системадаги X моддасининг моляр массаси.
т (X) — системадаги X модда массаси.
п (X)—системадаги X модда миддори.
Масалан: ДЦОг)— 70, 916 г/моль; ,
М(Са2+) =40, 08 г/моль
- M (NaCl)=58, 50 г/моль.
Компонентнинг масса улуши — w (X) ,w % (X) — нисбий катталик б^либ, системадаги (эритма) берилган компонент массасининг система (эритма) умумий мас-сасига нисбатини курсатади (процент концентрация ту-щунчаси Урнига) . У каср сонларда ва процентларда (%), йфодаланиши мумкин. *
w(X) = w(ff— ; w % (X) = —!Я- 100 % m (эритма), m (эритма)
. Масалан: w% (NaCl) =20%; w% (H(?l) =37%.
Моляр улуш—N (x) нисбийкатталик б^либ, система (эритма) даги компонент модда мицдорини система (эритма) умумий модда ми^дорига нисбатини ифодалайди:
Л’(Х)=_ п (эритма)
—Моляр улуш купинча N(X) ?(арфи бил ай ифодала-яади.
Хажмий улуш f(X) нисбий катталик, системадаги компонент ^ажмини, система (эритма) умумий ^ажмига нисбатига тенг:
ф(Х)=-^
V (эритма)
Моляр концентрация — с(Х) эриган модда мицдори-ни система (эритма) ^ажмига нисбатини курсатади.
с(х) = = -.молыл.
V (э—ма) М (X) -V (эритма)
Масалан, с(НС1) = 0,1 моль/л\ с(Си2+) = 0,2378 моль/л.
Моляль концентрация — в(Х) —эриган модда миц-дорини эритувчи массага нисбатини курсатади.
, . п (х) tn (X) ,
b (X) =--=------------— ----- , моль!кг
т(з-чя) М(Х)-т(э-чи)
Масалан: b(HGl)=0,l моль/кг.
Эквивалентлик омили — f экв (X) — —улчамсиз
катталик, у X модданинг кислота-асос реакцияларида бир водород ионига ёки оксидланиш-цайтарилиш реакцияларида бир электронга Tjrpif келадиган мавжуд заррачалир улушини ифодалайди. Эквивалентлик омили берилган реакция стехиометрияси асосида ^исобланади.
Масалан:
2 NaOH + H,SO, - Na,SO, + 2 H,0 fm (NaOH) - 1
Эквивалент — f9Ke (X) X — —, X — улчамсиз катталик, кислота-асос реакцияларида бир водород иони ёки оксвдда-ниш-цайтарилиш реакцияларида бир электронга эквивалент булган X модданинг мавжуд ёки шартли заррачалари.
Эквивалентнинг моляр массаси — М (/экв (X) X) == М х) — модданинг бир моль эквивалент массаси булиб, эквивалентлик омили шу модда моляр массасининг купайт-масига тенгдир:
М (/экв (X) X) = М X'j = /экв (X). М (X), г/моль
М (1/2 H2SOJ = 1/2 М (H2SOJ = 49,0, г/моль \
Эквивалент модда мицдори—п (Jакв(Х) X = п xj — эквивалент заррачаларидан ташкил топган модда миадори.
п == , моль. Масалан: п (1/2Са2+) = 0,5 моль
м —X)
\ Z / V
п (1/2 H2SO4) = 0,l лол*
Эквивалентнинг моляр концентрацияси—c(f3Ke(X) X = С (— X | системадаги (эритмадаги) эквивалент модда мик;-\ г /
Дорини шу система (эритма) ^ажмига нисбати:
/ 1 \ п I--X .
с W х) = е ( ~ х |= —- —-------п—----------------МОЛЬ/А
' г ' ' У(эРитма) м/—х) . V (эритма)
Масалан: с (1/2 HaSO4) = 0,1 моль/л
Эритма титри — Т(Х) — 1 мл эритмадаги х модда массаси.
Т(Х) = m (х) - , г/мл
V (эритма)
Т (НС1) = 0,003286 г/мл
Масалалар ва уларни ечиш намуналари
Эритма таркибини сон жи^атдан ифодалашда миддорий ^исоб-лар учуй цуйидаги белги (тавсия) лар ишлатилади: т (эритма)—эритма массаси, кг (г) т (X)—эриган модда массаси, кг (г) m (эритувчи)—эритувчи массаси, кг (Г) V — эритма ^ажми, л (мл) р — эритма зичлиги, г/мл М (X)— модданинг моляр массаси, г[моль п (X)—модда ми^дори, моль * 1 * ttKe = — — эквивалентлик омили
/ 1 \. ’' ' п (?зкв W х) = I ~Х I.— модданинг эквивалент фи^дори, моль М (/s«e W х) = М х) - эквивалентнинг моляр массаси , г!моль
(X) —компонентнинг масса улуши (%) с(Х)— эритманинг моляр концентрацияси, моль! л 9 ftKe (X) х = с X j — эритманинг моляр эквивалент концентрация-си моль! л *(Х) — эритманинг моляль концентрацияси, моль!кг Т (X)— эритма титри, г/мл А/(Х) —компонентнинг моляр'улуши Ф(Х) — компонентнинг ^ажмий улуши
Масалаларни ечишда цуйидаги нисбатлардан фойдаланинг:
/ 1 m(X)
U 1 M(vx)
n(X) = c(X)-V n(—x\ = c(^-x\-V \ в J \ e )
(эритма) = p-V
m(X) = n(X).M(X)
m (X) = n f — xV M/— xY \ 0 J \ 0 J /
T(X) = _^LW_-
V (эритма)
\ в J \0
Nm- n(X) - n(X) J n (эритма). n (X) + n (эритувчи) v (X) V(X)
<р(Х) =
V (эритма) V (X) + V (эритувчи) М(Х)-У (эритма)-с(Х)
т(Х) =
1000 п(Х)
---------- X т (Эритувчи)
1- масала . 50 г AljSO4)8-18 Н2О кристаллгидрат ва 200 г сув-дан ^осил булган эритмадаги кристаллгидрат ва сувсиз алюминий сульфат масса улушини дисобланг.
Берилган: т(Н20) = 200,0 г
m (Al (SO4)3-18 НаО) = 50,0 г '
М (А1а (SO4)3-18 НаО = 666,4 г/моль
М(А1а(SO4)a = 342,2 гЛиоль
ш % (А12 (SO4)3-18 Н2О = ?
Ечиш намунаси. w % (Ala (SO4)3
1. Досил булган Эритма массасини топамиз:
т (эритма) = т (модда) + т (Н2О) = 50,0 г + 200, 0 -f- 250,0 г
т (эритма) = 250,0 г ' —’
2. Эритмадаги AlgSOJ-18 НаО масса улушини топамиз;
^(AIjSOJa-lS'HjO)
w % (AlaSO4)3.18H3O)--------, 3 ч • 100 %
т (эритма)
50,0 г
w % Ala (SO4)3 . 18 НаО = 0 - • 100 % == 20,0 %
3. 50,0 г кристаллгидратдаги сувсиз туз массасини топамиз: Ala(SO4)3- 18,Н3О моляр массаси 666,4 г/моль га тенг AlgSOJg моляр массаси 342,2 г!моль га тенг.
1 моль A12(SO4)3-18 Н2Ода 1 моль Ala(SO4)3 бор.
Шундай ^илиб 1 моль-666,4 г/моль = 666,4 г (Ala (SO4)3-18 Н2О да и 1 моль-342,2 г!моль — 342,2'г А1а (SO4)3 бор.
666,4 г A1(SO4)3-18 Н2О —342,2 г AlaSO4)3
50,0 г Al (SO4),• 18 НаО — X г A12SO4)3, Пропорция тузамиз: 666,4: 342,2 = 50,0:Х Уни ечйб, алюминий сульфат массасини топамиз. '
1342,2 - 50,0
* = —-----------= 25,7
666,4
m (А1а(SO4)3 = 25,7 г
4. Сувсиз тузнинг масса улушини топамиз: a’%(Al»SO4)8=-^^--100% т (эритма)
25,7 г
w % (А1а(SO4)3 = тзт-7- • ЮО % = 10,3 % [250,0 г
w% (Ala(SO4)3 = 10,3o/0
Жавоб: w % (Ala (SO4)3 . 18 НаО = 20,0;%.
шо/о (A12(SO4)s= 10,3 %
Масала буйича саволлар.
1. Компонентнинг масса улуши нима?
Жавоб: Эритма таркибини сон жи^атдан ифодалашиинг бир тури булиб, эритмадаги компонент массасини шу эритма умумий массасига нисбати билан белгиланади.
2. Компонентнинг масса улуши кандай бирликларда ифодалана- ди?
Жавоб: Компонентнинг масса улуши каср сонларда ёки процент-ларда ифодаланади. Масалан, ош тузи эритмасидаги NaCl масса улу-
ши 0,1 ёки 10%. Бу шуни к^рсатадики, 100, 0 г туз эритмасида 10,0 г NaCl ва 90,0 г Н20 бор.
2-м.асала. 1,0 л-0,10 моль/л ли эритма тайёрлаш учун 96% (масса) (р=1,84 г/мл) ли H2S04 эритмасидан неча мл олиш керак?
Берилган: w: (H2SO4) = 96 % р (эритма) = 1,84 г!моль V (эритма) = 1,0 л р (H2SO4) = 0,I0 модь/л М (H2SO4) = 98,0 г!моль V (HsSO^?
Ечиш намунаси. <-
1. 1, 0 л 0, 10 моль/л концентрацияли эритмадаги H2SO4 массаси-ни топамиз. '
Маълумки, . . *
_ m(H2SO4)
2 М (H2SO4) • (эритма)
бундан m(H2SO4) = с (Н^О^ • М (H2SO4) • V (эритма)
моль • г • л
m(H2SO4) = 0,10 • 98,0 • 1,0 ---------- =9,8 г
л • МОЛЬ
m(H2S04) = 9,8 г
2. 9,8 г H2SO4 сацлаган 96,0 % (масса) H2SO4 эритмаси массаси-ни топамиз
т (H2SO4)
х w % (H2SO4) = --И- -- • ЮО %
т (гритма)
, ' 9,8 • 100 г х%
т (эритма) — —:— -------------= 10,4 г
h 96,0 %
3. Зичлигини билган зфлда H2SO4 эритмаси хажмини ани^лаймиз. . гп (эритма)
т (эритма) = V (эритма), р (эритма), бундан V (эритма) = —---------
- р (эритма)
V (эритма) —
10,4 г-мл „
—-------= 5,68 мл
1,84 г
Жалоб: V (HuSO*) = 5,68 мл
Масала
буйича саволлар
1. Эритманинг моляр концентрацияси нима билан аницланади? Жавоб: Эритманинг моляр концентрацияси эриган модда ми^дорн-нинг эритма ^ажми нисбатига тенг катталик. Улчов бирлиги —моль/л.
л(Х) т(Х) .
с(Х) =------------= ----------------• моль/л
V (эритма) т(Х)- V (эритма)
3-масала. 1 кг сувда 666, 0 г КОН эритилган, эритманинг зичлиги 1, 395 г/мл га тенг. Куйидагиларни анадланг.
а) эритма моляр концентрацияси;
61 эритманинг моляль концентрацияси; ♦
в) шу эритмадаги КОН моллар сони г) иш^ор ва сувнинг моляр улуши.
Берилган: т (HjO) = 1000,0 г - т (КОН) =666,0 г р (эритма) = 1,395 г]мл М (КОН) =56,21 г}моль М (Н40) = 18,0 г/лоль '
b (КОН) = ?, с (КОН) = ?, п (КОН) = ?, ЛГ(КОН) = ?, tf(H,O) = ?
Ечиш намунаси. 1. Косил болтан эритманинг моляль концентрация сини топамиз!
т(КОН)
в (кон) - м (К0Н). т (Hg0)
„ 666,0-моль . ,
в (КОН) = ------=11,76 моль!кг
56,11-1,0 г-кг
b (КОН)' = 11,76 моль!кг
2. Эритманинг умумий массасини топамиз:
т (эритма) = т (КОН) +"т (Н2О) т (эритма) = 666.,0 г + 1000,0 г = 1666,0 г
т (эритма) = 1666,0 г
3. Косил б)?лган эритма ^ажмини топамиз:
т (эритма) 1666,0 г-мл
V (эритма) =---------— = —, - ,------- = 1194 мл
р (эритма) 1,395 г
V (эритма) = 1194 мл = 1,194 л
4. Эритмадаги КОН моллар сонини топамиз:
m(KOH) 666,X) г-моль ,, „
п (КОН) = „ -----=11,8 моль
' ' М(КОН) 56,11 г
5. Эритманинг моляр крнцеитрациясини топамиз: л(КОН) 12,0 моль п .
—--------— — . - = 9,94 моль!л
V (эритма) 1,195 л с (КОН) = 9,94 моль!л
6. Эритмадаги Hs0 моллар сонини аницлаймиз:
m (Н»О) 1000,0 г • моль „ ,
л (Н.О) = —=--------------—-------= 55,5 моль
' 1 ’ М(Н»О) 18,0 л
7. Эритмадаги КОН моляр улушини топамиз:
V,кою = "(КОН) = 12,0. _
' ' п(КОН)+л(Н,О) 12,0 + 56,5
8. Эритмадаги Н^О моляр улушини топамиз:
v/H О) = П (Н-0) = 55,5
1 1 и(КОН) + л(Н2О) . 67,5 моль
Жавоб: Ъ (КОН) = 11,76 моль!кг с (КОН) = 9,94 моль!л п (КОН) = 12,0 моль ^(KOH) = 0,17 (Н,О) = 0,82
с(КОН) =
= 0,17
0,82.
Масала буйича саволлар
1. Моль нима? '
Жавоб: Бу углерод изотопининг С12 0,012 кг да нечта атом б?л-са; шунча ташкилий (структура) заррачалар садлайдиган модда мид-Доридир.
2. Модда миддори ва унинг массаси орасида богланиш борми?
Жавоб: Хр, п (X) = , бунда
,М(А)
п (X) — X модданинг миддори, моль т (X) — X модда массаси, г >
М(Х)— X модданинг моляр массаси, г/йоль
3. Эритманинг моляль концентрацияси нима булан ифодаланади?
Жавоб: Бу эриган модда миддорининг эрит^чи массасига нис-бати.
ь т= n(Xf = т(Х)
т эритувчи М (X) (эритувчи)
моль!кг
Моляр улуш Нима?
Жавоб: Моляр улуш модда миддорининг (ёки эритувчининг) эритмада бор дамма модда миддори йигиндисига нисбати билан Улчанади.
п (X) -|- п (эритувчи) Бу Улчамсиз бирлик.
4- м а с а л а. Натрий гидроксиднинг (кислота-асос реакцияси буйича) 500,0 мл 0,1 моль/л эритмасини тайёрлаш учун зарур 40% ли (р = 1,225 г!мл) H2SO4 ва сув дажмини анидланг.
Берилган: w %(H2SO4) = 40,0 % р = 1,225 г/мл
V (эритма) = 500,0 мл с (H^SOJ = 0,10 моль/л MfHgSOf) = 98,0 г/моль V (HaSOJ = ? У (Н2О) = ?
Ечиш намунаси
Реакциянинг бориш тенгламаси:
2NaOH + HsSO4=Na2SO1 + 2 Н2О (fs„(NaOH)=l: =
1.500,0 мл 0,1 моль/л эритмадаги HgSO4 массасинцтопамиз
с (1/2 H2SO4 = :
4 М 0HaSO4) • V (эритма)
ч m(H2S04)-100 % т (эритма) = --------————
ш% (H2SO4) . '
- - - , 2.45 * 100 е« % е1я -
т (эритма) =---------------= 5,12 мл.
3. Шу H2SO4 эритмасининг дажмини топамиз:
т (эритма) 6,125 г/мл _ ,,
V (эритма) =--------1 = ------;— =5,44 мл
р (эритма) 1,125 г/мл
V (H2SO4) = 5,44 мл
4. H2S04 эритмаси тайёрлаш учун керак б^ладиган сув дажмини 'топамиз. - г
V(H2O)= 500,00 мл — 5,44 мл = 494,50 мл
Жавоб: V (HjSO4 =5,44 мл, V(H2O) =494,50 мл
5-мисол. Антисептик восита— бриллиант к^кининг 2,0% (масса) ли спиртдаги эритмаси моляр концёнтрациясини анидланг.
JM (бриллиант куки) =492,0 г/моль; Р—0,80 г!мл
Берилган: <о% (модда) =2,0%
р (эритма) = 0,80 г/моль-
М (модда) =492, г/моль ,
С (эритма) =?
Ечиш намунаси:
1. <в% (модда) =2,0% деганда, биз 100 г бриллиант к$ки эритмаси да 2,0 г модда ва 98,0 г спирт борлигини Тушунамиз.
2. Спиртли эритма ^ажмини топамиз.
„. \ т (эритма) 100,0 г
V (эритма) = —: V (эритма) = ————7— =125,0 р (эритма) 0,80 г!мл
3. С эритма (модца)_ концентрациясини топамиз:
т (модда)
с (модда) =-------:---;------- ,
М (модда) • V (эритма)
2 • 1000 г • моль 2000 „ ,
с (модда) =----------------: -------------—- = 0,0370 моль/л
' 492,0 . 125,0 г/мл 492,0-125,0
Жавоб: с (модда) =0,0370 моль/л
6-мисол. Доривор препаратларни анализ дилишда кенг дУлла-ниладиган NaOH эритмаси титри 0,0360 г/мл га тенг. Унинг хлорид кислота билан реакциясида эквивалент моляр концентрацияей ^андай; NaOH нинг эритмадаги масса улуши (%) цандай. 1 л шун-дай эритма тайёрлаш учун зарур булган NaOH массасини дисоб-ланг.
Берилган: Т (NaOH) =0,0036 г/мл
V (эритма) —1,0 л
М (NaOH) =40,0 г/моль
р (эритма) = 1,00 г/мл . .
с (NaOH)=? ф% (NaOH)=?ff? (NaOH)=?
Ечиш намунаси:
Реакциянинг бориш тёнгламаси:
НС1 + NaOH = NaCl-Ь Н2О
ftK (НС1) = 1 f„,(NaOH) = 1
рщуидав цилиб, бундай^олатда NaOH эритмасининг моляр концен-^ррйИиясиии кУриб Утамиз.
• 1. 1000 мл эритма тайёрлаш учун зарур'булган NaOH массаси-
аи топамиз: . '
• ’ Т (NaOH) = : m (NaOH) = Т (NaOH)- V (эритма)
, V (эритма)
г-мл
m (NaOH)= 0,00360-1000-^-= 3,60 г.
2. Эритманинг моляр концентрациясини топамиз:
m(NaON) с (NaOH) = ——-----------.
М (NaON) • V (эритма) \
3,60 г • моль „ ,
с (NaOH) = —Н;------------ 0 -°900 м9ль/л
40 г / л
3. 1 л эритма массасини топамиз:
m (эритма) — p-V (эритма)
m (эритма) = 1000*1,0 мл-г/мл — 1000 г
4. Эритмадаги масса улушини (%) топамиз: w % (NaOH) = m (Na0H)- . 100 % m (эритма) .
3,6-100 г-% „ „ „
w % (NaOH) = = 0,36 %
1UUV*2
Жавоб: c (NaOH) =0,090 моль[л
<o% (NaOH) =0,36% m (NaOH) =3,60 г Масала буйиаа саволлар
1. Эквивалентлик омили нима?
Жавоб: Эквивалентлик омили /ЭЛв(*)= —-Улчовсиз катталик б^либ, у кислота-асос реакцияларида бир водород ионига эквивалент б$л-ган X модданинг реал (мавжуд) заррачалар улушини курсатадиган сон.
2. Эквивалентлик омили цандай ^исобланади?
Жавоб: У бирга тенг ёки ундан кичик каср сон б^либ, уни реакция стехиометриясига асосан ^исобланади.
3. Эритманинг эквивалент моляр концентрацияси нима билан аницланади?
Жавоб: У эритмадаги модда эквивалент ми^дорининг эритма ^ажмига нисбати билан ани^ланади.
C(f,Ke(X)X) = c — X =—;-----------=
\ г ) V (эритма)
m(X) a*---------------------: моль/л
M xj- V (эритма) f
4. Эквивалентнинг моляр концентрацияси циймати эритма титра билан цандай богланран?
Жавоб: Куйидаги нисбат мавжуд:
с( —л) • м(—х).
Т(Х) = —L------L?—'-,г/мл К
1000
Т(X) — эритма титри
с I — XI — эритманинг эквивалент моляр концентрацияси
\ 0 J ,
—Х^ — эквивалентнинг моляр массаси
Мавзунинг узлаштирилишини мустацил назорат дилиш учун са-вол ва масала лар.
1. СИ системаси буйича эритма таркибини, концентрациясинн ифодалаш усулларини санаб £тинг.
2. Моляр улуш, дажмий улуш дегани нима? )
3. Тиббиётда кенг дулланиладиган 10,0% ли СаС12-6Н20 эрит-масидаги кальций хлориднинг моляр улушини дисобланг.
Жавоб: N (СаС12-6Н20) =0,00905..
4. Физиологик эритма (0,86%) NaCl (р =1,00 г/мл) нинг моляр концентрациясинн дисобланг. Физиологик эритма тайёрлаш Учун 200 мл 20% (масса) ли NaCl эритмасига (р = 1,112 г/мл) данча сув д^шиш керак?
Жавоб: с (NaCl) =0,1470 мбль1л
V (Н20)=4,994 л
5. 280 г сув ва 40 г тлюкозадан иборат эритмада глюкозанинг масса улушини (%) топинг?
Жавоб: ш% (СвН120в) = 12,5%
6. 85% (масса) глицерин (С3Н303) эритмаси тиббий мадсадлар учун ишлатилади. Шу эритмада глицерин ва сувнинг Моляр улушини -дисобланг.
Жавоб: N (Н20) =0,474; N (С3Н303) =0,526
7. 10% (масса) ли глюкоза эритмасида тайёрланган 30% (масса) ли мочевина эритмаси тиббиёт амалиётида мия шишини камай-тириш учун ишлатилади. 1 л эритма тайёрлаш учун зарур бфлгаи мочевина массасини х.исобланг.
р (эритма) = 1,216 г! мл
Жавоб: m (0) = с (NH2.)2 = 364,8 г .
8. Биокимёвий усул билан дондагд данд миддорини анидлаш учун 45% (масса) ZnSO4-7H2O эритмаси зарур: а) 2 кг шундай эритма тайёрлаш учун данча сув ва туз керак? б) 500,0 Мл 0,1 моляль ва 0,1 моляр р = (1,019 г/мл) эритма тайёрлаш учун-чи?
Жавоб: a) m (Н2О) = 1100,0 г. m (ZnSO4-7H2O) = 900,0 <r.
б) m (НаО) = 495,3 г: m (ZnSO4-7 Н2О) = 14,23 гг.
в) ш(Н2О = 495,1 г: m(ZnSO4)-7H2O) = 14,37 г.
•9. Масса улушн 50% (масса) б^лган 200,0 г йод тинктурасини тайёрлаш учун неча грамм йод ва неча мл спирт (р=0,80 арил) керак?
Жавоб: m (12) = 10,0г;V (спирт) =237,5 мл.
10. Эквивалентлик омили нима?
11. Кимёвий бирикмадаги кимёвий элемент эквивалента нимага боглид?
12. Сирка эссенцияси билан огир задарланишда NaHCO3 нинг
ли эритмасини цон томир орцали (томчилаб ёки т^гридан-т^гри) я^Ьбориш беморларга жуда тез ёрдам курсатишнинг асосий усули ди-ф^србланади. Шу эритмада асоснинг эквивалент моляр концентрацияси ;' »^1ндай? Жабрланувчига юборилган 1 л шундай'эритмада неча грамм «аНСОз б^лади? - (
• Жавоб: с (NaHCO3) = 12 моль/Л
т (NaHCOs) = 10 г/л -
13. Меъда шйраси кислоталилиги етишмовчилигида ишлатилади-гаи 1 л 3,0% (масса) ли НС1 эритмаси тайёрлаш учун унинг 30% ли (Нр=1 ,15 г/мл) эритмасидан неча мл олиш керак? Досил булган Эрятманинг моляр концентрацияси цандай? »
(эритманйнг стандартизацияси NaOH буйича олиб борилади). '
Жавоб: V (НО) =84, 60 мл; с (НС1)—0,8220 Лщль/л.
14. К,уйидаги реакцияларда реакцияга киришаетган моддалар' эквивалентлик омили нимага тенг? t
NaOH + Н3РО4 = Na Н2РО4 + Н2О
2 NaOH + Н3РО4 Na2HPO4 + 2 НаО
3 NaOH + Н3РО4 — Na3PO4 + 3 Н2О
15. Никотин кислота — витамин РР —бир датор ферментларнинг Иростетик группаси булиб, органйзмнинг яшаш фаолиятида мудим роль уйнайди. Унинг тандислиги одамда пеллагра касаллигини кел-тириб чидаради. Даволаш мадсадида ишлатиладиган ампУлалар тар-кибида 1,0 мл 0,1% (масса) ли никотин кислота бор. Шу эритма . эквивалентинйнг моляр концентрациясини аницланг.
Стандартлаш NaOH эритмаси б^йича олиб борилади, Жавоб: с (никотин кислота) =0,00320 моль/л
ЛАБОРАТОРИЯ ИШИ
Концентрацияли эритмалар тайёрлаш
1-иш. Сульфат кислота билан кйслота-асос реакцияга киришиши учун натрий гидроксиднинг 500 мл 0,1 моль!л эритмасини унинг 10% ли (р=0,960 г/мл) эритмасидан тайёрланг.
2-иш. КОН нинг4,00%ли эритмаси (р = 1,0251 г/мл} дан кислота-асос реакция ^осил/ цилиш .учуй 250 мл 0,25 моль/л сульфат кислота эритмасини тайёрланг,
КИМЁВИИ РЕАКЦИЯЛАР КИНЕТИКАСИ
, Мавзунинг мацсади. 1. Реакция тезлигини олдиндан белгилаш ва аницлашга системали ёндошишни ^рга-ниш.
2. Биокимёвий жараёнлар механизмы ва кинетика-сини олдиндан белгилаш.
Урганилаётган мавзунинг а^амияти. Биокимёвий реакциялар кинетик булиб, маълум ва^т талаб ^илади. Шуницг учун кимёвий реакцияларнинг бориш механизмы ва кинетикасини ^рганиш ^амда уларни биологик систе-маларга ^уллашни билиш шифокорлар учун зарурдир. Доривор препаратлар кимёвий кинетика ^онунларига асосан таъсир цилади. Биологик объектларда борадиган жараёнлар очйк системаларга тааллу^ли булиб, модда ва энергия алмашинуви доимо ташци му^ит билан 6of-лиц булади. Бу системаларда биокимёвий реакциялар кетма-кет боради. Масалан: о^сил, углеводларнинг гидролиз реакцияси, моносахаридларнинг СО2га айлани-ши ва бонщалар. Биокимёвий реакцияларнинг к^пчи-лиги радикал ва фермен'тлар ищтирокида боради. Бу реакциялар говори тезлйкДа бажарилиши билан ажра-либ туради. Тирик организмда кимёвий узгаришларнинг руй бериши модда алмашинуви борадиган конкрет шаро-итга боглид булади. Биосистемалардаги кимёвий реакциялар биологик катализаторлар — ферментлар ёрдами-да амалга оширилади. Биокатализаторлар узига хослигвГ ва таъсир йуналишининг кл^орилиги ' билан ажра-либ туради. Уларнинг купчилиги узида металл ионлари ва о^силлар сацлайди. Масалан: гидролазалар тарки-бида рух, кальций, магний, марганец; оксидазалар тар-кибида эса темир, мис, молибден, кобальт бор.
Бир металл бошцасига алмаштирилганда металло-фёрмент фаоллиги узгаради ва купинча камаяди. Фер-ментларнинг активлиги пасайиши ферментопатия ёки 'энзимопатия деб номланадйган касалликларга олиб келади. Уларнинг ^аммаси ирсий касаллик ^исобла-нади. Масалан: альбинизм ^ужайра тирозинининг меланинга айланишини катализлайдиган тирозиназа фермента активлигининг камайиши оцибатида вужудга келади.
Бошлангич даража
1. Гомоген ва гетероген системалар.
2. Кимёвий реашгаялар тезлиги ^а^ида тушунча.
ИК'.З; Молекула ва ионлар ораеида борадиган реакция*
И|ар-
Мустацил тайёрланиш учун уцув материалларн
S'; -У • 1. Н. Л. Гл и н к а. «Умумий химия». Т. 1968. 214-бет.
2. X. Р. Р а 24 и м о в. «Анорганик химия». Т. 1974. 65- бет.
.... 3. X. У. Усмонов; X. Р. Рустамов, X. Р. Р а 24 и м о в, Фн-"Йо'дасавий химия. Т.
' 4. О. О. О л е н и н, Г. Н. Ф а д е е в, Неорганическая химия. М. ’ 1979. 32- бет.
J.'- 5. В. А. Бабков, Г. Н. Горшкова, А. М. Кононов,
- «Практикум по общей химии с элементами количественного анализа», . . М., 1978, 59-бет. Ч .
i
МАЪЛУМОТЛАР БЛОКИ
КИМЁВИЙ КИНЕТИКА
Кимёвий кинетика цуйидагиларни /ургатади:
1. Реакция тезлйгини аницлаш ва унинг модда та-биатига, концентрациясига, температурасига ва катали-заторларга богли^лигини. •
. 2. Реакция механизмини белгилаш, яъни турли бос-
кичларда ^осил б^ладиган оралиц моддалар табиатини аницлашни.
Кимёвий реакциялар тезлиги ва^т бирлиги ичида ре-акцияга киришаётган модда (ёки реакция ма^сулоти) концентрациясининг узгариши билан ифодаланади:
с, — с2 Д с v — —--= ±
Реакция тезлиги купгина омилларга боглиц. Концей-трациянинг кимёвий реакция тезлигига таъсирини мас-салар таъсир цонуни ифодалайди: доимий температурада кимёвий реакциянинг тезлиги реакцияга киришаётган. моддаларнинг концентрациялари кудайтмасига t^f-ри пропорционал:
• 2СО + О2 = 2СО2
v = Кс2 (СО)-с (О2) _
К — тезлик константаси, у доимий катталик булиб, реакцияга киришаётган моддалар концентрацияси бирга тенг б^лгандаги реакция тезлигидир.
К — реакцияга киришаётган модда табиати тем-пературага боглик б^либ, модда концентрациясига 6of-ли^ эмас. *
Гетероген реакцияларда цаттик; фазадаги модда концентрацияси реакция давомида одатда узгармайди. Шу-
нинг учун массалар таъсири зонуни тенгламасига кири-тилмайди.
Температуранинг кутарилиши реакция тезлигининг ортишига олиб келади, бу эса реакция тезлиги констан-Гасининг ортишига боглиц. Уз навбатида реакция тез-лигй константаси активланиш энергиясига боглиз.
Молекул ал ар кимёвий таъсирланишга учраши уйун Уртача энергнядан купроз кинетик энергияга эга були-ши керак. Бу энергия активланиш энергияси дейилади. Бундай энергияга эга булган молекулалар актив моле-кулалар хисоблана(ди.
Кимёвий реакция вацтида зар доим энергия тусиги енгилади, унинг чувдисида реакциянинг оралиц мазсу-лоти— активланган комплекс зосил б^лади. Активланиш энергияси — реакцияга киришаётган моддаларни активланган комплексдан ажратиб турадиган энергия т^сиридир.
Активланиш энергияси жуда юцори булганда- энергия тусигини енга оладиган молекулалар сони кам, реакция тезлиги эса жуда кичик булади.
Реакция тезлиги крисТантасини активланиш энергияси (Еа; ДЖ (моль)га боглицлигини Аррениус тенг-ламаси ифодалайди:
Яа
K = Z-pe~ кт
Z — зажм бирлигидаги молекуланинг бир секунддаги т^знашувлар сони;
е— натурал логарифма асоси (е=2,716...);
R— универсал газ доимийси (/?=8,31 ЖДиоль-К);
Т — абсолют температура, К;
Р — тузнашаётган молекулалар ориентациясига боглиз стерик купайтувчи.
Аррениус тенгламасининг бошза к^ринишларй зам маълум:
= Е3 /_1__ _1_\ е Ki 2,303 ' \Та rj
Еа—активланиш энергияси:
Ki, Ка— бошлангич (Гх) ва берилган (Та) температурадаги реакция тезлиги константаси.
Харорат кутарилганда кимёвий реакция тезлиги одат-да ортади. Вант-Гофф зоидасига к^ра, зарорат 10°С га к^тарилганда реакция тезлиги 2—4 марта ортади. Бу •ортиш реакциянинг температура , коэффициента дейилади: (v)
10
ва берилган (Z2) температурадаги реакция тез-feft... ”''
& ' ^ароратнинг к^тарилиши актив молекулалар сони-^Ц.-^динг ортишига олиб келади, уларнинг ^заро т^нашуви 'V туфайли реакция актисодир булади.
ч Кимёвий реакциялар механизмини аницлаш учун - экспериментал йул билан реакция тартибини ани^лаш зарур. ;
Реакция тартиби — реакция тезлиги тенгламасидаги реакцияга киришаётган моддалар кцрцентрациялари даражаси курсаткйчлари йигиндисига тенг сон.
Масалан: аА ЬВ пМ + nN
Vx=K1Ca(4).cb (В)
V2=^m(M) с" (У)
п^а-^-Ь; пз — т + п
п{ — т^гри реакция тартиби
п2 — тескари реакция тартиби
Элементар реакциялар битта кимёвий актда цатна-шаётган молекулалар сони буйича классификацияла-нади:
Бир молекула ^згаришига учрайдиган реакццялар --мономолекуляр реакциялар'дейилади.
Вг2ч±2Вг
Икки молекула ту^нашувидан ^осил булган элементар акт бимолекуляр реакциялар дейилади.
СО (г) + О2 (а)->СО2 (а) + 0 (г)
Тримолекуляр реакцияларда элементар акт учта молекула ту^цнашувида содир булади.
2NO (г) + Cl2 (е)-> 2NOC1
Бир элементар боскичдан куп босцичда борадиган реакциялар мураккаб реакциялар дейилади.
Тугри ва тескари йуналишда борадиган реакциялар цайтар реакциялар дейилади:,
СН3СООН 4-NaOH^ CH3COONa + Н2О
, Актив молекулалар сонини фац£т иситиш билан эмас, балки тебранма энергия кванти (ёруглик, рентген радио-
актив, ультратовуш ва бошдалар) билан з^ам ошириш мумкин. '
Еруглик таъсирида борадиган реакциялар. фотокимё-вий реакциялар дейилади. Одам организмида борадиган купчилик реакциялар фотокимёвий реакциялар цатори-га киради.
Одам терисида цуёшнинг ультрабинафша нурлари таъсирида рахитга царши активликка эга булган D витамина синтезланади.
Фотосинтез — усимликлар организмини одам ва ^ай-вонлар учун зарур булган кислород запаси билан тул-дирувчи жараён ^исобланади.
Нурнинг фотокимёвий таъсири шундаки, бунда реакцияга киришаётган молекула ёки атомлар фотонлар таъсирида ц^згалган ^олга утадщ.
Фотокимёвий реакциялар тезлиги ^згаришга учраёт-ган модда концентрациясига ва температурага боглиц б^либ, ютилган нурланиш энергияси мицдорига пропор-ционалдир.
1. Табиий фотокимёвий реакциялар организмга ижо-бий таъсир этади.
Масалан: цуёш нури таъсирида провитамин D витамин D га айланади, бу эса суяк тудималарининг реге-нерациясини кучайтиради.
2. Ультрабинафша нурлар бактерияларни ^лдиради, . унинг бу хусусиятидан инъекцион эритмаларни стерилизация цилишда фойдаланилади.
3. Фотокимёвий реакциялар биокимёвий реакциялар-нинг ц^згатувчиси (стймулятори) ^исобланади, шунинг учун баъзи касалликларни профилактика цилиш ва да-волашда куёш ванналаридан фойдаланилади.
Фотокимёвий реакциялар нурлантириш частотасига кура организмга салбий таъсир курсатиши мумкин. Масалан, 60Сг изотопининг радиоактив емирилиши (пар-чаланиши) натижасида ажралиб чи^адиган у-нурлар рак билан касалланган т^цималарни емиришга ижобий таъсир курсатиш билан бир вацтда, биокимёвий реак-цияларга салбий таъсир курсатади ва унинг натижасида нурланиш касаллиги вужудга келади. К°ВДа лейко-цитлар сонининг камайиб кетиши бунинг яццол далили булади.
Х,ар бири актив- заррачайинг з^осил булишига олиб делйдиган кетма-кет такрорланадиган реакциялар зан-жирли реакция дейилади.
Купчилик фотокимёвий реакциялар занжирли реакциялар дисобланади; (у>1) ёниш ва оксидланиш жара-
г*'
I'- . .
Цйтяри, крекинг, полимерланиш. Занжирли реакциялар-Кнг замонавий назарияси И. И. Сененов томонидан рвлаб ницилган.
Занжирли реакция уч босцичга б^линади:
|.1. Занжирнинг вужудга келиши.
2. Занжирнинг ривожланиши.
3. Занжирнинг узилиши.
И». Эркин атомлар. шунингдек эркин радикаллар зан-§Й.ирли реакцияларда актив заррачалар б^йиши мумкин. В4?*' ~
К КАТАЛИЗ, ФЕРМЕНТАТИВ КАТАЛИЗ
Р Кимёвий реакция тезлиги катализаторлар . иштиро-р/кида ортиб боради. Катализаторлар иштирокида бора-£ диган реакциялар каталитик реакциялар дейилади. Ка-£ тализатор таъсирида реакция тезлигининг ^згариш tr з^одисаси катализ дейилади.
I Ноорганик ва органик моддалар катализатор б^лиши мумкин. Реакцияда уларнинг массаси кцчик булиб, одатда реакция охирида ^згармай цолаверади. Катали-? заторлар фацат улар иштирокисиз секин борадиган г реакция тезлигини оширибгина ^олмай, балки катали-1 заторларсиз бормайдиган реакцияларни амалга ошири-. ши мумкин. Уларнинг характерли жойи шундаки, улар реакция давомида сарф б^лмайди ва шунинг учун охир-ги ма^сулот таркибйга кирмайди, Уларнинг иккинчн-ажралиб турадиган узига хослиги кимёвий мувозанатга
таъсир цилмаслигидир.
Гомоген ва гетероген катализ мавжуд. Гомоген ката-лизда катализатор ва реакцияга киришувчи моддалар бир (хил) фазада б^лади:
NO
2SO24-O2---->2SO3
Гетероген ёки контакт катализда катализатор одатда Каттиц модда б^либ, реакцион аралашма эса суюк ёки газсимон ^олатда булади:
VjOl ' _ 2SO24-Oa~-*2SO3
Гомоген катализда катализатор-массасининг з^амма- , си иштирок этади, шунинг учун кимёвий реакция тезлиги унинг концентрациясига т^гри пропорционал.
Тирик организмда ферментатив катализ амалга оши-рилади. Ферментлар — бу биокат^тизатррлардир, улар оцсил бирикмасидан иборат. ферментлар организмда минглаб кимёвий реакцияларни катализлайди, -Уларнинг биокимёвий узгаришлардаги биокатализаторлик
урни бошца кимёвий реакциялардаги катализаторларга Ухшаш.
Реакция тугагандан сунг, фермент катализатор каби дастлабки эркин ^олида ^олади. Ферментатив реакциялар одатда гетероген-каталитик реакциялар тур-' кумига киради.
Ферментлар оддий ва мураккаб турларга б^линади. Оддий ферментларда каталитик активлик фацат оцсил молекуласининг тузилишига боглиц. Мураккаб ферментларда активлик намоён булиши учун о^сил б^лмаган ташкил этувчи — кофактор зарур. Металл лонлари ёки мураккаб органик молекулалар, масалан, витаминлар, нуклеотидлар, ионлар ва бошцалар кофактор булищи мумкин. Кофакторсиз фаол булмаган фермент апофермент дебета лади.
Ферментлар говори даражада специфик булиб, юХо-ри даражада каталитик самара беради. Каталитик акт-да уларнинг фа^ат маълум ^исми — ферментларнинг актив маркази иштирок этади.
Кофермент сифатида металл ионларини сацловчи ферментлар — металлоферментлар дейилади. Металл ионлари учта вазифани бажаради: улар субстрат ва фермент-ни богловчй куприк х;осил Хилиши ёки каталитик группа (гурух)га хос булиши мумкин. Металл ионлари юцори каталитик активлик намоён булиши учун ферментларга бптимал конформация беришга ёрдамлашади. Фермент-нинг оцсил молекуласида муста^кам богланган кофак-торларни одатда — простетик группалар, кучсиз борлан-ганларини эса коферментлар деб номланади.
Металлоферментлар активлиги уларда металл ион-ларининг борлигига боглид, металл ионлари чихариб юборилса фермент активлиги йу^олади. Масалан, рух иони рлиб ташланса, карбоангидраза ферменти фаолди-гини йуцотади. Агар системага етарли михдорда туз куринишидаги рух ионлари киритилса, активлиги тик-ланади. ,
Масалалар ва уларни ечиш намуналарн
1-мисол. Реакция учун массалар таъсири цонуни ифодасини ёзинг:
1. 2 NO (г) + С12 (г) -> 2 NOC1 (г)
2. СаСО3 (К) X- СаО (К) + СОа (г)
Ечищ намунаси. 1. Массанинг таъсир конунига асосан: v=K& (NO) • с (С12)
2. Кальций карбонат цаттиц модда б^лгани учун унинг концентрацияси реакция давомида деярлй Узгармайди. Реакция тезлиги
гцуйидагича ифодаланади: V=K яъни, бу долат^а реакция тезлиги И’ маълум температурада доимий булади.
Г Масала буйича саволлар
Р 1. Кимёвий реакция тезлиги реакцияга киришаётган моддалар концентрациясига боглицми?
Жавоб: Ка. массаларнинг таъсир донунига к?ра берилган температурада кимёвий реакция тезлиги реакцияга киришаётган модда концентрациялари купайтмасига тугри пропорцнонал.
2-мисол. Температура коэффициента 2,8 га тенг, температурани , 20 °C дай 75 °C гача к^тарганда реакция тезлиги неча марта орта-ди? . *
Берилган: у = 2,8 ;
tt — 20°С
/2=75°С 4
Ечиш намунаси: 1. Реакция тезлигини tt да о(( билан, it да vt билан ифодалаймяз.
2. Температуранинг ортиши
Д t = /2 — = 75°С — 20°С = 55°С
3. Вант- Гофф доидасига асосан:^ — = v ~1°” ; =2,8*° = 2,85,6 деб ёзамиз.
vti vtt
Бу ифодани логарифлаймиз:
lg — = 5,5-lg 2,8 = 5,5-0,447 = 2,458 oh.
Бундан vt. ' — = 287. vtt
Масала буйича саволлар
1. Нима учун дароратнинг к^тарилиши кимёвий реакция тезли-гининг ортишига олиб келади?
Жавоб: Температура к^тарилганда $заро таъсирлашаётган зар-рачалар даракат тезлиги ортади, энг асосийси реакциянинг активланиш энергиясига тенг энергияга эга б?лган заррачалар — актив зар-рачалар сони ортади.
2. Вант-Гофф цоидасини асослаб беринг ва унинг математик ифодасини келтиринг.
Жавоб: Температура Дар 10 °C га к^тарилганда реакция тезлиги 2—4 марта ортди.
ю
-V
— температурадаги реакция тезлиги.
температурадаги реакциянинг бошлангич тезлиги
у — температура коэффициента булнб, 2 — 4 га тенг.
3-мнсол. Реакцияга киришувчи моддалар концентрацияси с (N0) =0,3 моль/л. ва с(СгОа)=0,15 мол^/л булган цуйидаги кимёвий реакция тезлиги 1,2 • 10~* моль/л. сек.
2NO (г)+ Оа (г)-»-2NO, (г)
Шу реакция учун тезлик константасини аницланг.
Берилган: с (NO) = 0,3 моль/л с(О2) = 0,15 моль!л v= 1,2-10—3 коль!л. сек.
. , К = ?
Ечиш иамунаси. Массанинг таъсир цоиунйга асосан: v = Kc»(NO)-c(Oa)
v
Бундан: К =-------
. ca(NO)«c(Oa)
____1,2‘10 3 - = 8,9 10«
0,3-0,3,0,15
Жавоб: К = 8,9-10-3
Масала буйича саволлар "
1. К,андай моддалар ^заро тез реакцияга киришади?
Жавоб: Ионлар орасидаги ва одатда нисбий электроманфийли-гига KjZpa узоцроц турадиган элементлар орасидаги реакциялар жуда тез боради.
2. Массанинг таъсир цонунйдаги тезлик константаск нимани к^р-сатади? '
Жавоб: Тезлик константаси— бу бошлангич модда концентрацияси 1 моль/л та тенг б^лган реакция тезлиги,
3. К цандай омилларга боглиц?
Жавоб: К — реакцияга киришаётган модда табиатига, темпера-турага боглиц б^либ, реакцияга киришаётган моддалар концентрациясига боглид булмайди. Бу реакция тезлигига оид катта-лик б^либ, реакция механизмларини белгилашда катта а^амиятга эга.
4-мисол. 1^андай моддалар салбий катализаторлар ва ингибитор дейилишини тушунтиринг.
Уларнинг фарци нимада?
Ечиш иамунаси. Реакция тезлигини камайтирадиган, аммо $зи реакциядан кейин ^згармай ^оладиган модда салбий катализаторлар дейилади. Масалан, водород ва хлордан водород хлорид олишда кислород салбий катализатор б?лади. Бундай моддалардан фардли равишда ингибиторлар реакция ма^сулоти таркибйга киради. Масалан, темир коррозиясида кальций карбонат —Са (НСОз) а— ингибитор булиши мумкин, унинг таъсирида металл снртида эримайдигаи темйр карбойат цлёнкаси (пустлоги) ^осил булади.
5-мисол._Температура 25 °C дан 35® гача к^тарилгандаги кимёвий жараённинг активланиш энергияси цийматини топинг; бунда тезлик константаси а) 2 мартаб) 5 марта ортади.
Берилган: = 25°С Тх — 298 К
4=30°С Т2 — 308 К
R = 0,00831 кЖ/моль • К
Ел =?
Ечиш иамунаси.' Реакция тезлигининг активланиш энергиясйга боглицлигини к^рсатувчи маълум нисбатни ц^ллаган долда кимёвий жараён активланиш энергияси цийматини ^исоблаймиз.
' RAnKi/Ki
Г ~ 1 1
Б:. ‘ Л “Т2
|$a) Реакция тезлиги константаёи 2 марта оширилганда активланиш рэнергияси
Г ' Р К-In, 0,00831-2,282-lg2 _
, Еа = J___£ - 0,000109 - 52,37 к^Хмоль
Л Tt ,
/_1_ _1_ ~та тезлиги константаси 5 марта оширилганда активланиш
—7— — -7-= 0,000109^ га тенг. 298 308 Г >
б) Реакция энергияси
0,00831-2,2821g5 '
£а =-----———--------= 121,93 кЖ/моль. га тенг.
0,000109
Жавоб: Реакция тезлиги константаси 2 марта оширилганда активланиш энергияси 52,37 кЖ/мольга, 5 марта оширилганда эса активланиш энергияси 121,93 кЖ/моль га тенг.
6- мисол. Водород пероксиднинг парчалаииш энергияси 25 °C да 75,24 кЖ/моль (Е) ни ташкил этади. Бирор биокатализатор ишти-рокцда эса Еа 50,14 кЖ/моль ни ташкил этадиг 25 °C да водород перокеиднинг биокатализатор иштирокида парчаланиш тезлиги веча марта ортишини ^исобланг.
Берилган: Е& = 75,24 кЖ1моль Х=25°С, Т — 298 К. £а{к)= 50,14 кЖ/моль Ki/K2 = ?
Ечиш намунаси. Реакция тезлигиви активланиш энергиясига боглиц-лигини курсатувчи маълум нисбатни цуллаган ^олда Н2О2 парчаланиш жараёнйнинг катализаторсиз (Еа) ва биокатализатор (£а(к)) иштирокида активланиш энергиясини ^исоблаймйз. Н2О2 цинг парчаланиши ^уйидаги реакция буйича борадй:
Н2О2-»-Н20+ 1/2 О2
Хисоблаш учун Аррениус тенгламасидан цуйидаги шаклда фойдаланамиз:
Е.-г;_<75.24-50.17).1000 д^
Kt 2.30-R-T 2.30-8,31-208
кЖ/моль ни Ж/моль га утказйш учун 1000 га купайтирилади).
К
1g —- = 4,4068. Бу цииматнинр антилогарифмасини топамиз, у 25000 га К2
тенг., —।
К
Шундай цилиб = 25000 марта ортган.
л2
Жавоб: Реакция тезлиги 25000 марта ортган.
Масала буйича савс^лар
1. -Катализатор нима учун реакция тезлигини оширади?
Жавоб: Катализатор активланиш энергиясини камайтиради, бу эса жараённинг тезлашувига олиб келади.
2. Катализатор таъсири жараён термодинамикаси билан дандаА богланган?
Жавоб: Агар реакция AG<0 системанинг эркин энергияси ка-майиши билан борса, дамма кимёвий реакциялар уз-узидан кечади. Катализатор ёрдамида фацат термодинамик эдтимоли булган жараён тезлигини узгартириш мумкин.
Ферментлар нима?
Жавоб: Ферментлар — юдори моляр массали одсиллар булиб, биологик таъсирга эга булган актив катализаторлардир.
Узлаштиришни мустадил назорат дилиш учун савол ва масалалар
1. Турлича тезликда борадиган реакцияларга мисоллар келТВ-ринг. Кимёвий реакция тезлиги нима билан Улчанади?
2. Куйидаги тенгламалар буйича борадиган кимёвий реакциялар тезлигининг" математик ифодасини (реакцияга киришувчи моддалар-нинг агрегат долатини дисобга олган долда) ёзинг.
NaOa~>2NO С Оо COj FeO + H3->Fe + Н2О
3. Температура коэффициента 2 га тенг булиб, температурани 10 °C га к^тарганда реакция тезлиги неча марта Узгаради?
Жавоб: 2040 марта.
4. ЗА+В->2С+Д — реакцияси бошлангандан маълум муддат Ут-гандан с?нг, моддалар концентрацияси с (А) =0,33 моль/л, с (3) = =0,01 моль/л, с (С) =0,008 моль/л ни ташкил этди. А ва В модда-ларнинг бошлангич концентрацияси дандай?
Жавоб: с (А) =0,42 моль/л, с (В) =0,14 моль/л.
5. - Фосген — турли синтезларда кислота долдигиии молекулага киритиш учун кенг дулланиладиган газ. Жуда задарли, биринчи жа-дон уруши даврида дарбий задарловчи модда сифатида дУлланилган. Уни дуйидаги реакция буйича олинади: -
2 СО (г) + С12 г-> 2 СОС1 (г)
СО ва С12 концентрацияларини 3 марта оширилганда реакция тезли-jh неча марта ортади? <
Жавоб: 9 марта.
6. Системага катализатор киритилишида реакция тезлиги орти-шини нима билан тушунтириш мумкин: активланиш энергиясининг камайиши, б) молекуланинг Уртача кинетик энергияси ортиши, в) туднашувлар сонининг ортиши, г) актив молекулалар сонининг Усиши (ортиши)?
7. Кандай ферментлар металлферментлар дисобланади? Металл-' ферментларда металл ионларининг роли кандай?
8. Ферментларнинг специфик таъсири нимага боглид.
9. Кимёвий катализаторларнн ферментдан фардини тушунтириб беринг.
10. Алкоголни кУп миддорда истеъмол дилиниши однбатида одам организмидагй баъзи ферментлар узининг актив конформация-сини йудотади. Бу додисани молекуляр даражада мумкин булган механйзмини таклиф этннг.
П._Алкоголдегидрогеназа ферментлари этиленгликолни задарли оксалат ионига, этанолни эса — ацетат ионига айлантиради. K.i]K3==K. катталик £4-St*ES мувозанат учун «К» этанолникига нисбатан этиленгликоль учун анча кичик. Шуни билган долда этиленгликоль билан задарлаиганда нима учун томирга этанол' юборилишини ту-' шунтиринг. Охиргиси улимни икки дисеа камайтиради. -
Лаборатория иши
КИМЕВИЙ РЕАКЦИЯ ТЕЗЛИГИНИНГ ТУРЛИ ОМИЛЛАРГА БОЕЛИКЛИГИ
1-тажриба. Кимёвий реакция тезлигининг модда табиатига, боглидлиги.
Пробиркаларга сирка ва хлорид кислота цуйинг ва уларнинг ^ар бирига металл ^олидаги рух б^лакчасини ташланг. Водород ажралиб чициши интенсивлигини так-Косланг. Реакция тенгламасини ёзинг. Жараённинг бо- ' ришидаги тезликнинг ^ар хиллигини тушунтиринг.
2- т а ж р и б а. Реакцияга киришувч^ моддалар кон-центрациясининг кимёвий реакция тезлигига таъсири.
Кора цогоз устига учта пробирка цуйинг. 1-про-биркага 15 томчи Na2S2O3 эритмаси, 2-пробиркага 10 томчи Na2S2O3 ва 5 томчи 3-пробиркага 5 томчи Na2S2O3 эритмаси ва 10 томчи Н2О куйинг. Ало^ида пробиркага 5 томчи сульфат кислота цуйинг. Кислотани 1- пробиркага цуйинг ва шу билан бир вацтда. секундо-мерни ёцинг. Кучсиз лойца х;осил булгунча утган вацт-ни аникланг. Худди шундай ^олатни 2- ва 3- пробирка-ларда ^ам текширинг. Натижаларни Жадвалга ёзинг ва хулоса чицаринг.
Пробирка номери Na2S,O8 томчилари сони н,о томчилари сони H,SO4 томчилари сони Вацт (сек.) Хулосалар
1 15 5
2 10 5 5
3 5 10 5
3- т а ж р и б а.'
Кимёвий реакция тезлигига темпе-
ратуранинг таъсири.
З.Ьтажриба, Иккита пробиркага 15 томчидан НС1 эритмаси томизинг. Эритманинг биттасини иситинг. Иссиц ва совук эритмаларга рух булакчасидан солинг. Водород пуфакчалари чициш тезлиги турлича эканини
такцосланг ва тушунтиринг.
3.2- т а ж р и б а. Иккита NaAsO2 ва HCI эритмаларидан Витта пробиркадаги эритмани даги лойкаланиш даражаси ф тушунтириб беринг.
агЗгОз, ИНГ.
Р-ва
инг. Проб
ни., солиштир
3.3- т а ж р и б а. Иккита пробиркага 5 томчидан СгС1з, комплексон (III) ва CH3COONa эрйтмаларидан томйзинг. Битта пробирками эритма цайнагунча циз'ди-ринг. Пробиркалардаги эритмалар ранги узгариш тезли-гини солиштиринг ва тушунтириб беринг.
- 4- т а ж р и б а. Кимёвий реакция тезлигининг катализатор иштирокига богли^лиги.
Иккита пробиркага 10 томчидан Н2С2О4 ва 8 томчидан сульфат кислота эритмаси солинг. Пробиркалар-нинг бирига бир неча булак MnSO4 кристалларидан солинг. Иккала пробиркага 5 томчидан КМпО4 эритма-сидан цушинг. Иккала пробиркадагн эритма рангининг ^чиш тезлигини таццосланг ва берилган реакцияда MnSO4 нинг а^амиятини тушунтиринг.
КИМЕВИЙ МУВОЗАНАТ
Мавзунинг маЦсади:
1. 1^айтар реакциялар боришини ани^лаШни ^рга-ниш. ’ - . .
2. Биологик системалардаги кимёвий реакциялар й^налишини олдиндан ани^лаш.
3. Турли омилларнинг мувозанат ^олатга ва унинг силжищига таъсирини экспериментал текшириш.
Урганилаётган мавзунинг а^амияти. Кимёвий реакцияларнинг купчилиги, жумладан тирик организмда кечадиган к^пчилик биокимёвий жараёнлар цайтардир. Шулардан баъзиларини мисол ^илиб келтирамиз:
1. Кондаги гемоглобиннинг вазифаси упкадан цон билан кислородни тирик организмнинг тузима ва з^ужай-раларига олиб боришдцр. Бу жараённи умумий тарзда цуйидагича тасвирлащ мумкин:
r-Fe2+(Wr-Fe2 + -O2 r-Fe2+— гем
Упкада кислород концентрацияси юцори б^лгани учун бу жараённинг мувозанати унг томонга- силжиган булади. Кужайраларда кислород концентрацияси анча кам, шунинг учун бу мувозанат чапга силжиган, бу нар-са ^ужайраларни доимо кислород билан таъминланиш-га олиб келади.
2. Ферментларнинг каталитик таъсири .цайтар жара-ён В^йича боради. Масалан, карбоангидраза кофермент сифатида фаол марказда Zn2+ сацлайди.
Ф^ьАФ+2п2+
Г Ф — карбоангидраза ферменти,
АФ — апофермент.
Организмда рух тан^ислигида мувоз.анат унгга сил-<жийди ва фермент активлиги камаяди. Рух ионлари ки-ритилиши мувозанатни чапга силжитади, бу эса карбо-ангидраза кондентрациясининг ортишига ва фермент активлигининг тикланишига олиб келади.
3. Огир металлар, масалан кумуш, мис, цургошин ва _ боищалардан за^арланганда комплекс ^ооил цилувчи j моддалар, масалан комплексон (III) ёрда^ида давола-нади. Улар организмдагига Караганда муста^камро^ комплекс бирикмалар ^осил ^илади ва 6j| комплекслар организмдан осон чицариб юборилади:
ФЧ-РЬ2+^Ф-РЬ2+
Nas [На у] 4- Pb2+ Naa [РЬ у] + Ф
4. Бактерицид хусусиятга эга булган доривор препа-ратлар. таъсиринй уларни ишдатганда мувозанатни сил-житиши билан тушунтириш мумкин. Масалан, изонико- тин кислота гидрозиди (ГИНК) таъсири. ГИНК бактерия ферментлари актив марказдаги металл катионлари билан узаро таъсирлашиб уларни комплекс ^олда 6of-' лайди. Бунинг натижасида мувозанат силжийди, фермент активлиги тушиб кетади ва бактерия ^алок б^лади.
Ф^АФ + М"4’1 ГИНК+ М"+—>-ГИНК-М(п-1>++ Н+
Бошлангич даража
1. Кайтар ва ^ай^мас реакциялар:
ЕГ. Тугри ва тескари реакциялар.
2. Комплекс бирикмалар бе^арорлик константалари ва ч^кманинг эрувчанлик к^пайтмаси константаларидан келиб чициб, комплекс бирикма ва чукма ^осил б^лиши билан борадиган реакциялар йуналищини аницлаш.
МУСТАЦИЛ ТАЙЁРЛАНИШ УЧУН УЦУВ МАТЕРИАЛ ЛАРИ
1. Н. Л. Глинка. <Умумий химия». Т. 1968. 220-бет.
2. X. Рустамов. «Умумий химия». Т. 1969. 83-бет.
3. X. Р, Рахимов. Анорганик химия. Т. 1974.
4. X. У. У с м о н о в, X. Р. Рустамов, X. Р. Рахимов. Физикавий химия. Т.
5. С. С. О л е н и н, Г. Н. Фадеев, Неорганическая химия, М, 1979, 35-бет.
6. А. Б. Б а б ков. Г. Н. Горшкова, А. Л. Кононов. Практикум - по общей химии с элементами количественного анализа. М., 1978, 64- бет.
7. А. С. Ленский. Введение в бионеорганическую и биофизи-чёскую химию. М., 1989, 80-бет. .
МАЪЛУМОТЛАР БЛОКИ
КИМЁВИИ МУВОЗАНАТ
Маълумки, барча кзйтар реакциялар охиригача бор-майди. Уларнинг боришида тугри реакцияларнинг тез-, лиги камайиб, тескарисиники ортиб боради. Маълум муд-датдан сунг уларнинг тезлиги бир хил булади, шунда кимёвий мувозанат царор топади. Кимёвий мувозанат-нинг ми^дорий характеристикаси — кимёвий мувозанат константасидир. Уни аммиакни синтез цилиш реакцияси учун келтириб чицарамиз. -
Na(a) + 3Ha(a)^2NH3(a)
v1 = ^c(Na)c8(Ha)
мувозанатда — vt
K1-c(Na)cs(Ha)=J<ac2(NH3)
Ki c»(NH8) . JL=v
A2 c(Na).c»(Ha)’ T
K.T —мувозанат константаси.
Мувозанат константаси тенгламасига кирувчи модда концентрацияси мувозанат концентрацияси дейилади.
Мувозанат константаси — ушбу ^арбратда доимий , сон бул’иб, реакция ма^сулоти ва бошланрич моддалар, мувозанат кбнцентрациялари орасидаги нисбатни курсатади. У канчалик катта булса, реакция ма^сулотининг ^осил б^лиши шунча тез булади.
аА + вВ + . . . сС + dD + . . .
к = cc(C),cd (Р) т Са(А)-сь(В)
Кт ифодасига цаттик; моддалар концентрациялари кирмайди. Реакцияларнинг бориш шароити узгартирил-. ганда кимёвий мувозанат бузилади. Бирор йуналиш буйича реакциянинг купрок бориши купинча бошланрич ^олатдаги мувозанатдан фарк киладиган янги кимёвий мувозанат кааРтопишига олиб келади. Бир мувозанат ^олатидан бошцасига утиш кимёвий мувозанатнйнг силжиши дейилади. Бу силжишнинг йуналиши Ле-Ша-телье конунига буйсунади: кимёвий мувозанатда турган системага ташцаридан бирор таъсир кУрсатилса, муво-
занат шу таъсирни камайтирувчи томонга силжийди. Температуранинг ортиши кимёвий мувозанатни эндотер-мйк реакция томон силжишига; босимнинг оширилиши газсимон моддалардаги умумий моллар сонининг кама-
. йишига; системадан реакция ма^сулотининг бирини олиб ташлаш мувозанатни тугри реакция томонга силжишига олиб келади. Катализатор мувозанат константаси ций-матига таъсир этмайди. Кимёвий реакция мувозанат константаси Гиббс ‘энергиясининг стандарт узгаришига боглик:
AG° = — 2,3 RTlgKi
г
298 К 25°С тенгламада куйидагича узгара^и.
Аж°98 = — 5,69 1g Каев,
бунда AG°98 кЖ/молларда ифодаланган.
Шундай килиб, бу тенгламалардан куринадикй, A G° < О, 1£К>0,яъни k> 1. Демак, AG°<0 булганда мувозанат турри реакция томонга силжийди ва ма^сулот чициши нис-батан юцори; A G° > О да lg k С 1 булиб, ма^сулот чи^иши кам булади. •
Ургатувчи масалалар ва уларни ечиш намуналари
1-мисол. А (г)+2В (г)ч±С (г) системада мувозанат концентра-циялари цуйидагича: с (А) =0,216 моль/л, с (В) =0,120 моль/л, с (С) =0,216 моль/л.
Реакциянинг мувозанат константасини ^амда А ва В моддаларнинг бошланрич концентрацияларини топинг.
Берилган:
с (А) = 0,216 моль/л
с (В) =0,120 моль/л с (С) = 0,216 моль/л
Кт = ? с(А0) = ? с(В0) = ?
Ечиш намунаси. 1. Берилган реакциянинг мувозанат константаси массалар таъсири цонунига мувофиц цуйидаги тенглама билан ифодаланади:
к С(О т с (А)-с2 (В)’
Тенгламага масалада берилган дийматларни кУйиб, Ктнинг сон кий* матини топамиз.
0,216 мол/л
т= 0,216 • 0,120а = 69’45'
Кт = 69,45
2. Реакция тенгламасига кура 2 моль А моддаси ва 2 моль В моддасидан 1 моль С моддаси ^осил бУлган. Бу масалада 216 моль А моддаси ва 0,216-2 =0,432 моль В моддаси сарф цилинганда сис- .. теманинг ^ар бир литрида 0,216 моль С модда ^осил булади.
Шундай цилиб, А ва & моддаларнйнг бошлангич концентрацияларя: с (Ло) = 0,216 моль/л 4- 0,216 моль!л = 0,432 моль!л с(В9) =0,120 моль!л 0,432 моль!л = 0,552 мо.'ь/л
Жавоб: = 69,4
с(Ло)=0„432 моль!л
С(ВО) = 0,552 моль/л
Масала буйича саволлар z
1. Мувозанат константаси нимани ифодалайдн?
Жавоб: У доимий кУрсаткич булиб, реакция ма^сулоти ва бошлангич моддалар мувозанат концентрациялари орасидаги нисбатни кУрсатади.
2. Кт = 69,4 булганда, реакциянинг бориши ^а^ида цандай хулоса чицариш мумкин?
Жавоб: Кт = 69,4, яъни Кт> 1. Бу циймат мувозанат тугри реакция томон силжиганини, яъни С модда ^осил булиши томон силжиб реакцияга киришаётган моддаларнйнг 50 % узаро бирикиб, реакция ма\-сулотларини ^осил цилишини кУрсатади.
2-мисол.. Куйидаги системада босим оширилганда кимёвий мувозанат цайси томонга силжийди?
2Н»(а) + О2 (г)^2Н2О (г)
Ечиш иамунаси. Берилган системада 2 моль Н2 ва 1 моль О2, яъни ^аммаси булиб 3 моль модда реакцияга киришади. 2 моль Н2О ^осил булади. Ле-Шателье цонунига асосан, босим оширилганда мувозанат чапдан унгга силжийди, чунки доимий ^ажмда 3 моль бошлангич моддадаи 2 моль ^осил булиши босимнинг камайишига олиб келади, яъни курсатилган таш^и таъсирни камайтиради.
Масала буйича саволлар
1. Ле-Шателье цонуни цандай таърифланади?
Жавоб: Агар .мувозанатда турган системага ташцаридан бирор таъсир кУрсатилса, системада шу таъсирни сусайтнрувчи йуналиш-даги жараён кучаяди.
2. Ле-Шателье ^онуни нимани ифодалайди?
Жавоб: Ле-Шателье. цонуни мувозанатдаги система х°латига да унинг силжишига турли омиллар таъсирини аницлайди.
3. Ле-Шателье цонунининг а^амияти цандай?
Жавоб: Ле-Шателье цонуни катта амалий а^амиятга зга, чуцки у лаборатория ва саноатда му^им булган ма^сулотларни олишда купчилиги цайтар булган кимёвий реакцияларни боищариш имкони-ятини беради.
4. Бу ^оиундан биокимёвий. жараёнларнинг боришини тушунти-ришда фойдаланиладими?
Жавоб: КУпчилик му^им биокимёвий жараёнлар: нафас олиш, ферментатив ва бошца жараёнлар ^айтардир, шунинг учуй улар кимёвий кинетика ва Ле-Шателье ^оиунларига бУйсунади.
3-мисол. Суров (справочник) маълумотларидан фойдалаиган долда сув гази ^осил булиш реакцияси мувозанат константаси бирга тент бУлгандаги температуранинг тахминий цийматларини топинг.
С (графит) + Н2О (а) ** СО (г) 4- Н2 (г) А Н° в A S° боншцлигини хисобга олманг.
Берилган: Ki = 1
*4 _ ДН^8 2С0,(г) = — Ш кЖ!маль
"Я ДН^8 (Н20) (г) = — ШкЖ1моль
;? г . Д S298 ICOg) (г) =198 Ж1моль К
Ь$°^(Ы)(г)=\ЫЖ1моль-К
'?? Д5^8 (Н2О)(г) = 198 Ж/жоль-К
• -/' ~ т = ? ~ ~
, ’ Ечиш намунаси. 1. Кимёвий реакция мувозанат константаси Гиббс энергияси стандарт ^згариши билан тенгламага мувофид бор-. Айд- *
AG; = -23/?ngKr \ .
2. Кт = 1 булгани учун /gKr = Igl = 0. Шуфай дилиб, Д G°T= О* : 3. Термодинамика таълимотидан маълумки, Д О ? = А Ну. —Т. Д$£' Агар Д GT = 0 б^лса, ушбу дароратда Д Hj. = Т -Д Бундан: Т = днЗ-. • Яв_
> AS°r
4; Масала шартига кура дисоблаш учун жадвалдан олинган Н°д8 * ва S°gt8 дийматларидан фойдаланамиз.
4 лн«98 = дновр(Со1(г;-дн«бр.(н2о)(г)
/ Д H29g = — 111 кЖ/моль — (—242 кЖ/моль).= 131 кЖ/моль
А ^298 = ^298 (СО« (г) + А $298 ^298 Графит) 4"
+ Д Sjgg (Н2ОГ)1
Д S°98 = 198 Ж/моль-fC + 131 ж/моль-К} — [5 Ж/мом-К +
4-189 Ж/мвль-К] — 329 Ж/моль К — 194,7 Ж!моль-К =
134,3 Ж!моль. К = 0,1343 к Ж/моль-К.
5. Т — —тенгламасйга ДН°98ва Д3298 нинг топилган ^ийматла-Д$298
рини чуйиб Т ни дисоблаймиз:
0,1343кЖ/моль
Жавоб: Т = 975,4 К
6. Кастар жараёндаги Д Gor ва Кг орасидаги богланишни к^рсатинг.
Жавоб: Д G? = 2,3 RTlgK.T
Агар К> 1 б^лса, унда lgK>0, Д/°<0 булади, бунда жараён Уз-^зидан мадсулот досил булиш томон боради.
Агар 1 б^лса, унда lgK. <.0, Д J> 0*булади, бунда жараён мад-сулот досил б^лиши томон бормайди.
за
Агар К — 1 булса, IgK — O, &GP = O, бунда система мувозанат дола-тида булади.
7. АН ва AS нималигини эсланг.
ЖавобГ Н — энтальпия системанинг иссидлик сацлаши; эн-тальпиянинг Узгариши AH = Qp (р —const). Улчами— кЖ/моль. S — энтропия системанинг тартиблилиги;
ДА’ — энтропиянинг узгариши. Улчами Ж/моль - К.
8. Ушбу дароратда модданинг стандарт долати деб нимага айти-
лади? /
Жавоб: Бу унинг стандарт шароитда соф модда куринишидаги долати: Бир моль модда, Г=298 К (25 °C), Р=101, 325 кПа. Стандарт узгаришлар юдори индекс ° билан курсатилади: ДН°; AS0; AG°.
9, Кимёвий реакция энтальпия (энтропия) сининг стандарт узгариши нима билан Улчанади?
Жавоб: У мадсулот досил булиш . стандарт энтальпия (энтропия) лар йигиндиси ва бошлангич модда досил булиш стандарт энтальпия (энтропия) лари йигиндиси орасидаги фард буйича Улчанади.
10. AG° нима?
Жавоб: G- изобар потенциал, Гиббс энергияси булиб, бир вадт-нинг Узида энтальпия ва энтропияларни кимёвий жараённинг бори-шига таъсирини курсатади. AG нинг Узгариши AG=AH—TAS нисбат буйича анидланади. Улчами — кЖ.
~ . 11. AH, AS, AG ва кимёвий реакциянинг бориши орасидаги бог-ланишни анидланг.
Жавоб: 1) AH<0,AS>0. Бунда AG<0 булиб, реакция дар дандай дароратда уз-узидан боради.
2. ДН>0, AS<0, бунда AG>0, Реакция Уз-Узидан бормайди, унинг бориши учун ташди таъсир зарур.
12. АН, AS, AG нимага боглид?
Жавоб: Бу катталиклар реакцияга киришаёгган модда табиатига, дароратга, агрегат долатига ва модда миддорига борлид.
13. A Н°, A S°, A Gr — стандарт Узгариш нима?
Жавоб: Таддослаш натижалари олиш учун улар стандарт до-латга келтирилади: 1 моль модда, Т=298 К (25 °C), р=101, 325 кПа.
Мавзунинг узлаштирилишини мустадил назорат дилиш учун савол ва масалалар
1. Реакциянинг кимёвий мувозанати дайси йуналишда силжийди?
кЖ
1. 2СО (г) + О2 (г) ч* 2СО2 (г) А Н° = —566
л кЖ
2. N2 (г) + О2 (p)=^2NO (г) ДН’=— 180
1) Харорат пасайганда?
2) Хэрорат ошганда?
2. Н2 (г) + 12 (г) ** 2HI (г) системасида водород концентрацияси 0,024 моль/л, йодники 0,005 моль/л, водород йодидники эса 0,090 моль/л булганда мувозанат дарор топади. Йод ва водороднинг бошлангич кон-центрацияларини анидланг.
Жавоб; CotHss) = 0,065 моль/л-, c0(J2) = 0,050 моль/л. .
3. Ферментларнинг кУпчилиги таркибида Mg бор. Бу фермент-ларйинг инактивацияси (фаолсизланиши) одам учун задарли берил-
ЛИЙ эдементи таъсирнда.рУй беради, бунда бериллий магнийни сихиб ; 4одарйб, фермент билан комплекслар хосил хилйди. Фермент актив-лягинйнг тиклаййшй нимага асосланади — магний тузларининг м^л мицдорда таъсири биланми?
4. Тилланинг ферментлар билан координацией бирикмалар хо-' у«йлхилиши натижасида одамга зарарли таъсир цилиши маълум. ‘-‘Igry за^арланишни даволашда одам организмига Олтингугурт сац-t ловчи лигаидлар, масалан цистеин юборилади:
. а‘ О
HS — СН2— сн — с/
nh, °н
... Организмда тилла комплексига цистеиннинг таъсир механизми-' Яй тушунтиринг.
'' о. Азот икки оксиди—NO2 уз ига хос дидли ^унгир газ, одам учун зарарли. Нитрат кислота олишда мухим хом ашё хисобланади, шунинг учун у билан ишлашда унинг зарарли таъсирини хисобга олйш керак. NO2 ХУЙидаги реакция буйича олинади:
2NO (г) + О2 (г} ч=ь 2NO2 (г)
л • •
I
< -4 моль азот оксиди ва 2 моль киёлороддан иборат бошлангич ара-Лашма тайёрланган, мувозанат холат вахтига келганда эса азотнйнг бошлангич михдоридан 20% холди, кимёвий мувозанат константаси Хийматини топйнг.
Жавоб: Кт = 40
6. Тиббий амалиётда бром препаратлари —NaBr, КВг к^п ишла-тилади. Уларни куп михдорда хабул хилгайда меъда ширасида во-дород бромид кислотаси анихланади (нима учун?). Куп михдордаги ,. КВг одам учун захарли. Бромидлар билан захарланганда к?п мих-* дор NaCl юбориш билан даволашни тушунтириб беринг.
Лаборатория иши
КИМЕВИЙ МУВОЗАНАТ БУЙИЧА СИФАТИЙ ТАЖРИБАЛАР 1-тажриба. Кимёвий мувозанатга реакцияга киришаётган модда концентрацияларининг таъсири.
Тажриба учун куйидаги реакциядан фойдаланиш Кулай:
FeCl3+3NH4SCN^3NH4C1 + Fe (SCN) 3
Fe (SCN3) модда т^к цизил рангга эга, FeCl3 эритмаси ,оч сариц'рангли. NH4SCN, NH4CI — рангсиз. Туртта конуссимон пробиркага 20 томчидан 0,005 моль/л FeCl3 эритмаси ва 0,015 моль/л NH4S CN эритмасидан солинг. Битта пррбиркани ^о^ил цилинган эритма билан тажриба натижаларини таккослаш УЧУН олиб куйинг. Кодган пробиркаларга куйидаги ^еактивлардан: бирин-чисига — 1 томчи NH4SCN нинг туйинган эритмасидан, иккинчисига —1 томчи Р'еС13нинг туйинган эрит-
масидан, учинчи пробиркага МН4С1нинг бир неча крис-талидан солинг. Х°сил булган эритмадар рангининг интенсивлигини эталон ранги билан солиштиринг. Куза-. тув натижалари ва' хулосаларни жадвалга ёзинг.
Пробирка № К^шилган реактив Ранг ннтенсивлигннинг узгариши, ранг фзгари* шининг йуналиши (сусайиши, кучайиши. мувоза-. натнинг чапга, унгга силжиши)
1. 2. 3. 4. -
Биринчи, иккинчи ва учйнчи пробиркалардаги ранг узгаришини туртинчиси билан таццослаб тушунтиринг.
2- т а ж р и б а. Температураиинг кимёвий мувозанат-га таъсири.-
2.1. йоднинг крахмал билан узаро таъсириданкУк рангли, мураккаб таркйбли йодкрахмал ^осил булади.
Реакция экзотермик, мувозанатни шартли равишда ^уйидаги схема билан ифодалаш мумКин;
йод+крахмал^йодкрахмал-bQ
Иккита пробиркага 4—5 томчидан крахмал эритма-сидан солинг ва 1 томчидан суюлтирйлган йод эритма-сидан кушинг. Эритма кук рангга буялади. Пробирка-ларнинг бирини киздиринг ва ранг Узгаришини кузатинг. Сунгра пробиркани жумракдан окаётган сув остида со-вутинг. Эритма рангида дандай узгариш руй беради? Тажрибани тушунтириб берйнг.
2.2. Иккита пробиркага 5—7 мл дистилланган сув, 2—3 томчи фенолфталеин ва 1 томчидан концентрланган аммиак эритмасидан солинг. Битта пррбиркани таццос-лаш учун ^олдиринг, иккинчисини циздй^инг. К,издириш эритмадан аммиак ажралиб чицищини ва шу билан бирга мувозанат силжишини курсатади.
NH3Ч-Н2о =rbNH4OH =₽tNH^ + ОН“ Хиздирилганда аммиак ’эритмаси рангининг узгаришини тушунтиринг. "
3- т а ж р и б а. Кимёвий мувозанатга му^итнинг таъсири. .
Хром (VI) иони ишкорий эритмада сариц рангли хромат иони- СгО|~ шаклида намоён булади. pH камайтирилиши натижасида СгО4~ протонлашади ва кислотали му^итда зар-галдок рангли бихромат иони—Сг2О?~ ^осил булади.
2CrOj~ + 2H+ ** Сг2о|- + Н20
Cr2O|“ + 20Н- =г* 2СгО^“ + Н2О
• Пробиркага 2—3 мл 10% (масс.) ли К2СГ2О7 эрит-масйдан дуйинг. Шу эритмага томчилаб концентр-ланган ипщор эритмасидан цуйинг, ранг ^згаришини кузатинг. Эритма сири^ рангга кирганда томчилаб концентрланган сульфат кислота ^шинг.^Ранг узгари-шини кузатинг. /
Содир б^лаётган ^одисаларни тушунтйринг.
' 4- т а ж р и б а. Мувозанатни кам дшзсоциациялана-
диган модда ^осил дилиш натижасида силжитиш.
Пробиркага 4—5 мл магний хлорид эритмасидан солинг ва секин-аста ч^кма ^осил булгунча натрий гидроксид эритмасидан ц^шинг. Чукмани чай^атинг', ^осил булган суспензияни бошда иккита пробиркага солинг.
Биринчи пробиркани таццрслаш учун ^олдиринг, ик-кинчисига чукма эригунча хлорид кислота ^шинг, учин-чисига чукма эригунча аммоний хлорид цушинг. Магний гидроксиднинг хлорид кислота ва аммоний хлоридда эришини тушунтириб беринг. .
КИСЛОТА-АСОСЛИ МУВОЗАНАТ
Мавзунинг мадсади: Доривор препаратлар ва биологик сую^ликларда pH ни экспериментал ани^лаш ва микдорий ^йсоблашни урганиш
Урганилаётган мавзунинг а^амияти. Водород ион-лари концентрациясининг доимийлиги тирик организм ички му^итининг му^им константаларидан биридир. Масалан, одам ^онининг pH и 7,4±0,04 га, меъдД_шира-синикй—1,85±0,15 га, с^лагиники—6,0±0,30 га, сий-дигйники —5,0—8,0 га тенг.
Биологик системаларда pH нинг, биринчи навбатда цбннинг сезиларли ^згариши ^аёт фаолиятининг чуцур бузилишига ва б^ибатда улимга сабабчи булиши мумкин.
Тирик организмда реакция му^итининг кислотали томонга ^згариши — ацидоз, ишцорий томонга узга-риши — алкалоз деб аталади. Ацидоз ^ам, алкалоз ^ам ^аёт учун хавфли. pH нинг нормадан кам булиши ферментлар фаоллигининг сусайииаига ва ^ужайралар-даги реакцияларнинг нормал бориши бузилишига олиб келади. Бу эса баъзи касалликларнинг келиб чицишига
сабаб булиши мумкин. Вир ^атор касалликларда одам организмида кислота-ишцор мувозанати бузилиши руй беради. Масалан, диабетнинг огир турида ацидоз, жйгар циррозида — алкалоз кузатилади.
Турли биологик сую^ликларда pH ни аницлйш тиб-•• биёт амалиётида зарур омиллардан ^исобланади.
Бошлангич даража /
1. Электролитик диссоциация асослари.
2. Кучли ва кучсиз электролитлар.
3. Электролит эритмаларда ионли мувозанат.
Мустацил тайёрланиш учун ухув материал лари
1. Н. Л. Г линка. «Умумий химия». 1968, 220-бет.
2. X. Р у с т а м ов. «Умумий химия». 1969. 83- бет.
3. С. С. Оленин, Г. Н. Фадеев. «Неорганическая химия».
М., 1985, 131- бет.
4. И. К. Ц и-т о в и ч. «Курс аналитической химии». М., 1985, 25- бет.
5. А. С. Л е н с к и й. «Введение в бионеорганическую и биофизическую химию». М., 1989, 139- бет.
МАЪЛУМОТЛАР БЛОКИ
КИСЛОТА ВА АСОСЛАРНИНГ ПРОТОЛИТИК НАЗАРИЯСИ АСОСЛАРИ
Бу назарияга асосан кислоталарга протон берувчи моддалар (ёки ионлар), асосларга эса протон бирикти-риб олувчи моддалар (ёки ионлар) киради. Униси хам буниси хам прото л ит л а р дейилади, Протон бериш Хайтар жараён булиб, бунда хосил булган х°лдих асос протонии бириктириб олиши ва яна кислота хосил цилиши мумкин: кислота^асос+Н+
Эритмада протонлар мустахил була олмайди, улар фацат кислотадан асосга утади. Шунинг учун эритмада доимо иккита жараён боради:
кислота! ч*.Н^" + ас ocj асос2 + н+ кислота2
Улар орасидаги, мувозанатни хуйидаги тенглама билан ифодалаш мумкин:
кислота! 4- асос2 ч* кислота2 + acoct
Ма сал ан: Ci -f- Н2О з=> н,0 + 4- С1~
Шундай хилиб, протолитик назарияга к^ра, бошлангич кислота ва асослардан доимо янги кислота в а асос
Хрсил булади, улар бундай жараёнларда тута ш кислота ва асослар дейилади. Нейтрал, молекулалар, мусбат ва манфий ионлар кислота ^амда асос булиши мумкин.
Кислоталар Асослар
НС1 ZZZZZ^H+4-СГ
н2о
NH+ Z~ZZX Н+ + NH3 \
Шуни эсда са^лаш керакки, сувли мухи^да хамма ионлар, жумладан водород катионлари Хам гидратланган булади. Гидратланган водород катионлари НзО*1- — гид-роксоний ионлари дейилади. Шундай хилиб, электролит-лар диссоциацияси тенгламаси тугрирох тарзда хуйида-гича ёзилади: '
НС1 + Н2О^Н3О+ + С1“ НСО3~ + Н2О=₽* Н3О+ + СО|-
Лекин к^пинча Соддалаштириш учун тенгламада Н3О+ эмас, балки Н+ деб ёзилади.
Баъзи моддалар. (ёки ионлар) шароитга хараб кислота ва асос хоссаси борлигини намоён хилади.,Масалан, сув NH3 билан таъсирлашганда кислота хоссаси борлигини намоён хилади. ‘
' ' nh3 + h2o=f*nh+ + oh-
НС1 билан узаро таъсирланганда эса асос хоссасини намоён хилади.
" , НС1 + Н2О=₽*Н3О+ + С1-
Нейтралланиш реакциясига протолит-ик назарияга кура протонии кислотадан асосга утиш жараёни деб хара-лади:
HCl + NH3^NH+4-Cr
Сув ионларининг купайтмаси. Водород курса т кич. Сув кучсиз электролит б^либ, ион-ларга жуда кам диссоцияланади:
н2о=^н+ + он-
ЗГ — с(Н+)-С (ОН ) , у- Л I о ю**-14
Адисс । Адисс — 4i°’
с (HgO)
Сувнинг диссоциацияланмаган молекулалар концентра-циясига доимий катталик (с (Н2О) = 55,55 моль/л) деб ца-раб, тенгламани хуйидагича ёзиш мумкин: (Н2О) =
~с (Н+)с (0Н-)= 1,8 10-“-55,55= 10-14 Кно = = с (Н+Н (ОН~)= ПТ14
чЛно— сувнинг ионли купайтмаси.
Шундай ^илиб, Н+ ва ОН- ионлари концентрация-ларининг купайтмаси сувда ёки суюлтирилган эритма-ларда доимий цийматга эга. У 22°С да 10-14 га -тенг. Эритма реакцияси Н+ концентрацияси билан характер-ланади. Нейтрал эритмаларда:
с (Н+) = с (ОН“) = К= Ю~7 моль/л.
Кислотали эритмалар: с (Н+)>с (ОН~)с(Н3)2> 10~7 моль) л Ишцорий эритмалар: с (Н+)<с (ОН~)с(Н3)< 10 ~7 моль/л Эритма реакциясини водород курсаткич — pH билан харак-терлаш оддий ва цулайроедир: • ,
pH — -1g с (Н+)
Нейтрал эритмалар: рН = 7
Кислотали эритмалар: рН<7
Ишцорий эритмалар: рН>7
Гидроксид ионлари концентрдциясининг тескари логарифма диймати рОН дейилади, рОН =—Igc (ОН-)га тенг. Шундай цилиб, рН + рОН=14 ; бундан рН = = 14—рОН, рОН= 14—pH.
Ургатувчи масалалар ва уларни ечиш намуналари
1-масала, с (ОН-) = 10—4 моль/л ва с (ОН-)= 10—u моль/л б£л-ган эритмадаги с (Н+) ни ^исобланг.
Берилган:
с (ОН-) = 10—14 моль/л
с (ОН-) = 10—11 моль/л
с(Н+) = ? ~
Ечиш иамунаси
с (Н+)-с (ОН)“) = 10-14
с (Н+) = 10—14/с (ОН)
1) с (Н+) = 10-14/(10-4 = 1О-10 моль/л
2) с (Н+) = 10—I4/IO-" = 10-3 моль/л
2-масала, с (ОН-) = 10“*® моль/л булган эритманинг с (н+) на pH ни ^исобланг.
Берилган: '
с (ОН-) = 10—* моль/л с (Н+) = ? рН = ?
Ечиш иамунаси:
рОН = - Igc (ОН-) = - IglO-• = 5
pH+ pOu — pH = 14 —рОН = 14 — 5 = 9
•с (НЪ = КГ*9 моль/л
9-масала, с (Н+): а) 2-10—4 моль/л; б) 5-10—» моль/л; „
' в) 9-10~’ моль/л булган эритма pH ини эргеобланг.
Берилган:
с (Н+ = 2-10~4 моль/л
• с («+) = 5-10-» моль/л
с (Н+) - 9-10-8 моль/л
pH = ?
Ечиш намунаси
pH = -lgc(H+) '
а) PH — — 1g (2-10—«>= — (— 4 + 0-3) = 3,70; pH = 3,70.
б) рН= — 1g (5,10-’) = —(—6 + 0,69) = 5,31; pH =5,31.
в) pH = — 1g (9-10-’) = — (- 9 + 0,95) = 8.05^ pH = 8,05.
Масала буйича саволлар
1. pH — нима? рОН — нима?
Жавоб: pH — бу Н+ ионлари концентрациясининг манфий ишо-’ рали унли логарифми; рОН—ОН— ионлари концентрациясининг манфий ишорали Унли логарифми. —
2. Кислотали, иш^орий ва нейтрал му^итда pH ^иймати ^андай?
Жавоб: кислотали му^итда рН<7
иищорий му^итда pH >7
нейтрал му^итда pH—1
3. Тиббий амалиётда биологик объектлар рН ини аниНлаш за-рурати борми?
Жавоб: биологик суюцликлар pH цийматининг доимийлиги билан характерланади, унинг узгариши биологик жараёнларнинг бузилишига олиб келади. Шунинг учун, pH ни аницлаш касалликни таш-^ис ^илиш, олдини олиш ва даволашдаму^имдир.
Мавзунинг узлаштирилишнни мустацил назорат цилиш учун савол ва масалалар
' 1. Протолитик назария ну^таи назаридан цандай бирикмалар асос ва кислоталар дейилади?
2. Кислотали, ипщорий ва нейтрал му^итларда pH ва рОН ций-матларини курсатинг.
3. Сув ионларининг купайтмаси ^андай омилларга бордиц?
' 4. Дистилланган сувнинг 25 °C даги pH ини ^исобланг. *
5. Тиббий амалиётда салицил кислота антисептик ва замбуругга царши восита-сифатида сиртга" ишлатилади, натрий салицилат эса — - ревматизмда огриц цолдирувчи ва иситма туширувчи восита сифати-Да-ичиш учун ишлатилади. Уларни спиртли эритмаларда индикатор, фенолфталеин ва лакмус ёрдамида ажратиш мумкинми? (Салицил кислота кристаллари сувда ёмон, натрий салицилат эса яхши эрий-дн). -
6. Агар меъда шираси рНи 2,30 булса, киши саломатлиги ла^и-Да цандай хулоса чицариш мумкин?
7. рН=6,0 булган бемор сийдигидаги с (Н+) ва с (ОН—) ни . анн^ланг.
8. Меъда шираси кислоталилиги камайганда тиббий препарат Сифатида ишлатиладиган 3% ли хлорид кислота эритмасининг с (Н+) ва pH Ини ани^ланг. *
Жавоб: pH=0,085.
9. Концентрацияси с (ОН) =3-10—5 моль л булган тиббий пре
парат натрий гйдрокарбонат сувли эритмасининг pH ини ^исоб-ланг.
Жавоб: рН = 9,52.
ЛАБОРАТОРИЯ ИШИ
Эритмалар pH ини калориметрии ани^лаш
(буферсиз усул)
Эритмалар pH ини буферсиз усулДа анидлаш учун Михаэлис кутичасидан фойдаланилади. У ^уйидагилар- дан иборат:
1) нитрофенолнинг бошлангич, цндуктори булган -туртта идиш.
2) pH узгариш оралиги 1—10 булган рангли шкала-ли универсал индикатор;
3) турт ^атор кавшарланган пробиркаларда эталон-лар;
4) чинни идишча ёки буюм ойначаси, шиша таё^ча ва пинетка;
5) 6 уячали ва пробиркали компаратор.
Ишнинг бажарилиши Михаэлис пробиркалари ёрда-мида рНни ани^лаш куйидагича бажарилади:
1) универсал индикатор ва рангли шкала буйича меъда ширасининг тахминий рНи анидланади. Бунинг учун буюм ойнасига меъда ширасидан бир неча томчи томизилади ва универсал индикатор цогозча дулланади. Индикаторли ^огозча рангини рангли шкала ранглари билан солиштирилади ва у буйича меъда ширасининг тахминий рНи ^иймати аницланади;
2) Михаэлис ^утисидан индикатор шундай танлана-дики, эритманинг топилган тахминий pH циймати индикатор ранг Узгариши оралигида булиши керак;
3) диаметри эталонники билан бир хил булган пробиркага 0,6 мл меъда шираси солинад'и ва 0,1 мл тан-лаб олинган индикатордан цУшиб аралаштирилади;
4) меъда шираси ва индикатор солинган пробиркани компараторга цуйиб Уша 'индикаторли эталон билан солиштирилади. Буялиш интенсивлиги мослиги эталон ва pH эритмасининг тенглигини курсатади. Шундай1 усулда сийдик pH ини анидлаб, бемор саломатлиги да-дида хулоса чицариш мумкин.
КИСЛОТА-АСОСЛИ МУВОЗАНАТ, БУФЕР ЭРИТМАЛАРНИНГ ХОССАЛАРИ
Мавзунинг мацсади: 1. Биологик системаларда буфер эритмалар таъсир механизмини олдиндан белги-лашни урганиш.
2. Буфер эритмалар pH ини ми^дорий ^исоблаш ва экспериментал аницлашни билиш.
Урганилаётган мавзунинг а^амияти. Буфер система-лар хоссаларини билиш ва уларни тиббий амалиётда конкрет масалаларни ^ал ^илишга тадбиц цила билиш зарур, чунки бу системалар организмда кислота-асос мувозанатини сацлаб туришда му^им рол уйнайди. Улар цон, ^ужайра ичи ва ^ужайралараро суюцликлар* кислоталилигини бошцариб туради, шу билан фермент ва гормонлар говори активлигини намоён $илиш учун оптимал шароц|г яратиб беради. Тирик . организмда к;он pH ининг нормал циймати 7,36. У бийдрбонат буфер системами ва ^оннинг бутун буфер^ сиримининг 75% ини ташкил этадиган к;удратли гемогаобин ва оксигемоглобин буфер системаси билан таъминланади. Артерияларда ^он pH ининг доимийлиги оксигемоглобин— гемоглобин системаси билан ушлаб турилади. Сийдик ва >;азм аъзолари сую^лигида фосфат буфернинг булиши му^им.
Бошланрич даража
1. Массалар таъсир конуни.
2. Кимёвий мувозанат, кимёвий мувозанатнинг сил-жиши.
3. бувнинг ионли купайтмаси, водород курсатгич.
4. Кучли ва кучсиз кислота ва асос эритмалари наза» рияси.
5. Эритма'концентрациясини ифодалаш усуллари.
Муста^ил табёрланиш учун удув материя л лари
1. X. Р. Рахимов. «Анорганйк химия». Т., 1974. 129-бет.
2. В. Н. А л е к с е е в. «Количественный анализ». М., 1972, 280-бет.
3. К. А. Селезнев, «Аналитическая химия». М., 1973, 30-бет.
4. И. К. Ц и т о в и ч. «Курс аналитической химии». М., 1985,. 31- бет.
5. С. С. Оленин, Г. Н. Фадеев. «Неорганическая химия». М., 1979, 135-бет.
4 6. А. С. Л е нс к и й. «Введение в бионеорганическую и биофизическую химию», М., 1989, 151-бет.
МАЪЛУМОТЛАР БЛОКИ
БУФЕР СИСТЕМАЛАР
Суюлтирилганда ^амда оз мицдорда кислота ва иш- $°Р К^шилганДа водород ионлари концентрациясини ;‘ДОиМий са^лай олади^ан эритмалар абуфер системалар-^•Дейилади. Улар таркибига кура 2 асосий хилда булади:
1) кучсиз кислота ва унинг тузи аралашмасидан ташкил топтан;
2) кучсиз асос ва унинг тузи аралашмасидан таш- . кил топтан;
Масалан:' СН8СООН + CH3COONa биринчи хил;
ч NH4OH + NH4C1 иккинчи хил; •
Буфер системалар водород курсаткичи pH ини Гендер-сон—Гассельбах тенгламаси буйича ^исоблаш мумкин: кислотали буфер учун pH = рК (к - та) — 1g - (кислотл) с (туз)
иш^орий буфер учун pH = 14 — рК (асос) + 1g
с (туз)
Буферларга оз мик;дорда кислота ёки ишцор цушил-ганда уларнинг pH и амалда узгармайди, чунки цуйида келтирилган тёнглама буйича ^^шилган кучли кислота (иш^ор) эквивалент мицдор кучсиз кислота (кучсиз-асос) ёки цушилган инщор (кислота) эквивалент миц-дордаги туз билан алмашинади.
СН.СООН СН3СООН , МяГ1
+ НС1---------->Ортади m 1
CH8COONa - CH3COONa
камаяди
бунда CH3COONa нинг бир ^исми СН3СООН га утади. Бунинг оцибатида водород ионлари тули^ богланади ва >с (Н+) ^амда pH цийматлари ортмайди. Бу системага ишцор ц^шилганда эса цуйидаги ^згариш руй беради.
СН3СООН СН3СООН
+ NaOH ----:---—► камаяди . „ А
- CHsCOONa v CH3COONa+
ортади
Бунда гидроксид ионлари сирка кислота протони бй-лан богланади. Шунинг учун с (ОН-) концентрацияси ортмайди, оцибатда эса pH деярли узгармай цолади.
Буфер системаларни 100 мартагача суюлтирищ уларнинг pH ига жуда кам таъсир кУрсатади, чунки иккала компонент концентрацияси бир меъёрда камаяди. Ю^о-рида келтирилган тенгламаларга к^ра с (кислота) ва с (асос) туз концентрацияси нисбати ^згармайди. Буфер -системаларнинг pH ини ушлаб туриш чекланган хусуси-ятдир ва у уларга ^ушилаётган кислота з^амда ишцор-нинг мицдорига боглиц б^лади.
г*
к- •
Буфер системанинг реакция муз^ити ^згаришира цар-. ши туриши буфер сигим билан у^лчанади. Буфер сирим Д литр буфер эритманинг pH ини бир.бирликка ^згар-,< тириш учун ^ушиладиган кучли кислота ёки кучли асос миллиграмм эквивалент массаси билан белгиланади. Буферни ташкил этувчи кислота (асос) ва туз концен-. трациясининг ортиши билан системанинг буфер сирими ортади. Шундай цилиб, буфер аралашма pH и фацат компонентлар нисбати ва кучсиз кислота ёки асоснинг диссоциация константасига (А'шсД буфф сирим эса компонентлар нисбати ва уларнинг концёнтрациясига борли^ булади.
Одам организмида оцсил буфери катта^золь ^йнайдй, у протеин (Pt) ва унинг кучли асос билан з^осил цилган тузидан ташкил топган:
Pt COOH + Pt COONa
К,онда гемоглобин, оксигемоглобин ва бикарбонат буфер,—H2CO34-NaHCO3 мавжуд.
Сийдикда ва овцат з^азм цилищ безлари суюцлигида фосфат буфернинг булиши NaH2PO4+Na2HPO4 катта а^амиятга эта.
Буфер системалар тирик организм нормал з^аёт фао-лияти учун зкуда зарур з^исобланади.
Масала ва уларни ечиш намуиалари
4- масала. Компонентлари бир хил нисбатларда олинган ва 0,1 моль/л сирка кислота ва 0,1 моль/л натрий ацетатдан ташкил топган ацетат буфер системанинг pH ини аницланг.
Берилган: ~ ‘
с (СН,СООН) =0,1 моль/л с (CHsCOONa) = 0,1 моль/л
. К (СН8СООН) = 1,8 10-»
, рН = ?
Ечиш намунаси. Геидерсон ва Гассель(5ах тенгламасига кура:
— с (к — та)
pH = pK-lg -с (туз)
' 0,1
р»=—lgl,8-10-» —1g ~ =[5 —Igl ,8 —Igl = 5—0,25 —0=4,75
- pH = 4,75 - lg — = 4,75 igl = 0
Жавоб: pH =4,75
2-масала. 9,0 мл 0,1 моль/л СН3СООН ва 1 мл 0,1 моль/л .CHjCPONa дан ташкил топган буфер сисЛманинг pH ини аншутанг. Эратмаиииг pH .и нечта бирликка узгаради?
. с (СН8СООН)=0,1 моль/л
Берилган:
с (CH8COONa) = 0,1 моль/л
V (СН3СООН) = 9,0 мл
V (CH3COONa) = 1,0 мл КСН3СООН= 1,8-10-°
pH = ?
£чиш намунаси
с (к — та) 0,1 • 9,0
pH = рК - 1g / = 4,75 - 1g =
с (туз) 0,1-1,0
= 4,75 — lg9 = 4,75 — 0,95 = 3,80. pH = 3,80.
Д pH = 4,75—3,80 = 0,95.
Жавоб: буфер система рНи компонентлар нисбати 9 марта ?з-•гартирилганда 0,5 бирликка j/згарди. Демак, pH компонентлар нйС-Латига богли^ экан.
3-масала. Компонентлари концентрацияси 0,1 моль/л булган .ацетат буферга 0,01 моль/л HCI ва NaOH эритмалари-^ушилгандан . сунгги pH ни аникланг.
Берилган: с (СНзСООН) =0,1 моль/л • _,
с (СН3 COONa)=0,l моль/л с (НС1) =0,01 моль/л с (NaOH) =0,01 моль/л
рН=? •
Ечиш намунаси. 1) HCI к;ушилгандан cJhf кислота концеитра-дияси 0,11 моль/л, тузники эса 0,09 моль/л булади:
0,11
pH = 4,75 — 1g = 4,66; Д pH = 4,75 — 4,66 = 0,09
2) NaOH цушилгандан сунг кислота концентрацияси 0,09 моль/л, -тузники эса — 0,11 моль/л булади:
0,09
pH = 4,75 —1g ^уу = 4,88; ДpH =4,75—4,88=—0,13
Жавоб: Буфер систёманинг pH и кислота ц^шилгандан с^нг 0,09 бирликка камаяди, ишцор цушилгандан с^нг эса 0,13 бирликка ортади.
4-масала. Компонентлар концентрацияси 0,5 моль/л булган аммиакли буфер система pH ини аникланг. С^нгра 1,0 мл шу эрит-мага 99,0 мл сув ц^шинг ва pH ини аникланг.
Берилган: с (NH4OH) =0,5 моль/л с (NH4CI) =0,5 моль/л V (Н2О)=99,0жл
рН=?
Ечиш намунаси. Сув билан суюлтирилгандан с^нг компонентлар .концентрацияси 0,005 моль/л га тенг булади.
0,005 '
pH = 14 - рОН = 14 - 4,75 + 1g уу^г - 9,25
Жавоб; рН=9,25.
Сув билан 100 марта суюлтирилганда буфер системанинг pH н
Нмрмайди, чунки компонентлар концентрациясининг камайиши бир' |ркл б?лади.
5-масала.. pH—4,0 булган буфер эритма ^осил цилиш учуж 1 литр 1,0 моль/л сирка кислота эритмасига неча грамм СН3 CQONa ц^шиш керак. Натрий ацетатнинг моляр концентрациясини ^исоб-«анг.
Берилган: pH=4,0
М (CHsCOONa) =82,0 г/моль
К (СН3СООН) = 1,86-Ю-5
с (СНзСООН) = 1,0 моль/л
с (CH3COONa)=? m (CH3COONa)=?
„ v- , с (СНзСООН)
Ечиш иамунаси pH — рК — 1g --------:--
с (CH3COONa)
рН=4,00 цийматни урнига цуямиз. Бундан:
, с (СН3СООН)
4Д) = рК — 1g TTFwmrwM’ = ?К~
= 4,75 — 4,00 = 0,75.
0,75 нинг антилога рифми 5,63 га тенг.
тенгламат'а мувофи^
too с (CH3COONa)
1
с (CHsCOONa)
= 5,63, с (CH3COONa) = — = 0,1740 моль!л 5,63
т (СНзСОО№)= с (CH3COONa)-A4 (CH3COONa) = = 0,1740 моль/л-82 г/моль — 14,57 г.
Жавоб: с (CH3COONa) = 1,1740 моль/л т (CH3COONa)= 14,57 г
z Масала буйича саволлар
1. Буфер системалар деб цандай системаларга айтилади? •
Жавоб: Буфер системалар деб, оз мицдорда кислота ва ишдор 1$шилганда ^амда суюлтирилганда водород ионлари концентрациясини доимий са^лаш хусусиятига эга булган эритмаларга айтилади.
2. Буфер аралашмалар таркибини келтиринг.
Жавоб: 1) Кучсиз кислота ва унинг тузидан ташкил топган;
2) кучсиз асос ва унинг тузидан ташкил топган;
3) куп асосли кислоталарнинг нордой тузларидан ташкил топ-Ган;
4) аминокислоталар ва оцсиллардан ташкил топган;
3. Буфер аралашма pH ини цандай ^исоблаш мумкин?
Жавоб: буфер система pH ини Гендерсон — Гассельбах тенгла-маси буйича ^исоблаш мумкин:
„ „ . с (к- та)
рН-Рк,.„-187^
с (асос) pH = 14 — рОНасос 1g - ~ с (туз)
4) Буфер сигим нима ва у нимага боглик?
Жавоб: буфер системанинг реакция му^ити ^згаришига ^арши-лик курсатиши буфер сигим билан ^лчанади, У 1 литр буфер эритма pH иНи бир бирликка узгартириш учун сарфлауадиган кучли кислота еки иццорнинг миллиграмм эквивалент масса бирлиги билан нфо-даланади. Буфер сигим компонентлар концентрациялари нисбатига 53
боглиц б^либ; концентрация цанча катта б^лса, сирим ^ам шунча катта булади.
5. Буфер системалар биологияда ^андай роль ^йнайди.у
Жавоб: улар тирик системаларда (организмларда) цон кислота-лилиги, хужайра таркиби ва ^оказоЛарни бопщаради, бу билан фермент вд гормонлар учун оптимал шароит яратилади.
Мавзунинг узлаштирилишини мустацил назорат ^илиш учун савол ' ва масалалар
1. Буфер системаларга таъриф беринг ва таркибини курсатинг.
2. Фосфат ва бикарбонат буферларнинг таъсир механизмини келтиринг.
3. Оцсил буфер компонентларини курсатинг.
4. Биологик сукиушклар — сийдик, ов^ат ^азм ^илиш безлари суюцлигида фосфат буфер таъсири амалга оширилади. Компонентлар нисбати бир хил булиб, 0,1 моль/л NaH2PO4 ва Na2HPO4 эрит-маларидан ташкил топган фосфат буфер pH ини аникланг.
Кн.РО4- = 6,8 IO'8
Жавоб: рН=7,17
5. К0НДа бикарбонат буфер концентрацияси ю^оридир. Компонентлар нисбати бир хил булиб, 0,1 моль/л Н2СО3 ва NaHCO3 дан ташкил топган буфер сув билан 100 марта суюлтирилганда; 0,01 • моль/л НС1 ёки NaOH цУшилганда pH циймати Узгарадими? с (Н2СО3)=4,5 10-’.
. Жавоб: компонентлар бир хил нисбатда булганда рН=6,3; НС1 Кушилгандан сУнг рН=;6,14; NaOH ^ушилгандан сУнг эса pH=6,48-100 марта суюлтирилганда эса pH Узгармайди.
6. Санитария-гигиена мацсадларида сувнинг умумий цаттицли-гини ани^лаш усули кенг тарцалган. Уни ОД моль/л ва 0,3 моль/л NH4OH ва NH4CI аралашмаларидан ташкил топган аммиакли буфер иштирокида олиб борилади. Юцорида келтириЛган аралашмаларнинг цайсй бирининг буфер сирими катта? х
1-лаборатория иши
БУФЕР ЭРИТМАЛАР ТАЙЕРЛАШ ВА УЛАРНИНГ ХОССАЛАРИНИ ТЕКШИРИШ
1-тажриба. Буфер эритма тайёрлаш. Тажриба учун 0,1 моль]л СН3СООН ва СН3 COONa эритмала-ридан фойдаланилади.
Еттита бир хил пробиркага жадвалда к^реатилган ^ажмларда сирка кислота ва унинг тузи эритмаларидан Куйинг, тажриба натижаларини ёзинг.
Хар бир пробиркага 3 томчидан метил заргалдок индикаторидан солинг, аралаштиринг ва жадвалда буфер аралашмалар рангини курсатинг. Аралашма pH йни Кисобланг.
2- т а ж р и б а. Буфер эритма pH ига суюлтиришнинг таъсири.
Пробиркада 5,0 мл сирка кислота ва худди шундай ^ажмдаги унинг тузидан ташкил топган буфер аралашма тайёрланг. 2,0 мл шу аралашмадан олиб бош^а про-
^®%Йробврка тар Г ЩМчг» Буфер аралашма таркиби, мл Аралашма нинг pH ини хисоб-лаиг Индикатор К?-шилгандан кейинги ранги
CH.COOH CHjCOONa
1 2 • S 9,0 7,0 5,0 3,0 1,0 1,0 3,0 5,0 7,0 9,0
е- 6 0,5 9,5
1 ?' . 7 0,2 9,8 к
*>
биркага солинг ва 6,0 мл сув цушиб суюлтиринг. ХаР бир пробиркага 2 томчидан метил цизили индикаторидан * к^шинг. Эритма дайси рангга буялади? Суюлтиришнинг буфер эритма pH ига таъсири ^а^ида хулоса чицаринг.
3- т а ж р и б а. Буфер эритма pH ига кислота ва. иш-Корнинг таъсири. Учта пробиркада 5,0 мл СН3СООН ва 5,0 мл GH3COONa дан ташкил топган буфер эритма тайёрланг. Биринчи пробиркага 5 томчи (0,1 моль/л) НС1, иккинчисига 5 томчи (0,1 моль/л) NaOH эритмаси, учйнчисига 5 томчи дистилланган, сув цуйинг, сунгра ^ар бирига 2 томчидан метил ^изили индикато-j ридан томизинг. Эритмалар рангини.' белгиланг. Оз г мицдордаги кислота ва йшкорнинг буфер эритма pH ига таъсири т^грисида хулоса чи^аринг.
2-лаборатория иши
КОН ЗАРДОБИ БУФЕР СйГИМИНИ АНИКЛАШ
Ишнинг бориши: стаканга 10,0 мл цон зардобидаи ^лчаб солинг ва шиша электрод ортали pH метрда унинг pH ини аницланг (pH). Пипетка билан 3,0 мл хлорид кислотанинг с (НС1) =0,0250 моль/л эритмасидан ^лчаб стаканга солинг. Кон зардббининг НС1 к^шилгандан кейинги pH ини ^исобланг (рН^.Натижаларни жадвал-га киритинг ва кон зардоби буфер сигимини куйидаги формула орда ли ^исобланг:
о V (НС1)-с (НС1)
Р V (буф)-(рН1-рН0)
Тартиб № V (цон зардоби) V(HC1) РНО * pHi f (кон зардоби)
II БОБ
ТИТРИМЕТРИК АНАЛИЗГА КИРИШ
Мавзунинг ма^сади: Тиббий амалиётда биологик „объектларни ва доривор моддаларни текщириш ^амда атроф-му^итни санитария нуцтаи назаридан ба^олаш учун ишлатиладиган титриметрик анализ усули асослари билан танишиш.
Урганилаётган мавзунинг а^амияти. Титриметрик анализ усули — доривор ва фармакологии препаратлар,. биологик объектлар мицдорий таркибини ани^лаш учун тиббий-биологик текширувларда кенг цулланилади.
Бошлангич' билим даражаси
1. Кислота, асос, тузларнйнг электролитик диссоциация назарияси асослари.
2. Кимёвий реакция турлари (молекуляр ва ио,нли кУринишда). ,
3. Эритмалар концентрациясинн ифодалаш усуллари.
Мустацил тайёрланиш учун укув материаллари:
1. В. Н. Алексеев. Мицдорий анализ. М., 1972, 193-бет.
2. А. А. Селезнев. Аналитическая химия. М. 1973, 164-бет.
3. И. К. Ц и т о в и ч. Курс аналитической химии. М., 1985. 212-бет. *
МАЪЛУМОТЛАР БЛОКИ
ТИТРИМЕТРИК АНАЛИЗ .
Бу анализ усули — ани^ланаётган модда билан. кимёвий реакцияга киришадиган титрланган эритма з$аж.-мини анш$ белгилашга асосланган. Титриметрик анализ-да титрланган эритмалар ишлатилади. Асосий операция — титрлаш, бунда сарф булган реагент ^ажми аник-ланаётган модда мицдорига эквивалент булади. Титрлаш жараёнида реакция тугаш нуцтасини аниклаш ло-зим — бу эквивалентлик нуктаси булади.
Бу усулда стандарт ва стандартланган эритмалар ишлатилади. Эритма ^ажмини аниц белгилаш учун бюретка, пипетка ва улчов колбалари каби Улчов идиш-лари ишлатилади.
Титриметрик анализ ^исоботи негйзида эквивалент-
fl
иф'
Ир Зонуни ётади: эквивалент моляр концентрацияси Ер хил булган эритмалар бир-бири билан тенг зажм-гарда реакцияга киришади. Турли эквивалентли моляр |онцентрацияли эритмалар реакцияга киришаётганда |ЯЙрнинг зажми концентрациясига тескари пропорци-Еал б^лади:
у. с(т*
Иккала реакцияга : киришувчи модда уфн эквива-лент моляр концентрациясининг зажмга купайтмаси _ доимийдир. Эквивалентлар зонунига асосланиб турли миздорий зисоблашлар олиб борйш мумкин. Масалан: эритма концентрациясини билган золда, унда эриган ‘модда массасини анизлащ мумкин:
fl Av /1 \ т/
с -•*! -Vi == с -•xs -У2
\ г ) \ z ]
Маълумки,
(- хЛ^
\ г /
Шундай цилиб, бу зийматни эквивалентлар зрнуни математик ифодасига зуйиб /n(Xt) ни зисоблаш мумкин:
\0 /
Титриметрик анализда зисоблашларни жуда юзори даражаДа анизлаш билан олиб бориш керак.
Эритмалар зажми миллиметрнинг юздан бир улу-шигача анизликда ^лчанади; масалан: V(HC1) = = 10,27 мл ёки У(NaOH) =22,82 лл. Эритма концентрацияси эса, туртта анизликдаги разам билан ^лчанади, масалан:
c(HCl) =0,1025 моль/л c (HCI) =0,09328 моль/л Т (НС1) =0,003729 г!мл Г(КОН) =0,003730 г/мл
Мавзу узлаштирилишини текшириш учун саволлар
1. Титриметрик анализда ишлатиладиган реакциялар цандай та-лабларга жавоб бериши керак?
2. Нима учун бюретка ва пипеткаларни ишлатишдан олдин ?ша ишлатиладиган эритма билан чайилади? Титрлаш колбасида хам шундай цилиш мумкинми?
3. Бюретка пипеткаси учида долган томчини нима цилиш керак?
4. Титрлашда экспериментатор бюретка буйича реагент эритма-сини титрлаш учун сарф булган эритманинг дуйидаги дажмларини белгиланг: 15, 27 мл, 18, 17 мл ва 12, 89 мл. Бу натижалар бир-би-рига ядинми? УларДан хисоблаш олиб бориш учун Урта арифметик диймат чидариш мумкинми? ..
5. Эквивалент моляр, концентрацияси ва эритма титри дандай бирликларда Улчанади?
6. К,уйида келтирилган хлорид кислота титрининг да йен дийма-ти титриметрик анализ дийматига жавоб' беради: 0,003 г/мл; 0,003715 г!мл\ 0,00371578 г!мл, 0,0037 г/мл.
Лаборатория иши
ТИТРИМЕТРИК АНАЛИЗДА ИШЛАТИЛАДИГАН ЛАБОРАТОРИЯ УЛЧОВ ИДИШЛАРИДА ИШЛАШ ТЕХНИКАСИ {СУВДА)
Титриметрик анализда эритма хажмини аниц белгилаш учун ишлатиладиган улчов идишлари: бюреткалар, пипеткалар ва улчов колбалари, Сув билан утказилади-ган тажрибада улардан ту₽ри фойдаланишни Урганиш лозим, чунки титриметрик усул билан анализ олиб бо-ришда асосий хатолик эритмалар ^ажмини нотурри белгилаш оцибатида келиб чицади.
КИС ЛОТА-АСОС Л И ИНДИКАТОРЛАР
Мавзунинг ма^сади: индикатор рангининг узгариш механизмини билиш ва титрлашнииг кислота-асос усу-лида биологик суюцликлар хамДа доривор препарат-ларни текширишда индикаторни тугри танлай олишни Урганиш.
Урганилаётган мавзунинг ахдмияти. Кислота-асосли индикаторлар рангининг узгариш назариясини бцдиш улардан бирини титрлаш учун айнан танлаш имконини беради, чунки биологик объектлар ва препаратлар ана-
Б8
Ийи натижаларининг аницлиги индикаторни т^рри тан-О билишга боглиц.
Бошланрич. даража
ж 1; Нейтралланиш реакциялари.
2. Нейтралланиш реакцияси турлари.
3. Массанинг таъсир цонуни;
4. Кимёвий, мувозанат.
*'• 5. Тузларнинг гидролизи.
6. pH-водород курсаткичи. *
Муста^нл тайёрланиш учун $кув материаллари
1. В. Н. Алексеев. Количественний анализ. 5Ц 1972, 238-бет.
2. К. А. Селезнев. «Аналитическая химия». М., 1973. С. 173- бет.
3. И. К. Цитович. Курс аналитической химии, М. 1985.
288-бет.
4. А. В, Б а б к о в, Г. Н. Горшкова, А. М. Кононов. Практикум по общей химии с элементами количественного анализа. М. 1978. 98- бет.
МАЪЛУМОТЛАР БЛОКИ
КИСЛОТА-АСОСЛИ ИНДИКАТОРЛАР
Ион назарияеига кура, кислота-асосли йндикаторлар кучсиз органик кислота ёки асослар булиб, уларнинг молекуласи ранги ион рангидан кескин-^арц цилади. Индикатор кучсиз электролит сифатида диссоциялэ-нади:
Hind ^Н++Ind" . (1>
Сувда эритилганда унинг икки шакли орасида мувозанат булади. Кислота ёки ишцор 1\ушилиши мувозанат-ни силжитади ва эритма индикаторни тегишли рангга буяйди. Унинг электролитик диссоциация константаси-ни ифодалаш учун цуйидаги ифода тугри булади:
„ _ с(Н+)-с(1™Г)
Лн1п“_ с (Hind) W
KHInd — индикаторнинг э^тимоллик ионлашиш константаси-дир.
(2) тенгламани узгартирамиз:
с (Hind) _ с (Н+)
с (Ind~) KHInj •
ва уни с (Н+) га нисбатан ечамиз:
С (Н+) = П..£1!М , ' 7 HInd c (Ind-)
бундан
' , келиб чидади
pH = рК - lg
c (Ind )
c (Hind) — индикаторнинг кислотали му^итдаги шакли; у ск таш билан ифодаланади;
с (Ind) — индикаторнинг ишцорий му^итдаги шакли, У сишк.ш. билан ифодаланади.
Шундай цилиб,
pH = pK-lg (3)
сишц ш.
рК = — 1g К — индикатор курсаткичи, (3) — тенглама индикатор ранги ва эритма рНи орасидаги богланишни курса-тади. AHInd ^анчалик кичик булса, у ^ушилаётган кислота ва асос та ъсирида шунчалик юдори pH да уд^рангини уз-гартиради. Агар ск _ та = сншч ш булса, унда та/свшк ш= 1 булади. Бунда pH-рК, яъни индикатор курсаткичи рНкат-талигини курсатадики, унда индикаторнинг 50% и—молекула шаклида, 50 % и—ион шаклида булади. Кислота ёки ишцор цушиш билан ск.та ш сишп ш нисбатини узгартириш улар орасидаги мувозанатнинг узгаришига олиб келади, бу эса ранг узгаришига сабаб булади. Одам кузининг ранг сезиш цоби-лияти чегараланган булиб, агар индикатор шакллари концентрацияси бир-биридан 10 марта фарц цилса, уларцинг бирини сезмайди. Шунинг учун индикатор ранги pH ни ^ар . ^андай узгаришида эмас, балки унинг маълум диймати ора-сида узгарадй. Бу нарса индикаторнинг ранг узгариши ора-лиги дейилади. У одатда рК га нисбатан ё у, ё бутомонга бир бирлик силжийди, яъни pH = рК ± I. Берилган индикатор билан титрлашнинг тугалланишидаги pH циймати титр-лаш курсаткичи дейилади ва рТ билан ифодаланади. Титр-лаш курсаткичи индикаторнинг бир шаклдан иккинчисига утишида ранг узгариши pH цийматининг ярим йигиндиси тари^асида ^исобланади.
Масалан: рТм 0 = (3,1 + 4,4)/2 = 3,75.
рТф.ф = (8+Ю)/2 = 9
щеал ^олатда титрлаш pH-рТ бул ганда тугайди.
шакллари бир хил булган pH
с к-та ш. с ишх ш.
Ир- Ургатувчи масалалар ва уларни ечиш намуналари
1-мисол. Ализарин саригининг ионлашиш константаси 10—11 га тенг. Индикаторнинг ранг Узгариш оралиги ва кУрсаткичини хисоб-№ -ланг. Унинг кислотали шакли сариц, ишЦорийси кук рангда.
К Берилган:
। 10~U
Е рК=? рН=?
Ечиш намунаси: 1. Ализарин сариги кучсиз кислота булиб, кис-лотали индикаторларга мансубдир. Унинг молекуласи диссоциация-* сини хуйидагича ифодалаш мумкин: i
/ Hind ч* Н+ -f- Ind” • '
Ионлашиш константасининг ифодаси:
с (Н+).-с (Ind~)
Лк с (Hind)
2. Индикаторнинг ионлашиш'константасини билган холда, индикатор pH кУрсаткичини дисоблаймиз: рК=—IgK рК=— lg lfl-n = ll
3. Йонлашган ва ионлашмаган Хийматинитопамиз.
pH = рК - 1g
ск- та ш. — с ИШ|) ш’ бунда Рн’ РК-Шундай хилиб, титрлаш курсаткичи
^рН — рКрН= — lg!0~ч= 11, яъни рТ я= 11 pH нинг бу хийматида эритма ранги сариц ва кУк уртасида булади.
‘4. К,андайдир кислота хУшиш натижасида pH камайиши индикаторнинг иккала шакли орасидаги мувозанат ск. таш. ортиши томон сил-жийди ва сарих ранг досил булиши ортади. ск-та ш/сищц ш. 93/9 = 10 га тенг булганда куз кук рангни сезмай холаДи ва эритма сарих булиб куринади. Бу ранг pH = рК — 1g (94/5) = рК — 1g 10 — 11 — 1 = 10. булганда ранг узгаришига олиб келмайди.
5. Ишхор хУшилишида худди шундай узгаришлар кузатилади. Бунда икки шакл орасидаги мувозанат сишкла ортиши васк.та ш камайиши томон силжийди. Нисбатлар ск. та ш/сит15 булганда кУк
ранг яххол кузатилади. Бу рН=рК — —-—а= рК — lgO,l = U+ • . сишк: ш
+ 1 = 12 булганда кузатилади. Кейинчалик ишхор хУшиш эритма ран-гини Узгартирмайди.
6. Шундай хилиб, ализарин саригининг ранг узгартириш оралиги рН=рК±1 га тенг.
Жавоб: рН=11±1; яъни рН=10—12 да индикаторнинг ранг Узгариши кузатилади.
2-мисол. Фенолфталеин иштирокида рангсиз, фенол хизали КУ" шилганда эса хизил рангга кирадиган эритма pH ининг тахминий Хийматини курсатинг. *
Ечиш намунаси: 1. Фенолфталеиннинг Утиш оралиги pH 8,0— 10,0, бунда у рангсиздан тУх хизилга Узгаради.
2. Фенол хизилйнинг утиш оралиги pH 6,8—8,4, бунда ранг са-рихдан хизилга узгаради.
3. Текширилувчи эритма фенолфталеин иштирокида рангсиз, фенол дизилй иштирокида эса дизил рангли бУлгани учун водород кУрсаткичининг тахминий диймати pH=8,0—8,4 булади.
Масала буйича саволлар ~
1. 1^айси йндикаторлар кислота-асосли индикаторларга мисол булади?
Жавоб: Эритма pH и узгаришига дараб рангини Узгартирадиган йндикаторлар кислота-асосли йндикаторлар дейилади. '
2. Кислота-асосли йндикаторлар нима?
Жавоб: Ион назариясига кура йндикаторлар кучсиз органик кислота ёки асос булиб, уларнинг ионлашмаган молекулалари ва ионлари дар хил рангда булади.
3. Кайси йндикаторлар бир рангли, дайсиниси икки рангли ин-дикаторлар дейилади?
Жавоб: Иккала 'шакли буялган йндикаторлар—икки рангли, фадат бир шакли буялгани эса бир рангли йндикаторлар дейилади. Масалан, фенолфталеин — бир рангли, фенол дизили — икки рангли индикаторлардир. •
4. Индикаторнинг ранг Утиш оралиги нима?
Жавоб: Бу эритма pH оралиги диймати булиб, унда индикаторнинг ранги бир шаклдан бошдасига Утади. Индикатор рангининг Узгариши pH нинг дар дандай Узгариищда содир бУлмайди, балки кУз сеза оладиган pH нинг маълум дийматлари орасида булади. Бу нарса индикаторнинг утиш оралиги дейилади. Фенолфталёинда Утиш оралиги pH 8,2—10,0, фенол дизилида эса pH 6,8—8,4 булади.
5. Индикатор курсаткичи нима?
Жавоб: Индикатор кУрсаткичи рК=рТ, унда К — индикаторнинг эдтимоллик ионлашиш константасидир.
6. Индикатор ранги ва эритма рНи орасидаги боглидликни кУр-сатинг.
Жавоб: pH = рК — 1g v сишк.ш
Мавзуни мустадил узлаштирилишини текшириш учун савол ва масалалар
1. Ионлашиш константаси 1,6-10—7 бУлган бромтимол кУки (кислотали индикатор) индикаторининг утиш оралиги ва кУрсаткичини дисобланг.
Жавоб: рК=6,8, Утиш Оралиги pH—6,8—7,8.
2. Агар эритма п — нитрофенол душилганда рангсиз, бром крезол кукидан хУшнлганда эса кУк рангга кирса п-нитрофенолнинг Утиш оралиги pH 5,6—7,6 бУлиб, ранг узгариши рангсиздан саридда-ча, бромтимол кукининг Утиш оралиги pH 3,8—5,4 булиб, сариддан кукка узгаради, мана шу холатлардаги биологик суюдликнинг тахминий pH ини анидланг.
Жавоб: pH=5,0—6,0.
3. Ион назариясига кура, ишдорий индикаторларга тааллудли булган метил дизили индикаторининг таъсирини тушунтиринг.
Кислота-асосли титрлаш усули
Мавзунинг мацсади: кислота-асос реакцияларининг бориш ^онунларинй билган ^олда биологик объект ва
ShboP препаратларда кислота ва асослар мицдорини Клашни Урганиш.
Урганилаётган мавзунинг а^амияти. Кислота-асосли элаш усули тиббий-биологик текширувларда клиник лизлар Утказиш, озик-овкат ма^сулотлари ва сувнинг итария-гигиена ^олатинитекшириш, дори шакллари трепаратларини анализ килишда кулланади. Бу усул ан эритмаларда кислоталар, иш^орлар ва гидролиз-аётган тузлар микдбрнни ани^лаш мумкин. М.аса-, бу усул билан меъда шираси,, сийдик'ва бош^а логик сую^ликлар кислоталилиги 'фкширилади. Г Доривор препаратлар сифатида ишлатиладиган хлорид, L сульфат, борат ва купчилик органик кислота эритма-лари микдорий анализ килинадн. .Санитария-гигиеник _ ? жи^атдан текширилганда озу^а ма^сулотларининг кис- ' у лоталилиги, сувнинг цзттицлиги ва бош^алар ани^ла-? надй. •
к; Бошлангич даража
; 1. Нейтралланиш реакцияси.
2. pH нинг водород курсаткичи.
i 3. Тузларнинг гидролиз реакцияси. '
Г 4. Кислота-асосли титрлаш усулининг индикатор на-
; зарияси. , -
5. Эритма таркибини ифодалаш усуллари.
6. Титрланган эритмаларни тайёрлаш.
Мустачил тайёрланиш учуй ?ЧУв матерйаллари
1. В. Н. Алексеев. Количественный анализ. М., 1972, 294-бет.
2. К. А. Селезнев. Аналитическая химия. М. 1973. 183-бет.
3. И. К. Цитович. Курс аналитической химик. М., 1985. 243, 249- бетлар.
4. А. В. Б а б к о в, Г. А. Гор ш ков а, А. М. Коно нов. Практикум на общей химии с элементами количественного анализа. М. 1978. 109, 116-бетлар.
МАЪЛУМОТЛАР БЛОКИ
КИСЛОТА-АСОСЛИ ТИТРЛАШ УСУЛЛАРИ
Кислота-асосли титрлаш усули негизида ма^сулоти-нинг бйри.сув булган нейтралланиш реакцияси ётади.
н++он-->н2о ♦'
Бу усулда цандайдир кучли кислотанинг титрланган эритмасидан фойдаланиб, ишцор мицдорини аниклаш (ацидиметрия) ёки титрланган ишцор эритмасидан фой-
даланиб кислота мицдорини аницлаш (алкалиметрия) мумкин. Эквивалентлик нуцтаси pH нинг маълум цийма-тида ётади ва узаро таъсирлашаётган кислота ва асос кучига боглиц булади.
Кйслота-асосли титрлашда Н+ ионларининг концен-трациясй, шунингдек эритма pH ининг узлуксиз узга-ришй руй беради. ^ушилган кислота (асос) эритмаси ^ажмига цараб, эритма pH узгаришининг график тас-вири титрлаш эгри чизиги/дейилади.
Титрлаш эгри чизигида pH- нинг кескин узгариши титрлаш сакраши дейилади. Титрлаш сакрашининг ур-таси эквивалент ну^та булади. Титрлаш эгрилигини бил-ган ^6лдД, унга мос индикатор танланади. КаР бир титрлашга фа^ат титрлаш курсаткичи эгриликдаги сакраш pH чегарасига (оралигига) кирадиган индика-торлар яроцлидир. Курилаётган >;олат учун утиш ора-лири pH 8,0—10,0 булган фенолфталеин ва утиш оралиги pH 3,1_4,4 булган метил заргалдоц ^амда ранг утиш орали^лари шу pH диймати ичида буладиган индика-торлар яроцлидир. -
Кучли кислотани кучли асос билан титрлашда кел-тирилган эгриликдан куринадики, сакраш pH 4—10 ора-лирида ётади. Кучсиз кислотани кучли асос билан титрлашда у pH 7,4—10 оралигида булади.
Кучсиз асосни кучли кислота билан титрлашда сакраш pH 6,2—4,0 оралигида булади. •
Эквивалент нуцта ^амма ^олатларда ^ам титрлаш сакраши Уртасида булади.
Титрлаш сакрашини аницлаш кислота ва асос миц-
г \
дорини ашщлашда индикатор танлаш учун зарур. Кйс-лота-асосли титрлашда кучли кислота ва асос эрйтма-
; лари йшчи эритма ^йсобланади. Купинча хлорид кис-, лота эритмаси ишлатилади, натрий тетраборатнинг стандартланган эритмасига кура стандартланадй. Бу туз-нинг сувли эритмаси гидролизланиши о^ибатида ишдо-рий реакция юз беради.
Na2B4O7 + Н2О 2NaOH 4- 4Н3ВО3 шунинг учун уни кислота билан тнтрласа булади:
NaOH + НС1 = NaCl 4- Н2О ‘'
Умумий тенгламадан:
Na2B4O; + 2НС1 + 5НаО == 2NaCl + 4Н3ВО3 курини’б турибдики, реакция натижасида кучсиз ортоборат кислота тупланади, унинг эритмаси pH—4,6. Де- ' мак, эквивалецтлик нудТасини метилоранж индикаторй ранг узгаришига цараб\бёлгиласак булади, чунки унинг ^тиш оралиги pH 3,0—4,4 да ётади. Стандартланган хлорид кислота эритмаси доривор препаратлар, асослар, гидролизланганда ишцор ^осил цилувчи тузлар ва бош-цаларни анализ цилишда ишлатилади.
Ацидометрик титрлаш
Стандартланган хлорид кислота эритмасини асослар/ ва гидролизланадиган тузлар миддорий анализа учун ишлатса булади. Мисол тари^асида NH3hh сувли эрит-маларда ани^лашни куриб чицамиз. Хлорид кислотанинг NH3 (сувли эритмада) билан узаро таъсири цуйидаги реакция тенгламаси буйича боради:
NH3 4-НС1 = NH4C1
7ЭКВ (NH3)=1, (НС1)=1.
Эквивалентлик ну^таси таъсирлашаётган моддалар 1 мицдори эквивалент булганда ^а)юр топади, яъни
п (NH,) = п (НС1)
L Бу катталикларни хуйидагича ифодалаш мумкин:
| . п (NH,) = п (НС1) = с (НС1).У (э-ма)
m(NH3) — NH3 массаси (вазни), г.
& М (NH3) —NH3 нинг моляр массаси, г/моль
Wtc(HCI) —НС1 нинг моляр концен^ацияси, моль/л. •<эритма)-НС1 эритмасининг ^ажми, мл.
ШШундай дилиб:
|»7534 65
= с (НО) • V (эритма)
М (NH3)
Бу ифоДадан куринадики, аммиак массаси
м (NHj) = с (HCl)-V (э-ма)-М (NH3) га тенг. Берилган тенгликни узгартирамиз:.
=с (НО)-М (NHJ
V (э-ма)
ва уни 1 мл га нисбатан ёзамиз:
с (HCl)-M (NH,)
1000
<NH»L ифодаси 1 мл НО неча грамм NH3 билан реакцияга киришишини, яъни хлорид кислота эритмасини амми-акка нисбатан титрини курсатади. Бу эритманинг ани^лана-ётган моддага нисбатан титри дейилади ва Т (HC1/NHS) билан ифодаланади. Демак, Т (HCl/NHj) = с "N^ , г/мл. с(НС1)—хлорид кислота эритмасини моляр концентрацияси, моль/л берилган ифода учун аниц катталик. M (NHs)—NH3 нинг моляр массаси, у 17 г/моль га тенг.
Бу маълум катталикларни j/ринларига дуйиб Т (HCI/NH3 ни) ^исоблаш мумкин, у хам доимий циймат-га эга булади. Агар цандайдир объектдан аммиакни ани^лашда унинг эритмасини титрлаш учун V(HC1) сарфланса, унда титрланаётган эритмадаги аммиак массаси: m(NH3) =T(HC1/NH3) • У(НС1) булади.
Иккита индикатор билан титрлаш
Ишцорлар мицдорини ани^лашда улар ^аводан карбонат ангидрид ва сувни ютиши натиждсида аралашма булиб цолади.
2NaOH + СО2 -> Na2CO3 + Н2О
Шунинг учун ишцорни анализ цилинганда таркибидаги NaOH ва Na2CO3 ни ани^лаш лозим булади.
Кислоталар миддорини титрлашнйнг кислота-асос усули билан анидлаш мумкин, уларнинг баъзилари до-'ривор препаратлардир. Кислота-асосли титрлашнинг бу усули алкалиметрия дейилади ва уни.амалга ошириш учун КОН ёки NaOH каби ипщорларнинг стйндартлан-ган эритмалари талаб цилинади. Завода NaOH сув ва СО2 ни жуда тез ютади:
2N аОН + С a24=tN О2СОз+Н2О
ygf/ Шундай цилиб, ишцор эритмалари албатта ^шимча сифатида карбонатлар са^лайди, бу эритмаларни кис-.,'лота мицдорини ани^лашга ишлатишдан аввал карбо-йатлардан тозалаш лозим.
• Иш^ор эритмаси стандартизациясинн масалан хлорид кислотанинг титрланган эритмаси ёрдамида олиб -борилади, бунда NaOH ва цушимча . Na2CO3 мицдори аницланади.
NaOH + HCl = NaCl + H2O ‘
Буни фенолфталеин ва метил заргалдо^ «.(оранжевый) нндикатори ишлатиб амалга ошириш мумкин.
Эритмадаги ^амма NaOH ва Na2Cu3 NaHCO3 ,ва NaCl га айланганда биринчи индикаторни фенолфталеин билан титрлаш тугалланади:
NaOH . . NaCl + Н.О
; +2НС1^—
NaaCO3 NaHCO3 + NaCl
демак, иш^орнинг ^аммаси ва натрий карбонатнинг яр-ми титрланади. Метил заргалдоц иштирокида эса нор-дон туз СО2 ва Н2О гача титрланади.
ЫаЦСО3 +.НС1 — - NaCl + СОг + Н2О
Берилган эритмани фенолфталеин индикатори иштирокида эритма рангсизлангунча титрланганда сарф булган НС1 ^ажми Vi ^олда белгиланади. Бу эритмадаги NaOH нинг ^аммаси ва Na2CO3 нинг ярйми учун сарф булган кислота ^ажми. Сунгра эритмага метйлзаргал-до^ цушиб титрлаш давом эттирилади. Сарф булган кислота У2 ^олда белгиланади. Бу Na2Co3 нинг ярмисини титрлаш учун сарф булган НС1 нинг ^ажми. На2СО3 нинг ^аммасини титрлаш учун сарф булган НС1 ^ажмй V3®V2’2 га тенг булаДи.
NaOH ни титрлаш учун сарф булган НС1 ^ажми V4=Vi— V2 га тенг булади., НС1 эритмасининг моляр эквивалент концентрацияси ва текширилаётган ишцор эритмасининг бошлангич ^аж-мини билган ^олда, NaOH ва Na2CO3 нинг концентрациясини ^исоблаш мумкин.
с (NaOH) с-.та.-У< №) I/ (эр-ма)
ундан С(НС1) — НС1 эритмасининг моляр концентрацияси.
с
1 NaaCO3U SiHCWHCO
2 3/ V (эр- ма)
ундан с ( -g- Na2CO3) — NaaCO3 нинг моляр эквивалент кон.
центранияси.
Ургатувчи масалалар ва уларни ечиш намуналари
1- мисол. Аммоний Гидроксидни -хлорид кислота билан титрлаш эгрилиги йулини тушунтиринг, берилган титрлаш реакцияси учун индикатор танланг.
Ечиш намунаси. 1. Айтайлик аммиакнинг сувли эритмасинц хлорид кислота билан титрлаяпмиз;
NH4OH + НС1 ч=е NH4CI + Н2О реакцияси натижасида NH4C1 тузи ^осил булади, бу эса эквивалент нуктадаги pH га таъсир этади.
2. NH4CI гидролизи натижасида эритмада кислотали му^ит х°-сил булади ва эквивалент нуцта pH <7 да жойлашади.
3. Кучсиз а сосни кучли кислота билан титрлаш эгрилигида сак-раш чегараси рН=4 дан pH 6,2 оралигида жойлашади. \
4. Шундай килиб, бундай титрлаш учун метил заргалдок (утиш оралиги pH 3,1—4,4) ва метил цизили (рН=4,4—6,2) каби индикаторлар я роцли.
Масала буйича саволлар
1. Титрлаш эгрилиги нимани ифодалайди?
Жавоб: кислота-асосли титрлаш усулидаги титрлаш эгрилиги титрлашда эритма pH курсаткичи узгаришининг график тасвиридир.
2. Титрлаш эгри чизигини ^йсоблаш ва кУриб чицишдан мацсад нима?
Жавоб: Анализ килишда индикаторни тугри танлаб олиш учун.
3. Титрлаш сакраши нима?
Жавоб: Ишчи эритманинг бир томчисида эквивалентлик нуцтаси я^инидй эритма pH инйнГ тез узгариб кетишй. '
4. Титрлаш сакрашида эквивалент нудтасй каерга жойлашган?
Жавоб: Титрлаш сакрашининг бошлангич ва охирги pH циймат-лари йигиндисининг ярми эквивалент ну^танинг pH ^ийматига тУг-ри келади.
Масалан: хлорид кислотани кучли инщор билан титрлашда титрлаш сакраши бошланиши рН-4, охири pH-Ю да, рТ-(4+10)/2-7.
5. Кандай ^олатларда титрлаш эгрилигидаги эквивалентлик нуцтаси нейтраллик ну^таси билан мое келади; кандай ^олатларда нейтраллик чизигидан цуйида ва юцорида жойлашади?
Жавоб: Кучли кислотани иш^ор билан титрлашда эквивалентлик нуцтаси нейтраллик нуктаси билан мос келади, кучсиз кислотани ишцор билан титрлашда эквивалентлик нуцтаси нейтраллик нудта-сидан ю^орида жойлашади (яъни рН>7); кучсиз асосни кучли кислота билан титрлашда эквивалентлик нуктаси нейтраллик нуцтаси-дан пастда жойлашади (яъни рН<7).
6. Титрлаш кУрсаткичи нима?
Жавоб: Бу pH циймати булиб, унда индикаторнинг 50% и молекула, 50% и ион шаклида бУлади.
7. Индикатор танлаш доидасини асослаб беринг.
Ж»об: Берилган з(ар бир титрлаш учун фацат титрлаи? кур-саткичи титрлаш сакраши оралигида ётадиган йндикаторлар ишла-Тиш мумкин.
2-мисол, Агар 20,00 мл хлорид кислота эритмасини титрлаш ’>У« 18,27 мл с v/a Na2B4O7) натрий тетраборат эритмаси сарфлан-унда хлорид кислота эритмаси эквивалентининг моляр концен-""^трацияси ва тит'рини ^исобланг. -
. , Берилган: V (Na2B4O7) = 20,00 мл
с (1/2 Na2B4O7) = 0,09528 моль/л
V (НС1) = 18,27 мл „
М (НС1) = 36,5 г/л<ол&.___________
с (НС1) = ? Т (НС1) =?
Ечиш намунаси: -
" Реакциянинг бориш тенгламаси:
Na2B4O7 + 2НС1 + 5Н2О = 2NaCl + 4НаВО3 /экв (HCI) = 1; fSKB (Na2B4O7) = 1/2
1. Эквивалентлар донунига кура HCI эритмаси концентрация-синн топамиз:
V (Na2B4O7)-c (1/2 Na2B4O7) = V (HCl)-c (HCI) •
/urn V (Na2B4O7)-c (1/2 Na2B4O7)
. 1 c(HCI)== ’ nii) ~~
‘ 20,00-0,09528 мл-моль/л ' .
с (HCI) =--------------- ---------= 0,1043 моль/л
18,27 мл-л
2. Эритма титрини с (НС1) дийматнга к$ра топамиз:
- с (HCl)-M (НС1) 0,1043-36,5 ,
(НС ) = -----—---------- = —----------— = 0,003870 г/мл
1000 1000
Жавоб: с (НС1) =0,1043 моль/л Т (НС1)=0,003870 г/мл '
3- масала. Хлорид кислота эритмасини цуйидаги реакцияга кУра кислота-асосли -титрлаш учун зарур булган 500,0 мл 0,1 моль/л ли эритма тайёрлаш учун Na2B4O7-ЮН2О дан цанча кераклигини ^и-собланг:
Na2B4O’+ 2НС1 + 5Н2О = 4H3BOS + 2NaCl
Берилган: V (эритма) = 500,00 мл с (i/2 Na2B4O7) = 0,l моль/л М (Na2B4O7) = 381,4 г/мол ь m (Na2B4O7) = ?
Ечиш намунаси:
1. Борадиган реакция тенгламаси:
[Na2B4O7 + 2НС1 4-5Н2О = 4Н3Й03 + 2NaCl
Тенгламадан f экв (Na2B4O7) = 1/2, f экв (НО) = 1 лиги кУри-нади. Бундан Na'2B4O7-10Н2О эквивалентининг моляр массаси
М (1/2 NajB4O7- ЮН2О) = f3KB (Na2B4O7- Ю.Н20)-Л1 (Na2B4O7- ЮН2О) ra тенг. M (1/2 Na2B4O7- 10H2O) = (l/2)-381,4 г/моль — 190,7 г!моль.
2. 0,5 л Na2B4O7-ЮН2О эритмасидаги моллар сонини- топамиз: h (Na2B4O7- 10Н2О) = с (* l/2 Na2B4O7-ЮН2О)-V (эритма) (
„ моль-л
n (Na2B4O7- ЮН2О) = 0,1 -0,5 --г— = 0,05 моль
л,
3. n (Na2B4O7-ЮН2О) нинг топилган цийматига кура ва М (i/2 Na2B4O7-ЮН2О) ни кузда тутиб, шу туз тортмасини ^исоблаймиз:
т (№2В4О, • 10Н2О) = n (Na2B4O7 • 10Н2О) • М (1/г Na2B4O, • ЮН 2О)
т (Na2B4O7-10H2O) =0,05-190,7 г/л(-Л<>= 9,53г. моль
Жавоб: т (Na2B4O7-ЮН2О) =9,53 г ёки т (Na2B4O7-ЮН2О) =
М Na,B,O,-10H,oj-y (эр- ма Na.B.Oj-lOHjO )^ — Na,B,O, ЮНгО^
1000
190,7-500-01 “ 1000 ‘ 9,53 Г
4- масала. 5,0 г НС1 500,00 улчбв колбасила эритилади. Хосил булган 2(0,00 мл эритмани титрлаш учун 0,1 моль/л NaOH дан 19,87 мл сарфланади. Шу эритма моляр эквивалент концентрациясини, титрини ва намунадаги водород хлорид масса улушини (%) дисоб-ланг.
Берилган:
т (намуна) =5,0 г
V (эритма) =500,0 мл
V (НС1) =20,00 мл
V (NaOH) = 19,87 мл . ’ :
с (NaOH) =0,1 моль/л М (НС1) =36,5 г/моль р (НС1) = 1,0 г/мл
- с(НС1) = ? Т(НС1)=? ш%(НС1) = ?
Ечиш иамунаси:
Борадиган реакция тенгламаси:
. NaOH+HCl = NaCl+H2O
Шундай цилиб: f экв (NaOH) = 1; /,экв (НС1) = 1
1. Эквивалентлар ^онунига кура НС1 эритмаси моляр концентра* циясини топамиз:
с (NaOH)-V (NaOH) = с (HCl)-V(НС1)
0,1-19,87 моль/л-мл „„„„„„ ,
с (НС1) = —------------------= 0,09936 моль/л
20,00-жл
2. с (НС1) цийматига кура эритма титрини ^исоблаймиз:
г (НСП = с <НС1) -М (НС1)
Т 1000 ’
0,09936-36,45 г-моль ,
Т (НС1) =----——----------------- 0,003627 гмл
' 1000 мл
3. 500 мл НС1 эритмаси массасини топамиз. m (эритма) = р-V (эритма)
' m (эритма) = I • 500,0 - = 500,0 г
МЛ
4. Эритмадаги НС1 нинг (%) масса улушини топамиз.
zunn V (HCl)-c (HCl)-M(HCl) ‘
m (НС!) — ---’--——------------ .
m (НС!) " м
w % (НС1) = —-------100 % «
m (эритма)
500,0-0,09936-36,45мл-г/моль-г ,
m (НС!) = --1-----------------------— = 1,81 г
1000 мл-моль
«.%№>- '^^-0.36й
Жавоб: с (НС1) = 0,09936 моль!л
Т (НС1) = 0,003627 г/мл
w % (НС1) = 0,36 %
Масала буйича саволлар
1. Кандай реакция кислота-асосли титрлаш усули (методи) асо-сида ётаяи?
Жавоб: Кислота-асосли титрлаш усули асосида нейтралланйш реакцияси ётади,
2. Кислота-асосли титрлаш усулида эквивалентлик нуцтаси цан-дай белгиланади (ашщланади)?
Жавоб: pH му^ити узгариши билан Уз рангини узгартирадиган кислота-асосли индикаторлар ёрдамида.
3. Кислота-асос усулидаги ишчи эритмаларни айтинг.
Жавоб: Кучли кислота ва ишдор эритмалари.
4. Кислота-ишцор усули клиник анализда цУлланиладими?
Жавоб: Бу усулдан меъда шираси кислоталилигини, тиббий ама-лиётда дУлланиладиган кислота ва асос эритмалари концентрация-Сини анидлашда, кислота, асос ва гидролизланувчи тузлар булган тиббий препаратлар анализи. дамда санитария-гигиена анализида озид-овдат мадсулотлари кислоталилигини, сувнинг даттидлиги ва бошдаларни анидЛашда дулланилади. '
5-мисол. 3,0 г чой содаси 250 мл ли улчов колбасидаги сувда эритилди:
NaHCO3+НС1=КаС1+СО2+НгО
реакцияси буйича шу эритманинг 10,00 мл ни титрлаш учун 0,1 моль [л хлорид кислота эритмасидан 11,53 мл сарф бУлди. Намуна-даги NaHCOa нинг масса, улуши дандай?
Берилган: m (намуна)=3,0 г
V (эритма) =250,0 мл
V (NaHCO3) = 10,00 мл
I (
V (HC1) = 11,53 мл I
с (НС1)=0,1 моль!л
~~ М (NaHCO3)—84,0 г/моль_____________
С (NaHCO3)=? т (NaOH) = ? <о % (NaHCO3)=?
Ечиш иамунаси.
1. Эквивалентлар донунига биноан NaHCO3 эритмасининг моляр ; _ концентрациясини топамиз:
/ЭК8 (НС1) = 1; 4KB(NaHCO3) = 1
c(HCl)-V(HCl) = c(NaHCO3)V(NaHCO3)
0,1,11,53 моль! л-мл c(NaHCO3)=---------------------=0,1153 моль/л
10,00 мл
2. c(NaHCO3) дийматига кура NaHCO3 эритмаси титринитопамиз;
™,игп> с (NaHCO3)-M(NaHCO3)
7(NaHCO3) =----------
0,1153-83,99 моль-г
T(NaHCO3)=——1------------------ = 0,009685-г/лм
1000 л-моль
3. Намунадаги NaHCO3 масса улушини (%) топамиз; у NaHCO3 нинг!00 г. (р = 1 г/мл) эритмаси массасидир.
[ w % (NaHCO3) = Т (NaHCO3)-100% = 0,009685-100 = 0,97 г
яъни w% (NaHCO3)'= 0,97%
Жавоб: с(NaHCO3) =0,1153 моль/л
Т (NaHCO3) = 0,09695 г/мл
о» % (№НСО3) = 0,97%
6-масала. Таркибида 1,0912 г СаСО3 садлаган сувли суспензия
30,00 мл НС1 эритмасида нейтралланади. НС1 эритмаси эквивален-тининг моляр концентрациясини анидланг.
Берилган;
т(СаСО3)= 1,0912 г
И(НС1) = 30,00 мл
М(СаСО3) =100,1 г/моль
с(НС1) = ?
Ечиш иамунаси: 1. Моддаларнйнг узаро таъсирлашуви дуйида-ги реакция тенгламасига кура боради:
СаСО3 + 2 НС1 = СаС12 + Н2О + СО2
/„8(НС1)=1 /экв(СаСО3)=1/2
1. Тенгламага кура, НС1 эритмаси моляр концентрациясини топамиз:
/п(СаСОя)-ЮОО 1,0912-1000 г-моль
С (НС1 =----------—-------- = --------:------------
1 V(HCl)M(i/2CaCO3) 30,00-50,04 мл-г = 0,6731 моль/л
Жавоб: с (НС1) =0,6731 моль/л
7-масала. Аммиакнинг сувли эритмасини титрлаш учун 0,1025 моль/л хлорид кислота эритмасидан 15,75 мл сарф булган. Текши-рилаётган эритмадаги аммиак массасини анидланг.
Берилган: V (НС1)= 15,75 мл с (НС1) =0,1025 моль/л М (NH3) = 17,0 е/лола
т (NH3)=?
Ечиш, намунаси. 1. Аммиакнинг сувли эритмада хлорид кислота -билан Узаро таъсири дуйидаги тенглама буйича боради:
NH,+ HC1 =NH4C1
7SKB(NH3)=1; f9KB(HCl) = l
2. Формулага кура эритмадаги аммиак массасини топамиз:
„ M(NH»).V(HCl).c(HCl) .
m(NHs) =------—. унда
1000 тшг,/мн. с(НС1)-Л! (NH3) - T(HCI/NH3)=- —-------------- t
' • 17,00-15,75-0,1025
m(NHs) =---------—--------— = 0,02741 г
lUUU __
.. Жавоб: m(NHs) = 0,02744 г
Масала буйича саволлар
1. Кислота-асосли. титрлаш усулининг дандай турлари бор?
Жавоб: Ацидиметрия — титрланган кислота эритмаси ёрдамида ишдор миддорини анидлаш, алкалиметрия — титрланган ишдор эритмаси ёрдамида кислота миддорини анидлаш.
2. Эритманинг анидланаётган моддага кура титри нима?
Жавоб: 1 мл ишчи эритма билан реакцияга киришувчи анидла-иаётган модданинг граммлар сони. Куп сонли анализларда ишчи эритмалар концентрациясини уларнинг текширилаётган моддага Нисбатан титри билан ифодалаш дулай, масалан:
' с(НС1)-М (NHS)
T(HC1/NH,) = 1000
, Ишчи эритма титрини бир марта дисоблаб олиб (с (НС1) ва М (NH3) — доимий катталик), бу модда массаси (вазни) ни титр сарф булган эритма дажмига к^пайтириб топилади.
Мавзунинг мустадил узлаштирилишини назорат днлиш учун савол ва масалалар
1. Кислота-асосли титрлаш асосида дандай реакциялар ётади?
2. Нейтралланиш ва тузларни гидролиз дйлиш реакциялари ора-снда дандай боглидлик бор?
3. Эквивалентлик нудтаси дандай долатларда рН=7, рН<7 ва рН>7 долатларда булади?
1 4. Сирка кислотани калий гидроксид билан тйтрлашга мос кела-
диган индикатор танланг.
Жавоб: ф^—ф, т—ф.
5. Фармацевтик препаратлар, масалан, ацетилсалицил, салицил, бонзой, никотин, лимон ва бошда шу каби карбон кислоталар ана-
; : лйзи NaOH эритмаси билан титрланади. Бундай анидлашга мос ке-с. ‘«(Диган индикаторларни тушунтиринг. *
Жавоб: ф-ф,т-ф.
__ . .
6. Хлорид кислота меъда ширасида 0,4—0,5% (масс.) ни ташкил этади. 10,00 мл (р=1,0 г/мл) меъда ширасини титрлаш учун NaOH нинг 0,1 моль/л эритмасиДан неча мл сарф булишини дисоб-ланг.
Жавоб: V (NaOH) = 12,33 мл
7. Огизни чайиш, к^зни ювиш учун ишлатиладиган борат кислота миддори алкалиметрик усул билан анидланади. Агар 2,00 мл Н3ВО3 ни титрлаш учун 10,00 мл 0,1 моль/л NaOH эритмаси-сарф-. ланган б^лса, борат кислота эритмасининг моляр концентрацияси ва масса улуши кандай?
Глиц 11
Н3ВО3 + NaOH ----> NaBO2 + 2Н2О f= — = — = 1.
Af(1/2HSBO3) = 61,83 г/моль, бунда соф борат кислота эмас, унинг глицеринли комплекси ишдор билан бир негизли кислота сифатида титрланиши дисобга олинади.
Жавоб: с(Н3ВО3) =0,500 моль/л-, ш% (Н3ВО3) = 3,09 %
8. Доривор препаратларни кислота-асосли титрлаш усулида анидлашга мисоллар келтйринг.
9. Анидланаётган моддага кура эритма титри нима? Анализ ^т--казилаётганда кандай долатларда бу усулдан фойдаланиш дулай?
10. Нима учун нейтраллаш усулида титрланган эритма тайёрлаш учун дар доим кучли кислота ва ишдорлардан фойдаланилади? '
И. Нима учун титриметрик анализда кучсиз асос ва кучсиз кислота орасида борадиган нейтралланйш. реакциялари ишлатилмайди?
12. 10% (масс.) ли аммиак эритмаси — новшадил спирти —бе-морларни бедуш долатдан чидаришда нафас олишнй кучайтириш учун ишлатилади. Унинг миддори ацидиметрик усул (м.етод) билан аницланади. Бунинг учун 5,00 мл препарат, дажми 100,0 мл ли кол-бадаги сувда эритилади. Агар 10,00 мл эритмани титрлаш учун 14,00 мл 0,1 моль/л НС1 эритмаси сарфланган б^лса, досил булган эритманинг моляр концентрацияси, масса улуши (%) ва титри. дан-дай? -
Жавоб; w % (NH3) =0,24%, c(NH3) = 0,1400 моль/л
7’(NHs) = 0,002380 г/мл
13. К^пгина дори шакллари таркибига кирадиган амидопирин иссид туширувчи, огрид долдирувчи, шамоллашга дарши таъсир курсатади. Унинг миддори асос дусусиятига эга модда булиб, унинг миддори ацидиметрик усул билан анидланади. Таркибида 0,10 г амидопирин ва 0,25 г аспирин булган 0,50 г порошокни эритишдан досил булган эритмани титрлаш учун хлорид кислотанинг-0,1 моль/л эритмасидан неча мл сарф булади.
Жавоб: V (НС1=4,33 мл
14. Тинчлантирувчи таъсирга эга кодеин препарата миддорини НС1 эритмаси билан, утиш оралиги (иитервали) pH 4,2—6,3 булган метил дизили иштирокида анидланади. Ушбу титрлашда эквивалент нудта жойлашган "pH содани тушунтиринг.
1- л а б о р а т о р и я иши
ХЛОРИД КИСЛОТА ЭРИТМАСИ КОНЦЕНТРАЦИЯСИНН АНИКЛАШ
Ишнинг бориши. Конуссимон титрлаш колбасига пипетка билан натрий тетраборатнинг стандартланган эритмасидан 20,00 мл улчаб солинади, 1—2 томчи метил
ЯЬгалдок эритмасидан кушиб, хлорид кислота эритмаси 1й|р1ан ранги бир томчидан сари^дан оч пуштйга ^згар-$унча титрланади. Титрлашни яна 2 марта такрорланг, ЛЙр-бирига я^ин натижаларнинг урта арифметик кийма-- ТЙЙи олиб, хлорид кислота эритмасининг титрини ^и-.Србланг. Тажриба натижаларини жадвалда курсатинг.
Тартиб № U(NatB4O7) МЛ сСЛМаЗА) моль/л v(HCl) мл с(НС1) моль/л T(VCl) е/мл V Индикатор
1. 2,-3. * метил зар-галлоц «—> « — »
^исобларни цуйидаги тенгламалар буйича бажаринг: ,„Г1. ' c(«V2NasB4O,)-V(Na2B,O7), ‘
с(НС1)=-----------------:------ моль/л
• V(HC1)
7(нс1)^ста-<^->г/жл
1000
М (HCI)— НС1 нинг моляр массаси, М(НС1) =36,5 г/моль, 8,2—8,4% (масс.) НС1 эритмаси меъда шираси кис-лоталилиги такчиллигида.томчи ва микстура к°латлар-да ичишга буюрилади. Унинг ми^дорий анализини натрий тетраборатнинг стандарт эритмаси ёки NaOH ва КОН ларнинг стандарт эритмалари ердамида ани^лаш мумкин. Анализ утказиш усули юцоридагидек.
2-лаборатория и ши
ЭРИТМАДАГИ АММИАК МАССАСИНИ КОНТРОХ-АНАЛИТИК УСУЛДА АН И КЛАШ
Ишнинг бориши: Аммиак эритмасидан титрлаш кол-басига маълум мицдорда олинг (Уцитувчи контрол вазифа сифатида беради), унга 1—2 томчи метил зар-галдок эритмасидан кУшинг ва сарик рангни охирги 1 томчи хлорид кислотасидан оч пушти рангга ^вгунча стандартланган хлорид кислота эритмаси билан титр-ланг. Аницлашни яна 2 марта кайтаринг, ухшаш на-тижалардан урта арифметик кисобцни олинг ва аммиак .массасини кисобланг. Тажриба натижаларини жадвалда курсатинг.
Анн^лаш №№ V (NH.) мл V (НС!) МЛ с(НС1) . моль/л r(HClNHe) г!мл 1 е Индикатор-лар •
. 1. 2. 3- метил заргалдоц —»— —«—
Хисобларни
т (NHS) = Т (HCI /NH3) • V (HCI), г тенглама буйича бажаринг.
Бунда Т (HCI/NH3) — НС1 нинг аммиакка нисбатан титри.
V(HC1) — НС1 нинг NH3 эритмасини титрлаш учун сарф булган хажми.
Аммиак тирик организмда парчаланиш мй^сулоти 'Хисобланади. Унинг бир цисми суткасига 0,5—1,2 г миц-дорда сийдик билан ажралади. Баъзи касалликларда аммиак ажралиб чи^иши купаяди. У одам учун за^ар-ли булиб, унинг Соф цондаги мицдори 0,05 мг%. Биологик объектларда аммиак миддорини анидлаш организмда патологик жараёнлар бор ёки й^цлигини характер-лайди ва диагностик ахамиятга эга. «Новшадил спир-ти»—10% ли NH4OH эритмаси булиб, тйббиётда цул-ланилади.
3-л а б о р а т о р и я и ш и
ЭРИТМАДА БИРИ км А ХОЛ ИДА УЧ РАЙ ДИ ГАН NaOH ва Na2CO3 ларнинг МАССАСИ ВА МАССА УЛУШИНИ АНИКЛАНГ
Ишнинг бориши. Текширилаётган эритмадан титрлаш колбасига пипетка билан улчаб 20,00 мл солинади, 1—2 томчи фенолфталеин кушиб бир томчидан малина ранг йуцолгунча НС1 эритмаси билан титрланади. Титр-лашга сарф булган НС1 хажми (Vj) ёзиб олинади.
Титрланган эритмага 1—2 томчи метил заргалдоц цушиб (бунда эритма сариц тусга киради) титрлашни HCI билан охирги бир томчи НС1 дан учмайдиган киз-гиШ ранг хосил булгунча давом эттирилади. Тйтрлашга сарфланган НС1 хажми ёзиб олинади (V2). Титрлашни яна икки марта такрорЛанг хамда ухшаш натижалардан. урта арифметик цийматни чикариб, эритмадаги NaOH
ва Na2CO3 ларнинг массаси ва масса улущларини ^исоб-ланг. Тажриба натижаларини жадвалда к^рсатинг.
№№ V (эритма) мл V1 (HCI) лсл V» (НС1) * мл с (НС1) моль/л тСЫавСОв) г m(NaOH) w%(Na,CO,) w% (NaOH)
Хисобларни тенгламалар буйича олиб боринг: т(NaOH) = (у1-Уа)(НС1)-М(Ы1ОН)-с(НС1) ’
К ’ 1000 |
w % (NaOH) = - m(-Na0H) ,i00% т(эритма)
2c(HCl)-Af (-^-Na2CO3'| -.......: — -Z—
w %(NaaCO.) = - (NaaC0») . 100%
, tn (эритма)
ОКСИДЛАНИШ-КАЙТАРИЛИШ ЖАРАЕНЛАРИ
Мавзунинг мацсади. Биологик системаларда кечади-ган оксидланиш-^айтарилиш реакцияларининг бориш имкониятлари ва уларга системали ёндошишни урганиш.
Урганилаётган мавзунинг а^амияти. Тирик организмда кечадиган биокимёвий жараёнларнинг к^пчилигй ок-сидланиш-^айтарилиш жараёнларидир, шунинг учун тиббий амалиётда оксидланиш-^айтарилиш реакцияларининг бориш цонуниятларини урганиш ва уларни бйо-логик системаларга татбиц этиш зарур. Таркибида^аёт учун зарур булган металлар — темир, мне, кобальт, молибден- ва бопща моддалар сацлайдиган металлофер-ментлар томинидан амалга ошириладиган. биокимёвий' оксидланиш-^айтарилиш жараёнларида кислород атоми электрон олиб, гидрооксогруппалар утиши, водород ва гидрид ионларнинг ажралиши ва бош^а жараёнлар руй беради. Усимликларда фотосинтез, тирик организмлар-да эса нафас олиш энг а^амиятли биоредокс жараён-лардир. Фотосинтезда ^уёш энергиясюшнг йигилиши (аккумуляцияси) ^уйидаги тенглама буйича СО2 нинг ^айтарилиши О2- нинг оксидланиши 5(исобига булади.
Mg — хлорофилл „ „ ,, О „
СО2 + Н2О + 4 hv-----------Н—C//u + О2
Cu2+,Mn2+, Fe2+ \Н 2
6Н-С//°------->-С6Н12О6
Одам ва ^айвон организмида глюкозанинг оксидла-ниш'и ва кислороднинг кайтарилиши йигилган энергия-нинг ажралиб чи^иши билан боради:
С6Н12Ов + 6О2 -> 6 СО2 + 6Н2О + Q
. Бошлангич даража
1. Бирикмаларда элементлар атоми оксидланиш да-ражасини ани^лаш.
2. Реакцияларнинг молекуляр ва ионли шаклларини тузиш. ,
3. Оксидланиш-цайтарилиш реакцияларини тузиш в а электрон баланс усулида коэффициентлар танлаш.
Мустацил тайёрланиш учун уцув материаллари
1. Н. Л. Г л и н к а. «Умумий химия». Т. 1968. 241- бет.
2. X. Рустамов. «Умумий химия». Т. 1969. 140-бет.
3. X. Р. Рахимов. «Анорганик химия». Т. 1974. 139-бет.
4. С. С. О л е н и н, Г. Н. Ф а д е е в. «Неорганическая химия». . М„ 1979, 146-бет.
5. И. К. Ц и т о в и ч. «Курс аналитической химии». М., 1985. 66- бет.
6. А. В. Б а б к о в, К. Н. Г о р ш к о в а, А. М. К о н он о в. «Практикум по общей химии с элементами количественного анализа». М., 1978, 129- бет.
7. А. С. Ленский. «Введение в бионеорганическую и биофизическую химию». М., 1989, 231-бет.
МАЪЛУМОТЛАР БЛОКИ
*’ ОКСИДЛАНИШ-КАИТАРИЛИШ РЕАКЦИЯЛАРИ, ИОН-ЭЛЕКТРОН УСУЛ
Оксидланиш-цайтарилиш реакциялари деб электрон олиш ёки бериш билан борадиган реакцияларга айти-лади, унда электронларнинг бир молекула атом ёки ионлардан бошцаларига утиши кузатилади. Электрон-ларни бериш жараёни оксидланиш, электронларнинг бирикиши эса кайтарилиш жараёнлари дейилади:
БОз~ + Н2О —2 е -> SOl~ + 2Н+ — оксидланиш
МпОГ + 8Н++.5е->- Мп2+ + 4Н2О— цайтарилиш
Т Оксидланишда атомнинг (ион) мусбат оксидланиш даражаси ортади, ^айтарилишда эса оксидланиш да-ражаси камаяди. Оксидланиш-^айтарилиш жараёнлари бир-бири билан узвий ботлиц. Электрон ^абул цилиб одган молекула, атом ёки ионлар оксидловчилар, электрон берадиганлари (йу^отадиганлари) — цайтарувчи-лар дейилади. Оксидланиш-цайтарилиш реакциялари уч хил булади.
' ' 1. Молекулалараро оксидланиш-цайтарилиш. Бу жа-раёнда оксидловчи ва ^айтарувчи турли ^молекулалар таркибида булади: . ,
2 HNO2 + H2S = 2NO + S + 2Н2®
NOT + 2Н+ + ё^ NO° + HaO
S2- —2e->S° . 1.
2. Ички молекуляр оксидланиш-цайтарилиш. Бу жа-раёнда молекула таркибининг бир ^исми оксидланади, цолгани цайтариладй. Бу турдаги реакцияларга к^пчи-лик термик парчаланиш жараёнлари мисол була ола-ди.
2 КСЮ3 = 2 КС1 + 30» С1+’+ бё->- СГ 2 20-2+ 4ё-> 0° 3
3. Диспропорцияланиш (уз-узини оксидлаш — уз-узи-ни ^айтариш). Бу жараёнда бир элементнинг узи ^ам оксидланади, ^ам ^айтарилади.
С13 + Н2О = нсг+ нею
С1? + 2ё->2СГ 1
С1° — 2ё->2С1+ 1
Оксидланиш-^айтарилиш реакцияЛарида коэффициент танлаш электрон баланс усулида ёки ион-электрон усул-да амалга оширилади.
Бу усул электролитик диссоциация ^ацидаги тушун-чани ва оксидловчи-цайтарувчи ион ёки молекулаларни сувли эритмаларда дандай б^лса шундайлигича ^абул цилади. Бунда тенгламалар тузилишининг умумий цои-даларига риоя ^илинади: кучсиз электролитлар ва кам эрийдиган моддалар молекула ^олида ёзилади. Ион-электрон усул ёрдамида реакцияда цатнашаётган ^ам-ма моддалар буйича коэффициентлар топилади.
Реакцияларнинг ионли тенгламаларига кислотали мудитда водород -ионлари сув молекулалари ёки ишдо-рий мудитда гидроксид ионлари киритилиши мумкин. Нейтрал мудитда эса тенгламанинп чап дисмига оксид-ловчи вагдайтарувчидан ташдари фадат сув молекулала-ч ри душилиши мумкин, реакция натижасида эса Н~ ва ОН- ионлари досил булиши мумкин. Бу усул оксидловчи ион (молекула) ларнинг дайтарилиш дамда дайтарувчи ион (молекула) ларнинг оксидланиш реакция (схема) ларини алодида тузиш, сунгра уларни умумий тенглама-га бирлаштиришга асосланган. Реакция натижасида уз-гармайдиган ионлар ионли схемага киритилмайди.
Усулни калий сульфитни калий перманганат билан оксидланиши мисолида куриб чидамиз'. Бу реакцияда оксидланиш ва дайтарилиш мадсулотлари кечаётган жараён мудитга боглид булади:
I. Кислотали мудитдаги реакция:
KaSO3 + KMnO4 + H2SO4->- KaSO4 + MnSO4 + Н2О
Калий перманганатнинг бинафша ранги деярли марганец сульфатга утганда рангсизланади. Реакциянинг ионли схемаси:
SOI- 4- МпОГ—Н4+ + SO1"4- Мп2+ + Н2О ионларнинг ^згариш схемасини алодида ёзамиз.
1.1
Схеманинг чап томониДа кислород атомлари етишмай-ди. Улар кислотали мудитда сув молекулалари сифа-тида д^шилади. Бунда* ажралиб чиддан водород ионлари тенгламанинг .унг томонига ёзилади.
SO|-+ Н20т> SO42-+ 2Н+
Тенгламанинг иккала дисмидаги дамма ион зарядлари йириндиси бир хил булиши керак. Шунинг учун чап томонДан 2 та электронни олиш зарур. Шундай дилиб:
' Sq~+ НаО — 2е“-> 2 SO2- + 2Н+.
SO|- оксвдланишга учрайди.
1.2. МпОГ-+Мп2+
Бунда буш долган 4 та кислород иони кислотали му-дитда водород ионлари билан бирикиб 4 молекула сув досил дил а ди.
МпО4- + 8 Н+ Мп2+ + 4 Н2О
г '
' чап ва унг томондаги ион зарядларининг йигиндиси (суммаси) бир хил булиши учун чап цисмга 5 та электрон бериш зарур. Шундай цилиб:
МпОГ 4- 8 Нг + 5е^ Мп2+ 4- 4 Н4О цайтарилишга учрайди.
1.3. Бир реакцияда ^айтарувчи берадиган ва оксид-ловчи ^абул циладиган электронлар сони бир хил 6J-лиши керак. Шунинг учун уларнинг сонини тенглашти-рамиз ва электрон тенгламаларни жамлайадиз:
SO1~ + H2O — 2ё—->SO42~ + 2H+; 5
МпОГ4-8Н+ + 5е---->Мп2++4Н^О 2~
5SO2- 4- 2МпО~ +~ 16 Н+-Ь 5Н2О -* 5SO2-4- 2Mti2+4-
4-10Н+8Н20
Шу тарифа реакциянинг ^хшаш ^адларини цис^артир-гандан сунг ионли тёнгламанинг цисцартирилган шак-лини ёзамиз.
5 SO2- 4- 2 МпО4- 4- 6 Н+ -> 5SO2- 4- 2 Мп2+ 4-. ЗН2О
Ионли тенгламага кура молекулаларини ёзамиз:
5 K2SO3 4- 2 КМпО. 4- 3H2SO4 = 6K2SO4 4- 2MnSO44-3HaO
2. Нейтрал му^итдаги реакция.
К25Оз 4- КМпО4 4- Н2О-> K2SO4 4- МпО2 4- КОН бинафша рангли калий перманганат ц^нгир рангли марганец П-оксид чукмасига утади. Якинлик биринчи ^о-латдагидек.
2.1. SO2-—-^SO2-
Нейтрал му^итда кислород атомлари етишмаса сув ц^шилади.
SO1- 4- Н2 О — 2е —> SO2-4- 2Н+
2.2. МпОГ—»-МпО2
Ажралиб чи^аётган 2 та кислород иони ишцорли -му^итда сув билан реакцияга киришиб гидроксид ион-ларини хосил цилади:
О2“4-Н2О—>-2ОН_
2.3. Электронлар балансига эришиш учун ярим ре-акцияларга коэффициентлар танл»ймиз ва уларни ¥$-шамиз:
6-7534 81
- • SO3~ + H2O — 2 eSOb 4-2H+ |3
МпОГ + 2H2O + 3 e—MnO2 4-40H~ | 2
3SQ2- 4- 3H2O 4- 2MnO~ 4- 4H2O->- 3SOp 4- 6H+ + + 2MnO24- 8OH“
, • Унг томонда 6H+4~ 8OH“->6HaO4-2ОН”
Демак,
3SQ2- 4- 2MnO- 4- H2O-> 3SO4-24-2MnO2 +2OH" ^исцартирилгандан сунг ионли тенгламани:
3SO2- 4- 2МпО7 + Н2° -* 3SO1“ + 2МпО2 + 2ОН“ ^амда тегишли молекуляр тенглама оламиз.
3K2SO3 4- 2КМпО4 4- Н2О =₽* 3K2SO4 4- 2МпО2 4- 2КОН
3. Иш^орий му^итдаги реакция:
K2SO3 4- КМпО4 4- КОН K2SO4 4- К2МпО4 + Н2О бинафша ранг калий перманганат, яшил тусли калий манганатга утади.
3.1. Ишцорий му^итда етйшмаган кислород ионлари ОН- ионлари орцали цушилади, долган Н+ ионлари эса сув молекулаларини ^осил ^илади:
SO|~ 4- 2ОН~ — 2ё-ь Sob 4- Н2О
3.2. МпО~ МпО4~
Перманганат ион узига битта электронни бириктириб олади:
МпОГ 4- е -* МпОЬ
3.3. Электронлар балансига эришиш учун ярим реакцияларга коэффициентлар танлаймиз ва уларни цу-шамиз. Ионли тенглама оламиз.
SO1- 4- 2ОН“ — 2 е^ SO«~ 4- Н2О МпОГ 4- е -► МпОЬ
1
2
SO2- 4- 2ОН- 4- 2MnO7-> SO2- 4- Н2О 4- 2МпО2-
Тегишли молекуляр тенглама цуйидаги куринишга эга:
KaSO3 4- 2КМпО4 4- 2КОН = K2SO4 4- 2К2МпО4 + Н2О
Ургатувчи масалалар ва уларни ечиш намуналари
1-мисол. Ушбу жараёнларнииг ^айси бирида азотнинг оксид-ланиши ва кайсинисида цайтарилиши р^й беради: Оксидланиш дара-жаси ^ар бир ^олатда дандай узгаради.
F -
NH+— N2; Nf—NO; 'NO7->NO^; NO2 — NO^'
Ечиш иамунаси. Атомларнинг электрон бериш жараёни оксидланиш деб аталади, у оксидланиш даражасинннг ортиши билан боради. Атомларнинг электронни бириктириб олиши дайтарилиш дейилади, у оксидланиш даражасинннг пасайишига олиб келади.
NH^-*N° . 2N3-—6e->-N° . —оксидланиш
NO~—>-NO N5t*~ + 3 e->-—дайтарилиш
NO“-*NO“ N3-^—2e->-№+ —оксидланиш
NO2-»-NO£" N4+ + e-*- N3+ —кайтарилиш
2-мисол. К,уйидаги реакцияларнинг кайси бирн оксйдланиш-Кайтарилиш реакциялари дейилади? %
1. Н3РО4 + 3NaOH = Na3PO4 + ЗН2О
2. КгСг2О7 + 2КОН = К2СгО4 + Н2О
3-Si + 4NaOH = Na4SiO4 + 2Н21
4. KCrO2 + Xl2 + 8KOH = 2K2CrO4 + 6KCl + 4H2O
Ечиш намунаси.
Оксидланиш-цайтарилиш реакциялари деб, реакцияга киришаётган моддалар таркибидаги бир ёки бир нечта атомларнинг оксидланиш даражаларининг узгариши билан борадиган реакцияларга айтилади. Келтирилган реакцияларнинг 3- ва 4-лари оксидланиш-цайтарилиш реакцияларидир.
3- мисол. Реакция тенгламасини тугаллаб, молекуляр шаклда ёзинг ва коэффициентларини танланг.
MnOJ* + J-4- Н+
Ечиш намунаси
Маълумки
1. МпО4~ ионлари оксидлозчи, J~ ионлари цайтарувчидир.
2. Кислотали мудитда МпО^" Мп2+ гача цайтарилади, яъни MnOf + 8Н++ 57-* Мп2++ 4Н2О
3. I- ионлари 12 гача оксидланади:
21~—2~е->-12
4. Тузилган ярим реакцияларга кура, уларни цушиб:
МпО4~ + 8Н+ + 5е"-»- Мп2+ + 4НаО 2 2I~ — 27->l£ 5
2MnOf + 8Н+ + 101“ 2Мп2+ + 4Н2О + 51°
ни оламиз.
5. Реакция тенгламаси молекуляр шаклдт цуйидагича булади:
2KMnO4/f-10 KI + 8HaSO4 = 2MnSO4 + 6К&04 -f- 5I2 4- 8H2O
Масала буйича саволлар
L К^андай моддалар оксидловчи-дайтарувчи деб аталадй?
Жавоб. Таркибида оксидланувчи элемент атомлари садлаган ' моддалар дайтарувчилар дейилади, таркибида дайтарнлувчи элемент атомлари садлаган моддалар эса оксидловчилар дейилади.
2. Коэффициент танлашнинг ион-электрон усулининг модияти нимала?
Жавоб: Бу усул электролитик диссоциация тушунчасига асос-л’анган ва оксидловчи-дайтарувчи ион ёки молекулаларни сувли эритмаларда ёки системаларда дандай долатда мавжуд булса шун-дайлигича курилади.
Мавзунинг мустадил узлаштирилишини текшириш учун савол ва масалалар
1. Оксидланиш-дайтарилиш реакцияси турларНни курсатинг.
2. Реакция тенгламасини тугалланг, коэффициентлар танланг, реакция турини курсатинг. "
I. КМпО4 + Н2О2—>-МпО24-
2. KMnOj—►K2MnO4 + MnOs +
’ t°
3. Ag2O----2Ag +
3. Кислород иштирокида борадиган фермеятатив жараёнларда у НгО ёки Н2О2 гача дайтарилиши мумкин. Бунда О2 билан б?лади-ган жараёнларни курсатинг.
4. Олтингугурт садлайдиган аминокислоталар таркибндаги ол-тингугурт ферментатив оксиДланади. Келтирилган жараёнларнинг ярим реакция тенгламаларини ёзинг:
R — SH феР^ент R—S—S—R
эд— оксидловчи (Ьеоментляр/* 4 2_ S2O3
5. Фотосинтез — мудим биологик жараён. Умумий натижа СО2 ни л» О
Н—С\ ' гача дайтарилишвдан ва сувни молекуляр кислородгача ок-сидлапишидан ташкил топган. Бошлангич босдични
4.4 hv Л®
СО2 + Н2О-------» Н—С." -|- С*2 куринишда ифодалаш мумкин.
Ярим реакция тенгламасини тузинг: '
6. Биологйк оксидланиш дамма тирик дуждйраларда борадигаи оксидланиш реакцияларининг йигиндисидир. Биологик оксидланиш механизмини умумий куринишда цуйидагича ифодалаш мумкин:
СдН42О2 Ц- О2 —*•. СО н20
Коэффициентарни танланг дамда глюкоза ва кислород билан дан-дай жараёнлар борншнни курсатинг. Ка^си модда оксидловчи, дай-синиси дайтарувчи булади?
РЕДОКС ПОТЕНЦИАЛ НИ АНИКЛАШ
Мавзунинг ма^сади: 1. Снстемднинг редокс потен-i циали ^ийматига асосан оксидланиш-^айтарилиш реак-? цияларида мувозанатни силжитишга системали ёндо-
шишни урганиш.
2/ Биомолекулалар редокс потенциалидан биокимёвий реакцияларни ^рганишда фойдаланиш.
^Урганилаётган мавзунинг а^амияти. Оксидланиш-цайтарилиш реакцияларининг бориши ва*й^налиши жумладан, одам организмида борадйганларя>.^ам реакцияга киришаётган моддаларнинг редокс пртенциалига боглиц булади. ’•
Шунинг учун биокимёвий реакцияларни тушунтириш ва асослаб беришда редокс потенциални билиб ншла-тиш ва узлаштириш организмда борадиган оксидланиш-Кайтарилиш реакцияларини бош^ариш имконини беради. Реакцияга кириШувчи моддалар редокс потенциаллари-
ни билиш биомолекулаларнинг узаро таъсирлашувини, Кайтар реакциялар йуналишини назарий аницдаш ва улардаги мувозанатни у ёки бу томонга силжйтиш им-
конини беради.
Бошлангич даража
1. Оксидлайиш-^айтарилиш реакциялари.
2. Оксидланиш-кайтарилиш реакция тенгламаларй.
3. Реакциянинг мувозанат ^олати ва уни силжитиш.
Мустацил тайёрланиш учун уцув матерзаллари
1. Н. Л. Г л и н к а. «Умумий химия». Т. 1968.
2. X. Рустамов. «Умумий химия». Т. 1969. 140-бет.
3. X. Р. Р а и м о в. «Анорганик'химия». Т. 1974.
4. С. С. Оленин, Г. Н. Фадеев. «Неорганическая химия». М., 1979. * '
5. К. Б. Я ц и м и р с к и й. «Введение в бионеорганическую химию».
6. X. X а к и м о в, А. 3. Татарски яг'«Периодическая система и биологическая роль элементов», Тошкент. 1985, 103—110-бет-лар.
7. А. С. Л е н с к и й. «Введение в бионеорганическую и биофизическую химию». М, 1989. 231-бет.
МАЪЛУМОТЛАР БЛОКИ
ОКСИДЛАНИШ-КАЙТАРИЛИШ (РЕДОКС) ПОТЕНЦИАЛЛАРИ — СИСТЕМАНИНГ ОКСИДЛОВЧИ ВА КАИГТАРУВЧАНЛИК КОБИЛИЯТИ улчови сифатида
Оксидланиш-Цайтарилиш реакцияларида оксидловчи электронки кабул килиб олиб — кайтарилади, кайтарув-чи — электронни бериб оксидланади. Оксидловчи ва кайтарувчиларнинг оксидланиш-кайтарилиш реакцияла-ридаги колати уларнинг кучига боглиц. Бу колатни тас-диклаш. учун куйидаги мисолларни куриб чикамиз.
Учта стаканга уч хил туз эритмалари куйилган: би-ринчисига КМпО4 эритмаси; иккинчисига КгСггО? эритмаси; учинчисига—Fe2(SO4)3 эритмаси. Кислотали му-Кит косил килиш учун каР бир стаканга 0,1 моль/л H2SO4 эритмасидан кушилган. .
. 1. ХаР бир стаканга KI эритмаси кУшилган- Учала колатда кам эркин 12 ажралиб чикишини кузатамиз.
1.1. Биринчи стаканда реакция куйидаги тенглама буйича боради:
2КМпО4 4- ЮК1 4- 8H2SO4 4- 2MnSO44-5Ia4- 6K2SO44-8HaO MnO- + 8H+ +5e“-> Mn2+4H20 2
21“ — 2e~->I°
1.2. Иккинчи стаканда
КаСг2О, + 6 KI + 7H2SO4 = Cr2(SO4)3 4- 3Ia +4K2SO44-7HaO
Cr2O2~ 4- 14H+ + 6e~ 2Cr3+ + 7HaO 1
212e~->I°
1.3. Учинчи стаканда
Fe2(SO4)3 4- 2KI = 2FeSO4 4- I8 4- KaSO< 2F3+4-2e"->2Fe2+ 1
21“ — 2e->I“
2. Иккинчи мисолда стакандаги шундай эритмалар-
га KI урнига КВг кушилган.
2,1. 2КМпО4 4- ЮКВг 4- 8H2SO4 = 2MnSO,4 4- 5Вга 4-
2Вг“ — 2е“* Вг°
4- 6KaSO4 4- 8НаО
МпО^ 4- 8Н+ 4- 5е“->Мп+24- 4На0 2
2Вг“ — 2е“* Вг° 5
2.2 К2Сг2О7 + бКВг + 7H2SO4 = Cr2(SOj3 4- 3Bra 4-+ 4K2SO4 + 7H2O
Cr 2C>2- + 14H+ + 6e~ 2Cr3+ + 7H2O 2Br“ — 2e~->Bro
1.
3
2.3 Fe2(SO4)3+ KBr 4-H2SO4-> реакция бермайди.
3. Учинчи мисолда худди шу стаканлардагн бёрил-ган эритмаларга КС1 ц^шамиз.
Охирги мисолда С1г фацат биринчи стаканда ажра-либ чи^ади. Кейинги икки стаканда хлор аяфелиши ку-затилмайди. _
2КМпО4 4- 10КС1 4- 8H2SO4 = 2MnSO4 4- 5CI2 4-
4- 6K2SO4 4- 8Н2О
MnO~+ 8Н+ -I; 5е~-> Мп2+ 4- 4Н2О 2
2С1~ —2е~->С1.® 5
Шундай ^илиб, учта оксидловчи — КМпО4, К2Сг2О7, Fe2(SO4)3 дан эн г кучлиси — КМпО4, кучсизи —Fe2(SO4)3.
Келтирилган мисолларда КГ энг кучли цайтарувчи, КС1 — кучсиз цайтарувчи, чунки у фацат энг кучли оксидловчи билан реакцияга киришади.
3">Вг>СГ
.Турли системаларнинг оксидловчи-цайтарувчилик цобилияти мицдори оксидловчилик (редокс) потенциал ^ийматига кура ани^ланади.
Оксидловчи-1$айтарувчи жуфтнинг абсолют потенциал ^ийматини . \аницлаб булмайди. Тавдосланиши мумкин булган натижалар олиш учун турли оксидла-ниш-^айтарилиш жуфтларйнинг электрод потенциали улчанаётганда уларнинг >^ар бирини стандарт жуфт билан сблиштириш керак. Стандарт жуфт сифатида 2Н+/Нг жуфти билан аницланган нормал водород электроди ишлатилади. Унинг стандарт электроди оксидловчилик потенциали «О» деб ^абул цилинган.
Системанинг стандарт оксидловчилик-цайтарувчилик потенциалини улчаш учун водороднинг стандарт потенциали «О» (ноль) деб цабул цилинади ва ЭЮК (электр юритувчи куч) ни улчаш осон булган гальваник элемент олинади.
Оксидловчи-^айтарувчи системаларнинг стандарт по-тенциаллари 5-жадвалда келтирилган.
Улар мусбат потенциал цийматининг камайиши ва
манфий потенциал цийматининг ортиб бориши тартиби-да жойлаштирилган. Бунинг натижасида оксидловчилик активлигй камайиб, ^айтарувчилик активлиги ортади. Масалан,
' О3 + 2Н+ + 2е~-> О2 + Н2О
Na+ + e~-*Na°
системанинг стандарт потенциали +2,07 в ва — 2,71 в га тенг. Бундан келиб чицади-ки, озон молекуласининг оксидловчилик хусусияти, натрий-атомининг эса цайта-рувчилик хусусияти энг кучли ифодаланган экан.
Оксидланиш-цайтарилиш потенциаллари цийматини билгин ^олда реакция йуналишини олдиндан айтиб верит мумкин. Масалан, бу моддалар орасида дандай жараёнлар амалга оширилади?
Вг2/2Вг~£° = 1,0б5в -
Fe3+/Fe2+ £° = 0,77 в
J2/2J- £0 = 0,54 в
Реакция йуналишини белгилаш учун цуйидаги доплата амал ^илинади: стандарт потенциал циймати говори булган бирикмаларнинг оксидланган шакли стандарт потенциал циймати кичик булган бирикмаларнинг ^айтарилган шакли билан ^заро таъсирлашади. Вг2(Е°= = 1,065 в) 12(Е°=0,53 в) га нисбатан кучлиро^ ойсид-Ловчи ва бундан чицадики, у 12°ни I- сацловчи эритма-лардан си^иб чицаради. Шунинг учун ^уйидаги реакциялар бориши мумкин:
Br2 + 2Fe2+-->2Br“ + 2Fes+
• Br2 + 2J“—->2Bf" +J2
2Fe3+ +2J“->'2Fe2+ +J2
Электрод потенциаллар узгарувчан. Улар модданинг оксидланган ва ^айтарилган шакллари концентрация-лари (ани^роги, активликлари) нисбатига, ^ароратга, эритувчи табиатига, му^ит pH ига ва бошца омилларга богли^.
Электрод потенциали цийматининг оксидланган ва ^айтарилган шакллар концентрациясига богли^лиги Нернст тенгламаси ортали ифодаланади: '
£ = £0 + 0’058 СОКСИДЛ.Ш
П ® СУ
Bfe системанинг стандарт редокс потенцнали.
У АгаР Соксидл. — Старил. б^ЛСЭ, уНДЭ .
К с* '
В£ ОКСИДЛ . , 1 1 п
К —у--------=1 1g 1 = О.унда
К Скайтарил.
Е = Е°, яъни системанинг редокс потенцнали стандарт Е: редокс потенциалга тенг булиб ^олади.
В. МпО~ ^айтарилишй Н+ ионлари иштирокида боради.
MnO“ + 8Н++ Fe2+Мп2++ Fe3++ 4Н2О
g Шунинг учун Е ни куйидаги тенглама буйича топилади:
I I д. 'о ,0,059, с(МпОГ)-с8(н+)
Е — Е° Ч---:—1g --------------
П c(Mn2+).
Бундан чица^ики, -
с(Н+)=1 моль/л ва с(МпО~) = с(Мп2+)
Е — Е° .
с(Н+) нинг ортиши Е ^ийматининг Е° никидан катта були-шига олиб келади. Металл ионларининг оксидланган ва цай-тарилган шакллари концентрацияси эритмада координацияга учраган сувни алмаштириши мумкин булган лигандларга > боглиц:
[М (H2O)e]n+ + nL -> [MLn (H2O)6_n ]n+ '
Лигандларцинг турли оксидланиш даражасини намоён ^иладиган металлар билан комплекс ^осил цилишга мойиллиги турличадир. Масалан: фенантролинни Fe3 + га нисбатан Fe2+ билан комплекс ^осил цилишга мойиллиги катта. Шунинг учун фенантрблин иштирокида Fe2+ концентрацияси камаяди, бу эса системанинг редокс потенцнали купайишига олиб келади,
’ [Fe (фен)3]3+ [Ре(фен)3]+2 = I булганда Е° = 1,10 в [Fe(H2O)e]3+ |Fe(H2O)2-= 1 булганда £’ = 0,77 в.
Организм темир сакловчи ферментларининг редокс потенцнали циймати +0,35 дан —0,42 в гача узгаради. Бундан темирпротеин Е = 0,35 в, ферродоксинники ' —0,42 в., бошца темир сацловчи ферментларнинг Е ций-- мати орали^ ^ийматларда булади. t
_ Темир са^ловчи ва бонща ферментларнинг редокс потенциаллари диймати турлича булгани учун орга-
низмда полисахаридлар, о^силлар, ёглар, гидролиз Mav сулотлари ва уларнинг узгариш ма^сулотларидаги функционал группалар босцичли (навбати билан) ок-сидланишга учрайди.
УрггГНилаётган масалалар ва уларни ечиш намуналари
1- мисол. Реакция цайси йуналишда боради: Fe2++ + I2=F*Fe3+ + 2r
Ечиш' намунаси. Оксидлрвчи ва кайтарувчининг узаро таъсири реакцияга киришаётган моддалар стандарт редокс потенциали Ё°, вольтларда ифодаланади) ^ийматига богли^: Масалан, £°Fe3+/Fe2+= 0,76 В; Е°12/2Г~ = 0,54В
К,оидага мувофиц, редокс потенциал цийматц. катта булган сис-теманинг оксидланган шакли редокс потенциал циймати кичик булган системанинг цайтарилган шакли билан узаро таъсирлашади. Бундан келиб чициб, цуйидаги ион тенгламани ёзиш мумкин:
2Fe3+ + 2I“^2Fe2++1“
2- мисол. Бир хил мицдор МпО~ ва Мп+2 дан [ташкил топган системанинг pH = 3; 6 даги редокс потенциалини з^исобланг. Берилган: с(МпО~) = с(Мп+2)
рН=3; pH =6 £=1,51 В
. £ = ?
Ечиш намунаси. Системанинг редокс потецциали
₽ 0,058 с(МпОГ)-с*(Н+)
Е = £и 4- —*.-- 1g--------------га тенг.
п с (Мп2+)
к Р 0,058 , с(МпОГ)-с8(Н+)
Бундан £=1,51+ --------1g-----1——-------
5 с (Мп2+)
1. pH—3; с(Н+) = 10“3 моль/л-,
0,058
£=1,51+——1g (IO-’) В, о
0,058
£= 1,51 +—----- (24-1) = 1,23 В
5
£t = 1,23 В
2. pH = 6; с(Н+) = 10“6 моль/л
0,058
£= 1,51+ -v— 1g (10—«)• В _ — °
0,058
£= 1,51 + —(—48-1) =0,55 В
5
£г = 0,55 в .
Жавоб. рН = 3; Е — 1,23 В pH = 6; Е = 0,55 В
Мавзуни узлаштириш буйича савол ва масалалар
1. Турли системаларнинг оксидлаш-цайтарнлиш имконияти мйц-доран цандай ифодаланади?
2. Стандарт оксиДлаш-^айтарилиш потенциали ^иймати ва оксидловчилик хусусияти орасида цандай боглидлик бор?
3. Металл ионлари'сацловчи биомолекулалар редокс потенциали диймати ^андай омилларга боглиК? *"
4. Редокс системани >$андай элементлардан тузиш ;мумкин?
5. а) Кислород сацловчи оксидловчилар- б) металл ионлари са^левчи системалар редокс потенциалларинн Кандай килнб ошириш мумкин? ’
6. Таркибида темир са^ловчи ферментлар редокс потенциалла-ри катталиги цандай? Турли бирикмалар редокс пОтенциаллари ора-сйдаги фарц цандай тушунтирилади?
7. Стандарт редокс потенциаллар ^ийматини билган ^олда ду-йидаги оксиДланиш-^айтарилиш реакциялари й^налишини аниц-ланг.
2 Fe 2+ -J- 2Hg2+ 2Fe3+ + Hg2+
Лаборатория иши
ОКСИДЛАНИШ- КАЙТАРИЛИШ РЕАКЦИЯЛАРИДА МУВОЗАНАТНИ силжитиш
1-тажриба. Оксидланиш- цайтарилиш реакциялари мувозанатини силжитишга мухит pH йинг таъсири.
Пробиркага 5—6 томчи (2% ли масс.) Na3AsO3 эритмасидан ва 3 томчи (2% ли масс.) J2 эритмасидан еолинг. Бунда As3+ ни As5+ гача оксидланиши туфайли 12 ранги учиб кетади.
Na3AsO3 + 12 + Н2О =₽* NaH, AsO. = 2NaI «Э «3 1 А * Л A »
AsO3F+H2O — 2e“->H2AsO- 1 l° + 2e-->2J- 1
Мувозанатни унгдан чапга силжитиш учун 8—10 томчи (10% ли масс.) НС1 эритмаси ва 1 томчи крахмал кУшинг. Эритма 12 ажралиб чи^иши туфайли кук рангга буялади. Оксидланищ-кайтарилиш реакциялари-да мувозанатни силжитишга pH нинг таъсири ^ацида хулоса чикаринг.
2- т а ж р и б а. Комплекс бирикма к0СИл булиши натижасида оксидланиш-цайтарилиш* реакциялари му-возанатининг силжиши.
Пробиркага 3 томчи (2% ли масс). FeClg эритмасидан ва шу концентрацияли KI эритмасидан 1 томчи ^уйинг.
2FeCI3 + 2KI = 2FeCI2 + I2 + 2КС1 реакцияси натижасида йод ажралиб чицади. Уни эритма ранги цизил-^унгир тусга киришидан аницлаш мумкин. Комплексон Ш [NazHzV] концентрланган эритмасидан цушинг. Бунда цизил-^нгир рангли эритма рангсизла-нади. Реакциянинг ^нгдан чапга силжиши Fe3+ нинг комплексон III билан муста^кам комплекс бирикма ^осил цилиши ва унинг натижасида [Fey] / [Fey] нинг редокс потенциалининг камайиши окибатида рун беради.
FeCl3 -р Na2[H2y] = H[Fey] + 2NaCl + HCI оксидланиш-кайтарилиш УСУЛИ БИЛАН ТИТРЛАШ Пёрманганатометрия
Мавзунинг ма^сади. Оксидланиш-кайтарилиш реак-цияларининг бориш цонуниятларини билган ^олда биологик объектлар ва доривор препаратлар ^амДа санитария-гигиена характерига эга булган объектларни пер-манганометрия усулида ани^Лаш.
Урганилаётган мавзунинг а^амияти. Титрлашнинг оксидланиш-кайтарилиш усули доривор препаратларни ““клиник ва санитария-гигиена жи^атидан текширишда . кенг ишлатилади. Калий перманганатнинг юцори оксидловчилик хусусиятидан фойдаланган ^олда уни биологик объектларда ^айтарувчиларни ани^лашда цуллаш мумкин. Масалан, перманганатометрия усули билан сийдикдаги сийдик кислотаси ми^дорини, цон зардоби-да Са2+ни, цонда ^анд моддасини, цон каталаза фер-менти активлигини ва бош^аларни ани^лаш мумкин. КМпО4 нинг оксидловчилик хоссас-идан* тиббий амали-ётда фойдаланилаДи, унинг 0,1—0,55% ли сувли эритмаси сиртга яраларни ювйш учун антисептик восита сифатида, 0,01—0,1% ли эритмаси о₽из ва томоцни ча-йиш учун, 0,02—0,1 % ли эритмаси эса за^арланганда меъдани чайиш учун ишлатилади.
Бошлангич даража
1. Оксидланиш-цайтарилиш реакцияларининг бориш ^онуниятлари.
I* Электрон баланс ва ион-электрон усулида оксидла-Т1иш-дайтарилиш реакцияларини тузинг.
Мустздил тайёрланиш учун уцув материаллари
1. А. В. Б а б ко в, Г. Н. Горшкова, А. М. *Ко н о Н о в. «Практикум по общей химии с элементами количественного анализа». М.,.1978, 135-бет. '
2. Б. М. Алексеев. «Миддорий анализ». 1972. 378-бет.
3. И. К. Цитович. «Курс аналитической химии». М., 1985. 271- бет.
МАЪЛУМОТЛАР БЛОКИ '
Перманганатометрик титрлаш усули
Перманганатометрия усули калий перманганатнинг дайтарувчиларни оксидлаш реакцияларига асосланган. у Калий перманганат оксидловчилик хоссаларини кисло-' тали, нейтрал ва ишдорий мудитларда намоён дилади. ОксиДланишни титриметрик анализда кислотали мудит-i да олиб борилади, чунки унда бу модданинг оксидлов-t чилик хусусияти кепрок намоён булади, титрлашда эса унинг Таркибига кирган ва рангли МпО4- деярли ранг-if’ сиз Мп2+ гача дайтарилади. Эквивалент нудтага эри-' шилгандан с^нг ортидча томчининг биринчисиёд титр-\ ланаётган суюдликни пушти рангга буяйди, бу эса титрлащни индикаторсиз олиб бориш имконини беради. Ишдорий ёки нейтрал мудитда дайтарилиш жараёнида МпО(ОН)г туд дунгир чукма досил булади, эритмада унинг мавжудлиги эквивалёнт нудтани анидлашни ди-ййнлаштиради. Модда эквиваленти деб оксидланиш-дайтарилиш реакцияларида модданинг бир электронга эквивалент миддорига айтилади, шунинг учун оксидловчи ёки дайтарувчи эквивалентининг моляр массасини модданинг бир молекуласи дабул диладиган ёки йудо-тадиган электронлар сонидан дисоблаб чидарилади. Шундай дилиб, оксидловчи (дайтарувчи) нинг эквивалент массасини бир молекуласи дабул килган (й^цот-ган) электронлар сонига б^линади.
^КМпО4 эритмаси концентрацияси бошлангич модда булган Шовул кислотасининг стандарт эритмаси ёрда-мида анидланади. Узаро таъсирлашув дуйидаги тенгла-ма буйича боради: •
2КМпО4 + 5Н2С2О4 4- 3H2SO4 = 2^nSO4 + K2SO4 +
+ 10СО2 + 8Н2О
> MnO~ + 8H+ + Г.е~-> Mn2+ + 4H2O C2O2-—2e~->-2CO20
2
5
2МпОГ + 5ОД-+ 16H+ 2Mn2+ + 10CO“+8H2O°
KMnO~ реакция натижасида 5 та электронни бириктириб ол-гани учун эквивалентами г моляр массаси шу массанинг 1/5 цисмига тенг.
М(1/5 КМпО4) = - = 31,61 г!моль га тенг.
5
Оксалат кислота реакция натижасида иккита электрон беради, шунинг учун эквивалентнинг модяр массаси:
М(’/2 = бЗ.ОЗг/лолб гатенг.
Перманганатометрия усули ц^лланилаётган вацтда цушимча (кераксиз) жараёнлар борадиган б^лса, цайта титрлаш усулидан фойдаланилади.
Масалан, тиббиётда ишлатиладиган NaNO2 эритмаси титри ва эквивалентнинг моляр концентрациясини анидлаш, цайта титрлаш усул цуйидаги реакцияларга асосланган.
1. 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4+ + 2MnSO4 + 3H2O
NO~ + H2O —2e-*-NO~+2H+.I5 МпО4-+ 8H++ 5е-> Mn2++ 4H2012
5NO2- + 2MnO~ + 6H+ =₽± 5NO-+ 2Mn+2 + 3H2O
2. 2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 4-10CO2.+8H2O
C2O2-—2e->2CO° 5
MnO4- + 8H+ + 5e->Mn2+ + 4H2O 2
5C2O2- + 2MnO- + 16H+ = 10CO° + 2Mn2+ + 8H2O
К,айта титрлаш усулининг мо^ияти орти^ча олинган КМпО4 Нинг титрланган эритмасига озгина кислота шиб, натрий нитрит эритмасидан аниц \ажмда ^ушнла-ди ва калий перманганатнинг ортйцча ми^дори оксалат кислотанинг стандарт эритмаси билан титрла-нади..
Масалалар ва уларни ечиш намуиаларн
1-масала. КМпО4 эритмаси концентрациясинн аницлаш учун ишлатиладиган 500 мл 0,05 моль/л ли эритма тайёрлаш учун керак булгйн оксалат кислота ми^дорийнани^ланг.
Берилган: V (эритма) — 500,0 мл *
М (Н 2С2О4 • 2Н2О) — 126,1 г/моль
Л1(КМпО4) = 158,0 г/моль с (*/2-Н2С2О4) = 0,050 моль/л m (Н2СгО4-2Н2О) = ?
Ечиш намунаси. Реакция тенгламасини тузамйз: *
’ 2КМпО4 + 5Н2С2О4 + 3H2SO4 = 2MnSO4 + Кг5О4 +;lpCOs + 8H2O
MnOf+8H+ + 5e~-> Mn* 1 2 *+ + 4H2O| 5
CjO2-—2е~-* 2СО° 2
2МпО~ + 5С2О4“ + 16Н+ 2Мп2+ + 10СО£ + 8Н2О
Тепгламадан куринадики, Н2С2О4 эквивалентининг моляр массаси цуйидагига тенг: . - -
М (1/2 Н2С2О4-2Н2О) — М^^у<-2—2— = —63,05 г/моль
2. .500,0 мл эритмадаги оксалат кислота массасини топамиз:
п A- ou ™ M(i/2НАО4• 2Н2О) • с е/2Н2С2О4)• У(ЙАО<)
1000 „ „ 63,05-0,050-500,0 г/моль-мл ,
т^иС^-гНаО) =-------:-— ----------------------1,581 г
1000 моль-мл
Жавоб. т (Н2С2О4-2Н2О) = 1,581 г
2- масала. 500,0 мл ли Улчов колбасидаги сувда 0,8 г КМпО4 эритилади. 20,00 мл 0,04741 моль/л оксалат кислота эритмасини титрлаш учун 18,30 мл КМпО4 эритмаси сарф булади. КД1пО4 эритмаси эквивалентининг моляр концентрациясинн ани1у1анг.
Берилган: т (намуна) =0,8 г
V (эритма) =500,0 мл
V (Н2С2О<) =20,00 мл с (V2 Н2С2О4) =0,04741 моль/л V (КМпОч) = 18,30 лл
М (КМпО4) = 158,01 г/моль
с (»/, КМпО4) = ? 7' (КМпО4) = ?
Ечиш намунаси.
1. Реакциянинг бориш тенгламаси:
2КМпО4 + 5HiCA + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O M (1/5 KMnO4) = 31,61’ ^моль
2. Эквивалент цонунига мувофи^ КМпО4 эритмаси эквивалентининг
моляр концентрациясинн топамиз:
zt /С VM n / eC/gHAOO-.VtHsCA) c(l/5KMnO4) =-----------------
V(KMqO4)
. 0,04741-20, Омоль/л.мл 'л ,
£(*/* KMnO4) =------------------------= 0,05181 моль/л
18,30 жл
3. c(*/5 KMnO4 цийматидан келиб чи)\иб, шу эритма титрини ^и-соблаймиз.
c(VRKMnO4).Af(*/5KMnO4)
WrA) =---------------------------
0,05181-31,61
Т(КМпО4) = —-----= 0,001638 г!мл
1000
3- масала. Натрий нитрит NaNO2 — тиббиётда стенокардияда ^он томирлари сицилишида томир кенгайтирувчи восита сифатида ишлати-лади. Бир марталик дозаси 0,1 — 0,2 г. Препарат анализи цуйидагича олиб борилади: 10,0 мл 0,5 % ли (масс) эритма улчов колбасида 200 мл гача суюлтирилади. КМпО4 с (1/* КМпО4) = 0,01025 моль/л нинг 40,00 мл эритмасига 20,00 мл H2SO4 (1:4) эритмасидан 20 мл ^уши-лади ва 20,00 мл NaNO2 эритмаси цуйиб аралаштирилади ва реакция тугалланиши учун 10 — 15 минутга ^олдирилади. Сунгра эритма 70 — — 80°С гача ^издирилади ва ортиб долган КМпО4 эритма рангсизлан-гунча Н2С2О4 эритмаси билан титрланади. Бунда масалан, H2G2P4, с (V2 Н2С2О4) = 0,01035 моль/л эритмасидан 21,45 мл сарфланади. NaNO2 нинг масса улуши (% да), еуюлтирилган эритмадаги моляр концентрацияси ва титрини ^иеобланг (р = 1,00 г/мл).
Берилган: V (NaNO2) = 20,00 мл .
, с (i/5 КМпО4) = 0,01025 моль/л
М (NaNO2) = 69,0 г/моль
V (КМпО4) = 40,00 мл с (!/в КМпО4) = 0,01035 моль/л V (Н2С2О4) =21,45 лл___________________
с (V2 NaNOj) = ? Т (NaNO2) = ? ro%(NaNO2)=?
Ечиш намунаси
1. Реакц'иянинг бориш тенгламаси:
1) 5№No2 + 2КМпО4 + 3H2SO4 = 5NaNO3 + K,SO4 + 2MnSO4 + 3H2O NO7 + H2O —2e-->NO7 + 2H+ 5
MnO4"+8H+4-5e-->-Mn2++4H2O 2
5NOf + 2MnO^ + 6H+-* 5NO7 + 2Mn2++3H2O
2KMnO4 + 5H2C2O4’+ 3H2SO4 = 2MnSO4 + K2SO4 + + 10CO2+8H2O
• MnO74-8H+4-5e-->Mn^+ + 4H2O 5
1 ОД- —2e-.->2CO°2 2
2MnO- + 5СД- / 16H+-^ 2Mn2+ + 10CO° + 8H2O
Тенгламадан куринадики, NaNO2 эквивалентининг. моляр массаси
м (V2 NaNOj) — M (№NOa)_ _ 34, go г/модь ra тенг!
2 . NaNO2 эритмаси эквивалентининг моляр концентрация-синй. топамиз:
c(1/2NaNOa) =
_ (У (KMnOj - с (1/5 KMnO4)] - [У (НаС2О4) - с (*/6 HAOJ
1. V (NaNO2)
С (J/2 NaNQ2)= (40,00-0,01025 - 21,45-0,01035) =
' 27 20,00 ;
= 0,009270 моль/л. '
. 3. NaNO2 эритмаси титрини топамиз:
т см мп 1 _ с <1Z2 NaNOa)-M (Va NaNOa)
... \ 0,009270-34,50 a пало mo , .
T (NaNOjj) = —-——-----------= 0,0003198 г/мл
4, Эритмадаги NaNO3 масса улушини (%) топамиз: w % (NaNO2) =
_ M(l/2NaNOa) [V(KMnO4)-c(»/6KMnO4)-V(H2p2O4)-c(l/2H2C2O4)].
1000-V (NaNOa)-10
200-100
1000-V (NaNOa)-10’
w % (NaNOJ =
Bl 34’5 f40’00 — °.01025) — (21,45 • 0,01035)-200-100 _ q 64 % 1000-200-10,0
Жавоб:
c (»/a NaNOa) = 0,009270 моль/л, T (NaNOa) = О.ОООЗГ98 г/мл, w% NaNO^) = 0,64%.
Масала б^Аича саволлар
1. Перманганатометрик титрлаш усули дандай реакцияларга асосланган?
Жавоб: Бу усул асосида МпО4— нинг кислотали му^итда Мп+* гача цайтарилиш ва ашщланаётган модданинг оксидланиш реакция-лари ётади.
2. Нима Учун титриметрик анализда купинча кислотали му^итда перманганат билан оксидлаш реакциялари дУЛланилади?
Жавоб: биринчидан, перманганатнинг кислотали му^итда оксидловчилик хусусияти ишцорий ва нейтрал т^итдагига Караганда анча говори, иккинчидан, кислотали му^итда титрлашда сувда эрув-чан, деярли рангсиз МпН ионлари косил булади. Нейтрал ва иш-цорий мукиТДа Зса тУк к^нгйр МпО (ОН)2 чукмаси тушади, ишцо-7—7534 97
рий мудцтда янаэквиаалентлик нухтасини белгилашни цийннлаш-тирувчи рангли МпОч2—хосил булади.
3. Буусулда цайси индикатор ишлатилади?
Жавоо: калий перманганат билан титрлаш индикаторсиз олиб борилади, чунки, титрлаш охиридаги унинг ортицча бир том'чиси эритмани яцкол пушти рангга буяйди, бу эса эквивалентлик нукта-сига эрншилганликни курсатади.
4. КМпО4 эквивалентининг огирлиги турли мухитларда бир хилми?
Жавоб: й?к, бир хил эмас, чунки турли мухитда МпО4— иони бириктириб олган электронлар сони хар хил:
Масалан, кислотали мухитда; МпО^- 4-8Н+4-5е— -► Mn2+-f-4HiO
□
нейтрал мухитда: МпО” 4- 2Н,0 4- Зе” -► МпОг + 4ОН—
. •м«,ВМ).лаа о
ишдорий мухитда: МпО^- + е— -> МпО2”
М (КМпО4) .
М (КМпО4) = - -—~
5. Нима учун КМпО4 нинг стандарт эритмасини аник тортма буйича тайёрлаб булмайдиУ
Жавоб: КМпО4 доимо дайтарилиш ма^сулотлари садлайди, масалан, дунгир рангли чукма — МпО (ОН) 2, ундан ташдари, сувга тушиб долган аммиак, органик моддалар таъсирида дайтарилади. Шунинг учун КМпО4 эритмасини тортма буйича тайёрлаб, 7—10 кунга доронги жойда долдирилади, чунки ёруглик КМпО4 парчала-нишини тезлаштиради, чукмага тушган МпО (ОН) 2 шиша фильтр ордали фильтрлаб олинади ва оксалат кислота эритмаси ёрдамида стандартланади.
6. Бу усулдан клиник анализда хам фойдаланиладими?
Жавоб: Бу усулдан-сийдикдаги сийдик кислотаси, дондаги кальций, оксидловчи фермент каталазани, санитария-гигиена анализида ичимлнк суви манбаъларидаги сувнинг оксидловчанлигини анидлаш- * да, дори шаклларини, масалан, водород пероксид, натрий нитрит, темир (II)-сульфат ва бошдаларни анидлашда ишлатилади.
Мавзунинг узлаштирилишини мустадил назорат дилиш учун савол ва масалалар
1. Перманганатометрик титрлашнинг модияти нимада? Нима учун бу усулда индикатор ишлатилмайди?
2, Куйидаги реакцияларда оксидловчи ва дайтарувчиларнинг моляр эквивалент массаларини хисобланг:
2.L КМпО4 + MnSO4 + НаО->- K2SO4 + МпО, 4- H,SO, 2-2. КМпО4 4- FeCl,4- НС1 МпС12 4- FeCls 4- КС1 4- Н,0 2.3. КМпО44-Н2О,-> МпО,+ КОН4-О24-.Н2О
Жавоб: 2.1. М (г/3КМпО4) =51,6 г/моль
М (i/2MnSO4) =75,0 sJmom
2.2. М. (1/6КМпО4 =31,01 г!моль; И (FeCI2) = 126 г/моль
м С/з КМпО4)=51,3 г/моль; М (*/* Н2О2) = 17 г/моль
3-Те“иР препаратлари, хусусан, FeSO4-7H2O тиббиётда турли ,.^|«ГОлогияли гипохром (темир тан^ислигидан келиб чи^адиган) ане-зКммярни даволашда ишлатилади. Препаоатнинг катталар учун до-
- Mrlt куннга 0,3—0,5 г дан 3—4 ма^ал. Тиббий препарат зргсобланган, -ЭДвшибида 0,28 г FeSO4-7H2O са^лайдиган БЛО таблеткасининг '£'-‘Згавмси таркибидаги темир массасини дисобланг. Битта таблетками-мл ли Улчов колбасила эритишдан з^осил булган эритмани
" Жмз цилиш учун КМпО4 эритмасини цандай концентрацияда тай-керак? Хосил булган эритма титри дандай?
Жав<>б: т (Fe) =0,056 г; с (1/з КМпО4)=0,01 мрль/л.
;;м-: ,4. Водопровод сувининг сифати санитария ходимлари томони-ДМГ доим назорат »;илиб турилади, Уларнинг вазифдси.сувнинг ок-' еидланувчанлигини текшириш ^исобланади. Сувнинг калий перман-Аганат билан оксидланувчанлиги шартли курсаткЦр б?либ, ундаги цайтарувчиларни характерлайди. Оксидланувчанлик 1 литр сувдаги
\ моддани оксидлаш учун сарф булган калий перманганатнинг мг лар . , сони билан белгиланади. Сувнинг. оксидланувчанлигини анидлащ
’ уиун 100,0 мл водопровод сувига 5,0 мл H2SO4 (1:3, му\ит учун), сУцгра 8,00 мл 0,01025 моль/л КМпО4 эритмаси кУшилади ва ара-"Лашма ^айнатилади. ^айнатилгандан сунг аралашмага 10,00 мл 0,01220 моль/л оксалат кислота з^ушилади. Кислота долдигини титр-д_ лаш учун 4,45 мл 0,01025 моль/л КМпО4 эритмаси сарфланган. Сув-• - нинг оксидланувчанлигини ани^ланг.
х Жавоб: А=1,73лг/л
' - б- К°н зардобидаги кальцийни аницлаш учун 0,500 мл зардобга
’ мУл аммоний оксалах кУшиб, Са2+ ни СаС2О4 з^олатида чуктирила-. ДИ. Чукма фидьтрлаб олиниб, ювилади ва сульфат кислотада эрити-лади. Эритма 0,01 моль/л калий перманганат билан Учмайдиган пуш^и рангга киргунча титрланади. Агар титрлаш учуй 2,50 мл калий перманганат эритмаси сарфланган булса, 100,0 мл зардобдаги кальций мивдорини (мг) з^исобланг.
Жавоб: т (Са) = 100лг. .
6. Сотувдагй тиббий препарат Н2О2 дан 1,00 мл олиб улчов кол-басида 100,0 мл гача сув билан суюлтирилади (р (Н2О2) 1,0 г/мл). Титр.лашда суюлтирилган эритманинг \ар 20,00 миллилитрига 0,0198 моль/л КМпО4 эритмасидан Уртача 16,90 мл. сарф бУлади. Тиббий препаратдагй HXh масса улушини (%) аникланг?
Жавоб: со % (Н2О2) =2,84%.
1-лаборатория иши
КАЛИЯ ПЕРМАНГАНАТ ЭРИТМАСИ КОНЦЕНТРАЦИЯСИНИ АНИКЛАШ
Ишнинг бориши: титрлаш, учун колбага 10,0 мл H2SO4 эритмаси (1:4), 2,0 мл MnSO4 нинг туйинган эритмаси; (катализатор) ^амда 20,00 мл титрланган оксалат кислотадан пипетка билан улчаб. солинади ва калий перманганат эритмаси билан доки бир томчидан 30 ^екундда учмайдиган оч пушти ранг ?(осил б^лгунча .титрланади. Титрлашни яна 2 марта такрорланади. Экспериментал натижаларни 8-жадвалга ёзинг. Бир-би-
7* 99
рига я^ин натижалардан урта арифметик 'цийматни олинг ра калий перманганат эритмаси эквивалентининг моляр концентрацияси ва титрини ^исобланг.
Тартиб № V (Н2С.О4). мл С (*/. Н,С,О.). моль/л V (КМпО4), мл f(*/,KMnO4) моль/л Т(КМпО4) г/мл
1
2
3
^исоблашни куйидаги тенглама буйича олиб борин г.
с (*/5 KMnOj = c(1/2H»C2OJ-V jH^O4) м л
т (KMnoj ~ -С(Г/5 К^-М (^кмпо,) г/мл v v 1000
М f/j KMnOJ—моляр эквивалент массаси
М (% КМпОД— 31,61 г! коль.
2-лаборатория и ши
ЭРИТМАДАГИ ВОДОРОД ПЕРОКСИД МАССАСИНИ КОНТРОЛ-АНАЛИТИК аницлаш
Водород пероксид КМпО4 билан оксидланиш-цайта-рилиш реакциясида ^айтарувчи хоссасини намоён ци-лади ва жараён куйидаги тенглама буйича бор^ди:
2КМпО4 + 5НаОа + 3HaSO4 = 2MnSO4+K8SO4+5Oa+8HaO
MnO4~ + 8Н+ + 5е“ ->Mn2+ + 4НаО 2 О*-—2е-->0° 5
Ишнинг бориши: титрлаш колбасига маълум з^ажм-да (укитувчи контрол вазифа сифатида беради) Н2О2 эритмасидан олинг. 3,0 мл H2SO4 эритмасидан (1:4.) ц^шинг ва КМпО4 эритмаси билан пушти ранг ^осил б^лгунча титрланг. Титрлашни яна 2 марта такрорланг. Экспериментал натижаларни жадвалга ёзинг. Ухшаш натижалардан урта арифметик кийматни олиб ^исоб-ланг. -
Тартиб № V (КМпО4), мл с (1/5 КМпО4), моль/л V (эр-ма H2Ot). мл а> % (Н,О,)
1
2
3
ТЫ" .
Хис°блаппш куйидаги тенглама буйича олиб боринг. /1 \ /1 \
М - Н2О21-7 (КМпО4)-с I-КМпО4
т(НА) = -^—;oo--?5---------------------Л
КМпО4) —эритма эквивалентининг моляр концентра-
- «ч цияси
м.е/,••НА) — моляр эквивалент массаси.
М С/2 Н2О2) = 17 г/моль ' ' » '
. 3-л а б о р а т о р и я иши '
•„ НАТРИЙ НИТРИТ ЭРИТМАСИ МОЛЯР ЭКВИВАЛЕНТ КОНЦЕНТРАЦИЯСИ ВА ТИТРИНИ АНИКЛАШ (КАЦТА ТИТРЛАШ)
Ишнинг бориши: . титрлаш учун кол бага 25,00— 30,00 мл КМпО4 эритмаси солинади, 10,00—15,00 мл г 20% ли сульфат кислота эритмаси ва 20,00 мл натрий нитрит эритмаси цушилади.
. ' Колба ^огщорини ёпиб, э^тиёткорлик билан яхшилаб аралаштирилади ва реакцияни охирига етказиш учун . 10—15 минут тутиб турилади. С^нгра эритма 70—80°С гача иситилади ва оксалат кислота эритмаси билан ка- лий перманганат ранги бир томчидан бутунлай йуцолиб ; кетгунча титрланади. Буни яна икки марта такрррланг, экепериментал натцжаларни жадвалга ёзинг. Ухшаш ,натижалардан урта арифметик ^ийматини олинг ва нат-
Хисоблашни куйидаги тенглама буйича олиб борин г. с С/2 NaNO2) =
_ (Г (KMnO4)- С е/6 КМпО4)] - [У(Н2С2О4)-с (У2 Н2С2О4)] моль
V (NaNOj) ♦ л
Т (NaNOJ NaNO2) г!мл
Йодометрия
Мавзунинг ма^сади: Оксидланиш-цайтарилиш реак-" цияларининг бориш цонунларини билган ^олда йодометрия усулида доривор препаратлар мицдорини анидлаш-' ни урганиш.
Урганилаётган мавзунинг адамияти. Титрлашнинг ' оксидланиш-дайтарилиш усули доривор препаратларни диализ дилишда, санитария-гигиена ва клиник анализ-да кенг ишлатилади.
Иодометрик титрлаш усулида дайтарувчилар дамда оксидловчилар миддорини анидлаш мумкин, бу эса тит-риметрик анализда ундан кенг фойдаланиш имконини беради. Бу усул билан эритмаларда альдегид ва кетон группаларни, ацетон, хинон, антипирин,' водород пероксид, сувдаги эркрн хлор, мис (II), нитритлар ва бош-даларни анидлаш мумкин. Мойлардаги йод сонини анидлаш ёгларни озид-овдатга яродлилигини бадолаш-да катта адамиятга эга,
Бошланрич даража
1. Оксидланиш-дайтарилиш реакцияларининг бориш донунлари. '
2. Электрон баланс ва ион-электрон усулда оксидланиш-дайтарилиш реакцияларини тузиш.
Мустадил тайёрланиш учун удув материалларн
1. И. К. Цитович. «Курс аналитической химии». М., 1985, 282- бет.
2. А. В. Б а б ков, Г. Н. Горшкова, А. М. Кононов. «Практикум по общей химии с элементами количественного анализа». М., 1976, 142-бет.
3. В. Н. Алексеев. «Количественный анализ». М., 1972, 395- бет.
МАЪЛУМОТЛАР БЛОКИ
ЙОДОМЕТРИК ТИТРЛАШ УСУЛИ
Бу усул эркин йод (12)нинг ион (I-) долдаги йод-гача дайтарилиши билан боглид булган оксидланиш-Дайтарилиш жараёнларидир.
1° + 2е-->2Г
ёкя I"* ионларини 1° гача оксидланишга асосланади:
2I-—2е-->1“
4
Эркин Йод нисбатан кучсиз оксидловчи, анион (I'') кучли цайтарувчидир. Титриметрик анализда йод тмасидан цайтарувчиларни аницдащда—ту три титр-да ва KI эритмасидан алмашиниш усулида океид-иларни анидлаШда фойдаланилади. Оксидловчи-инг Kira таъсири натижасида уларга эквивалент -м#Й^дорда молекуляр йод ажралйб чидади. Сунгра йод ЧЙФидартланган тиосульфат натрий эритмаси билан ;|цш(ланади. Шундай цилиб, оксидловчининг мйцдори :1Йуралиб чи^цан 12 мицдорига эквивалент булган JWS2O3 ^ажмига кура ^исобланади. Бу усулда крахмал 'эдвдикатор булиб, у йод билан т^д кук рангйи комплекс-<' адсорбцион оралиц бирикма досил цилади^
•^7 Дайтарувчилар миддорини йодометрии усулда дайта • тдтрлаш ордали анидлаш мумкин. Бунда текширилаёт-- ’ ган эритмага ортидча миддорда титрланган йод эрит-, маси душилади. Анидланаётган модда билан йоднинг эквивалент миддори реакцияга. киришади. Иоднинг ор-тйдча дисми ишчи эритма «— тиосульфат натрий билан титрлаб анидланади. Шундай дилиб, йоднинг умумий ва реакцияга киришмаган дисмларини билган- долда ' текширилаётган моддага эквивалент булган йод мид-
Дори дисобланади.
Масалалар ва уларни ечиш намуналари
1-масала. Иоднинг 5% ли сув-спиртли эритмаси антисептик во-сита сифатида дУлланилади. Na2S2Os нинг стандартланган эритмаси билан миддорий анализ дилинадиган бу эритманинг моляр концентрацияси дандай?
w % di) =5,0 %
М (1а) = 253, г!моль
р (эритма) = 1,0 г!мл
с (i/2 1») = ?
Ечиш намунаси
Реакциянинг бориш тенгламасиг
2Na2S2Os+I2=Na2S4Oe + 2Na[
2S2O|~ — 2e-->S4O|“
I° + 2e-->2J-
2S2O|- + I^34O|--h2I-
Бундан йод моляр эквивалент массаси:
М С/гЛг) = ~= 126,9 г!моль.
* *
1. 1000 мл йод эригмасининг (р = 1,00 г/жЯ)мас саси 1000 г. 1000 г эритмадаги 12 массасини топамиз:
... ® % (I2)-m (эритма) 5,00-1000-г
• . т (!•) =-------7—-----------=:--------------= 50,0 г
100 % 100 %
2. Бу эритма моляр эквивалент концентрациясинн топамиз:
> /1/ т А»)
М (1/2 I2)-V(pp)
50,0 г
с (l/2 Is) = —-— ---------— = 0,3940 жаль!л
127 п моль-\ л
Жавоб; с х/2 12) = 0,3940 мольГл
2- масала. Маргимуш (мишьяк) ангидрид А52СЬ-мрщдорини аниц-лацг йодометрик титрлаш усули билан бажарилади. Бу препарат тери касалликлари ва стоматологияда некрот'ик восита сифатида кам^онлик, дармонсизлик, асаб чарчаганда ичишга буюрилади. 1,24 г препаратни 250,0 мл ли Улчов колбасидаги сувда эритишдан ^осил булган ASjO3 масса улушини (%) ани^ланг. Х°сил булган эритманинг 25,00 мл ни оксидлаш учун 0,0980 моль/л 12 эритмасидан Уртача 24,10 мл сарф булган.
Берилган:
т (препарат) = 1,24 г
V (эритма) = 250,0 мл
V (AS2O3) = 25,00 мл у (К) =;.24,10 ял с (1/2 1.з) = 0,0980 моль!л М (AS2O3) = 197,8 г/моль
w % (AS2O3 — ?
Ечиш намунаси
Реакциянинг бориш тенгламаси:
AS2Os + 51а 4-5Н2О = 2H3ASO4 + 4HI
AS2O3 + 5Н3О — 4е~"->- 2ASO|X-{- 10Н+ 1
Т22е~ -»21~ 2
Бундан, мишьяк ангидрид .'моляр 'эквивалент массаси дуйидагига тенг булади: <
М (>/* AS2O8) = М (у ?Оз) = 1^82 = 49,46 г/МОЛь 4 4
1 М (V4 АзаО3)-У (1а)-с (М2 12)-100-У (эритма) _
W ° Sa 3 1000 -т (препарат) -V (AsaO3)
49,46-24,18-0,0980.100-250,00 г.л.моль-мл ,п
=-------------------------------------------- = 94,19 %
1000-1,24-25,00 моль.л.г-мл
Жавоб: w % (As2O3) = 94,19 % .
3-масала. Н2О2 дезинфекцияловчи восита сифатида ювиш ва чайиш.учун ишлатилади. Унинг 2,00-мл и 200,0 мл гача суюлтирилганда шу эритманинг 20,00 мл ни титрлаш учун 0,01800 моль/л натрий тиосульфат эритмасидан Уртача 19,00 мл сарф булган. Суюл-тнрилган ва суюлтирилмаган эритмаларда Н2О2 масса улушини (%) ва моляр эквивалент концентр'ациясини анидланг.
Берилган:
fc' V (HjOa) = 2,00 мл
L V (Na2S2O3) =- 19,00 мл
с (1/2 Na^Og) = 0,01800 моль/л М (Н2О2) = 34,0 г/моль V (эр-ма Н2О2) = 20,00 мл р (эр-ма) = 1,00 г/мл ,
х о» % (Н2Ог) = ? с ?/г Н2О2) = ?
Ечиш намунаси
Реакциянинг бориш тенгламаси:
Н2О2 + 2KI + H2SO4 = K2SO4 +12 + 2Н.О'
Н2О2 + 2Н+ + 2е- 2НаО !
21~ — 2е~->-1° . ‘
H2O2 + 2I- + 2H+->2H2O + lf
Бундан водород пероксид моляр эквивалент массаси
М (*/2 Н2О2) = ^М^2^2- = 17 0 г/М0Ль га тенг.
2 2
Реакцияда ажралиб чидан йод Na2S2O3 эритмаси билан титрлаб олинади-
2Na2S2O3-ф I2-* Na2S4Oe + 2NaI
Эквивалент цонунига мувофи^ Н2О2 моляр ^эквивалент концентрациясини топамиз;
с (V2H3O2)-V (НаО2) = с (NagS^-V (Na3SaO3) 0,0186-19?00 моль/л-мл ,
c(V2H2O2)= ’ ---———=0,01770 моль/л
4\J f\J\J MJl
с Р/.Н.О.) суюлтирилгунча
0,0177-200 , .
-----г—=р 1,770 моль/л га тенг. 2
.. c(V. Н2О2)-М Р/. Н2О2)-Ю0 1,77-1,0-100
w * (Н2°2) = -—7—“1555----------“ 1W0
3,01%.
Жавоб:
с Р/.НгОг) суюлтирилгунча — 1,770 моль/л
с (М2 Н2О2) суюлтирилгандан сунг —0,01770 моль/л (Н2О2)=3,01%
Масала буйича саволлар
1. Иодометрик анализ усули нимага асосланган?
Жавоб: йодометрик титрлаш асосида ^уйидаги оксидланиш-цайтарилиш реакцияси ётади.
1° + 2е- 21-
2. Бу усулнинг имкониятлари цандай?
Жавоб: 1 1$айтарувчиларни стандартланган йод эритмаси билан тУгридан-т^гри титрлаб аницлаш; 2) оксидл$>вчиларни алмашиш усу-лида м^л KI ишлатиб, ажралиб чи^дан 12 ни Na2S2O3 эритмаси билан тйтрлаб анш$ланади. “
3. Иодометрик титрлаш усулида дайси индикатор ишлатилади?
Жавоб: индикатор сифатида йод билан тУд кУк рангли комплекс адсорбцион аралаш бирикмалар досил дилувчи крахмал ишлатилади.
4. Бу усул клиник анализда ишлатиладими?
Жавоб: йодометрик титрлаш усули соддалиги ва анидлиги буйича энг яхшиларидан бири дисобланади; клиник анализда эса донда-ч ги данд миддорини, пероксидаза ферменти фаоллигини, водород ' пероксидни, формалинни, ичимлик сувидаги долдид хлорни анидлаш-да кенг ишлатилади?
Мавзунинг узлаштирилишини мустаднл назорат дилиш учун савол ва масалалар
1. К,айтарувчи ва оксидловчиларни йодометрик анидлаш нимага асосланган?
2. йодометрик анидлашда нималарга риоя дилиш керак?
3. Нима учун оксидловчиларни йодометрик анидлашда мул KI ишлатилади?
4. Сувдаги эркин хлорни анидлаш унинг йодидлардан эркин йодни сидиб чидаришига асосланган. К,уйидаги усулда бажарилган , иш натижасига кУра сувдаги эркин хлор масса улушини (%) дисобланг: колбага 20,00 мл сув дуйиб, устига 10,0—15,0 мл 10% ли KI эритмаси солинган. Ажралиб чиддан йод крахмал иштирокида 19,20 мл 0,01950 моль!л натрий тиосульфат эритмаси билан (р=1,00 г/мл) титрлаб олинади.
Жавоб: со % (С12) =.0,07%. ....
5. Аскорбин кислота (витамин С) янги узиб олинган сабзавот ва меваларда куп булади. У организмда оксидланиш-дайтарилиш жара-ёнларини бошдариб туради. Аскорбин кислота одам организмида синтез дилинмайди. Витамин С тандислиги ёки йУдолиб кетиши гипо-ёки авитаминоз ривожланишига олиб келади, бу эса цинга касалли-гининг келиб чидишига сабабчи булади. Аскорбин кислота кУпгина витамин, поливитамин препаратлар таркибига киради. Унинг анали-зи йодометрик усулда олиб борилади:
ОД8О, + !,-> ОДА + 2HI
1,20 г препаратни 100,0 мл сувда эритишдан досил булган аскорбин кислота масса улушини (%) дисобланг. Шу эритмадан 15,00 мл ни крахмал иштирокида титрлаш учун 21,00 мл 0,09730 моль/л йод эритмаси сарфланган. Аскорбин кислота эритмаси "моляр эквивалент концентрацияси дандай? '
Жавоб: с 1*/« ОДА) =0,1362 .моль/л; w% ОДА) = 99,89%
7. Формальдегид миддорини анидлаш уни йоднинг ишдорий эритмаси билан чумоли кислотасигача оксидлашга асосланган:
О О
Н— С/-|-Ia+2NaOH-»-H — 4- 2NaI + HsO
Н ОН
Акидлаш долдид йодни натрий тиосульфат билан дайта титрлаш усулида бажарилади. Агар формальдегиддан 2,00 мл олиб 100,0 мл колбада суюлтирилган ва досил булган эритманинг 10,00 Мл сига 40,00 мл 0,01940 моль!л 12 эритмаси дУшЯиган бУлса, унинг форма-линдаги масса улушини дисобланг. Йод долдигини титрлаш учун
мл 0,01980 моль/л NajSjOj эритмаси (р»1,00 г/мл} сарф-
1-лаборатория иши
-ИЙД ЭРИТМАСИ МОЛЯР ЭКВИВАЛЕНТ КОНЦЕНТРАЦИЯСИ ВА ТИТРИНИ АНИКЛАШ
Ишнинг бориши: титрлаш учун колбага 20,00 мл ^^Стандартланган натрий тиосульфат олинади ва 1,0 мл "кдрахмал иштирокида оч кук ранг косил булгунча йод :»>1фитмаси билан титрланади. Титрлашни яна икки мар-‘ta такрорланг. Натижаларни жадвалга ёзинг. Урта ^.'-.арифметик кийм^тини олиб, кисоблашни ^эажаринг?
Тартиб № V (Na,S,O3) мл V (I,) мл С (V1 11) моль]л т (I,) г/мл Индикатор
1. 2. 3. » Крахи ал
Кисоблашларни цуйцдаги тенглама буйича олиб боринг / 1 , \ _ V (Na^oj.c (Na,S2O3) .
*' \2 *) V (Ij>
г(ц _>(/, ЦМС/.Ц г/ .
У 1000.........
Йоднинг Сув-спиртли эритмаси тиббиётда антисептик во-сита сифатида ишлатилади. 12 ни сувли эритмаси KI иштирокида тайёрланади. 12 + К! ч* К13 косил булади.
2-лаб оратория и ши
СУВЛИ ЭРИТМАЛАРДА АСКОРБИН КЙСЛОТА МАССАСИНИ АНИКЛАШ
(Контроль-аналитик аниклаш)
Ишнинг бориши: титрлаш кодбасига аскорбин кислота эритмасидан маълум ^ажмда (укитувчи контрол иш тарицасида беради) олинади ва 1,0 мл крахмал эритмасидан кУшиб, бир томчидан кук ранг косил бул-гунча йод эритмаси билан титрланади. Титрлашни яна икки марта кайтаринг. Тажриба натижаларини жадвал-- га ёзинг. Бир-бирНга якин (кадлар) натижалардан Ур-
тача арифметик ^ийматини олиб ^исобланг. Натижа-ларни жадвалга ёзинг.
Тартиб'-номерн < V (СвН8О4), мл * V (крахмал) мл V (lj) мл т (С,Н»О.) Индикатор
' 1 2 3 крахмал
^исоблашни куиидаги тенглама буйича олиб боринг
т (С.н,ол - м <'' C-H-OJ-1' ">" ?'• '> ; г
' 6 8 6/ 1000
Аскорбин кислота мицдорини аницлаш унинг кай-тарувчилик хоссасига асосланган. йод аскорбин кисло-. та -таъсирида рангсизланади:
12 + С6Н8О6-> 2HI + С6Н6Ов
Янги сабзавотлардан шовул, карам, лавлаги, картошка, мевалардан олма, i^opa смородина, наъматак, цора-цанд ва бошцалар витамин С га бой. Яна витамин С — цичитци ут‘ ва игна барглиларда'Куп булади. Бу витамин цон ивишини тезлаштиради хва организмни инфекция-ларга царщилигини оширади.
Титрлашнинг бевосита усуллари
Х,ажмий анализда баъзан анализ цилин’аётга.н мод-дани тугридан-тугри титрлаш билан аниц натижа олиб булмайди. Бундай вацтларда цуйидаги бевосита усул-.. ларнинг бири ^улланилади: тескари титрлаш ва титрлашнинг урин алмашиш усули.
3- лаборатория ишя
1 ЭРИТМАДАГИ ВОДОРОД ПЕРОКСИД МАССАСИНИ КОНТРОЛ-АНАЛИТИК АНИКЛАШ (УРИН АЛМАШИШ
к, УСУЛИ)
Водород пероксид массасини $рин алмашиш усулида аницлаш цуйидаги реакцияга асосланган:
Н2О2 + 2KI + H2SO4 = KaSO, + I2 Ч- 2Н2О
Н2О2 + 2Н+ + 2Г -> 2Н2О 1
2Г — 2Г->1° 1
'/’Реакция натижасида ажралиб чиркан йодни натрий тиосульфат билан титрлаб олинади:
" 2Na,S2O, + n = Na2S4O64-2NaI
2S2O|~ — 2Г-> S4O2-
120+2е~->2Г
Ищнинг бориши; Титрлаш учун колбаса маълум Кажмда (у^итувчи контрол' аналитик вазифа тарицаси-да беради) водород пероксид олинади, 3.0 мл H2SO4 (c(H2SO4) =4,0 моль]л), 5,0 мл 5% ли КГва 3 томчи ; 30% молибдат аммоний (катализатор) ц^шилади. Реакция тулиц тугалланиши учун цоронги жойда 10 мин цолдирилади, сунгра ажралиб чиццан йод крахмал иштирокида стандартланган натрий тиосульфат эритмаси билан титрлаб олинади. Крахмални эритма сариц со-мон рангга кирганда цушилади. Х°сил булган к^к ранг бир томчи натрий тиосульфатдан рангсизланиши керак. Титрлашни яна икки марта кзйтаринг. Тажриба нати-жаларини жадвалга ёзинг. Бир-бирига якин натйжалар-дан ^рта арифметик ^ийматни олиб, текширилаётган эритмадаги водород пероксид массасини дисобланг:
Тартиб Na v (нД), МА V (NatS2Otf, МЛ с (NajSjO,), мом>!л т (НвО8). 6 Индикатор
1
2
3
Хисоблаш куйидаги тенгламалар буйича олиб борилади:
„ zpj q \ _ с (^а232О3)-Т (Na2S2O3)-M (V2 H2O2) k 2 27 ЮОО
с (Na2S2O3) — Na2S2O3 эритмасининг мол^р концентрацияси
М С1/, Н,О,) — Н,О2 мэляр эквивалент массаси
М (V2 Н2О2) == 17.0 г] моль
Водород пероксид эритмаси тиббиётда шиллиц парда-лар яллигланишида чайиш ва суркаш (стоматит, ангина) ^амда йирингли яраларйи дав^лашда кенг ишлатилади. Тери касалликларида водород пероксиддан дизенфекдияловчи воситаси сифатида фойдаланилади.
4-лаборатория иши ЭРИТМАДАГИ ФОРМАЛЬДЕГИД ЭКВИВАЛЕНТИНИНГ МОЛЯР КОНЦЕНТРАЦИЯСИ ВА ТИТРИНИ АНИКЛАШ (ТЕСКАРИ ТИТРЛАШ)
Эритмадаги формальдегидни йодометрия усулида аниклаш куйидаги реакцияга асосланган:
СН,0 + I, 4- 3NaOH = HCOONa + 2NaI + 2НаО
Текширилаётган модда эритмасига аввалдан ортикча олинган йод эритмасидан аник кажмда кУшилади, сУнг-ра колдик йод стандартланган Na2S2O3 эритмаси билан титрлаб олинади.
2Na,S,O8 + 12 = NaaS4O6 + £NaI 28Д—2e--^S4O|- 1 + 2е~-»-2Г" 1
Тенгламадан куринадики, I2 эквивалентининг моляр массаси
М (l/s Ij) = = 127 ^моль га тенг.
, Ишнинг бориши: титрлаш учун колбага 5,00 мл формальдегид эритмаси улчаб солинади, 20,00 мл йод эритмаси (титрланган) кушилади ва томчилаб 2,0 моль/л моляр концентрацияли NaOH эритмасидан сомон-сарик ранг к°сил б^лгунча кУшилади. Колбани шиша билан ёпиб, 4— 5 минут k°Pohfh жойда сакланг. Эритмага 2 моль/л концентрацияли 3 мл НС1 КУШИНГ ва аралащ-мани оч сарик рангга киргунча натрий тиосульфатнинг стандартланган эритмаси билан титрланг; 1 мл крахмал Кушинг, бунда эритма кук рангга буялади ва бир томчидан шу ранг йуколгунча титрлашни давом эттиринг. Титрлашга сарф булган натрий тиосульфат эритмасининг аник кажмини белгиланг. Титрлашни яна икки марта такрорланг, натижаларни жадвалга ёзинг. Бир-бирига якин натижалардан Урта арифметик кийматни олиб кисобланг.
Тартвб номери V (СНР), мл мл 0 (lf, Ю моль/л с (Na,S,O,), моль/л VRNaAO,), мл с(СН,О), моль/л Т(СН,О). е/мл
1
2 3
^ИЙйрмальдегиднинг моляр эквивалент концентрацияси кУ^и* |^®йгича топилади:
с (СН,О) = (1г)-с р/а '2)‘У <Na^tV> моль!л
V (СН2О)
Т (СН2О)= с <сн»°)-м (1/»CH2QL t г/мл
v юоо
Формальдегид тиббиётда дори моддалар олишда бош-9? лангич мауулот сифатида ишлатилади. Унинг 40% ли v эритмаси формалин деб аталади. Формалин оцсилга таъсир этиб, уни утти^ ва сувда эримайдиган ул ад и ва чиришдан сауайди. Шунинг учун уни анатомии препаратларни консервациялашда ишлДилади.
Формалин яна цул ювишда дезинфекцияловчи воси-та сифатида, куп терлашда (0,5—1%ли эритмаси), ас-боб-анжомларни дезинфекциялашда, клизма' учун (1:2000—1:3000 эритмалари) ишлатилади.
ГЕТЕРОГЕН МУВОЗАНАТ
Мавзунинг мауади: 1. Чуктириш ва эритиш реак-цияларидан усил булган мауулотларнинг хусусиятла-. рини урганишда системали ёндошувни Урганиш.
2 . Биологик системаларда кам эрийдиган моддалар усил булишини олдиндан айтиб бериш.
Урганилаётган мавзунинг аумияти. Чу’кма усил булиши ва эриш реакцияларининг бориш унунларини билиш чукма — эритма системаси булган тирик организмда борадиган кимёвий жараёнларни бошуриш ва , уларни биокимёвий системаларга татбиц цила билиш. Бу жараёнларнинг мувозанати бузилиши натижасида кам эрийдиган бирикмалар усил булиши ва уларнинг / йигилишидан .усил булган касалликлар мавжуд. Ма-салан, подагра, глаукома, атероскероз ва бошулар.
«Барийли» ва «стронцийли» рахит суякдаги кальций карбонатлари ва фосфатлари урнини стронций ва барий эгаллаши натижасида вужудга келади. Кам эрийдиган - бирикмалар усил булиши уларни ишлатишда тирик организмда уларнинг биометалл ва биолигандлар билан чукма усил цилиши мумкинлигини усобга олиш-. ни талаб цилади.
Меъда-ичак касалликларини даволашда к^пинча кислоташв камайтирувчи ва адсорбцияловчй восита си-фатидв кам эрийдиган, лекий меъдадаги НС1 да яхши эрийднган моддалар ишлатилади. Масалан: маг
ний оксид — MgO, кальций карбонат _ СаСО3 ва бош-цалар. Тиббий амалиётда уларнинг заХарлилигинн камайтириш учун ^ам кам эрийдиган моддалар цулла-нилади. Масалан: Н^гСЬ, А1(ОН)з ва баъзи бош^а моДдалар.
' Ва5О4.рентген-диагностикада контраст модда сифатида ишлатилади, чунки у кислоталарда эримайдиган (меъда ширасидаги НС1 да) туз, у ичакда сурилмайди ва организмга захарли таъсир курсатмайди.
Бошланрич даража
1. ^айтар ва ^айтмас реакциялар.
2. Кам эрийдиган бирикмалар ^осиЛ’ булиш реак-цияларининг ионли тенгламалари.
3. Массалар таъсири ^онуни; кимёвий мувозанат.
4. Кимёвий мувозанатни силжитиш.
5. Кислота, асос ва тузларнинг эрувчанлигини кур-сатувчи жадвалдан фойдаланишни билиш.
Мустацил тайёрланиш учун укув материаллари
1. Н. Л. Глинка. «Умумий Химия». Т. 1979. 220- бет.
2. X. Р. Рахимов. «Анорганик химия». Т. 1974, 95- бет.
- 3. С. С. О л е и и н, Г. Н. Ф а д ё е в. «Неорганическая химия», М., 1979, 137- бет.
4. И. К. Ц и т о в и ч. «Курс аналитической химии». М., 1985, 41- бет.
МАЪЛУМ ОТЛАР БЛОКИ
ЧУКТИРИШ ВА ЭРИТИШ ЖАРАЁНЛАРИ
Кам эрийдиган электролитлар эрувчанлиги эрувчан-лик купайтмаси константаси билан ифодаланади. Бу катталик, циййн эрийдиган электролитларнинг туйинган эритмасйдаги ионлар концентрациясининг купайтмаси доимий температурада доимий сондир:
КэкаяС! - с (Ag+)-c (СП =1.78-10*»
K3KAgC1 = c3 (Са*+)-с3 (РОЗ) = 2,0.10-»
Бир турдаги молекулалар К эк ^иймати цанча кичик булса, электролит шунча кам эрийди:
K3KAgC1 = c (Ag+)-c (С1-)= 1,7840-» K3KAgBr = c (Ag+)-c (Br-)^3-10-13
КЭКАе1 «с (Ag.+)-c (Г) = 8,3-10-”.
$73 Agl эяг кам эрийДи. Эритмадаги ион концентрация-“Сдари к^пайтмйси Кэк Кийматидан катта б^лгандагина tf-чУ’Кма тушади. Эритмйдй бир неча хил ионлар б^лгаи-
Да, энг кам эрийдиган бирикма биринчи навбатда ч^кмага тушади. Масалан, CH, Br, J- аралашмасига
* AgNO3 цушилганда дастлаб AgJ ч^кмага тушади. ''“Шундай т^илиб, бирикмаларнинг эрувчанлик купайтма-• ‘- сини билган холда реакция йуналишини белгилаш мумкин, бу эса кимёвий анализ олиб боришда жуда катта адамиятга эга. Кам эрийдиган электролитларнинг эрув-чанлиги температурага ботлиц. Бош^а моддалар таъси-рида реакция мудитини узгартириб, чуктири’ш реакциялари мувозанатини силжитиш мумкин. ।
Анализ олиб боришда сувда ёмон эрийдиган модда-ларни эритмага ^тказиш масаласи дам адамиятга эга. Чукмани эритиш учун унинг эришида досил булаётган йонларнинг деч булмаганда биттасининг концентрация-сини камайтириш керак. Бунга душиладиган реактив иони ёрдамида т^йинган эритмадаги ионларнинг бири-ни кам Диссоциланадиган бирикма тарзида боглаш й^ли билан эришилади: масалан, Mg(OH)2HHHr хлорид кис-.
I: лотада эришини дуйидагича тасвирлаш мумкин.
Mg(OH)s4* Mg2+ + 2ОН,- НС1 =FtН+СГ ОН- + н+-»нао
Унинг молекула ва ионлари орасидаги мувозанат бузилади ва у унгга силжийди. Бунинг натижасида чук* манинг эриши р^й беради. Шунингдек Mg(QH)2HH NH4OH да эришини кам тушунтирищ мумкин:
nh+
Mg Mga + 2OH-,NH4C1^NH+ + Cl-
oh-+nh+->nh4oh
_ Ургатувчи масалалар ва уларни ечиш намуналари
1-масал а. Куйида келтирилган ^олатларнинг цайси бирида кам эрийдиган электролит СаСОз эритмаси т^йинмаган:
с (Са2"1“)"С (СО2 ) = Дэксасо, (Са2+)-с (CQ3—)< ДэкС«со, , с (Са2+)-с (СО| )>^экс»со,
' Ечиш намунаси. CaCOs эритмаси с (Са2#)-с (СО|—) < КЭКСа СО, б^лганда туйинмаган булади ва бундай эритмада чУкма досил булмайди.
2-мисол. Таркибвда Mg2"*", Fe2+, Cu2+ булганэритмага NaOH эритмаси душилса, бириИчи навбатда дайси гидроксид досил булади?
Ечиш намунаси. Бу саволга жавоб бериш учун кУрсатилгай гид-роксидлар эрувчанлик купайтмаси константалари днйматини билиш керак, улар'нинг диймати эса дар биринннг эрувчанлигинй кУрсатади: ^ЭКМд(он)а = 6.-ЮО-10 КЭКРе (ОН), = 1,0. IO-» ^ЭКСи (ОН), = 5,0.10“2°.
Кэн дийматидан куринадики, биринчи булиб ч^кмага Си(ОН)„ сунг-ра Fe(OH), ва энг охирида Mg(OH), тушади.
3- мае ал а. Хуйидаги реакция дайси йуналишда боришини анид-ланг.
SrSO, | + Na2CO3=ft SrCO3 } -f- Na2SO4
Ечиш намунаси
КэКЗгЗО. = * • 10"*1 K3KSrCQt =1,1- 10-1О
Шундай дилиб, SrCO,, SrSO, га нисбатан кам эрувчан экан, . Шунинг учун реакция чапдан унгга дараб кетади:
SrSO, 4 + Na,CO, -> SrCO, | 4- Na,SO<
4-масала. 20°C да PbJ, нинг эрувчанлиги 1,3-10“’ моль!л гатенг. Шу бирикманинг эрувчанлик купайтмаси константасини топинг.
Берилган:
S (PbJg) = 1,3-10~* моль/л
^эк (PbJ,) = ?
Ечиш иамунаси. Хар бир моль PbJ, эришидан эритмада 1 моль РЬ2"*" ва 2 моль I— досил булади. Шундай дилиб, бу тузнинг туйинган эрит-масида дуйидаги мувозанат дарор топади:
PbJ,*cPb2+ + 2J“
Бундан, е (РЬ2'*') = 1,3-10—* моль/л, с (J—)= 2,6-10—* моль/л кЭКРЫ, =с (Pb2+)-c* (J-) = 1,3-IO-*-(2,6-10-*)2 = 8-10“»
Жавоб: Кэд(рьл() = 8» 10—*
Масала буйича саволлар
1. К,айси долатда электролит-эритмаси туйинган, туйинмаган ваута Tj/йинган булади?
Жавоб; с (Pb2+)-c* (J~) = K3KPbJj туйинган эритма
с (Р1?+) »с* (J—) < Кэкры, туйинмаган эритма
с (РЬ2‘|').с» (J—) > КЭкры Ута туйинган эритма
2. с (РЬ2+) концентрацияси 2 марта оширилганда ва с (J“) — 2 марта камайтирилганда с (РЬ2+) ва с* (J-) дийматининг купайтмаси дан-дай Узгаради?
Жавоб: туйинган эритмада ион концентрациялари купайтмаси дий-мати Узгармайди, чунки уларнинг купайтмаси доимийдир. Бундас (РЬ2+) нинг ортиши с (J—) нинг камайишига олиб келади ва аксинча.
' . . -
К-эк.= сРЬ2+.с2 (J')« . \
' 8-10~» = 2.(Pb2+).x»(J-)
' х» (J-)=-^^=^^-=1,6.10- »
- 2х х
2^: 1,6= 1,5
2х’ _____
Кэк = х-~2- = х’; х = /8-. Ю -»= 8,9-107»
Жавоб: с (РЬ2+) 1,5 марта ортади с (J-) 1,5 марта камаяди.
5-масала. 1 литр туйинган эритмада 6,3 -10~’ г кжьций. карбонат булади. Эрувчанлик купайтмаси константасини дисобланг.
. Берилган: т (СаСО3)= 6,3-10~’ г
1 V (эрит- ма) = 1 л.
М (СаСО3) = 100,0 г/моль
Ечиш намунаси. 1. СаСО, нинг туйинган -эритмаси моляр концен- • трациясини топамиз.
• „ ,г ГГ, . _ « (СаСО8)
. а 3 V (эр-ма) -Л1 (СаСО3)
„ 6,3-10~8 г-моль ,
с (СаСО3) =---Г"100—л— = 6’3" Ю”* моль л
2. СаСО3=*±СО2+ + СО|
1 моль СаСО3 диссоциациясида 1 моль Са2"*" ва 1 моль СО^2 досил булади, бундан уларнинг концентрациялари
с (Са2+) = 6,3 10“5 моль/л ва о (СО§’“)«6,3-10_| моль!л га тенг.
3. Топилган дийматларга кура дисоблаймиз:
Кэкс«со, = с (Са2+)< (СО2-) = 6,3- 10г-».6,3-10-“ = 3,9-10—•
Жавоб: Кдксасо, ~ 3»®' Ю“’
Масала буйича саволлар
1. Кайси ^олатда СаСО3 нинг эриши куаатилади?
Жавоб: Кам эрийдиган моддани эритиш учун досил булаётган ион-ларнинг бирини кам диссоциланадиган бирикма сифатида боглаш керак. Бу эба эритмадаги ион концентрациялари купайтмасини камайтиради ва унинг диймати Адксасо тузидан кичик булади ва эриш жараёни руй беради. Масалан, СаСО3 ни HCI, HNO3, СН3 СООН ва бошда кислота-ларда эритиш мумкин.
Мавзунинг узлаштирилишини мустадил назорат дилиш учун савол ва масалалар
1. Кам эрийдиган AgCl бирикмасининг эруАанлик купайтмаси кон-стаитасини келтириб чидаринг. У дайси омилларга боглид ва дайсила-рига боглид эмас?
2. с (Са2+) = 0,0010 моль/л, с (РО®-) — 0,0020 моль/л булганда
чукма досил буладими? Бу тузни НС1 эритмаснда эритиш мумкинми? Жавобингизни хисоблар билан исботланг.
Жавоб: 4-10—*5 > ^экса,(РО4), = 2‘ 10~1 2’. Ч^кма тушади.
3. Тиббиётда леъда-ичак йулини (трактини) рентгеноскопия ^илиш-да рентген- контраст модда сифатида бир стакан сувда (200 мл) тайёр-ланган- кам эрийдиган BaSO4 тузининг 50 — 100 г суспензияси (бут^аси) ишлатилади? Бу эритма туйинганми ёки туйинмаганми? К. экВаЗО = = 1.10-1».
Нима учун BaSO4 меъда ширасидаги НС1 да эримайди?
4. Натрий ва калий тузлари — хлоридлар, бромидлар, йодидлар фар-мацевтик препарат булиб хизмат ^илади. Бу препаратлар анализида га-логенидлар AgNO3 билан анидланади. С1—, Вг—, J- ионлари сацлаган эритмага AgNO3 таъсир эттирилганда AgC(, AgBr, AgJ тузлари цандай тартибда ч^кмага тушади.
*3KAgCl 1,8.10-10
^ЭКА£Вг ^>3' Ю’18
Яэклез 8,3-10-и
5. Меъда шираси кислоталилиги купайганда кислота камайтирувчи восита сифатида сувда эримайдиган, лекин меъда ширасидаги НС1 да эрийдиган СаСО3 ишлатилади. Бу препаратни CaSO4 га NaCO3 таъсир эттириб олиш мумкинми?
^ЭКСаБО, = 9-1 • Ю-8; ЛэкСаСО. = 4,8-IO"8
6. Меъда ширасида кислота купайганда MgO ишлатилади, у сувда деярли эримайди, лекин суюлтирилган минерал кислогаларда эрийди. Бу препаратнинг таъсири нимага богликлигини тушунтиринг.
Лаборатория и ши
КАМ ЭРИЙДИГАН ЭЛЕКТРОЛИТЛАРНИНГ ОЛИНИШИ ВА ХОССАЛАРИНИ УРГАНИШ
1- т а ж р и б а. Кам эрийдиган бирикмаларнинг х;о-сил булиши. Куйидаги тажрибаларни пробиркада ба-жаринг:
1) СаС12 + (NHJa С2О4->
2) Ва0ЧОз)2 + H2SO4-»-
3) FeSO44-NaOH->
4) РЬ(МОз)2 + КЗ->
5) CuSO4 + NaOH"
Кам эрийдиган бирикмалар ^осил булиш реакция-ларининг ион-молекуляр тенгламаларини ёзинг, рангла-рини белгиланг.
2- т а ж р и б а. Бир ион воситасида бир нечта кам эрийдиган бирикмалар ^осил булиши. 3 та пробиркага 2—3 томчидан кУРр°шин нитрат эритмаси солинг: би-ридчисига 3—4 томчи калий йодид, иккинчисига 3—4 томчи калий хромат, учинчисига эса 3—4 томчи калий
хлорид солинг. Х°сил булган кам эрийдиган бирикмалар рангини белгиланг. Реакцияларнинг ион электрон тенгламаларини ёзинг. Чукмаларнинг ^айси бири куп-рок; эрийди (камро^ эрийди).
3- т а ж р и б а. Мувозанатни кам эрийдиган бирикмалар ^ос'ил булиш томонига силжитиш. Пробиркага 2—3 томчи калий хромат эритмасидан солинг, 1—2 томчи кумуш нитрат эритмасидан цушинг, сунгра про-биркадаги аралашмага 2—3 томчи калий хлорид Кушинг. Чукма ва эритма ранги цандай узгаради? Реак-циянинг ион-молекуляр тенгламасини тузинг. Битта кам 1 эрийдиган, бирикманинг бошцасига утишини асо'слаб беринг. . ♦
^«(AgaCrOJ = 1,1 • IO"'2; Кэк(AgCl) = 1,78- 1<Г10
Эрувчанлик: Ag2CrO4=l • 10""4 моль/л
Эрувчанлик: AgCl = 1,28 • 10~5 моль/л
4-т а ж р и б а. Чукманинг эриш шартлари. Катта-лигининг чукма эришига таъсири. Учта пробиркага 2—3 томчидан кумуш нитрат солинг. Биринчисига 2—3 томчи калий хлорид, иккинчисига 2—3 томчи калий бромид, учинчисига 2—3 томчи калий йодид эритмалари-дан душинг. Чукмалар рангини белгиланг. ХаР бир пробиркадаги чукмага 3—4 томчидан аммиак эритмасидан цУшинг. К,айси ^олатда чукма тезроц эрийди? Нима учун? К.айси бирикма чукмаси. амалда эримайди? Кам эрийдиган кумуш бирикмаларининг ^осил булиш ва аммиакда эриш реакцияларининг ион-молекуляр тенгламаларини ёзинг.
5-т а ж р и б а. Баъзи амфотер гидроксидларнинг оли-ниши ва хоссаларн. Иккита пробиркага 3—4 томчидан ^Ургошин нитрат солинг, ^ар бирига кам эрийдиган цУргошин гидроксид ^осил булгунча 1—2 томчи иш^ор эритмасидан цушинг. Бирига 3—5 томчи нитрат кислота, бош^асига 3—5 томчи ишдор эритмаси 1$шинг. КУррошин гидроксид хусусиятини тушунтиринг? Реакцияларнинг ион-молекуляр тенгламаларини ёзинг. Хром (III)-сульфат билан худди шундай тажриба утка-зинг,
• _
, КОМПЛЕКС БИРИКМАЛАР
Мавзунинг мадсади: 1. Комплекс ^осил цилувчи реакция ма^сулотларининг характери, ишлатиш имкони-ятларини аницлашга системали ёндошувни урганиш.
2. Биологик системаларда комплекс бирикмалар 30-сил булишини олдиндан белгилаш.
3. Комплексонометрик титрлаш усулида мицдорий аниклаш олиб бориш.
Урганилаётган мавзунинг. азамияти. Комплекс зосил булиш реакцияларининг бориш зонуниятларини ва уларни биологик системаларга тадбиз зилишни билиш шифокорлар учун жуда зарур, чунки тирик организмда борадиган к^пчилик биокимёвий жараёнлар комплекс бирикмалар иштирокида боради. Хлорофилл — магний-нинг комплекс бирикмаси, гемоглобин — темирнинг комплекс бирикмаси, витамин В12— кобальтнинг комплекс бирикмаси ва бошзалар. Металлоферментлар; зам комплекс бирикмалардир. Масалан, цитохром оксидаза ва церулоплазмин — миснинг, карбоксипептидаза ва карбоангидраза— рухнинг комплекс бирикмасидир. Фер-ментатив жараёнларнинг активланиши (суниши) метал-ларнинг комплекс зосил зилишИ озибатида амалга оширилади. Масалан, магний организмда борадиган музим биокимёвий жараёнларнинг бири булган АТФ гидролизини катализлайди (кучайтиради). Бериллий магний сазловчи ферментларни, кадмий эса рух саз-ловчи ферментларни мустазкамроз комплекс зосил булиши ва биометалларни сизиб чизариши зисобига 4<нгибирлайди (сундиради). Комплекс зосил булиш жа-раёнларини доривор воеиталар (препаратлар) ишла-тишда Зисобга олиш керак, чунки уларнинг купчилиги биометаллар учун яхши лиганд булиши мумкин ёки таркибида металл сазлаганц золда организмдаги био-лигандлар билан мустазкам координацион бирикмалар Зосил зилиши мумкин.
Металларнинг, биринчи навбатда, огир металлар-нинг, масалан, симоб, з^ргошин, висмут, мишьяк ва бошзаларнинг ортизча миздорда организмга тушиши зазарли таъсир курсатади, бу нарса уларнинг организмдаги кислород, азот, олтингугурт ва бооща бно-элёментлар сазловчи биомолекулалар билан комплекс бирикмалар зосил зилишига боглиз. Бундай зазарла-нишларни даволаш организмга мустазкамроз, сувда яхши эрийдиган комплекс бирикмалар зосил зилувчи лигандлар киритиш йули билан* амалга оширилади. Бу жараёнда комплексонлар, унитиол ва бошза препаратлар самарали восита зисобланади.
Организмда биоэлементлар тазчиллигида одатда, уларни купинча одам организми учун зазарли булган /
^Ьорганик тузлар билан эмас, балки биолигандлар би-сЖн досил дилган координацион бирикмалар ортали ки-_ ^рнтнлади. Масалан, таркибида кобальт садловчи витамин В12, темир садловчи ферроцерон, гемостимулин* ра бошдалар шулар жумласидандир. Комплекс бирикмалар касалликларни даволашда ишлатилади. Масалан, платина бирикмалари ракка дарши препар атЛар булиб, хавфли шишларнинг усишини секинлаштиради. Купир СиС1г-2В6 туберкулез ва гепатит касаллигини даволайди, феррамид — темирнинг никотин кислота амиди билан комлекси. булиб, камдонликнинг, дамма турида дУлланилади, коамид — кобальтнинг никотин кислота амиди билан комплекса булиб, ёпид |уяк си-нишларининг битишига яхши таъсир курсатади.
Комплексонометрик титрлаш усули тиббий-бйологик изланишларда клиник, санитария-гдгиеник анализлар олиб боришда, фармацевтика ва доривор препаратлар анализида кенг дулланилади. Саксондан ортид элемент-нинг анидлаш усули ишлаб чйдилган.
Бу усул билан биологик суюдликлар, аъзолардаги кальций, магний ва бошда катионларни анйдлаш мумкин. Санитария-гигиена анализларида уни сувнинг умумий даттидлигини анидлаш учун ишлатилади. Комплекс досил дилиш реакциялари тиббиётда огир металлар билан задарланишда уларни лиганд сифатида ишлатила-диган комплексонлар билан эрувчан комплекс бирикмалар досил дилиб, организмдан чидариб юборишда дулланилади.
Бошланрич даража
. 1. Молекуляр ва ион тенгламалар. .
2. Массанинг таъсир донуни, кимёвий мувозанат.
3. Сувнинг даттидлиги. .
Мустадил тайёрланиш учун удув материаллари
1. Н. Л. Глинка. «Умумий химия». Т., 1968. 653-бет.
2. X. Р. Радимов. «Аноргаиик химия». Т. 1974. 148- бет.
3. X. Рустамов. «Умумий химия». Т. 1969.
4. С. С. Оленин., Г. Н. Фадеев. «Неорганическая химия». М. 1979 94 бет
5. И. К.’ Цитович. «Курс аналитической химии». М., 1985, 57, -263- бетлар.
6. Н. А. Алексеев. «Количественный анализ». М., 1972, 336-бет.
7. Н. А. Селезнев. «Аналитическая химия», М. 1973, 222- бет.
8. А. В. Б а б к о в, Г. Н. Г о р ш к о в а, А. М. К о н о н о в. «Практикум по общей химии с элементами количественного анализа».
9. А. С. Ленский. Введение в бионеОрганическую и биофизическую химию». М., 1989.
МАЪЛУМОТЛАР БЛОКИ
* ' КОМПЛЕКС БИРИКМАЛАР
Барча кимёвий моддаларни шартли равишда икки гуру^га булса булади:
1. Оддий ёки биринчи даражадаги бирикмалар: НаО, NH3, AgCl, KCN ва бошцалар.
2. Мураккаб ёки юцори даражадаги моддалар: [А£(МНз)2]С1, K,[Fe(CN)e], H? [HgClJ ва бошдалар.
Мураккаб ёки говори даражадаги моддалар ва бош-цалар оддий модда молекулаларининг узаро таъсири натижасида олинади:
AgCl + 2 NH.OH [Ag (NHs)al Cl + 2 НаО , Fe (CN)a + 4 KCN^K4 [Fe (CN)J
Уларнинг таркибига орган мураккаб ионлар комплекс ионлар деб аталади. Улар кристалл ва эритмаларда мустацил равишда мавжуд булиши мумкин:
{Ag(NH3)alCI^[Ag(NH3)a]+ + Cr
К4 [Fe (CN)J - 4 К+ 4- [Fe (CN)/’
Комплекс бирикмалар тузилишини А. Вернер назарияси тушунтириб беради.
tTV /Q / ^CN СМ лигандлар xK4[Fe(CN)6\ « 4К+ + комплекс хрсил килуйчи ташки марказиа стом дойра 'N комплекс ион заряди г 1 4- ички координацщж дойра | кЬерданацион ио».
’
у Комплекс бирикма эритмаларидаги мувозанат
Сувли эритмаларда комплекс бирикмалар диссоци-ланади. Бирламчи диссоциация кучли электролитлар диссоциацияси кУринишида боради;
100% ,
[Ag (NH3)2] Cl ——-»[Ag (NHs)a]++ СГ
Ички координацион сферанинг диссоциацияси комплекс заррача, марказий ион ва лигандлар орасидаги мувозанат билан характерланади, у (мувозанат) массанинг таъсир ^онунига буйсунади ва комплекс ионйинг бе^а-рорлик константаси деб ном олган мувозанат' константаси билан характерланади: I
[Ag(NH3)2]+^Ag++.2NH3°
к _c(Ag+).c»(NH3) б™ C([Ag(NH3)2+)
= 6,8 10-8
^•«арор комплекснинг бар^арорлик улчови булиб хизмат Билали. Комплекс цанча бар^арор булса,-бе^арорлик константаси циймати шунчалик кичик булади. Комплексларнинг барцарорлигини ба^олаш учун ^озирги ва^тда купинча К бе^арорга тескари цийматга эга булган бар^арорлик констан-тасидан фойдаланилади. .
Абекарор
Унинг логарифми бутун сонни ифодалайди ва бир цатор ^бирикмаларнинг бар^арорлигини солиштириш учун жу-да ^улайдир:
1g ₽ (Ag (NH3)2] Cl) = —1—5 = 7,23
O,o* 1U
Абекарор’ P’ ^gP цийматлари маълумотнома (справочник) лар-да келтирилади. Абекарор цийматидан фэйдаланган ^олда комплекс бирикмаларнинг ^осил булиши ва парчаланиши билан борадиган реакциялар йуналишйни аввалдан айтиб бериш мумкин.
1 1. Комплекс ^осил булиш. реакцияси ^амма вацт энг кам
Кеедарор Кимматга эга булган бирикма ^осил булиш томон-га, яьни энг барцарор комплекс бирикма з^осил булиш томон-га йуналади.
Масалан, К ([Ag (NO2)2]~) = 1,5- IO-3 /C ([Ag(NHD2I+) = 6,8- IO"8» : KAg[(CN)2D= lc-10-21
k
[Ag(CN)2] эяг кичнк к б екарор цимматга эга болтани учун биринчи ва иккинчи комплекслар KCN билан реакцияга киришиб, цианид бирикмаларни ^уйидаги тенглама буйича ^осил цилади.
' [Ag (NO^r + 2 CN~ -> [Ag (CN)J“ + 2 NO" [АбМВД+ +' 2 CN“ -> [Ag (CN) J“ + 2 NHS ёки цуйидаги реакция содир булиши мумкин:
[Ag(NO^r + 2NH8:2: [Ag (H^* + 2 NO2“
[Ag(CN)a]“ аммиак билан реакцияга киришмайди, чунки ^бецарор ’ I Ag (CN)J“ < [Ag (МНз)2]‘+
Ички комплекс бирикмалар
Кимёвий анализ учун ички комплекс бирикмалар катта а^амиятга эга.
Ички комплекс бирикмалар таркибида метаЛлга ал-машадиган водороддан ташцари та^симланмаган электрон жуфти сацлаган функционал группаларни са^лов-чи органик бирикмаларнинг металл ионлари билан реакцияга киришиши натижасида ^осил ^илинади. Бунда валентли богдан ташцари координацион (донор-акцептор) бог ^ам ^осил булади.
Металл катионлари билан узаро таъсирлашиб комплекс хосил циладиган водород ионлари сацловчи му^им группаларга - СООН, NOH, SH, ОН- ва бошдалар мисол булади.
Аминосирка кислотанинг мне тузи ички комплекс тузларга оддий мисол була олади.
О=С— Оч О —С«О
I I
НаС—NHf ^NHa—СНа
Ички комплекс бирикмаларнинг молекулалари цик-лик (^алцасимон) тузилишга эга. Уларда одатда беш ва олти аъзоли муста^кам ^ал^а булади. Сувда яхши ва кам эрийди, купинча ёрцин рангга эга булиб, кам ионланади. Комплексонлар деб номланадиган аминопо-ликарбон кислоталар ва уларнинг тузлари кенг ишлатилади, улар купчилик металл "ионлари билан мус-та^кам» купинча ёрцин рангли иаки комплекс бирикма ^осил ^йлади. Одатда, металл ионлари .ва комплексон-ларнинг нисбати 1:1 булади.
Комплексонлардан этилендиаминтетрасирка кислота В/ЭДТА) ва унинг икки натрийли тузи комплексон III ^еки трилон Б деб номланган ЭДТА нинг икки натрийли ' тузи катта а^амиятга эга.
Комплексоиометрик титрлаш усули
? Комплексоиометрик титрлаш усули асосида комплексон IIIнинг металл ионлари билан ички' комплекс бирикмалар ^осил цилиш реакциялари ётади. Комплексон Ш —ЭДТА нинг икки натрийли тузи цуйидаги ту-зилишга эга: '.
HOOCH.C\ zCH2COONa t
NaTOHJC/N~CHa~СН,—N\CHaCOOH ’ 2^»°
Ички комплекс бирикмалар — бу металл ибнларининг карбоксил группа водороди урнини эгаллашидан ва азот атомлари воситасида координацией бог зрсил цилишн-дан ^осил булган бирикмалардир. Одатда, цосил булган комплекс бирикмалар металл ионлари: лиганд—1:1• нисбатга жавоб беради, бу эса унинг маълум моляр концентр ацияли эритмаларини ишлатиш имконини беради:
---ООСНгС ^CH2C0QNa
УаввСН2 С ~ N Щ С00—
------------— Me-----------------
Комплексон III купчилик -катиондар билан сувда эрувчан бар^арор ички комплекс бирикмалар (тузлар) ^осил цилади, бу эса унинг мицдорини аниклаш учун ишлатиш имконини беради. Бу усулДа -эквивалентлик ну^тасини металл индикаторлар ёрдамида аницлана-ди, улар органик буё^лар булиб, металл катионлари билан бош^ача рангли комплекс бирикмалар ^осил Билали, лекин бу бирикмаларнинг муста^камлиги шу ка-тионларнинг комплексон III билан \осил ^илган би-рикмасиникидан кам. Масалан, кальций ва магний ионларини ани^лашда индикатор сифатида эриохром цора Т ишлатилади. Эриохром J^opa Т — уч негизли кучсиз органик кислота:
HsJnd ** Н+ + H8Jnd' 2 Н+ + Н Jnd2~ =₽* 3 Н+ + Jnd*" рН<3 да цизил, pH 7 —11 да кук, рН>12 да сариц- цо-воц ранг. pH < 10 да Са+2 ва Mg+2 ларнинг индикатор бн-
лан комплекси олча рангли булади. Са2+ ва Mg2+ тузлари-нинг комплексон III ва эриохром цора.Т иштирокида титр-лащда куйидаги реакциялар боради:
1. pH = 10 да эриохром крра Т Са2+ ва Mg2+ ионлари билан олча рангли комплекслар ^осил ^илади (бе^арор) '
Н Jnd2~ + Са2+ =₽* CaJnd“ + Н+
2. Кальций ва магний тузларини титрлашда, уларнинг индикатор билан богланмаганлари комплексон III билан муста^кам рангсиз комплекслар ^осил ^илади:
Са2+ + [Н2Г]2-=₽<[СаГ]2" 4- 2 Н+
рангсиз
3. Кальций ва магнийнинг эритмадаги эркин ионлари комплексон III билан мустангам комплекс ^осил цилиб булган-дан сунг, комплексон III шу катионларни энди бе^аррр [CaJnd]“, [MgJnd]- комплекслардан жуда барцарор [CaV]2-, [MgV]2- комплексларга боглайДи.
[CaJnd]- [Н2Г ]2~ + ОН- [Са]Г2~ + HJnd Г+ Н2О
олча ранг рангсиз кук
Эквивалент ну^тада эритма олча рангини кук яшил рангга j/згартиради.
Ургатувчи масалалар ва уларни ечиш намуналари
1- масала- Куйидаги комплексларни координацион назарияга к^ра таърифланг:
а) (Си (NH3)4J SO4, б) Na3 [Со (NO2)eJ, в) [Pt (NH3)2C12]
1. Марказий атомнинг оксидланиш даражаси.
2. Комплекс ионнинг заряди.
3. Лигандлар.
4. Таш^и сфера ионлари,
5. Координацион сон.
6. Комплекс ионнинг тури (катион, анион, нейтрал).
7. Комплекс ион диссоциацияси (бирламчи, иккиламчи).
8. Бецарорлик константани ифодалаш.
Ечиш намунаси
а) 1. +2 б) 1. +3. в) 1. 4-2
2. 4-2 2. —3. 2. 0
3. NH® . 3. NO2~ 3. NH°, СГ
4. SO|“ 4. Na+ 4.—
5. 4 5. 6 5. 4
6. Катионли 6. Анионли 6. Нейтрал
7.1' [Си (NH3)J SO4a* [Си (NH3)2+] 4- SO42“
2. • (Cu (NH3]^+ я* Си2+ 4 NH3
7.1. Na3 (Со (NOa).] ч* 3 Na+ 4- [ Со (NO2)el3-
2. [Со (NO2)e]3— =f>= Co3+ 6 NOa
7. [Pt (NH3)2C12) Pt2+ 2 NH3 + 2 Cl”
ca (NH3)-c8(Cl)
K«w-£.(Pf(NH,)lClll
„ K _ c(Cu2+).c‘(NH°) c(Cu(NH3)4]2+
_g(Co3+)-^(NO2-) c[Co(NOe)]3~ '
2-масала, Дуйидаги комплекс ионларнинг зарядини анидланг, улардан катионли, анионли ва ноэлектролитларини к^рсатинг.
a) [Co(NH3)5C1I б) [Cr(NHa)4PO4] в) [Ag(NH3)a] - б) [Сг(ОН),[ д) [Со (NH3)3 (NO2)3] е) [Cu(H2O)e[
Ечиш намунаси.
а) кобальт пони заряди +3 га, аммиак молекуласи заряди О га, хлор иони заряди—1 га тенг. Ички сферага кирувчи ион зарядларинииг алгебраик йигиндисини топамиз:
(+.3) + (0)Х5 + (-1) = +2
Комплекс ион заряди +2, у катионли [Со (NH3)bC]2+
б)Сг=(+3), NH3=(0), РО4 = (-3)
'(+ 3) + (°) X 4 4- (—3) = 0 нейтрал [Сг (NH3)4POJ
B)Ag=(+l), NH3 = (0)
(+ 1) 4* (0) X 2 = 4- 1 катионли (Ag (NH3)2]+
г) Сг = (+3) ОН = (—1)
(+ 3) + (— 1) X 6 = — 3 анионли [Сг (ОН) в]3—
д) Со = (+ 3), NH3 = (0) NO2 = (- 1)
(+ 3) + (0) х 3 4- (- 1) X 3 = 0 нейтрал [Со (NH3)3 (NOJal®
е) Си = (4- 2) Н2О = (0)
4-24-(0)х6=4-2 катионли [Си(Н2О)в]2+
3-масала. Кумуш нитрат PtCl4-6 NH3 эритмасидан кумуш хлор к^ринишидаги дамма хлорни ч^ктиради, PtCl4-3 NH3 тузи эритмаси таркибига кирган хлорни эса фа дат бир дисминигина ч^ктиради. Шу тузларнинг координацией формулаларини ёзинг, уларнинг дар би-ридаги платинанинг координацией сонини анидланг.
Ечиш намунаси. PtCl4*6 NH3 бирикмаси эритмасидан кумуш нитрат дамма хлор ионини ч^дгиради, демак т^рттала хлор иони дам ташди доирада жойлашган, Бу комплекс бирикманинг формуласи: [Pt (NH3)e]Cl4, PtCl4-3 NH3 тузи эритмасидан унинг Таркибига. кирган хлорнинг */« цисми ч^кади. Демак, битта хлор иони ташди доирада, долган учтаси эса ички доирада жойлашган. Бирикма дуйида-ги формулага мос келади. [Pt (NH3)3 С18]С1. Платинанинг координацией сони иккала бирикмада дам 6 га тенг.
Масала буйича-саволлар
1. Ушбу комплекс ионлар дайси турга кос? [Pt (NH3) С1]з [Pt (NH3)3 С1»]С1‘+.
Жавоб: Катиоили, аммиакли.
- 2. Комплекс досил дилувчи ва лигандларни курсатинг.
Жавоб: Платина — комплекс доил дилувчи, биринчи бирикма-да—[Pt (NH3)e] С !<—аммиак молекулалари ва иккинчисида хлор ва аммиак лигаидлар булиб дисобланади.
3. Комплекс доил дилувчининг заряди дандай?
Жавоб: марказий атом — комплекс доил дилувчининг заряди +4 га тенг.
4. Комплексларнинг ички сферасини курсатинг.
Жавоб: [Pt(NH3)e]Cl4 да [Pt(NH3)„]4+ [Pt (NH3)3G1S) Cl да [Pt (NH3),C13]3+
4-масала. МУл миддорда 1,0 моль/л NHS садлаган 0,1 моль/л [Ag (NHa)a] NO3 эритмадаги Ag+ иони концентрациясинн анидланг.
Берилган: c([AgNH3)s] NO3) = 0,1 моль!л c(NHg) —1,0 моль/л ^eKapoplAgCNH^j+^'O.S-lO-8
c(Ag+) = ?
Ечиш намунаси. 1. Комплекс бирикманинг эритмадаги Диссоциация теиглдмаси
[Ag(NH3)2]NO2^=[A^(NH3)2]+ + NO2- (1)
jAg(NH3)3]+^Ag++2NH® . (2)
NH3 миддори мул булганда мувозанат чапга силжийди ва (2)-диссоциация натижасида досил булаётган NH3 миддори кам булгани учун уни дисобга олмаса дам булади, яъни c(NHj) = 1,0 моль!л
9 „ c(Ag+).C2(NH)“
2-k«=-c^h8)s]+)’
Бу тенгликдан Ag иони концентрациясинн топамиз.
•^бецарор * c([Ag(NH3)a]+ 9,3.10-8.0,1
~ 1» ~
»9,3>10~9 моль/л
Масала буйича саволлар
1. Комплекс досил дилувчи, унинг оксидланиш даражаси, ли-гандлари ва координацией сонини курсатинг.
Жавоб: кумуш,+1, NH3, KCN=2.
_2. Комплекс ионда марказий атом в а лигандлар орасида дандай кимёвий бор мавжуд?
Жавоб: донор-акцептор, яъни координацией бор бор.
~3. МУл миддорда KCN эритмаси дУшилганда бу комплекс бузи-лиши мумкинми?
Жавоб: \а, чунки [Ag(CN)2J~ комплекси [Ag (NH3)2]+ ганисбатан мустадкамрод.
IF ^бекарор (Ag (NH8)s]+ = 9,3- IO"4 * * * 8
I' Кбекарор [Ag(CN)J-= 1,1-10—21
Ц- 5- масала. 1\айси ^олатларда курсатилган модда эритмалари орасида Jaapo таъсир вужудга келишини ани^ланг. реакция.тенгла-.
й- насини ёзинг. ,
р ' a) A[Ag(CN)2l + NH,->
Г 6M[Ag(NO2)a] + NHs-<-
s Ечиш намунаси. a} (Ag (NH3)2]+ ионининг бе^арорлик константаси
: 9,3-10~8 га [AgCN)2]— ники эса 1,1-10~21 га тенг. Шундай цилиб [Ag (CN)2]— комплекси муста^камроц. Шунинг учун у NH3« билан реак-' цинга киришмайди. ‘
б) [Ag (NO^a]- ионининг бе^арорлик константасй 1,8-10-Л, [AgNH3)2] + ники эса 9,3-10-8 га тенг. Бу холда [AgNH3)2]+— мустаV камрох комплекс. Уларнинг узаро таъсир реакциялари цуйидагича.
К [Ag (NO,),] + 2 NH3 = [Ag (NH3),] NO2 + KNO2
, 6- мисол. Комплекс ионлар бецарорлик константаси [CaV]2- =
= 2-10~ll, [MgV]2~=2-10~9 *. Эритмада Са+2 ва Mg2^ ионлари. бир--га келганда уларни титрлашда ^айси реакция биринчи навбатда бори-шини ани^ланг. ' ' i
(Са2-^ ва Mg2”*" нинг индикатор билан комплексининг бар^арорлиги бир хил деб ^исобланг.)
Ечиш намунаси. [CaV]2— — нинг бецарорлик константаси [MgV]2— никидан кичик, демак Са+2 сацлаган комплекс ион мустадкамроц ва комплексон III биринчи навбатда [CaJnd]~ билан таъсирлашиб Са+2 ни боглаб о л ад и.
1. [CaJnd]-+ [Н2Г[2+ +ОН~ X[Can2-+HJnd2-+H2O '
2. [MgJnd]-+ [На[Г2+-|-ОН“[Mgri2-+HJnd2--bH,O
Масала буйича саволлар
1. Комплексонометрик титрлаш усулида аницлашни цандай му-дитда олиб бориш керак?
Жавоб: Кучсиз иш^орий му^итда pH 8—10 да.
2. Нима учун аницлашни кислотали мудитда олиб бориш мумкин эмас?
Жавоб: Комплекс ион диссоциацияси мувозанати кучли кислотали му^итда парчаланиш томоига силжийди.
[МеГ]2-+ 2 Н+Ме2++ [Н2Г]2-
3. Аммиакли буфер аралашма нима ма^садда ^щилади?
Жавоб: кучсиз ишцорий му^цг хосил цилиш учун бунда мувозанат комплекс х°сил бУлиш томонга силжийди.
4. a) [CaJnd]-; б) [H2V]2~.- в) [CaV]2“; г) HJnd2- лар хан-
дай рангга эга?
Жавоб: а) цизил рангга; б) рангсиз; в) рангсиз; г) к^к-яшил •
рангга.
7-масала. 50,00 мл сувни Т эриохром-хораси иштирокида титр-
лаш учуй 4,86 мл 0,05050 моль!л комплексон III эритмаси сарфлана-
ди. Текширилаётган сувнинг цаттихлигини дисобланг.
Берилган: V(комп III) — 4,86 мл
с (комп III) — 0,05050 моль/л
У(НаО) —50,00 мл_________
х = ?
Ечиш намунаси. Сувнинг даттидлиги дуйидаги формула билан анидланади:
_ с (компл III) • V (компл III) . _ 4,86-0,05050
Х,= У(НаО) ’ ~ 50,00
.1000 — 4,9186
Жавоб: Х=4,91
Сувнинг умумий даттидлиги 1 литр сув таркибидаги Са+г ва Mg’+ катионлари моляр эквивалент массаларининг мингдан бир удушила анидланади.
Масала буйича саволлар .
1. Дандай тузлар сувнинг вадтинчалик, доимий ва умумий дат-тидлигига сабаб булади?
Жавоб: Са (НСО3)2, Mg (НСО3)а тузлари вадтинчалик, СаС1а, MgCl2, CaSO4, MgSO4 доимий, шу ионларнинг умумий йигиндиси умумий дат-тидликни досил дилади.
2. Сувнинг даттидлигини дандай дилиб йУдотиш мумкин?
Жавоб: вадтинчалик даттидлик дайнатиш билан йУдотилади.
Са (НСО3)а CaCOJ + СО 2 + Н2О
Доимийси эса NaaCOs, NaOH ва бошдаларни дУшиш билан йудоти-лади,
СаС1 а + NajCOs-* СаСО8| + 2 NaCl
MgCla + NaOH->Mg(OH,)|4- 2NaCl
8- масала. ZnSO4-7H2O антисептик таъсирга эга, унинг 0,5% ли эритмаси куз томчиси сифатида дулланилади. 20,00 мл шундай эрит-мани титрлаш учун сарф булган 0,0500 моль/л комплексон III эрит-масининг дажмини анидланг.
Берилган: w °/а (ZnSO4 • 7 НаО) = 0,50 %
с (комп. III) =0,0500 моль/л
V (ZnSO4-7HaO= 20,00 мл
М (ZnSO4-7 НаО) = 287,54 г/моль
Т (ZnSOj-7НаО) = 0,005 г/мл
V (комплекс III) = ?
Ечиш намунаси. Комплексон III рух ионлари билан дуйидаги нисбатда ички комплекс бирикма досил дилади. Me: лиганд 1:1,
1. Эритма р=1,00 г/мл дан келиб чидиб 20,00 мл эритмадаги ZnSO4-7 НаО миддорини пропорция ордали топамиз:
100,00 мл —0,5 г ZnSO4-7HaO
20,00 мл — х г ZnSO4-7H2O
20,00-0,5 мл-х „ „
х =' ------= 0,10 а
100,00 мл
2. Эквивалент донунига мувофид 0,10 г ZnSO4-7H2O ни титрлаш-га сарфланган 0,050 моль/л комплексон III эрйтмаси дажмини анид-лайм из.
m'(ZnSO« • 7 На0) • 1000 0,1-1000
fl V комплексон Ш = —------— = n лк.907 с =-
g с<компл III) • М (ZnSO* • 7HgQ) и,00-20/,о
Г =»= 6,96 мл
F Узлаштиришни муста^ил назорат килиш учун савол ва масалалар
L 1. Биологик жараён — азот фиксацияси механизмини . урганиш учун рутенийнинг комплекс бирикмаси кенг ишлатилади. Куйидаги бнрикмаларда рутенцйнинг координация сони ва лигандларнинг за-рядини курсатинг.
1) I(NH8)8 RuClJ, 2) [(NH3)8Ru(HsO)[ 3) [(NH3)sRu (NJ]
2. Охирги пайтларда неэлектролит бУлган пла^инанинг лиганд сифатида С1- ва NH3 сацлаган координацией бирикмалари ракка царши активлнкка эга эканлиги ани^ланди. КуйВДа келтирилгаи бирикмаларнинг дайсилари шундай активлнкка эгД“ 1) Кз [PtClJ, 2) IPt (NH3)a Cl2] 3) [Pt (NH3)3CllCl
3. Комплекс ионларнинг бе^арорлик ва бардарорлик константа-ларнни асослаб беринг. Баъзилари тиббиётда дори сифатида ишла-' тиладиган кобальтнинг координацией бирикмалари учун уларнинг таркибини ёзинг:
1) (NH4)2 [Со (SCNJJ, 2) Na3 [Со (NOa)e], 3) [Со (NH3)e[ С1а
4, Фармацевтик препаратларда Fes+ ни сифат жи^атдан аниклаш NH4SCN таъсирида олиб борилади, бунда Fe3-*- кизил рангли [Fe (SCN)e)3— комплекс к°сил цилади. Куйидаги тузли эритмаларга NH4SCN таъсир эттирилганда шундай ранг пайдо бУладцми?
1) (NH4)aFe(SO4)a-12HaO; 2) K»[Fe(CN).J: 3) FeCl3, 4) К, [FeF,].
Жавоб: Ха, FeCljбилан. Жавобингизни тушунтириб беринг.
.5. Рух катиони карбоангидраза ферментининг коферменти кн-собланади. Бу ферментнинг ингибирланиши одам организмига куп мицдорда симоб (II) бирикмалари тушганда содир булади. Симоб бирикмаларининг зазарли таъсирини тушунтиринг. Нима учун симоб билан закарланганда натрий тиосульфат ишлатилади?
^exapoP[KA-Zn}=7- 10-11;
*6eKapoP[KA-Hg]=7- КГ22 ^6eKaPoP(Hg<SaO3)] = 3>6.l0-30
6. I гурух а- элементлари кУпчилик биолигандлар учун жуда яхши комплекс к°сил килувчилардир. Куйидаги бирикмаларнинг 0,1 М Эритмаларида комплекс квсил дилувчи ион концентрациясинн аницланг.
1) [Ag(NH3)a[Cl, 2) К [Ag (NaO)a], 3) К (Ag (SCN)aJ, 4)K[Ag(CN)4]
tfiapop [Ag(NH3)3]+ = 5,75 - IO"8
Ябекарор lAg (NOg)J- = 1,50-IO-3
Абекарор [Ag(SCN)a[- = 2,9- IO"8
; Явекарор lAg(CN)3r =^8,0. IO-22 ♦ .
Бу эритмала[шинг кар бирига водород сульфид' таъсир эттирилганда нима содир бУлади?
9—7534 129
к, •
*MtAg>S=l,6..10-*e .
7. Комплексонлар моддаларнйнг дайси сннфига киради ва дан-дай максадла'рда ишлатилади? .
8. Сувнинг умумий даттидлигини анидловчи реакцияларни к?р-сатинг.
9- . Металл-ивдйкатор таъсир дилиш доидаларини курсатинг.
_10. Сувнинг даттидлик турлари ва уларни йУдотиш усулларйни курсатинг.
1. 50,00 мл сувни эрихром дора Т иштирокида титрлаш учун 4,58 мл 0,05110 моль/л комплексон эритмаси сарфланди. Текширида-ётган сувнинг умумий даттидлигини хисобланг.
Жавоб: Х=4'68.
12. Магний сульфат MgSO<-7H2O нинг 20—25% ли эритмасини гипертоник кризнсда мускул ичига ёки вена дон томирига 10,0—20,0 мл миддорда юборилади. Шу модданинг 20,0% ли 2,00 мл эритмасини титрлаш учун сарф буладиган 0,5235 моль/л комплексон III эритмаси дажмини дисоблавг.
р . = 1,235 г/мл
.Жавоб: V (комплекс. III) =38,28 мл.
13. Кальций хлорид— СаС12-6 Н2О эритмаси тиббий амалиётда турли патологик долатларда кенг ишлатилади. Ундаги кальций иони кислотали хром т^д к^ки иштирокида комплексоиометрик усулда анидланади.
Агар вена дон томири ордалй юбориладиган СаС12-6Н2О эритмасининг 5,00 мл га 4,50 мл (c(Na2H27)—0,5031 моль/л) комплексон III эритмаси сарфланган бужа, шу текширилаётган эритма компонентининг масса улушини днсобланг.
р = 1,125 г/мл.
Жавоб: w % (СаС12-6Н2О) = 9,95 %. .
1-лаб оратория иши
1- т а ж р и ба. Комплекс иой косил булиши. Ag+, Cu2+, Zn2+ тузлари эритмасига томчилаб NaOH эритма-сйдан цушинг. Косил булган гидроксид ч^кмани NH4OH реактивининг мул миддорида эритинг. Катионларга хос комплекс бирикмалар — аммиакатлар досил булади. Комплексларнинг- досил булган эритмаларига ишдор эритмасидан солинг. Металл гидроксидлари ч^кмага тушадими? Аммиакат досил б^лиш реакция тенгламаларини ёзинг.
2- т а ж р и б а. Комплекс анион досил булиши. а) Пробиркага 5 томчи Hg(NO3)2 эритмасидан солинг. 2 томчи KJ эритмасидан дутнинг. Ч^кма досил булиши-ни кузатинг. Чукмага аста-секин эриб кетгунча KJ то-мизинг. Реакция тенгламасини ёзинг.
б) Zn2+, А13+, Сг3+ тузлари эритмасига NaOH эритмасидан солинг. Косил булган гидрокид чукмала-рини реактивнинг мул миддорида эритинг. Гидроксо-
ИИИгаЙ^екслар ^осил булиш реакция тенгламаларинн
IIMSl-t а ж р и б а. Комплекс ^осил булиш реакцияси ^йт^ааиатини силжитиш. а) Пробиркага 5 томчи AgNO3 ^даВа-Ломчи NaCl эритмасидан солинг. Реакция тенгла-*'3£Е$ини ёзинг; _ .
W) косил булган AgCl чукмасига 10 томчи NH«OH ,:ШЙй®маси томизинг. Эриш реакцияси тенгламасини
- tZ a) у>сил б^лгаи эритмага 10 томчи HNO3 эритмаси-’.'даи цУшинг. AgCl чукмаси косил булиш реакцияси тенг-
. -'ЭЙсини ёзинг; t
У 4-т а ж р и б а. Комплекс бирикмаларнинг мустаккам-лиги. FeCl3 тузи эритмасига NH4SFN эритмасидан КУ‘ .шинг. ^осил булган эритма рангини белгиланг. NaF эритмасидан цУшинг. Бораётган ^одисаларни- тушун-тиринг.
, г Ябекарор IFe (SCN)e]3- = 5,9. КГ4, ^арор [FeFel3“ = 3,6- 10~r
5-г аж р и б а/ Комплекс бирикмалар эритмасидаги ’алмашиниш реакциялари FeCh тузи эритмасига
... K*[Fe(CN)6] эритмасидан, FeCl2 тузи эритмасига I KsIFejCNe)] дан ^Ушинг. \осил булган чукмалар-ран-V гини белгиланг, уларнинг ^осил булиш-реакция тенгла-
• ' маларини ёзинг. Ало^ида пробиркада бир неча томчидан • K4[Fe(CN)6] ва K3[(Fe(CN)6] эритмаларини аралаш-
• тиринг. Нима учун бу ^олда чукма к°сил булмайди?
2- л а б о р а т о р и я и ш и
СУВНИНГ УМУМИЙ КАТТИКЛИгини КОНТРОЛЬ-АНАЛИТИК ПУЛ БИЛАН АНИ КЛАШ
Ишнинг бориши: колбага титрлаш учун бюреткадан 100,00 мл .водопровод суви улчаб солинади. Унга 5,00 мл аммиакли буфер эритмаси (pH-Ю), шпатель учида индикатор эрихром цора Т (КУРУК NaCl билан аралашма К°лида) кУшилаДи ва комплексон III стандарт эритма-чси. билан олча рангдан кук рангга (яшил тусли) утгун-ча титрланади. Титрлаш сунгида комплексон'HI эритмасини томчилаб ки3ил ТУС батамом йУколгунча Кушилади. Титрлашни яна икки марта такцорланг. Таж-рйба натижаларини жадвалга ёзинг. Мос келган натижалардан урта арифметик кийматни олинг ва водопро- вод сувииинг умумий каттиклигини кисобланг. '
Тартиб Ns V (Н2О) мл И (компл. III) мл с(компл. II!) моль/л индикатор
1. ' 2. 3. эриохром цора Т
Сувнинг умумий ^аттищлигини (Са2+ ва Mg2+ 1 литр (^исобвда) цуйи-даги тенглама буйича дисобланг.
С (компл. Ill) .V (компл. III)-1000
* = И(НаО) ~
3-л.а боратория иши
ДОРИВОР ПРЕПАРАТЛАРДА КАЛЬЦИЙНИ КОМПЛ ЕКСОНОМЕТРИК АНИЦЛАШ
Иш-нинг бориши: колбага титрлаш учун 20,00 мл тек-шцрилувчи эритма, 5,0 мл аммиакли буфер эритмаси (pH-10), уч томчи мурексид индикаторидан солинади ва комплексон Ш нинг стандарт эритмаси билан дизил ранг бинафша рангга утгунча титрланади. Титрлашни яна 2 марта такрорланг. Мос келадиган натижалардан урта арифметик дийматни олиб кальций тузи моляр эквивалент концентрацияси ва титрини ^исобланг.
Тартиб № V (CaCla) мл с (CaClj) моль/л V (компл. III) мл с(компл. III) моль/л Т (СаС12) г/мл
1. 2. /
3. (
с(СаС18) = моль/л
• ” VfCaClii)
Т(СаС1 j = v v 1000
ЭРИТМАЛАРНИНГ КОЛЛИГАТИВ ХОССАЛАРИ
Мавзунинг ма^сади. 1. Эритмаларнинг коллигатив хоссаларини куришга системали ёндошувни ^урга-ниш.
2. Био.логик суюцликлар ва доривор эритмаларнинг осмотик 6ochmi£ мицдорини ^исоблашни билиш.
*r *
3. Изотоник ва гипертоник эритмалар таъсир меха-ч,<*Ш^жини тушунтириш.
Счу\^Ургадилаётган мавзунинг а^амияти. Осмос ^одисаси ^.«^ямлик ва тирик организмлар ^аётида катта роль уй--, йЙйди. ^ужайра юзаси ва организм ту^ималари— КЬби^лари ярим утказгич мембрана хоссаларига эга. ‘ 0£мотик босим организм4 ичида му^им омил булиб, ' Шйнг турли цисмларида эса сув тацсимотнни белги-лййди, осмоснинг циймати доимийдир. Одф ^онида ва &>йща биологик сукщликларда осмотик босим циймати дЬимййлиги таъминланиб туради. Тана ^арорати 37°С булганда унинг циймати 740—780 кПа (7,7 атм) ораси-булади. •
7 Биологик сую^ликлар осмотик босими цийматини , бузмаслик учун одам ва ^айвон организмига катта ^йЖмда фацат изотоник эритмалар цуйиш мумкин. Гипертоник эритмалар сурги воситаби сифатида ва ша-моллаш жараёнларида инъекция ^олида ишлатилади.
, Тиббиётда гипотоник эритмалар ишлатилмайди.
, . Доривор эритмалар ва турли биологик суюцликлар , осмотик босимини, осмотик концентрациясинн, доривор моддаларнинг нисбий молекуляр массаларини аниклаш - учун криометрик усул кенг ^улланилади. Бу усулдан ,яна кучсиз электролитлар дйссоциацияси даража на константасини, доривор препарат ^исобланган координацией бирикмалар, масалан коамид барцарорлик константасини, доривор препаратларнинг тозалик дара-жасини аницлашда хам фойдаланилади.
Бошлангич даража
1. Электролитлар ва ноэлектролитлар.
2. Эритма турлари.
- 3. Эритма концентрациясинн ифодалаш турлари.
Мустацил тайёрланиш учун уцув материалларн
1. Н. Л. Глинка. «Умумий химия». Т. 1968. 269- бег.
2. X. Р. Рации о в. «Анорганик химия». Т. 1974. 114-бет.
3. X. У. Усмонов, X. Р. Рустамов, X. Р. Рацимов. «Физика-вий химия». Т.
4. С. С. Оленин, Г. Н. Фадеев. «Неорганическая химия». М., -1979, 114-бет.
5. М. И, Р а в и ч — Ш е р б о, В. В. Новиков. «Физическая н коллоидная химия». М., 1975, 37- бет.
6. А. С. Ленский. «Введение в бионеорганическую и биофизическую химию», М., 1989, 112-бет.
- МАЪЛУМОТЛАР БЛОКИ
ЭРИТМАЛАРНИНГ КОЛЛИГАТИВ ХУСУСИЯТИ -
Дур босими, дайнаш ва музлаш дароратлари эрит-маларнинг энг асосий хоссалари дисобланади. Эритма-лар $зининг хоссаларига кура, тоза эритувчилардан фард дилади. Эритмаларнинг баъзи хоссалари эриган модда заррачалари сонига боглид булади. Буига дуйи-дагилар киради: музлаш, эриш дароратининг пасайиши ва тоза эритувчига нисбатан эритманинг дайнаш даро-рати ортиши, эритмаларнинг осмотик хоссалари. Эритмаларнинг музлаш дарорати пасайиши ва дайнаш дарорати/ ортиши эритувчи табиатига боглид булиб, 'эриган модда табиатига борлид булмайди. Масалан, 1л сувда 60 г мочевина эритилганда сувнинг музлаш дарорати 1,86° га камаяди. Бундай катталик сувнинг криоскопии доимийси дейидади ва 1 л сувда неэлектролит булган дар дандай модданинг моляр массасини эритганда сувли эритма—1,86°С да музлайди.
Ноэлектролитнинг бир моляр эритмасини тоза эритувчига нисбатан^музлаш (эриш) дарорати пасайиши криоскопии константа дейилади. Турли эритувчиларнинг криоскопии ионстанталари дар хил булади. Масалан, бензол учун К-5,12, камфора учун эса К-40,2-ва доказо.
Модданинг нисбий молекуляр. массасини анидлаш тоза эритувчига нисбатан .унинг эритмаси музлаш (эриш) дароратининг ^згаришици анидлашга асослана-ди. Бу мадсадлар учун эритувчи сифатида камфора ду-лай, чунки унинг криоскопик доимийси бошдаларники-га нисбатан бирмунча к^прод. *
Эритма устидаги туйинган буг босими тоза эритув-чиникидан бошда. У шундай дароратдаги тоза эритув-чиникидан камрод. Рауль донунига биноан — эритма устидаги туйинган буг босимининг камайиши учувчан б^лмаган эриган модда моляр улушига тугри пропор-ционал.
ДР
—= NB бундан Д Р =* Д РА — Рл
РА—эритувчининг эрйтма уствдаги буг босими
— тоза эритувчи уствдаги бур босими.
Эритма устидаги бур босимининг пасайиши эритувчи табиатига боглид б^либ, эриган модда табиатига
эмас. Рауль цонунидан иккита хулоса чи-
Ah Эритманинг музлаш дарорати тоза эритувчиникй-наст (кам):
А / музл. — К. Ь(у)
’ — криоскопии доимийлик
— эритманинг моляль концентрацияси ч v.
ритманнг цайнцш ^арорати тоза эрит^вчиникидан
1 эбулиоскопии доимийлик
Тажрибада А/муал. (А/кайв.) ни аницлаб, дель концентрациясини Хисоблаш мумкин, Л^инг нисбий молекуляр массасига тенгдир: /' ЬМ- w <х)-1000
* М (х)- m (эритувчи)
музя. ' М(х)./п(>чи)
--4’ »л / \ IZ т (х) • 1000
М(х) = К-------щ— --------
т(эритувчн) ’ Л *музл.
'' Бунда: К — криоскопии доимийлик, у сув учун .L8.6 град/моль Та тенг.
* , т(х)— эриган модда массаси, г;
т (х)—эриган модда массаси, а;
. Эритмалар музлаш ^ароратининг пасайиши ва ^айна ш ^ароратининг ортиши улардаги заррачалар сонига Цетлиц булади, унда электролит эритмаларйнинг хосса-лари бир хил концентрацияли неэлектролит эритмала-' рининг хоссаларидан фарц цилади, масалан:
1. NaCl=₽tNa++Cr эритмада
b(NaCl) = 0,01 моль/кг\
- fe(Na+) = 0,01 моль/кг -
, . b (СП) = 0,01 моль/ке, йигиндида 0,02 моль/кг га тенг,
? 2. О = C<NHa_________О = C<NHa
с . 'NH2 XNHa ,
. ч эритма
&(CO(NHj)j) = 0,01 моль/кг &(СО(ННа)а = 0,01 моль/кг
' Шунинг учун электролит (NaCl) эритмада эритма-
эритманинг мо-у сон эюцатдан
нинг музлаш ^арорати неэлектролит (мочевина) эрит-маникидан 2 марта куп. Бу цийматларнинг нисбати. изотоник коэффициент деб аталади:
*• . 1° =г ' А ^«лектролнтиинг муал.
Д ^иоэлектролитнинг му ал,
Эритмаларнинг осмотик хоссалари
Эритмаларнинг му^им хусусиятларидан бири, эриган модда заррачалари сонига боглиц булган осмотик хоссаларидир. Маълумки, эриган модда ва эритувчи заррачалари доимо ^аракатда булади. Шунинг учун турли концентрацияли эритмалар еки эритма. ва тоза эритувчи бир-бирига ц^шилганда уларни ташкил этувчи заррачалари диффузия ^исобига аралашади, бунинг р^ибатйда эритма концентрацияси тенглашади. Агар эритма ва тоза эритувчи орасига ёки ^ар хил концентрацияли эритмалар орасига эриган модда молекулала-ри ута олмайдиган ярим утказгич тусиц-мембрана жой-лаштирилса, эритувчинцнг мембранадан эритмага ва эритмадан эритувчи ^атламга ^тиши кузатилади. Эритувчи молекулаларининг тоза эритувчидан эритмага утиш тезлиги (ёки эриган модда концентрацияси кам-ро^ булган эритмадан) концентрацияси цзцори булган эритувчи цатламига ^тишига цараганда анча куп булади. Шунинг учун унда ^ажм ортади, концентрация эса камаяди. Бу осмос ^одисаси дейилади. Унинг миц-дорий характеристикаси осмотик босим булиб, эритмани ярим утказгич тусиц билан ажратилган эритувчи билан мувозанатга келтириш учун унга курсатиладиган (таъсир эттирилаДиган) босимга айтилади. Осмотик босим-нинг вужудга келишини аницлайдиган цонунлар газ цбнунларига ^хшашдир.
Эритмаларнинг осмотик босими Вант —Гофф цону-нйга буйсунади: ноэлектролитларнинг суюлтирилган эритмалари осмотик босими моляр концентрациясга (с), пропорционаллик коэффициентига (/?) ва абсолют ^а-роратга (Г.) тугри пропорционал: n-cRT, бунда /?— газ доимийси (/?=8,31 л. кПа/моль • К).
» Тенгламадан куринадики, осмотик босим циймати концентрация, ^ароратга боглиц б^либ, эритувчи ва эри-гац’ модда табиатига боглиц б^Лмайди. Вант—Гофф Хонуни ноэлектролитларнинг суюлтирилган эритмала-рига тааллуцлидир. Уни электролитларнинг суюлтирилган эритмалари учун !$ллашда ц^шимча к^пай?ирув-чи —изотоник коэффициент i киритилади. У электро-
gfehtr осмотик босимини шундай концентрацияли ноэлек-;^5д|нюлит осмотик босимидан неча марта катталигини •Д|^рсатадй:
Ж 1 Л,л/Лноэл.
n = ickT
'Х₽ноэл. назарий дисобланади.
; _ i = I + а(п — 1)
\ л — электролитик диссоциация даражаси;
1 п — эритмадаги ионлар сони. I
Стандарт цилиб олинган эритма осмотик босимига тенг осмотик босимли эритмалар — изотоник эритмалар дейилади, осмотик босими стандартникидан куп эритмалар — гипертоник, камлари — гипотоник эритмалар дейилади.
Биологик системаларда стандарт эритма сифатида . осмотик босими 740—780 кПа булган ^ужайра ичи су-го^лиги (цон) цабул килинган.
0,86% ли NaCl эритмаси худди шундай босимга эга, у цон плазмасига изотоник б^либ, физиологик эритма деб аталади. Биологик сую^ликлар — биринчи навбат-. да к0ННиНг осмотик босими доимийдир. Бу доимийлик изоосмия дейилади. Изоосмиянинг бузилиши организм . учун хавфлидир. Одам ёки ла®вон ррганизмига к^п ми^-дорда (литрлаб) организм осмотик босимини кутармай-диган изотоник эритмалар цуйиш мумкин. Гипертоник эритмаларнинг киритилиШи ^ужайралар сицили-шига олиб келади, бу яллигланган ^ужайралар учун фойдалидир. Шунинг учун яллигланишга ^арши доривор препарат сифатида томирга глкжозанинг 40% ли эритмасидан 20 ва 10 мл ва СаС1 эритмаларидан говорил ади. Гипертоник эритмаларнинг организмга хадда’н . ташцари куп юборилиши изоосмиянинг бузилишига олиб келиши мумкин. Бунда хужайралар сицилиши — плазмолиз, яЪни уларнинг ^алок б^лиши руй беради. Гипотоник эритмаларнинг куп мивдорда юборилиши эса ’ фгжайранинг буртиши ва ^обигинйнг ёрилишига олиб келади, масалан, эритроцитларда гемолиз, яъни уларнинг Залокати кузатилади. -
Ургатувчи масалалар ва уларни ечиш Амуналари
I- масала. 750 г бензолда 27,0 г модда эришидан доснл булган эритма 3,5°С да музлайди. Тоза бензол 5,2°С да музлайди. Бензолда эриган модда нисбий молекуляр массасини дисобланг.
Берилган: т (модда) = 27,0 г т (СвН,) = 750,0 г
—4аузл. (Э'Ма) = 3,50°С .
/музл.(СвНв)=5,50°С
К(С,н,) = 5,20 град/моль .
М (модда) = ?
Ечиш намунаси. 1. Тоза бензолга нисбатан эритма музлаш дарора-тининг пасайиши:
А4<узл. = 4<узл. (С,Н,) Лнузл. (э-ма) Д ч = 5,50° — 3,50° = 2,00 ни ташкил этади.
2. Бензолда эриган модда нисбий молекуляр массасини А7(муал ) дийматига кура дисоблаймиз: .
т (модда)- 1000
' . & '(иузль) ~ % М (модда) • т(С(Н|) .
т (модда) • 1000 М(модда) = Х
„ , . 27,0-1000 град. г. г. „„ „ .
М, . = 5,20 •---------------------------— 93,6 г/моль
(модда) 750,0-2,00 моль-г-град
Жавоб: М(модда) = 93,6
Масала буйича салол лар
1. Рауль донуни дандай таърифланади?
Жавоб. Эритма устидаги эритувчининг т^йинган бур босимининг нисбий пасайиши эриган модда моляр улушига тенг.
2. Эритманинг музлаш дарорати соф эритувчининг музлаш да-роратидан дандай фард дилади? Бу нимага боглид?
Жавоб. Эритманинг музлаш дарорати соф эритувчининг музлаш дароратидан паст. Бу эса даттид ва суюд фаза ^ртасида мувозанат дарор топганда модда кристалланиши бошланишига боглид. Бирор модда эритувчида эритилаётганда унинг молекулалари концентрацияси камайиб, эриши ортади. Янги мувозанат дарор топиши учун дароратни пасайтиршп керак.
3. Криоскопию доимийлик деб нимага айтилади ва у дандай омилларгд боглид булади?
Жавоб: Криоскопии доимийлик — К — музлаш дароратининг мо- ‘ ляр пасайиши булиб, у фадат эритувчи табиатига боглид булади, лекин эриган модда табиатига боглид булмайди.
4. Эритманинг музлаш дароратини улчаш нима учун. керак?
Жавоб: Криоскопии усул модда нисбий молеиуляр массасини, кучсиз электролитлар диссоциация констайтасини, комплекс бирикмалар- бедарорлик константалари ва бошдаларни анидлаш учун ишлатилади.
2-мисрл. 250 г сув ва 54,0 г глюкоза (СбН|2О6) дан ташкил топган эритма дайси дароратда кристалланиши .кераклигини дисоб-ланг.
Берилган: т (Н2О) =250,0 г'
т (СвН,2Ов) =54,0 г
М (С6Н12Ов) = 180,0 г/моль
К и,о =1,86 граб/жоль
t (крист.)—?
Ечиш намунаси.
¥ 1000 е сувдаги глюкоза массасини ^исоблаймиз:
250,0 г Н2О _----~ 54,0 а С8Н12Ов
1000 г Н2О ------X СвН,2Ов
1000-54,0
=—k.z, А = 216,-0
. 250,0
/л (СвН12Ов) = 216,0 г —
Глюкоза эритмасининг мол'яль концентрациясини «опамиз:
Цс.н„о.>- —
I»-’ • 3. Эритма Д f
М (СвН12Ов-/и (Н2О) '
, „ „ , 216,0-1000 е-моль , „ ’ .
b (С,Н12О6) = —д- -- -----= 1,20 моль/кг.
180,0’1000 г-кг
ни топамиз:
г
Д. f (крист.) == К-b (CGH12Oe) = 1,86-1,20 М°™ = 2,23°С.
моль • кг
4. Эритма кристалла,тиши ^ароратини топамиз.
Д/ (крист. =/(крист. э.-чи)—Д/ (крист, э —ма) Бизнинг мисолда эритувчи Н2О, унинг t (крист.) = 0°, демак, t (крист.) = 0 — 2,23° = — 2,23°С.
Жавоб:
ч.
t (крист, э — ма) =—2,23°С
“ 3-мисол. Биринчи эритма иккинчисига нисбатан гипертоник, изо-тоник ёки гипотониклигини тушунтиринг.
1. 1 моль/л NaCl ва 0,1 моль/л NaCl
2. 0,5 моль/л CO(NH2)2 ва 0,5 -моль/л CeHi2Oe
3. 0,1 моль/л NaCl ва.0,1 моль/л COlNHJa
Ечиш намунаси
Маълумки, суюцликлар осмотик босими Вант-Гофф цонунига мувофи^ ^исобланади:
л = с/? Г , п = i с RT
ноэлектролитлар учун электролитлар учун
Осмотик босим циймати эритма концентрацияси ва хароратга боглиь; булиб, эритувчи ва эриган модда табиатига боглик эмас, , ’ фацат заррачалар сонига богли^.
1. 1 мЪль/л NaCl 0,1 моль/л NaCl эритмасига нисатбан 10 марта . Катта концентрацияга эга, шунинг учун унинг л си юцори, яъни би-- .-ринчИ эритма, иккинчисига нисбатан гипертоникдир; '
2: Сийдикчил ва глюкоза, ноэлектролитлардир, уларнинг эрит-иалари бир хил концентрацияли, демак, уларнинг осмотик босими /' Хам био хил, шунинг учун бу эритмалар изотоникдир;
3. NaCl электролит, СО (NH2)2 неэлектролит. Электролит эрит-..„масида диссоциация натижасида ^осил булган заррачалар сони кУп: £ ' NaCl^Na+4-СП :
~4 = 1 + а(Л-1) = 1 + 1(2-1)=2 -
Шундай цилиб, биринчи эритма л си иккинчи эритманикига Караганда икки марта ю^ори булади, яъни у иккинчи эритмага нисбатан гипертоник. '
, Масала буйича сароллар
1. Нима учун электролит эритмаларга Вант-Гофф конуни ифо-дасига кура изотоник коэффициент киритилади?
Жавоб: Электролит эритмаларда осмотик босим худди шундай концентрацияли неэлектролит эритмасиникидан доим юцори булади, чунки уларда электролит молекуласи диссоциацияси натижасида ко* сил булган заррачалар сони кУп булади, айнан шунда изотоник коэффициент \ам кисобга олинади. Изотоник коэффициент киритилма-са электролитлар эритмаси осмотик босимини кис°блаб булмайди.
4- масала. Осмотик босими 37 °C да 760 кПа га тенг бУлиши учун 1 моль неэлектролит дандай кажмдаги эритмада бУлиши керак?
Берилган: п (модда)—1 моль
л=760 кПа
1=37 °C, Г=310 К
/?=8,31 л кПа j (моль К)
V (э—ма)=?
.Ечиш намунаси
Вант —Гофф цонунига бийоан n = cRT п (модда) - х , п (модда) с =“ Т/ 7 ! шундай цилиб, л= ——-------- R • Т.
V (э- ма) V (э- ма)
Бундан:
„ 1-8,31-310 моль-л-кПа-К „ „„
V (э- ма) =----------------------= 3,39 л.
760 кПа-моль- К
Жавоб: V (э-ма) = 3,39 л.
Масала б|йича саволлар
1. Суюцликларнинг осмотик босими дандай бирликларда Улча-нади?
Жавоб: сую^ликларнинг осмотик босими паскаль — Па ва килопаскаль— кПа ларда улчанадш (симоб устуни мм ва атм. босим Улчовлари эскирган кисобланади).
2. Эритманинг осмотик босими нима учун карорат ортиши билан ортади? f
Жавоб: ^арорат ортиши билан заррачалар каракат тезлиги ортади, бу эса молекулаларнинг узаро тУкнашувлар сони вртишига олиб келади. .
5-масала. Таркибида 3,0 г сахароза сацлаган 250 мл эритма 12 °C да 83,14 кПа осмотик босимга эга булади, Сахарозанинг нисбий молекуляр массасини анидланг?
Берилйн: V (эритма) =250,0 мл m (сахароза) =3,0 г /=12°С, Г=285 К Я=8,31 л- кПа/(моль-К) л=83,14 кПа
М = ?
Ечиш намунаси.
Вайт — Гофф тенгламаси:
, п(к)
= cRT унда с= ---------------
, . '(э-ма)
*Л-р'
— модданинг микдори, п(х) =
ffl(v)
Л1(х)
• RT
Д4 (X) — модданинг моляр массаси, 1/* . ' ' m(f)
Л.Л. Шундай килиб »= wp — . . , Бу тенгламадан келиб чицадики, ' mC^.R-T
ли(э-ма) “
Сон ^ийматларини бу ифодага хуйиб, уни ечамиз: 3,0-8,31-285 А1» =----------------
- 83,14-0,25
Жавоб: Мг = 342.
Масала буйича саволлар
г-л-кПа-К .
-------——— = 342 г/моль моль‘К.-кПа-л
1. Вант-Гофф донуни дандай моддаларнинг нисбий молекуляр массасини аниклаш учун цУлланилади?
Жавоб: Вант-Гофф цонуни купчилик моддаларнинг нисбий молекуляр массасини улЧаш учун ишлатилади. Айницса, у купчилик биологик сую^ликларни ташкил этувчи говори молекуляр бирикмалар эритмалари учун а^амиятли. Уларнинг нисбий молекуляр массасини музлаш ^ароратининг пасайиши буйича аницлаб бУлмайди, чунки АГ музл. жуда кичик. Бу эритмаларнинг осмотик босими эса Улчаш мумкин булган катталикдир.
2. Вант-Гофф донуни тиббиётда дандай а^амиятга эга?
Жавоб: Вант-Гофф цонунига биноан белгиланган осмотик бо-. симли эритмалар тайёрлаш ва уларни тиббиётда кУллаш мумкин, иккинчидан, бу цонунга мувофиц осмотик босимлари циймати тур-лича булган эритмаларнинг организмга таъсир механизмини тушун-тирщп мумкин.
Мавзунинг Узлаштирилишини мустацил назорат цилиш учун савол ва масалалар
1. Рауль ^онунини ифодалаб беринг. Унинг математик ифодаси-ни келтиринг.
2. Эбулио- ва криоскопии доимийларнинг физикавий маъноси дандай? Улар дандай омилларга боглик? ‘
3. 1000 г сувда 400 г гемоглобин эришида музлаш дарорати 0,012 °C га камаяди. Гемоглобиннинг нисбий молекуляр массасини ^исобланг. (Я (Н$О)—1,86 град/моль).
Жавоб: Мы=62015. е
4. Агар 40,0 г бензол ва 1,6 а нафталиндан иборат эритманинг цайнаш дарорати 0,8 °C га ортган булса, нафталиннинг нисбий молекуляр массасини хисобланг.
(Е — (С,Н,) = 2,57 град/моль
Жавоб: Л1л(С10Н,) = 128,5
5. Музлаш дароратшш 1° га тушириш учун 100 г сувда неча грамм сахароза (С^НмОц) эритилиши керак?
1° га кутариш учун-чи? К (Н2О) = 1,86 град! моль’,.
£(Н»О) =* 0,52 град!моль.
Жавоб: Л!1(СцНде0ц) = 18,38 г; /л2 (С12Н220ц) = 65,77 г.
- 6. 1,5г фенолни (СвН6ОН) Юг этил спиртида (С2Н6ОН) эриптанда дайнаш дарорати 0,185° кутарилади.
Спиртнинг эбулиоскопии доимийсинй анидаанг.
Жавоб: Е (С2НбОН) =0,116 град/моль.
7. Дон плазмасининг музлаш дарорати пасайиши —0,56 ° га теиг.
Конга изотоник булган натрий хлорид эритмасини тайёрлаш учун 1 литр сувда эритиш керак булган ош тузи миддорини дасобланг, Жавоб: т (NaCl) =8,81 г.
8. Биологик суюдаиклар, мевалар, гушт ва дан нима учун 0° да музламайди?
9. Молекулаларнинг Узаро мембрана билан ажратилган тоза сувдан глюкоза эритмасига ва аксинча утиш тезлигида динамик мувозанат дарор топадими, йу^ми шуни тушунтйринг. Агар дарор топ-са,_ у дандай шароитда руй беради?
10. 0,1 моль/л данд ва туз эритмалари,изотоникми? Жавобингиз-йи асаслаб беринг.
11. Плазмолиз ва гемолиз дадисасини осмотик босим асосида тушунтириб беринг. Одам организмига нима учун кУп мидаорда (литрлаб) фадат изотоник эритмалар цуйиш мумкин?
12. Жарродаикда «гипертоник богламлар» ишлатилади. Бу NaCl нинг гипертоник эритмасида ^уллаб йирингли ярага киритиб ^уйил-ган дока булакчаларидир. 10% ли гипертоник NaCl эритмасининг осмотик босимини дасобланг. (р—1,05 г/мл, а—0,89; t—37 °C). «Гипертоник боглам» ларнинг таъсири нимага асосланганини тушуцти-ринг.
Жавоб: я =8715 кПа.
13. 37 °C да (р—1,04 г/мл) тулиц диссоциланган 0,85% ли NaCl эритмасининг осмотик босимини дасобланг. Бу эритма данга нисбатан изотоникми? Шу эритманинг моляр концентрацияси дана-да?
Жавоб: л = 757 кПа; с (NaCl) =0,15 мола/л.
. 14. 3% (масс.) глюкоза эритмасини (р—1,011 г/мл) куп мида дорда томир ордали юбориш мумкинми?
Жавоб: я=434 кПа.
15. 30% ли MgSOr7 Н2О (р = 1,215 г/мл) эритмаси тиббиётда. сурги воситаси сифатида цУлланилади. Шу эритманинг 37 °C даги осмотик босимини дасоблаб топинг (а=0,92). —
Жавоб: л=3258 кПа.
1-л'аб оратор и я и ши
НИСБИИ МОЛЕКУЛЯР МАССАНИ КРИОМЕТРИК УСУЛДА АНИКЛАШ
Бу усулнинг мо^ияти шундаки, бу тажриба йули билан тоза эритувчи ва эритманинг музлаш ^ароратини аницлаш ва музлаш нуктасининг пасайишига кура моляр массани аниклашга ёрдам беради. Ишни бажариш
Имахсус асбобдан фойдала-ди. У совитувчи аралашма цалин деворли стакан — 1, [аштиргич — 2, ^оп^оц-—3, и диаметрли' пробиркалар — 7, эритма учун аралаштир-ва Бекман дифференциал >рат улчагичи (термометр) ташкил топган. Бекман ас-аввалдан 0°С Да симоб кур-саткичи 1,75—2,85°С оралигида „ буладиган -^илиб созлаб цуйил-0 ган булади.
Ишнинг бориши: ^алин деворли стаканга цор ёки муз со-- либ ош тузи цушицг ва яхшилаб > аралаштиринг. Совитувчи ара-лашмага ^арорат улчагич туши-“ ринг ва —6°С гача тушишини кузатинг. Ички пробиркага пи-
1- раем.
Осмос Улчагич.
f—далии деворли стакан: 2— аралаштиргич; 3 — допдок: 4, 7—пробиркалар; 5 — эритма; 3—Бекман термометри.
петка билан 10,00 мл дистиллар-Ган сув цуйинг, уни аралаштщ?-гич «а Бекман ^арорат улчагичи Урнатилган ^опцо^ билан ёпинг. Бекман ^арорат улчагичли про-биркани совитувчи аралашмага туширинг. Сувни аралаштиргич билан тухтовсиз аралаштириб
турган золда, ^арорат узгаришини кузатинг ва муз кристаллари ажралиб чи^ишига жавоб берувчи ^аро-ратни допинг. Одатда, тажрибада совиш озгина купроц булади ва музлаш ^арорат ну^тасидан пастро^ тушади. Бир оз пасайгандан сУнг симоб устуни бирдан сакраб ю^ори кутарилади ва сувнинг музлаш ^арорати нуцта-сида тухтайди. Бекман ^арорат улчагичи белгилаган
максимал ^арорат сувнинг ^а^иций музлаш ^арорати булади. Уни журналга 0,005°С гача ани^ликда ёзилади.
Пробирка муфтадан чицариб олинади, к$л билан иситиб, ундагц муз эритилади. Тажриба ^айтари-лади. г:
. Сувли пробиркани чицаринг, унга модданинг (мочевина, канД. глюкоза ва ^оказо) ани^.улчанган миц-дорини солинг ва аралаштириб турио эритинг. Пробиркани ^арорат улчагич ва аралаштиргичли цоп-цоц билан ёпинг, совитувчи аралашмага жойлаштиринг
ва аралаштириб туриб эритманинг музлаш хароратини аницланг. Пробиркани ХУЛ билан иситиб, муз кристал-ларнни эритинг ва тажрибани 3—4 марта такрорланг. Тажриба Иатижалари ва маълумотларни жадвалга ёзинг.
K-a-UKlO .
М =-------z---. г/моль
в-М°
М — модданинг моляр массаси (г/моль)
а — эриган модда массаси (г)
в — эритувчининг (сувнинг) массаси, г
К — сувнинг криоскопии доимийси, К-1,86 град/моль Д/° музл. тажриба нули билан аницланади.
Моляр масса сон жи^атидан модданинг нисбий молекуляр массасига тенг Мг (модда).
Модданинг тажрибада ани^ланган моляр массасини-Хациций ^иймати билан солиштиринг ва тажрибанинг нисбий хатосини ани^ланг: ,
МГ (цациций) — Мг (тошмгани)
Мг (?(ацщий)
2-лаборатория иши
ОСМОС, ТУРГОР (ЭНДООСМОС) ВА ПЛАЗМОЛИЗ (ЭКЗООСМОС) ХОДИСАЛАРИНИ КУЗАТИШ
2.1. тажриба. Тажриба утказиш учун иккита ца-лин деворли хажми 6 л ли идиш, иккита цалин деворлн 0,5 л хажмли кимёвий стакан, ярим утказгичли пленка (хайвон пуфакчаси, пергамент ёки целлофан) ингичка ип, шакар ишлатилади. •
хато (%) =
> a— гипертоник эритма; б.— гипотоник эритма.
1 « сув; 2,3 — шакарнинг туйинган эритмаси; 4 — сув.
' Ишга тайёргарлик: стакан тепасигача (бугзигача) цанднинг туйинган эритмаси билан тулдиринг. Стакан огзидан 3—4 см катталикда целлофан цир^иб олинг ва уни сувда ^улланг. Хулланган плёнкани остида ^аво пу-/ факчаларн ^олдирмай идишга тортинг. Парда четла-ринй ^айиринг, уни таранг тортинг, букланган жойла-? рини стакан орзи буйлаб тенг тацсимланг (бир неча марта чилвир билан айлантириб тугун ^илиб богланг). Иккинчи стаканни сув билан тулдиринг ва ярим утказ-гич парда билан шундай ёпинг.
Ишнинг бориши: биринчи стаканни 3/4 ^нсми сув билан тулдирилган катта идишга жойлаштиринг. Бо-шйда ясси турган ярим Утказгич парда 2—3 соатдан сунг шиша бошлайди (эндоосмос). Иккинчи стаканни: % ^исми ^анднинг туйинган эритмаси билан тулдирилган катта идишга жойлаштиринг. Бу ^олатда ясси парда ичга ботади (эндоосмос).
Бу ^одисаларни тушунтиринг.
2.2.- тажриба. Осмотик босим.
Ишга тайёргарлик; форштосснинг кенг тешигини ярим утказгич билан зич ^илиб богланг. Форштоссни фуксин' билан буялган цанднинг туйинган -эритмаси билан тепасигача тулдиринг. Форштосснинг ю^ориги учи резина найча билан узун шиша найга уланади (диа-метри 3—5 мм, узунлиги 1 м ли), унга эса тепасига ки-чик стакан бириктирилган эгик шиша найча уланади.
Ишнинг бориши. Тайёрлаб цуйилган осмотик ячей-кани сувли стаканга жойлаштиринг, узун найни эса штативга ма^камланг. Сув дар^ол стакандан ярим Утказгич плёнка ортали осмотик ячейка ичига томон v ракат цилади ва буялган цанд эритмаси найча ичида 10—7534 145
. 3- раем. Осмотик босим улчагич.
кутарила. бошлайди. Машгулот охирида найяа ичидаги эритманинг кутарилган баландлигини белги-ланг.' Суюдлик бир неча кундан сунг най юдорисигача кутарилади ва стаканга томади.
2.3- тажриба. Кон зардоби-нинг изотониклигини урганиш (эрит-роцитлар реакцияси буйича).
4 та пробирка тайёрланг. Про-биркаларга 3,0 мл дан 0,85, 0,8, 0,9% ли NaCl эритмалари ва дис-тилланган сув солинг. ^\ар бир про-биркага 2 томчидан цитратли дон дУшинг, шиша таёдча билан ара-лаштиринг. Бораётган додисаларни ёзиб олинг ва тушунтириб беринг. Улар дадида илмий асосланган ху-лосалар чидаринг. Саволларга ёзма равишда жавоб беринг.
1. Текшйриш учун донни дул
пробиркаларга олиш мумкинми? Жавобни асосланг.
КИМЕВИЙ РЕАКЦИЯЛАР ЭНЕРГЕТИКАСИ РЕАКЦИЯНИНГ ИССИЦЛИК САМАРАСИНИ АНИДЛАШ
Мавзунинг надсади. Нейтралланиш реакцияси иссидлик самараси миддорини термодинамика донунлари асосида анидлашни урганиш.
Урганилаётган мавзунинг адамияти. Тирик организм-лар термодинамикаси тирик организмларда энергиянинг узгариш (бир турдан иккинчисига утиши) жараёнлари-ни урганади. Бу энергия иш бажариш, тана дароратини садлаб туриш, организмда биокимёвий реакцияларнинг бориши учун зарур. Одам ва дайвонлар даёти учун асосий иссидлик манбаи углеводдир, ёг ва одсиллар резерв иссидлик ролини уйнайди. Уларнинг оксидланиши натижасида руй берган экзотермик реакция туфайлй дужайраларда даёт учун зарур булган энергия ажралиб чидади. Одам углевод, ёг, одсиллар ва бошда озуда мадсулотларини овдат бил.ан бирга истеъмол дилади. Организмнинг энергия сарфи билан озуда мадсулот-ларидаги энергия жамгармаси орасида богланишнинг
ИиЬжудлиги биокимёвий реакциялар энерГетикасини $р-Ипйш а^амиятини белгилайди. Бу озуца ма^сулотлари-ИшГи энергия косил булиш механизмини тушунйш учун Кжрурдир.
Соглом ва касал (бемор) ^ужайралар энергетикаси ЦЙа уларнинг рйвожланишини кузатиб туриш баъзи ка-кфалликлар, масалан, рак касаллигининг бошлангич &‘(ва^тли) диагностикасини ишлаб чи^ишга имкон бера-Гди. Ози^-ов^ат ма^сулотларининг эйергетик’рдоконият-ларини аницлаш турли ме^нат шароитларидаги киши-jjap учун зарур ов^атрационларини белгилаи имконини "беради.
Бошлангич даража.
к Экзотермик ва эндбтермик реакциялар.
у 2. Реакциянинг иссицлик самараси.
; • 3- Реакциянинг термокимёвий тенгламалари.
Мустацил тайёрланиш учун £кув материалларя
- 1. М. Л. Глинка. «Умумий химия». Т. 1968. 76-бет.
2. X. Р. Рахимов. «Анорганик химия». 1974. 56- бет. -
3. X. У. У с у о и о в, X. Р. Рустамов, X. Р. Рахимов. «Физйкавий химия». Т. 113- бет.
4. С. С. Оленин, Г. Н. Фадеев. «Неорганическая химия». М., 1979, 26-бет. '
5. А. В. Б а б ко в, Г. Н. Г о^шков а, А. М. Кононов. - «Практикум по общей химии с элементами количественного анализа» М., 1978, 51- бет.
6. А. С. Ленский. «Введение в. бионеорганическую и биофя4-зическую химию». М., 1989.
МАЪЛУМОТЛАР БЛОКИ
Кимёвий жараёнлар: иссиклик ютилиши — эндотер-мик ёки иссицлик ажралиб чициши — экзотермик жа-раён дейилади. Кимёвий богнинг узилиши доимо иссик-лик ютилиши билан (Qi), хосил булиши эса — ажралиб чи^иши билан (Qi) боради. Агар Qi>Qz булса жараён эндотермик, Qi<Qi булса экзотермик булади. Реакциянинг иссиклик самараси Q — Qi—Qi. У ^заро таъсирла-шаётган модданинг таркибига ва. агрегат х°латига бог-лик булади. Шунинг учун термокимёвий реакцияларда доим бу х°лат курсатилади: г — газсимон; с—-сук>к, к — кристалик. •
2 На(г) + О2(г)—>2Н2О(с)
Табиатда хамма жисмлар (моддалар) агрегат кола-тидан кзтъи назар, цандайдир ички энергия закирасига
эга, у система золатининг функцияси зисобланади. Унинг абсолют цийматини анизлаб булмайди, фацат ички энергия узгаришнни ^лчаш мумкин.
Энтальпия ёки системанинг исси^лик сацлаши му-Зим термодинамик катталик зисобланади. У ички энергия ва босимнинг иш зажмига булган купайтмалари йигиндиларидан збсил булади.
Н - U + pV
Энтальпия зиймати иссизлик самарасининг тескари ишораси билан олинган катталикка тенг. Шундай зи-либ, юзорида. келтирилган термокимёвий тенглама бу Зийматни зисобга олган зуйидаги золатга’ келади:
2Нг (г) + О2(г) -—> 2Н2О (с) А Н = —571,6 кЖ
Кимёвий реакцияларнинг иссизлик самараси фазат реакцияга киришувчи дастлабки ва охирги модданинг бошланрич ва охирги (агрегат) золатларига борлиц булиб, жараённинг бориши, яъни оралиц босзичларнинг сони ва характерига''боглиц булмайди. Гесс зонунидан фойдаланиб, жараённинг зар дандай босзичидаги ис-сицлрк самарасини зисоблаш мумкин, агар жараённинг бопща босзичларининг иссизлик самараси маълум бул-са, бутун жараённинг иссизлик самарасини анидлаш мумкин. У энергия сазланиш зонунининг хусусий ифо-дасидир. Хисоблаш учун бир хил золатдагй модданинг Зосил булиши замда ёниш иссицликларидан фойдаланиш мумкин. Бир моль глюкозанинг бир босцичда ёнишидан 2881 кЖ/моль иссизлик ажралиб чицади, агар одам организмида глюкозанинг ёниши бир босцичда борган-да эди, у энергия муллиги (к^плиги) дан залок бул ар эди. Аслида жараён бир затор оралиц босзичлар ортали руй беради, уларнинг зар бирида кам миздорда энергия ажралиб чи^ади, аммо Гесс зонунига мувофиз ажралиб чизан иссизликнинг оксидланишнинг займа босцичларидаги умумий миздбри шундайлигича, яъни 2881,2 кЖ]моль лигича цолади.
Мураккаб модданинг зосил булиш иссицлиги деб стандарт иссицлик самарасига, АЯ°х.в. яъни мазкур шароитда оддий моддалардан li моль мураккаб модда Зосил булишига айтилади.
Модданинг ёниш иссиЦлиги деб, унинг кислородда ёниш реакцйясидан зосил булган иссизлик самараси АЯ’гниш га айтилади. Одатда, зосил б^лиш иссйцлик-ларини стандарт шаройтга тааллуцли деб царалади: 25° С (298 К) 101,325 кПа стандарт иссизлик ёки зосил
В»$лиш стандарт энтальпиясй дёб аталади. Улар ДН'гэа ^илан белгиланади ва купчилик бирикмалар учун аник-Данган. Термокимёвий реакцияларда одатда стандарт ^ энтальпия кУрсатилади:
Н2 (г) +1 Оа (г) —-»- Н2О (с) ДН°98 = — 285,8 кЖ/моль
" Иссиклик самараси калориметрларда аникланади. Ис-‘ сиклик мицдори калориметрнинг Дамма цисм^даги умумий иссидлик сигими ва кимёвий реакция яёараёнида дароратнинг узгариши буйича анидланади. ^Реакцияга киришаётган моддалар ва сув массаси шундай танла-надики, натижада дарорат узгариши кам булиши керак. Реакцияга киришаётган модда ёки реакция мадсулотй-нинг 1 молига турри келадиган иссидлик миддорини ди-соблаб, унинг энтадьпияси анидланади.
' Ургатувчи масалалар ва уларни ечиш намуналари
1- масала. Баъзи сувснз тузларнинг эришига икки босдичда борадиган жараён деб цараш мумкин: 1) тузнинг гидратланиши (одатда иссидлик чидиши билан бОради, 2) гидратнннг эриши.
Д Нэриш (MgCl2)=—150,5кЖ/моль, A Н’рнш (MgCl2-6H2O) = - 12,3
кЖ/моль эканини билган долда MgCl2 сувсиз тузининг гвдратланищ ис-сидлигини дисобланг.
। Берилган: AH3pHI1I(MgCl2)=—150,5кЖ/люль
'___________Д Н°зрид,(MgCl2-6H2O) = -12,3 кЖ/моль
ДН° гидратлаииш — ?
Ечиш намунаси. 1. MgCl^ гидратлаииш тенгламасини тузамиз.* MgCl2 + п (Н2О) -> (Mg (Н2О)в)2+ + 2С1“(п-6) Н2О
х ДН°9риш. = — 150,5 кЖ/моль
2. Берилган жараённи шундай тасаввур дилиш мумкин:
. MgCl2 + 6H2O->MgCl2.6H2O Д//гидр. = ?
MgCl2-6H2O + aq -> [Мё(Н2О)в]2+ + 2С1Г aq
3. Гесс донунидан келиб чицадики: Д//эрнш = — 12,3 кЖ!моль
д ЯэрИш(МёС1г) = ДЯгидр + Дй?р-иш (MgCl2.6H2O)
шундай дилиб: '
ДЯ°гвдр = АЯ®риш (MgCl^ - Д Я°рнш (MgCl2-6H2O) '
Д//^идр = — 150,5 кЖ/моль — (—12,3 кж/моль) — —138,2 кЖ/моль
Жавоб. Д HQn№ = — 138,2 кЖ/моль
, 2-масала. Водород пероксид досил булиш иссидлнгини тажриба
йУля билан анидлаб булмайди, чунки оддий шароитда водороднинг кислород билан узаро таъсири натижасида сув досил бУлади, Лекин, Ненниг Н2О ва О га парчаланишидан досил булган иссидликни ва Н2О иссидлигини анидлаш мумкин.
Берилган; А Я°арч. (Н/М (с) — —98,2 кЖ/моль
' АН® б (Н2О) (с) = — 286,0 кЖ/моль
АН® б. (Н2О2) (с)=?
Ечиш намунаси: 1. Н2О2(с) досил булиш реакция тенгламасини тузамиз:
Н2 (г)О2 (г) = Н2О2(с)
Н2О(с) досил булиш реакция тенгламасини тузамиз. -
2. Н2(г) + 1/2 О2(г) = Н2О(с) АН® б =—285,8 кЖ/моль
3. Н2О2 парчаланиш реакция тенгламасини тузамиз;
H2Oa(4=H2O(c)4-V2 О2(а) ДЯпарч.=— 98,2 кЖ ёки
Н2О(с) + »/2 О2(г) = Н2О2(с) Д//^.б. = + 98-2 кЖ/моль
4. Гесс донунига кура, бу тенгламаларни комбинация лаб, излана-ётган дийматни топамиз:
Н2О (с) + «/202 (г) = Н2О2 (с) Д//х,б. = 98,2 кЖ /моль
Н2(г) + i/2 О2(г) = Н2О (с) &н\ б = — 286,0 кЖ/моль
Н2(г) + О2 (г) = Н2О2 (с) АН* б = ?
Шундай дилиб:
ДН®арч_ 0W (с) = ДН® Н2О (с) + ДЯ®. б. Н2О2) (с)
Л^°.б.(Н2Оа)(С)= ДН®арч (Н2О2) (с) + Д Я® б. (Н2О) (с)
ДЯ®.в. (НгОг) (С) = + 98,2 кЖ + (—286 кЖ) = — 187,8 кЖ Жавоб: Д Я® в (Н2О2) (с) = — 187,8 кЖ/моль
Масала бУйича саволлар
1. Реакциянинг термокимёвий тенгламалари нима?
Жавоб: Энтальпия (иссиклик самараси) узгаришлари кУрсатил-Тан кимёвий реакциялар термокимёвий тенгламалар дейилади.
-2. Гесс донуни дандай ифодаланади?
Жавоб: реакциянинг иссидлик самараси фадат реакцияда дат-нашаётган моддаларнинг бошлангич ва охирги долатларига боглид булиб, жараённинг оралид босдичларига боглид бУлмайди.
3. Термокимёвий тенгламалар билан арифметик амалларни ба* жарищ мумкинми?
Жавоб: Х^а, термокимёвий тенгламаларни дУшиш, олиш ва сон диЙматли кУпайтувчиларга кУпайтириш мумкин.
4, Гесс донунидан чидадиган дрсила (хулоса) дандай шардла-нади?
|Жм0б: Кимёвий реакция энтальпиясииинг стандарт узгариши шця мадсулоти досил булищ стандарт энтальпияларн йигинди-Кк бошлангич моддалар досил булиш стандарт энтальпияси айир-jswaf Тенг.
Тиббий-биологик текширишларда Гесс донунининг адамняти Наш
^Жавоб: Гесс донуни турли кимёвий, жумладан, биокимёвий ре-Вйялар (жараёнлар) энергетик характеристикаларини дисоблаш ЙЙнини беради. У реакциялар иссидлик самарасини бевосита Ул-1п мумкин бУлмаган лолларда дам днсоблаб чидаридг имконини ^ади, бу эса даёт учун зарур булган энергияни анидл^шда жуда
ИКмэунинг узлаштирилишини мустадид назорат дилинг учуй савол ИИт ва масалалар
MfcF- 1. Гесс донуни ва ундан чИДадиган досилани пфодалаб беринг.
КанДай дилиб реакцияга киришган мрданищ- досил булиш К&рдликлари ордали реакциянинг иссидлик самарасини дисоблаш жукин?.
'3. Глюкозанинг ёниш иссидлиги 2816 кЖ/моль, этил спиртининг Вмнбп иссидлиги 1236 кЖ/моль, СО^ (aq) нинг досил булиш иссидлиги — 412,9 кЖ/моль. Шу дийматларга кУра, глюкозанинг бижги* пЖцдапг биокимёвий жараён иссидлик эффектини дисоблаб чидаринг. К С,Н12О«—► 2CsH5OH + 2СО2
Жавоб: ДЯреак. = — 482 кЖ/моль
р’ 4. Фосфиннинг (одам учун жуда задарли газ) ёниш реакцияси арйуйидаги тенглама билан ифодаланади: -
К^ЗРН, (г) 4-4О2 (г) —► Р2О5 (к) + ЗН2О (с) ДН» = — 2449,7 кЖ/моль Вг’ Агар ДН° (РаО5) (к) = — 1596,2 кЖ/мрль А Н°(Н2О) (с)= -285,9 кЖ-ЕМль лиги маълум булса, РН3 нинг досил булиш иссидлигини дисоб-ряиг.
5. Коньюнктивитда антисептик ва буриштирувчи модда сифатида •Унге ишлатилади. Сувсиз рух сульфатнинГ эриш иссидлиги ,-ЛН°эриш = — 77, 6 кЖ/моль, ZnSO4.7Н2О гидратнинг эриш жсидлиги м веаДН°рнш==—17,9 кЖ/моль эканини билган долда сувсиз тузнинг гид-^ЛВггланиш иссидлигини анидланг.
РТ Жавоб: ДЯ°гияр. (ZnSO4) = — 59 кЖ/моль
.6. Глюкоза бактериялар иштирокида сут-кислотали бижгишда F сут кислотасига айланади. Бу реакциянинг иссидлик самараси Н’= 810 кЖ/моль га тенг. • Сут кислота (С3НвО3) досил булишидаги г иссидлик самарасини дисобланг.
ДЯ° б (С,Н12О9) = — 2616 кЖ/моль
Жавоб: Дй°. е. (С3НвО3) = — 1518 кЖ!моль
Лаборатория иши КУЧЛИ КИСЛОТА БИЛАН КУЧЛИ АСОСНИ НЕЙТРАЛЛАШ РЕАКЦИЯСИ ОРКАЛИ ИССИКЛИК САМАРАСИНИ АНИКЛАЩ
Ишни бажариш учун калориметрии мослама ишлатилади. У калориметрии стакан — 2 ^амда ички ва таш^н идишдан ташкил топган. Иссидлик йуцотили-шининг олдини олиш учун калориметрии идиш ва таш-^и стакан деворлари бир-бирига тегиши керак эмас. Бунинг учун улар орасига пукак поналар ^уйилади. Калориметрии стакан термометр 4, аралаштиргич 6 ва стаканга модда кири-тишга м^лжалланган во-
ронка 5 учун тешикли цоп^оц 3 га эга.
Ишнинг бориши: калориметрнинг ички (КУРУК) ста-канига 50,00 мл (бюретка билан) 1 М КОН эритмаси Куйинг. Унинг ^ароратини 0,1°С гача аникликда улчаб олинг. Шу ани^лик билан кислота эритмаси ^ароратини улчанг. Сунгра бюреткани 1 моль/л НС1 эритмаси билан тулдириб, воронка устига ма^камланг. Аралаштир-гични ишлатиб турган з^олда 50,00 мл кислота эритмасидан ишкорли калориметрии стаканга цуйинг. Эритмалар ц^шилгандан сунг ^арорат ^лчагич к^рсатган максимал (энг говори) ^ароратни белгиланг. Тажриба натижалари ва белгиларини жадвалда курсатинг.
WOH) V(HCI) МА ^бошн’С 5охирн°с Д<°С <1 к Ж ДН кЖ/моль Хато
50,00 50,00
Олинган натижаларга кура ^исоблаш олиб борилади: Сири с ва , с фаркига кура Д /°C ни топамиз:
AfC =s /°охнр С — С
Калориметрда ажралиб чи^ан иссидлик миддорини формула буйича топамиз: <7=ДГС-ДС
— системанинг иссизлик сигими, калориметрии калориметрии суюцлцк ва модда иссизлик сирим-
ИКрининг йигиндисидир.
ДС=С4Ш14- С2М2
Ci ва /П1 — реакция борадиган идишнинг массаси ИЬлиштирма иссизлик сигими.
Иг: С2 ва т2— калориметрдаги суюцлик учун ю^орйда-Вк цийматлар (эриган модда ва сувнинг мйссалари Вириндиси). Шиша калориметрдан фбйдалйнилганда Шйицлик ^тказувчанлик жуда кам булгани учун шиша Калориметрии идишнинг.иссицлик сиримини фсобга ол-Кшаса з^ам булади, яъни Ci ва rrti эритмаларнинг солит--. рГирма иссизлик Утиазувчанлиги ва зичлигини Н2О ций-|Ййатларига тенг деб ^абул цилиш мумкин:
|К р(НаО) == 1 г/мл
р С(Н2О) = 4,184 кЖ!кг-град. бу эса Са дир.
|Унда тенглама (1) Цуйидаги куринишга эга булади:
ь-’- q-hfC-c^n2
| —калориметрдаги /пк.та ва /пншкор йириндисидир:
m = ₽-V
I - /пк.та = 50 мл-1 г/мл = 50г
р — 50 мл • I г/мЛ =* 50 г
£ ша = 50г 4- 50г = 100г ёки 0,1 кг
f Шундай ^илиб,
q = - Cjffig = AfC • 4 J 84 • mt
q *~Ы°С-0,1- 4,184 = кЖ x
. кг-град
Иссизлик самарасини 1 моль модда ^исобида олиб бо-рамиз: • . \
Q = А .
п моль
Тажриба учун КОН ва НС1 ларнинг 50,00 мл 1 моляр эритмалари олинган. Шу эритмалардаги моллар сонник ^исоблаймиз.
п = сУ ♦
п « 1 • 0,05 0,05 моль
л
Шунмй кклиб. ,
Нейтралланиш реакциясининг иссидлик самараси — нейтралланиш реакциясининг стандарт энтальпиясидир Дтесйари ишора билан олинган, яъни
д/р =-1?__
298 0,05 моль
.Дажрибадаанидланган Д/Л^дийматларни назарий Д/7®дВ га диймат билан солиштиринг, тажрабадаги хатонинг % ини дисобланг.
% хато (АН°азаРи* АН°^лиД1 ; 100% A/jO .
^^назарий
III БОБ
БИОГЁН ЭЛЕМЕНТЛАР КИМЁСИГА КИРИШ ’ ' S-ЭЛЕМЕНТЛДР ВА УЛАРНИНГ ХОССАЛАРИ
Мавзунинг мадсади: 1. Кимёвий элементларнинг биологик жараёнларда датнашишини урганадиган булим — биоген элементлар кимёси билан танишиш.
2. Сифат анализи усули асослари билан танишиш.
3. S-элементлар ва уларнинг бирикмалари буйича сйстемали билимга эга булиш.
Биологик системаларда S-элементларни хосил дила-диган бирикмаларини башорат дилишни Урганиш.
I ва II гуруд S-элемент катионлари сифат реакция- -ларини. бажариш буйича кУникмага эга булиш.
Урганйлаётган мавзунинг адамияти. Бионоорганик диме учта фан — ноорганик кимё, биология ва биокимё фанларининг душилишидан вужудга келган. Биоген элементлар кимёси унинг бир булими дисобланади.
Кимёвий элементларнинг биологик ахамияти улар-нинг.Д. И. Менделеев даврий системасидаги урнига кура белгиланадиган физик-кимёвий хоссалари мажмуа-’сигабоглид.
Сифат анализи усули биологик объектлар, доривор препаратларнн сифат жидатидан текширишда кенг ишлатилади.
Тирик организмда водород бирикмалари жуда куп. У углерод, азот* олтингугурт ва бошда элементлар билан ковалент богланган долда булади. Н3О+ иони сифа-
154
/ '
ганда меъда шираснда куп миддорда булади, Бунда у Кйидролитик жараёнларда катализатор вазифасини ба-^.деаради дамда озид-овдат мадсулотлари бйлан бирга Эушган микробларни улдиради. Биомолекулалар ора-*"сида водород богнидосил дилиши водороднинг мудим ^хоссаси дисобланади.
- I гуруд S-элементлари—натрий ,ва калий, у макроэлемент б^либ, одам организми буйлаб тардалган. Нат
рий, ионлари дужайралараро суюдликда, калий эса — дужайра ички суюдлиги таркибида. куп буладй. Огир куйиш натижасида руй берган шок долатларй дужай-раларда К+ йудолишига сабаб булади. ^ужайранинг икки томони (ички ва ташди) даги осмотик^ босимни Иккита ион ушлаб туради. Бундан ташдари, нервлар-нинг' сезгирлиги ва мускул долати уларга боглид бу-
лади.
ЫаС1дан меъда ширасидаги хлорид кислота досил булиб туради. NaHCOs — одам танасидаги суюдлик-. ларда кислота-асос мувозанатини садлаб туриш учун буфер туз дисобланади.
Иккала ишдорий металлни буйрак ушлаб доладйва унинг бир дисми сийдик ортали ташдарига чидиб ке-: тади. •
II гуруд S-элементдари магний ва кальций, улар тирик организмнинг макроэлементлари дисобланади. Mg2+ ионлари активлаштирадиган *жуда куп ферментлар мавжуд. Бу элемент АДФ ни АТФ га айлан-тиришдек системанинг мудим реакциясида датнашаДи. Магний организмга антисептик, томир кенгайтирувчи таъсир курсатади. Усимликлар дунёсйда унинг адамияти жуда катта, у хлорофилл таркибига ,кн-
ради.
Одамда кальцийнинг асосий массаси суякларда фосфат, карбонат ва фторидлар куринишида булади. Ибн-лашган кальций кон ивиши, мушакларнинг кисКаРиши ва бущашишида иштирок этади. Одамнинг бу элёмент-ларга булган э^тиежи озик-овкат таркибидаги Са(П) Mg(II) оркали кондирилади.
Стронций одамнинг суяклари таркибида, барий эса кУз рангдор дзватида булади. Бу элементлар купроц микдорда кабул хилинганда одам учун закарли, улар кальцийни биомолекулалардан куп микдорда сикиб чи-Кариши мумкин. Бериллий дам задарли, у магнийни биомолекулалардан сидиб чицаради. • *
Таъсирига кура водород ионлари цаторига кирадиган тиббий препаратлар
НС1 — суюлтирилган хлорид кислота — меъда шираси кислоталилиги камдйганда ишлатилади;
НС1+ пепсин — ацидопепсин.
Н,О2 — «пергидроль» — Н2О2 нинг 30 % ли эритмаси, 3% ли Н2О2 эритмаси—дезинфекцияловчи восита.
Н2О2 + CCXNH^ — гидроперит — антисептик восита.
' I гуру^ S- элемент бирикмаларининг тиббиётда ишлатнлиши
Li2CO3 — психиатрия амалиётида ишлатилади;
z NaCl нинг 0,85% ли эритмаси куп цон йуцотганда томир ортали юборилади;
жарро^лик амалиётида 3,5% ли эритмалари ишлатилади.
NaHCO3 — меъда шираси кислоталилиги ортганда ней-траллаш учун ишлатилади;
Na2SO4-10H2O — сурги восита сифатида ишлатилади;
NaBr, КВг — тинчлантирувчи восита;
NaJ, KJ — цал^онсимон без касалликларида ишлатилади;
КС!—юрак аритмиясида ишлатилади;
CHgCOGK — сийднк ^айдовчи восита.
II гуруз [S- элементлари ва шу элемент бирикмаларининг Тиббиётда ишлатнлиши
AigO — адсорбцион (сурувчи) ва антацид таъсирга эга булиб, меъда-ичак касалликларида ишлатилади;
MgSO4-7H2O— гипертония, атеросклероз, сурункали тож-тбмир касалликларида ишлатилади.
MgS2O8-6H2O —«------«-----«—
3MgSiOa-M(HSiO8)2—тери касалликларини даволлашда ишлатилади. СаС12 • 6Н2О — аллергик касалликлар, тери касал-ликлари, нефрит, цон кетиши ва купгина бошца касаллик-ларни даволашда ишлатилади.
Г ОН ОН Н ОН 1
I II I 1 н—о—сн2—с—с—с—с—с€ Ml I I ' н н н он н
Г ОН 1
Са-5НаО
• • мс ода mnj^uv«4 ____
тилади;
CaPO3—О—СзН5(ОН)5 — асаб системаси тангликка учра-ганда ишлатилади;
' CaSO4-1/2HsO— гипсли богламлар;
BaSO4— }\изилунгач, меъда ва ичакларни рентгенологии текширишда ишлатилади.
Бошланрич даража
1. Д И. Менделеев даврий системасида жрйлашган элементлар ва шу элемент бирикмалари хоссала-рининг узгариш ^онуниятлари. t
2. Атомларнинг электрон тузилиши.
3. Молекулалардаги кимёвий 6of турлари.’
4. Кимёвий реакция тенгламаларйни шз леку л а ва ион шаклида тузиш.
Мустацил тайёрланиш учун уцув материаллари
1. Н. Л. Глинка. «Умумий химия». Т. 1968. 93, 621, 664-бет-лар.
2. К- Р. Рахимов. «Анорганик химия». Т. 1974. 49, 380, 355-бетлар.
3. С. С. Олени и, Г. Н. Фадеев. «Неорганическая химия». М., 1979 й. 191, 241, 297-бетлар.
4. В. Н. Алексеев. «Ярим микрометод билан цилинадиган кимёвий сифат анализн курен». Т. 1976. 17, 130, 202-бетлар.
5. К. А. С е л е з н е в. «Аналитическая химия». М., 1973 й. 65, 71, 82-бетлар. '
6. И. К. Цитович. «Курс аналитической химии». М., 1985 й. 84, 102, Ц4-бетлар.
7. X. К- К а к И м о в, А. 3. Татарская. «Периодическая система и биологическая роль элементов». Т;, 1985 й. 14. 16, 23- бетлар.
МАЪЛУМОТЛАР БЛОКИ
БИОГЕН ЭЛЕМЕНТЛАР КИМЕСИ
Биоген элементлар кимёси тирик хУжайраларда но-органик ионлар иштирокида борадиган кимёвий реакцияларни ^рганади. Элементлкрнинг биологик роли маълум даражада уларнинг физик-кимёвий хоссаларига боглид'. Элементларнинг биологик таъсирини та^цослаш унинг Д. И. Менделеев даврий системасидаги Урнига уй-вий богликлигини курсатади. Уларни хаётдаги урнига кура уч гуру^га ажратиш мумкин:
I. Биогён элементлар — тирик организм учун зарур булган fia-унинг танкислиги баъзи касалликларга олиб келадиган элементлар.
•
' 's, F, Cl,. J, Se, Na, K, Mg, Ca, Mn, Fe, Bi, Br, Ni, Co, Cr,V, Cu, Zn, Mo, 7 i, B, Sr, Zi, Ba; Si, As киради.
2. Биоген булмаган, . лекин доривор препаратлар тарки-бйга кирувчи элементлар: Ag, Au, Al, Pb, Sb, Bi, Pt ? З.'Холганлари зозирги вацтда доривор препаратлар таркибига кирмайдиган элементлардир.
>Биоген ва доривор препаратлар таркибига кирувчи элементлар йигмаси фаннинг ривожланиши билан ал-батта ортиб боради.
' -Элементлар тйрик организмга атроф-музит, заво, тупрод, сув ва зоказолар ортали тушади. Одатда, тирик зужайраларга табиатда бирмунча купроц тардалган элементлар овдат ортали тушади.
Одам организмидаги турли аъзолар фаолйятининг нормал ишлаши учун шу элементлар маълум миддорда ущланиб долади ва- т^планади. Бу нормадан четга чи-диш патологии бузилишларга олиб келади. Шунинг учун тйрик организмга зарур булган элементнинг ки-‘ритйлиши (ёки нокерагининг чидариб юборилиши) тиббиёт фанининг мудим вазифаси зисобланади.
Кимёвий сифат анализи
Аналитик кимёдаги бу б^лимнинг вазифаси модда ёки моддалар аралашмасининг сифатий таркибини анид-лашдан иборат. Амалда бу катионлар ёки анионларни анидлашга олиб келади. Тиббий амалиётда биологик объектларни сифат жидатидан анализ дилиш зарур. Тиббий амалиётда бирорта доривор препарат сифат жидатдан анализ дилинмай туриб ишлатилмайди.
Сифатий анализ учун фадат аналитик реакцияларни дуллаш мумкин. Булар сезиларли даражада ташзи Самара (узгариш) берадиган реакциялар б^либ, унинг асосида айнан шу бирикма зосил б^лгани анизланади ва текширилувчи катион ёки анион борлиги зазида ху-лоеа чидарилади. Реакциялар сезгир, тез ва охиригача борадиган булиши керак. Уларнинг музим шартлари мудит, дарорат, эритмадаги анидланаётган ион концент-рацияси^ва бошзалардир. Реакциянинг 5)зига хослиги унинг’ музИм хусусиятидир. Бошза ионлар иштирокида дидирилаётган ионни аниздаб берадиган реакциялар специфик реакциялар дейилади.
Специфик реакциялар ёрдамида текширилаётган эритманинг алодида порция (зисм)ларида ионларнинг анизланиши б^либ-булиб анализ дилиш дейлади.
L— Фа кат чекланган мц^дирда! n *
Ксамара берадиган реакциялар танловчи . ёки селектив Вреакциялар деб номланади. Реакция самара берадиган гионлар сони данчалик кам булса, реакциянинг селек-; тивлик даражаси шунча юцори булади. Ионларнинг маълум тартибда, каР бир ионни ани^лашга ^алал ^берувчи.ион йуцотилТандан кейин анидланиши систематик анализ дейилади. Бу анализда мураккаб аралаш- мадан аввал бир гурук. ионларни ажратиб ол^вчи гурук реакциялари ишлатилади. Берилган каР бцр ионни ‘аницланг учун эритмадан унга калал берувчи барча
ионлар ани^ланиб, йУ^отилганда сунг киришилади.
Шундай цилиб, систематик. анализДа ало^ида ион-г ларни ани^ловчи реакциялар билан бир даторда улар- ни бир-биридан ажратадиган реакциялар ^ам^уллани-лади.
Водород ва водород бирикмаларининг хоссалари
Водород атомининг электрон конфигурацияси 1S1. Унинг ягона электрони бевосита атом ядроси таъсир доирасида жойлашган. Электрони йу^отилганда Н+— протон ^осил булади. У энг енгил атом. Унинг молеку- > ласи икки атомдан иборат Н2.
1 2
Водород—газ, учта йзотопи бор: iH—протий, 1Н — дей-
терий (Д), 1Н — тритий (Т.)
Водород атоми оксидловчйлар.билан узаро таъсир-лашганда электронини осон бериб дайтарувчилнк сифа-тини намоён цилади:
2Н2 + О2 =₽* 2Н2О ЗН2 + N2 2NH3'
Н2 + Cl2 =₽* 2НС1 CuO + На Си + Н2О
Кучлиро^ ^айтарувчилар билан таъсирлашганда Узи ^ам дайтарилиши мумкин, бунда у гидридлар ^осил цилади. . ~
2К + Н3 = 2КН. Са + Н2 = СаН2
Шундай т^илиб, унинг хоссалари икки хил характер-га эга. Тирик организмда О, С, N, S, С1 ва бопщалар каби электроманфий элементлар билан богланган булиб, ковалент молекулаларни ^осил дилади.
Водороднирг му^им , бирикмалари — сув ва водород пероксид. Сув— табиатда энг кенг тардалган модда; У етарлича реакцияга киришиш добнлиятига эга булиб,' металлар, металмаслар, оксидлар, тузлар ва бош^алар
ларда лиганд ва к^пчилик булиб келади.
2На0 + Na = 2NaOH 4- На На0 + ВаО = Ва(ОН)а НаО + СО2 = НаСОа Сг(ОН)з +-NaOH + 2НаО = =Na[Cr(OH)4(HaO)2]
моддаларнйнг эритувчиси.
С1а + НаО + НС1 + нею NaaCOs + НаО = NaOH+ + NaHCO3
ZnCla + НаО = Zn(OH)C14-4-НС1
У жуда кучсиз электролит: НаОч±Н+ + ОН~.
Унинг молекулалари жуда ^утбланган ва водород бог вужудга келиши ^исобига ассоциланган (тупланган):
Н—О . . . Н Н
Н О—Н . . . О—Н .
Хаёт учун сувнинг а^амияти жуда катта: у тириклик жараёни борадиган му^ит булиб, узи ^ам гидролиз реакцияларида актив ^атнашади.
. ‘ Водород пероксид — Н2О2— шарбатсимон сую^лик, портлаш билан парчаланадиган бе^арор модда
2НаОа (с) — 2НаО (с) + О2 (г) АН = — 197,5 кЖ/моль
Н2О2—жуда кучсиз икки негизли кислота. Унинг тузлари Na2O2; ВаО2 ва пероксидлардир. Н2О2 — оксид-ловчи ва ^айтарувчилик хоссасига эга:
1. 2 KJ + Н2Оа + H2SO4 = J2 + K2SO4 + 2НаО
НаОа + 2Н+ 4- 2е = 2НаО окейдловчи
2. AgaO + НА = 2Ag + Н2О + О2
НаО2 = Оа 4- 2Н+ + 2е ^айтарувчи
Н2О2нинг 30% ли сувли эритмаси пергидроль деб аталади; 3% ли Н2О2 эритмаси тиббиётда дезинфек-цияловчи восита сифатида цУлланади. Водород пероксид тирик организмда аминокислоталарнинг оксидланиб парчаланишидан ^осил булади ва каталаза ^амда пероксидаза ферментлари таъсирида парчаланади.
I гуру^ s-элементлари ва шу элемент бирикмаларининг хоссалари
I rypy^ S-элементлари — литий, натрий, калий, рубидий, цезий ва франций ишцорий металлар деб ном-ланади. Ишцорий металл атомлари тапн^и. электрон цо-бигида биттадан электрон са^лайди — nS1. Уларнинг
. 4Z»1V1UVH « 11I1VUU 1 UH а Д vm oa луп ^адп-у .
катта булиб, ионланиш энергиялари диймати энГ ки- . чикдир. Улар кимёвий актив металлар, жуда кучли дайтарувчилар б^либ, фадат мусбат +1 оксидланиш да-ражани намоён дилади.
Ме°—1е-»-Ме+
Уларнинг кимёвий активлиги литийдан цезийга да-раб ортиб боради.'Улар электроманфий элементларга ва щу элементларни садловчи к^пчилик мураккаб мод-даларг% нисбатан реакцияга киришувчандир. Масалан:
2Na -|- Оа = Na2O2 2Li -f- S = LiaS
' 2K 4- Cla = 2KCI 2K + 2NH3 = 2KNHa 4т H4 2Na + 2HaO = 2NaOH + H2 4
Улар металлмаслар билан ионли бирикмалар досил дилади: NaCl, NaBr ва бошдалар. Водород билан осон гидридлар досил дилади:
2К+Н2=2КН
Ишдорий металд оксидлари реакцияга киришиш до-билйяти юдори бирикмалардир. Улар сув билан тез реакцияга киришиб, сувда эрийдиган гидроксиддар — иш-дорЛарни досил дилади:
Na2O+H2O=2NaOH бу металларнинг деярли дамма кислоталар билан досил дилган тузлари маълум. Одатда,' уларнинг купчи-лиги ион богланишли моддалар б^либ, сувда яхши эрийди. Кучсиз кислоталар билан досил дилган тузлари сувда1 гйдролизга учрайди ва ишдорий мудит досил дилади: '
NaaCO3 + НаО NaHCO3 + NaOH
II гуруд s-элементлари ва шу элемент бирикмаларининг хоссалари.
II гурУд S-элементларига типик элементлар—бе- • риллий, магний дамда ишдорий ер металлари — кальций, стронций, барий ва радийлар киради. Атомларнинг энг ташди электрон даватида 2 та электрон бор.— nS2. Уларда металлик хоссаси яддол ифодаланган булиб, ! активлиги жндатидан ишдорий металлардан сал фард г дилади. Кучли дайтарувчи булиб, фадат 4-2 оксидла-йиш даражасини намоён дилади.
L' > Ме°—2е->-Ме2+.
Ь. Уларнинг активлиги бериллийдан радий томон ор-ОИб бо.ради. Кальций, стронций ва барий, бериллий ва .
магнийдан фарцли равишда нисбатан катта атом ра-диуси ва кичик ионланиш энергияси циймати билан ха-рактерланади. Завода улар тез оксидланади ва купчи-лик электроманфий элементлдр билан Узаро таъсирла-нади. Mg ва Be ^авода оксид парда досил цилади.
2Са + О2 = 2СаО 3Ca + N2 = Ca3N2
2Ве + Оа = 2ВеО Mg + Cl2 + MgCla
Be + S = BeS
Фадат бериллий ва магний водород билан бевосита реакцияга киришмайди:
Mg + H2 = MgH2
ВеО ва Be (ОН) 2 яддол ифодаланган амфотер характерна эга,
Ве(ОН)2 + 2НС1 = ВеС12 + 2НаО
Ве(ОН)2 +2NaOH=Naa[Be(OH)J ' долган оксидлар — асосли кимёвий актив оксидлардир. Гидроксидларнинг кучи цуйидаги тартибда ортиб боради:
Ве(ОН)а -> Mg(OH)2 -> Са(ОН)2 Sr(OH)2 -> Ва(ОН)2
Худди шу тартибда уларнинг сувда эрувчанлиги дам ортиб боради. Магнийнинг к^пчилик тузлари сувда эрувчандир, ишдорий ер металларининг эса нордон тузлари ва хлоридлари, нитритлари эрувчан б^либ, аксин-ча, к^пчилик тузлари ёмон эрийди.. Тузларнинг эрувчанлиги кальцийдая барийга томон камайиб боради:
CaS04-> SrSO4->- BaSO4
СаСО3->- SrCO3-> ВаСО3
Са3(РО4)2 Sr^POJ, Ba3(P04)a
Бериллий ва магнийнинг ишдорий ер металлардан фардли равишда комплекс бирикмалар досил дилиш Хусусияти купрод: [Be (ОН)4 ]2, [BeF4]2-, [Mg(H2O)el2+,
Ургатувчи масалалар ва уларни ечиш намуналари
1-мисол. Водороднинг дутбсиз, дутбли ва ион куринишидаги бор досил дилган бирикмаларига мисоллар келтиринг.
Ечиш намунаси. 1, Н2— водород молекуласида дутбсиз бор тури намоён булади.
2. Водороднинг металлмаслар билан Узаро таъсирлашувида ко-валент бргли бирикмалар досил булади. Элементнинг электроманфий-лигн данчалик юдори булса, бор шунчалик дутбланган булади. К,у-тбли ковалент борли бирикмаларга Н2О HjS ва бошдалар киради.
3. Водороднинг металли бирикмалари — гидридлар — типик ионли бирикмалардир: №Н, СаН2 ва бошдалар.
В'3'" 1. Ковалент бог деб нимага айтилади?.
'*5 ' Жавоб: Жуфтлашмаган электронлардан досил булган атомлар-1 St ббглаб турувчи умумий электрон жуфт дисобига досил б$лган бб? ковалент бог дейилади.
2. Ковалент богнинг дандай турлари-бор? ;
Жавоб: дутбли, дутбсиз, ионли.
3. Бу турдаги богларга таъриф беринг ва мисоллар келтиринг.
Жавоб: 3.1. Кутбсиз ковалент бог умумий электрон жуфт дисо- бега досил булиб, электрон булути иккала атом ядролари орасида симметрии жойлашган. булади, У электроманфийлиги бир хил ёки « жуда ядин б^лгаи элементларни бириктиради. Масалан, Н2, С12, Оз, ВС13, СО2, CCU молекулалари ва бошдалар.
1 3.2. Атомлар Ърасидаги электрон будут оир атом томонга сил-жиган ковалент бог —дутбли ковалент бор дейилади. Б^ндай бор электроманфийлиги бир хил булмаган атомларнинг Узаро таъсири . Натижасида досил булади, масалан: H2OJH2S, NjOs, H2SO« ва бош-далар. а
3 .3. Умумий электрон булутнинг электроманфийлиги кучли булган элемент атоми томон туда силжиши натижасида зарядланган " ионлар досил булади ва улар орасида ион бог вужудга келади. У электроманфийлиги кескйн фард диладиган атомлар орасида Вужудга келади. Масалан: NaCl, КВг, LiOH, MgSCU ва бошдалар.
4. Гидридлар дандай хоссаларга эга?
. Жавоб: улар кучли дайтарувчилар, датто сув дам уларга кучли, таъсир кУрсатади:
NaH+H2O=NaOH+H2
. 2-мисол. Na2O2 гидролизини ион-молекуляр шаклда ёзинг. Na2O2 эритмаси дайнатилса, у узининг одартувчилик хоссаларини сдддаб доладими?
Ечиш намунаси. Гидролиз деб, моддаларнйнг сув билан Узаро - тдъсйр этиб, кам диссоциланадйган мадсулот досил булиши натижа-сЯда сув электролитик диссоциациясида мувозанатининг силжишига . айтилади. Na2O2—сувли эритмаларда кучсиз кислота — водород пероксид тузи сифатида гидролизга учрайди:
• Na2O2 + 2H2O=Ffc2Na0H + H2O2 "
. Ol~ +2Н2О^ Н2О2 -J- 2ОН-
NaiOr—кучли оксидловчи, бу хусусиятидан фойдаланиб, уни турли материа'лларни одартиришда ишлатилади. Na2O2 дайнатилганда пар-чаланиб кетади ва одартувчилик хусусиятини йУдотади:
- ; ло2
2Na2O2 + 2Н2О = 4NaOH + 2Н2О2(
*2И2О
Масала бУйича саволлар
< 1. Тузларнинг гидролиза деб нимага айтилади?
< Жавоб: Гидролиз деб, тузларнинг сув билан узаро таъсирлашиб, ’"7 Диссоциацияга учрамайдиган мадсулотлари — молекула ёки ионлар-MgBr досил булиши ва одибатда сувнинг ионланишидапГ мувозанат-. \ вднг силжишига айтилади.
2. Гидролиз натижасида мудит Узгарадими?
' Жавоб: Гидролиз эритма pH и узгариши билан боради.
3. pH нима?
Жавоб: pH — водород ноли концентрацияси Унли логарифмннинг тескарн ишора билан олинган цийматидир.
рН= —lgc (H+)—реакция му^итини характерловчи катталнк-дир.
нейтрал эритмаларда pH=7
.кислотали (нордон) эритмаларда рН<7
ишдорнй эритмаларда pH >7
4. Na2O2 тузи гидрощизи натижасида дандай му\ит \осил булади?
Жавоб: ишцорий му\ит ^осил булади, чунки туз кучли асос NaOH ва кучсиз кислота — Н2О2 дан ташкил топтан.
3- мисол. 150,0 г НгО2 эритмасига MnO2, H2SO< душилади. Ажралиб чиддан кислород нормал шароитда 10-3 ч * * * м3 хажмни эгаллайди. Бошлантнч эритмада Н2О2 нинг масса улушини (%) дисобланг.
Берилган: Ут =22,4 моль/л
т (эр-ма) = 150,0 ^(Ог) — Ю-» м3 Л1(Н2О2)=»34,0 г/моль »% (^02) = ?
Ечиш намунаси
1. Реакциянинг бориш тенгламаси:
Н2О2 + МпО2 + H2SO4 = MnSO4 + О2 -Ь 2НгО
МпО^+4Н+ + 2е~-»-Мп2+4-2Н,О 1
Н2О2 —2е-->О2 + 2Н+ .
Н2О2 + МпО, + 2Н+ -> Мп2+ + О2 + 2Н2О
2. 10~8 м8 О2 досил дилувчи Н2О2 массасини топамиз. Реакция тенгламасига кура, 1 моль Н2О2 1 моль О2, яъни 1 моль 34,0 г/моль= =-34,0гН2О2, 1 моль 22,4 л!моль = 22,4 л О2 ажратиб чицаради. Шартга кура, 10~8 м8, яъни 1 л О2 досил булган.
Ёзамиз; 34,0 г HjO2—* 22,4 л Ог-
. X г Н2О2 —1 л О2 . ,
Пропорция тузамиз:
34,0 .*22,4'= X : 1
т(Н2О2)= 1,52 г
3. Эритмадаги Н2О2 масса улушини топамиз.*
ш% (Н2О2) = -^-??8>-.100 %= -100 % = 1,01%
т (эр-ма) 150 г
Жавоб. m%(H2Ojjr= 1,01% ---
ч
Масала буйича саволлар
1. Ум — нима?
Жавоб: Ум — газнинг моляр ^ажми: нормал шароитда турли газларнинг 1моли 22,4 л дажмни эгаллайди?
2. Кандай шароит нормал шароит дейилади?
Жавоб: бу t— 0 “С (Г—273° X); (р —10,325 Да 1 атм).
4-мисо л. «Каустик сода», «кристалик сода», «кальцивирлаш »п ^Ж'ЙОДа», «ичцмлик сода» лар дандай таркибга эга? v
Ечиш намунаси. Каустик сода —NaOH натрий гидрокснднинг .техник номи.
Кристалик сода —натрий карбоиатнинг кристаллогидратлари:
МагСО3-ЮН2О; NajCOs.7HtO; NajCOs-HijO
'• 5 э- Кальцинирланган сода — кристаллизация сувн булмаган, аммнак-хлорид усулида олинган натрий карбонат Na2CO3.
NaCl + NHS + COj + Н2О = NaHCOs + NH4C1
-P SNaHCOa^ Na^COs+ COg 4-H»O
'. Ичимлик сода —натрий гидрокарбонат — NaHCO3— тиббиётда ва > .озиц-овцат саноатида ишлатилади.
. б-мисол. Калий карбонат эритмасида мудит реакцияси дандай? Куйидаги моддаларнинг дай бири унинг гидролизини теЗлаштиради?
а) КОН; б) ZnCl»; в) Н2О; г) K»S '
Ечиш намунаси. К2СО3— кучсиз кислота тузи сн^ктнда сувли эрйтмаларда гидролизга учрайди: "
КаСО, + Н2О КНСО, + КОН
, . KH^+lH^^HjpOs + KOH
Бу туз эритмасидаги мудит ишдорий,— pH >7.
Гидролиз — дайтар жараён.
. .а) КОН киритилиши К2СО3 гидролизини камайтиради:
- - K2CO3+H2O^ZZZtKHCO3+KOH
: - — КОН;
б) ZnCl2 нинг киритилиши гидролизни кучайтиради,, чунки бу реаккия-даги мувозанат чапдан унгга силжийди.
f ‘ " к2со3 + н2о*>=кнсо3 + кон
ZnCl2 + Н^О ч* ZnOHCl + НС1
KOH + HCI-* КС1 + Н2О
в) HjO киритилиши гидролизни’кучайтиради-']
+н,о
К2СОЭ + Н2О ~—> КНСОд + КОН
' - - t) K>S киритилиши гидролизни кам айтиради, чунки мувозанат унгдан - чапга силжийди:
к2соэ+н2о ** кнсо,+КОН
. V KjS + ^O^KHS + KOH
Масала буйича саволлар
1, Нима учун KsCO3 гидролизга учрайди?
Жавоб: К2СО3 кучсиз кислота тузи булганлиги учун гидролизга учрайди.
s. . - 2. Хамма тузлар дам гидролизга учрайдими?
- Жавоб: Кучли асос ва кучли кислотадан ташкил топган тузлар \ гидролизга учрамайди. Масалан, NaCl, NaNO3, K2S.O4 ва бошдалар.
_> - в-мисол. 10,0 г натрий амальгамаси сув билан узаро таъсирга
/учрагаада иш^ор эритмаси досил бУлди. Уни нейтраллаш учун
50,0 мл 0,50 моль/л хлорид кислота эритмаси сарф булди. Натрий-нинг амальгама таркибидаги’% (масс.) ини анидланг.
Берилган: т (дотишма) = 10,0 г
,У (HCI) = 50,00 мл с (НС1) = 0,50 моль!л ' М (Na) = 23,0 г/моль
w % (Na) = ?
Ечиш намунаси
Реакциянинг бориш тенгламаси:
1. 2Na + 2Н2О = 2NaOH + Н2
2, NaOH 4-HCI = NaCl + Н2О
/экв. (NaOH) = 1 /же. (НС1)=1
10,0 а амальгамадаги Na массасини топамиз:
М (Na)-c (HCl)-V (HCI) 23,0.0,50.50,0 k ’ 1000 1000
г-моль-л . =-----------= 0,575 г
моль-л
2. 10,0 г амальгамадаги Na нинг масса улуши (%) ни топамиз:
® % (Na) = -• ЮО % = • 100% — = 5,75 %
т (дотишма) 10,0 г
Жавоб: w % (Na) = 5,75 %
Мдсала буйича саво'ллар
1. Амальгамалар нима?
Жавоб: металларни симобда эритиб олинган дотишмалари амальгамалар дейилади. Актив металл амальгамалари кучли дайта-рувчилардир.
2. Ишдорий металлар дандай хоссаларга эга?
Жавоб: улар жуда кучли дайтарувчилар б?либ, сувнинг водород ионлари билан осой оксидланиб, сувни парчалайди,
2Na -Ь 2Н2О = 2№ОН + Н2
7-мисол. SrSO4 нинг эрувчанлик купайтма констангаси 3,6-10—1 SrCl2 ва K2SO1 нинг бир хил дажмдаги 0,002 моль/л эритмалари ар а-лаштирилганда SrSO4 чукма досил диладими?
Берилган: с (SrCl2) = 0,0020 моль!л с (KjSOj) = 0,0020 моль/л Кэк (SrSO4) = 3,6-10-*
Чукма досил буладими?
Ечиш намунаси. Ион концентрациялари купайтмаси эрувчанлии купайтмаси константаси Дийматидан юдорн булса, чукма досил 6У-ладими?
К9к (SrSO4) = с (Sr2+)-c (SO4~) = 3.6-10-*
SrCl2 ва КгЗО4 эритмалари аралаштирилганда эритма дажми-икки марта ортади, хар бир модда концентрацияси икки марта камаяди ва 0,0010 моль/л га тенг булади.
100%
SrCl2 Sr2++ 2С1~
'- ,00%
Kaso4~r2K+ + so!~
ЖП • • •
\ Шуйдай дилиб:
Ж-”ЯЧ» ' . О (Sr2+) = 0,0010 моль!л
с (С1-) = 0.0020 моль/л
<* < с (К+) — 0,0020 моль/л
с (SO4-) = 0,0010 моль/л
‘ %~ Sr2-*" ва SO2- ионлари концентрациялари купдйтмасини топамиз; * 6 (S^'b-C (SO2—)= 0,0010-0,0010 != 10-3. ю—s — io-•. Йон концентра-цвдлари купайтмаси эрувчанлик купайтмаси константасидан катта экан, '• Ю-*>3,6-10~7. Шунинг учун SrSO4 чУкмаси досил булади.
Масала буйича саволлар
1/Эрувчанлик купайтмаси константаси нимани ифодалайди?
Жавоб: у доимий сон булиб, шу дароратда тУйинган эритмада-. --.’ hl 4мон эрийдиган электролит ионлари концентрацияси кУпайтмаси-' * ГГтенгдир.
- z ,. 2. Кзк нимани ифодалайди?
s’ Жавоб: К9к чукма эрувчанлигини ифодалайди. Унинг диймати дан-. чалик кичик булса, чукма эрувчанлиги шунчалик кам булади.
К9к CaSO4 = 9,1.10-*
A3KSrSO4 = 3,6-10-’
Кэк BaSO4 = 1,1.10-1°
Г ,
.4 BaSO4 энг кам эрувчан зисобланади?
•Л 3. Чукма дачон досил булади?
. , Жавоб: ион концентрациялари купайтмаси шу дароратда Кэк
Дийматидан катта бУлса, чукма досил булади.
- 8-мисол. Нима учун Mg (ОН) 2 аммоний тузларида эрийди?
Ечиш намунаси. Маълумки, Mg (ОН) 2 аммоний тузларида эрий-; ДИ. Бу ОН— ионларининг кам диссоциланадиган NH4OH досил 6У-г.;’ иищд дисобига камайиши одибатидир. Аммоний тузлари таъсирида j. чУкма-эритма уртасидаги мувозанат бузилади ва чукма эриши то-: Мон снлжийди.
’.X' Mg(OH)24±Mg2+ + 2OH~
2NH+
• ' 2NH4C1 2С1- + -> 2NH4OH
- Масала буйича саволлар
1. 1^ийин эрийдиган электролитни дандай дилиб эритиш мумкин? ' Жавоб: Шундай. модда топиш керакки, у чУкманйнг туйинган ,,у .эритмаси досил дилган ионларнинг бири билан кам диссоциланади-ган бирикма досил дйлиб чукма-эритма уртасидаги мувозанатни чукмани эриши томонига силжитсин. -
*4 9-мисол. 135,0 г кальций карбид гидролиАанганда нормал ша-
JHWAa Улчанган данча дажм ацитилен досил булади.
Берилган: m (CaC-J = 135,0 e Vm = 22,4 г/моль M (CaCJ »= 64,08 л/моль
V (С2На) = ?
Реакция тенгламаси СаС2-|-Н2О->Са(ОН)24-С2Н2
Ечиш иамунаси. Реакция тенгламасидан кУринадики, 1 жом СаС2 t моль С2Н2 досил дилади, яъни 1 моль-64,08 г/моль=64,08 г. 1 моль-22,4 л/моль=22,4 л С2Н2 ни досил дилади.
Езамиз: . * _
64,08 г СаС2---22,4 л С2Н2 ~
135,0 СаС2---- X л CjH2
Пропорция тузамиз:
64,08 : 22,4 » 135,0: X х=2^0=47>19 64,08 '
V (С2На) = 47,19 л
Масала буйича саволлар
1. Кальцийнинг юдорн активлигини нима билан тушунтириш (исботлаш) мумкин?
Жавоб: кальцийнинг ташди даватида 2 электрон булиб, у ядродан анча узодда жойлашган. Шунинг учун кальций ташди электроники бошда атомларга енгил беради. Кальций бевосита металлмас-лар билан Узаро таъсирлашиб бирикмалар досил дилади: СаН2, СаО, Ca3N, CaS, СаС2 ва б. • .
2. Кальций карбид дандай мадсадларда ишлатилади?
Жавоб: кальций карбид ацетилен олишда кенг кУламда ишлатилади.
Мавэуни мустадил узлаштириш учун савол ва масалалар
1. Водород нима учун Д. И. Менделеев даврий жаДвалида дам биринчи, дам еттинчи гурудга жойлаштирилган?
2. Водороднинг металл ва металлмаслар билан досил дилган бирикмалари дандай номланади? Уларда кимёвий богнинг да$си тури вужудга келади? Водород билан биомолекулаларда богланган кимёвий элементлар номини айтинг?
3. Водород бор деб нимага айтилади? У дандай кучлар дисобн-га досил булади? Водород бор тирик организмда дандай роль уйнай-ди? Одсил ва полипептид молекулаларининг дайси жойида водород бог досил булишини кУрсатинг:
Н О
R-C —С^>
NH2 N
? NH —R C-C<f
A '°
”. OH c-c/ R- "°
он
.и г
НО—'С—C—N
о Н Н О ин
V I I // /
-с — N — С— С<
„ 1 I R
sc - R Н R Н К
АНормал шаронтда 4,2 г кальций гидрид ва сувнинг Узаро таъ-«дтижасида дандай дажмда водород досил бУлади?
W6l'V '(H2)—1,42 л
5Д. & г'-металл .оксйдини дайтариш учун нормал шаронтда ijp водород сарф булди. Шу металл эквивалентининг моляр :вни диеобланг.
юоб: М ('/< Me) —24,26 г/моль.
fl. Реакция тенгламасини тугалланг ва коэффициентлар танланг. £й долатларда Н2О2 оксидловчи, дайсиларида дайтарувчи экан-ши курсатинг. >
I. HtO, + H2S^S+ .. . <
2. НаО2 + KMnOjMnO2+ • . . ’
’ 3. Н2О2 H2SO3 —► H2SO4 -J" • • •
4. Н2О2 + КС1ОЯ—KGH-• • •
,• 7. 3% (масс.) ли H2O2 эритмаси тиббий препарат дисобланади. lfcQ-мл 2 моль/л KI эритмаси билан реакцияга киришиш учун 3% Х>*сс.) ли водород пероксид эритмасидан неча грамм сарф бУлиши-1№ дисоблаб топинг. курсатилган реакцияда унинг эквивалентининг
• > Явяяр массаси дандай?
< Жавоб: т (Н2О2) = 68;0 а. М Н2О,1 = 17,0 г
>... 1
8. Противогаз ва сув ости кемаларида ютувчи восита сифатида яялий ва натрий гидроксидлари аралашмаси ишлатилади., Нима учун ц* одам узод вадт противогаз тадиб юрса дам димидиб долмайди? д - Шули тушунтириб бёринг ва бунда борадиган реакция тенгламала-рини ёзинг (одам нафас чидаргандаги СО2 билан гидроксйдлар ора-’ ’ ^ида реакция боради).
9. Соглом одам меъда ширасининг рНи 1,5 га тенг.
.. Шу pH дийматига тугри келадиган водород ионлари концентра-. * ~ цнясини диеобланг. Шу концентрациядаги 1 л хлорид кислота эрит- 1 - - насини тУла нейтраллаш учун данча NaOH сарф булади?
' ‘ Жавоб: с (Н+)— 0,0316 яоль/л, m (NaOH) =1,264 г.
, 10. Элементлар тартиб Номера ортиши билан ишдорий металл
1рядиуслари ва ионлаииш пОтенциаллари дандай узгаради? Атомлар-< кшнг электрон, тузилиши асосида тушунтиринг.
- 11. Меъда шираси кислоталилиги ортганда NaHCO3 ичилганда меъда ширасида дандай реакция боради? Ацидозда 5,0 a NaHCOj тилса у билан данча хлорид кислота реакцияга киришади?
< Жавоб: т (НС1) =2,17 г.
Л2. Жарродлйк амалиётида NaCl нинг 3, 5, 10% (масс.) ли гн-Шфтоник эритмалари кенг ишлатилади. I л 10% (масс.) ли NaCl эритмаси тайёрлаш учун неча грамм туз олиш керак? Унинг таъсири нимага асосланган? (р= 1,11 а/лм).
Жавоб: т (NaCl) = 111,0 а.
13. Биологик суюдликлар — сийдикдаги, овдат дазм дилувйи безлар ширасидаги фосфат буфер — NaH2PO4+Na2HPO4 катта ада-миятга эга; Тузларнинг турли нисбатига кУра турЛН pH дийматла-
рига эга болгар буфер аралашмалар досил дилиш мумкин. Бу буфер системаларнр кбпинча лаборатория амалиётида физиологик жараёнлар боришини урганиш учун д^лланнлади. 1 ли^р 0,50 моль/л НзРО4 эритмасидан олиш мумкин б$лган NaH2PO4 ва Na2HPO4 массаларинн хисоблаиг.
Жавоб: m'(NaH2PO4) =59,5 г т (Na2HPO4) =70,5 г.
14. Йима учун калий катионини NaHC4H40e билйн анидлашни нейтрал мудитда олиб бориш керак? Жавобни реакция тенгламала-рн билан тушунтириб беринг.
, . 15. Тиббий амалиётда КВг ва NaBr тинчлантирувчи восита сифатида кенг ишлатилади. Агар эритмага натрий гексанитрокобаль-тат билан таъсир этилганда сарид ч?кма досил булса, текширилаёт-ган предаратда дандай туз булади?
16. NaCl ва КС1 дидСиз од кристалл порошок булиб, шур таъм-га эга, сувда яхши эрийди ва табиатда кенг тардалган. NaCl одатда томирга юборилади, КС1 дам томирга, аммо эдтиётлик билан фадат томчилаб юборилади, чунки тез юборилганда юрак "фаолияти огир , бузилишга учраши, датто у ^лимга олиб бориши дам мумкин. К,ан-- дай дилиб гексагидроксостибат (У) калий ёрдамида дайси идишда NaCl эритмаси борлигини анидлаш мумкин?
17. Подагра касаллигида одам' организмида т^планган сийдик кислота натрий ионлари билан бирикиб, уратларни досил дилади. Улар сувда ёмон эригани учун «тош» куринишида буйрак, сийдик пуфаги, бугинларДа тупланади.' Даволаш уродан ёрдамида олиб борилади. Унинг таркибида сийдик кислотаси таркибида досил бул-ган тузларни эритувчи литий бензоат бор. Бу препаратнинг таъсири нимага асосланган, тушунтириб беринг.,
100 днем препаратда литий бензоат мидцори 22,5 дисмни ташкил этса, препаратдаги литийнинг масса улуши дандай?
/ . О \
. CeHs-C^
\ оы/
Жавоб: т (Li) = 0,1509 г; ш % (Li) = 15,09 %
18. Ве(ОН)2 —Са(ОН)2 —Sr(OH)2 —Ва(ОН)2
даторида II группа асосий группачалари гидроксидларининг асосли хоссалари дандай ва нима учун ^згаради?
19. Стронций ва айнидса барий миддорининг ортиши одамда суякнинг м?ртлашишига олиб келади. Нима учун бу элементлар суякда асосан фосфат ва карбонатлар сифатидаги биоэлемент кальций £рнини эгаллайди.
20. Сувнинг даттидлиги унда Са3+ ва Mg2+ тузлари борлиги билан белгиланади. К^аттидлиги 2,86 булган 1 литр сувга неча -грамм Са (ОН)2 дУшиш керак.
Жавоб: т (Са (ОН)2) =0,106 г.
21. Тиббиётда купчилик касалликларни даволашда СаС12'6Н2О кенг ишлатилади. Бу дон тухтатувчи восита аллергия ва бошда куп-гина касалликларни даволашда кенг ишлатилади. Унинг 10, 5% (масс) ли эритмалари ичишга буюрилади. Ичишга буюрилган 10% (масс.) ли 1 ош дошид СаС12 эритмасида (10 мл) данча Са’Н борлигини дисобланг.
Жавоб: т (Са2+) =0,182 г.
22. Барий тузлари одам учун задарли. Нима учун BaSO4 тиббиётда рентгенконтраст модда сифатида ишлатилади.
23. MgSO4-7H2O магнезий одам марказий нерв системасига
ЯРг^вчлантируВчи таъсир курсатади. Бу препаратнинг таъсир доираси SBP-жтда кенг. Юцори дозада берилса, у седатив, наркотик таъсир кур-Ж^хатиши мумкин, Гипертония касаллигида мускулга 10 мл дан 20% g^-^uicc) ли MgSO4-7H2O (р= 1,120 г/мл) юборилади. Шундай кон-М£ $гнтрацияли эритма ^осил ^илиш учун 1 литр сувда шу туздан цан-ЕУ'Ч'й эритиш керак? Бу препаратдаги магнийнинг масса улуши (%) ST жандай?
5*7? Жавоб: т (MgSO4'7 Н2О) =250,0 г, ш% (Mg2+) = 1,95 а.
>- 24’ Аммоний оксалат эритмасидан фойдаланиб, идишда кальций
"• хлорид борлигига ишонч ^осил цилищ мумкинми? •
25. Меъда шираси кислоталилиги ошганда тиббиётда кальций V Харбонатнинг ишлатилиши нимага асосланган? 0,1 г препарат ичил-... ганда цанча водород хлорид богланади? '
.. Жавоб: т (НС1)=0,73 г
26. Калий бихромат сирка кислотали му^итда текширилаётган ’• эритманинг бир цисми билан сари^ чукма ^осил кил а ди. Ушбу эрит-ма доривор препарат була оладими? Асосли жавоб беринг.
Жавоб: Иуц.
' ' 1- л а б ор а т ор и я и ш и
r ' ГТУРУК S-ЭЛЕМЕНТ КАТИОНЛАРИНИНГ АЛО^ИДА СИФАТ РЕАКЦИЯЛАРИНИ УРГАНИШ
" Натрий ионлари реакцияси — Na+ - .
Калий гексагидроксостибиат (V) реактиви. Калий
- гексагидроксостибат (V)—K[Sb(OH)]6 нейтрал ёки кучсиз ишцорий му^итда натрий тузлари билан ок крис-таллсимон чукма—Na[Sb(OH)e] ^осил 1$илади.
NaCl + К [Sb(OH)cI = Na [Sb(OH)e]+ КС1 Na+ + [Sb(OH)6]~ = Na [Sb(OH)6] j
Ч^кма ^осил булиши эритма. совитилганда'ва шиша таё^ча билан пробирка деворига иш^аланганда тезла-шади. Текширилаётган эритма нордон булмаслиги керак, чунки эркин кислоталар иштирокида мета сурьма / • кислотасининг ок чукмаси ^осил булади.
' К [Sb (OH)e]'+ НС1 = HSbO31 + КС1 + ЗН2О Na [Sb(OH)6j чукмаси хоссасини текшириш
1. Чукма киздирилганда сувда эрийди.
2. Чукма уювчи иш^орларда эрийди.
Na [Sb(OH)6] + 2NaOH = Na3 [SbO2(OH)4] + 2H2O
Na [Sb(OH)6] + 2OH- = Na+ + (SbO2(OH)4]3” + 2H2O
Калий ионлари реакциями — K+
Натрий гидротартрат реактиви — NaHC4H4Oe
, Натрий гидротартрат — NaHC4H4Oe —’нейтрал му^итда калий,тузлари билан майда кристаллсимон чукма ^осил ци-лади.
/ П1
КС1 + NaHC.HA = KHC4HAI+NaCl
k+ + hc4ha-1 = khc4h4oj
, Чукма ^оенл булиши совитилганда аралаштирил-ганда ва шиШа таё^ча билан пробирка девори ишда-лаяганда тезлашади.
KHCiHiOg чукмаси хоссасици текшириш
1. Чукма циздирилганда сувда эрийди. , ~
2. Чукма кучли кислотада эрийди.
жнс4н а+на = ка + н2с4н а. ;кнс4н4о6+н+ = к+ + НАНА
3. Чукма уювчи ищдорли эритмаларда эрийди. :
- |КНС4Н А + КОН = КаС4Н А + Н2О
|КНС4НА + ОН- = к+ + с4н4о*7+ н2о Натрий гексанитрокобальтат (III) реактиви — Na3 [Co(NO2)e] Натрий гексанитрокобальтат (III) — (Na3 (Co^NOj),)—кучсиз кислотали ва нейтрал мудитда калий тузлари билан са-риц кристалик чукма — K2Na [Cc^NO^J ^осил дилади. .
2KQ + Na3 [CoCNOaJe] = K2Na [Co(NO2)6] | + 2NaCl 2K+ + Na+ + [GXNOJe]3- - K2Na [CofNO^] | Реакцияни нейтрал ёки кучсиз кислотали мудитда олиб бориш керак, чунки кучли кислотали муэ^итда реактив парчаланади.
Na3 [Со^О^] 4-HCI = H3 [Co(NO2)6] + NaCl
Н8 [Со (NOa)e] — бекарордир.
Шунингдек, реактив ишцорий мудитда ^ам парчаланади:
Nas [CotNO^] 4- 3NaOH = Co(OHiS) | 4- 6NaNO2
Co (OH)3 — тук; цунгир рангли чукма.
Аммоний ион реакциялари—NH+
Натрий ва калий гидроксидлари — NaOH, КОН
Уювчи ипщорлар циздирилганда аммоний тузлари-дан газсимон аммиак —NH3 ажратиб чи^аради.
NH4C1 4- NaOH = NH3 f 4- H2O 4- NaCl NH+4* ОН-= NH3 f 4-H2O •
NH3 ажралиб чи^ишини фацат ^идидангина эмас, балки пробирка устида ушлаб турилган нам цизил лакмус догозиннинг кукаришидан ^ам анидлаш мумкин.
Несслер реактиви (К2 [Hgl4]4 ва КОН 'аралашмаси)
Екммоний тузларига Несслер реактиви таъсир эттирилган-зргзил- BjfHFHp рангли ч^кма косил булади. -
£ Г Hg -]
NH4C1 + 2К2 [HglJ + 4КОН = О/ \^Н2 11+ ’
". Hg .
+ 7KI +КС1 + ЗН2О
Не 1
& - ’ NHt + 2 [Hgl4p- + 40H
Hg
+ 7I- + 3HaO .
iy. Йеакцияни бажараётганда албатта орти^ча 'фшвдорда у- реактив таъсир эттириш керак, чунки з^осил булаётган ^.'чукма аммоний тузларида эрийди.
Агар эритмада аммиак тузлари жуда оз б^лса, Л. Несслер реактиви таъсирида ^изил-ц^нгир рангли ч^к-ма косил булмайди, эритма сариц ёки заргалдоц рангга ' буялади.
•У
»- - 2-л а б о р ато р.и я иши
\г11 ГУРУХ, S-ЭЛЕМЕНТ КАТИОНЛАРИНИНГ ХУСУСИИ СИ ФАТ РЕАКЦИЯЛАРИНИ УРГАНИШ
' Магний иони реакцияси Mg2+
Натрий, калий гидроксидлари — NaOH, КОН
У" Уювчи иищорлар магний тузлари эритмасидан ок аморф ч^кма Mg(OH)2 ажратади
MgCl2 + 2NaOH == Mg(OH)21 + 2NaCl Mg2+ + 2OH- = Mg(OH)21
М§(ОН)1_чукмаси хоссаларини текшириш
1. Чукма^кислоталарда эрийди:
Mg(OH)2 4- 2НС1 = MgCJ2 + 2Н2О Mg(OH)2 4- 2H+ =xMg2+ + 2HaO
2. Чукма аммоний тузларида эрийди:
Mg(OH)2 + 2NH4C1 = MgCl2 + 2NH4OH
Mg(OH)2 + 2NH+ == Mga+ + 2NH4OH
Петрашен реакцияси
Иод эритмаси (йодли сув) ишцор иштирокида маг-' 'дай тузлари билан туц цунгир ч^кма хрснл калядд.
Пробиркага йодли сувдан 2—3 томчи томизиб, иш-Кор эритмасида зфлланган шиша таё^ча билан йод ранги ^чгунча цайта-кайта куллаб аралаштирилади. Хрснл-
б^лгав аралашмага магний тузи эритмасидан 1 томчи цУшилса, туц цУнгир рангли-чукма ^осил булади.
м8+2 '
12 4-2NaOH 2Z~ Nal 4-NalO 4-Н2О
‘ ' NaOH
MgC!a 4-2NaOH = Mg(OH)2 4-2NaCl‘
nMg (OH)2 4- mJ2 -> [Mg(OH)2b • mJ2|
Иод ва ишцор орасидаги реакция цайтар булиб, бу аралашмага магний ионлари туширилганда ор^ага цай-тиб Mg(OH)2 чукмаси ^осил булиши оцибатида мувозанат унгдан чапга силжийди, бунда молекула ^олида йод ажралиб чи^адй ва оц рангли чукма — Mg (ОН) 2 устига адсорбцияланиб (шимилиб) уни ту^ цунгир тус-га киритади. Реакцияни ортицча иш^ор иштирокида ба^ жариб булмайди.
Кальций катион реакциялари — Са2+
Сульфат кислота реактиви — H2SO4 '
‘Сульфат кислота — H2SO4 ва унинг эрувчан тузлари кальций тузлари билан оц кристалик чукма — CaSO4 ^осил цилади. ,
СаС1а + H2SO4 = | CaSO4 + 2HC1 -Ca2+ + SQ2+ = CaSO41
Чукма хоссасини текшириш
1. Чукма сувда иситилганда ^осил булади.
2. Чукма кислота ва уювчи иш^орларда эримайди.
Аммоний оксалат реактиви — (NH4)2C2O4
Аммоний оксалат (NH4)2C2O4—кальций тузлари билан майда оц кристалик чукма — СаС2О4 ^осил ^й-лади.
СаС12 + (NH4)2 СаО4 = СаС2О41 + 2NH4C1 Ca2+4-C2O2- = CaC2OJ
Киздириш чукма ^осил булишини тезлаштицади.
СаС^Оц чукмаси хоссаларини текшириш
Чукма минерал кислбталарда эрийди, лекин ВаС2О4 ва 5гСгО4дан фарцли равишда сирка кислотада эримайди:
CaCjO4 4- 2НС1 = СаС12 4- Н2С2О4
' СаС2О4 4-2Н+= Са2+4-Н2С2О4
Стронций катиони реакциялари Sr2+
Сульфат кислота реактиви — H2SO4 .
1 h -7'* '
'< Сульфат кислота — H2S64 ва эрувчан' сульфатлар “ стронций тузлари билан оц кристалл чукма — SrSO4 ; Косил дилади.
SrCl2 + H2SO4 = SrSO41 + 2HC1 Sr2++ SO*-= SrSO4 J
SrSO4 чукмаси хоссаларини текшириш
Чукма кислота ва Уювчи иш^орларда эримацди.
Гипсли сув реактиви—CaSO4-2H2O
Гипснинг туйинган сувли эритмаси стронций *тузла- ри билан оц рангли лой^а SrSO4 косил циладй.ч Эрит-мани циздириш лой^а к°сил булишини тезлаштйрадн. Бу реактив худди. шундай натижа берувчи Bt2+ иони ажратиб олинганидан с^нг олиб борилиши мумкин.
SrCl2 + CaSO4 = SrSO41 + СаС12
Sr2+ 4- SO2- = SrSO4 j
Барий катиони реакциялари — Ba2+
Сульфат кислота реактиви — H2SO4 !
Сульфат кислота H2SO4 ва эрувчан сульфатлар барий тузлари билан ок кристалик -чукма BaSO4 косил дилади.
ВаС12 4- H2SO4 = BaSO4 | 4- 2НС1 Ва2+ 4- SO2- =. BaSO4 |
? BaSO4 чукмаси хоссаларини текшириш
Чукма кислота ва ^ювчи ишкорларда эрийди.
Калий хромат реактиви—К2СгО4
Калий хромат — К2СгО4 барий тузлари билан сариц чукма Косил цилади ВаСгО4
ВаС12 4- К2СгО4 = ВаСгО41 4- 2 КС1
Ва2+4-СгО2“ = ВаСгО4
BaCrOt чукмаси хоссаларини текшириш
Чукма кучли кислоталарда эрийди, лекин сирка кив-лотада эримайди.
1 ВаСгО4 4-2HCI = ВаС12 4-Н2СгО4
ВаСгО4 4- 2Н+ = Ва2+ 4- Н2СгО4
Калий дихромат реактиви — К2Сг2О7
Калий дихромат — К2СгаО7— барий тузлари билан барий хроматнинг сариц чукмасини _к°сил дилади — ВаСгО4. Бу-' ^цнг сабаби куйидагича: Сг2О2 ионлари сувли эритмада СгО|~ 'Чонлари билан мувозанатда булади: Сг7О*—4-Н2О**2СгО4“4-
-+2Н+ Барий хромат дихроматга Караганда кам эрувчан б^лганиучун чукмага—'ВаСгО4 тушади
2ВаС1. 4- КАА + НА = ВаСгО41 + 2КС1 + 2НС1 Ва8+ + СгД- + Н2О = ВаСгО41 + 2Н+
ч Реакцияни’ Ва2+ ионлари т^ла ч^киши учун натрий ацетат иштирокида олиб бориш керак. Бунда натрий ацетат реакция давомида ажралиб чи^адиган ва ВаСгО< ни эритиши мумкин булган кучли кислота НС1ни кучсиз кислота СНзСООНта айлантиради, унда ВаСгО< эримайди. .
HCl + CH3COONa = NaCl + СН3СООН .
. d-ЭЛЕМЕНТЛАР ВА ШУ ЭЛЕМЕНТ • БИРИКМАЛАРИНИНГ ХОССАЛАРИ
. Мавзунинг ма^сади. 1. d-элементлар ва уларнинг бирикмалари ^а^ида системали билим олиш.
2. Биологик системаларда d-элемент бирикмалари ^рсил булишини олдиндан белгилашНи урганиш.
3. I, II, VI, VII гуру^ d-элементлари ва темир оила-сида сифат реакцияларини бажариш буйича уцувга эга б^лиш.
Урганилаётган мавзунинг а^амияти
I гуру^ d-элементлари орасида ^аёт учун энг а^амиятлиси мис булиб, унинг физиологик депоси жи-гардир. Мис гемоглобин каби кислород ташиш хусу-сиятига эга булган оцсил ва баъзи ферментлар — фенолаза, гемоцианин таркибига киради.
Мис оксидловчи-дайтарувчи фермент: цитохромокси-даза, церуллоплазмин ва бош^алар таркибига киради. Мис гемоглобин биосинтези учун зарурдцр, унинг орга-црзмда танцислиги уткир анемия, Менкес сйндроми, а^лий ривожланишдан ореада цолиш каби кассаллик-ларни келтириб чицаради.
Кумуш ва олтин бирикмалари одатда одам учун зазарли, лекин унинг кичик дозалари бактерицид таъ-сирга эга, шу сабабли тиббиётда сиртци восита сифатида ишлатилади.
II rypyjj d-э л ем ент л ар и д а н физиологик жи-^атдан а^амиятлиси рух. Бу катион бир цатор ферментлар учун кофактор б^либ келади. Масалан, карбоангидраза, карбоксипептидаза, алкоголдегидрогеназа ва
|^'<бошца 200 дан ортйц ферментлар бунга мисол бул а ола-ДИ. Рух зандли диабетда нормалловчи таъсир курса-fep- Тади ва шунинг учун инсулин таркибига киради, орга-низмда рух етишмаслиги ^сишни секиилаштиради. У Ь заст учун зарур, урнини зеч нарса билан алмаштириб I булмайдиган микроэлементдир.
Кадмий, айнизса си моб одам учун задарли зисобла-нади. Симоб организмда озсил билан мустазкам 6of-7 ланиб, унда йигилади ва чициб кетиши зийин булгани * сабабли огир за^арланишга олиб келади.
IV г у р у 3 d- э л е м е н т л а р и д а н титан» физиологик жизатдан фаол зисобланиб, заёт учун зарур элемент зисобланади, зон зосил б^лиш жара&ига сези-ларли таъсир этади ва уни стимуллайди (кучайтиради). У купчилик ферментлар таркибига киради ва тирик зу-жайрадаги биоредокс жараёнларда цатнашади.
VI гуру з d-э л е м е нт л а р и— хром, молибден, вольфрам .физиологик жизатдан фаол элемент. Хром усимлик ва зайвонот дунёсида кенг тарцалган, лекин Зозирги ва^тда унинг физиологик роли зазида куп.нарса маълум эмас. У глюкоза алмашинувида за-тнашади, диабетда углевод балансига таъсир этади. Унинг биологик таъсири марганецникига ухшашлиги. зазида маъ-лумотлар. бор. —
, Молибден ^симликлар ва одам учун физиологик азамиятга эга. Усимликларда у азот узлаштирилишиДа воситачилик зилади, нитратредуктаза фермента таркибига киради. ^айвон организмида молибден купчилик .ферментлар: ксаптиноксидаза,. гидрогеназа, ксантиндегидрогеназа, сульфитоксидаза, альдегидоксидаза таркибига киради.
VII гуруз d-э л ем енТл арид ан технеций ва ре- . нийнинг физиологик роли урганилмаган, марганец хое-салари эса яхши маълум. У биологик системаларда икки Мп2+ ва Мп3+ золатида булади. Бу элемент купчилик «жараёнларни, масалан, оксидловчи декарбоксил-ланишни катализлайди. ₽-оксикислота к^п сонли ферментлар — фосфатаза, оксидаза, гидролаза, липаза ва бошзалар таркибига киради. Тирик организмда углевод ва озсил алмашинувида затнашади, залзонсимон без фаолияти зам у билан боглиз. d-элементларига темир оиласи: темир, кобальт, никель киради. Бу эле’ментлар-дан темир ва кобальт физиологик жизатдан фаол б^-либ, заёт учун зарур ва улар ^рнини* бошза элемент боса олмайди.
Тем'ир ^симликлар, зайвонлар ва одам физиология-
. 12—7534 177
сида жуда му^йм роль уйнайди. Унинг етищмаслиги усимликларда азот, ёг ва минерал моддалар алмаши-нувини бузади, ^айвонларда микроцитар анемияни, одамда эса — алиментар анемия (гемоглобин курсаткичи пасайиши) ва бошцаларни келтириб чи^аради. У ^аёт учун'зарур ва урнини алмаштириб булмайдиган микроэлемент. Одам организмидаги темирнинг 60— 70% и гемоглобинда сацланиши унинг ^он ^осил булиш жараёнида жуда му^им ва масъулиятли вазифага эга эканлигини курсатади. Темир гемоглабинда гемнинг протопорфирини билан ички комплекс болида сацлана-ди. Миоглобин, цитохром, пероксидазд, каталазалар гем са^ловчилардир. Фиррит, сидерофиллин ва бошцалар гем сацлам’айдиганлар ^исобланади. Биокрмплекслар-дагн темир ионлари организмда кислород ташиш вази-фасини бажаради. Темир лиганд боглашига цараб у ёки бу валент ^олатда булади: масалан, гемоглобин ва мио-глобинда—Fe2+, каталаза ва оксидазаларда — Fe3+бу-лйди. t '
Кобальт ^ам юцори физиологик фаолликка эга. У витамин В12 — цианокобаламин (таркибида булиб, гемоглобин синтезида цатнашади, унинг етишмаслиги хавф-ли анемияни келтириб чи^аради. Кобальт ^аёт учун зарур элемент. У этаноламиноксидаза, глицилглицин-пептидаза ва бошдалар таркибйга киради ^амда фер-ментлар) активланишида цатнашади.
Никель узининг биосистемалардаги урнига кура ко-бальтга яцин туради. К°зирги вацтда унинг ферментатив жараёнларга специфик таъсири ^ацида маълумот-лар бор. Масалан, унинг мочевина парчаланишида ^ат-нашадиган уреаза ферменти таркибйга киришц аниц-ланган. Бу элементнинг з^аёт учун зарурлиги ^а^ида фикрлар бор.
1 гуру^ d-элемент бирикмаларининг тиббий препаратлари
CuSO4-5H2O — коньюнктивитни даволашда ишлатилади.
СиС13-2В6 — сил, пес, гепатит касалликларини даволашда ишлатилади. «купир»
мис (II)-цитрат — коньюктивитни даволашда ишлатилади. AgNO3 ляпис.— ялигланишга царши, куйдирувчй, бактерицид таъсирга эга, сиртк;и дори сифатида ишлатилади.
Протаргол, колларгол кумуш оирикмалари оулио, иу касалликларни даволашда ишлатилади.
(Au — S — СН2 — СНОН — СНа — 50з)2 — кризайол ту-'беркулёз, мохов, волчанка (цизилмия) ларни даволашда ишлатилади.
II гуру^ d- элемент бирикмаларининг тиббий препаратлари
ZnSO4'-7H2O — конъюнктивитни даволашда ^улланилади, сирт^и восита сифатида ишлатилади.
. ZnO—тери касалликларини даволашда кулланилади, сирт-
1^и восита. *
HgCl2— сулема — дезинфекциялозчи восита. ;
Hg(OH)2HgO— тери касалликларини даволашда йшла-тилади. |
HgO — тери касалликларини' даволашда цулланилади.
HgNH2Cl — тери касалликларини даволашда ишлатилади.
Hg2Cl2 — каломель — куз шох цаватини даволашда ишлатилади (^озирги ва^тда ичишга буюрилмайди).
VI, VII гуру^ d-элемент бирикмаларининг тиббий препаратлари
Г' КМпО4— антисептик восита
Na2CrO4 — Сг нишонлайган радиоактив изотоп билан он-кологияда диагностика максадларида ишлатилади
Темир оиласидаги d-элемент бирикмаларининг тиббий препаратлари
Коамид — кобальтнинг никотин кислота амиди билан координацией бирикмаси
Витамин В1а —
—«—
— цон ^осил. бу-лишида стимулятор ^исобла-нади .
— кам^онликда цулланилади
^айтарилган темир —темир етишмаслигидан келиб чик^ан анемияни даволащда цулланилади.
Темир глицерофосфат — бу ^ам шундай.
Темир лактат
s FeSO4-7HaO
Феррамид
- Ферроцерон
< Ферковен
Гемостимулин
* FeQ,-6HaO
— —«— —«—
— крн о^ишини тухтатишда цуллани-лади / .
12*
179
Бошлангич даража
1. Элементлар ва бирикма хоссаларининг Д. И. Менделеев даврий системасида жойлашган ^рнйга борли^-лиги.
2. Атомларнинг электрон тузилиши.
3. Молекулалардаги кимёвий 6of турлари.
4. Кимёвий реакция тенгламаларини ионли ва молекуляр шаклда тузиш.
Фойдаланиш учун уцув материаллари
1. Н: Л. -Глинка. «Умумий химия». Т. 1968. 634, 653, 683, 726, 738, 745- бетлар.
2. X. Р. Рахимов. «Анорганик химия». Т. 1974. 369, 391, 396-бетлар. ‘
3. С. С. Оленин, Г. Н, Фадеев. «Неорганическая химия», М„ 1979, 347, 372, 357, 308, 291-бетлар.
4. В. Н. Алексеев. Ярим микрометод билан ^илинадигаи-ким-ёвий сифат анализа курен». Т.', 1976. 353, 369, 358, 449, 488, 443, 483- бетлар.
5. К. А. Селезнев. «Аналитическая химия». М., 1973, 95, 92, 98, 111, ПО, 114-бетлар. -
6. И. К. Цитович. «Курс аналитической химии». М., 1985, 124, 132, 127, 120, 137, 138, 139-бетлар.
7. X. X- Хакимов, А. 3. Татарская. «Периодическая система и биологическая роль элементов». Т., 1985, 64, 57, 61, 50, 38- бетлар.
МАЪЛУМОТЛАР БЛОКИ
I гурух d-элементлари ва шу элемент бирикмаларининг хоссалари
I гурух d-элементларига мне, кумуш, олтин мисол булади. Улар атомининг элёктрон конфигурацияси {п—l)d10nS*. Бу металларнинг ранги узига хос булиб, мис-*-оч цирмизи, кумуш —- кукимтир, олтин — сарик-заргалдок рангли. Уларнинг кимёвий фаоллиги унча-лик, юцори эмас, улар кучсиз кайтарувчи булиб, цийин-чилик билан оксидланади. Активлик олтиндан мисга томон ортиб боради. Бу элементлар атомидаги энг тадцци ва у билан бирга охиридан битта олдинги кобикдаги электронлар \ам реакцияда цатнашади. Шунинг учун бу элементлар 4-1, +2, 4-3 оксидланиш даражасини намоён цилади. Мис учун 4-2, 4-1, кумуш учун 4-1, олтин учун эта 4-1 ва 4-3 оксидланиш даражаси харак-терли.
Одатдаги хароратда галогенлар ва кислород уларга таъсир этмайди. Улар водород, азот, углерод билан бевосита таъсирлашмайди. .Оксидловчилик хусусиятига эга булмаган кислоталар уларни эритмайди. Концентр-
Иманган H2SO4, концентрланган ва муътадил концентр* Ийкланган HNO3 Си ва Ag билан яхши реакцияга кири-к^шади.
. Си + 2HaSO4 = CuSO4 + SOa + НаО
Ц ” . Ag + 2HNO3 - AgNO3 + NOa + НаО
И? ' Олтин бу кислоталар билан реакцияга кйришмайди, Е. «шох ароги» (1 з^ажм концентрланган HNO3 ва 3 дажм |Г концентрланган НС1 аралашмаси) да эрийди: В" Au + HNO3 + 4НС1 = Н [AuC14J + NO + 2HaQ ‘ I. Уларнинг оксид ва гидрдксидлари жуда бедарор бйрик-jj. ^малар булиб, сувда эримайди, кумуш оксиди |асосли хоссага, мис ва ojjihh оксидлари — кучсиз амфотерлик
’Г хоссасига эга.
: 2 AgaO -X 4 Ag + Оа Cu(OH)a + 2НС1 = CuCla + 2НаО
' ’ Cu(OH). Д CuO 4- Н,0 Cu(OH)a + 2NaOH — Naa(Cu(OH)4] ьщип;а + -1- nau Au(0H)s + KOH = ^[Au(0H)4]
КОНЦ. ’
Бу элементлар жуда яхши комплекс досил дилувчилар-дир. Бунда 4 ва 6 координацией сонга эга булган катионли ва анионли комплекслар досил булади.
’ [Си(НаО)вГ+ ' [Аё№)а]+ [Au(CN)a]-
[Cu(NH3)4 (Н2О)2Г+ [Ag(CN)aJ- fAuCIJ-
[Cu(HaO)4 (NH.,)2]2+ [AgCS^,]3- [Аи(ОН)4Г
[Cu(OH)4p-• ]AgIJ-
[Cu(CN)4]3-
Мис тузлари: хлоридлар, сульфатлар, нитратлар, ацетатлар бирмунча эрувчан. Кумушнинг купчилик тузлари: галогенидлари, сульфатлари, хроматлари ва бош-цалар ёмон эрийди (AgNO3 яхши эрийди);
II гуруд d-элементлари ва шу элемент Л)ирикмаларининг хоссалари
П гуруд (l-элементлариги" рух, кадмий, £имоб мисол булади. Улар атомининг электрон конфигурацияси (п—1)d’°-nS2. Бу элементларнинг дар бири ^з даврида охирги d-элементдир, охиридан битта олдинги даватда якунланган (т^лган) d10 конфигурацияга эга. Бу билан .улар бошда d-элементлардан фарц дилади ва катта давр р-элементларига ухшаб кетади. Улар мусбат оксидла-нишнинг М2+даражасини намоён дилади.
Улар огир металлар—дайтарувчилардир. Завода сиртида окёид пардаси борлиги учун улар’бардарордир-лар. Улар диздирилганда купчилик металлма'слар билан осон реакцияга киришади:
2Zn4-O2 = 2ZnO Zn 4- Cl2 = ZnCl2 Hg + S = HgS
Pyx'в а кадмий электрокимёвий кучланишлар дато-рида водороддан чапда туради, шунинг учун кислород-сиз кислоталардан Н2 ни сидиб чидаради:
CdH- 2НС1 = CdCl + Н2
Рух диздирилганда ишдор эритмаларида эрийди:
Ч Zn + 2NaOH + 2НаО = Naa[Zn(OH)J + Н2
Кадмий ва симоб ишдорларда эримайди, симоб нитрат кислотада эрийди.
Jig + 4HNO3 = Hg (NO3)a + 2NO2 + 2HaO
Улар оксид ва гидроксидлар досил дилади; рух оксиди ва гидроксидлар амфотер, долганлари эса асос хусусиятига эга:
Zn(OH)2 + 2НС1 = ZnCla + 2НаО
Zn(OH)a + 2NaOH = Naa [Zn(OH)4]
Zn(OH) a + 2NaOH = NaaZnOa + 2HaO
Учала металлнинг даммаси катион ва анион типи-даги (туридаги) координация сони 4 ва 6 булган комплекс бирикма досил дилади:
[Zn(OH)4f- [Cdl4p- IHg(CN)4r"
[Zn(CN)4]2~ [Cd(SO4)a]2~ [Hgl4p“
[Zn(NH3)4]2+ [Cd(NH3)6]2+ [HgBrJ2-[Zn(HaO)e]8+ [Hg(NH3)J2+
Бу огир ^металларнинг тузлари сувда кам эрувчан. ХлориД, нитрат ва сульфатлари эрувчандир. Камма туз-лари сувли эритмада гидролизга учрайди ва кислотали мудитга эга булади. '
Zn(NO3)2 + НаО Zn(OH(NO3 + HNO3 Zn(OH) NO3 + H2O 4- Zn(OH)a + HxNO3
VI rypy^ d-элементлари ва шу элемент бирикмаларининг хоссалари
VI гуруд d-элементларига хром, молибден, волфрам киради. Хром ва молибден электрон конфигурацияси (п—l)ds-nS1, вольфрамники 5d-6S2. Бу элементлар $згарувчан оксидланиш даражасига эга, улардан +2, +3, 4-6 лари мустадкамрод. Бог досил булишида охирги ва охиридан битта олдингй даватдаги электронлар цат-нашади. Булар металл булиб, улардан хром жуда дат-
металл. Улар циздирилганда купчилик металлмрс-,р билан реакцияга киришади:
4Сг + 30а = 2Сг2О3 2Сг + 3C1S = 2СгС13
, , _1кат хром суюлтирилган кислоталардан водородни си-чицаради:
J Сг + H2SO4 = CrSO4'4- н2
<^Сромнинг кимёвий хоссаси ундаги Сг оксидланиш даражасига богли^. Сг2+ кучли ^айтару^ци.
2СгС12+2НС1 = СгС13 + Н4 ?
4СгС12 + О2 + 4НС1 = 4СгС13 + 2Н^О
Ст3+ — кучсиз ^айтарувчи.
2NaCrO2 + Вг2 4- 8NaOH = Na2CrO4 + 6NaBr 4- 4Н2О
Сг’+ — кучли оксидловчи:
KtCr2O7 + 3HaS + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4+ 7HaO
CrO, Cr(OH)2 — асосли хоссага эга
' Cr(OH)2 + 2HC1 = CrCl2 + 2HaO
Сг2О3, (Сг(ОН)3 — амфотер хоссага эга.
Cr(OH), + ЗНС1 = СгС13 + ЗН2О
Сг(ОН)3 + 3NaOH = Na3 [Cr(OH)e]
CrO3, H.2CraO, — кислотали хоссага эга
H2Cr2O7 + 4NaOH = 2NaaCrO4 4- ЗН2О
Сг2+ ва Сг3 ионлари жуда.яхши комплекс ^осил ^и-лувчилардир, Сг3+ эса «классик комплекс ^осил цилув-чи»дир. Катион ва анион типидаги (туридаги) жуда куп комплекслари маълум, улар купинча 4 ва 6 координация сонига тенг булади.
[Сг(НаО)в]2+, [Сг(Н2О)6]3+, [Сг(ОН)в]3~, [Сг(Н2О)5С1]2+ [Cr(H2O)4Cl2]+, [CrClJ3-
Сг2+ ва Сг+3 учун кислород ва азот са^ловчи лигандлар билан комплекс ^осил ^илиш характерли. Хромнинг хлоридлари, сульфатлари ва нйтратлари —эрувчан туз-лару цийин эрувчан гидроксидлар, фосфатлар, асосли тузларидир. Хром тузлари сувли эритмаларда гидро-лизга учрайдИ ва бунда асосли тузлар ^осил булади:
СгС13 + НОН Сг(ОН)С12 «|- НС1
Сг(ОН)С12 + НОН Сг(ОН)2С1 + НС1
Cr(QH)aCl 4- НОН Сг(ОН)3 4- НС!
> Кучли кислотадан >^осил булган хром тузлари кисло-тали мудитга эга.
VII гурух, d-элементлари ва шу элемент бирикмаларининг хоссалари
VII гуру^ 3-элементларига марганец, технеций, ре-ни киради. Уларнинг атом электрон конфигурацияси (и—l)d5nS2. Бу элементлар узгарувчан оксидланиш да-ражасига эга. Марганец учун купро^ 4-2, 4-3, 4-4, 4-6, 4-7 оксидланиш даражаси хос. Бор ^осил булишида таш-ци ва ундан длдинги цават электронлари цатнашади.
-Марганец бирмунча фаол металл. КизДирилганда купчилик металлмаслар, сув билан осон реакцияга ки-ришади, суюлтирилган кислоталардан водородни сициб чицаради:
3Mrf 4- Na = Mn3N2 Мп 4- 2Н2О = Мп(ОН)2 4- Н2 f
Мп 4- О2 = МпО2 Мп 4- 2НС1 = МпС12 4- Н2 f
Марганецнинг кимёвий хоссаси унинг оксидланиш дара-жасига боглид. Мп2+ — дайтарувчи
- 2MnSO44-5PbO24-6HNO3 = 2HMnO4 + 3Pb(NOs)24-— 2PbSO4 4-2Н2О
Мп4+— кучсиз дайтарувчи
ЗМпО2 4-КС1О3 4-6КОН = 3KaMnO4 + КС1 + ЗН2О
М6^—оксидловчи
ЗК2МпО4 4- 2Н2О = 2КМпО4 4- 4 КОН 4- МпОа
Мп7+ — кучли оксидловчи
2КМпО4 4- KNO, 4- 2КОН == 2К2МпО4 4- KNO3 4- Н2О 2KMnO44-3KNO2 +Н2О = 2МпО24-3KNO34-2КОН 2КМпО4 4- 5HNO2 4- HNO3 = 2Mn(NO3)2 4- 2KNO3 4- 3HaO
МпО, Мп(ОН)2 — асосли хоссага эга
Мп(ОН)2 4- 2НС1 = МпС12 4- 2НаО МпО2, МпО(ОН)2 (Н2МпО3)
Кислоталилиги куп булган амфотер хоссага эга
Н2МпО3 4- 2NaOH = NajMnO3 4- 2Н2О
МпС12 HaMnO34-4HCl=MnClZ 4-ЗНаО
С1,-
асосли хоссаси кучаяди Mn(OH)4, (H2MnOg), НМпО4
Мп(ОН)2, Мп(ОН)8 кислотали хоссаси кучаяди
«г
ж; г
Марганец ^амма валент ^олатларида куп сонли катионли анионли турдаги комплекс бирикмалар ^осил^илади. И^нга 6 ва 4 координация сонлари хос:
Е- [Mn(HiO)jH-, (Mn(CN)4]a“, [MnClJ2- ]MnF4]a~
бошдалар. Унинг нейтрал кбмплекслари — карбонил-Вйяари [M.n2(CO)ioI маълум, Марганецнинг хлорйдлари, ’ В&сульфатлари, нитратлари, ацетатлари, ишдорий метал-Кларнинг манганат ва перманганатлари сувда осой эрий-f диган б^либ, гидроксидлари, сульфидлари, карбонатла-Е ри, фосфатлари ва бошдалари сувда эримайди. Мп+2 В тузлари сувли эритмаларда гидролизга учрайди. ^шдо-р рий металл перманганатлари эса гидролизланмайди.
Темир оиласига мансуб d-элементлар ва шу элемент бирикмаларйнинг хоссалари t
Темир оиласидаги d-элементларга темир, кобальт, никеллар киради. Атомларининг электрон конфигурациям:
Fe — 3de4S2; Go — 3d74Sa; Ni — 3d84S2
Бу элементлар цуйидаги оксидланиш даражасига эга була олади:
г
£ . Fe— 4-2, +.3, +6
Со —+ 2, 4- 3
G Ni —4-2, + 3
„ Бу элементларнинг даммаси тугалланмаган d-добидча-£ га эга. Шундай дилиб, бог досил дйлищда 4- ва 2- до-би^чалар цатнашади. Улар ^ртача фаолликка эга б^л-
J ' ган узига хос металл булиб, купчилик металлардан я- фар^ли равишда магнитга тортилади. Улар оддий шаро-,' итда металламаслар билан сезиларли реакцияга кириш-j майди, амЕмо ^йздирилганда кимёвий активликка эга б^- г лади.
3Fe 4- 2О2 =. Fe3O4 3Fe 4- N2 = Fe3N2
Г Fe4-S = FeS Co 4~ Cl2 = СоС12
| 2Fe 4-3S = Fe2S3 3Ni 4-2P = Ni3Ps
, Темир говори дароратда сув билан реакцияга кири-
.L шади:
3Fe 4-4Н2О = Fe8O4-}-4Н21
У суюлтирилган кислоталардан водородни сшрГб чицаради. Кобальт, никель эса фаоллиги камроц б^лгани учун кислоталар билан секинро^ реакцияга киришади:
Fe + 2НС1 = FeCl2 + H21
Темир концентрланган сульфат кислота билан реакцияга ки. ришмайди.
Кимёвий активлик Fe — Со — Ni цаторида камаяди. Уларнинг бирикмаларида кимёвцй активлик элементнинг оксид-• ланиш даражасига богли^ булади:
Fe2+— кучли цайтарувчи:
10FeSO4 + 2КМпО4 + 8H2SO4 = 5Fe2(SO4)3 + + 2MnSO4 + K2SO4 + 8HaO
Fes+ — оксвдловчи
2FeCl3 + 2KI = 2FeCl2 + KC1 + I2
Fee+ — кучли оксидловчи:
к
4K2FeO4+ 10H2SO4 = 2Fe2(SO4)3 + 4K2SO4 + 3O2 + 10H2O
FeO, Fe(OH)3 — асос хоссаларини намоён дилади:
Fe(OH)2 + 2HC1 = FeCl2 + 2HaO
Fe2Oa, Fe(OH)3 — асосли хоссаси устун булган амфотер-лик хусусиятига эга.
2Fe(OH\ + 3H2SO4 = Fea(SO4)8 + 6Н2О Fe(OH)3 + 3NaOH = Na3 [Fe(OH)e]
КОНЦ.
FeO3, (HgFeQj) — кислотали хоссани намоён дилади.
FeO3 + Na2O = Na2FeO4
Co2+ бирикмалари Fe2+ бирикмаларига [нисбатан [кучсиз ^айтарувчи Fe2+, Fe(OH)2 — ^аводаги кислород билан осон оксидланади, Со(ОН)2 эса секин оксидланади, Ni(OH)2—оксид-ланмайди. Со3+ бирикмалари Fe3+ бирикмаларига нисбатан кучли оксидловчи.
Бу элементлар купчилик утувчи (^тиш) металлар каби жуда яхши комплекс ^осил ^илувчилардир. Комплекс бирикмалар ^ам анорганик, ^ам органик лигандлар билан катион ва анион типида ^осил булади. Одатда координация сони 4 ва 6 булади.
[Fe(H2O)6]2+ [Fe(H2O3]3+ [Co(H2O)e]2+ [Ni(H2O)e]2+
[Fe(Cl4)2+ [Co(NH3)e]2+ [Ni(NH3)6]2+
,[Fe(CNe]4~ [Fe(SCN)e]3- [Co])e(Cl4] [Ni(CN)4]2-
[Fe(CO)B] [Fe(CN)e]3’ [Co(SCN)4]2 “ [NiClJ2-
[FeFjr [Co(NO2)6]3-’
Купчилик комплекс бирикмалар узига хос рангга
' эга, уларнинг ^осил булиши сифат анализида шу ион-ларни аницлаш учун ишлатиш имконини беради.
Темирнинг уз ига хос хусусияти унинг СО билан комплекс ^осил цилишидир. Унинг тузилиши тригонал бипирамида булиб, темир атоми марказда жойлашган: : Fe + 5CO= [Fe(CO)g]. Бу элементлар кислород, азот, олтингугурт сазловчи лигандлар билан комплекс бирикмалар ^осил цилиши мумкин. Темир, кобальт, никелнинг . хлоридлари, сульфат ва нитратлари эрувчан тузлар-дир, гидроксидлари, сульфидлари, фосфатлари, йарбо-натлари, асосли тузлари ва бопщалар — эримайдиган тузлардир. Темир Ш-тузлари гидролизга купро'к; учрайди. t
FeCls + НаО ч* Fe(OH)Cla + НС1
Fe(OH)Cla 4- НаО =₽* Fe(OH)aCl + НС1
Fe(OH)aCl + НаО =₽»= Fe(OH)3 + НС1
Ургатувчи масалалар ва уларни ечиш намуналари
1-мисол. Нормал шаронтда Улчанган 25,0 л азот (II)-оксиди олиш учун 30% ли (масс) HNOs ва металл долдаги мисдан данча сарф дилиш керак?
Берилган:
и>% (HNO3) = 30 о/о'
V(NO) = 25,0 л
Vm = 22A л/моль
Af(HNO3) = 63,0 г/моль
Af(Cu) =63,54 г/моль
p(HNO3) =1,18 г/мл
V(HNO3) = ?
m(Cu) = ?
Ечиш намунаси. Реакциянинг бориш 'тенгламаси:
3Cu° + 8HNO3 = 3Cu(NO3)i + 2NO + 4НаО
Cu° — 2e--»-Cu2+ 3
NOf + 4Н+ + 3e~ NO° + 2Н2О 2 3Cu° + 2N + 8Н+ 3Cu2+ + 2NO° + 4HXO
25,0 л NO ажралиб чидиши учун керак булган мис массасини топамиз. Реакция тенгламасига кура, 3 моль мис 8 HN О3 биЛан Узаро таъсирлашганда 2 моль NO ажратиб чидаради. Шундай дилиб, 3 моль-63,54 г/моль = 190,62 г. Си 2 моль • 22,4 г/моль—44,8 л NO чидаради.
Езамиз:
190,62 г Си— 44,8 л NO Ха Си — 25,0 л NO
Пропорция тузамиз: 190,62:44,8 = X: 25
,л= №25£=106Л
44,8
NO
m (Cu) == 106,4 г
2. Мис билан реакциясида 25,0 л NO хосил дилаолган HNO3 массасини топамиз. Реакция тенгламасига кура 8 моль HNO3 2 моль NO Хосил дилади. Шундай дилиб, 8 Моль-63 г/моль = 504,0 гHNO3 2 моль X X 22,4 г/моль = 44,8 л NO ажратиб чихаради. Ёзамиз:
504,0 г HNO3—44,8 л NO - X eHNO3 — 25,0 л —
Пропорция тузамиз: 504 : 44,8 = X : 25
504,0-25,0
“ 44,8 “
т ((HNO3) = 28,1
3. Масала шартига кура реакция да суюлтирилган 30 % (масс) HNOS датнашади: .
28,1
w% (HNO)3 = т (эр-ма)
28,13 azHNO3 садловчи кислота эритмаси массасини топамиз:
- т (HNO3)-100%
т (эр- ма) =---------------
®%(HNO3) -
ч 28,13-100 г % •
т (эр - ма) =----— -------= 93,8 а
30 %
т (эр- ма) = 93,8 г.
4. Зичлиги р= 1,18 г/мл эканлигини билган долда,эритма дажмини топамиз:
V (HNO3) = — р эритма
V (HNOJ = 93^7я-Л<-.= 84,7 мл.
V (HNOS) = 84,7 мл
Жавоб:
т (Си) = 106,4 г
V (HNO3) = 84,7 мл
Масала буйича саволлар
1. Металл долдаги мис кислородсиз кислоталар билан реакцияга киришадими? -
Жавоб: мне активлиги кам металл б?либ, электрокимёвий куч-ланишлар даторида водороддан кейин туради ва кислоталардан во-дородни сидиб чидармайди.
2. Мне нитрат кислотадан дандай мадсулотлар ажратиб чихаради?
Жавоб: мис нитрат кислота билан оксидлапиш-дайтарнлиш механизмы буйича реакцияга киришади, реакция мадсулотлари HNO3 концентрациясига боглид булади:
Cu -J- 4HNO3 — Cu(NOa)24- 2NUj-f* кони.
Xu + 8HNO3 = 3Cu(NOj)2 4- 2NO 4- 4H2O . суюл.
2-мисол. Нима учун [Ag(NH3)2] Cl га нитрат кислота билан таъсир эттирилганда чукма тушади? Борадиган реакция модиятини тушунтиринг.
Ечиш намунаси
[Ag(NH3)j)] (Cl—комплекс туз булиб, 'сувли эритмада дуйидаги тенглама буйича диссоциланади:
[Ag(NH3)3l Cl [Ag(NH,)a]+ 4-С1-
\осил б^лгаи комплекс ион [Ag(NH3)a]+ оз булса дам диссоциаццдга учрайди:
[Ag(NH3)4+ * Ag+ 4- 2NH° Ябемрор = б-10~* '
Эритмага HNOa душилганда NHS н+ иони билан бирикиб муста дкам NH<+ ионини досил дилади:
(Ag(NH8j,]+=F*Ag+4- 2NH° . . .
' . 2HNO3«2NO74- 2NHt+ *
Эритмадаги комплекс ион мувозанатн чапдан унгга, яъни унинг . парчаланишини тезлаштириб, Ag~^ ионларинииг досил булиши томонга силжийди. Одибатда эритмада (cAg+) купайиб уни с (СГ) га купайтмаси К9к (AgCl) дан катта булади. Шунинг учун чукмага АС1 тушади.
3-мисол. 0,3 г кумуш танга булагини нитрат кислотада эри-тиб, досил булган эритмадан кумушни AgCl сифатида чУктирилди. Чукманинг огирлнги ювиб куритилгандан кейин 0,1990 г га тенг булди. Тангада нечр фоиз (масса буйича) кумуш булган?
Берилган:
т (танга) = 0,3 г
m(AgCl)= 0J990 г
Af(AgCl) = 143,3 г!моль
Al(Ag) = 107 г! моль
w % (Ag) = ?
Ечиш намунаси. Реакциянинг бориш тенгламаси:
3Ag 4- 4HNOS = 3AgNOa 4- NO 4- 2HaO Ag° —e~->Ag+
NO" 4- 4H+ 4- 3e~ biO° 4- 2HaO
3Ag° 4-NO7 4-4H+-> 3Ag°4-NO°4-2HaO
AgNO3 4- HCI = AgCl 4- HNO3
0,1990 г AgCl досил дилган- кумуш ионлари массасини анидлаймиз. ' Реакция тенгламасига кУра 1 моль Ag+ ( моль AgCl досил дилади. Шундай дилиб, 1 моль = 107,9 г, Ag^ 1 моль-143,3 г/моль == 143,3 г AgCl досил дилади. Езамиз: #
107,9 г Ag+ — 143,3 г AgCl
X г Ag+ — 0,1990 г AgCl
Пропорция тузамиз: 107,87 : 143,32= X :0,1990
v 107,87-0,1990 nttno
Х =-----——----------- 0.1498 г
143,32
. ' , т (AgCl) = 0,1498 г
2. Кумушнинг кумуш тангадаги масса улушини (%) топамиз:
m (Ag)
(Ag)= ' ~ -Y-100% т (танга)
0,1498 г%
w % № ~ 100 % ~ = 49>9 % своими г
Жавоб: w % (Ag) = 49.9 % _
Масала буйича саволлар
1. Нима учун кислоталар билан узаро таъсири натижасида кумуш водородии сидиб чидармайди?
Жавоб: кумуш активлиги кам металл, активлик даторида во-дороддан кейин туради, фадат оксидловчи кислоталар билан оксид-ланиш-дайтарилиш механизма' буйича реакцияга киришади.
4-мисол. Zn(NO3)2 ва Hg (NO3)2 тузлари суюлтирилган эрит-маларининг (концентрацияси бир хий) дайси бирида pH диймати кичик.
Ечиш намунаси. Симоб ва рух' тузлари кучсиз асосдан досил булганлиги учун сувли эритмаларда гидролизга учрайди. Гидролиз босдичма-босдич боради:
М (NO3)2 + Н2О & М (OH)NOS4- HNO3
М(ОН)+=^М2+ + ОН-
Бу мувозанатли жараён ЛГ(ОН)+ ионининг ди^роциациясига боглид булади ва Адисс диймати унинг миддорий характеристикаси булади. Кдисс. диймати данча катта булса, диссоциация жараёни шуича тулид боради. Маълумки,
K[zn(OH)]+ = 4 • 10~5; А’[нг(0Н)+= 5-iO—ii
K[zn(OH)]+>4[Hg(OH)]+ булгаии учун> н^°з)2 тузининг гидро-лизи Zn(NO3)2 га нисбатан купрод боради, демак Hg(NO3)2 эритмасининг pH и Zn(NO) никидан кичик булади.
5- мисол. Zn(OH)2 ва Hg(OH)2 гидроксидларида н дайсиниси К! да эрийди?
Ечиш намунаси. Иккала гидроксид1! дам'кам эрийдиган [моддалар б?либ, ч^кма ва унинг ионлари орасида мувозанат мавжуддир:
Zn(OH)2 ч* Zn2+ + 2ОН-
Hg(OH)2^Hg2+4-2OH-
Маълумки, Hg2+ ионларй 1“ ионлари билан жуда мустадкам [Hgl4]2 комплексини досил килади. К, <, = 1,5-10~30, Zn2+ ионла-
бецар. [Hgl4]z“
к
I
[ри эса 1“ ионлари билан жуда бедарор комплекс досил дилади. Шунинг учун Hg(OH)2 га KI нинг цушилиши чукма— эритма орасидаги мувозанатни бузади ва чукмавинг эриШи кузатилади.
Hg(OH)2^ Н^+-2ООН 4К1^41- + 4К+
Масала буйича саволлар <
1. Цандай долатларда кам эрийдиган бирикманйнг эриши содир булади? *.
!, Жавоб: чукма у досил дилаётган ионларнинг бири билан кам ; ' диссоцияланадиган бирикма досил циладиган реагентда эрийди.
6-мисол. 1,56 г рух карбонат ва рух оксид аралашмаси циэ-дирилганда 1,34 рух оксид досил булади. Бошлангич аргташма тар-кибини (масса буйича% да) дисбблаиг.
Берилган: m(ZnCO3 + ZnO) = 1,56 г
умумий m(ZnO) = 1,34 г
M(ZnCO3) = 125,4 г/моль
M(ZnO) — 81,4, г1 моль_
tt>%(ZnCOs) = ? m%(ZnO) = ?
Ечиш намунаси
Реакция тенгламаси
ZnCO3-V ZnO + со21 ZnO->ZnO J
Бунда: m(CO2) — m(ZnCO3 + ZnO) — m(ZnO) = = 1,56—1,36 = 0,20г
tn (COa) = 0,20 г
ZnCO3—>ZnO + CO2
125,5 г—>44 г. CO2.
X2—> 0,20 г CO2
v 125,5г-0,20г 25,10 n ,
/V =s —г; . — с»
44 г 44
Демак, m(ZnCOj) = 0,57 г
m(ZnO6ou]Jle) = n?(ZnCO3 + ZnO)—m(ZnCO3) ==
= 1,56 — 0,57 = 0,99г.
w% ZnO = m(Zn9! -*. • 100 = = 63,5 %
m(ZnCO3-ZnO) 1,56
w% (ZnCO,)= - -----100 - °’57'-0- = 36,9 %
V 37 m(ZnCO3+ZnO) 1,5^
Жавоби:
w% (ZnO) = 63,5%
w% (ZnCO3) = 36,9%
Масала буйича саволлар
1. Рух карбоцдт дандай хоссаларга эга?
Жавоб: рух карбонат диздирилганда ZnO ва СО2 досил дилиб парчалднади.
ZnO даерда ишлатилади?
Жавоб: рух оксиди тиббиётда антисептик (микробга дарши) восита сифатида ишлатилади. У рухли малдам дори (мазь) ва болалар сепма дориси таркибига киради. Рух оксидидан кимёвий Ыустадкам ва яхши допловчи суртма мойлар тайёрланади. ZnO шиша, глазурь, линолеум ва бошда материаллар таркибига киради.
7-масала. FeSO4 эритмасини 10,00 мл NaOH иштирокида оксид-лаб Fe(OH)s долида чуктирилади, фильтрлаб, ювиб диздирилганда 0,4132 г Fe2O3 досил булади. FeSO4 эритмасининг моляр концентра циясини дисобланг.
Берилган: V (FeSO4) = 10,00мл т (Fe2O3) = 0,4132 г .M(FeA) = 159,7 г!моль М (Fe) = 55,84 г!моль Af(FeSO4) = 151,9 г!моль
Ечиш намунаси '
1. FeSO< + 2NaOH = Fe(OH)2 + Na2SO4
2. 4 Fe(OH)a+ O2 + Н2О = 4 Fe(OH)s
3. 2 Fe(OH)3-> Fe2O3 + 3H2O ‘
FeSO4 эритмаси моляр концентрация сини топамиз. Тенгламадан;
с (FeSOJ =
т (Fe2O3) • 1000
М (1/2РеА)-У (FeSO4)
o(FeS04) =
0,4132-1000
78,84-10,0
= 0,5175------ га тенг.
л
Жавоб: с (FeSO4)= 0,5175 моль/л.
Масала буйича саволлар,
1. FeSO4 дандай хоссаларга эга?
Жавоб: икки валентли темир бирикмалари кучли дайтарувчи-лардир.
2. Эритманинг моляр концентрацияси нима?
Жавоб: Эритманинг моляр концентрацияси 1 л Эритмадаги эриган модда моллари сони билан ифодаланади.
nW m(X)
с(л) — у — М(Х\.У , моль/л
'(эр-ма) т V*/ '(эр-ма)
8- мисол. !Fe3+ учун хос реакция лар дан бири —т NH3SCN— аммоний тиоционат таъсиридир. Унда турли таркибли комплекс ионлар досил булади, хусусан, цип-цизил рангли [Fe(SCN)2]'*' дам досил булади. Аммоний тиоционат билан
1) (NH4)Fe(SO4)2-12Н2О s •;
г
1 2) [FeF2]Cl тузлари эритмасига таъсир этганда шу ранг досил 6J1-
/ ладими?
Ечиш намунаси. ' ,
1. NH4Fe(SO4)2-12Н2О — душ туз булиб, сувли эритмада уни таш-; кил этувчи дамма ионларга ажралади:
Г NH4Fe(SO4)2NHt + Fe3+ = 2SOf~
Унинг эритмасига аммоний тиоцианат таъсир эттирилганда комплекс ион (Fe(SCN)2j+ досил булиши одибатида Дип-дизил ранг досил булади. -
[FeF2|+ темирнинг комплекс ионидир. Сувли эритмада у диссотСила-нади: ;
; , [FeF2]+4± Fe3++ 2F- "
^бекарор [Fe(SCN)2]=5-10-4 *
К <=4,410-м
, бекарор [FeFJ т"
(FeF?]~*“ комплекс ионининг бедарорлик константаси [Fe(SCN)2l~F комплекс ионининг бедарорлик константасидан анча кичик. Бу фторид комплекса тиоцианат комплексидан анча мустадкам эканини курсатади. Демак, унга NH4SCN нинг таъсир этиши тиоцианат компл’екси досил булишига олиб келмайди.
Масала буйича саволлар
1. Комплекс ионининг бедарорлик константаси нимани ифода-лайди.
Жавоб: комплекс ионининг бедарорлик константаси унинг мус-тадкамлигини (бардарорлигини) ифодалайди. Бу катталик данча кцчик б^лса, комплекс ион шунча мустадкам дисобланади. Бедарорлик константасига тескари диймат бардарорлик константаси дейилади:
- Р~^беКар.
0 диймати данча катта булса, комплекс ион шунча бардарор булади .-i 2. Дандай дилиб Кбекарор дийматларини билган долда комплекс досил булиш реакцияларини бошдариш мумкин?
Жавоб: Хамма жараёнлар, шу жумладан, комплекс бирикмалар до-i сил булиши дам мустадкам, яъни Кбекар. лйги кам булган бирикмалар досил булиши томонга боради.
9-масала. 0,01 моль/л темир (П)-сульфат эритмаси ордали т^йингунча водород сульфид ^тказилса, темир (И)-сульфид чукмаси досил б^ладими й^дми? (эритма рН-5).
!. Берилган: c(FeSO4J= 0,01 моль/л
*oKPeS=5-10-lS
c(H2S) = 0,l моль/л
i KX(H2S) = 5,710-«
t- K2(H2S)= 1,2-Ю-13
| пН = 5________________
Ь. Чукма досил буладими? #
к; Ечиш намунаси. 1; Туйинган эритмадаги S-2 ионлари концентра-кк циясини дуйидаги тенглама буйича топамиз:
.. Ki.(HiS)«X2(H2S)-r:(H2S) 6,84-10~и-0,1
c (S-2) =---------------------------------------------
C*(H+) 10-1»
= 6,8* 10—14- pH = 5 булганда с (H"*") = IO-5 булади.
0,01 моль!л FeSO4 эритмасидаги Fe2+ концентрациясини топамиз c(Fe2^) — c (SO2-) = 0,01 моль! л = 10~2 моль!л.
3. Fe2+ ва S2 ионлари концентрациялари купайтмасини топамиз;-c(Fe2+) с(S2—) = 10-»-10—1* = 6,8-10“«
4. Ионлар купайтмаси с (Fe“^2)-c (S2-) = 6,8-10-1’ Шунинг учун чукма досил булади.
Масала буйича саволлар ,
1. К,айси долатда ёмон эрийдиган электролит 'чУкмаси тушади?
Жавоб: ёмон эрийдиган электролит ионлари концентрацияси купайтмаси К эк дийматидан катта булса, чУкма тушади,
10- мисол. Бошлангич модда сифатида калий дихромат олинса дандай дилиб хром-калийли аччидтош досил дилиш мумкин? 1 кг •аччидтош олиш учун зарур булган КгСг2О7 массасини топинг.
Берилган: - т (аччидтош) = 1,0 кг
М (К£г2О7)= 294,1 г! моль
/ М (аччидтош) = 499,1 г!моль
(К2Сг2О7) = ?
Ечиш намунаси. Хромкалийли аччидтошнинг формулам.
КСг (SO4)2.12Н2О
1. К2Сг2О7дан хромкалийли аччидтош олиш учун Сг6"^ ни Сг3+гача дайтариш лозим. Бу жараённи турли дайтарувчилар.• SO2, HI, H2S ва бошдалар ёрдамида амалга ошириш мумкин. Этил спирт билан дай-тариш энг дулай дисобланади, чунки бу долда бошда анорганик ионлар досил булмайди.
ЗС2Н5ОН + К2С2О, + 4H2SO4 + 17Н2О = K2SO4. Сг2 (SOJ3»24H2O+
4-С2Н4О
2. Реакция тенгламасидан кУринадики, 1 моль К2Сг2О7 дан 2 моль KCr(SO4)2-12Н2О досил булаяпти, яъни 1 моль-294,10 г!моль = 294,1 г дан 2 моль-559,09 г!моль — 1118,2 г KCr(SO4)2- 12НаО досил булади.
Ёзамиз; , -
294,1 в К2Сг2О? — 1118,2 г KCr(SO4)2.12Н2О
Хе К2Сг2О, — 1000,0в KCr(SO4)a- 12Н2О
Пропорция тузамиз:
294,1 : 1000 = X» 118,2
„ 294,1-1000 „„ „
х——2в41’°г ,
Жавоб: т (К2Сг2О7) = 0,264 кг
Масала буйича саволлар
1. Хромкалийли аччидтош KCr(SO4)2'12H2O моддаларнйнг дайси синфига киради?.
Жавоб: хромкалийлн аччицтош хром ва калийнинг tjsi ь Зисобланади.
2. Хромкалийлн аччицтош цаерда ишлатилади?
i , Жавоб: хромкалийлн аччицтош (Сг+3 нинг энг кенг тарацалган х тузи) кунчилик саноатида териНи ошлашда, т^имачилик саноати-да — ачитци ва буёц сифатида ишлатилади.
11- мисол. Мп* 2+ ионининг кислотали музитда РЬО2 таъсирида
' оксидланганда зосил булиш э^тимоли энг к^п булган мазсулотни к^рсатинг.
Ечиш намунаси.' Маълумки, кислотали музитда Мп2+ оксидланганда Мп7+> яъни КМпО4 зосил булади.
; Мп2+4Н2О — 5"-> М11О7+ 8Н+ ।
PtjO2 оксвдловчи булиб, кислотали музитда РЬ2+ гача дайтарилади.
РЬОа + 4Н+ + 2 е“~> РЬ2+ + 2НаО
Шундай. цилиб: -. .
Мп2+ + 4Н2О —5е~->МпО74-8Н 52 ' . РЬОа4-4 Н+ + 2е~-»-РЬ2+ +2НаО 2 5
_2Mn(NO3) 2"+ 5РЬО2 + 6HNO3 = 2НМпО4 + 5Pb(NOs)a + 2 НаО
2Мп2+ + 5РЬОа + 4Н+ -* 2МпО7 + 5РЬ2+ + 2НаО
' Тенгламанинг молекуляр шаклига утиш мумкин:
2Mn(NOs)2 + 5РЬОа + 6HNO3 = 2НМпО4 + 5Pb(NO3)a + 2НаО
Масала буйича саволлар
1 1. Оксидланиш-'Зайтарилиш реакцияси мазсулотлари дандай
омилларга боглиз?
Жавоб: Оксидланиш-цайтарилиш мазсулотлари реакция уткази-лаётган шароитга, биринчи навбатда, эритмадаги водород иони концентрациясига, температурага ва бошда омилларга боглид бу-лади. - 7
2. Оксидланиш ва цайтарилиш вацтида элементларнинг оксид-9 ланиш даражаси дандай узгаради?
Жавоб: оксидланишда элементнинг мусбат оксидланиш’дара-' жаси ортади, манфийси эса — камаяди,. дайтарилишда — мусбат оксидланйш даражаси камайиб, манфийси ортади.
12-мисол. 7,6 г FeSO< ни нейтрал, кислотали мудитли эритМа-, ларда оксидлаш учун зарур булган калий перманганат массасини .анидланг.
Берилган: т(FeSOJ ~ 7,6 г Л4 (FeSO4) = 152,0 г!моль М (КМпО4) = 158,0 г!моль
т (КМпО4) = ?
Ечиш намунаси. 1. Кислотали му^итда КМпО4 ва FeSO4 орасида Куйидаги реакция борадй;
10FeSO4 + 2КМиО4 -f- 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 4- 8H2O
2Fe2+ — 2e~->-2Fe3+ ' 5
MnOf+8H+ + 5e--* Mn2+4-4H2O 2
10Fe2+ + 2MnO7 + 16 H+->- 10Fe3++ 2Mn2+ + 8H2O
2. Реакция тенгламасига кура, 10 моль FeSO4 2 моль КМпО4 би-’ лан, яъни 10 моль-152,0 г/моль — 1520,1 г FeSO4 билан, 2 моль-158,0 г1модь = 316,1 г КМпО4 билан реакцияга киришади. '
Езамиз.*
1520,1 г FeSO4----316,1г КМпО4
7,6 г FeSO4 — X г КМпО4
Пропорция тузамиз: 1520,1 .*316,08г = 7,60:Х
, „ 316,1.7,6
Х =...."15M,i =1’58
Жавоб: т (KMnO4) = 1,58 г
3. Нейтрал мухитда КМпО4 ва FeSO4 орасида реакция.боради.
6FeSO4 + 2КМпО4 + 6Н2О = 2H2MnO3 + 4FeOHSO4 + {Fe(OH)2]SO4+
-f- K2SO4
2Fe2+— 2e~->2Fe3+ -
2MnO4“ + 2H2O + 6e“->- 2MnO^~ + 4OH“
3
1
6Fe2+ + 2MnO Г + 2H2O-> 6Fe3+ + 2MnO|“ + 4OH~
Реакция тенгламасига кура, 3 моль FeSO4 1 моль КМпО4 билан яъни
3 моль-152,0 г/моль = 456,0 г-
1 моль-158,04 г/моль = 158,0 г
реакцияга киришади. Ёзамиз:
456,0 г FeSO4—158,0 г КМпО4
7,6 г FeSO4---ХгКМпО41
Пропорция тузамиз: 456,0:158,0 = 7,6: X
158,0-7,6 '
Х=------НН—=2,63
456,0
_ m2(KMnO4) = 2,63 г
Жавоб: т^КМпО^ = 1,58 г; яг2(КМпО4) = 2,63 г
Масала бубича саволлар
1. КМпО4 дандай хоссаларга эга?
Жавоб: бу энг кучли оксидловчи.
2. КМпО4 турли му^игларда Дандай ма^сулотгача дайтарилади?
Жавоб: МпО~ ионининг дайтарилиши цуйидаги йуналишларда бо' риши мумкин:
кислотали мудитда: МпО” + 8Н"*" + 5е“-> Мп2+ +4Н2О
нейтрал ва ишдорий мудитда: MnOJ* + 2Н2О + З^-^МпОаЧ-+ 4ОН-
кучли ишдорий мудитда: МпО" + е—МпО2""
3. КМпО« тиббиётда ишлатиладими?
Жавоб: Ха, антисептик сифатида ишлатнлиши унинг оксидловчилик хоссасига асосланган, КМпО4 эритмаси тиббий-биологик объ-ектлар ва доривор прёпаратларда дайтарувчилар миддорини аниц-, лаш учун ишлатилади. _ .
< Мавзуни узлаштирилишни муста^ил назорат
Хилиш учун савол ва масалалар
1.1 гурух d-элементларининг бирдан юхори валёнтлик намоён Хилишини уларнинг атом тузилиши билан ‘ хандай уйгунлаштириш (келиштириш) мумкин?
2. NH3, С1-, Вг~, Н2О молекула, ва ионларини лиганд Сифатида Х^ллаб, мис (I), мис (П) ва кумуш' комплекс бирикмалари форму-лаларини ёзинг.' "I
/ 3. Кумуш нитрат —AgNOs ёки «ляпис» бактерицид куйдирувчи
таъсир курсатади. Hg(NO2)2 эса бундай хусусиятга эга эмас. К,ан-дай хилиб хлорид кислота ёрдамида икки моддаДан бири «ляпис» эканини анихлаш мумкинлигини тушунтиринг.
4. Православ черковида бу динга ишонувчиларга «муцаддас сув» сепилади. Бу сув узох вахт хавода бузилмай туриши Мумкин. Сув 'кумуш идйшларда сахланадй. ХаХйХатан Хам> бу сувни тай-ёрлашда илохйй. кучлар таъсир хиладими-й^хми? Шуни тушунтиринг.
5. Маълумки, тилла стоматология амалиётида тишларга хоп‘ лама тайёрлашда кенг ишлатилади. Нима учуй шундай хилиш мумкинлигини тушунтиринг.
6. Мис цитрат—(Сй2СвН4О7) -5Н2О тиббий амалиётда трахома : ва конъюнктивит да кузга суртиладиган малкам тайёрлашда ишлатилади. 20,0 г офтальмол препарати тайёрлаш учун 5 цисм мис ' цитрат, 6 хисм сувсиз ланолин, 89 хисм вазелин олинади. 20,0 г офтальмолдаги мис цитратнинг масса улушини (%) ва массасини Хисобланг.
Жавоб: и % (цитрат) =5%; m (Си — цитрат) = 1,0 в.
7. Кумуш нитрат эритмаси галогенид ионлар сахловчи доривор препаратларни текширишда кенг ишлатилади. Натрий бромид неврастения, невроз, истерия ва бошхаларда кенг ишлатилади. У к^п-яилик микстура (суюх дори) лар таркибйга киради. 100,0 мл Павлов микстурасида 0,9% (масс) натрий бромид, 0,25% (масс) кофеин натрий бензоат бор. Агар 10,0 мл шу препарат эритмасини 2,0 мл ' S% ли К2СгО4 иштирокида титрлаш учун 17,47 мл 0,05 моль/л AgNOs эритмаси сарф булган б^лса, NaBr нинг масса улушини : (%)топинг.
8. Мис .сульфат — CiiSO4-5H2O конъюнктивитларда антисептик •два богловчи (ёпипщох) восита сифатида ишлатилади. 100,0 мл 0,25% (масс) ли эритма тайёрлаш учун керак булган шу препарат массасини анихланг. Шу препаратда миснинг масса улуши (%) Хандай? _
Жавоб: т (CuSO4 • 5НаО) = 0,25 г w% (Си) = 0,06%
9. Суюлтирилган хлорид кислота меъда шираси кислоталилиги камлигида ишлатилади. Препаратнинг хаХихийлиги AgNO3 ёрда-мида анихланади. Бунда борадиган реакция тенгламасини ёзинг. 5,0 г 8,4% (масс) ли НС1 эритмасидаги хлор ионини т^ла ч^ктириш учун AgNO3 дан неча грамм олиш керак?
Жавоб: m (AgNO3) = l,94 г.
10. Мис, кумуШ, тилладан тайёрланган буюмлар одамнинг
кундалик даётида кенг тардалган. Хусусан, уларнинг купчилиги— зеб-зийнат, пул, идиШ-товод ва бошдалардир. Вадт утиши билан кумушдан тайёрланган предметлар дораяди, мисдан тайёрланган-лари — кУкараЖн (яшил тусга киради), тилладан тайёрланганларн деярли (амалда) узгармаслигини тушунтириб беринг.
1. Рух, кадмий ва симобяинг дайси маълум хоссалари уларни d-'элементлар Хаторига, дайсилари эса S- элементлар даторига киритишга имкон беришини анализ дилинг: элемент атомлари (n^-l)d10nS2 электрон конфигурацияга эга: элемент атомлари ташди электрон добидлар дисобига кимёвий бог досил дилади; элемент-ларга доимий валентлик характерли (фадат симоб узгарувчан оксидланиш даражасини намоён дилади), гуруд чегарасида ион бог досил дилишга мойиллик пасаяди, ионланиш потенциали кадмийдан симобга дараб ортади; элементларга комплекс досил дилиш харак-терлидир; кимёвий активлик рухдан симобга томон пасаяди; рух гидроксид (оз меъёрда кадмий) амфотердир; гидридлари бедарор; рух ва кадмий кимёвий хоссаларига кура узаро ядиндир; металлар Нисбатан юмшох ва осон эрувчандир.
12. Симобнинг барча бирикмалари, шу жумладан, оддийлари Хам жуда задарлидир. Симоб буги одам организмига кириб, уни задарлайди. Маълумки, металл х°лдаги симоб термометрларда кенг ишлатилади, улардан кундалик даётда ва биркимё лаборатория-ларида кенг фойдаланилади. Бехосдан термометр синдириб дУйил-са, симоби тукилиб кетади (металл долидаги сук>х симоб), уни албатта тУла йухотиш керак. Цайси реактив билан буни амалга ошириш мумкинлигинй тушунтиринг. Борадиган ’ кимёвий реакция тенгламасини ёзинг. Олинган бирикма хоссалари дандай (реакция тенгламалари билан тасдихланг).
13. Симоб дихлорид .тиббиёт амалиётида антисептик восита сифатида дулланилади. Бу препарат сифат анализида калий йодид билан дизил-заргалдод чукма досил дилади, чукма реактив (KJ) нинг мул мицдорида эрийди. Препарат таркибига Hg2^* ёки Hg^ кири-ши хахвда' хулоса ч и даринг. Борадиган реакция тенгламасини ёзинг.
14. Конъюктивитларда ZnSO4-7H2O антисептик ва буриштирувчи восита сифатида ишлатилади. 100.0 мл 0,5% (масс.) ли эритма тайёрлаш учун сарф булган ZnSO4-7H2O массасини анидланг. Бу препаратда рухнинг масса улуши (%) хандай? Агар сувсиз туз солинса, тортма (Улчов хисм) бир хил буладими?
Жавоб: т (ZnSO4 • 7Н2О) = 0,5 г w% (Zn) = 0,1%
15. Доривор препарат’ 5% (масс.) ли ZnSO4-7H2O эритмаси р= 1,00-г/мл таркибидаги рух сульфат михдорини титрлашнинг комплёксонометрия усулида анихланади. 5,0 мл препаратга сарф булган комплексон (III) С (комплексон III)—0,05М эритмаси даж-мини дисобланг. Эритмада рух сульфат эквивалентининг моляр концентрацияси хандай?
Жавоб: с (l/2ZnSO4.7H2O) = 0,03475 м о ль!л V (ко!ип Ш)=3,48лм.
'16. Карбоангидраза — дизил дон таначаларида булиб, СО2 гидратация ва дегидратация жараёнларини катализлайдиган фермент таркибига кофактор сифатида комплекс бирикма долила Zn+2 киради. Симоб организмга куп миддорда тушса, бу фермент активлигини йудотади. Сиз рух ва симоб комплексларининг барда-рорлцги хадида нима дея оласиз?
17. Болалар сепма дориси — 1 дисм рух оксид, 2 дисм крахмал, 8 дисм талькдан ташкил топган. Шу препаратдан 10,0 г тайёрлаш учун компонентлардан неча грамм олиш керак? Сепма дори таркибида компонентлар масса улуши (%) дандай?
|f' ж\об: w%(ZnO)=9,17%
Ц;- A w% (крах) = 18,2%
А ш % (тальк) = 72,0%
18. Тиббий амалиётда симобнинг хлоридлари ишлатилади:
’ HgCla — сулема
• . HgaClj—каломель
' !\ар бир препаратни сифат йули билан < (сифат реакциялари ’ ёрдамида) дадидийлигини анидлаш мумкинми?
Жавоб: Реакция тангламалари билан исботланг.
19. Тетройодомёркурат (II) калий K2IHgI4]+KOH нинг ишдор^й эритмаси тиббий препаратлар анализида сувда, доривор препаратлардан NH^" ионини анидлашда ишлатилади. Несслер реактиви номли» зралаш-ма — (К2 [HglJ-|-КОН) NH^ ионлари билан дизил-дУнгар л^кма до-^сил дилади:
Г /н^\ 1
о NH2 J . \HgZ J
Шу реакция тенгламасини юрак фаблияти бузилйши билан боглйд б^лгак кишиларда (сув йигилиши) диуретик таъсирга эга булган NH«C1 билан ёзиб беринг.
20. VIII гуруд d-элементларини икки хил усулда ажратиш дабул дилинган:
1.1. Темир ва платина оиласидаги металлар;
1.2. Fe — Ru — Os; СО—RhJr; Ni —Pd —Pt триадалари.
Куйидаги омилларнинг дайсилари у ёки бу ажратишда асос дилиб , олинган: атомларнинг ташди ички электрон добидларидаги Ухшаш-лик; ионланиш потенциалининг ядинлиги; атомларнинг оксидланиш i даражаси ва характерли (узига хос) валентликларидаги ядин дий-матлари; атомларнинг максимал оксидланиш даража ва валентлик-ларининг бир хил дийматлари; элементлар ва. уларнинг бирикмалари орасидаги кимёвцй хоссаларнинг ухщашлиги.
21. Fe3O4(K) +4СО(Г)= 3Fe(K)+ 4СО2(г) реакциясининг иссидлик самарасини (ДН) дисобланг. Кароратнинг ошиши бу мувозанатга дандай таъсир кУрсатади?
22. Маълумки, гемоглобин одам организмида Fe2+ дйсобига Упкадан тУдималарга кислород ташувчи булиб дисобланади Fe2+ гемоглобинда .гемпорфирин билан комплекс бирикма долида сад-ланади. Углероднинг тула ёш/аслигида углерод монооксид- СО досил булади, у одам учун задарли. Нима- учун СО мавжуд бул-ганда гемоглобиндаги Fe2+ О2 ни таший олмайди, бу эса одамни ' далокатга олиб келади.
23. Коамид — кобальт хлориднинг никотин кислота амиди билан координацион бирикмасидир, у дон досил булишини меъёрида тутиб туриш учун ишлатилади. Бу бирикмани А. Вернернинг координацион назариясига кУра характерлаб беринг:
24. Темир гемоглобин, миоглобин, купчилик ферментлар тар-кибига кириб, дон досил дилувчи аъзолар фаолиятини яхшилайди. Унинг етишмаслиги гипохром (темир тандислиги)—анемияни келтириб чидаради. Препарат сйфатида дайтарилган* темир ишлатилади. Унинг уэлаштирйлиши меъда ширасида эригандан сунг меъдади рУй беради. Кимёвий реакция тенгламасини ёзинг. Кай-
тарилган темир одатда бир дабулга 1,0 г дан тайинланади. Уни тула эритиш учун меъда ширасидаги хлорид кислотадан неча грамм керак булади? - ’
Жавоб: т (НС1) = 1,38 г.
25. Тиббий амалиётда «Сироп алоэ с железом» (темир сад-ловчи алоэ сиропи) деб номланадиган доривор препарат ишла-латиладй. Унинг 100,0 мл да 100,0 мл 20% (масс) ли темир хлорид РеС1з-6Н2О сифатида дУшилади. Шундай эритмани тайёрлаш учун темир гексагидрохлориддан данча олиш керак? Препаратдан 1 десерт дошид (10,0 мл) ичирилганда бемор неча грамм темир дабул дилади?
Жавоб: т (FeCl3 -6Н2О) = 20,0 г. т (Fe) = 0,04 г.
26. Тиббий амалиётда кристаллогидратлар булган. куйидаги препа-ратлар ишлатилади:
FeSO4.7H8O
CuSO4-5H2O MgSO4-7H2O
Уларни ишлатилиши, албатта, турлича, К,андай дилиб, дайси идиш-да темир купороси эритмаси борлигини аниклаш мумкин?
27. 0,4 г огирликдаги тиббий препарат — «Бло таблеткаси» тарки-бвда 0,28 г темир (II) сульфат FeSO4.7H2O садлайди. Битта таблетка-даги темир на сувсиз туз масса-улушларини (%) диеобланг.
т (FeSO4) = 0,15 г.; w% (FeSO4) = 37,5%
Жавоб: т (Fe) = 0,054 г; w % (Fe) = 13,5%
'28. Даврий системанинг VI груд элементлари хром, молибден ва вольфрамларнинг физик-кимёвий хоссалари узгаришини асослаб беринг. (Бу элементларнинг VII гуруд элементлари билан дандай ^хшашликлари бор?
29. Куйида келтирилган формулаларни координацион бирикма сифатида ёзинг ва уларнинг бедарорлик константаларини ифода-ланг.
CrCl3-5NH3; CiCl3-4NH3.HaO; Сг(НСаО4)3
30. Хром (III) тузларига аммоний сульфид таъсир эттирил-ганда хром гидроксид досил булади. Бу додисани тушунтиринг. Реакция тенгламасини ёзинг.
31. Калий дихромат—К^Сг2О7 жуда кучли оксидловчи. Унинг концентрланган H2SO4 билан аралашмаси «хромли аралашма» деб ном-ланади ва биокимёвий лабораторияларда кимёвий цдишларни ювишда
IP"
кенг ишлатилади. Уни тайёрлаш рецепта: 1 дисм К2Сг2О7, 1,5 десм HjO ва тенг дажмда концентрланган H2SO4(p = 1-.31 el мл} олинади. KjCr2O7 нинг масса улуши ва 200,0 г аралашма тайёрлаш учун унинг зарур булган маСсасини дисобланг.
Жавоб: си% (К2Сг2О7) = 20%; т (К2Сг2О7) = 40 г
32. 'Тиббий амалиётда КМпО4 нинг оксидловчилик хоссасидан фой-. даланилади. Бу антисептик воситадан яраларни ювишда, томод чайишда, задарланганда меъдани юэишда фойдаланилади. Тиббий амалиётда дул-ланйладиган КМпО4 нинг Зл 0,01 моль!л ли эритмасида неча грамм КМпО4 бор? Марганецнин! шу эритмадаги масса улуши (%) дандай? КМпО4 стандартизацияси Н2С2О4-2Н2О эритмаси буйича бажарилади. Бу жараёнда оксидлоачи s i цайтарувчининг эквивалентлар > моляр массаси дандай? ' .
Жавоб: m(KMnO4 — 4,74 г. ш%(Мп) = 0,158 % ф
Л4 (Vs КМпО4) = 31,6 г/лолэ М (1/2 Н2С2О4-2НаО) = 63 г/лшэ
~ 33. Тиббий- амалиётда невроз, ва неврастения касаллигида бром препаратлари, NaBr, КВг Эндемик будод, гипертиреоз, брон-хиал астма касаллигида йод пренартлари—Nal, KI кенг ишлатилади. Йод ва бром ионлари сифат жидатдан кислотали мудитда КМпО4 эритмаси таъсирида эркин долда h (Вг2) ажралиб, органик эритувчи датламида узига хос ранг пайдо булиши буйича анидланади. H2SO4 иштирокидаги KI билан КМпО4 орасида брра-диган кимёвий реакция тенгламасини ёзинг. 1,0 г KI (препарат-нинг бир марталик дозаси) га 2,0 г КМпО4 д^шилганда данча эркин йод ажралиб чидади?
Жавоб: т (12) = 0,70 г.
Реакция тенгламаларини тугалланг: ’
1);Ci€1s + H2O2+KOH->-
2) Na2CrO4 + NaBr + НС1-»
3) KaCrA + HI-*
_ 4) MnSO4 + РЬО2 4- HNOs->-
5) MnO2+H2SO4->
6) K2MnO4 + CI2->
7) KMnO4 4- MnCl2 + H2O->-
Ион электрон усулида коэффициентлар танланг.
34. Темир купороси — FeSO4-7H2O—гипохром (темир тандислиги) анемияни даволашда ишлатилади. Катталар учун препаратнинг бир марталик дозаси 0,5 г. Бу препарат эритмасидаги темир миддорини текширилаётган эритмани кислотали мудитда К2Сг2О7 эритмаси билан тугри-дан-тугри титрлаш усули билан анидлаш мумкин. Борадиган реакция тенгламаларини ёзинг, К7Рг2О7 моляр эквивалет массасини анидланг 0,5 г Ре5О4'7Н2О ни титрлаш учун 0,1 моль/л К2СгО7 эритмасидан неча мл кетади.
Жавоб: М(1/вК2Сг2О, = 49,0 el моль-, У (К2Сг2О7) = 18,00 млг
1-лаборатория иши
1 ГУРУХ б- ЭЛЕМЕНТ КАТИОНЛАРИНИНГ ХУСУСИЙ СИФАТ РЕАКЦИЯЛАРИНИ УРГАНИШ »
Си2- — мис иони реакциялари •
Натрий ва калий гидроксид реакти’лари—NaOH, КОН
Уювчи ишцорлар мис тузлари эритмасига таъсир этти-рилганда ^аво ранг чукма— Си (ОН)2 ни чуктиради.
СиС12 4-2NaOH = Си (ОН)21+2NaCl
Си2+ + 2ОН~ = Си (ОН)2 f
Чдкма хоссаларини текшириш
1. Чукма узо^ вак;т циздирилганда ^ора рангли мис’ок-
сиди ^осил цилиб парчаланади: Си (ОН)2->- СиО 4- Н2О
2. Чукма минерал кислоталарда эрийди:
Си (ОН)2 + 2НС1 = СиС12 + Н2О
Си (ОН,) + 2Н+= Си2+4-2НаО ‘
Чукма NH4OH эритмаси таъсирида эрийди. Си(ОН)34-4-4NH4OH-► [Cu(NH3)4 (НА)] (ОН)24-2Н2О
Cu(OH)2 4-2NaOH = Na2[Cu(OH)j]
Cu(OH2) + 2ОН-= [Си (ОН),]2”
Аммоний гидроксид реактиви — NH4OH
Мис тузи эритмасига э^тиётлик билан аммоний [гидроксид цушилганда яшил тусли асосли туз чукмага тушади.
2CuSO4 4- 2NH4OH = (CuOH)2SO41 4- (NH^^
2Cu2+ 4- 2NH4OH 4- SO?2 = (CuOH)2SO41 4-2NH4+
Cu(OH)2SO4 чукмаси хоссаларини текшириш
Чукма реактивнинг мул мицдорида кук рангли комплекс туз, ^осил цилиб эрийди:
(CuOH)2SO4 4- 8NH4OH = ]Cu(NH3)4]SO4 4-[Cu(NH3)4](OH)24-8H2O
(CuOH)2SO4 4-8NH4OH= 2 [Cu(NH3)4]2+ 4-SOl“ 4-
4-2OH“ 4- 8H2O
(CuOH)2SO4 чукмасининг бойца хоссалари Cu(OH)2 хос-сасига ухшаш.
Кумуш иони реакциялари — Ag+1
Хлорид кислота реактиви — НСЛ
Суюлтирилган хлорид кислота ва эрувчан хлоридлар кумуш тузлари эритмасидан, кумуш хлорид — AgCl — ивицси-мон чукмасини ^осил дилади.
' AgNOa 4- НС1 = AgCi| 4- HNO3 Ag+ + Cl“ = AgCl[
AgCl чдкмаси хоссаларини текшириш
1. Чукма кислоталарда эримайди.
2. Чукма NH4OH реактивининг мул миедорида комплекс туз^осил килиб эрийди:
• AgCl'+ 2NH4OH = [AgfNHJJ Cl + 2 HaO
AgCl + 2NH4OH -= [Ag(NH3)J+ + СГ + 2H2O
*
2- лаборатория иши
II ГУРУХ, d-ЭЛЕМЕНТ КАТИОНЛАРИНИНГ ХУСКиЙ СИФАТ
реакцйяларини Урганиш
Рух иони реакциялари — Zn+S
Натрий ва калий гидроксид реактиви — NaOH, КОН
Уювчи ишцорлар э^тиёткорлик билан кушилганда рух тузлари эритмаларидан оц иви^симон рух гидроксид Zn(OH)a ни чуктиради:
ZnCl2 + 2NaOH = Zn(OH)2; + 2NaCI
Zn2+- + 2OH- = Zn(OH)2J~
Zn(OH)2 чукмуси хоссаларини текшир ш
Zn(OH)2 — амфотер хоссага эга:
1. Чукма минерал кислоталарда эрийди:
Zn (ОН)2 + 2НС1 = ZhCl3 + 2НаО
Zn (ОН)2 + 2Н+ =Zn2+ + 2НаО
2. Чукма мул мицдордаги уювчи иш^ор эритмаларида эрийди:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Zn(OH)2 + 2OH“ = [Zn(OH4]~2
Натрий гидрокарбонат реактиви —NaHCO3
Натрий гидрокарбонат — NaHCO3 ва карбонатлар рух тузлари эритмасидан о^ чукма — рух гидроксидни Zn(OH)2 чуктиради.
ZnCl2 + 2NaHCOs = Zn(OH)2| + 2COaf + 2NaCl
Na2++ 2НСОГ = Zn(OH)2| + 2CO2f
Сувли^эритмаларда NaHCO3 гидролизг% учрайди: NaHCO3 + H2O NaOH + H2CO8
НСОГ + Hao OH" + HaCO8
203
Шундай дилиб, бу туз эритмасида ОН , СОз~ ва НСОГ ионлари бор. Zn(OH)2, ZnCO3 га рисбатан кам эрувчан бул-гани учун айнан шу бирикма чукмага. тушади.
Натрий сульфид реактиви — Na2S
Натрий- сульфид кучли ишдорий мудитда рух ионлари билан од чукма — ZnS рух сульфидин досил дилади. Рух тузининг 2 — 3 томчи эритмасига эдтиёткорлик билан 2 — 3 томчи NaOH эритмаси душинг. Хрсил булган Zn(OH)2 чук-масини NaOH нинг мул миддорида эритинг ва 2—3 томчи Na2S эритмасидан душинг. ZnS — од чукма досил булади:
ZnCl2 4- 2NaOH = Zn(OH)2| + 2NaCl
Zn2+ + 2OH“ = Zn(OH)2[
Zn(OH)2 + 2NaOH == Na2[Zn(OH)4]
Zn(OH)2 4* 2OH“ = [Zn(OH)4]2~
Na2[Zn(OH)4} + Na2S = ZnS| + 4NaOH
[Zn(OH)4p- + S2" = ZnSj 4- 4OH-
Симоб ионлари реакцияси — Hg2+
Натрий ва калий гидроксид реактиви — NaOH, КОН
Уювчи ишдорлар симоб (II) тузларига таъсир этганда эритмадан симоб оксидининг сарид чукмасини ажратади:
Hg(NO3)2 4- 2NaOH = HgO|. 4- 2NaNO3 4- Н2О
Hg2+ 4- 2OH" = HgO) 4- H2O
HgO чукмасининг хоссаларини текшириш
1. Чукма минерал кислоталарда эрийди:
HgO 4-2HNO3 = Hg(NO3)2 4-2Н2О
HgO 4- 2Н+ = Hg2+;4- H2O
2. Чукма уювчи ишдорларнинг мул эритмаларида эримайди.
Калий йоодд реактиви —KI
Калий йодид симоб (II)-катионларини дизил-зарралдод чукма — Hgl2 сифатида чуктиради.
Hg(NO3)a 4- 2KI = Hgl2|;+ 2KNO3
' . Hg2+4-2I- = HgI2|
' чукмаси хоссаларини текшириш
Чукма реактивнинг мул миддорида комплекс бирикма досил дилйб эрийди:
Hgl2 4-2KI = Ka[HgIJ
•. • HgIa + 2I-=[HgI<r-
Симоб ионлари реакцияси — Hg2+ Хлорид кислота . реактиви — НС1
Хлорид кислота Hg2+ ионлари билан ок; чукма — Hg2Cla ^осил\илади:
Hga(NO8)2 + 2HCl = HgICIa| + 2HN©s
Hg2+ + 2Cr = Hg2Cla| чдкмаси хоссаларини текщириш 1. Чукма суюлтирилган кислоталарда эримайди.
1 2. Чукма NH4OH нинг мул мицдорида эримайди ва к;о-
ра металл ^олдаги симоб чициши натижасида ^ораяди.
' -Hg2Cl2 + 2NH4OH = (NH2Hg2|Cl| + NH4C1 + 2HaO [NHaHga]Cl = [NHaHg]Cl + Hg|
- Металл \олидаги мис реактиви — Си
Тозаланган мис пластинка (мис танга) га 1 — 2 томчи __Hga(NO3)a томизилади. Бир оздан сунг ажралиб чиадан металл ^олдаги симобдан ялтироц дор ^осил булади:
Hga(NO3)a + Cu=Cu(NO3)a + 2Hg|
Hg2+ + Си = Cu2+ + 2Hg|
3- лаборатория иши.
' ТЕМИР ОИЛАСИДАГИ d- ЭЛЕМЕНТЛАРНИНГ ХУСУСИЙ F ’ РЕАКЦИЯЛАРИНИ ТЕКШИРИШ
к Темир иони реакциялари — Fe2+
Натрий ва калий гидроксид реактиви— NaOH, КОН
Уювчи ишцорлар Fe2+ тузлари, эритмаларига таъсйр эт-тйрйлганда ок чукма ^осил дилади. У хавода уз рангини Кизил--1(ун рирдан то к°Ра цунгиргача узгартирадн.
-FeSO4 + 2NaOH = Fe(OH)a 4 + Na2SO4 Fe2++ 2OH~ = Fe(OHaj|
, Fe(OH)a чукмасининг хоссаларини текшириш
1. 4jh<Ma ^авода осон оксидланиб цунрир рангли Fe(OH)s
|jra Утади. - ,
t4Fe(OH)a + Оа + 2НаО = 4Fe(OH),
if,2. Чукма минерал ва сирка кислотада эрийди:
Fe(OH)a + 2НС1 = FeCla + 2НаО
Fe(OH)a + 2H+ = Fes+ + 2HaO
3. Чукма уювчд ишцорларнинг мул эритмасида эримайди.
Калий гексацианаферрат (III)
Калий гексациайоферрат (III)- К3 [Fe(CN)e] Fe2+ ионлари билан нейтрал ёки кучсиз кислотали мудитда туц кук чукма—«турнбул куки» цосил дилади. Реактиви — KFe[Fe(CN)e]
FeCIa + K,[Fe(CN)e] = KFe[Fe(CN)j | + 2KC1
Fe2+- + K+ + [Fe(CN)6]3~ = KFe [Fe(CN)e]|
KFe[Fe(CN)6] чукмаси хоссаларини текшириш
I. Чукма кислоталарда эримайди:
2. Чукма уювчи ишцорлар таъсирида парчаланади:*
KFe [Fe(CN)e] + 2КОН = Fe(OH)a| + K3[Fe(CN)e]
KFe[Fe(CN)6] + 2OH-= Fe(OH)a| + [F^(CN)e]s“
. Темир ионлари реакцияси — Fe3+
Натрий ва калий гидроксид реактивлари NaOH, КОН
Уювчи ишцорлар Fe3+ тузларига таъсир этганда цизил-цунгир рангли темир гидроксид Fe(OH)3 чукмасини беради:
FeCl3 + 3NaOH = Fe(OH)3| 4- 3NaCl
Fe3+ + ЗОН" = Fe(OH)3|
Fe(OH)3 чукмаси хоссаларини текшириш
1. Чукма минерал кислоталарда эрийди:
Fe(OH)s 4-ЗНС1 = FeCl3 4-ЗНао
Fe(OH)3 4- ЗН+ = Fe3+ 4- ЗНаО
2. Чукма концентрланган уювчи ишцорларнинг ортицча мицдорида цисман эрийди.
Fe(OH)3 4- 3NaOH = Na3[Fe(OH)6]
КОНЦ.
Калий гексацианоферрат (II) реактиви — KJFe(CN)e]
Калий гексацианоферрат (II)- KJFe(CN)e] Fe3+ ионлари билан туц кук рангли чукма — «берлин лазури» KFefFefCNj)] ни цосил цилади.
FeCl3 4- 3KJFe(CN)J = KFe[Fe(CN)e]| 4- ЗКС1
Fe3+ 4- K+ + [Fe(CN)e]4“ = KFe[Fe(CN)e]|
Реакцияни темир тузи гидролизини камайтириш учун кучсиз кислотали муцитда олиб бориш керак:
Fe3+ + HaOZ=±[Fe(OH)[2+ 4- H+ 4-hci
Чукма хоссаларини текшириш
1. Чукма кислоталарда эримайди.
2. Чукма уювчи ишцорларда парчаланади;
KFe[Fe(CN)6] + ЗКОН = Fe(OH)s| + K4[Fe(CN)e] KFe[Fe(CN)e] 4- ЗОН" = Fe(OH)3| + [Fe(CN)e]4- 4- K+ Аммоний ёки калий тиоцианат реактивлари — NH. SCN, KSCN
J Калий ёки аммоний тиоцианат — NH4SCN, KSCN—мул микдорда олинганда Fe®+ билан эритмани цип-кизил рангга буяйдиган '
(Fe(SCN)6]3~ комплекс косил дилади:
FeCl3 + 6KSCNO K3[Fe(SCN)e] 4- ЗКС1
Fe+3 + 6SCN" [Fe(SCN)e]3-' [Fe(SCNe)]“3 хоссаларини текшириш
' Шовул, вино, фосфат кислоталар камДа фторидлар темир билан барцарорроц комплекс косил цилиши окибатвда эритма рангини учиради:
[Fe(SCN)e]3“ + 6F~ = ]FeFe]3“ 4- 6SCN’
Кобальт — Со2+ ионлари реакцияси
Натрий ва калий гидроксидлари— NaOH, КОН
^ювчи^ишцорлар эктиёткорлик билан цушилганда Со2+ тузларИ|Эритмасидан Со(ОН)С1 нинг кук рангли асосли ту-зини чуктиради:
СоС12 + NaOH = Со(ОН)С1| + NaCl
Со2+ + СИ + ОН“ = Со(ОН)С1|
ИшкорТ[кУшиш давом эттирилганда асосли туз цизил рангли Со(ОН)2 га айланади:
Со(ОН)С1 4- NaOH = Со(ОН)2| 4- NaCl
Со(ОН)С1 4-ОН" = Со(ОН)2|С1-
Со(ОН)2 чукмаси хоссаларини текшириш
1. Чукма кав° кислороди таъсирида цисман оксидланиб кобальт*(Ш) — гидроксид СО(ОН)3 ни к°сил цилиши оци-батида секин-аста цунрир тусга кира бошлайди:
4Со(ОН)2 4- О2 4- 2Н2О = 4Со(ОН),;
" 207
1
2. Чукма кислоталарда эрийди:
Со(ОН)2 + 2НС1 = СоС12 + 2Н2О
Со(ОН2) + 2Н+ = Сб2+ + 2Н2О
3. Чукма мул мицдордаги NH4OH да эриб, хира-сари^ рангли комплекс-бирикма ^осил дилади:
Со(ОН)а + 6NH4OH = [Co(NH3)e] (ОН)2 4- 6Н2О
Со(ОН)2 4- 6NH4OH = [Co(NH3)ap+ 4- 2ОН” 4- 6Н2О
4. Чукма уювчи ишцорнинг орти^ча мицдорида эримайди.
Аммоний тиоцианат реактиви — NH4SCN
Аммоний тиоцианат — NH4SCN Со2+ ионлари билан комплекс бирикма ^осил дилади. Комплекс органик эритувчилар, масалан, ацетонда яхши эрийди ва интенсив кук ранг ^осил дилади. Шунинг учун уни анидлашда NH4SCN нинг ацетон-даги туйинган эритмаси ишлатилади.
СоС12 + 4NH2SCN = (NHJ, [Co(SCN)4J 4- 2NH4Cl
Co2++ 4SCN-= [Co(SCN)4]3- .
Никель ионлари реакцияси — Ni2+
Натрий ва калий гидроксид реактивлари— NaOH, КОН
Уювчи иш^орлар Ni2+ тузлари эритмасидан оч яшил рангли никель гидроксид Ni(OH)2 ни чуктиради.
Ni(NO3)2 + 2NaOH = Ni(OH2)[ + 2NaNO3
Ni2++ 2OH-= Ni(OH)2|
Ni(OH)2 чукмаси хоссаларини текшириш
1. Чукма завода барцарор.
2. Чукма кислоталарда эрийди.
Ni(OH)2 + 2НС1 == NiCl2 + 2Н2О
Ni(OH)2 4- 2Н+ = Ni2+ = 2Н2О
3. Чукма NH4OH ййнг мул микдорида оч кук рангли комплекс бирикма ^осил цилиб эрийди.
Ni(OH)2 4- 6NH4OH = [NifNH^] (ОН)2 4- 6Н2О
Ni(OH)2 4- 6NH4OH = [Ni(NH3)e]2+ 4- 2OH~ 4- 6H2O
4. Чукма -уювчи иш^орнинг мул микдорида эримайди.
Диметилглиоксим реактиви Н3—С—С—С—СН8
II II
Чугаев реактиви НО—N N—ОН
j; Диметил глиоксим никель ионлари Ni2+ билаи pH 5—10 «ралирида цирмизи-1^изил рангли ички комплекс тузнинг крис-
—- чукмасини досил дилади:
|||£алик Ч)
Н,С ~ С - N -ОН........0 ~ N -С -СН3
I Ni I
>4.
Реакцияни pH- 5 булган ацетат буфер аралашмаси ‘ иш-эокида олиб борилади. У 1 томчи СН3СООН ва 5 томчи ^H3COONa душиш билан досил дилинадч. Реакцияни исроф-~***}рчиликка йул дуймай NH4OH иштирокида дам олиб 1(ориш ;Йумкин.
4-лаборатория иши
VI ВА VII ГУРУХ, а- ЭЛЕМЕНТ КАТИОНЛАРИНИНГ ХУСУСИЙ СИФАТ РЕАКЦИЯЛАРИНИ УРГДНИШ
к
?> Хром иони реакциялари Сг3+
Натрий ва калий гидроксид реактивлари — NaOH, КОН
. Уюачи ишдорлар эдтиёткорлик билан цушилганда хром $П1) тузлари эритмасидан кулранг яшил хром гидроксид 0г(ОН)3 чукмасини ажратади.
СгС13 + 3NaOH = Сг(ОН)3| + 3NaCl
Сг+3 4- ЗОН“ = Сг(ОН)3;
Сг(ОН)3 чукмаси хоссаларини текшириш
Сг(ОН)3 амфотерлик хоссасига эга.
1- Чукма минерал кислоталарда эрийди
Сг(ОН)3 + ЗНС1 = СгС13 + ЗН2О
Cr(OH)3 + ЗН+ = Сг3+ + ЗН2О
2. Чукма уювчи ишкррнинг мул миддорида эрийди.
. — Сг ОН)3 + 3NaOH = NajCr(OH)e]
Cr(OH)3 + ЗОН" = [Cr(OH)6]3~
ICr(OH)]3-— зумрад-яшил ранг ли.
Натрий гидрокарбонат реактиви—NaHCO3
Натрий гвдрокарбонат — NaHCO3 ва карбонатлар хром ари эритмасидан хром гидроксид Сг(ОН)3 чукмасини хо-дилади. .
СгС13 + 3NaHCOs = Cr(OH)J + 3NaCl + 3COaf
7534 209
Cr’+ + ЗНСОГ = Сг(ОН)з| 4- 3CO2f
NaHCO3 нинг сувли эритмасида гвдролизлашади.
NaHCOs + H2O₽t NaOH 4- Н2СО, нсог+Н2О ч* ОН-+ Н2СО3
- Щунинг учун бу тузнинг сувли эритмасида НСОГ, ОН" ва СОз~^йонлариЗбулади. Сг(ОН)8Сг2(СОз)3 га нисбатан кам эрувчан булгани учун айнан шу бирикма чукмага тушади.
Комплексон 111 реактиви — Na2[HsV]
КомплексонрП кучсиз кислотали [мухитда хром катиони билан диздирилганда бинафша рангли комплекс бирикма ^о-сил цилади. Унинг таркиби цуйидагича:
С,-----
’ Нг0
Хром тузи эритмасига зарур му^ит ^осил цилиш учун 2—3 томчи СН3СООН ва CH3COONa, сунгра комплексон III цушиш керак. Эритма циздирилганда 2—3 минутдан сунг узиг а хос бинафша ранг ^осил булади.
Марганец ионлари реакцияси -у Мп* 1 2+
Натрий ва калий гидроксид реактиви — NaOH, КОН
Уювчи ишцорлар марганец тузлари эритмасидан Мп(ОН)2 ок чукма ажратади:
МпС12 + 2NaOH = Мп(ОН)2| 4- 2NaCl ^n2+ + 2ОН- = Mn(OH)2| Mn(OH)2 чукмаси хоссаларини текшириш
1. Чукма завода осон 'оксидланиб, оц рангдан туц-цун-гир рангга утади:
2Мп(ОН)а4- О2 = 2МпО(ОН)а
2. Чукма кислоталарда эрийди:
Мп(ОН)2 4- H2SO4 = MnSO4 4- 2НаО
• Mn(OH)2 + 2H+= Mna++ 2H2O
3. Чукма уювчи ишкорнинг мул мицдорида эримайди.
4. Чукма аммоний тузларида эрийди.
. Мп(ОН)2 + 2NH4C1 = МпС12 + 2NH4OH
Mn(OH)2 +2NH4+= Мп2++ 2NH4OH
Шовул кислота реактиви — Н2С2О4
Шовул кислота — Н2С2О4 МпО(ОН)2 билан пушти.рангли комплекс ион [Мп(С2О4)зР- зосил дилади. Анидлаш усули . куйидагича; марганец тузи эритмасига 2—3 томчи КОН ёки NaOH дупшлади, шиша таё^ча билан ок чукма дуфгир тус-га киргунча аралаштирилади. Бунда цуйидаги реакдая содир булади: 1
2Мп(ОН)2 + О2 = 2МпО(ОН)2 (Н2МпО3)
Сунгра чукма эригунча шовул кислота эритмаси цуйила-ди ва эритма тини^-пушти рангга киради.
2НаМпО3 + 7Н2С2О4 = гЩМпСЭДз] + 2СО2-+ 6Н2О
Р-ЭЛЕМЕНТЛАР ВА ШУ ЭЛЕМЕНТ
бирикмаларининг хоссалари
( Мавзунинг мацсади: 1. Р-элементлар ва. шу элемент г» бирикмаларининг кимёвий хоссалари зазида системали : билимга эга булиш.
.. 2. Биологик системаларда p-элемент бирикмалари
с Зосил будишини аввалдан айтиб беришни урганиш.
Ъ 3. Ill, IV, V, VI туруз p-элемент катионларининг си-фат реакцияларини бажарйщ буйича уцувга эга булиш.
‘j . Урганидаётган мавзунинг а^амияти. III гуруз р-эле-ментларининг заёт учун зарурлиги бир хил эмас. Бор Усимликларнинг нормал усиши ва ривожланиши учун зарур микроэлемент зисобланади. Одам организмида
Ц эса у тит ва суяклар таркибига киради. Хозирги вацтда унинг одац учун физиологик вазифаси Урганилмоцда.
jL Алюминий ер устки цаватида кенг тар^алган булиб, уродам организмида доимо булади. Унинг ижобий физио-gk логик вазифаси зали яхши анизланмаган. У куп миц-К Дорда цабул зилинганда заёт учун хавф солади.
L; III Лфуз р-элементларидан таллий жуда зазарли.. Ж У ₽°ч тУкндишига олиб келади.
Ж у IV гуру^ р-элементларидан углероднинг физиологик ЕОХамиятибенихоя катта. Маълумки углерод барча тирик ^Еавжудотнинг асосидир. Бу элемент заёт учун зарур-В** 211
элементлар — водород, кислород, азот, олтингугурт ва бошцалар билан ковалент 6of ^осил цилишдек бе^иёс хусусиятга эга ^амда у бир, икки, уч богли занжирлар-ни ^осил цилиши мумкин.
Кремний одам организмида учраса-да, унинг физио-логик фаоллиги кам.
Калай ва" айни^са ^ургошин одам учун зазарли. X0' зирги ва^тда цургошиннинг таъсири зур бериб ^рганил-моцда, чунки у мотор ёцилгиси таркибига кириб, атмос-ферани ифлослантиради ва. одам соглигига салбий таъсир курсатади. ^озирги ва^тда унинг таъсирини тиш кариесининг кенг тар^алиши ва унда хавфли усмалар пайдо булиши билан богламо^далар.
V- гуру^ р- элементларидан — азот ва фосфор усим-лик ва ^айвонот дунёсида ^рнини алмаштириб булмай-диган элементлардир. Азот купчилик ферментлар тар-кибида микроэлёментни молекуланинг органик ^нсми билан борлаб туради, о^силдаги NH2 гуру^ таркибида му^им роль уйнайди, му^им биолигандлар — масалан, порфрин ва бошк;алар таркибига киради.
Фосфор — суякнинг ‘структура компонента ^исоб-ланади, ионларни мембрана ортали утказишда ^атна-шади, 1$онда булади, нуклеин кислоталар (ДНК, РНК) коферментлар (НАД, НАДФ, ФАД, ТПФ), макроэргик бирикмалар (АТФ, ГТФ, креатинфосфат) ва купгина бош^а бирикмалар таркибига киради. Унинг етишмас-лиги рахит касаллигини келтириб чидаради. Маргимуш (мишьяк) физиологик фаол элемент булиб, у эритро-цитлар хосил б^лишини тезлаштиради, организмни ба-цувват цилади. Маргимуш бирикмалари ю^умли касал-ларни даволашда бактериоцид модда сифатида ишлатилади. Маргимуш ва висмут одам учун зазарли, шунинг учун тиббий амалиётда уларнинг организмга таъсири х;исобга олинади. Уларнинг кичик дозадаги препаратлари даволашда ишлатилади.
VI гуру^ р-элементларидан кислород ва олтингугурт ^аёт учун жуда му^имдир. Одам кислород билан нафас олади. Одам организмида у богланган ^олда 60% (масс) ни ташкил этади. Олтингугурт аминокислота ва ферментлар — масалан, цистеин, цистин глютатион ва бош^алар таркибига киради.
Селен одам организмида кам микдорда учрайди, лекин купчилик физиологик жараёнлар билан богланган, глутатинонпероксидаза фермента таркибига киради. У ^аёт учун зарур. - -
< t
Аминарсон
V''
Ж Йоварсенол
Ж-^Ииарсенол
Ж , Сурьма бирикмалари
Bi(OH2)NO3
BiONOa, Bi ООН f Висмут бирикмалари
Б. VII гуру^ р-элементлари (Ас дан ташцари) фИзио-догик жи^атдан фаол: фтор тиш ва суяк таркибйга ки-1>ади, хлор — ^аёт учун-зарур макроэлемент, организмда ргерв импульсларини утказишда цатнашади, бром — ур-нини алмаштириб булмайдиган микроэлемент, у нерв ^хистемаси фаолиятига. таъсир курсатади, йод — ^аёт Г учун зарур элемент, ^алконсимон без гормонлари тар-кукибига киради. ' *
г, III ва V гуруц Р- элемент бирикмалари (металдар) нинг тиббий препаратлари 4
Н3ВО9 — антисептик восита сифатида сиртга ишлатилади.
* Na2B4O7- ЮН2О— бура, бу хам шундай.
; А1(ОН)3 — адсорбцияловчи восита, антацид таъсирга эга.
Буров сую^лиги — тери ва шиллик; ^аватлар яллигланишини f Ж ; даволашда ишлатилади.
KAI(SO4)2-12H2O— аччидтош, бу ^ам шундай
g' Na2HAsO4-7H2O — кам^онликда умумий цувват берувчи ва тонусни оширувчи восита.
ж As2O8—некрозга кдрши восита, стоматологияда ишлатилади.
Маргимуш бирикмалари:
амёбиаз, захмни даволаш учун ишлатилади.
—«— бу з^ам шундай
—«— бу з^ам шундай солыосурьмин, лейшманиозни даволашда ишлатилади.
меъда-ичак касалликларини даволашда, малкам дорйлари тери яллигланй-шида ишлатилади, малкам дорилари тери яллигланишида ишлатилади.
малкам дорилари тери яллигланишида ишлатилади
—«— —«— —«—
—«— —«— —«—
захмни даволашда ишлатилади.
—«— —.
___ зарур булган азот са^ловчи препарат-" 'Лар — аминокислоталар; гормонлар, витаминлар ва бошдалар жуда кенг тар^алган. Фосфор препаратлари, ,' унинг биошакли фосфат куринишидаги препаратлари ; жуда му^имдир.
5? - IV гуру^ Р-элемент бирикмаларининг .•у тиббий препаратлари
ЙЙ^РЬ(СН,СОО),-ЗН2О— буруштирувчи, антисептик, яллигла-' нишга карши восита;
Ксероформ
^Дерматол Бисмоверол Бийохинол 11ентабисмол
Каёт учун
% <
PbO—бу хам шундай;
VI, УПЧуруз Р-элементларининг тиббий препаратлари
NaCl—0,86% (масс) лиси изотоник эритма сифатида ' купчилик касалликларда ишлатилади.
. KCI — юрак аритмиясида ишлатилади.
NH4C1 — диуретик таъсирга эга.
NaBr, КВт — тинчлантирувчи таъсирга эга булиб, невроз ва неврастенияда ишлатилади.
Nal, KI — гипертиреоз, эндемик бу^оц ва бронхиал аст-мада ишлатилади.
Хлор индифферент ион сифатида купчилик доривор препаратлар таркибига киради.
Кислоталарнинг тиббиётдаги а^амияти
• Сульфат кислота. Сульфат кислота аниони одам ва ^айвон организмида о^сил ва аминокислоталар тарки-'бига кирувчи икки валентли олтингугуртнинг оксидла-ниши туфайли ^осил булади.
SO42- аниони организмдан сульфат тузлари в а сульфат кислота эфирлари сифатида сийдик билан чицари-лади.
Концентрланган сульфат кислота карбон сувларни куйдиради (кумирлайди). Унинг буглари йуталишга сабабчи булади ва нафас йуллари ^амда jhnca касал-ликларини келтириб чикаради.
Сульфит кислота. Эркин холда учрамайди. Унинг ангидриди—SO2 — рангсиз, бугувчи з^идли газ, шиллиц цаватларни таъсирлайди, ^ансирашга, катта мицдори \ушдан кетишга сабаб булади. SO2 гази билан сурун-кали за^арланиш оцибатида ишта^а й^олади, овцат ^азм цилиш аъзолари фаолияти бузилади ва нафас йул-лари яллигланади.'
SO2 гази микроорганизмлар, могор замбуруглари ва ^ашаротларни ^лдиради. Шунинг учун ундан хоналарни дезинфекция ^илишда фойдаланилади.
Карбонат кислота. Фа^ат сувли эритмалардагина мавжуд. Унинг ангидриди СО2 — одам ва ^айвон организмида оцсил, карбонсувлар ва ёгларнинг Оксидлани-шидан ^осил булади. Карбонат ангидрид ^оида эрийди ва ^пкага утади, нафас чицарилганда организмдан чи-циб кетади.
Карбонат кислота ва унинг тузлари натрий ^амда калий бикарбонатлар организмдаги буфер система таркибига кириб, цон pH ^ийматини доимий, 7,36 га тенг
иб са^лашда ^атнашади. Организмда Н2СО3 нинг нцислиги ^ушдан кетишга сабаб булади.
Фосфат кислота. Унинг анионлари модда алмашину-ядацатнашади. Тузлари одам ва ^айвонларнинг ^амма 1 ьзоларида са^ланади, улар суякда энг куп. Калий ва Латрийларнинг нордон фосфатлари ^он ва тузима суюк-^Мридаги буфер системалар таркибига кириб, т^има-йрда pH доимийлигини таъминлайди.
Фосфат кислота тузларининг сийдикдаги мицдорини
Яницлаш клиник а^амиятга эга. *
Борат кислота кам зазарли, кучсиз антисептик хос-. ’сага эга. Унинг сувли эритмаси (1—4 масс) дезинфек-цияловчи восита сифатида ишлатилади. ।
Хлорид кислота меъда шираси таркибида булади, I- 0,5% (масс) лиси ов^ат ^азм ^илишда цатнашади. Суюлтирилган (8% (маёс) ли) кислотаси меъда шираси кис-г'доталилиги камайганда ичилади.
I _ Бромид кислота. Унинг тузлари — бромидлар тибби-; ётда асаб бузилишининг турли шаклларида тинчланти- рувчи восита сифатида ^улланади.
’’ Йодид кислота. Унинг тузлари—йоди'длар— модда | алмашинувида му^им роль уйнайди. Йодид ионлар одам |’ва ^айвонларнинг турли аъзоларида йод-органик бирик-f ма сифатида сацланади, улар калцонсимон без гормон-J ларида кепрок- йоднинг ичимлик суви ва ов^атда F етишмаслиги турли касалликлар — эндемик бу^о^, мик-седема, кретинизм каби касалликларни келтириб чица-L ради. Натрий ва калий йодидлари тиббиётда доривор i препарат сифатида ишлатилади. Йоднинг 5% ли спирт-г ли эритмаёи антисептик воситадир.
г Сульфид кислота—H2S нинг сувдаги эритмаси. Организмда олтингугурт сазловчи аминокислоталарнинг
. парчаланиши натижасида ^осил булади. Водород суль-фид зазарли, уни узо^ ва^т нафасга олганда ^ид сезиш
[ добилияти йуцолиб, ^ушдан кетиш, цусиш ва улим руй i беради. .Таркибида эриган водород сульфид са^лаган' । табиий манбалар даволаш хусусиятига эга.
Нитрат кислота сиртци восита сифатида сугал ва > дадо^ни куйдиришда ишлатилади. Кислота ишлаб чицарадиган саноат корхоналари ^авосида доимо азот оксиди — хавфли за^ар (К2О дан таш^ари) булади.
Нитрит кислота ва унинг тузлари азот оксидларй ^о-, сил ^илиб парчаланади, унинг. натрийли тузлари .^он айланиш аъзолари фаолияти бузилганда^ишлатилади.
Сирка кислота ва унинг тузлари дерматологияда доривор препаратлар тайёрлашда ва озиц-ов^ат саноа-
L . . 215
Й-. ’
тида (сирка эссенцияси) таъм берувчи восита сифатида ишлатилади.
БОШЛАНРИЧ ДАРАЖА
1. Элементлар ва уларнинг бирикмалари хоссаларини Д. И. Менделеев даврий системасида жойлашган ур-~ ' нига цараб узгариш-донунлари.
2. Атомларнинг электрон тузилиши.
3. Молекулалардаги кимёвий 6of турлари.
4. Кимёвий реакция тенгламаларини молекула ва ион шаклида тузинг.
Мустацил тайёрланиш учун . укув материаллари
1. Н. Глинка. «Умумий химия» Т. 1968, 343, 374, 386, 419, 449, 467-бетлар.
2. Д. Р. Рахимов. «Аиорганик химия» Т. 1974, 203, 233, 269, 301, 338-бетлар.
• 3. С. С. Оленин, Г. Н. Фадеев. «Неорганическая химия»,
М„ 1979, 38, 229, 264, 314, 326, 336, 357-бетлар.
f 4. В. Н. Алексеев. «Ярим микрометод билан килинадиган химиявий сифат анализи курен». Т., 1976, 339, 455, 485, 451, 443, 525, 546- бетлар.
5. И. А. Селезнев. «Аналитическая химия». М., 1979, 90, 100, 108, 116, 121, 136, 144-бетлар.
6. И. К. Цитович. «Курс аналитической химии», М., 1985, 123, 113, 146-бетлар.
7. Х. Да кимов, А. 3, Татарская. Периодическая система и биологическая роль элементов. Т., 1985, 123, 117, 130, 150-бетлар. ' ?
МАЪЛУМОТЛАР БЛОКИ
III гуруд р-элементлари ва шу элемент бирикмаларининг хоссалари
III гуруд р- элементларига бор, алюминий, галлий, индий, таллий киради. Улар атомининг электрон кон-фигурацияси nS2np*. Бирмунча барцарор оксидланиш даражаси +3 дисобланади.
Бор — металл эмас, ундан кейин турган элементлар металд, охирги учта элемент — галлий, индий, таллий * алодида гурудга ажратилади.
Бор — купчилик элемент ва моддалар билан реакцияга киришади. Реакциялар одатда юдори дароратда боради. У дам оксидловчилик, дам дайтарувчилик хусу-сиятига эга:
3Mg4-2B = MgaB3 2В 4- ЗН2О = В2О34-ЗН2
В 4- 3HNOS = HSBO3 4- 3NO2
!>' 4B + O2 + 2B2Os
2B + 3Fea = 2BF3
2B 4- Na = 2BN
2B 4-2NaOH + 2Ha0 = 2NaBO2 + 3H2 КОНЦ.
Бор бевосита водород билан реакцияга киришмайди, лекин гидридларнинг купчилиги олйнган: В2Н6, В4Ню, ВзНп, ВбНю, В10Нц. Уларнинг тузилиши углеводород-ларнинг тузилишига ухшаш эмас/ Купчилиги задарли, баъзи деталларни тайёрлашда кенг ишлатилаДц.
Бор оксиди — В2О3 — кислотали оксид, сув билан реакцияга киришиб кислота ^осил дилади: ’
t B2O3 4- 3H2O = 2H3BO3
J. Унинг тузларидан энг а^амиятлиси тетраборатлар
g 4Н3ВО3 4-2NaOH = Na2B4O7 4-7НаО
L, Сувли эритмаларда улар кучли гидролизланади.
h Na2B4O7 4-7Н2Оч=ь4Н3ВО3 4-2NaOH
г Алюминий — жуда актив металл, завода оксид дат-/ лами билан копланади ва бу унинг фаоллиги пасаййши-s га олиб келади. Оксид ^атлами б^лмаганда купчилик металл ва бирикмалар билан реакцияга киришади.
4А1 + ЗО2 = 2А12О3 2А1 4- 3H2SO4 = Al^SO^ 4- ЗН2
- 2А1 4- ЗС12 = 2А1С1Э А1 4- 6NaOH 4- ЗН2О =
i = 2Na3jAl(OH)e]
Г 8А1 4- 3Fe3O4 = 4ALO3 4* 9Fe
fl;
Алюминий оксиди ва гидроксиди амфотерлик хоссасига
эга:
А1(ОН)3 4- ЗНС1 = А1С13 4- ЗН2О
А1(ОН)3 4- 3NaOH = Na3lAI(OH)6]
А1(ОН)3 4- NaOHK=NaAlO24- 2Н2О
А13+ — координация сони 4 ва б булган жуда яхши комплекс \осил хилувчидир.
[Al(H2O)e]+s [A1(OH)J- [AlBrJ-[А1(Н2О)5ОН)+а [А1(ОН)6]3- [AlFe]3-
Бу элемент хуш тузлар хосил Хилиши мумкин:
I КАЦЗО^игНр, NH4A1(SOJ2- 15н2О
. Купчилик алюминий тузлари эрувчандир. Унинг гид
роксид ва фосфатлари эримайди. Сувли эритмаларда алюминий тузлари гидролизланади:'
А1СЦ + Н2О А1(ОН)С1а + НС1
А1(ОН)С1а + Н2О А1(ОН)2С1 + НС!
А1(ОН)2С1 + НаОч* А1(0Н)3 + НС1
IV гуру^ р-элементлари ва уларнинг бирикмалари
IV гурУЗ Р-элементларига углерод, кремний, германий, цалай, цургошин киради. Улар атомининг электрон тузилиши nS2np2. Улар атомининг энг характерли оксидланиш даражаси +2, +4 ва —4. Углерод ва кремний узига хос булиб, металлмас, германйй, цалай, ц^ргошин эса металл ва ало^ида гуру^чага бирлашган . булиб, амфотер хоссага эга.
Углерод атоми бециёс Электрон тузилишга эга: унда валент электронлар сони валент орбиталлар сонига тенг, бу эса купчилик элементлар билан .ковалент 6of ^осил цилиш имконини беради ва турли сондаги богли чексиз занжирларни ^осил дилади. Углерод — органик дунё асосидир (унинг бу хусусиятини биоорганик кимё фа- -ни кури б чицади).
Углерод ва кремний жуда инертдир, уларнинг кимёвий фаоллиги ^арорат ортиши билак кучаяди. Улар цай-тарувчи булиб, металлар, металлмаслар ва баъзи бирикмалар билан реакцияга киришади;
2С4-Оа = 2СО СаО + С = СаС2 + СО
Са 4- 2 С = СаСа оксидловчи Si 4- 2С1а — SiCl4 C-f-2H2 = CH4 3 Si + 3 Na = Si3N4
С 4-HaO = СО 4-На Si + C = SiC
3C+4HNO3=3CO2+NO+H2O Ca + Si = Ca2Si
Si 4-2 NaOH + H2O = NaaSiOs + 2 H2
Диоксид CO2 — газ. SiOa — цаттиц модда, улар кислотали оксвд
’ СОа 4~ Н2О = Н2СО3 । о м пи м с п । u п СО8 + СаО = СаСО3 S1°2 + 2 Na0H =Na2SiO3 + Н2О Н2СО3 — икки асосли кучсиз бе^арор кислота, унинг тузлари гидролизланади;
НаСО3 =& НаО 4- СО2 Na2CO3 4- Н2О NaHCO3 4- NaOH
H2SiO3 — тоза (эркин) ^олда унинг тузларидан олинади, говори ^ароратга чидамсиз, тузлари кучли гидролизланади,
H2SiO3-> Н20 + SiO2
2 NatSiO3 + HaO Na2Si2O8 + 2 NaOH
S1O2—шиша таркибйга киради. Кремнийнинг орга-1К бирикмалари тиббиётда катта ^изи^иш уйготмо^да.
Германий, цалйй, ^ргощинлар гарчи металл булса 1М уларда металлик хоссаси анча сует ифодалангаи ^лади. '
Калай ва ^ургошин кислота ^амда инщорларда секин >ийди. \ .
Sn + 4 H2SO4 = Sn(SOJ2 + 2 SO2 + 4 H2O *
Pb + 2 KOH 4- 2 H2O = Ka [Pb (OH) J + Ha
Бу металларнинг водород, галоген ва кислородлар 1лан ^осил цилган бирикмалари маълум. Уларнинг ок-1Д ва гидроксидлари амфотерлик хоссасига эга,
РЬ (ОН)2 + 2 HNO3 = Pb (NO3)2 + 2 Н2О
--Pb (ОН)2 + 2 NaOH = Na2 [Pb (OH) J
Бу элементларнинг координация сони 4 га тенг б^л-in комплекс бирикмалари маълум.
[Pb(OH)?~ [Pb(NH3)J+2 fonCI,2^
[Sn(OH)J2- [Sn(H2O)J2+ l el
<сидловчи- цайтарувчилик хоссалари цуйидаги тартибда руй ради
оксидловчилик хусусияти ортади
Г Ge (IV) Sn (IV) Pb (IV)
s Ge (II) Sn (II) Pb (II)
f цайтарувчилик хоссаси камайяди
Яхши эрийдиганлари цургошин нитрат ва ацетатдир, купчилик тузлар, гидроксид, хлорид, сульфидлар сувда эримайди. •
( V гуру^ р-элементлари ва шу элемент бирикмаларининг хоссалари
V гуру^ р- элементларига азот, фосфор, маргмуш, сурьма, висмут киради. Улардаги атом, электрон конфигурациям nS2np3. Улардан азот ва фосфор типик ме-j таллмаслар, долган элементларни алодида гуру^га бирлаштирилади. улар эса амфотер. Элементларнинг i бар^арор оксиданиш даражаси 1—3, +3 ва +5, азот яна бошца оксидланиш даражали бирикмалар ^осил I ^илиши мумкин.
____________, — цаттик модда, тяпик металл-маслар, говори дароратда к^пчилик металлар, водород ва кислород билан бирикади.
6 Li + Na == 2 Li3N Na4-O2^2NO
3 Mg + 2 P = Mg3Pa N2 + 3H2^=2NHs
2P + 3H2^2PH3
Аммиак — NH3 — ^зига хос дидга эга газ, H+ ни бириктириб олиб, аммоний NH4+—катионига айланади.
Аммиакнинг сувдаги эритмаси — NH4OH. Аммиак металлар, металл оксидлари, кислоталар билан реакцияга киришади ва дайтарувчи дисобланади:
2 NH, 4- 2 Na = 2 NH2Na 4- Н2 оксидловчи
2 NH3 + 3 CuO == 3 Си + Na + 3 Н2О
NH3 + НС1 = NH4C1
4 NH3 + 3O2 = 2Na + 6H2O
4NH3 + 5Oa = 4NO 4- 6H2O
2 NH3 4- AgCl = [Ag (NH3)a] Cl
Аммоний тузлари сувда яхши эрийди, гидролизланади, реакцияга киришиш хусусияти бор, осон парчала-нади:
NH4Cl=PtNH34-HCr NH4C1 4- НаО NH4OH 4- НС1
Азот кислород билан бир неча бирикмалар досил дилади. Азотнинг бешта оксиди маълум: N2O, NO, NaO3, NO2, NaOs, NaO3 — нитрит кислота ангидрвди, иккаласи дам оксидлов-чилик, дам цайтарувчилик хоссасига эга: £
2HNO2 + 2Ш = J2 4-2NO +2НаО HNO2 4- КСЮ = HNO3 4- КС1 ,
Нитрит кислота бецарор: 2 HNO2 = NO 4- NOa 4- НаО NjjO6 — кислотали оксид дамда кучли оксидловчи:
2 NO2 4-2 NaOH = NaNO3 4-NaNO2 4-Н2О
N2Og — кислотали оксид, сув билан нитрат кислота — HNO3 досил дилади. Нитрат кислота — кучли кислота, оксидловчи, т^лид диссоциланади:
- HNO3^H+4- NO~
HNO3 концентрацияси ва дайтарувчининг табиатига кура у турли мадсулот досил цилиши мумкин:
NH3, N2, N2O, NOa, NO'
HNO3 — металл ва металлмасларни оксидлайди:
HH' Cu4-HNOs = Cu(NO8)a+2NOa + H,O
Е;' , S+ 6HNO3 = HaSQ3 +6NOa + 2HaO
Л 4 Mg 4- 10HNO3 = 4MgtNO3)a + NaO + 5HaO
Г ' 3 P + 5 HNO3 4- 2 Ha0 = 3 H3PO4 4-5 NO
Ей... • суюлт,
Е Нитратлар •—нитрат кислота тузлари, нитритлар — Вяйтрит кислота тузларидир. Ку’пчилик нитритлар сувда гэрийди ва кучли гидролизланади. Нитратлар ^ам сувда Орувчан булаб, оксидловчи ^исобланади.
Г NaN0a + Ha0^=Na0H4-HN0a \
f 2РЬ(ЫО3)а==2РЮ + 4ЫОа + Оа .
I' Фосфорнинг Р2О3 ва Р2О5 оксидлари — кислотали г Оксидлардир, уларга фосфит ва фосфат кислоталар мое -келади. ' -
г Р2О5 — 3 турдагн кислоталарни хосил дилади:
~ РаО8 4- НаО = 2 НРО3 (метафосфат)
Р2О5 4- 2 Н2О = Н4РаО7 (пирофосфат) Р2ОБ 4* 3 Н2О = 2 Н3РО4 (ортофосфат)
А^амиятлйси Н3РО4 булиб, уртача Кучли, уч негизли кислота, купчилик тузларни, хусусан урта ва нордон тузларни хосил дилади.
Маргимуш, сурьма ва висмут — металл, водород, кислород, олтингугурт билан реакцияга киришади, кислота билан хам реакцияга киришади, аммо водородни сициб чицармайди:
As2O3 4-6 Zn 4-12 НС1 = 6 ZnCla 4-2 AsH3 4-3 Н2О
4 As 4“ 3 O2 = AsaO3 2 Bi 4- 3 S — Bi2S3
2 Sb 4- 5 Cl2 = 2 SbCl6 Bi 4- 4 HNO3 = Bi (NO^ +
4-NO4-2HaO
ЭаО3 ва ЭаО5 оксидлари турли хоссага эга:]
AseOj Sb2O3 Bi2O3
кислотали асослиги куп асосли амфотер
As(OH)3 (HgAsOj) ' Sb(OH)3 Bi(OH)3
кислоталилиги куп асослиги куп асосли
амфотер ‘ амфотер
Sb+3 ва Bi+S тузлари осон гидролизланади:
SbCl3 4- 2 НаО Sb (ОН)аС1 4- 2 НО
As3O6, Sb2O8, Bi2O8—оксидлари кислотали хоссаси купроц оксидлардир.
As5* —Sb5+ — Bis+ — цаторида оксидловчилик хоссаси ортади, агар маргимуш ва сурьманинг оксидловчилик хусусияти фа^ат,кислотали, мудитда намоён булса, висмутники эса ^ам кислотада, ^ам ишцорий мудитда намоён булади.
H3AsO4 + 2 НJ = H3AsO3 4* J2 4- Н2О H3SbO4 4- 5НВг 1 = SbBr3 4-Вг 2 4- 4 Н2О
VI гуру^ р-элементлари ва шу элемент бирикмаларининг хоссалари
VI гуру^ р- элементларига кислород, олтингугурт, селен, теллур, полоний киради. Улардаги. атом электрон конфигурацияси nS2np4. Кислороднинг оксидланиш даражаси—2, олтингугурт, селен ва теллурлар—2, +4 ва 4-6 оксидланиш даражани намоён дилади.
Кислород ва олтингугурт — типик металлмаслар. Селен, теллур полоний ало^ида гуру^чага цжратилган. Полоний — металл.
Кислород—актив металлмас, аргон, неон; гелийдан ташцари ^амма элементлар билан бирикмалар ?^осил дилади, олтингугуртнинг фаоллиги камрок булиб, металл эмас, шунингдек купчилик бирикмалар ва элементлар билан реакцияга киришади.
Н24-О2 = 2Н,О
4Р4-5Оа = 2Р2О8
4 AI4- 3 О2 = 2 А12О3
4 NH3 4-3 О2 = 2 N2 4-6 Н2О
2 ZnS 4- 3 О2 = 2 ZnO 4- 2 SO.
2 SO2 4- О2 = 2 SO3
3S4- 8KOH = K2SO44-
4-3K2S4-4H2O
S4-H2 = H2S
S 4- O2 = SO2
S -f- Cl2 = SC12
S 4- Cu = CuS
S4-6HNO3 = H2SO4 + 4-6NO24-2H2O
Кислород — кучли. оксидловчи, унинг аллотропик шакл узгариши — О3 — озондир, у атомар кислород ^исобига янада кучли оксидловчилик хоссасини намоён цилади: х
О3---* О2 4- О
Кислород жуда куп кислотали, амфотер, асосли оксид-лар, гидроксидлар ва кислородли кислоталар ^осил ци-лади:
Na2O NaOH А12О3 А1(ОН)3 so3 H2SO4
асос хоссали амфотер хоссали кислота хоссали
222
Ге Олтингугуртнинг водородли бирикмаларидан энг му*
?дими водород сульфиддир. Бу — дайтарувчи, у узига хос Хидли газ, сувда эриганда кучсиз икки негизли кислота H2S >^осил дилади, унинг купчилик тузлари сувда эри* майди.
2HaS + ЗОа = 2НаО 4- 2SO2 HaS + 4 Br2 + 4 НаО= H2SO4 + 8 НВг HaS-b Си (NO3)a = CuS| + 2 HNO8
Олтингугурт SO2 ва SO3 оксидлари ^амда уларга 'тааллу^ли кислоталар H2SO3 ва H2SO4 х;осил дилади. SO2,i H2SO9 лар икки ёцлама, яъни оксидловчи-кдйтарувчилик хусусиятига эга: t
SOj 4- Br2 + НаО = H2SO4 + 2 НВг
SO2 4- 2HaS = 3S + 2HaO
H2SO8 + Cl2 + H2O = = HaSO4 + 2 HC1
H2SO4 + 2 H2S = 3 S + 3 H2O
HaSO3—бецарор: H2SO3 SOaf + H2O
H2SO4 — сульфат кислота кучли оксидловчи, унинг хоссаси концентрациясига боглид булади. У оддий мод-; далар билан ^ам, мураккаб моддалар билан ^ам реакцияга киришади, у кислоталарнинг барча хоссасига эга: - -
Г Zn + HaSO4 = ZnSO4 4- На
? суюлт.
Zn 4- 2 H2SO4 = ZnSO4 4- SO2 4- 2 H2O
3 Zn + 4H2SO4 = 3ZnSO4+ S + 4 H2O
4 Zn 4- 5 HaSO4 =Ю4гп5О44- H2S 4- 4 H2O ’ суюлт.
S 4-2 HaSO4 = 3 SO2 4-2 HaO КОНЦ.
H2SO4 — купчилик эрувчан ва эримайдиган тузларни ^осил дилади.
Олтингугурт шунингдек тиосульфат кислота Н2320з ни ^ам ^осил дилади: унда олтингугуртнинг бир ато-_ ми — 2, иккинчиси— +6 оксидланиш даражасига эга. Тиосульфат кислота бе^арор.
j H2SaO3-»S|4-SO24-H2O
Тиосульфатлар — дайтарувчи: ,
> . Na2S2O3 4-С1а 4-Н2О = Na2SO4 4-S| 4-2 НС1
VII гуруз p-элементлари вашу элемент бирикмаларининг хоссалари
~ VII гуруз р-элементларига фтор, хлор, бром, йод, астат киради. Улар дтомининг электрон тузилиши ns2np5. Улар —1, +1, + 3, +5, ±7 оксидланиш дара-жасини намоён дилади.
Хамма галогенлар — типик металлмаслар. Галоген-лар гурузчасида юцоридан пастга зараб зайтарувчилик хоссаси ортиб, оксидловчилик хоссаси камаяди. Галогенлар жуда фаол булиб, купчилик элемент ва бирикмалар билан узаро таъсирлащади.
,На+’С12 — 2НС1 Н2О + С12 = НС1 + нею
2 Na + С12 = 2 NaCl SiO2 + 2 F2 = SiF4 + O2
2P + 3C12 = 2PCI3
HF дан ташцари, замма галоген водородли кислоталар кучли кислоталар заторига киради, уларда кислота-ларнинг замма хоссалари бор булиб, зайтарувчилар зисобланади:
МпО2 + 4 НС1 = МпС12 + С12 + 2 Н2О 4Ш + О2 = 2 J2 + 2Н2О
Деярли замма металлар галогенидлар зосил циладн, бу галогенидлар кенг з^лланилади. Галогенид анионла-ри жуда яхши лигандлардир. .
[А1С1*]- [BeFJ2- [HgBrJ2- [А1Ев]3-
[BFj“ . [SiFe]2- [J8]“
Галогенлар затор кислородли бирикмалар зосил зила-
ди, лекин водород кислород билан бевосита реакцияга
киришмайди. Уларни галогенларнинг сув билан реакцияси ёрдамида ёки бошза усулда олинади:
С12 + н2о = на + нею
Хлорнинг зуйидаги кислородли кислоталари маълум:
нею—нсю2—нсю3—нсю4
Бу заторда хлорнинг оксидланиш даражаси ортйши билан оксидловчилик хусусияти камаяди, кислота кучи эса ортади.
НС1О — энг кучли оксидловчи.
HCIO4 — энг кучли кислота.
Ху йида уларнинг юз’ори оксидловчилик хоссасига баъзи мисоллар келтирамиз.
2 КСЮ = 2 КС1Н-Оа <
СаОС12+2НС1 = СаС12 +Н2О+С1а
2 НС102 = НСЮ + НС108
4 SOa + 2 НСЮ8 + 3 Н20 = 4 H2SO< + С12б ' 2КСЮ3 = 2КС1 + ЗО2 —
Ургатувчи масалалар ва уларни ечиш намуналари
1-мисол. «Щрх ароги» деб нимага айтилади? У цандай хоссага эга? «Шох ароги»нийг 'олтин билан реакцияси• тенгламасини ёзинг. . ' .
Ечиш намунаси. Бир дажм концентрланган нитрат кислота ва уч дажм концентрланган хлорид Кислофдан ташкил топган аралашмй «шох арори» -дейилади. Бу жуда кучли оксидловчи. «Шох арори»нинг таъсири цуйидагича асосланган:
HNO, + 3 НС1 = 2 Cl + NOCI + 2 Н2О
NOC1 = NQ4-C1
HNO3 + 3 HCI = 3 С1+ NO + 2HaO
Бунда HNQ3 HCI ни оксидлаб нитрозил хлорид хосил дилади. у эса атомар хлор ва NO хосил-хилиб парчаланади. Металлар билан таъсирлашганда хлор оксидловчи вазифасини бажаради: ара-лашма металлар шо\и — олтинни эритгани учун «нюх дроги* де-ган ном олган:
' Au+HNOS + 3HC1 = AuC134-NO + 2H2O ’
Эриш-олтинни атомар хлор оксидлаб, анионли комплекс хосил булиши хисобига бора ди: .
, Au + HNO3 + 4HCl = H[AuCl4l + NO + 2HaO
. Au + ЗС1—ЙС1 = Н [AuC14]
2-масала. Таркибида 35% (масс). Оа3(РО4)г сахлаган 5,0 кг фосфоритдан оддий суперфосфат олиш учун 70% (масс) ли (р—1,13 г/мл) сульфат кислотЗдан цанча хажмда олиш керак?
Берилган: ц> %. (H^OJ =70 % -
т (фосфорит) = 5,0 кг
. w % (Са3(РО4)2) = 35 %
-М (H2SO4) = 98,0 г/моль
М (Са3 (РО4)г) = 308,0 г/моль p(HaSO4)= 1,13_____________
V(H2SO4)=?
Ечиш намунаси. Оддий суперфосфат олиш учун дуйидаги кимёвий реакпиядан фойдаланил’ади:
+2Н.О
. Ca3(PO4)2 + 2H2SO4 7---2CaSO4-2H2O.+ Ca(H2PO4)2 -
1. 5 кг фосфоритдаги Саэ(РО4)2 массасини топамиз:
100,0 кг (фосфор) .——35,0 кг Са3(РО4)2
5,0 кг (фосфор) ——— х кг Са3 (РО4)2
15—7534 225
т (Са3 (PO4)j) = 1,75 кг
2. 1»75 кгСа3(РО4)а билан реакцияга киришйш учун зарур булган HjSO4 массасини топамиз. Реакция тенгламасидан кУринадики, 1 моль Са3(РО4)» 2 моль H2SO4 билан рёакцияга киришади. Шундай дилиб, 222 -.'—.□=308,0 кг, Са3(РО*)2 2 жола-98 кг= 196,0 кг H2SO4
HjSO4 массасини топамиз. Реакция тенгламасидан куринадяки, .1 жолб’308 г/моль =1 .
билан реакццяга киришади.
Езамиз:
308,0 кг Са3 (РО4)а----- 196,0 кг HaSO4
1,75 кг Са3 (РО4)а------Y кг HgSO*
Пропорция тузамиз: 308:198= 1,75: Y' '
198,0-1,75
Y = — ----= 1,11 кг
308,0
т (H2SO4)= 1,11 кг
3. К,анча 70 % ли эритма-таркибида 1,11 кг H2SO4 бор?
100,0 кг (эритма)—----- 70,0 кг
z кг (эритма) --------- 1,11 кг
100,0-1,11
z = ’—= 1,59
• _ . 70,0
т (эр-ма) = 1,59 кг
4. 1, 59 кг массали HaSO4 эритмаси дажмини топамиз:
т (эр-ма) 1,59 кг ' •
V = ----—1— — _ -—г — 1,40 л
р (эр-ма) 1,13 кг/л
Жавоб: V(HjSO4) == 1,40 л]
* Масала буйича саволлар
1. Фосфор бирикмалари даерда ишлатилади.
Жавоб: фосфор одам ва усимликлар даёти учун зарур элемент дисобланади, усцмликларда фосфор етишмаганда ерга минерал угит сифатида солинадш
2. Дандай минерал Уритлар маълум?
Жавоб: Ca(H2PO4)2 + CaSO4-H2O Са(НаРО4)а СаНРО4-НаО NH4HaPO4, (NH4)2HPO4
оддий суперфосфат; душ суперфосфат;
преципитат;
аммофос
3. Оддий суперфосфат уритининг дандай камчилйги бор?
Жавоб: у таркибида балласт модда CaSOy садлайди ва ер шурини оширади.
' 4. Тиббиётда фосфорнинг дандай бирикмалари дулланилади?
Жавоб: фосфор одам даёт фаолияти учун зарурдир, шунинг учуй фосфатлар тиббиётда кенг дУлланилади. Масалан, темир глицерофосфат, -АТФ ва бошдалар. ,
Таркибида. оксидланиш даражаси 3 булган фосфор садлаган бирикмалар зазарли дисобланади, уларнинг баъзилари рак касаллигини даволашда ишлатилади.
3-мисол. 210,0 г ЫаНСОз дан (иормал шаронтда) дандай . дажмда СО2 олишмумкин?
1) диздириш йули билан; 2) кислота таъсирида?
[ Берилган: т (NaHCO3) = 210,0 г । ' '>
• - • М (NaHCO,) = 84,0 g/моль , ’ « .
Vm = 22,4 л/моль *
V(CO2) = ?-
Ечиш намунаси.
• L .Реакциянинг бориш тенгламаси: •
2NaHCO3 = NaiCO3 + CO2 + H2o ' (1)
210,0 г NaHCOg дан досил буладаган СОа дажмини топамиз. Реак-шя тенгламасига »ура 2 моль NaHCOg 1 моль СОа досил дилади. Шун-(ай дилиб, 2 моль-84,0 г/моль = 168,0 г NaHCO3-1 моль-2z,4 л/моль = = 22,4 л СОа досил дилада. Езамиз: 168,0 a NaHCOg —$2,4 л СОа гЮ.0 г NaHCO3 — х. л.СОа ' > . ' .
Пропорция тузамиз: 168,0:22,4 — 2Ю:х А
• 22,4-210,0 ' А V
Г ' х~—— =28,0 л.
I 168,0
tV1(COa) = 28,0 л. '
2. Реакциянинг бориш тенгламаси;
NaHCOg+HCl = NaCl+COat+HaO (2)
210 г NaHCOg дан досил буладаган СОа дажмини топамиз. Реакция тенгламасига. кура, Г моль NaHCOg I моль СОа ни досил дилади. Щун-дай дилиб, 1 дцла-84,01 г/моль== 84,0 г. 1 моль-22,4: л/моль — 22,4 л СОа ажратиб чндарада.
г /Ёзашз:
84,0 a NaHCOg-—22,4 л-СОа
| . 210,0 a NaHCOg----Л аСОа
;* Пропорция тузамиз:
84,0:22,4 — 210,0;*
? ' - 22,4-210,0 ' „ „
х=3---^“7----— 56,0.
• 84,0 .
».!. ¥»(COg) = 56,0 л ' .
Жавоб: ki(COa) = 28/) лт Va (СОа) = 56,0 л
Масала буйича саволлар
1. Карбонатлар бошда тузлардан нима билан фард дилади?
Жавоб: Ишдорий ва ишдорий-ер металларидан ташдари дамма L* Жарбонатлар осон нарчаланиб, COS , ажратиб чидаради:
, Аи^Оз^ + ЗНгО^гАЦО^а + ЗСО^
«V - 2. Натрийнинг карбонат кислотали дандай тузлари маълум?
г, Жавоб: ИагСОз— натрий карбонат ва NaHCOj натрий гндря-
>'• карбонат. ,
' 3. Тиббиётда дайси туз ишлатилади?
Жавоб: тиббий амалиётда меъда шираси кислоталилиги ошиб , кетганда'NaHCOg тузи ишлатидади?
L 4. Унинг ишлатилиши нимага асосланган?
L Жавобг бу туз сувли эритмаларда гидролизланади ва меъда ? ширасидаги ортидча Н+ ионларнинг кучсиз «ейтралловчиси 6J-^-Лади:
Vis*
и* кг
... NaHCO3 + Hs0 a* NaOH + H2CO3
NaOH 4- HCl NaCl 4* H2O
5. Нима учун Na2CO3 ни доривор препарат сифатвда ишлатяб бул* майди?
. Жавоб: Na2CO3 гидролизида кучли ишдорий- мудит досил бйладр, чуйки Кдисс .(Н/ЮзУ Хдисс (НСО3) дан 10000 марта катта биринчи бос-Личда гидролиз иккинчисига Караганда купрод боради. Бунда к^п мид-дорда ОН" ионлари досил булади ва улар ички аьзоларни шикастлайди, Na/ZOj + Н2О ч* NaOH V NaHGO,
4-мисол. Кремний галогенидлари гидролизи реакцияси тенгла-маларини ёзинг. SiF4 гидролизцрйиг узига хос~ хусусияти дандай? СС14 гидролизи дам шу схемада бориши, мумкйнми?
Ечиш намунаси. Кремний галогенидлари сувли эритмаларда тулид гидролизга учраб, силикат да хлорид кислота досил дилади:
SiCl4 3 Н4О ч* H2SiO3 + 4 НС!
Шунинг учун нам давода.51С14 бугланганда НС1 нинг куюц тутуни досил булади. SiF4 — уткир дидли рангсиэ газ, у сувли эритмаларда гидролизланади:
SiF44-3H2O=rtH2SiO3 4-4 HF '
Косил б^лгаи водород фторид SiF4 билан гексафторсиликат кисло* тасини HsSiF, досил дилади:
SIF* 4* 2 HF = H2SiFe .
- Умумий жараён куйидаги*тенглама билан йфодаланади:
3SiF« 4-3 НЯО = 2 HsSiF« 4-HsSiOj
H2SiFe нинг таъсири HjSO^ га яцинроц булиб, жуда задарли.
СС14 гидролизи бу схема буйича бора олмайди. Углерод турт хлорид органик эритувчи булиб, сувда эримайдиган огир рангсиэ суюдлик. СС14 гидролизи фацат юдорн дароратда боради. Унинг гидролизга инерт (бефард) лиги шундаки, углерод атоми координация жидатдан туйинган булиб, гидролизни тезлаштиш учун сув молекулаларини узига бириктира олмайди.
Масала буйича саволлар
1. Гексафторсиликат кислота тузлари каерда ишлатилади?
Жавоб: Na^iFj—натрий фторсиликат сувда эримайдиган туз, инсектицид сифатида дулланилади, магний, рух ва алюминийнинг эрувчан фторсидикатлари курилишда ишлатилади. Бу моддалар Курилиш тошлари — одактош, мармарлар сиртини сув утказмайдн-Ган дилади. - '
5-масала. Таркибида 6% аралашма бор 25,0 т дУргошии ялти-рогидан данча металл долидаги дургошин олиш мумкин?-
Берйлган: ’ т (руда) = 25,0 г ш % (ар-ма) = 6,0 % M (PbS) = 239,2 г!моль М (Ph) 207,2 е/моль zn(Pb) = ?
К Ечиш намунаси. Реакцнянинг бориш тенгламаси:
IL 2PbSH-3Oa = 2РЬ0 4-2SO1 . .
Е.. 1. ^урвэшин ядтирогя таркибидаги аралашмалар массасини топамиз:
В 25,0 т (руда) —100 %
fe Xm (аралашма) —6%
ЕЙропорция тузамиз: 25:100 = Х:6
Г,- 25,0-6 ,
L ' . - w=l'5
Л/ . ...
ри (аралашма) = 1,5 т ;
‘ 2. Трза PbS массасини топамиз: т (PbS) = 25,0 т (руда) 4
> , Т (аралашма) =25,0—ль
Г Т - 1,5 г= 23,5 г. *
3. 23,5 т PbS дан олинган хУРРошин массасини топамиз. Реакция к-тенгламасидан куринадики, 1 моль PbS I моль РЬ хосил к,илади. Шун-вдвй хилиб, I моль. 239,2 г/моль = 239,2 a PbS. 1 моль. 207,2 г/моль=* |. = 207,2 г РЬ хосил хилади.
fe,.' Езамиз: 239,2 г PbS---- 207,2 г РЬ
£ 23,5 Г PbS —— X т РЬ
(Пропорция тузамиз: 239,2:207,2 = 23,4:у
239,2:23,5 '
У——- п =20,35
.239,2
Жавоб: m(Pb) = 20,35 т
Масала буйича саволлар
1. К^ргошиннинг энг мухим рудаси—«дУргошин ялтирога» нг формуласи дандай? . ’
Жавоб: «х^ргошнн ялтирогижнинг формуласи PbS- '
2. Металл Холидаги дургошин даерда ишлатилади?
i Жавоб: хУргошин у-нурларнй ютади, шунинг. учун ундан ра-оактив моддалар билан ишлашда химоя воситаси сифатида >йдаланилади. Маълумки, радйоактив моддалардан нурланиш 15дам хает фаолиятига салбий таъсир курсатади, бу эса радяоац-нурлардан химоя хиАинишни тадозо этади, шунинг учун реят-Ш хоналарида хУргошин экран ишлатилади.
6-масала. 20,0 мл сульфат кислота эритмасини найтраллаш Кун 24,30 мл 0,1 моль!г NaOH эритмаси сарф «булса, шу эрит-нинг 1,5 л литрда неча грамм сульфат кислота бор?
Берилган: V (эр- ма) = 1,5 л
Н? V (H2SO4) = 20,00 мл
К V (NaOH) = 24,20 мл .
К* ‘ с (NaOH) = 0,10 моль!л
fe. М (HaSO4) = 98,0 г/моль
М (NaOH) = 40,0 г/моль
Р- m(H2SO4)=?
fe Ечиш намунаси. Реакцнянинг бориш тенгламаси: в
fe 2 NaOH + HaSO4 = Na8SO4 + 2 HjO
| /ЭКВ(№ОН).= 1 /8квД5О4) = 1/2
Сульфат кислота массасини маълум формулага асосан /eitB(H2SOJ^ о х/а ни дисобга олиб топамиз:
cCNaOHl.VtNaOW.Me/aHsSO^-Vlsp-Ma)
m(H2SO4)« ——V(H2SOi).10Qo =
. 49,0.24,30.0,1.1500 г-моль „
~ 1000-20,00 мл '
Жавоб: m(HgSO4) = 8,93 г.
7-масала. Калий йодид 20,00 мл 0,1 моль/л хлорамин эритма* си билан оксидланганда ундан неча грамм йод ажралиб чидади?
Берилган: V (CaOClg) == 20,00 мл
Х/Ав) = 0,1 моль/л .
М (X/Jig) = 44 а/ моль ' M(J) ~ *26,9 г! моль
' m{JJ = ?
Ечиш намунаси. Реакциянинг бориш тенгламаси:
NaOCl 4- 2 KJ 4- 2НС1 =NaCl +.2 КС! + А+ на° ...'
2J“ — 2е —J§ ' 2 2 1
_ C10~4-2H++2e-»-Cl--i-Hs0'2’2 1
. 2j*~-i-c!O~+2h+-* j!! + ci~ + h,6
/экв (М=1 ’ /экв (CaOCls) = Vs
Ажралиб чиддан йод массасини топамиз:
, ' У(Х/А)-с(^Х/А.)-М(1/23^
- "«— „ . кхю-------------
20,00.0,1-J26,9 мл-моль-г
=.——2---------------------=0,2538 г.
1000 мл-моль
т (Jg) = 0,2538 г. v
Жавоб: m<Jg) = 0,2538 г. • s
Масала буйича саволлар
1. Хлорли ёки о^артирувчи о^ак тузларяинг цайси турига киради?
Жавоб: бу хлорид ва гипохлорид кислотаиинг аралаш тузи-лнр.
2. Хлорли одак дандай хусусиятга эга? . . .
Жавоб: бу кучли оксидлбвчи.
3. Хлорамин даерда ишлатилади?
Жавоб: хлорамин ?симликдан олинган толадарни одартиришда, тиббиётда хоналарни дезинфекциялашда ишлатилади.
I ; ' '• V \ . f- ' • . - ' '
Мавзунинг узлаштирилишини мустадил назорат ( дилиш учун-савол ва масалалар
Ташди электрон даватида биттадан электрон садлаган уд элементларидан фадат таллий (1) одатдагн шаронтда эр бирикма досил ‘дилади. Буни нима билан тушунтириш [? < ; .. •
Натрий Тетраборат — Na2B40r- 10Н2О — антисептик ва ялли-га дарщи восита. Нафас йулларини ингаляция дилйщ учун ладиган доривор препарат— бикарминат таблеткаларк гга 0,4 г натрий тетраборат, 0,4 г натрий гиЯдркарбонат, [атрий хлорцд, 0,004 г ментол киради. Таблеткани 1/2 ста-зда (120 мл) эритилади. Бу препаратнинг НфВ4Ог>1бЙ2О души дандай?
воб: w% (Na2B4O7-10Н2О) = 0,33% .
Чеъда ширасининг кислоталилиги ортиши билан боглид меъда-ичак касалликларини даволашда А1(ОН)3 ни бую-м аде ад нима?
препаратни куп мнддорда ичиш хавфли, сиз буни дандай ирасиз? ' .
<Уш туз б$лган дуйидаги кимёвий моддалар мавжуд:
KAI (SO4)2-10 Н2О
(NH4)2Fe(SO4)2-12 Н2О -
KCr (SO4)2-12 Н2О
амалиётда фадат биринчиси дон ту-хтатувчи восита ейфа-шлатиЛади. Дандай дилиб бу препаратнинг дадидийлигига, да К+, Als+, SO4_ ионлари борлигига ишониш мумкин?
Гиббий амалиётда азот (I) оксиди N2O ийлаТилаДи. Бу — цозаларда мает дилувчи, катта дозаларда кислород .билан жарродлик амалиётида анёсТезияловчи. восита сифатида лувчи газ N2O ни аммоний нитратин парчалаб олиш мум-t реакция тенгламасини ёзинг ва 10 кг NH4NO3 дан олина-12О дажмини диеобланг.
V(N20) =2800 л.
Этоларингологияда дулод томчилари сифатида кенг ишла-ан антисептик восита—борат спирти таркибида 3,0 г болота ва 100 мл гагча 70% (масс)Ли этил спирти бор. .Бу тдаги борат кислотанинг моляр улуши дандай," бу дандай ' «ддорини ташкил этади?
ls2O3 задарли булишига дарамай кичик дозаларда тиббиёт-:алай, стоматологияда- пульпани (тиш ковйгини) жонейз-шда ишлатилади. Нима учун бу бирикманинг терапевтик озгина оширйлса одамни задарланишга олиб келади?
1исМут нитрат асосан меъда-ичак касалликларида антйсеп-ита сифатида дулланилади. Унинг Таркиби: Bi (OH)2NO3, , BiOOH. Препарат: хлорид кисдотада эрийди. Препарат-[дидийлигини дайси сифат реакциялйри билан исбОтлайсиз? i тенгламасини ёзинг.
Нима учун углероддан фардли равишда кремний, германий^ ва дургошин каррали богларЭ=Э ваЭ=Э досил дилмайди?
1®- Тиббий амалиётда стенокардияда томир квнгайтирувчй Г*ро$ита сифатида натрий нитрит —NaNO2 ишлатйлади, аммо нат-нитрат —NaNO3 ишлатилмайди? Ташди куриниши буйича Тузлар жуда ухшаш. Унинг дадидийлигини данДай анидлаш /адоп!?
' 11. Цианид' кислота — HCN ва унинг тузлари одам учун за-ЧЦарли. Улар билан задарланиш улимга олиб келади. Бу жуда
кучсиз кислота (К=8-10-10). Унинг сувли эритмалардаги тузи ^айда й булади? Бу эритмаларда мудит реакцияси дандай булади?
12. Натрий гидрокарбонат тиббий амалиётда . меъда шираси кнслбталилиги ортганда дулланилади. Шу тузнинг 10% (масс) ли (р= 1,13 г/мл) эритмаси pH ини дисобланг.
Жавоб: рН=8,35.
13. Кальций карбонат— СаСО3 антиацид активликка эга, меъда шираси кислоталилиГи ортганда ишлатилади. Уни 'СаО дан GO2 утказиш йули билан олиш мумкин. ЮгСО2дан данча миддорда СаСОз олиш мумкинлигини дисобланг. )Бу препаратни кунига 1 граммдан 3 марта ичишга буюрилади. Синтезланган препарат неча кунга етади? - -
Жавоб: m (СаСО3) =44,6 h 15 кунгача. •
14. Кр.емний диоксид мудим сода —шиша ишлаб чидаришда ишлатилади. Шиша пишириш- 1400°С ли махсус печларда олиб бо-рилади. Бошланрич мадсулот. сифатида од,дум, сода ва оДактош олинади. Кимёвий реакциянинг бориш тенгламаларини ёзинг.
15. К^ррошин ацетат —РЬ(СНзСОО)2—терн ' яллигланишида буруштирувчи восита сифатида дулланилади. 0,5% (масс) ли 100 г эритма тайёрлаш учун- керак булган модда массасини дисобланг. Шу эритмадаги дУргошнн масса улуши дандай?
Жавоб: m(Pb(CH3COO)2=0,5 г.
16. Кийин эрийдиган шиша ва совун олишда калий тузи — 'поташ ишлатилади. Унга хлбрид кислота таъсир эттирилганда ажралиб чиддан газ рдакди сувни лойдалатади. Поташ таркибига дандай анион киради? Реакция тенгламаси ва поташ формула-сини ёзинг. .
17. VI гуруд р-элементларининг ташди электрон ; добиги электрон конфигурациясиии дисобга олган долда, уларнинг валент до-латлари ва оксидланиш дараэдаларини характерлаб беринг. Кислород атомлари мусбат +2,. +1, +2 дан юдори оксидланиш дара-жасига эга булиши мумкинмй?
18. 3,2 г миснинг концентрланган сульфат кислота билан реак--циясидаи ажралиб чиддан олтингугурт (П)-оксид гази 100,0 мл сувда эритилади. Х°сил булган. сульфит кислота эритмасининг моляр концентрацияси ва pH ини анидланг?
Жа*>об: с(Н25Оз)=0!504 моль/л.
. 19.’ Кислород тиббиетда кислород етишмаслиги билан боглид касалликларда нафас олишни яхшилаш учун ишлатилади. Одатда ,95% (масс) ли СО2 дан ташкил топтан аралашма —<карбоген» ишлатилади. Шу аралашмадан 250,0 мл тайёрланг. -
20. Тиббиётда суяк синищида ишлатилйдиган богламлар тайёр-лашда сульфат кислотанинг дайси тузи ишлатилади? Унинг бот-ламни дотириш таъсири нимага асосланган?
21. Водород сульфид одам учун жуда задарли газ дисобла-нади. Ундан нафас олннганда гемоглобин билан богланиб, Иара-лнчга сабаб булади. Амалда уни металл сульфидлардан олинади. Кипп аппаратида 100,0 г FeS га сульфат кислота таъсир эттирил-гакда досил буладигйн H2S дажмини анидЛанг.
Жавоб: V(H2S) =25,4 л.
22. NaCl, NaBr, Nal —тиббий препартлари клиникада кенг дУлланади.’ Унинг дадидийлигини сифат реакциялари билан ис-ботланг.
23. Хлорид кислота эритмаси — доривор препарат. У яна меъда ширасида булади. Унинг Уртача концентрацияси pH ини дисобланг. . ‘
Жавоб: pH —2.
24. Хлорид кислота 'эритмаси доривор препаратлар миддорини анйдлашдакенг ишлатилади. 5,00 мл 5% (масс) ли доривор препарат—NaHCO3 эритмасини анидлаш учун хлорид, кйслотанинг дандай концентрациясидан фойдаланиш керак?
- Жавоб: с (НС1) =0,100 моль/л.
25. Сунъий карловар тузи 22 ^исм -натрий сульфат, 18 дисм натрий гидрокарбонат, 9 дисм натрий хлорид, 1 дисм калий суль-‘ фатдан ташкил топганлигини анализ дилинг ва исботланг. 1)у ут дайдовчи ва сурги дори дисобланади. 100 г туз таркибйдаги дам-ма SO42- ионларйни чуктириш учун BaCh-ZHgO'дан -данЧа олиш
Жавоб: т(ВаС12-гНгО) =98,0 г.
1-лаборатория иши t
111, IV ВА V ГУРУХ р-ЭЛЕМЕНТ КАТИОНЛАРИНИНГ ХУСУСИЙ СИФАТ РЕАКЦИЯЛАРИНИ УРГАНИШ
А13+ —иони реакциялари .
Натрий ва калий гидроксид реактиви — NaOH, КОН
! - Уювчи ишдорлар эдтиёткорлик билан кущилганида алю-> миний тузи эритмасидан од лицилдод алюминий гидроксид ' чукмасини Al (OH)j ажратади: _
• А1С13 + 3 NaOH = А1(ОН)3| + 3 NaCl
А13+ + ЗОН“ = А1(ОН)3|
А1 (ОН)3-чукмаси хоссаларини Урганиш (текшириш)
' А1 (ОН)3 — амфотер хусусиятга эга.
1. Чукма минерал кислоталарда эрийди.
А1 (ОН)3 + 3 HCI = А1С13 + j3 Н2О
? А1(ОН)3 + ЗН+ = АГ3++ЗН2О
/ 2. Чукма уювчи -шицорнинг м^л миедорида |рийди:
• Al(OH)3 + 3NaOH = Na3[Al(OH)e]
Г ' А1(ОН)3 + ЗОЬГ = [А1(ОН)в]3~
j . Натрий гидрокарбонат реактиви — NaHCO3
Натрий гидрокарбонат — NaHCO3 ва карбонатлар алюми-ний тузлари билан ли^илдоц чукма А1(ОН)3 хосил дилади.
Г А1С13 + 3 NaHCO3 = Al(OH)3|-|-3NaCl+3CO2t
| А13+ + ЗНСОГ= А1(ОН)3| + ЗСО2|
NaHCO3 сувли эритмаларда гидролизга учрайди:
NaHCO3+H2O^NaOH+ Н2СО3
\Шундай дилиб,‘бу туз эритмасида ОН~ ва Н2СО3 бор.
А1(ОН)3 нйсбатан эрувчанлиги кам булгашг учун у чукма-га тушади. . '
Ализарин (I) реактиви — S—CuHsC^OH^SOsNa. Ализарин алюминий тузлари билан цирмизи-^изил рангли лак ^осил дилади. Реакция фильтр цогбз булагида бажарилади: фильтр догоз булагига 1 томчи алюминий тузи эритмаси томизилади. Унга газ долдаги аммиак билан ишлов берилади, бунйнг учун фильтр цогоз була-гини концентрланган аммиак эритмаси идиши устида ушлаб турилади. Дорни периферияси буйича ализарин* ли капилляр билан Ураб чидилади ва яна аммиак гази билан ишлов берилади. Бинафша фонда (аммиакли Му* дитдаги ализарин ранги) дирмизи-дизил ранг досил булади. Ализарин' алюминий билан ички комплекс туз досил дилади: ‘
Цургошин ионлари реакцияси — РЬ2+ Хлорид кислота реактиви — HCI
Суюлтифилган хлорид кислота в а хлоридлар дурго-шин тузларидан од говак дУргошин хлорид чукмасцни ажратиб чидаради.
РЬ (ЫОз)2 + 2 НС1 = РЬС12| + 2 HNO3 . Pb2+ +2СГ = РЬС12|
Pbcl2 — чукмаси хоссаларини текшириш.
1. Чукма ^айнаётган сувда эрийди.
2. Чукма кислоталарда' эримайди.
3. Чукма цую!$ уювчи ипщорларда эрийди.
Натрий ва калий гидроксид реактиви — NaOH,КОН
Уювчи ишцорлар э^тиётлик билан цуррошин тузла-рига таъсир эттирилганДа РЬ (ОН) 2 оц чукмаси ^осил булади:
л ' \
, Pb fNOjJa 4- 2 NaOH = Pb(OH)8| 4- 2NaNO8 Pb2+ + 2 OH“ = Pb(OH)2|
Pb(QH)? чукмаси хоссасини текшириш
Pb(OH)2 амфотерлик хоссасига эга. -
1. Чукма минерал кислоталарда эрийди:
' РЬ(ОН)2 +2НМОз = РЬ(ЫОз)а + 2Н2О Pb (ОН)Я + 2 н+ = РЬ2+ + 2 Н2О
2. Чукма уювчи ишкорНинг мул мицдорида* эрийди:
* Pb(OH)24-2NaOH = Na2[Pb(OH)4] ;
Pb(OH)a4-2OH“= [Pb(OH)4]2- '
Калий, йодид реактиви — KJ • *
Калий йодид— KJ — цУргошин тузлари эритмаси билан сариц аморф чукма — PbJ2 — цУргсипин' йодйдни Зосил зилади.
Pb (NO8)2+2 KJ = Pb Ja| + 2 KNO8
' . Pb2++2J“ = PbJa|
\PbJ2 ч$кмаси xQccacuHU текшириш •
1. Чукма реактивнинг мул микдорида зисман эрийди: Pb J8 + 2 KJ = Ка [PbJJ
' PbJa+2J“ = [PbJ/“ -
2. Чукма ^айнастган-сувда эрийди.
:л 3. Чукма суюлтирилган сирка кислотада дайнатил-ганда эрийди. К°сил булган эритмани секин-аста сови-' тилса, энди чук^а тйлла-сариц кристалл куринишида тушади. Бу сифат анализннинг энг чэдюйли реакцияла-ридан биридир. , ’ '
Маргимуш катиони реакциялари — As3+ Натрий тиосульфат реактиви — NaaS2O3
'Натрий тиосульфат — Na2S2O3 — кислотали мудитда {НС1) маргимуш (мишьяк) тузлари била» ^айнатил-ганда As^S3 — маргимуш сульфидйнинг сариц чукмаси Зосил булади. Реакциянинг бажарилишй: пробиркага 2—3 томчи NasAsOj, 1 томчи НС1 эритмаси ва 2—3 томчи Na2S2O3 эритмаси томизилади. Аралашма цайнагун-ча зиздирйлса 2—3 минутдан сунг чукма зосил булади.
2Na3As63+?Na2S2O8+6HCl = As2S8V+
4-3 Na2SO4 + 6 NaCi + 2 Н2О
2 AsO|~ 4- 3 S2O2- 4- 6 H+ = As2S3! 4- 3 ЭО42“ 4- 3 HaO
У ' . ' < 235. •
"К.‘ , ,
1 » •
As2S3 чукмаси хоссасини текшириш
1. Чукма уювчи ишцор эритмасида эрийди.
AsjS3 4- 6 NaOH = Na3AsQ3 4- Na3 AsS3 -f- 3 H2O AsjS3 + 6 OH~ + AsO3~ 4- AsS 3~ + 3 H3O
, NajAsSg'—тиотуз деб .номланади. Бу тиокислотага тегишли тузлардир. Тиокислоталар кислородли кисло-таларга ухшаш булиб, кисдородни олтингугуртга алма-шинганлиги билан фарц дилади: »
Н3АзОз — маргимуш (мишьяк) кислота.
H3AsS3 —тиомаргимуш (тиомишьяк) кислота.
H3SbO3 — сурьма кислота. H3SbS3 — тиосурьма кислота'. -
2. Чукма ишцорий металл сульфидларда эрийди: Na2S, K2S3 . • '
As2S34- 3 Na2S = 2 Na3AsS3 As2S3 +3S2" = 2AsS‘j~
* 3. Чукма аммоний карбонатда эрийди.
As2S3 + 3 (NH4)2CO3 = (NH4)3AsO3 4- (NH4)3 AsS3 4-3 CO2f As2S3 + 3 CO3- = AsO3- + AsS'-+3 CO2f
_ Висмут ионлари реакцияси — Bi3'*"
Натрий ва калий гидроксид реактиви NaOH, КОН
Уювчи ишцорлар висмут тузлари билан висмут гидроксид оь; чукмасини косил цилади:
Bi (NO3)S + 3 NaOH = Bi (ОН)3| 4- 3 NaNO3 в^ + зон-^вцону .
Bi (OH)3 чукмаси хоссаларини tjpeaHuiu
1. Чукма минерал кислоталарда эрийди:
Bi (ОН)3 + 3 HNO3 — Bi (NO3)3 4-3 Н2О Bi(OH)3 4-ЗН+=<Bi3+-р ЗН?О
2. Чукма уювчи ишцорнинг мул микдорида эримайди.
Калай (II)-хлорид реактиви — SnCl2
' Калай (И)-хлорид кучли ишцорий мукитда висмут туз-ларидан Bi3+ ни металл колигача цайТаради, у эса к°Ра чукма тарзида ажралади. Реакцнянинг бажарилиши: SnCl2 тузи эритмасига NaOH кушилади, Sn(OH)2 о^ чукмаси ^о-сил булади. Sn'(OH)2 амфотерлик хоссасига эгд. Уни NaOH нинг мул мицдорида эритилади, суигра висмут тузи эрит-
X -
маси цушилади. Бунда NaOH таъсирида ок аморф Bi(OH)3 чукма ажралади ва у бир ла^зада кайтарилган висмут метали косил булиши оцибатида дорайиб колада:
SnCl2+ 2 NaOH = Sn(OH)2| + 2 NaCl '
Sn(OH)2| + 2 NaOH = Na2 [Sn (OH)J, 'Bi (NO^ + 3 NaOH = Bi (OH)3| + 3 NaNO3 2 Bi (OH)3| + 3 Naa [Sn (OH)J = 2 Bi| + 3 Na2 [Sn (OH),]
' 2-лаборатория иши
АНИОНЛАРНИНГ ХУСУСИЙ СИФА1 РЕАКЦИЯЛАРИНИ УРГАНИШ Ч
IV ва V гурук р-элементлари ♦
Карбонат иони реакциялари — СОД" Барий хлорид реактиви—ВаС12
Барий Хлорид—ВаС12 карбонат эритмаларидан ок крис-талл чукма ВаСО3 ни ажратади.
: Na2COs + BaCl2 = BaCO3| + 2NaCl
СО2~+*Ва2+-= ВаСОу /. .
ВаСОа чукмаси хоссаларини текшириш
1. Чукма минерал кислоталарда эрийди:
ВаСО3|4-2НС1 = ВаС12 + Н2О + СО2| '
' BaCO3| + 2H+=.Ba2+-f-H20 + CO2t
;ч 2. Чукма сирка кислотада эрийди: '
h' ВаС03| + 2 СН3СООН = Ва (СН3СОО)2 + Н2О + СО2) 'ВаСО3 ч- 2СН3СООН = Ва2+ + 2 СН3СОО~+ Н2О + CO2f
Сульфат кислота реактиви —H2SO4 - . ,
Суюлтирилган сульфат кислота H3SO4 —карбонатларни зпарчалаганда СО2 ажралиб чикади. У о^акли сувдан 5'т-^дзилганда уни лойкалантирада. Бунда СаСО8 ок чукмаси _ ?-^сил булади:
‘Na2CO3 + HaSO4 = Na2SO4 + Н2О + CO2f
' ' СО|“ + 2Н+ = Н2О + СО2| '
д ' СО24- Са(ОН)2 = СаСО3|+ Н2О
СаСО3 чукмаси хоссаларини текшириш
1> Узок вакт СО2 утказилганда чукма эрийди:
ЙГ CaCOs|.+ COt-4--H,6 = Ca(H(>i),>
CaCO3| + CO2 + HaO = Ca2++2HC0f ’
' , Фосфат ион реакциялари—РО4~ Барий хлорид реактиви — ВаС1а
Барий хлбрид — ВаС1а гидрофосфат эритмаларадан од аморф ВаНРОл барий гидрофосфат •чукмасинн ажратади:
ЫазНРОл + ВаС12 = ВаНРО3| + 2 NaCl Ва2+ + НРО2“ = ВаНРСЦ
Аммоний гидроксид иштирокида барий фосфат досил булади: \ ' ' . .
2NaJHPO4 + 3BaCla + 2NH4OH = Ba3(PO4)1| +
+ 2 NH4C14-4 NaCl 4~ 2 НаО 3Ba2+ + 2HPO4“4-2NH4OH = Ba3(PO4)J +
+ 2NH4+ + 2HjO.
BaHPOt чукмаси хоссаларини текшириш,
1. Чукма минерал -кислоталарда эрийди:
ВаНРО4 + 2 HCI = AaClj 4- Н3РО4
• ВаНРО44-2Н+ = Ва2+4-Н3РО4
2. Чукма сирка кислотада эрийди:
2 ВаНРО4 4- 2СН3СООН = Ва(СН3СОО)а 4-Ва(НаРО4)а 2 ВаНРО4 4- 2 СН3СООН = 2 Ва2+ 4- 2 СН3СОСГ + 2НаРО’“
Магнезиал аралашма реактиви MgCla 4- NHtOH 4- NH4C1
Магний хлорид аммоний гидроксид ва аммоний хлорид иштирокида фосфат тузлари эритмасидан кристалик душ ту» MgNH3PO4 ажратади. Тажрибани бажариш: 3 томчи MgCIa эритмасига 2 томчи NH4OH ва досил буладиган Mg(OH)a эритмасига бир неча томчи NH4C1 душилади, сунгра 2 — 3 томчи NaHPO4 душилганда чукма досил булади^
MgCla 4- NaaHPO4 4- NH4OH = MgNHtPO4| 4-+ 2NaC14-HaO
Mg2+4-HPO2-4-NH4OH = MgNH4PO4| 4-HaO
. MgNHlPOi чукмаси хоссаларини текшириш
1. Ч^кма минерал кислоталарда эрийди:
MgNH4PO4 4- 3 HCI = MgCl, 4- NH4C14- Н3РО4 MgNH4PO3 4- 3 Н+ = Mg2+ 4- NH* 4- HaPO3
. 2. Ч^кма сирка кислотада эрийди: • -
\ MgNH4PO44-2CH8COOH = Mg(CH8COO)a4-
л • + 2NH4CH8COO +Mg(HaPO4)a .
MgNH4PO4 + 2 CH3COOH = Mg2* + 4 CH8COO“ + +2 NH* + 2HjPO4
ОксалАт иони реакциялари C,O4“ , Барий хлорид реактиви —BaCl,, Барий хлорид —BaCl, — оксалат эритмаларидан оц кристадин ч^кма ВаС^О4 ни ажратади:
'вД + (ЫНАСу>4’-ВаСД| + 2-КН<С1‘/- '
Ва2+5+С,р^ = ВаС,О4| |
ВаС204 чукмаси хоссаларини текшириш
1. Чукма минерал кислоталарда эрийди:
ВаСаО4 +2НС1 = ВаС1а+НаСаО4 4
ВаСаО4 4- 2 Н* = Ва2* = Н,С,О4
2. Чукма сирка кислртада эрийди.
ВаС,О4 + 2 СН8СООН = Ва (СН,СОО)а 4-Н,СаО4 ’
ВаС2О4 + 2 СН3СООН « Ва* + 2 СН.СОСГ + Н,С,О4
< Калий перманганат реактиви—КМпО4
Калий перманганат — КМпО4-кислотали му^итда цизди-рилганда CjO2- ионини карбонат ангидрид СО, гача оксйд-лайди, КМнО4 эритмаси эса рангсизланади.
’ 2 КМпО4 + 5 (NH4),C,O4 + 8 HaSO4 = 2 MnSO4 +
+ K,SO4 + 5 (NHJ,SO4 + 10 CO,+ 8 H,0
' Ацетат иони реакциялари — CH^COO"
Сульфат кислота реактиви —H,SO4
Сульфат кислота — HaSO4 сирка кислотанй унинг туз-ларидан ажратади, уни узига хос ^идига кура аникуганади: 2OH,C00Na + H,SO4 = Na,SO4 + 2 СН.СООН
2 СН8СОО~ + 2 Н* = 2 СН8СООН j Тажрибани иситиш билан олиб борилади!
. Этил спирт реактиви —С,Н,ОН ж
Этил спирта — С,Н,ОН— сирка кислота билан ё^имли нок эесениияси кредита эга булган сирка эталэфирини ^оснл v цилади. Тажрибани бажариш: 3 томчи CHsCUONa эритмаси-t та эдтаётлик билан 2 — 3 томчи концентрланган H,SO4 ва
. - - • ':/
1 — 2 томчи этил спирти ^ушилади. Аралашмани сув ^ам-момида бир оз циздирилади. * ' ’
2 CHdCOONa + 2 С2НЬОН 4- HjSO4 = ' V
= 2-СН8СООСаНб+Л'аг5О4 + 2Н,О
Нитрит ионлари реакцияси—NO^
' Сульфат кислота реактиви — HaSO4
Суюлтирилган сульфат кислота нитритларни парталаганда ^унгир газ —N02 ажралиб чи^ади:
2KNO2 + H2SO4 = KaSO4 + NO2f 4-NOf + Ha0
2 NO" + 2 H+ = NOf + NOaf + Ha0
Калий йодид реактиви — KJ
Калийхйодид кислотали • мухитда нитритлар таъсирида эркин J2 гача бксидланади. Реакцияни бажариш: пробиркага 2 — 3 томчи HaSO4 эритмаси, 2—.3 томчи KJ эритмасидан • ва бир неча томчи Эфир томизинг. Ажралиб чи^аётган йод эфир датламини бинафша рангга буя л ди:
2 KNOa 4- 2 KJ 4- 2 HaSO4 = 2-K3S04 4- 2 NO 4- Ja 4- 2 Ha0 2J- — 2e^ J°
. . N0~ + 2H+ + e-*N0 + Ha0
2J“ + 2NO7 + '4H+-Ja + 2NO + 2HaO
Нитрат иони реакциялари— NOg* Темир (II)-сульфат реактиви FeS04 —
Темир сульфат —FeSO4 нитратларни азот (П)- оксидгача — NO- цайтаради? у FeSO4 билан цунгир рангли комплекс бирикма [FeSO4 NO| ^осил цилади. Реакодяни бажариш: пробиркага KNO3 эритмасидан ^уйиб, FeSO4 кристалларйдан бир нечта солинг ва пробирка деворига теккизиб 1 томчи концентрланган HaSO4 туширинг:
6NaNO3 + 6FeSO4 -f- 4H2SO4 = SFeafSOJ, + Na2SO4 -H - . 4-2№О + 4ЙаО -
,, 2Fe«+ —2e“->2Fe3+ ~ 3
NO3- +'4H+ 4- 3e" NO + 2HaO 2
6Fe2+ 4- 2NOf + 8H+ -> 6Fe3+4-2NO 4- 4Ha0
- NO4-Fe2+4-SQ2--4Fe(NO)SO4]
. 3-лаборатория и ши
VI ВА VII ГУРУ* Р- ЭЛЕМЕНТЛАРИ АНИОНЛАРНЙНГ ХУСУСИЙ СИФАТ РЕАКЦИЯЛАРИНИ УРГАНИШ
Сульфид иони реакциялари — S 2~
Кумуш нитрат реактйвИ —AgNo3
Кумуш нитрат —AgNO3— сульфид эрйтмалари билан
*ора рангли чукма — Ag2S *осил циЛаДи: 4
. 2AgNO3 + Na2S = AgaS | + 2NaNO3
2Ag++ S2~ = Ag2S | •,- .'
Ag2Sчукмаси хоссаларини текшириш
1. Чукма суюлтирнлган хлорид кислотада эримайди.
2. Чукма аммиак эритмасида эримайди. •
’ 3. Чукма суюлтирнлган нитрат кислотада эрийди:
3Ag,S + 8HNO3 = 6AgNO3 + 3S+2NOI+4Н2О 3AgaS + ЗН+ + 2NO- = 6Ag+ + 3S + 2NO f + 4Н2О
Кадмий нитрат реактиви — Cd(NO3)2, Кадмии тузлари сульфидлар билан оч-сари^ рангли кадмий сульфид чукмасини CdS *осил дилади.
Cd(NOa)2 + Na2S = CdS | + 2NaN03
Cd2t 4-S2~ = CdS | .
CdS чукмаси хоссаларини текшириш
1. ЧУкма суюлтирнлган хлорид ва сульфат кислоталарда эрийди;
•CdS 4- 2HCI == CdCl2 + H2S CdS + 2Hr = Cd2+ + H2S
2. Чукма суюлтирнлган нитрат кислотада эрийди:
3CdS + 8HXOa=.3Cd(NOa)2 + 2NO +3S + 4H2O
Сульфат иони реакция лари — SO2-
Барий хлорид реактиви — ВаС12
Барий хлорид ВаС12 сульфат эритмаларидан о* кристалл чукма — BaSO^HH ажратади.
ВаС12 + Na2SO4 - BaSO4 | +2NaCl
Ba2+ + SQ2- BaSO41 -
« BaSOi чукмаси хоссаларини текшириш
1. Чукма минерал кислоталарда эримайди.
2. Чукма уювчи ишцорнинг му;1* мицдорида эри-" майди. . -
Сульфит иони реакциялари — $О32-Барий хлорид реактиви — ВаС12
Барий хлорид — ВаС,12— сульфит эритмаларидан oif чукма~ BaSO3 ни ажратиб чи^аради:
ВаС12 + Na2SO3 == BaSO3 | + 2NaCl • < Ва2+ 4- SO2- = BaSO31
BaS03 чукмаси хоссаларини текшириш
1. Чукма минерал кислоталарда эрийди:
BaSO. + 2НС1 = ВаС12 + Н20 4- S02 f
BaSO3 + 2Н+= Ва2++ Н20 + S02 f
Калий перманганат реактиви — КМпО4
Калий перманганат — КМп04 — реактиви сульфат кислота ^амда сульфитли эритмага ^ушилганда ранг-сизланади.
‘ 5KaSOa + 2КМпО4 + 3H2SO4 = 2MnSO4 + 6K,S0* * 4- ЗН2О
SO2- + Н20 — 2е~->- SO2- +2Н+ I 5
MriOj-4~ 8Н+4- 5e-->Mna+ + 4H2p|2 '
5SO2-+2MnO^+16H++5H2O^5SO2-+2Mn2++ . .
+ 10H++8H2O
Тиосульфат иони реакциялари-^S20|-
Барий хлорид реактиви — ВаС12
Барий хлорид — ВаОД тиосульфат эритмасидан о^ рангли чукма — BaS2O3 — тиосульфат барийни ажратади. - '
BaClj + Na2S2O3 = BaS2O31 + 2NaCl
• Ва2++ S2q~ = BaS2O, |
BaS2O3 чукмаси хоссаларини текшириш
Ч^кма минерал кислоталарда эрийди:
BaS2O3 + 2НС1 = ВаС12 + H2S2O3.
BaS2O3 + 2Н+ = Ba2+ + S02 f + S | + H20
Сульфат кислота реактиви — H2SO4
Тиосульфат эритмасига суюлтирилган сульфат кислота кушиб. цайнатганда элементар олтингугурт чи^иши натижасида эритма секин-аста лойцаланади:
Na2S2O3 4-H2SO4 = Na2SO4 + S021 + S | 4-Н20
S2O2- 4- 2H+ = S02 f 4- S j 4- H20
[Хлор иони реакциялари — CI~ —
Кумуш нитрат реактиви — AgNO3
Кумуш нитрат —AgNO3 хлорид эритмаларидан fo-ваксимон ок чукма — кумуш хлорид — AgCl ажратади.
AgNO3 + NaCl = AgCl) + NaNO3 .
Ag+ + Cl~ = AgCl | -
AgCl чукмаси хоссаларини текшириш
1. Чукма нитрат кислотада эримайди. »
2 - 2. Чукма мУл мицдордаги аймиак эритйасида эрий-
С ди: ' 4 .
t AgCl+-2NH^H^'[AgHW CI + IHjO
Г / AgCl + 2NH4OH = lAg(NH3)al+'+ Cl~ + 2H2O
Бромид ион реакциялари — Вг- :
Кумуш нитрат реактиви — AgNO3
Кумуш нитрат реактиви — AgNO3 — бромид эритма-* ларидан сарриш рангли чукма — AgBr ажратади (чуктиради).
AgNO3-г NaBr = AgBr | + NaNO3 Ag+4-Вг“ = AgBr 4 ?*' 1
& AgBr чукмаси хоссаларини текшириш
С 1. Чукма нитрат кислотада эримайди. ,
2. Чукма мул мИЦдордати . аммиак, эритмасида цис-
I)' май эрийди:
Г ' AgBr + 2NH4OH = [Ag(lQHa)J Br 4- 2HaO
AgBr + 2NH4OH = [Ag(NH3)J+ 4- Br“ + 2H,O
E . Хлорамин рейктиви—Cl2 *
| Хлорамин — Cl2 кислотали мухитда бр<Умидлардан В Узига хос-рангли эркин бром ажратади. Реакциянинг | бориши: бромид эритмасига 2—3 томчи H2SC>4 эритма^ си, 2—3 томчи хлорамин сув ва бир неча томчи эфир ёки f бензол, солиб, пробирка чайкатилади. Элементар бром эфир, цатламини сарик-зарралдод рангга буяйдн.
2NaBr + С12 = 2NaCl 4-Вга 2Вг-4-С12 = 2С1- + Вг2
, Йодид иони реакциялариJ-“
Кумуш нитрат реактиви — AgNO3
Кумуш нитрат'— AgNO3 йодид эритмасидан оч-са-рид рангли кумуш йодид —AgJ чу^ласини ажратади.
AgNO3 + Nal = Agl| + NaNO,
< Ag+4-I- = AgI| .
16* ’ ' 243
AgJ чукмаси хоссаларини текшириш
1. Ч^кма нитрат кислотада эримайди.
2 Чукма мул мицдордаги аммиакда эримайди.
Хлорамин реактиви —С12
Хлорамин — С12— кислотали мудитда йодидлардан узига хос'ранглйэркий йод ажратади. Реакциянинг ба- • жарилиши: йодид эритмасига, 2—3 томчи H2SO4 эритмаси, бир неча томчи эфир ёки бензол ва 2—3 томчи хлорамин солиниб, пробирка чай^атилади. Элементар йод эфир ^атламинй малина-бинафша рангга б^яйди.
2NaI + Cla = 2NaCl + Ia, '
2Г 4- С1а = 2СГ~ + 1а
•S, Р, d- ЭЛЕМЕНТЛАРНИНГ КИМЕВИЙ ХОССАЛАРИ
- S, р, d- ЭЛЕМЕНТ ТУЗЛАРИ ЭРИТМАСИНИНГ КОНТРОЛЬ-АНАЛИТИК АНАЛИЗИ
Мавзунинг мацсади: 1. s, р, d- элементлар кимёвий •хоссаларини биологик системаларга мувофицлаштирилг ган ^олда муста^камлаш. '
2, Доривор препаратлар таркибидаги s, р, d-элемент-лари сифат аналйзини олиб бориш у^увига эга булиш.
Урганилаётган мавзунинг а^амияти. Сифат анализи усуллари тиббий амалиётда биолргик объект ва доривор препаратлар сифат таркибини аницлашда кенг ишлатилади. ХаР бир тиббиёт ходи ми бу усулда ишлашни билиши керак.
Лаборатория иши
/s, р, d-элемент тузлари эритмасини контрол-анали? тик жизатдан текшириш (анализ эритмада бйтта катион ва,битта анион борлигига асосланган).
Талаба анализ учун 20—30 мл s, р ёки d-элемент т’узи эритмасидан олади. Анализ б^лИб-б^либ олиб бо-рйлади.- Катион ва анион текширилаетган эритманинг ало^ида-ало^ида ^исмларида очилади.
Лаборатория ишининг бйжарилиши (Анализ ^илиш тартиби)
1. Бошлангйч кузатув ва текширувлар.
Текширилаётган эритманинг таш^и куринйши, ран-гини белгиланг, эритма рангига цараб унда айрим ион турлари борлиги<\а^ида ^бошланрич хулоса чицаринг:
2. Эритма реакциясини (му^итини) анИ^лаш.
л Эритма (му^итини) реакциясини анидлаш учун универсал индикатор ^огоздан фойдаланилади:
.244
'l J'- - * .
Ион ранги Ионларнинг бфлйш э^тимоллигн Тфлдириш
Хаво ранг Си2+ ' Агар эритма рангсиз
сари^ Fe3+- - булса, унда жадвалда
^ирмизи . Со2+ ' ' келтирилган нойлар
ОЧ- ЯШИЛ ' Ni2+' • булмайди
бицафша- яшиЛ Сг3+ .
Инпфрий му^ит текширилаётган- эритмада куйли асос ка-тионлари К+, Na+, Са2+, Ва2+, Sr2+ бОрлигйдаЬ далолат беради, кислотали му^иг кучсиз асос катйонлари llg2+, Мп2+, Fe2+, Fe3+, Со2+, NP+, Cu2+, Hg2+, Ag+, Pb2+, Bi8+ ва бошдалар борлигйдан далолат беради. .
3. Уювчи инпуорлар таъсири,
• Агар эритма кислотали ёки нейтрал му^итга эга бул-са, пробиркага 2—<3 томчи NaOH эритмасидан солина-ди. ^оеил булган (ёки 6fлмаган) чукма р^нгини белгиланг на эритмада у ёки бу ион борлиги ^ацида хулоса чицаринг. -
7 ' Хосил болтан ч^кма ранги Од, давода кУнгир туе-га киради Б^рик яшнл Зангсимон КУк - Хаво ранг Сарик I. Кора О- '
катион Мп2+ Fe2+ Fe3+ Со2+ Си2+ Hg*+ Ag+ Hg|+ Mg2* Bi3+
Бошланрич текширувлар бажарилгандан сунг эрнт-мадаги катион ва анион анализини Хуйидаги тартибда олиб бориш керак?
Катионни анидлаш
Анализ .текщирилаётган эритманинг ало^ида кисми-# да (улушида) бажарилади. ’
4 Ag+, Hg|+, Pb2* катионларй борлигини аницлаш
? 5 томчи текширилаётган эритмага 3 — 5 томчи НСЬэрит-
г маси томизилади. Чукма ^осил булиши Ag+, Hg|+ ёкйРЬ2+ ? борлигини курсатади, Агар чукма тушса, унга NH4OH эрит-? маси таъсир э?тирилади. *
р ’ 4. 4.1. Ag+ ни анидлаш. Чукманинг мул михдордагй i; NH4OH да эриб кетйши Ag+ катиони-борлигини курсатади.
£ 4.2. РЬ2+ ни аниХлаЩ. Агар' чукмгГ^а мул миедорда
<-NH4OH таъсир эттйрилганда ^еч дандай узгарйш б^лмаса,
Pb2+ ионлари бор деб здгсобланадц. Уларнинг борлиги цу-йидаги реакция билан тасдшутанади: 5 томчи текширилаётган эритмага 3 томчи KI эритмасидан солинг. Бунда сариц ранг-ли аморф чукма ^осил булади. Чукма устига 1 — 2 томчи СН8СООН солиб иситилади. Чукма эрийди, аммо пробнркани совуц сувга солинганда яЛтиро^ тилла ранг кристаллар х,о-сйл булади. '
5. Ва2+, Са2+, Sr®+ катионлари борлигини ани^лаш .
*5 томЧи текширилаётган эритмага 1 томчи этил спирта ва 3—5 томчи Сульфат кислота цушинг. (X чукманинг ту-шиши текширилаётган эритмада Ва2+, Са2+, Sr2+катионлари борлигини курсатади.
5.1. Ва2+ ни аншугаш. 5 томчи текширилаётган эритмага 3 томчи CHaOOONa ва 3 томчи К2Сг2О7 эритмасидан цуша-миз. Сари^ чукма \осил булиши Ва2+ катиони борлигини курсатади.
5.2. Sr2+ ни ашщлаш. 5 томчи текширилаётган эритмага 3— 5 томчи гипсли сув — CaSO4-2H2O дуШйб, сув ^аммсь мида иситинг. 0ц лойца ^осил булиши Sr2'+ борлйгини курсатади. •
5.3. Са2+ ни ани^лаш. 5 томчи текширилаётган эритмага 3 — 5 томчи (NH4)3 С2О4 эритмасидан иушамиз. Сирка кис-лотада эримайдиган ок, чукманйнг хосил булиши Са2+ катй-онй борлигини курсатади. ,
6. Cu2+, Со2", Ni2+ катионлари борлигини ани^лаш
5 томчи текширилаётган эрцтмага 5 томчи NaOH эритма-" си цушинг. Чукмага мул мицдорда 25 % (масс) ли (концентрланган) аммиак эритмасидан крушин г. Чукманинг тулии эриб кетиши Cu2+. Со®+. Ni2+ борлигини курсатади.
6.1. Си2+ ни ани^лаш. Б томчи текширилаётган эритмага 1 томчи ЙН4ОН эритмасидан цушинг. Яшил тусли (фе-руза ранг) чукма ^осил булиши ва уни NH4OH нинг мул мицдорида эриб, интенсив кук рангли эритма х,осил цилйши Си2+ катиони борлигини курсатади^
6.2. Со2+ ни ани^лаш. 2 тОмчи текширилаётган эритмага аралаштириб туриб 5 томчи ацётондаги NH4SCN нинг туйинган эритмасидан ^ушинг. Со2+ катиони иштирокида эритма кук рангга буялади.
6.3. Ni2+ ни ани^лаш. 5 томчи текширилаётган эритмага 2 томчи СН3С0ОН, 2 томчи CH3GOONa эритмасидан ва 3 томчи диметилглиоксим эритмасидан цушинг. К,ирмизи-к,и-зил рангли чукманинг з^осйл булиши,Ni2+ катиони борлигини курсатади.
7. Mg2+, Mn2+, Fe2+» Fe8+, Hg2+, Bi3+ катионлари борлигини аницлаш
5 томчи текширилаётган эритмага 8 —10 томчи NaOH
эритмасидан ^ушамиз, Чукманинг ^осил булиши Mg2+, Mn2+, Fe2+, Fe3+, Hg2+ ёки Bi3+ борлигини курсатади.
7.1. Fe2+ ни аниклаш. 5 томчи текширилаётган эритмага 1—2 томчи НС1 ва 2 Томчи К3 [Fe(CN)e] эритмаларидан душинг. Тук кук рангли чукма тушиши Fe2+ катиони борлигини курсатади.
*7.2. Fe3+ ни аниклаш. 5 томчи текширилаётган эритмага 8 — 10 томчи KSCN эритмасидан цушинг. Эритмада кип- кизил рангнинг к°сил булиши Fe®+ борлигини курсатади.
7.3. МпИ ни аниклаш. 5 томчи текширилаётгай эритмага
3 томчи NaOH цушиб, шиша та^ча билан чукца цунгир . тусга киргунча аралаштиринг. Сунгра 3—5 томчи оксалат кислота кушиб чукма тулик^ эригунча аралаштиринг. Эрит- , манинг пушти рангга буялйши Мп2+ борлигини курсатади.
7.4. Bi3+ ни анн^лат. 5 томчи SnCja эритмасига 3 томчи NaOH эритмасидан цушинг. Косил булган чукмайи NaOH нинг мул миддорида эритинг. К°сил килинганаралашмага 3 томчи текширилаётган эритмадан ц^шинг. К^ора рангли -чукманинг косил булиши Bi3+ катиониборлигини курсатади.
7.5. , Hga+ ни аниклаш. 5 томчи текширилаётган эритмага 2 томчи KI эритмаси цушинг. \осил булган кизил-зар-, галдоц чукмани мул микдордаги KI да эригинг.
Косил килинган эрйтмага 1 томчи NH4C1 ва 5 томчи NaOH кушилганда цизил-кунрир рангли чукма тушиши Hga+. катиони борлигини курсатади.
7.6. Mg2+ ин аниклаш. Пробиркага 5 томчи йодли сув солинг ва эритма рангсизлангунча ИаОН да куллайгай шиша таёкча билан аралаштиринг. Шу аралашмага текширилаётган эритма цушилганда тук кунгир чукма косил булиши магний борлигини курсатади.
8 . А13+, Сг®+, Zna+ катионлари борлигини текшириш
5 томчи текширилаётган эритмага 3 томчи NaHC03 эритмасидан кУшинг- Чукма косил булиши А13+, Сг3+, Zna+ катионлари борлигини курсатади. ’ ,
8.1. А13+ ни аниклаш. Фильтр к°гоз булагига текширилаётган эритмадан J томчи томизинг. Фильтр koi-озни кон-* центрланган аммиак идиши устига'куйиб аммиак бури билан ишлов беринг. Догни периферияси (чети) буйича. ализарин эритмаси капилляра билан ураб чикинг ва яна газсимон аммиак билан ишлов беринг. Аммоний иштиройида бинафша фонда кирмизи- кизил ранг косил булади.
8.2. Сг3+ ни аниклаш. 5 томчи текширилаётган эритмага
1 — 2 томчй СН3СООН эритмаси, 1—2 . томчи CH8COONa ва 5 томчи комплексон III эритмасидан к$1шнг. Аралашма-ни иситинг. Хром; иштирокида 2 — 3 минут киздиргандан кейин бинафша ранг косил, булади. . .
8.3. Zn2+ ни аниклаш. 5 томчи текширилаётган эритмага 3 томчи NaOH эритмаси кушинг. ^эсил бу'лган чукмани NaOH нинг мулмшухорида -тулии, эритинг. 5 томчи Na2S эритмаси цушинг. Ок аморф чукма х,осил булиши Zn2+ борлигини курсатади.
Агар йцорида келтирилган реагентлар билан катион то-лилмаса, эритмада Ass+, К+, Na+ катионлари булиши мумкин. Улар куйидаги усулда аницланади. л
. 9. As8fни аниклаш
5 томчи текширилаётган эритмага 3 томчи Na2S2O3, 2 томчи НС1 цушиб аралаштиринг ва киздиринг. Сар’йк чукманинг тушиши As3+ катиони борлигини курсатади. "
10. К+ни аниклаш
$ томчи текширилаётган эритмага 3 томчи янги тайёрлан-ган Na3 [Co(NO2)9] эритмасидан кушинг. Сарик чукма к°сил булиши К+катиони борлигини курсатади.
11. Na+ ни аниклаш
5 томчи текширилаётган эритмага-5 томчи К [Sb(OH)e] эритмаси. кушинг. Эритмани совитинг, шиша таёкчаХ билан пробирка деворларига ишкаланг. Ок чукма к°сйл булиши Na+ катиони борлигини курсатади. »
Анионни* аниклаш. Анализ текширилаётган эритманинг алокида улушида бажарилади. .
1. SC^-, SO2-, S20ij ”, СО|_, РО3-, анионлари борлигини текшириш. '
5 томчи текширилаётган эритмага 3 томчи ВаС12 эрйтма-сидан кушинг. Чукма косилбулиши юкоридаги анионларнинг бирк-борлигини курсатади. <
1.1 SO|~ ни аниклаш. Чукма тушса, уни икки кисмга ажратинг: 1-сига мул микдорда НС1 эритмаси, 2-сига мул микдорда NaOH эритмасидан кушинг. Иккала к0^3 Лам чукманинг эримаслиги SO|~ аниони • борлигини курсатади.
1.2. SO,- ни аниклаш. 5 томЧи текширилаётган эритмага 2 томчи H2SO4 эритмасидан ва 2 томчи (томчилаб) КМпО4 эритмасидан кушинг. КМпО рангсйзланиши SO^- борлигини курсатади. с
Г.З. S20|~ ни аниклаш.5 томчи текширилаётган эритмага 3 — 5 томчи H2SO4 эритмасидан кушинг. Ок лойка к°* сил булиши Э2О^— аниони борлигини курсатади.'
1.4. СС§-ли аниклаш. 5 томчи текширилаётган эритмага 5 томчи НС1 эритмасидан кушинг. Одакли сувни лойка-лантирувчи газ ажралиб чикиши СО^-борлигини курсатади.
1.5. PQ3— ни аниклаш. 5 томчи MgCl2 эритмасига 2—3
Г'- - ; '
?•' томчи NH4OH ва 5.—6 томчи NH4C1 эритмалари душинг. г Олин гай «магнёзиал аралашмага» 3 томчи текширилаётган
эритмадан душинг. Од чукма тушиши РО^~ аниони борли-гини курсатади.
2. S2~, С1~, Вг~, 1Г анионлари борлигини текшириш
5 томчи текширилаётган эритмага. 2 томчи HNO3 ва 3 томчи AgNO3 эриТмаларидан душинг. Чукманинг досил бу-лиши юдоридаги анионларнинг бири борлигини курсатади.
Д.1. S2’’ . ни анидлаш, Текширилаётганэритманинг бир дисмага AgNO3 таъсир эттирилганда Дора чукманинг тушиши S2- борлигини курсатади. J3yанион* борлигинк текширилаётган эритманинг бир дисмига Cd(NOa)2 таъсир эттириб тас-дидланади. Сарик; чукманинг тушиши S2~ аниони борлигини тасдидлайди. - ’’
2 .2. С1 ни анидлаш. 5 томчи текширилаётган эритмага , 2 томчи HNO3 эритмаси ва 3 томчи AgNO3 эритмасидан \у-шинг. -NH4OH мул мидДорда ту ла эрийдиган од чукманинг досил булиши С1^ аниони борлигини курсатади. х /
2Д. Вг" ва 1~ ни анидлаш. 5 томчи текширилаетган эритмага 3 томчи сульфат кислота, бир неча томчи эфир ёки бензол ва 2 томчи хлорамин душинг. Эфир датламининг . саргиш-дунгир рангга б^ялиши Вг~, -малина-бинафша рангга буялиши эса 1“ аниони’ борлигини курсатади. -
3. NO~ ни анидлаш
5 томчи текширилаётган эритмага 2 томчи H2SO4 эритмаси, 3 томчи КI эритмаси ва бир неча томчи эфир ёки бензол душинг. Эфир датламини ажралиб чиддан эркин- йоД. бинафшаррангга б^яШи NO~ анйони борлигини курсатади.
4. NO” ни анидлаш
5 томчи текширилаётган эритмага бйр неча булак FeSO4-• 73НО кристалидан солинг ва пробирка девори буйлаб 1 томчи концентрланган .сульфат кислота душинг. Кристалла^ устида дора далда куринишидапгкомплекс досил булиши NQ^ аниони борлигини курсатади.
Катион ва анионни анидлагандан сунг улар борлигини;. узига хос сифат реакциялари билан тасдидланг. Агар дамма . узига хос сцфат реакциялари анидланган катион ва анионни тасдидласа, эритмаси анализ дилинган туз формуласини кур-сатинг.
Туз эритмаси контроль-аналитик аналнзини илмий рефе-рат билан якунланг. *
ИЛОВА
Жадвалда келтирилган маълумотлар профессор Ю. А. Ершов та^рири остида тузилган методик дулланмадан олинган.
- Физикавий доимийлар
Авогадро сони —/VA = 6,02-1083 лоль”1
Универсал газ доимийси — 7? = 8,31 кЖ/моль (кПа •
л1К.'моль; Па м9 (К/моль)
Газнинг нормал моляр ^ажми,—= 22,4 л/моль Планк доимийси—ft— 6,63 • 10“8* Ж]сек.
Электрон заряди — е — 1,60-10-1# Ал. <
Фарадей сони — F = 9,65-10* К л/моль
1-жадвал
* Улчамлар халдаро системам (СИ) нинг асосий бирликлари
Катталак . Бнрлик
кома | белгися
I. А С о еий катталиклар *
Узунлик метр. м
Вадт секунд : С
Масса килограмм кг
Электр ток кучи ампер А
Термодинамик дарорат кельвин К
Модданинг миддори МОЛЬ п
II. Вадт ва кенглик катталиклари купайтмаси
Хажм куб метр
Тезлик метр секунд м/с.
III. Механик ва иссидлик катталиклар и купайтмаси
Зичлик куб метрлардаги ки- кг/м*
Босим лограмм
Паскаль Па
Энергия, иш, иссидлик миддори, термодинамик ( Ж /
потенциал Жоуль
Энтропия ‘ Жоуль/Кельвин
Баъзи тузларнинг турли дароратдаги сувда эрувчаялиги (1г сувсиз модда 100 г сувдд)
. Модда o°c 10ч: _ 20е C 30°C 40°C
1. AgNOs Z 122 170 222 300 376
2. CuSO4-5H2O . 14,3 17,4 20,8 25 28,5
3. HgCl, 4,3- 5;6 6,6 8,3 9,9
4. . КС1 27,6 31,0 34,0 37,0 40,0
5. NH4C1 29,4 33,3 37,2 41,4 45,8
6. NaCl 35,7 35,8 36,0 36,3 36,6
7. Са(ЙСОэ)2 14,2 —. 14,3 —r 14,5
8. LijSO* 26,2 —• 25,7 24,5
9. MgSO4-H2O -7 38,6 co 36,3
3-жа двал
Баъзи органик моддаларнйнг ёниш нссицлиги
Модда Хрлати Ениш КЖ/ МОМ Модда Холати Ёниш. кЖ/моль
CH4 CCXNHjh c,H4 CjHjOH * г Ki\ г * с -882 -634' — 1390 —1370 С4Н12Ов C^lgOg CHSCOOH - 1 с с кр с ООО Ь- . ац • — — со г** со со сч со , ;1 1 1 1 „
4-жадвал
Тиббиёт ва фармацияда хулланиладиганбаъзи анорганик моддалар--нинг' сувда эржн иссицлиги
К Модда ДИ» эриш кЖ!мом ; Модда ДИ* эриш и)К.!м^ль
Г. AljfSOJj —350,5 MgCl2-6H2O —12,3
[>• СаС12 — 75,3 NtagCOg —23,6
CaCh-eHjO — 19,1 NajCOj-lOHjO —67,5
CuSO4 — 66,5 NajSO4 — 2,3
CuSO4-5H/> ^-11,6 Na2SO4- ЮН2О z —79,1
У/ КС1‘ — 16,7 ZnSO4 —77,6
fe к: 5-жадв ал
Тиббиёт ва фармацияда цулланиладиган баъзи моддаларнйнг термодинамик хоссалари
Д H°itt — модданинг досил б^лиш стандарт иссш$лиги, ЮК/моль
Д6°аи— оддий модалардан мураккаб модда досил булишада Гиббс энергиясининг стандарт энхропияси, кЖ/моль
Д£ам — модданинг стандарт энтропия си,л/мсмъК
Жадвалда хдбул килинган цийдартмалар: кр.— кристаллик долаг, г —гаасимон холат; aq —сувли эритмадаги модда миддорини курсатади.
МоДда ёки ион Холати Д Я’,,, ’ЛО»„. I A»S° не
1 ' 2 з 4 , | 5
' -'С графит 0 - 0 5,7
с олмос 1,9 2,9 2,4
со г —111 —137 198
со, Г ' —394 —394 214
со, aq -413 —386 121
ЩСОз aq —700 -623 187
HCOS- aq —691 -587 95
СО|- - aq -676 —528 —53
Са’+ aq . —543 —553 —55
СаО кр. —636 -604 40
Са(ОН)2 кр. —987 —897 76
CaSO4 кр. —1430 —1320 107
CaSO4-2H2O кр. —2020 —1790 194
• ' CaCI2 ; кр. —795 —750 114
СаС12 aq —877 —815 - 55
- СаС12-6Н2О кр.. —2600 t —
С1а г - 0 0 223
НС1 , Г ’ —92,3 —95,3 187
на aq — 167 — 431 ' 55
CuS04-3H2O кр.' —1680 —1400 225
CuSO4-5H2O кр. —2280 —1880 303
Н2О С —286 . —238 70.
Н2О г —242 -229 189
Н2О2 с ' —188 — 118 —
Н2О2 aq '—191 аша* • , . — .
КВг aq -372 —385 183
КС1 Г —216 —235 240
ка aq —419 —414 158
KJ aq —307 —334 212
• КМпО4 кр. —814 —714 172
MgCl2-6H2O кр, —2500 —1280 366
, ' 6-жадвал
Баъзи индикаторларнинг хвееалари
Индикатор Ранг узгариш оралиги Индикатор рК Индикатор ранги , < ' '
кислота шакли асос шакли
Метил заргалдок; 3,1—4,4 4,0 ХИЗИЛ сарш<
Метил хи?или 4,2-6,2 5,5 Хизил . сарих
Лакмус 5,0—8,0 7,0 Кизил kJk
п—нитрофенол 5,6—7,4 6,5 рангсиз сарих
Нейтрал хизили 6,8—8,0 7,‘5 ' дизил сариц-
-Фенолфталеин 8,2—9,8 9,0 рангсиз малина ранг
Тимолфталеин 9,3—10,5 9,9 рангсиз к£к
. 7- жадва л
Эритмй концентрациясини ифодалаш усуллари •
Номн Улчами Хисоблаш формулалари
1 2 3 -
Моляр концентрация е (X) моль! л с(Х)= V (эр-ма) _ т(Х)
Эквивалентнинг моляр кснцентрапияси с (-*—х) 2 моль/л М(Х;У(эр-ма) /1 ч /1 \ V г' / с —xU--\- л — •-\г V^p-ма) - ш(Х)
\ Ml—X рУ(эр-ма) \. s /
Молял концентрация (моляллик) моль!кг . в(Х}= п(‘Х1— = т(эр-чи) — 'Ц -
Компонентнинг масса улуши W ' ЛТ(Х)-т(9р-чи) • w-
т(эр>ма)
Компонентнинг масса , улуши % ларда w% Компонентнинг моляр ' улуши А/ „ > = 100% т(эр-ма) • N- п(Х) .
п(эр-ма) Ф- ИХ) .
Компонентнинг ^ажмий улуши f Титр Т(х) г! мл У(эр-ма) Т{Х) = V (эр-ма) •
!, ' ' ' - 8- ж а два л -
.Баъзи эритувчиларнинг криоскопии ва эбулиоскопии доимий лари
Эритувчи К, град, кг/моль Е, град Камаль-
1 2 3
С. .'< ?Бензол 'Нитробензол 'Ф»рка кислота 1,86 — 5,12 6,9 3,9 0,52, - 2,57 5,27 ♦ 3,1
_ ' 9-жадвал
Баъзи кай эрийдиган туз ва гидроксидларнииг сувли эритмалардаги эрувчанлик кулаЙтмаси константалари
—-— ~ -т Модда Кэн Модда Кэк
1 - - 2 3 ; V
AgBr . 5,3-10“» Sr3(PO4)2 1,0-10“»
AgSCN 1,1-10“ » Co(OH)s 2,0-10“»
Ag2Cr(J4 1,1-10“» CuS 6,3-10“»*
AgCl 1,78-10“» Cu(OH)2 5,0-10“»
Ag2Cr2O7 1,1-10“».. Cr(OH)9 6,3-10“»
AgJ , 8,3-10“*’ Fe(OH)2 1,0-10“»
AgsS 6,3-10“»° Fc(OH)3 3,2-10“»’
A1(OH) S ? 1,0.10“*» Hg2Cl2 1,3-10“ »
BaCO3 5,1-10“’ HgS 4,0-10“M
BaC2O4 1,1-10“7 MgCOs 4,0-10“5
BaCrO4 1,2-10“» Mg(OH)2 6;0-i0“»
Ba3(Po4)2 '6,0-10“» Mg3(PO4)2 1,0-10“»» •
BaSO4' - 1,1-10-» Mn(0H)2 4,5-10—18
СаС^з 4,8-10“’ MnS 2,5-10“»
2,3-10“’ PbCl, - 1,6-10“?
CaSO4 9,1-10“* PbCrO4 1,8-10“»
Cas(PO4)r ' 2,0-10“»’ PbJ2 1,1-10“’
CdS . 1,1-10-*’ Pb(OH)2 1,1-10“»’
PbSO4 1,6-10“8 PbS 2,5-10“»’
SrCOj 1,1-10“» Zn(OH)a 7.1-10-1’
SrCrO4 3,5-10“» ZnS - 1,6-10“»*
t>rCgO4 5,5-10“* ZnCO3 1,4-10-“
10-жадвал
Турли з(ароратдаги сувнинг ионли куНайтмаси
oc •c KH,o10“ , *c ' Kh,O10“
0 0,11 30 1,48 60 9,55
5 0,17 35 2,09 70 15,8
10 0,30 37 2,4 80 25,8
15 0,46 40 2,95 90 38,8
20 25 0,69 1,0 50 5,50 : 100 55,0 4 >
11- ж а л вал
25°С да стандарт оксидланиш-цайтарилиш потенциаллари
Электрод реакцияси E’, V
[Ag (NHJ31+ -H-* A g + 2NH3 +0,373
H,AsO4 + 2H+4-2 e-*• HAsO2 + 2H2O . ~+0,56
Br24- 2e*-*2Br— +1,065
Кислота* ва асос диссоциация констант аларн
Кислота К . РК
' . .1 . - ' 2 - 3
HjSO, К != 1,4-10“» 1,85
К2=6,0-Ю“» 7,20
H,s К1== 1,0-10-» » 6,99
н^со» К3=2,5-10-1’ . 12,60
Ki=4,5’10—» ’ ч 6,32
н.РО4 К2==4,8-10-11 •10,35
Кт^г.ыо-» | 2,15
К2=б,2-10“’ 7,21
. К.=5,0-10-1’ 12,0
Н,С4Н4О, g , К1®1,3-.10-» 2,89
К2=3,0-10“» , 4,52
СН.СООН н2с2о4 К,=1,74-10“» 4,76
Кх=5,6-10-» 1,25
K2=5,4-10“’ 4,27 '
nh4oh 1,76-10-» 4,75
Н»О •' 1,8-10-1’ 15,74
Са(ОН)2 К*2=4,040-» 2,40
Сй(ОН)2 К2=7,9-10-1’
Мп(ОН), ^=3,0-10-*' •
Zn(OH)2 Ki=4,4-10- » 4,36
'К2=1,5-10“• 8,83
13-жадвал
Сувли- эритмалардата баъзи комплекс юиларнииг бецарорлик константаси
Комплекс ион 1 Кбедарорлик Комплекс ион Кбедярорлик
1 2 3
[Ag(CN)2]~* Ag(NH3)2]+ AgINO2)2r Ag(SCN)2]“ |Ag(S2OJ)2]»-Cu(NH3)4)»+ Co[NH3)4)*^- Co(NUe).]»+ ICo(SCN)4]»+ 1,4-10-»» 5,75-10-^’ 1,48-10“» 5,37-10-»4 3,4.7-10^1» 9,33-10“i’ 4,07-10-’ 8,51-10-’ .6,31-10-» Fe(CN).j’“ Fe(CNeJ3“ Fe(SCN)3]’— [HgBr4]«-HgJ4]»-Ni(NH3)4]»+ Zn(NH.)4I»+t [Zn(SCN)4J’— A 6,17-10“” 1,0-10“»’ l,0-10T’x 5,99-10“« l,0-10“«i. 1.5-10-»» 3,4-10-’ 2,0-10“» 2,0-10-’
V 256 -- •_
14-жадвал Баъзи моддалар сувли аритмаларининг зич^вги ва коицен* трацняси (20°С)
р е/мл ®% р е/мл а>% p е/мл • P г/мл w%
1 ’ 2 3 4
1,0053 1,0268 1,0032 1,0181 1,0474 1,0036 1,0201 1,05443 . 1,0781. 1,0051 1,0250 1,0661 1,0947 <1,1394 1 4 1 4 10 Г 4 10 14 1 4 10 14 20 Натри б хлор ид 1,0707 10 1,11'62 1,1009 12 1,1478 Xл о ряд висл о та 1,0675 14 ' *1,1187 1,0980 20 1,1493 Нитрат кислота 1JJ50 20 1,2205 1,1404 ' 24 |,2463 1,1666 22 ’ 1,2847 13800 30 1,3100 Сульфат кислота 1,2185 30 1,4350 1,2515 34 1,4983 1,3028 40 1,5421 . 1,3384 44 . 1,6105 1,3951 50 1,6573 16 20 . 24 30 36 ' 40 46 50 54 60 64 70 74 1,1640 1,1972 1,1691 1,1980. 1,3219 1,3449 1,3866 1,3959 . 1,7272 1,7693 1,8144 1,8312 1,8361 22 . 26 . .34 40 52 56 64 66 80 . 84 90 94 93
15-жадвал Одам органнзмидаги кИмёвнб элементлар миддори — -• • - — : : : 11_— I -.
Мнедорн, огнр-лик процеятн Элементлар
10 1- 1р О', 01—1 10-’—10-* 10-*—10~8 io-*—ю-» 10-?—ю~* 10-«—10-» 10-’—10-* 10-*—10-» 10-’—Ю-* 10-?—10-* 10-м—10~* 0(62) С(21) Н(Ю) N(3) Са(2) Р<1) tK(0,23) S(0,16) С1(0,1) Na(0,08) Mg(0,027) Fe(0,01) ’Zn, Sr Cu, Cd, Br, Si, Cs J. Sn Мп, V, B, Si, Cr, Al Ba Mo, Pb, Ti Be, Ag , Co, Ni, La, Le, As, Hg, Bi Se, Sb, U Tb 4 . . Ru
258
сл
. Декада
I II III IV V
VII VIII
IX X
XI
XII XIII .
Кимёвий элементларнинг ер цатламида тар^алганлиги (В. И. Вернадский декадаларй буйщк)
Огирлик (% хисобида)
>10 • i-io-10-1—1. 10-2—10-1 10-3—10-2
10-*—10-8 '
10-8—10-4 10-8—10-»
. 10-’—10-« 10-8—10-’. . 10-8—10-8 10-10—10-8 ‘ IQ- ll;10-10
Элементлар
0(49,13) $1(26,00) г
А1(7,45), Fe(4,20).,'Ca(3,25), Na(2,40), К(2,35), Mg(2,35), Н(1,00)
Ti.(0,61), С(0,35), СЦ0.20), Р(0,12), $(0,10), Мп(0,40)
F, Ва, N, Sr, 2г, V, Ni, Zn, В, Си, Sr ’
Rb, Li, V, Be, Ce, Co, Th, Nd Pb, Ga, Mb, Br
U,; Vb, Dy, Gd, Sm, Er,’ La, Sn.
Sc, W, Cs-, Cd, As, Pr, Hf
Ar, Zr, Ag, Tu, Ao, Tb, J, Ge
Se, Sb, Nb, Ta, Eu; Jn, Bi, Tl, Ag
Pd, Pt, Л, Os, Po, Au, Kb, Gr, Те, He
>Ne, Re, Tc . '
Ra Pa
17-жадв'ал
Баъзн атом ва ионларнинг радиуслари (пм)
Атой, ион Ядро заряди атоми иони Атом ион Ядро заряди атоми иони
1 2 3 4 1 2 3 4
Н^Н-Не 2 . 53 208 Li, Li+ 3 155 60
1 93 — Be, Веа+ . 4 112 31
в, в»+ с с*+ 5 98 20 Zn, Zna+> 30 138 74
6 91 15 Ga, Ga3+ • > 31 141 62
ю №~ 7 92 171 Ge; Ge*+ 32 137 53
О Оа~ 8 73 140 As, As’+ 33 139 47
F F* 9 72 136 Se, Se»~ . 34 140 Ю8
Ne 10 71 Br, Br- 35 .114 195
11 190 95 Kr 36 112 —
Mg, Mga+ Al, Al3+ Si Si4+ 12 . 160 65 Rb, Rb+ 37 246 148
13 143 50 Sr, Sra+ 38 215 113
14 132 41 V, V3+ 39 178 93
P,’PS-S, S*~ ci, ci-Af 15 128 212 Zr, Zr4+ 40 160 80
16 127 184. Nb, Nb3+ 41 146 70
17 99 181 Mo, Moe+ 42 139 62
18 98 —- •Ru, Ru3+ 44 134 69
К K+ 19 235 133 Rh, Rha+ . 45 134 86
Ca Caa+ 20 197 99 Pd, Pda+ 46 137 86
•Sc, Sc3+ Ti Ti4+ 21 162 87 Ag, Ag+ A7 . 144 126
22 T47 68 Cd, Cda+ 48 154 97
V * v»‘+ 23 134 59* ’ In, In3+ 49 166 81
Cr, Cr'+ Mn Mn’+ 24 130 52 Sn, Sna+ 50 162 112
25 . 135 56 Sb, Sb®+ 51 159 62
26 126 76 Te,Tea+ 52 160 221
Co, Coa+ 27 125 74 J, J- 53 133 216
Ni Nia+ 28 124 . 72 Xe 54 131
Cu Cua+ 29 128' 69 Cs, Cs+ 55 267 169
Ba Baa+ 56 222 135 Pt, Pt»+ 78 139 96
57- 187 115 Au, Au+ 79 146 137
Ta, Tae+ 73 149 73 Hg, Hg4 '80 -157 НО
W, W4+ 74 141 68 Ta, Ta®+ 81 171 95
Os , bs4- 76 135 69 Pb, PbH-. 82 175 120
Ir, lr4+ 77 136 66 Bi, Bi®+ 83 170' 120
18-жадвал
Баъзи атомлариинг ионланиш энергияси (кЖ/моль)
' Атом . 1 Атом 1
1 2 2 . '
ВОДОРОД Лягай Бериллий ' 1312 2372 520 899 258 Натрий Магний-Алюминий Кремний 496 738 578 786
давоми
1 2 2 • - 2
Бор 801 Фосфор 1012
Углерод 1088 Олтингугурт 1000
Азот 1402 Хлор 1251
Кислород ... 1314 Аргон 1521
Фтор 1681 Калий 419 .
Неон 2081 . Кальций 590
Скандий 633 Стронций 549
Титан 658 Иттрий .‘600
Ванадий 650 Цирконий , 660
Хром 653. Ниобий ' 664:
Марганец 717 Молибден < 685
Темир 762 - Технеций ’ 702
Кобальт 759 • Рутений 711
Никель 737 Родий' 720
Мис 745 Палладий 804
Рух -906 Кумуш 731
Галлий .579 Индий 558
Германий 762 Кадмий 868
Маргимуш 947 Калай 709 .
Селен 941 Сурьма 834
Бром 1142 Теллур 869-
Криптон 1351 Йод 1008
Рубидий 403 Ксенон 1170
19- жад в ал
Баъзи атомларнинг электронга моййллик (^хшашлик) энергияси (кЖ моль)
Атом . в Атом Е Атом Е
1 2 1 2 '1 - 2
Водород 73 Фтор 333 Хлор 349
Гелий -21 Неон —56 Аргон . — 36'
Литий 56 Натрий 32 Калий 48
Бериллий —18 . Магний —21 Мне 118
Бор ' - 29 Алюминий 48 Бром 325 .
Углерод .123 Кремний 178 Кумуш 125
Азот ~20 Фосфор 71 Йод 297
Кислород 141 Олтингугурт 200 Цефтй Т [38
Туз ва гидроксидларнинг сувда эрувчанлиги г 20-ж а два л
1 2 3 •. 4 ‘ 5 . 6 3 7 .8 9 10 р. 11 12 13 н 15 1 , 16
1 1 J 56 46 Г 1 За .. 46 * . 1 № — g • 26 1 46 36 36 46 ’ 56 За ' 4д 36 1д • 1 1 1д 1 1д i 1 1 1 1 1 1 1Д 5в 2 5г 35. 1 1д 1 > 66 •' 1 За 56 4д 56 1 4а 4а 4а, ‘4а 56 ‘ 1 5а 5в 56 56 56 5а 56 5а 1 < 46 46 1 46 46 26 , 1 46 —и , 46 46 • 46 1 ? 2а 5д 5а 56 1 За 56 За '5а 5в' 1 5в . 56. 5в 5в 1 2— 56 1д 1 5г U 1 1д . 1 Зг 1 1 1 1 1 1 1д 4в 2г 36 4г 4г 1д 1 46 1 46 46 45 1 1 . 56 56 46 - 46 46 2 - 56 56 56 46 46 46 ,3 46 1д 2 J 1д 1 ; 1 1 1 1. т 1: 1 1 1д 1д г 1д 1 1Д 1 ,1 4д 56 46 1 . 4а 5а 4а 4а 4а 1 4а 46 56’ 4а 5а 4а 4а 1д 1 1 46’ 1 1 1 1 1 . 1 1 1 1. 36 5в 5е 5г 4а 1 1д 1 56 1 2а 56 46 56 1 • - За 56 5а 5а ,5а 'й 56 5а 4а 4а За 5а 55 1д 1 1 1д ,1д 1 1 1 • 1 1 1 . 1 1 5д 1в Зв 56 36 1 1Д 1. 1 1 1 1 • J 1д 1 1 56 1 2 1 1 1 1 Зв 2 . 1 1 ’ 1 1Д 1 1 1 46 1 56 1 46' 56 !• , 56 46 56 46 46 36 55 , 1 46 56 56 1 46 56 _ 46 46 56 1 56 46 56 56 56 36 46 56 • Алюминий Аммоний Барий' Висмут Темир (II) ТеМир III) ! Калий Кальций Кобальт Магний Марганец Мне (II) Натрий Никель Калай Симоб (I) Симоб (II) Кумуш Кургошин Стронций Хром (III)’ Рух
•Хромат £ сх О ' й. га о е 4‘’ ч О -1 ч о р 4 ч о га Г м О га СХ S X Й К о сх га э ч • о э ё £ S о н О Sf Ё я о сх < S я. . <и о сх • :-Х
90-жадвалга шартли белгилар \
18—20е ли сувдаги модда
1—яхши эрийди (5 г—100 мл да) л
2—Уртача эрийди (1—-2 г 100 мл да)
3-—Кам эрийди (0,1—1г 100 мл да)
4—ёмок эрийди (0,001—0,1 г 100 мл да)
5^- амалда эримайди (0,001 г 100 мл да)
Моддаларнинг кйслоталарга мунреабати
а —минерал ва сирка кислоталарда эрийди;
б — минерал кислоталарда эрийди ва сирка кислотада эримайди; - : * ' • -
в —оксидловчи кислоталарда (HNO3, HNOj+HCU эрийди, НС1 да эса эримайди; — - — ' , - *.< •
г — гидролизга тУскинлиК цйлувчи кислота иштирокида сувда эрийди. ’ . %
МУНДАРИЖА
1 Суз бошн . . . ......................... . . . . . . . 3
Кириш , . . . . , '. . . . .• ' 5
I боб. Кимёвий лабораторияларда ишлаш тартиби’ . . р . 7
' Кимёвий лабораторияларда ишлашда техника хавфеяз-лиги коидалари . . . . . . . . . . . . . . . .. 8 -
Лаборатория .иши. Концентрацияли эритмалар тайёр-' лат . . . . . . . . . . . . . • • • • . • ’21
Кимёвий реакциялар кинетикасн . . . . . . .. . . . 22
Маълумотлар блоки . . . . . ; » 23
Катализ,-.ферментатив катализ . . . . . . . . . . . . 27 7
Лаборатория иши. Кимёвий реакция тезлигининг турли омилларга богли^лиги . . . ’. . . . . . . . . . 33
Кимёвий мувозанат ............................................. 34’
Маълумотлар блоки . . . . . . -. . . . . . .• 36
Лаборатория иши. Кимёвий мувозанат буйича сифатий тажрибалар . . . . . . . ............; , л . . ... .... 41
Кислота-асосли мувозанат . .... . . . . . . . . .43
Маълумотлар, блоки . . . . . . , . . . ... . . 44 ;
Лаборатория иши. ЭриТмалар pH ини . калориметрик
аниклаш . . . . . ... .... . . . . . . 48
Кислота-асосли мувозанат, буфер эритмаларнинг хоссалари , . . . ^ . . .. ... ... . . . .... , 48
. Маълумотлар блоки . . . . ... .,,,................ 49
1-лаборатория иши.. Буфер эритмалар тайёрлаш ва уларнинг хоссаларини текшириш . . ... • ..... ... ' 54 ’
2-лаборатория иши. Кон зардоби буфер сигимини аник-
лаш . . . . '. , . . . . . . . ...............•. 55
II боб. Титриметрик анализга кириш . ........ 56
Маълумотлар блркн . ’. . . : ................ 56
Лаборатория ишй. Титриметрик анализда ишлатилади-диган лаборатория: Улчов идишларида ишлаш техни-каси . .... .................. . , . . . . . ’ . . 58
Кислота — асосли индикаторлар .......... 58
Маълумотлар блоки .; .... ... .... . '. ... 59
Кислота — асосли титрлаш усули . . . . . . ... 59
Маълумотлар блоки . . . . . . ... . . 63
1-Лаборатория иши. Хлорид кислота эритмаси концентра-циясини анидлаш . . .'............................... 74
2-лаборатория иши. Эритмадаги аммиак массасини контрол аналитик усулда анидлаш ...... .. ... . 75
^лаборатория иши. Эритмада бирикма до ли да учр ай дитан NaOH ва Ыа2СОз ларнинг массаси ва масса улушини анидланг . . . . . . . . . . . . .... . . 76
Оксидланнш-дайтарилиш жараёнлари . . ...... 77
Маълумртлар блоки ................................... 78
Редокс потенцйални анидлаш .' ... . . . 85
'Маълумотлар блоки 86
Лаборатория иши. Оксидланшп-дайтарилиш реакциялари-да'‘мувозанатни силжитищ . ............ 91
Океидланиш-дайтарилиш усули билан титрлаш .'. ... 92
Маълумотлар блоки . . , . . . . . . . .: . . . 93
1-лаборатория иши. Калий перманганат эритмаси» кон-центрациясини анидлаш . , . 99
2-лаборатория иши. Эритмадаги водород'пероксид массасини контрол-аналитик .анидлаш . . . . . - . . . . 100
3-лаборатория'иши. Натрий нитрит эритмаси моляр эквивалент концентрацияси ва титрини анидлаш . . . . 101
Маълумотлар блоки............. . . 102
1 -лаборатория < иши. Иод эритмаси моляр эквивалент концентрацияси ва. титрини анидлаш . . . . . ... 107
2-лаборатория иши. Сувли эритмаларда аскорбин кислота массасини анидлаш................ . .............. 107
3-лаборатория нши. Эритмадаги водород пероксид массасини контрол-аналитик анидлаш . *.. . . . . . ." 108
4-лаборатория иши. Эритмадаги формальдегид эквивалентининг моляр концентрацияси ва титрини анид- лаш ... .... . . . ... . . . . . . . ИО
Гетероген мувозанат . . ........... . Ш
Маълумотлар блоки . . ........ ..... ! 12
Лаборатория иши. Кам эрийдиган электролитларнйнг олиниши ва хоссаларини Урганиш , . . П6
Комплекс бирикмалар . ... . . . . .... ... , Н7
Маълумотлар блоки . . . . '. ..... .... . 120 .
1-лаборатория иши. Комплекс ион досил булиши . 130
2-лаборатория иши. Сувнинг умумий даттидлигинн контрол-аналитик й^л билан анидлаш . . .. . . . . .. . 131
3-лаборатория иши. Доривор препаратларда кальцийни комплексонометрик анидлаш ... . . . . , . ' . . 132
Эритмаларнинг коллигатив хоссалари . ....... 132
Маълумотлар блоки . . . . . . . . . . . .. . . . 134
1-лаборатория ишн. Нисбий молекуляр массани криометрик усулда анидлаш . ....... . . .... И2
2-лаборатория иши. Осмос тургоф ва плазмолиз додиса-ларини кузатиш-. . . . .-. ....................... 144
Кимёвий реакциялар энергётикаси. Реакциянинг иссид-лик самарасини анидлаш". ......................... 146
Маълумотлар блоки . . . . . . . ... . ... . 147
Лаборатория иши. Кучли кислота билан кучли асосни
sioixi • z • « 9 -** g 9 а • я ф в 4' Ф ф ф } а |
III боб. Биоген элементлар‘кимёсига кнриш . . . ... 154
S-элементлар ва уларнйнг хоссалари................ .. 154 •
Маълумотлар блоки . . . » ................. . . , . 157-
1-лаборатория иши. I гурух s-элемецт катионларининг . , алохи'да сифат реакцияларини урганиш . 171
2-лаборатория иши. И гурух s-элемент катионларининг хусусий сифат реакцияларини урганиш ... . . . . 173
d-элемёнтлар ва шу элемент < бирикмаларининг хосса- ,
лари . . ............................................. 176
Маълумотлар .блоки , . ........ . ..... . . . 180
.1-Лаборатория иши. Г гурух d-элемент катионларининг хусусий сифат реакцияларини .урганиш . . . . /. 201
2-лаборатория иши. II гурух d-элемент катионларининг хусусий сифат реакцияларини Урганиш . . . . . '. . 203
3-лаборатория иши;'Темир'ЪИласидаги d-элементларнинг хусусий реакцияларини текшириш , 205
4-лаборатория Иши. VI ва. VII гурух а-элемек катионларининг хусусий сифат реакцияларини Ургацти . . . 209
Р-элементлар ва шу элемент бирикмайарининг хоссалари . . . . . . •. . . . . . . . . .. . . . 211
Кислоталарнинг тиббиётдаги а^амняти . . . . .... 214
Маълумотлар блоки . . . . . . . ...... 216
1-лаборатория иши. Ill, IV, V гуру^ p-элемент к$тион-ларининг хусуейй сифат реакцияларийи Урганиш ‘ . 233
^лаборатория йши. Анионларнинг хусусий сифат реак-цияларини Урганиш . ... . . . . . . . . . . 237
3-лабораторий иши. VI ва VII гурух р-элементлари . . 241
s, p, d-элементларнинг кимёвий хоссалари . . . . , . 244
Илова .... . . . . . . . . ..... . . . 250