Автор: Рахманова А.Г. Виноградова Е.Н. Воронин Е.Е. Яковлев А.А.
Теги: лица и личные характеристики в патологии характеристики пациентов инфекционные и паразитарные болезни медицина
ISBN: 5-93673-019-0
Год: 2004
Текст
А.Г. Рахманова, Е.Н. Виноградова,
Е.Е. Воронин, А.А. Яковлев
ВИЧ-ИНФЕКЦИЯ
Санкт-П етербург
2004
A.G.Rakhmanova, E.N.Vinogradova,
E.E.Voronin, A.A.IakovIev
HIV-INFECTION
Saint Petersburg
2004
ББК 55.148
УДК 616-053.2
Рахманова А.Г. ВИЧ-инфекция. Санкт-Петербург, 2004 - 696 с
Настоящая книга является вторым, дополненным изданием книги, вышедшей в 2000
году, Л Г Рахманова "ВИЧ инфекция" В первом издании изложены разделы, касающиеся
преимущественно клиники и лечения ВИЧ инфекции, затронуты вопросы эпидемиологии,
диагностики и профилактики, приведены данные кандидатских и докторских диссертаций
сотрудников кафедры инфекционных болезней с курсом лабораторной диагностики СПИД
Медицинской академии последипломного образования (ректор - член-корр РАМН, засл
деятель наук РФ, профессор Н А Беляков) В книге учтены сведения литературы и
рекомендации Федерального научно-методического центра профилактики и борьбы со
СПИД (руководитель академик РАМН В В Покровский) Приведены материалы семинаров
Канадско-Российского проекта борьбы со CI1ИД (1999-2000)
Во втором издании расширены сведения по эпидемиологии и лабораторной
диагностике ВИЧ-инфекции, введены новые главы патогенез ВИЧ инфекции, вирусные
гепатиты и ВИЧ-инфекция Дополнена новыми сведениями глава по лечению больных
ВИЧ-инфекцией, как взрослых, так и детей Издание предназначено как руководство к
программам подготовки специалистов различного профиля по проблемам ВИЧ/СПИДа
Рецензент член корреспондент РАМН, заслуженный деятель науки Российской
Федерации, профессор Ю.В. Лобзнн.
Авторы
Рахманова Аза Гасановна, доктор медицинских наук, заслуженный деятель науки РФ профессор
кафедры инфекционных болезнен с курсом лабораторной диагностики СПИД Санкт-Петербургской
медицинской академии последипломного образования (СПбМАПО), главный инфекционист Городского
комитета по здравоохранению Санкт-Петербурга, научный руководитель Центра профилактики и лечения
ВИЧ-инфекции у беременных и детей М3 РФ,
Виноградова Елена Николаевна, доктор медицинских наук, профессор кафедры инфекционных
болезней с курсом лабораторной диагностики СПИД СПбМАПО, главный врач Санкт-Петербургского
городского центра по профилактике и борьбе со СПИД и инфекционными заболеваниями,
Воронин Евгений Евгеньевич, доктор медицинских наук, профессор кафедры инфекционных болезней
с курсом лабораторной диагностики СПИД СПбМАПО главный врач Республиканской клинической инфекционной
больницы, главный врач Центра профилактики и лечения ВИЧ-инфекции у беременных и детей М3 РФ,
Яковлев Алексей Авенирович, доктор медицинских наук, профессор заведующий кафедрой
инфекционных болезней, эпидемиологии и гигиены медицинского факультета Санкт-Петербургского
государственного университета, главный врач Городской инфекционной больницы Х»30 им С П Боткина, г
С Петербур!
ISBN 5-93673-019-0
© Рахманова А Г, 2004
© ООО "Двадцать первый век”
творческого союза работников
культуры “Возрождение”, 2004
Оглавление
Введение........................................................ 8
I Этиология, эпидемиология, патогенез, диагностика ВИЧ-инфекции.... 13
1.1. Подходы к эпиднадзору за ВИЧ-инфекцией.................... 16
1.2. Методы и тест-системы в диагностике ВИЧ-инфекции (соавторы
М.С.Воробьева, Г. И. Кирпичникова)........................... 54
Приложения. Инструкции и законодательные акты,
обусловливающие работу в лабораториях диагностики ВИЧ и
гепатитов................................................. 68
1.3. Классификации ВИЧ-инфекции у взрослых и детей........... 85
1.4. Патогенетические аспекты ВИЧ/СПИДа
(С.А.Кетлинский, Н. М.Калинина).............................. 103
2. ВИЧ-инфекция: лимфатическая система и система кроветворения
(соавторы Н.И.Кузнецов, В И.Ругаль, А.П.Ремезов, В.А.Неверов,
Г.Ю. Старцева)............................................... 145
2.1. Лимфатическая система................................... 145
2.2. ВИЧ-инфекция и система кроветворения.................... 152
3. Поражение респираторного тракта при ВИЧ-инфекции (соавторы
Ю.А.Фомин, И.М.Улюкин).......................................... 162
4. Поражения слизистой полости рта и желудочно-кишечного тракта при
ВИЧ-инфекции (соавторы А.П.Ремезов, В.А.Неверов, Г.Ю.Старцева) 184
5. Нервная система при ВИЧ-инфекции (соавторы Н.М.Жулев,
Б.А. Осетров, С.И.Пархоменко)................................... 209
6. Микозы при ВИЧ-инфекции (соавтор О.Х.Гяургиева)............. 245
6.1. Кандидоз при ВИЧ-инфекции............................... 249
6.2. Диагностика и лечение криптококкоза..................... 259
6.3 Менингит, обусловленный Rhodotorula rubra................ 270
6.4. Фунгемия Penici 1 lium chrysogenum при ВИЧ-инфекции..... 274
7. Герпесвирусные инфекции (соавторы Е.В.Степанова, Е. И. Романова)... 282
7.1. Простой герпес.......................................... 282
7.2. Ветряная оспа, опоясывающий герпес...................... 295
7.3. Вирусная инфекция Эпштейна-Барр......................... 302
7.4. Цитомегаловирусная инфекция............................. 307
7.5. Инфекция, вызванная вирусом герпеса человека 6 типа..... 316
7.6. Инфекции, вызванные вирусами герпеса человека 7 и 8 типов.
Саркома Капоши............................................... 318
7.7. Комплексная диагностика герпесвирусных заболеваний у больных
ВИЧ-инфекцией................................................ 321
7.8. Особенности течения варицелла-зостер-вирусной-инфекции на фоне
ВИЧ-инфекции (соавторы Л.Ю. Афонина, Н.В. Сизова, Н.В. Бурова) 324
8. Токсоплазмоз и ВИЧ-инфекция (соавтор Л.А. Тютликова)......... 333
9. Туберкулез при ВИЧ-инфекции (соавтор О.П.Фролова)............ 372
Ю. Вирусные гепатиты и ВИЧ инфекция (соавторы А.А.Яковлев,
Е.Н.Виноградова, А.Я.Комарова, В.Н.Корягин)................ 398
5
11. Терапия ВИЧ-инфекции (соавторы Е.Н. Виноградова, А. А. Яковлев).. 446
11.1. 0 диспансеризации пациентов с ВИЧ-инфекцией................. 446
11.2. Противовирусная терапия ВИЧ инфекции........................ 450
11.3. Антиретровирусные препараты................................. 451
11.3.1 .Нуклеозидные ингибиторы обратной транскриптазы (НИОТ, NNIRT).. 451
11.3.2. Ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ,
NNIRT)........................................................... 459
11.3.3. Ингибиторы протеазы (ИП, IP)............................. 466
11.3.4. Отечественные препараты (тимазид, никовир)............... 482
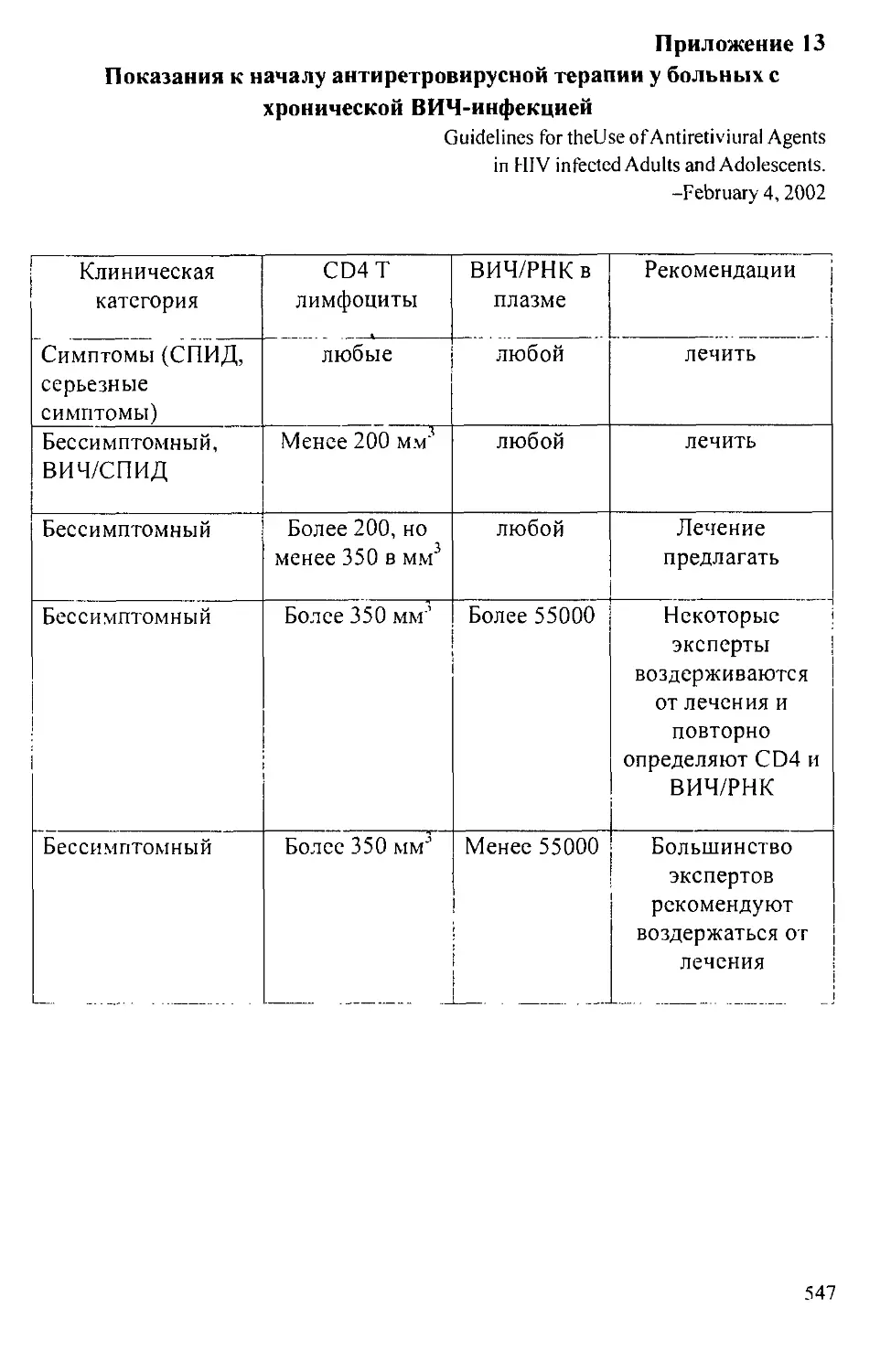
11.4. Рекомендации по началу антиретровирусной терапии............. 484
11.5. Антиретровирусная терапия при острой ВИЧ-инфекции............ 493
11.6. Перерывы в антиретровирусной терапии......................... 495
11.7. Изменения неэффективных режимов антиретровирусной терапии.... 497
11.8. Соблюдение режима лечения при ВИЧ-инфекции................... 501
11.9. Побочные эффекты антиретровирусной терапии................... 504
11.10. Резистентность при ВИЧ-инфекции............................ 507
Приложение 1. Нуклеозидные ингибиторы обратной транскриптазы,
разрешенные к применению в России.................................. 530
Приложение 2. Ненукпеозидные ингибиторы обратной транскриптазы..... 532
Приложение 3. Ингибиторы протеазы ВИЧ.............................. 533
Приложения 4,5,6. Лекарственные взаимодействия..................... 534
Приложение 7. Информированное согласие на проведение терапии ВИЧ-
инфекции........................................................... 540
Приложение 8-14. Общие рекомендации по началу и проведению
антиретровирусной терапии.......................................... 541
Приложение 15-17. Мониторинг антиретровирусной терапии............. 549
Приложение 18-19. Рекомендации по определению резистентности для выбора
оптимальных подходов к терапии..................................... 552
Приложение 20. Средняя стоимость антиретровирусных препаратов...... 554
Приложение 21. Практические рекомендации для врачей по использованию
Циклоферона в терапии ВИЧ-инфицированных пациентов................. 555
Приложение 22. Рекомендации по применению препаратов для лечения ВИЧ... 557
12. Химиопрофилактика ВИЧ-инфекции у новорожденных
(соавтор Е.Е. Воронин).............................................. 566
12.1. Факторы риска перинатальной передачи ВИЧ-инфекции........... 566
12.2. Схемы химиопрофилактики перинатальной ВИЧ-инфекции.......... 572
12.3. Антиретровирусная терапия беременных женщин................. 579
Приложение 1. Информированное согласие на проведение
химиопрофилактики передачи ВИЧ от матери к ребенку во время
беременности и родов............................................... 590
Приложение 2. Мониторинг ВИЧ-инфицированных женщин в период
беременности....................................................... 592
13.0 критериях диагностики и прогноза ВИЧ-инфекции у детей 1 года
жизни и особенностях их лечения (соавторы: Е.Е.Воронин,
ЛЮ. Афонина, IO. А. Фомин)........................................ 594
6
Приложение 1 График и объем обследования детей, рожденных от
ВИЧ-инфицированных матерей (рекомендации М3 РФ) 623
Приложение 2 Показания к антиретровирусной терапии детям с ВИЧ-
инфекцией 624
Приложение 3 Рекомендуемые антиретровирусные режимы для нача-
ла терапии у ВИЧ инфицированных детей 625
Приложение 4 Предложения по изменению режимов антиретрови-
русной терапии у детей 626
Приложение 5 Суточная доза применяемых в детской практике анти-
ретровирусных препаратов (Boennger Ingelheim) 627
Приложение 6 Применение Вирамуна * в педиатрической практике 629
Приложение 7 Расчет дозировок лекарственных препаратов для детей 631
Приложение 8 Психологические аспекты, связанные с ВИЧ-
инфекцией у женщин и детей 632
Приложение 9 Приказ Министерства Здравоохранения Российской
Федерации № 133, 1999 «О научно-практическом центре профилакти-
ки и лечения ВИЧ-инфекции у беременных и детей» 635
14 Меры профилактики оппортунистических заболеваний у ВИЧ-
инфицированных 650
15 Химиопрофилактика ВИЧ инфекции и вирусных гепатитов В и С у
медицинских работников (соавторы Г В Бочкова Е Н Виноградова,
BE Жочобов А А Яковчев) 657
16 Особенности лечения синдрома зависимости вследствие употребления
наркотических веществ при сочетании с вирусными гепатитами и ВИЧ
(соавторы А Я Гриненко Е В Стречянная С Н Бучеков) 665
17 Организация службы по профилактике ВИЧ-инфекции (соавтор
Б М Тайц ) 687
7
ВВЕДЕНИЕ
В 1981 году появилось сообщение о редкой инфекции от Центра по
контролю за заболеваниями США (CDC) с еженедельным отчетом о
озаболеваемости и смертности (MMWR, 1981). Сообщение содержало
информацию о пневмоцистной пневмонии у гомосексуальных мужчин. Другие
исследователи связали в это же время необычную инфекцию с опухолями, в
особенности с саркомой Капоши. Количество молодых мужчин, пораженных
этой инфекцией, увеличивалось и, таким образом, создалась проблема,
угрожающая здоровью. Иммунологическими исследованиями, выполненными
у этих больных, было показано специфическое повреждение Г-лимфоцитов,
преимущественно Т4 хелперов (CD4) клеток. В последующие годы были
описаны множественные оппортунистические вирусные, грибковые,
микобактериальные и протозойные инфекции, которые обычно характерны
для иммуносупрессивных лиц.
При ретроспективном анализе установлено, что интенсивное
распространение ВИЧ-инфекции началось в конце 70-х или начале 80-х годов,
преимущественно в некоторых городах Америки и Западной Европы, и
популяциях мужчин, имеющих секс с мужчинами, и инъекционных наркоманов,
а ранее в странах Африки и Карибского бассейна среди мужчин и женщин,
имеющих беспорядочные половые связи
Эпидемиология этого заболевания была охарактеризована CDC (Center
Diseases Control), которые назвали этот внезапно возникший синдром
синдромом приобретенного иммунодефицита (aquired immunodeficiency syn-
drome -AIDS), встречающимся у сексуально активных людей, инъекционных
наркоманов, реципиентов крови и ее продуктов. Было указано, что заболевание
имеет способ передачи такой же, как вирусный гепатит В.
В 1983 году Barre-Sinoussi в лаборатории Люка Монтаньи Института
Пастера в Париже был изолирован человеческий Т-клеточный лимфотропный
вирус (LAV), и в том же году Роберт Галло и его исследователи открыли Т-
лимфотропный вирус III типа (HTLV3). В последующем оказалось, что эти
вирусы идентичны. Вирус был назван как вирус иммунодефицита человека -
ВИЧ (human immunodeficiency virus - HIV).
Этот вирус относится к группе ретровирусов. РНК-содержащих,
имеющих фермент - обратную транскриптазу, которая обеспечивает в геноме
пораженных клеток появление дезоксирибонуклеиновой кислоты вируса с
поражением макрофагов и Т4 (CD4) лимфоцитов с репликацией в последних
вируса. Прогрессирующая деструкция иммунной системы приводит к развитию
синдрома приобретенного иммунодефицита (СПИД).
В связи с тем, что при этом заболевании присутствуют ВИЧ антитела еще
задолго до развития СПИДа, за рубежом заболевание получило еще и другое
8
название - ВИЧ-болезнь (HI V-disease). Было установлено, что после сероконверсии
может развиваться гриппоподобный синдром, иногда с клиникой энцефалита или
асептическою менингита, в течение многих лет люди могут без признаков болезни
оставаться носителями вируса, однако постепенно иммунная система разрушается
вирусом, число CD4 клеток падает, заболевание прогрессирует. Вначале появляются
такие симптомы, как слабость, ночные поты, потеря веса, кожно-слизистые
нарушения и персистирующая генерализованная лимфаденопатия (ПГЛ). При
дальнейшей прогрессии заболевания развивается опоясывающий герпес, оральный
кандидоз, волосистая лейкоплакия языка и другие. Этот синдром назвали СПИД-
связанным комплексом - ССК. (AIDS related complex - ARC). Такой комплекс
является, как правило, состоянием, прогрессирующим в дальнейшем к СПИДу. В
последующем оппортунистические и вторичные инфекции или опухоли дают
картину развернутого СПИДа. В некоторых случаях бессимптомная ВИЧ-инфекция
может прогрессировать вплоть до СПИДа. Однако к настоящему времени известны
практически здоровые носители "долгожители", живущие с ВИЧ более 10 лет.
В 1985 году Всемирной Организацией Здравоохранения (ВОЗ) была
конкретизирована первая классификация ВИЧ-инфекции, которая выделила
острую ВИЧ-инфекцию, длительное вирусоносительство, ПГЛ. СПИД -
связанный комплекс и СПИД. В 1993 году CDC была разработана новая
классификация, и были перечислены все оппортунистические, вторичные
инфекции и опухоли, характерные для СПИДа.
Первые случаи ВИЧ-инфекции в нашей стране были выявлены в начале
80-х годов В. И. Покровским. В дальнейшем в литературе был описан первый
случай ВИЧ-инфекции у гражданина СССР (Покровский В.В. и соавт., 1987,
1992). Первый случай смерти от СПИДа в СССР был описан в 1989 году
(Рахманова А.Г. и соавт., 1989).
Заболевание было названо ВИЧ-инфекцией, которая начала
регистрироваться с 1986 года, первоначально среди иностранцев, а с 1987 года и
среди граждан СССР. Особенностью подхода к этой проблеме в нашей стране
является регистрация всех выявленных ВИЧ-серопозитивных лиц и их
диспансеризация с момента регистрации. При этом ВИЧ-инфекция рассматривается
как болезнь, последовательно проходящая несколько стадий и фаз, вплоть до
развития СПИДа. Такой подход нашел отражение в клинической классификации
ВИЧ-инфекции, разработанной в 1989 год) академиком В.И.Покровским. Эта
классификация позволила представить симптомы и синдромы для ранней
диагностики заболевания еще до развития иммунодефицита, что стало реальным
в условиях отечественной системы эпиднадзора с регистрацией и диспансеризацией
с первых дней ВИЧ серопозитивных лиц.
В.В.Покровский выделяет несколько этапов развития эпидемии ВИЧ-
инфекции в России. До 1988 года заболевание регистрировалось
преимущественно среди иностранцев или лиц, имевших половые контакты с
9
иностранцами. В 1988-1989 годах автор охарактеризовал внутрибольничные
вспышки ВИЧ-инфекции в ряде городов России (Элиста, Волгоград, Ростов),
что определило создание центров профилактики и борьбы со СПИДом во всех
крупных городах СССР-России. С 1990 по 1995 год отмечался медленный рост
числа ВИЧ-инфицированных, зараженных половым путем, преимущественно
в городах. С 1996 года начался эпидемический подъем заболеваемости ВИЧ-
инфекцией среди инъекционных наркоманов (В.В.Покровский, 1998,2000), По
прогнозам специалистов в ближайшие годы количество ВИЧ-инфицированных
в России может достигнуть полмиллиона человек и больше.
Организация службы оказания медицинской помощи больным ВИЧ-
инфекцией в Санкт-Петербурге:
В Ленинграде - Санкт-Петербурге служба ВИЧ/СПИД начала
функционировать с 1987 года;
- В мае 1987 года открыта диагностическая референс-лаборатория в
инфекционной больнице им. С.П.Боткина для осуществления скрининга и
подтверждающих тестов, иммуноблота. К настоящему времени в городе имеется
более 20 лабораторий, осуществляющих первичный скрининг на ВИЧ-
инфекцию. В июне 1987 года открыт консультативно-диагностический кабинет
для проведения анонимного обследования и амбулаторной помощи
инфицированным ВИЧ, и начало функционировать 40-коечное боксированное
отделение для стационарного лечения. Наличие в больнице инфекционно-
хирургического, акушерско-гинекологического отделений, бактериологической,
серологической и гистоморфологической лабораторий, а также других
функционально-диагностических и лечебных подразделений, специалистов-
консультантов, позволяло решать практически все виды оказания медицинской
помощи больным с ВИЧ-инфекцией на различных стадиях заболевания:
- В августе 1987 года открыта лаборатория по обследованию на ВИЧ
донорской крови в службе переливания крови;
- В 1988 году организовано амбулаторно-поликлиническое отделение с
анонимным кабинетом в больнице № 30 им. С.П.Боткина как "Клинический
Центр по профилактике и борьбе со СПИД";
- В 1989 году создана централизованная лаборатория для тестирования
на ВИЧ, сифилис, гепатит В всей донорской крови;
- В 1990 году организован Северо-Западный Центр СПИД в НИИ
эпидемиологии и микробиологии им. Пастера;
- В 1991 году была открыта Республиканская Клиническая больница для
детей (Усть - Ижора);
- В 1992 году Центр по профилактике и борьбе со СПИД выделен в
самостоятельное учреждение, юридически независимое от инфекционной
больницы им. С.П.Боткина;
1 О
В 1997 году в инфекционной больнице № 30 организовано отделение
для ВИЧ-инфицированных наркоманов с введением в штат этого отделения
наркологов и психотерапевтов;
- В 1997 году организована работа по профилактике ВИЧ-инфекции у
наркоманов, автобус Фонда "Возвращение";
- 1999 год - открытие Научно-практического центра профилактики и
лечения ВИЧ-инфекции у беременных женщин и детей для оказания лечебно-
диагностической, консультативно-методической и научно-практической
помощи всем Российским центрам по профилактике и борьбе со СПИД
(приказ М3 РФ № 133 от 1993 года);
- 1999-2000 годы - активизация работы по профилактике ВИЧ-инфекции
и вирусных гепатитов у наркоманов с функционированием еще двух автобусов
при инфекционной больнице №10 (Городской гепатологический Центр), с
участием специалистов из города Мальмо (Швеция) и "Врачи мира" (Франция);
- 2000 год - реконструкция зданий, выделенных для центра профилактики
и борьбы со СПИД, с открытием лаборатории молекулярно-биологических и
углубленных серологических исследований;
г - В 2001 году Центр по профилактике и борьбе со СПИД был объединен
с Городским гепатологическим центром, что позволило иметь при Центре
стационар с блоком интенсивной терапии, хирургическим и гинекологическим
отделениями и открыть в 2002 году отделение сестринского ухода (хоспис) с
мобильной лечебно-консультативной бригадой;
Таким образом, оказание медицинской помощи больным ВИЧ-инфекцией
проводится в нескольких учреждениях. Амбулаторная помощь с
диспансеризацией проводится в Городском центре по профилактике и борьбе
-со СПИДом и инфекционными заболеваниями. Амбулаторная помощь детям
и взрослым оказывается и по месту жительства участковыми врачами и врачами
'Инфекционистами КИЗ и отделений инфекционных заболеваний и
иммунопрофилактики. Стационарная помощь проводится в отделениях
инфекционной больницы им. С.П.Боткина при участии всех подразделений и
служб больницы, включая инфекционно-хирургическое и акушерское
отделения; в стационаре Городского Центра по профилактике и борьбе со СПИД
и инфекционными заболеваниями, а также в республиканской клинической
больнице (Усть-Ижора), Российском научно-практическом центре для
беременных женщин и детей.
Во всех учреждениях оказывается психо-социальная поддержка
инфицированным ВИЧ и их семьям в специальных медико-социальных отделениях.
- В 2002 году при Центре профилактики и борьбы со СПИД и
инфекционными заболеваниями открыт первый в России хоспис для оказания
медико-социальной поддержки пациентам в стадии СПИДа с опухолями,
Цирротической стадией вирусного гепатита и другими состояниями. Вместе с
I 1
тем, каждый пациент хосписа может получать высокоактивную
антиретровирусную терапию по показаниям.
- В 2003 году при Центре начала функционировать выездная бригада для
оказания комплексной помощи больным ВИЧ/СПИДом на дому.
В связи с ростом ВИЧ инфекции у беременных женщин, в том числе
женщин-наркоманок, необследованных до родов на ВИЧ, в 2002 году женщинам
при поступлении в обсервационные родильные дома ставились экспресс-тесты,
при положительных результатах которых осуществлялась экстренная
химиопрофилактика невирапином (вирамуном) вертикальной передачи
инфекции от матери к новорожденному.
- В 1999-2000 гг. на базе СПбМ АПО работал Канадско-Российский проект
по СПИДу. Основной целью проекта являлось усиление развития потенциала
Российских Федеральных программ по СПИДу путем обучения специалистов,
внедрения международного опыта по профилактике ВИЧ-инфекции и оказанию
помощи больным, а также подготовке практических рекомендаций по
профилактике ВИЧ/СПИДа. В рамках проекта была осуществлена одна из
важнейших задач - подготовка дифференцированных программ обучения
специалистов (акушеров-гинекологов, фтизиатров, наркологов, педиатров и
других) по ВИЧ-инфекции.
В настоящее время служба по профилактике и борьбе со СПИД включает
Городской центр по профилактике и борьбе со СПИД и инфекционными
заболеваниями, инфекционные стационары, кафедры медицинской академии
последипломного образования и научно-исследовательские институты. При этом
имеется тесная взаимосвязь со службой Госсанэпиднадзора. Комитет по
здравоохранению города, являясь организатором службы, координирует
деятельность по проблемам СПИД всех вовлеченных учреждений, а также
наркологической, акушерско-гинекологической, дермато-венерологической
служб, служб охраны материнства и детства, для профилактики - центров
медицинской профилактики, планирования семьи, а также общественных
организаций. Работа по аспектам ВИЧ/СПИДа проводится и на уровне
межведомственной Комиссии при городской администрации для обеспечения
взаимодействия со всеми Комитетами (образования, по делам молодежи, печати
и средств массовой информации, труду и социальной защите населения), ГУИН,
ГУВД, общественными организациями, атакже с Законодательным собранием
и комиссиями, имеющими существенное значение в финансировании и
осуществлении городских целевых программ ("Анти ВИЧ/СПИД" и других).
Актуальность проблемы ВИЧ-инфекции для России, ее крупных
мегаполисов и, в частности, Санкт-Петербурга, и окружающих ее стран
ближнего зарубежья диктует необходимость освещения этой проблемы с
учетом отечественного опыта и опыта зарубежных стран, задолго до России
вовлеченных в эпидемию.
1 2
Глава 1. ЭТИОЛОГИЯ, ЭПИДЕМИОЛОГИЯ, ПАТОГЕНЕЗ,
ДИАГНОСТИКА ВИЧ-ИНФЕКЦИИ
Этиология. ВИЧ-инфекция - болезнь, вызываемая ретровирусом,
поражающим клетки иммунной, нервной и других систем и органов
человека, с длительным хроническим прогрессирующим течением,
завершающаяся развитием СПИДа и сопровождающих его
оппортунистических заболеваний. ВИЧ инфекцию относят к категории
медленных инфекций.
Начало изучения медленных болезней положил Сигурдсон
(Sigurdsson), который в 1954 году впервые описал в Исландии массовые
заболевания среди овец, обнаружив их общие признаки, которые были
суммированы в следующие:
1. Длительный скрытый период болезни (месяцы и годы).
2. Медленное развитие симптомов болезни, имеющих неуклонно
прогрессирующий характер, заканчивающихся, как правило, смертью.
3. Необычность поражения органов и тканей с преимущественным
поражением одной тканевой системы.
Основываясь на этих признаках, Сигурдсон предложил называть их
медленными инфекциями. Позже, в 1957 году на острове Новая Гвинея
было описано новое заболевание - куру («мозжечковая атаксия») у
коренных жителей-каннибалов и в ближайшие годы была доказана
инфекционная природа болезни.
В конце 60-х начале 70-х годов была открыта вирусная природа
подострого склерозирующего энцефалита. Возбудителем этого
смертельного заболевания оказался дефектный вирус кори.
В 1970-80-х годах были опубликованы монографии Тимакова и Зуева
«Медленные вирусные инфекции человека и животных», в которой
выделены вирусы-возбудители, способные вызвать медленные инфекции и
в их числе впервые охарактеризованы возбудители подострых
трансмиссивных губкообразных энцефалопатии человека и животных
(ПТГЭ) - куру, болезни Крейтцфельда-Якоба, креппи, трансмиссивной
энцефалопатии норок и др. (таблица I). Эти данные позднее были
суммированы в монографии «Прионные болезни» (Зуев А.В. и соавт, 1999).
Таблица 1
Медленные вирусные инфекции (Зуев В.А. и соавт., 1999)
Нозологическая форма_________|___________ Возбудитель
Человек
IIодострый склерозирующий Парамиксовирус - вирус кори
панэнцефалит
Подострый послекоревой Гот же
лейкоэнцефалит
13
Прогрессирующая врожденная
краснуха
Прогрессирующий краснушный
панэнцефалит
Подострый герпетический энцефалит
Подострый аденовирусный энцефалит
Прогрессирующая многочаговая
лейкоэнцефалопатия
Хронический инфекционный
мононуклеоз
Цитомегаловирусное поражение мозга
Кожевниковская эпилепсия и
прогрессирующий бульбарный
паралич
Хронический менингоэнцефалит при
иммунодефиците
Вирусный гепатит В
Вирусный гепатит С
Вирусный гепатит D
Вирусный гепатит G
Вирусный гепатит TTV
Синдром приобретенного
иммунодефицита
Т-клеточная лимфома
Балканская эндемическая нефропатия
Бешенство
Лимфоцитарный хориомснингит
Тогавируе - вирус краснухи
Тот же
Вирус простого герпеса
Аденовирус - аденовирусы типа 7 и 32
Паповавирусы - вирусы JC и ОВ-40
Герпесвирус - вирус Эпштейна -Барр
Герпесвирус - цитомегаловирус
Тогавируе - вирус клещевого
энцефалита
Пикорнавирус - вирусы полиомиелита
и ECHO
Гепаднавирус - вирус гепатита В
(частица Дейна)
Флавивирус - вирус гепатита С
Неклассифицированный вирус - вирус
гепатита D
Флавивирус - вирус гепатита G
Парвавирус (?) - TTV
Ретровирус - вирус иммунодефицита
человека
Ретровирусы - онкорнавирусы HTLV-I
и HTLV-11
Неклассифицированный вирус
Рабдовирус - вирус бешенства
Аренавирус - вирус лимфоцитарного
хориоменингита
Висна
Инфекционная анемия лошадей
Болезнь Борна
Алеутская болезнь норок
Лимфоцитарный хориомснингит
мышей
Бешенство собак
Африканская лихорадка свиней
Медленная гриппозная инфекция
мышей
Животные
Ретровирус - вирус висны
Ретровирус - вирус инфекционной
анемии лошадей
Борнавирус - вирус болезни Борна
Парвавирус - вирус алеутской болезни
норок
Аренавирус - вирус лимфоцитарного
хориоменингита
Рабдовирус - вирус бешенства
Иридовирус - вирус африканской
лихорадки свиней
Ортомиксовирус - вирус гриппа А
14
Прионные болезни выделяются из группы медленных инфекций в
особую подгруппу. Их возбудители неспособны вызвать острую форму
инфекционного процесса (таблица 2).
Прион - белковая инфекционная частица, процесс накопления которой
обусловлен взаимодействием с клеточным белком (Зуев А.А. и соавт., 1999)
____________________________________________________Таблица 2
А. Обычные вирусы
I. Облигатные возбудители медленных инфекций
1) Онкогенные вирусы
А) онкогенные вирусы человека: (?)
Б) онкогенные вирусы животных: вирус полиомы, SV40, вирус
миоматоза, вирус Рауса и др.
Возможная или предполагаемая патогенетическая основа:
Замедленная трансформация: РНК-содержащие онкогенные вирусы об-
ладают обратной транскриптазой.
Точковые мутации: утрачивается контактная ингибиция (цитидин-
мбнофосфат-трансфераза и уридин-монофосфат-трансфераза оказываются
дефектными).
2) Другие вирусы (например, ВИЧ, вирусы папова, висна, алеут-
ской болезни норок и др.)
II. Факультативные возбудители медленных инфекций (например,
вирусы кори, лимфоцитарного хориоменингита, бешенства, гепа-
титов В и С, чумы собак, герпеса, краснухи и др.)
Вероятная патогенетическая основа: нарушение иммунологической ре-
активности организма; персистенция вируса в дефектной форме.__
Б. Необычные вирусы.
А)возбудитель куру;
Б) возбудитель болезни Крейтцфельда-Якоба;
В) возбудитель трансмиссивной энцефалопатии норок;
Г) возбудитель скрепи.
Гипотетическая патогенетическая основа:
Необычные нуклеиновые кислоты; возбудитель вызывает пролифера-
тивные внутриклеточные процессы, такие, как чрезмерное образование
субклеточных мембран? Агент инкорпорирован в ДНК митохондрий? Или
.Является геном мембранной репликации?
Вирус иммунодефицита человека (ВИЧ) относится к семейству ретровирусов
(Retroviridae). Вирусная частица представляет собой ядро, окруженное оболочкой.
Ядро содержит РНК и ферменты—обратную транскриптазу (ревергазу), интегразу,
протеазу. При попадании ВИЧ в клетку, РНК под воздействием ревертазы
превращается в ДНК, которая встраивается в ДНК клетки-хозяина, продуцируя новые
вирусные частицы — копии РНК вируса, оставаясь в клетке пожизненно. Ядро
окружено оболочкой, в составе которой имеется белок — гликопротеид gp!20,
15
обусловливающий прикрепление вируса к клеткам организма человека,
имеющим рецептор — белок CD4.
В настоящее время известны 2 типа вируса иммунодефицита
человека, имеющие некоторые антигенные различия — ВИЧ-1 и ВИЧ-2,
последний встречается преимущественно в Западной Африке.
Как и все ретровирусы, ВИЧ характеризуется высокой
изменчивостью. Считают, что в организме человека по мере
прогрессирования инфекции от бессимптомной до манифестной
происходит эволюция вируса от менее вирулентного к более вирулентному
варианту.
ВИЧ нестоек во внешней среде. Он практически полностью
инактивиоуется прогреванием при температуре 56°С в течение 30 мин (для
гарантии безопасности препаратов крови их обрабатывают при 56...60° С в
течение 3-5 ч., а иногда и дольше). Вирус очень быстро погибает при
кипячении (через 1-3 мин.), при резком изменении реакции среды (pH
ниже 0,1 и выше 13), а также под воздействием дезинфицирующих
веществ в концентрациях, обычно используемых в лабораторной практике
(3% раствор перекиси водорода, 5% раствор лизола, 0,2% раствор натрия
гипохлорита, 1% раствор глутарового альдегида, 70% этиловый спирт,
эфир, ацетон и т.д.). ВИЧ в то же время весьма устойчив к
ультрафиолетовым лучам и ионизирующей радиации.
Однако, допускают, что вирус может сохраняться в высушенном
состоянии в течение нескольких часов и даже дней, но только в
жидкостях, содержащих ВИЧ в высоких концентрациях: в крови и сперме.
В крови, предназначенной для переливания, вирус переживает годы, в
замороженной сперме сохраняется несколько месяцев. Низкая
концентрация ВИЧ в других биологических жидкостях определяет его
быструю инакзивацию.
1.1. Подходы к эпиднадзору за ВИЧ инфекцией
СПИД является огромной и постоянно растущей социальной и
демографической глобальной проблемой мира, не исключая и нашу страну
(таблица 3). Правильное понимание воздействия СПИДа на здоровье и
жизнь как отдельного человека, так и общества в целом, влияния и
зависимости проблемы от состояния экономики и социальных показателей,
характеристики поведенческих стандартов в обществе, а также создание в
стране терпимого отношения к зараженным ВИЧ и больным наркоманией
и нетерпимого - к порочному рискованному поведению, поможез
выработать наиболее верную политику борьбы с этим недугом. В
действующих законах, касающихся главной ценности жизни - здоровья
человека, гармонично связаны правовые и нравственно-этические нормы.
16
что нашло отражение в принципиальных положениях нашей
законодательной медицинской базы.
Таблица 3
Глобальные данные по эпидемии ВИЧ/СПИДа, декабрь 2001
Число людей, живущих с ВИЧ/СПИДом* Всего Взрослое население Женщины Дети до 15 лет 40 млн. 37,1 млн. 18,5 млн. 3 млн.
Люди, впервые инфицированные ВИЧ в 2001 г. Всего Взрослое население Женщины Дети до 15 лет 5 млн. 4,2 млн. 2 млн. 800 000
Число случаев смерти от СПИДа в 2001 г. Всего Взрослое население Женщины Дети до 15 лет 3 млн. 2,4 млн. 1,1 млн. 580 000
Суммарное число детей в возрасте до 14 лет, ставших
сиротами в результате СПИДа (потерявших одного или обоих
родителей в результате СПИДа), по состоянию на 2001 год 14 млн.
*На начало 2003 юда число людей, живущих с ВИЧ'СПИДОМ, достигло 42 млн. человек.
Таблица 4
Впервые диагностированная ВИЧ-инфекция, распределение по
возрасту на момент диагностики, полу и географической области,
случаи с 1997 по 2000 годы, ВОЗ Европейский регион
Возраст (годы) Мужчины Женщины Всего
Число 1 % число % ЧИСЛО %
1 Запад 2 j 3 4 5 6 ... 7
<13 332 j 1,3 330 3,1 678 1,8
13-19 330 1,3 370 3,5 711 1,9
20-29 6223 i 24,2 3983 37,1 10281 27,7
30-39 10828 , 42,0 4027 37,6 14951 40,3
40-49 4649 ! 18,1 1161 10,8 5847 15,8
50+ 3004 . 1 1,7 659 6,1 3691 10,0
Всего 25753 ! 100,0 10724 100,0 37067 100,0
2. Заказ № К-4451.
17
1 2 3 4 5 7
Центр <13 829 22,2 601 34,3 1430 24,0
13-19 151 4,0 151 8,6 303 5,1
20-29 1129 30,2 583 33,3 1739 29,2
30-39 885 23,7 233 13,3 1125 18,9
40-49 447 12,0 96 5,5 549 9,2
50+ 203 5,4 63 3,6 266 4,5
Всего 3737 100,0 1752 100,0 5948 100,0
Восток <13 1302 1,6 1280 4,9 2582 2,2
13-19 13836 17,5 5386 20,8 19222 16,1
20-29 46127 58,4 14213 54,8 60340 50,5
30-39 14354 18,2 4171 16,1 18525 15,5
40-49 2727 3,5 633 2,4 3360 2,8
50-1- 604 0,8 235 0,9 839 0,7
Всего 78975 100,0 25922 100,0 119392 100,0
Всего Европейский регион ВОЗ 108465 38398 162407
Таблица 5
Случаи смерти среди больных СПИДом, распределение по путям
заражения и годам, ВОЗ, Европейский регион, данные на 31.12.00
Группы больных(по путям заражения) 1996 1997 1998 1999 2000 Всего
Г омо/биссксуальные мужчины 5085 3483 1837 1304 1091 49398
Инъекционные наркоманы (ИН) 7623 5009 3636 2796 1948 56019
Гомо/бисексуальныс ИН 212 168 105 95 31 2117
Гемофилия / патология коагуляции 249 135 88 55 42 2844
Реципиенты крови, ее компонентов, ткани 245 161 83 54 46 3188
Г етеросексуальные контакты 2925 1723 1388 1591 1101 19948
Передача от матери к ребенку 200 142 113 62 32 1800
Нозокомиальная инфекция НО 242 216 48 96 1180
Другие/неустановленные 693 461 310 250 183 6295
Всего 17342 11524 7776 6255 4570 142 789
18
По данным Российского научно-методического центра по
поофилактике и борьбе со СПИДом в стране более чем за 15 летний
период (с 1.01.87 г. по 1.12.2002 г.) зарегистрировано 225490 ВИЧ-
инфицированных граждан России, из них 5627 детей. 372 детей с
антителами к ВИЧ рождены ВИЧ-инфицированными матерями. У 782
пациентов, из которых 183 детей, поставлен диагноз СПИД. Погибло 595
ВИЧ-инфицированных, включая 122 ребенка.
В начале эпидемии в России
распространялся преимущественно половым путём
характеризовался медленным, но неуклонным ростом и
накоплением источников инфекции.
Нозокомиальная вспышка ВИЧ/СПИДа, охватившая в
вирус иммунодефицита
и процесс
постепенным
1988-90 годах
детей в некоторых городах юга России, дала существенный прирост числа
новых случаев, однако до 1996 г. основным путём передачи инфекции
оставался половой.
Как только (1996 г.) вирус проникает в среду внутривенных
наркоманов, наблюдается стремительный рост эпидемии.
Таблица 6
Регистрация ВИЧ-инфекции в России
Годы 1987-1995 1996 1997 1998 1999 2000 2001 2002
Кол-во случаев 1062 1511 4353 4035 20129 46479 83888 50378
За период с 1996 до 2001 года число ВИЧ-инфицированных более
чем в 40 раз превысило их количество за период 1987-1995 годы. Всего с
1987 г. по 1.08.03 г. в России установлено 229049 случаев заболевания.
Из общего числа ВИЧ-инфицированных преобладают мужчины, на
Долю которых приходится 78%. Более чем 80% пострадавших от ВИЧ
находится в возрастной группе 15-30 лет.
По оценкам В.В.Покровского в течение ближайших 5 лет половина
употребляющих наркотические вещества может заразиться ВИЧ, что может
вызвать катастрофический, до 100 тысяч случаев, в год рост числа больных
вИЧ/СПИДом. с учётом низкой рождаемости в стране эту ситуацию
эксперты оценивают как угрозу нации (Покровский В.В. с соавт., 2000).
Таким образом, эпидемия ВИЧ-инфекции в РФ имеет следующие
Тгапы развития:
- до 1988 года - инфекция распространялась половым путём и
выявлялась у лиц, имевших интимные связи с иностранными гражданами
(в основном, из стран Африки) или среди иностранцев, проживающих
временно в стране.
в 1988-1989 гг. в ряде городов России имело место
внутрибольничное распространение инфекции среди детей при
Парентеральном медикаментозном вмешательстве.
19
-1990-1995 гг. характеризовались медленным распространением инфекции
половым путём как среди гомосексуалистов, так и среди традиционно
ориентированных граждан, преимущественно в крупных городах.
С 1996 года эпидемия начала концентрироваться в среде инъекционных
наркопотребителей, что дало основание называть эту стадию
концентрированной эпидемией.
Принимая во внимание постоянно возрастающую заболеваемость
наркоманией и нежелание наркопотребителей обращаться за медицинской
помощью, можно полагать, что истинное число ВИЧ-инфицированных во много
раз больше регистрируемого. По оценкам экспертов этот коэффициент
составляет 6,0-10,0.
Рост числа ВИЧ-инфицированных среди инъекционных потребителей
наркотиков способствует активизации полового пути передачи и существенного
возрастания роли вертикального пути распространения вируса.
В 2001 гаду продолжался стремительный рост ВИЧ-инфекции и по темпам
прироста новых случаев Российская Федерация заняла первое место в мире.
По данным Федерального центра по профилактике и борьбе со СПИДом в 2001
году выявлено в 1,5 раза больше новых случаев ВИЧ инфекции в сравнении с
2000 годом (таблица 7). Вместе с тем, в 2002 году число вновь выявленных
случаев снизилось в 2 раза, что может быть связано с определенными сдвигами
в структуре наркорынка и активизацией полового пути передачи с выводом
ВИЧ в общую популяцию населения, выявляемость в которой затруднительна.
Характеристика эпидемического процесса по ВИЧ-инфекции в Санкт-
Петербурге.
В Санкт-Петербурге динамика заболеваемости ВИЧ-инфекцией отражает
в целом эпидемический процесс в России, но с некоторым опозданием.
Существенный рост заболеваемости в городе отмечен с 1998 года, когда
общее число впервые выявленных больных с ВИЧ-инфекцией превысило
количество больных за предшествующие 10 лет в 4 раза, а в 1999 г. - в 18 раз.
Первое заболевание ВИЧ/СПИДа у наших сограждан было установлено в
1987 году, когда анонимно обратилась за обследованием женщина, имевшая
множественные сексуальные контакты с гражданами африканских стран.
Количество ВИЧ-инфицированных соотечественников в последующие годы
представлено в таблице 8.
20
Таблица 7
Распределение ВИЧ-инфицированных в зависимости от факторов риска, 1993-2001 гг.
Федеральный Центр профилактики и борьбы со СПИД, М3 РФ
Основные ! Количество зарегистрированных случаев
факторы риска заражения ВИЧ 1993 1994 1995 1996 1997 1998 1999 2000 2001 Всего с 1987
N % N % N % N % N % N % N % N % N % N %
Гомосексуаль- ные контакты 34 32,4 72 44,4 85 43,1 93 6,1 55 1,3 70 1,7 76 0,4 70 0,1 77 0,1 774 0,4
Гетеросексу- альные контакты 53 50,5 54 33.3 59 29,9 90 5.9 220 5.0 304 7,5 687 3,5 1313 2,2 2189 2,5 5108 2,9
Переливание ВИЧ4- крови 0 0,0 0 0,0 1 0,5 0 0,0 3 0,1 5 0,1 2 0,0 3 0,0 8 0,0 27 0,0
Пребывание в нозокомиаль- ных очагах 3 2,9 1 0,6 2 1,0 2 0,1 1 0,0 0 0,0 1 0,0 4 0,0 0 0,0 276 0,2
Перинатальная инфекция 0 0,0 2 1,2 1 0,5 6 0,4 41 0,9 80 2,0 206 1,0 370 0,6 886 1,0 1602 0,9
От ребенку к матери при грудном вскармливании 1 1,0 0 0,0 0 0.0 0 0,0 0 0,0 0 0,0 0 0,0 0 0,0 0 0,0 22 0,0
От матери к ребенку при грудном вскармливании 0 0,0 0 0,0 0 0,0 0 0,0 0 0,0 1 0,0 0 0,0 0 0,0 0 0,0 1 0,0
В/в наркомания 0 0,0 3 1,9 6 3.0 1010 66,3 2526 57,7 1808 44,5 10832 54,6 36841 62,1 46274 53,1 99300 56,0
Нет данных 14 13,3 30 18,5 43 21,8 323 21,2 1531 35,0 1794 44,2 8047 40,5 20680 34,9 37743 43,3 70244 39,6
Всего 105 100 162 100 197 100 1524 100 4377 100 4062 100 19951 100 59281 100 87177 100 177354 100
N>
Таблица 8
Регистрация ВИЧ-инфекции в Санкт-Петербурге*
(по данным центра госсанэпиднадзора)
Годы Выявлено ВИЧ 1987 1988 1989 1990 1991- 1995 1996 1997 1998 1999 2000 2001 2002
Абсолютное количество 1 13 13 Г 7~ 93 42 77 106 440 5470 10117 5073
Показатель на 100 тысяч населения** 0,8 1.6 2,3 2,7 1 14,5 229,4 124,7
* ежемесячно в 2003 году регистрируется около 300 новых случаев ВИЧ-инфекции и, таким образом, кумулятивное число пациентов с
ВИЧ-инфекцией нарастает и суммарно составляет на 01.08.2003 - 20873. из них в возрасте 15-18 лет - 4108 (подростки), 19-29 лет -
13810.
** суммарный показатель пораженности населения города с 1987 по 2003 год составляет 410 на 100000 населения.
Эпидемиологический надзор за ВИЧ-инфекцией позволяет предположить,
что вирус иммунодефицита человека мог циркулировать в городе уже с 1982 г.
Это год рождения девочки с ВИЧ-инфекцией, мать которой была выявлена как
больная ВИЧ/СПИДом в 1988 году и погибла от него в 1991 году. Другим
аргументом, подтверждающим, что вирус иммунодефицита в городе
присутствовал уже в 80-е годы, явилась смерть в 1988 году женщины 29 лет от
пневмоцистной пневмонии, распространенного кандидоза ротовой полости,
верхних дыхательных путей, бронхов, пищевода, прибывшей в город из
Таджикистана в 1976 году и имевшей сексуальные контакты с гражданами
африканских государств в 1978-1979 годах, а впоследствии и представителями
европейских стран. При углублённом клиническом обследовании ВИЧ-
инфицированных женщин, выявленных до 1992 года, удалось установить дату
их предположительно возможного заражения ВИЧ в 1982-83 годах, когда они
имели сексуальные контакты с представителями африканских стран (Рахманова
А.Г. и соавт., 1989).
Динамика выявляемое™ иностранных граждан при регламентированном
ежегодном углублённом осмотре (студенты городских вузов) и обследовании
их на ВИЧ свидетельствует о преимущественном их выявлении в 1987-1990 гг.,
с 1991 года регистрируются лишь единичные случаи инфекции.
Некоторое снижение выявляемое™ ВИЧ-инфекции с 1990 года среди
иностранцев объясняется новыми требованиями нашей страны об
обязательности контроля их на ВИЧ перед выездом из страны проживания.
ВИЧ-инфицированные иностранцы были гражданами Эфиопии (первый
инфицированный из этой страны выявлен в нашем городе в 1987 году, до этого
случая Эфиопия не считалась эпидемическим очагом ВИЧ-инфекции), Конго,
Руанды, Уганды, Бурунди и 5 человек из Италии и США.
При обследовании женщин от смешанных браков с ВИЧ-
инфицированными африканцами, обучающимися в наших вузах установлено,
что они оказались заражёнными вирусом иммунодефицита человека,
предположительное время заражения - начало восьмидесятых годов.
В первые годы эпидемиологического надзора за ВИЧ-инфекцией удалось
установить и обследовать 23 половых партнёра (женщин) одного студента из
Руанды. ВИЧ-инфекция была выявлена у 4-х из них.
Эти факты свидетельствуют о том, что в начале 80-х годов в Санкт-
Петербург инфекция проникла, по всей вероятности, гетеросексуальным путём
из Африки.
23
250
Рисунок 1. Динамика регистрации новых случаев (инцидентность) наркомании и
ВИЧ-инфекцин (абс. число и показатель на 100000 населения) в Санкт-Петербурге*
! « Наркомания « ВИЧ-инфекция
10117
в 229.4
36
-----S 0,8
1996
72
В-м-
1997
104
-а 2Л--
1998
1999
Годы
2001
2002
суммарное число пораженных ВИЧ/СПИДом составляет 410 на 100 000 населения города
В дальнейшем с 1989-1990 годов нами прослежен новый подъём вы-
являемое™ ВИЧ-инфекции среди мужчин, имеющих секс мужчинами. В
дальнейшем количество ВИЧ-инфицированных мужчин в 2,5 раза превы-
шало число больных женщин.
Таблица 9
Распределение ВИЧ-инфицированных по полу
(на 100 тысяч населения данного пола по годам)
Годы 1987- 1995 1996 1997 1998 1999 2000 2001 2002
удечины 3,6 1,5 2,9 3,6 15,9 72,0 69,7 65,4
Женщины 1,6 0,3 0,4 1,1 4,0 28,1 30,3 34,6
Начиная с 1996 года, в городе в эпидемический процесс начинают
вовлекаться наркоманы. И, если в 1994-96 годах количество ВИЧ-
инфицированных наркопотрсбителей составило 10 человек, то в 1997-1998
грдзх было выявлено более 50 человек, из которых половина являлись жи-
телями Санкт-Петербурга и из города нс выезжали.
В последующие 2 года число ВИЧ-инфицированных непрерывно
растёт (рисунок 1).
В городе с 1997 года произошло вытеснение местных суррогатных
ОПиатов героином, который приводит к более быстрому формированию
наркотической зависимости.
Таким образом, в последние годы движущей силой эпидемического
Процесса становятся наркопотребители, доля которых в общем количестве
ВИЧ-инфицированных возрастает до 80-90%. Поскольку наркопотребите-
ли - молодые люди, то и в структуре ВИЧ-инфицированных они домини-
руют (15-30 лет).
Таблица 10
Показатель поражённости ВИЧ различных возрастных групп
______населения (на 100000 данного возраста) по годам_
1987- 1995 гг. 1997 г. 1998 г. 1999 г. 2000 г. 2001 г. 2002 г.
Моложе 20 чтет 1,9 4,7 9,8 18,9 133,5 275,4 338
_> 20,<30 лет 7,2 4,7 6,7 38,9 447,1 833,3 430,3
1^30 <40 лет 6,9 2,3 2,7 9,3 61,2 140,1 76,7
-J40 <50 лет 1,6 0,5 1,0 1,7 13,3 31,1 18,5
’ Старше 50 .лет 0,13 0,06 0,13 0,3 0,9 4,3 3,4
ЗЗсего _],6_ _23_ 9,2 __из,з_ 246,4 124,7
25
По данным экспертов в Санкт-Петербурге проживает от 70 до 120 тысяч
инъекционных наркоманов, количество же эпизодически употребляющих
наркотики и психоактивные вещества достигает 300 тысяч. Именно они - та
социальная группа, которая в будущем может стать больными ВИЧ-инфекцией
и внести серьёзные изменения в демографическую структуру города.
Как уже отмечено, по оценке экспертов-наркологов количество
наркопотребителей, проживающих в Санкт-Петербурге, составляет 120 тысяч.
Если учесть, что каждый 4-й наркопотребитель заражён вирусом
иммунодефицита человека (данные обследования инъекционных
наркопотребителей в 2001 г. по программе «снижения вреда», реализуемой в
городе Ассоциацией «Врачи мира»), можно предположить, что число ВИЧ-
инфицированных наркоманов составляет не менее 25 тысяч человек. В ноябре-
декабре 2001 года среди инъекционных наркопотребителей, обратившихся в
Автобусы для обмена шприцев и обследования на ВИЧ, выявлено 27,2% ВИЧ-
инфицированных.
Основными распространителями вируса иммунодефицита человека
являются мужчины, число которых в 2,5 раза превышает количество ВИЧ-
позитивных женщин. Однако, последние всё более активно вовлекаются в
эпидемию.
В 2/3 случаях первое употребление наркотика, чаще всего героина, было
инъекционным и лишь у 1/3 вовлечение в инъекционную наркоманию
происходило через курение марихуаны, гашиша или неинъекционное
употребление героина, метадона и др.
Возрастная структура ВИЧ-инфицированных свидетельствует о высокой
поражённости лиц 15-29-летнего возраста. На них приходится почти 70% всей
заболеваемости ВИЧ-инфекцией (таблица 10).
Ежегодно в Санкт-Петербурге проводится обследование на антитела к
вирусу иммунодефицита человека более 600 тысяч человек.
В истекшем году значительный рост выявляемое™ (в2,9 раза) установлен
в группе беременных (обследование на ВИЧ всех беременных), а также в 2 раза
- в группе больных венерическими болезнями, что может косвенно
свидетельствовать об оживлении полового пути распространения инфекции.
Однако, ведущим путём передачи вируса иммунодефицита человека остаётся
парентеральный. В 2001 г. доля инъекционных наркопотребителей в общей сумме
выявленных ВИЧ-инфицированных составила 79,8%.
До 1996 года в популяции ИН (инъекционных наркопотребителей)
в городе не отмечена циркуляция вируса иммунодефицита человека.
Высокий показатель выявляемое™ ВИЧ-инфицированных в группе
потребителей наркотических средств в 1997 году имел место за счёт
граждан Украины, Грузии, Белоруссии и др. территорий России, где
возник эпидемический подъём этой инфекции. Среди жителей Санкт-
26
Петербурга, потребляющих инъекционные наркотики, было выявлено
всего 9 человек из более 2000 обследованных, в 1998 году уже 15 человек.
В последующие годы их абсолютное число возросло до 334 (1999
год), в 2001 году частота выявления ВИЧ-инфекции в этой популяции
составляла 9 на каждые 100 обследованных.
Обращает на себя внимание значительный рост обнаруженных
серопозитивных к ВИЧ среди обследованных по эпидемиологическим
показаниям (Таблица 11).
Таблица 11
Показатель выявляемости ВИЧ-инфицированных среди
обследованных по эпидемиологическим показаниям (на 10 000)
Годы / показатель 1997 1998 1999 2000 2001
Санкт- Петербург - 2521,0 3703,7 19246,8 22522,0
Российская -Федерация 2756,2 2701,4 5851,9 6230,9 8268,2 (6 мсс.)
Выявляемость среди контактных по парентеральному введению
наркотиков в Санкт-Петербурге находится на уровне 22%. При
обследовании по Программе «Снижение вреда» - 25,0-27,1%, в то же время
общая выявляемость. ВИЧ-инфекции среди потребителей наркотиков
составляет 9,5%.
Указанные факты свидетельствуют об активизации циркуляции
вируса иммунодефицита человека в среде ИН с 1998 года, давшей в 2001 г.
экстраординарный подъем заболеваемости.
Такое широкое и быстрое распространение ВИЧ-инфекции среди ИН
объясняется, в первую очередь, реструктуризацией наркотического рынка
в последние годы, когда на смену традиционным российским
наркотическим средствам (мак, маковая соломка) пришли более жёсткие
наркотики: синтетические и полусинтетические из группы опиатов, нс
вызывающие трудности в его приготовлении, в первую очередь героин. По
данным бюро судебно-медицинской экспертизы (БСМЭ) в последние годы
число обследованных на присутствие наркотических и психотропных
веществ возросло более, чем в 10 раз, и составило в 2000 г. 4851 человек, в
2001 г. - 5417. Увеличилось количество положительных результатов с
47% в 1997 г. до -70,0% в 2001г. Прослежена тенденция роста
обнаружения наркотиков из группы опиатов и других наркотических
веществ с одновременным снижением обнаружения сильнодействующих
и лекарственных веществ.
Впервые в 2001 году в моче обследуемых обнаружен хингамин и
каннабиноиды, не встречавшиеся ранее.
27
Таблица 12
Долевое значение наркотических, психотропных и
сильнодействующих веществ, обнаруженных в моче
освидетельствуемых в 1996-2001 гг. в % % ко всем положительным
__________________пробам (по данным БС1У1Э)________________
Годы /наркотики 1996 1997 1998 1999 2000 2001
Опиаты (героин, кодеин, морфин) 18,6 25,0 45,4 72,7 76,8 63,7
Амфетамин, метадон, МДА 0,3 0,4 0,06 0,1 0,2 0,4
Эфедрон, эфедрин 9,5 4,7 4,6 3,9 2,8 2,5
Сильнодействующие вещества (производные барбитуровой кислоты, фенотиазина, трамал). 46,8 45,2 31,4 13,6 12,0 17,3
Лекарственные вещества (димедрол, хингамин, анальгин, аналептин, финлепсин и др.). 24,6 24,5 18,5 9,5 8,2 15,9
Итого 100,0 100,0 100,0 100,0 100,0 100,0
Потребление героина по данным опроса и исследования потребности
в шприцах различной ёмкости фонда «Возвращение», участвующего в
Программе «Снижение вреда», началось во 2-й половине 1998 года, когда
резко возросла потребность в 1,0 мл шприцах.
В последние годы отмечена тенденция роста острых отравлений
наркотическими веществами, о чём свидетельствуют данные института
скорой медицинской помощи им. Джанелидзе.
Таблица 13
Частота острых отравлений наркотическими веществами по годам по
материалам института скорой медицинской помощи им. Джанелидзе
Годы Общее число больных, пролеченных в отделении токсикологии В т.ч. количество острых отравлений наркотическими веществами
Абс. число Абс.число %
1996 5391 632 11,7
1997 5095 712 14,0
1998 5169 1106 21,3
1999 5504 1361 24,7
2000 6009 1685 28,0
2001 5427 2776 51,2
28
Таблица 14
Количество умерших в отделении токсикологии Института скорой
медицинской помощи им. Джанелидзе от передозировок
наркотическими веществами по годам от общего числа больных с
острыми отравлениями наркотическими средствами
Годы Число умерших
Абс.число %
1996 6 0,9
1997 16 2.2
1998 15 1,3
1999 21 15
2000 55 3,2
2001 112 4Д_
Причиной смерти чаще всего являлось внутривенное употребление
героина в комбинации с другими веществами.
До 1998 года обследование всех пациентов с острыми отравлениями
наркотическими средствами в отделении токсикологии этого стационара
на анти-ВИЧ проводилось с отрицательным результатом.
В 1998, 1999, 2000, 2001 годах соответственно тестированием на
ВИЧ-антитела удалось выявить соответственно 3, 4, 98 и 299 ВИЧ-
инфицированных пациентов.
В течение последних 3-х лет наблюдается тенденция увеличения
числа трупов, подлежащих судебно-медицинскому исследованию
(насильственная смерть, несчастный случай, внезапная при невыясненных
обстоятельствах и др.) с 11,5 тыс. в 1977 г. до 18 тыс. в 2001 году.
При исследовании биообъектов, взятых от трупов, погибших от
различных причин, обнаружены следующие вещества (Таблица 15).
Таблица 15
Динамика обнаружения различных веществ в биообъектах
(по данн1 | 1996я ям БС1\ - | 997 - 4Э в% 1998 1999 । 2000 2001”
Опиаты (героин, морфин) 14,5 12,7 23,2 40.7 , 38,1 28,0
Амфетамин, МДА, метадон 1,9 - 0,5 0,2
Эфедрин, эфедрон - 0,5 - 0,5 | - 0,5
Сильнодействующие вещества (производные барбитуровой кислоты, 1,4- бензодиазепина, фенотиазина, трамал) 76,7 69,2 76,8 54,2 I 57,8 | 49,0
Лекарственные вещества 8,4 16,3 - 4,0 ' 4,0 22,0
29
Из приведённой таблицы видно, что в последние годы
инъекционные наркопотребители вводят комбинации лекарственных и
наркотических веществ.
На протяжении 3-х последних лет число погибших от отравлений
мужчин в 5-6 раз превышало количество умерших женщин.
Среди умерших от отравлений преобладали лица 20-29 летнего
возраста (35-45%), причём среди мужчин наиболее высокие темпы роста
смертности в 1997-2001 гг. отмечены в возрастной группе 25-29 лет, а
среди женщин - 15-19 лет.
До 1998 года при обследовании на СПИД погибших от различных
причин антитела к ВИЧ не обнаруживались. В последующие годы
отмечено увеличение числа обнаружения ВИЧ-инфекции при судебно-
медицинской экспертизе, особенно интенсивное в 2001 году.
В 2001 году процент обнаружения антител к вирусу
иммунодефицита человека среди обследованных трупов составил 10%, что
вдвое выше предыдущего года.
Ведущей причиной смерти ВИЧ-инфицированных (по данным
БСМЭ) в 2001 году явилось употребление наркотических средств и
неизвестных ядов и травмы, несовместимые с жизнью, насильственная
смерть (80,3).
Таблица 16
Возрастная структура ВИЧ-инфицированных, вскрытых в бюро
судебно-медицинской экспертизы Санкт-Петербурга по годам
Годы Всего Из них Возраст (лет)
м Ж До 17 лет 17-20 21-29 30-39 40-49 50-59
1997 - - - - - - - - -
1998 2 2 - - - 1 1 - -
1999 19 17 2 - - 14 2 2 1
2000 106 90 15 3 7 75 18 2 1
2001 160 132 28 3 23 113 16 ^4 , 1 .
В городской инфекционной больнице № 30 имени С.П.Боткина
число умерших от СПИДа в 1987-1999 годы составило 34 человека, в 2000
году - 13, в 2001 году -12. Первый случай смерти от СПИДа в СССР был
установлен в Ленинграде в 1988 г. Наибольшее число погибших от СПИДа
в стационаре - лица 30-49 лет (68%).
Таким образом, в Санкт-Петербурге продолжается интенсивный рост
заболеваемости ВИЧ-инфекцией, который определяется, главным образом,
инъекционными наркопотрсбителями. Уровень инфицированное™
последних в разных группах обследованных (скрининговая, совместное
парентеральное введение наркотиков и по Программе «Снижение вреда»)
колеблется от 9,5 до 27%.
30
Вместе с тем, значительное большее число ВИЧ позитивных выявляется
в стационарах среди лиц с отравлениями, а также среди умерших, по данным
бюро судебно-медицинской экспертизы (БСЭМ). Последние не всегда
включаются в общую статистическую отчетность по ВИЧ инфекции.
В связи с особой актуальностью возрастной структуры ВИЧ
инфицированных жителей Санкт-Петербурга нами было изучено в процентном
соотношении распределение ВИЧ-инфицированных по возрасту. В 1987-1995
гг. лица в возрасте 15-18 лет составляли 3,1%, 19-29 лет-34,7%. В 1996-1998 гг.
-11,3 и43,1 %, соответственно. В последующие 1999,2000 и2001 годы процент
ВИЧ-инфицированных подростков в возрасте 15-18 лет имел неуклонную
тенденцию к росту: 19,5 - 28,5%, а в возрасте 19-29 лет: 58,3 - 64,3%. По
Прогнозам специалистов эпидемия ВИЧ/СПИД повлечет за собой тяжелые
последствия, воздействие которых будут ощущать последующие поколения.
В соответствии с этими данными следует отметить, что в Санкт-
-Петербурге наряду с ростом заболеваемости ВИЧ-инфекции среди лиц молодого
возраста нами установлено, что суммарное количество умерших ВИЧ
инфицированных и больных СПИДом с учётом БСМЭ составило в 1999 году
47, в 2000 - 118, а в 2001 -244. Из 244 умерших 75% было в возрасте до 30 лет.
Актуальной проблемой является химиопрофилактика ВИЧ-инфекции у
беременных и новорожденных, атакже у лиц, подвергшихся профессиональному
‘риску заражения. Согласно нашим данным, в 2000 году 18 медицинских
'работников получили химиопрофилактику в связи с профессиональными
Травмами, а в2001 году-25 человек.
В соответствии со статистическими данными в Санкт-Петербурге отмечен
рост заболеваемости ВИЧ инфекцией женщин. При обследовании беременных
Женщин в 2000 году показатель выявляемое™ ВИЧ инфекции составил 101 на 100
тысяч,ав2001 году-359. За 2001 год на первичном приеме у акушера-гинеколога
побывало 200 беременных женщин, пролонгирующих беременность, а на конец
2001 года их осталось 72. Однако, в январе 2002 года на первичном приеме было
уже 69 беременных, которые имели желание пролонгировать беременность. Следует
отметить, что в 2000 году в городской инфекционной больнице (ГИБ) № 30 было 21
родов с ВИЧ-инфекцией, а в 2001 году в 5 раз больше.
За весь период наблюдения на 03.01.02 года рождения по родильным
домам распределялись следующим образом: 478 в ГИБ № 30, 42 и 28 в
обсервационных роддомах № 15 и № 16, остальные в различных роддомах
города. Таким образом, основная масса рождений детей от ВИЧ
инфицированных матерей была в ГИБ № 30, в обсервационных родильных домах
№№ 15 и 16 - 70. В соответствии с последним распоряжением Комитета по
здравоохранению беременные из групп риска, не обратившиеся за антенатальной
помощью, будут получат ь ускоренную химиопрофилактику (по протоколу Hl V
NET012 - см. ниже), а новорожденные - вирамун в суспензии, с внедрением
31
метода экспресс-диагностики во всех родильных домах.
Для эпидемиологического надзора за ВИЧ-инфекцией в первом
десятилетии эпидемии использовались следующие ориентиры:
- учёт каждого случая ВИЧ-инфекции, независимо от стадии заболевания;
- учёт летальных исходов;
- данные широкого серологического скрининга населения на наличие
антител к ВИЧ-инфекции;
- расследование всех случаев ВИЧ-инфекции для установления путей и
факторов передачи;
- корреляционный анализ заболеваемости ВИЧ-инфекцией с другими
болезнями, имеющими общий механизм и пути передачи инфекции.
Изменения социального строя общества, утверждение приоритетов прав
личности, невмешательства в частную жизнь, изменения в силу ряда социально-
экономических причин стандартов поведения потребовали от эпидем иологов
пересмотра ряда принципов эпидемиологического надзора. Принимая во
внимание, что ВИЧ-инфекция, безусловно, является в первую очередь
поведенческой, зависящей как от склада личности, так и стандартов общества,
для проведения эпидемиологического надзора на современном этапе
необходимо иметь данные и следить за динамикой демографических, социально-
экономических, поведенческих его характеристик.
Именно включение в эпиднадзор данных социальной эпидемиологии
помогает вскрывать причины, факторы, движущие силы эпидемического
процесса, разрабатывать прогноз ситуации, принимать решения и давать
рекомендации по “корректировке” проводимых мероприятий.
Наличие социальных показателей и их динамика позволит своевременно
выявлять новые тенденции эпидемии. Необходимо расширить и постоянно
анализировать медицинские показатели здоровья, заболеваемости инфекциями
со сходным с ВИЧ механизмом передачи, смертности, рождаемости и т.д.
Структура эпидемиологического надзора'.
Основные критерии, используемые для эпидемиологического слежения
за ВИЧ-инфекцией:
1. Медицинские (прямые):
- показатели заболеваемости ВИЧ-инфекцией детей и взрослых;
- результаты скрининга на ВИЧ различных групп населения;
- данные молекулярной эпидемиологии (распространение различных
субтипов вируса на территории);
При написании раздела использованы материалы Канадско-Российского
проекта борьбы со СПИДом (руководитель направления Ливиана Кальсавара), данные
отдела особо опасных инфекций Центра Госсанэпиднадзора (зав. Г.В.Волкова),
Центра профилактики и борьбы со СПИД (Н.А.Ахтырская, И.В.Александрова).
32
- показатели заболеваемости инфекциями с половым путём передачи
(ИППП), парентеральными гепатитами и туберкулезом, в т.ч. заболеваемость
профессиональных групп: медики, милиция и др.;
- показатели заболеваемости и болезненности наркоманией,
токсикоманией;
- уровень заболеваемости психическими расстройствами;
- выявляемость ВИЧ в учреждениях ГУИН;
- уровень госпитализации и смертности от передозировок
психоактивными и наркотическими средствами;
- показатели заболеваемости внутрибольничными инфекциями.
При оценке показателей заболеваемости ИППП, парентеральными
гепатитами, туберкулезом, которая проводится Центрами госсанэпиднадзора
и соответствующими специализированными учреждениями, устанавливаются
возрастные и социальные доминанты, выявляются соответствующие тенденции
и определяется прогноз по ВИЧ/СПИДу.
Необходимо напомнить, что распространение вирусов гепатитов В и С в
среде наркопотребителей происходит более интенсивно и с большой скоростью,
что объясняется как свойствами возбудителя, гак и меньшей заражающей дозой.
Высокий уровень инфицированное™ вирусами гепатитов В и С инъекционных
наркоманов (ИН) является свидетельством неудовлетворительного прогноза
по ВИЧ в данной популяции. Гак, в Санкт-Петербурге в одном из районов на
протяжении 1995-97 годов выявлялась стойкая тенденция роста заболеваемости
гепатитами В и С. Через 2 года этот район стал лидером по выявляемое™
ВИЧ-инфекции среди других районов.
При анализе заболеваемости ИППП важным фактором, имеющем
значение для определения ведущих путей передачи, является сочетание ИППП
с наркоманией. Кроме того, заболеваемость ИППП выявляет также уровень
гигиенической и сексуальной культуры, использования населением приёмов
защищённого секса.
При анализе заболеваемости наркоманией необходимо учитывать и
структуру наркорынка, выявлять социальные предпочтения того или другого
наркотического и психоактивного средства.
Уровень заболеваемости психическими расстройствами является также
индикатором развития деструктивных процессов в экономике, политике, в
жизни общества, а также свидетельствует о выраженных фоновых изменениях
в генетическом коде популяции, что, в свою очередь, приводит к усилению
влияния на преступность и распространению изменённых ценностных
ориентаций, установок, стандартов поведения.
При оценке заболеваемости внутрибольничными инфекциями
выявляются причины их распространения, связанные как с недостаточным
Уровнем подготовки медицинских работников по эпидемиологии тех или иных
3. Заказ № К-4451
33
инфекционных болезней, так и дефицитом медицинского, дезинфекционного и
другого оборудования и инструментария и специфической профилактики
против гепатита В.
2. Медицинские (непрямые):
- уровень подростковой беременности;
- количество мед.абортов, в т.ч. у подростков;
- количество продаваемых средств, предупреждающих беременность (в
первую очередь презервативы);
- количество работающих круглосуточно аптечных киосков натерритории
микрорайонов;
- объёмы продажи презервативов и шприцев (день, ночь) аптечными
учреждениями (маркетинг шприцев ёмкостью 1,0 и более);
- распространенность алкоголизма.
3. Поведенческие показатели формируются путём социологических
опросов, которые проводятся Центрами по профилактике и борьбе со СПИД,
кожно-венерологической службой и инфекционистами, а также службой
госсанэпиднадзора при обследовании эпидочагов в учреждениях и коллективах
(школы, интернаты, ПТУ, колледжи, лицеи и др.) и получения данных из
“полиции нравов”;
- возраст начала половой жизни;
- секс с непостоянными партнёрами (количество за последние 12 мес.);
- использование презервативов при сексуальных контактах;
- культура потребления наркотиков (использование чужого или общего
инъекционного оборудования);
- секс-работники, их количество, число клиентов в неделю;
- уровень знаний о ВИЧ, путях его передачи и мерах профилактики
(показатель, отражающий готовность людей к безопасному поведению).
Исследования поведенческих особенностей в различных группах
населения проводится путем количественного и качественного
интервьюирования. Для проведения количественного интервьюирования
составляются анкеты с перечнем вопросов, необходимых эпидемиологу для
понимания факторов и стимулов эпидпроцесса, его тенденций. Результаты
анкетирования должны помочь эпидемиологу в выборе наиболее эффективных
мер противодействия эпидемии. Количественный метод исследования позволяет
устанавливать тенденции эпидпроцесса, её вектор, а также позволяет даже
измерять тенденции (рост распространения).
Качественные методы предполагают индивидуальные и групповые
интервью (фокус-группы), т.е. дискуссию, посвящённую определенной теме.
Групповое интервью может быть применено с успехом в эпидемиологии.
Однако, организация фокус-групп з ребуетявки к определенному времени
и месту участников дискуссии, что представляет определённую трудность.
34
Этот метод даёт информацию, которая не всегда может быть получена
при индивидуальном интервью. При проведении фокус-группы исследователь
в достаточно короткий отрезок времени может получить качественную
информацию, т,к- высказанные мнения одних людей могут служить
эффективным стимулом для других, или наоборот, провоцируют на
противоположную или иную точку зрения.
Групповое интервью способствует раскрепощению участников, отчего
достигается высокая искренность ответов.
Высокий темп обсуждения темы вызывает мобилизацию внимания и
концентрацию мыслей участников дискуссии и выражению этих мыслей
лаконичными, но более чёткими предложениями. И, что очень важно, работа в
фокус-группах заставляет её участников посмотреть на проблему с другой
стороны, если кто-то из них высказывает активное несогласие со стороны
отдельных её членов.
К недостаткам такого метода можно отнести возможность навязывания
мнения одного из участников групп (особенно, если это лидер по характеру)
другим, а также трудности контроля за работой группы со стороны ведущего.
Состав участников фокус-группы определяется задачами исследования.
По нашему мнению, при изучении распространения ВИЧ-инфекции среди ИН
целесообразно составлять группы одного пола.
Что касается возрастных различий, то, мы считаем, что неоправданно
сочетание лиц моложе 18 и старше 25 лет. То есть наиболее удобным для работы
является состав молодых людей до 18 лет и состав 18-25 лет. Наиболее
оптимальной, на наш взгляд, является численность фокус-групп 6-7 человек. В
такой группе легко и быстро устанавливается добросердечная атмосфера,
способствующая лучшему пониманию друг друга и откровенности мнений.
Дискуссии проводятся на нейтральной территории, в комфортной
обстановке. Каждый участник выбирает псевдоним и перед фокус-группой
должен заполнить анкету, где поставлены вопросы о его наркотическом и
сексуальном анамнезе.
Завершением работы фокус-групп могут быть выводы о факторах,
влияющих на инъекционную наркоманию и другие социальные явления,
интересующие эпидемиолога, о потребностях групп риска для снижения их
роли в эпидемическом процессе, и использование этих выводов для составления
профилактических программ.
Другим качественным методом сбора информации является
индивидуальное интервью (длительностью 2 часа и более) у представителей
групп риска. Этот метод позволяет выяснить причины и обстоятельства
попадания в группы рискованного поведения, установить поведенческие нормы,
распространенные стандарты взаимоотношений в подростковой и молодёжной
среде.
35
Такие интервью могут проводиться в стационарах, где лечатся больные
гепатитами, венерическими болезнями, наркоманией, ВИЧ-инфекцией, а также
в местах лишения свободы.
Качественные методы интервьюирования дают возможность получения
детальной и "незапланированной” информации.
В эпидемиологической практике сопоставление количественных и
качественных методов сбора информации помогает глубже понимать проблему,
оценивать адресность и эффективность принимаемых мер для сдерживания
эпидемического процесса, и определять потребности населения втех или иных
профилактических мероприятиях.
4. Социально-демографические показатели (данные показатели указывают
на социально-экономическую стабильность в обществе и влияют на образ
мыслей людей о выживании):
- возрастная и половая структура населения;
- показатели рождаемости и смертности (возрастная структура
смертности);
- структура причин смертности;
- миграционные процессы на территории и основные причины её;
- семейное положение (уровень браков и разводов);
- динамика внебрачной рождаемости;
- уровень безработицы;
- показатель занятости;
- средний доход на душу населения и прожиточный минимум;
- структура образования (количество школ, интернатов, детских домов,
домов ребенка, внешкольных учреждений);
- структура здравоохранения;
- динамика правонарушений на территории, в том числе и динамика
подростковой преступности;
- правонарушения, связанные с наркотическими средствами;
- учёт работы СМИ, направленной на просвещение населения по вопросам
СПИДа и родственных болезней.
Кроме того, необходимо знать о действии основных религиозных
конфессий и их отношении к людям сексуального и другого рискованного
поведения, для определения их роли и влияния на ход эпидемического процесса.
Владельцами социально-демографических показателей могут быть:
- управленческие структуры территорий;
- органы и учреждения государственной статистики;
- федеральные службы на территории;
- межведомственные комиссии;
36
- общественные организации (так, в Санкт-Петербурге
неправительственные организации могут предоставить данные о количестве
беспризорных детей, наркопотребителей и др.).
5. Организационный мониторинг включает динамическое слежение за
проводимыми профилактическими мероприятиями (составление и выполнение
программ, распоряжений, инструкций, рекомендаций, методических пособий
для осуществления профилактической работы), а также оценку уровня
подготовки медицинских и немедицинских работников по проблемам ВИЧ-
инфекции и родственных инфекций.
Метод дозорного эпиднадзора.
Обследование различных групп населения на ВИЧ-инфекцию даёт
представление о заболеваемости и распространённости в них ВИЧ-инфекции в
данный момент. Но проведение такого скрининга является дорогостоящим
мероприятием и не позволяет порой охватить достаточное количество лиц из
тех групп, которые определяют эпидемический процесс.
Исходя из изложенного, наиболее эффективным методом, позволяющим
получить информацию о циркуляции ВИЧ в тех группах населения, поведение
и образ жизни которых облегчает передачу ВИЧ и наиболее часто приводит к
инфицированию, является метод дозорного эпиднадзора.
Дозорный эпиднадзор должен проводиться постоянно для того, чтобы
определить динамику и скорость распространения событий.
Система дозорного эпиднадзора за ВИЧ-инфекцией подразумевает
осуществление регулярных “исследований по поперечным срезам”
заболеваемости ВИЧ-инфекцией в выбранных группах населения, которые
обозначают термином “дозорные группы”. Другими словами, с помощью
Дозорного эпиднадзора можно выявлять динамику эпидемии ВИЧ-
инфекции в разные промежутки времени, в различных группах населения и на
разных территориях. Теоретически дозорный эпиднадзор за ВИЧ-инфекцией
можно осуществлять в определённых группах населения или на базе
медицинских учреждений; последнее значительно более удобно, поэтому этому
варианту дозорного эпиднадзора отдаётся предпочтение.
Разработку системы дозорного эпиднадзора за ВИЧ-инфекцией начинают
с выбора дозорных групп населения. В соответствии с особенностями
распространения ВИЧ все население может быть разделено на группы с более
высоким и более низким риском инфицирования.
К группам с поведением, создающим повышенный риск заражения ВИЧ,
относятся:
- лица, имеющие половые контакты со множественными партнёрами,
например, больные с инфекциями, передаваемыми половым пузём (ЗППП);
37
лица, использующие недостаточно или неправильно
простерилизованные иглы, шприцы и другие инструменты, нарушающие
целостность кожных покровов, например, наркоманы, вводящие наркотики
внутривенно.
В качестве дозорных групп населения должны быть выбраны чётко
определяемые и легко достижимые контингенты. Поэтому дозорный эпиднадзор
предпочтительно должен быть организован в таких местах, где у людей берут
кровь для тех или иных целей; таким образом часть этой крови можно легко
отделить и использовать для исследования на антитела к ВИЧ с помощью
несвязанного анонимного тестирования. С точки зрения практического
осуществления программы дозорные точки должны быть выбраны с таким
рассчётом, чтобы исследованием были охвачены все основные группы риска.
Более того, такие места должны быть легко доступны и удобны, через них
должно проходить достаточное количество больных. В наибольшей степени
таким требованиям удовлетворяют учреждения для лечения больных с ЗППП,
центры лечения наркоманов и антенатальные медицинские учреждения,
работающие на внешнюю обсервацию.
В начальной стадии функционирования дозорного надзора
рекомендуемый объём выборки - 250 или больше образцов; такое число образцов
может быть получено в течение 8 недель. На приоритетных территориях
дозорный надзор за этой группой населения следует проводить даже в тех
случаях, когда ни в одной из дозорных точек за определенный промежуток
времени не может быть собрано 250 образцов.
Как уже было указано выше, дозорный эпиднадзор необходимо
осуществлять на дозорных группах с указанной численностью образцов и
повторя ть исследования один раз в год для выявления тенденций динамики
заболеваемости ВИЧ-инфекцией. Опыт практической работы показал, что более
целесообразно проводить эпиднадзор в большем числе
дозорных точек один раз в год, нежели обследовать дозорные группы населения
каждые 6 месяцев, но в меньшем числе дозорных точек. При повторных
обследованиях общая методология надзора и лабораторные методы должны
быть теми же, что и в предыдущих исследованиях; это позволит в дальнейшем
сравнивать результаты, полученные в разных местах. Желательно, чтобы в
каждой лаборатории серологические исследования выполнял один и тот же
лабораторный работник, чтобы свести к минимуму субъективные ошибки.
При проведении дозорного эпиднадзора в Санкт-Петербурге, когда
определялась распространённость вируса иммунодефицита человека в группах
анонимных инъекционных наркоманов, обитающих в разных полюсах города,
путём исследования остатков крови в сданных наркопотребителями в "Автобус"
шприцах была установлена высокая поражённость этих групп, в 2 раза
превышающая официальные данные обследования наркоманов.
38
Через 6 мес. повторное обследование по такой же методике выявило
более чем двухкратный рост инфицированности инъекционных наркоманов (с
10-12% в ноябре 1999 г. до 25% в мае 2000 года).
Общая же инфицированность этой группы населения при проведении
скрининга составила в мае 2000 года только 5,2%, что, однако, тоже в 2 раза
выше, чем в ноябре 1999 года. Приведённые данные свидетельствуют об
эффективности метода дозорного эпиднадзора, дающего более истинное
представление о развитии ситуации в группе высокого риска.
Работа с общественными организациями в целях эпиднадзора
Значительную роль в осуществлении надзора за ВИЧ-инфекцией играет
совместная работа госсанэпиднадзора и учреждений здравоохранения с
неправительственными организациями, занимающимися группами риска.
В Санкт-Петербурге большую поддержку со стороны Администрации
города и медицинской общественности получила Программа по снижению
вреда заболевания СПИДом среди внутривенных наркоманов, в реализации
которой активно участвуют Французская гуманитарная Ассоциация "Врачи
мира”, РОО "Возвращение”, Ассоциация "СПИД, секс, здоровье ” совместно
со Шведским правительством "Мальмо-Санкт-Петербург” в рамках "Автобуса
помощи наркозависимым”. Основной целью Программы является обеспечение
возможно более раннего контакта наркозависимого со специалистами с целью
проведения профилактической работы по предупреждению заражения
ВИЧ-инфекцией, вирусными гепатитами В и С и болезнями, передающимися
половым путём. Конкретными задачами в работе Автобусов является:
- информационная поддержка;
- консультации специалистов (инфекционные болезни, эпидемиология,
наркология, психология и др.);
- оказание первой врачебной помощи;
- проведение пред- и послетестового консультирования;
- осуществление забора крови с последующим лабораторным
исследованием на маркеры ВИЧ, ВГВ, ВГС и сифилис;
Сопоставление данных анкетирования и результатов обследования
пациентов Автобусов позволяет установить возрастную и половую структуры
инъекционных наркоманов и ВИЧ-инфицированных, стаж употребления
наркотиков и время возможного заражения, даёт представление о концентрации
ВИЧ-инфекции в этой среде на определённых территориях.
В Санкт-Петербурге работа общественных организаций, оказывающих
помощь наркопотребителям в Автобусах или стационарных пунктах в
соответствии с программой “Снижения вреда от введения наркотиков”,
направляется и контролируется санитарно-эпидемиологической службой. Для
39
снижения противодействия со стороны милицейских и других органов работе
передвижных Автобусов, обменивающих шприцы, иглы, оказывающих
медицинскую и психологическую помощь, проводящих обследование
посетителей на носительство маркеров вирусов гепатитов В и С и
иммунодефицита человека, подготовлено и выпущено специальное
Распоряжение губернатора, поддерживающего эту деятельность.
Автобусы и стационарный пункт обмена шприцев оборудованы согласно
требованиям Госсанэпиднадзора с целью минимизации возможности передачи
вирусов иммунодефицита, гепатитов В и С между клиентами и работниками
Программы.
Опыт работы Автобусов и, в частности, Автобуса «Мальмо-Санкт-
Петербург» свидетельствуют, что дозорный эпиднадзор позволяет полу чть более
полную информацию о частоте ВИЧ-инфекции в группах риска. Об
эффективности работы автобусов свидетельствуют результаты повторных
обследований лиц, обращающихся в Автобус (таблица 17).
40
Таблица 17
Результаты обследования внутривенных наркопотребителей в Автобусе Мальмо - Санкт-Петербург*
Годы Кол-во обследо- ванных 1 Выявлена ' ВИЧ- i инфекция Выявлено НВ V/HCV Кол-во повторно обследован- ных Впервые выявлена ВИЧ- инфекция Инфицированы HBV/HCV
2000 1017 ' 44 (4,3 %) 998 (98.1%) 130 6 (4,61%>) 119 (91,54%)
2001 1158 ! 239(20,6%) 990 (85,5%) 389 10 (2,57%) 373 (95,88%)
2002 621 ’ 43 (6,9%) ; 553 (89%) 468 10 (2.1%) -
Всего* 4189 ! 326 (11,6°%) 2541 (90,9%) 987 26 (2.6%) 492 (94,8%)
’Всего обследований - 4189, из них 2796 - впервые обследованных и 987 повторных многократных обследований.
Представлено на Международной конференции по СПИДу (Барселона 2002 год), авторы А.Г.Рахманова.
Е.Н.Виноградова, А.А.Яковлев, Л.Н.Крыга, Г.В.Волкова. Р.Альстсрлунд, М.Андерссон
Результаты повторного тестирования посетителей Автобуса подтвердили перспективность его работы,
повторно случаи ВИЧ-инфекции выявляются редко.
Требования к работе Автобуса по обмену шприцев в рамках программы
снижения вреда от использования наркотиков (составлены Г. В. Волковой,
Л.Н.Крыга)
Салон Автобуса (пункт) условно разделен на “чистую” и грязную”
половины. В “грязной” выделены:
- помещение для ожидания (при возможности);
блоки:
- обмена шприцев;
- выдачи презервативов;
- выдачи информационной литературы;
- взятия крови для исследования (минипроцедурная);
- для работы психолога;
- для работы нарколога, врача-инфекциониста и пр.
В чистой половине располагается персонал (раздевалка, места хранения
чистой спецодежды, запасов медикаментов, листовок, перчаток, дезсредств) и
пр. Здесь же имеется место для приёма пищи персоналом Автобуса.
"Чис тая” и "грязная” половины оборудованы рукомойниками для мытья
рук персонала.
Основные документы, необходимые для получения разрешения на работу,
разработаны в Центре госсанэпиднадзора.
1. Регистрационное удостоверение на право такой работы в городе, Устав
Ассоциации, Фонда и т.д.
2. Список персонала, включая шоферов, уборщиц и др. вспомогательного
состава с данными о результатах обследования на ВИЧ, гепатиты В и С, RW и
туберкулёз (флюорография).
3. Должностные инструкции каждого работающего, согласованные
санэпидслужбой и утверждённые руководителем организации.
4. Журнал профилактических прививок против гепатита "В” на каждого
работающего и о напряжённости иммунитета к нему в данное время.
5. Список персонала, теоретически подготовленного по проблемам ВИЧ-
инфекции и вирусных гепатитов с указанием даты проведения и сдачи зачёта
после теоретического и практического цикла.
6. Журнал учёта аварийных ситуаций (профессиональных травм).
Подготовка персонала, независимо от выполняемой работы, проводится
специалистами Центра госсанэпиднадзора. Ими же после соответствующего
тренировочного (практического) занятия принимается зачёт. Такие занятия
проводятся в зависимости от эпидситуации, но не реже 2-х раз в год.
7. Журнал учёта взятых анализов крови.
8. Журнал приёма пациентов.
9. Инструкция о противоэпидемическом режиме.
4
10.1 . обеззараживание и утилизацию шприцев, игл и других
использованных медицинских принадлежностей;
10.2 . выдачу стерильного материала (для взятия крови);
10.3 . исследование крови на ВИЧ-инфекцию, гепатиты В и С и си-
филис;
10.4 . дезинфекцию и стирку спец.одежды.
11. Документ об оснащенности работы данного объекта на I месяц
работы.
12. Журнал учёта контроля за соблюдением противоэпидемического
режима.
Завершается предварительная работа с персоналом Автобуса актом
(разрешением) о возможности работы данного объекта. Допуск новых
сотрудников осуществляется с разрешения службы госсанэпиднадзора
после собеседования и предоставления соответствующих документов.
Ежемесячно в Центр госсанэпиднадзора предоставляются данные о
проведенной работе:
- число обратившихся по поводу обмена;
- обследованных на ВИЧ и выявленных ВИЧ-позптивных.
Кроме того, для анализа ситуации учитываются данные
анкетирования обратившихся, которые проводи! психолог. Причём анкеты
не менее 2-х раз в год составляются также с учётом профессиональных
интересов эпидемиологов.
Важным моментом профилактической работы этого Проекта
является предоставление участникам (обратившимся) оперативной
информации о выявленных ВИЧ-инфицированных, больных гепатитами В
и С. сифилисом из числа обследованных в ’‘Автобусе”. Для этого
периодически (не реже 1-2-х раз в месяц) на видном месте в салоне
“Автобуса” вывешивается специальное сообщение.
Анализ результатов работы “Автобуса” вкупе с данными
эпиднадзора за ВИЧ-инфекцией способствует правильному определению
необходимого количества объектов по обмену шприцев и их дислокации.
43
Характеристика внутрибольничной ВИЧ-инфекции у детей (по
данным Волгоградского областного Центра по профилактике и борьбе со
СПИД)"
На фоне стремительного роста заболеваемости ВИЧ-инфекцией в
Российской Федерации закономерно возрастает частота заносов ВИЧ-
инфекции и риск внутрибольничного распространения ВИЧ в
соматических и других стационарах, как для детей, так и для взрослых. В
связи с этим приобретает особую актуальность проблема профилактики
нозокомиальной ВИЧ-инфекции.
Мы для разработки предложений по усовершенствованию
профилактики внутрибольничного распространения ВИЧ-инфекции
изучали клинику ВИЧ-инфекции у детей, инфицированных
парентеральным путём в стационарах Волгограда, выявляли и оценивали
факторы риска (ФР) инфицирования ВИЧ парентеральным путём.
Спектр ФР был определен методом экспертной оценки и на
основании анализа данных литературы (В.В.Покровский, 1996). К таковым
отнесли: прсморбидный фон и возраст пациентов, вид и кратность
парентеральных вмешательств, гемотрансфузии.
Исследуемую группу составили 56 детей, из них 52 были
инфицированы в стационарах парентеральным путем в возрасте от 1
месяца до 15 лет. В момент предположительного инфицирования дети в
возрасте от 0 до 3 лет составляли большинство - 71,2 %.
У 12 детей (23,1%) сформировался СПИД через 2 года после
инфицирования. При этом частота формирования СПИДа у детей,
инфицированных в возрасте до 1 года, составила 54,5%: у детей,
инфицированных в возрасте 1-3 лет - 19,2% (р<0.05), в возрасте 4 лет и
старше - 6,7% случаев (р<0,05).
Через 6 и более лет с момента инфицирования ВИЧ стадия 111 В
(СПИД) сформировалась у 81,8% детей, инфицированных в возрасте до I
года, в то время как среди детей, инфицированных в более старшем
возрасте, СПИД сформировался в 40,0-42,3% случаев (таблица 18).
Через 1-4 года летальность среди детей, инфицированных в возрасте
до 1 года, составила 54,5% (умерли 6 детей из II), среди детей,
инфицированных в более старших возрастах, - от 13% до 19%.
Таким образом, представленные данные показывают, что
инфицирование детей в раннем возрасте (до 1 года жизни) обусловило
прогрессирование заболевания к СПИДу, более высокую частоту и ранние
сроки летальных исходов (через 1-2-4 года с момента инфицирования).
Характер течения и исходы ВИЧ-инфекции зависели от структуры и
тяжести преморбидного состояния у детей.
По материалам кандидатской диссертации Н.В.Горшковой и информационно-методического
письма O.B.I biaiouinnon, И.А.Поповой, Н.В.Горшковой. СПб, 1999. под редакцией
А.Г.Рахмановой.
44
Таблица 18
Частота формирования СПИДа (стадия III В) у ВИЧ-инфицированных парентеральным путём детей
Волгоградской обл. в зависимости от возраста инфицирования и срока с момента инфицирования
Возраст в момент заражен ня Всего инфицировано Срок форми рования СПИДа с момента заражения
1-2 года 3 года 4года 5 года 6 и более лет Всего в ст. III В
абс. % (от общего числа иифи- цнрованн абс. % (от числа детей данной возраст- ной группы) абс. % (от числа де гей данной возраст- ной группы) абс. % (от числа детей данной возраст- ной группы) абс % (от числа детей данной возраст- ной труппы) абс % (от числа детей данной возрас- тной груп- пы) абс % (ОТ числа де гей дан- ной воз- раст- ной т руп- пы)
До 1 года 11 21,2 6 54,5* 0 0 1 9,1 1 9,1 0 0 8 81,8*
1-3 года 26 50,0 5 19,2* 1 3,8 1 3,8 2 7,7 2 7,7 II 42,3*
4 года и старше 15 28,8 1 6,7* 0 0 0 0 I 6,7 4 26,7 6 40,0*
Всего 52 100,0 12 23,1 1 1,9 2 3,8 4 7,7 6 11,5 25 48,1
р < < 0,05 - дети в возрасте до I г. в сравнении с др. возрастными группами
документированных у детей непосредственно в момент предполагаемого
инфицирования ВИЧ, наибольшую часть (40%) составляли тяжело протекающие
пневмонии и плевропневмонии; у 24% больных имели место часто
рецидивирующие ОРВИ иларинготрахеобронхиты; 16% детей находились в
стационарах по поводу хирургических вмешательств; у 13% детей были ОКИ с
тяжелым течением. Прочие тяжелые заболевания, в т.ч. сепсис, были
диагностированы у 7% больных.
У детей, заболевших СПИДом и умерших в течение первых 2-4 лет после
заражения, преморбидное состояние обусловили тяжёлые пневмонии,
преимущественно плевропневмонии (51%), проч нетяжелые заболевания (36%),
в том числе сепсис.
Тяжёлая бронхолёгочная патология, прочие тяжелые заболева-пия,
включая сепсис, характеризуются развитием тяжелого вторичного
иммунодефицита, возникающего как вследст-вие собственно заболеваний, так
и их массивной терапии (в частности, антибактериальной, кортикостероидной
и др.). Таким образом, преморбидные заболевания и состояния обусловили
высокую восприимчивость детей к ВИЧ и повлияли на характер течения и
исход ВИЧ-инфекции.
По данным отечественных исследователей, изучавших особенности
внутрибольничной вспышки ВИЧ-инфекции в г. Элиста (Калмыкия),
существенным фактором, определяющим характер течения и исход болезни,
были парентеральные вмешательства, проводимые детям с диагностической и
лечебной целями (B.B.11окровский, 1996). Известно также о выраженном
иммуносупрессивном воздействии на организм .длительных и множес твенных
парентеральных вмешательств и многократных гемотрансфузий.
Нами также изучена частота различных парентеральных вмешательств у
ВИЧ-инфицированных детей (рисунок 2). Установлено, что все дети (100,0%)
получали множественные внутримышечные и внутривенные инъекции.
Гсмотрансфузии - переливание цельной крови и компонен тов крови - выполнены
24 детям из 52 (46,2%), в том числе многократно (2 и более раз) ГТ получили 18
детей. Кратность ГТ варьировала от 1 до 6 раз, средняя кратность сос тавила
5,1. Среди 122 доноров ВИЧ - пози тивные не выявлены.
Одним из наиболее эпидемиологически опасных парентеральных
вмешательств является катетеризация магистральных кровеносных сосудов.
Большинство внутрибольничных инфекций крови связано с применением
внутрисосудистых устройств (Michele L. Pearson. 1997).
Час тота установки центрального венозного катетера (ЦВК) для проведения
массивной инфузионной терапии детям, инфицированным в нозокомиальных
очагах Волгограда, составила 82,7% (43 ребёнка из 52).
46
Причём большая часть катетеризаций выполнена детям, находившимся в
торакальном (20 детей) и реанимационном (18 детей) отделениях.
Рисунок 2
Частота различных парентеральных вмешательств у ВИЧ-
инфицированных детей (в %) N=52
Как известно из опубликованных работ, в нозокомиальных очагах Элисты
одной из вероятных причин распространения ВИЧ явилось использование
общего (контаминированного ВИЧ) шприца для промывки катетеров гепарином
(В.В. Покровский, 1997). И в нозокомиальных очагах Волгограда нельзя
исключить подобное нарушение противоэпидемического режима. Кроме того,
причиной инфекционных осложнений при катетеризации является
использование некачественно обработанного медицинского инструментария.
Выполнение такой процедуры, как плевральная пункция также
связано с высоким риском инфекционных осложнений, тем более, что
предрасполагающим фактором здесь является выраженная тяжесть
соматического заболевания у детей (тяжелые пневмонии,
преимущественно плевропневмонии).
Плевральные пункции выполнены 22 детям, находившимся на лечении в
торакальном отделении, что составило 42.3% отобщего числа инфицированных
в нозокомиальных очагах (52 ребёнка) и 88,0% от числа находившихся на лечении
в данном отделении (25 детей).
У 38 детей оценивали кратность парентеральных вмешательств как фактор
риска инфицирования парентеральным путём. Учитывали как среднесуточную
парентеральную нагрузку за весь период пребывания детей в стационаре, так и
максимальную суточную. С нашей точки зрения наибольший интерес
представляет анализ данных ио максимальной суточной нагрузке, поскольку
именно в условия,х высокой кратности парентеральных вмешательств за
небольшой (сутки) промежуток времени наиболее вероятны различные
нарушения их выполнения. В числе таких нарушений могут быть нарушения
47
противоэпидемических правил, включая использование общего и нестерильного
медицинского инструментария.
Нами установлено, что среднесуточная кратность парентеральных
вмешательств у ВИЧ-инфицированных детей колебалась от 3,5 до 24,8.
Максимальная кратность парентеральных вмешательств в сутки колебалась от
1 до 35. Наименьшую парентеральную суточную нагрузку - от 1 до 5
вмешательств - имели 4 ребёнка (10,5% из 38); ВИЧ-инфекция у них
прогрессировала медленнее, чем у детей с многократными вмешательствами.
Среди детей с кратностью парентеральных вмешательств в течение суток
6 и более СПИД развился у 20 детей (58,8%), 14 детей (41,2%) умерли. В этой
группе наиболее неблагоприятное течение ВИЧ-инфекции отмечалось у детей
с максимальной парентеральной нагрузкой, составившей 11-21 и более
вмешательств: 15 детей из 24 (62,5%) заболели СПИДом, большая часть из них
-13 детей (54,2%) - умерли. Частота летальных исходов среди детей с наиболее
выраженной суточной парентеральной нагрузкой (11 - 21 и более вмешательств)
оказалась существенно выше аналогичного показателя в группе детей с меньшей
суточной нагрузкой (6-10 вмешательств). Таким образом, кратность
парентеральных вмешательств в сутки можно считать фактором риска,
влияющим на характер течения, а именно на прогрессирование и летальный
исход.
Для изучения зависимости течения ВИЧ/СПИДа от действия
перечисленных выше факторов ретроспективно сравнивали группы больных
детей с быстрым (1-я группа) и медленным (2-я группа) прогрессированием к
СПИДу. В первую группу вошли 7 пациентов, у которых документировано
развитие СПИДа и летальный исход в течение 2-3-х лет от предполагаемого
момента инфицирования. Во вторую группу были включены 10 пациентов, у
которых через 9 лет после инфицирования клинические проявления выраже-ны
мало, что соответствует стадии начальных клинических проявлений ВИЧ-
инфекции (таблица 19).
В группе с быстрым прогрессированием 6 детей из 7 неоднократно
получали гемотрансфузии; среди 10 детей с медленным прогрессированием
ВИЧ-инфекции таковых не было.
48
Таблица 19
Характеристика групп больных детей с различным течением ВИЧ-
инфекции с учетом эпидемиологических данных
Факторы риска Группы больных Р
I (с быстрым прогрессирова- нием) п =7 11 (с медленным прогрессирова- нием) п=10
абс. % абс. %
1. Инфицирование в возрасте до 1 года 5 71,0 2 20,0 <0,05
2. Тяжёлая форма преморбидного заболевания 7 100,0 4 40,0
3. Многократные парентеральные вмешательства 7 100,0 2 20,0
4. Многократные гемотрансфузии 6 86,0 0 0
5. Иммунологические и гематологические нарушения:
5.1. тяжёлая иммуносупрессия 4 57,0 0 0
5.2. анемия (НЬ <80 г/л) 5 71,0 0 0
5.3.тромбоцитопения (<100 10 9/л) 2 28,0 0 0
5.4. ускоренная СОЭ (>40 мм/час) 6 86,0 0 0
Спектр клинических проявлений ВИЧ-инфекции у детей с быстрым
прогрессированием к СПИДу представлен следующими заболеваниями:
пневмоцистная пневмония, рецидивирующая бактериальная пневмония,
генерализованная ЦМВ-инфекция, распространенный и системный
кандидоз, герпетическая инфекция (простой герпес и герпес-зостер).
Поражение ЦИС с психомоторными нарушениями имело место у всех 7
пациентов. Все больные резко отставали в весе и росте.
Клинические проявления ВИЧ-инфекции у детей с медленной
прогрессией к СПИДу существенно отличались от таковых у детей с
4. Заказ № К-4451.
49
быстрой прогрессией: на фоне персистирующей генерализованной
лимфаденопатии (ИГЛ), умеренно выраженной гепатомегалии отмечали
рецидивирующие острые респираторные инфекции, в некоторых случаях
осложняющиеся рииосинуситами, отитами, а также рецидивами простого
герпеса в форме локализованной кожно-слизистой инфекции. У большей части
больных этой группы имели место поражения кожи в виде аллергодерматитов,
себореи, пиодермии. Как проявление хронической инфекции у большинства
детей диагностировали астено-всгетативный синдром. У детей,
инфицированных в раннем детстве (в возрасте до 1 года, йот 1 года до 3-х лет),
была заметно выражена задержка физического (отставание в весе и росте) и
психомоторного развития.
При анализе выраженности иммуносупрессии и гематологических
нарушений у пациентов сравниваемых групп также были выявлены
существенные различия. У 4 детей из 7 больных 1-й группы была
документирована тяжелая иммуносупрессия, что не наблюдалось ни у одного
пациента 2-й группы. Через 9 лет после инфицирования у 6 детей из 10 больных
2-й группы иммунологические показатели соответствовали норме.
Выраженные гематологические нарушения в виде анемии,
тромбоцитопении, ускоренной СОЭ регистрировались только у пациентов с
быстрой прогрессией к СПИДу. Анемия легкой степени, транзиторная
тромбоцитопения и умеренно ускоренная СОЭ отмечались у отдельных больных
второй группы.
Таким образом, ранний возраст, тяжелое преморбидное состояние и
интенсивные парентеральные вмешательства способствовали развитию
тяжелого вторичного иммунного дефицита и обусловили высокую
восприимчивость детей к ВИЧ и далее быс трое прогрессирование заболевания
к СПИДу и летальный исход.
Особенностью ВИЧ-инфекции у детей при заражении парентеральным
путём в с тационаре явилось отсутствие у большинс тва ос трой и бессимптомной
фаз заболевания. Обострения фоновых и сопутствующих заболеваний
способствовали прогрессированию иммунодефицита и присоединению
вторичных оппортунистических болезней. Преимущественными ВИЧ-
ассоциировапными состояниями и заболеваниями у детей, инфицированных
парентеральным путём в стационарах, явились: персистирующая
лимфаденопатия (ПГЛ) -100,0%; поражение органов бронхо-лёгочной системы
- 100,0%(в гом числе: лимфоидная интерстициальная пневмония (ЛИП) -17,0%.
пневмоцистная пневмония (ПЦП) - 17,0%, другие пневмонии и заболевания
верхних дыхательных путей); сис темный кандидоз-93,3%; поражения системы
органов пищеварения - 87,0%; гепатолиенальпый синдром - 78,3%;
генерализованные и рецидивирующие герпес-вирусныс инфекции
(ци томегаловирусом (ЦМВ) 40%, вирусом простого герпеса (ВПГ) - 27%);
50
генерализованные стрепто-стафилококковые инфекции - 20%; выраженные
формы задержки физического развития; ВИЧ-энцефалопатия.
Эпидемиологический анализ внутрибольничного распространения ВИЧ-
инфекции водной из больниц (больница «А», в которой инфицировано 45 детей
из 52, или 86,5%) выявил наиболее высокую интенсивность процесса в
торакальном и реанимационном отделениях (рисунок 3). Частота
распространения ВИЧ в этих отделениях оказалась существенно выше
аналогичного показателя (р < 0,005) в хирургическом (1,6%), токсикологическом
(1,2%), травматологическом (0,8) отделениях.
Рисунок 3
Частота внутрибольничной ВИЧ-инфекции (в %) в зависимости от
профиля отделений больницы "A" N=45
900 • t 12.0%
Наиболее интенсивное распространение ВИЧ в торакальном отделении
отмечалось в ноябре -декабре 1988 г. и январе 1989 г. Именно в этот период,
ноябрь-декабрь 1988 г., здесь нарушались санитарные нормы при размещении
коек. Подтверждением эпидемиологического неблагополучия в торакальном
отделении в этот период является также возникновение у двух детей вирусного
гепатита В, подтверждённого выделением HBsAg.
Адекватные противоэпидемические мероприятия, начатые в апреле
1989 г., купировали очаг в торакальном отделении в короткие сроки: в апреле и
мае зарегистрированы 2 случая, что составило 8,0% от числа
зарегистрированных здесь ВИЧ - позитивных (25 детей).
Факторами риска, обусловившими более интенсивное распространение
ВИЧ в реанимационном и торакальном отделениях, могли быть: более
4*
51
отягощённый преморбидный фон у детей данных отделений, более агрессивные
парентеральные вмешательства, другие факторы, характеризующие санитарно-
гигиенические условия и противоэпидемический режим; здесь выявлены
дефицит медицинского инструментария и дефекты его обработки; в период
существования очага площадь на 1 пациента составляла 2,0 м2 вместо 7,2 м2 по
санитарным нормам.
Таким образом, можно обобщить некоторые очевидные факторы
риска интенсивного распространения ВИЧ в торакальном и реанимационном
отделениях:
I. Факторы риска, обусловленные состоянием пациента:
• Вторичный иммунодефицит вследствие тяжёлых сопутствующих
заболеваний и преморбидного состояния и иммуносупрессивного эффекта
массивной парентеральной и гемотрансфузионной терапии у детей,
находившихся на лечении в данных отделениях;
П. Ятрогенные факторы риска, обусловленные медицинскими вмешательствами:
• Множественные, частые, сопряжённые с риском инфекционных
осложнений (эпидемиологически опасные) парентеральные
вмешательства: катетеризация магистральных сосудов, пунктирование
плевральной полости, гемотрансфузии);
• длительность отдельных парентеральных вмешательств (ЦВК и др.)
• отсутствие регламентированных алгоритмов эпидемиологически
безопасного выполнения медицинских манипуляций;
III. Факторы риска госпитальной среды (условия стационара):
• нарушения противоэпидемического режима в части обеспечения
адекватной дезинфекции и стерилизации медицинского инструментария,
использование общего шприца (для промывки катетеров гепарином) и др.
• дефицит медицинского инструментария;
• нарушения санитарно-гигиенических норм и правил размещения
пациентов.
Мероприятия по локализации очага ВИЧ-инфекции осуществлялись
оперативно и включали в себя:
• рациональную организацию эпидемиологического обследования
нозокомиальных очагов и обеспечение противоэпидемических мероприятий;
• одномоментное и полное выявление источников инфекции (с
использованием эпидемиологических, клинических, лабораторных методов);
• выявление факторов риска парентерального инфицирования и их
нивелирование засчётснижения кратности парентеральных вмешательств
посредством их строгого обоснования, включая гемотрансфузии; строгого
(контролируемого службами стационара - внутренний контроль, и
Госсанэпиднадзора- внешний контроль) соблюдения правил дезинфекции
и стерилизации медицинского инструментария;
52
• выявление других факторов риска госпитальной среды и их
устранение за счёт обеспечения достаточным количеством медицинского
инструментария, рационального размещения пациентов с соблюдением
санитарно-гигиенических норм, целенаправленной подготовки медицинского
персонала по ВИЧ-инфекции.
На основании полученных результатов изучения клинических и
эпидемиологических характеристик ВИЧ-инфекции у детей с парентеральным
путём инфицирования, эпидемиологического обследования нозокомиальных
очагов, можно сделать следующие выводы:
1. ВИЧ-инфекция у детей с парентеральным путём заражения имеет
особенности клинического течения, заключающиеся в быстром
прогрессировании инфекции и развитии стадий клинических проявлений в
первые 2 года от момента заражения, а также высокой летальностью, в том
числе в течение первых 5 лет с момента заражения. Частота манифестации
оппортунистических инфекций у детей с парентеральным путём инфицирования
и частота летальных исходов зависят от возраста и наличия вторичного
иммунодефицита в момент инфицирования, обусловленного преморбидными
заболеваниями и состоянием, видами и частотой парентеральных вмешательств.
2. Набыстрое прогрессирование ВИЧ-инфекции повлияли: ранний возраст
инфицирования, тяжёлые преморбидные и сопутствующие заболевания, частые
парентеральные вмешательства, гемотрансфузии, обострения фоновых
заболеваний и, как следствие, присоединение вторичных оппортунистических
болезней.
3. Интенсивность эпидемического процесса внутрибольничной ВИЧ-
инфекции в различных лечебных отделениях зависела от факторов риска,
обусловленных профилем отделения и условиями госпитальной среды.
4. Эффективная система контроля за внутрибольничным
распространением ВИЧ-инфекции включает в себя комплекс мер, направленных
на выявление источников инфекции и факторов риска внутрибольничного
распространения; нивелирование и устранение ФР.
53
1.2. Методы и тест-системы в диагностике ВИЧ-инфекции
Для диагностики ВИЧ-инфекции используют методы, направленные на:
а) выявление специфических антител к ВИЧ; б) обнаружение вирусных
антигенов; в) определение наличия вируса методом культивирования in vitro.
Методы диагностики ВИЧ-инфекции
Определение антител к ВИЧ (серологические методы - ИФА и иммунный блот).
• Иммуноферментный анализ (ИФА) позволяет выявлять антитела к ВИЧ.
• Иммунный блот позволяет определять антитела к отдельным белкам ВИЧ.
• ИФА может даватьложноположительные и ложноотрицательные реакции.
• Образцы крови, положительные в ИФА, необходимо подтверждать
иммунным блотом.
• Антитела к ВИЧ определяются как у больных, так и у здоровых детей,
рожденных ВИЧ-инфицированными матерями.
• Материнские антитела циркулируют в организме ребенка до 18 месяцев,
в редких случаях до 3-х лет.
• Положительные серологические тесты у ребенка до 18 мес. не
подтверждают наличие у него ВИЧ-инфекции.
• При (половом, инъекционном) путях инфицирования положительный
результат в ИФА, подтвержденный иммунным блотом, является
основным методом диагностики ВИЧ-инфекции.
• Антитела к ВИЧ при ВИЧ-инфекции могут не определяться, если у
пациента имеет место тяжелая агаммаглобулинемия.
Выявление антигена р24.
• Обнаружение антигена р24 обозначает присутствие ВИЧ в крови.
• Антиген р24 не связан с антителами только в начальный период
заболевания и в период развития симптомов СПИДа.
• Выявляется только на ранних стадиях и при прогрессировании
заболевания на заключительном этане болезни.
• Метод выявления антигена р24 характеризуется низкой
чувствительностью у детей первых месяцев жизни.
• Если у ребенка при рождении выявляется антиген р24, то развитие
раннего СПИДа в 4 раза более вероятно.
Определение ДНК ВИЧ полимеразной цепной реакцией (ПЦР)
• ПЦР - наиболее высоко чувствительный метод выявления генетического
материала вируса, включенного в клетку.
• У детей первых недель жизни при исследовании ДНК ВИЧ методом ПЦР
наблюдается большое число ложноположительных результатов в связи с
54
контаминацией материнской кровью, поэтому исследовать целесообразно
только венозную кровь.
Первое исследование в возрасте 48 ч. позволяет выявить около 40%
инфицированных младенцев.
Если ребенок был инфицирован во внутриутробный период, то уже через
48 часов после рождения определяются положительные результаты.
Если ребенок был инфицирован во время родов, то в возрасте 48 часов
жизни результаты будут отрицательными, но станут положительными
через 1 неделю - I месяц.
Наиболее оптимально первый раз определять наличие ДНК ВИЧ ПЦР у
новорожденных детей на 14-й день жизни (чувствительность 93%).
В возрасте 1 -2 мес. детям от ВИЧ-инфицированных матерей, у которых
первый анализ был отрицательным, следует повторить определение ДНК
ВИЧ методом ПЦР (чувствительность 96%).
Детей, рожденных ВИЧ-инфицированными матерями, у которых
получены отрицательные результаты теста при рождении и в возрасте 1 -
2 мес., необходимо повторно тестировать в 3-6 мес. (чувствительность
100%).
Недостаток метода - необходимость дорогостоящего оборудования и
достаточно высокая стоимость расходных материалов.
Выделение культуры ВИЧ.
Высокочувствительный метод выявления ВИЧ.
У детей первого месяца жизни ложноотрицательные результаты
наблюдаются в 50-70% случаев.
Применение этого метода диагностики ограничено из-за большой
трудоемкости исследования (результат можно получить через 2-4 недели)
и необходимости специально оборудованной лаборатории.
Определение РНК ВИЧ ПЦР
Определение РНК ВИЧ методом ПЦР позволяет выявлять нуклеиновые
кислоты вируса в плазме крови.
Этот метод не используется для диагностики ВИЧ-инфекции.
Число копий РНК ВИЧ в плазме крови, определяемое ПЦР, называется
«вирусной нагрузкой»
Вирусная нагрузка у детей старше 1 мес. и взрослых имеет очень важное
значение для прогнозирования течения заболевания, его исхода, выбора
тактики терапии.
Этот метод значительно дороже, чем ПЦР на ДНК ВИЧ.
55
Выявление специфических антител к ВИЧ
Иммуноферментный анализ (ИФА).
Наиболее доступным, распространенным и сравнительно дешевым
методом диагностики ВИЧ-инфекции является иммуноферментный анализ
(ИФА). Для исследования используют сыворотку и плазму.
Твердофазный иммуноферментный анализ (ELISA) является наиболее
популярным при диагностике различных вирусных, бактериальных, грибковых
болезней человека. Метод удобен для выполнения большого числа однотипных
исследований. В отличие от классических диагностических методов, основанных
на агглютинации, преципитации, в ИФА на первом этапе происходит образование
комплекса антиген-антитело, который затем проявляется с помощью фермент
- субстратной реакции (7).
Разработано несколько модификаций ИФА: прямой, непрямой,
конкурентный, блокирования, при этом один из специфических реагентов
иммобилизуется на твердой фазе, затем последовательно добавляют
исследуемую сыворотку, коньюгат, хромоген, проводя после каждой инкубации
промывку с целью удаления несвязавшихся компонентов. Результаты
регистрируют с помощью многоканального спектрофотометра и проводят
сравнение с контрольными образцами.
В качестве твердой фазы используют различные полимерные материалы:
полистирол, поливинил, полиамид, полипропилен, а также сефарозу, желатин,
пористые мембраны из нитроцеллюлозы. Твердая фаза может иметь форму
планшетов, пробирок, шариков. Чувствительность анализа определяется
природой твердой фазы и гидрофобностью специфического реагента. В
большинстве применяемых тест-систем в производственных условиях
иммобилизуют антигены трех типов: лизаты ВИЧ-инфицированных клеток,
рекомбинантные белки вирионов, синтетические белки ВИЧ. Антигены должны
быть максимально очищены, т.к. специфичность тест-систем, в первую очередь,
зависит от чистоты иммобилизованного белка.
Лизатные тест-системы относятся к тестам первого поколения, с их
помощью выявляются все присутствующие антитела, но они обладают
гиперчувствительностью и дают большое количество ложноположительных
результатов. В рекомбинантных тестах используют белки ВИЧ, полученные в
прокариотах, за счет встраивания отдельных генов ВИЧ, отвечающих за синтез
диагностически значимых белков. Обычно в рекомбинантных тест-системах
используют два - три белка ВИЧ, например: GP 120, GP 41, Р 24. Эти тест-
системы более специфичны, чем лизатные, но менее чувствительны.
В пептидных тест-системах используют синтетические пептиды ВИЧ,
полученные путем биохимического синтеза высококонсервативных эпитопов
ВИЧ.
56
Чаще всего это белки генов env, и в силу этого пептидные тест-системы
высоко специфичны, но обладают меньшей чувствительностью по сравнению
с лизатными тестами. Существуют зарубежные тесты, иммуносорбенты
которых содержат комплекс лизатных, рекомбинантных, пептитных антигенов.
Диагноз ВИЧ - инфекции основывается, прежде всего, на выявлении антител
кВИЧ.
Серологические тесты для выявления антител к ВИЧ подразделяются на
скрининговые тесты и подтверждающие (конфирматорные) тесты.
Большинство известных скрининговых тестов являются тестами с
применением метода иммуноферментного анализа (ИФА), который позволяет
одновременно, втечение одного рабочего цикла, исследовать большое количество
(не менее 90 на 1 планшете) образцов сывороток или плазмы крови человека.
Известны 3 генерации тестов в зависимости от характеристики применяемых
антигенов и конъюгатов в ИФА
Тесты 1-ой генерации основаны на использовании для сенсибилизации
планшет (приготовление иммуносорбента) антигена ВИЧ, представляющего собой
очищенный лизат ВИЧ, выращенного в культуре клеток лимфоцитов человека.
Такие тесты были первыми при разработке диагностических тест-систем. Как
показала практика, тест-системы с использованием вирусного лизата обладали
недостаточной чувствительностью и специфичностью.
Тесты 2-ой генерации основаны на применении в качестве антигенов ВИЧ
рекомбинантных белков и/или синтетических пептидов, соответствующих наиболее
антигенно-функциональным эпитопам ВИЧ - qp 160/120, qp 41, р 55, р 24 и т.д. Как
правило, для сорбции планшет используется комбинация рекомбинантных и/или
пептидных синтетических антигенов соответствующих ВИЧ типов 1 и 2.
Для тестов 2-ой генерации очень часто в качестве конъюгатов применяются
моноклональные пероксидазные конъюгаты к иммуноглобулинам человека класса
М и классаG.
Тесты 3-ей генерации - являются сендвич-ИФА, когда для получения
конъюгата применяется та же комбинация антигенов ВИЧ типов 1 и 2, которая
используется для сорбции планшет, но в этом случае -меченая пероксидазой хрена.
Применение конъюгатов к иммуноглобулинам класса М и конъюгатов
антигена ВИЧ + пероксидаза направлено на повышение чувствительности ИФА-
тестов, на выявление антител любой природы, в первую очередь ранних антител
(класса М), которые появляются значительно раньше антител классай (до 6 недели
после ВИЧ инфицирования), однако их циркуляция в крови достаточно
кратковременная.
В настоящее время разработаны тесты 4-ой генерации, в которых в
различной комбинации применяются антигены ВИЧ (рекомбинантные и/или
пептидные), атакже, помимо этого, как в иммуносорбенте, так и в конъюгатах
применяются моноклональные антитела к р24 - белку сердцевины ВИЧ (qaq),
57
который появляется на самой ранней стадии ВИЧ-инфекции, когда антител к
ВИЧ нет - период от 0 до 6 недель, который называют периодом
«серологического окна». Тесты 4-ой генерации направлены на выявление не
только антител (М и G) к ВИЧ, но и антигена ВИЧ р 24.
Таким образом, эти тесты предназначены для ранней диагностики ВИЧ-
инфекции. Кроме тестов непрямого ИФА и сендвич ИФА разработано большое
количество простых, не требующих специального оборудования тестов, таких
как агглютинация, иммунофильтрация, иммунохроматография, и т.д. В
зависимости от времени постановки теста они подразделяются на быстрые
(экспресс-тесты) и простые. Наборы для постановки этих тестов обеспечены
готовыми к применению реагентами, капельницами. Исследуемые сыворотки
или плазма используются, как правило, в неразведенном виде.
Положительный результат исследования проявляется в виде окрашенного
пятна или линии, в виде агглютинации эритроцитов или частиц латекса. Такие
тесты особенно пригодны в лабораториях, которые лимитированы
оборудованием и исследуют ежедневно небольшое количество образцов
сыворотки или плазмы крови человека.
В мире в настоящее время более 40 фирм выпускают более 100
наименований скрининговых тест-систем. К настоящему времени ВОЗ
рекомендовано три стратегии тестирования антител к ВИЧ, которые направлены
к максимальной информативности тестирования при минимально возможной
стоимости анализа. Каждая стратегия тестирования основывается на показателе
распространения ВИЧ-инфекции среди населения на конкретной территории
той или иной страны.
Во всех случаях обследования крови в организациях переливания крови
или трансплантации органов следует применять стратегию № 1.
При мониторинге населения на наличие ВИЧ-инфекции при показателе
> 10% - стратегия № I, при показателе < 10% - стратегия №2.
При постановке диагноза ВИЧ в случае клинических признаков ВИЧ/
симптомов ВИЧ при показателе> 30%-стратегия № 1,при показателе5 30%
-стратегия № 2. При отсутствии симптомов ВИЧ при показателе > 10% —
стратегия № 2, при показателе S 10% - стратегия №3.
Стратегия № 1
Все образцы сывороток плазмы тестируются в ИФА или в простом/
быстром тесте. Реактивные сыворотки обозначаются как положительные,
содержащие антитела к ВИЧ, нереактивные - как отрицательные, не содержащие
антитела к ВИЧ. Позитивные на ВИЧ сыворотки верифицируются в
иммуноблоте. При обследовании доноров крови или органов предпочтение
следует отдавать комбинированным ВИЧ -1/ВИЧ 2 тестам с выявлением ВИЧ-
антител и ВИЧ-антигенас наиболее высокой чувствительностью. В таком случае
58
доноры, образцы сывороток которых оказались реактивными при первичном
обследовании в наиболее чувствительном ИФА-тесте, должны быть отклонены
от донорства.
При мониторинге населения на ВИЧ чувствительность ИФА тестов должна
быть не менее 95%.
Стратегия №2.
Все образцы сыворотки/плазмы крови первично тестируются в ИФА-
тесте или в простом/быстром тесте. Первично реактивные (позитивные)
образцы тестируются повторно в ИФА-тесте или быстром/простом тесте,
основанных на других антигенах (вместо рекомбинантных - пептидные и
наоборот) или в тестах, полученных по принципиально другой технологии.
Повторно реактивные образцы обозначаются как положительные, содержащие
антитела к ВИЧ. Нереактивные образцы признаются отрицательными. Образцы
сывороток, реактивные в первичном тесте, но иереактивные при повторном
тестировании - должны быть ретестированы в двух различных ИФА-тестах.
Если получены противоречивые (конкордантные) результаты в двух ИФА тестах,
сыворотка признается как неопределенная. Все неопределенные результаты
должны быть зафиксированы и должны анализироваться отдельно в отчетах, а
пациенты, от которых получены такие образцы, должны быть взяты под
наблюдение для последующего обследования.
Стратегия № 3
Так же, как при стратегии № 2, все сыворотки первично тестируются в
ИФА-тест-системе или в простом/быстром тесте, реактивные (позитивные)
образцы тестируются повторно в другой тест-системе. Первично нереактивные
сыворотки обозначаются как ВИЧ-отрицательные. Сыворотки реактивные при
первичном тестировании, но нереактивные при повторном исследовании, должны
быть исследованы еще раз в обеих тест-системах. Стратегия № 3 требуег третьего
исследования, если сыворотка выявлена реактивной при первичном и повторном
исследовании водной и той же тест-системе. Третий тест при этом в обязательном
порядке должен основываться на тест-системе с другими антигенами или на
тест-системе, полученной принципиально другой технологией. Сыворотка,
реактивная в 3 тесте, обозначается как ВИЧ-позитивная.
Сыворотка, реактивная при первичной и вторичной постановке, но не
реактивная при третьем исследовании, обозначается как неопределенная.
Сыворотка, реактивная при первичном исследовании, но не реактивная
во втором и третьем исследовании, также обозначается как неопределенная
для пациентов, которые имели контакт по ВИЧ в последние 3 месяца и как
отрицательная для пациентов, которые не имели какого бы то ни было риска
заражения ВИЧ.
59
У всех пациентов, которые имели серопозитивные результаты при
исследовании первого образца сыворотки крови, следует получить
дополнительный образец сыворотки крови для повторного тестирования, чтобы
избежать технических или случайных ошибок.
Неопределенные результаты исследования сыворотки крови могут
быть получены у ВИЧ-пациентов, имеющих III или IV стадию СПИДа (по
критериям ВОЗ).
У пациентов, не имеющих симптомов ВИЧ-инфекции, при
неопределенных результатах исследования сыворотки крови необходимо
исследовать второй образец сыворотки крови, полученный не ранее, чем через
2 недели после первого образца крови. В случае получения неопределенного
результата при обследовании второго образца крови, необходимо провести
исследование его в подтверждающем тесте. При этом если неопределенный
результат подтверждается через 3, 6, 12 месяцев, пациента следует признать
ВИЧ-отрицательным.
Таким образом, стратегия № 1 применяется только для подтверждения
клинического диагноза ВИЧ-пациентов на 111 или IV стадии СПИДа и когда
ВИЧ-инфекция регистрируется более чем у 30% населения региона. При более
низких показателях распространения ВИЧ для постановки серологического
диагноза у пациентов 11I-IV стадий СПИДа используют стратегию №2.
При выборе тестов для выявления ВИЧ-антител для использования в
стратегиях № 2 и № 3 для первичного тестирования следует использовать тест-
систему с наиболее высокой чувствительностью, тогда как при втором и третьем
исследовании тест-системы должны быть с более высокой специфичностью,
чем при первичном исследовании образца сыворотки крови.
В Российской Федерации 9 предприятий выпускают 15 наименований
иммуноферментных тест-систем для выявления ан тител к ВИЧ 1 и 2 типов.
Большинство тест-систем являются препаратами 2 генерации, т.е. в
качестве иммуносорбента используются комбинации рекомбинантных белков
или синтетических пептидов, соотвествующих наиболее антигеноактивным
участкам ВИЧ 1 и 2 типа. В качестве конъюгатов используются моноклональные
или поликлональные антитела к иммуноглобулинам человека класса М и G.
Тест-системы 2-ой генерации: «Скрин-ВИЧ»; «Рекомбинант-ВИЧ 1+2»,
«Эколаб-тест ВИЧ 1,2»; «РекомбиБест»- анти ВИЧ 1 < 2;», «Амеркард анти ВИЧ
1/2"; “Пептоскрин -2”, “ВИЧ-1, ВИЧ-2-Авиценна’’.
В одной тест-системе в комбинацию антигенов ВИЧ включены
рекомбинантные белки ВИЧ-1 -О группы: ИФА-анти-ВИЧ Униф”.
Кроме того, разработаны и выпускаются 2 тест-системы 3 генерации, в
которых в качестве конъюгата используются комбинации антигенов ВИЧ 1 и 2
типов, меченые пероксидазой хрена: “Комби Бест-анти ВИЧ 1+2”, “Рекомбинант
ВИЧ 1,2ДСМ”.
60
Государственная приемка тест-систем при внедрении в практику,
постоянная оценка качества каждой выпускаемой серии, регулярные
сравнительные испытания (1 раз в 2 года) тест-систем, организуемые М3 РФ,
свидетельствуют о стабильном качестве отечественных препаратов, которые
не уступают аналогичным препаратам 2 и 3 генерации зарубежного производства
как по чувствительности, так и по специфичности.
Различные комбинации антигенов, различные конъюгаты и другие
технологические приемы, используемые при производстве отечественных тест-
систем, позволяют взаимозаменять их при обеспечении той или иной стратегии
диагностики ВИЧ-инфекции.
В РФ зарегистрированы две тест-системы 4 генерации зарубежного
производства, которые наиболее эффективны при обследовании доноров крови
и органов - наиболее опасных групп для распространения ВИЧ-инфекции -
“Вироностика ВИЧ Униформ II Аг/Ат” фирмы “Органон-техника” (Голландия)
и “Джен скрин плюс ВИЧ Аг/Ат” фирмы “Биорад” (Франция).
Эти тест-системы предназначены для одновременного качественного
выявления антигена р 24 ВИЧ (ранний антиген ВИЧ) и антител к ВИЧ 1 и 2 типа
классов М, A, G, т.е. направлены на максимальное сокращение “серологического”
окна при ранней диагностики ВИЧ-инфекции.
Иммуноблот(ИБ).
ИБ - это метод, являющийся верификационным и позволяющим дать
заключение об истинной позитивности, сомнительном результате или ложной
серопозитивности (3,10). ИБ также относится к иммунохимическим методам,
но, в отличие от ИФА, при постановке реакции выявляют не сумму антител, а
спектр антител к белкам ВИЧ.
Принцип метода состоит в том, что в специализированных
производственных условиях выращивают ВИЧ in vitro, вирусную массу
многократно очищают от примесей и дезинтегрируют вирус. Затем
фракционируют вирусные белки в полиакриламидном геле и переносят
электрофорезом разделенные белки ВИЧ на нитроцеллюлозную мембрану,
которую нарезают на полоски шириной 5 мм, именуемые стрипы. При
проведении исследования стрипы с вирусными антигенами помещают в планшет,
заливают исследуемой сывороткой, а полученные комплексы АГ-АТ проявляют
с помощью иммунохимической реакции, аналогичный ИФА. Учет результатов
визуальный: но наличию или отсулствию полос.
В сыворотке лиц, инфицированных ВИЧ-1, обнаруживают антитела к
следующим белкам: оболочки (env) -gpl60, gp 120, gp41; ядра (gag) - pl7, p24,
p55, а также ферментов вируса (pol) - рЗ 1, p51, рбб. У ВИЧ-2 детектируются
антитела к env - gp 140, gpl05, gp36; gag - pl6, p25, p56; pol - p68.
61
Результаты, полученные в ИБ, интерпретируются как положительные,
сомнительные и отрицательные (10). Согласно рекомендациям ВОЗ
положительными считаются сыворотки, в которых обнаружены антитела к двум
белкам гена env в сочетании или без реакции с другими белками (gag, pol). При
наличии взаимодействия с одним из белков оболочки в сочетании с другими
белками реакция считается сомнительной и рекомендуется повторное
тестирование с использованием набора другой серии или другой фирмы. Если
и после этого результат остается сомнительным, то рекомендуется исследование
в течение 6 месяцев (2 недели, 3 мес., 6 мес.)
По мнению В.В.Покровского, возможна трактовка сывороток как
положительных при наличии антител только к одному белку оболочки, особенно
в тех случаях, когда речь идет об обследовании в очагах ВИЧ-инфекции. На
основании только лабораторного анализа диагноз не может быть выставлен.
Для вынесения диагностического заключения необходимо учитывать данные
эпидемиологического анализа, клинического обследования (4). Известно, что
ИБ является менее чувствительным, чем ИФА и зачастую дает результаты,
которые трудно интерпретировать.
Молекулярно - генетические методы диагностики.
Молекулярная гибридизация и ПНР,
Методы ИФА, ИБ, несмотря на очевидную простоту, чувствительность,
доступность, имеют существенные недостатки, связанные с наличием
перекрестных реакций белков нормальных сывороток с антигенами ВИЧ, что
приводит к ложнопозитивным результатам. Такие случаи требуют
дифференциальной диагностики и прямого выявления нуклеиновых кислот в
исследуемом материале с помощью реакции молекулярной гибридизации и
полимеразной цепной реакции (ПЦР).
Диагностическая суть этих методов заключается в том, что у исследователей
имеются определенные олигонуклеотиды, воспроизводящие (или
комплементарные), высококонсервативные и высокоспецифичные
последовательности нуклеотидов из искомого генома. В реакции молекулярной
гибридизации такие олигонуклеотиды называют зондами, в методе ПЦР -
праймерами. В реакции молекулярной гибридизации назначение этих
специфических олигонуклеотидов - “найти” в исследуемой нуклеиновой кислоте
комплементарные последовательности, и сформировать структуры согласно
природе комплементарных взаимодействий между парами азотистых
оснований (Бобков А.Ф. и соавт., 1999, Бобкова М., 2000).
При ПЦР используют фермент Tag-полимераза, выделенный из термофильных
бактерий Thermus aguatieus, проявляющий активность при температуре 72°С.
62
Каждый цикл ПЦР состоит из трех этапов: а) денатурация исследуемой
нуклеиновой кислоты б) отжиг, во время которого праймеры связываются с
участками ДНК; в) комплементарное достраивание последовательности ДНК.
После каждого цикла количество ДНК удваивается, в течение двух часов
осуществляется 20-30 раз, при этом количество амплифицированной ДНК
увеличивается в тысячи раз (1).
Материалом для исследований служит кровь, культуральная жидкость,
ликвор, биопсийный материал, носоглоточные смывы, моча и пр.
биологические субстанции. Молекулярно-генетические методы перспективны
при необходимости ранней диагностики ВИЧ до появления в сыворотке АТ,
при неясных серологических результатах, при определении наличия ВИЧ в
организме новорожденных детей от инфицированных женщин. Целесообразно
использовать эти методы при обследовании серонегативных сексуальных
партнеров инфицированных лиц(18).
В настоящее время имеется множество модификаций ПЦР, но необходимо
учитывать, что для постановки реакции требуется не только специальное
оборудование, но и набор отдельных помещений с соблюдением особого
режима, нарушение которого приводит к ложнопозитивным результатам
вследствие контаминации реакции ампликонами.
Вирусная нагрузка.
В последние годы к известным маркерам прогрессирования ВИЧ-инфекции
(количество CD4 клеток, уровень альфа-2-микроглобулинов и неоптерина,
антитела к р24 антигену) добавилось прямое количественное определение РНК
ВИЧ в плазме. Этот маркер имеет главное значение среди всех остальных
маркеров прогрессирования болезни и контроля эффективности антивирусного
лечения (9,12).
Вирусная нагрузка (ВН) - это измерение количества вирусной РНК в
циркулирующей крови при инфекции ВИЧ. Установлено пять классов вирусной
нагрузки: менее 500,501 -3000,3001 - 10000,10000-30000, более 30000 копий/
мл. Уровень вирусной нагрузки имеет прогностическое значение, дает
возможность количественного учета влияния противовирусных препаратов на
течение инфекции и позволяет оценить кинетику репликации вируса. Снижение
количества вируса является бифазным процессом и соответствует ингибиции
репликации вируса в лимфоцитах в активной фазе инфекции и моноцитах,
макрофагах - в латентной фазе (12).
Показано, что скорость плазматического клиренса и продолжительность
жизни инфицированных клеток не зависят от ВН. Величина ВН свидетельствует
о количестве клеток, продуцирующих вирус, и о среднем количестве вируса
вне их. Прогрессия заболевания зависит от устойчивого равновесия между
продукцией вируса и разрушением инфицированных клеток, выражающаяся
63
в постоянном уровне концентрации вируса в крови. Авторы сообщают, что в
группе ВИЧ-инфицированных, погибающих в течение 5 лет, только у 8% ВН
поднимается выше 4350 копий / мл, у 62% - до 36270 копий/мл. При одинаковом
количестве CD4 клеток лица с большей ВН погибают раньше, чем с меньшей
ВН (11). Как правило, повышение содержания РНК ВИЧ в плазме коррелирует
с увеличением концентраций инфекционного вируса и ДНК провируса и со
снижением числа клеток CD4.
Таблица 20
AMPLIKOR HIV-I Moninor (Roche-Mol.- Sistems) NASBA HIV-1RNAQT (Organon -Teknika) QUANT1PLEX H1V-1 RNA (Chiron Corporation)
Замороженная плазма или сыворотка - 0,2 мл. Плазма, кровь, лейкоциты или СМЖ - 0,1 мл. Замороженная плазма.
Амплификация мишени с помощью обратной транс- криптазы П1 (Р Ко-амплификация РНК вируса дикого типа с 3 внутренними контролями Усиление сигнала методом разветвленной ДНК.
Колориметрическая метка Элек грохемилюминисцснт ныезонды Хемилюминисцептная метка
А - Е субтипы Определение всех известных субтипов А - Е субтипы
Порог чувствительности - 200 копий / мл Порог чувствительности- 4000 копий / мл. I lopor чувствительности - 10000 копий / мл.
6 часов - 10 образцов 5 часов - 1()_образцов 1,5 дня - 42 образца
Методы определения ВН отличаются высокой чувствительностью,
специфичностью и простотой. В настоящее время в мире для количественной
оценки используют три коммерческих набора (таблица 20).
Генотипирование и фенотипирование ВИЧ.
Термин “генотип” был предложен Иогансеном в 1909 году. В современной
генетике “генотип” рассматривают как единую систему генетических элементов,
взаимодействующих на различных уровнях (например, между аллелями одного
гена или различных генов). Генотип контролирует развитие, строение и
64
жизнедеятельность организма, т.е. совокупность всех признаков организма -
его фенотип. Особи с разными генотипами могут иметь одинаковый фенотип,
поэтому для определения генотипа организма необходимо проводить его
генетический анализ (генотипирование). Особи с одинаковым генотипом в
различных условиях могут отличаться друг от друга по характеру проявления
признаков, т.е. по фенотипу. В связи с этим в генетике используют понятие о
Норме реакции - возможном размахе фенотипической изменчивости без
изменения генотипа. При изменении генотипа говорят о генотипической
изменчивости, являющейся одним из условий эволюционного процесса.
Вирусы, как и другие организмы, обладают свойствами, передающимися
по наследству,т.е. генетическими признаками, проявление которых в конкретных
условиях характеризует их фенотип. В фенотипе вируса никогда не реализуются
полностью все генетические возможности. Фенотип каждого штамма - частный
случай проявления функции генома в конкретных условиях внешней среды.
Популяции штаммов всех известных вирусов генетически гетерогенны, различия
между клонами внутри популяции могут быть весьма значительными.
Все генетические признаки условно можно разбить на групповые,
видовые, внутривидовые и штаммовые. К групповым и видовым признакам
относят тип нуклеиновой кислоты, размеры и морфологию вирусов, тип капсида,
количество капсомеров, антигенную специфичность, устойчивость, наличие
ферментов, способность вызывать агглютинацию, патогенность для адекватных
лабораторных моделей, характер цитопатического действия на соответствующей
культуре клеток. Для проведения генетических исследований наибольшее
значение имеют внутривидовые (внутритиповые) признаки, позволяющие
дифференцировать варианты (мутанты, рекомбинанты) между собой.
К числу признаков, позволяющих дифференцировать штаммы, относится
патогенность для восприимчивого хозяина. Патогенность-это потенциальная
способность вируса вызывать инфекционный процесс. Степень выраженности
этого свойства у разных штаммов характеризует вирулентность вируса.
Вирулентность относится к полигенным признакам и представляет собой
функцию ряда генетических признаков вируса.
Проявление некоторых генетических признаков у вирусов связано с
особенностями структуры внутренних и наружных белков. При изучении
генетических признаков вируса необходимо учитывать также влияние факторов
внешней среды. Взаимосвязь генетических признаков представляет большой
теоретический и практический интерес, т.к. в процессе изменчивости вируса
нередко наблюдается одновременное изменение не одного, а нескольких
признаков. Предполагают, что в основе коррелятивной изменчивости лежат
различные причины: полигенность изучаемого признака, плейотропность
Действия гена, селекция мутантов.
5. Заказ № К-4451.
65
Исследование и идентификация нуклеотидных последовательностей
ретровирусов и, в частности, ВИЧ-1 показалоего чрезвычайную изменчивость.
На основании анализа нуклеотидных последовательностей генов Env и Gag
были выделены 10 генетических субтипов ВИЧ-1 (от А до J), относящихся к
группе М. Кроме этой группы были идентифицированы высокодивергентные
штаммы-группа О. Различия в геноме группы О и группы М составляют 35%.
В настоящее время доказана высокая частота рекомбинации у вируса
иммунодефицита человека, что, вероятно, связано с процессом смены матрицы
при обратной транскрипции. Обязательным условием рекомбинации, по-
видимому, является попадание в одну вирусную частицу 2-х копий РНК,
принадлежащих к вирусам разных субтипов. Вероятно, это случается при
циркуляции в популяции двух разных субтипов. В России около четверти всех
пациентов предположительно заражены рекомбинантными вирусами, что может
играть важную роль в течение заболевания, т.к. в организме инфицированного
происходит селекция рекомбинантных вариантов и появление наиболее
патогенных и резистентных вирусов.
Современные молекулярно-генетические данные позволяют выявлять и
сравнивать различные варианты ВИЧ, выделенные в различных странах, регионах
или у отдельных лиц, что играет важную роль в расшифровке эпидемий
(Покровский В.В., 1996, Бобков А.Ф., Казенова М.Р., Бобкова М.Р. и соавт., 2000).
Применение генотипирования ВИЧ повышает эффективность
комбинированного противовирусного лечения, поскольку на основании
определения генотипа возбудителя в схему лечения можно вносить необходимые
коррективы. Исследователи, обследуя “лекарственно-наивных” больных,
выявили резистентность у каждого девятого ВИЧ - инфицированного, не
получавшего ранее антиретровирусную терапию (“Reuters” 27.08.99 г.). Широкое
применение противовирусных препаратов приводит неизбежно к появлению
резистентных штаммов, обусловленных как рекомбинацией, так и
мутационныым процессом.
Выявлена также прямая корреляция между фенотипом вируса и
клиническим течением: вирусы с выраженным цитопатическим действием,
высоким уровнем репликации чаще выделяются на стадии СПИДа, в отличие
от штаммов с низкой реплицирующейся активностью и отсутствием ЦПД,
которые выявляются чаще на ранних стадиях.
Выделение вируса.
Культивирование ВИЧ in vitro.
Первые изоляты ВИЧ были получены влаборатории Р.Галло в 1983 году. Для
выделения ВИЧ использовали первичную культуру клеток (мононуклеарные
клетки крови) и перевиваемые линии (U-937, Molt-4, СЕМ). В качестве материала
66
обычно используют лимфоциты периферической крови, ликвор,
амниотическую жидкость, биопсийный материал мозга и солидных
лимфоидных тканей и пр. Основные этапы культивирования ВИЧ включают:
• выделение и культивирование мононуклеаров периферической крови in
vitro с митогеном ФГА в течение 3 суток;
• выделение мононуклеаров ВИЧ-инфицированного пациента;
• сокультивирование простимулированных клеток донора с клетками
пациента в присутствии фактора роста Т-лимфоцитов - интерлейкина-2.
• культивирование проводится в течение 3-4 недель, с постоянным
контролем и добавлением простимулированных клеток донора.
Для индикации вируса регулярно просматривают культуру клеток под
световым и электронным микроскопом на наличие ЦПД (синцитиев) и вируса.
Кроме того, используют определение обратной транскриптазы в надосадочной
жидкости, исследуют экспрессию антигена путем непрямой
иммунофлюоресценции, определяют антиген ВИЧ в ИФА, выявляют
нуклеотидные последовательности ВИЧ молекулярно-генетическими методами.
У одного и того же пациента на разных стадиях заболевания накапливается
различные антигенные варианты одного и того же изолята ВИЧ. Эта генетическая
вариабельность представляет серьезную проблему при конструировании
вакцинных и диагностических препаратов, а также играет важную роль в
возникновении резистентности к противовирусным препаратам (2). При
исследовании резистентности к AZT на клеточных линиях показано, что селекция
ВИЧ по разному осуществляется в организме пациента: из периферических
лимфоцитов выделяются штаммы как AZT-резистентные, так и чувствительные
к AZT, тогда как из сыворотки крови - только AZT-резистентные. Б.Лардер в
своих исследованиях отмечает, что AZT-резистентные штаммы появляются уже
через 6 месяцев после начала терапии, а через 12 месяцев от 80 до 90% всех
штаммов имели AZT-устойчивый фенотип.
Высокая генетическая изменчивость ВИЧ была доказана при
сравнительном анализе вариантов, выделенных от лиц, инфицированных одним
и тем же штаммом (доноры и реципиенты крови).
При культивировании выявлено, что не все штаммы обладают
цитопатогенным действием и образуют синцитии. Предполагают, что характер
цитоцидного действия на клетки связан с функцией генаепу. Необходимо также
учитывать, что морфологические изменения в клетках не являются частичным
результатом взаимодействия вируса и клетки, а определяются структурой
вирусной популяции, ее генетическими свойствами, механизмом
чувствительности клеточных культур. Культивирование ВИЧ in vitro практически
не дает ложнопозитивных результатов и является стандартом качества при
Диагностике ВИЧ-инфицированных.
5»
67
Приложение 1
Инструкции и законодательные акты, обуславливающие работу в
лабораториях диагностики ВИЧ и гепатитов
1. Инструкция по противоэпидемическому режиму работы в лабораториях
диагностики СПИД” от 5.06.90 г. N 42-28 / 38-90 г.
В данной инструкции изложена организация помещений диагностических
лабораторий, правила и противоэпидемический режим при проведении ИФА и
ИБ на ВИЧ-инфекцию. Описана доставка биологического материала,
обеззараживание его путем применения автоклавирования и дез. растворов и
мероприятия, проводимые при наличии аварийной ситуации. Список
приложений к инструкции включает следующие формы:
• направление на исследование крови на наличие антител к ВИЧ,
• журнал регистрации материала, поступающего на выявление антител к ВИЧ,
• журнал повторных исследований на выявление антител к ВИЧ,
• журнал обеззараживания инфицированных материалов,
• журнал регистрации и исследования сывороток, присланных на
подтверждение в реакции иммуноблота,
список лиц, содержащих антитела к ВИЧ, выявленных только в ИФА,
• журнал регистрации результатов исследований сывороток крови на
выявление антител к ВИЧ,
• журнал приготовления растворов дез.средств и нормы расхода.
2. “Методические указания по организации лечебно-диагностической помощи
и диспансерного наблюдения за больными ВИЧ-инфекцией”, приложение к
приказу М3 N170 от 16.08.94 г.
Подробно представлены лабораторные критерии для постановки диагноза
ВИЧ-инфекции. Описан забор материала, его транспортировка и хранение
сывороток крови. Изложены принципы твердофазного ИФА и возможные
ошибки при проведении реакции, учет результатов. При получении
положительного результата в ИФА сыворотка направляется в референс-
лабораторию на иммуноблот. В указаниях также подробно описан принцип
иммуноблота и учет результатов, которые интерпретируются как
положительные, сомнительные и отрицательные. Согласно рекомендациям ВОЗ,
положительной считается реакция при наличии антител к двум белкам оболочки
ВИЧ в совокупности или без антител к белкам генов gag или pol. Согласно же
рекомендациям Российского центра CI1ИД положительной считается реакция
при наличии антител только к одному из белков оболочки вируса. Обоснование
68
клинического диагноза ВИЧ-инфекции производится при наличии клинических,
лабораторных, эпидемиологических данных.
3. Постановление “О рабочем времени и отпусках работников, осуществляющих
диагностику и лечение ВИЧ-инфицированных, а также работающих с
материалами, содержащими вирус иммунодефицита человека” №2510/4429-
96-27 от 07.10.96.
В данном постановлении оговорена продолжительность рабочего времени
(36 часов в неделю) и отпуск (36 рабочих дней) следующим категориям
работников:
- Сотрудникам лабораторий, осуществляющим диагностику ВИЧ-
инфекции.
- Научным сотрудникам, выполняющим тематику по проблеме СПИДа.
- Сотрудникам научно- производственных объединений, предприятий,
выпускающим иммунобиологические препараты.
4. Федеральный закон "О предупреждении распространения в Российской
Федерации заболевания, вызываемого вирусом иммунодефицита” от 24.02.95 г.
Глава 2. Ст.7, посвящена медицинскому освидетельствованию, которое
может проводиться в учреждениях государственной, муниципальной или
частной системы здравоохранения, имеющих лицензию, но официальный
документ выдается только в учреждениях государственной или муниципальной
системы здравоохранения.
Ст.8. Медицинское освидетельствование должно быть добровольным.
Ст.9. Представлены группы населения, подлежащие обязательному
медицинскому освидетельствованию: доноры, работники отдельных
профессий, производств, учреждений, список которых утверждается
правительством Росинской Федерации.
Ст.12. Утверждены права людей на повторное медицинское
освидетельствование в учреждении по своему выбору.
5. Приказ М3 РФ “Об утверждении перечня организаций, предприятий,
производств и их структурных подразделений, работа в которых дает право на
установление надбавки в размере 20% оклада (тарифной сетки) за осуществление
диагностики и лечения ВИЧ-инфицированных, а также работу, связанную с
материалами, содержащими ВИЧ”№307 от 30.07.96 г.
Согласно приказу, сотрудники лабораторий (отделов, отделений, групп)
учреждений здравоохранения, на которых возложено исследование крови и
биологического материала на СПИД, имеют право на 20% надбавку к окладу.
69
6. Приказ М3 РФ “Об использовании иммуноферментных тест-систем для
выявления антител к ВИЧ в сыворотке крови человека" N 238 от 11.08.97 г.
На основании сравнительных испытаний диагностических
иммуноферментных тест-систем комиссией при Государственном НИИ
стандартизации и контроля качества медицинских иммунобиологических
препаратов им. Л.А.Тарасевича представлены следующие перечни:
- диагностические иммуноферментные тест-системы для выявления
антител к ВИЧ в сыворотке крови человека для обследования доноров
крови, органов и тканей, а также подтверждения и арбитража результатов
скрининговых исследований (6 тест-систем),
- диагностические иммуноферментные тест-системы для выявления
антител к ВИЧ в сыворотке крови человека д ля скрининга (9 тест-систем),
- диагностические иммуноферментные тест-системы для выявления
антител к ВИЧ в сыворотке человека, использование которых
приостанавливается до особого разрешения (4 тест-системы).
7. Приказ М3 РФ "О разрешении медицинского применения медицинских
иммунобиологических препаратов" N 366 от 17.12.98 г.
В приказе представлен дополнительный список диагностических тест-систем
для выявления антител к ВИЧ 1/2 -“Анти-ВИЧ-)/ВИЧ-2 ИФА (ДИАплюс)" и
"ЭКОлаб-тест ВИЧ 1/2”.
8. Приказ М3 РФ " О случае инфицирования детей ВИЧ в Республиканской
детской клинической больнице” от22.10.98 г.
Установлен факт переливания трем детям компонентов крови,
инфицированных ВИЧ. Комиссией М3 России выявлены нарушения
действующих положений в лаборатории, в результате чего ВИЧ-положительная
кровь попала в отделение переливания. В приказе подробно оговорены
мероприятия, направленные на обеспечение строгого контроля донорской крови
на ВИЧ-инфекцию и другие инфекционные заболевания. Кроме того, приказано
провести переподготовку медперсонала.
9. Приказ М3 РФ “Об использовании иммуноферментных тест-систем для
выявления антител к ВИЧ в сыворотке крови человека” N153 от 05.05.99 г.
Были проведены сравнительные испытания, показавшие, что качество тест-
систем, как российских, так и импортных значительно улучшилось, и спектр их
расширился. В результате приказано обеспечить проведение обследования
доноров крови, органов и тканей человека, первичное обследование, а также
подтверждение и арбитраж результатов скрининговых исследований на антитела
70
к ВИЧ, используя тест-системы, перечисленные в приложении 1 (26 тест-систем
различного происхождения). Для постановки окончательного лабораторного
диагноза рекомендуется использовать тест-системы, перечисленные в
приложении 2 (6 тест-систем). Впервые в приказе оговорена целесообразность
применения для лабораторий, имеющих небольшой объем исследований,
простых/быстрых тестов и их применение в ургентных ситуациях.
10. Санитарные правила по безопасности работы с микроорганизмами 3-4
группы патогености и рекомбинантными молекулами ДНК (СП. 1.2.006-93).
11. Безопасность работы с микроорганизмами 1-2 группы патогенности (СП
1.2.011-94).
12. Безопасность работы с микрорганизмами 3-4 группы патогенности и
гельминтами (СП 1.2.731 -99).
71
Приложение la.
N Название диагностикума
1 Амеркард - антиВИЧ 1,2
2 Пептоскрин -2
3 ИФА-анти ВИЧ-Униф
4 Скрин-ВИЧ
5 Скрин-ВИЧ-Э
6 Скрин-ВИЧ
7 Скрин-ВИЧ
8 ВироностикаН1У uni-form-2
9 HIV 1+2 env peptide Eia
10 Джснелавиа МИКСТ
11 Дженскрин
12 Эколаб-Вироностика4
13 ЭколабТест-ВИЧ 1,2
14 Эколаб-Дженелавиа-Микст
15 КомбиБест-Анти ВИЧ 1 т2
16 Рекомби Бест-анти ВИЧ 1+2
17 Рскомбинант-ВИЧ-1/ВИЧ-2
18 Антиген
19 СОВ AS -CORE АнтиВИЧ 1,2
EIA
20 Рекомбинант ВИЧ 1,2 Д/М
21 ВИЧ-1, ВИЧ-2-ИФА-
Авиценна
22 Vidas HIV DUO
23 Acssess HIV 1/2АБ
24 SED HIV '/,
25 Джсния ВИЧ-1/ВИЧ2
26 Иммунокомб Биспот ВИЧ 'А
Приложение 16.
N Название диагностикума
1 Иммунокомб ВИЧ-1+2
КомбФирм
2 Блот-ВИЧ
3 Lia-Tek HIV 111
4 Вестерн -Блот
5 New-lav-Blot
6 Inno-L.ia-HIV, Конфиматорный
Производитель
“Амеркард”, Москва
МБП, Москва
“Диагн.системы”, Н.Новгород
“Биосервис”, Москва
“Биосервис”, Москва
НИИЭМ им.Пастера, С-Петербург
ПКБ БП им.Мечникова, Москва
“Органон”, Нидерланды
“Лабсистсмс”, Финляндия
“Санофи Диаг.Пастер”,Франция
“Санофи Диаг.Пастер”, Франция
“Эколаб”, Электрогорск
“Эколаб”, Электрогорск
“Эколаб”, Электрогорск
“Вектор-Бест”, Новосибирская обл.
“Вектор-Бест”, Новосибирская обл.
“Вектор Майстар”, Новосибирск
“Вектор Майстар”, Новосибирск
“Хофман ля Рот”, Москва
“МБС”, Бердск
“Авиценна”, Москва
“БиоМерье”
“Санофи Диагнос.Пастер”, Франция
“Санофи Диагнос.Пастер”. Франция
“Санофи Диагнос.Пастер”, Франция
“Биоград”С-Петербург
Производитель
“Биоград”, Санкт-Петербург
“Биосервис”, Москва
“Органон”, Нидерланды
“Органон”, Нидерланды
“Санофи Диагнос. Пастер”,
Франция
"Лабораторная диагностика”
72
Приложение 2
Организация работы клинико-диагностических лабораторий по
предупреждению инфицирования пациентов и персонала вирусами
гепатитов В и С и иммунодефицита человека
(Центр Госсанэпиднадзора в Санкт-Петербурге, 2000)*
1. ТРЕБОВАНИЯ К ПОМЕЩЕНИЯМ ЛАБОРАТОРИЙ.
1.1. Клинико-диагностическая лаборатория может находиться либо в составе
лечебно-профилактического учреждения, либо быть самостоятельной
структурной единицей.
1.2. Расположение помещений лаборатории должно обеспечить поточность
поступающего на исследование материала и условия для выполнения правил
противоэпидемического режима. Работу в лаборатории необходимо
организовать так, чтобы движение всего поступающего в лабораторию
материала и чистой посуды было раздельным, а стерилизация и дезинфекция
проводилась в разных помещениях.
1.3. Лаборатория должна иметь:
- “чистые” помещения для персонала: кабинет заведующего,
ординаторская, места для хранения личной одежды, запасов чистой
лабораторной посуды, реактивов, комнаты для приема пищи, отдыха,
туалет и др.;
- помещения для работы с биологическим материалом: приема,
регистрации, разбора, рабочие помещения для исследования материала,
для его обеззараживания (автоклавную, экспозиционную), моечную,
туалет.
1.4. Лаборатория может функционировать только при исправных
водоканализационных системах. При аварийных ситуациях, временном
отключении от водоснабжения работа лаборатории приостанавливается, о чем
ставятся в известность руководители данного учреждения и территориальных
Центров санэпиднадзора.
1.5. Лаборатория должна быть обеспечена достаточным количеством раковин
при строгом их разделении - для производственного назначения и для мытья
рук и посуды персонала.
1.6. Помещения для работы с биологическим материалом необходимо оснастить
бактерицидными лампами (стационарными или переносными).
2. ТРЕБОВАНИЯ К ОРГАНИЗАЦИИ РАБОЧЕГО МЕСТА.
2.1. Лаборатория должна быть оснащена современной лабораторной мебелью,
вытяжными шкафами.
* ГВ.Волкова. О.В.Парков. Г.С.Стапанова, А.Н. Крыга. Т.Б. Кутасова и соавт.
73
2.2. Поверхность производственных столов для работы с биологическим
материалом должна быть из водонепроницаемого, кислото-щелочеустойчивого
и индифферентного к действию дезинфектантов материала.
2.3. Рабочее место должно иметь дополнительное искусственное освещение.
3. ТРЕБОВАНИЯ К ПЕРСОНАЛУ ЛАБОРАТОРИЙ.
3.1 .Ответственность за организацию и соблюдение противоэпидемического
режима возлагается на руководителя, который обязан организовать обучение
персонала лаборатории правилам и мерам профилактики внутрилабораторного
и внутрибольничного заражения инфекционными заболеваниями.
3.2. В каждой лаборатории приказом по учреждению назначается лицо,
осуществляющее контроль за соблюдением противоэпидемического режима.
3.3.На каждого сотрудника лаборатории разрабатываются функциональные
обязанности.
3.4. Вновь поступающий персонал не допускается до работы без вводного
инструктажа о действующих директивных документах по соблюдению
санэпидрежима для профилактики инфекционных болезней; в дальнейшем
инструктаж проводится не реже 1 раза в год под расписку каждого сотрудника
с принятием зачета; перемещение сотрудника на другой вид деятельности
должно сопровождаться дополнительным инструктажем; при выявлении
нарушений санэпидрежима организуется внеочередное принятие зачетов.
3.5. При приеме на работу поступающий персонал подлежит обязательному
обследованию на HBs-антиген и анти-ВГС и в дальнейшем ежегодно. Лица с
выявленными маркерами вирусных гепатитов (HBs-антигеном, анти-ВГС),
направляются к инфекционисту территориальной поликлиники для уточнения
и регистрации диагноза; такие лица допускаются к работе после
дополнительного инструктажа под расписку.
3.6 Персонал скрининговых ВИЧ-лабораторий обследуется дополнительно на
анти-ВИЧ при поступлении и в дальнейшем при диспансеризации 1 раз в год.
Сотрудники лаборатории обязаны ежегодно проходить диспансеризацию;
результаты диспансеризации должны находиться у администрации учреждения;
заболевшие сотрудники лаборатории при обращении за медицинской помощью
обязаны сообщать об особенностях своей работы; сотрудники, у которых
имеется подозрение на инфекционное заболевание или на носительство
маркеров, обязаны поставить в известность об этом заведующего лабораторией.
3.7. Персонал лаборатории подлежит обязательной вакцинации против гепатита
В как группа высокого риска. Вновь принимаемый персонал следует допускать
к работе после проведения вакцинации. В ряде случаев может быть допущен
после двух прививок с интервалом в 1 месяц и проведения серологического
контроля на титр антител с ВГВ.
74
4. ОБЕСПЕЧЕНИЕ САНИТАРНО-ПРОТИВОЭПИДЕМИЧЕСКОГО РЕЖИМА.
4.1. Кровь, костный мозг, мокроту, сперму, слюну, кал, мочу и другие секреты и
экскременты человека следует считать потенциально инфицированными вирусами
гепатитов В, С, Д, А, ВИЧ, онкогенными и др., атакже этиологическими агентами
сифилиса, туберкулеза, хламидиоза, трихомониаза и прочими возбудителями.
Поэтому в лабораториях, исследующих биологический материал, должно быть
обеспечено соблюдение режима, предусмотренного для работы в
микробиологических или вирусологических лабораториях.
4.2. Все помещения лаборатории, оборудование, инвентарь должны содержаться
в идеальной чистоте.
4.3. Ежедневная влажная уборка должна осуществляться с применением
моющих и дезинфицирующих средств не менее 1 раза в сутки, а при
необходимости - чаще.
4.4. Один раз в месяц в помещениях, где проводится работа с кровью,
сывороткой и другими биологическими жидкостями по утвержденному графику
делается генеральная уборка с использованием 3% раствора хлорамина, хлорной
извести или другими дезинфицирующими средствами. Во время генеральной
уборки тщательно моют стены и оборудование.
5. ТРЕБОВАНИЯ К ДОСТАВКЕ КРОВИ И ДРУГИХ БИОЛОГИЧЕСКИХ
ЖИДКОСТЕЙ В ЛАБОРАТОРИЮ.
5.1. Правила организации доставки и транспортировки крови и других
биологических жидкостей едины для всех лабораторий, независимо от видов
исследования. В помещении приёма материала на видном месте размещается
информация о правилах доставки его в лабораторию.
5.2. Кровь и другие биологические материалы доставляются в лабораторию
медицинскими работниками, либо нарочными, прошедшими соответствующий
инструктаж.
5.3. Материал для исследования доставляется в контейнерах, биксах, пеналах,
укладках, стерилизационных коробах. Не допускается транспортировка в
картонных коробках, деревянных ящиках, пакетах, сумках, портфелях, а также
самими пациентами.
5.4. Каждая проба этикетируется.
5.5. Направления на исследования помещают в отдельные палки либо
целлофановые пакеты. Не допускается помещение бланков направлений или
Другой документации внутрь бикса, контейнера и др.
5-6. Категорически запрещается помещать направления в пробирки с кровью.
^•7. В направлении категорически запрещается вносить поправки, изменения,
зачеркивания и т.д.
75
5.8. При пересылке крови из многопрофильных стационаров в другие
лаборатории не рекомендуется составление единого списка вместо направлений
(списков) из отделений во избежании ошибок при переписывании.
5.9. Все пробирки должны быть закрыты резиновыми или ватно-марлевыми
пробками, целесообразно использование шприц пробирок.
5.10. Пробирки устанавливают в штатив, помещаемый в бикс либо контейнере
уплотнителями (вата, поролон). После транспортировки крови уплотнитель,
ватно-марлевые пробки подвергают в лаборатории дезинфекции (хлорамин,
пресепт и др.) и утилизируются.
5.11. Запрещается возвращать уплотнитель в Л ПУ; не допускается использование
пробирок с отбитыми краями.
5.12 Освобождение контейнера проводится работником лаборатории.
Контейнеры дезинфицируют 2-х кратным протиранием дезинфицирующим
раствором с интервалом 15 минут или погружением в дезинфицирующий
раствор.
5.13. Штативы дезинфицируют в лабораториях погружением в
дезинфицирующий раствор.
5.14. Возврат штативов, ёмкостей из лаборатории осуществляется только после
дезинфекции, целесообразно иметь обменный фонд. Возврат пробирок
осуществляется только после дезинфекции и стерилизации. Такие же требования
предъявляются к доставке стекол с мазками для исследования на гонорею,
малярию, гистологию, грибки. Запрещается заворачивать мазки в направления
во избежании инфицирования персонала.
5.15. В лаборатории должны быть созданы условия для обработки рук лицам,
доставившим материал.
6. ТРЕБОВАНИЯ К ОРГАНИЗАЦИИ РАБОЧЕГО МЕСТА ЛАБОРАНТА ДЛЯ
ЗАБОРА КРОВИ В ЛАБОРАТОРИИ.
6.1. Взятие крови у пациента в лаборатории проводится в специально отведенном
помещении с раковиной для мытья рук.
6.2. Рабочий стол лаборанта должен быть условно разделен на “чистую” и
“грязную’’ половины и оснащен:
- дезинфицирующими средствами (3% хлорамин, 6% перекись водорода,
либо накопительными растворами: 4% перекись водорода с 0,5% моющим
средством и другими). Дезинфицирующие растворы должны находиться
в емкостях с этикетками и легкооткрывающимися крышками в
количестве, достаточном на одну рабочую смену;
- 70° спиртом в устойчивой подставке;
- биксом со стерильными ватными шариками в упаковках (мешочки из
двуслойной бязи или крафт-бумаги, указанной в ГОСТе 42-21-2-85) по
15-20 штук в каждой упаковке. Невскрытая упаковка сохраняет
76
стерильность в течение 3-х суток с момента стерилизации или до 20 суток
в стерилизационных коробах с фильтром или крепированной бумагой
‘Стерикинг” (Финляндия). Вскрытая упаковка должна быть использована
в течение одной смены;
- стерильными капиллярами (по 5-10 штук в у паковках), дата стерилизации
указывается на каждой упаковке;
- стерильными копьями (копья можно стерилизовать в конических
пробирках по 5-10 штук, острием вниз, либо в чашках Петри, по 7-10
штук); предпочтительно использование разовых стерильных копий;
- стерильными пинцетами, не менее 2-3 на каждого лаборанта. Во время
работы лаборанта пинцет хранится в сухой стерильной пробирке или в
растворе дез. средства;
- стерильными грушами в расчете на максимальное количество больных;
- стерильными предметными часовыми стеклами; либо разовыми и
стерильными пробирками или чашками, плашками;
- стерильными или чистыми перчатками в количестве, соответствующему
числу пациентов;
- индивидуальным полотенцем, которое должно меняться ежедневно;
- ёмкостями для сброса отработанного материала с дез. растворами;
6.3. не разрешается выкладывание отработанного материала, инструментов
прямо непосредственно на поверхность стола.
На “чистой” половине помещаются упаковки со стерильными капиллярами,
грушами, копьями, стеклами, мешочки со стерильными ватными тампонами,
стерильные пинцеты, перчатки, 70° спирт; на "грязной” - закрытые емкости с
дез.растворами для сбора отработанного материала, пробирка для сбора копий,
дез.растворы, емкость или целлофановый мешок для сбора перчаток.
7. ТРЕБОВАНИЯ К ОРГАНИЗАЦИИ ЗАБОРА КРОВИ В ОТДЕЛЕНИЯХ
СТАЦИОНАРА.
7.1. Взятие крови в отделении должно проводиться в специально отведенном
месте или у постели больного.
7.2. Для забора крови в отделении лаборант должен иметь укладку, которая
Должна быть удобной для переноса, легкой, закрытой, изготовленной из
материала, подвергающегося дезинфекции.
7.3 «Переносная» укладка условно делится на чистую и грязную половины.
- на «чистой» половине необходимо иметь упаковки со стерильными
капиллярами, грушами (в количестве, превышающем максимальный забор
крови), со стерильными копьями, стерильными стеклами, мешочками со
стерильными ватными тампонам и, упаковки не менее 2-х стерильных пинцетов,
перчатки одноразового назначения, предпочтительно стерильные (по количеству
пациентов).
77
- на «грязной» - закрытые ёмкости для сбора отработанного материала с
дезраствором, дезрастворы, мешок для сбора перчаток (любой разового
назначения).
8. ТРЕБОВАНИЯ К ОРГАНИЗАЦИИ ЗАБОРА КРОВИ НА ДОМУ
8.1. Для забора крови на дому необходима «переносная» укладка
(предпочтительно бикс), оснащенная стерильными пакетами по числу вызовов
на дом. В каждый пакет перед стерилизацией закладываются:
- копья, не менее 2-3 штук (в пробирке);
- капилляры (2-3 шт. в упаковке);
- груши, не менее 2 штук;
- стекла либо разовые пробирки, чашка Петри;
- пинцеты (не менее 2-х);
8.2. К каждому пакету прикладываются стерильные или чистые перчатки,
упаковка со стерильными ватными шариками, спирт 70°, чистое полотенце в
пакете, полиэтиленовый мешок для сбора отработанного материала и грязных
перчаток. Извлекать копья (скарификаторы), стерильные ватные тампоны следует
только стерильным пинцетом. Стерильные лабораторные инструменты следует
хранить в той же упаковке, в которой проводилась их стерилизация.
Отработанные копья сбрасываются в ту же пробирку, в которой они находились.
9. ТРЕБОВАНИЯ К РЕЖИМУ ПРИ ВЗЯТИИ И ИССЛЕДОВАНИИ КРОВИ.
9.1. При взятии крови место прокола обрабатывается тампонами, смоченными
в 70° этиловом спирте двукратно. Первую каплю крови следует удалить.
9.2. Не допускается повторное взятие крови тем же капилляром в случае, если
он имел контакте плашкой.
9.3. Не разрешается выпуск крови из капилляра (доведение ее до метки) на
палец (только на стерильный тампон или вату).
9.4. Не допускается очистка от крови кончика капилляра о ветошь, марлю,
полотенце, выложенные непосредственно на поверхность стола, а только в
ёмкость (чашка Петри, лоток и др.).
78
Приложение 3
Перечень иммуноферментных тест-систем, рекомендуемых для проведения первичной лабораторной диагностики
ВИЧ-инфекции (из приложения № 1 к приказу Министерства здравоохранения Российской Федерации № 292 от 30.07.2001)
№ группы Фирма-производитель Название тест-системы
1. Гест-системы, выявляющие одновременно антиген и антитело «Био-Рад» Франция «Органон техника» Нидерланды GENSCREEN PLUS HIV Ag-Ab Vironostika HIV Uni-Form 11 Ag/Ab
2. Тест-системы, выявляющие антитела групп А, М, G ЗАО «Вектор-Бест», г. Новосибирск «Диагностические системы», г. Нижний Новгород «Эколаб» г. Электрогорск ЗАО «МБС» г. Новосибирск «Био-Рад» Франция Комби-Бест-антн-ВИЧ-1-2 ИФА-АНТИ-ВИЧ-УНИФ ЭКОлаб-Вироностпка 1,2+0 Рекомбинант-ВИЧ 1,2 ДСМ GEENSCREEN HIV 1/2 (V.2)
3. Тест-системы, выявляющие антитела группы G «ЗАО Вектор-Бест» г. Новосибирск ООО «Амеркад» г. Москва «Эколаб» г. Электрогорск ООО МН «Авиценна» г. Москва ПКБ им. Мечникова г. Москва ЗАО БК «Биосервис» г. Москва РекомбнБест-анти-ВИЧ-1+2 Пептоскрин-2 ЭКОлаб ТЕСТ-ВИЧ 1,2 ВИЧ1-ВИЧ-2-ИФА-АВИЦЕННА СКРИН-ВИЧ СКРИН-ВИЧ
4. Тест-системы закрытого типа, требующие специального оборудования «Эббот» США «Эббот» США «Биомерье С. А.» Франция AXSYM system HIV-1/HIV-2 IM.x system HIV-l/HIVIII Plus VIDAS HIV DUO (HIV4)
5. Простые-быстрые тесты «Био-Рад» Фракция ЗАО «Биоград» г. С.-Петербург GENIE II HIV-l/HIV-2 Иммуиокомб Биспот ВИЧ 1,2
Простые/быстрые тесты («Иммунокомб Биспот ВИЧ 1/2». «GENIE II H1V-I/HIV-2») наиболее целесообразно применять в небольших
диагностических лабораториях (с объемом работы менее 90 исследований в день), не имеющих специального оборудования и высоко
квалифицированного персонала, а также в анонимных кабипсах.
Разрешается их применение для обследования доноров крови при ургентных ситуациях и в условиях, когда не имеется временных и
технических возможностей для проведения стандартного обследования крови на наличие антител к ВИЧ.
Использование простых/быстрых тестов, не указанных в настоящем приложении, для обследования доноров запрещается.
В службе переливания крови рекомендуется применять тест-системы из группы № 1, выявляющие одновременно антиген и антитела.
Приложение 4
Перечень тест-систем, рекомендуемых для подтверждения
результатов и арбитража первичных исследований сывороток крови
(из приложения № 2 к приказу Министерства здравоохранения РФ
№292 от 30.07.2001)
№ Фирма-производитель Название тест-системы
1. «Био-Рад» Франция GEENSCREEN PLUS HIV Ag-Ab
2. «Органон Техника» Нидерланды Vironostika HIV Uni-Form 11 Ag/Ab
3. «Биомерье С. А.» Франция VIDAS HIV DUO (H1V4)
4. ЗАО «Вектор Бест» г. Новосибирск КомбиБест-анти-ВИЧ-1-2
5. «Диагностические системы» г. Нижний Новгород ИФА-АНТИ-ВИЧ-УНИФ
6. «Эколаб» г. Электрогорск ЭКОлаб-Вироиостика 1,2+0
ЗАО «МБС»г. Новосибирск Рекомбинант-ВИЧ 1,2 ДСМ
8. «Био-рад» Франция GEENSCREEN HIV 1/2 (V.2)
Приложение 5
Перечень тест-систем, рекомендуемых для постановки
окончательного диагноза и подтверждения наличия антител к
вирусу иммунодефицита человека методом иммунного блота (из
приложения № 3 к приказу Министерства здравоохранения РФ №
292 от 30.07.2001)
№ Фирма-производитель I Название тест-системы
1. «Био-рад» Франция 1 NEW LAV BLOT 1
2. «Органон техника» | LIA ТЕК HIV 111
Нидерланды 1
3. ЗАО БК «Биосервис» г. i БЛОТ-ВИЧ
Москва
4. ЗАО «Биоград» г. С.- 1 ИММУНОБЛОТ ВИЧ 1,2
Петербург 1КОМБИФИРМ
5. «Эколаб» г. Электрогорск 1 ЭКО-лаб-БЛОТ-ВИЧ-l
9 препаратов не были рекомендованы для применения до проведения переаттестации. 1
80
6- Заказ № К-4451.
Приложение 6
Характеристика диагностических препаратов для выявления антител к ВИЧ
1 № i 1 Фирма-производитель 2 Название диагностикума з Серия № / хромоген 4 Годен до Время анализа 6 Регистрационное удостоверение • 7
; 1. НПО «Диагностические системы» г. Нижний Новгород «ИФА-АНТИ-ВИЧ- УНИФ» С. 13 № 133 ОФД С.11 № 129 ОФД С.12№ 130 ТМБ С.16№ 143 ТМБ 14.04.01 14.04.01 14.04.01 20.09.01 2 ч № 99/357/1 от 30.09.99
«ДС-ВИРОНОСТИКА ВИ 4-1*2-Аг/Ат» С.02 ТМБ С.ОЗ ТМБ С.09 ТМБ 04.06.01 02.07.91 29.09.00 1 чЗО мин Намоменг испытания регистрационное удостоверение отсутствовало
2. ООО МЦ «Авиценна», «ВИЧ 1-ВИЧ2-ИФА- г. Москва : Авиценна» С.43 № 183 ТМБ С.44 № 184 ТМБ 19.08.01 26.08.01 45 мин № 99/45/5 от 09.02.99
3. ПКБ им. И.И.Мечникова «СКРИН-ВИЧ» г. Москва ' С.22 № 28 ОФД С.23 № 29 ОФД 05.09.01 12.09.01 1 ч 15 мин № 92/132/6 ФС 42-3231 -95
4. 5~ ЗАО БК «Биосервис» г. Москва ГП НИИ им. Пастера г. Санкт-Петербург «Скрин-ВИЧ» " «ВИП-KOI ГГРОДЬ» С. 151 № 0385 ОФД С. 152 №0386 ОФД С.153№0387 ОФД ’ С. 10301 №тГоф С.20201 № 72 ОФД С.30301 №73 ОФД 15.09.01 20.09.01 25.09.01 17.09.01 1 ч 15 мин 1 ч 50 мин № 92/132/6 от 16.04.92 Не момент испытания регистр, удостоверение отсутствовало
«РЕКОМБИНАНТ- ВИП 1+2» С. 10201 №68 ОФД С.20201 №69 ОФД С. 30201 №70 ОФД Р№ 000184/01-2001 от 03.01.2001 до 03.01.2006 J
00
1 2 з 4 5 6 7
6. ЗАО «Вектор-Бест» г. Новосибирск «КомбиБест-аНти- ВИЧ-Н2» С. 48 № 305 ТМБ С.50 №394 ТМБ 11.09.01 1 ч 30 мин № 2000/88/1 от 03.03.2000
«РекомбиБест анти- ВИЧ-1+2» С.311 № 391 ОФД С.312 №392 ОФД 14.09.01 16.09.01 1 ч 20 мин Р№ 00306/0 1-2001 от 11.03.2001 до 11.03.2006
7. Предприятие «ЭКОлаб» г. Электрогорск «ЭКОлаб-Вироностика 1.2-0» С.2 № 142 ТМБ С.З № 14.3 ТМБ 30.01.02 1 чЗО мин №2/400/96 от 05.12.96
«ЭКОлабТЕСТ- ВИЧ-1,2» С.1 № 95 ОФД С.2 № 104 ОФД С.З № 105 ОФД 25.08.01 01.09.01 1 4 45 мин № 98/366/6 от 17.12.98
8. ЗАО«МБС» г. Новосибирск «РЕКОМБИНАНТ- ВИЧ 1,2 ДСМ» С.14№ 166 ТМБ С.15№ 167 ТМБ С.16№ 168 ТМБ 28.08.01 1 ч 15 мин Р№ 000219/01-2001 от 22.01.2001 до 22.01.2006
9. ООО «А.мерКарл» г. Москва «Пептоскрин-2» С.1 № 2406 ТМБ С.2 № 2415 ТМБ С.З № 2434 ТМБ С.4 № 2575 ТМБ 07.08.01 11.08.01 14.08.01 15.11.01 1 ч 15 Р№ 000131/01-2000 от 01.12.2000 до 01.12.2005
«Амеркард Анти-ВИЧ-1/2 К» С.1 № 2434 ТМБ С.2 № 2460 ТМБ С.З № 2462 ТМБ С.4 К№ 2573 ТМБ 13.08.01 22.08.01 26.08.01 15.11.01 мин Р№ 000130/01-2000 от 01.12.2000 до 01.12.2005
10 BIO-RAD Laboratories Франция “GENSCREEN HIV 1/2 (V.2) ОК0026ТМБ 15.09.01 1 чЗО мин №98/17 от 13.01.98 до 13.01.2003
“GENSCREEN PLUS HIV Ag-Ab” OY004U ТМБ 30.04.01 2ч П№ 01 2597/0 1-2000 от 19.01.2001 до 19.01.2006
1 1 1 2 3 4 5 6 7
11 “Murex Biotech Limited” Великобритания “Murex HIV Ag/Ab Combination” HB 9710 ТМБ 10.2001 2ч На момент испытания регистрационное удостоверение отсутствовало
1 I “12” L “Murex HIV-1.2.0” Н160410ТМБ H21 3910 ТМБ 07.2001 09.2001 1 ч 30 мин
“ORGANON TEKN1KA" Нидерланды “Vironostika HIV Uni- Form II Ag/Ab” 01011501 ТМБ 01011503 ТМБ 12.2001 12.2001 1 ч45 мин П№ 012119/01 от 18.07.2000 до 18.07.2005
13 ООЗТ HHK «ДИАПРОФ МЕД» Украина «1ФА-В1Я l/2-Ш-стрип» С.85 ОФД С.87 ОФД С.89 ОФД 07.11.01 01.12.01 10.01.02 2 ч П№ 012769/01-2001 от 14.03.2001 до 14.03.2006
14 “Roche” Швейцария “Cobas Core Anti-HIV- 1/H1V-2 E1A DAGS” 366101 10.2001 Авт. М3 РФ №98/1316 от 24.09.98 до 24.09.2003
15 “ABBOTT” США “AXSYM system HIV- 1 HIV-2” “IMx system H1V- l/HIV-2 III Plus” 75164 LUOO 8036 15.09.01 Авт. М3 МПР № 97/1043 от 19.09.97
Авт. М3 МПР №97/11180 от 20.10.97 до 20.10.2002
16 «Биомерье С.Л.» Франция “VIDAS HIV DUO” 750617901 09.2002 Авт.
17 “Ortho-Clinical Diagnistics a Johnson&Johnson company” “VITROS ANTI HIV1+2” МЗМПР № 98/144 от 4.02.2003 до 4.02.2003
18 ЗАО «Вектор-Бест» г. Новосибирск «ВИЧ-ЭКСПРЕСС» C.2.3 C.24 C.25 15.07.2001 16.07.2001 19.07.2001 10 мин Р№ 000303/01-2001 от 05.03.2001 до 05.03.2006
|~Г ____' "~2_________1 L_________X 3_______X_______4______ f_____5 X 6____________________7
ГТ9 Хо“ ЗЛО «Биоград» г. Санкт-Петербург BIO-RAD Laboratories Франция «ИММУНОКОМБ БИСПОТ ВИЧ 1,2» "XwLTisPOTinvTZ ~ HJV2” 010216 16.02.2002 №42/2000-1697-8 от 13.09.2000
MS 350 30.10.01 in 10 мин МЗМПР№9818 от 13.01.98 до 13.01.2003
“GENIE 11 HI V-1/ HIV-2" “Determine H1V-1/2/V1H-1/2” 010121 702180100 15.02.02 Т6.ТГ200Г П № 012839/01-2001 от 26.03.2001 до 26.03.2006
21 хх 23" 24 DYNABOT Со. Ltd. Япония Предприятие «ЭКОлаб» г. Электрогорск BIO-RAD Laboratories Франция ЗАО БК «Биосервис» г Москва ЗАО «Биоград» г. Санкт-Петербург 15 мин На момент испытания per истрационное удостоверение отсутство вале
«ЭКОлаб-БЛОТ - ВИЧ-1» “NEW LAV BLOT Г" C. 5-0700 K№ 545 1A0089 X.XIXXX^ 30.07.01 15.01.02 I- 3 ч 40 Mini ”3 ч!о " мин Р№ 000337/01 -2001 от 22.03.2001 до 22.03.2006 М3 МИР № D0 7 от 16.04.96
«Б/ЮТ-ВИЧ» «Й ММ УНОБЛОТВЙЧ 1.2 КОМБИФИРМ» 25.08.01 2 ч 30 мин № 93/160/19 от 12.07.93
25 001005 05.10.01 №42/2000-1697-6 от 13.09.2000
^26 ~27~ “ORGANON TEKNIKA” Нидерланды “LIATEK HIV III” 01020815 10.2001 П №012119/01 от 18.07.2000 до 18.07.2005
“GENELABS DIAGNOSTICS" Швейцария HIV BLOT 2.2 AE 1016 16.10.02 55 мин М3 МПР № 97/246 от 03.03.97
1.3. Классификации ВИЧ-инфекции у взрослых и детей
Инкубационный период при ВИЧ-инфекции составляет, как правило, 2 -
3 недели, но может затягиваться до 3-8 месяцев, иногда - больше. Вслед за ним
у 30-50% инфицированных появляются симптомы острой ВИЧ-инфекции,
которая сопровождается различными проявлениями, включающими в себя по
частоте следующие: лихорадка (96%), лимфаденопатия (74%), эритематозно-
макулопапулезная сыпь на лице, туловище, иногда на конечностях (70%),
миалгии или артралгии (54%). Реже встречаются другие симптомы, такие как
диарея, головная боль, тошнота и рвота, увеличение печени и селезенки
("мононуклеозоподобный синдром"). Неврологические симптомы встречаются
примерно у 12% больных и характеризуются развитием менингоэнцефалита
или асептического менингита и другими синдромами.
Острая ВИЧ-инфекция нередко остается нераспознанной из-за сходства
ее проявлений с симптомами гриппа и других распространенных инфекций.
Кроме того, у части больных она протекает бессимптомно. Для подтверждения
диагноза острой ВИЧ-инфекции целесообразно определять РНК ВИЧ с
помощью полимеразной цепной реакцией или антиген р24. Антитела к ВИЧ в
этот период могут не выявляться, они появляются позже, спустя 1-3 месяцев
после заражения.
Острая ВИЧ-инфекция, как правило, переходит в бессимптомную.
Начинается следующий период - вирусоносительство, продолжающийся
несколько лет (от 1 до 8 лет, иногда более), когда человек считает себя здоровым,
ведет обычный образ жизни, являясь источником инфекции.
Гораздо реже после острой инфекции начинается стадия персистирующей
генерализованной лимфаденопатии (ПГЛ), и в исключительных случаях болезнь
сразу прогрессирует вплоть до стадии СПИДа. 1II 'Л .характеризуется увеличением
лимфоузлов в двух и более группах (за исключением паховых лимфоузлов у
взрослых), сохраняющимся не менее 3-х месяцев. При этом увеличенные
лимфоузлы в диаметре достигают 1 см и более у взрослых и 0,5 см - у детей.
Наиболее часто увеличиваются шейные, затылочные, подмышечные
лимфоузлы. Они эластичны, не спаяны с подлежащей тканью, кожа над ними
не изменена. Стадия 11Г'Л также длится довольно долго - до 5 - 8 лет, в течение
которых лимфоузлы могут уменьшаться и вновь увеличиваться. В этот период
отмечается постепенное снижение уровня СЭ4-лимфоцитов, в среднем со
скоростью 50-70 клеток в 1 мм в год. На стадиях бессимптомной инфекции и
ПГЛ пациенты, как правило, к врачам не обращаются и выявляются при
случайном обследовании.
Вслед за этими стадиями, общая продолжительность которых может
варьировать от 2-3-х до 10 -15 лет, начинается симптоматическая хроническая
фаза ВИЧ-инфекции, которая характеризуется различными инфекциями
вирусной, бактериальной, грибковой природы, которые пока еще протекают
85
довольно благоприятно и купируются обычными терапевтическими
средствами. Возникают повторные заболевания верхних дыхательных путей -
отит, синусит, трахеобронхит и др., поверхностные поражения кожи -
локализованная кожно-слизистая форма рецидивирующего простого герпеса,
рецидивирующий опоясывающий герпес, кандидоз слизистых оболочек,
дерматомикозы,ееборрея и др.
Затем эти изменения становятся более глубокими, не реагируют на
стандартные методы лечения, приобретая упорный, затяжной характер. Человек
начинает худеть, потеря массы тела более 10%, появляются лихорадка, ночные
поты, диарея.
На фоне нарастающей иммуносупрессии развиваются тяжелые
прогрессирующие болезни, которые не встречаются у человека с нормально
функционирующей иммунной системой. Это болезни, которые ВОЗ определила
как СПИД-маркерные, СПИД - индикаторные.
Вторичные заболевания и оппортунистические инфекции развиваются в
связи с тяжелым иммунодефицитом, снижением CD4 Т лимфоцитов и высокой
вирусной нагрузки.
Рекомендации по определению вирусной нагрузки (Viral Load):
1. Без лечения - каждые 6-12 месяцев.
2. На фоне лечения - каждые 3 - 6 месяцев.
3. После перенесенной инфекции или вакцинации.
4. Для создания возможности определить подтипы вируса в популяции.
5. При изменении характера терапии.
6. В целях сопоставления с клиническим течением болезни и уровнем
CD4 лимфоцитов.
Клиническая классификация Центра по контролю за заболеваниями США
(CDC) (MMWR №35, 1986, Р.334-339) охватывала все известные в то время
варианты течения болезни, но не отражала её стадийность, не выделяла
инкубационный период и не несла прогностической информации.
Классификации ВИЧ-инфекции (В.И.Покровский, 1989), принятая в нашей
стране, наиболее удачна.
Клиническая классификация ВИЧ-инфекции (В.И.Покровский 1989 г.)
1. Стадия инкубации
2. Стадия первичных проявлений
2А - острая инфекция
2Б - бессимптомная инфекция
2В - персистирующая генерализованная лимфоаденопатия
3. Стадия вторичных заболеваний
ЗА - Потеря веса менее 10%; грибковые, вирусные, бактериальные
86
поражения кожи и слизистых; опоясывающий л ишай;
повторные фарингиты, синуситы.
ЗБ - Потеря веса более 10%; необъяснимая диарея или лихорадка
более одного месяца; волосистая лейкоплакия;туберкулез
легких; повторные или стойкие вирусные, бактериальные,
грибковые, протозойные поражения внутренних органов;
повторный или диссеминированный опоясывающий лишай;
локализованная саркома Капоши.
ЗВ - Кахексия; генерализованные бактериальные, вирусные,
грибковые, протозойные и паразитарные заболевания;
пневмоцистная пневмония; кандидоз пищевода, бронхов,
легких; внелегочный туберкулез; атипичные микобактериозы;
диссеминированная саркома Капоши; поражения
центральной нервной системы различной этиологии.
4. Терминальная стадия
Введение в классификационную систему стадии инкубации, включающей
в себя период ог момента заражения до ответа организма на него в виде появления
клинических проявлений и/или выработки антител обусловлено существующей
у нас практикой наблюдения за лицами, имевшими эпидемиологически значимый
контакте больными ВИЧ-инфекцией. При использовании методик, позволяющих
выявлять в организме зараженного вирус или его фрагменты, имеется
возможность диагностировать заболевание и на этой стадии.
Стадия первичных проявлений включает в себя состояния,
обусловленные непосредственно взаимодействием макроорганизма с ВИЧ.
Присоединение на фоне стойкого иммунодефицита вторичных
возбудителей и появление опухолей свидетельствует о переходе болезни в
стадию вторичных заболеваний. Терминальная стадия может развиться не только
в результате прогрессирования состояний, характерных для стадии ЗВ, но и
вследствие поражения ЦИС, не опосредованного другими, помимо ВИЧ,
возбудителями.
Таким образом, в данную классификацию могут вмещаться все
проявления болезни от момента заражения до гибели больного, включая и те,
которые, возможно, ещё и неизвестны.
Данные о распределении больных по стадиям болезни согласно
Российской классификации ВИЧ-инфекции на момент первичного обращения
в группах больных, выявленных в условиях стабильного низкого прироста
заболеваемости ВИЧ-инфекцией в России (до 1996 года) и в условиях быстрого
ее роста в 1998 году, представлены в таблице 21. Обращает на себя внимание
тенденция к увеличению доли больных, находящихся на ранних стадиях
болезни, что обусловлено изменением эпидемической ситуации - ростом числа
недавно зараженных пациентов.
87
Таблица 21
Распределение больных ВИЧ-инфекцией по стадиям заболевания
(Классификация В.И.Покровского, 1989г.), О.Г.Юрин, 1999
Стадии ВИЧ-инфекции Стадия инкубации (1) До 1996 года 1998 год
Кол-во _ о" _ _%_ । 0 Кол-во % _ 0 I 0
Стадия первичных проявлений (2А,2Б,2В) 154 67,8 132 i 88,0
Стадия (ЗА) 39 17,2 15 1 10,0
вторичных (ЗБ) 23 10,1 2 1,3
заболеваний (ЗВ) Терминальная стадия (4) Итого 9 2 ~ 4,0 0,9 1 : 0,7 0 : 0
227 100 150 ! 100
Изменившиеся за прошедшие 10 лет представления о течении ранних
стадий ВИЧ-инфекции дали основания внести изменения и в обозначение
состояний, входящих в стадию первичных проявлений (В.И.Покровский,
О.Г.Юрин, 2001). В частности, стадия 2А (острая инфекция) выделена в
отдельную, так как она отличается от стадий 2Б и 2В, как с точки зрения
патогенеза заболевания (активная репликация ВИЧ, развитие
иммунодефицита и оппортунистических заболеваний), так и по тактике
ведения больного, который на этой стадии нуждается в
противоретровирусном лечении. Кроме того, имеются данные, что
выраженность клинической симптоматики, отмечающейся в период острой
ВИЧ-инфекции коррелирует со скоростью дальнейшего прогрессирования
болезни. Таким образом, по мнению авторов, целесообразно выделить
отдельную стадию «Ранней ВИЧ-инфекции», в которой должны быть
варианты бессимптомной сероконверсии, острой ВИЧ-инфекции без
вторичных заболеваний, острой ВИЧ-инфекции с вторичными
заболеваниями. Стадии 2Б и 2В, не отличающиеся по прогностическому
значению и тактике ведения больного, автор считает целесообразным
объединить в одну стадию - субклинической инфекции.
Авторы так характеризуют предлагаемый ими новый вариант
классификации ВИЧ-инфекции, который отражает ' современные
представления о течении ВИЧ-инфекции:
• Период от момента заражения до ответа организма на него (стадия
инкубации);
88
• Первичный ответ организма на инфекцию (ранняя ВИЧ-
инфекция) в виде выработки антител, появления неспецифической
клинической симптоматики, развития транзиторного иммунодефицита и
проходящих вторичных заболеваний.
• Латентный период, точнее субклиническая стадия, когда
компенсаторные возможности макроорганизма способны поддерживать
уровень иммунитета, достаточный для защиты от оппортунистических
заболеваний.
• Период обратимой декомпенсации, когда на фоне угнетения
иммунитета развиваются вторичные заболевания, но возможны ремиссии
(как спонтанные, так и терапевтические) и возможно даже возвращение в
латентное состояние.
• Терминальная стадия, когда заболевание неуклонно
прогрессирует даже на фоне адекватной терапии.
Позже латентная стадия была заменена на субклиническую с учетом
возможности и в этой стадии высокой репликативной активности ВИЧ
(вирусная нагрузка).
Предлагаемая классификация выглядит следующим образом:
Классификация ВИЧ-инфекции (2001-2002 гг.)
1. Сталия инкубации
2. Стадия ранней ВИЧ-инфекции
Варианты течения:
Бессимптомная сероконверсия
Острая ВИЧ-инфекция без вторичных заболеваний
3. Субклиническая стадия
4. Стадия вторичных заболеваний
4А - Потеря веса менее 10%; грибковые, вирусные,
бактериальные поражения кожи и слизистых;
опоясывающий лишай; повторные фарингиты,
синуситы.
Фазы Прогрессирование (спонтанное, после ранее
проводимой противоретровирусной терапии, на
фоне противоретровирусной терапии).
Ремиссия (спонтанная, после ранее проводимой
противоретровирусной терапии, на фоне
противоретровирусной терапии).
4Б - Потеря веса более 10%; необъяснимая диарея или
лихорадка более одного месяца; волосистая
лейкоплакия; туберкулез легких; повторные или
стойкие вирусные, бактериальные, грибковые,
протозойные поражения внутренних органов;
повторный или диссеминированный опоясывающий
лишай; локализованная саркома Капоши.
89
Фазы Прогрессирование (спонтанное, после ранее проводимой
противоретровирусной терапии, на фоне
противоретровирусной терапии).
Ремиссия (спонтанная, после ранее проводимой
противоретровирусной терапии, на фоне
противоретровирусной терапии).
4В - Кахексия; генерализованные бактериальные, вирусные,
грибковые, протозойные и паразитарные заболевания;
пневмоцистная пневмония; кандидоз пищевода,
бронхов, легких; внелегочный туберкулез; атипичные
микобактериозы; диссеминированная саркома Капоши;
поражения центральной нервной системы различной
этиологии.
Фазы Прогрессирование (спонтанное, после ранее
проводимой противоретровирусной терапии, на фоне
противоретровирусной терапии).
5 - Терминальная стадия.
Стадии 4Л, 4Б, 4В в данном варианте классификации соответствуют
стадиям ЗА, ЗБ, ЗВ в классификации 1989 года. Данная классификация
адаптирована к современным условиям. Однако, без учета уровня
вирусной нагрузки и количества CD4 клеток весьма сложно и даже
невозможно выделять фазу ремиссии.
За рубежом используется классификация ВИЧ-инфекции, принятая
CDC в 1993 году. В отличие от других классификаций, классификация CDC
включает не только клинические проявления, но и иммунологические
показатели, уровень CD4 клеток. Приводим эту классификацию (таблица 22).
Таблица 22
Классификация ВИЧ-инфекции, предложенная центром по
контролю за заболеваниями (CDC, США) в 1993 для подростков и
____________________________взрослых_____________________________
Уровень CD4 Т-клеток Клинические категории
А В с
Бессимптомная острая(первичная) ВИЧ-инфекция или ПГЛ Манифестная но не А и не С спид- индикаторные состояния
1) >500/мкл А1 В1 С1
2) 200-499/мкл А2 В2 С2
3) < 200/мкл АЗ ВЗ СЗ
Клиническая категория А:
- острая (первичная) ВИЧ-инфекция;
- бессимптомное носительство ВИЧ;
90
- острая (первичная) ВИЧ-инфекция;
- бессимптомное носительство ВИЧ;
- персистирующая генерализованная лимфоаденопатия (увеличение
лимфатических узлов > 1 см, в двух анатомически не связанных друг с другом
регионах (исключая паховые), длительностью более трех месяцев.
Клиническая категория В:
- Бациллярный ангиоматоз;
- Оральный или вульвовагинальный кандидоз, персистирующий более 1
месяца или плохо поддающийся лечению (возникновение рецидива после
окончания лечения в пределах трех месяцев);
- Волосатая лейкоплакия языка;
- Herpes-zoster- инфекция с поражением только кожи, рецидивирующая
в течение 1 года или единичный эпизоде поражением внутренних органов;
-Листериоз;
- Воспалительные заболевания органов малого таза с тенденцией или
образованием тубо-овариальных абсцессов;
- Выраженная цервикальная дисплазия или цервикальная карцинома in
situ;
- Одно из двух конституциональных симптомов:
а ) документированная лихорадка с повышением температуры тела выше
38,5°С длительностью более 1 месяца, которую можно объяснить только как
связанную с ВИЧ-инфекцией; б) персистирующая более 1 месяца диарея,
которую можно объяснить только как связанную с ВИЧ-инфекцией;
- Идиопатическая тромбоцитопеническая пурпура;
- Периферическая нейропатия.
Клиническая категория С:
- Инфекция, обусловленная вирусом простого герпеса, вызывающая
кожно-слизистую язву, персистирующую более 1 месяца, или бронхит,
пневмонию, или эзофагит любой продолжительности;
- Цитомегаловирусные заболевания органов, кроме печени, селезенки и
лимфатических узлов, например, хориоретинит, колит;
- Саркома Капоши у лиц моложе 60 лет;
- Лимфома мозга (первичная) у лиц моложе 60 лет;
- Другой, не относящийся к болезни Ходжкина, тип лимфомы В-
клеточного или неизвестного иммунологического фенотипа и следующие
гистологические типы: а) мелкая, с нерасщепленными ядрами лимфома
(типа Беркита или другого типа), б) иммунобластосаркома (эквивалентна
любому из следующих типов, хотя необязательно в полном сочетании:
иммунолимфобластома,
91
крупноклеточная лимфома, диффузная гистиоцитарная лимфома, диффузная
недифференцированная лимфома или зрелая лимфома);
Злокачественая цервикальная карцинома;
Легочный или внелегочный туберкулез;
Атипичный микобактериоз, вызванный комплексом
Mycobacterium avium или Mycobacterium kansasii, или другими
Mycobacterium spp., или недифференцированными Mycobacterium,
диссеминированный (в органах кроме кожи, легких, шейных лимфатических
узлов и лимфатических узлов корня легкого или в сочетании с поражением на
этих участках);
Септицемия, вызванная Salmonella (не брюшнотифозной),
рецидивирующая;
Повторная пневмония (в течение 1 года) (подтвержденная
рентгенологически и с рентгенологически подтвержденным выздоровлением
между первым и вторым эпизодом, особенно, если она вызвана Streptococcus
pneumoniae, Haemophilus influenzae, Staphilococcus aureus, Грам
отрицательными микроорганизмами: Enterobacteriaceae, Pseudomonas);
Пневмония, обусловленная Pneumocystis carinii;
Токсоплазмоз центральной нервной системы;
Криптоспоридиоз с диареей, длящейся более 1 месяца;
Изоспороз с диареей, длящейся более 1 месяца;
Кандидоз пищевода, трахеи, бронхов или легких;
Внелегочный криптококкоз;
Кокцидиоидозный микоз, диссеминированный (в органах кроме
легких, шейных лимфатических узлов и лимфатических узлов корня легкого
или в сочетании с поражениями этих органов);
Гистоплазмоз диссеминированный (в органах кроме легких,
шейных лимфатических узлов и лимфатических узлов корня легкого или в
сочетании с поражениями этих органов);
Энцефалопатия, вызванная ВИЧ (клинические данные об
ннвалидизирующих состояниях, обусловленных нарушением познавательных
способностей и (или) двигательной функции, влияющих на работоспособность
или повседневную деятельность при отсутствии сопутствующих болезней или
состояний, кроме ВИЧ, которыми можно было бы объяснить эти данные);
Прогрессирующая многоочаговая лейкоэнцефалопатия;
Синдром истощения при инфекции ВИЧ (значительная
непроизвольная потеря массы тела на уровне более 10% (7 кг) отосновной
массы при наличии либо хронической диареи (жидкий стул не менее 2 раз в
день на протяжении более 30 дней), либо хронической слабости и
документированной лихорадки (интермиттирующей или постоянной на
протяжении более 30 дней) и отсутствии сопутствующих
92
болезней или состояний, кроме инфекции ВИЧ, которыми можно было бы
объяснить эти данные).
В I 994 году CDC была предложена новая, основанная на уровне CD4
клеток и клинических симптомах, классификация ВИЧ-инфекции для
детей. Приводим ее в таблицах 23, 24.
Таблица 23
Классификация ВИЧ-инфекции у детей моложе 13 лет, CDC
(1994)
Иммунологичес- Клинические критерии '
кие критерии Н - без симптомов А - со слабо выраженными симптомами В - умеренные клинические симптомы С - тяжелая (симптомы или синдром СПИДа)
Без иммуносупрессии HI А! В 1 О
Умеренная иммуносупрессия Н2 А2 В2 С2
Тяжелая иммуносупрессия ИЗ АЗ вз сз
Таблица 24
Классификация иммуносупрессии при ВИЧ-инфекции у детей
моложе 13 лет (1994)
Иммунологические критерии (CD4 I - лимфоциты) Возраст детей
До 12 месяцев 1 - 5 лет 6-12 лет
Абс. % Абс. % Абс. %
Нет данных за иммуносупрессию > 1500 >25 >1000 >25 >500 >25
Умеренная иммуносупосссия 750 - 1499 14-24 500 - 999 15-29 200 - 499 15-24
Тяжелая иммуносупрессия <750 <15 <500 <15 <200 <15
93
Клинические категории ВИЧ-инфекции.
Категория Н- нет симптомов или один из категории А.
Категория А - мало выраженные симптомы.
Эта категория ни В и ни С включает 2 или более ниже перечисленных:
- лимфаденопатию (более 0,5 см, более чем в2 областях увеличенные
лимфоузлы);
- гепатомегалию;
- спленомегалию;
- дерматиты;
- паротит;
- рецидивирующую респираторную инфекцию, отит, синусит.
Категория В - умеренно выраженные симптомы. Эта категория
ни А и ни С включает:
- анемию, тромбоцитопению и/или нейтропению (более 30 дней);
- бактериальную пневмонию, менингит, сепсис (один эпизод);
- орофарингеальный кандидоз, персистирующий более 2 месяцев, у
детей старше 6 месяцев;
- кардиомиопатию;
- цитомегаловирусную инфекцию у ребенка старше 1 месяца;
- диарею рецидивирующую или хроническую;
- гепатит;
- герпесвирусный стоматит рецидивирующий (более 2 эпизодов в год);
- герпесвирусный бронхит, пневмонию, эзофагите началом не ранее 1
месяца;
- герпес опоясывающий (два или более эпизода);
- лейкомиосаркому;
- лимфоидную интерстициальную пневмонию (ЛИП) или гиперплазию
прикорневых лимфоузлов;
- нефропатию;
- нокардиоз;
- персистирующую лихорадку более 1 месяца;
- токсоплазмоз у ребенка 1 месяца и старше;
- ветряную оспу диссеминированную.
Категория С - тяжелая симптоматика (СПИД-индикаторные болезни,
исключая ЛИП), состояния, определяющие диагноз СПИДа:
- серьезные бактериальные инфекции, множественные или
рецидивирующие, не менее 2 раз за 2-летний период, подтвержденные
гемокультурой, в виде септицемии, пневмонии, менингита,
остеомиелита, абсцессов различных органов и полостей (исключая отит,
поверхностный кожно-слизистый абсцесс, инфекцию, обусловленную
кавакатетером);
94
- кандидозный эзофагит или легочный кандидоз (бронхов, трахеи, легких);
- кокцидиоидомикоз диссеминированный;
- внелегочный криптококкоз;
- криптоспоридиоз или изоспороз с диареей более месяца;
- ЦМВ-болезнь у ребенка старше 1 месяца, исключая изолированные
поражения печени, легких или лимфоузлов;
- энцефалопатии: наличие прогрессирующих симптомов более двух
месяцев при отсутствии других заболеваний, кроме ВИЧ-инфекции:
а) задержка психомоторного развития или приобретенная
микроэнцефалия, атрофия коры мозга, подтвержденная
компьютерной томографией или ЯМР у ребенка старше 2 лет;
нарушение интеллекта, подтвержденное нейрофизиологическими
тестами;
б) приобретенные моторные нарушения, два или более: парез,
патологические рефлексы, атаксия или нарушение походки;
- герпес-симплекс-вирусная инфекция с кожно-слизистыми язвами,
персистирующая более месяца, или бронхит, пневмония или эзофагит
у ребенка старше 1 месяца;
- диссеминированный гистоплазмоз;
- саркома Капоши;
- первичная лимфома головного мозга;
- лимфома Беркита;
- лимфома В-клеточная;
- туберкулез, диссеминированный или внелегочный;
- микобактериоз диссеминированный атипичный с поражением
нескольких органов;
- микобактериум авиум-комплекс, или микобактериоз Канзаси
диссеминированный;
- пневмоцистная пневмония;
- прогрессирующая лейкоэнцефалопатия;
- сальмонеллезная септицемия рецидивирующая;
- токсоплазмоз головного мозга у ребенка старше I месяца;
- вастинг-синдром, при отсутствии заболеваний, сходных с ВИЧ-
инфекцией, объясняющий следующие симптомы:
а) стойкая потеря веса, более 10% от должного веса;
б) хроническая диарея (не менее чем 2-кратный жидкий стул в сутки
в течение 30 дней);
в) документированная лихорадка более 30 дней, интермиттирующая
или постоянная.
95
Прогностическими факторами прогрессирования ВИЧ-инфекции (I.Salit,
семинары канадско-российского проекта по СПИДу, CARP, 1999) могут являться
результаты лабораторных исследований и клинические данные.
Из лабораторных данных наибольшее значение имеют:
- вирусная нагрузка, которая является самым четким
прогностическим фактором, она же самый хороший критерий эффективности
антиретровирусной терапии.
- уровень CD4 Т-лимфоцитов. Это также один из наиболее важных
критериев прогрессирования болезни. При снижении CD4 более чем на 7%
риск прогрессирования ВИЧ-инфекции повышается в 35 раз по сравнению
с теми, у которых уровень CD4 стабилен. Увеличение количества CD4 клеток
на фоне антиретровирусной терапии - хороший прогностический признак.
- антиген р24. Определять этот антиген следует при отсутствии
возможности измерить вирусную нагрузку. Длительно положительный тест
на р24 указывает на возможность прогрессирования болезни.
- тип вируса. Обнаружение вируса, индуцирующего образование
синцития, свидетельствует о возможности уменьшения числа CD4 клеток и,
следовательно, прогрессирования болезни.
Клинические симптомы:
- рецидивирующий кандидоз;
- прогрессирующая диарея;
- волосистая лейкоплакия языка;
- повторный герпес зостер;
- длительный и ярко выраженный острый ретровирусный синдром;
- отсутствие антиретровирусной терапии.
Выделяют пациентов с ВИЧ-инфекцией, у которых в течение длительного
времени болезнь не прогрессирует в стадию СПИДа (“non- progressors7’)- К
этой группе относятся пациен ты, у которых очень долго, более 6 лет, сохраняется
стабильно нормальный уровень CD4 клеток, а показатели вирусной нагрузки
являются низкими.
Внедрение в клиническую практику антиретровирусной терапии
позволило выделить наряду с естественным течением ВИЧ-инфекции ВИЧ-
инфекцию на фоне антиретровирусной терапии.
96
Неестественная история ВИЧ-инфекции (на фоне антиретровирусной
терапии) (LSalit, канадеко-poccuiicKuii проект по СПИДу, CARP, семинары
£999 года)
Высоко активная антиретровирусная терапия - ВААРТ (highly active
antiretroviral therapy - HAART) может остановить естественное
прогрессирование ВИЧ-инфекции:
• благодаря снижению вирусной нагрузки
до <50 копий/мл у 50-70% больных
• благодаря увеличению числа клеток CD4
(на 150-200 клеток) у большинства больных
• благодаря улучшению иммунного статуса ВААРТ может
предупреждать развитие или даже излечивать оппортунистические
инфекции (ОИ) и даже злокачественные опухоли
• может отпадать необходимость в химиопрофилактике и/или
лечении оппортунистических инфекций
• увеличивается продолжительность жизни больных
Таким образом, в настоящее время в связи с внедрением
антиретровирусной терапии клиническая картина ВИЧ-инфекции существенно
изменилась, увеличилась продолжительность жизни больных, вторичные,
СПИД-индикаторные болезни стали регистрироваться реже, отпала
необходимость в их профилактике на фоне антиретровирусной терапии. Тем
не менее, в связи с тем, что многие больные, и в их числе наркоманы, остаются
без лечения и надлежащего диспансерного наблюдения, необходимость в
характеристике вторичных и оппортунистических болезней является
чрезвычайно важной. Следует также принимать во внимание, что не все больные,
находящиеся на антиретровирусной терапии, поддаются лечению, и у них
возможно прогрессирование болезни с развитием вторичных и
оппортунистических заболеваний.
7. Заказ № К-4451.
97
Литература
1. Ахтырская Н.А., Сизова Н.В., Рахманова А.Г. и соавт. Эпидемиология
ВИЧ-инфекции в Санкт-Петербурге//Эпидемиология и инфекционные
болезни.-1998. -№ 5. -С. 17-19.
2. Бобков А.Ф., Казеннова Е.В., Селимова Л.М. с соавт. Субтипы ВИЧ-1 в
России в 1987-1998 гг.//ЖМЭИ, 1999, N1, с.43-45.
3. ВИЧ-инфекция у детей // Метод.рекомендации под ред. Воротынцевой
Н.В., Учайкина В.Ф., ЧешикаС.Г. с соавт., // М.- 1990, -17 с.
4. Внутрибольничная ВИЧ инфекция. Информационно-методическое
письмо. Авторы: О.В.Платошина, И. А.Попова, Н.В.Горшкова. СПб, 1999.
5. Волкова Г.В., Рахманова А.Г., Андреева В.В. и соавт. ВИЧ-инфекция.
Оценка ситуации у инъекционных наркоманов в Санкт-Петербурге.-ССЗ,
СПб, 2001.-22 с.
6. Горшкова Н.В. Клинико-эпидемиологическая характеристика ВИЧ-
инфекции удетей с парентеральным путем инфицирования / Автореферат
дисс... к.м.н.. -СПб, 1998.-24 с.
7. Дмитриев В.И., Платонова Т.Н. Особенности течения ВИЧ-инфекции у
детей//Вопросы охраны материнства и детства-1991.-№9.-с.3-8.
8. Дозорный эпиднадзор за ВИЧ-инфекцией / Канадско-Российский проект
борьбы со CI 1ИДом. -СПб, 2000. -19 с.
9. Доклад о глобальной эпидемии ВИЧ/СПИДа// ЮНЭЙДС. -2002. -С. 237.
10. Дубровина М.П. Развитие эпидемии ВИЧ/СПИД инфекции в Свердловской
области // Мат. конф. «Актуальные вопросы ВИЧ-инфекции», Санкт-
Петербург, 29-31 октября 1997 г.-СПб.-1997.-С. 68-69.
11. Ермак Т.Н. Клинические особенности и структура оппортунистических
заболеваний у больных ВИЧ-инфекцией в России/Автореф.... докт. дис.,
М„ 1999
12. 3мушко Е.И., Митин Ю.И., Бельгесов А.Б. и др. Диагностика ВИЧ-
инфекции в ВС РФ: тенденции 1995-1997 гг.//Мат. конф. «Инфекционные
болезни: новое в диагностике и терапии», Санкт-Петербург, 1998. -СПб.
-1998.-С.32.
13. Карабеков А.Ж. Особенности эпидемиологии ВИЧ-инфекции у
наркоманов// Мат. конф. «Военно-медицинскиеаспекты ВИЧ-инфекции»,
Санкт-Петербург, 1999. -СПб. -С. 30-33.
14. Кравченко А.В., Юрин О.Г., Буравцова Е.В. и др. Ранние клинические
проявления ВИЧ-инфекции И Мед. помощь. -1993. -№ 5. -с. 26-28.
15. Ладная Н.Н., Покровский В.В., Бобков А.Ф. Распространение субтипов
ВИЧ-1 в России//Эпидемиология и инфекционные болезни. -1998. -№5.
-С. 19-23.
98
16. Лысенко А.Я., Турьянов М.Х., Ладовская М.В., Подольский В.И. // ВИЧ-инфекция
и СПИД-ассоциируемые заболевания. // М. ТОО «Рарогь» 1996,- 624 с.
17. Носик Н.Н., Носик Д.Н., Кузнецова Н.В. и др.Чувствительность канти-
ВИЧ-препаратам изолятов ВИЧ, выделенных на территории России.//
Вопросы вирусологии, 1997,112-114.
18. Онищенко Г.Г., Наркевич М.И., Голиусов А.Г. И ВИЧ- инфекция, развитие
эпидемии в Российской Федерации // ЖМЭИ -1997,- № 6.- с.47-50.
19. 0рганизация работы клинико-диагностических лабораторий по
предупреждению инфицирования пациентов и персонала вирусами
гепатитов В и С и иммунодефицита человека / Методические
рекомендации. Разработаны: Г.В.Волкова, О.В.Парков, ЕС.Степанова и
др. Центр Госсанэпиднадзора, Санкт-Петербург, 2000 г. -28 с.
20. Покровский В.И. ВИЧ-инфекция или СПИД. Терапевтич. архив 1989,
№11,с.5-12.
21. Покровский В.В. Эпидемиология и профилактика ВИЧ-инфекции и
СПИДа. -М.: Медицина. -1996. -246 с.
22. Покровский В.В., Ерамова И.Ю. Проникновение ВИЧ в популяцию
московских гомосексуалистов и распространение в ней // Журн.
микробиол. -1990. -№ 4. -С. 18-22.
23. Покровский В.В., Ерамова И.Ю., Кузнецова И.И. и др. Передача ВИЧ от
ребенка матери во время кормления грудью//Журн. микробиол.-1990.
-№3.-С. 23-26.
24. Покровский В.В., Ерамова И.Ю., Липетиков В.В. и др. //
Внутрибольничные вспышки ВИЧ-инфекции в Элисте//ЖМЭИ -1990.-
№4,-с. 17-23.
25. Покровский В.В., Ермак Т.Н., Беляева В.В., Юрин О.Г. ВИЧ-инфекция:
клиника, диагностика и лечение.-2000.-М.: ГЭОТАР МЕДИЦИНА. -496 с.
26. Покровский В.В., Юрин О.Г., Беляева В.В. и др. Клиническая диагностика
и лечение ВИЧ-инфекции. Практическое руководство для студентов и
врачей. -М., 2001. -92 с.
27. Покровский В.В., Янкина З.К. Эпидемиологическое расследование
первого случая СПИД, выявленного у гражданина СССР И Журнал
микробиологии, эпидемиологии и иммунологии. -1987. -№ 12. -С. 8-11.
28. Покровский В.И. Взаимосвязь клиники и эпидемиологии инфекционных
болезней // Эпидемиология и инфекционные болезни // М., Медицина,
1997,-№5,- с.4-6.
29. Тимаков В.Д., Зуев В.А. Медленные инфекции. М., 1977. С.279.
30. Покровский В.И., Покровский В.В. СПИД//М.: Медицина, 1988.-45 с.
31. Рахманова А., Волкова Г., Андреев В. и соавт. Анализ распространенности
ВИЧ-инфекции у лиц, употребляющих внутривенно наркотические
средства. -ССЗ, СПб, 2002.-14 с.
7*
99
32. Рахманова А.Г. Педиатрические аспекты ВИЧ-инфекции. -СПб. -1996. -
29 с.
33. Рахманова А.Г., Исаков В.А., Смирнов А.Н. и соавт. Случай смерти от
СПИДа в СССР//Тер. архив. -1989. -№ 11. -с. 37-39.
34. Рахманова А.Г. ВИЧ-инфекция, ССЗ, 2000, с.370.
35. Рахманова А.Г., Чайка Н.А. Синдром приобретенного иммунодефицита,
СПб, 1991,86 с.
36. Руководство по инфекционным болезням / Под ред. Проф. Ю.В.Лобзина
и проф. А.П.Казанцева//СПб.: ТИТ «Комета», 1996.-720 с.
37. Семина Н.А., КовалеваЕ.П., Генчиков Л.А. Эпидемиология и профилактика
внутрибольничных инфекций на современном этапе // Эпидемиология и
инфекционные болезни. - М., Медицина, 1997. - № 6.- с.4-8.
38. Семинары Canadian AIDS Russia Project (CARP), 1999.
39. Смольская T.T. Второе десятилетие жизни в условиях СПИДа - уроки и
проблемы. С.-Петербург, 1997.
40. Смольская Т.Т., Лещинская Н.П., Шилова Э.А. Серологическая
диагностика ВИЧ-инфекции//, 1992.
41 .Твердофазный иммуноферментный анализ. Труды института им. Пастера
//Л., 1988.
42. Хаитов Р.М., Игнатьева ГА. СПИД, М., 1992,352 с.
4 3.Эпиднадзор второго поколения за ВИЧ-инфекцией: следующая декада /
Канадско-Российский проект борьбы со СПИДом. -СПб, 2000. -48 с.
44 . Юрин О.Г, ИроваД.И., Габрилович Д.И. и др. Клинические проявления
и вопросы классификации ВИЧ-инфекции// Вестник РАМН.-1992. -№9-
10.-С. 16-19.
45 .1993 Revised Classification System for HIV infection. Center Diseases control,
MMWR 1992,4,RR-17
46 . Agut Henri.La charge virale premiere egine:conf.int.Sida,Vancover. //J.Sida.-
1996,57-58.
47 . AIDS // Weekly epid.Record, 1990,37,281 -283.
48 . Barre-Sinoussi F.,ChenTiam J.C., Rey F. et al. Isolation ofT-lymphotropic retrovirus
from patient at risk for Al DS //Science. - 1983.-Vol. 220.-P. 868-871.
49 . Bursaux Elisabet. La mesure de la charge virale en HIV-1 pernut d affinier le
pronostikde lamaladie// M/S: Med.Sci.-l 996,12, N.8-9,978-979.
50 .Centers for Disease Control. Pneumocystis carinii pneumonia among persons
with hemophilia//Ibid. -1982. -Vol. 31.- P. 365-367.
51 .Centers for Disease Control. Pneumocystis Pneumonia - Los Angeles //
Morbidity and Mortality Weekly Report. -1981. - Vol. 30. -P.305-307.
52 . Centers for Disease Control. Possible transfusion-associated AIDS.- California
// Ibid. -1982. -Vol. 31,- P.652-654.
100
53 .Centers for Disease Control. Prevention of AIDS: report of interagency
recommendations // Ibid. -1983. -Vol. 32. -P. 101-104.
54 .Centers for Disease Control. Update on Kaposi’s sarcoma and opportunistic
infections in previously healthy persons.-United States// Ibid. -1982. -Vol.
31.-p.294-301.
55 . Centers for Diseases Control and Prevention. 1994 revised classification system
for HIV infection in children less than 13 years of age // MMWR. -1994. -N43
(RR-12). -P. 1-10.
56 .Constantine N.T.et al. Retroviral Testing, Essentials for Quality Control and
Laboratory Diagnosis., CRC.Press., Florida, USA, 228 p., 1992.
57 . Gallo R.C. The AIDS virus // Scientific American. -1987. -Vol. 256,- P.46-56.
58 .GildonN., Beall M.D. Some troughts on viral load testing. People with HIV/
AIDS action coalition, June 1996//Medikal update, 1996,7.
59 .HIV/AIDS surveillance in Europe// UNAIDS/WHO. - 2001. -P. 60.
6O .Kricka L.J., Stott R.A. Иммуноферментный анализ с усиленной
хемилюминисценцией.//М. 1992,167-178.
61 .Levy J.A. HIV: detection and pathogenesis // in AIDS pathogenesis and
treatment. -Ed. Levy J.A. Marcel Dekker inc. -New York and Basel, 1989. -
P. 159-230.
62 . Levy J.A., Hoffman A.D., Kramer S.M. et al. Isolation of lymphadenopathy
retroviruses from San-Francisco patient with AIDS // Science. - 1984. Vol.
225.-P. 840-842.
63 .Operational characteristics of commercially available assays to detect
antibodies to HIV-1 and/or HIV-2 Human Sera, Report 9-10, Geneva, 1998,
WHO/BLS/98.1.
64 .Oral HIV found to be pinghly accurate.// Lancet, 1997,349, N.9047,259.
65 .Pappas M.G. Точечный твердофазный иммуноферментный анализ.//
М.,1992.
66 . Rakhmanova A., Volkova G., Andreev V. et al. Analysis of prevalence of Hl V
infection among intravenous drug users. -ASH, SPb. -2002. -7 p.
67 . Rakhmanova A., Volkova G., Sheluchina V. et al. HIV prevetion for persons
who use drugs. -ASH, SPb. -2000. -31 p.
68 .Rakhmanova A., Volkova G., Vinogradova E. et al. The Malmo - St.
Petersburg project for drug users (Epidemiology situation on HIV/AIDS in
St. Petersburg. Harm reduction program Drop-in-Center and Bus). -ASH,
SPb.-2002.-38 p.
69 .Sato P.A., Maskill W.J., Tamashiro H. et al. Стратегия лабораторных
исследований сывороток на ВИЧ-инфекцию: оценка альтернативных
подходов, не требующих применения метода вестерн-блоттинг//Бюлл.
ВОЗ,1994,т.72,70-75.
101
70 .Tamashiro H., Constantine N.T. Серологическая диагностика ВИЧ-
инфекции с использованием жидкостей из полости рта. // Бюлл. ВОЗ,
т.72, 1994,2,76-83.
71 . The HIV expert. A comprehensive review of HIV and its management. 1993.
72 . Volkova G., Naucler A., Sheluchina V. etal. Epidemiology situation on HIV/
AIDS in St. Petersburg (Harm reduction program Drop-in-Center and Bus). -
ASH, SPb.-2001.-30 p.
73 . Volkova G., Sheluchina V., Rakhmanova A., Vinogradova E., Kriga L.
Epidemiology situation on HIV/AIDS in St. Petersburg Harm reduction program
Malmo - St. Petersburg. -ASH. -SPb. -2000.-16 p.
74 .WHO. Provisional WHO clinical case definition for AIDS // Weekly
epidemiological record.-1986.-No. 10.-P.71.
75 . WHO. The HIV/AIDS pandemic: 1994 overview. -WHO, Geneva, 1994. -16 p.
76 .Wilber Judith C. Branched DNA for guantifikation of viral load. //
Immunol. Invest., 1997,26, N. 1 -2,9-13.
77 .World Health Organization. Guidelines on AIDS in Europe. -WHO,
Copengagen, 1985.-57 p.
102
1.4. Патогенетические аспекты ВИЧ/СПИДа
Проникновение вируса в клетку является многоэтапным процессом,
который начинается со связывания вируса с CD4 рецептором и хемокиновыми
рецепторами на Т-хелперах. Рецептор для вируса представляет собой CD4
молекулу, расположенную на поверхностной мембране Т-хелперов,
являющуюся мономерным белком и состоящую из 4 иммуноглобулиновых
доменов, с молекулярным весом 55 кД. После связывания с рецептором
гликопротеины вирусной оболочки сливаются с мембраной клетки-мишени,
что позволяет вхождение сердцевины вируса в цитоплазму, gp 120 гликопротеин
связывается с рецепторами на клетке хозяина, тогда как gp41 является
ответственным за слияние вируса с клеткой после максимального приближении
вируса к клетке. Связывание с рецептором не только прикрепляет и ориентирует
поверхностные гликопротеины вируса к мембране клетки, но и изменяет
конформацию гликопротеинов, которые проделывают последовательные этапы,
ведущие к слиянию мембран. Природа этих изменений до сих пор не понята,
так, наиболее изученными к настоящему времени являются конформационные
изменения gp 120. Связывание gp 120 с рецептором приводит к индукции его
конформационных изменений, которые делают возможным связывание gp 120
с CCR5 хемокиновым рецептором, который необходим для эффективного
вхождения в клетку практически всех изолятов вируса.
ВИЧ-1 и ВИЧ-2 проявляют тропность к CD4 Т-лимфоцитам посредством
связывания гликопротеина вирусной оболочки gpl20 с CD4 молекулой. До сих
пор топография gp 120-CD4 связывающего региона остается не выясненной
до конца. Lasky et al. показали, что аминокислотная последовательность
420-463 С-концевой части белка gp 120 вовлекается в CD4 связывание. Kleber-
Emons et al. выявили, что пептиды, входящие в 428-445 область, обладают
способностью блокировать образование синтиция. Замена аминокислот в
позициях 427 и 434 прерывают связывание вируса или частично нарушает
способность инфицировать клетку-мишень. Однако было показано, что N-
концевая часть молекулы gp 120 также содержит потенциальные CD4-
связывающие сайты. Так, два делятационных мутанта белка gp!20 в позиции
62-70 и 116-124 не обладали способностью связываться с CD4. Ряд авторов
утверждает, что третья петля белка gp 120 также может вовлекаться в связывай ие
CD4 молекулы. В значительном количестве работ было показано, что продукция
Цитокинов является результатом взаимодействия ВИЧ и CD4. Однако
топография сайтов CD4 связывающего региона, которые индуцируют цитокины,
До сих пор оставалась невыясненной.
Мы предприняли попытку расширить перечисленные выше исследования
и попытаться показать, какие структуры ВИЧ вовлечены в контакт с CD4. С
этой целью участки gp 120, использованные в нашей работе, были представлены
103
синтетическими пептидами, гомологичными N- и С-концевым регионам и CD4-
связывающему сайту. СО4-связывающая активность синтетических пептидов
была проанализирована на двух типах CD4 клеток: клона 3G6
трансформированной линии Т-лимфоцитов Jurkat и мононуклеарах
периферической крови человека. В проведенном анализе для сравнения (в
качестве положительного контроля) использовался рекомбинантный белок gp
120. Были получены данные о том, что различные регионы gpl20 могут
участвовать в связывании CD4 молекул, расположенных на лимфоцитах, а
возможно и других мононуклеарных клетках крови. Показано, что пептиды
последовательности 426-452,436-451,369-384 и 255-272 связываются с CD4(+)
лимфоцитами трансформированной линии Jurkat и мононуклеарами
периферической крови. Вероятно, CD4 связывающий регион является гораздо
более сложным, чем это было описано в ранних работах [93], и организован с
участием различных доменов, которые при кооперации образуют
конформационную структуру на поверхности вируса, которая способствует
прикреплению вируса к CD4(+) клеткам крови человека. Эту гипотезу
подтверждают данные других исследователей о том, что получаемые
структурные нарушения с помощью мутаций CD4 связывающего региона gp 120
приводят к отсутствию контакта между gpl20 и CD4. Этот факт подтверждается
нашими данными об исчезновении способности пептида426-452 связываться
с CD4 в случае отсутствия двух аминокислот в положении 441 и 442. По
гипотетическому представлению о CD4 связывающем ре-гионе, суммирующем
данные литературы и собственные результаты, контакт CD4 молекулы с белком
gp 120 происходит в трех регионах: 30-116,250-270,369-459, - причем за счет
использования конформационной структуры петель gp 120 белок вируса и
молекула CD4 действуют по принципу "ключ-замок". Было также интересно
выявить, всегдали связывание пептидов из структуры белка gp 120 приводит к
индукции цитокинов, и в случае разобщенности этих функций определить ту
часть CD4 связывающего региона белка gp 120, которая способна в клетках -
мишенях индуцировать синтез ФНО-а. Это исследование было предпринято в
связи с тем, что фактор некроза опухоли играет решающую роль в экспрессии
вирусного генома при ВИЧ-инфекции. Экспрессия гена ФНО-а на уровне
транскрипции осуществляется через семейство ядерных NF-кВ/ге! факторов.
Те же факторы контролируют экспрессию ВИЧ LTR. Показано, что ВИЧ-1,2
напрямую индуцируют продукцию ФНО-а, а обработка ФНО-а
инфицированных клеток усиливает процесс репликации вируса в 10 и более
раз. Нами было показано, что дети, больные ВИЧ-инфекцией, имеющие
одинаковые сроки от момента инфицирования до момента обследования, со
значимо более высокой спонтанной продукцией ФНО-а оказались в более
продвинутых стадиях заболевания по сравнению с детьми аналогичного
возраста с достоверно более низкой спонтанной продукцией ФНО-а
104
мононуклеарами периферической крови. Представлялось чрезвычайно важным
провести анализ ФНО-индуцирующей активности у пептидов, входящих именно
bCD4 связывающий регион gp!20,TaK как продукция ФИО клеткой-мишенью
обусловлена взаимодействием CD4 с вирусом. Было показано, что пептид 426-
452, связываясь с CD4, индуцирует синтез ФНО-а и белка р24 мононуклеарным и
клетками крови пациентов с ВИЧ инфекцией. Делеции двух аминокислот в
положении 441-442 приводят к утрате пептидом способности активировать
син-тез ФНО-а и белка р24. Полученные результаты соответствует данным,
которые свидетельствуют, что связывание gpl20 с CD4 приводит к индукции
синтеза ФНО-а, что, в свою очередь, способствует репликации вируса,
находящегося в '‘дремлющем” состоянии в клетке. Результаты работы указывают
также на то, что не только “классический” CD4 связывающий регион gp 120
вовлекается в контакте CD4+ мононуклеарами и индуцирует синтез ФНО-а, но
и другие смежные регионы, представлен-ные в нашей работе пептидами 255-
272 и 369-384 из 2 константного и 2 вариабельного регионов. В то же время
обнаружен пептид 436-451, способный связываться с CD4 клетками, но не
индуцировать ФНО-а. Индукция под воздействием пептида 426-452 в момент
его связывания с молекулой CD4 не только ФНО-а, но и ИЛ-lb, ИЛ-6, ИЛ-2 еще
раз подчерки-ваетзначение взаимодействия между вирусом и клеткой-мишенью
как для дальнейшего размножения вируса, так и инициации того каскада
изменений в иммунной системе, который в результате приводит к
иммунодефициту при ВИЧ-инфекции.
В последние годы (1995-1999) был раскрыт еще один механизм
проникновения ВИЧ в клетку-хозяина. Оказалось, что рецепторы для хемокинов
являются ко-рецепторами для вируса. Хемокины - это низкомолекулярные
молекулы, которые продуцируются, в основном, клетками воспаления
(лимфоциты, макрофаги, гранулоциты и эозинофилы) в ответ на стимуляцию
антигенами, митогенами и другими активаторами. Они обеспечивают
направленное движение клеток, имеющих хемокиновые рецепторы. Этот
феномен назван хематтрактацией. Движение обеспечивается взаимодействием
хемокина с его рецептором на клетке-мишени. При этом направленность
движения клетки происходит за счет увеличивающегося градиента
концентрации того или иного хемокина. Ниже приводятся данные о хемокиновых
рецепторах, их лигандах и типах клеток, в которых они преимущественно
синтезируются.
105
Таблица 25
Хемокиновые рецепторы, их лиганды и клетки несущие рецепторы
(по Machey C.R. с изменениями)
Название рецептора Хемокины-лиганды Клетки, экспрессирущие рецепторы
CCR 1 MIP-la, RANTES, МСР-2.3 Моноциты, Т-лимфоциты
CCR 2 а,Ь МСР-1,2,3,4 Моноциты, Т- лимф.,базофилы
CCR 3 Eotaxin, RANTES,МСР- 2,3,4 Базофилы, эозинофилы
CCR4 RANTES, MIP-la Базофилы, Т-лимфоциты
CCR 5 RANTES, MIP-la и p Моноциты, Т-хелперы 1 типа
CXCR 1 IL-8 Нейтрофилы, ЕК
CXCR2 IL-8, GRO-a, NAP-2, ENA- 78 Нейтрофилы, ЕК
CXCR3 IP-10,Mig Активированные Т-лимфоциты
CXCR4 SDF-1 Множество типов клеток
MIP - макрофагальный белок воспаления
МСР- макрофагальный хематтрактантный белок
Eotaxin - хематтрактант для эозинофилов
GRO - белок активирующий нейтрофилы, фактор роста меланомы
NAP - белок аттрактирующий нейтрофилы
ENA - эпителиальный белок, активирующий нейтрофилы
JP-10-белок, индуцирующий продукцию интерферона-у (ИФН-у)
Mig - индуктор ИФН-у
SDF - стромальный аттрактирующий фактор
Открытию роли хемокиновых рецепторов в качестве корецепторов ВИЧ
предшествовали данные о том, что супернатанты культивируемых CD8 клеток
обладали ингибирующим действием на инфицирование ВИЧ клеток-мишеней.
Поэтому большинство работ было ориентировано на поиски медиаторов,
которые по предположению должны синтезироваться CD8 лимфоцитами. В
момент написания обзора были открыты ИЛ-16, RANTES, М1Р-1а и MIP-1Ь,
но, судя по интенсивности публикаций на эту тему, следует предполагать
открытие новых рецепторов.
Было показано, что хемокиновый рецептор CXCR4 обеспечивает
проникновение ВИЧ, тропных к Т-клеткам, CCR2 макрофагам, a CCR3 - к
эозинофилам. CCR5 является характерным признаком Т-хелперов 1 типа.
Природные лиганды М1Р-1а и b и RANTES блокируют макрофаг-тропную ВИЧ
инфекцию, но не инфекцию, вызванную вирусами, тропными к Т-клеткам.
Антитела против М1Р-1а и RANTES способствуют инфицированию клеток ВИЧ.
Показано, что эотаксин прерывает связь вируса с рецептором CCR-3, что
указывает на большую роль этого рецептора в патогенезе ВИЧ инфекции.
106
Однако, эозинофилы, экспрессирующие на поверхности мембраны молекулу
CD4, могут быть инфицированы ВИЧ. Лиганд МСР-3 для CCR3 является
хематтрактантом для дендритических клеток, которые, будучи
инфицированными, играют большую роль в переносе ВИЧ через барьер
слизистых оболочек.
Структура, связывающая CCR5, локализуется в регионе, примыкающем
к V3 петле. Так при добавлении in vitro растворимого белка CD4 связывание
CCR5 с gp 120 увеличивается в 100-1000 раз. Это также свидетельствует о том,
что сайт связывания gp 120 формируется после связывания с CD4.
Отмечено, что прогрессия ВИЧ-инфекции связана с переменой
используемого корецептора с CCR5 на CXCR4, приводящей к утрате
блокирования вируса перечисленными выше хемокинами. Это также
ассоциируется с ускоренным снижением числа Т-лимфоцитов и плохим
прогнозом заболевания. Причиной этого изменения является мутация в регионе
V3 env гена. Помимо этого имеются также нарушения чувствительности вируса
к рецептору CCR5, причиной которых являются мутации в V2 регионе.
Роль CCR5 в инфицировании ВИЧ демонстрируется на пациентах-
гомозиготах с наличием делении в 32 положении молекулы CCR5, что
ассоциируется с уменьшением, но не абсолютным, риска переноса вируса,
снижением вирусной нагрузки и замедленной прогрессией заболевания.
Аллель рецептора CCR2-641 ассоциируется со снижением темпа прогрессии
заболевания у африканцев, но не у кавказоидов. Интересно, что генотип SDF-
1 3 А/3 А, являющийся лигандом CXCR4, связан с ускоренным развитием ВИЧ-
инфекции. С другой стороны, у мышей с отсутствием CCR5 рецептора
наблюдалась нарушенная функция макрофагов и усиленная активация Т-
клеточного иммунитета. Судя по этим данным блокирование хемокиновых
рецепторов, помимо прерывания вхождения вируса в клетку, может также
активировать противовирусный иммунитет, о чем свидетельствует активация
Т-лимфоцитов. Однако, нокаут-мыши с отсутствием CCR2 рецептора имеют
дефекты в неспецифической резистентности, что, по-видимому, связано с
нарушением рециркуляции макрофагов.
Роль хемокиновых рецепторов в ВИЧ инфицировании подчеркивается
рядом работ, в которых использовались модифицированные хемокины для
предотвращения связи вируса с клеткой мишенью. Так, рекомбинантные аналоги
RANTES обладают большим противовирусным действием. Аминооксипентан-
RANTES обладает высокой ингибирующей активностью в отношении
инфекционности ВИЧ, имеющих тропность к макрофагам, так как он блокирует
рециклирование CCR5. Введение мышам, зараженным ВИЧ,
модифицированных форм RANTES приводило к резкому угнетению инфекции,
но использование низких доз препарата и других субтипов вируса вызывало
парадоксальное усиление инфекции. Были также синтезированы молекулы,
107
связывающие хемокиновые рецепторы. В частности, одной из таких молекул
является ТМ-а-ацетил-нона-Э—аргинин амид, который in vitro блокировал
вхождение ВИЧ через CXCR4 рецептор. Сходные по эффекту данные были
получены при связывании того же рецептора CXCR4 с использованием
синтетического 18-членного пептида.
Представленный материал свидетельствует, что проникновение вируса в
клетки организма человека происходит путем связывания оболочечного белка
вирусаgp 120 с CD4 и хемокиновыми рецепторами. При этом оказывается, что
тропизм вируса к различным типам клеток обеспечивается разнообразием
хемокиновых рецепторов, которые экспрессированы на их поверхности.
Основными ко-рецепторами для ВИЧ являются CXCR4 и CCR5. В процессе
ВИЧ-инфекции часто происходит изменение тропизма вируса от CD4
позитивных клеток к макрофагам, что позволяет надеяться на успешное
использование модифицированных хемокинов для блокирования ко-рецепторов
для ВИЧ.
Нарушение функций Т-лимфоцитов
У Т-лимфоцитов при ВИЧ-инфекции снижена пролиферация, образование
антигенспецифических клонов, уменьшена реактивность в смешанной культуре
лимфоци тов. Все перечисленные дефекты объясняются тем, что Т-лимфоциты
утрачивают способность продуцировать Т-клеточный ростовой фактор - ИЛ-
2. ИЛ-2 влияет также на дифференцировку Т-клеток в различные
функциональные субпопуляции - CD4 и CD8 и на активность естественных
киллеров.
Дефицит ИЛ-2 нарастаете прогрессией заболевания. Снижение продукции
ИЛ-2 ассоциируется со снижением числа CD4 лимфоцитов, их хелперной
активности, способности реагировать на повторный антиген в смешанной
культуре лимфоцитов и пролиферации в ответ на ФГЛ.
Механизмы снижения числа CD4 лимфоцитов при ВИЧ-инфекции.
Одним из наиболее ярких признаков ВИЧ-инфекции является снижение числа
CD4 клеток в периферической крови, которое происходит не только при
наступлении симптомов заболевания, но и в лаг-периоде. Причины
исчезновения СО4-клеток из периферической крови различны, среди них можно
выделить следующие:
1) Одной из самых главных причин этого является непосредственная
гибель клеток под воздействием вируса.
2) В механизме цитотоксичности участвую! поверхностные белки вируса
суперантигены gp 120 и gpl 60, которые, связываясь с Ь-субъединицей
Т-клеточного антигенного рецептора, вызывают гибель С 04-клеток;
3) Синцитий образующий вирус формирует конгломераты вирусных
108
частиц и CD4 лимфоцитов, которые забивают сосудистые капилляры
и там погибают;
4) Цитотоксические лимфоциты (ЦТЛ), ЕК клетки (естественные киллеры)
и антитела участвуют в гибели СЭ4-лимфоцитов как прямым (ЦТЛ,
ЕК), так и опосредованным (антитело-зависимой цитотоксичности,
АЗЦТ) путем;
5) Апоптоз, который можетбыть инициирован у CD4 и CD8 лимфоцитов,
выделенных из крови пациентов с ВИЧ инфекцией, митогенами,
антителами к ТКР, суперантигенами и кальциевым ионофором, при
связывании CD4 с gp 120 с последующей обработкой клеток антителами
к CD3 и особенно сильно, если антитела к CD3 представлены IgE
изотипом. ВИЧ-индуцированный апоптоз использует
цитоплазматическую часть CD4 рецептора и может убыстряться путем
взаимодействия CD4 с р56кк. Блокирование апоптоза ингибиторами
белка и циклоспорином показывает, что этот процесс активный и
требует экспрессии гена и синтеза белка. Хорошо известно, что апоптоз
запускается взамодействием CD95 (Fas антиген) с лигандом и
последующей активацией целого ряда факторов, ответственных за
программированную гибель клеток. Однако в последнее время стало
известно, что при ВИЧ инфицировании апоптоз играет незначительную
роль в гибели CD4 клеток. Авторы, изучавшие этот вопрос, приходят
к выводу, 4TOCD4 лимфоциты подвергаются прямой гибели от вируса
путем некроза. Для доказательства этого они использовали модель с
репортерными генами, указывающими только инфицированные ВИЧ
клетки. Анализ инфицированных клеток показал, что частота
экспрессии CD95 на их мембране не превышает таковую на нормальных
клетках. У пациентов, несущих генетически дефектную Fas систему,
ВИЧ также убивает клетки. Это наблюдение подтверждается
экспериментальными данными, в которых показано, что в условиях
блокирования Fas-опосредованного апоптоза, ВИЧ также уменьшает
число CD4 клеток в культивируемых лимфоцитах линии Jurkat и СЕМ.
6) Аутоиммунный механизм. Известно, что структура gp 120 несет
аллоэпитопы, которые идентичны эпитопам молекул ГКГ И класса,
интерлейкина-2 рецептора, тимозина и ряда других. Именно
аллоэпитопы вирусной оболочки позволяют ВИЧ уйти от
иммунологического надзора и беспрепятственно проникать в клетки-
мишени.
7) Сокращение репертуара Т-клеточного антигенного рецептора (ТКР).
Показано, что в прогрессивной стадии ВИЧ-инфекции наблюдается
утрата разнообразия структуры ТКР и, особенно, вариабельного
региона его b-цепи. С уменьшением числа CD4 клеток % ненормальных
109
вариабельных b-цепей увеличивается с 7% в контроле до 35% у ВИЧ-
инфицированных пациентов. Эти наблюдения указывают на мощный
отбор CD4 клеток, не распознающих антигенные детерминанты вируса.
Химиотерапия прерывает этот процесс, приводя ТКР к нормальному
фенотипу.
8) Цитотоксическое действие фактора некроза опухолей (ФИО) на ВИЧ-
инфицированные клетки. Хорошо известно, что ФИО вызывает
цитолитический эффект, действуя на злокачественно
трансформированные, но не на нормальные клетки, а также на клетки,
инфицированные внутриклеточными микробами и простейшими.
Считают, что ФИО является одним из медиаторов киллинга
цитотоксических клеток и естественных киллеров. Ряд исследователей
считают, что цитотоксическое действие ФИО реализуется посредством
апоптоза.
9) Нарушения в транспортировке CD4 лимфоцитов при ВИЧ инфекции
являются также причиной снижения Т-хелперов в крови пациентов.
Было показано, что CD4 клетки, экспрессирущие рецепторы для ВИЧ
- CD4 и CXCR4 направляются в костный мозг, что приводит к
значительной утрате клеток в периферической крови и тканях, где они
обычно находятся. Эта возможность была продемонстрирована на
трансгенных животных, у которых на поверхности мембраны каждого
Т лимфоцита были экспрессированы оба упомянутых выше рецептора.
Более того, было показано, что наивные CD4 клетки несут CXCR4
рецептор для хемокинов. Особенно важно, что Т-хелперы 1 типа,
контролирующие развитие вируса, несут на своей поверхности
преимущественно CXCR3 и в связи с этим их маршрут может быть
изменен и они также могут покинуть предназначенные для них места
в лимфоидных органах.
В последнее время рассматриваются также новые данные, которые ставят
под сомнение факт массовой гибели CD4 клеток. В первую очередь учитывается,
что размножение вируса происходит в основном в лимфоидной ткани и суточная
скорость его репликации составляет 10 миллиардов вирионов при времени
полужизни вируса равной 6 часам. Вирусная нагрузка коррелирует со снижением
CD4 Т-лимфоцитов и прогрессией заболевания. Однако механизм снижения
числа СЭ4-клеток остается не полностью понятным. Возможно, что большую
роль играет скорость обновления CD4 клеток. Действительно, для правильной
оценки утраты этих клеток следует знать, как это связано со скоростью
появления новых CD4 клеток. Ряд авторов провели исследования по изучению
времени обновления CD4 клеток и показали, что оно равно 2 дням для
инфицированных клеток и около 2 дней для нормальных CD4 клеток.
Получается, что погибающие от цитотоксического действия вируса клетки
110
восполняются новыми CD4 клетками, те. возникает равновесие между утратой
и появлением новых клеток. Наблюдаемое рядом авторов увеличение
количества CD4 клеток у большинства пациентов через 30 дней после начала
высокодозной эффективной химиотерапии, по-видимому, можно объяснить
защитой клеток от инфицирования вирусом и последующей гибели. Постоянное
ускоренное обновление CD4 клеток, по мнению ряда авторов, приводит к
истощению резерва обновляющихся клеток.
Однако другая группа исследователей при изучении скорости обновления
CD4 лимфоцитов по длине теломера не обнаружила его уменьшения, что
отражает отсутствие ускоренного обновления клеток при ВИЧ инфекции. Более
того, примененный более корректный способ оценки скорости обновления CD4
клеток показал, что она снижена у пациентов с ВИЧ инфекцией. В качестве
возможных причин снижения обновления могут рассматриваться известные
данные об истощении тимуса, уменьшении числа стволовых клеток,
инфицирование Т-клеток синцитий-образующим вирусом, который быстрее
вызывает гибель тимоцитов. Эти данные противоречат предположению, что
химиотерапия защищает обновленные клетки от инфицирования ВИЧ. Поэтому
более логичное объяснение увеличения числа CD4 клеток после терапии связано
с перераспределением клеток между тканями и кровью, либо с увеличением
количества Т-клеток памяти, либо с сохранением наиболее медленно
обновляющихся CD4 лимфоцитов. Заключительный вывод остается прежним
истощение CD4 клеток связано с уменьшением скорости обновления, а
увеличение их числа после химиотерапии является кратковременным и не
отражает реконституцию лимфоидной ткани.
Нарушения функций В-лимфоцитов.
ВИЧ-инфекция при длительном хроническом ее течении вызывает
нарушения не только в клеточном иммунитете, но и гуморальном. Известно,
что ВИЧ влияет на функциональную активность В-лимфоцитов, увеличивая
синтез иммуноглобулинов и особенно продукцию IgG. Подавляющее количество
антител, несмотря на присутствие вируса, являются неспецифическими и
производятся в количестве большем, чем нормальными В-клетками. Эта
гиперпродукция иммуноглобулинов нарастает в ходе инфекции, специфические
антитела к вирусным белкам составляют о коло 5% от всех иммуноглобулинов.
Характерно, что наибольшее количество антител образуется на вирусные белки
Env и Gag, среди которых наиболее антигенными являются gpl20 и gp41
вирусной оболочки, атакже нуклеокапсидные белки р24 и pl 7. Однако динамика
Env- и Gag-антител различна. Уровень Env-анител максимален в период
прогрессии заболевания и остается высоким вплоть до смерти пациента, тогда
как Gag-антитела исчезают в этот период. Естественно, что прогностически
важными являются Env-антитела. Причина отсутствия протективной
антивирусной функции Gag-антител и падение их уровня в разгар заболевания
Ill
остается неясной. Ряд авторов считают, что этот феномен связан соснижением
хелперной функции лимфоцитов в связи с резким снижением числа CD4 клеток.
Если эта точка зрения правильна, то тогда остается неясным, почему
поддерживается высокий уровень антител к оболочечным белкам вируса.
Возможное объяснение этого противоречия связано с различными механизмами
представления антигенов, так как Env белки являются гликопротеинами, a Gag
- негликозилированными белками.
Было также показано, что в процессе острого развития инфекции число
клеток, секретирующих антитела, резко увеличивается, в то время как
гипергаммаглобулинемия отсутствует. Обратная картина наблюдается при
хроническом развитии инфекции, когда на фоне незначительного числа
антителопродуцирующих клеток наблюдается гипергаммаглобулинемия.
Приведенные данные показывают, что при ВИЧ-инфекции наблюдаются
инверсные взаимоотношения между уровнем антител в сыворотке крови и
числом циркулирующих В-клеток, продуцирующих иммуноглобулины. Одной
из причин этого несоответствия, возможно, является то, что циркулирующие
антителопродуцирующие клетки вносят незначительный вклад в уровень
иммуноглобулинов. Второй причиной может быть то, что при ВИЧ-инфекции
нарушается клиренс иммуноглобулинов мононуклеарными фагоцитами.
Вопрос, почему в крови наблюдается меньшее количество В клеток при
увеличенной продукции антител, имеет несколькоответов:(1) клетки погибают;
(2) клетки перераспределены среди тканей организма; (3) одна В-клетка
продуцирует большее количество антител; (4) клетки утрачивают способность
к обновлению.
Такая же закономерность может наблюдаться при анализе количества ВИЧ-
специфических В-лимфоцитов и уровнем анти-gp 120-антител. Очевидно, что
число антиген-зависимых клеток связано с вирусной нагрузкой клеток-мишеней.
Отсутствие виремии приводит к резкому падению числа ВИЧ-специфических
В-клеток. Увеличение анти-gp 120 антител, возможно, является результатом
активации вирусом макрофагов, которые в ответ продуцируют множество
гуморальных факторов и в том числе ИЛ-6, активирующий продукцию антител.
Увеличенное количество продуцируемых цитокинов может быть связано с
активацией клеток-продуцентов суперантигенами, которые имеются в структуре
вируса. Возможно, что суперантигены, связываясь с Vb-цепью Т-клеточного
или с VH3 региона В-клеточного антигенных рецепторов способствует мощном}
выбросу цитокинов, среди которых ИЛ-1, ИЛ4, ИЛ-6, ФИО, ТФР и ИЛ-10
могут стимулировать продукцию антител, с одной стороны, а с другой
способствовать гибели ВИЧ-специфических В-лимфоцитов.
Однако многие авторы отстаивают позицию, что сам вирус можеч
активировать В-лимфоциты к продукции антител. Одним из таких вирусных
белков является gp41 и особенно его С-концевая часть.
112
О существовании инверсных взаимоотношений между продукцией анти-
gpl20-антител и циркулирующих клеток свидетельствуют данные о резком
снижении числа специфических В-клеток после химиотерапии и неизмененной
концентрации антител. Предполагается, что роль антителопродуцирующих
клеток в этом случае выполняют В-лимфоциты костного мозга, которые
оказываются менее чувствительными к действию химиотерапевтических
препаратов.
Таким образом, в период острой и хронической ВИЧ-инфекции имеются
нарушения в функциональной активности В-лимфоцитов, характеризующиеся
следующими параметрами:
(1) гипергаммаглобулинемия, вызываемая, в основном, гиперпродукцией IgG;
(2) нарастание гипергаммаглобулинемии не приводит к увеличению титра ВИЧ-
специфических антител; (3) антитела, выработанные на Env gpl20 и gp41,
отражают ход ВИЧ-инфекции, достигая максимума в период прогрессии
заболевания; (4) aHTH-Gag-антитела не отражают стадии прогрессии заболевания
и ассоциируются скорее всего с репликацией вируса, падением числа CD4 клеток
и продукцией ФИО; (5) в развитии ВИЧ-инфекции наблюдается неспецифическая
поликлональная активация В-лимфоцитов, вызываемая прямыми (ВИЧ) и
опосредованными (другие микроорганизмы, цитокины, утрата Т-хелперного
контроля) путями; (6) химиотерапия способствует нормализации
взаимоотношений между антитело-продуцирующими клетками и титром
антител.
Нарушение функции .макрофагов
Еще несколько лет тому назад было принято, что макрофаги при ВИЧ-
инфекции значительно изменяют свою физиологическую активность, причем
не вследствие инфицированное™, а из-за факторов, возникших в результате
инфекции других клеток. Отмечалось, что у макрофагов снижается хемотаксис,
продукция активных форм кислорода, нарушается функция Fc и СЗ рецепторов,
отвечающих за клиренс имунных комплексов, антибактериальная токсичность.
Однако в последние годы были открыты субтипы ВИЧ, которые проявляют
тропизм к макрофагам и характеризуются низкой скоростью репликации и
неспособность формировать синцитий. Можно сделать предположение, что
отмеченные выше нарушенные функции макрофагов были связаны с их
инфицированием. Правомочность такого предположения исходит из данных
первых опытов, которые были проведены на клетках крови инфицированных
пациентов. В этих опытах были сделаны первые попытки выяснить клеточный
тропизм вируса и, в частности, к макрофагам. Был сделан вывод, что макрофаги
пациента не инфицируются вирусом и выполняют свою акцессорную функцию
в полном объеме. Позже было показано, что вирус в течение его медленной
Репликации (low slow) может изменять тропность от макрофагов к Т-
лимфоцитам, также как и тропность от одного хемокинового рецептора к
*• Заказ № К-4451.
ИЗ
другому, В настоящее время стало известно, что вирус может индуцировать
продукцию множества различных факторов (см. далее втексте), которые могут
инактивировать функции лимфоцитов и макрофагов и тем самым
способствовать беспрепятственной репликации в клетках организма. К
мононуклеарным фагоцитам относятся и клетки Лангерганса, являющиеся,
также как и макрофаги, клетками-мишенями для ВИЧ. Низкий уровень
репликации ВИЧ может быть усилен взаимодействием клеток Лангерганса с Т-
хелперами памяти и при переключении тропизма вируса с клеток Лангерганса
на Т-клетки. Pantaleo G. с соавторами, 1993, приводят данные о временном
распределении вирус-инфицированных клеток в лимфатических узлах, отмечая
при этом появление ВИЧ в фолликулярных дендритных клетках Лангерганса
через 2-3 года, т.е. после инфицирования лимфоцитов. Предполагается, что
вирус проникает в клетки Лангерганса с помощью хемокиновых рецепторов.
Иммунный ответ на ВИЧ
Цитотоксические лимфоциты играют большую роль в противовирусном
Т-клеточном иммунном ответе. Они несут на поверхности мембраны
гликопротеин CD8 и распознают пептидные антигены, в том числе и вирусные,
представляемые молекулами ГКГ 1 класса. Специфичность ЦТЛ при ВИЧ-
инфекции многообразна. Можно наблюдать ЦТЛ, направленные против белков,
кодируемых Gag, Env и Pol генами вируса. Первый идентифицированный
пептидный эпитоп Gag был декамером KRWIILGLNK. В настоящее время
таких эпитопов открыто большое количество и информация о них
накапливается в банке, который доступен для каждого исследователя.
Практически сразу после инфицирования пациента ВИЧ инициируется
мощный клеточный ответ, противовирусная активность которого определяют
ЦТЛ. Известно, что лица, подвергнутые инфицированию малыми дозами вируса
при переливании крови, наркоманы, использующие инфицированные шприцы,
медицинские работники, допустившие профессиональные ошибки при работе
с ВИЧ-инфицированными и другие группы лиц повышенного риска имеют в
периферической крови ВИЧ-специфические ЦТЛ. ЦТЛ вызываютлизис ВИЧ-
инфицированных клеток при соотношении ЦТЛ/мишень 50:1 в течение 6 ч - 4
сут. Вариабельность временных параметров уничтожения клеток-мишеней
связана, по-видимому, с методическими подходами (скорость изоляции ЦТЛ
из крови пациентов, сохранность активности ЦТЛ, способ оценки эффекта).
Возможно также, что эта вариабельность объясняется различной аффинностью
ТКР к вирусу, при этом ЦТЛ с высоким сродством к представленным антигенам
вируса поражает инфицированные клетки в более короткое время, чем другие
менее аффинные ЦТЛ. При этом оказывается, что среднее время полужизни ех
vivo инфицированных клеток у пациента с сильным ЦТЛ ответом равно 12 ч,
a in vivo 2 сут. Это свидетельствует, по видимому, о том, что скорость
обновления высоко аффинных ЦТЛ достаточно высока.
1 14
Было показано, что у асимптоматических пациентов с ВИЧ-инфекцией
наблюдаются эффекторные ЦТЛ, количество которых достигает 1% от
мононуклеарных клеток периферической крови, тогда как ЦТЛ памяти
встречаются гораздо чаще. Считается, что нарушение взаимоотношения между
эффекторами и клетками памяти связано с быстрой элиминацией эффекторных
ЦТЛ при отборе клеток с различным аффинитетом к ВИЧ-пептиду. В качестве
примера можно рассмотреть пациента с мощным ЦТЛ ответом на пептид р24
Gag, представляемый в ассоциации с молекулами ГКГ 1 класса,
рестриктированными по В-27. Этот ЦТЛ ответ оказался моноспецифическим,
так как большинство ЦТЛ было направлено на описанный выше декапептид.
После 12 лет асимптоматического течения ВИЧ-инфекции ЦТЛ ответ, количество
CD4 клеток и вирусная нагрузка были стабильны, за исключением структуры
иммунодоминантного пептида, в котором произошла замена метионина на
лейцин в позиции 2. Анализ показал, что у 100% вирионов изменились в
результате точечной мутации последовательности аминокислот в этом пептиде.
Связь мутантного пептида с ГКГ-В27 продолжала оставаться, но степень
связывания снизилась в 50 - 100 раз. Продолжительность ЦТЛ киллинга
мутантных вирус-несущих клеток возросла до 20 часов, по сравнению с нормой
-2 часа. Появление мутантного эпитопа было ассоциировано с падением числа
CD4 клеток в течение 3 лет с 360 до 10 кл/мкл, 30-ти кратным увеличением
вирусной нагрузки. Авторы считают, что эти данные могут свидетельствовать
о том, что чрезвычайно узкая специфичность ЦТЛ является результатом Т-
клеточного дефицита, а поэтому одна мутация в иммунодоминантном пептиде
может нарушить клеточный иммунный ответ и его противовирусную
активность. Другая группа исследователей подтвердили эти данные, с тем лишь
различием, что иммунодоминантный пептид был другим по структуре и
представлял собой участок молекулы gp 160.
Анализ корреляции ВИЧ-специфических ЦТЛ с прогрессией ВИЧ-инфекции
показал, что прямой связи между этими показателями либо не существует,
либо она чрезвычайно сложна для понимания. В поздней стадии заболевания
наблюдается снижение активности ЦТЛ, но механизмы этого феномена
остаются не до конца понятными. Рассматриваются следующие причины
снижения активности ЦТЛ: (1) утрата CD4 хелперной активности в связи с
резким падением их количества; (2) переключение CD4 хеперов 1 типа на 2 тип
и соответствующей утратой ИЛ-2 и ИФН-g как факторов, поддерживающих
Дифференцировку и активность ЦТЛ; (3) ВИЧ-инфицирование CD8 с
использованием хемокиновых рецепторов; (4) снижение активности ЦТЛ,
которое может индуцироваться различными субпопуляциями Т-клеток; (5) ВИЧ-
индуцированный апоптоз; (6) отсутствие CD8 клеток, несущих рецепторы к
ИЛ-7; (7) мутации в иммунодоминантных пептидах (см.выше) с последующим
нарушением представления антигена.
8*
115
Роль цитокинов в патогенезе ВИЧ-инфекции
Стремление вскрыть патогенетические механизмы иммунных нарушений
при ВИЧ-инфекции инициировало исследования роли цитокинов в их
возникновении и реализации
Взаимодействие ВИЧ и цитокинов на уровне клетки.
Как известно, вирусы для своего выживания включают все варианты
эксплуатации защитных механизмов хозяина. Это может быть
продемонстрировано и на примере взаимодействия между вирусами и
цитокиновой сетью хозяина. Многие вирусы, включая ВИЧ-1 и -2, используют
активацию синтеза и эффекты действия цитокинов хозяина для регуляции своей
экспрессии и поддержания вируса в латентном состоянии в клетке до
возникновения соответствующих условий микроокружения. Паразитизм вируса
характеризуется использованием внутриклеточных механизмов для его
репликации. В ряде случаев паразитизм вируса может превышать
возможности клетки и в результате приводить ее к лизису. Многие факторы
могут кардинально влиять на репликационные возможности клетки хозяина и
способность вируса инфицировать и реплицироваться в ней. К области
преимущественной важности относятся механизмы, регулирующие
внутриклеточную репликацию и экспрессию ВИЧ. Как известно, ВИЧ-1
инфицирует преимущественно клетки, экспрессирующие на своей поверхности
CD4 молекулу, являющуюся рецептором для этого вируса. Для того чтобы
осуществилась обратная транскрипция и интеграция вируса-этапы, значимые
для продуктивной инфекции, клетки-мишени должны не только
экспрессировать на своей поверхности CD4 молекулу, но и находиться в
активированном состоянии. После интегрирования с клеткой хозяина ВИЧ-
1 остается в латентном состоянии до тех пор, пока не возникнет нужная для
индукции вирусной репликации повторная активация клетки.
Усиление ВИЧ - пермиссивности путем воздействия цитокинов на ВИЧ
- экспрессию.
Понятие вирусной пермиссивности может быть определено как сумма
неких физиологических изменений в клетке, которые позволяют усилить
инфекционность или увеличить продукцию вирусных антигенов за счет клеток
хозяина, ранее не инфицированных или не экспрессировавших вирусные
антигены. Эти изменения в пермиссивности вируса возможны по крайне мере
на 4 уровнях. 1-й уровень отражает изменения в поверхностной экспрессии
самого вирусного рецептора или его акцессорной молекулы. Второй уровень
определяется клеткой хозяина, когда изменения в пермиссивности являются
результатом изменений на сигнальных путях, ведущих к вирусной репликации.
Третий уровень также находится в пределах клетки хозяина и пермиссивность
может быть связана с любыми изменениями стабильности или экспрессии
ДНК-связывающих белков, необходимых для эффективной вирусной
116
репликации. Четвертый уровень изменений пермиссивности является
результатом внутриклеточных сигналов, которые изменяют транскрипцию
вирусной РНК, стабильность или трансляцию, вызывая изменения в продукции
потомства вирионов.
Изменения мембранной экспрессии белков в клетке хозяина могут
потенциально влиять на каждый уровень вирусной пермиссивности. Наиболее
очевидно изменения наблюдаются при увеличении поверхностной экспрессии
вирусного рецептора - CD4 молекулы. Тем не менее, увеличение других
поверхностных белков на клетке хозяина можеттакже положительно влиять
на вирусную экспрессию непрямым изменением сигнальных путей, активацией
ядерных белков, повышением обшей клеточной активации или усилением
РНК-трансляции.
Общая концепция цитокин-индуцированных изменений вирусной
пермиссивности состоит в том, что цитокины могут влиять на некоторые или
на все 4 уровня, в зависимости от цитокина, вовлекаемого вируса и типа клетки
хозяина. Изменение ВИЧ-экспрессии под воздействием цитокинов
укладывается в концепцию цитокин-индуцированных изменений
пермиссивности вируса.
Влияние цитокинов на ВИЧ экспрессию изучалось на первичных культурах
клеток, полученных от больных ВИЧ-инфекцией и хронически
инфицированных клеточных линиях. Методами оценки результатов изучения
было определение экспрессии вируса методом полимеразной цепной реакции
(ПЦР) и внутриклеточного белка вируса р24. Клетки, интегрирующие ВИЧ и
содержащие “дремлющие" провирусы, похожи на существующий in vivo
резерв клеток, которые не экспрессируют ВИЧ вплоть до того момента, пока
не возникнут нужные комбинации внешних стимулов. Группа цитокинов,
которая ответственна за стимуляцию экспрессии генома и синтеза белков ВИЧ
и перевод латентной или хронической инфекции в активную вирусную
экспрессию не так мала. Цитокины, которые вовлечены в гомеостатическую
регуляцию иммунного ответа человека, такие как ИЛ-1, ИЛ-2, ИЛ-6, ФНО-а,
усиливают экспрессию вируса иммунодефицита человека. ИЛ-2 активирует
покоящиеся Т-хелперы, способствует повышению первого уровня ВИЧ-
пермиссивности. ФНО-а оказывает наиболее “драматическое” воздействие на
ВИЧ экспрессию в хронически инфицированных клетках в постинтегративной
фазе жизненного цикла вируса. Обработка хронически инфицированных клеток
различных по происхождению линий с помощью ФНО-а повышает2-й и 3-й
уровни пермиссивности вируса. Так, сигнал трансдукции с ФНО-а рецептора
(ФНО Рц) включает активацию комплекса протеинкиназ (независимый от
протеинкиназы С), которые определяют второй уровень пермиссивности.
Последние данные литературы говорят о том, что сигнал ФНО Рц заставляет
внутриклеточную сфингомиелиназу производить церамид - вторую
117
эффекторную молекулу. Церамид, действуя на третьем уровне пермиссивности,
освобождает ядерный фактор kB(NF-kB) от его цитоплазматического
ингибитора, что позволяет NF переместиться в ядро. Активный NF-kB в
пределах ядра связывается с энхансорным регионом в пределах ВИЧ-1 5'
длинного терминального повтора (LTR) и индуцирует вирусную
транскрипцию. Mellors W. с соавторами с целью доказательства первостепенной
роли ФНО-а в патогенезе ВИЧ инфекции in vitro обрабатывали макрофаги
периферической крови 0,05-50 нг\мл рекомбинантного ФНО-а перед
инфицированием или во время ВИЧ-инфекции и достигали увеличения
продукции вируса в 5 и более раз. Matsuyama Т. et al. провели аналогичные
эксперименты на Т-клеточных линиях (MOLT-4, CCRF-CEM, Jurkat, Н9),
инфицированных ВИЧ. Обработка рекомбинантным ФНО-а этих клеток уже
через час вызывала достоверное увеличение ВИЧ-специфической РНК, достигая
максимального уровня к 6 часам экспозиции. Число вирусных частиц также
возрастало к этому времени, d’ Addario показал, что обработка ФНО-а вызывает
не только повышение репликации вируса в ВИЧ-инфицированных клетках,
но и активирует гены ИЛ-ip (в20-40 раз увеличивая ИЛ-ip мРНК), и ФНО-а (в
14 раз увеличивая ФНО-а мРНК). В своих экспериментах авторы показали,
что ВИЧ-инфекция активирует оба - транскрипционный и трансляционный
механизмы, контролирующие экспрессию цитокинов. Vlach J. et al.
проанализировали в своей работе лимитирующие факторы, вовлеченные в
индукцию провирусной экспрессии ВИЧ, вызываемой ФНО-а. Они показали,
что существует выраженная прямая корреляция между повышением 9.2-кДа
ВИЧ-1-РНК, р24 в клетках и выбросом ВИЧ-вирионов в среду. С другой
стороны, нет прямой корреляции между уровнем индуцированных NF-kB
белков и экспрессией ВИЧ-1 провирусов. Присутствие ядерных NF-kB
специфических белков кажется значимым только для инициации вирусной
репликации, так как ВИЧ-транскрипты могли быть выявлены в ФНО-
стимулированных клетках в более поздние сроки после индукции, в то
время, когда NF-kB белки возможно было выявить в ядре. Kobayashi N. et al.
в своей работе показали, что те клеточные гемопоэтические перевиваемые
линии, которые продуцировали хотя бы небольшие количества ФНО-а, были
крайне чувствительны к инфицированию ВИЧ-1. Эта чувствительность к
инфицированию отменялась при добавлении в культуру антител к ФНО-а.
Данные авторов еще раз подчеркивают значение ФНО-а для репликации вируса.
Poli G. et al. в своей работе показывают, что ИЛ-1а и ИЛ-1 р индуцируют
экспрессию ВИЧ в латентно инфицированной промиелоцитарной линии
человека U1. ИЛ-1 в этом действии синергичен с ИЛ-6, но не ФНО-а.
Экспрессия ВИЧ в этих экспериментах контролировалась накоплением мРНК
и активностью обработанной транскриптазы. В отличие от ФНО-а, ИЛ-1
самостоятельно или в комбинации с ИЛ-6 не индуцирует активацию
118
транскрипционного фактора NF-kB выше конститутивного уровня в
нестимулированных U1. Полученные авторами данные указывают на то, что
по крайней мере в этой клеточной системе ИЛ-1, ИЛ-6 и ФНО-аактивируют
ВИЧ экспрессию через разные молекулярные пути. ИЛ-1 индуцированная
вирусная продукция купируется моноклональными антителами, направленными
против И Л-1 рецептора 1 типа. ИЛ-6 увеличивает вирусную продукцию, усиливая
трансляцию РНК вируса. С другой стороны, ИФН-а снижает трансляцию
вирусного белка и уменьшает тем самым освобождение зрелых вирионов.
Индуцированная цитокинами ВИЧ-1 экспрессия влияет на другие аспекты
физиологии клетки хозяина за счет добавочных эффектов собственно белков
вируса. В хронически инфицированной клеточной системе (клон HL-60-
промиелоцитарной клеточной линии, известный как ОМ-10) клетки,
выращиваемые в нормальной культуральной среде, восстанавливали
поверхностную экспрессию CD4 молекулы. Прямым результатом вирусной
активации после обработки ФНО-а было быстрое снижение экспрессии
поверхностного CD4 рецептора. Эти данные по снижению экспрессии CD4
могут быть объяснены частично прямым внутриклеточным
комплексированием между ВИЧ-оболочечным предшественником и его
естественным лигандом - CD4 молекулой. Показано, что вирусный белок Nef
может напрямую участвовать в снижении экспрессии CD4 рецептора. Это
может быть важным адаптационным механизмом для выживания ВИЧ, так
как предупреждает суперинфекцию, которая должна обязательно привести к
клеточной гибели вследствие внутриклеточного накопления неинтегрированной
вирусной ДНК. Предупреждение этого цитолитического цикла позволяет
хронически инфицированным клеткам пережить острый взрыв вирусной
Продукции, возвратиться на некоторое время к состоянию “покоя”, до тех
пор пока не возникнет повторный каскад внеклеточных стимулов. Индукция
Цитокинами ВИЧ-экспрессии в хронически инфицированных клетках in vivo
может быть лучше всего продемонстрирована на примере микроокружения
лимфоузла, являющегося наиважнейшим резервуаром ВИЧ с максимальной
Долей хронически инфицированных клеток. Поступление любого антигена в
лимфоузел вызывает иммунный ответ, включающий синтез и продукцию
Цитокинов. Локальное поддержание значительных концентраций цитокинов в
лимфатическом узле будет активировать ВИЧ экспрессию в клетках, дающих
Убежище интегрированным, но “дремлющим” вирионам и способствовать
трансмиссии в другие клетки внутри лимфоузла. Повторяющиеся стимуляции
патогенами субклинических инфекций усиливают прогрессию ВИЧ болезни.
Комплекс иммунорегуляторных сетей цитокинов, поддерживающих иммунный
гомеостаз даже втечение стадий кажущейся иммунологической стабильности
при ВИЧ-инфекции способствуют поддержанию постоянного уровня вирусной
экспрессии втечение продолжающегося бессимптомного периода инфекции.
119
Эффект ВИЧ-зкспрессии на синтез и продукцию цитокинов и их
рецепторов.
Длительно существующими обратными связями определяется роль ВИЧ в
регуляции своей собственной экспрессии путем активации синтеза и повышения
продукции ряда цитокинов, включая ФНО-а. Уровни циркулирующих цитокинов
(особенно ФНО-а, ИЛ-1 b и ИЛ-6) повышены у пациентов с ВИЧ инфекцией.
Вирус иммунодефицита человека и структурные компоненты ВИЧ индуцируют
экспрессию цитокинов в различных типах клеток. Экспрессия цитокинов,
индуцированная ВИЧ, не является универсальной и контролируется типом
клетки. Было показано, что ВИЧ-1 вирионы, внесенные в культуру мононуклеаров
периферической крови здоровых людей, индуцируют продукцию ими ИЛ-1 и
ФНО уже через несколько часов после экспозиции, хотя это событие не знаменует
начало продуктивной инфекции. Блокирование этого феноменас использованием
растворимого CD4 подтверждает версию о проведении сигнала через CD4
молекулу. Использование анти-С04 антител мимикрирует эффект ВИЧ-1
вирионов в этой экспериментальной системе. Механизм влияния ВИЧ на ФНО-
а продукцию остается неясным, хотя известно, что этот цитокин может
действовать в аутокринной и паракринной манере, усиливая ВИЧ экспрессию
в хронически инфицированных клетках. Так как одним из ответов
промиелоцитов на обработку ФНО-а является продукция вновь
синтезированного ФНО-а в хронически инфицированной ОМ 10,1 клеточной
системе, то аутокринная и паракринная ВИЧ-активация в клеточной культуре
может быть результатом эндогенной ФНО-а стимуляции. Полученные in vitro
данные показывают механизм поддержания ВИЧ экспрессии в период
субоптимальной экзогенной ФНО-а стимуляции in vivo. В ФНО-а
цитокиновой сети выделены в настоящее время несколько добавочных звеньев
действия. Так как ФНО-а может быть экспрессирован в виде мембранного
мономера, то перед тем как происходит его "сбрасывание”- "шеддинг” - и
сборка в биоактивный тример, он можетслужить сигнальным белком, который
взаимодействует с ФНО Рц на ближайшей клетке. Это юкстакринное
взаимодействие может быть механизмом передачи сигналарецептор-несущим
и экспрессирующим связанный с мембраной ФНО клеткам, или обеим
одновременно. ФНО Рц, сбрасываемый с активированных клеток, передает
сигнал отдаленным иммуноцитам через связанный с мембраной ФНО-а. Эта
передача сигнала описывается авторами как ретрокринное взаимодействие.
На клетках линии ОМ 10,1 была изучена роль растворимых ФНО Рц в
регуляции ФНО-а индуцированной ВИЧ экспрессии. Было обнаружено, что
растворимые ФНО Рц не только снижают количество аутокринно
синтезированного ФНО-а, но и ВИЧ экспрессию в активированных клетках.
Таким образом, до определенного времени именно ретрокринная передача
сигнала через связанные с мембраной цитокины и растворимые рецепторы
120
несет иммунорегуляторную ограничительную роль в репликативном ответе
вируса на внеклеточные сигналы.
Кроме вирусных структурных белков геном ВИЧ кодирует ряд хорошо
охарактеризованных регуляторных белков, которые влияют на вирусную
репликацию и нормальную физиологию клетки. Так, Tat регуляторный белок
оказывает влияние на клеточный ответ, включая индукцию ФНО-а и ИЛ-6
экспрессию. Buanaguro L. et al. показывают, что повышение экспрессии гена
ФНО-а является результатом активации ФНО промотора регуляторным белком
Tat. ФНО-а, в свою очередь, усиливает синтез и продукцию провоспалительных
цитокиновИЛ-1 иИЛ-6, аониусиливаютэкспрессию генома ВИЧ. Вовлечение
регуляторного белка Tat в модуляцию ФНО Рц требует дальнейших
подтверждений. Nef регуляторный белок ВИЧ так же играет роль во
взаимоотношениях вирус-клетка. Nef, ассоциированный с мембраной, может
быть вовлечен в регуляцию поверхностной экспрессии клеточных мембранных
белков, включая CD4 рецептор, и индукцию NF - кВ. Способность изменять
клеточный сигнальный путь, ведущий к активации вируса, объясняет роль Nef
в патогенезе ВИЧ инфекции. Сложность взаимодействий между ФНО-а,
поверхностными и секреторными рецепторами ФНО-а и ВИЧ побудила ученых
исследовать взаимосвязь между ВИЧ экспрессией и клеточным рецептором к
ФНО-а. Существует два различных рецептора к ФНО - 55 кД ФНО Рц(ФР55)
и 75 кД ФНО Рц (ФР75). Максимальный ответ на обработку ФНО-а, включая
клеточную пролиферацию, лизис вирус-инфицированных клеток и индукцию
NF-kB, относится к сигналам, опосредованным через ФР55. Хотя ФР75 вовлечен
в ФНО-индуцированный цитолиз, его роль сводится главным образом к
повышению аффинности, созданию функциональной “воронки”, с помощью
которой улавливается и направляется кФР55 растворимые молекулы цитокина
при циркуляции ФНО-а в низких концентрациях. Активация ВИЧ, как было
показано, не влияет на уровень экспрессии рецептора ФР55. Уровень экспрессии
ФР75 на ОМ 10,1 клетках значимо возрастал через 24 часа после вирусной
активации. Это являлось прямым последствием ВИЧ экспрессии и наблюдалось
в других обработанных ФНО-а неинфицированных HL-60 субклонах.
Предварительное изучение, проведенное авторами, показало, что ВИЧ
экспрессия не приводит к увеличению мРНК, которая кодирует ФР75. Авторы
считают, что в этом случае действует какой-то посттранскрипционный
механизм. Как известно, оба ФНО Рц могут сбрасываться с поверхности
активированных клеток. Предполагается, что существует ВИЧ-специфический
механизм, который предупреждает “шеддинг” ФР75, что приводит к его
накоплению на поверхности клетки.
Известно, что на активированных Т-лимфоцитах изменяется экспрессия
одного из рецепторов ИЛ-2 - р 55. Это изменение экспрессии связано с
активацией синтеза соответствующего NF-фактора транскрипции. При ВИЧ-
121
инфекции эту роль может выполнятьидругойфактортранскрипции-продукт
вирусного гена, который стимулирует экспрессию вируса, связываясь с
энхансером ВИЧ. С другой стороны, именно активация клетки является
необходимым условием для репликации вируса. Описан также ген Rpt-1,
экспрессирующийся только в покоящихся Т-хелперах, который кодирует
внутриклеточный белок, подавляющий активацию гена рецептора ИЛ-2 - р5 5
и вируса иммунодефицита.
Изменения в иммунной системе, опосредованные нарушением продукции
цитокинов под воздействием ВИЧ.
У пациентов с ВИЧ-инфекцией нарушен синтез и продукция многих
цитокинов. Как было показано, эти нарушения опосредуют белки вируса,
попадая в циркуляцию крови. Ameligoet al. всвоей работе, используя в качестве
модели рекомбинантный gp 120 ВИЧ, показали, что оболочечный белок
индуцирует при взаимодействии с мононуклеарами периферической крови
широкий спектр цитокинов, таких как ИФН-а у, ИЛ-6, ИЛ-10, ИЛ-1 а, 0,
ФНО-а, но не влияет на продукцию ИЛ-2 и ИЛЛ. Tyrinq et al., используя в
своем исследовании синтетический пептид 304-328, гомологичный структуре
gp120, на фоне классических индукторов изучали изменение продукции
цитокинов мононуклеарами здоровых лиц. Было выявлено снижение продукции
ИФН-а, -у, ИЛ-2, и усиление продукции ИЛ-1 Ь, ФНО-а. Как было показано
многими авторами, изменения в продукции цитокинов, опосредуемые белками
вируса, сопровождаются необратимыми изменениями в иммунной системе
при ВИЧ-инфекции и приводят к СПИДу.
Снижение продукции ИЛ-2 и рецепторов для него.
Как известно, для инициации иммунного ответа Т-клетки должны перейти
из состояния покоя в активированное состояние, что и происходит под
воздействием антигенов. Переход Т-клеток в активированное состояние
сопровождается синтезом de novo ИЛ-2. Покоящиеся Т-клетки не
экспрессируют высокоаффинных рецепторов к ИЛ-2, но после активации их
экспрессия происходит достаточно быстро. Взаимодействие ИЛ-2 с его
индуцированными клеточными рецепторами вызывает клеточную
пролиферацию, кульминацией которой является появление эффекторных
клеток, необходимых для полной реализации иммунного ответа. Существует
три субъединицы ИЛ-2Р-а,-Ь,-у. ИЛ-2Р-а - это Тас или CD25 антиген. В
норме большинство Т-клеток, В-клеток и больших гранулярных лимфоцитов не
экспрессируют ИЛ-2Р-а, но он может быть индуцирован антигенами. При ВИЧ
инфекции покоящиеся Т-клетки экспрессируют ИЛ-2Р-а, причем вирус
индуцирует увеличение скорости сбрасывания ИЛ-2Р-а с поверхности клетки.
Этим объясняется повышение у пациентов с этой патологией в сыворотке
растворимых форм ИЛ-2Р-а. Zola И. et al. показывают, что у пациентов с ВИЧ
122
инфекцией достоверно снижено число лимфоцитов, экспедирующих ИЛ-2
рецептор (в среднем 15% по сравнению с 31% в контроле). Авторы отмечают
отсутствие корреляции между числом СD4+лимфоцитов, которое снижается по
мере прогрессирования заболевания, и CD25+клетками. Из НО пациентов
32,7% имели менее 10% CD25+лимфоцитов,27,2% -11-15%, 19,1%-16-20%,
11,8% - 21 -25%, 5,4% - 26-30%, 3,6% - >30%CD25+ лимфоцитов. При изучении
продукции ИЛ-2 в ответ на индукцию мононуклеаров периферической крови
ФГА (М) или КонА в ВИЧ-инфицированных итальянских семьях были получены
результаты о раннем (по времени от начала заболевания) и значительном
снижении продукции ИЛ-2 вне зависимости от пола и возраста больных, причем
даже в бессимптомной стадии в ряде случаев авторам не удалось индуцировать
продукцию ИЛ-2 в ответ на митогены. Так, если у здоровых лиц продукция
ИЛ-2 в ответ на 10 мкг/мл ФГА в среднем составила 6,3±2,0 ед/мл, у больных в
стадии ССК-3,6±1,2 ед/мл, в стадии СПИД с саркомой Капоши -3,3±0,8 ед/мл,
в стадии СПИД с наличием оппортунистических инфекций - 1,0±0,7 ед/мл.
Снижение продукции ИЛ-2 авторы объясняют изменения ми в ИЛ-2 мессенджере
для синтеза мРНК, или изменением функционального состояния Т-клеток,
вызванным ВИЧ. Согласно другой версии, снижение продукции ИЛ-2 при ВИЧ-
инфекции происходит из-за взаимодействия gp 120-CD4, что приводит к
изменению сигнала трансдукции через CD3 антигенной рецепторный комплекс
(CD3-T1). Одно из возможных объяснений ингибиторного эффекта авторы видят
в том, что комплекс gp 120-CD4 может стерически препятствовать
формированию CD4-CD3-Ti комплекса, нужного для оптимальной активации Т-
клеток. Отмечаемая ингибиция экспрессии поверхностного ИЛ-2Р, но не мРНК
для ИЛ-2Р, ас другой стороны ингибирование как мРНК так и продукции ИЛ-2
говорят о том, что в течение активации CD4 клеток 2 различных сигнала
проводятся через CD3-Ti комплекс: один сигнал должен индуцировать ген ИЛ-
2Р, тогда как другой-ген ИЛ-2. Проведение последнего сигнала возможно лишь
в кооперации с CD4 молекулой, которая может быть нарушена предварительной
обработкой клеток белком gp 120 или анти-СО4 антителами. Этотсигнал, по-
видимому, также задействован в экспрессии ИЛ-2Р на посттранскрипционном
уровне - отсюда наблюдаемая ингибиция ИЛ-2Р экспрессии.
Увеличение синтеза и продукции ИЛ-lb и ФНО-а.
Повышение уровней ФНО-а, ИЛ-lb в сыворотке крови больных ВИЧ-
инфекцией отмечено многими авторами. Увеличение продукции этих цитокинов
вызывают целый ряд изменений в иммунной системе, способствующих более
быстрому прогрессированию заболевания. Так, увеличение продукции ИЛ-1
приводит к активации Т- и В-лимфоцитов, что способствует увеличению числа
инфицированных ВИЧ-клеток. ИЛ-lb индуцирует продукцию ИЛ-6,
Действующего на пролиферацию и дифференцировку В-лимфоцитов. ИЛ-1Ь
способствует запуску апоптоза Т-хелперов 1 типа, индуцирует экспрессию
123
рецепторов для ФНО-а, и способствует еще большим нарушениям в
иммунной системе.
ФНО-а усиливает пролиферацию Т-клеток, способствуя тем самым
активации репликации вируса, находящегося в ’‘дремлющем” состоянии,
индуцирует продукцию ИЛ-1 Р и ИЛ-6. Кроме того, ФНО-а, как известно,
оказывает также прямое цитотоксическое действие на инфицированные ВИЧ
Т-лимфоциты.
Изучение продукции цитокинов in vivo и исследование влияния изменений
в продукции эндогенных иммуномодуляторов на другие показатели иммунитета
представляется чрезвычайно важным для понимания ме-ханизма
иммунодефицита при ВИЧ-инфекции.
Показано, что понятие ВИЧ-пермиссивности включает активацию гена ФНО
и использование NF кВ ФНО для репликации вируса, что приводит к
горизонтальному распространению инфекции. Ряд авторов на-зывают ВИЧ-
инфекцию “болезнью ФНО”. В связи с вышесказанным у взрослых и детей,
больных ВИЧ инфекцией, были изучены особенности продукции ФНО-а in vivo,
и полученные данные сравнивались с другими параметрами иммунного статуса.
Несмотря на значительные индивидуальные различия уровня ФНО-р в
сыворотках крови больных одной и той же клинической стадии сред-ние величины
(М) были достоверно выше, чем в группе ВИЧ-негативных лиц. По мере
прогрессирования заболевания во всех группах обследован-ных практически
исчезали больные с уровнем ФНО-Р ниже 30 пг/мл и увеличивались с уровнем
более 300 пг/мл в сыворотке крови. Получен-ный нами коэффициент корреляции
между уровнем ФНО-Р и р24 в образцах сыворотки крови больных ВИЧ
инфекцией был равен 0,84, что говорит о высокой степени взаимосвязи между
этими параметрами, или другими словами, чем больше продукция ФНО-р, тем
выше уровень репликации вируса. В связи с этим мы считаем адекватной
проводимую специфическую терапию в том случае, когда она сопровождается
уменьшением количеств ФНО-Р и р24 в сыворотке крови наблюдаемых нами
пациентов. Как известно, ФНО-роказывает прямое цитопатическое действие на
хронически инфицированные Т-хелперы, кроме того, в ряде работ обсуждается
роль ФНО-р в инициации апоптоза Т-хелперов. Механизм того, как ФНО
селективно убивает ВИЧ инфицированные клетки, остается неясным. Одним из
возможных механизмов является то, что повышенная репликация вируса нарушает
внутриклеточную среду, за которой следует гибель клетки.
Изменения, происходящие с двумя параметрами - уровнем ФНО-р в
сыворотке крови и количеством CD4 лимфоцитов в мм3 в периферической крови,
которые мы наблюдали по мере прогрессирования заболевания у взрослых и
детей, говорят об обратно пропорциональной зависимости ме-жду ними, хотя
мы не идентифицировали, наблюдалась ли только гибель инфицированных
(цитопатическое действие ФНО), или всех (процессы апоптоза) СО4-лимфоцитов.
124
Увеличение синтеза и продукции ИЛ-6
Поликлональная активация В-лимфоцитов является характерной для ВИЧ-
инфекции (особенно в продвинутых стадиях заболевания - ARC и AIDS) и
проявляется гипергаммаглобулинемией, повышенным уровнем иммунных
комплексов в сыворотке и аутоантител, повышенным числом спонтанно
продуцирующих иммуноглобулины клеток, снижением специфического и
неспецифического ответа на антиген и митогены, накоплением плазматических
клеток в лимфоидных тканях, повышенной частотой В-клеточных лимфом.
Известно, что ИЛ-6 играет главную роль в терминальной В-клеточной
дифференцировке в иммуноглобулин-секретирующие клетки. Известно также,
что ВИЧ-инфекция ассоциирована с повышенным уровнем ИЛ-6 в плазме,
независимо от того, существует ли в данный моменту больного сопутствующая
инфекция. При использовании рекомбинантных вирусных белков gp 120 и gp 160
было показано, что в ответ на воздействие ими in vitro мононуклеары
периферической крови продуцируют биологически активный ИЛ-6. Авторы
показали, что оболочечный белок вируса действует напрямую на CD4 клоны
Т-клеток, индуцирует ИЛ-6 продукцию в отсутствие моноцитов. Эти данные
Подчеркивают, что оба типа клеток - и моноциты, и Т-клетки - продуцируют в
ответ на специфический антиген ИЛ-6, который играет важную роль в
патогенезе В-клеточной активации при ВИЧ-инфекции. Существует гипотеза
«постоянно циркулирующего ИЛ-6» при ВИЧ-инфекции, вызывающего
Поликлональную активацию В-клеток. Как известно, клетки памяти CD2+CD4+
Оказывают помощь В-лимфоцитам в продукции иммуноглобулинов. В ответ
НаантиСО2 антитела именно Т-клетки памяти, а не Т-наивные клетки начинают
секретировать ИЛ-6. Так как именно эта субпопуляция клеток инфицируется
преимущественно ВИЧ-1 как in vitro, так и in vivo, то инфицирование
«сопровождается секрецией ИЛ-6 и поликлональной активацией В-лимфоцитов.
Rautonen et al. обследовали детей с ВИЧ-инфекцией, инфицированных
вертикальным путем. Контрольную группу составили неинфицированные дети.
Исследовались ИЛ-6 и концентрации иммуноглобулинов в сыворотке крови.
ИЛ-6у ВИЧ-инфицированных детей был достоверно выше, чем у здоровых
и коррелировал с уровнем ФНО-а. Выявлена корреляция между ИЛ-6 и IgG,
ИЛ-6 и IgA концентрациями. В ходе наблюдения за больными детьми выявлены
содружественные изменения ИЛ-6 и IgG. Авторы делают вывод, что независимо
ОТ источника и начального стимула, дзительная продукция ИЛ-6 и ФНО-а может
возникать за счет создания аутокринной петли, способствующей повышению
Уровней этих цитокинов, что приводит к повышению синтеза
иммуноглобулинов и, что более важно, ВИЧ репликации. Birx et al., работая с
Мононуклеарами и сыворотками взрослых больных ВИЧ-инфекцией, показали,
Ито уровень ИЛ-6 в сыворотке и спонтанная продукция цитокина
'иононуклеарами была достоверно выше, чем у неинфицированных пациентов.
125
Авторы высказывают мысль, что ИЛ-6 может вызывать прогрессию ВИЧ-
инфекции, содействуя Т-клеточной пролиферации, так как in vitro ИЛ-6
стимулирует ее. Известно, что в активированных Т-клетках ВИЧ реплицируется
предпочтительнее по сравнению с покоящимися Т-клетками. В связи с этим
индуцированная ИЛ-6 Т-клеточная пролиферация может способствовать
экспансии пула ВИЧ-инфицированных Т-клеток.
Изменение продукции интерферона-а (ИФН-а)
Многочисленные работы посвящены исследованию роли ИФН-а в контроле за
развитием ВИЧ-инфекции. Так как ИФН-а продуцируется эндогенно в ответ на
вирусную инфекцию, предполагалось, что протективный эффект цитокина состоит
в пролонгировании бессимптомной стадии, которая типична для ВИЧ-инфекции.
ИФН-а действительно выявляется в сыворотках ВИЧ-инфицированных индивидов,
но оказалось, что он определяется и в поздних стадиях ВИЧ-инфекции и его
появление коррелирует с ухудшением прогноза. Появление ИФН-а в сыворотке
также описано в течение острой сероконверсии, вызываемой ВИЧ. Наличие в
поздних стадиях в сыворотке ИФН-а сопровождается отсутствием интерферонового
ответа мононуклеаров периферической крови на стимуляцию вирусом гриппа
или опухолевыми клетками. Предполагается, что существует интерфероновая
резистентность при ВИЧ-инфекции, которая, по мнению авторов, может быть
связана как со снижением числа и аффинитетаспецифических рецепторов, так и
с тем, что ИФН-а, который выявляется у ряда ВИЧ-инфицированных лиц.
блокирует взаимодействие между ИФН-у и его рецептором, значительно снижая
общую способность интерферонов защищать клетки от ВИЧ-инфекции. Другие
авторы, которые изучали ИФН-а в сыворотке больных ВИЧ-инфекцией и его
влияние на репликацию вируса, выяснили, что чувствительность ВИЧ к интерферону
имеется только в доклинических стадиях, а далее сывороточный высокий уровень
ИФН-а ассоциировался с низким CD4 и прогрессией заболевания (уровень в
сыворотке в стадии пре-СПИД был 40-50 ед/мл, встадии СПИД-150 ед/мл).
Разныеточки зрения в литературе на значение определения интерферона-
а в сыворотке крови пациентов с целью оценки противовирусной защиты
побудили нас исследовать данный цитокин в сыворотке кро-ви в сравнении с
уровнем антигенемии в различные стадии заболевания. Как показали данные
исследования, мы не выявили нарастания уровня интерферона в сыворотке
крови больных в стадиях с клиническими проявлениями, что трактуется
авторами как снижение чувствительности к интерферону. Более того, сравнение
с уровнем интерферона в сыворотке крови детей ЧДБ ОРВИ встадии ремиссии,
а также сравнение уровней интерферона с р24 антигенемией у больных ВИЧ-
инфекцией показывает, что уровень интерферона-а при ВИЧ-инфекции ниже,
чем в группе ЧДБ ОРВИ, прогрессивно снижается в ходе инфекции и находится
в обратно пропорциональной связи с уровнем белка р24, отражая
неэффективность противовирусной защиты при ВИЧ-инфекции.
126
Цитокин-индуцированное переключение с Т-xl ответа на Т-х2.
Известно, что эффекторные функции в иммунной системе могут быть
разделены на дватипа: клеточно-опосредованный и гуморальный. Эти два пути
иммунного ответа регулируются тремя различными субпопуляциями CD4
хелперных Т-клеток, обозначенных как ТхО, Тх1 и Тх2 клетки, которые
секретируют различный паттерн цитокинов. Клетки Тх1, продуцирующие, в
основном, ИЛ-2 и ИФН-у, повышают клеточно-опосредованный иммунный
ответ, тогда как Тх2 клетки секретируют ИЛ-4, 5, 6 и ИЛ-10, и стимулируют
гуморальное звено иммунного ответа. Существует представление, что Тх1 и
Тх2 субпопуляции происходят из общего предшественника (ТхО), который
секретирует ИЛ-12, высокие уровни ИЛ-2, но низкие ИЛ-4 или ИФН-у. Ряд
цитокинов, продуцируемых каждой из субпопуляций Т-лимфоцитов, обладают
способностью ингибировать продукцию цитокинов и эффекторные функции
реципрокной субпопуляции. В большинстве ситуаций иммунная система
развивает тот иммунный ответ, который наиболее эффективен для элиминации
антигена или патогена. Предполагается, что ИЛ-12 направляет иммунный ответ
по Тх1 типу, тогда как присутствие ИЛ-4 на ранних стадиях Т-клеточной
стимуляции (поликлональный или антигенспецифической) in vitro ведет к
сильной поляризации Т-клеток к Тх2 фенотипу и секреции высоких уровней
ИЛ-4 после рестимуляции. Тх1 дифференцировка на аналогичные стимулы
может быть индуцирована ИФН-у, особенно в отсутствие ИЛ-4. Переходом от
Тх1 к Тх2 ответу можно объяснить функциональную недостаточность клеточного
звена иммунного ответа, наблюдаемую втечение прогрессии ВИЧ-инфекции.
Прогрессирующая Т-клеточная дисфункция, которая сопровождает ВИЧ-
инфекцию и характеризуется в начале исчезновением пролиферативного ответа
на “забытые” антигены, затем на аллогенную стимуляцию и в конечном счете
- отсутствием ответа на митоген. При этом наблюдаются изменения
цитокинового профиля: снижение и исчезновение ИЛ-2 и ИФН-у продукции
сопровождается подъемом продукции ИЛ-4 и ИЛ-10. Это изменения знаменуют
переход из Тх1 в Тх2, то есть клеточного иммунитета в гуморальный.
Преобладание последнего ассоциируется с прогрессированием ВИЧ-инфекции.
Механизм, контролирующий переключение с Тх1 на Тх2 иммунный ответ,
является многофакторным, но ВИЧ играет непосредственную и активную
роль в этом процессе, изменяя продукцию иммунорегуляторных цитокинов.
В работе Fust et al. подтверждается значимость переключения с Тх1 на Тх2
ответ для патогенеза ВИЧ-инфекции. Выводы авторов базируются на
экспериментах, в которых исследовалась продукция цитокинов Тх1 типа или
Тх2 типа мононуклеарами периферической крови ВИЧ-инфицированных
пациентов после стимуляции антигеном или митогенами. Clerici М. et al.
показали сходные результаты, свидетельствующие, что при ВИЧ-инфекции
происходит переключение с Т-хелперного ответа 1 типа на Тх ответ 2 типа.
127
Однако Maggi et al. доказывают, чтоТ-клетки больных ВИЧ-инфекцией при
клонировании in vitro дают максимальное число ТхО клонов, в которых ВИЧ и
реплицируется. Авторам не удалось выявить ни одного клона Тх1 типа, в
котором бы происходила репликация вируса. Исходя из этого, авторы
утверждают, что в процессе ВИЧ-инфекции происходит сдвиг в сторону
образования клеток ТхО типа. Graziosi et al. подтвердили результаты группы
Maggi et al. Mosmann T.R., пытаясь объяснить несовпадение данных,
полученными разными группами исследователей, говорит об их правомочности
в случае, если существует баланс между индукцией Тх2 сдвига и быстрым
уничтожением Тх2 и ТхО клеток втечение инфекции. Предлагаемая T.R.Mosmann
гипотеза объясняет, почему аллергия и уровень иммуноглобулина Е,
характеризующий Тх2-подобный ответ, не так часто встречается у ВИЧ
пациентов, но высокий уровень IgE является маркером быстрого наступления
СПИД. С целью подтверждения этого положения клонировали CD4+CD45RO+
клетки трех больных ВИЧ-инфекцией в бессимптомной стадии и аналогичные
клетки двух серонегативных гомосексуалистов в качестве контроля.
Клонированные в рандомизированных условиях Т-клетки анализировались
по уровню секреции цитокинов после стимуляцией ФМА или анти-СОЗ МАТ.
По сравнению с контролем из клеток ВИЧ-инфицированных больных удалось
получить меньший процент ИФН-у продуцирующих Т-клеточных клонов, вто
время как ИЛ-4-продуцирующих клонов было значительно больше, чем в
контроле. Уровень продукции ИЛ-4 клетками клонов, полученных от ВИЧ-
инфицированных больных, был значимо больше, чем клетками клонов,
полученных от серонегативных гомосексуалистов. Процент ИЛ-2-
продупирующих клеточных клонов варьировал одинаково в клетках,
полученных от больных ВИЧ-инфекцией и в контроле. Процент клонов,
полученных от серонегативных гомосексуалистов, продуцирующих только Тх 1
цитокины, был максимальным и составил 71%. Из клеток, полученных от
двух других больных ВИЧ-инфекцией, процент клонов, продуцирующих
характерные для Тх1 цитокины, был резко снижен по сравнению с контролем
(53 и 36%), и был выявлен сдвиг в сторону продукции Тх2 цитокинов. Различия
в свойствах Т-клеточных клонов, полученных от ВИЧ-инфицированных
пациентов, могли быть объяснены различными сроками от момента
инфицирования до получения клеток. Для доказательства этого положения
было проведено клонирование криоконсервированных клеток, полученных
от одного и того же индивида за 8 месяцев до сероконверсии и через 33 и 51
месяц после. В согласии с высказанным положением процент ИФН-g -
продуцирующих клонов снижался по мере удлинения сроков от момента
инфицирования, в то время как процент клонов, продуцирующих ИЛ-4,
существенно возрос к моменту последнего взятия крови. Уровень продукции
ИФН-g резко снизился втечение ВИЧ-инфекции, вто время как продукция ИЛ-
128
4 стала выше за время наблюдения. Продукция ИЛ-2 каждым клоном несколько
снизилась к последним срокам наблюдения. Эти данные показывают, что после
возникновения ВИЧ-инфекции Т-клеточные клоны, полученные из CD4+ клеток
памяти, изменяют цитокиновый репертуар в сторону увеличения числаклонов,
продуцирующих Тх2 цитокины в комбинации со снижением числа клонов,
продуцирующих Тх1 цитокины. Vyakarnam сообщает, что использованные панели
Тх1 (высокий уровень продукции ИЛ-2, ИФН-у, отсутствует продукция ИЛ-4)
и Тх2 клонов (низкий уровень продукции ИЛ-2, ИФН-у при высокой продукции
ИЛЛ), полученные от серонегативных волонтеров, иммунизированных gag и
р24:Ту, различались по своим способностям регулировать ВИЧ. Txl клоны
ингибировали ВИЧ более эффективно, чем Тх2 клоны. Выводы Estaquier et al.
согласуются с приведенными выше данными, свидетельствующими, что главной
чертой ВИЧ-инфекции является снижение продукции цитокиновТх! типа, причем
более значительное, чем нарастание продукции Тх2 типа цитокинов. Этот
дисбаланс играет, по его мнению, роль пускового механизма в условиях
возникновения апоптоза. По мнению ряда исследователей, ВИЧ, вызывая
гиперпродукцию ИЛ-1, ФНО и ИЛ-6, гипопродукцию (вплоть до исчезновения)
главного ростового фактора Т-лимфоцитов - ИЛ-2 и повышение продукции
растворимых форм ИЛ-2 - рецептора, способен вызывать высокую степень
апоптотических процессов лимфоидных клеток и играть решающую роль в
механизме гибели CD4+ Т-лимфоцитов.
Таким образом, все вышеперечисленные нарушения цитокинового звена
иммунитета определяют развитие иммунодефицита при ВИЧ-инфекции.
/кмь нарушений синтеза и продукции цитокинов в прогрессировании ВИЧ-
инфекции и клинических проявлениях.
Цитокины - ФНО-а, ИЛ-1 р и ИЛ-6-демонстрируют наиболее широкий
спектр активностей. Они могут действовать в качестве эндогенных
дифференцировочных или активационных факторов иммунной системы и/
или выступать в роли провоспалительных медиаторов. Эти цитокины,
эффективно воздействуя на множественные клетки-мишени иммунитета и
воспаления, являются, по-видимому, факторами, определяющими уровень и
интенсивность действия этих ключевых систем организма. Увеличение
продукции провоспалительных цитокинов приводит к возникновению
различных патологических состояний организма, таких как кахексия, сепсис,
Церебральные нарушения и различные проявления аутоиммунитета и т.д. ВИЧ-
инфекция, которая сопровождается повышенной продукцией
провоспалительных цитокинов, еще и поэтому является предметом
комплексного изучения исследователей. Разнообразие действий
провоспалительных цитокинов связано не только с множеством клеток-
9- Заказ дь к.445]
129
мишеней, участвующих в воспалении, но и множеством других типов клеток,
включая кератиноциты, купферовские клетки печени, клетки почек, астроциты
и клетки микроглии мозга, которые продуцируют их в ответ на антиген. Как
известно, ВИЧ-инфекция часто сопровождается немотивированной лихорадкой
и изменениями в поведении и настроении. Эти изменения вызываются
эндогенными медиаторами - провоспалительными цитокинами, такими как
ИЛ-ip, ИЛ-6, ФНО-а, переносимыми с кровью в различные органы, в том
числе в мозг, отделенный от периферии гематоэнцефалическим барьером. При
анализе течения ВИЧ инфекции выясняется, что еще в преддверие проявления
клинической симптоматики пациенты отмечают у себя признаки выраженной
апатии: их перестает интересовать то, что до этого момента составляло
жизненные интересы. Было доказано, что причины изменений в поведенческих
реакциях и терморегуляции вызваны действием провоспалительных цитокинов,
которые секретируются активированными втечение инфекции макрофагами и
моноцитами и другими клетками иммунной системы и проникают в ЦНС.
Объективные и субъективные симптомы, аналогичные тем, которые
наблюдаются в стадии первичных проявлений инфекции, могут быть
инициированы введением липополисахарида или рекомбинантных цитокинов,
причем наиболее активными из последних являются ИЛ-1 а и ИЛ-10.
Повышение температуры, изменения поведения и настроения находятся под
прямым контролем структур головного мозга. В гипоталамусе имеются клетки-
мишени для цитокинов, изменение активности которых способствуют
проявлению указанных выше симптомов. Доза, которая необходима для их
индукции при введении цитокинов непосредственно вткани мозга, обычно в
100-1000 раз ниже, чем та, которая вызывает аналогичные эффекты при
введении цитокинов на периферии. Вопрос о том, каким образом цитокины
действуют на функции мозга, разрабатывается достаточно длительное время.
Показано, что цитокины - это гидрофильные пептиды, которые не могут пройти
через гематоэнцефалический барьер без помощи транспортной системы.
Предполагается, что цитокины могут войти в мозг там, где отсутствует
гематоэнцефалический барьер. Это - регион, где располагаются
околожелудочковые органы (circumventricular organs). Для индукции лихорадки
критическим околожелудочковым органом является васкулярное тельце
(organum vasculozum) терминальной пластинки (lamina terminalis) - OVLT,
которое находится на передней стенке третьего желудочка, очень тесно
связанного с медиальной преоптической зоной переднего гипоталамуса, участка,
предположительно запускающего лихорадку. В связи с наличием окончатых
капилляров и прилежащих астроцитов, расположенных в этом сенсорном органе
с низкой плотностью, переносимые с кровью цитокины могут поступать в
периваскулярное пространство OVLT. Здесь они взаимодействуют с клетками
мишенями, которые преобразуют иммунный (мессенджер) сигнал во
130
вторичные сигналы, способствующие индукции таких веществ, как
простагландины, которые далее свободно диффундируют к близлежащим нервным
клеткам-мишеням. Тем не менее, множественные эффекты цитокинов на функции
головного мозга плохо согласуются с концепцией “единственной двери” для
вхождения цитокинов в мозг. Более поздняя версия гуморальной теории состоит
в том, что эндотелий стенок капилляров, расположенных вокруг всего мозга,
связывает циркулирующие цитокины. Это действие результируется в активации
каскада мессенджеров нервной системы, имеющих различную функциональную
направленность, в зависимости оттого, где проявляется этот феномен. Эта теория
пренебрегает двумя факторами. Первый - цитокины чаще всего действуют как
аутокринные или паракринные связующие сигналы. Второй - цитокины имеют
рецепторы в глиальных клетках головного мозга. Кроме того, существуют
наблюдения, что уровень цитокинов транзиторно повышается в головном мозге в
течение иммунного ответа на периферии. Введение на периферии ЛПС индуцирует
экспрессию генов ИЛ-1, ИЛ-6 и ФНО-а в различных регионах головного мозга,
таких как гипоталамус или гиппокамп, причем цитокины, индуцированные в
йуювном мозге, отличаются от таковых, наблюдаемых в периферических
Лимфоидных (селезенка) и нелимфоидных (гипофиз) органах. Используя антитела
против ИЛ-1 р, группа Berkenbosch сумела показать появление иммунореактивного
ВЛ-1р в клетках микроглии и в периваскулярных и менингеальных макрофагах
Ирыс, получающих систематически инъекции ЛПС. Dantzer и соавторы считают,
До кроме гуморального пути воздействия иммунных мессенджеров на головной
ЦЮЗГ не исключается дополнительный - через нервные окончания сенсорных
Нейронов. Показана способность ВИЧ-1 индуцировать ФНО-а и ИЛ-ip в
вервичных культурах мозга крыс, инфицированных ВИЧ. Индукция этих
Цитокинов могла быть блокирована антителами, направленными к эпитопам gp 120
|fcgp41 оболочечного белка вируса. СПИД-ассоциированные неврологические
Ийложнения коррелируют с уровнем ВИЧ в мозге. Среди клинических проявлений
Наблюдаются следующие поражения центральной нервной системы: лихорадка,
(Кнксия, головная боль, невралгии, поведенческие изменения, двигательные и
Юнсорные дисфункции. Данные авторов по ингибиции продукции цитокинов
итителами к оболочечному белку ВИЧ показали, что ИЛ-1 р и ФНО-а могли быть
ННдуцированы независимо друг от друга путем нескольких триггерных механизмов,
НСрез различные активационные пути.
По мере прогрессирования заболевания у большинства пациентов с ВИЧ-
Йнфекцией отмечается поражение костного мозга, сопровождающееся анемией,
Лейкопенией и тромбоцитопенией, причина которых недостаточно ясна.
Geissler с соавторами, не исключая прямого инфицирования гемопоэтических
НЯеток-предшественников в костном мозге и их иммуноцитолиза, рассматривают
Действие на них ингибирующих цитокинов, таких как ФНО-а. С этой целью они
Лечили действие этого цитокина на рост колоний из плюрипотентных (CFU-
131
GEMM), эритроидных (BRU-F) и гранулоцитарно-макрофагальных (CFU-GM)
предшественников гемопоэза костного мозга больных ВИЧ-инфекцией и здоровых
волонтеров в метилцеллюлезных культурах. Исходно число колоний у больных
ВИЧ-инфекцией (плюрипотентных, эритроидных и гранулоцитарно-
макрофагальных) было снижено по сравнению с таковыми в группе волонтеров.
Цитокин ингибировал образование и рост колоний гемопоэтических клеток-
предшественников больных ВИЧ-инфекцией и здоровых лиц. Однако
чувствительность гемопоэтических клеток-предшественников больных ВИЧ-
инфекцией к воздействию ФНО-а была большей и 50% ингибиция роста колоний
достигалась при использовании достоверно более низких доз цитокина.
Эксперименты научной группы Geissler и соавт. доказывают, что при хронической
экспозиции клеток-предшественников гемопоэза больных ВИЧ-инфекцией с
ФНО-а наблюдается также in vivo при этой инфекции, что может в конце концов
приводить к прогрессирующему поражению костного мозга. Ulich с соавт. и
другие исследователи пишут об индуцированной провоспалительными цитокинами
- ФНО-а, ИЛ-1 а-p, ИЛ-6 - нейтропении. Нейтропения, по их мнению, возникает
в результате снижения циркулирующих нейтрофилов за счет их внутрисосудистой
адгезии, как в результате изменения поверхности нейтрофилов под воздействием
ФНО-а, ИЛ-1 р, так и в результате экспрессии нейтрофил-эндотелиальных
прилипающих молекул. С точки зрения авторов, цитокины стимулируют
прилипание нейтрофилов к эндотелию независимым от синтеза белка воздействием
на нейтрофилы, также как и синтезом de novo РНК адгезионных молекул. ИЛ-1 р,
ФНО-а активируют нейтрофилы, стимулируют нейтрофильную агрегацию и
являются хемоаттрактантами для нейтрофилов и моноцитов. ИЛ-6 вызывает, в
свою очередь, апоптоз нейтрофилов. ФНО-а вызывает так же снижение
циркулирующих лимфоцитов. Механизмами, которые могут объяснить снижение
циркулирующих лимфоцитов под воздействием ФНО-а, являются:
цитотоксический эффект на лимфоциты; внутрисосудистое “краевое стояние",
миграция лимфоцитов в лимфоидные и нелимфоидные органы и ткани и снижение
рециркуляции лимфоцитов из грудного протока. Исследователи, описывая роль
ФНО-а и ИЛ-lb возникновении анемии, отмечают как снижение продукции
эритроцитов, так и укорочение периода жизни циркулирующих эритроцитов под
воздействием цитокинов. ФНО-а вызывает экспрессию тканевых факторов,
вызывающих коагуляцию и играет роль в диссеминированном внутрисосудистом
свертывании. Вызывая краевое стояние тромбоцитов в мелких капиллярах и
сосудах, ФНОаспособствуеттромбоцитопении. Среди множественных мишеней
ФНО-а эндотелиальные клетки (ЭК) представляют большую важность. Эти
клетки играют роль не только в локальном воспалении, но также являются
регуляторным механизмом иммунитета, коагуляции и гемостаза. ФНО-а вызывает
изменения ЭК, которые приводят к множественной сосудистой патологии -
геморрагическим некрозам, модуляции фиброза или демиелинизации а также
132
микрососудистой патологии, способствующей осложнениям ФНО-а вызванной
иммунопатологии. Важными ФНО-индуцированными изменениями, приводящими
к повреждению ЭК, являются коагуляционные процессы (ФНО-а индуцирует
прокоагуляционную активность ЭК, стимулирует продукцию ТАФ и фактора
Вилли-Брандта), способствующие тромбозу и активации тканевого
плазминогенного активатора. ФНО-а вызываеттакже повышение адгезивности за
счет активации или синтеза de novo адгезионных молекул на поверхности ЭК,
стимулирует выброс адгезионными молекулами хемоаттрактантов, которые
приводят к трансмиграции лейкоцитов и лимфоцитов через сосудистую стенку,
индуцируег синтез РЕ2, простациклина,тромбоксана и оксида натрия и эндотелина,
воздействующих на сосудистый тонус.
Как известно, в коже провоспалительные цитокины продуцируются
инфильтрирующими эпидермис лейкоцитами (как и в других тканях) и
кератиноцитами. Известно, что клегки Лангерганса и кератиноциты могут быть
инфицированы вирусом иммунодефицита и активированы, что приводит к
повышенной продукции ФНО-а, ИЛ-lb и ИЛ-6. Эти цитокины вносят
существенный вклад в наблюдаемые изменения кожи, такие как синдром
выхода внутрисосудистой жидкости через стенки сосуда, краевое стояние
лейкоцитов, повреждение клеток кожи и их некроз или фиброангиогенез. Таким
образом, особенностью патологических процессов в коже при ВИЧ-инфекции
является участие эпидермальных клеток в продукции провоспалительных
цитокинов в результате их активации вирусом иммунодефицита.
Множество органов подвергаются изменениям при гиперпродукции
провоспалительных цитокинов, в частности, в легких развивается воспаление
и геморрагия,что приводит к раннему нарушению оксигенации, “гепатизации”
легкого за счет инфильтрации нейтрофилами и эритроцитами альвеол. ФНО-а
индуцирует синтез более “поздних" провоспалительных цитокинов (ИЛ-1 р, ИЛ-
61 которые усиливают его повреждающее действие на легочную ткань.
Исследователи, описывая непосредственное повреждающее действие ФНО-а,
останавливаются на следующих симптомах: диарее, апоптозе клеток слизистой
12-перстной кишки, геморрагическом некрозе слизистой слепой кишки. Также
характерными симптомами являются воспаление, инфаркты и некрозы в кишечнике
и желудке. Отмечается замедление эвакуации желудочного содержимого и
Повышение скорости опорожнения слепой кишки. Гиперпродукция ФНО-а
Приводит к некрозу верхушек ресничек тонкой кишки, вызывает выраженное
Повреждение эндотелиальных клеток, приводящее к отсоединению от базальной
мембраны. Механизм большинства кишечных повреждений под воздействием
ФНО-а может быть связан с сосудистыми нарушениями, что приводит к
Плохой перфузии слизистых. При снижении скорости кровотока повреждение
эндотелия становится особенно значимым, так как еще больше снижается
Поступление кислорода и питательных веществ в кишечник.
133
ФНО-а блокирует синтез липопротеинлипазы и при длительной
гиперпродукции вызывает катаболические процессы в организме. Наблюдаемое
при ВИЧ-инфекции снижение массы тела, а в стадии СПИД - кахексия
непосредственно связаны с длительной гиперпродукцией ФНО-а.
Таким образом, приведенные нами данные литературы последних лет
отражают представления о роли цитокинов в репликации вируса
иммунодефицита человека, возникновении прогрессирующих изменений
иммунной системы и в клинических проявлениях ВИЧ-инфекции. Роль
фактора некроза опухоли в экспрессии вируса иммунодефици-та человека,
картирование генов ФНО-а и на 6-й хромосоме человека в зоне большого
комплекса гистосовместимости HLA между генами HLA-B и генами
гистосовместимости III класса, выраженное неравновесное сцепление между
аллелями ФНО и HLA, ассоциации между различными ФНО аллелями и уровнем
экспрессии цитокина, описанные в литературе корреляции между HLAаллелями
и характером течения ВИЧ инфекции определили необходимость обоснования
роли иммуногенетических механизмов в патогенезе ВИЧ-инфекции.
Проведенное нами HLA-A, -В, -DR типирование выявило достовер-ное
увеличение частоты встречаемости антигена HLA А10 в группах больных ВИЧ-
инфекцией (детей и взрослых) по сравнению с контроль-ными группами (/'>3,85,
RR в группе взрослых был равен 4,22, в группе детей - 4,09). В группе ВИЧ-
инфицированных детей значимо чаще встре-чался антиген В40 (w 60) (х2 = 5,23,
RR=3,49). В группе взрослых больных достоверно чаще встречались антигены
В8 (х2 = 6,87, RR=2,17), 21 (х2 = 5,43, RR=2,60), 22 (/ = 6,62, RR=4,46), достоверно
реже В15 (х2==Ю,98, RR=0,039). Полученные результаты, как и данные других
авторов, являются констатацией научных наблюдений, но не доказываютуча-стие
иммуногенетических механизмов в патогенезе ВИЧ-инфекции. Зада-чей
исследования было показать, что уровни продукции фактора некроза опухоли,
главного патогенетического фактора прогрессии ВИЧ-инфекции, HLA
детерминированы. Суммарно данные о влиянии наличия в фенотипе больного
определенных HLA- А, -В, -DR антигенов на спонтанную продукции ФНО-а
выглядятследующим образом: антигены HLAA19, А28,В7, В 12,В 13,DR2,DR6
связаны с более низкой спонтанной продукцией ФНО-а (группа 1), HLA-A 1, В8,
В16, В35, В40, В41, DR 1, DR3 (группа2) -с более высокой. Наличие таких антигенов
в фенотипе больного как HLA-A2, АЗ, А10, А11; В5, В14, В15, В17, В18, В21, В22,
В27; DR 4, DR5, DR7 (группа 3), по нашим данным, не оказывает влияния на
спонтанную про-дукцию ФНО-а мононуклеарами периферической крови больных
ВИЧ-инфекцией. Ввиду наличия высокой степени прямой корреляции (р=0,74)
между уровнем спонтанной продукции ФНО-а и р24 антигенемией у больных
ВИЧ-инфекцией HLAантигены, входящие в 1 группу, были на-званы "антигенами-
протекторами” (ассоциированные с медленной про-грессией ВИЧ-инфекции),
во 2 группу - ‘"антигенами-провокаторами” (ассоциированные с быстрой
134
прогрессией ВИЧ-инфекции), в 3 группу - несвязанные с прогрессией ВИЧ-
инфекции. При сравнении данных литературы и проведенного нами разделения
HLA антигенов выявлены значительные совпадения. .
Знаменательным является тот факт, что перечень антигенов HLA,
связанных с быстрой прогрессией заболевания и, в нашей трактовке, с
достоверно более высокой продукцией фактора некроза опухолиос, совпадает
в 100% случаев, перечень антигенов, связанных по данным литературы с
медленной прогрессией заболевания, совпадаете описанными нами “антигенами
протекторами” в 66,6% случаев, антигены HLA, не влияющие на продукцию
ФНО-ос в большинстве случаев не описываются другими авторами, или
связываются не с прогрессией заболевания, ас другими его характеристиками.
Выявление в группе детей больных ВИЧ-инфекцией достоверного увеличения
В40 и в группе взрослых В8 по сравнению с контролем позволяет предположить,
что генетически детерминированный более высокий уровень продукции ФНО-
а мононуклеарами периферической крови способствовал у этих пациентов
более ранней репликации и размножению вируса. Сравнение полученных нами
данных с данными литературы говорит о правомочности использования
маркеров генетической детерминированности высокой продукции ФНО-а в
прогнозировании течения ВИЧ-инфекции, отбора групп риска по
предполагаемому злокачественному течению инфекции и назначению в более
ранних сроках специфической терапии.
Данный обзор посвящен описанию различных механизмов
возникновения иммунодефицита при ВИЧ-инфекции. Следует отметить, что
развитие иммунодефицитного состояния является результатом взаимодействия
клеток иммунной системы и вируса. С одной стороны, вирус различными
способами поражает иммунную систему, ас другой - клетки иммунной системы
способствуют распространению вируса в организме. В настоящее время
становится очевидным, что рецепторами для вируса являются молекулы,
играющие важную роль в обеспечении тканевого гомеостаза организма и, в
частности, иммунной системы. Описаны корецепторы для ВИЧ, которые
представляют собой рецепторы для С-С и С-Х-С хемокинов. Отмечены
возможные терапевтические направления по блокированию проникновения
вируса в клетки мишени с помощью модифицированных хемокинов. Проведен
на новом материле анализ роли цитокинов в защите от вируса и их роли в
патогенезе ВИЧ-инфекции. Показано, что ряд цитокинов и, особенно, группа
провоспалительных монокинов, таких как ФНО, ИЛ-6 и ИЛ-1, играет
значительную роль в ускорении репликации ВИЧ. С другой стороны ИЛ-2,
ИЛ-12 и ИФН-у являются факторами защиты организма от распространения
вируса путем активации пролиферации и дифференцировки цитотоксических
Т-лимфоцитов, являющихся сдерживающим фактором развития в клетках
вируса иммунодефицита человека. Рассмотрены новые данные о нарушении
135
хематтрактации CD4 лимфоцитов, что приводит к значительному снижению
этих клеток в периферической крови. Высокодозная химиотерапия приводит
к реконституции CD4 Т-лимфоцитов. Проанализированы данные о роли
сочетаний аллелей главного комплекса гистосовместимости 1 и II класса в
скорости развития ВИЧ-инфекции у различных групп пациентов.
Несмотря на значительные успехи в изучении патогенеза ВИЧ-
инфекции следует отметить, что подходы к предупреждению и лечению
заболевания находятся в начальной стадии развития.
Клетки иммунной системы существуют для защиты человека от
бактерий, вирусов, простейших, других микроорганизмов, опухолевых клеток
и прочих чужеродных агентов. Вначале макрофаги захватывают чужеродный
агент — антиген и перерабатывают его таким образом, что он начинает
распознаваться лимфоцитами, имеющими в оболочке белок-рецептор CD4
(Т-хелперы). Т-хелперы с помощью лимфокинов активируют В-лимфоциты,
которые вырабатывают иммуноглобулины — антитела, способные связать
определенный антиген, т. е. являющиеся специфичными. Образуются
комплексы антиген — антитело, которые выводятся из организма человека.
Зараженные ВИЧ Т4 клетки не могут осуществлять свою иммунную
функцию, а, следовательно, В-клетки перестают синтезировать
специфические антитела, но начинают производить большое количество
неспецифических иммуноглобулинов. Происходят постепенное
разрушение иммунной системы, нарушение нормальной реакции на
чужеродный агент. Человек, зараженный ВИЧ, становится беззащитным
перед микроорганизмами, в том числе и перед такими, которые не
представляют угрозы для нормального человека (оппортунистические
инфекции). Получают возможность развиваться злокачественные опухоли.
В патологический процесс почти всегда вовлекается нервная система,
куда ВИЧ проникает с инфицированными моноцитами. Поражение клеток
нейроглии приводит к функциональным, а затем и трофическим
повреждениям нейронов, ткани мозга, нарушению мозговой деятельности
и, в конечном итоге, развитию слабоумия (СПИД-деменции).
У части больных имеют место функциональные и морфологические
изменения спинного мозга и периферической нервной системы.
Первичное инфицирование ВИЧ приводит к длительному
бессимптомному периоду инфекции, причины которой окончательно не
известны. При этом вирусемия держится на низком уровне, а репликация
(размножение) вируса происходит медленными темпами. Ускорение
репликации ВИЧ обуславливает ухудшение течения инфекции и клиническую
манифестацию. Причины, которые приводят к интенсивной репликации
вируса, называются ко-факторами или триггерами. Ими могут быть
герпесвирусы или любые другие антигены, стимулирующие Т-4 лимфоциты.
136
Литература
1. Калинина Н.М. Цитокины в иммунопатогенезе и клинических проявлениях
ВИЧ-инфекции: Автореф. дисс. докг. мед. наук. -СПб. -1996. -36 с.
2. Калинина Н.М., Рахманова А.Г. Новое в патогенезе ВИЧ-инфекции И Мат.
конф. «Актуальные вопросы ВИЧ-инфекции», Санкт-Петербург, 1997. -
СПб.-1997.-С. 78-79.
3. Кетлинский С.А., Калинина Н.М. Иммунология для врача. -СПб:
Г иппократ. -1998. -С. 75-79.
4. d’AddarioM., Wainberg М.А., Hiscott J. Activation of cytokine genes in HIV-
1 infected myelomonoblastic cells by phorbol ester and TNF//J. Immunology.
1992. Vol. 148, № 4.-P. 1222-1229.
5. Agostini C., Zanbello R., Trentin L., Cerutti A. et al. Expression of TNF
receptors by T cells and membrane TNF-a by alveolar macrophages suggests
a role for TNF-a in the regulation of the local immune responses in lung of
HIV-1-infected patients //J. Immunology. 1995. Vol.154. P.2928-2938.
6. AlkhatibG., Locafi M., Hennedy P.E. et al. HIV-1 coreceptor activity ofCCR5
and its inhibition buy chemokines: independence from G protein signaling
and importance of coreceptor down modulation // Virology, 1997, Vol.234,
P.340-348.
7. Amadori A.,Zamarchi R., Veronese M.L., Panozzo M. et al. В-cell activation
during HIV infection Il.Cell-to cell interactions and cytokine requirement /
/ J.Immunology. 1991. Vol. 146, № 1. P.57-62.
8. Ameglio F., Capobianchi M., Castilletti C., Cordialifei P. et al. Recombinant
gp 120 induces IL 10 in resting peripheral blood mononuclear cells; correlation
with the induction of other cytokines//Clin. Exper. Immunol. 1994. Vol.95,
№3.-P. 455-458.
9. Ameisen J .C. Programmed cell deth and AIDS: from hypothesis to experiment.
Immunology today, 1992,Vol. 13, P.388-391
10. Amidei A., Aiello A., Delia D.et al. IL-12 inhibits apoptosis induced inhuman
Thl clone by gp 120/CD4 cross linking and CD3/TCR activation or IL-2
deprivation//J. Biol.Chem. 1995. Vol.l61,№ 1. P.14-21.
11. Arditi M„ Rabat W., Yogev R. Serum TNF-a, IL-1 b, p24 antigen concentrations
and CD4+ cells at various stages of HIV-1 infection in children Pediatr //
In fee. Desease J. 1991. Vol. 10, №6. P.450-455.
12. Aukrust P., Liabakk N-В., Muller F., Lien E. et al. Serum levels of tumor
necrosis factor-a (TNF-a) and soluble TNF receptors in human
immunodeficiency virus type 1 infection correlation to clinical, immunologic
and virologic parameters// J.Infect.Dis. 1994. Vol. 169,№2. P.420-429.
13. Baler M., Werner A., Bannert N.„ Metzner K., Kurth R. HIV suppression of
interleukin 16//Nature, 1995, Vol.378,№6557, P.563.
137
14. Balkwill F. Cytokines in health and desease // Immunol.Today. 1993.
Vol.14,№4. P.149-150
15. Ban., Haour F., LenstraR. Brain IL-1 gene expression induced by peripheral
lipopolysacharide administration Cytokine. 1992. № 4. P.48-51.
16. Belec L., Dupre T., PrazurkT. et al. Cericovaginal overproduction specific
IgG HIV contrasts with normal or impaired IgA local response in HIV-
infection // J.Infect. Dis, 1995, Vol. 172, P.691-697.
17. Bender B.S., Bohnsach J.F., Sourlis S.H. et al. Demonstration of defective
C3-receptor mediated clearence by the reticuloendothelial system in
patients with AIDS //J.Clin. Invest., 1987, Vol.79, P.715-720.
18. Berberian L., Goodglich L., Kipps TJ. et al. Immunoglobulin VH3
gene products: natural ligands for HIV gp 120 // Science, 1993, Vol.261,
P.1588-1591.
19. Bettinardi A., Imberty L., Sottini A. et al. Detection of donal T cell
population with closely related T cell receptor junctional sequences in
persons at high risk for HIV infection and patients acutely infected with
HIV//J.Inf. Dis., 1997, Vol. 175, №2, P.272-282.
20. Binley J.M., Klasse P.J., Cao Y. et al. Differential regulation of the antibody
perponsestogag and env proteins of HIV type I // J.Vilology, 1997, Vol.71,
P.2799-2809.
21. Birx D.L., Redfield R.R., Tencer K., Fowier A. et al. Induction of IL-6
during human immunodefficiency virus infection // Blood. 1990. Vol.76,
№ 1. P.2303-2310.
22. Biswas P., Poli G., Orenstein J., Fauci A. Cytokin-mediated induction of
HIV expression and cell death in chronically infected U1 cells; do TNFa
and g interferon selectively kill HIV-infected cells? // J. Virology, 1994.
Vol.68,№4. P.2598-2604.
23. Boue F., Wallon C., Goujard C., Barre-Sinoussi et al. HIV induces IL-6
production by human B-lymphocytes: role of IL-4 // J.Immunol. 1992.
Vol. 148, № 12. P.3761-3767.
24. Bowland-Jones S., Tan B., McMichell A. Role of cellular immunity
in protection against HIV infection // Adv.Immunol, 1997. Vol.65.
P. 277-346.
25. Bravo R., de la Rua A.R., Sampelayo T., Balas A., Vicario J.L., Alcaide
J.F., Arnaiz-Yillena A. Predisposition asociade al sistema HLA de la
infeccion HIV en mnos nasedos de madres seropositivas: epitopos
compartidos у asociacion multi-locus // Immunologia. 1991. Vol. 10,
Suppl. 1. P.51.
26. Butera S.T. Cytokine involvement in viral permissiveness and the
progression of HIV disease // J.Cellular Biochemistry. 1993. № 53.
P.336-342.
138
Tl. Butera S.T., Roberts B.D., Folks T.M. Regulation of HIV-1 expression
by cytokine networks in CD4+ model of chronic infection//J.Immunol.
1993. Vol.150. P.625-627.
28. Cellins K., Chen B., Kolamas et al. HIV-1 Net protein protects infected
primary cells aguinst killing by CIL//Nature, 1988, Vol.391, P.397-401.
29. Chehimi J., Starr S.E., Frank 1. Impaired 11-12 Production in HIV-infected
patients// J.Exp.Med. 1994. Vol.179. P.1361-1366.
30. Cheingsong-Popov R., Panagiotidi C., Bowcock C. Relation betureen
humoral responses to HIV gag and env proteins at seroconversion and
clinical outcome of HIV infection // Br. Med J., 1991, Vol.302, P.23-26.
31. Chirmule N., Kalyanaraman V.S., Saxinder C. et al. Localization of В
cell stimulatory activity of HIV-1 to the carboxyl tcininus of gp 41 //
AIDS. Res. Hum. Retrovir., 1990, Vol.6, P.299-305.
32. Clapham P.R., Weiss R.A. HIV: spoilt for choice of coreceptors // Nature,
1997, Vol.388, №6639, P.230-231.
33. Clements-Mann M., Weinhold K., Matthews T.J. et al. Immune response
to VIR type 1 induced by canarypox expressing HIV-1 mn gp 120, HIV-
1 sf2, gp 120, or Both vaccines in seronegotive adults // J.Inf. Dis. 1998,
Vol. 177, № 5, P. 1230-1246.
34. ‘lerici M. and Shearer G.M. A TH1 TH2 switch is a critical step in the
ethiology of HIV infection//Immunology Today. 1993. Vol.14, № 3.
P.107-110.
35. Clouse K.A., Cosentino L.M., Weih K.A., Pyle S.W. et al. The HIV gp
120 envelope protein has the intrinsic capacity to stimulate monokine
production // J.Immunol. 1991. № 9. P.2892-2901.
36. Connor R.I., Sheridan K., Ceradini D. et al. Change in coreceptor use
correlotes with desease progression in HIV-1 enfected individuals //
J.Exp. Med. 1997, Vol.185,№4, P.621-628.
37. Corbpil J., Tremblay M., Richman D. HIV-induced apoptosis requires
the CD4 receptor cytoplasmic tail and is accelerated by interaction of
CD4 with P56kk // J. Exp. Med. 1996, Vol. 183, №1, P.39-48.
38. Dalglish A.G., Beverly P.Cl., Clapham P.R. et al. The CD4 antigen is an
essensial component of the receptor for the AIDS retrovirus // Nature,
1984, Vol.312, P.763-767.
39. Davey R., Chaitt D., Piscellei S. et al Subcateneous administration of
1L2 in HIV-1 infected persons // J. Inf. Dis., 1997, Vol. 175, N3, P.4,
P781-789
40. Deng H.K., Unitmaz D., Kewal Ramani V.N., Littman D.R. Expression
cloning of new receptors used by simian and human immunodeficiency
viruses//Nature, 1997, Vol.388, 6639, P.296-300.
41. Del Prete G., Maggi E., Romagnani S. Human Thl and Th2 cells:
139
functional properties, mechanisms of regulation and role in disease //
Lab.Invest. 1994. Vol.70,№3. P.299-306.
42. Devis C., Dikic I.,Unitmaz D. Signal transmission due to for HIV-1
envelopes interactions with chemokine receptors CXCR4 or CCR5 //
J.Exp.Med. 1997,Vol. 186,N10, p.296-300.
43. De Vries R.R.P. HLA and disease: from epidemiology to immunotherapy
// Eur.J.Clin. Invest. 1992. Vol.22, № 1. P.1-8.
44. Dinarello C.A. The biological properties of interleukin-1 //
Eur.Cytoc.Netw. 1994. Vol.5,№6. P.517-531.
45. Dittmer M.T., Simmens G., Hiblotts S. et al. Langerhans cellropism of
HIV tybe 1 subtypes of though isolates derived from different
transmission groups//J. Virol, 1997. Vol.71, P.8008-8013.
46. Donald J. A. Progression of HIV-related disease is associated with HLA
DQ and DR alleles defined by resrticted fragment length polimorphism
//Tissue antigens. 1992. Vol.39, № 5. P.241-248.
47. Domarchi F.D., Adda di Fagagna F., Talaschi B. et al. Activation of
transcription factor NF (kappa) В by the Fat protein in HIV type 1 // J.
Virology, 1996, Vol.70, №7, P.422-4237.
48. Doranz B.J., Grovit-Ferbas K., Sharron M.P. A small-molecule inhibitor
directed against the chemokine reseptor CXCR4 prevents its use as an
HIV-1 coreuptor//J. Exp. Med. 1997, Vol.186,№ 8, P.1395-1400.
49. Emilie D., Galanaud P. Cytokines and AIDS // Rev. Path. 1993. №43.
P.565-567.
50. Fabio G. HLA associated susceptibility to HIV infection // Clin.Exp.
Immunol. 1992. Vol.87, №1. P.20-23.
51.58 . Fauci A.S. Cytokine regulation of HIV expression // Limphokine
Res. 1992. Vol.9, №4. P.527-531.
52. Fleury S., de Boer B.J., Rizzardi P. et al. Limited CD4+ feel Is renewal in
early HIV-1 infection: effect of highly active antiretroviral therapy// Nature
Med., 1998, Vol.4,№4, P.794-801.
53. Franciotta D.M. Tumor necrosis factor alpha (TNFa) levels in serum
and cerebrospinal fluid of patients with AIDS //Funct.Neurol. 1992.
Vol.7, № 1. P.35-38.
54. Frost S.D.W., Me Lean A.R. Germinal centre detruction as a major
pathway of HIV pathogenesis// J.AIDS. 1994. Vol.7, № 3. P.236-245.
55. Furci L., Scarlatti G., Burastero S. et al. Antigen-drived CC chemokine
mediated HIV-1 suppression by CD4(+) Teel Is from expored uninfected
individuals expessing the will-type CCR-allele // J. Exp. Med., 1997,
Vol. 186, P.455-460.
56. Fust G., Dierich M., Hidvegi T. Role of humoral factors in the progression
of HIV desease//Immunology today. 1995. Vol.16, №4 P.167-169.
140
57. Gandhi R., Chen B., Straus S. et al. HIV-1 directly kills CD4 T Cells by
a Fas-independent mechanism // J. Exp. Med., 1998, Vol. 187, № 7, P. 1113-
1122.
58. Gea-Banadoche J.C., Weiskopf E.E., Hallahan C. et al. Progression of
HIV-disease in associated with increasing disruption with in the CD4+
Tcell receptor repertoire // J. Inf. Dis., 1998, Vol. 177, № 3, P.579-585.
59. GlushaCova S., Grivel J-Ch., Fitzcerald W. et. al. Evidence for HIV-1
phenotype switch as a causal factor in aquired immunodeficiency // Nature
Med., 1998, Vol.4,№3, P.346-349.
60. Goldfried M., Van Der Poll T., Weverling G. Soluble receptors for tumor
necrosis factor as predictors of progression to AIDS in asymptomatic
human immunodeficiency virus type 1 infection// J.Infect.Dis. 1994.
Vol. 169,№4. P.739-745.
61. Gorchov G., Neumann A., Kereveur A. et al. Perturbation of CD4+ and
CD8+ Tcells from an immunodominant cytotoxic T-lymphocyte response
associated with progression ofto AIDS // Nature Med., 1997, Vol.3, № 2,
P.212-217.
62. Granelli-Piperno A., Moser B., Pope M. Efficient interaction of HIV-1
with purified dendritic cells via multiple chemokine receptors // J. Exp.
Med., 1996, Vol. 184, P.2433-2438.
63. Grau G.E., Lou J. TNF in vascular pathology: the importance of platelet-
endothelium interactions. 51 st Forum in Immunology "TNF in pathology:
old facts and new questions”. 1993. P.355-363.
64. Greenway A. et al. HIV-1 Net binds directly to tck and mitogen-activated
protein kinase, inhibiting kinase activity. J. Virol, 1996, Vol.70,N10,
P.6701-6708 Habeshaw T.A. HLA mimicry by HIV-1 gp 120 in the
pathogenesis of AIDS // Immunology Today. 1994. Vol.l 5, № 1. P.39-40.
65. Groux H., Torpiep G., Monte D., Monton J. et aL Activation induces
death by apoptosis in CD4+ T cell from HIV infected asymptomatic
individuals // J. Exp.Med. 1992. Vol. 175. P.331-340.
66. Habeshaw T.A. HLA mimicry by HIV-1 gp 120 in the pathogenesis of
AIDS // Immunology Today. 1994.Vol.l 5, N1, p.39-40.
67. Hernandez-Pando R., Rook G.A.W. The role ofTNF in T-cell-mediated
inflammation depends on the Thl/Th2 cytokine balance //
Immunology. 1994. №82. P.391-395.
68. Ho D.D., Neumann A.U., Perelson A.C. et al. Rapid turnover of plasma
virions and CD4 lymphocytes in HI V-infection // Nature, 1995, Vol 373,
N6510,H.123-126.
69. Hober D., Lucas B., Wattre P., Carpon A. et al. TNF-a production by
U937 promonocytes is enchanced by factors released from HIV infected
T4 lymphocytes. TNF-a is one of the mediators cousing lisis of HIV
141
infected T4 cell // Clin.Immun. and Immunopathol., 1992. Vol.62, № 2.
P.168-175.
70. Itescu S. HLA-B35 is associated with accelerated progression in AIDS
// J.Acquir.Immune Defic. Syndr. 1992., Vol.5, № 1. P.37-45.
71 .Jongeneel C.V., Briant L., Udalova I.A. et al. Extensive genetic
polymorphism in the human tumor necrosis factor region and relation
to extended HLA haplotypes // Proc.Natl..Acad.Sci.USA, 1991,Vol.88.
P.9717-9721.
92. Mastroianii C.M. Tumor necrosis factor (TNF-alpha) and neurological
disorders in HIV infection // J.Neurol.Neurosurg. Psychiatry, 1992.
Vol.55,№3. P.219-221.
93. Matsuyama T., Kobbayashi N., Yamamoto N. Cytokines in HIV
infection: is AIDS a tumor necrosis factor disease? 11 AIDS. 1991. № 5.
1405-1417.
94. Montaner L., Gordon S. Th2 cytokines in AIDS // Lancet. 1994. Vol.344,
№8922. P.625-626.
95. Mosmann T.R. Cytokine patterns during the progression to AIDS //
Science. 1994. Vol.265. P.193-194.
96. Morris L., Binlay J.M., Clas B.A. HIV-1 antigen-specific and nonspecific
В cell responses are sensitive to combination antiretroviral therapy // J.
Exp. Med., 1998. Vol.188,№2, P.233-245.
97. Mummidi S., Ahuja S.S., Gonzalez E. et al. Genealogy of the CCR5
loius and chemokine system gene variants associated with altered rates
ofHIV-1 disease progression//Nature Med., 1998, Vol.4, № 7, P.786-
793.
98. Murkami T., Nakajima T., Koyanaqi Y. et al. A small molecule CXCR4
inhibitor that blocks T cell line tropic HIV-1 infection //J. Exp. Med.,
1997, Vol.186, № 8. P.1389-1393.
99. PakkerN., Notermans D., de Boir R. et al. Biphasic kinetics of peripheral
blood T cells after triple combination therapy of HIV-I infection: a
composite of redistribution and proliferation //Nature Med., 1998, Vol.
4, №2, P.208-214.
100. Pantaleo G. Graziosi C., Demarest J. HIV infection is active and
progressive in lymphoid tissue during the clinically latent stage desease
//Nature. 1993. Vol.362, № 641 8. P.355-358.
101. Pantaleo G., Cohen O., Schocher T., Fauci A. et al. Evolutionary
pattern of HIV replication and distribution in lymph nodes following
primary infections: implications for antiviral therapy // Nature Med.,
1998, Vol.4, №3, P.341-349.
102. Piguet P.F. TNF and the pathology of the skin. 51st Forum in
Immunology “TNF in pathology: old facts and new questions”. 1993.
142
P.320-326.
103. Poli G., Fauci A.S. Cytokine modulation of HIV expression ll Semin.
Immunol. 1993. №5. P.165-167.
104. Pope M., Gezelter S., Gallo N. et al. Low levels of HIV-1 infection in
cutaneous dendritic cells promote extensive viral replication upon
binding to memory CD4+ T cells // J. Exp. Med., 1995, Vol.182, № 6,
P.2045-2056.
105. Quilichini R., Gastaut J.A. Increased interleukin-6 production is
associated with disease progression in HIV infection//AIDS. 1991. №
5. P.1139-1140.
106. Rizzuto C.D., Wyatt R., Sodboski J. et al. A conserved HIV gp 120
glycoprotein structure involved in chemokine receptor binding //
Science, 1998, Vol.280, P 1949-1953.
107. Rook G.A.W., Vyakarnam A. Cytokines, limphokines, mycobacteria
and AIDS//Res.Microbiol. 1992. Vol.143, №4. P.406-410.
108. Rosenberg Y.J. Anderson A.O., Pabst R. HIV induced decline in
blood CD4/CD8 rations: viral killing or altered lymphocyte traffick //
Immunology today, 1998, Vol. 19, N 1, P. 10-17
109. Sneck R.F., Webrly K., Platt E.J. et al. Selective employment of
chemokine receptors as HIV-1 coreceptors determined by individual
amino acods with in the envelope V3 loop // J. Virol., 1997, Vol.71,
P.7136-7139.
110. Subbramanian R., Kessores-Elbaz A., Lodge R. et al. HI V-l Vpr is a
positive regulator of viral transcription and infectivity in primary human
//J. Exp. Med., 1988, Vol.7,№7, P.l 103-1112.
111. Tae-Wook Chun, Engel D. Misell S. Induction of HIV-1 replication in
latently infected CD4 T cells using a combination of cytokines // J.
Exp. Med., 1998, Vol, 188, N 1, P. 83-91.
112. Tenner-Racz K., Stell Brinn H.J., Schneider C. The under larged lymph
nodes of HIV-1 infected asymptomatic patients with high CD4 T cells
counts are sites for virus replication and CD4 T cell proliferation. The
impact of highly active antiretroviral therapy // J. Exp. Med., 1998,
Vol. 187, №6, P.949-960.
113. UNAIDS. Report on the global HIV/AIDS epidemic. June, 1998 //
WHO, Geneva, 1998. 73 p.
114. Verani A., Scarlatti G., Comar M. et al. Gcc chemohines released by
lipopolysaccharide (LPS) stimulated human M suppress HIV-1
infection in both В and T cells // J. Exp. Med., 1997, Vol. 1 85, № 5,
P.805-816.
115. Wei X., Ghosh S.K., Taylor M.F. et al. Viral dynamics in HIV-1
infection // Nature, 1995, Vol. 373, N 6510, Pl 17-122.
143
116. Wilson A.G., De Vries N., Pociof F., Di Gio vine F.S. et al. An allelic
polimorphism within the human TNFa promotor region is strongly
associated with HL A-Al, B8, DR3 alleles 11 J.Exp.Med. 1993. Vol. 177.
P.557-560.
117. Wolters K.C., Schuitemaker H., Miedema F. Rapid CD4 T-cell turnover
in HIV-1 infection: a paradigm revisited // Immunology today, 1998,
Vol.19, Nl, P.44-49.
118. Wu L., Gerard N.P., Wyatt R. et al. Sodorski CD4 induced interaction
of primary HIV-1 gp 120 glicoproteins with the chemokine receptor
CCR-5 //Nature, 1996, Vol.384,№6605, P. 179-183,184-187.
119. Zauli G., Vitale M., Gibellini D., Capitani S. Inhibition of purified CD34+
hematopoetic progenitor cells by HIV-1 orgp 120 mediated by endogenous
TGFb // J. Exp. Med., 1996, Vol. 183, № 1, P.99-108.
120. Zinkernagel R., Hengartner H. T-cell-mediated immunopathology versus
direct cytolysis by virus: implications for HIV and AIDS // Immunology today.
1994. Vol. 15,№ 6. P.262-268.
121. Znhon Y., Kurihara G., Rusech R-P. et al. Impaired В cell function and
enhanced T cell-dependent immune response in mice lacking CCR5, the
mouse homologue of major HIV-1 coreceptor//J.Immunol., 1998, Vol. 160,
№8, P.4018-4025.
122. Zola H., Koh L.J., Mantzioris B.X., Rhodes D. Patients with HIV infection
have a reduced proportion of lymphocytes expressing the IL2 receptor p55
chain (TAC, CD25)//Clin.Immunol. Immunopathol. 1991. Vol.59. P. 16-25.
144
Глава 2. ВИЧ-ИНФЕКЦИЯ: ЛИМФАТИЧЕСКАЯ СИСТЕМА
И СИСТЕМА КРОВЕТВОРЕНИЯ
2.1. Лимфатическая система
Лимфатическая система, включающая в себя лимфатические капилляры
и сосуды, а также находящиеся по их ходу лимфатические узлы, является
составной частью иммунной системы. Поражение лимфатической системы при
ВИЧ-инфекции у значительного числа больных сопровождается развитием
генерализованной лимфаденопатии. В связи с этим вначале рассмотрим
структуру и функционирование лимфатических узлов (рис. 4).
Рпс.4. Строение лимфатического узла.
Корковый слой лимфатического узла включает:
а) синус коркового слоя (СКС), заполненный фагоцитами; он дренирует
межклеточные пространства;
б) первичные фолликулы (ПФ), которые содержат скопления небольших
лимфоцитов в сети дендритных клеток;
в) вторичные фолликулы (ВФ), имеющие мантию, включающую те же
компоненты, что и ПФ, и зародышевые (герминативные) центры, содержащие
малые и большие лимфоциты, лимфобласты, макрофаги и дендритные клетки;
10. Заказ № К-4451.
145
г) диффузный корковый слой (ДКС), где находится большое количество
малых лимфоцитов, макрофагов и высокоэндотелиальных венул (ВЭВ).
Мозговой слой включает:
а) синус мозгового слоя (СМС), который заполнен фагоцитами и служит
для миграции циркулирующих Т- и В-лимфоцитов, лимфобластов после
антигенной стимуляции;
б) мякотные шнуры (МШ) - пространства, содержащие плазматические
клетки и лимфобласты.
Лимфа, содержащая лимфоциты, макрофаги и, время от времени,
антигены, циркулирует через органы лимфатической системы, в т.ч. через
лимфатические узлы, под действием осмотического давления и сокращения
мышц. При этом она проходит по афферентным сосудам и далее синусам
лимфатического узла, представляющим собой систему полостей, выстланных
макрофагами. Лимфоциты, содержащиеся в лимфе, фильтруются через ткани
лимфатического узла, при этом В-лимфоциты мигрируют в фолликулы, а Т-
лимфоциты остаются в диффузном корковом слое. Часть лимфоцитов достигают
ВЭВ диффузного коркового слоя, прикрепляются к специализированным
эндотелиальным клеткам и, проникая в кровеносное русло, покидают
лимфатическую систему.
Как известно, целый ряд патологических процессов в лимфатической
системе вообще, и в лимфатических узлах в частности, от лимфаденопатии до
злокачественных лимфом, ассоциированы с ВИЧ-инфекцией. Однако ВИЧ-
ассоциированная лимфоидная пролиферация может быть обусловлена и другими
инфекционными агентами, такими, как микобактерии пневмоцисты,
герпетические вирусы, риккетсии, и др. [5,12].
Причины поражения лимфатической системы при ВИЧ-инфекции.
К основным причинам развития поражений лимфатической системы при
ВИЧ-инфекции относятся:
1 .прямое воздействие ВИЧ на лимфатическую систему;
2 .вторичные инфекции, вызванные оппортунистическими и патогенными
облигатными паразитами;
3.опухоли.
1. Прямое воздействие ВИЧ на лимфатическую систему.
Клетками-мишенями для ВИЧ в лимфатической системе являются
прежде всего СЭ4-лимфоциты, дендритные клетки, моноциты/макрофаги и в
значительно меньшей степени какие-либо другие клетки. Уже на ранних стадиях
ВИЧ-инфекции они оказываются зараженными ВИЧ, что предопределяет
дальнейшее поражение лимфатической системы другими вирусами и
оппортунистическими агентами по мере прогрессирования заболевания.
146
Рассмотрим наиболее значимые для клиницистов результаты прямого
воздействия ВИЧ на лимфатическую систему, касающиеся в основном
поражения лимфатических узлов.
Установлено, что реакция лимфоузлов при ВИЧ-инфекции подразделяется
на несколько типов, которые представляют собой последовательные стадии
динамического процесса, начинающегося с гиперплазии и заканчивающегося
атрофией [6]. Эти стадии в значительной степени коррелируют с симптомами
развивающейся болезни.
Выделяют следующие типы (стадии) лимфаденопатии:
1. фолликулярная гиперплазия;
2. гиперваскулярный фолликулярный тип;
3. смешанный фолликулярный тип;
4. фолликулярная инволюция с лимфоидным истощением.
При фолликулярной гиперплазии (называемой еще нередко
эксплозивной) фолликулы очень крупные, неправильной формы, иногда
распространяются почти на весь узел [6]. Гиперплазированные герминативные
(зародышевые) центры окружены мантийными зонами, которые часто
выглядят прерывистыми и утрачивают характерное концентрическое
расположение лимфоцитов, последние могут проникать в герминативные
центры. По мере укрупнения фолликулов внутри герминативных центров
увеличивается количество центробластов, видны многочисленные митозы.
Исследование с помощью моноклональных антител показало возрастание
субпопуляции CD8- и CD 19-лимфоцитов [11,16]. В парафолликулярных синусах
много моноцитоидных клеток со слабо эозинофильной цитоплазмой.
Электронномикроскопические и иммуноморфологические данные
показывают, что дендритные клетки и Т-лимфоциты в герминативных центрах
инфицированы ВИЧ, в них обнаружена активация вирусной РНК [11,14].
Паракортикальная зона также обычно гиперплазирована, представлена
преимущественно малыми лимфоцитами, иммунобластами, встречаются
нейтрофильные лейкоциты. Характерным является снижение соотношения
CD4- и СО8-лимфоцитов за счет уменьшения количества СО4-лимфоцитов.
Патоморфологическую картину дополняют: увеличение числа плазматических
клеток, большое количество расширенных и полнокровных сосудов,
гемофагоцитирующих макрофагов, мелких скоплений полиморфноядерных
лейкоцитов, многоядерные гигантские клетки, подобные обнаруживаемым
при вирусных инфекциях, многоядерные иммунобласты. Изучение
цитокиновой активности в лимфатических узлах при ВИЧ-инфекции
позволило установить прямую зависимость между уровнем образования у-
интерферона и степенью лимфаденопатии, атакже прямую зависимость между
Уровнем активности интерлейкинов (ИЛ-2 и ИЛ-4) и активацией В-
лимфоцитов [4].
10*
147
Гиперваскулярный фолликулярный тип лимфаденопатии у больных
СПИДом часто ассоциирован с саркомой Капоши; характеризуется
изменениями, напоминающими ангиофолликулярную гиперплазию. В ткани
лимфоузлов увеличено количество плазматических клеток, много мелких
древовидноветвящихся кровеносных сосудов; спектр изменений фолликулов
широк - от крупных с гиперплазированными герминативными центрами до
гиалинизиро ванных.
Смешанный фолликулярный тип лимфаденопатии характеризуется
наличием как гиперплазированных, так и инволютивных фолликулов с
уменьшением числа дендритных клеток, заселением паракортикальной зоны
плазматическими клетками и редукцией СЭ4-лимфоцитов. Причем разрушение
дендритных клеток относится к наиболее частым патологическим изменениям,
наблюдаемым в герминативных центрах лимфатических узлов при ВИЧ-
инфекции [3,8]. Предполагают, что активное участие в этом принимают
цитотоксические СО8-лимфоциты [15]. Этот тип лимфаденопатии чаще
наблюдается при возникновении оппортунистических инфекций.
Фолликулярная инволюция с лимфоидным истощением характеризуется
полным отсутствием различимых фолликулов и герминативных центров.
Описывают два морфологических варианта этой стадии: первый
характеризуется большим количеством иммунобластов, плазматических клеток
и пролиферирующих кровеносных сосудов (налом инаетангиоиммунобластную
лимфаденопатию); второй - почти полной редукцией лимфоцитов, обилием
гемофагоцитирующих макрофагов; сохранившиеся лимфоциты представлены
СО8-лимфоцитами. Отмечается большая выраженность субкапсулярного и
синусоидального фиброза [ 1 ].
Клинические проявления стадии острой ВИЧ-инфекции обычно включают
симптомы полиаденопатии [1, 2, 10]. Увеличение периферических
лимфатических узлов чаще всего начинается с затылочной или заднешейной
области, позднее увеличиваются подчелюстные, подмышечные и паховые
лимфоузлы. Они имеют размеры 1-3 см в диаметре, мягковато-эластическую
консистенцию, не спаяны друг с другом и безболезненны. Кожа над ними не
изменена. Продолжительность полиаденопатии, возникшей в стадии острой
ВИЧ-инфекции, обычно составляет 2-4 нед [1]. В некоторых случаях
прогрессирующего течения заболевания полиаденопатия не ликвидируется в
эти сроки, а трансформируется в персистирующую генерализованную
лимфаденопатию (ПГЛ) [1,13].
Диагностическими критериями ПГЛ при ВИЧ-инфекции являются: 1)
невоспалительное увеличение лимфатических узлов в 2 и более областях; 2)
длительность состояния более 3 месяцев; 3) отсутствие связи лимфаденопатии
с другими патологическими процессами, способными вызвать увеличение
лимфоузлов. При неподтвержденном диагнозе ВИЧ-инфекции обязательным
148
является назначение диагностических тестов (ИФА и др.) для ее подтверждения
[9]. Биопсия лимфатических узлов, выполненная в эти сроки, позволяет обычно
выявить признаки фолликулярной гиперплазии.
В ранние стадии ВИЧ-инфекции описано развитие синдрома
гиперлимфоцитоза, характеризовавшегося повышенным содержания CDS-
лимфоцитов в периферической крови, диффузной лимфоцитарной
инфильтрацией тканей различных органов и ПГЛ [7]. Клинические проявления
варьировали в зависимости от стадии заболевания и интенсивности
инфильтрации тканей различных органов. При этом синдроме наблюдали:
интерстициальную пневмонию, поражение слюнных желез, псевдотуморозную
спленомегалию, периферическую нейропатию. Предполагают, что этот синдром
является следствием иммунной реакции на ВИЧ-инфекцию индивидуумов,
имеющих следующие виды HLA-антигенов: HLA-DR5 и HLA- А1, В8, DR.3 [7].
В более поздние сроки прогрессирующего заболевания, особенно в случае
развития оппортунистических инфекций, лимфатические узлы постепенно
уплотняются и становятся плотновато-эластической консистенции.
Морфологически этому соответствует смешанный фолликулярный тип
лимфаденопатии.
В терминальном периоде заболевания наблюдается заметное уменьшение
и даже как бы исчезновение большинства из увеличенных в предшествующем
лимфатических узлов. Морфологическое исследование выявляет
фолликулярную инволюцию с лимфоидным истощением. Так, при физикальном
обследовании, проводившемся за 3 дня до смерти первой из умерших от СПИДа
в Ленинграде в 1988 г. больной Г., 29 лет, с нераспознанной при жизни
Пневмоцистной пневмонией, не выявлено увеличения каких-либо групп
лимфатических узлов. На аутопсии, как особенность случая, отмечены малые
размеры бронхопульмональных лимфоузлов (на фоне тяжелой легочной
патологии). Морфологические данные свидетельствовали о полном стирании
рисунка узлов и обеднении их лимфоидными элементами. В синусах и
субкапсулярно отмечено скопление крупных клеток со светлой цитоплазмой.
Среди клеточного состава преобладали зрелые лимфоциты. Эндотелий синусов
- набухший.
Динамика изменений периферических лимфатических узлов в разные
периоды течения ВИЧ-инфекции хорошо видна на примере течения заболевания
У больного С.
Больной С., 58 лет, поступил в Городскую инфекционную больницу №
30 им. С.П.Боткина в Санкт-Петербурге в сентябре 1993 г. с диагнозом:
опоясывающий герпес, грибковый стоматит. При обследовании была выявлена
ВИЧ-инфекция в стадии 111 А-Б. Объективно отмечались: умеренная
интоксикация, субфебрильная температура, сухой кашель, распространенные
герпетические высыпания на коже поясничной области, правой ягодицы и бедра,
149
правого коленного и голеностопного суставов, выраженный болевой
синдром. На слизистой оболочке твердого неба, язычка - кандидозные
наложения. При осмотре пальпировались множественные переднешейные,
заднешейные, надключичные, подмышечные лимфатические узлы
размерами около 1 см в диаметре плотновато-эластической консистенции;
подчелюстные лимфоузлы были мелкими и болезненными. Через месяц,
при улучшении общего самочувствия и состояния на фоне лечения
антибактериальными, антимикотическими препаратами и витаминами,
обращало на себя внимание увеличение до 1,5-2,0 см и изменение до
мягковато-эластической консистенции всех групп лимфоузлов. Клинически
был выставлен диагноз: ВИЧ-инфекция III Б; ороэзофагиальный кандидоз;
опоясывающий герпес; правосторонняя среднедолевая пневмония;
себорейный дерматит лица; разноцветный лишай; микоз стоп с
онихомикозом; ЦМВ-инфекция, латентная стадия; хронический
пиелонефрит вне обострения. В гемограмме: анемия (гемоглобин - 113 г/
л), ретикулоцитоз, умеренная тромбоцитопения, значительное ускорение
СОЭ (до 56 мм), которое сохранялось и при выписке (другие показатели
нормализовались). В иммунограмме в этот период заболевания: CD4- 21%
(231)-» 26,3 % (334); CDg - 48,5% (533) -» 41,5% (536); коэффициент CD,
/CDs-0,43 —> 0,62; CD,0-33 % (363)-» 19,4 % (230).
Заболевание прогрессировало и уже в конце 1995 г. ВИЧ-инфекция у
больного была в стадии СПИД. При очередном, в период ухудшения,
стационарном лечении в больнице № 30 (декабрь 1995 г.) отмечалась заметная,
по сравнению с предыдущими госпитализациями, динамика лимфоаденопатии.
Пальпировались мелкие (менее 1 см в диаметре) заднешейные и подчелюстные
лимфоузлы, имевшие плотновато-эластическую консистенцию. Через 2 месяца
на фоне постепенного ухудшения общего состояния шейные лимоузлы уже
не пальпировались, единичные подмышечные имели размеры не более 0,5 см
в диаметре. При лабораторном исследовании в гемограмме определялись:
значительная тромбоцитопения, лейкопения, СОЭ была ускорена до 60 мм/ч.
Иммунологические показатели также были резко изменены (при поступлении
и после начала стационарного лечения): CD4 -26 % (195) —» 27 % (218), CDS -
26 % (193)-» 30 % (243), CD16-19%(142,9)-»26%(211),CD2,-16%(120)->
26 % (211), CD,() - 21 % (158) -» 27 % (218), IgM - 2 -»1,7, IgA -6,5 -» 5, IgG
-18-» 13,6,ЦИК-0,1 -» 0,11.
Несмотря на проводимое лечение, состояние больного постоянно
ухудшалось и в августе 1996 года он скончался. Посмертно был выставлен
диагноз: ВИЧ-инфекция встадии СПИДа; подострый вялотекущий энцефалит.
СПИД-дементный комплекс; двусторонняя пневмоцистно-бактериальная
пневмония; ороэзофагиальный кандидоз; себорейный дерматит лица, микоз
стоп с онихомикозом; ЦМВ-инфекция (латентная стадия); кахексия.
150
Сопутствующие заболевания: хронический пиелонефрит; остеохондроз
грудного отдела позвоночника; атеросклероз сосудов головного мозга с
преходящим нарушением мозгового кровообращения.
Таким образом, наши данные, как и наблюдения других клиницистов
[1], свидетельствуют о том, что при прогрессировании ВИЧ-инфекции наличие
во всех региональных группах мелких плотных лимфатических узлов
прогностически менее благоприятно, чем преобладание крупных с мягковато-
эластической консистенцией лимфоузлов.
II. Поражения лимфатической системы, вызванные вторичными
инфекциями.
В основе этого вида поражений лежит воздействие оппортунистических
и облигатно патогенных паразитов на органы лимфатической системы. Так,
массивное поражение лимфатических узлов при СПИДе возбудителями
оппортунистических инфекций нередко вызывает в них гранулематозные
процессы. Инфекции, вызванные облигатно патогенными паразитами, крайне
агрессивны, быстро генерализуются, устойчивы к терапии [12].
III. Опухоли.
При быстром локальном увеличении лимфатических узлов у больного
СПИДом следует думать о саркоме Капоши или о злокачественной лимфоме;
особенно характерно поражение этими опухолями бедренных,
парааортальных, забрюшинных лимфоузлов. Бубоны обычно наблюдаются
при злокачественной лимфоме. Они требуют дифференциации с поражением
лимфатических узлов микобактериями. Биопсия лимфатического узла с
последующим морфологическим исследованием является в таких случаях
обязательным диагностическим мероприятием.
Литература.
I. Лысенко А.Я.,Турьянов М.Х., Лавдовская М.В., Подольский В.М. ВИЧ-
инфекция и СПИД-ассоциируемые заболевания,- М., 1996. -624 с.
2. Рахманова А.Г., Чайка Н.А. Синдром приобретенного иммунодефицита
(СПИД). Рекомендации для врачей,- Л. -1989. -120 с.
3. Хаитов Р.М., Игнатьева ГА. СПИД,- М., 1992,- 352с.
4. Boyle M.J. et al. //Clin. Exp. Immunol.- 1993,- v.92, N1.- p. 100-105.
5. Brousset P. et al. //Hum Pathol.- 1996,- v.27, N3.- p.263-268.
6. Chadburn A. et al. //Hum. Pathol.- 1989,- v.20.- p.579-587.
7. Malbec D. et al. //Rev Med Interne.- 1994.- v. 15, N10.- p. 630-633.
8. Mori S. //Virchows Arch.- 1994.- v.424, N4.- p.397-401.
9. Paauw D.S. et al.//JAMA.- 1995.-v.274,N 17,-p. 1380-1382.
151
10. Pedersen C. et al. //Ugeskr Laeger. 158(18):2526-9,1996 Apr 29.
11. Peuchmaur M. et al. //Pathol. Res. Pract.- 1989,- v. 185, N1.- p. 123
12. Said J.W. //Semin. Diagn. Pathol.- 1997,- v.14, N1.- p.48-53.
13. Schechter M.T. et al. //J. Acquir. Immune Defic. Syndr. Hum. Retrovirol.-
1995,- v.8,N5.- p.474-479.
14. Schmitz J., et al.//J. Immunol.- 1994,-v. 153, N3.- p. 1352-1359.
15. Sunila I. et al. //Histopathology.- 1997.- v.30, N1.- p.31-40.
16. Vitolo D. et al. //Pathol. Res. Pract. - 1989.- v. 185, N1.- p. 170.
2.2. ВИЧ-инфекция и система кроветворения
Одними из факторов, способствующих прогрессированию ВИЧ-инфекции,
являются нарушения, развивающиеся в системе кроветворения у ВИЧ-
инфицированных больных. Спектр этих изменений довольно многообразен и
касается всех звеньев гемопоэза, как периферической крови, так и костно-
мозгового кроветворения.
Характерным для ВИЧ-инфекции является уменьшение числа CD4-
лимфоцитов,заканчивающееся выраженным иммунодефицитом (4,16,29). Schittman
с соавт. (1988) считают, что ВИЧ может инфицировать все клетки крови, имеющие
CD4 рецептор. Этого же мнения придерживаются Р.М.Хаитов и Г.А.Игнагьева (1992),
выделяя прямые клетки-мишени для ВИЧ в организме человека.
Под цитопатогенным эффектом следует понимать не только уменьшение
количества клеток, но и нарушение их функции, возникающее при репликации
ВИЧ внутри клетки (3). Разрушительный цитопатогенный эффект отсутствует в
двух группах клеток: дендритных лимфоцитах и их предшественниках и
моноцитах /макрофагах.
В крови содержание дендритных лимфоцитов не превышает 1 % от числа
ядерносодержащих клеток. Незрелой формой этих клеток считают клетки
Лангерганса, которые, так же как и дендритные клетки, локализуются в слизистой
и коже. Предполагают, что эти клетки могут первыми инфицироваться ВИЧ,
учитывая их локализацию. Физиологической функцией дендритных клеток
является представление чужеродного антигена Т-лимфоцитам. Р.М.Хаитов и
Г. А.Игнатьева (1992) указывают, что дендритные клетки продуцируют ВИЧ в 30
раз больше, чем СО4-лимфоциты, при этом пролиферации и гибели дендритных
клеток не происходит. По их мнению, дендритные клетки одинаково легко
заражаются всеми изолятами ВИЧ.
Репликация вируса ВИЧ в клетках моноцитарно-макрофагального звена
происходит с ускоренной интенсивностью без цитонекротического как
изолированно, так и в комбинации между собой. Сочетание этих изменений
чаще выявляется на поздних стадиях заболевания (33, 34).
152
действия вируса. Уменьшения числа моноцитов практически не
наблюдается и в поздней стадии СПИДа (10), а изменения их
функциональной активности связаны с уменьшением цитокинетической
активности лимфоцитов (11).
Взаимодействие ВИЧ с эозинофилами осуществляется путем
связывания gp 120 с CD4 рецептором, который представлен на
плазматической мембране эозинофила и имеет такую же структуру, как и у
CD4 лимфоцитов (17).
Тимоциты заражаются всеми изолятами ВИЧ. Репликация вируса
в этом типе клеток, по сравнению с CD4 лимфоцитами периферической
крови, происходит более эффективно (26). Особенно эффективная
репликация ВИЧ отмечается в клетках предшественниках, которые
экспрессируют одновременно на своей поверхности антигены CD4 и CD8.
Большое значение имеет поражение этих клеток в патогенезе заболевания
ВИЧ-инфекцией у детей. Гимус у детей является высокоэффективным
продуцентом ВИЧ, причем в тимусе отсутствует нормальная
физиологическая регенерация клеток.
Следующим типом клеток, которые поражает ВИЧ, являются
В- лимфоциты. Эти клетки, как и тимоциты, инфицируются всеми
изолятами ВИЧ. Цитолиз В-лимфоцитов наблюдается только при
сочетанном поражении В-лимфоцитов ВИЧ и вирусом Эпштейн-Барр. В
клетках, неинфицированных вирусом Эпштейн-Барр, процесс репликации
ВИЧ имеет вялотекущий характер без цитолиза. Однако поражение
В-лимфоцитов ВИЧ может быть в равной мере как при инфицировании
вирусом Эпштейн-Барр, так и без него. Наличие CD4 рецепторов при
поражении В-лимфоцитов не является обязательным фактором (20).
Изменения периферической картины крови при ВИЧ-инфекции
зависит от стадии заболевания. Наиболее отчетливые нарушения
отмечаются в позднюю стадию заболевания.
Таблица 26
Характеристика изменений периферической картины крови у
ВИЧ-1 инфицированных больных (по Re М., Zauli G.)
Стадия заболевания Начальная стадия Поздняя стадия
Нейтропения +1- ++
Анемия +/- +
Ретикулоцитопения - +
Тромбоцитопения +/- т
Моноцитопе н и я - +
Изменения периферической картины крови, а именно, нейтропения,
анемия, тромбоцитопения, могут встречаться у больных ВИЧ-инфекцией
153
Развитие нейтропении обычно совпадает с появлением
оппортунистических инфекций и усугубляется использованием средств,
применяемых при лечении этих инфекций, а также AZT (5). Abraham N.G.
et. al. (1993), исследуя токсическое влияние AZT на кроветворные клетки
костного мозга, показал, что AZT угнетает рост и развитие множества
кроветворных клеток, в том числе и гранулоцитарный росток. Механизмы
развития цитопении в периферической крови при выраженной клинической
симптоматике ВИЧ-инфекции разнообразны. Одним из факторов,
способствующих возникновению анемии, является дефицит витамина В 2
и фолиевой кислоты. Однако это не имеет существенного значения в
развитии анемии. Наиболее вероятным механизмом анемии при ВИЧ-
инфекции следует считать гипопролиферацию клеток эритроидного ряда,
на что указывает ретикулоцитопения (33).
В последние годы показано, что одним из регуляторов эритропоэза
является интерлейкин-1 (ИЛ-1) (12). Установлено, что ИЛ-1 способствует
вступлению в S-фазу ранних гемопоэтических предшественников (КОЕс)
и дозозависимым образом повышает число КОЕс-9 в костном мозге. Число
гранулоцитарных, моноцитарных, мегакариоцитарных колоний также
возрастает под влиянием больших доз ИЛ-1. Действуя синергично с
эритропоэтином, ИЛ-1 стимулирует и рост ранних эритроидных
предшественников (КОЕ-Э) как в костном мозге, так и в селезенке. В то
же время поздние стадии эритропоэза под влиянием ИЛ-1 угнетаются,
что проявляется уменьшением числа ретикулоцитов и эритроцитов в
периферической крови. Показано также, что в присутствии ФИО ИЛ-1
вызывает супрессию эритропоэза (32).
Довольно частым и единственным проявлением гематологических
изменений у ВИЧ-инфицированных как в стадии СПИДа, так и при
асимптомном течении инфекции может быть тромбоцитопения (7, 30,
35). Как известно, рецепторы CD4 на тромбоцитах отсутствуют, что
исключает прямое воздействие ВИЧ на эти клетки. R.S.Busch с соавт.
(1990), исследуя кроветворный костный мозг с использованием
специфических моноклональных антител к мегакариоцитам,
установили, что мегакариоциты составляют около 0,4% от
ядерносодержащих клеток костного мозга и на 25% этих клеток
экспрессирован антиген CD4, примерно в тех же количествах, что и на
Т-лимфоцитах. Наличие CD4 антигена на этих клетках дает право
говорить о прямом поражении вирусом ВИЧ мегакариоцитов и
объясняет патогенез тромбоцитопении при ВИЧ-инфекции. Помимо
этого механизма тромбоцитопения у ВИЧ-инфицированных может быть
обусловлена аутоиммунной агрессией (6, 35).
154
Основной клеткой-мишенью для ВИЧ являются Т-лимфоциты. ВИЧ
оказывает на Т-лимфоциты выраженное цитопатогенное действие, вызывая
их цитолиз при интенсивной репликации. Во-вторых, в результате взаимо-
дейтсвия gp 120 и CD4 рецепторов Т-лимфоцитов происходит слияние кле-
ток с образованием синцитиев (4, 24, 25). В третьих, гибель
Т-лимфоцитов может происходить в результате аутоиммунного воздейст-
вия, а также в результате поражения клеток памяти Т-лимфоцитов (16). Ци-
топатогенный эффект воздействия ВИЧ способствует нарушению функ-
циональной активности Т-лимфоцитов, что ведет к изменению их пролифе-
ративной и цитокинетической активности (25). Кроме этого, состояние и
функциональная активность Т-лимфоцитов регулируется опосредованно
стромой костного мозга через лимфоидных предшественников (18, 19).
У большинства больных ВИЧ-инфекцией выявляются нарушения
кроветворной функции костного мозга (8, 23, 36). Наиболее общим син-
дромом поражения костного мозга при ВИЧ-инфекции является миелодис-
плазия. Несмотря на наличие в периферической крови цитопении, при ис-
следовании костномозговой ткани у больных ВИЧ-инфекцией в начальной
стадии определяются гиперпластические нарушения (15). Однако при про-
грессировании заболевания развивается гипоплазия.
Таблица 27
Изменения костного мозга у ВИЧ-инфицированных (по Re М.)
ранняя стадия поздняя ста- дия
Гранулоцитарный росток норма/гиперплазия гипоплазия
Эритроцитарный росток норма/гипсрплазия гипоплазия
Мегакариоцитарный росток норма/гиперплазия гипоплазия
Лимфоциты Т-клетки в спокойном или активном состоянии
Плазмоциты Увеличение числа
Полученные нами результаты изучения состояния костного мозга у 8
ВИЧ-инфицированных больных подтверждают имеющиеся литературные дан-
ные. У 3 больных ВИЧ инфекцией в стадии 2В (по В.И. Покровскому) имело
место нормальное количество клеток костного мозга, у 4 больных ВИЧ-
инфекцией в стадии ЗА была обнаружена гипоплазия костного мозга и у одного
155
больного в стадии ЗБ костный мозгбыл повышенной клеточности, с преобладанием
молодых и уменьшением количества зрелых клеток. У всех ВИЧ-инфицированных
больных были выявлены признаки дисмиелопоэза. Эритроидный росток
характеризовался нарушением структуры эритроидных островков, увеличением
макрофагов среди эритрокариоцитов, появлением мегабластов и многоядерных
эритроидных элементов. Гранулоцитарный росток характеризовался снижением
количества зрелых гранулоцитов и нарушением локализации молодых клеток,
которые располагались не эндостально, а в центральных отделах лакун.
Дисмегакариопоэз характеризовался увеличением среди мегакариоцитов клеточных
форм с резким уменьшением объема цитоплазмы. Зачастую на светооптическом
уровне определить цитоплазму было практически невозможно. На этом фоне в
костном мозге ВИЧ-инфицированных больных выявлялось увеличение
лимфоцитов, плазмоцитов и гистиоцитарных элементов.
У всех обследованных ВИЧ-инфицированных больных были обнаружены
структурные перестройки кроветворного микроокружения. Объем
синусоидальных сосудов в гистологических препаратах больных хотя и не
отличался от показателей здоровых лиц - 5,2±0,7% (у здоровых - 5,0±1,0%),
однако обращало на себя внимание появление эндотелиоцитов с крупными
просветленными ядрами, апо периферии сосудов обнаруживались лимфоидные
и плазмоцитарные скопления. При анализе интрамедуллярных ретикулярных
клеток установлено увеличение их количества в костномозговых лакунах -
6,9±0,7 (у здоровых - 2,9±0,8). Наряду с увеличением количества ретикулярных
клеток у 5 больных выявлен очаговый ретикулярный склероз. Это больные
ВИЧ-инфекцией в стадии ЗА и один больной в стадии ЗБ, у которого
ретикулярный склероз был особенно выражен.
Увеличение объема жировой ткани костного мозга установлено у 4 ВИЧ-
инфицированных. Объем трабекулярной кости при ВИЧ-инфекции не изменялся.
Однако на поверхности костных балок у ВИЧ-инфицированных больных
происходило уменьшение количества эндостальных стромальных клеток -
0,7±0,02 (у здоровых 1,3±0,1).
Следует отметить, что наиболее выраженные изменения картины
костного мозга были выявлены у больного Г'., 28 лет, инфицированого
предположительно при гомосексуальном контакте в 1991 г. К моменту
проведения исследования ему был поставлен диагноз ВИЧ-инфекция в стадии
3-Б, персистирующая генерализованная лимфаденопатия, рецидивирующий
простой герпес кожно-слизистая форма вне обострения. Состояние пациента
расценивалось как удовлетворительное. Показатели периферической крови
у данного больного практически не отличались от картины крови здорового
человека: Hb 110 г/л, эритроциты 3,5х10|2/л, лейкоциты4900, палочкоядерные
- 5%, сегментоядерные элементы - 43%, эозинофилы - 3%, лимфоциты - 42%,
моноциты - 7%, СОЭ - 10 мм/ч. Существенные изменения были выявлены
156
при исследовании Т-лимфоцитов: CD4 - 173х109/л, CD8 - 276х109/л.
Противовирусная терапия больному не проводилась. Каких-либо жалоб на
состояние здоровья больной не предъявлял. Клинические данные и
самочувствие больного не соответствовали тем выраженным изменениям
структуры костного мозга, которые были выявлены при исследовании
трепанобиоптата. Обнаруженные изменения костного мозга: нарушение
структуры эритроидных островков с преобладанием молодых форм,
уменьшение объема зрелых гранулоцитов и очаговый склероз стромальной
ткани указывали на тяжелое прогрессирующее течение инфекции. Через два
месяца состояние больного резко ухудшилось. Появились жалобы на
выраженную слабость, периодические обморочные состояния, нарушения
зрения. С подозрением на черепно-мозговую травму больной в бессознательном
состоянии был госпитализирован в стационар на 7 день от момента появления
жалоб. На пятый день пребывания в стационаре больной умер, не приходя в
сознание. При аутопсическом исследовании костномозговой ткани структурные
изменения ее характеризовались сниженной клеточностью, уменьшением
объема эритроидных клеток и гранулоцитов, малофункционально активными
мегакариоцитами, гистио-плазмоцитарными скоплениями и обширными
очагами желатиноидного перерождения костного мозга.
Представленные данные свидетельствуют, что при ВИЧ-инфекции
структурные изменения костного мозга затрагивают как гемопоэтическую ткань,
так и стромальные элементы костного мозга. Дисмиелопоэз может быть
обусловлен рядом причин. Как известно, нарушение пролиферации и
дифференцировки кроветворных клеток при ВИЧ-инфекции связаны с
непосредственным вирусным поражением клеток-предшественниц гемопоэза
(7). Кроме того, одним из факторов, способствующих миелодисфункции, может
быть вирусное инфицирование клеток кроветворного микроокружения с
последующим изменением их свойств (28). В литературе имеются сведения о
непосредственном вирусном поражении эндотелия синусоидальных сосудов и
изменении их функциональных способностей (21). Стромальные фибробласты
костного мозга могут инфицироваться как ВИЧ-1, так и ВИЧ-2, но интенсивной
репликации вируса в них не наблюдается. Кроме того, если рядом со
стромальными клетками находятся Т-лимфоциты, то возможно и их
инфицирование (13). В результате прямого воздействия ВИЧ на стромальные
клетки происходит нарушение их функциональной активности. Снижается
выработка ими колониестимулирующих факторов (9, 22), влияющих на
пролиферацию и дифференцировку клеток-предшественников не только
миелоидного ряда, но и лимфоидных предшественников.
Нарушение морфофункциональной активности стромальных клеток
костного мозга выявляется на любой стадии ВИЧ-инфекции (22). При
проведении исследования состояния костного мозга у наших пациентов,
157
находящихся на разных стадиях ВИЧ-инфекции, нами были получены
аналогичные результаты.
Поражение стромальных клеток при ВИЧ-инфекции обусловлено не
только прямым цитопатогенным действием вируса. Как известно, при ВИЧ-
инфекции происходит гиперпродукция провоспалительных цитокинов
ФНО-а, ИЛ-ip, ИЛ-6 (1). Доказано, что цитокины лимфоцитарного и
макрофагального происхождения ФНО-а и ИЛ-ip оказывают регуляторное
воздействие на функциональную активность клеток костного мозга (2).
ФНО-а оказывает свое воздействие на клетки мишени через специфические
рецепторы двух видов, а большинство клеток-мишеней гемопоэтического ряда
экспрессируют оба вида этих рецепторов (6). ФНО-а способен оказывать
цитостатическое и цитолитическое действие на различные нормальные и
трансформированные клетки in vitro (30). Он также вызывает ингибирование
продукции стромальными клетками колониестимулирующих факторов(14).
Большое значение в патогенезе нарушений функциональной активности
стромальных клеток костного мозга при ВИЧ-инфекции имеет наличие ко-
инфекции, и, прежде всего, цитомегаловирусной (ЦМВИ). Инфицирование
цитомегаловирусом здоровых лиц обычно приводит к легкому или
субклиническому заболеванию, не вызывая у них каких-либо гематологических
нарушений. Развитие ЦМВИ наблюдается главным образом у иммунодефицитных
пациентов, в том числе и ВИЧ- инфицированных. ЦМВ может инфицировать как
гемопоэтические клетки-предшественники, так и стромальные клетки. Можно
констатировать, что клетки костного мозга являются мишенью для ЦМВ-
диссеминации. В результате дополнительного инфицирования ВИЧ-пациентов
ЦМВ явления лимфо- и миелосупрессии у них могут быть более выраженными
и связанными как с прямым угнетением роста клеток-предшественниц, так и с
недостаточностью саморегенерации стволовой клетки, вызванной дисфункцией
стромальных клеток. ЦМВ может проявлять свои супрессивные действия на
кроветворные клетки, оказывая как прямое воздействие, так и опосредованное,
способствуя нарушению их цитокинетической активности (27).
Спорным является вопрос об инфицировании ВИЧ полипотентной
стволовой кроветворной клетки (ПСКК). Предположение о возможности
инфицирования ПСКК ВИЧ высказывалось некоторыми исследователями на
основании того, что уже на ранних стадиях ВИЧ-инфекции может наблюдаться
снижение клеток-предшественников гранулоцитарного, эритроидного и
мегакариоцитарного ряда (34). Эти предположения при попытке заражения
ВИЧ ПСКК in vitro не были подтверждены (22). Отрицательные результаты были
получены также при исследовании клеток CD34 методом полимеразной цепной
реакции с целью выявления наличия включений ВИЧ.
Снижение числа клеток предшественников и нарушение их функции
связывают с нарушением регуляторной функции стромальных клеток костного
158
мозга у больных ВИЧ-инфекцией. Пролиферация и дифференцировка
кроветворных клеток-предшественников, включая лимфоидные, регулируется
стромальными клетками костного мозга посредством межклеточных контактов
и стромальных цитокинов (35). Уменьшения числа костномозговых
гемопоэтичеких предшественников у этих больных может быть вызвано
гиперпродукцией ФНО-а, который ингибирует также и рост ПСКК (24).
Негативное действие ФНО-а оказывает и на формирование колониеобразующих
клеток гранулоцитарной, моноцитарной и эритроидной природы (8).
Гематологические нарушения, выявляемые при ВИЧ-инфекции, не являются
ведущими клиническими симптомами в картине заболевания. Однако выраженность
этих изменений указывает на тяжелое прогрессирующее течение инфекции.
Следует отметить, что наибольшее значение имеют изменения
функциональной активности стромальных клеток, которые могут быть
обнаружены на ранних стадиях ВИЧ-инфекции. НарушенШ их функциональной
активности способствует прогрессированию развития иммунодефицитного
состояния, причем морфологические и функциональные изменения клеток
костного мозга и стромальных клеток могут быть обнаружены раньше, чем
уменьшение числа CD-4 лимфоцитов в периферической крови.
Своевременная коррекция этих нарушений, возможно, могла бы
уменьшить развитие иммунодефицитного состояния. По мнению некоторых
исследователей (19, 22, 28), существенным фактором, который следует
учитывать при разработке новых методов лечения, является то, что ВИЧ не
поражает CD34 клетки предшественницы. Клетки CD34, по их же мнению,
могут стать стратегической мишенью, воздействие на которую будет
препятствовать инфицированию ВИЧ вновь развивающихся CD4 лимфоцитов.
159
Литература
1. Калинина Н.М., Рахманова А.Г. // Актуальные вопросы ВИЧ-инфекции,
СПб, 1997.-с. 7-11.
2. Козлов В.А., Цырлова И.Г., Чеглякова В.В.//Докл. Ан. СССР, 1984 г,-
т. 275.-№ 1. -с. 247-249.
3. Хаитов Р.М., Игнатьева Г. А. // СПИД. -М. -1992. -352 с.
4. Хазелтайн И.А., Флосси В.С.//В мире науки, 1988. -с.20-29.
5. Abraham N.G, Chertko J .L et.al Л Exp. Hematol. -1993. -v. 21 (2). -p. 263-268.
6. Brockaert P, Libert C., Everaerdi B., et al // Immunobiology. -1993. -v.
187.-p. 317-392.
7. Basch R., Kouri Y.H, Karpatkin S. // PNAS. -1990. -v. 87 (20). -p. 8085-8089.
8. Caux C., Saeland S., Faure C., et al. // Blood. -1990. -v. 75. -№ 1. -p. 2292-2298.
9. Delacretas E, Perey L., Schmidt P., et al. // Virchows Arch. A. Pathol. Anat.
Histopathol. -1987. -v. 411. -p. 4543-4548.
10. Folks T. M., Kester S. N., Orenstein J.M. et al // Science. -1988. -v. 42
(4880).-p. 919-922.
11. Freedman A .R., Zhu., H., Levine J. D., et al. // Nat. Med. -1996. -v. 2(1).
-p. 46-51.
12. Gallicchio V. S., Shedlofsky S. L, Swin A.T., et al //J. biol. Response Modit.
-1989.-v. 8.-p. 422-439.
13. Groopman J. E. // Retroviruses of human AIDS and related animal dis. -
Paris. -1990.
14. Jongen M., Pocters R., Swack A.J., et al.//Eur. J. Clin. Invest.-1993. -
v. 23, suppl. 1. -p. 39.
15. Karcher D.S., Frost A.R. // Am. J. Clin. Pathol. -1991. -v. 95. -p. 63-71.
16. Lipford E.H., Marglick J.B., Longo D.L. et al. // Blood.-1988.-v. 72 (5).
p. 1674-1681.
17. Lircey D. R., Dorcky D.,Nicholsen-WelkerA., etal.// J. Exp. Med. -1989.
-v. 169.-p. 327-332.
18. Mayani H., Guilbert L.J., Jonowska-Wieczorek A. // Eur. J. Haematology. -
1992.-v. 49.-p. 225-233.
19. Mir N., Costello C., Luckit J.,et al // Eur. J. Haematology. -1989. -v. 42. -
p. 339-343.
20. Mouroe J. E., Calender A., Munlder C. // J. Virology. -1988. -v. 62. -№ 9.
-p. 3497-3500.
21. Moses A. V., Williams S. Heneveld M. L., et al // Blood. -1996. -v. 87. -№
3.-p. 919-925.
22. Neal T.F., Holland H.K., Baum C.M., et al // Blood. 1995. -v. 86. -№ 5. -p.
1749-56.
23. Re M., Zauli G, Furlini G, et al // Arch. Virol. -1993. -v. 129. -p. 53-58.
24. Roodman GD., Bird A., Hutzler D., et al // Exp. Haemal. -1987.-v. 15.-p. 928-935.
160
25. Rosenberg //Clin. Immunal. Immunopatol. -1989, Jan 50 (1 Ptz). -s. 149-156.
26. Rossi A., Calabro M.L., Panozzo M., et al // AIDS Res. Hum. Retrovir. -
1990,-v. 3.-p. 287-298.
27. SingGK., Ruscett F.W.//Baillieres Clin. Haematol.-1995, Mar.8 (l).-p.
149-63.
28. Sun N.C.J., Shapshak P., Lachant N.A., etal. // J. Clin. Pathol.-1989. -v. 92
(5).-p. 589-594.
29. Schittman S. M., Lane H.C., Kath J., et al. 11 J.Immunol. -1988. -v. 1514
(12).-p. 4184-6.
30. Sugarman B.J.,Aggarwal B.B., Hass P.W., etal.//Scince. -1985.-V. 230.-
p. 943-946.
31. Vassiliadis S. 11 Haematologia. -1994. -v. 26 (1). -p. 29-37.
32. Wang C.O., Udupa K.B., Lipschitz D. A.//Blood.-1991.-v. 78.-№ 10,
suppl. 1. -p. 50.
33. Zon L.L, Arkin C., Groopman J.E. 11 Br. J. Haematol. -1987. -v. 66. -p.
251-256.
34. Zon L.L, Groopman J.E. 11 Semin. HematoL -1988. -v. 25. -p. 208-218.
35. Zucker-Franklin D., Cao Y.// Proc. Natl. Acad. Sci USA.-1989.-v. 86. -p.
5595-5599.
36. Zauli G., Re M., Visani G.,et al //J. Infect. Dis. -1992. -v. 166.-p. 710-715.
"• Заказ№кЧ451.
161
Глава 3. ПОРАЖЕНИЯ РЕСПИРАТОРНОГО ТРАКТА
ПРИ ВИЧ-ИНФЕКЦИИ
Поражения респираторного тракта при ВИЧ-инфекции являются
основной причиной заболеваемости и смертности. Более чем у 80% больных
ВИЧ-инфекцией диагностируются поражения легких, из которых 90% имеют
инфекционный генез (White D.A., Stover D.E., 1988, Hopewell Р.С., Luce J.M.,
1985, Murray J.F. et al, 1984, Stover D.E. et al, 1985). В последнее время
увеличивается количество неинфекционных поражений легких, возможно, это
связано с улучшением диагностики и лечения. Данные аутопсий показывают
значительные патологические изменения в нижних дыхательных путях у
большинства пациентов в стадии СПИДа (McKenzie R. et al, 1991), При этом
отмечается, что, несмотря на нередко близкие клинические проявления и
диагноз, а также умеренные различия при макроскопическом исследовании,
характер микроскопических изменений во всех наблюдениях существенно
варьировал (Цинзерлинг В.А., и др., 1997).
3.1. Основные формы болезней легких при ВИЧ-инфекции
(Wagner RP, Farber HW, 1996)
Инфекционные поражения
Бактериальные: вызванные Streptoccoccus pneumoniae, Haemophilus
influenza, Mycobacterium tuberculosis, комплексом
Mycobacterium avium.
Протозойные: вызванные Pneumocystis carinii.
Вирусные: вызванные цитомегаловирусом.
Грибковые: криптококкоз, гистоплазмоз, кокцидиоидомикоз.
Новообразования
Саркома Капоши.
Не-ходжкинская лимфома.
Другие болезни
Лимфоидная интерстициальная пневмония.
Инфекционные поражения легких являются результатом
недостаточно сти иммунной системы, защищающей организм от
длительного воздействия патогенных микроорганизмов, которые
вызывают новые заболевания или способствуют обострению уже
имеющейся соматической патологии на фоне ВИЧ-инфекции. На ранних
стадиях ВИЧ-инфекции, когда количество СО4-лимфоцитов относительно
сохранно, пациенты страдают теми же болезнями легких, что и остальное
население (Murray JF, Mills J, 1990, Magnenat J-Let al, 1991, Wallace JM et
162
al, 1993). Когда же количество СО4-лимфоцитов падает ниже 20% - 200
клеток/мм’, пациенты попадают в группу риска по оппортунистическим
инфекциям (Mazur Н et al, 1989). Хотя пневмоцистная пневмония является
наиболее часто диагностируемой оппортунистической инфекцией,
встречаются и другие протозойные, грибковые, вирусные,
микобактериальные нетуберкулезной этиологии, бактериальные
поражения легких (Рахманова А.Г. и др., 1989, 1997, 1998). Возможность
инфицирования тем или иным специфическим патогеном зависит от места
жительства, мобильности, преморбидного фона, социо-экономического
статуса больного. При этом отмечено, что региональные проявления
иммунодефицита, вызванные ВИЧ, зависят от местного преобладания
потенциальных оппортунистических микроорганизмов. В странах,
эндемичных по вирулентным микроорганизмам, лица со СПИД и
умеренным иммунодефицитом могут умереть от болезней, вызванных
этими возбудителями, раньше, чем в странах с высоким жизненным
уровнем.
По данным научной литературы последних лет в нашей стране
наиболее частыми пневмониями при ВИЧ-инфекции являются пневмонии
и бронхиты бактериальные (39,1-41,5), реже пневмоцистоз (6,9%) (Ермак
Т.Н., 1999, Юрин О.Г., 1999). Эти данные приведены в таблице 28.
Таблица 28
Нозологическая структура легочной патологии у больных ВИЧ-
инфекцией и ее динамика (Юрии О.Г., 1999)
Вторичные заболевания Число случаев по годам
1987-1993 1994
Абс. % Абс. %
Пневмонии и бронхиты бактериальные 9 39,1 12 41,5
Пневмонии и бронхиты кандидозные 5 21,7 1 3,4
Криптококкоз 1 4,4 0 0
Туберкулез 3 13,0 7 24,1
Пневмоцистная пневмония 3 13,0 2 6,9
Цитомегаловирусная пневмония 0 0 4 13,8
Лимфоидный интерстициальный пневмонит 1 4,4 0 0
.Саркома Капоши 1 4,4 1 3,4
Плоскоклеточные злокачественные .опухоли 0 0 2 6,9
Итого 23 100 29 100
и*
163
3.2. Бактериальные инфекции
Рецидивирующие пневмонии в настоящее время рассматриваются в
свете тесной связи между ВИЧ-инфекцией и обычной бактериальной
инфекцией легких. Пневмонии различного генеза - наиболее часто
встречающиеся легочные поражения при ВИЧ-инфекции, с преобладанием
пневмококковой пневмонии, которая встречается в 5 раз чаще, чем в остальной
популяции (Magnenat J-L et al, 1991, Wallace JM et al, 1993). Пневмонии,
вызванные Haemophilus influenzae, M. tuberculosis, S.aureus, возбудители рода
Legionella, Chlamydia pneumoniae, возбудителями рода Klebsiella, также широко
распространены, диагностируются и бронхиты той же этиологии (Габбасов
Ш.Ф. и др. 1997, Blasi F et al, 1994). Бактериальные пневмонии у ВИЧ-
инфицированных больных часто сопровождаются бактериемией и могут
рецидивировать даже после адекватной терапии (Gilks Chp et al, 1990, Pinching
AJ, 1990).
Синдром персистирующего заболевания легких, вызванный
Pseudomonas aeruginosa, подобный тому, который имеет место при
муковисцидозе, описан у больных ВИЧ-инфекцией (Baron AD et al. 1991). В
большинстве случаев эта инфекция является приобретенной и имеет вялое
течение. Хорошо поддаваясь лечению, она рецидивирует более чем у 80%
больных, что требует длительной мощной антибиотикотерапии (Baron AD,
Hollander Н, 1993).
Поражение легких, вызываемое Nocardia asteroides, у ВИЧ-
инфицированных встречается все чаще. Клинически определяются лихорадка,
кашель, одышка, боли в грудной клетке. Рентгенологически находят поражение
верхних долей легких в виде полостей, усиления легочного рисунка или
интерстициальных инфильтратов. Кроме того, могут определяться
плевральный выпот, увеличение лимфоузлов в корне легкого (Kramer MR,
Uttamchandani RB, 1990). Диагностика основывается на обнаружении
возбудителя в мокроте, в материале, полученном в ходе трансбронхиальной
биопсии, биопсии кожных поражений и лимфоузлов. Так как
рентгенологическая картина сходна с таковой при реактивации туберкулеза,
должна проводится бронхоскопия в случае, если анализ отхаркиваемой
мокроты не подтверждает диагноз.
Поражения легких, вызванные Rhodococcus equi, в основном
диагностируют у ВИЧ-инфицированных больных, которые имеют контакт с
сельскохозяйственными животными и почвой, которую эти животные
загрязняют. Пневмонии, развивающиеся у этих больных, характеризуются
лихорадкой, кашлем, усталостью, болями в грудной клетке плеврального
характера, нарастающей одышкой, развивающейся в течение 2-3 недель
(Harvey RL, Suntrum JC, 1991, Verville RD et al, 1994). Рентгенологически
164
определяется усиление легочного рисунка с образованием полостей, нередко
плевральный выпот. Хотя находки в мокроте и крови часто подтверждают
диагноз, иногда требуется биопсия и/или торакоцентез.
Нозокомиальные пневмонии часто встречаются у ВИЧ-инфицированных
больных. Частые госпитализации и ухудшение местного и общего иммунного
ответа увеличивают риск заболеваний легких, вызванных S.aureus, P.aeruginosa
и кишечной грамотрицательной флорой (Tuker KJ et al., 1992).
В ряде случаев диагностируется хронический бронхит, трактуемый как
проявление экстрагенитальной формы хламидийной инфекции (Габбасов
Ш.Ф. и др., 1997).
Описаны случаи пневмоний, вызванных Corynebacterium
pseudodiphthericum (Cohen J et al, 1992).
Отмечено выделение на фоне оппортунистических инфекций у ВИЧ-
инфицированных больных другой бактериальной флоры (например, кокк
Leuconostoc citreum - Giacometti A et al, 1993), но диагностическое значение ее
не всегда ясно.
3.3. Микобактериальные инфекции
Туберкулез (см. специальный раздел).
Атипичный микобактериоз
Mycobacterium avium - комплекс (МАК)
M.avium - комплекс (М. avium и intracellulare) наиболее часто встречается
.у больных ВИЧ-инфекцией. МАК склонен к генерализации с поражением
различных органов и тканей даже на ранних стадиях болезни. Так как легкие
часто инфицированы микобактериями, иногда может быть диагностирован
.первичный очаг, из которого удается изолировать возбудитель болезни. Наличие
МАК обычно устанавливается рентгенологически, и выделение возбудителя
не влияет на прогноз заболевания. Частота диагностирования МАК при
помощи бронхоскопии составляет примерно 50% и возрастает до 80% при
применении трансбронхиальной биопсии.
Лечение МАК: основной режим - рифабутин 300 мг/д; альтернативный
режим - кларитромицин 500 мг х 1-2 р/д, азитромицин 500 мг х 3 р/нед;
показания к проведению химиопрофилактики - СО4-лимфоциты менее 100 /
мм3. Вторичная профилактика не проводится (необходимо пожизненное
лечение).
Атипичные микобактерии, отличные от МАК
Из респираторного тракта больных СПИД было выделено несколько
образцов атипичных микобактерий (M.xenopi, M.fortuiturn, M.cansasii,
M.haemophiliurn). Mycobacterium cansasii - вторая по значимости
нетуберкулезная микобактерия после МАК, которая диссеминирует у больных
165
с тяжелым иммунодефицитом. Клинически определяются лихорадка, кашель,
одышка. Рентгенологически определяются тонкостенные полости и сетчатые
модулярные инфильтраты, напоминающие туберкулез. Заболевание протекает
торпидно, с редкими обострениями. Остальные указанные микобактерии
имеют меньшее клиническое значение.
3.4. Вирусные инфекции
У ВИЧ-инфицированных больных часто встречается диссеминированная
цитомегаловирусная инфекция, которая клинически проявляется в виде
хориоретинита, энцефалита, эзофагита, гепатита, колита, поражения
надпочечников, пневмонии (Wallace J.M., Hannah J., 1987), при этом пневмония
диагностируется у 23% больных (Шахгильдян В.И. и др., 1997). Как правило,
больные СПИДом - это лица с уже имеющейся латентной ЦМВИ, поэтому
заболевание может начаться незаметно, исподволь. Клинические и
рентгенологические признаки поражения легких не специфичны.
Окончательный диагноз требует нахождения характерных внутриядерных
включений при гистологическом исследовании легочной паренхимы,
полученной в ходе бронхоскопии с трансбронхиальной биопсией. Отмечено,
что на фоне ЦМВ-пневмонии часто встречаются другие легочные поражения,
например, пневмоцистная пневмония. Наличие легочных поражений требует
тщательного офтальмологического осмотра, так как лечение ЦМВ-ретинитов
может предотвратить слепоту. Антивирусная терапия может быть
неэффективной для лечения легочных проявлений ЦМВИ и применяется в
основном для лечения ретинитов, колитов, полирадикулопатии (Шахгильдян
В.И. и др., 1997).
Герпесвирусная инфекция редко вызывает пневмонии у ВИЧ-
инфицированных больных, однако, выделение вирусов из дыхательных путей
происходит довольно часто. Диагноз пневмонии, вызванный Herpes simplex,
может быть установлен только при наличии гистологического подтверждения
легочного поражения в случае, если других патогенов не выявлено (Murray
SF, Mills, J, 1990). Диагноз Varicella zoster - пневмонии значительно менее
сложен - рентгенологически определяются диффузные двусторонние
инфильтраты у больных с распространенным опоясывающим герпесом.
Человеческий герпесвирус 6 типа также описан как причина пневмонии с
летальным исходом у больных ВИЧ-инфекцией в стадии СПИД.
3.5. Грибковые инфекции
Криптококковая инфекция у ВИЧ-инфицированных больных обычно
протекает в виде менингита, при этом пневмонии диагностируются у 10-30%
больных (Рахманова А.Г., Гяургиева О.Х., 1997, Cameron ML et al, 1991). Легкие
рассматриваются как самое поражаемое место при криптококкозе. Необходимо
166
отметить, что у больных СПИДом с криптококкозом без поражения ЦНС почти
в 2/3 случаев диагностируется легочная патология, в то время как у больных с
криптококковым менингитом лишь в 18% обнаруживаются признаки
поражения легких, что может свидетельствовать о спонтанном разрешении
криптококковой пневмонии до/на фоне криптококкового менингита. Легочный
криптококкоз протекает скрыто или по типу неспецифической пневмонии,
поэтому эта форма выявляется редко. Клинически у больных могут
определяться кашель с мокротой, иногда с прожилками крови, тупые ноющие
боли в грудной клетке, тахипноэ, чувство нехватки воздуха, иногда приступы
удушья. Рентгенологически обычно выявляются фокальные или диффузные
интерстициальные инфильтраты в средних и нижних отделах легких 2-7 см в
диаметре (“монеты”), реже встречаются большие нечеткие инфильтраты,
симулирующие злокачественную опухоль, могут встречаться полости,
прикорневая аденопатия и плевральный выпот. Иногда наблюдаются
мелкоочаговые распространенные поражения легких, напоминающие
милиарный туберкулез. Нахождение возбудителя в мокроте или материале
бронхо-альвеолярного лаважа требует проведения люмбальной пункции для
исключения менингита (см. специальный раздел).
3.6. Протозойные болезни
Токсоплазмоз у больных СПИДом обычно протекает в форме
Энцефалита, абсцесса головного мозга. Пневмония этого генеза может иметь
место самостоятельно (как реактивация латентной инфекции) или как
осложнение поражения ЦНС. Клинически определяются диспноэ, лихорадка,
Непродуктивный кашель, быстро прогрессирующая дыхательная
Недостаточность, сходная с таковой при септическом шоке (гипотензия,
метаболический ацидоз, ДВС). Пневмонию токсоплазменной этиологии
следует подозревать у лиц, находящихся на химиопрофилактике ПЦП
аэрозолем пентамидина. Рентгенологически определяются модулярные
Инфильтраты или различные усиления легочного рисунка. Для установления
диагноза необходимо обнаружение возбудителя в материале биопсии (Murray
JF, Mills J, 1990).
Возбудители стронгилоидоза и криптоспоридиоза могут вызывать
Поражения легких у больных с поражением желудочно-кишечного тракта этой
этиологии. Клинико-рентгенологические черты неспецифичны. Выделение
возбудителя стронгилоидоза из мокроты свидетельствует о поражении легких,
окончательный диагноз ставится после обнаружения личинок возбудителя в
Дуоденальном содержимом, фекалиях, коже, моче. У больных легочным
криптоспоридиозом клинически определяется непрерывный кашель.
Гистологически возбудитель обнаруживается в эпителии бронхов, при этом в
альвеолах он определяется редко, а поражение легочной ткани пока не описано.
167
В отличие от стронгилоидоза, эффективной терапии диссеминированного
криптоспоридиоза не разработано, и больные обычно погибают от
неподдающегося терапии заболевания желудочно-кишечного тракта.
Легочные поражения микроспоридиального генеза сейчас расцениваются
как осложнения поражения желудочно-кишечного тракта, вызванного
Encephalitozoon hellem или Septata intestinalis, однако есть данные об аэрогенном
пути заражения. Клинико-рентгенологические находки неспецифичны. Есть
мнение, что микроспоридийные инфекции протекают нередко и в форме
бессимптомного паразитоносительства, в связи с чем не совсем ясно, что
представляет собой острое состояние - результат ли свежего заражения или
реактивации латентной формы паразита. Хотя микроспоридии могут быть
обнаружены в материале бронхоальвеолярного лаважа, в кале, в моче, в смывах
с конъюнктивы, для подтверждения диагноза необходима электронная
микроскопия.
В последнее время стали диагностировать поражения легких
акантамебного генеза. Патогенным для человека являются 7 видов рода
Acanthamoeba: A.astronix (поражает ЦНС), A.castellani (ЦНС, глаза),
A.culbertsoni (ЦНС, глаза), A.hatchetti (глаза), A.palestinesis(HHC), A.polyphaga
(ЦНС, глаза). На фоне недостаточности иммунной системы они вызывают
локальную (кожные язвы, пневмонии, кератиты) или генерализованную формы
патологии с развитием гранулематозного амебного энцефалита (ГАЭ).
Акантамебы проникают в организм человека через повреждения на роговой
оболочке глаз (загрязненная вода, контактные линзы) и респираторный тракт.
Из первичных очагов поражения происходит гематогенная диссеминация
возбудителя с развитием деструкции клеток, некрозами, геморрагиями. При
диссеминации возбудителя (чаще всего в вещество мозга, мягкую и паутинную
мозговые оболочки, базальные ганглии) развивается гранулематозный процесс.
Если резистентность организма сохранена, гранулематозный процесс
протекает достаточно выраженно, с преобладанием в гранулеме клеток
Лангханса, если же снижена - то преобладает некротический воспалительный
процесс. Определяется лишь небольшое число полиморфноядерных
лейкоцитов, а численность акантамеб в зоне некроза пропорциональна
интенсивности воспалительной реакции. Клинико-рентгенологическая картина
поражения легких при акантамебиазе неспецифична. Развивающаяся на фоне
ГАЭ бронхопневмония является наиболее частой причиной смерти. Диагноз
ГАЭ можно предполагатьу больногос иммуносупрессией; особенно в случаях,
напоминающих клинически бактериальный энцефалит, но бактериологически
не подтвержденный. Акантамебный кератит можно подозревать у больных,
перенесших травму глаза или носящих контактные линзы, для него особенно
характерен быстро прогрессирующий абсцесс роговицы уникальной
кольцевидной формы. Инфильтрат формирует парацентральное кольцо с
168
чистым или относительно чистым дном. Прежде чем процесс углубится,
начинается деструкция и изъязвление роговицы глаза. Для диагностики
акантамебиаза используют материал глубокого соскоба с роговицы, биоптата
язвы, слизь из горла, носоглотки, кожные узелки, фекалии, спинно-мозговую
жидкость. Заболевание обычно заканчивается летально, возможно, вследствие
поздней диагностики.
Пневмоцистная пневмония
Пневмоцистная пневмония (ПЦП) - наиболее часто диагностируемое
СПИД-индикаторное заболевание. Клинические проявления
пневмоцистоза полиморфны и в значительной мере определяются
состоянием иммунной системы ВИЧ-инфицированного больного. Она
определялась примерно у 70% больных ВИЧ-инфекцией, и, несмотря на
раннюю диагностику и активную терапию, смертность достигала 10-20%
(Freedberg КА et al, 1991). Пневмонии часто развиваются более медленно,
чем у других больных с иммуно дефицитом, а иногда - очень быстро.
Обычно клинически определяются лихорадка, одышка, недомогание,
непродуктивный кашель, также могут быть озноб, боль в грудной клетке,
отделение мокроты. У 2/3 больных ПЦП наблюдаются слабо выраженные
признаки ДВС-синдрома. При осмотре обращают на себя внимание
лихорадка и тахипноэ, аускультация легких обычно патологии не
выявляет. Рентгенологически определяются диффузные двусторонние
интерстициальные инфильтраты, они могут быть нежные в начале
заболевания. Описаны полостные образования, фокальные инфильтраты,
нодулярное усиление легочного рисунка. Обычно определяются
апикальные инфильтраты, особенно у лиц, получавших медикаментозную
профилактику аэрозолем пентамидина. У 5-10% больных
рентгенологическая картина легких бывает без патологии, даже при
клинических проявлениях болезни (Curtis JL, Goodman Р, Hopewell PC,
1986, White DA, Stover DE, 1988, Oprial M et al, 1994). Увеличенные
прикорневые или медиастинальные лимфоузлы и плевральный выпот
редки, при этом необходимо проводить дифференциальную диагностику с
другими заболеваниями. Описаны также сочетания ПЦП с саркомой Капоши,
лимфомой легких, туберкулезной или грибковой инфекциями, при
которых наблюдались выпоты в плевральной полости. Пневмоторакс,
плевральные буллы и кистозные поражения (тонкостенные, не
заполненные фибрином или жидкостью - De Lorenzo LJ et al, 1987,
Hopewell PC, Luce. JM, 1985) все чаще диагностируются как проявление
ПЦП. Риск пневмоторакса увеличивается у больных с повторной ПЦП и
У тех больных, кто получал химиопрофилактику аэрозолем пентамидина.
Кроме того, факторами риска возникновения пневмотоцеле являются
механическая вентиляция легких, трансбронхиальная биопсия,
169
трансторакальная пункционная биопсия, молодой возраст больных.
Установлено, что характер легочной деструкции связан с длительностью
инфицирования P.carinii. При анализе артериальной крови определяется
гипоксемия и измененный альвеолярно-артериальный кислородный
градиент, но эти показатели могут быть и нормальными у больных с
легким течением ПЦП или в ее начале. Легочные пробы обычно
показывают уменьшение способности к выделению из организма СО2, а
галлиевая сцинтиграфия показывает его диффузное поглощение. Отмечено
увеличение лактат-дегидрогеназы в сыворотке крови, которое коррелирует
с тяжестью болезни. Диагностика ПЦП традиционно основывается на
выделении возбудителя из тканей легких или отделяемого дыхательных
путей, для чего в ряде случаев необходимо провести бронхоскопию с
бронхоальвеолярным лаважем (чувствительность БАЛ для диагностики
ПЦП составляет 90%). Трансбронхиальная биопсия и лаваж верхних
дыхательных путей также значительно улучшают показатели диагностики
(Yung RC et al, 1993). Говоря о пневмоцистозе, нельзя не упомянуть о том,
что у ВИЧ-инфицированных P.carinii вызывает также хориоидит,
тиреоидит, отит и мастоидит, поражение ЖКТ (Carter TR et al, 1988),
гепатит, поражение селезенки (Pilon VA et al, 1987), абсцесс мозга (Мауауо
Е et al, 1990 ) при отсутствии поражения других органов и систем.
Таблица 29
Прогностические факторы неблагоприятного течения
пневмоцистной пневмонии
1. Длительный период одышки/сухого кашля (более 4
недель).
2. Частота дыхательных движений более 30/мин.
3. Повторные ПЦП.
4. Наличие других возбудителей в бронхоальвеолярном
лаваже.
5. Плохая оксигенация крови (Ра О менее 55 мм рт.ст. или
альвеолярно-артериальный кислородный градиент более 30 мм
рт.ст.)
6. Низкий показатель альбумина сыворотки крови (менее
3,5 мг/дл).
7. Выраженные рентгенологическе изменения в легких.
8. Лейкоцитоз (количество лейкоцитов крови более
10900/мм).
9. Высокий показатель лактат-дегидрогеназы сыворотки
крови (более 300 Ul/л).
170
Лечение
а. Наиболее длительно применяющимся для лечения ПЦП препаратом
является пентамидин. Дозировки его не отличаются от таковых у больных
без ВИЧ-инфекции, но частота побочных эффектов выше (45% - Kovacs JA
et al, 1984). Побочные эффекты развиваются в сроки от 6 до 16 дней (в
среднем 10,4 дня), это анемия, нейтропения, гипонатриемия, повышение
уровня креатинина, почечная недостаточность, брадикардия, панкреатит,
гипо / или гипергликемия. Для предотвращения этих состояний предложено
проводить ингаляции пентамидина по 600 мг на ингаляцию. Оптимальным
является размер частиц ингаляционной смеси диаметром 1 -2 мкм. В случае
появления при ингаляции кашля или бронхоспазма они снимаются
бронхолитиками.
б. Бисептол предпочтительнее давать больным с почечной
недостаточностью, так как его можно назначать в редуцированной дозе с
сохранением эффекта действия и он не обладает столь выраженной
нефротоксичностью, как пентамидин. Желательно назначать его и больным
с микст-инфекцией вследствие широкого антимикробного действия.
(Пентамидин же может быть препаратом выбора у больных с первичной
аллергией на бисептол. Внутривенное введение пентамидина
предпочтительнее бисептола у больных с предшествующей лечению
нейтропенией, тромбоцитопенией или анемией). Однако терапия
бисептолом бывает затруднена из-за частых (40-45%, Лысенко А.Я. и др,
1996) побочных явлений: сыпь, тошнота, рвота, анемия, нейтропения.
Наиболее часто это бывает через 10-12 дней после начала терапии и обычно
прекращается после прекращения приема препарата.
Для лечения ПЦП умеренной степени тяжести применяют сочетание
бисептола и фурозолидона (курс 14 дней) с одновременным назначением
ингаляций аминохинолов или метрагила в течение 10 дней с последующим
применением трихопола. Рекомендуются следующие схемы приема препарата:
- бисептол
• детям от 2 до 5 лет - 240 мг (2 т по 120 мг) * 2 р/д.
• детям от 5 до 12 лет - 480 мг (4 т по 120мг) * 2 р/д
• старше 12 лет - 960 мг (2 т по 480 мг) * 2 р/д, в тяжелых
случаях - 3 р/д.
- фуразолидон-10 мг/кг в сутки в 4 приема, ингаляции аминохинола
- До года 0.012г, с 1 года до 2 лет - 0.025 г, с 2до 4 лет - 0.035 г, с 4 до 6 лет
- 0.05 г, с 6 до 8 лет - 0.075 г, с 8 до 12 лет - 0.1 г, с 12 до 16 лет - 0.15 г, по
две ингаляции в течение 10 дней.
171
- ингаляции метрагила -7.5 мг/кг 2 р/д в течение 10 дней.
- трихопол - до 1 года - 0.125 г/д, с 2 до 5 лет - 0.25, с 5 до 10 лет-
0.375, с 10 до 15 лет - 0,5 г/д ( в два приема).
Для лечения тяжелых форм ПЦП применяют более сильнодействующие
препараты или вышеуказанные, но в более мощном терапевтическом режиме.
Ранее общеупотребительной дозой считалась такая: 4 мг/кг пентамидина,
растворенного в 250 мл 5% декстрозы, 1 р/д внутривенно капельно медленно
в течение 14-21 дня. В настоящее время адекватной дозой считается 3 мг/кг
веса. Стандартный курс лечения бисептолом - 20 мг /кг триметоприма + 100
мг/кг сульфаметоксазола в 4 приема ежедневно в течение 14-21 дня. При
непереносимости высоких доз препаратов количество их может быть
уменьшено: до 15 мг/кг триметоприма и 75 мг/кг сульфаметаксазола.
в. К препаратам резерва относят дапсон, который назначают по 100 мг/
д перорально в течение 21 дня. В связи с меньшей эффективностью его не
рекомендуют для лечения тяжелых форм пневмоцистоза. Предпочтителен курс
дапсона в сочетании с триметапримом: 100 мг дапсона + 20 мг/кг/день
триметоприма (на 4 приема) в течение 21 дня. Основным побочным эффектом
от сочетания этих препаратов является развитие гемолиза у больных с
дефицитом глюкозо-6-фосфат-дегидрогеназы. Отмечается также
метгемоглобинурия, при появлении которой препараты необходимо отменить,
и назначить больному 1-2 мг/кг метиленовой сини внутривенно. Так как эти
два препарата обладают взаимоактивирующим действием, побочные эффекты
от их сочетания также выше.
г. Весьма эффективно сочетание триметрексата и лейковорина по схеме:
30-45 мг/м2 поверхности тела/деньв/в триметрексата в течение 21 дня + 20 мг/м2
поверхности тела /день в 4 дозах лейковорина в течение 23 дней. Кроме этой.
Sattler FR et al (1990) рекомендуют также следующие схемы лечения: а)
триметрексат 45 мг/м2/д + лейковорин 80 мг/м2/д, б) триметрексат 60 мг/м2/д J
лейковорин 80 мг/м2/д, в) триметрексат 60 мг/м2/д + лейковорин 160 мг/м2/д.
д. Для лечения ПЦП умеренной степени тяжести предпочтение отдается
сочетанию клиндамицина и примахина, описаны 2 схемы терапии по 21 дню:
а) примахин 30 мг* 1 р/д перорально + клиндамицин 900 мг * 3 р/д в/в, затем
по 450 мг * 4 р/д перорально; б) примахин 30 мг * 1 р/д + клиндамицин 600
мг * 4 р/д перорально. Эти схемы лечения нельзя применять у больных с
дефицитом глюкозо-6-фосфат-дегидрогеназы, на 2-3 неделе лечения
необходимо мониторирование уровня метгемоглобина.
172
Показания к проведению химиопрофилактики: пневмоцистоз в
анамнезе или СО4-лимфоциты менее 200/мм3 или 2-х недельная лихорадка
неясного генеза.
Основной режим - бисептол 480 - 1-2 таблетки в день или 3 таб. в
неделю.
Альтернативный режим - аэрозоль пентамидина 300 мг/мес или в/в 4
мг/кг * 2-4 нед, или дапсон 25-100 мг/д или 100 мг 2-3 раза/нед.
Согласно рекомендациям Российского методического центра
профилактики и борьбы со СПИДом рекомендуются основные и
поддерживающие курсы лечения (таблица 30).
Таблица 30
Лечение пневмоцистной пневмонии (РСР) у больных ВИЧ-инфекцией
(Методические рекомендации М3 РФ, 1999)
Основной курс терапии первого ряда
Триметоприм по 0.015 г/кг/день
Сульфаметоксазол 0.075 г/день
Торговые названия - Септрин, Бисептол, Бактрим в/в или п/о,
21 день. Суточная доза принимается в 3-4 приема.
Основной курс терапии второго ряда
Триметоприм по 0,015 г/кг/день, п/о, в/в
плюс
Дапсон по 0,1 г/дснь, п/о, 21 день
Клиндамицин 1,2 г/день, в/в или п/о,
плюс
Примахин 0,03 г/день, п/о, 21 день
Больным с дыхательной недостаточностью (рО2 < 70 mmHg)
показано назначение кортикостероидов:
Преднизолон по 0,08 г/день (0,04*2) в течение 5 дней,
затем по 0,04 г 1 раз в день в течение 5 дней,
затем по 0,02 г до конца лечения.
По завершении курса проводится поддерживающая терапия -
Триметоприм 0,08 г / Сульфаметоксазол 0,04 г (детям 0,02 г 0,1
г) по 1 таблетке 1 раз в день.
173
Приведем клинический пример больной, умершей от ПЦП (первый случай
смерти от СПИДа в СССР).
Больная Е, 29 лет, служащая, наблюдалась с 1985 г. водной из поликлиник
Ленинграда. Перенесла вирусный гепатит в 1974 г., страдала хроническим
тонзиллитом и хроническим двусторонним аднекситом. С 1976 г. - хронический
пиелонефрит, герпетическая инфекция (локализованная форма с поражением
слизистых губ). Переливания крови отрицала. Много позже стало известно,
что больная с 1979 г. имела неоднократные интимные связи с иностранцами, в
том числе с африканцами.
Ухудшение состояния было отмечено с февраля 1988 г.: жалобы на общую
слабость, боли в горле, волнообразное повышение температуры до 39° С,
ознобы, кашель (сухой, периодически со слизистой мокротой). Констатирован
хронический тонзиллит (обострение). Аллергическая реакция на ампициллин.
С мая 1988 г.— лекарственный стоматит.
Очередное ухудшение самочувствия с 25.07.1988 г. Беспокоили общая
слабость, сухой кашель, боли в горле. Диагноз: ОРЗ; трахеит; пневмония (?).
Обследована в противотуберкулезном диспансере, данных о наличии
туберкулеза не получено. В анализе крови: умеренный лейкоцитоз со сдвигом
влево, эозинофилия, СОЭ 53 мм/ч. На рентгенограмме органов грудной клетки
— легкие без инфильтративных изменений. В поликлинике больную
многократно осматривали врачи различных специальностей, однако не было
настороженности в выявлении инфекционной патологии.
Впоследствии самочувствие и состояние больной ухудшились,
сохранялась лихорадка, нарастала общая слабость, кашель со слизистой
мокротой, в связи с чем она была госпитализирована 19.08.1988 г. При
поступлении жалобы на общую слабость, покашливание с отхождением
мокроты серозного характера, жжение в груди, по вечерам ознобы с
повышением температуры до 39°С, налеты белого цвета на слизистой оболочке
полости рта. Было выяснено, что больная похудела на 12 кг за 5 мес., отмечала
снижение аппетита и появление ощущения «труднопроходимое™ пищи».
При объективном обследовании состояние было удовлетворительным,
кожа чистая, сыпи не было. На мягком небе, дужках и задней стенке глотки
имелись налеты белого цвета. Пальпировались лимфоузлы в подчелюстной
области диаметром до 1 см, в левой подключичной ямке — 3 мм,
безболезненные, не спаянные с клетчаткой. При перкуссии грудной клетки
легочный звук, справа от угла лопатки книзу участок притупленного звука,
дыхание жесткое. Печень и селезенка не пальпировались.
В клинике больную широко обследовали (посевы крови, клинические
анализы, консультации с целью уточнения характера поражения органов
дыхания). 30.08.1988 г. самочувствие больной значительно ухудшилось:
состояние средней тяжести, усилился кашель, одышка, сердцебиение.
174
гипотония. В легких дыхание жесткое, хрипов не было. При
фиброэзофагогастроскопии выявлены налеты на слизистой пищевода,
признаки гастрита. В промывных водах бронхов обнаружены в значительном
количестве грибы рода Кандида. Диагностировано кандидозное поражение
слизистой ротовой полости, верхних дыхательных путей, бронхов, пищевода,
в связи с чем больная была переведена в клинику глубоких микозов ГИДУВа,
где проводили дезинтоксикационную, антибактериальную и
иммуностимулирующую терапию. Несмотря на проводимое лечение,
состояние больной прогрессивно ухудшалось, поэтому ее перевели в отделение
реанимации с диагнозом: распространенный кандидоз полости рта, верхних
дыхательных путей, пищевода; двухсторонняя пневмония. Сопутствующие
диагнозы: хронический бронхит в стадии обострения; хронический тонзиллит
в стадии обострения. Осложнения: дыхательная недостаточность II— III ст.;
сердечно-сосудистая недостаточность I—II ст.
Врачи отделения реанимации констатировали у больной Г. острую
двустороннюю пневмонию, острую дыхательную недостаточность III ст.,
сепсис. Состояние тяжелое: кожа влажная, акроцианоз, тахикардия,
выраженная одышка, в легких выслушивались влажные хрипы слева в задне-
нижних отделах. Данные лабораторного исследования свидетельствовали о
нарастании анемии, лейкоцитоза с резким палочкоядерным сдвигом влево до
метамиелоцитов, лимфопении; СОЭ 64 мм/ч. Выявлено резкое угнетение Т-
клеточного звена иммунитета с дисбалансом основных иммунорегулирующих
клеток.
Больной проводили интенсивную терапию, однако, ее состояние быстро
ухудшалось, нарастали клинические признаки ОДН и легочно-сердечной
недостаточности: сохранялась одышка 40—60 в 1 мин, тахикардия,
интоксикация, гипоксия (РО, в капиллярной крови около 47 мм). Комплексная
антибактериальная и патогенетическая терапия успеха не имела; на третьи
сутки пребывания в отделении больная скончалась.
На секции обнаружены диффузные поражения легочной ткани,
расцененные как альвеолит, гипоплазия лимфатических узлов корней легких,
признаки выраженной дыхательной недостаточности с умеренным
хроническим венозным застоем в большом круге кровообращения.
Беременность в пределах 4 нед. Грибковые поражения слизистых оболочек
при посевах секционного материала не выявлены. При микроскопическом
изучении срезов легочной ткани были выявлены массовые скопления
пенистого экссудата в альвеолах, что характерно для картины пневмоцистной
пневмонии. Вирусологическое и бактериологическое обследование
сопровождалось выделением разнообразной кокковой флоры.
Патологоанатомический диагноз: диффузный альвеолит с поражением всей
паренхимы легких; острая дыхательная и сосудистая недостаточность;
175
паренхиматозная дистрофия печени, почек и миокарда; хронический тонзиллит.
Следует обратить внимание, что, несмотря на отрицательный результат первого
серологического обследования на ВИЧ-антитела, наличие необычных
клинических проявлений («легочный дебют» системного заболевания и
длительно текущий распространенный кандидоз) побудило врачей сделать
повторное обследование на СПИД еще в отделении, но в связи с молниеносным
течением болезни исследование на ВИЧ-инфекцию было выполнено лишь
посмертно. Обследование на СПИД трупной крови в ИФА и иммуноблотинге
в специализированных лабораториях Москвы и Ленинграда выявили полный
спектр антител к индивидуальным белкам ВИЧ.
На основании клинико-эпидемиологических и секционных данных,
результатов серологического и иммунологического обследования был
установлен диагноз: СПИД, легочная форма - пневмоцистная пневмония;
распространенный кандидоз ротовой полости, верхних дыхательных путей,
бронхов и пищевода; хронический тонзиллит; беременность; дыхательная и
сердечно-сосудистая недостаточность.
По-видимому, больная была давно инфицирована ВИЧ, а в феврале -
августе 1988 г. имела место клиническая манифестация СПИДа.
Непосредственно клиника СПИДа этой больной была связана с
оппортунистическими инфекциями: распространенным кандидозом
желудочно-кишечного тракта и органов дыхания, а также пневмоцистной
пневмонией, которая протекала крайне тяжело с прогрессирующим нарастанием
легочно-сердечной недостаточности.
В приведенном наблюдении лечение пнемоцистной пневмонии, при ее
диагностике, даже во время пребывании больной в отделении интенсивной
терапии было возможно и эффективно, однако, в то время врачи не знали
клинику ПЦП, не определяли напряжение кислорода в крови. А эти
клинические данные (внезапная одышка, непродуктивный сухой кашель,
диффузные изменения в легких) при определении напряжении кислорода в
крови могли послужить для определения диагноза ПЦП с назначением
клиндамицина или бисептола внутривенно, что завершилось бы
выздоровлением больной.
Таким образом, патология легких при ВИЧ-инфекции многогранна,
полиэтиологична. Своевременная и правильная диагностика способствует
раннему назначению этиотропной терапии, что важно для предупреждения
прогрессирования болезни.
3.7. Опухоли
Саркома Капоши (СК) у больных СПИД протекает обычно с поражением
кожи и слизистых оболочек. Тем не менее, поражение внутренних органов,
особенно лимфатической системы, имеет место у 50% больных кожной формой
176
СК. Поражение саркомой легких обычно происходит на фоне диссеминации
(Санджиева Д.Б. и др., 1997), хотя изолированное поражение легких также
описано. Наиболее часты неспецифические клинические симптомы (лихорадка,
потеря веса), но больные могут жаловаться и на одышку, кровохарканье,
плевральные боли в грудной клетке, стридор. Физикальное исследование обычно
малоинформативно, хотя стридор может вызывать массивные поражения
верхних дыхательных путей (Malabonga VM, Smith PR, 1990). Рентгенологически
определяются двусторонние интерстициальные или паренхиматозные
инфильтраты (или и те, и другие), иногда с нечеткими очертаниями и
сопутствующим плевральным выпотом, в ряде случаев - массивным.
Дифференциальный диагноз СК может требовать и биопсии ткани легких,
однако, обнаружение типичных проявлений СК втрахее и бронхиальном дереве
во время бронхоскопии считается достаточным у больных с установленным
диагнозом. Эндобронхиальная, трансбронхиальная биопсия или бронхиальная
щеточная биопсия с цитологическим исследованием обычно диагностического
значения не имеют, иногда информативна биопсия плевры.
Лимфомы. В отличие от не-ходжкинской лимфомы в серонегативной
популяции ВИЧ-ассоциированная лимфома обычно диссеминирует (Kaplan
LD et al, 1989) с поражением нервной системы, желудочно-кишечного тракта,
печени. Поражения легких менее часты, при этом рентгенологически
определяются увеличенные медиастинальные лимфоузлы, интерстициальные
и паренхиматозные инфильтраты, одиночные паренхиматозные узлы,
утолщение плевры с выпотом, иногда массивным. Трансбронхиальная биопсия
редко информативна. Обычно требуется биопсия ткани легкого. Показано, что
эта лимфома обычно появляется в терминальных стадиях ВИЧ-инфекции
(Roithmann S et al, 1991), в отличие от лимфомы Беркита, которая может быть
на любой стадии болезни.
Ходжкинская лимфома также более часта у ВИЧ-инфицированных
больных, но поражения легких встречаются реже, чем при не-ходжкинской
лимфоме. Подобно не-ходжкинской лимфоме для установления
окончательного диагноза требуется биопсия ткани легкого. Рентгенологически
определяются медиастинальные поражения и двусторонние инфильтраты.
Бронхогенная карцинома. У больных ВИЧ-инфекцией описаны также
случаи бронхогенной карциномы (Karp S et al, 1993, Tenholder MF et al, 1993),
хотя точно не установлено, является ли эта карцинома осложнением ВИЧ-
инфекции. Больные ВИЧ-инфекцией и БК были курильщиками табака и
диагноз им был установлен в более раннем возрасте и на более продвинутой
стадии болезни, чем у иммунокомпетентных больных. Некоторые больные
жили более 2 месяцев после установления диагноза.
177
Заказ№ К-4451.
3.8. Лимфоидная интерстициальная пневмония
Лимфоидная интерстициальная пневмония (ЛИП) имеет неясную
этиологию, обычно встречается у детей на стадии СПИД, но может определяться
и у взрослых. Синдром зависит от HLA - типа больного и наиболее часто
встречается у лиц негроидной расы с HLA - DR5 и реже у других с HLA-DR6.
Клинически у детей выявляется медленно прогрессирующая одышка,
непродуктивный кашель, могут быть лихорадка и потеря веса. Физикально
определяется аденопатия, гепатоспленомегалия, увеит, увеличение слюнных
желез, при аускультации часто слышны хрипы в нижних отделах легких.
Рентгенологически определяются двусторонние нижнедолевые
интерстициальные или ретикулонодулярныс инфильтраты, подобно изменениям
при ПЦП, легочный рисунок не дифференцируется, корни расширены,
неструктурны. В анализах крови определяется гипергаммаглобулинемия и
лимфоцитоз.
Диагноз ЛИП у взрослых сложен. Клинические проявления
неспецифичны, и, вследствие ее редкости, ЛИП обычно не учитывается при
оценке одышки. Повторные бактериальные пневмонии в большой степени
связаны с ЛИП и могут затруднять диагностику. Больные ЛИП могут
поддаваться терапии с учетом выделенных из мокроты патогенных
микроорганизмов, и рентгенологическая картина в легких может улучшаться,
однако нормализуется редко. Гистологическое исследование материала
трансбронхиальной биопсии и биопсии тканей легких показывает
альвеолярную и интерстициальную инфильтрацию лимфоцитами и
плазматическими клетками.
Неспецифическая интерстициальная пневмония - гистологическое
понятие, которое подразумевает нахождение при биопсии мягкой
мононуклеарной инфильтрации с разной степенью интерстициального отека,
отложения фибрина, альвеолярной клеточной гиперплазии, утолщения септ и
фиброза. Симптомы поражения респираторного тракта неспецифичны, но
заболевание в ряде случаев может протекать и бессимптомно (Ogibene FP et
al, 1988). Диагноз основывается натипичных гистологических находках после
исключения заболеваний другой этиологии. Клиническое течение болезни
обычно стабилизируется или улучшается без специфической терапии.
Легочная гипертензия
Этиология ВИЧ-ассоциированной легочной гипертензии остается
неясной (Mette SA et al, 1992). Даже несмотря на то, что легочная
гипертензия встречается в 10-100 раз чаще на фоне ВИЧ-инфекции - это
все еще относительно нечастые находки. Клинически ВИЧ-
ассоциированная легочная гипертензия с ходна с первичной легочной
гипертензией, хотя прогрессирует более быстро, при этом больные
могут находиться на начальных стадиях ВИЧ-инфекции. Обычна быстро
178
нарастающая одышка при физическом усилии при отсутствии инфекции
или новообразования. Рентгенологически определяется нормальная
легочная паренхима, расширение границ сердца вправо, усиление
сосудистого рисунка. Эхокардиографически определяется легочная
гипертензия, но для подтверждения диагноза необходимо прямое
измерение давления в легочной артерии.
Лимфаденопатия. ПГЛ является обычной находкой при ВИЧ-
инфекции, однако прикорневые и медиастинальные лимфоузлы не всегда
являются частью этого синдрома. Поэтому необходимо больных с
рентгенологически подтвержденной торакальной аденопатией тщательно
обследовать на инфекции и новообразования. Биопсия экстраторакальных
лимфоузлов часто может помочь в установлении диагноза.
3.9. Дифференциальная диагностика заболеваний
респираторного тракта
В 1984 году National Heart, Lung, and Blood Institution опубликовал
доклад о проделанной работе по изучению легочных заболеваний на фоне
ВИЧ-инфекции и опубликовал алгоритмы по рентгенологической
диагностике этих заболеваний (Murray JF, Felton СР, Garay SM et al, 1984)
(таблица 31).
Таблица 31
Дифференциальная диагностика рентгенологических находок у ВИЧ-
_ инфицированных больных (Murray JF, Mills J, 1990)
Рентгенологические Заболевания
изменения Диффузные ретикулонодулярныс инфильтраты Пневмоцистная пневмония Туберкулез Диссеминированный гистоплазмоз Диссемипир. коцидиоидомикоз ЛИП
Фокальное усиление легочного рисунка Бактериальная пневмония Саркома Капоши Криптококкоз Бронхогенная карцинома
Нормальная картина 11невмоцисгная пневмония Диссемипир. МАК-комплекс Диссеминированный гистоплазмоз Легочная гипертензия
Лимфаденопатия Туберкулез Саркома Капоши Диссемипир. МАК-комплекс I Ie-ходжкипская лимфома
Плевральный выпот Саркома Капоши Туберкулез Не-ходжкинская лимфома Пиогенная эмпиема
12*
179
В последующем эти диагностические алгоритмы были уточнены и
дополнены R.P. Wagner и H.W.Farber (1996), в интерпретации которых они и
проводятся:
1. Больные с лихорадкой, кашлем, одышкой или потерей веса должны
подвергаться рентгенологическому исследованию грудной клетки.
2. Если рентгенологическое исследование грудной клетки патологии не
выявляет, необходимо измерить альвеолярно-артериальный кислородный
градиент, определить поглотительную способность СО, и/или выполнить
таллиевое сканирование легких. Если результаты всех трех исследований
недиагностичны, заболевание легких маловероятно.
3. Если рентгенологически определяется фокальная патология,
необходимо начать определение традиционной инфекционной патологии.
Культивирование и окраска обнаруженных в мокроте бактерий и
кислотоустойчивых бацилл должны быть включены в исследование. Если
рентгенологически определяются диффузные инфильтраты, эмпирически
лечение ГЩП должно быть начато преимущественно у больных со СПИДом,
которые имеют незначительные или умеренные нарушения газообмена.
4. Должна преследоваться цель установить точный диагноз у больных,
которые не имеют СПИД-ассоциированных заболеваний. Исследование
мокроты на P.carinii, кислотоустойчивые бактерии и другие патогенные
микроорганизмы является первым шагом в этом направлении. В учреждениях,
где такие исследования сделать затруднительно, целесообразно проведение
фибробронхоскопии с бронхоальвеолярным лаважем. Подобное исследование
рекомендуется больным, у которых рентгенологические изменения в легких
носят фокальный, мягкий характер, или другие атипичные проявления ПЦП, у
которых обычная пневмония исключена.
5. Если исследование мокроты или первичная бронхоскопия с
бронхоальвеолярным лаважем недиагностичны, целесообразно выполнить
бронхоскопию с бронхоальвеолярным лаважем, бронхиальную щеточную
биопсию и множественные трансбронхиальные биопсии. Материалы биопсий
и лаважа должны быть должным образом культивированы и окрашены, как
бактериальные патогены (включая микроорганизмы рода Legionella, P.carinii,
кислотоустойчивые бациллы, грибы), так и ЦМВ. Они должны подвергаться
также общепринятому цитологическому и гистологическому исследованию.
6. Если бронхоскопия с трансбронхиальной биопсией недиагностичны, а
клиническая картина заболевания больного ухудшается, необходимо выполнить
повторную бронхоскопию с трансбронхиальной биопсией, или даже биопсию
легочной ткани.
7. Если бронхоскопия с трансбронхиальной биопсией недиагностична, а
больной клинически стабилен, необходимо провести определение
180
1. поглотительной способности и альвеолярно-артериального
кислородного градиента и/или таллиевое сканирование. Если результаты
этих исследований покажут, что состояние больного стабильное или
улучшается, необходимо будет продолжить клиническое наблюдение. Если
результаты покажут ухудшение состояния, необходимо будет провести
повторную бронхоскопию или биопсию легочной ткани.
С целью ранней диагностики нозологического диагноза
целесообразно использовать алгоритм предложенный John Bartlett G. 1999
г. Ниже приводится его характеристика.
Схема 1
Патология легких
кашель, лихорадка, одышка
Нормальная рентгенограмма
Ненормальная рентгенограмма
Способность к диффузии:
артериальное рО2 < 80 мм Hg
или пульсовой оксиметрии
Билатеральные
инфильтраты
Нормальная Ненормальная
Интерстициальные Полости в легких
Сливная долевая (каверны)
пневомния или
бронхопневмония
Исследуй мокроту
Посев и бактериоскопия
мокроты для диагности-
ки анаэроб, инф., тубер-
кулеза, грибк.пораж.
легких
Позитивная ПЦП Негативная
культура крови, мокроты или
бронхиального содержимого
(исслед. на бактерии, микобактерии,
или не получена
легионедлы)
Ан тибиотико терапия
Постановка
Нет
Снижение артериального
▼ Прогреесир.
Бронхоскопия инфильтраты
бронхо-ал ьвеолярны й
лаваж ± биопсия
I -
J------1--------оронхоскопия
ПЦП Нет ПЦП
диагноза диагноза
лечение
▼
бронхоскопия
Лечение
181
Литература
1. Батурина Л.А., Бурова Н.В., Воронин Е.Е. и др. “Новые возможности
реабилитации ВИЧ-инфицированных”, веб.:“Актуальные вопросы ВИЧ-
инфекции” (сборник материалов научно-практической конференции 29-
31 октября 1997 г.), СПб, “ССЗ”, 1997, стр. 32.
2. Методические рекомендации М3 РФ «Диагностика и лечение ВИЧ-
инфекции», 1999.
3. Райзе Ф.Е., Улюкин И.М., Бурова Н.В. и др. “Генерализованные формы
туберкулеза у больных с ВИЧ-инфекцией”, там же, стр. 107-108.
4. Рахманова А.Г., Бейер 7'.В„ Чайка Н.А. Пневмоцистоз и СПИД. -СПб. -
1992.-67 с.
5. Рахманова А.Г., Исаков В.А., Смирнов А.В. и др. Случай смерти от СПИДа
в СССР//Тер. архив. -1989. -№11. -с. 44-47.
6. Рахманова А.Г., Пригожина В.К., Степанова Е.В. и др. “Вторичные
заболевания у СПИД/ВИЧ пациентов”, там же, стр. 116-117.
7. Ремезов А.П., Неверов В.А., Корецкий Л.А. “Принципы терапии
оппортунистических инфекций у больных с ВИЧ-инфекцией: туберкулез
и СПИД", там же, стр. 118-120.
8. Санджиева Д.Б., Бурдаева Т.Ю., Васильева Г.Г. “Особенности течения
саркомы Капоши у двух детей со СПИД”, там же, стр. 126-128.
9. Цинзерлинг В.А., Комарова Д.В., Куликова Н.А. и др. “Морфологическая
характеристика ВИЧ-инфекции в Петербурге”, там же, стр. 147-148.
10. Улюкин И.М., Рустанович А.В., Воронин Е.Е. “ВИЧ-инфекция -
психофизиологические показатели на разных стадиях болезни”, там же,
стр. 143-144.
1 ЕЮрин О.Г. ВИЧ-инфекция. Кликика и лечение/Докт. дисс., 1999.
12 .Carter TR, Cooper PH, Petri WA et al. “Pneumocystis carinii infection on the
small intestine in a patient with aquired immunodeficiency syndrome”,
Am.J.Clin.Pathol, 1988, 89, pp. 678-683.
13 .Curtis JL, Goodman P, Hopewell PC. “Noninvasive tests in the diagnostic
evaluation for Pneumocystis carinii pneumonia with suspected of having the
acquired immunodeficiency syndrome”, Am.Rev.Resp.Dis., 133, p. 182.
14 .Freeding KA, 7’osteson ANA, Cohen CJ, Cotton DJ. “Primary prophylaxis for
Pneumocystis carinii pneumonia in HIV-infected people with CD-4 count below
200/mm: A cost effectiveness analysis”, J.Aquir.Immune Defic.Syndr., 1991,
pp. 521-31.
15 . Gallant JE, Richard DM, Chaisoon RE. “Prophylaxis for opportunistic infections
in patients with Hl V-infection”, Ann.Intern.Med., 1994, 120, pp. 932-44.
16JohnG. Bartlett. Medical care of patients with HI V-infection, eight edition, 1998-
1999.
182
17 . Kaplan LD, Abrams DI, Feigal E et al. “AIDS - assiciated non-Hodgkin’s lymphoma
in San-Francisco”, J AM A, 1989,261, pp. 719-24.
18 .Karp J, Profeta G, Maranz PR, Karpel JP. “Lung cancer in patients with
immunoceficiency syndrome”, Chest, 1993,103, pp. 410-13.
19 .Malabonga VM, Smith PR. “Upper airway obstruction due to Kaposi’s sarcoma
in the acquired immunodeficiency syndrome”, NY State J.Med., 1990,90, pp.
613-14.
20 .Mayayo E, Vidal F, Alvira R, et al. “Cerebral Pneumocystis carinii infection in
AIDS”, Lanset, 1990, v. 336, p. 1592.
21 .Mette SA, Palevsky HI, Pietra GG et al. “Primary pulmonary hypertension
associated with human immunodeficiency virus infection”, Am.Respir.Dis.,
1992, 145, pp. 1196-1200.
22 .Murray SF, Mills J. “Pulmonary infectious complication on human
immunodeficiency virus infection (part 1)”, Am.Rev.Resp.Dis., 1990,141, pp.
1356-72.
23 .0gibene FP, Masur H, Rogers Petal. “Nonspecific interstitial pneumonitis without
evidence on Pneumocystis carinii in asymptomatic patients with human
immunodeficiency virus (HIV)”, Ann.Intern.Med., 1988,109, pp. 874-79.
24.Pilon VA, Echols RM, Celo JS, Elmendorf SL. “Disseminated Pneumocystis
carinii infection in AIDS”, N.Engl.J.Med., 1987, 316, pp. 1410-11.
25.Roithmann S, Tourani J-M, Andrieu JM. “AIDS - associated non-Hodgkin
lymphoma”, Lanset, 1991,338, pp. 884-5.
26.Sattler FR et al. “Trimetrexate - leucovorin dosage evaluation study for treatment
of Pneumocystis carinii pneumonia”, J.Inf.Dis., 1990,161, pp. 91-96.
27 .Tenholder MF, Jackson HD. “Bronchogenic carcinoma in patients seropositive
for human immunodeficiency virus”, Chest, 1993,104, pp. 1049-53.
28 . Wagner RP, Farber HW. “Pulmonary Manifestation”, in “HIV-infection. A Primary
Care Manual”, ed. H.Libman, RA Witzburg, Little, Broun and Company, 1996,
pp. 139-163.
29 .Wallace JM, Rao AV, Glassroth J, et al. “Respiratory illness in persons with
human immunodeficiency virus infection: The Pulmonary Complication of HI V
Infection Study Group”, Am.Rev.Resp.Dis., 1993, 148, pp. 1523-29.
30 .Yung RC, Weinacker AB, Steiger DJ. “Upper and middle lobe bronchoalveolar
lavage to diagnose Pneumocystis carinii pneumonia”, Am.Rev.Resp.Dis., 1993,
148, pp. 1563-66.
183
Глава 4. ПОРАЖЕНИЯ СЛИЗИСТОЙ ПОЛОСТИ РТА И
ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ПРИ ВИЧ-ИНФЕКЦИИ
Эпидемиологические и клинические наблюдения с определенностью
указывают на то, что слизистая рта и желудочно-кишечный тракт (ЖКТ)
является одним из основных мест внедрения ВИЧ и различных возбудителей
и местом проявления ранних симптомов заболевания. Иначе говоря, слизистая
рта и органы ЖКТ-это первые мишени, поражаемые при СПИДе [35, 66].
Отчетливо выраженные поражения ЖКТ описываются у 50% больных
СПИДом в США и 90% больных в Африке и на Гаити [22, 32, 34, 48, 60,
61,63].
Wasting-syndrome, характеризующийся хронической диареей, часто
рефрактерной к терапии, мальабсорбцией и более чем 10% потерей массы
тела за 1-2 мес., является одной из главных манифестаций прогрессирующего
течения поздней стадии заболевания. В Африке термином «Slim disease»
еще до открытия ВИЧ обозначали состояние, соответствующее понятию
«Wasting-syndrome». Это состояние включало следующие симптомы:
анорексия (у 100%), длительная, более 1 мес., лихорадка (97%), хроническая
диарея (93%), потеря массы тела более 10% (93%).
Учитывая высокую частоту поражения ЖКТ в тропиках при СПИДе,
ВОЗ в 1985 г. [79] рекомендовала следующие клинические критерии («критерии
Банги») для предварительной диагностики этого заболевания в тропических
странах. Диагноз СПИДа устанавливается, если пациент имеет 2 из трех
больших признаков заболевания:!) потеря массы тела более 10%; 2)
хроническая диарея (более 1 мес.); 3) длительная лихорадка (более 1 мес.) и
хотя бы один из малых признаков: 1) упорный кашель более 1 мес.; 2)
генерализованный зудящий дерматит; 3) опоясывающий герпес в анамнезе;
4) кандидоз ротоглотки; 5) хроническая прогрессирующая или
диссеминированная герпетическая инфекция, вызванная ВПГ; 6)
генерализованная лимфаденопатия.
Однако, не только тонкокишечная диарея, анорексия, потеря массы тела
и кандидоз ротоглотки относятся к симптомам поражения ЖКТ при ВИЧ-
инфекции. Нередко встречаются и признаки поражения толстой кишки.
Особенно часто это наблюдается у лиц с гомосексуальной ориентацией, и
получило в англоязычной литературе наименование «Gay bowel syndrome»
- кишечный синдром «геев». Он включает: болевые ощущения в прямой кишке
и гипогастрии, метеоризм, тенезмы, признаки дисхезии, кровотечения и др.
Причины поражения ЖКТ при ВИЧ-инфекции.
К основным причинам развития поражения ЖКТ при ВИЧ-инфекции
относятся:
1. прямое воздействие ВИЧ на ЖКТ;
184
2. вторичные инфекции, вызванные оппортунистическими и
патогенными облигатными паразитами;
3. опухоли.
4.1. Прямое воздействие ВИЧ на ЖКТ.
В 20% случаев персистирующей диареи, возникающей при ВИЧ-
инфекции, в желудочно-кишечном тракте и кале больных не удается обнаружить
каких-либо возбудителей вторичных инфекций [26,73]. В таких случаях нередко
употребляется термин «идиопатическая СПИД-энтеропатия». Принято считать,
что этот вид энтеропатии возникает вследствие прямого воздействия ВИЧ не
только на клетки иммунной системы кишечника - СЭ4-лимфоциты и макрофаги,
но и на некоторые специализированные клетки кишечника. К последним, как
установили еще в конце 80-х годов два исследователя из Калифорнийского
университета в Сан-Франциско Ченг-Мейер и Леви, относятся
серотонинпроизводящие хромаффинные клетки кишечника. По мнению D.P.
Kotler и др. [31, 38, 39, 40] в основе развития СПИД-энтеропатии лежат
специфическое воздействие ВИЧ и аутоиммунные реакции. Эти исследователи
одними из первых обнаружили при СПИД-энтеропатии как функциональные,
так и морфологические изменения со стороны кишечника. Функциональные
изменения включали нарушения всасывания D-ксилозы и стеаторею.
Гистологическое исследование биоптатов тощей и прямой кишок позволило
выявить в тощей кишке атрофию ворсинок, гиперплазию крипт и увеличение
содержания интраэпителиальных лимфоцитов. В прямой кишке обнаружены
ядерные вирусные включения, инфильтрация Lamina ргорпатучными клетками,
очаговая дегенерация клеток в области основания крипт. По мнению ряда
исследователей [37,54,66] в развитии персистирующей диареи и HIV-wasting
syndrom большое значение имеет высокий уровень образования цитокинов (в
частности, фактора некроза опухолей - TNF-a), в организме и в том числе в
ЖКТ больных. Данные, полученные сотрудниками нашей кафедры,
свидетельствуют о том, что при прогрессирующем течении ВИЧ-инфекции
спонтанная продукция TNF-a мононуклеарами периферической крови в 100%
случаев и уровень TNF-a в плазме в 70% случаев были выше
среднестатистических показателей в соответствующих стадиях заболевания [9].
Основными клиническими проявлениями СПИД-энтеропатии являются:
хроническая диарея тонкокишечного типа, мальабсорбция и потеря массы
тела [42].
Диагностика заболевания возможна лишь при исключении иной
этиологии поражения ЖКТ и обнаружении в биоптатах тонкой кишки
признаков инфицирования клеток ВИЧ [19].
Лечение-. 1) этиологическая терапия основного заболевания - ВИЧ-
инфекции;
185
2) патогенетическая терапия:
- диетовитаминотерапия [14,17];
- регидратация и реминерализация;
- коррекция белкового, жирового, углеводного и других видов обмена;
- неспецифические и специфические антицитокиновые средства
(кетотифен,трентал, моноклональные anti-TNF антитела) [54];
- иммунокорригирующая терапия («мягкая» иммуносупрессия);
3) симптоматическая терапия - использование рекомбинантных
человеческих гормона роста и инсулиноподобного ростового фактора [65,77],
анаболических стероидов[29].
4.2. Вторичные инфекции и опухоли.
В основе этого вида поражений лежит воздействие оппортунистических
и облигатно патогенных возбудителей наЖКТ. По данным K.Arasteh [12],
основанным на изучении гастроинтестинальной манифестации СПИДа у 5600
стационарных больных, нозология их различна. Удельный вес различных
нозологических форм и их разновидностей:
кандидоз полости рта 29,1%
кандидоз пищевода 8,6%
ЦМВИ 6,4%
криптоспоридиоз 2,9%
микроспоридоз <2,0%
сальмонеллез 2,3%
клостридиозный псевдомембранозный колит <2,0%
изоспороз <2,0%
лямблиоз <2,0%
амебиаз <2,0%
кампилобактериоз <2,0%
атипичный микобактериоз 8,4%
Используя условно таксономический принцип, рассмотрим характер
поражения ЖКТ в зависимости от этиологического фактора.
Цитомегаловирусная инфекция (ЦМВИ)
ЦМВИ наблюдается у 50% серопозитивных по ВИЧ-инфекции и является
одной из наиболее частых причин смерти больных со СПИДом. В 10% случаев
диарея у больных ВИЧ-инфекцией обусловлена ЦМВ [62].
Спектр поражения ЖКТ данным вирусом включает [24]:
- хронический ЦМВ-сиалоденит и, как следствие, нарушение саливации,
обработки пищевого комка в полости рта и вторичные инфекционные
заболевания слизистых оболочек полости рта;
186
- хронический эзофагит (катаральный, эрозивный, язвенный);
- хронический эрозивно-язвенный гастродуоденит;
- полипоз желудка (чаще поражается антральный отдел);
- ЦМВ-энтеропатия;
- язвенно-некротический энтероколит;
- язвенный колит [50];
- васкулит толстой кишки (в колоноцитах и эндотелии сосудов
определяются включения, характерные для ЦМВ).
Среди осложнений вышепредставленной патологии описаны
кровотечения, асцит, перфоративные процессы, перитонит, острое расширение
кишки и др. [41].
Диагностика-. 1) цитологические исследования (слюна, промывные воды
желудка и кишечника, моча); 2) гистология биоптатов слизистой ЖКТ; 3)
иммунофлюоресцентное исследование мазков-отпечатков и биоптатов
слизистой оболочки; 4) ИФА; 5) ПЦР; 6) вирусологическое исследование
биоптатов.
Лечение. Препаратами выбора являются: ганцикловир в дозе 5мг/кг 2
раза в сутки внутривенно и фоскарнет в дозе бОмг/кг 3 раза в сутки
внутривенно. Курс лечения составляет 14-21 день.
Простой герпес
Спектр поражения ВПГ-I включает:
- афтозный гингиво-стоматит;
- афтозный эзофагит.
ВПГ-П типа чаще вызывает поражения у лиц с гомосексуальной
ориентацией [8,25]. Среди них: пузырьково-язвенные поражения перианальной
области и хронический (дистальный) проктит.
Диагностика-, во многом совпадает с распознаванием
цитомегаловирусной инфекции. Чаще всего не используется лишь
цитологическое исследование.
Лечение. Препаратами выбора являются: ацикловир и родственные ему
средства. Стартовая доза ацикловира составляет 2 г в сутки, в дальнейшем 1
г в сутки. Курс лечения не менее 10-14 дней.
Энтеровирусная, ротавирусная и аденовирусная инфекции, хотя и не
относятся к числу ВИЧ-ассоциированных заболеваний, однако, имеют все
основания, по нашему мнению, стать в недалеком будущем актуальными
вторичными инфекциями, вызывающими поражение ЖКТ у больных ВИЧ-
инфекцией.
187
Хламидиозы
Поражения ЖКТхламидиями обычно встречаются улиц, использующих
генитально-оральные и генитально-анальные варианты сексуальных связей [74].
При этом С. trachomatis (серовары D-К) вызывают, по нашим наблюдениям,
хроническое катаральное поражение ротоглотки и хронический проктит [51,
57, 71]. В тех странах, где встречается венерическая лимфогранулема,
вызываемая С. trachomatis (LGV-серовары), эти серовары возбудителя
приводят к развитию хронического колита [ 15, 58].
Диагностика-. 1) исследование биоптатов и соскобов со слизистой
оболочки кишки в реакции иммунофлюоресценции; 2) культивирование
хламидий (на культуре клеток); 3) исследование крови в ИФА; 4) исследование
соскобов слизистой оболочки кишки в ПЦР.
Лечение. Препаратами выбора являются макролиды, фторхинолоны и
тетрациклины. Эффект системного применения этих средств может быть
дополнен местным их использованием.
Сальмонеллез
Сальмонеллез как суперинфекция встречается на фоне СПИДа значительно
чаще, чем при других инфекционных заболеваниях [46,70]. Сальмонеллезная
рецидивирующая септицемия является СПИД-индикаторной болезнью II гр.
(список CDC/WHO, 1988), т.е. при лабораторно верифицированной ВИЧ-
инфекции указывает на наличие терминальной ее стадии - СПИД (в соответствии
с классификацией CDC 1993 г. - клиническая категория С).
Наиболее часто заболевания вызывают S. enteritidis и S. typhiinurium.
Наивысшую опасность и с клинических, и с эпидемиологических позиций
для больных ВИЧ-инфекцией представляют госпитальные штаммы S.
typhimurium.
На ранней стадии ВИЧ-инфекции сальмонеллез обычно протекает как
локализованная инфекция - в гастроинтестинальной форме. На поздней стадии,
у больных клинической категории С, - в септической форме. В этом случае
наблюдается тяжелое, нередко рецидивирующее течение заболевания и
отсутствие заметного эффекта от проводимой антибиотикотерапии [27].
Диагностика-. 1) бактериологический метод (посевы кала, мочи, крови
и др.) 2) серологические исследования (РИГА, ИФА и др.); 3) молекулярно-
генетические (ПЦР); 4) экспрессные (МФА, РИГА с иммуноглобулиновыми
диагностикумами) и др.
Лечение: препаратами выбора являются фторхинолоны, цефалоспорины
3-4-го поколений, аминогликозиды, рифампицины (рифакол). Следует
подчеркнуть, что эффективность лечения сальмонеллеза у больных ВИЧ-
инфекцией во многом зависит от качества терапии основного заболевания,
способствующего повышению активности иммунной системы.
188
Кампилобактериоз
Как показали исследования французских клиницистов, кампилобактерии
выделялись от больных СПИДом значительно чаще, чем от здоровых [16]. При
обследовании больных СПИДом, имеющих диарейный синдром, чаще всего
высевались Camp, jejuni, Camp, cinaedi и Camp, fetus.
Основным клиническим проявлением кампилобактериоза у больных
ВИЧ-инфекцией является гастроэнтероколит, имеющий, как правило, затяжное
течение. Кампилобактериоз у больных клинической категории С нередко
протекает в септической форме.
Диагностика-. 1) бактериологический метод (посевы кала, крови и др.)
с использованием анаэростата; 2) серодиагностика (РИГА, ИФА).
Лечение', к препаратам выбора относятся аминогликозиды, макролиды
и метронидазол.
Шигеллезы
У больных с ранними стадиями ВИЧ-инфекции шигеллезы протекают
как локализованные заболевания, в поздней стадии могут носить септический
характер [52].
Диагностика-. 1) бактериологический метод (посевы кала, крови и др.)
2) серологические исследования (РИГА, ИФА и др.); 3) молекулярно-
генетические (ПЦР); 4) экспрессные (МФА, РИГА с иммуноглобулиновыми
диагностикумами) и др.
Лечение-, к препаратам выбора относятся фторхинолоны.
Эшерихиозы, как и два предыдущих бактериоза, хотя и не относятся к
числу ВИЧ-ассоциированных заболеваний, однако имеют все основания, по
нашему мнению, стать в недалеком будущем актуальными вторичными
инфекциями, вызывающими кроме поражения ЖКТ, смертельные осложнения
у больных ВИЧ-инфекцией [72].
Микобактериозы
Микобактериозные поражения ЖКТ при ВИЧ-инфекции могут быть
обусловлены микобактериями туберкулеза и атипичными микобактериями.
Туберкулез кишечника и мезентериальных лимфатических желез
представляет собой реактивацию латентной инфекции и может встречается
на любой из стадий ВИЧ-инфекции [4, 67]. К основным клиническим
проявлениям этого заболевания относятся:
- персистирующая лихорадка;
- потеря массы тела;
- мезаденит;
- нарушения стула;
189
- кишечные кровотечения.
Микобактериозы, вызванные атипичными микобактериями комплекса
M.avium-intracellulare возникают обычно в поздней стадии ВИЧ-инфекции
[2,21,30,53]. При этом можетбыть поражен любой участок ЖКТ (начиная от
пищевода и до аноректальной области). Заболевание протекает как
генерализованная инфекция. Типичными клиническими проявлениями ее
являются:
- боли в животе;
- диарея;
- гепатоспленомегалия;
- генерализованная лимфаденопатия.
Патологические изменения в кишечнике сходны с изменениями при
болезни Уиппла. У многих пациентов отсутствует характерная для туберкулеза
гранулематозная реакция.
Диагностика-. 1) бактериологическое исследование фекалий, крови и
др. материала; 2) ИФА сыворотки крови и других жидкостей; 3)
гистологическое исследование материала.
Лечение-, используется комбинированная этиотропная терапия,
включающая при туберкулезе аминогликозиды, рифампицины, фторхинолоны,
этамбутол, пиразинамид, а при атипичном микобактериозе еще и макролиды
(кларитромицин), циклосерин и др. [6, 28,68].
11севдомембранозный колит, вызванный Cl. difficile
Описан у части больных клинических категорий В и С (CDC, 1993).
Проявляется длительной, плохо поддающейся терапии диареей с характерными
патологическими примесями в стуле [6,43,44].
Диагностика: 1) эндоскопия (ректороманоскопия и др.) [49]; 2)
бактериологическое исследование кала.
Лечение: препаратами выбора являются ванкомицин и метронидазол.
Гонококковый проктит
Встречается у лиц, использующих генитально-анальный вариант секса.
Может иметь острое и хроническое течение.
Диагностика: микроскопия мазков, реже другие методы исследования.
Лечение: антибиотиками выбора являются пенициллины и
полусинтетические пенициллины, антибиотики широкого спектра действия,
фторхинолоны.
Кандидоз
Кандидоз относится к наиболее часто встречающимся формам
гастроинтестинальной манифестации СПИД [ 1,56,71 ]. Он протекает в виде:
190
-орального,
- ороэзофагиального,
- ороэзофагогастрального; и очень редко
- ороэзофагогастроинтестинального кандидоза.
Свыше 50% инфицированных ВИЧ, у которых имеется оральный
кандидоз, в пределах 2 лет обнаруживают полную симптоматику СПИДа.
Продолжительность же жизни после возникновения кандидоза пищевода не
превышает 6 мес. Приводим случай продолжительной диареи, обусловленной
тяжелым дисбактериозным поражением толстой кишки, вт.ч. ее кандидозным
поражением.
Больной М., 49 лет, наблюдался нами в Городской инфекционной
больнице № 30 им. С.П.Боткина в Санкт-Петербурге с 1995 г. Диагноз ВИЧ-
инфекции был выставлен в ноябре 1994 г. (выявлен при обследовании в КВД
в связи с серорезистентным сифилисом; инфицирован при гомосексуальных
контактах).
С августа 1996 г. у больного появился жидкий, водянистый стул со слизью
не чаще 2-3 раз в сутки. В посевах кала патогенной флоры и криптоспоридий
обнаружено не было. В лечении применялся циплокс, дифлюкан. На протяжении
3 месяцев до и во время следующей госпитализации (ноябрь 1996 г.) характер
стула и его частота сохранялись прежними. При лабораторном обследовании в
посевах кала отмечался рост: enterococcus - 108, Candida - умеренный рост, st.
aureus - 106, криптоспоридии не обнаружены. В гемограммах: анемия,
тромбоцитопения, высокие цифры СОЭ (от 30 до 70 мм/ч). В иммунограммах:
CDM - 30% (540) ->14% (143), CD4 - 29% (522) ->30% (306), CD8 - 33% (594)
—>32% (326) и CD4/CD8 -0,88 ->0,9 (до появления патогенной флоры в посевах
кала и при ее появлении соответственно). В протеинограмме общий белок -
82,8 -> 86,4 г/л, альбумины 50,3 -> 52,3%, глобулины осх - 4,4 -> 3,4%, а2 -
7,3 -> 6,5%, Р-11,4—> 9,3%, у - 26,6 -> 29,0%. Во время последней
госпитализации получал массивную антибактериальную и противогрибковую
терапию (бисептол, аугментин, циплокс, гентамицин, низорал, дифлюкан) без
эффекта. В дальнейшем больной был выписан по настоятельной просьбе для
Дальнейшего лечения домой, где при нарастающих явлениях кахексии и ОССН
умер 14.04.97 г. При вскрытии в кишечнике имел место язвенно-
псевдополипозный кандидозный распространенный колит (с поражением всех
отделов толстой кишки).
Гистоплазмоз
На фоне иммунодеффицита гистоплазмоз может иметь не только
локализованный или моновисцеральный, но и диссеминированныйтиптечения
[7, 64, 78]. У 75% больных в патологический процесс вовлекается и ЖКТ.
191
Встречается у больных ВИЧ-инфекцией несравненно реже, чем кандидоз.
Диагностика: 1) посевы с последующим микологическим
исследованием; 2) ИФА и другие методы иммунохимической диагностики.
Лечение: к препаратам выбора относятся имидазольные препараты
(кетоконазол, интраконазол и др.) [36].
4.3. Криптоспоридиоз.
Доля криптоспоридиоза вэтиологической структуре кишечных инфекций
за последние годы заметно возросла во многих, в т.ч. экономически развитых
странах. По данным паразитологического отдела ГЦ ГСЭН (зав. Л .П. Антыкова)
Санкт-Петербурга удельный вес криптоспоридиоза среди верифицированных
в городе диарейных заболеваний у детей составил около 2%.
Вместе с тем криптоспоридиоз является одной из наиболее частых
этиологических форм кишечных инфекций у больных СПИДом [5,6,11,69].
Относится к СПИД-индикаторным болезням 1 гр. (список CDC/WHO, 1988).
Криптоспоридиоз - протозойное заболевание человека, обычно
протекающее в гастроинтестинальной форме с нарушением всасывательной
функции кишечника и принимающее тяжелые формы у лиц с
иммунодефицитом. У больных СПИДом криптоспоридиоз имеет длительное,
часто инкурабельное течение.
Этиология. Криптоспоридии - простейшие (Protozoa), относящиеся
к подклассу кокцидий. Известно около 20 видов криптоспоридий, хозяевами
которых являются различные животные (телята, овцы и др.). Человек-хозяин
только одной криптоспоридии (C.Garnhami), но строгой специфичности
хозяев нет. Полное развитие паразита происходит в организме одного хозяина
(человека или животного) и завершается выделением с фекалиями ооцист,
устойчивых к действию неблагоприятных факторов, способных длительно
сохраняться во внешней среде и заражать новых хозяев. Ооцисты
криптоспоридий диаметром 4-5 мкм заглатываются человеком или животным
с пищей или водой. В кишечнике хозяина ооцисты проходят в течение 4-7
дней определенный цикл развития (спорозоиты, трофозоиты, мерозоиты) до
образования и выделения с фекалиями новых ооцист.
Эпидемиология. Источником инфекции являются человек и различные
животные. Механизм передачи - фекально-оральный. Известны семейные и
внутригоспитальные вспышки криптоспоридиоза. Криптоспоридии-одна из
частых причин «диареи путешественников».
Патогенез. Инфекция начинается с заглатывания ооцист, которые
начинают усиленно размножаться в кишечнике, что приводит к дегенеративным
изменениям энтероцитов. Нарушаются всасывание пищеварительных веществ,
воды и электролитов, ферментативная деятельность кишечника.
J92
Присоединение рвоты увеличивает потерю жидкости и электролитов. В
ряде случаев болезнь может протекать без диареи, что объясняется
повреждением криптоспоридиями слизистой оболочки желудка.
При криптоспоридиозе могут поражаться эпителий глотки, гортани,
пищевода, желудка, но наиболее часто повреждается эпителий тонкой кишки.
На фоне иммуносупрессии возникают тяжелые формы болезни, помимо
пищеварительной системы в патологический процесс вовлекаются другие
органы и ткани.
Клиника. Инкубационный период продолжается от 4 до 14 дней.
Клиническая картина криптоспоридиоза зависит от состояния иммунной
системы.
У лиц с нормальной иммунной системой криптоспоридиоз чаще
протекает субклинически, при манифестной форме болезни возникают
небольшая лихорадка, слабость, анорексия, тошнота, рвота и водянистый
«холероподобный» стул до 20 раз в сутки в течение 7-14 дней,
сопровождающийся болью в животе. Прогноз обычно благоприятный, за
исключением детей с недостаточностью питания.
У больных с иммунодефицитом, в том числе с ВИЧ-инфекцией встадии
СПИДа, заболевание приобретает тяжелый хронический характер. У них на
фоне высокой температуры тела отмечается прогрессирующая диарея
перемежающегося или постоянного типа с большой потерей жидкости,
прогрессирующим похуданием.
В стадии СПИДа криптоспоридии могут поражать желчный пузырь,
желчевыводящие пути, легкие.
Бронхолегочный (респираторный) криптоспоридиоз характеризуется
лихорадкой, лимфаденопатией, длительным кашлем со скудной слизистой, реже
слизисто-гнойной мокротой, одышкой, цианозом. В мокроте можно обнаружить
ооцисты криптоспоридий. При биопсии выявляется метаплазия поверхностных
эпителиальных клеток бронхов. У больных СПИДом описана и двусторонняя
интерстициальная пневмония, обусловленная криптоспоридиями. Ооцисты при
этом выявляются в альвеолярных макрофагах. Респираторный криптоспоридиоз
завершается смертью больных, несмотря на массивную химиотерапию.
Диагностика. Микроскопическое исследование мазка фекалий,
окрашенного по Цилю-Нильсену (или Кестеру или Романовскому-Гимзе)
является ведущим методом подтверждения этого заболевания. Диагностика
основывается на обнаружении ооцист криптоспоридий в испражнениях. Кроме
того, используются серологические методы - ИФА и др. Нередко при СПИДе
криптоспоридиоз сочетается с кандидозом, пневмоцистной,
Цитомегаловирусной, токсоплазменной и другими инфекциями, что
обусловливает злокачественное течение, приводит к резкому истощению и
смерти больных.
>3. Заказ № К-4451.
193
Лечение. Этиотропных средств терапии, достаточно эффективных при
криптоспоридиозе, нет. Полноценная легкоусвояемая пища без грубой
клетчатки (стол № 4), обильное питье достаточны для выздоровления
больных с легкой и даже среднетяжелой формами криптоспоридиоза. У
лиц с иммунодефицитами любой природы рекомендуется применение
спирамицина 3 г в сутки, а также пероральная, парентеральная
регидратация. В терапии используются макролиды, клиндамицин,
фуразолидон и другие препараты. Однако, основное значение имеет
патогенетическая терапия и более эффективное лечение основного
заболевания - ВИЧ-инфекции.
Профилактика такая же, как при всех кишечных инфекциях.
В качестве иллюстрации последнего приводим описание
характерного типа течения криптоспоридиоза на фоне СПИДа.
Больной У., 35 лет, наблюдался нами в Городской инфекционной
больнице № 30 им. С.П.Боткина в Санкт-Петербурге с 1993 г. Диагноз ВИЧ-
инфекции установлен в 1993 г. (выявлен при обследовании в КВД по
поводу сифилиса, инфицирован при гомосексуальных контактах).
Кишечная дисфункция и патологический стул возникли у больного с
января 1994 г. (в стадии П1-Б по В.И.Покровскому), на фоне
прогрессирующего ухудшения самочувствия и состояния (нарастание
общей слабости, снижение массы тела, постоянная лихорадка на
субфебрильных и фебрильных цифрах). При лабораторном обследовании
отмечались следующие изменения: в гемограмме снижение гемоглобина
(85 - 90 г/л), эритропения, ретикулоцитоз, тромбоцитопения,
палочкоядерный сдвиг, ускоренная СОЭ до 25-35 мм/ч; в протеинограмме
отмечалась гипоальбуминемия (43,8%), о^-глобулины - 3,3%; а2-глобулины
- 6,1%; Р-глобулины -13,8%; у-глобулины 35,1%; в иммунограмме CD4 -
36 % (414), CD8 - 31,5% (362), К= 1,14; в копрограмме лейкоциты и
эритроциты до 10 в п/зр; дополнительных обследований не проводилось
из-за досрочной выписки больного из стационара. Получал азидотимидин,
циплокс, бисептол, ампициллин длительно с хорошим эффектом
(улучшение самочувствия, нормализация температуры и стула). В марте -
апреле 1995 г. отмечал неустойчивый стул (не обследовался, ВИЧ-инфекция
в стадии Ш-В).
С конца апреля 1996 г. у больного возникло учащение стула до 20 и
более раз в сутки (жидкий, водянистый, зловонный, периодически с
примесями крови). При исследовании кала с 30.04.96 г. неоднократно
определялись ооцисты криптоспоридий. Получал ферментные препараты,
метрогил, в течение месяца - энтероседив, на фоне которых удалось
добиться кратковременной нормализации стула к концу июня, однако с
начала июля возобновился жидкий стул до 7-8 раз в сутки на фоне
194
продолжающейся лихорадки и прогрессивного ухудшения общего
состояния. Попытка купировать диарею суммамедом в сочетании с
фуразолидоном и ферментативными препаратами не дала положительного
результата и вновь был назначен энтероседив, после чего частота стула
снизилась до 1-2 раз в сутки, однако сохранялось вздутие живота,
постепенно усиливались боли по ходу толстой кишки. Указанные
симптомы сохранялись весь дальнейший период заболевания.
Гематологические показатели в этот период нестабильные, сохранялись
эритро- и тромбоцитопения, анемия; в протеинограмме: общий белок 62,8
->59,9 г/л; альбумин - 42%, о^-глобупины - 5,0%; а2-глобулины - 5,2%; 0-
глобулины -11,8%; у-глобулины -36,0%; иммунологические показатели
также значительно варьировали (в приведенных ниже данных до
обнаружения криптоспориидий и при развернутой клинике кишечного
криптоспоридиоза соответственно).
CD,0 - 19% (116)->34% (150), CD4-23%(148)-> 19%(71)
cd' - 32% (207) -> 28% (105), CD25 - 19% (123) ->13% (49)
CD|6 - 26% (168)->17% (64)
IgA - 4,8 -> 8,0 г/л, IgM - 1,6 -> 1,0 г/л, IgG - 18 -> 18,0 г/л,
ЦИК-0,1 ->0,03
Состояние больного прогрессивно ухудшалось и 01.09.96 г. на фоне
резко выраженного истощения он скончался. Клинический диагноз
(подтвержденный затем на аутопсии):
ВИЧ-инфекция в стадии СПИДа (СЗ по CDC, 1993), ВИЧ-энцефалит,
энцефалопатия.
Сопутствующие заболевания: Рецидивирующий простой герпес,
цитомегаловирусная инфекция. Правосторонняя нижнедолевая пневмония
смешанной этиологии. Туберкулез внутригрудных лимфатических узлов,
инфильтративная фаза, ВК(-). Криптоспоридиоз, кишечная форма.
Кандидоз слизистых оболочек полости рта. Хронический простатит.
Осложнения: Кахексия, панцитопения, токсический
медикаментозный гепатит (05.96 г.), острая сердечно-сосудистая
недостаточность.
В приведенном наблюдении непосредственной причиной смерти
больного СПИДом послужил криптоспоридиоз, лечение которого было
безуспешным
Изоспороз.
Возбудители - Isospora belli и Isospora natalensis относятся, как и
криптоспоридии, к кокцидиям.
По клинике изоспороз во многом сходен с криптоспоридиозом [5,
6, 23, 69J. Однако, вследствие различий в патогенезе (в отличие от
криптоспоридиоза, изоспороз - внутриклеточный протозооз) имеется и
13»
195
своеобразие в клинических проявлениях заболевания. К ним относятся:
более частое присутствие в кале патологических примесей слизи и крови,
а в копрограмме - лейкоцитов и эритроцитов.
Диагностика: основана на исследовании проб фекалий с
применением методов обогащения. Наиболее широко применяют
флотационные методы (Фюллеборна, Дарлинга). Используется и метод
формалин-эфирного осаждения. Препараты нередко окрашивают по методу
Циля-Нильсена или с использованием его модификаций [5,6].
Лечение: эффективны ко-тримоксазол и метронидазол.
Циклоспороз.
Возбудитель заболевания - Cyclospora caetanensis относится к подклассу
кокцидий. Обладает способностью к внутриэпителиальному
паразитированию. Экологической нишей для паразита является эпителий
дистального отдела двенадцатиперстной и тощей кишки. Циклоспороз, как и
два предыдущих протозооза, вызывает у иммунокомпетентных лиц
самолимитирующуюся тонкокишечную диарею, а в качестве
оппортунистической инфекции на фоне СПИДа - персистирующее диарейное
заболевание [6]. Однако, и при ВИЧ-инфекции описаны случаи спонтанного
исчезновения симптомов заболевания [55]. В целом этот вид протозооза имеет
более легкое течение у больных ВИЧ-инфекцией, чем два предыдущих.
Диагностика: используются методы обогащения с последующей
фиксацией и окраской аналогично исследованиям, проводимым на
криптоспоридиоз.
Лечение: к препаратам выбора относится ко-тримоксазол [33].
Микроспоридоз.
Среди патогенных для человека видов микроспоридий два -
Enterocytozoon bieneusi и Septata intestinalis наиболее часто вызывают у больных
ВИЧ-инфекцией поражение желудочно-кишечного тракта и персистирующую
тонкокишечную диарею [6, 13, 18, 42. 59]. На фоне СПИДа (у больных
клинической категории С - CDC, 1993) микроспоридоз может приобрести
черты генерализованной инфекции и закончиться летально [20].
Диагностика: 1) паразитологическое исследование проб фекалий [75];
2) исследование биоптатов двенадцатиперстной, тощей и подвздошной кишок,
окрашенных по Граму, Гимза или 1Виффу; 3) электронномикроскопическое
исследование биоптатов.
Лечение. Препаратами выбора являются альбендазол и метронидазол [45].
Бластоцистоз.
Возбудитель - Blastocystis hominis относится к простейшим,
экологической нишей для которых является дистальная часть подвздошной
кишки, слепая, восходящая и поперечно-ободочная кишка. Активизация
196
паразита обычно возникает на фоне выраженного иммунодефицита и
сопутствующего ему дисбактериоза кишечника [10,47].
В клинике заболевания присутствуют симптомы энтероколита: диарея
(стул нередко содержит примесь слизи), дискомфорт и боли в мезо- и
гипогастрии, метеоризм, тошнота, анорексия. В периферической крови часта
эозинофилия.
Диагностика: микроскопия мазков фекалий, окрашенных железным
гематоксилином, по Романовскому-Гимза или трихромовым красителем.
Применение методов обогащения значительно увеличивает чувствительность
анализа [6].
Лечение: препаратом выбора является метронидазол.
Лямблиоз пока не представляют серьезной проблемы при ВИЧ-
инфекции, но может составить ее в будущем. Течение же на фоне СПИДа
такого толстокишечного протозооза, как амебиаз, начинает представлять
определенную проблему для целого ряда стран с жарким климатом. Это связано
с учащением развития внекишечных форм данного заболевания.
Стронгилоидоз.
Является одной из немногих глистных инвазий, имеющих значение при
ВИЧ-инфекции. Это связано с патогенетически обусловленной возможностью
аутоинвазии и массивной паразитемией с развитием в наиболее тяжелых
случаях диссеминированного стронгилоидоза [3,5,6,76].
Диагностика: 1) клинические проявления (аллергия и изменения в
гемограмме);
2) паразитологическое исследование.
Лечение: препаратом выбора является минтезол (тиабендазол) или
мебендазол.
Опухоли ЖКТ.
1. Саркома Капоши может развиться на любом участке ЖКТ, начиная
со слизистой оболочки полости ртадо аноректальной области [19,49].
2. Различного вида лимфомы также могут возникать на любом из
участков ЖКТ, однако, наиболее часто встречаются в тонкой кишке [19,49].
3. Сквамозноклеточная карцинома чаще всего обнаруживается на языке
и в аноректальной области.
4. Волосатая лейкоплакия обычно локализована на языке и слизистой
оболочки полости рта.
5. Остроконечные кондиломы чаще обнаруживаются в перианальной
области.
197
Ниже мы представляем разработанную и используемую нами в
повседневной работе схему обследования больного ВИЧ-инфекцией с
признаками поражения ЖКТ(с гастроинтестинальной манифестацией).
4.4. Алгоритм обследования больного с гастроинтестинальной
манифестацией СПИД.
I. Если у больного диарея, то кал берется для повторного:
1) посева на тифо-паратифозную, дизгруппу, УПФ и грибы,
кампилобактериоз, иерсиниоз;
2) исследования на яйца глистов и простейшие;
3) окраски мазка фекалий по Цилю-Нильсену (или Кестеру,
Романовскому-Гимзе) с целью выявления криптоспоридий, изоспор и др.
4) теста на токсин клостридий;
5) ИФА на ротавирусы.
П. Если у больного кишечное кровотечение, тенезмы или то и другое,
производят ректороманоскопию или фиброколоноскопию с биопсией (или
соскобом) слизистой оболочки кишки.
1) содержимое кишки исследуют на:
- шигеллы (посев);
- кампилобактерии (посев);
- микобактерии туберкулеза (посев);
- атипичные микобактерии (посев);
- гонококки (микроскопия мазка со слизистой оболочки);
2) биоптаты (или соскобы со слизистой оболочки) исследуют на:
- ЦМВ (цитологическое или гистологическое исследование, МФА);
- ВПГ(МФА);
- новообразования (гистологическое исследование).
III. Если у больного имеет место диарея тонкокишечного типа и
потеря массы тела - производят фиброгастродуоденоеюноскопию с
биопсией слизистой оболочки кишки.
1) аспирируют содержимое тонкой кишки для исследований на
простейшие и яйца глистов (микроскопия), для посева на тифо-
паратифозную группу, УПФ (с подсчетом колоний) и грибы;
2) биоптаты исследуют на:
-ЦМВ;
- новообразования.
198
Поражения полости рта у людей, зараженных ВИЧ-инфекцией,
относятся к числу первых симптомов заболевания, характеризующихся
большой частотой и разнообразием. Более того, наличие
псевдомембранозного кандидоза полости рта и оральной волосистой
лейкоплакии является убедительным признаком того, что ВИЧ-инфекция
переходит в стадию СПИДа. Появление ранних признаков иммунодефицита
имен-но в полости рта вполне понятно: сопутствующее подавление
иммунитета способствует пролиферации условно патогенных микробов, что
вызывает характерные поражения этой лока-лизации.
Приводим (с некоторыми сокращениями) опубликованное ВОЗ (1995)
«Руководство по исследованиям проявлений ВИЧ-инфекции, локализованных
в полости рта». Его авторами являются Сандра Л. Мельник, Рут Навьяк-
Раймер, Душанка В. Клейнман, Филипп А. Сванго (Департамент
здравоохранения и социального обеспечения США).
4.5. Классификация поражений полости рта, связанных с ВИЧ-
инфекцией
Группа 1. Поражения, часто связанные с ВИЧ-инфекцией:
кандидоз:
эритематозный,
гиперпластический,
псевдомембранозный,
(Примечание: с Candida albicans часто бывает связан ангулярный
хейлит).
волосатая лейкоплакия,
ВИЧ-гингивит,
ВИЧ-некротизирующий гингивит,
ВИЧ-периодонтит,
саркома Капоши,
лимфома не-Ходжкина.
Группа 2. Поражения, реже связанные с ВИЧ-инфекцией:
атипичные изъязвления,
заболевания слюнных желез:
сухость рта, связанная со снижением слюноотделения,
одностороннее или двустороннее опухание основных слюнных
желез,
тромбоцитопеническая пурпура,
вирусные инфекции (кроме вызываемых вирусом Эпштейна—Барр):
цитомегаловирусная инфекция,
инфекция, вызываемая вирусом простого герпеса,
инфекция, вызываемая папилломавирусом (бородавкообразные
199
поражения):
остроконечные кондиломы,
очаговая гиперплазия эпителия - вульгарные бородавки
вирус ветряной оспы - опоясывающего герпеса:
- опоясывающий герпес
- ветряная оспа
Группа 3. Поражения, вероятно связанные с ВИЧ-инфекцией:
бактериальные инфекции (исключая гингивит/периодонтит):
Actinomyces israelii,
Enterobacter cloaceae,
Escherichia coli,
Klebsiella pneumoniae,
Mycobacterium avium intracelluiara,
Mycobacterium tuberculosis,
болезнь кошачьих царапин,
реакции на лекарственные препараты (ульцеративная, мультиформная
эритема, лихеноидная) обострение атипичного периодонтита,
грибковые инфекции (кроме кандидоза):
Aspergillus flavus,
Cryptococcus neoformans,
Geotrichum candidum,
Histoplasma capsulatum,
Mucoraceae,
меланотическая гиперпигментация,
неврологические нарушения:
паралич лицевого нерва
невралгия тройничного нерва
остеомиелит,
синусит,
подчелюстной целлюлит,
плоскоклеточная карцинома,
токсический эпидермолиз.
Диагностические критерии
Хотя желательно регистрировать все поражения в полости рта,
выявленные в процессе исследования, более практически обоснованный
подход заключается в том, что заранее намечаются определенные
(“целевые”) изменения, которые, по-видимому, должны встречаться
наиболее часто. Этим поражениям посвящен данный раздел, хотя в
классификации перечислены все поражения полости рта,
которыевыявляются у ВИЧ-инфицированных.
200
Диагностика широко распространенных ВИЧ-ассоциированных
поражений полости рта может основываться на приводимых ниже
критериях, которые, в свою очередь, были составлены путем адаптации
критериев, опубликованных Контрольным центром ЕЭС по оральным
проблемам ВИЧ-инфекции и Сотрудничающим центром ВОЗ по оральным
проявлениям инфекции, вызываемой вирусом иммунодефицита человека’,
а также Сотрудничающей группой США по оральным поражениям при
СПИД**е. Данные критерии дают ориентировочные указания, связанные с
постановкой предположительного диагноза на основании только
клинических проявлений. При постановке более определенных диагнозов
следует ориентироваться на некоторые дополнительные процедуры,
которые по мере возможности включены в приводимые ниже примечания.
Грибковые заболевания:
псевдомембра- Желто-белые, неплотно прикрепленные к основе
нозный (легко поддающиеся удалению) бляшки,
кандидоз расположенные в любом участке полости рта. При их
эритематозный
(атрофический)
кандидоз
ангулярный
хейлит
Примечание.
удалении остается гипсремированная, иногда
кровоточащая поверхность слизистой.
Эритематозные (атрофические) макулярные бляшки
на поверхности слизистой. В некоторых участках,
например, на дорсальной поверхности языка, где в
норме имеются сосочки, часто отмечается
депапилляция (исчезновение сосочков). Одновременно
с этим обычно поражается небная слизистая, цвет
которой варьирует от светло-розового до багряно-
красного.
Трещины или вытянутые язвы в углах рта.
Воспалительная эритема разной степени. По краям
трещин может отмечаться гиперкератоз.
Для постановки окончательного диагноза при
вышеуказанных поражениях требуется также
морфологическое подтверждение наличия гиф кандид
в мазках из поражений, в том числе в препаратах,
окрашенных гидроокисью калия, реагентом Шиффа -
йодной кислотой и по Граму.
EEC-clearinghouse on Oral Problems Related to HIV Infection and WHO Collaborating
Center on Oral Manifestations of the Human Immunodeficiency Virus. An update of the Classification
and diagnostic criteria of oral lesions in HIV in infection. Journal of oral pathology and medicine.
1991.20(3), 97—100.
" (ireenspan J.S. et al. Oral manifestations of HIV infection. Definitions diagnostic criteria,
and principles of therapy. The USA Oral AIDS Collaborative Group. Oral surgery, oral medicine and
oral pathology. 1992. 73(2), 142—144.
201
Бактериальные заболевания
эритематозная гингивальная полоса Непрерывная полоса эритемы у края десен шириной не менее 1 мм, простирающаяся вдоль всей границы с зубами. Могут быть также поражены прилегающие участки зубов.
гингивит Ульцеративное или некротическое разрушение десневой ткани, часто сопровождающееся притуплением или кратерообразными углублениями межзубных сосочков. Иногда могут появляться псевдомембранозные образования. Тканевая деструкция ограничивается только тканью десен и не распространяется на костную ткань альвеол.
некротизирую щий периодонтит Прогрессирующая некротизация периодонта с быстрым снижением прикрепления периодонта к зубной альвеоле. Могут быть видны некротизированные участки костной ткани зуба.
Примечание. Окончательный диагноз может быть поставлен в случае быстрой (в течение 4 недель) потери ткани при отсутствии других причин деструкции твердых и мягких тканей периодонта. Требуется рентгенограмма.
хронический периодонтит Любое деструктивное заболевание периодонта с потерей костной ткани, образованием карманов и подвижностью зубов, но без признаков изъязвления, некроза или появления ложных мембран. Это поражение может быть связано или не связано с ВИЧ- инфекцией.
Вирусные заболевания
Инфекция, вызываемая вирусом простого герпеса.
рецидивирую- щий герпес на губах Единичные или множественные пузырьки или изъязвления с образованием струпа в области красной каймы губ и прилегающих участков кожи лица. (У пациентов, зараженных ВИЧ-инфекцией, рецидивирующая форма может быть более тяжелой, распространенной и длительно текущей).
герпетический стоматит Отдельные, множественные или сливные поражения, которые могут обнаруживаться вместе с везикулами на ороговевшей слизистой, в частности, в
202
герпетический стоматит Отдельные, множественные или сливные поражения, которые могут обнаруживаться вместе с везикулами на ороговевшей слизистой, в частности, в области твердого неба, прилегающих участков десен и дорсальной поверхности языка. Иногда в процесс могут быть включены неороговевшие участки слизистой. Выявляются также округлые или имеющие нечеткие очертания поражения с минимальными или выраженными эритематозными ореолами.
Примечание. Для постановки окончательного диагноза инфекций, вызванных вирусом простого герпеса, требуется также подтверждение наличия вируса с помощью таких методов исследования, как иммуногистохимический анализ и культивирование.
Инфекции, вызываемые вирусом Эпштейна—Барр
волосистая лейкоплакия Уплощенные в вертикальном направлении несколько приподнятые наложения на дорсальной или боковых поверхностях языка, не счищающиеся шпателем. Эти поражения могут также обнаруживаться в других участках полости рта, обычно вместе с поражениями языка.
Примечание. Для постановки окончательного диагноза при этих поражениях требуется подтверждение наличия вирусных частиц герпетического типа методом электронной микроскопии или обнаружение вируса Эпштейна—Барр с помощью метода гибридизации. Лечение противогрибковыми препаратами иногда позволяет отличить эти поражения от хронического гиперпластического кандидоза.
Идиопатические поражения
рецидивирующие афты Единичные или множественные рецидивирующие четко очерченные язвы слизистой полости рта с беловатыми фибринозными ложными мембранами, окруженными эритематозным ореолом. Эти язвы обычно не распространяются за пределы слизистой, однако у пациентов с ВИЧ-инфекцией они могут
атипичные изъязвления поражать ткани надкостницы. Данные поражения могут обнаруживаться в любом участке слизистой полости рта; они обычно
203
Новообразования
саркома Капоши Одно или несколько эритематозных голубоватых
полости рта или фиолетовых пятен или бляшек, иногда с
изъязвлениями. Эти поражения преимущественно
располагаются на твердом небе или деснах.
лимфома не- Плотное, эластичное, часто красноватое или
Ходжкина слабо-фиолетовое набухание, иногда с
изъязвлениями. Наиболее частая локализация этих
поражений - на деснах и небной слизистой.
Примечание. Единственный способ постановки
окончательного диагноза при этих поражениях -
исследование биоптатов пораженной ткани.
4.6. Процедура клинического обследования
Хотя для полноценного исследования полости рта требуется лишь
ограниченное оборудование, при этом необходимо хорошее освещение: для
данных целей пригодны зубоврачебная лампа, головная лампа или головное
зеркало. Для надавливания на слизистую щек и язык требуются
стоматологическое зеркало и язычный шпатель; для рассмотрения некоторых
участков полости рта и ротоглотки необходимо стоматологическое зеркало.
Если имеется соответствующее оборудование, то следует делать фотоснимки
всех необычных или представляющих особый интерес поражений, выявленных
в процессе обследования. Фотоснимки исключительно важны при сомнительном
диагнозе; они могут быть использованы для динамического наблюдения или
сопоставления, для документирования, в качестве дополнительных материалов
для графиков, диаграмм и письменных описаний. Фототека, содержащая
иллюстрации различных поражений, выявленных у местного населения, всегда
является ценным дополнением к обычным учебным материалам.
Процедура обследования полости рта должна проводиться по четко
разработанной и постоянно применяющейся методике. Перед началом осмотра
у пациента должен быть удален зубной протез. Следует отмечать все
наблюдающиеся изменения,такие как необычная окраска(белая и/или красная),
язвы, припухлости и набухания. Необходимо отмечать структуру (консистенцию)
ткани, а наблюдающиеся поражения исследовать методом пальцевой пальпации.
При этом следует соблюдать меры предосторожности против заражения.
Рекомендуются следующие процедуры:
Губы
Губы рассматривают у пациента с закрытым, а затем повторно - с
открытым ртом. Отмечают цвет, консистенцию ткани и любые отклонения во
внешнем виде красной каймы губ.
204
Слизистая нижней губы и нижняя десневая борозда
Проводят визуальное исследование слизистой у основания нижней
челюсти; при этом рот больного должен быть полуоткрыт. Отмечают цвет и
набухание слизистой основания нижней челюсти и десен.
Слизистая верхней губы и верхняя десневая борозда
Осматривают слизистую у основания верхней челюсти и уздечку, рот
больного должен быть при этом не полностью открыт.
Комиссуры, слизистая щек и щечные борозды (верхняя и нижняя)
Пользуясь ретрактором, осматривают у больного с широко открытым
ртом всю слизистую оболочку щек - начиная от комиссур вглубь до передних
тонзиллярных дужек. Отме-чают пигментацию, цвет, консистенцию и
подвижность слизистой. Необходимо иметь уверенность в том, что комиссуры
полностью осмотрены и не были закрыты во время ретракции.
Десны и альвеолярные края (отростки)
Осмотр производят со всех сторон (т.е. щек, неба и языка).
Язык
Когда рот больного полуоткрыт, а язык неподвижен, осмат-ривают
дорсальную поверхность языка, отмечая наличие набуханий, изъязвлений и
налетов, а также изменения цвета и плотности. Отмечают также любые
отклонения в характере сосочков, покрывающих поверхность языка. Просят
больного высунуть язык и отмечают отклонения в его подвижности. С помощью
роторасширителя (ретрактора) осматривают края языка и его вентральную
поверхность. Язык (и особенно его задние боковые края) можно более тщательно
обследовать, если захватить кончик языка с помощью кусочка марли; при этом
язык больше выдвинется вперед. Однако при этом следует соблюдать
соответствующие меры по предупреждению заражения.
Дно полости рта
При поднятом языке больного осматривают дно полости рта на наличие
каких-либо отклонений. С помощью стоматоло-гического зеркала перемещаю!
язык в разные стороны, чтобы можно было осмотреть ткани, покрывающие
лингвальную борозду и нижнечелюстную ямку.
Твердое и мягкое небо
У больного с откинутой назад головой и широко открытым ртом мягко
надавливают стоматологическим зеркалом на основание языка. Осматривают
твердое, а затем — мягкое небо.
Примечание. У некоторых больных отмечается склонность к рвотному
рефлексу.
Необходимо пальпировать все слизистые оболочки и ткани лица, язык и
Дно полости рта, а также подчелюстные и шейные лимфатические узлы. Шейную
и подподбородочную области следует пальпировать для того, чтобы определить
состояние лимфатических узлов (увеличенные, подвижные или неподвижные,
205
напряженные или ненапряженные). При исследовании ротоглотки необходимо,
чтобы рот больного был широко открыт так, чтобы были видны миндалины и
верхняя часть глотки; легкое надавливание на спинку языка может облегчить
осмотр.
Литература
1. Антонов В.Б. идр.//Клинич. медицина. -1990. -№3. -С.128-131.
2. Войтова Д.И., Чайка Н.А., Рахманова А.Г. Микобактериозы и СПИД. -
СПб., 1991.-28с.
3. Гиновкер А.Г., Чайка Н.А. Стронгилоидоз и СПИД.-СПб., 1991.-40 с.
4. Греймер М.С., Рахманова А.Г., Чайка Н.А. Туберкулез и СПИД. -СПб.,
1991.-28 с.
5. Лысенко А.Я. Лавдовская М.В. СПИД-ассоциируемые инфекции и
инвазии.-М., 1992.-380 с.
6. Лысенко А.Я., Турьянов М.Х., Лавдовская М.В., Подольский В.М. ВИЧ-
инфекция и СПИД-ассоциируемые заболевания,- М., 1996. -624 с.
7. Никифорова Н.А., Чайка Н.А. Гистоплазмоз и СПИД. Рекоменд. для
врачей. -Л., 1990. -48 с.
8. Пригожина В.К., Чайка Н.А., Рахманова А.Г. Герпетическая инфекция и
СПИД. Рекоменд. для врачей. -Л., 1990. -44 с.
9. Рахманова А.Г., Пригожина В.К. Инфекционные болезни. Справочник
для врача. -СПб. -1999. -с. 354.
10. Халдеева Н.А. и др. //Актуальные вопросы ВИЧ-инфекции: Сб. матер,
науч.-практ. конф.-СПб., 1997.-С. 146-147.
11. Чайка Н.А. //Мед. паразитол. -1992. -№4. -С. 48-51.
12. Чайка Н.А., Бейер Т.В. Криптоспоридиоз и СПИД. Рекомендации для
врачей. -Л. -1990. -72 с.
13. Arasteh К. Opportunistische Infektionen und Wasting Syndrom. //Wasting
und AIDS: die Behandlung der HlV-bedingten Kachexie /hrsg. von H Jager.
Unter Mitarb von P.H.Althoff...- Stuttgart; N. Y.: Thieme, 1997. -S. 27-36.
14. Asmuth D.M. et al.//Clin. Inf. Dis. -1994. -v. 18. -p. 819-825.
15. Bacon P. //Nurs. Stand. -1996. -v. 11. -№ 11-12. -p. 44-46.
16. Bauwens J.E. et al. // Clin. Inf. Dis. -1995. -v. 20. -№ 3. -p. 576-581.
17. Beaugerie L. et al. //Gastrointestinal Endoscopy. -1996. -v. 44. -№ 6.-p.663-
666.
18. Bowers J.M., Dois CL. //J. Ass. Nurs. AIDS Care. -1996. -v. 7. -№4. -p. 83-
89.
19. Brasil P. et al. // Rev. Inst. Med. Tropic.de Sao Paulo. -1996. -v. 38. -№ 2.-p.
97-102.
206
20. Саса К. et al. //Bildgebung. -1995. -v. 62. -№ 4. -p. 244-251.
21. Cali A. et al. //J. Eucariot. Microb. -1993. -v. 40. -p. 102-112.
22. Chin D.P. //The AIDS knowledge base. -1994. -p. 6.4-1 - 6.4-14.
23. Colebunders R. et al.//Gut. -1988. -v. 29. -p. 1687-1691.
24. De Hovitz J.A. et al. //N. Engl. J. Med.- 1986.- v.315,N2.- p.87-90.
25. Drew W.L., Jacobson M.A. //The AIDS knowledge base. -1994. -p. 6.13-1 -
6.13-12.
26. Erlich K.S. //The AIDS knowledge base. -1994. -p. 173-191.
27. Farthing MJ. et al. //J. Antimicrob. Chemother. -1996. -v. 37. -p. 61-70.
28. Fischl M.S. et al. //Arch. Intern. Med. -1986. -v. 146. -p.l 13-115.
29. Gautzenberg B. et al. //Arch. Intern. Med. -1990. -v. 153. -№ 8. -p. 358-372.
30. Gold J. et al. //AIDS. -1996. -v. 10. -№ 7. -p. 745-752.
31. Havlic J.A. etal. //J. Inf. Dis. -1992. -v.165. -p.577-580.
32. HeiseC., etal.//Gastroenterology. -1991. -v. 100. -p. 1521-1527.
33. Heise W., et al. // Dtsch. Med. Wochenschr. -1988. -v. 113. -p.l588-1593.
34. Hoge C.W. et al. // Lancet. -1995. -v. 345. -p. 691-693.
35. JanoffE.N., Smith P.D. //Gastroenterol. Clin. North America. -1988. -v.17. -
p. 451-463.
36. Johanson J.F. // Canad. J. Gastroenterol. -1996. -v.10. -№ 7. -p.461-468.
37. Just-Nubling G. et al. //Eur. J. Clin. Microb. Inf. Dis. -1991. -v. 10. -p. 917-
925.
38. Kelly P. et al. //QJM. -1996. -v. 89. -№ 11. -p. 831-837.
39. Kotler D.P. et al. //Dig. Dis. Sci. -1993. -v. 38. -p. 1119-1127.
40. Kotler D.P. et al. //Am. J. Pathol. -1991. -v. 139. -p. 823-830.
41. KotlerD.P. eta). //Ann. Intern. Med. -1984. -v. 101. -p. 421-428.
42. Kyriazis A., Mitra S.K.//Arch. Pathol. Lab. Med. -1992. -v. 116. -p. 495-499.
43. Lambl B.B. et al. // AIDS. -1996. -v. 10. -№ 7. -p. 739-744.
44. Layer P. et al. // Med. Klinik. -1996. -Bd. 91. -№ 1. -S. 65-71.
45. Layer P. et al. // Med. Klinik. -1996. -Bd.91, № 1 -S. 73-80.
46. Lecuit M. et al. //Clin. Inf. Dis. -1994. -v. 19. -p. 332-333.
47. Levine W.C. et al. //J. Inf. Dis. -1991. -v. 164. -p. 81-87.
48. Libre J.M. et al. //Lancet. -1989. -v. 1. -p. 221.
49. Malebranche R. et al. //Lancet. 1983. -v. 2. -p. 873-877.
50. Mauss S. et al. //Bildgebung. -1995. -Bd.62, № 4. -S. 252-258.
51. Meiselman M.S. et al.//Gastroenterology. -1985. -v. 88. -p.171-175.
52. Morise K., Yamamoto H., Kusugami K.//[Japanese] Nippon Rinsho -
Japan.J.Clin.Med.-1994. -v.6. -p. 167-169.
53. Nelson M.R. et al. //AIDS. -1991. -v. 5. -p. 1031-1032.
54. Nyberg D.A. et al. //Am. J. Radiol. -1985. -v. 145. -p. 297-299.
55. Ockenga J. et al. //Eur. J. Clin. Pharmacol. -1996. -v. 50, № 3. -p.l67-170.
56. Pape J.W. et al.//Ann. Intern. Med. -1994.-v. 121.-p. 654-657
207
57. Pena J.M. et al. // Rev. Inf. Dis. -1991. -v. 13. -p. 872-875.
58. Quinn T.C. et al. //N. Engl. J. Med. -1981. -v. 306. -p. 195-200.
59. Quinn T.C. et al. //N. Engl. J. Med. -1983. -v. 309. -p. 576-582.
60. Rebeneck L. et al. //Ann. Intern. Med. -1993. -v. 119, № 9. -p. 895-899.
61. Rene E. et al. //Dig. Dis. Sci. -1989. -v. 34. -p. 773-780.
62. Riecken E.O., Zeitz M., Ullrich R. //Baiiliere’s Clin. Gastroenterol. -1990. -v.
4.-p. 385-403.
63. Rodgers V.D., Kgnoff M.F.// West. J. Med. -1987. -v. 146, № 1. -p. 57-67.
64. Santangelo W.C., Krejs G. //Amer. J. Med. Sci. -1986. -v. 5. -p. 328-334.
65. Sarosi G.A., Johnson P.C. // Sem. Resp. Inf. -1990. -v. 5, № 2. -p. 146-150.
66. Schambelan M. et al. //Ann. Intern. Med. -1996. -v. 125, № 11. -p. 873-882.
67. Schmidt W., Schneider T., Ullrich R. Immunsystem des Darms bei der H1V-
Infektion. //Wasting und AIDS: die Behandlung der HI V-bedingten Kachexie
/hrsg. von H.Jager. Unter Mitarb von P.H.Althoff...- Stuttgart; N.Y.: Thieme,
1997.-S. 17-26.
68. Shecter C.F. //The AIDS knowledge base. -1994. -p.6.5-1 - 6.5-6.
69. Small P.M. et al. //N. Engl. J. Med. -1991. -v. 324. -p. 289-292.
70. Soave R. // Inf. Dis. Clin. North. Am. -1988. -v. 2. -p. 485-493.
71. Sperber S.J., Schleupner C.J. //Rev. Inf. Dis. -1987. -v. 9. -p. 925-934.
72. Tauber M.G., Lee B. //The AIDS knowledge base. -1994. -p. 6.7-1 - 6.7-9.
73. Turner M.E. et al //Pediatr. Nephrol. -1997. -v. 11, №2. -p. 161-163.
74. Ullrich R. et al. //Immunol. Res. -1991. -v. 10. -p. 456-464.
75. Valdespino-Gomez J.L. //Salud Publica de Mexico. -1995. -v. 37, № 6. -p.
549-555.
76. VeberB. etal.//N. Engl. J. Med. -1992. -v. 326. -p. 161-166.
77. Viegra-Herrera G. et al. //Acta citol. -1988. -v. 32, № 2. -p. 277-278.
78. Waters D. et al. //Ann. Intern. Med. -1996. -v. 125, № 11. -p. 865-872.
79. Wheat LJ. et al.//Medicine. -1990. -v. 69. -p. 361-374.
80. WHO case definition for AIDS surveillance in adults and adolescents. //WER,
1994.-v. 69, № 37. -p. 273-275.
81. Zollner B. et al. //Infection. -1993. -v. 21, № 5. -p. 318-320.
208
Глава 5. НЕРВНАЯ СИСТЕМА ПРИ ВИЧ-ИНФЕКЦИИ
Клинические проявления поражений нервной системы встречаются на
различных стадиях ВИЧ-инфекции у 40% пациентов, а у 4-5% из них
неврологическая симптоматика становится первым клиническим проявлением
манифестации болезни. Поданным аутопсий патоморфологические изменения
нервной системы встречаются у 70-80% умерших от СПИДа. Углубленные
морфологические исследования позволяют считать, что патология нервной
системы может быть обнаружена практически во всех случаях СПИДа
(Михайленко А.А., Осетров Б.А., Головкин В.И., 1993; Price R., Brew В., 1988;
Maj М. et al, 1994; Heaton et al, 1995; Zeifert P., 1996).
По частоте поражения различных органов и систем при ВИЧ/СПИД-
инфекции нервная система стоит на втором месте после иммунной. Это
связано с множеством патогенетических механизмов поражения как
центральной, так и периферической нервной системы.
Основной причиной поражения нервной системы является сродство
вирусного мембранного гликопротеида gp 120 (или gp 105 при ВИЧ-2) к
клеточному рецептору астроцитов CD4. Механизм проникновения вируса в
клетку двухкомпонентен: 1) модификация клеточной мембраны комплексом
gp 120-CD4 с освобождением зоны действия для gp 41 - еще одного вирусного
оболочечного белка; 2) белок gp 41 клетки облегчает шлипперизацию
(протаскивание) вириона внутрь клетки. Кроме того, глиальные клетки
поражаются не только вследствие инфицирования, т.е. проникновения вириона
(ВИЧ) внутрь клетки, но и вследствие мембранного их лизиса белком gp 120.
Еще большую плотность, чем на астроцитах, рецептор CD4 имеет на
Т4-лимфоцитах-хелперах/индукторах. В нормальной СМЖ были
обнаружены иммунокомпетентные клетки, в том числе и Т-хелперы.
Цитологическая характеристика ликвора и крови не совпадает ни в
количественном, ни в функциональном отношении. Так, в СМЖ хелперов
— 70±9%, супрессоров — 20±1%, а в крови — 44±11% и 20±7%
соответственно (Brinkman C.I., 1983). При этом периферические лимфоциты
в реакции бласттрансформации реагируют на мозговые антигены серого и
белого вещества, а лимфоциты СМЖ на нормальные мозговые антигены,
естественно, не реагируют (Малашхия Ю.А., 1986). Кроме того, в ликворе
присутствуют естественные киллеры (ЕК), обладающие цитотоксичностью
в отношении Т-лейкемических клеток и защищающие таким образом мозг
от развития лимфомы. Следовательно, для развития Т-лимфомы мозга нужен
вирус, избирательно поражающий ЕК. Таким вирусом, как известно, является
онкоретровирус HTLV-1. Очевидно также, что достаточно большое
содержание хелперов-СО4+ в ликворе и их поражение ВИЧ приведет к
местному снижению иммунитета и развитию оппортунистических
И. Заказ № К-4451.
209
нейроинфекций: криптококкового менингита, герпетического
менингоэнцефалита и др.
Из 100 клеток нейроглии на астроциты приходится 61, олигодендроциты
— 29, микроглиальные клетки — 10. Кроме того, все они настолько тесно
взаимодействуют с нейронами и взвешены в ликворе, что создают впечатление
единой нейроно-глиально-ликворно-сосудистой системы (Ройтбак А. И.,
1983).
Эндотелиальные клетки сосудистых сплетений оболочек мозга и
эпендимы желудочков тоже на своей поверхности несут рецептор CD4.
Развивающийся при их поражении вирус-индуцированный васкулит головного
и спинного мозга приводит к воспалению мезенхимальных элементов нервной
ткани и вторичной демиелинизации, что клинически проявляется развитием
синдромов рассеянного энцефаломиелита, рассеянного склероза и
вакуольной миелопатии.
Согласно теории двойного распознавания, вирусные антигены должны
одновременно взаимодействовать с клетками-мишенями (CD4+) и клетками
главного комплекса гистосовместимости (HLA). Действительно, во внешних
полипептидных цепях gp 120, HLA-DR, HLA-DQ и CD4 выявлен один и тот же
тетрапептид Арг-Фен-Асп-Сер. Антитела к этому тетрапептиду при ВИЧ-
инфицировании в организме человека перекрестно реагируют с клетками
CD4+, создавая аутоиммунный компонент глиотоксических реакций.
Гуморальный иммунитет при нейро-СПИДе, как и клеточный, весьма
неполноценен. В начале заболевания, как и при многих нейровирусных
инфекциях, в СМЖ появляется IgM (в норме отсутствующий) и увеличивается
содержание IgG, позже их концентрация снижается, а остается повышенным
содержание IgA. Однако, поликлональная гипериммуноглобулинемия в
функциональном отношении недостаточна. Имеется диспропорция уровней
субклассов иммуноглобулинов: содержание IgG, и IgG, увеличено, a IgG, и
IgG4 —снижено. Прогрессирующее снижение IgG, в СМЖ создает условие
для развития оппортунистических менинго-энцефалитов, активации латентных
инфекций (простой и опоясывающий герпес, цитомегалия и др.).
Еще одним важным аспектом нарушения гуморального иммунитета
(Бельгесов Н.В. с соавт., 1991), а, по нашему мнению, нейроэндокринной
регуляции иммунологического барьера мозга, является блокирование
антителами к gp 120 участков клеток и их внеклеточных рецепторов,
чувствительных к пептидным гормонам костного мозга и вилочковой железы.
В 1984 г. l.Wybran показал возможность синтеза в ткани мозга(в гипоталамусе)
тимозидноподобного гормона, дифференцирующего стволовые клетки СМЖ
вТ-лимфоциты. Михайленко А.А., Осетров Б.А., Головин В.И., 1993, показали,
что при таком СПИД-ассоциированном заболевании, как рассеянный склероз,
костномозговые клетки не реагируют дифференциацией на гормоны тимуса.
210
а реагируют на миелопептиды типа далартина. Не исключено, что реставрация
Т-звена иммунологического барьера мозга должна вначале проводиться с
помощью гормонов (факторов) костного мозга и только затем с помощью
препаратов типа тималина или тимогена. Это соответствует и тому, что
макрофаги ЦНС, как и макрофаги вообще - это клетки костномозгового
происхождения. Для реставрации функции нейроглиального комплекса,
следовательно, также необходимы препараты костного мозга.
Кроме иммунорегулирующих гормонов (интерферон, тимозин и др.) в
СМЖ и в тканях мозга образуются и присутствуют нейропептиды —
рилизинговые гормоны эпифизарно-гипоталамического комплекса,
являющиеся основой трофики нейронов и нейромедиаторами тормозного
или возбуждающего действия. Комплекс СПИД-деменция по своему
территориальному обеспечению значительно шире, чем непосредственные
вирус-индуцированные цитопатические очаги разрушения нервной системы.
Деменция при нейро-СПИДе во многом является результатом снижения
нейротрофического влияния биорегулирующих веществ церебрального
перивентикулярного происхождения, например, вазопрессина — пептида
памяти (Ашмарин М.Г. и др., 1977). Спинальные поражения (синдром БАС,
амиотрофии и др.) связаны с недостатками другого нейропептида —
тиролиберина, широко распространенного в ЦНС, включая спинной мозг
(Schally, 1978 и др.). Нейротрофическое влияние пептидов мозга может
проявляться как непосредственно (синтез нейрональных нуклеотидов), так и
опосредованно — через дисбаланс свободных аминокислот СМЖ.
Предполагается, что ГАМК и глицин обладают тормозным влиянием не только
на электрогенез нейронов, но и на нейроаллергические и аутоиммунные
процессы. Триптофан, предшественник серотонина, также тормозит
иммунологические реакции. Энцефалитическая реакция в форме
эпилептических судорог связана с депрессией ГАМК-ергического влияния
(дефицит ГАМК и глицина). Атактический синдром связан не только с
очаговым поражением мозжечка, но и с недостатком серотонина (сравните:
нейролептическая антисеротониновая атаксия). Таким образом, патогенез
нейро-СПИДа сложен, многокомпонентен и связан не только с
непосредственным внедрением ВИЧ в ЦНС, но и с нарушением функций
иммунной и эндокринной систем мозга.
Патогенетические факторы, приводящие к поражению нервной системы
на различных стадиях ВИЧ-инфекции, могут быть систематизированы
следующим образом.
Синдромы поражения ЦНС
1. Первичное (непосредственное) действие ВИЧ.
2. Аутоиммунные реакции.
3. Оппортунистические и вторичные инфекции.
14*
211
4. Опухоли.
5. Сосудистые осложнения.
6. Психогенные факторы.
7. Ятрогенные причины.
5.1. Первичное поражение нервной системы ВИЧ
Пути проникновения ВИЧ в ЦНС еще полностью не расшифрованы.
Наиболее распространены следующие гипотезы: 1) ВИЧ попадает в ЦНС с
помощью инфицированных макрофагов, проникающих через
гематоэнцефалический барьер (вариант “троянского коня”); 2) ВИЧ
проникает в ЦНС по нервным волокнам; 3) ВИЧ проникает в ЦНС через
щели между эндотелиальными клетками капилляров и инфицирует клетки
нейроглии.
Патологические изменения нервной системы, вызванные
непосредственно ВИЧ, встречаются на любой стадии инфекции.
Некоторые формы первично-вирусных поражений нервной системы
возникают при ВИЧ-инфекции уже в стадии первичных проявлений болезни
в период сероконверсии, другие неврологические синдромы развиваются
на более поздних стадиях болезни в связи с прогрессирующим нарушением
функций иммунной системы.
Бессимптомная ВИЧ-инфекция ЦНС
В настоящее время установлено, что ранняя бессимптомная инфекция
центральной нервной системы вирусом иммунодефицита человека является
правилом. Это заключение основывается на исследовании СМЖ у
серопозитивных клинически здоровых лиц. При этом обнаруживается
увеличение числа клеток, повышение содержания белка и
иммуноглобулинов, признаки интратекального (“забарьерного”) синтеза
антител к ВИЧ, из СМЖ может быть выделен вирус иммунодефицита
человека.
Бессимптомная инфекция ЦНС может развиться вместе с поражением
других органов и систем. В остром периоде онасочетается с ВИЧ-виремией.
Остается неясным, при каких условиях бессимптомная ВИЧ-инфекция
трансформируется в клинически манифестный асептический менингит или
энцефалит.
Асептический менингит
В ряде описаний содержатся указания на асептический менингит,
возникающий в период сероконверсии или вслед за ней, но отмечается, что
чаще асептический менингит наблюдается в более поздние сроки ВИЧ-
инфекции у серопозитивных лиц при отсутствии каких-либо других
симптомов болезни, а также в стадии пре-СПИДа (стадии ЗА и ЗБ по
212
классификации В.И.Покровского). Асептический менингит может протекать
как в острой, так и в хронической форме. При обеих формах наблюдаются
менингеальные симптомы, но более отчетливые признаки менингита
отмечаются при острых формах. В некоторых случаях отмечается поражение
черепных нервов, более часто страдают V, VI и VIII нервы, при этом может
наблюдаться рецидивирующий паралич Белла.
При исследовании СМЖ определяется мононуклеарный плеоцитоз,
умеренное повышение содержания белка; содержание глюкозы оказывается
нормальным. Предполагается, что асептический менингит является
результатом прямого поражения оболочек вирусом иммунодефицита
человека, так как вирус легко выделяется из СМЖ. Сам по себе асептический
менингит отличается доброкачественным течением. Имеются данные о том,
что наличие асептического менингита не сказывается на возможности
развития СПИД-дементного комплекса.
Асептический менингит может протекать атипично, в частности,
течение может быть рецидивирующим, может наблюдаться поражение
длинных проводящих путей.
Острый энцефалит
Возникает у части больных в период сероконверсии или вскоре после
нее (первые три месяца болезни). Его клиническими симптомами являются
лихорадка, общее недомогание, изменения настроения, эпилептические
припадки, изменения уровня сознания. Острый период продолжается
примерно 1 неделю, отчетливых неврологических последствий не
наблюдается. Острый энцефалит связывается с прямым поражением
головного мозга вирусом иммунодефицита человека.
5.1.1. СПИД-дементный комплекс
Подострый энцефалит, вызванный вирусом иммунодефицита человека,
является причиной СПИД-деменции, которая развивается на поздних стадиях
ВИЧ-инфекции у значительной части больных.
По данным различных авторов, СПИД-дементный комплекс (СДК)
наблюдается у 1/3 - 1 /2 больных, при этом у 1/4 больных признаки СДК
предшествуют развитию других традиционных признаков СПИДа.
Патоморфология. При подостром ВИЧ-энцефалите отмечается
атрофический процесс в головном мозге, о чем свидетельствуют расширение
борозд и истончение извилин коры больших полушарий и расширение
желудочковой системы. Атрофия мозга может быть выявлена прижизненно
с помощью компьютерной томографии. При осмотре мозга отмечается также
бледность белого вещества больших полушарий.
При микроскопическом исследовании определяется картина
подострого менингоэнцефалита. В головном и спинном мозге повсеместно
213
выявляется периваскулярная инфильтрация; она более выражена в белом
веществе полушарий головного мозга, чем в коре; в большей степени
страдают лобные и затылочные доли, подкорковые узлы, мозжечок, варолиев
мост. В составе периваскулярных инфильтратов обнаруживаются
мононуклеары, макрофаги с пенистой цитоплазмой и макрофаги,
содержащие бурый пигмент, а также микроглиоциты.
Важной патоморфологической особенностью подострого ВИЧ-
энцефалита является наличие в инфильтратах многоядерных гигантских
клеток, что связано с одним из существенных биологических свойств ВИЧ
— придавать зараженным клеткам способность формировать синцитий
(слияние клеток). Многоядерные клетки являются настолько важной и
характерной особенностью морфологических изменений головного (и
спинного) мозга при ВИЧ-энцефалите, что некоторые авторы (Price R.W.,
Brew В.J., 1988) считают правомерным использование термина
“многоядерноклеточный энцефалит” для его обозначения. Взгляды
различных исследователей на происхождение многоядерных клеток
расходятся. Предполагается, что эти клетки могут быть или
инфицированными макрофагами, или гистиоцитами, или Т-хелперами,
утратившими Т4-эпитопы; последнее предположение подтверждается
формированием многоядерных гигантских клеток из Т4-клеток в их культуре.
Помимо периваскулярной инфильтрации в веществе головного мозга
обнаруживаются микроглиальные узелки, очаги некроза, демиелинизация и
астроцитарный глиоз.
С помощью иммунохимических методов было показано, что клетки
периваскулярных инфильтратов содержат белки ядра и оболочек ВИЧ (р24
и р41), однако, количество вирусного антигена неодинаково в разных случаях;
антигены ВИЧ обнаруживаются в глиальных и эндотелиальных клетках, а
также в многоядерных клетках; в нервных клетках антигены ВИЧ
обнаруживаются редко. Таким образом, ВИЧ не проявляет отчетливого
нейротропизма, имея в качестве клеток-мишеней систему макрофагов-
моноцитов.
Имеется предположение о том, что инфильтрация мозговой ткани
макрофагами сопровождается освобождением цитокинов, таких как фактор
некроза опухолей, а также пероксидазы и свободных кислых радикалов, что
может привести к повреждению миелина, которое обнаруживается при СДК.
При ВИЧ-инфекции в головном мозге определяются также и некоторые
другие изменения, не являющиеся, однако, ВИЧ-специфическими. К числу
таких изменений относятся вакуолярная лейкоэнцефалопатия,
спонгиоформные изменения и утрата пигмента черной субстанцией.
Вакуолярная лейкоэнцефалопатия представлена вакуолизацией белого
214
вещества височных и затылочных долей больших полушарий головного мозга,
мозолистого тела, белого вещества мозжечка и варолиева моста.
Гистологические исследования дают основания предполагать, что вакуоли
могут быть результатом дегенерации олигодендроцитов или
интрааксональной дегенерации.
Спонгиоформные изменения представлены образованием большого
числа мелких вакуолей в поверхностных слоях коры и перивентрикулярных
областях мозга; этим изменениям сопутствует реактивный астроцитарный
глиоз и уменьшение числа нервных клеток. Подобные изменения
обнаруживаются при болезни Альцгеймера и при алкогольной
энцефалопатии. Предполагается, что спонгиоформные изменения могут
возникать в результате отека мозга или вызываться токсическими веществами,
имеющимися в ЦСЖ.
Депигментация черной субстанции обнаружена у 90% больных
СПИДом. Микроскопически отмечается дегенерация клеток черной
субстанции в виде грубых изменений ядра и цитоплазмы или цитолиза с
остатками гранул меланина на месте лизированной клетки. Причина этих
изменений неизвестна.
Патоморфологическая картина подострого ВИЧ-энцефалита в полной
мере соответствует клинически наблюдающейся деменции субкортикального
типа и сочетающимися с ней неврологическими расстройствами.
Степень выраженности деменции коррелирует с числом многоядерных
клеток.
Клиническая картина СПИД-дементного комплекса (СДК). СДК
является обычным проявлением ВИЧ-инфекции, наблюдающимся на поздних
стадиях заболевания: наиболее характерными признаками СДК являются
нарушения психических функций, поведенческих реакций и движений.
СДК обычно развивается у больных после появления
оппортунистических инфекций или опухолей, но в некоторых случаях СДК
является первым признаком заболевания. Иногда при этом наблюдаются такие
признаки ВИЧ-инфекции, как лимфаденопатия, недомогание, потеря веса,
оральный кандидоз; в других случаях могут быть лабораторные признаки
иммунодепрессии.
Начальными симптомами болезни могут быть нарушения в когнитивной
сфере, в первую очередь, трудности концентрации внимания и нарушения
памяти. Больные начинают терять ход мысли или разговора, многие из них
жалуются на “замедленность” мышления. Повседневная работа становится
для больных все более утомительной; для того, чтобы справиться с обычной
работой, требуется все больше времени. Нарушения памяти и трудности в
сосредоточении внимания начинают приводить к явным промахам в работе,
215
в связи с чем появляется необходимость пользоваться записями, записывать
на листке бумаги план действий. В тех случаях, когда профессиональная или
бытовая деятельность требует от пациента повышенного внимания и
активности, нарастающая деменция может проявить себя значительно раньше.
В других случаях изменения познавательной деятельности и личностные
изменения первыми замечают близкие друзья и члены семьи больного. К числу
таких изменений относятся элементы социальной неприспособленности и
апатия.
Депрессивный синдром наблюдается у таких больных реже, чем можно
было бы ожидать; в некоторых случаях отмечаются агитированные
органические психозы, которые могут предшествовать другим признакам
болезни. Такие пациенты возбуждены, гиперактивны, может развиваться
гипоманиакальное состояние.
В ранних стадиях болезни формальные психологические тесты могут
не выявить каких-либо отклонений от нормы, однако, ответы являются
характерно замедленными, даже если их содержание оказывается адекватным.
При дальнейшем прогрессировании болезни появляются трудности при
выполнении тестов, направленных на оценку внимания, тестов с подбором
противоположных по значению слов и чисел, тестов на решение
интеллектуальных задач. Начинает преобладать замедление мышления, апатия.
Больные становятся безразличными по отношению к своей болезни, не могут
правильно оценить сложившуюся ситуацию. Двигательные расстройства могут
развиваться в ранней стадии СДК. Появляются жалобы на нарушения
равновесия и координации движений. Больной начинает часто ронять вещи,
движения рук становятся менее быстрыми и точными, ухудшается почерк,
появляются нарушения глотания и артикуляции.
Нарушения координации движений приводит к частому спотыканию
или падениям, при ходьбе больной проявляет особую осторожность.
Обнаруживаются симптомы орального автоматизма — хоботковый и
носогубный рефлексы, менее часто выявляется хватательный рефлекс. Обычно
имеется гиперрефлексия. Нарушаются последовательные противоположно
направленные движения кистей и стоп (адиадохокинез). Появляются
глазодвигательные расстройства — замедление движений глазных яблок,
нарушается плавность следящих движений глаз, выявляется замедленность и
неточность движений глазных яблок. В последующем усиливается атаксия,
что проявляется в нарушениях ходьбы по прямой линии. Появляется и
нарастает слабость ног, что вместе с атаксией ограничивает возможности
самостоятельного передвижения больного. В поздней стадии болезни обычно
имеются нарушения мочеиспускания и дефекации.
В терминальной стадии болезни состояние больного почти
соответствует “вегетативному” состоянию. Больной безучастно лежит в
216
кровати, не способен к самостоятельному передвижению, не контролирует
функции тазовых органов, однако, за исключением периодов сомноленции,
имеется определенный уровень бодрствования; коматозное состояние
обычно связано с присоединившимися инфекционными и иными
осложнениями. Portegies Р. (1995) предлагает выделять несколько
клинических стадий развития СДК (таблица 32).
Таким образом, начальными проявлениями СДК являются
расстройства памяти, психическая несобранность, потеря интереса к
работе и окружающим, апатия, притупление эмоций, задержка
психомоторных реакций, снижение либидо; в последующем могут
присоединяться дезориентировка, спутанность, эпилептические припадки,
сопор и кома, при затяжном течении - мутизм, деменция. Наряду с этим
развиваются двигательные расстройства в форме нижнего спастического
парапареза, атаксии, нарушения функции тазовых органов.
Таблица 32
Клинические стадии СПИД-дементного комплекса
Стадия 0 Нормальные психические и двигательные функции
Стадия 0,5 (субклиническая) Слабо выраженные симптомы при сохраненной активности и способности к ТРУДУ-
Стадия 1,0 (слабовыражснная) Несомненные признаки функциональной недостаточности: способен выполнять все, но лишь в определенных пределах.
'Стадия 2,0 (умеренная) Работать не может, но выполняет основные обязанности по самообслуживанию.
Стадия 3,0 (выраженная) Значительный интеллектуальный или двигательный дефект.
Стадия 4,0 (конечная) Состояние, близкое к вегетативному.
По мнению R.Price и Brew В. (1988), СДК представлен типичной
триадой симптомов - нарушениями познавательной деятельности,
Двигательными расстройствами и изменениями поведения.
Продолжительность развития СДК обычно исчисляется месяцами,
вместе с тем, известны случаи, при которых от времени появления первых
симптомов до гибели больного проходило лишь несколько недель.
При исследовании СМЖ у больных ВИЧ-инфекцией со СДК
определяется умеренное повышение содержание белка до 1,0 г/л
(примерно у двух третей больных) и умеренный мононуклеарный цитоз -
До 200 в 1 мм3 (примерно у одной четверти больных).
ВИЧ может быть выделен из СМЖ многих больных со СДК, что,
однако, не является обязательным признаком именно СДК, т.к. вирус
может быть выделен из СМЖ при бессимптомной инфекции, при серозном
217
менингите, т.е. и при отсутствии СДК. Большее значение имеет выявление
в СМЖ антигенов ВИЧ, в первую очередь р24, при этом клиническое значение
имеют количественные показатели.
По мнению вышеназванных авторов, диагноз СДК должен
основываться на сумме клинических и лабораторных признаков.
Диагноз СПИД-дементного комплекса (по В. Navia и R. Price, с изм., 1986):
Эпидемиологические данные. Принадлежность к группе риска:
гомосексуалисты, лица, которым производилось внутривенное вливание
лекарств или переливание крови и ее препаратов, дети или гетеросексуальные
партнеры ВИЧ-инфицированных лиц.
Соматические признаки ВИЧ-инфекции.
Бессимптомная доказанная ВИЧ-инфекция
СПИД-ассоциированный комплекс (стадии ЗА и ЗБ) по В.И.
Покровскому
Развитая картина СПИДа (стадия ЗВ, терминальная стадия)
Клинико-неврологические признаки
Деменция
Двигательные нарушения (нарушение движения, тремор, атаксия,
парапарез)
Поведенческие нарушения (социальная несостоятельность,
органические психозы).
Нейродиагностические исследования. Компьютерная томография или
ядерно-магнитный резонанс. КТ головного мозга выявляет атрофию коры
головного мозга и другие нарушения.
Иммунологические данные. Уменьшение отношения CD4/CD8
лимфоцитов периферической крови, другие признаки недостаточности
функции Т-лимфоцитов, макрофагов.
Серологические данные. Антитела к ВИЧ в сыворотке крови.
Выделение вируса. Выделение ВИЧ из крови, СМЖ или мозга,
обнаружение антигенов ВИЧ.
Патпоморфологическое исследование (биопсия или аутопсия).
Изменение белого вещества: многоядерные клетки и макрофагальная
инфильтрация.
Некоторые авторы (R.Price, В.Brew, 1988; Everall J., 1995) выделяют
наряду со СДК диффузные энцефалопатии, представляющие собой
поражения головного мозга метаболического происхождения, возникающие
при системных заболеваниях у больных СПИДом, такие как пневмония с
гипоксией, сепсис и др. Такие энцефалопатии наблюдаются и у больных, не
страдающих СПИДом. В некоторых случаях деменция является результатом
развития СДК и метаболической энцефалопатии одновременно.
218
Одним из препаратов, который используется у больных с деменцией, является
глиатилин (холин альфосцерат). Глиатилин - новое соединение, содержащее 40,5%
холина, которое способно проникать через гематоэнцефалический барьер и служить
донором для биосинтеза нейротрансмиттера ацетилхолина в пресинаптических
мембранах холинергических нейронов. Кроме того, глиатилин, являясь
предшествеником фосфолипидов мембран, участвует в анаболических процессах,
ответственных за мембранный фосфолипидный и глицеролипидный синтез,
оказывая положительное влияние на функциональное состояние мембранных
структур клеток, улучшая цитоскелет нейронов, увеличивая массу органелл
(рибосом и митохондрий). При применении глиатилина улучшалась
психоэмоциональная сфера (выравнивался эмоциональный фон, увеличивалась
переносимость эмоционального напряжения, исчезала раздражительность),
улучшалась умственная деятельность (оперативность и организованность
мышления), улучшалась память. Глиатилин применяется по 1 капсуле (400 мг) 3
раза в сутки, до еды. Продолжительность курсов при этом от 3 до 6 месяцев.
5.1.2. Прогрессирующая вакуолярная миелопатия.
Прогрессирующая вакуолярная миелопатия (ПВМ) также как и СДК,
является результатом прямого поражения спинного мозга вирусом
иммунодефицита человека. ПВМ в значительной части случаев сочетается с
СДК, но может развиваться изолированно или преобладать в клинической
картине ВИЧ-инфекции.
ПВМ проявляется развитием нижнего спастического парапареза,
сенситивной атаксии, ранними нарушениями функций тазовых органов.
Степень выраженности спинальных расстройств бывает различной, в целом
нарушения чувствительности менее значительны, чем двигательные
расстройства, “уровень” чувствительных расстройств не определяется.
Клинические и патоморфологические данные указывают на
преимущественное поражение средне- и нижне-грудного отдела спинного
мозга (в отличие от фуникулярного миелоза, связанного с недостатком
витамина В , когда больше страдает шейный и верхне-грудной отдел спинного
мозга, а нарушения мочеиспускания развиваются относительно поздно). ПВМ
обычно имеет подострое или хроническое прогрессирующее течение.
При патоморфологическом исследовании обнаруживаются
Дегенеративные изменения проводящих путей спинного мозга, главным
образом боковых и задних столбов, в форме их вакуолизации; изучение
продольных срезов показывает, что вакуоли являются результатом
интрааксональной дегенерации. В некоторых случаях подобные изменения
проводников выявляются в варолиевом мосту, внутренней капсуле и лобных
Долях. Отмечается также инфильтрация макрофагами и многоядерными
клетками. В срезах спинного мозга показано наличие ВИЧ-антигена р24.
219
Следует отметить, что при ВИЧ-инфекции может наблюдаться картина
острого или подострого поперечного миелита, обусловленного вирусом
варицелла-зостер, а также эпидуральной или интрадуральной лимфомой.
Поражения спинного мозга, сочетающиеся с полирадикулопатией, могут быть
вызваны ЦМВ. Доказана связь “тропического” нижнего парапареза с HTLV-1.
5.1.3. Периферические невропатии
Примерно у 1/3 всех ВИЧ-инфицированных лиц имеются клинические или
субклинические признаки поражений нервной системы, связанные с прямым
воздействием ВИЧ или имеющие другой генез. Периферические невропатии,
являющиеся результатом прямого воздействия ВИЧ, могут осложнять течение ВИЧ-
инфекции в любой из ее стадий. Во время сероконверсии или вскоре после нее
наблюдаются различные по характеру невропатии, но частота их развития невелика.
В их число входят плечевая плексопатия, мононевриты черепных или
периферических нервов, а также острая демиелинизирующая полиневропагия.
Все эти формы поражений нервной системы имеют доброкачественное течение и
заканчиваются полным спонтанным выздоровлением.
К неврологическим синдромам, первичная ВИЧ-природа которых
предполагается, но не доказана достоверно, относится также симметричная
дистальная, преимущественно сенсорная, полиневропатия, имеющая признаки
аксонопатии, которая может наблюдаться в стадиях ЗА и ЗБ, но чаще развивается
в стадии ЗВ и терминальной стадии. Характерным признаком этой невропатии
является то, что субъективные чувствительные нарушения в виде парестезий
появляются значительно раньше других нарушений чувствительности и
двигательных расстройств. Некоторые больные испытывают настолько сильное
жжение в ногах, что избегают ходьбы.
При электрофизиологическом исследовании обнаруживаются первично
аксональные изменения, при патоморфологическом исследовании выявляются
изменения толстых миелинизированных волокон.
В поздних стадиях ВИЧ-инфекции может развиваться быстро
прогрессирующая полирадикулопагия, проявляющаяся преимущественно вялой
нижней параплегией, резким повышением содержания белка в СМЖ, нарушением
функции тазовых органов. При патоморфологическом исследовании
обнаруживается воспаление и некроз спинальных ганглиев.
У больных СПИДом описана преимущественно вегетативная
полиневропатия, которая может приводить к выраженной ортостатической
артериальной гипотензии или коллапсам.
К периферическим невропатиям, имеющим лишь опосредованную связь с
ВИЧ-инфекцией, следует отнести демиелинизирующие невропатии аутоиммунного
генеза, а также невропатии, связанные с оппортунистическими инфекциями,
системной лимфомой и токсическим действием лекарственных средств.
220
5.2. Аутоиммунные поражения нервной системы
К неврологическим синдромам аутоиммунного генеза относятся
некоторые виды периферических невропатий, а также поражения головного
и спинного мозга, составляющие синдром рассеянного энцефаломиелита.
Полиневропатии аутоиммунного генеза, относящиеся кмиелинопатиям,
чаще развиваются втечение бессимптомной или латентной стадий ВИЧ-инфекции.
По своим проявлениям они соответствуют синдрому Гийена-Барре или хроническим
воспалительным демиелинизирующим полиневропатиям другой природы, за тем
исключением, что при исследовании СМЖ часто определяется небольшой
лимфоцитарный плеоцитоз. При биопсии нервов обнаруживаются периваскулярные
воспалительные инфильтраты и демиелинизация нервных волокон.
5.3. Оппортунистические инфекции
Оппортунистические инфекции, возникающие по мере
прогрессирования иммунодефицита, могут протекать с поражением нервной
системы.
Среди них необходимо выделить следующие:
1. Микозы
- кандидоз
- криптококкоз
2. Вирусные инфекции
- герпесвирусные (простой, опоясывающий герпес, инфекции
ЭБ, ЦМВ, герпесвирусы 6,7, 8 типов)
- паповавирусные
3. Бактериальные инфекции
- туберкулез
- атипичный микобактериоз
- сепсис, вызванный различной патогенной и условно
патогенной флорой
4. Протозоозы
- токсоплазмоз
5. Гельминтозы
-стронгилоидоз
Патогенез, клинические проявления некоторых из этих инфекций
изложены в соответствующих разделах.
Вместе с тем, необходимо остановиться особо на цитомегаловирусной
инфекции (ЦМВ). Согласно комплексным исследованиям, выполненным под
Руководством В.В.Покровского (Шахгильдян В.И. и соавт., 1995,1997; Ермак
Т.Н. и соавт., 1995; Юрин О.Г. и соавт. 1995; Беляева В.В. и соавт., 1996,
1999), поражения центральной нервной системы обусловлены главным
образом ЦМВ.
221
По данным В.И.Шахгил ьдяна (1997), из наблюдавшихся автором больных с
ВИЧ-инфекцией и ЦМВИ, подтвержденной вирусологическими методами
исследования, поражение головного мозга ЦМВ-вирусом было диагностировано у
25,5% всех больных. При этом среди больных, умерших от СПИДа, у 10% был
подтвержден диагноз ЦМВ-энцефалита с наличием ретинита. На первый план у
пациентов с ЦМВ поражениями головного мозга выступали выраженные изменения
в психическом статусе, имевшие место у 91,7% больных, вплоть до деменции с
грубыми нарушениями памяти, разрушением интеллектуальной деятельности,
резким снижением двигательной активности, нарушением контроля за функциями
тазовых органов. При ЦМВ-энцефалите отмечены слабо выраженные
менингеальные знаки, повышение судорожной активности в виде эпилептиформных
приступов, расстройства функций черепно-мозговых нервов.
Патоморфологические изменения у погибших пациентов с ВИЧ и ЦМВ-
инфекциями выявили деструкгивный вентрикулит и паравентрикулярный энцефалит
с распространением поражения на подкорковые структуры, иногда на большие
полушария.
Авторы наблюдали больных с миелитами, полирадикулопатиями, вероятно,
ВИЧ и ЦМВ этиологии, у них посмертно были выявлены некротические поражения
спинного мозга на уровне шейных, грудных и поясничных сегментов.
Цитируем ые данные авторов свидетельствуют о необходимости внедрения
молекулярно-биологических (ПЦР) методов диагностики ЦМВИ, ибо нередко
патология центральной и периферической нервной системы может быть
обусловлена совместным воздействием ЦМВ и ВИЧ, что в настоящее время
поддается специфической терапии.
В наших наблюдениях проявления ЦМВ-инфекции с поражением нервной
системы отмечены у 5 больных, из них один, в связи с ЦМВ энцефалитом и
ретинитом, ослеп.
Приведем одно из наших наблюдений.
Больной Т. 39 лет, диагноз ВИЧ-инфекции установлен в 1992 г., уровень CD4
составлял 598/мм3. В декабре 1996 г. развивается энцефалопатия,
характеризующаяся нарушением памяти, походки, зрения - ретинитом.
Серологически подтвержден диагноз ЦМВ-инфекции. CD4 снизились до 139/мм3,
установлен диагноз ВИЧ-инфекция в стадии СПИДа. Больному был назначен
ганцикловир без существенного эффекта. Заболевание, вызванное ВИЧ и ЦМВ,
прогрессировало, развиласьСПИД-деменция с нарушением памяти, сознания, речи.
Слепой, неопрятный, слюнотечение, непроизвольное мочеиспускание, истощение
-таким он выглядел до комбинированной противовирусной терапии.
В марте 1997 г. больному впервые в нашем городе, а возможно и в России,
были назначены ретровир, эпивир и инвираза. Спустя месяц состояние больного
существенно улучшилось, сознание стало ясным, он смог ходить, его поведение
мало чем отличалось от поведения здоровых людей, уровень CD4 возрос до 243/
222
Схема 2
Алгоритм обследования больного с патологией ЦНС
(Bartlett J., 1999)
Прогрессирующая ВИЧ-инфекция
Ф
нарушения психо-эмоционального статуса,
головные боли, очаговые симптомы
Ф
Исследование крови на токсоплазму
и криптококковый антиген
Компьютерная и магниторезонанс томография
Очаговые повреждения нет повреждений
атипичные повреждения
+отрицательный серотест
на токсоплазмоз,
криптококкоз, сифилис
люмбальная пункция
эмпирическое лечение
токсоплазмоза
(пириметамин и
сульфопрепараты)
хороший
ответ
дополни тел ьн ые
воздействия
нет ответа в
течение недели
лечить до
выздоровления
дексаметазон
исследование в ПЦР
на ЦМВ, ЭБВ (лимфома),
HSV и другие
мм3. До настоящего времени больной получает антиретровирусную терапию,
состояние стабильное, CD4 - 330-460/мм3.
Это и другие наши наблюдения дают основание утверждать значение ВИЧ в
развитии энцефалопатии и деменции. Остальные возбудители, такие как ЦМВ,
криптококк, вирус простого герпеса и другие реализуются в развитии энцефалита
и деменции в комплексе с ВИЧ. Ввиду этого необходима этиотропная
комбинированная терапия. Неудачи влечении ЦМВ-энцефалитаи энцефалита другой
этиологии были обусловлены отсутствием противоретровирусной терапии,
определяющей благоприятный исход неврологической патологии.
Далее следует остановиться на паповавирусной инфекции, вызывающей
Ш>огвёссирующую мультифокальную лейкоэнцефалопатию (ПМЛ). По данным
223
аутопсий ПМЛ имеется примерно у 2% больных СПИДом; доказано, что ПМЛ
может развиться у 0,5-1,0% всех ВИЧ-инфицированных. ПМЛ вызывается
вирусами папова (папилломы-полиомы-вакуолизирующими), которые очень
редко вызывают лимфопролиферативные заболевания у иммунокомпетентных
лиц. Вместе с тем, ПМЛ наблюдалась у больных, получавших
иммуносупрессивную терапию в связи с пересадкой органов или
злокачественными опухолями. ПМЛ развивается как неуклонно
прогрессирующий подострый энцефалит с появляющимися в начале
психическими нарушениями и присоединяющимися затем очаговыми
неврологическими симптомами (гемипарез, гемигипестезия, гемианопсия,
афазия, атаксия и т.п.).
При КТ головного мозга обнаруживаются ненакапливающие контраст
очаги пониженной плотности, не дающие масс-эффекта, располагающиеся
почти исключительно в белом веществе головного мозга и лишь при большой
множественности поражения - веером веществе. При исследовании биоптата
мозга выявляется типичная картина, включающая демиелинизацию,
внутриядерные включения в олигодендроцитах, а также гипертрофию и
гиперплазию астроцитов.
Эффективное лечение не разработано, применение известных препаратов
противовирусной группы не приносит успеха.
5,4. Опухоли
Саркома Капоши (СК)
В соответствии с Международной гистологической классификацией
опухолей 1974 года СК относится к злокачественным опухолям кровеносных
сосудов. В обычных условиях СК являлась редким заболеванием,
наблюдавшимся у пожилых мужчин, а также у лиц, получавших
кортикостероидные гормоны и иммунодепрессанты. СК оказалась
исключительно частой опухолью у больных СПИДом — она наблюдается у
23% всех больных. В отличие от классических форм СК, которые представляют
собой относительно ограниченное поражение кожи, СПИД-ассоциированная
саркома Капоши протекает в различных формах и имеет, как правило, более
агрессивное течение. Выделяют ограниченные кожные и диссеминированные
кожные формы, висцеральную форму с поражением желудочно-кишечного
тракта и лимфатических узлов, сочетанную кожную и висцеральную формы. В
некоторых случаях наблюдалась локализация опухоли в головном мозге с
соответствующей неврологической симптоматикой и КТ изменениями.
Возможно течение СК только с местными проявлениями и с общими
симптомами в виде лихорадки и потери веса. Средняя продолжительность жизни
больных при изолированных формах СК составляет 12-18 месяцев, при наличии
224
СК и оппортунистических инфекций — 6-9 месяцев.
Лечение СК у больных СПИДом представляет трудно разрешимую
проблему, т.к. обычно применяемая химиотерапия и лучевая терапия усиливают
иммунодефицит и делают больных более подверженными оппортунистическим
инфекциям.
Для лечения применяют винбластин, винкристин, адриамицин,
блеомицин, их сочетания, альфа-интерферон, лучевую терапию (см. в других
разделах).
Лимфома головного мозга
При СПИДе экстралимфатическое расположение лимфом является
правилом. По некоторым данным, до 42% лимфом находилось в ЦНС.
Среди всех больных СПИДом первичные лимфомы мозга наблюдаются
с частотой от 0,48 до 5%.
Клиническим проявлениями первичной лимфомы мозга являются
симптомы, обычные для опухолей головного мозга: при КТ обнаруживаются
очаговые изменения, накапливающие контраст. Следует учитывать возможность
наличия множественных опухолевых очагов в головном мозге (особенность,
свойственная лимфомам мозга при ВИЧ-инфекции). Прогноз при лимфоме
мозга плохой, продолжительность жизни больного после появления первых
симптомов опухоли составляет 2-3 месяца.
Системная лимфома, приводящая к инфильтрации лимфоидными
элементами, в первую очередь, мозговых оболочек, проявляется
множественными мононевропатиями черепных нервов, множественными
монорадикулопатиями и спинальными расстройствами. Обсуждается роль
Эпштейн-Барр вируса и HTLV-1 в происхождении лимфом при СПИДе.
Лечение лимфом проводится химиотерапевтическими средствами
(метотрексат, блеомицин, адриамицин, циклофосфан, лейковорин), применяется
лучевая терапия.
5.5. Сосудистые осложнения
Причины возникновения нарушений мозгового кровообращения
многообразны. Заражение астроцитов и эндотелиальных клеток,
периваскулярный воспалительный процесс могут быть причиной
повреждения гемато-энцефалического барьера, нарушения проницаемости
сосудистой стенки, возникновения ишемии мозговой ткани, формирования
синдрома диссеминированного внутрисосудистого свертывания. У многих
больных СПИДом выявляется транзиторная или перманентная
тромбоцитопения, сопряженная с развитием геморрагического синдрома
различной, в том числе церебральной локализации. Патология сердца (более
чем у 50% больных), включая эндокардиты, может также быть одной из причин
церебральных сосудистых осложнений. В части случаев не исключается роль
•5. Заказ № К-4451.
225
формирования и разрыва микотических аневризм и кровоизлияний в опухоль,
в частности в саркому Капоши.
Одним из вариантов поражения сосудов головного мозга при ВИЧ-
инфекции является так называемая кальцифицирующая васкулопатия у детей. В
некоторых случаях выявляется кальцификация базальных ганглиев.
Кальцифицирующая васкулопатия расценивается в качестве признака,
указывающего на то, что ВИЧ проникаете ЦНС через эндотелий мозговых сосудов.
Все перечисленные и другие неуточненные патогенетические механизмы
могут быть основой церебральной сосудистой патологии, которая клинически
манифестирует соответствующими неврологическими проявлениями в форме:
1) транзиторных ишемических атак; 2) ишемического инсульта; 3)
геморрагического инсульта.
5.6. Другие синдромы поражения центральной и
периферической нервной системы
Поражения ЦНС относятся к широко распространенным вариантам
патологии, сопутствующей СПИДу, и могут выявляться в любой стадии
заболевания, в том числе и до развития иммунодефицита. Частота вовлечения
периферического отдела нервной системы составляет 15-50% от общего числа
больных, а при более углубленном и целенаправленном изучении и включении
в анализ субклинических форм достигает 80-90%. Возможно сочетание такой
патологии с синдромами ЦНС.
Тонкие механизмы поражений ЦНС окончательно не установлены.
Клинические проявления могут определяться как прямым влиянием ВИЧ,
так и воздействием оппортунистических инфекций, злокачественных
новообразований, медикаментозной терапии.
Наиболее частый клинико-неврологический вариант поражения ЦНС у
больных СПИДом (10-30% больных) — хроническая сенсорная невропатия
(полиневропатия). Клиническая характеристика: дистальная локализация
поражений и их симметричность, боли в ногах, болезненные парестезии,
мучительные дизестезии, снижение болевой и вибрационной, реже
температурной, чувствительности, угасание рефлексов, вегетативные нарушения.
Описан клинический вариант сенсорной невропатии, которой морфологически
сопутствовало избирательное перерождение ростральных (шейно-грудных)
отделов пучка Голля. Несколько реже встречается сенсомоторный вариант со
слабостью и атрофией мышц конечностей. Необходимо некоторое уточнение:
при клинических проявлениях сенсорной невропатии электрофизиологическими
методами возможна верификация заинтересованности не только сенсорных,
но и моторных волокон. Из черепных нервов с большей закономерностью
регистрируется поражение V, VII, VIII нервов.
226
Таблица 32а
Поражения центральной нервной системы у больных ВИЧ-инфекцией (в%)
Клинические формы Стадии ВИЧ инфекции
ПА (п^9) ПБ (п=31) пв (п=54) ША (п=И9) П1Б (п=102) ШИ (п=61)
Острым энцефалит 5,9±0,1
Асептический менниягит 9,710/3
Менингоэнцефалиты:
бактериальный 3,2± 0,1 7,5± 0,2* 5,910.2
токсоплазмепнын 9,0±0,2
грибковый 14,3± 0,4* 10,210,1
герпетический 5,810,1 4,1±0,2
цитомегаловирусным 13,8± 0,2
Нейросифилис 5,510,2 6,2±0,1 7,9±0,4* 5,1±0,2
СПИД-деменция 8,710Д 10,810,3 27,1* 0,5*
Смешанная энцефалопатия 27,810,4 39,510,5* 41,510,3» 22,110,2 12,110,3
Вакуолярная миелопатия 2,8 ЮД
Опухоли ЦНС 4,3± 0.1
Прогрсссирушая многоочаговая лейкодистрофия 1,010,1 3,9 ±0,2*
Нарушения мозгового кровообращения 2,4Ю,1 4,7± 0,2*
* - различие между группами достоверно (р<0,05)
Только асептический менингит и острый энцефалит наблюдались нами у больных
с содержанием CD4 0.3-0.5х109/л, вторичные и оппортунистические заболевания
отмечались лишь у пациентов при СЕ>4 0,2 и ниже.
Другой частый вариант поражения нервов и корешков воспалительно-
демиелинизирующего характера - хроническая прогрессирующая полиневропатия
(полирддикулоневриттипаГийена-Барре). Клинические проявления: проксимальная
локализация, асимметричность поражений, арефлексия, вялые парезы, незначительные
расстройства чувствительности. В церебро-спинальной жидкости регистрируются
повышение белка и плеоцитоз. Электромиография и элекгронейрография позволяют
верифицировать преимущественный характер процесса или аксонопатию. При биопсии
нервов выявляются мононуклеарно-макрофагальная инфильтрация, уменьшение
количества аксонов, первичная демиелинизация и аксональная дегенерация.
Кроме ВИЧ подобную клиническую форму (с восходящим течением по
типу Ландри) может вызывать цитомегаловирус. В отдельных случаях
полирадикулоневрит сопутствует инфекционному мононуклеозу.
Среди других этиологических вариантов укажем на следующие.
Избирательное поражение передних корешков спинного мозга и двигательных
черепных нервов может вызывать цитомегаловирус. Причиной краниальных
невропатий может быть криптококк. Варицелла зостер вирус, значительно реже
вирус простого герпеса, способны индуцировать формирование таких
15*
227
клинических синдромов, как радикулоганглионеврит, лорадикулоганглионеврит,
постгерпетическая невралгия. У ВИЧ-инфицированного больного описывалась
прогрессирующая двусторонняя люмбосакральная плексопатия после
перианалбного абсцесса. Поражение как спинальных корешков, так и черепных
нервов может возникать при системной лимфоме. В редких случаях возможно
формирование туннельных невропатий (саркома Капоши). Генерализованная
форма лимфомы Беркитта с патологическими переломами позвонков, костей
таза и конечностей может сопровождаться компрессией спинальных корешков и
нервов — формируются радикулярные и невральные синдромы.
В единичных работах целенаправленно у ВИЧ-инфицированных
анализировались поражения вегетативной нервной системы. Установлено, что
симпатическая и парасимпатическая дисфункция выявляется у 1/2
обследованных. Такая дисфункция может быть следствием поражения как
центральных, так и периферических вегетативных структур.
Неоднократно верифицировались поражения мышц, обусловленные как
непосредственным воздействием ВИЧ (с выделением вируса из мышечной ткани),
так и другими причинами. Более частый клинический вариант — полимиозит. В
биоптате обнаруживаются эндомизиальные и периваскулярные инфильтраты,
некроз мышечных волокон. В других случаях (миопатический вариант)
гистологически выявляются гранулярная дегенерация волокон с явлениями
миофагии и агрегации мононуклеарных клеток, участки регенерации, иногда
очаговый некроз мышечных волокон без воспалительной клеточной инфильтрации.
Представленный широкий спектр полиморфных неврологических
проявлений СПИДа, необходимость дифференциации с большим кругом
заболеваний разной природы существенно затрудняют диагностический
процесс и предопределяют необходимость использования многих
инструментальных и лабораторных методов: КТ, МРТ, ПЭТ, ЭМГ, ЭНГ,
нейропсихологического тестирования, исследования церебро-спинальной
жидкости и других.
Однако, несмотря на столь сравнительно небольшой процент ВИЧ-
энцефалита как одной из причин смерти, следует отметить, что у всех больных
с другими причинами смерти были выявлены изменения, характерные для
ВИЧ-энцефалита.
В лечении ВИЧ-энцефалита, ВИЧ-деменции и сопутствующей ему
герпесвирусной инфекции, включая ЦМВ, имеет значение антиретровирусная
терапия с выбором препаратов, проникающих через гематоэнцефалический
барьер (таблица 33).
Наряду с этим, следует принимать во внимание, что и некоторые
ненуклеозидные ингибиторы обратной транскриптазы, такие как невирапин,
хорошо проникают через гематоэнцефалический барьер и могут
использоваться влечении ВИЧ-энцефалопатии.
228
Таблица 33
Проникновение антиретровирусных препаратов через гематоэнцефалитический барьер*
Препарат Концентрация в СМЖ (мкмоль) диапазон** 1С5о (мкмоль)
Абакавир Зидовудин Диданозин Зальцитабин Ламивудин Ставудин 2,58*** 0,28 0,17 0,01 0,28 0,24 0,26-3,7 0,0003 -0,1 0,08- 11,6 0,001 -0,1 0,004-0,1 0,05 - 0,5
* методические разработки представлены компанией Глаксо Вэллкам, 1999 * * 1С>о - концентрация, которая определялась в исследованиях с использованием различных клеточных линий и штаммов вируса * ** через 3-4 часа после приема препарата Концентрация абакавира в СМЖ в 9 раз превышает IC50
5.7. Психогенные факторы
Во всех стадиях ВИЧ-инфекции возможно развитие реактивных
невротических и психотических состояний. Поскольку проблема СПИДа
получила в наше время большой общественный резонанс, а основное
направление, санитарно-просветительная работа, усиленно подчеркивает
опасность и тяжесть болезни, широкое ее распространение, что
способствует формированию фобических синдромов, то возникновение
реактивных невротических и психотических состояний возможно даже в
период инкубации болезни, например, после случайной половой связи.
Реакция на произошедшее инфицирование или болезнь может быть
различной - от адаптивного варианта до выраженного патологического, в
формировании которых принимают участие многие факторы, в том числе
преморбидные свойства личности, конкретная ситуация, степень
информированности больного о сущности болезни, поведение и
отношение медицинских работников и лиц из ближайшего окружения
"больного, а также сами проявления болезни. Следует также учитывать, что
в позднем периоде болезни реакция на болезнь формируется при наличии
органического повреждения мозга и может быть в связи с этим атипична.
Реактивные состояния проявляются чаще всего симптомами тревоги
и депрессии, нередко с суицидальными идеями, наблюдаются выраженная
ипохондрия, кратковременные реактивные психозы, паранойя,
шизофреноподобный психоз. Тревога часто сопровождается ажитацией,
паникой, анорексией, бессонницей, а также чувством безысходности и
гнева, направленного нередко на врачей.
229
Весьма характерны для инфицированных и больных обсессивно-
компульсивные расстройства. Они могут возникать самостоятельно как реакция
на сообщение об инфицировании или на болезнь, или быть вторичными после
появления депрессии. В таких случаях больные занимаются многочасовыми
обследованиями своего тела в поисках специфической сыпи или подозрительных
пятен; переживания больных заключаются в постоянных мыслях о смерти, самом
процессе умирания, навязчивых воспоминаниях о сексуальных партнерах, от
которых могло произойти заражение, опасений возможности случайного
заражения родственников или близких бытовым путем.
При ВИЧ-инфекции описаны сложные психопатологические синдромы,
которые могут иметь длительное многомесячное течение и предшествовать
органическому поражению мозга и деменции. Симптоматика таких синдромов
весьма разнообразна и включает бредовое мышление, галлюцинации,
параноидную подозрительность, идеи собственной переоценки, асоциальность,
уплощение аффекта. Подобные психопатологические синдромы в ряде случаев
требуют дифференциальной диагностики с эндогенными заболеваниями -
шизофреноподобными психозами, острыми параноидными психозами,
паранойей, депрессивными психозами, а также стойкими гипоманиакальными
и маниакальными состояниями.
Важной психологической проблемой, с которой приходится
сталкиваться ВИЧ-инфицированным лицам, является социальная изоляция.
Больных часто увольняют с работы, от них отказываются родственники и
друзья, распадаются семьи, больные начинают чувствовать себя “париями
современного общества”. Особенно тяжело страдают дети, которых в ряде
случаев исключают из школы, лишают возможности посещать детский сад и
общаться о другими детьми. В ряде случаев даже в больничных условиях
больные ощущают наличие “стены” между ними и медицинским персоналом.
Известны случаи убийства больных СПИДом.
В последнее время в значительном числе стали наблюдаться больные,
страдающие невротическими состояниями с навязчивым страхом заболеть
СПИДом - со “спидофобией”. Чаще такие состояния наблюдаются у лиц,
относящихся к группам риска по СПИДу, но в ряде случаев спидофобия
наблюдалась у лиц, не имевших никакой реальной возможности заразиться
СПИДом; спидофобия трудно поддается коррекции.
V.Vitaletty с соавт. описали “СПИД-тревожный синдром” у
гомосексуалистов, включающий три основных симптома: навязчивые мысли
о возможности заболеть СПИДом, страх смерти и внутриличностный конфликт
в связи с гомосексуальностью.
Во всех стадиях ВИЧ-инфекции, также как и при других инфекционных
заболеваниях, возможно развитие неспецифического астенического или
астено-вегетативного синдрома.
230
При изучении психологического статуса ВИЧ-инфицированных в нашей
стране (Покровский В.В.,БеляеваВ.В., 1994, Беляева В.В., 1999) показано, что
наибольшая выраженность психоэмоциональных реакций наблюдалась у
больных с впервые установленной ВИЧ-инфекцией, а также при
прогрессировании болезни.
Авторы считают необходимым консультирование, использование
методики профилактики суицидального поведения. При этом
психофармакология, по мнению авторов, имеет вспомогательный характер. Из
препаратов авторы использовали триптизол в минимальных дозах (20 мг), а
также транквилизаторы с преимущественно тормозным компонентом действия:
феназепам 1,0-1,5 мг/сутки, нозепам до 30 мг/сутки, интразепам 5-10 мг/ночь.
Одним из антидепрессантов является препарат Триттико, активно
действующим началом которого является тразодон. Тразодон показан при
депрессивных синдромах, вызывая быстрое снятие тревоги, улучшая общие
соматические симптомы, настроение и психомоторику. Триттико принимается
в виде однократной дозы 75-150 мг перед сном.
В.В.Беляева (1999) выделяет три критических периода психической
адаптации пациентов.
Первый критический период, адаптационный период, - при обнаружении
серопозитивности, обусловленный психической травмой. На этом этапе
выявляются психоэмоциональные реакции с деструктивным поведением при
нередко соматическом благополучии.
Во второй критический период возникают глубокие формы психической
дезадаптации.
Третий период нарушений психической адаптации возникает в
терминальной стадии, когда возможна церебральная недостаточность
органического генеза.
Автором разработана комплексная система консультирования,
позволяющая решать проблемы психической адаптации.
В.В.Беляева и соавт. (1999) описывают 5 случаев необратимых
психических расстройств (деменции) у больных с обусловленным ВИЧ-
инфекцией иммунодефицитом (4,3% из 115 больных ВИЧ-инфекцией в стадии
СПИДа). У всех был подтвержден диагноз манифестной цитомегаловирусной
инфекции, высокой концентрацией ДНК цитомегаловируса в крови
обнаружением ДНК цитомегаловирусных клеток в биоптатах.
Клинически у пациентов отмечались: бездеятельность, странности
поведения, резкие нарушения памяти, нарушения речи, способности к чтению,
появлялись общемозговые симптомы - головные боли, слабовыраженный
менингеальный синдром, нистагм, невропатия глазодвигательного нерва.
У всех больных наблюдалась лихорадка, за несколько дней до смерти
развивалась спутанность сознания, переходящая в кому.
231
При патологоанатомическом исследовании был выявлен некротический
процесс с образованием очагов деструкции в стенках желудочков,
перивентрикулярной зоне, подкорковых структурах.
David Соор (семинары CARP, 1999), характеризуя психоэмоциональные
расстройства при ВИЧ-инфекции, выделяет выраженные депрессии, которые
характеризуются совокупностью признаков:
длительное угнетенное состояние;
утрата чувства удовольствия;
стыд, вина, самобичевание;
суицидные попытки/мысли;
нарушение аппетита и либидо;
нарушение познавательных способностей;
задержка психомоторики или возбуждение.
Факторами риска развития депрессии являются случаи депрессии в семье,
отсутствие социальной поддержки, прогрессирование ВИЧ-инфекции. Частота
депрессии увеличивается при прогрессировании ВИЧ-инфекции за 18 месяцев
додиагнозаСПИДа- 15%,за6 месяцевдо диагноза СПИДа-34%,через6 месяцев
после диагноза СПИД - 43% (Halman, 1998).
При этом возможны суицидные попытки, факторами риска которых
являются: выраженная депрессия, дискриминация, злоупотребление алкоголем.
Для лечения депрессии рекомендуется психотренинг, психотерапия,
психофармакотерапия.
David Соор выделяет также факторы, которые могут способствовать
плохой адаптации пациента к своему ВИЧ-статусу:
• нежелание рассказывать освоем ВИЧ-статусе кому-либо из друзей или близких;
• реальные или предполагаемые ограничения доступа к социальной помощи;
• отказ от ранее существовавших отношений и активности;
• обостренное чувство стигмы у пациента и/или его семьи;
• реальное или предполагаемое отторжение / дискриминация со стороны
семьи, друзей, сообщества;
• поведение, характеризующееся высокой степенью риска (например,
проституция);
• большие финансовые проблемы;
• потеря жилья или неадекватная поддержка / уровень обслуживания, не
соответствующие стадии болезни;
• очень плохое или неправильное понимание рискового поведения, этиологии
и развития ВИЧ-инфекции, атакже значения предлагаемого лечения;
• наличие множества нерешенных проблем, в частности, сексуальной
ориентации / образа жизни (например, внутренняя гомофобия);
• неспособность решать жизненные проблемы в прошлом (например, смерть
близких, изменения места работы, переезды, расставания с близкими людьми и т.п.).;
232
• большие утраты в прошлом, многочисленные потери (например, смерть
любимого человека, родителей, детей);
• высокий “биологический эмоциональный порог”;
• принадлежность к этническим меньшинствам, которые могут осуждать
гомосексуализм или другие модели поведения, связанные с высоким риском
заражения ВИЧ, атакже языковой барьер при поиске лечения;
• отрицание ВИЧ+статуса, препятствующее получению лечения.
David Соор выделяет факторы, которые могут способствовать плохой
адаптации пациента и членов его семьи к процессу умирания и смерти:
• отсутствие необходимой информации у больного и членов его семьи
(течение болезни, прогноз) или концентрация всего внимания на других аспектах
болезни, или эмоциональная закрытость;
• отсутствие инициирования эмоциональной / социальной поддержки;
• неспособность пациента и членов его семьи подготовиться к печальным
Событиям (“живем сегодняшним днем”);
• отсутствие “предварительного оплакивания” или “репетиции смерти” -
другими словами, если эти вопросы не обсуждаются пациентом и членами его семьи,
То и не представляется возможным излить заранее хотя бы часть будущего горя;
• интенсивные дискуссии о характере лечения больного и ухода за ним
между членами семьи пациента или между ними и самим больным.
При этом David Соор рекомендует следующие мероприятия:
• информация, осуществляемая медицинскими учреждениями,
общественными организациями, информационными центрами, “горячими
линиями”, отдельными медицинскими работниками;
• учебные группы психологической помощи;
• группы психотерапии, руководимые психологами, клиническими
социальными работниками, психиатрами или опытными медсестрами;
• индивидуальное, парное, семейное консультирование, проводимое
названными выше специалистами, имеющими специальную подготовку;
• группы консультации и поддержки, организованные в сообществах и
руководимые подготовленными добровольцами из представителей самих этих
Пораженных / вовлеченных в эпидемию сообществ;
• консультирование по финансовым вопросам, проводимое
подготовленным финансистом, хорошо знающим правительственные
программы оказания социальной помощи;
• консультирование по вопросам наркомании, проводимое
профессионалами, имеющими опыт работы и специальнгую подготовку по
вопросам борьбы с наркоманией и алкоголизмом;
• группы консультации и поддержки, организованные в этнических
233
группах населения или для женщин; эти службы должны удовлетворять
потребности этнических меньшинств и женщин; в их составе могут быть
переводчики, должны быть изданы санитарно-просветительные материалы
на родном языке;
• юридическая помощь; программы должны дать предварительные
юридические советы по проблеме ВИЧ/СПИДа (жилье, работа, страховка);
• помощь на дому - сестринский уход, уборка жилья, приготовление
пищи, оказание медицинских услуг больному в домашних условиях;
• финансовая помощь; государственные и общественные программы
оплаты лекарств и повседневных расходов; оказание длительной финансовой
поддержки в случае наступления инвалидности;
• доставка продуктов питания; общественные организации
добровольцев доставляют горячую пищу тяжелым больным и инвалидам на
дом с оплатой продуктов питания по себестоимости;
• доставка лекарств на дом;
• кратковременное пребывание в больнице или хосписе для того, чтобы
те, кто постоянно ухаживает за больным, могли немного отдохнуть;
• дома поддержки - дома, занимаемые группой людей, которые помогают
тем больным, кто не может справляться с болезнью в одиночку, но кому еще не
требуется постоянное пребывание в больнице;
• бригады для проведения паллиативного лечения.
Весьма существенное значение имеет психотерапевтическая поддержка
инфицированных ВИЧ и больных СПИДом, осознание ими активной роли в
борьбе за свои права работать, получать необходимую медикаментозную
терапию, как индивидуально, так и в сообществах (W.Flanagan, семинары
CARP, 1999). Большой интерес для психотерапевтической поддержки
больных имеет характер взаимоотношений врача и пациента.
Эффективную клиническую беседу при заболевании ВИЧ-инфекцией/
СПИДом описывают David Соор и Irving Salit, семинары CARP, 1999)
Общение, ориентированное набольного, влияет на его здоровье, так как:
• Обеспечивается более точная запись истории болезни;
• Меньше неправильно поставленных врачом диагнозов;
• Увеличивается самораскрытие больного;
• Увеличивается доверие к врачу/лицу, осуществляющему
медицинский уход;
• Увеличивается понимание больным диагноза и лечения;
• Возрастает согласие больного и врача относительно природы
основных существующих проблем;
• Увеличивается согласованность / соблюдение плана лечения.
Ключевые компоненты подхода, ориентированного набольного:
• Понимание заболевания пациента и опыта болезни из их субъективной
234
перспективы путём использования открытых вопросов и внимание к вербальному/
невербальному поведению и эмоциональной реакции/ сознанию больного.
• Понимание “всего человека” путём изучения истории жизни,
вопросов личности и развития, в котором отмечаются существующие
проблемы.
• Отыскание “точек соприкосновения” с пациентом относительно темы
беседы, целей лечения, и роли врача и пациента в плане осуществления
помощи.
Общая структура направленной на пациента беседы:
Определить проблемы
Шаг 1
Исследовать восприятие пациентов и понимание диагноза, и
воздействия, которое оно имело на отношения, как познавательные, так и
эмоциональные.
Шаг И
Просмотреть ожидания пациента относительно ухода.
Установить цели и приоритеты
Шаг Ш
Определите и согласуйте цели и приоритеты, гарантирующие
соответствующее медицинское обслуживание.
Роли врача и больного в осуществлении лечения.
Шаг IV
Определите роли и врача и пациента и определите, кто за что будет
отвечать при проведении лечения.
Методика проведения беседы/ методы:
• Отражение чувства
• Пересказывание
• Подведение итогов
• Постановка открытых вопросов
• Применение модели принятия решения, основанной на проблеме
• Когнитивная переоценка
Отразить чувство означает точно заново сформулировать чувства,
выраженные неявно или явно путём общения с больным. Оно касается, прежде
всего, процесса сопереживания, идентификации чувств, затем
формулирования реакции для “отражения” назад пациенту.
Фразы обратной связи обычно включают фразы типа:
“ Кажется, вы чувствуете.................“
“ Я ощущаю, что вы чувствуете............”
“ Чувство, стоящее за всем этим, оказывается одним из.”
Перефразирование (пересказ) включает сообщение обратно пациенту
235
сути того, что он сказал. Оно скорее включает отражение познавательной
(когнитивной) стороны, а не чувственной.
Пациент:
“Мне не нравится, что я должен бросить курить, потому что это плохо
для моей иммунной системы. В конце концов, я курил две пачки в день в
течение 20 лет, и я не знаю, как я когда-либо смогу бросить курить”.
Врач:
Реакция (Перефразирование, передача содержания):
“Вы не уверены, что вы можете отказаться от такой закоренелой
привычки”
(Отражение чувства)
“Вы кажетесь взволнованным оттого, что вы не способны отказаться
от сигарет”.
Перефразирование, подобно отражению чувства, требует, чтобы мы
определяли и идентифицировали то, что было сообщено и затем вновь заявляли,
это поддерживает пациента; помогает пациенту распознать, что было упомянуто,
получить информацию относительно точности нашего восприятия;
сосредоточить внимание пациента и дать направление будущей связи; и дать
возможность исправлять любое непонимание.
Суммирование задач, чтобы помочь больному собраться с мыслями с
помощью воспоминания основного содержания своего общения за
определённый период времени. Главная тема, критические элементы и важные
моменты связываются, чтобы помочь больному яснее понять ситуацию.
Суммирование задач может также использоваться, чтобы показать, что мы
уделяем пристальное внимание получению обратной связи от больного, чтобы
поддерживать дальнейшую дискуссию по этой теме и чтобы закрыть конкретную
тему обсуждения или завершить беседу.
Открытые вопросы дают лучшую возможность общения, чем
“закрытые вопросы”. Это происходит потому, что они более открыто
приглашают к разговору и не ограничивают больного в его ответах.
Скрытые вопросы Открытые вопросы
Вы хорошо себя чувствуете? Как Вы себя чувствуете?
Не могли бы вы немного Ваш брак удачный?
рассказать о вашем браке?
Отправляетесь ли Вы домой на Каковы Ваши планы на
выходные? выходные?
Какая помощь, как Вы думаете,
Вам может понадобиться?
Вам нужна будет патронажная
сестра?
236
Применение модели принятия решения, которая строится на
проблемной основе, означает разделение каждой проблемы на компоненты
и постановку контролируемых целей лечения больного, у которого имеются
эти проблемы.
Когнитивная переоценка
• “Искажённые мысли” вызывают болезненные эмоции, такие как депрессия
или возбуждение, и часто вызывают непрерывные конфликты с другими.
• Проще говоря, “мы чувствуем так, как мы думаем”.
• Если мы можем помочь больным идентифицировать негативное
мышление, которое может способствовать появлению болезненных эмоций
или разрыву социальных связей, то мы можем помочь им бороться с таким
мышлением и “на рациональной основе переоценить” свою ситуацию.
• Это может в конечном счёте улучшить их ощущение своего состояния
и уменьшить негативные состояния, такие как депрессия или волнение.
• Поскольку многие больные имеют общие “искажения сознания”, связанные
с ВИЧ-инфекцией, то врачу полезно корригировать их, когда они проявляются.
• Этот когнитивный/поведенческий подход был признан
исследователями эффективным при лечении этой группы населения.
Общие нарушения сознания:
Фильтрация проявляется наблюдением только за одной частью ситуации
с исключением всего остального.
Полярное мышление включает восприятие всего в его крайнем
проявлении, “либо белое, либо чёрное”, и ничего посередине.
Чрезмерное обобщение означает широкий общий вывод, основанный
только на одном свидетельстве.
Чтение мыслей - это, когда вы основываете свои предположения и выводы
на вашей “способности” знать мысли других людей.
Катастрофизация, когда вы объясняете всё вокруг себя таким образом,
который отражается на вас и часто на вашей самооценке.
Сдерживающие заблуждения включают либо ощущение того, что
события в вашей жизни полностью контролируются внешней силой
либо что вы за всё в ответе.
Заблуждение справедливости означает, что вы попадаете в капкан, когда
вы судите действия людей по правилам, которые вы придумали
относительно того, что справедливо и что несправедливо.
Рациональный довод - это ошибочная вера в то, что всё, что вы
чувствуете, должно быть верным.
Заблуждение изменения - это допущение того, что другие люди изменятся,
чтобы подойти вам, если вы окажете на них достаточное давление, и что
ваше счастье зависит оттого, будут ли вызваны эти изменения.
237
Глобальное наклеивание ярлыков означает высказывание широкого
суждения, основанного на очень небольшом свидетельстве.
Порицание - это когда всегда кто-то виноват, если дела идут плохо, либо
вы, либо кто-то другой.
Заявление как следует действовать означает действия по неоспоримым
правилам, по которым все, включая вас, должны действовать.
Правота - это нарушение включает в себя постоянную потребность
оправдывать свою точку зрения или поведение.
Заблуждения относительно вознаграждения на небесах.
Это действительно заблуждение Мартина; вы думаете, что, если вы
всегда будете делать “то, что надо”, вы в итоге будете вознаграждены!
Вы можете идентифицировать нарушение сознания в этих заявлениях
больного и каков будет более разумный ответ?
Дополнительные полезные методы
• Преувеличенная оценка
Например, при беседе с больным, страдающим от алкогольной или иной
зависимости, если вы спросите их об истории употребления спиртного или
другого вещества, преувеличивайте количество вещества, которое, как вы
предполагаете, они принимают.
«Как много вы сейчас пьёте? Около 24 кружек пива в день?»
Это делается потому, что лица, находящиеся в алкогольной и иной
зависимости часто будут преуменьшать потребление, основанное на их
собственном ощущении того, что врач находит социально допустимым.
Тогда больной может ’‘исправить,” называя истинное количество,
которое, вероятно, меньше.
• “Притворство врача”
Это происходит, когда врач принимает позу “ограниченного знания”,
когда фактически он знает больше.
“Я могу здесь полностью ошибаться, но я думал, что возможно у вас были
проблемы, связанные с регулярным приёмом этого лекарственного средства”.
Это даёт возможность больному “не согласиться” с неуверенным
заявлением врача, и он скорее даст более правдивый ответ, чем содержится в
утверждении врача:
«Вы не принимаете ваших лекарственных средств, которые мы вам
прописали, не так ли»?
Основные коммуникативные направления для проводящего беседу
Проводите её просто; избегайте чересчур научного языка.
Задайтесь вопросом “Что этот диагноз значит для больного?”
Принимайте во внимание образование и личность больного, когда
238
вы решаете, как раскрыть информацию.
Не передавайте всю диагностическую информацию во время
одного интервью, если вопросы очень сложные.
Оставляйте паузы для вопросов больного.
Не спорьте с отказом; он может играть практическую роль для
больного.
Всегда спрашивайте больного, что ему было сказано и что он
понимает о природе/значении болезни.
Не уничтожайте всех надежд.
Не говорить никакой неправды.
Внимательно относитесь к ценностям больного и тому, как они
могут повлиять на уступчивость больного и результаты
вмешательства.
Не подрывайте право больного на свое собственное
волеизъявление
Обнаружение обоих точек соприкосновения относительно плана
ведения больного: проблемы и приоритеты, цели и лечение, роли врача и
больного в ведении больного. Осознание больным активной роли в борьбе
за свои права работать, получать необходимую медикаментозную терапию.
Авторы указывают на необходимость выявления всех социальных и
психологических потребностей больного с направлением его к социальным
работникам,психологам и психиатрам.
5.8. Поражение периферической нервной системы у ВИЧ-
инфицированных и больных СПИДом
Состояние периферической нервной системы было изучено у 228
пациентов с ВИЧ инфекцией, находившихся под диспансерным наблюдением
невропатолога Городского Центра профилактики и борьбы со СПИД, из них
179 жителей Санкт-Петербурга. Наряду с жителями города наблюдались
иного-родние пациенты (51 человек или 21,7% от общего числа), в том
числе 22 жителя Ленинградском области.
ВИЧ-инфекция выявлялась преимущественно у лиц мужского пола
(за весь период наблю-дения соотношение мужчин и женщин составляло
2,4:1), в возрасте до 40 лет(за все годы на-блюдения - 85,6%).
Тревожен тот факт, что в эпидемический процесс все чаще вовлекаются
молодые люди от 15 до 19 лет. Возрастной диапазон у наблюдаемых нами
больных мужчин составил 16-43 года, у женщин 16-49 лет.
239
За весь период наблюдения явно доминирует половой путь передачи
инфекции (69,8% всех случаев). Гомосексуальные половые контакты
отмечены в 97 случаях из 180 (53,9%), гетеросексуальные - в 83 (46,1%).
Следует отметить, что в последние годы все большую роль начинает
играть парентеральный путь передачи инфекции при внутривенном
введении наркотиков. Вертикальный путь инфицирования констатирован
лишь в двух случаях. При анализе социальных аспектов проблемы следует
обратить внимание, что высшее образование имели 24,3%, остальные
среднее специальное (32,8%) и среднее (42,9%)? 50% выявленных
относились к числу неработающих.
Структура клинических форм (по классификации В.В.Покровского)
представлена в таблице 34.
Таблица 34
Клини- ческие формы Число ВИЧ-инфицированных
Взятых на ДУ в течение 1998 г. Состоящих на ДУ на 01.01.1999 г.
Мужчин Женщин Всего Мужчин Женщин Всего
11Б 9 8 17 28 13 41
ПВ 19 10 29 63 37 100
П1А 7 1 8 28 16 44
ШБ 1 1 2 19 10 29
111В 2 - 2 13 1 14
Всего 38 20 58 151 77 228
Из приведенных данных следует, что на поздних стадиях ВИЧ-
инфекции (ШБ и II1B) находились лишь 4 человека из 58, впервые взятых
на диспансерный учет в 1998 году (7%), и том числе на стадии СПИДа - 2
(3,5%).
В группе лиц, оставшихся на диспансерном учете по состоянию на
01.01.99 года, стадии ШБ и I11B суммарно определялись у 43 из 228
пациентов (18,8%), в том числе СПИД - у 14 (6,1%).
Поражения периферической нервной системы относятся к широко
распространенным вариантам патологии при ВИЧ-инфекции (по
литературным данным 15-50%) и могут выявляться на любой стадии
заболевания, и том числе и до развития иммунодефицита.
Частота вовлечения периферического отдела нервной системы
составляло в наших наблюдениях 50,4% от общего числа всех
наблюдаемых пациентов.
Клинические проявления определялись как прямым влиянием ВИЧ.
так и воздействием оппортунистических инфекций, медикаментозной
терапией.
240
Также отмечалось сочетание синдромов поражения периферической
и центральной нервной системы.
Частота клинических синдромов поражения периферической
нервной системы представлена в таблице 35.
Таблица 35
Клинические синдромы поражения периферической нервной системы
Клинические синдромы Стадии ВИЧ-инфекции по В.В.Покровскому
11 11 III III III Всего
М Ж м Ж М Ж м Ж М ж М Ж
1. Мононевронатии -черепных нервов 1 - - - 2 - 1 - 4
-периферических нервов - - - - 2 - 1 - - 3 -
2. Множественные - 1 - 3 - 4 - - - 8 -
мононевропа!ни
2. Полиневропатии -острая демиелинизирующая 2 2 -
-хроническая демиелинизирующая -токсическая - - - - - - - - 1 - 1 -
(наркотики) 9 5 8 4 - - - - - - 17 9
-алкогольная - - 5 2 3 1 2 - 2 - 12 3
-медикаменюзная - - - - 2 1 4 3 1 - 7 4
-сенсорные - - - - - - 3 2 5 1 8 3
4. Радикуло-
ганглиониты - - - - 7 2 2 - - - 9 2
5. Постгерпегическая невралгия 1 1 - - 1 1
6. Миозиты - 3 5 1 2 1 - - - - 7 5
7. Полимиозиты 2 - - - - - 3 2 1 1 6 3
ВСЕГО 14 X 19 7 21 6 21 7 10 2_ 85 30
Из данной таблицы следует, что частота синдромов в стадии
вторичных заболеваний на фоне умеренного либо выраженного
иммунодефицита в 1,5 раза чаще по сравнению с сероконверсией.
Соотношение каждого отдельно взятого синдрома между
мужчинами и женщинами на ранних стадиях составило 2 : 1, на поздних -
3 : 1, в стадии СПИДа 5:1.
Наиболее частый клинико-неврологический вариант поражения ПНС
У ВИЧ-инфицированных — полинсвропатии различного генеза (66 случаев
- 28,8%), в том числе алкогольного и токсического генеза - 41 наблюдение
(18%).
•6- Заказ № К-4451.
241
На период первичных проявлений (сероконверсии) приходится 15
случаев (6,6% от всех наблюдений). На стадиях вторичных заболеваний
умеренного и выраженного иммунодефицитов - 67 наблюдений (29,3%).
Из клинико-неврологических синдромов нами наблюдались
следующие: периферическая невропатия лицевого нерва (4), невропатия
локтевого нерва (2), невропатия малоберцового нер-ва (1), плечевая
плексопатия (I), острая демиелинизирующая полиневропатия (2), острый
полимиозит (2), локальные миозиты (9), сенсорные полиневропатии (11),
полимиозиты (аутоиммунные)-?, медикаментозные полиневропатии (11),
радикулоганглионевриты (ВЗВ) -11.
При ЭМГ, ЭНМГ верифицировался преимущественный характер
процесса - миелинопатия, либо аксонопатия. При миологических синдромах
диагноз обосновался нормальной скоро-стью проведения импульса по
нервам, спонтанной активностью при ЭМГ.
Клиническая характеристика неврологических и миологических
синдромов на фоне ВИЧ - инфекции имели ряд особенностей, таких как:
• отсутствие выраженных обще-интоксикационных синдромов
• ареактивность течения заболевания
• нестойкость болевых синдромов
• склонность к рецидивному течению
• более длительный регресс кожных проявлений при неосложненных
формах заболевания
• резистентность к специфической противовирусной терапии.
Литература
1 .Беляева В.В. Нарушение психической адаптации человека при ВИЧ-
инфекции. Докторская диссертация в виде научного доклада, - М., 1999.
2 . Беляева В.В., Шахгильдян В.И., Кравченко А.В. Деменция как следствие
цитомегаловирусного энцефалита у больных СПИДом, - журнал
неврологии и психиатрии, - 1999, - 4, - с. 29-32.
3 . Коркина М.В., Марилов В.В., МариловаТ.Ю. О некоторых психиатрических
и психологических аспектах СПИДа (обзор). - Ж. невропатологии и
психиатрии им.С.С. Корсакова, 1989, т. 89, вып. 10, с. 137-145.
4 .Михайленко А.А., Осетров Б.А., Головкин В.И. НейроСПИД. Учебно-
методическое пособие. Военно-медицинская академия, СПб., 1993,80 с.
5 .Михайленко А.А. НейроСПИД. В кн.: Дифференциальная диагностика
нервных болезней: Руководство для врачей / Под ред. Г.А. Акимова. -
СПб.: Гиппократ, 1997. - (608 с.) - с. 583-589.
6 . Осетров Б. А. Инфекционные и дизиммунные поражения нервной системы. -
В кн.: Новое в диагностике и лечении нервных болезней (Материалы к 100-
242
летию кафедры невропатологии).-СПбМАПО, 1993,(140 с.)-с. 100-108.
7. Пархоменко С.И.Патология нервной системы при ВИЧ-инфекции.
Авторефер. канд. дисс. СПб, 2004.
8. Покровский В.В. Синдром приобретенного иммунодефицита (СПИД) в
неврологии и психологии (Обзор). - Ж. невропатологии и психиатрии
им. С.С. Корсакова, 1987, т. 87, вып. 10, с. 1561-1565.
9. Покровский В.В., Беляева В.В. Психоневрологические аспекты ВИЧ-
инфекции. - Вестник РАМН, - 1994, 1, - с. 23-25.
10. Рахманова А.Г., Веровая А.В., Бейер Т.В. Токсоплазмоз и СПИД. -СПб.
-1992.-59 с.
11. Шахгильдян В.И. Клинико-лабораторная характеристика, диагностика
и лечение цитомегаловирусной инфекции у больных ВИЧ-инфекцией.
Автореф. дисс., - М., - 1999 г.
12. Bartlett J. Medical care of Patients with HIV infection. VII Edition, 1999, p.
191.
13. Boccelllari A. Assessing and diagnosing AIDS dementia complex. In AIDS
Dementia Complex Training Manual. San Francisco: Family Survival Project,
1990.
14. Boccellari A., Zeifert P. Management of neurobehavioral impairment in Hl V-
1 infection. Psychiatric Clinics ofNorth America. 1994; 17(1): 183-203.
15. Bornstein RA, Nasrallah HA, Para MF et al. Duration of illness and
neuropsychological performance in asymptomatic HIV infection. Journal
of Neuropsychiatry and Clinical Neurosciences. 1994; 6(2): 160-164.
16. Everall IP. Neuropsychiatric aspects of HI V infection. Journal ofNeurology,
Neurosurgery, and Psychiatry. 1995; 58(4): 399-402.
17. Heaton RK, Grant I, Butters N, et al. The HNRC 500 - Neuropsychology of
HIV infection at different disease stages. Journal of the International
Neuropsychological Society. 1995; 1(3): 231-251.
18. Maj M, Satz P, Janssen R, et al. WHO Neuropsychiatric AIDS Study, cross-
sectional phase II: Neuropsychological and neurological findings. Archives
of General Psychiatry. 1994; 51 (1): 51 -61.
19. Navia BA, Jordan BD, Price RW. The AIDS dementia complex: 1. Clinical
features. Annals ofNeurology. 1986b; 19(6): 517-524.
20. Price RW, Brew BJ. The AIDS dementia complex. Journal of Infectious
Diseases. 1988; 158(5): 1079-1083.
21. Portegies P. Review of antiretroviral therapy in the prevention of HIV-related
AIDS dementia complex (ADC). Drugs. 1995; 49 (Suppl 1): 25-31.
22. Power C, Johnson RT. HIV-1 associated dementia: Clinical features and
pathogenesis. Canadian Journal of Neurological Sciences. 1995; 22(2): 92-100.
23. Stern Y, Liu X, Marder K, et al. Neuropsychological changes in a prospectively
followed cohort of homosexual and bisexual men with and without HIV
is*
243
infection. Neurology. 1995; 45 (3, Part 1): 467-472.
24. White DA, Heaton RK, Monsch AU, et al. Neuropsychological studies of
asymptomatic human immunodeficiecy virus type 1 infected individuals.
Journal of the International Neuropsychological Society. 1995; 1(3): 304-315.
25. Zeifert P„ Leary M., Boccellari A. Treatment ofcongnitive inpairment. Focus,
1996, VII, p. 1-7.
244
Глава 6. МИКОЗЫ ПРИ ВИЧ-ИНФЕКЦИИ
Микозы являются важнейшими из вторичных и оппортунистических
заболеваний при ВИЧ-инфекции. Важность их определяют высокая частота
и тяжесть вызываемых грибами поражений. Среди десятков различных
микозов, зарегистрированных у ВИЧ-инфицированных больных,
кандидозный эзофагит, криптококкоз, кокцидиодомикоз и гистоплазмоз
относят к СПИД-индикаторным, и определенные клинические формы этих
микозов считаются значимыми для определения стадии ВИЧ-инфекции. В
классификацию ВИЧ-инфекции, предложенную экспертами CDC в 1993 г.,
были внесены следующие формы микозов (6):
кандидоз орофарингеальный (молочница),
кандидозный вульвовагинит, персистирующий, часто
рецидивирующий или плохо поддающийся лечению,
кандидоз бронхов, трахеи и легких,
кандидоз пищевода,
распространенный или внелегочной кокцидиоидомикоз,
внелегочной криптококкоз,
распространенный и внелегочной гистоплазмоз.
Развитие этих микозов свидетельствует о прогрессировании ВИЧ-
инфекции и служит индикатором перехода бессимптомной стадии в
клинически выраженную.
Почти за 20 лет до описания первого случая СПИДа было указано, что
Candida albicans может маркировать самые ранние стадии иммунодефицита,
которые выявляются только с помощью современных лабораторных тестов
(4). В 1984 году, когда еще не были разработаны методы лабораторного
подтверждения ВИЧ-инфекции, Klein R.S. и соавторы указали, что оральный
кандидоз является важным признаком, предвещающим развитие СПИДа (30).
Криптококкоз был также известен еще в доСПИДовскую эру; впервые
заболевание описали Busse и Buschke в 1894 году. Криптококкоз встречается
повсеместно, и к нему восприимчивы не только люди, но и животные. У
практически здоровых болезнь, как правило, протекает малосимптомно или
латентно, заканчивается самоизлечением и потому выявляется редко. У
ослабленных больных криптококкоз протекает манифестно и требует лечения.
Поэтому клинически значимый криптококкоз рассматривается как
оппортунистическая инфекция.
Гистоплазмоз и кокцидиоидомикоз относится к эндемичным
заболеваниям. На территории Российской Федерации достоверных случаев
этих микозов не зарегистрировано. Термин гистоплазмоз используется для
обозначения двух различных заболеваний: американского гистоплазмоза
(возбудитель Histoplasma capsulatum var.capsulatum) и африканского
245
гистоплазмоза (возбудитель Histoplasma capsulatum var.duboisil). До эпидемии
СПИДа диссеминированный гистоплазмоз был редкой болезнью, наблюдался
у новорожденных и при тяжелом иммунодефиците. Сегодня в восточных и
центральных штатах США, в экваториальной Африке диссеминированный
гистоплазмоз признан частой клинической формой у больных ВИЧ-
инфекцией (28, 53). Американский гистоплазмоз, вызываемый Histoplasma
capsulatum, является одним из признаков СПИДа и одной из классических
грибных оппортунистических инфекций. В Африке же случаи африканского
гистоплазмоза, вызываемого Histoplasma duboisli, крайне редки. Возможно,
это связано с тем, что африканский гистоплазмоз обычно регистрируется в
сельских областях, где ВИЧ-инфекция встречается не так часто. У больных
гистоплазмозом при СПИДе отмечается резкое снижение СЭ4-клеток в
крови до 33/мм3. Почти во всех случаях гистоплазмоз приобретал
диссеминированные формы с вовлечением ретикулоэндотелиальной
системы. Спектр клинических проявлений болезни широк: очаговые и
обширные пневмонии, лимфаденопатия, анемия, лейкопения,
тромбоцитопения, панцитопения, недостаточность надпочечников,
хориоретинит, менингоэнцефалит, эндокардит, простатит, поражения
желудочно-кишечного тракта, слизистой ротовой полости, кожи, длительная
лихорадка. Диагностика основана на получении положительных результатов
микробиологического и гистологического исследований. В 80% диагноз
устанавливают по положительным посевам крови, биопсии костного мозга.
Возбудитель кокцидиоидомикоза Coccidioides immulttis. Гриб
встречается в регионах с жарким засушливым климатом. Эндемичные районы
расположены в Северной Мексике, Центральной и Южной Америке, на юго-
востоке США. К доминирующим проявлениям болезни относятся лихорадка,
озноб, ночные поты. Наиболее часто обнаруживаются пневмонии,
лимфаденопатия. Нередки менингоэнцефалит, гепатоспленомегалия,
поражения щитовидной железы и надпочечников, остеомиелит, артрит,
простатит, подкожные абсцессы. При гистологическом исследовании выявляют
сферулы, а в посевах патологического материала - культуру гриба-возбудителя.
Методы серологической ди-агностики недостаточно надежны (48).
В ранний период эпидемии ВИЧ-инфекции к маркерам СПИДа был
отнесен инвазивный аспергиллез, но позже, в связи с редкостью случаев
аспергиллеза, это заболевание исключили из классификации (12,47). В США
из 972 больных СПИДом, которые находились под наблюдением в течение
10 лет, Aspergillus spp. был выделен из материала от 45 больных (4,6%) при
жизни и у 4 - посмертно. Однако, только у 5 из них был инвазивный
аспергиллез. По данным других авторов, частота аспергиллеза при СПИДе
составила 11/162. Более того, по данным Denning D.W. и соавторов, 1991 г.,
из 1762 больных СПИДом у 1067 были выявлены легочные заболевания, в
246
том числе 6 микозов и ни одного случая аспергиллеза, в отличие от больных
лейкозами, у которых частота поражения аспергиллезом достигает 70%, а
после пересадки сердца- 14% (14). Поэтому неудивительно, что аспергиллез
был исключен из списка ВИЧ-ассоциированных заболеваний. В большинстве
случаев аспергиллез развивался у больных с низким уровнем CD4 клеток, но
были и редкие случаи развития аспергиллеза на ранних стадиях ВИЧ-
инфекции. Предрасполагающие факторы в развитии аспергиллеза включают
нейтропению, прием кортикостероидов, пневмопатии, курение марихуаны,
использование антибиотиков.
С 1988 года при СПИДе регистрируют случаи системного микоза,
вызванного Penicillium marneffei, у лиц, живущих или путешествующих в Юго-
Восточной Азии (18). Заболеваемость этим микозом из года в год нарастает.
По-видимому, в будущем пенициллиоз-marneffei будет включен в разряд
СПИД-ассоциированных поражений. К наиболее характерным клиническим
проявлениям болезни относятся: лихорадка, генерализованная
лимфаденопатия, снижение массы тела, поражение кожи по типу
контагиозного моллюска, образование язв на небе и гениталиях,
конъюнктивит, тонзиллит, поражение легких и ЖКТ. Диагноз устанавливают
обнаружением Penicillium marneffei в биосубстратах, чаще в костном мозге,
крови, коже. Информативны также гистологические исследования
лимфатических узлов, печени, кожи, костного мозга, позволяющие выявить
дрожжеподобные клетки (тканевая форма гриба). Без лечения исход
пенициллиоза-marnfrei при СПИДе фатален.
К настоящему времени более 50 видов грибов разных таксономических
групп и физиологических свойств были выделены от больных СПИДом.
Спектр включает часто встречающиеся кожные патогены, возбудителей
редких микозов и различные плесени - возбудители оппортунистических
инфекций. Некоторые условно-патогенные грибы, крайне редкие при прочих
ослабляющих организм состояниях, при СПИДе наблюдаются часто
(например, Penicillium marnfrei). В последнее время увеличилось число
сообщений об инфекциях, вызванных необычными возбудителями. Есть
микозы, которые встречаются при СПИДе очень редко - реже, чем у 1%
больных, даже если микоз ограничен особой географической зоной.
Возбудители этих микозов перечислены в таблице 36. Кроме того, в таблице
36 отражено количество случаев каждого заболевания, известных по данным
мировой литературы. Многие микозы встречались не чаще 1 раза, а самый
частый из них описан только у 43 ВИЧ-инфицированных больных. За период
с 1993 по 1995 год количество необычных микозов увеличилось (13, 24, 39,
46, 51, 54).
247
Таблица 36
Грибы - возбудители редких микозов при СПИДе
Название гриба Число зарегистрированных случаев
до 1993 года в 1995 году
Absidia corymbifera 3 3
A Item aria alternata Auerobasidium pullulans 2 1 __ 2 1
Bipolaris sp. 1 1
Blastomyces dermatitidis 5 22
Chrysosporium parvum var.parvum 0 1
Cryptococcus curvatus 0 1
Cryptococcus neoformans var. gatii 5 8
Cunninghamella berthollctiae 1 1
Curvularia sp. 1 1
Exophiala jeanselmei 1 1
Fusarium spp. 2 2
Gcotrichum candidum 2 2
Hanseniaspora guilliermondii 1 1
Histoplasma capsulatum var. duboisii 1 1
Mucor spp. 0 2
Paracoccidioides brasiliensis 5 13
Pcnicillium marneffei 7 43
Penicillium decumcns ; 1 1
Pseudoallesheria boydii 1 1
Rhinocladiella atro virens 1 1
Rhizopus sp. 4 4
Rhodotorula rubja (R. mucdaginosa) Saccharomyces cerevisiae Scedosporium apiospermum _1 2 1 5 "
0 3
Scedosporium prolificans (S.inflatum) 1 3
Schizophyllum commune 1 1
Sporobolomyces salmonicolor 1 1
Sporothrix schenckii 8 9
Torulopsis (Candida) glabrata 1 2
' Trichosporon spp. 1 3
248
6.1. Кандидоз при ВИЧ-инфекции.
Кандидоз является наиболее частой вторичной инфекцией. Почти все
пациенты колонизированы Candida, при этом почти у половины
миконосителей выявляются мицелиальные формы гриба без каких-либо
клинических проявлений. Чрезвычайно редки случаи, когда больные
проходят через все стадии ВИЧ-инфекции до смерти без единого эпизода
орального кандидоза (9, 26, 41). Болес 90% больных СПИДом имеют, по
крайней мере, один эпизод орофарингеального кандидоза (36).
Орофарингеальный и вагинальный кандидоз могут развиваться у
бессимптомных носителей ВИЧ, однако чаще эти заболевания появляются
при снижении количества CD4 в крови. Риск развития кандидоза нарастает
с прогрессированием иммунодефицита. На II стадии ВИЧ-инфекции
орофарингеальный кандидоз был у 8% больных, на III стадии - у 6,5%, на
стадии IV - у 81%. Частота орального кандидоза при 200/мкл< CD4 <
500/мкл составляет 33%, при CD4 < 100/мкл - 44% (17).
В таблице 37 представлена частота микозов в зависимости от уровня
СП4-клеток в крови на основании наших наблюдений.
Таблица 37
Частота микозов у больных ВИЧ-инфекцией
при разных уровнях СВ4-клеток в крови
Микозы Количество СП4-клеток в кро CD4 500/мкл>С04>200/мкл >500/мкл 1 ВИ CD4 <200/мкл
количество больных (%)
кандидоз Слизистой ротовой полости и глотки 26,7 62,1 94,7
кандидоз пищевода кандидоз кожи кандидозный вульвовагинит 5,6 4,4 2,8 45,0 8,6 21,1 26,3 Г 2,6
кандидоз гортани, трахеи,легких, кишечника, менингит, Диссеминирован- ный кандидоз 2,2 6,9 26,3
Большинство больных локальных жалоб, обусловленных
орофарингеальным кандидозом, не предъявляло. Только 4 человека
249
отмечали боль в горле 3 - першение в горле, 1 - затрудненное глотание, 2 -
жжение во рту, 2 - сухость во рту. Поражение локализовалось: на щеках (16),
на твердом небе (19), на мягком небе (17), на языке (64), на глотке (16), в
углах рта (14). У 72/78 (92,3%) признаки кандидоза слизистых оболочек рта
и глотки обнаруживались в нескольких местах одновременно.
Орофарингеальный кандидоз проявлялся гиперемированной слизистой (49),
налетами на слизистых (22), точечными кровоизлияниями (4), эрозиями (9),
энантемами (8), инъецированностью слизистых (7), обложенностью языка
(59), сглаженностью сосочков языка (4), географическим языком (2),
отечностью языка (3), заедами в углах рта (14), лейкоплакией (1). Кандидоз
ротовой полости был подтвержден обнаружением гиф, псевдогиф, дрожжевой
флоры в посеве. По клиническим формам кандидоза больные распределились
следующим образом: эритематозная - 31, псевдомембранозная - 21,
ангулярный хейлит - 14, гиперпластическая -эрозивная - 9, атрофический
оральный кандидоз - 8, кандидозный глоссит - 64. При определении
клинической формы учитывалось одно из проявлений орофарингеального
кандидоза, хотя на самом деле почти всегда выявлялось одновременно
несколько признаков. Кроме того, макроскопическая картина слизистых
отличалась лабильностью. К примеру, на фоне гиперемированной слизистой
или энантем появлялись белые налеты и, наоборот, после очищения слизистой
от налетов обнажалась отечная гиперемированная слизистая. Поэтому деление
орофарингеального кандидоза на клинические формы представляется весьма
условным.
Гиперемированная, сочная, рыхлая слизистая оболочка полости рта и
глотки встречались с наибольшей частотой и, по-видимому, эритематозная
форма являлась начальным проявлением орофарингеального кандидоза,
потому что у 11 больных в процессе наблюдения это было первое проявление
кандидоза. При псевдомембранозном варианте кандидоза обнаруживались
творожистые и пятнистые налеты различной распространенности - от едва
заметных очагов до почти тотальных. Налеты были белого, реже кремового
цвета. Порой характер налетов изменялся; временами представляя собой
белые пластинчатые наложения, а иногда становясь крошковидными,
творожистыми. Массивные налеты сопровождались выраженной гиперемией
и отеком слизистой.
В ряде случаев выявлялись эрозивные поверхности, окаймленные
белым ободком, из них в трех случаях удалось проследить, что появлению
эрозий предшествовали энантемы, что позволило ретроспективно оценить
энантему как начальное проявление кандидоза. Редким типом был кандидоз,
напоминающий по виду лейкоплакию. Такая форма была зарегистрирована у
1 больного. У этого больного развитию кандидозной лейкоплакии
предшествовало длительное канди до носительство в полости рта (не менее 2
250
лет), азатем кандидозный глосситв виде густых белых налетов на дорзальной
поверхности отечного языка. Впервые кандидозная лейкоплакия развилась
после длительного алкогольного эксцесса. На нижней поверхности языка
появились два (по одному с каждой стороны) белых налета-пятна овальной
формы, неровных, ландкартообразных очертаний, плотных, блестящих, с
перламутровым оттенком, плотно спаянных с подлежащими тканями. Слева,
на фоне описанных изменений, определялось солитарное пупковидное
вдавление. В соскобах из зон поражения был выделен мицелий гриба,
получена культура Candida albicans и обнаружены цитологические признаки
бактериально-микотического глоссита. После неэффективного лечения
нистатином и леворином был назначен итраконазол в дозе 100 мг в сутки. С
4-5 дня началось рассасывание лейкоплакии подобно таянию льдинки. К 20
дню было достигнуто полное рассасывание очага поражения.
Кандидозный глоссит начинался с налета на спинке языка, со временем
развивалась отечность языка с пропечатыванием контура зубов по его боковым
поверхностям, зональной или тотальной атрофией языка с образованием либо
полян “облысения”, либо лакированного, “резинового” языка. При этом язык
приобретал ярко-красный или малиновый с синюшным оттенком цвет, был
блестящим, полированным. У трех больных сформировались глубокие
борозды и язык приобрел вид “географического”.
Одной из частых форм, сопутствующих кандидозу слизистых ротовой
полости, был ангулярный хейлит, характеризовавшийся гиперемией,
мацерацией и образованием эрозий или трещин в одном или обоих углах рта.
Микотической заеде всегда сопутствовал оральный кандидоз.
В период активации кандидоза из слизи ротовой полости выделяли
различные виды кандида: Candida albicans (78), Candida krusei (9), Candida
tropicalis (5), Candida kefyr(2), Candida parapsilosis (1). У 54% больных имела
место кандидо-бактериальная ассоциация (Staphylococcus aureus,
Streptococcus hemolyticus).
Иммунодиагностика кандидоза слизистых ротовой полости и глотки у
ВИЧ-инфицированных больных была изучена в 54 случаях. Средняя величина
титра антител к Candida albicans в РИГА составила 8,7 (колебания от 2 до 11),
в РТНГА - 8,7 (колебания от 4 до 11), в ИФА- 1:309 (колебания от <1:100 до
1:1600).
Важной особенностью течения кандидоза ротовой полости и глотки
было рецидивирование заболевания. После прекращения антимикотического
лечения симптомы кандидоза возобновлялись через полгода и даже через
несколько дней после прекращения лечения, когда кандидоз приобретал
характер постоянно рецидивирующего заболевания и требовал постоянного
применения противогрибковых препаратов.
Терапия орофарингеального кандидоза проводилась 65 больным. Для
251
этого применялись нистатин, леворин, кетоконазол, флюконазол, итраконазол.
При этом нужно отметить, что в 30 случаях антимикотические препараты
назначались по поводу системного микоза. В подавляющем большинстве
случаев лечение было эффективным. У 8 человек лечения нистатином и
леворином было недостаточно, поэтому им были назначены кетоконазол,
флюконазол и итраконазол. У 3 человек потребовалась замена кетоконазола
на флюконазол (2) и итраконазол (1). У 2 лечение итраконазолом было
прервано из-за развившейся токсикодермии (1) и из-за неэффективности (1).
Замена итраконазола на флюконазол усилила проявления токсикодермии, а
во втором случае лечение кандидоза было завершено кетоконазолом.
Эффективность лечения нистатином и леворином составила 20/28,
кетоконазолом 24/27, флюконазолом - 15/15, итраконазолом - 6/8.
Таким образом орофарингеальный кандидоз имел разнообразные и
динамичные визуальные проявления, легко диагностировался, как правило,
не вызывал ухудшения состояния больных, не создавал проблем в подборе
антимикотического лечения.
Диагностика и лечение кандидоза пищевода при ВИЧ-инфекции.
Кандидоз пищевода был выявлен у 18 больных. Эту группу составили
6 женщин и 12 мужчин. Возраст больных колебался от 6 до 58 лет и в среднем
равнялся 34,8 годам. У 5 больных способ и сроки инфицирования не были
установлены. 5 заразились ВИЧ в гетеросексуальных контактах, 6 - в
гомосексуальных. Двое больных были инфицированы парентеральным путем
в период лечения в медицинских учреждениях. Сроки от предполагаемого
момента инфицирования до выявления кандидоза пищевода составили от 3
до 13 лет, в среднем - 6,8 лет. В I случае кандидоз пищевода развился в острой
стадии ВИЧ-инфекции.
У 7 из 18 больных этой группы стадия СПИДа была определена до
выявления кандидоза пищевода в связи с наличием кандидоза трахеи и легких
(1), криптококкоза (3), туберкулеза (3), ВИЧ-энцефалопатии (3), затяжной
язвенно-некротической герпетической инфекции (1), генерализованной
саркомы Капоши (I), цитомегаловирусного ретинита (1). У 11/18 кандидоз
пищевода был первым ВИЧ-ассоциированным заболеванием.
Кандидоз пищевода развивался на фоне различных патологических
состояний: герпетической инфекции (8), персистирующей лимфаденопатии
(6), кандидоза кожи (6), цитомегаловирусной инфекции (4), гепатомегалии
(4), миокардиодистрофии (4), анемии (4), лейкопении (3), ВИЧ-энцефалопатии
(4), бронхо-легочного воспаления (4), туберкулеза легких (2), кандидоза трахеи
(2), кандидоза легких (2), криптококкоза (25).
Минимальное количество лимфоцитов в период выявления кандидоза
252
пищевода равнялось 115*109, а максимальное - 3268*10’. Средняя величина
общего количества лимфоцитов составила 1094*109. Для СО4-лимфоцитов
минимальный, максимальный и средний показатели равнялись 48/мм5, 840/
мм3, 397,7/мм3. Для коэффициента CD4/CD8 аналогичные показатели
составили 0,53, 0,94 и 0,73. По стадиям ВИЧ-инфекции больные
распределились следующим образом: С1 - 5 человек, С2 - 9, СЗ - 4. Доля
больных кандидозом пищевода на стадиях ВИЧ-инфекции составила; С1 -
62,5%, С2 - 45%, СЗ - 22,2%. На иммунологических подстадиях 1,2,3 - 5,6%,
45%, 21,1% соответственно.
Оральный кандидоз был выявлен у всех больных этой группы, причем
у 10/18 поражение ротовой полости было диагностировано за 1 год (у 5
человек), за 2 года (у 1 человека), за 3 года (у 2 человек), за 6 лет (у 1 человека)
до развития эзофагита. В большинстве случаев субъективных патологических
ощущений в ротовой полости не было, только один больной жаловался на
боли, у двоих была сухость во рту и у одного “жжение” во рту. У 10 из 18
выявлялись характерные для молочницы белые налеты на фоне яркой,
гиперемированной, сочной слизистой (у 10), эрозий (у 4) и точечных
кровоизлияний (у 1). Клинические признаки глоссита были выявлены у 2.
однако белые налеты на спинке языка различной степени выраженности были
обнаружены у всех. Реже определялась сглаженность сосочков языка (у 2).
Возбудителем орального кандидоза у 15/18 была Candida albicans, у 1
сочетание Candida albicans и Candida tropicalis, у 2 - сочетание Candida albicans
и Candida krusei.
4 больных кандидозом пищевода специфических жалоб не предъявляли,
и поражение пищевода было выявлено у них по результатам эндоскопического
исследования. У остальных 14 больных имелись субъективные ощущения,
связанные с эзофагитом: боли за грудиной (7/14), затрудненное прохождение
пищи по пищеводу (5/14), неприятные ощущения за грудиной (1/14), чувство
жжения (2/14). У трех больных, кроме того, была тошнота, и отсутствие
аппетита у 1 (таблица 38).
Фиброэзофагогастродуоденоскопия была выполнена 11 больным. У 7
был выявлен катаральный эзофагит, у 2 - катарально-эрозивный эзофагит и
еще у 2 - катарально-язвенный эзофагит. На слизистой обнаруживались белые
налеты различной степени выраженности - от точечных наложений до
массивных. Протяженность эзофагита также варьировала: от поражения
третьей части длины пищевода до тотального. Патологические изменения
обнаруживались в верхней трети (5 человек), в средне-нижней (2 человека),
по всей дпине (4 человека). Протяженность поражения не коррелировала с
тяжестью изменений, обнаруживаемых при эндоскопическом исследовании.
253
Таблица 38
Клинические и лабораторные показатели при кандидозе
пищевода у ВИЧ-инфицированных больных
Показатель Относительное количество больных
Жалоб нет 4/18
Боли за грудиной 7/18
Затрудненное прохождение пищи 5/18
Неприятные ощущения за грудиной 1/18
«Жжение» за грудиной 2/18
Тошнота 3/18
Оральный кандидоз в анамнезе 10/18
Титр антител к Candida albicans в сыворотке крови (РИГА): выше диагностического ниже диагностического 10/12 2/12
Титр антител к Candida albicans в сыворотке крови (ИФА): выше диагностического ниже диагностического 3/12 9/12
Титр антител к Candida albicans в сыворотке крови (РТНГА): выше диагностического ниже диагностического ... 1 7/10 3/10
Титр антигена к Candida albicans в сыворотке крови (РИГА): выше диагностического ниже диагностического 5/10 5/10 ।
В биосубстратах был получен рост Candida albicans. Сравнение
макроскопической картины кандидоза ротовой полости и кандидоза
пищевода показало следующее. При наличии гиперемии и белых налетов
на слизистой пищевода выявили стоматит с наложениями молочницы у
всех больных. А при катаральном эзофагите из 5 только 1 имел
псевдомембранный кандидоз ротовой полости.
254
Рентгеноконтрастное исследование пищевода отклонений от нормы не
выявило. Результаты иммунодиагностики кандидоза: титры выше
диагностических зарегистрированы у 10 из 12 в РИГА, у 3 из 12 - в ИФА и у
7 из Ю - в РТГА (таблица 38). При этом средние величины титров равнялись
0'1, 1:460, 6 для каждой из реакций. Титры антигена Candida albicans,
превышающие норму, были выявлены у половины больных, средняя величина
была равна 6. Таким образом, в РИГА было наименьшее число
ложноотрицательных результатов, в ИФА - наибольшее; трое из четырех имели
ложно-отрицательные результаты, РТГА заняла промежуточное положение.
Чувствительность метода диагностики кандидоза пищевода по титру антител
к Candida albicans в РИГА составила 83,8%, по титру антител к Candida albicans
в ИФА - 25%, по титру антител к Candida albicans в РТГА - 70%. Кроме того,
в РИГА и в РТГА средние величины существенно превышали верхний предел
нормы, в отличие от ИФА, где средняя величина соответствовала норме. Титры
днтигена Candida albicans у больных кандидозом пищевода превышали норму
в половине случаев. Средняя величина титра составила 4.
Для лечения кандидоза пищевода применялись нистатин (6),
кетоконазол (11), флюконазол (7), итраконазол (5). Нистатин назначался по
500 000 - 1 000 000 ЕД три раза в день, кетоконазол по 200-400 мг в день,
флюконазол по 100-400 мг вдень и итраконазол 100-400 мг в день. 10 человек
цз 13 получали антимикотическое лечение до развития кандидоза пищевода,
ц это лечение назначалось по поводу кандидоза слизистых ротовой полости.
6 человек получали нистатин. Всем больным, получавшим нистатин,
пришлось заменить лечение на другой препарат, так как эффект нистатина в
период развития кандидоза пищевода был неполным (у 1 больного) или
отсутствовал (у 5 больных) (таблица 39). Кетоконазолом лечили 11 больных;
Эффективность препарата была хорошей у 5/11. У 1/11 развивался рецидив
кандидоза сразу после отмены лечения, у 5/11 - лечение кетоконазолом было
заменено на лечение флюконазолом в связи с недостаточной эффективностью.
А у 2 из них в последующем была произведена вынужденная замена на
Итраконазол по той же причине. Итраконазол привел к излечению кандидоза
У этих больных. Коэффициент эффективности кетоконазола, отражающий
Долю случаев эффективного применения этого препарата, равен 54,6%. Двоим
больным был проведен основной курс лечения флюконазолом и в
Последующем была проведена вторичная профилактика этим же препаратом.
В последующем одному из них была произведена замена на
Итраконазол по желанию больного без клинических показаний. Еще у 3
больных флюконазол был эффективным средством лечения после
неудачного лечения кетоконазолом, а двоим потребовалась еще и замена
на итраконазол. Коэффициент эффективности флюконазола составил
255
71,4%. Итраконазол был эффективным у 4/5. Только в 1 случае после
неэффективного лечения итраконазолом было достигнуто выздоровление
от кандидоза пищевода в процессе лечения кетоконазолом. Коэффициент
эффективности лечения итраконазолом равен 80%.
Таблица 39
Эффективность антимикотических препаратов для лечения
кандидоза пищевода у ВИЧ-инфицированных больных
Препарат Результаты лечения Коэффициент эффективности (%)
Эффективен Неэффективен
Нистатин (п-6) - 6 0
Кстоконазол(п~11) 6 5 54,6
Флюконазол (п=8) 5 3 62.5
Итраконазол (п=5) 4 1 80,0
Для сравнительной оценки антимикотических препаратов, кроме
коэффициента эффективности, дополнительно были проанализированы
результаты лечения после замены неэффективного препарата (таблица
40). В 3 случаях флюконазол был назначен после отмены кетоконазола,
против 1 случая, когда кетоконазол был эффективнее флюконазола. В 2
случаях итраконазол переломил ситуацию, когда флюконазол был
неэффективным. Только у 1 больного из всех антимикотических
препаратов наиболее эффективным оказался кстоконазол.
Таблица 40
Вынужденная замена антимикотического препарата в связи с его
неэффективностью в лечении кандидоза пищевода
Неэффсктив ный препарат Препарат, на который была произведена замена
кетоконазол флюконазол итраконазол
эффективность
4- + - 4- -
Нистатин п=6 1 - 5 - - -
Кетоконазол /////////////////,'/////////// 3 2 -
Флюконазол - - ШИШ ШШШШШШШШШ 2 1
Итраконазол 1 - - - /ZW/////////////////
256
Таким образом, клиническое течение кандидоза пищевода имело ряд
особенностей: сроки от момента инфицирования до развития кандидоза
пищевода колебались от 3 до 13 лет (в среднем 6,8 лет); развитию кандидоза
пищевода предшествовал и сопутствовал кандидоз слизистой ротовой
полости, у половины больных кандидоз пищевода был первым СПИД-
ассоциированным заболеванием; появлению кандидоза пищевода
предшествовали и сопутствовали различные вирусные, бактериальные и
микотические осложнения, в период выявления кандидоза пищевода средний
уровень С 04-клеток составил 397,7/мм3, а коэффициент CD4/CD8 - 0,70; чаще
других клинических признаков выявлялись боли за грудиной, затрудненное
прохождение пищи; методы серологической диагностики, основанные на
выявлении антигена Candida albicans и антител к Candida albicans имеют
вспомогательное значение: основной метод подтверждающей диагностики
кандидоза пищевода-эзофагоскопия с микробиологическим исследованием,
рентгеноконтрастирование пищевода было неинформативным.
Обобщая результаты лечения кандидоза пищевода, следует отметить
несколько аспектов:
для лечения кандидоза пищевода высокоэффективны препараты
системного действия, в отличие от препаратов, не абсорбирующихся из
желудочно-кишечного тракта;
из препаратов системного действия наиболее эффективны
флюконазол и итраконазол.
Диагностика и лечение кандидоза гортани и трахеи при ВИЧ-инфекции
Были выявлены 1 случай кандидоза гортани и 1 случай кандидоза
трахеи. Оба диагноза были установлены по наличию белых налетов на
слизистых оболочках гортани и трахеи, выделению из зон поражения Candida
alblicans.
Средний возраст больных 23,5 лет. Сроки ВИЧ-инфицирования
остались неизвестными; в 1 случае не был установлен и путь заражения, во
втором случае - заражение произошло в гетеросексуальных контактах.
Кандидозу гортани и трахеи предшествовали орофарингеальный кандидоз и
кандидоз пищевода, опережая в среднем на 1,5 года, а сроки развития
кандидоза кожи были сопоставимы со сроками развития кандидоза трахеи.
Кроме кандидоза, у 1 больной был онихомикоз кистей. Из немикотических
проявлений ВИЧ-инфекции были выявлены: персистирующая
генерализованная лимфаденопатия (1), ВИЧ-энцефалопатия (1), хронический
Диарейный синдром смешанной этиологии (1), ВИЧ-кахексия (1).
Кандидоз гортани и трахеи характеризовались подострым развитием:
Умеренным кашлем со слизистой мокротой (1), осиплостью голоса (1). При
эндоскопическом исследовании были определены визуальные признаки
17- Заказ№К-4451. 25 7
кандидозного поражения - отечная гиперемированная слизистая с точечными,
легко снимающимися, беловатыми наложениями. В этот период в анализах
крови: гемоглобин 85 и 108 г/л, эритроциты 2,9 и 3,6x10'2/л, тромбоциты 47
и 167x10’, лейкоциты 2,8 и 3,6х10’л, палочкоядерные нейтрофилы 4 и 11%,
сегментоядерные нейтрофилы 59 и 40%, эозинофилы 2 и 0%, лимфоциты 31
и 49%, моноциты 4 и 11%, СОЭ 16 и 15 мм/час. Иммунограмма: общее
количество Т-лимфоцитов 251 и 1111 /мм3, СО4-лимфоциты 92 и 529/мм3, CD4/
CD8 0,58 и 0,91.
Титры антител к Candida albicans в РИГА - 14 и 2; в ИФА - 1:400 и <
1:100; в РТГА 7 и < 4. Таким образом, только у 1 больной титр антител к Candida
albicans превышал верхний предел нормы в двух реакциях - РИГА и РТГА.
Уровень антигена Candida albicans был в пределах нормы в обоих случаях.
Для лечения кандидоза трахеи и гортани применяли флюконазол (2),
итраконазол (2), кетоконазол (1). Флюконазол назначался в дозе от 50 до 200
мг, итраконазол - по 100-200 мг, кетоконазол - 200 мг. Лечение кандидоза
трахеи было проведено флюконазолом, и после завершения основного курса
проводилась вторичная профилактика в связи с быстрым развитием рецидива
орофарингеального кандидоза. Препарат переносился хорошо, без побочных
реакций. Первый основной курс лечения кандидоза гортани был проведен
итраконазолом. Препарат был эффективен и не давал побочных реакций. В
последующем лечение рецидивов проводилось кетоконазолом и
флюконазолом и, в связи с недостаточной эффективностью последних, было
заменено на итраконазол.
Диагностика и лечение кандидоза легких при ВИЧ-инфекции.
Кандидоз легких был выявлен у 4 больных, при этом при жизни диагноз
был установлен у 3, а у I - после смерти.
Эту группу составили 1 ребенок и 3 мужчин. Все мужчины -
гомосексуалисты; срок ВИЧ-инфицирования был установлен в 1 случае и
составил 7 лет. Ребенок был заражен в медицинском учреждении за 6 лет до
развития кандидоза легких.
У всех 4 больных кандидозное поражение легких развилось на фоне
раннее установленного СПИДа. Из заболеваний, включенных в клиническую
классификацию ВИЧ-инфекции, у них имели место: ВИЧ-энцефалопатия (1).
оральный кандидоз (4), кандидоз кожи (1), кандидоз пищевода (2), микоз стоп
и онихомикоз (2), трихофития (1), криптококкоз (1), пневмоцистоз (1).
рецидивирующая герпетическая инфекция (1), туберкулез легких (2).
В анализах крови: анемия (2), лейкопения (3), тромбоцитопения (3).
Иммунологические показатели соответствовали 2 (у 2) и 3 (у 2) подстадиям
ВИЧ-инфекции.
258
Во всех случаях кандидоз легких был не единственной легочной
патологией, а представлял собой заболевание, присоединившееся к активному
туберкулезу легких (2), криптококкозу легких (1), лимфоидной
интерстициальной пневмонии (1), пневмоцистозу (1), и, кроме того, кандидоз
развивался на фоне посттуберкулезного пневмосклероза (1). Состояние всех
больных оценивалось как крайне тяжелое. В клинической картине
доминировали признаки интоксикации, истощения. Повышение температуры
до фебрильной. Кашель умеренный, со слизистой или слизисто-гнойной
мокротой. Над зоной поражения выслушивались сухие и влажные хрипы. У
двух больных в мокроте и в промывных водах бронхов был обнаружен
мицелий гриба, а в посевах рост Candida albicans. У 1 больного диагноз не
был установлен в связи с коротким сроком наблюдения, тяжестью состояния
и быстро наступившей смертью от прогрессирующего гематогенно-
диссеминированного туберкулеза, сочетавшегося с криптококкозом и
пневмоцистозом легких. Рентгенологическая картина отличалась
разнообразием - от диффузного мелкоочагового поражения до отграниченного
инфильтрата. Разграничить, какие из рентгенологических проявлений были
обусловлены кандидозом, а какие другими пневмопатиями, не представлялось
возможным, даже при ретроспективом анализе. В двух случаях диагноз
кандидоза легких был подтвержден эффективным лечением
антимикотическими препаратами. Для лечения применялись флюконазол (1),
кетоконазол (1), итраконазол (2). В двух других случаях - по результатам
посмертного исследования, но ни в одном из них кандидоз не был причиной
смерти. Возбудителем во всех случаях была Candida albicans. Гриб выделили
из слизи ротовой полости (3/3), мочи (2/3), кала (3/3), мокроты (2/3), печени,
легких, мышц (1/3). Титры специфических антител были выше
диагностически значимых в обеих реакциях - РИГА и ИФА. Диагноз
диссеминированного кандидоза был установлен по совокупности
клинических, лабораторных тестов, а также по результатам пробной
антимикотической терапии. Лечение системными антифунгальными
препаратами было эффективным в 2 случаях (амфотерицин Б - 1,
интраконазол - 2, кетоконазол - 1). Одна больная умерла на фоне лечения
флюконазолом, и причиной смерти был признан кандидосепсис.
6.2. Диагностика и лечение криптококкоза при ВИЧ-инфекции
Второй по значимости микотической инфекцией признан криптококкоз.
Криптококковая инфекция при СПИДе выявляется с неодинаковой частотой
в различных регионах мира: в Европе - 2-4%, в Америке - 30% (2, 8, 10, 15,
20, 23, 25, 31, 49, 50, 55). По материалам Республиканской клинической
инфекционной больницы (поселок Усть-Ижора) и Городской инфекционной
больницы № 30 (г. Санкт-Петербург) частота криптококкоза составила 17%
17*
259
среди больных СПИДом. Уровень CD4 клеток в крови больных в период
выявления криптококкоза колебался от 48/мм3 до 354/мм3, составляя в среднем
201/мм3. Поданным литературы риск развития криптококкоза особенно велик
при снижении количества CD4 клеток до 100/мм3.
Возбудителем криптококкоза является дрожжеподобный
капсулообразующий гриб. Подавляющее большинство случаев криптококкоза
у людей вызвано Cryptococcus neoformans, исключительно редко Cryptococcus
albidus, Cryptococcus laurentii, Cryptococcus curvatus. Все случаи криптококкоза
у ВИЧ-инфицированных больных, находившихся под нашим наблюдением,
были обусловлены С. neoformans. Грибы С. neoformans подразделяются на
два варианта: Cryptococcus neoformans var. neoformans и Cryptococcus
neoformans var. gratii. Cryptococcus neoformans var. neoformans встречается в
Европе и США, Cryptococcus neoformans var. gratii - в Восточной Азии,
Африке, Австралии. У ВИЧ-положительных больных криптококкоз вызван
преимущественно Cryptococcus neoformans var. neoformans.
Основными входными воротами инфекции являются легкие, куда споры
гриба из почвы попадают с вдыхаемым воздухом. В легких, в месте внедрения
гриба, развивается первичный аффект. Легкие рассматриваются как самое
поражаемое место при криптококкозе. Легочный криптококкоз протекает
скрыто или по типу неспецифической пневмонии, поэтому эта форма
клиницистами выявляется редко. Нам первичный легочный криптококкоз
удалось диагностировать у 11% больных ВИЧ-инфекцией. Наиболее
выявляемой клинической формой криптококкоза является менингит/
энцефалит. Примечательно, что к моменту развития криптококкоза
центральной нервной системы легочные очаги рассасываются.
Нами характеризуется криптококкоз у 11 больных, у которых выделена
культура криптококков, и у 7 человек, у которых дополнительно был обнаружен
антиген Cryptococcus neoformans в сыворотке крови. Эту группу больных
составили 7 мужчин и 4 женщины. Средний возраст-41 год, колебания возраста
от 21 до 54 лет. Факторы риска включали: гомосексуализм (4 человека),
гетеросексуальные связи с ВИЧ-инфицированными лицами (6 человек),
парентеральные инъекции (1 человек). Длительность наблюдения за больными
до 2 лет. У 6 добились успешного лечения, у 1 лечение было неэффективным и
3 лечение не проводилось. 5 из 11 умерли. Результаты патологоанатомического
исследования подтвердили излечение или наличие криптококкоза. При этом в
2 случаях криптококкоз был назван непосредственной причиной смерти, у
которых он не был диагностирован при жизни или неадекватно лечился.
Причиной нераспознанного криптококкоза были короткие сроки наблюдения
и тяжесть состояния; ВИЧ-инфицирование у этого пациента было обнаружено
за несколько дней до смерти.
260
У 3-х больных были известны сроки заражения ВИЧ. У них
криптококкоз развился через 12-15 лет после инфицирования. Криптококкозу
предшествовали и сопутствовали рецидивирующая герпетическая инфекция
(4 человека), рецидивирующий оральный кандидоз (8 человек), кандидоз
пищевода (2 человека), рубромикоз стоп с онихомикозом (3 человека),
рубромикоз кистей с онихомикозом (1 человек), нейродермит (3 человека),
кандидоз трахеи (1 человек), кандидоз кожи (3 человека), кандидоз легких (1
человек), туберкулез (1 человек).
У 6 человек криптококкоз был первой диагностированной
оппортунистической инфекцией, связанной со СПИДом. До диагностики
криптококкоза у всех больных стадия ВИЧ-инфекции оценивалась как ЗА -
ЗБ. У двух больных СПИД-связанное состояние было определено при
выявлении криптококкурии из-за наличия кандидоза пищевода.
Общее количество больных криптококкозом центральной нервной
системы составило 8 человек. У всех криптококкоз протекал в виде менингита
или менингоэнцефалита. У 5 из них диагноз был подтвержден выделением
гриба из спинно-мозговой жидкости, а в 1 случае - на основании признаков
менингита, развившегося на фоне фунгемии, и наличия антигена Cryptococcos
neoformans в ликворе. Двое больных имели рецидив после первого эпизода
менингита. С учетом 2 эпизодов рецидивирования всего было изучено 8
острых случаев крииптоккоза. Менингит или менингоэнцефалит были
первыми признаками криптоккоза у 4/8 (50%). При этом только у 2 из них
отсутствовал экстраневральный криптококкоз. Все остальные имели кроме
криптоменингита или криптоменингоэнцефалита еще, по крайней мере, одну
зону экстраневрального поражения: фунгемию (2), пневмонию (1),
диссеминацию (3). 2/8 больных не имели признаков поражения центральной
нервной системы; у одного была только легочная инфекция и диагноз был
установлен на аутопсии, у другого - был диссеминированный криптококкоз,
подтвержденный фунгемией и метастазированием в кожу. В таблице 41
представлены клинические проявления и лабораторные показатели при
криптококкозе центральной нервной системы у 8 больных ВИЧ-инфекцией.
Анализ клинических проявлений криптококкоза центральной нервной
системы показал, прежде всего, что такие важные диагностические симптомы
менингита, как головная боль, гипертермия, признаки раздражения мозговых
оболочек, встречались с частотой около 50%. Многие из больных имели
неспецифические симптомы, такие, как слабость, лихорадка или снижение
массы тела до выявления криптококкоза, и причина этих симптомов осталась
не вполне понятной.
261
Таблица 41
Клинические проявления криптококкового
менингита/менингоэнцефалита при ВИЧ-инфекции (8 больных)
Клинические признаки Частота
Головная боль 6/8
Гипертермия 5/8
Тошнота 4/8
Рвота 3/8
Головокружение 2/8
Светобоязнь 3/8
Чувство заложенности в ушах 2/8
Общая слабость 8/8
Снижение аппетита 3/8
Снижение массы тела 6/8
Дисфагия 1/8
Дизартрия, диплопия 1/8
Ухудшение памяти 3/8
Состояние тяжелое средней тяжести удовлетворительное 6/8 2/8 1/8
Менингеальные симптомы: отрицательные сомнительные положительные 5/8 2/8 1/8
Болезненная перкуссия черепа 2/8
Болезненность при надавливании глазных яблок 2/8
Истощение 3/8
Эйфория 2/8
Вялость, заторможенность 4/8
Психические нарушения 6/8
Папулезная и пустулезная сыпь с экскори- ациями 4/8
262
Головная боль была жалобой у 4/6, имела различную интенсивность,
чаще локализовалась в лобно-теменной области. Порой головная боль
нарастала волнообразно в течение нескольких месяцев. Лица, прежде
страдавшие головными болями (гипертоническая болезнь, остеохондроз,
синуситы), не могли отличить их характер от новых менингеальных. В
сочетании с волнообразностью головной боли это создавало значительные
диагностические трудности, поскольку исчезновение боли могло
хронологически совпадать, например, с излечением сопутствующего
гайморита. Гипертермия отмечена у 4/6. Величина температуры колебалась
от субфебрильной до фебрильной. Максимальная температура - 39°. На фоне
множественности инфекционных осложнений у ВИЧ-инфицированных
больных утверждать или отрицать связь высокой температуры с микозом
бывало непросто.
Приведем одно из наших наблюдений. Больной С., 42 лет, был
инфицирован ВИЧ 15 лет назад. Наряду с иммунодефицитным состоянием
имели место персистирующая генерализованная лимфаденопатия, себорея
волосистой части головы, стрептодермия, кандидоз слизистой ротовой
полости и рецидивирующий простой герпес. В течение многих лет до ВИЧ-
инфицирования больной страдал остеохондрозом и хроническим гайморитом,
которые сопровождались головными болями. За последние четыре месяца
дважды перенес лихорадочные состояния с высокой (до 39°) и длительной
(до 3 недель) температурой. Лечился антибактериальными препаратами по
поводу предполагаемой пневмонии с эффектом.
Поступил в плановом порядке. При поступлении отмечал ухудшение
состояния в течение 2 недель. Беспокоили сильная головная боль в лобной
части, озноб, боли в левом ухе, обильная зудящая папулезная сыпь,
неприятные ощущения во рту. Ухудшение состояния связывал с пребыванием
на сквозняке и не сомневался в том, что головная боль вызвана обострением
гайморита, так как подобное с ним случалось.
В процессе обследования были выявлены кандидоз ротовой полости,
обострение хронического гайморита, сегментарная пневмония. Признаки
раздражения мозговых оболочек отсутствовали. Па компьютерных
томограммах головы были обнаружены признаки энцефалопатии и
гидроцефалии. В посевах крови роста грибов не было. Антиген Cryptococcus
neoformans и антитела к Cryptococcus neoformans в сыворотке крови
обнаружены не были. От спинно-мозговой пункции больной отказался. На
фоне антибактериального лечения головная боль исчезла, а температура
нормализовалась. Контрольные лабораторные и рентгенологические
исследования подтвердили улучшение. Больной был выписан. Через неделю
он поступил в стационар повторно в тяжелом состоянии. Беспокоили
нелокализованная интенсивная головная боль, которая плохо купировалась
263
анальгетиками, светобоязнь, боль при движении глазных яблок, слабость,
двоение в глазах, дисфагия, дизартрия. Симптом Кернига был положи-
тельным, ригидность затылочных мышц выражена умеренно. Из спинно-
мозговой жидкости и из крови был получен рост Cryptococcus neoformans.
Данное наблюдение демонстрирует трудности ранней диагностики
криптококкового менингита при ВИЧ-инфекции. Криптококкоз был диаг-
ностирован поздно. Причинами нераспознанного в первую госпитализа-
цию криптококкоза были, во-первых, характер головной боли, который не
отличался от известных больному при обострении гайморита, во-вторых,
головная боль регрессировала на фоне антибактериального лечения, в-
третьих, были сопутствующие инфекции, излечение которых совпало с
нормализацией состояния больного, в-четвертых, имели место ложно-
отрицательные серологические реакции, специфичные для Cryptococcus
neoformans, в-пятых, были отрицательные посевы крови в жидкой среде
Сабуро. Ретроспективный анализ показал, что выявленные у больного при-
знаки гидроцефалии не получили убедительного объяснения на начальном
этапе и были недооценёны.
В другом нашем наблюдении у ВИЧ-инфицированного пациента,
кроме криптококкоза, иммунодефициту сопутствовали рецидивирующая
герпетическая инфекция, оральный кандидоз, микоз стоп с онихомикозом,
обусловленные Trychophyton rubrum. В процессе двухмесячной антифун-
гальной терапии наступило клиническое выздоровление и постепенное
очищение ликвора от криптококков. В период завершающего лечения со-
стояние больного резко ухудшилось с повышением температуры до 39°С.
резкой слабостью, потливостью. Головной боли и признаков раздражения
менингеальных оболочек не было. Для исключения обострения криптоме-
нингита была выполнены контрольная люмбальная пункция.
Таблица 42
Результаты микологического исследования ликвора в динамике
№ Период микроскопическое исследование культуральное исследование
1. до лечения дрожжевые клетки в большом количестве Cryptococcus neoformans
2. через 40 дней лечения единичные дрожже- вые клетки отрицательное
3. через 55 дней лечения в период новой волны ли- хорадки грибов нет отрицательное
Динамика микологического исследования ликвора свидетельствова-
ла о том, что лечение криптоменингита эффективное, а следовательно ги-
пертермия не связана с микотическими осложнениями.
264
Причина ухудшения состояния оставалась неясной длительное
время, несмотря на тщательное обследование больного. Диагностический
поиск затянулся более, чем на 1 месяц. Только по результатам
противотуберкулезной тест-терапии было доказано наличие туберкулеза.
Главной особенностью клинических проявлений криптококкового
менингита следует признать отрицательные менингеальные симптомы,
только у одного больного они были отчетливо положительными.
У 6 из 8 отмечены психические нарушения в виде снижения памяти,
некритичное™, эйфории, подавленности, изменения личностных
характеристик и даже признаки глубокой энцефалопатии. Частым
признаком была папулезно-пустулезная сыпь, располагавшаяся на
туловище и конечностях, сопровождавшаяся легким зудом.
Сыпь была выявлена у 6 из 8 больных, 3 из них имели фунгемию.
Хотя Cryptococcus neoformans не был обнаружен в материалах из
папулезно-пустулезных образований, их связь с криптококкозом, по-
видимому, существует, так как прогрессирование и регрессирование
кожных изменений хронологически совпадало с фазами течения
криптококкоза.
Компьютерная томография головы была выполнена 5 больным, у 2
выявлено расширение ликворосодержащих и ликворопроводящих путей и
в 2 случаях было указано на наличие участков повышенной плотности. На
томограмме реконвалесцента криптококкового менингита уклонений от
нормы не было обнаружено (таблица 43).
Таблица 43
Лабораторные и инструментальные показатели криптококкового
менингита/менингоэнцефалита при ВИЧ-инфекции
Тест Частота
Наличие антигена Cryptococcus neoformans в сыворотке крови 5/8
Компьютерная томография головы расширение ликворопроводящих и ликворосодержащих путей 2/8
участки повышенной плотности 2/8
Спинно-мозговая жидкость цитоз выше нормы 5/8
реакция Панди положительная 6/8
реакция Нонне-Апельта положительная 6/8
концентрация белка выше нормы 6/8
концентрация сахара выше нормы 4/8
концентрация хлоридов выше нормы Микологическое исследование ликвора: 0/8
высев Cryptococcus neoformans 7/8
Цналичие антигена Cryptococcus neoformans 3/8
265
Спинно-мозговая жидкость у всех больных была бесцветная,
прозрачная. Цитоз от 11x106/л до 16x10 /л преимущественно за счет
лимфоцитов. У 1 больного это исследование было невозможно из-за огромного
количества грибов. Реакция Панди и Нонне-Апельта были положительными
у 4/6. Содержание белка превышало норму у половины больных, однако было
не выше 0,66 г/л, а содержание сахара было повышенным у всех (3/3), в то
время как концентрация хлора всегда была в пределах нормы.
Микологическое исследование спинно-мозговой жидкости:
положительная микроскопия у 5/6 и положительные посевы были у 7 больных.
Антиген Cryptococcus neoformans был обнаружен у 3. Для оценки
диагностической значимости исследования антигена Cryptococcus neoformans
в сыворотке крови было обследовано 38 инфицированных больных; у 8 был
диагностирован криптококкоз, у 3 - криптококкурия, у 27 криптококки в
биосубстратах отсутствовали. Среди больных криптококкозом у 5/8 был
выявлен антиген Cryptococcus neoformans в сыворотке крови и ни у одного
титр антител к Cryptococcus neoformans не превышал норму. При
криптококкурии у 1 из 3 титр антигена был выше диагностически значимого.
Такие же результаты получены при исследовании титра антител среди
больных, в биосубстратах которых криптококки обнаружены не были; у 7/25
была ложно-положительная реакция на антигены Cryptococcus neoformans.
Таким образом, эффективность серологической диагностики по выявлению
антигена в сыворотке крови составила 69%, по специфичности - 71% и
чувствительности - 63%. Эффективность и специфичность серологической
диагностики по обнаружению антител к Cryptococcus neoformans в сыворотке
крови составили 85% и 65% соответственно. Суммарно диагностическое
значение серологических тестов для диагностики криптококкоза отражает
величина эффективности в 67%.
Одна пациентка за месяц до развития криптоменингита перенесла
нижнедолевую левостороннюю пневмонию, которая рентгенологически
проявлялась диффузной очаговой инфильтрацией в обоих легких с большей
выраженностью в субкортикальных отделах верхних долей. Больная
жаловалась на сухой кашель и одышку. При аускультации над обоими легкими
были слышны рассеянные влажные и сухие хрипы. На фоне лечения
флюконазолом наступило улучшение, подтвержденное рентгенологически.
Эти данные позволяют предполагать наличие первичного поражения
криптококком легких.
Диссеминированный генерализованный криптококкоз был
диагностирован по тяжелому состоянию (4/4), истощению (4/4), появлению
на фоне гепатомегалии и спленомегалии (3/4), развившемуся мочевому
синдрому (1/4), выделению гриба из венозной крови (4/4), регрессии
клинических проявлений на фоне антимикотического лечения (3/4) или по
266
результатам посмертного патологоанатомического исследования (1/4).
В последнем случае на вскрытии был выявлен генерализованный
криптококкоз с поражением оболочек и ткани головного мозга на фоне ВИЧ-
энцефалита. Также было обнаружено поражение печени, селезенки,
лимфатических узлов, легких, надпочечников. При микроскопическом
исследовании криптококки различных размеров и формы выявлялись в
паутинной и мягкой мозговых оболочках, субарахноидальном пространстве,
а также периваскулярно в коре и в субкортикальном белом веществе.
Макрофагальная реакция была незначительной, а гигантские многоядерные
клетки, характерные для ВИЧ-энцефалита, не обнаруживались.
Криптококковый гепатит характеризовался множественными очагами некроза
печени; в одних очагах скопления криптококков отсутствовала какая-либо
Клеточная реакция, в других - определялись отдельные многоядерные
(иакрофаги. В легких криптококки располагались преимущественно в
утолщенных межальвеолярных перегородках. Множественные
Криптококковые гранулы выявлялись в надпочечниках. Имелось массивное
Криптококковое поражение селезенки, красная пульпа сплошь была
нафарширована криптококками, фоликулы с явлениями значительной
редукции. Обнаружение криптококков внутри сосудов ряда органов
свидетельствовало об их диссеминации в момент смерти.
У одной больной Cryptococcus neoformans был выявлен в язвах. Этот
случай заслуживает отдельного рассмотрения, так как криптококки вначале
были обнаружены в отделяемом язв, а лишь затем - в крови.
Больная Г., 30 лет, была выявлена как ВИЧ-инфицированная около года
назад и лечилась по поводу кожных язв, Candida albicans и Candida krusei,
Которые через 10 месяцев рецидивировали в виде эрозивно-язвенных
поражений. Диагноз вновь был подтвержден выделением Candida albicans и
Candida krusei из кожных язв. Одновременно ухудшилось общее состояние,
Стало соответствовать септическому. Больная жаловалась на резкую слабость,
из-за которой не могла встать, лихорадку, прогрессирующее снижение массы
Тела. Увеличилась степень гепатомегалии, появились спленомегалия и
признаки поражения почек. Возбудителя сепсиса выявить не удавалось:
посевы крови и мочи были отрицательными; в частности, не было роста
грибов в жидкой среде Сабуро. Однако в этот период кроме Candida albicans
и Candida krusei в отделяемом кожных язв впервые стал отмечаться рост
Cryptococcus neoformans в соотношении 1:20:30 к грибам рода Candida.
Появление Cryptococcus neoformans в отделяемом кожных язв расценили как
проникновение этого гриба из тока крови через поврежденные сосуды в
области кожных язв, а следовательно, причиной септического состояния
был криптококкоз. Это заключение в последствии было подтверждено
267
выделением Cryptococcus neoformans из венозной крови и спинно-мозговой
жидкости.
Данное наблюдение диктует необходимость широкого
использования микологических методов исследования в клинической
практике.
Таблица 44
Лечение криптококкоза при СПИДе
Режим лечения кол-во боль- ных длитель- ность курса результаты лечения комментарии
Флюконазол 200-400 мг в/в или перорально (в сутки) 3 7, 40, 45 дней -излечение 2 больных, получавших флюконазол не менее 40 дней -смерть одного больного на седьмой день лечения -в 1 случае смерть наступила через 4 мес. после завершения основного курса, -у 1 больного развился рецидив -1 умер от диссе- минированного криптококкоза
Итраконазол 400 мг 2 30, 60 дней излечение больным проводилась вторичная профилактика, рецидивов нет
Флюконазол 200-400 мг + Итраконазол 400-600 мг 5 45 дней - 6 мес. -в одном случае итраконазол был отменен в связи с неэффективностью -у всех улучшение; -у 1 - после излечения - рецидив -1 больная умерла от ВИЧ-миокардио- патии, - 4 больных живы
Из 8 больных криптококкозом антимикотическое лечение
проводилось 7 больным, 1 больной умер без лечения. 3 больных, кроме
первого основного курса лечения, получили антифунгальные препараты
для профилактики. Таким образом, в общей сложности изучена
эффективность лечения 10 острых эпизодов криптококкоза. У 3 больных
для лечения криптококкоза был использован флюконазол. В 2 случаях был
268
применен итраконазол. У 5 применялись оба препарата (таблица 44). У 2
уольных был использован флюконазол внутривенно по 400 мг в первый день
я по 200 мг со второго дня. Препарат назначали для лечения криптококкового
иенингита и криптококкового менингита с криптококкозом легких. У обоих
зольных через 40-45 дней наступило клиническое излечение, подтвержденное
элиминацией гриба из спинно-мозговой жидкости и регрессией
патологических изменений в легких. Один больной получал флюконазол по
поводу диссеминированного криптококкоза в возрастающей дозе 200 и 400
Иг внутривенно. Несмотря на проводимое лечение, через несколько дней
Наступила смерть от генерализованного криптококкоза.
Итраконазол был назначен 2 больным в дозе 400 мг в сутки по поводу
криптококкового менингита и фунгемии. Основной курс лечения имел
[щительность 30 и 60 дней. После завершения основного курса лечения обоим
Вольным проводилась профилактика рецидива итраконазолом по 200 мг в
£уткй длительностью 3 и 6 месяцев. Рецидивирование криптококкоза отмечено
не было: время наблюдения 0,5 и 1,5 года соответственно.
В 5 случаях применялись итраконазол и флюконазол последовательно.
В 1 из них замена препарата была вынужденной в связи с неэффективностью
итраконазола. У больных этой группы наступило клиническое улучшение (1)
или излечение (4), но искоренения криптококкоза добились только у 3/5. 1
больная умерла через 2 месяца лечения флюконазолом; смерть наступила от
ВИЧ-миокардиопатии. Остальные имели длительность лечения до 6 месяцев.
У 1 больного криптококкоз был излечен, но через 2 месяца развился рецидив.
Оба препарат^переносились хорошо, никаких побочных реакций ни у
одного не было зарегистрировано.
Таким образом, клиническое течение криптококкоза имеет ряд
особенностей:
у большинства больных это было первое СПИД-ассоциированное
Заболевание;
развитию криптококкоза предшествовали и сопутствовали
бактериальные, вирусные и некриптококковые микотические проявления;
в период выявления криптококкоза средний уровень CD4
составил 201/мм3 (24,4%), а коэффициент CD4/CD8 - 0,70;
чаще других клинических признаков были выявлены головная
боль, гипертермия, психические нарушения;
изменения спинно-мозговой жидкости, в ликворе и в крови
выявлялся криптококкоз;
дополнительным способом диагностики криптококкоза может
быть обнаружение Cryptococcus neoformans в отделяемом язв
вскриптококковой этиологии;
269
- методы серологической диагностики, основанные на выявлении
антигена Cryptococcus neoformans и антител к Cryptococcus neoformans.
имеют вспомогательное диагностическое значение;
- возможно развитие генерализованного криптококкоза с поражением
не только ЦНС, но и печени, почек и других органов.
Флюконазол и итраконазол являются эффективными средствами
лечения криптококкоза у ВИЧ-инфицированных больных; эффективность
флюконазола составила 7/8, эффективность итраконазола - 6/7. Излечение
с элиминацией гриба из ликвора было достигнуто у 4/10. При этом ни у
одного больного не было отмечено побочных реакций. Случай смерти от
криптококкоза на фоне лечения флюконазолом нельзя в полной мерс
отнести к неэффективности препарата, поскольку была мала суточная доза
и длительность лечения. Однако один случай неэффективного лечения
итраконазолом является бесспорным. Больная получала препарат 20 дней в
дозе 200-400 мг в сутки и на этом фоне наступило ухудшение состояния,
появилась фунгемия, развился диссеминированный криптококкоз.
Назначенный в последующем флюконазол оказался эффективным, хотя
был применен в более тяжелых условиях, чем итраконазол. Полученные
данные свидетельствуют также и о том, что результаты лечения зависят or
сроков диагностики, а стало быть, и тяжести криптококкоза.
6.3. Менингит, обусловленный Rhodotorula rubra.
Грибы рода Rhodotorula - это несовершенные дрожжи
базидиомицетного ряда, относящиеся к семейству Cryptococcaccae.
Известно широкое распространение этих грибов в окружающей среде: они
обнаруживаются в воздухе, морской воде, на растительном материале.
Некоторые виды Rhodotorula выделяют от человека. Этот гриб может
присутствовать на коже и на ногтях как сапрофит [5], может
колонизировать респираторный и мочевыделительный тракты [1, 29].
конъюнктиву [19]. Некоторые виды Rhodotorula, а именно Rhodotorula
rubra (син. Rhodotorula mucilaginosa) и Rhodotorula giutinis, составляют
менее 0,5% культур дрожжей, выделяемых изо рта, и более 12% изолятов
- из кала и ректальных тампонов. Ввиду частого выделения Rhodotorula из
биосубстратов, контактирующих с внешней средой, факт наличия в них
этого гриба имеет весьма ограниченное значение. По-иному оценивается
обнаружение Rhodotorula в крови, костном мозге, спинно-мозговой
жидкости, т.е. в биосубстратах, не контактирующих с внешней средой, эго
важный признак для диагностики родоторулеза. Согласно каталогу грибов
Ainsworth и Bisby, Rhodotorula относится к этиологическим агентам
оппортунистических микозов [7, 27] и развивается в условиях
нарушенной иммунной защиты и гомеостаза, как правило, в
терминальной стадии длительно текущих процессов [19, 33, 44]. Среди
факторов риска наибольшее значение имеют опухоли и длительно стоящие
270
внутривенные и перитониальные катетеры. В роде Rhodotorula различают
от 8 до 18 видов, а в качестве патогенов называются Rhodotorula pillmanae,
Rhodotorula pallida, Rhodotorula marina, Rhodotorula giutinis и Rhodotorula
rubra [19, 38, 44]. Среди системных микотических поражений эта инфекция
относится к группе казуистически редких: описано несколько случаев
поражения кожи, легких, почек [43], эндокарда [33, 38], брюшины, печени,
костного мозга [45], щеки [38], горла и единственное наблюдение
родоторулезного менингита у мужчины с острой лейкемией [40]. У ВИЧ-
инфицированного ребенка был описан случай диссеминированного
микоза, вызванного Rhodotorula nmiuta [34]. В 1960 году Riopedre и
соавторы сообщили о выделении Rhodotorula rubra из спинно-мозговой
жидкости, кала, мочи, глотки и кожи у трехмесячного ребенка, который
находился в коматозном состоянии (диагноз не указан) [42]. Ряд работ
посвящен сепсису, вызванному Rhodotorula у больных с сосудистыми
катетерами [3, 27, 29, 32, 38], в том числе у одного ВИЧ-
инфицированного больного [53]. Все эти случаи демонстрируют
достаточный потенциал Rhodotorula для инвазии тканей и показывают,
что этот гриб может быть причиной серьезных системных микозов.
Клиническая картина заболевания неспецифична и широко варьирует от
легких до тяжелых форм. Для диагностики родоторулеза обязательным
является выделение гриба при посеве биосубстрата на питательную среду.
Вопрос о тактике лечения родоторулеза не решен. Сообщают о
случаях успешного лечения амфотерицином Б в сочетании с
флюцитозином, а также об эффективности монотерапии амфотерицином
Б и флюцитозином [3, 19, 33, 38, 44]. Вместе с тем, известны случаи
рецидива после клинического излечения амфотерицином Б [45] и случаи
смерти, несмотря на проводимое антимикотические лечение [40]. В
противовес этому стоят случаи самоизлечения при родоторулезе
центральной нервной системы [42] и случаи инволюции родоторулезного
сепсиса после удаления сосудистого катетера без дополнительного
антимикотического лечения [33, 38]. Однако показания к назначению
специфического лечения до сих пор не определены. Также не изучена
сравнительная эффективность препаратов и неизвестна необходимая
длительность лечения.
Нами описан первый в мировой практике случай менингита,
обусловленного Rhodotorula rubra, при СПИДе.
Мужчина, 39 лет. Выявлен в 1989 году по контакту с ВИЧ-
инфицированным половым партнером. Заражение, вероятно, произошло в
1988 году. Многие годы злоупотреблял алкогольными напитками, курил.
Имел сопутствующие заболевания - сифилис (1989 год), микоз стоп и
кистей с онихомикозом, бронхит курильщика. С 1990 года беспокоили
слабость, периодические кратковременные эпизоды криптогенной диареи.
Постепенно терял в весе - суммарно около 15 кг. В 1992 году исподволь
271
развилась раздражительность, эмоциональная лабильность, затем
появилась умеренная головная боль. К январю 1993 года головная боль
стала постоянной и значительной по интенсивности, начались подъемы
температуры. В это время состояние больного было относительно
удовлетворитель-ное. При осмотре выявлен ряд патологических признаков.
Пальпировались периферические лимфатические узлы (подчелюстные,
задне-шейные, подмышечные); плотные, подвижные, безболезненные,
размером 1,0-1,5-2,0 см. На коже груди и в межлопаточной области
определялись участки себорейного дерматита. Имелся атрофический
онихомикоз с микозом кистей и стоп. Заеды в углах рта. Язык густо обложен
белым налетом, слизистая оболочка полости рта гиперемирована, с
беловатым налетом в области глотки, афтозными элементами на мягком небе.
При осмотре в неврологическом статусе отклонений от нормы не
обнаруживалось. Больной в сознании, активен. Интеллект соответс-твовал
социо-культурному и возрастному уровню. Признаки раздражения мозговых
оболочек отсутствовали. Лицо симметричное. Объем движений глазных
яблок полный. Нарушений тактильной, температурной, глубокой суставно-
мышечной и болевой чувствительности не было.
В анализах крови: СОЭ - 38 мм/час, гемоглобин -150 г/л, эритроциты
- 4,5х10|2/л, лейкоциты 3,9x10’/л, палочкоядерные нейтрофилы - 5%,
сегментоядерные нейтрофилы - 46%, эозинофилы - 6%, лимфоциты - 59%,
моноциты - 4%, общий белок - 46 г/л, альбумины - 38%, глобулины 62%:
альфа-1 - 4%, альфа-2 - 6%, бета - 14%, гамма - 38%. В сыворотке
обнаружены антитела к HIV-1: gp 160, gp 110, gp 120, gp 41, p55, p68, в
иммунограмме зафиксировано снижение количества СВ4-хелперов (17%-
259 /мм3) и снижение коэффициента CD4/CD8 - 0,55. IgA - 5,00 г/л, IgG -
14,18 г/д, IgM - 1,24 r/л. При культуральном исследовании соскоба с языка
и мазков с миндалин на среде Сабуро получен рост Candida albicans.
Серологическое исследование с антигеном Candida albicans, а также
исследование на токсоплазмоз и цитомегаловирусную инфекцию оказались
отрицательными. Посев крови на микрофлору роста не дал. На
рентгенограмме органов грудной клетки выявлялось умеренное усиление
легочного рисунка с перибронхиальными уплотнениями. Еще в 1992 году
на компьютерной томографии была установлена атрофия лобных долей
головного мозга. Для лечения кандидоза слизистых-оболочек полости рта
был назначен кетоконазол в дозе 200-400 мг в сутки. Противовирусная
терапия проводилась виролексом и ретровиром. По поводу бронхолегочного
воспаления больной получал антибактериальные пре параты (оксациллин
и бисептол). В течение месяца на фоне проводимого лечения афты и белые
налеты в ротовой полости исчезли, уменьшился кашель, однако головная
боль имела тенденцию к усилению и сохранялась высокая температура.
272
При осмотре больного - без ухудшения, в том числе
и в неврологическом статусе. На электроэнцефалограмме выявлены
умеренно выраженные изменения биоэлектрической активности головного
мозга, укладывающиеся в картину нейроинфекии, с диагностической целью
была произведена люмбальная пункция. Получена белая прозрачная спинно-
мозговая жидкость с нормальным цитозом и нормальным уровнем белка.
При микроскопии в ликворе обнаружены дрожжевые клетки, после
инкубации в жидкой среде Сабуро при 57°С в течение 5 дней из спинно-
мозговой жидкости выделена культура дрожжей розоватой окраски. Гриб
не образовывал псевдомицелия, не ферментировал углеводы, не
ассимилировал инозит и был отнесен к Rhodoturula rubra. Было проведено
определение чувствительности выделенного штамма к флюцитозину
методом серийных разведений. Минимальная подавляющая концентрация
препарата составила 25 мкг/мл, т.е. ниже, чем достигаемая концентрация
в спинно-мозговой жидкости при лечении больных. Антимикотическая
терапия проводилась микоцетином (флюцитозин) в дозе 175 мг/кг в день,
на 5-7 день лечения наступило зна-чительное улучшение самочувствия,
исчезла головная боль, нормали-зовалась температура. Общая длительность
лечения составила 15 дней. Выраженный клинический эффект сочетался с
элиминацией Rhodotorula rubra из спинно-мозговой жидкости. В течение
последующих 7 месяцев рецидива менингита не наблюдалось. Вторичная
профилактика не проводилась. Через 7 месяцев состояние больного резко
ухудшилось, повысилась температура до 39-40°С и развилась сильная
головная боль. Боль локализовалась преимущественно в височно-теменной
области, усиливалась к вечеру и ощущалась больным «как-будто вбивают
гвозди». Боль плохо купировалась анальгетиками. Кроме того, были
слабость, жидкий частый стул, кашель со скудной слизистой мокротой,
потливость и бессоница. Состояние было оценено как средне-тяжелое.
Слизистая ротовой полости яркая, с небольшими белыми налетами.
Симптомы поражения нервной системы и, в частности, менингеальные
знаки отсутствовали, и в целом неврологический статус не имел отклонений
от нормы. В этот период CD4 составили 23% (305/мм3), CD8 - 39% (517/
мм3), коэффициент 0,59.
При диагностической люмбальной пункции была получена
бесцветная, прозрачная жидкость; цитоз - 177x109/л, нейтрофилов 3007,
при микроскопии в ликворе - дрожжевые клетки в большом количестве, в
посеве рост Rhodotorula rubra.
Результаты микологического исследования ликвора в сочетании с
клинико-лабораторными данными позволили установить рецидив
родоторулезного менингита. В результате лечения спороноксом
(итраконазол) в суточной дозе 400 мг в течение 1 месяца состояние и
18-Заказ№К-4451. 273
самочувствие больного улучшилось. При повторном исследовании ликвора
грибы не обнаружены. Больной постоянно принимал итраконазол по 100-
400мг/сутки для профилактики рецидива.
Таким образом, наряду с менингитом, вызванным Cryptococcus
neoformans, был документирован случай менингита, вызванного дрожжами,
которые образовывали красные колонии, не формировали псевдомицелий,
не ассимилировали инозит и были идентифицированы как Rhodotorula rubra.
Течение менингита характеризовалось постепенным прогрессированием в
течение нескольких месяцев со слабовыраженными признаками раздражения
мозговых оболочек и слабовыраженными небольшими воспалительными
изменениями в ликворе. Итраконазол и флюцитозин оказались эффективными
средствами лечения.
6.4. Фунгемия Penicillium chrysogenum при ВИЧ-инфекции.
Пенициллиоз был диагностирован у одного больного, проявлялся
фунгемией и был подтвержден двукратным выделением Penicillium
chrysogenum из венозной крови. Ниже приводится описание этого случая.
Мужчина 46 лет. Срок инфицирования неизвестен. Был выявлен как
ВИЧ-инфицированный три года назад по клиническим показаниям: частые
простудные заболевания. 4 месяца назад была установлена ВИЧ-инфекция в
стадии III Б; кандидоз слизистой полости рта, рецидивирующая герпетическая
инфекция.
При поступлении - жалобы на одышку, повышенную температуру тела
до 38-39 градусов, потливость, похудание, дефицит массы тела до 10%,
слабость. При осмотре пальпировались увеличенные периферические
лимфатические узлы, размеры которых местами достигали 2,0 см. Слизистая
полости рта была гиперемированная, отечная, рыхлая. На слизистой мягкого
неба и на миндалинах определялся белый налет, легко снимающийся. По
центру языка - болезненная трещина на фоне густого белого налета. Кожа
стоп с небольшим гиперкератозом, муковидной припорошенностью с
утолщением мутных ногтевых пластинок. Над легкими выслушивались
немногочисленные сухие хрипы. Иммунологические показатели: CD4-
лимфоциты 18% (263/мм3), CDS-лимфоциты 31% (454/мм3), коэффициент-
0,58. В соскобах с языка и со слизистых рта обнаружена Candida alb., в кожных
и ногтевых чешуйках со стоп - рост Trichophyton rubrum. По результатам
морфологического исследования шейного лимфатического узла был выявлен
туберкулезный лимфаденит, по поводу которого была начата
противотуберкулезная терапия. В связи с частыми внутривенными вливаниями
больному был установлен подключичный сосудистый катетер. Через 2 недели
появилась папулезная сыпь на лице, а в посевах венозной крови был
зарегистрирован рост Penicillium chrysagenum. Повторные исследования
274
подтвердили фунгемию. Рост Penicillium chrysogenum был также получен с
кожи лба по месту папул. На фоне сочетанного противотуберкулезного и
антимикотического (кетоконазол в дозе 400 мг/сутки) лечения
нормализовалась температура, улучшилось самочувствие, исчезла сыпь на
лице.
Таким образом, у ВИЧ-инфицированного больного на фоне
противотуберкулезного лечения и длительного пребывания катетера в вене
развилась фунгемия, клинически проявлявшаяся папулезными высыпаниями
на коже лица. Лечение кетоконазолом и извлечение катетера привели к
Излечению, подтвержденному исчезновением фунгемии.
В настоящее время разработаны и внедряются в практику
усовершенствованные препараты для лечения микозов. К их числу следует
отнести амбизон - липосомальный амфотерицин.
В последние годы благодаря разработке липосомальной системы
транспорта лекарственных веществ, разработке амбизома (амфотерицина В)
стало возможным преодолеть недостатки даунорубицина.
Амфотерицин В - полиеновый макролид, продуцируемый штаммами
Streptomyces nodosum (актиномицеты). Это препарат широкого спектра и
очень активен в отношении многих видов грибов, в том числе Cryptococcus
neoformatus, Aspergillus, Candida и других. Амфотерицин разрушает
двуслойные мембраны грибов, либо формирует в них поры и нарушает
окислительно-восстановительные процессы, при этом препарат может
повредить клетки человека.
В новом препарате АМБИЗОМ амфотерицин находится внутри
липосом. Липосомы состоят из очищенных фосфолипидов с насыщенными
жирными кислотами и содержат холестерол. После растворения липосом в
соответствующем органическом растворителе амфотерицин оказывает свое
воздействие на грибы.
Амбизом содержит во флаконе:
- амфотерицин 50 мг
- сахарозу 900мг
- ДСФГ 84 мг
- холестерол 52 мг
- сукцинат натрия 27 мг (8 - 10 мг натрия)
- альфа-токоферол 0,64 мг.
Препарат разводится стерильной водой для инъекций. При добавлении
12 мл воды во флакон амбизома получается раствор, содержащий 4 мг/мл
амфотерицина.
Для инфузии используют разведение от 0,2 до 2 мг/мл, которое
получают, добавляя 5% глюкозу. Амбизом вводится внутривенно в течение
30 - 60 мин, не смешивая с другими растворами, особенно солевыми. Терапию
18*
275
амбизомом начинают с дозы 1 мг/кг в день с повышением до 3 мг/кг.
Суммарная доза составляет 1 - 2 г за 2 - 4 недели, при необходимости она
увеличивается до 8 г на курс. У больных с криптококковым менингитом
суммарная доза составляет 4,4 г. В тяжелых случаях возможно использовать
более высокие дозировки.
Исследованиями A. Leenderet al. (1997) показано, что 3-недельный курс
амбизома 4 мг/кг в сутки в/в в сравнении с 0,7 мг/кг амфотерицина был более
эффективен и не сопровождался нефротоксичностью у больных со СПИД-
ассоциированным криптококковым менингитом.
Установлена безопасность и эффективность Амбизома в лечении
криптококкового менингита в многоцентровом Европейском
исследовании. Больные включались в исследование, если диагноз
криптококкового менингита был подтвержден результатами посевов крови,
спинномозговой жидкости или материалов из любых других источников.
У всех пациентов выявлены ВИЧ-1 антитела. В 23 случаях можно было
оценить клиническую эффективность, в 21 - микологическую. У всех был
криптококкоз, у 19 из 23 - криптококковый менингит. Все участники
исследования получали липосомальный амфотерицин В в дозе 1 мг/кг в
день в первый день, 2 мг/кг во второй день, и затем по 3 мг/кг/д. Лечение
проводилось как минимум 42 дня и прекращалось, если результаты посевов
из всех мест, где раньше высевался Cryptococcus, были отрицательными в
течение 2 недель. Суммарная доза была в среднем 4,4 г. Никто из больных
не получал других противогрибковых препаратов в течение исследования
(Coker Н. et al, 1993).
Заключение
Грибковые поражения кожи и слизистых являются наиболее частыми
и ранними вторичными заболеваниями у больных с ВИЧ-инфекцией. Их
лечение адекватно проводить с использованием нистатина (2,0-4,0 г/сутки) и
леворина (1,0-2,0 г/сутки), а при неэффективности - кетоконазола (0,1-0,2 г/
сутки).
Из СПИД-индикаторных заболеваний для нашей страны характерны
кандидоз пищевода и системные глубокие микозы, прежде всего,
криптококкоз.
Необходимо использование методов ранней диагностики, главным
образом, культуральных методов исследования, или серологических, однако
последний метод менее информативен. Лечение криптококкового менингита
должно проводится назначением амфотерицина, однако чаще используется
276
флюконазол, либо итраконазол внутривенно первые пять- семь дней с
последующим приемом препаратов перорально в течении 8-10 недель для
профилактики рецидивов. Перспективным препаратом является
липосомальный малотоксичный амфотерицин - АМБИЗОМ.
Литература
1 . Batellier L., Chaumeil С., Liotet S. Champignons et lentilles de contact:
Revue generale. Journal de Mycologie Medicale, 1992, v.2, p. 132-
139.
2 . Bennet J. E., Dismukes W. E., Duma R. J. et al. A comparison of
amphotericin В alone and combined with flucytosine in the treatment
of cryptococcal meningitis. N. Engl. J. Med., 1979, v. 301, p. 126-131.
3 . Braun D. K., Kauffman C. A. Rhodotorula fungemia: A life-threatening
complication of inwelling central venous catheters. Mycoses, 1992, v.
35, № 11-12, p. 305-308.
4 . Cartledge J. Oral candidiasis: special concerns in the HIV-positive
patient. Clinician, 1993, v. 11, № 7, p. 27-31.
5 . Causey D. M., Leedom J. M., Olsen C. Rhodotorula rubra septicemia
in an AIDS patient with an in-dwelling Hickman catheter. Abstract MBP
83, 5-th. International Conference on AIDS, 1989, Montreal, June, 4-
9.
6 . Center for Disease Control. 1993 revised classification system for HIV-
infection and expanded surveillance case definition for AIDS among
adolescents and adults. United States. MMWR CDC Surveill. Summ.,
1992, v. 41 (rr-17), p. 17-21.
7 . Chabasse D. Les nouveaux champignons opportunistes apparus en
medicine. Revue generale. J. Mycol. Med., 1994, v. 4, p. 9-28.
8 . Chuck S. L., Sande M. A. Infections with Cryptococcus neoformans in
the acquiered immunodeficiency syndrome. N. Engl. J. Med., 1989, v.
321, p. 794-799.
9 . Coleman D. C., Bennet M. A., Sullivan D. J. et al. Oral Candida in
HI V-infection and AIDS: New perspectives/ new approaches. Crit. Rev.
Microbiol., 1993, v. 19, p. 61-82.
lO .Colenbunders R., Mann J. M., Francis H., Bila K. Evaluation of clinical
case-definition of acquiered immunodeficiency syndrome in Africa.
Lancet, 1987, 1, p. 492.
11 .Coulaud J. P. Manifestations cliniques de I’ immuno-deficiency humaine
HIV chez 1’ africain. Med. Trop., 1988, v. 48, p. 327.
12 .Council of State and Territorial Epidemiologist. Revision of the CDC
277
surveillance case definition for acquiered immunodeficiency syndrome.
MMWR, 1987, v. 36, suppl. 1, p. 1-15.
13 .Cunliffe N. A., Denning D. W. Uncommon invasive mycoses in AIDS.
AIDS, 1995, v. 9, №5, p. 411-420.
14 .Denning D. W., Follansbee S. E., Scolard M. et al. Pulmonary
aspergillosis in the acquiered immunodeficiency syndrome. N. Engl. J.
Med., 1991, v. 324, p. 654-662.
15 .Dismukes W. E. Cryptococcal meningitis in patients with AIDS. J.
Infect. Dis., 1989, v. 157, p. 624-628.
16 .Dover J. S. Cutaneous manifestation of human immunodeficiency virus
infection. Part II. Arch. Dermatol., 1991, v. 127, p. 1549-1557.
17 .Dreizen S. Oral candidiasis. American J. Medicine, 1984, v. 30, p. 28-
33.
18 .Drouhet E. Penicilliosis due to Penicillium marneffei: A new emerging
systemic mycosis in AIDS patients travelling or living in Southeast Asia.
Review of 44 cases reported in HIV infected patients during the last 5
years compared to 44 cases of non-AIDS patients reported over 20 years
. J. Mycol. Med., 1993, v. 4, p. 195-224.
19 .Dupont B. Invasive fungal infections caused by yeasts as emerging
pathogens
20 .Eng R. H. K., Bishburg E., Smith S. M., Kapila R. Cryptococcal
infections in patients with acquiered immunodeficiency syndrome. Am.
J. Med., 1986, v. 81, p. 19-23.
21 .Goldani L. Z., Sugar A. M. Paracoccidioidomicosis and AIDS. Clin.
Infect. Dis. , 1995, v. 21, p. 1275-1281.
22 .Gradon J. D., Timpone J. G., Schnittman S. M. Emergence of unusual
opportunistic pathogens in AIDS: A Review. Clin. Infect. Dis., 1992, v.
15, p. 134-157.
23 .Holmberg K., Meyer R. D. Fungal infection in patients with AIDS and
AIDS-related complex. Scand. J. Infect. Dis., 1986, v. 18, p. 179-192.
24 .Horowitz 1. D., Blumberg E. A., Krevolin L. Cryptococcus albidus and
mucormycosis empyema in a patient receiving hemodialisis [review].
Southern Medical Journal, 1993, v. 86, №9, p. 1070-1072.
25 .HorsburgC. R. Jr., SelikR. M. Extrapulmonary cryptococcosis in AIDS
patients: risk factors and association with decresed survival [abstract
584]. In: Proceeding of the 28-th Interscience Conference on
Antimicrobial Agents and Chemotherapy. Washington, DC: American
Society for Microbiology, 1998.
26.Itin P. N., Lautenschlager S., Fluckiger R., Rufli T. Oral manifestations
in HIV-infected patients: Diagnosis and management. J. Am. Acad.
Dermatol., 1993, v. 29, p. 749-760.
278
27 .Jimenez-mejias M. E., Ortis Leyba C., Jimenez Gonzalo F. J. et al.
Fungemia for Rhodotorula mucilaginosa en relation con nutrition
parenteral total. Enfermedades Infecciosas у Microbiologia Clinica,
1992, v. 10, №9, p. 543-546.
28 . Johnson P. C., Khardori N., Najjar A. F. et al. Progressive disseminated
histoplasmosis in patients with the acquiered immunodeficiency
syndrome. Am. J. Med., 1988, v. 85, p. 152-158.
29 .Kiehn T. E., Gorey E., Brown A. E., Edwards F. F., Armstrong D. Sepsis
due to Rhodotorula related to use of indwellingcentral venous catheters.
Clinical Infectious Disease, 1992, v. 14, p. 841-846.
30 .Klein R. S., Harris C. A., Small С. B. et al. Oral candidiasis in high-
risk patients as the initial manifestation of the acquiered
immunodeficiency syndrome. N. Engl. J. Med., 1984, v. 311, p. 354-
358.
31 .Kovacs J. A., Kovacs A. A., Polis M. at all. Cryptococcosis in the
acquiered immunodeficiency syndrome. Ann. Intern. Med., 1985, v. 103,
p. 533-538.
32 .Kreger-van Rij N. J. W. (Ed.). The Yeasts: A Taxonomic Study. Elsevier
Science Pubs, New York , 1984.
33 .Leeber D. A., Scher 1. Rhodotorula fungemia presenting as “ endotoxic
shock” .Archives of Internal Medicine, 1969, v. 123, p. 78-81.
34 .Leibovitz E., Rigaud M., Chandwani et all. Disseminated fungal
infections in children infected with the human immunodeficiency virus.
Pediatric Infectious disease Journal, 1994, v. 10, №12, p. 888-894.
35 .Lerner C. W., Tapper M.L. Opportunistic infection compalicating
acquiered immune deficiency syndrome. Medicine, 1984, v. 63, p. 155-
164.
36 .Lewis J. L., Rabinovich S. The wide spectrum of cryptococcal
infections. Am. J. Med., 1972, v. 53, p. 315-322.
37 .Mathieson R., Dutta S. K. Candida esophagitis. Dig. Dis. Sci., 1983, v.
28, p. 365-370.
38 .Naveh Y., Friedman A., Merzbach D., Hashman N. Endocarditis caused
by Rhodotorula succefully treated with 5-fluorocytosine. British Heart
Journal, 1975, v. 37, p. 101-104.
39 .Perfect J. R., Shell W. A., Rinaldi M. G. Uncommon invasive fungal
pathogens in the acquiered immunideficiency syndrome. J. Med. Vet.
Mycology, 1993, v. 31, №2, p. 175-179.
40 .Pore R. S., Chen J. Meningitis caused by Rhodotorula sabouraudia,
1976, v. 14, p. 331-335.
41 .Powderly W. G. Fungal infections on patients with AIDS. In: Antifungal
Agents, v. 1: Flucanozole. Powderly W.G. and Van’t Wout J. (Eds.).
279
Marius Press, Carnforth, Lancashire, England, 1992, p. 70-81,
42 .Riopedre R. N., De Cesare I., Miatello E., Cariua M. A., Zapater R. C.
Aislamiento de Rhodotorula mucilagenosa del L. С. E., heces , orina,
ezudo foringeo у piel de un lactante de 3 meses. Revista de la
Associacion Medica Argentina, 1960, v. 74, p. 431-434.
43 .Rippon J. W. Medical Mycology. (The Pathogenic Fungi and the
Pathogenic Actinomycetes). 3- rd, ed., W. B. Saunders, Philadelphia,
1988.
44 .Rose A. H., Harrison J. S. (Eds.). The Yeasts. Academic Press, London,
1989.
45 .Rusthoven J. J., Feld R., Tuffnel) P. G. Systemic infection by
Rhodotorula spp. in immunocompromised host. Journal of Infection,
1984, v. 8, p. 241-246.
46 .Seebiger H. P. R., Tintelnot K. Mechanism of pathogenesis -why are
certain mycoses rare in AIDS patients? In: Mycoses in AIDS patients,
New York, London, 1990, p. 155-159.
47 .Singh N., Yu V., Rish J. D. Invasive aspergillosis in AIDS. South. Med.
J., 1991, v. 84, №7, p. 822-827.
48 .Singh V. R., Smith D. K., Lawerence J. Coccidioidomycosis in patients
with HIV. Clin. Infect. Dis., 1996, 23, p. 563-568.
49 .Snider J. B., Simpson D. M., Nielsen S. et all. Neurogical complications
of acquiered immune deficiency syndrome: analysis of 50 patients .
Ann. Neurol., 1983, v. 14, p. 403-418.
50 .Spenser P. L., Jackson G. G. Fungal and mycobacterial infections in
patients infected with the human immunodeficiency virus. J. Antimicrob.
Chemother., 1989, v. 23, suppl. A.,p 107-125.
51 .Tawfik O. W., Papasian C. J., Dixon A. Y., Potter L. M. Saccaromyces
cerevisiae pneumonia in a patient with acquiered immynodeficiency
syndrome. J. Clin. Microbiol., 1989, v. 27, №7, p. 1689-1691.
52 .Trier J. S., Bjorkman D. J. Esophageal, gastric, and intestinal
candidiasis. Am. J. Med., 1984, v. 77, suppl. 4D, p. 39-43.
53 .Wheat L. J., Connolly-Stringfield P. A., Baker R. L. et all. Disseminated
histoplasmosis in the acquiered immunodeficiency syndrome: clinical
findings, diagnosis and treatment, and rewiew of the literature.
Medicine, 1990, v. 69, p. 361-374.
54 .Wride W. Pulmonale mucormyeose bei einem HIV-infizierten patienten.
DMW: Dtsch. Med. Wochenschr., 1995, v. 120, №22, s. 818.
55 .Zuger A., Louie E., Holzman R. S. et all. Cryptococcal disease in
patients with the acquiered immunodeficiency syndrome: diagnostic
features and outcome of treatment. Ann. Intern. Med., 1986, v. 104, p.
234-240.
280
56 .Presont C., Scolaro M., Kennedy P. et al. Liposomal daunorubicin
treatment of HIV-associated Kaposi-s sarcoma/ Lancet 1993,341, 124z.
57 .Poizot-Martin I. etal study on treatment of Kaposi Sarcoma associated
to AIDS by Daunoxome in hospital prescription in France. 4O-th Annual
Meeting of ASH, Florida, 4-8 December, 1998.
58 .Гяургиева O.X. Микозы при ВИЧ-инфекции / Докт. дисс. -СПб. -1996.
59 . Рахманова А.Г., Гяургиева О.Х. Криптококковая инфекция при СПИДе/
В кн. Актуальные вопросы ВИЧ-инфекции. -СПб. -1997. -с. 17-21
281
Глава 7. ГЕРПЕСВИРУСНЫЕ ИНФЕКЦИИ
Герпесвирусные инфекции (ГВИ) вызываются вирусами из семейства
герпесвирусов, которые инфицируют человека в ранние сроки жизни с
переходом в латентное течение или персистентную инфекцию с
минимальным повреждающим эффектом. Герпесвирусы (ГВ) способны
реактивироваться и реплицироваться в условиях полноценно
функционирующей иммунной системы, а также вызывать многообразные
манифестные формы заболеваний в условиях возникновения
иммунодефицита.
Известно около 80 представителей этого семейства, имеющих
широчайший круг хозяев, восемь из них выделены от человека: вирусы
простого герпеса 1 и 2 типов - ВПГ1 и ВПГ2 (HSV 1,2), вирус ветряной
оспы/опоясывающего герпеса — ВЗВ (VZV), вирус Эпштейна-Барр — ВЭБ
(EBV), цитомегаловирус — ЦМВ (CMV), вирус герпеса человека б — ВГЧ-
6 (HHV 6), вирус герпеса человека 7 — ВГЧ-7 (HHV 7), вирус герпеса
человека 8 — ВГЧ-8 (HHV 8).
Представители ГВ на основе биологических свойств сгруппированы в
три подсемейства - альфа, бета и гамма. В подсемейство альфагерпесвирусов
входят ВПГ1, ВПГ2, ВЗВ; кбетагерпесвирусам относятся ЦМВ, ВГЧ-6, ВГЧ-
7; гаммавирусам - ВЭБ, ВГЧ-8.
7.1. Простой герпес (ПГ)
Этиология. Геном ВПГ представлен двуспиральной линейной ДНК,
которая упакована в капсид. С наружной поверхности вирус покрыт
липопротеиновой оболочкой. По набору белков-антигенов различают ВПП
и ВПГ2, геномы которых на 50% гомологичны.
Попадая в организм человека, ВПГ прикрепляется к клетке, имеющей
на своей поверхности определенные рецепторы, сливается с ней, в результате
чего освобождается капсид, который входит в цитоплазму клетки. ДНК вируса
проникает в генетический аппарат клетки хозяина и пожизненно остается в
нем в неактивном состоянии. Простой герпес, также как вирусный гепатит
В, С, ВИЧ-инфекция и др., относится к интеграционным болезням.
Если в зараженной клетке происходит размножение вируса, то новые
вирионы появляются очень быстро — уже через 10-15 часов, при этом
клетка повреждается.
С ВПГ2 связывают рак шейки матки и вульвы. Изучается роль ВПГ в
развитии атеросклероза (наряду с вирусом Эпштейна-Барр).
Вирусы простого герпеса термолабильны, инактивируются при
температуре 50-52°С через 30 мин, сравнительно легко разрушаются под
воздействием ультрафиолетовых и рентгеновских лучей. Этиловый спирт.
282
протеолитические ферменты, фосфатазы, желчь, эфир и другие органические
растворители быстро инактивируют ВПГ.
Эпидемиология. Источниками инфекции являются люди,
инфицированные вирусом, независимо от того, протекает у них инфекция
латентно или манифестно.
У инфицированного человека вирус обнаруживают в различных
секретах, в зависимости от локализации поражения: носоглоточной слизи,
конъюнктивном секрете, слезе, содержимом везикул, эрозий, язв,
менструальной крови, вагинальном, цервикальном секретах, околоплодных
водах, сперме. В период вирусемии ВПГ циркулирует в крови и выделяется
с мочой.
Пути передачи простого герпеса разнообразны. Наиболее частый путь
заражения при орофациальном ПГ — контактный, воздушно-капельный.
Заражение происходит через посуду, полотенце, игрушки и другие предметы
обихода. Известен оро-оральный путь передачи при поцелуях.
Такими путями заражается около 80% детей в возрасте до б лет, при
этом на пораженность как детей, так и взрослых влияют социально-
экономические условия. 90% детей до 10 лет и почти все взрослые,
относящиеся к неблагополучным слоям населения, заражены ВПГ. Люди с
высоким социально-экономическим уровнем жизни инфицируются в более
поздний период жизни, а часть взрослых остаются неинфицированными.
Простой герпес является одной из наиболее распространенных
болезней, передающихся половым путем (БППП). До недавнего времени
этиологическая роль при генитальном процессе отводилась ВПГ2, однако, в
настоящее время известно, что ВПП вызывает такую же локализацию
поражений. Большинство людей инфицируются генитальным герпесом с
началом половой жизни.
Группы риска такие же, как при вирусном гепатите В и ВИЧ-инфекции.
Распространению инфекции способствуют алкоголизм и наркомания, которые
ведут к беспорядочной половой жизни и внебрачным связям.
Передача ПГ от матери к плоду происходит различными путями. Чаще
плод инфицируется интранатально во время прохождения по родовым путям,
если женщина страдает генитальным герпесом и, особенно, если к моменту
родов имеются клинические проявления. При этом входными воротами для
вируса являются носоглотка, кожа, глаза плода. Риск заражения ребенка при
наличии генитального герпеса во время родов составляет около 40% и зависит
от уровня материнских нейтрализующих антител, длительности безводного
периода, применения инструментов во время родов. Если перед родами
женщина переносит первичную инфекцию, то риск неонатального герпеса
увеличивается до 70%.
283
При генитальном герпесе у женщин вирус может проникать в полость
матки восходящим путем через цервикальный канал с последующим
инфицированном последа и плода.
В период вирусемии у беременной женщины, страдающей любой
формой ПГ, в т.ч. и лабиальным герпесом, возможно проникновение вируса
через плаценту.
При любом варианте инфицирования имеют место различные
последствия для беременности и плода (ребенка). Так, до инфицирования
плода нередко поражаются все три оболочки плаценты, сосуды пуповины,
что приводит к преждевременному прерыванию беременности.
Привычное невынашивание беременности может быть связано с ВПГ.
Инфицирование на ранних сроках беременности опасно в связи с
возможными антенатальной гибелью плода и формированием пороков
развития. При заражении плода в поздние сроки беременности возможны
различные варианты ПГ — от тяжелой инфекции с летальным исходом до
рождения здорового ребенка.
Необходимо помнить о том, что возможно постнатальнос
инфицирование детей при наличии ПГ не только у матерей, но и у
медицинского персонала.
Рассмотренные пути передачи ПГ — контактный, воздушно-
капельный, половой, от матери к плоду, являются естественными путями.
Но также как при гепатитах В, С, D, ВИЧ-инфекции, следует акцентировать
внимание медицинских работников на искусственных путях передачи ПГ.
Поскольку при любой форме ПГ имеет место вирусемия, возможен
парентеральный путь заражения, что встречается, например, у наркоманов.
Фактором передачи инфекции может быть консервированная кровь,
трансплантаты органов, тканей, сперма (при искусственном оплодотворении).
В отличие от вирусных гепатитов и ВИЧ-инфекции, вирусемия при
простом герпесе обычно кратковременная, поэтому парентеральный путь
заражения встречается нечасто.
В медицинских учреждениях возможно заражение при использовании
загрязненных инструментов, применяемых в гинекологической,
отоларингологической, офтальмологической, дерматологической практике.
Патогенез. Входными воротами доя ВПГ служат кожные покровы и
слизистые оболочки.
В большинстве случаев первичное заражение ВПГ протекает
бессимптомно или в легкой форме. Вирус адсорбируется на поверхности
эпителиальной клетки, проникает внутрь, где размножается, приводя клетку
к гибели. В зоне пораженной клетки возникает очаг воспаления. Клинически
это проявляется хорошо известными симптомами: чувством жжения,
гиперемией, образованием папулы, везикулы. Новые вирионы попадают в
284
лимфатические сосуды, затем в кровь. В результате вирусемии ВПГ попадает
в различные органы и ткани, но особый тропизм он имеет к клеткам нервных
ганглиев. Не исключается проникновение вируса в нервные ганглии из места
внедрения через нервные окончания и аксоны.
При нормальном иммунном ответе вирус выводится из органов и
тканей, за исключением паравертебральных чувствительных ганглиев, где
он сохраняется в латентном состоянии на протяжении всей жизни хозяина.
Механизмы латенции и реактивации вируса изучены недостаточно. Как
при любой хронической вирусной инфекции, при ГВИ на определенной
стадии развивается иммунная недостаточность, обусловленная
биологическими свойствами ВПГ. Периодические обострения герпеса будут
связаны с нарушением определенного равновесия «иммунная система -
пораженная клетка», при этом координирующим звеном будет состояние
иммунной системы. Некоторые исследователи придают большое значение
генотипическим особенностям иммунного ответа индивидуума на ВПГ.
Имеет значение недостаточная активность макрофагов, CD4 лимфоцитов,
подавляется активность естественных киллеров, цитотоксических
лимфоцитов, а также снижается выработка медиаторов иммунитета, в т.ч.
интерферона. Антитела, которые образуются в результате инфекции, не
обладают защитным эффектом и не предупреждают инфицированйя.
При дефектах иммунной системы начинается активация вируса и его
репродукция. Вирус по аксонам выходит из нервных ганглиев, поражая
участки кожи и слизистых оболочек, иннервируемых соответствующим
нервом. Вновь происходит поражение клеток, репродукция вируса, вирусемия
и локализация его в тех же нервных ганглиях с переходом в неактивное
состояние. По мере прогрессирования иммуносупрессии активация вируса
становится более частой, в процесс вовлекаются новые ганглии, меняется
локализация и увеличивается распространенность очагов поражения кожи и
слизистых оболочек. При тяжелом иммунодефиците поражаются различные
органы — головной мозг, легкие, печень, процесс принимает
генерализованный характер, что наблюдается при ВИЧ-инфекции, терапии
иммунодепрессантами, лучевой терапии.
Во многих странах выделены микрогруппы риска по ПГ, это, как
правило, люди с приобретенным иммунодефицитом. Некоторые авторы
предлагают такой термин, как «герпетизм» - т.е. ненормальная
конституциональная предрасположенность к ПГ, проявляющаяся
рецидивирующим орофациальным и генитальным ПГ.
Клиника. Клинические проявления ПГ чрезвычайно многообразны как
по локализации, так и по тяжести поражений (Схема 3).
Первичный ПГ возникает при первом контакте человека с вирусом.
Инкубационный период длится от 2 до 14 дней. Орофациальный
285
первичный ПГ наблюдается преимущественно у детей в возрасте от 6 мес.
до 5 лет и значительно реже — у взрослых.
Схема 3
Варианты течения простого герпеса
ПОЛОСТЬ РТА ВИСЦЕРАЛЬНАЯ
ВЕРХНИЕ
ДЫХАТЕЛЬНЫЕ
ПУТИ
ГЛАЗА
ДИССЕМИНИРОВАННАЯ
ПОЛОВЫЕ ОРГАНЫ
У 80-90% первично инфицированных детей заболевание протекает в
латентной форме и только у 10-20% зараженных имеются клинические
проявления. Наиболее частой формой первичного герпеса является острое
респираторное заболевание, этиология которого, как правило. не
расшифровывается. Другая, также весьма распространенная, форма
болезни — афтозный стоматит, встречающийся преимущественно у детей.
Первичный герпес может проявляться различными поражениями кожи,
конъюнктивы или роговицы глаза.
Первичный генитальный герпес возникает в более позднем возрасте
с началом сексуальной жизни. Для любой формы первичного герпеса,
протекающего с клиническими проявлениями, характерен выраженный
общеинфекционный синдром, сопровождающийся лихорадкой и
признаками интоксикации.
Вторичный (рецидивирующий/ герпес возникает в результате
реактивации имеющегося в организме вируса. Рецидивы герпеса по
сравнению с первичной инфекцией протекают обычно с умеренными
признаками интоксикации, лихорадки (иногда они вообще отсутствуют), с
менее выраженными изменениями очага поражения в виде отека,
гиперемии.
Первичный и вторичный герпес имеют одинаковую локализацию
поражения и формы болезни. Выделяют локализованные,
распространенные и генерализованные формы ПГ.
286
Локализованный и распространенный герпес.
Локализованный ПГ имеет четко ограниченную локализацию, которая
обычно соответствует месту внедрения вируса (при первичном герпесе) и/
или месту его выхода в ткани (при вторичной инфекции). Если очаг поражения
углубляется и/или распространяется на близлежащие ткани, возникает на
отдаленных участках кожи или слизистых оболочек, считают, что имеет место
распространная форма ПГ, свидетельствующая о снижении функции
иммунной системы.
Поражения кожи. Типичными являются пузырьковые высыпания, чаще
локализующиеся в области каймы губ и крыльев носа. Однако может быть
поражение кожи различной локализации: лба, шеи, туловища, конечностей
и т.д. У многих пациентов высыпаниям предшествует чувство жжения,
кожный зуд, гиперемия, отек. Затем появляются папулы, превращающиеся в
везикулы, наполненные серозным содержимым. Через несколько дней
содержимое пузырьков мутнеет, они разрываются, в результате чего
образуются мокнущие эрозии, которые вскоре покрываются бурыми
корочками и эпителизируются над ними. На месте отторгнувшихся корок
остается постепенно исчезающая пигментация. Одновременно с
образованием везикул могут умеренно увеличиваться регионарные
лимфоузлы. Весь процесс разрешается в течение 7-14 дней.
Атипичные формы ПГ имеют многообразные проявления. У некоторых
пациентов основным симптомом становится резкий отек подкожной
клетчатки, гиперемия. Это может привести к диагностическим ошибкам и
даже неправильному диагнозу «флегмона» с последующим хирургическим
вмешательством. При этом вместо ожидаемого гнойного отделяемого
получают скудное серозно-сукровичное отделяемое. Такая форма ПГ носит
название отечной и встречается чаще у медицинских работников, имеющих
контакт с ВПГ (перевязочный материал, стоматологические инструменты и
т.д.).
Простому герпесу может сопутствовать мультиформная эритема. У
75% больных пусковым фактором в развитии кожной мультиформной
эритемы являются вирусы ПГ.
Иногда высыпания при простом герпесе локализуются по ходу нервных
стволов, напоминая опоясывающий герпес, однако болевой синдром,
характерный для последнего, отсутствует или выражен незначительно. Это
зостериформный простой герпес, встречающийся чаще у лиц с
иммуносупрессией.
Герпетиформная экзема (экзема Калоши) встречается у детей грудного
или более старшего возраста, реже у взрослых, страдающих экземой,
атопическим дерматитом и другими поражениями кожи. Обычно заболевание
начинается остро и сопровождается повышением температуры тела до 40°С,
с ознобом и интоксикацией. В первые сутки, иногда позже (3-4 дня), на
287
пораженных участках кожи появляются однокамерные пузырьки с прозрачным
содержимым, распространяющиеся постепенно на соседние здоровые участки
кожи, присоединяется вторичная инфекция. Пузырьки лопаются, образуются
мокнущие эрозивные поверхности, которые затем покрываются корками. При
обширных поражениях заболевание протекает крайне тяжело. Летальность у
детей в возрасте до 1 года составляет 10-40%. Экзема Капоши также
наблюдается при иммунодефицитных состояниях, в т.ч. при ВИЧ-инфекции.
К атипичным относится и язвенно-некротическая форма простого
герпеса, маркирующая тяжелую иммуносупрессию. Она встречается при
ВИЧ-инфекции в стадии СПИДа, а также у онкологических,
гематологических пациентов на фоне лучевой, кортикостероидной,
цитостатической терапии.
Как показывают многочисленные исследования, вирусы ПГ 1,2 на фоне
ВИЧ-инфекции вызывают кожно-слизистые поражения, имеющие
часторецидивирующий, распространенный характер, длительно (более 1
мес.) не заживающие. В стадии СПИДа у больных развиваются язвенно-
некротические поражения ПГ (СПИД-индикаторное заболевание 1 группы
по классификации ВОЗ, когда диагноз СПИДа может быть поставлен без
лабораторного подтверждения), когда на месте везикул образуются язвы,
постепенно увеличивающиеся в размере, достигающие в диаметре 2 см и
более. Такие кожные поражения стойко сохраняются в течение нескольких
месяцев, а обратное развитие с отторжением корок, эпителизацией язв и
последующим рубцеванием происходит очень медленно.
Выделяют геморрагическую форму ПГ, когда везикулы имеют
кровянистое содержимое, что наблюдается у пациентов с нарушением
системы гемостаза.
Поражение слизистых оболочек полости рта.
Острый гингивостоматит может быть проявлением как первичной, так
и рецидивирующей инфекции. Эта форма болезни является наиболее частой
клинически выраженной формой у детей младшего возраста. Начинается
заболевание остро с повышения температуры до 39-40°С и явлений
интоксикации. На гиперемированных и отечных слизистых оболочках щек.
языке, неба и десен, а также на миндалинах и в глотке возникают множество
пузырьков, которые через 2-3 дня лопаются и изъязвляются. На их месте
образуются поверхностные эрозии, афты. Выздоровление наступает через
2-3 недели, однако у 40% пациентов возникают рецидивы. Во время
рецидивов общеинфекционный синдром отсутствует или слабо выражен.
Острое респираторное заболевание, вызванное ВПГ, нс имеет
типичных клинических проявлений и диагностируется крайне редко.
288
Возможно развитие рецидивирующих фарингитов.
Поражение глаз (офтальмогерпес).
Первичный офтальмогерпес развивается у людей, не имеющих
противовирусного иммунитета. Заболевание наблюдается чаще у детей в
возрасте от 6 мес. до 5 лет и у взрослых в возрасте от 16 до 25 лет.
Первичный офтальмогерпес протекает тяжело, часто сочетается с
распространенными поражениями кожи, век, слизистых оболочек полости
рта.
Рецидивирующий офтальмогерпес протекает в виде
блефароконъюнктивита. везикулезного и древовидного кератита,
рецидивирующей эрозии роговицы, эписклерита или иридоциклита, а в ряде
случаев — в виде хориоретинита или увеита. Этиология кератитов в 66%
связана с вирусами простого герпеса. Герпетическими кератитами
обусловлено более 60% роговичной слепоты.
Поражение половых органов (генитальный герпес) — одна из наиболее
частых клинических форм инфекции.
Чаще всего генитальный герпес протекает бессимптомно. ВПГ может
персистировать у мужчин в мочеполовом тракте, а у женщин — в канале шейки
матки, влагалище и уретре. Лица с бессимптомным генитальным герпесом
служат резервуаром инфекции.
Генитальный герпес особенно тяжело протекает при первичном
инфицировании, сопровождаясь лихорадкой и признаками интоксикации.
После инкубационного периода продолжительностью около 7 дней на
половых органах развиваются отек и гиперемия, затем появляются
везикулярные высыпания на половом члене, в области вульвы, влагалища и
промежности. Сыпь, как правило, обильная и сопровождается региональным
лимфаденитом. Везикулы быстро лопаются, образуя эрозивные, эрозивно-
язвенные поверхности. Все это сопровождается чувством жжения, зудом,
мокнутием, болезненностью, затрудняет, нередко делает невозможными
половые контакты, что приводит к развитию невротических состояний.
У 50-75% людей после первичного инфицирования возникают
рецидивы, имеющие аналогичную клиническую симптоматику. Поражения,
в ряде случаев, нс ограничиваются наружными половыми органами. В
патологический процесс вовлекаются , у женщин—влагалище, цервикальный
канал, шейка и полость матки, яичники, уретра, мочевой пузырь; у мужчин
— уретра, мочевой пузырь, предстательная железа, семенники. И у мужчин,
и у женщин при орогенитальных контактах поражаются миндалины,
слизистая оболочка полости рта, при аногенитальных — область ануса,
прямая кишка.
19. Заказ»К-4451.
289
У людей с тяжелым иммунодефицитом, в т.н. у больных ВИЧ-инфекцией
в стадии СПИДа, развиваются тяжелые язвенно-некротические поражения
половых органов. Язвенно-некротические поражения у мужчин
гомосексуалистов нередко располагаются в области ануса с поражением
прямой кишки.
В то же время, по мере рецидивирования выраженность местных
изменений несколько стихает и могут наблюдаться абортивные формы. При
этих формах типичные везикулезные высыпания отсутствуют или появляются
единичные элементы на короткое время. Больных беспокоят чувство жжения,
зуд, незначительные гиперемия, отек кожи и слизистых половых органов.
У женщин рецидивирующий герпес, вызванный ВПГ2, может привести
к возникновению карциномы шейки матки.
Поражение нервной системы. К локализованным и распространенным
формам относятся ганглионит, ганглионеврит, радикулоневрит, которые могут
сопровождаться высыпаниями, но нередко протекают без них.
Генерализованный простой герпес.
Выделяют висцеральную и диссеминированную формы
генерализованного ПГ. При висцеральной форме имеет место поражение
одного органа или системы. Возникают серозный менингит,
менингоэнцефалит, гепатит, пневмония и т.п. Описана возможность
проникновения ВПГ в мозг гематогенным или ретроаксональным, из ганглиев
нервов, путями. Нс исключается первичное размножение вирусов в ганглиях
с последующим распространением в мозг, или непосредственно в клетках
мозговой ткани (глиальных, нейрональных).
Диссеминированная форма ПГ, встречающаяся только у лиц с тяжелой
иммуносупрессией и у детей до 1 мес., относится к СПИД-индикаторным
болезням. Течение ее укладывается в клинику вирусного сепсиса —
поражение многих органов и систем сопровождается лихорадкой,
интоксикацией, геморрагической сыпью, кровотечениями. Развиваются
тяжелый гепатит, тяжелый диффузный менингоэнцефалит, бронхопневмония,
кератоконъюнктивит, синдром ДВС. Во всех пораженных органах -
обширные некрозы, геморрагические поражения. Летальность составляет
80%.
Врожденная инфекция, вызванная ВПГ, возможно, встречается чаще,
чем диагностируется. Так же, как и приобретенная, она может протекать в
локализованной, распространенной и генерализованной формах.
Диссеминированная инфекция характеризуется развитием гепатита,
энцефалита, пневмонита, с поражением кожи и слизистых оболочек или без
таковых. Если лечение не проводится, летальность достигает 65%.
Диагностика. Используются вирусологические, иммунологические и
серологические методы исследования.
290
Одним из наиболее чувствительных и специфических методов для
установления диагноза является выделение ВПГ на чувствительных клеточных
культурах.
Серологические методы (РСК, ИФА) выявляют антитела к ПГ. Эти
методы имеют лишь относительную диагностическую ценность, не
позволяют с достаточной степенью достоверности установить этиологию
той или иной формы болезни и могут служить лишь для ретроспективной
диагностики.
Более доступным является метод экспресс-диагностики для
обнаружения вирусных антигенов в биосубстратах. Для этого можно
использовать реакцию иммунофлюоресценции.
В последнее время все большее значение приобретают молекулярно-
биологические методы, в основе которых лежит выявление
вирусспсцифических нуклеиновых кислот в исследуемом материале.
Наибольшей чувствительностью для выявления ДНК герпесвирусов
характеризуется полимеразная цепная реакция (ПЦР).
Такие методы, как цитологические, электронная микроскопия,
являются неспецифичными и мало информативными.
Лечение. Терапия больных ПГ индивидуальна и зависит от формы
инфекции, тяжести, частоты рецидивов.
При локализованных кожно-слизистых формах, протекающих легко, с
необширными поражениями и редкими рецидивами (1 раз в 6 мес. и реже)
можно ограничиться любыми патогенетическими, симптоматическими
препаратами, которые обладают дезинфицирующим, подсушивающим,
эпителизирующим эффектом.
Если ПГ рецидивирует часто (1 раз в 3 мес. и чаще), либо причиняет
пациенту' физический или моральный ущерб даже при редких рецидивах,
требуется особый подход к терапии, который определяется как система
этапного лечения. В систему этапного лечения входит купирование острого
процесса в период рецидива, проведение противорецидивной терапии и
диспансерное наблюдение.
В период рецидива лечение начинают одним из противовирусных
препаратов, при этом его используют как можно раньше (желательно до
появления везикул). Одним из эффективных препаратов является ацикловир,
который действует исключительно в клетке, пораженной вирусом, что
обеспечивает ему низкую токсичность.
Ацикловир имеет различные коммерческие названия: зовиракс.
виролекс, цикловиран и др. Выпускается:
— для парентерального применения: флаконы по 250 мг в виде
натриевой соли,
— для перорального применения: таблетки и капсулы по 200 мг. 400
мг. 8(Ю мг- суспензия (в 5 мл 200 мг препарата),
>9* 291
— для наружного применения: крем 5%, глазная мазь 3%.
Доза и курс ацикловира зависят от длительности болезни, частоты
рецидивов, распространенности поражения и составляет от 200 мг 5 раз в
день в течение 5 дней до 400 мг 5 раз в день в течение 7-14 дней. Детям
старше 2 лет препарат назначают в такой же дозировке.
Особенно интенсивным должно быть лечение пациентов с различными
иммунодефицитными состояниями, распространенной, генерализованной
формами ПГ, особенно на фоне ВИЧ-инфекции. Таким больным (взрослым
и детям старше 12 лет) ацикловир можно назначать внутривенно 5-15 мг/кг
массы тела каждые 8 часов в течение 5-7 дней, при необходимости дольше,
возможно, с переходом на пероральный прием.
В настоящее время появились ацикловирустойчивые штаммы вируса,
что потребовало производства новых препаратов. В клинической практике
используются ганцикловир, фоскарнет, вальтрекс, преимущественно при
тяжелых формах инфекции.
Валацикловир (вальтрекс) — от 1 000 мг до 1500 мг в сутки в течение
7 дней в таблетках.
Фамвир (фамцикловир) — от 500-600 мг до 1500 мг в сутки в течение
7 дней в таблетках.
Ганцикловир (цимсвсн) — 1-5 мг/кг массы в сутки (2 раза в день) при
тяжелых, распространенных, генерализованных формах ПГ внутривенно, в
течение 2-3 недель.
Фоскарнет (фоскавир) — 40-60 мг/кг массы внутривенно каждые 8
часов при тяжелых и генерализованных формах ПГ.
Перспективно использование препаратов нового поколения:
цидофовира, флацитобина, зонавира. пенцикловира. а так же лобукавира.
который используется и при ВИЧ-инфекции. Возможно назначение и других
противовирусных препаратов:
— Рибавирин (виразол, рибамидил, виремид) — перорально в капсулах
по 200 мг 3-4 раза в сутки в течение 7-10 дней. Детям — по 10 мг/кг массы
тела в сутки за 3-4 приема, 7-10 дней.
— Алпизарин выпускается в виде таблеток 0,1 г и мази (2% и 5%).
Назначается индивидуально в зависимости от формы и течения ПГ в дозе:
0.1-0,3 г 3-4 раза в сутки в течение 7-10 дней.
— Хслспин (хелышн, бривудин) — таблетки по 0,125 г и мазь (1% и
5%), взросльм — 4 таблетки в сутки 4-10 дней, детям 5 мг/кг массы тела 3
раза в день 5 дней.
— Флакозид — применяется в таблетках 0,1 -0,5 г 3 раза в сутки 5-10
дней.
— Полиром — таблетки 0.3 г в сутки 3 дня; 2% гель или мазь местно.
— Тромантадин — 1 % гель местно и другие препараты.
— Арбидол — в таблетках по 0.1 г 3 раза в сутки 5 дней.
292
Препараты для перорального и парентерального использования
обязательно сочетают с противовирусными средствами для местного
применения.
Мазью и кремом начинают пользоваться при появлении первых
признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают
вплоть до эпителизации эрозий. Рано начатое местное лечение может
прервать патологический процесс и не допустить развитие везикул.
Назначают одну из следующих противовирусных мазей или кремов, отдавая
предпочтение той, которая аналогична принимаемым таблеткам:
— зовиракс — крем 5%, 5 раз в день,
— алпизарин мазь 2%, 4-6 раз в день,
— оксолин — мазь 1%-2%, 2-3 раза в день,
— пандавир (полиэтерин, азаломицин М, гелексин) — мазь 1%, 2-3
раза в день,
— теброфен— мазь 2%-3%-5%, 2-4 раза в день,
— трифлюридин— мазь 0,5%, 2-3 раза в день,
— тромантадин — гель 1%, 3-4 раза в день,
— флореналь — мазь 0,5%, 2-3 раза в день,
— бромуридин — мазь 2%-3%, 2-3 раза в день.
Патогенетическая терапия направлена на нормализацию функции
иммунной системы организма, в т.ч. на активацию системы интерфероновой
защиты.
В ранний период рецидива показано введение специфического
иммуноглобулина внутимышечно 1,5-3 мл ежедневно в течение 5-10 дней.
Перед назначением средств, обладающих воздействием на иммунную
систему, рекомендуется провести исследование иммунограммы, а также
показателей интерферонового статуса.
При значительных нарушениях выработки интерферона для коррекции
назначают интерфероны: реальдирон, реаферон, интрон-А, виферон и др.
Можно использовать индукторы интерферона, благодаря которым в
организме человека стимулируется выработка эндогенного интерферона. С
этой целью назначают один из препаратов:
- циклоферон — внутримышечно по 2 мл 5 инъекций (1, 2, 4, 6, 8 дни),
- ларифан — мазь 0,05% 3-4 раза в день или подкожно в дозе 10 мг (1
ампула) 4 инъекции с интервалом в 3 дня, курс не более 2-х недель,
- госсипол - 3% мазь,
- мегасин -3% мазь,
- мефенаминовая кислота — в таблетках по 0,5 г после еды 5-10 дней,
- ридостин - ампулы по 8 мг, 1 раз в день в течение 2 дней с перерывом
4-5 дней, курс 3 недели,
- нсовир — 250 мг подкожно 3 дня ежедневно, затем 2 недели через день.
293
Обосновано сочетанное использование противовирусных
химиопрепаратов с альфа-интерферонами или его индукторами, обладающее
синергетическим потенцирующим эффектом и тормозящее развитие
мутантов. С этой целью интерфероны назначают в дозе 1 млн. ЕД
внутримышечно 1 раз в сутки в течение 10 дней. Возможно местное
назначение интерферона в чередовании с противовирусными мазями.
При нарушениях клеточного иммунитета возможно назначение
тимогена, Т-активина, тималина и т.п.
Кроме того применяются неспецифические средства: дибазол,
мстилурацил. витамины С, Е, А, поливитамины с микроэлементами.
Рекомендуются растительные адаптогены, которые назначают на исходе
рецидива: элеутерококк, аралия мань-чжурская, заманиха, левзея, женьшень,
китайский лимонник, солодка и др.
При выраженном отеке, чувстве жжения, зуде в качестве
патогенетической терапии применяют нсстероидныс противовоспалительные
препараты (индометацин, вольтарен и др.). При необходимости назначают
симптоматические средства.
Противорецидивное лечение также является комплексным и состоит
из назначения противовирусных и патогенетических препаратов.
В период ремиссии, за 10-14 дней до предполагаемого рецидива,
рекомендуется один из противовирусных препаратов, доза и iwpc которого
индивидуальны. При этом подбирается наиболее эффективный препарат,
поддерживающая доза, учитывается его переносимость, поскольку при часто
рецидивирующем герпесе возможно длительное лечение прерывисто-
курсовым методом (12 месяцев и дольше).
Противовирусные мази должны использоваться в межрецидивный
период постоянно — смазываются места привычных высыпаний. Желательно
чередовать мази с периодичностью в 3-4 недели.
Обязательно назначение ьурсов интерферона и/или его индукторов,
растительных адаптогенов, нсспецифичсских иммуномодуляторов,
витаминов С, Е. А.
Критериями эффективности проводимого этапного лечения являются
следующие:
— увеличение продолжительности ремиссии в 2 раза и более,
— уменьшение площади поражения,
— уменьшение местных симптомов воспаления (отек, зуд и т.д),
— уменьшение продолжительности высыпаний,
— укорочение времени эпителизации.
— исчезновение или уменьшение общеинфекционного синдрома.
Если есть положительная динамика хотя бы по 1 -2 параметрам, лечение
можно считать успешным. Необходимо информировать больного о
хроническом характере инфекции, нс представляющей угрозы для жизни, и
критериях эффективности проводимой терапии.
294
Профилактика ПГ такая же, как предупреждение контактных инфекций
(вирусный гепатит В) и болезней, передаваемых половым путем.
Разрабатываются вакцины для специфической профилактики ПГ.
Эффективная и безопасная вакцина должна обладать минимальной
вирулентностью и максимальной иммуногенностью, должна стимулировать
образование полноценного иммунитета, но не вызывать реактивации
латентного штамма и нс инфицировать человека. В настоящее время
проводится работа над созданием подобных вакцин в США, Великобритании,
Франции.
7.2. Ветряная оспа, опоясывающий герпес
Этиология. Варицслла-зостер-вирус (ВЗВ), являясь представителем
альфагсрпесвирусов, обладает морфологическими характеристиками,
сходными с другими вирусами этого семейства, в частности, с ВПГ.
Эпидемиология. Источником инфекции является человек, больной
ветряной оспой (ВО) или опоясывающим герпесом (ОГ), представляющий
опасность с конца инкубационного периода до отпадения корок. Заболевание
передается воздушно-капельным путем и является высококонтагиозным.
Первая встреча с вирусом происходит в первые 6-8 лет жизни у 90% людей и
проявляется ветряной оспой. У людей, переболевших ветряной оспой,
сохраняется иммунитет к реинфекции из экзогенных источников. Случаи
повторного заболевания практически неизвестны. Однако около 5% женщин
детородного возраста не имеют иммунитета и могут заболеть ВО, что
определяет еще один путь передачи инфекции — вертикальный.
Инфицирование беременной ВЗВ на ранних сроках может привести к
развитию эмбриопатий, гибели плода, на поздних - к развитию тяжелого
заболевания новорожденного, в 30% случаев заканчивающегося смертью
ребенка.
Редкими являются контактный и парентеральный пути заражения, в
основном, когда источником инфекции является больной вторичной
(рекуррентной) инфекцией — опоясывающим герпесом.
Патогенез. Вирус варицелла-зостср, попавший в нсиммунный
восприимчивый организм, как пра-вило, воздушно-капельным путем,
реплицируется в носоглотке и/или верхних дыхательных путях. При
первичной, ост-рой ВЗВ-инфскции, которая обычно проявляется клиникой
ветряной оспы (ВО), вирус проявляет прежде все-го эпитслиотропные
свойства с развитием генерализованной инфекции. Впоследствии ВЗВ
продвигается центробежно вдоль чувствительных нервов к спинальным
ганглиям и ганглиям черепномозговых нервов. Механизм, обеспечивающий
латентность вируса, определяется действием специальных ви-русных генов,
а также ассоциацией вирусов с клетками подходящего типа. Вирус может
персистировать в черепномозговых и спинальных ганглиях и ЦНС, роговице
295
и кератоцитах, мононуклеарных клетках, пищеводном сплетении. В сохранении
и реактивации вируса играют роль нейроны и ненейронные клетки.
Реактивация вируса - основа клинической манифестации хронических
форм инфекции. Реактивация латентного вируса с последующей репликацией
может сопровождаться бессимптомным шеддингом вируса, проявляться на
субклиническом уровне, приводить к пораже-нию различных отделов нервной
системы и внутренних органов, а также к тяжелой неврал-гии и
распространению вируса вдоль по сенсорному нерву, что проявляется
клиникой опоясывающего герпеса (ОГ) с высыпаниями на покровных тканях.
Процесс сопровождается вирусемией, которая у иммуносохранных лиц
продолжается 2-3 недели, тогда как при выраженном иммунодефиците может
длиться долго, в течение меся-цев. На фоне иммуносупрессии поражаются
также слизистые оболочки мочевыводящих путей, желудочно-кишечного
тракта. Изменения можно обнаружить в печени, почках, легких и других
органах.
Помимо кожных изменений, вирус при ОГ вызывает острую
воспали-тельную реакцию в задних корешках спинного мозга и
соответствующих церебральных ганглиях. При реактивации вируса в
клинической картине на первый план выступают не столько
эпителиотропные, сколько нейротропные его свойства. Персистенция вируса
на поверхности ней-ронных клеток приводит к снижению их функциональных
способностей и, как следст-вие, возникновению болевого синдрома. До
настоящего времени мало понятным остается механизм формирования
постзостсрной невралгии (ПЗН).
Ветряная оспа (первичная инфекция ВЗВ).
Клиника. Инкубационный период от 10 до 23 дней. У одних детей
заболевание начинается остро с повышения температуры до 38-39°С, а затем
к концу первых - на вторые сутки появляется характерная сыпь. У других —
внезапно на фоне незначительной лихорадки или даже при нормальной
температуре на различных участках кожи, в том числе волосистой части
головы, появляются пятна, которые в течение нескольких часов превращаются
в папулы, а затем в пузырьки — везикулы. При легкой, среднетяжслой формах
сыпь отсутствует на коже ладоней и подошв.
Везикулы разной величины, мягкие на ощупь, без инфильтрированного
основания, иногда с пупкообразным вдавлением в центре, держатся 1 -2 дня,
затем подсыхают, оставляя после себя корочки без нагноения. Некоторые
везикулы нагнаиваются, превращаются в пустулы с мутным желтовато-
зеленым содержимым, через 2-3 дня тоже образуется корочка. После
отпадения корочек (а это происходит через 6-10 дней после их образования),
дефектов кожи, как правило, нс остается. Особенностью ВО является
подсыпание новых элементов сыпи в течение 6-8 дней. Поэтому у одного и
296
того же больного можно обнаружить сыпь на разных стадиях развития - пятна,
папулы, везикулы, пустулы, корочки.
Наряду с высыпаниями на коже обнаруживают энантему на слизистой
щек, языка, мягкого и твердого неба, миндалин, глотки — вначале это
небольшие пузырьки, затем быстро заживающие эрозии.
У ослабленных детей и взрослых ВО сопровождается более длительной
лихорадкой, тяжелой интоксикацией, обильными высыпаниями на различных
участках кожи, в том числе на подошвах и стопах, слизистой трахеи, бронхов,
мочеполовых путей. Сыпь может приобретать буллезный, геморрагический
характер, приводить к гангренозным изменениям кожи и слизистых оболочек.
Такие формы ВО называются гангренозной, геморрагической.
Тяжелыми осложнениями являются пневмония, энцефалит, миокардит,
гепатит. Более высокому риску развития тяжелых форм генерализованной
инфекции с угрозой для жизни подвергаются лица с наследственным
иммунодефицитом, получающие иммунодепрессанты, а также ВИЧ-
инфицированные.
Врожденная инфекция. Случаи внутриутробного заражения ветряной
оспой редки. Инфицирование плода на ранних сроках приводит к порокам
развития. Если плод инфицирован незадолго до окончания беременности,
то возникает типичная ветряная оспа разной степени выраженности. У детей,
зараженных внутриутробно, редко, но встречается опоясывающий герпес в
раннем возрасте.
Диагностика. В типичных случаях не представляет трудности и
основывается на клинико-эпидемиологических данных. При необходимости
верификации используют те же лабораторные методы исследования, что и
при простом герпесе.
Лечение. Госпитализируются больные с тяжелыми, осложненными
формами ВО, остальных лечат дома. Назначают постельный режим на 6-7
дней, молочно-растительную диету, обильное питье. Особое внимание
уделяют чистоте постельного белья, обработке элементов сыпи 2 раза в день
спиртовыми растворами анилиновых красок, уходу за полостью рта.
По показаниям проводится симптоматическая терапия.
Больным с тяжелыми и среднетяжелыми формами ВО, на фоне
иммуносупрессии назначают противовирусные препараты в среднеих
терапевтических дозах сроком на 3 - 5 дней (зовиракс, виролекс, алпизарин,
хелепин и др. - см. «Простой герпес»), которые обладают высокой
эффективностью при этой инфекции.
Имеется специфический иммуноглобулин, который также может быть
использован в лечении.
Опоясывающий герпес
(вторичная, син.: возвратная рекуррентная инфекция ВЗВ).
297
Клиника. Различают локализованную, распространенную и
генерализованную формы ОГ (таблица 45).
Таблица 45
Клиническая классификация инфекции, вызванной ВЗВ
А. Первичная В. Вторичная (персистентная)
I. Латентная II. Манифестная Ветряная оспа Опоясывающий герпес
- легкая - средне-тяжелая - тяжелая без осложнений с осложнениями: - менингоэнцефалит - пневмония 1. Локализованные формы Нервная (ганглионевропатия. гангл ио радику л опатия) кожно-слизистая (поражения кожи и/или слизистых в пределах 1 дерматома) а)типичная б) язвенно-некротическая 2. Распространенные формы кожно-слизистые (поражения кожи, слизистых оболочек, глаз, органов слуха, половых органов и др. в пределах 1 пли нескольких дерматомов с распространением очагов поражения за пределы дерматома 3. Генерализованные формы а) висцеральные менингит менингоэнцефалит пневмония гепатит и др. б) диссеминированные - поражение 2-3 и более органов
Примеры клинического диагноза: Опоясывающий герпес, распространенная форма, ганглионит Гассерова узла справа, поражение кожи лица, кератоконъюнктивит. Опоясывающий герпес. локализованная нервная форма. | ганглионсврпт Th4 слева.
Из локализованных форм наиболее часто встречается ганглио-
кожная. при которой в процесс вовлекаются межпозвоночные ганглии
грудного, реже поясничного отдела. Болезнь начинается внезапно, с
появления жгучих болей по ходу ветвей пораженного чувствительного
нерва в месте будущих высыпаний, которые продолжаются в течение 3-4
298
дней, а иногда — 10-12 дней. Нередко боли становятся нестерпимыми,
усиливаются при малейшем прикосновении к коже, при охлаждении,
движении. Затем возникают гиперемия и инфильтрация кожи пораженной
области, на фоне которых образуются пузырьки, заполненные прозрачным
содержимым, вначале единичные, а в последующем их становится все
больше, группируясь, они занимают большую поверхность кожи. Серозное
содержимое пузырьков быстро мутнеет, образуются пустулы, которые
лопаются, засыхают и превращаются в корочки. Процесс завершается через
1-3 недели эпителизацисй. Кожные изменения часто сопровождаются
лихорадкой, интоксикацией. Неврологические боли обычно уменьшаются с
появлением высыпаний, но у части больных сохраняются несколько месяцев
и даже лет, что обусловлено развитием ганглионита, ганглионеврита.
Реже наблюдается глазная и ушная формы ОГ. При глазной форме
поражается ганглий тройничного нерва (Гассеров узел) и высыпания
локализуются по хода ветвей тройничного нерва — на слизистых оболочках
глаза, носа, коже лица. Типично поражение кожи и слизистых оболочек с
одной стороны лица. Особенно опасно высыпание пузырьков на роговице,
что сопровождается явлениями кератита с последующим образованием
рубцов и нарушением зрения. Ушная форма ОГ характеризуется поражением
коленчатого узла лицевого нерва. Высыпа-ния располагаются на ушной
раковине и вокруг нее, в наружном слуховом проходе. Может развиться
паралич лицевого нерва. Глазная и ушная формы ОГ характеризуются
выраженным болевым синдромом, который может сопровождаться
интоксикацией.
На фоне иммунодефицита развивается гангренозная (некротическая)
форма болезни. Обильные сливающиеся пузырьковые высыпания быстро
превращаются в пустулезные, лопаются, покрываются сплошной коркой,
после отпадения которой образуются эрозии и глубокие язвы. Некротическая
ткань отторгается, оставляя значительные дефекты, заживление которых
происходит длительно путем рубцевания.
Наряду с локализованными формами ОГ, протекающего с поражением
кожных покровов, есть формы инфекции, при которых высыпания
отсутствуют. Это абортивные формы, единственным проявлением которых
являются ганглионит, нейропатии. Диагностировать абортивную форму
крайне сложно, поэтому пациенты лечатся у невропатологов, которые
устанавливают синдромальный диагноз: невропатия лицевого, тройничного
нервов, межреберная невралгия и др., не расшифровывая этиологию.
Иммунодефицит определяет и распространненую форму ОГ, когда
везикулезные высыпания появляются не только по ходу нервов, но и на других
участках кожи и слизистых оболочек, носят дискретный характер и
напоминают ветряную оспу.
299
Такая форма ОГ нередко встречается у больных лимфолсйкозом, острым
лейкозом, лимфогранулематозом и у пациентов, длительно получающих
кортикостероидные, цитостатические препараты.
Особенность течения опоясывающего герпеса у ВИЧ-инфицированных
заключается в развитии рецидивирующего течения у лиц любого возраста.
Поражения кожи могут сопровождаться развитием язвенно-некротических
процессов, рубцов, пигментаций, протекают длительно с присоединением
бактериальных инфекций.
Генерализованная форма ОГ может быть висцеральной и
диссеминированной. При висцеральной форме в патологический процесс
вовлекается какой-то один орган. Так, при поражении черепных нервов
(ушной и глазной ОГ) нередко развивается серозный менингит. Поэтому,
если у больного возникли даже минимально выраженные общемозговой и
оболочечный синдромы, его необходимо госпитализировать. У ослабленных
пациентов довольно высока вероятность развития энцефалита, нейропатии
различной локализации. Иногда возникают гепатит, пневмония.
Диссеминированная форма ОГ наблюдается редко. Повышенному
риску развития такой формы (около 10%) подвергаются лица с
иммунологической недостаточностью — ВИЧ-инфекция, заболевания крови,
онкологическая патология, пересадка органов, особенно костного мозга.
Летальность при диссеминированном ОГ достигает 60%.
Опоясывающий герпес обычно встречается у лиц старше 40 лет при
возникновении факторов, приводящих к иммуносупрессии — респираторные
инфекции, перегревание, переохлаждение и пр., а также у всех других,
имеющих причины для развития иммунодефицита.
Как правило, ОГ нс рецидивирует. Рецидив ОГ у пациента обязывает
искать причину иммунологической недостаточности, в т.ч. обследовать на
ВИЧ-инфекцию, если этот пациент молодого возраста или нс найдено других
причин.
Используются специфические лабораторные методы диагностики,
такие же, как при простом герпесе и ветряной оспе.
Лечение. Больные тяжелыми, генерализованными формами ОГ
подлежат стационарному лечению. Поскольку они являются источниками
инфекции для неиммунных людей, госпитализация проводится в
инфекционный стационар.
Помимо симптоматической терапии, направленной на купирование
болевого синдрома, предупреждения вторичного инфицирования везикул и
т.д., назначаются противовирусные препараты перорально и местно с первых
дней болезни (см. раздел «Лечение простого герпеса»). Применяют высокие
дозы препаратов весь период активной инфекции до прекращения высыпания
и появления корочек с целью предупреждения постзостерной невралгии:
300
ацикловир назначают в таблетках по 800 мг 5 раз в сутки 7-10 дней, а при
генерализованных формах, иммунодефицитных состояниях - парентерально
5-10 мг/кг 3 раза в сутки;
ганцикловир 5 мг/кг в сутки внутривенно 2 недели;
фамвир 250 мг 3 раза 7 дней, при риске развития или развивающейся
постзостерной невралгии, при иммунодефицитных состояниях - 500 мг 3
раза в сутки 7-10 дней;
вальтрекс 1000 мг 3 раза в сутки 7 дней.
В лечении также применяют препараты интерферона.
Для купирования болевого синдрома, отека, чувства жжения
используют нестсроидныс противовоспалительные препараты.
Следует предостеречь от назначения больным ОГ кортикостероидных
препаратов, в т. ч. мазей.
При невралгиях рекомендуется карбамазепин (тсгретол, финлспсин)
100-200 мг утром и вечером в первые сутки, затем дозу можно повышать на
100 мг ежедневно до 800-1000 мг/сутки в зависимости от интенсивности
боли. С этой же целью назначают леривон - в первый день 1/4 таблетки (в 1
таб.-ЗО мг) на ночь, 2 день - 1/2 таб., 3 день - 3/4 таб., с 4 дня по 1 таб. 2
недели. Анальгетическое действие оказывают этосуксимид, триметин,
клоназепам, сердалут.
Эффект могут оказать физиотерапевтические методы лечения.
Лечение постгерпетических невралгий представляет большие
трудности. Наряду с методами лечения, разработанными невропатологами
(медикаментозные, плазмофорез, иглоукалывание, физиотерапия и др.),
может быть предпринята попытка использовать противогсрпетические
препараты в высоких дозах длительным курсом, например, зовиракс до 4000
мг/сут 10-14 дней.
Профилактика. Больной ветряной оспой изолируется до
выздоровления (5 день после появления последнего элемента сыпи, при этом
могут оставаться не отпавшие корочки).
На контактных детей в возрасте до 7 лет, не болевших ВО.
накладывается карантин с 11 по 21 день от момента разобщения с больным.
В настоящее время разработана и прошла клинические испытания
вакцина против ВЗВ, которая оказалась эффективной и безопасной. Вакцина
обеспечивает защиту всех серонегативных лиц, но по-видимому, она будет
иметь особое значение у детей, получающих иммунодепрессанты.
Пассивная иммунотерапия используется для профилактики ВЗВ-
инфскции у беременных и новорожденных в случае контакта. С этой целью
применяется специфический иммуноглобулин - не раньше, чем через 2 дня
и не позже, чем через 4 дня после контакта с ВЗВ.
301
7.3. Вирусная инфекция Эпштейн-Барр
Этиология. Вирус ЭБ - вирус герпеса человека 4 типа. Обладает
тропизмом к В-лимфоцитам.
Кроме лимфоцитов, ВЭБ способен поражать эпителиальные клетки,
которые становятся источником вируса в организме.
Эпидемиология. Источником инфекции является человек,
инфицированный ВЭБ, независимо от наличия или отсутствия клинических
симптомов. Основной механизм передачи инфекции—контактный, который
реализуется контактно-бытовым, половым путями. Возможен воздушно-
капельный путь передачи, не являющийся ведущим. ВЭБ передается от
матери к плоду. Известны искусственные пути передачи вируса при
гемотрансфузиях, трансплантации органов и др.
ВЭБ широко циркулирует среди населения — 50% детей и 85%
взрослых имеют антитела к вирусу.
Наиболее часто регистрируется инфекционный мононуклеоз -
первичная инфекция ВЭБ. Максимальная частота заболеваемости
наблюдается в возрасте 14-18 лет. Вирус может выделяться во внешнюю
среду в течение 18 мес. после первичной инфекции. У 15-25% здоровых
серопозитивных лиц вирус выделяют из смывов ротоглотки, а у
иммунодефицитных в 25-50% случаев.
Распространению инфекции ВЭБ способствуют низкий уровень
санитарно-гигиенических навыков, сексуальной культуры, неблагополучное
социально-экономическое положение.
Патогенез. У подавляющего большинства людей первая встреча с
вирусом протекает бессимптомно и лишь у небольшого числа проявляется
синдром инфекционного мононуклеоза - первичная инфекция ВЭБ
продуктивного типа. Если вирус попадает в организм со слюной, то
первичным местом его репликации служит эпителий ротоглотки, где ВЭБ
может не только размножаться, но и персистировать. Далее вирус проникает
в эпителиальную и лимфоидную ткань, на месте внедрения развивается
воспалительная реакция. Размножившийся в эпителиальных и лимфоидных
тканях вирус попадает в кровь и гематогенным путем в регионарные
лимфоузлы, затем отдаленные и в органы, богатые лимфоидной тканью, что
проявляется лимфаденопатией и гепатосплсномегалией. В-лимфоциты
поддерживают продуктивную инфекцию, вызванную ВЭБ, и являются
клетками, имеющими поверхностные рецепторы для вируса (CD21). В
небольшой части В-лимфоцитов вирус может существовать латентно.
У больных с иммунодефицитом может наблюдаться генерализация
инфекции с поражением многих органов и систем. Чаще возникают серозный
менингит, менингоэнцефалит, полирадикулонсврит.
Клиника. Клинические варианты течения вирусной инфекции ЭБ
представлены в таблице 46.
302
Таблица 46
Клиническая классификация инфекции, вызванной ВЭБ
ПЕРВИЧНАЯ ВТОРИЧНАЯ
Инфекционный мононуклеоз - типичный - атипичный - стертый Нейроинфекнионные поражения Опухоли: - лимфома Беркита - носоглоточная карцинома - лейкоплакии - В-клеточная лимфома Нейроинфекционные поражения Хронический инфекционный мононуклеоз
Инфекционный мононуклеоз
Инфекционный мононуклеоз — вирусная болезнь,
характеризующаяся поражением лимфатической ткани и протекающая с
лихорадкой, тонзиллитом, увеличением лимфоузлов, печени, селезенки,
изменением периферической крови.
Патогенез. В организм человека вирус проникает через слизистую
оболочку верхних дыхательных путей и попадает в кровь, поражая В-
лимфоциты. Последние начинают активно делиться, что приводит к
появлению в периферической крови большого количества атипичных
клеток — мононуклеаров. В результате заболевания формируется стойкий
иммунитет. У части больных инфекция принимает хроническое или
латентное течение и проявляется у лиц с нарушением функции иммунной
системы. Именно поэтому инфекционный мононуклеоз считается СПИД-
индикаторным заболеванием.
Клиника. Инкубационный период — 5-15 дней. Заболевание
начинается остро ознобом, лихорадкой. С первых дней болезни
отмечаются боли в горле при глотании. Тонзиллит может быть выражен в
различной степени — от катарального до язвенно-некротического.
Одновременно нарастает интоксикация - слабость, недомогание, миалгии.
У части больных наблюдается эритематозно-розеолезная сыпь.
Характерным признаком является увеличение лимфоузлов, что
наблюдается у 90% больных и сохраняется в среднем около 3 недель.
Характерный симптом - гепато- и спленомегалия (у 50%). У некоторых
больных появляется желтуха, увеличиваются показатели концентрации
билирубина (преимущественно за счет непрямой фракции) и активности
АлАТ.
Инфекционный мононуклеоз — заболевание довольно длительное.
Лихорадка держится до 2-3 недель, а увеличение печени и селезенки — 3-4
303
недели и более. Болезнь может протекать в легкой, среднетяжелой и тяжелой
формах. В разгар болезни у 25% больных возникают различные кожные
высыпания — эритематозные, розеолоподобные и др.
Осложнения встречаются редко.
В ряде случаев может иметь место и подострое начало заболевания с
продромальными явлениями: на фоне общего недомогания отмечается
субфебрильная температура, нерезко выраженные катаральные симптомы.
У отдельных больных ведущей жалобой является боль в животе, чаще
в правой подвздошной области, иногда наблюдается тошнота и рвота, вздутие
живота, задержка стула или понос. Заболевание может развиваться и
незаметно; при этом первым симптомом, который заставляет больного
обратиться к врачу, является увеличение лимфатических желез.
У людей с иммуносупрессией встречается фатальный инфекционный
мононуклеоз, протекающий с тяжелыми осложнениями, которые могут
привести к смерти.
Имеются сообщения о спорадическом или связанном с хромосомой X
бурном течении инфекционного процесса (Х-лимфопролифсративный
синдром - Х-ЛП), сопровождающемся пролиферацией лимфатической ткани
и дисфункцией печени и заканчивающемся смертью 40% больных (мужчин)
в случае первичной инфекции. У больных развиваются тяжелые
иммунологические или гематологические нарушения.
Осложнениями инфекционного мононуклеоза являются:
- гематологические: аутоимунная гемолитическая анемия,
тромбоцитопения, гранулоцитопения:
- кардиологические: перикардит, миокардит;
- неврологические: менингит, менингоэнцефалит, миелит, нейропатия:
- разрыв селезенки.
Известна хроническая форма инфекционного мононуклеоза.
При увеличении бронхолегочных лимфатических желез больных может
беспокоить кашель, при увеличении кардиальных лимфоузлов — боли в
области сердца разной интенсивности и продолжительности.
Своеобразные изменения отмечаются со стороны крови. В первые дни
болезни наблюдаются умеренная лейкопения, нейтропения, лимфоцитоз,
появляются плазматические клетки. На 4-5-й дни болезни и позже развивается
лейкоцитоз до 10-12х10ч/л, увеличивается количество лимфоцитов,
моноцитов и плазматических клеток, появляются своеобразные атипичные
мононуклсары, отличающиеся большим полиморфизмом по форме и
структуре.
В большинстве случаев атипичные мононуклеары обнаруживают в
крови в первые дни болезни, но особенно их число увеличивается в разгар
болезни. Реже появление мононуклеаров может быть отмечено на 8-11 дни
304
болезни. Атипичные мононуклеары обнаруживают у 50% детей и 90-95%
взрослых. Эти клетки сохраняются на протяжении нескольких недель, но
постепенно их количество уменьшается.
Среди клеток «белой крови» доля мононуклеаров колеблется от 10 до
50% и выше. В отдельных случаях в разгар болезни все мононуклеары могут
быть атипичными, причем их количество коррелирует с тяжестью болезни.
Инфекционный мононуклеоз у большинства больных заканчивается
выздоровлением через 2-4 недели. Однако, у некоторых пациентов длительно
сохраняются лимфаденопатия, гепатосплсномсгалия, атипичные
мононуклеары в крови, что свидетельствует о затяжном, а, возможно, и
хроническом течение инфекции.
Генерализованная инфекция ВЭБ встречается на фоне тяжелой
иммуносупрессии у больных СПИДом, при трансплантации органов и
характеризуется неблагоприятными исходами.
ВЭБ может вызывать острые и хронические нейроинфекционныс
поражения, как на фоне инфекционного мононуклеоза, так и независимо от
него. Наиболее типичная форма - полирадикулонсврит по типу синдрома
Гийена-Барре. Кроме этого, возможны мононейропатии (синдром Белла),
миелит, энцефалит.
Диагностика инфекционного мононуклеоза основывается на анализе
периферической крови. Отмечаются лейкоцитоз, увеличение числа
одноядерных клеток — лимфоцитов, моноцитов и появление атипичных
мононуклеаров. Проводятся серологические реакции, основанные на
агглютинации сывороткой больного бараньих или лошадиных эритроцитов
(реакции Пауля-Буннсля, Гоффа-Бауэра и др.). Специфическими методами
являются: ИФА (нарастание титра антител IgM к вирусу Эпштейна-Барр),
ПЦР.
Лечение симптоматическое. Антибиотики назначают только при
появлении бактериальных инфекций (например, пневмонии).
Опухолевые заболевания
У лиц с выраженной иммунологической недостаточностью на фоне
СПИДа ВЭБ вызывает опухоли — лимфому Беркитта, лейкоплакии слизистых
оболочек языка, полости рта, реже половых органов, назофарингеальную
карциному, а также лимфопролиферативные заболевания.
Лимфома Беркитта распространена в странах Центральной Африки.
Океании, преимущественно у детей в возрасте 3-7 лет. В настоящее время
заболевание регистрируют в Европе, США не только у детей, но и у взрослых
с тяжелым иммунодефицитом, в т.ч. СПИДом.
Классический вариант опухоли — единичные или множественные
новообразования челюсти, которые могут диффузно распространяться на
20. Заказ № К-4451.
305
слюнные железы, щитовидную железу, разрушать кости, вызывая деформацию
носа, нарушение дыхания и глотания, выпадение зубов, деформацию челюстей.
Носоглоточная карцинома — злокачественная опухоль, которая
локализуется на латеральной стороне полости носа или в области среднего
носового хода, быстро прорастает в носоглотку и дает метастазы в
подчелюстные лимфатические узлы. Первичные симптомы — нарушение
носового дыхания. Затем появляются слизистогнойные выделения из носа,
в которых может быть примесь крови. По мере роста опухоли снижается
острота слуха, больных беспокоит шум в ушах, боли иррадиируют в височную
область. При расположении опухоли на боковой стенке глотки наблюдаются
нарушение слуха, невралгия ветви тройничного нерва. Быстро развиваются
и общетоксическис симптомы.
Лейкоплакии. У лиц с нарушениями иммунной системы вирус
Эпштейна-Барр способен вызывать развитие лейкоплакии слизистых
оболочек языка, полости рта (особенно по ходу' прикуса зубов), красной каймы
губ (особенно нижней губы). Может быть поражена также слизистая оболочка
вульвы, реже очаги локализуются на головке полового члена у мужчин, на
клиторе, во влагалище и на шейке матки у женщин. Появляются участки
белого или беловато-серого цвета диаметром 2-3 см. Границы этих уча-стков
довольно четко выражены. Складки слизистой оболочки сглаживаются, на
пораженных участках появляется чувство жжения, онемения, нарушение
вкусовых ощущений. При травмировавши этих участков отмечается
кровоточивость. Есть сведения об участии ВЭБ в возникновении других
лимфопролиферативных заболеваний.
Диагностика. Диагноз ставят на основании характерных клинических
гистологических изменений. Кроме того, используют реакции
иммунофлюоресценции с биопсийными клетками и сывороткой больных.
ИФА для обнаружения антител к ВЭБ, ПЦР.
Лечение.
Показана противовирусная терапия. Эффективны следующие
противовирусные препараты:
Ацикловир — 5-15 мг/кг массы 3 раза в сутки внутривенно в течение
2 недель или 1 -2 г в сутки внутрь в таблетках'.
Ганцикловир — 5 мг/кг массы в сутки 2 раза в день внутривенно в
течение 2-3 недель;
Фамвир — от 500-600 мг до 1500 мг в сутки в течение 7-10 дней;
Вальтрскс — от 1000 мг до 1500 мг в сутки в течение 7-10 дней;
Фоскарнст — 40-60 мг/кг массы каждые 8 часов внутривенно 7-14
дней.
Изучается возможность применения адефовира, бривудина.
цидофовира, лобукавира. При опухолях одновременно используют
цитостатики — циклофосфан, эмбихин, винкристин и др.
306
Возможно назначение препаратов интерферона.
От кортикостероидной терапии при инфекции ВЭБ следует
воздержаться. Назначают патогенетическую и симптоматическую терапию.
7.4. Цитомегаловирусная инфекция (ЦМВИ)
Цитомегаловирусная инфекция — болезнь с преимущественно
латентным течением у взрослых, характеризуется трансплацентарной
передачей и внутриутробным поражением плода. У ослабленных лиц
возможны генерализованные формы болезни с поражением внутренних
органов и центральной нервной системы.
Этиология. ЦМВ — герпесвирус 5 типа. Повреждающее действие
вируса на клетку проявляется образованием гигантских клеток с
внутриядерными включениями, содержащими размножающийся вирус и
называемыми «совиный глаз».
Эпидемиология. Источником инфекции является человек, зараженный
ЦМВ. После первичной инфекции выделение вируса обычно продолжается
несколько месяцев до тех пор, пока не переходит в латентную форму. При
врожденных и перинатальных инфекциях вирус непрерывно выделяется 4-8
лет.
Поскольку в подавляющем большинстве случаев ЦМВИ протекает в
субклинической форме, то источники инфекции не выявляются, не
изолируются и длительное время остаются резервуаром вируса. У
инфицированного человека вирус находится в слюне, моче, влагалищном
секрете, сперме, грудном молоке, слезах, крови и многих внутренних органах.
По данным серологических исследований, проведенных в разных
странах на протяжении последних 10 лет, следы перенесенной ЦМВ-
инфекции выявляются у 40-60% детей в возрасте до 5 лет и у 30-90% взрослых
старше 25 лет.
Механизм передачи ЦМВИ контактный, а пути передачи такие же. как
при простом герпесе. Передача ЦМВ от матери к плоду реализуется чаще,
чем у других вирусов. Врожденная ЦМВИ встречается у 1 % новорожденных.
Наибольшую опасность для плода представляет внутриутробное
инфицирование (нарушения органо- и гистогенеза, самопроизвольный аборт,
гибель, тяжелое врожденное заболевание). Степень риска определяется при
этом сроками антенатального инфицирования и иммунологическим статусом
матери. Риск внутриутробного заражения плода составляет 40-50%. Грудное
молоко может играть роль фактора передачи ЦМВ.
Серьезная проблема - заражение ЦМВ реципиентов крови. В нашей
стране доноры пока не обследуются на ЦМВИ. В то же время известно, что
при переливании крови от серопозитивных доноров заражается от 15 до 40%
20*
.307
детей и 2-3% взрослых. Еще более сложные проблемы связаны с
трансплантацией органов, поскольку фактором передачи инфекции может быть
не только перелитая кровь, но и пересаженный орган. Так, например, при
трансплантации костного мозга ЦМВ заражается 5% реципиентов.
Установлено, что основными факторами, обеспечивающими заражение,
являются низкий уровень жизни, гигиенических навыков и особенно
скученность. Различные детские учреждения, школы способствуют
распространению инфекции. (ЦМВ был выделен с поверхности
пластмассовых игрушек, которые дети брали в рот).
Патогенез. Различают ЦМВИ приобретенную (первичную и
вторичную) и врожденную, патогенез которых изучен недостаточно.
После внедрения вируса в организм через слизистые оболочки полости
рта, желудочно-кишечного тракта, половых органов или непосредственно в
кровь, наблюдается вирусемия и инфицирование вирусом Т и В-лимфоцитов,
макрофагов. Репликация ЦМВ возможна в эпителии, эндотелии, фибробластах,
гладких мышечных клетках, костном мозге. У иммунокомпетентных лиц
вирусемия, как правило, не приводит к развитию манифестных форм болезни,
но ЦМВ остается в состоянии латенции в различных органах. Вирус имеет
выраженный тропизм к эпителию слюнных желез и почек, где сохраняется в
неактивном состоянии и выделяется со слюной и мочой. Снижение
концентрации альфа-интерферона вследствие ЦМВИ играет основную роль в
развитии иммуносупрессии.
Недавние исследования показали, что ЦМВ может оказывать онкогенное
действие, вызывая экспрессию онкогенов.
Клетки, инфицированные ЦМВ, видоизменяются. Характерный
патоморфологический признак — гигантские клетки, выявляемые в
различных тканях, слюне, мокроте, осадке мочи, цереброспинальной
жидкости.
ЦМВИ — заболевание, опосредованное иммунной системой. При
иммуносупрессии возникают клинические синдромы, локализация, тяжесть,
распространение которых зависят от иммунного ответа организма на вирус.
При тяжелой иммуносупрессии развиваются генерализованные формы
инфекции с нередким неблагоприятным исходом.
Клиника. Для ЦМВИ характерно субклиническое, латентное течение,
но все чаще стали встречаться тяжелые формы заболевания, обусловленные
первичным инфицированием или реактивацией вируса.
Приобретенная первичная инфекция у подавляющего большинства
(более 90%) детей и взрослых протекает латентно. И только у небольшой
части инфицированных возникают клинические симптомы: сиалоадснит —
увеличение слюнных желез (чаще углочелюстных) и мононуклсозоподобный
синдром.
308
Схема 4
Клинические формы инфекции, вызванной ЦМВ
Врожденная
Приобретенная
Острая Хроническая
1 .Поражения ЦНС
- микроцефалия
- психомоторные
нарушения
2.Поражения печени
- хронический
гепатит
- цирроз
3.Поражения
легких
- пневмосклероз
- фиброз
Первичная
Вторичная
латентная
---ЦМВ мононуклеоз-----
генерализованная-
ЦМВ паротит
Мононуклеошый синдром характеризуется умеренной лихорадкой,
недомоганием, гепатоспленомегалисй, редко наблюдается тонзиллит. При
исследовании периферической крови обнаруживают лимфоцитоз, и
возможны атипичные мононуклеары. От инфекционного мононуклеоза,
вызванного ВЭБ. болезнь отличается отсутствием генерализованной
лимфаденопатии, яркого тонзиллита. отрицательными или
слабоположительными реакциями гетероагглютинации (Пауля-Буннеля.
Гоффа-Бауера), большого количества атипичных мононуклеаров.
Иногда первичная инфекция может принять волнообразное течение,
когда периоды ремиссии сменяются клиническими проявлениями со
стороны каких-либо органов и систем. Больные с наследственным
иммунодефицитом. принимающие иммунодепрессанты, ВИЧ-
инфицированные в стадии СПИДа подвергаются более высокому риску
развития висцеральных и диссеминированных форм ЦМВИ. По мере
прогрессирования иммунодефицита утяжеляются поражения, вызванные
ЦМВ. Возникают пневмония, поражение печени, желудочно-кишечного
тракта, поражение глаз (ретинит). Часто вовлекается в процесс нервная
система.
Наряду с тяжелыми энцефалитами развиваются вялотекущие
энцефалопатии, заканчивающиеся слабоумием. Описаны периферические
нейропатии. Кроме того, ЦМВИ может сопровождаться васкулитом,
тромбоцитопенией и др. симптомами.
ЦМВИ при реактивации вируса (вторичная инфекция) протекает
менее бурно, чем острая инфекция. Развивается рецидивирующий ЦМВ
309
паротит или генерализованная форма, что характерно для
иммуносупрессированных лиц.
ЦМВИ является одним из самых тяжелых оппортунистических
заболеваний при СПИДе и нередко - непосредственной причиной летальных
исходов. По мнению ряда исследователей, клинически выраженная ЦМВИ
наблюдается у 20-40% больных СПИДом, вызывая при этом полиорганные
поражения. В то же время установить истинную частоту и клинический облик
манифестных форм ЦМВИ чрезвычайно трудно, так как многие клинические
признаки этой инфекции неспецифичны и часто ЦМВИ протекает под маской
других нозологических форм или в сочетании с ними. У больных ВИЧ-
инфекцией наиболее часто ЦМВ поражает орган зрения. Ретинит развивается
у 15-50% больных со СПИДом, нередко приводя к слепоте в результате полной
атрофии зрительных нервов или тотальной отслойки сетчатки вследствие
некротического ретинита. Офтальмоскопически процесс протекает в виде
многочисленных очагов некротического ретинита с геморрагиями, с
образованием ватообразных очагов. Центральная нервная система поражается
у 10-20% пациентов в виде подострого энцефалита, менингоэнцефалита,
миелита, полирадикулопатии, полинейропатии нижних конечностей. По
данным последних исследований, в основе СПИД-деменции лежит
сочетанное поражение головного мозга ЦМВ и ВИЧ в виде микроскопических
инфарктов коры головного мозга, вентрикулоэнцсфалита с исходом в
некротическое поражение черепно-мозговых нервов и паравентрикулярной
паренхимы. У больных со СПИДом при генерализованной ЦМВИ может
развиться тяжелое поражение надпочечников (в виде очаговых
коагуляционных некрозов коркового и мозгового слоев с наличием в местах
некрозов цитомегалоклеток), язвенно-некротическос поражение желудочно-
кишечного тракта (эзофагит, энтероколит), гепатит, склерозирующий
холангит, нефрит, миокардит, панкреатит, пневмония. На поздних стадиях
ВИЧ-инфекции развивается синдром истощения, одной из причин которого
является диссеминированная ЦМВИ. При патологическом действии ЦМВ
на костный мозг развивается панцитопения. ЦМВ является не только
оппортунистом ВИЧ-инфекции, но и наоборот способствует се
прогрессированию, помогая проникать ВИЧ в CD4 лимфоциты с помощью
белка US-28, кодируемого ЦМВ. В свою очередь белок ВИЧ gp 120
активирует ЦМВ.
ЦМВ может играть роль в развитии заболеваний половых органов
женщин, вирус обнаруживали в шейке матки, эндометрии, яичниках,
фаллопиевых трубах. У ВИЧ-инфицированных женщин одной из причин,
приводящих к развитию карциномы шейки матки, является ЦМВ.
Врожденная инфекция на ранних стадиях развития плода приводит к
уродствам и нередко к гибели плода или новорожденного. Заражение на
310
поздних сроках не нарушает строение органов и проявляется в постнатальном
периоде в виде желтухи, гепатоспленомегалии, тромбоцитопенической
пурпуры, поражения центральной нервной системы и пневмонии.
Характерный клинический признак цитомегалии — геморрагический
синдром. Обычно уже в первые часы или в течение первых суток после
рождения у ребенка на лице, туловище, конечностях появляются
множественная петехиальная сыпь, кровоизлияния в кожу, слизистые
оболочки, кровотечение из пупка, кровь в стуле. Обычно геморрагический
синдром через 8-10 дней бесследно проходит и может снова возникнуть через
несколько недель. У некоторых детей с первых дней жизни возникает желтуха,
развиваются пневмония, дыхательная недостаточность, поражаются почки.
При врожденной ЦМВИ отмечаются хориоретиниты, катаракта, атрофия
зрительного нерва, заканчивающаяся развитием полной слепоты. При острой
форме врожденной ЦМВИ гибель детей наступает в первые недели или
месяцы жизни, чаще всего от присоединяющихся вторичных инфекций.
У детей, перенесших острую форму, отмечается волнообразное течение
хронической формы. Формируются пороки развития ЦНС, гепатит,
поражения легких.
Диагностика. Наиболее простой и доступный метод— цитологическое
исследование осадков мочи, слюны, мокроты, спинномозговой жидкости и
др. биосубстратов. При микроскопировании мазков после специальной
обработки обнаруживают крупные клетки округлой или овальной формы с
ядерным включением, окруженным светлым ободком. Чувствительность
составляет около 50%, возможны ложноположительные результаты.
Применяется серологический метод (ИФА как наиболее
чувствительный), основанный на обнаружении антител класса JgG
(свидетельствующие об инфицированности) и JgM (об активации инфекции).
Отсутствие JgG антител при наличии Ig М антител и вируса в крови
свидетельствует об остром заражении ЦМВ и серьезной угрозе тяжелого
поражения внутренних органов.
Специфическими являются методы выделения вируса из
биологических жидкостей на культуре клеток (трудоемкий, чувствительность
невысока), ускоренный метод культивирования вируса с определением ЦМВ
антигенов с помощью моноклональных антител, молекулярной
гибридизации. На сегодняшний день все большее значение приобретает ПЦР,
которая дает возможность качественного и количественного анализа ДНК
вируса в биологических жидкостях и тканях.
311
Приведем клинический пример.
История болезни 18504/2000 г. Больная Б.
ВИЧ инфекция установлена в 1988 году, выявлена по контакту с ВИЧ/
СПИД пациентом, студентом, жителем одной из африканских стран. В этот
период, как и последующие 10 лет, была практически здорова, работала
регистратором, зав. отделом кадров в одной из поликлиник города.
Обратилась однажды с просьбой помочь в связи с дискриминацией. Её
увольняли с работы, узнав, что она ВИЧ инфицированная. После разговора
с главным врачом поликлиники ее не уволили, и она продолжала работать.
Несмотря на уговоры о необходимости диспансеризации и лечении, она
отказывалась от каких-либо контактов с врачами по поводу ВИЧ инфекции.
С 1999 года у нее появилась лихорадка, слабость, потеря веса, кандидоз
слизистых рта. После многократный обострений с 18.08.1999 ей была
оформлена инвалидность, она не работала, жила с мамой-пенсионеркой. С
мая 2000 года присоединился сухой кашель, провалы в памяти, эйфория,
сменяющаяся депрессией.
26 июля 2000 года госпитализирована в тяжелом состоянии: пониженное
питание, себорейный дерматит, отмечалось выпадение волос. Слизистая рта
разрыхлена, на твердом и мягком небе, на языке, у корня языка белый
творожистый налет, волосистая лейкоплакия языка. Подмышечный
лимфаденит до 1,5 см, пульс 104-110 уд в минуту', тоны сердца отчетливо
выслушиваются, в легких рассеянные сухие хрипы, живот безболезнен при
пальпации, границы печени увеличены на 2 см от правой реберной дуги,
селезенка не увеличена, стул в норме, кандидоз перианальной области,
симптомов менингоэнцефалита нет.
Назначены: Бисептол 480 по 10 мл х 2 р в день в/в
Рстровир 400 мг х 2 р в день в/в
Дифлюкан 150 мг
Стрептомицин 1,0 в/м
Изониазид 0,6
Этамбутиол 0,4 х 3 р в день
Осмотр офтальмолога: ретинопатия, хореоритинита нет.
С 22.08 Хивид 0.75х 3 р в день
Видекс 200 мг х 2 р в день
Дифлюкан 150 мг х 3 р в день
Ретровир 400 мг х 2 р в день в/в
Рифампицин 0,6
Этамбутиол
Изониазид
Бисептол 480 10,0 х 2 р в день в/в
Стрептомицин 1,0
.312
С 29.08 Ацикловир 400 мг х 3 р в день
Герпетические высыпания на коже.
Криптококк в ликворе не обнаружен
Больная умерла 14.09.2000
Клинический диагноз:
ВИЧ инфекция в стадии СПИДа. Распространенный кандидоз (слизистых
рта. глоссит, перианальной области), кожно-слизистый герпес,
криптококковый менингоэнцефалит, истощение, деменция.
Сопутствующие: Хронический калькудезный холецистит.
Данные обследования:
Таблица 47
Клинический! анализ крови больной Б. от 02.08,2000
Наименование Результат Норма
Эритроциты 2,9 4,5-5,5* 1012/л
Гемоглобин 90 130-160 г/л
Лейкоциты 1 6-8*109/д
Эозинофилы э 3%
Палочкоядерные 3 4%
Сегментоядерные 63 4%
Лимфоциты 28 23
Моноциты 4 6
СОЭ 40 1-10 мм/час
Таблица 48
Клинический анализ крови больной Б. от 20.08.2000
Наименование Результат Норма
Эритроциты 2.0 4.5-5.5* Ю!7л
Гемоглобин 90 130-160 г/л
Лейкоциты 3 6-8*109/л
Эозинофилы 0 3%
Палочкоядерные 7 4%
Сегментоядерные 83 4%
Лимфоциты 8 23
Моноциты 7 6
СОЭ 40 1-10 мм/час
313
Таблица 49
Биохимическое обследование больной Б. (18.11.98)
Наименование Результат Норма
Трансаминазы: АЛТ ACT Сахар 16 __37 5.0 1-40 е/л 1-40 е/л __ 3.3-5,5 ммоль/'л
Анализ мочи (23.11.98)
Белок: 0,033
Лейкоциты: 2-4
Цилиндры гиалиновые: 1-2
Мазок с языка: клетки многослойного плоского эпителия, обильная
полиморфная флора, псевдомицелий дрожжеподобных грибов. Посев
крови: стрептококк эпидермальный. Криптококк выделен из ликвора.
Компьютерная томография: атрофические изменения мозга, без
очаговых изменений, расширены ликворные пространства.
Пс1то;югоаншюл1ическш' диагноз: ВИЧ инфекция в стадии СПИДа.
Аплазия лимфоузлов, истошение, ВИЧ менингоэнцефалит.
Оральный, генитальный и перианальный кандидоз, мелкоочаговая
левосторонняя пневмония.
Гистологически: генерализованная ЦМВ инфекция с поражением
печени, почек, надпочечников, слизистой желудка, тонкой и толстой
кишок, поражение эпендимы желудочков и тканей головного мозга.
Заключение: В приведенном наблюдении у больной спустя 12 лет
после предполагаемого инфицирования половым путем развился
генерализованный кандидоз: стоматит, глоссит, кандидоз псрианальной
области и половых органов, кожно-слизистый герпес, бактериемия с
высевом эпидермального стрептококка, левосторонняя пневмония. При
жизни серологически и многократно цитологически ни в ликворе, ни в
мазках со слизистых, ни в осадке мочи ЦМВ не выявлен. Лишь
цитологически посмертно установлена ЦМВ септикопиемия, однако без
хориорстинопатии. Ввиду нераспознанной и нелеченной ЦМВ инфекции
противовирусная терапия была неэффективной. Приведенное наблюдение
демонстрирует трудности в диагностике ЦМВ инфекции, вероятно, лишь
исследование методом ПЦР ликвора, цитологические повторные
исследования мочи могли бы установить этиологию вторичного
заболевания. Что касается антиретровирусной терапии (АРВТ). то важно
отмстить ее неэффективность при нераспознанных и нелеченных
оппортунистических инфекциях. Своевременная назначенная АРВТ
314
предупредила бы развитие ЦМВ инфекции, а уже при ее наличии только одна
АР ВТ без специфической терапии ЦМВ инфекции не может дать позитивного
результата.
Лечение. Из имеющихся противовирусных препаратов активны в
отношении ЦМВ:
Ганцикловир (цимевен) капсулы 250 мг (84), флаконы 500 мг (1) -
активируется под действием вирусных фосфотрансфераз с образованием
трифосфата, преимущественно ингибирующего ДНК-полимеразу ЦМВ.
Внутривенное введение: лечение угрожающей жизни и зрению ЦМВ
инфекции (ретинит, колит, эзофагит, пневмония и др. Начальное лечение: 5
мг/кг в течение часа, каждые 12 часов на протяжении 14-21 дня у больных с
нормальной функцией почек. Поддерживающее лечение (при опасности
рецидива): суточная доза 6 мг/кг 5 раз в неделю или 5 мг/кг ежедневно.
Пероральный прием: поддерживающая терапия ЦМВ ретинита, при
условии стабилизации ретинита под действием индукционной терапии, 3 г
в сутки, профилактика ЦМВ инфекции у ВИЧ-положительных лиц (ДНК
ЦМВ 2500 - 50000 копий в мл плазмы при CD4< 50 клеток в мм3) 1000 мг 3
раза в сутки.
Фоскарнет (фоскавир) 60-90 мг/кг массы тела 3 раза в сутки внутривенно
Терапия проводится в течение 14-21 дня.
После окончания индукционной терапии больным с ослабленной
иммунной системой для профилактики рецидива назначают
поддерживающий курс (суточные дозы препаратов уменьшают вдвое). При
рецидиве заболевания лечение повторяется. Количество лечебных курсов у
одного больного может быть от 1 до 5-7. Длительность поддерживающей
терапии - от 2 недель до 2 месяцев.
Возможно сочетание терапии ганцикловиром с введением
ацитомегаличсского иммуноглобулина (Цитотек, Германия). Цитотск
(cytotek) является важным препаратом для лечения ЦМВИ. Виростатики
(ганцикловир, цимевен) блокируют обратимо вирусную ДНК полимеразу,
после их отмены возможны рецидивы, формируется резистентность.
Применение цитотека, содержащего специфические ЦМВ нейтрализующие
антитела, обезвреживает как свободный вирус, так и вирус, выходящий из
клеток.
Во время беременности человеческий иммуноглобулин цитотек
является единственным средством терапии первичной и вторичной ЦМВИ.
Для беременных и новорожденных виростатики противопоказаны.
Иммуноглобулин дозируют в единицах Пауля Эрлиха института, титр ЦМВ
антител составляет 50 PEI. При терапии манифестной инфекции вводят 2
мл/кг массы тела каждые два дня до исчезновения клинических симптомов.
315
С профилактической целью и для поддерживающей терапии вводят 1 мл/кг
массы тела внутривенно капельно. Препарат эффективен и против других
герпес вирусов, в частности, против вируса Эпштейн-Барра и вируса простого
герпеса.
В связи с появлением резистентных к ганцикловиру, фоскарнсту форм
для лечения ЦМВИ применяют новые препараты - цидофовир, адсфовир,
лобукавир.
Этиотропная терапия сочетается с иммуномодулирующей (см.
«Простой герпес»).
При ЦМВИ инфекции у беременных основная задача — предупредить
активацию вируса. Проводят общеукрепляющую, витаминотерапию. Может
быть использован иммуноглобулин в течение первых 3 месяцев
беременности.
Профилактика. Вакцины дзя специфической профилактики ЦМВИ
активно разрабатываются. До внедрения вакцинопрофилактики в практику'
необходимы тс же мероприятия, что при вирусном гепатите В, про-стом
герпесе. Необходимо оберегать беременных от контактов с детьми, больными
врожденной ЦМВИ, т.к. они выделяют вирус во внешнюю среду до 5 лет. В
случае рождения женщиной ребенка с ЦМВИ следующую беременность
следует рекомендовать не ранее, чем через 2 года (срок персистенции вируса
при локализованной приобретенной ЦМВИ).
Прогноз при генерализованной цитомегалии, особенно врожденной,
протекающей с поражением ЦНС, чрезвычайно серьезный. У больных
СПИДом цитомегаловирусный менингоэнцефалит может быть одной из
причин смерти.
7,5. Инфекция, вызванная вирусом icpneca человека 6 тина
Этиология. По своей морфологической структуре ВГ 6 сходен с
другими ГВ, по составу ДНК существенно отличается от них. С ЦМВ у
них обнаружен общий фрагмент генома. По физико-биологическим
свойствам близок к ЦМВ.
Эпидемиология. Инфекция ВГ 6 широко распространена. Втечение
первых 2 лет жизни инфицируется 60% детей. Антитела к ВГ 6
обнаруживают более, чем у 26% населения. Механизм и пути передачи
изучены недостаточно. В естественных условиях инфекция
распространяется воздушно-капельным путем. Вирус обнаруживают в
слюне, слюнных и бронхиальных железах, в смывах из носоглотки и
гортани. Возможно заражение при гсмотрансфузиях, трансплантации
органов, при использовании медицинских инструментов,
контаминированных вирусом. Имеются сообщения о случаях заражения
наркоманов, а также медицинских работников при случайных уколах иглой,
содержащей кровь инфицированных или больных. Возможен
316
вертикальный путь заражения, т.к. антиген вируса присутствовал в
материале в ряде случаев спонтанных выкидышей. ВГ 6 выделен из
цервикального канала шейки матки. Однако реактивация вируса в
процессе беременности в организме женщины может не происходить, а в
большинстве случаев инфицирование происходит постнатальнум путем.
Возможен также и половой путь заражения.
Патогенез. ВГ 6 тропен к лимфоцитам CD4. CD3. CD5, CD7. CD8.
Вирус реплицируется в Т и В-лимфоцитах, моноцитах, мегакариоцитах,
макрофагах, глиальных клетках, клетках тимуса, эпителиальных и
эндотелиальных клетках. Репликация сопровождается деструкцией и
лизисом клеток.
Ктннка разнообразна - от латентных форм до диссеминированной
инфекции с летальным исходом (таблица 50).
У подавляющего большинства зараженных ВГ6 формируется
латентная инфекция. Однако описаны клинические синдромы, которые
связывают с этиологической ролью ВГ6.
Таблица 50
Клинические формы инфекции, вызванные ВГЧ 6
Первичная Вторичная
Внезапная экзантема у новорожденных и детей Лимфопролиферативные заболевания (иммунодефицит, лимфаденопатия, поликлональная лимфопролиферация)
Синдром хронической усталости (миалгический энцефаломиелит)
Инфекционный мононуклеоз Злокачественные лимфомы: - неходжкпнекая лимфома - периферическая Т-клсточная лейкемия - В-клеточная лимфома - дерматопатическая лимфопатия - болезнь Ходжкина - синусоидальная В-клсточная лимфома - плеоморфная Т-клсточная лимфома
Г истпоцитарный некротический лимфаденит (Kikuchi's lymphadenitis)
Внезапная экзантема распространенное детское заболевание в
возрасте от 4-5 месяцев до 3 лет. характеризующееся острым началом,
иногда подъемом температуры до 39-40°С, незначительной
интоксикацией, невыраженными катаральными явлениями. На 4-й день
болезни температура снижается, одновременно или через несколько часов
появляется сыпь в виде дискретных бледно-розовых элементов диаметром
317
2-5 мм Обычно высыпания появляются сначала на спине, а затем на животе,
груди, разгибательных поверхностях конечностей. На лице сыпь встречается
редко. Через 2-3 дня сыпь исчезает, нс оставляя следов. При исследовании
периферической крови определяют лейкопению — до 3x109- 4x109 в мкл,
нейтропению, относительный лимфоцитоз и моноцитоз.
Может наблюдаться злокачественное течение с петехиальной сыпью,
панцитопенией, кровотечениями, летальным исходом. Возможен серозный
менингит, менингоэнцефалит с доброкачественным течением.
До 30% инфекционного мононуклеоза, серонегативного по антителам
к ВЭБ, связывают с ВГ 6.
Следует обратить внимание врачей, что диагноз «инфекционный
мононуклеоз» можно считать синдромальным, т.к. это полиэтиологичное
заболевание, связанное с вирусом Эпштейна-Барр, цитомегаловирусом, ВГ6,
ВИЧ, возможно, и другими.
Манифестная первичная инфекция у взрослых отмечается крайне
редко. Если развивается, то характеризуется длительной лимфаденопатией,
мононуклеозоподобным синдромом, гепатитом и др.
Кроме того, с ВГЧ-6 связывают синдром хронической усталости
(миалгический энцефаломиелит), для которого характерны: острое
гриппоподобное начало с повышением температуры до 38°С; боли в горле;
небольшое увеличение шейных, затылочных, подмышечных лимфоузлов;
необъяснимая генерализованная мышечная слабость; мигрирующие миалгии,
артралгии; расстройства сна, раздражительность; повышенная физическая
утомляемость с последующей длительной усталостью.
ВГЧ-6 может вызывать как доброкачественные
лимфопролиферативные заболевания (лимфоденопатия и др.), так и
злокачественные лимфомы.
ВГ 6 индуцирует литическую репродукцию вируса ЭБ в В-клстках.
латентно инфицированных этим вирусом. ВГ 6 может как ингибировать, так
и индуцировать ВИЧ.
Циагностика. Вирусологическая, серологическая. Используют ПЦР.
Лечение. Ганцикловир, фоскарнет могут быть эффективными при
лечении больных манифестными формами ВГЧ 6-инфекции. ВГ 6
чувствителен к препаратам нового поколения - адсфовир, цидофовир.
Специфическая профилактика не разработана.
7.6. Инфекции, вызванные вирусами герпеса человека 7 и 8 типов
ВГЧ-7 недостаточно изучен. Вирус был обнаружен в Т-лимфоцитах
(С D4) и отнесен к лимфотропным вирусам. Вирус также может инфицировать
CD8 лимфоциты и моноциты. Имеет идентичные участки ДНК с ЦМВ и
ВГЧ 6. Вероятно, инфекция широко распространена среди населения — вирус
был выделен из слюны 87% взрослых и 70% детей старше года. В крови
доноров ДНК ВГЧ 7 выявлена у 97,3% обследованных лиц. Предполагается
воздушно-капельный путь передачи, возможно заражение при переливании
крови и трансплантации органов.
318
Клинические проявления инфекции ВГЧ 7 изучаются. Считают, что
вирус может вызывать лимфопролиферативные заболевания, внезапную
экзантему, синдром хронической усталости и иммунодефицита, проявляется
лихорадкой, гепатоспленомегалией и панцитопенией.
Принципы терапии не разработаны.
ВГЧ-8 - вирус, ассоциированный с саркомой Капоши. Вызывает
мультифокальное заболевание с преимущественным поражением кожи,
внутренних органов и лимфатических узлов.
ВГ 8 по биологическим свойствам подразделяют на 3 варианта - А, В,
С. А - связывают с классической саркомой Капоши и СПИД-
ассоциированными поражениями кожи и внутренних органов. В и С - с
лимфопролиферативными заболеваниями: лимфомами, генерализованными
лимфаденопатиями, болезнью Кастлемана.
Вирус широко распространен: более 25% взрослого населения и 90%
ВИЧ-инфицированных имеют антитела к ВГ 8.
В основе диагностики лежат те же методы, которые используют для
диагностики других герпесвирусов.
Саркома Капоши
Саркома Капоши (СК) была впервые описана в 1872 г. венгерским
дерматологом Moritz Kaposi, как медленно развивающаяся опухоль. Она
появляется в виде пурпурно-багровых плотных пятен, как правило,
локализующихся на ногах у пожилых людей итальянского или восточно-
европейского происхождения. Гистологически у больных выявляются
пролифелирующие веретенообразные клетки и разрастание мелких
кровеносных сосудов. Промежутки между капиллярами содержат эритроциты
и гемосидерин.
В дальнейшем были описаны 2 типа болезни в виде
диссеминированной опухоли с поражением кожи и различных органов, а
также у молодых людей, проживающих в Африке южнее Сахары,
получавших вследствие трансплантации иммуносупрессивную терапию
(кортикостериоды, азатиоприн и др.),
Первые случаи саркомы Капоши, связанные с ВИЧ/С ПИДом, были
описаны в 1881 г. В последующем было показано, что примерно у 35%
больных СПИДом имеет место саркома Капоши.
Саркома Капоши была классифицирована какСПИД-индикаторная
болезнь, склонная к генерализации с поражением различных органов и
тканей, являющаяся причиной смерти больных СПИДом.
Предположительно этиологическим агентом саркомы Капоши считают
герпес вирус VIII типа. Саркома Капоши чаще наблюдается у мужчин,
имеющих секс с мужчинами, и у них же удастся обнаружить этот же тип
герпес вируса.
Выделяют следующие стадии саркомы Капоши у больных СПИДом:
1. кожная локализованная форма;
2. кожная форма с быстрым распространением, агрессивная, нередко с
319
наличием региональной лимфоаденопатии;
3. генерализованная форма с поражением слизистых, с возможным
вовлечением лимфоузлов;
4. с поражением слизистых, выстилающих различные внутренние органы
и ткани.
В наших наблюдениях Саркома Капоши послужила единственной
непосредственной причиной смерти 2 из 48 (4,2%) умерших от ВИЧ-инфекции
в стадии СПИДа больных. Еще у 2 больных она отягощала течение других
оппортунистических инфекций, затрудняя их лечение.
В последние годы в результате применения высокоактивной
антиретровирусной терапии (highly active antiretroviral therapy -
HAART) число больных саркомой Капоши уменьшилось. Саркома Капоши
стала редко регистрироваться у больных СПИДом.
Лечение саркомы Капоши являлось сложной задачей и проводилось
по тем же принципам, что и лечение других опухолей.
Местное лечение
1. Криотерапия с замораживанием жидким азотом.
2. Введение химиопрепаратов в очаги поражения - винбластина,
интерферонов.
3. Облучение.
Химиотерапия
Используются различные препараты: винкристин, винбластин,
циклофосфан и др. Рекомендуются интерфероны в больших дозах: 18-36
млн. ЕД ежедневно или несколько раз в неделю повторными курсами. Такая
терапия плохо переносится больными и экономически не оправдана.
Широкое применение в нашей стране нашел проспидин, который
вводится по 100 мг/сутки внутримышечно в течение месяца, однако после
лечения возникают рецидивы.
В настоящее время наиболее эффективно лечить саркому Капоши с
использованием такого мощного противоопухолевого препарата, как
даунорубицин. Однако из-за высокой токсичности препарат применялся
ограниченно. В последние годы благодаря разработке липосомальной системы
транспорта лекарственных веществ и разработке даунозома стало возможным
преодолеть недостатки даунорубицина.
Даунозом - комплекс антрациклина, даунорубицина и липосомальной
системы. Специфический состав липосом, со строго определенным
соотношением фосфатидилхолина и холестерина сообщает им повышенную
стабильность в плазме. Липосомы, содержащие даунорубицин. избирательно
проникают в ткань опухолей человека (Forsscn et al, 1992). Благодаря
небольшому диаметру липосомальный препарат избирательно накапливается
в ткани опухоли. Захваченное опухолевыми клетками активное вещество
высвобождается и оказывает максимальный противоопухолевый эффект. При
саркоме Капоши у ВИЧ-инфицированных пациентов препарат вводят в
начальной дозе 40 мг/м2 каждые 2 недели до устойчивого эффекта. Препарат
обладает низкой кардиотоксичностью. Даунозом разводят в 5% растворе
320
глюкозы (0,2 - 1 мг в 1 мл), нельзя смешивать с другими растворами или
лекарственными препаратами. Даунозом вводят медленно в течение 30 - 60
минут внутривенно. Несовместимость даунозома с другими препаратами, в
частности с противовирусными, не описана.
7.7. Комплексная диагностика герпесвирусных заболеваний у
больных ВИЧ-инфекпией
Особенности течения герпесвирусных заболеваний у больных ВИЧ-
инфекцией и выделение СПИД-индикаторных болезней приведено в каждом
из разделов.
В связи с тем, что в настоящее время в практику внедрены молекулярно-
биологические методы, в частности ПЦР, нами изучалась клиника
герпесвирусных заболеваний суммарно и использовалась ПЦР с различными
диагностикумами для определения нуклеотидных последовательностей ВПГ
1 и 2, ВЗВ, ВЭБ, ЦМВ, ВГЧ-6. Эти исследования позволяют утверждать, что
при ВИЧ-инфекции, как правило, регистрируются микст-герпесвирусныс
заболевания.
Ввиду этого, мы приводим наш опыт по характеристике
герпесвирусных заболеваний у больных ВИЧ-инфекцией отдельным
разделом.
Под наблюдением находилось 95 пациентов с ВИЧ-инфекцией,
лечившихся в инфекционной больнице № 30 им. С. П.Боткина, на различных
стадиях заболевания. Из 48 больных в стадии II Б-В (по классификации
Покровского В.И.) у 23% пациентов наблюдали локализованные
орофациальные или генитальные редкорсцидивирующие формы ПГ. У всех
больных, находившихся в данной стадии заболевания, обнаруживались 1g
G к ВПГ 1, 2, более, чем у 30% - ДНК ВПГ 1, 2 типов.
Наряду’ с маркерами ВПГ в стадии ПВ выявляли маркеры ЦМВ, ВГЧ
6 и ВЭБ. Частота обнаружения клеток, пораженных ЦМВ, при цитоскопии
осадка мочи и слюны составила 26,7%. Выявление у 23% больных IgM к
ЦМВ и у 34,3% пациентов ДНК ЦМВ может свидетельствовать о реактивации
латентной ЦМВИ на данной стадии. ДНК ВГЧ 6 и ВЭБ в стадии ПВ ВИЧ-
инфекции выявляли соответственно у 26% и у 6,7% пациентов.
По мере прогрессирования ВИЧ-инфекции в стадиях III А-В (48
человек) у ВИЧ-инфицированных наблюдались поражения кожи, вызванные
ВПГ (39%), слизистых оболочек ротовой полости (6,5%) и половых органов
(9,7%). В стадии III В (16 человек) частота выявления постоянно
рецидивирующих герпетических поражений ПГ возрастала. При этом
преобладали распространенные формы поражения кожи (язвенно-
некротический герпес в 12,5%), слизистых оболочек ротовой полости
(везикулярно-эрозивный гингивит 18,8%) и половых органов (22,5%). Более,
чем у 80% пациентов выявляли ДНК ВПГ 1, 2.
Клиническая манифестация ЦМВИ на стадиях вторичных проявлений
преимущественно протекала в виде хориорстинитов и увеитов. Частота
21- Заказ № К-4451. 32!
обнаружения клеток, пораженных ЦМВ, составила в стадиях 111А-Б 32,6% и в
стадии ШВ -41,8%. Частота выявления нуклеотидных последовательностей
ЦМВ методом молекулярной гибридизации возрастала в стадиях 111 А-Б и ШВ
(69% и 92%). Если в стадии III А вторичные инфекции, вызванные вирусами
герпеса, протекали благоприятно, этиотропная терапия была эффективна, то
на последующих стадиях инфекции они прогрессировали и уже столь хорошего
эффекта от противовирусной терапии не наблюдалось.
Наряду с этим на стадии вторичных заболеваний (III А-Б у 12,5% и IIIВ
у 65,4%) методом молекулярной гибридизации были выявлены нуклеотидные
последовательности вируса Эпштейна-Барр. При этом ниу одного из больных
не было зарегистрировано клинической инфекции ЭБ. Вместе с тем, у
обследуемых пациентов диагностировали остроконечные кондиломы,
лейкоплакию языка, язвенно-некротические поражения кожи, лимфому.
ДНК ВГЧ 6 обнаружена у 26% ВИЧ-инфицированных в стадии П В. Частота
ее обнаружения в III А-Б стадии достигала 41,9% и возрастала до 88% в ШВ -
IV стадии. Клинически это соответствовало прогрессированию астено-
вегетативного синдрома, появлению синдрома “хронической усталости”,
развитию деменции.
Следует отметить, что на стадии СПИДа среди герпесвирусных
поражений на первое место выходят генерализованная ЦМВ инфекция и
распространенный, упорно рецидивирующий ПГ.
При анализе летальных исходов 27 больных СПИДом, лечившихся в
больнице им.С.П.Боткина с 1987 по 1999 гг, генерализованная ЦМВИ выявлялась
у 13 человек (48%). ЦМВИ протекала с менингоэнцефалитом, хориоретинитом,
поражением слюнных желез, легких, желудочно-кишечного тракта, селезенки,
надпочечников, почек. Различные формы простого герпеса были
диагностированы у 18 больных (70%), в том числе часто или непрерывно-
рсцидивирующая форма наблюдалась у 50% пациентов, распространенная форма
- у 5 человек (27%), язвенно-некротический герпес -у 3 (17%). У одного больного
была диагностирована генерализованная форма простого герпеса. Данные
иммунологического исследования при последней госпитализации показали, что
концентрация CD4 лимфоцитов менее 200 в 1 мм3 наблюдалась у 48% больных
(из них менее 100 в 1 мм3 - у 24%).
Таким образом, проведенными комплексными клинико-лабораторными
исследованиями, включая метод молекулярной гибридизации, установлено
значение маркеров герпесвирусов в прогрессировании ВИЧ-инфекции.
Увеличение числа герпесвирусов коррелировало с прогрессированием ВИЧ. При
этом прогностически наиболее значимым можно считать комплексное
определение ДНК ВПГ, ЦМВ и ВГЧ 6 у больных с ВИЧ-инфекцией. Проведенные
исследования показывают, что выявление комплекса герпесвирусов при ВИЧ-
инфекции опережает клинические нарушения и позволяет прогнозировать
клиническую манифестацию СПИДа. Полученные нами данные имеют значение
как для прогноза, так и для совершенствования способов терапии ВИЧ-инфекции.
322
Литература
1. Актуальные вопросы ВИЧ-инфекции. Сб. мат. науч.-прак. конф, - под ред.
Рахмановой А.Г. - СПб. - 1997.
2. Афонина Л.Ю., Белянская И.Г., Рахманова А.Г. Опоясывающий герпес у
ВИЧ-инфицированных / В кн. Актуальные вопросы ВИЧ-инфекции, СПб.
1997, с. 25-27.
3. Белянская И.Г. Клинико-неврологические варианты опоясывающего
герпеса//Канд, диссерт, СПб, 1997
4. Исаков В. А., Чайка Н.А, Ермоленко Д. К. Вирус герпеса 6-го типа и СПИД.
-Л.-1991.
5. ЛебедеваН.Н. Пригожина В.К., СтепановаЕ.В. Сб. «Инфекционныеболезни
с половым путем передачи» подред. АТ.Рахмановой, Б.М.Тайца. - СПб.
-1995.-с.40-46
6. Львов Н.Д., Мельниченко А.В. Вопр. вирусол. - 1999. -№ 3.-с.105-111.
7. Марченко Н.Р., Шахтильдян В.И., Шипулина О.Ю. и др. Эпидемиология и
инфекционные болезни. - 1998. -№ 5.-с.36-38.
8. Миндел А. Генитальный герпес - «забытая эпидемия». - Заболевания,
передаваемые половым путем. - 1995, - № 1. - с. 11-17.
9. Неизвестная эпидемия: герпес. - под ред. Хахалина Л .Н. - Смоленск. -1997.
10. Пригожина В.К., Чайка Н. А., Рахманова А.Г. Герпетическая инфекция и
СПИД.-Л.-1990.
11. Рахманова АГ, Мальцева И.В., Чайка Н.А. Вирус Эпштейна-Барр и СПИД.
-Л.-1990.
12. Рахманова А.Г, Исаков В.А., Чайка Н.А. Цитомегаловирусная инфекция
и СПИД.-Л. - 1990.
13. Рахманова А Г, Пригожина В.К., Неверов В.А. Герпесвирусные и ВИЧ-
инфекции. -СПб - 1995.
14. Рахманова А.Г, Степанова Е.В., Касьянов А.Д, и др. Клин. мед. - 1997. -
7.-с. 56-59
15. Rakhmanova A., Volkova G.. Remesov A., Stepanova Е. HIV/AIDS and
sexually transmitted diseases in St.Petersburg. - 1998 - p. 17.
16. Шахтильдян В.И., Кравченко А.В., ШипулинаО.Ю. и др. Тер. арх. -1996.
-т.68.-№4.-с.65-68.
17. Шахтильдян В.И. Новый медицинский журнал. - 1997. -№ 2. - с.2-6.
18. ШипулинаО.Ю., Шахтильдян В.И., ШипулинГА. и др. Вопр. вирусол. -
1998.-т. 43. - №2.-с.91-95.
19. Шахтильдян В.И., Кравченко А.В., Марченко Н.Р. Эпидемиология и
инфекционные болезни. - 1999. -№3. -с.45-50.
20. Balfour НН.Ir. Fletcher С. V, Erice A. Antimicrobial Agents & Chemotherapy.
- 1996 Dec. - 40( 12). - р. 2721 -6.
21»
323
21. Dwyer D.E., Cunningham A.L. Bailliere’s Clin. Obstct. Gynaecol. - 1993. -v.
7№ 1.-p.75-105.
22. Flood J., Drew W.L., Miner R. J. of Infect. Dis. -1997 Aug. -176(2). - p. 348-
52.
23. Hendrix R.M., Wagenaar M., Slobbe R.L. J. of Clin. Pathol. - 1997 Jan. -
50(1).-p. 59-63.
24. Herpes. J. of the IHMF. - 1998. - v.5. - N 3. - p.59-82
25. KunnoA.. AbeM„YamadaM. Liver. - 1997 Jun. - 17(3).-p.l29-32.
26. Managmcnt of herpesvirus infections in the immunocompromised host with
and without HIV infection. Building international congress. - IHMF, 1995. -
p.37.
27. Managment of herpesvirus infections in the immunocompromised host with
and without HIV infection. Building international congress. - IHMF, 1996. -
p.67.
28. Rozenthal S.L., Stanberry L.R. Clin. Inf. Dis. -1997 Feb. -24(2). -p. 135-9.
29. Sinzger C., Jahn G., Jntervirology. - 1996. - 39(5-6). -p. 302-19.
30. Watanabe S., Arima K., Nishioka M. Liver. - 1997 Apr. -17(2). -p. 63-9.
31. Whitley J., MeignierB. Biotechnology. - 1992. -v.20. -p.223-254
7.8. Особенности течения варицелла-зостер-вирусной-инфекции
на фоне ВИЧ-инфекции
Известно, что опоясывающий герпес (ОГ) является клиническим
проявлением реактивации латентной инфекции и связывается со стойким или
преходящим угнетением клеточного иммунитета, вследствие чего нередко
(30%) наблюдается у больных с ВИЧ-инфекцией [4|, а его рецидивирующая
форма у лиц до 60 лет рассматривается в качестве одного из ВИЧ-индикаторных
заболеваний. Установлено, что от 22 до 73% всех больных с ОГ составляют
ВИЧ-инфицированные. ОГ является ранним маркером иммуносупрессии
обусловленной вирусом иммунодефицита человека, и часто регистрируется
у ВИЧ-инфицированных, не имеющих проявлений каких-либо других
заболеваний, то есть при умеренных иммунных дисфункциях [3], за месяцы и
годы до появления других оппортунистических инфекций или опухолей [ 1 ]. В
связи с этим ОГ, особенно в странах с широким распространением вируса
иммунодефицита человека, имеет предсказывающее значение для
последующего выявления ВИЧ-инфекции у молодых людей с вероятностью
41%, при этом риск значительно возрастает при краниальной локализации
ОГ [12]. Было установлено, что в течение 4-х лет после диагностирования ОГ
приблизительно у 50% ВИЧ-инфицированных развивается СПИД.
Sellitti Т.Р. с соавт. (1993) среди наблюдаемых больных разных
возрастных групп с офталмичсской формой ОГ в 26% случаев выявили ВИЧ/
СПИД-инфскцию. Офталмическая форма ОГ встречается у ВИЧ-
324
инфицированных чаще и связана с большей частотой таких осложнений, как
кератит и увеит. Только среди больных с иммунодефицитом, как показывает
практика, при ОГ развивается острый некроз сетчатки [9].
Наблюдения зарубежных исследователей показывают, что ОГ,
протекающий у ВИЧ-инфицированных:
• с выраженным болевым синдромом и/или
• в тяжелой форме и/или
• с локализацией высыпаний в области головы и шеи,
связан с прогрессированием ВИЧ-инфекции к стадии СПИД.
Висцеральная дисссминация при ВЗВ-инфекции происходит или после
ОГ, или при отсутствии поражения покровных тканей. Частота возникновения
диссеминированных форм ВЗВ-инфекции после локализованных у ВИЧ-
инфицированных неизвестна, но она не кажется высокой.
Прогрессивные неврологические дисфункции у больных в стадии СПИД
могут развиться спустя некоторое время после ОГ (недели и месяцы) и
привести к летальному исходу вследствие зостер-энцефалита. Культура
вируса была получена также из цереброспинальной жидкости больных с
подострым менингоэнцефалитом без кожных высыпаний [1]. У больного
СПИДом описан прогрессивный ВЗВ-энцефалит без кожных проявлений,
доказанный гибридизацией in situ и иммунофлюоресцентным исследованием
биоптатов мозга [10]. Обнаружены еще две формы поражения ЦНС вирусом
варицелла-зостср при ВИЧ-инфекции, не характерные для
иммунокомпетентных лиц. У одного из больных, молодого человека 30 лет, с
выраженной иммуносупрессией (CD4(+) Т-лимфоциты составляли 290/мм3),
без высыпаний на покровных тканях развились быстропрогрсссирующие вялая
параплегия, гипсстсзия, задержка мочи, психомоторные нарушения,
сопровождающиеся фебрильной лихорадкой и приведшие к смерти в течение
1 недели. Выявлен диффузный вентрикулшп с включениями Cowdry типа А
в клетках эпендимы, экстенсивные некротические и геморрагические
изменения с выраженным некротизирующим васкулитом в пределах всего
спинного мозга и спинальных ганглиев. Иммунохимичсскими методами
выявлены ВЗВ-позитивныс включения в клетках эпендимы, глиальных,
эндотелиальных и шванновских клетках. Гибридизацией in situ обнаружен
ВЗВ-геном в лсптомснингсе, мозге, спинном мозге и спинальных ганглиях.
Подобные нсйропатологичсскис данные и многочисленные включения,
содержащие ВЗВ, были обнаружены в мозге, спинном мозге и ганглиях у 40-
летнего больного СПИДом, умершего от фульминантной восходящей
миелорадикулопатии, которая ранее была описана как «некротизирующий
васкулит нервной системы». Прямое инфицирование мозга вирусом варицелла-
зостср у больных СПИДом, как было показано, вызывает лейкоэнцефалшпы
и невоспалительные васкулопатии, может приводить к менинго-миело-
325
радикулиту, возможно, вторичному по отношению к вентрикулиту [2].
Moulignier А. и соавт. (1995), описавшие у больного со СПИДом стволовой
энцефалит без кожных высыпаний с наличием внутриядерных включений в
нейронах, астроцитах, олигодендроцитах, считают необходимым включить
ВЗВ-инфскцию в дифференциальную диагностику заболеваний нервной
системы у больных СПИДом [8].
Известно, что на фоне ВИЧ-инфекции клинические проявления и
характер течения ассоциированных инфекций могут иметь существенные
особенности. Нами проанализированы особенности течения ОГ, развившегося
у 12 или 12,4% из 97 ВИЧ-инфицированных лиц, наблюдавшихся в Санкт-
Петербурге стационарно и амбулаторно в 1987-1995 годах (из них 6 из 38
женщин (15,8%) и 6 из 59 мужчин (10,2%). Возраст больных-от 3 до61года,
в среднем составил 38,9 лет.
У 3 больных диагноз ОГ был поставлен анамнестически, у 8 больных
заболевание развилось на поздних стадиях ВИЧ-инфекции (IIIA, ШВ) в сроки
от 2 месяцев до 5 лет от момента выявления. В одном случае ОГ сыграл роль
СПИД-индикаторного заболевания, на фоне которого были выявлены ВИЧ-
специфические антитела.
У всех пациентов обнаруживалось значительное снижение показателей
клеточного звена иммунитета, коэффициент дифференцировки [CD4(+) /
CD 8(+)] составил меньше 0,6.
Начало ОГ характеризовалось преимущественно синдромом
инфекционного токсикоза: умеренно выраженной лихорадкой (в 6 случаях
был выявлен кратковременный периодический субфебрилитет, в 3-х случаях
- кратковременное повышение температуры до 38,0-38,5°С. в 3-х случаях
повышения температуры не отмечалось), общим недомоганием (4
наблюдения), головной болью (4 наблюдения). У 2 больных первым симптомом
заболевания была сыпь и у 2 больных - локальные боли в местах будущих
высыпаний.
Отмечалась преимущественно спинальная локализация сыпи: в области
грудных сегментов - у 4 больных, поясничных - у 3, шейных - у 2 больных.
Краниальная локализация ОГ была выявлена в 3 случаях, в одном из них -
офталмический ОГ. Высыпания появлялись, в основном, на 1 неделе
заболевания, с последующим их нарастанием и характерным полиморфизмом.
Поражения кожи в большинстве случаев были глубокими, в 4 случаях с
формированием эрозий, в 5 случаях с наслоением вторичной бактериальной
флоры, в результате чего исходом сыпи у 4 больных явилась пигментация и у
4 больных - пигментация с рубцеванием. Диссеминация сыпи была
зарегистрирована лишь в одном наблюдении.
Локальный болевой синдром был значительно выражен (+++) в 4-х
случаях, умеренно (++) - в 5, слабо выражен (+) - в 3 случаях. Формирование
326
хронической зостер-ассоциированной боли (ХЗАБ) было выявлено у 2
больных (длительность болевого синдрома более 6 недель), однако, спустя 8-
9 недель интенсивность болей значительно уменьшилась, и через 6 месяцев
жалоб на боли эти больные не предъявляли.
Чувствительные расстройства были чаще представлены в виде
гипестезии (9 наблюдений), и лишь в 3 случаях начальная гиперестезия после
появления высыпаний сменялась гипестезией. Наиболее долго (около 2 лет
после перенесенного ОГ) гипестезия сохранялась у 2 больных, имевших в
течение болезни длительный и выраженный болевой синдром.
Поражение при ОГ ЦНС и оболочек мозга, сопровождающееся
усилением общемозговых симптомов и нарушением сознания по
дефицитарному или продуктивному типу, появлением очаговых пирамидных
и экстрапирамидных симптомов, развитием менингеального синдрома, у ВИЧ-
инфицированных больных выявлено не было. Также не было отмечено
развития периферических парезов и параличей.
Длительность течения опоясывающего герпеса у больных этой группы
колебалась от 1 до 6 недель и составила: 1 неделю - у 2-х, 2 недели - у 2-х, 4
недели - у 4-х и 6 недель - у 3-х больных.
Клинически в 3-х случаях было выявлено рецидивирующее течение
заболевания, что составило 25%: в одном случае у девочки, рожденной от
ВИЧ-инфицированной матери, впервые ОГ развился в 3-х летнем возрасте,
затем рецидивировал в 4 года и в 12 лет, уже на фоне выявленной ВИЧ-
инфекции; во втором случае ОГ зарегистрирован через 4 года после выявления
ВИЧ и рецидивировал через 1 год и через 2 года; в третьем случае ОГ был
диагностирован через 1,5 года после выявления ВИЧ и рецидивировал через
2 месяца.
При изучении особенностей течения опоясывающего герпеса у ВИЧ-
инфицированных, находящихся на стационарном лечении в Республиканской
клинической инфекционной больнице, выявлено, что из 646 обследованных
больных (в том числе 78 детей) ОГ диагностирован в 61 случае, что составило
9,4%. Проведенный анализ показал, что наибольшее количество случаев ОГ
зарегистрировано на стадиях ВИЧ-инфекции, соответствующих категориям
А и В по CDC- по 37,7%. Однако, при исследовании частоты регистрации ОГ
у ВИЧ-инфицированных в зависимости от стадии болезни оказалось, что на
стадии А она составляет лишь 5,2% (23 случая у 446 больных), на стадии В -
20,9% (23 случая у 110 больных) и на стадии С -16,6% (15 случаев у 90 больных).
У19,7% больных отмечены повторные случаи заболевания. У трети больных
формировались рубцово-атрофические изменения кожи различной степени
выраженности.
Таким образом, немногочисленные на сегодняшний день наблюдения
не позволили нам выявить тяжелые формы опоясывающего герпеса у ВИЧ-
327
инфицированных лиц. Обобщая полученные данные, следует отметить, что
ОГ чаще развивался на поздних стадиях ВИЧ-инфекции, существенными
особенностями течения ОГ у ВИЧ-инфицированных были склонность к
рецидивированию, затяжной характер течения, а также более глубокий
характер поражения кожи с частым формированием рубцово-атрофических
изменений.
Приводим 2 выписки из истории болезни.
Выписка из истории болезни №1. Больной С., 58 лет. Клинический
диагноз: ВИЧ-инфекция в стадии ШБ. Системный кандидоз (оро-
фарингеальный, эзофагит). Опоясывающий герпес Ц 4 справа, осложненный
рубцовыми изменениями кожи. Правосторонняя среднедолевая очаговая
пневмония с поступления. Себорейный дерматит лица. Разноцветный лишай.
Микоз стоп, онихомикоз. Начальные проявления волосатой лейкоплакии языка.
Хронический пиелонефрит вне обострения.
Заболел в конце августа 1993 года, когда почувствовал слабость,
недомогание, непостоянный субфебрилитет в течение нескольких дней; 25.08.93
появились выраженные жгучие боли в области правого бедра, локально -
повышенная чувствительность кожи. Через 2 дня больной обнаружил
высыпания справа, которые вначале появились в области поясницы, затем
распространились на ягодицу, в паховую область, на гениталии, передне-
внутреннюю поверхность бедра и голени. Высыпания носили нарастающий
характер в течение одной недели, везикулы были крупными, местами сливались
в буллы, а также вскрывались, образуя мокнутия и эрозии. Присоединилась
вторичная инфекция. С 1.09 в течение 4 дней лихорадил до 40°С.
Боли после появления сыпи не уменьшились, а напротив, усилились,
приобрели "простреливающий’' характер. Больной наблюдался и лечился
амбулаторно с 30.08, но заболевание приняло затяжной характер. С 25.09
обнаружил налет на языке, появились слабость и субфебрилитет, 26.09
обратился в поликлинику и был направлен на госпитализацию в ЛОР-отделснис
с подозрением на герпетическую ангину; откуда сразу же переведен в
Городскую инфекционную больницу № 30 им. С.П. Боткина с диагнозом
«герпетическая инфекция». Таким образом, больной С. с сохраняющимся
болевым синдромом и поражением кожно-слизистых покровов поступил в
стационар 26.09.93 г. на пятой-шестой неделе ОГ.
При поступлении: высыпания локализовались справа в области
поясницы, на ягодице, в паховой области и передне-внутренней поверхности
нижней конечности и носили характер крупных глубоко сидящих темного
цвета корок на гиперемированной инфильтрированной коже, темных
пигментных пятен и местами формирующихся атрофических и рубцовых
изменений. Выявленная при поступлении гиперестезия в области высыпаний
сохранялась около 2 недель, затем на пораженных участках обнаруживалось
.328
снижение чувствительности (гипестезия). Общемозговая симптоматика была
слабо выражена: умеренная головная боль, астено-невротичсский синдром.
Менингеальные знаки отсутствовали. Периферических парезов выявлено не
было. Температурная реакция характеризовалась кратковременными 2-3-х
кратными подъемами температуры до субфебрильных цифр.
Помимо ОГ у больного с поступления выявлены множественные
поражения покровных тканей, из которых особенно выраженными были оро-
фарингеальный кандидоз, а также микотическое поражение стоп.
Заподозренный при первичном осмотре иммунодефицит с вторичными
заболеваниями подтвержден обнаружением ВИЧ-спсцифических белков.
Гемограмма от 1.10.93 г.: гемоглобин -113 г/л, эритроциты -3,5x1 ()12/л;
цветовой показатель - 0,95; тромбоциты - 195х1012/л; ретикулоциты - 2%;
лейкоциты - 2,5x109/л; нейтрофилы палочкоядерные - 4%, сегментоядерные -
46%; эозинофилы - 2%; лимфоциты - 44%; моноциты - 2%, плазматические
клетки - 2%; СОЭ - 45мм/час.
В анализах мочи при поступлении и перед выпиской выявлен белок -
до 0,066 г/л, лейкоциты - до 7-10 в поле зрения.
Иммунограммы больного в динамике от 1.10.93 г. и в скобках от 25.12.95
г: лейкоциты -2,5 (1,6)х109/л; лимфоциты - 44% -1100/мм3 (47% - 752/мм3);
CD4(+) Т-лимфоциты -231 (195) /мм3; CD8(+) Т-лимфоциты - 533(195)/мм3:
CD4(+)/CD8(+)=0,43 (1.0). Содержание иммуноглобулинов классов М и G - в
пределах нормы, а содержание иммуноглобулинов класса А было
незначительно повышенным - 6,5 г/л (5.2 г/л - верхняя граница нормы).
Терапия: антиретровирусная терапия, антимикотические препараты,
антибактериальные средства; ацикловир внутривенно 3 дня и перорально 5
дней, комплекс витаминов группы В, нсстероидныс противовоспалительные
средства, физиотерапевтическое лечение, симптоматические средства. На
фоне проводимой терапии основные проявления ОГ регрессировали: кожные
покровы очистились от корок спустя 8 недель от начала лечения,
одновременно уменьшилась и выраженность болевого синдрома.
Множественные проявления различных грибковых инфекций также
регрессировали.
Исходом сыпи явились пигментация и рубцевание, которые, наряду с
легкой гипестезией, обнаруживались через 1 год и 2,5 года. Боли перестали
беспокоить через 1 месяц после выписки из стационара (около 4-х месяцев
от начала ОГ). В последующие годы состояние больного прогрессивно
ухудшалось, в начале 1994 года по совокупности клинических данных и
показателей иммунограммы констатирован СПИД, а летом 1996 года при
явлениях генерализованной цитомегаловирусной инфекции, СПИД-деменции,
постоянного фебрилитета больной скончался.
329
Выписка из истории болезни № 2. Больная М., 41 год: Инфицирована
половым путем, выявлена как ВИЧ-инфицированная в 1988 г., находится под
наблюдением Городского Центра по профилактике и борьбе со СПИДом до
настоящего времени, неоднократно находилась на стационарном лечении и
обследовании в Городской инфекционной больнице № 30 им. С.П. Боткина и
в Республиканской клинической инфекционной больнице (РКИБ). Фоновые
заболевания - хронический аднексиг и рецидивирующий простой герпес:
лабиальный с детства и генитальный с 18 лет с частыми рецидивами
локализованной формы. В 1992 г. впервые перенесла опоясывающий герпес.
Показатели клеточного звена иммунитета - Т-лимфоциты, СП4-Т-лимфоциты,
СО8-Т-лимфоциты, индекс дифференцировки - были снижены незначительно:
за 4 месяца до заболевания - 62% (1266 в мм5), 21% (424 в мм5), 41% (841 в
мм5) и 0,5 соответственно, а в разгар высыпаний - 59% (1284 в мм ), 24% (522
в мм5), 35% (762 в мм5) и 0,69 соответственно. Заболевание протекало
достаточно легко, началось 5.10.92 г. с недомогания и появления типичных
зудящих болезненных высыпаний в области грудных дерматомов слева (D3 6).
Получала виролекс внутривенно в течение 3 дней, затем перорально в дозе 4
грамма в сутки. На 8 день болезни госпитализирована в Республиканскую
клиническую инфекционную больницу, где продолжала получать виролекс
еще в течение 10 дней. На 19 день от начала болезни жалоб не предъявляла,
все элементы сыпи подсохли и начали отпадать, а к концу 4-й недели болезни
кожа полностью очистилась от высыпаний.
С 1993 г. отмечает повышенную утомляемость, ночные поты, ас 1994 г.
- выраженную слабость, недомогание, утомляемость. Весной 1994 г. перенесла
второй эпизод ОГ. также протекавший нетяжело и пролеченный амбулаторно
ацикловиром, при этом через 4 месяца после заболевания выявлено снижение
абсолютного количества С 04-лимфоцитов до 183 в мм5 (21 %) с дальнейшим
повышением до 369 в мм5 (22,5%). С 1995 г. получает специфическую терапию,
на фоне которой количество СО4-лимфоцитов повысилось и оставалось
стабильным до начала 1997 г. в пределах 21-28% или 508-621 в мм5. В начале
осени 1996 г. по совокупности клинических проявлений и показателей
клеточного звена иммунитета (CD4 21% - 350 в мм5, CD8 35% - 583 в мм5,
индекс дифференцировки 0,6) стадия ВИЧ-инфекции определена как С2 по
классификации CDC. Через месяц после прекращения приема фосфазида
больная перенесла третий эпизод опоясывающего герпеса, который отличался
упорным, длительным течением и малой чувствительностью к
противовирусным препаратам. Заболевание началось 12.10.97 г. с появления
болей под правой молочной железой с иррадиацией в лопатку. 19.10. появились
зудящие болезненные высыпания в области грудных дерматомов справа (D2
,), с 23.10 отмечала усиление болей, которые прибрели характер жгучих,
распространились на правое плечо и предплечье. Больная была
330
госпитализирована и получала, помимо симптоматических средств и местного
лечения, зовиракс в течение 3 недель в дозе 4-5 граммов в сутки, из них часть
- внутривенно. На фоне проводимой терапии сохранялся субфебрилитет и
отмечено волнообразное течение заболевания с появлением типичных свежих
высыпаний на 3,4 и 8 неделях болезни. При исследовании церебро-спинальной
жидкости патологических изменений не выявлено. Показатели клеточного
звена иммунитета в разгар ОГ составили: СП4-Т-лимфоциты 20% - 589 в мм’.
СВ8-Т-лимфоциты 38% - 1119 в мм3, индекс дифференцировки 0,53. Через
месяц от начала болезни интенсивность болей уменьшилась и элементы сыпи
начали подсыхать, а через 6 недель боли исчезли. Единичные элементы сыпи
сохранялись до выписки, т.е. через 2 месяца от начала ОГ.
Таким образом, по нашим наблюдениям, течение опоясывающего
герпеса на фоне ВИЧ-инфекции у взрослых имело следующие особенности:
1. Отсутствие выраженных общеинтоксикационных симптомов.
2. Относительная благоприятность течения заболевания.
3. Нестойкость болевого синдрома.
4. Более длительный регресс кожных проявлений при неосложненных
формах заболевания.
5. Склонность к рецидивирующему течению.
6. Резистентность к противовирусной терапии.
Заключение: опоясывающий герпес у пациентов с ВИЧ-инфекцией
приобретает рецидивирующий характер течения с появлением двух или трех
эпизодов болезни без развития менингоэнцефалита, заболевание имеет
относительно благоприятный характер течения, наиболее частым
осложнением является формирование умеренно выраженных рубцово-
атрофических изменений кожи. Для манифестации хронической ВЗВ-
инфекции в виде опоясывающего герпеса необходимо сохранение резервных
возможностей иммунной системы. Ни у одного из больных с ВИЧ-инфекцией
и опоясывающим герпесом уровень CD4+ Т-лимфоцитов не снижался ниже
критического уровня, характерного для СПИДа (<200 в мм3).
Литература
1. AIDS: etiology, diagnosis, treatment, and prevention./ Edited by
V.T.DeVita, S.Hellman, S.A.Rosenberg.-2,ld ed.-J.B. Lippincott Company,
USA, 1988.-474p.
2. Chretien F., Gray F., Lesos M.C. et al. Acute varicella-zoster virus
ventriculitis and meningo-myelo-radiculitis in acquired immunodeficiency
syndrome. // Acta. Neuropathol. Bed.-1993.-86(6).-p.659-65.
3. Crowe S.M. Unusual features of herpes simplex or zoster infection that
suggest HIV infection.// Med. J. Aust.- 1993 Feb.l.-158(3).- p 186-7.
331
4. Donofrio P., Migliaccio G., Schettino A. Herpes zoster in pazienti con
AIDS. // Ann.ital.dermatol.clin.csper.-1995.-49 N2.-p.62-4.
5. Jackson A.C. Acute viral infections. // Current Opinion in Neurology. Vol
8.-N3.- 1995 June.
6. Jacobson M.M., Bergen T.J. et al. Acyclovir-resistant varicella -zoster
virus infection after chronic oral acyclovir therapy in patients with the
acquired immunodeficiency syndrome (AIDS). //Ann.Intern.Med.-1990.-
Vol.12.-N3.-p.187-191.
7. Lentz D., Jordan J.E., Pike G.B., Enzmann D.R. MRI in varicella -zoster
virus leukoencephalitis in the immunocompromised host.//J. Comput.
Assist. Tomogr.- 1993 Mar-Apr.-17(2).-p.313-6.
8. Moulignier A., Pialoux G., Dega H. Et al. Brainstem encephalitis due to
varicella-zoster virus in a patients with AIDS.//Clin. Infec. Diseas.-1995,-
20 N5.-p. 1378-80.
9. Sellitti T. P, Huang A.J., Schilfman J., Davis J.L. Association of herpes zoster
ophthalmicus with acquired immunodeficiency syndrome and acute retinal
necrosis. //Am. J. Ophthalmol.-1993 Sep. 15,-116(3).-p. 297-301.
10. Silliman C.C., Tedder D., Ogle J.W. et al. Unsuspected varicella-zoster
virus encephalitis in a child with acquired immunodeficiency syndrome./
/J. Pediatr.-I993 Sep.-123 (3).-418-22.
ll. Yasuyki E. The immunotherapy for patients with positive HIV usings
glicyrrhizin. //Tenth International Conference on AIDS.-Yokohama,7-12
August 1994.-p.218.
12. Yedomon H.G., Doango-Padonou E, Adjibi A. et al. Herpes Zoster, predictive
clement of human immunodeficiency virus infection (HIV). Epidemioclinical
study in Cotonou (Benin) // Bull.Soc. Pathol. Exot.-1993,- 86(2).-p. 87-9.
13. Yochida M., Yamagami N. et al. Case report: detection of varicella-zoster
virus DNA in maternal breast milk. //J.Med. Virol.-1992.-Vol.33.-N2.-
p.108-10.
332
Глава 8. ТОКСОПЛАЗМОЗ И ВИЧ-ИНФЕКЦИЯ
Распространенность, этиология, эпидемиология и патогенез
токсоплазмоза.
Токсоплазмоз - это врожденное или приобретенное зооантропонозное
паразитарное заболевание с разнообразными путями передачи, характеризуется
хроническим течением, поражением нервной системы, органов
ретикулоэндотелиальной системы (лимфоузлы, печень, селезенка), частым
поражением скелетных мышц, миокарда и глаз.
Токсоплазмоз не теряет своей актуальности для врачей всего мира, что
обусловлено:
• широкой распространенностью возбудителя в природе и чрезвычайно
частой регистрацией этой паразитарной инвазии. Зараженность
токсоплазмозом в Великобритании составляет 20-40%; в США - 50-60%; во
Франции - 80-90% (Barker К.Е. et al., 1992), а опасность инфицирования с
каждым прожитым годом возрастает на 0,5-1,0%. Считается, что антитела к
возбудителю имеют 0,5 млрд, человек на земном шаре.
• поражением любых органов и тканей организма (пантропизм
возбудителя);
• наличием вертикального пути передачи инфекции от матери к плоду.
Например, в Великобритании число случаев острой инвазии у беременных
женщин составляет 2,0-2,6 на 1000, а уровень трансплацентарной передачи
возбудителя находится в пределах до 40% (Joynson D., 1992; Koskinemi M. et
al., 1992);
• у иммунокомпетентных лиц инфекция протекает бессимптомно, т.к.
возбудитель ведет себя как условно-патогенный микроорганизм;
• активация латентного токсоплазмоза происходит на фоне
иммунодефицитных состояний (ВИЧ-инфекция, сахарный диабет,
гормонотерапия, длительный прием иммунодепрессантов).
История токсоплазмоза начинается с 1908 г., когда Nicole и Manceaux
наблюдали вмононуклеарах печени и селезенки Северо-Африканского грызуна
(Clenodactilys gundi) паразита, похожего на лейшманию, однако дальнейшее
изучение морфологических характеристик паразита показало, что он не
является Leischmania, и для него предложили наименование Toxoplasma («toxon»
в переводе с греческого «арка»). В 1914 году Кастеллани обнаружил паразита у
погибшего солдата, а в 1923 г. пражский офтальмолог Janku описал цисты в
сетчатой оболочке глазау 11 месячного ребенка с врожденной гидроцефалией,
микрофтальмией с колобомой. Эти паразиты позднее были распознаны Levaditi
(1928) как цистная форма Toxoplasma gondii, он же впервые предположил
возможную связь между токсоплазмозом и врожденной гидроцефалией. Однако
333
заболеванию стали уделять серьезное внимание только с 1937 г., когда Wolf и
Cowen описали летальный случай гранулематозного энцефалита у
новорожденного, вероятно, зоонозной природы, a Sabin, занимающийся
изучением токсоплазмоза у морских свинок, подтвердил его паразитарную
природу. Исследования, проведенные Wolf и Cowen, подтвердили роль
Toxoplasma gondii как причину перинатальной инфекции. Открытие
возможности инфицирования токсоплазмами в течение жизни принадлежит
Pincerton и Weinman, которые в 1940 г. констатировали летальный исход
генерализованного токсоплазмоза у молодого мужчины. В 1?41 г. Pincerton и
Henderson описали летальные исходы острого заболевания, сопровождавшегося
лихорадкой и экзантемой у 2 взрослых больных, и в том же году Sabin наблюдал
случай токсоплазменного энцефалита у ребенка. В 1948 г. Sabin и Feldman
впервые разработали серологический тест, который позволил исследовать
эпидемиологические аспекты токсоплазмоза, и продемонстрировали, что
токсоплазмоз является широко распространенной инфекцией человека во всем
мире, протекающей преимущественно в субклинической и латентной форме.
В СССРтоксоплазмы впервые были обнаружены в 1930 г. Д.Н.Засухиным
и Н.А.Гайским у сусликов. В 1958 г. С.Г.Васина и Д.Н.Засухин впервые в нашей
стране выделили человеческий штамм T.gondii из мозга детей, погибших от
врожденного токсоплазмоза (Рахманова А.Г. и др., 1992).
Возбудитель токсоплазмоза - внутриклеточный паразит Toxoplasma gondii,
относится к типу простейших (Protozoa), классу споровиков (Sporozoa), отряду
кокцидий (Coccidia).
Сложный жизненный цикл Toxoplasma, протекающий при участии
промежуточного и окончательного хозяина, был расшифрован лишь в 70-х годах
(Hutchison; Frenkel; Overdulve). Было выяснено, что цисты Т. gondii способны
продолжать свое развитие в организме кошки при скармливании ей мышей,
зараженных цистами токсоплазмы. В клетках кишечного эпителия происходит
бесполое развитие паразита, за которым следует формирование макро- и
микрогаметоцитов, копуляция гамет и формирование зиготы. Ооциста
спорулирует во внешней среде и имеет изоспороидное строение. Так впервые
была доказана кокцидийная природа Toxoplasma и обоснована правомочность
ее включения в класс Sporozoa (Бейер ТВ., Полянский Ю.И., 1979).
В жизненном цикле выделяют несколько стадий и ультраструктур
токсоплазм:
1) эндозоиты и цистозоиты - вне- и внутриклеточные стадии, образующиеся
в разных органах и тканях у промежуточных хозяев (включая человека) в
результате бесполого размножения - эндодиогении и эндополигении;
2) мерозоиты - внутри- и внеклеточные стадии, образующиеся в результате
бесполого размножения - шизогонии в эпителиальных клетках кишечника
основного хозяина (кошка и другие кошачьи);
334
3) спорозоиты - инвазионная стадия, образующаяся в результате спорогонии,
происходящей в ооцисте уже вне основного хозяина - кошки;
4) микро- и макрогаметы - половые стадии развития, образующие в
основном хозяине в результате слияния зиготу и затем покоящуюся стадию -
ооцисту (содержащую по 2 спороцисты, в каждой из которых по 4 спорозоита),
которая затем выводится во внешнюю среду (Засухин Д.Н., 1980). Через 5
дней после попадания ооцист в почву они спорулируют, в каждой из них
образуется 8 спорозоитов, и ооцисты становятся патогенными.
Таким образом, в настоящее время известны два типа размножения
токсоплазм: 1) бесполое, включающее эндодиогению, эндополигению и
шизогению. Стадиями бесполого размножения являются эндозоиты
(расположенные вне- и внутриклеточно) и цистоиты или цисты; 2) половое
(гаметогония), стадиями которого являются макро- и микрогаметоциты,
образующие при слиянии ооцисту.
Отличительной особенностью кишечной фазы жизненного цикла
токсоплазмы является то, что она служит продолжением развития цистозоита,
а не спорозоита. Спорозоит способен к внекишечной пролиферации во
внутренних органах хозяина, зараженного ооцистами, в том числе и кошки,
которая в этом случае становится и промежуточным хозяином (Бейер Т.В.,
Полянский Ю.И., 1979). В жизненном цикле паразита внекишечная фаза
бесполого развития имеет значительный удельный вес. Из всех токсоплазмид
T.gondii имеет наибольшее число промежуточных хозяев - 350 видов домашних
и диких млекопитающих и птиц. Это тем более удивительно, что паразит
представлен всего лишь одним видом - T.gondii. Возможно, что именно
двойственность жизненного цикла, состоящая в сочетании признаков гомо- и
гетероксенности, является одной из причин почти всеобщего охвата животных
в качестве промежуточных хозяев токсоплазмы, а также к приводит к
генерализованному поражению органов и тканей зараженного хозяина.
При инфицировании окончательного хозяина (кошки) ооцистами
латентный период значительно удлиняется (до 25 дней), а при заражении
цистами он составляет 3-5 дней. У кошки, зараженной ооцистами, наблюдается
генерализованное поражение внутренних органов. До 5-7 дня спорозоиты
сохраняются в кишечнике в спящем состоянии, с 10-го по 18-й день поражение
кишечника не обнаруживается. Развитие токсоплазмы в кишечном эпителии
происходит с 20 по 25-й день после заражения, в дальнейшем эндозоиты T.gondii
развиваются в клетках системы мононуклеарных фагоцитов (гистиоциты lamina
propria кишечника, стромы внутренних органов, купферовских клетках печени,
ретикулярных клетках лимфатических узлов, селезенки и др.), в мышцах и
нервных клетках. Это - быстро пролиферирующие стадии, встречающиеся в
организме в острый период заболевания. Развитие паразита происходит внутри
паразитоформной вакуоли; временные скопления эндозоитов, находящиеся
335
внутри таких вакуолей, носят название псевдоцист (Бейер Т.И., 1979). При
разрушении псевдоцист из каждой выходит 10-15 тыс. возбудителей, которые
инвазируют здоровые клетки, что снова приводит к образованию псевдоцист.
Позже образуется истинная тканевая циста как внутри, так и вне клетки хозяина.
Способ деления эндозоитов весьма необычен для простейших и носит название
эндодиогонии, когда помимо бинарного деления происходит внутреннее
почкование материнской клетки (описан в 1958 г. N. Goldman). Эндодиогония
характерна и для цистных форм токсоплазм, хотя происходит в более медленном
темпе. Цисты с медленно развивающимися цистозоидами (брадизоитами)
появляются в головном мозге, глазах, скелетных и сердечных мышцах через 1 -
2 недели после заражения. При хроническом течении токсоплазмоза цисты
могут либо обызвествляться, либо разрушаться с выходом токсоплазм, что
влечет рецидив заболевания. Как показали результаты электронно-
микроскопического исследования цист в головном мозге мышей (Ferguson
D.J.P., 1988), внутриклеточное расположение надежно защищает их от иммунной
системы хозяина за счет отсутствия контактов паразитарных антигенов с
иммунокомпетентными клетками. Одним из “иммунологически
привилегированных” органов, куда не проникают антитела, помимо головного
мозга, является орган зрения (Лысенко А.Я. и др., 1996).
Размножаясь, токсоплазмы изменяют метаболизм клеток, что ведет к
их быстрому разрушению и некрозу. Такие очаги некроза встречаются втканях
печени, лимфатической системы, мозга, глаз и т.д., в клетках эпителия
кишечника эти изменения менее выражены. При введении в эксперименте 6-
8 дневным мышам в лобную долю мозга 3 мкл взвеси, содержащей 104
тахизоита (Hofflin J., Conly F., Remington J., 1987), было выяснено, что уже
через 3 дня в месте инокуляции можно обнаружить T.gondii во
внутриклеточных вакуолях, на 7-й день регистрируется воспалительная
реакция с менингеальной и периваскулярной инфильтрацией
мононуклеарными лимфоцитами, отеком, очагами некроза; в течение 2-й
недели тахизоиты исчезают и появляются цисты, вокруг которых
воспалительная реакция отсутствует. Через 1 месяц после заражения клеточная
инфильтрация в местах заражения ослабевает, через 2 месяца очаги некроза
уменьшаются, а в других органах (сердце, легкие, печень) отмечаются очаги
воспаления. У мышей с подавленной иммунной системой само заражение
смертельно. С 4-го дня после заражения в большом количестве выявляются
преимущественно внеклеточные стадии паразита, быстро увеличивается зона
поражения, где идет разрушение тканей. Авторы отмечают сходную картину
у мышей и людей при токсоплазменном энцефалите.
По степени эпидемиологической опасности все источники инфекции
T.gongii подразделяются на 2 группы: основные (кошки, сельскохозяйственные
животные, мясо которых употребляется в пищу); дополнительные (грызуны.
336
птицы, собаки). Особое значение как источник инфекции имеет беременная
женщина. Существуют следующие пути передачи инфекции: алиментарный -
при заглатывании цист, содержащихся в сыром или недостаточно термически
обработанном мясе (цисты погибают при температуре выше 66°); геооральный
- при употреблении пищи, контаминированной почвой, содержащей ооцисты,
выделенные кошкой; трансплацентарный - при инфицировании женщины в
период беременности; в результате гемотрансфузии и трансплантации органов
и тканей от инфицированного донора.
В большинстве случаев встреча хозяина с T.gondii заканчивается
бессимптомным носительством, без клинических проявлений, а
инфекционный процесс при этом характеризуется только иммунологическими
сдвигами (Казанцев А.П., 1985).
В результате проведенных экспериментов (Коновалова С.И., 1979)
выяснено, что напряженность нестерильного иммунитета при токсоплазмозе
зависит от вирулентности штамма T.gondii. Авирулентные и слабо вирулентные
штаммы обычно вызывают более стойкий иммунитет, чем вирулентные, хотя
иммунитет, развивающийся после первичной инфекции, не в полной мере
защищает организм от заболевания и гибели при встрече с большей дозой
возбудителя в эксперименте. При повторном заражении кроликов, морских
свинок и белых мышей, перенесших инвазию вирулентным штаммом,
устойчивость вырабатывается в среднем в 60-70% случаев. Сравнение
характера течения и исходов заболевания у животных одного вида при
пероральном заражении показало, что ооцисты значительно вирулентнее, чем
цисты, точнее - спорозоиты более вирулентны, чем цистозоиты токсоплазм
(Шевкунова Е.А. и др., 1979).
Конечным звеном в цепи взаимодействия паразит-хозяин является
установление равновесия между ними, когда иммунная система хозяина
способна защищать его от рецидивов и реинфекций. Предположение об особой
роли клеточного фактора иммунитета было высказано еще в 1929 г. Levaditi.
Клеточную природу иммунитета к токсоплазмам иллюстрируют выраженные
изменения паракортикального слоя лимфатических узлов и тимус-зависимых
участков селезенки, проявляющихся в увеличении их размеров и количества
пиронинофильных малых лимфоцитов. При экспериментальном токсоплазмозе
первым ответом на внедрение возбудителя является реакция ретикулярной
ткани и прежде всего макрофагально-эндотелиальной системы, где в дальнейшем
формируются ретикулогистиоцитарные и лимфоцитарные микрогранулемы. В
ретикулярных клетках селезенки наблюдается массовое размножение
трофозоитов с образованием псевдоцист, и она становится как бы инкубатором
паразитов. Трофозоиты обнаружены в клетках эпителиальных желез и
макрофагах, а фагоцитоз и гистиоцитарная реакция носят незавершенный
характер, несмотря на пролиферацию гистиоцитов и ретикулярных клеток.
22. Заказ № К-4451.
337
Поскольку, находясь внутри клетки, трофозоиты защищены от влияния антител,
они могут свободно транспортироваться макрофагами, и фагоциты из средства
защиты превращаются в место длительного сохранения, размножения и
расселения трофозоитов токсоплазм (Коновалова С.И., 1979). Имеются
сообщения о значительной роли нейтрофилов в диссеминации токсоплазм в
начальной фазе инвазии до выработки антител (Nacao М., Konishi Е., 1991)
Как для внутриклеточной инфекции для токсоплазмоза характерна
специфическая сенсибилизация организма. Используя иммунные и
аллергоцитохимические пробы (с токсоплазменным диагностикумом, АГ-
экстрактами аллогенных тканей эмбриона, плаценты человека с 0(1) группой
крови, лизатами эритроцитов) и биохимические методики Пьяновой Р.Е. и
Воропаевой Н.М. (1992г.) было установлено, что хронический токсоплазмоз
сопровождается сенсибилизацией, распространяющейся на механизмы
регуляторного аппарата: систему ацетилхолина, гистамина, нейтральных
гликопротеинов. Известно, что эффект их действия охватывает все жизненно
важные функции организма и, таким образом, аллергический компонент можно
считать основным в патогенезе хронического токсоплазмоза и одной из причин
его клинического полиморфизма. Декомпенсация холин- и
гистаминергических процессов, парасимпатикотония, повышение
концентрации естественных иммуномодуляторов (гистамин, ацетилхолин,
серомукоиды) и выраженная токсоплазменная сенсибилизация организма
являются основой для активации синтеза аутоантител: в сыворотке крови
преобладают цитотоксические микропреципитины к нормальным тканям
организма. Исходя из этого, авторы делают вывод об аутоагрессивном
синдроме как о ведущем в симптомокомплексе хронического токсоплазмоза
и являющимся причиной неблагоприятного влияния на плод у беременных
женщин, не связанного с непосредственным проникновением эндозоитов через
плаценту. В экспериментальной работе Долидзе А.И. (1988 г.) было
обнаружено, что у зараженных токсоплазмами белых крыс часть самок
оказалась бесплодной. У зародышей этих крыс еще до поступления зародышей
из яйцеводов в матку нарушаются процессы роста и дифференцировки, а в
роли повреждающего фактора выступают не токсины паразита, а
высвободившиеся из фагоцитарных лейкоцитов лизосомальные нуклеазы.
Красильников А.А. и соавт. (1985) выяснили, что одним из основных
механизмов воздействия T.gondii на организм хозяина является их собственное
иммуносупрессивное действие. В острой фазе инфицирования угнетается
первичный антительный иммунный ответ, подавляется функция как Т-
хелперов, так и В-клеток, а также Т- и В-клеток памяти. В результате
подавления Т-хелперов снижается активность макрофагов, которые способны
противостоять инфекции только при участии Т-клеток или выделяемых ими
веществ. Авторы считают, что вместе с этим блокируется или супрессируется
338
ряд других защитных механизмов иммунной системы, в которых обязательно
участие макрофагов, например, клеточно-опосредованный иммунный ответ,
секреция Т-лимфоцитами лимфокинов, формирование гиперчувствительности
замедленного типа. Эндозоиты исчезают из крови примерно в то же время,
когда появляются специфические антитела, однако паразитемия может
наблюдаться и при наличии антител в высоких титрах. Красильников А.А. и
др. (1985) предположили, что это, возможно, связано с отсутствием «индуктора
иммунопоэза», генерируемого активированными лимфоцитами. По их мнению,
разблокировка от супрессивного действия В-клеток происходит быстрее, чем
Т-клеток и, возможно, именно Т-клетки (хелперы) являются продуцентами
«индуктора иммунопоэза», а полная элиминация эндозоитов зависит именно
от их активности. Восстановление активности Т-клеток стимулирует появление
специфических антител, воздействующих на внеклеточных паразитов и
подавляющих способность токсоплазм проникать в неповрежденные клетки.
Макрофаги становятся способны противостоять действию паразита, и
фагоцитоз в этом случае носит завершенный характер. Фагоцитоз трофозоитов
T.gondii запускает метаболический взрыв с помощью моноцитов (Лысенко
А.Я. и др., 1996). Респираторный взрыв генерирует перекись водорода,
супероксид и другие метаболиты кислорода, подавляющие размножение
токсоплазм. При нормальном иммунном ответе хозяина погибает 90%
трофозоитов, остальные инцистируются.
Об усилении способности перитонеальных макрофагов под действием
ФНО (фактор некроза опухоли) и у-интерферона подавлять рост и размножение
T.gondii сообщили в 1991 г. Chand U.R. et al. При обработке культуры клеток
кишечного эпителия человека рекомбинантным человеческим у-интерфероном
Dimier 1.Н., Bout D.T. (1997) наблюдали резкое угнетение размножения
токсоплазм. у-интерферон блокирует развитие паразита в фибробластах,
индуцируя активность индоламин-2-З-диоксигеназы, что нарушает катаболизм
триптофана, необходимого для размножения T.gondii. Добавление в среду
триптофана несколько уменьшало ингибирование, но не полностью, что
свидетельствует о существовании другого механизма ингибирования (Schmitz
J.L., 1989). Результаты исследования Yong Е.С. et al. (1994) показали, что в
стимулированных у-интерфероном макрофагах 5-липоксигеназы (лейкотриен
В4, С4) - продукты метаболизма арахидоновой кислоты - вызывают повреждение
клеточной мембраны и органелл, таким образом способствуя уничтожению
фагоцитированных токсоплазм. Luder C.G. et al. (1998) определили, что
зараженные T.gondii макрофаги выделяют вещества, подавляющие экспрессию
МНС II, что повышает устойчивость внутриклеточного паразита к действию
иммунной системы. При изучении механизма иммуносупрессии при
токсоплазмозе Khan Imtiaz A. et al. (1995) установили значительную роль
интерлейкина-10, являющегося антагонистом у-интерферона.
22*
339
Блокирование активности Т-клеток приводит к неуправляемому
размножению токсоплазм, причем в эксперименте было установлено, что
антитоксоплазменная активность Т-клеток, реализуемая через активацию
макрофагов, присуща субпопуляции TJ, но не Th2 Т-клеток (Fischer H.G. et
al., 1992). Однако Hunter С.A., Roberts C.W., Alexander J.В. (1992) считают
иначе. При токсоплазменном поражении головного мозга у мышей с помощью
полимеразной цепной реакции авторы определяли кинетику продукции
цитокинов в мозговых тканях. По их мнению, выявление на ранних стадиях
инвазии у мышей с большим количеством мозговых цист транскриптов
интерлейкина-4 указывает на роль субпопуляции Th2 CD4+ лимфоцитов в
развитии токсоплазменного энцефалита. В работе Deckert-Schliiter М. et al
(1995) было установлено, что при заражении мышей токсоплазмами в головном
мозге, где происходит размножение паразита, значительно повышается
содержание иРНК у-интерферона, ФИО, интерлейкина-2, -6, -10, -12, в то же
время содержание иРНК интерлейкина-4 увеличивается незначительно.
Одновременно в селезенке зараженных мышей в большей степени повышено
содержание иРНК различных цитокинов, особенно интерлейкина-2,
участвующих в регулировании пролиферации Т-клеток. Авторы установили,
что генетическая восприимчивость к заражению токсоплазмами коррелирует
с содержанием в головном мозге иРНК у-интерферона, ФНО и интерлейкина-
6. Jaqueli Jeronimo (1993) выяснил, что при токсоплазмозе содержание
растворимого рецептора интерлейкина-2 повышено в среднем в 4 раза,
повышена также активность и аденозиндезаминазы. При этом наблюдается
корреляционная связь между уровнем интерлейкина-2, активности
аденозиндезаминазы и титрами антитоксоплазменных антител класса IgG.
В сопротивляемости ктоксоплазмам большое значение имеет популяция
лимфоцитов естественных киллеров. Dannamann В. et al. (1989) не наблюдали
усиления лизиса при инкубировании T.gondii с NK клетками, обработанными
рекомбинантным интерлейкином-2 и а-интерфероном, однако
цитотоксичность против цист возрастала при воздействии клеток-киллеров,
активированных лимфокинами. По данным Jano A. et al. (1989)
цитотоксический эффект проявляют клетки CD5+, CD4+, CD8+, они вызывают
лизис пораженных T.gondii клеток-мишеней, рестриктированных по 1 классу
HLA. Khan Imtiaz A. et al. (1991) отмечают выраженное цитотоксическое
действие у CD8+ лимфоцитов, которые вырабатывают у-интерферон и
интерлейкин в высоких титрах и оказывают прямое цитотоксическое действие
на внеклеточные T.gondii в культуре. Цитотоксическую активность CD8+ Т-
клеток в отношении зараженных паразитом клеток Subauste Carlos (1991)
рассматривает как важный компонент механизма резистентности клеток к
заражению T.gondii. Kasper L. et al (1995) установили, что интерлейкин-7
стимулирует размножение про-В-клеток, CD4+, CD8+ лимфоцитов, повышает
340
цитотоксичность CTL и NK. клеток, имеющих важное значение в
антипаразитарной защите. Khan Imtiaz A., Kasper Lloyd Н. (1996) обнаружили,
что при одновременном введении мышам рекомбинантного интерлейкина-15
и растворимого лизата токсоплазм происходит интенсивная пролиферация
спленоцитов, экспрессирующих при стимуляции антигеном токсичные для
токсоплазм антиген-специфичные CD8+лимфоциты. Под действием антигена
эти клетки пролиферируют и длительное время сохраняют память о
зараженных паразитом клетках, т.о. играя определенную роль в развитии
иммунной памяти хозяина. Интересно, что у инвазированных паразитом
матерей содержание CD8+ повышено, а количество CD4+ снижено (Hohlfeld
Р., 1990). Однако, как выяснили Воложин А.И. и др. (1993), при беременности
содержание CD8+ значительно превышает норму, достигая 70%, а количество
CD4+ снижается менее чем на 30%.
Исследования Hunter Christopher A. et al. (1995) показали, что в регуляции
Т-лимфоцит-независимой резистентности к T.gondii большая роль
принадлежит трансформирующему рост P-фактору. Причем он ингибирует
индуцированную интерлейкином-12 продукцию у-интерферонаИК клетками.
Chumpitazi B.F.F. et. al. (1998) определили, что тахизоиты T.gondii индуцируют
активирование тромбоцитов, которые ингибируют внутриклеточный рост
паразита с помощью опосредуемого тромбоцитами ростового фактора. Он
же усиливает продукцию фибробластами интерлейкина-6.
У больных хроническим приобретенным токсоплазмозом (Моисеенко
А.В., Савин В.А., Попков А.В. и др., 1998) повышается содержание
лимфоцитов с фенотипом CD8 и CD16, происходит увеличение количества
антигенпрезентирующих HLA-DR мононуклеаров (ИКО-l (anti-HLA-DR) и
клеток, экспрессирующих рецептор интерлейкин-2/ИКО-Ю5(апб-ил-2).
Выявлено повышение уровней сывороточного IgG, IgM, а также средне- и
мелкомолекулярных ЦИК, показателей фагоцитоза и теста восстановления
нитросинего тетразоля. Одновременно происходит снижение уровня CD4, CD3
и В-лимфоцитов (CD19, CD72).
Gomez Marin J.E., Pinon J.M., Bonhomme A. et all. (1997) изучали
взаимосвязь цитокинов с различными клиническими формами токсоплазмоза.
Авторы предполагают, что поражение глаз у иммунокомпетентных больных
связано с гиперреакцией цитокинов клеточной реакции (у-интерферон,
интерлейкин-12, -2). Врожденный токсоплазмоз, специфический энцефалит
У больных с иммунодефицитом, активный хронический токсоплазмоз
характеризуется гиперреакцией цитокинов гуморальной реакции
(интерлейкины-4, -10). По мнению исследователей, в основе различных
клинических форм токсоплазмоза лежит нарушение иммунологического
равновесия.
341
Таким образом, для полной антипаразитарной защиты необходима
согласованная работа как клеточного, так и гуморального звена иммунной
системы, хотя различные патофизиологические аспекты взаимодействия
паразита и хозяина и механизмы иммунитета продолжают изучаться.
Клиническая картина и классификации заболевания.
Особенности морфологии и патогенеза токсоплазмоза обусловливают
чрезвычайный полиморфизм клинической картины заболевания. В зависимости
от времени инфицирования, путей передачи, органных поражений и активности
процесса было предложено несколько классификаций болезни. Одной из первых
была классификация J.Siim (1957,1971), где выделялось 5 основных форм: 1)
'лимфогландулярная; 2) экзантематозная; 3) энцефалитическая; 4) глазная; 5)
миокардитическая.
В классификации A. Berengo (1974) представлены: 1) острая форма:
генерализованная и лимфогландулярная; 2) хроническая: неврогенная - чисто
неврогенная, нейроофтальмическая, нейроэндокринная; мышечная - с
поражением скелетной мускулатуры, миокарда, миометрия; 3) латентная
инфекция.
По классификации O.Thalhammer (1957, 1971), выделяют острую
генерализованную форму врожденного токсоплазмоза, протекающую с
повышением температуры, пятнисто-папулезной сыпью, желтухой,
гепатоспленомегалией; подострую - с явлениями активного энцефалита в
сочетании с поражением глаз; хроническую - с постэнцефалитическими
дефектами и пороками развития глаз (гидроцефалия, кальцификаты в мозге,
микрофтальм, анофтальм, атрофия зрительного нерва и др.)
Классификация Д.Н.Засухина (1980): 1. Острый приобретенный
токсоплазмоз: 1) Кишечная форма (острый гастроэнтерит, энтерит с
мезентериальным лимфаденитом). 2) Лимфонодулярная форма (моно- и
полиадениты). 3) Экзантемная (генерализованная). II. Подострый
приобретенный токсоплазмоз: 1) Цереброспинальная форма. 2) Глазная форма.
3) Миокардит. 4) Миозит. III. Хронический приобретенный токсоплазмоз
(полисистемное заболевание с хроническим поражением ЦНС.
пищеварительного тракта, лимфатических узлов, миокарда, глаз, скелетной
мускулатуры, миометрия). IV. Латентная инфекция.
В предложенных классификациях использовался преимущественно
органный принцип построения без учета патогенеза заболевания, а поскольку
при токсоплазмозе одновременно поражаются многие органы и системы, это
только порождает дойойнительные диагностические трудности.
Классификация, базирующаяся на патогенетической основе и отражающая
клинические особенности заболевания, предложенная А.П.Казанцевым, в
настоящее время широко используется клиницистами нашей страны.
342
Классификация А.П.Казанцева(1985): 1) первично-латентная форма; 2)
острая; 3) первично-хроническая; 4) вторично-хроническая; 5) вторично-
латентная форма (с резидуальными явлениями). По способу инфицирования
токсоплазмоз делится на приобретенный и врожденный.
Инфицированность человека T.gondii в подавляющем большинстве
случаев (95%) не приводит к развитию выраженного процесса и заканчивается
формированием здорового бессимптомного носительства возбудителя (Мороз
Б.В., Никифоров В.Н., Трякина И.П., 1989). При определенных нарушениях
состояния иммунной системы, врожденных и приобретенных
иммунодефицитах развивается клинически выраженная токсоплазменная
инфекция. Наиболее часто заболевание сопровождается субфебрильной
температурой и лимфаденопатией. Генерализованная лимфаденопатия
выявлялась у 64,6% больных хроническим токсоплазмозом, в том числе у 42,2%
больных обнаружено поражение мезентериальных лимфатических узлов
(Казанцев А.П., 1985). Из обследованных 113 больных преимущественное
поражение лимфатических узлов наблюдалось у 18,5%, у 20,7% был выражен
субфебрилитет и общеинтоксикационный синдром (Мороз Б.В., 1989). При
токсоплазменной лимфаденопатии обычно поражаются лимфатические узлы
в области шеи и головы, хотя часто заболевание протекает бессимптомно или
с незначительными жалобами (вялость, утомляемость), имеющими
доброкачественный характер (Me Cabe Robert Е. et al., 1987). Нередко при
токсоплазменных лимфаденитах ставятся ошибочные диагнозы
лимфогранулематоза, ретикулосаркомы, туберкулезного лимфаденита,
инфекционного мононуклеоза, поэтому больных с лимфаденопатией неясной
этиологии необходимо обследовать на токсоплазмоз (Метакса Г.Ю.,
Цынкаловский И.Б., 1988). По данным Pimeroy С., Filice G.A. (1992),
смертность от токсоплазменной пневмонии наблюдается в 55% случаев при
неправильной постановке диагноза и отсутствии адекватного лечения. У лиц
с иммунодепрессией летальность составляет 40%, а при диссеминированном
токсоплазмозе вовлеченность легких регистрируется в 33%. Описаны случаи
поражения желудочно-кишечного тракта. Так например, при обследовании
388 больных токсоплазмозом (Федичкина Т.П., Шевкунова Е.А., Сивуха ТА.,
1979) поражения желудочно-кишечного тракта в виде хронического гастрита,
колита, холецистита было выявлено у 70,9%, причем гастрит чаще протекает
со снижением секреторной функции желудка, а в клинике доминирует синдром
кишечной диспепсии. Функционально-морфологические изменения печени,
сопровождающиеся повышением грубодисперсных фракций белков, общих
липидов, холестерина, при снижении количества альбуминов, сахара крови,
сдвиги в минеральном обмене при хроническом и остром токсоплазмозе в
эксперименте Крахмальникова Г.Х., Голосарский Б.Н. (1983 г.) объясняют
токсоплазменной интоксикацией и развитием гиперсенсибилизации в ответ
343
на продукты жизнедеятельности паразита. При токсоплазмозе у 26,3% больных
возникают очаговые или диффузные изменения миокарда, сопровождающиеся
неполной блокадой предсердно-желудочкового пучка, нарушениями ритма и
проводимости. Электрокардиографические изменения выявляются у 63,3%
пациентов (Казанцев А.П., 1985). Описана застойная кардиомиопатия (Новиков
Ф.Е., Грачева Л.И., 1982), миокардиты и эндокардит токсоплазменной
этиологии (Виноградова А.В. и др., 1982; Гольдберг ГА., Баранова М.Н., 1988).
Большое количество исследований посвящено поражению глаз. Из 1386
больных хронической формой заболевания свежий хориоретинит наблюдали
в 7,4% случаев, старые очаги хориоретинита в 9,7%, увеит у 1,3% больных, а
всего поражение глаз было выявлено у 25,4% обследованных (Казанцев А.П.,
1985). Поданным Зейналовой Э.И. и Левина Б.Ш. (1989 г.), частота поражения
заднего отдела увеального тракта составила 14,8%. Исследования Ljungstrom
I. et al. (1992) показали, что T.gondii проявляет тропизм к тканям сетчатки,
поскольку имеет специфические рецепторы. Очень часто наблюдаются
поражения различных отделов нервной системы. При хроническом
токсоплазмозе изменения ЦНС были выявлены у 89,8% больных, чаще
наблюдались неврозоподобные функциональные изменения, но встречались
и признаки вялотекущего энцефалита, сопровождающегося диэнцефальными
кризами, нарушениями терморегуляции, эпилептиформными припадками,
описаны церебральный арахноидит, серозный менингоэнцефалит, абсцесс
мозга (Казанцев А.П., 1985).
Особое значение токсоплазмоз имеет в гинекологической и
педиатрической практике. Хронический токсоплазмоз часто является причиной
прерывания беременности - самопроизвольных выкидышей и
преждевременных родов (Омаров С.М., Саидов М.С., 1984), здесь могут играть
свою роль нарушения функции миометрия вследствие хронического
специфического метроэндометрита, а также нейроэндокринные расстройства,
обусловленные поражением диэнцефальной области головного мозга (Саидов
М.С., Шевкунова Е.А., Нурмагомедов С.Н., 1984). Неблагоприятное действие
T.gondii часто проявляется нарушением менструального цикла и первичной
аменореей (Асатова М.М., 1991). Токсоплазменная инвазия, как одна из причин
воспалительных процессов в матке и гормональных нарушений, может
приводить к первичному или вторичному бесплодию (Колесникова-Тартынских
Л. А., 1998).
Среди инфекционных причин перинатальной патологии токсоплазмоз
занимает одно из главных мест. По данным А.В. Цинзерлинга, Глуковца Н.Г
(1994 г.), среди причин гибели детей от внутриутробных инфекций это
заболевание стоит на 6 месте после микоплазмоза, герпеса, хламидиоза,
цитомегалии, краснухи и других вирусных и бактериальных инфекций. На
каждую 1000 новорожденных в разных странах мира приходится от 1 до 8
344
детей с врожденным токсоплазмозом (Шевкунова Е.А., Саидов М.С., 1985).
Ежегодно в США рождается 3300 детей с врожденным токсоплазмозом,
расходы на лечение и обучение которых составляют 221,9 млн. дол. в год.
Около 5-7% женщин впервые инфицируются токсоплазмами именно в период
беременности, а среди этих случаев приблизительно в 30% возможно
заражение плода (Радзинский В.Е., Чистякова М.Б., 1992). Смертность
потомства при заражении матери в период беременности без лечения
составляет 50% (Remington J.S., 1990). У большинства женщин, родивших
детей с врожденным токсоплазмозом, во время беременности не было явных
признаков заболевания, у 90% инфицировавшихся во время беременности
женщин заболевание протекало латентно и только у 10% проявлялось
лимфаденитом и лихорадкой. Однако передача возбудителя от матери плоду
может произойти при любой клинической форме (Шевкунова Е.А., Саидов
М.С., 1985). Penev-Koteva L. et al. (1987 г.) изучали патофизиологические
изменения плаценты у женщин с положительной серологической реакцией
на токсоплазмоз и органы новорожденных детей. В плаценте в случае
обнаружения свободных паразитов и псевдо цист отмечены воспалительные
изменения, эозинофильные инфильтраты, некроз, обызвествление и
периваскулярный фиброз, а также атрофия клеток Лангханса, отек ворсинок
плаценты, уменьшение количества кровеносных сосудов и лимфатических
узлов, некроз некоторых ворсинок. У детей цисты обнаружены в миокарде
без реакции воспаления, в мозговых оболочках и мозге рядом с цистами -
очаги воспаления с центрами некроза и кальцификации. Заражение плода
гематогенно может происходить как прямым путем - поражение T.gondii
тканей зародыша, так и опосредованно - воздействие на плод токсинов
токсоплазм. У инфицированных женщин внутриутробная гибель плода
наблюдалась в 3 раза чаще, а преждевременные роды в 10 раз чаще, чем у
неинфицированных (Сидельникова В.М. и др., 1988). При хроническом
токсоплазмозе у женщины нет паразитемии, и риск заражения плода
гематогенным путем отсутствует, поэтому повторного рождения больного
ребенка практически не отмечается. Только острый токсоплазмоз во время
беременности может привести к поражению плода, как на эмбриональном
уровне, так и фетальном периоде его развития (Казанцев А.П., 1985; Лысенко
А.Я., 1996; Мороз Б.В. и др., 1998). Если беременная женщина заразилась
перед родами, у новорожденного будет острый период генерализации
инфекции с клиникой общего инфекционного заболевания. Поэтому при
заражении T.gondii женщине рекомендуется воздержаться от зачатия ребенка
в течение 6-9 месяцев (Vilena 1. et al., 1998). При заражении женщины после
29 недели беременности ребенок рождается с подострым энцефалитом и с
симптомами внутричерепной родовой травмы. Удельный вес токсоплазмоза
среди причин врожденной патологии ЦНС составляет 20%. Токсоплазмы
345
размножаются в эндотелиальных клетках сосудов головного мозга и в нервных
клетках, образуя псевдоцисты; в артериях мозга возникает отек и
пролиферация интимы с сужением просвета, в венах - некроз, тромбозы,
кровоизлияния, вокруг сосудов развивается гранулематозный процесс,
пораженные клетки некротизируются, обызвествляются, возникают цисты;
при эпендиматите образуются спайки, развивается гидроцефалия (Семенова
Е.И., 1979). У больных в этой стадии наблюдается нистагм, страбизм,
тонические и эпилептические судороги, парезы, параличи, задержка
психического развития. При заражении беременной в сроки до 29 недели
ребенок рождается в постэнцефалитической хронической стадии с задержкой
формирования и дифференцировки мозга, с клиникой порока развития мозга
и глаз. Поражение глаз при врожденном токсоплазмозе наблюдается в виде
микрофтальмии, помутнения хрусталика и стекловидного тела, увеита,
хориоретинита, атрофии зрительного нерва. При заражении женщины в III
триместре беременности 70-80% детей рождаются без клинических
проявлений болезни (Милевская-Бобуля Б. и др., 1990). Поздними
проявлениями врожденного токсоплазмоза у детей первого года жизни
являются симптомы подострого энцефалита, а у детей старшего возраста -
судорожный синдром, хориоретинит, олигофрения. При обследовании 58
детей с врожденным токсоплазмозом Фадеева М.А. и др. (1987 г.) отмечают,
что на первом месте стоит поражение глаз и ЦНС, у 44,8% больных выявлена
висцеральная патология: поражение сердца по типу миокардита и
миокардиодистрофии (37,9%), печени (22,3%), легких (12%); при острой
форме врожденного заболевания - лихорадка, сыпь, затяжная желтуха; в
позднем возрасте - головная боль, олигофрения, сердечно-сосудистые
расстройства, артериальная гипертония, поражение глаз. При длительном
наблюдении (в среднем 27 лет) за 15 больными с врожденным токсоплазмозом
иридоциклит был выявлен у 100%, атрофия зрительного нерва у 83%.
патология радужки у 50%, у 40% катаракта, страбизм и микрофтальмия
(Meenken С. et al., 1995).
Большое значение имеет токсоплазмоз как отягощающий фактор у
реципиентов органов и тканей. При обследовании 33 больных (Holliman R.b:.
et al., 1991), перенесших операции по пересадке сердца, у 3 был выявлен
токсоплазмоз, причем у 1 пациента заболевание закончилось летально.
Отмечается, что ни в одном случае не наблюдали реактивацию хронической
инфекции или заражение токсоплазмозом при переливании крови. Candolfi
Е. et al. (1988) приводят наблюдение 5 случаев развития токсоплазмоза при
12 пересадках сердца. Развитие или активация латентной инфекции у
реципиентов органов, возможно, часто связана с применением
иммуносупрессивной терапии у пациентов этой группы.
346
Лабораторная диагностика.
Лабораторная диагностика токсоплазмоза представляет определенные
трудности. Для прижизненной диагностики применяют иммунологические
и паразитологические методы (биопроба на мышах, куриных эмбрионах,
кошках); выделение возбудителя из крови с использованием метода клеточных
культур. Широко используются серологические реакции РСК, РНИФ (реакция
непрямой иммунофлюоресценции), реакция Сейбина-Фельдмана, различные
агглютинационные тесты: РИГА, РА, РЛА, аллергическая внутрикожная
проба. К сожалению, по результатам этих реакций нельзя достоверно оценить
сроки инфицирования, давность и активность токсоплазменного процесса;
часто они дают ложноположительные результаты у пациентов с наличием
антиядерных антител, при красной волчанке, ревматоидном артрите,
орнитозе, бруцеллезе и некоторых других инфекционных болезнях. С
середины 70-х годов одним из наиболее перспективных методов диагностики
стал иммуноферментный анализ, особенно определение различных классов
иммуноглобулинов. При использовании реакции ELISA (enzym-linked
immunosorbent assay), sandwich-ELISA, PIC-ELISA, реакции
иммунофлюоресценции было выяснено, что IgG появляются в сыворотке
крови в поздние сроки инфицирования и могут сохраняться длительное
время, наличие IgM свидетельствует не только о свежем токсоплазмозе или
врожденной инфекции, но часто регистрируется как ложноположительная
реакция у наркоманов (Ara М. et al., 1992). Более существенное значение
имеют обнаруженные в ELISA IgA и IgE, так, например, IgA начинают
выявляться сразу же вслед за IgM, но исчезают значительно раньше (Le
Fichoux Y., 1988). У пациентов со специфическими IgM или IgG антителами
антитоксоплазменные IgE были выявлены у 86% больных. Они появляются
в начале инвазии и сохраняются только 4 месяца, в то время как IgM
сохраняются в сыворотке крови до 1-1,5 лет; IgE не проходят через плаценту
зараженной матери, при врожденном токсоплазмозе выявляются в течение
1-го года жизни и при рецидивах инфекции (Pinon J.M., 1990). На выявление
IgA антител не влияет наличие ревматоидного фактора или нормальных
антител IgM, они также не проходят через плацентарный барьер. В
исследованиях Decoster Anne et al., (1990) из 8 детей с врожденным
токсоплазмозом IgA выявлялись во всех случаях, в то время как IgM только
У 3 детей. Для диагностики аномалий и дефектов развития невральной трубки
плода целесообразно определять концентрацию альфа-фетопротеина и
активность ацетилхолинэстеразы (Полестеров Ю.А. и др., 1990).
Рекомендуется также проводить УЗИ плода в различные сроки беременности
и осуществлять динамическое обследование серонегативных женщин не
менее 3-х раз: до 12 недели беременности, на 20-24 неделе и на 32-36 неделе
(Шевкунова Е.А., Саидов М.С., 1985).
347
В диагностике острого и хронического токсоплазмоза высоко эффективен
вестерн-иммуноблотинг (Bordes Е., 1990). Одним из способов
усовершенствования существующих ИФА тест-систем для диагностики
острого и реактивации приобретенного токсоплазмоза может быть
использование экскреторно-секреторных антигенов (ESA) тахизоитов
T.gondii, поскольку они появляются в крови инвазированных с первых дней
инвазии, а при переходе в хроническую форму их количество резко снижается
(Дедкова Л.М и др., 1999). Антитела сывороток больных острым
токсоплазмозом реагируют главным образом с белками ESA, имеющих
молекулярную массу 79, 70, 57, 48 и 29 кДа.
При исследовании эффективности полимеразной цепной реакции (Farqa
М. et al., 1992) показана ее высокая чувствительность и специфичность.
Техника применения ПЦР позволяет диагностировать заболевание втечение
1-го дня, тест показывает 100% чувствительность, т.к. сего помощью можно
определить даже единичного паразита (Cazenava Jean et al., 1992). Метод
ПЦР считается перспективным для диагностики токсоплазмоза глаз, с этой
целью определяют ДНК T.gondii в водянистой влаге при пункции передней
камеры глаза (Aouizerate F. et al., 1993). Rodrigues J.C. et al. (1997) считают,
что выявление классов антител и авидности 1g не имеют диагностического
значения; определение паразитарной ДНК методом ПЦР дает четкие
результаты в 81% случаев лишь у нелеченных пациентов, однако у
пролеченных больных его чувствительность составляет лишь 20%.
Токсоплазмоз р ВИЧ-инфицированных.
Основное значение токсоплазмоз в настоящее время приобретает как
оппортунистическое заболевание у людей с иммунодефицитами, особенно
при СПИДе (Catar G.,1990). Инвазия T.gondii является своего рода
кофактором, ускоряющим и отягощающим течение СПИДа. При поражении
вирусом клеток, в которых сформировалась циста, латентная токсоплазменная
инфекция может реактивироваться с исходом в диссеминацию (Лысенко А.Я.
и др., 1996). Проведенные клинические и экспериментальные исследования
свидетельствуют, что сопутствующий токсоплазмоз потенцирует
индуцированные ВИЧ нарушения деятельности иммунной системы, отягощая
тем самым течение СПИДа (Lin Dah-Sheng, Bowman D.D., 1992).
Предполагается, что T.gondii индуцируют продукцию носителем ВИЧ фактора
некроза опухоли, который стимулирует выработку Т-клеточных белков.
Последние связываются с длинной терминальной последовательностью
аминокислот ВИЧ, что способствует дальнейшей активации вируса и
одновременно усиливает иммунодефицит, вызывая дисфункцию CD4 клеток.
При этом усиливается и размножение токсоплазм.
У больных СПИДом возможно развитие диссеминированного
токсоплазмоза с поражением легких, глаз, лимфатических узлов, желудочно-
348
кишечного тракта (Garcia Linnea W. et al., 1991), летальные исходы от острого
токсоплазменного миокардита без поражения других органов (Blanche Р. et
al., 1993, Hoffman Р. et al., 1990), описан случай некротизирующего
панкреатита с мультисистемной органной недостаточностью, вызванной
T.gondii (Ahaja Sunil К. et al., 1993). >
Оказалось, что ЦНС является наиболее чувствительной к реактивации
токсоплазменных цист по сравнению с другими тканями, а развившееся
заболевание без специфической терапии приводит к летальному исходу.
Токсоплазменный энцефалит является наиболее распространенной
оппортунистической инфекцией ЦНС у больных СПИДом. В Западной
Европе около 30% ВИЧ-позитивных лиц погибают от этого заболевания. В
Африке при патологоанатомическом исследовании в Уганде церебральный
токсоплазмоз выявлен в 5-23% случаев (Zumla A. et al., 1991). В течение 40
месяцев в Барселоне у 57 больных СПИДом из 394 обследованных
зарегистрировано 78 эпизодов токсоплазменного энцефалита. Наиболее
распространенными симптомами были фокальные неврологические
нарушения и лихорадка, в 70,3% с помощью компьютерной томографии в
мозге определялись множественные очаги пониженной плотности (Gonzaiez-
Clemente J.M. et al., 1990).
У пациентов co СПИДом возможна реактивация латентной инфекции,
а обнаружение IgG указывает на перенесенную инфекцию, вероятное наличие
цист и возможный риск развития заболевания. По данным Dannemann В.
(1992), более 95% токсоплазменных энцефалитов связаны с реактивацией
латентной инфекции как результат прогрессирующего снижения клеточного
иммунитета и наиболее часто случаются, когда количество CD4 лимфоцитов
<0,1 х 109/л, если CD4>0,2 х 10’/л - заболевание регистрируется значительно
реже.
Среди ВИЧ-инфицированных пациентов с токсоплазменным энцефалитом
у 90% уровень CD4 лимфоцитов составлял <200 кл/ммЗ, но наибольший риск
развития заболевания регистрировался, когда их количество падало <100 кл/
мм3 (Luft В.J., Remington J.S., 1992). Больных часто беспокоили головная боль,
сонливость, развивалось нарушение когнитивной функции с последующим
развитием очаговой симптоматики у 2/3 пациентов, что являлось проявлением
множественных поражений мозга. Среди очаговой симптоматики наиболее
часто встречаются гемипарезы, поражение ЧМН, афазия, очаговые
эпилептические припадки, поражение сенсорной системы (Clough L.A., Clough
J.A., Maciunas R.J., et al., 1997). Поскольку в патологический процесс
вовлекаются базальные ганглии и ствол мозга, наблюдаются также атаксия,
дисметрия, расстройства двигательной функции. Очаговые симптомы сначала
преходящие, быстро прогрессируют и приводят к летальному исходу.
349
Менингизм обычно отсутствует, а общесоматические симптомы (лихорадка,
слабость, т.д.) вариабельны.
Диагноз токсоплазменного энцефалита основывается на совокупности
клинических неврологических проявлений, серологических исследований,
данных компьютерной томографии и подтверждается путем выявления
тахизоитов или цист в мозговой ткани при аспирации иглой или биопсии
(Tuazon U., 1989). При использовании реакции агглютинации антитела
обнаруживались у 69,5% из 190 обследованных ВИЧ-инфицированных
(Antunes F. et al., 1990); из 25 больных СПИДом токсоплазменный энцефалит
был зарегистрирован в 37,5% случаев, причем заболевание развивалось на
фоне низких титров или даже отсутствия специфических антител.
S.В.Porter (1992) приводит наблюдения 13 из 80 пациентов (16%),
которые при клиническом токсоплазмозе не имели антител при
использовании метода непрямой иммунофлюоресценции. Таким образом,
автор отмечает, что достоверность метода является сомнительной в пробах
с низкими титрами антител.
J.Zuffery et al. (1993) считают, что диагностика церебрального
токсоплазмоза проводится на основании типичных изменений при
сканировании мозга КТГ или магнитным резонансом в сочетании с
клинической и рентгенологической эффективностью специфического
лечения, а также гистологическими изменениями при тканевой биопсии или
аутопсии.
Рутинные исследования цереброспинальной жидкости (ЦСЖ) обычно
мало информативны. Антитоксоплазменные антитела в ЦСЖ
обнаруживаются только у 30-50% больных. Использование контрастной КТГ
или ЯМР обычно выявляет множественные паренхимальные узловые или
кольцевидные поражения, хотя у отдельных пациентов они могут быть
единичными. Очаги обычно локализуются в церебральных гемисферах и
базальных ганглиях, изредка определяются геморрагии и кальцификаты. При
микроскопии определяются некротизирующие абсцессы с непостоянными
петехиальными кровоизлияниями и периферически локализованными
трофозоитами. Следует заметить, что подобные изменения нередко
встречаются и при вирусных энцефалитах, а трофозоиты трудно
отдифференцировать от некротических масс. В связи с этим необходимо
производить специфическое иммунохимическое окрашивание, что повышает
достоверность диагноза.
При обследовании J.Zuffery et al. (1993) влечение 4-х лет из 715 ВИЧ-
инфицированных серопозитивных к T.gondii было 360 (50%) при
использовании метода прямой агглютинации и непрямой
иммунофлюоресценции. Разницы между двумя методами не было.
Распространенность антител увеличивалась с возрастом: у пациентов 25 лет
350
и моложе - антитела выявлены у 40%, у пациентов 50 лет и старше - до 60%.
Ежегодная частота сероконверсии составила 0,5%. Риск развития острого
заболевания был значительно выше у серопозитивных пациентов, так, у 13%
(47 из 360) развилась острая инфекция (43 - церебральная форма, 3 - глазная,
1 - красного костного мозга). IgM были обнаружены у 6% (2 из 33) больных
острым токсоплазмозом, при сравнении с контрольной группой - у 2,5% из
390 пациентов без него. IgA выявлены у 6 из 33 (18%) больных с острым
токсоплазмозом, у 12 (3%) в контрольной группе 390 пациентов. У пациентов
с острым токсоплазмозом частота обнаружения высоких титров IgG была
статистически достоверно выше (30%) по сравнению с контрольной группой
(3%); только у 9 из 48 (18,7%) пациентов с острым токсоплазмозом были
низкие титры IgG. Исходя из этого, авторы делают вывод, что у больных
СПИДом целесообразно определять IgG в парных сыворотках с раститровкой,
отсутствие же IgG с высокой долей вероятности позволяет исключить острый
токсоплазмоз у ВИЧ-инфицированных. Обнаружение IgM у этих больных
имеет небольшую значимость даже при использовании чувствительных
методик - иммуносорбентной агглютинации, в то же время полезно
определять IgA.
При анализе иммунологического статуса 261 ВИЧ-инфицированных в
разные стадии болезни (Тютликова Л.А., 2000) было выявлено, что у лиц с
титром антитоксоплазменных IgG в разведении меньше 1:100 не происходит
значительного угнетения клеточного и гуморального иммунитета, а уровень
CD3, CD4, CD8 и В-лимфоцитов не отличается или даже превышает
показатели в группе серронегативных к T.gondii, таким образом демонстрируя
латентный токсоплазмоз. В то же время об активации токсоплазмоза
свидетельствует рост титра специфических IgG в разведении 1:100 и выше,
а также обнаружение IgM, при этом наблюдается значительное угнетение Т-
клеточного звена иммунной системы (как CD4, так и СО8-лимфоцитов),
усугубляющееся на фоне прогрессирования ВИЧ-инфекции. На всех стадиях
ВИЧ-процесса у серопозитивных к T.gondii происходит более выраженное
увеличение уровня основных сывороточных иммуноглобулинов IgG и IgM.
При изучении активности токсоплазмоза у этих пациентов оценивались
следующие клинические показатели: температура, ее длительность и
периодичность, размеры и болезненность лимфатических узлов, боли в
животе, размеры печени, наличие диареи, симптомы интоксикации ЦНС
(головная боль, депрессия, ухудшение памяти, нарушение сна,
головокружение, судороги, потеря сознания); признаки органического
поражения ЦНС (энцефалопатия, арахноидит, поражение черепно-мозговых
нервов, опухоли, деменция, эписиндром, атрофия коры и кальцинаты
головного мозга, менингоэнцефалит); различные поражения глаз, легких,
кожи и миокарда. Было установлено, что для клинической диагностики
351
манифестного токсоплазмоза у ВИЧ-инфицированных на стадии ША-ШБ(по
классификации В.В.Покровского) наиболее значимым является следующий
симптомокомплекс: частые эпизоды длительной высокой лихорадки,
генерализованная лимфаденопатия с диаметром лимфатических узлов более
3 см, болезненными при пальпации, выраженная гепатомегалия, хориоретинит,
энцефалопатия, признаки интоксикации ЦНС, сопровождающейся
головокружением. У больных на стадии II1B-IV активация T.gondii
характеризуется поражением ЦНС с развитием менингоэнцефалита,
подтверждаемого ядерно-магнитным резонансом головного мозга и
обнаружением антитоксоплазменных антител в ликворе.
Более 97% пациентов с токсоплазменным энцефалитом имеют IgG к
T.gondii (Zanderle R. et al., 1991). Риск его развития у серопозитивных к T.gondii
со СПИДом в 27 раз выше, чем у серонегативных (Oksenhendler Е. et al.,
1994). 10-летнее исследование в Сан-Франциско по выявлению
оппортунистических инфекций среди гомосексуалистов со СПИДом
позволило установить, что частота заболевания составляет 0,05 случая в год.
В США токсоплазменный энцефалиту больных СПИДом встречается среди
негров - 5,2%; у белых - 4,2%; у наркоманов - 5,9%, а у гомосексуалистов -
4,6%. Частота больше в северо-восточных и южных регионах - 5,6%, а в
северо-центральных и западных штатах - 4,4-4,1 %. Токсоплазменные
энцефалиты реже встречаются у детей со СПИДом - 0,86% из всех СПИД
индикаторных заболеваний, зарегистрированных в 1992 г. Однако T.gondii
могут быть переданы плоду при отсутствии клиники у матери. Неизвестно,
как связана степень иммуносупрессии у матери с передачей паразита в матке.
В одном отчете описано, что 3-й и 5-й ребенок у матери с бессимптомной
токсоплазменной инфекцией были внутриутробно инфицированы и ВИЧ, и
T.gondii, а 4-й родился здоровым. Marty Р. et al. (1994) приводят случай
внутриутробного заражения плода вследствие рецидива токсоплазмоза на
22-й неделе беременности у ВИЧ-инфицированной женщины. В сыворотке
её крови определялись IgG 400 МЕ/мл, IgM отсутствовали, одновременно у
плода была диагностирована гидроцефалия и произведен медицинский аборт.
Уровень сероконверсии у ВИЧ-инфицированных лиц составляет в
среднем 0.9% в год, однако индивидуальный риск заражения варьирует в
больших пределах, в зависимости от индивидуальных особенностей жизни
и региона проживания (Richard F.O., Kovacs J.A., 1995). Таким образом,
чрезвычайно важно знать инфицированность популяции в регионе, поскольку
это может служить показателем местного заражения T.gondii у ВИЧ-
инфицированных.
352
Лечение и специфическая профилактика
Проблема лечения токсоплазмоза представляет значительные сложности,
это связано с особенностями цикла развития возбудителя, патогенеза
заболевания и множественными органными поражениями. Обычно целью
терапии являются тахизоиты или пролиферативные формы, в то время как
цисты, источник тахизоитов, уничтожить сложнее. В 1948 г. G.Hotchgins
предложил противомалярийный препарат пириметамин, в 1952 г. D.Eyles и
N.Coleman уточнили механизм его действия на паразита, а позже доказали
синергическое действие пириметамина и сульфаниламидов. Пириметамин
ингибирует переход фолиевой кислоты в фолиниевую, за счет чего блокируется
синтез нуклеиновых кислот в T.gondii. В результате нарушения метаболизма
токсоплазмы становятся более чувствительны к воздействию
сульфаниламидов. Побочный эффект пириметамина - токсическое действие
на гемопоэз (снижается уровень гемоглобина, лейкоцитов, тромбоцитов). Эти
нарушения нивелируют путем назначения фолиниевой кислоты. К недостаткам
препарата относится его плохая переносимость больными; воздействие только
на эндозоиты, на цистные формы препарат практически не действует; при
назначении во время беременности он оказывает тератогенное действие. Так
например, за период наблюдения 1972- 1988 г. (Philip-Howard et al., 1990) у 76
пациентов было выраженное побочное действие, причем в 53% описаны
тяжелые осложнения: в 15 случаях - гранулоцитопения, 5 - летальный исход,
6 больных умерло от миокардита, у 3 - метгемоглобинемия, у 6 - нарушение
дыхания, у 4 - кожные поражения, у 3 отмечался судорожный синдром, причем
осложнения чаще наблюдали у женщин (2/3 случаев) в течение 2,5-3,9 недель
после приема препарата. Часто вместе с ПМ+СА назначают инъекции лидазы,
которая, изменяя консистенцию гиалуроновой кислоты, повышает тканевую
проницаемость и тем самым способствует воздействию препаратов на цистные
формы. Применение триметоприма (комбинированный препарат бисептол),
по механизму действия сходного с пириметамином, значительного эффекта в
лечении токсоплазмоза по сравнению с классической схемой лечения не дало
(Засухин Д.Н., 1980). К изменению нормальной формы наружной мембраны
токсоплазм приводит применение бреомицина (иммунодепрессант) и
бестатина (ингибитор аминопептидазы) (Akao S. et al., 1986).
Большого внимания заслуживает вопрос о лечении беременных женщин
и профилактике врожденного токсоплазмоза. Для этой цели более всего
подходит спирамицин (ровамицин), антибиотик, получаемый из Streptomyces
anbofaciens. Препарат создает высокую концентрацию в различных тканях,
плазме крови и, что особенно важно, в плаценте. При этом он хорошо
переносится и не оказывает тератогенного действия на плод (Descotes J. et
al., 1988; Chang H.R. et al., 1988; Coureur J. etal., 1988; Robert E. et al., 1989;
Wong S-Y., Remington J., 1994). Учитывая особенности патогенеза,
23. Заказ № К-4451.
353
иммуносупрессивное действие T.gondii, выраженную аллергизацию
макроорганизма, в комплексном лечении токсоплазмоза рекомендуется
использование антигистаминных препаратов, иммуномодуляторов, таких как
левамизол, декарис (Лукьянова Т.А. и др., 1981; Матернова В., Шевкунова
Е.А., 1979; Ноева Н.А. и др., 1981). Для иммунокоррекции инфицированных
T.gondii животных как способ повышения эффективности вакцин против
гриппа рекомендуется применение Т-активина, тимогена, нуклеината натрия
(Кольцова И.Г, 1992). Десенсибилизирующее и иммуностимулирующее
действие оказывает вакцинотерапия токсоплазмином, использующаяся при
лечении хронического токсоплазмоза (Казанцев А.П., 1985).
Таким образом, лишь единичные препараты активны против токсоплазм.
Для лечения токсоплазмоза у ВИЧ-инфицированных также применяют
препараты, вмешивающиеся в метаболизм фолатов в тахизоидах -
сульфаниламиды (ингибиторы гидроптероат синтетазы HPS) и ингибиторы
дигидрофолатредуктазы DHFR (триметоприм и пириметамин). Последние
действуют более эффективно на протозойную дигидрофолатредуктазу при
малярии (Garrod L.P., Lambert Н.Р., O'Grady F., 1981). Другие антифолатные
препараты включают триметрексат, потенциальный ингибитор DHFR,
пиретрексин и дапсон - ингибитор HPS. Некоторые ингибиторы синтеза
бактериальных протеинов также являются активными против токсоплазм,
вероятно, с таким же механизмом действия. Это клиндамицин, спирамицин.
новые макролиды - рокситромицин, кларитромицин, азитромицин.
Последний воздействует и на цистные формы (Huskinson-Mark J. et al., 1991).
В эксперименте (Blais J., Chamberland S., 1992) выяснили, что азитромицин
накапливается в макрофагах и сохраняется там на протяжении периода
инвазии, онтормозитсинтез белка в свободных тахизоитах и инвазированных
макрофагах. Об успешном применении препарата для лечении
токсоплазменного энцефалита у ВИЧ-инфицированных сообщили Saba J. et
al. (1993). Азитромицин назначался больным в ударной дозе 1000 мг вместе
с 200 мг пириметамина, с последующим снижением до 500 мгазитромицина
и 75 мг пириметамина в сутки в течении 27 дней. С этой же целью Eliot W. et
al. (1994) использовал азитромицин в качестве монотерапии: начальная доза
составляла 1500 мг, с последующим снижением до 1000 мг в сутки.
Chang H.R. et al. (1990) считают возможным применение при
токсоплазменном энцефалите у ВИЧ-инфицированных доксициклина, в ряде
исследований (Tardif С. et al., 1992; Hagberg L. et al., 1993) доказана
эффективность клиндамицина в сочетании с пириметамином; при высокой
концентрации клиндамицина (40 мкг/мл) тормозится синтез белка в
тахизоитах T.gondii. Об эффективности ровамицина при активации
токсоплазмоза, хламидиоза и криптоспоридиоза сообщается Зайковой Э.Ф.
и др. (1998).
354
Влияние на способность паразита синтезировать нуклеиновые кислоты
обеспечивает 3-й механизм воздействия на T.gondii. Атоваквон -
антималярийный препарат активен против пролиферативных форм и цист
(Araujo F.G. et al., 1991). Другим экспериментальным препаратом является
арпиноцид.
Предметом множества исследований является иммунотерапия.
Использование CD8 лимфоцитов, интерлейкина-2, р- и у-интерферонов
показало защитный эффект в экспериментальных моделях (McCabe R.E. et
al., 1984; Sharma S.D. et al., 1985; Schmitz J.L. et al., 1989; Hakim F.T. et al.,
1991). Для предупреждения токсоплазменного энцефалита у ВИЧ-
инфицированных с низким уровнем CD4 оценивалось несколько
профилактических режимов. К сожалению, из-за отсутствия широких,
проспективных, контролируемых, рандомизированных исследований все
проведенные исследования имеют противоречивые результаты. Монотерапия
была признана неэффективной.
Как считает Landman R. et al. (1993), только ежедневный прием бисептола
960 мг или комбинация дапсон 50 мг в день и пириметамина 50 мг в неделю
могут быть рассмотрены для клинического использования.
Считается, что первичная профилактика токсоплазмоза должна
проводиться ВИЧ-инфицированным пациентам, серопозитивным к T.gondii,
С уровнем CD4<0,2xl0’. Если уровень CD4<0,05, рекомендуется начинать
профилактическое лечение независимо от наличия антител к T.gondii, так
как существует риск ложноотрицательной серологии при первичной
инфекции.
Хотя проспективных рандомизированных исследований не проводилось
среди серопозитивных со СПИДом, клинические наблюдения (Oksenhendler
Е. etal., 1994; Carr A. et al., 1992; Hardy W.D. et al., 1992; May Т.Н. et al., 1994;
Podzamczer D. et al., 1993; Bozzette S.A. et al., 1995; Canessa A. et al., 1992) и
экспериментальные (Grossman RL., Remington J.S., 1979) показывают, что
ко-тримоксазол в дозах, профилактических для пневмоцистной пневмонии,
эффективен и для профилактики токсоплазменного энцефалита.
В ретроспективном исследовании, проведенном Carr A. etal. (1992) было
выявлено, что ни у одного пациента из 22 серопозитивных со СПИДом,
получавших низкие дозы бисептола 960 мг х 2 раза в день 2 дня в неделю
Для профилактики пневмоцистной пневмонии, не развивался
токсоплазменный энцефалит, в то время как у 12 (33%) из 36 серопозитивных
пациентов со СПИДом, получавших пентамидин для профилактики
пневмоцистной пневмонии, заболевание развилось. Несколько
проспективных исследований бисептола (но ни одно из них не было
спланировано специально для оценки профилактики токсоплазменного
ЭнПефалита) были получены противоречивые данные: при анализе всех
23*
355
пациентов, прошедших курс лечения, была показана эффективность бисептола.
но при intent-to-treat анализе он не давал защитного эффекта.
В США наиболее часто используется дапсон в качестве монотерапии для
профилактики пневмоцистной пневмонии у пациентов, не переносящих
бисептол. В эксперименте на мышах он не был эффективен для профилактики
токсоплазмоза(Derouin F. et al., 1991), хотя результаты одного исследования
на людях показали эффективность препарата в дозе 100 мг х 2 раза в неделю,
при сравнении с пациентами, получавшими пентамидин 100 мг каждые 2
недели (Torres R.A. et al., 1993). Исследования на животных и клинические
данные показывают, что комбинация дапсон и пириметамин более
эффективны для лечения инфекции (Girard P.M. et al., 1993; Brun-Pasaud М
et al., 1994; Clotet В. et al., 1991; Derouin F. et al., 1991). Открытое
проспективное рандомизированное исследование французских
исследователей показало, что у серопозитивных со СПИДом, получавших
дапсон 50 мг в день, пириметамин 50 мг в неделю и лейковорин 25 мг в
неделю, по сравнению с пациентами, получавшими пентамидин
ингаляционно 300 мг в месяц, токсоплазменный энцефалит развился в 14%
и 25% соответственно (Girard P.M. et al., 1993). При проведении intent-to-
treat анализа относительный риск развития токсоплазменных энцефалитов
был в 2,4 раза выше у лиц, получавших пентамидин. В проспективном
сравнительном рандомизированном исследовании в Испании бисептол 960
мг х 2 раза в день 3 раза в неделю сравнивался с дапсоном 100 мг в наделю
и пириметамином 25 мг в неделю для профилактики пневмоцистной
пневмонии. В обеих группах не было разницы в количестве случаев
токсоплазменных энцефалитов (Podzamczer D. et al., 1993).
Дапсон имеет более длительный Т1;, и меньше побочных эффектов,
однако обе комбинации могут привести к побочным эффектам, требующим
или снижения дозы или прекращения лечения; низкие же дозы: дапсон 100
мг, пириметамин 25 мг в неделю неэффективны (Mallolas J. et al., 1993).
Стандартной терапией 1 линии для острого токсоплазмоза является
комбинация пириметамина 50-70 мг в день и сульфадиазина 4-6 г в день per
os. Для более высокой концентрации пириметамин используется 100-200 мг
однократно, длительность терапии 6 недель. Из-за высокого уровня побочных
эффектов до 45% пациентов вынуждены прекратить лечение (Haverkos H.W..
1987). Наиболее частые побочные явления - сыпь и лихорадка. Для
нейтрализации токсического действия пириметамина на костный мозг
совместно со специфической терапией следует назначать фолиниевую кислот}
(лейковорин 10 мг в день). Следует иметь в виду, что гематоксичность
потенцируется антиретровирусными препаратами, от приема которых следует
воздержаться во время лечения токсоплазмоза. Кроме того, зидовудин
проявляет антагонистический эффект с пириметамином (Israelski D.M. Тош
356
C., Remington J.S., 1989). Сульфаниламиды могут вызывать ряд нежелательных
лекарственных реакций, таких как кристаллурия, гематурия и почечная
недостаточность, которые устраняются регидратацией, ощелачиванием мочи
и снижением дозы препарата. Эффективным иммуномодулирущим
препаратом фармакотерапии при ВИЧ-инфекции с часто рецидивирующими
оппортунистическими заболеваниями является имунофан (Прокопенко В.Д.
и др., 1998). Он также оказывает детоксикационное, гепатопротективное
действие, вызывает инактивацию свободнорадикальных и перекисных
соединений, что способствует улучшению гематологических, биохимических
и иммунологических показателей (Потемина Л.П., Хотько Н.И., 1998).
Пациенты, которые не переносят сульфаниламиды, могут получать
лечение комбинацией пириметамина и клиндамицина (1200-4800 мг в день)
(внутрь или в/в. Два проспективных контролируемых исследования
(Dannemann В. et al., 1992; Katlama С., 1991) показали, что эта комбинация
сравнима с комбинацией пириметамин-сульфаниламиды, хотя нежелательные
реакции, связанные с клиндамицином, и необходимость прекращения
лечения наблюдались у 30% пациентов. Они включали: кожную сыпь,
нейтропению и желудочно-кишечные расстройства, преимущественно
(диарею, реже наблюдался псевдомембранозный колит.
Альтернативная комбинация препаратов для лечения включает
сульфаметоксазол и триметоприм (Canessa A. et al., 1992), пириметамин и
кларитромицин (Fernandez-Martin et al., 1991), пириметамин и азитромицин
(Saba J. et al., 1992), пириметамин и доксициклин (Hagberg L., Palmertz В.,
Lindberg J., 1993), клиндамицин и 5-фторурацил (Dhiver С. et al., 1993) и
монотерапия атоваквоном (Kovacs J.A., 1992). Однако не было проведено
широких клинических испытаний для подтверждения любого из этих
режимов.
В Европейском мультицентровом рандомизированном исследовании
(Katlama С. et al., 1996), включавшем 299 больных токсоплазменным
энцефалитом ВИЧ-инфицированных, сравнивали эффективность двух схем
терапии: пириметамин 50 мг ежедневно с 2400 мг клиндамицина или с 4 г
сульфадиазина в течение 6 недель с последующей поддерживающей терапией
25 мг пириметамина ежедневно с 1200 мг клиндамицина или 2 г
сульфадиазина. В intent-to-treat анализе показано, что пириметамин-
клиндамицин был менее эффективен для лечения токсоплазменного
энцефалита, риск прогрессирования заболевания был в 1,84 раз выше по
сравнению со стандартной схемой терапии.
После лечения острого токсоплазмоза почти у всех пациентов без
поддерживающей пожизненной терапии наблюдаются рецидивы (Cohn J.A.
et al., 1989) из-за неспособности большинства этих препаратов разрушать
цистные формы паразита. Поддерживающая терапия состоит из 25-50 мг
357
пириметамина и 2-4 мг сульфадиазина (Leport С. et al., 1988). Пациенты,
неспособные переносить высокие дозы сульфаниламидов во время лечения
острой фазы, могуг получать лечение схемой, являющейся профилактической
для пневмоцистной пневмонии. Если сульфаниламиды противопоказаны,
могут быть назначены пириметамин 25 мг в день и клиндамицин 1200 мг в
день (Remington J.S., Vilde J.L., 1992; Uberti FoppaC. et al., 1991).
Интермитирующая терапия дважды в неделю пириметамином и
сульфадиазином (Pedrol Е. et al., 1990) или монотерапия пириметамином в
дозе 50 мг в день (de Gans J. et al., 1992) могут быть также эффективны в
качестве длительной супрессивной терапии. Альтернативные схемы
включают комбинацию пириметамина с дапсоном или монотерапию
атовак боном.
В 1996 г. Дэвидом Хо было сообщено об эффективном использовании
для лечения ВИЧ-инфицированных комбинированной терапии (HAART -
Highly Active Antiretroviral Therapy), где одновременно назначаются
ингибиторы обратной транскриптазы и ингибиторы протеазы в различных
сочетаниях (Рахманова А.Г. и др., 1999).
Поскольку активация латентной токсоплазменной инфекции у ВИЧ-
инфицированных наблюдается при тяжелой иммуносупрессии, то наилучшей
превентивной/поддсрживающей терапией заболевания является
восстановление иммунной реактивности. Следовательно, именно контроль
над ВИЧ с использовании режима HAART, повышающим количество CD4
лимфоцитов, будет наиболее успешным при долговременном подавлении
токсоплазм по сравнению с назначением специфических препаратов. В
исследовании Furrer Н. et al. (1999), из 262 пациентов с увеличением CD4-
клеток на фоне HAART более 200 кл/мм3,121 были серопозитивны к T.gondii
и составляли группу риска. Все они прекратили прием антитоксоплазменных
препаратов. За период наблюдения в среднем 11,3 месяцев ни в одном случае
не было токсоплазменного энцефалита.
Анализ динамики частоты токсоплазменных энцефалитов, проведенный
Saktor et.al. (1999), показал, что максимальная заболеваемость
регистрировалось при использовании в лечении ВИЧ монотерапии в 1990-
1992 гг. - 5,4 случаев на 1000 человек в год; внедрение HAART привело к ее
значительному уменьшению: в 1996-1997 гг. - 3,2.
По данным Галиной М.В. и др. (1999), применение в течение двух лет
HAART было эффективно у 70% пациентов, частота развития серьезных
нежелательных явлений составляла около 10%.
Количество пациентов со СПИДом с каждым годом увеличивается во
всем мире. В связи с этим необходима исследовательская программа для
профилактики токсоплазменного энцефалита и в нашей стране. Должна
изучаться ежегодная частота первичного токсоплазмоза среди ВИЧ-
358
инфицированных серонегативных к T.gondii пациентов; должны быть
идентифицированы факторы риска для сероконверсии. Необходимо постоянно
регистрировать и обновлять данные о распространенности токсоплазменной
инфекции, чтобы сотрудники органов здравоохранения могли оценить риск
заражения T.gondii в их районе. Должна быть оценена эффективность советов
для уменьшении уровня сероконверсии в областях с высоким риском
заражения и среди лиц с индивидуальными бытовыми особенностями.
Требуются дополнительные исследования для разработки лечения и первичной
профилактики острого токсоплазмоза, лечения и вторичной профилактики
пациентов из группы риска. В настоящее время выбор терапии для каждой
ситуации является трудной задачей из-за отсутствия широких контролируемых
исследований, подтверждающих эффективность лечения. Применение
большинства лекарственных препаратов сопровождается возникновением
нежелательных побочных эффектов, заставляющих пациентов отказаться от
назначенной терапии. Существует необходимость разработки новых, хорошо
переносимых противотоксоплазменных препаратов, особенно с антицистной
активностью, что может привести к полной элиминации паразита, таким
образом позволит пациентам избежать последующего длительного приема
супрессивной терапии. Дополнительная информация требуется о
потенциальной роли новых макролидных антибиотиков азалидов и атоваквона
в профилактике и лечении токсоплазменного энцефалита. Нуждается в
дальнейшем изучении роль цитокинов в патогенезе заболевания. Остается
открытым вопрос о риске и профилактике врожденного токсоплазмоза от
ВИЧ-инфицированной серопозитивной матери.
359
Литература
I. Аристова Г.Ф. Влияние токсоплазменной инвазии на обмен макро- и
микроэлементов у беременных и небеременных женщин: Автореф. дис.
...к-та мед.наук. - Владивосток, 1991. - 22 с.
2. Асатова М.М. Роль токсоплазменной инфекции в формировании
акушерской и перинатальной патологии: Автореф. дис.... д-ра мед.наук.
- Ташкент, 1991. - 45 с.
3. Бейер Т.В. Метаболизм Toxoplasma gondii// Токсоплазмиды. Сборник
«Протозоология». Вып. 4. - 1979. -С. 49-62.
4. Васильева И.С. Врожденный токсоплазмоз (риск развития,
профилактика): Автореф. дис. .. .к-та мед. наук. -СПб. -2002. -С. 25.
5. Виноградов А.В., Новиков Ф.Е., Грачева Л.И. Применение тиндурина
для лечения токсоплазменного миокардита у взрослых больных/'
Кардиология. - 1982. - N 4. - Т. XXII. - С. 9-11.
6. ГалинаМ.В., Голохвастова Е.Л., Моргунова Н.М. и др. Опыт двухлетнего
проведения высокоактивной антиретровирусной терапии (ВААРТ) ВИЧ-
инфекции// Русский журнал ВИЧ/СПИД и родственные проблемы. -
1999.-т.З.-№ 1.-С.126.
7. Гольдберг Г.А., Баранова М.Н. Случай длительного наблюдения за
больной токсоплазменным миокардитом и эндокардитом// Клиническая
медицина. - 1988. - С.130-132.
8. Дедкова Л.М., Гладкова С.В., Бормотов Н.И. и др. Белковый состав и
иммунохимические свойства экскреторно-секреторных антигенов
Toxoplasma gondii// Русский журнал ВИЧ/СПИД и родственные
проблемы.- 1999. - т.З. - № 1. - С. 106.
9. Жуманбаева Г.К., Козаченко Н.В. К вопросу о значении токсоплазмоз-
ассоциированных инфекций// Русский журнал ВИЧ/СПИД и родственные
проблемы. - 1999. - т.З. - № 1. - С.128.
10. Зайкова Э.Ф., Дроздов В.Н., Томилова Л.А. и др. Опыт диагностики и
лечения оппортунистических инфекций// 5 Российский съезд врачей-
инфекционистов: Тез.докл. - М., 1998. - С. 105-106.
11. Засухин Д.Н. Проблема токсоплазмоза//М., Медицина. -1980. - 309 с.
12. Казанцев А.П. Токсоплазмоз//Л.: Медицина. - 1985. - 167 с.
13. Колесникова-Тартынских Л.А. Роль токсоплазменной инфекции в
этиологии бесплодия у женщин//Эпидемиол. и инфекц. болезни. - 1998.
-№ 6. -С.41-43.
14. Кольцова И.Г. и др. Коррекция иммунного статуса инфицированных
токсоплазмами животных как способ повышения эффективности вакцин
против гриппа: [Докл.] 5 Всес. съезда протозоологов, Витебск, сент..
1992// Цитология. - 1992. - 34, № 4. - С.79.
360
15. Коновалова С.И. Иммунитет при токсоплазмозе// Токсоплазмиды.
Сборник «Протозоология». Вып. 4. - 1979. - С. 63-74.
16. Красильников А.А., Никифоров В.Н., Ноева Н.А. Причинно-
следственные связи при токсоплазмозе// Советская медицина. - 1985. -
N 4.-С.55-60.
17. Крахмальникова Г.Х., Голосарский Б.Н. Состояние печени при
хроническом токсоплазмозе//Врачебное дело. - 1983. -N 3. - С. 119-121.
18. Лобзин Ю.В., Казанцев А.П., Васильев В.В. и др. Хронический
токсоплазмоз: рациональная терапия // Рос. мед.вести. - 1997. - 2, № 3.
-С.67-69.
19. Лукьянова Т.А. Токсоплазмоз у детей (клиника, диагностика, лечение,
профилактика): Автореф. дис.... к-та мед.наук. - М., 1986. - 25 с.
20. Лысенко А.Я., Лавдовская М.В. СПИД-ассоциируемые инфекции и
инвазии// Москва. - 1992. - 327 с.
21. Лысенко А.Я., Турьянов М.Х., Лавдовская М.В., Подольский В.М. ВИЧ-
инфекция и СПИД-ассоциируемые заболевания// Москва. -1996. - 624 с.
22. Матернова В., Шевкунова Е. А. Лечение токсоплазмоза// Клиническая
медицина,-1979.-N 5.-С.21-25.
23. Метакса Г.Ю., Цынкаловский И.Б. Распознование токсоплазменных
лимфаденитов// Врачебное дело. - 1988. - N 3. - С. 116-118.
24. Милевская-Бобуля Б., Ровецкая-Тшебицка К.., Мачеевски 3. и др.
Длительные наблюдения за детьми и их матерями из группы риска
заражения токсоплазмозом// Акушерство и гинекология. - 1990. - N 1. -
С. 22-24.
25. Моисеенко А.В., Савин В.А., Попков А.В. и др. Анализ результатов
лечения больных хроническим приобретенным токсоплазмозом// 5
Российский съезд врачей-инфекционистов: Тез.докл. - М., 1998. - С.212.
26. Мороз Б.В., Никифоров В.Н., Трякин И.П. Токсоплазмоз в клинической
патологии// Казанский медицинский журнал. - 1989. -N 3. - С. 179-181.
27. Мороз Б.В., Дзуцева Ф.К., Саркисов С.Э. и др. Инаппарантный
токсоплазмоз в патологии беременности и плода// 5 Российский съезд
врачей-инфекционистов: Тез.докл. - М., 1998. - С.216.
28. Ноева Н.А. и др. Применение левамизола (декариса) для лечения больных
хроническим приобретенным токсоплазмозом//Сов. мед. - 1981. - № 3.
-С.45-49.
29. Новиков П.Л. Токсоплазмоз (клиника, диагностика, лечение)//
Здравоохранение Белоруссии. - 1983. - N 9. - С. 73-75.
30. Новиков Ф.Е., Грачева Л.И. Застойная кардиомиопатия
токсоплазменной этиологии// Кардиология. - 1982. - N Т. XXII. - С.
106-108.
361
31. Пархоменко С.И., Жулев Н.М., Рахманова А.Г. и др. Клинические
особенности течения менингоэнцефалитов у ВИЧ-инфицированных
пациентов//5 Российский съезд врачей-инфекционистов: Тез.докл. -М.,
1998.-С.240-241.
32. Покровский В.В. ВИЧ-инфекция или СПИД? // Тер. архив. -1989. - № 11.
-С.3-6.
33. Покровский В.В., Ладная Н.Н., Савченко И.Г. и др. Эпидемия ВИЧ-
инфекции в России// Эпидемиология и инфекционные болезни. - 1998. -
№5.-С.4-11.
34. Покровский В.В. Патогенез и этиотропная терапия ВИЧ-инфекции//
Эпидемиология и инфекционные болезни. - 1998. - № 5. - С.53-59.
35. Покровский В.В., Юрин О.Г. Алгоритм диагностики ВИЧ-инфекции//
Эпидемиология и инфекционные болезни . - 1999. - №2. - С.28-35.
36. Потемина Л.П., Хотько Н.И. Некоторые данные по клиническому
изучению имунофана у ВИЧ-инфицированных// 5 Российский съезд
врачей-инфекционистов: Тез.докл. - М., 1998. - С.256-257.
37. Прокопенко В.Д., Папуашвили М.Н., Шелепова Т.М. и др. Опыт
иммунокоррекции имунофаном у ВИЧ-инфцированных и больных
СПИДом // Русский журнал ВИЧ/СПИД и родственные проблемы. -1998.
-т.2. -№ 2. -С.33-34.
38. Пьянова Р.Е., Воропаева Н.М. Аутоиммунный компонент в патогенезе
хронического токсоплазмоза : [Докл] 5 Всес. съезда протозоологов,
Витебск, сент., 1992// Цитология. - 1992. - 34, № 4. - С. 125.
39. Радзинский В.Е., Чистякова М.Б. TORCH-комплекс и его роль в
перинатологии//Акушерство и гинекология. - 1990.-N 1.-С. 4-7.
40. Рахманова А.Г., Веровая А.В., Бейер ТВ., Чайка Н.А. Токсоплазмоз и
СПИД// С-Петербург. -1992. - 69 с.
41. Рахманова А.Г. ВИЧ-инфекция, профилактика ВИЧ-инфекции у
новорожденных//Санкт-Петербург. - 1997. -40с.
42. Рахманова А.Г, Пригожина В.К. Справочник по инфекционным болезням/
/ Санкт-Петербург. -1999. - 344 с.
43. Рахманова А.Г, Яковлев А.А., Халдеева Н.А. и др.// ВИЧ-инфекция:
комбинированная противоретровирусная терапия. - С.-Петербург. -1999.
-50 с.
44. Ройт А. Основы иммунологии// Москва. - 1991. - 328 с.
45. Рудова И.Б. Нейротоксоплазмоз у взрослых и подростков (диагностика,
лечение): Автореф. дис.... д-ра мед.наук. - Л., 1991. - 39 с.
46. Семенова Е.И. Врожденный токсоплазмоз// Педиатрия. -1979. -N 1.- С.
30-36.
362
47. Тютликова Л.А. Токсоплазмоз при ВИЧ-инфекции (частота, клинико-
иммунологическая характеристика): Автореф. дис. ...к-та мед.наук.-
Санкт-Петербург, 2000. - 22 с.
48. Фадеева М.А., Лукьянова ТА., Тамарова Л.Д. Диагностика врожденного
токсоплазмоза// Педиатрия. - 1987. - N 2. - С. 77-81.
49. Фадеева М.А., Лукьянова Т.А., Шевкунова Е.А., Тамарова Л.Д.
Приобретенный токсоплазмоз у детей// Вопросы охраны материнства и
детства. - 1987. - N 3. - С. 23-26.
50. Федичкина Т.П., Шевкунова Е.А., Сивуха ТА. О поражении желудочно-
кишечного тракта при токсоплазмозе// Советская медицина. -1979. -N 5.
-С. 25-30.
51. Федосеева В.Н., Порядин Г.В., Ковальчук Л.В. и др. Руководство по
иммунологическим и аллергологическим методам в гигиенических
исследованиях// Москва. - 1993. - 320 с.
52. Hermans Р. Гемопоэтические факторы роста для поддерживающей
терапии ВИЧ-инфицированных больных// СПИД: реальность и
перспективы. Материалы научно-практической конференции 25 апреля
1997. - Москва. -1997. - С. 1-18.
53. Шевкунова Е. А., Саидов М.С. Профилактика врожденного токсоплазмоза
в женской консультации// Акушерство и гинекология. - 1985. - N 10. - С.
61-63.
54. Шибалова ТА. Ультраструктурная организация и формы размножения
токсоплазмин//Токсоплазмиды. Сборник «Протозоология». Вып. 4.-1979.
-С. 38-48.
55. Ahlfors Karin et al. Incidence of toxoplasmosis in pregnant women in the city
of Malmo, Sweden// Scand. J. Infec. Diseases. - 1989. - 21, N 3. - P.315-321.
56. Ahuja Sunil K. et al. Necrotizing pancreatitis and multisystem organ failure
associated with toxoplasmosis in a patient with AIDS// Clin. Infec. Diseases.
- 1993,- 16, N3.-P.432-434.
57. Akao S. et al. Ultramicroscopic studies on the influence of breomycin and
bestatin to Toxoplasma gondii//J.Eltctron. Microsc. -1986. - 35, N 4. - P.3351-
3352.
58. Antunes F. et al. Toxoplasms antibodies and toxoplasmic encephaalitis in
HIV-infected people// Bull. Soc. fr. parasitol. - 1990. - 8, N 2. - P.945.
59. Aourizerate F. et al. Detection of Toxoplasma gondii in aqueous humour by
the polymerase chain reaction// Brit. J. Ophthalmol. - 1993. - 77, N 2. - P.107-
109.
60. Ara M. et al. Persistent IgM+ IgM- pattern in the serology of toxoplasmosis
frequency and implicated population// Enferm. infecc. у microbiol. clin. -
1992,- 10, Supl.N2.-P.69.
61. Araujo F.G., Huskinson J., Remington J.S. Remarcabel in vitro and in vivo
activites of the hydroxynaphthoquinon, 566C80, against tachyzoites and tissue
363
cysts of Toxoplasma gondii// Antimicrobial Agents and Chemother. -1991. -
35.-P.293-299.
62. Biggs B.-A., Leydon J., Hayes K., Hewish M. Humoral responses to toxoplasma
antigens in AIDS patients//Austral. andN.L.J. Med. - 1993. -23, N 4. - P.442.
63. Blais J., Chamberland S. Interacellular accumulation of azithromycin and
mode of action against Toxoplasma gondii// Clin, and Invest. Med. - 1992. -
15, N 4.-P.73.
64. Blanche P. etal. Miocarditetoxoplasmique aucours du SIDA. Apropos d’un
casguerissantsoustraitement// Sem. hop. Paris. -1993. -69, N 7. - P. 181-182.
65. Bordes E etal. Western blottihgasanew technique for the serological diagnisis
of toxoplasmosis in man// Bull. Soc. fr. parasitol. - 1990. - 8, N 2. - P.946.
66. Bozzette S.A. et al. A randomized trial of three anti-Pneumocystis agents in
patients with advanced human immunodeficiency virus infection//N. Engl. J.
Med. -1995.-332.-P.693-699.
67. Brun-Pasaud M. et al. Experimental evalution of combined prophylaxis ageinst
murine pneumocystosis and toxoplasmosis// J. Infect. Dis. - 1994. - 170. -
P.653-658.
68. Canessa A. et al. Cotrimoxazole therapy of T.gondii encephalitis in AIDS
patients// Eur. J. Clin. Microb. and Infect. Dis. - 1992. -11. -P.125-130.
69. Carr A., Tindall B., Brew B.J. etal. Low-dose trimethoprim-sulfamethoxazole
prophylaxis for toxoplasmic encephalitis in patients with AIDS// Ann. Intern.
Med.- 1992,- 117. - P. 106-111.
70. Catar G. Toxoplasmosis and its relevance// Bull. Soc. fr. parasitol - 1990. - 8,
N 2. - P.666.
71. Cazenave Jean et al. Contribution of a new PCR assay to the prenatal diagnosis
of congenital toxoplasmosis//Prenat. Diagn. -1992,- 12,N 2. - P.l 19-127.
72. Chang H.R. et al. Role of THF and IL-1 in infections with T.gondii//
Immunology. - 1990. - Vol. 69, N 1. - P.33-37.
73. Chumpitazi B.F.F. et al. Human platelet inhibition ofToxoplasmagondii growth
// Clin, and Exp. Immunol. -1998. - 111,N 2. - P.325-333.
74. Claire P., Gregory F. Pulmonary toxoplasmosis: a review// Clin. Infec. Diseases.
- 1992,- 14, N 4.-P.863-870.
75. CIotet B. et al. Twice-weekly dapsone-pyrimethamine for preventing PCP
and cerebral toxoplasmosis// AIDS. - 1991. - 5. - P.601-602.
76. Clough L.A., Clough J.A., Maciunas R.J. et al. Diagnosing CNS mass lesions
inpatientswith AIDS//The AIDS Reader 7(3): 83-88,93-97, 100, 1997. @
1997 SCP Communications, Inc.
77. Cohn J. A. et al. Evalution of the policy of empiric treatment of suspected
toxoplasma encephalitis in patients with the acqured immunodeficiency
syndrome// Am. J. Med. - 1989. - 86. - P.521-527.
78. Dannemann B. et al. Treatment of toxoplasmic encephalitis in patients with
AIDS. A randomized trial comparing pyrimethamine plus clindamycin to
364
pyrimethamine plus sulfadiazine/ZAnnals of Internal Med. - 1992. - 116. -
P.33-43.
79. de Gans J. et al. Pyrimethamine alone as maintenance therapy for central
nervous systen toxoplasmosis in 38 patients with AIDS// J. AIDS. -1992. - 5.
-P.l 37-142.
80. Deckert-Schliiter M. et al. Dynamics ofthe intracerebral and splenic cytokine
mRNA production in Toxoplasma gondii-resistant and -susceptible congenic
strains of mice // Immunology. - 1995. - 85, N 3. - P.408-418.
81. Decoster A. et al. Detection of anti-P30 antibodies in toxoplasmosis by Plate 1 la
Toxo IgA//5th Eur. Congr. Clin. Microbiol, and Infect. Diseases, Oslo, Sept.
9-11, 1991: Abstr. - Oslo. -1991. - P. 180.
82. Decoster Anne etal. IgA antibodies against P30as markers of congenital and
acute toxoplasmosis// Lancet. -N 8620. - P.l 104-1107.
83. Derouin F, Chastang C. In vitro effects of folate inhibitors on T.gondii//
Antimicrob. agents Chmother. -1989. - Vol 33, N 10. - P.l753-1759.
84. Derouin F. et al. Anti-toxoplasma effects of dapsone alone and combined
with pyrimethamine// Antimicrob. Agents Chemother. - 1991.- 35.- P.252-
255.
85. Dhiver C. et al. Five fluoro-uracil-clindamycin for treatment of cerebral
toxoplasmosis//AIDS. - 7. - P.143-144.
86. Dimier I.H., Bout D.T. Inhibition ofToxoplasmagondii replication in IFN-y-
activated human intestinal epithelian cells // Immunol, and Cell Biol. -1997. -
75,N5.-P.511-514.
87. Dubey J.P. et al. Effect of hidh temperature on infectivity ofToxoplasma
gondii tissue cysts in pork// J.Parasitol. - 1990. - Vol.76, N 2. - P.201-204.
88. Eliot W., Godofsky M.D. Treatment of presumed cerebral toxoplasmosis
with azithromycin//The new England journal of medicine. -1994. - Vol.330.
-N 8.-P.575-576.
89. Excler J.L. et al. Sero-epidemiological survey for toxoplasmosis in Burundi/
/Trop. Med. and Parasitol. - 1988. - 39, N 2. - P.139-141.
90. Farqa M. et al. Diagnostico de toxoplasmosis cerebral en paciences con
sindrome de immunodeficiencia adqirida mediante PMR: [Rep.J 5 Congr.
S1EMC, Barcelona, 10-13 nov., 1992// Enferm. infecc. у macrobiol. clin. -
1992,- 10, N2.-P.56.
91. Ferguson DJ.P. An immuno-electron microscopic study ofthe tissue cyst of
Toxoplasma gondii in mouse brain// EU REM 88.: Proc. 9th Eur. Congr. Electron
Microsc., Yore, 4-9 Sept., 1988. - Vol. 3. - Bristol; Philodelphia, 1988. - P.207-
208.
92. Fernandez-Martin et al. Pyrimethamine-clarithromycine combination for
therapy ofacude toxoplasma encephalitis in patients with AIDS//Antimicrob.
Agents and Chemoth. - 1991. - 35. - P.2049-2052.
93. Fiscer H.G. et al. Macrophages as target and affector cells during in vitro
infection by T.gondii the interaction with helperTcells determines macrophage
365
antiparasitic activity: [Pap.] Eur. Conf. Basic and Clin. Aspects Macrophage
Biol. «Macrophage 1992», Regensburg, Sept. 20-22, 1992// Pathobiology. -
1992.-60, N 1.-P.8.
94. Furrer H., Egger M.,Opravil M. et al. Discontinuation of primary prophylaxis
against pneumocystis carinii pneumonia in HIV-1 .infected adults treated with
combination antiretroviral therapy//The New England Journal of Medicine -
1999.-Vol.340.-N 17.-P. 1301-1306.
95. Garcia Linnea W. et al. Aquired immunodeficiency cyndrome with disseminated
toxoplasmosis presenting as an acute pulmonary and gastrointestinal illness//
Arch. Pathol, and Lab. Med. - 1991. - 115, N 5. - P.459-463.
96. Garrod L.P., Lambert H.P., O’Grady F. Modes of Action// Antibiotics and
Chemotherapy. -1981. - 5. - P.252-253.
97. Girard P.M. et al. Dapson-pyrimethamine compared with aerosolized
pentamidine as primary prophylaxis against Pneumocystis carinii pneumonia
and toxoplasmosis in HIV infection//N. Engl. J. Med. - 1993.-328. - P. 1514-
1520.
98. Goldsmith R.S. et al. Low Toxoplasma antibody prevalense in serologic surveys
of humans in southern Mexico// Arch, invest, med. -1991. - 22, N 1. - P.63-73.
99. Gomez Marin J.E., Pinon J.M., Bonhomme A. et all. Does human toxoplasmosis
involve an imbalance in T1/T2 cytokines?//Med. Hypotheses. -1997. -48, N
2.-P.161-169.
100. Gonzaiez-Clemente J.M. et al. Toxoplasmosis encefalica enpacientes con
sindrome de immunodeficiencia adquirida. Estudio clinico-radiologico у
resultados terapeuticos de 78 episodios// Med. clin. - 1990.-95, N 12. - P.441-
446.
101. Grossman P.L.Remington J.S. The effect of trimethoprim and
sulfamethoxazole on Toxoplasma gondii in vitro and in vivo// Am. J. Trop.
Med. Hyg. -1979. - 28. - P.445-455.
102. Hagberg L., Palmertz B., Lindberg J. Doxycycline and pyrimethamine for
toxoplasmic encephalitis// Scand. J. Infect. Dis. -1993.-25, N 1. - P. 157-160.
103. Hakim F.T. et al. CD8+ T cells from mice vaccinated against T.gondii are
cytotoxic for parasite-infected or antigen-pulsed host cells// J. Immunol. -
1991. -147. - P.2310-2316.
104. Hardy W.D. et al. Trimethoprim-sulfamethoxazole versus aerosolized
pentamidine for secondary prophylaxis of Pnevmocystis carinii pneumonia
in Al DS patients receiving zidovudine: AIDS clinical trial group protocol 012.N/
/ Engl. J. Med. -1992,- 327. - P. 1842-1848.
105. Herrera G, VillaltaO., VisonaK. Trimethoprim-sulfametoxazole treatment
of toxoplasma encephalitis in AIDS patients// Programs and Abstracts of VII
International Conference on AIDS, Florence, Italy. -1991,- 262 p.
106. Haverkos H.W. Assessment oftherapy fortoxoplasma encephalitis. The ТЕ
Study Group//Am. J. Med. - 1987. - 82. - P.907-914.
366
107. Hofflin Jesse M et al. Murine model of interacerebral toxoplasmosis// «J.Infec.
Diseases». - 1987. - 155,N 3. - P. 550-557.
108. Hoffman P., Bernard E., Michiels J. etal. Myocardite aiguetoxoplasmique:
cause mort au cours d’immunodeficience acquise/ZArch. malad. coeuret vaiss.
- 1990.-83,N 11.-P.1735-1738.
109. Holliman R.E. et. al. Toxoplasmosis and heart transplantion// J. Heart and
Lung Transplant. - 1991.-10, N 4,- P.608-610.
110. Hunter Christopher A., Roberts C.W., Alexander J.B. Kinetics of cytokine
mRN A production in the brains of mice with toxoplasmic encephalitis: [Pap.]
1st Eur. Congr. Protozool.// Eur. J. ProtistoL - 1992. - 28, N 3. - P.334.
111. Hunter Christopher A. etal. Transforming growth factor-P inhibits interleukin-
12-induced production of interferon-y by natural killer cells: A role for
transforming growth factor-P in the regulation ofT cell-independent resistance
to Toxoplasma gondii // Eur. J. Immunol. - 1995. - 25, N 4. - P.994-1000.
112. Huskinson-Mark J., Araujo F.G., Remington J.S. Evaluation of the affect of
drugs on the cyst form of Toxoplasms gondii// J. Infect. Dis. - 1991.- 164.-
P. 170-177.
113. Israelski D.M.,Tom C., Remington J.S. Zidovudine antagonizes the action
of pyrimethamine in experimental infection with T.gondii//Antimicrob. Agents
and Chemother. -1989. - 33. - P.30-34.
114. Jeannel Dominique et al. Epidemiology of toxoplasmosis amond pregnant
women in the Paris area// Int. J. Epidemiol. -1988. - 17, N 3. - P.595-602.
115. Joynson David H.M. Epidemiolody of toxoplasmosis in the U.K.// Scand.
J.Infec. Diseases. Suppl. - 1992. - N84. - P.65-69.
116. KatlamaC. et al. Pyrimethamine-clindamycin vs. pyrimethamine-sulfadiazin
as aqute and long-term therapy for toxoplasmic encephalitis in patients with
AIDS//Clin. Infect. Dis. -1996. - 22. - P.268-275.
117. Katlama C. Evalution of the efficacy and safety of clindamycine plus
pyrimethamine for induction and maintenance therapy of toxoplasmic
encephalitis in AIDS// Eur. J. Clin. Microb. and Infect. Dis. - 1991. - 10. -
P.189-191.
118. Kasper Lloyd H., MatsuuraTadashi, Khan ImtiazA. IL-7 stimulates protective
immunity in mice ageinst the intracellular pathogen, Toxoplasma gondii //
J.Immunol. -1995. - 155, N 10. - P.4798-4804.
119. Khan Imtiaz A., Matsuura Tadashi, Kasper Lloyd H. IL-10 mediates
immunosupression following primary infection with Toxoplasma gondii in
mice // Parasite Immunol. - 1995. - 17. N 4. - P.l 85-195.
120. Khan Imtiaz A., Kasper Lloyd H. IL-15 augments CD8+- T cell-mediated
immunity ageinst Toxoplasma gondii infection in mice // J. Immunol. -1996.
-157,N5.-P.2103-2118.
121. Kovacs J.A. and the NIAID-Clinical Center Intramural AIDS Program.
Efficacy of atovaquone in treatment of toxoplasmosis in patients with AIDS/
/Lancet. - 1992. - 340. - P.637-638.
367
122. Landman R., Hirschel B.,Oksenhendler E. Elements de recommandations/
/ Med. Mai. Infect. - 1993. - 23. - P.746-760.
123. Le Fichoux Y., Marty P., Chan H. Les IgA seriques specifiques dans le
diagnostic de la toxoplasme acquise et congenitale// Rev. fr.lab. - 1988. - 17,
N178.-P.51-62.
124. Lebech Morten, Petersen Eskild Medfodt toxoplasmose og ojehistjties//
Ugeskr. Laeger. - 1992. - 154,N 6. - P.339-345.
125. Leport C. et al. Treatment of central nervous system toxoplasmosis with
pyrimethamine/sulfadiazine combination in 35 patients with the acquired
immunideficiency syndrome//Am. J. Med. - 1988. - 84. - P.94-100.
126. Lin Dah-Sheng, Bowman D.D. Toxoplasma gondii: an AIDS enhancing
cofactor// Med. Hypotheses. -1992. - 39,N 2. - P.l40-142.
127. Lodar Jernej et al. Incidence of congenital toxoplasmosis in the Republic of
Slovenia// Scand. J.Infec. Diseases. - 1992.-224, N 1. - P.l05-108.
128. Ljungstrom I. et al. Toxoplasma gondii: Cross-reactiong antigens and receptors
associatid with the retinal epithelium // 6th Eur. Multicoiloq. Parasitol., The
Hague, Sept. 7-11, 1992: Programme and Abstr. - The Hague, 1992. - P.98.
129. Luft B.J., Remington J.S. Toxoplasmic encephalitis in AIDS// Clin. Infect.
Dis.- 1992.-N 15.-P.211-222.
130. Luder C.G.K. etal. Down-regulation ofMHC class II molecules and inability
to up-regulate class I molecules in murine macrophages after infection with
Toxoplasma gondii //Clin, and Exp. Immunol. - 1998. - 112, N 2. - P.308-316.
131. Mallolas J. et al. Primary prophylaxis for Pneumocystis carinii pneumonia:
a randomized trial comparing cotrimoxazole, aerosolized pentamidine and
dapsone plus pyrimethamine//AIDS. - 1993. - 7. - P.59-64.
132. Marty P. et al. Prenatal diagnosis of severe fetal toxoplasmosis a result of
toxoplasmic reactivation in an HIV-1 seropositive woman // Prenat.Diagn. -
1994.- 14,N5.-P.414-415.
133. Mason James C. et. al. Toxoplasmosis in two renal transplant recipients from
acingle donor// «Transplantation», 1987. - 44, N4. - P.588-591.
134. May Т.Н. et al. Trimethoprim-sulfamethoxazole versus aerosolized
pentamidine for primary prophylaxis of Pneumocystis carinii pneumonia: a
prospectiv, randomized controlled clinical trial// J. Acquir. Immune. Defic.
Syndr. - 1994.- 7.-P.457-462.
135. McCabe R.E., Luft B. J., Remington J.S. Effect of murine interferon gamma
on murin toxoplasmosis// J. Infect. Dis. - 1984. - 150. - P.961-962.
136. McCabe Robert E. et al. Clinical spectrum in 107 cases of toxoplasmic
lymphadenopathy/7 Rev. Infec. Diseases. - 1987. - 9, N 4. - P.754-774.
137. McCabe Robert E. et. al. Clinical spectrum in 107 cases of toxoplasmic
lymfadenopathy// «Rev. Infec. Diseases». -1987. - 9, N 4. - P.754-774.
138. Meenken C. et al. Longterm ocular and neurological involvement in severe
congenital toxoplasmosis// Brit. J.Ophthalmol. -1995. - 79, N 6. - P.581-584.
368
139. Morten L., Eskild P. Medfodt toxoplasmose og ojenaftektion. En oversigt
med seks sygehistories// Ugeskr. Laeger. -1992. -154, N 6. - P.339-345.
140. Nakao M., Konishi E. Proliferation of Toxoplasma gondii in human
neutrophils in vitro//Parasitology. - 1991,- 103,N 1.-P.23-27.
141. Oksenhendler E. et al. Toxoplasma gondii infection in advenced HIV infection/
/ AIDS. - 1994. - N8. - P.483-487.
142. Pedrol E. et al. Central nervous system toxoplasmosis in AIDS patients:
efficacy of an intermittent maintenance therapy// AIDS. - 1990. - 4. - P.511-
517.
143. Penev-Koteva L. eyt al. The morfological features of some organs in
toxoplasmosis// «Pathol. Res. and Pract.». - 1987. - 182, N 4. - P.541-542.
144. Phillip-Howard P.A, West L. J. Serious adverse drug reactions to
pyrimethamin-sulphadoxin, pyrimethamin-dapsone and to amodiaquine in
Britain// J. roy. Soc. Med. - 1990. - Vol. 83, N 2. - P.82-85.
145. Pinon J.M. et al. Detection of specific immunoglobulin E in Patients with
toxoplasmosis//J. Clin. Microbiol. - 1990. -28,N 8. - P.1739-1743.
146. Podzamczer D. et al. Thrice-weakly cotrimoxazole is better then weekly
dapsone-pyrimethamine for primary prevention of Pneumocystis carinii
pneumonia in HIV-infected patients// AIDS. - 1993. - 7. - P.501-506.
147. Pomroy Claire, Filice Gregory A. Pulmonary toxoplasmosis: a review// Clin.
Infec. Diseases. - 1992. - 14, N 4. - P.863-870.
148. Porter S.B., Sande M.A. Toxoplasmosis of the central nervous system in the
acquired immunodeficiency syndrome//New Engl. J. Med. - 1992. - 327. -
P. 1643-1648.
149. Remington J.S., Vilde J.-L. Clindamycin fortoxoplasma encephalitis in AIDS/
/Lancet. -1991. - 338. - P.l 142-1143.
150. Remington Jack S. The tragedy ofToxoplasmosis// Pediat. Infec. Disease J.
- 1990.-9, N 10.-P.762-763.
151. Remington Jack S., Klein J.O. Toxoplasmosis// Infectinous Diseases of the
Fetus and Newborn Infant. - 1990. - 195 p.
152. Richards F.O., KovacsJ.A., LuftB.J. Preventing toxoplasmic encephalitis in
persons infected with human immunodeficiency virus// Clin. Infect. Dis. -
1995.-21.-P.49-56.
153. Rodrigues J.C. et al. Evalution of different techniques in the disgnosis of
Toxoplasma encephalitis// J. Med. Microbiol. - 1997. - 46, N 7. - P.597-601.
154. Roquers C. et al. Diagnostic de la toxoplasmose cerebrate per isolement en
culture cellulaire de toxoplasmes danse les biopsies cerebrales// Bull. Soc. fr.
parasipol. - 1988. - 6, N 1. - P.57-64.
155. Saba J. et al. Apilot study of the pyrimethamine/azithromycin combination for
acute therapy of toxoplasma encephalitis in AIDS// The Third European
Conference on Clinical Aspects and Treatment ofHI V infection. -1992. - 47 p.
24. Заказ № K-4451.
369
156. Saba J. et al. Pyrimethamin plus azithromycin for treatment of acute
toxoplasmic encefalitis in patients with AIDS// Eur.J.Clin.Microbiol.lnfect.Dis.
- 1993.-N 12.-P.853-856.
157. Saktor N.C. et al. The changing incidence of HIV-1 infection: normalization
by antiretrovi ral therapy// 6th Conference on retroviruses and opportunistic
infections, Chicago, III. - 1999.
158. Scemanna M., Relier S.P. Infections virales et parasitaires du nouveau-ne.
Epidemiologic, etiologie, diagnostic, treatment// Rev. Prat. (Paris). - 1989. -
Vol. 39, N 10.-P.805-898.
159. Schmitz J.L. et al. Beta interferon inhibits T.gondii growth in human
monocyte-derived macrophages// Infect, and Immunol. - 1989. - 57. - P.3254-
3256.
160. Sharma S.D., Hofflin J.M., Remington J.S. In vivo recombinant interleukin
2 administration enhances survival against a lethal challenge with T.gondii// J.
Immunol. - 1985,- 135.-P.4160-4163.
161. Suzuki Yasuhiro et al. lnterferon-y: the major of resistance against Toxoplasms
gondii//«Science». -1988. -240, N 4851. - P.516-518.
162. Tardif C., Blais J., Chamberland S. Can clindamycin control the replication
of Toxoplasma gondii?//Clin, and Invest. Med. - 1992,- 15,N4. - P.7^.
163. Torre D., Casari S., Speranza F. et al. Randomized trial of trimethoprim-
sulfamethoxazol versus pyrimethamine-sulfadiazine for therapy of toxoplasmic
encephalitis in patients with AIDS//Antimicrobial agents and chemotherapy.
-1998.-42,N6.-P.1346-1349.
164. Torres R.A. et al. Randomized trial of dapsone and aerosolized pentamidine
for the prophylaxis of Pneumocystis carinii pneumonia and toxoplasmic
encephalitis//Am. J. Med. - 1993. - 95. - P.573-583.
165. Tuazon Carmelita U. Toxoplasmosis in AIDS patients// J.Antimicrob.
Chemother. - 1989. - 23, suppl. A. - P.77-82.
166. Uberti Foppa C. et al. A retrospective study of primary and maintenance
therapy of toxoplasmic encephalitis with oral clindamycin and pyrimethamine/
/ Eur. J. Clin. Microb. and Infect. Dis. - 1991. - 10. - P.l 87-189.
167. Vilena I. etal. Prenatal diagnosis of congenital toxoplasmosis transmitted by
an immunocompetent woman infected before conception // Prenat. Diagn. -
1998.- 18,N10.-P.1079-1081.
168. Yong E.C., Chi E.Y., Henderson W.R. Toxoplasma gondii alters eicosanoid
release by human mononuclear phagocytes: Role of leukotrienes in interferon
у-induced antitoxoplasma activity // J. Exp. Med. - 1994. - 180&( !&), N S.-
Р. 1637-1648.
169. Zangerle R., Allerberger F., Pohl P. High risk of developing toxoplasmic
encephalitis in AIDS patients seropositive to Toxoplasma gondii// Med.
Microbiol. Immunol (Berl). -1991. -180. - P.59-66.
370
170. Zufferey J. et al. Prevalence of latent toxoplasmosis and serological diagnosis
of active infection in HIV-positive patients// Eur. J. Clin. Microbiol. Infect.
Dis.-Vol. 12,N 8. - P.591-595.
171. Zumla A. et al. Toxoplasma serology in Zambian and Ugandan patientsn
infected with the human immunodeficiency virus// Trans. Roy. Soc. Trop.
Med. and Hyg. - 1991. - 85, N 2. - P.227-229.
24»
371
Глава 9. ТУБЕРКУЛЕЗ ПРИ ВИЧ-ИНФЕКЦИИ
Обострение эпидемиологической ситуации по туберкулезу в мире
связывают со стремительным нарастанием масштабов пандемии ВИЧ-
инфекции (5,10,6,27). Отсутствие надежных средств профилактики и лечения
последней позволяют отнести эту проблему к одной из самых актуальных на
современном этапе, так как высокая инфицированность микобактериями
туберкулеза и быстрое распространение в той же среде ВИЧ делают прогноз
сочетанной патологии крайне высоким. В странах с высокой
инфицированностью населения ВИЧ у 30-50% больных ВИЧ-инфекцией
развивается туберкулез, и при этом резко растет смертность от заболевания,
достигая 43-89% (197). Среди умерших лица в возрасте 20-49 лет составляет
54,2 % (12, 17).
По материалам отчетов Европейского регионального бюро ВОЗ,
заболеваемость туберкулезом в сочетании со СПИДом наиболее
.распространена среди наркоманов (на 20% выше, чем среди остальных
контингентов больных ВИЧ-инфекцией). В ряде Европейских стран, где
преобладает такой путь передачи ВИЧ, число больных ВИЧ/СПИДом с ко-
инфекцией туберкулезом составляет 42-51 % (Испания, Португалия) (65,
•67,69).
Ряд авторов отмечает, что туберкулез на фоне ВИЧ-инфекции
реализуется в 50-70% случаев как внелегочный, наслоившийся на СПИД, чаще
уже в финале, когда клеточный иммунитет и, в частности, уровень CD4
лимфоцитов подавлен в наибольшей степени (22,23,24,40, 57,58). При этом
туберкулез имеет клинические особенности, что приводит к задержке
диагностики. В странах Европы риск развития внелегочного туберкулеза при
СПИДе повышен среди выходцев Южной Африки и больных наркоманией. У
последних при сочетании этих двух инфекций, по сравнению со всей
популяцией, чаще выявляют менингит, а при туберкулезном менингите
больные наркоманиями составляют 21% (29). Прогноз заболевания в таких
случаях неблагоприятный (33,41).
Из внелегочных форм туберкулеза, вне зависимости от стадии ВИЧ-
инфекции, выявляют поражение лимфатических узлов - примерно у 30% всех
больных (16). Затем по частоте поражения следуют специфические изменения
в селезенке, печени, хотя абсцесс селезенки представлен как редкий случай
(21, 29, 60). Описаны поражения поджелудочной железы (45), брюшной
стенки, поясничных мышц, зарегистрирован абсцесс в толще грудной стенки,
молочной железы, абсцессы головного мозга (24,45, 64).
У детей в слаборазвитых странах первое место среди внелегочных форм
занимает костно-суставной туберкулез. Нередко последний на фоне ВИЧ-
инфекции приобретает генерализованный характер с поражением легких,
кишечника, мозговых оболочек, печени, селезенки, мезентеральных
лимфатических узлов, перикарда, глаз и т.д. (12, 14,28, 34, 35, 64,68, 69).
372
Все авторы отмечают сложность диагностики туберкулеза,
протекающего на фоне СПИДа. Она связана, в первую очередь, с трудностями'
раннего распознавания туберкулеза из-за сходства клинической симптоматики
этих двух заболеваний (7,46, 50, 51,58).
Основными клиническими проявлениями туберкулеза на фоне ВИЧ-
инфекции являются астения, постоянная или интермиттирующая лихорадка,
длительный кашель, значительное снижение массы тела, диарея (19). В 65%
случаев при осмотре выявляются увеличенные лимфатические узлы,
преимущественно шейные и подмышечные, реже паховые, плотной
консистенции, бугристые, плохо смещающиеся при пальпации (19,24).
В то же время, мнения авторов по вопросу основных диагностических
критериев туберкулеза у больных ВИЧ-инфекцией достаточно противоречивы.
Одни из них считают, что обширность туберкулезного поражения легких в
условиях ВИЧ-инфекции обычно менее выражена, чем без нее. Другие
отмечают, что у половины больных рентгенологически диагностируется
милиарный туберкулез, при этом он может осложняться септическим шоком
с нарушением функций многих органов, а трудности его диагностики
обусловливают запоздалое лечение и частые летальные исходы (1,2, 18,25,
41).
Туберкулез у ВИЧ-инфицированных нередко сочетается с банальной
бактериальной пневмонией, что также затрудняет диагностику из-за
специфики симптоматики и, в свою очередь, задерживает начало адекватного
лечения. При этом банальная пневмония отнюдь не является обычным
осложнением туберкулеза, а служит причиной его прогрессирования.
Трудность диагностики туберкулеза у ВИЧ-инфицированных, кроме
выше указанного, связана с абацилярностью мокроты и другого отделяемого
(52, 62, 67). В то же время, у таких больных значительно чаще, чем при
туберкулезе без ВИЧ-инфекции, встречают бактериемию. Именно выявление
микобактерий в крови, при отсутствии их в мокроте, в 33% случаев является
первым признаком туберкулеза у инфицированных ВИЧ (25).
R.W. Shafer et al., изучавшие вопрос бактериовыделения у больных
туберкулезом на фоне ВИЧ-инфекции, у 15% пациентов выявляли
микобактерии туберкулеза методом микроскопии в крови, в 28% случаев
высевали из крови. При диссеминированном туберкулезе бактериемия имела
место в 83% случаев, а при наличии у больного, кроме туберкулеза, других
оппортунистических инфекций - в 100% случаев (59).
Широко применяемая во фтизиатрической практике
туберкулинодиагностика с использованием ее различных модификаций для
выявления внелегочных форм туберкулеза у больных ВИЧ-инфекцией
оказывается малоэффективной из-за анергии к туберкулину (32, 50). У
373
инфицированных ВИЧ анергия к туберкулину встречается в 90% случаев, а у
неинфицированных - только в 40%.
Учитывая частоту внелегочных поражений у больных ВИЧ-инфекцией,
в диагностике туберкулеза немаловажная роль отводится биопсиям.
Пункционные биоптаты берут из выявленных подозрительных очагов
поражения, в частности, из лимфатических узлов, селезенки, печени (34,60,
66).
Отмечают беспрепятственное размножение микобактерий туберкулеза
в микрофагах при слабом гранулемообразовании и преимущественно
внелегочные локализации поражения. Выявляемые гранулемы в 90% случаев
более крупные с выраженной некротизацией. Туберкулез во всех наблюдениях
проявляется милиаризацией или многоочаговой диссеминацией (18).
В аспиратах из лимфатических узлов в 71 % случаев удается выделить
микобактерии туберкулеза.
В 25-50% случаев туберкулезный процесс можно установить только
благодаря наличию микобактерий туберкулеза, так как характерные для
туберкулеза гранулемы отсутствуют (63,67).
При патологоанатомическом исследовании нередко определяют
признаки пониженной реактивности при слабом гранулемообразовании с
преобладанием некрозов. При этом выявленные морфологические изменения
имеют сходство с прогрессирующим милиарным туберкулезом в
“доСПИДовую эру”.
Частая внелегочная локализация туберкулеза в условиях
предварительной инфекции ВИЧ предполагает широкое использование в
диагностике неясных случаев компьютерной томографии, сонографии. В
качестве дополнительного исследования для диагностики туберкулеза
рекомендуют использовать метод иммуноферментного анализа (51, 56).
Проведено исследование специфичности и чувствительности метода
иммуноферментного анализа при выявлении антител к микобактериям с
использованием антигена А60. Сыворотки от 100 больных с подозрением на
внелегочный туберкулез исследовались параллельно с образцами от 10
культурально положительных случаев заболевания и от 25 здоровых людей
контрольной группы соответствующего пола и возраста. В целом,
положительные ответы при этом тесте составили 80,0%, при 100%
чувствительности и 92% специфичности.
Тяжесть проявления туберкулезного процесса прямо пропорциональна
степени угнетения иммунитета. При снижении уровня СО4-лимфоцитов более
100/мм3 отмечают частую генерализацию процесса и повышенное содержание
иммуноглобулинов А, М, G. При этом степень повышения концентрации IgG
чаще пропорциональна тяжести туберкулезного процесса, тогда как
374
содержание иммуноглобулинов А и М не зависит от тяжести туберкулезного
процесса.
Среди СПИД-ассоциированных заболеваний, сочетанных с
туберкулезом, чаще отмечают саркому Капоши, цитомегаловирусную
инфекцию, кандидоз, в то же время локализованные формы туберкулеза у
больных ВИЧ-инфекцией наблюдают преимущественно раньше других
оппортунистических болезней.
Туберкулез на фоне ВИЧ-инфекции гораздо сложнее поддается лечению.
Общепринятые 6-ти месячные курсы лечения туберкулеза при ВИЧ-инфекции
явно недостаточны и следует проводить лечение в течение 9 месяцев, а после
окончания основного курса лечения назначать пожизненно
химиопрофилактику изониазидом. Это оправдано, учитывая частоту
рецидивов, наступающих и после эффективного годичного курса
противотуберкулезной химиотерапии.
Проведенное изучение штаммов микобактерий туберкулеза при
первичном заболевании туберкулезом на фоне ВИЧ-инфекции и при
повторном заболевании тех же пациентов показало, что только в одном случае
имела место реинфекция, а во всех остальных причиной развития активного
туберкулезного процесса был рецидив (57).
Наличие ВИЧ у ранее болевших туберкулезом в 30% случаев приводит
к рецидиву туберкулеза (49), в связи с чем этим больным требуется длительное
последующее наблюдение и лечение.
По данным B.Dautrenberg с соавторами, оптимальный режим терапии
туберкулеза слагается из рифампицина (7-10 мг/кг), изониазида (5 мг/кг),
этамбутола (7-10 мг/кг) и 100 мг клофазимина. Такой режим подходит не
только при туберкулезе, но и при другой микобактериальной инфекции (54).
S. Robert с соавторами на основании исследований, проведенных в
Уганде, рекомендуют комбинацию из трех противотуберкулезных препаратов:
изониазида, рифампина, пиразинамида.
P.Nunn с соавторами, также на основании исследований, проведенных
в Африке, считают целесообразным для лечения туберкулеза у ВИЧ-
инфицированных применять комбинацию из 5 противотуберкулезных
препаратов: стрептомицина, изониазида, рифампицина.
Установлено, что у всех пациентов с множественной лекарственной
устойчивостью микобактерий туберкулеза наблюдается отрицательная
динамика течения туберкулезного процесса. Больным с ухудшающимся
состоянием или отрицательной рентгенологической картиной целесообразно
проводить корректировку антибактериального лечения (55).
Исследования, проведенные на основе молекулярно-генетической
технологии, позволяют исключить возможность передачи устойчивых
штаммов от человека к человеку. Вероятно, основными причинами
375
устойчивости микобактерий являются плохое выполнение требований режима
лечения противотуберкулезными препаратами или пониженная абсорбция
рифампина организмом пациента (26,28).
Низкую эффективность лечения туберкулеза нередко связывают с
частым нарушением пациентами режима лечения (55). Так, например, в
настоящее время только 15% больных туберкулезом в США проходят полный
курс лечения под наблюдением врача. В то время как около 20% вообще его
не завершают (23).
J.H.Grosset в 20% случаев наблюдал побочные явления от лекарственных
препаратов, при этом, по его мнению, выбор препаратов для лечения
туберкулеза в условиях ВИЧ-инфекции не имеет особого значения (26).
При лечении туберкулеза у ВИЧ-инфицированных, особенно
внелегочного, ряд исследователей широко прибегает к хирургическим
вмешательствам, выполняя резекции различных органов, дренирование
абсцессов (46).
В то же время имеется достаточно большое количество наблюдений об
эффективности консервативного лечения.
Ряд авторов показали, что в связи с нарушением режима лечения, в
первую очередь это касается лиц, больных наркоманиями, а также с
назначением краткосрочных курсов лечения, возрастает частота лекарственной
устойчивости микобактерий туберкулеза у пациентов, в результате чего они
являются распространителями этих возбудителей среди остального населения
с повышенным риском заболевания (55, 59).
В Берне провели анализ выявленных за два года больных туберкулезом.
Из их числа 16% оказались больными наркоманией, бродягами, носителями
ВИЧ. У всех обследованных культурально выявили микобактерии туберкулеза.
Последние подвергли структурно-молекулярному анализу с целью выявления
определенных фракций бактериальной ДНК, обуславливающих резистентность
микобактерий ко многим противотуберкулезным препаратам. В результате
исследования было установлено, что больные из “социальных низов” населения
являются носителями микобактерий с определенной структурой ДНК. Такой
вывод, по мнению авторов, справедлив для всей Европы и США.
Несвоевременная и неправильная организация лечения больных ВИЧ-
инфекцией в сочетании с туберкулезом влечет за собой еще и возникновение
нозокомиальных очагов туберкулеза в тюрьмах.
Один из режимов, предложенных Х.Альбино, Л.Райхман, (1999),
состоит из четырех препаратов, принимаемых в прерывистом режиме 3 раза
в неделю с помощью терапии прямого наблюдения (ТПН) длительностью 6
месяцев всего или 3 месяца после того, как посевы становятся
отрицательными - применяется тот вариант, который окажется дольше. В
наиболее популярном режиме применяются 4 препарата (изониазид,
376
рифампицин, пиразинамид, этамбутол) в течение двух месяцев и затем 2
препарата (изониазид, рифампицин) втечение четырех месяцев с ожиданием
отрицательных посевов через два или три месяца (72). При использовании 4
препаратов в течение всего периода лечения наблюдаются неудачи или
рецидивы у больных, прекративших прием до окончания курса лечения.
Поэтому возможен прерывистый прием препаратов, хотя данный режим
недостаточно гибок при пропуске доз, в то время как ежедневный режим
толерантен к большему проценту ошибок.
При ежедневном приеме медикаментов и хорошем клиническом и
рентгенологическом эффекте выполнение режима лечения считается
адекватным, если больной принял 80% или более предписанных доз
противотуберкулезных препаратов. При прерывистом режиме приема 2 раза
в неделю 100% доз должно быть принято и задокументировано ТПН, курс
лечения должен быть продлен в случае пропуска большого количества доз.
Если в курсе лечения есть пропуски, необходимо принять клинически
обоснованное решение, но отправной точкой всегда должны быть
отрицательные результаты посевов, т.е. нужно достичь этого момента и
рассчитать разумную длительность фазы продолжения.
Лечение ВИЧ-инфицированных пациентов должно быть
индивидуализировано. Если микроорганизмы пансенситивны, т.е.
чувствительны ко всем препаратам, и иммуносупрессия минимальна, тогда
эффект от лечения должен быть отличным при условии надлежащего приема
препаратов. Тем не менее, при глубокой иммуносупрессии, кахексии и
обширном заболевании выздоровление может быть медленным и может
потребоваться 6 месяцев лечения после получения отрицательных посевов.
Ввиду этого, необходимо рассмотреть вопрос о более длительной, чем 3-4
месяца, фазе продолжения лечения, чтобы избежать опасных рецидивов.
Авторы считают, что у больных СПИДом часто бывает очень трудно отличить
рецидив от реинфекции, и требуется полноценное клиническое решение,
чтобы решить, использовать ли первичный лекарственный режим, считая,
что это просто рецидив, возникший за счет пассивных в прошлом
микроорганизмов, или добавить два или три новых препарата в связи с
подозрением на реинфекцию резистентными к лекарственным препаратам
микроорганизмами.
Если несоблюдение режима приема препаратов вырастает в проблему,
а в 80% эта проблема явно или неявно присутствует, тогда должна быть
немедленно организована ТПН, или, другими словами, когда специально
назначенный человек непосредственно наблюдает и контролирует
физическое поглощение всех медикаментов. Клиницист вполне может гибко
подходить к составлению расписания по применению ТПН: использовать
преимущества прерывистого режима приема препаратов в тех случаях, когда
377
его применение обосновано, а также назначать место и время наблюдения
так, чтобы это оптимизировало исполнительность пациента (72).
Обеспечение транспортом, службой ухода за детьми, переводчиками, а
также атмосфера уважения и заботы сильно способствует качественному
лечебному процессу. Консультации по наркотикам, алкоголю и ВИЧ
обязательны и имеют прямое воздействие на лечебный процесс.
Использование поощрений и побудительных стимулов, таких как легкая
закуска, еда, деньги на транспорт помогают привлечь больного. Авторы
считают, что даже принуждение и заключение под стражу для защиты
здоровья больного и общества как последнее средство может быть
необходимо. Вина за неудачу не должна возлагаться на больного. Наряду с
лечением такими препаратами как изониазид, рифампицин, этамбутол в
настоящее время рекомендуют использовать фторхинолоны,
ципрофлоксацин, офлоксацин (таривид), левофлоксацин, которые имеют
менее выраженные побочные действия.
Описаны вспышки туберкулеза с устойчивостью ко многим
лекарственным препаратам в лечебных учреждениях (31). Удалось установить
цепочки, по которым распространялась инфекция. Передача возбудителей
начала происходить в 6 больницах между больными СПИДом. От больных
СПИДом инфекция распространилась на работников здравоохранения и от
них к другим больным, а от тех, в свою очередь, к членам их семей. В каждой
из этих больниц отмечались нарушения инфекционного контроля при
осуществлении процедур. Дополнительной причиной возникшей ситуации
явилось частое отсутствие на рентгенограммах характерных для туберкулеза
изменений у ВИЧ-инфицированных и отсутствие бактериовыделения, что,
в свою очередь, задерживало выявление заболевания и принятие
соответствующих мер по ограничению распространения туберкулеза в
стационаре. Дальнейшее изучение инфицированности медицинских
работников в очагах туберкулеза проведено на примере 2-х больниц с
помощью туберкулиновых кожных проб. Исследование показало, что
инфицирование микобактериями туберкулеза произошло в 33% - 50%
случаев. По крайней мере, у 8 работников развился туберкулез и четверо из
них умерли (умершие медики были инфицированы ВИЧ). Процент умерших
от туберкулеза среди больных СПИДом из этих очагов равнялся 72 - 89.
Средний интервал между установлением диагноза и смертью больного
составлял от 4 до 18 недель (31).
В России для лечения туберкулеза у ВИЧ-инфицированных используют
комбинацию из четырех препаратов: стрептомицин, рифампицин, изониазид
и этамбутол Cgg, при основном курсе лечения в течение 12 месяцев (1,4).
При этом важным является вопрос возникновения лекарственной
устойчивости у возбудителя туберкулеза на фоне ВИЧ-инфекции, особенно
378
к изониазиду и рифампицину (3,28, 31,39,43, 55, 56). Ряд исследователей
первичную устойчивость микобактерий туберкулеза к противотуберкулезным
лекарственным средствам отмечали очень редко, а некоторые ее в течение
последних 8 лет вообще не наблюдали. В то же время имеются сведения о
том, что у 33% больных имеет место устойчивость хотя бы к одному из
противотуберкулезных препаратов.
Для обеспечения раннего распознавания устойчивости возбудителя
туберкулеза ко многим препаратам рекомендуют пользоваться контрольным
рентгенологическим обследованием больных.
Широкое распространение туберкулеза среди ВИЧ-инфицированных
требует реализации комплекса мер, касающихся профилактики туберкулеза.
Одно из ведущих мест в системе предупреждения туберкулеза у ВИЧ-
инфицированных отводится химиопрофилактике, однако, рекомендации по
этому вопросу достаточно разноречивы.
Рекомендуют проводить химиопрофилактику всем больным СПИДом
изониазидом по 300 мг вдень втечение 12 месяцев (57). Существует мнение,
что химиопрофилактика должна осуществляться лишь в отношении лиц с
повышенным риском заболевания туберкулезом.
Учитывая опыт проведения химиопрофилактики туберкулеза
изониазидом у ВИЧ-инфицированных многими специалистами, Всемирная
Организация Здравоохранения рекомендует больным ВИЧ-инфекцией
проводить туберкулиновые пробы с 5 ТЕ или 2 ТЕ и при реакции в 5 мм и
более назначать пациентам профилактический прием изониазида по 5 мг/кг,
но не более 300 мг в сутки, на протяжении 6-12 месяцев.
При этом обращается внимание на то, что величина реакции на пробу
Манту 5 мм в качестве порогового значения кожного теста вполне подходит
для инфицированного ВИЧ взрослого населения, независимо от их
вакцинального статуса (12).
По данным опубликованным в рамках Глобальной программы ВОЗ
по СПИДу в группах тубинфицированных больных СПИДом, не получавших
курс химиопрофилактики туберкулеза, частота развития заболевания
достигала 100% втечение года наблюдения.
В то же время, ряд специалистов считают, что успех и экономическая
эффективность химиопрофилактики оказываются в повседневной практике
значительно меньше прогнозируемого показателя. Это связывают с отказом
больных от наблюдения и приема лекарственных препаратов, недостаточным
назначением химиотерапии врачами при наличии показаний, незавершением
полного курса химиопрофилактики более чем в 50% случаев.
В России проблема туберкулеза у ВИЧ-инфицированых является
чрезвычайно актуальной. На фоне крайне неблагополучной эпидситуации
379
по ВИЧ-инфекции, связанной с вовлечением в эпидемический процесс
парентеральных наркоманов, растет угроза распространения туберкулеза.
Социально отягощенной группой, наиболее подверженной
заболеванию туберкулезом, являются лица, прибывающие из ИТУ, больные
наркоманией, безработные, мигранты. То есть те же самые группы, которые
имеют повышенный риск заболевания ВИЧ-инфекцией.
Учитывая все вышеизложенное, становится ясно, что в ближайшие
годы в стране следует ожидать резкий рост заболеваемости туберкулезом
среди больных ВИЧ-инфекцией.
Первый случай сочетанного заболевания туберкулезом и ВИЧ-
инфекцией у россиян был выявлен в 1990 году. С этого момента в нашей
стране число случаев сочетанного заболевания туберкулезом и ВИЧ-
инфекцией начало возрастать от 1 случая в 1990 году до 35 в 1996 году. За
весь период был зарегистрировано! случай (75 мужчин и 16 женщин). Среди
больных туберкулезом 37 страдали наркоманией и столько же имели
судимость и находились в ИТУ.
Контакты по туберкулезу в 3 случаях были семейными, в 7 - с больными
туберкулезом друзьями, в 5 - в стационаре. Следует отметить, что 17
пациентов болели туберкулезом до инфицирования ВИЧ.
Диагноз туберкулеза легких установлен 82 пациентам на основании
клинико-рентгенологических данных, из них бактериологическое
подтверждение получено лишь у 26 (микобактерии туберкулеза выделены
из мокроты в 25 случаях, из мочи - в 1 случае), морфологически - у 3,
методом туберкулинодиагностики - у 10 человек. В 6 случаях диагноз был
установлен только при патологоанатомическом исследовании.
У 18 больных туберкулезом легких имела место генерализация
процесса с распространением на другие органы, при этом было от 1 до 10
различных локализаций поражения.
Изолированный внелегочный туберкулез наблюдался только в 2
случаях: в первом - туберкулез мочеполовой системы, установленный
бактериологически, и во втором - туберкулез периферического
лимфатического узла, выявленный при гистологическом исследовании
биоптата узла.
Туберкулез развился на фоне ВИЧ-инфекции у 64 пациентов (70,4%),
ВИЧ-инфекция на фоне туберкулеза - у 17 (18,7%) и у 10 больных было не
ясно, какое из заболеваний началось первым.
Проведенный нами анализ показал, что у больных на ранних стадиях
ВИЧ-инфекции и в течение первых двух лет наблюдения, туберкулез имеет
те же формы и клинические проявления, что и у больных, не инфицированных
ВИЧ. Исследования рентгенограмм органов грудной клетки у этих больных
не выявили каких-либо особенностей по сравнению с больными, не
инфицированными ВИЧ.
380
У больных на поздних стадиях ВИЧ-инфекции и в течение 4 и более
лет наблюдения, структура форм туберкулеза значительно изменяется, при
этом удельный вес диссеминированного туберкулеза и туберкулеза
внутригрудных лимфатических узлов составляет 84,4%. При этом у 36,4%
больных имеет место генерализация легочного туберкулезного процесса.
Поражается около 6 органов: это селезенка, печень, почки (по 13,6%),
лимфатические узлы (11,6%). Изолированный внелегочный туберкулез, в
отличие от данных зарубежных авторов, выявлялся редко и составил в
структуре туберкулеза только 2,2%.
Среди клинических проявлений туберкулеза на поздних стадиях ВИЧ-
инфекции преобладали явления выраженной интоксикации (97,7%), кашель
(93,2%), одышка (52,3%).
Распространенность туберкулезного процесса была значительной. Так,
поражение обоих легких имело место в 40% случаев.
Кроме того, у 27,2% этих больных встречались распространенные
бронхоадениты, которые никогда не наблюдались на ранних стадиях ВИЧ-
инфекции.
Рентгенограммы больных ВИЧ-инфекцией на поздних стадиях чаще
соответствовали распространенному туберкулезу внутригрудных
лимфатических узлов или диссеминированному туберкулезу.
Диссеминированный туберкулез характеризовался появлением по всем
легочным полям мелких очагов (полиморфных или мономорфных) средней
интенсивности. Иногда яркая клиническая картина опережала на 4-14 недель
появление диссеминации на рентгенограммах и характеризовалась только
умеренным обогащением легочного рисунка по интерстициальному типу. У
12% больных признаки диссеминации на рентгенограмме так и не появились,
хотя на вскрытии был выявлен гематогенно-диссеминированный туберкулез
легких с рядом внелегочных локализаций. В 5% случаев диссеминированный
туберкулез сочетался с туберкулезом внутригрудных лимфатических узлов,
у 2% больных через 1,5 месяца удалось наблюдать переход туберкулеза
внутригрудных лимфатических узлов (паратрахеальный узел) в
диссеминированный туберкулез легких. В 2% случаев на фоне диссеминации
дифференцировались междолевые границы уплотненной плевры.
Туберкулез внутригрудных лимфатических узлов проявлялся на
рентгенограмме расширением корней легких, отсутствием их структурности.
Поражались с одинаковой частотой как трахеобронхиальные, так и
бронхопульмональные узлы.
Инфильтративный туберкулез проявлялся тенеобразованиями
размерами 2,5-3,5 см в диаметре с довольно нечеткими контурами и
полиморфной или мономорфной структурой. При этом отмечались отсевы
в верхнюю долю другого легкого или в нижнюю долю того же легкого (3),
распад выявлен в двух случаях.
381
Наши наблюдения позволяют предположить, что отеевы в нижние
доли происходили при распространении инфекции лимфогенным путем, а
в верхние - гематогенным. Каверны в легких были малых и средних
размеров с преобладанием экссудативной реакции и также с усилением
легочного рисунка вокруг.
Рисунок 5
Частота выявления различных форм туберкулеза у больных
ВИЧ-инфекцией в зависимости от стадий последней
Ранние стадии
70.0"
_15,0%
Поздние стадии
----------(
I
I
61,4% i
инфильтративные +• очаговые формы
Внутригрудных л/узлов диссеминированный
Сложность диагностики туберкулеза была обусловлена и тем, что у
26 больных наблюдались СПИД-ассоциировапные инфекции: у 21
пациента имел место кандидоз слизистых, у 10 - кандидоз висцеральный. \
8 - герпес рецидивирующий, у 8 - цитомегаловирусная инфекция, у 7 -
энцефалопатии, обусловленные ВИЧ, у 3 - микозы, у 3 - токсоплазмоз, у 5
- саркома Капоши, у 2 - пневмоцистоз, у 2 - криптококкоз и у 1 больного -
аспергиллез.
Бактериологические исследования позволили подтвердить диагноз у
половины больных, при этом микобактерии были выделены из мокроты 25
пациентов.
Среди больных на поздних стадиях ВИЧ-инфекции туберкулез
составил 18,2%, в то время как на ранних -45%, что, по-видимому,
382
находится в прямой зависимости от уменьшения числа случаев туберкулеза
в фазе распада. На ранних стадиях ВИЧ-инфекции количество таких случаев
составляет 50%, а на поздних уже 20%.
При соблюдении режима лечения течение туберкулеза у больных на
ранних стадиях ВИЧ-инфекции имеет благоприятный прогноз.
Неблагоприятное течение туберкулеза у больных этой группы главным
образом обусловлено вредными привычками и асоциальным образом жизни
(60% страдают наркоманией и были инфицированы ВИЧ при внутривенном
введении наркотиков, 15% - алкоголизмом, 70% не работают и ведут
асоциальный образ жизни).
Течение туберкулеза у больных на поздних стадиях ВИЧ-инфекции
имеет благоприятный исход только при своевременном распознавании и
адекватном лечении.
Изучение результатов лечения больных на поздних стадиях ВИЧ-
инфекции показало, что излечение от туберкулеза имело место у 8 пациентов,
из них в 2 случаях имел место диссеминированный зуберкулез легких, в 2 -
внутригрудных лимфатических узлов и по одному - очаговый,
инфильтративный, первичный туберкулезный комплекс (у ребенка) и
мочеполовой. Кроме того, у 8 больных туберкулезом, получавших лечение в
течение 5-11 месяцев и умерших от совокупности СПИД-ассоциированных
заболеваний, на вскрытии признаков активного туберкулеза не установлено.
Восемь больных продолжают получать специфическую терапию, 4 из
них сроком до 5 месяцев и 4 - от 6 до 11 месяцев. Для лечения этих 8 больных
использовались основные противотуберкулезные препараты: рифампицин,
изониазад, этамбутол, пиразинамид, стрептомицин, канамицин, фтивазид,
метазид. Основной курс лечения начали с четырех препаратов, через 3-6
месяцев переходили на два препарата. Длительность основного курсалечения
составила: у одного больного - 8 месяцев, у одного 9 месяцев, у 1 10
месяцев, у 4 - 12 месяцев.
Эффективность лечения больных 4-6 группы наблюдения оценена с
учетом критериев В.С.Гавриленко. Излечено 23,5% больных, значительное
Улучшение отмечено у 11,8%, улучшение - у 20,5%, без перемен (включая
летальный исход) - у 44,2% пациентов.
Анализ безуспешного лечения туберкулеза у 15 больных показал, что у
9 (60%) из них неэффективность лечения была связана с большой
распространенностью туберкулезного процесса из-за поздней диагностики
и сочетанием его с рядом тяжелых СПИД-ассоциированных заболеваний,
Утяжеляющих течение туберкулеза, у 2 (13,3%) - с неудовлетворительным
лечением (были назначены препараты одной группы, низкие дозировки,
отсутствовала патогенетическая терапия), у 4 (26,7%) - с отказом от лечения
383
в связи с утяжелением течения кандидоза, плохой переносимостью
противотуберкулезных специфических препаратов и другими причинами.
Осложнения туберкулеза у больных проявились спонтанным
пневмотораксом (у 2 человек), сердечно-легочной недостаточностью (у 10),
острой почечной недостаточностью (у 1) и бронхопульмональным свищем
(у 1 пациента).
Анализ результатов патологоанатомических исследований умерших на
поздних стадиях ВИЧ-инфекции показал, что в 8 наблюдениях признаки
активного туберкулезного процесса на фоне специфической терапии уже
отсутствовали, а смерть наступила из-за других СПИД-ассоциированных
заболеваний, у 9 умерших туберкулез был подтвержден на аутопсии, у 6 -
выявлен только по результатам гистологического исследования.
Больной Р., 49 лет. История болезни 16619/94, больница им.
С.П.Боткина, СПб.
Поступил в стационар 11 августа 1994 года в крайне тяжелом
состоянии, периодами неадекватен.
Из анамнеза удалось выяснить, что ухудшение состояния начал
отмечать около 4 месяцев назад, когда появилась нарастающая слабость.
Сухой кашель, субфебрилитет, постепенно переходящий в фебрилитет и
гиперфебрилитет, быстрое и значительное снижение массы тела, повторные
кишечные дисфункции, за неделю до госпитализации появилась папулезная
сыпь без зуда. За медицинской помощью больной, зная свой ВИЧ статус и
желая это скрыть, до последнего времени не обращался. Предположительно
инфицирован ВИЧ около 6-7 лет назад.
Всего за 4 месяца больной потерял более 10 кг веса, температура
поднялась до 40 градусов, кашель приобрел тяжелый, мучительный характер.
При осмотре кожные покровы бледные, на коже туловища и
конечностей яркая плотная папулезная сыпь. Кандидоз слизистых. Пульс
100 уд/мин, ритмичный, ЧД - 28.
Определяется генерализованная лимфаденопатия, в отдельных группах
периферические лимфатические узлы увеличены до 1,5-2,0 см.
При аускультации в легких отмечено только жесткое дыхание. Тоны
сердца приглушены, тахикардия. Живот болезненный во всех отделах. Печень
и селезенка выступают из-под края реберной дуги. Стул жидкий.
На рентгенограмме отмечено только усиление легочного рисунка, на
сцинтиграмме костей и почек патологии не выявлено. Больной неоднократно
осмотрен фтизиатром.
В общем анализе крови: умеренный нейтрофильный лейкоцитоз, СОЭ
до 61 -65 мм/час. В моче: снижение удельного веса, единичные лейкоциты и
эритроциты.
384
УЗИ внутренних органов - патологии не выявлено. После 3 дней
обследования и реанимационных мероприятий в специализированном
отделении для больных ВИЧ-инфекцией пациент умер.
При патологоанатомическом исследовании установлен туберкулезный
лимфаденит нижних трахеобронхиальных узлов с гнойным расплавлением,
пери портальных, мезентеральных, подмышечных и паховых узлов, массовая
гематогенная диссеминация туберкулезного процесса в легкие, селезенку,
печень, почки, вилочковую железу, надпочечники. Кроме того, у больного
выявлена нижнедолевая пневмоцистная, криптококковая и кандидозная
пневмонии.
В приведенном наблюдении отмечается комплексная патология легких:
пневмоцистоз, криптококкоз, туберкулез. При этом причиной смерти явился
туберкулезный сепсис с гематогенным поражением большинства групп
лимфоузлов, печени, почек, вилочковой железы, надпочечников.
Следовательно, при ВИЧ-инфекции в стадии СПИДа туберкулез на
фоне других оппортунистических инфекций приобретает неуправляемое
течение.
Выводы для лечения: ранняя диагностика туберкулеза, комплексное
обследование больных на другие заболевания с их лечением.
Больной М., 28 лет. История болезни 1018/93. Пациент поступил в
Республиканскую инфекционную больницу в декабре 1992 года, с жалобами
на высокую температуру тела (38-39°С), сухой мучительный кашель,
проливные поты, резкую слабость, увеличение лимфатических узлов в
подмышечной области, значительное уменьшение массы тела.
Из анамнеза известно, что больной инфицирован ВИЧ около 9 лет
назад. Инфицирование микобактериями туберкулеза, по-видимому,
произошло от подруги, умершей от туберкулеза 2 месяца назад.
Общее состояние больного при поступлении средней тяжести. Кожные
покровы бледные, кандидоз слизистых. Пульс 94 уд/мин, ЧД - 22 /мин.
Увеличены все основные группы лимфатических узлов до 1 см в диаметре, в
подмышечной области слева они образуют пакет размером 2x3 см,
подвижный, безболезненный.
В легких дыхание жесткое, хрипы не определяются. Живот мягкий.
По реберной дуге определяется край печени.
На рентгенограмме корни легких справа расширены за счет
внутригрудных лимфоузлов, главным образом бронхопульмональной группы,
со спонтанной диссеминацией в нижние отделы правого легкого.
Реакция на пробу Манту с 2 ТЕ - отрицательная. Посевы мокроты,
мочи, крови на микобактерии туберкулеза - отрицательные.
Общий анализ крови: НЬ - 106 г/л; эр. - 3,6х1012/л; тромб. - 139х 109/
л; лейкоциты -2,2x109/л; п/я - 5%, с/я - 72%; лимф - 30%; СОЭ —42 мм/час.
25- Заказ № к-4451. 385
Иммунограмма: CD4- 162/мм3, CD8-257/mm3, CD4/8-0,71; IgA
- 4.6, IgM - 3,4 г/л, IgG - 16,6 г/л.
16.12.92 удален “пакет” увеличенных лимфатических узлов в
подмышечной области. При гистологическом исследовании последнего
установлен туберкулезный лимфаденит, активная фаза с наличием
микобактерий туберкулеза.
Больному установлен диагноз: ВИЧ-инфекция ЗВ стадия, стадия
СПИДа или СЗ по CDC, туберкулез периферических и внутригрудных
лимфатических узлов с диссемипацией в нижнюю долю правого легкого,
гепатоспленомегалия, кандидоз пищевода, и назначена специфическая
противотуберкулезная терапия 4 препаратами (стрептомицин, тубазид,
рифампицин, этамбутол). Основной курс лечения составил 12 месяцев. Через
1,5 года больной умер от ВИЧ-энцефалита.
При патологоанатомическом исследовании данных за туберкулез уже
не было.
В данном наблюдении имелись трудности в диагностике туберкулеза,
а своевременное выявление могло бы обеспечить его адекватное лечение.
Больной Ф., 37 лет. История болезни 135/97, поступил из ИТУ 02.97 в
Республиканскую инфекционную больницу с жалобами на высокую
температуру тела (до 40°С), обильные поты, мучительный сухой кашель,
одышку, боль в нижних отделах грудной клетки.
Из анамнеза известно, что больной инфицирован ВИЧ
предположительно 4 года назад при совместном введении наркотиков с ВИЧ-
инфицированным. Ухудшение состояния отметил около 6 месяцев назад. При
обследовании в тюремной больнице однократно высеяны из мокроты
микобактерии туберкулеза.
При поступлении общее состояние больного тяжелое, кожные покровы
бледные, температура тела 40°С, ЧД - 32, пульс - 100 уд/мин.
Определяются увеличенные шейные, подмышечные, паховые
лимфатические узлы до 1 см в диаметре, плотные, подвижные,
безболезненные. В легких дыхание жесткое с единичными хрипами в нижних
отделах.
На рентгенограмме справа корень легкого расширен, неструктурен, с
выраженной мономорфной мелкоочаговой диссеминацией.
В общем анализе крови НЬ - 69 г/л; Эр-2,1х1012/л; Тромб. - 81 х 109/
л; с/я - 57%, п/я - 37%, лимф. - 37%, мои. - 5%, СОЭ - 75 мм/час.
Иммунограмма: CD4 - 239/мм3; CD8 - 383/мм3; CD4/8 - 0,65; IgA -
3,26 г/л; IgM - 1,46 г/л; IgG - 14,39 г/л.
Больному установлен диагноз: ВИЧ-инфекция ЗВ стадия, С2 по CDC,
диссеминированный туберкулез легких в фазе обсеменения, БК (-). Кандидоз
внутренних органов. Рецидивирующая герпетическая инфекция. Назначена
386
в полном объеме противотуберкулезная и противоретровирусная терапия, на
фоне которой резко обострился кандидоз пищевода, в связи с чем больной от
лечения отказался и получал нерегулярно изониазид и витаминотерапию. Через
месяц больной умер.
При патологоанатомическом исследовании установлено: туберкулез
паратрахеальных, нижних трахеобронхиальных, подмышечных,
парааортальных, мезентеральных, печеночных, перипанкреатических (с
гнойным распадом) лимфатических узлов. Гематогенная диссеминация:
множественные ацинозные и ацинозно-нодозные очаги казеозного некроза
во всех долях легких, мелкие казеозные очаги казеозного некроза в обеих
почках, селезенке. Базальный туберкулезный лептоменингит. Левосторонняя
нижнедолевая пневмония. Распространенный кандидоз пищевода.
Данный пример демонстрирует трудности лечения туберкулеза в связи
с наличием других заболеваний, таких как кандидоз пищевода,
рецидивирующая герпетическая инфекция на фоне тяжелого
иммунодефицита. Включение комбинированной антиретровирусной терапии
могло бы иметь важное значение для исхода заболевания.
По нашим данным в 86,7% случаев туберкулез явился ведущей причиной
смерти, при этом у всех умерших имела место гематогенная диссеминация
туберкулеза с легочными и внелегочными поражениями (рис. 6).
Рисунок 6
Причины смерти больных туберкулезом с ВИЧ-
инфекцией
86,7%
□ прогрессирование ТБ
сочетание ТБ и других вторичных заболеваний
В 13,3% случаев причиной смерти послужило сочетанное развитие
туберкулеза и других СПИД-ассоциированных заболеваний (токсоплазмоза,
ЦМВ-инфекции, саркомы Капоши).
2s« 387
Морфологическая картина туберкулезного процесса на поздних стадиях ВИЧ-
инфекции проявлялась в 26,6% случаев характерными туберкулезными
гранулемами, а в 73,4% они отсутствовали. При этом в 72,7% имели место
очаги ареактивного казеозного некроза, с наличием микобактерий туберкулеза
в 40% случаев, а в 27,3% - только гнойное расплавление тканей с большим
числом микобактерий.
Летальность от туберкулеза больных СПИДом за 3 последних года
составила 20,8%, 16,7% и 20,0% соответственно, а среди всех умерших от
СПИДа удельный вес туберкулеза как причины смерти составил 35,7%, 50,0%
и 33,3% соответственно.
Кроме того, учитывая, что шести больным СПИДом диагноз туберкулеза
был выставлен только на вскрытии, а 25% умерших вскрытие вообще не
проводилось, можно заключить, что далеко не все больные туберкулезом
выявлены. Особенно это касается внелегочного туберкулеза, так как в 93,4%
случаев туберкулез внелегочной локализации выявляют только на вскрытии.
В связи с этим особое значение приобретает вопрос диагностики туберкулеза.
В целях установления чувствительности к туберкулину больных ВИЧ-
инфекцией нами проведен анализ результатов проб Манту с 2 ТЕ у 1074
человек. Изучение чувствительности к туберкулину проводилось в
следующих группах: больные ВИЧ-инфекцией - 81 человек, туберкулезом -
121, сочетанное заболевание туберкулезом и ВИЧ-инфекцией - 27,
страдающих наркоманией - 52, здоровые граждане - 812.
У 75,1% больных туберкулезом на ранних стадиях ВИЧ-инфекции
туберкулиновая проба оказалась положительной и в одном - гиперергической.
В тоже время на поздних стадиях ВИЧ-инфекции реакция на пробу Манту с
2 ТЕ была отмечена только в 13,4% случаев.
Из-за значительного снижения чувствительности к туберкулину на поздних
стадиях ВИЧ-инфекции мы считаем возможным использовать в целях
диагностики проведение внутрикожной туберкулиновой пробы с меньшим
разведением (5-10 ТЕ).
В качестве дополнительного скринингового метода обследования на
туберкулез групп повышенного риска заболевания ВИЧ-инфекцией и ВИЧ-
инфицированных целесообразно использовать метод иммуноферментного
анализа, позволяющий выявить антитела к микобактериям туберкулеза.
В целях изучения целесообразности проведения химиопрофилактики
туберкулеза у больных ВИЧ-инфекцией мы наблюдали 152 пациентов.
Однократное проведение химиопрофилактики, рекомендуемое рядом
зарубежных авторов, по нашему мнению, не может иметь длительный эффект,
так как нарастающий иммунный дефицит приводит к развитию туберкулеза
у инфицированных микобактериями туберкулеза независимо оттого, получил
388
больной однократно ранее курс изониазида или нет, о чем свидетельствуют и
частые рецидивы заболевания туберкулезом после завершения лечения.
В целях проведения химиопрофилактики больным ВИЧ-инфекцией мы
усовершенствовали общепринятый в России метод с учетом нарастающего
иммунодефицита у ВИЧ-инфицированных и установленного нами
постепенного снижения чувствительности к туберкулину вплоть до полного
отсутствия на поздних стадиях ВИЧ-инфекции. Ввиду этого рекомендуется
ставить пробу Манту с 5-10 ТЕ и более.
На стадиях 1-2В ВИЧ-инфекции химиопрофилактика назначалась по
общепринятым во фтизиатрии показаниям для всех граждан изониазидом в
дозе по 10 мг/кг в течение 3 месяцев.
Больным, начиная со стадии ВИЧ-инфекции ЗА (18 наблюдений)
химиопрофилактика назначалась индивидуально, с учетом следующих
положений. Лицам, имеющим положительную реакцию на пробу Мангу в
момент обследования или в анамнезе, заболевание туберкулезом в анамнезе,
наличие признаков перенесенного туберкулеза (рентгенологических или др.),
контакт с больным туберкулезом в анамнезе, химиопрофилактика
проводилась изониазидом по 10 мг/кг 2 раза в год по 3 месяца. При наличии
гиперергической реакции на пробу Манту, виража туберкулиновой пробы,
контакта с больными туберкулезом химиопрофилактика проводилась
непрерывно.
Больным ВИЧ-инфекцией в стадиях ЗБ и ЗВ химиопрофилактику
изониазидом по 10 мг/кг по 3 месяца 2 раза в год проводили при наличии в
анамнезе положительной реакции на пробу Манту или контакта с больным
туберкулезом.
Во всех остальных случаях назначали изониазид по 10 мг/кг в сочетании
с пиразинамидом или этамбутолом 3 месяца 2 раза ежегодно, а при
постоянном контакте - непрерывно.
Всего химиопрофилактику удалось провести 13 пациентам при сроке
наблюдения от 1 до 4 лет. При этом никто из пациентов, получивших курсы
химиопрофилактики, туберкулезом не заболел. Из отказавшихся от
химиопрофилактики 21,1% заболели туберкулезом.
Изучение ситуации по разделу третичной профилактики туберкулеза у ВИЧ-
инфицированных, с целью определения путей ее активизации, показало, что
13,3% больных имели неблагоприятный исход заболевания туберкулезом на
фоне ВИЧ-инфекции из-за назначения им несоответствующей
противотуберкулезной терапии. Наши наблюдения позволили разработать
систему мер профилактики туберкулеза у ВИЧ-инфицированных, которая
включает в себя следующие мероприятия:
389
1. Создание системы информирования широких слоев населения и
групп повышенного риска заболевания туберкулезом и мер профилактики
туберкулеза путем:
- ненавязчивого введения вопросов и ответов о туберкулезе в
различные игровые программы средств массовой информации;
- создания и трансляции теле- и радио клипов с информацией о
туберкулезе и адресах учреждений, проводящих скрининговое
обследование на туберкулез;
- группового и индивидуального информирования лиц с
повышенным риском заболевания в наркологических, кожно-
венерологических диспансерах, центрах по профилактике и борьбе со
СПИДом, а также активистами организаций, таких как “Матери против
наркотиков” и др., в местах частого пребывания этих контингентов (в
пунктах обмена шприцев для наркоманов и т.д.).
2. Проведение ежегодного систематического скринингового
обследования на туберкулез больных из групп риска на заболевание ВИЧ-
инфекцией и туберкулезом путем флюорографии, иммуноферментным
методом, по показаниям - бактериологическим.
3. Организация диспансерного наблюдения за больными ВИЧ-
инфекцией в аспекте туберкулеза должна осуществляться с момента
выявления инфицирования ВИЧ у пациента и включать ежегодное
проведение туберкулинодиагностики с динамическим слежением за ее
результатами, обследование органов грудной клетки с созданием
рентгенографического архива, бактериологическое обследование лиц,
имеющих хронические воспалительные заболевания (хронический бронхит,
пиелонефрит, эндометрит и т.д.).
4. Проведение ВИЧ-инфицированным химиопрофилактики
туберкулеза с учетом стадий ВИЧ-инфекции и имеющего у них место
снижения чувствительности к туберкулину. На ранних стадиях ВИЧ-
инфекции она проводится по общепринятым во фтизиатрии принципам.
Начиная со стадии ША ВИЧ-инфекции больным с положительной пробой
Манту, в том числе в анамнезе, наличием признаков перенесенного
туберкулеза или болевшим им, а также имевшим контакт с больными
туберкулезом, а также больным с высоким риском заболевания
туберкулезом, она проводится двумя препаратами.
5. Организация качественного лечения больных туберкулезом и
ВИЧ-инфекцией с проведением полноценных основных и
противорецидивных курсов лечения на базе стационаров для лечения
больных ВИЧ-инфекцией путем подготовки врачей инфекционистов,
оказывающих лечебную помощь ВИЧ-инфицированным больным
туберкулезом по фтизиатрии, а также включение в штат центров по
390
профилактике и борьбе со СПИДом фтизиатров для консультирования по
вопросам диагностики и лечения туберкулеза у ВИЧ-инфицированных и
диспансерного наблюдения за этими контингентами.
6. Осуществление индивидуального консультирования больных и их
близких по вопросу целесообразности проведения в полном объеме
основных или противорецидивных курсов лечения туберкулеза.
7. Организацию медико-психологической поддержки больным
психотерапевтом центра по профилактике и борьбе со СПИДом.
8. Обеспечение госпитализации больных туберкулезом в
боксированные палаты в соответствии с противоэпидемическими
требованиями.
9. Обучение больных и их родственников основам
противоэпидемических требований в домашних условиях.
10. Организация систематического обследования медицинского
персонала, работающего с больными ВИЧ-инфекцией, на туберкулез.
11 .Организация системы социальной помощи ВИЧ-
инфицированным больным туберкулезом, включающей в себя организацию
реабилитационных учреждений с трудовыми мастерскими для этой
категории больных и подготовку кадров социальных работников при
центрах по профилактике и борьбе со СПИДом.
Заключение
Анализ структуры клинических форм туберкулеза у больных на ранних
стадиях ВИЧ-инфекции при течении ее 1 -2 года показал, что она аналогична
таковой у неинфицированных ВИЧ. Так, инфильтративный и очаговый
туберкулез на ранних стадиях ВИЧ-инфекции наблюдался в 70% случаев.
На поздних стадиях ВИЧ-инфекции структура форм туберкулеза существенно
изменилась. Удельный вес диссеминированного туберкулеза и туберкулеза
внутригрудных лимфатических узлов составил 61,4%. У больных на поздних
стадиях ВИЧ-инфекции довольно часто наблюдалась генерализация
туберкулезного процесса. При этом, наряду с поражением легких,
наблюдалось поражение селезенки, печени, почек, лимфатических узлов и
мозговых оболочек.
Клинические проявления туберкулеза у всех больных
характеризовались выраженной интоксикацией, кашлем, одышкой,
отмечалось поражение обеих легких, при этом туберкулезный процесс
затрагивал все легкое или верхние доли. Распространенные бронхоадениты
выявлялись только напоздней стадии ВИЧ-инфекции в 1/3 случаев, на ранней
стадии они вовсе не отмечались.
Весьма затруднительной была рентгенологическая диагностика
туберкулеза у больных с поздней стадией ВИЧ-инфекции. У них отмечалось
умеренное обогащение легочного рисунка по интерстициальному типу, наличие
391
мелких полиморфных или мономорфных очагов по всем легочным полям. На
вскрытии у этих больных был выявлен гематогенно-диссеминированный
туберкулез легких с внелегочными локализациями, чаще всего с поражением
внутригрудных лимфатических узлов. Туберкулез внутригрудных лимфоузлов
проявлялся на рентгенограмме расширением корней легких, отсутствием их
структурности, при этом поражались преимущественно трахеобронхиальные
и бронхопульмональные лимфоузлы.
Сложность диагностики и лечения туберкулеза у пациентов с ВИЧ-
инфекцией была обусловлена наличием других ВИЧ-ассоциированных
заболеваний: кандидоза, в том числе висцерального, рецидивирующего
герпеса, цитомегаловирусной инфекции, токсоплазмоза, саркомы Капоши и
криптококкоза.
Чрезвычайно затрудняло диагностику туберкулеза редкое выявление
микобактерий туберкулеза в мокроте у больных с ВИЧ-инфекцией на поздней
стадии заболевания (20% против 45% на ранних стадиях ВИЧ-инфекции).
По-видимому, это связано с уменьшением числа случаев туберкулеза в фазе
распада.
Течение туберкулеза у больных на ранних стадиях ВИЧ-инфекции
имело благоприятный прогноз при соблюдении режима лечения, однако, у
наркоманов и хронических алкоголиков из-за асоциального поведения
туберкулез прогрессировал, и лечение его было затруднительным. На поздних
стадиях ВИЧ-инфекции благоприятный исход наблюдался только при ранней
диагностике и назначении адекватной терапии, включающей не менее 4-х
препаратов. Следует отметить, что у 5% больных с ВИЧ-инфекцией
выделялись полирезистентные штаммы, что способствовало летальному
исходу заболевания даже при назначении самой активной
противотуберкулезной терапии.
Для лечения пациентов рекомендуется использовать следующие
противотуберкулезные препараты: римфампицин, изониазид, этамбутол,
пиразинамид, стрептомицин, канамицин, фтивазид, а также офлоксацины.
Основной курс лечения начинается с 4-х препаратов, через 3-6 месяцев
возможно применение 2-х препаратов. Длительность курса лечения должна
составлять не менее восьми месяцев.
Неэффективность лечения туберкулеза у больных ВИЧ-инфекцией
была обусловлена:
• Поражением большой поверхности легких, внутригрудных
лимфатических узлов и других органов;
• Наличием других СПИД-индикаторных заболеваний, которые
неадекватно лечились и были поздно распознаны или затрудняли лечение
больных;
• Неправильным назначением препаратов: низкие дозировки,
препараты одной группы;
• Отсутствием противовирусной терапии.
392
Результаты исследований указывают на необходимость комплексного
обследования больных даже при подтвержденном диагнозе туберкулеза для
проведения комплексной терапии с учетом возможных оппортунистических
заболеваний.
Литература
1. Алексеева Л.П., Горбачева Э.С., Груздев Б.М. Туберкулез у ВИЧ-
инфицированных и больных СПИДом И Пробл. туб. - 1996. -№2 - с. 16-17
2. Ассоциированный с ВИЧ туберкулез в развивающихся странах:
клинические особенности, диагностика, лечение. И Бюл. ВОЗ - 1992. Т.
70, - № 4. - с.75-85
3. Биглхор Р., Бонита Р., Кьельстрем Т. Основы эпидемиологии - Женева:
ВОЗ, 1994.-338с.
4. Владимирский, М.А., Полозков М.А. Серологический скрининг на
основе иммуноферментного анализа для активного выявления больных
туберкулезом. И Туб. и эколог. -№2. -с.28-31
5. Вовк А.Д., Антоян С.Н., Поддубный А.Ф. Туберкулез легких у больных
ВИЧ-инфекцией И Русский журнал ВИЧ/СПИД и родственные проблемы
- 1997. Т.1, № 1 - с.139-140
6. Дорожкова И.Р., Медведева И.М. Проблема лекарственной устойчивости
возбудителя туберкулеза на современном этапе И Туб. и эколог. - 1997 -
№2.-с.25-28
7. Кравченко А.В., Юрин О.Г, Алексеева Л.П. и др. // Тер. арх. - 1996. -
№4.-с.69-71
8. Кочетов Б.И. СПИД и заболевания легких // Пробл. туб. - 1991. - №9 -
с.51-54
9. Сон И.М. Показатель заболеваемости населения туберкулезом и его связь
с другими статистическими показателями // ЭВМ во
фтизиопульмонологии: Тез. док. - М., 1995. - с.12
10. Хаитов Р.Н., Игнатьева ГА. СПИД. Москва: Народная академия культуры
и общечеловеческих ценностей, 1992. - 352с.
1 ГХауадамова Г.Т., Аруинова Б.К., Бидайбаев Н.Ш. и соавт. Особенности
течения туберкулеза у ВИЧ-инфицированных больных // Проблемы
туберкулеза. -2001. -№ 5. -С. 34-36.
12. Шилова М.В. Информативность показателей смертности для оценки
эпидемиологической ситуации И ЭВМ во фтизиопульмонологии: Тез.
док. - М., 1995. - с.8
13. Шилова Н.В. Эпидемиологическая обстановка по туберкулезу в
Российской Федерации // Материалы пленума правления научно-
медицинской ассоциации фтизиатров и научно-практической
393
конференции, посвященной 70-летию Марийского Республиканского
ПТД. - Йошкар-Ола.- 1996.-с.23-24
14. AIDS and Other Manifestations of HIV Infection / Ed. G. B. Wormser.-2-nd
Ed.//New York, 1992.-P.927-929.
15. Champ M.E., Hckey M.M., Gazzara M.H. Re-emergence of tuberculosis: Letter/
/ Brit. Mod. J. - 1993. - Vol. 306. N 6882 - P. 932
16. Cote T.R., Nelson M.R., Anderson Sh.P. The present and future of AIDS and
tuberculosis in Illinois //Amre. J., publ. Hith. - 1990. - Vol.80. N8. - P. 950-953
17. Cowie R.I., Sharpe J.W. A high incidence of extra-pulmonary tuberculosis
without HIV infection: association with age and country of birth. // Thorax. -
1995. - Vol. 50. Suppl. 2. - AD 3, S. 54.
18. Dicksont D. Tuberculosis in relat to AIDS П Santa News. - 1989. - Vol. 28, N2.
-P. 4
19. Disseminated tuberculosis in the Acquired Immunodeficiency Syndrome Era
I A. Ross Hill, S. Prernkumar, S. Brustien et al. // Amer. Rev. Resp. Dis. -
1991,- Vol. 114, N5.-P. 1164-1170
20. Duncanson F.P., Hewlett D., Maayan S. Mycobacterium tuberculosis infection
acquired immunodeficiency syndrome. A review of 14 patients //Tubercle. -
1986.-Vol. 67, N4-P.295-302
21. Emergence of drug-resistant M. Tuberculosis in HI V- infected patients / L.M.
Monno,G. Angarano, S. Cabonaraet al.//Lancet.- 1991. - Vol. 337,N8745
- P.852. - Letter.
22. J Epidemiology of extrahulmonfy tuberculosis .A comparative analysis with
pre-AIDS Era. I J.B. Mehta, A. Dutt, 1. Harvill, K.M. Mathews // Chest. -
1991.-Vol.99,N5-P.1134.
23. Epidemiology of extrahulmonfy tuberculosis. A comparative analysis with
pre-AIDS Era. I J.B. Mehta, A. Dutt, 1. Harvill, K.M. Mathews // Chest. -
1991,-Vol.99,N5-P.1134-U38
24. Epidemiology of extrahulmonfy tuberculosis among persons with AIDS in
the United States / L.Slutsker, K.G. Castro, J.W. Ward, S.W. Dooley //Clin.
Infect. Dis.- 1993.-Vol. 16,N4-P.513-518
25. Factors associated with extrapulmonary tuberculosis as an AIDS-difining
disease in Evrope/V. Schwoebel, M.C. Delmas, R.A. Ancelle-Parc, J.B. Brunei
// Tubercle. - 1995. - Vol. 76, N4 - P.281 -285
26. Frequency of M. tuberculosis bacteremia in patients with tuberculosis in an
area endemic for AIDS / R. W. Shafer, R. Coldberg, M. Sierra et al. //Amer.
Rev. resp. Dis.- 1989.-Vol. 140,N6-P.1611-1613
27. Grosset J. H. Treatment of tuberculosis in HIV infection//Tubercle.- 1992. -
Vol. 73, N6-P.378-383
28. Grzybowski S. Tuberculosis in the third world // Thorax. - 1991. - Vol. 46,
N10.-P.689-691
394
29. Guidelines on the management of tuberculosis and HIV infection in the United
Kingdom // Brit. med. J. - 1992. - Vol. 304, N6836. - P. 1231 -1233.
30. Hematogenous dissemination ofM. Tuberculosis in patients with AIDS /R.A. Clark,
S.L. Blacklley, D. Greer et al. // Rev. Infect. Dis. - Vol. 13, N 6. - P. 1089-1092
31. HIV testing and surveillance among tuberculosis patients and tuberculosis
prevention in HIV infected persons in Europe. П HIV / Surveillance in Europe.
- 1995. - Quartely report n 46, N 2. - P. 49-54
32. Hospital outbreak of multidrug-resistant M. tuberculosis infection. Factor in
transmission to staff and HIV- infected patients IC. Beck-Sague, S. W. Dooley,
M.D. Hutton et al. 11 J. Amer. Med. Ass. -1992. - Vol. 268, N 10. - P. 1280-1086
33. Huebner R.E., Villario M.E., Snider D. E. Tuberculosis skin testing and the
HIV epidemic. И J. Amer. Med. Ass. - 1992. - Vol. 267, N 3. - P.409-410
34. Impact of human immunodeficiency virus type I on tuberculosis in rural Haiti
/ R. Long, M. Scalcini, J. Manfredaet al.//Amer. Rev. resp. Dis. -1991. - Vol.
143,N 1.-P.69-145.
35. Independent origin of mono-rifampin-resistant M. tuberculosis in patients
with AIDS IM. Lutfey, P. Della-Latta, V. Kapus et al. 11 Amer. Rev. resp. Dis.
- 1996,- Vol. 153, N 2.
36. Influence of HIV status on pathological changes in tuberculosis pleuritis /
J.M. Kitiuya, G. Richter, P. Perendoom et al. //Tubercle. - 1994. - Vol. 75, N
3.-P.195-198.
37. Kenneth G. Castro Tuberculosis as an Oppotunistic Disease in Persons Infected
with Human Immunodeficiency Virus. / Clin. Infec. Dis. - 1995. -21, N L-
P.66-71.
38. Landesman S.H. Commentary: Tuberculosis in New York City’s the
consequencec and lessons of failure // Amer. J. publ. Hith. - 1993. - Vol. 83,
N 5.-P.766-768.
39. Lerner B.H. New York City’s tuberculosis control efforts: the historical
limitations ofthe“Waron consumption”//Amer. J. publ. Hith. - 1993. - Vol.
83,N 5.-P.758-766.
40. Lichterfeld A., Ferlinz R. Tuberculose und HIV-Infection // Pneumologie. -
1991.-Vol. 45, N 1.-P.1-8.
41. Meeting the challenge of multidrug resistant tuberculosis ; Summary of the
conference И Center for Disease Control, 22-23 of January, 1992. - 5p. Multiple
organ failure in generalized disseminated tuberculosis. / M. Sydow, A. Schauer,
T.A. Crozier, H. Burchardi // Resp. Ked. - 1992. - Vol. 86, N 6. - P.517-519.
42. Murray J.F. Gurser Duet: HIV infection and Tuberculosis // respiration. -
1991,-Vol.57,N3.-P.210-220.
43. Mucobacterium tuberculosis bacteremia in patients with and without human
immunodeficiency virus infection. IE. Bouza, M.D. Diaz-Lopez, S. Moreno
et al. // Arch. Intern. Med. - 1993. - Vol. 57, N 3. - P.496-500.
395
44. Mucobacterium tuberculosis infection.//The AIDS knowledge base. - 1994.
-P. 6.5-16.5-6
45. Ormerod L.P. Drug resistant tuberculosis: problemson the horizon//Thorax.
- 1993.-Vol. 48, N 10.-P.957-958.
46. Osteoarticular tuberculosis in childreh: report of two cases in identical twins
I E.S.C. Sarinh, A.P. Pessea, J.F.P. Seares, O.A.F. Caheca//Tubercle. - 1994.
- Vol. 75, N3.-P.239-240.
47. Pancreatic tuberculosis as a manifestation of infection with the human
immunodeficiency virus / W.A. Eyer-Silva, C.A. Moraid de Sa, J.F.C. Pinto,
C.A.M. Gameiro П Clin. Infect. Dis. - 1993. - Vol. 16, N 2. - P.332. Lenner
48. Pithie A.D., Chickes B. Fine-neeble extrathoracic lymphnode aspiration in
HIV-associated sputum-negative tuberculosis П Lancet. - 1992. - Vol. 340,
N 8834-8835.-P.l 504-1505.
49. Quantitative bacillary response to treatment in HIV-associated pulmonary
tuberculosis I R.J. Brindle, P.P. nunn, W. Githui et al. //Amer. Rev. resp. Dis.
- 1993.-Vol. 147, N 4.-P.958-961.
50. Randomised controlled trial of dexamethasone in tuberculous meningitis / S.
Kumarvelu, K. Prasad, A. Khosia et al. //Tubercle. - 1994. - Vol. 75, N 3. -
P.203-207.
51. Recurrence of Hl V-related tuberculosis in an endemic area be due to relse or
reinfection / P. Godfrey-faussett, W. Githui, B. Batchelir, R. Brindle, J. Paul et
al. //Tubercle Lung Dis. - 1994.- Vol. 75, N 3. -P. 199-202.
52. Reichman LB. HIV-infection - a new face of tuberculosis / Ibid. - 1988. -
Vol. 63, N3.-P.l9-24.
53. Reichman LB. How to ensure the continued resurgence of tuberculosis //
Lancet. - 1996. - Vol. 347, N 8995. - P. 175-177.
54. 1993 Revised Classification System for HIV infection and expande surveillance
case definition for AIDS among adoles-cents and adults // Morbid. Mortal
Wkle Rep. - 1992. - Vol. 41, N PR- 17.
55. Rieder H.L. Epidemiology of tuberculosis in Europe// Eur. Resp. J.~ 1995. -
Vol. 8, Suppi. 20. - P.620s-623s.
56. Rifabutin in combination with clofasimine, isoniasid and ethamdutol in
treatment of AIDS patients with infections due to opportunist mycobacteria /
B. Dautsenberg, C. Truffot, A. Mignon et al. //Tubercle. - 1991. - Vol. 72, N
3.-P.168-175.
57. Rise-resistant tuberculous meningitis in AIDS patient: retter / D.L. Horn, D.
Hewlett, S. Petersonetal.//Lancet.- 1993.- Vol. 341,N 8838.-P.l 177-178.
58. Rodpigues C. BCG- revaccination against tuberculosis. // Lancet. 1996.
N 9057.-P.611-178.
59. Serodiagnosis of extra-pulmonary tuberculosis by ELISA / Munshi, S.
Chiddarwar, A. Patel, S. Grover // Indian J. Pathoi. Microbiol. -1993. - Vol.
36, N 4. - P.356-360. - Abstract.
396
60. Shafer R. W., Jones W.D. Relapse oftuberculosis in a. Patient with the acquired
immunodeficiency syndrome despite 12 month of antituberculous therapy
and continuation of isoniazid. // Tubercle. -1991. - Vol. 72, N 2. - P. 149-151.
61. Shold pulmonary tuberculosis be an AIDS defining dignosis in patients infected
with HIV?/C. Perrone, A. Ghoubontni, C. Leport etal. //Tubercle. - 1992.-
Vol. 73, N 1,-P.39-44.
62. Small P.M. Treatment of tuberculosis in patients with advahced human
immunodeficiency virys infection. // New End. J. Med. - 1991. Vol. 324. -
P.289-292.
63. Splenic tuberculosis in patients with AIDS I J. Ped-ro-botet, M.T. Maristany,
R. Miralles et al. // Rev. Infect. Dis. - 1991. - Vol. 13, N 6. - P. 1069-1071.
64. Springrtt V.H. Sutherland I. Are-examination of the viriations in the efficacy
of BCG vaccination against tuberculosis in clinical trials //Tubercle. - 1994.
- Vol. 75, N3.- P.227-233.
65. Styblo K. Mogliche ausw erwortebenen immunodefekts (AIDS) auf die
tuberculose riestandarten und Entwicklungsia Pneumologie. - 1990. Vol. 44,
Sonde - P.647-652.
66. The HIV epidemic and its effect on the tuberculosis situation in the Netherlands
/ H. Van Deutekorn, A.A. Warris-Versteegen, P. Krijnen et al. // Tubercle. -
1993.-Vol.74,N3.-P.159-162.
67. Tuberculous abscesses in patients with AIDS / H. Lupatkin, N. Bran, P.
Flomenberg, M.S. Simberkoff // Rev. Infect. Dis. - 1992. - Vol. 14, N S.-
Р. 1040-1044.
68. Tuberculosis as an AIDS defining disease in Europe. 11 HIV/AIDS surveillance
in Europe. - 1995. Quarterly report n 46, N 2. - P.37-49.214. Tuberculosis
case rates by states: United States, 1994.
69. Tuberculous chest wail abscess in patients with AIDS: Letter/ G. Cache, M. Yebra,
E. Berrocal,J. Ruis//Clin. Infect. Dis. - 1993.-Vol. 16,N 5,-P.727-728.
70. Tuberculosis et infection par ie virus HIV. Epidemiologic et particularites. / O.
Fenoyl, F. Cazenave-Roblot, P. Roblot et al. // Sem. Hop. Paris. - 1988. - Vol.
64, N 49-50.-P.3143-3148.
71. Tuberculosis meningitis in patients infected with the humman
immunodeficiency virus/J. Berenguer, S. Moreno, F. Lagunaet al.//N. Engl.
J.Med.- 1992.-Vol. 326, N 10. - P.668-672.
72. Tuberculous meningitis in patients infected with the humman
immunodeficiency virus: Letters/Е. Martinez, J. Lopez-Contreras, P. Domingo
etal.; P. Martinez-Martin;A.J. Plant; H.Tealman,J. Batungwanayo,J. Clerinx
etal.; J. Bereguer, S. Moreno, E. Bouzaet al. //N. Engl. J. Med. - 1992.-Vol.
327,N 16.-P.l 170-1172.
73. Альбино X., Райхман JI. Лечение туберкулеза//Большой целевой журнал
о туберкулезе. -1999. -№ 5. -с. 28-32.
397
Глава 10. ВИРУСНЫЕ ГЕПАТИТЫ И ВИЧ-ИНФЕКЦИЯ.
В связи с ростом наркомании в России и в странах бывшего СССР
резко увеличилась заболеваемость парентеральными вирусными гепатита-
ми и, прежде всего, гепатитом С.
Суммарно количество выявленных случаев вирусного гепатита С
(острого, хронического, носительство) в 2000 году составило по РФ
105439, по Санкт-Петербургу 13200, в 2001 году - 122855, 12571, соответ-
ственно.
Таблица 51
Заболеваемость парентеральными вирусными гепатитами, нар-
команией и ВИЧ/СПИДом в Санкт-Петербурге по годам
(на 100 тыс. населения)
Нозолог.формы/ годы 1996 1997 1998 1999 2000 i 2001 2002
Гепатит В (острый) 32,4 24,6 29,4 84,7 76,4 | 50,7 25,2
Хр. гепатит В 31,7 35,4 37,1 34,3
Носители HBV 68,9 65,8 | 67,5 49,6
Гепатит С (острый) 16,4 19,0 29,5 94,7 89,2 57,7 22,1
Хр.гепатит С 66,8 72,9 ! 74,6 69,5
Носители HCV 106,9 И3,9 । 131,3 138,7
Наркомания 68,7 71,9 97,6 136,6 167,0 ! 186,4
ВИЧ-инфекция 0,8 1,6 2,3 9,2 113,3 1 229,4 .. 124,7*
*По суммарным данным пораженность ВИЧ С анкт-Пегербурге составляет 400 на
100.000 населения (1987-2002).
В этой связи на данном этапе чрезвычайно актуальным является изучение
взаимосвязи ВИЧ инфекции и вирусных гепатитов, прежде всего, гепатита С.
10. 1. Вирусный гепатитС
Вирус гепатита С (НСV) содержит однонитевую РНК и по структуре своего
генома относится к флавивирусам (Svehart J. Е. et al., 1990; Brillanti S. et al., 1991).
Геном ВГС имеет 2 нетранслируемые области (5NTR и 3NTR) и ряд регионов,
кодирующих вирусспецифическую протеазу, несколько структурных протеинов,
включающих нуклеотиды ядра (core) и 2 оболочечных гликопротеида (Е1, Е2/
NS 1). Последние выявляются в эндоплазматическом ретикулуме. Возможно, когда
идет процесс протеолитической дезинтеграции во время репликации вируса,
гликопротеиды Е1 и Е2 липидной оболочки ВГС накапливаются в аппарате
Гольджи. Остальные неструктурные протеины также участвуют в репликации
вируса (Cristiano К. et al., 1991), при этом включаются две
398
вирусные протеазы (NS2 и NS3), а также хеликаза (9NS3) и РНК-
полимераза (NS5).
На основании различий нуклеозидных последовательностей в области
NS5 P.Simmonds (1993) в своей классификации выделяет 76 различных штаммов
вируса, которые составляют 6 больших групп с 40 подгруппами. Y.Okamoto et
al. (1992) также выделяют 6 основных генотипов, но на основании различий
нуклеотидных последовательностей в области ядра вируса. Клиническая
значимость этих штаммов пока недостаточно изучена, но для отдельных
регионов мира характерна циркуляция различных генотипов вируса.
Определить распространение HCV-инфекции в общей популяции
населения сложно. Например, в США среди доноров антитела к HCV были
выявлены у 0,6%, в Западной Европе и Канаде - у 0,3%, в Японии и на юге
Европы-у 1,2 1,5%.
Среди групп высокого риска - гемофиликов и инъекционных наркоманов
в США антитела к HCV выявлялись в 60 - 70% (Mendenhall С. et al., 1991).
Поданным М. Alter, 1992 (CDC-Центры по борьбе с болезнями Службы
общественного здравоохранения США), в США ожидается ежегодно появление
150 000 новых случаев гепатита С. Из них 37 500 составят манифестные формы,
а приблизительно у 93 000 инфицированных заболевание может прогрессировать
до хронического гепатита и у 30 700 - сформируется цирроз печени. Около
8000-10 000 пациентов, вполне вероятно, умрут от этой инфекции.
Парентеральный путь передачи при вирусном гепатите С, по данным
исследователей, в 90% случаев связан с переливаниями крови (SeefFL.B. et al.,
1992). Примерно 7% получивших переливание крови приобретают HCV. После
внедрения скрининга крови на антитела к HCV частота посттрансфузионного
гепатита С снизилась до 0,03%. Однако такие продукты крови, как препараты
свертывания и криопреципитат, могут быть фактором передачи гепатита С, а
вот иммуноглобулин - нет.
Гепатит С в настоящее время - серьезная проблема для наркоманов, а
также лиц, работающих с кровью или ее продуктами. Так, было показано, что
7 из 68 (10%) лиц, пораненных иглами от больных, оказались зараженными
вирусом гепатита С (Nishiguchi S. et al., 1991).
Непарентеральный путь передачи вируса гепатита С изучен еще
неполно. Возможен половой путь, а также внутрисемейное
распространение этой инфекции (Као J.H. et al., 1992; Thomas D.L. et al.,
1995; Михайлов М.И., 2001). Содержащая липиды оболочка вируса С
способствует его сохранению и устойчивости к внешним воздействиям и,
по-видимому, как при гепатите В, здесь реализуется бытовой кровно-
контактный путь передачи. В семейно-бытовых очагах передача вируса
выявляется в2 и менее процентах случаев (Pachucki С. et al., 1991). Заражение
фекально-оральным путем отрицается.
399
Высокий риск заражения вирусом гепатита С половым путем отмечен на
Тайване: у проституток антитела к вирусу С выявлены в 3,5%, тогда как у доноров
- в 0,95%. Показано также инфицирование супружеских пар и гомосексуалистов
(Svehart J. et al., 1990). По данным R. Vranckx (1995), у доноров Бельгии анти
HCV выявлены в 0,33%, а у гомосексуалистов - в 0,82%.
Возможна и перинатальная трансмиссия С вируса от матери к плоду, хотя
внутриутробная передача маловероятна (Svehart J. et al., 1990; Weiner A. et al.,
1993; Zanetti A. et al., 1995).
По данным С.Л.Мукомолова (1994, 1999), в Санкт-Петербурге частота
выявления анти HCV у доноров различных учреждений колебалась от 2,4%
(кадровые доноры) до 26,3% (доноры с повышенной активностью АлТ). У
коммерческих доноров установлено увеличение частоты анти HCV в зависимости
от возраста: у лиц до 30 лет она составила 1,1%, в последующих возрастных
группах достигала 4,5% (р < 0,05), причем чаще у мужчин, чем у женщин. Среди
беременных женщин С-Петербурга выявляемость антител к HCVустановлена в
0,7% случаев, среди медицинских работников - в 1,2%, вто время как у лаборантов
- в 6,3%. Особый интерес представляют данные о высокой частоте выявления
антител к HCV в окружении больных с хроническим гепатитом С - 15%. Эти
наблюдения нуждаются в накоплении, однако здесь не отрицается значение
полового пути передачи вируса гепатита С.
Гепатотропность HCV была доказана экспериментально, когда удалось
воспроизвести его репликацию в гепатоцитах. Размножение вируса в
лабораторных условиях наблюдается также на Т-клеточных линиях (Houghton
М. etal., 1991). Вирусная РНК выявляется в печени методом ПЦР уже на первой
неделе заражения в цитоплазме большинства гепатоцитов. Спустя несколько
недель уровень РНК-позитивных клеток уменьшается. В последующем количество
вирусных частиц периодически может увеличиваться, но это не всегда коррелирует
с наличием РНК в сыворотке крови или со степенью воспалительных изменений
в печени. Внепеченочная репликация вируса убедительно не доказана, но не
исключается возможность размножения вируса в Т-лимфоцитах (Abe К. et al.,
1992). В опытах на обезьянах при их парентеральном инфицировании было
показано, что вирусная РНК как маркер виремии ВГС выявляется в сыворотке в
течение первых двух недель от момента заражения (Shindo М. et а!., 1992).
Максимальная виремия наблюдается в начале острого периода болезни. Антитела
появляются спустя 6-12 недель от начала развития гепатита (рисунок 7).
Прежде всего выявляются антитела к структурным (связанным с ядерным
белком) протеинам и частично - к неструктурным белкам - NS3 и NS4 регионов
генома (Nakatsuji J. et al., 1992). Гистологически на 1-й неделе наблюдаются
одиночные внутрилобулярные некрозы печеночных клеток, что приводит к
подъему уровня активности АлТ, наряду с этим выявляются дегенеративные
изменения гепатоцитов и лимфоцитарная инфильтрация (Bach N. et al., 1992).
400
50
HCV РНК
Рис. 7. Динамика серологических изменений при острой HCV инфекции. HCV
РНК в сыворотке появляется очень рано. Появление анти-HCV отсрочено. По мере
хронизации заболевания отмечаются характерные колебания активности АЛТ.
Проведенные исследования показывают, что по меньшей мере 50%, а
возможно 80-95% инфицированных не имеют отчетливой острой фазы болезни,
прежде чем инфекция становится хронически персистирующей (рисунок 8).
Рисунок 8
Варианты возможного течения вирусного гепатита С
Заражение | * Бессимптомное . течение 80-95% J Хронический гепатит 60-80%
Острый гепатит 5-20% 1 Цирроз печени околр 60%
Карцинома печени
1 5%
Это является, вероятно, следствием постоянной изменчивости HCV. Хотя
персистентная инфекция у человека нетипична для флавивирусов, такой вариант
возможен у зараженных животных. У человека представители флавивирусов
(ранее - арбовирусы группы В) вызывают геморрагические лихорадки (в том
числе желтую лихорадку, ГЛПС) и клещевой энцефалит.
В биоптатах печени при хроническом течении инфекции в гепатоцитах
видны клетки, содержащие антиген, явления внутрилобулярного воспаления и
26- Заказ № К-4451.
401
фиброз. В отличие от хронического гепатита В при хроническом гепатите С
чаще выявляется деструкция холангиол и жировая инфильтрация гепатоцитов
(Серов В.В. и соавт., 1995,1996; Lefowitch J. et al., 1993; Villari D. et al., 1995).
Причина формирования хронически персистирующей инфекции пока до
конца неясна. Появившиеся в ответ на инфицирование антитела к НС V постоянно
циркулируют. Как было показано, у больных с хронической инфекцией уровень
антител в крови в среднем даже выше, чем при остром гепатите (Iwarson S.,
1994). Это наводит на мысль о второстепенной роли гуморального звена
иммунитета при вирусном гепатите С. Роль клеточного иммунитета при ГС
изучена также частично. Например, установлено, что CD8 - цитотоксические
Т-лимфоциты распознают вирус при хронической инфекции, но элиминация
возбудителя таким образом не происходит (Shimuzu Y.K. et al., 1992).
В процессе персистенции размножение вируса в печеночных клетках по
результатам ПЦР находится на низком уровне. Поэтому можно полагать, что
прямое цитопатическое действие вируса на клетки хозяина не играет ведущей
роли в механизме развития хронического патологического процесса. В то же
время считают, что иммунологически опосредованное повреждение печени
при гепатите С выражено больше, чем при гепатите В (Lemon S., Brown Е.,
1995). Повреждение гепатоцитов, вероятнее всего, обусловлено не только
цитотоксическим действием лимфоцитов на вируспродуцирующие гепатоциты,
но, возможно, дополнительно развитием перекрестной аутоиммунной реакции
из-за большого сходства HCV-протеинов и белков печеночных клеток.
Однако еще предстоит изучить роль неспецифического *воспаления
клеток, макрофагов и цитокинов при хроническом течении гепатита С.
Установлена прямая взаимосвязь между хронической С вирусной
инфекцией и первичным раком печени. Вероятно, вирус гепатита В чаще,
чем HCV приводит к развитию рака печени. Однако в Японии, напротив,
соотношение частоты рака при гепатите С и гепатите В составляет 2:1
(Okamoto J. et al., 1992; Jakahashi M. et al., 1993; Hayden G. et al., 1995; Шерлок
III., Дули Д., 1999). В то же время неясно, каким образом HCV,
располагающийся в цитоплазме без выявленного механизма обратной
транскрипции в ДНК, способен привести к карциноме. По-видимому,
имеют значение длительное повреждение гепатоцитов иммунокомпетентными
клетками, накопление свободных радикалов и другие факторы, приводящие
клеточную ДНК к злокачественной трансформации.
Имеются факторы, которые указывают также на возможную роль в
патогенезе вирусного гепатита С различных генотипов вируса. Если
возможность развития цирроза печени в настоящее время связывают со всеми
генотипами вируса, то в формировании печеночной карциномы в одной из
работ отводится особенная роль генотипу 1Ь, 11 и IV (Pozzato G. et al., 1994).
Генотипы HCV 2 и 3 значительно лучше поддаются интерферон-терапии, чем
402
генотип I (Omata M. et al., 1991; Shindo M. et al., 1992). Тип I (lb) связывают c
более тяжелым течением болезни, рецидивами после трансплантации печени и
возможностью развития рака печени. Также как и тип I, тип IV характеризуется
резистентностью к лечению (Ш.Шерлок, Дж.Дули, 1999).
Возможна ли суперинфекция различными субтипами HCV, еще неясно.
Но, без сомнения, возможно развитие гепатита В+С, который имеет ряд
особенностей. C.L.Mendenhall et al. (1991) рассматривают HCV наряду с вирусом
гепатита D как кофактор в развитии фульминантного гепатита В и высказывают
сомнение по поводу возможности протекания гепатита С как моногепатита.
При хроническом течении гепатита В+С, как правило, доминирует один из
вирусов, при этом наблюдается феномен интерференции между ними.
В организме человека возможна медленная мутация вируса с появлением
новых штаммов (Chen D. et al., 1990). Показано также, что иммунитет к одному
из штаммов вируса не защищает от заражения другими. Развивающийся
иммунитет при НС V инфекции не стойкий и не всеобъемлющий, что затрудняет
разработку вакцинопрофилактики. Однако у небольшой группы зараженных
наблюдается полное очищение организма от инфекции.
Трудно спрогнозировать время разработки и внедрения протективной
вакцины против вирусного гепатита С. Здесь очевидны проблемы, связанные с
широкой вариабельностью вируса, недостаточно изучены механизмы иммунной
защиты, отсутствует надежный метод культивирования HCV, и нет модели на
животных, отвечающей этой цели.
Клинические формы вирусного гепатита С и естественный прогресс
патологического процесса характеризуются, как правило, бессимптомным
началом, преимущественно хроническим персистирующим течением,
возможностью формирования цирроза печени, вплоть до развития печеночно-
клеточной карциномы.
Во временном аспекте эволюция естественного течения HCV
инфекции представляется следующим образом: от момента инфицирования
до установления диагноза хронического гепатита (ХГ) проходит в среднем
13,5 лет, до перехода хронического гепатита в цирроз печени - 20,5 лет, до
карциномы печени - приблизительно 28 лет.
По данным S.lwarson (1994), частота развития ХПГ в течение 8 лет
наблюдения за больными гепатитом С составила 25%, ХАГ с циррозом - 23%,
а карциномы печени - 52%. В другом исследовании при более длительном
наблюдении (в течение 11 лет) было показано, что среди 100 больных ХПГ
развивается в 34% случаев, ХАГ с циррозом печени - у 42% больных, а
гепатоцеллюлярная карцинома - в 19%. Инкубационный период при вирусном
гепатите С, по данным разных авторов, находится в пределах 2-12 недель.
Острый вирусный гепатит С. Большинство случаев острого гепатита С
не сопровождается выраженной клинической симптоматикой. Желтуха
2б-
403
отмечается у 10-15% заболевших. Поэтому большинство больных остаются с
нераспознанным диагнозом. При этом гепатит С не имеет специфических черт и
не отличим от других нозологических форм вирусных гепатитов. При
сопоставлении степени выраженности отдельных симптомов с гепатитами
другой этиологии исследователи отмечают, что они выражены при вирусном
гепатите С слабее, чем при гепатитах А, В и Е. Степень повышения уровня
активности АлТ и билирубина в крови также не столь велики.
Фульминантный гепатит С. Развитие фульминантного вирусного
гепатита С, как уже отмечалось, некоторыми авторами отрицается. ГС отводят
только роль кофактора, когда при вирусном гепатите В развивается тяжелое
молниеносное течение болезни, которое приводит к смерти. В то же время
имеется сообщение из Японии о частом (до 20 - 30%) развитии такого варианта
при моно гепатите С. В США и Европе случаи фульминантного гепатита С, судя
по данным литературы, встречаются редко.
Хронический вирусный гепатит С. Это наиболее частая форма инфекции,
но не у всех больных в анамнезе можно выделить острый период болезни.
Типичная клиническая картина представляет собой персистирующую инфекцию
с периодическими обострениями, которые сопровождаются выявлением
маркеров HCV и повышением АлТ с возможными внепеченочными знаками.
Но нередко при прогрессирующем хроническом гепатите и циррозе печени,
доказанными морфологически, уровень активности АлТ остается нормальным
(Aach R. et al., 1991).
Течение хронического гепатита С относительно длительное время не
сопровождается тяжелыми клиническими проявлениями и осложнениями. Так,
в одном исследовании (Krawitt Е., 1995) сообщается о группе инфицированных
HCV, включавшей 131 больного. Все они заразились при переливании крови,
наблюдения продолжались с 1980 по 1994 г. При первичном обследовании 23
жаловались на хроническую слабость и утомляемость и также у 2/3 были
установлены явные признаки поражения печени. В 20% случаев был
диагностирован хронический персистирующий гепатит, а в 23% - хронический
активный гепатит. Течение ХПГ было доброкачественным и сопровождалось
незначительными клиническими проявлениями, хотя в ряде случаев он
трансформировался в ХАГ. Однако более чем у половины был обнаружен цирроз
печени и в 5% случаев - рак печени. В процессе наблюдения дополнительно еще
у 5 больных сформировалась печеночно-клеточная карцинома. Цирроз печени,
вызванный HCV, у этих больных имел следующие черты: у 80% больных имелась
тромбоцитопения, у 40% определялся асцит, у 18% больных было варикозное
расширение вен пищевода и признаки печеночной энцефалопатии.
Возможность определять анти HCV у больных в клинической практике
впервые позволило осуществить диагностику гепатита С. В последующие
годы стали использовать определение антител к структурным и неструктурным
404
белкам HCV, анти HCV IgM и рекомбинантный иммуноблот RIBA (Логинов
А.С. исоавт., 1994; ВиноградоваЕ.Н., 1996;МихайловМ.И., 1996-2001;Яковлев
А. А., Виноградова Е.Н., 1999,2000). В результате этого резко снизилась частота
посттрансфузионного гепатита, наиболее часто вызываемого HCV.
Накопленные в последние годы данные показали, что интерпретация
иммунологических (серологических) тестов затруднительна, ибо 25-90% проб,
положительных при скрининговом анализе, отрицательны в RIBA(Widell A. et al.,
1991). RIBA, как дополнительный тест к ИФА скринингу, не имеет преимуществ
по мнению Н. Krarup et al. (1997). Все анти HCV позитивные больные, указывают
авторы, должны тестироваться на РНК HCV независимо от результатов “RIBA
test”. Наряду с этим авторы отмечают, что при остром гепатите С антитела
вырабатываются поздно или вовсе не вырабатываются, а при их наличии сложно
расценивать активность текущей инфекции. Ввиду этого наиболее надежно
определять HCV виремию с помощью ПЦР (Cristiano К. et al., 1991; Nishiguchi S.
etal., 1991; PorchonC.etal., 1992; Feray C.etal., 1993). Как отмечают цитируемые
выше авторы, выявление виремии качественным методом в целом коррелирует
со степенью повышения активности АлТ. Однако последняя в ряде случаев
запаздывает, и поэтому для мониторирования эффективности противовирусной
и иммуномодулирующей терапии лучше использовать определение РНК HCV.
Изучение нами острого гепатита С у 68 больных показало, что у 29 была
легкая форма, у 37-средней тяжести и у 2-тяжелая форма заболевания. У всех
больных диагноз острого гепатита С был подтвержден с помощью ПЦР.
Только на 14 - 21 дни болезни у всех больных были выявлены
общие анти HCV. Следовательно, в разгар острого гепатита С наиболее
надежным методом диагностики является ПЦР как метод, позволяющий
верифицировать острые формы заболевания.
Для более объективной характеристики моно острого гепатита С в эту
группу были включены только те больные, у которых в серологических реакциях
и ПЦР не было выявлено при первичных и повторных исследованиях маркеров
других вирусов гепатита, а также маркеров из группы герпесвирусов.
Возраст больных был от 16 до 59 лет, мужчин - 47, женщин - 21. За 2 - 6
недель до заболевания 24 больных лечились у стоматолога или получали
инъекции в поликлиниках и стационарах, 2 больных были донорами, 2 - врачами-
хирургами, 4 - медсестрами, 14 - являлись инъекционными наркоманами, у 2 -
жены были больны хроническим гепатитом С. У остальных 20 человек указаний
на парентеральные вмешательства не было.
В желтушный период заболевания основными жалобами были слабость,
снижение аппетита, ноющие боли в правом подреберье, реже тошнота, рвота
(8 больных), зуд кожи (2 больных), боли в суставах (6 больных). Желтушность
была выражена слабо у 29 больных, умеренно - у 37, а у 2 больных отмечена
яркая желтушность кожи и склер. Размеры печени по среднеключичной линии
405
ниже реберной дуги увеличивались на 2,5-3 см у 10 больных, до 2,5 см - у 48
больных, а у 10 больных они не изменились. Селезенка пальпировалась у 7
больных. У большинства больных наблюдались легкие и среднетяжелые формы,
а тяжелая форма лишь у 2,9%. Геморрагический синдром отмечен у 1 больного
в местах инъекций.
При изучении лабораторных показателей у больных острым гепатитом
С при поступлении в стационар отмечено наличие гипербилирубинемии в
пределах 34,0 - 217 мкмоль/л, АлТ - 6,5 - 44,6 ммоль/ч.л. Содержание
альбуминов колебалось от 51,7 до 66,6%, а, - 2,3 - 3,8%, а, - 4,8 - 9,0%, р - 7
- 9% и у - 12-21%. Альбумино-глобулиновый коэффициент был в пределах
1,1 - 2,2, альбумино-гамммаглобулиновый - 2,0 - 3,6. Тимоловая проба
повышалась в пределах 3,3 - 25,2 ед.
При изучении клинико-биохимических показателей в динамике
заболевания у 18 больных отмечен длительный период гипербилирубинемии.
В среднем он составил 35±5,4 дней, у 32 больных его длительность составила
29±3,2 дня, у 18 больных при выписке на 38-40-й день от начала желтушного
периода сохранилась гипербилирубинемия в пределах 22,1-29,0 мкмоль/л.
Активность АлТ снижалась еще более медленно и при выписке лишь у 24
больных была нормальной, а у остальных 44 больных она колебалась в пределах
2,9 - 5,8 ммоль/ч.л.
Из 68 больных на этапе диспансеризации в нашем поликлиническом
отделении наблюдалось 42 больных, имевших клинико-биохимические
проявления болезни. Результаты обследования 42 больных на протяжении 8 -
10 месяцев диспансерного наблюдения позволили установить у 26 хронический
гепатит со слабо выраженной активностью.
Мы попытались дать общую характеристику хронического гепатита С
как последствия острой формы заболевания. Это важно, прежде всего, для
того, чтобы дать ориентиры прогноза перехода из острых форм гепатита С в
хронические, атакже проанализировать с критическим подходом возможности
обострения хронического гепатита С в дебюте установленной острой формы
заболевания, не используя традиционный, не всегда практически осуществимый
и иногда ошибочный подход, включающий пункционную биопсию печени.
У всех наблюдаемых больных было отмечено острое или подострое
начало болезни с четким преджелтушным периодом заболевания по
смешанному типу (лихорадочно-диспепсический и астеновегетативный
синдромы с артралгиями у половины больных). У всех были
эпидемиологические предпосылки инфицирования в виде парентеральных
вмешательств в пределах 20 - 35 дней до начала болезни. В анамнезе
отсутствовали симптомы патологии печени и желчевыводящих путей.
Существенно отметить, что РНК HCV у больных была положительной
при повторном исследовании в период выписки из стационара при наличии
406
гипербилирубинемии у 23 больных (20,5 - 29,0 мкмоль/л) и повышенной
активности АлТ у всех (3,6-10,3 ммоль/ч.л.), что давало основание установить
затяжную форму заболевания при выписке из стационара. Ни один из этих
клинических симптомов заболевания (степень и характер гепатомегалии,
спленомегалия, геморрагический синдром и другие), результаты УЗИ в острый
период заболевания не указывали на диагноз хронического гепатита и его
прогноза. Об этом свидетельствовали лишь затяжное течение болезни, повторное
выявление РНК HCV и длительное сохранение антител к структурным и
неструктурным белкам вируса.
Клинико-лабораторные проявления изучены нами у 98 больных с моно
хроническим гепатитом С, подтвержденным выявлением нуклеотидных
последовательностей вируса в ПЦР. Важно отметить, что общие анти HCV,
которые в общей клинической практике являются основным критерием
диагностики гепатита С, выявлялись систематически лишь у 72,6% больных. У
остальных они выявлялись транзиторно, при одном из повторных наблюдений.
В то же время неструктурные антитела к НС V были выявлены у 80% больных,
а структурные антитела к HCV - у 90% обследуемых. Из этого следует вывод о
необходимости комплексного серологического обследования больных
хроническим гепатитом в целях этиологической верификации диагноза.
Из 98 больных 26 ранее наблюдались нами в клинике как больные с острым
гепатитом С, и в последующем на этапе диспансеризации в поликлиническом
отделении. Остальные поступали в стационар с диагнозом вирусный гепатит С
либо при плановом обследовании с наличием общих анти HCV, либо по
клиническим данным из-за наличия субиктеричности слизистых и кожных
покровов, либо из-за астеновегетативных и диспепсических жалоб с
гепатомегалией и гиперферментемией, выявляемой при обращении к врачу в
поликлинике.
Основными жалобами больных, находящихся на стационарном лечении,
были слабость (100%), плохой аппетит (85,4%), тошнота (45,5%), ноющие боли
в правом подреберье (38,6%). Артралгии и зуд кожи отмечены лишь у 2,3%
больных. Геморрагический синдром в виде носовых кровотечений и
петехиальных высыпаний наблюдался у 4 больных (4,6%). Такие характерные
для ХГ симптомы, как телеангиоэктазии и “печеночные ладони”, наблюдались
в 22,4 и 19,4% соответственно. Гепатомегалия была выражена умеренно. Печень
выступала на 1,5 - 3,0 см ниже реберной дуги и была умеренной плотности.
Селезенка пальпировалась у 32 больных (32,6%).
Умеренно выраженная желтушность кожных покровов и слизистых
отмечена у 32 больных (32,6%), субиктеричность кожи и склер - у 26 больных
(26,4%). У остальных цвет кожи и слизистых был нормальным. Следовательно,
можно считать, что желтуха не является ведущим синдромом хронического
гепатита С.
407
При анализе биохимических показателей отмечено, что из 98 больных
уровень билирубина крови был нормальным у 26 человек, у большинства он не
превышал 100 мкмоль/л. Таким образом, у 1/3 больных хронический ГС протекал
без желтухи. В среднем уровень гипербилирубинемии составил 76,0±28,1
мкмоль/л (без крайних значений выше 200 мкмоль/л у 2 больных). Активность
АлТ была повышена у 96 из 98 больных, то есть практически у всех. Степень
повышения активности АлТ колебалась в широких пределах.
Уровень альбуминов снижался ниже 60% у 82 больных, из них ниже 55%
- у 28, ниже 50% - у 15. Альбумино-гаммаглобулиновый коэффициент был
снижен (ниже 3,0) у 78 из 98 больных, однако ниже 2,0 он был только у 15
больных. Тимоловая проба была повышенной у 93 из 98 больных, составляя в
среднем 9,6±3,6 ед. Количество тромбоцитов ниже 250х10|2/л было у 48%
больных.
Таким образом, типичные признаки, характерные для HCV инфекции:
- длительное “немое”, скрытое течение болезни, маскируемое
хроническим алкоголизмом, стеатозом печени, хотя при тщательном
обследовании симптомы патологии печени могут быть выявлены;
- манифестация заболевания, его обострение возникло в связи с
наслоением дополнительной инфекции. В данном наблюдении - при рожистом
воспаление голени;
- преобладание склеротических (цирротических) изменений над
цитолитическими;
- печеночная энцефалопатия обусловлена выпадением функции печени,
выраженным асцитом, коллатеральным кровообращением.
Проведенными совместными исследованиями установлено, что сыворотки
здоровых доноров практически не реагировали в тест-системе на анти-HCV core
IgM. Распределение сывороток доноров по оптической плотности при постановке
теста на анти-HCV core IgM в ИФА происходило, в основном, в области до 0,15
оптических единиц (о.е.). Суммарно в этой области находилось 81,2%, а средняя
оптическая плотность образцов составила 0,099 о. е. Это свидетельствует о том,
что тест-система достаточно специфична. Лишь единичные образцы показали
оптическую плотность выше0,21 о.е.; при этом максимальное значение показателя
равное 0,234 о.е. наблюдалось в 1 из 48 образцов (2,1 %). Идентичными оказались
и результаты тестирования сывороток больных вирусными гепатитами А и В, а
также ВИЧ-инфицированных. Средние показатели оптической плотности образцов
этих категорий пациентов колебались в пределах 0,083—0,135 о.е., а максимальные
значения показателей не превысили 0,3 о.е. (0,232—0,280 о.е.). Указанные
результаты позволяют сделать заключение об отсутствии перекрестного
реагирования синтетических пептидов, соответствующих антигенным
детерминантам ядерного белка вируса ГС, с антителами к другим инфекционным
агентам, связанным и не связанным с поражением печени.
408
Одним из самых достоверных критериев специфичности диагностических
препаратов является соответствие результатов, полученных с помощью
разработанного препарата и «золотого» стандарта (тест-системы, получившей
самые высокие оценки специалистов). В случае с тест-системами на анти-HCV
core IgM такой стандарт отсутствует. В связи с этим были проведены
сопоставления результатов тестирования на анти-ВГС core IgM в ИФА и на
РНК HCV методом ПЦР сывороток больных вирусными гепатитами. Результаты
этого сопоставления представлены в таблице 52.
Таблица 52
Совпадение результатов исследования 271 образца сывороток больных
вирусными гепатитами на РНК ВГС в ПЦР и анти-ВГС core IgM в ИФА
Маркеры | IgM анти ВГС I соге-1 IgM анти ВГС core - Итого
РНК ВГС+ 1 66 34 100
РНК ВГС- 1 45 126 171
Всего 1 111 160 271
Полное совпадение результатов отмечено в 192 образцах из 271 (70,8%),
что следует признать достаточно высоким показателем при сопоставлении
методов, основанных на разных принципах (определение серологических сдвигов
— ИФА; определение генома вируса—ПЦР). Следует отметить, что более часто
анти-HCV core IgM выявлялись в сыворотках позитивных по РНК HCV (66%),
чем в РНК-негативных (26,3%), р<0,001. Полученные результаты свидетельствуют
о высокой специфичности разработанной тест-системы.
И, наконец, еще одним критерием специфичности тест-системы является
воспроизводимость результатов при исследовании сывороток одного и того
же пациента, полученных в динамике. В связи с этим было проведено
исследование сывороток 23 больных (РНК HCV и анти-HCV core IgM-
негативных при первичном обследовании) в динамике наблюдения от 14 до213
дней (72,1 ± 10,7). Кратность исследования образцов, полученных на различных
сроках заболевания составила 2-6 раз (2,9x0,2), а общее число исследований —
68. При этом, во всех случаях исследуемые образцы оказались негативными по
анти-ВГСсоге IgM.
При остром ГС анти-ВГСсоге IgM выявлялись у 86,7% больных в первые
две декады болезни. Следовательно, определение антител класса IgM является
полезным для объективизации диагноза острого ГС, наряду с другими клинико-
лабораторными данными. Предполагая, что анти-HCV core IgM появляются
раньше соответствующих антител класса IgG, было проведено тщательное
изучение сывороток, полученных от 13 больных острым ГС, оказавшихся РНК
HCV и анти-HCV core IgM-позитивными.
409
Таблица 53
Анти-ВГС core IgM и другие маркеры вирусного гепатита С у больных ХГС с манифестными проявлениями
Больной Анти ВВС Lia Те kHCV- - 1/3 Анти-ВГС core РНК
скрининг С1 С 2 сз С4 Е NS3 NS4 NS5 рез. ОП 490 рез. ВГС
Г-ва + 3+ 3- но* но 2+ 3+ 3+ 4+ + 0.57 + +
В-ов + 3+ 3- но но 1 + 1 + 4+ + 1.22 4~ +
С-ва -г 44- 4+ но но -/- - 2+ +/- + 1.21 4~ -
Г'-ий 4- 3+ 3+ но но 4-/- 3+ 4+ 2+ + 3.00 + -
Д-ов + 3+ 2+ но но - - 1 + 1 + + 0.65 + +
В-св + 4+ 4+ но но 2+ 2+ 2+ 2+ + 1.25 4~ +
Ф-ва + 3+ 3- но но 2-1- 3+ 3+ 4+ + 0.87 + +
Р-ич + 4+ 4+ но но 2+ 1 + 3+ 4+ + 0.73 4~ +
И-ль + - - но но - - 3+ - + 0.82 4~ +
Ва-в + 4+ 4+ но но - - 2+ 4+ + 1.45 + +
А-ян + 4+ 4+ но но 2+ 3+ 3+ 1 + + 0.63 + +
С-ев 4 3-4 34- но но - - 1 + - + 0,75 4~ +
Дополнительно были использованы скрининговые тесты на наличие анти-
HCV (выявляют антитела класса IgG) и иммуноблотинг. Два из 13 образцов
оказались отрицательными как в скрининговом тесте, так и в иммуноблотинге.
Кроме этого, в двух случаях при наличии позитивного результата в скрининговой
тест-системе иммуноблотинг оказался неопределенным. Это подтверждает
ценность теста на анти-HCV core IgM для диагностики острой ГС-инфекции.
Сопоставление спектра антител к различным белкам вируса ГС и анти-HCV
core IgM позволяет сделать заключение, что при острой HCV-инфекции
имеется корреляционная связь только по антителам к ядерному белку вируса,
что также подтверждает и специфич-ность разработанного препарата.
У больных хроническим ГС с манифестацией процесса анти-HCV core
IgM выявлялись в 61,2%. Сопоставление 4 тестов на различные маркеры
вирусного ГС, проведенное на материале 12 больных хроническим ГС с
наличием анти-HCV core IgM (таблица 53), показало, что РНК HCV
присутствовала в 9 образцах. Поскольку антитела класса IgM циркулируют
более длительно, чем РНК, можно предположить, что в подобных случаях они
являются единственным доказательством имевшей место репродукции вируса.
Указанное подчеркивает диагностическую ценность теста на анти-HCV core
IgM у больных с хроническими формами инфекции. Можно отметить, что во
всех образцах сывороток больных хроническим ГС наблюдались значительные
количества антител к ядерному белку вируса класса IgG (3—4 балла по
иммуноблотингу).
Кроме этого, имела место корреляционная связь между РНК HCV, антителами
к белку NS5 (РНК-зависимая PH К-полимераза) и анти-HCV core IgM.
IgM anti-HCVcore+
IgM anti-HCVcore -
Рис. 9. Морфологические изменения в гкани печени у больных хроническим ГС в
зависимости от наличия анти-HCVcore IgM в сыворотке. ЦП — цирроз печени: ХПГ —
хронический персистирующий гепатит; ХЛГ — хронический активный гепатит.
Указанное свидетельствует, что анти-ВГСсоге IgM отражают наличие
активной вирусной репродукции у больных хроническим ГС. При наличии
последней у больных хроническим ГС можно ожидать и более интенсивных
изменений в ткани печени, объективным критерием которых являются
результаты прижизненного морфологического изучения биптатов печени.
Результаты изучения биптатов были доступными у 21 больного. При этом, у 7
411
из них в сыворотке крови обнаруживались анти-ВГСсоге IgM, а у 14 — нет.
Распределение больных по выраженности морфологических изменений в этих
2 группах показано на рисунке 9.
У большинства больных при наличии анти-HCV core IgM в сыворотке
имело место значительное изменение архитектоники печени,
укладывающееся в картину ХАГ (71,4%) или цирроза печени (14,3%). В
противоположность этому, вторая группа (анти-HCV core IgM-негативная)
была, в основном, представлена больными хроническим персистирующим
гепатитом. Полученные результаты свидетельствуют о необходимости
использования антивирусных препаратов для подавления репродукции
вируса у больных анти-HCV core IgM-позитивным хроническим ГС. Можно
предполагать, что при эффективности такого лечения вслед за исчезновением
РНК HCV должны исчезать и антитела класса IgM к ядерному белку вируса.
В связи с этим, было осуществлено динамическое наблюдение за 42
больными ГС, получавшими антивирусную терапию. В зависимости от
динамики анти-ВГСсоге IgM все больные были разделены на 3 группы.
Первую группу составили 18 человек, у которых зафиксирована
положительная (исчезновение анти-ВГСсоге IgM) динамика. Длительность
наблюдения составила в среднем 84,6 дня, а кратность обследования — 3,3
раза. У большинства больных этой группы наблюдалась стойкая ремиссия и
нормализация биохимических показателей. Вторую группу составили 20
больных, у которых в динамике наблюдения постоянно обнаруживались
анти-HCV core IgM. Длительность наблюдения составила в среднем 54,9
дней, а кратность обследования — 3,1. У больных этой группы, как правило,
нормализации клинико-биохимических показателей не наступало, что
свидетельствовало о неэффективности использованного для лечения
препарата. И, наконец, в 3 группу вошли 4 больных, у которых имела место
флюктуация анти-ВГС core IgM. За такими больными необходимо более
длительное наблюдение.
Таким образом, результаты динамического наблюдения за больными ГС с
использованием теста на анти-HCV core IgM позволяют, с одной стороны, оценить
эффективность лечения, а с другой — свидетельствуют о воспроизводимости
разработанного метода, что свидетельствует о его специфичности.
Последнюю группу для оценки диагностической значимости определения
анти-HCV core IgM составили 66 доноров крови — позитивных по анти-
HCV при скрининговом тестировании. С использованием иммуноблотинга
наличие анти-HCV было подтверждено у 45 доноров (68%), в 3 случаях
установлен неопределенный результат, а 18 позитивных в скрининге
результатов не подтвердились иммуноблотингом. Анти-HCV core IgM были
выявлены в 20 образцах от подтвержденных в иммуноблотинге доноров (44%).
в одном из 3 сомнительных образцов и в 1 отрицательном образце (5,4%).
412
Позитивные результаты по анти-HCV core IgM в двух последних группах
свидетельствуют о необходимости более тщательного обследования и
наблюдения за донорами, позитивными по анти-HCV в скрининговых тестах.
Выборочное исследование сывороток 13 анти-HCV — позитивных доноров на
РНК HCV позволило установить ее наличие в 9 образцах (69,2%). В этой группе
сывороток оказалось 6 образцов положительных по анти-HCV core IgM. Во
всех случаях они содержали и РНК HCV в ПЦР, то есть наблюдалась 100%
корреляция результатов. Полученные результаты свидетельствуют о высоком
проценте хронической персистирующей инфекции среди доноров-«носителей»
анти-HCV и их потенциальной опасности для окружающих. Наличие анти-
HCV core IgM у этих лиц можно квалифицировать как признак активной
репродукции вируса.
Таким образом, разработанная иммуноферментная тест-система для
выявления анти-HCV core IgM отличается достаточно высокой специфичностью,
так как отсутствуют перекрестные реакции с антителами класса IgM к антигенам
других вирусов гепатита и другим инфекционным агентам; не выявлено
положительных реакций при исследовании сывороток здоровых доноров. Полное
совпадение результатов при параллельном определении анти-HCV core IgM и
РНК HCV у больных вирусными гепатитами отмечено в 70,8%.
Диагностическая ценность тестирования сывороток больных вирусными
гепатитами на анти-HCV core IgM определяется циркуляцией этих антител у
значительной части больных острыми и хроническими манифестными формами
ГС и корреляцией между обнаружением в сыворотке крови РНК HCV и антител
класса IgM. Указанное позволяет по тесту на анти-HCV core IgM
квалифицировать активно текущую вирусную инфекцию.
У больных хроническим манифестным ГС анти-HCV core IgM
достаточно часто циркулируют наряду с РНК HCV. Это свидетельствует о
значении вирусной репродукции в патогенезе хронического ГС. Установлено,
что при наличии анти-HCV core IgM в сыворотке крови у больных
хроническим ГС наблюдаются более выраженные морфологические
изменения ткани печени. У анти-НСУ-позитивных доноров анти-HCV core
IgM выявляются более чем в 40%. Это свидетельствует о наличии активной
репродукции вируса ГС улиц, субъективно считающих себя здоровыми, и
об их потенциальной опасности как источников инфекции. Тест на анти-
HCV core IgM может быть рекомендован для включения в план обследования
доноров-лносителей» анти-HCV.
Определение анти-HCV core IgM у больных ГС в динамике является
объективным критерием эффективности использования различных
противовирусных препаратов для лечения. Как правило, при наличии эффекта
от лечения у больных анти-HCV core IgM в сыворотке переставали выявляться.
В большинстве случаев хронического по-ражения печени, в том числе
413
при инфекции гепатот-ронными вирусами, основным механизмом гибели клеток
служит апоптоз. За много лет до открытия апоптоза был описан характерный
гистологический признак вирусного гепатита - округлые гомогенные
эозинофильные образования, часто содержащие пикнотичное ядро. Эти
образования, названные тельцами Каунсильмена, представляют собой не что иное,
как гепатоциты в состоянии апоптоза (Аруин Л.И., 1998, Буеверов А.О., 2001).
Farinati F. et al (2001) придают существенное значение нарушению
баланса между цитопролиферацией и апоптозом. Авторы считают, что эти
изменения могут свидетельствовать о наличии карциногенеза в печени.
Дисбаланс между показателями цитопролиферативного индексирования и
апоптозом был связан с усилением поражения печени, что сопровождалось
выраженными биохимическими изменениями и повышением уровня
содержания железа. Показатели апоптоза и цитопролиферации были выше среди
пациентов с циррозом, чем среди пациентов без цирроза печени. Авторы
считают, что для прогноза гепатита С существенное значение имеют как
показатели апоптоза, так и индекс цитопролиферации и определение их
соотношения, что может иметь значение не только для прогнозирования цирроза
печени, но и для своевременной диагностики гепатоцеллюлярной карциномы.
В целом, острый вирусный гепатит С в сравнении с гепатитом В
характеризуется более легким течением. Тяжелые формы при гепатите В
наблюдались у 18,1% больных, при гепатите С у 2,9% (р<0,05). В то же время
развитие хронического гепатита В отмечено у 18% больных, тогда как при
гепатите С в 3-4 раза чаще - у 88,9% больных (р<0,05). Хронический гепатит С
в отличии от хронического гепатита В характеризуется медленно
прогрессирующим течением нередко с манифестацией только в цирротической
стадии заболевания. Приоритетное значение в диагностике острого гепатита С
имеет использование метода ПЦР для выявления РНК HCV, для диагностики
хронического гепатита С - обнаружение в ИФА дифференцированных антител
к HCV, а для определения репликативной активности - ПЦР на наличие HCV
виремии.
Генотипы HCV, циркулирующие в Санкт-Петербурге, и их
взаимосвязь с тяжестью течения болезни.
В настоящее время показано, что HCV может быть представлен 6
различными генотипами и многочисленными субтипами, которые имеют разное
распространение в регионах и континентах, а каждый из них может вызывать
повторные эпизоды гепатита (Okamoto Y. et al., 1992; Simmonds P. et al., 1993.
1995). Авторами установлено, что генотипы I и II HCV наиболее часто
встречаются в Европе и США, а для стран Юго-Восточной Азии более
характерны генотипы IV - V, а также VI. Полагают, что тяжесть гепатита и
414
развитие гепатоцеллюлярной карциномы, нередко наблюдаемой в Японии,
обусловлено наличием в стране генотипов III - IV.
Исследованиями K.Yoshioka et al. (1992) показано, что больные с гепатитом,
вызванным HCV I генотипом, менее успешно лечатся интерфероном, чем больные
с другими генотипами HCV. Установлено также, что HCV-инфекция, вызванная
генотипом II, при условии низкого уровня виремии легче поддается ИФ терапии,
чем инфекция, вызванная НСVI генотипа (Kohara М. et al., 1995).
Генетическое многообразие HCV привело к созданию нескольких
классификаций его генотипов, что создает некоторые сложности в
сопоставлении и интерпретации данных. Однако, имеются работы, где генопиты
HCV по различным классификациям приведены в соответствие друг с другом
(L.-J. van Doorn, 1994).
Учитывая клиническую значимость определения генотипов HCV, нами
впервые в Санкт-Петербурге совместно с лабораторией молекулярной вирусологии
и генной инженерии НИИ PAMI1 (зав. лаб. М.П.Грудинин) было проведено изучение
генотипов вируса во взаимосвязи с тяжестью течения болезни.
Был обследован 41 больной, которые по данным ПЦР имели в сыворотке
крови РНК HCV. Для удобстваоценки полученных результатов все протипированные
вирусы обозначили в соответствии с классификацией Stuyver (одного из авторов
тест-системы для генотипирования "1NNO - LIPA HCV II). После установления
генотиповбыли получены следующие результаты: тип 1а выявлен у 6 человек, 1b
- у 23 человек, 2а - у 7 человек, За - у 3 и 1 b+За - у 2 человек.
Тяжелое течение наблюдалось только у больных с генотипами 1b и 2а, у
остальных доминировали среднетяжелые формы. В то же время у больных с
другими генотипами заболевание протекало или в легкой форме, или
среднетяжелой приблизительно с одинаковой частотой.
Среди больных с установленным генотипом вируса гепатитаС 23 человека,
как уже отмечалось выше, имели одновременно вирусный гепатит В. При
двойной инфекции тяжелое течение наблюдалось чаще, чем при моно гепатите
С. Соответственно это составило 18,8% и 5,6% случаев. Примечательно, что
ГВ встречался только у больных с гепатитом С, вызванных генотипом 1 b или
2а. Этот факт также указывает на то, что генотип 1 b вызывает более тяжелое
течение заболевание. При сравнении этих двух групп, где встречались все случаи
микст гепатитов, различия в характере заболевания были очевидными.
Подводя итоги результатам обследования на HCV-виремию и
генотипирование вируса, можно прийти к следующим выводам:
Преимущественно циркулирующим в Санкт-Петербурге генотипом HCV
является генотип 1 b (56,1%), реже встречается генотип 2а (17,1 %) и еще реже
- генотипы 1а и За (14,6% и 7,4% соотвественно). Возможно сочетанное
выявление двух генотипов НС V.
Не выявлено четкой зависимости между тяжестью течения острого и
415
хронического гепатита и генотипом HCV. Однако среднетяжелые и тяжелые
формы заболевания отмечены среди больных с генотипами 1b и 2а HCV.
У больных с острым и хроническим гепатитом С отмечена микст-
инфекция в сочетании с HBV инфекцией в 56,1%. При этом у 45,3% была
легкая, а у 65,7% - средней тяжести формы течения болезни, последняя
преимущественно у пациентов с генотипом lb HCV.
У больных с моно гепатитом С легкие формы были у 41,2% больных.
Острый гепатит имел преимущественно легкое течение, в то время как
хронический гепатит у половины больных протекал в форме средней тяжести.
Эти данные подтверждают высказываемую в литературе и нами точку
зрения, что хронический гепатит С у больных при репликативной форме
заболевания имеет медленно прогрессирующее течение со скудной клинической
симптоматикой и с мало измененными биохимическими показателями.
Представленные данные свидетельствуют об общности патогенеза,
клинических темпов развития болезни, длительности бессимптомной стадии и
неуклонно прогрессирующем течении, сдерживаемом так называемой
этиотропной терапией - интерфероном и рибавирином. Однако, в отличие от
ВИЧ-инфекции, этиотропная терапия гепатита С несовершенна.
Для лечения больных гепатитом С, также как и ВИЧ-инфекцией,
используется комбинированная противовирусная терапия. При ВИЧ инфекции
каждый из препаратов ингибирует конкретный фермент - обратную
транскриптазу (АЗТ, эпивир, хивид, зерит, видекс и другие), протеазу
(фортоваза, калетра, криксиван и др.). При гепатите С таких целенаправленных
препаратов еще не разработано, а используемые интерфероны и ребетол
(рибавирин) не являются специфичными для HCV этиотропными препаратами.
Наиболее известные препараты для лечения хронического гепатита -
интерфероны. Вирусологи считают интерферон идеальным противовирусным
веществом, ибо он действует на вирус в клетке и вне ее.
Биологическими исследованиями было установлено, что интерферон
индуцирует клетки не только после инфицирования вирусом, но и при воздействии
токсинов бактерий, а также веществ растительного происхождения. Известно,
что интерферон обладает не только противовирусным действием, но также влияет
на рост и размножение клеток и управляет иммунным ответом организма.
Большая часть вирусов не способна вызывать инфекцию в тех клетках, где
образовался интерферон, независимо оттого, чем вызвано его образование.
Интерферон, попадающий в клетки извне и разносимый кровью в
различные части организма, удаленные от первичного источника, также
препятствует развитию вирусной инфекции.
Механизм противовирусного действия интерферона объясняют
стимуляцией в клетке комплекса биохимических процессов, приводящих к
образованию противовирусных белков, которые препятствуют размножению
416
вирусов в клетке (рисунок 10).
Препараты интерферона (ИФ) пользуются наибольшей популярностью
в лечении больных ВГ, и в особенности хронических форм болезни.
Из трех известных препаратов интерферона - альфа, бета и гамма,
обладающих противовирусным, иммуномодулирующим и
антипролиферативными свойствами, широкую известность в терапии ВГ
получил интерферон альфа.
Применяют как нативный, так и рекомбинантный а-ИФН. Нативный а-
ИФН содержит практически все субтипы. К нативному а-ИФН относят
следующие препараты: велферон («Glaxo Wellcome», Великобритания),
эгиферон («Egis», Венгрия), альфаферон («Le-IFN альфа Си Эн Си», Италия).
В клинической практике последних лет широко применяют препараты а-ИФН,
получаемые с помощью рекомбинантной технологии. Препараты
рекомбинантного а-ИФН практически вытеснили природный. Их основным
преимуществом является высокий технологический уровень производства,
исключающий возможность контаминации какими-либо дополнительными
инфекционными агентами; недостатком - вероятность накопления
нейтрализующих противоинтерфероновых антител, что приходится учитывать
в процессе лечения. Поэтому нативный а-ИФН назначают больным вирусными
гепатитом при выявлении у них антител к рекомбинантному ИФН.
Иммуномодулирующие эффекты интерферонов при хронической
вирусной инфекции обусловлены:
- усилением экспрессии антигенов 1 класса главного комплекса
гистосовместимости (МНС);
- усилением активности цитотоксических Т-клеток;
- усилением активности естественных киллеров.
Противовирусный эффект обусловлен угнетением синтеза белков вируса,
изменением обменных процессов в клетках, возрастанием активности латентной
эндонуклеазы и синтезом олигоаденилсинтетазы. Эги ферменты подавляют
синтез вирусных белков и расщепляют уже созданные (Соловьев В.Д.,
Бектемиров Т. А., 1981).
Применение лейкоцитарного человеческого ИФ, который использовали
многие специалисты, было ограничено из-за его высокой стоимости и трудностей
получения. В последующем был использован генноинженерный ИФ альфа, и в
числе первых, кто показал его эффективность при гепатитах В и С, были
J.Hoofnagle et al. (1986, 1999). Авторами, а также их последователями было
установлено, что влияние на репликацию HBV оказываюттолько большие дозы
и пролонгированные курсы лечения. Однако даже при этом эффективность
лечения наблюдалась лишь у 1/3 больных.
Авторами было показано, что в процессе лечения у 2/3 больных
отмечается нормализация активности сывороточных ферментов, уменьшается
27-Заказ № К-4451. 4 1 7
Рисунок 10
Механизм действия интерферонов (F.Dianzani, S.Baron, 1994)
ДНК вирусы и РНК
ретровирусы
Этапы развития в клетке
▼
Раздевание
▼
Транскрипция
ДНК -> т РНК в ядре
Действие
функций тРНК
транскрипции
Т рансляция
Аппарат
Г ольджи
Протеины
2)ингибирование
трансляции
метилаза, 2’,5’
олигоаденилат-
циклаза
протеинкиназа
фосфодиэстсраза
тРНК
метилирование
функций
вирусной РНК
3)ингибирование
синтеза белков
ГЛИКОЗИ.1-
трансферазы
тРНК протеин
гликозирование
Сборка
вирусных
частиц
Глико
протеины
4) ингибиция
созревания
вирионов
гликозил-
трансфераза
Созревание
гликопротеинов
Отпочковывание
вирусов
Выход из клетки
Изменение
мембран
После связывание ИФ со специфическими рецепторами клетки, клетка
получает сигналы, нарушающие синтез белков
418
репликация вируса после 6 месячного лечения ИФ (3 раза в неделю по 3 ME).
Однако стойкая ремиссия продолжительностью более 2 лет получена при
использовании генноинженерного интерферона не у всех больных.
Выделяют следующие варианты ответа на интерферонотерапию: 1)
полный - клинико-биохимическое выздоровление, стойкое освобождение от
вирусов: многократно отрицательная ПЦР втечение 6 месяцев; 2) частичный
-улучшение клинико-биохимических показателей, исчезновение маркеров
репликации, снижение вирусной нагрузки; 3) отсутствие эффекта.
Факторами, предрасполагающими к полному ответу на
интерферонотерапию («идеальный» пациент) при хроническом гепатите С,
являются:
• отсутствие цирроза печени
• возраст моложе 50 лет
• HCV РНК низкое содержание в плазме
• HCV генотип не Го
Эффективность ИФ при хроническом гепатите С была изучена во
взаимосвязи с генотипами HCV. При ГС выявлена зависимость степени
чувстви тельности к ИФ в зависимости не только от генотипа вируса, но и от
степени виремии и стадии болезни. Так, J.Camps et al. (1993) показали,
что при ХГ эффективность ИФ терапии составляет 76%, а при ХГ с циррозом
- лишь 24%. По данным M.Kohara et al. (1995), лечение ИФ больных
гепатитом С 1 генотипа дает лучший эффект, чем при использовании
препарата при ГС II типа.
Обострения после отмены ИФ и резистентность больных с ГС к
препарату побуждают к поиску более совершенных способов терапии.
Ребетол является синтетическим аналогом гуанозина, полагают, что
препарат оказывает ингибирующий эффект на вирус зависимую РНК
полимеразу. Известно также, что ребетол обладает иммуномодулирующим
действием и повышает активность Т-хелперов в элиминации вируса гепатита
С. Преимуществом ребетола является возможность приема перорально в
виде капсул по 200 мг активного вещества. Ребетол не взаимодействует с
ферментами цитохрома С, однако он снижает эффективность азидотимидина
и ставудина, не воздействуя на ингибиторы протеаз ВИЧ. Ребетол применяют
внутрь в дозе по 1 000 мг в день в 2 приема вместе с пищей. Длительность
лечения зависит от клинического течения заболевания. Ребетол (рибавирин)
противопоказан при заболеваниях щитовидной железы, беременности,
тяжелой сердечной недостаточности, гемоглобинопатиях. Побочное
Действие ребетола проявляется в виде гемолизов с развитием анемии, возможно
появление крапивницы, бронхоспазма.
Таким образом, изучение результатов лечения рибавирином при
хроническом гепатите С в дозах 1000 - 1200 мг в день в 2 приема в течение 2
27*
419
недель показало отчетливое снижение уровня АлТ, при этом побочные эффекты
были минимальными (Reichard О. et al., 1991). Авторы считают перспективным
использование рибавирина в комплексе с альфа-интерферонами в лечении
больных хроническим гепатитом С.
Таблица 54
Результаты применения рибавирина при гепатите С
(Lai Ming - Lang et al, 1996)
Время Нормализация АЛТ Отрицательньй результат ПЦР Эффект
Рибавирин и а- интерфе рон Толь- ко интер ферон Рибавирин Интерферон Интерферон Рибавирин Интерферон индуцирован ный а-интер- ферон
К концу лечения (%) 16(76) 7(37) 19(90) 8(42) 16(76) 6(32)
После лечения % 24 недели 10(48) 2(H) 10(48) 2(11) 10(48) 1 (6)
48 недель 9(43) 2(H) 9(43) 1 (6) 9(43) 1 (6)
96 недель 9(43) 2(11) 9(43) 1 (6) 9(43) 1 (6)
He перспективно применение ИФН при следующих состояниях:
- Методы контрацепции, не исключающие беременность;
- Лечение программным гемодиализом;
- Прогрессирующая почечная недостаточность;
- Анемия в тяжелой форме (гемоглобин <11 g/dl);
- Гемоглобинопатия;
Автор предлагает следующие варианты лечения:
- Первичные пациенты: с виремией > 2 млн копий рекомендуется терапия
в течение 12 месяцев; с виремией <2 млн копий рекомендуется терапия в течение
6 месяцев;
- Пациенты, не ответившие ранее на моно- или комбинированную
терапию: рекомендуется лечение интерфероном-а и рибавирином в течение
6 месяцев.
Индукторы интерферона:
1. Циклоферон - иммуномодулятор, индуктор интерферона,
иммуностимулятор, ампулированная форма, 12,5% по 2 мл, в упаковке 10
таблеток, применяется по схеме через 1-2 дня в течение 1-4 месяцев.
420
повторными курсами, 4 таблетки в день перорально до 4-6 месяцев.
2. Амиксин - низкомолекулярный синтетический индуктор интерферона,
0,25 мг (таблетки) 2 раза в день 3 раза в неделю в течение 2-х недель, возможны
повторные курсы (Москва, НИИ ФХМ)
3. Гепатофальк-планта - обладает противовоспалительным действием,
содержит чистотел, обладающий противовирусным действием, стимулирует
синтез интерферона, применяется по схеме: капсулы по 140 мг, 100 мг, 25 мг,
применяется по2-3 капсулы втечение нескольких месяцев (фирма«Фальк»).
Цитокины: ронколейкин, беталейкин
Новым золотым стандартом в лечении гепатита В и С стал ПЕГ-
интерферон (ПЕГ интрон, пегасис). Молекулы пег-интрона массой от 12 до
20000 дальтон не выводятся почками и длительно циркулируют в организме.
Преимущество соединения интерферона с полиэтиленгликолем заключается
в удобстве дозировки - введение 1 раз в неделю, индивидуальным подбором
дозы - с учетом веса больного.
При этом наблюдается устойчивый вирусологический ответ в связи с
постоянной циркуляцией в крови активного интерферона и отсутствием
возможности выработки антител к препарату или резистентных штаммов.
Введение пег-интрона 0,5 мкг/кг в неделю в течение 12 месяцев в
сравнении с интерфероном 3 млн. ME 3 раза в неделю 12 месяцев
сопровождается устойчивым вирусологическим ответом у больных
хроническим гепатитом С - в 18% против 12% и в 25% против 18% при
увеличении дозы пег-интрона до 1 мкг/кг в неделю втечение 12 месяцев. При
этом новые побочные эффекты, специфические для пег-интрона, в сравнении
с интроном А не выявлены.
Авторы, использовавшие пег-интрон в дозе 1,5 мкг/кг и ребетол в дозе
10,6 мг/кг в течение года, отметили устойчивый ответ на лечение даже при
генотипе I (в 48% случаев) НС вируса, а при генотипе 2 и 3 - в 88% случаев. В
сочетании с рибавирином (гепатит С) или зеффиксом (гепатит В) пег-интрон
наиболее перспективен в сравнении с использованием интерферона по обычной
схеме (Блохина Н.П., 2000).
Существенно отметить, что больные с выраженным фиброзом печени
отвечали на лечение пег-интроном также хорошо, как больные с минимальным
фиброзом или без него (Pawlotsky J.M., 2000; Manns М.Р., 2000).
Однако, комбинированная терапия с использованием пег-интерферона
нередко сопровождается такими побочными эффектами, как гемолитическая
анемия, нарушения функции щитовидной железы и, в единичных случаях,
психические нарушения. Из-за этого отЗ до 7,6% больных прекращают лечение
ребетолом (Sherlok Sh., 1993).
В последние годы показано образование резистентных штаммов НС
421
вируса к противовирусным агентам вследствие, прежде всего, образования
антител к интерферонам и связывания ими интерферона, а также появления
квазиспециев, резистентных не только к интерферону, но и к рибавирину
(Pawlotsky G., 2000). Для улучшения качества терапии больных
интерферонами рекомендуется мониторинг противовирусной терапии,
включающий наряду с иммунологическими, вирусологическими и
морфологическими исследованиями определение антител к интерферону.
Мониторинг противовирусной терапии.
Давно известно, что каким бы не было хорошим лекарство, конечный
результат терапии всегда зависит оттого, насколько правильно оно используется.
Широкое внедрение в клиническую практику различных препаратов,
обладающих прямым или косвенным противовирусным эффектом, определило
необходимость разработки методологии их использования.
Противовирусная (этиотропная)терапия хронических вирусных гепатитов
является несомненно обоснованной, так как позволяет добиваться снижения
признаков воспаления в ткани печени и замедления прогрессирования
заболевания, исчезновения клинических симптомов болезни, приводит к
нормализации показателей цитолитического синдрома и прекращению активной
репликации вируса.
Отличительная особенность такой терапии заключается в том, что:
Требуется наукоемкое высокотехнологическое лабораторное
сопровождение;
J Терапия должна проводиться хорошо подготовленными
специалистами;
J Необходимо проводить динамическое наблюдение за наличием
ответа на лечение для корректировки дальнейшей тактики или отказа от терапии;
J Существует высокая вероятность возникновения временных
побочных эффектов от приема препаратов, требующих вмешательства
специалиста;
J Отсутствует быстрый результат терапии, что создает
дополнительные трудности психологического плана, как для пациента, так и
для врача;
J Необходим контроль отдаленных результатов;
J Терапия длительная и очень дорогая.
Указанные особенности определили необходимость разработки
методологии проведения противовирусной терапии при хронических
вирусных гепатитах.
На основании опыта проведения этиотропной терапии хронических
вирусных гепатитов в период с 1994 по 2000 год был разработан мониторинг
противовирусной терапии хронического вирусного гепатита С.
Для проведения мониторинга противовирусной терапии был разработан
комплекс медицинской документации, состоящий из:
1. Листа динамического наблюдения
2. Стандартизированных карт:
• предварительного обследования
• текущих визитов
•неожиданных визитов
•цитолитического криза
3. Лист сопутствующей терапии
4. Дневник пациента
5. Анкета оценки качества жизни
Обследование пациента проводится обычно в течение 3 месяцев в
соответствии с алгоритмом, отраженным в картах предварительного
обследования (-12; -8; -4 недели). За это время необходимо установить точный
этиологический диагноз, выявить сопутствующие заболевания, которые могут
являться противопоказанием для проведения такой терапии, а также определить
те критерии, которые позволят выбрать наиболее адекватный вариант
противовирусной терапии.
Особое внимание следует обратить на то, что на этом этапе в
обязательном порядке должны быть выполнены следующие исследования:
1. Определена вирусная нагрузка.
2. Определена выраженность цитолитического синдрома.
3. Установлено наличие или отсутствие маркеров других вирусных
гепатитов.
4. Определены предикторы результативной терапии.
5. Проведены: ультразвуковое исследование гепатобилиарной зоны,
органов брюшной полости и щитовидной железы;
6. электрокардиографическое исследование (как фоновое для
контроля возможных изменений в процессе терапии);
7. Получены данные пункционной биопсии печени, которые, наряду
с выраженностью цитолитического синдрома и уровнем вирусной нагрузки,
могут определять выбор препаратов и длительность лечения.
Конкретные параметры контроля могут варьировать в зависимости
от возможностей лечебного учреждения, однако чем шире проводится
обследование на этом этапе, тем меньше неожиданностей может
возникнуть в процессе терапии, точнее осуществляется подбор схемы
терапии и выше ее результативность. В целом можно сказать, что первые
визиты до начала терапии призваны определить:
1. Активность хронического вирусного гепатита С.
2. Имеет место моно или микст вирусная инфекция.
3. Выявить сопутствующую патологию, влияющую на выбор
терапии.
423
Особо следует остановиться на такой сопутствующей патологии, как
наркомания. Мы рассматриваем возможность терапии наркозависимых,
но не ранее чем через шесть месяцев после прекращения употребления
наркотиков. К сожалению терапия у таких пациентов малоперспективна,
так как во время ее проведения такие пациенты зачастую возвращаются к
употреблению наркотиков. Это не только снижает эффективность терапии,
но и представляет угрозу возникновения психических расстройств (вплоть
до суицидных попыток).
Сроки предварительного наблюдения могут достигать трех месяцев,
поскольку необходимо убедиться, что репликация вируса имеет
постоянный характер, определить динамику цитолитического синдрома,
подготовить пациента к дорогостоящей терапии, выявить сопутствующие
инфекции или состояния, требующие предварительного лечения. В
частности, с нашей точки зрения, целесообразно провести санацию
желчевыводящих путей, поскольку более 90% больных хроническими
вирусными гепатитами имеют воспалительные заболевания желчевыводящих
путей.
Карта текущего визита содержит информацию об основных клинико-
лабораторных параметрах, отслеживаемых в процессе терапии. Такая карта
разработана для каждого из запланированных визитов в течении всех 96 недель
ведения больного. На 0, 2, 4, 8, 20, 40, 60, 78, 96 неделях объем проводимых
клинико-лабораторных тестов должен, в первую очередь, обеспечивать контроль
за основными параметрами возможных осложнений терапии.
Углубленное обследование проводится на 12,24,36 и 48 неделях терапии,
которое включает в себя определение вирусной нагрузки, данные
инструментального обследования.
Карта 14 и 16 недели отличается от остальных карт объемом лабораторных
исследований, так как в это время возможен переход от монотерапии к
комбинированной терапии.
Изначально комбинированная противовирусная терапия может быть
изменена с полной сменой комплекса препаратов, как правило, на 14 и/или 26
неделе.
Повторная пункционная биопсия печени может проводиться в период с
48 по 96 неделю, но не ранее.
Карта неожиданного визита служит для регистрации данных в случае
самостоятельного обращения пациента при ухудшении самочувствия. Эта карта
не имеет большого количества фиксированных лабораторных тестов и
предоставляет врачу возможность выбрать план обследования пациента в
соответствии со своими собственными представлениями.
Карта цитолитического криза содержит лабораторный алгоритм,
позволяющий установить причины его возникновения на фоне проводимой
424
терапии.
Карта динамического наблюдения содержит абсолютные значения и
графическое изображение данных АЛТ, количественные и качественные
результаты ПЦР. Формируется врачом на основании данных карт текущего
визита для визуализации динамики процесса, оценки эффективности терапии
и возможности своевременного внесения коррекций в курс терапии.
Лист сопутствующей терапии позволяет четко отслеживать
дополнительную патогенетическую и симптоматическую терапию.
Дневник пациента необходим для субъективной оценки состояния
здоровья пациента; фиксации точной даты различных побочных явлений, а также
легкой сопутствующей патологии. Целесообразность ведения дневника пациента
обусловлена длительностью амбулаторного этапа терапии и необходимостью
фиксировать состояние пациента в промежутках между визитами к специалисту.
Анкета оценки качества жизни, которая заполняется 7 раз в течение
двухлетнего периода, позволяет объективно оценить этот важнейший параметр
как в процессе лечения, так и в период дальнейшего наблюдения за пациентом.
Таким образом, мониторинг противовирусной терапии направлен на:
• стандартизацию технологии обследования и лечения пациентов,
• исключение возможных ошибок, существенно влияющих на проведение
терапии,
• предотвращение необоснованных вариаций терапии,
• снижение вероятности появления выраженных побочных эффектов
препаратов в процессе лечения,
• помощь лечащему врачу в проведении обследования.
Использование мониторинга предоставляет дополнительные
возможности для сопоставления результатов терапии, проводимой в различных
центрах и способствует внедрению противовирусной терапии в широкую
клиническую практику.
Для пациента мониторинг дает четкое представление о сроках лечения,
достигнутых результатах и делает его “соучастником” терапии.
10.2. Вирусный гепатит С и ВИЧ
Гепатит С приравнивают к оппортунистическим инфекциям при ВИЧ/
СПИДе вследствие утяжеления последнего.
425
ЛИСТ ПРЕДВАРИТЕЛЬНОГО ОБСЛЕДОВАНИЯ
ФИО № Пол
Вес возраст
Дата 1
Предварительный визит 1 1 2 -8 _ 11 -4 i
Недели до начала терапии । -12
Вирусологическое обследование 1
HBsAg L. - 1
HBsAb 1 . 1 1
HBcorlgM ’HBcorIgG_ _HBcAg HBcAb |>’пи liduuvo ihMwviH
PCR DNA HBV ~l 1
HCVAb ищем мшим -J
HCV Ab IgM
PCR RNA HCV 1,:!ЧСС1 пенно количест I
HDVAbJgM HDV Ab IgG 'ври не> ('холимое! и •при иео^юда^ости 1
PCR RNA HDV при пеоУдимости ( 1
HIV 1
CMV _AbJgM Г CMV Ab IgG f г" - ~ ।
PCR CMV Г ! i
EBV_AbJgG ; EBV Ab IgM 1 f !
EBV_PCR___
HGVPCR__ _
ttvdnapcr
_____________________Другие исследовани1!
а-фетопротсин__________________I________
НТ - - - - . ... .
Ab _к тиреоглобулину i Ab к тирсоидпероксидазе 1 I1 ' _,! —-jl ... i
AN As । Anti-LKM 1 . .. .j
Иммунограмма ।
CD4 । CD 8 । _NK | CDI6 j Генотипирование HCV 1 _ ц я ! • J ! s L .. Я j 1 -J
426
ЛИСТ ПРЕДВАРИТЕЛЬНОГО ОБСЛЕДОВАНИЯ (продолжение) '
ФИО№Пол;
Вес Возраст
Дата 1
Предварительный визит 1 2 3
11едели до начала терапии -12 -8 -4
Клинический анализ крови
Эритроциты Гемоглобин Лейкоциты Нейтрофилы Лимфоциты Моноциты - 11
Тромбоциты СОЭ ' '/4' - О —
_____Биохимический анализ крови
АЛТ ".
Билирубин * . J
ЩФ
Холестерин
ггтп
Протромбин
Креатинин
Мочевина
Глюкоза
Амилаза
Fc
К
Na
Протеинограмма
Альбумины
Альбумин/глобулиновый
коэффициент
Р-глобулин
у-глобулин
Общий анализ мочи
_Белок
_Сахар
-Эритроциты
.Лейкоциты
Диастаза
427
Частота выявления смешанной инфекции HCV/ВИЧ среди пациентов из
групп высокого риска (Dieterich etal., 1999):
- 30-40% среди всех ВИЧ-инфицированных,
10% среди пациентов с HCV-инфекцией,
- 85% среди пациентов с гемофилией,
- 52-90% среди в/в наркоманов,
- 4-8% среди ВИЧ-инфицированных гомосексуалистов.
Риск трансмиссии (Rey Stuart, 2001) HCV инфекции в сравнении с ВИЧ
инфекцией при парентеральных вмешательствах в 10 раз выше: 5% против 0,5%
(соответственно при уколах иглой), а перинатальная передача НС V в 5 раз ниже
верти калькой трансмиссии ВИЧ у нелеченных беременных (5% против 25%).
У инъекционных наркоманов HCV инфекция развивается примерно в
течение первых 10 месяцев использовании наркотиков, I IBV инфекция - в 60%
, а ВИЧ инфекция - в 20% (Garfein et al., 1996).
Однако в случае коинфекции ВИЧ и HCV риск перинатальной трансмиссии
возрастает для обеих инфекций.
Таблица 55
Частота перинатальной трансмиссии при коинфекции HIV/HCV
(адаптирована Herchow et al 1997, Rey Stuart 2001)
Г HCV перинатальная передача_____; HIV перинатальная передача_____
HCV - HIV- (22 пациента) - 35% _ ~_i. HCV • Н1\ (161кациешов) -25%
। HCVtHIV-(94 пациента) - 0.1% . HIV 'НСV-(326 пациентов) - 18% i
Г ед .
1________.___.____________________J______________________________ ._
Передача HCV инфекции половым путем значительно выше при
ассоциированной с ВИЧ инфекции в сравнении с моноинфекцией.
По сравнению с HCV моноинфекцией при смешанной инфекции ВИЧ i-HCV
имеет место более высокая частота развития цирроза, более тяжелое течение
HCV инфекции, более высокая летальность вследствие болезни печени
(McGovan, 1999). Низкое количество CD4: клеток, злоупотребление алкоголем
и длительность HCV инфекции ассоциируются с быстрой прогрессией
заболевания. Это особенно выражено у больных, систематически
употребляющих алкоголь более 50 грамм в день и при CD4 ниже 200/мм3
(Benchamon et al., 1999). Более 50% больных ВИЧ-инфекцией, умерших от
заболеваний печени, имели РНК ВИЧ < 400 копий/мл или количество CD4'-
лимфоцитов >200 клеток/мм3.
• Возникает необходимость отмены АРВТ из-за гепатотоксичности при
HCV инфекции (Melvin D. et al., 2000).
Таким образом, негативное влияние высокой РНК HCV на прогрессию
ВИЧ инфекции и проводимую АРВТ снижает продолжительность жизни
428
Рисунок 11. HCV+HIV инфекция: географическое распределение
Частота обнаружения HCV среди ВИЧ-инфицированных
(по данным, опубликованным или нпелставленным в 1990-2001 ггЛ
В настоящее время заболевания печени - основная причина смерти
больных ВИЧ-инфекцией, не связанная со СПИДом, преимущественно среди
инъекционных наркоманов (CHORUS database).
Таблица 56
Смертность от печеночной недостаточности пациентов с ВИЧ-
инфекцией (Garcia-Samaniego J. et al., 2002)
Случаи Испания Италия
1991-1995 1996-2000 1987 1996
Смерти в госпитале 312 137 305 46
Заболевания печени 15 (5%) 36 (26%) 35 (13%) 16 (35%)
Частота внепеченочных проявлений, таких как криоглобулинемия,
порфирия кожи, лимфомы, диабет увеличивается при приеме алкоголя, что
более выражено при ВИЧ инфекции (Mehtas, 2000)
Подчеркивая значение гепатита С инфекции как оппортунистический для
ВИЧ инфекции, следует отметить, что у коинфицированных пациентов выше
HCV РНК (вирусная нагрузка) в сравнении с моноинфекцией, и при этом
отмечается более быстрая прогрессия гепатита к циррозу печени при CD4 ниже
200/мм3 (Thomas D., et al 2000).
При этом риск частоты смертельных исходов выше при коинфекции ВИЧ/
HCV (Darby S.et al, 1997).
Сочетанные отягощающие факторы HCV и ВИЧ инфекций:
• Более быстрая прогрессия HCV инфекции при продвинутой ВИЧ
инфекции с более быстрыми темпами развития фиброза в печени, в особенности
у инъекционных наркопотребителей (Bica J. et al., 2001).
• В более короткие сроки развитие цирротической стадии со смертельным
исходом.
• Развитие первичного рака печени в молодом возрасте.
• Вертикальная HCV трансмиссия в 15-36% при коинфекции с ВИЧ против
5% только при наличии HCV (Thomas D. et al., 1998).
Высокий риск прогрессии ВИЧ болезни наблюдался среди HCV
инфицированных пациентов, которые продолжали оставаться активными
инъекционными наркоманами.
Влияние гепатита С на ВИЧ инфекцию:
• Высокий уровень вирусной нагрузки РНК HCV определяет скорость
прогрессии ВИЧ инфекции (Daar Е. etal., 2001).
• Отрицательное влияние HCV на антиретровирусную терапию (АРВТ),
повышение гепатотоксичности.
430
больных ВИЧ/СПИДом.
ВИЧ может затруднять лабораторную диагностику как ВИЧ инфекции,
так и гепатита С. Это наиболее выражено у больных, находящихся в стадии
СПИДа. Ввиду этого, при наличии патологии печени для установления ее
вирусной этиологии необходим комплекс лабораторных исследований в
динамике.
Описан случай посттравматического инфицирования ВИЧ и вирусом
гепатита С медицинского работника, у которого антиВИЧ были выявлены спустя
9,5 месяцев, а антиНСУ через 13,5 месяцев. В дальнейшем у больного развилась
печеночная недостаточность со смертельным исходом через 28 месяцев после
заражения (Ridzon R. et al., 1997).
Результаты изучения состояния печени при ВИЧ-инсЬекиии.
При гистологическом исследовании биоптатов у пациентов с ВИЧ
инфекцией в стадии начальных проявлений болезни (ПГЛ) выявлено
повреждение печеночной паренхимы у всех пациентов (Рахманова А.Г. и соавт.,
1989). Наиболее частыми изменениями, встретившимися во всех образцах
биоптатов, были следующие: появление гепатоцитов со светлой оксифильной
цитоплазмой и с пылевидной хологенной пигментацией; неравномерно
выраженные дистрофические изменения цитоплазмы по типу зернистой и
вакуольной дистрофии; ядерно-ядрышковый полиморфизм; пролиферация
купферовских клеток. Кроме того, обнаружена умеренная мононуклеарная
инфильтрация вокруг отдельных гепатоцитов, не выходящая за пределы
терминальной пластинки. У 4 инфицированных в биоптатах найдены крупные
жировые вакуоли в гепатоцитах. В 4 образцах отмечены изменения портальных
трактов, характеризующиеся умеренной мононуклеарной инфильтрацией,
колл аге н и зац ие й.
Таким образом, в биопсийном материале ткани печени, полученном у
Инфицированных ВИЧ, обнаружены цитоплазматические и кариологические
изменения гепатоцитов при наличии скудной воспалительной мононуклеарной
внутридольковой и портальной инфильтрации, что может быть расценено как
следствие генерализованной вирусной инфекции, возможно, вызванной
ВИЧ.
Таким образом, на ранних стадиях ВИЧ-инфекции:
1. При обследовании пациентов, инфицированных половым путем, были
обнаружены изменения печеночной ткани у лиц, не имеющих маркеров
вирусных гепатитов.
2. Гепатомегалия в сочетании с персистирующей генерализованной
лимфаденопатией является ранним клиническим признаком ВИЧ инфекции. У
инфицированных ВИЧ на стадии ПГЛ имеются изменения функциональных
проб печени - уменьшение содержания альбумина в сыворотке крови,
431
снижение уровня сулемовой пробы.
3. Гистологические изменения печеночной паренхимы на стадии ПГЛ
характеризуются слабо выраженными признаками цитолиза, холестаза и
умеренным мезенхимально-воспалительным синдромом. При СПИДе эти
изменения усугубляются - возникают дистрофия печеночных клеток (макро- и
микростеатоз), воспалительная внутридольковая и перипортальная
инфильтрация.
Эти изменения являются субстратом для прогрессирующих изменений
печени при коинфекции HCV. В отличие от моноинфекции гепатит С у ВИЧ-
инфицированных имеет прогредиентное течение без длительной латенции.
ВИЧ-инфекция и гепатит С по .материалам инфекционных
стационаров г. Санкт-Петербурга
При анализе данных о ВИЧ инфекции в сочетании с ВГС до вовлечения в
эпидемию наркопотребителей, по нашим результатам, из более чем 3000 ВИЧ
инфицированных пациентов ВГС был установлен у 89 - 2,97%. Количество
ВИЧ инфицированных с коинфекцией HBV и HCV резко увеличилось за
последние 3 года и составило 96,6%, при этом:
HIV+HBV выявлено у 42,7%,
HCV+HIV-у 48,8%,
микст инфекция HBV+HCV+HIV-у 34,8%.
У всех больных с коинфекцией вирусными гепатитами и ВИЧ в анамнезе
была инъекционная наркомания, большинство из них были в возрасте 20-30
лет. У 47% уровень АЛТ был увеличен в 1,5-3 раза, билирубин в 1,5 раза.
Количество CD4 составляло 816,17±82,56 среди коинфицированных пациентов
и намного реже было менее 500 клеток/мм3. Вирусная нагрузка у 14 пациентов
с коинфекцией HBV, HCV и ВИЧ составляла 54885± 15872 (1260-264300) копий
РНК ВИЧ/мл и 436566±28414 копий РНК HCV/мл (35930-848712). Эти данные
приведены в таблице 57.
Сумарные данные о взаимоотягчающем влиянии HCV и ВИЧ-инфекции
приведены в таблице 58.
Алгоритм лечения хронического гепатита С у пациентов с ВИЧ инфекцией
(Berenguer J. etal., 2002).
Если имеется повышение АЛТ в течение 6 месяцев и наличие РНК HCV
в крови, необходимо учесть следующие данные:
432
1аказ№ К-4451.
Таблица 57
Клинические и лабораторные показатели у пациентов с коинфекцией ВИЧ и вируса гепатита С
ф. Срок инфици рования ВИЧ (мес.) Стаж употреб ления наркоти ков (годы) ACT (N 0-45 ед/л) АЛТ (N 0-50 ед/л) Билиру- бин N 2-21 мкмоль/ л ЩФ N 21-150 ггтп N 0-65 Тромбо циты N 140- 415 HCV RNA PCR IU/ml H1V-1 RNA PCR copies/ ml CD4+, % N 38-46 CD4+, абс. N 700- 1100
Б 12 3 39 67 21 58 37 163 503043 44 884 24,2 339
К 12 5 50 72 15 75 44 201 382653 141285 23 548
Щ 12 6 24 31 19 58 44 259 677 797 57619 21 732
У 12 1 48 96 12 49 51 119 520 450 37 364 2865 521
3 6 2 17 25 17 65 121 222 600 34 938 20,7 455
ч 12 2 41 86 7 43 23 343 235 021 58 248 29 800
м 12 1 34 61 17 78 30 174 346 951 56 905 34,8 804
Е 6 1 57 123 14 77 61 154 54418 37 261 36,4 983
Я 12 1 35 45 31 69 46 189 35 930 264 300 40 777
л 6 2 24 23 19 50 23 309 600 42 543 28,6 653
А 6 1 27 33 12 71 44 258 478 012 39 220 21,4 493
Таблица 58
Сочетанные отягощающие факторы HCV и ВИЧ инфекций
❖ Более быстрая прогрессия HCV инфекции при продвинутой ВИЧ инфекции с
более быстрыми темпами развития фиброза в печени, в особенности у
инъекционных наркопотребителей (Bica J. Et al., 1998)
❖ В более короткие сроки развитие цирротической стадии со смертельным
исходом
❖ Развитие первичного рака печени в молодом возрасте |
❖ Вертикальная HCV трансмиссия в 15-36% при коинфекции с ВИЧ против 5% :
только при наличии HCV (Thomas D. et aL, 1998)
ВИЧ инфекция у пациентов с гепатитом С I
❖ Высокий уровень вирусной нагрузки РНК HCV определяет скорость i
прогрессии ВИЧ инфекции (Daar Е. Et al., 2001)
❖ Отрицательное влияние HCV на антиретровирусную терапию (АРВТ),
повышение гепатотоксичности
❖ Возникает необходимость отмены АРВТ из-за гепатотоксичности при HCV
инфекции (Melvin D. et al., 2000) I
Вывод: негативное влияние высокой РНК HCV на прогрессию ВИЧ инфекции и |
проводимую АРВТ, снижает продолжительность жизни больных ।
_________ВИЧ/СПИДом.____________________________________________________
Особенности терапии гепатита С при ВИЧ инфекции
Частота длительной ремиссии гепатита С при лечении альфа интерфероном ;
(ИФН) одинакова у ВИЧ позитивных и ВИЧ негативных - 22,5% и 25,9% I
(Soriano V. Et al., 1996, 1997) i
При «продвинутой» ВИЧ инфекции и низком уровне CD4 лимфоцитов эффект ।
ИФН терапии снижается (Neumann A. et al., 1998).
При генотипе 1 и выраженном фиброзе длительность лечения 1 год, для !
остальных - 6 месяцев. I
При коинфекции HCV + HIV год лечения более эффективен при любом ।
вирусологическом ответе.
ИФН 3-5 млн МЕЗ раза в неделю может вызвать быстрое снижение CD4
лимфоцитов, но это результат перемещения их в лимфоидные органы, 1
поэтому у большинства больных это обратимо (Landau A. et al., 2000).
Пег ИФН 1,5 мкг/кг еженедельно + рибавирин 400 мг 2 раза в день (13±2 мкг/кг) ;
на фоне АРВТ в течение 1 года и более (Bril 1 ianti et al., 1999).
Лабораторный мониторинг антивирусной терапии HCV + HIV коинфекции:
- ежемесячный контроль биохимических показателей,
- определение уровня CD4 лимфоцитов, РНК HCV определять каждые 3 !
месяца
Рекомендуют при CD4>500/mm3 обеспечить лечение гепатита С, при CD4 200-
500/мм3 и РНК ВИЧ менее 5000 копий в мл - лечить в первую очередь гепатит
С, при cd4 ниже 100/мм3 - лечение ВИЧ инфекции с назначением ВААРТ
I приоритетно (Bartlet L, 2002)____________________ ________________
434
Рисунок 12. Диаграмма сравнения вирусной нагрузки у пациентов
исследуемой и контрольной групп
VL - совокупность пациентов с ВИЧ-инфекцией;
VLC - совокупность пациентов с коинфекцией ВГС.
Рисунок 13. Диаграмма сравнения количества CD4+ лимфоцитов
(клеток/мм3).
CD4 - совокупность пациентов с ВИЧ-инфекцией;
CD4C - совокупность пациентов с коинфекцией ВГС
Box & Whisker Plot
1200
1100
юоо
900
800
700
600
500
400
□
□
CD4 CD4C
~Т~ ±Std. Dev.
I I ±Std. Err.
□ Mean
435
28*
Особенности терапии гепатита С при ВИЧ инфекции
Стандартная терапия HCV инфекции апьфа-интерфероном способствует
антивирусному эффекту, потенциируя клеточный иммунный ответ. Наиболее
приемлимый режим 3 ME 3 раза в неделю, который снижает HCV вирусную
нагрузку и переносится лучше, чем более высокие дозы. Вместе с тем, многие
авторы отмечают, что более эффективен Пег-интерферон (Heathcoate Е et al
2000, Zeuzem S et al 2001).
Для предупреждения рецидивов HCV инфекции необходимо
комбинировать альфа-интерферон с рибавирином. При этом наиболее стойкий
эффект наблюдается у больных со 2-м или 3-м генотипом HCV вируса. Для
таких пациентов достаточна терапия в течение 6 месяцев, в то время как при
других генотипах лечение необходимо продолжать втечение года.
Побочные эффекты интерферона, такие как депрессия, боли, лихорадка,
нейтропения, тромбоцитопения, дисфункция щитовидной железы, выпадение
волос, неблагоприятны для ВИЧ инфекции. Побочные эффекты рибавирина,
включая анемию, тератогенность, требуют коррекции человеческим
эритропоэтином.
Схема 5
Терапевтический режим:
HCV генотип 1 или 4 HCV генотип 2 или 3
I
I
I
Пегинтрон + рибавирин Пегинтрон + рибавирин
1000-1200 мкг (75 кг) или
1,5 мг/кг/недслю (более 75 кг) IFN альфа + рибавирин
(3 млн. 3 раза в неделю)
ПЦР к 24 неделе
заболевания
Отрицательна
4 позитивных фактора: 4 негативных фактора
1) генотип 2 или 3
2) исходная HCV РНК <3,5x106
копий/мл
3) стадия фиброза 0 (или 1) без
септ
4) женщины, возраст до 40 лет
заверши лечение к 48 неделе рассмотреть продолжительность
лечения
436
- контроль за ВИЧ инфекцией (CD4 и вирусная нагрузка),
- хорошая переносимость ВААРТ,
- отказ от алкоголя и наркотиков,
- отсутствие противопоказаний к терапии ИФН и рибавирином,
- возможность соблюдать режим лечения,
- биопсия печени, генотип HCV и вирусную HCV РНК нагрузку,
- контрацепция 6 месяцев.
Частота длительной ремиссии гепатита С при лечении альфа
интерфероном (ИФН) одинакова у ВИЧ позитивных и ВИЧ негативных - 22,5%
и25,9%(Soriano V. etal., 1996, 1997).
При «продвинутой» ВИЧ инфекции и низком уровне CD4 лимфоцитов
эффект ИФН терапии снижается (Neumann A. etal., 1998).
При генотипе I и выраженном фиброзе назначают ИФН и рибавирин 400
мг 2 раза, длительность лечения 1 год, для остальных - 6 месяцев. При
коинфекции HCV + HIV год лечения более эффективен при любом
вирусологическом ответе.
Считают, что ИФН 3-5 млн ME 3 раза в неделю может вызвать быстрое
снижение CD4 лимфоцитов, но это результат перемещения их в лимфоидные
органы, поэтому у большинства больных это обратимо (Landau A. et al.,
2000). Рекомендуют использовать Пег ИФН 1,5 мкг/кг еженедельно + рибавирин
400 мг 2 раза в день (13±2 мкг/кг) на фоне ВААРТ в течение 1 года и более
(Brillianti et al., 1999)
Лабораторный мониторинг антивирусной терапии HCV + HIV
коинфекции должен включать ежемесячный контроль биохимических
показателей, определение уровня CD4 лимфоцитов, РНК HCV определять
каждые 3 месяца (мониторинг HCV-инфекции приведен выше).
Специальными исследованиями было показано, что комбинированная
антиретровирусная терапия при сочетанной ВИЧ и HCV инфекциях оказывает
более токсическое влияние на печень, существенно повышая уровень трансфераз
(АЛТ, ACT) (Sulkowski М. et al 2000).
Приведенные в таблице 59 данные свидетельствуют о том, что
гепатотоксичность наблюдается преимущественно на ритонавир и еще более
выраженная - на сочетание с саквинавиром.
В то же время другие препараты не демонстрируют столь высокую
гепатотоксичность. В исследованиях когорты из 30 пациентов, получавших
мощную антиретровирусную терапию между 1996 и 1999 годами, у пациентов
с наличием HCV инфекции в 30% случаев наблюдалась относительно высокая
прогрессия к СПИДу или смерти.
Механизм повреждения печени при ВААРТ (Garcia-Samaniego J. et al.,
2002) объясняют следующими факторами:
- прямой цитопатический эффект (например, ритонавир),
- синдром иммунной перестройки у больных с гепатитом С,
437
Таблица 59
Частота гепатотоксичности (повышение активности АЛТ,
ACT) при сочетанных HCV и ВИЧ инфекции: примерный процент
случаев на сто лиц в месяц (адаптировано Sulkowski М. et al., 2000)
препараты HCV- H1V+ HIV+ HCV+
нельфинавир 1,5 3,1
2 нуклеозидных ингибитора обратной транскриптазы 1,5 4,1
индинавир 2,7 3,8
саквинавир 0,8 4,1
ритонавир 7,2 9,1
Ритонавир+саквинавир 8,8 18,5
- гиперчувствительность (невирапин, абакавир),
- холестаз (индинавир, невирапин),
- митохондриальная токсичность и стеатоз (например, зерит, АЗТ).
У пациентов с HCV длительно персистировала ВИЧ вирусная нагрузка
свыше 400 копий в мл в сравнении с HCV пациентами, у них также отмечена
супрессия CD4 клеток (Greub G. et al., 2000).
В связи с тем, что нелеченная ВИЧ инфекция обычно фатальна, лечение
ВИЧ болезни должно быть первичным для коинфицированных пациентов,
однако в каждом конкретном случае необходимо уточнить, нуждается ли гепатит
С в предшествующем лечении до назначения антиретровирусной терапии.
Решение должно быть основано на результатах биопсии, которая должна
повторяться каждые 2 или 3 года у пациентов с прогрессирующим фиброзом
печени (стадия 3,4). Лечение должно быть начато независимо от уровня CD4
клеток для предупреждения смертельного исхода от печеночной
недостаточности. При слабом или умеренно выраженном фиброзе, стабильной
HCV инфекции и сохраненной иммунной функции (CD4 выше 350/мм3) также
следует лечить HCV инфекцию, если вирусная нагрузка высока. Лечение не
рекомендуется больным с декомпенсированным заболеванием печени.
Лечение HCV инфекции Пег-интерфероном и интерфероном должно
быть, как отмечено выше, длительностью не более 6 месяцев. В течение лечения
обоих заболеваний необходимо определять уровень печеночных ферментов,
уровень CD4 клеток, РНК ВИЧ и HCV.
438
Таблица 60
Ответ на интерферонотерапию больных с хроническим гепатитом
С с ВИЧ позитивным статусом (Garcia-Samaniego J. et al., 2000)
ВИЧ+ (п=80) ВИЧ- (п=27)
Ранний ответ (3 мес. от начала лечения) 38,8% 44,4%
Ответ к концу лечения (12 мес. от начала лечения) 32,5% 37%
Устойчивый ответ (12 мес. после окончания лечения) 22,5% 25,9%
Лабораторный мониторинг антивирусной терапии HCV + HIV
коинфекции:
- ежемесячный контроль биохимических показателей
- уровень CD4 лимфоцитов, РНК HCV определять каждые 3 месяца.
Лечение гепатита В при ВИЧ инфекции более перспективно, чем гепатита
С, ввиду того, что имеются антиретровирусные агенты, воздействующие на
HBV. К их числу относится ЗТС (ламивудин), адефовир итенофовир. Причем
последний оказался эффективен и при инфекции, вызванной HBV-мутантом.
Критерии для пересадки печени больным с ВИЧ-инфекцией и конечной
стадией заболеваний печени (Garcia-Samaniego J. et al., 2002) такие же, как для
общей популяции. При этом должны соблюдаться следующие условия:
а) ВИЧ-инфекция бессимптомная с CD4 более 500/мм3, вирусной
нагрузкой не более 10000 копий РНК ВИЧ;
б) больные на антиретровирусной терапии без стадии С в прошлом
(исключая туберкулез) и CD4 лимфоцитами более 200/мм3 и вирусной нагрузкой
на неопределяемом уровне (менее 200 копий/мл Ампликор);
в) наркоманы: отказ от героина и кокаина более 2-х лет, отсутствие
алкоголизма последние 6 месяцев.
При проведен и и трансплантации печени в целях экстренной профилактики
гепатита В может быть использован специфический иммуноглобулин человека-
гепатект. Гепатект изготовлен из плазмы здоровых, полноценно
обследованных доноров. Многоступенчатая инактивация вирусов
посредством специальных процессов полностью исключает риск передачи
различных вирусов.
1 мл гепатектасодержит95% иммуноглобулина, ампулы по 2 мл (100 ME)
и 10 мл (500 ME). После инокуляции материала, подозрительного на содержание
гепатита В, вводят 6-12 ME (0,12-0,20 мл) гепатекта на кг массы тела, но не
менее 10 мл. В отделениях гемодиализа инъекция 7 ME (0,14 мл) гепатекта на кг
массы тела.
Для профилактики инфицирования трансплантата печени у HBsAg
положительного пациента внутривенно вводят во время операции после
439
удаления печени реципиента и до трансплантации новой печени 10 000 ME (200
мл) гепатекта, в послеоперационном периоде в течение 7 дней 2000 ME (40 мл).
Минимальная длительность терапии 6 месяцев.
Для профилактики гепатита В у новорожденных применяют гепатект
непосредственно после рождения однократно в дозе 20 ME (0,4 мл) на кг массы
тела, но не менее 2 мл.
Не исключается, напротив, даже рекомендуется пересадка печени
больным с ВИЧ-инфекцией и прогрессирующими вирусными гепатитами.
Таким образом, сочетанные ВИЧ-инфекция и гепатит С (коинфекция)
имеют неблагоприятное течение. Каждое из этих двух заболеваний приобретает
прогредиентный прогрессирующий характер с более высокими значениями
показателей высокой репликативной активности вирусов: АЛТ и уровень
HCV РНК при гепатите С, а при ВИЧ-инфекции - уровень РНК ВИЧ и
степень снижения CD4 лимфоцитов.
Однако, при этом сроки инфицирования и длительность хронической
болезни могут иметь решающее значение для назначения конкретной терапии.
Как правило, наркопотребители прежде всего заражаются гепатитом С и позднее,
реже одновременно, ВИЧ. Ввиду этого, первично они нуждаются в мониторинге
и лечении гепатита С на самом наилучшем уровне (пег-интрон, пегасис,
рибавирин), позволяющем освободиться от возбудителя. В иных
неблагоприятных ситуациях, когда имеет место неуспех терапии гепатита С и/
или прямые показания к лечению ВИЧ-инфекции, возможно сочетанное лечение
этих заболеваний с назначением пегилированных форм интерферона и
антиретровирусных препаратов с относительно низкой гепатотоксичностью.
Гепатит С, как одна из наиболее частых коинфекций у наркопотребителей
с ВИЧ-инфекцией обязывает к разработке более совершенных комбинированных
методов обследования и лечения.
440
Литература:
1. Буеверов А.О. «Место гепатопротекторов в лечении заболеваний
печени» И РМЖ Болезни органов пищеварения, 2001, №1,16-18.
2. Буеверов А.О. Хронический гепатит С с аутоиммунными проявлениями
И Мир вирусных гепатитов. -2000. -№12. С. 6-9.
3. Виноградова Е.Н. Вирусные гепатиты В и С (проблемы диагностики и
терапии): Автореф... дис. д-ра мед. наук. -СПб., 1997. -38 с.
4. Виноградова Е.Н. Вирусный гепатит С. - СПб, 1995. - С. 41.
5. Вирусные гепатиты и другие актуальные инфекции. Сборник научных
работ под ред. А.А.Яковлева, Е.Н.Виноградовой в 2-х томах. СПб,
ССЗ., 1997,с.215.
6. Жмуровская Л.С., Ключаева А.А. Вирусные гепатиты сочетанной
этиологии у лиц, использующих введение психоактивных веществ
внутривенно И Мир вирусных гепатитов. -2000. -№ 12. С. 3-5.
7. Мукомолов С.Л. Вирусный гепатит С. Клинико-эпидемиологическая и
лабораторная характеристика: Автореф. дис.... докт. мед. наук. - СПб,
1994.- 35 с.
8. Рахманова А.Г., Пригожина В.К., Смирнов А.В. и др. Поражение печение
у инфицированных вирусом иммунодефицита человека// Клиническая
медицина.-1989. -№ 11.-С. 44-47.
9. Серов В.В., Постникова Т.Н., Бродская И.К. Сочетанная вирусная
(HCV+HBV) патология печени // Новые направления в гепатологии:
Тез. междунар. Фальк симп. № 92. - СПб., 1996. - С. 352.
10. Серов В.В., Северина Л.О., Секамова С.М. и др. Сравнительная
характеристика вирусных гепатитов В и С // Арх. патологии. - 1996. -
№ 5. - С. 40-47.
11. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей / Перевод
с английского. -Москва. -1999. -860 с.
12. Яковлев А.А., Виноградова Е.Н., Рахманова А.Г. Хронические вирусные
гепатиты. - СПб, 2002.
13. Aach R.D., Stevens С.Е., Hollinger F.B., et al. Hepatitis C virus infection
in post-tranfusion hepatitis.An analysis with first- and second-generation
assays //N.Engl.J.Med. - 1991. - Vol.325. - P.1325-1329.
14. Abe K.., Inchauspe G., ShikataT., Prince A.M. Three different patterns of
hepatitis C virus infection in chimpanzees// Hepatology. -1992. - Vol.l5.
-P.690-695.
15. Alan B., Drogan O., Farelli M. Detection of a common deletion in the
mitochondrial DNA of patients with chronic hepatitis C and hepatic steatosis
// Hepatology. -2000. -abstract 32, 259.
441
16. Alter M.J., Margolis H.S., Krawczynski K., et al. The natural history of
community-acquired hepatitis C in the United States // N.Engl.J.Med. -
1992.-Vol.327.-p.1899-1905.
17. Bach N., Thung S.N., Schaffner F. The histological features of chronic
hepatitis C and autoimmune chronic hepatitis: A comparative analysis //
Hepatology. - 1992. - Vol. 15. - P.572-577.
18. Benhamou Y., Bochet M., DiMartinp V., et al. Liver fibrosis
progression in human immunodeficiency virus and hepatitis C virus
coinfected patients. The Multivirc Group // Hepatology. -1999. -V.
30.-P. 1054-1058.
19. Bril lanti S., Garson J.A., Tuke P.W. Effect of alpha-interferon therapy on
hepatitis C viremia in community-acquired chronic non-A, non-B hepatitis:
A quantitative polymerase chain reaction study // J.Med.Virol. - 1991.-
Vol.34.-P.136-141.
20. Chen D.S., Kuo G.C., Sung J.L., et al. Hepatitis C virus infection in area
hyperendemic for hepatitis В and chronic liver disease: The Taiwan
experience // J.Infect.Dis. - 1990. - Vol. 162. - P.817-822.
21. Cristiano K., Di Bisceglie A.M., Hoofnagle J.H., et al. Hepatitis C viral
RNA in serum of patients with chronic non-A, non-B hepatitis: Detection
by polymerase chain reaction using multiple primer sets // Hepatology. -
1991.-Vol.14.-P.51-55.
22. Darby SC., Ewart D.W., Giangrande P.L. et al. Mortality from liver cancer
and liver disease in haemophilic men and boys in UK given blood products
contaminated with hepatitis C // Lancet. -1997. -V. 350. -P. 1425-1431.
23. Feray C., Gigou M., Samuel D., et al. Hepatitis C virus RNA and hepatitis
В virus DNA in serum and liver of patients with fulminant hepatitis //
Gastroenterology. - 1993. - Vol. 104. - P.549-555.
24. Garfein R.S., Vlahov D., Galai N. et al. Viral infections in short-term
injection drug users: the prevalence of the hepatitis C, hepatitis B, human
immunodeficiency, and human T-lymphotropic viruses // Am. J. Public
Health.-1996.-V. 86.-P. 655-661.
25. Greub G., LedergerberB., Battegay M etal. Clinical progression, survival,
and immune recovery during antiretroviral therapy in patients with HIV-I
and hepatitis C virus coinfection: the Swiss HIV Cohort study // Lancet. -
2000.-V. 356.-P. 1800-1805.
26. Hayden G.H., Jarvis L.M., Simmonds P., Hayes P.C. Association between
chronic hepatitis C infection and hepatocellular carcinoma// Lancet. -1995.
-Vol.345.-P.928-929
27. Heathcote E.J., Shiffman M.L., Cooksley W.G. et al. Peginterferon alfa-2a
in patients with chronic hepatitis C and cirrhosis // N.Engl.J.Med. -2000.
-V. 343.-P. 1673-1680.
442
28. Hershow R.C., Riester К.A., Lew J. et al. Increased vertical transmission
of human immunodeficiency virus from hepatitis C virus-coinfected
mothers. Women and infants transmission study // J, Infect. Dis. -1997. -
V. 176.-P. 414-420.
29. Hougton M., Weiner A., Han J., et al. Molecular biology of the hepatitis C
viruses: Implications for diagnosis, development and control of viral
diseases // Hepatology. - 1991. - Vol.14. - P. 381 - 388.
30 .1warson S. The natural course of chronic hepatitis C // Microbiol. Rev. -
1994.-Vol.4.-P.201-204.
31. Jakahashi M., Yamada G., Migamoto R., et al. Natural history of chronic
hepatitis. - Amer.J.Gastroenterol. - 1993. - Vol.88. - P. 240-243.
32. Kao J.-H., Chen P.-J., Yang P.-М., et al. Intrafamilial transmission of
hepatitis C virus: The important role of infections between spouses //
J.lnfect.Dis. - 1992.- Vol. 166. -P.900-903.
33. Krarup H,, Drewes A., Jacobsen S. et al. Is supplemental anti-НСV testing
necesssary ? 11 Gastroenterology. - 1997. - Vol.l 12,suppl. - P.A1309.
34. Krawitt E.L. Chronic hepatitis // Principles and Practice of Infectious
Diseases. -1995. -P. 1153-1159.
35. Lemon S.M., Brown E.A. Hepatitis C virus // Principles and Practice of
Infectious Diseases. - 1995. - P.1474-1485.
36. Mehta S.H., Brancati F.L., Sulkowski M.S. et al. Prevalence of type 2
diabetes mellitus among persons with hepatitis C virus infection in the
United States //Ann. Intern. Med. -2000. V. 133. -P. 592-599.
37. Mendenhall C.L., SeeffL., Diehl A.M., etal. Antibodies to hepatitis В virus
and hepatitis C virus in alcoholic hepatitis and cirrhosis: their prevalence
and clinical revelance // Hepatology. - 1991. - Vol. 14. - P.581-589.
38. Nakatsuji Y., Matsumoto A., Tanaka E., et al. Detection of chronic hepatitis
C virus infection by four diagnostic systems: First-generation and second-
generation enzyme-linked immunosorbent assay, second-generation
recombinant immunoblot assay and nested polymerase chain reaction
analysis // Hepatology. - 1992. - Vol. 16 - P.300-305.
39. Nishiguchi S., Kuroki T., Yabusako T., et al. Detection of hepatitis C virus
antibodies and hepatitis C virus RNA in patients with alcoholic liver disease
// Hepatology. -1991. - Vol.l4. - P.985-989.
40. Okamoto Y., Kurai K., Okada S.-L, et al. Full-length sequence of a hepatitis
C virus genome having poor homology to reported isolates. Comparative
study of four distinct genotypes // Virology. -1992. -Vol. 188. -P. 331 -341.
41. Okamoto Y., Kurai K., Okada S.-L, et al. Full-length sequence of a
hepatitis C virus genome having poor homology to reported isolates.
Comparative study of four distinct genotypes// Virology. - 1992. - Vol.l 88.
- P. 331 - 341.
443
42. Omata M., Yokosuka О., Takano S., et al. Resolution of acute hepatitis C
after therapy with natural beta interferon // Lancet. - 1991. - Vol.338. -
P.941-915.
43. Porchon C., Kremsdorf D., Pol S., et al. Serum hepatitis C virus RNA and
hepatitis В virus DNA in non-A, non-B post-transfusional and sporadic
chronic hepatitis // J.Hepatol. - 1992. - Vol. 16. - P.l 84-189.
44. Pozzato G., Kaneko S., Moretti M., et al. Different genotypes of hepatitis
C virus are associated with different severity of chronic liver diseases //
J.Med.Virol. - 1994. - Vol.43. - P.291 -296.
45. Seeff L.B., Hollinger F.B., Alter H.J. et al. Long-term mortality and
morbidity of transfusion-associated non-A, non-B, and type C hepatitis: A
national heart, lung, and blood institute collaborative study // Hepatology.
-2001.-V. 33.-P. 455-463.
46. Simmonds P., Rose K.A., Graham S., et al. Mapping of serotype-specific,
immunodominant epitopes in the NS-4 region of hepatitis C virus (HCV):
Use of type-specific peptides to serologically differentiate infections with
HCV types 1,2, and 3 // J.Clin.Microbiol. - 1993. - Vol.31. - P. 1493-1503.
47. Sulkowski M., Dietrich D. Strategies for the Management of HIV/HCV
Coinfection. -2001. -P. 1521.
48. Sulkowski M.S., Thomas D.L., Chaisson R.E., Moore R.D. Hepatotoxicity
associated with antiretroviral therapy in adults infected with human
immunodeficiency virus and the role of hepatitis C or В virus infection //
JAMA. -2000. -V. 283. -P. 74-80.
49. Svehart J.E., Di Bisceglie A.M., Murray L.M., et al. Risk for non-A, non-
B (type C) hepatitis through sexual or household contacts with chronic-
carriers // Ann.Intern.Med. - 1990. - Vol.l 12. - P.544-545.
50. Thomas D.L. Astemborski J., Vlahov D. et al. Determinants of the quantity
of hepatitis C virus RNA// J. Infect. Dis. -2000. -V. 181. -P. 844-851.
51. Thomas D.L., Zenilman J.M., Alter H.J., et al. Sexual transmission of
hepatitis C virus among patients attending sexually transmitted diseases
clinics in Baltimorean analysis of 309 sex partnerships //J.Infect.Dis. -
1995. -Vol. 171,- P.768-775.
52. Villari D., Pernice M., Spinella S., et al. Chronic hepatitis in patients with
active hepatitis В virus and hepatitis C virus combined infections: a
histological study//Amer.J.Gastroenterol. -1995. - Vol.90,N 6. - P.955-958.
53. Weiner A.J., Thaler M.M., Crawford K., et al. A unique, predominant
hepatitis C virus variant found in an infant born to a mother with multiple
variants // J.Virol. - 1993. - Vol.67. - P.4365-4368.
54. Widell A., Mansson A.-S., Sundstrom G., et al. Hepatitis C virus RNA in blood
donor sera detected by polymerase chain reaction: Comparison with supplementary
hepatitis C antibody assay // J.Med.Virol. -1991. - Vol.35. - P.253-258.
444
55. Wiley T.E., McCarthy M., Breidi Letal. Impact of alcohol on the histological
and clinical progression of hepatitis C infection // Hepatology. -1998. -V.
28.-P. 805-809.
56. Zanetti A.R., Tanzi E., Paccagnini S. et al. Mother-to-infant transmission
of hepatitis C virus. Lombardy Study Group on Vertical HCV transmission
// Lancet. -1995.-Vol. 345. -P. 289-291.
57. Zeuzem S., Herman E., Lee J.H. et al. Viral kinetics in patients with
chronic hepatitis C treated with standard or peginterferon alpha2a //
Gastroenterology.-2001.-V. 120.-P. 1438-1447.
445
Глава 11. ТЕРАПИЯ ВИЧ-ИНФЕКЦИИ
11.1. О диспансеризации пациентов с ВИЧ-инфекцией.
Важнейшим приоритетом в СССР, а позже в России, являетя положение
о необходимости регистрации самых ранних стадий ВИЧ инфекции, в том числе
клинически бессимптомной (т.н. «ВИЧ-носительство»). В 1989 году была
принята первая клиническая классификация ВИЧ-инфекции В.И.Покровского,
в которой были выделены инкубационный период, стадия первичных
проявлений, в том числе бессимптомного носительства, стадия вторичных
заболеваний. Эта прогрессивная классификация позволяла рассматривать
больных ВИЧ-инфекцией и с бессимптомной стадией болезни («носителей»)
как пациентов, нуждающихся в диспансерном наблюдении и обследовании.
Позже, в 1991 году были организованы Центры профилактики и борьбы со
СПИДом, одной из основных задач которых явилась диспансеризация пациентов
с ВИЧ-инфекцией, их тщательное клинико-лабораторное осбледование для
раннего выявления и лечения вторичных и оппортунистических заболеваний.
Принятый Государственной думой Федеральный закон о предупреждении
распространения в Российской Федерации заболевания, вызываемого ВИЧ (24
февраля 1995 года) закрепил положение о правах ВИЧ-инфицированных на все
виды медицинской помощи с момента обследования и установления диагноза
ВИЧ-инфекции. При этом указано, что медицинское освидетельствование с
выдачей документа о наличии ВИЧ-инфекции осуществляется только в
учреждениях государственной или муниципальной формы собственности.
Медицинское освидетельствование включает лабораторное обследование, оно
является добровольным, проводится с предварительным и последующим
консультированием (статьи 7,8 Закона).
Согласно рекомендациям Минздрава и специалистов Федерального центра
профилактики и борьбы со СПИДом рекомендуется активное привлечение ВИЧ-
инфицированных на обследование в целях психологической поддержки,
своеверменного выявления угрозы прогрессирования болезни и назначения
лечения. Многокомпонентное обследование включает первичное, повторное
плановое и внеплановое.
При первичном обследовании проводится:
- Осмотр лечащего врача (консультирование, сбор анамнеза, полное
физикальное обследование).
- Регистрация вторичных заболеваний, их динамика, течение.
- Регистрация сопуствующих заболеваний.
446
- Оценка качества жизни по шкале Карновского.
- Рентгенография грудной клетки (если не проводилась в течение
последних 6 месяцев).
- Ультразвуковое исследование (УЗИ) органов брюшной полости
(печень, поджелудочная железа) и почек.
- Консультация окулиста (глазное дно).
- Консультация оториноларинголога (исследование слуха).
- Консультация невропатолога.
- Консультация стоматолога.
- У женщин - консультация гинеколога.
- Исследование сыворотки или плазмы крови на антитела к ВИЧ
методами твердофазного иммуноферментного анализа (ИФА). (При
получении положительного результата повторное обследование и
в реакции иммунного блота осуществляется только если ранее это
... исследование не проводилось или вызывало сомнения).
- Общий анализ крови (гемоглобин, гематокрит, тромбоциты,
эритроциты, лейкоциты, лейкоцитарная формула, СОЭ).
- Биохимический анализ крови (креатинин, мочевина, аланиновая
аминотрансфераза-АЛТ, аспарагиновая аминотрансфераза-ACT,
щелочная фосфатаза- ЩФ, лактатдегидрогеназа-ЛДГ, билирубин
и его фракции, кретинин фосфокиназа - КФК, амилаза или липаза,
глюкоза).
- Общий анализ мочи.
- Исследования на маркеры вирусных гепатитов В и С.
- Серологическое исследование на маркеры сифилиса.
- Иммунологическое обследование (определение уровня CD4 и CDS-
лимфоцитов с использованием проточной цитометрии,
моноклональных антител).
- Определение уровня РНК ВИЧ в крови (если такая возможность
имеется).
Консультации специалистов могут не проводиться, если
соответствующее обследование квалифицированно выполнил лечащий
врач. По усмотрению лечащего врача при наличии дополнительных
показаний могут проводиться и другие исследования. Если при
обследовании установлена ВИЧ-инфекция в стадии 4В или выявлен уровень
СО4-клеток менее 0,2x109/л, рекомендуется провести исследование
головного мозга методом компьютерной томографии (КТ)
или ядерно-магнитного резонанса (ЯМР).
В дальнейшем больному проводятся повторные плановые обследования,
447
целью которых является своевременное выявление показаний для начала
противоретровирусной терапии, а если она уже проводится - для ее коррекции.
Плановые обследования рекомендуются в стадиях 2-3 (субклинической)
один раз в 6 месяцев, а в более поздних стадиях ВИЧ инфекции 1 раз в 3 месяца.
Если известно, что уровень СО4-лимфоцитов менее 0,5x109/л, плановые
обследования проводятся 1 раз в 3 месяца. По своему объему плановые
обследования несколько отличаются от первичного. При них не проводятся
исследования на антитела к ВИЧ, консультации узких специалистов (за
исключением стоматолога, окулиста и невропатолога) проводятся лишь при
наличии показаний, исследование на маркеры вирусных гепатитов В и С и
сифилиса проводится 1 раз в 24 недели. Объем планового повторного
обследования зависит также от стадии болезни и, если известно, уровня CD4-
клеток. У больных в стадии 3 при уровне CD4>0,5x109Zn или неизвестном, а
также у больных в стадии 4А с уровнем CD4>0,5x 109/л рентгенография органов
грудной клетки и УЗИ органов брюшной полости проводится 1 раз в год (48
недель), в остальных случаях она проводится 2 раза в год (1 раз в 24 недели).
Консультации невропатолога и окулиста проводятся у этих пациентов 1 раз в 24
недели, в остальных случаях 1 раз в 12 недель.
При наличии дополнительных эпидемиологических и клинических
показаний, свидетельствующих о наличии вторичных или сопутствующих
заболеваний, для диагностики которых объем планового обследования
недостаточен, по решению лечащего врача могут проводиться дополнительные
исследования.
Внеплановые осбледования проводятся при обращении пациентов по
клиническим состояниям (ухудшение состояния здоровья, появление
необычных симптомов и т.д.), атакже для решения этических, психологических
и социальных вопросов.
Основными принципами терапии больных ВИЧ-инфекцией являются:
диагностика и лечение вторичных оппортунистических
заболеваний, их первичная и вторичная профилактика;
антиретровирусная терапия, ее мониторинг в целях
систематической коррекции осложнений;
психотерапевтическая и социальная реабилитация.
448
Таблица 61
График и объем обследования больного ВИЧ-инфекцией при
назначении и проведении противоретровирусной терапии
Процедура Отбор’ Сроки (месяцы)
2 4 8 12 Далее
Сбор анамнеза 4- 4- -г 4- + Ежемесячно
Физикальное обследование 4- 4- 4- 4- 4- Ежемесячно
Определение стадии заболевания -к 4- 4- + 4- Ежемесячно
Определение индекса качества жизни 4- + 4- 4- Ежемесячно
Регистрация связанных с ВИЧ заболеваний 4- 4- 4- Ежемесячно
Консультация окулиста — + 1 раз в 3 месяца
Консультация невропатолога” -1- 4- 1 раз в 3 месяца
Консультация ЛОР" 4- 4- 1 раз в 3 месяца
Консультация гинеколога 4- 4- 1 раз в 3 месяца
Рентгенография грудной клетки - 4-
УЗИ органов брюшной полости и малого таза -к 1 раз в 3 месяца
Уровень CD4 лимфоцитов Концентрация РНК ВИЧ 4- + + 4- 4- 4- 4- 1 раз в 3 _месяца 1 раз в 3 месяца
Общий анализ крови 4- -Г 4- 4- + Ежемесячно
Биохимический анализ крови 4- 4- 4- 4- 4- Ежемесячно
Общий анализ мочи Исследования на маркеры гепатитов ВиС 4- 4- -г 4- 4- 4- Ежемесячно
Экспресс-тест на беременность 4-
Оценка нежелательных явлений 4- 4- -г + При каждом обращении
Оценка сопутствующего лечения 4- 4- 4- 4- 4- При каждом обращении
Примечание: ’При проведении отбора могут использоваться результаты
исследований, полученных в течение двух недель до начала лечения, за исключением
рентгенографии и УЗИ (могут использоваться результаты за последние 6 месяцев), а
также теста на беременность (проводится не позднее 3 дней до начала лечения при
последующем применении контрацепции)
При применении препаратов, токсичных в отношении глаз, органов слуха
или нервной системы, соответственно.
449
11.2. Противовирусная терапия ВИЧ инфекции.
Антивирусная терапия является неотъемлемой и важнейшей частью
комплексной терапии ВИЧ-инфекции, которая также включает лечение и
профилактику оппортунистических инфекций, патогенетическую,
иммунокоррегирующую, симптоматическую, общеукрепляющую терапию и
психосоциальную помощь. В основе назначения противовирусных средств лежит
воздействие на механизмы репликации ВИЧ, которые непосредственно связаны
с периодами жизнедеятельности вируса. Жизненный цикл ВИЧ достаточно
хорошо изучен, он состоит из нескольких этапов:
- внедрение ВИЧ в клетку, имеющую маркер CD4;
- преобразование вирусной РНК в ДНК в цитоплазме инфицированной
клетки;
- внедрение провирусной ДНК в ядро и ее интеграция в генетический аппарат
клетки-хозяина;
- синтез вирусных белков, сборка вируса и выход новых вирионов из клетки.
Известны четыре класса антиретровирусных средств, которые
ингибируют репликацию ВИЧ на разных этапах его жизненного цикла: два
класса ингибиторов обратной транскриптазы (ОТ) - аналоги нуклеозидов и
не нуклеозидные ингибиторы ОТ, они нарушают работу уникального вирусного
фермента обратной транскриптазы, при помощи которой осуществляется
преобразование РНК ВИЧ в ДНК; третий класс - ингибиторы вирусного фермента
- протеазы, они действуют на этапе сборки новых вирусных частиц, препятствуя
формированию полноценных вирионов, способных инфицировать другие
клетки организма. Наконец, четвертый класс - интерфероны и некоторые другие
препараты, препятствующие прикреплению вируса к клеткам-мишеням. В
настоящее время также изучаются возможности применения химиопрепаратов
с другими механизмами антиретровирусного действия, например,
гидроксимочевина (Hydroxyurea, Hydrea, Droxia-Bristol Myers Sqibb).
В последние годы для более успешного лечения пациентов с ВИЧ-
инфекцией разработана так называемая комбинированная противовирусная
терапия, которая предусматривает совместное использование ингибиторов
обратной транскриптазы и ингибиторов протеазы в различных сочетаниях.
Другим общепринятым названием данного вида лечения в зарубежной
литературе является Highly Active Antiretroviral Therapy (HAART) -
высокоактивная антиретровирусная терапия (ВААРТ). Впервые применение
высокоактивной комбинированной ВИЧ-терапии началось в 1995 году, о чем
было сообщено на конгрессе по СПИДу в Ванкувере в 1996 году Дэвидом Хо.
профессором национального института здоровья США. К настоящему времени
опыт комбинированной терапии не позволяет считать эти лекарства радикально
450
излечивающими болезнь, однако, их использование продлевает жизнь
пациентов, улучшает ее качество, предупреждает развитие иммунодефицита и
тяжелых оппортунистических инфекций, замедляя тем самым развитие СПИДа
и снижая смертность.
Цели терапии ВИЧ и средства их достижения:
§ Максимальное и долговременное подавление вирусной репликации.
§ Восстановление и/или сохранение иммунологических функций.
§ Улучшение качества жизни.
§ Уменьшение связанной с ВИЧ заболеваемости и смертности.
Средства достижения целей терапии:
§ Максимизация приверженности к антиретровирусным режимам.
§ Рациональная последовательность лекарств с учетом определения
резистетности ВИЧ к препаратам.
§ Сохранение выбора будущего лечения, упрощение схем лечения.
§ Использование комплекса препаратов, действующих на различные ферменты
ВИЧ.
К настоящему времени известно более 15 антиретровирусных препаратов
(см. приложения).
11.3. Антиретровирусные препараты.
11.3.1. Ингибиторы обратной транскриптазы - аналоги нуклеозидов.
Нуклеозидные аналоги имеют слегка измененную структуру натуральных
нуклеозидов-тимидина, цитидина, аденозина или гуанозина. Интрацеллюлярно
под действием клеточных ферментов эти препараты превращаются в активные
трифосфатные формы, которые обратная транскриптаза ВИЧ ошибочно
использует вместо натуральных нуклеозидтрифосфатов для удлинения цепи
ДНК. Однако отличия в структуре аналогов и натуральных нуклеозидов делают
невозможным присоединение следующего нуклеотида в растущей цепи
вирусной ДНК, что приводит к ее терминации.
Наиболее изученным препаратом, включаемым в комплекс
противовирусных средств, является азидотимидин.
Азидотимидин (3'-азидо.2'3'-дидеокситимидин. АЗТ, зидовудин,
ретровир; Glaxo-Smithklein) - синтетический аналог натурального нуклеозида
тимидина - был предложен для лечения пациентов с ВИЧ-инфекцией в 1985 г. и
долгое время являлся одним из наиболее эффективных противовирусных
средств.
В нашей стране АЗТ выпускается под коммерческим названием тимазид.
Второй отечественный нуклеозидный аналог фосфазид также является
производным азидотимидина, он также утвержден для широкого применения.
451
АНТИРЕТРОВИРУСНЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ВИЧ
Стадии репродукции ВИЧ
1 - Проникновение ВИЧ в CD4 + клетку
2 - ВИЧ является ретровирусом, в котором генетическая информация представлено одинарной РНК,
в отличие от большинсгве других организмов имеющих двойную ДнК. Для репликации вирус ислользует
фермент обратную транскриптазу обеспечивающую синтез ДНК из РНК.
3 - ДНК ВИЧ проникает в ядра CD4 ♦ клетки и встраивается в ДНК клетки Затем ДНК ВИЧ вынуждает клетку
синтезировать множество копий вируса
4 - Сборка новых вирусных частиц, покидающих клетку и готовых к инфицированию новых CD4+ клеток
Место действия
ненуклеозидиь!х ингибиторов
обратной гронскрилгозы
Место действия
нуклеозидных ингибиторов
обратной гронокрилгазы
Место действия
ингибиторов лратеазь!
Ненуклеозидные
ингибиторы обратной
транскриптазы
Ненуклеозидне ингибиторы
обратной транскриптазы (ННИОТ)
блокируют репликацию 8ИЧ путем
связывания с обратной
транскриптазой и предотвращения
синтеза ДНК из вирусной РНК. Эти
препараты названы
«ненуклеозидными» ингибиторами,
так как хотя они имеют тоже место
действия, что и нуклеозидные
ингибиторы, но механизм их
действия принципиально другой.
Нуклеозидные ингибиторы
обратной транскриптазы
Нуклеозидные ингибиторы обратной
транскриптазы (НИОТ)
встраиваются в ДНК вируса,
изменяя ее и блокируя дальнейшую
репликацию вируса.
Zerif (ставудин, d4T)
Retrovir’ (зидовудин, ZDV, AZT)
ЗЮ (ламивудин)
Combivir™ (ламивудин-зидовудин)
Hivids’ (зальцитабин, ddC)
Videx':' (диданозин, ddl)
Ziagen!M (абакавнра сульфот)
протеозы
Ингибитолы пратеазы сказывают
свое дайепше ча п:клодмвй стадии
регоедукции вируса. С»и блокируют
сборку вирусных частиц м их
высвобождение из CD4+ клетки
Cri*:van* (индинавир)
Vi-acftplv (непфиновира мезилат)
Invirase™ ^гсквнчэвира мезилат
твердые калсугь)
Fo-towhe* (саквинавир -
мягкие капеупь.)
Noryir’* (ритонавир)
ВИРАМУН19 (невирапин)
Rescriplor4 (делавирдина мезилат)
Stocfin® (ифавиренц)
Внутри клетки АЗТ фосфорилируется, превращаясь в активный метаболит
АЗТ-трифосфат, который конкурентно ингибирует присоединениетимидина к
растущей цепи ДНК. осуществляемое ОТ. Замещая тимидинтрифосфат, АЗТ-
трифосфат блокирует присоединение следующего нуклеотида к цепи ДНК,
поскольку его 3'-азидогруппа не может образовать фосфодиэфирной связи.
АЗТ является селективным ингибитором репликации ВИЧ-1 и ВИЧ-2 в
CD4 Т-лимфоцитах, макрофагах, моноцитах, обладает способностью проникать
в ЦНС через гематоэнцефалический барьер.
АЗТ рекомендован для лечения всех ВИЧ-позитивных взрослых и
подростков с количеством СО4-лимфоцитов менее 500/мм3, а также детей с
ВИЧ-инфекцией. В последние годы АЗТ широко используется с целью
химиопрофилактики перинатальной ВИЧ-инфекции.
Препарат хорошо всасывается при пероральном приеме (до 60%). Период
полувыведения из клетки составляет примерно 3 часа. Накопленный опыт
показал, что оптимальная доза препарата для взрослых составляет 600 мг в
сутки: по 200 мг х 3 раза или по 300 мг х 2 раза в сутки (Fisch) М.А. et al., 1990),
но, в зависимости от стадии ВИЧ-инфекции, переносимости препарата, может
быть снижена до 300 мг/сут. По мнению большинства европейских
исследователей доза АЗТ 500 мг в сутки также может рассматриваться как
оптимальная (Kitchen V.S. et al., 1995). АЗТ выводится почками, поэтому у
пациентов с хронической почечной недостаточностью дозы препарата должны
быть снижены.
Детям препарат назначается из расчета 90-180 мг/м2 поверхности тела
каждые 6 часов (AmFAR’s AIDS/HIV treatment directory, 1997).
В проведенных исследованиях было показано, что АЗТ отчетливо замедляет
репликацию ВИЧ и прогрессию ВИЧ-инфекции у пациентов с бессимптомной и
симптоматической ВИЧ-инфекцией и улучшает качество жизни, снижая тяжесть
оппортунистических инфекций и неврологических дисфункций. При этом в
организме повышается количество CD4 Т клеток и снижается уровень вирусной
нагрузки (Fisch! М.А. et al., 1989; Cooper D.A. et al., 1993).
Побочные эффекты АЗТ в основном связаны с необходимостью
использования больших доз и токсичностью препарата для костного мозга.
Среди них отмечаются анемия, лейкопения и другие симптомы - усталость,
сыпи, головные боли, миопатии, тошнота, бессонница.
Устойчивость к АЗТ формируется у большинства больных при
Длительном приеме (более 6 месяцев). Для снижения выработки резистентных
Штаммов рекомендуется применение АЗТ в комбинации с другими
антиретровирусными препаратами.
453
В настоящее время наряду с АЗТ втерапии ВИЧ-инфекции применяются
другие нуклеозидные аналоги - диданозин, зальцитабин, ставудин, ламивудин,
абакавир и комбивир. Сведения о нуклеозидных ингибиторах обратной
транскриптазы (НИОТ) приведены в приложении 1.
Диданозин (2',3'-дидеоксиинозин, ddl, видекс; Bristol-Myers Squibb) -
синтетический аналог пуринового нуклеозида дезоксиаденозина был вторым
антиретровирусным агентом, утвержденным длятерапии ВИЧ-инфекции в 1991 году.
После проникновения в клетку, диданозин превращается клеточными
энзимами в активный дидеоксиаденозин-трифосфат, проявляя выраженную анти
ВИЧ-1 и анти ВИЧ-2 активность.
Первоначально ddl использовался у взрослых пациентов с
симптоматической ВИЧ-инфекцией в комбинации с начатой ранее АЗТ-терапией,
в дальнейшем его стали применять в сочетании с другими противовирусными
средствами, а также в качестве монотерапии. Рекомендуемые дозы для
взрослых: более 60 кг веса тела-200 мгх 2 раза в сутки, менее 60 кг - 125 мг
х 2 раза в сутки, для детей - 90 - 150 мг/м2 поверхности тела каждые 12 часов.
В настоящее время ddl (видекс) предложено назначать 1 раз в сутки по
400 мг взрослым и 180-240 мг/кг в сутки детям.
Эффективность впервые начатой ddl-монотерапии ВИЧ-инфекции
примерно такая же, как АЗТ-монотерапии. Однако, по данным Spruance S.L. et
al. у пациентов, получавших АЗТ-монотерапию, переход на ddl-монотерапию
был более эффективным, чем продолжение приема АЗТ (Shafer R.W. et al.,
1994). По данным Englund J. et al., ddl, либо один, либо в комбинации с АЗТ.
был более эффективным, чем один АЗТ, в терапии ВИЧ-инфекции у детей
(Englund J. et al., 1996).
Получены данные о том, что in vitro диданозин (а также аналоги цитидина
- зальцитабин и ламивудин) более активен в отношении неактивированных
мононуклеаров периферической крови, чем в активированных клетках, в
противоположность зидовудину и ставудину, поэтому рационально
использовать комбинации из этих препаратов (Gao W-Y, ShirasakaT, Johns DG
etal., 1993).
Наиболее серьезными побочными эффектами ddl являются панкреатиты,
вплоть до развития панкреонекроза с летальным исходом, а также
периферические нейропатии, их частота растет с увеличением дозы препарата.
Среди прочих негативных проявлений встречаются нарушения функции почек,
изменения печеночных тестов. Появление таких симптомов, как тошнота, боли
в животе, увеличение амилазы или липазы являются показанием для перерыва
в ddl-терапии до исключения панкреатита.
454
Такие лекарственные препараты как дапсон, кетоконазол должны
приниматься за 2 часа до приема ddl, так как таблетки ddl могут ингибировать
желудочную абсорбцию дапсона и кетоконазола. Необходимо проявлять
осторожность при совместном пероральном приеме ганцикловира с ddl, так
как при этом увеличивается риск возникновения панкреатита.
Развитие ddl-резистентных штаммов ВИЧ возникает при длительном
приеме препарата. Исследования показали, что комбинация ddl/АЗТ не
предупреждает возникновения вирусной резистентности (Scrip World
Pharmaceutical News, 1998), аснижение чувствительности к АЗТ развивается с
одинаковой частотой у пациентов, получающих АЗТ-терапию или комбинацию
АЗТ/ddl (PludaJ.M. etal., 1995).
Зальцитабин (2', З'-дидеоксицитидин, ddC, хивид; Hoffmann-La Roche) -
пиримидиновый аналог нуклеозида цитидина, в котором гидроксильная группа
вЗ' положении заменена атомом водорода. После превращения в активный 5'-
трифосфат под действием клеточных киназ он становится конкурентным
ингибитором обратной транскриптазы.
DdC был одобрен для применения в комбинации с АЗТ у пациентов,
ранее не получавших антиретровирусную терапию, а также в качестве
Ионотерапии для замены АЗТулице прогрессирующей ВИЧ-инфекцией или с
непереносимостью АЗТ. В исследованиях было показано, что при сочетании
зальцитабина и зидовудина достоверно увеличивалось содержание CD4+ клеток
более, чем на 50% от исходного, уменьшалась частота развития состояний,
Определяющих диагноз СПИДа и летальных исходов у ранее не леченньк ВИЧ-
инфицированных пациентов и у больных, получавших противовирусную
Терапию. Длительность терапии составляла в среднем 143 недели (AIDS Clinical
Trials Group Study Team, 1996).
Однако, несмотря на то, что широкие клинические испытания
Продемонстрировали хороший терапевтический эффект при сочетанном
использовании ddC и АЗТ, в настоящее время рекомендуется использовать ddC
в тройной терапии, включающей ингибитор протеазы.
Рекомендуемая доза препарата для взрослых и подростков составляет 0,75
мг х 3 раза в сутки, детям до 13 лет 0,005-0,01 мг/кг веса тела каждые 8 часов.
Частыми побочными проявлениями являются головная боль, слабость,
расстройства ЖКТ. Наиболее характерные осложнения - периферические
нейропатии, которые встречаются у пациентов с продвинутой ВИЧ-инфекцией
примерно в 1/3 случаев. У 1% лиц, получающих ddC, развиваются панкреатиты.
Редко встречаемые осложнения - стеатоз печени, язвы ротовой полости или
пищевода, кардиомиопатии.
455
Лекарственные взаимодействия: сочетанное применение ddC с некоторыми
препаратами (хлорамфеникол, дапсон, диданозин, изониазид, метронидазол,
рибавирин, винкристин и др.) увеличивает риск возникновения периферических
нейропатий. Внутривенное введение пентамидина может вызвать панкреатит,
поэтому не рекомендуется его применение одновременно с ddC.
Резистентность к ddC развивается приблизительно втечение одного года
лечения. Совместное использование ddC с АЗТ не предупреждает развития
резистентности. Возможна перекрестная резистентность с другими
нуклеозидными аналогами (ddl, d4T, ЗТС) (AmFAR’s AIDS/HIV treatment
directory, 1997).
Ставудин (2'3'-дидегидро-2',3'-деокситимидин, d4T, зерит; Bristol-Myers
Squibb)-аналог естественного нуклеозида тимидина. Активен в отношении ВИЧ-
1 и ВИЧ-2. Ставудин фосфорилируется в ставудин-5'-трифосфат при помощи
клеточных киназ и ингибирует вирусную репликацию двумя путями: ингибируя
обратную транскриптазу и путем прерывания формирующейся цепи ДНК.
Не рекомендуется использовать ставудин совместно с зидовудином (АЗТ).
т.к. они конкурируют за одни и те же клеточные ферменты. Однако зерит
успешно можно применять в тех случаях, когда терапия зидовудином не показана
или ее необходимо заменить. Терапевтический эффект ставудина усиливается
при назначении его совместно с диданозином, ламивудином и ингибиторами
протеазы. Зерит обладает свойством проникать в ЦНС, предупреждая развитие
ВИЧ-деменции (Bartlett J.G., 1996).
Дозы препарата для взрослых и подростков: более 60 кг веса -40 мг х 2
раза в сутки, 30 - 60 кг веса - 30 мг х 2 раза в сутки.
Недавно препарат был утвержден для использования при ВИЧ-инфекции
у детей в дозе 1 мг/кг веса каждые 12 часов при весе ребенка менее 30 кг.
Среди побочных явлений зерита отмечают нарушение сна, кожные
высыпания, головные боли, расстройства ЖКТ. Редким, но наиболее тяжелым
проявлением токсичности является дозозависимая периферическая нейропатия,
иногда отмечается повышение уровня печеночных ферментов.
Случаи возникновения d4T - резистентности встречались редко.
Зерит и видекс были одобрены FDA как терапия первой линии ВИЧ-
инфекции.
По мнению S.Moreno (2002) резистентность к d4T развивается более
медленно, чем к АЗТ. В настоящее время выделяют три основных побочных
эффекта, связанные с нарушением обмена липидов: липоатрофия.
липодистрофия и липогипертрофия. Одно из исследований показало
значительные различия между d4T и АЗТ у больных с липоатрофией, но без
456
гипертрофии, другое исследование показало сходную частоту липодистрофии,
встречающуюся при лечении d4T и АЗТ. Форма d4T для приема 1 раз в день
(100 мг в таблетке) (зерит PRC) удобная и является оптимальной для соблюдения
приверженности и может улучшить клинические исходы (S.Moreno, 2002).
Ламивудин (2',3'-дидеокси-3'-тиацитидин, ЗТС, эпивир; GlaxoSmithKlinfe)
используется при ВИЧ-инфекции с 1995 года. Внутриклеточно ламивудин
фосфорилируется в активный 5'-трифосфат(Ъ-ТР) с периодом полувыведения
из клетки от 10,5 до 15,5 часов. Активный L-TP конкурирует с натуральным
деокси цитидин-трифосфатом за присоединение к растущей цепи провирусной
ДНК, ингибируя таким образом ОТ ВИЧ.
Препарат обладает высокой биодоступностью при пероральном приеме
(86%), выводится почками, принимается по 150 мг дважды в сутки (для взрослых
и подростков весом более 50 кг), детям до 13 лет назначается по 4 мг/кг веса
каждые 12 часов.
Установлен синергизм действия ламивудина и ретровира. При сочетанной
терапии этими препаратами задерживается появление резистентных к
химиотерапии штаммов ВИЧ. Хороший антивирусный эффект отмечен также
при использовании ЗТС в комбинации с d4T и ингибиторами протеазы.
Ламивудин успешно используется для лечения не только ВИЧ-инфекции, но и
хронического вирусного гепатита В. Преимущество ламивудина по сравнению
с другими ингибиторами обратной транскриптазы заключается в возможности
использования препарата 2 раза в сутки, что значительно облегчает проведение
комбинированной терапии.
Изучается использование комбинаций АЗТ/ЗТС и АЗТ/ЗТС/индинавир
при ВИЧ-инфекции у детей.
Токсичность ламивудина минимальная. При его приеме могут отмечаться
такие симптомы как головная боль, тошнота, диарея, нейропатия, нейтропения,
анемия.
Известно, что резистентность к ЗТС формировалась у пациентов,
принимавших препарат более 12 недель (ММ WR, CDC, 1998).
Фирма GlaxoSmithKline также производит комбинированнный
противоретровирусный препарат комбивир, одна таблетка которого содержит
два нуклеозидных аналога - ретровир (зидовудин) - 300 мг и эпивир (ламивудин)
- 150 мг. Комбивир принимается по 1 таб. дважды в сутки, что значительно
упрощает проведение комбинированой терапии. Препарат хорошо сочетается
с другими антиретровирусными средствами и проявляет максимальные
супрессивные свойства в тройной терапии, рекомендован для ВИЧ-позитивных
пациентов, начинающих противовирусную терапию, или уже получавших
зо. Заказ № К-44'il.
457
другие препараты. Комбивир отчетливо замедляет прогрессию ВИЧ-болезни и
снижает смертность.
Наиболее частыми побочными эффектами комбивира являются головная
боль (35%), тошнота (33%), утомление/недомогание (27%), назальные признаки
и симптомы (20%), атакже проявления, связанные непосредственно с входящим
в его состав зидовудином, такие как нейтропения, анемия, при длительном
применении - миопатии.
Комбивир не рекомендуется назначать детям до 12 лет, пациентам, вес
которых меньше 110 фунтов (примерно 50 кг), больным с почечной
недостаточностью.
Азидотимидин (ретровир), хивид (зальцитабин), видекс (диданозин),
ламивудин (эпивир), ставудин (зерит), комбивир, утверждены к применению в
нашей стране.
В настоящее время прошел клинические испытания еще один новый
препарат из группы нуклеозидных аналогов - абакавир.
Абакавир или зиаген (GlaxoSmithKline) - аналог натурального гуанозина,
имеет уникальные внутриклеточные пути фосфорилирования, что отличает его
от предыдущих нуклеозидных аналогов. Принимается в дозе 300 мг х 2 раза в
сутки. Обладает хорошей биодоступностью при пероральном приеме, способен
проникать в ЦНС.
Исследования показали, что при монотерапии абакавир значительно
снижал уровень вирусной нагрузки, а в сочетании с АЗТ и ЗТС, а также с
ингибиторами протеазы (ритонавир, индинавир, фортоваза, нелфинавир,
ампренавир) уровень вирусной нагрузки становился неопределяемым (AIDS
Clinical Care, 1998). Клинические исследования показали, что пациенты,
находящиеся на ddl -, или d4T - терапии лучше реагировали на добавление
абакавира, нежели те, что получали АЗТ, или АЗТ/ЗТС.
Переносимость абакавира в целом хорошая. При его применении иногда
возникали аллергические реакции (2-5%), нейтропения, кожные высыпания,
тошнота, головные или абдоминальные боли, диарея, однако несвоевременно
выявленные гиперчувствительные реакции могут привести к серьезным
последствиям или даже смерти больного. Проведенные клинические испытания
не выявили какого-либо перекрестного взаимодействия абакавира с другими
проги во ретро ви ру с н ы м и п ре паратам и.
При проведении монотерапии абакавиром в течение 12-24 недель были
отмечены редкие случаи формирования резистентных штаммов ВИЧ, однако.
АЗТ-терапия или ЗТС-терапия могут вызвать перекрестную резистентность к
абакавиру.
458
Адефовир-дипивоксил (Preveon, Gilead Sciences) - первый нуклеотидный
аналог, уже содержащий в своем составе монофосфатную группу (аденозин-
монофосфат), что облегчает дальнейшие этапы фосфорилирования, что и делает
его более активным в отношении широкого спектра клеток, особенно
покоящихся. Адефовир обладает длительным периодом полужизни в клетке,
что позволяет использовать препарат один раз в сутки в дозе 1200 мг. Препарат
выводится почками. Взаимодействия адефовира с другими противовирусными
агентами к настоящему времени изучены не достаточно. Установлено, что
адефовир проявляет активность в отношении других вирусных агентов, таких
как вирус гепатита В и цитомегаловирус (ЦМВ), что делает его перспективным
в использовании у больных ВИЧ-инфекцией с вирусным гепатитом В и ЦМВ-
инфекцией.
Разработан и подготовлен для клинической апробации новый препарат
компании GlaxoSmithKline-тризивир, включающий 300 мгретровира, 150 мг
эпивира и 300 мг абакавира, препарат рекомендован к применению по 1 табл. 2
раза в день.
Введение в комбивир еще одного из самых мощных нуклеозидных
ингибиторов обратной транскриптазы - абакавира позволит преодолеть
формирование резистентности к ретровиру и эпивиру.
Опыт применения комбинаций из двух нуклеозидных аналогов показал,
что в целом комбинированная нуклеозидная терапия (АЗТ/ddl, АЗТ/ddC или
АЗТ/ЗТС) является более эффективной по сравнению с моно- АЗТ- или ddl-
терапией, однако нуклеозидным аналогам присущи недостатки: обратная
транскриптаза ВИЧ быстро мутирует и становится не чувствительной к
медикаментам, которые, в свою очередь, способны вызывать побочные
эффекты, поэтому необходимо использовать нуклеозидные ингибиторы
обратной транскриптазы с ингибиторами других ферментов ВИЧ, в частности,
С ингибиторами протеазы.
11.3.2. Ненуклеозидные ингибиторы обратной транскриптазы
(ННИОТ) - новейший класс антиретровирусных веществ, которые
останавливают репликацию ВИЧ (приложение 2). Эти препараты действуют на
Тех же стадиях процесса, что и нуклеозидные ингибиторы ОТ, но другим
образом. Они не встраиваются в растущую цепь ДНК, а присоединяются
Непосредственно к обратной транскриптазе, вблизи ее каталитического участка,
предотвращая преобразование РНК ВИЧ в ДНК (рисунок 14). Каждый из
препаратов этого класса обладает уникальной структурой, однако все они
подавляют репликацию только ВИЧ-1, но не активны в отношении ВИЧ-2.
30*
459
Принципиальное ограничение применения ННИОТ в качестве монотерапии
связано с быстрым развитием вирусной резистентности. возможно формирование
перекрестной устойчивости вируса к различным ННИОТ (но не к нуклеозидным
ингибиторам ОТ), что связано с возникновением мутаций в ОТ. ННИОТ
синергичны с большинством нуклеозидных аналогов и ингибиторов протеазы,
что позволяет более успению использовать их в комбинированной терапии.
В настоящее время в мировой практике для терапии ВИЧ-инфекции
используются три 1II 1ИОТ-делавирдии. невирапин, эфавиренц(стокрин).
Рисунок 14. Механизм действия ННИОТ
460
Делавирдин (Rcscriptor, Upjohn) - выпускается в таблетках по 100 мг,
суточная доза составляет 1200 мг (400 мг х 3); 51% препарата выводится с
мочой и 44% - с калом.
Делавирдин метаболизируется системой цитохрома Р450, подавляя его
ферменты. Поскольку метаболизм многих наиболее общих лекарственных
средств также связан с системой цитохрома, делавирдин обладает выраженным
лекарственным взаимодействием, например, с фенобарбиталом, циметидином,
ранитидином, цизаприном и др. (приложение 2). При одновременном приеме
делавирдина и ddl снижаются плазменные концентрации как одного вещества,
так и другого, поэтому делавирдин должен быть принят за один час до или
после приемаddl. Напротив, совместное введение делавирдина и индинавира
или саквинавира повышает плазменный уровень ингибиторов протеазы,
поэтому рекомендуется снижать дозы этих препаратов при совместном
использовании с делавирдипом. Не рекомендуется совместно с дславирдином
применять рифабутин и рифампицин.
Наиболее характерным проявлением токсичности делавирдинаявляется
сыпь.
Невирапин (Virainune, Берингер Ингельхайм)-лекарственная форма-
таблстки 200 мг и суспензия для перорального применения. Невирапин
непосредственно соединяется с обратной транскриптазой, вызывая разрушение
каталитического участка фермента, и блокирует РНК- и ДНК-завнсимую
полимеразную активность. Невирапин не конкурирует с нуклеозидными
трифосфатами. Препарат проникает во все органы и ткани, в том числе в
плаценту и центральную нервную систему. Препарат принимается по схеме:
первые 14 дней - но 200 мг х 1 раз в день, далее по 200 мг 2 раза в день.
Препарат метаболизируется системой цитохрома Р450. индуцируя его
ферменты; 80% вещества выводится с мочой. 10% - с калом.
Известно, что при ионотерапии к невирапину бысто формируются
резистентные штаммы ВИЧ, поэтому рекомендуется использовать данный
препарат только в комплексной терапии с антиретровирусными препаратами.
Имеются данные о совместном применении невирапинас ddl или с АЗТ/ddl у
детей с симптоматической ВИЧ-инфекцией. Результаты исследования показали,
что в целом комбинированная терапия хорошо переносилась, однако, иногда
пациен ты, получающие невирапин, вынуждены были прервать лечение ввиду
выраженных кожных высыпаний (таблица 62). Проводятся клинические
исследования по дальнейшему изучению эффективности невирапина в
предупреждении перинатальной ВИЧ-инфекции (Mellors J. et al., 1995).
461
Таблица 62
Приложение к документу «Основная информация о препарате ВИРАМУН®
0199-03 от 23.07.99»
Изменение режима дозирования невирапина при появлении сыпи
Описание сыпи Действия в отношении невирапина
itleBHgwKunitasi/ умервнная сыпь (возможно сопповпждастся зудом) Эритема Диффузные эри тематозные МйКу.чезнЫе ИЛИ макулопапулезные кожные высыпания 1 Грием препарата может быть продолжен. Если сыпь или продромальные симптомы появились во время вводного периода лечения Вирамуном. дозу препарата не следует повышать до исчезновения сыпи. Если прием невирапина был прекращен более, чем на 7 дней, следует начинать повторное назначение препарата с вводного периода в режиме 200 мг/сут
Крапивница. См. выше, однако, если прием невирапина был приостановлен, при повторном назначении в вводном периоде нет необходимости.
Выраженная сыпь Раадирри'отурниад эртта'гозная или макуло-папулезная Сыпь или мокрое шелушение • Сосудистый Отек • Реакция плазмы крови * Синдром С тивенса-Джонсона , 7 Токсический эпидермальный некролиз Немедленная окончательная отмена препарата
Любая сыпь, сопровождающаяся такими симптомами как Лихорадка > 39°С Появление волдырей Поражения полости рта ‘ Когп.кткпивит " Значитильнывшз.менения печеночных проб Отек лица • Миалгия/артралгия fГемедленная окончательная отмена препарата
Лю^ая сыпь, сопровождающаяся персчяелнввыаги'симптомами и ’ нарушением функции внутренних органов Гепатит • Грйнулоцитонения । Эб'ЗИНбфйлия । Нарушение функции почек Немедленная окончательная отмена препарата
462
Вирамун (невирапин) высокоэффективен как в начальной, так и в
поддерживающей антиретровирусной комбинированной терапии. Весьма
существенно, что вирамун высокоэффективен как у пациентов с развившейся
резистентностью к ингибиторам протеазы, так и у пациентов с непереносимостью
данной группы препаратов. Следует отметить, что препарат, нормализуя жировой
обмен, уменьшает побочные эффекты ингибиторов протеазы.
Вирамун’хорошо переносится больными при длительном применении,
имеется опыт использования более 7 лет:
• Спектр нежелательных эффектов является предсказуемым.
Не влияет на психический статус и не вызывает липодистрофию.
• Суточная доза для поддерживающей комбинированной терапии составляет
2 таблетки однократно или 2 раза по одной таблетке в сутки.
• Прием препарата не зависит от приема и характера пищи.
- Вирамун высокоэффективен в начальной и поддерживающей
антиретровирусной комбинированной терапии у детей и взрослых, как с низкой,
так и с высокой вирусной нагрузкой; высокоэффективен и наиболее экономичен
в предупреждении перинатальной трансмиссии ВИЧ-1 инфекции; эффективен
у пациентов с развившейся резистентностью к ингибиторам протеазы; не
обладает перекрёстной устойчивостью к ингибиторам протеазы и нуклеозидным
ингибиторам обратной транскриптазы.
Вирамун® обладает уникальной биодоступностью - более 90%; быстро
проникает во все органы и ткани, включая плаценту, нервную систему и грудное
молоко.
Широкие возможности комбинации в схемах практически со всеми
антиретровирусными препаратами и препаратами для лечения
оппортунистических инфекций.
Таблица 63
Результаты использования Вирамуна в схемах APT
у пациентов, ранее не получавших лечения
Схема терапии Количество пациентов Основные результаты Ссылка
NVP+d4T+3TC | 73 (невирапнн+ 16,4% - ранее не ставудинт . получавших лечение ламивудин) 1 27,4% - с опытом лечения препаратами из класса | НИОТ 54.8% - с опытом лечения । препаратами из класса ИП 1,4% - с опытом лечения , препаратами из класса ННИОТ Комбинация препаратов NVP4d4T+3TC продемонстрировала свою эффективность, хорошую переносимость и удобство приема препаратов во всех исследованных группах вне зависимости от изначальной вирусной нагрузки Yozviak et al. 40th ICAAC, Toronto, 2000. Abstract 1519.
463
Таблица 64
Исследование COMBINE NVP+2HMOT
Результаты использования Вирамуна в схемах APT
у пациентов, ранее не получавших лечения
Схема терапии Количество пациентов Основные результаты Ссылка
NVP+Combivir (невирапин+ зидовудин & ламивудин) Схема сравнения: NVF+Combivir (нелфинавир+ зидовудин & ламивудин) 142 Схема терапии Вирамун + Комбивир, возможно, является наилучши.м выбором для начальной APT, особенно у пациентов с низкой приверженностью к терапии Podzdamczer et al. 8th Conference on retroviruses and opportunistic infections, Chicago, 2001. Abstract 327.
В исследованиях, проводившихся P.Barreiro и соавт., 2000, оценивались
эффективность и безопасность перехода от ингибиторов протеазы к невирапину
у пациентов с вирусной нагрузкой менее 50 клеток в мл. Из 138 наблюдаемых
больных, у которых была такая вирусная нагрузка и которые получали на
протяжении 6 месяцев режимы лечения, включающие ингибиторы протеазы,
104 были переведены на невирапин, а 34 продолжали получать прежнее лечение.
Авторы пришли к выводу, что замена ингибиторов протеазы невирапином
безопасна как в вирусологическом отношении, так и иммунологически,
обеспечивает значительное улучшение качестважизни и у половины больных
улучшает изменения формы тела, связанные с липодистрофией на 6 месяце
приема, хотя уровень нарушения липидов в сыворотке остается неизменным.
В другом исследовании, выполненном RuizL. и соавт., 2001, установлено,
что ИП-связанный режим лечения, включающий невирапин, оказался
эффективной альтернативой для больных. Тритерапия, основанная на
невирапине, достигала поддерживаемого контроля уровня РНК ВИЧ и
улучшения иммунологического ответа через 48 недель наблюдения у пациентов.
Переключение на невирапин значительно улучшило липидный профиль в группе
А, хотя не имелось различий между группами на конец исследования.
Невирапин высокоэффективен и экономичен в предупреждении
вертикальной передачи ВИЧ от матери к плоду. Стоимость курса лечения
примерно в 100 раз дешевле других схем лечения (см. ниже). При этом частота
ВИЧ-трансмиссии снижается в 3-4 раза. Препарат не обладает перекрестной
устойчивостью с ингибиторами протеазы и нуклеозидными аналогами, обладает
хорошей переносимостью при длительном применении.
Взаимодействие невирапина с аналогами нуклеозидов (азидотимидином,
видексом или хивидом), а также с ингибиторами протеазы (саквинавиром и
индинавиром) не требует коррекции режима дозирования.
464
При совместном применении невирапина с ингибиторами протеазы,
пероральными контрацептивами, рифабутином, рифампицином снижаются
плазменные концентрации этих веществ, поэтому необходим тщательный
мониторинг.
На 7-й конференции, посвященной ретровирусам и оппортунистическим
инфекциям (Сан-Франциско, 2000) сообщалось о целесообразности комбинации
невирапина с комбивиром (Podzamczer D. et al, 2000). Было показано, что
комбинация комбивир/невирапин обладает значительно большей активностью,
чем режим, содержащий комбивир и нелфинавир. У больных, получавших
комбинацию ко.мбивира и невирапина, спустя 6 месяцев от начала терапии
существенно снижался уровень вирусной нагрузки, вплоть до неопределяемого
и повышался уровень CD клеток. При этом лечение больным назначалось при
исходной вирусной нагрузке больше 1500 копий РНК в мл еще до развития
СПИДа. Следует отметить, что 39% леченных были инъекционными
наркоманами и до этой терапии антиретровирусное лечение не получали
(Podzamczer D. et al, 2000). По сравнению с больными, получавшими нелфинавир
с комбивиром, у больных комбинация невирапин+комбивир реже давала
побочные эффекты и реже приходилось ее отменять в связи с ее более хорошей
переносимостью. Однако, согласно общепринятым данным, нелфинавир в
отличие невирапина обладает менее выраженными побочными эффектами
действия. Ввиду этого, можно рекомендовать 2 схемы альтернативно или
последовательно.
Другие ННИОТ находятся в стадии клинических испытаний, среди них-
ловирид - неконкурентный ингибитор ОТ ВИЧ-1, уникален по структуре,
обладает одинаковым для всех ННИОТ механизмом действия, характеризуется
быстрым развитием вирусной резистентности.
Компанией DuPont-Merk был разработан новый ненуклеозидный
ингибитор обратной транскриптазы эфавиренц (Efavirenz, сустива, DMP-266,
стокрин), который обладает длительным периодом полураспада (40-55 часов),
в связи с чем возможен однократный прием препарата в дозе 600 мг/сут(АЮБ
Clinical Саге, 1998). В настоящее время эфавиренцутвержден к применению в
России.
Эфавиренц был введен в применение в 1998 году. В комбинации с двумя
ингибиторами обратной транскриптазы эфавиренц оказался более
эффективным, чем ингибиторы протеазы и невирапин. Эфавиренц быстрее и
продолжительнее ингибирует ВИЧ'до 144 недель (J. van Lunzen, 2002).
Преимуществом использования эфавиренца перед другими препаратами
является его продолжительный период полужизни (~48 часов). Эфавиренц
465
хорошо переносится. Начальный побочный эффект на ЦНС заметно снижается
после нескольких первых недель лечения. J.van Lunzen (2002) предлагает новую
форму препарата-600 мг в одной таблетке, которая принимается 1 раз вдень,
вместо 3 таблеток по 200 мг. Это облегчает прием препарата и уменьшает фактор
забывчивости, тем самым улучшая приверженность терапии.
В специальном исследовании (Montana trial, ANRS 091) предлагается в
комбинации новый препарат - элштрицитабин (emitricitabine) 200 мг, ddl -
400 мги эфавиренцбОО мг однократно (Molina J. et al, 2000). Все медикаменты
даются перед сном. При этом у 95% больных уже через 48 недель снижался
уровень вирусной нагрузки, а уровень CD4 Т-лимфоцитов увеличивался на 209
клеток.
11.3.3. Ингибиторы протеазы
Ингибиторы протеазы (ИП) представляют собой гетерогенный по
структуре класс противовирусных средств, которые, в отличие от ингибиторов
обратной транскриптазы, действуют на заключительном этапе репродукции
ВИЧ.
Вирусная протеаза включается в работу на стадии воспроизведения
вирионов. Аспартат-протеаза действует как ножницы, разрезая полоски белков
на зрелые вирусные частицы, которые затем покидают инфицированную клетку-
воспроизводителя ВИЧ. Ингибиторы протеазы связывают активный участок
фермента, предупреждая образование полноценных вирусных частиц,
способных поражать другие клетки.
Этот класс противоретровирусных средств в настоящее время считается
самым высокоактивным в отношении ВИЧ-инфекции. Лечение этими
препаратами приводит к положительной динамике суррогатных маркеров
инфекции (повышению числаСЭ4+ клеток и снижению концентрации вируса в
крови, то есть вирусной нагрузки), кроме того, их применение дает больным
клинические преимущества - снижает смертность и частоту клинических
состояний, определяющих диагноз СПИДа. Ингибиторы протеазы проявляют
противовирусную активность как в лимфоцитах, так и в клетках моноцитарного
ряда. Их преимуществом является активность в отношении изолятов ВИЧ.
устойчивых к зидовудину. Для оказания противовирусного эффекта
ингибиторам протеазы, в отличие от нуклеозидных аналогов, не требуется
внутриклеточный метаболизм, поэтому они сохраняют продолжительный
эффект в хронически инфицированных клетках.
В настоящее время в мировой практике применяются 4 ингибитора
протеазы ВИЧ - саквинавир (инвираза), индинавир (криксиван), нелфинавир
466
(вирасепт), ритонавир (норвир). В России ритонавир пока еще не утвержден к
применению. Сведения об ИП представлены в приложении 3.
Саквинавир (инвираза; Hoffmann La-Roche) - первый из ингибиторов
протеазы, утвержденный для применения при ВИЧ-инфекции и является
наиболее мощным из них, подавляя in vitro образование синцития, улучшая
функцию дендритных клеток, несущих антиген, что позволяет предполагать
способность препарата восстанавливать иммунный статус.
.Саквинавир метаболизируется под действием ферментов системы
цитохрома Р450. Индукторы ферментов этой системы, а также рифампицин
угнетаютего активность. Саквинавир проявляет выраженную противовирусную
активность в сочетании с АЗТ, зальцитабином (ddC), а также с ламивудином и
ставудином. Он эффективен и хорошо переносится как больными,
начинающими терапию, так и теми, кто уже получал нуклеозидные аналоги.
Установлено, что комбинация саквинавира, зидовудина и зальцитабина обладает
синергичной активностью in vitro, уменьшает развитие резистентности к
каждому из этих препаратов (Craig J. et al., 1996).
Изучение эффективности этого ингибитора протеазы у 97 больных при
тройной терапии: ретровир200 мг х 3 раза в сутки, зальцитабин 750 мгх 3 раза
в сутки, саквинавир 600 мг х 3 раза в сутки показала наиболее благоприятную
динамику тритерапии в сравнении с моно- и битерапией. При этом отмечалось
увеличение числа CD4 клеток, существенное снижение вирусной нагрузки и
отсутствие заметных признаков токсичности. Следует учесть, что, в отличие
от ретровира, ингибиторы протеазы, равно как и большинство других
ингибиторов обратной транскриптазы, плохо проникают через
гематоэнцефалический барьер, а потому назначение ретровира является
обязательным.
Саквинавир в форме геля (SYC), выпускаемый под названием Фортоваза,
отличается высокой биодоступностью по сравнению с твердой формой
препарата (HGC). Применяется в дозе 1200 мгхЗ раза в сутки или 1600 мг2
раза в сутки в комбинации с ритонавиром 400 мг2 раза в сутки. Одновременное
применение комбинации саквинавир/ритонавир (400 мг/400 мг) обеспечивает
удобство дозирования - 2 раза в сутки, рекомендовано для первой линии
терапии. Специальными исследованиями было установлено, что при
использовании ретровира, эпивира и фортовазы вирусная нагрузка снижается
значительно быстрее, чем при использовании криксивана (Scrip Magazine, 1998).
В 1999 году установлен новый режим дозирования фортовазы. Новая
схема лечения, при которой ингибитор протеазы фортоваза (саквинавир)
назначается один раз в сутки в комбинации с минимальными дозами ритонавира
467
(другого ингибитора протеазы), позволяет поддерживать терапевтические
концентрации саквинавира в течение всего 24-часового интервала дозирования.
Фортоваза назначается в дозе 1600 мг в сутки + ритонавир 100 мг в сутки.
По данным А.В.Кравченко и соавт., 2002, комбинированная терапия
препаратами Фортоваза/Норвир + Никавир + Видекс больных ВИЧ-инфекцией
втечение 24 недель была эффективной: достигнуто снижение уровня РНК ВИЧ
на 2,01 log!0. а у 63% больных - ниже уровня определения тест-системой (400
копий в мл), медиана количества CD4 лимфоцитов увеличилась на 220 клеток
в 1 мм3, значительно повысился иммунорегуляторный коэффициент
(соотношение CD4/8). Авторами показано, что использование в течение 6
месяцев в терапевтической схеме усиленного ингибитора протеазы ВИЧ
(комбинация Фортоваза/Норвир) в минимальных суточных дозировках
практически не оказывает влияния на показатели липидного обмена.
Применение Фортовазы вместе с одной капсулой Норвира в сутки позволяет
уменьшить суточную дозу фортовазы до 8 капсул (вместо 18), сократить
кратность приема ингибитора протеазы ВИЧ до 1 раза в сутки (вместо 3) и
почти в 2 раза снизить месячную стоимость ингибитора протеазы. Схема,
включающая Фортовазу/Норвир, Никавир и Видекс, может быть рекомендована
в качества терапии 1-го уровня для лечения ВИЧ-инфицированных пациентов.
Нелфинавир (вирасепт; Roche-Agouron Pharmaceuticals) -рекомендован
для лечения ВИЧ-инфекции каку взрослых, так и у детей (Ragni М. etal., 1992).
Препарат активен в отношении как ВИЧ-1, так и ВИЧ-2.
Препарат выпускается в следующих лекарственных формах: таблетки 250
мг, таблетки, покрытые оболочкой 250 мг, порошок для приема внутрь 50 мг/1 г.
Рекомендуемые дозы для взрослых-750 мгх 3 раза в сут. или 1250 мг2
раза в сутки, для детей - 20-30 мг/кг веса тела х 3 раза в сут. Биодоступность
нелфинавира при пероральном приеме составляет до 80%.
Получен высокий терапевтический эффект при сочетании нелфинавира
с зидовудином, ламивудином и ставудином (Schooley R., 1997), изучается
совместное применение с другими нуклеозидными ингибиторами ОТ, в
частности, с абакавиром, ингибиторами протеазы - саквинавиром, индинавиром,
ритонавиром, ампренамиром и ННИО'Г - делавирдином, невирапином,
лоривидом,ифавиренцем.
Контролируемые клинические исследования нелфинавира (вирасепта) в
комбинации с другими противовирусными препаратами продолжительностью
не менее 1 года продемонстрировали стойкое снижение уровня РНК ВИЧ-1 в
плазме и увеличение числа CD4 клеток как у ранее нелеченных, так и у ранее
леченных ВИЧ-1 инфицированных пациентов.
468
Нелфинавир ингибирует систему цитохрома Р450, поэтому не
рекомендуется одновременный прием других наиболее общих лекарственных
средств, использующих для метаболизма систему цитохрома, среди них
терфенадин, ципрадин, триазолам, рифампин и др. (приложение 4).
Карбамазепин, фенобарбитал, фенитион могут снижать концентрацию
нелфинавира в плазме, напротив, индинавир, саквинавир, ритонавир могут
увеличивать ее. При совместном приеме с диданозином нелфинавир должен
быть принят за два часа до или через час после приема диданозина.
Взаимодействия ИП с другими лекарственными веществами отражены в
приложении 5.
При монотерапии к нелфинавиру довольно быстро вырабатывается
вирусная резистентность, однако, в комбинации с нуклеозидными аналогами
появление резистентности может задерживаться. Так, например, из 55
пациентов, принимавших нелфинавир один, или в комбинации с АЗТ и ЗТС,
резистентность появлялась у 56% реципиентов одного нелфинавира и у 6%
реципиентов комбинированной терапии (Agauron Pharmaceuticals, 1997).
Резис тентность к нелфинавиру может не вызывать перекрестной резистентности
с другими ингибиторами протеазы.
Большинство из наблюдавшихся в клинических исследованиях побочных
эффектов были выражены слабо. Самым частым побочным действием при
использовании нелфинавира в рекомендованных дозах была диарея. Другие
возможные побочные эффекты: сыпь, метеоризм, тошнота, уменьшение числа
нейтрофилов, повышение активности кретинкиназы и АЛТ/АСТ.
Нелфинавир метаболизируется и выводится в основном печенью. Поэтому
необходимо соблюдать осторожность при назначении препарата больным с
нарушением функции печени.
Преимущества использования Вирасепта (Нелфинавира) в схемах ВААРТ
первой линии:
- мутация в кодоне D30N - основная при терапии нелфинавиром,
- D30N приводи г к уменьшению жизнеспособнос ти вируса и не является
причиной перекрестной резистентности с другими ИП,
- у пациентов, ранее получавших нелфинавир, эффективно применение
других ИП в схемах 2-ой линии. ,
Ритонавир (норвир; Abbott Laboratories) показал наилучшую
эффективноеть при использовании его в дозе 600 мг х 2 раза в сутки. Препарат
может быть использован для монотерапии или в комбинации с нуклеозидными
аналогами. Исследования Danner et al., 1995, продемонстрировали
дозозависимое снижение вирусной нагрузки и увеличение количества CD4+
469
клеток при лечении ритонавиром втечение 16-32 недель. Cameron etal., 1996,
представили результаты широких клинических испытаний, демонстрирующих
замедление прогрессии болезни и снижение смертности у больных СПИДом,
которым к стандартной терапии нуклеозидными аналогами был добавлен
ритонавир. Предварительные данные показали, что ритонавир можно
использовать для начальной терапии одновременно с ретровиром и
зальцитабином (ddC) или ламивудином. Mellors et al., Molla et al.
продемонстрировали высокую результативность совместного использования
ритонавира и саквинавира, при этом значительно снижался уровень вирусной
нагрузки и увеличивалось количество CD4H- клеток (Molla A, Korneyeva М,
Chernyavsky Т et al., 1997).
Ритонавир ингибирует ферменты системы цитохрома Р450 и изменяет
плазменные концентрации многих лекарственных средств, в связи с чем
некоторые медикаменты необходимо исключить, а для других изменить дозы
при совместном использовании с ритонавиром (приложения 4, 5).
Прием ритонавира может сопровождаться появлением нежелательных
проявлений, таких как аллергические реакции, тошнота, рвота, диарея,
анорексия, парестезии, астения, изменения печеночных тестов, а также диабет,
характерный для всех утвержденных ингибиторов протеазы.
Резистентность к ритонавиру часто вызывает возникновение
резистентности к индинавиру, реже - к нелфинавиру.
Рисунок 15.
Схема адаптированна ид Hiv/AIDS Handbook 3rd erf. Boston: lota) Learning Concepts. )<W;77,
470
Индинавир (криксиван; Merck) имеет преимущество по сравнению с
саквинавиром и ритонавиром: из-за низкой связываемости с белками достигает
более высоких концентраций в плазме, тканях и проникает в ЦНС.
Рекомендуемая доза препарата составляет 2400 мг/сут. (800 мгх 3 р.), индинавир
принимается натощак за 1 час до или 2 часа после приема пищи, биодоступность
при пероральном приеме составляет 65%. Изучается возможность
использования препарата у детей.
Индинавир значительно снижает уровень вирусной нагрузки и увеличивает
количество CD4+ клеток, когда используется один или в комбинации с аналогами
нуклеозидов. Однако многие исследования подтверждают наибольший эффект
криксивана в комбинированной терапии (Gazzard В., 1999).
Резистентность к индинавиру развивается довольно быстро, но в меныпей
степени у тех пациентов, кто начинал принимать индинавир в комбинации с
другими антиретровирусными агентами и ранее не получал анти-ВИЧ-терапии
(Корр J.B. et al., 1997). Индинавир-резистентные штаммы ВИЧ-1 способны
проявлять выраженную устойчивость и к другим ингибиторам протеазы -
ритонавиру, нелфинавиру, меньше - к саквинавиру (Condra J.H. et al., 1995).
Индинавир ингибирует цитохром Р450, поэтому необходимо избегать
совместного его использования с другими лекарственными средствами,
использующими для метаболизма систему цитохрома Р450 (приложение 4).
Диданозин снижает абсорбцию индинавира, поэтому рекомендуется раздельный
прием этих двух препаратов с интервалом 1 час. Кетоконазол ингибирует
метаболизм индинавира, в связи с чем доза индинавира должна быть снижена
до 600 мг х 3 раз в сут. В свою очередь, индинавир ингибирует метаболизм
рифабутина, что требует снижения дозы рифабутина на 50%. Другие
лекарственные взаимодействия индинавира представлены в приложении 5.
При приеме индинавира могут отмечаться такие нежелательные
осложнения как диабет, гемолитическая анемия, а также нефролитиаз и дизурия,
которые связаны со способностью индинавира образовывать кристаллы в моче
(Klaus Heintz, 1997).
Ампренавир (141 \У94)-один из новейших потенциальных ингибиторов
протеазы ВИЧ-1 и ВИЧ-2, разработанный GlaxoSmithKline, разрешен к
применению в RP. Препарат обладает хорошей пероральной биодоступностыо
(>70%), характеризуется длительным периодом полувыведения (около 7 часов)
(Spruance S.L. et al., 1994), назначается в дозе 1200 мгх 2 раза в сутки независимо
от приема пиши. Метаболизируется, как и другие ингибиторы протеазы,
системой цитохрома Р450. Оказывает хороший терапевтический эффект при
тритерапии с АЗТ и ЗТС. Изучались комбинации с другими ингибиторами
протеазы (фортовазой, индинавиром, нелфинавиром) - во всех случаях
471
отмечалось значительное снижение вирусной нагрузки (AIDS Clinical Care, 1998).
Схема применения ампренавира и ритонавира (Arvieux С. et al., 2002):
Ампренавир 600 мг+ритонавир 200 мг2 раза в день для больных с безуспешной
комбинацией 3-х препаратов. Ампренавир и ритонавир назначались с двумя
или тремя другими противовирусными препаратами. Снижение доз ампренавира
и ритонавира благодаря их комбинации уменьшалотоксический эффект каждого
из препаратов и оказалось эффективным по клинико-лабораторным данным
(снижение вирусной нагрузки в 2 раза по сравнению с исходной через 2,5 мес.
с 4,86 х 1010 log до 2,95 х I010 log, повышение CD4 со 187 до 365 х 106 log/л. В
числе побочных эффектов небольшой степени выраженности зафиксированы
диарея, повышение уровня холестерола и триглицеридов.
Фирма Берингер Ингельхейм представляет новый ингибитор протеазы -
типранавир. Типранавир в настоящее время находится во II фазе разработки.
Это первый препарат из нового класса непептидных ингибиторов протеазы.
Клинические испытания показывают, что основными побочными эффектами
препарата являются гастроинтестинальные проявления, особенно диаррея,
которая обычно успешно лечится (V.Miller et al., 2000).
Предложен новый препарат - .чопинавир, который является ингибитором
протеазы и огчетливоспижаетуровеньвирусной нагрузки. Лопинавир в комбинации
с другим ингибитором протеазы - ритонавиром получил название калетра. Калетра
первый комбинированный препарат из класса ингибиторов протеазы ВИЧ,
производимый компанией «Abbott Laboratories» с 2000 года и зарегис трированный в
России в феврале 2002 года. Сочетание в одной капсуле Калетры 133,3 мглопинавира
и 33,3 мг ритонавира (80 мг лопинавира и 20 мг ритонавира в 1 мл раствора дня
приема внутрь), позволяет достичь высоких, длительно сохраняющихся концентраций
лопинавира в плазме крови, которые обеспечивают мощный противовирусный
эффект препарата при приеме его в дозе 400/100 мг 2 раза в день.
При назначении Калетры в сочетании с 2 ПИОТ (d4T и ЗТС) пациентам,
ранее не получавшим антиретровирусных препаратов, через 144 недели лечения
уменьшение содержания РНК ВИЧ менее 400 копий в 1 мл плазмы было отмечено
в 98% (ОТ-анализ) (Study 720; Thompson М., et al. 8th ECAATH, 2001). Более
того, прирост числа CD4 клеток у пациентов с исходно низким количеством
CD4 лимфоцитов (менее 50 клеток в 1 мм') был существенным в группе
пациентов, получавших Калетру-265 клеток (группа нелфинавира- 198 клеток)
(Study 863; RuaneP., et al., 1st IAS, 2001).
У пациентов, ранее получавших лечение хотя бы одним ингибитором
протеазы ВИЧ (Study 765), через 144 недели терапии препаратом Калетра в
сочетании с невирапином и 1 НИОТ в 86% и 73% случаев регистрировали
472
снижение РНК ВИЧ менее 400 и 40 копий в 1 мл плазмы, соответственно (ОТ-
анализ) (Hicks С. et aL, 8th ECAATH, 2001).
Взаимодействие с другими лекарственными средствами:
- увеличение дозы калетры до 533 мг/133 мг (4 капсулы или 6,5 мл) 2
раза в день во время еды при приеме с препаратами невирапин или
ифавиренц производится пациентам, у которых отмечено клинически
предсказуемое снижение чувствительности вируса к лопинавиру (по
результатам лечения или лабораторным данным).
- дозировка других ИП должна быть уменьшена при приеме с калетрой.
На основании ограниченного числа наблюдений дозировка
ампренавира составляет 750 мг 2 раза в день, индинавира 600 мг 2
раза в день, саквинавира 800 мг 2 раза в день при приеме этих
препаратов с калетрой. Оптимальные дозы других ИП в комбинации
с калетрой с учетом их безопасности и эффективности не определены.
- рекомендуется снижение суточной дозы рифабутина (300 мг в день)
до 75% (максимальная доза 150 мг через день или 150 мг 3 раза в
неделю). При назначении такой комбинации препаратов необходим
тщательный мониторинг за развитием нежелательных явлений.
Возможно, будет необходимо дальнейшее снижение дозы рифабутина.
- необходим тщательный мониторинг при одновременном назначении
калетры и ингибиторов ГМГ-КоА редуктазы: правастатина,
флувастатина или минимальных доз аторвастатина и церивастатина.
В исследовании 863 при лечении калетрой у 9% пациентов отмечалось
повышение уровня холестерина (>300 мг/дл) и триглицеридов (>750 мг/дл).
При наличии у больных ВИЧ-инфекцией гепатита В или С необходимо с
острожностыо назначать калетру, поскольку имеются данные, что через 60 недель
лечения в 12% случаев имело место повышение уровня АЛТ (у больных без
вирусных гепатитов - в 3% случаев), что было полностью сопоставимо с частотой
повышения уровня АЛТ у больных ВИЧ-инфекцией и хроническими гепатитами
В и С, получавшими нелфинавир - наиболее безопасный препарат из класса
ингибиторов протеаз ВИЧ - 17% (Bernstein В. et al., 8<h ECAATH, 2001).
На фоне приема калетры наблюдали развитие панкреатита. В части случаев
отмечали повышение уровней триглицеридов. Несмотря на то, что причинно-
следственная связь калетры и панкреатита не доказана, повышение уровней
триглицеридов в крови может свидетельствовать о повышенном риске
возникновения панкреатита. Если пациент предъявляет жалобы на наличие
тошноты, рвоты, болей в животе, а также при обнаружении в сыворотке
повышенных уровней амилазы или липазы, лечение калетрой и/или другими
антиретровирусными препаратам и должно быть приостановлено. У пациентов,
31. Заказ № К-4451
473
получающих лечение ИП, сообщают о случаях развития гипергликемии,
сахарного диабета и повышенной кровоточивости (у пациентов с гемофилией).
Калетру необходимо с осторожностью применять при поражениях
печени, включая вирусные гепатиты В, С, и при повышении уровней
аминотрансфераз.
Формы выпуска:
- Мягкие желатиновые капсулы: рекомендуемая доза для взрослых - 3
капсулы 2 раза в день во время еды, каждая капсула калетры содержит
133,3 мг лопинавира и 33,3 мг ритонавира.
- раствор для приема внутрь: рекомендуемая доза раствора калетры для
приема внутрь взрослым пациентам - 5 мл 2 раза в день во время еды,
рекомендуемая доза для детей от 6 месяцев до 12 лет определяется в
соответствии с площадью поверхности тела ребенка.
- каждые 5 мл содержат400 мг лопинавира и 100 мг ритонавира.
Принимать калетру легко: нет ограничений по диете, нет требований по
количеству употребляемой жидкости.
В педиатрической практике детям рекомендуется назначать калетру
(лопинавир и ритонавир) одновременно с невирапином (Hsu Л. et al., 2000).
В исследовании, сообщенном на конференции в Глазго (октябрь 2000 г.) Julio
Montaner активизируется схема, включающая два ингибитора протеазы: индинавир
1200 мг и ритонавир 100 мг или индинавир 800 мг4 ритонавир 200 мр либо саквинавир
1600 мг, ритонавир 100 мг+эфавиренц600 мг 1 раз вдень, либо калетра.
Новые формы и дозы известных и исследуемых антиретровирусных
препаратов (R.Gulick., Topics in HIV medicine, 2002. 10, 14-15)
ПИОТ (NRTIs)
ddl - капсулы, защищенные от ЖКТ
секретов - однократно
ЗТС/АЗТ/абакавир - двухкратно
омтрицитабин (FTC)
ННИОТ (NNRTIs)
эфавиренц капсула 600 мг
каправирин (Ag-1549)
ТМС-125
Ингибиторы протеазы
Агазанавир
типранавир
ТМС 114
474
Ингибиторы протеазы
1.-870810
S-1360
Ингибиторы ВИЧ рецепторов и
корецепторов
Ингибитор CD4 BMS-806
Ингибиторы корецепторов -
CXCR-4 ингибитор AMD-070
CCR5 ингибитор Pro-140 SCH-D
Ингибиторы фузии
эифувиртид(Т-20)
В-1249
Фармакокинетический профиль позволил разработать первый ИП для
приема один раз в день (2 капсулы по 200 мг) атазанавир. При таких условиях
приема концентрация атазанавира (зривада) остается в области значений,
превышающих 1С90 в течение длительных сроков. Атазанавир имеет
благоприятный профиль побочных эффектов, редко вызывает образование
резистентных форм, безопасен и эффективен в течение более 48 недель, не
вызывает повышения уровня липидов и триглицеридов (М.Флепп, Седьмой
Европейский симпозиум по лечению ВИЧ-инфекции «На всю оставшуюся
жизнь», Будапешт, 1-3 февраля 2002 года).
Таким образом, атазанавир:
- мощный, безопасный и хорошо переносимый,
- по антивирусной активности близок к нелфинавиру,
- можно сочетать со всеми базовыми схемами применения ПИОТ,
- наименьшее количество принимаемых таблеток по сравнению с
другими ИП,
- в отличие от других ИП. не вызывает повышения уровня липидов.
- профиль резистентности, неидентичный профилю других ИП.
Новыми кандидатами, способными заменить ингибиторы протеазы,
являются АВТ 378 и типранавир.
Типранавир представляет собой новый класс непептидных ингибиторов
протеазы ВИЧ-1. Типранавир показал великолепную активность в отношении
разнообразных лабораторных штаммов ВИЧ-1 и изолятов, полученных от
больных, включая резистентные к нуклеозидным ингибиторам обратной
транскриптазы ВИЧ - зидовудину и делавирдину. Предшествующие
эксперименты показали, что комбинация типранавира с ритонавиром
дополнительно проявляет умеренный синергичный антивирусный эффект в
отношении ВИЧ-изолятов, чувствительных к ритонавиру, и сильная синергия
возникает в отношении изолятов. резистентных к ритонавиру.
Типранавир сохранял постоянную антивирусную активность в отношении
клинических изолятов ВИЧ, полирезистентных к ингибиторам протеазы, и
может оказаться полезным для комбинаций с другими антиретровирусными
препаратами в режимах терапии для пациентов, у которых применение терапии,
содержащей ингибиторы протеазы, оказалось неэффективным.
Другим мощным нуклеозидом является adefovir, к которому
чувствительны многие резистентные к нуклеозидам штаммы.
Роль иммуностимуляторов, таких как интерлейкин 2, в реконструкции
иммунной системы, требует дальнейшего изучения.
Проведенными нами исследованиями показана высокая эффективность
нового нснуклеозидного ингибитора обратной транскриптазы (ННИОТ) - ТМС
31* ' 475
125. Препарат является производным диазил-пиримидина. Его большим
преимуществом является способность воздействовать на штаммы ВИЧ,
имеющие ключевые мутации к ННИОТ - K103NL1001. ТМС 125 оказывает
выраженную супрессию на ВИЧ, существенно подавляя репликацию вируса
при незначительных побочных эффектах. Проводился 7-дневный курс
монотерапии больным, ранее не леченным.
Таблица 65
Клинические испытания ТМС 125 (ненуклеозидный ингибитор
обратной транскриптазы - NNRTI - diasyl-pyrimidine)
(Gruzdev В., Rakhmanova A., Iakovlev a. et al., 2001)
ТМС 125 900 мг 2 раза (п-12) Плацебо (п=7)
Возраст, лет ВИЧ РНК, копий/мл CD4, клеток/мм3, абс. CD4, % ВИЧ РНК копий/мл менее 400 менее 50 • 24,9 22 512 510 24,9 67% 17% 25,1 56 700 777 34,6 0 0
Фармакокинетика День 1 День 7 Конценту ма к си мал ьная “ 93,3±49,7 418,9±121,1 >ация, нг/мл средняя 89,1 429
1 (8,3%)
1 (8,3%)
1 (8,3%)
1 (8,3%)
1 (8,3%)
Побочные эффекты ТМС 125:
Диспепсия
Головная боль
Сыпь
Повышение АЛТ (125-250 ед)
Билирубинемия (22-31 мкмоль/л)
Потенциально активны будут ингибиторы фузии. Препарат Т-20 (Enfuvirtide)
находится в стадии клинических испытаний. Возможные преимущества
ингибиторов фузии: эффективность, безопасность, отсутствие перекрестной
резистентности. Возможные недостатки: парентеральное введение, образование
антител, высокая стоимост ь. Препарат Т-20 сливается с gp 41 - поверхностным
маркером ВИЧ - и,тем самым, делает невозможным соединение ВИЧ с клетками,
имеющими рецептор CD4. Существенно отметить, что Т-20 (энфувиртид)
синергичен по своему действию с нуклеозидными и ненуклеозидными
ингибиторами обратной транскриптазы, а также с протеазой (рисунки).
476
Какова роль гидроксимочевины?
Большой интерес вызывает гидроксимочевина, поэтому исследования
будут продолжаться, чтобы оценить ее потенциальную роль как помощника
противовирусной терапии. Гидроксимочевина использовалась как компонент
различных режимов высокоактивной антиретровирусной терапии (ВААРТ),
особенно содержащих диданозин (ddl), с которым она имеет синергичное анти-
ВИЧ действие.
Этот новый подход к антиретровирусной терапии разрабатывает
избирательное подавление гидроксимочевиной клеточной рибонуклеотидной
редуктазы. Ингибиция рибонуклеотидной редуктазы значительно понижает пулы
внутриклеточного диоксирибонуклеозидноготрифосфата. Как например, хотя
гидроксимочевина не является первичным антиретровирусным агентом, она
ингибирует репликацию ВИЧ непрямым путем, блокируя обратную
транскриптазу, которая зависит от внутриклеточного диоксирибонуклеозидного
трифосфата как субстрата.
Некоторые клинические исследования демонстрируют in vitro и in vivo
эффективность гидроксимочевины для подавления репликации ВИЧ при
использовании ее в комбинации с ddl и другими нуклеозидными ингибиторами
обратной транскриптазы. Исследования также наводят на мысль, что
способность гидроксимочевины ограничивать число CD4+ Т-лимфоцитов
клеток-мишеней может также способствовать активности этого препарата in
vivo в комбинации с антиретровирусными.
Предварительные исследования показывают, что режимы, содержащие
гилроксимочевину, основательно ингибирует вирусную репликацию, если их
начинать в период первичной ВИЧ сероконверсии (см. ниже). По меньшей мере
один пациент из маленькой группы имел очень низкий провирусный резервуар
в периферической крови, когда лечился гидроксимочевиной, ddl и ингибиторами
протеазы и поддерживал неопределяемую вирусную нагрузку после
прекращения ВААРТ. В другой группе доложено, что у двух пациентов,
принимающих только ddl и гидроксимочевину, имелся синдром отмены после
прекращения лечения. Третья группа, однако, выявила, что РНК ВИЧ в плазме
быстро вернулась к высокому уровню после прекращения ВААРТ с или без
гидроксимочевины во время первичной ВИЧ-инфекции. Тем не менее, один
пациент из этого исследования имел менее 50 копий РНК ВИЧ в мл плазмы на
протяжении 46 недель после прекращения ВААРТ. Этот случай позволяет
предположить, что ранняя терапия может изредка индуцировать «ремиссию»
репликации ВИЧ.
477
Рисунок 16. Механизм действия
ингибиторов фузии
Рисунок 17. Ингибитор gp41:
Т-20 (Enfuvirtide)
С-спираль N-спираль
36 аминокислот
Слияние с gp41 и невозможность HIV
соединиться с СБ4-клетками
Синергизм с НИОТ, ННИОТ и
Также имеет смысл исследовать, как потенциально действует
гидроксимочевина на ВИЧ резервуар у больных, которые достигли
неопределяемого уровня РНК в плазме на ВААРТ. Гидроксимочевина
относительно маленькая молекула, которая может проникать через
гематоэнцефалический барьер и таким образом также способна пересекать
барьер кровь-testes.
Кроме того, этот агент может значительно ингибировать процесс частичной
обратной транскрипции внутри полной длины обратной транскрипции, шаг,
необходимый для вирусной интеграции в геноме хозяина. Если обратная
транскриптаза в норме задерживается в некоторых клеточных резервуарах половой
системы, как и в других клеточных пулах, гидроксимочевина может в дальнейшем
задерживать обратную транскрипцию и снижать провирусную интеграцию в
клетках половой системы. Это гипотеза предполагает, что гидроксимочевина
может быть основным кандидатом для снижения или прекращения развития
резервуаров провируса ВИЧ и реплицирующегося вируса.
Недавние исследования оценивали гидроксимочевину, ddl и ингибиторы
протеазы во время острой ВИЧ инфекции. Этот режим приводил к
неопределяемой виремии (в клинических испытаниях) и значительно снижал
латентно инфицированные CD4+ Т-лимфоциты у некоторых из этих больных.
Другие исследования показали, однако, что ВААРТ без гидроксимочевины при
ВИЧ инфекции также позволяет большей части больных достигнуть
неопределяемой вирусной РНК в плазме и можетснизить латентный резервуар
Т-лимфоцитов. Подобный подход, использующий нуклеозидный аналог
абакавир и ингибитор пролиферации лимфоцитов микофеноловую кислоту,
может также изменить остаточную репликацию ВИЧ.
Один из методов иммунотерапии в перерыве ВААРТ - метод PANDAs,
который включает гидроксиурию, не вызывающую мутацию ВИЧ и
компенсаторно ddl, ее вызывающий. Таким образом, контролируется
прерывистая ВААРТтерапия. Авторами (Lor F. et al., 2002) отмечено при этом
повышение уровня интерферона. Такой способ воздействия можно сравнить с
«терапевтической» вакциной, которая как специфический антиген индуцирует
Т-клетки (рисунок 18).
Ауто вакцинация.
А) пациенты без терапии ввиду высокой вирусной нагрузки без ВИЧ
иммунного ответа
В) на фоне ВААРТ ниже порогового уровень ВИЧ не может стимулировагь
специфический ВИЧ иммунитет
С) больные в период перерыва ВААРТ могут из-за бустерного эффекта
повышать иммунный ответ
480
Таблица 66
Стратегии, которые могут истощить вирусные резервуары
Стратегия Потенциальные агенты
Ингибировать процесс частичной обратной транскрипции внутри полной длины обратной транскрипции Гидроксимочевина
Ограничить пул активированных CD4+ Т-лимфоцитов клеток-мишеней (циторедуктивная терапия) Циклофосфамид, гидроксимочевина, иммунотоксины
Усиление первичного ВААРТ режима Многие антиретровирусные препараты, идеально с наименьшими побочными эффектами
Активация латентно инфицированных клеток ИД-2 с или без ОКТЗ или анти CD8 и антиСОЗ биспецифичных клональных антител; ВИЧ специфичный антиген; интерферон гамма (чтобы акти виро вать м оноциты/макрофаги)
D) Панда вызывает специфический иммунный ответ, так как число ВИЧ
превышает пороговый уровень, способный повысить клеточный иммунный
ответ, но при этом вирусная нагрузка ниже порогового уровня.
Рисунок 18
Аутовакцинация (Lori et al., 2002)
Высокий порог
антигена
ниже порогового
Уровня антигена
Вир. нагрузка
Л) До ВААРТ В) ВААРТ С) перерыв в D) Панда
терапии
лечении метод
И Угощенный
Сильный
Без ответа
481
11.3.4. Отечественные антиретровирусные препараты
Отечественный азидотимидин (тимазид) (“Ассоциация АЗТ”) выпускается
в капсулах по 0,1 г и рекомендуется к использованию в тех ситуациях, когда
показано применение ретровира, зидовудина (Глаксо Вэллкам). Одним из
наиболее эффективных отечественных препаратов является фосфазид, который
выпускается «Ассоциацией АЗТ» под коммерческим названием никавир (5'-Н-
фосфонат натриевая соль азидотимидина), таблетки 0,2 г. Никавир относится к
классу ингибиторов обратной транскриптазы ВИЧ. Препарат защищен не только
российским, по и зарубежными патентами.
Никавир близок к широко применяемому для терапии ВИЧ-инфекции
азидотимидину (Тимазид, Ретровир) по своей химической структуре, механизму
действия, противовирусной активности, однако, значительно менее токсичен
для организма (в 6-8 раз), а также обладает пролонгированным действием, то
есть дольше сохраняется в крови в терапевтической концентрации, что дает
возможность предполагать схему его приема один раз в сутки.
На стадии доклинических испытаний было также показано, что
биодоступность и биоэквивалентность никавира сравнимы с азидотимидином:
он не обладает мутагенным. ДНК-повреждающим, канцерогенным и
аллергизирующим действием. Неблагоприятное действие на развитие плода
при беременности отмечалось только при использовании 20-кратных
терапевтических доз (при использовании 10-кратных терапевтических доз не
отмечалось).
Закончены мультицентровые клинические испытания никавира на 134
ВИЧ-инфицированных пациентах в течение 3-14 месяцев. Координатором
испытаний выступал Российский научно-методический центр по профилактике
и борьбе со СПИДом. В качестве локальных центров в испытаниях участвовали:
Республиканская клиническая инфекционная больница (г. Санкт- Петербург).
Центры СПИДа в г. Твери, Нижнем Новгороде, Волгограде, Краснодаре, Тюмени.
Ставрополе.
Результаты испытаний показали высокую терапевтическую
эффективность никавира у пациентов, применявших препарат как в виде
монотерапии, так и в составе комбинированной терапии. Повышение уровня
С1Э4-лимфоцитов в среднем в 2-3 раза, снижение медианы уровня РНК ВИЧ
(вирусная нагрузка) в среднем в 3-4 раза (более чем на 0,5 log ) наблюдались \
подавляющего большинства пациентов (73,2%), принимавших никавир.
Положительный терапевтический эффект (восстановление иммунного статуса
и снижение угрозы развития оппортунистических заболеваний) носил
4S2
устойчивый характер при всех изучаемых суточных дозах: от 0,4 г до 1,2 г в 2-
3 приема.
В качестве стандарта рекомендована схема приема никавира по 0,4 г два
раза в день. Для детей: 0,01 - 0,02 г на килограмм веса в 2 приема. Рекомендуется
принимать препарат перед едой и запивать стаканом воды. При поражениях
центральной нервной системы ретровирусом препарат назначают в суточной
дозе 1,2 г. При выраженных побочных явлениях (маловероятно) суточная доза
снижается до 0,4 г у взрослых и до 0,005 г на килограмм веса у детей. Курс
лечения - неограниченный, при необходимости прерывистыми курсами не менее
трех месяцев.
Никавир хорошо переносится не только взрослыми, но и детьми. Обычные
для других антиретровирусных препаратов побочные явления, такие как
тошнота, рвота, головные боли, диарея, миалгия, анемия, тромбоцитопения,
нейтропения практически не наблюдались у пациентов на протяжении всего
времени применения никавира. Кроме того, результаты исследований
показывают возможность применения никавира для пациентов, у которых в
процессе ранее проводимой терапии развилась непереносимость азидотимидина
(ретровира, тимазида). Не отмечено развитие резистентности к никавиру при
длительном (более года) приеме. Низкая токсичность препарата открывает
перспективы применения его в качестве профилактического средс тва при риске
ВИЧ-инфицирования.
Ввиду вышеизложенного, есть все основания считать никавир
перспективным препаратом для терапии ВИЧ-инфекции, имеющим серьезные
преимущества перед аналогичными препаратами, применяемыми в настоящее
время в мировой клинической практике, а создание Никавира - несомненным
достижением отечественной науки и технологии.
Препарат никавир рекомендован к медицинскому применению (11риказ
М3 РФ о медицинском применении №358/5.10.99). Выпускается «Ассоциацией
АЗТ» в таблетках по 0,2 г и 0.4 г. упаковка №20.
Отечественный препарат «Никавир» в 2-3 раза дешевле зарубежных
антиретровирусных препаратов («Retrovir». «Abacavir». «Epivir» Glaxo Wellcome
Inc, «Videx», «Zerit» Bristol-Myers Squit Corn и другие).
Результаты применения никавира в трехкомпонентной комбинированной
антиретровирусной терапии с применением ингибиторов обратной
транскриптазы: никавир, видекс и ненуклеозидный ингибитор вирамун у 25
взрослых больных оказалось весьма эффективным и не сопровождалось какими-
либо побочными явлениями (А.В.Кравченко и др., 2001). В последние годы
количество антиретровирусных средств постоянно увеличивается, лечение
483
ВИЧ-позитивных лиц становится комплексным и продолжает
совершенствоваться. При назначении антиретровирусной терапии выделяют
пациентов с асимптомной и симптоматической ВИЧ-инфекцией, а среди
последних - категорию лиц с продвинутой стадией болезни. Отдельно
рассматриваются подходы к назначению антиретровирусной терапии в острую
фазу заболевания, а также основные принципы для смены неэффективных
режимов или их отдельных компонентов.
11.4. Рекомендации по началу антиретровирусной терапии
Решение относительно начала антиретровирусной терапии должно
приниматься совместно врачом и пациентом. Перед назначением терапии в
каждом случае необходимо произвести клинико-лабораторное обследование
больного, определить клинические показания и противопоказания, оценить
лабораторные параметры и, с учетом полученных данных, выработать
приемлемую схему лечения. Чрезвычайно важно провести с больным
психологическую подготовку с целью обеспечения неукоснительного
выполнения избранного режима.
Лабораторные показания относительно начала антиретровирусной
терапии, а также ее изменения должны основываться на мониторинге таких
параметров, как уровень РНК ВИЧ в плазме (вирусная нагрузка) и количество
С1)4+Т-клеток в периферической крови. Эти тесты являются важнейшими в
оценке вирусной репликации, иммунного статуса пациента и риска
прогрессирования болезни. Изначально вирусная нагрузка определялась лишь
с целью прогноза заболевания, в настоящее время она также служит тестом
для оценки результатов лечения пациентов. Многочисленные наблюдения
указывают на улучшение клинических результатов (уменьшение смертности и
случаев продвижения к СПИДу) при снижении вирусной нагрузки.
Международное сообщество по СПИДу провело в США специальное
совещание по антиретровирусной терапии у взрослых с учетом консенсуса оз
декабря 1999 года. Это совещание по сравнению с принятыми в 1995 году
рекомендациями дало более расширенные сведения относительно мониторинга
в процессе лечения с учетом определения резистентности (рисунок 19).
Кроме того, было учтено появление новых антиретровирусных препаратов,
в частности, эфавиренца, абакавира и ампренавира, что дало основание
пересмотреть имевшиеся ранее рекомендации. В соответствии с пересмотренными
рекомендациями антиретровирусная терапия показана больным:
- с уровнем ВИЧ РНК выше 30 000 копий/мл,
- уровнем CD4 лимфоцитов 350/mL,
484
Рисунок 19
Мониторинг антиретровирусной терапии: что когда измерять?
Некоторые фармакологи полагают, что если
терапевтический мониторинг препаратов имеет
клиническое значение, он может быть использован
(вместе с мониторингом приверженности) вскоре после
- лечение также можно рекомендовать больным с ВИЧ РНК от 5000 до 30000
копий/мл и уровнем CD4 лимфоцитов между 350 и 500 х 106/л,
- терапию можно также считать показанной, если CD4 лимфоциты выше
500 х10‘7л, а ВИЧ РНК от 5000 до 30000 копий/мл с учетом возможной
прогрессии заболевания у больных с высокой вирусной нагрузкой.
Лечение серьезных оппортунистических заболеваний должно
предшествовать антиретровирусной терапии.
В 2002 году показания к назначению антиретровирусной терапии (APT)
больным с ВИЧ инфекцией стали более жесткими (Antiretroviral therapy
quidelines, International AIDS society JAMA, 2002, V. 288). В соотвествии с этими
рекомендациями начало APT у ранее нелеченных больных рекомендуется при:
- симптоматичной ВИЧ инфекции,
- бессимптомной ВИЧ инфекции при CD4 клетках ниже 200 имм- крови,
- бессимптомной ВИЧ инфекции с CD4 выше 200 в случаях их быстрого
снижения или высокого уровня вирусной нагрузки, выше чем 50000-100000
РНК копий/мл.
При этом учитывается риск индивидуальной токсичности,
взаимодействия лекарств, их фармакокинетика. Большое значение придается
заинтересованности больного влечении и способности быть приверженным к
терапии.
Согласно рекомендациям М3 РФ (1999,2001) показаниями к началу APT
являются острая ВИЧ инфекция и стадии 111 А-Б и В, лабораторными
показаниями являются: снижение CD4 лимфоцитов ниже 0,3x109 при
повышении концентрации РНК ВИЧ в крови более 60000 коп/мл. Если эти
показатели выявлены впервые, то для решения вопроса об APT необходимы
повторные исследования с интервалом не менее 4-х недель, при этом в стадию
3 А (2В по классификации 1999 года) назначается моно- или дитерания. ВААРТ
рекомендуется назначать при CD4 ниже 0,2x10'7л (ниже 200 в мл). В IV (V
стадия по классификации 1999 года) APT не назначается.
Количественное измерение уровня РНК ВИЧ в плазме рекомендуется
выполнять непосредственно перед назначением антиретровирусной терапии и
через 4-8 недель лечения, что позволяет оценить начальную эффективность
терапии. У большинства пациентов за это время происходит быстрое снижение
вирусной нагрузки (0,5 - 0,7 log, , или приблизительно в 3 - 5 раз), а через 12-16
недель она становится ниже уровня определения (< 500 копий РНК/мл плазмы).
Скорость снижения вирусной нагрузки индивидуальна и зависит от многих
факторов: начального уровня вирусной нагрузки и количества CD4I Т-клеток.
наличия предшествующей терапии и ее продолжи тельности, а также присутствия
оппорзунистических инфекций и приверженности пациента выбранному режиму.
486
Последующие измерения вирусной нагрузки должны выполняться
каждые3-4 месяца. Если черезб месяцевлечения дважды измеренная вирусная
нагрузка остается более 500 копий РНК/мл плазмы, антиретровирусная терапия
должна быть изменена.
В настоящее время разработаны более чувствительные методы
определения вирусной нагрузки (до 50 копий РНК/мл). Клинические данные
подтверждают, что снижение уровня РНК ВИЧ ниже 50 копий/мл ассоциируется
с более полной и длительной вирусной супрессией, нежели при снижении РНК
ВИЧ до 50 -500 копий/мл плазмы.
Не рекомендуется измерять вирусную нагрузку в течение 4 недель после
завершения лечения любой интеркуррентной инфекции, симптоматического
заболевания или после иммунизации.
С целью получения более достоверных результатов определение вирусной
нагрузки должно выполняться в одних и тех же условиях ввиду существующих
различий среди коммерческих тестов.
Терапия первой линии: терапия должна проводиться комбинацией
препаратов с высокой противовирусной активностью ихорошей переносимостью.
Первая схема должна оставлять стратегические варианты на будущее, т.е. включать
препараты, дающие наименьшую перекрестную резистентность.
Рекомендуемые схемы: А/.ТДЗТС+IDV, AZT+3TC+EFV. Нелсон
рекомендует вместо AZT+3TC-DDIJ-D4T.
В настоящее время намечается переход к новой концепции APT, на основе
разнообразия препаратов создавать более простые схемы лечения, включая
такие, когда можно принимать препараты 1 раз в сутки. Рекомендуемые схемы:
EFV-DDH3TC, EFVi-D4T+3TC. Использование для терапии первой линии
простых и эффективных схем может продлить срок ее эффективности, т.е.
снизить необходимость ВААРТ второй линии.
Рекомендации по назначению антиретровирусной терапии у пациентов с
асимптомной ВИЧ-инфекцией.
К настоящему времени получены убедительные данные о том, что
антиретровирусная терапия обеспечивает успех и показана всем пациентам с
симптоматической ВИЧ-инфекцией, независимо от показателей вирусной
нагрузки и СО4+Т-клеток, однако для лиц с асимптомной ВИЧ-инфекцией с
количеством CD4 i-Т-клеток > 500/мм’’ можно говорить только о теоретически
предполагаемом успехе использования антиретровирусных средств ввиду
отсутствия данных о достаточно длительных наблюдениях.
Используемые в настоящее время комбинации антиретровирусных
агентов обладают выраженным противовирусным эффектом, однако, все
они способны вызывать побочные явления, осложнения и взаимодействовать
487
с другими лекарственными средствами, поэтому решение о назначении
лечения пациентам с хронической асимптомной ВИЧ-инфекцией должно
основываться на сопоставлении ряда факторов, определяющих риск и пользу
терапии.
Серьезными аргументами, влияющими на решение начать терапию,
являются: реальная или потенциальная возможность достигнуть максимального
подавления вирусной репликации; сохранение иммунных функций; улучшение
качества и продление жизни; снижение риска возникновения лекарственной
резистентности из-за ранней супрессии вирусной репликации; минимальные
токсические эффекты и лекарственные взаимодействия.
Негативными факторами раннего назначения антиретровирусной терапии
могут служить: потенциальные неблагоприятные лекарственные эффекты;
потенциальный риск развития ранней лекарственной резистентности;
потенциальное ограничение выбора терапии в будущем и др.
При принятии решения о назначении терапии асимптомным больным
должны учитываться желание пациента начать терапию, степень существующего
иммунодефицита, определяемого количеством СЕМ+Т-клеток, риск прогрессии
ВИЧ-болезни, определяемый уровнем РНК ВИЧ в плазме, потенциальная польза
и риск начальной терапии, вероятность приверженности пациента
предписанному режиму.
В случае назначения терапии необходимо использовать мощные
комбинации с целью добиться снижения вирусной нагрузки до неопределяемого
уровня. В целом терапия показана всем пациентам с количеством СО4+Т-клеток
< 500/мм3 или уровнем вирусной нагрузки > 10000 копий (bDNA), или > 20000
копий PI IK (RT-PCR) в 1 мл плазмы.
Однако для пациентов с асимптомной ВИЧ-инфекцией в настоящее время
рассматриваются два подхода к назначению антиретровирусной терапии: первый
- терапевтически более агрессивный, когда большинство пациентов должно
лечиться на ранних ст адиях болезни, учитывая, что ВИЧ-инфекция практически
всегда является прогрессирующей; второй - терапевтически более осторожный
подход, допускающий более позднее начало антиретровирусной терапии с
учетом степени предполагаемого риска и пользы.
Первый подход основан на принципе раннего началатерапии до развития
значительной иммуносупрессии и достижения неопределяемого уровня
вирусной нагрузки. Так, все пациенты с количеством СО4+Т-клеток меньше
500/мм’, а также те, у кого количество CD41 Т-клеток больше 500/мм3, но
уровень вирусной нагрузки более 10000 копий (bDNA) или 20000 копий (RT-
PCR) в I мл плазмы, должны начать антиретровирусную терапию. Раннее
значение антиретровирусной терапии может способствовать сохранению
488
иммунокомпетентных клеток и выработке должного иммунного ответа, поэтому
рекомендуется всем больным с первичной инфекцией при наличии
возможностей назначать антиретровирусную терапию.
При более консервативном подходе пациентам с низким уровнем вирусной
нагрузки и небольшим риском прогрессии ВИЧ-болезни с количеством CD4+T-
клеток менее 500/мм3 терапия не назначается. В таких случаях продолжается
мониторинг и наблюдение пациентов.
Если терапия начата у пациентов, ранее не принимавших
антиретровирусные препараты, то она должна начинаться с режимов,
предполагающих снижение вирусной нагрузки до неопределяемой.
Основываясь на опыте использования антиретровирусных агентов,
рекомендуется начинать терапию с двух нуклеозидных ингибиторов ОТ иодного
сильного ингибитора протеазы (ИП) (приложение 10). Возможны и другие
альтернативные режимы. Они включают два ИП, например, ритонавир и
саквинавир (с одним или двумя НИОТ) или невирапин вместо ИП. Двойная
ИП-терапия ритонавиром и саквинавиром без НИОТ подавляет виремию ниже
предела определения и удобна для приема дважды в день, однако надежность
этой комбинации не вполне установлена, поэтому рекомендуется добавлять по
крайней мере один НИОТ, если терапия начинается с двух ИП.
Замена ИП на невирапин или использование только двух НИОТ не снижает
вирусную нагрузку ниже порога определения, как при сочетании двух НИОТ +
ИП, поэтому данные комбинации должны применяться только в тех случаях,
когда более жесткое лечение невозможно. Однако, некоторые эксперты
обсуждают выбор тритерапии, включающей либо ИП, либо невирапин для
пациентов, ранее не принимавших аниретровирусные агенты.
Другие режимы, использующие два ИП или ИП + ННИОТ в качестве
начальной терапии, сейчас проходят клинические испытания. Клинические
изучения двух утвержденных ННИОТ, подтвержденные результатами измерения
вирусной нагрузки, выявили преимущество невирапина надделавирдином.
Необходимо учесть, что, хотя ЗТС является сильным НИОТ в комбинации
с другим и НИОТ, могут возникать ситуации, при которых не достигается полной
вирусной супрессии, и тогда к ЗТС быстро развивается вирусная резистентность.
Поэтому рекомендуется оптимальное использование этого препарата в
комбинации из трех или более антиретровирусных агентов. В подобных режимах
должны использоваться и другие антиретровирусные агенты, такие как ННИОТ
- невирапин и делавирдин, к которым быстро развивается резистентность.
Новые варианты терапии были предложены в последние годы. Они
включают эфавиренц(сустива), зидовудин и ламивудин (возможно, комбивир),
Заказ N" К-4451.
489
другой вариант: индинавир, зидовудин и ламивудин, а также эфавиренц, d4T,
ЗТС) (Staszewski S. et al.; Bartlett J. et al, 2000; Aribos J., Glasgow, 2000).
Использование антиретровирусных агентов в качестве монотерапии не
показано, за исключением случаев, когда нет другого выбора, или у беременных
женщин для профилактики перинатальной инфекции.
С началом терапии все препараты должны приниматься синхронно, в
полной дозе, но при использовании ритонавира, невирапина и сочетания
ритонавира с саквинавиром дозы препаратов следует изменить. Информация о
лекарственных взаимодействиях ННИОТ и ИП представлена в приложении 5.
Особое внимание должно быть уделено лекарственным взаимодействиям ИП с
другими лекарственными средствами.
Рекомендации по началу антиретровирусной терапии у пациентов с
продвинутой ВИЧ-инфекцией.
Стадия ВИЧ-инфекции у пациентов с оппортунистическими инфекциями,
вастинг-синдромом или злокачественными опухолями расценивается как
продвинутая. Все пациенты с продвинутой ВИЧ-инфекцией должны получать
антиретровирусную терапию, однако при этом необходимо учитывать некоторые
особенности. Если у пациента имеется острая оппортунистическая инфекция
или другое осложнение ВИЧ-инфекции, при решении начать терапию
необходимо тщательно подбирать антивирусные режимы с учетом
лекарственной токсичности, приемлемости выбранной терапии, лекарственных
взаимодействий и лабораторных изменений. Начальная терапия должна
включать максимально интенсивные режимы (два НИОТ : один ИП). Начатая
антиретровирусная терапия не должна прерываться во время острой
оппортунистической инфекции или злокачественного процесса, если это не
связано с токсичностью препаратов, их непереносимостью или лекарственными
взаимодействиями.
У пациентов с прогрессирующей к СПИДу ВИЧ-инфекцией, получающих
усложненные комбинации антиретровирусных агентов, возможны
множественные лекарственные взаимодействия, поэтому выбор должен быть
сделан с учетом всех потенциальных взаимодействий и перекрестной
токсичности препаратов. Например, использование рифампина для лечения
активных форм туберкулеза является проблематичным у пациентов,
принимающих ингибиторы протеазы, которые отрицательно действуют на
метаболизм рифампина, но, в то же время, являются необходимыми для
эффективной супрессии вирусной репликации у пациентов с продвинутой ВИЧ-
инфекцией. Наоборот, рифампин снижает концентрацию ИП в крови, что может
490
сделать выбранный режим субоптимальным. Однако, несмотря на то, что
рифампин противопоказан или не рекомендуется для совместного
использования со всеми ингибиторами протеаз, обсуждается вопрос о
возможности его применения в уменьшенных дозах.
Другими факторами, осложняющими течение продвинутой ВИЧ-
инфекции, являются синдром истощения и анорексия, наличие которых у
пациента может нарушить абсорбцию определенных ИП и снизить
эффективность антиретровирусной терапии.
Костномозговая супрессия, ассоциируемая с АЗТ, атакже нейтропении,
вызываемые ddC, d4T и ddl, могут усугублять прямые эффекты ВИЧ, что может
привести к их лекарственной непереносимости.
Гепатотоксичность, ассоциируемая с некоторыми ИП, может ограничивать
использование этих лекарственных веществ, особенно у пациентов с
дисфункцией печени.
Абсорбция и период полужизни некоторых лекарственных веществ могут
бы ть изменены при одновременном использовании антиретровирусных агентов,
особенно ИП и ННИОТ. чей метаболизм вовлекает ферменты системы
цитохрома Р450: ритонавир, индинавир, саквинавир, нелфинавир и делавирдин
- ингибируют ее, невирапин -индуцирует. Ингибиторы системы Р450 цитохрома
обладают потенциальным свойством повышать концентрацию некоторых
лекарственных препаратов, имеющих аналогичные пути метаболизма. Добавляя
ингибитор системы Р450 цитохрома, иногда можно улучшить
фармакокинетический профиль выбранных агентов (например, добавляя
ритонавир к саквинавиру) и их противовирусный эффект, однако эти
взаимодействия moi ут привести к угрожающим жизни последствиям, поэтому
пациенты должны быть информированы о всех возможных последствиях, и
решение о назначении таких комбинаций должно быть согласовано с пациентом.
Начало мощной антиретровирусной терапии часто ассоциируется с
некоторой степенью восстановления иммунных функций. В этой связи у
пациентов с продвинутой ВИЧ-инфекцией и субклиническим течением
оппортунистических инфекций (атипичные микобактериозы или ЦМВИ) могут
развиться новые иммунные реакции в ответ на патоген и, соответственно, моп'т
появиться новые симптомы, связанные с изменением иммунного и/или
воспалительного ответа. Эти явления не должны расцениваться как неудачи
антиретровирусной терапии. В таких случаях необходимо проводить лечение
оппортунистических инфекций параллельно с антиретровирусной терапией и
одновременно контролировать уровень вирусной нагрузки.
32*
491
Сочетанные с ВИЧ болезни, требующие осторожности при
использовании некоторых лекарств.
(Hoffmann-Kamps, HIV Medicine, 2003)
Гепатит С Невирапин, поддерживающие ИП
Гепатит В Невирапин, поддерживающие ИП (Ламивудин и Тенофовир могут воздействовать благоприятно)
Анемия АЗТ, возможно также, Ламивудин
Полиневропатия Ставудин. Зальцитабин. Диданозин
Почечные заболевания Индинавир, взможно также. Тенофовир
Диабет ИП
Гипертония Индинавир
Инфаркт миокарда И1 ((благоприятно действует Невирапин)
Психозы (другие заболевания ЦНС) Ифавиренц
Хроническая диарея Нелфинавир, другие ИП
492
11.5. Антиретровирусная терапия при острой ВИЧ-инфекции.
По имеющимся сведениям, не менее 50%, а возможно и до 90% лиц в
стадии острой ВИЧ-инфекции имеют хотя бы некоторые симптомы так
называемого «острого ретровирусного синдрома», следовательно, они являются
кандидатами для проведения ранней терапии. Получены данные о ближайшем
эффекте лечения на величину вирусной нагрузки и число СО4+Т-клеток, однако
отдаленные клинические результаты противоретровирусной терапии первичной
ВИЧ-инфекции неизвестны. Завершенные к настоящему времени клинические
исследования ограничивались малым размером выборки, короткой
продолжительностью наблюдения и нередко такими схемами терапии, которые,
по современным представлениям, обладают недостаточно оптимальной
противовирусной активностью. Тем не менее, эти исследования в целом
поддерживают точку зрения о необходимости противоретровирусной терапии
на стадии острой ВИЧ-инфекции. Проводимые в настоящее время клинические
исследования изучают отдаленную клиническую эффективность более мощных
терапевтических схем.
Теоретическое обоснование для раннего вмешательства аргументируется
следующим образом:
- необходимо подавить начальный «взрыв» вирусной репликации и
снизить степень диссеминации вируса в организме;
- необходимо уменьшить степень тяжести острой фазы заболевания;
- возможно, терапия повлияет на первоначальную локализацию вируса,
что, в конечном итоге, может снизить скорость прогрессирования заболевания;
- возможно, терапия снизит скорость мутации вирусов благодаря
подавлению их репликации.
Многие специалисты согласны с лечением острой ВИЧ-инфекции, исходя
из теоретических обоснований и ограниченных данных клинических
исследований, говорящих в его пользу, а также опыта, накопленного
клиницистами, занимающимися ВИЧ-инфекцией. Однако, врач и больной
должны четко осознавать, что лечение первичной ВИЧ-инфекции основано на
теоретических соображениях и потенциальные преимущества, описанные выше,
нужно сопоставлять с возможным риском, который включает:
- побочные эффекты в отношении качества жизни, связанные с
токсическим действием лекарственных препаратов и особенностями их приема;
- вероятность развития лекарственной резистентности в том случае, если
начальная терапия не приведет к эффективному подавлению репликации вируса,
что ограничит возможность выбора терапии в будущем;
493
- необходимость проводить лечение с неопределенной длительностью.
Многие эксперты рекомендуют назначать противоретровирусную
терапию всем пациентам с лабораторными признаками острой ВИЧ-инфекции,
которые включают наличие РНК ВИЧ в плазме, определенной чувствительным
методом ПЦР, или bDNA, в сочетании с результатами серологической
диагностики ВИЧ-инфекции (антитела к ВИЧ). Несмотря нато, что определение
РНК ВИЧ в плазме является предпочтительным методом диагностики, в случае,
если такой возможности нет, может быть целесообразным тест на антиген р24.
Как только врач и больной приняли решение о проведении
противоретровирусной терапии по поводу первичной ВИЧ-инфекции, они
должны ставить целью подавление концентрации РНК ВИЧ в плазме до уровня
ниже порога определения. Накопленный опыт позволяет предполагать, что схема
лечения острой ВИЧ-инфекции должна включать комбинацию двух НИОТ и
один мощный ИП. Возможно применение тех же препаратов, что используются
для лечения уже развившейся ВИЧ-инфекции.
Поскольку: 1) конечной целью терапии является подавление репликации
вируса ниже порога определения, 2) преимущества терапии основываются,
главным образом, на теоретических соображениях и 3) отдаленный клинический
эффект пока не доказан, любая схема, которая, как ожидается, не приведет к
максимальному угнетению вирусной репликации, не приемлема для лице острой
ВИЧ-инфекцией. Для дальнейшего изучения роли противоретровирусной
терапии при первичной инфекции требуются дополнительные клинические
исследования.
Определение РНК ВИЧ в плазме и количества CD4+ клеток, а также
мониторинг токсических явлений в острой фазе ВИЧ-инфекции следует
проводить по обычным правилам, то есть в начале лечения, через 4 недели, а
затем каждые 3-4 месяца. Некоторые специалисты считают, что не обязательно
определять РНК ВИЧ на четвертой неделе для оценки эффективности терапии
по поводу острой инфекции, потому что вирусная нагрузка может снижаться
(по сравнению с пиковой) даже в отсутствие лечения.
Многие эксперты считаюттакже, что, помимо пациентов с острой ВИЧ-
инфекцией. лечение необходимо и лицам с подтвержденной сероконверсией в
предыдущие 6 месяцев. Хотя начальный «взрыв» виремии у инфицированных
взрослых обычно исчезает в пределах двух месяцев, лечение в это время
обосновывается тем, что репликация вируса в лимфоидной ткани в первые 6
месяцев после инфицирования все еще не максимально подавлена иммунной
системой.
494
Приводим одно из наших наблюдений.
Пациент Н. инфицирован при однократном введении героина (со слов,
«попробовал») в мае 1999 года. При анонимном обследовании в сентябре 1999
выявлены антиВИЧ. За месяц до этого обследование на ВИЧ дало отрицательный
результат. После получения положительного результата на ВИЧ обратился за
медицинской помощью, при обследовании выявлена высокая вирусная нагрузка
- до 800000 копий РНК ВИЧ в 1 мл плазме, CD4 - 746/мм3, выявлен также
гепатит С, РНК НС V позитивна. Больному назначен азидотимидин (ретровир)
600 мг в сутки, ламивудин (эпивир) 300 мг в сутки и фортоваза 1200 мг 3 раза
в сутки. При исследовании через месяц вирусная нагрузка снизилась до
неопределяемого уровня.
Однако, несмотря на то, что большинство экспертов считает
обоснованной противовирусную терапию у больных острой ВИЧ-инфекцией
(Департамент здоровья США, 1999 год), длительность этой терапии неизвестна.
В то же время, многие эксперты считают целесообразным лечить ее
неопределенно долгое время, так как после прекращения терапии РНК ВИЧ
может появиться вновь или возрасти.
11.6. Перерыв в антиретровирусной терапии.
Иногда по тем или иным причинам (непереносимые нежелательные
эффекты, взаимодействие лекарственных веществ, отсутствие препарата и
т.д.) приходится прерывать антиретровирусную терапию. Достоверных
сведений о том, насколько дней, недель или месяцев можно без последствий
отменить один препарат или всю комбинацию, нет. Если возникает
необходимость в прерывании антиретровирусной терапии на длительный срок,
то теоретически лучше отменить все препараты, чем продолжать терапию
одним или двумя антиретровирусными средствами. Такой подход позволяет
свести к минимуму риск появления устойчивых штаммов вируса.
Перерыв в противовирусной терапии рекомендуют также отечественные
авторы (О.Г.Юрин, 1999 год). Однако, с нашей точки зрения, перерыв
возможен только при контроле за уровнем СО4-клеток и вирусной нагрузкой.
По поводу перерывов влечении идет большая дискуссия. Одни авторы
предлагают перемежающуюся терапию, другие считают целесообразным
делать перерывы в лечении. Интермиттирующая терапия рекомендуется тем
больным, у которых РНК ВИЧ снижается ниже 500 копий в мл, перерывы
считают возможными отЗ до 6 месяцев. Наиболее перспективно эти перерывы
495
проводить тем больным, у которых вирусная нагрузка ниже 50 копий в мл, а
CD4 выше 300 в мм3. Dybul М и соавт., 2001 рекомендуют следующую схему
перемежающейся терапии: зерити ламивудин, индинавир втечение? дней, 7
дней перерыва и это лечение продолжается в течение года. Авторы сообщили
положительный результат использования этой схемы. Поданным Faussi, 2001,
у больных на перемежающейся терапии был меньше выражен синдром
липодистрофии, и наблюдалось снижение общих триглицеридов и
холестерина.
В последующем Dybul и соавт. проанализировали результаты лечения
70 больных, которые получали лечение в течение 8 недель и 4 недели без
лечения (интермиттирующаятерапия). Втечение каждой отмены препаратов
примерно на20% увеличивался уровень вирусной нагрузки. Несущественно,
но снижалось количество CD4 клеток. Уровень липидов в крови снижался
также. Согласно последним рекомендациям при вирусной нагрузке выше 30-
50 копий РНК в мл и CD4 клеток ниже 400 терапия рекомендуется длительная,
однако возможны перерывы, но только в ситуации, когда наблюдается стойкая
супрессия вирусной репликации и существенное улучшение
иммунологических показателей. Больные, у которых в анамнезе было CD4
ниже 200 и зарегистрированы оппортунистические инфекции, должны
находиться систематически на медикаментозной терапии без каких-либо
перерывов.
Специальными швейцарско-испанскими исследованиями показано, что
перемежающаяся терапия у больных с уровнем ВИЧ РНК ниже 400 копий в
мл и CD4 выше 300 в мм’, получавших высокоактивную антиретровирусную
терапию четырьмя циклами из 8 недель лечения и 2 недель перерывов, была
успешной. Лечение останавливалось спустя 40 недель и больные не получали
терапию до 52 недели включительно, однако, терапия назначалась, если в
плазме уровень РНК ВИЧ повышался свыше 5000 копий в мл.
В мультицентровых исследованиях, проведенных C.Fagard (2000), Lori
и соавт. (2000-2002 гг.) в городах Италии и США, была показана возможность
и перспективность перерывов в антиретровирусной терапии. Использование
комплекса из 3-4-х противовирусных средств может при ВААРТ у хронических
больных с ВИЧ инфекцией дать временный эффект, но может сопровождаться
рикошетным повышением вирусной нагрузки и снижением CD4 лимфоцитов.
Ввиду этого, предлагается использовать в период перерывов в лечении
препараты, повышающие клеточный иммунный ВИЧ специфический Th 1 Т-
клеток и уровень гамма-интерферона.
496
Таблица 67
Примеры изменений вирусной нагрузки (ВН) и CD4 клеток в
перерыве ВААРТ
Периоды CD4 ВН
1 2 3
1 1. До ВААРТ 256 180 000
2. Перед перерывом в лечении 616 49
3. спустя 2-8 недель перерыва 440 35796
—
1. До ВААРТ 168 727 999
2. Перед перерывом в лечении 428 49
3. спустя 2-8 недель перерыва 492-238 74
—
1. До ВААРТ 256 180 000
2. Перед перерывом в лечении 616 49
3. спустя 2-8 недель перерыва 440-311 35 796-88
228
Следовательно, перерывы в ВААРТ оправданы, целесообразны. Вместе
с тем, они требуют контрольных определений CD4 и вирусной нагрузки, по
меньшей мере, ежемесячно или лучше спустя 2 недели после отмены ВААРТ.
11.7. Изменение неэффективных режимов антиретровирусной терапии.
Неэффективность терапии может возникать по причине многих
обстоятельств, таких как начальная вирусная резистентность к одному или
нескольким агентам, измененная абсорбция или метаболизм препаратов,
неблагоприятное влияние лекарственных фармакокинетик на уровень
терапевтических средств и др.
Основным параметром в оценке терапевтического результата является
вирусная нагрузка. Клинические осложнения и изменения количества СD4+T-
клеток могут дополнять тест вирусной нагрузки в оценке ответа на терапию.
В случае терапевтической неудачи критериями для смены
антиретровирусной терапии являются:
497
- снижение ВИЧ РНК в плазме через 4-8 недель от начала лечения менее
чем 0.5-0.7 log|n;
невозможность снизить вирусную нагрузку до неопределяемого
уровня в течение 4-6 месяцев от начала терапии;
- возобновление определения вируса в плазме после начальной
супрессии до неопределяемого уровня, что подтверждает развитие
резистентности;
- троекратное или более увеличение ВИЧ РНК в плазме;
- неопределяемая виремия у пациентов, получающих комбинированную
терапию из двух НИОТ (пациенты, получающие два НИОТ, достигшие цели
неопределяемой вирусной нагрузки, имеют выбор - продолжить этот режим
или изменить его на более приоритетный режим. Предыдущий опыт показывает,
что большинство пациентов, оставшихся надвойной НИОТ-терапии, в конце
концов терпят вирусологическую неудачу по сравнению с пациентами,
использующими приоритетные режимы);
- упорное снижение количества СЭ4^Т-клеток, подтвержденное по
крайней мере двумя отдельными исследованиями;
- клиническое ухудшение.
В отношении изменения терапии должны расматриватьсятри категории
пациентов:
- лица, принимающие один или два НИОТ с определяемой или
неопределяемой вирусной нагрузкой:
- лица, находящиеся на мощной комбинированной терапии, включая ИП.
с возобновившейся виремией после начальной супрессии до неопределяемых
уровней;
- лица, находящиеся на мощной комбинированной терапии, включая ИП.
у кого вирусная нагрузка никогда не снижалась до неопределяемого уровня.
Измененный режим у всех пациентов должен максимально подавлять
вирусную активность, однако, для первой категории лиц выбор новых
комбинаций гораздо шире, так как они не принимали ИП.
Обсуждение альтернативных режимов должно учитывать сил\
замещающего режима, переносимость препаратов и приверженность пациента
данному режиму.
Рекомендации по модификации терапии («Рекомендации по лечению
ВИЧ-инфекции у взрослых и подростков», Департамент здоровья США, май
1999 года).
498
Предыдущая терапия
Два нуклеозидных
ингибитора обратной
транскриптазы+
нелфинавир
ритонавир
индинавир
саквинавир
Два нуклеозидных
ингибитора обратной
транскриптазы+
ненуклеозидный
ингибитор обратной
транскриптазы
Два нуклеозидных
ингибитора обратной
транскриптазы
Один нуклеозидный
ингибитор обратной
транскриптазы
Новая терапия
Два новых ингибитора обратной транскриптазы :
ритонавир; индинавир; саквинавир+ритонавир;
ненуклеозидный ингибитор обратной
транскриптазы+ритонавир или индинавир
саквинавир+ритонавир;
нелфинавир+ненуклсозидный ингибитор
обратной транскриптазы; или
нелфинавир t-саквинавир
саквинавир-ритонавир;
нелфинавир+ненуклсозидный ингибитор
обратной транскриптазы; или
нелфинавир+саквинавир
ритонавиртсаквинавир; или ненуклеозидный
ингибитор обратной транскриптазы1 индинавир
Два новых ингибитора обратной
транскриптазы-ингибиторы протеазы
Два новых ингибитора обратной
транскриптазы- ингибитор протеазы
Два новых ингибитора обратной
транскриптазы+ритонавир и саквинавир
Один новый ингибитор обратной
транскриптазы < ненуклеозидный ингибитор
обратной транскриптазы - ингибитор протеазы
Два ингибитора протеазы+нснуклсозидный
ингибитор обратной транскриптазы
Два новых ингибитора обратной
транскриптазы • ингибитор протеазы
Два новых ннгибигора обратной
транскриптазы+нснуклеозидный ингибитор
обратной транскриптазы
Один новый ингибитор обратной
транскриптазы+ненуклсозидный ингибитор
обратной транскриптазы + ингибитор протеазы.
Рекомендации для изменений в терапии различаются в соответствии с
показаниями для изменений. Если желаемое снижение вирусной нагрузки было
достигнуто, но у пациента развилась токсичность или непереносимость,
499
необходимо заменить препарат, вызвавший неблагоприятные эффекты, на другой
из того же класса агентов с отличным профилем токсичности и переносимости.
На Седьмом Европейском симпозиуме по лечению ВИЧ-инфекции «На
всю оставшуюся жизнь», Будапешт, 1-3 февраля 2002 года, были актуальными
следующие вопросы по терапии ВИЧ-инфекции: что делать после первой
неудачи, как выбрать терапию второй линии, попытаться найти схему, в
максимальной степени способную подавлять ВИЧ РНК до <50 копий. При этом
рекомендуется проводить:
• Анализ истории болезни - выбор антиретровирусного препарата на
основе мнения экспертов и соображений стандарта лечения
• Анализ на резистентность: генотипический и/или фенотипический,
перекрестная резистентность.
• Тщательная оценка переносимости/токсичности.
• Определение концентраций лекарственных препаратов в организме -
следует учесть:
- Приверженность лечению;
- лекарственные взаимодействия - ИП, в сочетании с усилением
их ритонавиром, учет токсичности и, в частности,
митохондриальной гипертоксичности;
- мониторинг концентраций препарата;
- фармакокинетику препаратов.
Если желаемое снижение вирусной нагрузки было достигнуто, но пациент
получал режим не приоритетной категории (два НИОТ или монотерапию),
можно продолжить начатую терапию под тщательным контролем уровня
вирусной нагрузки, или добавить другой препарат к текущему режиму согласно
интенсивным терапевтическим схемам. Большинство экспертов считают, что
использование неинтенсивных схем заканчивается неудачей, и рекомендуют
приоритетные режимы. Имеются сведения, подтверждающие неудачу
терапевтически мощных режимов, включающих ИП, вследствие выработки
перекрестно-резистентных штаммов ВИЧ, особенно если вирусная репликация
не была полностью подавлена. Такие явления наиболее характерны для класса
ИП. Очевидно, что вирусные штаммы, которые стали резистентными к одному
из ИП, становятся менее чувствительными к большинству или ко всем ИП. Так,
успех комбинации ИП + два ННИОТ может быть ограничен, даже если все
компоненты отличаются от предыдущего режима, в этом случае возможна
замена на два ИП. Возможные комбинации из двух ИП в настоящее время
продолжают активно изучаться (Корр J.B. et al., 1997).
Изменение режима по причине терапевтической неудачи идеально должно
вовлекать полное замещение всех компонентов на препараты, ранее не
500
используемые пациентом. Обычно используются два новых НИОТ и один новый
ИП, два ИП с одним или двумя новыми НИОТ, или ИП в комбинации с ННИОТ.
Могут позребоваться изменения доз препаратов, объясняемые лекарственными
взаимодействиями, когда используются ингибиторы протеазы или ИП+ННИОТ
(приложение 5).
Согласно рекомендациям М3 РФ, разработанным Российским Научно-
методическим центром профилактики и борьбы со СПИДом (1999 г.)
обосновываются разные схемы противовирусной терапии. Монотерапия
отечественными препаратами -тимазидом 0,2x3 раза, фосфазидом 0,4x3 раза в
сутки рекомендуется в начальных стадиях ВИЧ-инфекции при количестве CD4
ниже 500 и/или при вирусной нагрузке от 20.000 до 100.000 копий РНК ВИЧ.
Битерапия с применением ингибиторов обратной транскриптазы показана при
наличии клинических проялений и при неэффективности монотерапии с учетом
количества CD4 клеток и уровня вирусной нагрузки. Однако, авторы считают
возможным назначать комбинированную терапию только по клиническим
показаниям при отсутствии лабораторных данных. Мы приводим одну из таблиц
комбинированной терапии (приложение 14), в которой приведена стоимость
каждого из курсов: монотерапии, битерапии и тритерапии втечение года.
Каргину будущей терапии ВИЧ-инфекции ведущий ученый по этой
проблеме B.Gazzard (1999) рисует пессимистично. Стандартная высокоактивная
антиретровирусная терапия, включающая 2 НИОТ в комбинации с ингибиторами
протеазы или ННИОТ снижает вирусную нагрузку до неопределяемого самыми
чувствительными методами уровня. Такая терапия является стандартом для
лечения больных, ранее не получавших антиретровирусной терапии.
Однако, во-первых, длительные, в течение 3 лет клинические изучения
позволяют усомниться в эффективности лечения. Во-вторых, стоимость
комбинированной терапии в течение года достаточно дорога. В-третьих,
исследования, включая удобство, токсичность, фармакологические
взаимодействия, резистентность и отсутствие эффекта, требуют новых идей
для антиретровирусной терапии.
11.8. Соблюдение режима лечения при ВИЧ-инфекции
Появление высокоактивной антиретровирусной терапии вызвало
необходимость соблюдения режима лечения для получения хороших
результатов. Следствием несоблюдения назначенного режималечения является
риск того, что лекарство не будет иметь эффекта. Главная опасность заключается
в том, что недостаточная доза антиретровирусного препарата вследствие
501
несоблюдения режима лечения может привести к увеличению количества ДНК
в плазме, развитию резистентности к лекарственным препаратам и негативным
последствиям в плане прогрессирования заболевания и летального исхода.
Факторами, влияющими на аккуратность приема лекарств пациентом, являются:
- стадия заболевания, больной должен сознавать опасность, которую несет
болезнь и верить, что соблюдение режима лечения уменьшит эту
опасность;
- режим лечения должен подразумевать, что больной понимает сложность,
продолжительность, безопасность и стоимость предложенного ему
режималечения;
- взаимоотношения между пациентом и работником здравоохранения, врач
должен мотивировать необходимость последовательно соблюдать
предписанный курс лечения ввиду пользы для больного и течения
заболевания.
Начальный режим лечения должен тщательно подбираться с учетом
пожеланий пациента и его образа жизни. При этом участие фармаколога,
который владеет детально фармакологическими характеристиками препарата,
является чрезвычайно важным. Фармацевт должен обсуждать с пациентом
количество принимаемых таблеток в день, возможность выбора удобных
вариантов лечения, обязательность соблюдения интервалов между дозами,
требования к диетотерапии и ограничения в питании. Особенно важно учитывать
побочные реакции, а также возможность взаимодействия лекарств (см.
приложения). Необходимо также принимать во внимание ограничения вусловиях
хранения лекарств. Некоторые из лекарств хранятся в специальных условиях,
что следует учесть для тех, кто принимает лекарства вне дома. У некоторых
пациентов есть трудности с глотанием, для них следует подобрать препараты,
выпускаемые в жидкой форме.
Одним из главных моментов является союз между пациентом и
медицинским работником, основанный на уважении сторон и честном обмене
информацией (понимание - "compliance”). Для улучшения соблюдения режима
лечения необходимо учитывать индивидуальные потребности каждого
конкретного пациента, разъяснять предписанные инструкции и обеспечить
памятками по соблюдению режима и графика лечения. Целесообразно
проверить, что запомнил больной после каждого консультирования. При
последующих наблюдениях целесообразно иметь тесный контакте больным,
возможность посещения или звонка пациенту для выяснения сложностей в
приеме лекарств и соблюдения схемы лечения. Необходимо следовать правил)':
обеспечить наилучшее лекарство для данного пациента с учетом присущего
ему образа жизни. Фармацевт, обсуждая с пациентом все вопросы, связанные
с принимаемым лекарством, может сыграть важную роль и помочь ВИЧ-
инфицированному в достижении наилучшего результата лечения.
502
Причины низкой приверженности к APT (А.В.Кравченко, 2001):
- проблема психологической адекватности пациента (депрессия,
наркомания, психотропные побочные эффекты препаратов),
- значительное количество таблеток для каждодневного приема (иногда
около 40).
- многократность приема препаратов в сутки,
- сложные условия приёма препаратов связанные с:
- временем суток,
- наличием, характером и временем приема пищи,
- приемом других препаратов,
- особенностями приема(например, индинавир необходимо запивать
не менее 1,5 л жидкости, что при 3-х разовом приеме составляет
4,5 л каждый день),
- большой размер таблеток и капсул,
- неприятный вкус препаратов (ритонавир, например, имеет вкус смеси
алкоголя и касторового масла),
- выраженные побочные реакции (особенно со стороны ЦНС.
липодистрофия, гипергликемия, лактоацидоз, гиперлипидемия, кровотечения,
остеопороз, сыпь и т.д.),
- продолжающийся прием наркотиков.
Низкая приверженность к терапии приводит к:
- росту вирусной нагрузки, ухудшению состояния и повышению смертности,
- развитию резистентности,
- резкому снижению её эффективности.
Недостаточная приверженность лечению-основная причина снижения
эффективности APT. Наиболее частые причины неудовлетворительной
приверженности: большая занятость или забывчивость больных (52%),
нахождение вне дома (46%), изменение образа жизни (45%), депрессивное
состояние (27%), отсутствие препарата (20%) и т.д. То есть распространенность
нарушений назначенной схемы лечения колеблется от 23% до 50%. Реальный
путь повышения приверженности - использование более простых схем
препаратов, предпочтительно с приемом I раз вдень, например, ddl (видекс)
400 мг, ламивудин (эпивир) 300 мг, зерит (ставудин) 1,0 в сутки и другие.
Режим приема препаратов 1 раз вдень, как было показано N.'Nelson (2002),
эффективен и хорошо переносится. Уменьшение количества таблеток облегчает
прием, улучшает приверженность и поэтому имеет потенциальный
терапевтический успех.
503
11.9. Побочные эффекты антиретровирусной терапии
В соответствии с классификацией (Antiretroviral guidelines, 2002)
выделяют классоспецифические побочные эффекты (характерные для класса
препаратов) и характерные для конкретных препаратов в составе класса.
Классоспецифические побочные эффекты НИОТ: гиперлактатемия с
возможным стеатозом печени, в редких случаях-липодистрофия (Lenzon, 1997).
Классоспецифические побочные эффекты ИП - расстройства ЖКТ,
гиперлипидемия, липодистрофия, снижение чувствительности периферических
тканей к инсулину. Метаболические нарушения, вызванные ИП, коррелируют с
продолжительностью их приема. Нарушения липидного обмена могут являться
фактором риска в развитии сердечно-сосудистых заболеваний.
Подходы к снижению побочных эффектов APT: выбор комбинаций
препаратов с минимальными побочными эффектами, оптимизация доз препаратов
(использование мониторинга), возможность перерыва в лечении, более поздние
сроки началатерапии или поочередное назначение разных схем, использование
новых, менее токсичных препаратов или менее токсичных лекарственных форм.
Использование ингибиторов протеазы привело к возникновению синдрома
липодистрофии, который характеризуется перераспределением жировых
отложений: потерей жировой клетчатки в области лица и отложением жира в
области живота и шеи (горб «Буффало») с увеличением груди, а также диабетом
и риском кардиоваскулярных заболеваний. Ингибиторы обратной транскриптазы
в меньшей степени причастны к этому синдрому (Carr А., 1999). Автор приводит
характеристику этого синдрома с учетом других сведений литературы.
Физические и метаболические нарушения при синдроме липодистрофии
А. Один или более из следующих симптомов нафоне приема ингибиторов
протеазы.
1. Уменьшение или потеря жира на лице, руках, ногах.
2. Аккумуляция жира на животе, задней области шеи («горб Буффало»), груди
у женщин.
3. Сухая кожа и губы.
В. Метаболические расстройства
Гиперлипидемия является специфическим для ИП эффектом.
Продолжительность лечения ИП - существенный фактор риска развития
метаболических нарушений. Гиперхолестеринемия развивается у 26% больных,
принимавших ИП в течение 1 года, у 51% после 2 лет и у 83% после 3 лет.
Липодистрофия развивается более чем у 60% больных, принимавших ИП (Saag М..
2002). У таких бальных повышен риск сердечно-сосудистых заболеваний. Симптомы
не являются основанием для отмены ингибиторов протеазы. Следует решить вопрос
504
о переводе наэфавиренц или назначить ингибитор протеазы атазанавир, который не
вызывает липополидистрофии и даже способен корригировать синдром.
Препараты для лечения дислипидемий:
Статины - подавляют синтез холестерина.
• Фибраты - стимулируют активность ЛП-липазы.
Смолы, адсорбирующие желчь - повышают выведение
холестерина и липидов из организма.
Липостат (правастатин натрия). Каждая таблетка содержит 10 или 20 мг
правастатина натрия. Вспомогательные вещества: лактоза, повидон,
микрокристаллическая целлюлоза, натрия карбоксиметилпеллюлоза и магния стеарат.
Липостат относится к классу ингибиторов ГМГ-КоА редуктазы, новых
гиполипидсмических агентов, которые снижают биосинтез холестерина. Эти
агенты являются конкурентными ингибиторами З-гидрокси-З-
метилглютарилкоэнзима А (ГМГ-КоА) редуктазы - фермента, катализирующего
начальный этап биосинтеза холестерина, а именно конверсию ГМГ-КоАМ в
мевалонат, определяющий скорость процесса в целом.
Лечение препаратом Л ипостат должно рассматриваться в качестве одного
из компонентов воздействия на множественные факторы риска у лиц с
повышенным риском атеросклеротического заболевания сосудов,
обусловленного гиперхолестеринемией.
Липостат должен применяться в дополнение к диете с ограничением по
насыщенным жирам и холестерину в тех случаях, когда ответ на диету и другие
немедикаментозные методы лечения является недостаточным.
Способ применения и дозы. Перед началом лечения препаратом л и по стат
больному следует назначить стандартную диету для снижения уровня
холестерина. Во время лечения препаратом больной должен продолжать
соблюдать эту диету. Рекомендованная доза препарата липостат составляет от
10 до 40 мг, раз вдень перед сном. Обычно исходная доза составляет 10-20 мг.
Если концентрация холестерина в сыворотке значительно повышена(например,
общий холестерин более 300 мг/дл), исходную дозу можно повысить до 40 мг
вдень. Липостат можно принимать безотносительно ко времени приема пищи,
а суточную дозу можно разделить на несколько приемов. Поскольку
максимальный эффект назначенной дозы проявляется в пределах четырех
недель, в этот период следует регулярно определять содержание липидов и
соответственно проводить корректировку дозы с учетом ответа больного на
препарат и установленных правил лечения.
Серьезным осложнением является остеопения, остеопороз и остеоневроз
(Schambelan М. et al., 2002). Пациентам, у которых имеется боль в костях или
33. Заказ № К-4451.
505
суставах, показаны рентгенологические исследования. Лечение проводится с
использованием кальцие-фосфоровых и витаминных препаратов. При
остеонекрозе и патологических переломах показано хирургическое лечение.
Указания по интегрированному применению препаратов1
(Dr. Frieder Albertth, 2003 Diakonisches, Werk in Deutchland).
7. Ожидать отклонения от режима лечения. Всегда следует исходить
из того, что режим лечения соблюдаться не будет.
2. Рассматривать лечение с точки зрения пациента. Медперсоналу
следует понять положение каждого отдельного пациента. Врач должен
знать об ожиданиях, целях, ощущениях и взглядах пациента
относительно болезни и лечения.
3. Развивать между пациентом и врачом партнерские отношения.
Ответственность за принятые решения должна одинаково
распределяться между пациентом и врачом. Это означает, что пациент
должен получить доступную, понятную информацию, чтобы иметь
возможность принимать адекватные решения относительно терапии.
4. Занять позицию, ориентированную на пациента. Удовлетворенность
пациента является главным критерием. Вопросы, пожелания и
ощущения пациента должны образовывать исходную точку терапии.
Все отклонения должны обговариваться.
5. Индивидуализировать лечения. Все моменты терапии, все для терапии
необходимые вспомогательные средства должны обговариваться в
индивидуальном порядке. Универсальных решений следует избегать.
6. Привлечь к совместной работе семью. Семью и круг близких друзей
следует привлекать к процессу лечения для поддержки. Пациенту
необходимо помочь при борьбе с болезнью не отказываться от
социального окружения.
7. Обеспечить продолжительность и доступность. Пациент должен
быть абсолютно уверен в продолжительности идоступности терапии.
8. Принять во внимание услуги других специалистов в социальной
области и области здравоохранения. Врач может обеспечить только
одну часть профессиональной помощи при борьбе с болезнью.
Необходимо привлекать и других специалистов.
9. Повторять все. Усилия для достижения совместной работы в рамках
терапевтических отношений должны прилагаться постоянно на
протяжении всего лечения.
1 Meichenbaum and Turk: Facilitating treatment adherence: A practioner’s guidebook. New
York, 1987
506
10. Не сдаваться. Проблематика комлпайенс чрезвычайно сложна и
многогранна. Отношение к болезни и смерти является
основополагающей темой в жизни, особенно в отношениях между
врачом и пациентом. Лишь в тесном и постоянном сотрудничестве
врач и пациент могут достичь успеха.
11.10. Резистентность при ВИЧ-инфекции
Резистентность является результатом изменения участка связывания
ингибитора с белком-мишенью. Типы резистентности в зависимости от метода
определения: фенотипическая определяется способностью ВИЧ расти при
высоких концентрациях АРП, генотипическая выражается как изменения
нуклеотидной последовательности гена, кодирующего вирусный белок,
являющийся мишенью действия АРП, «виртуальный фенотип». Первичные
мутации являются специфическими по отношению к АРП и снижают
чувствительность вируса не менее, чем в 4 раза, вторичные мутации
способствуют селекции штаммов вируса, имеющих в своем геноме первичные
мутации (Richman D„ Stasze wsk is., 1997).
Тест на определение резистентности позволяет значительно повысить
эффективность лечения, назначенного на основе его результатов. Общепринята
необходимость определения резистентности вируса к АРП у больных,
получавших антиретровирусную терапию (особенно две и более схем). Однако,
возможность инфицирования резистентными штаммами вируса требует
постановки теста уже при составлении первой схемы. Основным способом
борьбы с появлением и селекцией резистентных штаммов является надежное
подавление репликации вируса.
Общие механизмы резистентности:
Изменения в сайте связывания препарата: замена аминокислоты
стерически препятствует связыванию ингибитора, замена
аминокислоты нарушает ее взаимодействие с другими остатками.
«Дистанционные» эффекты: изменение аминокислотного остова
меняет конформацию сайта связывания ингибитора
Компенсаторные мутации - замена аминокислоты стабилизирует
фермент?
Почему возникает резистентность:
§ Спонтанные мутации в геноме ВИЧ. Вирус с 1 или 2 мутациями уже
имеется у всех инфицированных больных.
зз*
507
§ Частичное подавление ВИЧ способствует развитию резистентности
(через селективное давление) в результате применения
субоптимальных доз препарата, недостаточной приверженности APT
и т.д.
§ Заражение резистентным вирусом - частое явление.
Показания для определения резистентности
1. Острый ретровирусный синдром или ранняя сероконверсия. Это позволяет
выбрать оптимальный ритм лечения с учетом возможности приобретения
резистентного штамма.
2. Для определения неудачной терапии. Лечение неэффективно по данным
вирусной нагрузки и/или уровню CD4 Т-лимфоцитов.
3. При назначении терапии после травматизации. Однако, это сомнительно,
ибо неоходимо быстрое назначение лекарств.
4. Беременным до начала перинатальной ВИЧ-транмиссии.
5. При хронической ВИЧ-инфекции перед началом терапии.
Генотипические методы определения резистентности являются менее
дорогостоящими и более быстрыми (и, соответственно, используются более
широко), однако интерпретация информации, которую получают с их помощью,
довольно сложна. Дело в том, что точное воздействие каждой мутации на
чувстви тельность к лекарственному препарату неоднозначно, поскольку при
наличии нескольких мутаций важно взаимодействие между ними. Даже когда
присутствует одиночная мутация, ее фенотипическое проявление в виде
резистентности может быть неполным.
Таблица 68
Сравнение методов определения резистентности
Определение по генотипу
Определяется мутация в гене
ви руса
Метод дешевле (450-565 евро)
Время анализа 1-4 педели
Можно выявить эффект
нескольких мутаций
Методы могут не обнаружить
точечные муiации
Чуне твит елытос i ь имеет
ограничения (вирусная нагрузка, %
мутап га в популяции)
Определение по фенотипу
; Измеряется чувствительность
вируса
Метод дороже (850-1020 евро)
Время анализа 2-8 недель
Анализ чувствительности к одному
препарату (не комбинации)
Метод может обнаруживать новые
мутации и/или комбинации
508
Для решения таких проблем компания Virco разработала концепцию и
метод определения «виртуального» фенотипа ВИЧ, которая позволяет более
надежно предсказывать фенотипическую резистентность на основании
имеющихся генотипических данных. Метод, предлагаемый Virco, заключается
в использовании базы данных по образцам ВИЧ, для которых чувствительность
была определена на основании фенотипического анализа и для которых имеются
также данные по генотипу. Сравнение мутаций в образце ВИЧ, полученном от
больного, с базой данных позволяет определить «виртуальный» фенотип ВИЧ
для каждого АРП. Схема этого подхода приведена ниже.
Схема 6
Виртуальный фенотип: связь генотипа с фенотипом
База данных по фенотипу База данных по генотипу Г енотип
Средняя Совпадение с больного
1С 50 4 Проводится
генотипом больного * поиск мутаций
может быть в базе
ограниченным
Дает более привычные данные для интерпретации, чем генотипирование
Требует меньше времени и финансовых затрат, чем реальное
фенотииирование
На момент проведения исследования определение реального фенотипа
считалось золотым стандартом
I IpociiCKi ивная клиническая верификация отсутствует
Таблица 69
Фенотипическая резистентность ВИЧ к различным
антиретровирусным препаратам
Выборка из 7169 изолятов ВИЧ, отобранных случайным образом
Препарат Фенотипическая резистентность ।
ddl t 12,4% ;
AZT 1 32,9% 1
ЗТС | 50% 1
Препарат 1592 । 28% ।
d4J J И ,8%
Серьезной проблемой последних лет становится увеличение числа случаев
инфицирования штаммами ВИЧ, резистентными к АРП. Иллюстрацией служат
цифры, доложенные на конференции по ВИЧ/СПИДу в Чикаго в 2001 г. (таблица 70).
509
Таблица 70
Трансмиссии резистентных вариантов ВИЧ-1
1995-1998 1999-2000 Р
Любая резистентность* 3.5% 14% 0,001
Резистентность к НИОТ 2,7% 8,2% 0,03
Резистентность к ННИОТ 1,3% 7,1% 0,007
Резистентность к ИП 0,4% 8,2% 0,001
?2 препаратов 0,4% 5,8% 0,002
*> 10-кратное увеличение резистентности в тесте PhenoSense
Таблица 71
Резистентные мутации
Мутации и кодоны Препараты не предлагаются
1 2
Нуклеозидные аналоги V75T T215F или K70Rx(M41L, D67N, L210W, К219Е) Ml 84V М184V-I-T215F±(R211К или L214F или G333D/E) MI84V+(K65R или 1.74V) L74V±(K65R, Ml84V) T69D±(K65R, L74V, Ml84V) QI51M±(A62V, V751, F77L, Fl 16Y) Ставудин Зидовудин /АЗТ/ Ламивудин Зидовудин и ламивудин Абакавир Диданозин Зальцитабин Мультинуклеозидная резистентность
Ненуклеозидные аналоги K103N или V106A или Y181С или Y188C/I или G190A/S или P236I. Невирапин, делавирдин или ифавиренц
Ингибиторы протеазы G48V и L90M G48V или 1.90М и любые две из следующих мутаций: L101/R/V. 154V, A71V/T, G73S, 184V) Саквинавир Саквинавир и частичная резистентность к ритонавиру и индинавиру
M461I/L или V82A/F/T/V-jiio6bie две из следующих мутаций: 1.101, K.20M/R. L24/I, V32I, I54V/L, A71V/T, G73S. I84V, 1.90М. D30N или любые три из следующих мутаций: M36I, M46I/L, A71V/T, V77I, I84V, N88D, L90M) Ритонавир, индинавир Нелфинавир
In vitro определяется чувствительность ВИЧ-штаммов к
антиретровирусной терапии. Используют 2 метода (Carpentner et al., 2000;
Bartlety, 2000).
510
Таблица 72
Сопоставление генотипической резистентности и фенотипической
резистентности
Генотипическая Фенотипическая
Доступность Большая Менее доступная
Стоимость $ 360-480 для RT и PI генов $800-1000
Ответ Через 5-7 дней 10-14 дней и позже
Вирусная нагрузка (требуемая) >1000 коп/мл Результаты трактовать совместно с экспертом, может не совпадать с фенотипической резистентностью > 1000 копий/мл Более чувствительный тест, но порог чувствительности (резистентности) недостаточно ясен. Дает количественную оценку. Результаты сообщаются как GC50, GC90, что означает, что требуемые концентрации лекарства ингибируют 50%, 90% или 95% ВИЧ штамма
Таблица 73
Мутируемые кодоны, определяющие резистентность
к антиретровирусным агентам
Гены протеазы Первичная Вторичная 10,20, 26,32,56, 71,77, 84,90,99 20,32,33,36, 54 и т.д. 10,20,24... 10, 36,46, 71,73...
Индинавир Ритонавир Саквинавир Нелфинавир 46, 82 46 48,90 30,90
Гены RT
АЗТ 41,70,215 41,67,210,219
DDJ 65, 74 65, 184
DDC 65,69,74, 184 65,69, 184
ЗТС 44, 118, 184 -
d4T
Абакавир 65,74, 184 41,67,70...
Множественная к RT 69, 151 41,62,67, 70,75...
Невирапин 103, 106, 108, 181, 188, 150 100
Ифавиренц 103, 188, 190 100, 108, 225
511
Таблица 74
Возможные режимы, следующие за инициальным неэффективным комплексным и вирусологическим
режимом для предупреждения резистентности (JAMA, 2002, V.288)
Начальный режим Предупреждение резистентности Возможные изменения
ННИОТ+НИОТ+ИП с ритонавиром или без него M184V**, если режим включает ламивудин Пересмотреть/усилить НИОТ компонент, изменить ННИОТ режим. Ритонавиром усилить ингибиторы протеазы, если они ранее не применялись
ННИОТ+2НИОТ-ИЛ M184V с/без ННИОТ ассоциированными мутациями, если режим включает ламивудин Пересмотри/усиль НИОТ Измени ИП, если ННИОТ резистентносгь.
ИП с/бсз низкими дозами ритонавира ч- ННИОТ + 1 или 2 НИОТ Ml84 Vic/безННИОТ ассоциированной мутацией, если режим включает ламивудин Пересмотри/усиль НИОТ компонент. Назначь ритонавир как бустер ИП, исключи ННИОТ, если к ним есть мутации
НИОТ + ИП с небольшими дозами ритонавира-^ННИОТ ННИОТ ассоциируемые мутации Исключи ННИОТ и добавь 2 НИОТ
** M184V мутация сообщает о высоком уровне резистентности (500-1000 раз сниженная чувствительность) к ламивудииу и низкий
уровень резистентности к абакавиру (в 2-4 раза снижение чувствительности)
Приведем наши наблюдения.
Больная Г., 41 года. ВИЧ инфекция выявлена в июле 1998 года, когда в
реанимационном отделении был установлен кандидозиый эзофагит и сепсис.
Срок и характер инфицирования неясен, вероятно, половой.
Больная находилась в реанимационном отделении, 2 дня на ИВЛ (в связи с
сепсисом). Тогда количество CD4 было 200 клеток/мм! и с 26.08.98 начато лечение
инвиразой, хивидом и ретровиром, спустя 2 месяца от начала лечения CD4
увеличились до 257. вирусная нагрузка составляла 250000 до лечения, через 2
мес. - 26300. Ноябрь-декабрь •• фурункулез кожи живота. Через 7 мес. от начала
лечения вирусная нагрузка возросла до 101000, в связи с чем лечение изменено:
вместо ретровира - вирасепт. Больная начала получать вирасепт, зерит и эпивир.
CD4 346 от 02.04.99, вирусная нагрузка 25000, однако в сентябре 1999 возросла
до 55000. К лечению добавлена гидрея (гидроксиурия).
Новая госпитализация связана с продолжением лечения в условиях дневного
стационара. Объективно при осмотре 14.09.99 патологии не выявлено, лимфоузлы
шейные мелкие, подмышечные не пальпируются. Продолжала получать вирасепт
12 таблеток в день, эпивир 3 таблетки в день, зерит 4 таблетки в день, гидрею по
1 таблетке 2 раза в день. 18.11.99 - явления острого бронхита, 29.12.99 лечение
продолжается, однако вирусная нагрузка возросла.
20.04.99 лимфоциты 4200. CD4 24% (343), CD8 21% (300), К 1,1.
17.11.99 CD4 28% (269), CD8 24% (230), К 1,1.
В 2000 году продолжала лечение, состояние удовлетворительное. 15.02 CD4
- 24% (336), CD8 23% (322), лимфоциты 5000, в связи с низким уровнем CD4
назначен нейпоген по 1,6 мл - 48 ME подкожно № 5. При выписке 18.04.00
гемоглобин 132, лимфоциты 5000, CD427%(553), CD8- 18% (369), К 1,5. Вирусная
нагрузка 05.99-25000,06.99-55000, добавлена гидрея. В июне 2000 года вирусная
нагрузка составили 83672. Решено изменить терапию.
Приведенное наблюдение свидетельствует о необходимости постоянного
контроля за вирусной нагрузкой, которая являлась одним из основных критериев
для смены антиретровирусной терапии. Антиретровирусная терапия покачала
хорошую эффективность, однако возникала необходимость корригировать ее
каждые 8-10 месяцев. Лечение ВААРТ было эффективным только благодаря
определению резистентности ВИЧ к препаратам и изменению схем лечения.
Следует отметить, что перерыв в лечении длительностью в месяц сопровождался
резким ухудшением клинико-лабораторных данных (см. рисунок 20).
Больной М.. 28 лет, инфицирован предположительно в 1999 году
инъекционно. Диагноз ВИЧ-инфекция III А (кандидоз, герпес, диарея), хронический
гепатит С. Лечение под контролем выявления резистентности и учет
гепатотоксичности препаратов позволил подобрать схему лечения, обладающую
наименьшими побочными действиями, удобную в приеме и эффективную по
результатам определения CD4 клеток и вирусной нагрузки (рисунок 21).
513
Рисунок 20
Больная Г.Ф., 41 год ВИЧ-инфекция С2, впервые положительный
результат на ВИЧ в июле 1998 года
Кандидозный эзофагит, сепсис
Путь инфицирования - гетеросексуальный, когда?
Дата Количество CD4 (клеток/мл) Вирусная нагрузка (копий РНК/мл) Лечение
26.08.98 200 250.000 АЗТ, Инвираза Саквинавир
26.10.98 257 23.300
Март 1999 фурункулез 101.000 Н4Т ЗТС, Нелфинавир Гидроксимочевина
Июль 1999 200 250.000 АЗТ, ЗТС нельфинавир
Сентябрь 1999 270 2.600
Январь 2000 270 101.000 M184V АЗТ ЗТС T215Y D30n нелфинавир
Февраль 2000 - 15.000 ddl, (14Т саквинавир
X 2000 - 1 месяц - перерыв в лечении
05.10.00 120 470.000 Зерит Невирапин Ритонавир Криксиван
20.11.00 376 >400 Абакавир Вирамун Ритонавир Криксиван
15.05.01 263 90.000
Август 2001 - 107.000 ' Без APT 29.08.01
14.12.01 376 523.000 14.01.02 абакавир вирамун ритонавир фортоваза
26.06.02 276 - Абакавир Вирамун Ритонавир саквинавир
22.08.02 276 4.700 30.07.02 зерит абакавир калетра
Подтип ВИЧ => В (PR-RT)
Мутации, ассоциированные с резистентностью:
=5 111-V1 2000 Первично RT-RNA, M184V, Т215у, M41L, другие L214F,
Зидовудин, ЗТС, нелфинавир (D30n, L63P, L33I)
514
Рисунок 21
Больной М., 28 лет ВИЧ-инфекция В-2, впервые положительный результат
на ВИЧ в феврале 1999 года
ПГЛ, диарея, кандидоз, простой герпес
Хронический гепатит С
Пути инфицирования - парентеральный, когда?
Дата Количество CD4 (клеток/мл) Вирусная нагрузка (копий РНК ВИЧ/мл) Вирусная нагрузка (копий РНК HCV/мл) АЛТ Лечение
22.06.99 627 6700 1500.000 100-150 Ретровир ЗТС Инвираза
25.01.00 310 Очень низкая -
08.02.00 310 1600 * Ретровир, ЗТС вирасепт
13.10.00 333 80 180 Ритонавир Вирамун зерит
26.01.01 367 - -
22.05.01 649 <200 90 Абакавир вирамун норвир
12.10.01 301 -
15.12.01 546 4850 3,69 log До 15.01.02 перерыв в лечении
Январь 2002 749 4850 36 Абакавир зерит
10.06.02 728 - 19
18.06.02 175.308 -
02.08.02 150.884 -
05.09.02 540 Менее 400
12.10.01 УЗИ: диффузные изменения печени, селезенка не увеличена.
Лечение реафероном 3 месяца, смена терапии, отмена вирамуна и иорвира
Подтип ВИЧ - A (PR-RT)
Мутации, ассоциированные с резистентностью:
=> июль 2000: в гене протеазы: M36I, V77I, I93L;
в гене ОТ: M184V, A62V, R211S, L214F
=> Ламивудин
=> октябрь 2000: в гене протеазы: М361, V77I
в гене ОТ: A62V
515
Проведенное нами определение мутаций к антиретровирусным
препаратам позволило выявить их у 7 из 50 обследованных больных (14%). Эти
данные приведены в таблице 75. Исследования были выполнены в Национальной
лаборатории Мадрида (руководитель R.Najera). Резульаты исследований были
суммированы в диссертации Е.А. Москвиной.
Таблица 75
Мутации в генах обратной транскриптазы и протеазы у 50 больных
Л.Рахманова. Е.Москвина, R.Najera
Мутации в гене обратной Мутации в г зне протеазы
транскриптазы __
первичные вторичные первичные вторичные 1
M184V A62V L90M L101 i
T215Y R211S М461 М361 |
L214F D30N L 154V ।
S68R V771 !
R83K А71Т 1
H208Y 193 L |
T69I L63S ।
Т200А K20R
М41L. L63P _ J
Определение d)енотипа методом виртуального фенотипирования у
пациентов, не получающих и получающих ВААРТ.
У 13 пациентов первой группы, которые никогда не получали
антиретровирусной терапии, был определен фенотип с помощью виртуального
фенотипирования. 4 пациента (30,8%) находилисьпа момент обследования в стадии
IIIА, остальные 9 (69,2%) - ПВ. Количество РНК ВИЧ-1 в плазме колебалось от
6905 до 264300 коп/мл плазмы и составила в среднем 66371±18951 коп/мл.
Количество CD4 находилось в интервале от 219 до 1608 кл/мм3. Среднее значение
CD4 составило 786,5+116 кл/мм1.
У большинства пациентов (9 - 69,2%) при генотипировании был выявлен
субтип А, у 3(23,1 %) человек - субтип В, у 1-го (7.7%) рекомбинаниный субтип
АЕ. Пациент с субтипом АЕ инфицировался в 1996 году при внутривенном
введении наркотиков, находясь в Калининграде. Все остальные пациенты
инфицировались на территории Санкт-Петербурга. Все пациенты,
инфицированные гомосексуальным путем, имели субтип В.
В результате генотипирования в протеазном геноме у 1 1 (84,6%)
пациентов была выявлена мутация 361, у 3 (23,1%) - 771, у одного (7,7%)
101. У 3-х человек по две мутации 361 + 771 (2 пациента) и 361 + 101. В геноме
обратной транскриптазы мутации выявлены у 4 х (30,8%). Это следующие
мутации: 211 К, 62V, ЗЗЗЕ, ЗЗЕ. Один пациент имел в геноме обратной
516
транскриптазы две мутации 21IK+33E. Эти результаты представлены в
таблице 76.
Таблица 76
Результаты генотипирования у пациентов, не получавших ВААРТ
Субтипы 1 ! Мутации в протеазном гене. ! Мутации в гене обратной ! транскриптазы. 1
А 1 361 I ' 1
А 1 361 ' - 1
А 1 i 361 Т - _ -
А 361 1 ' I
А 361 1 : - 1
В 1 361 101 211К 1
A i 361 J 1 |
А 361
... 361 771
А 361 771 62V 1
В 771 ЗЗЗЕ '
А 361 ” - i J
В । - 1 ЗЗЕ 211К |
Вес имеющиеся мутации в геноме вирусов относятся к вторичным, и
они не привели к изменению фенотипа. У всех пациентов вирусы оказались
чувствительны ко всем имеющимся на сегодняшний день противовирусным
препаратам. Результаты виртуального фенотипирования были подтверждены
классическим фенотипированием.
4 пациентам второй группы, получающим ВААРТ втечение года (комбивир
I таб. 2р/сут гэфавиренцбОО мг/сут)были проведены гено- и фенотипирования.
Средний возраст обследуемых составил 36,0±1.7 лет. Срок инфицирования
колебался от 2 до 8 лет и составил в среднем 4.25±2,8 лет. Три пациента на момент
обследования находились в стадии IIIА и один в стадии ПВ. Количество CD4
колебалось от 563 до 742 кл/мм’ и составило в среднем 655-45 кл/мм3. Через год
приема ВААРТ у трех пациентов количество PI 1К ВИЧ-1 было ниже 400 коп/мл,
У одного - 1010 коп/мл и составило в среднем 4155.203 коп/мл. У этой группы
517
пациентов было обнаружено большое количество мутаций: от 5 до 8 в протеазном
гене и от 8 до 14 в гене обратной транскриптазы. Однако, все зарегистрированные
мутации носили вторичный характер и не привели к изменению фенотипа,
поэтому у данных пациентов вирусы оказались также чувствительными ко всем,
имеющимся на сегодняшний день антиретровирусным препаратам. Полученные
данные представлены в таблице 77.
Таблица 77
Результаты генотипирования пациентов, получавших ВААРТ в
течение года(п=4)
Мутациивпротеарномгене ПЗП/V, N37H, R41K,’ 16211/V, E65E/D, V77I, 193L, F99F/L Мутации_в гене обратной транскриптазы V53V/I. K43K/Q Q102K, 11421/V, C162S? V1791, R211R/K/Q K219K/E, T286F,V293I, E297K
I15V,E35D,M36J,R41K,R57K,D6 0Е,1621/V V211,K49R,T69S, Q102K,V106I,D123D/E,I178L.T200A/V, E203E/D,R211A/T, V245K,A272P,R277R/K.V293V/I
VI 1V/1,L33I,L63P,I64V,H69Y R83K,V90V/I,Q 102K.C 162S,E 169E/D.T20 0I,R211R/K,R277K
N37H,R41K.L63L/1,V771.I93L M16M/1,V351.G45E,K73K/E,Q102K,I142V, R211 T,K249K/R.T286A, V2931.E297K.E30 2E/G
Отсутствие резистентности у пациентов, получающих терапию в течение
года, говорит об адекватности проводимой противовирусной терапии.
Для сравнения методом виртуального фенотипирования мы определили
фенотип у троих пациентов, получающих ВААРТ в течение 4-5 лет. Эти пациенты
получали терапию длительное время различными схемами.
Пациент Т., мужчина 30 лет, с диагнозом: «ВИЧ-инфекция, стадия [11Б.
Персистирующий орофарингеальный кандидоз. Потеря массы тела менее 10%.
Себорейный дерматит» получает ВААРТ с марта 1999 года. На старте
противовирусной терапии количество РНК ВИЧ-1 не определялось, а уровень
CD4 составил 19% (119 кл/мм’). Первоначально была назначена схема двумя
препаратами (два нуклеозидных ингибитора обратной транскриптазы), и с марта
1999 по июль 1999 пациент получал зерит 80 мг/сут + видекс 400 мг/сут. Через
три месяца приема антиретровирусных препаратов вирусная нагрузка составила
670 коп/мл плазмы. В августе 1999 к этой схеме был прибавлен ингибитор
протеазы - инвираза, данную схему пациент получал до мая 2000 года; с июня
2000 года по август 2000 года получал зерит 80 мг/сут + ламивудин 300 мг/сут +
518
криксиван 2400 мг/сут. В сентябре был сделан вынужденный перерыв в терапии
из-за отсутствия препаратов. С ноября 2000 года по сентябрь 2002 года получал
комбивир 2 табл./сут + вирамун 400 мг/сут. В августе 2002 года состояние
пациента ухудшилось- появились слабость, ночная потливость, субфебрильная
лихорадка. Вирусная нагрузка составила 200000 коп/мл плазмы, aCD4-4%20
(кл/мм3). Пациенту была изменена схема лечения. С сентября по настоящее
время получает калетру 1000 мг/сут +зерит 80 мг/сут + ламивудин 300 мг/сут.
Через 4 месяца лечения новой схемой состояние пациента улучшилось: исчезли
слабость, ночная потливость, восстановился вес. В январе 2003 года вирусная
нагрузка составила 365 коп/мл, CD4 -13,1 % (92 кл/мм3).
Пациент Г., мужчина 34 лет, с диагнозом: «ВИЧ-инфекция в стадии ШБ.
ВИЧ-менингоэнцефалит в 1997 году. Персистирующий оральный кандидоз.
Часторецидивирующий простой герпес. Экзема. Себорейный дерматит. Герпес
зостер в 2000 году» получает ВААРТ с 1997 года. На старте противовирусной
терапии количество РНК ВИЧ1 составило 236 390 коп/мл, aCD4 24% (250 кл/
мм3). 20 августа 1997 года была назначена тритерапия двумя ингибиторами
обратной транскриптазы и одним ингибитором протеазы (ретровир, ламивудин,
криксиван). В течение первого месяца пациент плохо переносил прием препаратов
из-за выраженной тошноты и в течение двух недель не принимал ламивудин.
Через месяц терапии количество РНК ВИЧ1 составило 13683 коп/мл. Таким
образом, с августа 1997 года по апрель 1999 года пациент получал ретровир 600
мг/сут + ламивудин 300 мг/сут + криксиван 2400 мг/сут; с мая 1999 года по июль
2000 года фортаваза + зерит 80 мг/сут + видекс 400 мг/сут; с августа 2000 года по
май 2002 года зерит 80 мг/сут + видекс 400 мг/сут + вирамун 400 мг/сут; с июня
2002 по июль 2002 год вирамун 400 мг/сут + комбивир 2 табл./сут. Количество
РНК ВИЧ-1 определялось в июле 1998 года, в ноябре 1998, в марте 1999 и
соогветственно составило 23364 коп/мл, 30182 коп/мл и 40097 коп/мл, то есть ни
разу не было достигнуто полное подавление репликации вируса. В июле состояние
пациента резко ухудшилось- появился диарейный синдром, потерял более 10%
массы тела, был диагностирован генерализованный кандидоз желудочно-
кишечного тракта. Пациенту была изменена схема терапии и назначены абакавир
600 мг/сут + криксиван 1600 мг/сут + ритонавир 400 мг/сут. В результате новой
терапии был получен хороший клинический эффект - прекратилась диарея,
пациент восстановил свой вес. Однако, через 4 месяца новой терапии вирусная
нагрузка составила 33911 коп/мл, a CD4 20,4% (102 кл/мм3).
Пациент П., мужчина 42 лет, с диагнозом: «ВИЧ-инфекция в стадии ШБ.
Персистирующий орофарингеальный кандидоз. Часто рецидивирующий простой
герпес. Рецидивирующие бактериальные пневмонии в 1999 году. Себорейный
519
дерматит» получает противовирусную терапию с 1999 года. На старте ВААРТ
вирусная нагрузка составила 1 570 305 коп/мл и CD4 20,7% 200 кл/мм3. В марте
1999 года была назначена битерапия двумя нуклеозидными ингибиторами
обратной транскриптазы (ретровир+видекс). Таким образом, с марта 1999 года
по июнь 1999 года больной получал ретровир 600 мг/сут -*• видекс 400 мг/сут; с
июля 1999 года по 19 августа 2002 года - криксиван 2400 мг/сут + зерит 80 мг/сут
т видекс 400 мг/сут. В августе 2002 года состояние пациента ухудшилось, перенес
очередную пневмонию, схема была изменена на ритонавир 800 мг/сут + криксиван
400 мг/сут + видекс 400 мг/сут т зерит 80 мг/сут. Однако, через 4 месяца новой
терапии вирусная нагрузка составила 196810 коп/мл, a CD4 12,3%.
В результате проведенного генотипирования у всех исследуемых
пациентов были обнаружены первичные мутации, которые в совокупности со
вторичными привели к формированию резистентности к большинству
противовирусных препаратов. Полученные данные представлены в таблице 78.
Таблица 78
Результаты генотипирования у пациентов, получавших ВААРТ в
течение 4-5 лет (п=3)
I г-----------------------1 1
| । Мутации в протеазном Мутации в гене обратной j
I у । гене. транскриптазы.
В
Т.
Г. В
п.
। 41L, 62V, 67N, 70R,
I 101 39V 71 V 84V 90М* 1 791, 75А' 75М' 75Т’ 103N’
। lui.jyv./i v.04v,>v.vi . 164v. 215Y, 2I9E,
_______|_23_8Т___________________
| 41L, 67N, ’ ll. 1061,
i 1Л1 34. -7TT -7-71 OOXT I 481, 18IV- l8lC’
I 101, 61,73Т,771,90Л | 190A, 210W, 211 К,
_______________________________________I2J5Y, 2J19N, 33_3E________
. F . 401, 20R, 361. 48V, 54V, I41L, 67N, 70R.1181’
_!__________L7£S J 2A__________________lA'JJk2!5 K. 219Q___________
* жирным шрифтом выделены первичные мутации
41L- резистентность к АЗТ-t перекрестная кзериту и ламивудину,
70R - резистентность к АЗТ+перекрестная к зериту и ламивудину,
215Y- к зериту, перекрестная к АЗТ,
190А - к невирапину,
48V - ко всем ингибиторам протеазы,
461 - к индинавиру,
90М - к санквинавиру.
82А- к ритонавиру.
520
Таким образом, у двух пациентов терапия была начата лишь двумя
препаратами, пациенту Г. первоначально было назначено три препарата, однако,
с самого началабыл нарушен рекомендуемый режим приема. Крометого, схемы
терапии менялись зачастую из-за отсутствия необходимых препаратов. В
результате у всех описанных пациентов ни разу не было зарегистрировано полное
подавление вируса, что привело к формированию резистентности.
Полученные результаты убедительно свидетельствуют о том, что подбор
новых схем терапии должен осуществляться с учетом данных по устойчивости
ВИЧ к антиретровирусным препаратам,особенно для пациентов, длительно
находящихся на лечении.
Основные направления ВААРТ на ближайшее будущее:
1. Повышение приверженности лечению за счет использования
более простых схем приема, предпочтительно 1 раз в день.
2. Использование менее токсичных препаратов (включая менее
токсичные лекарственные формы), что особенно важно в
условиях долгосрочной терапии.
3. Ориентация на фармакокинетику, которая может помочь
облегчить лечение для больного, позволяя избежать завышения
доз, и открыть пути к тому, чтобы создать способы для
подавления вируса в тех тканях и клетках организма, где ВИЧ
пока малодоступен для действия имеющихся АРП.
4. Серьезное внимание должно быть обращено на проблему
резистентности. Необходимо стремиться использовать те АРП и
их комбинации, которые с меньшей вероятностью будут
способствовать отбору резистентных вариантов, и шире
применять анализы на резистентность, чтобы избежать
назначения АРП и их комбинаций вслепую без знаний
особенностей биологии вируса у конкретного больного.
34. Заказ № К-4451.
521
Пример ответа визуального фенотинулирования
RulBtance>a»toel*tMI mutation* Identified:
•Silttype
aiulysk!
jS^
Drug Hitcku le dtttbU* PwpaitiM ol шЦй oaphn ^vattMori .Шпагат 'Ж^йилЕ' ^ма(**1М‘*ЦякуЙ1<8»<М«3“м 25 • 50 75 (%) Folddaije (йМигпопш- susapt&laranga)' m;
Trade tune fltMlJt мм
URTI 1 В. 1 1
Retrovir® Zkbudne $44 21.6 /4.0}.
Epivif® lamiwdhe 328 4.5 (4Ы
Vfc® DUuotlne 64 2.1 (Z0)
Hjvid® ШаЫм 65 1.3 . (2.0)-
litit® StaviriM 227 2.1 (1,75)-
Saoen® Abaowfr 6! iSSSSS^^SS^S0 й
uutTi . •
'Vreajtv TewWOF 139 u:
M№l "/• * 111
Nwkiplm 16 57.0 (M)
descriptor® PdaMe 20 11.4 (IM)
Sista®, Siccrin® EMwz It Кйа1нйаням&1Шям^^м Mi'.‘(S.O}
i и '
Crutan® Indinavir 200 . 6.4 (3J0)
Hsftlr® Ritonavir 199 7.2 (3.S)
Wraapt® Heltnavlr 199 """ ' '" 11ГТ 11 . 18.4 (4.0)
Invirase®, .'ormsc® Saquinavir 199 =SsSSS£==S3Km& ’ 3.7 (15)
Agqwase® Miprenavir bnsj.rjsrrrrri » «АЫ1МЩ 1 /М 2J (M).
A component of Kale»® Loplnavir 38 2.8 • (2.S) 9*
522
Мутации ВИЧ-1, устойчивые к лекарствам.
Мутации в генах обратной транскриптазы, ассоциируемые с
резистентностью к НИОТ и ННИОТ*.
(Aguila R. et al; Topics in HIV medicine, 2003; v3, p92-94) (к стр 527)
НИОТ Колоны
A3T( 1.2) М 41 L Е 44 D D 67 N К 70 R V 1 18 L 210 W т 215 Y F К 219 Q Е
Зерит (1-3) М 41 L Е 44 D D 67 N К 70 R V 118 I L 210 W Т 215 Y F К 219 Q Е
Видекс (4,5) К 65 R L 74 V
Хнвил к 65 R Т 69 D I. 74 V М 184 V
Абакавир (6) К 65 R L 74 V Y 115 F м 184 V
Энивир(7) Г. 44 D V 118 1 М 184 V 1
Тенофовир (1.8) К 65 R Г "
Мультирез истентноев NAM's (9) М 41 L Е 44 D D 67 N к 70 R V 118 1 L 210 W Т 215 Y Г К 219 Q Е
34*
523
ННИОТ Колоны
Невирапин L 100 1 К 103 N V 106 А м V 108 1 Y 181 Y С Y G 188 : 190 С : 1. 1 А Н 1
Ифавиренц (10-12) 1. 100 1 К 103 V 106 м V 108 1 Y 181 С I Y ! G 188 190 . S 1. ' А Р 225 Н
Мулыирези- Стентиое( ак- кумуляция мутации). (13) L 100 1 V 106 А Y 181 С 1 ' G 1 : 190 1 i S ; А М 230 L
Мульти рези- стентное к ННИОТ. (14-15) к 103 N V 106 м Y 188 L ;
524
Мутации в генах протеазы, ассоциируемые с резистентностью к
ингибиторам протеазы
525
Мутации в гене оболочки gp41, ассоциируемые с резистентностью
ко входным ингибиторам.
Примечания.
1. Мутации М184 могут увеличивать чувствительность к АЗТ, Зериту или Тенофовиру
Клиническое значение их неизвестно.
2. Недавние данные по обратным мутациям в кодоне 215 обнаружили, что
Т215D\C\S\E\N\A\V замещения могут вызывать резистентность к АЗТ и Зериту
при назначении их “наивным” больным.
3. Мутации в колоне 75(V75T\M\S\A ) наблюдались in vitro, и могут быть связаны с
низким уровнем изменений чувствительности к Зериту.
4. K65R мутации или L74V мутации и\или в комбинации с T69D\N могут приводить
к резистентности к Видексу.
5. Основываясь на предварительных, неопубликованных данных, M184V мутация
не вызывает негативных воздействий в in vivo реакциях на Видекс, даже несмотря
на то, что мутация снижает чувствительностью vitro.
6. В присутствии с NAMs, M184V мутация содействует уменьшению
чувствительности к Абакавиру, и связано с ослабленной реакцией in vivo. Тем не
менее, в одиночку. M184V мутация не ассоциируется с пониженной вирусной
реакцией к Абакавиру in vivo.
7. E44D и VI181 мутации сравнимы с низкой резистентностью к Эпивиру, когда
сопровождаются некоторыми другими ассоциированными с НИОТ мутациями
(M41L, D67N, L210W, ТЗ15Y\F, K219Q\E) в отсутствие совместной M184V мутации.
8. Аккумуляция NAMs (M41L, D67N, K70R, L210W, T215Y\F, K219Q\E (не включая
E44D и V1181)) повышают резистентность к Тенофовиру. Мутации М41L и L210W
способствуют этому больше других. Поэтому, номер и тип NAMs будет определя ть
степень понижения чувствительности. T69D\N\S может также содействовать
снижению чувствительности к Тенофовиру.
9. НИОТ-ассоциируемые мутации (NAMs), включая M41L, E44D, D67N. K70R. VI181.
L210W. Т215Y\F, и K219Q\E ассоциируются с кросс-резистентностью к ПИОТ-
526
они изображены розовыми линиями в позициях. E44D и VI181 мутации названы
как NAMs в последних исследованиях, E44D и VI181 мутации были наиболее
частыми у больных, получавших АЗТ и Эпивир и ассоциировались с высоким
уровнем резистентности к АЗТ. При наличии с совместной с другими NAMs
E44D и VI181 мутации сравнимы с резистентностью к Эпивиру. Анализ группы
АСТУ показал, что E44D мутации обычно вырабатываются при АЗТ\<1<11режиме.
10. Превалентность Y318F мутации в клинических изоляторах вместе с мутациями
K.103N, Y181C и P236L было приблизительно 5%, 2% и 15% соответственно. In
vitro эти мутации сравнительны с резистентностью к Невирапину и Ифавиренцу.
11. Y181CU мутация не создается Ифавиренцем , но ее присутствие способствует
кросс-резистентности низкого уровня к лекарству. Клиническое действие этой
мутации может быть преодолено более активным антиретровирусным режимом ,
хотя отсутствие опытных клинических данных еще address этот вопрос.
12. V108I и Р225Н способствуют развитию резистентности к Ифавиренцу, когда
присутствуют в комбинации с другими ННИОТ-ассоциируемыми мутациями.
Хотя VI081 или Р225Н в одиночку не сравнимы с измеримой резистентностью
лабораторных штаммов ВИЧ-1, их наличие в клинических изолятах может засечь
первичную селекцию вариантов, устойчивых к Ифавиренцу.
13. Аккумуляция 2 или более подобных мутаций существенно уменьшает клиническую
пользу всех распространенных ННИОТ.
14. K103N или Y188L мутации в одиночку могут уменьшать клиническую
значимость ННИОТ.
15. V106М мутация сравнима с резистетностью высокого уровня in vitro к Невирапину
и Ифавиренцу. Эта мутация наблюдалась только ВИЧ С клинических изолятах.,
хотя site-directed мутагенез показывает , что V106M сравним с кросс-
резистентностью ко всем ННИОТ в ВИЧ В.
16. Резистентные мутации в гене протеазы классифицируются на “major ” и “minor”.
Major:
В-основном, major мутации образуются сначала в присутствии лекарств; или
проявляются на биохимическом или вирусологическом уровне как альтернатива
медикаментозного связывания или торможения вирусной активности или
репликации. Major мутации оказывают влияние на фенотип. В-основном, эти
мутации являются последствиями медикаментозного лечения.
Minor:
Главным образом, minor мутации возникают позднее major мутаций, и особого
влияния на фенотип не имеют. В некоторых случаях, их воздействие может быть
вызвано репликативной активностью major мутаций.
527
17. Для Индинавира, мутации, показанные как major, могут не быть первыми
проявившимися, так, как они присутствуют в большинстве клинических изолятов
в комбинации с остальными мутациями.
18. Major и minor мутации не были определены для Лопинавир\Ритонавир-
ассоциируемой резистентности, так, как нету ясных данных, определяющих
степень воздействия с этой лекарственной комбинацией. Аккумуляция 6 или
более таких мутаций ассоциируется с уменьшенной реакцией на
Лопинавир\Ритонавир. Информация по продукту сообщает, что аккумуляция 7 или
8 мутаций сравнима с резистентностью к лекарству. Несмотря на это. недавние
сведения предполагают, что по меньшей мере 4 мутации могут быть асоциированы
с резистентностью такого высокого уровня. Дальнейшие клинические опыты и
исследования нуждаются в лучшем определении мутаций, которые воздействуют
на клиническую эффективность Лопинавира\Ритонавира. Это является причиной,
чтобы учитывать фенотип для определения индивидуальных особенностей.
19. Мутация протеазы L63P является общей для вирусов, которые никогда не
подвергались действию ингибиторов протеазы и может быть более превалентной
в вирусах у пациентов, у которых ИП-составляюший режим был провален. В то же
время , самостоятельно. L63P не вызываетзаметных повышений в IC50 для каждого
ИП. L63P показана для Лопинавира\Ритонавира (но не других ИП) потому, что
исследования показали, что эта мутация в присутствии множества других мутаций
ассоциирована с клиническим провалом.
20. Когда Атазановир назначаегся пациентам как начальный ИП. то он приводит к мутации
150L и А71V. Когда он используется как дополнительный висстес Саквинавиром, то
приводит к 1541. и 184V. In vitro, Атазановир приводит к V32I, М461, 184V и N88S.
Хотя другие major мутации не вызываются Атазаповиром как in vivo, так и in vitro,
эти мутации связываются с кросс- резистентностью к Атазановиру, особенно в
комбинации с другими известными ИП- резистентными мутациями.
21. Аккумуляция 4 и более таких мутаций .может вызвать мульти-ИП резистентность.
22. По данным, резистентные мутации в оболочечном гене gp4 1 первично
идентифицированы на позициях с 36 по 45 на первом heptad repeat region(HRl).
Эти мутации были идентифицированы в вирусах пациентов, подвергавшхея
медикаментозному лечению и сравнимы с резистентностью или пониженной
восприимчивостью. Важно отметить, что вирусы дикого типа показаны 500-fold
range в восприимчивости и мутации в других частях оболочки может повлиять на
восприимчивость к Энфувиртиду. Дальнейшие исследования нуждаются в оценке
клинической уместности этих мутаций.
Для каждого аминокислотного остатка буква над строкой показывает
аминокислоту, ассоциируемую с диким типом вируса, а буква(ы) под строкой
показывают изменения, связанные с развитием вирусной резистентости. Номер
показывает позицию мутации в белке. Мутации, вызванные ингибиторами протеазы
в Gag clearage sites не показаны, так, как их содействие в выработке резистен тности
еще не полностью изучено.
528
Буквенные обозначения аминокислот.
А-аланин М-метионин
С-цистеин N-аспарагин
D-аснарагат Р-пролин
Е-глутамат Q-глутамин
Е’-фснилаланин R-аргинин
G-глицин S-серин
Н-гистидин Т-треонип
1-изолейцин V-валин
К.-ЛИЗИН W-триптофан
L-лсйцин Y-тирозин
Сокращения.
ИП- ингибиторы протеазы.
ПИОТ-нуклеозидные ингибиторы обратной транскриптазы
ННИОТ-ненуклеозидиые ингибиторы обратной транскриптазы
NAMs- НИОТ- ассоциированные мутации
Торговые название антиретровирусных препаратов
(Guidelines for Use of Antiretroviral Agents in HIV-l-Infected Adults and Adolescents,
July 14, 2003)
Препарат Принятая аббревиатура Производитель Торговое название
Нуклеозидные ингибиторы обратной транскриптазы (НИОТ)
Зидовудин AZT ГлаксоСмитКляйн Регровир
Лампвудин зге ГлаксоСмитКляйн Эпивир
Абакавпр АВС ГлаксоСмитКляйн Знатен
Зидовудин + Ламивудин AZT/3TC ГлаксоСмитКляйн Комбивир
Зидовудин - Ламивудин + Абакавпр AZI73TC/ABC ГлаксоСмитКляйн Гричпвир
Диданочин ddl Бристол-Майерс- Сквибб Видекс
Ставудин d4T Бристол-Майерс- Сквибб Зерит
Зальцитабин ddC Рош Хивид
Ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ)
Ифавиренц EFV Бристол-Майерс- Сквибб Стакрин
Невирапин NVP Берингер Ингельхайм Вирамун
Ингибиторы протеазы (ИП)
Ампренавир APV Глаксо Смит Кляйн Агенераза
Индинавир IDV Мерк Шарп Доум Криксиван
Ритонавир RTV Эббот Норвпр
Лопинавир +• Ритонавир LPT/RTV Эббот Калетра
Нельфииавир NFV Рош Вирасепт
Саквинавир SQV. FTV Рош Фортоваза
..Саквинавир мезилат INV Рош Инвираза
529
Приложение 1
Нуклеозидные ингибиторы обратной транскриптазы, разрешенные к применению в России
Характеристика лекарственного вешества Лзидотимидин, зидовудин АЗТ,ЗДВ,ретровир Зальцитабии ddC.хнвид Диданозин ddl, видекс Ставудин d4T.зерит Ламивудин ЗТС, эпивир Знатен, абакавир
1 2 3 4 5 6 7
Форма выпуска Сироп: 10 мг/мл. Капсулы 100, 300 мг Раствор для в/в введения 10 мг/мл Таб. 0,375 мг или 0.75 мг Таблетки 25. 50, 100, 150 мг Порошки 100. 167. 250 mi- Пероральный рас- твор 1 мг/мл Капсулы: 15, 20. 30 и 40 мг Сироп 10 мг/мл Т аблетки 150 мг Таблетки 300 мг Сироп
Дозы (мг/сут) 200 х 3 или 300 х 2 или 250 х 2 детям до 180 мг/м" каждые 6-8 часов 0,75 мг х 3 дети: 0,005-0.01 мг/кг каждые 8 часов Таб.: >60кг: 200х 2 <60кг: 125x2. детям 90-150мг/.м: каждые 12 часов > 60 кг: 40 х 2 30 - 60 кг: 30 х 2 детям 1 мг/кг каждые 12 часов 150x2 детям 4 мг/кг каждые 12 часов 300 мг х 2 детям 8 мг/кгх 2
Биодоступность при приеме внутрь 60% 85% Таблетки -40% Порошок - 30% 86% 86% 83%
Период полужизни в сыворотке 1.1 часа 1.2 часа 1.6 часа 1.0 часа 3-6 часов 1,5 часа
Период полужизни внутри клетки 3 часа 3 часа 25 - 40 часов 3.5 часа 12 часов 3.3 часа
Выведение Метаболизируется в АЗТ-глюкуронид, который выводится почками Почечная экскреция 70% Почечная экскреция 50% Почечная экскреция 50% Почечная экскреция в неизмененном виде Почечная экскреция 82%
Нежелательные явления Угнетение костного мозга: анемия, гра- нулоцнтопенля, на- рушения ЖКТ, го- ловная боль. астения, редко миопатия, миозит, печеночные Головная боль, слабость, редко: периферическая нейропатия, пан- креатит, печено- чные нарушения, стоматит, сыпи Диарея, боли в жи- воте, тошнота, рво- та. Редко: нейропа- тии, электролит- ные нарушения. Необычно: панкре- атит, депигмен- тация. Головная боль, на- рушения ЖКТ. сы- пи, перифрическая нейропатия, панкре- атит, увеличение ак- тивности ферментов печени Головная боль, тошнота, сыпь, боли в животе, диарея. Редко панкреатит, нейтропения Головная боль, тошнота
1 2 ; 3 4 5 6 7
Взаимодей- ствия с ле- карствами Увеличение токсич- j Циметидин, ам- ности при сочетании i фотерицин, с ганцикловиром, i ампноглпкози- а-интерфероном, би- j ды могут септолом. У меньше- | уменьшить кли- нпе клиренса может ! ренс зальцита- быть связано с циме- | бина. Совмест- тидином, метадоном, j ное применение Флюконазол может ; с лиданозином увеличить клиренс i не рекоменду- ретровира. Метабо- | ется из-за уве- лизм усиливается при личенпя риска использовании ри- | нейропатии, фампицина, рифабу- । Пентамидин тина, кларитромици- | увеличивает на. Рибавирин | риск панкреати- уменьшает внутри- । та. клеточное фосфори- i лирование. Не назна- | чать с d4T (низкий , эффект). j Уменьшает абсорб- цию низорал, итра- коназол, тетрацик- лин, ципрофлокса- цин, поэтому ddl дают спустя 2-6 ча- сов после их прие- ма. Ганцикловир может увеличить токсичность ddl. Индинавир может быть назначен спус- тя час после приема ddl на голодный же- лудок. Нецелесообразно назначать с рет- ро-виром (снижа- ется активность) Бисептол уве- личивает уро- вень ламивули- на в крови. Вместе с ретро- виром редко образуются ус- тойчивые штаммы
Дополни- тельные рекоменда- ции Принимается с пищей 1 Назначается на- или за 1 час до или i тощак за 1 час после. При тяжелой । до еды или че- почечной недоста- | рез 2 часа после точности уменьшает- j еды. У.меньша- ся доза. При анемии 1 ется доза при добавляют эритро- i нарушении поетин, при грануло- | функции почек, цитопении - нейпо- । ген. ' 1 Порошок для детей должен быть сме- шан с антацидами 10 мг/мл. Прини- мать на голодный желудок спустя 2 часа после пли за час до еды. Раствор хранить в холодиль- нике, стоек 30 дней Назначается с пи- щей. Уменьшить дозу при нару- шении функции почек. Раствор взбалтывать пе- ред применени- ем. Хранить в холодильнике. Раствор стоек 30 дней. Может быть назначен с пи- щей. Растворы хранятся при комнатной температуре. Дозы снижают при печеночной дисфункции. Может быть назна- чен с пи- шей, прием пищи не влияет на биодоступ- ность пре- парата.
Приложение 2
532
Ненуклеозидные ингибиторы обратной транскриптазы
Генерическое название Торговое название Невирапин Вирамун Делавирдин,Рескриитор(не утвержден к применению в РФ) Ифавиренц Стокрин, Сустива
Форма выпуска Режим дозирования Биодоступность при приеме внутрь Период полужизни в сыворотке Выведение Лекарственные взаимодействия Нежелательные явления Таблетки 200 мг 200 мгх 1 (14 дней), затем 200 мг х 2,'сутки, или 400 мг х 1 раз в сутки >90%. препарат быстро проникает во все органы и т кани. включая плаценту, нервную систему 25-30 часов Метаболизируется цитохромом Р450. 80% выводится с мочой (глюкуронизированные метабо- литы. <5% - в неизмененном виде). 10% - с калом. Индуцирует ферменты системы цитохрома Р450; взаимодействия, требующие тщательного мониторинга, предполагаются со следующими препаратами: рифампицин, рифабутин, оральные контрацептивы, ингибиторы протеазы, триазолам и мидазолам Сыпь, повышение активности трансаминаз, гепатит Таблетки 100 мг 400 х 3 (4 таблетки по 100 мг с небольшим количеством жидкости) 85% 5.8 часов Метаболизируется цитохромом Р450. 51% выводится с мочой (<5% - в неизмененном виде). 44% - с калом. Подавляет ферменты системы цито- хрома Р450. Не рекомендуется одно- временный прием терфенадина, асте- мизола, альпрозолама, мидазолама, ци- заприда. рифабутина, рифампина, три- азолама. производных спорыньи, ам- фетаминов, нифедипина, противосу- дорожных (фенитоина, карбамазепина, фенобарбитала). Делавирдин повы- шает концентрации кларитромицина, дапсона. хинидина, варфарина, инди- навира. саквинавира. Раздельный при- ем с антацидами и дидаиозином (пере- рыв не менее 1 часа) Головные боли Таблетки 200 мг 600 мг 1 раз в день вне зависимости от приема пищи Длительный конечный период полувыведения. что позволяет назначать препарат 1 раз в сутки Не рекомендуется одновременный прием с мидазоламом, так как они метаболизируются при участии фермента цитохрома Р450, что создает риск увеличения побочных явлений. Ифавиренц усиливает метаболизм индинавира и при одновременном их приеме дозы индинавира увеличивают до 1000 мг каждые 8 часов. Ифавиренц снижает концентрацию саквинавира, в связи с чем его дозы при одно- временном приеме увеличиваются. Сыпь, головокружения, нарушения равновесия, сна. эйфория.
Приложение 3
Ингибиторы протеазы ВИЧ
| Препарат, форма выпуска Режим дозиро- вания. мг/сут. Связь с приемом пищи Условия хранения Побочные эффекты Примечания
Инвираза (саквинавир) Хоффман Ла Рош Капсулы 200 мг Фортоваза (мягкие желатиновые капсулы) 600 х 3 (9 капсул в сутки) 1200 .мг 3 раза в сутки Принимать во время или сразу после еды, содержащей достаточное количество жира Инвираза - при комнатной темпе- ратуре в плотно закрытом флаконе. Фортоваза - при температуре 2-8°С Диарея, тошнота, боли в животе Не рекомендуется снижать дозу из-за низкой биодоступности
Норвир (ритонавир) Эббот Капсулы 100 .мг 600 мг 2 раза (12 капсул в сутки) Прием во время еды или после еды. запивать молоком В холодиль- нике Астения, диарея, тош- нота, рвота, перифери- ческие парестезии Для комбинированной и монотерапии
Криксиван (индинавир) Мерк Шарп и Доум Капсулы 200 и 400 мг 800 мг 3 раза (6 или 12 капсул в сут ки) Принимать натощак, запивая водой в большом количестве или нежирным молоком. За сутки выпивать нс менее 1,5 л жидкости дополнительно При комнатной температуре. Из флакона не выни- мать вдагоугтлоти- итель Нефролитиаз, гнпербилирубинемия, боли в животе, тошнота При печеночной недостаточности дозу снизить до 600 х 3 р/сут, при нефроли- тиазе прервать на 1-3 дня или отменить
Нелфинавир (вирасепт) Хоффман Ла Рош Таблетки 250 мг и порошок 50 мг 750 Mi’ х 3 (9 таб. в сутки) для детей по- рошок разво- дится молоком или водой 20-30 мг/кг х 3 Принимать во время еды, запивая полноценным необезжиренным молоком (3,5 - 4% жирности) При комнатной температуре. Разведенный порошок использовать в течение 6 часов Диарея, тошнота, метеоризм Для комбинированной терапии. Соблюдать осторожность при назначении больным с нарушенной функцией печени
Калетра (в капсуле - 133 мг лопинавпраи 33.3 мг ритонавира Эббот 400/100 2 раза в день Независимо от приема пищи При комнатной температуре Панкреатит, диарея, гепатотоксичность Для комбинированной терапии, осторожно у больных при гепатите В и С
Приложение 4
Препараты, которые не следует применять совместно с ингибиторами протеазы
Тпп препаратов Инвираза (саквинавир) Норвир(ритонавир) Криксиван (индинавир) Вирасепт (нелфинавир) Возможные альтернативы
Анальгетики - Меперидин, пироксикам, пропоксифен - - Ацетаминафен аспирин,оксикодон
Сердечно- сосудистые (антиарптмики) - Амиодарон, энкаилпн. флекаинид, пропафенол. хинидин - - Клинический опыт очень ограничен
Сердечно- сосудистые (антаюиисты кальция) - Бепридил Клинический опыт очень ограничен
Противотубер- кулезные рифампин рифабутин рифампин рифампин Альтернатива рифабу- тину. кларитромицин, этамбутол
Алкалоиды спорыньи (сосудосуживаю- _шче)_ Ан ги гистаминные Ди гидроэрго- тамин, эрготамин Астемизол терфенадин Ди ги дроэрготам и н, эрготамин Дигидроэрготамин, эрготамин Дигидроэрготамин, эрготамин Лоратадин (кларитин)
Желудочно- кишечные цизаприд цизаприд цизаприд цизаприд Клинический опыт очень ограничен
Психотропные (антидепрессанты) - бупропион - - Флюоксетин дезипрамин
Психотропные (нейролептики) - Клозапин пимозид - - Клинический опыт очень ограничен
Психотропные (седативные и снотворные) Мидазолам триазолам Клоразепат, диазепам, эстазолам, флуразе- пам, мидазолам, триазолам золпидем
Приложение 5
Эффекты ингибиторов протеазы и других часто используемых препаратов, выявленные в исследованиях по лекарственным
взаимодействиям (коррекция дозы проводится врачом)
Группа и название препарата Инвираза (саквинавир, Рош) Рекоменда- ции Норвпр (ритонавир, Эббот) Рекоменда- ции Криксиван (индинавир, Мерк) Рекоменда- ции Вирасепт (нелфинавир, Рош-Агурон) Рекоменда- ции
1 2 3 4 5 6 7 8 9
Не-нуклеозидные ингибиторы обратной транскриптазы
Делавирдин Пятикратное увеличение лис саквинавир Данные по эффектив- ности и бе- зопасности комбинации ограничены: частый мо- ниторинг ACT и АЛТ Данных о взаимодей- ствиях дела- вирдина в дозе 400-600 мг 2 р. и ри- тонавира 300 мг 2 р.в сут. нет Данных об эффективное ти и безо- пасности комбинации нет Повышение плазменных концентра- ций инди- навира на 40% Снижение дозы инди- навира до 600 мг 3 р. Дозы нелфи- навира увели- чиваются в 2 раза, делавир- дина снижаю- тся на 50% Дозы стандартные
Невирапин Снижение лис саквинавира на 27% Данных об эффективное ти и безо- пасности комбинации нет С нижение лис ритонавира на 11% (0-12 часов) Дозы стандартные Снижение лис индинавира на 28% (0-8 часов) Увеличение дозы индина- вира до 1000 мг каждые 8 час. Данных об эффектив- ности и безо- пасности ком- бинации нет Некоторые эксперты используют нелфинавир 1000 мг х 3 р., неви- рапин 200 мг х 2 р. вдень
Ингибиторы протеазы
Индинавир < Увеличение AUC нелфи- навира на 83%, индинавира на 51% Данных об эффективно- сти и безо- пасности комбинации нет
1 2 э 4 5 6 7 8 9
Нелфинавир Увеличение AUC нелфи- навир3 на 18%. саквина- вира - на 392% (при ис- пользовании мя! ких жела- тиновых кап- сул саквина- вира, пли Фортовазы) При исполь- зовании тве- рдых капсул саквинавира коррекция дозы не тре- буется: по коррекции лозы мягких •желатиновых капсул дан- ных нет. Увеличение AUC нелфи- навира на )52%. изме- нение AUC ритонавира незначитель- ное Безопасность п эффектив- ность комби- нации не установлены Увеличение AUC нелфи- навира на 83%, индинавира - и а 51 % Безопасность и эффектив- ность комби- нации не установлена
Ритонавир 20-крат ное увеличение концентрации саквинавира при лозах ри- тонавира 400- 600 мг 2 р'сут Дозы саквинавира 400 мг х 2 р.. ритонавира - 400 мг х 2 р. в сут. Нет данных Увеличение AUC нелфи- навира на 152%, изменение AUC ритонавира незначительное Безопасность и эффектив- ность комби- нации нс установлены
Саквинавир 20-кратное увеличение концентра- ции саквина- вира в равно- весном сос- тоянии при дозах рито- навира 400- 600 мг 2р. Рекомендуют ся дозы: Инвираза НЛП фортоваза -- 400 мт х 2 р. и ритонавир 400 мг х 2 р. в сут. Уровень саквинавира в крови уве- личивается в 4-7 раз Нет данных Увеличение AUC нелфи- навира на 18%. саквинавира - на 392% (при использовании .мягких желати- новых капсул саквинавира. или Фортовазы) При исполь- зовании твердых капсул сак- винавира коррекции дозы не требуется; по коррекции дозы мягких желатиновых капсул дан- ных нет.
35. Заказ№ К-4451.
/ ! 1 2 .. Г "3 4 5 6 7 8 9
1 Противогрибковые
: Флюконазол : (Дифлюкан) 1 Данных нет Флюконазол увеличивает AUC ритонавира на 15% Коррекция лозы не требуется Снижает AUC индинавира на 19±33% Коррекция лозы нс требуется
Кетоконазол (Низорал) Кетоконазол увеличивает уровни саквинавира в 3 раза Коррекция лозы не тре- буется, если кетоконазол дается по 200 мг в сутки, а саквинавир по 600 мг 3 раза Уровни кетоконазола увеличивают ся в 3 раза Кетоконазол увеличивает AUC индинавира на 68±48% Снизить дозу индинавира до 600 мг каждые 8 часов Кетоконазол увеличивает AUC нелфинавира на 35% Коррекция дозы не требуется
Прот ивоту 'беркулезн ые
Кларитро- мицин Данных нет AVC кларитро- мицина увеличивает- ся на 77% Коррекция дозы у больных с почечной недостаточ- ностью AUC индина- вира увели- чивается на 29±42%,AUC кларитроми- цина увели- чивается на 53±36% Коррекция дозы не требуется
Рифабутин Рифабутин снижает концентрацию саквинавира на 40% Вместо рифабутина использовать альтернатив- ные препараты AIJC рифа- бутина уве- личивается в 4 раза, AUC метаболита рифабутина увеличивает- ся в 35 раз Одновремен- ный прием ритонавира и рифабутина противопо- казан AUC рифа- бутина уве- личивается на 204±142% Вдвое уменьшить дозу рифабутина AUC рифабутина увеличивается на 207% Вдвое уменьшить дозу рифабутина
1 2 3 4 5 6 7 8 9
Рифампицин (рпфадпн. другие) Рифампин снижает концен'1 рации саквинавира на 80% Рифампин и саквинавир не следует назначать вместе Рифампин снижает кон- центрацию ритонавира на 35% Рекомендует ся увеличить лозу ритонавира Рифампин и индинавир не следует назначать вместе Рифампин снижает кон- центрацию нелфинавира примерно на 82% Рифампин и нелфинавир не следует назначать вместе
Разные
Оральные контрацеп- тивы Данных нет ДОС этинпл- эстрадиола снижается на 40% Следует увеличить дозу контра- цептивов или использовать другие меры контрацеп- ции Снижение этинил эстра- диола на 24±П%, норэтиндро- на-26+14% Коррекция лозы не требуется Снижение этинил эстра- диола на 47%, норэтиндрона - 18% Сменить или использовать дополнитель- ные методы контрацеп- ции
Увеличение дис дезипрамина на 145% Необходимо снижение дозы Грейпфруто- вый сок сни- жает концен- трацию ин- динавира на 26%
Снижение AUC теофил- лина на 43% Может по- требоваз ься увеличение дозы -
Курение табака снижает AUC ритонавира на 18%
AUC - площадь под кривой “концентрация-время”
Приложение 6
Взаимодействие лекарств: ингибиторы протеазы и неиуклеозидиые ингибиторы обратной транскриптазы
Действие лекарств на уровень (АиСв)/Дозу
I Действующее 1 лекарство Ритонавир Саквинавир* Нельфинавир Амиренавир
Индинавир (IDV) 1 Уровни: IDV Т 2-5 раз Доза; ограниченные данные для 1DV 400 мг 2 раза + RTV 400 мг 2 раза, или IDV 600 мг 2 раза + RTV 200 мг 2 раза, или 1DV 800 мг 2 раза ч RTV 100 или 200 мг 2 р. Уровни: IDV нет эффекта SQV Т 4-7 раз' Дозы: недостаточно данных Уровни: IDV Т 50% NFV Т 80% Дозы: Ограниченные данные для 1DV 1200 мг 2 раза - NFV 1250 мг 2 раза Уровни: APV AUC Т 33% Дозы: не изменяются
Ритонавир (RTV) • Уровни: RTV не i эффекта SQV Т 20 раз ' Дозы: Инвираза или фортоваза 400 мг 2 раза + RTV 400 мг 2 раза Уровни: RTV нет эффекта NFV Т 1,5 раза Дозы: ограниченные данные для RTV 400 мг 2 раза <- NFV 500-750 мг 2 раза Уровни: APV AUC Т в 2,5 раза Дозы: недостаточно данных
Саквинавир (SQV) 1000х2р RTV 100х2р, • Уровни: SQV Т 3-5 раз NFV Т 20%s Дозы: Стандартная NFV Фортоваза 800 мг 3 раза Уровни: APV AUC Ф 32% Дозы: недостаточно данных
Нельфинавир (NFV) 500 мл х 2pasa RTV 400 мл х 2р • • f Уровни: APV AUC ? 1,5 раза Дозы: недостаточно данных
* Различные изучения взаимодействия лекарств завершены с саквинавиром, даваемым как инвираза или фортоваза. Результаты исследования,
проведенные с инвиразой. не могут быть применены к фортовазе.
‘ Проводилось с инвиразой
° Проводилось с фортовазой
539
Приложение 7
Информированное согласие на проведение терапии
ВИЧ-инфекции
Я________________________________________________________________
(Фамилия, имя, отчество полностью)
19____года рождения, настоящим подтверждаю свое добровольное согласие на проведение мне
химиотерапии ВИЧ-инфекции и/или химиопрофилактики оппортунистических заболеваний с
использованием следующих препаратов:
Я подтверждаю, что мне разъяснено, почему проведение данной терапии необходимо, разъяснено
действие назначаемых мне препаратов, что я получил (получила) информационный листок для
больного и ознакомился (ознакомилась) с ним, что мне сообщен контактный телефон, по которому я,
в случае необходимости, могу связаться с моим лечащим врачом или лицом, его замещающим.
Я осознаю:
• Что назначаемое мне лечение направлено на подавление размножения вируса иммунодефицита
человека (ВИЧ) в организме и на предотвращение развития связанных с ВИЧ-инфекцией вторичных
заболеваний, что оно не приведет к полному излечению от ВИЧ-инфекции и не предотврати:
полностью возможность заражения мною других лиц.
• Что назначенное мне лечение в любой момент может быть прекращено по моему собственному
желанию или решению лечащего врача, в том числе и из-за несоблюдения мною режима приема
препарата или обследования. В случае прекращения лечения по решению лечащего врача мне
должны быть разъяснены причины этого решения.
• Что назначаемые мне лекарственные препараты разрешены к применению в России.
• Что, как и любое лекарственное средство, они могут вызывать некоторые побочные реакции,
информация о которых приведена в информационном листке для больного, с которым я ознакомился
(ознакомилась).
Я обязуюсь:
• Проходить медицинское обследование для контроля за лечением по установленному трафику,
заполнять предусмотренные для этого анкеты, сдавать на анализы кровь и мочу.
• Принимать назначенные мне лекарственные препараты строго в соответствии с предписанием
лечащего врача.
• Сообщать лечащему врачу обо всех нарушениях назначенного мне лечения или прекращении его
по каким-либо причинам;
• Сообщать лечащему врачу обо всех изменениях в состоянии моего здоровья во время лечения и
делать это незамедлительно (в течение сучок), если я считаю, что эти изменения связаны с приемом
назначенных мне препаратов.
• Не принимать, нс посоветовавшись с лечащим врачом, какие-либо не назначенные им
лекарственные препараты (даже если они назначаются другим врачом для приема не в экстренном
порядке). Гели же прием этих лекарств неизбежен (например, в экстренных случаях) обязательно
сообщать об этом лечащему врачу.
Подпись больного: Дата:_____________________
Врач_______________________________________________________Дата:
(ФИО, разборчиво) (подпись)
540
Приложение 8
Общие рекомендации по началу и проведению
антиретровирусной терапии:
Обеспечить добровольное консультирование, тестирование и дальнейшее проведение
психосоциальной поддержки для соблюдения режима терапии.
Обеспечить обследование на ВИЧ-связанные заболевания и оппортунистические
инфекции.
Обеспечить лабораторный мониторинг, включая гематологические, биохимические
тесты для определения токсичности лекарств, а также определения иммунологических параметров
и вирусной нагрузки.
Соблюдать адекватный прием лекарств, учитывая наличие перекрестной
резистентности между лекарствами для лечения ВИЧ-инфекции и лекарствами для лечения ВИЧ-
ассоциированных состояний.
Определить возможность длительной закупки лекарств для проведения длительной
терапии
Дать информацию и провести тренинг по безопасности и эффективности прописанных
медицинских лекарств пациенту и лицам, наблюдающим за пациентами.
Рентгенография грудной клетки, а при необходимости томограмма грудной клетки и
других органов.
Перед началом или изменением антиретровирусной терапии дважды должны быть
измерены вирусная нагрузка и количество С04+Т-клеток.
Все пациенты с симптоматической или продвинутой ВИЧ-инфекцией должны получать
высокоинтенсивную противоретровирусную терапию.
Решение о назначении антиретровирусной терапии пациентам с асимптомной ВИЧ-
инфекцией должно основываться на комплексной оценке вирусологических, иммунологических
и психосоциальных факторов. В целом терапия показана пациентам с количеством CD4i- Т-
клеток < 500/мм'; если количество CD4+ Т-клеток > 500/мм’, пациенты могут находиться под
наблюдением врача без назначения антиретровирусной терапии или получать специфическое
лечение. В таких случаях необходимо учитывать риск прогрессии ВИЧ-инфекции к СПИДу,
определяемый уровнем РНК ВИЧ и количеством CD4+Т-клеток.
С целью достижения максимальной вирусной супрессии необходимо начинать терапию
с высокоинтенсивных режимов, включающих ингибитор протеазы и два нуклеозидных ингибитора
ОТ; могут быть использованы другие комбинации, но они менее оптимальны.
Многие факторы, включая возобновление определения РНК ВИЧ в плазме после
начальной супрессии до неопределяемого уровня, могут указывать на терапевтическую неудачу.
Решение относительно изменения терапии или назначения новых режимов должны
быть тщательно обсуждены.
Пациентам с острой ВИЧ-инфекцией, вероятно, показана высокоингенсивная
антиретровирусная терапия; длительность лечения определенно не установлена и может
продолжаться в течение многих лет. если не всей жизни.
Учитывая высокую стоимость антиретровирусной терапии и быстрое формирование
резистентности к препаратам в некоторых странах рекомендуется назначать лечение при CD4<300
и вирусной нагрузке, превышающей 300 000 РНК ВИЧ в мл (WHO, 2000).
541
Приложение 9
Рекомендации по началу антиретровирусной терапии у нелеченных
больных (AIDS-society, 2002)*
Тип болезни Рекомендации
Симптомы ВИЧ болезни Лечение рекомендуется
Асимптомная ВИЧ CD4 ниже 2ОО/мм3 Лечение рекомендуется
Асимптомная ВИЧ CD4 выше Подход к лечению должен быть
200/мм3 индивидуальным и основан на:
- CD4 350/мл, но с тенденцией к - уровне CD4 и скорости его
снижению снижения
- при уровне ВИЧ РНК выше 50.000 - уровне ВИЧ РНК в плазме
- 100.000 копий/мл - способности больных быть
- снижение CD4 должно быть приверженными к терапии
поводом для определения вирусной - индивидуальном риске
нагрузки токсичности лекарств при их комбинациях и сочетаниях
*Antirctrov iral Treatment for Adult HIV Infection in 2002. Updated Recommendations of
the International AIDS Society -USA Pannel (JAMA, July 10, 2002, V. 288, N 2)
542
Позже, в 2003г. была добавлена детализация рекомендаций по
начальной терапии у бессимптомных пациентов.
(Hoffmann-Kamps, HIV Medicine, 2003)
1. При уровне CD4 ниже 200клеток\мл лечение нужно начинать как
можно скорее. Тем не менее, нужно время, чтобы познакомиться с
пациентом, провести надлежащий совет, и начать сперва с профилактических
или диагностических процедур (консультирование).
2. При уровне CD4 выше 200клеток\мл, времени имеется больше.
Должна приниматься во внимание личная история(болезни) пациента.
3. Понижение уровня CD4 более 4eMt на 80-100клеток\мл в год - слишком
много. Не медлить с началом лечения.
4. Уровень CD4 может значительно варьироваться. Необходимо
проводить анализ непосредственно перед началом лечения (особенно, если
он в пределах 200-300кл.\мл).
5. Уровень CD4 выше 350кл.\мл: подождите. Проверять каждые 3
месяца.
6. Чем больше вирусная нагрузка, тем больше необходимо проверок
уровня CD4. При вирусной нагрузке»50000копий\мл, определения CD4
должны проводиться как минимум, каждые 2 месяца.
7. Начало лечения может быть оправдано при уровнях CD4 более
350кл.\мл- если вирусная нагрузка очень высокая, а уровень CD4 падает
очень быстро, или пациент требует этого (после обсуждения с врачом).
543
Приложение 10
Рекомендуемые антиретровирусные препараты для терапии установленной ВИЧ-инфекции
(CDC, MMWR, 1998,47 (RR3)
Колонна А Колонна Б
Индинавир Нельфинавир Ритонавир Саквинавир-SGC* Ритонавир + саквинавир-SGC или HGC** Зидовудин + ddl d4T + ddl Зидовудин + ddC Зидовудин + ЗТС*** d4T + ЗТС***
Предпочитаются : один выбор из колонны А (ИП) + один выбор из колонны Б (2 НИОТ)
Альтернатива: один ННИОТ (невирапин)” + два НИОТ (колонна Б) или саквинавир (инвираза) + два НИОТ (колонна Б)
Обычно не рекомендуется: два НИОТ (колонна Б)
Не рекомендуется^: все монотерапии; d4T + зидовудин; ddC + ddP; ddC + d4T'; ddC+ ЗТС
* - вирусологические данные и клинический опыт с саквинавиром-SGC ограничен по сравнению с другими ИП;
* *- использование ритонавира 400 х 2 раза в сут. с саквинавиром-SGC (фортоваза) 400 х 2 раза в сут. приводит к похожей AVC
лекарства и антиретровирусной активности при использовании инвиразы 400 х 2 раза в сут. в комбинации с ритонавиром. Однако эта
комбинация с фортовазой изучена недостаточно широко и при использовании фортовазы могут быть больше гастроинтестинальные
токсические явления;
* ** - высокий уровень резистентности к ЗТС развивается в течение 2-4 недель при использовании частично супрессивных режимов;
оптимально использование в комбинации из трех лекарственных препаратов, что снижает вирусную иа1-рузку до < 500 копий/мл;
” - только комбинация из двух НИОТ и одного ННИОТ - зидовудин -г ddl + невирапин, как было показано, подавляет виремию до
неопределяемой у большинства пациентов. Эта комбинация изучалась у пациентов, начинающих антиретровирусную терапию;
+ - зидовудин-терапия может обсуждаться для профилактического использования у беременных женщин с низкой вирусной нагрузкой
и высоким количеством CD4-k,tctok с целью профилактики перинатальной трансмиссии;
эти комбинации НИОТ не рекомендуются на основании недостатка клинических данных, использующих комбинацию, и/или
совместной токсичности.
Приложение 11
Выводы по начальным режимам антиретровирусной терапии
Carpenter et al. JAMA, January 19, 2000: 283 (3); 384
Преимущества Недостатки
2НИОТ+ 1 ИП Убедительные клинические данные Длительный опыт вирусной супрессии Большая нагрузка таблетками может помешать будущему назначению ингибиторов протеазы Обладают токсичностью
2НИОТ + 2ИП Высокий потенциал Низкая нагрузка таблетками Высокая нагрузка таблетками с таким же режимом
2 НИОТ + 1 ННИОТ Низкая нагрузка таблетками Равный потенциал с режимом ингибиторов протеазы Ограниченные данные по продолжительности Мешает будущему назначению ННИОТ режимов
3 НИОТ Отсрочены 2 класса (ИП, ННИОТ) Низкая нагрузка таблетками Более низкий потенциал у пациентов с высокой базовой вирусной нагрузкой Ограниченные данные но отдаленным результатам Может помешать будущим НИОТ режимам Потенциальная конвергенция митохондриальной токсичности.
545
Приложение 12
Рекомендации экспертной группы по СПИДу,
США, 28 января 2000
Риск и успехи раннего начала антиретровирусной терапии у
пациентов с асимптомной ВИЧ-инфекцией
Потенциальный успех.
Контроль вирусной репликации и мутации; уменьшение вирусной нагрузки
Предупреждение прогрессирования иммунодефицита; потенциальная
поддержка или реконструкция нормальной иммунной системы
Задержка прогрессии СПИДа и удлинение жизни
Снижение риска отбора резистентного вируса
Снижение риска токсичности лекарства
Возможное снижение риска вирусной трансмиссии
Потенциальный риск
Снижение качества жизни из-за побочных эффектов лекарств и неудобство
текущих максимально подавляющих режимов
Раннее развитие лекарственной резистентности
Трансмиссия лекарственно резистентного вируса
Ограничение в будущем выборе антиретровирусных агентов вследствие
развития резистентности
Неизвестная долговременная токсичность антиретровирусных препаратов
Неизвестная продолжительность эффективности текущей
антиретровирусной терапии
546
Приложение 13
Показания к началу антиретровирусной терапии у больных с
хронической ВИЧ-инфекцией
Guidelines for theUse of Antiretiviural Agents
in HIV infected Adults and Adolescents.
-February 4, 2002
Клиническая категория CD4T лимфоциты ВИЧ/РНКв плазме Рекомендации 1 i
Симптомы (СПИД, серьезные симптомы) любые любой лечить
Бессимптомный, ВИЧ/СПИД Менее 200 мм3 любой лечить
Бессимптомный Более 200, но менее 350 в мм3 любой Лечение предлагать
Бессимптомный Более 350 мм’’ Более 55000 Некоторые эксперты воздерживаются от лечения и повторно определяют CD4 и ВИЧ/РНК
Бессимптомный Болес 350 мм'’ Менее 55000 Большинство экспертов рекомендуют воздержаться от лечения
_
547
Приложение 14
Варианты схем противоретровирусной терапии
(Рекомендации М3 РФ, 1999)
Лечебная схема USS в год.
№ Препараты Разовая доза (г) раз в сутки Суточная доза (г)
1 Тимазид (АЗТ) 0,2 3 0,6 1314
1.2 Фосфатид (Ф-АЗТ) 0,4 2 0,8 2920
2.1 Тимазид (АЗТ) 0,2 3 0,6 3822
Хивид (ddC) 0,00075 3 0,00225
2.2 Ретровир (AZT) 0,2 3 0,6 5902
Хивид (ddC) 0,00075 3 0,00225
2.3 Ретровир (AZT) 0.2 3 0,6 5628
Видекс (ddl) 0,2 2 0.4
2.4 Зерит (D4Т) 0,04 2 0.08 5066
Видекс (ddl) 0.2 2 0.4
3.1 Фор го ваза 1,2 3 3,6 10512
Тимазид (АЗТ) 0.2 3 0,6
Хивид (ddC) 0,00075 3 0.00225
3.2 Форт оваза 1.2 3 3,6 12866
Ретровир (AZT) 0.2 3 0.6
Хивид (ddC) 0.00075 3 0.00221
3.3 Криксиван 0,8 3 2,4 11673
Ретровир (А7.Т) 0,2 3 0.6
Хивид (ddC) 0.00075 3 0,00225
3.4 Вирасепт 0,75 3 2.25 11650
Ретровир (AZT) 0.2 3 0,6
Хивид (ddC) 0.00075 3 0,00225
3.5 Фортоваза 1.2 3 1,8 12593
Ретровир (AZT) 0,2 3 0.6
Видекс (ddl) 0,2 2 0,4
3.6 Криксиван 0,8 3 2,4 11103
Ретровир (AZT) 0,2 3 0,6
Видекс (ddl) 0,2 2 0,4
3.7 Вирасепт 0,75 3 2,25 11377
Ретровир (AZ.T) 0,2 3 0,6
Видекс (ddl) 0.2 2 0.4
3.8 Фортоваза 1.2 3 1,8 13162
Ретровир (AZT) 0.4 2 0,8
Эпивир (3 ГС) 0,15 О 0.3
3.9 Криксиван 0,8 3 2.4 11673
Ретровир (AZT) 0.4 2 0.8
Эпивир (ЗТС) 0.15 2
548
Приложение 15
Измерение РНК ВИЧ в мониторинге антиретровирусной терапии
Уровни РНК ВИЧ, которые предполагают начало терапии Более 30 000 - 50 000 копий/мл
Цели определения уровня ВИЧ РНК после начала лечения «ниже уровня определения» (в настоящее время ниже 50 копий/мл, ранее менее 400 копий/мл)
Выбор времени целевого ответа «ниже уровня определения» в пределах 3-4 недель начала антиретровирусной терапии (у больных с высоким базовым уровнем РНК ВИЧ максимальная супрессия может быть в пределах 6-8 месяцев)
Частота измерения РНК ВИЧ базовый уровень: 2 определения за 3-4 недели порознь в пределах 1 месяца начала терапии, чтобы подтвердить антиретровирусную активность режима каждые 2 месяца до тех пор, пока уровень вирусной нагрузки станет неопределяемым каждые 3-4 месяца с этого времени вместе с количеством CD4
549
Приложение 16
Мониторинг токсичности н осложнений ВААРТ
(рекомендации AIDS society, 2002)
Токсичность /определение Лекарственные сочетания Клинико- лабораторные данные Мониторинг Рекомендации
Молочнокислый ацидоз бессимптомные (<10 ммоль/л) симнтомные (10 ммоль/л и более) ни от Гепатоз, тошнота, рвота, потеря веса, повышение АЛТ, молочной кислоты определение уровня молочной кислоты при уровне лактата более 10 ммоль/л прекратить терапию, более 5 ммоль/л при симптомах повторить определение лактата
Изменения липидного обмена и yi доводов, увеличение уровня триглицеридов, уровня глюкозы, ненормальное распределение жировых отложений ассоциируется с ингибиторами протеазы, в т.ч. ритонавиром панкреатит, повышение уровня триглицеридов, гипергликемия определение уровня триглицеридов, липидов. холестерина и его фракций медикаментозная коррекция, замена ингибиторов протеазы на ННИОТ
Гепатотоксичность чаше наблюдается при коинфекции с HBV и HCV, развивается при приеме невирапина, а у беременных при сочетании зерита и ddl Гепатомегалия. повышение AJ1T/ACT определение печеночных проб коррекция медикаментами, зерит и ddl у беременных лучше избегать
Приложение 17
Стратегия улучшения приверженности: связанная с медицинским персоналом
Установите доверие
Работайте как педагог, источник информации, осуществляя поддержку и
наблюдение.
Будьте доступны между визитами для решения вопросов, проблем через
пейджер, включая отпуск/конференции
• Сохраняйте приверженность наблюдению; интенсивному лечению в периоды
низкой приверженности (например, частые визиты, привлечение семьи/друзей,
других членов команды, направленные на ментальное здоровье или службу
химической зависимости)
• Используйте здоровье бригады для всех больных; для трудных больных; для
специальных нужд, например, будьте педагогом для подростков или
наркоманов.
Обсуждайте влияние новых диагнозов на приверженность, например,
депрессии, заболеваний печени, возвратной химической зависимости, и
включайте внедрение приверженности в лечение.
Стратегия улучшения приверженности: связанная с пациентом
Обсуждайте план лечения, который пациент понимает и которому он/она
вверяется.
Определите время, многочисленные встречи, чтобы изучить и объяснить цель
терапии и необходимость приверженности.
• Установить готовность принимать препараты до первого назначения, как
предписано.
Привлечь семью и друзей к поддержке плана лечения.
Разработать конкретный план для специфического режима, связи с приемом
пищи, ежедневного расписания, побочных эффектов.
Обеспечить письменное расписание и картинки препаратов, ежедневно или
еженедельно коробочки с пилюлями, будильник, пэйджер, другие механические
помощники в приверженности.
Обеспечьте приверженность поддерживающих групп или добавьте
приверженность к регулярной повестке дня поддерживающих групп.
• Обеспечьте связь с местными организациями по поводу приверженности с
образовательными сессиями и практическими направлениями.
Направления улучшения приверженности: связанное со здоровьем бригады
Используйте медсестер, фармацевтов, педагогов, добровольцев, руководителей,
консультантов по лекарствам, помощников врачей, практикующих медсестер,
научных медсестер, чтобы укрепить приверженность.
• Дополнить внедрение приверженности к описанию работы ВИЧ поддержки
членами бригады; дополнить продолжение защитной роли, чтобы улучшить
доступность пациента.
551
Приложение 18
Перекрестная резистентность среди доступных классов
антиретровирусных лекарств и возможности последующих сочетаний
лекарств такого же класса
Вероятность перекрестной резистентности Возможности сочетаний Комментарии
ННИОТ Высокая Нет Возможен только один шанс
ИП Высокая/У меренная Да Рекомендации относительно оптимальных сочетаний не могут быть сделаны только из истории антиретровирусной терапии
НИОТ Умеренная/Низкая Да Перекрестная резистентность может обусловлена уникальным путем передачи мульти- лекарственной резистентности
552
Приложение 19
Рекомендации по определению резистентности для выбора
оптимальных подходов к терапии
Клинические состояния Рекомендации Подходы к улучшению лечения
Первичная ВИЧ инфекция Предложить обследовать, однако терапия не должна откладываться до результатов тестирования. При выявлении лекарственной резистентности следует изменить терапию и стимулировать специфический иммунный ответ.
Подтвержденная ВИЧ-инфекция Предложить обследовать, однако у нелеченных пациентов возможно появление резистентных штаммов, что требует обследования и учета. Отложить лечение до получения результатов определения резистентности. Однако, это всегда возможно учитывать.
Первично леченная ВИЧ инфекция при недостаточном ответе на лечение Рекомендуется обследование Определить препарат (препараты), к которым резистентен ВИЧ
Множественные неудачные режимы лечения Рекомендуется обследовать резистентность, в особенности к тем лекарствам, которые применялись Исключить препараты, к которым сформировалась резистентность. Использовать наиболее эффективные препараты.
* Беременность Рекомендуется обследование Улучшить лечение беременных и матерей и качество профилактики ВИЧ у новорожденных
*Рекомендации. International AIDS Society. JAMA, 2000, 283, p. 2424.
36. Заказ № К-4451.
553
Приложение 20
Средняя стоимость антиретровирусных препаратов
Антиретровирусные Стоимость в месяц Стоимость в год
препараты __(US$_) (US_$)
Зидовудин (АЗТ,ретровир) 280 1 3360
Диданозин (ddl, видекс) 202 2424 d
Зальцитабин (ddC) 210 2520
Ставудин (зерит, d4T) 259 3108
ЗТС (эпивир, ламивудин) _239 2868
Комбивир (AZT+3TC) 519 6228
Абакавир (зиаген) 295 3540
Делавирдин 223 2676
Невирапин (вирамун) 255 3060
Эфавиренц (стокрин, сустава) 389 4668
Саквинавир (инвираза) 570 6840
Саквинавир (Фортоваза) 565 6780
Индинавир (криксиван) 435 5220
Ритонавир(норвир) 612 7344
Нелфинавир (вирасепт) 563 6756
Источник: The 1999 HIV Drug Guide, Jan/Feb 1999.
554
Приложение 21
Практические рекомендации для врачей по
< использованию Циклоферона в терапии ВИЧ-
инфицированных пациентов
Исходя из многолетних наблюдений за ВИЧ-инфицированными,
полученных в ходе их лечения низкомолекулярным индуктором интерферона
циклофероном можно дать нижеследующие рекомендации практическим
врачам для использования ИФ в терапии ВИЧ-инфицированных пациентов:
1. Применение циклоферона в терапии ВИЧ-инфекции сопровождается
стабилизацией клинических проявлений заболевания, улучшением состояния,
а также гематологических и иммунологических показателей больных.
2. Циклоферон хорошо сочетается со всеми основными лекарственными
средствами, его рекомендуется использовать, когда имеются признаки активной
репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с
обострениями различных оппортунистических заболеваний.
3. Циклоферон оказывает наилучшее иммуномодулирующее действие
при числе CD4 менее 500, но не ниже 200 и наибольшее противовирусное
действие при уровне вирусной нагрузки до 30 тысяч копий в 1 мл.
4. Циклоферон может использоваться (курсами) у больных с выраженной
иммуносупрессией в промежутках после окончания противовирусной терапии
с целью улучшения гематологических и иммунологических показателей,
повышения качества жизни больных.
5. Особенно перспективным представляется поочередное
использование циклоферона с ингибиторами протеаз и ингибиторами обратной
транскриптазы.
6. Учитывая полученный терапевтический эффект применения
циклоферона на ранних стадиях развития ВИЧ-инфекции, представляется
целесообразным изучить возможности применения циклоферона как средства
превен тивной терапии и профилактики, в частности, у медицинских работников,
подвергшихся риску заражения ВИЧ.
7. Учитывая низкую токсичность препарата и его высокую
противовирусную активность, перспективным может оказаться его
использование для профилактики вертикального пути передачи ВИЧ.
8. Циклоферон может оказаться перспективным профилактическим
средством при сомнительных контактах и контактах с заведомо ВИЧ-
инфицированными партнерами, а также при лечении наркозависимых.
9. Полученные данные свидетельствуют, что применение циклоферона в
качестве иммуностимулятора способствует восстановлению показателей
иммунной системы (содержание CD3, CD4, CD8 лимфоцитов, а также
функциональной активности лимфоидных и гранулоцитарных клеток) у
больных, находящихся на ранних стадиях ВИЧ-инфекции (стадия 11 Б, ПВ, III А).
Одновременно с этим зарегистрировано снижение уровня вирусной нагрузки,
зачастую до неопределяемых значений (менее 200 копий РНК ВИЧ в мл).
10. На более поздних стадиях развития заболевания (1ПБ-1ПВ) применение
циклоферона не сопровождается терапевтическим эффектом, что требует
дальнейшего исследования с использованием других схем назначения препарата
и комбинации его с традиционной антиретровирусной терапией.
11. Оптимальными на сегодняшний день можно считать следующие схемы
для лечения ВИЧ-инфекции:
а) для ампулированной формы циклоферона (12,5% раствор по 2 мл) - по
4 мл (2 ампулы) внутримышечно по схеме: 1,2,4,6, 8,10,13, 16,19, 22,25,28
день, затем в тех же дозировках до 4 месяцев. После чего делается 4-х недельный
перерыв и схема повторяется. Для детей до 14 лет доза препарата уменьшается
вдвое (по 1 ампуле — 2 мл внутримышечно). Препарат вводится по той же
схеме, что и взрослым.
б) для таблетированной (кишечнорастворимой) формы циклоферона по
0,15 - по 4 таблетки 1 раз в сутки перорально по схеме: 1,2,4,6,8,10,13, 16,19,
22, 25, 28 день, затем 1 раз в 5 дней до 4 месяцев. После чего делается 4-х
недельный перерыв, и схема повторяется. Для детей до 14 лет доза препарата
сокращается до 2-х таблеток. Прием препарата осуществляется по той же схеме,
что и взрослым.
Введение препарата необходимо проводить под контролем уровня CD4
каждые 4 месяца (по окончании каждого курса). Целесообразна также оценка
результатов терапии по уровню вирусной нагрузки 1-2 раза в год.
12. Исчезновение у ряда инфицированных ВИЧ на разных стадиях
заболевания иммунологических и вирусологических показаний к
проведению противоретровирусной терапии может иметь важное значение для
разработки новых подходов к лечению ВИЧ-инфекции, снижению риска
развития резистентности к терапии и повышению экономической
эффективности терапии ВИЧ/СПИДа.
556
Приложение 22
Рекомендации *по применению препаратов для лечения ВИЧ.*
(Gilead, 2003)
Нуклеотид- нуклеозидные ингибиторы обратной транскриптазы
Название лекарства । Дозы для взрослых Диетические показания
Один реп а день
Виреад (Viread, TDF) (Тенофовир ) Одна 300-мг таблетка в день С пищей
Эмтрива (Emtriva, cmtricitobine, FTC) Одна 200-мг капсула в день Независимо от приема пищи
Видекс ЕС (Videx. didanosine, ddl) При весе более 60 кг- одна 400-.мг капсула в день; при весе менее 60 кг- одна 250-мг капсула в лень Принимать на голодный желудок; не принимать с пищей.
Зерит XR (Zerit. stavudine, d4T) При весе более 60 кг- одна ЮО-.мг капсула в лень; при весе менее 60 кг- одна 75-мг капсула в день. Независимо от приема пши.
1 ii:ih 2 рази в день
Эпивир (Epi\ ir. lamivudine. ЗТС) по 2* 1 50-мг таблетки в день или одна 300- мг таблетка в день. Независимо от приема ПИШИ.
Видекс (Videx, didanosine. ddl) При весе более 60 кг 2*1 OOmj таблетки 2 раза в день или 1 *200-мг таблетка 2 раза в день На голодный желудок за 0,5- -> часа до еды.
— .. 2 риза в день
Pei ровир (Retrovir, zidovudine, AZT) (Зидовудин. АЗТ) ио 2*300мг таблетки в день Независимо or приема пиши
Комбивир (AZT-3TC) (АЗТ.3 ГС) по 2 таблетки (1 таблетка содержит 300мг АЗТ и 1 50mi ЗТС) в день Независимо от приема пиши
557
Гризивир (Trizivir) (ЛЗТ-ЗТОЛВС) i_ 2 габяетки(одна таблетка содержит 300мг АЗТ. 150мг ЗТС и 300мг АВС) в день 1 независимо or приема пиши । 1 1
г Знатен (Ziagen, abacavir, ABC) (Абакавир. ABC) Две ЗОО-.mj таблетки в день 1 Независимо ог приема пиши 1 1
Зериг (sravudine, d4T) При весе более 60 кг- 2*40-мг капсулы в день, при весе менее 60 кг- 2*30-.мг капсулы в день . „ .. . Независимо от приема пищи L
3 />(/?(/ li PUIlh
Хивид (/ak'habine. ddC) Но 3*О.7?-м| таблетки в лень Независимо от приема пиши
* Непуклеозпдные пнт пбиторы обратной транскрипты 1 । 1 pas в ()е//ь । . ... ............ . ... . 1
(уст ива (Sus(i\a. efaxirenz. LTV) (Ифавиренц) Одна 600-мг 1аблетка в день г На голодный желудок, желательно перед сном
2 раза a t)enh
Внрамхн (Viramune. nevirapine. NVP) (Невирапин) Одна 200-мгтаблетка вдень в течение 14 дней, затем но две заблеткн вдень 3 раза н день Независимо <>1 приема пищи
Рескршпор (dela\ irdine. DI.V) (Делавирдин) По две 200-мг таблетки 3 раза в день независимо от приема пиши
Ингибиторы протеазы
/ раз а день - - - - - - д г~ - J
Рейагаз (Reyataz, atazanax if. ATV) (А газановир) I i - - -- Норвир ! (Norxir.riionavir. RTV) J (Ритонавир) 1 Две 200-мг капсулы в день 2 раза в день - - - По 6* 1ОО-.мг капсул 2 раза в день. Начать с 3-х । капсул 2 раза в день.через 14 дней увеличить дозу до полной Принимать во время еды , Г" -- - - - - Принимать во время еды 1 1
558
Агенераза (Agenerase. amprenavir, APV) (Ампренавир) По 8* 150-мг капсул 2 раза в день Может приниматься как с едой, так и без нее; не прини- мать с жирной нишей
Калетра (Лоппнавир'.риюнавир. LPVVRTV) ПоЗ капсулы(1 капсула содержит 133.3мг лопинавира- 33.3мг ритонавира) 2 раза в день Принимать во время еды
1 , 1 z паи j риза в день
Вирасепт (Nelfinavir, NFV) (Нелфинавир) По 3*250мг капсулы 3 раза в день. По 5*250мг капсул 2 раза в день или По 2* 625мг капсулы 2 раза в лень Принимать во время еды или с любой нишей
3 раза в deiih
. Криксиван (Crixivan, indinavir, IDV) (Индинавир) По 2*400mi капсулы 3 раза в день( каждые 8 часов) На голодный желудок или с легкой, нежирной нишей
Фортоваза (Saquinavir, SQV-SGC) (Саквинавир) по 6*200мг капсул 3 раза в день Во время еды или через 2 часа после еды
Входные (фузионные) ингибиторы
Фу JCOII (enfuviiiide, Т-20) (Энфувиртид) При весе более 43 кч 2 инъекции в день по 90мг(1мл) в верхнюю половину плеча, бедра или в живот Независимо от приема пиши
* Необходимо иметь в виду, что лекарства, в том числе, Виреад, не излечивают ВИЧ-инфекцию, не
уменьшают передачу ВИЧ, и должны приниматься только в комбинации с другими препаратами,
применяемыми при лечении ВИЧ
559
Литература
1. Диагностика и лечение ВИЧ-инфекции. Методические рекомендации для
врачей МЗРФ, М., 1999. -86 с.
2. Кравченко А.В., Саламов Г.Г, Богословская Е.В. и др. Трехкомпонентная
комбинированная антиретровирусная терапия с применением
ингибиторов обратной транскриптазы ВИЧ // Эпидемиология и
инфекционные болезни.-2001. -№ 4.-С. 32-35.
3. Лечение ВИЧ-инфекции. Методические рекомендации. Медицинская
академия последипломного образования. Канадско-Российский проект
борьбы со СПИД. Авторский коллектив. -СПб, 2000. -169с.
4. Лысенко А.Я., Турьянов М.Х., Лавдовская М.В., Подольский В.М. ВИЧ-
инфекция и СПИД ассоциируемые заболевания.-М. 1996.-С.533.
5. Москвина Е.В. Вторичные заболевания при ВИЧ-инфекции. Канд, дисс.,
2003.
6. Покровский В.В., Ермак Т.Н., Беляева В.В., Юрин О.Г. ВИЧ-инфекция.
Клиника, диагностика, лечения. ГЭОТАР Медицина. -М., 2000. -488 с.
7. Покровский В.В., Юрин О.Г, Беляева В.В. и др. Клиническая диагностика
и лечение ВИЧ-инфекции. Практическое руководство для стедунтов,
врачей-интернов, клинических ординаторов и врачей всех
специальностей.-М., 2001.-92 с.
8. Сизова Н.В. Клинико-лабораторные данные на реальных стадиях ВИЧ-
инфекции с учетом комбинированной терапии. Канд, дисс., 2003.
9. Agauron Pharmaceuticals. Complete prescribing information, Virasept
nelfinavir mesylate (product insert), 1997.
10. AIDS Clinical Care, May 1998, V10, N5, p.33-34.
11. AIDS Clinical Care, May 1998, VI0, N5, p.35-36.
12. AIDS Clinical Care, May 1998, V10,N5, p.36-39.
13. AmFARs AIDS/HIV treatment directory, 1997, Vol.9,№l, p.27.
14. AmFARs AJDS/H1Vtreatment directory, 1997, Vol.9,№l, p.28.
15. Antiretroviral Treatment for Adult HIV Infection in 2002. Updated
Recommendations ofthe International AIDS Society -USA Pannel // JAMA,
July 10, 2002, V. 288, N 2.
16. Arvieux C„ Tattevin P., Souala F.M. et al. Salvage therapy with amprenavir
and ritonavir: prospective study in 17 heavily pretreated patients//HIV clinical
trials. -2002. -Vol. 3. -N 2. -P. 125-132.
17. Bartlett J.G.Antiretroviral therapy in patients with HIV infection. 1996,1999,2002.
560
18. Burchett S.K. et al. Early toxicity experience in combination therapy of advanced
pediatric disease. Abstract 1264,35th ICAAC, San Francisco, 1995.
19. Caar A., Cooper D.A. Adverse effects of antiretroviral therapy // Lancet. -
2000.-Vol. 356.-P. 1423-1430.
20. Cameron В et al. Prolongation of life and prevention of AIDS in advanced
HIV immunodeficiency with ritonavir. Abstract LB6a, 3rd conference on
Retroviruses and Opportunistic Infections, Washington DC, 1996.
21. Cameron D.W., Japour A.J., Xu Y. et al. Ritonavir and saquinavir combination
therapy for the treatment of HIV infection. -AIDS. -1999. -V. 13. -P. 213-
224.
22. Carcelain G., Li T.S., Renaud M et al. Antiretroviral therapy and immune
reconstitution // J.Soc.Biol. -1999. -V. 193. -P. 5-10.
23. Carpenter C.C., Cooper D.A., Fischl M.A. et al. Antiretroviral therapy for
HIV infection in adults // JAMA. -2000. - V. 283. -P. 381 -390.
24. Carr A. HIV protease Inhibitor induced lipodystrophy Syndrome AIDS
reviews. 1999 № 1, p 29-36.
25. Condra JH et al. In vivo emergence of HIV-1 variants resistant to multiple
protease inhibitors. Nature 374:569-71,1995.
26. Cooper D.A., Gatell J.M., Kroon S. et al. Zidovudine in persons with
asymptomatic HI V-infection and CD4+ cells counts greate rthan 400 per cubic
millimetre. New England Journal of Medicine 1993; 329:297-303.
27. Currier J., Halvir D. Complication of HIV disease and therapy // Topics in
HIV Medicine.-2002.-V. 10. -P. 11-17.
28. Danner et al. A shot-termstudy of the safety, pharmacokinetics, and efficacy of
ritonavir, and inhibitor of HI V-l protease.N ENGLJ MED 333:1528-33,1995.
29. Dormont J. et al. A phase 1/11 dose-ranging study ofthe safety and activity of
Ro 31 -8959 (HI V-proteinase inhibitor) in previosly zidovudine (ZDV) treated
HIV-infected individuals. Abstract WS-B26-3, IX Inti Conf AIDS, Berlin,
1993.
30. Dube. Clin.lnfect.Dis. -2000. -Vol. 31. -P. 1216.
31. Englund J. Et al. ACTG 1152: Efficacy and Safety Study Result. 21st AID
Clinical Trials Group Meeting, Washington, 1996.
32. Fischl M.A., Richman D.D., Causey D.M. etal. Prolonged zidovudine therapy
in patients with AIDS and advanced AIDS-related complex. Journal of the
American Medical Association 1989,262:2405-2410.
33. Fischl M.A..et al. A randomized controlled trial of a reduced daily dose of
zidovudine in patients with the ecquired immunodeficiency syndrom. N ENGL
JMED323(15):1009-14,1990.
561
34. Flepp M. A novell and potent once-daily protease inhibitor//ART for Life:
advances in the treatment of HIV disease. 7th European HIV symposium. 1-3
February 2002, Budapest. Abstract book. -P. 33.
35. Gazzard B.The picture of future therapy. Internal. J. ofClinical Practice 1999,
suppl. 103:45-9.
36. Glesby M. Overview of Mitochondrial toxity of Nucleoside Reverse
Transcroptase inhibitors//Topics in HIV Medicine.-2002. -V. 10.-P. 42-46.
37. Glesby M.J., Hoover D.R., Vaamonde C.M. Osteonecrosis in patients infected
with human immunodeficiency virus // J. Infect. Dis. -2001. -V. 184. -P. 519-523.
38. Gruzdev B., Rakhmanova A., Iakovlev A. etal. A randomized, double-blind,
placebo-controlled trial in antiretroviral nanve, HIV-1 infected subjects with
ТМС 125 as 7-Day monotherapy // 811' European conference on clinical aspects
and treatment of HIV infection in Athens, Greece, October 27-31, 2001.
Abstrast237.
39. Guidelines for theUse of Antiretiviural Agents in HIV infected Adults and
Adolescents. -February 4,2002
40. Gulick R.M. et al. Treatment with indinavir, zidovudine, and lamivudine in
adults with human immunodeficiency virus infection and prior antiretroviral
therapy. NEJM 337:734-9, 1997.
41. Hance A.J., Lemiale V, Izopet J. et al. Changes in hunan immunodeficiency
virus type I population after treatment interruption in patients failing
antiretroviral therapy//J. Virol.-2001. -V. 75. -P. 6410-6417.
42. Haubrick R.H. Structured treatment interruptions. Top HIV Med. -2000. V.
8.-P. 9-13.
43. Havlir D.V., Gilbert P.B., Bennet K. et al. Effects oftreatment intensification
with hydroxyurea in HIV-infected patients with virologic suppression //AIDS.
-2001.-V I5.-P. 1379-1388.
44. Hirsch M.S., Brun-Vezinet E, D’Aquila R.T. et al. Antiretroviral drug resistance
testing in adult HIV-1 infection//JAMA. -2000. -V. 283. -P. 2417-2426.
45. Hirsch M.S., Conway B., D’Aquila R.T. et al. Antiretroviral drug resistance
testing in adults with HIV infection//JAMA. -1998. -V. 279. - P. 1984-1991.
46. Hogg R.S. Yip B., Chan K.J. et al. Rates of disease progression by baseline
CB4 cell count and viral load after initiating triple-drug therapy. -JAMA.
200 l.-V. 286.-P. 2568-2577.
47. International AIDS Society-USA Resistance Mutations Project Panel. Update
on Drug Resistance Mutations in HI V-l .Available at: http://www.iasusa.org/
resistance_mutations/revisedmutafigures-l 1.30.01 .pdf. Accessibility verified
June 4,2002.
562
48. Kitchen V.S. et al. Safety and activity of saquvinavir in HI V-infection. Lancet
345:952-55,1995.
49. Klaus Heintz, Armin Traute. Aktiv gegen das Virus. 1997, 77 s.
50. Kopp J.B. et al. Crystalluria and urinary tract abnormalities assotiated with
indinavir. Ann Inten Med 127:119-25, 1997.
51. Lenzo N.P., Garas B.A., French M.A. Hepatic steatosis and lactic acidosis
associated with stavudine treatment in an HIV patient//AIDS.-1997.-V. 11.
-P. 1294-1296.
52. Lori F. Hydroxyurea and HIV //AIDS. -1999.-V. 13.-P. 1433-1442.
53. Lori F., Foli A., Maserati R. etal. Control of HIV during a structures treatment
interruption in chronicallu infected individuals with vigorous T-cell responses
// HI V clinical trials. -2002. -Vol. 3. -N. 2. - P. 115-124.
54. Mary-Krause. 8th CROI, Chicago, 2001. Abstract 657
55. Mellors J et al. Antiretroviral activity of the oral protease inhibitor, MK-639 in
p24 antigenemic, HIV-1 infected patients with < 500 CD4+ ctlls. Abstract
1172,35th ICAAC, San Francisco, 1995.
56. Mellors J.W., Munoz A.M., Giorgi J.V. et al. Plasma viral load and CD4+
lymphocytes as prognostic markers of HIV-1 infection // Ann Intern Med. -
1997.-V. 126.-P. 946-954.
57. Mirochnick M. Etal. safety and pharmacokinetics of nevirapine in HIV-infected
pregnant women and their newborns. Abstract 403, 3rd conference on
Retroviruses and Opportunistic Infections, Washington DC, 1995.
58. MMWR, CDC: Recommendation and Reports. April 24,1998/Vol.47N.RR3.
59. Moreno S. Enhancing proven benefits to patients//ART for Life: advances in
the treatment of HIV disease. 7th European HIV symposium. 1-3 February
2002, Budapest. Abstract book. -P. 29.
60. Moyle. AIDS 2001. Vol. 15.-P. 1503.
61. Murphy R. The toxicity profile ofantiretroviral drugs with a focus on nevirapine
//In: Optimising HIV Treatment - Building on Experience, 15 March 2002.-P. 4.
62. Nelson M. From evolution to revolution // ART for Life: advances in the
treatment of HIV disease. 7th European HIV symposium. 1-3 February 2002.
Budapest. Abstract book. -P. 13.
63. Pluda J.M. et al. Phase I/II study of 3TC (lamivudine) in HIV-positive
asymptomatic or mild AIDS-related complex patients: sustained reduction in
viral markers. AIDS 9:1323,1995.
64. Powderly W.G., Saag M.S., Chapman S. et al. Predictors of optimal virological
response to potent antiretroviral therapy//AIDS. -1999. -V. 13. -P. 1873-
1880.
563
65. Ragni M etal. A phase 1/11 study ofcombination zidovudine and didanosin in
HIV positive asymptomatic patientts. Symposium; The Role ofDidanosine in
the Management of HIV Disease, Paris, 1992.
66. Romeu. 39th ICAAC, 1999, San Francisco. Abstract 1292.
67. Rosenberg E.S., Altfeld M., Poon S.H. et al. Immunecontrol of HIV-1 after
early treatment of acute infection. -Nature. -2000. -V. 407. -P. 523-526.
68. Saag M.S., Powderly W.G., Schambelan M et al. Switching antiretroviral
drugs for treatment of metabolic complications in HIV-1 infection//Top
HIV Med.-2002.-V. 10.-P. 47-51.
69. Schwartz R., Kazanjian P., Slater L. et al. Resistance to tipranavir is
uncommon! in a randomized trial of tipranavir/ritonavir (TPV/RTV) in
multiple Pl-failure patients (BI 1182.2) // 9th Conference on Retroviruses
and opportunistic infections. February 24-28,2002. Seattle, Washington.
562 T.
70. Scrip Magazine, February, 1998, Dr Clare Sansom.
71 .Scrip World Pharmaceutical News, February 18, 1998.
72. Shafer R.W. et al. Combination therapy with zidovudine and didanosine selects
for drug-resistant human immunodeficiency virus type 1 strains with unique
patterns of pol gene mutations. JID 1669:722-9,11994.
73. Spruance S.L. et al. Didanosine compared with continuation of zidovudine in
HIV-infected patients with signs of clinical deterioration while receiving
zidovudine. A randomized, double-blind clinical trial. Ann Intern Med 120:360-
368,1994.
74. St. Clair M. et al. Oral presentation on VX-478. New-York University Medical
Center Forum on Protease Inhibitors, New-York, 1995.
75. Staszewski S., Keiser R, Montaner J. etal. Abacavir-lamivudine-zidovudine
vs indinavir-lamivudine-zidovudine in antiretroviral-naive HIV-infected adults
//JAMA. 2001. -V. 285. -P. 1155-1163.
76. Stern J. Hepatic safety and Viramune // In: Optimising HIV Treatment
Building on Experience, 15 March 2002. ~P. 5.
77. Valk M., Kastelein J., Murphy R. et al. Nevirapine-containing antiretroviral
therapy in HIV-1 infected patients results in an anti-atherogenic lipid profile/
/AIDS. -2001. -Vol. 15 -P. 2407-2414.
78. Van Lunzen J. Keep it strong and make it simple//ART for Life: advances in
the treatment of HIV disease. 7lh European HIV symposium. 1-3 February
2002, Budapest. Abstract book. -P. 23.
79. Wilkin T., Hay M., Hoyan C. Management of Antiretroviral therapy // Topics
in HIV Medicine.-2002.-V. 10.-P. 18-35.
564
80. Volberdin P.A., Lagakos S.W., Koch M.W. et al. Zidovudine in asymptomatic
human immunodeficiency virus infection. A controlled trial in persons with
fewer than 500 CD4-positive cells per cubic millimetre. New England Journal
of Medicine 1990;322:941-949.
81. Yamashita T.E., Phair J.P., Munoz A. et al. Immunologic and virologic response
to highly active antiretroviral therapy in the Multicenter AIDS Cohort Study /
/AIDS.-2001.-V. 15.-P. 735-746.
82. Yeni P.G., Hammer S.M., Carpenter C.CJ. et al. Antiretroviral treatment for
adult HIV infection in 2002 //JAMA. -2002. -Vol. 288. -No. 2. -P. 222-235.
565
Глава 12. ХИМИОПРОФИЛАКТИКА ВИЧ-ИНФЕКЦИИ У
НОВОРОЖДЕННЫХ
12.1. Факторы риска перинатальной передачи ВИЧ-инфекции
Источником при ВИЧ-инфекции у новорожденных являются, как
правило, матери - носители ВИЧ или больные СПИДом. Чаще всего это
родители из групп риска, прежде всего наркоманки или женщины,
имеющие беспорядочные половые связи. Однако, не каждый ребенок,
рожденный инфицированной женщиной, заражен ВИЧ. Риск
вертикальной трансмиссии колеблется от 10 до 40%. В среднем в
промышленно развитых странах врожденная ВИЧ-инфекция
наблюдается у 25% детей, рожденных серопозитивными женщинами, а в
Африке этот показатель составляет около 50% (Working group on Mother
to Infant Transmission of HIV, 1995).
Таблица 79
ВИЧ-инфекция у беременных в РФ и Санкт-Петербурге
Российская Федерация Санкт-Петербург
Годы Обследовано Выявлено 1 Показатель на Показатель на
ВИЧ+ ! 100000 1 обследованных 100000 обследованных
1993 4 868 898 3 I 0,1
1994 1.. 4 148 910 8 1 0,2 1
1995 3 267 045 7 0,2 ! 1
1996 2 848 042 18 1 0,6 J
1997 2 831 597 96 1 3,4 0,9
1998 2 444 006 125 , 5,1 2,0 . . J
1999 2 491 545 298 । 12,0 5,0
1 2000 I 2 566 183 766 ! 29.8 f 92,3
; 2001 I 2 557 799 2431 | 95,1 369,5
I 2002 2 922 008 3353 1 114,7 392,4
Однако следует иметь в виду, что и ВИЧ-серонегативные дети, рожденные
от больных матерей, неполноценны и нуждаются в диспансеризации.
У детей, рожденных ВИЧ-иозитивными женщинами, отмечаются высокие
показатели смертности. Так, в возрасте до 5 лет умирают 25% ВИЧ-позитивных
и 12% ВИЧ-негативных детей, рожденных матерями-вирусоносителышцами
566
или больными, тогда как в контрольной группе от здоровых матерей смертность
детей не превышает 5%. Полагают, что это объясняется снижением врожденного
иммунитета у детей, матери которых больны ВИЧ-инфекцией. Такие дети чаше
болеют различными тяжелыми инфекциями с летальным исходом. Кроме того,
существенную роль играет экономический фактор (тяжелое материальное
положение в семьях с больными СПИДом) и отсутствие у больной матери
возможности обеспечить полноценный уход за ребенком. Среди детей с ВИЧ
инфекцией при перинатальной ВИЧ-трансмиссии от матерей почти у 14%
диагностируется СПИД уже в течение первого года жизни, а у 11 -12% диагноз
СПИДа устанавливается в последующий год жизни.
Согласно содержащимся в документе Европейского центра ВОЗ
критериям постановки диагноза ВИЧ-инфекции у рожденных от ВИЧ-
инфицированных матерей, ребенок до 18 месяцев считается инфицированным,
если у него в двух или нескольких тестах получена культура ВИЧ, положительная
ПЦР или выявлен антиген ВИЧ. Ребенок, рожденный от ВИЧ-инфицированной
матери, считается неинфицированным, если имеются два и больше негативных
исследования на определение ВИЧ-антител в ИФА в возрасте от 6 до 18 месяцев
или один негативный результат старше 18 месяцев и нет других позитивных на
ВИЧ лабораторных тестов, и нет СПИД-индикаторных болезней.
В материалах, содержащихся в одном из последних изданий XX века по
перинатальной ВИЧ-трансмиссии, выделяют:
- раннюю ВИЧ трансмиссию (in utero), если инфекция может быть
определена уже в первые 48 часов жизни ребенка.
- позднюю трансмиссию - в родах (intrapartum) - при отрицательных
результатах исследования на ВИЧ в течение первой недели и обнаружении ВИЧ
в период с 7 по 90-й день жизни при отсутствии грудного вскармливания.
С помощью культурального исследования ВИЧ был найден в крови у 15%
ВИЧ-инфицированных детей в течение 48 часов от момента рождения. Это
показывает что заражение могло произойти еще в матке в процессе развития плода.
От 62% до 85% перинатальной трансмиссии осуществляется в родах
или в раннем неонатальном периоде. Приблизительно 93% ВИЧ-
инфицированных детей имеют маркеры вируса по данным ПЦР в течение 30-
90 дней после рождения (Medscape, HIV/AIDS Clinical Management, vol. 16, http:/
/www.medscape.com).
Передача ВИЧ от матери ребенку возможна в период беременности,
при родах и при грудном вскармливании
Для предотвращения инфицирования ребенка при грудном
вскармливании рекомендуется детей, родившихся от ВИЧ-инфицированной
женщины, не прикладывать к груди и не кормить материнским молоком. При
невозможности вскармливания без материнского молока должна проводится
его пастеризация.
567
Применение химиопрофилактики передачи ВИЧ от зараженной женщины
ее ребенку во время беременности и родов (при отказе от последующего
грудного вскармливания молоком инфицированной женщины) значительно
снижает риск заражения ребенка (с 28-50% до 8%). Такая эффективность при
достаточной безопасности для матери и плода доказана лишь для схем с
применением азидотимидина, которые приводятся в общепринятых
рекомендациях.
Химиопрофилактика перинатального заражения ВИЧ включает в себя:
• Химиопрофилактику в период беременности;
• Химиопрофилактику в период родов;
• Химиопрофилактику для новорожденного.
Наиболее успешные результаты получаются при проведении всех трех
компонентов химиопрофилактики, однако, если какой-либо из компонентов
провести не удаегся (например, вследствие позднего выявления ВИЧ-инфекции
у женщины), это не является основанием для отказа от следующего этапа.
При назначении препарата женщине проводят консультирование, в ходе
которого ее информируют о целях и возможных эффектах применяемого
лечения.
Факторы, которые могут усилить передачу ВИЧ новорожденному
Многочисленными исследованиями установлено значение характера
течения беременности и родов, ВИЧ статус родильницы, грудное вскармливание
(Nielsen et si., 1997; Mayaux М. etal., 1997; Cao Y. Et al., 1997). Суммируя эти
данные, можно представить их последовательно.
В период беременности, до родов:
Высокая виремия:
- начальная ВИЧ-инфекция;
- ухудшение здоровья матери, иммуносупрессия, прогрессирующие
болезни;
- Р24 антигенемия;
- уровень CD4 клеток ниже 200 в мм3.
В период родов:
- роды продолжительные, с разрывом мембран;
- инвазивные вмешательства, повреждающие плод;
- эпизиостомия;
- степень контактов жидкостей материнских и новорожденного.
После родов:
Грудное вскармливание. Оно на 16% увеличивает шансы
прогрессирования уже произошедшей ВИЧ-инфекции и на 26% увеличивает
первичное инфицирование после родов.
Из факторов вируса приоритетная роль принадлежит вирусной нагрузке.
Показано, что при вирусной нагрузке:
568
- менее 1 000 копий РНК ВИЧ/мл частота вертикальной передачи составляет
0/57 родов,
- 1000-10000 копий РНК ВИЧ/мл - 39/183 (21 %),
- 50000 - 100000 копий РНК ВИЧ/мл - 17/54 (31 %),
- более 100000 копий РНК ВИЧ/мл-26/64 (41%).
Как следует из этих данных, основное внимание при назначении
беременной антиретровирусной терапии должно быть уделено степени
репликативной активности ВИЧ и даже при обсуждении вопроса о кесаревом
сечении необходимо, прежде всего, учитывать уровень вирусной нагрузки. Ввиду
этого, в последних рекомендациях Американского Колледжа акушерства и
гинекологии, J.Bartlett (2000-2001), рекомендуется скептически относится к
кесареву сечению, отдавая приоритетное значение антиретровирусной терапии
беременных, которая способна существенно снизить вирусную нагрузку.
Характеристика факторов риска приведена в таблице 80.
Таблица 80
Потенциальные факторы риска перинатальной ВИЧ-1 трансмиссии
Lynne М., Wilfert С., 1999
i Материнские факторы
' Поведенческие факторы во время беременности
I Незащищенный сексуальный контакт во время беременности
| Курение
j Наркомания
| Пшцевые/связанные с ВИЧ
| • Низкий уровень витамина А
Продвинутая стадия заболевания
Иммунологические
Низкий уровень CD4 лимфоцитов
Повышенный уровень CD8 лимфоцитов
I Низкий титр или низкая активность ВИЧ-1 специфических антител
___ Низкий ВИЧ-1 специфический клеточный иммунитет
Вирусологические
Высокая вирусная нагрузка
Вирусный генотип
♦ Избирательная трансмиссия иммуно-ускользающих вирусных мутантов
Вирусный фенотип
♦ Продукция синцития
। ♦ Медленная/низкая репликация
' ♦ Тропизм макрофагов _______________________________________
37. Заказ № К-4451.
569
Плацентарные факторы !
Дифференцировка CD4 рецепторов, представляемых плацентарными j
клетками I
Чувствительность плацентарных клеток к ВИЧ-1 инфекции [
Экспрессия цитокинов плацентарными клетками '
Хориоамнионит I
Сифилис и другие инфекции, передаваемые половым путем I
* Другие причины (курение, кокаин)_____________________________|
Факторы плода |
Незрелая функциональная иммунная компетентность
Чувствительность лимфоцитов плода к ВИЧ-1 инфекции I
Генетические
♦ HLA гаплотип |
♦ Генотип ВИЧ-1 i
Факторы в родах I
Цервиковагинальные/маточные j
Цсрвиковагинальная вирусная нагрузка |
ВИЧ-1 специфический иммунный ответ слизистой ।
♦ ВИЧ-llGG, IgM, секреторный IgA |
♦ Клеточный I
Микро/макро трансфузия крови от матери к плоду I
Акушерские факторы i
Продолжительность разрыва мембраны '
Вид родоразрешения ।
Инвазивные акушерские процедуры/мониторинг плода !
Факторы новорожденного j
Целостность кожи
* Уровень секреции желудочного сока j
ВИЧ-1 специфический иммунный ответ 1
Генетические|
Факторы грудного вскармливания
Ассоциированная с клетками вирусная нагрузка в молоке I
Вирусная нагрузка вне клеток в молоке ।
Время прикладывания, продолжительность кормления '
ВИЧ-1 специфический локальный иммунный ответ (ВИЧ-1 IgG, IgM, |
секреторный IgA)
Неспецифическая защита (лактоферрин) |
Тем не менее, кесарево сечение существенно снижает риск перинатальной
ВИЧ трансмиссии (таблица 81).
570
Таблица 81
Частота перинатальной ВИЧ трансмиссии с учетом приема
АЗТ в течение беременности и характер ролоразрешения
Perinatal HIV Guidelines Working Group,
August 28, 2002
Характер изучения Терапия Частота ВИЧ-трансмиссии
Кесарево сечение Другие способы Коэффи циент
Число % Число %
Исследовательские данные (метаанализ Без АЗТ 58 / 559 10,4 1021 / 5385 19,0 0,49
15 когортных групп) N.Engl. J.Med., 1999; 340; 977-987. АЗТ 4/ 196 2,0 92/ 1255 7,3 0.26
Рандомизированное исследование Без АЗТ 2/51 4,0 16/82 20,0 0,20
Lancet, 1999; 353; 1035-9 АЗТ 7/119 L 1.0 5/117 4,0 0.20
Однако, проведение АЗТтерапии в течение беременности является более
важным профилактическим мероприятием, чем только кесарево сечение.
Безусловно, следует сочетать и химиопрофилактику и кесарево сечение, если
оно проводится надежно, с согласия беременной, предупредив ее об
инфекционных и прочих осложнениях.
Тактика родоразрешения для ВИЧ-инфицированных
• Следует избегать длительного безводного периода, поскольку передача
ВИЧ от матери к ребенку возрастает при безводном периоде более 4 часов;
• Не следует проводить амниотомии, если роды протекают без
осложнений;
• Следует избегать любой процедуры, при которой нарушаются кожные
покровы или повышается возможность контакта плода с кровью матери
(инвазивного мониторинга);
• Не следует проводить эпизиотомию или перинеотомию как рутинную
методику;
• Избегать наложения акушерских щипцов, вакуум-экстракторов;
• Не желательно проводить родовозбуждение и родоусиление;
• Проводить санацию родовых путей на протяжении всего родового акта
(2% раствором хлоргексидина каждые 2 часа);
• Новорожденного желательно вымыть в дезинфицирующем или мыльном
растворе, избегать повреждений кожи и слизистых;
• Кесарево сечение выполнять по акушерским показаниям или в плановом
порядке, взвешивая риски и преимущества для матери и плода.
571
Решение относительно операции кесарева сечения должно приниматься
в индивидуальном порядке с учетом наличия доступных средств лечения,
состояния здоровья матери и прогноза для плода.
При выборе метода ведения родов путем операции кесарева сечения
рекомендуется внутривенное назначение АЗТ беременной заЗ часа до начала
операции и новорожденному АЗТ-сиропа на протяжении первых 6 недель жизни
согласно протоколу 076. Операцию рекомендуется выполнить до начала
родовой деятельности и разрыва плодных оболочек.
Невирапин назначается за 4-8 часов до предполагаемой операции, с
последующим назначением сиропа новорожденному в первые 48-72 часажизни.
В послеоперационном периоде рекомендуется профилактика
инфекционных осложнений (назначение антимикробных препаратов), атакже
тромбоэмболических осложнений.
12.2. Схемы химиопрофилактики перинатальной ВИЧ инфекции
В соответствии с протоколом ACTG 076 (MMWR, 1994,43, RR-1: 1-20)
для профилактики передачи ВИЧ противовирусная терапия назначается:
До родов: орально АЗТ 300 мг2 раза или 100 мгх 5 раз, начиная с 14-34
недель беременности на протяжении всего ее периода, продолжая вплоть до
родов;
В период родов: в период родов АЗТ назначается внутривенно в дозе 2
мг/кг веса в первый час, инфузия продолжается в дозе 1 мг/кг веса тела в час
вплоть до родов;
Новорожденному: новорожденному показано оральное назначение АЗТ в
сиропе 2 мгнакг веса каждые 6 часов в течение первых 6 недель жизни, начиная
с 8 -12 часов после рождения. Если ребенок не можег принимать препарат орально,
АЗТ вводится внутривенно 1,5 мг/кг веса зела каждые 6 часов.
Контролируемыми исследованиями установлено, что из 184 детей в группе
беременных с ВИЧ-инфекцией на плацебо зараженными ВИЧ оказалось 25,5%.
в то время как из 180 детей, рожденных от ВИЧ-позитивных матерей,
получавших АЗТ, оказалось 8,3%. Это различие в высокой степени статистически
достоверно. Токсичность АЗТ при этом оказалась минимальной.
Таким образом, изучение азидотимидина (син. ретровира, зидовудина)
для профилактики перинатальной ВИЧ трансмиссии по протоколу 076
показали высокую эффективностьтакого метода при назначении препарата
беременным и их новорожденным при условии отказа от грудного
вскармливания.
В более поздних рекомендациях CDC MMWR, 1998 (RR-3)
предусматривают прием беременными стандартной антиретровирусной
терапии, рекомендуемой взрослым.
572
Сравнение результатов этого исследования с другим (HI V NET 012),
в котором участвовало 626 женщин, инфицированных ВИЧ 1 в госпитале
Уганды, показало эффективность и экономическую целесообразность
использования невирапина беременным в период родов и новорожденным.
В рандомизированном протоколе 626 беременных получали 200 мг
невирапина перорально в начале родов, и сладкую суспензию 2 мг/кг -
новорожденные в течение 72 часов от рождения. В контрольной группе
зидовудин (АЗТ) - 600 мг перорально беременным назначали в начале
родов и 300 мг каждые 3 часа до родов, а новорожденным 4 мг/кг орально
2 раза в день в течение 7 дней после родов. Дети исследовались на ВИЧ
при рождении, спустя 6-8 недель и 14-16 недель в ПЦР для выявления РНК
ВИЧ-1. Почти все дети (98,8%) были на грудном вскармливании, а 95%
продолжили его до 14-16 недель. Оценочный риск инфицирования
новорожденных в группе зидовудина и невирапина был 10,4% и 8,2% при
рождении, 21,3% и 11,9% к 6-8 неделям и 25,1 % и 13,1% к 14-16 неделям.
По мере увеличения возраста младенцев эффективность невирапина в
сравнении с зидовудином нарастала и составила 47% к возрасту 14-16
недель. Оба режима химиопрофилактики хорошо переносились, и
побочных эффектов отмечено не было. Таким образом, снижение риска
ВИЧ-трансмиссии в течение первых 14-16 недель отмечено у большинства
женщин, получавших невирапин и продолжающих грудное вскармливание.
Простой и дешевый режим снижения вертикальной трансмиссии ВИЧ 1
для развивающихся стран является приоритетным (Marseille Е. et al., 1999).
Укорочение режима приема зидовудина беременными женщинами
до нескольких недель до родов и в течение родов также уменьшало частоту
вертикальной трансмиссии ВИЧ-1 на 37-38% у вскармливающих грудью
женщин и на 50% у невскармливающих (Shaffner N. et al., 1998).
Исследование PETRA, проведенное группой исследователей (Saba
J., 1999), в котором беременные получали антепартум, интрапартум и
постпартум зидовудин и ламивудин, а сравниваемая группа - плацебо,
показало 50% эффективность к 6 неделе исследования новорожденных.
Сравнительное изучение стоимости различных вариантов
химиопрофилактики вертикальной ВИЧ-трансмиссии (Guay et al., 1999;
Luzuriaga К et al., 1997; Krogstad P. et al., 1999) выявило, что наибольшую
эффективность и наименьшую стоимость имеет HI VNET012 (таблицы 82,83).
Наличие возможности проведения полного курса зидовудина согласно
протоколу 076, рекомендованного для США, стран Европы (MMWR, 1998) и
других развитых стран, не противоречит использованию невирапина. Дешевизна
(около 4 долларов США), эффективность профилактики вертикальной
трансмиссии невирапином должны служить основанием для широкого
внедрения этой схемы в практику.
573
Таблица 82
Стоимость предупреждения вертикальной
ВИЧ-трансмиссии в Южной Африке (Mark Mascolini, 1999)
Протокол Способ введения Стоимость в местной валюте
ACTY 076 Длительный курс АЗТ (зидовудина) 1562
'аиландская схема Короткий курс АЗТ 562
Petra Короткий курс АЗТ/ЗТС (ламивудина) 400
Petra Длительный курс АЗТ/ЗТС 1850
HIV NET 012 Nevirapine 200 мг однократно беременной в родах, новорож- денному в течение 72 час. 2 мг/кг 35
Таблица 83
Сопоставление эффективности 2 режимов профилактики ВИЧ-
трансмиссии в схеме ШУ NET 012 (Mark Mascolini 1999)
Последовательность АЗТ 600 мг в родах, затем 300 мг каждые Зч. матери 4 мг/кг 7 дней новорожденному (п=302) Nevirapine (200 мг в одной дозе в родах матери, 2 мг/кг в одной дозе в течение 72 часов от рождения новорожденному(п=307) Р
3 день 10.4% 8,2% . NS
6-8 день 21.3% 11.9% 0.0027 J
14 - - 16 день 25,1% 13.1% 0.006
На седьмой Европейской конференции по клиническим аспектам и
лечению ВИЧ-инфекции (сентябрь 1999 года) было показано, что использование
ингибитора протеазы фортовазы (саквинавира) в комбинации с азидотимидином
и ламивудином является наиболее эффективным в профилактике вертикальной
ВИЧ-трансмиссии.
Исследование, проведенное в Таиланде и Великобритании, показало, что
терапия фортовазой, азидотимидином и ламивудином, начиная со срока
беременности 14 недель, до родов, а у новорожденных монотерапия 6 недель
азидотимидином дали хороший эффект по переносимости препаратов.
Нарушений в развитии плода не отмечено, а вес при рождении и последующее
развитие новорожденных расценивались как нормальные. Уровень вирусной
нагрузки за весь период исследования у женщин был ниже 400 копий РНК ВИЧ/
мл. Ни у одного из 13 младенцев, проверенных в ПЦР, данных за ВИЧ
574
получено не было. Тем не менее, стоимость этой терапии будет превышать
стоимость химиопрофилактики невирапином.
В рекомендациях, подготовленных Российским научно-методическим
центром по профилактике и борьбе со СПИДом, рекомендованы три режима
химиопрофилактики перинатального заражения: в период беременности, родов
и для новорожденного с использованием отечественного азидотимидина. Во
время родов одним из вариантов химиопрофилактики рекомендован невирапин
200 мг однократно при начале родовой деятельности.
Преимущества химиопрофилактики вертикальной ВИЧ трансмиссии в
виде 2-х этапного режима невирапином в период родов и новорожденным после
родов заключаются не только в стоимости, но и в возможности более широкого
использования этой схемы. Известно, что беременные могут уклоняться от
обследования на ВИЧ до родов, что затрудняет назначение химиопрофилактики
с 14 недель. В условиях нашей страны ВИЧ-инфицированные наркозависимые,
как правило, обращаются за медицинской помощью перед родами
непосредственно, что делает для них профилактику невирапином наиболее
подходящей. Использование сладкой суспензии невирапина и новорожденным
обосновывает применение схемы HIV NET 012 достаточно широко.
Таблица 84
Конечный период полужизни невирапина у детей при
длительном назначении препарата* (Dransfield et al., 1998)
Возраст Конечный период полужизни п
2 мес. - 1 год 32
1 - 4 года 21
4-8 лет 18
> 8 лет 28
’Суспензия во флаконе 240 мл для приема внутрь, концентрация невирапина 10
мг/мл
Учитывая фармакокинетику невирапина - быстрое всасывание из
желудочно-кишечного тракта и длительное сохранение достаточно высоких
концентраций в крови и тканях беременной - родильницы - новорожденного
(таблица 84), рекомендуется назначение его всем беременным, которые не
получили своевременную химиопрофилактику ВИЧ трансмиссии. Это, в первую
очередь, относится к женщинам из групп риска - наркоманкам, поступающим
в больницу в период уже начинающихся родов. Ввиду этого, целесообразно
организационно решать этот вопрос. По опыту скандинавских стран
целесообразно сочетать протокол 076 и HI V Net, то есть проводить длительную
химиопрофилактику адотимидином и эпивиром, а в период родов
дополнительно назначать невирапин. Это особенно важно для беременных с
«продвинутой» ВИЧ инфекцией, высоким уровнем вирусной нагрузки.
575
Продолжающееся исследование HIVNET 023, проводимое в Южной
Африке и Зимбабве, изучает роль невирапина в профилактике передачи ВИЧ-1
через грудное молоко. Матери и дети получают режим невирапина HIVNET
012 во время родов и коротко после родов. Дополнительно дети будут получать
невирапин на протяжении 6 месяцев после рождения один раз в неделю, либо
дважды в неделю, либо ежедневно. Через 6 месяцев женщинам будет
предложено прекратить кормление грудью (Boeringer Ingelheim, 2001).
При изложении вопросов профилактики ВИЧ-инфекции у новорожденных
весьма важными являются мультидисциплинарные подходы к обучению
медицинского персонала и социальных работников, обеспечивающих
предтестовое и послетестовое консультирование (до и после обследования на
ВИЧ-антитела, скрининг в ИФА и, возможно, в иммуноблоте и ПЦР), а также
для проведения необходимых анамнестических, клинических и лабораторных
исследований. Важными являются проблемы консультирования и помощи в
целом семье.
В последующие годы режим профилактики перинатальной ВИЧ
трансмиссии упростили, предложив разные дозы и варианты в целях облегчения
реализации применения в практике (таблица 85).
Таблица 85
Дозы и время перорального режима профилактики ВИЧ
трансмиссии от матери к новорожденному
AIDS, 2002, 16: 1991-1999
Протокол Лекарство До родов с 36 недели В родах После родов матери 1 неделю 11осле родов младенцу 1 1.тацебо
] - - 2 3 4 5 6 7
Petro-Ci АЗТ 300 мг2 р 300 Ml- каждые 3 часа 0 0 да
Ditrame 250-300 мг 2 раза 500-600 мг 250-300 мг 2 раза в день 0 Да
HJV/NET 012 АЗТ 0 600 .мг и 300 мг каждые 3 ч (первая доза - нагрузка) 0 4 мг/кг каждые 12 часов Пезавер uieHbi
HIV М Т 012 Невирапин 0 200 мг 0 2 мг/кг первые 72 часа незавер шены
576
1 2 3 4 5 6 7 |
Petra' Л RMA АЗТ 300 мг 2 р 300 мг каждые 3 ч 300 мг 2 р 4 мг/кг каждые 12 ч ла !
З ТС (ла- мивудин) 150 мг 2 р 150 мг2 р 150 мг 2 р 2 мг/кг каждые 12 ч да
ARMB АЗТ 0 600 мг и 300 мг каждые 3 часа 300 мг 2 р 4 mi7кг каждые 12 ч да
ЗТС 0 150 мг 2 р 150 мг 2 р 2 мг/кг каждые 12ч да
ARM В АЗТ 0 600 мги 300 мг каждые 3 часа 0 0 ла
ЗТС 0 150 мг 2 р 0 0 да
Saint АЗТ 0 300 мг каждые 3 ч 300 мг 2 р 2 мг 2 р нет
ЗТС 0 150 мг 2 р 150 мг 2 р А Т 6 мг 2 р нет
Saint Невирапин 0 200 мг 200 мг в пределах 24- 48 ч) 6 мг (к 24-48 ч) нет .... J
Вместе с тем, в связи с наличием в Африке нс только большого
количества ВИЧ инфицированных беременных, но сложностей отказа от
грудного вскармливания, схемы химиопрофилактики и их
эффективность оцениваются с учетом возможности его использования.
Таблица 86
Частота ВИЧ трансмиссии (%) при различных протоколах
химиопрофилактики и грудного вскармливания
AIDS.-2002,-V. 16.-В. 1991-1999
1) к 3 месяцу и более 3 месяцев____2) к 6 месяцу жизни
Зап. Африка в целом, АЗТ Кения, искусственное вскармливание
111V \| 1 012 (невирапин) 1) -12% 2) -16% 1) -15% 2) -24% 1) -10-12% 2) -20%
Зап. Африка плацебо Кения, грудное вскармливание
HIV'NET (АЗТ) 1) -21% 2) -25% 1) -25% 2) -30% 1) -20-24% 2) -36%
577
Наиболее целесообразно использовать безопасный и эффективный
режим, подавляющий вирусную нагрузку, когда в предродовый период
используется высокоактивная антиретровирусная терапия (ВААРТ).
Таблица 87
Альтернативные подходы к перинатальной ВИЧ трансмиссии
Протоколы Страны Режимы
С DC риск ВИЧ трансмиссии снижается с 18,9 до 9,4% (плацебо) Таиланд АЗТ короткий курс (300 мг 2 раза с 36-й недели беременности, 300 мг каждые 3 часа после начала родов и до их завершения
Ditramc Кот де Вуар Буркина Фасо АЗТ короткий курс 300 мг 2 раза с 36-38 нед. беременности 500-600 мг при начале родов и 300 мг 2 раза 7 дней после родов
PHP (perinatal HIV prevention trail) соответствует протоколу 076 или начинается с 35 недели беременности Таиланд АЗТ длительный или короткий курс
Petra Южная Африка Танзания, Уганда АЗТ, ЗТС (эпивир) 1—
BMS094 Южная Африка зерит (d4T), ddl (видекс), d4T+ddI или АЗТ короткий курс
Исследованиями Н.В.Дстковой, выполненными под руководством
В.В.Покровского, была показана перспективность трехэтапной
химиопрофилактики с назначением азидотимидина (тимазина или
фосфазида) беременным, невирапина 200 мг матери в начале родовой
деятельности и после родов ребенку в течение 3-х дней по 2 мг/кг/сутки.
578
Схемы профилактики вертикальной передачи ВИЧ
женщине в родах и младенцу
(Федеральный Центр профилактики и борьбы со СПИД)
Основная схема
Схема 1. Азидотимидин (ретровир) в форме раствора для
внутривенного введения. Препарат назначается с началом родовой
деятельности до момента отделения ребенка от матери (пересечения
пуповины). В течение первого часа родов он вводится из расчета 0,002 г/кг
веса пациентки, а затем доза снижается до 0,001 г/кг в час.
Схема 2. Невирапин (вирамун) - таблетка 200 мг однократно с началом
родовой деятельности. Если роды продолжаются более 12 часов, необходимо
повторить прием препарата в той же дозировке. Если пациентка получала в
период беременности азидотимидин, его прием во время родов продолжается
по прежней схеме совместно с невирапином.
Резервные схемы.
Схема 3. Лзидотимидин (ретровир) перорально-300 мгс началом родовой
деятельности, затем по 400 м г каждые 4 часа до момента отделения ребенка от
матери (пересечения пуповины). Если в период беременности больная получала
азидотимидин, его следует отменить.
Химиопрофилактика ВИЧ-инфекции у новорожденного
Схема 1. Азидотимидин-сироп перорально 2 мг/кг веса ребенка каждые
6 часов в течение 6 недель. Еженедельно доза препарата пересчитывается в
зависимости от веса ребенка.
Схема 2. Невирапин-суспензия перорально по 2 мг/кг веса ребенка 1 раз
в день в течение 3 дней с интервалом в 24 часа.
12.3. Антиретровирусная терапии беременных женщин
(Recommendations 28.11.2002)
APT для беременных такая же, как и для небеременных женщин. Режим
трехкомпонентной терапии АЗТ беременным с 14 недели беременности,
продолжающийся всю беременность, внутривенное введение АЗТ в родах
и 6-недельный прием новорожденным уменьшает риск перинатальной
трансмиссии.
В рекомендациях для уменьшения перинатальной ВИЧ трансмиссии,
подготовленных группой экспертов под редакцией Lynne Mofenson
579
(28.11.2002, http://www.ede.gov/mmwr/preview/mmmwrhtml/rr5118al.htm)
приводятся схемы лечения беременных женщин и различные способы
профилактики перинатальной ВИЧ трансмиссии. Необходим индивидуальный
подход к каждой беременной женщине. Эксперты учитывают при этом уровень
CD4 лимфоцитов, вирусную нагрузку до началатерапии. В то же время, общие
принципы лечения взрослы,х с ВИЧ инфекцией с учетом вирусной нагрузки и
клинических проявлений заболевания, приведенные в предыдущей главе,
являются обязательными для беременных.
Вместе с тем, целесообразно максимально отсрочить начало
комбинированной терапии для того, чтобы предупредить появление
резистентных штаммов. Лечение в течение беременности является крайне
сложным из-за недостатка наших знаний фармакокинетики и побочных
эффектов большинства антиретровирусных агентов. Метаболизм лекарств и
характер их распространения в организме в период беременное™, концентрация
их в плаценте, в плоде и фармакокинетика во всех этих субстратах является
крайне сложной и неизученной. Имеется лишь информация относительно
влияния на плод и беременности азидотимидина, ламивудина, диданозина и
невирапина, изучена их фармакокинетика у плода. Но о других препаратах, и
в частности ингибиторах протеазы сведений недостаточно. Недостаточно
изучено влияние антиретровирусных препаратов на функции плаценты и
рост плода, неизвестно, как они влияют на характер течения родов и
сохранение различных систем организма у новорожденного от ВИЧ
позитивной матери, которая получала ант иретровирусную терапию. Ввиду
этого, назначение прот ивовирусных препаратов беременным должно быть
продумано и оценено в каждом конкретном случае. Особенно важно хорошо
обследовать беременную до назначения или в процессе использования
антиретровирусных препаратов, особенно ингибиторов протеазы, которые
могут вызывать гипергликемию, оказывающую неблагоприятное воздействие
на беременность и на плод, вплоть до его гибели. Поэтому необходим
тщательный контроль за содержанием сахара в крови и глюкозурии.
Необходимо также знать полный биохимический профиль каждой
беременной и регулярно проводить ультразвуковое исследование плода в
третьем триместре беременност и и повторно с интервалами в 4-6 недель.
При этом следует учитывать рост плода и объем амниотической жидкос ти
(Tuomala R., 1999).
Антиретровирусные препараты. назначаемые беременным.
Ан ал ог и пука еошдов
- Азидотимидин (ретровир, зидовудин) 300 мг2 раза или 100 мг 5
раз в день до родов, 2 мг/кг/час в период родов, затем 1 мг/кг/час.
Новорожденным 2 мг/кг каждые 6 часов в течение 6 недель (MMWR,
1995,44).
580
- ЗТС (ламивудин, эпивир), категория В, 150 мг 2 раза
- ddl (диданозин, видекс) в общепринятых дозах (200 мг/сутки) в
категорию В (CDC классификация), не рекомендуется назначать
беременным совместно с зеритом.
- Лбакавир (зиаген) 300 мг 2 раза в день, категория С.
Ингибиторы протеазы
- Лмпрснавир (агенераза) 1200 мг 2 раза в сутки, категория С
Ненук/еозидные ингибиторы обратной транскриптазы
- Невирапин (вирамун) 200 мг 2 раза, категория С
- Эфавиренц (сустива) 600 мг однократно, беременным не
рекомендуется.
Следовательно, беременные с категорией В и С и высокой
вирусной нагрузкой после 14 недели беременности могут и/или должны
получать антиретровирусную терапию.
Таблица 88
Выбор антиретровирусных препаратов для лечения беременных
женщин
Степень риска Влияние препаратов на беременность
антиретровирусных
препаратов
А Адекватные и контролируемые исследования
беременных не выявили риска для плода в.
течение первого триместра (отсутствуют данные
о существовании риска в последующих •
триместрах).
В Исследования на животных не выявили риска для i
плода; исследований на людях не проводили.
С Безопасность препарата для человека не i
подтверждена; исследования на животных не •
проводились или выявили риск применения 1
препарата. Лекарство не следует назначать
беременным, пока не будет доказано
преимущество его эффективности по побочным ;
действиям. !
D Имеется свидетельство о негативном влиянии j
препарата на плод на основе проведения 1
исследований. Однако, польза от применения:
данного препарата для беременных допускает его
применение, несмотря на потенциальный риск.
581
Таблица 89
Классификация антиретровирусных препаратов по степеням
риска для беременных
Препарат __Категория риска
Ритонавир (норвир), калетра В
Нелфинавир (вирасепт) В
ddl (видекс) В
Саквинавир (инвираза, фортоваза) В
d4T (зерит) С
Индинавир (криксиван) С
АЗТ (ретровир) С
Невирапин (вирамун) С
ddC (хивид) С
ЗТС С
При проведении химиопрофилактики перинатальной ВИЧ
трансмиссии следует учитывать состояние беременной, ВИЧ статус и
терапию в соответствии с ним (таблица 91).
Рекомендации последних лет (1999-2001) для беременных с ВИЧ-
инфекцией считают оправданным комплекс следующих мероприятий:
- Беременных женщин следует обеспечить такими антиретровирусными
препаратами, как АЗТ (ретровир, зидовудин), ddl (видекс), ddC (хивид), эпивир
(ламивудин), d4T (зерит), невирапин (вирамун), ритонавир (норвир),
ампренавир, саквинавир (инвираза, фортоваза) или индинавир (криксиван).
Однако с учетом беременности эти препараты назначаются при строго
контролируемом наблюдении и тщательном обследовании.
- целесообразно на 38 неделе предлагать кесарево сечение. Однако, при
низкой вирусной нагрузке (ниже 1 000 Pl 1К ВИЧ/мл) нужно оценить риск для
беременной оперативного вмешательства;
- Беременные, которые получают антиретровирусную терапию, при
проведении кесарева сечения должны дополнительно получить АЗТ
внутривенно за 3 часа перед операцией.
- Если назначение АЗТ по протоколу 076 до родов, в период родов и
после родов обеспечено, то кесарево сечение необязательно.
Таким образом, основная роль в снижении частоты вертикальной
перинатальной ВИЧ трансмиссии принадлежит антиретровирусной терапии,
купирующей активность вируса.
В рекомендациях по снижению риска перинатальной ВИЧ трансмиссии,
подготовленных Центром по исследованию материнства и детства
национального института здоровья детей и национального института
582
Таблица 90
Доклинические и клинические данные, относящиеся к применению антиретровирусных препаратов у
беременных
Антиретровирусные препараты Категория беременности* Плацентарная передача (соотношения лекарства у ребенка.матери) Долговременное исследование канцерогенности у животных Тератогенность у грызунов
1 2 3 4 5
Зидовудин** С Да (человек) 0,85 4- (грызуны, вагинальные опухоли) + (близко к летальной лозе)
Зальцитабин С Да (макаки) 0,30-0,50 (грызуны, Т-лимфомы) + гидроцефалия на высоких дозах
Диданозин в Да (человек) 0,5 Отр. отсутствие опухолей, длительное обследование на грызунах Отр.
Ставудин с Да (макаки) 0.76 Не завершено Отр. (но понижает содержание кальция в костях)
Ламивудин с Да (человек) -1,0 Отр. отсутствие опухолей, длительное исследование на грызунах Отр.
Абакавир с Да (крысы) Не завершено анасарка и скелетные деформации при дозе 1000 мг^кг (х35 в приложении к человеку) во время органогенеза
Саквинавир в Неизвестно Не завершено Отр.
Индинавир С Да. «Значительная» у крыс, низкая у кроликов Не завершено Отр. ' но дополнительные ребра у крыс
Ритонавир В Да (крысы) Не завершено Отр.
1 2 3 i 4 5
Нельфштавир Лмпренавир в_ с Неизвестно Неизвестно Нс завершено Не завершено — Отр. , удлинение тимуса. | незавершенная оссификания костей: низкий вес тела
Невирапин с Да (человек) -1.0 Не завершено Отр.
Делавирдин с Да (крысы) Не завершено Деф е кт м ежжел у доч ко во й перегородки ;
Эфавиренц с Да (обезьяны, крысы, кролики) - 1.0 Не завершено Анэнцефалия; анофтальмия; j микрофтальмия (обезьяны) ;
* Категории беременности:
Л - адекватное и хорошо контролируемое исследование беременной женщины не выявляет риска для плода во время первого
триместра беременности (и нет доказательств существования риска в следующие триместры);
В - репродуктивное исследование животных не выявляет риска для плода, но хорошо контролируемое исследование беременной не
может быть проведено;
С - Безопасность для беременности у человека не определялась, исследования на животных были либо положительны по фетальному
риску или не проводились, лекарства не могут быть применены, если только потенциальные преимущества не перевешивают
потенциальный риск для плода;
[) - Наличие риска для плода у человека основано на данных побочных реакций, полученных при исследовательских экспериментах,
но с учетом потенциальных успехов от применения препарата у беременных они могут быть допущены к использованию, несмотря на
их потенциальный риск.
X - Исследования у животных или доложенные побочные реакции показывают, что риск, связанный с применением препаратов у
беременных женщин, определенно перевешивает возможные успехи.
** Несмотря на недавние данные, полученные у животных, показывают потенциальную тератогенность зидовудина, котла доза,
близкая к легальной, дается беременным гры зупам. значительные данные у человека, имеющиеся к настоящему времени, показывают,
чго риск для плода очень мал. котла дается беременным женщинам позже 14 недели гестации. Отдаленные исходы у 734
новорожденных от ВИЧ-инфицированных матерей на протяжении до 6 летнего возраста не показывают какого-либо развития опухоли.
Однако, нет досзлатных данных о более поздних эффектах на протяжении более длительного срока наблюдения.
здоровья США от 28 августа 2002 года отмечается необходимость
использования более агрессивного режима, чем ранее, для
полного подавления вирусной репликации. Стандартный подход к лечению
беременных с ВИЧ инфекцией следует рекомендовать, инкорпорируя АЗТ
химиопрофилактику. Для более четкого учета обеспечения химиотерапии и
химиопрофилактики ВИЧ-инфекции у беременных и новорожденных
предлагается создавать регистр-«Antiretroviral Pregnancy Registry».
Рекомендации по уменьшению риска перинатальной ВИЧ трансмиссии.
1. ВИЧ инфицированная беременная, которая не получала
антиретровирусную терапию (APT)
• Обследование и при показаниях назначение терапии,
• Трехкомпонентный режим АЗТ химиопрофилактики должен быть
предложен всем беременным женщинам?
• Беременные, у которых есть клинические симптомы, иммунологические и
вирусологические показания, АЗТ назначается в комбинации с другими препаратами,
в особенности если вирусная нагрузка выше 1 000 копий РНК ВИЧ/мл,
Таблица 91
Противоретровирусная терапия у беременных (Bartlett J., 2001)
Клиническая стадия, наличие(+)или отсутствие (-) проявлений вторичных заболеваний CD4 (109/л) РНК ВИЧ (в мл) 11ротиворетровирусная терапия
1 2 3 4
2А >60000 Проводится
<60000 Неизвестно Не проводится Проводится
2Б, В U 0,2 >60000 Проводится
<60000 Не проводится*
Неизвестно Не проводится
<0.2 Проводится
Неизвестно >60000 <60000 " Неизвестно Проводится _ Не проводится* Не проводится*
(-) U 0,2 >60000 <60000 Неизвестно Проводится Не проводится* Не проводится*
<0,2 Проводится
38. Заказ Ке К-4451.
585
1 2 3 4
ЗА Неизвестно >60000 Проводится
<60000 Неизвестно Не проводится* Не проводится*
(+) НО,2 >60000 <60000 Неизвестно Проводится Не проводится* Проводится
<0,2 Проводится
Неизвестно >60000 <60000 Неизвестно Проводится Не проводится* Проводится
(-) >0,2 >60000 <60000 Проводится Не проводится*
Неизвестно Не проводится*
<0,2 Проводится
>60000 <60000 Неизвестно Проводится Не проводится* Не проводится*
ЗБ Неизвестно
н >0.3 >20000 <20000 Неизвестно Проводится Не проводится* _ Проводится
<0,3 Проводится
Неизвестно Проводится
ЗВ (-) >0,2 >20000 <20000 Неизвестно Проводится Не проводится* Не проводится*
<0,2 Проводится
Неизвестно >20000 __ <20000 Неизвестно Проводится Не проводится* Не проводится*
(+) Проводится
2А Независимо Неизвестно <60000 "" 2 >60000 Проводится Не проводится Проводится
2Б.В Независимо Неизвестно <60000 >60000 Не проводится* Не проводится* Проводится
ЗА Независимо Неизвестно <60000 _ >60000 Неизвестно Не проводится* Не проводится* Проводится Не проводится*
586
_ 1 ЗБ 2 ъ Независимо 4 <60000 >60000 5 Не проводится* Проводится
(+) >0,3 Неизвестно <60000 >60000 Проводится Не проводится* Проводится
<0,3 Независимо Проводится
Неизвестно Независимо Проводится
ЗВ (-) Неизвестно <60000 Не проводится* Не проводится*
>60000 Проводится
Проводится
* Примечание: До 14 недели беременности не проводится, позже вопрос о назначе-
нии лечения решается повторно
• Целесообразно первые 14 недель беременности воздержаться от APT.
2. ВИЧ позитивная женщина в текущей беременности получала APT
• Продолжить терапию после 14 недель, АЗТ должен являться
компонентом комбинированной терапии,
• Необходимо контролировать формирование резистентности и при ее
развитии отменять лекарства,
• Назначение АЗТ рекомендуется новорожденным.
3. ВИЧ инфицированная в родах, которая не получала APT до родов.
• Могут быть рекомендованы несколько эффективных режимов,
• Одна доза невирапина в начале родов и одна доза невирапина младенцу
в первые 48 часов жизни,
• Орально АЗТ и ламивудин (ЗТС) в родах и затем в течение 1 недели и
для новорожденного также,
• Внутривенное введение АЗТ в родах и 6 недель новорожденному,
• 2 дозы невирапина с внутривенным введением АЗТ и 6 недель АЗТ
новорожденному.
• После родов следует определить вирусную нагрузку и CD4 Т-
лимфоциты.
4. Младенец, рожденный ВИЧ позитивной женщиной, не леченной APT
• 6-ти недельная АЗТ профилактика как можно раньше, лучше в первые
6-12 часов после рождения,
• ранняя диагностика ВИЧ инфекции.
В связи с тем, что женщина в детородном возрасте с ВИЧ инфекцией
38*
587
может не знать о беременности в первом триместре и получать ВААРТ,
рекомендуется:
- выбирать метод контрацепции, чтобы уменьшить риск непланируемой
беременности,
- обучение и консультация о перинатальной ВИЧ инфекции,
- модификация терапии с целью уменьшить ее тератогенность (избегать
эфавиренц, гидроксиурею),
- выбирать лекарства, предупреждающие риск перинатальной ВИЧ
трансмиссии,
- проводить профилактику оппортунистических инфекций, вакцинацию
против гриппа, гепатита В,
- улучшить питание,
- проводить диагностику инфекций, имеющих риск перинатальной
передачи.
Женщине в детородном возрасте должно быть оказано первостепенное
внимание, планируя ее семью, поддерживая психологически и социально.
Рекомендации, связанные с резистентностью к антиретровирусным
препаратам и тестированию беременных женщин на резистентность
• Всем беременным женщинам должна предлагаться высокоактивная
антиретровирусная терапия, чтобы максимально супрессировать вирусную
репликацию, уменьшить риск перинатальной трансмиссии и минимизировать
риск развития вирусной резистентности.
•Женщинам, которым комбинированная противовирусная терапия
не обязательна (РНК ВИЧ < 1 000 копий/мл) и которые хотят ограничить
применение антиретровирусных препаратов во время беременности,
должна предлагаться монотерапия в режиме трехкомпонентной
профилактики зидовудином (или, в исключительных обстоятельствах, два
нуклеозида). В такой ситуации развитие резистентности должно быть
минимизировано ограниченной вирусной репликацией (предполагая, что
уровень РНК ВИЧ остается низким) и ограниченным временем применения
зидовудина. Монотерапия зидовудином не подавляет репликацию ВИЧ до
неопределяемого уровня в большинстве случаев и имеется теоретическое
предположение, что такая терапия может быть выбрана для зидовудин
резистентных вирусных вариантов, потенциально ограничивая будущие
позиции терапии; эти вопросы должны обсуждаться у беременных женщин.
• Рекомендации по тестированию на резистентность беременных ВИЧ-
инфицированных женщин такие же, как для небеременных пациентов:
острая ВИЧ инфекция, вирусологическая неудача или недостаточное
подавление вируса после начала антиретровирусной терапии, или высокая
588
вероятность наличия резистентного вируса, основанная на преобладании
в популяции или характеристике источника.
•Женщины, которые имеют анамнез предполагаемой или
документированной резистентности к зидовудину.
589
Приложение 1
Информированное согласие на проведение химиопрофилактики передачи
ВИЧ от матери ребенку во время беременности и родов
Я, _______________________________________________________
(Фамилия, имя, отчество полностью)
19___года рождения, настоящим подтверждаю свое добровольное
согласие на прием лекарственных препаратов, направленных на предотвращение
заражения моего будущего ребенка вирусом иммунодефицита человека.
Я подтверждаю, что мне разъяснено, почему проведение данной
профилактики необходимо, разъяснено действие назначаемых мне и моему
будущему ребенку препара-тов, что я получила информационный листок для
больного и ознакомилась с ним.
Я осознаю:
• Что по состоянию моего здоровья лечение по поводу ВИЧ-инфекции
мне в на-стоящее время не нужно, и что назначаемые мне препараты необходимы
ис-ключительно для предотвращения заражения моего ребенка вирусом
иммуно-дефицита человека (ВИЧ) во время беременности и родов.
• Что назначенные мне препараты должны подавлять репликацию
(размножение) вируса в моем организме и предотвратить его проникновение в
организм моего будущего ребенка.
• Что даже при абсолютном соблюдении мною всех правил приема
препаратов полной гарантии предотвращения заражения моего будущего
ребенка нет. Риск, что он родится зараженным, составляет в таком случае 8%,
однако, если назначенная мне химиопрофилактика не будет проводиться, или
будет прово-диться с нарушениями, этот риск возрастет до 30%.
• Что назначенная мне химиопрофилактика может в любой момент быть
прекра-щена по моему желанию.
• Что, если вследствие проведения химиопрофилактики возникнет угроза
моему здоровью, я буду проинформирована об этом для принятия решения о
целесообразности дальнейшего ее проведения.
• Что, если вследствие проведения химиопрофилактики возникнет угроза
моей жизни, она может быть прекращена по решению лечащего врача. В этом
случае мне должны быть разъяснены причины этого решения.
• Что назначаемые мне лекарственные препараты разрешены к
применению в России.
• Что, как и любое лекарственное средство, они могут вызывать некоторые
по-бочные реакции, информация о которых приведена в информационном
листке для больного, с которым я ознакомилась.
590
• Что, после родов я не должна вскармливать моего ребенка грудью, так
как это повысит риск его заражения.
Я обязуюсь:
• Проходить медицинское обследование для контроля за действием
назначенных мне препаратов по установленному графику, заполнять
предусмотренные для этого анкеты, сдавать на анализы кровь и мочу.
• Принимать назначенные мне лекарственные препараты строго в
соответствии с предписанием лечащего врача.
• Сообщать лечащему врачу обо всех нарушениях в приеме назначенных
мне препаратов или прекращении его по каким-либо причинам. Сообщать
лечащему врачу обо всех изменениях в состоянии моего здоровья и делать это
незамедлительно (в течение суток), если я считаю, что эти измене-ния связаны
с приемом назначенных мне препаратов.
• Не принимать, не посоветовавшись с лечащим врачом, какие-либо не
назначен-ные им лекарственные препараты (даже если они назначаются другим
врачом для приема не в экстренном порядке). Если же прием этих лекарств
неизбежен (на-пример, в экстренных случаях), обязательно сообщать об этом
лечащему врачу.
Подпись больного:Дата:
Врач Дата:
(ФИО, разборчиво) (подпись)
591
Приложение 2
Мониторинг ВИЧ-инфицированных женщин в период беременности
(L.Mofcnson, 1999)
Исследование Частота Цель
1 2 3
ВИЧ антитела Письменное документальное подтверждение 2-х раздельных исследований Документировать, что мать ВИЧ инфицирована
Тест на беременность по сыворотке крови или моче Один раз Документировать беременность
Раннее ультразвуковое исследование Один раз Документировать наличие жизнеспособной внутриматочной беременности; раннее подтверждение акушерской даты; помочь с определением времени начала антиретровирусной терапии
Ультразвук на 18-21 неделях Один раз Отображение пороков развития плода; установить акушерскую дату
Туберкулиновый тест Один раз Установить вторичный статус
Рентген грудной клетки Один раз, после первого триместра Выявить формы туберкулеза, другую легочную патологию
Базовая вирусная нагрузка и количество CD4+ Два раза Установить базовые значения (сели нс сделано до этого)
Вирусная нагрузка и количество CD4+ Ежемесячно Мониторинг эффективности терапии; раннее выявление привыкания и резкого увели- чения вирусной нагрузки. Документирование иммунной деструкции. Может прово- диться реже у матерей с документированным ста-
592
1 2 3
Полный клинический анализ крови, включая тромбоциты Каждый триместр Мониторинг токсичности антиретровирусных препаратов, степени активности ВИЧ инфекции.
Тесты функции печени: сыворо- точная АлАТ, АсАТ, общий билирубин, сывороточная амилаза Каждый триместр Определение гепатотоксичности антиретровирусных препаратов, установить базовые значения для обнаружения поздних осложнений беременности. Может проводиться чаще, если выше базового уровня.
Кандидоз ротовой полости Осмотр ротовой полости при каждом посещении врача. Мониторинг функции иммунной системы.
Влагалищное исследование При каждом посещении врача Проводится для лечения, снизит до минимума воспаление в гениталиях у женщины.
Культуральное исследование на вирус простого герпеса Культура из подозрительных повреждений кожи Как только обнаружен вирус простого герпеса, начинать активную профилактику ацикловиром на весь оставшийся срок беременности.
Заболевания, передающиеся половым путем Выполнить полное обследование при постановке на учет и в третьем триместре .. Раннее лечение заболеваний, передающихся половым путем, может повлиять на вертикальную (трансплацентарную) передачу.
593
Глава 13. О КРИТЕРИЯХ ДИАГНОСТИКИ И ПРОГНОЗА ВИЧ-
ИНФЕКЦИИ У ДЕТЕЙ 1 ГОДА ЖИЗНИ И ОСОБЕННОСТЯХ ИХ
ЛЕЧЕНИЯ
Диагностика ВИЧ-инфекции у детей представляется крайне сложной.
В этой связи еще в 1985 году Всемирная Организация Здоровья выделила
критерии, которые позволяют предполагать наличие СПИДа у детей, к ним
относятся:
потеря веса,
хроническая диарея более месяца,
пролонгированная лихорадка более месяца,
малые знаки, такие как генерализованная лимфоаденопатия,
орофарингеальный кандидоз,
персистирующий кашель,
генерализованный дерматит,
подтвержденная ВИЧ-инфекции у матери.
Наиболее четко ВОЗ определила диагноз для Африканских стран,
где затруднена лабораторная диагностика:
1. Большие знаки
потеря веса или недостаточное питание,
хроническая диарея более месяца,
длительная лихорадка более месяца.
2. Малые знаки
генерализованная лимфоаденопатия,
орофарингеальный кандидоз,
персистирующий кашель,
генерализованный дерматит,
подтвержденная ВИЧ инфекция у матери.
Детский СПИД в Африке устанавливается, если имеется по меньшей
мере два больших или два малых симптома.
В 1994 году CDC была предложена новая, основанная на уровне CD4
клеток и клинических симптомах, классификация ВИЧ-инфекции для детей.
Приводим ее в таблицах 92, 93.
594
Таблица 92
Классификация ВИЧ-инфекции у детей моложе 13 лет, CDC (1994)
Иммунологичес- кие критерии Клинические критерии
Н-без симптомов А - со слабо выраженными симптомами В - умеренные клинические симптомы С - тяжелая (симптомы или синдром СПИДа)
Без иммуносупрессии HI А1 В 1 О
Умеренная иммуносупрессия Н2 А2 В2 С2
Тяжелая иммуносупрессия НЗ АЗ ВЗ СЗ
Таблица 93
Классификация иммуносупрессии при ВИЧ-инфекции у детей
моложе 13 лет (1994)
Иммунологические критерии (CD4 Т- лимфоциты) Возраст детей
До 12 месяцев 1 - 5 лет 6-12 лет
Абс. % Абс. % Абс. %
Нет данных за иммуносупрессию > 1500 >25 >1000 >25 >500 >25
Умеренная иммуносупоессия 750- 1499 14-24 500- 999 15-29 200 - 499 15-24
Тяжелая иммуносупрессия <750 <15 <500 <15 <200 <15
Клинические категории ВИЧ-инфекции.
Категория Н - нет симптомов или один из категории А.
Категория А - мало выраженные симптомы.
Эта категория ни В и ни С включает 2 или более ниже перечисленных:
- лимфаденопатию (более 0,5 см, более чем в 2 областях увеличенные
лимфоузлы);
- гепатомегалию;
- спленомегалию;
- дерматиты;
- паротит;
595
- рецидивирующую респираторную инфекцию, отит, синусит.
Категория В - умеренно выраженные симптомы. Эта категория ни А и
ни С включает:
- анемию, тромбоцитопению и/или нейтропению (более 30 дней);
- бактериальную пневмонию, менингит, сепсис (один эпизод);
- орофарингеальный кандидоз, персистирующий более 2 месяцев, у
детей старше 6 месяцев;
- кардиомиопатию;
- цитомегаловирусную инфекцию у ребенка старше 1 месяца;
- диарею рецидивирующую или хроническую;
- гепатит;
- герпесвирусный стоматит рецидивирующий (более 2 эпизодов в год);
- герпесвирусный бронхит, пневмонию, эзофагит с началом не ранее
1 месяца;
- герпес опоясывающий (два или более эпизода);
- лейкомиосаркому;
- лимфоидную интерстициальную пневмонию (ЛИП) или гиперплазию
прикорневых лимфоузлов;
- нефропатию;
- нокардиоз;
- персистирующую лихорадку более 1 месяца;
- токсоплазмоз у ребенка 1 месяца и старше;
- ветряную оспу диссеминированную.
Категория С - тяжелая симптоматика (СПИД-индикаторные болезни,
исключая ЛИП), состояния, определяющие диагноз СПИДа:
- серьезные бактериальные инфекции, множественные или
рецидивирующие, не менее 2 раз за 2-летний период, подтвержденные
гемокультурой, в виде септицемии, пневмонии, менингита, остеомиелита,
абсцессов различных органов и полостей (исключая отит, поверхностный
кожно-слизистый абсцесс, инфекцию, обусловленную кавакатстером);
- кандидозный эзофагит или легочный кандидоз (бронхов, трахеи,
легких);
- кокцидиоидомикоз диссеминированный;
- внелегочный криптококкоз;
- криптоспоридиоз или изоспороз с диареей более месяца;
- ЦМВ-болезнь у ребенка старше 1 месяца, исключая изолированные
поражения печени, легких или лимфоузлов;
- энцефалопатии: наличие прогрессирующих симптомов более двух
месяцев при отсутствии других заболеваний, кроме ВИЧ-инфекции:
а) задержка психомоторного развития или приобретенная
микроэнцефалия, атрофия коры мозга, подтвержденная компьютерной
596
томографией или ЯМР у ребенка старше 2 лет; нарушение интеллекта,
подтвержденное нейрофизиологическими тестами;
б) приобретенные моторные нарушения, два или более: парез,
патологические рефлексы, атаксия или нарушение походки;
- герпес-симплекс-вирусная инфекция с кожно-слизистыми язвами,
персистирующая более месяца, или бронхит, пневмония или эзофагит у
ребенка старше 1 месяца;
- диссеминированный гистоплазмоз;
- саркома Капоши;
- первичная лимфома головного мозга;
- лимфома Беркита;
- лимфома В-клеточная;
- туберкулез, диссеминированный или внелегочный;
- микобактериоз диссеминированный атипичный с поражением
нескольких органов;
- микобактериум-авиум комплекс, или микобактериоз Канзаси
диссеминированный;
- пневмоцистная пневмония;
- прогрессирующая лейкоэнцефалопатия;
- сальмонеллезная септицемия рецидивирующая;
- токсоплазмоз головного мозга у ребенка старше 1 месяца;
- вастинг-синдром, при отсутствии заболеваний, сходных с ВИЧ-
инфекцией, объясняющий следующие симптомы:
а) стойкая потеря веса, более 10% от должного веса;
б) хроническая диарея (не менее чем 2-кратиый жидкий стул в сутки в
течение 30 дней);
в) документированная лихорадка, более 30 дней, интермиттирующая
или постоянная.
Несколько позже в 1994 году (L.Belec et al, 1994) модифицировали
предложенные ранее определения и добавили рецидивирующую пневмонию
и повторные инфекционные заболевания, повторяющиеся в течение года в
виде двух-трех эпизодов, при отсутствии других причин иммуносупрессии.
В Африке отмечено увеличение частоты неходжкинской лимфомы, которая
является причиной неблагоприятного исхода заболевания (Lucas S. et al.,
1994, Evans J. et al, 1997).
Анализируя диагностические критерии, P.Palumbo, В.Sandra (1998)
отмечают, что для ВИЧ-инфекции у новорожденных и детей
вирусологические исследования имеют большую ценность, чем
серологические. Результаты ПЦР или выявление культуры вируса в
периферической крови являются наиболее аргументированными для
диагноза ВИЧ-инфекции (таблица 94). Можно определять антиген р24, однако
это менее специфично. Каждый позитивный диагностический тест
597
требует повторного определения, так как возможны фальш-позитивные
результаты (Paehl С. et al., 1994).
Таблица 94
Критерии постановки диагноза ВИЧ-инфекции у детей
(Европейский центр по эпидемиологическому
мониторингу СПИДа, 1995)
Инфекционный статус Критерии
ВИЧ- инфицированный ребенок 1. Ребенок моложе 18 мес., у которого выявлены антитела к ВИЧ или он рожден ВИЧ-позитивной матерью, а также получены положительные результаты (но не исследование пуповинной крови) в 2 независимых исследованиях одного или нескольких тестов по выявлению ВИЧ: • Выявлен антиген ВИЧ р24, Отмечена положительная ПЦР, Получена культура ВИЧ. 2. Ребенок 18 мес. и старше, рожденный от ВИЧ- серопозитивной матери или получивший переливание крови или кровепродуктов, или с другим установленным путем передачи (включая половой контакт и т.п.), если у него многократно обнаруживаются антитела к ВИЧ, в том числе в подтверждающих тестах, или его состояние соответствует критериям пункта 1.
Неопределенный статус Имеется риск перинатальной передачи, но нет вышеперечисленных критериев инфицированности, и при этом ребенок: 1. Серопозитивен в ИФА и в подтверждающем тесте и ему нет 18 месяцев к моменту исследования; 2. рожден от инфицированной матери, но нет данных о результатах обследования ребенка на антитела к ВИЧ.
Ребенок не инфицирован Ребенок родился от серопозитивной матери, при этом у него: 1. Документированы 2 или больше негативных исследования на определение антител к ВИЧ в ИФА в возрасте от 6 до 18 мес. или 1 негативный результат в возрасте 18 мес. и старше; 2. Нет других лабораторных свидетельств инфекции (2 положительных тестов на обнаружение вируса, если они проводились); 3. Нет болезней, свидетельствующих о развитии СПИДа.
Если ВИЧ-инфицированная женщина будет кормить своего
неинфицированного внутриутробно или в родах ребенка грудью или своим
грудным молоком, то ребенок может инфицироваться при грудном
I вскармливании.|
598
Таблица 95
Прогрессия к СПИДу и смертность у детей с вертикальной ВИЧ
трансмиссией, наблюдаемых с момента родов (Greenberg A. et al., 1999)
Процент прогрессии к СПИДу к 1 году Процент умерших к 1 году 21 месяцу 5 годам 10 годам США 9-25 % 10% 26-30 % 40% Африка • 30% 34% 50% 75%
Таблица 96
Тесты для диагностики ВИЧ инфекции у новорожденных и детей
первого года по материалам “Children's Hospital AIDS Program New
Jersey Medical School” (А.Г.Рахманова, 1996)
Тесты Их оценка
ВИЧ культура Специфичный высокоинформативный тест
АнтиВИЧ IgG Положительный результат в первые 9 мес. (ИФА, имму- ноблот) может быть связан с материнскими антителами
р-24 антиген Специфичность около 65%
АнтиВИЧ IgM Специфичность та же
ПЦР Высокоспецифична и чувствительна позже 2 месяцев жизни
Анти-ВИЧ IgA Высокочувствительный тест, но не в первые 2-3 месяца жизни
Поликлональная гипергам- маглобулинемия С первых месяцев жизни, не специфична
Лейкопения, тромбоцитопе- ния С первых месяцев жизни, не специфична
Уменьшение CD4 Т- лимфоцитов и соотношения CD4/CD8 С первых месяцев жизни, не специфична
При перинатальной ВИЧ-трансмиссии в первые два дня вирус, как
правило, нс обнаруживается и выявляется позже (таблица 97). Ввиду этого,
предлагается рабочая гипотеза, согласно которой время выявления ВИЧ в
крови новорожденного может указывать на особенности инфицирования
трансплацентарно или во время родов (Bryson Y. et al, 1992; Dickover R. ct
al., 1994). Однако, эта гипотеза нуждается в дальнейшем подтверждении.
L.Kalish et al, 1997 не выявили различий в частоте выявления ВИЧ-
культуры у новорожденных с различными вариантами инфицирования:
599
внутриутробно или перинатально. Вместе с тем M.Mayaux et al, 1996, на
основании многочисленных исследований пришли к выводу, что риском
прогрессии ВИЧ-инфекции новорожденных может быть раннее выявление
вируса в крови. Следовательно, независимо от выводов о характере инфи-
цирования, раннее выявление виремии у новорожденных, ее высокий уро-
вень можно рассматривать, как критерий быстрого прогрессирования
болезни.
Таблица 97
Время перинатальной трансмиссии
(Lynne Mofenson, Catterine Wilfert, 1999)
Внутриматочно (intrauterine) Интранатально Постнатально (грудное вскармливание)
ВИЧ выявляется в плацентарных клет- ках ВИЧ обнаружива- ется в тканях плода и амниотической жидкости Возможно наруше- ние развития плода Положительные вирусологические исследования вы- являются в 20-60% у младенцев к мо- менту рождения ВИЧ выявляется из церви- ковагинальных секретов «Острая» первичная инфекция при негативных вирусологических ис- следованиях к рождению с после- дующим позитивным результатом в течении первого года жизни у 40- 80% младенцев Позднее проявление симптомов бо- лезни (спустя 12 мес у 70 %) Выявление ВИЧ р24 антигена в цервиковагинальных секретах ассо- циируется с увеличением риска ин- фекции. В сочетании с разрывом мембран риск инфицирования на- растает. Возможен защитный эффект кеса- рева сечения. ВИЧ выявляется в клет- ках и внеклеточно в со- держимом грудного мо- лока. Описаны случаи инфици- рования младенцев при грудном вскармливании от ВИЧ-позитивных «кормилиц». Мета анализ накоплен- ных данных указывает на увеличение риска инфи- цирования при грудном вскармливании,
Согласно последним рекомендациям (декабрь 2001) вирусологиче-
ские тесты рекомендуется проводить в 1 месяц и всем детям к 6 месяцам.
Это четко подтверждает диагноз ВИЧ инфекции.
Позитивный вирусологический тест (ВИЧ культура ДНК или РНК в
ПЦР) указывает на возможное наличие ВИЧ инфекции и должно быть
подтверждено повторными тестами у младенцев к 48 часам, 1 или 2 меся-
цам жизни и далее в возрасте 3 и 6 месяцев.
ВИЧ ДНК ПЦР - предпочтительный диагностический тест у младен-
цев. Дети с негативными результатами в первые 48 часов обследуются по-
вторно в возрасте 14 дней. Если и в этот период она отрицательна, ПЦР по-
вторяют через один месяц, затем два месяца жизни. При отрицательных ре-
зультатах ПЦР сс повторяют в 3 и 6 месяцев жизни. Два или более отрица-
тельных результата исследования на ВИЧ антитела, выполненные к 6 меся-
цам с интервалом в 1 месяц между исследованиями, также могут быть ис-
пользованы для исключения ВИЧ инфекции у детей без клинических дан-
ных. ВИЧ инфекция может быть надежно исключена,
600
если ВИЧ антитела при отсутствии гипогаммаглобулинемии не выявляются к
18 месяцам, нет клинических и вирусологических данных.
Большое внимание для прогноза ВИЧ-инфекции у детей 1-го года
жизни придается уровню СЭ4-лимфоцитов, не столько абсолютному, сколько
их процентному содержанию. Развитие иммунодефицита способствует
прогрессии заболевания. Показано, что если у новорожденных число CD4-
лимфоцитов ниже 750,500 и 200 клеток/мм3, это отражает тяжелую иммунную
супрессию и может быть причиной развития пневмоцистной пневмонии с
быстрой прогрессией заболевания (Simonds R., et al, 1995; Thea D., et al,
1996). Вместе с тем, рекомендуется одновременное определение CD4-
лимфоцитов и вирусной нагрузки и их сопоставление: высокий уровень
вирусной нагрузки и низкое содержание СЭ4-лимфоцитов как абсолютное,
так и процентное, являются наиболее достоверными критериями прогрессии
ВИЧ-инфекции (De Rossi A. et al, 1998; Polumbo P. et al, 1998).
Эти данные были подтверждены исследованиями, в которых, наряду
с определением вирусной нагрузки и СЭ4-лимфоцитов, анализировалось
состояние тимуса и фенотип ВИЧ (Rosenzweig М. et al, 1993; Stanley S. et al,
1993; Calabro M. et al, 1995; Su L. et al, 1995; Uittenbogaart C. et al, 1996; De
Rossi A. et al, 1998).
Авторы показали, что наиболее неблагоприятное течение наблюдается
у детей, у которых вирус обладает наибольшей способностью образовывать
синцитий и поражать макрофаги. Изучение фенотипа вируса позволило
классифицировать МТ-2 клетки, в которых микроскопически выявлялась
баллонная дистрофия с образованием синцития. Выделены варианты ВИЧ,
которые обладали высоким макрофагальным тропизмом, обусловливая
быстрое прогрессирование болезни (Reinhardt Р. et al, 1995; Nielson Y et al,
1995).
В норме число CD4+ Т-лимфоцитов у детей значительно выше, чем у
взрослых. Количество Т-клеток у детей становится таким же, как у взрослых
примерно к 6-летнему возрасту (The European Collaborative Study, 1991).
Количество клеток CD4+ и их деление на популяции может быть
использовано в качестве суррогатного маркера прогрессирвоания ВИЧ-
инфекции; этот показатель необходимо определить до начала любой
антивирусной терапии. Глубокие изменения в составе и количестве CD4-
клеток в течение первого года жизни характеризуют быстрое
прогрессирование ВИЧ-инфекции (Discover RE et al., 1994) и указывают на
необходимость немедленно начинать проведение высокоактивной
антиретровирусной терапии.
Определить количество свободных вирусных частиц в плазме крови
можно с помощью ПЦР на РНК ВИЧ. Для этого могут быть использованы
различные методы. Поскольку каждый из этих методов имеет различный порог
чувствительности, а также обладает определенной специфичностью,
39. Заказ № К.4451. ^01
их следует применять постоянно как мониторинг вирусной нагрузки для
определения эффективности проводимой терапии у каждого конкретного
больного.
У ВИЧ-инфицированных детей определяются очень высокие
показатели вирусной нагрузки, которые сохраняются в течение
значительного времени (Dickover RE et al., 1994). Возможно, это является
показателем острой ВИЧ инфекции. Аналогично этому у взрослых
показатель вирусной нагрузки (число копий РНК ВИЧ) резко
увеличивается во время первичной виремии - острой ВИЧ инфекции, а
через 6-12 месяцев происходит резкое падение вирусной нагрузки,
совпадающее с развитием клеточного и гуморального иммунного ответа.
У детей после достижения ими годовалого возраста снижение
показателей вирусной нагрузки происходит значительно медленнее
(Palumbo РЕ et al., 1997). В большинстве исследований, проведенных к
настоящему времени, указано, что персистенция высоких уровней РНК
ВИЧ в крови детей в возрасте до 1 года коррелирует с плохим прогнозом
при ВИЧ-инфекции (Shearer WT et al., 1997; Palumbo PE et al., 1997).
Длительные, в течение 5 лет, наблюдения за детьми, рожденным от
ВИЧ-позитивных женщин, показали, что из 374 пациентов с процентным
относительным числом CD4 клеток менее 10% смертельный исход
наблюдается в 80-97%, у детей с числом CD4 клеток от 10 до 20%
смертельные исходы встречаются значительно реже - в 44% и еще реже,
если CD4 превышают 25%. Тем нс менее, у иелеченных
антиретровирусными препаратами детей к 5 годам жизни частота
смертельных исходов достаточно высока при исходном уровне CD4
клеток выше 25-30% (таблица 98).
Таблица 98
Связь исходного уровня (в %) CD4+ Т лимфоцитов с
долгосрочным риском смерти у ВИЧ инфицированных детей
_______________(Mofenson L. et al, 1997)_________
Исходный уровень Количество больных Смерть
Число %
<5% 33 32 97
5-9% 29 22 76
10-14% 30 13 43
15-19% 41 18 44
20-24% 52 13 25
25-29% 49 15 31
30-34% 48 5 10
>35% 92 30 33
Средняя продолжительность наблюдения 5,1 лет
"Включены 374 пациента, у которых были доступны данные об исходном уровне
CD4 Т лимфоцитов
602
Менее демонстративна связь частоты смертельных исходов с
уровнем вирусной нагрузки при рождении в первые 6 месяцев жизни.
Так, при 100000 копий РНК ВИЧ спустя 5 лет наблюдения умерло 15%
детей, а при количестве 50000 копий РНК ВИЧ - 28% детей. Вместе с
тем, очень высокие показатели вирусной нагрузки - 1 млн РНК ВИЧ/мл
и более существенно чаще приводят к смерти детей (таблица 99).
Таблица 99
Связь исходного количества копий РНК ВИЧ с долгосрочным риском
смерти у ВИЧ инфицированных детей (Mofenson L. et al, 1997)
Исходный уровень (копий/мл) Количество больных Смерть
Число %
Неопределяемый (например, < 4.000) 25 6 24
4.001-50.000 69 19 28
50.001 - 100.000 33 5 15
100.001 -500.000 72 29 40
500.001 - 1.000.000 20 8 40
>1.000.000 35 25 71
Всего 254 92 36
Определен в гест-системс NASBA
" Средний возраст 3,4 лет
Сопоставление процентного содержания CD4 клеток и уровня
вирусной нагрузки показало значимость для прогноза обеих показателей
(таблица 100).
Таблица 100
Связь исходного количества копий РНК ВИЧ и числа CD4 Т
лимфоцитов с риском смерти у ВИЧ инфицированных детей
(Mofenson L. et al, 1997)
Исходный уровень РНК ВИЧ (копий /мл) Количество ** Смерть
/ исходный уровень CD4 (%) больных Число %
< 100.000
>15% 103 15 15
<15% 24 15 63
> 100.000
>15% 89 32 36
<15% 36 29 81
Вместе с тем, статистически достоверной разницы в частоте
смертельных исходов у детей с CD4 клетками менее 15% при вирусной
39» 603
нагрузке до 100000 копий РНК ВИЧ и более этого показателя выявлено не было
(таблица 100). Эти данные указывают на приоритетное значение определения
CD4 лимфоцитов для прогноза ВИЧ инфекции у детей.
Мониторинг ВИЧ-инфекции у детей 1-го года жизни (Guidelines for
use of antiretroviral agents in pediatric HIV infection, 1999):
- лучшим маркером прогрессирования заболевания у детей может
служить изменение процентного содержания, а не числа CD4, их следует
определить как можно раньше после получения положительного результата
тестирования на ВИЧ и затем каждые 3 месяца.
- результаты тестирования на РНК ВИЧ у перинатально
инфицированных младенцев отличаются от результатов у взрослых. Высокий
показатель вирусной нагрузки сохраняется у инфицированных детей в
течение длительного времени, что отражает меньшую эффективность
незрелой, но развивающейся иммунной системы в сдерживании репликации
вируса и наличии большего числа клеток, чувствительных к ВИЧ.
- у детей с перинатальной ВИЧ-инфекцией количество копий РНК
может снижаться даже без лечения в течение первых лет жизни, однако у
большинства взрослых оно устойчиво сохраняется на высоких уровнях.
Чтобы уменьшить степень влияния биологической вариабельности
результатов анализов на клиническое ведение пациентов, нужно брать два
исходных образца и использовать среднее от этих двух тестов для сравнения
с последующими результатами.
Дополнительные клинико-лабораторные исследования.
Дополнительные клинико-лабораторные исследования должны включать
общий анализ крови и биохимические исследования крови, включая определение
печеночных ферментов, амилазы, липазы, молочной дегидрогеназы и уровня
иммуноглобулинов. Так как усиление репликации вируса нередко связано с
развитием цитомегаловирусной инфекции в первые месяцы жизни ребенка,
многие клиницисты рекомендуют проводить кулыуральное исследование мочи
на цитомегаловирусы в течение первых 6 месяцев.
Выбор необходимых исследований для оценки состояния детей более
старшего возраста определяется наличием соответствующих клинических
данных. В частности, можно произвести исследование головного мозга
(ядерный магнитный резонанс или компьютерная томография) для оценки
ниличия или отсутствия атрофических изменений головного мозга, а при
наличии соответствующих показаний - рентгенологическое
исследование органов грудной клетки. Оценка функций гуморального
иммунитета у детей более старшего возраста может
604
быть проведена путем определения титров антител после иммунизации.
Клеточный иммунитет можно оценить с помощью внутрикожных аллер-
гических тестов или путем постановки лимфопролиферативных тестов in
vitro.
Таблица 101
Шкала риска тяжелого течения и летального исхода при инфекци-
______онных заболеваниях у детей раннего возраста (в баллах)____________
/. Риск по антенатальному и перинатальному периодам
0 — отсутствие указаний на патологию беременности, требовавшую выдачи
больничного листа; отсутствие указаний на патологические состояния и
заболевания новорожденного, требовавшие задержки выписки из родиль-
ного дома или госпитализации
1 — наличие вышеуказанной патологии либо в антенатальном периоде, либо
интра-и постнатально
2 — сочетание патологии беременности и патологии новорожденного ____
II. Риск по сопутствующим заболеваниям и состояниям
0 — отсутствие хронических заболеваний и аномалий развития
2 — наличие хронических заболеваний или врожденных пороков развития без
проявления активности или периодической декомпенсации функций
3 — наличие хронических заболеваний или врожденных пороков с проявле-
ниями активности или периодической декомпенсацией функций________
III. Риск по нарушениям питания
0 — питание ребенка не нарушено
2 — выраженный недостаток питания (гипотрофия) или выраженный избыток
питания (тучность)________________________________________________
IV. Риск по аллергологическому анамнезу
0 — отсутствие указаний на повторные аллергические реакции, требовавшие
консультации врача или приема медикаментов
1 — наличие указаний на повторные аллергические реакции, требовавшие
__________консультации врача или приема медикаментов____________________
V. Риск по социально-бытовым факторам
0 — благополучный быт, семья, хороший контакт с поликлиникой
1 — неблагополучие по одному из вышеуказанных признаков
2 — неблагополучие по двум-трем из вышеуказанных факторов__________
VI. Транзиторпый риск
0 — отсутствие в течение последнего месяца острых заболеваний, прививок,
введения иммуноглобулина, перемен места жительства, поступления в
детские коллективы
I — наличие в эти сроки одного из вышеперечисленных событий
2 — наличие в течение последнего месяца двух и более из перечисленных вы-
L _ Ш£С°быТИЙ_ _________ _______________ ___
Примечания.
I. Транзиторпый риск констатируется при оценке состояния ребенка каждый раз вновь
во время первого посещение врача при очередном остром заболевании.
2. Общин риск оценивается суммой баллов, набранных конкретным ребенком.
Всем детям с ВИЧ-инфекцией рекомендуется начинать лечение как
можно раньше, хотя пока что имеется недостаточно данных по поводу
605
эффективности раннего назначения комбинации антиретровирусных препаратов
у детей (Luzuriaga К. et al., 1997). В то же время, имеются очень существенные
данные, касающиеся динамики вирусной репликации во время первичной
виремии у взрослых. Целесообразность назначения ранней терапии заключается
в том, что быстрое начало агрессивной антиретровирусной терапии может
защитить иммунную систему ребенка, снизить распространение вируса,
понизить концентрацию вирусов в организме и способствовать улучшению
клинического исхода.
Дополнительные рекомендации по лечению ВИЧ-инфицированных
детей включают: лечение всех ВИЧ-инфицированных детей с клиническими
симптомами ВИЧ-инфекции (клинические категории А, В или С) или с
признаками, доказывающими наличие иммунологической недостаточности
(иммунологическая категория 2 или 3) независимо от возраста ребенка или
показателей вирусной нагрузки.
Если принято решение о начале лечения, то антиретровирусную
терапию нужно начинать как можно раньше в следующих ситуациях:
- Уровни РНК ВИЧ высокие или повышаются (увеличение в 5 раз для
детей младше 2 лет)
- Абсолютное количество клеток CD4+ или их процентное содержание
быстро снижается до второй иммунологической категории.
- Развиваются клинические симптомы инфекции.
- Вирусная нагрузка превышает 100 тыс. копий РНК ВИЧ в 1 мл.
- У детей старше 30 месяцев уровни РНК ВИЧ такие, при которых
рекомендуется лечение ВИЧ+ взрослых (больше 10000 копий/мл).
При лечении всех ВИЧ-инфицированных детей должны
использоваться комбинации антиретровирусных препаратов. Единственный
случай, когда применяется монотерапия, это шестинедельный
профилактический курс у ребенка, родившегося от ВИЧ-инфицированной
матери. Это лечение должно позже смениться комбинированной терапией,
если у ребенка установят ВИЧ-инфекцию.
Схемой выбора рекомендуется считать применение двух нуклеозидных
ингибиторов обратной транскриптазы (НИОТ) и одного ингибитора протеазы.
Обоснованием для проведения такой терапии является стремление максимально
подавить вирусную репликацию. Правильность такого подхода была успешно
доказана в селективных исследованиях, где у детей было достигнуто снижение
количества РНК ВИЧ до неопределяемых значений (Krogstad Р. et al., 1999).
Второй вариант схемы лечения, если имеются проблемы с
токсичностью или соблюдением режима приема ингибиторов протеазы,
заключается в терапии двумя НИОТ в комбинации с ненуклеозидным
ингибитором обратной транскриптазы (ННИОТ), например, с невирапином,
или только двумя НИОТ. Однако следует помнить, что это - так называемые
альтернативные схемы; они могут не дать устойчивой
606
супрессии вируса и сравнительно часто приводят к развитию
лекарственной резистентности. Предварительные данные клинических
испытаний у детей (PACTG 338) показали, что комбинированная терапия,
включающая ингибиторы протеазы, является более эффективной (о чем
свидетельствуют снижение вирусной нагрузки до неопределяемых
значений и повышение субпопуляции клеток CD4+), чем терапия двумя
препаратами НИОТ (Yogev Retal, 1997; Van Dyke R. Et al., 1998; Fischl Met
et al„ 1998).
Показания к началу антиретровирусной терапии должны обсуждаться
с теми, кто обеспечивает уход за младенцами с учетом приверженности
терапии, соблюдения режима лечения и возможности его обеспечения.
Подростки постпубертатного возраста должны следовать указаниям по
применению антиретровирусных препаратов у взрослых и подростков.
Показания для начала антиретровирусной терапии у детей с ВИЧ
инфекцией'
1. Клинические симптомы, ассоциированные с ВИЧ инфекцией
(например, клинические категории А, В или С).
2. Наличие иммунной супрессии, определяемой по абсолютному
количеству или процентному содержанию CD4 Т-лимфоцитов
(например, иммунологическая категория 2 или 3).
3. Возраст моложе 12 месяцев - независимо от клинического,
иммунологического или вирусологического статуса.
4. Для асимптомных детей старше 1 года с нормальным иммунным
статусом возможны два подхода: 1) начинать терапию независимо от
возраста или наличия симптомов; 2) воздержаться от лечения в
ситуации, когда риск прогрессии заболевания низкий и другие
факторы (например, сомнение в стойкости реакции, безопасности и
соблюдении указаний врача) склоняют отложить лечение. В этих
случаях необходимо обеспечить регулярное наблюдение за
состоянием здоровья детей и мониторирование клинического,
иммунологического, вирусологического статуса. Факторы для
решения о начале терапии включают следующие:
Высокий или повышающийся уровень количества копий РНК ВИЧ;
Быстрое снижение CD4 Т клеток - абсолютного числа или процента
до иммунной категории 2;
Развитие клинических симптомов.
Долгосрочные наблюдения за детьми, получающими
антиретровирусную терапию, показали значение исходной вирусной
нагрузки и возраста детей не момент назначения лечебных препаратов.
Неблагоприятный прогноз (прогрессия заболевания и смерть) отмечались
1 Guidelines for use of Antiretroviral agents. August 2001
607
чаше у детей l-го года жизни при исходно высокой вирусной нагрузке
(свыше 500.000 копий РНК ВИЧ). Эти данные, приведенные в таблице
102, свидетельствуют о необходимости лечения детей до 1 года, а
определение вирусной нагрузки может служить основанием для
усиленных режимов терапии.
Таблица 102
Связь между исходным уровнем РНК ВИЧ по возрасту при
вхождении в группу риска и прогрессированием заболевания или
смертью за время отдаленного наблюдения среди ВИЧ
инфицированных детей, получающих антиретровирусную терапию
(Palumbo Р, et al., 1998)
Возраст на момент вхождения / исходный уровень РНК ВИЧ (копий/мл) Количество больных Прогрессия заболевания или смерть
Число %
< 30 месяцев
< 1.000-150.000 79 9 И
150.001 - 500.000 66 13 20
500.001 - 1.700.000 76 29 38
>1.700.000 81 42 52
> 30 месяцев
< 1.000-15.000 66 0 0
15.001 -50.000 54 7 13
50.001 - 150.000 80 13 16
> 150.000 64 22 34
Начальная антиретровирусная терапия
Для новорожденных:
Два нуклеозидных ингибитора обратной транскриптазы
Или
Невирапин + два нуклеозидных ингибитора обратной транскриптазы
Или
Ингибиторы протеазы + два нуклеозидных ингибитора обратной
транскриптазы
Рекомендованы начальные комбинации для новорожденных: зидовудин
+• DDI или азидотимидин с нельфинавиром или ритонавиром
Для старших младенцев или детей:
Один активный ингибитор протеазы + два нуклеозидных ингибитора
обратной транскриптазы
Альтернативный режим:
- невирапин + два нуклеозидных ингибитора обратной транскриптазы,
- два-три нуклеозидных ингибитора обратной транскриптазы, например
АЗТ+ЗТС+абакавир,
608
- лопинавир/ритонавир (калетра) с двумя ингибиторами обратной
транскриптазы или одним ННИОТ.
- Индинавир или саквинавир (фортоваза) в мягких желатиновых
капсулах и два нуклеозидных ингибитора транскриптазы для детей,
которые могут глотать капсулы,
- Ампренавир в комбинации с двумя ингибиторами обратной
транскриптазы или абакавиром.
В связи с тем. что антиретровирусная терапия назначается на долгие
годы, при начале такого лечения нужно принимать во внимание
возможные ограничения последующего выбора терапии при развитии
лекарственной резистентности. Необходимо также учесть комплексный
подход к лечению, включая полноценное питание, уход, массаж и т.п.
Приведем пример.
Часто используемые в педиатрии комбинации препаратов для
начальной терапии:
Азидотимидин+ ламивудин + нелфинавир
Азидотимидин + ламивудин + ритонавир
Ставудин + диданозин + нелфинавир
Ставудин + диданозин + ритонавир
Ставудин + ламивудин + нелфинавир
Ставудин + ламивудин + ритонавир
Азидотимидин + ламивудин + невирапин
Ставудин + ламивудин + невирапин
Ставудин + диданозин + невирапин
Нелфинавир + невирапин +азидотимидин +ламивудин
Нелфинавир + ифавиренц +азидотимидин + ламивудин
Описывают как наиболее удачную схему лечения детей
комбинацию азидотимидина, диданозина и невирапина (Luzuriago К. et
al., 1997).
В контролируемых исследованиях, проведенных у детей 1 года
жизни использовался в разных сочетаниях невирапин (ACTG 180 и 356,
Luzuriaga К., 1997, 1999). При этом наилучший эффект отмечен на
тройной терапии. У этих детей в возрасте от 2,5 мес. до 16 мес. исходная
вирусная нагрузка колебалась в пределах 41.000 - 1.5 млн копий РНК
ВИЧ/мл плазмы. После назначения невирапина 120 мг/м2 один раз в день
первые 8 дней, а затем 200 мг/м2 с 29 по 196 день, АЗТ 240 мг/м2 три раза
в день и диданозина 120 мг/м2 два раза в день уровень РНК ВИЧ в
609
более позднем исследовании изучались эффективность невирапина в
комбинации с азидотимидином и эпивиром у детей в возрасте от 3 мес до 2-х
лет (Luzuriaga et al. 1999). Из 9 детей у 6 отмечено существенное длительное
снижение вирусной нагрузки. Вместе с тем, важным фактором для
эффективности антиретровирусной терапии являются питание, уход,
психоэмоциональная поддержка. Приведем пример. Лиза К., родилась
24.02.1998, мать сняли с теплохода в г. Сочи. Родом мать из Луганска, а в Сочи
ехала отдыхать. Роды у нее были преждевременные на 28 неделе. Роды 1,
беременностей -5.0 матери сведений нет, из роддома на 3-и сутки она утла,
оставив младенца.
Лиза родилась недоношенной, весом 1 кг 170 г, находилась в отделении
реанимации первые 7 суток и в последующем в течение 1,5 месяцев в отделении
раннего детства больницы г. Сочи. С 15 апреля по 16 августа 1998 года была на
обследовании и лечении в детской клинике Федерального центра профилактики
и борьбы со СПИДом, где ей был установлен диагноз ВИЧ инфекции - 20 мая
1998; в 3 месяца жизни по клиническим данным и результатам ПЦР. С 16 августа
1998 года по настоящее время находится на лечении в Республиканской
клинической больнице - научно-практическом центре ВИЧ инфекции для
беременных и детей с диагнозом ВИЧ инфекция CII1 иммунологическая категория.
Гипотрофия 1 ст., спастический тетрапарез, анемия, рецидивирующие
бактериальные инфекции, кардиомиопатия, орофарингеальный кандидоз,
замедленное психомоторное развитие, менингоэнфефалит VHI-IX 2001. В динамике
наблюдения отмечалось резкое отставание психомоторного развития. До 2-х лет
не сидела без поддержки, в 3 года стояла с поддержкой, ходить начала
самостоятельно с 4-х лет, не говорит. Рост (длина) 36 см при рождении, в 2 года -
72 см и 4 года - 90 см. Вес к 1 году - 2950, к 2 годам - 8800, к 4 годам - 12800, зубы
- 14, в 2 года. Не ест самостоятельно, только с соски или через зонд. Вирусная
нагрузка в 7 месяцев жизни 86.552, CD4 - 13% - 794 клеток, назначен ретровир и
эпивир на фоне антибактериальной терапии, получала весь 1999 год. CD4 - 41 %,
вирусная нагрузка 48.900. Втечение 1,5 лет- перерыв влечении. После подъема
вирусной нагрузки до 880.000 РНК ВИЧ/мл и снижения CD4 до23%-918 клеток
в 2,5 года получает тритерапию - видекс, норвир и зерит. На этом фоне вирусная
нагрузка снизилась до неопределяемого уровня, a CD4 повысились до 34% - 828
клеток/мл. Однако, масса тела оставалась низкой - 8.400 г, рост 84 см, ела через
зонд, без поддержки не ходила. Включение массажа, лечебной физкультуры и
индивидуальных занятий способствовало развитию девочки: она стала есть и
пить с поильника, ложкой. Ходит самостоятельно, произносит отдельные слова,
к 2003 году (5 годам и 7 месяцам) рост - 96 см, вес - 12800 г, продолжает получать
тритерапию. Однако, в декабре 2002 года выявлено повышение вирусной нагрузки
до 8689 копий РНК ВИЧ/мл. В январе назначена калетра вместо норвира, видекс
и зерит. В течение года на этом фоне отмечено увеличение массы тела и длины,
вирусная нагрузка ниже определяемого уровня.
610
Таблица 103
Вес (г) _ _ Данные Ли Рост 1 клиника (см) i зы К. (род» CD4 ' мм’ лась_163)9.98 Вирусная на- грузка Копии РНК/ВИЧ мл плазмы } Лечение Психомоторное развитие
11 98 VI 98 1170 2950 36 . Пневмония 1
IX 98 i l 13% 794 21% 889 86 552 Не сидит
10.01.99 Слабость. ОРВИ, диарея, I пневмонии Ретровир + ЗТС с 10.01 по 6.12.99 Не ходит, сидит с поддерж- кой
6.12.99 i Частые ОРВИ, гепатомегалия 41% 1312 48 946 Не ходит
5.02.00 (2 года) 8800 72 '14 зубов । Кандидоз, ОРВИ, отит, лим- । фаденопатия, гепатомегалия Грубая задержка психомо- торного развития. Сидит, но не ходит, стоит с поддерж-
XII 2000 8780 75 ! Частое пребывание в ОРИТ 23% 918
11 2001 (3 года) 10830 78 VIII - IX - менинго-энцефалит (криптококковый?) 32% 950 6.03 880000 VII - 11921 С 10.05.01 ин- декс, норвир, зерит
IX 2001 1 ЯМР: полисннусит, хр. отит демиелинизация белого веще- 1 ства головного мозга VIII - менее 400 Не ест сама, плохо из рожка, ест через зонд, не ходит, не говорит
V-VI 2002 4 г. 3 .мес. 8400 84 1 Редкие ОРВИ, диарея редко, 1 печень +1.5 см 1 i 34% 828 АЛТ 63 Е/л Менее 400 норвир, видекс зерит + массаж индивидуаль- ный воспитатель Ест через зонд, не ходит, не говорит
VIII 2002 II 2003 12800 13600 90 1 ЯМР: демиелинизация белого I вещества. Полсинусита нет. 95 1 1 28% 1465 XII 2002 9689 менее 400 С I 2003 г. - ви- декс, зерит, ка- летра Самостоятельно ходит, гу- ляет, произносит отдельные слова, ест с поильника, ино- гда с ложки, но не самостоя- тельно
В приведенном личном наблюдении у девочки от ВИЧ инфицированной
матери, брошенной ею с недоношенностью и гипотрофией I степени, диагноз
ВИЧ инфекции в стадии СПИДа установлен в 6 месяцев жизни. Эффективность
антиретровирусной битерапии была недостаточной, а повторный курс
тритерапии успешный. Удалось снизить вирусную нагрузку до неопределяемого
уровня. Тем не менее, психомоторное развитие, масса тела не изменялись к
лучшему. Включение в терапевтическую схему физиотерапевтических процедур,
лечебной физкультуры, индивидуального воспитателя позволило существенно
дополнить результаты антиретровирусной и иной медикаментозной терапии.
Изменение схемы антиретровирусной терапии
Общим правилом в медицине является необходимость изменения
лечения, если оно не дает результатов. Неудача в лечении ВИЧ-
инфицированных детей характеризуется прогрессированием заболевания,
что клинически проявляется нарастанием слабости, развитием новых
болезней - индикаторов иммунодефицита или ухудшением течения
неврологических проявлений ВИЧ-инфекции. Ухудшение иммунологических
и вирусологических показателей также свидетельствует о необходимости
замены терапии. Снижение количества CD4+ клеток или повышение
показателя вирусной нагрузки, как описывалось ранее, означает усиление
репликации вируса.
Учитывая сложность проведения комбинированной терапии, можно
сказать, что в таких ситуациях нередко возникают проблемы с обеспечением
лекарственными препаратами или с соблюдением очень сложных схем
лечения. Клиницисты должны определить, действительно ли
прогрессирование заболевания является результатом недостаточной
эффективности терапии, а не результатом несоблюдения назначенного
режима лечения (приема не всех доз препарата, нерегулярного приема
лекарств и т.д.).
Вирусологические показатели неэффективности лечения детей:
• Менее чем 10-кратное снижение от начальных значений РНК ВИЧ у
детей, получающих 2 препарата НИОТ и один ингибитор протеазы или менее
чем пятикратное снижение от начальных значений у детей, получающих
менее активную терапию через 8-12 недель лечения.
• Определяемые уровни РНК ВИЧ через 4-6 месяцев терапии (может
быть дольше, если используется ультрачувствительный метод). Идеальной
задачей является подавить репликацию вируса полностью, хотя это может
быть недостижимо у каждого отдельного пациента. В связи с этим данный
признак не является абсолютным и снижение количества РНК ВИЧ на 1,5-2,0
log|0 по сравнению с начальными значениями (если уровни РНК низкие) может
обосновывать возможность продолжения ранее выбранной терапевтической
схемы.
612
• Повторное определение РНК ВИЧ у ребенка, у которого были
неопределяемые уровни после начала терапии.
• Продолжающееся нарастание количества РНК ВИЧ после начала
терапии более чем в три раза у детей двух или старше лет и повышение
более чем в 5 раз у детей моложе 2 лет.
Иммунологические показатели неэффективности лечения детей:
• Изменение иммунологической категории.
• Для детей с иммунологической категорией 3 (менее 15% клеток CD4+)
стабильное снижение на 5% и более.
• Быстрое и значительное снижение абсолютного числа клеток CD4+.
Клинические показатели неэффективности лечения:
• Прогрессирующее неврологическое ухудшение.
• Задержка развития ребенка, проявляющаяся снижением веса и роста,
несмотря на правильное питание, и при отсутствии других причин.
• Прогрессирование заболевания, определяемое как переход из одной
клинической категории в другую.
Смена терапии может быть оправдана также наличием признаков
токсичности какого-либо препарата или симптомами непереносимости, или
если в будущем появится другая, более мощная схема лечения.
Дополнительные мероприятия для оказания помощи ВИЧ-
инфицированному ребенку
Питание:
Дети с ВИЧ-инфекцией часто нуждаются в дополнительном питании.
У таких детей часто возникают расстройства со стороны ЖКТ,
орофарингеальные поражения и кариес зубов. Эти состояния могут
приводить к анорексии, дефициту питания, потере массы тела и задержке
развития. Когда необходимо дополнительное питание, должна быть
обеспечена высококалорийная диета с повышенным содержанием белка. В
настоящее время доступны и могут использоваться многие белки и
калорийные добавки. Продукты, которые имеют большой риск
контаминации инфекционными микроорганизмами (такими как
Salmonella, Listeria, Giardia, и Campilobacter), должны быть исключены из
применения.
Стимуляторы аппетита могут быть полезными у некоторых детей,
однако при применении таких препаратов калорийность пищи редко
удавалось увеличить более чем на 10%. Питание через назо-гастральный зонд
может понадобиться в условиях значительной потери массы тела и анорексии.
Дети лучше принимают обычные пищевые продукты, и они более удобны, чем
питание через назо-гастральные зонды. Полное парентеральное питание (ППП)
613
- это обычно последняя возможность. Прежде чем перейти на ППП, необходимо
тщательно оценить риск, связанный с постоянным катетером (включая
ассоциированную с ним инфекцию), и качество жизни, и стоимость этого
мероприятия. Замедление развития ребенка - частая проблема при ВИЧ-
инфекции, однако, в последнее время получены обнадеживающие результаты
предварительного изучения гормона роста у детей с ВИЧ-инфекцией.
Иммунизация
Для ВИЧ-инфицированных детей рекомендуется следующая схема
вакцинации (MMWR Morb Mortal Wkly Rep. 1995):
• Рутинная иммунизация: вакцина против гепатита В; дифтерийный и
столбнячный анатоксины; бесклеточная коклюшно-дифтерийно-столбнячная
вакцина; вакцина против Haemophilus influenzae типа b.
• Рутинная иммунизация с исключениями: вакцина против кори-
паротита-краснухи не должна применяться, если у ребенка
иммунологическая категория 3, предложенная Центрами по профилактике
и контролю болезней (CDC), в связи с возможной диссеминацией живых
аттенуированных вирусов; по той же причине вакцинация против ветрянки
противопоказана.
• Модифицированная вакцинация: ВИЧ-инфицированным детям и детям,
имеющим контакты с ВИЧ-инфицированными детьми, вместо оральной
полиомиелитной вакцины следует давать убитую (инактивированную)
полиомиелитную вакцину, так как живые полиовирусы из оральной вакцины
могут длительное время выделяться с фекалиями и вызывать вакцин-
ассоциированные заболевания у иммунокопрометированных больных.
• Дополнительная иммунизация: детям в возрасте два года и старше
рекомендуется пневмококковая вакцина. Рекомендуется также детей старше
6 месяцев и членов их семей ежегодно вакцинировать против гриппа.
Скрининг на туберкулез
У ВИЧ-инфицированных детей и членов их семей рекомендуется
проводить ежегодное тестирование на туберкулез. Реакция Манту должна
ставиться вместе с контролем для выявления анергии. Если у ребенка
отсутствует реакция на туберкулин, то рекомендуют проводить ежегодную
рентгенографию легких. В США плановая иммунизация вакциной БЦЖ не
проводится. Однако во многих странах иммунизацию против туберкулеза
обычно проводят в первые месяцы жизни. Применение вакцины БЦЖ у
ВИЧ-инфицированных детей без каких-либо симптомов заболевания не привело
к повышению риска диссеминации Mycobacterium bovis. Тем не менее,
существует потенциальный риск такой диссеминации, поэтому не следует
проводить иммунизацию детям с умеренными или выраженными проявлениями
иммуносуспрессии.
614
Пассивная иммунизация
Если ВИЧ-инфицированный ребенок контактировал с больным ветряной
оспой, ему показано в течение 72 часов от момента контакта ввести
внутримышечно противоветряночный иммуноглобулин, если известно, что
у этого ребенка нет необходимого количества антител или он ранее не болел
ветрянкой.
Ведение больных с оппортунистическими инфекциями
Лечение младенцев и детей с ВИЧ инфекцией должно проводиться
комплексно с учетом вторичных и оппортунистических инфекций. До
появления высокоактивной антиретровирусной терапии повышение
выживания среди ВИЧ-инфицированных детей достигалось, в первую
очередь, за счет правильной первичной и вторичной профилактики
оппортунистических инфекций (ОИ), а также за счет ранней диагностики и
лечения. Далее представлены современные профилактические и
терапевтические схемы.
Пневмония, вызванная Pneumocystis carinei
До появления современных рекомендаций: у детей, родившихся от
ВИЧ-инфицированных женщин, в возрасте 6 недель начинать профилактику
пневмоцистной пневмонии (ПЦП), эта инфекция была самой частой
оппортунистической инфекцией у детей. В результате внедрения этих
рекомендаций заболеваемость ПЦП среди ВИЧ-инфицированных детей
значительно снизилась. У детей ПЦП чаще всего возникает в возрасте 3
месяцев, т.е. во время первого контакта с микроорганизмами окружающей
среды. Пневмоцистная пневмония может развиться и у старших детей, у
которых имеется быстрое снижение количества лимфоцитов CD4+.
Профилактика пневмоцистной пневмонии у детей проводится с учетом
уровня CD4 лимфоцитов (таблица 104).
Первичная профилактика ПЦП у детей:
• Триметоприм-сульфаметоксазол: пероральный прием по 150 мг/м2 в
сутки 3 раза в неделю в течение трех последовательных дней.
• Дапсон: по 2 мг/кг перорально один раз в день.
• Пентамидин в виде аэрозоля: (дети старше 5 лет); по 300 мг назначают
через ингалятор «Респригард-2» ежемесячно (MMWR 1995, 44, RR-4; 1-11).
615
Таблица 104
Рекомендации CDC по профилактике ПЦП у детей
От рождения до 6 недель - ребенок, контактный по ВИЧ- инфекции Профилактика не проводится
От 6 недель до 4 месяцев - ребенок, контактный по ВИЧ- инфекции Профилактика проводится
От 4 до 12 месяцев - наличие ВИЧ-инфекции не уточнено или подтверждено Проводится профилактика
От 4 до 12 месяцев - ВИЧ-инфекция исключена Профилактика не проводится
1-2 года. У ВИЧ-инфицированного ребенка число лимфоцитов CD4-r менее 750 клеток/мм3 или меньше 15% Проводится профилактика
2-5 лет, у ВИЧ-инфицированного ребенка число лимфоцитов CD4 менее 500 клеток/мм3 или меньше 15% Проводится профилактика
От 5 лет, у ВИЧ-инфицированного ребенка число лимфоцитов CD4- менее 200 клеток/мм3 или меньше 15% Проводится профилактика
Ребенок любого возраста, болевший ранее ПЦП Рекомендуется пожизненная профилактика
Пневмоцистная пневмония может возникнуть у детей в возрасте до
12 месяцев, у которых абсолютное количество лимфоцитов CD4+ ниже
1500 клеток/мм3. Первичное лечение ПЦП начинается с внутривенного
введения триметоприм-сульфаметоксазола (суточная доза триметоприма
составляет 15-20 мг/кг/день в четыре приема).
Схема 7
Алгоритм диагностики ВИЧ инфекции у младенцев 1 месяца -
_______________ВИЧ культура или ПЦР_____________________
| Начало профилактики пневмоцистной пневмонии (ПЦП) |
ПЦР или ВИЧ культура позитивны: - повтори для подтверждения продолжай профилактику - установи стадию болезни - назначь терапию - передай в службу терапевтической помощи ПЦР или ВИЧ культура негативны: - повтори к 4-6 месяцам - продолжай профилактику определяй симптомы болезни и ее признаки
|Культура или ПЦР позитивны|
ПЦР или ВИЧ-культура негативны:
- установив неинфицированность,
прекратить профилактику
- подтверди антиВИЧ исследованием
616
Появление высокоактивной антиретровирусной терапии привело к
повышению числаСЭ4+у детей, у которых до лечения были низкие показатели
CD4+. Однако данные о степени иммунологического восстановления после
эффективной терапии весьма противоречивы. Результаты клинических
испытаний, оценивающие, можно ли прекратить профилактику у детей со
значительным повышением количестваCD4+ клеток после антиретровирусной
терапии, все еще окончательно не оценены. Иммунологические функции и
масштабы восстановления клеток CD4+ не известны. В связи с недостаточной
информацией будет предусмотрительно продолжать профилактическое лечение
детям, у которых были низкие показатели количества лимфоцитов CD4+, а
теперь имеются значения, близкие к нормальным.
Грибковые инфекции
У ВИЧ-инфицированных детей часто возникают рецидивы грибковых
инфекций. В частности, доминирующим микозом является кандидоз
слизистых оболочек полости рта (“молочница”). Кандидоз пищевода может
возникать при прогрессирующей ВИЧ-инфекции и вызывать дискомфорт,
затруднение при глотании и анорексию. У ВИЧ-инфицированных детей
функция нейтрофилов не столь нарушена, как лимфоцитов, поэтому,
генерализованная фунгемия встречается редко. Следует всегда помнить о
возможности развития таких осложнений у тех пациентов, у кого имеются
постоянные катетеры или у которых отмечается нейтропения.
Кандидоз слизистых оболочек полости рта можно лечить местным
применением клотримазола или миконазола. Обычно нистатин не эффективен
у детей, у которых имеется рецидив молочницы. Если лечение не помогает,
то используйте флуконазол, итраконазол или кетоконазол. Продолжительная
профилактическая терапия может привести к формированию устойчивости,
поэтому лучше лечить каждый эпизод инфекции отдельно. Инвазивный
кандидоз следует лечить курсом внутривенного амфотерицина В. Поражения
кожи, вызванные Candida, обычно лечат местными препаратами.
Онихомикозы, обусловленные Candida или Trichophyton, могут быть
вылечены флуконазолом, итраконазолом или гризеофульвином, но, как
правило, требуется пролонгированный курс.
Криптококковый менингит у детей развивается редко. Диагноз
устанавливают по наличию криптококкового антигена в СМЖ или благодаря
идентификации организмов в тушевых препаратах или при использовании
других способов окраски. После начального курса лечения амфотерицином
В и. флуцитозином (препарат 5FC) следует проводить поддерживающую
терапию флуконазолом и интраконазолом.
40. Заказ№ К-4451.
617
Вирусные инфекции
Цитомегаловирусная инфекция (ЦМВ) часто вызывает множество
проблем у детей с прогрессирующим течением ВИЧ-инфекции. Клиническими
проявлениями ЦМВ-инфекции могут быть ретинит, энцефалит, колит, эзофагит
или пневмония. Цитомегаловирусный ретинит встречается у детей редко: при
обследовании 116 детей с количеством лимфоцитов CD4+ <50 клеток/мм3, ЦМВ
ретинит отмечался у 3,4% пациентов (Du L.T. et al., 1999). Диагноз ставят на
основании результатов исследования биоптатов, так как периодическое
появление ЦМВ в моче отмечается нередко и демонстрирует только наличие
колонизации. Лечение ЦМВ-инфекции состоит во внутривенном введении
ганцикловира или фоскарнета; оправдана поддерживающая терапия.
Рецидивирующий ретинит является частым осложнением и требует повторной
терапии ганцикловиром или фоскарнетом. При пероральном приеме
ганцикловир имеет слабую биоуевояемость; имеются сообщения о его
неэффективности при ЦМВ-инфекции. Количественный анализ наЦМВ поможет
лучше организовать профилактическое лечение, если имеются достоверные
критерии прогноза заболевания. ЦМВ-инфекция у детей была ассоциирована с
повышенной частотой прогрессирования ВИЧ-инфекции (Kovacs A. etal., 1999).
У ВИЧ-инфицированных детей также могут возникать рецидивы
герпетической инфекции, обусловленной вирусом простого герпеса (ВПГ);
они требуют профилактики или лечения ацикловиром перорально. Инфекция,
вызванная вирусом ветряной оспы - опоясывающего лишая (varicella zoster
virus), может протекать более тяжело, чем у иммунокомпетентных больных.
К тому же у ВИЧ-инфицированных детей могут быть рецидивы
опоясывающего герпеса (герпеса зостера), которые вовлекают один или
несколько дерматомов. Одно из уникальных проявлений герпетической
инфекции - это рецидив ветряной оспы. Повторные эпизоды менее серьезны,
чем предыдущие, а поражения обычно типичны, везикулярные, в виде зерен
и безболезненные. Прямой метод флуоресцирующих антител или
культуральные исследования соскобов позволяют выявить наличие вируса.
Больных с тяжелой герпес-зостерной инфекцией следует лечить
ацикловиром внутривенно, который можно затем заменить пероральным
ацикловиром. У вируса простого герпеса и ветряной оспы - опоясывающего
лишая может развиться устойчивость к ацикловиру, особенно в тех случаях,
когда препарат используют для проведения поддерживающей терапии.
Микобактериальные инфекции
Дети с ВИЧ-инфекцией являются особенно чувствительными к
инфекциям, обусловленным микобактериями. Контакт с туберкулезными
бактериями происходит весьма нередко, причем среди ВИЧ-
инфицированных взрослых превалируют полирезистентные штаммы
микобактерий туберкулеза. Терапию обычно начинают изониазидом.
618
рифампицином и пиразинамидом, а в случаях внелегочного туберкулеза можно
добавить аминогликозид (стрептомицин или амикацин). Этамбутол у детей
младше 4 лет не применяют из-за риска токсического неврита зрительного нерва.
Использование этого препарата требует тщательного офтальмологического
наблюдения. Детям, которые находятся в контакте с больными активными
формами туберкулеза, рекомендуется профилактическое лечение изониазидом.
У ВИЧ-инфицированных детей реакция Манту диаметром 5 мм и более
рассматривается как положительная. При отсутствии признаков активного
заболевания (отсутствие симптомов или нормальная картина на
рентгенограмме) дети с положительными результатами внутрикожных тестов
должны получать терапию изониазидом в течение 9 месяцев.
Диссеминированная инфекция, вызванная бактериями комплекса
Mycobacterium avium intracellulare (MAI или MAC), является частым
осложнением у детей со значительной степенью прогрессирования ВИЧ-
инфекции. Для борьбы с этим заболеванием нередко можно с успехом
использовать комбинацию из двух или трех препаратов, включая макролиды
(кларитромицин или азитромицин), рифабутин и этамбутол. Можно
применять и другие препараты, активные в отношении комплекса
Mycobacterium avium intracellulare, в том числе амикацин, клофазимин и
ципрофлоксацин. Развитие комплекса Mycobacterium avium intracellulare в
целом является терминальным событием и признаком тяжелого
иммунодефицита. Улучшение состояния ВИЧ-инфицированных пациентов
с помощью высоко активной антиретровирусной терапии может привести
к значительному подавлению инфекции, вызванной бактериями комплекса
Mycobacterium avium intracellulare. Профилактику микобактериальной
инфекции, обусловленной комплексом Mycobacterium avium intracellulare,
рекомендуется проводить тем детям в возрасте 6 лет и старше, у кого
количество клеток CD4+ <75/мм3Для профилактики можно использовать
рифабутин, кларитромицин или азитромицин. Из-за взаимодействия
рифабутина с ингибиторами протеазы для этого в настоящее время чаще
используют макролиды.
Криптоспоридиоз
Криптоспоридии являются возбудителями хронической
водянистой диареи у ВИЧ-инфицированных детей. Инфекцию очень трудно
санировать. Клиническое ведение заключается в возмещении жидкости,
дополнительном питании и применении антидиарейных препаратов.
Паромомицин, как и азитромицин, был эффективен в ликвидации симптомов
заболевания. Опыт применения обоих препаратов у детей в этом направлении
ограничен. Октреотид (аналог соматостатина) также помогал при тяжелых
диареях. Препараты применяют подкожно или внутривенно; побочным
эффектом является панкреатит.
40*
619
Токсоплазмоз
Токсоплазмоз является редким поражением ЦНС у ВИЧ-инфицированных
детей. У взрослых заболевание обычно развивается в результате реактивации
имеющейся инфекции. У детей заболевание является следствием вертикального
инфицирования. Для лечения применяют пириметамин, сульфадиазин и
фолиновую кислоту. Клиндамицин может использоваться в случаях
гиперчувствительности к сульфаниламидам. Рекомендуют проводить
поддерживающую терапию.
Рецидивирующие бактериальные инфекции
Рецидивы серьезных бактериальных инфекций, особенно вызванные
Streptococcus pneumoniae, Staphylococcus aureus и Haemophilus influenzae,
являются основными клиническими проявлениями у ВИЧ-
инфицированных детей, причем очень часто возникают пневмонии. ВИЧ-
инфицированным детям с гипогаммаглобулинемией, со слабой выработкой
поствакцинальных антител или с рецидивирующими инфекциями назначают
внутривенный иммуноглобулин, который дают в профилактических целях
каждые 4 часа. Еще одним показанием для назначения внутривенного
иммуноглобулина является торпидное течение инфекции на фоне
стандартного антибактериального лечения. Профилактика триметопримом-
сульфаметоксазолом также эффективна для предотвращения рецидивов
бактериальных инфекций.
ВИЧ-энцефалопатия
Поражение ЦНС является частым проявлением ВИЧ-инфекции у детей
и приводит к когнитивным и моторным нарушениям. Оппортунистические
инфекции, связанные с ВИЧ, и опухоли могут вызвать дисфункцию нервной
системы, хотя большинство случаев поражения ЦНС связаны с самой
ВИЧ-инфекцией. Вирус иммунодефицита способен инфицировать
микроглию. В ряде исследований измеряли вирусную нагрузку в спинно-
мозговой жидкости с помощью ПЦР на РНК ВИЧ и в тканях мозга с
помощью ПЦР на ДНК и связывали повышения вирусной нагрузки с
когнитивными нарушениями. Антиретровирусная терапия полезна у
пациентов с поражениями ЦНС вирусом иммунодефицита, особенно
зидовудин и ставудин, которые эффективно проникают через гемато-
энцефалический барьер. Ингибиторы протеазы не достигают высоких
концентраций в ЦНС, однако улучшение неврологического статуса после лечения
этими препаратами может быть обусловлено непрямым механизмом снижения
количества вирусов.
ВИЧ-энцефалопатия проявляется задержкой умственного развития или
регрессивными изменениями у детей младшего возраста, ухудшением
620
образности речи у детей в возрасте от 2 до 4 лет и аномалиям поведения с
потерей концентрации и памяти у старших детей. Прогрессирующие моторные
знаки, особенно спастическая диплегия и оральная моторная дисфункция,
являются выраженными признаками, в частности, в самом начале
энцефалопатии. Приобретенная микроэнцефалопатия может протекать с
атрофией мозга или кальцификацией базальных ганглиев. Тяжелая
энцефалопатия с началом в первые 12 месяцев жизни встречается в подгруппе
детей с вертикальной передачей инфекции и быстрым прогрессированием
заболевания и имеет плохой прогноз.
Трудно дифференцировать ранние признаки энцефалопатии от
нарушений функции, обусловленных хроническим заболеванием, плохими
социальными условиями или отрицательным эмоциональным окружением,
особенно у детей более старшего возраста. Таким образом, наблюдение за
развитием неврологических изменений является важной частью ухода за
ВИЧ-инфицированными детьми. Оценка должна проводиться
мульдисциплинарной группой, включающей клинического психолога,
детского психолога и, если требуется, логопеда и специалиста по
трудотерапии.
Лимфоидная интерстициальная пневмония
ЛИП - это частое легочное проявление у ВИЧ-инфицированных детей.
Такое заболевание редко возникает у взрослых. ЛИП превалирует у
перинатально зараженных ВИЧ-инфицированных детей по сравнению с
детьми, приобретшими инфекцию позже. ЛИП связана с первичным
контактом с вирусом Эпштейна-Барр и может также отражать частный ответ
развивающейся иммунной системы на ВИЧ. У некоторых детей, несмотря
на рентгенологические изменения, втечение многих лет могут отсутствовать
симптомы, поэтому лечение не требуется. У других развиваются вторичные
бактериальные инфекции, которые требуют проведения агрессивной терапии
для избежания поражения легких. У многих развивается одышка или
обструктивные заболевания. В таких случаях терапия ингаляционными В-
агонистами могла быть полезной. У некоторых детей развиваются
бронхоэктазы, причем у многих больных они прогрессируют в хроническую
дыхательную недостаточность, сходную с кистозным фиброзом
(муковисцидозом). Длительная антибактериальная терапия и
физиотерапия могут принести пользу. В некоторых случаях используют
гормональные препараты, когда в результате ЛИП развивается гипоксия. В
предыдущей классификации педиатрической ВИЧ-инфекции, предложенной
Центрами по профилактике и контролю болезней (CDC), ЛИП включался в
категорию СПИД-индикаторных заболеваний. Однако в связи с тем, что дети с
ЛИП имели лучший прогноз, чем дети с другими состояниями, в последние
621
годы ЛИП не относят к состояниям, характерным для тяжелых форм
иммунодефицита (клиническая категория «С») (MMWR Morb. Mortal. Wkly Rep.
1994).
Другие клинические проявления ВИЧ-инфекции
У детей с ВИЧ-инфекцией могут появиться симптомы заболевания почек
(ВИЧ-нефропатия), которые могут варьировать от изолированной протеинурии
до тяжелого нефротического синдрома и почечной недостаточности. Полностью
развившаяся ВИЧ-нефропатия - не частое клиническое проявление; однако
изолированная протеинурия нередко может не диагностироваться в течение
длительного времени. Патофизиология поражения почек при ВИЧ-инфекции
еще не изучена.
ВИЧ-миокардиопатия - также позднее проявление ВИЧ-инфекции у
детей. Сердечные и легочные осложнения ВИЧ-инфекции у детей изучались
в многоцентровом исследовании Группой по педиатрическим сердечно-
легочным осложнениям вертикально передающейся ВИЧ-инфекции.
Заболевания сердца в этой популяции пациентов обнаруживали чаще, чем
ожидалось. Небольшие отклонения в сердечной деятельности были найдены
у значительной части детей. Застойная сердечная недостаточность была
частой находкой при прогрессирующей ВИЧ-инфекции. Патогенез
поражений сердца при ВИЧ-инфекции находится в стадии изучения.
Гематологические осложнения возникают при ВИЧ-инфекции часто.
Тромбоцитопения может развиться при антиретровирусной терапии, хотя
аутоиммунный механизм также может проявляться. Лечение
предусматривает внутривенное введение иммуноглобулина, антирезусных
антител и гормональных препаратов. Нейтропения также является частой
лабораторной находкой, связанной с ВИЧ или специфическими
антиретровирусными препаратами. Если снижение дозы не ликвидирует
проблему (особенно часто это касается лечения зидовудином), то оправдано
применение колониестимулирующего фактора. Анемия связана с
применением зидовудина, с частым взятием крови на анализы (особенно у
детей младшего возраста) и с прогрессированием заболевания. Панцитопения
часто обнаруживается у пациентов с микобактериальными инфекциями в
связи с диссименацией MAI в костном мозге.
622
Приложение 1
График и объем обследования детей, рожденных от ВИЧ-ннфицированных матерей
Процедура Сроки (месяцы)
При рождении 1 2 3 \ 4 6 9 12 15* 18 24
Физикальное обследование -г 4- + i + 4- + 4- + + +
Антропометрическое обследование -г 4- + ; + 4- + -4- +
Оценка физического и психомоторного развития 4- + + + + 4- + •f +
Регистрация связанных с ВИЧ заболеваний 4- + + + + 4- 4- + +
Рентгенография грудной клетки
Уровень CD4 лимфоцитов + + + + + + +
РНК ВИЧ При наличии лабораторной базы
ИФА, ИБ 4 Lt J + + — + + + _|_*** + + +
Общий анализ крови 4-
Биохимический анализ крови + + + 4- 4- 4- +
Общий анализ мочи 4- + + + + 4- 4“ +
Исследования на маркеры гепатитов В и С 4- + + + 4- +
Содержание иммуноглобулинов или протеинограмма +
Серологические исследования на сифилис, ВГВ, ВГС, ВПГ, ЦМВ, токсоплазмоз + + + + +
Цитологические исследования на ЦМВ слюны и мочи + + + 4- +
Примечание: *Исследования проводятся при наличии при предыдущем обследовании клинических и лабораторных
признаков ВИЧ.
**При положительном результате предыдущего исследования
***При отрицательном результате предыдущего исследования
Приложение 2
Показания к антиретровирусной терапии детям с ВИЧ инфекцией
Guidelines for use of antiretroviral agent
in pediatric HIV infection. December 14, 2001
> Клинические симптомы, категории А, В или С
> Иммуносупрессия при CD4 Т клетках (абсолютного числа или
%) 2 или 3 иммунологической категории
> Возраст моложе 12 месяцев в соответствии с клиническим,
иммунологическим или вирусологическим статусом
> Для бессимптомной ВИЧ инфекции у детей 1 года и старше с
нормальным иммунным статусом предлагаются 2 выбора.
Выбор 1. Начать лечение независимо от возраста и симптомов.
Выбор 2. Воздержаться от лечения, если низок риск прогрессии
болезни, имеются сложности по соблюдению режима лечения. При этом
обязателен иммунологический или вирусологический мониторинг.
Факторы, которые должны быть решающими для назначения терапии:
> Высокая или нарастающая вирусная нагрузка (количество копий
РНК ВИЧ/мл плазмы)
> Быстрое снижение числа или % содержания CD4 Т лимфоцитов,
указывающих на умеренную иммуносупрессию (категория 2).
> Развитие клинических симптомов.
624
Приложение 3
Рекомендуемые антиретровирусные режимы для начала терапии
у ВИЧ инфицированных детей
Настоятельно рекомендуется
Клинические испытания показывают существенное улучшение и устойчивое
подавление репликации ВИЧ:
один высокоактивный ингибитор протеазы (нельфинавир или ритонавир)
т два нуклеозидных аналога обратной транскриптазы. Рекомендуется комбинация АЗТ и
ddl, АЗТ и ЗТС и зерита с ddl. Недостаточно данных о комбинации зерита и ЗТС и зерита
и ddC*.
Для детей, которые могут глотать капсулы: ненуклеозидные ингибиторы
обратной транскриптазы (эфавиренц) + 2 ингибитора обратной транскприптазы или
эфавиренц** + нельфинавир и один ингибитор обратной транскриптазы.
Альтернативные рекомендации
Клинические испытания свидетельствуют об отчетливой супрессии ВИЧ
репликации, но 1) длительность лечения у детей достаточно не изучена, 2) эффективность
лечения снижается за счет побочных эффектов. 3) ограниченный опыт работы с
младенцами и детьми.
Невирапин и два ингибитора обратной транскриптазы
абакавир в комбинации с АЗТ и ЗТС
лопинавир/ритонавир с двумя ингибиторами обратной транскриптазы или
одним нуклеозидным ингибитором обратной транскриптазы и одним ненуклеозидным.
индинавир или саквинавир с мягких желатиновых капсулах и два
нуклеозидных ингибитора обратной транскриптазы для детей, которые могут глотать
капсулы.
Предлагается только при особых обстоятельствах
Клинические испытания свидетельствуют: 1) супрессия репликации вируса менее
продолжительна, чем при первых двух режимах 2) данные предварительные или
неоднозначные для применения первичной терапии, но могут быть с определенным
основанием использованы.
• два ингибитора обратной транскриптазы
ампренавир в комбинации с двумя ингибиторами обратной транскриптазы
или абакавиром.
Не рекомендуется
Вследствие: I) возможной перекрестной токсичности и/или 2) вирусологической
несостоятельности
любая монотерапия**
зерит и АЗТ
ddC и ddl
ddC и зерит
• ddC и ЗТС
* ddC отсутствует в жидкой форме и наименее показан в сочетании с АЗТ
** Исключая АЗТ профилактику, назначаемую младенцам втечение первых шести
недель жизни для профилактики перинатальной ВИЧ трансмиссии. Если у младенцев
подтверждается ВИЧ инфекция, по завершению АЗТ профилактики терапия должна быть
изменена на комбинированный режим антиретровирусных препаратов.
625
Приложение 4
Предложения по изменению режимов антиретровирусной
терапии у детей
Guidelines ARV agents in Pediatric HIV infection,
December 14, 2001
Вирусологические данные
• менее чем на 1,0 log|0 снижение ВН (копий РНК ВИЧ) спустя 8-
12 недель от начала терапии для тех, кто получает тритерапию. Для тех, кто
получает битерапию, снижение ВН не менее чем 0,7 log|0 от исходной.
• ВН не снижается до неопределяемого уровня спустя 4-6 месяцев
от начала лечения.
• Повторно повышение ВН у тех, у кого она снизилась до
неопределяемой.
• Увеличение ВН у детей, у которых она резко снизилась, но не
удалось достичь неопределяемого уровня, после лечения более чем в 3 раза
(0,5 logl0) у детей моложе 2 лет или более чем в 5 раз (0,7 log10) у детей
старше 2 лет.
Иммунологические данные
• Изменение иммунологической категории.
• Для детей с CD4 Т клетками менее чем 15% (3 иммунологическая
категория) еще большее снижение (до 10%).
• Быстрое или сохраняющееся снижение абсолютного количества
CD4 Т лимфоцитов (более чем на 30% за 6 месяцев).
Клинические данные
• Прогрессирующая неврологическая симптоматика.
• Замедление роста или неуклонное снижение веса, несмотря на
полноценную диету и отсутствие других причин.
• Изменение клинической категории (например, переход категории
А в категорию В).
626
Приложение 5
Суточная доза применяемых в детской практике антиретровирусных препаратов (Boeringer Ingelheim)*
Группа/препарат Средняя доза у детей Примечания
1 2 3
Ненуклеозидные ингибиторы обратной транскриптазы
Невирапин (10 мг/м.т) Начальная доза 4 мг/кг в течение 14 дней; Затем поддерживающая доза: у детей >2 мес<8 лет - 7 мг/кг два раза в день; У детей >8 лет - 4 мг/кг два раза в день. Максимальная рекомендуемая доза: 400 мг/сут. Суспензия со сладким вкусом. Перед каждым применением следует осторожно встряхнуть. Одобрена к применению у детей старше 2 месяцев. Хранить при комнатной температуре.
Эфавиренц (50 мг, 100 мг, 200 мг) 200 мг один раз в день (10-15 кг) 250 мг один раз в день (15-20 кг) 300 мг один раз в день (20-25 кг) 350 мг один раз в день (25-32,5 кг) 400 мг один раз в день (32,5-40 кг) 600 мг один раз в день (>40 кг) Применяется у детей старше 3 лет с массой тела более 10 кг и способных проглатывать твердые капсулы
Аналоги нуклеозидов
Абакавир (раствор, содержащий абакавира сульфат в количестве, эквивалентном 20 мг/мл абакавира) 8 мг/мл в сутки у детей от 3 месяцев до 16 лет. Максимальная доза: 600 мг/сут. Принимать вне зависимости от приема пищи. Хранить при температуре 20-25°С.
Ламивудин (ЗТС, 10 мл/мг) 4 мг/кг два раза в день у детей от 3 месяцев до 16 лет. Максимальная доза: 300 мг/сут. Раствор для приема внутрь. Принимать вне зависимости от приема пищи. Хранить при температуре 2-ЗО°С.
Ставудин (d4T, 1 мг/мл) 1 мг/кг через каждые 12 часов (<30 кг) 30 мг два раза в день (30-59 кг) 40 мг два раза в день (>60 кг) Раствор для приема внутрь (после растворения порошка) следует хранить в холодильнике при температуре 2-8°С. Перед употреблением взбалтывать. Срок хранения 30 дней.
627
® Дозы основаны на рекомендациях производителей препаратов и одобрены в США и/или в Европе. Альтернативные режимы дозирования
некоторыех препаратов в настоящее время изучаются.
1 2 3
Диданозин (ddl. 10 мл/мг) 120 мг/м2 каждые 12 часов Раствор для приема внутрь (приготовленный из порошка). Хорошо взбалтать перед применением. 1 Хранить в холодильнике (2-8°С). Принимать более । чем за 30 мин до и 2 часа после еды. ,
Зидовудин (Z.DV или AZT, 50 мг/мл) Профилактическая доза (доношенный новорожденный: 2 мг/кг внутрь через каждые 6 часов в течение 6 недель, начиная с 12 часов после рождения. 180 мг/м" (720 мг/м2) через каждые 6 часов. Максимальная доза не должна превышать 200 мг/6 часов Сироп с запахом клубники. Хранить при температуре ' 15-25°С. 1 i
Ингибиторы протеазы 1
Нелфинавира мезилат (50 мг в одной мерной ложке (1 г)) 20-30 мг/кт три раза в день у детей в возрасте 2-13 лет Раствор для приема внутрь (приготовленный из j порошка). Срок хранения раствора 6 часов (можно j смешивать с небольшим количеством воды, молока, детской питательной смеси, соевого детского | питания, соевых или молочных пищевых добавок). При добавлении кислых продуктов или соков раствор ' приобретает горький вкус. Принимать во время еды | или легкой закуски. Следует принимать через 1 час । после или за 2 часа до приема ddl.
Ритонавир (80 мг/мл) Начальная доза 250 мг/м' через каждые 12 часов. Дозу увеличивают на 50 мг/м2 2 раза в день каждые 2-3 дня до 400 мг/.м" 2 раза в день (рекомендуемая доза). Если рекомендуемая доза обладает низкой переносимостью, следует использовать максимальную дозу с хорошей переносимостью. Максималызая доза: 600 мг2_р в дены _ _ _ _ Раствор для приема внутрь. Не охлаждать. Хранить | при температуре 20-25°С. Хорошо взболтать перед | применением. Не применять после истечения срока > годности. I I
* Дозы основаны на рекомендациях производителей препаратов и одобрены в США и/или в Европе. Альтернативные режимы дозирования
некоторых препаратов в настоящее время изучаются.
**Дозы представлены в расчете на I кг массы тела или на 1 м" поверхности тела.
Поверхность тела - роетз'(с.мхмасса тела (кг)/3600)
Приложение 6
Применение Вирамуна® в педиатрической практике
Вирамун® (невирапин) Регистрационное удостоверение, таблетки N I1-8-242-N 011046
Вирамун® (невирапин) Регистрационное удостоверение, суспензия N П N 011661/01 -2000
Преимущества препарата:
1. Высокоэффективен в начальной и поддерживающей антиретровирусной
комбинированной терапии у детей, как с низкой, так и с высокой вирусной нагрузкой.
2. Вирамун* обладает уникальной биодоступностью среди антиретровирусных
препаратов - более 90%. Препарат быстро проникает во все органы и ткани, включая
плаценту; нервную систему и грудное молоко.
3. Снижение относительного риска при вертикальной трансмиссии составляет
42% после 18 месяцев в условиях грудного вскармливания!
4. Наиболее экономически выгоден среди препаратов класса ННИОТ и класса ИП.
5. Широкие возможности комбинации в схемах с другими антиретровирусными
препаратами и препаратами для лечения оппортунистических инфекций.
6. Вирамун' хорошо переносится больными:
- Со времени регистрации Вирамуна' в СШЛ (1996) не наблюдалось пи одного
неожиданного побочного явления.
- Нс влияет па психический статус больного.
- Не вызывает липодистрофию.
7. Вирамун" удобен в применении:
- Достаточно однократного приема в сутки.
- Прием препарата нс связан с приёмом пищи.
8. Вирамун' одобрен М3 РФ для лечения взрослых и детей.
• Развитие программы клинического применения невирапина у детей и взрослых
проводилось одновременно.
• В СШЛ и в Европейском сообществе Вирамун' одобрен к применению в
сочетании с другими антиретровирусными средствами для лечения ВИЧ-1
инфицированных детей.
• Комбинированное лечение, включающее невирапин, эффективно применяется
у детей и сопровождается вирусологическим и иммунным ответом. Некоторые дети
находятся на лечении Вирамуном* более 6 лет.
Рекомендуемые дозы для дегей.
• Рекомендуемая доза Вирамуна® для детей в возрасте от двух месяцев до восьми
лет при пероральном назначении составляет 4 мг/кг массы тела один раз в день в течение
двух недель, затем 7 мг/кг два раза в день.
• Рекомендуемая доза Вирамуна® для детей старше восьми лет при пероральном
назначении составляет 4 мг/кг массы тела один раз в день в течение двух недель, затем 4
мг/кг два раза в день.
Общая суточная доза для любого пациента не должна превышать 400 мг (Dransfield
et al. 1998 (U98-3028 and U98-3031).
629
Дозировка Вирамуна в суспензии для детей
Возраст от 2 мес до 8 лет (пе| эвые 2 недели)
Доза Вирамуна в первые две недели (в мг на кг веса) Вес больного (в кг) Суточная доза (в мг) Доза в первые 2 недели (в мг) Кол-во флаконов в месяц
4 3 12 14 168 2400 0,07
4 4 16 14 224 2400 0,09
4 5 20 14 280 2400 0,12
4 6 24 14 336 2400 0,14
4 7 28 14 392 2400 0,16
4 8 32 14 448 2400 0,19
4 9 36 14 504 2400 0,21
4 10 40 14 560 2400 0,23
4 20 80 14 1120 2400 0,47
4 30 120 14 1680 2400 0,70
4 40 160 14 2240 2400 0,93
- доза 1 раз в день
Возраст от 2 мес до 8 лет (остальной период)
Месячная доза Вирамуна (в mi- на кг веса тела) вес больного (в кг) Суточная доза (в мг) Месячная лоза КОЛ-ВО флаконов в месяц
7 3 42 30 1260 2400 0,53
7 4 56 30 1680 2400 0,70
7 5 70 30 2100 2400 0,88
7 6 84 30 2520 2400 1,05
7 7 98 30 2940 2400 1,23
7 8 112 30 3360 2400 1,40
7 9 126 30 3780 2400 1,58
7 10 140 30 4200 2400 1,75
7 20 280 30 8400 2400 3,50
7 30 420 30 12600 2400 5,25
7 40 560 30 16800 2400 7,00
доза 2 раза в день
- суточная доза превышает 400 мг
630
Приложение 7
Расчет дозировок лекарственных препаратов для детей
Длина тела
3 «
£ 1 см
О а
X г95
УО"- -90
10"- -85
8"- -80
Г6~- i-75
V— ^-70
X'- -85
Z0"- -60
10"- -55
8— -50
1'6"- -45
V— -40
2"~ -ЗБ
1'0'—' -30
10”- -25
Масса теле
Фунты кг
6S-*-30
«н;
55-i -25
: •
«И :
«i -20
ад-:
35-
-15
30-
• .
25; .
; г-10
20- L 9
к а
15- Г 7
7 6
' ~ 5
io-:
' - 4
5-;
2
Приложение 8
Психологические аспекты, связанные с ВИЧ-инфекцией
у женщин и детей (материалы Канадско-Российского проекта по СПИДу)
- Решение: сохранение/прерывание беременности у ВИЧ-
инфицированных родителей;
- Сложности определения оптимального времени сообщения ВИЧ-
положительному ребенку о его диагнозе;
- Проблемы сообщения родственникам, друзьям, соседям, начальству
на работе о диагнозе ВИЧ-инфекции у ребенка;
- Изоляция и социальная стигматизация;
- Депрессия, горе и дезориентация;
- Невозможность поддерживать “нормальный” образ жизни,
характерный для возраста и стадии развития ребенка;
- Угроза сохранению и функционированию семьи;
- Гнев / чувство вины / обвинение обстоятельств заражения;
- Усталость, вызванная сложностью ухода за больным ребенком;
- Отсутствие необходимых элементарных средств и поддержки;
- Отсутствие финансовых ресурсов;
- У детей более старшего возраста и подростков - проблемы
сексуальности, информации о безопасном сексе, информация о ВИЧ-
инфекции полового партнера, проблемы наркомании, принятие решения в
случае наступления беременности;
- Смерть / горе / проблемы паллиативной терапии.
Психологические аспекты, связанные с ВИЧ-инфекцией у
нескольких членов одной семьи
- Жизнь в условиях неясности о дальнейшей эволюции болезни;
- Страх множественных потерь;
- Чрезмерный груз ответственности, стресс и борьба с ситуацией;
- Нарушение функций родителей / механизмы адаптации;
- Информирование детей о наличии ВИЧ-инфекции у родителей;
- Взаимные чувства гнева, обвинения, вины;
- Изоляция, стигматизация, отсутствие поддержки;
- Горе по поводу ухудшения физического состояния, самооценки,
сексуальности и репродуктивного потенциала;
- Проблемы “родителя-одиночки”;
- Наркомания и бедность;
- Семейная наркомания и одиночество;
- Ожидание (“планирование”) будущих потерь;
- Развитие аффектации/тревожных состояний и других психических
расстройств.
632
Психологическая оценка ожидаемой адаптации семьи к ВИЧ-инфекции
- Информирование ребенка и семьи о диагнозе и реакция на наличие
болезни;
- Убеждения, отношение и ожидания в отношении лечения и исхода;
- Способность противостоять болезни во время предшествовавших
кризисов;
- История депрессивных состояний и/или злоупотребления
наркотиками или алкоголем;
- Характер и стабильность жилища и работы;
- “Качество взаимоотношений” между членами семьи и с близкими
и дальними родственниками;
- Кто обеспокоен диагнозом ВИЧ-инфекции и какова реакция этих
людей?
- Социально-экономический статус семьи;
- Социально-культурные факторы и религиозные верования, которые
могут оказывать влияние на выбор решения о лечении и адаптации;
- История предшествующих потерь;
- Источники эмоциональной и финансовой поддержки; наличие
медицинской страховки;
- Состояние здоровья всех членов семьи.
Специальное консультирование и поддержка детей и семей в Канаде
- Три специализированных поликлиники в провинции Онтарио для
лечения ВИЧ-инфицированных детей при детских больницах;
- Специализированные поликлиники для лечения ВИЧ-
инфицированных детей обеспечивают квалифицированной медицинской
помощью и консультированием для решения соответствующих
психологических, социальных, экономических, диетологических,
функционально-реабилитационных и фармакологических проблем;
- Детальная социально-психологическая оценка и план лечения
многопрофильной командой для каждого ребенка и каждой семьи
- Доступность индивидуальной, парной, семейной и групповой
социально-психологической терапии на местах и в других учреждениях,
которые связаны с ресурсами сообществ;
- Ресурсы сообществ, предлагающих практическую помощь, визиты
в больницу, периодическую разгрузку людей, которые ухаживают за
больными, транспортировка, юридическая защита, лечение детей и уход за
ними, помощь в поисках юридической поддержки, обеспечение диетическими
продуктами и детским питанием, одежда, подгузники и предметы ухода за
детьми;
41. Заказу» К-4451.
633
- Летние лагеря и другие социальные программы для расширения
сети социальной поддержки для ВИЧ-инфицированных детей и
семей;
- Множество "горячих" и "дежурных" телефонных номеров и
печатных материалов для детей и семей, живущих с ВИЧ-
инфекцией и планирующих свое будущее.
Примеры инновационных программ:
Пример 1. Группы поддержки "Идем вместе "
Группы, которые возглавляют представители сообществ
Различные группы для ВИЧ-инфицированных и пораженных эпидемией
детей, рассчитанные на разные возрастные категории (от 6 до 16 лет)
Группы родителей
Темы:
"Кому рассказать и как рассказать"
"Защищайте себя - рассказывайте нс всю правду"
"Проблемы здоровья: медицинская помощь и борьба с инфекциями в
домашних условиях"
"Здоровая сексуальность"
"Борьба со стрессом"
Пример 2. Горячая линия "Матери с риском ВИЧ-инфекции"
Горячая линия, функционирующая при "Больнице для больных детей" и
проводящая бесплатные анонимные консультации по телефону
беременным женщинам и женщинам, которые планируют беременность,
по проблеме "Вертикальная передача ВИЧ-инфекции и правильное
решение во время беременности".
Пример 3. Специализированная «Поликлиника для ВИЧ-инфицированных
детей» в «Больнице для больных детей»
634
Приложение 9
Министерство Здравоохранения Российской Федерации
ПРИКАЗ
19.04.99 №133
О научно-практическом центре профилактики и лечения ВИЧ-инфекции у
беременных женщин и детей
В целях реализации Федерального закона "О предупреждении
распространения в Российской Федерации заболевания, вызываемого
вирусом иммунодефицита человека (ВИЧ-инфекции)" и обеспечения
квалифицированной лечебно-профилактической помощи ВИЧ-
инфицированным беременным женщинам и детям ПРИКАЗЫВАЮ:
1. Создать научно-практический центр профилактики и лечения ВИЧ-
инфекции у беременных женщин и детей Министерства
здравоохранения Российской Федерации (далее Центр) на базе
Республиканской клинической инфекционной больницы
Министерства здравоохранения Российской Федерации (г.Санкт-
Петербург. п.Усть-Ижора) на функциональной основе.
2. Работу центра организовать в соответствии с Положением о научно-
практическом центре профилактики и лечения ВИЧ-инфекции у
беременных женщин и детей (приложение)
3. Обязанности руководителя Центра возложить на главного врача
Республиканской клинической инфекционной больницы
Министерства здравоохранения Российской Федерации Воронина
Е.Е.
4. Научное руководство работой Центра возложить на заведующую
кафедрой инфекционных болезней с курсом лабораторной
диагностики СПИД медицинской академии постдипломного
образования Минздрава России (г. Санкт-Петербург) проф.
Рахманову А.Г.
5. Руководителям органов управления здравоохранением субъектов
Российской Федерации направлять в Центр ВИЧ-инфицированных
беременных женщин и детей на консультацию и лечение в
соответствии с действующим законодательством Российской
Федерации, нормативными и правовыми актами Минздрава России
Контроль за выполнением настоящего приказа возложить на Первого
заместителя министра Онищенко Г.Г.
41*
635
ПОЛОЖЕНИЕ
(.Общие положения.
1.1. Научно-практический центр профилактики и лечения ВИЧ-инфекции
у беременных женщин и детей Министерства здравоохранения Российской
Федерации (далее Центр) организуется на базе Республиканской клинической
инфекционной больницы Министерства здравоохранения Российской
Федерации (г. Санкт-Петербург, п. Усть-Ижора) на функциональной основе.
1.2. Центр возглавляет главный врач Республиканской клинической
инфекционной больницы Министерства здравоохранения Российской
Федерации.
1.3. Деятельность Центра осуществляется в соответствии с планами,
согласованными с Минздравом России.
2. Задачи и функции
2.1.Основные задачи Центра:
- оказание медицинской и консультативной помощи ВИЧ-
инфицированным беременным женщинам и детям;
мониторинг за ВИЧ-инфицированными беременными женщинами и
детьми в России;
подготовка кадров и научно-методических материалов по вопросам
оказания лечебно-профилактической помощи ВИЧ-инфицированным
беременным женщинам и детям.
2.2.В соответствии с основными задачами Центр осуществляет
следующие функции:
сбор оперативной и статистической информации о больных ВИЧ-
инфекцией беременных женщинах и детях;
- анализ и оценка ситуации о распространенности ВИЧ-инфекции среди
беременных женщин и детей и адекватности проводимых лечебно-
профилактических мероприятий среди этих контингентов;
подготовка и издание информационных, аналитических и учебных
материалов по вопросам профилактики, диагностики и лечения ВИЧ-
инфекции у беременных женщин и детей;
разработка и внедрение мероприятий по совершенствованию
профилактики, диагностики и лечения ВИЧ-инфекции у беременных
женщин и детей;
- оказание методической и практической помощи лечебно-
профилактическим учреждениям по вопросам профилактики,
диагностики и лечения ВИЧ-инфекции у ВИЧ-инфицированных
беременных женщин и детей;
- организация и проведение мероприятий по подготовке специалистов
центров по профилактике и борьбе со СПИДом и других лечебно-
636
профилактических учреждений по вопросам профилактики, диагностики
и лечения ВИЧ-инфекции у беременных женщин и детей;
проведение прикладных научных исследований по вопросам
профилактики, диагностики и лечения ВИЧ-инфекции у беременных
женщин и детей;
- участие в разработке федеральных и региональных программ по
предупреждению ВИЧ-инфекции, оценке хода их реализации и
эффективности;
проведение мероприятий по гигиеническому образованию и
воспитанию населения по вопросам профилактики ВИЧ-инфекции у
беременных женщин и детей.
3. Центр ежегодно представляет в Управление охраны здоровья матери и
ребёнка и в Департамент госсанэпиднадзора Минздрава России отчёты о
проделанной работе.
4. Реорганизация и ликвидация Центра осуществляется в соответствии
с действующим законодательством Российской Федерации.
637
Количество детей,
рожденных от ВИЧ+ матерей
на Украине, в России, Беларуси
WHO
Eiirojn;
Страны 1997 1998 1999 2000 ;
Украина 272 482 549 600
Россия 43 132 153 800 !
Беларусь 17 29 38 60 '
Около 1/3 ВИЧ+ беременностей заканчивается прерыванием
беременности.
638
WHO
Europe
Факторы, влияющие на риск
передачи ВИЧ-инфекции
от матери к ребенку
> Уровень виремии у матери. Чем выше концентрация
вируса в крови у матери - тем выше риск
перинатальной передачи ВИЧ.
> Родоразрешение ВИЧ+ женщин путем планового
кесарева сечения снижает риск передачи ВИЧ
приблизительно в 2 раза.
> Преждевременный разрыв/вскрытие плодного пузыря
(более чем за 4 часа до родов) почти в 2 раза
увеличивает риск передачи ВИЧ.
> Снижение количества клеток CD4+ свидетельствует об
увеличении риска передачи ВИЧ.
> Патология плаценты - увеличивает риск передачи ВИЧ
(внутриутробно).
> Факторы, связанные с плодом - вес при рождении
менее 2500 грамм и/или срок беременности менее 38
недель связаны с повышенным риском передачи ВИЧ.
639
WHO
СТРАТЕГИИ ПРОФИЛАКТИКИ
Europe
> Первичная профилактика.
> Прерывание беременности.
> Антиретровирусная терапия в течение беременности.
> Отказ от грудного вскармливания и введение
заместительного кормления.
> Некоторые другие факторы, которые, как считается,
снижают возможность вертикальной передачи ВИЧ-
инфекции:
- вагинальный лаваж перед родами;
- кесарево сечение;
- добавление питательных веществ, таких как витамин
А цинк, селениум, рассматриваются как возможные
профилактические вещества.
Первичная профилактика ВИЧ в контексте беременности
> Информационные, образовательные и
коммуникационные программы.
> Скрининг и лечение инфекций, передающихся половым
путем.
> Пропаганда использования презервативов.
> Консультирование по ВИЧ.
NB: Риск инфицирования младенцев возрастает, если мать
инфицируется во время беременности или грудного
вскармливания.
640
WHO
Europe
APB режим с доказанной эффективностью
Длительный курс АЗТ
Антенатальный
Интранатальный Постнатальный
Короткий курс АЗТ
АЗТ+ЗТС (1)
АЗТ+ЗТС (2)
Невирапин
Начало
36 недель родов Роды
Роды недель
1 неделя после
после родов
родов
14 недель
Литература
1. Афонина Л.Ю., Фомин Ю.А., Воронин Е.Е. идр. Профилактика
перинатальной ВИЧ-инфекции // Мат. 3-го съезда Российской ассоциации
специалистов перинатальной медицины, Москва, 11-13 сентября 2000г. -
2000 -М.:ГОУ ВУНМЦ М3 РФ. -с. 252-254.
2. Воронин Е.Е. ВИЧ-инфекция у детей/Дисс... д.м.н., СПб, 2001.-323 с.
3. Воронин Е.Е. Простой герпес у детей с ВИЧ-инфекцией/Дисс.... к.м.н.,
СПб, 1995.-150с.
4. Деткова Н.В. Химиопрофилактика передачи ВИЧ инфекции от матери к
ребенку: Автореф. дис. ... канд. мед. наук. -М„ 2003. -22 с.
5. Платошина О.В., Попова И.А., Горшкова Н.В. Внутрибольничная ВИЧ-
инфекция: клинико-эпидемиологическая характеристика, профилактика.
Информационно-методической письмо. -СПб. -1999. -21 с.
6. Покровский В.В., Ерамова И.Ю., Кузнецова И.И. и др. Передача ВИЧ от
ребенка матери во время кормления грудью//Журн. микробиол. -1990.
-№3.-С. 23-26.
7. Попова И.А., Бурова Н.В., Фомин Ю.А. и др. ВИЧ-инфекция у детей //
Эпидемиология и инфекционные болезни. -1998. -№5. -с.38-42.
8. Попова И.А., Бурова Н.В., Фомин Ю.А. и др. Клинические особенности
ВИЧ-инфекции у детей при парентеральном инфицировании // Мат. конф.
"Актуальные вопросы ВИЧ-инфекции", Санкт-Петербург, 29-31 октября
1997 г. - СПб: ССЗ. - 1997.-С. 11-17.
9. Пренатальные и перинатальные инфекции. Отчет ВОЗ. Грац, 24-26 мая
1982г.-ВОЗ.-1982,-164с.
10. Рахманова А.Г. Педиатричекие аспекты ВИЧ-инфекции. Профилактика
ВИЧ-инфекции у новорожденных. СПб. 1996
11. Рахманова А.Г, Воронин Е.Е., Фомин Ю.А. ВИЧ-инфекция у детей. -
СПб, 2003.-439 с.
12. Семинары Canadian AIDS Russia Project (CARP), 1999.
13. 1994 Recommendations of the US Public Health Service task force on the use
of Zidovudine to reduce perinatal transmission of! 1IV. CDC, MMWR. - V. 43.
-1994.
14. 1994 Revised Classification System for HI V-infection in Children less than
13 years age. CDC, MMWR. -V.43.-1994.
15. 1999 USPHS/1DSA Guidelines for the Preention of Opportunistic Infections
in Person Infected HIV. -MMWR Supplement. -Annals of Intern. Med. -1999.
-December. -V. 131. -P. 873-903.
16. Abrams EJ, Weedon JC, Lambert G, Stedetee R, and the NYC Perinatal HIV
Transmission Collaborative Study. HIV viral load early in life as a predictor
of disease progression in HIV-infected infants // Мат. конф. "Proceedings of
642
the XI International Conference on AIDS", July 1996; Vancouver, British
Columbia. - 1996.-Abstract We-B. 311.
17. Altice F et al. "Nevirapine induced opiate withdrawal among injection drug
users with HIV infection receiving methadone" //AIDS. - 1999. - V13. - N8.
- P.957-62.
18. Andiman W., Shearer W. // Pediatric AIDS. -1999. -P. 33.
19. Assessment ofPharmokinetic interactions between Kaletra(lopinavir/ritonavir
or АВТ-378/r) and Nevirapine in pediatric subjects 11 Poster 440 5th Interna-
tional Congress on Drug Therapy in HIV infection, Glasgow, UK, October
22-26,2000.
20. Barnhart HX, et al. Natural history of human immunodeficiency virus dis-
ease in perinatally infected children; an analysis from the Pediatric Spectrum
of Disease Project. Pediatrics. 1996; 97: 710-716.
21. Bertolli J., St Louis M.E., Simonds R.J. etal. Estimating the tiing of mother-
to-child transmission of human immunodeficiency virus in a breast-feeding
population in Kinshasa,Zaire// J. Infect. Dis. -1996. -V. 174. -P. 722-726.
22. Blanche S, et al. Longitudinal study of 94 symptomatic infants with perinatally
acquired HIV infection: evidence far a fifmodal expression of clinical and
biological symptoms //Am. J. Dis. Child. - 1990. - V. 144. - P. 1210-1215.
23. Bryon YJ, Luzuriaga K., Sullivan JL., Wara DW. Proposed definition for in
utero versus intrapartum transmission of HIV-LN Engl J Med 1992; 327 (17):
1246-1247.
24. Bryson Y. Perinatal HIV-1 transmission: recent advances and therapeutic in-
terventions //AIDS. -1996. -V. 10 (Suppl. 3). -P. 33-42
25. Bryson YJ, et al. Proposed definitions for in utero versus intrapartum trans-
mission ofHIV-1 UN. Engl. J. Med. - 1992. - V. 327. - P. 1246-1247.
26. Bryson YJ, et al. The role of maternal autologous neutralizing antibody in
prevention ofmaternal fetal HIV-1 transmission//J. Cell. Biochem. - 1993. -
17E(suppl). - P. 95.
27. Cao Y, Qin L., Zhang L. Maternal Hl V-l viral load and vertical transmission
of infection: The Ariel Project for the prevention of HIV transmission from
mother to infant. //Nat Med. - 1997. - N 3. - P. 549-552.
28. Cao Y„ Krogstad P., Korber ВТ etal. Maternal HIV-1 viral load and vertical
transmission ofinfection: The Ariel Project for the prevention ofHIV trans-
mission from mother to infant II Nat. Med. -1997.-No 3.-P. 549-552.
29. Centers for Disease control and Prevention. 1995 revised guidelines for pro-
phylaxis against Pneumocystis carinii pneumonia for children infected with
or perinatally exposed to HIV. MMWR Morb. Mortal. Wkly. Rep. 1995; 44(RR-
4): 1-11.
30. Centers for Disease control and Prevention. Public health service task force
recommendations for use of antiretroviral drugs in pregnant women infected
643
with HIV-1 for maternal health and for reducing perinatal HIV-1 transmission
in the United States. MMWR Morb Mortal Wkly Rep 1998; 47 (RR-2): 1 -30
31. Centers for Disease Control and Prevention. U.S. Public Health Service Task
Force recommendations for human immunodeficiency virus counseling and
voluntary testing for pregnant women// MMWRep. - 1995.- N44(RR-7). -
P. 1-14.
32. Clinical Fellowship programme. National Pediatric and Family HIV Resourse
Centre. Newark, New Jersey, 1995.
33. Cooper Er., Nugent RP, DiazCet al. After AIDS Clinical Trial 076: the chang-
ing pattern of zidovudine use during pregnancy, and the subsequent reduc-
tion in vertical transmission of HIV in a cohort of infected women and their
infants //J. Infect. Dis. -1996. -v. 174. -p. 1207-1211.
34. Dabis F., Newell M.L., Francen L et al. for the Ghent working group on
mother-to-child transmission of HIV. Prevention of mother-to-child trans-
mission of HIV in developing countries: recommendations for practice //
Health Policy and Planning 2000, 15: 34-42.
35. De Rossi A., Masiero S., Giaquinto C, et al. Dynamics of viral replication in
infants with vertically acquired human immunodeficiency virus type 1 infec-
tion. J Clin invest 1996; 97 (2): 323 - 330.
36. Dickover R, Kwok S, Wei L, Christopherson C, Bryson Y. HIV RNA peak
during early viremia is a major determinant of clinical course in perinatally
infected infants. 3rd Conference on Retro-viruses and Opportunistic Infec-
tions. Washington, DC, 1996:93.
37. Division on AIDS. NIH. Zidovudin for the prevention of HIV transmission
from mother to infant// Morbidity and Mortality Weekly Report. -1994. -Vol.
343.-No. 8909.-P. 285-288.
38. Du L.T., Coats D.K., Kline M.W. et al. Incidence of presumed cytomegalovi-
rus retinitis in HIV-infected pediatric patients//J. Aapos. -1999. -No3 (4). -P.
245-249.
39. Ekpini E.R., Wiktor S.Z., Satten G.A. et al. Late postnatal mother-to-child
transmission of HIV-1 in Abidjan, Cote d'Ivoire// Lancet. -1997. -V. 349. -P.
1054-1059.
40. Eshleman S.H., Mracna M., Guay L.A. et al. Selection and fading of resis-
tance mutations in women and infants receiving nevirapine to prevent HIV-1
vertical transmission (HIV-1 NET012)//AIDS,2001. Vol. 15(15).-P. 1951-
1957.
41. Goedert J.J. et al. Mother-to-infan transmission of human immunodeficiency
virus type 1: association with prematurity or low anti gp-120//Lancet. -1989.
-No2.-P. 1351-1354.
42. Greenberg A., Davis F., Lawrence H. etal. HIV infection in Africa// Pediatric
AIDS.-1999.-p. 23-46.
644
43. Guay L., Musoke P., Fleming T. et al. Intrapartum and neonatal single dose
nevirapine compared with zidovudine for prevention of mother-to-child trans-
mission of HIV 1 in Kampala, Uganda: H1VNET randomized trial // Lancet.
-1999.-354.-795-802.
44. Guay L.A., Musoke P., FlemingT. et al. Intrapartum and neonatal single-dose
nevirapine compared with zidovudine for prevention of mother-to-child trans-
mission ofHIV-1 in Kampala, Uganda: HIVNET012 randomised trial // Lan-
cet. -1999. -Vol. 354 (9181). -P. 795-802.
45. Guidelines for the use of antiretroviral agents in HIV-infected adults and ado-
lescents. January 28,2000//HIVClinical Trials.-2000.- V. 1. -N1.- P. 60-110.
46. Johnson VA., Woods C., Hamilton C.D. et al. Vertical transmission of multi-
drug-resistance human immunodeficiency virus type 1 (HIV-1) and contin-
ued evolution of drug resistance in an HIV-1-infected infant//J.Infect.Dis. -
2001.-Vol. 183. -No 11. -P. 1688-1693.
47. Kalish LA, Pit J, Lew J, et al. Defining the time of fetal or perinatal acquisi-
tion of human immunodeficiency virus type 1 infection on the basis of age at
first positive culture. Women and Infants Transmission Study (WITS). J In-
fect Dis 1997; 175 (3):712-715.
48. Kovacs A., Schuluchter M., Easley K. et al. Cytomegalovirus infection and
HIV-1 disease progression in infants born to HIV-1 infected women: Pediat-
ric Pulmonary and Cardiovascular Complications of Vertically Transmitted
HIV Infection Study Group. N Engl J Med. 1999; 341(2): 77-84.
49. Kuhn L, Abrams EJ, Matheson PB, et al. Timing of maternal-infant HIV
transmission: associations between intrapartum factors and early polymerase
chain reaction results. New York City Perinatal HIV Transmission Collabora-
tive Study Group. AIDS 1997; 11 (4), 429 - 435.
50. Kuhn L, Thea DM, Steketee RW, and the Perinatal AIDS Collaborative Trans-
mission Study. Timing of mother-to-child HIVtransmission and disease pro-
gression in infected children. Conference on Global Strategies for the Pre-
vention of HIV Transmission from Mothers to Infants. Washington, DC,
1997:61.
51. Lallemant M., Jourdain G., Kim S. et al. A trial of shortened zidovudine
regimens to prevent mother-to-child transmission of human immunodefi-
ciency virus type 1 //N.Engl.J.Med, 2000. -Vol. 343. -No 14. -P. 982-991.
52. Landesman S.H., Kalish L.A., Burns D.N. et al. Obstetrical factors and the
transmission of human immunodeficiency virus type 1 from mother to child:
The Women and Infants Transmission Study // N.Engl. J. Med. -1996. -V.
334.-P. 1617-1623.
53. Lipshultz S.E., Easley K.A., Orav E.J., et al. Absence of cardiac toxicity of
zidovudine in infants//N. Engl. J. Med. -2000. -Vol. 343. -No 11. -P. 759-766.
54. Luo C. Strategies for prevention of Mother-to-child transmission of HIV //
645
Reproductive Health Matters.-2000.-V. 8.-No 16.-P. 144-155.
55. Luzuriaga K., Bryson Y., Krogstad P. et al. Combination treatment with
zidovudine, didanosine and nevirapine in infants with human immunodefi-
ciency virus type 1 infection. N.Engl.J.Med. 1997; 336: 1343-1349.
56. Mandelbrot L., Landreau-Mascaro A., Rekacewicz C., et al. Lamivudine-
zidovudine combination for prevention of maternal-infant transmission of
HIV-1 //JAMA,2001.-Vol. 285.No 16.-P. 2083-2093.
57. Mannucci P.M., Gringeri A., Savidge G. et al. Randomized double-blind,
placebo-controlled trial of twice-daily zidovudine in asymptomatic
haemophiliacs infected with the human immunodeficiency virus type 1 //
Brit.J.Haemotol., 1994.-Vol. 86.-No l.-P. 174-179.
58. Marseille E., Kahn J. Mmiro F. et al. The cost-effectiveness of a single dose
nevirapine regimen to mother and infant to reduce vertical HIV transmission
in Uganda. Lancet 1999; 354: 803-09.
59. Mayaux M.J., Dussaix E., Isopet Jet al. Maternal virus load during pregnancy
and the mother-to-child transmission of human immunodeficiency virus type
1: the French perinatal Cohort Studies// J. Infect. Dis. -1997. -v. 175. -P. 172-
175.
60. Mayaux MJ, Burgard M, Teglas JP, et al. Neonatal characteristics in rapidly
progressive perinatally acquired HIV-1 disease. The French Pediatric HIV
Infection Study Group, JAMA 1996; 275 (8): 606 - 610.
61. McKinney RE, et al. A multicenter trial of oral zidovudine in children with
advanced HIV disease //N. Engl. J. Med. - 1991. - V. 324. - P. 1018-1025.
62. Minkoff H., Burns D.n., Landesman S. Et al. The relationship of the duration
of ruptured membranes to vertical transmission of HIV // Am. J. Obstet
Gunecol. -1995. -V. 173. -P. 585-589.
63. Mirochnick M., Fenton T., Gagnier P. et al. Pharmacokinetics of nevirapine
in HI V-l-infected pregnant women and their neonates: Pediatric AIDS Clini-
cal Trials Group Protocol 250 Team //J. Infect. Dis. -1998. -V. 178(2). -P. 368-
374.
64. Mofenson L.M., Korelitz J., Meyer W.A. et al. The relationship between se-
rum human immunodeficiency virus type 1 (HlV-l) RNA level, CD4 lym-
phocyte percent, and long-term mortality risk in HI V-l-infected children //J.
Infect. Dis., 1997.-V. 175.-P. 1029-1038.
65. Mofenson L.M., Lambert J.S., Stiehm E.R. et al. Risk factors for perinatal
transmission of human immunodeficiency virus type 1 in women treated
with zidovudine//N.Engl.J.Med. -1999. -V. 341. -P.385-393.
66. Moodley D. The SAINT trial: nevirapine (NVP) versus zidovudine (ZDV)
lamivudine (3TC) in prevention of peripartum HIV transmission // XIII In-
ternational AIDS conference. Durban, South Africa. July 2001. (Abstract
LBOr2).
646
67. Newell ML. Vertical transmisssion of HIV-1: maternal immune status and
obstetric factors: The European Collaborative Study //AIDS. -1996. - N10. -
P. 1675-1681.
68. Nielsen K. A descriptive survey of pediatric human immunodeficieny virus-
infected, longterm survivors // Pediatrics. -1997. - V. 99. -N4. - P. 134-143.
69. Nielson K, Dillon M.,Boyer P. et al. Peripartum risk factors for vertical trans-
mission of HI V // Program and abstracts of a Conference on Global Strategies
for the Prevention of HIV Transmission from Mothers to Infants. -1997. -
Washington, DC. -Abstract 56.
70. Nielson K, Garratty E, Palumbo P, et al. Virus phenotype in MT-2 Cell lines
among vertically HIV-infected pediatric long-term survivors. 35th Interscience
Conference on Antimicrobal Agents and Chemotherapy, San Francisco, CA,
September 17 - 20,1995.
71. Nolan M.L., Greenberg A.E., Fowler M.G. A review of clinical trials to pre-
vent mother-to-child HIV-1 transmission in Africa and inform retional inter-
vention strategies//AIDS.-2002.-V. 16.-P. 1991-1999.
72. Palumbo PE, Raskino C, Fiscus S et al. Correlation of HIV plasma RNA
levels with clinical outcome in a large pediatric trial (ACTG 152). In: Pro-
ceedings of the Fourth Conference on Retroviruses and Opportunistic Infec-
tions: January 1997; Washington, DC. Abstract LB 14.
73. Palumbo PE., Raskino C., Fiscus S., et al. Predictive Value of Quantitative
Plasma HIV RNA and CD4+Lymphocyte Count in HIV-infected infants and
Children. JAMA 1998; 279 (10): 756 -761.
74. Pizzo PA. Effect of continuous intravenous infusion of zidovudine (AZT) in chil-
dren with symptomatic HIV infection//N. Engl. J. Med. - 1988,-V.319. - P. 889-
896.
75. Recommendation for use of antiretroviral drugs in pregnant Hl V-l -infected
women for maternal health and interventions to reduce perinatal HIV-1 trans-
mission in the United States. -August 2002. -46 p.
76. Recommendation ofU/S/ Public Health Service on the use of Antiretroviral
Agents to treat Pregnant women and reduce Perinatal Transmission of HIV
(ACTG076). N Engl I Med. 1994:331 p. 1173 -1176.
77. Rogers M., Lindegren M„ Simons R. Et al. Pediatric HIV infection in the
United States// Pediatric AIDS. -1999. -P. 3-13.
78. Rosenzweig M., Clark DP, Gaulton GN. Selective thymocyte depletion in
neonatal HIV-1 thymic infection. AIDS 1993; 7(12): 1601 - 1605.
79. Rubsamen-Waigmann H, etal. Reversal of HIV-phenotype to fulminant rep-
lication on macrophages in perinatal transmission//Lancet. - 1989. -N2. - P.
1155-1156.
80. Saba J. On behalf ofthe PETRATrial Study Team. Interim analysis of early
efficacy of three short ZDV/3TC combination regimens to prevent mother-
647
to-child transmission of HIV-1: the PETRA trial. 6th Conference on Retroviral
and Opportunistic Infections, Chicago, IL, Jan 31 - Feb 4, 1999 (abstr. 57)
81. Scott GB, et al. Survival in children with perinatally acquired HIV type 1
infection // N.Engl. J. Med. - 1989. - V. 321. - P. 1791-1796.
82. Shaffer N., Chuchoowong R., Mock P.A. et al. Short-course zidovudine for
perinatal HIV-1 transmission in Bangkok, Thailand: a randomised controlled
trial //Lancet 1999; 353:773-80
83. Shearer WT, Quinn TC, LaRussa P, et al. Viral load and disease progression
in infants infected with human immunodeficiency virus type 1 .Women and
Infants Transmission Study Group. N Engl J Med 1997; 336(19): 1337 - 1342.
84. Shearer WT, Quinn TC, LaRussa P. et al. Viral load and disease progression
in infants infected with human immunodeficiency virus type 1. N.Engl.J.Med.
1997; 336: 1337-1342.
85. Simonds RJ, Lindegren ML, Thomas P, et al. Prophylaxis against Pneumocystis
carinii pneumonia among children with perinatally acquired human immu-
nodeficiency virus infection in the United States. Pneumocystis carinii Pneu-
monia Prophylaxis Evalution Working Group. N Engl J Med 1995; 332 (12):
786-790.
86. Stanley SK, McCune JM, Kaneshima H, et al. Huan immunodeficiency virus
infection of the human thymus and disruption of the thymic microenviron-
ment in the SCID-hu mouse. J Exp Med 1993; 178 (4): 1151 - 1163.
87. Steihm E.R. Newborn factors in maternal-infant transmission of pediatric
HIV infection // J. Nutr. -1996. -V. 126. -P. 2632 - 2636.
88. Su L, Kaneshima H, Bonyhadi M,etal. HIV-1 induced thymocyte depletion
is associated with indirect cytopathogenicity and infection of progenitor cells
in vivo. Immunity 1995; 2(1): 25-36.
89. The European Collaborative Study. Children born to women with HIV-1
infection: natural history and risk of transmission. Lancet. 1991; 337: 2453-
260.
90. The International Perinatal HIV Group. The mode of delivery and the risk of
vertical transmission ofhuman immunodeficiency virus type 1: a meta-analysis
of 15 prospective cohort studies // N. Engl. J. Med. -1999. - V. 340. - P. 977-
987.
91. The P2C2 Study Group. The pediatric pulmonary and cardiovascular com-
plications of vertical transmitted HIV (P2C2 HIV) infectio study: design and
methods// J. Clin. Epidemiol.-1996. -V.49. -P. 1285-1294.
92. Thea D.M. et al. And the New York City Perinatal HIV Transmission
Collaborati veGroup. The effect of maternal viral load on the risk of perinatal
transmission ofHIV-1 // AIDS. -1997. -No 11. -P. 437-444.
93. Thea DM, Lambert G, Weedon J, et al. Benefit of primary prophylaxis before
18 months ofage in reducingthe incidence of Pneumocystis carinii pneumo-
648
nia and early death in cohort of 112 human immunodeficiency virus-infected
infants. New York City Perinatal HIVTransmission Collaborative Study Group.
Pediatrics 1996; 97(1): 59-64.
94. Tudor-Williams G, et al. HIV-1 sensitivity of zidovudine and clinical out-
come in children // Lancet. - 1992. - V. 339. - P.15-19.
95. Uittenbogaart CH, Anisman DJ, Jamieson BD, et al. Differential tropism of
HIV-1 isolates for distinct thymocyte subsets in vitro. AIDS 1996; 10(7): F9-
F16.
96. UNAIDS: AIDS epidemic update: December 1999
97. Van Dyke R, Saez-Liorans X, Nelson RP et al. Antiretroviral activity and
safety of abacavir/ 3NC/ADV in therapy experienced children. In: Program
and abstracts of the 12th World AIDS Conference; June 28 - Jyly 3, 1998;
Geneva, Switzerland. Abstract 18/12255.
98. Welles S.L., Pitt J., Colgrove R. etal. HIV-1 genotypic zidovudine drug resis-
tance and the risk of maternal-infant transmission in the Women and Infants
Transmission Study Group//AIDS, 2000.-Vol. 14. -No 3. -P. 263-271.
99. Working group on Antiretroviral Therapy and Medical Management of HIV
Infected Children. Guidelines for the Use of Antiretroviral Agebts in Pediatric
HIV Infection. National Pediatric and Family HIV Resource center and Health
Resourcesand Services Administration; April 15,1999: 1-50 and December
14,2001.
100. Working Group on Mother-To-Infant Transmission of HIV. Rates of mother-
to-infant transmission of HI V-l in Africa, America, and Europe: results from
13 perinatal studies// J. Acquir. Immun. Defic. Syndr. Retroviral. -1995; 8:506-
10.
101. Yogev R., Stanley K., Nachman S.A. et al. For the PACTG 338 Protocol
Team. Virologic efficacy of ZDV+3TC vs d4T+Ritonavir (RTV) vs
ZDV+3TC+RTV in stable antiretroviral experienced HIV-infected children
(Pediatric ACTG Trial 338) // Proceedings of the 37th Interscience Cong, on
Antimicrobial Agents and Chemotherapy. -September 1997. -Toronto, Ontario.
-Abstract LB-6.
42. Заказ №K-4451.
649
Глава 14. МЕРЫ ПРОФИЛАКТИКИ ОППОРТУНИСТИЧЕСКИХ
ЗАБОЛЕВАНИЙ У ВИЧ-ИНФИЦИРОВАННЫХ. ПРОФИЛАКТИКА
ПОСЛЕ ПОЛОВОГО КОНТАКТА И ИСПОЛЬЗОВАНИЯ
ВНУТРИВЕННО НАРКОТИКОВ
Для профилактики оппортунистических инфекций рекомендуется
диспансеризация ВИЧ-инфицированных пациентов, их наблюдение и
обследование. В нашей стране диспансеризация ВИЧ-инфицированных
осуществляется с момента их выявления и регистрации. Согласно
рекомендациям, изложенным в приказе № 170 (1991 год) и методическим
рекомендациям Российского Федерального научно-методического центра по
профилактике и борьбе со СПИДом (Покровский В.В. и соавт., 1999), пациенты
активно приглашаются на плановое обследование, с их добровольного
согласия, 1 раз в 6 месяцев на стадиях ПБ и ПВ и 1 раз в 3 месяца на
последующих стадиях болезни или с вторичными клиническими
проявлениями. Рекомендуется также учитывать уровень CD4 лимфоцитов,
если он менее 500/мм3, то плановые обследования проводятся 1 раз в 3 месяца.
При ухудшении состояния больного обследование проводится при первом
же его обращении. При обследовании больного, как первичном, так и
последующем, производится клинический анализ крови, определяются
основные биохимические показатели (билирубин, АЛТ, щелочная фосфатаза,
глюкоза), общий анализ мочи, туберкулиновая проба (с 5 ТЕ), исследование
крови на маркеры вирусных гепатитов В, С, D, сифилис, обследование крови
на токсоплазмоз, герпес вирусы, включая ЦМВ, исследование кала на яйца
глист и простейшие, рентгенография органов грудной клетки, УЗИ органов
брюшной полости и почек, ЭКГ и осмотр специалистов (дерматолог,
невропатолог, стоматолог и другие). Обязательным является определение
количества CD4 и CD8 лимфоцитов и, при возможности, других
иммунологических показателей. Необходимо стремиться к регулярному
определению вирусной нагрузки (РНК ВИЧ в плазме крови). При выявлении
вторичного заболевания проводится его лечение.
При уровне CD4 клеток ниже 200/мм3 проводится первичная
профилактика оппортунистических инфекций: пневмоцистной пневмонии,
криптококкоза, герпес вирусных заболеваний, включая ЦМВИ, в соответствии
с рекомендациями, изложенными ранее.
Первичная профилактика проводится для предупреждения
возникновения вторичных и оппортунистических болезней, а после
перенесенных таковых заболеваний осуществляется вторичная профилактика
для предупреждения рецидивов. Особое внимание следует уделять
химиопрофилактике и лечению туберкулеза (см. соответствующий раздел).
650
ВИЧ-инфицированные должны быть оберегаемы от различных
инфекционных заболеваний, ибо любое заболевание может привести к
прогрессированию ВИЧ-инфекции, ввиду этого необходимо соблюдать особый
режим поведения, питания и соблюдать определенные условия жизни в
соответствии с рекомендациями, разработанными службой здравоохранения
США (приводим их ниже).
Бытовые и экологические заражения
В самой обычный деятельности всегда есть риск заражения
туберкулезом, в первую очередь для ВИЧ-инфицированных. Чтобы избежать
заражения, больной должен располагать информацией о распространенности
туберкулеза в обществе и данной социальной группе, о мерах
предосторожности, принятых на данном рабочем месте для предотвращения
трансмиссии туберкулеза. Эта информация может повлиять на частоту
обследований больного на туберкулез.
Родители и воспитатели детей находятся под большим риском
приобретения ЦМВ-инфекции, криптоспоридиоза и других инфекций (таких
как гепатит А и лямблиоз) от детей. Этот риск может быть уменьшен, если
соблюдаются элементарные гигиенические правила, прежде всего, мытье рук
после контактов с мочой или слюной, перед едой.
Занятия, включающие контакты с животными (ветеринарная работа в
зоомагазинах, на фермах и бойнях) могут повысить риск заражения
криптоспоридиозом, токсоплазмозом, сальмонеллезом, кампилобактериозом
или инфекцией Bartonella. Однако, доступных данных недостаточно, чтобы
оправдать рекомендацию против работы в таких местах.
В эндемичных гистоплазмозных районах больные должны избегать
занятий, связанных с уходом за домашней птицей (чистки клеток и насестов,
контактов с почвой под насестами), а также таких занятий, как исследование
пещер.
Заражение через воду и еду
Сырые и плохо приготовленные яйца (включая еду, которая может
содержать сырые яйца: некоторые сорта голландского сыра, майонез)
недоваренная птица, морепродукты; непастеризованные молочные продукгы
могут содержать патогены. Птица и мясо должны готовиться до того, пока
полностью не прожарятся внутри при температуре 73,8 С°. Все продукты
необходимо тщательно мыть перед употреблением.
Сырое мясо не должно соприкасаться с другими продуктами. Руки,
разделочные доски, ножи и другие кухонные принадлежности должны быть
вымыты после приготовления сырых продуктов.
Хотя распространенность листериоза очень мала, он является серьезным
42*
651
заболеванием среди ВИЧ-инфицированных людей с иммуносупрессией.
Некоторые сыры и полуфабрикаты (хот-доги, вырезки) могут вызвать
листериоз. Во избежание этого всю пищу необходимо перед употреблением
подвергать тепловой обработке.
Из-за риска заражения криптоспоридиозом и лямблиозом ВИЧ-больные
не должны пить воду из открытых природных водоемов. Нужно избегать
плавания в воде, которая может содержать животные выделения и нельзя при
плавании глотать воду.
Рекомендуется также и водопроводную воду употреблять только после
кипячения. При вспышках инфекционных заболеваний воду следует кипятить
не менее одной минуты. Использование фильтров и бутылочной воды
уменьшает риск заражения.
Заражения при общении с животными
Предупреждая ВИЧ-больных о риске заражения инфекциями при
общении с животными, медицинские работники должны учитывать
психологический аспект. Нельзя категорически запрещать им иметь домашних
животных. Но необходимо дать подробные инструкции по их содержанию.
Если у животного начинается диарея, его необходимо срочно показать
ветеринару. Выделения следует обследовать на криптоспоридии, сальмонеллы
и кампилобактерии. ВИЧ-больные должны, по-возможности, избегать
контактов с животными, больными диарреей.
При приобретении нового животного ВИЧ-инфицированные должны
избегать контактов с ними не менее шести месяцев. В зоомагазинах, на
ярмарках и птичьих рынках часто не соблюдаются гигиенические и санитарные
нормы, поэтому нужно быть особенно осторожными, купив животных в таких
местах. Животное должно быть проверено ветеринаром на наличие
возможных инфекций.
Больные должны мыть руки после контактов с животными, особенно
перед едой, и избегать контактов с отходами и зуалетом для животных. Нужно
беречься от кошачьих царапин или укусов, чтобы не заразиться инфекцией
Bartonella. Если все же это случилось, нужно немедленно промыть рану и
не разрешать зализывать се кошке.
Следует исключить контакты с рептилиями (змеями, ящерицами,
черепахами) и экзотическими животными.
Заражения в поездках
Поездки, особенно в развивающиеся страны, могут быть очень
рискованными для ВИЧ-инфицированных людей в плане заражения
оппортунистическими патогенами.
В поездках велик риск заражения через питье и еду. Еда и напитки, в
652
особенности сырые овощи и фрукты, полуфабрикаты, водопроводная вода,
лед, молочные продукты представляют наибольшую опасность. Безопасные
для употребления в поездах продукты: горячая еда, фрукты (очищенные перед
употреблением), бутылочные напитки, горячие чай или кофе, пиво, вино и
кипяченая вода.
Антимикробная профилактика диареи не рекомендуется для ВИЧ-
инфицированных людей. Такая терапия может вызвать резистентность
микробов к лекарственным препаратам. В некоторых обстоятельствах (когда
риск инфицирования очень велик) может быть использована профилактика
антибиотиками. Для этой цели могут применяться фторхинолоны
(ципрофлоксацин 500 мг в день) или триметоприм-сульфаметоксазол (ТМР-
SMZ, двойная доза ежедневно).
Больные должны также получить советы о необходимости профилактики
малярии, получить лечение иммуноглобулином и вакцинацию перед поездкой
в тропических странах. Они должны избегать прямых солнечных лучей и
контактов с песком, то есть непременно должны носить одежду и обувь в
местах с повышенной солнечной радиацией.
Живые вирусные вакцины ВИЧ-инфицированным противопоказаны.
Исключением является противокоревая вакцина, но она не рекомендуется
лицам с иммуносупрессией. Последним показано применять иммуноглобулин.
Выполняя все вышеприведенные рекомендации, ВИЧ-инфицированные
до минимума понизят риск заражения оппортунистическими инфекциями.
Профилактика после полового контакта и использования внутривенно
наркотиков
Потенциальная роль постконтактной профилактики заражения ВИЧ через
половой контакт или шприцевой при инъекционном введении наркотиков
спорна. Что должен делать клиницист в случае обращения пациента через
короткий срок после такого контакта? Нужно ли предлагать лечение на основании
риска заражения? Риск инфицирования после полового контакта трудно
определить, хотя эпидемиологическое исследование предполагает многие
факторы, которые повышают риск передачи (таблица 105).
653
Таблица 105
Факторы, которые могут повысить риск инфицирования ВИЧ
______________через половой контакт__________________
ВИЧ-инфицированный партнер Высокий уровень вирусной нагрузки в плазме Высокий уровень вирусной нагрузки в сперме/влагалище Месячные во время контакта Контакт при воспалительных заболеваниях половых органов
Неинфицированный партнер Генетическая предрасположенность Язвенные заболевания гениталий Воспалительные заболевания гениталий Цервикальная эктопия
Характеристики полового акта Травма Принятие душа до анального или вагинального секса Увеличенная продолжительность или интенсивность сношения
Вирусные .характеристики Тропизм макрофагов Не образующий синцитий фенотип
Данные, первоначально основанные на моделировании, показали
возможность инфицирования от 0,8% до 3,2% через эпизод анального сношения
и от 0,05% до 0,15% через эпизод вагинального сношения. При сравнении
оцениваемого риска после чрез кожного контакта 0,32% и после использования
иглы 0,67%. В других сообщениях, риск передачи для профессионального,
полового и контакта при введении инъекционных наркотиков схож, варьируя
незначительно.
Возможная схема для назначения лечения, используемая в Сан-Франциско
и некоторых других местах, основывается на риски, оцениваемом по времени
обращения. Лечение предлагается при анальном и вагинальном контактах,
включая контакт слизистой со спермой. Однако, показания для лечения
различаются среди клиницистов и программ, предлагающих профилактику
после контакта.
Рациональность постконтактной профилактики в случае полового
или шприцевого контакта схожа с таковой в случае профессионального
контакта: эффективность профилактической терапии биологически
654
оправданна, риск передачи в таких ситуациях низкий, но не нулевой, и
предлагаемое лечение оказывается разумно безопасным. К настоящему времени,
однако, не имеется данных по эффективности профилактики после полового
контакта или инъекционного приема наркотиков, тогда как имеются, по меньшей
мере, несколько случаев эффективности при профессиональном контакте.
Профилактика профессионального заражения одобрена авторитетными учеными
(Управление профессиональной безопасности и здоровья, Служба
общественного здоровья США), но профилактика после половых контактов и
использования внутривенно наркотиков не была полностью одобрена
Международным обществом по СПИДу США и другими.
Другие исследования по использованию профилактики при контактах
общества с ВИЧ включают ее стоимость, ее выполнимость, частично по
отношению к приверженности и, что наиболее важно, ее влияние на
общественное здоровье. Влияние на общественное здоровье постконтактной
профилактики профессиональных контактов мало, так как количество контактов
невелико ввиду очень малого количества случаев ВИЧ-инфекции. В теории
программы для профилактики при половых контактах и использовании
внутривенно наркотиков имеют огромное влияние на общественное здоровье.
Однако не ясно, будут ли такие программы успешными или неудачными. С
пессимистической точки зрения, существование таких программ приводит к
потере осторожности в поведении (схема 8), результатом чего является
увеличение контактов и случаев ВИЧ-инфекции. Крометого, если профилактика
неэффективна, повышается риск непредвиденного случая лекарственной
резистентности вируса. При оптимистическом прогнозе случаи инфицирования
должны уменьшаться при эффективности профилактики, снижении рискового
поведения, эффективности профилактики в предупреждении установленной
инфекции и определении недиагносцированных инфекций среди лиц,
обратившихся для лечения. Проекты, поддерживаемые CDC и Национальным
институтом здоровья, предназначены для того, чтобы оценить выполнимость
программ и величину их потенциального риска и успеха.
655
Рисунок
Пессимистический (слева) и оптимистический (справа) прогнозы влияния постконтактной профилактики и
профилактических программ
Пессимистический прогноз: увеличение случаев ВИЧ
Оптимистический прогноз: снижение случаев ВИЧ
Недавний контакт
Недавний контакт
Профилактика
рофилактика
Не ВИЧ
инфицирован ВИЧ инфицирован
Риск выше4! "*
-----Риск ниже—*
Риск отсутствует
Профилактика неэффективна
Больше лекарственная
резистентность
Нс диагностирован
* Диагноз и лечение -J
Отсутствие действия на
частоту встречаемости
Не ВИЧ инфицирован
Риск выше
Риск ниже
—Риск отсутствуетч-J
Профилактика эффективна
Уменьшение случаев ВИЧ
ВИЧ инфицирован
Не диагностирован
^Диагноз и лечение
Снижение частоты
встречаемости
Глава 15. ХИМИОПРОФИЛАКТИКА ВИЧ-ИНФЕКЦИИ И
ВИРУСНЫХ ГЕПАТИТОВ ВИСУ МЕДИЦИНСКИХ РАБОТНИКОВ
ВИЧ-инфекция и гемоконтактные (парентеральные) вирусные
гепатиты В и С относятся к категории преимущественно хронических
инфекционных заболеваний, завершающихся развитием синдрома
приобретенного иммунодефицита (СПИДа), а при гепатитах - цирротической
стадии с возможным развитием гепатоцеллюлярной карциномы.
Заражение медицинского работника чаще всего происходит при
загрязнении кожи и слизистых биологическими жидкостями больного
(кровью, сывороткой, ликвором, спермой и др.) и при травматизации их во
время выполнения медицинских манипуляций (порез, укол, повреждение
кожи мелкими обломками кости и др.)
Следует отметить, что заражение вирусами гепатитов В и С, в отличии
от ВИЧ, происходит значительно легче и чаще в связи с их меньшей
инфицирующей дозой и высокой устойчивостью вируса во внешней среде.
Риску профессионального инфицирования чаще всего подвержены
медицинские работники, которые соприкасаются с кровью и ее
компонентами. В первую очередь это сотрудники гематологических,
реанимационных, стоматологических, гинекологических, хирургических
и гемодиализных отделений, процедурных кабинетов, лаборанты и т.д., а
также лица, работающие на производстве по заготовке крови, ее компонентов
и ее препаратов.
Учитывая возможную инфицированность крови и биологического
материала человека вирусами СПИДа, гепатитов, цитомегаловирусами,
рядом онкогенных вирусов, правила профилактики профессионального
заражения распространяются на все лечебно-профилактические
учреждения, независимо от профиля. Эти правила сводятся к максимальному
предотвращению возможности загрязнения кожи и слизистых.
Для профилактики профессионального инфицирования необходимо:
- при выполнении манипуляций медицинский работник должен быть
одет в халат, шапочку, сменную обувь, выходить в которой за пределы
лабораторий, отделений запрещается;
- все манипуляции, при которых может произойти загрязнение рук
кровью, сывороткой или другими биологическими жидкостями
проводить в перчатках. Резиновые перчатки, снятые единожды, повторно
не используются из-за возможности загрязнения рук. В процессе работы
657
перчатки обрабатываются 70% спиртом, 3% хлорамином, спиртовым
раствором хлоргексидина и др.;
- медицинские работники должны соблюдать меры предосторожности
при выполнении манипуляций с режущими и колющими инструментами
(иглы, скальпели, ножницы); открывая бутылки, флаконы, пробирки с
кровью или сывороткой, следует избегать уколов и порезов перчаток и рук;
- при повреждении кожных покровов необходимо немедленно
обработать и снять перчатки, выдавить кровь из ранки, затем под проточной
водой тщательно вымыть руки с мылом, обработать их 70% спиртом и
смазать ранку 5% раствором йода. При загрязнении рук кровью следует
немедленно обработать их тампоном, смоченным 3% раствором
хлорамина или 70% спиртом, вымыть их двукратно теплой проточной водой
с мылом и насухо вытереть индивидуальным полотенцем;
- если кровь попала на слизистые глаз, их следует сразу же промыть
водой или 1% раствором борной кислоты. При попадании на слизистую
носа - обработать 1% раствором протаргола; на слизистую рта - полоскать
70% раствором спирта или 0,05% раствором марганцево-кислого калия
или 1% раствором борной кислоты;
- при угрозе разбрызгивания крови и сыворотки, обломков костей
следует применять средства защиты глаз и лица: защитную маску, очки,
защитные щитки;
- разборку, мойку, споласкивание медицинского инструментария,
пипеток, лабораторной посуды, приборов или аппаратов, которые
соприкасались с кровью или сывороткой, надо проводить только в резиновых
перчатках после предварительной дезинфекции (обеззараживания);
- мед. работники, имеющие раны на руках, экссудативные поражения
кожи или мокнущий дерматит, на время заболевания отстраняются от ухода
за пациентами и контакта с предметами для ухода. При необходимости
выполнения работы все повреждения должны быть закрыты напальчниками,
лейкопластырем;
- бланки направлений в клинико-диагностическую лабораторию
категорически запрещается помещать в пробирки с кровью;
- поверхность рабочих столов в конце рабочего дня (а в случае
загрязнения кровью - немедленно) обрабатываются 3% раствором
хлорамина или 6% раствором перекиси водорода с 0,5% моющего средства.
Причем, если поверхность загрязнена кровью или сывороткой, процедуры
выполняют дважды: немедленно и с интервалом в 15 минут;
658
- заполнение учетной и отчетной документации должно вестись на
чистом столе;
- запрещается принимать пищу, курить и пользоваться косметикой
на рабочих столах;
- не стоит проводить никаких парентеральных и лечебно-
диагностических процедур мед.персоналу в тех помещениях, которые
предназначены для обслуживания больных.
Для надежной защиты медицинских работников от гепатита В
проводится 3-кратная иммунизация по схеме 0-1-6, т.е. через 1 и 6 месяцев
после первой прививки (вакцины компаний “Мерк, Шарп&Доум”, либо
“Смит Кляйн Бичем”, либо “Комбиотек”).
В тех случаях, когда произошла травматизация рук и других частей
тела с загрязнением кожи и слизистых биологическими жидкостями, мед.
работнику, не привитому ранее против гепатита В, проводится иммунизация
по эпидемическим показаниям также 3-кратно в более короткие сроки (по
схеме 0-1-2) с ревакцинацией через 12 месяцев в поликлиническом
отделении инфекционной больницы № 30 им. С.П.Боткина (тел.: 277-
56-71) или Санкт-Петербургском городском центре по профилактике и
борьбе со СПИД (тел.: 251-96-29). Прививка в этих случаях должна
проводится как можно скорее - не позднее 1-2 суток после травмы. Травмы
мед. работников должны учитываться в каждом лечебно-
профилактическом учреждении. Пострадавшие должны наблюдаться не
менее б-]2 месяцев у врача-инфекциониста. Медицинское наблюдение
проводится с обязательным обследованием на маркеры вирусных гепатитов
В, С и ВИЧ-инфекции.
Хотя первейшей мерой профилактики заражения медицинского
персонала вирусом СПИДа является предотвращение непосредственного
контакга с кровью и жидкостями инфицированного организма, но,
если вследствие повреждения кожи или слизистых медработника такой
контакт все же случился, необходимо прибегнуть к посттравматической
профилактике (ПТП) с помощью таких антиретровирусных средств как
азидотимидин (ретровир), индинавир (криксиван), эпивир (ламивудин) и
некоторые другие (CDC, MMMWK; 1996; 45:468-72: JAMA, 1996
July 10; 276 (2)).
Контрольными исследованиями установлено, что азидотимидин
эффективен в посттравматической ВИЧ-профилактике. Азидотимидин
примерно на 79% уменьшает риск ВИЧ-сероконверсии после
постгравматического ВИЧ-инфицирования. Перспективные исследования
659
применения азидотимидина для ВИЧ-инфицированных женщин и их детей
показывают, что непосредственный профилактический эффект
азидотимидина на плод и/или новорожденного выражается в 67%-ном
уменьшении перинатальной ВИЧ-трансмиссии, защитный эффект
азидотимидина лишь частично объясняется уменьшением титра ВИЧ в
материнской крови. Посттравматическая профилактика (ПТП) точно так
же снижает ретровирусную активность. В среднем, риск ВИЧ-инфекции при
чрезкожном проникновении крови от ВИЧ-пациента составляет 0,3%.
Наиболее высокий риск инфицирования отмечается при глубоких
поражениях кожных покровов, подвергшихся воздействию видимой крови
на медицинском инструментарии, при соприкосновении с инструментом,
находившимся в вене или артерии пациента (например, с иглой при
флеботомии), или в организме больного (следовательно, имевшего высокий
титр ВИЧ). Чем больший объем крови был задействован, тем выше риск.
При поверхностных повреждениях кожи риск инфицирования уменьшается
и составляет 0,1% и менее в зависимости от объема крови и титра ВИЧ.
Пока данные об эффективности и токсичности ПТП, а также риске ВИЧ-
инфицирования при тех или иных повреждениях кожи ограниченны.
Однако, в большинстве случаев подобные травмы не приводят к ВИЧ-
инфицированию. Поэтому при назначении ПТП следует принимать в
расчет ее потенциальную токсичность. Если есть такая возможность,
лучше обратиться за рекомендациями к экспертам в области
антиретровирусной терапии и ВИЧ-трансмиссии.
Известно, что сочетание азидотимидина (ретровира) и ламивудина
(эпивира) увеличивает антиретровирусную активность и преодолевает
формирование резистентных штаммов. Добавление протеазы (индинавир,
саквинавир) особенно показано в случаях, связанных с высоким риском
инфицирования. Однако, учитывая вероятность возникновения
резистентных штаммов, добавление ингибиторов протеазы целесообразно
и при ситуациях меньшего риска.
660
Таблица 106
Профилактика ВИЧ-инфекции при риске парентерального
инфицирования
Степень риска заражения* Высокая (тип 1) Объем химиопрофилактики 11астоятельно рекомендуется
При глубоком колющем (иглой) или резаном (скальпель т.д.) поражении, сопровождающемся кровотечением** Комбинированная терапия обязательна в течение 4 недель: прием 3-х препаратов - 2-х ингибиторов обратной транскриптазы: азидотимидин 200 мг х 3 раза в сутки ламивудин 150 мг х 2 раза в сутки и одного из ингибиторов протеазы: индинавир 800 мг х 3 раза в сутки саквинавир 600 мг х 3 раза в сутки
Умеренная (тип 2) При net лубоких поражениях с "капельным" отделением крови Предлагается Комбинированная терапия в том же режиме или
с использованием в течение 4-х недель 2-х ингибиторов обратной грансктриптазы
Минимальная (тип 3) Желательна
При поверхностной травматизации ; кожи и слизистых или попадании । биологически,х жидкостей на | слизистые Терапия азидотимидином в течение 4-х недель
2 ингибитора обратной транскриптазы
*Учитывается ВИЧ-стагус пациента, с кровью которого был контакт:
- при травматизации от бессимптомного пациента с высоким уровнем СЕ>4 Т-
хелпсров и низкой вирусной нагрузкой (количество копий РНК ВИЧ в 1 мл плазмы крови)
проводится химиотерапия по 3 типу.
- При развернутой клинической картине заболевания, уровне CD4 Т-хелперов ниже
500 и/или высокой вирусной нагрузке проводится химиопрофилактика по 1 типу (.(.Bartlett.
Medical Management of'HIV infection. USA. Baltimore. 1998)
** Если у пациента до контакта не выявлено позитивной серологии и нет данных о
его негативном серологическом тесте, предпочтителен экспресс-тест, поскольку его
результаты станут известны уже в течение одного часа. Стандартные серологические
тесты могут отнять от 3 до 7 дней, но негативный результат ИФЛ обычно доступен в
течение 24-48 часов. Если пациент имеет заболевание с острым синдромом ВИЧ-
инфекции. то тестирование должно включать также измерение уровня ВИЧ РНК или
ВИЧ ДНК.
661
При 23-х изучениях в связи с ранениями иглами медицинских работников
ВИЧ-трансмиссия была выявлена в 20 из 6135 (0,33%), (Bartlett 1., 1999). В
исследованиях CDC 37 случаев с сероконверсией и у 39 в контроле (MMWR,
1996,45,468) показано, что риск был при:
- глубоких повреждениях,
- видимой крови в ране,
- игла находилась в вене или артерии,
- источник был с прогрессирующим заболеванием и, вероятно, с высокой
вирусной нагрузкой.
На основании этих исследований позже, в 1998 году, была предложена более
точная агрессивная антиретровирусная терапия (MMWR, 1998,47, RR - 7).
Рекомендуется последовательно оценить риск повреждения (ЕС -
exposure code), затем изучить или исследовать ВИЧ-статус пациента (HI V SC -
status code) и далее на основании этих данных определить характер
профилактики (схема 9).
Схема 9
шаг 1
определить характер повреждения (ЕС - exposure code)
источник инфицирования содержал кровь или жидкость организма или
другие потенциально опасные материалы
тип повреждения
слизистые и кожа только кожа, чрезкожные повреждения она интактна
^^объем^^ не проводится тяжесть повреждения
маленький большой (капля (несколько короткое капель время) длительно) ECI ЕС2 нсбольшая^игла^^игл^ с экскориацией глубокое кожи проникновение ЕС2 с поврежде- нием сосуда ЕСЗ
662
шаг 2
определить ВИЧ-статус человека, от которого произошло повреждение
слизистых (HIV SC - status code)
вич- ВИЧ- ВИЧ статус
негативный позитивный неизвестен
посттравма- низкая вирусная высокая обследуй и выбери
тичная нагрузка или вирусная режим
профилакти- асимптомное нагрузка,
ка (РТ-Р) не инфицирова- продвинутая
проводится ние и высокие ВИЧ-
CD4 инфекция,
низкий
уровень CD4
HIV ST 1 HIV ST 2
H1V режим 2
шаг 3
определить посттравматичную профилактику
ЕС 1 HIVST 1 химиопрофилактика не предлагается, риск мало вероятен, необходимо учитывать токсичность лекарств
1 2 предлагается основной режим, однако, следует учес ть риск токсичности лекарств и риск инфицирования и выбрать преимущества между ними
2 1 рекомендуется основной режим профилактики, риск ВИЧ-трансмиссии вероятен
2 2
3 1 и2
рекомендуется расширенный режим
тип повреждения увеличивает риск ВИЧ-трансмиссии
663
Стоимость профилактики PEP (J. Bartlett, 2000)
Дозировка: Упаковок Цена $*
1. Азидотимидин (150 мг) 2 раза в сутки 1 250
+Ламивудин (300 мг) (1 уп„ 60 таб.)
Комбивир+
2. Невирапин 1 раз в сутки по 200 мг 1 357
(Вирамун) в первые 14 дней
2 раза в сутки по 200
мг в последующем
Итого: 607
* розничные цены в московских аптеках на 29.05.2000
+временно в московских аптеках отсутствует
Рекомендуемые режимы:
Основной режим - включает зидовудин (АЗТ) 600 мг в 2-3 приема в день и
ЗТС (ламивудин) 150 мг 2 раза в день или комбивир 2 раза в день
Усиленный режим - основной режим и дополнительно нельфинавир 750
мг - 3 раза в сутки или криксиван 800 мг каждые 8 часов
664
Глава 16. ОСОБЕННОСТИ ЛЕЧЕНИЯ СИНДРОМА ЗАВИСИМОСТИ
ВСЛЕДСТВИЕ УПОТРЕБЛЕНИЯ НАРКОТИЧЕСКИХ ВЕЩЕСТВ
ПРИ СОЧЕТАНИИ С ВИРУСНЫМИ ГЕПАТИТАМИ И ВИЧ
Глобальные социальные изменения в нашей стране приводят к тому,
что увеличивается количество людей, которые, сталкиваясь с трудно
разрешимыми проблемами, пытаются их решать с помощью наркотических
средств.
За последние 10 лет в России стремительно развивается эпидемия
наркомании. Эта тенденция подтверждается ростом показателя
заболеваемости - количества больных, которым медицинская помощь
оказывалась впервые в жизни. В 1991 году уровень заболеваемости
наркоманией среди населения России составлял 3,9 на 100000 населения, а
в 1998 году показатель числа впервые обратившихся за медицинской
помощью составил 35,4 на 100 тысяч населения, т.е. за 8 лет произошло его
увеличение в 9 раз (Иванец Л.Н., Анохина И.П., Корчагина Г.А., 1999).
В эпидемический процесс вовлечены все группы населения, в том
числе дети, подростки, женщины. В России, начиная с 1991 года, число
подростков с диагнозом наркомания, впервые взятых на учет, увеличилось
почти в 15 раз. Поданным Городского наркологического диспансера Санкт-
Петербурга заболеваемость среди подростков составляла в 1989 году 3,1 на
100000, в 1998 году 29,4, в 2001 - 186,4 на 100000.
Статистика Минздрава России показывает, что количество состоящих
на учете больных с диагнозом наркомания за последние 10 лет выросло в 5
раз. При этом среди несовершеннолетних уровень заболеваемости
наркоманией почти в 2,5 раза выше, чем среди всего населения.
Среди различных социальных групп молодежи, пробовавших
различные наркотические вещества, 32% вводили наркотики внутривенно.
Множественные немедицинские внутривенные вмешательства приводят к
заражению вирусами гепатитов С, В. По данным различных исследований,
90% внутривенных потребителей героина могут быть инфицированы вирусом
гепатита С, процент ВИЧ-инфицированных может составлять до 84%, как,
например, в Германии (GolzJ., 1997). С 1996 года Россия перешла во вторую
стадию развития эпидемии ВИЧ-инфекции, когда вирус попал в среду лиц,
использующих внутривенное введение наркотиков. В 1996 году были
зарегистрированы единичные случаи ВИЧ-инфекции у наркозависимых в
Санкт-Петербурге, в 1997 году потребители наркотиков составляли 47,2%
среди новых случаев, в 1998 году - 50%, а 1999 году их число увеличилось
до 80% (Ахтырская Н.А., Сизова Н.В., Рахманова А.Г, 1999). Проблема
наркомании, таким образом, тесно переплелась с проблемой СПИДа. По
данным интервьюирования 28,8% потребителей наркотиков пользуются для
43. Заказ № К-4451.
665
внутривенных инъекций нестерильными шприцами и иглами, используют
постоянно стерильные шприцы и иглы - 23,9%(Рахманова А.Г., Линева М.Ц..
Гриненко А.Я., 1999). Появление среди ВИЧ -инфицированных
наркозависимых приводит к удорожанию лечения на 38%, увеличению сроков
лечения на 42% (Stan de Vlaming, 1999).
Особенности иммунитета у больных с синдромом
зависимости вследствие употребления героина.
У больных опийной наркоманией важное значение имеет изменение
иммунологического гомеостаза, проявляющегося в большинстве случаев в
нарушении клеточного звена иммунитета. Наблюдается снижение
функциональной активности лимфоцитов крови, которое выражается в
угнетении пролиферативного ответа лимфоцитов на митогены; выраженное
снижение электрофоретической подвижности лимфоцитов; повышение
содержания растворимой формы молекулы межклеточной адгезии sICAM 1
(ЛедвановаТ.Ю., Ледванов М.Ю., Фирстова В.В., 1998). У наркозависимых
наблюдается снижение количества CD4 , повышение концентрации
сывороточных иммуноглобулинов, ослабление ответа лимфоцитов на
митогены, уменьшение активности натуральных киллеров. Наркоманы,
вводящие наркотики внутривенно, погибают в 4 раза чаще из-за наркомании,
чем вследствие развития СПИД-ассоциированных заболеваний.
Однако, у инъекционных потребителей наркотиков, имеющих ВИЧ,
повышается риск пиогенных инфекций, риск развития стрептококковой
пневмонии и пневмонии, обусловленной гемофильной палочкой,
увеличивается в 4 раза (Vlaming S., 1999).
Увеличение числа употребляющих наркотики среди пациентов
соматических и инфекционных больниц требует организации комплексного
лечения сочетанной патологии. При поступлении 40% больных вирусными
гепатитами нуждаются в оказании помощи в связи с проявлениями
абстинентного синдрома героиновой наркомании. Учитывая, что 45%
пациентов с вирусными гепатитами составляют лица в возрасте до 20 лет,
особую тревогу вызывает дальнейший прогноз состояния их здоровья.
Особенностью течения вирусных гепатитов у наркозависимых является
репликация нескольких вирусов, моноинфекция гепатита С встречается в
38,6% случаев, микст-гепатиты (HAV + HCV, HAV + HCV + HBV,
HBV+HCV) встречаются в 51,3% случаев, рсинфекция вирусом гепатитом
А на фоне вирусного гепатита В отмечается в 10,1% случаев (Рахманова А.
Г., Яковлев А.А., Виноградова Е., 1997). Репликация одновременно
нескольких вирусов увеличивает вероятность хронического течения
гепатитов, тем более трудно добиться выздоровления от острого вирусного
гепатита, если пациент продолжает употребление наркотиков.
666
Но группа пациентов, зависимых от наркотиков, не должна быть
дискриминирована, и они имеют право на проведение противовирусного
лечения, так как основные закономерности вирусологических и
иммунологических изменений у ВИЧ-инфицированных наркозависимых
такие же, как и у ВИЧ-позитивных пациентов, не принимающих наркотики.
Аккуратность приема больными лекарств во время проведения тритерапии
зависит, прежде всего, от психологической поддержки, хотя необходимым
условием проведения тритерапии является фаза ремиссии наркомании
(VLAHOV et aL, J. AMER. 1998).
В соответствии с Классификацией психических и поведенческих
расстройств десятого пересмотра (1992) диагностическими критериями
синдрома зависимости являются:
А. сочетание физиологических, поведенческих, и когнитивных
явлений, при которых употребление психоактивного вещества или класса
веществ занимает в системе ценностей больного ведущее место.
Б. диагноз зависимости может быть поставлен только при наличии
трех и более нижеперечисленных симптомов втечение некоторого времени
за предыдущий год:
сильная (иногда непреодолимая) потребность принять психоактивное
вещество;
нарушение способности контролировать длительность приема и
дозировку вещества;
физиологическое состояние отмены, характерное для данного вещества,
когда прием вещества был прекращен или снижен;
использование другого вещества для облегчения или избежания синдрома
отмены;
признаки толерантности, такие, как повышение дозы вещества для
достижения такого эффекта, который достигался раньше меньшей дозой;
прогрессирующее забвение других интересов и удовольствий, кроме
употребления вещества; все больше времени посвящается добыванию,
приему и восстановлению после приема вещества;
продолжение приема вещества, несмотря на негативные последствия (при
осознании связи между приемом и последствиями).
Общие принципы лечения наркомании
Статья 34, п.6 Закона о наркотических средствах и психотропных
веществах (1998), указывает: «запрещено лечение наркомании
наркотическими средствами и психотропными веществами, внесенными в
список 2». В соответствии с этим законом особенностью лечения зависимых
от наркотиков в России является отсутствие программ заместительной
терапии (метадоновых программ поддержки), которые широко используются
667
в зарубежных странах для больных СПИДом с синдромом зависимости
вследствие употребления наркотических веществ.
Эффективное лечение наркомании является трудной задачей, так как
представляет собой комплекс мероприятий, направленных на коррекцию
изменений, произошедших на биологическом, психическом, социальном
уровнях вследствие употребления наркотиков.
Основной задачей терапии является купирование основных синдромов:
абстинентного синдрома, психической и физической зависимости.
Первый этап лечения заключается в проведении дезинтоксикационных
мероприятий и купировании проявлений абстинентного синдрома.
Второй этап - психокоррекционные мероприятия, направленные на
предупреждение рецидива заболевания, заключаются в фармакологическом
и психотерапевтически ориентированном воздействии, посещении групп
самопомощи.
Третий этап - социальная реабилитация: терапевтические сообщества,
семейная психотерапия, группы АН.
Этап реабилитации больной проходит после стационарного лечения,
но уже в больнице необходимо пациенту предоставить информацию об
общественных организациях, занимающихся помощью наркозависимым,
ВИЧ-инфицированным. В данной статье этот этап лечения подробно не
освещается.
Первый этап терапии.
Важным моментом в организации лечения пациентов, зависимых от
наркотиков, является создание режима, исключающего употребление
наркотиков. Это достигается, с одной стороны, специальным охранительным
режимом, с другой стороны, использованием психотерапевтических методик,
направленных на усиление мотивации отказа от употребления наркотиков.
Способствует воздержанию от употребления наркотиков во время лечения
и дисциплинирует больных возможность проверки на содержание
наркотических веществ в моче (экспресс-тест системы).
Абстинентный синдром - одно из наиболее тягостных для больных
наркоманией проявлений заболевания, угроза развития абстиненции часто
является причиной продолжения наркотизации. Длительность острых
проявлений абстиненции на фоне острых вирусных гепатитов составляет
10-14 дней и более, так как поражение печени за счет хронической
интоксикации наркотическими препаратами сочетается с острыми
воспалительными изменениями, вызванными вирусом гепатита. Процесс
терапии наркомании на начальном этапе включает в себя проведение
дезинтоксикационных мероприятий и купирование абстинентного синдрома
668
с нормализацией соматоневрологических нарушений и коррекцией
психопатоподобных расстройств. Далее необходимы полное восстановление
нарушений метаболизма и нормализация психического состояния.
Длительность и качество ремиссии во многом зависит от правильного
проведения начального этапа.
Фармакотерапия абстинентного синдрома носит индивидуальный
характер и заключается в подборе патогенетических средств, которые не
обладают гепатотоксическим действием, позволяют применять их в разгар
вирусного гепатита, а также проводить поддерживающую и
противорецидивную терапию. Применение патогенетически обоснованных
средств позволяет восстановить дисбаланс в системах нейромедиации,
вызванных употреблением наркотических веществ.
Патогенетическими средствами купирования опийного абстинентного
синдрома являются следующие препараты: клофелин, тиаприд (тиапридал),
хлорметиозол (геминеврин), трамал, холецистокинин, пирроксан, налоксон.
В терапии абстинентного синдрома эфедроновой наркомании специфическим
средством является бромкриптин.
Тиапридал, избирательный антагонист Д-2 дофаминовых рецепторов,
препарат, который не обладает гепатотоксическим действием, не вызывает
зависимости при длительном применении, обладает аналгетическим
эффектом, анксиолитическим эффектом, хорошо переносится больными,
имеет противорвотное действие и является препаратом выбора в лечении
абстинентного синдрома опийной наркомании на фоне вирусного гепатита.
Среди средств патогенетической терапии, нормализующих дисбаланс
в системах катехоламиновой нейромедиации, используется клофелин,
агонист альфа-2 адренорецепторов ЦНС, активизирующий их
постсинаптические образования и подавляющий норадренергическую
активность. В первую очередь обладает эффективностью в отношении
соматовегетативных расстройств, влияние на психопатологические и
алгические расстройства менее выражены.
Трамал рекомендуется использовать вне обострения вирусного гепатита,
так как это средство, как и другие центральные анальгетики, дезаминируется
в печени.
В таблице 107 представлены средства патогенетической терапии
опийного абстинентного синдрома, степень их влияния на его составляющие.
Выбор препарата зависит от степени выраженности симптомов синдрома
отмены, в ряде случаев может быть достаточным назначения клофелина или
пирроксана в сочетании с транквилизаторами, но при этом необходимо
помнить о возможном снижении давления. При снижении АД ниже 90/60
мм рекомендуется введение кордиамина 25% 1,0 подкожно, проведение
коррекции дозировки.
669
снижении АД ниже 90/60 мм рекомендуется введение кордиамина 25%
1,0 подкожно, проведение коррекции дозировки.
Таблица 107
Влияние патогенетических средств на расстройства, возни-
_______кающие при опийном абстинентном синдроме._________
Препараты . Соматовеге- тативныс расстройства Болевой синдром Психопато- логические расстройства Неврологи- ческая сим- птоматика
Клофелин +
Тиаприд _ +_ +++_ __ +++
Хлорметиозол - - 4-4~ +~+
Трамал + 4-+4- -
Холецистокинин +++- ++ -
Бутироксан -L.4- + +
Пирроксан ++Д + -г
Второй этап терапии.
Для купирования аффективной и психопатоподобной симптомати-
ки в структуре абстинентного синдрома используются нейролептики и
антидепресанты. В зависимости от выраженности у больных тревоги,
возбуждения, ипохондрических расстройств, нарушений поведения мож-
но назначать один из препаратов: сонапакс, тсрален. неулептил, эглопил.
Для подавления патологического влечения к наркотикам можно
использовать один из препаратов: финлепсин, эглонил, конвулекс, сук-
силеп. Наблюдение за больными показало актуализацию влечения на 9-
10 сутки и 14-15 сутки госпитализации, подобные обострения продолжа-
лись от 4 до 12 часов и купировались повышением доз нейролептиков и
антидепрессантов. Именно в дни общего ухудшения состояния на фоне
актуализации патологического влечения к наркотикам часть пациентов
стремится покинуть клинику (Шевцов А.В., Винникова М.А., 1998).
У большинства больных отмечаются агрипнические расстройства,
поэтому в вечернее время назначаются транквилизаторы. Часто пациенты
требуют назначения внутривенного введения реланиума, так как стремятся
получить состояние любой эйфории. Рекомендуется введение реланиума
только внутримышечно, внутривенное введение усиливает патологическое
влечение к наркотику.
670
В постабстинентном периоде часто наблюдается астенический
симптомокомплекс, поэтому рекомендуются ноотропные препараты,
витамины группы В. Ноотропные препараты назначаются на длительный
срок 30-45 дней. Пирапетам может усиливать патологическое влечение к
наркотику, предпочтительно назначение ноотропила, фенибута. Ранние
рецидивы возникают через 3-5 недель после отказа больного от наркотиков
из-за сопутствующих психопатологических расстройств, поэтому активная
фармакотерапия должна продолжаться.
Если преобладают аффективные расстройства, рекомендуется один
из антидепрессантов (амитриптилин, мелипрамин, миансерин) или
нейролептиков с антидепрессивным компонентом действия (терален,
сонапакс, эглонил). При психопатоподобных и неврозоподобных нарушениях
назначается один из атипичных нейролептиков (хлорпротиксен, карбидин,
тиаприд), антиконвульсантов, транквилизаторов. Транквилизаторы следует
назначать короткими курсами из-за возможности возникновения
перекрестной зависимости.
У больных опийной наркоманией не рекомендуется применение
холинолитиков, трициклических антидепрессантов и высоких доз
нейролептиков в остром периоде абстиненции, так как эти препараты
обладают способностью провоцировать развитие острых психотических
расстройств при отмене опиатов.
Психотическая симптоматика обычно развивается у больных к концу
1-2 суток от начала терапии, чаще в вечернее и ночное время.
Характерно, что назначение нейролептиков может усугублять тяжесть
состояния и продлевать делирий. Положительная динамика наблюдается при
использовании экстракорпоральной детоксикации (плазмаферез), или
методов инфузионной терапии с применением ноотропов в высоких дозах
(Стрелец Н.В., Петракова Л.Б. и др., 1997).
Опиаты
Историческая справка.
Опиум получают из Papaversomniferum, одной из разновидностей мака,
который выращивается по всей Азии и на всем Ближнем Востоке. До 1997
года опийные наркотики встречались в следующих видах: маковая соломка -
измельченные и высушенные части стеблей и коробочек мака;
ацетилированный опий - готовый к употреблению раствор, полученный в
результате ряда химический реакций; опиум-сырец - специально
обработанный сок мака. С 1997 года эти препараты с «черного» рынка
вытеснил героин - синтетический препарат, представляющий собой белый
кристалический порошок. Основные пути введения: героин вводится
671
интраназально, внутривенно, опиум-сырец употребляют перорально,
посредством курения может употребляться “коричневый” героин более
высокого качества, чем опиум-сырец. Стоимость героина для начинающего
составляет приблизительно 10-15 рублей, “стажированный “ наркозависимый
вынужден тратить в зависимости от толерантности от 250 до 1000 рублей в
сутки. Для того, чтобы достать деньги на наркотики, наркозависимые
вовлекаются в криминальный бизнез. Поданным правоохранительных органов
каждое третье преступление совершается потребителем наркотиков.
Основным наркотиком для внутривенного введения в Санкт-
Петербурге является героин (92%). Известно, что метаболизм героина
происходит в печени. При вирусном поражении печени поступление
наркотика в кровь усиливает интоксикацию, так как наркотические
анальгетики подвергаются биотрансформации в печени, превращаясь в
глюкурониды, частично экскретируются с желчью в просвет кишечника, из
которого вновь всасываются (энтеропатическая циркуляция).
По современным представлениям, действие героина и других опиатов
вызывается стимуляцией эндорфиновой системы в мозге.
Клиника острой интоксикации опийной наркомании в соответствии
с Международной классификацией болезней десятого пересмотра (1992).
Симптомы острой опийной интоксикации легкой и средней степени
тяжести: благодушное настроение, ускоренная речь и быстрая смена
ассоциаций, поверхностность суждений, снижение критики к своему
поведению, высказываниям, узкие зрачки, бледность, сухость кожных
покровов, снижение артериального давления, урежение сердечного ритма,
повышение сухожильных рефлексов, снижение моторной функции кишечника
с запорами.
Полное купирование признаков острой опийной интоксикации
происходит в течение суток при легкой и средней степени выраженности.
Рекомендуется: кордиамин 25% 1,0 подкожно, сульфокамфокаин 10% 2,0 в/м,
кофеин- бензоат натрия 20% 1,0 подкожно, в/м, тиамина бромид 6% 4,0 в/м,
пиридоксин 5% 4,0 в/м, никотиновая кислота 1 % 2,0 в/м, аскорбиновая кислота
5% 5,0 с 40% раствором глюкозы 10 мл в/в, цианокобаламид 0,01% 1,0 в/м.
Передозировка является одной из самых частых причин смерти лиц,
потребляющих опийную группу наркотических средств.
Симптомы тяжелой степени опийной интоксикации: вялость,
сноподобное состояние, нарушение сознания, редкое поверхностное дыхание,
брадикардия, узкие зрачки, бледность, сухость кожных покровов, снижение
672
артериального давления. Наиболее важное диагностическое значение имеют
резко суженные зрачки с отсутствием или вялой реакцией на свет.
Исключение составляет состояние аноксии от тяжелой передозировки, когда
зрачки расширяются.
При тяжелой степени интоксикации применяются специфические
антагонисты: налоксон 0,4 мг-1,0 мл 1-2 раза, а также кордиамин 25% 1,0
подкожно, сульфокамфокаин 10% 2,0 в/м, кофеин-бензоат натрия 20% 1,0
подкожно, в/м.
Детоксикация: электролитные растворы, растворы сахаров -
физиологический раствор 400, раствор Рингера 400, трисоль 400, хлосоль
400, 5% раствор глюкозы 400, 10% раствор глюкозы в/в капельно, папангин
10-20 мл в/в, раствор калия хлорида 1% 100-150 мл в/в капельно.
Гидрокарбонат натрия 4% 100-150 мл в/в капельно по показаниям.
Плазмозамещающие растворы: реополиглюкин 400, полиглюкин 400 в/в
капельно. Дезинтоксикационные растворы: гемодез 400 в/в капельно.
Соотношение вводимых растворов электролитов: растворов сахаров/
плазмозамещающих/дезинтоксикационных растворов =2:2:1.
Общее количество введенной жидкости зависит от состояния больного
и степени интоксикации и может достигать 6 литров в сутки.
Витамины: тиамин бромид 5% 4 мл в/м, пиридоксин 5% 4 мл в/м,
никотиновая кислота 1% 2 мл в/м, аскорбиновая кислота 5% 5 мл с 40%
раствором глюкозы 10 мл в/в, цианокобаламид 0,01% 1,0 в/м.
Пирацетам 20%-10 мл в/в с 40% раствором глюкозы 10 мл, пантогам
1,5-3 г/сутки, аминалон 0,25 6 таблеток в сутки, глютаминовая кислота 0,25
4 таблетки в сутки.
Экстракорпоральная детоксикация: плазмаферез, энтеросорбция.
В таблице 108 представлены препараты, рекомендованные для лечения
опийной интоксикации в зависимости от степени тяжести.
Легкая и средняя степень интоксикации, как правило, не требует
проведения специального лечения. Детоксикация приближает развитие
симптомов отмены, которые обычно развиваются через 6-8 часов после
последнего приема героина. Часто больные в состоянии интоксикации
отказываются от инфузионной терапии, показанной по тяжести проявлений
основного заболевания, для лечения которого поступили в инфекционный
стационар.
673
Таблица 108
Препараты, применяемые для купирования опийной интоксикации
Препараты Дозировка препаратов в зависимости от тяжести интоксикации
легкая средняя тяжелая
Налоксон — 0,4-1 1-2 раза подъязычно или в/в I
Кордиамин 25% 1,0 в/в, п/к 1,0 в/в, п/к 1,0 в/в, п/к ।
Сульфокамфокаин 10% 2 мл в/м, в/в 2 мл в/м, в/в 2 мл в/м, в/в
Кофеин-бензоат натрия 20% 1 мл в/м, п/к 1 мл в/в, п/к, в/м 1 мл в/в, п/к, в/м ;
Физилогический раствор 0,9% —— 400 мл в/в
Р-р Рингера ___ — 400 мл в/в
Трисоль — — 400 мл в/в S
Глюкоза 5% —— ____ 400 мл в/в
Глюкоза 10% ---- —— 400 мл в/в
Калия хлорид 1% ____ ---- 100-150 мл в/в
Рсополиглюкин —— —— 400 мл в/в
Г емодез 400 мл в/в
Гемодез-М —— —— 400 мл в/в
Панангин — —— 10-20 мл в/в
Витамин В|_6%__ Витами В6 6% 4,0 мл в/м 4,0 мл в/м 4,0 мл в/м 4,0 мл в/м 4,0 мл в/м 4,0 мл в/м
Никотиновая кислота 1% Витамин В13 0,01 % Аскорбиновая кислота 5% 2,0 мл в/м 1,0 мл в/м 5,0 мл в/в 2,0 мл в/м 1,0 мл в/м 5,0 мл в/в 3,0 мл в/м 1,0 мл в/м 5,0 мл в/в
Пирацетам 20% ---- ---- 5,0-20,0 мл в/в
Пиридитол — —— 0,2-0,8 г/сут
Пантогам 1,5-3,0 г/сут
Аминалон — — 6,0 г/сут
Глютаминовая кислота —— ---- 4,0 г/сут
Плазмаферез +
Энтеросорбция
В соответствии с Международной классификацией болезней
десятого пересмотра для выставления диагноза отмены необходимо
наличие не менее 3 следующих критериев.
674
Критерии состояния отмены опиоидов.
I. сильное желание принять опиоидное средство;
2. кровотечение из носа или чихание;
3. слезотечение;
4. мышечные боли или судороги;
5. абдоминальные судороги;
6. тошнота или рвота;
7. диарея;
8. расширение зрачков;
9. образование гусиной кожи или периодический озноб;
10. тахикардия или гипертензия;
11 .зевота;
12. беспокойный сон.
Как видно из критериев состояния отмены, предлагаемых в МКБ-10,
очень многие симптомы синдрома отмены опиоидов сходны с симптомами,
наблюдаемыми при вирусном гепатите. Наиболее часто встречаются
мышечные боли, расширение зрачка, озноб, нарушение сна. Для
дифференциальной диагностики имеет значение тот факт, что эти симптомы
возникают после прекращения введения наркотического средства и могут
быть купированы приемом этого вещества. Больные, как правило, достаточно
хорошо знают проявления абстиненции у себя и часто указывают на
появление чувства отвращения после введения наркотика при появлении
интоксикации, вызванной вирусным поражением печени. Введение наркотика
не приводит к ожидаемому улучшению в состоянии, а иногда приводит к
усилению симптомов интоксикации.
Легкая степень абстиненции наблюдается чаще в результате
употребления героина в течение 3 месяцев ежедневно в дозе приблизительно
0,1 - 0,2 г в сутки у начинающих внутривенное употребление и
характеризуется нерезко выраженными вегетативными расстройствами
(риноррея, слезотечение, озноб, частое дыхание), алгический синдром
выражен слабо.
Средняя степень тяжести абстиненции наблюдается при более
длительных сроках употребления героина - 6 - 9 месяцев, толерантость
достигает 0,25-0,5 г сутки для лиц, употребляющих в течение первого года,
наркозависимые, длительное время употребляющие наркотики, достигают
такой толерантности после перерыва за 1-3 месяца. Симптомы: нерезко
выражены вегетативные расстройства, алгический синдром,
психопатологическая симптоматика.
675
Таблица 109
Основные схемы применения психотропных препаратов для лечения
абстинентного синдрома опийной наркомании в зависимости
от степени тяжести проявлений.
Схемы Степень тяжести
лечения легкая Средняя тяжелая ।
№1 Клофелин 0,0003- 0,00045 г/сут Тиапридал до 0,3 г/сут Диазепам 0,01-0,06 г/сут Баралгин 5-15 мл/сут Финлепсин 0,4- 0,6/сут Клофелин 0,00045- 0,0006 г/сут Типридал до 0,6 г/сут Диазепам 0,5% в/м 2-12 мл/сут Баралгин 5-15 мл/сут Пикамилон 0,06-0,15 г/сут. Финлепсин 0,4 -0,6 г/сут. Леривон 0,03 г/сут. Клофелин 0,00045- 0,0006 г/сут. Тиапридал до 0.8 г/сутки. Диазепам 0,5%- 2-12 мл/сутки. Баралгин 5-15 мл/сут 1 Пикамилон 0,06- 0,15 г/сут. । Финлепсин 0,4-0,6 г/сут. Леривон 0,06-0.09 . г/сут. 1
№2 Тиапридал до 0,Зг/сут. Геминеврин 1800мг Пирроксан 0,06г/сут. Максигам 5- 15мл/сут. Неулептил 0,01- 0,04г/сут. Тиапридал О.бг/сут. Геминеврин 2400мг. Пирроксан 0.09г/сут. Максигам 5 - 15мл/сут. Неулептил 0,01 - 0,04г/сут. Леривон 0,03г/сут. Тиапридал до 0,8г/сутки Геминеврин 1 3200мг/сут 1 Пирроксан 0,12г/сут Максигам 5- 15мл/сут Неулептил 0.01- 0,04г/сут Леривон 0,06-0,09 i г/сут.
№3 । Клофелин 0,0003- 0,00045г/сут. Геминеврин 1800мг/сут Тиапридал до О,3г/сутки. Баралгин 5-15мл/сут Финлепсин 0,4- 0,6г/сут. Клофелин 0,00045- 0,0006г/сут. Геминеврин 2400мг Тиапридал до О.бг/сут Баралгин 5-15.мл/сут Финлепсин 0.4- О.бг/сут Леривон 0,03г/сут Клофелин 0,00045- 0,0006г/сут । Геминеврин 3200мг\сут Тиапридал до 0,8г/сут Баралгин 5-15мл/сут ' Финлепсин 0,4- 0,6г/сут Леривон 0,06-0,09 г/сут. !
676
Толерантность к героину носит индивидуальный характер и может давать
лишь ориентировочно ожидаемую степень тяжести проявлений абстинентного
синдрома. При легкой степени выраженности абстинентного синдрома
патогенетические препараты назначаются на 3-5 дней, при средней степени
на 7 дней, при тяжелой степени длительность лечения 10-12 дней.
Хорошо зарекомендовали себя схемы лечения абстинентного синдрома,
в основе которых лежит сочетание тиапридала с клофелином. Предложенные
в таблице 109 схемы лечения использовались успешно в терапии опийного
абстинентного синдрома у беременных женщин с вирусными гепатитами и
ВИЧ-инфекцией.
При развитии септических осложнений у ВИЧ-инфицированных
наркозависимых болевой синдром рекомендуется купировать тиапридалом
в сочетании с баралгином, особенно если требуется длительное
обезболивание. Трамал назначается на короткие сроки, так как к нему
развивается привыкание. Препарат клофелин при септических состояниях,
особенно при подозрении на септический эндокардит, назначается
осторожно.
У ряда пациентов наблюдались при назначении тиапридала
экстрапирамидные расстройства - лингвооральный синдром, окулогирный
криз (судорога взора), скованность, акатизия, которые купировались
назначением циклодола 0,002-0,004 внутрь, реланиумом 20-40 мг в/м, кофеин-
бензоат натрия 20% 1,0 подкожно.
История болезни.
Больной 3., 19 лет, поступил с жалобами на слабость, плохой сон, боли
в эпигастральной области, потемнение мочи.
При поступлении состояние средней тяжести, кожные покровы с
выраженной желтухой, склеры иктеричные. Лимфатические узлы мелкие,
подвижные, безболезненные при пальпации.
Пульс 72 уд. в минуту, АД 120/70 мм. Тоны сердца ясные. Дыхание
жесткое, рассеянные сухие хрипы. Живот мягкий, безболезненный. Печень
на 3,5 см выступает из-под края реберной дуги, плотная, безболезненная.
Моча темная. Стул оформленный, светлый.
Из анамнеза известно, что родился доношенным, рос и развивался
нормально. Наследственность не отягощена. Окончил 9 классов. Работает
помощником кровельщика. Перенес черепно-мозговую травму в детстве,
освобожден от службы в Армии с диагнозом: посттравматическая
энцефалопатия. Оперирован в 1994 году по поводу аппендицита.
Курит с 9 лет, выкуривает пачку сигарет в день. Алкоголь попробовал в
12 лет, атипичные реакции на алкоголь отрицает, предпочитает употребление
пива, толерантность до 2,0 л. Курить анашу начал в 15 лет. В 17 лет начал
677
употреблять героин сначала интраназально, затем внутривенно. Употребление
носило эпизодический характер 1-3 раза в месяц.
Был обследован по контакту с больным вирусным гепатитом в ноябре
1998 году, выявлен вирусный гепатит С, HCV АЬ+, безжелтушная форма,
легкое течение.
Биохимические анализы крови при поступлении:
АлАт 638 ед/л
Билирубин 18 мкмоль/л
Сулемовая проба 2,0 ед
Тимоловая проба 0,6 ед
Маркеры: HAV JgM (-), HBs Ag (-), HBcor Ab (-), HCV Ab (+).
Во время лечения вирусного гепатита был замечен в употреблении
наркотиков, самовольно покинул отделение. Продолжал употребление
наркотиков, введение героина стало ежедневным. Толерантность до 0,25 г в
сутки. Перенес абстинентный синдром в мае 1998 года, лечился анонимно,
отмечалась ремиссия 2 месяца летом 1998 года. Возобновил наркотизацию с
сентября этого же года.
Заболевшим себя считает с 22.11.99, когда поднялась температура до
38, появилась слабость, тошнота, снижение аппетита. Потемнение мочи
появилось 26.11.99, заметил желтушность кожи. Последнее употребление
героина накануне поступления в стационар. При поступлении биохимические
анализы:
АлАт 1376 ед/л
билирубин 159 мкмоль/л
тимоловая проба 17,9 ед
сулемовая проба 1,3 ед
протромбиновый индекс 72%
Альбумины 53 г/л
Глобулины: альфа-1 - 3,7%
альфа-2 - 8,4 %
бета - 8,0%
гамма - 27%.
Маркеры: HBcorAb(+), HBsAg(+), HCV(+), HAVJgM(+).
Данные УЗИ: диффузные изменения, гепатоспленомегалия.
Больной получил базисную терапию вирусного гепатита и терапию
абстинентного синдрома героиновой наркомании. Выписан с улучшением.
Диагноз: острый вирусный гепатит А -г В, среднетяжелое течение,
желтушная форма, сопутствующий хронический гепатит С. Наркомания
вследствие употребления героина, абстинентный синдром.
678
Эта типичная история болезни, которая позволяет проследить
формирование зависимости от героина у пациента. На фоне продолжающегося
употребления наркотиков происходит реинфекция вирусами гепатитов А, В и
формирование хронического процесса в печени из-за репликации вируса
гепатита С.
Нейролептики аминазин, азалептин, терален, этаперазин, тизерцин,
хлорпротиксен, которые рекомендуется в лечении наркоманий в кратком
клиническом руководстве под редакцией Н.Н.Иванца, у больных с
заболеваниями печени используются ограничено.
Сочетание степени тяжести вирусного гепатита и абстинентного
синдрома определяет выбор схемы лечения. Как показывает практика, при
тяжелых формах вирусного гепатита проявления абстиненции уходят на
второй план, как правило, независимо от стажа употребления наркотиков и
толерантности. Ведущей терапией является лечение проявлений
интоксикации, вызванных вирусным поражением печени. По мере улучшения
состояния больного появляется необходимость лечения психопатологических
расстройств.
Среднетяжелые формы гепатитов требуют проведения
дезинтоксикационной терапии, которая является аналогичной при
абстинентном синдроме. Проведение патогенетической терапии купирования
абстинентного синдрома на фоне выраженных клинических проявлений
гепатита переносится больными хорошо.
При легких формах течения гепатита, когда основными в терапии
являются режим, диета, симптоматическое лечение, основные жалобы
составляют проявления абстинентного синдрома героиновой наркомании.
Схема выбора лечения определяется степенью выраженности клиники
абстинентного синдрома.
Проведение адекватной терапии синдрома отмены не влияло на
положительную динамику биохимических показателей, вто же время, в ряде
случаев наблюдали связь повышения биохимических показателей с
нарушением режима воздержания от наркотиков.
Терапия постабстинентной фазы опийной наркомании с 10 по 21 день
направлена на купирование аффективных, психопатоподобных,
неврозоподобных расстройств, коррекцию поведения, купирование влечения
к наркотикам.
Рекомендуется налтрексон, антидепрессанты: гептрал 0,4-1,6 г/сутки,
амитриптилин 0,04-0,15 г/сутки, герфонал 0,15-0,25 г/сутки, лудиомил 0,025-
0,075 г/сутки, коаксил 0,025-0,05 г/сутки, мелипрамил 0,075- 0,2 г/сутки,
пиразидол 0,05-0,15 г/сутки, анафранил 0,02-0,05 г/сутки, паксил 0,02-0,04 г/
сутки, прозак 0,02-0,04 г/сутки, леривон 0,03-0,09 г/сутки.
679
Средства, подавляющие патологическое влечение к наркотику (оди низ
препаратов): Финлепсин 0,4-0,6 г/сутки, Суксилеп 0,5-1,0 г/сутки, Конвулекс
0,9-1,2 г/сутки, Фалилепсин 0,2-0,3 г/сутки.
По показаниям со 2-3 суток нейролептики (один из препаратов):
Неулептил 0,01-0,04 г/сутки, Эглонил 0,2-0,6 г/сутки, Сонапакс 0,03-0,05
г/сутки, Галоперидол 0,005-0,015 г/сутки.
Ноотропы: пантогам 1,5-3,0 г/сутки, пикамилон 0,06-0,15 г/сутки,
фенибут 0,75-1,0 г/сутки.
Аминокислоты: аминалон 1,0-1,5 г/сутки, глутаминовая кислота 0,75-
1,0 г/сутки, церебролизин 3-5 мл в/м 1 раз в сутки.
Физиотерапия: ИРТ, электротранквилизация, массаж, акупунктура.
Психотерапия.
В связи с длительными сроками пребывания в стационаре пациентов
с ВИЧ-инфекцией перспективно более широко использовать препарат
антаксон - антагонист опиатов - в постабстинентном периоде с целью
профилактики ранних рецидивов.
Антаксон - налтрексона гидрохлорид является чистым антагонистом
опиатов. 50 мг антаксона способны блокировать фармакологические действия
введенных внутривенно 25 мг героина на протяжении 24 часов. Курс лечения
до 3 месяцев.
В фазе ремиссии проводится профилактика рецидивов, купирование
влечения к наркотикам, коррекция аффективных и психопатоподобных
расстройств. Рекомендуются: налтрексон, антидепрессанты, средства,
подавляющие влечение к наркотику, ноотропы, витамины, аминокислоты.
Физиотерапия. Психотерапия: семейная, поведенческий контракт,
рациональная, групповая, эмоционально-стрессовая, гипнотерапия, суггестия
на фоне электротранквилизации, аутотренинг.
Психостимуляторы.
К этой группе относятся кокаин, амфетамины, эфедрон, первитин.
Кокаин является ведущим наркотиком в странах Латинской Америки, в
России употребление кокаина распространено в ограниченных кругах из-за
его высокой стоимости.
В местах проведения свободного времени молодежи предлагаются
синтетические наркотики, производные амфетамина: МДМА - «АДАМ»,
МЕДА - «ЕВА», экстази и др.
Среди пациентов в Санкт-Петербурге 7-8% употребляют эфедрон -
препарат психостимулирующего действия, который самодельно
приготовляют из лекарственных средств, содержащих эфедрин. В некоторых
регионах России этот наркотик является ведущим наряду с героином.
680
После первых приемов эфедрона состояние интоксикации длится 6-8
часов, по мере продолжения введения эфедрона этот промежуток
укорачивается, в связи с чем увеличивается частота введения до 15 раз в
сутки. Спустя определенный промежуток времени у каждого больного
вырабатывается свой ритм введения наркотического вещества. Это может
быть введение наркотика в течение 3-4 дней с последующим перерывом от
нескольких дней до нескольких недель, у некоторых больных встречается
употребление эфедрона ежедневно втечение нескольких лет.
Симптомы интоксикации: повышенная чувствительность к внешним
раздражителям, Многоречивость, стремление к непродуктивной
однообразной деятельности, мидриаз, отсутствие или резкое снижение
прямой и содружественной реакции на свет, нарушение конвергенции,
горизонтальный мелкоразмашистый нистагм, тахикардия, повышение
давления, симптоматика, свидетельствующая о поражении пирамидной,
экстрапирамидной и мозжечковой системы. Состояние интоксикации может
продолжаться 3-4 часа, затем сменяется вялостью, апатией, чувством
разбитости, тоскливым настроением.
При интоксикации вследствие употребления психостимулирующих
средств проводится следующая терапия.
Дезинтоксикация: физиологический раствор 400,0, раствор Рингера
400,0, трисоль 400,0, хлосоль 400,0,5% раствор глюкозы, 10% раствор глюкозы
- в/в капельно, панангин 10-20 мл в/в, раствор калия хлорида 1 %-100-150,0 в/
в капельно; реополиглюкин 400,0; полиглюкин 400,0 - в/в капельно.
Соотношение вводимых растворов электролитов: растворов сахаров/
плазмозамещающих/дезинтоксикационных растворов = 2:2:1. Общее
количество введенной жидкости не должно превышать 1-1,5 л/сутки.
Сердечные гликозиды: строфантин 0,05% 1-2 мл/сутки, дигоксин
0,025% 1-2 мл/сутки, коргликон 0,06% 1-2 мл/сутки.
Витамины: пиридоксин 5% 4,0 в/м, тиамин бромид 6% 4,0 в/м,
никотиновая кислота 1% 2,0 в/м, аскорбиновая кислота 5% 5,0 с 40%
раствором глюкозы 10,0 в/в, цианокобаламид 0,01% 1,0 в/м.
Ноотропы: пирацетам 20% 5,0-10,0 в/м или в/в с 40% раствором
глюкозы 10,0.
Дегидратационная, спазмолитическая терапия: раствор магния
сульфата 25% 5-10,0 в/в, раствор эуфиллина 2,4% 5-10,0 в/в, дибазол 1% 2-
6,0 в/м, в/в, раствор но-шпы 2% 2-4 мл в/м, трентал 2% 5 мл в/в, фуросемид
1% 1-4 мл по показаниям.
Транквилизаторы, снотворные, седативные препараты (по показан и я м);
Диазепам 0,5% 2,0-10 мл в/в, в/м, Феназепам 0,002-0,004 г/сутки,
пирроксан 0,015-0,06 г/сутки, натрия оксибутират 20%> 10-20,0 внутрь.
Экстракорпоральная детоксикация: плазмаферез, энтеросорбция.
44. Заказ № К-4451.
681
Абстинентный синдром начинается чаще на следующие сутки после
последнего введения эфедрона и продолжается в среднем 7-8, в отдельных
случаях до 14 дней.
Абстинентный синдром проявляется общей слабостью, вялостью,
раздражительностью, постоянной сонливостью, депрессией с тяжелыми
дисфориями, элементами негативизма. Соматические осложнения
проявляются миокардиодистрофией, на ЭЭГ - гипертрофия левого желудочка,
диффузные мышечные изменения, нарушения внутрижелудочковой
проводимости (Пятницкая И.Н. и др., 1986). После употребления эфедрона в
течение 2-3 лет появляются признаки хронической интоксикации марганцем
(как примеси в кустарно изготовляемом эфедроне), которые сводятся к
появлению хореиформных гиперкинезов - размашистых движений руками и
ногами, от которых больному трудно удержаться, и парезу мягкого неба, языка,
лицевых мышц.
С целью купирования острых абстинентных расстройств вследствие
употребления психостимуляторов проводится специфическая терапия
бромкриптином 0,00175-0,0035 г/сутки.
По показаниям:
Диазепам 0,01-0,06 г/сутки или 0,5% 2-12 мл/сутки в/м,
Грандаксин 0,05-0,3 г/сутки, Нитразепам 0,005-0,03 г/сутки,
Феназепам 0,0005-0,002 г/сутки, Хлозепид 0,01-0,04 г/сутки,
Мелипрамил 0,075- 0,2 г/сутки, Пиразидол 0,05-0,15 г/сутки,
Анафранил 0,02-0,05 г/сутки, Паксил 0,02-0,04 г/сутки,
Прозак 0,02-0,04 г/сутки.
Ноотропы: пирацетам 1,2-2,4 г/сутки, пиридитол 0,2-0,4 г/сутки,
пикамилон 0,06-0,15 г/сутки.
Аминокислоты: аминалон 1-1,5 г/сутки,
глутаминовая кислота 0,75-1,0 г/сутки,
церебролизин 3-5 мл в/м 1 раз в сутки.
Витамины.
Физиотерапия.
Галлюциногены.
Галлюциногенами называются вещества, способные при их приеме даже
в малых дозах вызывать галлюцинации. К ним относятся ЛСД, мескалин,
псилоцибин, псилоцин, диметоксиамфетамин, триптамин, диметилтриптамин,
2,5-диметокси-4-метиламфетамин.
ЛСД - синтетический наркотик, синтезированный в 1943 году,
превышающий по силе действия втысячи раз мескалин. Мескалин был выделен
из какгуса пейота, который использовался индейскими племенами во время
ритуальных обрядов. Псилобицин и псилоцин содержатся в грибах, которые в
682
больших количествах вырастают в нашем регионе в августе - октябре.
Высушенный гриб содержит 0,4-0,2 процента псилобицина. Влияние
галлюциногенов на центральную и периферическую нервную систему
обусловлено действием на высвобождение нейромедиаторов: серотонина,
дофамина, норадреналина. Симптомы: мидриаз, повышение давления,
тахикардия, тремор, повышение рефлексов, тошнота. Типичное психоактивное
действие: эйфория, визуальные галлюцинации, изменение восприятия цвета,
формы, тактильные галлюцинации, потеря ощущения времени, перепады
состояния от расслабленности до появления чувства страха, паники.
Продолжительность действия, как правило, 8-12 часов. Прием галлюциногенов
может провоцировать первый приступ шизофрении и аффективных психозов
(Личко А.Е., Битенский В.С., 1991).
С целью полного купирования симптомов острой интоксикации
используются аналептики и психостимуляторы: кордиамин 25% 1,0 в/в, п/к,
сульфокамфокаин 10% 2,0 в/м, кофеин бензоат натрия 20% 1,0 в/в, п/к, в/м.
Проводится детоксикация: физиологический раствор 400, хлосоль 400,
трисоль 400, раствор Рингера400,5% раствор глюкозы 400,10% раствор глюкозы
400 в/в капельно, реополиглюкин 400, полиглюкин 400, гемодез 400,
гидрокарбонат натрия 4% 100-150,0 по показаниям, панангин 10-20 мл в/в, 1%
раствор калия хлорида 100-150 в/в капельно. Соотношение вводимых растворов
электролитов: растворов сахаров / плазмозамещающих/дезинтоксикационных
растворов = 2:2:1. Общее количество вводимой жидкости зависит от состояния
больного и степени интоксикации, может достигать 6 л/сутки.
Витамины: тиамина бромид 6% 4 мл в/м, пиридоксин 5% 4 мл в/м,
никотиновая кислота 1 % 2мл в/м, аскорбиновая кислота 5% 5 мл с 40% раствором
глюкозы 10 мл.
Ноотропы: пирацетам 20% 5-10 мл в/м или с 40% раствором глюкозы 10
мл в/в.
Дегидратационная, спазмолитическая терапия: раствор магния сульфата
25% 5-10 мл в/в, раствор эуфиллина2,4%-5 10 мл в/в, раствор но-шпы 2% 2-4
мл в/в, раствор фурасемида 1% 1-4 мл (по показаниям).
Экстракорпоральные методы детоксикации: плазмаферез, энтеросорбция.
Каннабиоиды.
Конопля произрастает в регионах с умереннотеплым климатом. Основной
психоактивный элемент получил название дельта-9-тетраксидканнабиол.
Высушенные и измельченные листья, части цветущих верхушек конопли
называются марихуаной, «травкой», гашиш - смесь прессованной смолы,
пыльцы. Содержание каннабиоидов в марихуане 1-3%, в гашише 10-15%, в
гашишном масле 40-60%. Этот наркотик смешивают с табаком и употребляют
в виде курения. Этот наркотик является самым распространенным наркотиком
44.
683
первой пробы, а также часто используется как замена основного наркотика в
постабстинентном периоде или ремиссии.
Симптомы интоксикации: инъекция сосудов склер, тахикардия, снижение
мышечной силы, расстройства сознания в виде оглушения, может быть
гиперактивность с безудержным смехом, болтливостью, нарушение восприятия
окружающего, кратковременная память и внимание ослаблены.
С целью купирования симптомов острой интоксикации проводится
детоксикация: физиологический раствор400, хлосоль400,трисоль400, раствор
Рингера 400,5% раствор глюкозы 400,10% раствор глюкозы 400 в/в капельно,
реополиглюкин 400, полиглюкин 400, гемодез 400, гидрокарбонат натрия 4%
100-150,0 по показаниям, панангин 10-20 мл в/в, 1% раствор калия хлорида
100-150 в/в капельно. Соотношение вводимых растворов электролитов:
растворов сахаров / плазмозамещающих / дезинтоксикационных растворов -
2:2:1. Общее количество вводимой жидкости зависти от состояния больного и
степени интоксикации, может достигать 6 л/сутки. Витамины: тиамин бромид
6% 4 мл в/м, пиридоксин 5% 4 мл в/м, никотиновая кислота 1% 2 мл в/м,
аскорбиновая кислота 5% 5 мл с 40% раствором глюкозы 10 мл.
Ноотропы: пирацетам 20% 5-10 мл в/м или с 40% раствором глюкозы 10
мл в/в.
Дегидратационная, спазмолитическая терапия: раствор магния сульфата
25%-5-10 мл в/в, раствор эуфиллина2,4%-5 10 мл в/в, раствор но-шпы 2% 2-4
мл в/в, раствор фурасемида 1% 1-4 мл по показаниям.
В лечении острого абстинентного синдрома вследствие употребления
каннабиоидов используются транквилизаторы, снотворные и седативные
препараты: диазепам 0,01-0,06 г/сутки, грандаксин 0,05-0,3 г/сутки, нитразепам
0,005-0,03 г/сутки, феназепам 0,0005-0,002 г/сутки, хлозепид0,01-0,04 г/сутки,
альпрозолам 0,5-2,0 г/сутки.
Средства, подавляющие патологическое влечение к наркотику, один из
препаратов:
финлепсин 0,4-0,6г/сутки, Су ксилеп 0,5-1,0г/сутки,
Конвулекс 0,9-1,2 г/сутки, Фали-лепсин 0,2-0,3 г/сутки,
Неулептил 0,01-0,04 г/сутки, Эглонил 0,2-0,6 г/сутки,
Сонапакс 0,03-0,05 г/сутки, Галоперидол 0,005-0,015 г/сутки.
Ноотропы: пирацетам 1,2-2,4 г/сутки, пиридитол 0,2-0,4 г/сутки,
пикамилон 0,06-0,15 г/сутки, пантогам 1,5-3 г/сутки.
Витамины: аевит 4-6 капсул/сутки, пангексавит 2-3 таблетки в сутки,
аэровит 1 -2 таблетки в сутки, квадевит 2-3 таблетки в сутки, глутамевит 2-6
таблетки в сутки, компливит 2-3 таб/сутки, аскорутин 3-5 таблетки в сутки,
липоевая кислота 0,025-0,5 г/сутки.
Аминокислоты: аминалон 1-1,5 г/сутки, глутаминовая кислота0,75-
1,0 г/сутки, церебролизин 3-5 мл в/м 1 раз в сутки.
684
Неспецифические биостимуляторы: алоэ 1,0 п/к, тактивин 100 мкг п/к.
Физиотерапия: ИРТ, электротранквилизация.
Психотерапия.
Симптоматическое лечение: антиаритмические средства, аналептики.
анальгезирующие средства, ферментные лекарственные средства.
Заключение.
Эпидемия наркомании приводит к увеличению употребляющих
наркотики пациентов, которые инфицируются вирусами гепатитов В, С и ВИЧ.
Вопросы диагностики и тактики лечения должны решаться комплексно,
с учетом имеющихся клинических проявлений, совместно врачами наркологами
и инфекционистами.
Предоставленные материалы являются ориентиром в работе врачей,
которые сталкиваются с проблемой зависимости.
Выбор лекарственных препаратов решается индивидуально в соответствии
с клиническими проявлениями заболевания.
Литература
1. Ахтырская Н.А., Сизова Н.В., Рахманова А.Г. и др. Особенности
эпидемии ВИЧ-инфекции в Санкт-Петербурге. Тезисы Российско-
Американского совещания «Стратегии предупреждения наркоманий и
связанных с ними инфекционных заболеваний», -1999.
2. Веселовская Н.В., Изотов Б.Н., СавчукС.А.//Вопросы наркологии.-1998.
-№2. -С. 43-52.
3. Воронин К.Э.//Лекции по клинической наркологии (под редакцией
Н.Н.Иванца). -М.: Российский благотворительный фонд «НАН». 1995.-
С. 157-174.
4. Иваней Н.Н. Антидепрессанты в терапии патологического влечения к
психоактивным веществам. - М.: Инфоконт, 1997. -С.20-26.
5. Иванец Н.Н., Даренский И.Д., Стрелец Н.В., Уткин С.И. Лечение
алкоголизма, наркоманий и тксикоманий.- М., 1998.
6. Ивинец Н.Н., Винникова М.А.// Вопросы наркологии,- 1998.-№4.-С.10-
13.
7. Ледванова Т.Ю., Ледванов М.Ю., Фирстова В.В.//Вопросы наркологии.
-1998. -№3.-С. 71-76.
8. Личко А.Е., Битенский В.С. Подростковая наркология: руководство. -
Л.: «Медицина». - 1991,- С. 184.
9. Марков И.В., Афанасьев В.В., Цыбулькин Э.К., Неженцев М.В.
Клиническая токсикология детей и подростков. -СПб.: Интермедика. -
1998.-С.134-235.
10. Найденова Н.И.//Вопросы наркологии. -1998 г. -№4. -С. 14-16.
685
11. Полятыкин С.А., Рассадина Н.А., Виноградова А.В. Опыт применения
препарата антаксона в наркологической практике. -М.: РБФ «НАН». -
1999.
12. Пятницкая И.Н. Наркомании (руководство для врачей).- М.: «Медицина»
1994.
13. Рохлина М.Л., Воронин К.Э. и др. Принципы фармакотерапии
наркоманий. - М.: Минздрав РФ.-1997.
14. Стрелец Н.В., Петракова Л.Б. и др. Острые психозы у больных
хроническим алкоголизмом и опийными наркоманиями, развивающиеся
в ходе стационарного лечения. - М.: Минздрав РФ. -1997.
15. Шевцов А.В., Винникова М.А.//Вопросы наркологии. -1998. -№4. -С. 17-
20.
16. Novak, Schifman, Brikman, Drogensucht, -Stuttgart. -1996.
17. Rakhmanova A., Iakovlev A., Vinogradova E., Vlasov N. Viral hepatitis in
drug users in St. Petersburg; The tendency. -St. Petersburg. -1997.
686
Глава 17. ОРГАНИЗАЦИЯ СЛУЖБЫ ПО ПРОФИЛАКТИКЕ
И БОРЬБЕ СО СПИДОМ В КРУПНОМ ГОРОДЕ
Организация службы оказания медицинской помощи больным ВИЧ-
инфекцией в крупном городе.
Организация службы ВИЧ/СПИД в крупном городе в связи с наличием
многопрофильных специализированных инфекционных стационаров, научно-
исследовательских институтов, академии последипломного образования и
других учреждений не могла сводиться только к формированию Городского
центра по профилактике и борьбе со СПИД. Служба по профилактике и
борьбе со СПИД включает Городской центр по профилактике и борьбе со
СПИД, инфекционные стационары, кафедры академии последипломного
образования и Научно-исследовательские институты. При этом имеется
тесная взаимосвязь со службой Госсанэпиднадзора. Комитет по
здравоохранению города, являясь организатором службы, координирует
деятельность по проблемам СПИДа со всеми учреждениями, вовлеченными
в этот процесс, а также наркологической, акушерско-гинекологической,
охране материнства и детства, дермато-венерологической, инфекционной
служб, для профилактики - центры медицинской профилактики, центры
планирования семьи, с общественными организациями. Работа по аспектам
ВИЧ/СПИДа проводится и на уровне городской администрации для
обеспечения взаимодействия со всеми Комитетами, а также с
Законодательным собранием и комиссиями, имеющими существенное
значение в финансировании и осуществлении городских программ (схема
10).
Структуры службы профилактики и борьбы со СПИДом прошли в
Санкт-Петербурге следующие этапы:
- май 1987 года - создание диагностической лаборатории в
инфекционной больнице им. С.П.Боткина для осуществления скрининга и
подтверждающих тестов, иммуноблота. Эта лаборатория получила название
референс-лаборатории, которая работает по настоящее время. К настоящему
времени в городе имеется 13 лабораторий, осуществляющих первичный
скрининг на ВИЧ-инфекцию;
- июнь 1987 года - организация консультативно-диагностического
кабинета для проведения анонимного обследования и амбулаторной помощи
инфицированным ВИЧ. Открытие 40-коечного боксированного отделения в
инфекционной больнице им. С.П.Боткина для различных видов
специализированной помощи и стационарного лечения (в инфекционно-
хирургических, акушерско-гинекологических и других подразделениях
инфекционной больницы);
687
Схема 10
688
август 1987 года--открытие лаборатории по обследованию на ВИЧ
донорской крови в службе переливания крови;
- март 1988 года-организация амбулаторно-поликлинического отделения
с анонимным кабинетом в больнице № 30 им. С.П.Боткина, выделившегося в
самостоятельную структуру «Центр СПИДа» (в 1990 году);
- май 1989 года - создание централизованной лаборатории для
тестирования на ВИЧ, сифилис, гепатит В всей донорской крови;
- август 1989 года-организация Северо-Западного центра СПИД в НИИ
им. Пастера, открытие межведомственной лаборатории с правом
подтверждения;
- 1991 год - открытие Республиканской Клинической больницы для
детей (Усть-Ижора);
- 1992 год - выделение центра профилактики и борьбы со СПИД в
самостоятельное учреждение, юридически независимое от инфекционной
больницы им. С.П.Боткина;
- 1997 год - организация в инфекционной больнице № 30 еще одного
отделения для ВИЧ-инфицированных наркоманов с введением в штат этого
отделения наркологов и психотерапевтов;
1997 год-организация работы по профилактике ВИЧ-инфекции
у наркоманов, автобус Фонда «Возвращение»;
1999 год - открытие Научно-практического центра для
беременных женщин и детей для оказания лечебно-диагностической,
консультативно-методической и научно-практической помощи всем
Российским центрам по профилактике и борьбе со СПИД;
1999-2000 годы - активизация работы по профилактике ВИЧ-
инфекции и вирусных гепатитов у наркоманов с функционированием еще
двух автобусов при инфекционной больнице №10 (Городской
гепатологический Центр) с участием специалистов из города Мальмо
(Швеция) и «Врачи мира» (Франция);
2000-2001 года - реконструкция зданий, выделенных для центра
профилактики и борьбы со СПИД, с формированием в них специальных
подразделений для больных с ВИЧ-инфекцией.
Таким образом, оказание медицинской помощи больным ВИЧ-
инфекцией проводится в нескольких учреждениях
• амбулаторная помощь с их диспансеризацией в Городском центре
по профилактике и борьбе со СПИДом, а также в городской
инфекционной больнице им. С.П.Боткина, где открыт с 1999 года
дневной стационар
• стационарная помощь в отделениях инфекционной больницы им.
С.П.Боткина, вт.ч. в отделении для наркозависимых при участии
689
всех подразделений и служб больницы, включая инфекционно-
хирургическое и акушерско-гинекологическое отделения; в
стационаре Городского Центра по профилактике и борьбе со СПИД,
а также в республиканской клинической больнице (Усть-Ижора),
российском Научно-практическом центре для беременных женщин
и детей.
Пациент имеет право выбора для лечения в любом из указанных выше
подразделений. Во всех учреждениях оказывается психо-социальная
поддержка инфицированным ВИЧ и их семьям, а в инфекционной больнице
им. С.П.Боткина для них создан специальный медико-социальный отдел.
В медицинских учреждениях, наряду с лечебно-диагностической и
консультативной помощью, осуществляется профилактическая работа.
Все медицинские учреждения являются каналами профилактики ВИЧ/
СПИДа, они же осуществляют до- и послетестовое консультирование наряду
с лечением больных и уходом за ними.
В соответствии с рекомендациями М3 РФ диспансерное наблюдение
за ВИЧ-инфицированными лицами осуществляется в плановом порядке на
ранних стадиях ВИЧ-инфекции один раз в месяц, а в более поздних стадиях
заболевания - 1 раз в 6 месяцев.
При этом проводятся клинические обследования, а также
лабораторные, включая определение СВ4-лимфоцитов и, при возможности,
вирусной нагрузки. При уровне СВ4-лимфоцитов менее 500/мм3 плановое
обследование проводится 1 раз в 3 месяца.
При наличии показаний проводятся консультации различных
специалистов, инструментальные исследования, кожно-туберкулиновый тест
(проба Манту). Целью диспансерного наблюдения является оказание
своевременной медицинской помощи, а также психологической поддержки.
По действующему законодательству обследование пациентов проводится с
добровольного согласия, однако рекомендуется активное приглашение ВИЧ-
инфицированных на обследование и лечение и, как мы указывали выше,
больной имеет право выбора для лечения и получения других видов медико-
социальной помощи.
Организация службы по профилактике ВИЧ-инфекции.
В условиях роста числа ВИЧ-инфицированных, преимущественно в
среде инъекционных наркоманов на фоне резкого роста числа
наркозависимых в городе, особую актуальность в качестве способа борьбы с
эпидемией ВИЧ/СПИДа принимает профилактика ВИЧ-инфекции и других
болезней, передаваемых половым путем, профилактика наркомании.
Информационно-просветительские программы по профилактике
вышеперечисленных заболеваний являются неотъемлемой частью городской
690
программы, направленной на укрепление здоровья всего населения и
собственно входят в сферу гигиенического воспитания и образования
населения. Конечной целью подобного рода программ является формирование
установок человека на здоровый образ жизни, формирование навыков
здорового образа жизни и предупреждение таких заболеваний как ВИЧ-
инфекция и др. ЗППП, вирусные гепатиты с парентеральным путем передачи,
наркомания.
Основные принципы организации профилактики ВИЧ-инфекции.
Все профилактические программы основываются на объективной оценке
ситуации по данным заболеваниям, на результатах социологических
исследований, проведенных в различных социальных группах населения.
Очень важно учитывать особенности российской ментальности, традиций, с
преобладанием духовного отношения к высоким чувствам любви,
исключительной ценностью семейных отношений с целью исключения
отрицательной реакции части общества, реагирующей на пропаганду
безопасного секса как на «развращение» молодежи.
Для формирования профилактических программ прежде всего
необходимо определить потребности для их эффективного осуществления.
Только после выявления и обозначения существующих потребностей
возможно правильное принятие решений, планирование и оценка
эффективности мероприятий.
Главными инструментами для оценки потребностей той или иной
территории являются методы эпидемиологической статистики,
эпидемиологических и социально-гигиенических исследований целевых
групп населения.
В результате исследований выявляется отношение населения в целом,
той или иной социальной группы к исследуемой проблеме, отношение к своему
здоровью, уровень информированности населения в отношении ВИЧ-
инфекции, факторов риска заболевания и др.
Необходимо использование принципов системы общественного
здравоохранения, направленных на улучшение здоровья и предупреждение
заболевания, как на местном, так и на национальном уровне, используя
работников здравоохранения, специалистов по общественному
здравоохранению, санитарно-просветительной работе, научных работников,
представителей общественности (обществ) и политических деятелей.
Структура и функции профилактических программ.
1. Первичная профилактика.
Она рассчитана на практически все здоровое население. Такие виды
программ чрезвычайно важно рекомендовать для проведения в подростковой
691
среде, т.е. это своего рода различные просветительные и образовательные
программы, например программы по половому воспитанию подростков,
программы по безопасному сексу, «Жизнь без наркотиков» и др.
2. Вторичная профилактика.
Она проводится среди людей, имеющих тот или иной опыт
взаимодействия с вредным агентом. В сущности, это есть не что иное, как
профилактические программы, направленные на предотвращение
дальнейшего распространения, например, наркотиков, а также программы,
направленные на снижение вреда от их употребления: снижение риска,
связанного с инъекционным введением (обмен шприцев - Автобус или
стационарно в наркологических кабинетах и кожно-венерологическом
диспансере, снижение частоты инъекций), уменьшение риска, связанного с
сексуальным поведением (повышение частоты использования
презервативов), конфиденциальное и анонимное добровольное тестирование
с до- и послетестовым консультированием, поощрение позитивного
изменения поведения.
3. Третичная профилактика.
Это комплекс мероприятий, направленных на улучшение качества жизни
людей, попавших в зависимость оттого или иного вредоносного фактора, т.е.
развитие широкой сети социальных и реабилитационных мероприятий.
Информирование и обучение осуществляется по нескольким
направлениям:
• Образование широких слоев населения через средства массовой
информации.
• Выделение целевых групп и работа в группах:
молодежные группы (учащиеся школ, средних учебных
заведений, студенты, воинские коллективы).
педагоги школ, средних учебных заведений, преподаватели
ВУЗов.
родители школьников и учащихся,
группы волонтеров.
медицинские работники (врачи разных специальностей,
средний медицинский персонал, лабораторные работники и др.).
группы повышенного риска (люди гомосексуальной
ориентации, проститутки, наркоманы, беспризорные дети, люди,
находящиеся в местах лишения свободы).
• Работа на индивидуальном уровне (ВИЧ-инфицированные
пациенты, пациенты анонимных кабинетов, приходящие на анонимное
тестирование и консультирование и др.).
Характеристики обучающих программ с учетом возраста обучаемых:
учет возрастных характеристик:
692
- уровень 10-12 лет - объяснение психологических и
физиологических изменений растущего организма «Я знаю, что со мной
происходит»,
- уровень 12-15 лет - формирование мотивации на отказ от
социального экспериментирования на себе «Я не спешу пробовать табак,
алкоголь, наркотики, начать сексуальную жизнь»,
- уровень 15-17 лет-формирование модели психологически зрелого
социально-ответственного поведения в отношении собственного здоровья
«Я хочу быть здоровым, я знаю, как уберечься от ЗППП, ВИЧ-инфекции,
наркотиков»,
- уровень 18 лет - формирование мотивации к семейно-брачным
отношениям и безопасному сексу: «Чтобы быть счастливым, надо быть
здоровым, уметь любить и быть любимым».
Необходимо, с учетом того, что подавляющее число ВИЧ-
инфицированных в России (80-90%) - это наркоманы, добиться
психологической «иммунизации» детей против наркотиков на наиболее раннем
возрастном уровне.
Методы проведения профилактической работы.
1. Проведение образовательных семинаров по вопросам
эпидемиологии, профилактики, лечения, социальным аспектам ВИЧ-
инфекции для корреспондентов местных средств массовой информации,
включая теле- и радиокорреспондентов.
2. Подготовка и публикации в органах печати материалов (статьи,
интервью, обращения, открытые письма и т.п.) по проблеме ВИЧ/СПИД с
упором на вопросы эпидемиологии и предупреждения заражения ВИЧ-
инфекции.
3. Подготовка радиоматериалов (информации, беседы, круглые
столы, дискуссии, радиоклипы и т.п.) по вопросам профилактики ВИЧ-
инфекции среди различных групп населения, в первую очередь молодежи
и потребителей наркотиков и обеспечение их трансляции по местным
радиоканалам.
4. Организация трансляции по каналам местного телевидения
видеоклипов по профилактике ВИЧ-инфекции.
5. Создание специальной телевизионной рубрики или цикла передач,
посвященных вопросам обсуждения различных аспектов проблемы ВИЧ/
СПИД, сделав основной упор на молодежной аудитории.
6. Подготовка информационных материалов по различным аспектам
проблемы ВИЧ-инфекции и размещение их в местных компьютерных сетях.
7. Подготовка и проведение лекций, бесед, круглых столов, дискуссий
по вопросам ВИЧ-инфекции среди учащихся старших классов
693
общеобразовательных школ, профессионально-технических училищ,
техникумов, высших учебных заведений.
8. Обучение средствам и методам предупреждения заражения ВИЧ-
инфекцией пациентов медицинских учреждений и отделений
наркологического профиля, отделений вирусных гепатитов инфекционных
больниц.
9. Кроме профессионалов привлечение молодежных лидеров,
молодежных кумиров.
10. Использование популярных изданий, различных молодежных
собраний.
11. Проведение профилактики, основанной на сообществе общения
(outreach - стратегия), направленной в той общественной группе, где данный
индивид живет или проводит время.
Работа в «труднодоступных группах», построение доверительных
отношений с наркозависимыми.
12. Профилактика, основанная на принципе равенства.
Эта работа проводится Центром по профилактике и борьбе со СПИД,
Центром медицинской профилактики, координационным центром по
профилактике наркомании городского наркологического диспансера, кожно-
венерологической службой, другими лечебно-профилактическими
учреждениями и общественными организациями (схема 11).
ВИЧ-инфекция
Список авторов:
Афонина Л.Ю., Бурова Н.В., Виноградова Е.Н., Воробьева М.С.,
Воронин Е.Е., ГяургиеваО.Х., Жолобов В.Е., Жулев Н.М., Калинина Н.М.,
Кетлинский С.А., Кирпичникова Г.И., Комарова А.Я., Корягина В.Н.,
Кузнецов Н.И., Неверов В. А., Осетров Б. А., Пархоменко С.И.,
Рахманова А.Г., Ремезов А.П., Романова Е.И., Ругаль В.И., Сизова Н.В.,
Старцева Г.Ю., Степанова Е.В., Тютликова Л.А., Улюкин И.М.,
Фомин Ю.А., Фролов О.П., Яковлев А.А.
Верстка-Л.В. Немцев
Сдано в печать 12.03.04
Формат 60 х 90 1/16
Тираж 3000 экз.
Печать офсетная.
Издательство “21 век”, г. Самара, 443099,
ул. Ленинградская, 77, офис 48
Заказ № К-4451.
Отпечатано с готовых диапозитивов в ГУП «ИПК «Чувашия».
428019. г. Чебоксары, пр. И. Яковлева, 13.