Автор: Солвей Дж. Г.
Теги: лекарственные средства в соответствии с их активным веществом зоология здравоохранение медицинские науки медицина биохимия медицинская биохимия
ISBN: 978-5-9704-3275-4
Год: 2015
Текст
Medical Biochemistry
at a Glance
Or. I.G. Salway
Schunl nf Uinmedical and Molecular Scieuces
University nf Surrey
Guildferd
Surrey, UK
Third edition
®WI LEY- BLACKWELL
A John Wiley & Sons, Ltd., Publication
Дж.Г. Солвей
Наглядная
МЕДИЦИНСКАЯ
БИОХИМИЯ
Перевод с английского
А.П. Бабищевич, О.Г. Терещенко
Под редакцией
чл.-кор. PAN Е.С. Северина
3-е издание,
переработанное и деполненнве
Москва
Издательская группа «ГЭОТАР-Медиа»
2015
УДК 1577.1+615.272|(076.6)
ББК 28.672и73+52и72
С 60
03-ПРЧ-1362
Солвей, Дж. Г.
С60 Наглядная медицинская биохимия : учеб, пособие / Дж. Г. Солвей ; пер. с англ. А. П. Вабищевич, О. Г. Терещенко ;
под ред. Е. С. Северина. — 3-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2015. — 168 с. : ил.
ISBN 978-5-9704-3275-4
В третьем издании популярного учебного пособия представлена информация по широкому кругу вопросов современной
биохимии. Все процессы проиллюстрированы наглядными рисунками и схемами, которые значительно облегчают понимание
и запоминание непростого материала. Особое внимание уделено медицинским аспектам обмена веществ у человека (указаны
нарушения при различных заболеваниях и возможные мишени действия лекарственных препаратов). Добавлен раздел, посвя¬
щенный основным аспектам молекулярной биологии. Описаны клеточный цикл, структура, функции и свойства РНК и ДНК,
проблемы современной молекулярной биологии.
Предназначено студентам медицинских вузов, также может быть полезно всем, кто интересуется биохимией или хочет
закрепить полученные ранее знания.
УДК [577.1+615.2721(076.6)
ББК 28.672я73+52я72
All Rights Reserved. Authorised translation from the English language edition published by John Wiley & Sons Limited. Responsibility for the accu¬
racy of the translation rests solely with «GEOTAR-Media» Publishing Group and is not the responsibility of John Wiley & Sons Limited. No part
of this book may be reproduced in any form without the written permission of the original copyright holder, John Wiley & Sons Limited.
Все права защищены. Данное издание является переводом оригинальной англоязычной книги, изданной John Wiley & Sons Limited.
Перевод выполнен ООО M3damejtbCKOH группа «ГЭОТАР-Медиа». John Wiley & Sons Limited не несет ответственность за качество
перевода. Никакой Mamepuaji из данной книги не может быть использован без согласия John Wiley & Sons Limited.
© 2012 by John Wiley & Sons, Ltd.
© ООО Издательская группа «ГЭОТАР-Медиа»
перевод на русский язык, 2015
ISBN 978-5-9704-3275-4
Содержание
Предисловие к изданию на русском языке 6
Предисловие к третьему изданию 7
Благодарности 8
Список сокращений 9
Основные обозначения 10
Перевод единиц массы в единицы СИ 11
1. Кислоты, основания и ионы водорода (протоны) 12
2. Что такое pH 14
3. Образование и поступление протонов в кровь
и их удаление из крови 16
4. Метаболический алкалоз и метаболический ацидоз 18
5. Респираторный алкалоз и респираторный ацидоз 20
6. Аминокислоты и первичная структура белка 22
7. Вторичная структура белка 24
8. Третичная и четвертичная структура белка. Коллаген...26
9. Реакции окисления-восстановления. Коферменты
и простетические группы 28
10. Анаэробный синтез АТФ: субстратное фосфорилирова¬
ние, синтез АТФ из фосфокреатина, аденилаткиназная
реакция 30
11. Аэробный синтез АТФ 32
12. Биосинтез АТФ путем окислительного фосфорилирова¬
ния (часть I) 34
13. Биосинтез АТФ путем окислительного фосфорилирова¬
ния (часть II) 36
14. Что происходит в случае утечки протонов пли электро¬
нов из дыхательной цепи 38
15. Свободные радикалы, активные формы кислорода
и окислительное повреждение 40
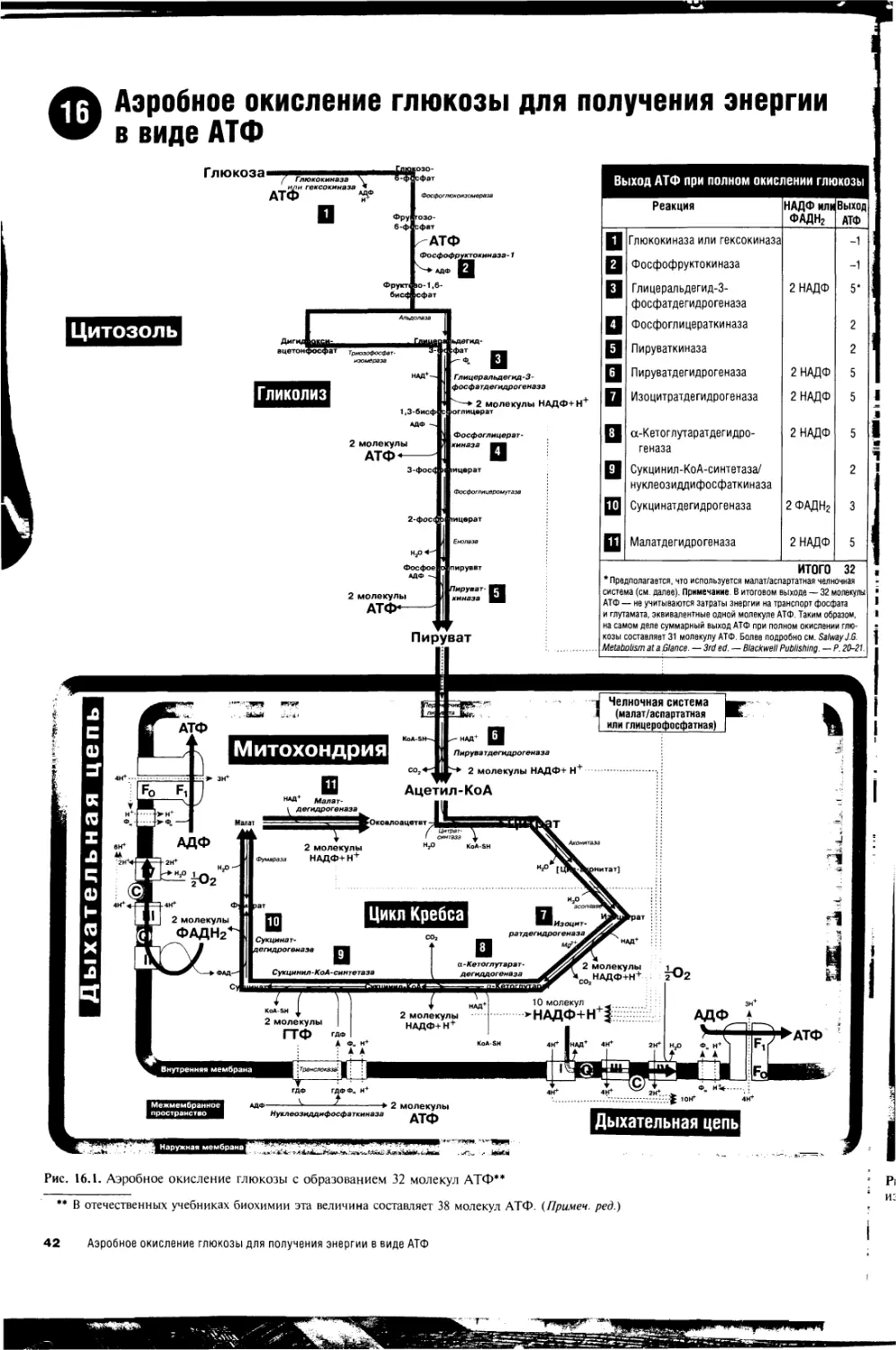
16. Аэробное окисление глюкозы для получения энергии
в виде АТФ 42
17. Анаэробное окисление глюкозы: гликолиз
с образованием АТФ и лактата 44
18. Анаэробный гликолиз глюкозы в эритроцитах,
2,3-БФГ и эффект Бора 46
19. Углеводы 48
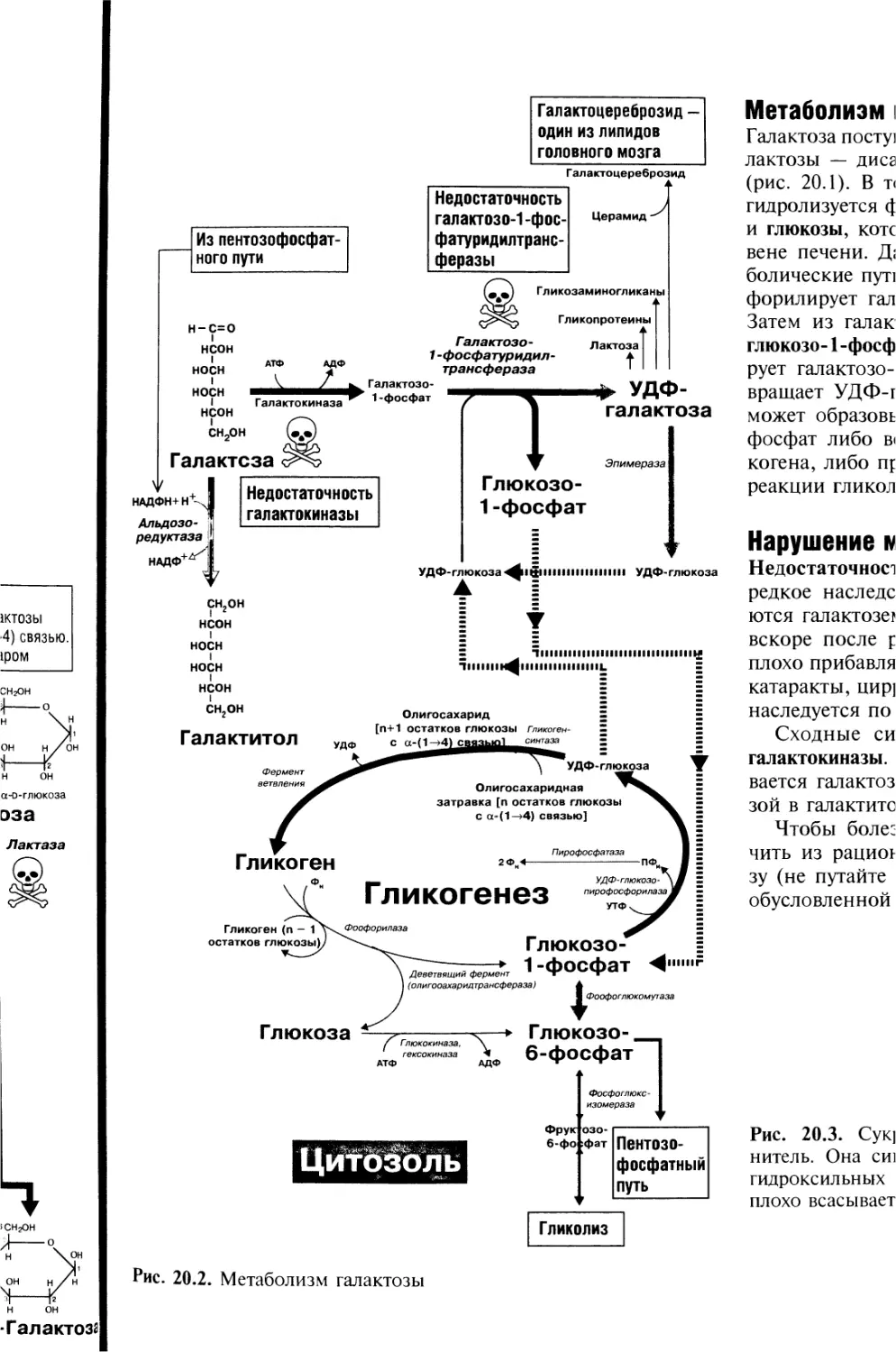
20. Всасывание углеводов. Метаболизм галактозы 50
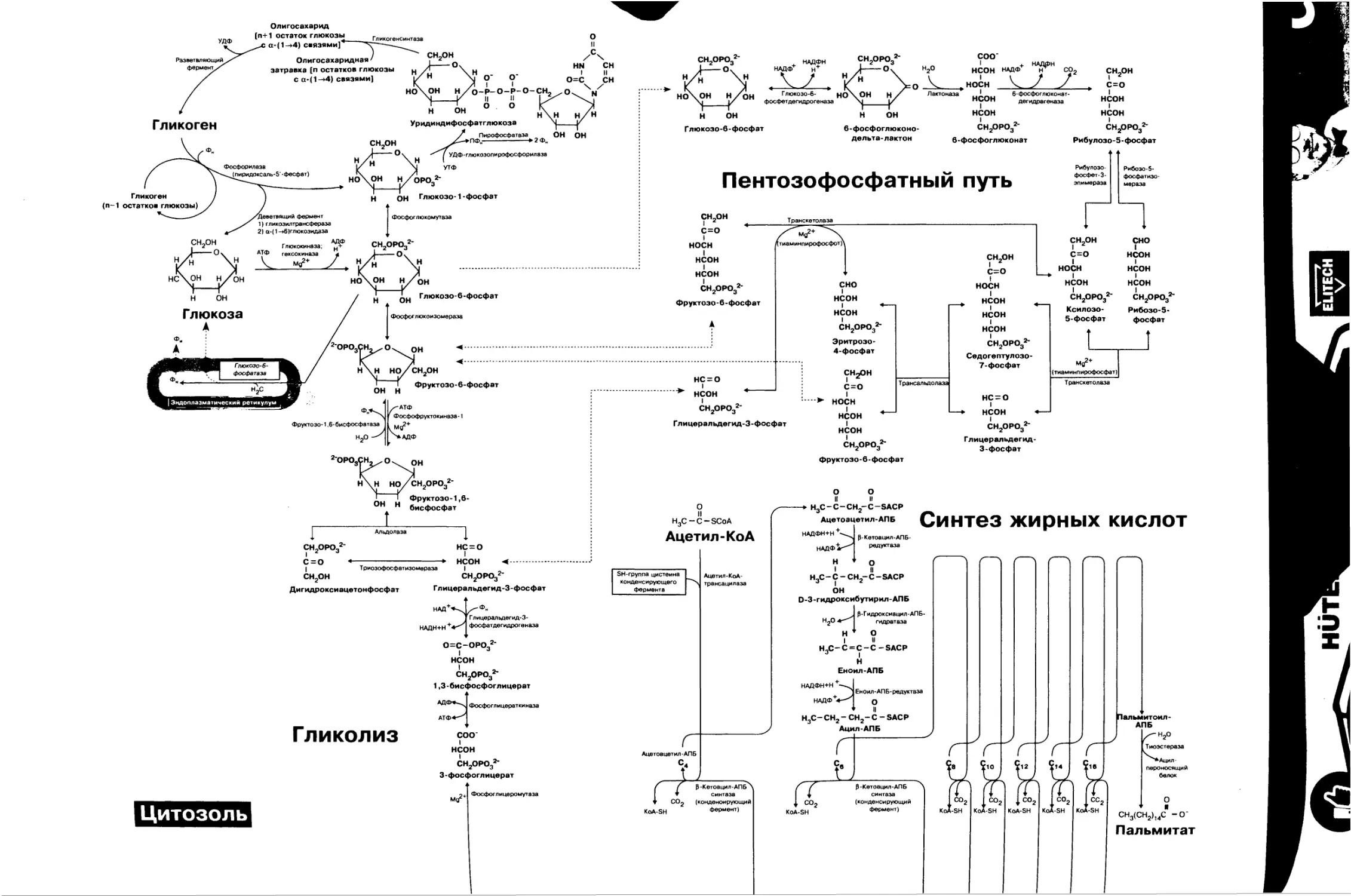
21. Метаболизм глюкозы в печени: гликогенез и липогенез....52
22. Метаболизм фруктозы 54
23. Гомеостаз глюкозы 56
24. Глюкозозависимая секреция инсулина р-клетками 58
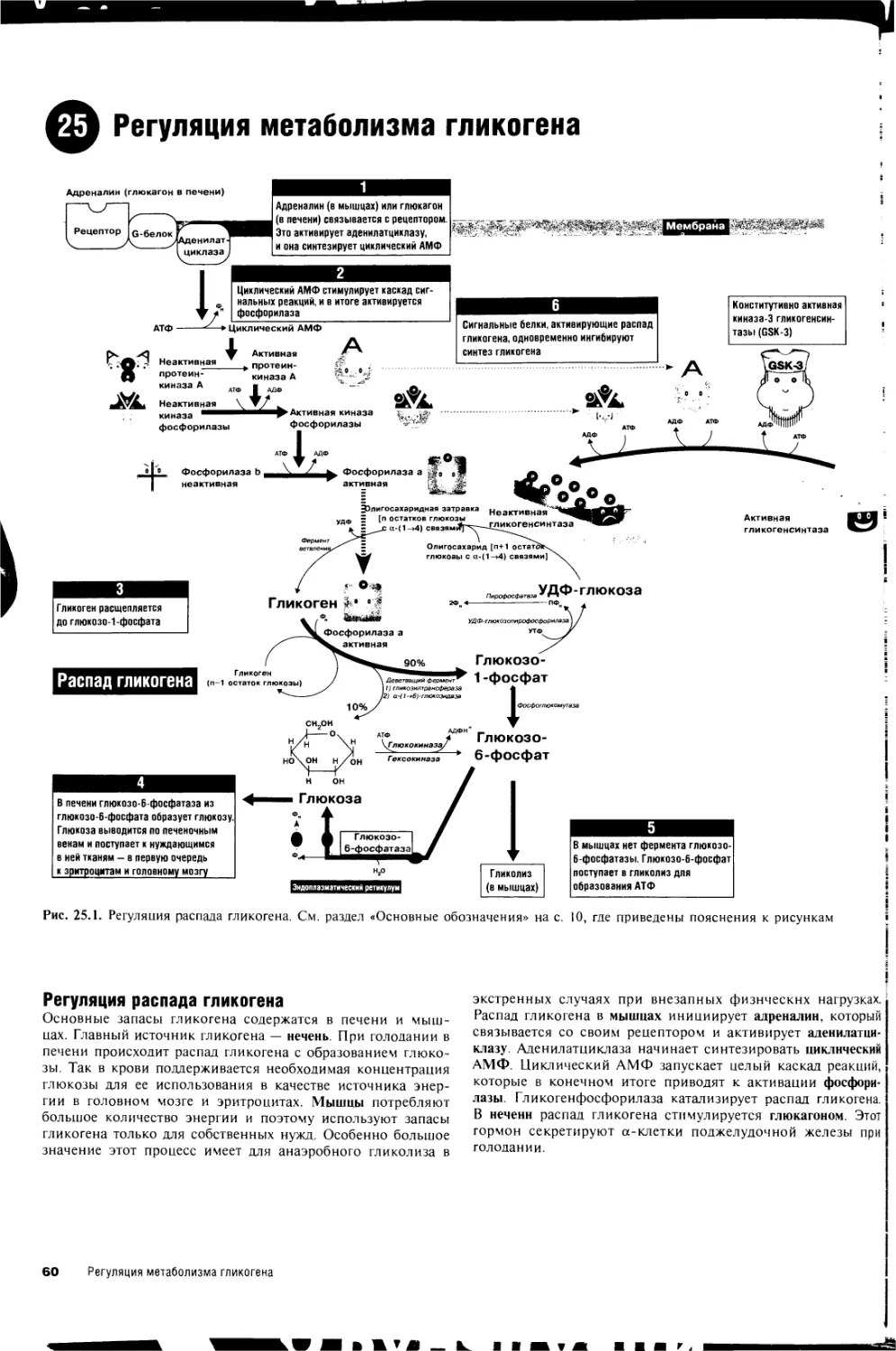
25. Регуляция метаболизма гликогена 60
26. Распад гликогена (гликогенолиз) и болезни
накопления гликогена (гликогенозы) 62
27. Трансдукция сигнала инсулина. Сахарный диабет 64
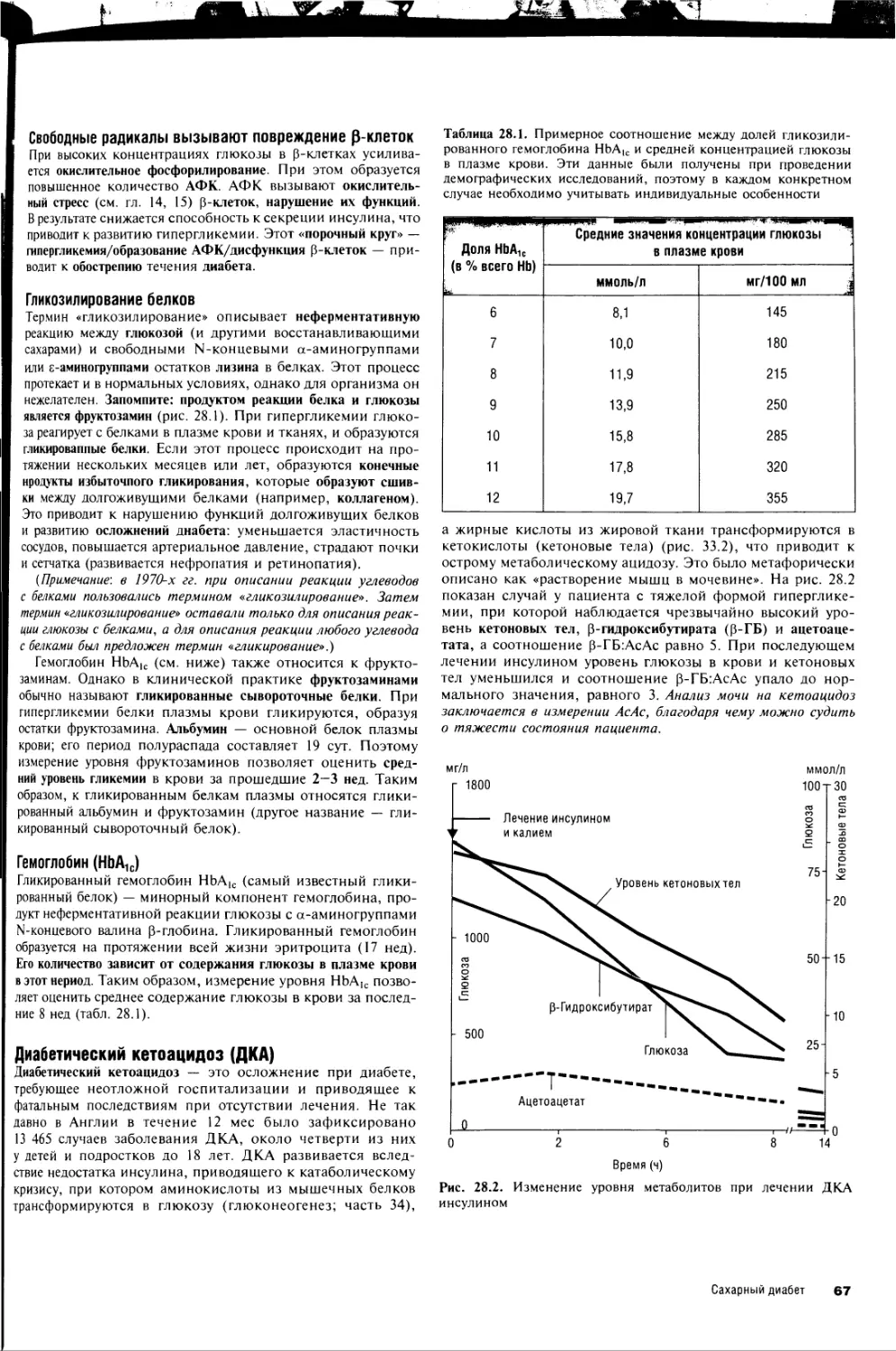
28. Сахарный диабет 66
29. Метаболизм алкоголя: гипогликемия, гиперлактатемия
и жировой гепатоз 68
30. Ферменты: номенклатура ферментов, кинетика
ферментативных реакций, ингибиторы 70
31. Регуляция активности ферментов 72
32. Регуляция гликолиза и цикла Кребса 74
33. Окисление жирных кислот для образования АТФ
(в мышцах) и кетоновых тел (в печени) 76
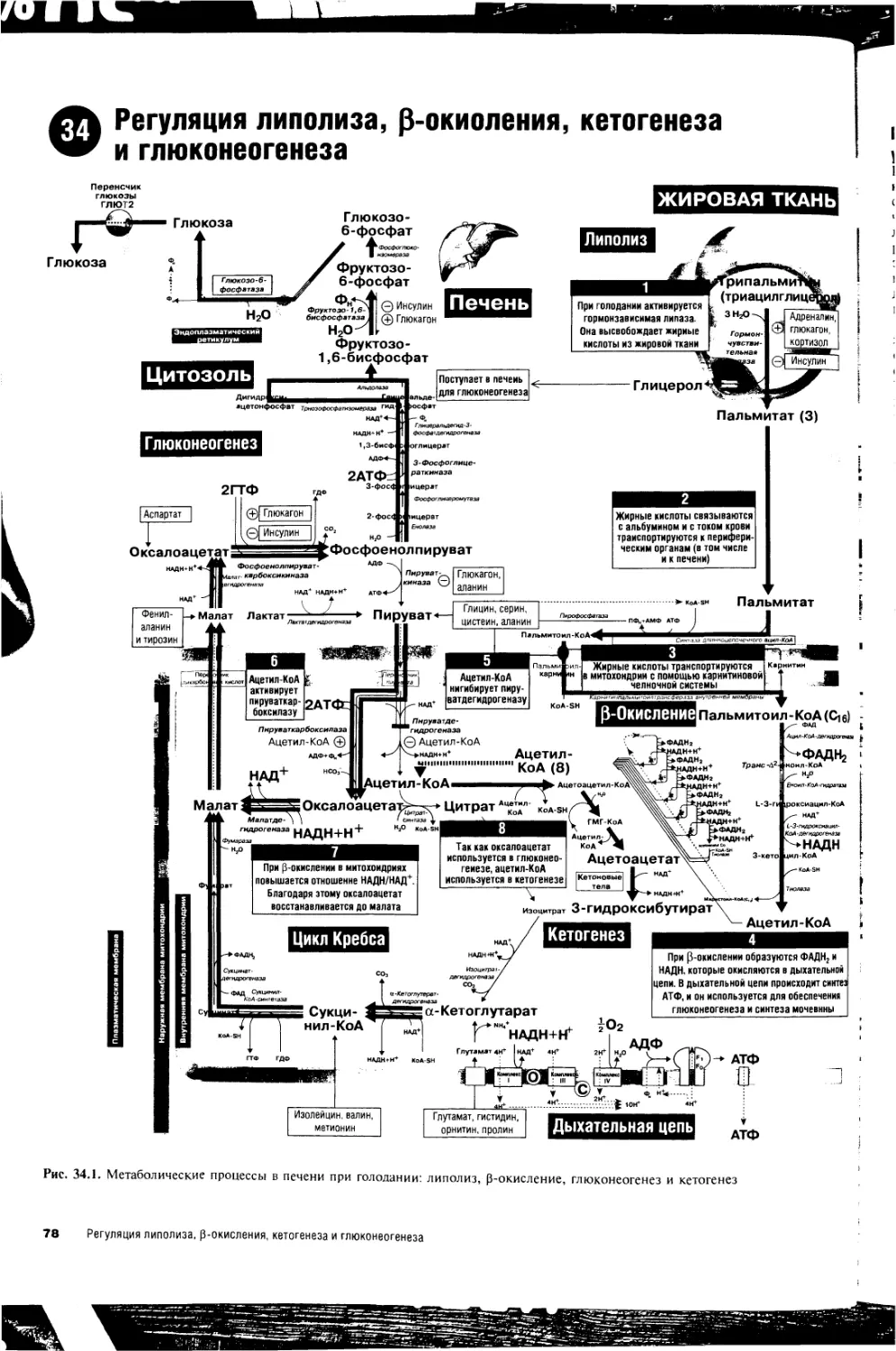
34. Регуляция липолиза, р-окисления, кетогенеза
и глюконеогенеза 78
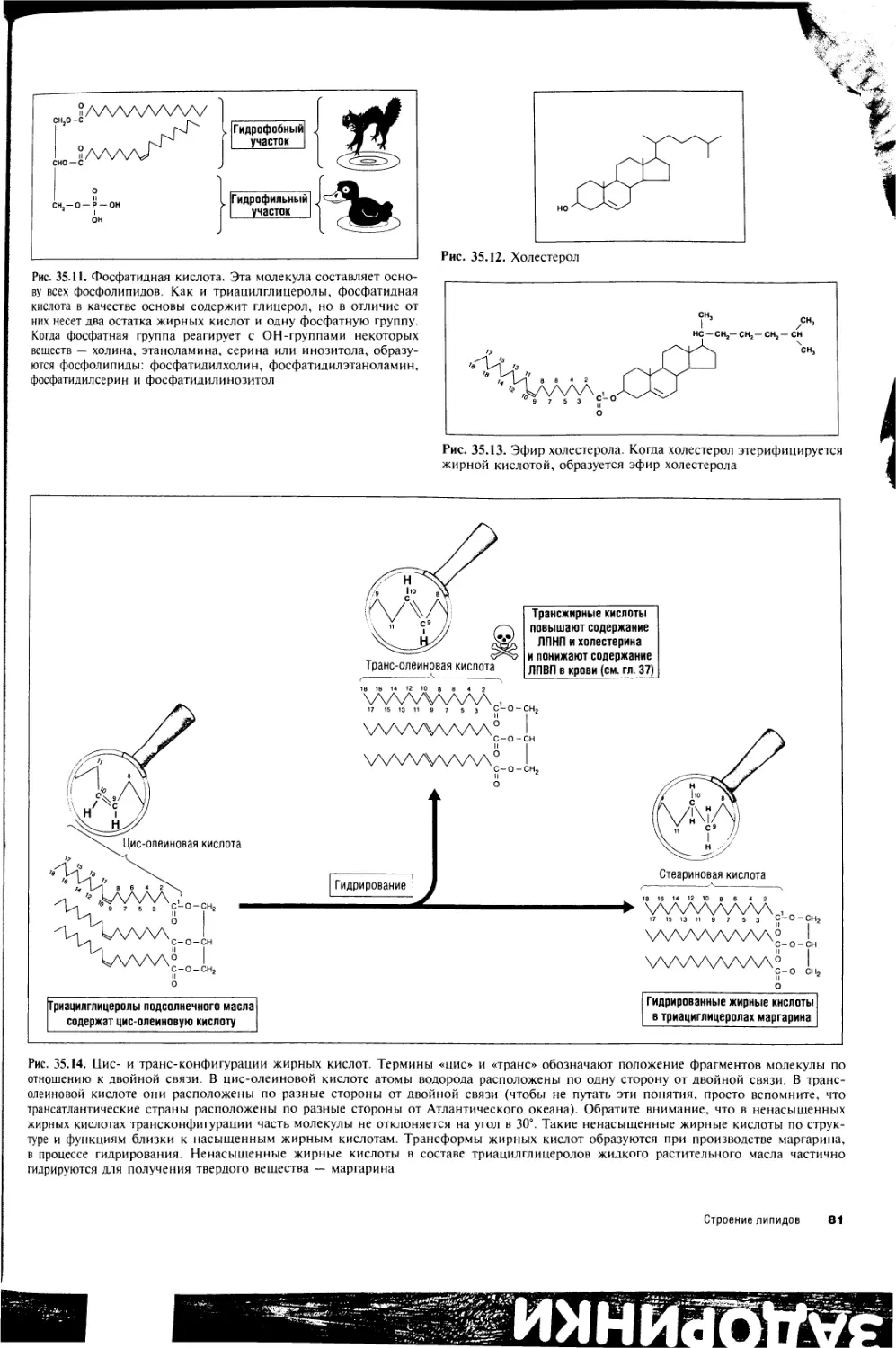
35. Строение липидов 80
36. Фосфолипиды (часть 1): фосфолипиды и сфинголипиды ...82
37. Фосфолипиды (часть II): мицеллы, липосомы,
липопротеины и мембраны 84
38. Синтез холестерола из углеводов и жиров 86
39. Метаболизм ЛПОНП и ЛПНП
(прямой транспорт холестерола) 88
40. Метаболизм ЛПОНП и ЛПНП
(транспорт эндогенных триацилглицеролов) 90
41. Метаболизм ЛПВП
(обратный транспорт холестерола) 92
42. Всасывание триацилглицеролов и холестерола,
поступающих с пищей, и их удаление из крови;
метаболизм хиломикронов 94
43. Стероидные гормоны: альдостерон, кортизол,
андрогены и эстрогены 96
44. Цикл мочевины и краткий обзор катаболизма
аминокислот 98
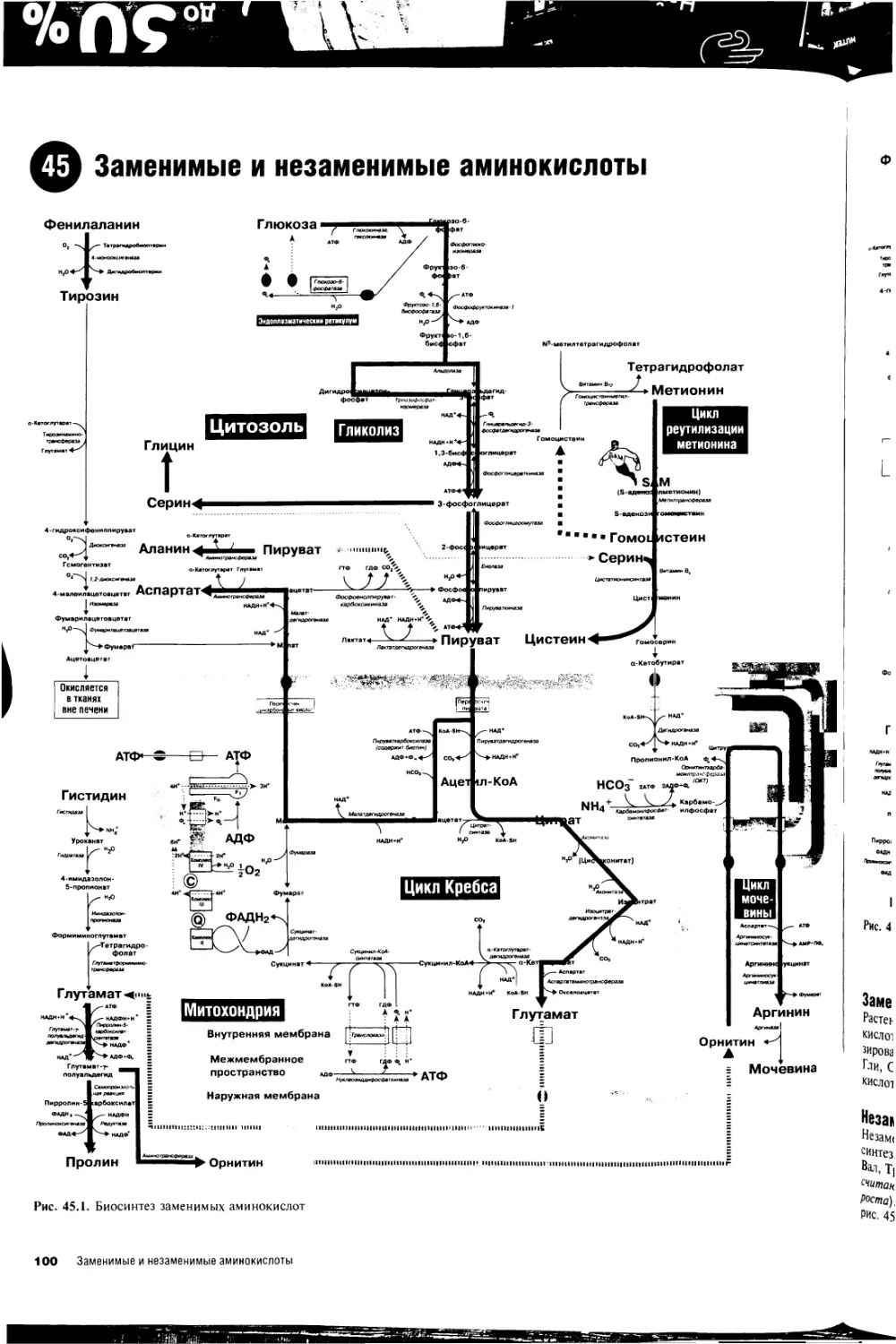
45. Заменимые и незаменимые аминокислоты 100
46. Метаболизм аминокислот: получение энергии в виде
АТФ, образование глюкозы и кетоновых тел 102
47. Нарушение обмена аминокислот: болезнь кленового
сиропа, гомоцистинурия, цистинурия, алкаптонурия
и альбинизм Ю4
48. Метаболизм фенилаланина и тирозина в норме
и при патологии 106
49. Продукты метаболизма триптофана и гистидина 108
50. Гем, билирубин и порфирия ПО
51. Жирорастворимые витамины (часть I):
витамины А и D 112
52. Жирорастворимые витамины (часть II):
витамины Е и К 114
53. Водорастворимые витамины (часть 1): тиамин,
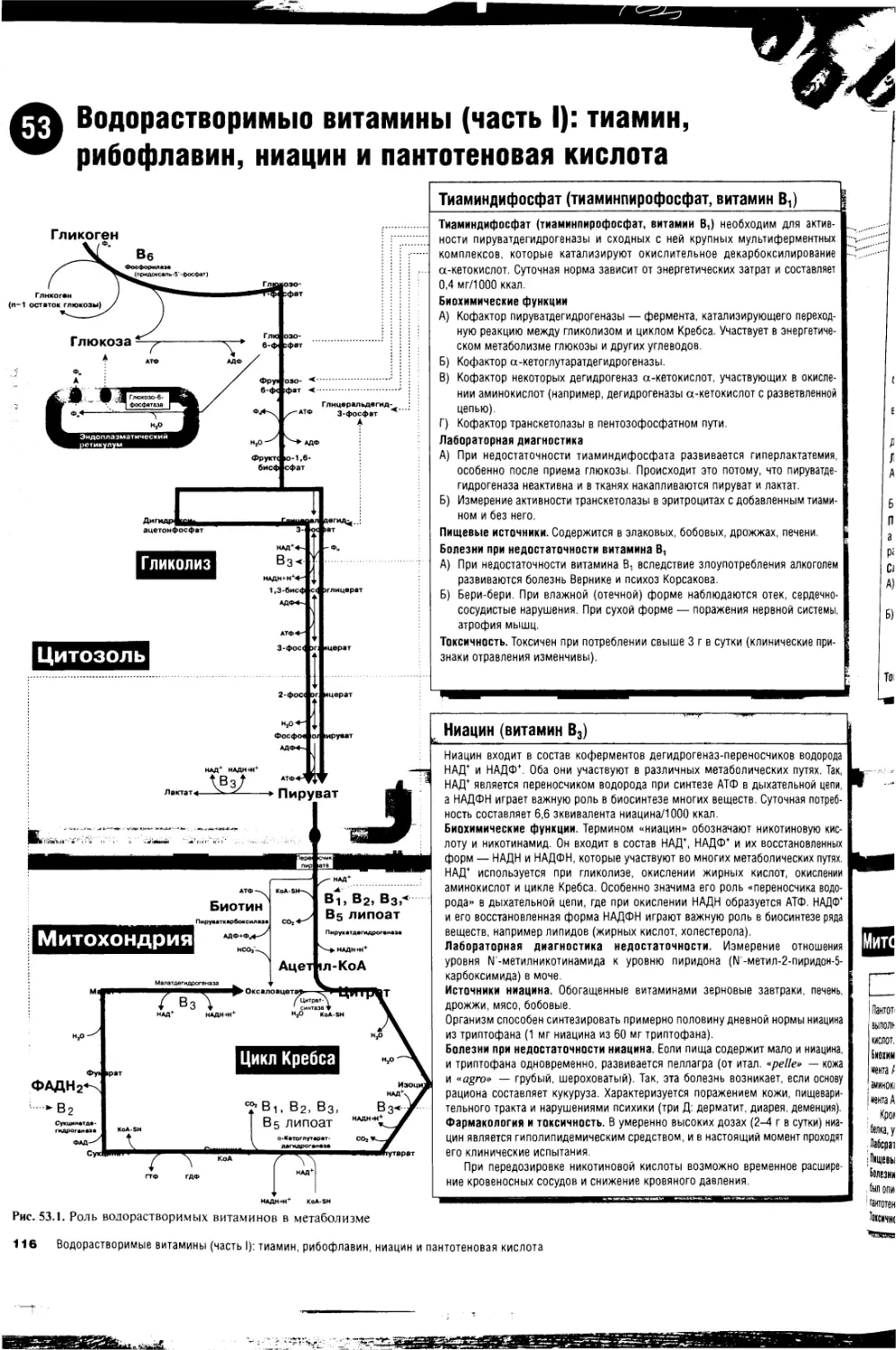
рибофлавин, ниацин и пантотеновая кислота 116
54. Водорастворимые витамины (часть II):
пиридоксальфосфат (В6) 118
55. Водорастворимые витамины (часть III):
фолат и витамин В,2 120
56. Водорастворимые витамины (часть IV):
биотин и витамин С 122
57. Клеточный цикл 124
58. Метаболизм пиримидинов 126
59. Метаболизм пуринов 128
60. Структура ДНК 130
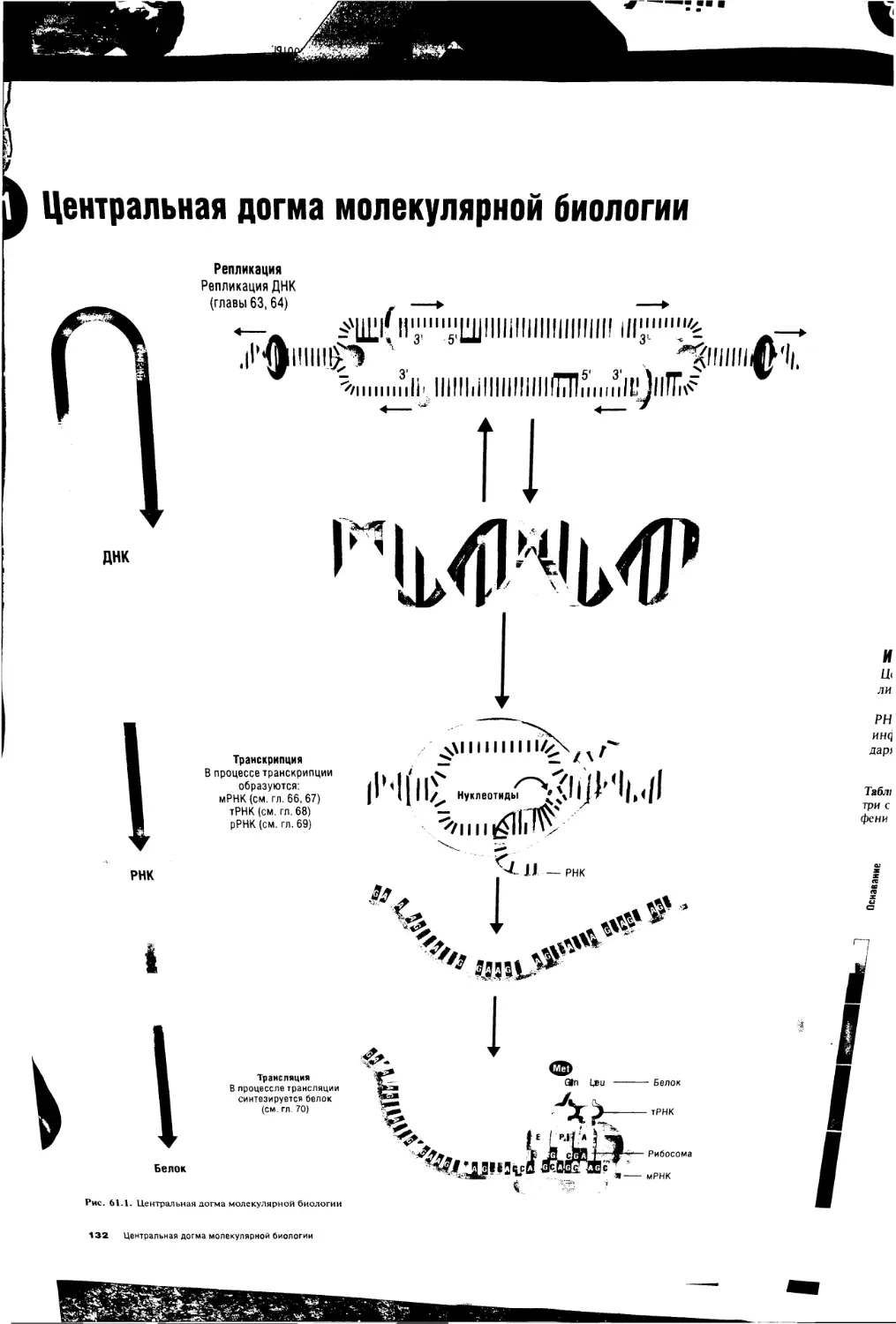
61. Центральная догма молекулярной биологии 132
62. Организация ДНК в хромосомах 134
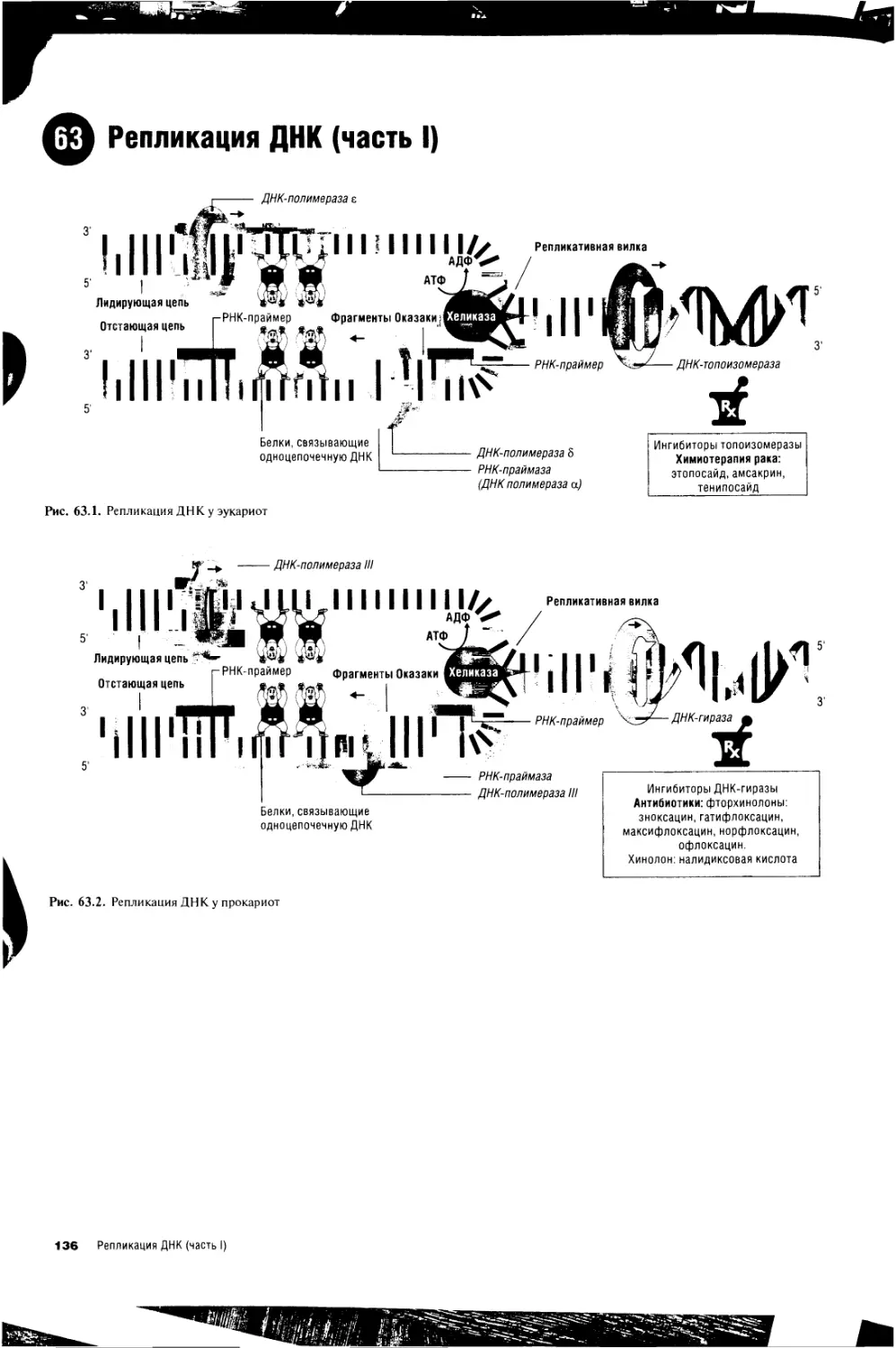
63. Репликация ДНК (часть 1) 136
64. Репликация ДНК (часть II) 138
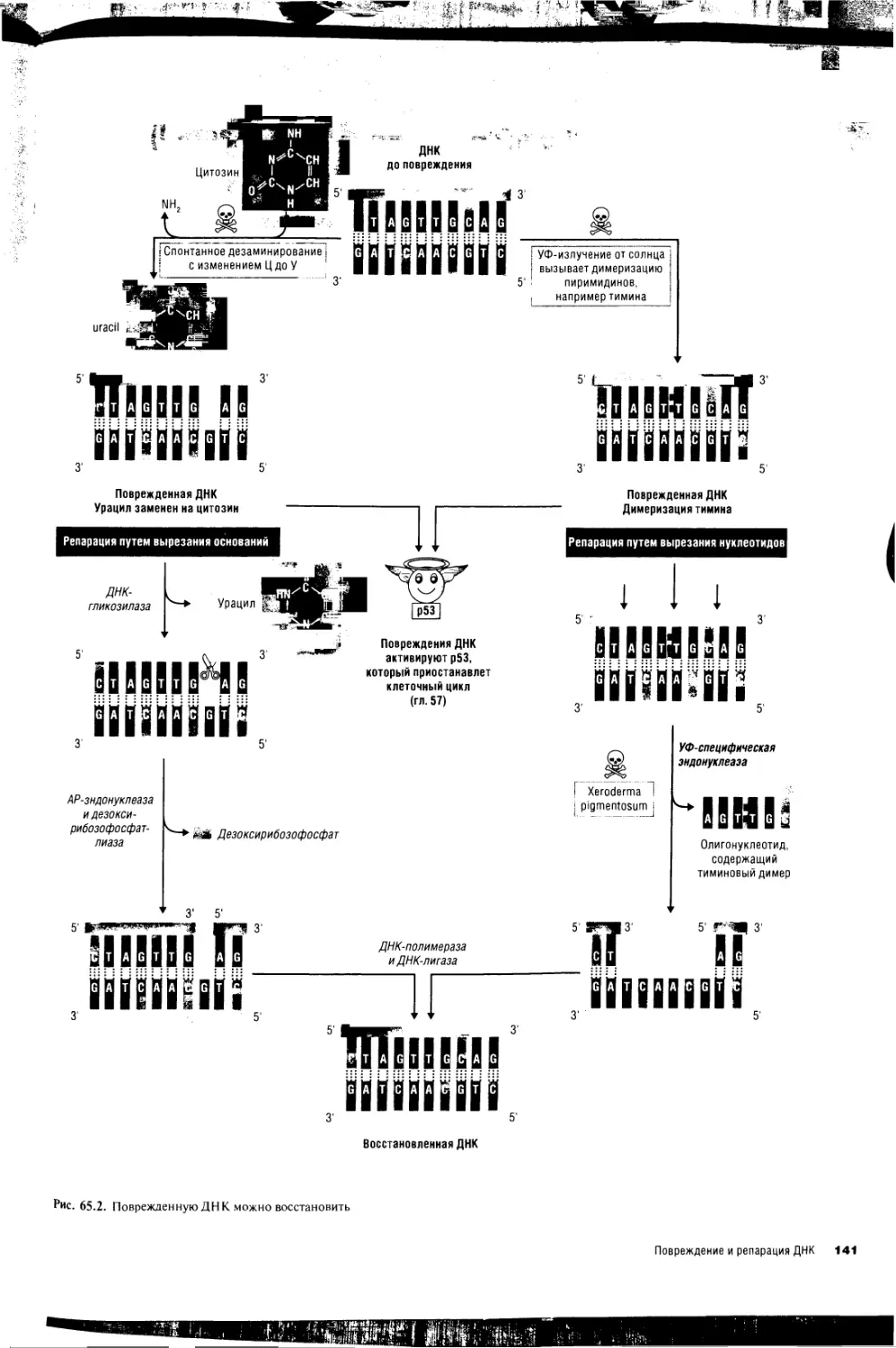
65. Повреждение и репарация ДНК 140
66. Транскрипция ДНК с образованием мРНК (часть 1) 142
67. Транскрипция ДНК с образованием мРНК (часть 11)... 144
68. Транскрипция ДНК с образованием тРНК 146
69. Транскрипция ДНК с образованием рРНК 148
70. Трансляция и синтез белка 150
71. Сравнение процессов транскрипции ДНК,
репликации ДНК и синтеза белка в клетках
эукариот и прокариот 152
72. Клиническая лабораторная диагностика
[совместно с доктором Дж.В. Райтом, почетным
членом Королевской коллегии патологоанатомов
(Dr. J.W. Wright, FRCP, MRCPath)] 154
Предметный указатель 156
Предисловие к изданию
на русском языке
«Наглядная медицинская биохимия» написана английским автором доктором
Дж.Г. Солвеем в удобной для восприятия форме — в виде схем, которые пред¬
ставляют основные биохимические процессы и метаболические пути в клетках
различных тканей и органов человека. Все схемы сопровождаются исчерпываю¬
щими комментариями, акцентирующими внимание читателя на самых значитель¬
ных аспектах анализируемых биохимических процессов. Рассмотрены важнейшие
классы химических соединений, участвующих в основных биохимических про¬
цессах, описаны их строение и свойства, главные метаболические пути, опреде¬
ляющие жизнедеятельность организма, а также механизмы их регуляции в живой
клетке. В каждом разделе анализируются врожденные и приобретенные наруше¬
ния метаболизма, их роль в развитии патологических состояний и пути медика¬
ментозной коррекции таких нарушений.
Третье издание дополнено таким важным разделом, как молекулярная био¬
логия. Сложный для понимания материал изложен, как и во всей книге, четко,
лаконично и затрагивает основные аспекты молекулярной биологии; рисунки и
схемы помогают ориентироваться и лучше понимать происходящие процессы на
клеточном уровне.
В тех случаях, когда изложение некоторых вопросов биохимии отличается от
принятого в отечественных учебниках биохимии, сделаны соответствующие при¬
мечания. В частности, это касается представлений о количестве молекул АТФ,
образующихся при окислении восстановленных коферментов в дыхательной цепи.
Издание рассчитано на студентов, аспирантов и преподавателей биологических
и медицинских вузов, биохимиков, биологов, медиков, а также на широкий круг
читателей, интересующихся молекулярными процессами обеспечения жизнедея¬
тельности организма, механизмами возникновения патологии и ее коррекции.
Чл.-кор. РАН,
проф. Первого МГМУ
им. И.М. Сеченова
Е.С. Северин
Предисловие к третьему изданию
Учебное пособие «Наглядная медицинская биохимия» предназначено для сту¬
дентов медицинских вузов и студентов биомедицинских специальностей: био¬
химиков, ученых медицинских лабораторий, ветеринаров, стоматологов, фар¬
макологов, физиологов, физиотерапевтов, диетологов, санитаров, медицинских
физиков, микробиологов и будущих спортивных врачей. В нем кратко и наглядно
изложен предмет биохимии: каждая тема занимает один книжный разворот. Эта
книга выходит в серии «Наглядные пособия», в которой особенно ценится крат¬
кость изложения. В связи с этим некоторые стороны биохимии (в частности,
молекулярная биология) рассмотрены в другом учебнике — «Наглядная меди¬
цинская генетика».
Нередко студенты медицинских специальностей, изучающие биохимию как
второстепенный предмет, бывают просто поражены теми трудностями, с которы¬
ми они сталкиваются. Их частые вопросы, вроде таких: «Что же нам надо знать из
всего этого?» или «Нужно ли запоминать все структурные формулы и все химиче¬
ские реакции?» — должны быть хорошо знакомы лекторам. Действительно, био¬
химия — сложный предмет, перегруженный множеством деталей. Перед студен¬
тами же стоят две задачи: 1) изучить и понять главные биохимические принципы
и реакции, не вдаваясь особо в детали строения соединений; 2) подготовиться
к экзаменам, внимательно изучив лекции и прошлые экзаменационные работы,
чтобы выделить тот объем материала, который им предстоит выучить.
Наше пособие поможет студентам справиться с обеими задачами. На первых
страницах книги приведены подробные схемы метаболических путей, форму¬
лы веществ и ферменты, катализирующие реакции в основных метаболических
процессах. Изучив их, студенты смогут понять и усвоить принципы биохимии
метаболических процессов. Студентам следует выяснить конкретные требования
своего экзаменатора, чтобы определить объем необходимой для запоминания
информации.
В заключение скажу, что на создание этой книги меня вдохновил успех книги
«Наглядный метаболизм», которую я написал в 1994 г. и которая выдержала уже
три переиздания. Книга «Наглядный метаболизм» более сложна, чем «Наглядная
медицинская биохимия», но обе они написаны в одном стиле, и поэтому заинте¬
ресованные читатели после знакомства с «Наглядной медицинской биохимией»
могут продолжить изучение метаболизма и его нарушений уже на более высоком
уровне.
Дж.Г. Солвей
Суррей, Англия
j.salway@btinternet.com
/о
Благодарности
После обсужления с моим редактором нового, третьего издания «Наглядной
медицинской биохимии» стадо очевидно, что в него должен быть включен раздел,
посвяшенный молекулярной биологии. К сожалению, молекулярная биология
не самый мой сильный предмет. Прежде чем начать работу’ над этой книгой, я
отправился на четыре дня в Чешир, к моим друзьям, д-ру Питеру Барту и его
жене Джейн. Питер посвятил свою карьеру молекулярной биологии, и поэтому я
был очень рад, когда он предложил освежить мои знания в этой увлекательной
теме. Мне был оказан теплый прием в их красивом доме. Так я стал учеником
Питера. Мы определили и структурировали содержание и порядок глав. Конечно,
помимо работы мы уделяли время отдыху, таким образом, у меня вышел очень
приятный, продуктивный и незабываемый визит. Питер помогал мне советами и
одобрениями вплоть до завершения последней страницы книги. Без неоценимой
помощи Питера невозможно было бы написание этой книги.
И вновь мне посчастливилось работать с Элейн Леггетт из Оксфордского союза
дизайнеров и иллюстраторов. Первоочередной задачей Элейн было обновить худо¬
жественную составляющую книги и сделать все схемы и иллюстрации, которые
присутствовав во втором издании, цветными и яркими. Вторая задача — интер¬
претация и оформление моих примитивных набросков рисунков для новой главы
«Молекулярная биология», что она и сделала с присущим ей талантом.
На рождественской вечеринке я встретил моего старого коллегу, профессо¬
ра Питера Гольдфарба. Окрыленный духом Рождества, он предложил мне свою
помощь и уделил время прочтению моей книги. С присущим ему вниманием к
деталям он просмотрел мою работу, дал несколько мудрых советов и конструк¬
тивную критику.
Я очень благодарен читателям, которые присылали мне по почте сообщения
об ошибках, друзьям и коллегам, советам экспертов, в частности д-ру Кимберли
Доуди, д-ру Люси Элфик, д-ру Анне Глоун, проф. Киту Фрейну, Розмари Джеймс,
проф. Гарри Иоанну, проф. Джорджу Кассу, д-ру Лизе Мейра и д-ру Хелен Стокс.
Кроме того, я еще раз хотел бы выразить благодарность тем, кто внес свой неоцени¬
мый вклад во второе издание этой книги: проф. Лоран Агиуса, д-ру Уинну Ахерну,
д-ру Беатрис Эванс, д-ру Мартину Эгертону, проф. Джорджу Элдеру, д-ру Джанет
Браун, д-ру Джеффри Гиббонсу, д-ру Барри Гулду, д-ру Брюсу Гриффину, проф.
Стивену Халлорану, проф. Крису О’Каллагану, д-ру Анне Саада и Мари Скерри.
Многие рецензенты отметили отличный индекс цитирования на рецензию,
составленную Филиппом Эслеттом для второго издания, и я был очень рад, когда
он согласился помочь мне еще раз.
Мой редактор Мартин Дэвис поддерживал меня на протяжении всей моей
работы. Он отвечал на мои электронные письма с необычайной быстротой —
наиважнейшее условие для обеспечения эффективного завершения работы.
Кроме того, было очень приятно работать с другими членами профессиональной
команды Wiley-Blackwell, в особенности с Хизер Эддисон, Лесли Эслетт, Хелен
Харви, Карен Мур, Лорой Мерфи и Беомом Нортоном.
К сожалению, некоторые ошибки и неточности будут иметь место в книге, и я
был бы очень признателен, если вы обратите на них мое внимание.
Наконец, я еще раз благодарен моей жене Ники за поддержку, терпимость к
моей постоянной занятости в связи со сроками публикации, а также за хранение
в строгом порядке документов и бумаг, связанных с написанием этой книги.
Дж.Г. Солвей
Суррей, Англия
j.salway@btinternet.com
Список сокращений
® — обозначение препаратов, аннулированных
из Государственного реестра Л С
р — обозначение не зарегистрированных в РФ лекарственных
средств
2.3- БФГ — 2,3-бисфосфоглицерат
2.3- ДФГ — 2,3-дифосфоглицерат
АДФ — аденозиндифосфат
АКТГ — адренокортикотропный гормон
АЛТ — аланинаминотрансфераза
АМФ — аденозинмонофосфат
АТФ — аденозинтрифосфат
АФК — активные формы кислорода
ГЛЮТ — переносчик глюкозы
ГМГ-КоА — З-гидрокси-З-метилглутарил-КоА
ДНК — дезоксирибонуклеиновая кислота
КК — креатинкиназа
КоА — коэнзим А
КОМТ — катехол-О-метилтрансфераза
ЛПВП — липопротеин высокой илотности
ЛПНП — липопротеин низкой плотности
ЛПОНП — липопротеин очень низкой плотности
ЛППП — липопротеин промежуточной плотности
МАО — моноаминоксидаза
мтДНК — митохондриальная ДНК
НАД+ — никотинамидадениндинуклеотид
НАДФ+ — никотинамидадениндинуклеотид фосфат
РНК — рибонуклеиновая кислота
ТКИД — тяжелый комбинированный иммунодефицит
УТФ — уридинтрифосфат
Ф-2,6-бисФ — фруктозо-2,6-бисфосфат
ФАД — флавинадениндинуклеотид
ФИФ2 — фосфатидилинозитол-4,5-бисфосфат
ФИФЗ — фосфатидилинозитол-3,4,5-трифосфат
ФМН — флавинмононуклеотид
ЦМФ — цитидинмонофосфат
ЭАР — эквивалент активности ретинола
HbAlc — гликированная фракция гемоглобина
ORAC (oxygen radical absorbance capacity) — способности
поглощения радикалов кислорода
pH — водородный показатель
Основные обозначения
С
Пояснения к картинкам
Лекарственное средство
Метаболический процесс
протекает в сердечной мышце
ГЫ
Когда инсулин связывается
с а-субъединицами, проис¬
ходит аутофосфорилирование
Р-субъединиц, и рецептор
активируется
Болезнь или яд
Метаболический процесс
протекает в скелетных мышцах
IRS-1 — субстрат-1
инсулинового рецептора
Показатели анализа крови
имеют диагностическое значение
Пока
имен
S Выведение с мочой или фекалиями.
Результаты анализа мочи/кала имеют
диагностическое значение
SAM (S-аденозилметионин),
донор метильных групп
Метаболический процесс
протекает в печени
Метаболический процесс
протекает в почках
Предмет текущих исследований
или клинических испытаний;
спорные данные
f Предмет текущих исследований
или клинических испытаний;
спорные данные
Потребление пищи;
содержится
в пищевых продуктах
Циклический АМФ
Неактивная Активная
протеинкиназа А протеинкиназа А
Протеинкиназа А активируется циклическим АМФ,
который связывается с регуляторными (ингибирующими)
субъединицами, и они отделяются от каталитических субъединиц
Белок р85. Это регуляторная
субъединица фосфоинози-
тол-3-киназы. Белок р85
связывает субстрат-1 инсулино¬
вого рецептора с фосфоинози-
тол-3-киназой. Имеет молеку¬
лярную массу 85 кДа
Фосфоинозитол-З-киназа.
Фосфорилирует гидроксильную
группу фосфатидилинози-
тол-4,5-дифосфата (ФИФ2)
в положении 3 с образованием
фосфатидилинозитол-3,4,5-три-
фосфата (ФИФЗ)
Серин/треонин-протеинкиназа (другие
азвания — Akt, протеинкиназа В)
Серин/треонин-протеинкиназа
(протеинкиназа В). Связывается
с фосфатидилинозитол-3,4,5 -
трифосфатом
Фрсфоинозитол-зависимая киназа-1
Фосфоинозитол-зависимая
киназа-1, активируется
фосфатидилинозитол-3,4,5-
трифосфатом
Киназа-3 гликогенсинтазы
Киназа-3 гликогенсинтазы.
Активируется при
голодании. Ингибируется
ферментом серин/треонин-
протеинкиназой путем
фосфорилирования
Протеинфосфатаза-1
Активируется в ходе
трансдукции сигнала
инсулина
рц.. "yn.i,i^.u v -.. .ДЛЬ1 А’
ЯГ
10
Перевод единиц массы в единицы СИ
Общий билирубин
<20 <1>2
мкмоль/л (+17,1) мг/ЮОмл
160 -□
49
8
47
h 6
4 5
4
Е- з
2
1
^0
140 -
120 -
100 -
80 -
60
40-
20 —,
О J
Кальций
2,0-2,5 8 10
ММОЛЬ/Л (+0,25) мг/ЮОмл
4,0-
F 16
4 15
3,5 -
4 14
"
4 13
3,0-
4 12
4 11
2,5 -
4°
1
И
2,0 -
4 8
_
4 7
1.5 -
4 6
_
4 5
1.0 —
44
-
4 3
0,5 -
OJ т— О
ll.ll 1111111 i 1
0 -
Тироксин(Т4)
7 ос (х 12,87)
7,25 «— - 0,5—2,0
НМОЛЬ/Л (+12,87) НГ/ЮОМЛ
80
[г 6,0
70 4
60 4
50 4
40 4
30 4
10
О J
Креатинин
60-120 0,6-1,3
МКМОЛЬ/Л (+68,4) мг/ЮОмл
800 -о г- 9
700 -
600
500 4
400 4
300 4
200-
100
4 8
4 7
4 6
4 5
L 4
42
0J
Триглицеролы
Целевой Целевой
уровень (х о от) уровень
<1,5 4 <133
ММОЛЬ/Л (+0,0113) мг/ЮОмл
4,0 1 h 350
3,5 -
3.0
2,5-
2.0
i.s4
1,0
о,5Н :
- 300
- 250
200
- 150
1
100
-50
0J L_o
„ of -7.4=0,000000040 моль/л
т е. antilogy =40 НМОль/л
8,0 -л г-Ю
7,9
7,3^7,45)
35-45 ммоль/л
[Н+].
pH = -f«>9io tH 1 8 “Оля*
т.е.100 нмоль/л
, ^одю О0000001 = pH 7,0
7.8 4
7.7
7.6-
7,5 4
:
7,4
- i
7,3 4
7,2 4
7,1 4
7,0 4
6.9 4
6.8 4
6.7-
Г 15
г 20
4 25
4 30
:
- 40
- 50
- 60
-70
- 80
90
b юо
130
Ь 160
200
Общий холестерин
Целевой Целевой
уровень (х 0,0259) уровень
< 4,0 < <155
ММОЛЬ/Л (+0,0259) мг/ЮОмл
8-3 Рзоо
7 -
2 -
О J
- 250
- 200
150
- 100
50
L- О
11
HDsoa @
__ t
лашшен (Щ)
Кислсты, сснсвания и ионы водорода (протоны)
Определение pH
pH — это отрицательный десятичный логарифм концентра¬
ции ионов водорода.
pH=log10[H+]
Так, при рН=7,0 концентрация ионов водорода составляет
0,0000001 ммоль/л, или 10_7 ммоль/л.
Десятичный логарифм 0,0000001 равен —7,0.
Таким образом, отрицательный десятичный логарифм равен
-(-7,0), т.е. +7,0. Отсюда рН=7,0.
10 000 х 100 000 = 1 000 000 000 = 109
или
104 хЮ5 = Ю9
(при умножении чисел их показатели степени складываются)
Log у= log х-log у
Log ^ — log х
Рис. 1.1. Вспомним свойства логарифмов
Число
Запись в виде
10 в степени «п»
Логарифм по
основанию 10
1000
103
3,0
100
ю2
2,0
10
101
1,0
1
10°
0
0,1
10‘1
-1,0
0,01
Ю-2
-2,0
0,0000001
Ю-7
-7,0
Число
Логарифм по основанию 10
1
о -
2
0,301
3
0,477
4
0,602
5
0,699
6
0,778
7
0,845
8
0,903
9
0,954 Е
10
1,0
20
1,301
30
1,477
200
2,301
2000
3,301
Рис. 1.2. Некоторые числа и их логарифмы
Единица
Принятое обозначение
1 моль на литр
0,001 моль на литр
0,000001 моль на литр
0,000 000 001 моль на литр
1 моль/литр — 1 моль/л
1 миллимоль/литр —1 ммоль/л
1 микромоль/литр — 1 мкмоль/л
1 наномоль/литр — 1 нмоль/л
Рис. 1.3. Расшифровка единиц для обозначения концентрации
веществ в растворе
Значение pH
Эквивалентные значения концентрации протонов
в других единицах
pH 1
0,1 моль ионов водород на литр, или
10й моль ионов водорода на литр, или
10"1 г иона водорода на литр
pH 14
0,00000000000001 моль/л, или
10'14 моль ионов водорода на литр, или
10'14 г ионов водорода на литр
Что такое основание
Основание — зто вещество, способное присоединять протон (ион водоро- ;
да, Н+) с образованием кислоты. Примером сопряженного основания явля-1
ется лактат: он присоединяет протон с образованием молочной кислоты "
Что такое кислота
Кислота — зто вещество, которое диссоциирует в воде, высвобождая
протоны (ионы водорода, Н+). Пример кислоты — молочная кислота
Сильная кислота (например, соляная кислота)
Это кислота, которая полностью диссоциирует в воде,
высвобождая протоны
Слабая кислота (например, мочевая кислота)
Это кислота, которая диссоциирует в воде не полностью. В приведенном
примере мочевая кислота диссоциирует на урат и протон
Рис. 1.4. Определение кислот и оснований по Брёнстеду-Лоури
[Bronsted, Lowry]
Рис. 1.5. pH и эквивалентные значения концентрации протонов
12 Кислоты,основания и ионы водорода (протоны)
■ UUUI 1/\П
лвшшен 'ytnj
nooszxa
J0d±X3Lf£
d0088
wo6l iaoozi afroz:s
BVHdBlMXdHfl Vl/HU
■*066fr
OOZL/S9l-UtT
BVHdBlMXdHtl Vl/HU
Ш
f
Y
E
\
Величина pH артериальной крови при ацидозе
Примеры
pH 6,8
160 нмоль/л
pH 6,9
130 нмоль/л
Метаболический ацидоз
pH 7,0
100 нмоль/л
(например, диабетиче-
pH 7,1
80 нмоль/л
ский кетоацидоз,
почечный канальцевый
pH 7,2
63 нмоль/л
ацидоз); респираторный
pH 7,3
50 нмоль/л
ацидоз
Нормальные значения pH артериальной крови
pH 7,35
45 нмоль/л
pH 7,36
44 нмоль/л
В норме уровень pH
pH 7,38
42 нмоль/л
атериальной крови
pH 7,40
40 нмоль/л
колеблется в диапазоне
7,35-7,45
pH 7,42
38 нмоль/л
(45-35 нмоль Н7л)
pH 7,44
36 нмоль/л
pH 7,45
35 нмоль/л
Величина pH артериальной крови при алкалозе
Примеры
pH 7,5
32 нмоль/л
pH 7,6
26 нмоль/л
pH 7,7
20 нмоль/л
Метаболический алкалоз;
pH 7,8
16 нмоль/л
респираторный алкалоз
pH 7,9
13 нмоль/л
pH 8,0
10 нмоль/л
Рис. 1.6. Примеры значений pH, встречающихся в клинической
практике
Что означает pH?
pH — это водородный показатель раствора (Power of Hydrogen).
Величина pH, по определению, равна отрицательному деся¬
тичному логарифму концентрации ионов водорода. У чита¬
телей может возникнуть вопрос, зачем вообще понадобилось
вводить новое понятие, не проще ли выражать концен¬
трацию ионов водорода в обычных единицах. Дело в том,
что понятие pH было введено химиками. Оказалось, что
при проведении химических опытов значительно удобнее
выражать концентрацию ионов водорода через водородный
показатель. В клинической практике мы измеряем pH арте¬
риальной крови, который варьирует незначительно — от 6,9
до 7,9, но химики имеют дело со всем спектром возмож¬
ных значений pH, от 1 до 14. Если бы мы выражали кон¬
центрацию ионов водорода в обычных единицах (моль/л),
вычисления оказались бы слишком громоздкими (в каче¬
стве примера такие значения приведены на рис. 1.3). Таким
образом, использование pH значительно облегчает и сокра¬
щает расчеты. На рис. 1.6 показаны нормальные значения
pH крови и крайние значения, которые наблюдаются при
патологических состояниях, сопровождающихся развитием
ацидоза или алкалоза.
Шкала pH — не линейная!
Выражение «pH крови пациента изменился на 0,3 единицы»
означает, что концентрация ионов водорода повысилась (или
понизилась) вдвое.
Когда мы слышим, что «pH артериальной крови паци¬
ента повысился/понизился на 0,2», мы можем недооценить
истинное изменение концентрации ионов водорода. Всегда
нужно помнить: значение pH — это логарифм. Так, если pH
артериальной крови снизился с 7,20 до 7,00, это означает,
что концентрация ионов водорода изменилась на 37 нмоль/л,
а падение значения pH с 7,00 до 6,80 соответствует повыше¬
нию [Н+] на 60 нмоль/л.
Десятичный логарифм числа 2 равен 0,3 (2=100-3). Поэтому
если pH падает на 0,3 единицы, например, с 7,40 до 7,10,
это значит, что концентрация ионов Н+ повысилась вдвое
(с 40 до 80 нмоль/л). Соответственно повышение pH с
7,40 до 7,70 отражает понижение концентрации ионов Н+
с 40 до 20 нмоль/л.
Уравнение Гендерсона-Хассельбаха
Слабая кислота диссоциирует следующим образом:
НВ<->Н++В~.
Слабая кислота протон + сопряженное с кислотой
основание,
где НВ — слабая кислота, которая диссоциирует на про¬
тон Н+ и сопряженное основание В- [примечание: обычно
авторы обозначают сопряженное основание символом «А-»
(анион кислотного остатка), однако А — это первая буква
английского слова «кислота» (Acid), что может ввести уча¬
щихся в заблуждение].
По закону действующих масс:
„ [Н*] + (В-]
к=~т~’
где К — константа диссоциации.
Прологарифмируем полученное выражение:
logK=log[H+]+log[B“]-log[HB]
—log[H+]=—logK+log[B“]-log[HB]
т.е. pH=pK+log([B_]/[HB]).
И в итоге получим уравнение Геидерсона—Хассельбаха:
рН=рК+1(^([сопряжепное основание]/[кислота]).
Клиническая значимость уравнения
Г ендерссна-Хассельбаха
Проиллюстрируем ее на примере респираторного ацидоза и
респираторного алкалоза.
По уравнению:
pH=pK+log ([сопряженное основание]/[кислота]).
Значит, для бикарбопатной буферной системы оно имеет вид:
[НС0-]
pH ос log
РС03
Или, паоборот, концентрация иопов водорода:
РС02
[Н+] ос
[нсо;
Другими словами, концентрация ионов водорода пропорцио¬
нальна отношению количества С02 к концентрации бикар¬
боната в крови. Следовательно, при гиперкапнии (высокой
концентрации С02 в крови) отношение рС02 к НС03_ пре¬
вышает нормальное значение. Значит, концентрация про¬
тонов повышена (т.е. значение pH низкое). Такое состояние
называется респираторным ацидозом.
Напротив, гипокапния, вызванная гипервентиляцией лег¬
ких, приводит к респираторному алкалозу. В этом состоянии
концентрация С02 в крови понижена. Соответственно концен¬
трация протонов также будет низкой (т.е. pH высоким).
Клиническая значимость pH и буферных систем будет
описана в гл. 2—5.
Кислоты,основания и ионы водорода (протоны)
13
fl Что такое pH
Почему же многие учащиеоя не могут разобрать¬
ся в теории кислот и оснований?
Это происходит из-за злоупотребления сложившимся
«псевдонаучным жаргоном»
Часто теорию кислот и оснований считают трудной темой.
В этой теории рассматривается понятие кислоты как веще¬
ства, способного диссоциировать на анион кислотного остат¬
ка (сопряженное основание) и на ион водорода (протон). Еще
в 1962 г. Криз (Creese) с соавторами в своей статье в журнале
«Ланцет» (Lancet) писали, что «в медицинской литературе,
посвященной этой теме, авторы злоупотребляют псевдонауч¬
ным жаргоном, что только сбивает читателей с толку»*.
Трудности возникают из-за традиционной номенклатуры,
которую проиллюстрируем таким диалогом:
* Creese R., Neil M.W., Ledingham J.M., Vere D.W. The terminol¬
ogy of acid-base regulation // Lancet. — 1962. — Vol. 419.
Студент
Студент
Студент
Студент
Студент
Студент
Больной в отделении интенсивной терапии с лактацидозом
рН=7,15 имеет концентрацию лактата в артериальной крови
5,4 ммоль/л. В чем же разница между молочной кислотой и
лактатом?
Профессор
Да, но, если молочная кислота диссоциирует почти полностью,
это означает, что в крови при лактацидозе содержится очень
малое количество молочной кислоты.
Молочная кислота при нормальном pH крови почти полностью
диссоциирует на сопряженное основание — лактат — и протон [Н+]
(чертит структурные формулы этих веществ на обороте конверта).
соон
)
снон
\
СНз
<6
С00‘
I
снон
СНз
Молочная кислота Лактат + протон
Да, конечно. При рН=7,15 из уравнения Гендерсона-Хассельбаха следует, что на каждые 2000 молекул лактата
приходится одна молекула молочной кислоты (ниже приведены расчеты профессора).
[ЕГ1 „ ,, „ . „ _ , _ , лактат
рН=рК+1од
[НВ]
При рН=7,15 рК молочной кислоты =3,85.
7,15=3,85+!од
молочная кислота
Профессор
log
лактат
молочная кислота
=7,15—3,85=3,30. Возьмем отрицательные логарифмы:
лактат
молочная кислота
= 2000.
Значит, такая концентрация
сопряженного основания —
лактата — в крови превыша¬
ет норму?
Это значит, что при рН=7,15 на каждые 2000 молекул лактата приходится одна молекула молочной
кислоты, т.е. доля молочной кислоты составляет 0,05%.
И эта повышенная концен¬
трация лактата может быть
летальна?
Профессор
Ясно... И чем ниже pH,
тем выше концентрация
протонов
Нет, на самом деле сам лактат — «хорошая» молекула. Он
вступает в глюконеогенез и является метаболическим предше¬
ственником глюкозы. Опасна повышенная концентрация
протонов в крови.
Профессор
Именно так, ведь pH — это отрицательный десятичный
логарифм концентрации ионов водорода (т.е. протонов).,
Профессор
(с нотками торжества в голосе):То есть, когда мы
говорим, что артериальная кровь имеет кислую
реакцию, на самом деле в ней содержится очень
мало молекул кислоты. Не лучше ли назвать такой
раствор гиперпротонным?
Хммм... нет, это неправильно.
Студент
Но ведь при так называемом лактацидозе мы имеем
избыток сопряженного основания — лактата —
и протонов, которые образовались вследствие
диссоциации молочной кислоты. То есть сама
молочная кислота практически отсутствует...
Быть может, правильнее было бы назвать такое
состояние «молочнокислая гиперпротонемия»?
Профессор
Пожалуй, такое название больше
соответствует истине. Беда лишь в том, что
оно никогда не приживется.
Профессор
14
Что такое pH
IUUUI1ЛП
лэшшен
VUUK
bVHdbl/AXdHtl Vl/HU
Диссоциация молочной кислоты
На рис. 2.1 показано, как изменяется отношение концентра¬
ций лактата и молочной кислоты с увеличением pH. Когда
концентрации лактата и молочной кислоты равны (т.е. отно¬
шение лактат/молочная кислота = 1), pH принимает значе¬
ние рК для молочной кислоты, равной 3,85.
лактат 2000
молочная кислота ; 1
10 000
Отношение
молочная кислота
Рис. 2.1. Зависимость между степенью диссоциации молочной
кислоты и значением pH. Вы видите, как меняется pH при изме¬
нении отношения лактат/молочная кислота. Когда концентрации
лактата и молочной кислоты одинаковы (т.е. значение дроби рав¬
няется 1), pH равен значению рК для молочной кислоты (таким
образом, рК молочной кислоты = 3,85)
Молочная кислота и бикарбонатная буферная система
Чтобы продемонстрировать работу бикарбонатной буферной
системы в домашних условиях in vivo, понадобится всего
несколько минут. Просто обеспечьте себе физическую нагруз¬
ку в анаэробных условиях: пробегитесь как можно быстрее
(лучше в гору), задержав при этом дыхание. В это время
в ваших мышцах будет проходить анаэробный гликолиз с
образованием молочной кислоты, которая диссоциирует на
лактат и протон [Н+] (рис. 2.2)*. Чтобы снизить концентра¬
цию протонов, с ними реагирует бикарбонат, а образующаяся
угольная кислота распадается на воду и С02. Повышение
концентрации С02 стимулирует гипервентпляцию легких, и
избыток образованного С02 удаляется вместе с выдыхаемым
воздухом.
* Схема, показанная на рис. 2.2, — появление протонов при
образовании молочной кислоты, строго говоря, не является пра¬
вильной, и мы приводим ее только потому, что она встречается
практически во всех учебниках. Тем же читателям, которые не
хотят довольствоваться этим стандартным, но неверным объ¬
яснением повышения концентрации протонов, рекомендуем
ознакомиться со следующей работой: Robergs R.A., Ghiasvand F.,
Parker D. Biochemistry of exercise-induced metabolic acidosis // Am.
J. Physiol. Regul. Integr. Comp. Physiol. — 2004. — Vol. 287. —
P. R502-R516.
Глюкоза
r
АТФ
^ Глюкоз
АДФ
Фрукте ю-6-фосфат
Гликолиз
Дигидр
Фруктозо-1
—4
-6-фосфат
► АДФ
5-бисфосфат
НгО NH,
Почка
Н+
НСОз"
Бикарбонат
СОО'
I
неон
I
сн.
Н++ Лактатф
ч
[Н2СО3]
Угольная кислота
НгО
л
Фосфос о
АДФ -
3 >осфат
1,3-Бисфсфглицерат
АДФ
N
/
АТф 4
3-Фос<Вог|ицерэт
2-Фос or ицерат
НАД* НАДН+Н+
СОО'
I
с=о
I
сн.
Пируват
Лактатдегидрогеназа
со2
Рис. 2.2. Гомеостаз молочной кислоты и pH поддерживается
бикарбонатной буферной системой. Бикарбонатная буферная
система удаляет из раствора протоны [Н+], образующиеся в про¬
цессе анаэробного гликолиза. Протоны связываются при образо¬
вании молекулы воды, а С02 выводится через легкие
инсиж but/ OHBiogedced
Hosoa ©
Что такое pH 15
хата
зашшен
1
О Образование и поступление протонов в кровь
и их удаление из крови
^ Протоны образуются в процессе метаболизма
1. С участием углекислого газа
При тканевом метаболизме глюкозы, жирных кислот и аминокис¬
лот образуется С02. В присутствии фермента карбоангидраэы С02
реагирует с водой с образованием угольной кислоты. Последняя
диссоциирует на анион бикарбоната и протон. Таким образом, мы
можем рассматривать углекислый газ как предшественник слабой
кислоты.
С02+Н20 н2С02-> НС03"+Н+.
Углекислый газ + вода каР6°?н|илРа”—> угольная кислота -»
анион бикарбоната + протон.
2. Протоны образуются при анаэробном метаболизме глюкозы,
кетогенезе, катаболизме метионина и цистеина
Процесс анаэробного гликолиза приводит к образованию лактат-
анионов и протонов (гл. 22).
Глюкоза -» лактат- + Н+.
Аналогичным образом при окислении жирных кислот образуются
ацетоацетат, (3-гидроксибутират и протоны (гл. 31).
Метионин -> H2S04 -> S042- + 2Н+.
Цистеин -» H2S04 -» S042- + 2Н+
Рис. 3.1. Ацинарные клетки поджелудочной железы поставляют
протоны в кровь
Поджелудочная железа поставляет протоны в кровь
Ацинарные клетки, окружающие проток поджелудочной железы,
декретируют панкреатический сок. В нем содержатся ионы НС03"
в высокой концентрации (до 125 ммоль/л). В кишечнике панкреа¬
тический сок нейтрализует кислую среду пищевого комка, посту¬
пающего из желудка. Секреция ионов НС03" в панкреатический сок
сопровождается выделением такого же количества протонов
в кровь (рис. 3.1).
Рис. 3.2. Реабсорбция бикарбоната из первичной мочи в кровь
Роль почек в регуляции концентрации протонов в крови
Почки играют ведущую роль в регуляции уровня pH плазмы крови.
В почках: 1) происходит удаление протонов в мочу и 2) регулирует¬
ся концентрация НС03- в плазме крови.
Обратное всасывание бикарбоната
На рис. 3.2 показано, как происходит реабсорбция ионов НС03"
из первичной мочи в кровь
16 Образование и поступление протонов в кровь и их удаление из крови
■ UUUI 1/\П
мшшен VI4J
• UU3CAVJ
^H3JOdi^3L/e
•*0088
иоб1 iaoozL at^oz:s
BVHdBlMXdHfl Vl/HU
•*066fr
rt firn -r
OOZL/S9l-ytT
BVHdBl/AXdHtl Vl/HLI
"Ч*ГТ*ГЧ'Г'™"ЧТ -
» ft k
Образование «новых» ионов бикарбоната сопряжено с выведением
протонов в мочу
Помимо реабсорбции иона НС03~из первичной мочи, почки также
могут синтезировать «новые» ионы бикарбоната. Этот процесс
может быть связан с двумя процессами.
1 — выделение протонов вместе с NH3 с образованием l\IH4+ (рис. 3.3).
Под действием карбоангидразы образуются протоны (Н+) и «новые»
ионы НС03~, которые секретируется в плазму околоканальцевых
капилляров. Выведение протонов из организма осуществляется при
участии глутамина, который образуется в мышцах. Сначала фермент
глутаминаза дезаминирует глутамин, превращая его в глутамат, затем
глутамат, в свою очередь, дезаминируется ферментом глутаматдеги-
дрогеназой. В обеих реакциях образуется аммиак NH3, который диф¬
фундирует в первичную мочу. Здесь NH3 связывается с Н+ с образова¬
нием ионов аммония l\IH4+, которые выводятся из организма с мочой.
2 — присоединение протонов к гидрофосфат-ионам с образовани¬
ем дигидрофосфат-ионов (рис. 3.4).
Как и в первом случае, в ходе карбоангидразы образуются про¬
тоны (Н+) и «новые» ионы НС03~, которые секретируются в плазму
околоканальцевых капилляров. Но в этом случае протоны свя¬
зываются с ионами моногидрофосфата НР042- с образованием
дигидрофосфат-ионов Н2Р04~, которые эскретируются с мочой.
Illlllllllllllllli
NH3
fill I4'r IIIIIL
V i
Глутамин |
Глутаминаза =
Глутамат- |
J Глутамат- =
цегидрогеназа =
Новые ионы НСОз
поступают в кровь
а-Кето-
2-
глутарат ‘
пнй
0
Na+
ЗНСО}
Глюкоза-
СО,
НгО
NH4 выделяется
с мочой
Рис. 3.4. Образование «новых» ионов бикарбоната, сопряженное
с экскрецией ионов дигидрофосфата
Рис. 3.3. Образование «новых» ионов бикарбоната, сопряженное
с экскрецией ионов аммония
Образование и поступление протонов в кровь и их удаление из крови
17
тль. Tw-frxrzc
Метаболический алкалоз и метаболический ацидоз
Шг
Н+
^ Н+
Основная причина: из-за про¬
должительной рвоты происходит
избыточная потеря Н+ и обез¬
воживание. Концентация
протонов в крови снижается
(значение pH крови растет)
5
2
Слизистая оболочка
желудка производит
избыточное количество
НС03", чтобы восста¬
новить нормальную
концентрацию протонов.
[НСО3-] в крови растет
Компенсация: гиповентиляция легких
приводит к повышению рС02 в крови
НС03"
Почечный клубочек
Метаболический алкалоз
1. Основная причина: одной из причин развития метаболического
алкалоза является продолжительная рвота, из-за которой про¬
исходит избыточная потеря Н+ вместе с содержимым желудка.
2. Чтобы восстановить концентрацию протонов, в слизистой обо¬
лочке желудка осуществляется карбоангидразная реакция.
Однако вместе с протонами образуются и ионы НС03~, которые
накапливаются в крови и повышают pH крови.
3. Компенсация: при алкалозе наблюдается гиповентиляция лег¬
ких. С02 не удаляется при выдохе, и рС02 в крови повышается.
4. Избыточное образование НС03~ почками: в норме, когда кон¬
центрация НС03~ в крови превышает верхнюю границу нормы
(примерно 33 ммоль/л), она достигает своего порога выведе¬
ния, и избыточный НС03~ выводится с мочой. Однако при мета¬
болическом алкалозе, вызванным рвотой, порог выведения
может подняться до чрезмерно высокого уровня из-за:
1) обезвоживания, 2) повышенной концентрации альдостерона,
3) гипокалиемии. Из-за этого стимулируется реабсорбция
НС03~ из мочи в канальце, и концентрация НС03" в крови под¬
держивается на повышенном уровне.
Другие причины метаболического алкалоза
. Прием тиазидных диуретических средств.
. Введение НС03~
Первичная моча
НСО3- пер¬
вичной мочи
Проксимальный
каналец
Плазма
околока*
нальцевого
капилляра
Na+-
нсо3_н+^
г
Н2С03
► Na+
4
Н2СО3
Карбоангидраза
со2-* со
А
НгО
НгО
НС03"
I
НСОу,
реаосорби-
рованный
в кровь
Внимание: [НС03~] в крови поддерживается на уровне,
превышающем норму, так как порог выведения НС03_
(в норме равный 23-33 ммоль/л) повышается
при обезвоживании
Рис. 4.1. Метаболический алкалоз
18 Метаболический алкалоз и метаболический ацидоз
IUUUI 1АП
мшшен
лоиппьпоу -ОГНКАИи ЦЩ
lOOSZAQ
И1Янко1Геэоу / ии 061 ехэиС (Дэиеи^ / ig 002 I
ЪЪ JcVO curuuuu tfHHyAUJ / ПП [)£ gNJVfU UidlltHU
HNHKOtTeoou/ n«s9i :p«0Mtrdi9«eHiy/19002 L
*0088
wo6L iboozi at^ozs
bVHdblMXdkin Vl/HU
<* 066
OOZl/S9l-Ut7
bVHdbl/AXdHM Vl/HLI
l
I
s
I
i
I
Метаболический ацидоз
1. Основная причина: избыточное образование протонов проис¬
ходит при тяжелых нарушениях обмена веществ, таких как диа¬
бетический кетоацидоз (гл. 31) и лактоацидоз (гл. 22). Низкий
pH крови может быть смертельно опасен.
2. Действие буферной системы: бикарбонатная буферная система
первая реагирует на повышение концентрации протонов. НС03“
связывается с протонами, образуя угольную кислоту (Н2С03),
которая распадается на С02 и Н20.
3. Компенсация: низкий уровень pH стимулирует дыхательный
центр в головном мозге и вызывает гипервентиляцию легких.
Человек интенсивно выдыхает С02, чтобы снизить значение
рС02. Такая патологическая гипервентиляция называется «боль¬
шое дыхание», или «дыхание Куссмауля».
4. Коррекция (1) — удаление протонов: поступающий из мышц
и печени глутамин дезаминируется ферментом глутаминазой.
Продукт этой реакции, глутамат, в свою очередь, дезаминиру¬
ется ферментом глутаматдегидрогеназой до а-кетоглутарата.
Образовавшиеся молекулы NH3 (аммиака) диффундируют в
мочу в почечных канальцах, где к ним присоединяются прото¬
ны. В результате образуется l\IH4\ который выводится с мочой.
Выведение Н+ в виде ионов аммония — замечательная способ¬
ность почек: при метаболическом ацидозе интенсивность выве¬
дения l\IH4+ может в 10 раз превышать свой обычный уровень.
5. Коррекция (2) — восстановление потерь НС03": вместе с выве¬
дением ионов аммония почки синтезируют новые ионы НС03",
которые поступают в кровь и восполняют потери бикарбоната
(см. пункт 2).
Другие причины метаболического ацидоза
• Заболевание почек, при котором протоны выводятся недоста¬
точно интенсивно и накапливаются в крови. Сюда относятся:
1) почечная недостаточность (при которой нарушены все функ¬
ции почек, в том числе фильтрация и выведение протонов);
2) почечный канальцевый ацидоз (специфическое нарушение
работы канальцев, при котором снижается выведение протонов).
• Прием лекарств и токсических веществ: избыточное количество
протонов образуется при метаболизме метанола и этиленглико¬
ля, которые входят в состав антифризов.
• Диарея с избыточными потерями НС03~ из кишечника: при такой
диарее желчный пузырь, поджелудочная железа и слизистая
оболочка двенадцатиперстной кишки усиленно синтезируют
бикарбонат, восполняя его потери. При этом в крови увеличива¬
ется концентрация протонов.
Глутамин
поступает
из мышц
и печени
П
NH 4+
Коррекция (1):
выводится
Н+ реагирует с NH3. Образованный NH4* выводится
с мочой
с мочой (при тяжелых формах метаболического
ацидоза в день выводится до 300 ммоль NH4*)
Рис. 4.2. Метаболический ацидоз
Метаболический алкалоз и метаболический ацидоз
19
инеиж шлг oweiogedeed
Y31J /Г"
о Респираторный алкалоз и роопираторный ацидоз
со2СОг СО2
согсОо
“-СО, СО?
со,СОГ 2
н+
н+ н
н+ +
Н+
[Н+] понижается
(т.е. pH возрастает)
НСОз
Карбоангидраза
Основная причина: избыточное
выведение С02 из-за
гипервентиляции
Г
1 Карб(
Н2СО3
со2
Снижение
рС02крови
Н2О
Г
Респираторный алкалоз
3
1. Основная причина: гипервентиляция.
2. Гипервентиляция приводит к гипокапнии (низкому зна¬
чению рС02 в артериальной крови).
3. Из-за низкого значения рС02 равновесие в карбоанги-
дразной реакции смещается в сторону образования С02.
Этот процесс происходит с затратой протонов. Их кон¬
центрация в крови снижается, и pH крови возрастает.
4. Компенсация: при нормальном функционировании почек
компенсация возможна за счет снижения реабсорбции
ИС03'из канальцевой мочи. В результате концентрация
НС03"в крови падает, значение НС03'/рС02 уменьшается,
и pH снижается.
Почечный клубочек
Первичная моча
нальцевого
капилляра
Другие причины респираторного алкалоза
Респираторный алкалоз развивается при целом ряде
заболеваний. Существует несколько возможных причин
гипервентиляции. Так, дыхательный центр в ЦНС активи¬
руется при волнении, психических расстройствах, сильной
боли или повышении температуры. При передозировке
салицилатов усиливается вентиляция легких и развивается
респираторный алкалоз, за которым может последовать
метаболический ацидоз. Гипервентиляция и гипокапния
также могут быть вызваны раздражением рецепторов груд¬
ной клетки при пневмотораксе, легочной эмболии и отеке
легких. Среди других причин респираторного алкалоза —
искусственная вентиляция легких, печеночная недостаточ¬
ность, сепсис.
Компенсация (1):
снижение реабсорбции НС03'
Н+<
НСОз"
Na+
Н2СО3
С02 С02
Карбо-
ангидраза
НгО
Компенсация (2):
чтобы компенсировать низкое
значение рС02 крови, почки
выделяют больше ионов НС03~
Рис. 5.1. Респираторный алкалоз
20
Респираторный алкалоз и респираторный ацидоз
кяшплн
—Iff Г" ЛЗ 13
jauiuieif и
lUUb^AU
d3H3JOdl)Gl/G
э
ШР
<*0088
1Шг6
nuoi xauuct aruz.b
«VHd«l/A>*dHn Vl/HU
<* 066 b
OOZI/591-UU
BVHdBl/AXdHri Vl/HU
1 /mr»f
H
,+
H
H H
[H+] в крови
растет (т.е. pH
2
J
рС02 крови повышается,
из-за чего равновесие
в карбоангидразной
реакции смещается
в сторону образования
протонов
-*■ MUU3
1
НСОз-,
реабсор-
бированный
в кровь
1
Основная причина:
недостаточное выведение
С02 из легких при дыхании
НгСОз
t
I
Карбоангидраза
iiJiillillliiniilllliilllllllllMlllllllllllllilll
co2
Респираторный ацидоз
.. ■ - rtn-bi
Основная причина: легочные заболевания, при которых
нарушается вентиляция легких или диффузия газов, что
приводит к гиперкапнии (повышению рС02 в артериаль¬
ной крови). Другая причина гиперкапнии — нарушение
работы дыхательного центра в ЦИС, который управляет
дыхательной мускулатурой (см. ниже).
Из-за высокого значения рС02 равновесие в карбоанги-
дразной реакции смещается в сторону образования Н+
(протонов).
Вследствие этого [Н+] в крови растет, т.е. pH понижается.
Компенсация: в почках усиливается реабсорбция НС03"
из канальцевой мочи в кровь. Тем самым значение
отношения НС037рС02 возрастает, что влечет за собой
повышение pH.
Другие причины респираторного алкалоза
Стимуляция дыхательной мускулатуры ухудшается при
травматическом повреждении ЦНС, инсультах, при угне¬
тении ЦНС из-за передозировки опиатов и обезболиваю¬
щих лекарств.
Повреждение нервных путей, связывающих дыхательный
центр и дыхательную мускулатуру, также вызывает гипо¬
капнию. Сюда можно отнести травмы спинного мозга,
синдром Гийена—Барре, рассеянный склероз, боковой
амиотрофический склероз, полиомиелит.
Нарушение вентиляции легких, например, при пневмо¬
тораксе, травме грудной клетки.
НгО
1ШЗ
Почечный клубочек
Первичная моча
Проксимальный
каналец
Плазма около-
канальцевого
капилляра
НСОз -►ЗНСОз
Нгсоз
Карбоангидраза
сс2-^ со2«
НгО ► НгО
Na+
НС03'
Компенсация:
в почках усиливается
реабсорбция НС03~,
и [НС03~] в крови
повышается, чтобы
компенсировать вы¬
сокое значение рС02
Рис. 5.2. Респираторный ацидоз
Респираторный алкалоз и респираторный ацидоз 21
инеиж ыж oHeiogedee^
HDSOS <М)
X3Td
jamnmi
t (й)
г
Аминокиолоты и первичная отруктура белка
Аминокислоты с гидрофильными радикалами
Серосодержащие
радикалы
СОО'
I
сосг
НДМСН
СОО"
сн.
I
сн,
-сн-
I
сн.
Н, NCH
сн.
Цистеин
окисляется
до цистина
сн,
I 2
S
S
I
сн.
SH
Цистеин
(Цис)
сн.
сн.
2
-сн-
Два остатка цистеина могут
ковалентно связываться, образуя
дисульфидную связь («дисульфид-
ный мостик»), которая играет важ¬
ную роль в структуре некоторых
молекул, например инсулина (гл. 26)
Цистин нсн+н.
СОО'
Метионин
(Мет)
Радикалы, содер¬
жащие карбо-
ксильные группы
Эти кислоты диссоци¬
ируют при физиоло¬
гических условиях
(рН=7,4), и радикалы
приобретают отри¬
цательный заряд
СОО'
СОО'
Н, NCH
СН,
сн.
сн.
2
СОО'
I 2
СОО'
Аспартат
(Асп)
Глутамат
(Глу)
Радикалы,
содержащие
основание
СОО'
NH
NH,
СОО'
Аргинин, лизин
и гистидин при физио¬
логических условиях
(рН=7,4) принимают
протоны, и радикалы
приобретают положи¬
тельный заряд
Hg+NCH
СН,
рК = 6,0
СН,
NH
I
C-NH,
СН,
Суммарный заряд гисти¬
дина равен нулю при
рН=7,65 (это изозлек-
трическая точка
гистидина). При pH <7,65
гистидин приобретает
положительный заряд
сн.
сн,-сн-соо~
+NH,
"^НН,
Аргинин
(Apr)
Лизин
(Лиз)
.N ■- +.->NH
н/ хн
NH,
Гистидин (Гис)
Радикалы, содержащие амидогруппу
СОО'
Радикалы, содержащие гидроксильную группу
Аспарагин и глутамин -
амиды аспарагиновой
и глутаминовой кислоты
СОО'
I
Н, NCH
СН,
сн.
сн.
CONHg
Аспарагин
(Асн)
CONHj,
Глутамин
(Глн)
Гидроксильные группы
серина и треонина
участвуют в реакциях
фосфорилирования
(гл.10,27,29)
СОО'
СОО'
H,+NCH
» I
Серин
(Сер)
снон
I
СНд
Треонин
(Тре)
Рис. 6.1. Классификация аминокислот, основанная на их растворимости в воде. Растворимость аминокислот зависит от структуры
радикала R, который может быть гидрофильным или гидрофобным
22 Аминокислоты и первичная структура белка
IY/СШПЛН лайнмен (М)
IU urij_
Hi-innuuejuy/ mm 061, :е»эи17 diamEHtf/ig qqz L
J WU W -,ww UO .^r.u
HisHhOt/EDOU / им S9L :вхэи1Г diaweHtf/ig 002 l
iooszao
d3H3JOdlX3l/G
6 0088
W0611900ZL dt^OZS OOZL/SQL-I itT
bVHdbl/AXdHtl Vl/MU ^ 066'Ь KVHdKIMJIdHTi Vl/klU
ДОСВУ
тяяргегтгаг-
COOH
I
H+NCH
3 I
CH„
COO'
H+NCH
3 I
CH,
Катион
Цвиттер-ион
COO'
CH,
Анион
Рис. 6.3. Кривая титрования аланина
Рис. 6.4. Первичная структура белка. Полимеризация аминокис¬
лот с образованием полипептидной цепи. Структура полипептид-
ной цепи изображена на рисунке стрелкой-зигзагом, где стрелка
направлена в сторону С-конца
Аминокислоты
20 аминокислот являются структурными компонентами бел¬
ков (рис. 6.1). В белках аминокислоты соединены пептидны¬
ми связями в определенной последовательности, и эта после¬
довательность называется первичной структурой белка.
В аминокислотах a-атом углерода связан с аминогруппой,
карбоксильпой группой, атомом водорода и радикалом R,
специфичпым для каждой аминокислоты (рис. 6.2). При
физиологических условиях (рН=7,4) карбоксильный оста¬
ток диссоциирует с образованием свободного протона (П+)
и карбоксильной группы (СОО), а аминогруппа присоеди¬
няет протон (Н), образуя NI13+. Таким образом, при рН=7,4
аминокислота может иметь и положительный, и отрицатель¬
ный заряды. В таком состоянии ее называют цвнттер-ионом
(что по-немецки значит гибридный ион), или биполярным
ионом. Диссоциация аланнна показана на рис. 6.3, где при¬
ведена кривая титрования этой аминокислоты.
При низком значении pH (т.е. при высокой копцентрации
Н+) и амино-, и карбоксильная группы аланина присоеди¬
няют по протону. В этом случае аминокислота становится
катионом (поскольку группа СООН нейтральна, а NH3 несет
положительный заряд).
Для запоминания: катион (cation) несет заряд t, т.е. «+».
При высоком значении pH (т.е. при пизкой концентрации П)
обе группы — и аминогруппа, и карбоксильная группа — теря¬
ют протон. Кислота не заряжена (группа СОСГ заряжена отри¬
цательно, группа NH2).
Первичная структура
Белки — это полимеры, характеризующиеся специфической
последовательностью аминокислот, составляющих полипеп-
тидную цепь. Полипептидная цепь имеет N-конец (NI13+) и
С-конец (СОО-) (рис. 6.4). Первичной структурой белка назы¬
вается последовательность аминокислот, его составляющих.
Она определяет способ сворачивания полипептидной цепи в
пространстве, т.е. трехмерную форму белка.
Аминокислоты и первичная структура белка
23
I
Вторичная структура белка |
j
Вторичная структура
Вторичную структуру белка определяют водородные связи
между атомами, образующими пептидную связь. Третичная
структура белков (гл. 8) обусловлена связями между радика¬
лами аминокислот.
(3-Цепь и (3-слой
По своей структуре полипептидная цепь может быть орга¬
низована как p-цепь. Когда несколько таких p-цепей свя¬
зываются друг с другом, они формируют параллельный или
антипараллельный р-слой.
а-Спираль
Полипептидные цепи стабилизируются водородными связя¬
ми с образованием правозакрученной а-спирали (рис. 7.3).
Рис. 7.1. Антипараллельный p-слой. Полипептидная цепь суще¬
ствует в виде зигзагообразной p-цепи. р-Цепи могут связывать¬
ся друг с другом водородными связями, образуя p-слой. Если
соседние p-цепи в p-слое ориентированы противоположно, эта
структура называется «антипараллельный р-слой»
При изменениях первичной структуры белка
меняется и его вторичная структура: так, делеция
одной аминокислоты вызывает муковисцидоз
Первичной структурой белка называют последовательность
аминокислот в пептидной цепи. Всего лишь одна неправиль¬
ная аминокислота в цепи из 1480 аминокислот может изме¬
нить функции белка. Именно это происходит при муковнс-
цидозе. Это врожденное заболевание, при котором нарушена
структура гена CFRT (cystic fibrosis transmembrane conductance
regulator — трансмембранный регулятор проводимости при
муковисцидозе). Продукт этого гена — трансмембранный
белок, который в норме выполняет функцию транспорте¬
ра для ионов хлорида; однако в случае муковисцидоза его
1
Рис. 7.2. Параллельный р-слой. Три p-цепи связываются водо¬
родными связями, формируя р-складчатый слой. Поскольку
р-цепи ориентированы в одном направлении, р-слой называется
параллельным
Правозакрученная
спираль. Если палец
правой руки
ориентировать
по направлению
спирали, сжатые
пальцы окажутся
«закручены» против
часовой стрелки.
Такая спираль и
называется
правозакрученной
*
Рис. 7.3. Правозакрученная а-спираль
24 Вторичная структура белка
ЮТШПЛН
jauiuieu W
оншяаэоиэн виэад
И£нэд :винЕ1ии ии^
/ ww 99 ;Эо06 Ei/nuodu EHvigAirj / им 0£ :е>юи1Г diaHBHff
и1Яньо&ЕЭои / им 061- ENOMt/ dianieHtf / ig 002 l
/SS :Эо06 Ei/mjodu енидАщ / мм ог :вюис diaweMff
HNHhotfEoou / ни ggi TxoHffdiaweMtf/igooiJ l
пооегла
3H3JOdlX3l/G
d 0088
W061. iaoo2L a^ozs
bVHdKl/AXdHtl Vl/HU
066 V
002l/S9l-Ut7
dVHdfcOMXdHri Vl/HU
!
I
i
Рис. 7.4. Мутация AF508 вызывает муковисцидоз. Из-за дедеции
трех оснований — СТТ — в бедке CFRT отсутствует фенилала¬
нин в позиции 508. Функции такого белка нарушены, и вслед¬
ствие этого развивается муковисцидоз. Примечание: деления
основания не влияет на изолейцин в позиции 507, так как и АТС,
и ATT кодируют изолейцин
функции нарушаются. Самая распространенная причина
муковисцидоза, которая наблюдается у 70% больных, —
деления трех пар оснований в гене CFRT, из-за чего мутант¬
ный белок CFRT не содержит фенилаланина в положении
508 (рис. 7.4). Эта мутация называется АР508-мутацией (А —
делецня, F — фепилалании, 508 — положение фенилалани¬
на в первичной структуре белка). После синтеза дефект¬
ный CFTR-белок сворачивается в неправильную вторичную
структуру и удерживается в эндоплазматическом ретикулу¬
ме. Из-за отсутствия транспортера для ионов хлора клетки
секретируют густую вязкую слизь, которая накапливается в
дыхательных путях и нарушает функционирование легких.
Кроме того, нарушается экзокринная функция поджелудоч¬
ной железы, что проявляется в синдроме мальабсорбции.
Перестройка вторичной структуры приона
вызывает губчатую энцефалопатию (болезнь
Крейтцфельда-Якоба, «коровье бешенство»)
Прионы — это белковоподобные инфекционные части¬
цы. Они не содержат РНК или ДНК, а состоят только из
белка. Перестройка вторичной структуры прионов вызыва¬
ет губчатую энцефалопатию — почесуху (у овец) и губчатую
энцефалопатию крупного рогатого скота («коровье бешен¬
ство»). К прионным болезням человека относятся болезнь
Крейтцфельда-Якоба, куру (она распространилась из-за тра¬
диции каннибалов поедать человеческий мозг) и «новый
вариант болезни Крейтцфельда-Якоба». Белок приона (РгРс) —
обычный клеточный белок с неизвестной функцией, который
экспрессируется в нейронах. Как показано на рис. 7.5, в норме
вторичную структуру приона составляют главным образом
а-спирали. Однако РгРс может перестроиться в инфекцион¬
ную форму PrPsc (sc — от слова scarpie, почесуха), вторичная
структура которого в основном представлена р-складчатыми
слоями. Из-за этого изменяется третичная структура белка
(о которой ниже), что и вызывает губчатую энцефалопатию.
Механизм превращения а-спиралей в [3-складчатый слой
неизвестен. Каким-то образом наличие дефектных молекул
PrPsc стимулирует переход нормальных молекул РгРс в PrPsc-
форму, и по цепной реакции болезнь распространяется по
всему мозгу подобно тому, как ложка дегтя портит всю бочку
меда.
Присутствие молехул PrPsc
нарушает структуру РгРс
Губчатая энцефалопатия
(например, почесуха, болезнь
Крейтцфельда-Якоба)
PrPsc
Патогенная форма белка приона,
вызывающая почесуху или
болезнь Крейтцфельда-Якоба
| Рис. 7.5. Белки прионы. В норме белок прион (РгРс) растворим и состоит в основном из а-спиралей. Но в мутантной форме приона,
которая вызывает почесуху (PrPsc), часть а-спиралей переходит в (3-складчатую конформацию, и белок становится нерастворимым.
Мутантная форма PrPsc «инфекционна», так как в ее присутствии а-спирали трансформируются в (3-конформацию
Вторичная структура белка
25
Третичная и четвертичная структура белка. Коллаген
Рис. 8.1. Третичная структура. р-Складчатые слои и а-спирали
сворачиваются в пространстве с образованием двух разных моно¬
меров креатинкиназы (КК-М и КК-В)
Димер КК-ММ
Фермент скелетной мускулатуры
Г2-- -Ю яАЮ
Димер КК-ВВ
Фермент головного мозга
Определение активности КК-МВ
в сыворотке крови используется
в диагностике инфаркта миокарда
Димер КК-МВ
Фермент сердечной мышцы
Рис. 8.2. Четвертичная структура. Два разных мономера креатин¬
киназы — КК-М и КК-В — связываются с образованием трех
вариантов димеров. Это гомодимер КК-ММ (фермент скелетной
мускулатуры), гомодимер КК-ВВ (фермент головного мозга) и
гетеродимер КК-МВ (характерен для ткани сердечной мышцы)
Третичная структура белка
Третичная структура белка — это взаимное расположение 1;
в пространстве p-цепей, р-складчатых слоев и а-спнралей.
Примеры различных способов укладки — мономеры креа¬
тинкиназы КК-М и КК-В (рис. 8.1).
Четвертичная структура белка I
Многие белки состоят из нескольких полипептидных цепей,
которые связаны нековалентными связями. Мономером назы¬
вается один отдельный белок, состоящий из одной полипеп-
тидной цепи. Когда мы говорим о четвертичной структуре
белка, это означает, что в его состав входят несколько моно¬
меров: 2 мономера образуют димер (рис. 8.2), три — трнмер, '
четыре — тетрамер и т.д. Олигомеры состоят из большого
числа мономеров. j
Коллаген ]
При кипячении соединительная ткань превращается в
желатин, который можно использовать как клей. Отсюда и |
возникло название «коллаген» (по-гречески «kola» значит
«клей»). На настоящий момент известно 19 разных типов
коллагена. Коллагены — структурные белки соединительной
ткани, самые многочисленные белки человеческого организ¬
ма. Коллагены по-разному распределены в организме: так,
коллаген I типа содержится главным образом в связках, сухо¬
жилиях и коже, а коллаген II типа — в хрящевой ткани.
Структурные единицы коллагена — а-спирали, которые скру¬
чиваются в тройпую сиираль. В первичной последовательно- .
сти коллагена повторяется мотив -Гли-X-Y-. В этой после¬
довательности X обычно представлен пролином. На месте Y
чаще всего находится остаток пролина, гидроксилированный
в витамин С-зависимой реакции: таким образом, Y пред- j
ставляет собой остаток гидроксипролина. В других случаях Y
может быть представлен остатком гидроксилизина (рис 8.3). 1
Глицин — необходимый компонент коллагена. Это самая I
маленькая аминокислота: ее радикал R представлен лишь 1
одним атомом водорода. Пространство в тройной спирали т
ограничено, и другие, более крупные, молекулы аминокислот 1
просто не могли бы там поместиться. 1
С",
сн„
Синдром Элерса-Данло
Недостаточность лизил-
гидроксилазы при син¬
дроме Злерса-Данло VI типа
Лизингидроксилаза
©
+NH,
I 3
СН,
I 2
но-с-н
он,
сн„
/V
У
v
Витамин С
//.С'.
И
>4
t Vi ,ж
Остаток лизина
Остаток
гидроксилизина
Рис. 8.3. Гидроксилирование остатков лизина при образовании
коллагена
Биосинтез коллагена
Коллаген — нерастворимый гликопротеин внеклеточного
матрикса. Каким же образом фибробласты — клетки, синте¬
зирующие коллаген, образуют нерастворимый внеклеточный
белок? Все дело в том, что синтез коллагена осуществляется
в 2 стадии: внутриклеточной и внеклеточной (рис. 8.4).
На внутриклеточной стадии происходит синтез
проколлагеиа
Сначала внутриклеточный белковый аппарат синтезирует
полипептидные а-спирали (длиной примерно в 1000 амино¬
кислот). Некоторые из остатков пролина и лизина гидрокси-
лируются в ходе реакций, для которых необходим витамин С
(гл. 58). Некоторые остатки гидроксилизина гликозилируют-
ся. Потом а-спирали объединяются, сплетаясь друг с другом,,
и образуют тройную спираль проколлагена, который являет¬
ся растворимым белком.
На внеклеточной стадии формируются коллагеновые
волокна
Проколлаген секретируется клеткой во внеклеточную жид¬
кость. Фермент проколлагенпептидаза удаляет глобулярные
26 Третичная и четвертичная структура белка. Коллаген
it It/UUriAH
С \
Эндоплазматический ретикулум
Витамин С
©
Цинга
Синдром Элерса-Данло
1 ^ I
Авитаминоз С
Недостаточность лизилгидро-
ксилазы при синдроме
Элерса-Данло VI типа
X
О
А
ТА
О
X
Гликозилирование
гидроксилизина
Пролилгидроксилаза
и лизилгидроксилаза
гидроксилируют остатки
пролина и лизина (гл. 55)
ц»
~М0
ОН
Цитозоль
/
nh3+
ЕЯ
| Формирование тройной спирали
С-концевой пропептид
'g Галактоза Глюкоза
«V. *
Плазматическая мембрана
Внеклеточное пространство
Проколлаген секретируется
клеткой во внешнюю среду.
Пептидаза удаляет пропептиды,
и формируется тропоколлаген
Проколлагенпептидаза
J К
N-концевой
.99.9
Тропоколлаген
9 , 9 9
С-концевой
пропептид
0 о о о о
1 1 1 1 1
1_ .t-_
пропептид
Образование микрофибрилл
Нерастворимые молекулы тропоколлагена свя¬
зываются друг с другом в микрофибриллы.
В присутствии фермента лизилоксидазы остатки
лизина и гидроксилизина образуют связи друг
с другом. Эти поперечные связи придают микро¬
фибрилле прочность на растяжение
sядовдсшт* шшжта здштекк* ыжяштв
I I I I I I ill ill ill ii
wssr шгьатхяш sгтгтхта шявяя&яш ss/sw*
i i i i i l i i i i i i i i i i
wuwsat ят&шта ь&шт&ъм sse
i i i i i i i i i i i i i i i i i
ьгттатаж ssma^sRsar iraora sasseraasraaMf soranamt
Рис. 8.4. Биосинтез коллагена
пропептиды с N- и С-концевых участков молекул проколла¬
гена, и образуется нерастворимый тропколлаген. Молекулы
тропоколлагена объединяются в микрофибриллы, причем
они располагаются в шахматном порядке так, что каждая
молекула тропоколлагена перекрывается с соседними на чет-
Микрофибриллы объединяются
в полимерное коллагеновое волокно
верть своей длины. Наконец, в присутствии лизиноксидазы
остатки лизина и гидроксилизина реагируют друг с другом,
формируя поперечные связи, что придает микрофибрилле
прочность на растяжение, и микрофибриллы объединяются
в одно полимерное коллагеновое волокно.
Третичная и четвертичная структура белка. Коллаген
27
инеиж В1ЛГ oweiogedeed
HDS08 Ш
ADtGN3 ПАРА 3AVS хэи
лэшшен I?
О Реакции окисления-восстановления.
Коферменты и проотетичеокие группы
(Флавин I
НзСХХ^ ан НзХг”/
H,CA^'NANA0 / H,Ca^'NaN
NH
Рибитол-
фосфат
сна-с-с-с-сн^о -P = 0
он он он 1-
ФМН
окисленная
форма
НИН О'
сж^с-е-с-еи^о -р = о
он он он L
ФМНН2
восстановленная
форма
Рис. 9.1. ФАД (флавинадениндинуклеотид) восстанавливается Рис. 9.2. ФМН (флавинмононуклеотид) восстанавлива- !
до ФАДН2 ется до ФМНН2
о I Никотинамид
О +iT
н н И
с- NH_
НАД+
окисленная форма
НАДН+Н+
восстановленная форма
° 1 Никотинамид |
НАДФ+
окисленная форма
Рис. 9.3. НАД+ (никотинамидадениндинуклеотид) восстанавливается Рис. 9.4. НАДФ+ (никотинамидадениндинуклеотидфос- _
до НАДН фат) сходен по строению с НАД+, но содержит рибозо- .
2’-фосфат. НАДФ+ восстанавливается до НАДФН (на
рисунке не показан)
Пирофосфат]
I Тиамин | H3CWCH2~CH2- о - р - о - р - о-
£Т"гНг'
,-NjS О С-
Тиаминпирофосфат
(ТРР)
Рис. 9.5. Кофермент А. Содержит сульфгидрильную группу — SH-rpynny Рис. 9.6. Тиамиидифосфат (тиаминпирофосфат)
p-меркаптоэтиламина. Это функциональная группа кофермента, которая
вступает в реакцию, например, с карбоксильными группами жирных
кислот
28 Реакции окисления-восстановления. Коферменты и простетические группы
|ашшен ^
ItTUUI I АН
• и t uuo \
lUUbcTAU
d3H3JOdl»3l/G
a 0088
-Lauu^i. at'UZ.S
«VHdbl/A>»dnn Vl/HU
f
Переносчики водорода: коферменты НАД+
нНАДФ+
НАД+ и НАДФ+ (рис. 9.3 и 9.4) — это коферменты, обра¬
зующиеся из ниацина (гл. 55), которые действуют как косуб-
страты. Они необходимы для нормальной работы целого ряда
ферментов. Вместе с ферментом X они акцептируют ионы
водорода, образующиеся в процессе окисления, и восстанав¬
ливаются до НАДН и НАДФН соответственно. После этого
НАДН и НАДФН отделяются от фермента X и диффунди¬
руют от него, чтобы в дальнейшем взаимодействовать уже
с другим ферментом — Y. Теперь они играют роль доноров
водорода в реакции восстановления и возвращаются в окис¬
ленное состояние (НАД+ и НАДФ+).
Несмотря на структурное сходство, НАД+ и НАДФ+
выполняют разные функции. НАДН играет важную роль в
энергетическом обмене (гл. 20 и 31) и реакциях катаболиз¬
ма. НАДФН участвует в анаболических реакциях, например в
синтезе жирных кислот (гл. 23) и развитии реакции «окисли¬
тельного взрыва» (гл. 18).
Следует помнить основной принцип: коферменты ПАД+,
НАДФ+ и кофермент А обязательно должны рециклнровать
(рис. 9.7): они образуются из витаминов, присутствуют в
организме в очень маленьких концентрациях и после фер¬
ментативной реакции, в которой коферменты восстанавли¬
ваются, они должны быть окислены в другой ферментативной
реакции. Представьте, что НАД+ и НАДФ+ — это рабочие
пчелки, которые кружат по всей клетке, собирая водород и
передавая его потребителям.
Другие кеферменты: кофермент А и тиамин
дифосфат
Строение кофермента А и тиамин дифосфата показано на
рис. 9.5 и 9.6. О других коферментах см. в главах, посвящен¬
ных витаминам (гл. 55—58).
Простетические группы: ФАД и ФМН
ФАД (рис. 13.1) и ФМН (рис. 13.2) — это кофакторы фермен¬
тов, образующиеся из рибофлавина (гл. 55). Подобно НАД+
и НАДФ+ они выступают в роли косубсратов в реакциях
окисления—восстановления и восстанавливаются до ФАДН2
и ФМНН2. Однако, в отличие от НАД+ и НАДФ+, ФАД и
ФМН являются не коферментами, а простетическими группа¬
ми. Все время своего существования они ковалентно связаны
с ферментами и являются частью их структуры.
Ацетил-КоА
-Кетоацил-АПБ-
редуктаза
Из дыхательной
В дыхательную
цепи
цепь
Оксалоацетат-
Цитра теин таза
♦•Цитрат
Рис. 9.7. Рециклирование коферментов. НАД+, НАДФ+ и кофермент A (KoA-SH) возвращаются в цикл, взаимодействуя с другим
ферментом в метаболическом пути. На рисунке рециклирование коферментов показано на примере метаболического пути, в ходе
которого из глюкозы синтезируются жирные кислоты
Реакции окисления-восстановления. Коферменты и простетические группы
29
abbvzt
О
Анаэробный синтез АТФ: субстратное
>■ фосфорилирование, синтез АТФ из фосфокреатина,
аденилаткиназная реакция
I
Высокоэнергетическк с N
Хсх Ч
NH.
| Высоко;
\ бо- /<у
у, Т Р| Та|
О-Р—о—Р О—Р-О-СН
сн
\ I
АМФ(аденозинмонофосфат)
АДФ (аденозиндифосфат)
АТФ (аденозинтрифосфат)
Рис. 10.1. Строение аденозинтрифосфата (АТФ)
Гликолиз
нс = о
I
неон
I ,
СН2ОРОэ2
Г лицеральдегид-3-фосфат
НАД
НАДН+Н
о=с-оро 2'
I 3
неон
сн2оро32
1 ,Э-Бисфосфоглицерат
АТФ
Фосфоглицера ткиназа
СОО'
I
неон
сн2оро|
З-Фосфоглицерат
2-Фосфоглицерат
I
СОО'
I ,
С-ОРО2'
II 3
сн2
Фосфоенолпируват
Пируваткиназа
АТФ
СОО'
I
с=о
I
сн3
Пируват
Рис. 10.3. В цикле Кребса путем субстратного фосфорилирова- Рис. 10.2. Образование АТФ в ходе гликолиза путем субстратного
ния образуется ГТФ, который затем под действием нуклеозидди- фосфорилирования
фосфаткиназы превращается в АТФ
При физической нагрузке
Фосфокреати
Креатинкиназа
Креатин
н —^ /—АДФ^чХ^ Фн
гинкиназа\ I
ин ■*—-^^Ч^-АТФ яш^
Определение активности
креатинкиназы в сыворотке крови
используется в диагностике ин-
фаркта миокарда и болезней мышц
Из фосфокреатина обра¬
зуется АТФ, необходимый
для работы мышц
В период покоя
Фосфокреатин
Креатин
X
АДФ
АТФ
В неработающих мышцах
накапливается АТФ, который
используется для образова-
ния фосфокреатина
Рис. 10.4. Образование АТФ из фосфокреатина при физической нагрузке и синтез фосфокреатина из креатина в период покоя
АДФ+адф ► АТФ + амф
Аденилаткиназа
Рис. 10.5. Образование АТФ из двух молекул АДФ в процессе
аденилаткиназной реакции
30 Анаэробный синтез АТФ: субстратное фосфорилирование, синтез АТФ из фосфокреатина, аденилаткиназная реакция
IUUUI1АП
«шшен ^
АТФ (аденозинтрифосфат): молекула,
обеспечивающая энергией живые клетки
Молекулы АТФ жизненно необходимы. АТФ служит источ¬
ником энергии, необходимой для сокращения мышц, про¬
ведения нервного импульса, протекания многих биохимиче¬
ских реакций и т.п. В покое расходуется 28 г (1 унция) АТФ в
минуту, что эквивалентно 1,4 кг (3 фунта) в час, а при физи¬
ческой нагрузке расход АТФ достигает 0,5 кг в минуту! АТФ
состоит из аденина, рибозы и трех фосфатных групп, кото¬
рые называются а-, р- и у-фосфатными группами (рис. 10.1).
Гидролиз высокоэнергетических фосфоангидридных связей
между р- и у-атомами фосфора или между а- и р-атомами
фосфора высвобождает энергию, необходимую для прове¬
дения биохимических реакций, т.е. для поддержания жизни
организма.
Самый энергетически выгодный метод синтеза АТФ —
это аэробное окислительное фосфорилирование (гл. 20 и 31).
Однако АТФ может также образоваться в анаэробных услови¬
ях, хотя и с меньшей эффективностью. Существует три спосо¬
ба анаэробного синтеза АТФ: субстратное фосфорилирование,
образование АТФ из фосфокреатина и в результате аденнлатки-
назной реакции. Хотя анаэробный синтез АТФ и не так энер¬
гетически выгоден, способность синтезировать АТФ в бескис¬
лородной среде может иметь жизненно важное значение.
Синтез АТФ путем субстратного
фосфорилирования
На рис. 10.2 показано, что АТФ образуется в процессе глико¬
лиза в ходе фосфоглицераткиназной и пнруваткиназной реак¬
ций, а также в цикле Кребса в ходе реакции, катализируемой
ферментом сукцинил-КоА-синтетазой с участием нуклеозидди-
фосфаткиназы (рис. 10.3). Примечание: для этих реакций кис¬
лород не требуется.
Получение АТФ из фоофокреатина
Фосфокреатин — это «аварийный запас» высокоэнергетиче¬
ского фосфата, который можно использовать для быстрого
образования АТФ, необходимого для сокращения мышц в
анаэробных условиях. Этот интенсивный механизм синтеза
АТФ может в экстренных ситуациях спасти жизнь; однако
запасы фосфокреатина расходуются очень быстро, всего за
несколько секунд.
В периоды покоя, когда молекул АТФ много, креатинки-
наза фосфорилирует креатин с образованием фосфокреатина.
Особенно важна роль этой реакции в мышцах. Если вдруг
требуется сделать резкий рывок, фосфокреатин фосфори¬
лирует АДФ до АТФ, необходимого для сокращения мышц
(рис. 10.4) По этой причине фосфокреатин еше называют
«фосфаген».
Креатин выводится в форме креатинина
Креатин — это аминокислота, не входящая в состав бел¬
ков. Креатин синтезируется из аргинина и выводится с мочой
в форме креатинина (гл. 44). Уровень креатинина в крови и
клиренс креатинина используются для оценки скорости клу¬
бочковой фильтрации при нарушении работы почек.
Примечание: не путайте креатин, креатинин и карнитин.
Прием креатина повышает работоспособность
Эргогенные средства — это вещества, которые повышают
скорость, силу или выносливость спортсмена. Многие из них
опасны и запрещены к использованию. Мнения противоре¬
чивы, тем не менее многие ученые сходятся на том, что креа¬
тин — единственное эргогенное средство, для которого научно
доказано его свойство повышать работоспособность как при
спринтерских, так и при продолжительных нагрузках.
Образование АТФ из АДФ под действием
аденилаткиназы
После того как АТФ гидролизуется для высвобождения энер¬
гии, необходимой для сокращения мышц, в клетках образуется
и накапливается АДФ. Но АДФ тоже содержит энергоемкую
а-фосфоангидридную связь (рис. 10.1). Природа изобрета¬
тельна: эта энергия становится доступной после того, как
в анаэробных условиях две молекулы АДФ под действием
аденилаткиназы образуют АТФ (рис. 10.5) (раньше фермент
аденилаткиназу называли миокиназой).
Анаэробный синтез АТФ: субстратное фосфорилирование, синтез АТФ из фосфокреатина, аденилаткиназная реакция 31
инеиж autJ OHEiogedcej
илсла
SSfJ -*WT: ’ Tt
^ЕХЭ-U /ZTSs
ф Аэробный
синтез АТФ
Патологии митохондрий
1) Атрофия зрительного нерва Лебера
2) Синдром MELAS
3) Болезнь Ли
О
Порин
О
Белок-
переносчик
Карнитиновый
челночный
механизм
о
Кристы
Матрикс
Внутренняя мембрана
Межмембранное пространство
Наружная мембрана
Митохондрия
Комплекс
V
Комплекс
Комплекс
II
Комплекс
Комплекс
1
III
IV
Дыхательная цепь
о
Рис. 11.1. Схема строения митохондрии
Синтез АТФ в дыхательной цепи путем
окислительного фосфорилирования
Митохондрия
Митохондрия (рис. 11.1) — это органелла, по размеру сопо¬
ставимая с бактериальной клеткой. Примечательно, что у
митохондрии есть две мембраны. Наружная мембрана про¬
низана молекулами порина. Порины образуют каналы, по
которым через мембрану могут проходить молекулы с массой
менее 10 кДа. Внутренняя мембрана ПРАКТИЧЕСКИ непро¬
ницаема; она образует впячивания — кристы. Через внутрен¬
нюю мембрану свободно проходят только небольшие молеку¬
лы — вроде Н20 и NH3. Лишь немногие другие молекулы с
помощью белков-переносчиков и челночных систем способ¬
ны преодолеть этот барьер.
Считается, что митохондрия — пример эндосимбиоза.
Внутренняя мембрана митохондрии с заключенным в ней содер¬
жимым когда-то была древней анаэробной бактерией, которая
проникла в примитивную клетку на ранних этапах эволюции.
Сохранились и следы прошлого: так, митохондрия имеет свою
собственную ДНК {мтДНК), кодирующую 37 генов. 24 из них
участвуют в трансляции мтДНК, остальные кодируют белки
дыхательной цепи. Примечательно, что только 13 из всех бел¬
ков митохондриальной дыхательной цепи (а всего их более 85)
закодированы в мтДНК. Остальные кодирует ядерная ДНК, и
они транспортируются в митохондрию из цитоплазмы.
Дыхательная цепь
Дыхательная цепь (рис. 11.2) — эффективный путь получения
АТФ с использованием НАДН и ФАДН2, которые образуют¬
ся в процессе окисления метаболического «топлива» [прежде
всего углеводов и жирных кислот (гл. 20, 31)]. Дыхательная
цепь состоит из пяти комплексов — I, II, HI, IV и сложного
комплекса грибовидной формы (комплекс V). Грибовидный
«мультикомплекс» состоит из субъединиц F[ (субъеди¬
ница «один») и F0 (субъединица «О», связывает олигоми-
цин). Некоторые из комплексов дыхательной цепи содержат
цитохромы, которые транспортируют электроны по цепи:
комплекс III содержит цитохром Ь, а комплекс IV — цито¬
хром а/аЗ. Кроме того, в транспорте электронов принимают
участие убихинон (кофермент QI0) и цитохром С. Все ком¬
плексы дыхательной цепи расположены во внутренней мем¬
бране митохондрий. Комплексы 1, III и IV не только перено¬
сят электроны, но также выполняют функцию молекулярных
протонных насосов: они «выкачивают» протоны из матрик¬
са в межмембранное пространство. Внутренняя мембрана
непроницаема, в частности, она непроницаема для протонов,
поэтому они возвращаются в матрикс только одним путем -
через протонный канал комплекса F^Fq, который в этот
момент синтезирует АТФ.
Поток электронов упрощенно показан на рис. 11.2. В гл. 16
описано, как поток электронов — электрический ток — при¬
водит в действие протонные насосы. И наконец, схема дыха¬
тельной цепи в виде картинок изображена на рис. 13.1.
32
Аэробный синтез АТФ
сн
I
COO'
Рис. 11.2. Транспорт электронов в дыхательной цепи. На схеме показан поток электронов от промежуточных метаболитов цикла
Кребса (малата и сукцината) к кислороду по цепи переноса электронов, через комплексы 1, 11, 111, IV
Патологии митохондрий
Существуют различные нарушения дыхательной цепи.
Многие из них наследственно передаются по материнской
линии, поскольку все митохондрии зиготы происходят
из митохондрий яйцеклетки. При делении клетки тысячи
молекул мтДНК случайным образом распределяются между
дочерними клетками, поэтому разные ткани могут содер¬
жать как нормальные, так и мутантные молекулы мтДНК
(это состояние называется гетероплазмией). Вследствие этого
клиническая картина при таких патологиях очень изменчива.
Мутации в ядерных генах, кодирующих белки дыхательной
цепи, передаются по аутосомному типу и обычно вызывают
более тяжелые нарушения.
Атрофия зрительного нерва Лебера
Атрофия зрительного нерва Лебера вызывается мутацией
участка митохондриальной ДНК, который кодирует одну из
субъединиц комплекса I. От этого нарушения дыхательной
цепи митохондрий сильнее всего страдает, по-видимому,
зрительный нерв. Болезнь проявляется во взрослом возрасте
и приводит к потере зрения.
Митохондриальная энцефаломиопатия, лактацидоз
и инсультоподобные эпизоды (синдром MELAS)
Причина синдрома MELAS — мутация гена мтДНК, коди¬
рующего лейциновую транспортную РНК митохондрий. Эта
мутация влияет на трансляцию мтДНК, и поэтому при син¬
дроме MELAS нарушена структура всех комплексов дыхатель¬
ной цепи, кроме комплекса II, который полностью кодирует¬
ся ядерным геномом.
Болезнь Ли
Болезнь Ли — дегенеративное заболевание центральной нерв¬
ной системы с характерными патологическими изменениями.
Обычно развивается в раннем возрасте. Заболевание генети¬
чески гетерогепно: чаще всего причиной болезни являются
мутации участков ядерных геномов, кодирующих компонен¬
ты дыхательной цепи, однако в некоторых случаях болезнь
Ли развивается из-за мутаций митохондриальных генов. При
болезни Ли может быть нарушена активность АТФ-синтетазы
(комплекса V) или комплексов I, II, III, IV. При некоторых
формах болезни Ли имеют место нарушения активности пиру-
ватдегидрогеназного комплекса (гл. 30).
Недостаточность пируватдегидрогеназного комплекса при¬
водит к повышению в крови концентраций пирувата, лак¬
тата и аланина. У некоторых больных наблюдается улучше¬
ние состояния при приеме липоевой кислоты или тиамина
(коферментов пируватдегидрогеназного комплекса). С огра¬
ниченным успехом применяется лечение кетогенной низ¬
коуглеводной диетой. (Кетоновые тела легко проходят гема¬
тоэнцефалический барьер, и при их катаболизме образуется
ацетил-Ко А независимо от пируватдегирогеназного комплекса.)
Аэробный синтез АТФ
33
Биосинтез АТФ путем окислительного
фосфорилирования (часть I)
е'
н
в;
Оксалоацетат фумарат
Сукцинат
Малат
НАДН+Н+
2Н+- НАД+1 2Н+
ФАД ФАДН2 К°мплекс 2Н+
Комплекс III
(убихинон-
цитохром
с-оксидоре-
дуктаза)
Внутренняя
мембрана
митохондрии
Комплекс IV
ТОХром С (цитохром-
(восстанов- оксидаза)
ленный)
Протонный
насос
Протонный
насос
Межмембранное
пространство
2Н+
АТФ
Протоны возвращаются в матрикс через
протонный канал субъединицы F0.
Энергия протонного тока используется
АТФ-синтетазой (F^ для синтеза АТФ
из АДФ и неорганического фосфата (OJ
К
п
А
ю
и
а
ст
в
ч<
ВС
(с
Hi
В(
Д1
к
п
ф
(Н
лт
HI
к
пь
Рис. 12.1. Биосинтез АТФ путем окислительного фосфорилирования (часть 1)
к<
в
пр
во
; НО
\ ко
\ ко
1 CT]
Ко
Эл
л о
eai
пр
АТ
Эт<
со;
АТ
34 Биосинтез АТФ путем окислительного фосфорилирования (часть I)
Биосинтез АТФ в дыхательной цепи, в котором принима¬
ет участие как поток электронов (е“), так и поток прото¬
нов (Н+), происходит путем окислительного фосфорилиро¬
вания. Дыхательная цепь состоит из четырех комплексов
(I, И, III, IV) и структуры грибовидной формы — АТФ-
синтаза с субъединицами F0/F, или комплекса V, который
синтезирует АТФ из АДФ и неорганического фосфата (Ф„).
Ниже будет рассмотрено, как создается поток электронов и
протонов в дыхательной цепи: первый начинается от ком¬
плекса 1, второй — от комплекса II.
Комплекс I
Поток электронов начинается от НАДН. Энергия для синтеза
АТФ возникает благодаря разделению зарядов в комплексе I,
которое вызывает движение электронов (электрический ток)
и протонов (протонный ток). Молекулярный насос комплек¬
са I выкачивает четыре протона в межмембранное простран-
: ство. Другие комплексы (III и VI) тоже выкачивают протоны
| в межмембранное пространство, и образуется электрохими-
I ческий градиент протонов; в конечном итоге все эти протоны
I возвращаются обратно через протонный канал АТФ-синтазы
| (см. ниже). В комплексе I электроны переносятся с НАДН
I на убихинон (кофермент Q). Два электрона и два протона
I восстанавливают убихинон до убихинола (QH2), и убихинол
I движется в толще мембраны к комнлексу III.
Комплекс II
Поток протонов начинается от ФАДН2. Комплекс II содержит
ФАД в виде простетических групп нескольких дегидрогеназ
(например, сукцинатдегидрогеназы). Этот ФАД восстанав¬
ливается до ФАДН2. Далее комплекс II передает электро¬
ны убихинону (Q) для последующего переноса электронов
к комплексу III. Примечание: комплекс II не выкачивает про¬
тоны.
Комплекс III
В роли донора электронов выступает убихинол QH2, который
при этом окисляется до убихинона Q и в этом виде может
возвращаться обратно и принимать следующую пару электро¬
нов и протонов. Убихинол передает электроны на цитохром,
который транспортирует их в комплекс IV. Протонный насос
комплекса III выбрасывает 4 протона в межмембранное про¬
странство.
Комплекс IV
Электроны, поступившие от цитохрома с, передаются кис¬
лороду, и кислород полностью восстанавливается с образо¬
ванием воды. Комплекс IV выбрасывает в межмембранное
пространство только 2 протона.
ние благодаря тому, что она ингибируется олигомииином,
а субъединица F| была первой открытой и выделенной «фрак¬
цией* среди всех элементов дыхательной цепи. Поток про¬
тонов проходит через протонный канал и запускает молеку¬
лярный двигатель, который заставляет АДФ и Фн реагировать
друг с другом, образуя молекулы АТФ.
Чтобы синтезировать одну молекулу АТФ и транспорти¬
ровать ее в цитозоль, требуется 4 протона. При окислении
I молекулы НАДН+ высвобождается 10 протонов, энергия
которых достаточно дзя образования 2,5 молекул АТФ. При
окислении 1 молекулы ФАДН2 высвобождается 6 протонов,
энергии которых достаточно для синтеза 1,5 молекул АТФ*.
Утечка электронов приводит к образованию
активных форм кислорода
Примерно 2% электронов высвобождаются из дыхательной
цепи и связываются непосредственно с кислородом, обра¬
зуя активные формы кислорода (АФК) (гл. 18). Если рабо¬
та дыхательной цепи нарушена, АФК образуются в большем
количестве. Эти вещества повреждают митохондрии, вызывая
все большие нарушения дыхательной цепи. Возникает пороч¬
ный круг, и в результате из-за накопления различных повреж¬
дений под действием АФК происходит старение клетки.
Дыхательные яды
Вещества, которые ингибируют образование АТФ, потенци¬
ально токсичны для организма.
Амитал и ротенон блокируют транспорт электронов в
комплексе 1. Ротенон выделяют из корней растения деррис
(Derris scandens) и нередко используют в качестве природ¬
ного пестицида. Он малотоксичен для человека, поскольку
плохо всасывается в желудочно-кишечном тракте. Однако
ротенон ядовит для рыб, так как быстро всасывается через
жабры. К тому же при долговременном воздействии ротенон
опасен и для человека, так как вызывает развитие болезни
Паркинсона.
Антимицин блокирует транспорт электронов в комплек¬
се 111.
Цианиды (CN-), угарный газ (СО) и азиды (N3“) ингибиру¬
ют комплекс IV. Поэтому при отравлении цианидом блокиру¬
ются аэробные метаболические процессы, несмотря на то что
кровь достаточно насыщена кислородом. Из-за остановки
аэробного метаболизма венозная кровь принимает цвет арте¬
риальной крови. Кроме того, наблюдается гипервентиляция,
поскольку из-за накопления молочной кислоты стимулирует¬
ся дыхательный центр.
Олигомицин блокирует протонный канал (F0 в комплексе V)
и не дает протонам возвращаться в матрикс. Поэтому АТФ-
синтаза (F|) теряет способность синтезировать АТФ.
АТФ-синтаза (комплекс V)
Этот комплекс состоит из «ножки гриба* — субъединицы F0,
содержащей протонный канал, и из «выпуклой части* —
АТФ-синтазы (или F,). Субъединица F0 получила свое назва-
* В отечественных учебниках биохимии принято считать эти
значения равными «3* и «2* соответственно, т.е. при окислении
1 молекулы НАДН образуется 3 молекулы АТФ, а при окислении
ФАДН2 — 2 молекулы АТФ, что отражает теоретический максимум
синтеза АТФ. (Примеч. ред.)
Биосинтез АТФ путем окислительного фосфорилирования. Часть I
35
Биосинтез АТФ путем окислительного
фосфорилирования (часть II)
1
2
3
В ходе окислительно-восстановительных реакций
(для примера приведена малатдегидрогеназная
реакция) образуется НАДН, который поступает
в комплекс I. В комплексе I происходит разделение
зарядов: протоны выбрасываются в межмембран¬
ное пространство, а электроны восстанавливают
убихинон (0) до убихинола (QH2). Убихинол
Происходит окисление
ФАДН2. Протоны и элек¬
троны восстанавливают
убихинон (Q) до убихинола
(QH2), который поступает
в комплекс III
В комплексе III убихинол
(0Н2) отдает два протона
и два электрона. Четыре
протона выбрасываются
в межмембранное про¬
странство, а два электрона
передаются цитохрому с
I г
поступает в комплекс 111
Малат Оксалсацетат
> 1
НАД+ НАДН+Н +
2Н+ t I 2Н+
2Н+ ФМНН2 ФМН
Комплекс I
Внутренняя мембрана митохондрии
Межмембранное пространство
Комплекс III
Ингибируется ротеноном
и амиталом
Ингибируется
антимицином А
На рис. 13.1 показан поток электронов и протонов в дыхатель¬
ной цепи. Электроны и протоны от НАДН+ через комплекс I
и от ФАДН2 через комплекс И передаются комплексу III.
Затем электроны транспортируются в комплекс IV, где они
присоединяются к кислороду. В это время протоны выкачи¬
ваются протонными насосами из матрикса в межмембранное
пространство и возвращаются обратно в матрикс через про-:
тонный канал F0-субъединицы АТФ-синтазы (комплекс V)j
Поток протонов (протонный ток) включает молекулярный
двигатель — F1-субъединицу АТФ-синтазного комплекса, и онач
располагает молекулы АДФ и Фн таким образом, что они
объединяются в молекулы АТФ. !
}
36
Биосинтез АТФ путем окислительного фосфорилирования (часть II)
6
Протонный ток. Протоны
возвращаются обратно
в матрикс через протонный|
канал в субъединице F0
Рис. 13.1. Окислительное фосфорилирование. Картинки изображают транспорт протонов и электронов по дыхательной цепи, в кото¬
рой путем окислительного фосфорилирования синтезируется АТФ. В гл. 15 этот же процесс описан более кратко, в форме экзаме¬
национного ответа
Биосинтез АТФ путем окислительного фосфорилирования. Часть
37
— I— Р щ — I тл
мшшен
€Ц Что происходит в случае утечки протонов
w или электронов из дыхательной цепи
NO_
Динитрофенол разобщает процессы окисли-
лительного фосфорилирования и транспорта
электронов, выводя протоны в матрикс
Наружная мембрана
митохондрии
!
I
I
I
Рис. 14.1. Динитрофенол и разобщающий белок разобщают процессы окислительного фосфорилирования и транспорта электронов \
I
Утечка протонов и электронов из дыхательной
цепи
Мы узнали из предыдущих глав, какую роль играет поток
электронов и поток протонов в процессе синтеза АТФ из
АДФ путем окислительного фосфорилирования. Однако
неизбежно возникают ситуации, при которых происходит
утечка либо протонов, либо электронов из дыхательной цепи.
Утечка протонов повышает теплопродукцию. Утечка электро¬
нов приводит к образованию активных форм кислорода (АФК),
потенциально очень токсичных.
Утечка протонов и теплопродукция
Динитрофенол
Во время Первой мировой войны у рабочих военных заво¬
дов отмечали повышение температуры и потерю массы тела.
Причиной этих изменений был динитрофенол — взрывчатое
вещество, которое производили на заводах. Благодаря спо¬
собности «повышать скорость метаболизма» динитрофенол
даже стали использовать в препаратах для снижения массы
тела, но в 1930-х гг. он был запрещен из-за вредных побоч¬
ных эффектов. Динитрофенол вызывает утечку протонов
из межмембранного пространства в матрикс, минуя АТФ-
синтазную систему (рис. 14.1).
Динитрофенол — «разобщающее вещество»: он разобщает
процесс транспорта электронов и окислительное фосфорилнро-
вапие. В межмембранном пространстве митохондрии отри¬
цательно заряженный динитрофенолят-анион присоединяет
протон, образуя динитрофенол — жирорастворимое вещество,
которое диффундирует через внутреннюю мембрану мито¬
хондрия в матрикс. В матриксе динитрофенол диссоциирует,
высвобождая протон. Таким образом, динитрофенол унич¬
тожает градиент протонов, а энергия, которая могла быть
использована для синтеза АТФ, рассеивается в виде тепла.
Поэтому рабочие военных заводов и страдали от повышения
температуры тела. ,
Разобщающий белок
Разобщающий белок-1 (другое название — термогенин) обна¬
ружен только в буром жире млекопитающих. Он ответствен
за теплопродукцию при действии холода без появления дро¬
жания. Разобщающий белок-1 обеспечивает поток протонов
из межмембранного пространства в матрикс, и энергия при
этом рассеивается в виде тепла (рис. 14.1).
г
38
Что происходит в случае утечки протонов или электронов из дыхательной цепи
Нейтрофил
фагоцитирует
бактерию
Клеточная
мембрана
нейтрофила
Утечка электронов из дыхательной цепи вызыва¬
ет образование активных форм кислорода (АФК)
АФК очень токсичны. Образование АФК и их вредное воз¬
действие на организм подробно описаны в гл. 19, так что
читатели сначала могут изучить содержание гл. 19, а потом
вернуться к этому тексту.
Дыхательная цепь основной источник АФК
Теоретически молекулярный кислород должен полностью вос¬
станавливаться в комплексе IV четырьмя электронами, обра¬
зуя воду и не образуя других промежуточных соединений.
Однако иногда происходит частичное восстановление кисло¬
рода, и образуются супероксид-анион-радикалы (см. гл. 19).
Кроме того, иногда утечка электронов происходит из ком¬
плексов 1 и II в реакциях с убихиноном, и эти электроны
тоже восстанавливают кислород. В целом около 2% молеку¬
лярного кислорода в клетке переходит в форму свободных
супероксидных радикалов, и природа разработала защитные
механизмы, чтобы избавиться от них. Ферменты супероксид-
дисмутаза, глутатнонредуктаза и каталаза нейтрализуют опас¬
ные АФК.
Полезные свойства АФК: при окислительном взрыве
образуется дезинфицирующий раствор
Хотя АФК очень токсичны, они могут быть полезны для
организма. В качестве примера рассмотрим «окислительный
взрыв». «Окислительный взрыв» — это внезапное резкое уси¬
ление аэробного метаболизма с образованием хлорновати¬
стой кислоты, которая убивает патогенные микроорганизмы
(рис. 14.2).
Фагоциты — макрофаги и нейтрофилы — защищают орга¬
низм от патогенных микроорганизмов с помощью микро-
бицидных пептидов и литических ферментов. Они также
продуцируют окислители, обладающие микробицидным
действием. Их синтез сопровождается временным усилени¬
ем окислительного метаболизма — «окислительным взрывом»
(рис. 14.2, более подробно — рис. 15.1). Нейтрофилы фаго¬
цитируют бактерии в огражденную мембраной фагосому,
и на мембране фагосомы активируется НАДФН-оксндаза,
которая образует супероксид-апионы. Фермент супероксид-
дисмутаза превращает супероксид-анионы в кислород и
пероксид водорода. В нейтрофилах (но не в макрофагах)
также содержится фермент миелопероксидаза, который ката¬
лизирует окисление ионов хлора пероксидом водорода с
образованием хлорноватистой кислоты (да-да, именно это
вещество дезинфицирует воду в бассейнах и используется
как бытовой отбеливатель!). При диссоциации хлорновати¬
стой кислоты образуются гипохлорит-ионы, которые убива¬
ют микроорганизмы.
Хронический гранулематоз — редкое заболевание, сце¬
пленное с Х-хромосомой, при котором снижена активность
НАДФН-оксидазы. Из-за этого макрофаги и нейтрофи¬
лы в значительной степени теряют свою способность уби¬
вать микроорганизмы. Больные особенно восприимчивы
к инфекциям, вызываемым Mycobacteria, Escherichia coli и
Staphylococci, поскольку эти бактерии синтезируют каталазу,
которая защищает их от пероксида водорода, продуцируемо¬
го фагоцитами.
Что происходит в случае утечки протонов или электронов из дыхательной цепи 39
njaua \tH;;
двшшен
©
Свободные радикалы, активные формы киолорода
и окиолительное повреждение
о о о о
о I о
о
о о о о
Молекулярный кислород (02)
2НгО (электрон)
>oh)N
о о
о о
о о
о
о о
Утечка электронов
Хронический гранулематоз
о2
происходит из цепи
_ 9 9
1 О О о о
Вызван недостаточностью
переноса электронов
^ 2 электрона
1 / о
\. ж _ г\. О ГК
НАДФН-оксидазы
дыхательной цепи
® О о W
О
/НАДФН>\
КомплекоIV
О О О О
+оксидаза \
Супероксиданион
НАДФ+ НАДФН+Н+
о о
о
о о
о
о о
СОЛ
о о
Супероксиданион
СОЛ
Супероксид-
дисмутаза
— О О
2 протона (Н+)
Свободные гидроксильные
радикалы повреждают
структуру ДНК и вызывают
перекисное окисление липидов,
в результате чего поврежда-
ются клеточные мембраны
о о
о
о о
0
о
о
0
о
о о
оо
Молекулярный кислород
(Ог)
9 О
9 О
г% <■
* °
Ионы железа и меди
w « W о
катализируют
О о
ерокси*
о о
водорода
реакцию Хабера-Вайса
(Н202)
НзО
GSH GSSG
восстановленный окисленный
глутатион глутатион
(электрон)
О .
Протон (Н+)
Глюкозо¬
б-фосфат
2HzO +02
Fe
2+
Fe
з+
HoO
о о
о
Н+
99
О »
Си
Си
2+
НоО
9 9
Анион хлорида
(СГ)
Миелопероксидаза
О О
Свободные
гидроксильные
радикалы
(° ОН)
(самые
опасные АФК)
НАДО
9 О
о о % о ;
9 9
О
НоО
2'-'2
9 О
О
о О
н2о
Под воздействием
ионизирующего
излучения из воды
образуются
свободные
гидроксильные
радикалы
ff
НоО
ГЛЮКОЗО-6-
фосфатдегидрогеназа
Глюкозо-6-
фосфоглюконат
О О 9 9
Хлорноватистая кислота
(НСЮ)
- <'02) + (CI)
Синглетный Анион хлорида
кислород
О Протон (Н +)
Фавизм
Вызван недостаточ¬
ностью глюкозо-6-
фосфатдегидрогеназы
9 О
о о % о ;
9 9
О
О О 9 9
Г ипохлорит-анион
(СЮ)
(сильный антисептик, убивает бактерии)
Рис. 15.1. Образование свободных радикалов и активных форм кислорода
40
Свободные радикалы, активные формы кислорода и окислительное повреждение
rrt»; i
»-VZ. О 3
Активные формы кислорода и свободные радикалы
К активным формам кислорода (АФК) относятся следующие
соединения:
1) свободные радикалы, например гидроксильный радикал
•ОН (примечание: не путайте гидроксильный радикал с
гидроксильным ионом 0¥Г, это разные соединения);
2) ионы (в частности, гипохлорит-ион СЮ”, сопряженное
основание для хлорноватистой кислоты, активный компо¬
нент бытовых отбеливателей);
3) соединения, которые являются одновременно и ионом, и
свободным радикалом (супероксид-анион О2-);
4) молекулы (такие как пероксид водорода Н202).
Свободный радикал — это любое самостоятельно суще¬
ствующее соединение, которое несет на внешней орбите
хотя бы один неспаренный электрон (обозначается точкой •).
Особенно страдают от действия свободных радикалов нена¬
сыщенные жиры: воздействие на них свободных радикалов
приводит к перекисному окислению липидов. Свободные
радикалы — очень нестабильные, короткоживущие молекулы,
которые практически сразу реагируют с ближайшими моле¬
кулами, вызывая повреждение клетки. Чтобы восстановить
свою пару электронов на внешней орбите, свободный ради¬
кал забирает электрон у соседней молекулы. Но теперь уже
другая молекула несет неспаренный электрон и становится
свободным радикалом. По цепной реакции электрон пере¬
дается от одной молекулы к другой, нарушая установленные
законы и порядок в клетке. И результатом этих действий
может оказаться повреждение клетки.
Образование свободных радикалов
Дыхательная цепь
Дыхательная цепь — главный источник свободных радика¬
лов кислорода. Теоретически молекулярный кислород дол¬
жен полностью восстанавливаться в комплексе IV четырьмя
электронами с образованием воды и без образования каких-
либо других промежуточных соединений. Но иногда кислород
восстанавливается не полностью, и образуются супероксид-
анион-радикалы. Кроме того, зачастую утечка электронов
происходит из комплексов 1 и II в реакциях с убихиноном,
и эти электроны тоже восстанавливают кислород. В целом
около 2% молекулярного кислорода в клетке переходит в
форму свободных супероксид-радикалов, и природа разрабо¬
тала защитные механизмы, чтобы избавиться от них.
Ионизирующее излучение
Если Н20 и 02 подвергаются воздействию ионизирующего
излучения, образуются свободные радикалы. Этот принцип
используется в лучевой терапии рака, хотя излучение может
пагубно влиять и на здоровые клетки. При лучевой терапии
свободные радикалы в большом количестве образуются в
прицельно облучаемых опухолевых клетках, вызывая леталь¬
ные повреждения их ДНК.
Загрязняющие вещества (поллютанты)
Табачный дым содержит эпоксиды и пероксиды, которые
могут повреждать альвеолы легких. В табачных смолах при¬
сутствуют свободные радикалы, образовавшиеся из хинонов
и семихинонов. Вдыхание неорганических частиц, например,
асбеста, вызывает повреждение ткани легких свободными
радикалами.
Ишемия миокарда и реперфузионное повреждение
миокарда
Реперфузия — жизненно важный механизм, благодаря кото¬
рому восстанавливается поток насыщенной кислородом крови
к ишемизированным тканям. Однако реперфузия приводит к
образованию свободных радикалов кислорода. Считается, что
они ответственны за повреждение тканей при реперфузии.
Ионы металлов
Ионы переходных металлов, особенно ионы меди и железа,
катализируют образование опасных гидроксильных радика¬
лов (*ОН) из перекиси водорода в реакции Хабера-Вайса.
Поскольку железо участвует в окислительном повреждении,
концентрация свободных ионов железа в клетке должны регу¬
лироваться хелаторами железа (например, внутриклеточными
белками, депонирующими железо, например ферритином).
Свободные радикалы: польза или вред?
Полезное действие свободных радикалов
Свободные радикалы не всегда приносят вред организму.
Так, клетки эндотелия образуют оксид азота (NO*) для регу¬
ляции кровяного давления. Пероксид водорода используется
в синтезе тироксина. Кроме того, АФК выделяются фагоци¬
тами в процессе «окислительного взрыва» для уничтожения
патогенных микроорганизмов (см. гл. 18).
Вредное воздействие свободных радикалов
Как правило, свободные радикалы причиняют организ¬
му вред. Они вызывают перекисное окисление липидов и
нарушают их структуру, повреждают ДНК и вызывают рак.
Окислительное повреждение клеток свободными радикалами
приводит к преждевременному старению организма и раз¬
витию целого ряда дегенеративных заболеваний (чаше всего
сердечно-сосудистых). Самые опасные свободные радика¬
лы — гидроксильные (•ОН)
Механизмы защиты от свободных радикалов
и активных форм кислорода
Ферментативная защита
Супероксиддисмутаза переводит супероксид-анионы в перок¬
сид водорода, а каталаза вызывает разложение пероксида
водорода на неопасную для организма воду и молекулярный
кислород (рис. 15.1). Кроме того, пероксид водорода раз¬
рушается цитозольным ферментом — селепзавнсимой глута-
тионпероксидазой, и это основной путь удаления пероксида
водорода из клетки.
Перехватчики свободных радикалов
Перехватчики свободных радикалов — молекулы, которые
реагируют со свободными радикалами и делают их без¬
опасными для организма. Особенно богаты ими продукты
с высоким содержанием витаминов А, С и Е (см. гл. 53, 54
и 58), а также продукты, содержащие в большом количестве
такие соединения растительного происхождения, как фено¬
лы, полифенолы, флавоноиды. Эти вещества имеют высо¬
кую способность к поглощению радикалов кислорода (oxygen
radical absorbance capacity, ORAC) и являются мощными пере¬
хватчиками свободных радикалов. Считается, что они сни¬
жают риск развития некоторых хронических дегенеративных
заболеваний.
Спессбнесть к поглощению радикалов кислорода,
величина 0RAC
Относительно недавно усилился интерес к полезным свой¬
ствами продуктов с высокими значениями ORAC. Величина
ORAC — это оценка общего содержания антиоксидантов в
пище (например, фенолов и витаминов С и Е), которая выра¬
жается в ммоль ТЭ/кг, где ТЭ — это «тролокс-эквивалент».
Тролокс — водорастворимый аналог витамина Е, который
обладает мощным антиоксидантными свойствами и исполь¬
зуется как эталонный препарат при тестировании пищевых
продуктов в лабораторных условиях.
Свободные радикалы, активные формы кислорода и окислительное повреждение 41
Hosoa
jaiuuieif (W)
о
Аэробное окисление глюкозы для получения энергии
в виде АТФ
Глюкоза
( Глюкокиназа V
или гексокиназа *
АТФ Т
Выход АТФ при полном окислении глюкозы
Фосфоглюкоизомераза
ФруХгозо-
б-фДсфат
^АТФ
фосфофруктокиназа-1
ддф
Фрукт)
бисф
Цитозоль
ДипчАцвд
ацетонфосфг
0-1,6-
сфат
'^т Триозофосфат•
иэомероэа
НАД+-
Гликолиз
1,3-бисф
АДФ
2 молекулы
АТФ-*—
|« ьдегид-
:фат __
"Ч Q
Глицеральдегид-3-
фосфатдегидрогеназа
► 2 молекулы НАДФ+ Нч
оглицврат
Фосфое
ддф
2 молекулы
АТФ*—
Фосфоглицерат-
киназа шт
3-фос<ф( |ицерат
Фосфоглицеромутаэв
2-фос<£Ьфицврат
Енолаэа
пируввт
Пируват-
киназа
Пируват
Реакция
Ш
Глюкокиназа или гексокиназа
Фосфофруктокиназа
Глицеральдегид-3-
фосфатдегидрогенаэа
Фосфоглицераткиназа
Пируваткиназа
Пируватдегидрогеназа
Изоцитратдегидрогеназа
ос-Кетоглутаратдегидро-
геназа
Сукцинил-КоА-синтетаза/
нуклеозиддифосфаткиназа
Сукцинатдегидрогеназа
Малатдегидрогеназа
НАДФ ИЛ1
ФАДН2
ИВыход
АТФ
2 НАДФ
2 НАДФ
2 НАДФ
2 НАДФ
2ФАДН2
2 НАДФ
-1
-1
5*
2
2
5
5
5
2
3
5
ИТОГО 32
Предполагается, что используется малат/аспартатная челночная
система (см. далее). Примечание В итоговом выходе — 32 молекулы
АТФ — не учитываются затраты энергии на транспорт фосфата
и глутамата, эквивалентные одной молекуле АТФ. Таким образом,
на самом деле суммарный выход АТФ при полном окислении глю¬
козы составляет 31 молекулу АТФ. Более подробно см. SalwayJ.G.
Metabolism at a Glance. — 3rd ed. — Blackwell Publishing. — P. 20-21.
Рис. 16.1. Аэробное окисление глюкозы с образованием 32 молекул АТФ**
В отечественных учебниках биохимии эта величина составляет 38 молекул АТФ. (Примеч. ред.)
42 Аэробное окисление глюкозы для получения энергии в виде АТФ
Малат/аспартатная челночная система
и глицерофосфатная челночная система
НАДН образуется в цитозоле ферментом глицеральдегид-3-
фосфатдегидрогеназой. Для окисления в дыхательной цепи,
сопряженного с синтезом АТФ, он должен проникнуть в
матрикс митохондрии, однако внутренняя мембрана мито¬
хондрии непроницаема для НАДН. Эта проблема решается
благодаря существованию челночных систем. В малат/аспар-
татной челночной системе электроны и протоны переносятся
с НАДН на малат, в глицерофосфатной челночной систе¬
ме — на глицерол-3-фосфат.
Малат/аспартатпая челночная система. Цитозольная малат -
дегидрогеназа переносит электроны и протоны с НАДН на
оксалоацетат, образуя малат. Транслоказа дикарбоновых кис¬
лот переносит малат в митохондрию, взамен транспортируя
в цитозоль а-кетоглутарат. Митохондриальная малатдегидро-
геназа переносит электроны и протоны с малата на НАД+ с
образованием оксалоацетата и НАДН. НАДН окисляется в
дыхательной цепи и обеспечивает синтез 2,5 молекул АТФ.
Для завершения цикла оксалоацетат в реакции трансамини-
рования превращается в аспартат, который выходит в цито¬
золь и там превращается в оксалоацетат.
Глнцерофосфатпая челночная система. Цитозольный фер¬
мент глицерол-3-фосфатдегидрогеназа переносит электро¬
ны и протоны с НАДН на дигидроксиацетонфосфат. При
этом образуется глицерол-3-фосфат. Расположенный во
внутренней мембране митохондрии фермент глицерол-3-
фосфатдегидрогеназа переносит электроны и протоны от
глицерол-3-фосфата на свою простетическую группу ФАД.
Образовавшийся ФАДН2 передает протоны и электроны е
дыхательную цепь, что обеспечивает синтез 1,5 молекул АТФ.
В этой реакции снова образуется дигидроксиацетонфосфат, и
оборот цикла завершается.
Глюкоза
Гликолиз
Цитозоль
Глюкозо-6-
фодфат
Фруктозо-
6-фосфат
АТФ
>осфофруктокиназа -1
Фруктоао-1,6-
бисфосфат
Дигидроксиацетонфосфат
сн2он
Дигидроксиацетонфосфат
illllfllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllll НАД Н+Н+<
^Оксалоацетат
НАДН+Н+
Малат-
дегидрогеназа
НАД+-
Малат/
аспартатная
челночная
система
Сукцинат*
Дыхательная цепь
Рнс. 16.2. Малат/аспартатная челночная система и глицерофосфатная челночная система переносят восстановленные эквивалент
из цитозоля в митохондрии
Аэробное окисление глюкозы для получения энергии в виде АТФ
4
Ф Анаэробное окисление глюкозы:
гликолиз с образованием АТФ и лактата
Гликоген
гликоген
(г»— 1 остаток
глюкозы)
Деветвящий формент
I — Гликозилтрансфораэа
U — а-( 1 пюкозндаза
I Фосфоглюкомутаза
Глюкоза
Гликолиз
Гексокиназа
или глюкокиназа '<
АТФ в печени) ад^Ф
ээ\
Глюкозо¬
б-фосфат
фруктозо-
б-фосфат
\ АТФ
■ Фосфофруктокиназа- 1
Г
АДФ
Фруктозо-1 ,б-
бисфосфат
АльдолазаА
Дигидрокси-
ацетонфосфат
НАДН-*Н+ <■
НАДН*Н+ <-
1,3-бисфосфоглицерат ^
(2 молекулы) Ев
АДФ ^ | |Д- адф
[ 3-фосфоглице-
\раткина за
АТФ
АТФ
3-фосфоглицерат
(2 молекулы)
Поступает в глю-
конеогенез в пе¬
чени (цикл Кори)
н
2-фосфоглицерат
(2 молекулы)
Анаэробные
условия, вслед¬
ствие чего
НАДО не может
окисляться
в реакциях
дыхательных
путей
Фосфоенолпируват
(2 молекулы) VI
адф -^| адф ti
Т Пируваткиназа
АТФ
сосг
I
неон
I
сн3
Y
НАД+ НАДН+Н+
А А
АТФ
Лактат*^
(2 молекулы)
Лактатдегидрогеназа
Пируват
(2 молекулы)
Рис. 17.1. Анаэробный метаболизм глюкозы и гликогена с обра¬
зованием АТФ
Анаэробный гликолиз
При отсутствии кислорода (т.е. в анаэробных услови:
из глюкозы можно получить 2 молекулы АТФ (рис. 17.
Однако сначала потребуется израсходовать АТФ в гек<
киназной и фосфофруктокиназной реакциях (табл. 17.
Фруктозо-6-фосфат в итоге расщепляется на 2 моле!
лы глицеральдегид-3-фосфата, которые затем окисляк
ся глицеральдегид-3-фосфатдегидрогеиазой с образовани
двух молекул НАДН. Две молекулы АТФ образуются в ф<
фоглицераткиназной реакции, еще две молекулы АТФ
в пируваткиназной реакции. Примечание: в аэробных усло>
ях НАДН, окисляясь в дыхательной цепи, образует HAJt <
глицеральдегид-3-фосфатдегидрогеназной реакции (следу
помнить, что НАДН и НАДД представлены в клетке в небо
ших количествах и всегда должны рециклировать). Однакс
аиаэробпых условиях НАДН используется лактатдегидроге1
зой для восстановления пирувата, а образовавшийся НА
снова используется глицеральдегид-3-фосфатдегидрогеиаз<
В лактатдегидрогеназной реакции образуется лактат, кот
рый с током крови транспортируется в печень и поступав
цикл Кори, где из него в ходе глюконеогенеза синтезирует
глюкоза (рис. 17.2).
Обратите внимание, что когда источником глюкозо
фосфата выступает гликоген, общий выход АТФ в анаэрс
ном гликолизе составляет 3 молекулы (табл. 17.2)
Таблица 17.1. При анаэробном гликолизе из одной молекулы
глюкозы образуются 2 молекулы АТФ
^ Выход АТФ при анаэробном окислении глюкозы до лактата
Реакция
НАДН или
фадн2
Выход
АТФ
П Гексокиназа (или глюкокиназа в печени)
-1
Я Фосфофруктокиназа-1
-1
Я З-Фосфоглицераткиназа
2
П Пируваткиназа
2
Итого
2
Таблица 17.2. При анаэробном гликолизе из одного глкжозног
остатка гликогена образуются 3 молекулы АТФ
Выход АТФ при анаэробном окислении одного глюкозного остатк;
гликогена до лактата
Реакция
НАДН или
Выход
фадн2
АТФ
Q Фосфофруктокиназа-1
-1
Я З-Фосфоглицераткиназа
2
Д Пируваткиназа
2
Итого
3
44
Анаэробное окисление глюкозы: гликолиз с образованием АТФ и лактата
aiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiii iiih^iii и
= Г ликоген
Мышцы
Глюкоза
Образованный в мышцах
лактат поступает в печень
Лактат-
Пируват
Образованная в печени глюкоза|
поступает в мышцы
Печень
Глюкоза-
Глюконеогенез
■Jlllllllllllllllllllllllllllllllllllllltfi
▼ 1
Лактат ► Пируват =
JJ
7IIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIII IIIII^HI llllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllllffi
Рис. 17.2. Цикл Кори. В мышцах глюкоза преобразуется в лактат. Лактат поступает в печень, где снова превращается в глюкозу
глюкоза снова поступает в мышцы
Метаболизм лактата: цикл Кори
Лактат постоянно образуется из глюкозы в процессе анаэроб¬
ного гликолиза в эритроцитах, сетчатке и мозговом веществе
почек. Этот лактат снова превращается в глюкозу в цикле
Кори. Лактат переносится в печень и превращается в глю¬
козу в процессе глюконеогенеза. Образование глюкозы из
лактата требует затраты 6 молекул АТФ (см. гл. 32). Если
из-за поражения печени цикл Кори блокируется, в
низме накапливается лактат и развивается гиперлакта
Гиперлактатемия часто протекает бессимптомно, и этс
ма распространенное состояние, не представляющее
зы для жизни. Лишь в редких случаях развивается оп
лактацидоз, с которым не справляются буферные си
организма.
Анаэробное окисление глюкозы: гликолиз с образованием АТФ и лактата
ф
Анаэробный гликолиз глюкозы в эритроцитах,
2,3-БФГ и эффект Бора
Глюкоза
^шао-6-
фосфа
' Гексокиназа\
АТФ
Гликолиз
Фру1
f
Фосфоглю-
коизоме-
раза
>30-6-
АТФ
Фосфофруктокиназа-1
АДФ
фрук 030-6-
фо фат
Альдолаза А
Дигидрокси-
ацетонфосфат
Триозофос-
фатизомераза
1
Глицеральдегид-
” 3-фосфат
НАД+ -
НАД+ -
НАДН+Н+^
НА^Н+Н+^“
Гпицеральдегид-3-
фосфат дегидро¬
геназа
1,3 - бисфосфоглиц ера т
(2 молекулы)
АДФ—.В Ш, АДФ
АТФ
1-фосфоглице-
уаткиназа
АТФ
3-фосфогли-
церат
СОСГ
I
НООН
1
сн.
АТФ
ч и-
фосфо
церат
Н
2-фосфогли-
церат
I |Ено.
фоенолпир)
2 молекулы
4|
Фосфоенолпируват
(2 молекулы)
АДФ
Пируват-
киназа
АТФ
Фторид ингибирует
гликолиз и поэтому
используется как
консервант проб
крови при опреде¬
лении содержания
глюкозы
НАД
+ *
Лактат Ц*
(2 молекулы)
Лактатдегидрогеназа
СОО-
I
с=о
I
СН3
— Пируват
шш (2 молекулы)
Рис. 18.1. Анаэробный гликолиз в эритроцитах
Рис. 18.2. Образование 2,3-бисфосфоглицерата в эритроцитах
Эритроциты транспортируют большое количество кислорода,
которым снабжают все органы человека. По иронии судьбы
сами они не могут использовать этот кислород. Источником
энергии для эритроцитов служит глюкоза, при окислении
которой в ходе анаэробного гликолиза в эритроцитах образу¬
ется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритро¬
цитах невозможно, так как в них отсутствуют митохондрии и
вместе с ними все ферменты цикла Кребса. Кроме того, в них
отсутствуют также ферменты, необходимые для окисления
жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем
органам и тканям организма. Гемоглобин эритроцитов
прочно связывается с кислородом, образуя оксигемоглобин
Однако в периферических тканях эритроциты должны отдатв
этот кислород другим клеткам. Это осуществляется благодаря
явлению, известному под названием эффекта Бора. Эффект
Бора создается благодаря двум факторам: протонам и 2,3-
бисфосфоглицерату (рис. 18.2).
1. Протоны вытесняют кислород из оксигемоглобина
Работающим мышцам необходим АТФ, и поэтому в ню
46
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора
о Углеводы
бсн2он
н он
ос-о-Глюкоза
н -с= о
2*
н - С - ОН
з1
ь но-с-н
- 41
н -с-он
51
н - с - он
I
бсн2он
бсн2он
н он
о-Глюкоза (3-о-Глюкоза
(ациклическая форма)
36%
а-Аномер
4i
н-с-он
51
н - с-он
( I
Чбсн2он
(З-Аномер
Номенклатура: что такое D-, L- и d-, I- углеводы
Первые исследователи химии углеводов описывали их структурные различия
по оптической активности (способности вращать плоскость поляризованного
света по часовой стрелке или против нее). Они обнаружили, что глюкоза
вращает плоскость поляризации света вправо, а фруктоза - влево. Это
свойство стали отображать в названии углеводов буквами «d» (правовраща¬
ющие, от лат. dexter— правый) и «I» (левовращающие, от лат. laevus —
левый). Впоследствии было установлено, что асимметричный атом С5 и
d-глюкозы, и 1-фруктозы находится в D-конфигурации (D заглавная), т.е.
ОН-группа расположена с правой стороны от С5. Поэтому буквы «d» и «I»
вышли из употребления; вместо них для описания оптической активности
стали использовать знаки «+» и «-».
Глюкоза
В природе глюкоза существует в форме D-глюкозы. Этот энантиомер также
называют декстрозой, что нередко приводит к путанице: так, при внутривен¬
ных вливаниях врачи часто называют глюкозу декстрозой, а при анализе
крови измеряют концентрацию «глюкозы крови». Даже в одной медицин¬
ской статье могут употребляться оба термина!
Когда глюкоза растворяется в воде, она подвергается мутаротации и может
существовать как в виде циклических форм, так и в виде молекул с линей¬
ной структурой. Почти все молекулы глюкозы в растворе принимают одну
из двух циклических форм: 36% процентов глюкозы находится в форме
а-0-глюкозы, a 64% — в форме (3-0-глюкозы. Эти формы различаются
положением ОН-группы относительно аномерного атома углерода С1.
У а-аномера ОН-группа направлена вниз, у (3-аномера — вверх. Ацикличе¬
ская промежуточная форма (с линейной структурой) составляет лишь
0,003% всей глюкозы в растворе.
Если белки организма долгое время подвержены воздействию высокой
концентрации глюкозы, происходит гликозилирование белков, при котором
нарушаются их структура и функции. Этот эффект определяет токсичность
глюкозы. Гликозилирование белков — причина многих осложнений
сахарного диабета (см. гл. 33).
6СН2ОН о_
он
%
СНгОН
(3 45-Фруктоза
(пиранозная форма)
(З-о-Фруктоза
(фуранозная форма)
1
сн.он
i 2
2С = 0
з'
но-с-н
н-с-он
5 I
н-с-он
6СН2ОН
D-Фруктоза
(ациклическая форма)
а-о-Фруктоза
(пиранозная форма)
бсн2он 0>
1
СН2ОН
*
он
ос-о-Фруктоза
(фуранозная форма)
Природную фруктозу (о-фруктозу) называют также устаревшим
названием «левулоза». Как и глюкоза, в растворе она существует
в а- и (3-формах, которые, в свою очередь, могут обратимо принимать
пиранозную (шестичленный цикл) и фуранозную (пятичленный цикл)
формы. Фосфаты фруктозы существуют в фуранозной форме.
Инулин. Некоторые растения запасают полимер фруктозы — инулин
(только не путайте его с инсулином). Это питательное вещество, анало¬
гичное крахмалу. Инулин содержится в репчатом луке, луке-порее,
бананах; особенно богаты инулином клубни топинамбура (Helianthus
tuberosus). Инулин плохо переваривается и иногда вызывает метеоризм.
Но в этом есть и свои плюсы: клиренс инулина — «золотой стандарт»
измерения скорости клубочковой фильтрации, так как после внутривен¬
ного вливания инулин полностью выводится с мочой.
Рис. 19.1. Номенклатура углеводов
Рис. 19.2. Строение фруктозы
Рис. 19.3. Гликоген
48 Углеводы
Амилоза
Растения обычно запасают углеводы в виде крахмала. Крахмал — полимер
глюкозы, состоящий из амилозы и амилопектина. Амилоза представляет
собой цепочку из остатков глюкозы, объединенных а-(1->4) связью.
В амилопектине некоторые глюкозные остатки объединяются связью а-(1->6),
благодаря чему возникают точки ветвления. При употреблении крахмала
с пищей он расщепляется а-амилазой слюны и а-амилазой поджелудочной
железы. Линейные участки расщепляются с образованием дисахарида
мальтозы, а остатки глюкозы в точках ветвления, связанные
а-(1—>6) — изомальтозы.
Рис. 19.4. Крахмал
н он
Лактулоза
Лактулоза — синтетический ди¬
сахарид, состоящий из галакто¬
зы и фруктозы. Это легкое сла¬
бительное средство. Помимо
того что лактулоза вызывает
разжижение стула, она также
подкисляет содержимое тол¬
стой кишки и поэтому удаляет
аммоний из крови при печеноч¬
ной недостаточности.
н
4 о
н-с = о
1
сн9он
1 2
\н
н-с-он
н-с=о
К Л
но-с-н
но-с-н
но\ он н /он
н-с-он
н-с-он
з| К
сн2он
сн2он
н он
D-Ксилоза
D-Ксилоза
Ксилулоза
(циклическая
(ациклическая
форма)
форма)
D-Ксилоза содержится
в зернах и фруктах
Это пентоза,
которая по строению сходна с близкой ей гексозой —
глюкозой. После всасывания практически вся D-ксилоза
выводится в неизмененном виде, поэтому проба
на толерантность к ксилозе используется при
диагностике нарушения всасывания в кишечнике.
Примечание: ксилоза относится к альдозам, ксилулоза — к кетозам.
он н
(З-2-Дезокси-
D-рибоза
Рибоза — пентоза рибонуклеиновой
кислоты (РНК)
Дезоксирибоза входит в состав
дезоксирибонуклеиновой кислоты (ДНК).
Это производное рибозы, в которой
гидроксильная группа у второго атома углерода
замещена атомом водорода.
Рис. 19.5. Лактулоза
Рис. 19.6. D -ксилоза и ксилулоза
Рис. 19.7. Рибоза и дезоксирибоза
6СН20Н н он
Трегалоза
Трегалоза была обнаружена в куколках жука Trehala
manna. Полагают, что это и есть манна небесная из
известного библейского сюжета. Трегалоза — дисаха¬
рид из 2 молекул глюкозы, объединенных а-1-связью.
Именно она придает сладкий вкус манне. Трегалоза
содержится в гемолимфе насекомых и в грибах. Это
вещество стабилизирует третичную структуру белков
(см. гл. 8), не позволяя им денатурировать при обезво¬
живании. Например, содержащая трегалозу селагинелла
чешуелистная (Selaginella lepidophylla) может несколько
лет находиться в полностью высушенном состоянии, но,
если ее размочить водой, она расправится и зазеленеет.
Это свойство трегалозы используется для хранения
белков — гормонов и антител.
СН„ОН
I 2
неон
I
носн
I
неон
I
неон
сн2он
сн2он
носн
неон
сн2он
носн
носн
н-с-он
неон
носн
но-с-н
неон
неон
н-с-он
сн2он
сн2сн
сн2он
Сорбитол Маннитол Галактиол
Спирты углеводов — многоатомные спирты (полиолы)
Ксилитол
Сорбитол
Ранее больные диабетом использовали вместо сахара сорбитол.
Однако сейчас считается, что сорбитол не полезен.
Маннитол при внутривенном вливании является мочегонным средством.
Галактитол накапливается в организме при галактоземии.
Ксилитол — спирт ксилозы; его добавляют в жевательную резинку
в качестве подсластителя, предупреждающего развитие кариеса.
Рис. 19.8. Трегалоза
Рис. 19.9. Спирты углеводов
Углеводы 49
Всаоывание углеводов. Метаболизм галактозы
Очсм 0>)CN OHtW
OHtW
iC^iOu<D^
Амилоза
Амилопектин
Гликоген
т
Крахмал
а-Амилаза
(фермент слюны
и панкреатического сока)
Мальтоза и изомальтоза
Это дисахариды глюкозы.
В мальтозе остатки глюкозы
объединены ct-(1—>4) связью,
в изомальтозе — а-(1 -»6)
связью
Ингибиторы а-глюкозидазы
Акарбоза (прекоза) и миглитол (глизет) ингибируют а-глюкозидазу. Эти
лекарства назначаются больным сахарным диабетом II типа. Они увеличивают
время переваривания поступающего с пищей крахмала, поэтому повышение
содержания глюкозы в крови после приема пищи происходит медленнее
и выражено не так сильно
Сахароза
Сахароза состоит из остатков глюкозы и фруктозы, объеди¬
ненных <х-(1 —>2) связью. Сахароза содержится в растениях,
например в сахарном тростнике и фруктах
Лактоза
Лактоза состоит из остатков галактозы
и глюкозы, объединенных |3-(1->4) связью.
Ее еще называют молочным сахаром
бСНгОН
6СН2ОН
бСНгОН
iCHjOH
н ОН н он
Мальтоза
Мальтаза
Сахараза/
изомальтаза
н он
Изомальтоза
I
р-о-галактоза
а-о-глкжоза
Сахароза
D-Лактоза
Недостаточность
сахаразы/изомальтазы
Сахараза/изомальтаза
т
Недостаточность лактазы
Лактаза — фермент щеточной каемки (микроворсинок) знтеро-
цитов тонкого кишечника. При недостаточности лактазы лактоза,
поступающая в организм с пищей, не расщепляется, что вызы¬
вает метеоризм и диарею. Выделяют первичную недостаточность
лактазы взрослых, вторичную недостаточность лактазы и врож¬
денную недостаточность лактазы (встречается реже всего).
Первичная недостаточность лактазы взрослых наследуется по
аутсомно-рецессивному типу. Она развивается из-за снижения
активности лактазы, обычно после отлучения ребенка от груди,
и встречается и у подростков, и у взрослых. В странах Северной
Европы недостаточность лактазы встречается только у
15% европейцев, но в некоторых этнических группах ее частота
достигает 50-100%.
Вторичная недостаточность: развивается из-за поражения
щеточной каемки знтероцитов при заболеваниях тонкого
кишечника.
Врожденная недостаточность: встречается в очень редких
случаях, лактаза полностью отсутствует.
Лактаза
бСНгОН
бСНгОН о
(3-о-Глюкоза
Рис. 20.1. Всасывание углеводов
(З-о-Фруктоза
р-о-Галактоза
50
Всасывание углеводов. Метаболизм галактозы
I
Галактоцереброзид -
один из липидов
головного мозга
Галактоцереброзид
Галактитол
Гликоген
Гликоген (п - 1
остатков глюкозы)
Олигосахарид
[п+1 остатков глюкозы Глтоген-
с а-(1-»4)свяаью^^^а'аза
УДФ-глюкоза
Олигосахаридная
затравка [п остатков глюкозы
с а-(1—>4) связью]
Пирофосфатаза
Гликогенез
Глюкозо-
УДФ-глюкоэо-
пирофосфорилаза1
УТф *>
Деветвящий фермент
(олигосахаридтрансфераза)
Глюкоза
гексокнназа
1 -фосфат
ia) *
I Фосфоглюкомутаза
Глюкозо¬
б-фосфат
п
VOKQ- I
" 1
фрук 030-
Цитозоль
б-фо
фат
Пентозо-
фосфатный
путь
Гликолиз
Метаболизм галактозы
Галактоза поступает в наш организм при употреблении в пищу
лактозы — дисахарида, состоящего из галактозы и глюкозы
(рис. 20.1). В тонком кишечнике лактоза (молочный сахар)
гидролизуется ферментом лактазой с образованием галактозы
и глюкозы, которые прямо поступают в печень по воротной
вене печени. Далее галактоза может вступать в те же мета¬
болические пути, что и глюкоза. Сначала галактокиназа фос-
форилирует галактозу с образованием галактозо-1-фосфата.
Затем из галактозо-1-фосфата и УДФ-глюкозы образуется
глюкозо-1-фосфат и УДФ-галактоза. Эту реакцию катализи¬
рует галактозо-1-фосфатуридиятрансфераза. Эпнмераза пре¬
вращает УДФ-галактозу в УДФ-глюкозу, из которой также
может образовываться глюкозо-1-фосфат. Далее глюкозо-1-
фосфат либо вступает в метаболический путь синтеза гли¬
когена, либо превращается в глюкозо-6-фосфат и вступает в
реакции гликолиза или же пентозофосфатного цикла.
Нарушение метаболизма галактозы
Недостаточность галактозо-1-фосфатурнднлтрансфсразы —
редкое наследственное заболевание, при котором развива¬
ются галактоземия и галактозурия. Обычно оно проявляется
вскоре после рождения. У ребенка наблюдается рвота, он
плохо прибавляет массу тела. Без лечения возможно развитие
катаракты, цирроза печени и умственной отсталости. Болезнь
наследуется по аутосомно-рецессивному типу.
Сходные симптомы развиваются при недостаточности
галактокиназы. В обоих случаях в тканях организма накапли¬
вается галактоза, которая восстанавливается альдозоредукта-
зой в галактитол.
Чтобы болезнь не прогрессировала, необходимо исклю¬
чить из рациона продукты, содержащие галактозу и лакто¬
зу (не путайте эти заболевания с ненерсноснмостью лактозы,
обусловленной недостаточностью лактазы, рис. 20.1).
СНгСН
Сукралоза
Рис. 20.3. Сукралоза — недавно разработанный сахарозаме-
нитель. Она синтезируется из сахарозы путем замещения трех
гидроксильных групп атомами хлора. Считается, что сукралоза
плохо всасывается и не метаболизируется в организме
Рис. 20.2. Метаболизм галактозы
Всасывание углеводов. Метаболизм галактозы
51
Галактоцереброзид
один из липидов
головного мозга
Г алактоцереброзид
Из пентозофосфат-
ного пути
Недостаточность
галактозо-1 -фос-
фатуридилтранс-
феразы
Церамид
н-с=о
I
неон
I
носн
I
НОСН I
I
неон
I
СНо0Н
Г л икозаминогл иканы
Гликопротеины
АТФ
V
АДФ
/ .
Галактозо-
1 - фосфатуридил-
трансфераза
Лактоза
t
Галактокиназа
Г алактозо-
1-фосфат
7
Галактсза
НАДФН+ Н+-
Альдозо-
редуктаза
!
НАДФ
Недостаточность
галактокиназы
т
УДФ-
галактоза
Эпимераза
V
СН-ОН
I 2
неон
i
носн
I
носн
I
неон
I
сн,он
Галактитол
Гликоген
ф„
Гликоген (п - 1
остатков глюкозы)
Глюкозо-
1 -фосфат
УДФ -глюкоза-^ittiiiiiiiiiiiiiiiiin УДФ-глюкоза
: iiiiiiiiiiiiiiiiiiiiiiiiiiiiiiinig
IIIIIIIII^IIIIIIIIIIIIIIIIIL z.
Олигосахарид
[П+1 ОСТатКОВ ГЛЮКОЗЫ Гликоген-
с а-(1-^4)свяаью^синтаза
УДФ-глюкоза
Олигосахаридная
затравка [п остатков глюкозы
с а-(1-»4) связью]
Пирофосфатаза
Гликогенез
Глюкозо-'
УДФ-глюкозо-
пирофосфорилаза J
УТФ ч
^ * 1 -фосфат
Деветвящии фермент кг
(олигосахаридтрансфераза)
~ Фосфоглюкомутаза
Глюкоза
^ Глюкокиназа,
гексокиназа
АТФ
I
АДФ
ЦитШоль
Глюкозо-
6-фосфат
Фосфоглюкс- I
изомераза I
Фрук 030-
6-фо фат IПентоз
Пентозо-
фосфатный
путь
Гликолиз
Метаболизм i
Галактоза посту]
лактозы — диса
(рис. 20.1). В т<
гидролизуется 4
и глюкозы, коте
вене печени. Д:
болические пуп
форилирует тал
Затем из галак
глюкозо- 1-фосф
рует галактозо-
вращает УДФ-i
может образовь
фосфат либо В(
когена, либо щ
реакции гликол
Нарушение м
Недостаточное
редкое наследс
ются галактозег
вскоре после р
плохо прибавля
катаракты, цир]
наследуется по
Сходные си
галактокиназы.
вается галактоз
зой в галактитс
Чтобы боле:
чить из рациог
зу (не путайте
обусловленной
Рис. 20.3. Сук]
нитель. Она си]
гидроксильных
плохо всасывает
Рис. 20.2. Метаболизм галактозы
Метаболизм глюкозы в печени: гликогенез и липогенез
Инсулин активирует гликогенсинтазу и стимулирует
синтез гликогена из глюкозо-6-фосфата
Инсулин
Олигосахарид
Гп+1 ос
©
Гпикогенсинтаза
Гликоген
Урилрндифос»
фашлюкоза
Гликогенез
Глюкоза
Гпюкокиназа
(в печени)
Глюкозс(1 -фосфат
Фосфоглюкомутаза
Глюкозо-
/ Гексокиназа\ 6-фОСфЭТ
at<»(в мышцах) адф
Высокие концентрации АТФ
и цитрата ингибируют фосфо-
фруктокиназу-1, и в клетке
накапливается глюкозо¬
б-фосфат
Фруктозо-
6-фосфат
Фруктоза- »
/ ,6-бисфосфатаэа
Фосфоглюкоиэомераза
©
АТФ
&
Фосфофруктокиназа-1
<
Цитрат
Дмгидвокси-
и.
АДФ
ФруКТОЗО-
бисфосфат
ацетонфосфат тртзофосфат-
изомераза НАДн
^Глииеоа
Г ЛИКОЛИЗ
3-фффат
Ф„
НАДН+Н+<
1,3-бисфо(
АДФ^-^
АТФ*~"
3-фосфоглицерат
2-фосфоглицерат
н20«—"
Фосфоенолпируват
АДФ^—^
АТф«-
фоглицерат
Фосфоглице-
раткиназа
Фосфоглицеромутаза
Пируваткинаэа
Пиру|ват
Ацетил-КоА
нр
У
IT 7^
/ Малатдвгидрогеназа
НАД+
> Оксалоацетат
2 молекулы
НАДН+Н+
^—
/ Цитрат- Л
( синтаза X
Синтез гликогена из глюкозы
Когда после периода голодания следует прием пиши, печень
восполняет запасы гликогена. Этот процесс стимулируется
инсулином (рис. 21.I). Сходным образом происходит синтез
гликогена в мышцах. Глюкоза в процессе пищеварения обра¬
зуется при переваривании крахмала и дисахаридов — сахаро
зы, галактозы и т.п. Регуляция гликогенеза описана в гл. 27,
Образование жиров (триацилглицеролов)
из глюкозы
Когда запасено достаточное количество гликогена, избыточ¬
ная глюкоза под влиянием инсулина превращается в триа-
цилглиперолы (рис. 2I.2). Триацилглицеролы не запасаются
в печени [если же это происходит, то наблюдается ожирение
печени (жировой гепатоз). Так, ради получения деликатеса
фуа-гра несчастных гусей кормят насильно, что приводит к
жировому гепатозу]. В норме триацилглицеролы включаются
в состав липопротеинов очень низкой плотности и транс¬
портируются из печени в жировую ткань, где и происходит
запасание жиров (см. гл. 40).
Цитрат
[Ци< 1КОнитат]
Фумарат
*
фадн2*-^
ФАД.
Цикл Кребса
Сукцинат -
дегидрогеназа
НАДН ингибирует изоцитрат-
дегидрогеназу, что приводит
к накоплению цитрата
а-Кетоглутарат-
У
Сукминят .. Сукцинил-КоА-синтегаза^ дегидрогеназа „
у 4 * —Сукцинил-КоА^ —— а-Кетоглутар,
НАДН+Н+
'СОг 2 молекулы
Когда энергетические
потребности клетки удов¬
летворены, в ней накап¬
ливаются АТФ и НАДН
НАДН+1^
)02 АДФ
Дыхательная цепь
►атф
Гл
сг
L
Ф>
Сук
Рис. 21.1. Превращение глюкозы в гликоген печени
52 Метаболизм глюкозы в пе
погенез
I
Олигосахарид [п+1
УДФ пгтатрк гпюкпаы щ
4) связями]
Гликоген
Олигосахаридная затравка
[п остатков глюкозы
с а-(1-»4) связями]
Синтез гликогена
продолжается до
полного восстанов¬
ления его запасов
Гликогенез
Глюкозо-6-
фосфзтде-
HjO
Глюкозо - гидрогеназа 6 -фос фоглюконо
6-фосфоглюконат-
дегидрогеназа
СОг
21
Рибозо-
5-фосфат
6-4
люкоза
Глюкозо;
7 Гпаюютаэа 6-фОСфЭТ
АТФ ДДф А
\
о-лактон
НАДФ" НАДФН+Н-*
А
Фруктозе-
6-4|осфат 4
Фруктозо-2,6-бисфосфат
снимает ингибирующее влияние
цитрата и АТФ на фосфофрук-
токиназу-1 (см. гл. 31,32).
Фруктсзо-2,6-бисфосфат
синтезируется в печени в ответ
на сигнал инсулина
фруктозо- •<-
Фи^Х
Фруктоза- \
1-бисфос-
фатвэа )
н-о-^
6-фрсфат <
АТф @| АТФ + цитрат
Пентозофосфатный
путь
—7 ^
НАДФ * НДДфН+Н*
А
Т
Тронскетолаза
Фосфофруктокиназа -1
К*
►адф@
Фрук гозо-
1,6-бис фосфат
Фруктозо-2,6-
бисфосфат
Дигидрокси-
ацетонфосфат
Глицеос
Гликолиз
НАД" -
НАДН+Н+<
1,3-бисфосфоглицерат
АДФ -
АТФ4-
3-фосфоглицерат
2-фосфоглицерат
н2о 4-
Фосфоенолпируват
АДФ -
АТФ
iaj дегид-
>о фат 4-
' (тиамин-
пирофосфат)
Эритрозо-
4-фосфат
Седогептулозо- t
Фруктозо-
‘ 6-фосфат 4
7-фосфат
Глицеральдегид-
3-фосфат
Ксил >зо-
5-фо ;фат
(тиамин-
пирофосфат)
Транскетолаза
Если глюкозо-6-фосфат не
используется для синтеза
гликогена, он поступает
в пентозофосфатный путь.
В пентозофосфатном пути
образуется НАДФН, необ¬
ходимый для синтеза
жирных кислот
Риб эзо-
5-фс сфат
Синтез жирных
кислот
Ацетил-
КоА
Ацетоацетил-АПБ
С4
Г7
Ацилперено-
сящий белок
Малонил-АПБ
KoA-SH
k KoA-SH
$-Кетоацил-АПБ-
синтазз (конден¬
сирующий фермент)
Малонил-КоА
Жирные кислоты обра¬
зуют сложные эфиры
с глицерол-З-фосфатом
-триацилглицеролы.
Триацилглицеролы
выводятся из печени
в составе ЛПОНП
и транспортируются
в жировую ткань
Ацил-КоА с
длинным ациль¬
ным остатком
Циклический АМФ
НАДФН+Н* НАДФ*
Пируват*
Малонил-КоА
Н^АДФ+Фн4^ A Q
© ^Ацетил-КоА-
0 (биотин) I карбокси- 0
НСОэ~+АТФ -'I
Ацетил-Ко А©
А
А :
Глюкагон
Инсулин
Цитрат
Этерификация
Пальмитат
I Малатдегид-
./Малат jрогеназа^ Оксалоацетат^
Наружная мембрана митохондрии
Внутренняя мембрана митохондрии
! Певнс
4Hli
ПереМсчик
i Ajyi
та}
тоикарбонщых кислот.
АТФ
Пируваткарбоксилаза
АДФ+ФИ-
НСОг
(биотин)
Малат4-
гг
НАД*
НАДН+Н"
НгО-
^4 АДФ+Фн
Цитратлиаза
■ АТФ
- KoA-SH
Пируватдегидрогеназа@) ИНСуЛИН I I мтпат
Глицеролн
3-фосфат
Триапаль-
митин
(триацилглицерол)
1
Пальмитат
KoA-SH
KoA-SH
*
©
Пальмитоил-КоА
4т
ПФМ+АМФ АТФ
1 Сиитетаза ацил-КоА с длинным ацильным остатком |
НАД"
НАДН+Н+
Оксалоацётат ^
нр
KoA-SH
41Ш111111111Ш11МШШШ1Ш1-
► Цитрат
[Цис-аконитат]
н7о
Фумарат
Цикл Кребса
Сукиинат-
дегидрогеназа
KoA-SH
ФАД
Сукцинат 4—
л.
Сукцинил-КоА-
еннтегаза
Сукцинил-КоА 4-
ч-Кетоглутврат-
дегидрогвназа
Малонил-КоА ингибиру
ет к а р н нтинпальмитоил-
трансферазу наружной
мембраны. Это приводит
к блокированию карни-
тиновой челночной
системы, и образующий
ся пальмитат не может
попасть в митохондрии
для ^-окисления
(см. гл. 33,34)
■—^ Карнитинпальмитоилтрансфераза наружно^ мембраны
Пальмитоилкарнитин Карнитин
Карнитинпальмитоилтрансфераза енутреннж мембраны
KoA-SH I
Пальми-
тоил-КоА
Карнитиновая
челночная система
Изоцитрат
а-Кетоглутарат
^ НАД+
Изоцитрат-
дегидрогеназа
НАДН+Н+
НАДН ингибирует изоцитрат-
дегидрогеназу (рис. 21.1)
Рис. 21.2. Превращение глюкозы в жиры (триацилглицеролы) в печени
Метаболизм глюкозы в печени: гликогенез и липогенез 53
г г
Метаболизм фруктозы
Олигосахарид
[п+1 остаток глюкозы
с а-( 1 —>4) связями]
Активируется
под действием
инсулина
Уриянди-
фосфа-шлюкоэа
Олигосахарид
[п+1 остаток глюкозы
с а-(1-+4) связями]
ОН Н
Фруктоза
гексокиназз
Цитозоль
ГЛЮТ5
фруктоза
АТФ
фруктокиназа
АДФ
носн2 СН,ОРО?
>укт
J:
Фруктозо-
1,6-бисфосфат
Фосфоглюко-
изомераза
Фруктозо-
6-фосфат
НО/ОН
ОН Н
Фруктозо -
1 -фосфат
i
Альдолаза В
Гл и цер альдегид
АТФ
| Триозо-
1киназа
^*АДФ
Глидера ль- с
дегид-3-
фосфат
Альдолаза В
Триозофосфот-
Глицеральдегид-
^ 3-фосфат
НАД+Я
Г лицеральдегид-
3-фосфатдегид-
рогеназа
НАДН
1,3-бисфосфоглицерат
■ Фосфоглицерэ т-
, киназа
АТФ 4-^
▼
3-фосфоглицерат
Фосфоглицв-
ромутаза
Рис. 22.1. Метаболизм фруктозы в печени
он н
Фруктоза
*л£1Н1нф|||^фруктоза
ГЛУТ 5
Гексокиназа
АТФ АДФ
Цитозоль
он н
Фруктозо-
6-фосфат
Фруктозо-1,6
бисфосфатэза
н2о
Фруктозо-1,6-
бисфосфат
,РШм
ифосфа
АТФ
Фосфофругтокиназа-1
АДФ
Дигидрвющ-
ацетонфосфаТ-
Алцоолаза
ГлицвраЛдегид-
Триоэофосфатиэомераза
ицерау дет»
Гликолиз
Рис. 22.2. Метаболизм фруктозы в мышцах
Метаболизм фруктозы в норме
Метаболизм фруктозы в печени
Фруктоза — фруктовый сахар, и уже из названия ясно, что
фруктоза содержится во фруктах. Кроме того, она в соеди¬
нении с глюкозой входит в состав сахарозы, т.е. обычного
столового сахара. В кишечнике сахароза гидролизируется
сахарозой и изомальтазой, расщепляясь на фруктозу и глю¬
козу (см. гл. 20). Затем фруктоза транспортируется из кишеч¬
ника в печень, где вступает в метаболический путь, пока¬
занный на рис. 22.1. Фруктоза попадает в клетки печени с
помощью транспортера, неудачно названного переносчиком
глюкозы-5 (ГЛЮТ5). Фруктокииаза фосфорилирует фрукто¬
зу и образуется фруктозо-1-фосфат. Фруктозо-1-фосфат рас¬
щепляется на дигидроксиацетонфосфат и глицеральдегид; эту
реакцию катализирует альдолаза В. Затем глицеральдегид
фосфорилируется, превращаясь в глицеральдегид-3-фосфат,
и это вещество вместе с дигидроксиацетоифосфатом вступает
в гликолиз. В период пищеварения в печени из фруктозы
может синтезироваться гликоген и/или триацилглицеролы
(примечание: «альдолаза» также катализирует обратимое рае-
щепление фруктозо-1,6-бисфосфата на дигидроксиацетонфос¬
фат и глицеральдегид-3-фосфат, см. «Номенклатура альдолаз»,
см. гл. 18).
Метаболизм фруктозы в мышцах
Метаболизм фруктозы в мышцах показан на рис. 22.2.
Фруктоза фосфорилируется гексокиназой с образованием
фруктозо-6-фосфата. Фруктозо-6-фосфат затем используется
для синтеза гликогена, а если запасы гликогена полны, то в
энергетическом обмене (в гликолизе).
Нарушения метаболизма фруктозы
Недостаточность фруктокиназы
(идиопатическая фруктозурия)
Недостаточность фруктокиназы в печени (рис. 22.3) — редкое
заболевание, при котором фруктоза накапливается в крови
и моче. Наиболее распространена эта болезнь в еврейских
семьях. Фруктозурия неопасна для здоровья: больные имеют
нормальную продолжительность жизни. Иногда при анализе
54
Метаболизм фруктозы
Олигосахарид
ln+1 остаток глюкозы
с а-(1-+4) связями]-*
Олигосахаридная
затравка [п остатков
глюкозы с а-(1*4) связямиТ
Гликоген
Ф..
фосфорилаза
Цитозоль
он н
Фруктоза
При наследственной
непереносимости фруктозы
гликогенолиз полностью
блокируется из-за
накопления фруктозо-1-
ГЛЮТ5
‘^(iiiiiiiiiiotiiMiimiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiniii^^- фруктоза
АТФ
Фруктокиназа
кАДФ
НОСН2 сн2оро32"
Идиопатическая фруктозурия
(недостаточность фруктокиназы)
В тканях накапливается
фруктоза
Фруктозо-
1 -фосфат
0 фосфата и отсутствия Фн
Деветвящнй фермент
I) гликозилтрансфераза
2) а-( 1->6)-глюкоэидаза
Глюкоэо-6-
фосфатаэа
н,о
Эндоплазматический ретикулум
Уридииди-
фосфатглюкоза
Фрукгозо-
1,6-биофосфат
Альдолаза В
Наследственная
непереносимость
фруктозы
(недостаточность
альдолазы В)
Наследственная
непереносимость фруктозы
(недостаточность альдолазы В)
В тканях накапливается
фруктозо-1-фосфат, истощая
запасы неорганического
фосфата Фи
Дигид рокси-
ацетонфосфат
Г лицеральдегид-
3-фосфат
^Альдолаза В
НАД+«-^
н+н л
Глицеральдегид-3-
фосфатдегидрогенаэа
Г лицеральдегид
АТФ
Триозокиназа
НАДН+
1,3-бисфовфоглицерат
АДФ^
АТФ Я—^
Глицеральдегид- -лн.л
3-фосфат
З-фосфаглицерат
I Фосфоглицеромутззд
В процессе анаэробного
гликолиза (например,
в эритроцитах) постоянно
образуется лактат
->
Лактат накапливается, поскольку:
1) синтез АТФ блокируется из-за
истощения запасов Фн;
2) для глюконеогенеза требуется
альдолаза В
Рис. 22.3. Нарушения метаболизма фруктозы
I мочи фруктозу принимают за глюкозу и ошибочно диагно¬
стируют сахарный диабет.
Наследственная непереносимость фруктозы,
или недостаточность альдолазы В
Наследственная непереносимость фруктозы передается по
аутосомно-рецессивному типу. Причина этого тяжелого
заболевания — недостаточность фермента печени альдола¬
зы В (рис. 22.3). Болезнь обычно проявляется, когда ребенка
переводят с грудного молока на пищу, содержащую фрук¬
тозу. Уже в первые 20 мин после начала кормления у него
начинается тяжелая рвота, развивается гипогликемия. Из-за
накопления молочной кислоты развиваются метаболический
ацидоз и компенсаторная гипервентиляция. Без лечения
ребенок плохо прибавляет массу тела, происходит истощение
организма, а из-за постоянного повреждения печени разви¬
вается цирроз.
Болезнь развивается из-за того, что в печени после упо¬
требления в пищу фруктозосодержащих продуктов происхо¬
дит накопление фруктозо-1-фосфата. Это практически сразу
вызывает торможение метаболических путей: в частности,
гликогенолиза, глюконеогенеза и связанных с ними путей.
Накопление фруктозо-1-фосфата приводит к следующим
последствиям.
1. Истощаются запасы неорганического фосфата (Фн), из-за
чего ингибируется гликогенфосфорилаза и синтез АТФ.
2. Блокирование этих процессов нарушает образование глю¬
козы в печени и приводит к гипогликемии.
3. Накапливающийся АМФ распадается до мочевой кислоты.
Возникает гиперурикемия (см. гл. 59).
В итоге метаболизм в печени практически останавли¬
вается. Однако в других тканях (например, в эритроцитах)
продолжается анаэробный метаболизм, и в печень поступа¬
ет молочная кислота. Поскольку ее использование обычным
путем в цикле Кори невозможно (см. гл. 17), развивается
лактапидоз.
Чтобы болезнь не прогрессировала, необходимо просто
исключить из рациона продукты, содержащие фруктозу и
вещества, расщепляющиеся до фруктозы (например, сахаро¬
зу, сорбитол). У детей развивается природное отвращение к
сладкому, и в дальнейшем они избегают употреблять фрук¬
тозосодержащие продукты. У этой болезни есть и положи¬
тельная сторона: дети с наследственной непереносимостью
фруктозы не знают, что такое кариес.
Метаболизм фруктозы 55
Гомеостаз глюкозы
Фаза
всасывания
(абсорбтив-
ный период)
1
з 30
га
о
Q
с;
|_
Ct
О
X
о
га
о.
20-
Постабсорбтивный
период
II
Экзогенная глюкоза
Гликоген
Начало
голодания
III
1 1 I 1 I I I I Г
О 2 3 4 6 8 10 12 14 16 18 20 22 24 26 28 32
Часы
Сутки
ь
Источник
глюкозы крови
Экзогенная
глюкоза
Гликоген
Глюконеогенез в печени
Глюконеогенез в печени
Гликоген
Глюконеогенез в печени
и почках
Глюконеогенез в печени
и почках
Ткани, потребля¬
ющие глюкозу
Все
1
Все ткани, кроме печени.
Мышцы и жировая ткань —
на минимальном уровне
Все ткани,кроме печени.
Мышцы и жировая ткань —
на минимальном уровне
Головной мозг, эритроциты,
мозговое вещество почек в не¬
большом количестве — мышцы
Головной мозг — на мини¬
мальном уровне, эритроциты,
мозговое вещество почек
Основной источник
энергии для
головного мозга
Глюкоза
Глюкоза
Глюкоза
Глюкоза,
кетоновые тела
Кетоновые тела, глюкоза
Рис. 23.1. Скорость утилизации глюкозы на протяжении пяти фаз гомеостаза глюкозы. [Адаптировано из Ruderman N.B. Muscle amino
acid metabolism and gluconeogenesis // Annu. Rev. Med. — 1975. — Vol. 26. — P. 245-258. © Annual Reviews www.annualreviews.org. with
permission.!
Значение гомеостаза глюкозы
Нормальная концентрация глюкозы в крови натощак коле¬
блется между 3,5 и 5,5 ммоль/л. После приема пищи кон¬
центрация глюкозы резко возрастает примерно до 9 ммоль/л,
но через 2 ч она возвращается к прежнему уровню.
Примечательно, что даже при длительном голодании или при
энергичной физической нагрузке уровень глюкозы в крови
не опускается ниже 3,5 ммоль/л. Так, даже у спринтеров и
марафонцев, несмотря на резкое увеличение потребления
глюкозы мышцами, в крови поддерживается нормальный
уровень глюкозы. Если бы не эта замечательная способность,
то при снижении концентрации глюкозы в крови головной
мозг лишился бы своего источника энергии — глюкозы и
наступила бы смерть.
Предотвращение гипогликемии:
основные положения
1. Лучший источник энергии для головного мозга — глюко¬
за. Если уровень глюкозы в крови падает (это состояние
называется гипогликемией), головной мозг лишается свое¬
го источника энергии. Снижение уровня глюкозы в голов¬
ном мозге (нейрогликопения) приводит к потере созна¬
ния, коме, повреждению нервных клеток и неизбежному
летальному исходу.
2. Из гликогена печени можно быстро получить глюкозу. В пер¬
вые несколько часов голодания выделяется гормон глю-
кагон, под влиянием которого происходит расщепление
гликогена печени до глюкозы. Благодаря этому поддержи¬
вается нормальная концентрация глюкозы в крови (приме¬
чание: мышечный гликоген используется только мышцами).
56
Гомеостаз глюкозы
3. Головной мозг не может иснользовать жирные кислоты в
качестве источника энергии. Жирные кислоты в крови
связаны с альбумином: только так они могут транспорти¬
роваться в водной среде. Но этот белок слишком велик,
чтобы преодолеть гематоэнцефалический барьер.
4. Головной мозг может использовать кетоновые тела в каче¬
стве источника энергии. Если человек не ест больше двух
дней, головной мозг адаптируется к использованию кето¬
новых тел в качестве источника энергии. Запомните: при
голодании в печени из жирных кислот образуются кетоно¬
вые тела.
5. Мышцы и другие ткани служат источником глюкозы. Во
время голодания белки тканей распадаются до аминокис¬
лот, происходит атрофия тканей. В печени из гликогенных
аминокислот в ходе глюконеогенеза образуется глюкоза
(см. гл. 46), а из кетогенных аминокислот — кетоновые
тела. Некоторые аминокислоты являются одновременно и
гликогенными, и кетогенными.
6. Глюкоза не может образоваться из жирных кислот. К сожа¬
лению, нз жирных кислот нельзя получить глюкозу (см.
гл. 34). Таким образом, когда кончаются запасы глико¬
гена, главными субстратами синтеза глюкозы в процессе
глюконеогенеза становятся аминокислоты, образующиеся
при распаде тканей.
Опасные последствия гипергликемии
Без лечения у больных сахарным диабетом концентрация глю¬
козы в крови нередко повышается до 20 ммоль/л (гиперглике¬
мия), а в некоторых случаях даже до 60 ммоль/л. Хотя глюкоза
является важным источником энергии, повышенная концен¬
трация глюкозы в крови нежелательна по ряду причин.
1. Осмотический эффект. При высоком содержании глюкозы
в крови существенно возрастает осмотическое давление
крови. Это приводит к диффузии воды из клеток в кровь
и усиленному выведению воды почками. В результате про¬
исходит дегидратация тканей; если же происходит обезво¬
живание клеток головного мозга, человек впадает в кому.
2. Гликозилирование белков. При умеренном повышении кон¬
центрации глюкозы в крови происходит неферментатив¬
ное гликозилирование свободных остатков аминокислот
клеточных и внеклеточных белков. Гликозилирование бел¬
ков — причина развития хронических осложнений сахарно¬
го диабета: нейропатии, нефропатии и ретинопатии.
3. Образование АФК. Есть данные, что гипергликемия вызы¬
вает образование АФК (см. гл. 15). АФК повреждают струк¬
туру липидов, белков и ДНК, поэтому предполагается, что
АФК играют роль в развитии осложнений диабета.
Пять фаз поддержания гомеостаза глюкозы
На рис. 23.1 показано, как в норме изменяется уровень глю¬
козы в крови после приема пищи и в процессе 40-дневного
голодания. В зависимости от источника образования глюко¬
зы в крови можно выделить 5 фаз.
I. Фаза всасывания (абсорбтивный период) I. Во время еды
углеводы, поступающие в организм с пищей (т.е. экзоген¬
ные), перевариваются и всасываются. В организм поступа¬
ет большое количество экзогенной глюкозы, и концентра¬
ция глюкозы в крови возрастает. (3-Клетки поджелудочной
железы секретируют инсулин, который стимулирует обра¬
зование гликогена из глюкозы в мышцах и печени. Когда
запасы гликогена достаточны, в печени из глюкозы синте¬
зируются триацилглицеролы. Триацилглицеролы в составе
липопротеинов очень низкой плотности транспортируют¬
ся в жировую ткань, где и запасаются для хранения.
2. Постабсорбтивный период II. Примерно через 3 ч заканчи¬
вается поступление экзогенной глюкозы, а-Клетки подже¬
лудочной железы секретируют глюкагон, который стиму¬
лирует в печени распад гликогена до глюкозы. Благодаря
этому уровень глюкозы в крови повышается. Примерно
через 6 ч глюкагон стимулирует в печени и другой про¬
цесс — глюконеогенез.
3. Начало голодания III. Примерно через 14 ч после приема
пищи в образовании глюкозы в равной степени задей¬
ствованы оба пути: распад гликогена и глюконеогенез.
Примерно столько времени проходит между ранним
ужином и поздним завтраком. Постепенно доля глюко¬
зы, образующейся из гликогена, падает, а доля глюкозы,
образующейся в процессе глюконеогенеза, возрастает. Это
продолжается до 32 ч голодания.
4. Голодание средней продолжительности IV. После 32 ч голо¬
дания запасы гликогена в печени полностью исчерпыва¬
ются. С этого времени единственным источником глю¬
козы становится глюконеогенез, который активируется
глюкокортикостероидным гормоном — кортизолом. При
глюконеогенезе происходит атрофия тканей: в первую оче¬
редь расходуется мышечная ткань. Она используется как
источник аминокислот — субстрата для глюконеогенеза.
К счастью, в это же время в печени начинается синтез
кетоновых тел из жирных кислот, и головной мозг адап¬
тируется к использованию кетоновых тел в качестве источ¬
ника энергии. Это позволяет снизить затраты глюкозы и
минимизировать потери мышечной ткани.
5. Длительное голодание V. Фаза 5 наступает после 16 сут
голодания. В этой фазе человек может прожить еще 24 сут
(итого 40 сут), если он имеет источник воды. Во время
этой последней фазы единственным источником глюко¬
зы становится глюконеогенез. Головной мозг в качестве
главного источника энергии использует кетоновые тела,
потребляя глюкозу на минимальном уровне.
Глюконеогенез, атрофия мышц
и плохое заживление ран
Глюкагон начинает стимулировать глюконеогенез примерно
после 6 ч голодания, но интенсивная стимуляция глюконео¬
генеза наступает через 32 ч голодания, когда подключает¬
ся гормон кортизол. Примечание, глюкокортикостероидный
гормон кортизол — катаболичсский стероид. Он активирует
расщепление белков мышц и других тканей до аминокислот,
которые выступают в роли предшественников глюкозы в глю¬
конеогенезе. Атрофия мышц — вынужденная мера, на которую
приходится идти, чтобы обеспечить головной мозг глюкозой.
Поэтому необходимо обеспечить дополнительное питание
больным, восстанавливающимся после хирургического вме¬
шательства или обширных травм (например, синдрома дли¬
тельного сдавливания или сильных ожогов). Если больной не
получает достаточное количество пиши, в его организме пре¬
обладают катаболические процессы и происходит истощение
мышц и тканей. Чтобы раны заживали, необходимо усилить
анаболические процессы, для чего и требуется дополнитель¬
ное питание.
Гомеостаз глюкозы
57
Глнжозозавиоимая секреция иноулина р-клетками
Глюкоз»-——Г люкоза^
Пере-
носчик
глюкозы
ГЛЮТ2
PHHI
(активирующая
мутация)
Активация рецептора
сульфонилмочевины (SUR1)
производными сульфонил¬
мочевины закрывает
АТФ-зависимые К+-каналы
Производные сульфонилмочевины
стимулируют секрецию инсулина
А-цепь
Ls-sl
Инсулин
Рис. 24.1. В р-клетках при метаболизме глюкозы образуется АТФ, который стимулирует секрецию инсулина
58
Глюкозозависимая секреция инсулина р-клетками
Таблица 24.1. Пояснение к рис. 24.1
1. Глюкоза проникает в (3-клетку с помощью переносчика глюкозы ГЛЮТ2. Здесь она фосфорилируется глюкокиназой и вступает в глико¬
лиз. Продукты гликолиза поступают в цикл Кребса, а продукты цикла Кребса — в дыхательную цепь, где образуется АТФ.
2. При высокой концентрации АТФ АТФ-зависимые калиевые каналы (КАТФ-каналы) закрываются.
3. В состоянии покоя плазматическая мембрана поляризована и несет на внутренней стороне отрицательный заряд — потенциал покоя.
Когда под воздействием АТФ калиевые каналы закрываются, в клетке накапливаются положительно заряженные ионы калия К+, и мем¬
брана деполяризуется. При деполяризации мембраны открываются кальциевые каналы, и в клетку поступает поток ионов кальция Са++.
4. Ионы кальция Са++ активируют синаптотагмин, с помощью которого секреторные гранулы сливаются с плазматической мембраной и про¬
исходит секреция инсулина.
5. Kir 6.2/SUR1 комплекс. Препараты сульфонилмочевины (глибенкламид, гликлазид, толбутамид) связываются с SUR1 — рецептором суль-
фонилмочевины, и КДТФ-каналы (Kir 6.2) закрываются. Мембрана деполяризуется, и происходит секреция инсулина.
Метаболизм в (3-клетках
(3-Клетки — клетки островков Лангерганса поджелудочной желе¬
зы. Они синтезируют, хранят и секретируют инсулин. Инсулин
секретируется после приема пищи. Согласно гипотезе «метабо¬
лического топлива», процесс секреции инсулина связан с метабо¬
лизмом глюкозы в р-клетках, в ходе которого синтезируется АТФ.
АТФ служит биохимическим сигналом, запускающим секрецию
инсулина. Если человек употребляет в пищу высокоуглеводные
продукты, в кишечнике образуется и всасывается большое количе¬
ство молекул глюкозы. При метаболизме этой глюкозы образуется
большое количество АТФ, и соответственно инсулин также будет
секретироваться в больших количествах (т.е. пропорционально
содержанию углеводов в пище).
В табл. 24.1 описаны стадии данного процесса (эта таблица
дополняет рис. 24.1)
Инкротины усиливают секрецию инсулина
Инкретины ГПБ-1 (глюкагонподобные белки) и ГЗИП (глюкозо¬
зависимые инсулинотрофные полипептиды) являются гормонами
кишечника, способствующими усилению выработки инсулина в
ответ на прием пищи (рис. 24.1). ГПБ-1 потенциально полезен
в качестве антидиабетического лекарства, но недостатком его
является быстрый распад под действием дипептидилпептидазы-4
(ДПП-4). Для преодоления этого недостатка были синтезиро¬
ваны аналоги ГПБ-1 (миметики иикретииа), устойчивые к дей¬
ствию ДПП-4, такие как экзеназид и лираглутид. Также в рамках
клинических испытаний были использованы ингибиторы ДПП-4
(глиптины), усиливающие выработку инкретина, такие как сита-
глиптин, видаглиптин, саксаглиптин и алоглиптин.
Врожденные нарушения метаболизма в (3-клетках
приводят к избыточней или недсстаточной
продукции инсулина
Встречаются редкие врожденные нарушения метаболизма, кото¬
рые приводят к гипогликемии или гипергликемии.
Избыточное образование инсулина
Повышенная секреция инсулина вызывает стойкую гиперинсу-
линемическую гипогликемию новорожденных (PHHI — persistent
hyperinsulinaemic hypoglycaemia of infancy). Причина этого забо¬
левания — мутация, при которой активируется экспрессия гена
глюкокиназы. Стойкая гиперинсулинемическая гипогликемия
новорожденных также наблюдается в случае мутации, инактиви¬
рующей калиевые каналы Kir6.2 (табл. 24.2, рис. 24.1).
Недостаточное образование инсулина
Диабет 11 типа взрослых у молодых (MODY— maturity onset
diabetes of the young), как правило, легкая форма диабета.
Причина заболевания — мутация, инактивирующая ген глю¬
кокиназы или факторы транскрипции, регулирующие синтез и
секрецию инсулина.
Неонатальный сахарный диабет (PNDM — permanent neonatal
diabetes mellitus) проявляется обычно в первые 6 мес после рожде¬
ния. Раньше больным назначали постоянные инъекции инсулина.
Однако недавно было показано, что около 30% больных неона¬
тальным сахарным диабетом несут мутацию, активирующую ген
Kir6.2 субъединицы КАТФ-калиевых каналов*. Из-за этого обра¬
зуется недостаточное количество инсулина и, следовательно, раз¬
вивается диабет (см. табл. 24.2, рис. 24.1). Соответственно, если
генетический анализ подтверждает мутацию калиевых каналов,
следует назначать производные сульфонилмочевины.
Структура молекулы инсулина
Предшественник инсулина проинсулин запасается в (3-клетках.
В секреторных гранулах ферменты протеазы отщепляют С-цепь
проинсулина и образуют активный инсулин — димер, состоящий
из А- и В-цепей.
Таблица 24.2. Врожденные нарушения метаболизма в (3-клетках
Глюкокиназа; гете¬
розиготные носите¬
ли, активирующая
мутация
Из-за повышенной активности глюкокиназы
метаболизм глюкозы в р-клетках протекает
слишком интенсивно. Инсулин образуется
в избыточном количестве. Развивается стой¬
кая гиперинсулинемическая гипогликемия
новорожденных
Глюкокиназа; гетеро¬
зиготные носители,
инактивирующая
мутация
Из-за сниженной активности глюкокиназы
метаболизм глюкозы в р-клетках протекает
медленно, что приводит к снижению секре¬
ции инсулина, развитию диабета взрослых
II типа у молодых
Kir6 2; гетерозигот¬
ные носители, акти¬
вирующая мутация
(К inwardly rectifying
channel — калиевый
канал входящего
выпрямления)
КАТФ-каналы постоянно активны (открыты),
из-за чего инсулин не может секретироваться
из клетки и развивается неонатальный сахар¬
ный диабет. Согласно современным данным,
состояние таких больных улучшается при
лечении производными сульфонилмочевины
Kir6.2; гетерозигот¬
ные носители, инак¬
тивирующая мутация
КАТФ-каналы неактивны (закрыты), что при¬
водит к постоянной секреции инсулина.
Развивается стойкая гиперинсулинемиче¬
ская гипогликемия новорожденных
SUR1 (рецептор
сульфонилмочеви¬
ны); гетерозиготные
носители, активирую¬
щая мутация
При активирующей мутации SUR1 КАТФ-
каналы все время остаются закрытыми.
Инсулин постоянно секретируется клетками,
и наблюдается стойкая гиперинсулинемиче¬
ская гипогликемия новорожденных
Инактивирующая
мутация SUR1 не
описана
* Gloyn A.L., Pearson E.R., Antcliff J.F. et al. Activating mutations in
the gene encoding the ATP-sensitive potassium channel subunit Kir 6.2 and
permanent neonatal diabetes // N. Engl. J. Med. — 2004. — Vol. 350. —
P. 1838-1849.
Глюкозозависимая секреция инсулина р-клетками
59
Регуляция метаболизма гликогена
Адреналин (глюкагон в печени)
"W
Адреналин (в мышцах) или глюкагон
(в печени) связывается с рецептором.
Это активирует аденилатциклазу,
и она синтезирует циклический АМФ
4ШШ.И;Я*
Циклический АМФ стимулирует каскад сиг-
ф , нальных реакций, и в итоге активируется
фосфорилаза
Неактивная
Ж протеин-
ж
киназа А
Циклический АМФ
Активная
протеин-
киназа А
Сигнальные белки, активирующие распад
гликогена, одновременно ингибируют
синтез гликогена
Конститутивно активная
киназа-3 гликогенсин-
тазы (GSK-3)
Щ0 / -
Неактивная
киназа я^т
фосфорилазы
,ТФ I АДФ
\ V Я А
Активная киназа
фосфорилазы
Ч^
- K.-J
Фосфорилаза b,
неактивная
I
\т/
АДФ
^ Фосфорилаза а 0;
активная
3>лигосахаридная затравка НеактИвНая
удф 2 [п остатков глюкозы
а-(1->4) связям **
гликогенсинтаза
Фермент
веталени!
АДФ АТФ
\ )
Олигосахарид [п+1 остаток
глюкоаы с а-(1->4) связями]
Гликоген расщепляется
до глюкозо-1-фосфата
Распад гликогена
Гликоген
(п—1 остаток глюкозы)
Пирофосфа таза
УДФ-глюкоз опирофосфо
УТФ
Г люкозо-
1 -фосфат
В печени глюкозо-6-фосфатаза из
глюкозо-6-фосфата образует глюкозу.
Глюкоза выводится по печеночным
венам и поступает к нуждающимся
в ней тканям - в первую очередь
к эритроцитам и головному мозгу
Активная
гликогенсинтаза
&
УДФ-глюкоза
6-фосфат
Эндоплазматический ретикулум
В мышцах нет фермента глюкозо¬
б-фосфатазы. Глюкозо-6-фосфат
поступает в гликолиз для
образования АТФ
Рис. 25.1. Регуляция распада гликогена. См. раздел «Основные обозначения» на с. 10, где приведены пояснения к рисункам
I
Регуляция распада гликогена
Основные запасы гликогена содержатся в печени и мыш¬
цах. Главный источник гликогена — печень. При голодании в
печени происходит распад гликогена с образованием глюко¬
зы. Так в крови поддерживается необходимая концентрация
глюкозы для ее использования в качестве источника энер¬
гии в головном мозге и эритроцитах. Мышцы потребляют
большое количество энергии и поэтому используют запасы
гликогена только для собственных нужд. Особенно большое
значение этот процесс имеет для анаэробного гликолиза в
экстренных случаях при внезапных физических нагрузках.
Распад гликогена в мышцах инициирует адреналин, который
связывается со своим рецептором и активирует аденилатци¬
клазу. Аденилатциклаза начинает синтезировать циклический
АМФ. Циклический АМФ запускает целый каскад реакций,
которые в конечном итоге приводят к активации фосфори¬
лазы. Гликогенфосфорилаза катализирует распад гликогена.
В неченн распад гликогена стимулируется глюкагоном. Этот
гормон секретируют а-клетки поджелудочной железы при
голодании.
60
Регуляция метаболизма гликогена
dO±Vd3H3JOdl>Gl/e
° UUOO
<LQ8irb
BVHdBlM^dHfl Vl/HU
BVHd
Мембрана
Гликоген
(n-1 оотаток глюкозы)
H ОН
Глюкоза
Синтез гликогена
Неактивная
протеинфосфатаза-1
Рис. 25.2. Регуляция синтеза гликогена. См. раздел «Основные обозначения» на с. Ю, где приведены пояснения к рисункам
Регуляция синтеза гликогена
Синтез гликогена инициируется после связывания инсу¬
лина со своим рецептором. При этом происходит аутофос¬
форилирование остатков тирозина в рецепторе инсулина.
Запускается каскад реакций, в которых поочередно активиру¬
ются следующие сигнальные белки: субстрат-1 инсулинового
рецептора, фосфоипозитол-3-кипаза, фосфоинозитол-зависимая
киназа-1, протеипкиназа АКТ (см. гл. 27). В конечном итоге
ингибируется кипаза-3 гликогенсиптазы. При голодании
гликогенсинтеза-3 постоянно активна и инактивируется толь¬
ко на короткое время после нриема пищи, в ответ на сигнал
инсулина. Она ингибирует гликогенсинтазу путем фосфо¬
рилирования, не позволяя ей синтезировать гликоген. Во
время приема пищи инсулин активирует каскад реакций,
в результате которого ингибируется кнназа-3 гликогепсипта-
зы и активируется протенпфосфатаза-1. Протеинфосфатаза-1
дефосфорилирует гликогенсинтазу, и последняя начинает
синтезировать гликоген из глюкозы.
Протеинтирозинфосфатаза и ее ингибиторы
Как только прием пищи заканчивается, протеинтирозин¬
фосфатаза блокирует действие инсулина. Она дефосфори¬
лирует остатки тирозина в рецепторе инсулина, и рецептор
переходит в неактивную форму. У больных диабетом II типа
активность протеинтирозинфосфатазы чрезмерно повыше¬
на, что приводит к блокированию сигнала инсулина, и клет¬
ки оказываются невосприимчивы к инсулину. В настоящее
время проводятся исследования, направленные на создание
ингибиторов протеинфосфатазы, с помощью которых станет
возможным разработать новые методы лечения в лечении
диабета II типа.
Poninniiua moTofirinmona гпнц’пгоиа
dU!Vd3H3.
Распад гликогена (гликогенолиз) и болезни накопления
гликогена (гликогенозы)
Плазматическая мембрана
Фермент
ееп
Олигосахаридная затравка
[п остатком глюкозы4*
а-(1-+4) связями]
Гптогенсшттезе
Олигосахарид
|п+1 остаток глюкозы
с а-(1-+4) связями]
Гликоген
гФ
Глюкагон
У риди иди фосфат -
Пнрофосфатшэй глюкоза
©
Фосфорилаза
УДФ-ГЛЮЯОЗОПНрСН
Гликоген
(п-1 остаток глюкозы]
Глюкоэо-
1 -фосфат
Переносчик
глюкозы ГЛЮТ2
Ч -
^mibiiiihiiiiiibiiiiiii Глюкоза—
▲ I
10 %-i
Остаточный докстрин
к| Фосфог/вдгомугкэа
!'еветвящии
фермент
Глюкоэо-
Гмококмнезл,
гекссямнеае
* 6-фосфат
Й
Глюкоза
Ч
Эндоплазматический ретикулум ]
Рис. 26.1. Распад гликогена в печени (в норме). Печень — основ¬
ной источник запасов гликогена. При голодании секретируется
глюкагон, который стимулирует распад гликогена печени до глю¬
козы. Глюкоза поступает в кровь и с током крови переносится
к головному мозгу, где она выполняет роль источника энергии
для этого органа. При распаде гликогена в печени превраще¬
ние глюкозо-6-фосфата в глюкозу катализируется глюкозо-6-
фосфатазой
Раопад гликогона в норме
Гликоген запасается в мышцах и печени. При голодании рас¬
ходуется гликоген печени, а при повышенной физической
нагрузке — гликоген мышц.
Гликогонозы
При гликогенозах наблюдаются нарушения запасания глико¬
гена; 4 из 12 типов гликогенозов представлены на рис. 26.3—
26.6.
О iQr O'
Кислая а-(1-*4)-глюкозидаза VY —
Болезнь Помпе
Недостаточность кислой
а-(1->4)-глюкозидазы (фер¬
мента лизосом) приводит к на¬
коплению гликогена, особенно
в сердце, печени и мышцах
Глюкоза
Олигосахаридная затравка
Рис
стат
для
мио
Гл
ла
Рис. 26.2. Распад гликогена в мышцах (в норме). Мышцы!
используют запасенный гликоген исключительно для собствен-!
ных нужд в качестве источника энергии. При интенсивны!!
нагрузках в анаэробных условиях, например, при действии адре-|
налина (реакции «спасайся или сражайся»). Особенно интенсив-1
но анаэробный гликолиз протекает в белых мышцах. В мышш1|
нет глюкозо-6-фосфатазы
Олигосахаридная затравка
удф [п остатков глюкозы^
а-(1 -»4> связями]
Фермент
eeiBi
__ Гликогвнсимтвм
Олигосахарид
[n+1 остаток глюкозы
с а-(1 -»4) связями]
У риди иди фосфат-
Гликоген
Ф
Гликоген
(п-1 остаток глюкозы) у
Остаточный
декстрин
Фосфоглкжомутаэа
Глюкоза
Деветвящий
фермент
Глюкоэо-
6-фосфат
Болезнь Кори
Из-за недостаточности
деветвящего фермента
в печени и других органах
накапливается остаточный
декстрин
G
Рис. 26.3. Гликогеноз II типа (болезнь Помпе). Гликогеноз
II типа наследуется по аутосомно-рецессивному типу. Причина
болезни — недостаточность кислой а-(1—>4) глюкозидазы, фер¬
мента лизосом. Из-за накопления гликогена через 2—3 мес после
рождения развивается кардиомегалия. Кроме того, поражаются
печень и мышцы, что приводит к обшей мышечной слабости.
Предполагается, что в лечении гликогеноза II типа будет эффек¬
тивна ферментозаместительная терапия
Рис. 26.4. Гликогеноз III типа (болезнь Кори). Гликогеноз III тиш|
вызван недостаточностью деветвящего фермента, при которойII
печени и других органах накапливается аномальная форма гли-1
когена — остаточный декстрин. Это разветвленная молекула, f|
которой вместо полноценных ветвей в местах а-(1->6)-связеИ|
расположены укороченные ветви-обрубки. Болезнь характеризу-|
ется гипогликемией и гепатомегалией
Рис
ГЛЮ
ся 1
ГИП.
62
Распад гликогена (гликогенолиз) и болезни накопления гликогена (гликсгенозы)
Олигосахаридная затравка
удф [п остатков глюкозы^
с п-(1 -*4) связями]4
гптогансиитаза
Гликоген
(Фи1
Болезнь Мак-Ардла
Недостаточность
фосфорилазы
в скелетных мышцах
Олигосахарид
[п+1 остаток глюкозы'4'
с а-(1-*4) связями]
Урндимдифосфат-
ПирофосФатаэз глюкоза
Гликоген
(п-1 остаток глюкозы)
Глюкоза
гпюкогиназа.
гвксокииазя
АТФ
Фосфослюкоизомераза
Фруктозо-
6-фосфат
IW
АТФ
1 1 IV
Фруктозо-
1,6-бисфосфат
I
Гликолиз
Рис. 26.5. Гликогеноз V типа (болезнь Мак-Ардла). Эта болезнь наследуется по аутосомно-репессивному типу. Она обусловлена недо¬
статочностью мышечной фосфорилазы (миофосфорилазы). При гликогенозе V типа мышцы не могут расщеплять мышечный гликоген
для получения энергии. При физических нагрузках такие больные страдают от быстрой усталости и мышечных спазмов, наблюдается
миоглобинурия
Глюкоза, посту¬
пающая с пищей
Олигосахаридная затравке
[п остатков глюкозы
=Гликоген
Гликогенез
Гликогенолиз
остаток глюке
• (1-»4) связями]
Глк
6-
НАДФН
ЧШ0*”Глюкозо-6- """”1ТОМ
фосфатде-
НАДФН используется в синтезе
жирных кислот (см. гл. 23)
Уридиндфосфат-
I N
— П®
УДФ-1 лкзкозопиро ■'
фосформлаза
УТФ
Z Гликоген
Z (п-1 остаток
“ глюкозы)
Фосфорилаза
^пиридо*саль-5'-фосфет)
l ДеаетвящиЯ фаршиг.
} 1) гпмозилтраисфераза
12} а-< >-*6)-глюкоэидаза
Глюкозо-
* 1-фосфат
Till
W ,. Пюпхиюза W Глюкоэо-
1»-ГЛЮКОЗавННИН^Н^^^ 6-фосфат "■
А й It
Я Я Фосфоглюко-
Я А изомераза
Ч Я ▼ ’
А у? Я фруктоэо- ■<
0 ф Глюкозо-6 "" yW 6-фосфат Ч
«К •-I фосфатаза \ щ/ ^ ^_дтв
Фосфоглкномутаза
НАДО»
V
.... V
НАДО'
V
6- фосфоглюкона т
дегидрогеназа
гидрогеназа
Пентозофосфатный путь
Фруктозо- ^
НАДФН
]?
РибуЛОЭО-
5-фосфат
Рибулоэо-
фосфат-3-
эпииераза
6-фосфат f мф'
(\ намннпнрофосфвт)
нр
Болезнь Гирке
Недостаточность
глюкозо-6-фосфатазы
1 б*кфосфатаза
н,о
ДигидрЖь
вцетонфосфат
ФосфофруктоАиназа -1
АДФ
Гликолиз
Триозофосфат-
иэомераза
деги^ 3 (юсфат
НАД" —
Глицеральдегид*
3-фосфат
Эрнтроэо-
Оедогептулоэо-
Рибозо-5-фосфат используется
в синтезе пуринов. Развивается
гиперурикемия и подагра
(см. гл. 59)
Рибоэо-6-
фосфат-
изомераза
4-фосфат
7-фосфат ^ ■■
Трансаль-
Фруктозо- ^
долаза
Глицеральдегид^
6-фосфат
3-фосфат
— Ксилулоэо-
5-фосфат
Рибозо-
5-фосфат
тизмиипирофосфат.
Г лицеральдоид-Э-
|тдег идрогенаэа
Накапливается пируват и лактат.
Пируват может быть использован
для синтеза жира (см. гл. 21)
Рис. 26.6. Гликогеноз I типа (болезнь Гирке). Наследуется по аутосомно-рецессивному типу. Болезнь обусловлена недостаточностью
глюкозо-6-фосфатазы в печени. Из-за этого печень не может регулировать уровень глюкозы в крови, и у новорожденных развивает¬
ся тяжелая гипогликемия. Избыточный гликоген запасается в печени и почках. Из-за накопления глюкозо-6-фосфата развиваются
гиперлактатемия, гиперлипидемия, гиперурикемия и подагра
Распад гликогена (гликогенолиз) и болезни накопления гликогена (гликогенозы) 63
Трансдукция сигнала инсулина. Сахарный диабет
Фосфатидилинозитол-
3,4,5-фосфат
(ФИФ3)
Для лечения
диабета разра¬
батываются
иигибиторы
протеинтирозин-
фосфатазы
И)К-1
Конститутивно
к
активная
фосфоинозитид-
о' о ’ К
зависимая киназа-1
Рецептор инсулина
активируется путем
аутофосфорилирования
по остаткам тирозина.
С активированным
рецептором связывается
и фосфорилируется им
субстрат-1 рецептора
иисулина
Активный
субстрат-1
рецептора
инсулина
С субстратом-1
рецептора инсулина
взаимодействует белок
р85 и фосфоинози-
тол-3-киназа
С ФИФЗ взаимодействует проте-
инкиназа АКТ и фосфоинозитид-
зависимая киназа-1. Фосфоино-
зитид-зависимая киназа-1 фос-
форилирует, и тем самым активи¬
рует протеинкиназу АКТ
Фосфоинозитид
Сахарный
диабет
II типа
Мутация гена
протеинкиназы
АКТ нарушает
синтез
гликогена
Гликоген <4
Синтез гликогена
ш,,
Mult:
Протеинкиназа АКТ инициирует перемещение
переиосчика глюкозы ГЛЮТ4 в плазматиче¬
скую мембрану. Благодаря этому клетка
интенсивно поглощает глюкозу
Глюкоза
Рис. 27.1. Трансдукция сигнала инсулина приводит к стимуляции синтеза гликогена (согласно гипотезе о взаимодействии
фосфоинозитол-зависимой киназы-1 и протеинкиназы АКТ). Пояснения к картинками приведены на с. 10, в разделе «Основные
обозначения»
64 Трансдукция сигнала инсулина. Сахарный диабет
Белок 1
I
с=о
h-Tnch
3 I
сн2он
Серин
Белок >
сн,-сн-с=о
он Тирозин
Белок
с=о
H+NCH
3 I
снон
I
сн«
Сериновая л
Кдротеинкиназу
*•/ Протвин-
* фосфатаза
АТФ Тирозиновая А^ф
\протеинкиназа/
7,Протеин-
фосфатаза
атф Трвониновая АДф
^протеинкиназа
j Протвин-
► фосфатаза
с=о
о
H+NCH
3 | II
СИ, о-р-сг
2 I
о-
\
£^Белок (
V .>
о-
J
I
Белок L'
I
с=о
Нз^СН о
сн—о— Р—о
СИ-
Треонин
Рис. 27.2. Обратимое фосфорилирование белков
ных белков. В результате этих взаимодействий активируются
или ингибируются определенные регуляторные процессы.
На рис. 27.1 показано, как инсулин связывается с рецепто¬
ром инсулина. При этом рецептор активируется путем ауто¬
фосфорилирования по остаткам тирозина. Активированный
рецептор связывает субстрат-1 инсулинового рецептора.
Субстрат-1 инсулинового рецептора теперь привлекает белок
р85 — регуляторную субъединицу фосфоинозитол-3-киназы.
Фосфоинозитол-З-киназафосфорилируетфосфатидилинозитол-
4,5-бисфосфат (ФИФ2) в третьем положении с образовани¬
ем фосфатидилинозитол-3,4,5-трифосфата (ФИФ3). Далее
ФИФ3 привлекает к мембране фосфоинозитол-зависимую
киназу-1 и протеинкиназу АКТ (ранее — протеинкиназа В).
Они связываются друг с другом, фосфоинозитол-зависимая
киназа-1 фосфорилирует протеинкиназу АКТ и активирует
ее. Протеинкиназа АКТ теперь способна фосфорилировать
киназу-3 гликогенсинтазы и тем самым ее инактивировать.
Киназа-3 гликогенсинтазы конститутивно активна; при голо¬
дании (когда инсулин не вырабатывается) она фосфорилирует
гликогепсинтазу и тем самым подавляет ее активность. Таким
образом, когда киназа-3 гликогенсинтазы активна, синтез гли¬
когена приостанавливается. Но под воздействием инсулина
протеинкиназа АКТ ингибирует киназу-3 гликогенсинтазы,
и гликогенсинтаза теперь может перейти в активную форму.
Ее активирует протеинфосфатаза-1 путем дефосфорилирова¬
ния. В это же время протеинкиназа АКТ через другой каскад
сигналов стимулирует транслокацию переносчиков глюкозы
ГЛЮТ4 из цитозоля в плазматическую мембрану. Это способ¬
ствует усилению транспорта глюкозы внутрь клетки. В при¬
сутствии активированной гликогенсинтазы из этой глюкозы
образуется гликоген.
Регуляция активнести ферментов путем
обратимого фосфорилирования белков
Около трети всех клеточных белков содержат фосфатную
группу и могут подвергаться ковалентной модификации при
фосфорилировапии и дефосфорплировании. Это обратимое фос¬
форилирование изменяет конформацию белка, а вместе с ней
принципиально меняются и его свойства: фермент из неактив¬
ного становится активным (или наоборот). Фосфорилированию
подвергаются остатки аминокислот, содержащих гидроксиль¬
ную группу. Чаще всего фосфорилируются остатки серина,
реже — тирозина и треонина (рис. 27.2, гл. 31). Реакцию фосфо¬
рилирования белков катализирует протеинкиназа, а реакцию
дефосфорилирования — протеинфосфатаза. Значение этого
механизма регуляции активности ферментов в живых клетках
очень велико: так, протеинкиназы и фосфатазы составляют до
5% всех белков, кодируемых в геноме человека. Недавно было
показано, что нарушения фосфорилирования белков наблю¬
даются при некоторых болезнях — сахарном диабете II типа,
раке. С исследованием регуляции активности протеинкиназ и
фосфатаз связывают надежды на создание новых эффектив¬
ных лекарств для лечения этих заболеваний.
Трансдукция сигнала инсулина
Гипотеза о взаимодействии фосфоинозитол-зависимой
киназы-1 и протеинкиназы АКТ
Инсулин индуцирует в клетке множество различных собы¬
тий. Он может стимулировать транслокацию переносчика
глюкозы ГЛЮТ4 из цитоплазмы в плазматическую мембрану,
стимулирует синтез жирных кислот, белков, гликогена и др.
Примечательно, что все эти события могут происходить при
взаимодействии инсулина всего лишь с единственным рецеп¬
тором инсулина. Этот феномен называют плейотропным (что в
переводе с греческого означает «множество путей») эффектом
инсулина. Все начинается с того, что инсулин связывается с
рецептором и инициирует взаимодействие различных сигналь-
Нарушения трансдукции сигнала инсулина
Данные клинических исследований свидетельствуют в пользу
гипотезы о взаимодействии фосфоинозитол-зависимой киназы-1
и протеинкиназы АКТ. Ниже приведены три примера.
Лепречаунизм (синдром Донохью)
Это очень редкая наследственная болезнь. Малыши плохо при¬
бавляют массу тела и внешне напоминают ирландских мифи¬
ческими существ — эльфов (leprechaun). Больные страдают от
тяжелых форм диабета и умирают в раннем возрасте. Причина
болезни — нарушение строения и функций рецептора инсули¬
на. Это приводит к тому, что клетки не воспринимают сигнал
инсулина, хотя секреция инсулина не нарушена.
Мутация протеинкиназы АКТ (протеинкиназы В)
Недавно была описана целая семья с мутацией гена протеин¬
киназы АКТ*. В соответствии с гипотезой о взаимодействии
фосфоинозитол-зависимой киназы-1 и протеинкиназы АКТ
члены семьи страдали от диабета II типа.
Протеинтирозинфосфатаза
В промежутках между приемами пищи секреция инсулина
прекращается, и трансдукция сигнала инсулина в клетках
должна прекращаться. Протеиптирозинфосфатаза осуществля¬
ет дефосфорование рецептора инсулина, инактивируя его, и
тем самым сигнал инсулиновый блокируется. Однако у ряда
больных диабетом была описана избыточная активность про¬
теи нтирозинфосфатазы, которая препятствовала активирова¬
нию рецептора инсулина. В настоящее время прилагаются
усилия для создания ингибиторов протеинтирозинфосфата-
зы, которые могут оказаться эффективными лекарствами для
лечения диабета II типа.
* George S., Rochford J.J., Wolfrum С. et al. A family with severe
insulin resistance and diabetes due to mutation in AKT2 // Science. —
2004. - Vol. 304. - P. 1325-1328.
Трансдукция сигнала инсулина. Сахарный диабет 65
Сахарный диабет
СНгОН
I
сн2он
Основание Шиффа
Рис. 28.1. Глюкоза неферментативно реагирует со свободными
N-концевыми а-аминогруппами и е-аминогруппами остатков лизи¬
на в белках. В результате этой реакции образуются фруктозамины
Слово «диабет» имеет греческое происхождение (dia —
«через, сквозь», bainen — «проходить») и описывает избыточ¬
ное образование мочи при этом заболевании (полиурию).
При сахарпом диабете, diabetes mellitus, моча сладкая на вкус
(слово mellitus значит «медовый»), при несахарном диабете,
diabetes insipidus, моча несладкая (insipid — безвкусный). Не
переживайте, в наше время врачам уже не нужно пробовать
мочу на вкус при постановке диагноза! Сахарный диабет раз¬
вивается из-за педостаточпой активности инсулина, а несахар¬
ный диабет — из-за сниженной активности вазопрессина (анти-
диуретического гормона).
При сахарном диабете наблюдается гипергликемия. Она
развивается из-за пониженной секреции инсулина или из-за
нарушения функций инсулиновых молекул (а иногда и по
обеим причинам сразу). В 2010 году было зарегестрировано
285 случаев заболевания, и уже к 2030 году ожидается рост
числа больных до 439. Существует два основных типа сахар¬
ного диабета — сахарный диабет I типа и сахарный диабет
II типа. Также встречается диабет беременных и другие, более
редкие типы сахарного диабета (например, диабет взрослого
типа у молодых).
Сахарный диабет I типа
Раньше сахарный диабет I типа называли инсулинзависимым
сахарным диабетом и диабетом молодых (ювенильным). Он
встречается у 0,5% населения и характеризуется внезапным
развитием, обычно до 25 лет, и потерей массы тела. Причина
заболевания — разрушепие р-клеток под действием аутоим-
муппых процессов вируспой ипфекции. Предполагается, что
это происходит из-за того, что белки р-клеток напоминают
по структуре фрагменты вирусных белков (гипотеза «молеку¬
лярной мимикрии»). Иммунная система организма атакует и
вирус, и р-клетки, разрушая их. Секреция инсулина прекраща¬
ется, и развивается сахарный диабет I типа.
Сахарный диабет N типа
Сахарный диабет II типа прежде был известен как инсулин-
независимый сахарный диабет, диабет взрослых. Эта болезнь
встречается у 3—5% населения и долгое время развивает¬
ся медленно и незаметно. Диагностируют сахарный диабет
II типа уже в среднем возрасте. Нередко это заболевание
сопровождается ожирением.
При сахарном диабете II типа инсулин секретируется в
достаточном количестве, а иногда даже в избыточном. Однако
наблюдается инсулинорезистентность: молекулы ипсулина!
выполняют свои функции недостаточно эффективно. Почему!
же это происходит? Было предложено множество версий!
объясняющих это явление. Сейчас считается, что существую?
разные формы сахарного диабета II типа. Так, инсулиноре¬
зистентность может быть вызвана структурными нарушениям*
любого из перечисленных белков: молекулы инсулина, рецеп¬
тора инсулина, сигнальных белков и ферментов, участвую¬
щих в поступлении и метаболизме глюкозы и липидов (см.
гл. 21, 25, 27).
Сахарный диабет беременных
(гестационный сахарный диабет)
Временный период инсулинорезистентности при беремен¬
ности — нормальное явление, но примерно в 4% случаев
резистентность к инсулину выражена слишком сильно и при¬
водит к гипергликемии. Это заболевание называют сахарный
диабетом беременных. Причина инсулинорезистентности
при беременности не выявлена. Однако было показано, что
резистентность к инсулину коррелирует с повышением уровнв
эстрогенов и плацентарного лактогена, а также с понижение*
уровня адипонектина (адипонектин повышает чувствитель¬
ность клеток-мишеней к инсулину).
Диабет взрослого типа у молодых
Диабет взрослого типа у молодых (MODY; от англ, maturitj
onset diabetes of the young) встречается примерно у 1—2% боль¬
ных диабетом, однако часто остается нераспознанным. Болезт
(как и сахарный диабет I типа) развивается в молодом воз¬
расте. При диабете взрослого типа у молодых р-клетки не!
теряют способность секретировать инсулин, однако он обра¬
зуется в недостаточном количестве, и развивается гипергли¬
кемия (см. гл. 24). Диабет взрослого типа у молодых — врож¬
денное заболевание, наследуемое по аутосомно-домипаптном)
типу. При этом заболевании нарушена структура одногс
гена. Так, в Англии 87% случаев диабета взрослого типа)
молодых вызвано мутациями одного из шести генов: глю¬
кокиназы (MODY 2) (см. гл. 24) и факторов транскрипции
печеночного ядерного фактора 4а (MODY 1); печеночного
ядерного фактора la (MODY 3); инсулинового промоторно-
го фактора-1 (MODY 4); печеночного ядерного фактора^
(MODY 5); Neuro Dl-p (MODY 6).
(Название «диабет взрослого типа у молодых» появилой
в 1974 г., когда сахарный диабет II типа называли «диабея
взрослых». По современной номенклатуре было бы логично назы¬
вать это заболевание сахарным диабетом I/ типа у молодых.)
Токсичность глюкозы
Глюкоза — важный источник энергии для всех тканей, осо¬
бенно для эритроцитов. Но по иронии судьбы глюкоза може?
нриносить вред клеткам, если ее концентрация в крови долго?
время остается высокой. Это происходит по следующим при¬
чинам.
Осмотический эффект
Глюкоза — осмотически активное вещество. При высоко!
концентрации глюкозы во внеклеточном пространстве вод)!
диффундирует из клеток во внеклеточную жидкость и в кровь
а также интенсивно выводится с мочой. Происходит обезво¬
живание тканей.
66 Сахарный диабет
Свободные радикалы вызывают повреждение 0-клеток
При высоких концентрациях глюкозы в р-клетках усилива¬
ется окислительное фосфорилирование. При этом образуется
повышенное количество АФК. АФК вызывают окислитель¬
ный стресс (см. гл. 14, 15) р-клеток, нарушение их функций.
В результате снижается способность к секреции инсулина, что
приводит к развитию гипергликемии. Этот «порочный круг» —
гипергликемия/образование АФК/дисфункция р-клеток — при¬
водит к обострению течения диабета.
Гликозилирование белков
Термин «гликозилирование» описывает неферментативную
реакцию между глюкозой (и другими восстанавливающими
сахарами) и свободными N-концевыми а-аминогруппами
или е-аминогруппами остатков лизина в белках. Этот процесс
протекает и в нормальных условиях, однако для организма он
нежелателен. Запомпите: продуктом реакции белка и глюкозы
является фруктозамин (рис. 28.1). При гипергликемии глюко¬
за реагирует с белками в плазме крови и тканях, и образуются
глнкироваппые белки. Если этот процесс происходит на про¬
тяжении нескольких месяцев или лет, образуются конечные
продукты избыточного гликирования, которые образуют сшив¬
ки между долгоживущими белками (например, коллагеном).
Это приводит к нарушению функций долгоживущих белков
и развитию осложнений диабета: уменьшается эластичность
сосудов, повышается артериальное давление, страдают почки
и сетчатка (развивается нефропатия и ретинопатия).
(Примечание: в 1970-х гг. при описании реакции углеводов
с белками пользовались термином «гликозилирование». Затем
термин «гликозилирование» вставали только для описания реак¬
ции глюкозы с белками, а для описания реакции любого углевода
с белками был предложен термин «гликирование».)
Гемоглобин НЬА1с (см. ниже) также относится к фрукто-
заминам. Однако в клинической практике фруктозаминами
обычно называют гликированные сывороточные белки. При
гипергликемии белки плазмы крови гликируются, образуя
остатки фруктозамина. Альбумин — основной белок плазмы
крови; его период полураспада составляет 19 сут. Поэтому
измерение уровня фруктозаминов позволяет оценить сред¬
ний уровень гликемии в крови за прошедшие 2—3 нед. Таким
образом, к гликированным белкам плазмы относятся глики-
рованный альбумин и фруктозамин (другое название — гли-
кированный сывороточный белок).
Гемоглобин (НЬА1с)
Гликированный гемоглобин НЬА,С (самый известный глики-
рованный белок) — минорный компонент гемоглобина, про¬
дукт неферментативной реакции глюкозы с а-аминогруппами
N-концевого валина (3-глобина. Гликированный гемоглобин
образуется на протяжении всей жизни эритроцита (17 нед).
Его количество зависит от содержания глюкозы в плазме крови
в этот период. Таким образом, измерение уровня НЬА1с позво¬
ляет оценить среднее содержание глюкозы в крови за послед¬
ние 8 нед (табл. 28.1).
Диабетический кетоацидоз (ДКА)
Диабетический кетоацидоз — это осложнение при диабете,
требующее неотложной госпитализации и приводящее к
фатальным последствиям при отсутствии лечения. Не так
давно в Англии в течение 12 мес было зафиксировано
13 465 случаев заболевания ДКА, около четверти из них
у детей и подростков до 18 лет. ДКА развивается вслед¬
ствие недостатка инсулина, приводящего к катаболическому
кризису, при котором аминокислоты из мышечных белков
трансформируются в глюкозу (глюконеогенез; часть 34),
Таблица 28.1. Примерное соотношение между долей гликозили-
рованного гемоглобина НЬА1с и средней концентрацией глюкозы
в плазме крови. Эти данные были получены при проведении
демографических исследований, поэтому в каждом конкретном
случае необходимо учитывать индивидуальные особенности
Доля НЬА1с
(в % всего НЬ)
Средние значения концентрации глюкозы ^
в плазме крови
ммоль/л
мг/100 мл |
6
8,1
145
7
10,0
180
8
11,9
215
9
13,9
250
10
15,8
285
11
17,8
320
12
19,7
355
а жирные кислоты из жировой ткани трансформируются в
кетокислоты (кетоновые тела) (рис. 33.2), что приводит к
острому метаболическому ацидозу. Это было метафорически
описано как «растворение мышц в мочевине». На рис. 28.2
показан случай у пациента с тяжелой формой гиперглике¬
мии, при которой наблюдается чрезвычайно высокий уро¬
вень кетоновых тел, p-гидроксибутирата (Р-ГБ) и ацетоаце¬
тата, а соотношение р-ГБ:АсАс равно 5. При последующем
лечении инсулином уровень глюкозы в крови и кетоновых
тел уменьшился и соотношение р-ГБ:АсАс упало до нор¬
мального значения, равного 3. Анализ мочи на кетоацидоз
заключается в измерении АсАс, благодаря чему можно судить
о тяжести состояния пациента.
мг/л ммол/л
Время (ч)
Рис. 28.2. Изменение уровня метаболитов при лечении ДКА
инсулином
Сахарный диабет 67
ф
Метаболизм алкоголя: гипогликемия, гипорлактатемия
и жировой гепатоз
Гипогликемия,
вызванная
употреблением
алкоголя
Глюкоза
А
Глюкозо-
6-фссфат
ч
А
Глюкозо¬
б-фосфатаза
л
н,о
НИЯ53ПТВ^^^И1
.j
Фруктозо-1,6-
бисфосфат
Цитозоль
снзсн2он
Этанол
Дигидрокси-
ацетонфосфат
Глицер; льдегид-
НАД+ -
В алкогольдегидрогеназной
реакции образуется НАДН
и соотношение НАДН/НАД+
в цитозоле повышается
ГОЛОДАНИЕ
Глюконеогенез
ингибирован
НАДТ
НАДН + Н+
1,3-бисфо
АДФ«-^
АТФ
З-фосфо
2-фосфс
гдф со.
Оксалоацетат
V Г,
;фоглицерат
глицерат
ПРИЕМ ПИЩИ
В составе хиломикронов
триацилглицеролы поступают
в кровь, где проходит высво¬
бождение жирных кислот
под действием липопроте-
инлипазы капилляров
7ии1шш1111ш11шш1ш1шш1ш11111111ш^ Пальмитат
Алкогольдегидрогенаэа
НАДН+Н + 11111111111111,11111111,111111,11 ,||1111111111И11|11ШП11П1£
Фосфоенолпируват-
карбокоикиназа
глицерат
н2о -
Фоефовнблпируват
АДФ
СН3СНО
Ацеталь¬
дегид
При высоком соотношении
НАДН/НАД+ малатдегидро-
геназа восстанавливает
оксалоацетат до малата, и
глюконеогенез ингибируется
НАД'
Малатде-
гидрогеназа
Г
НАД"*" НАДН+НН
Лактат
Жировой гепатоз
Жирные кислоты не окисляются в печени, так
как [3-окисление заингибировано. Поэтому
из жирных кислот и глицерол-3-фосфата обра¬
зуются и накапливаются в печени триацил¬
глицеролы, что приводит к ожирению печени
При высоком соотношении
НАДН/НАД+ повышается
интенсивность образования лактата
Малат
А
Пируват-4^-* Малат
Лактатде- /малик- ж
X фермент
гидрогеназа СОз =
Ш11ШШШ1Ш11ШШШ,НМ111М1ПШ1Ш1Ш1111ПМШ11|£
Малатде-
гидрогеназа
ГГ
Ацетил-КоА
Г*'
Оксало¬
ацетат
НАД*
НАДН+Н"
HjO-
О
► АДф4фн
Цитратлиаэа
N- АТФ
^ KoA-SH
=
f-
- ■
Переносчик
А/^Переносчик
L
S.
дикарбоновых кислот
^ пирувата
Ацетальдегид
НАД+ -
Митохондрия
if
©
Карнитиновая
челночная
система
АТФ
Дисульфирам
ингибирует ацетальдегиддегидрогеназу
и используется при лечении алкогольной
зависимости. Дисульфирам вызывает
избыточное накопление ацетальдегида,
которое вызывает у человека неприятные
ощущения
(биотин)
KoA-Sl
Пируваткарбоксилаза
(биот
АДФ
СОг
НАД
Пируват дегидрогеназа1
НАДН+Н+
Цитрат
р-Окисление
Ацетальдегиддегидрогенаэа
НАДН+Н+
В результате ацеталь-
дегиддегидрогеназной
реакции соотношение
НАДН/НАД+ в митохон¬
дрии повышается
Ацетил-Ка
нг° [Цис-аконитат]
фадн2*-ч
Сукцинат-
дегидрогеназа
При высоком соотноше¬
нии НАДН/НАД+ цикл
Кребса ингибируется
Цикл Кребса
f
НАДН+Н*
-► НАДН+нЛ
СН3СОО'
Ацетат
ФАД-
Сукцинат ч
Сукцинил-
КоА-синтатаза
Г
Пукциния-
I а-К
I ДОГ
Г Л
Л
Код
▼
НАД+
Г
ГТФ ГДФ
СО* KoA-SH
:-Кетоглутарат-
дегидрогеназа
а-Кетоглутарат
Гидроксиацил-
■дегидрогеназа
Изоцитрат
При высоком соотношении
НАДН/НАД+ (3-окисление
ингибируется
Иэоцитрат-
I дегидрогеназа
СО*
НАД+
Внутренняя мембрана
Рис. 29.1. Метаболизм алкоголя
68
Метаболизм алкоголя: гипогликемия, гиперлактатемия и жировой гепатоз
Метаболизм этанола
Умеренное употребление алкоголя полезно для здоровья, но
избыточное приносит вред. В цитозоле клеток содержится
фермент алкогольдегидрогеназа, который быстро преобразу¬
ет этапол в ацетальдегид. В ходе этой реакции кофермент
НАД+ восстанавливается до НАДН. В результате соотношение
НАДН/НАД+ в цитозоле увеличивается. Ацетальдегид транс¬
портируется в митохондрии, где он окисляется ацетальдегид-
дегидрогеназой, и образуется ацетат. При этой реакции повы¬
шается соотношение НАДН/НАД+ в митохондриях.
Гипогликемия
При высоком соотношении НАДН/НАД+ в цитозоле окса-
лоацетат не вступает в глюконеогенез, а восстанавливается
до малата. И если вам приходилось употреблять спиртное
на голодный желудок, то вы, несомненно, знакомы с непри¬
ятными последствиями падения концентрации глюкозы в
крови. Ведь глюкоза — это главный источник энергии для
головного мозга! Вот уж кто никогда не забудет об этом, так
это мой приятель Кит [Keith]*. А для завзятого алкоголика,
который регулярно пренебрегает пищей и употребляет только
спирт, гипогликемия может иметь весьма серьезные послед¬
ствия, — вплоть до комы.
Лактацидоз
При повышенном соотношении НАДН/НАД+ в цитозо¬
ле лактатдегидрогеназа восстанавливает пируват до лактата
(рис. 29.1). К тому же малат, образующийся, как было опи¬
сано выше, также превращается в лактат. Таким образом,
избыточное употребление спирта приводит к развитию лак-
тацидоза.
Ингибирование цикла Кребса
На рис. 29.1 показано, что при высоком соотношении НАДН/
НАД+ в митохондриях оксалоацетат восстанавливается до
малата под действием малатдегидрогеназы. Кроме того, в этих
условиях приостанавливается окисление а-кетоглутарата и
изоцитрата. В результате цикл Кребса ингибируется.
Жировой гепатоз
Жировой гепатоз (ожирение печени) развивается вследствие
нарушения метаболизма при избыточном употреблении
алкоголя. Причина его развития — повышенное соотноше¬
ние НАДН/НАД+ в митохондриях, при котором блокируется
р-окисление жирных кислот.
На рис. 29.2 показано, что в митохондриях печени аце¬
тальдегид под действием ацетальдегиддегидрогеназы превра¬
щается в ацетат. В этой же реакции НАД+ восстанавливается
НАДН, и значение дроби НАДН/НАД+ повышается. Из-за
высокого значения НАДН/НАД+ блокируется окисление
(3-гидроксиаиил-КоА в гидроксиацил-КоА-дегидрогеназной
реакции, и в результате ингибируется р-окисление жирных
кислот.
* По невероятному совпадению, когда я писал эту главу, мне
позвонил Кит и сообщил, что только что получил травму из-за гипо¬
гликемии, которая развилась вследствие употребления алкоголя. Кит
работает садовником. В тот злополучный день он позавтракал на ско¬
рую руку и целый день упорно трудился, пропустив второй завтрак и
обед, а после поехал выступать на вечернем хоровом концерте (Кит
состоит в клубе любителей хорового пения). К этому времени после
долгих физических нагрузок его запасы гликогена в печени были уже
израсходованы. Перед концертом он в дружеской компании выпил
стакан вина. Во время выступления он вдруг покрылся испариной,
у него закружилась голова, и он упал, правда, не в горячие объятия
сопрано, а назад, со ступенек сцены. Очнулся Кит уже на пути в
больницу с переломом малой берцовой кости.
Однако в печень продолжают поступать жирные кислоты,
образующиеся после расщепления липидов, поступающих с
пищей. Поскольку (3-окисление жирных кислот невозмож¬
но, они образуют сложные эфиры с глицеролом и в виде
триацилглицеролов накапливаются в печени. Это состояние
называется жировым гепатозом.
Метанол и этиленгликоль образуют токсичные
продукты
Метанол используется как антифриз, а также добавляется в каче¬
стве денатурирующего агента. Аналогичным образом этилен¬
гликоль используется в качестве антифриза, преимущественно
в автомобилях. Оба вещества сами по себе не являются токсич¬
ными, но после их попадания в организм они быстро метабо-
лизируются алкогольдегидрогеназой до метаболитов (муравьи¬
ной и щавелевой кислоты), которые, в свою очередь, являются
потенциально опасными. Фомепизол (4-метилпиразон) инги¬
бирует алькогольдегидрогеназу и используется в медицине для
лечения отравлений метанолом и этиленгликолем.
Острый ацидоз
Вызывает
повреждения
сетчатки
Щавелевая кислота
Причины ацидоза
(рис. 4.2)
Вступает в реакцию
с кальцием,образуя
нерастворимые
кристаллы оксалата
кальция,которые
осаждаются
в почечных
канальцах
Рис. 29.2. Метаболизм метанола и элитенгликоля
Метаболизм алкоголя: гипогликемия, гиперлактатемия и жировой гепатоз
69
€Ц Ферменты: номенклатура ферментов,
* кинетика ферментативных реакций, ингибиторы
Класс ферментов
Каталитическая функция
Пример
КФЗ
Гидролазы
Реакции гидролиза
(расщепление субстра¬
та с присоединением
молекулы воды
по месту разрыва)
КФ 3.1.3.9
Глюкозо-6-
фосфатаза
Класс ферментов
Каталитическая функция
Пример
КФ2
Трансферазы
Переносят функцио¬
нальные группы
от одного субстрата
к другому
КФ 2.7.1.11
6-фосфофрук-
токиназа-1
Цитозоль
Класс ферментов
Каталитическая функция
Пример
КФ5
Изомеразы
Перестраивают моле¬
кулы субстратов,
образуя изомеры
КФ 5.3.1.1
Триозофосфат-
изомераза
СОО'
h|nch
СОО'
I
с = о
I
сн,
I г
сн,
I г
СОО'
сн3
Аланин
ос-Кетоглутарат Глутамат
_L
Аланинаминотрансфераза
А
Класс ферментов
Каталитическая функция
Пример
КФ2
Трансферазы
Переносят функцио¬
нальные группы
от одного субстрата
к другому
КФ 2.6.1.2
Аланинамино¬
трансфераза
шя
Класс ферментов
Каталитическая функция
Пример
КФ1
Оксидоредуктазы
Переносят электроны
или атомы водорода
от одного субстрата
к другому
КФ 1.1.1.27
Лактатдегидро-
геназа
Класс ферментов
Каталитическая функция
Пример
КФ6
Л и газы
(синтетазы)
Соединяют молекулы
субстратов друг с дру¬
гом, используя энергии]
гидролиза АТФ
КФ 6.4.1.1
Пируват-
1 карбоксилаза
Малат•
дегидрогеназа
Окса-
Класс ферментов Каталитическая функция
Пример
КФ4
Лиазы
Расщепление
субстрата
(не гидролиз)
КФ 4.1.3.6
Цитратлиаза
V ь 1 I
V лоацетат
НАДН+Н+ н2°
Z'-(игра Г\
I сингаза X
Рис. ЗОЛ. Классификация ферментов
Номенклатура ферментов
Здесь приведены номенклатура и классификация ферментов,
рекомендованные Международным союзом по биохимии и
молекулярной биологии 1UBMB www.chem.qmul.ac.uk/iubmb.
Выделяют 6 классов ферментов (КФ1, КФ2, КФЗ и т.д.),
которые, в свою очередь, делятся на подклассы (рис. 30.1).
Кинетика ферментативных реакций:
график зависимости скорости реакции
от концентрации субстрата
На рис. 30.2 приведен график зависимости начальной ско¬
рости ферментативной реакции от концентрации субстрата.
Скорость реакции (V) возрастает пропорционально повыше-
70
Ферменты: номенклатура ферментов, кинетика ферментативных реакций, ингибиторы
Рис. 30.3. График фермента Лайнуивера—Берка (график
Михаэлиса—Минтен в обратных координатах)
S
S
=г
х:
я
ОЭ
О.
А
Н
О
о
а.
о
х:
О
Рис. 30.4. График фермента Михаэлиса—Минтен в присутствии Рис. 30.5. График фермента Лайнуивера-Берка в присутствии
ингибиторов конкурентного и неконкурентного типа ингибиторов конкурентного и неконкурентного типа
нию концентрации субстрата (S) до тех пор, пока все актив¬
ные центры фермента не будут работать с максимальной
интенсивностью — тогда скорость реакции достигает своего
максимума (Vmax) (12 единиц). Из этого графика можно выве¬
сти константу Михаэлиса—Минтен (Km). По определению,
Km — это «концентрация субстрата, при которой скорость
реакции составляет половину от максимальной (Vmax/2)». Иа
рис. 30.2 Km = 1 ммоль/л.
Если вместо концентрации субстрата и скорости реак¬
ции взять обратно пропорциональные им величины, зависи¬
мость становится линейной. Такой график, изображенный на
рис. 30.3, называется графиком Лайнуивера—Берка.
Конкурентное и неконкурентное ингибирование
На рис. 30.4 показано, как выглядит график Михаэлиса-
Минтен (зависимость V от [S]) без ингибиторов и в при¬
сутствии ингибиторов конкурентного или неконкурентного
типа. Рисунок 30.5 иллюстрирует те же процессы в коор¬
динатах Лайнуивера-Берка (т.е. в обратных координатах).
Приведенный на рис. 30.4 фермент в отсутствие ингибитора
имеет Vmax= 10 единиц и Km = 2 ммоль/л.
Ингибиторы конкурентного типа используются в качестве
лекарств. По своей структуре они сходны с природным суб¬
стратом и поэтому конкурируют с ним за доступ к сайту
связывания на ферменте. Так, противоопухолевый препарат
метотрексат имеет структурное сходство с фолатом — субстра¬
том дигидрофолатредуктазы (гл. 58). Метотрексат использует¬
ся для ингибирования дигидрофолатредуктазы при химио¬
терапии рака.
Из рис. 30.4 следует, что ферменту в присутствии инги¬
битора конкурентного типа требуется большее количество
субстрата, чтобы «выиграть» соревнование с ингибитором.
При достаточном количестве субстрата ингибитор-конкурент
уступает первенство ферменту, и последний может работать
с максимальной скоростью Vmax. Примечание: конкурентный
ингибитор закрывает сайт связывания субстрата на фермен¬
те, тем самым уменьшая сродство фермента к субстрату;
другими словами, он повышает Кт (в приведенном примере до
4 ммоль/л), но Vmax при этом остается неизменной.
Ингибиторы неконкурентного типа. Ингибитор неконку¬
рентного типа связывается не с субстратсвязываюшим сай¬
том, а с другим сайтом фермента, поэтому ингибирующий
эффект нельзя преодолеть посредством повышения концен¬
трации субстрата. Чтобы понять принцип неконкурентно¬
го ингибирования, достаточно запомнить, что для каждого
субстрата существует свой сайт связывания. Таким образом,
повышение концентрации одного субстрата никак не повли¬
яет на связь ингибитора с ферментом, который блокирует
другой (несубстратсвязываюший) сайт фермента. Поэтому
ингибиторы неконкурентного типа блокируют определенную
долю молекул фермента, не изменяя Km, но понижая Vmax на
некоторый постоянный процент.
Ферменты: номенклатура ферментов, кинетика ферментативных реакций, ингибиторы
71
Регуляция активности ферментов
Регуляция активности ферментов через доступность кофакторов
Общепринятой терминологии не существует; ниже приведены
термины, используемые в данном издании. Кофактором назы¬
ваются вещества как органические, так и неорганические, необ¬
ходимые для проявления активности фермента. Так, все пере¬
численные ниже вещества являются кофакторами.
Кофермент
Коферменты — это растворимые органические молекулы,
которые способны связываться с различными ферментами
и отделяться от них, например, НАД+ является коферментом
различных дегидрогеназ (гл. 9).
Простетическая группа
Простетическая группа — это органическая молекула, кова¬
лентно связанная со своим ферментом на протяжении всего
периода его существования. Пример простетической группы —
ФДД
Металлозависимые ферменты
Для ряда ферментов в роли кофакторов выступают раствори¬
мые ионы металлов, например Mg++. Mg++ связывается с АТФ
и обеспечивает необходимую структуру субстрата для киназных
реакций (например, для гексокиназной реакции).
Металлоферменты
У этих ферментов катионы металлов входят в структуру фер¬
мента. Пример цинксодержашего металлофермента — алко-
гольдегидрогеназа. Она содержит цинк, связанный с атомом
серы цистеина — аминокислоты, которая входит в состав
активного центра фермента.
Быстрая ~
регуляция
Занимает не¬
сколько секунд.
При быстрой
регуляции изме¬
няется актив¬
ность фермента
Регуляция
активности
ферментов
За счет наличия
кофакторов
или субстратов
За счет присут¬
ствия аллосте¬
рических инги¬
биторов или
активаторов
Путем обратимого
фосфорилирования/
дефосфорилирования,
осуществляемых
ферментами
протеинкиназами/
фосфатазами
Путем ковалент- _
ных модификаций -
Активация
проферментов
путем протеолиза
I
!
Гликоген
Глюкоза
удф.глюкоза
-► Фоофофрукто-
киназа-1
Глюкозо-
1 -фосфат
^.Глюкозо-
6-фосфат
t
Фруктозо-
6-фосфат
к АТФ
Кадф
Фруктозо-
1,6-бисфосфат
Гликолиз
Г”
Холестерол
Медленная
* регуляция
Занимает несколько
часов или дней.
При медленной ре¬
гуляции изменяется
количество молекул
фермента
Путем повышения (или понижения) интен¬
сивности распада фермента. К молекулам
фермента присоединяется убиквитин. Он
служит сигналом для протеолитических
комплексов-протеосом, которые расщепляют
ферменты с убиквитиновыми метками
Путем увеличения (или уменьшения) скорости
синтеза фермента. Регулируется синтез белка
в рибосомах на уровне транскрипции или
трансляции
Холестерол
t
Мевалонат
НАДФ+
ГМГ-КоА-редуктаза
НАДФН+Н+—^
Г идроксиметил-
глутарил-КоА
(ГМГ-КоА)
Рецепторы
лпнп
движутся
к мембране
Аминокислоты'
ф Жирные киоооты
Глицерол
Синтез
ГМГ-КоА-редуктазы
и рецепторов ЛПНП
регулируется
SREBP-2
© Высокий уровень хслестерола
© Низкий уровень холестерола
Холестерол
J
Мевалонат
~ -+■ | ’ КоА-
[реиуктаза
ГМГ-КоА
Ацетил-КоА
Пируват
Регуляция на уровне экспрессии генов
Уровень холестерола контролируется путем регуляции его
образования и выведения в печени (гл. 38 и 41). Регуляторным
ферментом синтеза холестерола является ГМГ-КоА-редуктаза.
Поглощение холестерола печенью из крови, где он присут- 5
ствует в составе ЛПНП, осуществляется с участием рецепторов
ЛПНП клеток печени. Под действием высокой концентрации
холестерола в клетках печени происходит подавление синтеза
ГМГ-КоА-редуктазы и рецепторов ЛПНП. Это происходит с |
участием фактора транскрипции SREBP-2, который регули¬
рует экспрессию этих генов (Sterol Regulatory Element Binding I
Protein — белок, связывающий стерол-регулируемый элемент i
генов). Напротив, при низком уровне холестерола синтез ГМГ- |
КоА-редуктазы и рецепторов ЛПНП активируется.
~ —
72
Регуляция активности ферментов
Наличие коферментов
Активность многих ферментов зависит от присутствия в среде
их коферментов, например НАД+ (НАД+ можно рассматри¬
вать и как косубстрат). Для примера рассмотрим митохон¬
дриальный фермент малатдегидрогеназу. Малатдегидрогеназа
содержится в тканях, требующих большого количества энер¬
гии, например в мышцах. При активном аэробном синтезе
АТФ НАДН в дыхательной цепи окисляется до НАД+. При
наличии НАД+ малатде-
НАД
1*
Манат -
гидрогеназа катализирует
дегидрогеназа последнюю реакцию в цикле
*• Оксалоацетат {^ребса: она ОКИСЛЯвТ МЭЛЭТ
до оксалоацетата (рис. 16.1,
Т
НАДН+Н'
реакция 11). Таким образом, цикл Кребса продолжает свою
работу. Образующиеся в ходе цикла Кребса молекулы НАДН
поступают в дыхательную цепь, и синтез АТФ продолжает¬
ся. Однако при голодании в печени происходит р-окисление
жирных кислот с образованием большого количества молекул
НАДН. Часть их расходуется для синтеза АТФ, необходимо¬
го для глюконеогенеза и синтеза мочевины, однако темпы
образования НАДН превышают темпы его окисления. Таким
образом, НАДН накапливается в клетке. При высокой кон¬
центрации НАДН малатдегидрогеназа восстанавливает окса¬
лоацетат до малата, тем самым поддерживая глюконеогенез
(рис. 34.1, реакция 7).
Обратимое фосфорилирование
Протеинкиназы способны фосфорилировать определенные остат¬
ки серина, тирозина или треонина в белках, а протеинфосфата-
зы — дефосфорилировать их (см. гл. 27 и 29). Фосфорилирование и
дефосфорилирование изменяет конформацию ферментов и влияет
на их активность, повышая или понижая ее. Этот очень важный
^Гликогенсинтаза
Активная
протеинкиназа
Активная киназа-3
гликогенсинтазы
Гликоген
Синтез гликогена
Гликогенсинтаза
(неактивная)
Глюкозо-
1 -фосфат
Активная
протеинфосфатаза-1
механизм регуляции обеспечивается тем, что протеинкиназы и фос¬
фатазы составляют до 5% всех белков, кодируемых в геноме чело¬
века. Недавно было показано, что нарушения фосфорилирования
белков наблюдаются при целом ряде болезней — раке, диабете,
при воспалениях. Поэтому исследование протеинкиназ и фосфатаз
является мишенью для создания новых эффективных лекарств.
Метаболизм гликогена регулируется путем фосфорилирования/
дефосфорилирования белков (рис. 25.1,25.2 и гл. 27). Участвующие
в процессе белки обозначены картинками, чтобы учащемуся было
проще их запомнить. Гормоны адреналин (в мышцах) и глюкагон
(в печени) повышают концентрацию циклического АМФ и акти¬
вируют протеинкиназу А. Протеинкиназа А, взаимодействуя с дру¬
гими киназами (например, с конститутивно активной киназой-3
гликогенсинтазы), фосфорилирует до 9 остатков серина в гли-
когенсинтазе инактивирует ее. Протеинфосфатаза-1 (ее акти¬
вирует инсулин) дефосфорилирует гликогенсинтазу, тем самым
активирует ее.
Белок
Белок
с=о
H^NCH
J I
сн2он
Серин
АТФ „ АДФ
Протеин- ^
КсеринкиназаJ t
Протеин-
ф фосфатаза
С = 0
, I „
H+NCH О
J | II
сн,— О—Р—О"
г I
О'
U
Аллоотерические эффекторы
У ферментов существует сайт связывания субстрата. Субстраты
связываются с ним и превращаются под действием фермента в
продукт реакции. Некоторые ферменты имеют и другой сайт
связывания — так называемый аллостерический сайт, кото¬
рый регулирует активность фер¬
мента. При связывании аллосте¬
рического эффектора (ингибитора
или активатора) со своим (инди¬
видуальным) аллостерическим
центром происходит ингибирова-
фруктозо-6-фосфат
АТФ
Фосфофрук- 0
токиназа-^у
АДФ-
Фруктозо-2,6-
бисфосфат
Фруктозо-1,6-бисфосфат
Теоретическая кривая
графика Михазлиса-
Минтен
Концентрация АТФ (ммоль/л)
Рис. 31.1. Регуляция активности ферментов
ние или активация фермента. В качестве примера рассмотрим
фосфофруктокиназу-1, отвечающую за регуляцию энергетиче¬
ского обмена (в мышцах) и липогенеза (в печени). График пока¬
зывает, что в присутствии достаточного количества фруктозо-6-
фосфатапри повышении количества АТФ до 1 ммоль/л активность
фосфофруктокиназы-1 повышается, поскольку АТФ связывается
с сайтом связывания субстрата. Если бы фосфофруктокиназа-1
вела себя в соответствии с кинетикой Михаэлиса— Минтен
(рис. 30.2), то скорость реакции соответствовала бы черте пунк¬
тирной линии на рис. 31.1. Однако при более высоких концен¬
трациях АТФ связывается уже с ингибирующим аллостериче¬
ским сайтом фосфофруктокиназы-1 и подавляет ее активность.
Таким образом, АТФ является одновременно и субстратом, и
аллостерическим ингибитором фосфофруктокиназы-1. Но у
фосфофруктокиназы-1 существует очень сильный аллостериче¬
ский активатор — фруктозо-2,6-бисфосфат. Даже в очень низ¬
ких (микромолярных!) концентрациях фруктозо-2,6-бисфосфат
способен активировать фосфофруктокиназу-1. |Фруктозо-2,6-
бисфосфат синтезируется из фруктозо-6-фосфата ферментом
фосфофруктокиназой-2. В печени фосфофруктокиназа-2 акти¬
вируется инсулином (он стимулирует липогенез); в сердечной
мышце фосфофруктокиназа-2 активируется адреналином (он
стимулирует энергетический обмен.)] График иллюстрирует, что
при концентрации 1 мкмоль/л фруктозо-
2,6-бисфосфат отменяет ингибирующее
действие АТФ на фосфофруктокиназу-1.
Область физиологической
концентрации АТФ
Регуляция активности ферментов
73
Регуляция гликолиза и цикла Кребса
Глюкоза
V:'i!г: ■ "‘у' ;;;:.УНУ;'' '; ;;
Переносчик
глюкозы
(ГЛЮТ)
Глюкоза
!!!'!
Глюкокиназа (в печени)
АТФ
Гексокиназа
(в других тканях)
0*
АДФ
Глюкоэо-
6-фосфат
Фосфоглюкоизомераза
Гексокиназа
(ингибируется по принципу обрат¬
ной связи глюкозо-6-фосатом)
Фруктозо-
6-фосфат
к
■ Ф(Х
Цитозоль
Дигидр.
ацетон'
I
АТФ©
фосфофруктокиназа-1
ДФ Q
Фруктозо-1,6-
бисфосфат
Фруктозо-2,6-бисфосфат, АМФ
АТФ,
цитрат
Щш
осфа
Триозофосфат-
изомераза
Гликолиз
ш
НАД+—-
1,3-бисф
АДФ
АТФ^—"
3-фос<$ Аицерат
2-фос<ф| жцерат
Енолаза
Фосфоенолпируват
а ьдегид-
фат
ф«
Глицеральдегид-З-
фосфатдегидрогеназа
^ ►НАДН+Н+
оглицерат
Фосфоглицераткиназа
Фосфоглицеромутаза
АДФ
АТФ
•I
©
Пиру ват-
киназа
Активация по принципу прямой связи
фруктозо-1,6-бисфосфатом
Пируват
©
В печени ингибируется аланином и циклическим АМФ
(синтез циклического АМФ стимулирует глюкагон)
пгд;щ:ш!м
АДФ
Нуклеозиддифосфеткиназа
Дыхательная цепь
АТФ
Рис. 32.1. Регуляция гликолиза и цикла Кребса
74
Регуляция гликолиза и цикла Кребса
Регуляция гликолиза
В разных тканях гликолиз выполняет разные функции. В белых
мышцах, сетчатке и эритроцитах в процессе гликолиза осущест¬
вляется анаэробный синтез АТФ, а в качестве побочного продукта
образуется молочная кислота (см. гл. 17). При аэробном глико¬
лизе в мышцах образуется пируват, который окисляется в цикле
Кребса. Продукты цикла Кребса поступают в дыхательную цепь,
и уже в ней синтезируется АТФ. В печени и жировой ткани в
ходе аэробного гликолиза и пентозофосфатного пути образуется
пируват, используемый для синтеза жирных кислот. Помните,
что регуляция метаболических путей всегда имеет свою логику:
именно функция процесса определяет способы его регуляции.
На стадии поступления глюкозы в клетку процесс гликолиза
регулируется транспортерами глюкозы (ГЛЮТ), глюкокиназой
или гексокиназой, фосфофруктокиназой-1, пируваткиназой и
пируватдегидрогеназой.
Транспортеры глюкозы ГЛЮТ
Глюкоза поступает в клетку с помощью транспортеров глюкозы
(ГЛЮТ). Существует несколько типов транспортеров глюкозы —
ГЛЮТ1, ГЛЮТ2 и т.д. Все они расположены в плазматической
мембране, кроме ГЛЮТ4, который регулирует поступление глюко¬
зы в клетку и тем самым регулирует гликолиз в мышцах и жировой
ткани. При голодании молекулы ГЛЮТ4 располагаются во внутри¬
клеточных везикулах. После приема пищи под действием сигнала
инсулина происходит перемещение ГЛЮТ4 в плазматическую мем¬
брану, и клетка начинает интенсивно поглощать глюкозу.
Глюкокиназа и гексокиназа
Эти ферменты катализируют первую реакцию гликолиза — фос¬
форилирование глюкозы до глюкозо-6-фосфата. Гексокиназа
содержится во многих тканях; у этого фермента низкое значение
Km (т.е. высокое сродство к глюкозе). Гексокиназа по принципу
обратной связи ингибируется продуктом реакции — глюкозо-6-
фосфатом. Глюкокиназа содержится в печени и Р-клетках под¬
желудочной железы. У глюкокиназы, напротив, высокое значе¬
ние Km (т.е. низкое сродство к глюкозе). В печени она активна
при высоких концентрациях глюкозы (до 15 ммоль/л), которая
после приема углеводсодержащей пищи поступает из кишечника
в печень по воротной вене печени. (Важно: глюкокиназа нахо¬
дится в печени.)
Фосфофруктокиназа-1
Активация фосфофруктокиназы-1. Этот фермент активирует¬
ся фруктозо-2,6-бисфосфатом (Ф-2,6-бисФ). Кроме того, АМФ
также активирует фосфофруктокиназу-1. Высокие концентрации
АМФ говорят о том, что клетка испытывает педостаток в энергии
и требуется усилить синтез АТФ. Поэтому АМФ способствует
интенсификации гликолиза.
(Впечени образование фруктозо-2,6-бисфосфата активируется под
действием инсулина и ингибируется под действием глюкагона. В ске¬
летных мышцах образование этого вещества стимулируется высокой,
а ингибируется низкой концентрацией фруктозо-6-фосфата.)
Ингибирование фосфофруктокиназы-1. Высокая концентра¬
ция АТФ ингибирует фосфофруктокиназу-1, и интенсивность
гликолиза снижается. Кроме того, этот фермент ингибируется
цитратом.
Пируваткиназа
Ингибирование пируваткиназы. В печени пируваткиназу ингиби¬
руют аланин и циклический АМФ. Эти вещества образуются при
голодании. При голодании секретируется глюкагон, который
стимулирует синтез циклического АМФ. Аланин же образуется
при распаде мышечных белков при голодании и используется
для синтеза глюкозы в процессе глюконеогенеза (см. гл. 44).
При ингибировании пируваткиназы блокируется использование
фосфоенолпирувата в гликолизе, и в клетке интенсифицируется
глюконеогенез (рис. 46.2).
Активация пируваткиназы. В печени пируваткиназа активиру¬
ется фруктозо-1,6-бисфосфатом (активация по принципу прямой
связи). Этот процесс особенно важен при переходе от периода
голодания к липогенезу. При голодании пируваткиназа неактив¬
на, и в клетке интенсивно идет глюконеогенез, а при липогенезе
пируваткиназа активируется (см. гл. 23).
Пируватдегидрогеназа
Пи ру ват дегидрогеназа — комплекс из трех ферментов, который
расположен в митохондриях. Он контролирует скорость посту¬
пления пирувата в цикл Кребса.
Активация пируватдегидрогеназы. После приема богатой угле¬
водами пищи под действием инсулина происходит активация
пируватдегидрогеназы в печени и жировой ткани, где пируват
требуется для синтеза жирных кислот (см. гл. 23). Фермент также
активируется своим субстратом (пируватом) и коферментами КоА
и НАД+. Наконец, повышение концентрации АДФ также акти¬
вирует пируватдегидрогеназу. Уровень АДФ повышается, когда
клетка испытывает недостаток в энергии. Повышение концен¬
трации АДФ свидетельствует о необходимости активации цикла
Кребса и дыхательной цепи для синтеза АТФ.
Ингибирование пируватдегидрогеназы. Высокие концентрации
АТФ ингибируют пируватдегидрогеназу, и окисление пирувата в
цикле Кребса приостанавливается. Кроме того, активность фер¬
мента ингибируют продукты пируватдегидрогеназной реакции —
ацетил-КоА и НАДП. Такая ситуация создается при голодании,
когда в качестве источника энергии используются жирные кисло¬
ты, из которых образуется ацетил-КоА. В этом случае ингибиро¬
вание пируватдегидрогеназы способствует сохранению пирувата
для синтеза глюкозы. [Примечание: во время голодания пируват
образуется из резервных запасов, т.е. из глюкозы, образующейся
из гликогена и аминокислот, образующихся при распаде белков
мышц (см. гл. 46).]
Регуляция цикла Кребса
В разных тканях цикл Кребса выполняет разные функции. Так,
в мышцах и головном мозге в цикле Кребса ацетил-КоА окис¬
ляется с образованием НАДН и ФАДН2, которые используются
для синтеза АТФ в дыхательной цепи (см. гл. 11 —13). В печени
при голодании ацетил-КоА не окисляется в цикле Кребса. Вместо
этого цикл Кребса используется для синтеза малата из некоторых
аминокислот, который превращается в оксалоацетат и вступает
в глюконеогенез (см. гл. 46). После приема пищи ацетил-КоА в
печени и жировой ткани поступает в цикл Кребса на очень корот¬
кий период. В первой реакции цикла он преобразуется в цитрат,
затем экспортируется в цитозоль и используется для биосинтеза
жирных кислот (см. гл. 21).
Изоцитратдегидрогеназа
Изоцитратдегидрогеназа ингибируется при высокой концентра¬
ции НАДН. Кофермент изоцитратдегидрогеназы — НАД+. Когда
НАД+ восстанавливается до НАДН, изоцитратдегидрогеназа
инактивируется, поскольку ее кофермент отсутствует.
Нарушения активности пируватдегидрогеназы
Недостаточность тиамина
В нервной ткани ведущую роль в синтезе АТФ играют гликолиз и
дальнейший синтез ацетил-КоА в пируватдегидрогеназной реак¬
ции, который затем окисляется в цикле Кребса. Для нормально¬
го функционирования пируватдегидрогеназы необходим тиамин.
При недостаточности тиамина активность фермента снижается, и
нервная ткань испытывает недостаток в производимой энергии.
Развиваются гиперлактатемия, заболевания нервной системы; в
тяжелых случаях — болезнь Вернике, психоз Корсакова (см.
гл. 53). Недостаточность тиамина наблюдается при хроническом
алкоголизме, из-за плохого питания.
(Запомните, что, хотя ацетил-КоА может образовываться из
жирных кислот независимо от пируватдегидрогеназной реакции,
головной мозг не может использовать жирные кислоты в качестве
источника энергии, поскольку они не проходят через гематоэнце¬
фалический барьер.)
Болезнь Ли
Некоторые формы болезни Ли вызываются дисфункцией пирува-
дегидрогеназы (см. гл. 11).
Регуляция гликолиза и цикла Кребса 75
©Окисление жирных кислот для образования АТФ
(в мышцах) и кетоновых тел (в печени)
Выход АТФ при полном окислении пальмитата
Реакция
НАДН или
фадн2
Выход
АТФ
Ц Синтаза длинноцепочечного ацил-КоА
-2
Q Ацил-КоА-дегидрогеназа (х 7)
7 ФАДН2
10,5
Q L-3-гидроксиацил-КоА-дегидрогеназа (х7)
7 НАДН
17,5
Q Изоцитратдегидрогеназа
8 НАДН
20
Q а-Кетоглутаратдегидрогеназа
8 НАДН
20
Q Сукцинил-КоА-синтетаза/нуклеозиддифосфаткиназа
8
Q Сукцинатдегидрогеназа
8 ФАДН2
12
Q Малатдегидрогеназа
8 НАДН
20
ИТОГО 106
Примечание: в общем выходе реакции —106 молекул АТФ — не учитываются затраты энергии на транс¬
порт фосфата, эквивалентные 2 молекулам АТФ. Таким образом, на самом деле выход реакции составляет
104 молекулы АТФ [Salway J.G. Metabolism at a Glance. — 3rd ed. — Blackwell Publishing. — P. 38-39].
Жирные кислоты
поступают в мышцы
в качестве источника
энергии
▼
Пальмитат
Карнитиновая
челночная
система
Межмембранное
пространство
Дыхательная
цепь
Нуклеозиддифосфаткиназа
АТФ
Рис. 33.1. Окисление жирных кислот в мышцах и образование АТФ, необходимого для сокращения мышц
Глюкоза
Цитозоль
дфЧ^Т
ГФ-Л
2АТ<
Глюконеогенез
oxaloacetate-
2ГТФ ГДф СО,
Наружная мембрана
Трипальмит!
(триацилглицерол)^
Гормон-Л
I чулствитщ^мая
Iлипаза
используются
для синтеза
кетоновых тел
Жирные кислоты
переносятся
в печень, где „ „н^. ПаЛЬМИТЭТ (3)
игппльэиттгя ~ ' 9
KoA-SH
Карнитиновая
челночная система
► KoA-SH
Пальмитоил-КоА^
ПФ„+АМФ АТФ
- ^
Синтаза длинноцепочечного ацил-КоА
Межмембранное пространство
Внутренняя мембрана
^ Карнитинпальмитоилтрансфераза наружно^ мембраны
Пальмитоилкарнитин Карнитин
I Карнитинпальмитоилтрансфераза внутренней мембраны
KoA-SH
У
Пальмитоил-КоА(С1б)
Недостаточность карнитина
(первичная и вторичная)
Малат-#
Оксалоацетат восстанавли¬
вается до малата. Малат
выходит из митохондрии
в цитозоль и используется
в глюконеогенезе
Малатдегидрогеназа
■ ^ и. Оксало
пн*дн+н* ацетат'
Цитрат-
синтаза
Н-О
Ацетил-КоA KoA-SH
^ Ацетоацетил-КоА
► фАДНг
>Н*ДН-
P-Окисление
Цикл Кребса
Цитрат
>«*дн2
► НАДН+Н*
ФАД
дегидрогеназа
S* ФАДНг
Транс -Л2-^ноил- КоА
нр
Еиоил-КоА-
гидратаза
i10
Образование АТФ в мышцах
В аэробных условиях лучшим источником энергии для мышц
являются жирные кислоты, которые для образования АТФ
предварительно подвергаются (3-окислению (рис. 33.1).
Гидрокси-
метилглутарил-КоА
(ГМГ-КоА)
Ацетил-КоА
L-3-гидроксиацил-КоА
НАД+
ш L-3-гидрохсиацил-
КоА-дегидрогеназа
^НАДН-Щ"1
3-кетоЬцил-КоА
Образование АТФ и кетоновых тел в печени
При голодании или в случае неконтролируемого сахарно¬
го диабета жирные кислоты поступают в клетки печени и
транспортируются из цитозоля в митохондрии (рис. 33.2). Дая
переноса жирных кислот в матрикс митохондрий используется
карнатиновая челночная система.
Карнитиновая челночная система
Пальмитоил-КоА связывается с карнитнном, образуя пальмито-
нлкарннтин. Эту реакцию катализирует карнитинпальмитоил¬
трансфераза наружной мембраны митохондрий. Во внутренней
мембране митохондрий расположена другая карнитинпальмн-
тоилтрансфераза. Она катализирует обратную реакцию, расще¬
пляя пальмитоилкарнитин на карнитин и пальмитоил-КоА*.
При недостаточности карнитина жирные кислоты не
могут проникнуть в митохондрии, (3-окисление жирных кис¬
лот останавливается и развивается гипогликемия.
Кетогенез
При (3-окислении жирных кислот образуются ацетил-КоА,
НАДН и ФАДН2. НАДН и ФАДН2 окисляются в дыхатель¬
ной цепи, и образованный АТФ для обеспечения реакций
глюконеогенеза (см. гл. 34) и синтеза мочевины (см. гл. 44).
Из ацетил-КоА образуются кетоновые тела: ацетоацетат и
(3-гидрокснбутират. Из ацетоацетата в небольших количествах
образуется ацетон, поэтому от людей, использующих низко¬
углеводную диету, и от диабетиков при кетоацидозе при
выдохе исходит характерный фруктовый запах (изо рта) — это
запах ацетона. Примечание: когда еоотношение НАДН/HAJt
высокое (например, при диабетическом кетоацидозе) равнове-
* В отечественных учебниках биохимии эти ферменты принято
называть соответственно карнитинацилтрансфераза I и карнитина-
цилтрансфераза II. (Примеч. ред.)
Ацетоацетил-КоА
Реакция протекает спонтанно
Ацетон «— Ацетоацетат
Кетоновые тела -
ацетоацетат и (3-гидро-
ксибутират- выходят
из печени и использу¬
ются головным мозгом
и мышцами для их
обеспечения энергией
Миристоил - КоА
(С,а)
Кетогенез
^Тиолаза
' *
Ацетил-КоА
(З-Гидроксибутират
(3-гидроксибутират)
Рис. 33.2. Окисление жирных кислот в печени и образование
АТФ (для глюконеогенеза) и ацетил-КоА (для кетогенеза)
сие в fi-гидроксибутиратдегидрогеназной реакции смещается в
сторону образования fi-гидроксибутирата. Таким образом, при
диабетическом кетоацидозе концентрация (3-гидрокс и бутирата
может в 5 раз превышать концентрацию ацетоацетата.
Запомните: метод определения содержания кетоновых тел в
реакции с нитропруссидом позволяет измерять только кон¬
центрацию ацетоацетата, но не основного кетонового тела
Р - гид ро кс и бути рата.
Окисление жирных кислот для образования АТФ (в мышцах) и кетоновых тел (в печени) 77
ф
Регуляция липолиза, р-окиоления, кетогенеза
и глнжонеогенеза
Перенсчик
глюкозы
ГЛЮТ2
ЖИРОВАЯ ТКАНЬ
Глюкоза
Глюкоза
Е>м
i
Глюкозо-6-
J
фосфатаза
\
Глюкозо¬
б-фосфат
t0OC0OrntOK
изомераза
Фруктозо-
6-фосфат
Липолиз
н2о
Эндоплазматическим
Цитозоль
© Инсулин
© Глюкагон
Фруктозо-
1,6-бисфосфат
Печень
При голодании активируется
гормонзависимая липаза.
Она высвобождает жириые
кислоты из жировой ткани
рипальми
(триацилглиц
Адреналин,
глюкагон,
кортизол
Дигидр<
L
Апьдолаза
Jm
Глюконеогенез
ацетонфосфат трнозофосфатизомераза ГИД
НАД+-4—
НАДН+Н+ —'
1,3-бисф*
АДФ4—■
2ГТФ
ГДФ
2АТФ=:
3-фос4 •Аицерат
Аспартат
Оксалоацетс
НАДН+Н*"
НАД*
Фенил¬
аланин
и тирозин
2-фос<Щ>| 1ицерат
Енолаза
;Фосфоенолпируват
Поступает в печеиь
для глнжонеогенеза
альде-
юсфат
■— Ч
ГпицеральдешД’З-
фосфатдегиорогеназа
оглицерат
3- Фосфоглице-
раткиназа
<-
Глицерол
Пальмитат (3)
Фосфоглицеромутвза
Фосфоенолпируват-
!алаг- кврбоксикиназа
I егидрогеназа
НАД+ НАДН+Н+
Пирува т-
киназа (3)
Малат Лактат
! Пер<
|ликарбО!
Глюкагон,
аланин
Жирные кислоты связываются
с альбумином и с током крови
транспортируются к перифери¬
ческим органам (в том числе
и к печени)
Глицин, серин,
цистеин, аланин
’ KoA-SH
Пальмитат
Пирофосфатаза
П а льмито ил - Ко
• ЛФь+АМФ АТФ
J
Синтаза йлпиноцепочечнрго ацил-КоА |
Ацетил-КоА
активирует
пируваткар-
боксилазу
Пнруваткарбоксилаза
Ацетил-КоА ©
АДФ+Ф**-'
■ + НСОз-
Ацетил-КоА
нигибирует пиру-
ватдегидрогеназу
Жирные кислоты транспортируются
в митохондрии с помощью карнитиновой
челночной системы
Карнитин
Кариитиипальмитойптрансфераза внутренней мембраны
KoA-SH
Малат
Ф} 1 >ат
Пнруватде-
гидрогеназа
© Ацетил-КоА
НАДН+Н+ Ацетил-
Ацетил-КоА ■ и» Ацетоацетил-КоА''
( \
(3-Окисление
Пальмитоил-КоА(С1б)
L Малатде-
гидрогеназа
Фумараза
Н2°
Оксалоацетат^^-* Цитрат
' сингаза ^
А П |_| _L |_I +
Ацетил-
КоА
KoA-SH
НАДН+Н
г^ФАДНг
^р*£АДН+Н*"
+ФАДН2
^РЛАДН+Н+
^.ФАДНг
г ^НАДН+Н^
При р-окислении в митохоидриях
повышается отношение НАДН/НАД+.
Благодаря этому оксалоацетат
восстанавливается до малата
Так как оксалоацетат
используется в глюконео-
геиезе, ацетил-КоА
используется в кетогенезе
Кетоновые
тела
Цикл Кребса
-*ФАД1^
Сукцинат -
дегидрогеназа
- ФАД Сукцинил-
^коА - синтетаз.
со.
Сукци-
Изоцитрат-
дегидрогеназа t
со,
a-Кетоглутарат-
дегидрогеназа
а-Кетоглутарат
Транс -Л2-
Ацетоацетат
^ФАДН2
*+}АДН+Н*
рЬФАДНг
1ЛДН+Н*"
‘ ФАДН2
НАДН+Н*"
L-3-ri
НАДН+Н*
Изоцитрат 3“ гидроксибутират
фдд
Ацил-КоА -легилрпгрчяу
, ФАДНз
(нонл-КоА
н2о
Еноил-КоА-гидратаза
роксиацил-КоА
МАД+
СЗ-гидро*сиацнл-
КоА •дегидрогеназа
Кетогенез
♦ НАДН
З-кето цил-КоА
Ацетил-КоА
НИЛ-
.
КоА
k
НАД+
▼
*
•
Ntt,+HAflH+Hf
io2
При (3-окислении образуются ФАДН2 и
НАДН, которые окисляются в дыхательной
цепи. В дыхательной цепи происходит синтез
АТФ, и он используется для обеспечения
глюконеогенеэа и синтеза мочевины
ГДФ
Глутамат 4Н+
НАДН+Н+
НАД+
1
4Н+
2Н+
r'll ^ Ш Комллм^К^^|| Комплекс i
1 * |8Л|; i"
Изолейцин, валин,
метионин
АДФ
| Комплекс Я
IV
у
АН*1, ■
У
4Н*..
1 У
2Ht.
Глутамат, гистидин,
орнитин, пролин
;"■£ ЮН*
4Н*
Дыхательная цепь
АТФ
ж
АТФ
□
Рис. 34.1. Метаболические процессы в печени при голодании: липолиз, (3-окисление, глюконеогенез и кетогенез
78
Регуляция липолиза, р-окисления, кетогенеза и глюконеогенеэа
При голодании печень поддерживает нормальный
уровень глюкозы в крови
Главным источником энергии для головного мозга является глю¬
коза. Если в головной мозг поступает недостаточное количе¬
ство глюкозы (такое состояние называется нейрогликопенией),
человек впадает в кому. Так, при инсулиноме секреция инсу¬
лина повышена, и наблюдаются гипогликемия, обмороки,
расстройства поведения (иногда их ошибочно принимают за
эпилепсию или психиатрическое расстройство). С симптома¬
ми гипогликемии также хорошо знакомы больные сахарным
диабетом I типа; они вынуждены регулировать уровень глю¬
козы в крови приемами пищи и инъекциями инсулина.
Нормальный уровень глюкозы в крови натощак поддер¬
живается на уровне между 3,5 и 5,5 ммоль/л. Организм спо¬
собен регулировать уровень глюкозы в крови, несмотря на
огромные расходы глюкозы во время предельных нагрузок.
У спринтера на 100-метровой дистанции расходуется гликоген
мышц, а у бегуна-марафонца глюкоза образуется из триацил-
глицеролов гликогена мышц и печени. Даже при длительном
голодании (в течение нескольких недель) уровень глюкозы в
крови не опускается ниже 3,5 ммоль/л. Жизненно важную
роль в поддержании гомеостаза глюкозы играет печень (см.
гл. 23).
Гликоген печени
В первые несколько часов голодания глюкагон инициирует в
печени активацию распада гликогена (гликогенолиз), чтобы
не допустить падения уровня глюкозы в крови. Образованная
глюкоза поступает в кровь (рис. 26.1).
Что проиоходит, когда гликоген печени
израоходован
Глюконеогеиез. Запасов гликогена печени хватает на
24 ч. ГОЛОВНОЙ МОЗГ НЕ МОЖЕТ ИСПОЛЬЗОВАТЬ
ЖИРНЫЕ КИСЛОТЫ В КАЧЕСТВЕ ИСТОЧНИКА
ЭНЕРГИИ, А СИНТЕЗИРОВАТЬ ГЛЮКОЗУ ИЗ ЖИРНЫХ
КИСЛОТ НЕВОЗМОЖНО. Таким образом, уже через 24 ч
организм расходует все запасы углеводов (т.е. гликоген).
Головной мозг не может использовать в качестве источни¬
ка энергии жирные кислоты, получаемые из триацилглице-
ролов. Основным источником энергии для мозга остается
глюкоза, которая образуется из продуктов распада мышеч¬
ных белков. Да, в экстренных случаях требуются экстренные
меры! Итак, через 24 ч голодания глюкокортикоидный гор¬
мон кортизол активирует те метаболические пути, в кото¬
рых части мышечной ткани распадаются до аминокислот. Из
некоторых этих аминокислот теперь можно синтезировать
глюкозу в процессе глюконеогенеза. Таким образом, когда
гликоген печени израсходован, развивается атрофия мышц.
Примечание: именно поэтому больным, восстанавливающимся
поме обширных травм: хирургических вмешательств, ожогов,
синдрома длительного сдавливания, — требуется полноценное
питание. Заживление ран будет идти медленно, если больной
не ест и в его организме преобладают катаболические про¬
цессы, такие как атрофия мышц при глюконеогенезе.
Кетогенез. При голодании в печени из жирных кислот
образуются кетоновые тела. К счастью, после двух дней голо¬
дания головной мозг адаптируется к использованию кето¬
новых тел в качестве источника энергии. Теперь глюкоза
расходуется на минимальном уровне, и интенсивность глю¬
конеогенеза уменьшается.
Регуляция липолиза
Липолиз — процесс образования жирных кислот и глицеро-
ла из запасенных в белой жировой ткани триацилглицеролов.
Регулирует липолиз гормоночувствительиая липаза, которая
активируется гормонами, секретируемыми при голодании:
глюкагоном и кортизолом. При потреблении пиши инсулин
ингибирует гормоночувствительную липазу и обеспечивает
запасание триацилглицеролов. Примечание: в ходе липолиза
образуется глицерол, который используется для синтеза глю¬
козы в процессе глюконеогенеза. Жирные кислоты, высво¬
бождающиеся из жировой ткани, нерастворимы в водной
среде и не могут транспортироваться с током крови. Поэтому
они связываются с альбумином, и уже в таком виде кровь
доставляет их к периферическим тканям.
Регуляция р-окисления
Для р-окисления жирные кислоты необходимо доставить в
митохондрии. Транспорт жирных кислот через внутреннюю
мембрану митохондрий обеспечивает карнитиновая челноч¬
ная система (см. гл. 21). Малоиил-КоА ингибирует транспорт
жирных кислот в митохондрии, блокируя карпитинпальмито-
илтрансферазу наружной мембраны*. Малонил-КоА образует¬
ся при потреблении пищи, когда происходит синтез жирных
кислот. Чтобы эти жирные кислоты не были сразу же разру¬
шены в митохондриях в процессе р-окисления, малонил-КоА
ингибирует карнитиновую челночную систему.
Регуляция глюконеогенеза
Регуляторные ферменты глюконеогенеза находятся в печени
и почках.
1. Пируваткарбоксилаза (митохондриальный фермент) актив¬
на при наличии АТФ и биотина. Ее активирует ацетил-
КоА. Кортизол индуцирует синтез пируваткарбоксилазы.
2. Фосфоенолпируваткарбоксикиназа (цитозольный фермент)
активна при наличии ГТФ. Глюкагон индуцирует синтез
фермента, а инсулин подавляет его.
3. Фруктозо-1,6-бисфосфатаза (цитозольный фермент) инги¬
бируется фруктозо-2,6-бисфосфатом. Глюкагон запускает
распад фруктозо-2,6-бисфосфата, а инсулин — его образо¬
вание.
4. Глюкозо-6-фосфатаза — фермент эндоплазматического
ретикулума.
Регуляция кетогенеза
Интенсивность кетогенеза растет пропорционально концен¬
трации жирных кислот в крови. Кетогенез усиливается при
голодании и особенно при неконтролируемом сахарном диа¬
бете I типа, когда развивается диабетический кетоацидоз.
* В отечественных учебниках биохимии этот фермент принято
называть карнитинацилтрансфераза I, а фермент внутренней мембра¬
ны — карнитинацилтрансфераза II. (Примеч. ред.)
Регуляция липолиза, р-окисления, кетогенеза и глюконеогенеза
79
Строение липидов
CHJDH
I 2
снон
I
СН90Н
18 16 14 12 10 0 6 4 2
WVWWVVi
17 15 13 11 9 7 5 3
с-он
II
о
Рис. 35.1. Глицерол. Рис. 35.2. Пальмитиновая кислота (гексадекано-
Этот трехатом- вая кислота). Это насыщенная жирная кислота
ный спирт является из 16 атомов углерода (С(6). Все атомы углерода,
структурной основой кроме С1, образующего карбоксильную группу
молекул триацилгли- кислоты, полностью насыщены водородом
церолов
Рис. 35.3. Стеариновая кис¬
лота (октадекановая кисло¬
та). Это насыщенная жир¬
ная кислота из 18 атомов
углерода (С|8). Все атомы
углерода, кроме CI, обра¬
зующего карбоксильную
группу кислоты, полностью
насыщены водородом. На
рисунке приведена упро¬
щенная схема строения
кислоты, где атомы водо¬
рода не показаны
кислота. Это С,8:2 поли-
ненасыщенная жирная
кислота. Она состоит
из 18 атомов углерода и
содержит 2 цис-двойные
связи,
С12
у атомов С9 и
Рис. 35.7. Арахидоновая кисло¬
та. Это С20:4 полиненасыщенная
жирная кислота. Она состоит из
20 атомов углерода и содержит
4 цис-двойные связи, у атомов
С5, С8, С11 и С14. Примечание:
иногда ее неправильно называ¬
ют арахнидоновой кислотой.
Пожалуйста, не путайте грече¬
ское слово arakos (арахис, земля¬
ной орех) е arachnidae — пауками!
Арахидоновая кислота не имеет
никакого отношения к паукам!
Рис. 35.4. Цис-олеиновая кис¬
лота. Это С|8 | мононенасы-
щенная жирная кислота. Она
имеет одну двойную связь,
расположенную у атома угле¬
рода С9. Таким образом, не
все валентности атомов СЮ
и С9 насыщены водородом, и
каждый из них может присо¬
единить еще по одному атому
водорода. Обратите внима¬
ние, что половинки моле¬
кулы, разделенные двойной
связью, отклоняются от пря¬
мой линии на 30 градусов.
Определение цис- и транс¬
конфигурации приведено на
рис. 35.14
Рис. 35.6. у-Линоленовая кислота. Это С|8:3
полиненасыщенная жирная кислота. Она
состоит из 18 атомов углерода и содержит
3 цис-двойные связи, у атомов С6, С9 и CI2
Рис. 35.8. Эйкозапентаеновая кислота. Это С20:5 полиненасыщенная жирная кислота.
Она состоит из 20 атомов углерода и содержит 5 цис-двойных связей, у атомов С5,
С8, СП, С14 и С17. Номенклатура. Существует и другой способ обозначения атомов
углерода у жирных кислот, когда используются греческие буквы. Так, этот способ
часто используется в диетологии. Атом углерода в составе карбоксильной группы не
учитывается. Следующий за ним атом углерода называется а-, затем идет (3-, у- и так
до последней группы греческого алфавита — со. С обратной стороны цепочки идут
атомы col, со2, соЗ и т.д. По такой номенклатуре эйкозапентаеновая кислота — неза¬
менимая жирная кислота, содержащаяся в рыбьем жире, — называется юЗ-жирной
кислотой. Химики считают, что приоритет в номенклатуре соединений принадлежит
им, и обозначают последние атомы буквами п: пI, п2, пЗ и т.д.
о
м
сн2о- с
I О
I II
сно —с
I О
I II
сн,о- с
/VWVVWV
AAA/WVAA/
/VWVVWV
Рис. 35.9. Докозагексаеновая кислота. Это
С22;б полиненасыщенная жирная кислота.
Она состоит из 22 атомов углерода и содер¬
жит 6 цис-двойных связей, у атомов С4, С7,
СЮ, С13, С16, С20. Докозагексаеновая кис¬
лота —- незаменимая жирная кислота, содер¬
жится в рыбьем жире. По другой номенкла¬
туре относится к соЗ-жирным кислотам
Рис. 35.10. Триацилглицерол. Молекула триацилглицерола состоит из трех остатков
жирных кислот, связанных сложноэфирными связями с глицеролом — структурной
основой молекулы (отсюда и название «триацилглицерол»), В состав триацилглице¬
рола могут входить разные жирные кислоты. На рисунке показан вариант, когда все
три остатка жирных кислот являются остатками стеариновой кислоты. Такой тригли-
церол называется тристеарат. (В химии чаще используется термин «триацилглицерол»
Привычный в медицинской практике «триацилглицерид» подразумевает наличие в
молекуле «трех глицеролов», что неверно.)
80 Строение липидов
Рис. 35.11. Фосфатидная кислота. Эта молекула составляет осно¬
ву всех фосфолипидов. Как и триацилглицеролы, фосфатидная
кислота в качестве основы содержит глицерол, но в отличие от
них несет два остатка жирных кислот и одну фосфатную группу.
Когда фосфатная группа реагирует с ОН-группами некоторых
веществ — холина, этаноламина, серина или инозитола, образу¬
ются фосфолипиды: фосфатидилхолин, фосфатидилэтаноламин,
фосфатидилсерин и фосфатидилинозитол
Рис. 35.12. Холестерол
Рис. 35.13. Эфир холестерола. Когда холестерол этерифицируется
жирной кислотой, образуется эфир холестерола
Рис. 35.14. Цис- и транс-конфигурации жирных кислот. Термины «цис» и «транс» обозначают положение фрагментов молекулы по
отношению к двойной связи. В цис-олеиновой кислоте атомы водорода расположены по одну сторону от двойной связи. В транс¬
олеиновой кислоте они расположены по разные стороны от двойной связи (чтобы не путать эти понятия, просто вспомните, что
трансатлантические страны расположены по разные стороны от Атлантического океана). Обратите внимание, что в ненасыщенных
жирных кислотах трансконфигурации часть молекулы не отклоняется на угол в 30°. Такие ненасыщенные жирные кислоты по струк¬
туре и функциям близки к насыщенным жирным кислотам. Трансформы жирных кислот образуются при производстве маргарина,
в процессе гидрирования. Ненасыщенные жирные кислоты в составе триацилглицеролов жидкого растительного масла частично
гидрируются для получения твердого вещества — маргарина
Строение липидов 81
€\ Фосфолипиды (часть I): фосфолипиды
^ и сфинголипиды
Фосфолипиды
Фосфолипиды — важные компоненты клеточных мембран и
липопротеинов (см. гл. 37). Они относятся к амфифильным
соединениям, т.е. содержат гидрофобные и гидрофильные
участки и имеют сродство и к водной, и к неводной среде.
Гидрофобная часть молекулы фосфолипида может связы¬
ваться с молекулами липидов (которые также гидрофобны),
а гидрофильная часть молекулы связывается с водой. Таким
образом, фосфолипиды формируют «мостики» между водой
и липидами.
Все фосфолипиды построены на основе фосфатидной кис¬
лоты (рис. 36.1). Фосфатидная кислота состоит из «остова»
глицерола, двух остатков молекул жирных кислот и остатка
фосфорной кислоты, которые связаны с глицеролом эфир¬
ными связями. На рисунке приведен пример фосфатидной
кислоты, содержащей стеариновую кислоту. Фосфатная груп¬
па может реагировать с гидроксильными группами серина,
этаноламина, холина или инозитола. При этом образуются
фосфатидил серин, фосфатидил этанол амин, фосфатидилхолин
и фосфатидилинозитол соответственно.
Фосфатидилхолин
Фосфатидилхолин также называют лецитином. Это вещество
часто добавляют в пищевые продукты в качестве эмульгатора.
С его помощью липиды связываются с молекулами воды.
Респираторный дистресс-синдром новорожденных
Респираторный дистресс-синдром часто наблюдаетея у недо¬
ношенных детей. Незрелые легкие не могут образовать легочный
сурфактант — дипальмитоиллецитин. Если альвеолы спадаются
и не могут раскрыться из-за силы поверхностного натяжения
(это состояние называется ателектазом), развивается дыхательная
недостаточность. Дипальмитоиллецитин снижает сплу поверх¬
ностного натяжения и позволяет расшириться альвеолам ново¬
рожденного. Чтобы оценить, способны ли легкие плода нормаль¬
но функционировать, нужно измерить отношение концентраций
лецитина и сфингомиелина в околоплодных водах.
Фосфатидилинозитол
Фосфатидилинозитол — структурная основа всех фосфоино-
зитидов. Пример фосфоинозитида — фосфатидилинозитол-
82 Фосфолипиды (часть I): фосфолипиды и сфинголипиды
Ганглиозиды
М-ацетилгалак-|
тозамин I'
I
Галактоза — Глюкоза —
I
Сиаловая кислота
Церамид
Р - Гексозаминидаза А
Болезнь Тея-Сакса
Глобозиды
Галактоза —Галактоза— Глюкоза —Церамид
Из-за недостаточности (3-гексо-
Тригексозидцерамид
заминидаэы А накапливаются
ганглиозиды
и
Болезнь Фабри
Из-за недостаточности
Агалозидаза альфа
Ферментозаместнтельная
^ К|. о 11оти пга пэ1гтп#зэмии
а-Галактоцереброзидзза
а-галактоцереброзидазы
терапия
г 11 d цс 1 пл1 d j id 1ч i u/Od ivi и п
1
накапливаются глобозиды
▼
Галактоза— Глюкоза— Церамид
I
Сиаловая кислота
(N-ацетилнейраминовая
кислота, NANA)
Сульфат
I
Галактоза— Церамид
Нейрамииидаза
т
■* Галактоза—Глюкоза —Церамид
4
Глюкоза —Церамид
0-glucocerebrosidasi
Арилсульфатаза А
(цврвброзидсульфатаза.
Метахроматическая
лейкодистрофия
Недостаточность лизосомальной
арилсульфатазы А
Болезнь Гоше
Из-за недостаточности
р-глюкоцереброэидазы
накапливаются глюкоцереброэиды
Имиглюцераза
Ферментозаместительная
терапия
фосфат холина
Галактоза —
Церамид
Сфингомиелиназа
$-Галактоцереорозидаза
Болезнь Ниманна-Пика (А и В)
Недостаточность сфингомиелинаэы
Болезнь Краббе
и
Синдром Фарбера
Из-за недостаточности (3-галактоцереброзидазы
Церамидаза
Недостаточность церамидазы
накапливаются галактоцереброзиды
1
I4* Жирная кислота
Сфингомиелин
(церамид-фосфорилхолин)
Сфингозин
Рис. 36.3. Катаболизм сфинголипидов и сфинголипидозы
3,4,5,-трнсфосфат (ФИФ3), который участвует в трансдукции
сигнала инсулина (см. гл. 29).
Сфинголипиды
Сфинголипиды — основные структурные компоненты кле¬
точных мембран; особенно богат сфинголипидами миелин.
По строению сфинголипиды схожи с фосфолипидами, но
их гидрофильный остов представлен не глицеролом, а сери¬
ном (рис. 36.2). Основу сфинголипидов составляет сфингозин.
Сфингозин образуется в реакции между пальмитоил-КоА и
серином, в котором пальмитоил-КоА теряет один атом угле¬
рода, выделяющийся в виде С02. При N-ацетилировании
сфингозина образуются церамиды, которые входят в состав
многих сфинголипидов, например сфингомиелина. Кроме того,
церамид содержится в цереброзидах и ганглиозидах (соедине¬
ниях, содержащих остатки углеводов). Сфинголипидозы — это
болезни лизосом, при которых нарушена деградация сфинго-
миелинов (рис. 36.3). Накопление липидов в тканях приводит
к развитию заболеваний.
Сфингомиелин
Сфингомиелин состоит из церамида и фосфорилхолина
(рис. 36.2). Его также называют церамидфосфорилхолином.
По своему строению сфингомиелин аналогичен фосфатидил-
холину.
Цереброзиды
Цереброзид образуется при связывании моносахарида с пера-
мидом. Так, при связывании глюкозы с церамидом образуется
глюкоцереброзид (глюкозилерамид), а при связывании галак¬
тозы — галактозилцереброзид (галактоцерамид) (рис. 36.2).
Цереброзиды также называют «моногликозилцерамидами».
Глобозиды — цереброзиды, содержащие несколько углевод¬
ных остатков.
Болезнь Гоше
Среди лизосомных болезней накопления чаще всего встре¬
чается болезнь Гоше, которая наследуется по аутосомно-
рецессивному типу. Причина болезни — недостаточность
фермента (З-глюкоцереброзидазы (рис. 36.3). Это приводит
к избыточному накоплению глюкоцереброзида в головном
мозге, печени, костном мозге, селезенке. При болезни Гоше
I типа (без поражений нервной системы) проводится фер¬
ментозаместительная терапия: больные получают рекомби¬
нантную (3-глюкоцереброзидазу. Возможно, в будущем будет
использоваться генная терапия, основанная на переносе гена
p-цереброзидазы в ДНК кроветворных стволовых клеток.
Ганглиозиды и глобозиды
Ганглиозиды образуются при связывании церамида с олиго¬
сахаридом и N-ацетилнейраминовой кислотой (сиаловой кисло¬
той). Ганглиозиды составляют около 5% всех липидов голов¬
ного мозга.
Болезнь Фабри
Болезнь Фабри — редкая Х-сцепленная лизосомная болезнь,
при которой наблюдается недостаточность а-галактоцеребро-
зидазы А (см. рис. 36.3). Это приводит к накоплению в орга¬
низме глобозида церамидтригексозида (глоботриазилцерами¬
да). От этого страдают почки и сердечно-сосудистая система,
повышается риск инсульта. С 2002 г. для лечения болезни
Фабри доступна ферментозаместительная терапия с исполь¬
зованием рекомбинантной а-галактоцереброзидазы.
Фосфолипиды (часть I): фосфолипиды и сфинголипиды 83
При голодании печень поддерживает нормальный
уровень глюкозы в крови
Главным источником энергии для головного мозга является глю¬
коза. Если в головной мозг поступает недостаточное количе¬
ство глюкозы (такое состояние называется нейрогликопенией),
человек впадает в кому. Так, при инсулиноме секреция инсу¬
лина повышена, и наблюдаются гипогликемия, обмороки,
расстройства поведения (иногда их ошибочно принимают за
эпилепсию или психиатрическое расстройство). С симптома¬
ми гипогликемии также хорошо знакомы больные сахарным
диабетом I типа; они вынуждены регулировать уровень глю¬
козы в крови приемами пищи и инъекциями инсулина.
Нормальный уровень глюкозы в крови натощак поддер¬
живается на уровне между 3,5 и 5,5 ммоль/л. Организм спо¬
собен регулировать уровень глюкозы в крови, несмотря на
огромные расходы глюкозы во время предельных нагрузок.
У спринтера на 100-метровой дистанции расходуется гликоген
мышц, а у бегуна-марафонпа глюкоза образуется из триацил-
глицеролов гликогена мышц и печени. Даже при длительном
голодании (в течение нескольких недель) уровень глюкозы в
крови не опускается ниже 3,5 ммоль/л. Жизненно важную
роль в поддержании гомеостаза глюкозы играет печень (см.
гл. 23).
Гликоген печени
В первые несколько часов голодания глюкагон инициирует в
печени активацию распада гликогена (гликогенолиз), чтобы
не допустить падения уровня глюкозы в крови. Образованная
глюкоза поступает в кровь (рис. 26.1).
Что происходит, когда гликоген печени
израсходован
Глюкоиеогенез. Запасов гликогена печени хватает на
24 ч. ГОЛОВНОЙ МОЗГ НЕ МОЖЕТ ИСПОЛЬЗОВАТЬ
ЖИРНЫЕ КИСЛОТЫ В КАЧЕСТВЕ ИСТОЧНИКА
ЭНЕРГИИ, А СИНТЕЗИРОВАТЬ ГЛЮКОЗУ ИЗ ЖИРНЫХ
КИСЛОТ НЕВОЗМОЖНО. Таким образом, уже через 24 ч
организм расходует все запасы углеводов (т.е. гликоген).
Головной мозг не может использовать в качестве источни¬
ка энергии жирные кислоты, получаемые из триапилглице-
ролов. Основным источником энергии для мозга остается
глюкоза, которая образуется из продуктов распада мышеч¬
ных белков. Да, в экстренных случаях требуются экстренные
меры! Итак, через 24 ч голодания глюкокортикоидный гор¬
мон кортизол активирует те метаболические пути, в кото¬
рых части мышечной ткани распадаются до аминокислот. Из
некоторых этих аминокислот теперь можно синтезировать
глюкозу в процессе глюконеогенеза. Таким образом, когда
гликоген печени израсходован, развивается атрофия мышц.
Примечание: именно поэтому больным, восстанавливающимся
noaie обширных травм: хирургических вмешательств, ожогов,
синдрома длительного сдавливания, — требуется полноценное
питание. Заживление ран будет идти медленно, если больной
не ест и в его организме преобладают катаболические про¬
цессы, такие как атрофия мышц при глюконеогенезе.
Кетогеиез. При голодании в печени из жирных кислот
образуются кетоновые тела. К счастью, после двух дней голо¬
дания головной мозг адаптируется к использованию кето¬
новых тел в качестве источника энергии. Теперь глюкоза
расходуется на минимальном уровне, и интенсивность глю¬
конеогенеза уменьшается.
Регуляция липолиза
Липолиз — процесс образования жирных кислот и глицеро-
ла из запасенных в белой жировой ткани триацилглиперолов.
Регулирует липолиз гормоночувствительная липаза, которая
активируется гормонами, секретируемыми при голодании:
глюкагоном и кортизолом. При потреблении пиши инсулин
ингибирует гормоночувствительную липазу и обеспечивает
запасание триацилглицеролов. Примечание: в ходе липолиза
образуется глицерол, который используется для синтеза глю¬
козы в процессе глюконеогенеза. Жирные кислоты, высво¬
бождающиеся из жировой ткани, нерастворимы в водной
среде и не могут транспортироваться с током крови. Поэтому
они связываются с альбумином, и уже в таком виде кровь
доставляет их к периферическим тканям.
Регуляция |3-окисления
Для (3-окисления жирные кислоты необходимо доставить в
митохондрии. Транспорт жирных кислот через внутреннюю
мембрану митохондрий обеспечивает карнитиновая челноч¬
ная система (см. гл. 21). Малонил-КоА ингибирует транспорт
жирных кислот в митохондрии, блокируя карнитинпальмито-
илтрансферазу наружной мембраны*. Малонил-КоА образует¬
ся при потреблении пиши, когда происходит синтез жирных
кислот. Чтобы эти жирные кислоты не были сразу же разру¬
шены в митохондриях в процессе (3-окисления, малонил-КоА
ингибирует карнитиновую челночную систему.
Регуляция глюконеогенеза
Регуляторные ферменты глюконеогенеза находятся в печени
и почках.
1. Пируваткарбоксилаза (митохондриальный фермент) актив¬
на при наличии АТФ и биотина. Ее активирует аиетил-
КоА. Кортизол индуцирует синтез пируваткарбоксилазы.
2. Фосфоенолпируваткарбоксикиназа (цитозольный фермент)
активна при наличии ГТФ. Глюкагон индуцирует синтез
фермента, а инсулин подавляет его.
3. Фруктозо-1,6-бисфосфатаза (цитозольный фермент) инги¬
бируется фруктозо-2,6-бисфосфатом. Глюкагон запускает
распад фруктозо-2,6-бисфосфата, а инсулин — его образо¬
вание.
4. Глюкозо-6-фосфатаза — фермент эндоплазматического
ретикулума.
Регуляция кетогенеза
Интенсивность кетогенеза растет пропорционально концен¬
трации жирных кислот в крови. Кетогенез усиливается при
голодании и особенно при неконтролируемом сахарном диа¬
бете I типа, когда развивается диабетический кетоацидоз.
* В отечественных учебниках биохимии этот фермент принято
называть карнитинацилтрансфераза 1, а фермент внутренней мембра¬
ны — карнитинацилтрансфераза 11. (Примеч. ред.)
Регуляция липолиза, (3-окисления, кетогенеза и глюконеогенеза
79
Строение липидов
СН.ОН
I 2
снон
I
сн.он
16 16 14 12 10 8 6 4 2
VWWVWV,
17 15 13 11 9 7 5 3
с-он
II
о
Рис. 35.1. Глицерол. Рис. 35.2. Пальмитиновая кислота (гексадекано-
Этот трехатом- вая кислота). Это насыщенная жирная кислота
ный спирт является из 16 атомов углерода (С)6). Все атомы углерода,
структурной основой кроме С1, образующего карбоксильную группу
молекул триацилгли- кислоты, полностью насыщены водородом
це ролов
Рис. 35.3. Стеариновая кис¬
лота (октадекановая кисло¬
та). Это насыщенная жир¬
ная кислота из 18 атомов
углерода (С18). Все атомы
углерода, кроме С1, обра¬
зующего карбоксильную
группу кислоты, полностью
насыщены водородом. На
рисунке приведена упро¬
щенная схема строения
кислоты, где атомы водо¬
рода не показаны
кислота. Это С18:2 поли-
ненасыщенная жирная
кислота. Она состоит
из 18 атомов углерода и
содержит 2 цис-двойные
связи, у атомов С9 и
С12
Рис. 35.7. Арахидоновая кисло¬
та. Это С2о:4 полиненасыщенная
жирная кислота. Она состоит из
20 атомов углерода и содержит
4 цис-двойные связи, у атомов
С5, С8, C1I и С14. Примечание:
иногда ее неправильно называ¬
ют арахнидоновой кислотой.
Пожалуйста, не путайте грече¬
ское слово arakos (арахис, земля¬
ной орех) с arachnidae — пауками!
Арахидоновая кислота не имеет
никакого отношения к паукам!
Рис. 35.4. Цис-олеиновая кис¬
лота. Это С|8:, мононенасы-
щенная жирная кислота. Она
имеет одну двойную связь,
расположенную у атома угле¬
рода С9. Таким образом, не
все валентности атомов СЮ
и С9 насыщены водородом, и
каждый из них может присо¬
единить еще по одному атому
водорода. Обратите внима¬
ние, что половинки моле¬
кулы, разделенные двойной
связью, отклоняются от пря¬
мой линии на 30 градусов.
Определение цис- и транс¬
конфигурации приведено на
рис. 35.14
Рис. 35.6. у-Линоленовая кислота. Это С|8:3
полиненасыщенная жирная кислота. Она
состоит из 18 атомов углерода и содержит
3 цис-двойные связи, у атомов С6, С9 и CI2
Рис. 35.8. Эйкозапентаеновая кислота. Это С20:5 полиненасыщенная жирная кислота.
Она состоит из 20 атомов углерода и содержит 5 цис-двойных связей, у атомов С5,
С8, СП, С14 и С17. Номенклатура. Существует и другой способ обозначения атомов
углерода у жирных кислот, когда используются греческие буквы. Так, этот способ
часто используется в диетологии. Атом углерода в составе карбоксильной группы не
учитывается. Следующий за ним атом углерода называется а-, затем идет (3-, у- и так
до последней группы греческого алфавита — to. С обратной стороны цепочки идут
атомы col, со2, соЗ и т.д. По такой номенклатуре эйкозапентаеновая кислота — неза¬
менимая жирная кислота, содержащаяся в рыбьем жире, — называется соЗ-жирной
кислотой. Химики считают, что приоритет в номенклатуре соединений принадлежит
им, и обозначают последние атомы буквами n: n 1, п2, пЗ и т.д.
сн "Л/wwwv
о
I II
сно —с
I О
I II
сн„о - с
M/VWWV
/WVWVW
Рис. 35.9. Докозагексаеновая кислота. Это
С22.6 полиненасыщенная жирная кислота.
Она состоит из 22 атомов углерода и содер¬
жит 6 цис-двойных связей, у атомов С4, С7.
СЮ, С13, С16, С20. Докозагексаеновая кис¬
лота — незаменимая жирная кислота, содер¬
жится в рыбьем жире. По другой номенкла¬
туре относится к соЗ-жирным кислотам
Рис. 35.10. Триацилглицерол. Молекула триацилглицерола состоит из трех остатков
жирных кислот, связанных сложноэфирными связями с глицеролом — структурной
основой молекулы (отсюда и название «триацилглицерол»), В состав триацилглице¬
рола могут входить разные жирные кислоты. На рисунке показан вариант, когда все
три остатка жирных кислот являются остатками стеариновой кислоты. Такой тригли-
церол называется тристеарат. (В химии чаше используется термин «триацилглицерол».
Привычный в медицинской практике «триацилглицерид» подразумевает наличие в
молекуле «трех глицеролов», что неверно.)
80 Строение липидов
Рис. 35.11. Фосфатидная кислота. Эта молекула составляет осно¬
ву всех фосфолипидов. Как и триацилглицеролы, фосфатидная
кислота в качестве основы содержит глицерол, но в отличие от
них несет два остатка жирных кислот и одну фосфатную группу.
Когда фосфатная группа реагирует с ОН-группами некоторых
веществ — холина, этаноламина, серина или инозитола, образу¬
ются фосфолипиды: фосфатидилхолин, фосфатидилэтаноламин,
фосфатидилсерин и фосфатид ил и нозитол
Рис. 35.12. Холестерол
Рис. 35.13. Эфир холестерола. Когда холестерол этерифицируется
жирной кислотой, образуется эфир холестерола
Рис. 35.14. Цис- и транс-конфигурации жирных кислот. Термины «цис» и «транс» обозначают положение фрагментов молекулы по
отношению к двойной связи. В цис-олеиновой кислоте атомы водорода расположены по одну сторону от двойной связи. В транс¬
олеиновой кислоте они расположены по разные стороны от двойной связи (чтобы не путать эти понятия, просто вспомните, что
трансатлантические страны расположены по разные стороны от Атлантического океана). Обратите внимание, что в ненасыщенных
жирных кислотах трансконфигурации часть молекулы не отклоняется на угол в 30°. Такие ненасыщенные жирные кислоты по струк¬
туре и функциям близки к насыщенным жирным кислотам. Трансформы жирных кислот образуются при производстве маргарина,
в процессе гидрирования. Ненасыщенные жирные кислоты в составе триацилглицеролов жидкого растительного масла частично
гидрируются для получения твердого вещества — маргарина
Строение липидов 81
€% Фосфолипиды (часть I): фосфолипиды
* и сфинголипиды
Рис. 36.1. Строение фосфолипидов
Фосфолипиды
Фосфолипиды — важные компоненты клеточных мембран и
липопротеинов (см. гл. 37). Они относятся к амфифильным
соединениям, т.е. содержат гидрофобные и гидрофильные
участки и имеют сродство и к водной, и к неводной среде.
Гидрофобная часть молекулы фосфолипида может связы¬
ваться с молекулами липидов (которые также гидрофобны),
а гидрофильная часть молекулы связывается с водой. Таким
образом, фосфолипиды формируют «мостики» между водой
и липидами.
Все фосфолипиды построены на основе фосфатидной кис¬
лоты (рис. 36.1). Фосфатидная кислота состоит из «остова»
глицерола, двух остатков молекул жирных кислот и остатка
фосфорной кислоты, которые связаны с глиперолом эфир¬
ными связями. На рисунке приведен пример фосфатидной
кислоты, содержащей стеариновую кислоту. Фосфатная груп¬
па может реагировать с гидроксильными группами серина,
этаноламииа, холина или инозитола. При этом образуются
фосфатидилсерии, фосфатидилэтаиоламии, фосфатидилхолии
и фосфатидилииозитол соответственно.
Фосфатидилхолин
Фосфатидилхолии также называют лецитином. Это вещество
часто добавляют в пищевые продукты в качестве эмульгатора.
С его помощью липиды связываются с молекулами воды.
Респираторный дистресс-снндром новорожденных
Респираторный дистресс-синдром часто наблюдается у недо¬
ношенных детей. Незрелые легкие не могут образовать легочный
сурфактант — дипальмитоиллецитин. Если альвеолы спадаются
и не могут раскрыться из-за силы поверхностного натяжения
(это состояние называется ателектазом), развивается дыхательная
недостаточность. Дипальмитоиллецитин снижает силу поверх¬
ностного натяжения и позволяет расшириться альвеолам ново¬
рожденного. Чтобы оценить, способны ли легкие плода нормаль¬
но функционировать, нужно измерить отношение концентраций
лецитина и сфингомиелина в околоплодных водах.
Фосфатидилииозитол
Фосфатидилииозитол — структурная основа всех фосфоино-
зитидов. Пример фосфоинозитида — фосфатидилииозитол-
N-aUeTI
тоз
Галак
Спало
л-Гексо*
Талакп
Сиал<
(N-aueTi
кис
С
Арилсу/
(церебР03*1
Су
Рис. 36..
3,4,5,-т|
сигнала
Сфинг
Сфинго.
точных
По стрс
их гцдр<
ном (рис
Сфинго
серином
рода, Bi
сфингоз
многих с
иерамид
ниях, со
болезни
миелине
к развит
Сфинго!
Сфинго»
(рис. 36
По свое;
холину.
Церебрс
Церебро
милом. 1
глюкоцер
тозы —
82 Фосфолипиды (часть 1): фосфолипиды и сфинголипиды
КП
Ганглиозиды
N-ацетилгалак-^
тозамин |
I
Галактоза-Глюкоза — Церамид
I
Сиаловая кислота
Ъ-Гвксозаиинидаза А
Болезнь Тея-Сакса
Из-за недостаточности р-гексо-
заминидаэы А накапливаются
ганглиозиды
Глобозиды
Галактоза — Галактоза — Глюкоза — Церамид
Тригексозидцерамид
^ N-ацетилгалактозамин
а-Галактоцереброзидаза
Болезнь Фабри
Из-за недостаточности
а-галактоцереброзидазы
накапливаются глобозиды
Агалозидаза альфа
Ферментоэаместительная
терапия
Галактоза - Глюкоза— Церамид
I
Сиаловая кислота
(N-ацетилнейраминовая
кислота, NANA)
Сульфат
I
Галактоза— Церамид
Нейраминидаза
т
Г ал актоза—Глюкоза — Церамид
•1
Глюкоза - Церамид
Арилсульфатаза А
(цереброзадсульфатаза
С V
Метахроматическая
лейкодистрофия
Недостаточность лизосомальной
арилсульфатазы А
3-glucocerebrosidast
Болезнь Гоше
Имиглюцераза
Из-за недостаточности
Ферментозаместительная
(3-глюкоцереброзидаэы
терапия
накапливаются глюкоцереброзиды
Фосфат холина
Галактоза— Церамид
(3-Галактоцере
1
Церамид
Сфингомиелиназа
Болезнь Краббе
Из-за недостаточности (3-галактоцереброзидазы
накапливаются галактоцереброзиды
Болезнь Ниманна-Пика (А и В)
Недостаточиость сфингомиелиназы
Сфингомиелин
(церамид-фосфорилхолин)
Синдром Фарбера
церамщ]аза1 Недостаточность церамидазы
Жирная кислота
Сфингозин
Рис. 36.3. Катаболизм сфинголипидов и сфинголипидозы
3,4,5,-трнсфосфат (ФИФ3), который участвует в трансдукции
сигнала инсулина (см. гл. 29).
Сфинголипиды
Сфинголипиды — основные структурные компоненты кле¬
точных мембран; особенно богат сфинголипидами миелин.
По строению сфинголипиды схожи с фосфолипидами, но
их гидрофильный остов представлен не глицеролом, а сери¬
ном (рис. 36.2). Основу сфинголипидов составляет сфингозин.
Сфингозин образуется в реакции между пальмитоил-КоА и
серином, в котором пальмитоил-КоА теряет один атом угле¬
рода, выделяющийся в виде С02. При N-ацетилировании
сфингозина образуются церамиды, которые входят в состав
многих сфинголипидов, например сфингомиелина. Кроме того,
церамид содержится в цереброзидах и ганглиозидах (соедине¬
ниях, содержащих остатки углеводов). Сфинголипидозы — это
болезни лизосом, при которых нарушена деградация сфинго-
миелинов (рис. 36.3). Накопление липидов в тканях приводит
к развитию заболеваний.
Сфингомиелин
Сфингомиелин состоит из церамида и фосфорилхолина
(рис. 36.2). Его также называют церамидфосфорилхолином.
По своему строению сфингомиелин аналогичен фосфатидил-
холину.
Цереброзиды
Цереброзид образуется при связывании моносахарида с цера-
мидом. Так, при связывании глюкозы с церамидом образуется
глюкоцереброзид (глюкозилерамид), а при связывании галак¬
тозы — галактозилцереброзид (галактоцерамид) (рис. 36.2).
Цереброзиды также называют «моногликозилцерамидами».
Глобозиды — цереброзиды, содержащие несколько углевод¬
ных остатков.
Болезнь Гоше
Среди лизосомных болезней накопления чаще всего встре¬
чается болезнь Гоше, которая наследуется по аутосомно-
рецессивному типу. Причина болезни — недостаточность
фермента (З-глюкоцереброзидазы (рис. 36.3). Это приводит
к избыточному накоплению глюкоцереброзида в головном
мозге, печени, костном мозге, селезенке. При болезни Гоше
I типа (без поражений нервной системы) проводится фер¬
ментозаместительная терапия: больные получают рекомби¬
нантную p-глюкоцереброзидазу. Возможно, в будущем будет
использоваться генная терапия, основанная на переносе гена
Р-цереброзидазы в ДНК кроветворных стволовых клеток.
Ганглиозиды и глобозиды
Ганглиозиды образуются при связывании церамида с олиго¬
сахаридом и N-ацетилнейраминовой кислотой (сиаловой кисло¬
той). Ганглиозиды составляют около 5% всех липидов голов¬
ного мозга.
Болезнь Фабри
Болезнь Фабри — редкая Х-снепленная лизосомная болезнь,
при которой наблюдается недостаточность а-галактоцеребро¬
зидазы А (см. рис. 36.3). Это приводит к накоплению в орга¬
низме глобозида церамидтригексозида (глоботриазилцерами-
да). От этого страдают почки и сердечно-сосудистая система,
повышается риск инсульта. С 2002 г. для лечения болезни
Фабри доступна ферментозаместительная терапия с исполь¬
зованием рекомбинантной а-галактоцереброзидазы.
Фосфолипиды (часть I): фосфолипиды и сфинголипиды 83
Ф Фосфолипиды (часть II): мицеллы, липосомы,
липопротеины и мембраны
Рис. 37.1. Фосфолипиды. Молекула фосфолипида содержит
гидрофильный участок, например, фосфорилсерин или фосфо-
рилхолин. На рисунке он обозначен уточкой («гидрофильный»
означает «любящий воду»)
Рис. 37.2. Мицеллы. Когда молекулы фосфолипидов оказыва¬
ются в водной среде, они связываются друг с другом, образуя
мицеллы. Мицелла — сферическое образование. Внутри нее рас¬
положены гидрофобные части молекул, образующие ядро мицел¬
лы, а гидрофильные части обращены наружу и связываются с
окружающими молекулами воды
Рис. 37.3. Липосомы. Это небольшие искусственные везикулы.
Они образуются при интенсивном перемешивании фосфолипи¬
дов в воде или при воздействии ультразвука. Липосомы исполь¬
зуют в качестве капсул для гидрофильных лекарств. Так, они
позволяют проникать в клетки некоторым лекарствам против
рака. Кроме того, липосомы используются при создании косме¬
тических средств
Холестерол-, г Фосфолипид
Рис. 37.4. Липопротеины. Это макромолекулярные комплексы,
с помощью которых осуществляется транспорт липидов в токе
крови. Во внешнем слое липопротеинов содержатся фосфолипи¬
ды и белки, а ядро составляют гидрофобные триацилглицеролы
и эфиры холестерола. Классификация липопротеинов основана
на различиях в их плотности, которые позволяют разделить эти
частицы при центрифугировании. Плотность зависит от состава
липопротеина: от соотношения белков (веществ с высокой плот¬
ностью) и липидов (веществ с низкой плотностью) в их соста¬
ве. Так, например, липопротеины высокой плотности на 50%
состоят из белков и имеют максимальную плотность, тогда как
хиломикроны, в которых белки составляют лишь 1%, и липопро¬
теины очень низкой плотности имеют самую низкую плотность
Фосфолипид
Холестерол
I ■.... 1...4ьцда?
Рис. 37.5. Мембраны. Мембраны клеток млекопитающих органи¬
зованы как бимолекулярный слой и содержат молекулы фосфо¬
липидов, белков и холестерола
i
84 Фосфолипиды (часть II): мицеллы, липосомы, липопротеины и мембраны
Таблица 37.1. Аполипопротеины и их свойства. Аполипопротеины расположены в наружном белоксодержащем слое липопротеинов. Они в зна¬
чительной мере определяют свойства разных липопротеинов
АпоА1
Содержится в ЛПВП (где составляет 90% всех белков), в хиломикронах (3%). Имеет высокое сродство к холестеролу.
Удаляет холестерол из клеток. Активирует лецитин:холестерол-ацилтрансферазу
АпоВ48
Содержится в хиломикронах. Образуется в кишечнике во время всасывания жиров и активного биосинтеза триацилглице-
ролов
АпоВЮО
Содержится в ЛПОНП и их производных — ЛППП, ЛПНП. Образуется в гепатоцитах, когда происходит синтез триацилгли-
церолов и холестерола. Связывается с рецептором
АпоС2
Содержится в хиломикронах и ЛПОНП. Активирует липопротеинлипазу, когда хиломикроны и ЛПОНП достигают тканей-
мишеней
АпоЕ
Содержится в хиломикронах, ЛПОНП, ЛПВП. Связывается с рецептором
Таблица 37.2. Липопротеины плазмы крови. Как показано на рис. 37.4, липопротеины имеют сферическую форму и состоят из гидрофильной
оболочки и гидрофобного ядра, содержащего липиды. Их функция заключается в транспорте липидов в водной среде крови. Внешняя поверх¬
ность липопротеинов богата фосфолипидами и аполипопротеинами (табл. 37.1), состав которых во многом определяет свойства липопротеинов
Липопротеины плазмы крови
Хиломикроны
Липопротеины
очень низкой плот¬
ности (ЛПОНП)
Липопротеины
промежуточной
плотности (ЛППП)
Липопротеины
низкой плотности
(ЛПНП)
Липопротеины высокой плотности
(ЛПВП)
А1 *ИЛ0МИКр0нЬ' ^
в £
/
ЛпоНГ1 02
V-rf
\т
ЛппП
iei^
ЛпнП
fcarifqr*^
; 0 :
\щ
А1 ЛПВГ1С2
Образуется
В кишечнике
В печени
Из ЛПОНП
Из ЛПОНП
и ЛППП
В кишечнике и печени
Функция
Транспорт поступив¬
ших с пищей триацил-
глицеролов и холе¬
стерола из кишечника
к периферическим
тканям
Прямой транс¬
порт эндогенных
триацилглицеролов
и холестерола из
печени к перифери¬
ческим тканям
Предшественник
ЛПНП
Транспорт холе¬
стерола
1. Осуществляет обратный транспорт
холестерола из периферических тка¬
ней в печень.
2. Запасает аполипопротеин С2
и аполипопротеин Е, которые
передает хиломикронам и ЛПОНП.
3. Собирает аполипопротеины, высво¬
бождающиеся из хиломикронов
и ПОНП при действии на них липопро-
теинлипазы в капиллярах
Содержание веществ, %
Триацилглице-
ролы
90
65
30
10
2
Холестерол/
Холестеро-
ловый эфир
5
13
40
45
18
Фосфолипиды
4
12
20
25
30
Белки
1
10
10
20
50
Фосфолипиды (часть II): мицеллы, липосомы, липопротеины и мембраны
85
1 Синтез холестерола из углеводов и жиров
j£
Аторвастатин,
ловастатин,
мевастатинР,
правастатин,
симвастатин
Гликопротеиды
1
Долихол «
Убихинон <
Убихинон необходим
для синтеза АТФ
в дыхательной
цепи (см. гл. 15)
Дыхательная цепь
Некоторые больные, принимающие
ингибиторы ГМГ-КоА-редуктазы
(статины), жалуются на мышечную
слабость. Поскольку статины
снижают темпы образования
убихинона. возможно, в этих
случаях эффективным окажется
дополнительный прием убихинона
Витамин D
Транспортируется
из печени в составе
ЛПОНП (см. гл. 39)
Этерификация холестеро-
ла лецитин:холестерол-
ацилтрансферазой
Лецитин
(фосфатидилхолин)
Лизолецитин —
Лецитин:холестерол-
ацилтрансфераза (см. гл. 41, 42)
1
Фарнезил-
пирофосфат
Солнечный
свет
7-дегидрохолестерол
Синтез солей
желчных кислот
[г05
^ НАДФН+Н*
Ацетмл-КоА (~)
»надф-
Ингибируется
холатом
7-а-гидроксилаза
Рис. 38.1. Образование холестерола из углеводов и жиров
86 Синтез холестерола из углеводов и жиров
1
Холестерол: польза или вред
Холестерол относится к липидам. Свое название он получил
от греческих корней chole (желчь) и ster (твердый). Дело в
том, что холестерол содержится в желчи и при избыточной
концентрации кристаллизуется, образуя «твердую желчь», т.е.
желчные камни. В английском названии cholesterol «ol» ука¬
зывает на то, что это вещество является спиртом. Холестерол
выполняет целый ряд функций в организме. Так, он входит
в состав клеточных мембран. Из холестерола синтезируются
соли желчных кислот (рис. 38.1) и стероидные гормоны —
альдостерон, кортизол, тестостерон, прогестерон и эстрогены
(см. гл. 43). Однако, если уровень холестерола в крови слиш¬
ком высокий, холестерол откладывается на внутренних стен¬
ках артерий и развивается атеросклероз. Холестерол также
может откладываться в мягких тканях в виде желтых отло¬
жений, образуя ксантомы (от греческого xantho — желтый)
сухожилий, ладоней, роговицы и ксантелазмы.
Биосинтез холестерола
Холестерол может синтезироваться из поступающих
с пищей углеводов или триацилглицеролов
В печени холестерол образуется с использованием метаболи¬
тов глюкозы. Так, при ее метаболизме в пентозофосфатном
пути синтезируется НАДФН, в гликолизе образуется пируват,
который под действием пируватдегидрогеназы превращает¬
ся в ацетил-КоА (рис. 38.1). В качестве источника ацетил-
КоА также может выступать процесс р-окисления жирных
кислот. Ацетил-КоА далее превращается в З-гидрокси-З-
метилглутарил-КоА (ГМГ-КоА). ГМГ-КоА-редуктаза (регу¬
ляторный фермент синтеза холестерола) восстанавливает
ГМГ-КоА до мевалоната, используя НАДФН. Мевалонат
через множество промежуточных соединений, которые не
показаны на рисунке, превращается в холестерол.
ГМГ-КоА-редуктаза регулирует биосинтез холестерола
Чтобы предотвратить гиперхолестеролемию и ее вредные
последствия для организма, необходимо регулировать био¬
синтез холестерола. Фермент, регулирующий синтез холесте¬
рола, — ГМГ-КоА-редуктаза. В многочисленных исследова¬
ниях, посвященных регуляции активности этого фермента,
было показано, что существует три механизма регуляции:
• активность ГМ Г-Ко А-редуктазы снижается в присутствии
продукта реакции — холестерола (ингибирование по прин¬
ципу обратпой связи);
• действие инсулина приводит к повышению активности
ГМ Г-Ко А-редуктазы, а глюкагона к ее понижению. Эти
гормональные эффекты опосредованы каскадами фос¬
форилирования белков, в результате которых ГМГ-КоА-
редуктаза активируется или ингибируется, аналогично
тому, как осуществляется регуляция метаболизма гликоге¬
на (см. гл. 27, 31);
• холестерол понижает уровень транскрипции гена ГМГ-КоА-
редуктазы, понижая образование мРНК, необходимой для
синтеза ГМГ-КоА-редуктазы (см. гл. 31).
Лечение гиперхолестеролемии статинами
Статины обратимо ингибируют активность ГМГ-КоА-
редуктазы и блокируют синтез холестерола. Поскольку кон¬
центрация холестерола снижается, усиливается экспрессия
генов рецепторов ЛПНП. В результате клетки интенсивно
эндоцитируют частицы ЛПНП, забирая больше холестерола в
системе ЛПНП из крови. Использование статинов в медици¬
не стало прорывом в предупреждении сердечно-сосудистых
заболеваний. Примечание: статины снижают темпы обра¬
зования предшественников холестерола: мевалоната и всех
остальных промежуточных соединений. В частности, ингиби¬
руется синтез фарнезилпирофосфата, предшественника убихи-
нона. Поскольку убихинон — необходимый компонент дыха¬
тельной цепи (см. гл. 11 — 13), в которой синтезируется АТФ,
полагают, что прием статинов может снижать образование
АТФ, необходимого для энергетического обмена в работаю¬
щих мышцах. Так, некоторые больные, принимающие ста¬
тины, жалуются на боли в мышцах и мышечную слабость.
Возможно, в таких случаях окажется эффективным дополни¬
тельный прием убихинона (кофермента Q!0).
Сопутствующие продукты в биосинтезе холестерола:
убихинон, долихол и витамин О
Выше было отмечено, что одним из важных сопутствующих
продуктов в биосинтезе холестерола является убихинон, необ¬
ходимый для функционирования дыхательной цепи. Однако
запомните и другие сопутствующие продукты: долихол (он
участвует в биосинтезе гликопротеидов) и витамин D (см.
гл. 51).
Прямой транспорт холестерола из печени к перифериче¬
ским тканям
Синтезированный в печени холестерол нужно доставить к
периферическим тканям. Однако холестерол нерастворим в
водной среде крови. Поэтому он включается в состав липо¬
протеинов очень низкой плотности (ЛПОПП) и уже в таком
виде с током крови доставляется к тканям (см. гл. 39). Сходным
образом осуществляется транспорт холестерола, поступившего
в организм с пищей. В клетках кишечника он включается в
состав гидрофильных сферических структур — хиломикронов,
которые уже транспортируются к тканям (см. гл. 37).
Обратный транспорт холестерола из перифрических
тканей в печень
Липопротеины высокой плотности (ЛПВП) забирают холе¬
стерол из тканей и переносят в печень (см. гл. 41). Часто
ЛПВП называют «хорошими липопротеинами», а холестерол
в их составе — «хорошим холестерол ом».
Биосинтез солей желчных кислот
Соли желчных кислот (хенодезоксихолат и холат) необхо¬
димы для эмульгирования липидов перед их всасыванием
в кишечнике. Их синтез из холестерола регулирует 7-а-
гидроксилаза.
Синтез холестерола из углеводов и жиров 87
ен aodeaox этж/09 atrig
Метаболизм ЛПОНП и ЛПНП
(прямой транспорт холестерола)
Транспорт холестерола в печень и из печени
Печень состоит из совокупности клеток, известных как
дольки печени (рис. 39.1). Каждая долька снабжается кро¬
вью из двух источников. Как и другие органы, долька печени
получает насыщенную кислородом кровь, которую приносит
печеночная артерия. Но, кроме того, дольки печени снабжа¬
ются и венозной кровью, поступающей от кишечника через
воротную вену печени. В этом отношении печень являет¬
ся уникальным органом. По воротной вене от кишечника к
печени поступают глюкоза и другие образованные при пище¬
варении вещества. Важно: хиломикроны не транспортируют¬
ся по воротной вене печени. С током лимфы они переносятся
по лимфатической системе и попадают в грудной проток, где
присоединяются к току крови. Продукты метаболизма выво¬
дятся из печени двумя путями. Большая часть веществ поки¬
дает печень через печеночную вену, расположенную в цен¬
тре дольки. Некоторые вещества — например, соли желчных
кислот — выводятся через желчный проток.
Синтез и транспорт холестерола
В печени происходит синтез холестерола из глюкозы (см.
гл. 38). Часть синтезированных молекул холестерола образу¬
ет сложные эфиры с жирными кислотами, формируя эфиры
холестерола — гидрофобные вещества [реакцию катализиру¬
ет ацил-КоА-холестеролацилтрансфераза (рис. 39.2)]. Вместе
с гидрофобными триацилглицеролами эфиры холестеро¬
ла упаковываются в ядро формирующихся незрелых частиц
ЛПОНП, которые покидают печень через печеночную вену и
движутся с током крови к периферическим тканям. В капил¬
лярах периферических тканей липопротеинлипаза удаляет из
QК СЕРДЦУ
i
Печеночная вена
ПЕЧЕНОЧНАЯ
ДОЛЬКА
Желчный проток
К КИШЕЧНИКУ Q
© ОТ СЕРДЦА
Е
L
Печеночная артерия
От кишечника
I ОТ КИШЕЧНИКА
Рис. 39.1. Кровь поступает к печеночной дольке через печеноч¬
ную артерию и воротную вену. По печеночной вене кровь выхо¬
дит из печеночной дольки
Прямой транспорт
холестерола (
к периферическим тканям
Рис. 39.2. Прямой транспорт холестерола к периферическим тка¬
ням и выведение холестерола в виде солей желчных кислот
ЛПОНП большую часть триацилглицеролов, гидролизируя
их до жирных кислот и глицерола. Образуются остаточные
ЛПОНП, или так называемые липопротеины промежуточ¬
ной плотности (ЛНПП), относительно богатые холестеролом.
В результате удаления аполипопротеина Е образуются части¬
цы ЛПНП. Они покидают кровь, связываясь с рецепторами
ЛПНП клеток и распадаясь на составляющие их вещества.
Синтезированный холестерол выводится из организма после
превращения в соли желчных кислот (см. гл. 38), которые
выводятся из печени через желчный проток в кишечник.
Здесь большая часть солей желчных кислот реабсорбируется
и поступает обратно в печень (это называется энтерогепати-
ческой циркуляцией).
Нарушение метаболизма ЛПНП
Гиперлипидемия II типа
При семейпой гиперхолестеролемии уровень холестерола в
сыворотке крови очень сильно повышен. Без лечения такие
больные умирают в молодом возрасте из-за ишемической
болезни сердца. Причина развития гиперхолестеролемии -
нарушение строения рецепторов ЛПНП. Из-за этого клетки
тканей не могут забирать ЛПНП из крови. ЛПНП накапли¬
ваются в крови, и их избыточная концентрация приводит к
развитию атеросклероза.
88 Метаболизм ЛПОНП и ЛПНП (прямой транспорт холестерола)
Прямой транспорт
холестерола (
)
к периферическим тканям
Рис. 39.2. Прямой транспорт холестерола к периферическим тка¬
ням и выведение холестерола в виде солей желчных кислот
ЛПОНП большую часть триацилглицеролов, гидролизируя
их до жирных кислот и глицерола. Образуются остаточные
ЛПОНП, или так называемые липопротеины промежуточ¬
ной плотности (ЛППП), относительно богатые холестеролом.
В результате удаления аполипопротеина Е образуются части¬
цы ЛПНП. Они покидают кровь, связываясь с рецепторами
лпнп клеток и распадаясь на составляющие их вещества.
Синтезированный холестерол выводится из организма после
превращения в соли желчных кислот (см. гл. 38), которые
выводятся из печени через желчный проток в кишечник.
Здесь большая часть солей желчных кислот реабсорбируется
и поступает обратно в печень (это называется эптерогепати-
ческой циркуляцией).
Нарушение метаболизма ЛПНП
Гиперлипидемия II типа
При семейной гиперхолестеролемии уровень холестерола в
сыворотке крови очень сильно повышен. Без лечения такие
больные умирают в молодом возрасте из-за ишемической
болезни сердца. Причина развития гиперхолестеролемии -
нарушение строения рецепторов ЛППП. Из-за этого клетки
тканей не могут забирать ЛПНП из крови. ЛПНП накапли¬
ваются в крови, и их избыточная концентрация приводит к
развитию атеросклероза.
Холестирамин,холестипол -
Положительно заряженные
ионообменные смолы. Они
связывают отрицательно за¬
ряженные соли жирных кислот,
и этот комплекс выводится
из организма с фекалиями
Метаболизм ЛПОНП и ЛПНП (прямой транспорт холестерола)
89
Ф Метаболизм ЛПОНП и ЛПНП (транопорт эндогенных
триацилглицеролов)
Биосинтез триацилглицеролов в печени
В гл. 21 описано, как из глюкозы можно синтезировать жир¬
ные кислоты. Далее эти жирные кислоты этерифицируются,
образуя триацилглицеролы. Эти триацилглицеролы не долж¬
ны накапливаться в печени — в противном случае развивается
жировой гепатоз, как у гусей при насильственном кормлении
для приготовления фуа-гра. Гидрофобные жировые глобулы
необходимо вывести из печени в водную среду крови. Для
этого триацилглицеролы упаковываются в гидрофильную
оболочку из фосфолипидов и белков, и в результате образу¬
ются ЛНОНП. ЛПОНП выводятся из печени по печеночной
вене и транспортируются к периферическим тканям.
Удаление триацилглицеролов из крови
тканях-мишенях
По пути к тканям-мишеням формирующиеся ЛПОНП получа¬
ют от ЛПВП аполипопротеины апоС2 и апоЕ. Теперь они ста¬
новятся «зрелыми» ЛПОНП. В капиллярах тканей-мишеней
апоВЮО и апоЕ связываются с рецептором ЛПОНП, а апоС2
активирует липопротеинлипазу (ее активность также стимули¬
рует инсулин). Липопротеинлипаза гидролизует триацилгли¬
церолы в составе ЛПОНП, расщепляя их на жирные кислоты
и глицерол. Их дальнейшая судьба зависит от типа ткани-
мишени:
1) в жировой ткани жирные кислоты снова связываются с
глицеролом и образуют триацилглицеролы — запасные
вещества;
2) в мышцах жирные кислоты могут использоваться в каче¬
стве источника энергии;
3) в различных тканях из жирных кислот и глицерола синте¬
зируются фосфолипиды для построения клеточных мем¬
бран.
Прямой транспорт
холестерина(и три¬
ацилглицеролов) к пе¬
риферическим тканям
Расщепление липопротеинов промежуточной
и низкой плотности (ЛППП и ЛПНП)
В капиллярах периферических тканей под действием липо-
протеинлипазы из ЛПОНП образуются ЛНПП, из кото¬
рых затем формируются ЛПНП. В печени аполипопротеин
апоВЮО частицы ЛПНП связывается с рецептором ЛПНП.
Далее рецепторы интернализуются клеткой, где частицы
ЛПНП распадаются на жирные кислоты, глицерол, амино¬
кислоты и холестерол.
Нарушения метаболизма ЛПОНП
Гиперлипидемия III типа
Желтые прожилки на ладонях указывают на гиперлипидемию
III типа. Это редкое заболевание, наследуемое по аутосомно-
Рис. 40.1. Метаболизм ЛПОНП и ЛПВП
рецессивному типу, при котором нарушена структура моле¬
кул апоЕ. В норме апоЕ связывают остаточные ЛПОНП и
хиломикроны с рецептором, и происходит интернализация
и последующее расщепление этих структур в клетке. Но при
болезни этого не происходит, и в крови накапливаются оста¬
точные компоненты ЛППП. При электрофорезе сыворотки
крови проявляется характерная широкая р-полоса.
Гиперлипидемия IV типа
Это дислипидемия, наследуемая по аутосомно-доминантному
типу, при которой образуется избыточное количество триа¬
цилглицеролов и соответственно ЛПОНП-частиц. При этом
концентрация холестерола в сыворотке крови остается в пре¬
делах нормы или слегка повышена.
90 Метаболизм ЛПОНП и ЛПНП (транспорт эндогенных триацилглицеролов)
Периферические ткани.
ЛПВП удаляет избыток
L
холестерола из клеток |
Обоатный транспорт
ЛПВП
(зрелый)
холестерола в печень
(г=
АпоА1 ЛПВП
активирует
лецитин:холе-
стерол-ацил-
трансферазу
Лизофосфати-
дилхолин
А1
. Лецитин
(фосфатидилхолин)
К печени по м
печеночной артерии'
В плазме крови вновь
ацилируется жирными
кислотами, связанными
с альбумином
А1лпвП.Щ
АлоА1-содержащая
частица, потерявшая
липиды
ЛПВП
(незрелый)
ЛПВП передают апоС2
и алоЕ частицам ЛПОНП
<о
Т
7~
Свободный Холестёрол
холестерол
I
Лилопротеинлилаза
активируется апоС2 и
стимулируется инсулином
риче- ;
ЛПВП удаляют
излишки холе-
стерола из клеток
КАПИЛЛЯР
Гиперлипидемия
IV типа
Повышено
содержание ЛПОНП
Гиперлипидемия
III типа
Из-за нарушения
структуры алоЕ
ЛППП-частицы
не расщепляются
Липопроте-
инлипаза
ЛПВП
1ПН1
3ецептор ЛПОНП]
Гиперлипидемия
I типа
Недостаточность
липопротеинлипазы,
недостаточность
апоС2
(Гиперлипидемия щщдрг
Утипа
Диабет
Фибраты
(например,
гемифиброзил*3)
активируют
липолротеин-
липазу
Глицерол
■ПпнП
А.'-фОС
Поврежденные свободными
радикалами ЛПНП, захватыва¬
ются макрофагами внутренней
артериальной стенки.
Образуются
атеросклеротические бляшки
Соли
желчных
кислот
Энтерогепатическая
циркуляция солей
желчных кислот
•-J
КИШЕЧНИК
В мышцах
используются
в энергетическом
обмене
и различных тканях
используются в син¬
тезе фосфолипидов
I
▼
Выводятся
с фекалиями
]
для построения
■
Положительно заряженные
ионообменные смолы. Они
связывают отрицательно за¬
ряженные соли жирных кислот,
и зтот комплекс выводится
из организма с фекалиями
Метаболизм ЛПОНП и ЛПНП (транспорт эндогенных триацилглицеролов)
Метаболизм ЛПВП (обратный транспорт холестерола)
ЛПВП — «хорошие» липопротеины,
которые удаляют излишки холестерола
Богатые холестеролом ЛПНП часто называют «плохими»
липопротеинами. В отличие от них, ЛПВП являются «хоро¬
шими» липопротеинами. ЛПВП удаляют избыток холестеро-
та из клеток и переносят его в печень, где холестерол преоб¬
разуется в соли желчных кислот.
ЛПВП получают холестерол нз двух источников.
При действии липопротеинлипазы на липопротеины в
первую очередь происходит гидролиз триацилглицеролов:
они расщепляются на жирные кислоты и глицерол. Однако
при этом процессе высвобождается и некоторое количе¬
ство холестерола, который включается в состав ЛПВП и
доставляется в печень, где происходит его утилизация.
Белки-нереносчики семейства АВС — широко распро¬
страненные белки, содержащие АТФ-связывающий уча¬
сток (ATP-binding cassette). Они транспортируют субстрат,
используя энергию гидролиза АТФ. Семейство АВС явля¬
ется одним из самых больших известных семейств бел¬
ков. Среди них есть и переносчик холестерола АВС-А1,
который содержится во многих тканях (на рис. 41.1 не
показан). Он переносит избыточный холестерол в части¬
цы ЛПВП, а уже частицы ЛПВП поступают в печень, где
холестерол утилизируется.
Глюкоза
см. гл. 23
См. гл. 10,38 и 42
Триацилглицеролы
— Ацил-КоА
KoA-SH
Развивается, когда темпы
синтеза триацилглицеро¬
лов превышают темпы
их удаления из печени
в составе ЛПОНП
ПЕЧЕНЬ
(г - ==^
Покидают печень
по печеночной вене
у- sj
1г
Удаление холестерола в виде солей желчных
кислот
Из холестерола образуются соли желчных кислот (см. гл. 38),
которые через желчный проток поступают в кишечник.
Здесь соли желчных кислот эмульгируют жиры, облегчая их
последующий гидролиз. Эмульгированные жиры гидролизу¬
ются липазой, секретируемой в кишечник поджелудочной
железой. Примерно 95% солей желчных кислот всасывает¬
ся в кишечнике и по воротной вене печени возвращается
обратно в печень (так осуществляется «энтерогенатическая
циркуляция»). Около 5% солей желчных кислот выводится с
фекалиями.
Антихолестероловые препараты способны прерывать цикл
энтерогепатической циркуляции. Эти препараты представля¬
ют собой положительно заряженные ионообменные смолы,
которые связываются с отрицательно заряженными солями
желчных кислот. Этот комплекс выводится с фекалиями.
Прямой транспорт хо¬
лестерола (и триацил¬
глицеролов) к перифе¬
рическим тканям
Рис. 41.1. Метаболизм ЛПВП (обратный транспорт холестерола)
92
Метаболизм ЛПВП (обратный транспорт холестерола)
Периферические ткани.
ЛПВП удаляет избыток
холестерола из клеток
ЛПВП
(зрелый)
Обратный транспорт
холестерола в печень
AnoAl в составе частиц
ЛПВП активирует леци-
тин:холестерол-ацил-
трансферазу. Лецитин:
холестерол-ацилтранс-
фераза превращает
свободный холестерол
в эфиры холестерола,
которые включаются
в состав ЛПВП-частицы
A1I
1ПВ
К печени по л
печеночной артерии"
АпоА1 -содержащая
частица, потерявшая
липиды
Лизофосфати* ^
дилхолин
Ле ц и тин:холестерол -
ацилтрансфераза
- Лецитин
(фосфатидилхолин)
В плазме крови вновь
ацилируется жирными
кислотами, связанными!
с альбумином
Периферические ткани
ЛПВП удаляют излишки
холестерола из клеток
Гиперлипидемия
II типа, семейная
гиперхолестеро-
лемия
Недостаточность илй
неправильное строение
рецепторов ЛПНП
Гиперлипидемия
I типа
Недостаточность
липопротеинлипазы,
недостаточность
апоС2
Фибраты
(например,
гемифиброзил*3)
активируют
липопротеинлипазу
Глицерол
■ПпнП
В
100
Через желчный
Через ворот-
проток
ную вену
у
печени
^СолИ^
желчньГ
кислот
Атеросклероз
; Поврежденные свободными
I радикалами ЛПНП захватыва¬
ются макрофагами внутренней
артериальной стенки.
Образуются
атеросклеротические бляшки
Энтерогепатическая
циркуляция солей
желчных кислот
КИШЕЧНИК
Выводятся
с фекалиями
Холестирамин,холестипол
Положительно заряженные
ионообменные смолы. Они
связывают отрицательно
заряженные соли жирных кислот,
и этот комплекс выводится
из организма с фекалиями
Метаболизм ЛПВП (обратный транспорт холестерола)
93
Всасывание триацилглицеролов и холестерола,
поступающих с пищей, и их удаление из крови;
метаболизм хиломикронов
поступившим с пищеи
Соли Липаза
желчных поджелудочной
кислот железы
.wm~r
Липаая
поджелуд
железы
Орлистат
Ингибирует липазу
поджелудочной железы
Жирные . _
W- + Глицерол
кислоты
Q J Переносчик
холестерола АВС-А1
Холестерол
Растительные стеролы
и станолы (содержатся
в некоторых маргаринах)
Ингибируют захват
холестерола транспортером,
блокируя всасывание
холестерола
Эфир
холестерола
В энтероцитах снова
образуют
триацилглицеролы
Холестерол Триацилглицеролы
Ингибиторы АХАТ - потенциальные
лекарственные средства, снижающие
уровень холестерола в крови
Рнс. 42.1. Всасывание триацилглицеролов и холестерола, поступающих с пищей, и их удаление из крови. Метаболизм хиломикронов
Всасывание триацилглицеролов, поступающих
с пищей
Триацилглицеролы, поступающие с пищей, попадают в
кишечник, где эмульгируются солями желчных кислот.
Секретируемая в просвет кишечника липаза поджелудочной
железы гидролизует эмульгированные триацилглицеролы,
расщепляя их на жирные кислоты и глицерол. Жирные кис¬
лоты и глицерол всасываются клетками кишечника и вновь
образуют сложные эфиры — триацилглицеролы.
Всасывание холестерола в кишечнике
Поступающий с пишей холестерол всасывается в энтеро-
циты с помощью специфического переносчика холестерола
в клетках кишечника АВС-А1 (см. гл. 41). В клетках ацил-
КоА-холестеролацилтрансфераза (АХАТ) этерифииирует
холестерол с образованием гидрофобного эфира холестерола.
За счет этой реакции поддерживаются высокие темпы вса¬
сывания холестерола. Возможно, это хорошо в тех случаях,
когда человек редко употребляет в пищу продукты, богатые
холестеролом (например, мясные). Однако при обильном
питании такое эффективное всасывание холестерола при¬
носит только вред. Употребление маргаринов, обогащенных
растительными стеролами, помогает уменьшить всасывание
холестерола и снизить его содержание в крови. В настоящее
время для снижения всасывания холестерола разрабатывают¬
ся ингибиторы ацил - КоА-холестерол ацилтрансферазы. Недавно
появился новый лекарственный препарат — эзетимиб, кото¬
рый ингибирует всасывание холестерола (однако механизм
его действия неясен).
Хиломикроны
Триацилглицеролы и эфиры холестерола покрываются обо¬
лочкой из фосфолипидов и апоВ48 и формируют незрелые
хиломикроны. Энтероциты секретируют хиломикроны в лим¬
фатическую систему, и хиломикроны с током лимфы дости¬
гают грудного протока. Здесь они попадают в кровь — в пра- j
вую и левую подключичные вены.
Удаление триацилглицеролов из крови
С током крови хиломикроны попадают в капилляры, где
они получают от ЛПВП аполипопротеины апоЕ и апоС2.
В тканях-мишенях хиломикроны связываются с липопроте-
инлипазой, которая ассоциирована с отрицательно заряжен¬
ными протеогликанами. АпоС2 активирует липопротеинли-
пазу, и она гидролизует триацилглицеролы, расщепляя их
на жирные кислоты и глицерол. Дальнейшая судьба жирных
кислот зависит от типа ткани. В жировой ткани жирные кис¬
лоты и глицерол снова образуют триацилглицеролы, которые
запасаются в жировой ткани. В мышцах жирные кислоты
могут использоваться в качестве источника энергии.
Утилизация холестерола
При разрушении хиломикронов липопротеинлипазой высво¬
бождается холестерол. Его связывают ЛПВП и переносят
в печень, где он используется для синтеза солей желчных
кислот.
Дополнительная литература: Frayn K.N. Metabolic
Regulation: a Human Perspective. — 2nd ed. — Oxford
Blackwell Publishing, 2003.
94 Всасывание триацилглицеролов и холестерола, поступающих с пищей, и их удаление из крови; метаболизм хиломикронов
го
(1)
—1
о
-1
О)
ч
О)
—1
и
О)
го
-е-
■б
о
Z
Н
CD
■и
О)
т
Z
0)
о
н
0
ч
О)
sz 3 ч:
■Ln.
ш
Периферические ткани.
ЛПВП удаляет избыток
холестерола из клеток
ЛПВП
(зрелые)
Обратный транспорт
холестерола в печень
ЛП8П
передают
С2 и
Е ЛПОНП
АпоА1 частиц ЛПВП активирует
лецитин:холестерол-ацилтранс-
феразу. Лецитин:холестерол-
ацилтрансфераза удаляет
свободный холестерол, образуя
эфир холестерола, которые
включаются в состав ЛПВП
(«хороший» холестерол)
:А1
А1 ©
К печени по ,
печеночной артерии
АпоА1-содержащая
частица, потерявшая
липиды
^ Лиэофосфати-__^.
дилхолин
Лецмтин:холеотерол-
ацилтрансфераза
- Лецитин
(фосфатидилхолин)
В плазме крови
вновь ацилируется
жирными кислотами,
связанными
с альбумином
А1
ЛПВП (незрелый)
т
т
т
Липопротеинлипаза
активируется апоС2 и
стимулируется инсулином
Свободный I
холестерол Холестерол
ЛПВП передает апоА1
апоС2 и апоЕ
хиломикронам
А1
КАПИЛЛЯР
^ЛОМИКРОНЬ1/
(зрелые)
\%
ЫИ 1ЛШ М.
Периферические ткани
ЛПВП удаляет избыточный
холестерин из клеток
Г иперлипидемия
IV типа
Рецептор
остаточных
хиломик-
ронов
Липопроте¬
инлипаза
JCTATOHHbfi
{ломикроНя
Гиперлипидемия
I типа
Недостаточность
лнпопротеинлипазы,
недостаточность
апоС2
Гиперлипидемия
Утипа
Диабет
Фибраты
(например,
гемифиброзил*3)
активируют
липопротеинлипазу
Глицерол
Гиперлипидемия
III типа
Нарушено
строение апоЕ
Через желчный
Через ворот-
проток
ную вену
▼
печени
JCWIM
желчных
кислот
Энтерогепатическая
циркуляция солей
желчных кислот
В жировой ткани
образуют эфиры
с глицеролом и запа¬
саются в форме
триацилглицеролов
Жирные
кислоты
КИШЕЧНИК
ТКАНИ-МИШЕНИ
клеточных мембран
В мышцах
используются
в энергетическом
обмене
и различных тканях
используются в син¬
тезе фосфолипидов
I
Выводятся
с фекалиями
]
для построения
■ - г
Положительно заряженные
ионообменные смолы. Они
связывают отрицательно
заряженные соли жирных кислот,
и зтот комплекс выводится
из организма с фекалиями
Всасывание триацилглицеролов и холестерола, поступающих с пищей, и их удаление из крови; метаболизм хиломикронов
95
о
Стероидные гормоны: альдостерон, кортизол,
андрогены и эстрогены
(гидрокортизон)
Альдостерон
Является минералокортикоидом. Он стимули
рует обмен ионов К+ на ионы Na+ в почечных
канальцах.
Реабсорбция Na+T, секреция К+1,
секреция Н+ Т
Кортизол
Является глюкокортикоидом. Катаболи-
ческий стероидный гормон. Он стимулирует
глюконеогенез, липолиз и распад белков
тканей (см. гл. 34)
Андрогены
Анаболические стероидные гормоны.
Стимулируют синтез белков и развитие
вторичных мужских половых признаков
Эстрогены
Способствуют развитию
женских вторичных
половых признаков
Рис. 43.1. Биосинтез стероидных гормонов
96 Стероидные гормоны: альдостерон, кортизол, андрогены и эстрогены :
I
I
Стероидные гормоны
Существует четыре основных типа стероидных гормонов:
минералокортикоиды, глюкокортикоиды, мужские половые
гормоны (андрогены) и женские половые гормоны (эстро¬
гены). Заметьте, что аидростендион — предшественник как
андрогенов, так и эстрогенов. В самом деле, по чьему-то мет¬
кому наблюдению, Ромео и Джульетта отличаются всего лишь
кето-группой при 3-м атоме углерода и метильной группой
при 10-м атоме углерода стероидного ядра.
Г иперальдостеронизм
Первичный гнперальдостеронизм (синдром Конна) — ред¬
кое заболевание, обусловленное опухолью коры надпочеч¬
ников, секретируюшей альдостерон. Из-за этого организм
теряет ионы калия и водорода, которые выводятся с мочой.
Развиваются гипокальциемия, метаболический алкалоз. Чаше
встречается вторичный гинеральдостероннзм, который разви¬
вается из-за поражения почек или печени.
Хроническая недостаточность коры надпочечни¬
ков (болезнь Аддисона)
Болезнь Аддисона — редкое заболевание с возможным
летальным исходом. Причина болезни — атрофия надпочеч¬
ников, которая приводит к сниженной секреции альдостерона
и кортизола. Болезнь характеризуется низким артериальным
давлением, потерей ионов натрия с мочой, снижением массы
тела и пигментацией слизистых оболочек. Недостаточность
коры надпочечников развивается также из-за нарушения
функционирования гипофиза, сопровождающегося наруше¬
нием образования адренокортикотропного гормона (АКТГ).
Гиперкортицизм: синдром Кушинга
Кортизол секретируется корой надпочечников в ответ на
стресс и голодание. Он стимулирует расщепление жиров, а
также образование глюкозы из аминокислот, образующихся
при распаде белков тканей. Таким образом, кортизол — ката-
болический стероидный гормон, который секретируется при
голодании. Природные стероиды этого типа или их синтетиче¬
ские аналоги (в частности, дексаметазон) называются глюко¬
кортикоидами. Секреция кортизола регулируется гипоталамо-
гипофизарной системой. Сначала гипоталамус секретирует
кортиколибернн, который стимулирует секрецию АКТГ перед¬
ней доли гипофиза. Затем АКТГ стимулирует секрецию кор¬
тизола корой надпочечников. При избыточной продукции
кортизола развивается синдром Кушинга. Синдром Кушинга
может возникать по четырем причинам: ятрогенно, при аде¬
номе гипофиза, при аденоме или карциноме надпочечников,
а также при эктопическом образовании АКТГ.
1) Самым распространенным является ятрогенный* синдром
Кушинга.
2) Впервые синдром был описан Кушингом у больного с ред¬
кой первичной аденомой гипофиза, секретируюшей АКТГ.
Такое состояние называется болезнью Кушинга.
* Ятрогенный синдром Кушинга также называют экзогенным или
лекарственным синдромом Кушинга, так как обусловлен длительным
лечением глюкокортикоидами или другими стероидами. (Примеч.
ред.)
3) В дальнейшем были описаны больные с первичной опу¬
холью надпочечника — доброкачественной (аденома)
или злокачественной (карцинома), при которой уровень
кортизола в крови был повышен, но уровень АКТГ был
понижен.
4) Эктопическое образование АКТГ происходит, например,
при мелкоклеточном раке легкого.
При синдроме Кушинга больные имеют характерный
внешний вид — лунообразное лицо, худые ноги и руки при
выраженном ожирении туловища, и их фигура напоминает
грушу на ножках-спичках. Это вызвано накоплением висце¬
рального жира при этой болезни. Сначала может показаться,
что развитие ожирения при высоком уровне катаболического
гормона (кортизола) противоречит всякому здравому смыслу.
Однако надо вспомнить, что кортизол стимулирует глюконео-
генез, и в крови повышается уровень глюкозы, что, в свою
очередь, вызывает усиление секреции инсулина. При син¬
дроме Кушинга уровень кортизола в крови высок настолько,
что даже новышенное содержание инсулина не может снизить
концентрацию глюкозы в крови. Но в висцеральной жировой
ткани действие инсулина оказывается более сильным, чем
действие кортизола, и инсулин стимулирует экспрессию гена
липопротеинлипазы. Это способствует накоплению жира, и
прежде всего висцерального, а не подкожного: ожирение про¬
исходит там, где выше скорость кровотока и где выше число
адипоцитов.
Половые гормоны
Нарушение синтеза андрогенов: недостаточность
5-а-редуктазы
Дигидротестостерон образуется из тестостерона под дей¬
ствием фермента 5-а-редуктазы. При недостаточности
5-а-редуктазы реакция блокируется, и в крови повышает¬
ся соотношение тестостерон/дигидротестостерон (рис. 43.1).
Дигидротестостерон в 4 раза активнее, чем тестостерон,
поэтому новорожденные мальчики при недостаточности
5-а-редуктазы имеют половые органы неопределенной при¬
надлежности. Главная задача в таких случаях — правильное
определение пола.
Ингибиторы 5-а-редуктазы
Фипастерид и м иноке ид ил используются для лечения андро¬
генной алопеции. Финастерид также применяется при
доброкачественной гипертрофии предстательной железы
для уменьшения ее размеров. Флутамид блокирует рецептор
тестостерона и используется в лечении карциномы предста¬
тельной железы.
Ингибиторы ароматазы: новые лекарства против рака
молочной железы
Ингибиторы ароматазы, например аиастрозол, летрозол и
эксеместан, блокируют синтез эстрогенов из андростендио-
на. Это новые лекарства, разработанные для лечения рака
молочной железы (рис. 43.1). Клинические испытания летро-
зола оказались настолько успешными, что их пришлось оста¬
новить: врачи посчитали неэтичным продолжать давать пла¬
цебо добровольцам из контрольной группы.
Стероидные гормоны: альдостерон, кортизол, андрогены и эстрогены
97
Д| Цикл мочевины и краткий обзор катаболизма
аминокиолот
При катаболизме аминокислот образуются ионы
аммония (NH4+)
В желудке белки гидролизуются под действием пепсина с
образованием аминокислот. Дальнейший гидролиз белков и
всасывание аминокислот проходят в кишечнике. Часть этих
аминокислот используется для биосинтеза белков, в том
числе при восстановлении поврежденных тканей, биосинтеза
гормонов, пиримидинов, пуринов и т.д. Избыток аминокис¬
лот может использоваться в глюконеогенезе или энергетиче¬
ском обмене. Но при катаболизме аминокислот образуются
очень токсичные ионы аммония (NH4+). Чтобы обезопасить
организм от их действия, ферменты превращают ионы 1ЧН4+
в нетоксичную мочевину, которая сразу выводится почками.
В цикле мочевины из ионов аммония образуется
мочевина
При катаболизме аминокислот ионы 1ЧН4+ образуются либо
непосредственно при дезаминировании некоторых аминокис¬
лот, либо сначала в результате трансаминирования образует¬
ся глутамат, который затем дезаминируется, образуя NH4+
(рис. 44.1). Затем ион аммония реагирует с ионом бикарбо¬
ната и двумя молекулами АТФ с образованием карбамоил-
фосфата (реакцию катализирует карбамоилфосфатсинтета-
за*). Карбамоилфосфат реагирует с орнитином, образуя (под
действием фермента орнитин-карбамоилтрансферазы) цитрул-
лин. Затем с цитруллином связывается аспартат (он является
донором второй аминогруппы мочевины) и образуется арги-
ниносукцинат, который расщепляется на фумарат и аргинин.
Наконец, аргинин в реакции гидролиза под действием арги¬
назы расщепляется на мочевину и орнитин, и орнитин вновь
поступает в цикл образования мочевины.
Примечание: не путайте упомянутую карбамоилфосфатсин-
тетазу с карбамоилфосфатсинтетазой II, которая участвует
в синтезе пиримидинов (см. гл. 58).
Нарушения цикла мочевины: недостаточность
орнитин-карбамоилтрансферазы
Существует целый ряд довольно редких нарушений цикла
образования мочевины. Самое распространенное среди них —
недостаточность орнитин-карбамоилтрансферазы, наследствен¬
ное Х-сцепленное заболевание. При тяжелом течении болезни
новорожденные мальчики быстро умирают из-за отравления
аммиаком. Но у некоторых мальчиков встречаются и легкие
формы заболевания. У девочек-гетерозигот клинические про¬
явления болезни варьируют широко: иногда болезнь проте¬
кает бессимптомно.
В 1990-х гг. все возлагали надежды, что генная терання
поможет вылечить недостаточность орнитин-карбамоил¬
трансферазы. Больным с легкими формами недостаточности
вводили в печень соответствующий ген с использованием
аденовирусного вектора. Однако у 17 больных перенос генов
был выражен слабо, а когда 18-й больной умер от осложне¬
ний, клинические испытания были запрещены.
При недостаточности орнитин-карбамоилтрансферазы кар¬
бамоилфосфат накапливается в цитозоле клеток и превраща-
* В отечественных учебниках этот фермент принято называть кар-
бамоилфосфатсинтетаза 1. (Примем. ред.)
Рис. 44.1. Краткий обзор катаболизма аминокислот и детоксика¬
ции ионов NH4+ путем образования мочевины
ется в оротовую кислоту. Эту реакцию катализирует аспар-
таттранскарбамоилаза (см. «Биосинтез пиримидинов», гл. 50).
Оротовая кислота обнаруживается в моче, и этот показатель
используется в диагностике заболевания.
Креатин
Предшественником креатина является аргинин. Он реагирует
с АТФ с образованием креатинфосфата (см. гл. 10). Креатин
в форме креатинина выводится с мочой.
98
Цикл мочевины и краткий обзор катаболизма аминокислот
Цикл мочевины и краткий обзор катаболизма аминокислот
99
Заменимые и незаменимые аминокислоты
Фенилаланин
Глюкоза
А
*>зо-6
Татрагидробиоптарии
моиооксигенаэв
Дигмдробмосттарми
а-К*тог/гутар*т
Тирозинамимо-
трч«сфераза ,
Глутамат 4^
Глицин
Серинф
Ы5-метилтетрагидрофолат
Тетрагидрофолат
Л
Витамин Вт?
Цитозоль Гликолиз
Гомоцистинметмл-
трансфвраза
Гпииёралы&гид-З-
фосфатдагидроганаза
Гомоцистеин
оглицерат
Фосфоглицараткиназа
4-гидроксифенилпируаат
Э - фос фог л и це рат
Фосфотлицоролкутаза
а-Ке тог/гут арат
"Д*”* Аланин 4 \ i Пируват
Алтютрансфераза
Диокснгеназа
СО
Гсмогентмзат
Амимотрамсфараза
НАДН+Н*4—ч,
а-Катог/тутарат Глутамат
1,2-диокснгеназа Л )
4-малеилацетоацетат АС П Э |ЭТЗТ^ ^ ^
^Изомерам
Фумарилацвтоацвтат
Н2° —Фуиарилаиетоацетвза НАД*
^ ^-►фyм•paf ►М^ат
Ацвтоацвтат
i
i4 11И111111^
ГТФ ГДФ со^
2-фос<
ацетат-
Малет-
дагидроганаза
yJJ
Фсх^фоенолпируват-
карбоксикииаза
Фосф
АДФ4-
Лактат-4-
над* надн+k^V
V/ 'Г
Метионин
Цикл
реутилизации
метионина
ицерат
Емолаза
1ируаат
Пируваткиназа
► Серин
Si М
(S-адвио: л метионин)
Матилгрансфараза
S-аденоэ
ГомоаЖютеин
Витамин В.
Лактэтдегидрогенвза
Пируват Цистеин
Окисляется
в тканях
вне печени
Пере: они».
;<1и*арб0и
АТФ-^
Гистидин
Гистидаза
NH»+
Уроканат
> ЭН*
м
1
рТерё
гти| дата !
АТФ—^
Пируаатхарбоксилаза
('содержит биотин)
АДф+ф
НСОз
НАД*
I
Мала тдвгидрогеназв
СО,
Ацет
КоА-З
НАД*
П ируаатдвторогенаэа
>НАДН + Н*
1Л-КоА
НАД*
Дегидрогеназа
со,-*^|Ч>и*Дн*^ ^
Пропионил-КоА
Орнмтинткарба-
ыкжлтрансферэза
НСО3 2АТФ 2АДФ+Ф. (<ЖГ)
nh4
2А^Ф
АДФ
Гидратаэа
Г
HjO
4-имидаэолон-
5-пропионат
HjO
Компмп
• 2Н*
IV
-> Н,0
2°2
н-Р
У
т
НАДН+Н*
[ацетат-
Цитраг-
сиюазв
HjO KoA-SH
т
Фумараза
из° [Ци< тконитат]
4Н* <4
Ишидаэолон-
пропионаза
1-4Н*
Кмаи««<
Ш
Фумарат
Цикл Кребса
Формиминоглутамат
трап
фолат
^-Тетрагидро
Глуташатфоршшино-
трансфвраза
(§) ФАДН2н^
Сукцинаг-
догидроганаза
Сукцинат 4"
Сукцинил-КоА-
симтетаза
Т
Глутамат <1>н&
НАДФН+Н
Пирролин-5-
В карбоксила?
лолуалодвгпд-Р
НАДфт
НАД' *" Щ '■Г АДФ+ф,
Глутамат-у-
полуальдегид
СвМОЛрОиЗйО'1ь
мая реакция
Пирролин-б^сарбоксилат
фаДн a надфн
Пролиноксиганазащ[ Радуггаза
ФАД-*-' ■ ^ НАДФ
KOA-SH
Митохондрия
-Сукцинил-КоА4-
▼
ГТФ
ГДФ
а-Катоглутарат-
дагидроганаэа
а-Кв
НАД+1
НАДН+Н* KoA-SH
Карбамо
Карбакюилфосфат- илфосфат
симтегазе
трат
Аспвртвг
Аспартагамино трансфараза
Оксаловцетет
А Ч Н*
: А А
Глутамат
Пролин
Внутренняя мембрана
Межмембранное
ПрОСТраНСТВО адф-
Наружная мембрана
•Транслоказа-
f
ГТФ
амр-пф.
АргининЛукцинат
Аргинин
Аргиназе
ГДФ ф н*
Орнигин
1
Нунлеозидаифосфаг киназа
АТФ
Мочевина
О
"1 шиш к: •::<!; ::*!miiiriiu>ii
)Ш||11Ш111||1|Ш1||||||||||||ЙШ1||||1ШКТ1
HiiutiiiMiiHiC
Алмно трансфараза
► Орнитин
1ШШ1|||1|1М1|||||||||||||||||||11|||||||П1Ш||!> 11|1||||||||||1||11|Г||||||||1Ш||||||||||||||||||||||||||1|11П11||11|11Ш1Г
Рис. 45.1. Биосинтез заменимых аминокислот
100
Заменимые и незаменимые аминокислоты
Фенилаланин
У*- Твтрагидробиоптврии
4-монооксигеназа
Дигидробиоптврин
Тирозин
й-К*тог/тут*ргт_
Тцюзииамино-
трвмсфервэа
Гиутит^--''
4гидроксифенилпируват
М5-метилтетрагидрсфолат
Тетрагидрофолат
-^♦Метионин
Витамин В12
Триптофан
1
"омоиис теинмв тил -
трансферам
N-формилкииуреиии
Гомоцистеин
▲
:д*
1МОГ0Н1
СО
Гомогентиэет
7,2-диоксиганаза
Ксаитуреиат
(вещество желтого цвета)
4-малеилацетоацетат
^Изомврвзя
фумарилацвтоацетат
Mj®—фушрнлоцйтоаиегаза
^^►фумарет
Ацетоацетат
Формиат
Кинуреиии
I
Окисляется
в тканях
вне печени
3-гидроксикинуроиии
Аланин А
3-гидроксиаитраиилат
I
2-амиио-З-карбокси*
мукоиоаый полуальдегид
2-аминомуконоаый
полуальдегид
I
2-емииомукоиет
Цикл
реутилизации
метионина
SAM
(S-адеиоэилметиоиии)
^ Метилгрансфераза
S-аденозилгомоцистеин
i
■ Гомоцистеин
Серин
Метильная группа
передается акцептору
Циста тионинсинтаза
Треонин
Цистетиоиин
а-Кетоадипат
Цистеин -*^г
Гомосерии
I
а-Кетобутират
О
Лизин
i
Сахаропии
2 1
2-аминоадипат-
полу альдегид
1
2-амииоадипат
Аминотраис-
фераза
Аминокислоты
с разветвленной цепью
Изолейцин Валин Лейцин
^ Аминотрансфераза | Аминотрансфераза | Аыинотрамсфераза
Гистидин
[]
▼
Уроканат
Гидратам \
Митохондрия
\г'
nh4
НСОэ 2АТФ 2АДФ
Карба
Карбамонлфосфат- моил фосфат
Орнитинкарба-
иои/ттрансфераза
4-имида золой*
5-лропионет
^ нзО
1 Имидазолом-
прогтомаза
□ □
О
Формимииоглутемат
Тетрагидрофолат
Цикл
мочевины
Глуташтфорнимимо-
трансфвраза
Глутамат
тт-г-
ЦДйгид*
огвназа
Аргининсухцинат-
сиитетвэа
COf
■ НАД*
Дегидрогеназа
► НАДН+-Н*
а-Кетоадипат а-Кето-0-ме
О (
гилвалерат а-Кет
> (
оиэоеалерат а-Ке
> <
гоизокапроат
>
I I I Карнит
1 1 (челночные
новый I Кариит
механизм 1 ! чялночньи
■новый 1 I Карнип
механизм I 1 челночный
новый 1
KoA-SH ^ ^ НАД+ КаА-SH
Дегидрогеназе
СОг ■4"^ 'Чч“4 НАДН+Н+ СОг 4*^
▼
НАД* KOA-SH-^
Дегидрогеназа
НАДН+Н+ сог4-,,/
НАД* KoA-SH-^
Дегидрогеназа
'Ч">-НАДН+Н+ ССг4-^
* 1
f НАД*
Дегидрогеназа
^-►НАДН+Н*
г
Пропионил-КоА
Глутарил-КоА
а-Метилбутирил-КоА Изобутирил-КоА Изовалерил-КоА
О
Аргииииосукцииат
Аргинино-
сукцинатлназа
- I
Глутамат-
полуведвгнд*
авпироганаза
- АТф
НАДФН+Н
/7ирролим*5‘
карбоксипат-
сикгетаэе
НАДФ*
Аргинин
Аргиназа I
Орнитин-*-И
Мочевина
К
АДФ+фи
Глутамат-у-
полуальдегид
Аминокислоты с разветвленной цепью —
источник энергии для скелетных мышц
Хотя аминокислоты с разветвленной цепью относятся к
незаменимым аминокислотам, при физической нагрузке
они окисляются и используются для синтеза АТФ скелет¬
ными мышцами (см. гл. 46). Есть данные, что употребление
аминокислот с разветвленной цепью до и после физических
нагрузок позволяет спортсменам снизить повреждения мышц
из-за нагрузок и усилить синтез мышечных белков.
Самолроизааль-
1нл« реакция
Пирролии-5-карбоксилат
ФАДН,
фолинохснгеназа
ФАД <
НАДФН'
Радугтазв
Чч^НАДФ^
Пролин
Аминотрансфераза
Рис. 45.2. Катаболизм незаменимых аминокислот
Заменимые аминокислоты
Растения могут синтезировать все необходимые им амино¬
кислоты. Животные (в том числе и человек) способны синте¬
зировать только половину из нужных им аминокислот: Тир,
Гли, Сер, Ала, Асп, Цис, Глу, Про (рис. 45.1). Такие амино¬
кислоты называются заменимыми.
Белковое голодание
Маразм и квашиоркор
Термин «маразм» используется для описания тяжелых слу¬
чаев белкового голодания у детей. Степень тяжести белко¬
вого голодания определяют, сравнивая массу тела ребенка с
нормальной массой для данной возрастной категории. Здесь
приведена одна из возможных классификаций. При нормаль¬
ном питании масса тела ребенка составляет 90—110% нормы,
при легкой гипотрофии — 75—90%, нри тяжелой гипотрофии
(маразме) — менее 60% нормы.
Если при истощении наблюдаются отеки, используют тер¬
мин «квашиоркор», а в крайне тяжелых случаях — «маразм-
квашиоркор».
Белковое голодание часто развивается у госпитализиро¬
ванных больных, особенно у лиц пожилого возраста. Из-за
белкового голодания плохо идут процессы заживления ран,
появляются пролежни.
Незаменимые аминокислоты
Незаменимые аминокислоты — те, которые не могут быть
синтезированы в организме человека. К ним относятся Фен,
Вал, Трп, Тре, Иле, Мет, Гис, Apr, Лей и Лиз (правда, многие
считают, что Арг и Гис необходимы только детям в период
роста). Катаболизм незаменимых аминокислот показан на
рис. 45.2.
Кахексия
Кахексия — крайняя степень истощения организма, общая
атрофия. Как правило, развивается во взрослом возрасте
из-за недоедания. При кахексии атрофируются жировая
ткань, кишечник, поджелудочная железа и мышцы. Кахексия
обычно развивается на поздних стадиях тяжелых заболеваний
(в частности, при раке).
Заменимые и незаменимые аминокислоты 101
4Гх1.1Л|1111Кт
Метаболизм аминокислот: получение энергии в виде
АТФ, образование глюкозы и кетоновых тел
Фенилаланин
Триптофан Метионин
а-Катоглутар*т
Тироэи мамино
трансферам
Глут«м«т 4^
Орнитин
Рис. 46.1. Окисление аминокислот для получения энергии в виде АТФ
Катаболизм аминокислот для получения энергии
в виде АТФ
Распространенная ошибка большинства учебников — пред¬
ставление о том, что углеродные «скелеты» аминокислот
окисляются в цикле Кребса. Следует помнить, что в цикле
Кребса окисляется ацетил-КоА — до 2 молекул С02. Таким
образом, чтобы полностью окислить аминокислоту, прежде ее
надо преобразовать в ацетил-КоА. Так и происходит с боль¬
шей частью аминокислот: из них образуется ацетил-КоА,
который затем поступает в цикл Кребса (рис. 46.1). В про¬
цессе его окисления образуются НАДН и ФАДН2, необхо¬
димые для синтеза АТФ в дыхательной цепи. Примечание:
некоторые аминокислоты — гистидин, глутамат, пролин и
орнитин — вступают в цикл Кребса в виде а-кетоглутарата.
а- Кетоглутарат частично окисляется в цикле Кребса фермен¬
том а-кетоглутаратдегидрогеназой с высвобождением одной
молекулы С02. Неиспользованная часть углеродного «скелета»
теперь должна покинуть митохондрию, чтобы после ряда пре¬
вращений вновь оказаться в ней в виде ацети,1-КоА. И только
потом он будет полностью окислен в цикле Кребса.
102 Метаболизм аминокислот: получение энергии в виде АТФ, образование глюкозы и кетоновых тел
Нарушение обмена аминокислот: болезнь кленового
сиропа, гомоцистинурия, цистинурия, алкаптонурия
и альбинизм
Ксантуренат
(вещество
желтого цвета)
Триптофан
i
N-формилкинуренин
Формиат
-3-гидроксикинуренин
i
Синтез
НАД+ и
НАДО*
— 2-амино-З-карбокси-
муконовый полуальдегид
I
i
а-Кетоадипат
М5-метилтетра-,^
гидрофолат ~
Недостаточность
метионинсинтазы
Фолат
I
Ди гидрофолат
Тетрагидрофолат
Фолатный
ЦИКЛ
N , N -метилентетрагидрофолат
I
М5-метилтетра-
гидрофолат
В,
Г
Гомо¬
цистеин
^ Бетаин Диметилглицин
Тетрагидрофолат
Метионин- t
синтаза у
f Метил- 'Ч
\трансфераза\
Л
Метионин
if
Бетаин
Понижает уровень
гомоцистеина в крови
при некоторых фор¬
мах недостаточности
метионинсинтазы
Цикл реутилизации
метионина
Болезнь кленового сиропа
Болезнь кленового сиропа наследуется по аутосомно-
рецессивному типу. Причина болезни — недостаточность
дегидрогеназы а-кетокислот с разветвленной цепью (рис. 47.1).
Эти а-кетокислоты образуются из аминокислот с разветвлен¬
ной цепью — изолейцина, валина и лейцина. При недостаточ¬
ности фермента они накапливаются и выводятся с мочой,
придавая ей характерный запах кленового сиропа. И амино¬
кислоты с разветвленной цепью, и а-кетокислоты с разветвлен¬
ной цепью относятся к нейротоксичным веществам. Если они
накапливаются в крови, развиваются тяжелые неврологиче¬
ские нарушения, возможны отек головного мозга, умственная
отсталость. Для лечения болезни необходимо употреблять в
пищу продукты с низким содержанием этих аминокислот.
Гомоцистинурия
Не так давно повышенную концентрацию гомоцистеи¬
на в крови включили в факторы риска развития сердечно¬
сосудистых заболеваний. Впрочем, уже довольно давно было
замечено, что без лечения при гомоцистинурии часто раз¬
виваются поражения сосудов. Кроме того, у таких больных
нарушается структура хрящевой ткани, что приводит к остео¬
порозу, смещению хрусталика глаза и долихостеномелии (от
греческого dolicho — длинный, stenos — узкий, melos — конеч¬
ность; эта аномалия также называется «паучья кисть»).
Классическая форма гомоцистинурии развивается при нару¬
шении работы цистатионин-р-синтазы. При недостаточности
другого фермента — метионинсинтазы (метилтетрагидрофо-
латгомоцистеинметилтрансферазы) — наблюдается гиперго-
моцистинурия.
Обратите внимание на орфографию: при гомоцистинурии
повышен сывороточный гомоцистеин.
SAM
(S-аденозилметионин)
Метидтрансфераза
V .
Метильная группа
т
передается акцептору
S-аденоэилгомоцистеин
1
* Гомоцистеин
Цистатионин-
сиитаза
Г омоцистинурия
При недостаточной
активности цист -
атионин-р-синтазы
или метионинсинтазы!
гомоцистеин
вводится с мочой
Пиридок-
сальфос-
фат
Цистатионин
Недостаточность
цистатионин-р-синтазы
Цистеин'
Изолейцин
^ Аминотрансфераза
Рис. 47.1. Болезнь кленового сиропа, гомоцистинурия и цист¬
инурия
Валин
^ Аминотрансфераза
Лейцин
^ Аминотрансфераза
гомосерин а-Кето-р-метилвалерата-Кетоизовалерата-Кетоизокапроат
Болезнь
кленового сиропа
а-Кетокислоты
с разветвленной
цепью выводятся
с мочой
104 Нарушение обмена аминокислот: болезнь кленового сиропа, гомоцистинурия, цистинурия, алкаптонурия и альбинизм
Фенилаланин
PI
Г омогентизиновая
кислота
1Диоксигеназа
\гомогентизи-
ЧОВОЙ кислоты^
4-малеилацетоацетат
^Иэомераза
фумарилацетоацетат
Г
ГНС
Алкаптонурия
Недостаточность
диоксигеназы
гомогентизиновой
кислоты
Фуиарилацегоаиетаза
44—Фумарат
Ацето ацетат
1
Окисляется
в тканях
вне печени
Рис. 47.2. Альбинизм и алкаптонурия
Недостаточность метионинсинтазы
Метионинсинтаза — В12-зависимый фермент; который в
качестве кофермента использует 1Ч5-метилтетрагндрофолат
(рис. 47.1). Этот фермент катализирует перенос метильной
группы с Ы5-метилтетрагидрофолата на гомоцистеин с обра¬
зованием метионина. При недостаточности метионинсинтазы
накапливается гомоцистеин, что приводит к гипергомо-
цистинемии, межобластной анемии и задержке умственного
развития. В ряде случаев состояние больных улучшается при
приеме фолатов и витамина В12. Кроме того, можно при¬
нимать бетаин: в этом случае используется обходной метабо¬
лический путь, в котором бетаин отдает метильную группу
гомоцистеину для образования метионина.
Недостаточность цистатионин-р-синтазы
Недостаточность цистатионин-р-синтазы наследуется по
аутосомно-рецессивному типу (рис. 47.1). Это самая распро¬
страненная причина гомоцистинурии. Среди всех наруше¬
ний аминокислотного обмена недостаточность цистатионин-
Р-синтазы находится на втором месте по излечимости. Так,
в ряде случаев состояние больных улучшается при приеме
пиридоксина, однако многим больным он не помогает.
Пероральное употребление бетаина нередко способствует
эффективному снижению уровня гомоцистеина в сыворотке
крови.
Цистинурия
Цистинурия наследуется по аутосомно-рецессивному типу.
При цистинурии нарушено обратное всасывание некото¬
рых аминокислот в почечных канальцах: цистина, орнитина,
аргинина и лизина. Цистин (димер цистеина, см. гл. 6) плохо
растворим в воде и накапливается в канальцевой жидкости,
образуя камни в почках и мочевом пузыре (развивается так
называемый цистиновый уролитиаз). Свое название цистин
получил после того, как в мочевом пузыре (cyst) были обна¬
ружены цистиновые камни.
Алкаптонурия
Алкаптонурия наследуется по аутосомно-рецессивному типу.
Это легкое заболевание, которое никак не влияет на продол¬
жительность жизни. Причина развития алкаптонурии — недо¬
статочность оксидазы гомогентизиновой кислоты (рис. 47.2).
Накапливающаяся гомогентизиновая кислота выводится вме¬
сте с мочой и постепенно окисляется на воздухе в пигмент
черного цвета. Обычно болезнь выявляется, когда родители
замечают черные пятна на пеленках и подгузниках.
Кроме того, следы пигмента постепенно накапливаются
и в тканях, особенно в хрящевой. В четвертой декаде жизни
они придают ушному хрящу голубовато-черную или серую
окраску.
Альбинизм (глазокожный альбинизм)
Альбинизм — нарушение синтеза или обмена кожного пиг¬
мента меланина (рис. 47.2). Глазокожный альбинизм 1 типа
развивается из-за нарушения структуры тирозиназы и насле¬
дуется по аутосомно-рецессивному типу. При этом заболева¬
нии в волосах, глазах и коже полностью отсутствует пигмент.
Из-за отсутствия меланина в коже у таких больных повышен
риск развития рака кожи.
Нарушение обмена аминокислот: болезнь кленового сиропа, гомоцистинурия, цистинурия, алкаптснурия и альбинизм 105
Фенилаланин
Тетрагмдробиоптврин ^ NADP+
-монооксигеназа Удигидробиогггерин-
Кредуктаза
Ди гидробиопт врин
NADPH+H+
Тирозин
а-Кетоглутарат
Тирозинамино-'
трансферам <
Глутамат
l-ДОФА
Тирозиназа
Альбинизм
Недостаточность
тирозиназы
Дофахинон
i
Дофахром
Меланин
Дофамии
О,
н2о -
Норадреналин
S-аденозил-
гомоциствин
S-аденозилметил-
4-гидроксифенилпируват
о,
Адреналин
Г омогентизиновая
кислота
°2~^Диоксигеназа
]гомогентизи-
+НОВОЙ кислоты^
4-малеилацетоацетат
^1зомераза
Фумарилацетоацетат
Алкаптонурия
Недостаточность
диоксигеназы
гомогентизиновой
кислоты
н2о-^
фумарилацетоацетаза
Фумарат
Ацетоацетат
Окисляется
в тканях
вне печени
Рис. 47.2. Альбинизм и алкаптонурия
Недостаточность метионинсинтазы
Метионинсннтаза — В12-зависимый фермент; который в
качестве кофермента использует 1Ч5-метилтетрагидрофолат
(рис. 47.1). Этот фермент катализирует перенос метальной
группы с М5-метилтетрагидрофолата на гомоцистеин с обра¬
зованием метионина. При недостаточности метионинсинтазы
накапливается гомоцистеин, что приводит к гипергомо-
цистинемии, мегалобластной анемии и задержке умственного
развития. В ряде случаев состояние больных улучшается при
приеме фолатов и витамина В12. Кроме того, можно при¬
нимать бетаин: в этом случае используется обходной метабо¬
лический путь, в которс
гомоцистеину для образе
Недостаточность цистг
Недостаточность циста
аутосомно-рецессивном]
страненная причина го
ний аминокислотного о»
р-синтазы находится на
в ряде случаев состоян
пиридоксина, однако
Пероральное употребл
эффективному снижен?
крови.
Цистинурия
Цистииурия наследуете
При цистинурии нару
рых аминокислот в поч
аргинина и лизина. Ци
растворим в воде и на:
образуя камни в почка
называемый цистиновь
получил после того, ка
ружены цистиновые ка
Алкаптонурия
Алкаптонурия наследуе
Это легкое заболевани
жительность жизни. П]
статочность оксидазы
Накапливающаяся гом
сте с мочой и постеп(
черного цвета. Обычн
замечают черные пятнг
Кроме того, следы
и в тканях, особенно
они придают ушному
окраску.
Альбинизм (глазо!
Альбинизм — наруше
мента меланина (рис.
развивается из-за нар
дуется по аутосомно-i
нии в волосах, глазах
Из-за отсутствия мелг
риск развития рака к<
Метаболизм фенилаланина и тирозина в норме
и при патологии
СН,-СН-СОО‘
I ъ-Кетоглугарат
NH, I Глутамат
сн.-с-соо
L Глутамат
Аминотранофераза
Фенилаланин Фенилпируват
Фенилкетонурия
Повышается содержание
фенилпирувата в моче
Фенилкетонурия
s' Тетрагидробио
* птерин
Фенилаланин-
. гидрсксилаза
'ч
~^Ди гидробиотерин-
Тироксин
Меланин
Тирозин-3-моноокс*ген
Дигидробиоптерин•
Алкаптонурия
См. гл. 47
НАДФ+
Дигидробиолтеринредуктаза
НАДФН+Н+
Феохромоцитома
Повышается концентрация
норадреналина
в плазме крови
Феохромоцитома
Повышается содержание
норметадреналина в моче
Аббревиатуры
МАО — моноаминоксидаза. Инактивирует катехоламины
путем окислительного дезаминирования
О2 Н2О Н2О2
R— СН2 — СН2 ~ NH3 -
-♦ R— СН2 — СНО
Моноаминоксидаза 2
NH4
КОМТ — катехол-0-метилтрансфераза. Инактивирует
катехоламины, перенося метильную группу с S-аденозил-
метионина на кислород катехоламина
S-аденозилметионин
он
1.
комт
S-аденоэилгомоцистеин
ОСНз
ООН3
Моноаминоксидаза
но-сн
Окисление
:
CH2NH3
Норадреналин
Норметадреналин
l-ДОФА
Болезнь Паркинсона
Дигидроксифенилаланин
Дигидроаскорбат 4-~«
Н20 4-».
Ингибиторы
декарбоксилазы
(карбидопа,
бенсеразид)
Дофамин-^-
монооксигеназа
Оз
Аскорбат —■^
но-сн —
I
сн2он
3,4-дигидрокси-
фенилгликоль
комт Т
СНО
З-метокси-4-
гидроксимиидальный альдегид
Восстановление^
ОН
ОСНз
-► но—сн
сн2он
З-метокси-4-
гидроксиминдальная кислота
т
Норадреналин”
S-адемоэил метионин
S-аденоэнлгомоцистеии
N
КОМТ
3,4-дигидрокси*
миндальный альдегид
3,4-дигидрокси-
миидальная кислота
ОСН3
СОСГ
Ванилилминдальная
кислота
(З-метокси-4-гидроксм-
миндальная кислота)
ГООН
Гомованилиновая
кислота
но-сн
I
СН2—NH— СН3
Адреналин
ОСН3
НО-СН
I
CH2-NH-CH3
Метадреналин
Феохромоцитома
Повышается содержание
метадреналина в моче
Феохромоцитома
Повышается содержание
ванилилминдальной
кислоты в моче
Нейробластома
В моче повышается
содержание гомо-
ванилиновой кислоты
Феохромоцитома
Повышается концентрация
адреналина в плазме крови
Рис. 48.1. Метаболизм фенилаланина и тирозина в норме и патологии
106 Метаболизм фенилаланина и тирозина в норме и при патологии
Метаболизм фенилаланина и тирозина в норме
Фенилаланин — незаменимая аминокислота. При окислении
4-го атома углерода ароматического кольца фенилаланина
образуется тирозин. Катализирует эту реакцию фенилала-
нингидроксилаза (ее другое название — фенилаланин-4-
монооксигеназа), а кофактор этого фермента является
тетрагидробионтерин (ВН4). Тирозин — предшественник кате¬
холаминов: дофамина, норадреналина и адреналина, а также
гормонов щитовидной железы (трийодтиронина и тирокси¬
на). Название «адреналин» имеет латинское происхождение
и отражает место синтеза этого гормона — «над почкой».
Американцы в погоне за независимостью называют этот же
гормон «эпинефрин» (что значит «над почкой» по-гречески).
Итак, название гормона связано с органом, где происхо¬
дит его секреция — с мозговым веществом надпочечника.
Англичане называют надпочечник adrenal gland, американ¬
цы — epinephral gland.
Нарушение метаболизма фенилаланина.
Фенилкетонурия
Фенилкетонурия — наследственная болезнь, при которой
нарушен метаболизм фенилаланина, и фенилаланин вместе
с кетоном фенилпируватом накапливается в организме. Без
лечения фенилкетонурия приводит к умственной отсталости.
Скрининг новорожденных (с помощью недавно введенного
метода тандем-масс-спектрометрии) позволяет диагности¬
ровать фенилкетонурию сразу же после рождения и начать
лечение, при котором риск умственной отсталости снижается
до минимального. Классическая фенилкетонурия наследует¬
ся по аутосомно-рецессивному типу. При этом заболевании
снижена активность фенилаланингидроксилазы, и лечение
заключается в переводе на диету с низким содержанием
фенилаланина. У некоторых больных уровень фенилаланина
в крови снижается при проведении перорального нагрузоч¬
ного теста с тетрагидробиоптерином (ВН4), особенно если
используется чистый бИ-ВЬЦ-диастереоизомер.
Нарушение метаболизма тирозина:
алкаптонурия и альбинизм
Эти нарушения метаболизма тирозина описаны в гл. 47.
Метаболизм дофамина, норадреналина
и адреналина
Биосинтез
Тирозин — предшественник катехоламинов: дофамина, норад¬
реналина и адреналина. Адреналин запасается в хромаффин¬
ных клетках мозгового вещества надпочечников; он секре-
тируется в экстренных, стрессовых ситуациях. Норадреналин
(префикс «нор» означает отсутствие метильной группы) явля¬
ется нейромедиатором: он секретируется в синаптической
шели в области нервного окончания. Дофамин — промежу¬
точное вещество в биосинтезе норадреналина и адреналина.
Он содержится в дофаминергических нейронах черной суб¬
станции (substantia nigra) головного мозга.
Катаболизм
Главную роль ферменты в катаболизме катехоламинов
играют ферменты катехол-О-метилтрансфераза (КОМТ) и
моноаминоксидаза (МАО). КОМТ переносит метильную
группу с S-аденозиметилметионина (см. гл. 47) на кислород
у третьего атома углерода ароматического кольца катехола¬
мина (рис. 48.1). После этого возможны два равновероят¬
ных варианта развития событий. В первом случае катехо¬
ламины сначала метилируются катехол-О-метилтрансферазой
и образуются «метилированные амины» — норметадреналин и
метадреналин, которые далее подвергаются окислительному
дезаминированию МАО, и продукт МАО-реакции окисляется
до З-метокси-4-гидроксиминдальной кислоты (ее другое назва¬
ние — ванилилминдальная кислота). Если же события раз¬
виваются по второму пути, катехоламины сначала вступают
в реакцию с МАО, в которой происходит их окислительное
дезаминирование. Далее следует реакция окисления, продук¬
ты этой реакции метилирует КОМТ и образуется 3-метокси-
4-гидроксиминдальная кислота.
Метаболизм катехоламинов при патологиях
Недостаток дофамина при болезни Паркинсона
При «дрожательном параличе» (так впервые в 1817 г. была
названа болезнь Паркинсона) происходит разрушение дофа¬
минсодержащих нейронов черной субстанции (substantia nigra)
головного мозга. Существенные достижения в лечении этой
болезни были достигнуты, когда больным стали назначать
L-ДОФА (леводопа) — предшественник дофамина. В отли¬
чие от дофамина, леводопа может проходить через гематоэнце¬
фалический барьер. Эффективным оказался дополнительный
прием карбидопы и бенсеразида. Эти вещества не проходят
через гематоэнцефалический барьер; они подавляют актив¬
ность периферической декарбоксилазы и не позволяют ей
расщеплять L-ДОФА. Благодаря этому больные могут при¬
нимать гораздо меньшие дозы L-ДОФА.
Избыточное образование адреналина
при феохромоцитоме
Феохромоцитома — редко встречающаяся опухоль мозгового
вещества надпочечников, которая синтезирует избыток адре¬
налина и/или норадреналина. До 1990 г. феохромоцитома
часто оставалась нераспознанной, и в большинстве случаев
опухоль диагностировалась уже при вскрытии. В настоящее
время диагноз можно установить с помощью магнитно-
резонансной томографии брюшной полости, после чего
опухоль удаляют хирургическим путем. При феохромоци¬
томе больные страдают от приступов сильной гипертензии,
повышенного потоотделения и головной боли. Из-за при¬
ступообразного характера симптомов кровь и мочу для ана¬
лиза необходимо собирать сразу после приступа; результаты
анализов, собранных в промежутки между кризами, часто
оказываются нормальными. При диагностике заболевания
измеряют уровень метадреналина, норметадреналнна и вани-
лилмиидальной кислоты в моче. Иногда показателен и уровень
адреналина и норадреналина в крови.
Избыточное образование дофамина
Нейробластома — опухоль, синтезирующая избыток дофа¬
мина. Она может развиться в любом месте организма.
Нейробластомы образуются из клеток нервного гребня и
обычно появляются у детей до 5 лет. Диагностическое значе¬
ние имеет повышение уровня ванилилминдальной кислоты и
продукта катаболизма дофамина — гомованилиновой кислоты
в моче.
I
Метаболизм фенилаланина и тирозина в норме и при патологии 107
Продукты метаболизма триптофана и гиотидина
Активируется
кортикостероидами
Кинурениновый
путь
Триптофан
Диоксигеназа
Т«трагмдробиолт«рин
,°2
Гидроксилааа
1 HjO
. Дигидробиоптмрнн
№формилкинурении
5 - гидрокс и три птоф а н
и Формиат
При голодании аланин
вступает в глюконео-
генеэ (в печени)
Ксантуренат
(вещество желтого цвета) Кинуренин
t ^
1 3-гидроксикинуренин
Кинуреназа
Аланин-» ^
Индоламиновый
путь
3-гмдроксиантранилат
г
Цитозоль
Образует ниацин
для синтеза
НАД* и НАДФ+
I
2-амино-З-карбоксимуконовый
полу альдегид
2-аминомуконовый
полуальдегид
2-аминомуконат
5-гидрокси-
триптамин
(серотонин) “Т^о^сит^птам^Г
5-гидроксииндолуксусная
кислота
Мелатонин
а-Кетоадипат
При карциноидном
синдроме уровень
5-гидроксииндол-
уксусной кислоты
в моче повышен
Рис. 49.1. Метаболизм триптофана в кинурениновом (с образованием НАД+ и НАДФ+) и индоламиновом пути (с образованием
серотонина и мелатонина)
Триптофан — предшественник НАД*, НАДФ*,
серотонина и мелатонина
Образование НАД* и НАДФ* в кинурениновом метаболи¬
ческом пути
Кинурениновый путь (рис. 49.1) — основной путь метаболиз¬
ма триптофана. В нем образуются предшественники НАД* и
НАДФ+ (они также синтезируются из поступающего с пищей
ниацина) (см. гл. 55). В среднем из 60 мг триптофана обра¬
зуется 1 мг ниацина.
Серотонин
Серотонин (5-гидрокситриптамин) образуется из триптофана
в индоламиновом метаболическом пути. Серотонин отвечает
за хорошее настроение. При снижении уровня серотонина в
мозге развивается депрессия. Селективные ингибиторы обрат¬
ного захвата серотонина — класс хорошо зарекомендовавших
себя лекарств-антидепрессантов. Они продлевают присут¬
ствие серотонина в синаптической щели и, таким образом,
стимулируют передачу сигналов между нейронами. При этом
возникает ощущение эйфории.
108 Продукты метаболизма триптофана и гистидина
N^'
-CH.-CH-COO"
2 .1
+NH, _
-Z
Гистидимдекарбоксялаза
Р=гсн2-сн2
' Lu +NH,
N^/NH
Г ИСТИДИН
Гистамин
Рис. 49.2. Образование гистамина из гистидина
Моноаминовая теория патогенеза депрессии
Моноаминовая теория патогенеза депрессии была предложе¬
на более 35 лет назад для описания биохимических наруше¬
ний при депрессии. Согласно этой теории, депрессия разви¬
вается при недостатке моноаминов (например, норадреналина
и серотонина) в синапсах, что приводит к снижению синапти¬
ческой активности в головном мозге. Напротив, избыточное
количество моноаминов в синапсах и повышенная синапти¬
ческая активность в головном мозге приводят к чрезмерной
эйфории, развивается маниакальный синдром.
Известно, что системное введение кортикостероидов сни¬
жает уровень серотонина. Кортикостероиды стимулируют
активность диоксигеназы, и триптофан поступает преимуще¬
ственно в кинурениновый метаболический путь, минуя иидола-
миновый путь (и соответственно синтез серотонина). Низкое
содержание серотонина в головном мозге может быть при¬
чиной депрессии. Больные с высоким уровнем кортизола
(например, при синдроме Кушинга) подвержены депрессиям,
что находится в соответствии с моноаминовой теорией.
Карциноидный синдром и 5-гидроксииндолуксусная
кислота
Серотонин превращается в 5-гидроксииидолуксусную кислоту,
которая выводится с мочой. При карционндном синдроме
уровень 5-гидроксииндолуксусной кислоты в моче повышен.
Мелатонин
Мелатонин образуется из серотонина в клетках эпифиза
и секретируется в период темного времени суток. Обычно
секреция мелатонина начинается ночью и способствует засы¬
панию. В период светлого времени суток концентрация мела¬
тонина в крови очень низка.
Гистамин
Гистамин участвует в формировании местного иммунно¬
го ответа и аллергических реакциях. Он также стимулиру¬
ет секрецию соляной кислоты желудочного сока. Гистамин
образуется при декарбоксилировании гистидина (рис. 49.2).
Продукты метаболизма триптофана и гистидина 109
Гем, билирубин и порфирия
г
Сукцинил-КоА
Гемин, гематин,
гема аргинат
©
Синтаза 5-амино-
левулиновой кислоты
Этанол, половые
стероидные гормоны,
барбитураты,суль-
фонамиды, противо-
судорожные средства
Глицин
Гем
В печени синтаза 5-аминолевулиновой
кислоты ингибируется гемом по прин¬
ципу обратной связи. Гем регулирует
транскрипцию, стабильность мРНК и
импорт этого фермента в митохондрии
2H4-
• со2
•KoA-SH
5-аминолевулиновая
кислота (2 молекулы)
Отравление
свинцом
Fe3+-
©
Fe2'
Недостаточность
порфобилиногенсинтазы
(очень редкое наследственное
неврологическое заболевание;
наследуется по аутосомно-
рецессивному типу)
Свинец ингибирует
реакцию восстановления
Медленное внутривенное
вливание натрий-кальциевой
соли зтилендиаминтетраук-
сусной кислоты способствует
выведению свинца с мочой
[ 2 р-цепи
2 а-полипептида
ГбМОГЛОбиН ■■■Hill,,
(Fe24)
I
Метгемоглобин
(Fe?T
Низкое сродство
к кислороду
Эритропозтическая протопорфирия
Не острая болезнь. Как правило, передается
по аутосомно-доминантному типу, выявляется
у детей. Характерна светочувствительность.
Накопление протопорфирина приводит
к дисфункции печени. Повышенная концентрация
протопорфирина в эритроцитах видна под
флюоресцентным микроскопом
Митохондрия
Свинец
©
Порфобилиноген-
синтаза (или дегидрогеназа
шинолевулиновой кислоты)
Протопорфирин IX
2НгО
ЗНг
Порфобилиноген
(4 молекулы)
Острая
интермиттирующая
порфирия
(наследуется по аутосом-
ному типу, поражаются
нервная система, печень)
Псрфирино-
геноксидаза
Пестрая порфирия
Острое заболевание, наследуемое
по аутосомно-доминантному типу.
Наиболее распространена у белокожих
жителей Южной Африки. Относится
к печеночным порфириям. Характерны
приступы нейропсихических
расстройств, светочувствительность
Протопорфириноген IX
Порфобилиногендезаминаза
f 4ЫНя
Г идроксиметилбилан
Эритропозтическая уропорфирия
(болезнь Гюнтера)
Болезнь не острая, наследуется по
аутосомно-рецессивному типу. Вы¬
является в раннем возрасте. Харак¬
терны светочувствительность, на¬
рушение строения ногтей, розовая
или коричневая окраска зубов.
Наблюдаются нормохромная гипер¬
плазия костного мозга, увеличение
селезенки (спленомегалия)
Уропорфириноген
Ш-оинтаза
Наследственная
копропорфирия
Острая болезнь, наследуемая
по аутосомно-доминантному
типу. Относится к печеночным
порфириям. Характерны при¬
ступы нейропсихических рас¬
стройств, светочувствительность
НгО
4С02
Уропорфириноген III
Уропорфириноген
111-декарбоксилаза
•2Н4
•2С02
Копропорфирино
геноксидаза
Копропорфириноген III
Неферментативная
реакция.
Имеет значение, если
накапливается
гидроксиметилбилан
1 Порфиоия кожи поздняя
| Не острая, обычно приобретенная болезнь.
| Развивается при злоупотреблении алкоголем,
| применении эстрогенов, гепатите С. Относится
! к печеночным порфириям. Наблюдаются
i светочувствительность, гепатомегалия
Цитозоль
-►Оо
Синглетный кислород
(цитотоксичен)
Свет
Синглетный кислород
образуется при порфириях
со светочувствительностью
Активированный
порфири(
НгО
4СОг
•Уропорфириноген I-
Декарбоксилаза
Протопорфирин IX
Копропорфирин II
Уропорфирин III
Уропорфирин I
Копропорфирин I
6Н 6Н 6Н 6Н 6Н
Копропорфириноген
Неферментативное
окисление
Рис. 50.1. Гем, билирубин и порфирии
110
Гем, билирубин и порфирия
"Ill,
"Ill,
UIIIIIIIIIIIIIIIIIMIIIIIIIIIIIIIIIIIIlJ
Гем
Биливердин
Гемоксигеназа
Билирубин
Билирубин-
альбумин^
J
Альбумин
Билирубин (гидрофобное
вещество) связывается
с альбумином в плазме крови
и доставляется в печень.
Лигандин переносит его
внутрь клетки к эндоплаз¬
матическому ретикулуму.
Здесь билирубин конъюгирует
с УДФ-глюкуронатом
и становится гидрофильным
1
Лигандин
А
Билирубин-лигандин
Синдром Жильбера
(умеренная недостаточность
УДФ-глюкуронилтрансфе-
разы)
Синдром Криглера-Найяра.
(тяжелая недостаточность
УДФ-глюкуроиилтрансферазы)
Лигандин
УДф-
глюкуронил-
трансфераза.
2 молекулы
УДФ-глюкуроновой
киолоты
2УДФ
Эндоплазматический
ретикулум
Гепатоцит
НгО
у
■ Бактериальные ферменты
2 молекулы
^ глюкуроновой кислоты
Билирубин
8Н-^
Бактериальные ферменты
Почки
Билирубин-
диглюкуронид
)
Уробилиноген
ф*Уробилин,
МОЧА
Бактериальные
ферменты
Стеркобилиноген нв^нвавш^Стеркобилин i
ФЕКАЛИИ
Биосинтез гема
Гем синтезируется из сукцинил-КоА и глицина. Синтез гема идет
в большинстве клеток, особенно интенсивно в печени и кровет¬
ворных клетках костного мозга. Гем, синтезированный в печени,
используется для образования некоторых гемсодержаших белков,
в первую очередь белков семейства цитохрома Р450 и цитохро-
мов дыхательной цепи. В эритроцитах гем связывается с глоби¬
ном, образуя гемоглобин. Биосинтез гема в печени регулирует¬
ся синтазой 5-аминолевулиновой кислоты, которая ингибируется
гемом по принципу обратной связи. Когда же концентрация гема
снижается, синтаза 5-аминолевулиновой кислоты активируется.
Порфобилиноген — одно из промежуточных соединений в син¬
тезе гема. При дезаминировании порфобилиногена образуется
гидроксиметилбутилан, а при его циклизации — уропорфирино-
ген III, предшественник гема (рис. 50.1).
Острая интермиттирукнцая порфирия
Острая интермиттирующая порфирия развивается из-за недо¬
статочности порфобилиногендезаминазы и наследуется по
аутосомно-доминантному типу. Это единственная порфирия,
для которой не характерна светочувствительность. Накопление
5-аминолевулиновой кислоты и порфобилиногена вызывает
острые желудочно-кишечные боли, неврологические и психиа¬
трические приступы. Приступы провоцируются употреблением
алкоголя и целого ряда лекарств, например барбитуратов и ораль¬
ных контрацептивов. Дело в том, что в метаболизме этих веществ
участвует система цитохрома Р450. Гем — необходимый компо¬
нент цитохрома Р450, поэтому при активации ферментов системы
цитохрома Р450 используется весь свободный гем. Концентрация
гема падает, синтаза 5-аминолевулиновой кислоты активирует¬
ся и интенсивно синтезирует порфобилиноген. Но из-за недо¬
статочности порфобилиногендезаминазы этот порфобилиноген
накапливается, что вызывает приступ острой интермиттирующей
порфирии. У таких больных при хранении моча принимает цвет
портвейна. Диагностическое значение имеет повышенный уро¬
вень норфобилиногена в моче. Больным назначают внутривен¬
ные инъекции гематина, которые снижают активность синтазы
5-аминолевулиновой кислоты.
Порфирии со светочувствительностью
При недостаточности какого-либо фермента в пути синтеза гема
из гидроксиметилбутилана и далее происходит накопление про¬
межуточных соединений. Они подвергаются неферментативному
окислению, и образуются порфирины, которые при воздействии
света образуют синглетный кислород 02\ Это вещество токсично
для клеток, и его накопление определяет развитие светочувстви¬
тельности к действию солнечного света.
Отравление свинцом
Свинец ингибирует порфобилиногенсинтазу и феррохелатазу, бло¬
кируя синтез гема. Это приводит к развитию микроцитарной
гипохромной анемии и порфирии. При отравлении свинцом в
моче повышается уровень 5-аминолевулиновой кислоты.
Катаболизм тома о образованием билирубина
В клетках ретикулоэндотелиальной системы гемоксигеназа пре¬
вращает гем в билирубин. Билирубин — гидрофобная молекула,
поэтому для транспорта в крови он связывается с альбумином.
При желтухе билирубин образуется в избыточном количестве.
Накопление липофильного билирубина в головном мозге вызы¬
вает энцефалопатию. В норме билирубин поступает в печень,
где конъюгируется с глюкуроновой кислотой, образуется водо¬
растворимый билирубиидиглюкуронид. Он поступает в желчь и
попадает в тонкий кишечник, где под действием ферментов
бактерий из него образуется уробилиноген. Уробилиноген может
частично всасываться в кишечнике, снова поступать в печень и
экскретироваться в желчь. Небольшое количество уробилиноге-
на преобразуется в уробилин и выводится с мочой. Кроме того,
часть уробилиногена в кишечнике превращается в стеркобилин и
выводится с фекалиями.
Гем, билирубин и порфирия m
Жирорастворимые витамины (часть I): витамины А и О
Рис. 51.1. Образование ретиноевой кислоты из р-каротина
Жирорастворимые витамины A, D, Е и К всасываютея в кишечнике
и включаются в состав хиломикронов (см. гл. 42). Если при болезни
ухудшается всасывание жиров и наблюдается етсаторея, снижается
и поступление этих витаминов в организм. Кроме того, авитаминоз
одного или нескольких жирорастворимых витаминов может развить¬
ся при нарушении работы панкреатической липазы, ответственной
за всасывание жиров. Так, это наблюдается при муковисцидозе.
Витамин А
Витамин А — общее название нескольких соединений, кото¬
рые включают различные формы витамина А [ретинол (спирт),
ретиналь (альдегид), ретиноевую кислоту (карбоновую кислоту)],
а также каротиноиды, которые являются провитамином А. Из
этих каротиноидов в метаболических путях образуется ретинол,
например из Р-каротина (рис. 51.1).
Биохимические функции
1. Зрение. Из ретинола образуется 11-цис-ретиналь. Он связы¬
вается с опсином в палочках сетчатки, формируя зрительный
пигмент родопсин. Фотон преобразует 11-цис-ретиналь в
трансформу и инициирует серию реакций, в результате кото¬
рых формируется сигнал в зрительном нерве. По зрительному
нерву сигнал поступает в головной мозг, где на основе посту¬
пившей информации создаются зрительные образы.
2. Регуляция экспрессии генов. При окислении ретиналя образу¬
ется ретиноевая кислота, которая влияет на экспрессию генов.
В ядре ретиноевая кислота связывается с рецептором, регули¬
рующим активность хромосомных специфических элементов
ответа на ретиноевую кислоту (RARE — retinoic acid response
elements). Активируя и подавляя транскрипцию генов, ретиное¬
вая кислота регулирует дифференцировку клеток. Таким обра¬
зом, витамин А важен для роста и развития клеток, в том числе
лимфоцитов, определяющих развитие иммунного ответа.
Болезни при недостаточности внтамнна А
1. Нарушения зрения. На ранних стадиях недостаточность вита¬
мина А приводит к ухудшению зрения в темноте. При тяжелых
Рис. 51.2. Ликопен и астаксантин относятся к каротиноидам, но
не являются предшественниками витамина А
формах недостаточности развивается ксерофтальмия, а затем
и рубцевание роговицы, наступает слепота. От недостаточ¬
ности витамина А страдают более 100 млн детей, живущих
в бедных странах, где основу рациона составляет рис.
2. Нарушение дифференцировки клеток. Витамин А — «противо-
инфекционный» витамин. При его недостатке нарушается
дифференцировка клеток, в том числе и лимфоцитов, что
приводит к развитию иммунодефицита и повышенной вос¬
приимчивости к инфекциям.
Пищевые источники
Витамин А может поступать в организм в виде уже готового рети¬
нола или образовываться из предшественников — провитамина А.
Готовый витамин А в форме эфиров ретинола содержится в про¬
дуктах животного происхождения. Рекомендованная суточная
доза готового витамина А составляет 0,9 мг для мужчин и 0,7 мг
для женщин. Активность источников провитамина А оценива¬
ется в эквивалентах активности ретинола (ЭАР): так, например,
активность Р-каротина = 12 ЭАР, поскольку из 12 мг пищевого
Р-каротина образуется 1 мг ретинола.
1. Готовый витамин А содержится в печени, витаминизирован¬
ных зерновых завтраках, яйцах, молочных продуктах.
2. Провитамин А. Каротиноиды — большое семейство окра¬
шенных соединений, синтезируемых растениями. Примерно
10% каротиноидов имеют р-ионное кольцо, которое необхо¬
димо для активности витамина А. К таким каротиноидам
относится, например, Р-каротин, содержащийся в моркови.
Каротиноиды содержат несколько двойных связей, благода¬
ря чему они способны эффективно перехватывать свободные
радикалы и нейтрализовать синглетный кислород.
Многие каротиноиды не являются предшественниками витами¬
на А. 90% каротиноидов не являются предшественниками вита¬
мина А, но все они прекрасные перехватчики свободных ради¬
калов. Примеры таких каротиноидов — ликопены (содержащиеся
в помидорах) и астаксантин (рис. 51.2). Астаксантин — мощный
антиоксидант, который применяют в медицине для лечения ряда
заболеваний. Он имеет розовую окраску и содержится в тканях
водных организмов: лосося, креветок, омаров и в водорослях.
Очень богата астаксантином водоросль Haematococcus pluvialis, из
которой его получают в промышленных масштабах.
Токсичность
При избыточном потреблении готового витамина А возможен
гипервитаминоз А. Повышенные дозы витамина А опасны для
плода при беременности: ретиноевая кислота участвует в регуляции
дифференцировки клеток, и ее избыток приводит к порокам разви¬
тия. Согласно недавним исследованиям, длительный прием высо¬
ких доз витамина А может приводить к развитию остеопороза.
Печень белого медведя ядовита! 500 г печени белого медведя
содержит до 10 млн ME витамина А. Случаи острого отравления
были зарегистрированы у исследователей Арктики, их собак и
эскимосов.
112 Жирорастворимые витамины (часть I): витамины А и D
Ультрафиолет
(эргокальциферол)
7-дегидрохолестерол
t
Биосинтез
холестерола (см. гл. 38)
25-гидрокси-
холекальциферол
(кальцидиол)
Паратгормон
©
1 -а-гидрок-
силаза
Почка
\"--
Саркоидоз
Хроническая почечная
Под действием внепочечной
недостаточность
1-а-гидроксилазы образуется
Недостаточная активность
избыточное количество
1-а-гидроксилазы приводит
1,25-дигидроксихолекальци-
к гипокальциемии и нефрогенной
ферола, что приводит
остеопатии. Возможно развитие
к гиперкальциемии
i
Г
тяжелых форм рахита
1,25-дигидроксихолекальциферол
или кальцитриол
(активная форма)
V У V
Рис. 51.3. Метаболизм витамина D
Аналоги витамина А
Изотретиноин и этретинат — аналоги витамина А. Они при¬
меняются для лечения кожных заболеваний. Так, изотретино-
ин используется при лечении тяжелых случаев акне (однако он
противопоказан при беременности, см. выше). Этретинат® ранее
применяли для лечения псориаза, но сейчас в ряде стран этот
препарат запрещен.
Витамин D
Витамин D — «витамин солнечного света». Впервые его выде¬
лили в виде неочищенной смеси, названной витамином Dj {Dx
уже не входит в состав витаминных добавок). Эргостерол (рас¬
тительный эквивалент холестерола) под действием ультрафиоле¬
тового излучения превращается в витамин D2 (эргокальциферол).
Витамин D3 (холекальциферол) образуется в коже под действием
I ультрафиолетового излучения 7-дегидрохолестерола — промежу-
1 точного вещества в пути биосинтеза холестерола. Под действием
1 излучения В-кольцо стероидного ядра 7-дегидрохолестерола раз-
\ рывается (рис. 51.3). Холекальциферол далее гидроксилируется в
1 печени, образуя 25-гидроксихолекальциферол. Затем он еще раз
\ гидроксилируется в почках, и образуется самая активная форма
\ витамина. 1,25-дигидрокеихолекалышферол (его называют каль-
I имтриолом).
1 Биохимические фикции
\ \,25-дигидроксихолекальциферол регулирует обмен кальция,
\ повышая его уровень в крови. Он усиливает всасывание полу-
\ ченного с пищей кальция в кишечнике, усиливает мобилизацию
\ кальция из костной ткани при низкой концентрации кальция в
\ крови, а в почках стимулирует реабсорбцию кальция в кровь.
\ Лабораторная диагностика недостаточности
\ Диагностическое значение имеет низкий уровень кальция в моче.
\ Рекомендуется измерить уровень 25-гидроксихолекальциферола
\ в сыворотке крови.
Пищевые источники
Витамин D содержится в рыбьем жире, жирных видах рыбы (сар¬
динах, макрели, лососе и др.). Некоторые продукты, например зер¬
новые завтраки, апельсиновый сок, маргарин и молоко, обогащены
витамином D (холекальциферолом или эргокальциферолом).
Болезни при недостаточности витамина D
Недостаток витамина D вызывает гипокалъциемию и развитие
рахита (у детей) и остеомаляции (у взрослых). Гипокалъциемия
может быть причиной судорог и тетании. Возможны несколько
причин недостаточности витамина D.
1. Недостаток солнечного света. Если человек проводит много
времени на солнце, в его организме синтезируется достаточ¬
ное количество витамина D. Однако гиповитаминоз D может
развиться в зимний период у лиц, проживающих в широтах
севернее или южнее меридиана 40°, в первую очередь у смугло¬
кожих (особенно если они еще и одеты с ног до головы). Так,
у мусульманских женщин, живущих на севере Европы, повы¬
шен риск развития гипокалъциемии.
2. Нарушение всасывания в кишечнике. Заболевания поджелу¬
дочной железы или непроходимость желчных протоков могут
вызвать стеаторею и авитаминоз D.
3. Хроническая почечная недостаточность. В почках происходит
а-\-гидроксилазная реакция, в ходе которой образуется
\,25-дигидроксихолекалъциферол. При хронической почеч¬
ной недостаточности запускается целый каскад событий,
приводящих к развитию вторичного гиперпаратиреоза, а в
тяжелых случаях — третичного гиперпаратиреоза и нефро-
генной остеопатии.
Токсичность
При гипервитаминозе D наблюдается гиперкалъциемия, что
может привести к развитию остеопороза, кальцинозу внутренних
органов (например, почек и сердца) и мочекаменной болезни.
Повышенная чувствительность к витамину D при саркоидозе.
При саркоидозе во внепочечных саркоидных гранулемах высо¬
ко активна \-а-гидроксилаза, которая превращает витамин D
в \ ,25-дигидроксихолекальциферол. Избыточное количество
последнего вызывает развитие гиперкальциемии. Подобная ситу¬
ация наблюдается при некоторых лимфомах и саркомах.
Жирорастворимые витамины (часть W.
Жирорастворимые витамины (часть II): витамины Е и К
I
Липопротеинлипаза
активируется апоС2 и
стимулируется инсулином
Жирные Глицерол
кислоты
а-Токоферол
(витамин Е)
т—►
Прием витамина Е
(500 ME в сутки)
может предупре¬
дить развитие
сердечно-сосуди¬
стых заболеваний
job
100
Атеросклероз
Поврежденные свободными
радикалами ЛПНП захватываются
макрофагами в стенках сосудов.
Формируются атеросклероти¬
ческие бляшки
Аминоксилоты
Жирные кислоты
1 ^
i
1
Глицерол
Расщепление
л
Рецептор
ЛПНП
К У
▼
Холестерол
Рис. 52.1. Витамин Е защищает липопротеины низкой плотности от окислительного повреждения
Витамин Е
Витамином Е называют группу соединений, к которым отно¬
сятся восемь токоферолов (а-, р-, у- и 8-) и четыре токо-
триенола (а-, р-, у- и 8-). Наибольшее значение имеют
а-токоферолы.
Биохимические функции
а-Токоферол является антиоксидантом. Он защищает поли-
ненасыщенные жирные кислоты от повреждения свободными
радикалами, особенно велика его роль в клеточных мембранах
эритроцитов. По некоторым данным, а-токоферол снижает
уровень окислительного повреждения липопротеинов низ¬
кой плотности (ЛПНП) и тем самым препятствует развитию
атеросклероза (см. гл. 15, 39). Правда, до сих пор нет убеди¬
тельных доказательств, что пищевая добавка а-токоферола
снижает риск развития сердечно-сосудистых заболеваний.
Но, согласно недавним исследованиям, при употреблении
500 ME а-токоферола в сутки подавляется окисление жиров
в зоне атеросклеротических поражений.
Лабораторная диагностика недостаточности
Измерение уровня витамина Е в тромбоцитах.
Пищевые источники
Содержится в растительных маслах, орехах, овощах с зеле¬
ными листьями.
Болезни при недостаточности витамина Е
Болезни при недостаточности витамина Е наблюдаются
у детей, больных муковисцидозом, а также при стеаторее.
Повреждение мембран эритроцитов приводит к развитию
гемолитической анемии, а повреждение нервных клеток —
к поражению периферической нервной системы.
Токсичность
Неприятные симптомы при передозировке витамина Е обыч¬
но выражены слабо. При низком уровне витамина К высокие
дозы витамина Е могут вызвать увеличение времени сверты¬
вания крови.
114 Жирорастворимые витамины (часть II): витамины Е и К
Витамин К
Витамин К (от датского koagulation — коагуляция) существует
в двух природных формах: витамин К| (филлохинон) и вита¬
мин К2 (менахинон). Витамин К3 (менадион) — их синтетиче¬
ский водорастворимый аналог.
Биохимические функции
Витамин К необходим для активности витамин К-зависимой
у-глутамилкарбоксилазы, которая ответственна за посттранс¬
ляционную модификацию остатков глутамина (Glu) в
у-карбоксилированные остатки глутамина (Gla). Этот фер¬
мент связан с мембраной и карбоксилирует белки, кото¬
рые транспортируются из эндоплазматического ретикулума.
Так образуется небольшое семейство витамии-К-зависимых
белков. Некоторые витамин-К-зависимые белки регулиру¬
ют свертываемость крови и довольно хорошо изучены. Но
недавно были открыты и другие белки этого семейства. Это
остеокальцин (Gla-белок кости) и Gla-белок матрикса, уча¬
ствующие в метаболизме костной ткани.
Таким образом, витамин К выполняет следующие функ¬
ции.
1. Участвует в свертывании крови. В витамин-К-зависимой
у-глутамилкарбоксилазной реакции происходит карбок-
силирование остатков глутамата в предшественниках
антикоагулянтов: нротромбине и факторах VII, IX и X.
Так образуются активные формы антикоагулянтов. При
этом происходит регенерация витамина К в «витамин
К-эпоксидном цикле».
2. Участвует в минерализации костей. Недавно было показа¬
но, что витамин К важен для правильного роста и разви¬
тия костей.
Лабораторная диагностика недостаточности
Измеряется уровень карбоксилированных Gla-белков в крови.
Пищевые источники
Основной источник филлохинона (витамин Kj) — раститель¬
ные масла и овощи с зелеными листьями. Менахинон синте¬
зируется бактериями флоры толстого кишечника.
Болезни при недостаточности витамина К
1. Геморрагическая болезнь новорождеппых. Передача вита¬
мина К через плаценту малоэффективна, поэтому может
развиться авитаминоз. Болезнь характеризуется кровоиз¬
лияниями у новорожденного.
2. Поскольку желудочно-кишечный тракт новорожденных сте-
рилеп, витамин К не может синтезироваться бактериями.
3. Грудное молоко содержит мало витамина К.
4. Остеопороз. Согласно недавним исследованиям, недоста¬
точность витамина К повышает риск переломов и разви¬
тия остеопороза.
Токсичность
При передозировке филлохинона и менахинона какие-либо
неприятные симптомы не наблюдались. Однако передози¬
ровка менадиона приводит к окислительным повреждениям
мембран эритроцитов.
Жирорастворимые витамины (часть И): витамины Е и К 115
Водорастворимыо витамины (часть I): тиамин,
рибофлавин, ниацин и пантотеновая кислота
Гликоген
Гликоген
(п—1 остаток глюкозы)
Тиаминдифосфат (тиаминпирофосфат, витамин
Тиаминдифосфат (тиаминпирофосфат, витамин В,) необходим для актив¬
ности пируватдегидрогеназы и сходных с ней крупных мультиферментных
комплексов, которые катализируют окислительное декарбоксилирование
а-кетокислот. Суточная норма зависит от энергетических затрат и составляет
0,4 мг/1000 ккал.
Биохимические функции
A) Кофактор пируватдегидрогеназы — фермента, катализирующего переход¬
ную реакцию между гликолизом и циклом Кребса. Участвует в энергетиче¬
ском метаболизме глюкозы и других углеводов.
Б) Кофактор а-кетоглутаратдегидрогеназы.
B) Кофактор некоторых дегидрогеназ а-кетокислот, участвующих в окисле¬
нии аминокислот (например, дегидрогеназы а-кетокислот с разветвленной
цепью).
Г) Кофактор транскетолазы в пентозофосфатном пути.
Лабораторная диагностика
А) При недостаточности тиаминдифосфата развивается гиперлактатемия,
особенно после приема глюкозы. Происходит это потому, что пируватде-
гидрогеназа неактивна и в тканях накапливаются пируват и лактат.
Б) Измерение активности транскетолазы в эритроцитах с добавленным тиами¬
ном и без него.
Пищевые источники. Содержится в злаковых, бобовых, дрожжах, печени.
Болезни при недостаточности витамина В1
А) При недостаточности витамина В, вследствие злоупотребления алкоголем
развиваются болезнь Вернике и психоз Корсакова.
Б) Бери-бери. При влажной (отечной) форме наблюдаются отек, сердечно¬
сосудистые нарушения. При сухой форме — поражения нервной системы,
атрофия мышц.
Токсичность. Токсичен при потреблении свыше 3 г в сутки (клинические при¬
знаки отравления изменчивы).
Ниацин (витамин В3)
дтф-^
Биотин N
Митохондрия
Пируй ткарбоксмлаэа
АДф+ф «А
НСОз"-
Малатдегидрогеназа
В-1, Вг, Вз,-1
В5 липоат
Пирукатдагмдрогаиаэа
Ч'-* НАДН-Ж»
Ацет 1Л-К0А
мам*
Фу» »рат
ФАДНг*^
В2
Сукцинатде-
гидрогаиаэа
—У Оксалоацет
/ В-Г 1 у Цитрат
▼ О ▼ синтаза .
НАД* НАДН-Ж* НаО KoA-SH
Цикл Кребса
суква
в2, в3
В5 липоат
7 '
а-Катоглутарат-
дагидроганаэа
НАД*
Ниацин входит в состав коферментов дегидрогеназ-переносчиков водорода
НАД+ и НАДФ+. Оба они участвуют в различных метаболических путях. Так,
НАД+ является переносчиком водорода при синтезе АТФ в дыхательной цепи,
а НАДФН играет важную роль в биосинтезе многих веществ. Суточная потреб¬
ность составляет 6,6 эквивалента ниацина/1000 ккал.
Биохимические функции. Термином «ниацин» обозначают никотиновую кис¬
лоту и никотинамид. Он входит в состав НАД\ НАДФ+ и их восстановленных
форм — НАДН и НАДФН, которые участвуют во многих метаболических путях.
НАД+ используется при гликолизе, окислении жирных кислот, окислении
аминокислот и цикле Кребса. Особенно значима его роль «переносчика водо¬
рода» в дыхательной цепи, где при окислении НАДН образуется АТФ. НАДФ*
и его восстановленная форма НАДФН играют важную роль в биосинтезе ряда
веществ, например липидов (жирных кислот, холестерола).
Лабораторная диагностика недостаточности. Измерение отношения
уровня N -метилникотинамида к уровню пиридона (1\Г-метил-2-пиридон-5-
карбоксимида) в моче.
Источники ниацина. Обогащенные витаминами зерновые завтраки, печень,
дрожжи, мясо, бобовые.
Организм способен синтезировать примерно половину дневной нормы ниацина
из триптофана (1 мг ниацина из 60 мг триптофана).
Болезни при недостаточности ниацина. Еоли пища содержит мало и ниацина,
и триптофана одновременно, развивается пеллагра (от итал. «pelle» — кожа
и «agro» — грубый, шероховатый). Так, эта болезнь возникает, если основу
рациона составляет кукуруза. Характеризуется поражением кожи, пищевари¬
тельного тракта и нарушениями психики (три Д: дерматит, диарея, деменция).
Фармакология и токсичность. В умеренно высоких дозах (2-4 г в сутки) ниа¬
цин является гиполипидемическим средством, и в настоящий момент проходят
его клинические испытания.
При передозировке никотиновой кислоты возможно временное расшире¬
ние кровеносных сосудов и снижение кровяного давления.
НАДН-+Н* KoA-SH
Рис. 53.1. Роль водорастворимых витаминов в метаболизме
116 Водорастворимые витамины (часть I): тиамин, рибофлавин, ниацин и пантотеновая кислота
г
Рибофлавин (витамин В2)
Рибофлавин (витамин В2) участвует в энергетическом метаболиз¬
ме глюкозы и жирных кислот. Он входит в состав ФАД — просте-
тической группы некоторых ферментов, участвующих в реакциях
окисления-восстановления. Также рибофлавин входит в состав фла-
винмононуклеотида комплекса I дыхательной цепи.
Биохимические функции. Входит в состав ФАД. Это простетическая
группа, которая:
а) содержится в мультиферментных комплексах, участвующих в
окислительном декарбоксилировании:
1) кофактор пируватдегидрогеназы — фермента, катализи¬
рующего переходную реакцию между гликолизом и циклом
Кребса. Кофактор а-кетоглутаратдегидрогеназы;
2) кофактор некоторых дегидрогеназ а-кетокислот, участвую¬
щих в окислении аминокислот (например, дегидрогеназы
а-кетокислот с разветвленной цепью);
б) простетическая группа сукцинатдегидрогеназы (фермента цикла
Кребса);
в) входит в состав флавинмононуклеотида комплекса I дыхательной
цепи;
д) кофактор ацил-КоА-дегидрогеназы (фермента р-окисления).
Лабораторная диагностика
А) Измерение активности глутатионредуктазы эритроцитов (ФАД-
зависимого фермента).
Б) Изменение содержания рибофлавина в моче.
Пищевые источники. Содержится в молоке, печени, дрожжах, яйцах,
а также в витаминизированных зерновых продуктах (однако в нату¬
ральных крупах и злаках рибофлавина мало).
Следует помнить
А) Воспаленный язык малиново-красного цвета может быть проявле¬
нием недостаточности витамина В2.
Б) Рибофлавин разрушается под действием ультрафиолетового
излучения. Поэтому при лечении физиологической желтухи мето¬
дом фототерапии необходимо дополнительно давать новорож¬
денным рибофлавин.
Токсичность. Случаев отравления не зарегистрировано.
у
Глюкозо
6-фосфат
НАДФ* НАДфН+Н*
НАДФ* НАДФН+Н* СОг
Глюкоэо-6-
фосфат дегидрогеназа
6-фосфоглюконо-
6-лактон
6-фосфо
’ глюконат
:£21Л.
Q-фосфоглюкоиат-
дегмдрогеиаза
> Рибозо-5-фосфат
Пентозофосфатный путь
Фруктозо-
6-фосфат
Транскатолаза
в
Эритрозо-'
4-фосфат
^лицеральдегид-
3-фосфат
Фруктозо-
6-фосфат
^Свдогептулозо-
7-фосфат
3-фосфат
Рибозофосфат-
3-элимераза
Рибозо-5-
фосфатизомераза
• Ксилозо- Рибозо-5-фосфат
5-фосфат
t
t
Транскетолаза
Вт
Цитозоль
Митохондрия
|3-0кисление
Ацетил-КоА
i
Пантотеновая кислота (витамин В5)
Пантотеновая кислота (витамин В5) входит в состав кофермента А, который
выполняет множество функций в метаболизме углеводов, липидов и амино¬
кислот. Суточная потребность в пантотеновой кислоте составляет 4-7 мг.
Биохимические функции. Пантотеновая кислота входит в состав кофер¬
мента A (KoA-SH), который участвует в метаболизме углеводов, липидов и
аминокислот («SH» обозначает концевую сульфгидрильную группу кофер¬
мента А, см. гл. 9).
Кроме того, пантотеновая кислота входит в состав ацилпереносящего
белка, участвующего в синтезе жирных кислот.
Лабораторная диагностика. Измеряется концентрация витамина В5 в крови.
Пищевые источники. Содержится во всех продуктах.
Болезни при недостаточности пантотеновой кислоты. У военнопленных
был описан «синдром жжения ног», развивающийся при недостаточности
пантотеновой кислоты. Других проявлений недостаточности не отмечено.
Токсичность. Не токсичен в дозе до 10 г/сут.
Транс -Д2-
►»АДН,
Вз
► надн+н+ 3-кето
Миристоил КоД(С,4)
ФАД
В2'
Ацил-КоА-дегидрогеназа
^'-►ФАДНг
ноил-КоА
Н Р
Ь-3-гидр< ссиацил-КоА
l-3-гидроксиацил-
vKoA-дегидрогеназа
Х^-ФНАДН+Н+
дня-КоА
нВб'
Ацетил-КоА
Водорастворимые витамины (часть I); тиамин, рибофлавин, ниацин и пантотеновая кислота
11
-я
Водорастворимые витамины (часть II):
пиридоксальфосфат (В6)
Фенилаланин
Гликоген
Тетрагидро*
биолтарин
монооксигеназа
Дигмдробмоптери!
НАД «Г
Дигидробио-
птеринредуктаза
НАДФН-Н*
Фосфорилаза в6
Гликоген
(п-1 остаток глюкозы)
созо-
:фат
со2+
Гомог
о-
Фумари.
н,о-^
Деветвящий фермент
1) гликозилтрансфераза
'2) а-(1 6)-глюкозидаза
а-Катоглутарат
В6
Тирозинаминотрансфераза
Глутамат
Аланин
Измерение содержания сывороточной
AJ1T используется при диагностике
заболеваний печени
Глюкоза
Распад гликогена
4 - гидроксфен и л п и руват
о.
Диоксигеназа
нтизат
1.2-диоксигеназа
u-Катоглутарат Глутамат
W г
Аланинамино-
трансфераза (АЛТ)
а-Катоглутарат Глутамат
Глюкоза образуется
в ходе глюконеогенеза
Пируват
4-мале*фцатоацетат
Изомераза
НАДН-Ж*
цетоацетат
Фумарилацеюацетаза
Фосфоенолпируват-
карбоксилаза
Мала тдегидрогеназа
ри
НАД*"
-4>Малат
Лактат*-
Ацетоацетат
1
Окисляется
в тканях
вне печени
Гистидин
Гистидаза
Mi
Пируват образуется
в ходе гликолиза
Цитозоль
НАД* НАДН+Н*
Лакта тдегидрогеназа
АТФ-^
Пируваткарбоксилаза
(биотин)
АДФ+ФМ<-^
НСОзХ.
НАД*
Малат-
\егидрогеназа
НАД
1st
KoA-SH —-s. ^ НАД*
Пируватдегидрогеназа
НАДН+Н*
со3
Ацетил-КоА
Митохондрия
NH,
Фолатный
цикл
Уроканат
Гидратаза (
4-имидазолон-
5-пропионат
НгО
\
оацетат
к
НАДН+Н
7* V
/Ци тра тсинтазА
Н-0 к^д
♦ Цитрат
KoA-SH
Фумараза
Аконитаза
Н2° [Цис-аконитат]
W* Л/1(?матенилтетра-
гидрофолат
HKt
Г
Имидазолонпропионаза
Формиминоглутамат
^ Тетрагидрофолат
Гпутаматформимино-
трансфераза
Фумарат
▲
ФАДНа4-^
М-формимино-
татрагидрофолат.
ФАД
Цикл Кребса
Сукцинат-
дегидрогеназа
со3
4
Сукцинат*-
г
KoA-SH
Сукцинип-КоА-синтетаза
-Сукцинил-КоА*-
а-Кетоглугарат-
дегидрогеназа
а-Кетоглутарат
НАДНЖ
Глутамат
К
Глутамат-у
полуальдегид
дегидрогеназа
НАД
АТФ
НАДФН-Н*
Пирролин-5-карбо
\ксилатсинтетаза
НАДФ
АДф+фй
В6
Глутамат-у
полуальдегиддМИНОТра„сфвраза
ъ
^ре,
Самопроизвольная
акция
Пирролин-5-карбоксилат
i
ФАДНа
Пролиноксигеназа
ФАД
^ НАДФН+Н
Редуктаза
НАДФ
СОг
▼
1
I ' |
НАД*
f
t
ГТФ ГДФ
НАДН-Ж* KoA-SH
Глутамат
А
Пролин
Орнитин
Рис. 54.1. Роль витамина В6 в метаболизме
118 Водорастворимые витамины (часть И): пиридоксальфосфат (В6)
Трансаминирование
Для проведения реакции трансаминирования требуется вита¬
мин В6 (пиридоксальфосфат), который участвует в метаболиз¬
ме аминокислот. На рис. 54.2 показан перенос аминогрупп с
разных аминокислот на а-кетоглутарат с образованием соот¬
ветствующих кетокислот и глутамата. В качестве примера
показана аланинаминотрансфераза (АЛТ). АЛТ катализирует
обратимую реакцию, в которой аминогруппа передается от
аланина а-кетоглутарату и образуются глутамат и пируват.
АЛТ появляется в сыворотке крови при повреждении клеток
печени и используется в лабораторной диагностике для оцен¬
ки функционального состояния печени.
Ксантуренат
(вещество желтого цвета)
выводится с мочой
при недостаточности
витамина В6
Триптофан
1
№формилкниуремин
Ксантуренат (вещество
желтого цвета)
Кииуронии
Формиат
I
З-гидроксикинуренин
При недостаточности витамина В6
темпы синтеза НАД+ и НАДФ+
снижаются. См. раздел «Источники
ниацина» (см. гл. 55)
В6
Кинурениназа
3-гидроксиантранилат
I
~ 2-амимо-З-карбокси-
муконовый полуальдегид
4
2-аминомуконовый
полуальдегид
2-аминомукоиат
Цитозоль
Ы5-метилтетрагидрофолат
а-Кетоадилат-
Тетрагидрофолат
Витамин Bj2 ^
Гомоцистеин-
метилтрансфараза
Метионин
Гомоцистеин
А
SAM
(5~аденозилметионин)
Метилтранс-
фараза
S-адемозилгомоцистеин
1
Гомоцистеин
|в6
Метильная
группа переда-
ется акцептору
Цистатионин
ь
Гомосерин
Лизин
Цистеин ^
Г лутамат
Пиридоксальфосфат (В6)
Витамин Вб (пиридоксальфосфат) необходим для проведения некото¬
рых реакций в метаболизме аминокислот (и, в частности, трансами¬
нирования). Кроме того, он участвует в распаде гликогена, биосинте¬
зе витамина В3 (НАД+) из триптофана и катаболизме гомоцистеина.
Суточная норма потребления — 1,5 мг. Высокие дозы витамина В6
токсичны.
Биохимические функции. Пиридоксальфосфат участвует в ами-
нотрансферазных реакциях (реакциях трансаминирования) в мета¬
болизме аминокислот. Таким образом, он нужен и при биосинтезе
заменимых аминокислот, и при окислении аминокислот для получения
энергии. Кроме того, пиридоксальфосфат является важной составной
частью гликогенфосфорилазы.
Лабораторная диагностика
А) Измерение концентрации В6 в плазме крови.
Б) Измерение уровня ксантурената (вещества желтой окраски) в моче
после приема триптофана внутрь. В норме катаболизм триптофана
происходит с участием В6-зависимой кинурениназы, но при недо¬
статочности В6 ксантуренаты накапливаются.
Пищевые источники. Содержится в мясе, рыбе, молоке, орехах.
Недостаточность пиридоксальфосфата. Чаще всего наблюдается
при алкоголизме. При недостаточности происходит воспаление языка,
губ, слизистых оболочек рта.
Примечание: при недостаточности пиридоксальфосфата также снижа¬
ется синтез НАД+ и других веществ из триптофана (см. ниацин).
Изолейцин
В6
Валин
В,
Лейцин
В6
Аминотрансфераза Аминотрансфераза
Сахаропин
2-аминоадипат-
полуальдегид
2-аминоадипат
В6
Аминотрансфераза
а-Кето-Р-метилаалерат
О
а-Кетоизовалерат а*Кетоиэокапроат
а-Кетоадипат
О
| Карнитиновая |
(челночная система |
KoA-SH
НАД+
Дегидрогеназа
•*-^'Ч^НАДН+Н+ СО;
KoA-SH-^ НАД+ Ко
Дегидрогеназа
>2 «"'Г'+н А
^ НАД+
Дегидрогеназа
KoA-SH
Ч'*НАДН+Н+ СОХ+НАДН+Н+ С02Ч^ НАДН4«+
а-Метилбутирил-КоА Изобутирил-КоА Изовалерил-КоА
СОг
□
- НАД+
KoA-SH
ч
4
4
Метилмалонат-
лолуальдвгид
4
Пропионил-КоА
4
D-метилмалонил-КоА
4
L-метилмаломил-КоА
Дегидрогеназа
^►НАДН+Н+
Глутарил-КоА
Мутаза^ Витамин В12
Сукцинил-КоА
Ацетил-КоА Ацетоацетат
Ацетил-^у
КоА
Ацетил-КоА
Ацетил-КоА
Митохондрия
Рис. 54.2. Роль витамина В6 в метаболизме (продолжение)
Водорастворимые витамины (часть II): пиридоксальфосфат (В6) 119
I
ф
Водорастворимые витамины (часть III): фолат
и витамин В12
Фолат
Рибозо-5-фосфат
3
Бикарбонат
^-Г лутамин
..5 ..10
N ,N -метиленте-
Имидазолонпролионаза
Формимино-
Метилмалоновая кислота
выводится с мочой при
недостаточности витамина В12
гидрофолат ГЛуТЭ1
I |ГЯУ1
5 I .
N -формимиио-
амат
Тетрагидро¬
фолат
Глутаматформимино-
трансфвраза
тетрагидрофолат ГлутаМЭТ
Рис. 55.1. Роль фолата и витамина В|2 в обмене веществ
120 Водорастворимые витамины (часть III): фолат и витамин
iooszao
3H3JOdix3i/e
*0088
Mimrnrpom 771"" 0£ :вюи v diemutt
ni4HhotreaoU/WW06L :enoutf dianentf /lg 002 l
W06L±80021. dt’OZS
bVHdbl/AXdMtl Vl/HLJ
/ "" ее ЭоОб Bi/nuodu ВНИ9Л1/1 / П7 -pnouK:ЕЭЭЩ
d066fr 9.0ZL/^~utr
Витамин B12
Риск развития недостаточности витамина В12 повышен у веге¬
тарианцев, особенно у строгих вегетарианцев (веганов).
Симптомы при недостаточности напрямую связаны с двумя
функциями этого витамина.
1. Развивается вторичная недостаточность фолата, которая
приводит к мегалобластической анемии и норажению нерв¬
ной системы (сходным образом проявляется недостаточ¬
ность фолата). Из-за отсутствия витамина В12 блокируется
перенос одноуглеродных фрагментов углерода, участвую¬
щих в образовании нуклеотидов для синтеза ДНК и РНК.
Кроме того, нарушается перенос метильной группы, необ¬
ходимой для синтеза фосфатидилхолина (фосфатидилхо-
лин входит в состав миелиновых оболочек).
2. Накопление метилмалонил-КоА приводит к поражепию
нервной системы (при недостаточности фолата накопления
метил малонил-КоА не происходит).
Суточная потребность в витамине В|2 составляет 2 мкг.
Биохимические функции
Витамин В|2 (кобаламин) существует в двух активных фор¬
мах, которые участвуют в двух разных реакциях:
1) метилкобаламин необходим для проявления активности
метионинсинтазы (гомоцистеинметилтрансферазы) при
регенерации метионина из гомоцистеина;
2) дезоксиаденозилкобаламин нужен для проявления актив¬
ности метилмалонил-КоА-мутазы.
Лабораторная диагностика
1. Полный анализ крови. Средний объем эритроцитов.
2. Измерение концентрации кобаламина в плазме крови.
3. Тест Шиллинга. Пациент принимает радиоактивно мечен¬
ный витамин В)2, а после измеряется его выведение с
мочой. Если выводится менее 10% меченого В12, это сви¬
детельствует о возможной недостаточности витамина В12.
В этом случае пациент вновь принимает меченый В12, но
уже совместно с внутренним фактором. Если после этого
выводится более 10% меченого В|2, то подтверждается диа¬
гноз пернициозной анемии.
4. Измерение содержания метилмалоновой кислоты в моче.
Пищевые источники
Витамин В12 содержится только в продуктах животного про¬
исхождения (особенно богата им печень), поэтому веганы
нередко страдают от недостаточности В12.
Болезни при недостаточности витамина В12
I. Из-за снижения активности метионинсинтазы развивает¬
ся межобластная анемия (сходная картина наблюдается
при недостаточности фолата). При пернициозной анемии
париетальные (обкладочные) клетки желудка разрушаются
в результате аутоиммунного процесса и теряют способ¬
ность образовывать внутренний фактор — гликопротеин
массой 50 кДа, который необходим для всасывания коба¬
ламина в подвздошной кишке.
2. Развивается гомоцистинемия, которая приводит к
сердечно-сосудистым заболеваниям.
3. Вследствие сниженной активности метилмалонил-КоА-
мутазы происходит накопление метилмалонил-КоА.
Считается, что это вещество конкурирует с малонил-
КоА — предшественником жирных кислот для синтеза
липидов.
Фолат
Серин, триптофан и гистидин передают одноуглеводные
фрагменты производным фолата. Эти группы используют¬
ся в синтезе ДНК и РНК при клеточном делении и росте.
Запомните: для метаболизма и функционирования фолата
необходим витамин В)2.
Биохимические функции
Фолат восстанавливается до тетрагидрофолата, который
является переносчиком некоторых одноуглеводных фрагмен¬
тов. Это:
формил -СНО
метенил —СН=
метилен — СН2—
метил СН3—
Они используются в биосинтезе пуриновых и пиримиди¬
новых оснований ДНК и РНК. Поэтому тетрагидрофолат
жизненно необходим для роста и деления клеток.
Лабораторная диагностика недостаточности фолата
1. Измерение уровня фолата в плазме/сыворотке крови или
в эритроцитах.
2. Проведение гематологического исследования с целью
выявления мегалобласной анемии.
3. Проведение теста FIGLU для определения в моче уровня
метаболитов после приема гистидина.
Пищевые источники
Овощи с зелеными листьями (по-латински folium означает
«лист»), а также дрожжи.
Болезни при недостаточности
1. Фолат требуется для роста и деления клеток, напри¬
мер кроветворных клеток в красном костном мозге.
Недостаточность приводит к развитию мегалобластной
анемии.
2. Умеренная недостаточность фолата при зачатии вызыва¬
ет у зародыша нарушение формирования нервной труб¬
ки, например Spina bifida (порок развития позвоночника).
Женщинам, планирующим беременность, рекомендуется
принимать фолаты в дозе 400 мкг/сут.
3. При недостаточности развивается гипергомоцистинемия,
а это фактор риска развития сердечно-сосудистых заболе¬
ваний.
Водорастворимые витамины (часть III): фолат и витамин В12 121
Водорастворимые витамины (часть IV): биотин
БИОТИН
Биотин участвует в реакциях карбоксилирования, которые играют важную
роль в глюконеогенезе и синтезе жирных кислот. Суточная потребность
составляет 40 мг.
Биохимические функции. Участвует в карбоксилазных реакциях, например,
биотин является кофактором пируваткарбоксилазы (в глюконеогенезе) и
ацетил-КоА-карбоксилазы (в синтезе жирных кислот).
Лабораторная диагностика. Измерение концентрации биотина в крови.
Недостаточность биотинидазы — редкое наследственное заболевание,
при котором наблюдается недостаточность биотина (даже если биотин
поступает с пищей). Диагностическое значение имеет активность биотини¬
дазы в сыворотке крови. Этот фермент высвобождает биотин из биоцитина.
Биоцитин образуется из биотинсодержащих ферментов в тканях (в процессе
обновления клеток) и в просвете кишечника (при переваривании поступаю¬
щих с пищей белков).
Источники биотина. Дрожжи, печень, молоко, яйца.
Недостаточность. При нормальном питании обычно не развивается. В конце
1970-х гг. было выдвинуто предположение, что недостаточность биотина
у младенцев является возможной причиной синдрома внезапной смерти
новорожденных. Согласно этой гипотезе, при недостаточности биотина бло¬
кируется глюконеогенез и развивается гипогликемия с летальным исходом.
При недостаточности биотина нарушается синтез жирных кислот и соответ¬
ственно изменяется состав жирных кислот в сыворотке крови. Наблюдается
гиперхолестеролемия (полагают, что ацетил-КоА вступает в путь синтеза
холестерола из-за сниженной активности) ацетил-КоА карбоксилазы и соот¬
ветственно невозможности синтезировать малонил-КоА для дальнейшего
синтеза жирных кислот.
В белке сырого яйца содержится авидин, который связывается с биотином
в желудочно-кишечном тракте, препятствуя его всасыванию. Недостаточность
биотина развивается, если ежедневно употреблять по две дюжины сырых яиц.
Ацетил-КоА
АДФ+ФН
Витамин С 4
нейтрализует свободные радикалы
Свободные радикалы -
токсичные побочные продукты,
образующиеся в дыхательной цепи
НАДН+Н
ГТФ ГДф
НАДН+Н+ KoA-SH
2O2 АДФ
Н^О Ф. н+
£ А А
АТФ
у
4Н*..
' У
2Н*_._
ЮН*
Дыхательная цепь
122 Водорастворимые витамины (часть IV): биотин и витамин С
ж
ними
iiiiitiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiA;
o2
Остаток*
1
Остаток
пролила nPTcZa"aPO~ ГИДрОКСИПрОЛИЛЭ
С «
Коллаген!
Биосинтез
коллагена
Витамин С
Витамин С (аскорбиновая кислота) участвует реакциях в гидроксила-
зирования, остатков пролина и лизина с участием пролин- и лизингид-
роксилаз в процессе образования коллагена (см. гл. 8). Кроме того, он
является перехватчиком свободных радикалов. Суточная потребность
составляет 50-60 мг.
Биохимические функции
A) Участвует в гидроксилировании пролина и лизина, которое необхо¬
димо для образования поперечных связей в микрофибрилле колла¬
гена.
Б) Действует как перехватчик акцептора свободных радикалов, преду¬
преждая окислительное повреждение ряда веществ, например
липидов клеточных мембран и ЛПНП (липопротеинов низкой плот¬
ности), а также белков и ДНК. Тем самым он препятствует возник¬
новению мутаций и развитию раковых заболеваний.
B) Предотвращает окислительное повреждение витамина Е.
Г) Участвует в биосинтезе карнитина, норадреналина. Также нужен
цитохромам Р450 — ферментам микросом, которые участвуют в
метаболизме лекарств и ядовитых веществ.
Лабораторная диагностика. Измерение уровня витамина С в лейко¬
цитах (в лейкоцитарной пленке).
Синтез норадреналина
Т ирозин —► L-ДОФА
Oj—v
► С
Н.О Ч-''
Дофамин- р-гидрсксилаза
Норадреналин
S-адемоаилмети >i
S-аденозилметилгрансфереза
$- аденозил- «И
гомоцистеин
Адреналин
Рис. 56.1. Роль биотина и витамина С в метаболизме
Пищевые источники. Содержится в свежих фруктах (особенно в
цитрусовых) и овощах.
Недостаточность витамина С. Из-за нарушения синтеза коллагена
развивается цинга. У больного кровоточат десны, появляются гемато¬
мы, плохо заживают раны.
Дополнительный прием витамина С способствует заживлению ран
и рассасыванию подкожных гематом при некоторых типах синдрома
Элерса-Данло.
Водорастворимые витамины (часть IV): биотин и витамин С 122
Клеточный цикл
Функция клетки и клеточное разнообразие
В любой момент времени большинство клеток организма
проявляют функцию данной ткани или органа, компонентом
которых они являются. К примеру, они могут быть вовле¬
чены в какой-либо метаболический процесс или выработку
гормонов и ферментов для пищеварительной системы. Тем
не менее, получая сигнал от фактора роста, они начинают
делиться. Поврежденные посредством какой-либо травмы
клетки могут быть заменены группой здоровых. Клетки чело¬
веческого организма могут делиться со скоростью несколько
миллионов в секунду! На протяжении этого процесса ДНК
материнской клетки должна быть реплицирована в дочер-
р53и Rb- это гены-супрессоры опухоли,
которые блокируют развитие клеточного цикла
Контрольная
точка G2
Контрольная точка Spindle
г, с, , „ - / п •» и n I Knrf B.R- Medical Genetics at a Glance, 2nd edn.
Рис. 57.1. Клеточный цикл (источник: Pntcnara и.j. кин
Publishing: Oxford. — 2008)
— Blackwell
124 Клеточный цикл
нюю клетку. Более того, должен быть сбалансирован уровень
молодых и умирающих клеток. При недостаточном количе¬
стве здоровых клеток происходит атрофия тканей. В то же
время, если клетки начинают неконтролируемо вырабаты¬
ваться с высокой скоростью, то возникают условия для роста
опухоли. В эукариотических клетках процесс клеточного
деления регулируется при участии регуляторных белков в
системе контроля клеточного цикла.
Система регуляции клеточного цикла
Клеточные биологи полагают, что клеточный цикл можно
разделить на пять фаз: GI, S, G2, М и GO. При условии обна¬
ружения дефектов клеточный цикл приостанавливается на
следующих контрольных точках: контрольная точка G1, кон¬
трольная точка G2 и контрольная точка сборки веретена деления в
фазе митоза. Супрессоры опухоли белок р53 (белок «ангел-
хранитель», или «страж генома») и белок Rb регулируют цикл,
начиная с фазы G1 и до фазы S. При мутации р53 или Rb, в
результате которой нарушена функция подавления, возника¬
ет неконтролируемый рост и деление клеток и, как следствие
этого процесса, развитие опухоли.
I. Фаза роста G1 (от англ, growth). Это начальная фаза роста,
в течение которой клетка проявляет свои метаболические
функции и подготавливает нуклеотиды для дальнейшего
синтеза ДНК (см. гл. 58, 59).
Неактивная cdk1
Активный комплекс cdkl/циклин В
Инициация митоза
Неактивная cdk1
На контрольной точке G1 детектируются повреждения ДНК,
вызванные химическими веществами или ионизирующим
излучением (см. гл. 65). При обнаружении повреждения
ДНК «страж генома» белок р53 приостанавливает клеточный
цикл, позволяя устранить повреждение у ДНК до вступления
в фазу S-цикла. Белок р53 конститутивно экспрессируется в
здоровых клетках (см. гл. 65). Опухолевый супрессор белок Rb
также конститутивно вырабатывается в клетке и ингибирует
развитие клеточного цикла. Для вступления цикла в фазу S
необходимо нахождение белка Rb в гиперфосфорилирован-
ном состоянии, что обусловливает последующее развитие
цикла. Дальнейшее протекание процесса определяется эпи¬
дермальным фактором роста и активацией циклинзависимой
киназы (cdk) cdk/циклинового комплекса. Как и следует из
названия, cdk активна при условии наличия связи с цикли-
ном. В течение фазы S циклин Е связывается с cdk2, образуя
активный сйк2/циклии Е комплекс, который сигнализирует о
старте фазы S, вызывая начало репликации ДНК. До начала
вступления цикла в фазу G2 геном должен быть полностью
реплицирован.
2. Фаза синтеза (фаза S). В течение фазы S осуществляется
синтез ДНК и происходит репликация всех хромосом в
геноме.
3. Фаза G2. Клетка увеличивается в размере, митохондрии
реплицируются, хромосомы конденсируются, белки
(микротубулярные белки), необходимые на стадии митоза,
синтезируются в этой фазе. В точке контроля G2 подтвержда¬
ются целостность структуры ДНК и объем клетки. Если провер¬
ка удовлетворительна, то наступает стадия митоза, начало
которой определяется наличием активного cdk/циклин В
комплекса.
4. Фаза митоза (фаза М). В точке проверки веретена деления реа¬
лизуются гарантии того, что все хромосомы правильно уком¬
плектованы на фибрах веретена деления до начала клеточ¬
ного деления.
5. Фаза цитокинеза (фаза С). Фаза цитокинеза наступает, когда
цитоплазма разделяется перегородкой, образуя две дочер¬
ние клетки.
6. Фаза GO. Некоторые типы клеток идут в обход основно¬
го клеточного пути, переходят в стадию GO: в частности,
постоянными клетками фазы GO являются красные кровяные
тельца, нейроны, клетки сердечной и костной мышцы.
Клетки, долговременно находящиеся в фазе GO, могут
быть регенерированы из стволовых клеток. Другие клет¬
ки, такие как клетки печени или лимфоциты, стабильны
и входят в фазу GO, пребывая в состоянии покоя до тех
пор, пока они не будут стимулированы внешним факто¬
ром для дальнейшего вступления в фазу G1. Некоторые
клетки, такие как волосяные фолликулы, клетки кишеч¬
ника, эпителиальные клетки, клетки кожи и костного
мозга, являются неустойчивыми клетками и очень быстро
делятся. Они вступают в фазу G1, минуя фазу GO.
Фазы GI, S и G2 известны как интерфаза. Интерфаза обыч¬
но длится около 23 ч, но может быть короче в клетках
кишечника и клетках, пораженных раком. Она гораздо
длиннее фазы митоза, которая обычно занимает около 1 ч.
Клеточный цикл 12£
Метаболизм пиримидинов
Illlltllllllltllllltllllllllltlllllllllllllllltll IlllllllllllllllltlllllItlltllllllllll Illlllllllllllltllllltllllllllllllllllllllllllllllllliif
Глюкоза надфн
1 СГ
юкозо- _J
= Триптофан
НАДФН г НАДФН+Н
Дигидрофолат-
редуктаза,
НАДФ
Фолат
Глюкозо
Q-фосфат
РИООЙО-
5Ц>осфат
© Метотрексат
Дигидрофолат
Кинуренин
Формиат
НАДФМ+Н+^
Дигидрофолат-'
редуктаза^
НАДФ+
Пентозофос-
фатный
Гликолиз
Ацетил-КоА
Оксалоацетат-
© Метотрексат
>
Тетра-
гидрофолат
АТф
Фолатный
цикл
* АДФ+Ф„
М10-формил-
тетрагидоофолат
>агидоо
нилтот£
А/5, А/10-метенилтетрагидрофолйт
НАДФН+Н
НАДФ"
М8,М10-метилентетрагидрофоАа
fH+4©l
НАДФН
НАДФ
•ф ■ ■ ■ Л ■■■■■■■■■■ IIC .
^ ■ ЛР-метилтетра-
гидрофолат
Бикарбонат
Глутамин --
©
Обратное
ингибирование
УТФ
Карбамоил-
ьфосфатсмнтетаза II
2АДФ+ФН
г^-1
Карбамоилфосфат
Аспартат —
Карбамои.
Рибозо-5-фосфат
Дигидрфоротат
- ФМН
АТФ ■
Глутамин Аспартат
о
II
HN3 4 5 СН
I
II
о"!'
Бикарбонат
С2 вен
Оротат
5-фосфо-
рибозил-'
Дигидрофолат
редуктаза
ПФИ
ПИ
Оротидин» жофосфат
ат
5-фос-
форибозил-
пирофосфат
УМФ
(уридинмонофосфат)
Синтез
пиримидинов
Гомоцисгеин-
метилтранс-
фераза
Гомоцистеин
Метионин
S-аденозилметионин
Метилтрансфараза
J
S-аденозилгомоцистеин
♦
Гомоцистеин
Тетра-
гидрофолат
Серин
Цистатионин
Серингидрокси-
метилтрансфераза
+W5, АГ°-метилен-
тетрагидрофолат.
Метаболизируется
до сукцинил-КоА
Глицин
► /V
/V10-
метилентетра-
гидрофолат
Метильные группы
jпереносятся к акцептору
Пурины (см. гл. 51)
1114
УТФ
+
ЦДФ
*
I дЦДФ
цШО
дУМФ
(диоксимонофомфат)
Тимидилат-
синтаза
Флюороцил-
химиотерапия
Используется
в химиотерапии
онкологических
заболеваний
—► Дигидрофолат
1
Поступает
в фолатный цикл
УТФ ЦТФ ГТФ АТФдГТФ дАТФ дЬуф дТТФ
Гидроксимочевина
Используется
в химиотерапии
рака и при лечении
аутоиммунных
заболеваний
РНК
ДНК
^ Нуклваза ^
ЦТФ УТФ
I 1
Уридин Цитидин*
^ Нуклваза ^
дЦМФ дТМФ
Ь
NH*
УМФ ТМФ
Путь
реутилизации
> Уридин
2-дезокситимидин
Рибозо-1 -фосфат
Катаболизм
пиримидинов
Рибозо-1 -фосфат
Фи —*sJ
втг1
*.ПФ.
^-►ПФн
HN
I
,С
СН
HN
СН
Урацилтимин-
фосферибозил-
трансфераза
а-фосфо--<-
рибозил-
0 N
/СН3
с
I II
СН
3 N
Н
пирофосфат
Тимин
Урацил*
Урацил
Тимин
о=с^
q а СН2
1
о=с^ /СН3
о аСН
рсн2
NH3
рсн2
NH3
Р- Аланин
Р-Аминоизобутират
Рис. 58.1. Метаболизм пиримидинов
126 Метаболизм пиримидинов
I
Пурины Пиримидины
0
0
NH.
II к,
р N
HN/KC^ Ч„и
I II СН
II
н1\Гс^сн
I 2
^СН
h2n/c^i\kckn/
i и
o*VCH
н
н
н
Гуанин (Г)
Урацил(У)
Цитозин(Ц)
NH.
i 2
0
0
|\KCxC^N4
I II сн
и
/С.
HN ^C-Ribose
HrVCH;
Н(Х^/Сч\|/
н
I и
н
н
Аденин(А)
Псевдоуредин (ф)
Тимин (Т)
NH,
I 2
i АТФ (аденозинтрифосфат)
сн.
I 2
сн2
•ацил (Д)
Рис. 58.2. Пуриновые и пиримидиновые основания
Оонования, нуклеозиды и нуклеотиды
К пуриновым основаниям относятся аденин (А) и гуанин (Г),
а к пиримидиновым основаниям — цитозин (Ц), тимин (Т) и
урацил (У) (рис. 58.2).
Основания связываются с рибозой или дезоксирибозой,
образуя соответствующие нуклеозиды: аденозин, гуанозин,
цитидин, тимидин и уридин. Например, в состав дУМФ вхо¬
дит дезоксирибоза.
При добавлении одной или нескольких фосфатных групп
образуется соответствующий нуклеотид. Например, нуклео-
зид аденозин может образовать следующие нуклеотиды: аде-
нозинмонофосфат (АМФ), аденозиидифосфат (АДФ) и аде-
нозиитрифосфат (АТФ) (рис. 58.3).
Примечание: аденин, гуанин и цитозин содержатся и в РНК, и в
ДНК. Урацил содержится только в РНК, тимин — только в ДНК (не
путайте тимин с витамином В — тиамином).
N/CxC^\
I II L
сн
н
Гипоксантин
(Основание)
Инозин (Нуклеозид) (I)
Н1\Г
С 6
о^%-
н
Дигидроу*
Рис. 58.3. Аденозинтрифосфат (АТФ)
в цикле мочевины и регулирует цикл мочевины (см. гл. 44).
Карбамоилфосфатсинтетаза I — митохондриальный фермент,
в качестве источника азота он использует ион аммония; кар¬
бамоилфосфатсинтетаза II — цитозольный фермент, в каче¬
стве источника азота для него является у-амидная группа
глутамина. Кроме того, в биосинтезе пиримидинов участвует
1М5,М1()-метилентетрагидрофолат: он передает метальную группу
дУМФ и образуется дТТФ, необходимый для синтеза ДНК.
Катаболизм пиримидинов
ЦМФ и дЦМФ дезаминируются и распадаются до ураци-
ла, дТМФ распадается до тимина. И урацил, и тимин могут
поступить в нуть реутилизации и вновь использоваться для
синтеза нуклеотидов. В противном случае они распадаются
до р-алаиина и p-аминоизобутирата соответственно.
Химиотерапия при онкологических заболеваниях
Раковые клетки делятся и растут значительно быстрее, чем
здоровые клетки. В период (S-фазы) клеточного цикла в них
происходит интенсивный синтез ДНК и РНК. Поэтому для
лечения раковых заболеваний были изобретены антагонисты
фолата, антипиримидины и антипурины (так называемые
анти метаболиты), которые ингибируют деление клеток.
Пиримидины и пурины необходимы для роста
клотки и клеточного деления
Пиримидины и пурины выполняют множество разных функ¬
ций: это и субстраты, и коферменты, и сигнальные молекулы
в метаболических путях. Кроме того, это главные составляю¬
щие ДНК и РНК. Поэтому они жизненно необходимы для
роста и деления клеток. Так, при внутриутробном развитии
плода очень важно обеспечить его пуринами и пиримидина-
ми. И при зачатии, и во время беременности мать должна
получать с пищей все субстраты и коферменты, требующиеся
для биосинтеза азотистых оснований. Особенно необходимы
витамин В12 и фолат (см. гл. 55). Недостаток этих витаминов
вызывает пороки развития. И наоборот, для прерывания вне¬
маточной беременности показано употребление метотрексата
(антагониста фолата, см. ниже).
Биосинтез пиримидинов
Предшественники пиримидинового кольца — это бикарбо¬
нат, глутамин и аснартат (рис. 58.1). Регулирует биосинтез
пиримидинов карбамоилфосфатсинтетаза II. Ее активность
ингибирует по принципу обратной связи уридинтрифосфат
(УТФ). Примечание: не путайте этот фермент с карбамоил-
фосфатсинтетазой /; последняя образует карбамоилфосфат
Антагонист фолата
Метотрексат — структурный аналог фолата. Он ингибирует
дигидрофолатредуктазу, блокируя реакцию восстановления
фолата и дигидрофолата до тетрагидрофолата — предшествен¬
ника N5, М,0-метилеитетрагидрофолата. Последний необхо¬
дим для синтеза дТТФ и соответственно для синтеза ДНК.
К несчастью, метотрексат также воздействует и на здоровые
клетки. Чтобы защитить здоровые клетки от токсическо¬
го действия метотрексата, после начала лечения назначают
фолиниевую кислоту (Ы3-формилтетрагидрофолат), которая
является активной формой фолата.
Антипиримидины
Хорошо зарекомендовали себя фторсодержащие противора¬
ковые лекарства, являющиеся аналогами пиримидинов (так
называемые фторпиримидины, например 5-фторурацил).
5-Фторурацил ингибирует тимидилатсинтазу, блокируя реак¬
цию образования дТМФ из дУМФ, предотвращая его мети¬
лирование. Таким образом, он препятствует образованию
необходимого предшественника ДНК и биосинтез ДНК
ингибируется.
Антипурины
Анти метаболиты пуринов описаны в гл. 59.
Метаболизм пиримидинов 127
Метаболизм пуринов
Глюкоза надфн
341111111111111111П1111111111М1111111111111111111М1111111111111111111111111111111111111111111^ Рибозо-5-фосфат
АТФ
АМФ
= Триптофан
1 I
Г ток озо
в-фосфат
“Т, |
~р}»('0зо- i
б^фррфат
£
НАДФН+Н'
Фолат
дИпадрофол5г>| @ Метотрексат
редуктаза * г
Формиат
Кинурвнин
надф
Дигидрофолат
Пентозофос-
фатный
Г ликолиз
НАДФН+Н+
Дигидрофолат-^1
редуктазал
НАДФ+ "
(
аМ
игидро<
-I
if
' —-*1
Рибозофосфатпирофосфаткиназа
5-фосфорибозил пирофосфат
Глутамин—
Глутзмат
|)|)-5-Фосфорибозиламин
© Метотрексат ,*Хлицин-х
Тетра- 5'....'.
гидрофолат
АТФ
Ацетил-КоА
Фолатный
цикл
АГ-формил-
твтрагидрофолат- •
Оксалозцзтзт-
НАДФН+Н
НАДФ
N5- мвтилтвтра-
гидрофолат
Г^:
эагидоо
И
нилтет|
H+«--^t
пгиленте
N, А/1 -метен ил тетра гидрофолат
НАДФН+Н+ч
надф
->■ N 5, А/1 °- метил ентетра гидрофолат
Т етра гидрофол ат
в,? f
^Метионин
N5- мети лтетра -
гидрофолат
Запасной
путь синтеза
метионина
» М-^юрмил^
тетрагидрофолат
Глутамин-
АТФ -
АДФ+Фм*“
СОг
S-аденозилметионин
Метильная группа
передается акцептору
S - ад е нози л гом оци стеи н
♦
Гомоцистаин
i
Цистатиомин
I
V Серин
:Тетра-
ГЙДрОфОЛаТ' Свринтдро^и-
мвтмлтрансфвреза
Метаболизируется
до сукцинил-КоА
W5, А/10-метмлен-
твтрагидрофолат
Глицин
Аспартат-
Фум*рат4—
►М1°формил-
тетрагидро-
фолат
. НзО
Амидофосфорибо
зилтрансфораза
©
Ч"'—► АДФ+Фн
Глицинамидт
рибонуклеотид
Тетрз-
ФормилглиЦин-
амидрибонукАеотид
^НзО
-—АТФ
^~>АДФ+ФН
Формилглйцин-
амидинрибонуклеотид
КАИР
-—АТФ
' ► АДФ+фи
САИКАР
s>—фТНР
ФАИКАР
Г—► НаО
Пиримидины
(см. гл. 50)
Гидроксимочевина
НАДФМр„бон кле Используется
\,тИдр°еНд¥у™аза »химиотерапии рака I
и лечении аутоим-
мунных заболеваний!
ЦТФ УТФ ГТФ АТФ
1111
РНК
ГМФ|
А
ИМФГМФАМФ
Путь
реутилизации
^-►НФи
Аденинфосфорибоэилтрансфораза
Катаболизм
пуринов
1
АМФ
^—► «,
АТФ идАТФ инги¬
бируют рибонук-
леотидредуктазу
по принципу
обратной связи
Пиримидины
(см. гл. 50)
Г I
дГТФ дАТФ дТТФ дЦТФ
1111
Аденозин
ДНК
Аденозин-
дезаминаза
Гуанозин
ин~ I Г \
■5|S
Инозин
Дефицит АДА
Синдром Леша-Найхана
PRPP^
Аденин
ПФ.
Гипоксантингуанин-
фосфорибозилтрансфераза
'ч~- 5-фосфо-
_ рибозил-^
пирофосфат
Гуанин -*
Гипоксантин
Пуриннуклеозид-
фосфорилаза
Рибозо- Рибозо-
фосфат фосфат
Гуанин
Уратоксидаза
1*
Дефицит фосфорила
для пуриновых нуклеотидов
Гипоксантин
1Ксантин-
оксидазаф
Аллантоин-
Ксантин
■ Ксантин-
\оксидаза Q
— Урат
Ж.
Аллопуринол
Он ингибирует ксантин-
оксидазу и используется
при лечении подагры
Рекомбинантная
уратоксидаза
Мочевая
* кислота
Подагра
Образование кристаллов мочовой кислоты
Рис. 59.1. Метаболизм пуринов. АИР — 5-аминоимидазолрибонуклеотид; КАИР — 4-карбокси-5-аминоимидазолрибонуклеотид;
САИКАР — 4-М-сукцинил-5-амино-4-имидазол-4-карбоксамидрибонуклеотид; АИКАР — 5-амино-4-имидазол-4-
карбоксамидрибонуклеотид; ФАИКАР — 5-формамидо-4-имидазол-4-карбоксамидрибонуклеотид
128 Метаболизм пуринов
Рибозо-5-фосфат
® —j f
»+—A™
Рибозофосфат-
'ирофосфаткиназа
-фосфорибозил-
пирофосфат
СО:
З-5-Фосфо
Глицин^
Глицинамидр
N '"-формил-
Ч'->*ДФ+Ф»
бонуклаотид
-Аспартат
Глицин
ф
тетрагидрофолат’4
Формы
амидриб<
Глутамин
4, с ^ N'“-формил
hn'^'sc тетрагидро
нс 2 4 с g ®,сн фолат
"N
N’“-формил- Т
тетрагидро- I
а фолат Глутамин
Глутамг
ФормиА-л
амидинри(
АТФ -
АДФ+ФН +
СОг
Аспартат
..ТУ1 -формил-
тетрагидрофолат
ФА
Глутамин
Фосфорибозил •
пирофосфат-
амидотраисфераза
ибозиламин
^ Тетрагидрофолат
HjO
ИМФ
Рис. 59.2. Происхождение атомов в молекуле пурина
Биооинтез и распад пуринов
Пуриновые нуклеотиды ГТФ и АТФ играют важную роль
в промежуточном метаболизме и регуляции метаболизма.
Аденин также входит в состав циклического АМФ, ФАД,
НАД+, НАДФ+ и кофермента А. Кроме того, ГТФ, АТФ и их
дезоксипроизводные дГТФ и дАТФ являются предшествен¬
никами синтеза РНК и ДНК, необходимых для клеточного
роста и деления. Для биосинтеза пуринов (рис. 59.1) необходи¬
мы аминокислоты глутамин, глицин и аспартат, а также трип¬
тофан. Из триптофана образуется формиат, который реагиру¬
ет с тетрагидрофолатом, образуя 1Ч10-формилтетрагидрофолат.
Его формильная группа включается в структуру пуринового
основания. Также для биосинтеза пуринов требуется моле¬
кула С02.
В результате катаболизма пуринов образуются соли мочевой
кислоты — ураты. Они плохо растворимы в водной среде и
крови и могут выпадать в осадок в виде мочевой кислоты. При
этом развивается подагра (см. ниже).
Происхождение атомов в молекуле пурина
Происхождение атомов в молекуле пурина показано на рис. 59.2.
Недостаточность аденозиндезаминазы.
Тяжелый комбинированный иммунодефицит
Недостаточность аденозиидезамнназы — очень редкое нару¬
шение, наследуемое по аутосомно-рецессивному типу.
Недостаточность аденозиндезаминазы приводит к нако¬
плению АТФ и дАТФ, которые по механизму обратной
связи ингибируют рибонуклеотидредуктазу в тимоцитах и
В-лимфоцитах периферической крови. Нарушается синтез
ДНК, соответственно и образование Т- и В-лимфоцитов.
Развивается тяжелый комбинированный иммунодефицит
(ТКИД), наследуемый по рецессивному типу. Недостаточность
аденозиндезаминазы — причина 20-30% случаев ТКИД. При
этом заболевании дети крайне восприимчивы к инфекциям:
в качестве примера можно вспомнить фильм «Мальчик в пла¬
стиковом пузыре». Это фильм про Дэвида Веттера (1970-е гг.),
который всю свою недолгую жизнь (12 лет) провел внутри
пластиковой камеры-«пузыря». Предполагается, что генная
терапия окажется эффективна против недостаточности аде¬
нозиндезаминазы: в настоящий момент проводятся клиниче¬
ские испытания.
Подагра
Подагра нередко развивается при обильном употреблении
высокобелковой пищи и алкоголя. При переваривании про¬
дуктов, богатых нуклеиновыми кислотами, образуются ураты,
а употребление алкоголя способствует накоплению лактата.
Лактат препятствует интенсивному выведению уратов из орга¬
низма, поскольку конкурирует с ними за выведение почками.
Ураты илохо растворимы в воде и при высокой концентра¬
ции в крови выпадают в осадок в виде кристаллов мочевой
кислоты. Развивается подагра. Отложения солей мочевой
кислоты вызывают довольно сильные боли — взгляните на
картину «Подагра» Джеймса Гилрея (James Gilray) 1799 г.
Игольчатые кристаллы мочевой кислоты часто откладывают¬
ся вокруг суставов, особенно в суставах больших пальцев ног.
Они могут накапливаться в мочевыводящих путях, образуя
камни, или в коже в виде подкожных узелков — тофусов
(часто в мочке уха). Подагру лечат ингибитором ксантинок-
сидазы — аллопуринолом, который блокирует образование
мочевой кислоты.
Синдром быстрого распада опухоли
Синдром быстрого распада опухоли — осложнение химио¬
терапии с возможным летальным исходом. Он развивается
при многочисленных и/или крупных опухолях, когда при
химиотерапии погибает большое число раковых клеток.
Высвобождающиеся ДНК и РНК разлагаются до мочевой
кислоты, которая откладывается в почечных канальцах, вызы¬
вая острую почечную недостаточность. Согласно последним
данным, для лечения и предупреждения синдрома быстрого
распада опухоли при злокачественных болезнях крови необ¬
ходимо принимать рекомбнпантную уратоксидазу (которая
превращает мочевую кислоту в растворимый аллантоин).
Химиотерапия при онкологических заболеваниях
Метотрексат, 6-меркаптопурин и гидроксимочевина ингиби¬
руют синтез пуриновых нуклеотидов и дезоксирибонуклео-
тидов. Тем самым они останавливают синтез РНК и ДНК и
соответственно тормозят рост и деление клеток. Особенно
чувствительны к таким лекарствам опухолевые клетки, кото¬
рые растут и делятся быстрее, чем здоровые (например, клет¬
ки лимфомы высокой степени злокачественности).
Синдром Леша-Найхана
Синдром Леша—Найхана — редкое Х-сцепленное нару¬
шение аденинфосфорибозилтрансферазы — фермента пути
реутилизации пуринов. Из-за интенсивного накопления
мочевой кислоты развиваются подагра и мочекаменная
болезнь. Заболевание проявляется умственной отсталостью и
навязчивым стремлением к самоповреждению: больные куса¬
ют себе губы, язык, пальцы, бьются головой.
Метаболизм пуринов 129
А
paint!
Структура ДНК
. А
3' 5’
Цитозин «ьдаС::::
Тимин
10 пар
оснований
на один
виток
Дезоксирибо- ^ с...
зофосфатный
«остов»
•с
Гуанин
Аденин
Цепи
антипараллельны
Правозакрученная
спираль
Правая рука с поднятым
вверх большим пальцем
в направлении спирали,
пальцы закручены
против часовой стрелки.
Это указывает
на правозакрученную
спираль
Рис. 60.1. Двойная спираль
Двойная спираль
ДНК имеет структуру спирали, состоящую из двух нитей,
двойная спираль, в которой закодирована генетиче¬
ская информация. Скелет каждой цепочки состоит из
2’-дезоксирибозофосфатных молекул, соединенных фосфо-
диэфирными связями (рис. 60.1). Цепи антипараллельны, т.е.
5’-конец одной цепи комплементарен З’-концу другой цепи.
К Г-концу каждой дезоксирибозы присоединяется один
из пуринов (аденин или гуанин) или ниримидин (цитозин или
тимин).
Пары оснований и «плавление» ДНК (денатурация
ДНК)
Две цепи ДНК связаны между собой водородными связями,
образующимися между парами оснований: аденин связывается
с тимином двумя водородными связями (А=Т), в то же время
гуании связывается с цитозином тремя водородными связями
(Г=Ц)- Это значит, что связь между гуанином и цитозином
прочнее, чем между аденином и тимином. Соответственно у
Тимин
5'
Рис. 60.2. Пары оснований, соединенные посредством водородных
связей
130
Структура ДНК
Теломера
TTAGGG З'-конец заполняется
Множественная шести- 18-ю нуклеотидами до 5'
нуклеотидная последовательность
Рис. 60.3. У позвоночных теломера представляет собой шестинуклеотидную носледовательность: ТТАГГГ
ДНК с большим процентным соотношением цитозина и гуа¬
нина температура, требуемая для разделения двойных нитей
ДНК, выше.
Теломеры и теломеразы
В 2009 г. Нобелевской премией в области физиологии и меди¬
цины было удостоено исследование «Как хромосомы защи¬
щены теломерами и теломеразами». Теломеры — это участки
на концах хромосомной ДНК. Они напоминают наконечни¬
ки на шнурках, которые предотвращают их от обтрепанности
(рис. 60.3). У позвоночных теломеры имеют последователь¬
ность ТТАГГГ, представляющую собой замкнутый наконеч¬
ник на каждом из концов хрупкой цепи ДНК. Теломеры
синтезируются теломеразами, состоящими из белка и РНК.
РНК предоставляет матрицу для синтеза теломерной ДНК.
Активность теломераз понижается в старых и раковых клет¬
ках вследствие нестабильности хромосом.
Структура ДНК 131
Центральная догма молекулярной биологии
Репликация
Репликация ДНК
И
W
Транскрипция
В процессе транскрипции
образуются:
мРНК (см. гл. 66, 67)
тРИК (см. гл. 68)
рРИК (см. гл. 69)
Белок
Трансляция
В процессле трансляции
синтезируется белок
(см. гл. 70)
Рис. 61.1. Центральная догма молекулярной биологии
PH
ин4
дар)
Табл/
три с
фен и
СВ
ев
СВ
CJ
132 Центральная догма молекулярной биологии
Центральная догма
Центральная догма, сформулированная Фрэнсисом Криком
в 1958 г., заключается в том, что генетическая информация
передается от ДНК к РНК, от РНК к белку следующим
образом:
ДНК->РНК->белок.
Детали показаны на рис. 61.1. Этот переход достигается
путем трех процессов.
1. Репликация — процесс, при котором двойная спираль ДНК
создает идентичную себе копию, используя родительские
пени как матрицу для считывания.
2. Транскрипция — процесс, в течение которого генетиче¬
ский код переводится в последовательность РНК. Новая
цепь может быть мРНК, тРНК или рРНК. мРНК содержит
инструкцию к коду для создания будущей аминокислот¬
ной последовательности. Следует отметить, что у эукариот
только 2% ДНК несет информацию (т.е. является генами).
98% ДНК выполняет структурную, регуляторную и защит¬
ную функции.
3. Трансляция — процесс, в котором закодированная в
мРНК, тРНК и рибосомах информация расшифровыва¬
ется и переводится в последовательность аминокислот
(см. гл. 70).
Иоключения из центральной догмы
Центральная догма была неопровержима с момента ее форму¬
лирования и до момента открытия приоиов и РНК-вирусов.
В качестве генетического материала РНК вирусы содержат
РНК. Это могут быть одно- и двухцепочечные РНК; у вируса
инфлюэнции, в частности, репликация происходит благо¬
даря специфичной РНК-полимеразе. Ретровирусы, напри-
Таблица 61.1. Генетический код составлен в виде триплетов по
три основания в каждом. Например, УУУ кодирует аминокислоту
фенилаланин, а УЦУд кодирует серин
мер вирус иммунодефицита человека, реплицируется внутри
клетки хозяина, продуцируя собственную ДНК при помощи
обратной транскриптазы, которая впоследствии встраивается
в геном хозяина.
Приоиы (от англ, proteinaceous infectious + on — белко¬
вая инфекция) — это микроскопические частицы белка,
вызывающие неврологические болезни, например болезнь
Крейтцфельда-Якоба (часть 7). Прионы размножаются путем
катализируемого превращения гомологичного ему клеточно¬
го белка в злокачественную форму приона без какого-либо
участия ДНК и РНК.
Генетический код
Генетический код основан на трехбуквенном кодоне, каж¬
дый из которых состоит из трех оснований. Каждый три¬
плет соответствует определенной аминокислоте (рис. 61.1).
Кодон мРНК АУГ сигнализирует о начале считывания поли-
пептидной рамки, в которой каждый триплет кодонов озна¬
чает определенную последовательность аминокислот. Стоп-
кодонами мРНК являются УАА, УГА, УАГ.
Свойства генетического кода
1. Однозначность. Каждый кодон соответствует только одной
аминокислоте. Исключение можно встретить в прока¬
риотической клетке. N-формилметионин отвечает за старт
начала трансляции. Он находится на P-сайте в рибосоме,
где он «топчется» на преимущественно первой позиции
кодона (см. гл. 68) Таким образом, хотя АУГ и является
стартовым кодоном, значительное число генов начина¬
ются с последовательности ГУГ, УУГ или ГУГ. И у про¬
кариот, и у эукариот триплет АУГ кодирует аминокислоту
метионин.
2. Вырожденность. Одна аминокислота может соответствовать
нескольким кодонам: например, аргинин, серин и лейцин
имеют по шесть кодонов. Лейцин может быть закодиро¬
ван как УУФ, УУГ, ГУУ, ЦУЦ, ЦУФ и ЦУГ. Исключение
составляют аминокислоты метионин и триптофан, каждая
из которых имеет по одному кодону, АУГ и УГГ соответ¬
ственно.
3. Непрерывность и неперекрываемость. Код считывается
с фиксированной начальной точки (АУГ) триплетного
кодона. Код представляет собой последовательность осно¬
ваний, между кодонами отсутствуют промежутки. Более
того, кодоны не перекрываются.
4. Универсальность. Невероятно, но генетический код оста¬
вался неизменным на протяжении эволюции, он почти
одинаков для всех живых организмов, начиная от микро¬
скопических бактерий и заканчивая голубыми китами.
Однако существуют исключения, преимущественно в
митохондриальных ДНК.
Таблица 61.2. Генетический код. Генетический код основан на
последовательности нуклеотидов, считываемых в направлении
5'-3' в мРНК. Например, последовательность ЦУА — это ами¬
нокислота лейцин. Следует отметить, что в ДНК кодирующая
последовательность для лейцина будет ЦТА (в РНК У заменяет¬
ся на Т). Комплементарной последовательностью на матричной
цепи ДНК будет ГАТ. Это соответствует спариванию оснований
в ДНК цепи, т.е. С—Г, А—Т.
Кодирующая нить
5‘
ATG
AAG
СТА
GCT
3‘
DNA
, Матричная нить
3‘
ТАС
ттс
GAT
CGA
5'
мРНК
5'
A G
A G
C A
GC
3‘
Аминокислоты
N
Met or
START!
Lys
Leu
Ala
C
Центральная догма молекулярной биологии
133
^9 Организация ДНК в хромооомах
|| 'с' HI 'с' |
(I ь
Хромосомы в периоде
метафазы при делении клетки
(см. гл. 57)
Теломера
Теломера
Хроматид
Центромера
(Ьъ
4
Рнс. 62.1. ДНК объединяется с белками, образуя хроматин, который упакован внутри ядра
Организация ДНК эукариот
В человеческом организме ядерная ДНК разделена по всей
длине на 23 пары хромосом. Общая длина молекулы ДНК 2 м,
средняя длина молекулы ДНК в одной хромосоме 4 см. Ширина
ДНК примерно 2 нм. В качестве наглядного примера увели¬
чим пропорционально нить ДНК до размера шерстяной нити
шириной 2 мм, длина этой нити будет 2000 км, или 1250 миль.
Вся эта молекула должна быть упакована и структурирована
внутри клетки и нуклеосом и быть способна: 1) к репликации
внутри клетки; 2) к транскрипции для синтеза РНК. Если пред¬
ставить себе, что молекула ДНК — это 23 клубка шерстяной
нити, становится очевидным, что в такой ситуации возникают
предпосылки для хаоса и беспорядочного образования узлов
(рис. 62.3). Организация ДНК показана на рис. 62.1 и 62.2.
Митохондриальная ДНК
Небольшая часть человеческой ДНК принадлежит мито¬
хондриальной ДНК, которая располагается в митохондриях
и участвует в синтезе некоторых митохондриальных бел¬
ков. Полагают, что митохондрия — это «призрак» древних
бактериальных клеток, миллионы лет назад установивших
симбиотические отношения (эндосимбиоз) с эукариотиче¬
скими клетками. митДНК имеет кольцевую двухцепочечную
структуру, схожую по строению на прокариотическую ДНК
(рис. 63.4) митДНК наследуется по материнской линии. Это
происходит вследствие того, что клетки спермы не привносят
свои митохондрии во время оплодотворения.
Организация ДНК прокариот
Хромосомная ДНК
У прокариот хромосомная ДНК — это циклическая двухцепо¬
чечная молекула, связанная с белками. Ее размер варьируется в
промежутке от 160 000 до 12 000 000 пар оснований (рис. 63.4).
Плазмиды ДНК
Плазмиды — это малые кольцевые ДНК, содержащие при¬
мерно 1000—200 000 пар оснований. Они участвуют в процес¬
се переноса генов, например, между бактериями различных
видов при формировании устойчивости к антибиотикам.
Организация ДНК у вирусов
Вирусы могут содержать в своем составе либо ДНК, либо
РНК. У ДНК -вирусов молекула ДНК двухцепочечная, за
исключением парвовирусов, которые имеют очень малую
структуру, примерно 25 нм в диаметре и содержащую одио-
цепочечную ДНК (от лат. parvus — маленький). Большинство
ДНК-вирусов являются линейными молекулами, за исклю¬
чением кольцевых вирусов папилломы, полиомы и гепато-
вирусов (гепатит В).
Хроматин, зухроматин и готорохроматин
1. Хроматин состоит из ДНК и регуляторных белков и белков
упаковки.
2. Эухроматин — менее конденсированная, свободная форма
хроматина, которая принимает участие в транскрипции.
3. Гетерохроматин — высококонденсированная, уплотненная
форма хроматина, неспособная участвовать в транскрип¬
ции.
В различных типах клеток функционируют различные участ¬
ки гена. Этот процесс контролируется конденсированным/
деконденсированным состоянием хроматина. В процессе
деления клетки вся ядерная ДНК в метафазных хромосомах
находится в высококонденсированном состоянии (рис. 62.2).
После завершения процесса деления ядерная ДНК деконден-
сируется, а гены возобновляют транскипцию/трансляцию.
Метилированная ДНК влияет на экспрессию гена, что приво¬
дит к разнице в функциях материнских и дочерних клеток.
134 Организация ДНК в хромосомах
Двойная цепь ДНК
Диаметр 2 нм. Степень упаковки 1.
Катушка или фибра хроматина 30 нм
Диаметр 30 нм. Степень упаковки 50:1.
Интерфаза.
Нуклеосомы сворачиваются, формируя хроматиновое волокно
(шесть нуклеосом на виток)
Нуклеосомы: форма хроматина в виде «бусины на нити»
Диаметр 11 нм. Степень упаковки 10:1.
ДНК взаимодействует с гистонами, образуя хроматин.
Гистоны и белки богаты аминокислотами аргинином и лизином,
следовательно, они имеют положительный заряд. Две копии
каждого из четырех гистонов: Н2А, Н2В, НЗ и Н4 - объединяются,
подобно октамеру, формируя «бусины». В качестве «нити»
выступает молекула ДНК, имеющая отрицательный заряд
вследствие имеющихся фосфатных групп в своем составе.
ДНК дважды оборачивается вокруг октамера, образуя нуклеосому.
Пятый гистон - Н1, известный как линкерный гистон,
организовывает архитектурную структуру нуклеосомы
Петельные домены
Диаметр 250 нм. Степень упаковки 250:1.
Хроматиновые волокна формируют серию петель,
котрые жестко зафиксированы (50 петель на виток).
Матрица состоит из «негистонового хромосомного белка»
Хромосома метафазы
Диаметр 840 нм. Степень упаковки 5000:1.
Хромосома состоит из двух хроматид, соединенных в области
центромеры.
р-плечо (от франц. petit- маленький). Короткое плечо,
q-плечо - длинное плечо
Гетерохроматин
Диаметр 840 нм. Стпень упаковки 5000:1.
Высококонденсированная форма хроматина организована
как витки в стурктуру, напоминающую бутоны розы.
Витки формируют хромосомы
(18 петель на виток)
Дочерняя клетка 2
Рис. 62.2. ДНК плотно упакована, что позволяет ей полностью помещаться в ядре клетки
Рис. 62.3. Длинная нить ДНК может запутываться в хаотичном порядке
Организация ДНК в хромосомах 135
Репликация ДНК (часть I)
ДНК-полимераза г
Лидирующая цепь
Отстающая цепь
111 III 111 Ч/
Afl<DV
гРНК-праймер Фрагменты Оказаки?
W ft.
Репликативная вилка
iihImT
mitii
Белки, связывающие
одноцепочечную ДНК
Л
£$'‘
пих пппимапэоа Я
Ингибиторы топоизомеразы
Химиотерапия рака:
РНК-праймаза
этопосайд, амсакрин,
(ДНК полимераза а)
тенипосайд
Рис. 63.1. Репликация ДНК у эукариот
ДНК-полимераза III
II111111II//
АДФ^
АТФ
Репликативная вилка
Лидирующая цепь
Отстающая цепь
[-РНК-праймер фрагменты Оказаки
Белки, связывающие
одноцепочечную ДНК
ДНК-гирам^ъ
РНК-праймаза
ДНК-полимераза III
Ингибиторы ДНК-гиразы
Антибиотики: фторхинолоны:
зноксацин, гатифлоксацин,
максифлоксацин, норфлоксацин,
офлоксацин.
Хинолон: налидиксовая кислота
Рис. 63.2. Репликация ДНК у прокариот
136 Репликация ДНК (часть I)
Отстающая цепь
(фрагменты Оказаки) Лидирующая цепь
Отстающая цепь
(фрагменты Оказаки)
ЬДф|!И|ф
■*>
i,« №Ж#
„ ф,
mC.c
'„‘uCT iiini'v
Репликативный
глазок
Репликативная
вилка
Репликативный
глазок
Рис. 63.3. Множественные репликативные глазки у эукариот
Репликативная
вилка
Репликативный
глазок
Репликация ДНК происходит во время роста клетки
Во время роста клетки ДНК (генетический материал) должна
быть скопирована с высокой степенью точности в дочернюю
клетку. Этот процесс называется репликацией ДНК. Он осу¬
ществляется при помощи различных типов ДНК полимераз,
действие которых заключается в присоединении 5’-фосфата
дезоксирибонуклеотида — dATO, dlTO, dTTO, dUTO к
З’-гидроксил-группе растущей цепи ДНК.
Репликация эукариот и прокариот имеет много общих черт, но
тем не менее имеет существенные различия в деталях (рис. 63.1
и 63.4). В главе 71 приведена сводная таблица, в которой опи¬
саны различия репликации прокариот и эукариот.
ЧМШ 111
V4*
V
г- Репликативный глазок
МИМ/,
ф-
|'>/Ш11111!1111П|\'Ч
Репликативная
вилка
Точка начала репликации
Эукариоты в своем составе содержат гораздо большее количе¬
ство ДНК, чем прокариоты. Вследствие этого для ускорения
процесса репликации у эукариот формируются множествен¬
ные репликативные глазки (рис. 63.3) На каждом глазке начало
репликации происходит с образования двух репликативных
вилок. У прокариотических клеток, в отличие от эукариотиче¬
ских, существует только один репликативный глазок (рис. 63.4).
Последовательность оснований в точке начала репликации
эукариот и прокариот содержит высокую концентрацию А и
Т, что облегчает разделение нитей. Как мы помним, двойная
связь А=Т гораздо легче разрывается, чем связь Ц=Г.
Рис. 63.4. Единственный репликативный глазок у прокариот
Репликация ДНК (часть I) 137
Репликация ДНК (часть II)
Белки, связывающие
одноцепочечную ДНК
1 ‘ 3 1
Хеликаза Топоизомераза
Лидирующая цепь
Отстающая цепь
iiii'ni' irT‘nf?iirt’ii\4 l,
I - Полимераза б
РНК-праймаза
6 (также известная
Полимераза £ как полимераза а)
MHMI'MIMIHll"
Mil'll]1 |I nlivil
А?
РНК-праймер
Фрагменты Оказаки
аМЧМ1"|11'||1'"!|'"*
Разрыв
одноцепочечной ДНК
/ /Т 8
// РНК-праймер
llll'l 'Ml'nll'llll'llV"
|ф.|ф%|1’\4>%9'1
vA
Разрыв одноцепочечной ДНК
1И!.Ш!.И!»11;П" пуут %
® тку
1ИГП1 411 tillin'^
t 10
Промежуток сшивается лигазой
мим
Рис. 64.1. Стадии репликации ДНК. у эукариот
%> 11
Хеликаза
и топоизомераза
138 Репликация ДНК (часть II)
Репликация двойной спирали ДНК
Репликация ДНК носит нолуконсерватнвный характер.
Двойная спираль разделяется на две одиночные нити,
каждая из которых формирует матрицу для последующе¬
го считывания. Каждая новая сформированная ДНК имеет
в своем составе одну вновь синтезированную цепь и одну
от материнской ДНК. В процессе репликации соблюдает¬
ся правило комплементарности пар оснований. Таким образом,
если на матричной нити находятся А или Т, то на вновь
синтезированной напротив них будут Т и А соответственно.
Аналогичным образом, если на матричной Г или Ц, то на
новой — Ц и Г. Итак, две дочерние спирали ДНК идентич¬
ны родительской спирали. В процессе репликации можно
выделить следующие стадии.
• Расплетание ДНК. Две цепи расплетаются, образуя две
комплементарные друг другу однонитевые ДНК. Процесс
катализируется ферментом ДНК-хеликазой на репликативной
вилке.
• Белки, связывающие одноцепочечную ДНК (SSB — от англ,
single-stranded binding proteins), препятствуют обратно¬
му комплементарному связыванию нитей и стимулируют
активность хеликазы.
• Топоизомераза эухариот (гираза прокариот) предотвращает супер-
скручнванне. Расплетание двойной спирали ДНК вызывает
появление положительных супервитков впереди идущей
хеликазы. Напряжение суперспирализации снимается
действием топоизомеразы (гиразы), которая разрывает обе
нити ДНК, заворачивает нить, а затем восстанавливает
связь в месте разрыва.
• Гистоны. В процессе репликации гистоны перемещаются,
но затем возвращаются на прежнее место для упаковки
новой двойной спирали.
• ДНК-полимеразы. Некоторые типы ДНК-полимераз синте¬
зируют ДНК путем присоединения дезоксирибонуклеоти-
да dATO, бГТФ, бТТФ, 6ЦТФ к свободному З’-ОН-концу
ДНК. Эти ферменты считывают информацию с матрицы
ДНК в направлении 3’5’. Природа полимераз эукариот еще
не до конца понятна. Одна из моделей (рис. 64.1) показы¬
вает, что полимераза е преимущественно репликаза «лиди¬
рующей цепи». Рост цепи осуществляется в направлении
3’-5’, начинаясь у репликативной вилки. Полимеразы а и б
объединяются и участвуют в синтезе цепи «запаздывания».
• Цепь «запаздывания». Проблема! Как мы помним, ДНК-
полимераза считывает информацию с матрицы ДНК в
направлении 3’-5’, противоположном от репликативной
вилки. Другими словами, она растет в неправильном направ¬
лении! ДНК растет в обратном направлении от репликатив¬
ной вилки короткими последовательностями, которые полу¬
чали название фрагменты Оказаки. В этом процессе участвует
комплекс ДНК-полимераз а и б. Первым делом ДНК полимераза
а (РНК-праймаза) синтезирует РНК-праймер. Затем поли¬
мераза б формирует короткие последовательности ДНК
(фрагменты Оказаки), оставляя промежуток между ними и
предыдущем РНК-праймером. Затем РНК-праймер удаляется,
ДНК-лигаза сшивает фрагменты по липким концам.
Таблица 64.1. ДНК-репликация у эукариот
1
ДНК-хеликаза и репликативная вилка
ДНК-хеликаза раскручивает двойную спираль ДНК, образуя У-образную
репликативную вилку
2
Белки, связывающие одноцепочечную ДНК
Удерживают одиночные цепи на репликативной вилке, предотвращая их от
соединения
3
Сверхспирализация, вызванная хеликазой
Топоизомераза разрезает, а затем соединяет спираль ДНК, удаляя положи¬
тельные сверхвитки
4
РНК-праймер
Лидирующей цепи достаточно лишь одного РНК-праймера. Отстающей цепи
необходим РНК-праймер для каждого фрагмента Оказаки
5
РНК-праймаза
ДНК-полимераэа а (также известная как РНК-праймаза) взаимодействует с
ДНК-полимеразой 5, формируя тем самым полимеразный комплекс. Праймаза
синтезирует РНК-праймер, который присоединяется к ДНК при помощи ДНК
полимеразы 5
6
ДНК-полимеразы
Полимераза 5: синтезирует ДНК на запаздывающей цепи (фрагменты
Оказаки).
Полимераза е: синтезирует ДНК на лидирующей цепи
7
Фрагменты Оказаки
Около 100-200 нуклеотидов
8
При удалении РНК праймера остается промежуток,
который заполняется ДНК
Единственный праймер с лидирующей цепи, множественные праймеры с
отстающей цепи удаляются РНКазой Н (РНКаза Н: действует как гибрид ДНК
и РНК). Полимераза 5 синтезирует ДНК, заполняя промежуток, оставленный
РНК-праймером
9,10
ДНК-лигаза сшивает одноцепочечный разрыв
Одноцепочечный разрыв находится на З'-гидроксильном конце фрагмента
Оказаки. ДНК лигаза присоединяет этот З'-гидроксиконец к свободному
5'-фосфатной группе, образуя фосфодизфирную связь
11
Хеликаза и топоизомераза
Хеликаза и топоизомераза движется вдоль ДНК-цепи
Репликация ДНК (часть II) 139
vpejopja
Повреждение и репарация ДНК
F Пурин Г № Пурин ВЕЯ
Пиримидин ЩПиримидин
Рис. 65.1. Мутации трансверсии и транзиции
Повреждения ДНК и мутации ДНК отличаются
друг от друга
Хотя репликация — процесс очень точный и аккуратный, но
каждый день в одной клетке может быть до 10 000 основа¬
ний, которые были либо повреждены, либо ошибочно вклю¬
чены в ДНК!
Мутации ДНК — это наследуемые изменения в последо¬
вательности оснований. При сравнении пар оснований при
мутациях отклонения не могут быть выявлены и соответ¬
ственно исправлены. Мутации могут быть не очень серьез¬
ными, если они возникают в некодирующей части ДНК. Тем
не менее иногда они могут стать причиной возникновения
функционально аномальных белков, которые приводят к раз¬
личным заболеваниям.
Точечные мутации — это замена одного основания. Они под¬
разделяются на мутации транзиции и трансверсии (рис. 65.1)
Транзиции — замена пуринового основания на пуриновое либо
пиримидинового основания на пиримидиновое. Трансверсия —
замена пуринового основания на пиримидиновое.
Повреждения ДНК
Повреждения ДНК могут быть вызваны ошибкой ДНК-
полимеразы (удаление либо вставка оснований), разрывом
нитей ДНК (вызванное рентгеновским излучением) либо
образованием поперечных связей между нитями дуплекса, пре¬
пятствующее разделению нитей, например поперечное сши¬
вание между молекулами тимина.
Повреждения ДНК возникают, когда структура ДНК дезо¬
риентирована и имеет физические отклонения от нормы.
Окислительный метаболизм, ионизирующее и ультрафиоле¬
товое излучение вызывают образование активных форм кисло¬
рода (reactive oxygen species — ROS) (см. гл. 15). ROS окисляет
гуанин до 8-оксо-7,8-дигидрогуанина(8-оксогуанина) и ура-
цил до 5-гидроксиметилурацила. Также активные формы кис¬
лорода способствуют разрыву нитей ДНК. Ультрафиолетовое
излучение повреждает ДНК, связывая ковалентно близлежа¬
щие пиримидины (рис. 65.2). Димеризация близкорасполо¬
женных тиминовых молекул продуцирует нарушения, дефор¬
мирующие спираль ДНК.
Спонтанное дезаминирование оснований
Распространенной причиной повреждений ДНК является
спонтанное дезаминирование оснований, например дезами¬
нирование цитозина до урацила (рис. 65.2). Как мы помним,
урацил является основанием присутствующим исключительно
в РНК, и нахождение его в молекуле ДНК не соответствует
норме. В РНК урацил образует пару с аденином. В свою оче¬
редь, цитозин образует пару с гуанином, таким образом, если
цитозин дезаминируется до урацила, то возникнет некомпле¬
ментарная пара оснований урацила с гуанином, что приводит
в дезориентированию спирали ДНК. Данный тип поврежде¬
ния устраняется в процессе репарации, который называется
удалением основания.
Репарация ДНК
Удаление поврежденных оснований
Данный тип репарации используется для исправления оши¬
бок, вызванных одним основанием. На рис. 65.2 показано, как
ошибочное основание урацил (дезаминированный цитозин)
вырезается с области Г-конца дезоксирибозы ферментом
ДНК гликозплазой, оставляя после себя АР-сайт. АР-сайт —
сайт, лишенный оснований, не имеющий в своей структуре ни
пурина, ни пиримидина - его также называют «безпуриновый»,
или «безпиримидиновый». Затем АР-эидонуклеаза разрезает
5’-связь. Этот процесс осуществляется дезоксирибозофосфат-
лиазой, которая возвращает дезоксирибозофосфат на место
разреза на З’-конце. Наконец, промежуток заполняется путем
действий активной ДНК полимеразы, а место разреза сшива¬
ется ДНК-лигазой.
Репарация поврежденных нуклеотидов
Данный тип репарации используется в случае, если повреж¬
дение ДНК было вызвано ошибкой более одного основания
либо обширным повреждением областей, например нарушение
структуры двойной спирали, вызванное бензо-а-пиренолом
или афлатоксином. Для осуществления процесса требуются
специфические эндонуклеазы. Они отщепляют олигонуклео¬
тиды, имеющие в своем составе поврежденные основания.
На примере, показанном на рис. 65.2, УФ-специфическая
эндонуклеаза отщепляет поврежденные участки, явившие¬
ся результатом димеризации двух тиминовых оснований. По
окончании процесса свободные промежутки заполняются
под действием фермента ДНК-полимеразы, сшивание разреза
осуществляется ДНК-лигазой.
Xeroderma pigmentosa — редкое аутосомно-рецессивное забо¬
левание, вызванное нарушением работы УФ-специфической
эндонуклеазы. При этой мутации повреждения ДНК, вызван¬
ные солнечным светом, не могут быть устранены. Пациентов
с такой мутацией ДНК называют «дети ночи».
Репарация несоответствия оснований (Mis-matched-
репарация)
О несоответствии оснований, образованных в процессе
репликации ДНК, говорят, если не соблюдается правило
комплементарное™ оснований ГгЦ или А=Т. В таком случае
их находит и исправляет ферментативный комплекс восста¬
новления несоответствий. Некомплеменарные нуклеотиды
идентифицируются и вырезаются, а промежуток заполняется
вновь синтезированными основаниями ДНК-полимеразой.
Мутации в этом ферментативном комплексе приводят к
неправильным исправлениям ошибок несоответствия пар
оснований и могут вызывать различные болезни, например
неполипозный колоректальный рак прямой кишки.
Двухцепочечные повреждения и разрыв хромосомы
Причиной двухцепочечных повреждений может стать ионизи¬
рующее излучение. Если такое случается, то процесс репара¬
ции может быть недостаточно точен, что приводит к мутации
в ДНК и сбоям в работе клетки, например к раку кожи.
При некоторых типах рака на последующих стадиях про¬
исходят необратимые повреждения в хромосомах.
140 Повреждение и репарация ДНК
11
г
'si if.'
Цитозин|
N^CnCH
I II
o>c'ikch
I
днк
до повреждения
nh2
L
Спонтанное дезаминирование 1
с изменением Цдо У
ШшШ
uracil
1Т9ШВ gg
iljjllliilju
Поврежденная ДНК
Урацил заменен на цитозин
Репарация путем вырезания оснований
ДНК-
гликозилаза
Урацил
giBBtBH!
iBBassiiB.
Повреждения ДНК
активируют р53,
который приостанавлет
клеточный цикл
(гл. 57)
АР-зндонуклеаза
идезокси-
рибозофосфат-
лиаза
ЙЖ Дезоксирибозофосфат
3' 5'
вввавв
iiBIUiiiBi
ДНК-полимераза
иДНК-лигаза
УФ-излучение от солнца
вызывает димеризацию
5' I пиримидинов,
I например тимина
ШВ1ВШ1
Поврежденная ДНК
Димеризация тимина
Репарация путем вырезания нуклеотидов
1
i
ВВВВВШВ
шжш
I Xeroderma !
| pigmentosum j
УФ-спецнфическая
эндонуклеаза
^ BBSBBI
Олигонуклеотид,
содержащий
тиминовый димер
В!
iiiiiiiiii
■л
BBIBBBiBBS
Восстановленная ДНК
Рис. 65.2. Поврежденную ДНК можно восстановить
Повреждение и репарация ДНК 141
Транскрипция ДНК с образованием мРНК (чаоть I)
Участок, регулирующий транскрипцию
Основной
(базовый)
Промотор go промотор. 5'-некодирующий
Энхансеры ЦААТ пгнлпаний ТАТА-бЛОК РЯпгнпианий ичлстпк
Рис. 66.1. Транскрипция ДНК у эукариот с целью синтеза м PH К
Матричная РНК у эукариот
РНК полимераза II синтезируется в ядре клетки из нуклеоти¬
дов АТФ, ГТФ, ЦТФ, УТФ (не ТТФ) используя матричную
нить ДНК. На рис. 66.1 показан процесс транскрипции.
1. Инициация транскрипции. Транскрипционные факторы
(напр., SREBP, часть 31) связываются с областью нромото-
ра (блок ТАТА и блок ЦААТ) в гене, тем самым стимули¬
руя присоединение ДНК-полимеразы II.() Это дает начало
процессу транскрипции. Блоки оснований ТАТА и ЦААТ
богаты основаниями Т и А, следовательно, имеют сла¬
бые водородные связи между основаниями, что облегчает
раскрытие двойной спирали ДНК и последующее обра¬
зование транскрипционного кольца. Теперь полимераза II
приближает АТФ, ГТФ, ЦТФ и УТФ к матричной нити
ДНК и начинает процесс полимеризации в соответствии
с комплементарностью пар оснований с образованием
РНК. На некотором расстоянии от блока ТАТА находится
область, называемая энхансером, которая, в свою очередь,
также связывается с фактором транскрипции.
2. Элонгация. Полимераза II движется вдоль нити ДНК, фор¬
мируя первичный транскрипт пред-мРНК. Этот процесс
происходит в транскрипционном кольце.
3. Сайленсеры. Транскрипция репрессируется ингибитора¬
ми регуляции, которые связываются с областями в гене,
называемыми сайленсерами. Сайленсеры (не показаны на
рис. 66.1) могут находиться на некотором расстоянии от
гена, который они регулируют. Тем не менее они могут
взаимодействовать с РНК-полимеразой, образуя петлю и
ингибируя транскрипцию.
4. Терминация. Терминация транскрипции у эукариот еще не
достаточно изучена.
5. Пред-матричная РНК. Первым продуктом транскрипции
ДНК под воздействием РНК-полнмеразы II является пред-
мРПК. Она имеет кэп, хвост, некодирующую область —
интроны и кодирующую — экзоны, может быть моди¬
фицирована внутри ядра до того момента, когда будет
находиться в цитозоле в виде матричной мРНК.
6. Гуанозиновый кэп. ГТФ и S-аденозин-метионин образу¬
ют метилированный гуанозинтрифосфат (метилирован¬
ный ГТФ) для формирования защиты на 5’-конце в виде
7-метилгуанозинового кэпа.
7. Поли-А-хвост. После транскрипции, без матрицы ДНК,
поли-А-полимераза присоединяет 100-250 молекул
АТФ к З’-конпу пред-мРНК, формируя поли-А-конец.
Полиаденилированная последовательность на З’-конце сиг¬
нализирует о данном образовании. Поли-А-конец способ¬
ствует облегчению прохождения мРНК из ядра в цитозоль
и приостанавливает его деградацию. Чем длиннее поли-А-
конец, тем больше время полужизни мРНК. Деградация
мРНК контролирует стабильную экспрессию гена. Виды
мРНК с коротким полупериодом жизни (<1 часа) связаны
с генами, продукты экспрессии которых выполняют регу¬
ляторные функции, например контроль клеточного цикла.
Типы мРНК с длинным полупериодом жизни (5—24 ч)
связаны с «генами домашнего хозяйства», отвечающими за
метаболизм и синтез белка.
8. Процессинг пред-мРНК. Как вырезаются интроны и проис¬
ходит сплайсинг экзонов, описано в главе 67.
РНК-полимераза-
Кодирующая цепь ДНК
Транскрипция
В процессе транскрипции ДНК 5'
могут образовываться
мРНК (часть 66, 67), 3'
тРНК (часть 68),
рРНК (часть 69)
|1
Матричная нить ДНК-
Образование РНК-
,ч/
Субчастица ДНК-
полимеразы,
расплетающая ДНК
Нуклеотиды
3 УТФ
5'
у/\ II Kill
РНК-полимераза движется вдоль цепи ДНК,
поспепенно раскручивая ее
Рис. 66.2. РНК-полимераза движется вдоль цепи ДНК и считывает информацию с матричной нити ДНК в транскрипционном глазке
142 Транскрипция ДНК с образованием мРНК (часть I)
Область транскрипции
Экзон 1
Интрон
Экзон 2
met —lys- le!T -ala
Белок
Рис. 66.3. Транскрипция ДНК у эукариот с целью синтеза мРНК
В* -талассоанемия
Это заболевание вызвано точечной мутацией на поли-А-
сигнальном сайте, где ААТААА становится ААЦААА. У паци¬
ентов нарушена способность продуцировать (3-цепь мРНК,
необходимая для синтеза (3-глобина — компонента гемогло¬
бина. Это приводит к острой форме анемии.
Ядовитые грибы
РНК-полимераза II ингибируется а-аманитином, токсином
яда белой поганки (Amanitaphalloides). Если по ошибке съесть
бледную поганку, результат может быть смертельным.
Эукариоты
Матричная РНК (мРНК) эукариот синтезируется РНК-
полимеразой II, транспортная РНК синтезируется РНК-
полимеразой III (см. гл. 68), рибосомальная РНК синтезиру¬
ется РНК-полимеразами I и III (см. гл. 69).
Прокариоты
Хотя транкрипция прокариот и эукариот имеет довольно
много общих черт, принципиальные отличия систематизи¬
рованы в табл. 71.2.
Транскрипция ДНК с образованием мРНК (часть I) 143
Транскрипция ДНК с образованием мРНК (часть II)
Рис. 67.1. Процессинг пред-мРНК у эукариот
144 Транскрипция ДНК с образованием мРНК (часть II)
Пред-матричная РНК
В предыдущей главе было сказано, что первичным продуктом
транскрипции ДНК, катализируемой РНК-полимеразой II,
является пред-мРНК. Она состоит из экзонов, несущих гене¬
тическую информацию, необходимую для синтеза белка.
Экзоны разделены между собой некодирующими последова¬
тельностями — интронами. К тому моменту, когда последо¬
вательность экзонов будет переведена в последовательность
аминокислот для осуществления синтеза белка, интроны
должны быть перемещены, а экзоны образовать единую
последовательность.
Процессинг пред-мРНК
Основание АГГУ находит границы экзон/интрон и помечает
их как левый сплайс-сайт и правый сплайс-сайт. Э то возможно
благодаря тому, что 5’-край (левый) АГГУ метит ГУ — левый
край. Аналогично З’-край (правый) АГГУ отмечает АГ — пра¬
вый край. В последующем границы будут называться 5’-АГГУ
и АГГУ-3’ соответственно.
Сплайсосомы
Процесс формирования пред-мРНК осуществляется ком¬
плексом, который называется сплайсосомой. Он состоит из
малых молекул РНК (малые РНК) и белков, образуя несколь¬
ко различных типов малых ядерных рибокуклеопротеинов
(snRNP). Один вид snRNP связывается с 5’-концом (левым
краем) интрона, в то же время другой вид snRNP связывается
с З’-концом (правым краем) интрона.
Точка ветвления аденинового нуклеотида
Внутри области интрона находится специфическая точка вет¬
вления аденина. Некоторые малые РНК связываются с интро¬
нами, вызывая тем самым скручивание их в петлю таким
образом, чтобы 5’-АГГУ граничил с точкой ветвления аде¬
нинового нуклеотида. Рибозофосфатная связь между ГГ раз¬
рывается, свободный экзон 1 и 5’-ОН от гуанина формируют
5’->2’ фосфодиэфирную связь с 2’-ОН концом точки вет¬
вления.
Л
Точка ветвления
аденинового
нуклеотида
/АУЛ/5
Рис. 67.2. 2'—5’-фосфодиэфирная связь формируется в момент, когда
интрон образует «лассо» в точке ветвления аденинового нуклеотида
Лассо
Следующая за рибозофосфатной связью ГГ связь разрывает¬
ся, свободный экзон 2 и отделенный в форме лассо интрон
раскрываются и распадаются до нуклеотидов.
Сплайсинг зкзонов 1 и 2. Альтернативный сплайсинг
Наконец, свободный З’-конец экзона 1 образует связь со
свободным 5’-концом белка. У человека и других много¬
клеточных организмов некоторые пред-мРНК могут быть
соединены таким образом, что альтернативный экзон может
использоваться для построения более чем одной пред-мРНК
и более одного белка в отдельно взятом гене. Это позволя¬
ет 23 000 генам человеческого генома составить белковую
карту из 100 000 белков! Например, из одного гена берут свое
начало кальцитоцин и нейропептид кальцитоцинзависимого
белка.
Волчанка
У пациентов с такой болезнью организм синтезирует анти¬
тела к snRNP, вызывая отклонения в процессе синтеза пред-
мРНК.
Транскрипция ДНК с образованием мРНК (часть II)
145
Транскрипция ДНК с образованием тРНК
тРНК образует транскрипционный глазок
при помощи РНК-полимеразы III
/ ^.\П I 111 v
Процессы РНК
1. Удаление интронов.
2. Модиифкация оснований.
3. Присоединение
последовательности ЦЦА
кЗ'-концу Г
1
S.J»*
П
Ч,
^ МП1 1,1 tl
‘f|*|f. "
тРНК
Нуклеоплазма Ядерный
1 конверт
Аминокислотный
сайт присоединения
ОН 3'
Цитозоль
Акцепторный
участок
ТфЦ-петля
Конечная
с f последовательность ЦЦА
с
5'
с;
с;
1Ж
ш
с
Д-петля
111
;;е
Дигидроуридин
тРНК
инозин
I
мРНК
В
с с
Таблица 68.1. Теория неоднозначности пар оснований
Правила теории Крика о неоднозначности пар оснований
объясняют, каким образом некоторые типы тРНК
соответствуют более чем одному кодону. Например,
антикодон УГИ треониновой тРНК (тРНК тре) может
спариваться с кодонами мРНК; АЦА, АЦЦ и АЦУ.
тРНК 5‘
основание антикодона
мРНК 3’ *
основания кодона
А
и
С
G
G
С or U
и
A or G
I
A or С or U
Неоднозначная Й
\
Неоднозначная
I
\
‘П03ИЦИЯ мрнк g с
В
“ позиция мрнк -
с
3' 5'
И. J
5 5' 1
1
2
Неоднозначная
позиция
Триптофановый кодон
Треониновый кодон
Треониновый кодон
Рис. 68.1. Транскрипция ДНК с образованием тРНК
146
Транскрипция ДНК с образованием тРНК
Синтез транспортной РНК у зукариот и прокариот
Различные виды тРНК эукариот синтезируются РНК-
полимеразой III во внутриядерном пространстве. Первичные
продукты транскрипции подвергаются различным моди¬
фикациям. Все транскрипты имеют группу ЦЦА, которая
присоединяется к 3’-концу. Основания модифицированы и
вследствие этого получены нетипичные продукты. Например,
урацил может быть либо превращен в псевдоуридин (у), либо
гидрировать до дигидроурацила (а). Другой пример — это
дезаминирование аденина с образованием инозина.
Все типы РНК прокариот, включающие различные типы
тРНК, синтезируются РНК-полимеразой, которая представ¬
ляет собой сложный комплекс, состоящий из нескольких
субъединиц.
Структура тРНК
Примерно 15% всей РНК приходится на долю тРНК. Каждой
аминокислоте соответствует по меньшей мере одна специфи¬
ческая тРНК, а также различные типы тРНК, в составе кото¬
рых имеется от 75 до 95 нуклеотидов. До недавнего времени
считалось, что тРНК — самая маленькая единица в семействе
РНК. Это было до середины 1960-х гг., когда была открыта
микроРНК, еше более малая единица.
Все молекулы тРНК свернуты таким образом, что обра¬
зуют стабильную трехмерную структуру, напоминающую в
плоскости лист клевера. Молекулы соединены между собой
водородными связями в соответствии с правилом компле-
ментарности оснований. Как результат, в структуре появ¬
ляются области в виде петель и спиралей. Все терминато¬
ры на З’-конце имеют последовательность ЦЦА, которая
называется сайтом прикрепления аминокислот. Около 10%
тРНК состоит из нестандартных оснований. Например, для
Т\|/Ц петля с псевдоуридином у характерно тиминовое свя¬
зывание с рибозой (обычно связывается с дезоксирибозой),
дигирдоуридин (Д) на Д-петле. Нетля может варьировать в
размере от 3 до 21 нуклеотидов. Стабильность структуры
обеспечивают четыре области, насыщенные парами осно¬
ваний Г=Ц, соединенные прочными тройными связями.
Антикодон содержит три основания, которые распознают
комплементарный ему триплет кодона на мРНК. Триплет
УГИ показан в качестве примера на рис. 68.1. Он распознает
три из четырех кодонов мРНК для треонина: АЦА, АЦЦ и
АЦУ. Это возможно благодаря тому, что тРНК не является
жееткой конструкцией.
Гипотеза Крика о неоднозначнооти пар оснований
(теория колебаний)
Генетический код включает четыре различных основания,
организованных в виде кодонов, по три основания в каж¬
дом. Таким образом, мРНК имеет 43 (т.е. 64) тринлета кодона
(рис. 61.1). Три из этих кодонов являются СТОП-кодонами.
Они связываются с факторами релиза, тем самым термини¬
руя трансляцию. Итак, остается 61 кодон. Это значит, что
61 тРНК с 61 комплементарными антикодонами нуждается в
паре в виде кодонов. Но это не так. Нз постулата, что гене¬
тический код вырожден (табл. 61.1), в 1966 г. Крик выдвинул
гипотезу о неднозначности пар оснований. Он предположил,
что первые два основания каждого кодона на петле тРНК
образуют идеальное спаривание А=У, Г=Ц, но из-за формы
петли третье основание не может быть расположено доста¬
точно близко. В табл. 68.1 приведены правила спаривания
оснований для соответствия кодон-антикон. Он включа¬
ет инозин (И), который впоследствии был открыт на петле
антикодона у некоторых молекул тРНК.
Е. coli имеет 45 видов тРНК, от одного до двух для фени¬
лаланина или цистеина и до пяти для лейцина.
Процесс присоединения аминокислот к тРНК
Основной функцией тРНК является образование связей со
специфичной ему аминокислотой. Данный процесс становит¬
ся возможным благодаря ферменту из семейства аминоацил-
тРНК-синтетаз. Он выступает посредником между тРНК и
аминокислотами и ответственен за точность выбора правиль¬
ной аминокислоты. Фермент находит специфичную данной
тРНК аминокислоту и присоединяется к ней. В первую
очередь тРНК вступает в реакцию со своей специфичной
аминокислотой, реакция катализируется специфической
аминоацил-тРН К-синтетазой.
Метионин является исключением из правила. Он может
быть присоединен к двум типам тРНК, это зависит от сле¬
дующих факторов:
1) если он действует как сигнал СТАРТ для иницииро¬
вания синтеза белка, т.е. инициатор метионил-тРНК
(мет-тРНК);
2) если он взаимодействует с белком, как и любая другая
аминокислота, т.е образуя метионил-тРНК.
Затем нагруженная тРНК переносит аминокислоты к
рибосоме для последующего включения их в белок (часть
70). В этом месте антикодоны тРНК комплементарно связы¬
ваются с кодонами мРНК.
N-формилметионин прокариот
fMet отмечает точку начала синтеза белка прокариот и имеет
свою специфичную транспортную РНК — TPHKfMet. Обычно
по окончании синтеза белка fMet удаляется.
Фермонты «лунного света»
Не так давно ученые из Исследовательского института
Скриппса (США) обнаружили, что тирозил-тРНК-синтетаза
человека функционирует по двум направлениям. Номимо
своей постоянной работы в области синтеза белка (связыва¬
ние тРНК с тирозином), она также стимулирует рост крове¬
носных сосудов. В то же время триптофанил-тРНК-синтетаза
не только связывает тРНК с триптофаном, но и ингибирует
рост кровеносных сосудов. Это исследование имеет богатый
клинический потенциал. Тирозил-тРНК-синтетаза является
проанглиогеном и может использоваться в качестве про¬
мотора для выращивания новых кровеносных сосудов при
сердечно-сосудистых заболеваниях. Вместе с тем стороны
триптофанил-тРНК-синтетаза является антианглиогеном и
может использоваться для ослабления кровеносных сосудов,
питающих раковую опухоль.
МикроРНК
Традиционно считалось, что тРНК является самым малень¬
ким представителем в семействе РНК. Однако недавно был
обнаружен еше более малый тип РНК, состоящий всего лишь
из 22 нуклеотидов. Он был назван микроРНК (miPHK).
Считается, что они связываются с мРНК, контролируя ста¬
бильность этой молекулы.
Транскрипция ДНК с образованием тРНК 147
Транскрипция ДНК с образованием рРНК
Р * _ 60S-
ера —
50S-
субъединица
субъединица
-
т
о
со
30S-
' субъединица
субъединица
eOS-рибосома
708-рибосома
Эукариот
прокариот
Рис. 69.1. Рибосомы эукариот и прокариот
Рибосомы эукариот и прокариот отличны
друг от друга.
Около 80% общей массы РНК приходится на самую распро¬
страненную группу — рибосомальную РНК. Взаимодействуя
с множеством белков, они формируют рибосому — рабочую
основу для синтеза белков из аминокислот.
Рибосома состоит из двух субъединиц. Субъединица 40S
эукариот взаимодействует с субъединицей 60S, образуя рибо¬
сому 80S (рис. 69.1). В клетках прокариот процесс немного
отличается: субъединица 30S взаимодействует с субъедини¬
цей 50S, образуя рибосому 70S.
Единицы Сведберга: 40S и 60S относят к коэффици¬
ентам седиментации, измеряемым в сведбергах (S). Число
седиментации зависит от размера и формы макромолекулы.
Единица S, в отличие от единицы массы, величина не адди¬
тивная. Например, частицы 40S и 60S имеют молекулярные
массы 1,5 и 3,0 г/моль, следовательно, масса рибосомы равна
4,5 г/моль. Но объединенные частицы 40S и 60S имеют коэф¬
фициент седиментации 80S.
в качестве антибиотика при определенных обстоятельствах
может быть полезно благодаря слабой внутриклеточной диф¬
фузии в клетках эукариот.
Биосинтез рибосомальной РНК эукариот
Биогенез рибосом осуществляется в ядрах, в которых гены
рРНК подвергаются транскрипции под воздействием РНК
полимеразы I, образуя транскрипты 45S (рис. 69.2). В пер¬
вую очередь транскрипты 45S выполняют функции орга¬
найзера и индуцируют формирование ядрышек, в которых
множество копий генов рибосомальной ДНК переводятся
в РНК.
Прохождению этого процесса сопутствуют следующие ста¬
дии: свежеприготовленные транскрипты пред-рРНК связы¬
ваются с белками, формируя предрибонуклеиновые части¬
цы. Родительская рибосома состоит примерно из 67% РНК
и 33% белка в массовых процентах. Спейсеры вырезаются из
45S РНК, распадаясь при этом на компоненты рРНК 28S,
18S, 5,8S, 18S, с присоединенными белками направляются на
формирование рибосомальной субъединицы 40S.
В то же время за пределами ядрышек гены 5S рРНК подвер¬
гаются транскрипции под воздействием РНК-полимеразы 111.
5S рРНК движется в ядрышко, в котором, взаимодействуя с
28S и 5,8S рРНК и различными белками, формирует рибосо¬
мальную субъединицу 60S. Субчастицы 40S и 80S мигрируют
в цитозоль, где они, взаимодействуя с мРНК, формируют
матричную 80S. Стабильный и высокоукомплектованный
молекулярный комплекс РНК и его тесное взаимодействие
с различными рибосомальными белками означают, что рибо-
сомные субъединицы являются чрезвычайно стабильными
структурами и могут использоваться неоднократно.
Сайты Е, А, Р
Рибосомы содержат в своем составе три тРНК, связанных
между собой сайтами Е, А, Р, участвующих в синтезе белка
(часть 70).
Сайт А — аминоацил сайт или сайт акцептор. Связывает ами-
ноацил тРНК, которая переносит аминоацильную группу на
полупептидную цепь.
Сайт Р — пептидный сайт содержит тРНК, связанный с поли-
пептидной цепью. Инициированная мет-тРНК связывается с
этим сайтом и дает сигнал начала ассоциации рибосом, а
впоследствии дает сигнал началу полипептидного синтеза.
Сайт Е — сайт выхода. Выход тРНК из рибосомы.
Пуромицин заходит в сайт А, примыкает к полипептидной
цепи и начинает движение в направлении сайта Р. Тем самым
создается проблема дальнейшего принятия и присоединения
к цепи новой аминоацильной группы, так как отсутствует
компонент тРНК. Таким образом, происходит прекращение
синтеза полипептида. Пуромицин блокирует синтез белка
и эукариот, и прокариот. Однако применение пуромицина
Как устроены рибосомы прокариот
Поскольку прокариоты лишены ядра, биогенез рибосом про¬
исходит в цитозоле. Рибосомальная РНК синтезируется един¬
ственным мультиферментным комплексом, который называ¬
ется РНК-полимераза. Рибосомы прокариот имеют гораздо
меньший размер, чем эукариот. Субъединица 50S состоит из
множества белков, субъединиц 23S и 5S рРНК. Малая субъе¬
диница 30S состоит из нескольких белков и 16S рРНК. Эти
субъединицы объединяются между собой и формируют рибо¬
сому 70S (рис. 69.1).
Хотя рибосомы прокариот очень похожи на рибосомы
эукариот, все же между ними существуют довольно важные
различия, которые были открыты учеными, работающими в
области разработки лекарств. Были синтезированы лекарства,
специфично действующие на бактериальную рибосому, инги¬
бируя синтез белка. Например, тетрациклины связываются с
A-сайтом рибосомы, препятствуя дальнейшему связыванию
аминоацил-тРНК-синтетазы. Тетрациклин используется как
антибиотик широкого спектра действия.
148
Транскрипция ДНК с образованием рРНК
Транскрипционный
глазок
- РНК-полимеразаI
Транскрипционный
Ч\И I 1 < IV,
4Uj-/V%/ \/Л/
I
5‘\Л*
/Ч/Ч/Ч/Ч/ Ч/Ч/ Ч/Ч/ Ч/Ч/ Ч/Ч/
45S рРНК
преимущественно
подвергается
транскрипции
Белки
II
Ядро
/Ч/Ч/Ч/Ч/Ч^
45S
ч/~Г
tr
40Б-субъединица
^ Процессинг ^
бОБ-субъединица
Ч/Ч/Ч.^
18S
X
28S
ч/Viyfyi
iaIAI/
5.8S
/ч/ч/ <4-
5S
Цитозоль
РНК-полимераза
/ч/Ч/ч/Ч/
5SрРНК
пплазмат
W’W.’H»-
Нуклеоплазма!
Ядерный
конверт
&
SOS-рибосома
Рис. 69.2. Биосинтез рибосомальной РНК и образование рибосомы у эукариот
Транскрипция ДНК с образованием рРНК
Трансляция и синтез белка
Генетическая информация, закодированная в последователь¬
ности триплетов оснований на матричной РНК, транслиру¬
ется с целью получения последовательности аминокислот.
Это значит, что белок, состоящий из последовательности
аминокислот, заложен в генетической информации. Процесс
трансляции и синтеза белка показан на рис. 70.1 и описан
далее (на рис. 70.1 указаны стадии 1—7).
1. Связывание тРИК с амнпокислотой. Аминокислота присо¬
единяется к соответсвуюшей ей тРНК с помощью специ¬
фической аминоацил-тРНК-синтетазы (см. гл. 68).
Тем временем для инициирования синтеза белка необхо¬
дим специфический инициатор тРНКте'. Он взаимодействует
с метионином, как показано на рис. 70.1.
2. Инициация. Факторами инициации у эукариот явялются
белки, которые вступают во взаимодействие с инициатором
тРНКте'. Он связывается с P-сайтом на 40S рибосомаль-
ной субъединице и распознается 7-метилгуанозиновым
кэпом (7-MG cap) на 5’-конце РНК. Субъединица движет¬
ся вдоль мРНК до тех пор, пока не обнаружит старт-кодон
АУГ.
3. Формирование 80S инициирующего комплекса. Распознавание
СТАРТ кодона (АУГ) на мРНК осуществляется с помо¬
щью предшествующей Козак последовательности, до того
момента как сформирован прединициирующий комплекс.
Наконец, рибосомальная субъединица 60S объединяется с
субъединицей 70S, образуя 80S рибосомальный комплекс.
4. Элонгация. Следующая аминоацил-тРНК-синтетаза —
глицинил-тРНК-синтетаза, связывающаяся с сайтом А,
кодонами ЦАГ на мРНК. Инициатор метионил-тРНК
(специфический) связывается с рибосомальным сайтом Р,
в то время как другие аминоацил-тРНК-синтетазы связыва¬
ются с A-сайтом. Связывание тРНКаз с A-сайтом эукариот
происходит при участии факторов элонгации eEFl и eEF2.
Процесс также идет благодаря энергии ГТФ, которая также
необходима для синтеза белка.
5. Формирование пептидной связи. Две аминокислоты образу¬
ют ковалентную пептидную связь, при участии фермента
пептидилтрансферазы(эта каталитическая РНК известна
как рибозим).
6, 7. Транслокация и элонгация. Рибосома передвигается на
три нуклеотида в направлении З’-конца вдоль мРНК, рас¬
полагая вновь синтезированный пептид на P-сайте. Тем
временем инициированная тРНК, свободная от амино¬
кислот, движется в сторону Е-сайта. Теперь вакантное
место на A-сайте свободно для присоединения аминоацил-
тРНК.
8. Синтез белка и терминация. Реакции 4—7 повторяются в
каждом последующем кодоне, но синтез белка продолжает¬
ся до тех пор, пока не будет достигнут СТОП-кодон (УГА,
УАГ или УГГ), тогда высвобождается фактор терминации,
освобождая готовый пептид.
9. Посттрансляционпая модификация белка. Зачастую синтези¬
рованный белок оказывается функционально неактивным.
Цепь сворачивается в трехмерную структуру, формируя
белки шапероны, образующиеся в процессе синтеза. Тем
не менее для полноценной функциональной активности
наибольшая функциональная активность требуется после
стадии трансляции, т.е при деметилировании, фосфорили¬
ровании, дефосфорилировании, гликозилировании, агре¬
гации с другими белками.
150 Трансляция и синтез белка
4V Gin ;Leu
u
I
Метионин
1. Нагрузка тРНК
Активированная аминокислота
присоединяется ктРНК
iE р А
6 JB *4
Эсс^ссй ScJJffcfjJJcT
«Л.?- . _ -•
Метионил-тРНК-синтаза
^^
tRNA,Met
ATP
AMP
РР;
и | с
метионил-тРНК
*р Щр
408-субъединица
7-МГ-
кэп
7. Элонгация к
Элонгация: последующая
аминоацил-тРНК связывается
сА-сайтом. «Пустая» тРНК
выходит через Е-сайт
3'
Лейцинил-тРНК
if
ГТФ
Г
^ ГТФ
Gin
Е Р А
СМС'
7-МГ-
кэп
Iccfc Сj$T
* •
■м 3'
2. Инициация
Аминоацил-тРНК
связывается с 408-субъединицей
6.Транслокация
Транслокация:пептидил-тРНК
движется в направлении Р-сайта
GDP + Pi
GTP
Gin
Рис. 70.1. Трансляция мРНК и синтез белка эукариот
ш
Трансляция и синтез белка 151
«а* I ■
Д| Сравнение процессов транокрипции ДНК, репликации
ДНК и синтеза белка в клетках эукариот и прокариот
Таблица 71.1. Обобщение и сравнение репликации ДНК у прокариот и эукариот (см. гл. 63, 64)
IF"""’™ Процесс
Эукариоты
Прокариоты
|. Структура ДНК
Линейная ДНК
Кольцевая ДНК
Механизм
Репликация ДНК-процесс полуконсервативный. При репликации родительская ДНК образует две
дочерние молекулы ДНК, каждая из которых состоит из одной родительской нити и из одной дочерней
вновь синтезированной нити. В процессе синтеза есть лидирующая цепь (продолжительный синтез) и
запаздывающая цепь с фрагментами Оказаки (непродолжительный синтез)
Ориджин-репликации
Множественные репликативные глазки
Единственный репликативный глазок
ДНК-хеликаза и репликативная
вилка
ДНК-хеликаза расплетает двойную спираль ДНК, образуя У-образную репликативную вилку
Белки, связывающие одноцепочеч¬
ную ДНК
Поддерживают расплетенные одноцепочные нити ДНК, препятствуя их соединению
Сверхвпирализация, вызванная
хеликазой
Гираза прокариот и топоизомераза (эукариоты) разрезает и вновь сшивает цепь ДНК для снятия напря¬
жения сверхскручивания
РНК-праймер
Лидирующая цепь нуждается лишь в одном РНК-праймере. Отстающая цепь нуждается в РНК-праймере
на каждый новый фрагмент Оказаки
РНК-праймаза
ДНК-полимераза альфа (также известная
как РНК-праймаза) взаимодействует с ДНК-
полимеразой, образуя комплекс. Праймаза
синтезирует РНК-праймер к той ДНК, к которой
присоединена ДНК-полимераза
Праймаза синтезирует РНК-праймер к ДНК, к кото¬
рой присоединена ДНК полимераза ill
ДНК полимеразы
Полимераза альфа (также известная как
рНК-праймаза, см. пункт 5). Полимераза
бета «лечит» ДНК (см. гл. 65). Полимераза
гамма синтезирует ДНК на запаздывающей
цепи (фрагменты Оказаки). Полимераза е
синтезирует ДНК на лидирующей цепи
1. Полимераза III: полимераза лидирующей цепи:
а) ДНК полимераза: наращивает лидирующую цепь.
Подобным образом происходит на запаздываю¬
щая цепь, за исключением того, что для каждого
фрагмента Оказаки требуется предварительно
сформированный РНК-праймер: б) Подлинность
новой цепи доказывается при использовании 3'-5'-
эндонуклеазной активности
2. Полимераза I: ДНК восстанавливающий фер¬
мент, удаляет РНК-праймер: (а) РНКаза Н актив¬
ность: 5'-3'-экзонуклеаза удаляет РНК праймер
(«Н» означает гибрид (hybrid) ДНК/РНК). (б) ДНК-
полимеразная активность: заполняет промежутки,
оставленные после удаления РНК-праймера
Фрагменты Оказаки
Около 100-200 дезоксирибонуклеотидов
Около 1000-2000 дезоксирибонуклеотидов
При удалении РНК-праймера оста¬
ется промежуток, который заполня¬
ется ДНК
Единственный праймер лидирующей цепи,
множественные праймеры запаздывающей
цепи удаляются РНКазой Н (РНКаза Н: дей¬
ствует на гибрид РНК и ДНК). Полимераза
гамма синтезирует ДНК, заполняя промежуток,
оставленный РНК-праймером
Единственный праймер лидирующей цепи, мно¬
жественные праймеры отстающей цепи удаляются
полимеразой I, которая в дальнейшем синтезирует
ДНК и заполняет вакантные промежутки
ДНК-лигаза сшивает «промежутки»
«Щели» возникают на З'-гидроксиконце фрагмента Оказаки. ДНК-лигаза присоединяет к
З'-гидроксиконец к свободной 5'-фосфатной группе, образуя фосфодиэфирную связь
Хеликаза и топоизомераза
Хеликаза и топоизомераза (эукариоты) и гираза (прокариоты) движется вдоль цепи ДНК
Теломеры
Теломераза, РНК-содержащая обратную транс¬
криптазу, присоединяет ТТАГГГ, повторяющуюся
последовательность к 5'-концу ДНК, образуя
теломеру, которая защищает конец хромосомы
(см. гл. 60)
Кольцевая хромосома. Кольцевая ДНК не имеет
конца, соответственно нет нужды в теломерах
Конец транскрипции
В процессе репликации в одной из Ю10 дезоксирибонуклеотидов возникают ошибки.
Исправления (репарация) происходят в течение процесса репликации при участии 3'-5'-экзонуклеазы,
в ДНК-полимеразном
I комплексе
152 Сравнение процессов транскрипции ДНК, репликации ДНК и синтеза белка в клетках эукариот и прокариот
Таблица 71.2. Обобщение и сравнение транскрипции ДНК у эукариот и прокариот
Процесс
Шот
Яшариоты
РНК-полимераза
Различные типы РНК-полимеразы: РНК поли¬
мераза II, синтезирующая мРНК.
РНК-полимераза III синтезирует тРНК.
РНК-полимераза I и III синтезирует рРНК
Единственный многосоставной комплекс, син¬
тезирующий мРНК, тРНК, рРНК
Области промотора
Промоторная последовательность ЦААТ сле¬
дует за основным промотором ТАТА (блок
Хогнесса)
Последовательность ТТГАЦА(-35) следует за
ТАТААТ(-10 или блок Прибноу) находятся в
3'-5'-направлении транскрипции
Области энхансеров
Последовательность ДНК, увеличивающая
скорость транскрипции
У прокариот не представлены
Кзп мРИК
5'конец защищен 7-МГ кэпом
(7-метилгуанозиновый кэп)
Имеет 5'-трифосфатный кэп. Он удаляется
фосфорилазой, которая инициирует дегра¬
дацию мРНК. Время полужизни мРНК —
несколько минут. Большинство мРНК кодируют
более чем один генный продукт. В некоторых
случаях, ферменты, отвечающие за определен¬
ный метаболический путь, транскрибируются
в одной «поли-цистронной мРНК». Такие кла¬
стеры функционально схожих генов известны
как опероны, например lac-оперон. Это способ¬
ствует координированному контролю
мРНК-конец
У мРНК есть поли-А-конец
У мРНК есть поли-А-конец. Да! Вопреки попу¬
лярным теориям, описанным во многих учеб¬
никах, прокариотическая мРНК действительно
имеет поли-А-конец!
Таблица 71.3. Обобщение и сравнение транскрипции ДНК эукариот и прокариот
Процесс
Эукариоты
Прокариоты
Рибосомальные субъединицы
40S и 60S
30S и 50S
Рибосомальный комплекс
80S
70S
Факторы инициации белка
Эукариотические факторы инициации
Факторы инициации
Стартовый кодон (АУГ) кодирует
Метионин
N-формилметионин
Последовательность, усиливающая инициа¬
цию выше стартового кодона (АУГ)
Последовательность Козака ГНЦРЦЦАУГ (где
Н - любой нуклеотид, а Р - пурин)
Последовательность Шайна-Далгарно.
АГГАГГННННННННАУГ (где Н - любой нуклеотид)
Факторы элонгации
Эукариотичекие факторы элонгации
Прокариотические факторы элонгации
Наркотики/токсины
Рицин (токсин) из касторового масла бобов
(Ricin communis), ингибирующая синтез
белка, расщепляя и тем самым инактивируя
28S рРНК. Одна молекула рицина атакует все
рибосомы в клетке и убивает ее.
Токсин дифтерии: экзотоксин, секретируемый
Corynebacterium diphtheriae, которые инакти¬
вируют эукариотический фактор элонгации 2.
Одна молекула может убить клетку
Аминогликозиды препятствуют формированию
инициирующего комплекса.
Тетрациклины связываются с A-сайтом и блоки¬
руют присоединение аминоацил-тРНК.
Тетрациклины связываются с A-сайтом и блоки¬
руют присоединение аминоацил-тРНК.
Хлорамфеникол ингибирует пептидил-
трансферазы (рибозимы).
Макролиды и клиндамицин связывается
с SOS-субъединицей и блокируют транслокацию
Сравнение процессов транскрипции ДНК, репликации ДНК и синтеза белка в клетках эукариот и прокариот 153
(Л
Jb
о>
о
о
ТЭ
Альбумин (30-50 г/л или 3-5 г/дл)
Кальций (2,0-2,5 ммоль/л или 6-10 мг/дл)
Фосфат (0,8-1,4 ммоль/л или 2,5-4,3 мг/дл)
Глюкоза натощак (<6,0 ммоль/л или <108 мг/дл)
Креатинин (60-120 мкмоль/л или 0,6-1,3 мг/дл)
Мочввая КИСЛОТа (нормальные значения приведены ниже
Мочевина(3-7 ммоль/л или АМК 8-20 мг/дл)
Бикарбонат (23-33 ммоль/л)
Калий
(3,5-5,0 ммоль/л)
Натрий (135-145 ммоль/л)
Общий холестерол [целевой уровень <4,0 ммоль/л или <155 мг/дл (для лечащихся больных)]
Триглицериды (триацилглицеролы) (<1,5 ммоль/л или <133 мг/дл)
Щелочная фосфатаза, см. нормальный диапазон значений для данной лаборатории
Примечание. [Н*] означает
концентрацию протонов.
pH — это отрицательный
десятичный логарифм
величины [Н*] (гл. 1 и 2).
Билирубин (<20 мкмоль/л или <1,2 мг/дл)
у-Глутамилтрансфераза, см. нормальный диапазон значений для данной лаборатории
АЛТ (аланинаминотрансфераза), см. нормальный диапазон значений для данной лаборатории
ЛДГ (лактатдегидрогеназа), см. нормальный диапазон значений для данной лаборатории
КК (креатинкиназа), см. нормальный диапазон значений для данной лаборатории
Свободный тироксин (7-25 пмоль/л или 0,5-2 нг/дл)
ТТГ (тиреотролный гормон) 0,3-5,0 мЕ/л
Заболевания почек
Желудочно-кишечные заболевания
Рвота с восполнением
потерянной жидкости водой
Рвота без восполнения
потерянной жидкости ведой
Кровотечения
Мальабсорбция
Воспалительные заболе-
вания кишечника
Диарея
Острый панкреатит
Гипонатриемия может возникать из-за дилюции крови
Изменения вызваны обезвоживанием и потерей хлорида
Повышается содержание мочевины, особенно при кровотечениях из верхних
отделов желудочно-кишечного тракта
Жир в кале Т. зластаза кала I. Фолаты, В12 и кальций могут быть I. Протромбиноеое время может увеличиваться
Измерьте уровень антител к зндомизию, чтобы подтвердить или исключить глютеновую болезнь (целиакию)
Клиническая картина может напоминать таковую при мальабсорбции
Изменения выражены при продолжительной диарее
/роввнь амилазы в сыворотке крови Т в первые 2-3 дня. В тяжелых случаях
Г пьтпрпточный метгймальбумин
mill
Ч
Заболевания дыхательной системы
О
ж
е
о
Ja
е
1 CD
* О
& Ж
*
со
Острый нефрит
Н
н
д
н
Протеинурия, гематурия, цилиндры в моче, титр анител к стрептолизину *
Г) Т кпмплймйнт J, о
Острая почечная
недостаточность
Н
Г
д
л
н
н
Уровень натрия в моче 1 при предпочечной недостаточности "
Хроническая почечная
недостаточность
Н
*
•W
*
Д
t
*
н
t
—
-*
°
Если уровень кальция повышен, возможен первичный или третичный гиперпаратиреоз го
Нефротический синдром
н
н
н
*
t
д
н
Сильно выражена протеинурия. Для оценки прогноза полезно исследовать клиренс ^
различных белков
Камни в почках
н
н
Проверьте содержание кальция, уратов и оксалатов в моче. В редких случаях х
втмпжня пигтинипия Э ■
Заболевания печени
1 О
Острый гепатит
н
н
g
-g
й
*
Выясните тип гепатита (А, В или С). Билирубин в моче Т, особенно в период фазы выздоровления.
но иногда заболевание протекает в безжелтушной Форме. Исключите токсический гепатит °
Острый некроз печени
н
ж
ж
*
ж
Протромбиноеое время повышено. С прогрессированием болезни уровень § *
билиоубина растет. концентрации Феоментов снижаются » А)
Хронический персисти-
дуюший гепатит
н
н
н
н
н
н
н
Проверьте печеночный В антиген 5 2Q
Хронический активный
гепатит
н
н
н
*
ж
IgG Т, возможны положительные результаты анализа на антиядерный фактор *
и аититрпа к f\рпкям гпалкпй миркипятл/пи 2
Врожденный билиарный
цирроз печени
н
*
*
н
ж
Положительный результат анализа на антитела митохондрий, IgM Т, церулоплазмин Т jjj S
Цирроз печени
портальный
н
н
д
*
н
н
н
Протромбиноеое время увеличено, при диффузных поражениях печени у-глобулины 1, уробилиноген Л ^
в моче Т. Исключите болезнь Вильсона (измерьте уровень меди в сыворотке крови), гемохроматоз а-
Непроходимость внепече-
ночных желчных протоков
н
ж
г
г
н
Билирубин в моче Т Sj ЗЕ
Инфильтрация/заражение
паразитами
н
ж
н
н
При очаговом поражении печени у-глутамилтрансфераза и щелочная о
Фосфатаза могут Т без появления желтухи д
Гемолитическая желтуха
н
н
н
н
н
Непрямой билирубин Т, ретикулоциты Т, билирубин в моче §{ вЛ
не обнаруживается, уробилиноген в моче Т «и ^
Избыточное употребле¬
ние алкоголя
J £
н
/
н
н
ж
н
R
Измерьте уровень алкоголя в крови. Средний объем эритроцитов Т. 3
Проверьте уровень глюкозы в крови при алкогольной коме, особенно у детей 5 ЯЕ
Сердечно-сосудистые
забо
лева
ния
Инфаркт миокарда
*
Измерьте тропонин 1 (или КК-МВ) при острых приступах. Активности ферментов г
повышаются в следующей последовательности: КК, ACT, ЛДГ *-
Сердечная недостаточность
н
н
н
н
н
н
н
н
Повышенные концентрации ферментов могут указывать на ишемический гепатит ®
о
■о
о
■о
ш
Клиническая лабораторная диагностика 155
Острый панкреатит
\ уровень амилазы в сывиршке криви
1Т сывороточный метгемальбумин
В нврвьш О ДПИ. D 1ИЛЧШ101Л Ы1утаил
Заболевания дыхательной системы
Острая дыхательная
недостаточность
Н
н
н
i_H
рОг-Ь, рСОг? [H4t, pHi. Некомпенсированный респираторный ацидоз
Хроническая дыхательная
недостаточность
н
Jfc.
t
1—
рОгФ, рСОгТ, (Н+) нормальная или Т, pH нормальный ипи Т. Компенсированный
респираторный ацидоз
Остеопороз
н
н
тг
"Т
111!1
1 1
большее диагностическое значение имеют результаты измерений минеральной
плотности кости, а не биохимические показатели
Рахит и остеомаляция
*
*
Витамин D-L
Болезнь Педжета
н
н
*
1111
Содержание кальция может повышаться при иммобилизации
Первичный
типерпаратиреоз
н
V
1 1 1 [Уровень ПТГ чрезмерно высокий. Проба со стероидными гормонами.
1111 уровень кальция остается высоким
Гиперкальциемия при
злокачественных опухолях
н
",
*
н
Проба со стероидными гормонами: уровень кальция обычно падает.
Уровень ПТГ не повышен
Подагра
Ш
Исключите дисфункцию почек и прием диуретических средств из возможных
причин гиперурикемии
Миелома
0
н
н
н
.
L_
При электрофорезе выявляется полоса парапротеинов. Для подтверждения диагноза проведите иммуно¬
электрофорез. Число плазматических клеток в костном мозге 1, протеинурия Бенс-Джонса
Сахарный диабет
Диабетический
кетоацидоз
Д
tV
Гипотиреоз
Гипертиреоз
Аддисонова болезнь
(недостаточность коры надпочечников)
Синдром Кушинга
Синдром Конна
Несахарный диабет
Синдром неадекватной секреции
антидиуретинеского гормона
Натрий. Обычно значительные колебания
его концентрации происходят из-за изме
нения водного баланса. При многих
болезнях неспецифично понижается
Калий. В случае гемолиза проб крови или
в не разделенных на компоненты пробах
результаты анализов ложно завышаются
Бикарбонат. Если результаты сильно отличаются
от нормы, проверьте содержание газов и [Н+]
в крови (или pH)
Мочевина. Концентрация повышается при обезвоживании,
однако клинические признаки имеют большую значимость,
чем лабораторные показатели. Содержание мочевины повы-
шается при употреблении белковых продуктов
Мочеааи кислота Концентрация зависит от содержания белков в пище.
Нормальные значения -0,12-0,42 ммоль/л (у мужчин и женщин
после менопаузы) и 0,12-0,36 ммоль/л (у женщин до менопаузы)
Креатинин. Клиренс креатинина обычно не дает дополнительной
информации I
Глюкоза. Важно учитывать время, прошедшее после еды
Фосфаты Содержание снижается при употреблении высокоугпеводной пищи.
Повышается, если проба крови не была разделена на компоненты или при гемолизе
Кальций. В крови часть кальция связана с альбумином. Поэтому при оценке общего
уровня кальция в сыворотке необходимо учитывать и уровень альбумина. Подсчитыва¬
ется содержание кальция «с поправкой на альбумин». Избегайте венозного застоя: при
нем результаты анализов ложно завышаются
Альбумин. Многие методы лабораторных анализов завышают низкие значения содержания
альбумина
Диагностические критерии: уровень глюкозы в крови натощак превышает 7 ммопь/п
и/или через 2 ч после приема 75 г глюкозы превышает 11,1 ммопь/п
Глюкозурия и кетонурия. )Н+) в крови t, pH I. При измерении уровня креатинина по методу Яффе воз-
можно завышение результатов анализа. Примечание: общий дефицит калия и натрия в организме
^ При подозрении на нарушения функций щитовидной железы прежде всего измеряют уровень Ш
Секреция ТТГ не стимулируется тиролиберином
Если возможно, проведите пробу с синактеном перед назначением стероидов. Кортизол
плазмы крови X и не изменяется после введения синактена. Уровень АКТЕ в плазме крови Т
Уровень кортизола в плазме и суточная экскреция кортизола Т. Кортизол не ингибируется дексаметазоном.
Суточные колебания кортизола не выражены. Уровень АКТГ в плазме крови при гипофизарном синдроме
Кушинга повышен, при эктопическом—сильно повышен, при опухолях надпочечников — понижен
| Ренин в плазме крови I, альдостерон Т
[ Проба с лишением воды. Попиурия остается, относительная плотность мочи не повышается
Осмолярность мочи ниже, чем у «максимально разведенной мочи». Натрий в моче t. Исключите
1 недостаточность коры надпочечников, почечную недостаточность и прием диуретических препаратов
Уровень тиреотропного гормона повышен у новорожденных (до 40 мЕ/л)
I Свободный тироксин. Может неспецифически снижаться при многих заболеваниях.
1 Также можно измерять свободный Та
Креатинкиназа. Это фермент сердечной мышцы, скелетных и гладких мышц и головного мозга.
Имеет значение активность разных изоферментов КК. Особенно важен уровень активности
КК-МВ при диагностике инфаркта миокарда
ЛДГ — фермент печени, сердца, скелетных мышц, эритроцитов и почек
АЛТ. Умеренно повышается при ожирении и метаболическом синдроме. Ин¬
дикатор жирового гепатоза (не связанного со злоупотреблением алкоголем)
у-Глутамилтрансфераза. Повышается при абдоминальном ожирении, при избы¬
точном употреблении алкоголя и других веществ: фенитоина, барбитуратов
Билирубин. Часто причиной доброкачественной гипербипирубинемии
является болезнь Жильбера, при которой повышен непрямой билирубин
Щелочная фосфатаза. Особенно значима активность разных изоферментов:
костей, печени, кишечника и плаценты. Повышается при срастании переломов,!
поздней беременности и у детей в период быстрого роста
Триглицериды (триацилглицеролы). Рекомендуется делать анализ натощак
Н Нормальный
Н
н
^ От высокого до очень высокого
^ От низкого до очень низкого
Нормальный или ниже
нормы (низкий)
Нормальный или выше
нормы (высокий)
Низкий. Сопутствующий!
п признак, не имеет диаг-
w ностического значения
Высокий. Сопутствую¬
щий признак, не имеет
Д диагностического
значения
Редко, высокий,
о Необычное сочетание
Холестерол. См. рекомендации по липидному обмену Британского объединенного
профессионального медицинского общества [British Joint Societies Lipid Guideness (2004)]'
Эта простая схема не включает все возможные факторы, влияющие на результаты лабораторных анализов и их интерпрета¬
цию. Поэтому при постановке диагноза обязательно учитывайте клинические особенности и результаты других анализов
^ Высокий или низкий
Редко, высокий. 1
R Нв имеет диагностиче-
•ф' Очень низкий
Низкий
ского значения
С прогрессированием
1 ^ Очень высокий
Высокий
болезни повышается
редметныи указатель
1,25-Дигидроксихолекальциферол 113
2,3-БФГ 46
5-а-Редуктаза 97
5-Гидрокситриптамин 108
5- Фторураиил 127
6- Меркаптопурин 129
7- а-Гидроксилаза 87
7-Дегидрохолестерол 113
25-Гидроксихолекальииферол 113
А
Абсорбция радикалов кислорода 41
Авидин 122
Адаптация высотная 47
Аденилатциклаза 60
Аденин 127
Аденинфосфорибозилтрансфераза 129
Аденозин 127
Аденома
гипофиза 97
надпочечников 97
Адипонектин 66
Адреналин 60, 73, 107
АДФ 127
Азиды 35
АКТ Г 97
Активатор аллостерический 73
Активные формы кислорода 35, 38, 39,
41, 57, 67
Аланин 75
Аланинаминотрансфераза 119
Алкалоз
метаболический 18
респираторный 20
Алкаптонурия 105
Алкоголизм 75
Алкогольдегидрогеназа 69, 72
Аллантоин 129
Альбинизм 105
Альбумин 67
Альдолаза 47, 54
Альдостерон 87, 97
Аминокислота 23, 98
гликогенная 57, 103
заменимая 101
кетогенная 57, 103
незаменимая 101
Амины метилированные
метадреналин 107
норметадреналин 107
Амитал 35
Аммоний 98, 127
АМФ 55, 75, 127
циклический 60
Амфифильность 82
Ан астро зол 97
Аидрогены 97
Андростендион 97
Анемия
гемолитическая 114
несфероцитарная 47
мегалобластическая 121
мегалобластная 121
микроцитарная гипохромная 111
наследственная гемолитическая 47
пернициозная 121
Антидепрессанты 108
Антикоагулянты 115
Антимицин 35
Антиоксидант 114, 123
Антипиримидины 127
Антипурины 127
Аполипопротеин 85
апоВЮО 90
апоЕ 90
апоС2 90, 94
Аргинин 31, 98
Аргининосукцинал 98
Ароматаза 97
Аспартат 43, 98, 127, 129
Астаксантин 112
Атеросклероз 87
Атрофия
зрительного нерва Лебера 33
мышц 57, 79
общая 101
тканей 57
АТФ 31, 43, 59, 77, 116, 127
АТФ-синтаза 35
АТФ-синтетаза 33
Аутофосфорилирование 65
Ацетальдегид 69
Ацетальдегиддегидрогеназа 69
Ацетат 69
Ацетил-КоА 75, 77, 87, 102
Ацетил-КоА-холестеролацплтранс-
фераза 88, 94
Ацетоацетат 77
Ацетон 77
Ацидоз 55
лактат 33
метаболический 19
респираторный 21
Б
Барьер гематоэнцефалический 57, 107
Белок
гликированный 67
переносчики семейства АВС 92
разобщающий-1 38
Бетаин 105
Бешенство коровье 25
Бикарбонат 15, 98, 127
Билирубин 111
Билирубиндиглюкуронид 111
Биотин 122
Биоцитин 122
БМГ-мутаза 47
Болезнь
Аддисона 97
бери-бери 116
Вернике 75, 116
геморрагическая новорожденных
115
Гоше 83
кленового сиропа 104
Крейтцфельда-Якоба 25
новый вариант 25
куру 25
Кушинга 97
Лебера 33
Ли 33, 75
Мак-Ардла 63
мочекаменная 129
Паркинсона 35, 107
пеллагра 116
Фабри 83
В
Вазопрессин 66
Валин 104
Вектор аденовирусный 98
Взрыв окислительный 39
Витамин
А
П2
в,
П6
В2
П7
В3
П6
в5
П7
в6
П9
В12
105, Г
С
123
D
87, ИЗ
Е
114
К
115
Г
Газ угарный 35
Галактоза 51
Галактозилиереброзид 83
Галактозо-1 -фосфат 51
Галактокиназа 51
Ганглиознды 83
Гексокиназа 44, 54, 75
Гем 111
Гематин 111
Гемоглобин 47
HbAlc 67
фетальный 47
Гемоксигеназа 111
Ген
CFRT 24
Гепатоз жировой 69, 90
Гепатомегалия 62
Гетероплазмия 33
Гндроксилизин 26
Гидроксиметилбутилан 111
Гндроксимочевина 129
Гидроксипролин 26
Г иперальдостеронизм
вторичный 97
первичный 97
Гипервентиляция 55
Гипервитаминоз
А 112
В, 116
В3 116
D 113
Е 114
К 115
Гипергликемия 57, 59, 66
Гиперинсулинемия 59, 97
Гиперкапния 13
Гиперлактатемия 45, 63, 75, 116
Гиперлипидемия 63
156 Предметный указатель
Гиперхолестеролемия 87, 122
семейная 88
Гиповитаминоз
А
112
в,
116
В2
117
В3
116
в5
117
в6
119
В12
121
С
123
D
113
Е
114
К
115
Гипогликемия 55, 56, 59, 62, 69, 77
гиперинсулинемическая 59
Гипокальциемия 113
Гипокапния 13
Гипотеза
метаболического топлива 59
молекулярной мимикрии 66
Гипотрофия 101
Гистамин 109
Гистидин 102, 109, 121
Гликоген 48, 56, 57, 60, 62
Гликогеноз 62
V типа 63
Гликогенолиз 57, 62
Гликогенсинтаза 65
Гликогенфосфорилаза 119
Гликозил 117
Гликозилирование 57
Гликолиз 59
анаэробный 44, 62
в эритроцитах 46
Глицеральдегид 54
Глицеральдегид-З-фосфат 44, 47, 54
Глицеральдегид-З-фосфатдегидрогеназа
43, 44
Глицерол 79, 80
Глицин 26, 111, 129
Глобозиды 83
Глоботриазидцерамид 83
Глутамат 98, 102, 115, 119
Глутамин 115, 127, 129
Глутатионпероксидаза селензависимая
41
Глутатионредуктаза 39, 117
Глюкагон 56, 57, 60, 75, 79
Глюкоза 56, 79
Глюкозо-6-фосфат 75
Глюкозо-6-фосфатаза 62, 79
Глюкозотоксичность 66
Глюкокиназа 59, 75
Глюкокортикоиды 97
Глюконеогенез 44, 45, 57, 69, 73, 75,
77, 122
Глюкоцереброзид 83
Глюкуроновая кислота 111
ГМГ-КоА 87
ГМ Г-Ко А-редуктаза 72, 87
Голодание 57
Гомеостаз глюкозы
Гомоцистеин 104, 119
Гомоцистеинемия 121
Гомоцистеинметилтрансфераза 121
Гомоцистеинурия 104
Гормон
адренокортикотропный 97
катаболический стероидный 97
Гранулематоз хронический 39
График Лайнуивера-Берка 71
Гуанин 127
Гуанозин 127
д
Давление крови осмотическое 57
Дезаминирование 111
окислительное 107
Дезоксиаденозилкобаламин 121
Дезоксигемоглобин 47
Дезоксирибоза 49, 127
Декарбоксилаза периферическая 107
Декарбоксилирование 109
окислительное 117
Декстрин 62
Депрессия 108
Дефосфорилирование 65
Диабет
сахарный 66
I типа 66, 79
II типа 61, 65, 66
MODY 66
гестационный 66
инсулинзависимый 66
инсулиннезависимый 66
неонатальный 59
ювенильный 66
Дигидроксиацетонфосфат 55, 58
Дигндротестостерон 97
Д и гидрофолат 127
Дигндрофолатредуктаза 71, 127
Диета кетогенная низкоуглевоцная 33
Динитрофенол 38
Диоксигеназа 109
Дипальмитоиллецитин 82
Долихол 87
Долихостеномелия 104
Дофамин 107
Дыхание Куссмауля 19
большое 19
3
Заболевание с антителами против
базальных мембран гломерул. см.
Синдром Гудпасчера
Закон действующих масс 13
И
Излучение ионизирующее 41
Изолейцин 104
Изомальтаза 54
Изоретиноин 113
Изоцитрат 69
Изоцитратдегидрогеназа 75
Иммунодефицит комбинированный
тяжелый 129
Ингибиторы
конкурентные 71
неконкурентные 71
обратного захвата серотонина 108
Инозитол 81, 82
Инсулин 52, 59, 61, 65, 66, 73
Инсулинома 79
Инсулинорезистентность 66
Ион
гипохлорит 39
металлов 41
Ишемия миокарда 41
К
Кальмитоилкарнитин 77
Кальцитриол 113
Каналы калиевые АТФ-зависимые 59
Карбамоилфосфат 98
Карбамоил фосфате и нтетаза 98
I 127
И 98, 127
Карбоангидраза 16, 47
Карнитин 77, 123
Карнитинпальмитоилтрансфераза 77,
79
Каротиноиды 112
Карцинома
надпочечников 97
предстательной железы 97
Каскад фосфорилирования белков 87
Каталаза 39
Катехоламин 107
Катехол-О-метилтрансфераза 107
Кахексия 101
Квашиоркор 101
Кетоацидоз диабетический 77, 79
Кетогенез 77, 79
Киназа-3 гликогенсинтазы 61, 65, 73
Кинурениназа В6-зависимая 119
Кислород синглетный 111
Кислота
З-метокси-4-гидроксиминдальная
107
5-аминолевулиновая 111
5-гидроксииндолуксусная 109
N-ацетилнейраминовая 83
ванилил миндальная 107
гомованилиновая 107
желчная 87
соль 92
жирная 57, 79, 90
[3-окисление 87
у-линоленовая 80
арахидоновая 80
гексадекановая 80
докозагексаеновая 80
линолевая 80
октадекановая 80
пальмитиновая 80
соль 87
стеариновая 80
цис-олеиновая 80
эйкозопентаеновая 80
липоевая 33
метилмалоновая 121
молочная 15, 129
мочевая 129
никотиновая 116
ov»dbUA>fdHtl Vl/Ии
II типа 88
III типа 90
IV типа 90
Гиперпаратиреоз вторичный
Гиперурикемия 55, 63
13
абсорбция 57
голодание 57
длительное голодание 57
постабсорбционный период 57
умеренное голодание 57
инсижшлгонв1о9м
HOSP* ^
оротовая 98
пантотеновая 117
ретиноевая 112
сиаловая 83
соляная 109
фолиевая 127
фосфатидная 81, 82
фосфорная 82
хлорноватистая 39
Кислотность 12
Классификация
аминокислот 22
углеводов 48
ферментов 70
Клетка хромаффинная 107
КоА 75
Коллаген 26, 67, 123
Комплекс
пируватдегидрогеназный 33
хелатный 41
Константа Михаэлиса-Минтен 71
Кортизол 57, 79, 87, 97
Кортиколиберин 97
Кортикостероиды системные 109
Кофактор 72
Кофермент 72
а-кетоглутаратдегидрогеназы
117
Q10 32
А 29, 117
Ацил-КоА-дегидрогеназы 117
дегидрогеназ а-кетокислот 116,
пируватдегидрогеназы 116, 117
пируваткарбоксилазы 122
транскетолазы 116
Крахмал 49
Креатин 31, 98
Креатинин 31
Креатинкиназа 31
Креатинфосфат 98
Кристы 32
Ксантиноксидаза 129
Ксантомы
ладоней 87
сухожилий 87
Ксантуренаты 119
Ксерофтальмия 112
Ксилоза 49
Ксилулоза 49
Л
Лактат 15,44,45,69,116,129
Лактатдегидрогеназа 44, 69
Лактацидоз 45, 55, 69
Лактоген плацентарный 66
Лактоза 51
Лактулоза 49
Лейцин 104
Лепречаунизм 65
Летрозол 97
Лецитин 82
Лизин 67, 123
Лизингидроксилаза 123
Ликопены 112
Липаза 92
гормоночувствительная 79
Липолиз 70
Липопротеинлипаза 90, 92, 97
Липопротеины 84
ЛПВП 87, 92
ЛПНП 88, 114
ЛПОНП 57, 88
ЛППП 88, 90
Липосома 84
М
Малат 69, 73
Малатдегидрогеназа 73
Малонил-КоА 79
МАО 107
Маразм 101
Мевалонат 87
Меланин 105
Мелатонин 109
Менадион 115
Менахинон 115
Метадреналин 107
Металлоферменты 72
Метилирование 107
Метилкобаламин 121
Метилмалонил-КоА 121
Метилмалонил-КоА-мутаза 121
Метионин 105
Метионинсинтаза 104, 105
116, Метионинсинтетаза 121
Метотрексат 127, 129
Миелопероксидаза 39
Минералокортикоиды 97
Миноксидил 97
117 Миоглобинурия 63
Митохондрия 32
Мицелла 84
Модификация белков ковалентная 65
Моноаминооксидаза 107
Моногликозилцерамнды 83
Мономер 26
Мочевая кислота 55
Мочевина 77, 98
Муковисцидоз 24, 114
Мутация
глюкокиназы 66
инсулинового промоторного
фактора-1 66
печеночного ядерного фактора 1а 66
печеночного ядерного фактора 4а 66
печеночного ядерного фактора 4(3 66
протеинкиназы АКТ 65
Kir6.2 59
Neuro Al-p 66
Н
НАД 29, 69, 72, 75, 116
НАДН 29, 35, 43, 44, 69, 73, 77, 102
НАДО 29, 116
НАДФН 29, 87
НАДФН-оксидаза 39
Недостаточность
1,25-дигидроксихолекальциферола 113
аденозиндезаминазы 129
альдолазы А 47
альдолазы В 47, 55
биотина 122
биотинидазы 122
галактозо-1 -фосфатуридил-
трансферазы 51
галактокиназы 51
гексокиназы 47
глюкозо-6-фосфатазы 63
деветвяшего фермента 62
дегидрогеназы а-кетокислот с развет¬
вленной цепью 104
дыхательная 82
кислой а-(1->4)-глюкозидазы 62
лактазная 51
миофосфорилазы 63
моноаминов 109
ниацина 116
орнитин-транскарбамилазы 98
пантотеновой кислоты 117
пиридоксальфосфата 119
пируваткиназы 47
порфобилиногендезаминазы 111
почечная
острая 129
хроническая ИЗ
рибофлавина 117
триаминпирофосфата 116
фолата 121
фосфоглюкоизомеразы 47
фруктокиназы 54
холекальциферола 113
цианокобаламина 121
цистатионин-р-синтазы 105
Нейробластома 107
Нейрогликопения 56, 79
Непереносимость
лактозы 51
фруктозы 47, 55
Ниацин 29, 108, 116
Никотинамид 116
Норадреналин 107, 123
Норметадреналин 107
Нуклеозид 127
Нуклеозиддифосфаткиназа 31
Нуклеотид 127
О
Обезвоживание 66
клеток головного мозга 57
Ожирение 66, 97
висцеральное 97
Окисление
анаэробное 31
аэробное 31
Оксалоацетат 43, 69, 73
Оксигемоглобин 46
Оксидаза гомогентизиновой
кислоты 105
Олигомер 26
Олигомицин 32, 35
Определение по Брёнстеду-Лоури 12
Опсин 112
Орнитин 98, 102
Орнитин-карбамоилтрансфераза 98
Остеопороз 104, 115
Островки Лангерганса 59
Отравление
витамином
А 112
D 113
Е 114
СВИНЦОМ 1 1 1
158 Предметный указатель
п
Пальмитоил-КоА 77, 83
Паршшч дрожательный 107
Пеллагра 116
Переносчик холестерола АВС-А1 92
94
Перехватчики свободных радикалов 41
Пероксид водорода 41
Пиридоксальфосфат 119
Пиридон 116
Пиримидин 98, 127
Пируват 69, 75, 116, 119
Пируватде гид роге наза 75, 116
Пируваткарбоксилаза 79
Пируваткиназа 75
Подагра 63, 129
Показатель водородный раствора 13
Полиурия 66
Поллютанты 41
Порин 32
Порфирин 111
Порфирия 111
интермиттирующая острая 111
Порфобилиноген 111
Порфобилиногенсинтетаза 111
Принцип обратной связи 87
Прионы 25
Провитамин А 112
Прогестерон 87
Проинсулин 59
Проколлаген 26
Пролин 102, 123
Пролингидроксилаза 123
Простетическая группа 72
Протеинкиназа 65, 73
А 73
АКТ 61
Протеинтирозинфосфатаза 65
Протеинфосфатаза 65, 73
-1 61, 65, 73
Протонный ток 35
Протромбин 115
Психоз Корсакова 75, 116
Пурин 127, 129
Путь
индоламиновый 108
кинурениновый 108
пентозофосфатный 87, 116
реутилизации 127
пуринов 129
Р
Радикал
свободный 41
супероксид-анион 39, 41
Рак легкого мелкоклеточный 97
Реакция
а-1-гидроксилазная 113
(3-гидроксибутиратдегидрогеназная
77
у-глутамилкарбоксилазная 115
аденилаткиназная 31
аденилатциклазная 31
аминотрансферазная 119
гидроксиацил-КоА-дегидрогеназная
69
карбоангидразная 47
карбоксилирования 122
конденсации дигидроксиацетонфос-
фата и глицеральдегид-3-фосфата
47
лактатдегидрогеназная 44
окислительно-восстановительная 29
пируватдегидрогеназная 75
пируваткиназная 31, 44
с нитропруссидом 77
Хобера-Вайса 41
Реперфузия 41
Ретиналь 112
Ретинол 112
Рецептор
инсулина 65, 66
инсулиновый 61
ЛПНП 72, 87, 88, 90
Рециркуляция витамина К 115
Рибоза 49, 127
Рибонуклеотидредухтаза 129
Рибофлавин 117
Родопсин 112
Ротенон 35
С
Сайт
аллостерический 73
связывания 73
Саркоидоз 113
Сахароза 54
Связь фосфоангидридная 31
Серин 65, 73, 81, 82, 121
Серотонин 108, 109
Синдром
быстрого распада опухоли 129
внезапной смерти младенцев 122
Гийена-Барре 21
длительного сдавления 57
Донохью 65
жжения ног 117
карциноидный 109
Кона 97
Кушинга 97, 109
ятрогенный 97
Леша-Найхана 129
маниакальный 109
респираторный дистресс-синдром
новорожденных 82
эктопической секреции АКТГ 97
Элерса-Данло 123
ME LAS 41
Синтаза 5-аминолевулиновай кислоты
111
Система
буферная би карбонатная 15
гипоталамо-гипофизарная 97
челночная карнитиновая 77, 79
Склероз амиотрофический 21
Стати ны 87
Стеаторея 114
Стеркобилин 111
Структура белка
вторичная 24
первичная 23
третичная 26
четвертичная 26
Сукралоза 51
Сукцинатдегидрогеназа 117
Сукцинил-КоА 111
Сукцинил-КоА-синтетаза 31
Супероксиддисмутаза 39, 41
Сурфактант 82
Сфингозин 83
Сфинголипидоз 83
Сфинголипиды 83
Сфингомиелин 83
Т
Тела кетоновые 57
Теория моноаминовая 109
Теплопродукция 38
Термогенин 38
Тестостерон 87, 97
Тест Шиллинга 121
Тетрагидробиоптерин 107
Тетрагидрофолат 121, 127
Тетрамер 26
Тиамин 33, 75, 116
дифосфат 29
Тиаминпирофосфат 116
Тимидилатсинтаза 127
Тимидин 127
Тимин 127
Тирозин 61, 65, 73, 107
Тирозиназа 105
Тироксин 41, 107
Токотриенол 114
Токоферол 114
Тофус 129
Трансаминирование 119
Транскетолаза 116
Трегалоза 49
Треонин 65, 73
Триацилглицеролы 52, 57, 80, 94
Тример 26
Триптофан 108, 116, 119, 121, 129
Тролокс 41
У
Убихинон 32, 35, 87
УДГ-глюкоза 51
Уравнение Геидерсона-Хассельбаха 13
Урат 129
Уратоксидаза модифицированная 129
Урацил 127
Уридин 127
Уридинтрифосфат 127
Уробилин 111
Уробилиноген 111
Уролитиаз цистиновый 105
Уропорфобилиноген 111 111
Ф
ФАД 29, 43, 72, 117
ФАДН 35, 75, 77, 102
Фарнезилпирофосфат 87
Фенилаланин 107
Фенилаланингидроксилаза 107
Фенилкетонурия 107
Фенилпируват 107
Феохромоцитома 107
Ферменты 70
металлозависимые 72
Ферритин 41
Феррохелатаза 111
Филлохинон 115
Фи насте рид 97
Предметный указатель 15
Флавин мононуклеотид 117
Флутамид 97
ФМН 29
Фолат 71, 121, 127
Формилтетрагидрофолат 129
Фосфате н 31
Фосфатидилинозитол 81, 82
Фосфатидилинозитол-4,5-бисфосфат 65
Фосфатидилсерин 81, 82
Фосфатид ил холин 81, 82, 121
Фосфатидилэтаноламин 81, 82
Фосфатуридилтрансфераза 51
Фосфоглицераткиназа 31
Фосфоенолпируваткарбоксилаза 79
Фосфоинозитид 82
Фосфоинозитол-З-киназа 61, 65
Фосфоинозитол-зависимая киназа-1
61, 65
Фосфокреатин 31
Фосфолипиды 81, 82, 84
Фосфорилаза 60
Фосфорилирование 31, 65
окислительное 35
Фосфорилсерин 84
Фосфорилхолин 84
Фосфофруктокиназа 44, 73
-1 75
Фруктоза 48, 54
Фруктозамин 67
Фруктозо-1,6-бисфосфат 47
Фруктозо-1,6-бисфосфатаза 79
Фруктозо-1,6-бисфосфат-альдолаза 47
Фруктозо-1-фосфат 54
Фруктозо-2,6-бисфосфат 75
Фруктозо-6-фосфат 44, 54
Фруктозурия 54
Фруктокиназа 54
X
Хенодезоксихолат 87
Хиломикроны 87, 94
Холат 87
Холекальииферол 113
Холестерол 81, 87
Холин 81, 82
ц
цАМФ 75
Цвиттер-ион 23
Цепь дыхательная 32, 39, 41, 59, 111
Церамид 83
Церамидтригексозид 83
Церамиды 83
Цереброзиды 83
Цианиды 35
Цианокобаламин 121
Цикл
Кори 44, 45
Кребса 59, 69, 73, 75, 102, 116
метионина 121
пентозофосфатный 51
Циркуляция энтерогепатическая 92
Цистатионин-р-синтаза 104
Цистинурия 105
Цитидин 127
Цитозин 127
Цитохром
(3 32
а/аЗ 32
Р450 111, 123
С 32, 35
Цитрат 75
Цитруллин 98
Ч
Челночная система
глицерофосфатная 43
малат/аспартатная 43
Ш
Шунт Рапопорта-Люберинга 47
Э
Эйфория 108
Эксеместан 97
Эктопия хрусталика 104
Энцефалопатия
билирубиновая 111
губчатая крупного рогатого скота 25
митохондриальная 33
Эпимераза 51
Эпинефрин 107
Эпифиз 109
Эрго кальциферол 113
Эргостерол 113
Эстрогены 66, 87, 97
Этанол 69
Этаноламин 81, 82
Этерификация 90
Этретинат 113
Эфир
холестерола 81, 88
гидрофобный 94
Эффект
Бора 46
осмотический 57, 66
плейотропный 65
Я
Яд дыхательный 35
а-Галактоцереброзидаза А 83
а-Кетоглутарат 69, 102
а-Кетоглутаратдегидрогеназа 102
а-Кетокислота с разветвленной цепью
104
(3-Аланин 127
(З-Аминоизобутират 127
(З-Гидроксибутират 77
(З-Глюкоцереброзидаза 83
(3-Каротин 112
А-Глицеральдегид-З-фосфатлиаза 47
L-ДОФА 107
N 5, N10- Метилентетрагидрофолат 127
^-Метилтетрагидрофолат 105
N-метил ни коти нам ид 116
S-Аденозиметил метионин 107
-■ ГДЕ И КАК КУПИТЬ КНИГИ i*i
Оптовые продажи
Продажи вузам (ГУ, ГМУ, ГМА), опт. (ЧП, ИП, другие организации)
Тел ./факс: (495) 921-39-07 (доб.152, 290, 132, 120, 192, 143);
(495) 662-91-32, (916) 876-90-59, 877-08-71; e-mail: iragor@geotar.ru; andreev@geotar.
Прямые продажи
Тел./факс: (495) 228-09-74, (915) 313-30-23, (495) 921-39-07
Продажи училищам и колледжам — доб. 207,
продажи библиотекам, бибколлекторам, НИИ — доб. 113,
продажи учебным центрам, ЛПУ и другим организациям — доб. 209;
e-mail: bookpost@geotar.ru
Интернет-магазин: www.medknigaservis.ru
Фирменные магазины «МЕДБУК» (Москва)
М. «Фрунзенская»,
Комсомольский пр-т., д. 28
(Московский дворец молодежи,
вход со стороны Детского парка).
Тел.: (916) 877-06-84,
(499) 685-12-47
М. «Коньково»,
«Юго-Западная»,
ул. Островитянова, д. 1
(РНИМУ им. Н.И. Пирогова, главный
корпус, студенческий вход, налево).
Тел.: (495) 434-55-29
М. «Цветной бульвар», «Сухаревская»
ул. Садовая-Самотечная, д. 13, стр. 1.
Тел.. (985)387-14-57,
(495) 684-32-65
М. «Новокузнецкая»,
ул. Садовническая, д. 9, стр. 4.
Тел.: (495) 228-09-74,
(495) 921-39-07 (доб. 139, 226)
Фирменный магазин «Медкнига» (Казань)
Ул. Бутлерова, д. 31. Тел.: +7 (843) 238-8-239, +7 (950) 312-80-27; e-mail: gafurova@mail.ru
Время работы: ежедневно с 09.00 до 19.00
j РЕАЛИЗАЦИЯ МЕДИЦИНСКОЙ ЛИТЕРАТУРЫ В СНГ
i ;; (ПРЕДСТАВИТЕЛЬСТВА ИЗДАТЕЛЬСТВА, ФИЛИАЛЫ,
й ^«iiHifMMrA^EPbl, МАГАЗИНЫ) iiL и III и mill'' МРШ
Издательская группа «ГЭОТАР-Медиа» в Украине
Винница
ЧП Максименко Е.В., ул. Блока, 14.
Книга-почтой в Украине,
а/я 4539.
Тел.: (3804) 326-605-10,
(3806) 883-473-89.
E-mail: maxbooks@svitonline.com
Днепропетровск
Тел.: (380) 50-453-66-44,
56-778-34-39.
E-mail: bolotnikov68@mail.ru
Донецк
«Буквамед» — медицинская
литература, ул. Октября, 14.
Тел.: (38062) 338-21-11
Киев
«Буквамед» — медицинская литература,
ул. Ярославская, 39
(ст. м. «Контрактовая площадь»).
Тел.: (38044) 463-76-96
Киев
ЧП Л.С. Сниткина.
Тел.: (38044) 274-49-79
Одесса
«Дом книги», ул. Дерибасовская, 27.
Тел.: (0428) 22-74-50
Харьков
Харьковский ГМУ, пр-т Ленина, 4.
«Медицинская академическая книга».
Голов Е.А. Тел.: (38067) 579-45-01
Представительство Издательской группы «ГЭОТАР-Медиа»
в Украине
Украина, 04108, г. Киев, пр-т Правды, 8.
Тел.:+ 38 (044) 578-26-30.
E-mail: geotarmedia@ukr.net
Представительство Издательской группы «ГЭОТАР-КазМедиа»
ТОО «ГЭОТАР-КазМедиа»
Республика Казахстан,
010000, г. Астана, ул. Бейбитшилик, 54, кв. 3.
Тел.: (7172) 39-82-62.
E-mail: yuliya_borisenko@list.ru
Дилер Издательской группы «ГЭОТАР-Медиа» в Республике Беларусь
ЧПТУП «Дар-Ника»
Республика Беларусь, 247760, г. Мозырь,
ул. Ленинская, 9/10.
Тел.: (37529) 662-46-51,
(37529) 730-13-66
Дилер Издательской группы «ГЭОТАР-Медиа» в Республике Беларусь
ООО «Лебенскрафт»
Республика Беларусь, 210024, г. Витебск,
пр-т Победы, 7/1, коми. 112.
Тел.: (37529) 718-41-51
Олигосахарид
[п+1 остаток глюкозы
а-(1—^4) связями]
Олигосахаридная
затравка [п остатков глюкозы
с а-(1->4) связями]
Гликогенсинтаэа
Г ликоген
Фосфорилаэа
(пиридоксаль-5'-фесфат)
Гликоген
(п— 1 остатков глюкозы)
сн2он
'деветвящий фермент
1) г ликозилтрансфараза
2) а-(1->6)глюкозидаза
но\он н/о-р-о-р-о-сн^о 4 х
н он
Уридиндифосфатглюкоза
Пирофосфатаза ОН ОН
ПФН ► 2 Фн
УДФ-глюкозопирофосфорилаза
УТФ
ОН Глюкозо-1 -фосфат
Фосфоглюкомутаза
Глюкокиназа;
гексокиназа
АДФ
СН20Р032'
X—
-°Ч
Н/н
\н
1
X
н/°»
/ Н
—к
Глюкозо-б-фосфат
НДДФН
НАДФ+ н+
АУ
Глюкозо-6- НО\ОН
фосфетдагидрогамаза
СН„ОРО
СОО
I
НСОН НАДФ
НАДрН
ДФ Н1" СО;
У-A А
СН.ОН
I 2
н он
Глюкозо-6-фосфат
H ОН
б-фосфоглюконо-
дельта-лактон
НСОН
I
НСОН
I -
СН20Р03
б-фосфоглюконат
6-фосфоглюконат-
дегидрагеназа
с=о
I
НСОН
I
НСОН
СН20Р032-
Рибулозо-5 - фосфат
Пентозофосфатный путь
Рибулозо-
фосфет-3-
эпимераэа
Фосфоглюкоизомераза
ОН
СН„ОН
I 2 4
с=о
I
НОСН
I
НСОН
I
НСОН
I 9
сн2оро32_
фруктозо-б-фосфат
А
Транскатолаза
н\н НО/СН2ОН
ОН н
Фруктозо - б-фосфат
Фруктозо-1,6-бисфосфатаза Mq2
Н20 —^ >*АДФ
\ ' Фосфофруктокиназа-1
^OPOgCH, ^О
сн2оро32~
Фруктозо-1,6-
бисфосфат
Альдолаэа
сн2оро32'
с=о
I
снон
Т риозофосфатизомераза
нс = о
I
НСОН
I
СН2ОРО.
Mfl2"1
тиаминпирофосфот )л
СН9ОН
I г
с=о
t
Рибозо-5-
фосфатизо-
мераза
НС-О
НСОН *
I -
сн2оро32_
Глицеральдегид-З-фосфат
СНО
■
НОСН
НСОН
1 «—
НСОН
1
. НСОН .
► ,
НСОН
СНдОРОз2"
НСОН
Эритрозо-
4-фосфат
СН«ОН
CHgOPO^
Се доге птул030-
7-фосфат
1
с=о
Трансальдолаэа
1
► НОСН
X
-о
II
о
1 л
НСОН
—► НСОН <—
1
1
НСОН
СН20Р032’
СНдОРОз2-
Г лицерал ьдегид-
3-фосфат
СН„ОН
I 2
с=о
I
носн
I
неон
I
сн2оро32'
Ксилозо-
5-фосфат
CHO
I
НСОН
I
НСОН
I
НСОН
сн2оро32
Рибозо-5-
фосфат
I I
Mfl2+
(тиаминп ирофосфат)
Транскетолаза
О
II
H3C-C-SCoA
Ацетил-КоА
2-
Дигидроксиацетонфосфат
Г лицеральдегид-3-фосфат
SH-группа цистеина
конденсирующего
фермента
НАД
НАДН+Н
Г лицералвдегид-3-
фосфатдегидроганаза
о=с-оро32'
НСОН
I
СНдОРОд2"
1,3-бисфосфоглицерат
АДФ*-
АТФ-4—^
Гликолиз
Фосфогл ицератки наза
СОО‘
I
НСОН
I -
сирро2-
3-фосфоглицерат
Г
Ацетоацетил АЛБ
Цитозоль
Фосфоглицеромутаэа
Г
i
Ацетил-КоА-
трансацилаза
фруктозо-б-фосфат
О О
II II
-► h3c-c-ch2-c-sacp
Ацетоацетил-АПБ
НАДФН+Н +
НАДФ
н
Р-Кетоацил-АПБ-
редуктаза
О
II
Синтез жирных кислот
г
Н,с- С - СН--С -SACP
3 , 2
ОН
D - 3 - гидрокс ибути р ил - АП Б
1-Г идроксиацил-АПБ-
гидратаза
идроксис
Н2°*"Т
и ▼
Н т О
I II
HX-C = C-C-SACP
3 I
Н
Еноил-АПБ
НАДФН+Н
НАДФН
Еноил-АПБ-редуктаза
О
r II
Н3С- СНг - снг- С - SACP
СО,
KoA-SH
Р-Кетоацил-АПБ\
синтаза
(конденоирующий
фермент)
а
Ацил-АП Б
г
1
KoA-SH
(1 - Кетоацил - АЛБ
синтаза
(конденсирующий
фермент)
Пальмитоил
АПБ
^Н2°
Тиоэстераза
'Ч'"ч*Ацил-
пероносящий
белок
СН3(СН2),4С -О-
Пальмитат
wr
_^r-
COO'
l
HCOPO-2'
I 3
ch2oh
2-фосфоглицерат
О О
o-c-ch2-c-sacp
Малонил-АПБ
~т т
Маломил-КоА
сн2он
Этерификация
СН2ОС(СН2)14СН3
о
л
СНОС(СН2) сн3
СН2ОС(СН2)14СН3
Трипальмитин
(триглицерид)
Г ормоичув-
ствительмая
лилаза (а жиро¬
вой ткани)
ПРИГЛАШЕНИЕ К СОТРУДНИЧЕСТВУ
Издательская группа «ГЭОТАР-Медиа» приглашает к сотрудничеству
авторов и редакторов медицинской литературы,
литературы по ветеринарии и агротехнике.
ИЗДАТЕЛЬСТВО СПЕЦИАЛИЗИРУЕТСЯ НА ВЫПУСКЕ
учебной литературы для вузов и колледжей, атласов,
руководств для врачей, переводных изданий.
По вопросам издания рукописей обращайтесь в отдел по работе с авторами.
Тел.:(495)921-39-07. '
L
Учебное издание
Солвей Дж.Г.
НАГЛЯДНАЯ МЕДИЦИНСКАЯ БИОХИМИЯ
Перевод с английского
А.Н. Вабищевич, О.Г. Терещенко
Под редакцией
Е.С. Северина
3-е издание, переработанное и дополненное
Главный редактор издательства С.Ю. Кочетков
Зав. редакцией А. В. Андреева
Выпускающий редактор И.Н. Самуилова
Корректоры О.С. Гварамадзе, Л. И. Базылевич
Компьютерная верстка С. В. Луценко
Дизайн обложки Т.В. Делицина
Технолог О.А. Ильина
Подписано в печать 27.10.2014. Формат 60x90 */8. Бумага офсетная.
Печать офсетная. Объем 21 уел. печ. л. Тираж 1000 экз. Заказ № 3257
ООО Издательская группа «ГЭОТАР-Медиа».
115035, Москва, ул. Садовническая, д. 9, стр. 4.
Тел.: 8 (495) 921-39-07.
E-mail: info@geotar.ru, http://www.geotar.ru.
Отпечатано в ОАО «Тверской полиграфический комбинат».
170024, г. Тверь, пр-т Ленина, д. 5.
ISBN 978-5-9704-3275-4
9 785970 432754 >
ОТЛИЧИТЕЛЬНЫЕ ОСОБЕННОСТИ СЕРИИ
• Краткость: основной материал по дисциплине в неболь-
шом объеме
• Наглядность: множество примеров и иллюстраций
• Эффективность: студент готовится к экзамену на «от¬
лично», а врач получает современное представление
о предмете
В третьем издании популярного учебного пособия
представлена информация по широкому кругу во¬
просов современной биохимии. Все процессы про¬
иллюстрированы наглядными рисунками и схемами,
которые значительно облегчают понимание и запоми¬
нание непростого материала. Особое внимание уделе¬
но медицинским аспектам обмена веществ у челове¬
ка (указаны нарушения при различных заболеваниях
и возможные мишени действия лекарственных пре¬
паратов). Добавлен раздел, посвященный основным
аспектам молекулярной биологии. Описаны клеточ¬
ный цикл, структура, функции и свойства РНК и ДНК,
проблемы современной молекулярной биологии.
Предназначено студентам медицинских вузов, так¬
же может быть полезно всем, кто интересуется биохи¬
мией или хочет закрепить полученные ранее знания.
8 Сирии
вышли книги;
Наглядная
анатомия
•кн i С4 ji
гастроэнтерологи
Наглядная
иммунология
Наглядная
нефрология
Наглядная
педиатрия
Наглядная
физиология
\
Наглядная
эндокринология
Наглядные
инфекционные
болезни
и микробиология
И Ь о
OIU|!(JIL ' а * Ъ'- ЧНЙ
Наглядная
медицинская
статистика