Автор: Прист Ф.Дж. Кэмпбелл Й.
Теги: микробиологические производства бродильные производства производство напитков производство вкусовых продуктов пищевое производство биология микробиология
ISBN: 5-93913-087-9
Год: 2005
Brewing Microbilogy
Third edition
Edited by
Fergus G. Priest and Iain Campbell
International Centre for Brewing and Distilling
Heriot-Watt University
Edinburgh, UK
KLUWER ACADEMIC/PLENUM PUBLISHERS
233 Spring Street, New York, New York 10013-1578
Микробиология пива
3-е издание
Под редакцией
Фергюса Дж. Приста и Йена Кэмпбелла
Перевод с англ.
под общей редакцией Т. В. Мелединой и Тыну Сойдла
Санкт- Петербург
2005
УДК 663 .4= 20
ББК 36.87 Англ
М59
М59 Микробиология пива / Прист Ф. Дж., Й. Кэмпбелл (ред.); пер. с англ. под
общ. ред. Т. В. Мелединой и Тыну Сойдла. — СПб: Профессия, 2005. — 368 с, ил.,
табл., сх.
ISBN 5-93913-087-9
ISBN 0-306-47288-0 (англ.)
Микробиологические риски, возникающие как в процессе производства пива, так и
на его пути к потребителю, являются важнейшими проблемами для менеджеров по качеству
и сотрудников лабораторий пивоваренных предприятий. Продолжая выпуск современных
изданий для пивоваров, издательство «Профессия» предлагает перевод третьего (исправлен-
ного и дополненного) издания широко известной среди специалистов книги «Микробиоло-
гия пива». В новое издание помимо изменений, связанных с новыми тенденциями в практике
пивоварения, вошли разделы, касающиеся микробиологических аспектов работы минипив-
заводов. Книга сочетает в себе черты справочника и практического руководства и может быть
использована специалистами по качеству и сотрудниками лабораторий не только пивоварен-
ных предприятий, но других отраслей индустрии напитков, включая поставщиков сырья и
оборудования, будет полезна студентам и аспирантам профильных вузов, а также представ-
ляет интерес для микробиологов.
Все права защищены. Никакая часть данной книги не может быть воспроизведена в какой бы то ни было форме без
письменного разрешения владельцев авторских прав
Информация, содержащаяся в данной книге, получена из источников, рассматриваемых издательством как падеж-
ные. Тем не менее, имея в виду возможные человеческие или технические ошибки, издательство не может гарантиро-
вать абсолютную точность и полноту приводимых сведений и не несет ответственности за возможные ошибки,
связанные с использованием книги
Original English language edition published by Kluwcr Academic/Plenum Publishers
All rights reserved Kluwcr Academic/Plenum Publishers
ISBN 5-93913-087-9
ISBN 0-306-47288-0 (англ.)
© 2002, Kluwer Academic/Plenum Publishers
© 2005, изд-во «Профессия»
© 2005, Бслодсдова А., Горожанкипа И., Рапопорт Д.,
Файзулласв Т., перевод
УДК 663 .4= 20
ББК 36.87Англ
Оглавление
Предисловие 8
Глава 1. Микробиологические аспекты пивоварения 9
1.1. Введение 9
1.2. Солодоращение 11
1.3. Пивоварение. Затирание и кипячение с хмелем 12
1.4. Брожение 13
1.5. Послебродильные операции 18
1.6. Краткое резюме 23
Глава 2. Биохимия и физиология роста дрожжей 25
2.1. Введение 25
2.2. Клеточный цикл 25
2.3. Рост клеток и цикл брожения 26
2.4. Состав клетки, ее питание и основной метаболизм 26
2.5. Энергетический и промежуточный метаболизм 27
2.6. Биохимия дрожжей и производство пива 35
2.7. Резюме 62
Глава 3. Генетика дрожжей 68
3.1. Введение 68
3.2. Генетические особенности Saccharomyces cerevisiae 68
3.3. Потребность в новых пивных дрожжах 72
3.4. Генетические методы 73
3.5. Применение методов рекомбинантной ДНК к пивным дрожжам 81
3.6. Молекулярно-биологические подходы к определению дрожжей 97
3.7. Природа генома пивных дрожжей 99
3.8. Коммерческое использование генетически модифицированных
пивных дрожжей 102
3.9. Краткое резюме 103
Глава 4. Микробиота ячменя и солода 111
4.1. Микробиота ячменя 111
4.2. Микробиота солода 127
4.3. Влияние микроорганизмов на солодоращение 135
4.4. Влияние микробиоты на пиво и спирт 143
4.5. Риски для здоровья 148
4.6. Оценка плесневой контаминации 156
Глава 5. Грамположительные бактерии в пивоварении 171
5.1. Введение 171
5.2. Молочнокислые бактерии 172
5.3. Лактобактерии 179
5.4. Педиококки 189
5.5. Лейконостоки 193
5.6. Гомоферментативные кокки 194
6
5.7. Кокурии, микрококки и стафилококки 195
5.8. Бактерии, образующие эндоспоры 196
5.9. Идентификация родов грамположительных бактерий, встречающихся
в пивоваренном производстве 197
5.10. Краткое резюме 198
Глава 6. Грамотрицательные бактерии в пивоварении 204
6.1. Введение 204
6.2. Уксуснокислые бактерии 205
6.3. Энтеробактерии 208
6.4. Zymomonas 217
6.5. Анаэробные грамотрицательные палочки 218
6.6. Megasphaera 220
6.7. Прочие бактерии, неспособные к брожению 221
6.8. Обнаружение, подсчет и выделение 221
6.9. Заключение 223
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 229
7.1. Введение 229
7.2. Систематика дрожжей 229
7.3. Свойства дрожжей, необходимые для их идентификации 234
7.4. Выявление диких дрожжей 236
7.5. Идентификация диких дрожжей 238
7.6. Влияние диких дрожжей на пивоваренное производство 240
7.7. Устранение диких дрожжей 244
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации
микробиологических загрязнений 248
8.1. Введение 248
8.2. Методы, основанные на измерении импеданса
(электропроводности и емкостного сопротивления) 251
8.3. Микрокалориметрия 254
8.4. Турбидиметрия 255
8.5. Проточная цитометрия 256
8.6. АТФ-биолюминесценция 258
8.7. Микроскопический метод обнаружения микроколоний 262
8.8. Метод DEFT 264
8.9. Chemscan 265
8.10. Метод белковых «отпечатков пальцев» при электрофорезе
в полиакриламидном геле 266
8.11. Кариотипирование (снятие хромосомных «отпечатков пальцев») 267
8.12. Иммуноанализ 268
8.13. Гибридизация с использованием ДНК-зондов 271
8.14. Цепная реакция полимеразы 273
8.15. Полимеразная цепная реакция полиморфной ДНК, амплифицированной
случайным образом 275
8.16 Краткое резюме 276
Оглавление 7
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 284
9.1. Что такое идентификация? 284
9.2. Разные подходы к идентификации 285
9.3. Идентификация микроорганизмов по нуклеиновым кислотам 286
9.4. Методы исследования белков 297
9.5. Методы исследования особенностей клеточного состава 298
9.6. Методы изучения морфологии и поведения микроорганизмов 301
9.7. Заключительные замечания 303
Глава 10. Микробиология и санитария на мини-пивзаводах США 307
10.1. Введение 307
10.2. Сырье 307
10.3. Технология и готовый продукт 309
10.4. Поверхности, контактирующие с пивом 311
10.5. В заключение 312
Глава 11. Мойка и дезинфекция в пивоварении 314
11.1. Введение 314
11.2. Определения 314
11.3. Стандарты мойки и дезинфекции в пивоварении 315
11.4. Способы мойки 318
11.5. Состав загрязнений 322
11.6. Моющая способность 323
11.7. Принципы действия моющих средств на загрязнения 323
11.8. Щелочные моющие средства и каустик 324
11.9. Комплексообразователи 325
11.10. Кислоты 327
11.11. Поверхностно-активные вещества 329
11.12. Дезинфектанты и дезинфицирующие вещества,
используемые на пивоваренных предприятиях 331
11.13. Окисляющие дезинфектанты 332
11.14. Дезинфектанты неокислительного действия 336
11.15. Обработка воды 339
11.16. Пар 341
11.17. Заключение 341
Глава 12. Микробиологические методы анализа в пивоварении 343
12.1. Введение 343
12.2. Микробиологический анализ сырья 344
12.3. Дрожжи 351
12.4. Сусло и брожение 358
12.5. Стерильность оборудования 359
12.6. Пиво 364
12.7. Заключение 367
Предисловие
Последнее издание этой книги выходило в свет в 1996 г. и с тех пор в пивоварении
многое изменилось. В частности, крупные пивоваренные компании объединились в
международные концерны, в различных частях мира доказали свою жизнеспособ-
ность минипивзаводы... Не менее крупные изменения коснулись и организаций,
занимающихся научно-техническими аспектами пивоварения. В многочисленных
лабораториях была определена полная последовательность генома Saccharomyces
cerevisiae, изучены проявления его деятельности (транскрипция и трансляция),
а также было точно определено, «как работают дрожжи». Это открытие, несомненно,
внесет большой вклад в понимание брожения дрожжей и образования вкусовых ком-
понентов, так как стало возможным проследить в ходе брожения одновременно все
гены клетки. В главах 2 и 3 данного издания читатель сможет ознакомиться с этой
быстро развивающейся областью современной биохимии и молекулярной биологии,
а в главе 7 — с новой систематикой 5. cerevisiae и диких дрожжей.
Еще одно достижение в области молекулярной характеристики и идентификации
микроорганизмов, произошедшее после выхода предыдущего издания, основано в
значительной степени на цепной реакции полимеразы (ЦРП) для описания опреде-
ленных фрагментов ДНК. Хотя в лабораториях пивоваренных предприятий постоян-
но используются немногие из этих методов, их скорость, точность и возможности
очень привлекательны. Как только эти методы станут более автоматизированными и
менее дорогостоящими, они наверняка будут включены в технологии обеспечения
качества продукции. Кроме этого, в книгу включены новые главы о роли микробио-
логии в технологии пивоварения (особенно на минипивзаводах), а также глава,
посвященная обоснованию микробиологических анализов, используемых на пивова-
ренных предприятиях. Мы выражаем признательность Б. Фланнигану за дополне-
ния, внесенные в раздел о микроорганизмах ячменя и солода, а также Э. Хилл за по-
мощь в подготовке диаграмм.
Микробиология пивоварения имеет длинную интересную историю, и мы надеем-
ся, что третье издание этой книги убедит читателя в том, что в этой области еще мно-
го неизвестного.
Фергус Г. Прист, Йен Кэмпбелл (Fergus G. Priest, Iain Campbell),
ICBD, г. Эдинбург
Глава 1
МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ
ПИВОВАРЕНИЯ
Йен Кэмпбелл (lain Campbell)
1.1. Введение
Можно утверждать, что не только микробиологические аспекты пивоварения, но и
микробиология как наука ведет свое начало с получения пива. Большой вклад в раз-
витие современной микробиологии внесли исследования проблем порчи пива, прове-
денные Луи Пастером. Пивоварение — это, по существу, слияние усилий инженеров
со знаниями из области ботаники, общей химии, биохимии и микробиологии. Архео-
логические данные свидетельствуют о том, что пиво варили еще 4000 лет до н. э. [10],
однако о микробиологическом характере этого процесса узнали лишь 150 лет назад.
В последнее время одной из задач микробиологии стала оптимизация технологии
для достижения высокой эффективности и качества. Существуют два принципиаль-
ных аспекта микробиологии пивоварения: а) качество производственной культуры
дрожжей и б) контроль возможного микробиологического загрязнения продукта.
Ниже мы посвятим отдельную главу полному описанию различных микробиологи-
ческих аспектов производства пива, а здесь дадим лишь общее представление о мик-
робиологии в производстве алкогольных напитков, особенно пива (о других аспектах
пивоварения см. [4,8,10]). Общая технология процесса пивоварения представлена на
схеме 1.1.
В большинстве стран основным сырьем для производства пива является ячменный
солод, который служит благоприятной средой для развития микрофлоры (см. гла-
ву 4). Основная часть этих микроорганизмов в нормальных условиях не способна раз-
виваться в пиве. Развитие большинства грибов и бактерий подавляется одним или
несколькими из нижеперечисленных факторов: антимикробными свойствами хмеля;
снижением рН во время брожения с 5,0-5,2 в сусле до 3,8-4,0 в пиве; образованием
С02 и анаэробными условиями; увеличением содержания этилового спирта. Отсут-
ствие этих защитных факторов приводит к предрасположенности сусла к порче, во
избежание чего в сусло должны быть внесены дрожжи сразу же после, а лучше во
время перекачки. При должном выполнении процессов, предшествующих брожению,
развитие инфицирующих микроорганизмов будет подавлено внесением большого ко-
личества засевных дрожжей. Пиво с присущими ему антимикробными свойствами и
низким уровнем несбраживаемых Сахаров является относительно стабильной средой,
однако в анаэробных условиях определенные виды бактерий и дрожжей способны
развиваться на полисахаридах или других органических соединениях, оставшихся
после брожения [3]. Источником инфицирования сусла и пива может являться со-
лод, в котором содержится небольшое количество молочнокислых, уксуснокислых
микроорганизмов и энтеробактерий (табл. 1.1), способных размножаться в благопри-
ятных условиях. Сильное инфицирование возможно в неохмеленном или слабоалко-
10
Йен Кэмпбелл
гольном пиве, где отсутствует один из защитных факторов. В табл. 1.1 также пред-
ставлены аэробные контаминанты пива — например, дрожжи дыхательного типа и
уксуснокислые бактерии, однако присутствие этих микроорганизмов может быть
вызвано лишь нарушениями в технологаи розлива при наличии в таре атмосферного
кислорода.
СОЛОДОРАЩЕНИЕ
Модификация крахмала ячменя (подготовка к гидролизу в заторном чане)
Гидролиз белка => свободный аминный азот
Структурные изменения в целях получения более рыхлой консистенции эндосперма
ДРОБЛЕНИЕ, ЗАТИРАНИЕ
Получение при дроблении нужного среднего размера частиц
Ферментативный гидролиз и экстракция с помощью горячей воды Сахаров, аминокислот,
других питательных веществ, используемых дрожжами => сусло
КИПЯЧЕНИЕ СУСЛА
Кипячение с хмелем для извлечения ароматических и горьких веществ => охмеленное сусло
Стерилизация
БРОЖЕНИЕ
Превращение при помощи дрожжей сбраживаемых Сахаров в спирт и С02
{Saccharomyces cerevisiae)
Образование вкусо-ароматических веществ, являющихся побочными продуктами метаболизма
дрожжей
Удаление нежелательных летучих соединений (например, H2S) при выделении С02
ПОСЛЕБРОДИЛЬНЫЕ ОПЕРАЦИИ
Созревание (улучшение вкуса)
Осветление
Розлив
Пастеризация
Схема 1.1. Краткое описание процесса пивоварения
Таблица 1.1. Микробиологические контаминанты в производстве пива
с 2 s
* i t i
I £ g • i
ill» i i
Стадия ! I 1 i . t ■
I о 8 | % | P 8
Ячмень и солод + + _ + + - + -
Начало брожения _ + + + + - + -
Дображивание __ + + _ + _-
После брожения _ + + + + + _ +
Глава 1. Микробиологические аспекты пивоварения
11
1.2. Солодоращение
Пиво готовится из злаков, а углеводом злаковых культур является крахмал. Дрож-
жи не способны его переработать, в связи с чем зерна предварительно проходят ста-
дию солодоращения, в ходе которой происходит модификация крахмала, а затем, при
затирании, крахмал гидролизуется с образованием сбраживаемых Сахаров. Так как
солодоращение — это контролируемый процесс, подобный натуральному проращи-
ванию, соложению может быть подвергнута любая злаковая культура, а ячмень ши-
роко применяется для производства пива благодаря особым свойствам его оболочек,
которые ограничивают развитие инфицирующих грибов и образуют натуральный
фильтрующий слой при фильтровании сусла.
Для солодоращения подходят не все сорта ячменя. Помимо необходимых ботани-
ческих характеристик (отсутствие периода покоя или эффективность модификации
сорта), важным свойством является содержание азота. Слишком низкий уровень
аминного азота в сусле ограничивает рост дрожжей, однако чаще встречаются с про-
блемой слишком высокого содержания в ячмене азота (превышающего необходи-
мый для развития дрожжей уровень). Избыток азота, особенно аминного, приводит
к микробной порче готового пива (прежде всего молочнокислыми бактериями, см.
главу 5).
Поскольку ячмень созревает только осенью, а солодоращение проводят на протя-
жении всего года, зерно с влажностью 20-25% должно быть высушено до содержания
влаги 11%, подходящей для хранения перед солодоращением. Такая влажность пре-
дотвращает инфицирование микроорганизмами (особенно грибами), и, кроме того,
при такой влажности зерно еще не теряет своей жизнеспособности. Сушка и хранение
предназначенного для солодоращения ячменя должны тщательно контролироваться
во избежание риска перехода зерна в состояние покоя или его гибели. Для предотвра-
щения повреждения зерна рекомендуется щадящий режим сушки [11].
При солодоращении эндосперм крахмала зерна модифицируется в результате
действия гидролитических ферментов, его структура изменяется. Одновременно
происходит гидролиз белков протеолитическими ферментами до потребляемых
дрожжами аминокислот и пептидов. Процесс солодоращения происходит в три эта-
па — замачивание, проращивание и сушка, причем каждый из этих этапов может
быть подвержен микробиологическому загрязнению (см. главу 4). Замачивание
в воде происходит в течение 48 ч при температуре 15-18 °С обычно в две или более
стадии с воздушными паузами, стимулирующими рост зародыша, подобно тому, как
это происходит в природе. Влага, тепло и аэрация при замачивании и проращива-
нии вызывают рост микрофлоры, неизбежно присутствующей на поверхности зер-
на (см. главу 4). Проросший и модифицированный зеленый солод для лучшего хра-
нения подвергают сушке, в ходе которой формируется характерный «солодовый»
привкус. Так как на практике фактором, предотвращающим микробную порчу, яв-
ляется активность воды, а не процент содержания влаги, то влажность, достигну-
тую во время проращивания (46-50%) необходимо уменьшать до пригодной для
хранения (5%). При этом необходимо найти компромисс между требованиями
к микробиологической стабильности и энергетическими затратами на сушку. Дру-
гие аспекты сушки (усиление цвета и вкуса, сохранение гидролитической активно-
сти протеолитических и амилолитических ферментов, участвующих в затирании)
12
Йен Кэмпбелл
имеют в основном биохимическую и химическую природу, хотя и приводят к сопут-
ствующему сокращению микрофлоры.
1.3. Пивоварение. Затирание и кипячение с хмелем
При затирании на пивоваренном предприятии из зерна извлекаются необходи-
мые для дрожжей питательные вещества. В варочном отделении солод (возможно,
с другими несоложеными злаками) размалывают, затирают и сусло фильтруют. За-
тем сусло кипятят с хмелем, осветляют и охлаждают до температуры начала броже-
ния. Наибольший интерес с микробиологической точки зрения вызывают начало и
конец операций, осуществляемых в варочном отделении. Дробилки солода проекти-
руют таким образом, чтобы зерна размалывались до мелких частиц, что приводит к
лучшей экстракции Сахаров и других потребляемых дрожжами питательных ве-
ществ, но помол должен осуществляться при возможно наименьшем повреждении
оболочек зерна. Хотя эта проблема в основном инженерная, здесь присутствуют и
микробиологические аспекты. Образующаяся при дроблении пыль не должна попа-
дать в бродильное отделение, так как микрофлора зерна содержит микроорганизмы-
контаминанты. На некоторых предприятиях солод увлажняют либо подвергают
кратковременной обработке паром при низком давлении, благодаря чему уменьша-
ется возможность повреждения в дробилке умягченных оболочек, и эффективность
фильтрования в фильтр-чане повышается. Помимо прочего при этом уменьшается и
возможность инфицирования, взрывоопасность и риск для здоровья, связанный с
образованием мелких сухих частиц пыли, однако источником порчи может стать
рост микроорганизмов на скоплениях влажных зерен или пыли в дробилках. Хотя
бактерии родов Bacillus и Clostridium в таких условиях способны расти, порчу пива
вызовут не они, а продукты их метаболизма — например, масляная кислота, которая
остается в готовом пиве.
Первоначально в качестве вкусовых добавок при производстве пива использова-
ли много разных трав, однако в настоящее время неотъемлемой частью пива стал
хмель. Возможно, он занял это место благодаря тому, что пиво, сваренное с хмелем,
характеризуется высокой микробиологической стабильностью. Разные сорта хмеля
различаются по содержанию горьких кислот, смол и масел, но все они в большей или
меньшей степени обладают антимикробными свойствами [12]. Точный механизм
этого воздействия еще не известен, но по всей видимости а-кислоты ингибируют
рост большинства бактерий, особенно грамположительных. Вкусовые вещества из-
влекаются при кипячении в течение 60-90 мин с одновременной стерилизацией и
увеличением плотности сусла, а также изомеризацией хмелевых а- и р-кислот. Од-
новременно удаляется грубый привкус зерна. При использовании в рецептуре глю-
козы, сахарозы или мальтозы (в кристаллическом виде или в сиропе), их лучше все-
го вносить именно на этой стадии. Эти добавки могут быть не стерильными, в связи
с чем в требованиях к качеству обычно указывается максимально допустимое коли-
чество микроорганизмов (КОЕ) — например, 2 х 103/г. При таком содержании мик-
роорганизмов для достижения стерилизующего эффекта достаточно 15-30 мин ки-
пячения сусла с хмелем.
В настоящее время большинство пивоваров используют хмель в виде полуфабри-
катов — либо гранулированный, приготовленный из шишек хмеля, либо хмелевой
Глава 1. Микробиологические аспекты пивоварения
13
С02-экстракт. При использовании изомеризованного хмелевого экстракта отпадает
необходимость кипятить сам хмель, однако сусло по вышеперечисленным причинам
кипятить необходимо. Изомеризованный экстракт (как и содержащие сахар добав-
ки) добавляется в конце кипячения. При кипячении сусла с хмелем образуется оса-
док, состоящий из белково-дубильного комплекса (белок/таннин), нерастворимых
солей кальция и фосфатов, которые удаляются до начала брожения, поскольку их
присутствие негативно влияет на процесс брожения и, как следствие, на органолеп-
тические показатели пива.
После кипячения сусла с Шишковым хмелем традиционным методом сусло освет-
ляют фильтрованием через осевший слой хмелевой дробины. Гранулы или экстракт
не обеспечивают подходящую фильтрующую среду, и сусло в этом случае осветляют
центрифугированием либо в вирпуле, где хмелевая дробина и осадок горячего сусла
оседают в центре в виде воронки, а осветленное сусло выводится сбоку емкости. Бла-
годаря тому, что вирпул при работе нагревается до температуры около 100 °С и в нем
нет подвижных частей, данная операция не вызывает микробиологических проблем.
Затем до внесения культуры дрожжей сусло охлаждают до температуры ниже
8 °С. Охлажденное сусло должно аэрироваться обычно до содержания растворенно-
го кислорода в 6-8 ррт (частей на миллион). Количество присутствующих в сусле
ненасыщенных жирных кислот и стеролов слишком мало для роста дрожжей, необ-
ходимого для эффективного брожения, и, следовательно, начальная аэрация сусла
позволяет дрожжам синтезировать эти вещества (см. главу 2). К этим технологи-
ческим этапам предъявляются значительные микробиологические требования —
в частности, к чистоте теплообменника, к его герметичности во избежание смешива-
ния сусла с потенциально инфицированной, просачивающейся в сусло охлаждаю-
щей водой, к стерильности трубопроводов и бродильного танка, куда поступает сус-
ло, к стерильности предназначенного для аэрации воздуха и к микробиологической
чистоте засевных дрожжей. При поиске причин инфицирования на производстве
следует рассмотреть все эти возможности.
1.4. Брожение
Для микробиологов эта стадия производства наиболее интересна и важна, однако
здесь мы коснемся вопросов брожения лишь в общих чертах. Метаболизм дрожжей
мы подробно рассмотрим в главе 2, а в главах 5-7 — меры предосторожности, исклю-
чающие инфицирование дрожжей бактериями при брожении. Источники контами-
нации при брожении могут быть разными, в том числе и уже упомянутые (особенно
сусло), но основными из них можно считать воздух, засевные дрожжи, бродильный
танк, линии трубопроводов и контрольно-регулирующую арматуру.
1.4.1. Дрожжи
На протяжении долгой истории пивоварения брожение осуществлялось в откры-
тых емкостях, которые и по сей день используются на многих небольших предприя-
тиях, работающих по% традиционной технологии. В начале пивовары использовали
дрожжи из атмосферы или с пивоваренного оборудования (эта технология и сегодня
используется при приготовлении бельгийского пива «Ламбик») [16]. Помимо всего
прочего, признаком хорошо протекающего брожения было интенсивное выделение
14
Йен Кэмпбелл
двуокиси углерода, выносившей часть дрожжей на поверхность с образованием тол-
стой пенной шапки (отсюда и происходит название таких дрожжей — «верховые
дрожжи»). При удачной ферментации эта дрожжевая шапка собиралась, для чего
убирали боковую панель бродильного танка либо применяли систему Burton Union,
которая и по сей день используется на пивоваренном предприятии Marstons Brewery
в г. Бертон-он-Трент. Собранные дрожжи использовались для внесения в следую-
щее брожение и т. д. Пивовары поняли ценность свойств здоровых дрожжей задолго
до того, как требования к ним были сформулированы в микробиологических терми-
нах (табл. 1.2).
Таблица 1.2. Основные свойства пивоваренных дрожжей
Стабильное образование желаемых вкусо-ароматических продуктов метаболизма
Быстрое брожение
Эффективное брожение (максимальное образование этилового спирта, минимальное
образование биомассы дрожжей)
Устойчивость к ингибирующим факторам в пиве и сусле (осмотическое давление, токсичный
эффект от накопившегося этилового спирта и С02)
Подходящие флокуляционные и седиментационные свойства в конце брожения (для «верховых»
дрожжей — образование шапки)
Высокий уровень жизнеспособности у засевных дрожжей
Высокий уровень генетической стабильности при последующих ферментациях
Происхождение большинства дрожжей, широко используемых в современном
пивоварении, не установлено — скорее всего, они восходят к баварским монастыр-
ским пивоварням (не менее 300 лет назад). Вероятно, первоначальный штамм пиво-
варенных дрожжей был инфицирован или гибридизировался с дикими дрожжами
или местными винными дрожжами [9]. Эти «низовые дрожжи» нового типа броже-
ния не образовывали пенную шапку и содержали слишком мало дрожжей для даль-
нейшего пересева в следующую ферментацию. Дрожжи для последующего броже-
ния следовало снимать со дна бродильного чана в конце ферментации. Возможно,
тогда же было обнаружено, что эти новые дрожжи идеально подходят для дображи-
вания при низких температурах, улучшая органолептические свойства пива и уве-
личивая содержание двуокиси углерода.
Пиво этого типа было впервые сварено в Баварии и со временем приобрело попу-
лярность далеко за ее пределами. В 1842 г. эти дрожжи попали к чешским пивоварам
и на их основе они стали варить пиво в г. Пльзень. Этот тип пива (возможно, не со-
всем справедливо) во многих странах получил название «пльзеньский», хотя в Вели-
кобритании для него используется термин «лагерный». Через несколько десятилетий
чешские дрожжи были украдены одним из Йоргенсенов, владельцев датской компа-
нии «Карлсберг» — по легенде, эти дрожжи он вывез на голове под шляпой, и они
пережили переезд в дилижансе до Дании. Там в 1880-х г. пионер в области системати-
Глава 1. Микробиологические аспекты пивоварения
15
ки и технологии дрожжей Э. Хансен первым вывел чистую культуру дрожжей и уста-
новил разницу между «верховыми» дрожжами традиционного пивоварения Бельгии,
Великобритании и Германии (которые он назвал Saccharomyces cerevisiae) и «низовы-
ми» дрожжами, использовавшимися в Баварии и Чехии (5. carlsbergensis, в настоящее
время это название не используется, см. главу 7). Чистая культура дрожжей S. carls-
bergensis впоследствии распространилась по миру и способствовала популярности
пльзеньского (лагерного) типа пива.
Закрытые бродильные танки в пивоваренной промышленности стали применять-
ся с 1970 г. Несмотря на то что сначала они были всего лишь новой версией традици-
онных прямоугольных открытых танков, в настоящее время они стали цилиндроко-
ническими танками брожения (ЦКТБ). Сильная циркуляция при брожении,
вызванная движением пузырьков С02 вверх и движением вниз при понижении тем-
пературы благодаря расположенным на стенках емкости рубашкам охлаждения,
приводит к увеличению активности дрожжей, а также позволяет более эффективно
контролировать температуру. Такие танки особенно хорошо подходят для низовых
дрожжей — в ЦКТБ снимать верховые дрожжи невозможно, и, кроме того, при силь-
ной циркуляции над бродящим суслом образуется большая шапка пены, чем в не-
глубоких прямоугольных танках, которая может занимать до половины объема
ЦКТБ, что ведет к неэффективному использованию дорогого оборудования. Хотя
для пива с использованием верховых дрожжей можно применять пеногасители, все
же более предпочтительно использовать другие штаммы, не образующие много
пены, но обладающие теми же органолептическими свойствами. Очевидно, что ла-
герные дрожжи подходят не для всех случаев, так как отличаются от верховых по
органолептическим свойствам.
Те или иные штаммы или их смесь могут быть использованы для определенных
сортов пива. В последнем случае рекомендуется использовать дрожжи, предвари-
тельно смешанные в определенных пропорциях. В прошлом периодичность выведе-
ния чистой культуры определялась без четкой программы, но в современном пиво-
варении наблюдается тенденция к выращиванию чистой культуры дрожжей после
достижения определенного числа генераций. Под номером генерации понимается
генерация не определенной клетки, а номер очередного цикла брожения с использо-
ванием тех же дрожжей. Дрожжи могут находиться в хорошем состоянии, но их вы-
ведение из производственного цикла в соответствии с фиксированной программой
размножения упрощает планирование производства. При ферментации высокоплот-
ного сусла причиной дегенерации дрожжей могут стать высокая концентрация эти-
лового спирта (не менее 8%), другие метаболиты, а также осмотическое давление,
что приводит к невозможности многократного использования культуры, и для каж-
дого цикла брожения придется разводить новую чистую культуру.
В оценке качества засевных дрожжей существует два аспекта: дрожжи должны быть
а) в активном состоянии и б) не инфицированными вредными для пива бактериями и
дикими дрожжами. Для оценки жизнеспособности дрожжей (см. главы 2 и 12) приме-
няются разные методы, однако наиболее прост и достаточно точен метод микроскопи-
рования с использованием для определения мертвых клеток метиленового синего. Так
как этот тест занимает около 15 мин, его можно использовать для подтверждения жиз-
неспособности дрожжей (она должна составлять 99-100%, но не менее 95%) и, удосто-
16
Йен Кэмпбелл
верившись в этом, принимать решения — применять ли эти дрожжи для засева. Кон-
центрация засевных дрожжей обычно составляет 1-2 х 107 клеток/мл (для высоко-
плотного сусла — больше), но на производстве более удобно первоначально измерить
массу дрожжей. Предпочтительно сразу после засева проверить концентрацию дрож-
жей в сусле, используя либо микроскопический подсчет, либо посредством доступных
в настоящее время автоматизированных методов обработки информации, получаемой
со встроенных в линию (in-line) датчиков [1]. Хотя жизнеспособность дрожжей может
и должна определяться до каждого цикла брожения, выявление контаминантов — про-
цесс более долгий, и тестировать дрожжи стандартными микробиологическими мето-
дами до пересева не целесообразно. Для определения наличия контаминантов в дрож-
жах полезны методы «мгновенной» биолюминесценции, иммунологические методы
или метод на основе ЦРП (их результаты можно получить до засева дрожжей в сусло,
см. главы 8 и 12), однако в настоящее время они применяются довольно редко. К счас-
тью, возможность внезапного инфицирования бактериями или дикими дрожжами до
критического состояния почти невероятна — количество контаминантов обычно уве-
личивается при брожении от цикла к циклу, постепенно, и поэтому показать развитие
этой проблемы могут рутинные микробиологические анализы. Простейшим анализом
уровня инфицирования, который может применяться даже на примитивных пивова-
ренных производствах, является дегустация бродящего пива. Нежелательное измене-
ние вкуса и аромата пива дает пивовару информацию об уровне инфицирования и воз-
можности дальнейшего использования дрожжей.
«Верховые» дрожжи при брожении традиционного эля образуют шапку, а съем
дрожжей производят в ходе наиболее активной фазы брожения — в середине лога-
рифмической фазы, если использовать термины, описывающие развитие дрожже-
вой клетки. У этой системы два преимущества: во-первых, дикие дрожжи, не образу-
ющие развитую пену, и бактерии-контаминанты остаются в основном в бродящем
пиве, и, во-вторых, даже если дрожжевая культура представляет собой смесь штам-
мов, она собирается на том же этапе брожения, и пропорции отдельных штаммов
в смеси остаются теми же. Многие предприятия, работающие по традиционным тех-
нологиям, использовали одни и те же дрожжи в течение многих лет, а иногда и не-
скольких столетий. В сильно охмеленных крепких элях сочетание высокого содер-
жания хмеля, высокой начальной плотности и высокой концентрации спирта
в конечном продукте уменьшает возможность возникновения благоприятных усло-
вий для роста диких дрожжей. Учитывая, что большинство бактерий менее устойчи-
вы к воздействию кислот, чем S. cerevisiae, на многих предприятиях для уничтоже-
ния бактерий-контаминантов дрожжевую культуру регулярно промывают кислотой
например, ортофосфорной) [13].
При брожении лагерного пива или эля в закрытых ЦКТБ с использованием дрож-
жей, не образующих обильную пену (что позволяет более эффективно использовать
объем емкости), съем дрожжей осуществляют при их оседании в конце брожения.
Обычно конус ЦКТ оснащается охлаждающей рубашкой, способствующей поддер-
жанию осевших дрожжей в хорошем состоянии. Известно, что жизнеспособность
дрожжей в пиве в результате долгого контакта с этиловым спиртом и другими по-
бочными продуктами метаболизма падает на несколько процентов, но при этом про-
является и защитный эффект, выражающийся в том, что погибают бактерии и дикие
Глава 1. Микробиологические аспекты пивоварения
17
дрожжи. Известно, что дрожжевые клетки неодинакового возраста обладают разной
способностью к седиментации [14], и частично это явление объясняется большим
количеством образующихся при почковании «шрамов» у старых клеток. Это приво-
дит к формированию в конусе бродильного танка слоев дрожжей разного возраста и
жизнеспособности, в связи с чем для размножения следует брать более молодые
дрожжи из верхнего слоя.
Хотя первые ЦКТБ имели такие же размеры, что и старые бродильные чаны,
в настоящее время общепринятым стало проектирование крупных ЦКТБ, вмещаю-
щих несколько варок, и это порождает микробиологические проблемы. Для предот-
вращения контаминации в первую поступающую в танк варку необходимо внести
дрожжи. При этом возникает вопрос: засевать ли дрожжи поэтапно на каждую варку
в соответствии с ее объемом или задавать в первую варку все дрожжи, рассчитанные
на весь танк? Еще более серьезен аналогичный вопрос относительно растворенного
кислорода, так как если дрожжи при необходимости можно засеять позже, то позд-
няя аэрация может вызвать проблемы с образованием вкуса и аромата. На самом
деле эти вопросы являются частью проблемы выбора наилучшего технологического
режима. Естественно, существует некий максимальный размер ЦКТБ, ограничен-
ный производительностью варочного отделения — при не соблюдении этого усло-
вия может сложиться ситуация, когда дрожжи в ЦКТБ будут ферментировать сусло
быстрее, чем будет производиться очередная порция сусла.
1.4.2. Бродильные емкости и их обвязка
Как уже упоминалось выше (см. раздел 1.3), для варочных емкостей достаточно
лишь мойки, тогда как для бродильных аппаратов, трубопроводов и соединительной
арматуры необходимы и мойка, и стерилизация. Эти процедуры и основные причи-
ны их необходимости мы рассмотрим в главе 11, но достижение стандартов микро-
биологической чистоты зависят не только от надлежащей стерилизации. Не менее
важно проектировать емкости и трубопроводы таким образом, чтобы максимально
уменьшить риск их инфицирования.
Ниже мы рассмотрим несколько примеров, демонстрирующих основные принци-
пы конструирования установок, которые позволяют поддерживать чистоту и сте-
рильность культуры дрожжей. Следует избегать абсолютно плоских поверхностей,
так как при мойке разбавленные остатки сусла и пива могут образовывать лужицы,
в которых достаточно питательных веществ для роста вредных микроорганизмов.
В связи с этим трубопроводы на протяжении всей длины должны иметь постоянный
уклон или, если это невозможно, слив в наиболее низкой точке. Существует вариант,
когда трубы при простое заполняют стерилизующим раствором, но в этом случае
трубопроводы и клапаны необходимо проектировать особым образом, препятствуя
смешиванию сред (стерилизующего раствора с суслом и пивом). Наиболее удачное
решение проблемы мойки при проектировании танка — это коническое или вогну-
тое дно со сливом в наиболее низкой точке. Для качественной мойки танк или бро-
дильная емкость с плоским дном должны иметь небольшой уклон к сливу, все углы
должны быть скруглены, а внутренняя поверхность должна быть гладкой без каких-
либо выступов. Внутренние препятствия типа змеевиков охлаждения не позволяют
проводить надлежащую мойку, в связи с чем регулирование температуры следует
18
Йен Кэмпбелл
проводить при помощи рубашек. Для работы в условиях стерильности с чистой куль-
турой не годятся некоторые типы клапанов. С микробиологической точки зрения
для клапана трубопровода на пивоваренном производстве необходимы следующие
свойства: а) должен быть исключен контакт пива или других жидкостей с потенци-
ально загрязненной окружающей средой и б) вся внутренняя поверхность клапана,
находящаяся в контакте с пивом, должна стерилизоваться в один прием. Важны и
другие особенности — например, обеспечение несмешиваемости сред, но это уже не
относится к микробиологии.
1.4.3. Воздух
Воздух несет в себе риск микробиологического загрязнения по двум причинам.
Первая причина касается предприятий с традиционными открытыми емкостями.
В атмосфере бродильного отделения могут присутствовать вредные микроорганиз-
мы из брызг, образующихся при мойке соседнего танка; пыли, содержащей остатки
злаков, которые переносятся по воздуху из дробильного отделения; бактерии и
дрожжи (в основном с окружающих здание растений и цветов), привнесенные вен-
тиляцией. В определенное время года (особенно осенью) содержание в воздухе мик-
роорганизмов животного и растительного происхождения достигает концентрации
2,5105 дрожжеподобных грибов/м3 [6]. В период сельскохозяйственных работ кон-
таминация находящимися в воздухе микроорганизмами может нарушить работу
предприятия, даже если оно находится в центре города на большом расстоянии от
полей.
Второй причиной является аэрация сусла. Несмотря на ее необходимость с био-
химической точки зрения (см. главу 2), при этом возможно микробиологическое за-
грязнение. Адиабатическое нагревание воздуха в компрессоре не достаточно для его
стерилизации, в связи с чем воздух должен проходить через обеспложивающие
фильтры. В настоящее время на многих предприятиях для обеспечения высокого
уровня растворения кислорода, необходимого при ферментации высокоплотного
сусла, используются баллоны со сжатым кислородом (при использовании сусла
в 1,5-2 раза более плотного, чем обычно, необходимо соответствующее повышение
уровня растворенного кислорода), а поскольку чистый кислород стерилен, его фильт-
ровать не нужно.
1.5. Послебродильные операции
Хотя большинство послебродильных операций в производстве пива связаны в ос-
новном с решением инженерных проблем, у них имеются биохимические и микро-
биологические аспекты. Биохимические аспекты дображивания мы рассмотрим
в главе 2, а здесь затронем микробиологические аспекты некоторых послебродиль-
ных операций.
1.5.1. Осветление
Обычно пиво фильтруют до «бриллиантовой» чистоты (за исключением бочково-
го, которое осветляют оклеивающими веществами, см. раздел 1.5.2). В настоящее
время использование асбеста запрещено, и вместо него в качестве фильтрующей сре-
ды применяют волокна целлюлозы или частицы диатомита или перлита с точно за-
Глава 1. Микробиологические аспекты пивоварения
19
данными размерами частиц. Фильтры из целлюлозы должны либо а) иметь доста-
точное количество листов (для обеспечения необходимой фильтрующей поверхно-
сти, соответствующей запланированной скорости потока, либо 6) слои волокон цел-
люлозы должны быть нанесены на перфорированную основу из нержавеющей стали.
При этих способах суспензию диатомита обычно дозируют в поток неосветленного
пива, создавая тем самым дополнительный фильтрующий слой. По мере роста коли-
чества намытого материала увеличивается способность к удерживанию частиц.
Хотя теоретически эти материалы можно использовать для обеспложивания пива,
однако это не целесообразно, так как достаточно мелкие частицы фильтровальных
материалов существенно снижают поток пива [7]. Пространство между волокнами
и частицами зачастую бывает больше размера дрожжевых клеток, и микроорганиз-
мы и вещества мути задерживаются в фильтрующем слое под действием статическо-
го электричества, а высокая скорость потока и большой перепад давлений в фильтре
приводят к вымыванию из него микроорганизмов. Обычно фильтрование проходит
при низких температурах (около О °С) — в основном в целях образования «холод-
ной» мути, которая затем отфильтровывается из пива. Кроме того, что низкие темпе-
ратуры предотвращают или, по крайней мере, ограничивают рост микрофлоры
в пиве или в фильтре. Если дрожжи все же размножаются, то дрожжевая почка мо-
жет перейти в фильтрат — несмотря на то что материнская клетка будет задержана
в фильтре.
Такие фильтры можно применять для уменьшения содержания дрожжей до
10 клеток/л, намного меньше, чем 105 клеток/л (такое количество образовывает ви-
димую муть). При больших объемах производства пиво, отфильтрованное подобным
образом, может покинуть бродильное отделение без дальнейшей обработки, и мож-
но быть уверенным, что в течение некоторого короткого периода хранения (не более
недели, желательно около 3 сут) отсутствует риск, что это небольшое количество
клеток возрастет до критического уровня. Для увеличения срока годности пива его
пастеризуют. В этом случае можно применять большую скорость потока через
фильтр. Хотя пиво, содержащее до 100 клеток культурных дрожжей/л, можно обезо-
пасить путем его пастеризации, все же следует стремиться к наименьшему количе-
ству дрожжей в пиве до пастеризации.
Вместе с тем все популярнее становятся мембранные обеспложивающие фильт-
ры, особенно на небольших и средних предприятиях, хотя обеспложивающее фильт-
рование и асептический розлив применяют и на крупных пивзаводах [15]. Для пива,
отфильтрованного через такие фильтры, не нужна пастеризация, и таким образом
экономится энергия и устраняются возможные негативные изменения вкуса и аро-
мата пива, возникающие при его нагреве. Мембранные фильтры — это полностью
механические устройства с размером пор около 0,45 мкм, в которых задерживаются
бактерии, дрожжи и мутеобразующие вещества. Преимущество мембранного фильт-
ра заключается в том, что у него не ограничено рабочее давление, а недостаток —
в том, что некоторое количество частиц может быстро его «забить». Минимизиро-
вать этот недостаток можно применением тангенциально-поточного фильтрования,
но и в этом случае обычно используют два последовательно соединенных фильтра.
Путем предварительного грубого фильтрования удаляют по возможности различ-
ные инородные тела и микробную биомассу, а затем с помощью мембранного фильт-
20
Йен Кэмпбелл
pa пиво стерилизуют, тем самым обеспечивая повышенную скорость потока и долго-
вечность фильтра. Обеспложивающие фильтры могут быть изготовлены как из
неорганических материалов (керамики или композитных материалов), так и из орга-
нических (например, из ацетата целлюлозы или поликарбонатов) [2].
1.5.2. Оклейка
Эффективными осветляющими веществами являются различные коллагены и
другие животные белки. Они действуют в течение нескольких недель и широко ис-
пользуются в виноделии. Для производства пива это слишком долго, и для осветле-
ния традиционного английского бочкового пива применяют рыбий клей, который
изготавливают из плавательных пузырей крупных тропических рыб (крупных из-за
удобства извлечения пузырей, а тропических — из-за более высокой сопротивляемо-
сти к денатурации белков под воздействием температуры). Эти плавательные пузы-
ри сушат и растворяют в пищевых органических кислотах (лимонной, яблочной или
винной). Смешивание необходимо проводить в холоде и с минимальным сдвигом.
Молекулы рыбного коллагена в рыбьем клее чувствительны к нагреванию и механи-
ческому воздействию, которые существенно уменьшают оклеивающую способность,
зависящую от молекулярной массы (в идеале, не менее 400 кДа). Вязкий раствор
рыбьего клея хранят при 2-4 °С с использованием в качестве антибактериального
консерванта S02, которая на этой стадии технологического процесса также препят-
ствует попаданию растворенного кислорода.
Большинство дрожжей в конце процесса ферментации оседают, и в суспензии ос-
тается лишь 105-106 клеток дрожжей/мл. Эти дрожжи выполняют дображивание
в бочках оставшихся сбраживаемых Сахаров (или сахара, добавленного при розливе
в бочки) до 1%. В бочках, отправляемых в торговлю, процесс дображивания еще не
закончен, и таким образом пивовар и бармен будут зависеть от действия рыбьего клея,
осветляющего пиво до приемлемой прозрачности. Рыбий клей не является особо
мощным коагулянтом — в случаях нарушения режима транспортировки и при обра-
зовании С02 в ходе дображивания в бочке он не эффективен. Дрожжи захватываются
сетеподобной структурой рыбьего клея и оседают на дне бочки (обычно по стенкам)
лишь через некоторое время, и поэтому рыбий клей является идеальным коагулян-
том для применения вне пивзавода — он быстро (в пределах суток) действует в спо-
койном пиве и сохраняет свою активность при тряске во время перевозки или хране-
ния в погребе. Кроме того, некоторые пивоваренные предприятия в настоящее время
применяют его для предварительного осветления пива еще до розлива в бочки, банки
или кеги, уменьшая тем самым нагрузку на фильтры.
1.5.3. Микробиологические аспекты розлива
Бочковое пиво занимает лишь небольшую долю рынка Великобритании и Север-
ной Америки, и фактически его больше нигде не производят. В пивоварении приме-
няют два основных принципа разлива: а) стерилизация пива до асептического роз-
лива в чистые и стерильные емкости (обычно кеги), и б) розлив отфильтрованного
пива в чистую тару (обычно стеклянные бутылки и металлические банки с последу-
ющей пастеризацией, увеличивающей срок хранения (по меньшей мере до 6 мес,
в настоящее время — до 1 года). В обоих случаях тепловая обработка в пастеризаци-
Глава 1. Микробиологические аспекты пивоварения
21
онных единицах одинакова (1 ПЕ = 60 °С/мин). В туннельных пастеризаторах, при-
меняемых для пастеризации бутылок и банок, используют более низкие температу-
ры (обычно 60-62 °С), но пастеризация ведется более продолжительное время. Не-
которые предприятия предпочитают свои системы пастеризации. Теоретически
пастеризации в 5 ПЕ достаточно для гибели небольшого количества прошедших че-
рез фильтры пивных дрожжей, но точно обеспечить подобный уровень довольно
сложно; чтобы уничтожить присутствующие в пиве более термоустойчивые бакте-
рии или дикие дрожжи, может возникнуть необходимость в пастеризации до 30 ПЕ.
Так как увеличение интенсивности тепловой обработки может негативно сказаться
на вкусе и аромате пива (особенно при случайном попадании при розливе атмосфер-
ного кислорода в верхнюю часть бутылки или банки), выбор степени пастеризации
(в ПЕ) должен быть компромиссом между потенциальным риском образования «зат-
хлого» окисленного вкуса и микробиологический чистотой.
Бутылки и банки часто используют для розлива небольших объемов пива. Если
алюминиевые или стальные банки не несут в себе риска микробиологического за-
грязнения, то для розлива в возвратную или одноразовую стеклянную или пласт-
массовую тару (обычно ПЭТ-бутылки) требуются особые системы обеспечения сте-
рильности.
1.5.4. Стеклянные бутылки
Во многих странах по экономическим причинам и в связи с проблемами охраны
окружающей среды применяется система возврата бутылок. Так как после использо-
вания бутылки могут быть сильно загрязнены, перед повторным их использованием
необходима тщательная мойка и стерилизация. Конвейер бутылкомоечной машины
проходит через следующие секции: а) мойка щелочным дезинфицирующим сред-
ством с удалением этикеток, мойка и дезинфекция внутренней поверхности бу-
тылки, б) ополаскивание горячей водой, удаляющей остатки моющего средства, и
в) сушка. После этого бутылки сразу же поступают на розлив. Микробиологическая
чистота и корректная работа оборудования постоянно контролируются путем слу-
чайного отбора бутылок с участка между мойкой и розливом. Одноразовые бутылки
не требуют тщательной мойки — для удаления загрязнений, образующихся во время
хранения, достаточно их промыть струей горячей чистой воды непосредственно пе-
ред розливом, но и в этом случае необходим выборочный контроль чистоты. Воз-
вратные и одноразовые бутылки не рекомендуется путать, так как они выпускаются
в соответствии с различными ТУ, хотя за исключением мойки процесс розлива в них
одинаков.
При использовании сложного высокоскоростного оборудования типовой процесс
розлива состоит в том, что в каждую бутылку дозируется осветленное отфильтрован-
ное пиво с содержанием микроорганизмов < 100 КОЕ/л. Для достижения приемле-
мой стойкости пива необходимо, чтобы содержание кислорода в таре фактически рав-
нялось нулю. Для вытеснения воздуха из каждой бутылки обычно непосредственно
перед розливом используют двуокись углерода или азот; пена заполняет свободное
пространство бутылки, но не переливается через край. Для контроля вспенивания
при приближении к укупорочному автомату каждую бутылку ударяют небольшим
молоточком, или вспенивание регулируют путем впрыска небольшого количества
22
Йен Кэмпбелл
воды (< 1 мл). Важно, чтобы С02 и N2 были стерильны, а впрыскиваемая вода — не
только стерильна, но и деаэрирована. После укупорки (пробки должны быть стериль-
ны) бутылки проходят через пастеризатор, где температура постепенно поднимается
до 60-62 °С и выдерживается до достижения необходимого количества ПЕ. Затем
бутылки опрыскивают холодной водой, охлаждая их до температуры окружающей
среды (для предотвращения «перепастеризации» из-за постепенного охлаждения).
Затем следует этикетирование и упаковка, которые с микробиологической точки зре-
ния интереса не представляют.
1.5.5. Банки
Розлив в банки во много схож с розливом в одноразовые бутылки — от предвари-
тельной внутренней промывки до охлаждения после пастеризации, причем мини-
мальны и последующие отличия: не нужны этикетки и требуется меньше защитной
упаковки. Источником контаминации баночного пива могут быть виджеты, образу-
ющие пену, в связи с чем они и содержащийся в них газ должны стать предметом
микробиологического анализа.
1.5.6. Розлив пива, подвергшегося обеспложивающему
или ускоренному фильтрованию
ПЭТ и другие пластиковые бутылки недостаточно устойчивы к тепловой обработ-
ке и не выдерживают пастеризации, в связи с чем пиво необходимо стерилизовать
еще до розлива в них. На некоторых предприятиях обеспложивающее фильтрование
применяют для экономии энергии и предотвращения снижения вкусовых свойств.
В обоих случаях требования к стерильности предъявляются не только к пиву, но и
к таре и оборудованию розлива. Температура при производстве новых стеклянных
или ПЭТ-бутылок гарантирует их стерильность, но контаминация возможна при
транспортировке или хранении тары. Их моют также струей теплой чистой воды не-
посредственно перед розливом. В настоящее время имеется оборудование асептиче-
ского розлива напитков с защитой заполняемого пространства стерильным газом
(С02 или N2). Таким образом, проблемы розлива несколько отличаются от проблем
с пастеризацией пива.
1.5.7. Пиво в кегах
При розливе в кеги возвратная тара проходит следующие этапы: а) ополаскивание
и слив, б) мойка соответствующим моющим средством, в) стерилизация паром (кон-
денсат используется для окончательного ополаскивания), и д) розлив (на некоторых
установках этапы а) и б) совмещены). На большинстве линий кеги проходят через
систему параллельных линейных конвейеров, но современные линии основаны на
карусельном принципе (аналогично системам розлива в бутылки и банки). Следует
внимательно подходить к выбору моющего средства. Каустическую соду не следует
использовать для мойки алюминиевых кег (NaOH вступает в реакцию с алюминием,
образуя газообразный водород, см. главу 11), а в кегах, изготовленных из нержавею-
щей стали, она инактивируется остаточной двуокисью углерода. При ограниченном
времени обработки каждого кега наиболее практичный метод — стерилизация па-
ром. Так как дозирующее устройство соприкасается с кегой физически, риск конта-
Глава 1. Микробиологические аспекты пивоварения 23
минации довольно низок (при условии, что система розлива и трубопроводы во вре-
мя каждой пересменки моются и стерилизуются).
1.5.8. Отпуск пива в розлив
Как и во всей пищевой промышленности, отпуск пива в розлив должен соответ-
ствовать стандартам, утвержденным органами здравоохранения. Пивоваренные
предприятия заинтересованы в том, чтобы люди были удовлетворены качеством
пива и чтобы его потребление увеличивалось. Без соответствующих санитарно-ги-
гиенических мероприятий в местах хранения, регулярной мойки и дезинфекции
труб разливочного аппарата микробиологическая порча пива неизбежна. Несмотря
на все микробиологические преимущества, требовать ежедневной их мойки не сто-
ит — ее проводят не реже раза в неделю (остатки пива удаляют из линии, трубопро-
воды заполняют моющим/дезинфицирующим средством и выдерживают в течение
ночи). Наиболее подвержены контаминации а) соединение кега с разливной труб-
кой, б) все стыки трубопроводов, в) разливной патрубок на стойке, но согласно [5],
отмечается и развитие инфицирующий микрофлоры на шершавых участках старых
труб (данные получены после их демонтажа). Все подозрения на возможную порчу
пива в результате неправильного проведения розлива должны сниматься путем про-
ведения микробиологического анализа (чаще всего применяют исследование маз-
ков, взятых с участков а), б) и в).
1.6. Краткое резюме
Пивоварение относится к микробиологическим процессам. Сегодня, когда миром
правят высокие технологии, легко забыть о том, что основное в производстве про-
дуктов брожения — это дрожжи, преобразующие сахара в спирт с достижением точ-
но сбалансированного вкуса и аромата готового продукта (будь то пиво, вино или
виски). В настоящее время мы только начинаем понимать деятельность дрожжей на
все усложняющемся геномном уровне, и в главах 2 и 3 мы подробно рассмотрим фи-
зиологию и генетику дрожжей применительно к брожению пива.
При брожении должны быть созданы условия, исключающие присутствие диких
дрожжей и бактерий, ведущих к порче пива. Природа этих организмов, источниками
которых являются ячмень и солод, с их характеристиками, влиянием на готовый
продукт и процесс брожения, методы определения и уничтожения будут рассмотре-
ны в главе 4. Мы надеемся, что внимание к микробиологическим основам производ-
ства пива приведет к улучшению стойкости и качества продукта и прочим положи-
тельным следствиям.
Литература
1. Carvell, J. P. // Ferment. - 1997. - № 10. - Р. 261.
2. Dunn, А. Е., Leeder, G. I., Molloy, F., and Wall, R. // Ferment, -1996. - 9. - P. 155.
3. Hammond, J. R. M, Brennan, M, Price, A. //J. of the Institute of Brewing. -1999. -105. - P. 113.
4. Handbook of Brewing / Hardwick, W.A. (ed.). - NY: Dekker, 1995.
5. Harper, D. R. // Brewers Guardian. -1981. - 110(7). - P. 23.
6. Last, F. T, Price, D. T. // The Yeasts, Vol. 1, Biology of Yeasts (eds A. H. Rose, J. B. Hamson). -
London: Academic Press, 1969. - P. 183.
24
Йен Кэмпбелл
7. Leeder, G. I. // Ferment. - 1998. -№ 11. - P. 108.
8. Lewis, M. J., Young, T. W. Brewing. — London: Chapman and Hall, 1995.
9. Matini, A. V., Young, T. W. // International J. of Systematic Bacteriology. -1985. -№ 35. -
P. 508.
10. Moll, M. Beers and Coolers. — Andover: Intercept, 1994.
11. Palmer G. H. Cereal Science and Technology. — Aberdeen: Aberdeen University Press, 1989.
12. Simpson, W.J. //J. of the Institute of Brewing. - 1993. - № 99. - P. 405.
13. Simpson, W. J., Hammond, J. R. M. // J. of the Institute of Brewing. -1989. - № 95. -
P. 347-354.
14. Smart, K. A. // Brewers Guardian. -1999. - N° 128. - P. 19.
15. Tagaki, S. // Ferment. - 1993. -№ 6. - P. 185.
16. Van Oevelen, D., Spaepen, M., Timmermans, P., Verachtert, H. // J. of the Institute of
Brewing. - 1977. - № 83. - P. 356.
Глава 2
БИОХИМИЯ И ФИЗИОЛОГИЯ РОСТА ДРОЖЖЕЙ
Дж. Колин Слотер (J. Colin Slaughter)
2.1. Введение
Дрожжи — это эукариотические одноклеточные организмы, подобные на биохими-
ческом уровне всем остальным эукариотическим клеткам. В последнее время в боль-
шинстве исследований дрожжей эти организмы использовались как модели для изу-
чения более сложных эукариотов — не столько из-за подлинного интереса к свойствам
организма при промышленном брожении, сколько из-за простоты их культивирова-
ния и достижений генетики по анализу полной геномной структуры [39], а также из-за
легкости работы с ними. В последнее время получена обширная информация по био-
химии и молекулярной биологии дрожжей, и цель этой главы — осветить наиболее
важные аспекты при производстве пива. Основные материалы приведены в известных
учебниках [69,108,118], в посвященных дрожжам книгах [27,107,114] и на большом
количестве веб-сайтов (например, база данных по геному Saccharomyces находится
на сайте http://genome-wwwstandford.edu/Saccharomyces> а много методик работы с ге-
номами и протеомами Saccharomyces — на сайте http://scientistcentral.com.
2.2. Клеточный цикл
Будучи помещенными в жидкую питательную среду (такую, как сусло) при тем-
пературе от 5 до 35 °С, дрожжевые клетки начинают размножаться, и продолжается
это до тех пор, пока не будет исчерпано хотя бы одно из необходимых питательных
веществ. Каждая клетка последовательно проходит ряд этапов, известных под назва-
нием клеточного цикла [115]. В результате клеточная масса и размеры клеток увели-
чиваются (фаза Gj), и при достижении некоторого критического размера происхо-
дит синтез ДНК наряду с началом формирования почки (5-фаза). После этого
начинается митоз (М-фаза), при котором хромосомы разделяются на две, одна из
которых с необходимыми цитоплазматическими органеллами проникает в развива-
ющуюся почку. Затем синтезируется перегородка для отделения почки от материн-
ской клетки, и в некоторый момент времени вновь образованная дочерняя клетка
отделяется. У Saccharomyces cerevisiae между 5- и М-фазами нет четкой фазы Gv как
у некоторых других типов клеток. У некоторых штаммов пивных дрожжей почки не
отделяются от клеток, в связи с чем появляются короткие цепочки из клеток. Как
известно, до начала 5-фазы клетка должна достичь некоторого минимального разме-
ра, и только тогда материнская клетка будет почковаться, образуя новую дочернюю
клетку. Процесс почкования продолжается, если состав жидкой питательной среды
соответствует потребности дрожжей, в противном случае они переходят в стацио-
нарную фазу GQ. Такие клетки характеризуются низкой скоростью обмена веществ
и (по сравнению с растущими клетками) значительной устойчивостью к стрессу.
При постоянных стрессовых условиях наблюдается рост псевдомицелия, пред-
ставляющего главное изменение модели роста и клеточного цикла. Клетки удлиня-
26
Дж. Колин Слотер
ются, почкование становится униполярным, и почки не отделяются от материнской
клетки [37].
2.3. Рост клеток и цикл брожения
В пивоварении дрожжевые клетки выращивают, во-первых, для накопления необ-
ходимого количества семенных дрожжей. При этом процесс культивирования осуще-
ствляется в аэробных условиях и продолжается до достижения необходимого коли-
чества биомассы. Во-вторых, прирост биомассы во время брожения ограничивается
одной-двумя генерациями (клеточными циклами), так как при получении пива важ-
нейшей задачей является спиртовое брожение. С биохимической точки зрения меж-
ду двумя этими процессами разница незначительна. Брожение проходит достаточно
сложно, так как при этом ставится несколько целей — экономичное преобразование
сусла в пиво, обеспечение желаемых качественных характеристик (рН, содержания
спирта, профиля ароматических соединений, накопление биомассы дрожжевых кле-
ток с достаточно высокой жизнеспособностью, чтобы их можно было использовать в
качестве семенных дрожжей при последующих брожениях, и т. п.).
Во время роста дрожжевые клетки потребляют сахара, азотистые соединения, ионы
неорганических соединений и витамины. В результате рН среды падает до величины
4,0, при этом выделяются этиловый спирт и двуокись углерода (от 35 до 70 г/л в зави-
симости от плотности сусла и достигнутой степени сбраживания). Также выделяют-
ся некоторые органические вещества и неорганические соединения серы, количество
которых колеблется от 0,1 до 50 мг/л. Многие из этих соединений очень важны для
образования аромата, и их трудно контролировать в производственной практике.
Неизменные качественные характеристики разных партий одного пива обеспечива-
ются использованием семенных дрожжей с высокой жизнеспособностью и энергией,
постоянной продолжительностью брожения при контролируемой температуре и про-
должительностью созревания в присутствии дрожжей. Важный аспект биохимии
дрожжей, не связанный с ароматом, — это флокуляция дрожжей, то есть группирова-
ние клеток с образованием агломератов клеток, которые, связываясь с пузырьками
газа, могут подниматься на поверхность или опускаться на дно. Это явление привело
к введению понятий «верховые» или «низовые» пивоваренные дрожжи. Очень важ-
но, чтобы дрожжи флокулировали тогда, когда это требуется. Если это происходит
очень рано и брожение не завершается, то это будет иметь неприятные последствия
для качества пива, а если флокуляция произойдет слишком поздно, то выделение
дрожжей из конечного пива будет затруднено.
2.4. Состав клетки, ее питание и основной метаболизм
Подобно другим живым клеткам, дрожжевые клетки в основном состоят из воды,
а сухие вещества представлены главным образом полимерными соединениями — уг-
леводами, белками и нуклеиновыми кислотами, в состав которых входит шесть эле-
ментов (углерод, водород, кислород, азот, фосфор и сера). Дрожжевые клетки могут
расти в относительно простой среде, используя в качестве сбраживаемых Сахаров
глюкозу, фруктозу, галактозу, сахарозу, мальтозу или мальтотриозу. Источником азо-
та для них служат аммоний, мочевина или аминокислоты. Кроме того, для размноже-
ния дрожжей необходимы фосфаты, сульфаты, хлориды, кислород, а также ряд ионов
Глава 2. Биохимия и физиология роста дрожжей
27
металлов (калия, магния, кальция, железа, меди, цинка и марганца). Большинство
штаммов дрожжей нуждаются в небольших количествах одного или нескольких
витаминов (биотина, пиридоксина, пантотеновой кислоты, тиамина, мезоинозитола,
р-аминобензойной кислоты и никотинамида). Потребность в этих витаминах зависит
от штаммовых особенностей дрожжей. Дрожжи могут расти анаэробно, однако для
анаэробного роста более двух генераций среда должна содержать длинноцепочечные
ненасыщенные жирные кислоты и эргостерин.
2.5. Энергитический и промежуточный метаболизм
Знания в этой области уже достаточно устоялись, и основные сведения приводят-
ся в известных учебниках и на веб-сайтах, в связи с чем ниже мы рассмотрим эти
аспекты лишь в общих чертах. Как уже отмечалось выше, энергия, необходимая для
проведения биосинтеза и до некоторой степени для контролируемой деградации по-
лимерных компонентов клеток, образуется при распаде моносахаридов (в частно-
сти, глюкозы) и некоторых простых олигосахаридов. В результате гликолиза (путь
Эмбдена-Мейргофа, Embden-Meyerhof) (рис. 2.1) из 1 моля глюкозы образуется 2 моля
пировиноградной кислоты (пирувата). Затем 1 моль пирувата при участии пируват
декарбоксилазы и алкогольдегидрогеназы преобразуется в 1 моль этилового спирта
и 1 моль диоксида углерода. Биологическая задача этих двух последних реакций —
окисление НАДН, образовавшегося ранее при участии глицеральдегид-3-фосфат-
дегидрогеназы, до никотинамидадениндинуклеотида (Н АД+), что позволяет продол-
жить перенос углерода и синтезировать аденозинтрифосфат (АТФ). Данный путь
включает как утилизацию, так и образование АТФ, давая чистый прирост АТФ в
2 моля на каждый моль перерабатываемой глюкозы. Это отражает поглощение толь-
ко около 4% аккумулируемой в сахаре энергии. Такой неэффективный процесс спир-
тового брожения происходит до тех пор, пока концентрация сахара превышает 5 г/л;
при более низких концентрациях глюкозы в присутствии кислорода S. cerevisiae ме-
таболизируют сахара путем более эффективного процесса митохондриального окис-
лительного фосфорилирования, обычно используемого эукариотами. При окисли-
тельном фосфорилировании из пирувата образуется в основном ацетил-КоА, а не
ацетальдегид. Далее метаболизм осуществляется в цикле трикарбоновых кислот
(ЦТК) и цепи переноса электронов. В результате образуется около 30 моль АТФ на
1 моль глюкозы. Сахара полностью окисляются до воды и двуокиси углерода.
АТФ используется клетками для поддержания клеточных структур и регулирова-
ния их состава, а также для увеличения клеточной массы как термодинамическая
движущая сила. Основными реакциями здесь являются биосинтез полисахаридов,
белков и нуклеиновых кислот во время роста [69, 109, 119]. Углеродные мономеры
полимеров образуются при промежуточном гликолизе и через этапы процесса ЦТК.
Например, накопление полисахарида гликогена происходит за счет глюкозо-6-фос-
фата — так же, как и глюкана клеточных стенок, хитиновых и маннозных частиц гли-
копротеинов (рис. 2.2); липиды образуются из ацетил-КоА. Синтез фосфолипидов и
сфинголипидов идет при участии аминокислоты серина (рис. 2.3); предшественни-
ки (прекурсоры) аминокислот, нуклеиновых кислот и белков образуются из 3-фос-
фоглицерата, пирувата, фосфоенолпирувата, эритрозо-4-фосфата, оксалоацетата и
2-оксоглутарата (табл. 2.1). Использование оксалоацетата и 2-оксоглутарата в каче-
28
Дж. Колин Слотер
Глюкоза
АТФ-
Гвксокиназа
1
АДф-
Глюкозо- 6-фосфат
I Фосфогексоимераза
Фруктозо-6-фосфат
АТФ^1
1 Фосфофруктозокиназа
АДФ^Ч
Фруктозо-1,6-дифосфат
Альдолаза
ТриозофосА.
Дигидроксиацетон-фосфат изомераза Глицеральдегид-3-фосфат
глицвральдвгид-3-фосфат-дегидрогеназа
НАДН
Глицерат-1,3-дифосфат
АДФ->1
АТФ^1
3-фосфоглицераткиназа
f
Глицерат-3-фосфат
I Фосфоглицеромутаза
Глицерат-2-фосфат
| Енолаза
Фосфоенолпируват
АДФ -J
Пируваткиназа
АТФ ^
Пируват
Пируватдекарбоксилаза
Алкогольдегидрогеназа
Ацетальдегид —^* *^» Этанол
со2 С > +
НАДН НАД+
Рис. 2.1. ПутьЭмбдена-Мейергофа(гликолитический)
v^ Пирув
Глава 2. Биохимия и физиология роста дрожжей
29
Глкжозо-6-фосфат
Мугаза
Глюкозо-1 -фосфат
УТФ >J
J
Изомвраза Изомвраза
* ъ Фруктозо-6-фосфат * »" Манноэо-6-фосфат
i
Пирофосфорилаза
Глутамин
Амидотрансфераза
Глутамат
Глюкозамин-6-фосфат
Ацетил КоА
Ацетилаза
Мугаза
УДФ глюкоза
А
А
Синтетаза
УДФ
Гликоген р-глюканы
КоА
N-ацетилглюкоэамин-в-фосфат
Мугаза
N-ацвтил глюкоэамин-1 -фосфат
УТФ
Маннозо-1-фосфат
ГТФ -J
А
Пирофосфорилаза
ФФн
ГДФ манноза
Протеин «^ I
А
ГДФ
Гликопротеин
Трансферам
<MV
А
Пирофосфорилаза
УДФ- N- ацетилглкжозамин
УДФ
Синтетаза
Хитин
Рис. 2.2. Образование полисахаридов из глюкозо-6-фосфата
Ацетил-КоА ^^
Пальмитил-КоА ► Пальмитолеил-КоА
I Кислород
Стеарил-КоА
Олеил-КоА
:о>ат/
Глицерин-3-фосфат/ Глицерин-3-фосфат \ Серии Кислород
у ^"n!
Мевалонат
т
Сквален
N
Триацилглицерины Фосфолипиды Сфинголипиды
Рис. 2.3. Образование липидов из ацетилКоА
Стеролы
30
Дж. Колин Слотер
стве промежуточных продуктов метаболизма требует непрерывного синтеза оксало-
ацетата путем реакции двуокиси углерода с пируватом или фосфоенолпируватом
(рис. 2.4). Эту реакцию часто называют анаплеротической или восполняющей реак-
цией, так как благодаря ей образуется оксалоацетат, необходимый для осуществле-
ния реакций в ЦТК.
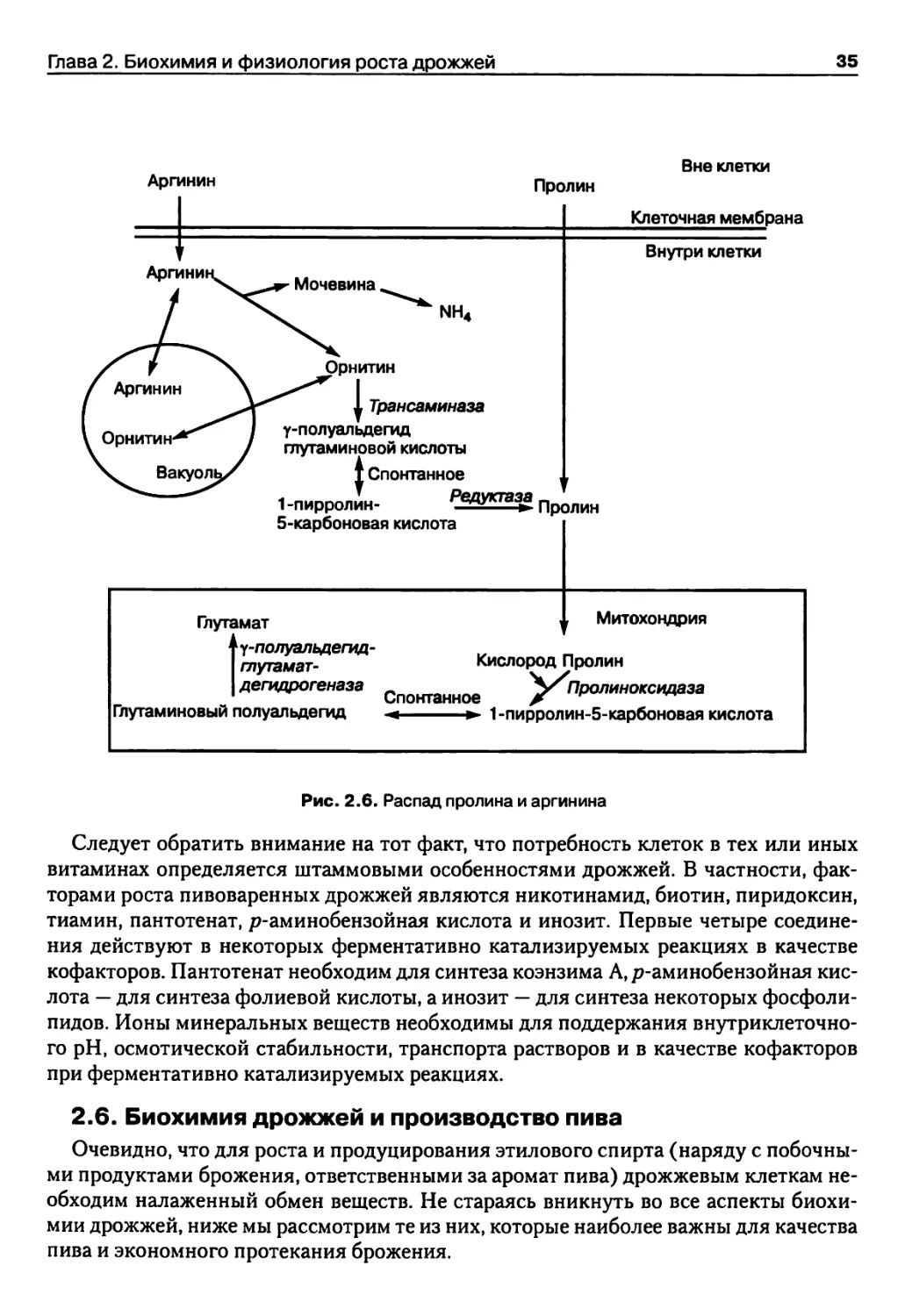
Азот поступает в клетку благодаря активному переносу аммония, аминокислот,
небольших пептидов или мочевины. После абсорбции мочевины образуется аммо-
ний (рис. 2.5а), который затем ассимилируется так же, как и аммоний, поступающий
Таблица 2.1. Биосинтетические взаимосвязи аминокислот
2-оксокислота
3-фосфогидроксипируват
(из 3-фосфоглицерата)
Пируват
2-оксоизовалерат (из пирувата)
2-оксоизокапронат
(из пирувата через 2-оксоизовалерат)
2-оксо-З-метилвалерат
(из оксалоацетата через аспартат и треонин)
Оксалоацетат
2-оксоглутарат
2-оксоадипинат (из 2-оксоглутарата)
2-оксофенилпируват (из фосфоенолпирувата
и эритрозо-4-фосфат)
2-оксо-р-гидроксифенилпируват
(из фосфоенолпирувата и эритрозо-4-фосфат)
Предшественник
аминокислоты*
Фосфосерин
Алании
Валин
Лейцин
Изолейцин
Аспартат
Глутамат
а-аминоадипинат
Фенилаланин
Тирозин
Производные
аминокислоты
Серии, глицин,
цистеин, триптофан
Аспарагин, метионин,
треонин,изолейцин
Глутамин, аргинин,
пролин
Лизин
Тирозин
(кислородзависимый)
*Некоторые аминокислоты образуются путем прямого переаминирования 2-оксокислот.
В некоторых случаях эти соединения в дальнейшем метаболизируются до получения других
аминокислот. Главное исключение из правил составляют серии, лизин, глутамат, триптофан
и гистидин.
В этом случае продуктом переаминирования является фосфосерин, и серии образуется из
этого соединения под действием фосфатазы.
а-Аминогруппа лизина вводится переаминированием на промежуточном этапе с образо-
ванием а-аминоадипиновой кислоты. Вторая аминогруппа вводится из глутамата через про-
межуточный продукт сахаропин с образованием лизина.
Обычно глутамат синтезируется из эквивалента его оксокислоты (2-оксоглутарата) под
действием фермента НАДФН-глутаматдегидрогеназы. Трансаминаза работает при реакциях
биосинтеза других аминокислот, где аминогруппа глутамата переносится к оксокислоте с об-
разованием эквивалента аминокислоты и 2-оксоглутарата.
Триптофан синтезируется напрямую из индол-3-глицеринфосфата (полученного из фос-
фоенолпирувата и эритрозо-4-фосфата) замещением целой молекулы серина на фрагмент
глицеральдегид-3-фосфата.
Гистидин синтезируется из АМФ единственным путем. а-Аминогруппа вводится пере-
аминированием имидазолацетолфосфата, и продукт преобразуется в гистидин через две по-
следующие ферментативные реакции.
Глава 2. Биохимия и физиология роста дрожжей
31
в клетку из питательной среды. S. cerevisiae не могут утилизировать нитраты или
протеины. Аммоний преобразуется в глутамат в результате реакции, катализируе-
мой ферментом никотинамидадениндинуклеотидфосфатглутамат-дегидрогеназой
(НАДФ-глутаматдегидрогеназой) (рис. 2.56). Эта аминокислота может быть преоб-
разована в 3 другие аминокислоты — глутамин, пролин и аргинин путем изменения
углеродного скелета, оставляя неизменными а-аминогруппы. В других случаях
а-аминогруппа глутамата может быть использована для получения 2-оксокислоты
Фосфоенолпируват •
АДФ-
Цитрат
Цис-аконитат
Аконитат
Изоцитрат
Оксалоацетат
*, Аспартат
)ацетат ^** ^^ i
4 ( л
Глутамат 2-оксоглутарат
НАД+-^|
НАДН^4
Малат
А
Фумарат
4
НАДН
С02
2-оксоглутарат-^ Сукцинил-КоА-^ Сукцинат
NH4 I
НАДФН->1
НАДФ*
J
Глутамат
Рис. 2.4. Цикл трикарбоновых кислот и анаплеротическое образование оксалоацетата. Тонкие стрел-
ки показывают направления синтеза аспартата и глутамата. Толстые стрелки показывают два ана-
плеротических направления, пунктирные стрелки — реакции полного цикла ЦТК, осуществляюще-
гося в митохондриях
32
Дж. Колин Слотер
при реакции переаминирования с образованием новой аминокислоты и 2-оксоглута-
рата (рис. 2.5с). В некоторых случаях эти аминокислоты являются конечными про-
дуктами (например, тирозин, аланин, валин, лейцин и изолейцин), но в других слу-
чаях большинство аминокислот образуются путем изменения углеродного скелета
(табл. 2.1). Например, аспартат образуется переаминированием оксалоацетата, яв-
ляясь предшественником аспарагина, треонина и метионина, а также углеродным
предшественником изолейцина. Таким образом, глутамат действует как прямой пе-
реносчик азота от аммония в аминокислоты. В случае нескольких других аминокис-
лот (серина, глицина, цистеина, лизина, гистидина и триптофана) метаболические
пути являются более сложными (табл. 2.1) Как мы покажем ниже, при такой после-
довательности биосинтеза не существует непосредственно 2-оксокислотного пред-
шественника аминокислоты, являющейся важной характеристикой качества пива.
Источником азота по-прежнему прямо или косвенно является глутамат.
Хотя такой путь, катализируемый НАД-зависимой глутаматдегидрогеназой, явля-
ется основным способом ассимилирования аммония дрожжами, значение Км этого
фермента для аммония очень высоко, и при низких концентрациях источника азота
также используется дополнительная система. Она основывается на совместном дей-
ствии двух ферментов — глутаминсинтетазы, образующей глутамин из глутамата
путем добавления аммония (с низким значением А"м для аммония), и НАДФН-зави-
симой глутаматсинтазы (глутамат-оксоглутарат-аминотрансфераза или GOGAT),
Вне клетки
Клеточная
мембрана
Внутри клетки
Мочевина
NHJ
Аминокислоты •
Низкомолекулярные
пептиды
NH4
или /
глутамин."*' АТФ АДФ
7—Т
Карбамоилфосфат
-► Аминокислоты
^акуоль
Аминокислоты^
Рис. 2.5а. Источники азота и основные взаимодействия. Большая часть аммония в клетке преобра-
зуется в аминокислоты через глутамат. Энзимология синтеза карбамоилфосфата сложна, но соеди-
нение может сформироваться из аммония или глутамата, действующего как донор азота. Это тре-
буется для синтеза аргинина и пиримидиновых оснований
Глава 2. Биохимия и физиология роста дрожжей
33
Из глюкозы путем гликолиза
и реакций цикла ЦТК
2-оксогпутарат
НАДФН
NHJ
НАДФ'
Дегидрогеназа
Глутамат
Аминокислота
Трансаминаза
2-оксокислота
Из глюкозы через гликолиз, реакции цикла ЦТК,
реакции пентозофосфатного пути
До гпутамина, пролина и аргинина и анаплеротические реакции
Рис. 2.5Ь. Ассимиляция аммония
Аминокислота (R2) 2-оксокислота (R1)
2-оксокислота (R2)
/
Биосинтез из глюкозы
Трансаминаза
Аминокислота (R1)
\
Из внешней среды
Рис. 2.5с. Ассимиляция внешних аминокислот путем переаминирования
34
Дж. Колин Слотер
образующей из глутамина и 2-оксоглутарата две молекулы глутамата. Метаболиче-
ский эффект здесь сходен с действием глутаматдегидрогеназы — для образования
глутамата аммоний переносится к 2-оксоглутарату.
Дрожжи могут эффективно синтезировать все необходимые аминокислоты из угле-
вода и аммония, но на практике они предпочтительнее используют аминокислоты.
Небольшие пептиды (менее 6 аминоацильных остатков) поступают внутрь клетки
и гидролизуются в вакуолях до отдельных аминокислот, однако в первую очередь для
биосинтетических процессов дрожжи используют свободные аминокислоты из среды
или аминокислоты, гидролизованные в вакуолях. В том случае, когда содержание ами-
нокислот в среде превышает их потребность, усваиваемые дрожжами аминокислоты
трансаминируются с образованием ct-оксикислот (рис. 2.5с) с последующим их декар-
боксилированием до альдегидов и далее восстановлением до высших спиртов, кото-
рые удаляются из клетки (см. раздел 2.6.5). При дезаминировании аминокислот выс-
вобождается аммиак. Судя по всему, он не столь важен для пивоварения, поскольку
обычно требуется молекулярный кислород. Тем не менее известно, что специфичные
ферменты могут быть катализаторами анаэробного дезаминирования аспартата, фе-
нилаланина, цистеина, серина и треонина. Алании может дезаминироваться под дей-
ствием специфичной НАД-зависимой дегидрогеназы. Освобожденный аммоний мо-
жет быть реассимилирован под действием НАДФ-зависимой глутаматдегидрогеназы.
Глутамат также может дезаминироваться под действием специфичной НАД-зависи-
мой дегидрогеназы, однако регуляция транскрипции предохраняет дрожжи от проду-
цирования НАД- и НАДФ-зависимых глутаматдегидрогеназ. Концентрация фермен-
тов регулируется наличием в среде глутамата. Отдельные аминокислоты различаются
по их способности выступать в качестве единственного источника азота, и поэтому
рост дрожжей происходит более интенсивно, если в среде присутствует несколько
аминокислот. Особое внимание в пивоварении следует уделять утилизации пролина.
Строго говоря, пролин — это иминокислота, являющаяся обычным компонентом бел-
ков. Пролин преобладает среди аминокислот, входящих в белок ячменя, и поэтому
в сусле это наиболее типичное азотное соединение низкой молекулярной массы. Так
как метаболизм пролина происходит только в аэробных условиях, бродящие дрожжи
не способны его утилизировать, и пролин остается в готовом пиве. По той же причине
дрожжи плохо утилизируют аргинин во время брожения (рис. 2.6).
Основной функцией аминокислот является их участие в синтезе белка, но некото-
рые из них помимо этого активно включаются и в другие важные сферы метаболизма.
Так, серии — основной источник азотистых компонентов фосфолипидов и сфинголи-
пидов, метионин через промежуточный 5-аденозилметионин принимает участие
в метаболических реакциях и в образовании полиаминокислот, а глицин, аспарагино-
вая кислота и глутамин способствуют биосинтезу нуклеотидов и, следовательно, нук-
леиновых кислот. Глицин действует как предшественник гема.
Рибозофосфатный компонент нуклеотидов образуется из глюкозо-6-фосфата по
пентозофосфатному пути (рис. 2.7). Этим путем также поставляется эритрозо-4-фос-
фат, предшественник ароматических аминокислот и НАДФН, необходимой для био-
синтеза многих соединений (в том числе глутамата). В условиях пивного брожения
основная функция пентозофосфатного пути — это обеспечение промежуточных соеди-
нений для поддержания биосинтеза, а не стимулирование гликолиза и синтеза АТФ.
Глава 2. Биохимия и физиология роста дрожжей
35
Аргинин
Пролин
Мочевина.
NH4
Орнитин
L Трансаминаза
у-полуальдегид
гпутаминовой кислоты
t Спонтанное
Вне клетки
Клеточная мембрана
Внутри клетки
1 -пирролин-
5-карбоновая кислота
Редуктаза _
-=йг ► Пролин
Глутамат
Iy-полуальдегид-
глутамат-
дегидрогеназа
Глутаминовый полуальдегид
Митохондрия
Кислород Пролин
Спонтанное У^Пролиноксидаза
-► 1 -пирролин-5-карбоновая кислота
Рис. 2.6. Распад пролина и аргинина
Следует обратить внимание на тот факт, что потребность клеток в тех или иных
витаминах определяется штаммовыми особенностями дрожжей. В частности, фак-
торами роста пивоваренных дрожжей являются никотинамид, биотин, пиридоксин,
тиамин, пантотенат, р-аминобензойная кислота и инозит. Первые четыре соедине-
ния действуют в некоторых ферментативно катализируемых реакциях в качестве
кофакторов. Пантотенат необходим для синтеза коэнзима А, р-аминобензойная кис-
лота — для синтеза фолиевой кислоты, а инозит — для синтеза некоторых фосфоли-
пидов. Ионы минеральных веществ необходимы для поддержания внутриклеточно-
го рН, осмотической стабильности, транспорта растворов и в качестве кофакторов
при ферментативно катализируемых реакциях.
2.6. Биохимия дрожжей и производство пива
Очевидно, что для роста и продуцирования этилового спирта (наряду с побочны-
ми продуктами брожения, ответственными за аромат пива) дрожжевым клеткам не-
обходим налаженный обмен веществ. Не стараясь вникнуть во все аспекты биохи-
мии дрожжей, ниже мы рассмотрим те из них, которые наиболее важны для качества
пива и экономного протекания брожения.
36
Дж. Колин Слотер
Глюкозо-6-фосфат
НАДФ+—%,
ГлюкозО'6-фосфатдвгидрогвназа
НАДФН-
6-фосфогпюконо-б-лактон
Лактоназа
6-фосфоглкжонат
НАДФ+-
НАДФН^Л
С02
6'фосфоглюконатдегидрогеназа
Рибулозо-5-фосфат
Фосфопентозоизомераза\. Фосфопентозоэпимераза
Рибозо-5-фосфат Ксилулозо-5-фосфат
Транскетолаза
Глицеральдегид-З-фосфат Седогептулозо-7-фосфат
Трансальдолаза
Фруктозо-6-фосфат
Эритрозо-4-фосфат
/Гранскетолаза^^ Глицеральдегид-З-фосфат ■
>
Гликолиз
Ксилулозо-5-фосфат
Фруктозо-6-фосфат
Рис. 2.7. Пентозофосфатный путь
Глава 2. Биохимия и физиология роста дрожжей
37
2.6.1. Контроль за поступлением Сахаров в клетки и их утилизацией
При пивном брожении основная реакция — это преобразование Сахаров сусла в
этиловый спирт и двуокись углерода. Она крайне важна, так как является необходи-
мым этапом при превращении сусла в пиво, а ее скорость и характер протекания оп-
ределяют время, необходимое для главного брожения и достижения окончательной
концентрации спирта в пиве.
Сусло бывает разным в зависимости от концентрации Сахаров и других характе-
ристик, зависящих от состава помола, процесса затирания и дополнительного при-
менения ферментов и сахарных сиропов. В том случае, когда затор готовят только
с использованием солода, сусло имеет следующий примерный состав (в % от общего
содержания углеводов) [12]: гексозы (глюкоза и фруктоза)— 9%, сахароза— 6%,
мальтоза — 41% , мальтотриоза — 14%, мальтотетроза — 6% и декстрины — 22%. Ос-
новным сбраживаемым сахаром (около 57% общего количества) является мальтоза,
которая вместе с мальтотриозой составляет 75% веществ, сбраживаемых пивоварен-
ными дрожжами. Интенсивность брожения определяется скоростью поступления
этих сахаридов в клетки и последующим их расщеплением до глюкозы [36, 86].
Прежде всего из сусла утилизируется глюкоза, и только после этого начинается по-
требление мальтозы и далее мальтотриозы (рис. 2.8).
Биохимический процесс внутри клеток проще понять, начав с дрожжей, накоплен-
ных к концу бродильного цикла. На этой стадии сусло уже не содержит глюкозы
и клетки метаболизируют мальтозу и мальтотриозу (рис. 2.9). При этом дрожжи ут-
рачивают большинство транспортных систем глюкозы (так как последние включают-
ся присутствием глюкозы), но экспрессируют гены НХТЪ и ЯХТ7, которые кодируют
транспортеры белков с низким значением Кмддя глюкозы (около 1,5 мМ или 2,7 г/л)
и подавляются ее высокими концентрациями. Таким образом, дрожжевые клетки не
теряют способности к поглощению глюкозы [9, 85]. Ограничение питательных ве-
ществ постепенно приводит к остановке роста клеток, отдельные клетки после завер-
шения клеточного цикла приостанавливают начало процесса Gx и вместо этого пере-
ходят в фазу роста GQ. В стационарной фазе скорость метаболизма значительно
снижается, гены для транспортных систем Сахаров (за исключением НХТЪ и НХТ7)
и аминокислот приостанавливают преобразование, а собственно белки в результате
эндоцитоза частично удаляются из плазматической мембраны [74]. Синтез большин-
ства цитоплазматических ферментов (например, мальтозогидролазы) прекращается,
а имеющиеся ферменты удаляются скорее всего под действием системы цитоплазмы
«убиквитин/протеазома», утилизирующей АТФ [60, 113]. Клетки поддерживают
свою способность к гидролизу сахарозы, поскольку инвертаза располагается снаружи
цитоплазматической мембраны в околоплазматическом пространстве, и таким обра-
зом благодаря эндоцитозу или протеолизу приобретают иммунитет.
Когда эти клетки переносятся в новое сусло в качестве свежих семенных дрож-
жей, происходит ряд биохимических явлений. Наиболее важные из них связаны
с присутствующей в сусле глюкозой. При этом наблюдается несколько глюкозопо-
давляющих эффектов: потребление мальтозы и мальтотриозы прекращается даже
в том случае, когда эти соединения присутствуют (в противном случае индуцирова-
лись бы их системы транспорта и метаболизма) [56, 90, 91]; транспортеры глюкозы
Hxt6p и Hxtlp быстро исчезают [65] и предотвращается полное развитие митохонд-
38
Дж. Колин Слотер
Концентрация
углеводов
Мальтоза
Дни ферментизации
Рис. 2.8. Модель поглощения Сахаров из солодового сусла
рий, где осуществляется окислительное фосфорилирование (даже в том случае, если
кислород присутствует в максимальной концентрации) [41].
С другой стороны, глюкоза явно стимулирует метаболизм [48]. По данным [40],
10-минутная выдержка клеток в стационарной фазе в присутствии глюкозы (но не
источника азота) вызывает дисперсию центральной вакуоли и запуск пути синтеза
аденина. При переносе клеток в среду оптимального состава сокращается лаг-фаза.
Эти эффекты, судя по всему, являются скорее реакцией на присутствие источника
углерода, чем его метаболизмом. В ходе последующих исследований были получены
примеры биохимических воздействий глюкозы на активацию ферментов, их моди-
фикацию и на индукцию экспрессии генов. Действие при уровне &45-генов приводит
к увеличению внутриклеточной концентрации циклического аденозинмонофосфата
(цАМФ), активации протеинкиназы А и последующему фосфорилированию белков.
Основной механизм метаболического контроля — степень, до которой фосфорилиру-
ется ферментный белок. Хорошо изученным примером, имеющим отношение к бро-
Глава 2. Биохимия и физиология роста дрожжей
39
С"*»жи San" Внутри
Мальтотриоза -
Мальтоза -
Сахароза
- Глюкоза -
-Фруктоза -
Галактоза
-► Мальтотриоза
к
-► Мальтозаг
Гексокиназа _ л .
-► Глюкоза ^т щ^ » Глюкозо-6-фосфат
АТФ АДФ
Гексокиназа ^ - . .
-Фруктоза ^~ "^ » Фруктозо-6-фосфат
АТФ АДФ
—► Галактоза
АТФ-U
1 Галакгокиназа
АДФ-*^[ Фосфогалактозо-
Т уридилтрансфераза
Галактозо-1 -фосфат —у \ * Глюкозо-1 -фосфат
Фосфоглюко-
изомераза
УДФ-глюкоза *#-
удф-галактоза
Эпимераза
Рис. 2.9. Поглощение и ассимиляция Сахаров сусла
жению, является увеличение активности и синтеза 6-фосфофруктокиназы по мере
уменьшения фруктозо-1,6-дифосфата. Тем самым происходит превращение глюкозы
в этиловый спирт по гликолитическому пути [114].
Распад внутриклеточного гликогена до глюкозы происходит сразу же после внесе-
ния дрожжей в питательную среду. Гликогенолиз (распад гликогена) начинается
с фосфоролитической деградации гликогена под действием фосфорилазы. В присут-
ствии фосфора от гликогена отщепляется глюкозо-1-фосфат, который фосфоглюко-
мутазой превращается в глюкозо-6-фосфат, а последний метаболизируется в реакци-
ях гликолиза. Фосфорилирование гликогенсинтазой (Gsy2p), напротив, ингибирует
фосфорилазу. Таким образом, внутриклеточный уровень содержания цАМФ и, сле-
довательно, активной протеинкиназы А определяет направление движения между
глюкозой и гликогеном. Физиологический эффект гидролиза гликогена заключается
в стимулировании метаболизма путем обеспечения притока углерода к гликоли-
тическому пути еще до того, как высокопродуктивные транспортеры глюкозы Hxtpl
40
Дж. Колин Слотер
и НхСрЗ, только что индуцированные присутствием внешней глюкозы, окажут суще-
ственное влияние на транспорт углевода в клетку. По мере исчерпания внутриклеточ-
ных запасов глюкозы и перехода клеток на утилизацию мальтозы и мальтотриозы
действие фосфорилирования на фосфорилазу ослабляется, и синтез гликогена вос-
станавливается при участии фермента гликогенсинтетазы [34,35,93].
До сих пор не ясно, каким способом глюкоза активирует и индуцирует АТФазу
плазматической мембраны [32, 38]. Этот фермент «выкачивает» водородные ионы
из клеток, создавая межмембранный градиент, благодаря которому клетке легче осу-
ществлять протонзависимое поглощение аминокислот, ионов металлов, мальтозы
и мальтотриозы. По всей видимости, существуют много и других сфер биохимии, где
глюкоза оказывает положительный эффект, но уже ясно, что с биохимической точки
зрения лаг-фаза после внесения дрожжей является очень активным периодом в жиз-
недеятельности клетки.
После лаг-фазы наступает период, который характеризуется одновременным
сбраживанием сусла и приростом биомассы (см. рис. 2.9). В опытах с дрожжами по
мере уменьшения концентрации глюкозы можно было бы ожидать изменений в про-
филе транспортеров глюкозы [9]. Основными транспортерами (передаточными ме-
ханизмами) здесь выступают Hxtlp (индуцируемый высокой концентрацией глюко-
зы, Км в 100 мМ) и Hxt3p (индуцируемый любой концентрацией глюкозы, Км =
=60 мМ). С падением концентрации глюкозы Hxtlp исчезает и заменяется на Hxtlp
и HxtAp (индуцируемые низкой концентрацией глюкозы, но подавляемые высокой,
Км = 10 мМ), a Hxt3p сохраняется. Наконец, после исчерпания запасов глюкозы все
эти транспортеры исчезают и заменяются на Hxt&p и Hxtlp (оба они подавляются
глюкозой, Км = 1,5 мМ). Согласуясь с этим предположением, традиционный анализ
поглощения глюкозы целыми клетками показывает постоянное уменьшение значе-
ния Км глюкозы по мере падения концентрации глюкозы в сусле. Когда концентра-
ция глюкозы опускается ниже 0,5% масс, подавление М/41-генов прекращается, и
клетки переходят на поглощение и утилизацию мальтозы, а затем — мальтотриозы
(см. рис. 2.9). Внутриклеточный гидролиз этих Сахаров, по всей видимости, обеспе-
чивает клетку глюкозой, участвующей в обменных процессах.
В ходе экспериментов было выявлено 5 местоположений локуса MAL с тремя ген-
ными кодировками для пермеазы, гидролазы и регуляторного белка. Исследования
кинетики дрожжей идут параллельно с работами по изучению механизма транспор-
та мальтозы [6] и пассивной адсорбции Сахаров в клетки. В работе [22] было показа-
но, что у дрожжей для эля и лагерного пива имеет место интенсивный траспорт
мальтозы внуть клетки. Это несоответствие сюрпризом не стало, учитывая различ-
ную историю штаммов дрожжей; пивные дрожжи всегда отбирались по их способ-
ности расти на мальтозе. По мальтотриозе было проведено относительно немного
работ, но очевидно, что, как и в случае с мальтозой, поглощение трисахарида явля-
ется протоннозависимым. Мальтотриоза целиком транспортируется в клетки, где
гидролизуется до глюкозы. Транспортер, переносящий мальтотриозу, кодируется
геном AGT1, его специфичность невысока и сродство к мальтозе выше, чем к маль-
тотриозе [43]. Это помогает объяснить результаты, полученные в [22], а также
последовательное поглощение мальтозы и мальтотриозы из сусла, поскольку на ки-
нетическом уровне мальтоза будет более конкурентоспособным ингибитором по-
Глава 2. Биохимия и физиология роста дрожжей
41
требления мальтотриозы. Ген AGTI был выявлен в 29 из 30 исследованных штаммах
пивных дрожжей [55].
С активными семенными дрожжами брожение солодового сусла должно проходить
без затруднений, однако с увеличением содержания в сусле глюкозы могут возникать
проблемы в утилизации других Сахаров. Высокая начальная концентрация глюкозы
задерживает достижение той точки в цикле брожения, когда происходит переключе-
ние на метаболизм мальтозы. Как уже отмечалось выше, это подразумевает опреде-
ленную биохимическую активность, и если среда содержит недостаточно необходи-
мых питательных веществ, то переход от утилизации моносахаридов к утилизации
дисахаридов может замедлиться (так называемый «мальтозная лаг-пауза») или вооб-
ще не произойти (наступит прекращение брожения).
Хотя большинство работ в этой области посвящено глюкозе и мальтозе, заслужи-
вают внимания и два других сахара — фруктоза и галактоза. Фруктоза обычно встре-
чается в солодовом сусле, и ее концентрация может увеличиваться при использова-
нии сахарозы, инвертного сахара или сиропа с высоким содержанием фруктозы.
Этот сахар поступает в клетку теми же механизмами, что и глюкоза, но потребление
происходит медленнее. Метаболизм фруктозы идет путем прямого фосфорилирова-
ния до образования фруктозо-6-фосфата, которым начинается гликолитический
путь (см. рис. 2.9). С увеличением расщепления глюкозы способность к транспорту
глюкозы и фруктозы понижается из-за потери транспортеров гексозы с низким срод-
ством. Это незначительно влияет на потребление сахаридов солодового сусла, но
если начальная концентрация фруктозы из-за применения в пивоварении Сахаров
существенно увеличивается, то по окончании брожения пиво будет содержать оста-
точные количества фруктозы. Фруктоза имеет намного более низкий порог ощуще-
ния, чем другие сахара сусла, что может привести к появлению сладковатого вкуса
пива. Не так давно в лагерных дрожжах был идентифицирован ген FSY1, который
кодирует высоко специфичный протонзависимый транспортер фруктозы [105]. Зна-
чение этого для пивоварения еще не ясно.
Галактоза в солодовом сусле в заметных количествах не представлена, но при ис-
пользовании в пивоварении в качестве углеводного компонента гидролизованной лак-
тозы галактоза может выявляться в эквимолярных глюкозе количествах [21]. Галакто-
за потребляется и усваивается собственной системой (см. рис. 2.9), требующей для
индукции этот вид сахара [57]. Судя по экспериментам с дрожжами, утилизация галак-
тозы должна происходить только в сусле, в котором концентрация глюкозы (и мальто-
зы) уже снижена до низкого уровня. Как и у мальтозы, переключение на метаболизм
галактозы включает другие биохимические механизмы, в связи с чем возникают те же
проблемы замедления или остановки брожения в сусле с низким содержанием пита-
тельных веществ. Тем не менее в практике пивоварения вопросы утилизации галакто-
зы и мальтозы оказываются очень важными. Изучение 6 штаммов дрожжей для эля и
6 штаммов лагерных дрожжей показало, что при сбраживании мальтозной и галактоз-
ной среды штаммы дрожжей для эля обнаружили тенденцию к предпочтению мальто-
зы, а большинство штаммов лагерных дрожжей быстрее и полнее потребляли галакто-
зу [20]. Такое же различное использование мальтозы и галактозы было выявлено при
добавлении галактозы в сусло (подразумевалось, что галактоза будет использоваться
при производстве лагерного пива, но не эля).
42
Дж. Колин Слотер
2.6.2. Взаимосвязь между ростом дрожжей и продуцированием
этилового спирта
Основной проблемой для бродильных производств является установление взаи-
мосвязи между ростом микроорганизмов и образованием продуктов метаболизма,
так как обычно желательно то или другое, и обе эти ситуации встречаются в пивова-
рении. Так, при получении чистой культуры преследуется цель накопления биомас-
сы, в то время как при брожении накопление биомассы приводит к уменьшению ко-
личества этанола в пиве.
Было показано, что для всех гликолитических ферментов увеличение генной до-
зировки не оказывает никакого воздействия на гликолитический перенос [97]. Это
свидетельствует о том, что интенсивность гликолиза ограничивается субстратом
и что, похоже, фактором, ограничивающим эту интенсивность, является транспорт
глюкозы внутрь клетки. Было высказано предположение, что повышение интенсив-
ности поглощения глюкозы путем увеличения активности ферментов транспорта
белков должно вызывать увеличение интенсивности брожения. Похоже, эта ситуа-
ция является более сложной, поскольку там, где при неограниченном доступе глю-
козы в клетки происходит их гибель, были выявлены чувствительные к глюкозе му-
танты. Этот механизм заключается в том, что при неограниченном количестве
внутриклеточной глюкозы, которая фосфорилируется при участии гексокиназы
и фосфофруктокиназы, из среды поглощается большое количество фосфора, в ре-
зультате чего невозможно протекание другой, связанной с фосфорилированием ре-
акции, катализируемой глицеральдегид-3-фосфат-дегидрогеназой, и гликолиз пре-
кращается с высокой внутриклеточной концентрацией гексозофосфатов. Было
высказано предположение, что при нормальном клеточном синтезе сс-а-1,1-дисаха-
рида (трегалозы) из двух молей глюкозо-6-фосфата реакция, высвобождающая фос-
фат, служит механизмом поддержания гликолитического переноса путем выравни-
вания концентрации глюкозо-6-фосфата относительно неорганического фосфата
[111]. При уменьшении концентрации глюкозы в среде клетки могут гидролизовать
трегалозу и фосфорилировать глюкозу до глюкозо-6-фосфата, возвращая углерод
для гликолиза. Сейчас уже ясно, что гликоген и трегалоза (так называемые «резерв-
ные углеводы») активно способствуют нормальному течению метаболизма и выжи-
ванию клеток, а не только действуют как запасные соединения.
На биохимическом уровне существует чрезвычайно тесная связь между ростом
клеток и продуцированием этилового спирта, которому способствует синтез АТФ.
Эта связь осуществляется через аллостерические взаимодействия между аденозин-
дифосфатом (АДФ), АТФ и ферментами и на более простом субстратном уровне —
преимущественно через отношение АТФ/АДФ. АТФ участвует во многих реакциях
биосинтеза, продуктом которых является АДФ, сам по себе представляющий суб-
страт, используемый для синтеза АТФ во время гликолиза. Таким образом образо-
вание этилового спирта также связано с биосинтезом и ростом клеток.
В богатой питательными компонентами среде клеточная система транспорта бел-
ков, ферментов и генов приспособлена для регулирования каталитической активно-
сти внутри клетки для обеспечения ее роста [48]. Известны случаи, когда системы
транспорта Сахаров зависят от поглощения азотистых соединений, хотя вероятно, что
Глава 2. Биохимия и физиология роста дрожжей
43
подобная зависимость существует и от других компонентов питательной среды [67,
94,102]. По исчерпании источников азота способность клеток к утилизации Сахаров
быстро падает независимо от присутствия в среде Сахаров. В этих условиях скорость
распада белков в клетках (ферментов транспорта Сахаров в клетку, пермеаз) состав-
ляет 2 ч. Практическое значение этой модели поведения проявляется в конце броже-
ния пива, когда плотность сусла лишь ненамного выше заданной плотности данного
сорта пива. Обычно стараются ограничить рост дрожжей концентрацией питатель-
ных веществ в сусле. После исчерпания лимитирующего питательного вещества ак-
тивность транспорта Сахаров клетки снижается независимо от наличия Сахаров. Если
это произойдет слишком рано, то интенсивность брожения будет очень быстро сни-
жаться, и существует опасность, что заданная конечная плотность вообще не будет
достигнута или для ее достижения понадобится значительно больше времени.
Взаимосвязь доступных источников азота и усвоения Сахаров трактовалась ана-
логично механизму токсичного действия этилового спирта на клетки при брожении
вина [96], и, похоже, наблюдается в более крепких сортах пива. Было высказано
предположение, что высокие концентрации этилового спирта увеличивают прони-
цаемость плазматической мембраны и затрудняют поддержание протонного гради-
ента. Следствием этого является снижение поглощения аммония и аминокислот, так
что клетки испытывают нехватку азота независимо от наличия в среде ассимилиру-
емых азотистых соединений. Основной реакцией на такую ситуацию является опи-
санная выше деградация ферментов транспорта Сахаров в клетки, так что брожение
прекращается даже в полноценной питательной среды.
2.6.3. Жизнеспособность и витальность клеток
Обычно эти два термина понимают следующим образом: жизнеспособность отно-
сится к живым клеткам, а витальность — это мера активности клеток. Для семенных
дрожжей и жизнеспособность, и витальность должны быть по возможности макси-
мально высокими, так как они являются важнейшими характеристиками для опреде-
ления хода последующего брожения. Тем не менее значительной проблемой является
разработка способов измерения этих свойств (было предложено несколько способов)
[68]. Наиболее информативным тестом, несомненно, является тест на размножение,
позволяющий ответить на два вопроса: может ли клетка размножаться и с какой ско-
ростью? При использовании такого теста, однако, могут быть получены заниженные
результаты по числу клеток и их жизнеспособности, поскольку многие пивные дрож-
жи образуют клеточные скопления или цепочки. По самой своей природе такие тесты
являются очень медленными и в качественном аспекте ненадежными.
В попытках ускорить определение жизнеспособности и витальности клеток было
предложено много разных методов анализа. Для оценки жизнеспособности клеток
широко применяется окрашивание (например, метиленовой синью). В основе мето-
да лежат разная проницаемость плазматических мембран мертвых и живых клеток
для окрашивающего вещества, а также их различия в способности осуществлять хи-
мические превращения в цитоплазме. Клетки подсчитывают под микроскопом, а их
витальность оценивается как отношение окрашенных (мертвых в случае примене-
ния метиленовой сини) к неокрашенным клеткам (в данном случае живым). Этот
тест достаточно быстрый, но из-за присутствия клеток с разной интенсивностью
44
Дж. Колин Слотер
окраски могут возникать ошибки, так что здесь многое зависит от субъективной
оценки лаборанта.
Для повышения объективности оценки были разработаны методы, с помощью ко-
торых определялись конкретные биохимические характеристики клеток — АТФ,
аденилат-заряд, НАДН, гликоген и стерины. Наблюдается тенденция к приравнива-
нию высоких концентраций этих соединений и высокой жизнеспособности клеток,
однако количество данных биохимических соединений может сильно варьировать
и не иметь никакого отношения к жизнеспособности. Концентрация одного из них
может быть низкой из-за того, что клетка очень активна и оно быстро метаболизиру-
ется. С другой стороны, высокая концентрация может означать, что утилизация со-
единения прекратилась, и поэтому содержание данного вещества в клетках увеличи-
лось. Тем не менее в одинаковых условиях подобные тесты могут оказаться
полезными [103]. Важным свойством, отражающимся на жизнеспособности клеток,
является целостность цитоплазматической мембраны, измеренная или емкостным
зондом, или по степени поглощения или выделения специфических метаболитов.
Эта проба особенно полезна потому, что ее можно включить в производственный
процесс, обеспечив автоматическое измерение жизнеспособности клеток в ходе вне-
сения дрожжей. Данный метод не гарантирует от ошибок, так как, например, клетки
с проницаемой мембраной, которые могут быть зарегистрированы как мертвые, на
самом деле могут восстановить свою жизнеспособность через несколько минут пос-
ле контакта со свежей питательной средой.
Вопрос о витальности клеток еще более сложен. Единственный надежный метод —
это брожение, но для получения ответа (связанного с общим ходом брожения) требует-
ся 18-24 ч. Более быстрыми тестами, хорошо коррелирующими с характеристиками
последующего брожения, являются тест на степень подкисления и тест на интенсив-
ность потребления кислорода. Первый предположительно связан со способностью
глюкозы стимулировать упоминавшуюся выше АТФазную активность цитоплазма-
тической мембраны, а второй — со способностью клетки к синтезу необходимых ли-
пидных соединений цитоплазматической мембраны (см. следующий раздел).
2.6.4. Реакции биосинтеза, для которых необходим
молекулярный кислород
Одна из особенностей, отличающая эукариоты от прокариотов, — это использова-
ние в качестве субстрата для некоторых реакций кислорода. Дрожжи здесь не ис-
ключение, и последствия для пивоварения могут быть очень существенными.
а) Образование ненасыщенных жирных кислот
Ненасыщенные жирные кислоты являются необходимым компонентом содержа-
щихся в дрожжах триацилглицеринов, фосфолипидов и сфинголипидов (рис. 2.10).
Триацилглицерины входят в состав липидов визикул, находящихся в цитоплазме.
Раньше полагали, что их роль — это выполнение функции резервных соединений
[99], однако в настоящее время считается, что везикулы представляют собой место
биосинтеза стерина. Фосфо- и сфинголипиды являются важными компонентами
мембран, в частности цитоплазматической мембраны, причем соотношение между
ними определяет проницаемость клеточных мембран [46, 98].
Глава 2. Биохимия и физиология роста дрожжей
45
Стеариновая кислота (С^о)
Олеиновая кислота (Ci&i)
НОНС
/
■ч
СН2ОН
R2OCOHC
R2OCOHC
/
\
СН2ОН
Глицерин
CHjOCOR,
/
V
CH2OCOR1
С —О
Н2 \
н2
О О" С—N+
2 СН3
Фосфатидилхолин
CH2OCOR3
Триацил глицерин
НО
\ Н
ROC CH—С
\ / ^
N-СН СН(СН2)12СН3
Н \
С—"0v H
О V С—N+
н2 \
2 СН3
Сфингомиелин
Рис. 2.10. Структура жирных кислот, триацилглицеринов, фосфолипидов и сфинголипидов
Насыщенные жирные кислоты синтезируются внутри клетки путем многоступен-
чатой конденсации ацетил-КоА [119] или могут поступать непосредственно из пита-
тельной среды. Ненасыщенные жирные кислоты образуются путем окисления насы-
щенных соединений (рис. 2.11) и также могут поступать из питательной среды.
б) Образование эргостерина
Эргостерин — это основной стерин дрожжей, играющий важную роль в структуре
цитоплазматической мембраны [98]. Он синтезируется из ацетил-КоА через мевалонат
и линейный углеводород С30 — сквален. Это соединение в результате окисления пре-
вращается в ланостерин и далее модифицируется в эргостерин в ходе нескольких реак-
ций (для некоторых из которых требуется кислород) (рис. 2.12). Эфиры эргостерина
присутствуют в цитоплазме и используются во время роста клеток.
Значение для дрожжей этих двух путей синтеза, для которых необходим кисло-
род, заключается в том, что после исчерпания запасов кислорода в сусле ненасыщен-
46
Дж. Колин Слотер
Стеарил-КоА
1/202-
Л-9 непредельная
Восстановленный
цитохром Ь5
2Н+
жирная кислота —
NADT
десатураза
Цитохром Ь5-редуктаза
Н20
Окисленный
цитохром Ь5
НАДН + Н+
Олеоил-КоА
Рис. 2.11. Образование ненасыщенных жирных кислот
ные жирные кислоты и эргостерин становятся важнейшими питательными веще-
ствами, которые для продолжения роста клеток и брожения должны поступать из
сусла. В связи с тем, что этих соединений в сусле явно недостаточно, большое значе-
ние имеет насыщение сусла кислородом до определенного уровня, необходимого для
роста и размножения клеток. Потребность дрожжей в кислороде определяется штам-
мовыми особенностями дрожжей, содержанием растворенного в сусле кислорода,
а также жирных кислот и эргостерина.
2.6.5. Метаболизм аминокислот и образование
сенсорно-важных ароматических соединений
Как уже отмечалось выше, дрожжи могут синтезировать все необходимые амино-
кислоты из углеводов и аммония, однако чаще для этой цели используются амино-
кислоты из питательной среды. Метаболизм аминокислот связан с образованием
некоторых соединений, влияющих на аромат пива: высших спиртов, эфиров, альде-
гидов и кетонов, а также неорганических соединений серы.
С точки зрения постоянства вкуса и аромата пива следует обратить внимание на
существование среди культур дрожжей «petite»-мутантов, которые получили свое
название из-за того, что на агаре образуют маленькие колонии. Эти дрожжи не со-
держат митохондриальной ДНК, а также многих ферментов, участвующих в мета-
болизме аминокислот, вследствие чего механизм образования летучих соединений
у них очень изменчив. По этой причине использование «petfte»-дрожжей в пивова-
рении не допустимо.
а) Высшие спирты
В рамках нормального метаболизма дрожжи продуцируют 2-оксокислоты, кото-
рые могут быть переаминированы до аминокислот или декарбоксилированы до аль-
дегидов; последние, в свою очередь, редуцируются до спиртов (рис. 2.13). Основной
Глава 2. Биохимия и физиология роста дрожжей
47
СНа
н<Г |
о
А.
н2с.
н,
СН2ОН
Мевалонат
/N
Сквален
Рис. 2.12. Предшественники эргостерина
48
Дж. Колин Слотер
Глюкоза
у Гликолиз
и пути биосинтеза
Глугамат
2-оксокислота
2-оксоглутарат
Декарбоксилаза
Трансаминаза
С02
Альдегид
а-аминокислота
НАДН
НАД"
Дегидрогеназа
Спирт
Рис. 2.13. Образование высших спиртов
путь преобразования углеводов в клетке лежит через гликолиз до пирувата (2-оксо-
кислоты), из которого далее может образоваться аминокислота аланин или ацеталь-
дегид, а затем этиловый спирт (см. рис. 2.1). Такая связь существует и для других
путей биосинтеза аминокислот в тех случаях, когда предшествующим предпослед-
ним соединением является 2-оксокислота (табл. 2.2). Получающиеся в результате
спирты относятся к «высшим спиртам», поскольку в них больше углеродных атомов,
чем в этиловом спирте. При брожении высшие спирты также могут образовываться
из 2-оксокислот, продуцируемых в результате переаминирования аминокислот, со-
держащихся в питательной среде (см. рис. 2.5с). Иногда как синоним для термина
«высшие спирты» используют понятие «сивушные масла» или «сивушные спирты».
Несмотря на то что ферменты, преобразующие пируват в этиловый спирт, взаимо-
Таблица 2.2. Аминокислоты и происхождение высших спиртов
Аминокислота
2-оксокислота
Высший спирт
Треонин
Валин
Лейцин
Изолейцин
Фенилаланин
Тирозин
2-оксобутират*
2-оксоизовалерат
2-оксоизокапронат
2-оксо-З-метилвалерат
2-оксо-фенилпируват
2-оксо-р-гидроксифенилпируват
л-пропанол
Изобутанол
(2-метилпропанол)
Изоамиловый спирт
(3-метилбутанол)
Оптически активный
изоамиловый спирт
(2-метилбутанол)
Фенилэтанол
Тирозол
* 2-Оксобутират образуется из треонина путем дезаминирования в рамках данного пути био
синтеза от треонина в изолейцин, а не в результате переаминирования.
Глава 2. Биохимия и физиология роста дрожжей
49
действуют и с другими 2-оксокислотами, внутри клетки происходят еще более слож-
ные явления. В эти и другие реакции включаются иные ферменты, и до сих пор пол-
ного понимания происходящего нет [24, 26].
На практике, однако, важными факторами в регулировании биосинтеза высших
спиртов из 2-оксокислот являются природа азота в среде и скорость роста клеток.
2-оксокислоты могут быть образованы двумя путями: переаминированием поступа-
ющих извне аминокислот или синтезом из углеводов на предпоследней стадии био-
синтеза аминокислот. Клетки более склонны поглощать доступные аминокислоты
из питательной среды, а поскольку основным регулятором биосинтеза является кон-
центрация аминокислот внутри клетки, то продуцирование 2-оксокислот зависит от
количества и степени утилизации азота в питательной среде. Этот механизм хорошо
изучен на генном уровне [119]. Таким образом, образование сивушных масел больше
всего происходит в сусле с высокой или низкой концентрацией поглощаемого азота.
Хорошо сбалансированный рост клеток, сопровождающийся биосинтезом белков,
характеризуется низкой внутриклеточной концентрацией промежуточных продук-
тов синтеза и, следовательно, незначительным образованием высших спиртов.
б) Эфиры
Эфиры образуются в ходе реакции между спиртами и кислотами, и для образова-
ния вкуса и аромата пива количество этих соединений очень важно. Механизм обра-
зования эфиров еще не вполне изучен. Спонтанная реакция была отвергнута как
слишком медленная, так как в пиве обнаруживаются разные концентрации их пред-
шественников (прекурсоров). Большинство исследователей склоняется к тому, что
в механизме образования эфиров большую роль играет фермент алкогольацилтранс-
фераза (ААГ), служащий катализатором реакции между спиртом и каким-либо про-
изводным ацил-КоА. В настоящее время полагают, что в дрожжах присутствуют три
фермента этого типа [31]. Наиболее распространенным активированным ацилдери-
ватом является ацетил-КоА, а доминирующим спиртом — этиловый, так что не уди-
вительно, наиболее широко распространенный эфир — это этилацетат, хотя более
значительный вклад в образование вкуса и аромата пива вносит изоамилацетат.
Предполагают, что присутствие неацетатных эфиров отражает включение более
длинной цепи ацил-КоА, продуцируемого в ходе метаболизма жирных кислот. На
практике ситуация еще более запутывается из-за присутствия в дрожжевых клетках
эстеразы, способной гидролизовать эфиры, так что сам по себе биосинтез не может
служить надежным индикатором концентрации эфиров в пиве.
в) Альдегиды и кетоны
Соединения этого типа, образующиеся во время главного брожения, оказывают
на аромат пива нежелательное влияние, и одна из главных функций дображивания
и созревания пива — их удаление.
Ведущим соединением в этой группе является ацетальдегид, представляющий со-
бой промежуточное соединение при образовании этилового спирта в ходе брожения
пива. Из клеток выделяется достаточное количество ацетальдегида, что позволяет
без труда аналитически и по вкусу обнаруживать его в пиве после дображивания.
Именно это соединение в основном формирует «зеленую», «травянистую» ноту све-
50
Дж. Колин Слотер
он
соон
2-ацетогидроксибутират
Спонтанно
Г С02
2,3-пентандион
Рис. 2.14. Синтез вицинальных дикетонов
жеприготовленного пива, а поскольку оно спонтанно реагирует с другими соедине-
ниями (особенно с диоксидом серы) нежелательный аромат довольно быстро исче-
зает после дображивания.
Другие важные соединения в этой группе относятся к вицинальным дикетонам.
Дрожжами в ходе брожения образуются два соединения — 2,3-бутандион (диацетил)
и 2,3-пентандион; они характеризуются низким порогом ощущения вкуса и аромата,
а также придают пиву нежелательную «маслянистую» ноту. Из этих двух соединений
диацетил представляется более важным, так как образуется в большом количестве
и у него ниже порог ощущения вкуса и аромата, чем у пентандиона. Для снижения
концентрации вицинальных дикетонов свежее пиво некоторое время необходимо вы-
держивать с дрожжами. Продолжительность стадии контакта пива с дрожжами в про-
цессе созревания пива определяется именно этой реакцией.
Оба указанных вицинальных дикетона образуются из промежуточных продуктов
биосинтеза аминокислот. Биосинтез диацетила связан с синтезом валина, а 2,3-пентан-
диона — изолейцина (рис. 2.14). Первыми уникальными для каждого пути биосинтеза
промежуточными продуктами являются: на пути от пирувата к валину — а-ацетолак-
тат, а на пути от 2-оксобутирата к изолейцину — а-ацето-а-гидроксибутират. Эти со-
единения выделяются из клеток и в сусле подвергаются спонтанному окислительному
декарбоксилированию с образованием диацетила и 2,3-пентандиона, которые усваива-
ются дрожжами. Диацетил редуцируется до 2,3-бутандиола, а а-ацето-а-гидроксибу-
тират — до 2,3-пентандиола (эти соединения на аромат не влияют). Естественно, пиво-
вары заинтересованы и в низком высвобождении а-гидроксикислот, и в уменьшении
количества вицинальных дикетонов. Между тем, несмотря на большое количество вы-
Глава 2. Биохимия и физиология роста дрожжей
51
полненных в этом направлении работ, четких путей снижения синтеза а-гидроксикис-
лот нет. Снижение содержания вицинальных дикетонов в дрожжевой клетке происхо-
дит, вероятно, с помощью нескольких специфичных дегидрогеназ. О каких-либо дру-
гих биологических функциях этих ферментов данных нет, но их поведение в ходе
брожения и от штамма к штамму меняется [26].
Сульфат
АТФ
.Л
Аденилилсульфатпирофосфорилаза
ФФй-
Аденозин 5*-фосфосульфат (АФС)
АТФ
АФС-киназа
Аспартат
Гомосерин
Ацетил-КоА
Л
АДФ
3'-фосфоаденозин-5'-фосфосульфат(ФАФС)
ФАФС-редуктаза
Носитель протеинсульфита
(тиоредоксин)
КоА
О-ацетилгомосерин
Ацетат
Гомоцистеин
w
Метионин
Цистеин
Сульфитредуктаза
Носитель протеинсульфида
(тиоредоксин)
Сульфгидрилаза
Носитель белка
Рис. 2.15. Утилизация сульфата и образование SO, и H2S
52
Дж. Колин Слотер
г) Неорганические соединения серы
В ходе брожения обычно образуются два газа — S02 и H2S, и их количество в пиве
зависит от штамма дрожжей, состава сусла и условий брожения. Практическое значе-
ние этих соединений заключается в антиокислительном и консервирующем действии
S02 (особенно благодаря его способности образовывать с альдегидами не имеющие
вкуса и аромата соединения) и в очень неприятном запахе и токсичности H2S, которые
проявляются даже в низких концентрациях. Считается, что оба эти соединения обра-
зуются из промежуточных продуктов на пути биосинтеза, которые уменьшают потреб-
ление из питательной среды сульфата до уровня содержания сульфида в клетке. Это
соединение реагирует с О-ацетилгомосерином с образованием метионина (рис. 2.15).
Образование О-ацетилгомосерина требует поступления ацетил-Ко А, синтез которого
зависит от наличия кофермента А. Проблема с дрожжами заключается в том, что они
не могут синтезировать этот кофермент de novo, и в качестве предшественника им не-
обходимо наличие в питательной среде пантотеновой кислоты. Если этого витамина
недостаточно, дрожжи оказываются неспособны синтезировать метионин, но продол-
жают поглощать сульфат и восстанавливать его до сульфида. Последний в клетке уже
не используется и выделяется из нее в среду в виде H2S. В некоторых случаях дрожжи
могут восстанавливать сульфат до сульфида почти стехиометрически [59]. Содержа-
ние сульфита определяет биосинтез S02, так как удаление гена сульфитредуктазы
МЕТ10 приводит к намного большему образованию газа [44].
Факторы, определяющие синтез S02 и H2S, точно не известны (за исключением
доступности пантотената в сусле). Ранее предполагалось, что на ранних стадиях бро-
жения метионин предотвращает потребление сульфата с помощью известных меха-
но о но о
2-метил-5-этил-4-гидрокси-3(2Н)-фуранон 2-этил-5-метил-4-гидрокси-3(2Н)-фуранон
НО О
2,5-диметил-4-гидрокси-3(2Н)-фуранон
Рис 2.16. Ароматически активные 4-гидрокси-3(2Н)-фураноны
Глава 2. Биохимия и физиология роста дрожжей
53
низмов регулирования метаболизма (включая подавление транспортеров сульфата),
что подтверждалось тем, что S02 и H2S обычно образовывались на завершающей ста-
дии брожения [30]. Эта теория была отвергнута после того, как в [29] было показано,
что в начале брожения потребление сульфата и метионина происходит одновремен-
но, а по данным молекулярной биологии типичная концентрация метионина в сусле
(около 0,2 мМ) недостаточна для подавления транспортеров сульфата.
2.6.6. Другие ароматические соединения
а) Органические кислоты
В пиве содержится несколько органических кислот, образуемых в ходе метабо-
лизма дрожжей (в частности, при гликолизе и в цикле трикарбоновых кислот), но
в формировании аромата они большой роли не играют [51, 77,100].
4-гидрокси- ( 21Л) -фураноны
Дрожжами могут образовываться два соединения этого типа — 2,5-диметил-4-гид-
рокси-3(2Н)-фуранон и 2(или 5)-метил-5(или2)-этил-4-гидрокси-3(2Н)-фуранон
(рис. 2.16) — скорее всего из промежуточных продуктов реакции Майяра во время
сушки солода [7, 45, 71]. Оба эти соединения имеют сладковатый карамельный или
ирисовый привкусы, низкий вкусо-ароматический порог ощущения, а также, веро-
ятно, участвуют в формировании «элевых» нот в аромате.
Фенольный вкус и аромат
Некоторые штаммы дрожжей, особенно дикие дрожжи, способны декарбоксили-
ровать в сусле производные циннаминовой кислоты с образованием винилфенолов,
которые для большинства сортов и видов пива считаются посторонними вкусо-аро-
матическими веществами. Соответственно, большинство штаммов пивных дрожжей
отбираются по отсутствия этих соединений. Типичными примерами могут служить
декарбоксилирование р-кумаровой кислоты (с образованием 4-винилфенола) и фе-
руловой кислоты (с образованием 4-винилгваякола) (см. главу 7).
2.6.7. Внеклеточные протеолитические ферменты
Обычно считается, что 5. cerevisiae не выделяют ферменты, способные гидролизо-
вать пептидные связи, и не могут использовать белок в качестве источника азота.
Небольшие пептиды, поддерживающие рост клеток, потребляются целиком и гидро-
лизуются внутри клетки. Тем не менее в пивоварении встает вопрос о выделении
ферментов, поскольку хорошо известно, что пиво может содержать кислую протеа-
зу, продуцируемую дрожжами. Практическое значение этого заключается в том, что
данный фермент может отрицательно влиять на пенообразующую способность пива
по мере его старения. Этим ферментом, по-видимому, является протеиназа А — кис-
лая протеаза, обнаруженная в вакуоли дрожжей [64, 81]. Ее концентрация в среде
в ходе брожения медленно повышается и после завершения ассимиляции азота пре-
вышает исходную в несколько раз. По всей вероятности, большая часть протеина-
зы А выделяется живыми клетками, а не в результате автолиза [81]. Возможный ме-
ханизм (для пивоварения еще не изученный) может состоять в том, что под
влиянием стресса в конце брожения клетки ошибочно перемещают протеиназу А в
цитоплазматическую мембрану (вместо вакуолярной), и таким образом этот фер
54
Дж. Колин Слотер
мент выделяется. Это было подтверждено двумя экспериментами. В первом из них
для изучения состава вакуоли и поступления вакуолярных белков на поверхность
клетки применялось изменение пептидной сигнальной последовательности на про-
преферменте [49, 73]; во втором эксперименте чрезмерное подавление в винных
дрожжах РЕРА (гена для протеиназы А) привело к выделению данного фермента
[87] — по-видимому, из-за перегрузки вакуолярных мембран.
2.6.8. Реакция на осмотическое давление
Осмотическое давление возникает из-за стремления воды проникнуть через полу-
проницаемую мембрану в сторону более концентрированного из двух разделенных
этой мембраной растворов. Такое давление прямо пропорционально концентрации
молекул, которые не могут пройти через мембрану. Цитоплазматическая мембрана
дрожжевых клеток характеризуется полупроницаемостью относительно воды и гид-
рофильных соединений с высокой молекулярной массой. Следовательно, когда
в питательной среде низкая концентрация сухих веществ, то дрожжевые клетки ис-
пытывают гипоосмотический стресс и стремятся впитать воду. В более концентри-
рованной среде (например, в сусле) у клеток наблюдается гиперосмотический
стресс, что приводит к отдаче воды и «сморщиванию» клеток. По-видимому, пиво —
среда с очень небольшим осмотическим давлением, в то время как сусло имеет высо-
кую концентрацию сухих веществ, вследствие чего клетки во время внесения их
в сусло испытывают осмотический стресс. Степень этого стресса зависит от плотно-
Глкжоза
Гликолиз
Фруктоза-1,6-дифосфат
Дигидроксиацетонфосфат
НАДН-
Глицерол-З'фосфат-
дегидрогеназа
НАД"
Глицерин-3-фосфат
Фосфатаза
Глицерин
Глицеральдегид-3-фосфат
? Гликолиз
Пируват
Рис. 2.17. Биосинтез глицерина
Глава 2. Биохимия и физиология роста дрожжей
55
сти сусла и типа Сахаров, а его влияние на дрожжи зависит от физиологического со-
стояния дрожжевых клеток. Растущие клетки гораздо более чувствительны к нему,
чем клетки, пребывающие в стационарной фазе [117], что может быть связано с на-
коплением трегалозы в стационарной фазе [19, 50]. Хотя роль трегалозы в осмоус-
тойчивости до сих пор полностью не ясна, по-видимому, ее действие такое же, как
при термошоке [101]. Сахара препятствуют денатурированию белков и для стабили-
зации содержимого клетки функционально взаимодействуют с возникающими в ре-
зультате термошока белками [13,47].
Как правило, гиперосмотический стресс вынуждает дрожжевые клетки «сморщи-
ваться» и перед началом роста им необходим некоторый адаптационный период. В это
время существенно возрастает синтез глицерол-3-фосфатдегидрогеназы, что приводит
к существенному увеличению внутриклеточной концентрации глицерина (ЯОС-путь,
рис. 2.17), противодействующей осмотическому давлению сусла [1,2]. Глицерин мо-
жет проникать через цитоплазматическую мембрану, и в отсутствие стресса его переме-
щение облегчается порами в мембране. Гиперосмотический стресс вынуждает эти поры
закрываться, что снижает скорость выделения глицерина. Считается, что у S. cerevisiae
нет активных систем потребления глицерина, выявленных у некоторых осмотолерант-
ных дрожжей. В результате процесса брожения снимается стресс и уменьшается внут-
риклеточная концентрация глицерина [52].
«Сморщивание» дрожжевых клеток наблюдается уже через минуту гиперосмоти-
ческого стресса, но может пройти несколько часов до регистрации существенного уве-
личения содержания внутриклеточного глицерина. В работе [79] было высказано
предположение, что дрожжи обладают хорошо развитой системой реагирования на
осмотическое давление (помимо упоминавшегося выше более длительного срока
адаптации) — в частности, ферментным механизмом замены Na+/H\ расположенным
в эндосомных/предвакуолярных отделениях [99]. Этот механизм носит название на-
трий-водородного насоса. Натриевый насос осуществляет активный транспорт ионов
Na+ через мембрану, и при этом ионы Na* поступают внутрь клетки. В результате фер-
мент мог бы незамедлительно реагировать на «сморщивание» цитоплазмы путем под-
качки в нее Na* из вакуоли с дальнейшей подачей в том же направлении воды, проти-
водействуя таким образом ее отдаче во внешнюю питательную среду. В настоящее
время уже ясно, что реакция дрожжевых клеток на осмотический стресс — явление
гораздо более сложное и общее, чем предполагалось до недавнего времени [8].
В отличие от рассмотренного выше HOG-пути синтеза глицерина при гиперосмо-
тических условиях, гипоосмотические условия вызывают переключение метаболиз-
ма на ФКС-путь (фосфокиназы С). Одним из результатов этого является стимуля-
ция системы синтеза клеточной стенки [5], прочность которой увеличивается, и,
следовательно, возрастает способность клетки физически противостоять поступле-
нию в нее воды.
2.6.9. Реакция на стресс, вызванный этиловым спиртом
Основным фактором в выборе штаммов дрожжей для промышленного примене-
ния является их способность противостоять концентрации образуемого этилового
спирта. Этиловый спирт действуют в той или иной степени токсично на все дрожже-
вые штаммы, но его эффективная ингибирующая концентрация варьирует в широ-
56
Дж. Колин Слотер
ком диапазоне. Кроме того, в определении стойкости дрожжей к этиловому спирту
большое значение имеет состав питательной среды [16, 23, 114]. Токсические свой-
ства этого соединения — результат увеличения проницаемости и пористости клеточ-
ной мембраны, что приводит к проблемам с транспортом раствора и поддержанием
межмембранного протонного градиента, важного для потребления многих питатель-
ных веществ. Кроме того, наблюдается дефицит доступной цитоплазме воды. Прав-
да, в этой сфере существует еще много не известного. Понятно, что этиловый спирт
не активирует HOG-иутъ биосинтеза, который регулирует синтез глицерина в ответ
на гиперосмотический стресс [109]. Реакция клеток на воздействие этилового спир-
та в лабораторных условиях проявляется в увеличении степени ненасыщенности
имеющихся в цитоплазматической мембране жирных кислот, в росте содержания
эргостерина, синтезе трегалозы и продуцировании специфических белков термошо-
ка (Hsp). Было показано, что этиловый спирт стимулирует синтез Hsp\2. Этот белок
содержится в мембране и повышает ее стойкость к этиловому спирту [95]. Слож-
ность решения вопросов, связанных с установлением механизмов устойчивости кле-
ток к этиловому спирту, еще более возрастает, так как были выявлены более 250 ге-
нов, участвующих в этом процессе [И].
Все вышесказанное основано преимущественно на лабораторных исследованиях,
так что в промышленных условиях ситуация может быть совершенно другой. Во-
первых, к тому времени, когда концентрация этилового спирта существенно возрас-
тет, клетки наверняка будут не способны изменить состав липидов цитоплазмати-
ческой мембраны, поскольку для такого изменения необходим молекулярный
кислород, который при нормальном брожении уже полностью утилизирован в тече-
ние несколько часов после внесения дрожжей (о синтезе липидов см. раздел 2.6.4).
Во-вторых, к тому времени, когда концентрация этилового спирта в сусле увеличит-
ся настолько, что включится реакция индукции, способность клеток синтезировать
специфические белки термошока может быть снижена из-за дефицита питательных
веществ.
2.6.10. Реакция на стресс, вызванный двуокисью углерода
Микробиологическая токсичность двуокиси углерода известна уже давно [28,42],
причем ее действие на дрожжи подробно описано. При концентрациях, эквивалент-
ных давлению газа выше 0,2 атм, данное соединение стимулирует рост клеток [84] —
возможно из-за стимулирования анаплеротического синтеза таких соединений, как
оксалоацетат, путем реакций карбоксилирования (рис. 2.4.). Хотя в сложных средах
этот эффект выражен меньше, чем в простых, было высказано предположение, что
при брожении пива при высокой скорости внесения дрожжей начало роста наблюда-
ется раньше из-за более быстрого увеличения концентрации двуокиси углерода
в свежем сусле. При давлении газа около 0,5 атм цикл трикарбоновых кислот инги-
бируется [80], но спиртовое брожение продолжается вплоть до давления в 4,0 атм
[17]. Деление клеток прекращается при давлении около 2,5-3,0 атм [80]. При этом
клетки проходят через S-фазу, но не почкуются, и поэтому они характеризуются
двойным составом ДНК и большими, чем обычно, размерами [70]. При концентра-
циях двуокиси углерода, позволяющих клеткам расти, отмечается явное влияние
двуокиси углерода на формирование летучих ароматобразующих соединений [4, 66,
Глава 2. Биохимия и физиология роста дрожжей
57
75,92]. Во всех случаях образование высших спиртов снижается, а действие на эфи-
ры и вицинальные дикетоны зависит от конкретного штамма дрожжей и условий
культивирования.
До сих пор специалисты не пришли к единому мнению о биохимическом механиз-
ме действия двуокиси углерода [58]. Возможны несколько вариантов. Растворенная
в воде двуокись углерода может действовать как конкурентоспособный ингибитор
декарбоксилаз и уменьшать количество подвергающихся реакции декарбоксилиро-
вания соединений путем увеличения концентрации продукта; она может вызывать
общие нарушения в цитоплазматической мембране и изменения в составе жирных
кислот; она может вступать в реакцию с аминогруппами белков с образованием кар-
баматов; в ходе исследований in vitro показано присутствие иона НСО~, который
является анионным ферментным модификатором, вызывающим как активацию, так
и ингибирование (в зависимости от фермента); двуокись углерода взаимодействует
с заряженными группами в цитоплазматической мембране, изменяя их электриче-
ские и ионные свойства; недиссоциированная карбоновая кислота (Н2СОэ) пред-
ставляет собой полярную молекулу, которая может ассоциироваться с конечными
группами на поверхности белков, изменяя их свойства. Очевидно, что механизмы
действия двуокиси углерода очень разнообразны и, наверное, мы никогда точно не
узнаем, как именно это соединение влияет на метаболизм дрожжей в тех или иных
условиях брожения пива. В связи с этим интересно отметить, что предлагается ис-
пользовать двуокись углерода как вспомогательное средство в производстве водных
растворов промышленных ферментов и белков (из-за ее полезного влияния на по-
вышение растворимости и обеспечение стабилизации) [76].
Хотя полного теоретического понимания роли двуокиси углерода до сих пор нет,
практическое использование этого газа строится на его влиянии на так называемое
«ускоренное брожение» или «брожение под давлением». Обычно для ускорения
спиртового брожения после первой фазы роста при лагерном брожении температуру
увеличивают, и путем ограничения отвода газа повышается давление двуокиси угле-
рода, что уменьшает образование летучих ароматических соединений. Точные усло-
вия определяются эмпирически таким образом, чтобы они соответствовали аромату
традиционного пива [75].
Во всем этом важнейшим фактором является не давление, а концентрация двуоки-
си углерода в питательной среде. Эта концентрация зависит от температуры, скорос-
ти синтеза и скорости перехода из жидкой фазы. По данным наблюдений газ выходит
из раствора не без труда, и даже в случае, когда никаких попыток к ограничению вы-
хода газа не предпринимается, сбраживаемое сусло характеризуется некоторой сте-
пенью перенасыщения двуокисью углерода, эквивалентной избыточному давлению
в 1,5 атм. Следовательно, при любых условиях следует ожидать некоторого ее влияния
на характеристики брожения, что хотя бы частично объясняет чрезвычайную чувстви-
тельность продуцирования летучих ароматических веществ к условиям брожения.
2.6.11. Реакция на кислородный стресс
Относительно способности дрожжей противостоять окислительному стрессу про-
ведено большое количество исследований. У клеток имеются защитные механиз-
мы — на субстратном уровне, например, глутатион, полиамины, эритроаскорбино-
58
Дж. Колин Слотер
вая кислота, ионы металлов, тиоредоксин и др., а на ферментном уровне — каталаза,
супероксиддизмутаза, глутатионпероксидаза, тиоредоксинпероксидаза, а также ре-
дуктаза, метионинредуктаза и ДНК-восстанавливающие ферменты [53]. В пивном
брожении, однако, значение кислородного стресса не так велико, так как клетки под-
вергаются воздействию кислорода в течение короткого периода времени лишь в на-
чале брожения, поэтому в ходе реакций, протекающих в митохондриях, в клетки по-
ступает очень небольшое количество активного кислорода, способного отрицательно
повлиять на жизнедеятельность дрожжей.
Тем не менее, как субстрат кислород очень важен для биосинтеза ненасыщенных
жирных кислот и эргостерина, необходимых для роста клеток (см. раздел 2.6.4).
Так же важно, но в пивоварении еще далеко не ясно, влияние кислорода на пове-
дение генов. Хотя на большинство генов кислород не влияет, исследования в хе-
мостатной культуре показали, что в аэробных условиях сильнее экспрессированы
140 генов, а в анаэробных — 219 [110]. Только в аэробных или только в анаэробных
условиях экспрессируется очень небольшое число генов. В большинстве случаев
функция генных продуктов, на которую влияет кислород, не известна. При внесении
в свежее сусло дрожжи подвергаются воздействию кислорода в его максимально воз-
можной концентрации, что, по-видимому, приводит в действие зависящую от кон-
центрации экспрессию или подавление не подавленных глюкозой генов, деятель-
ность которых регулируется кислородом [88]. Вместе с тем кислород дрожжами
быстро метаболизируется так, что за несколько часов питательная среда его лишает-
ся, дрожжи переходят на анаэробный метаболизм, и модель экспрессии генов долж-
на приспосабливаться к этой новой окружающей среде, сохраняющейся в течение
всего оставшегося периода брожения [89]. Тагим образом, оказывается, что в первые
несколько часов после засева дрожжи в своих попытках приспособиться к условиям
высокой концентрации кислорода (существующей очень короткое время) могут ис-
тратить энергию и материал, необходимые для осуществления обмена веществ. Вли-
яние этого на продолжительность лаг-фазы и интенсивность первоначального бро-
жения до сих пор неизвестно.
2.6.12. Старение клеток
При неблагоприятных условиях дрожжевые клетки могут погибнуть или подверг-
нуться автолизу на любых стадиях роста, но даже при хороших условиях клетки жи-
вут не вечно. Как и другие эукариоты, дрожжевые клетки обычно способны к деле-
нию лишь определенное количество раз, и число делений определяется штаммом
(обычно около 20-30 генераций) [54]. Для исследователей дрожжевые клетки обла-
дают тем преимуществом, что возраст клетки легко определяется по числу почечных
рубцов. Для разнесения клеток по возрасту разработаны лабораторные методики.
В настоящее время идентифицированы и клонированы 12 генов, определяющих ста-
рение клетки, что позволило описать отличительные признаки, по которым можно
определить их «возраст» [54]. Говоря кратко, по мере старения клетки увеличиваются
в размере, клеточная стенка становится толще, а интенсивность метаболизма падает.
По-видимому, вряд ли старение клеток очень важно для пивоварения, поскольку раз-
множающаяся дрожжевая культура всегда содержит около 50% новых дочерних кле-
ток, которые еще не почковались («девственные» клетки), 25% клеток с одним почеч-
Глава 2. Биохимия и физиология роста дрожжей
59
ным рубцом, 12,5% — с двумя и 12,5% — с тремя или более рубцами. Очень немногие
клетки при этом близки к гибели. То же относится и к клеткам, находящимся в стаци-
онарной фазе. Некоторые проблемы могли бы возникнуть, если бы при сборе семен-
ных дрожжей каким-либо образом предпочтение отдавалось более старым клеткам
(например, путем отбора более крупных клеток), тогда семенные дрожжи характери-
зовались бы низкой жизнеспособностью и имели продолжительую лаг-фазу. Это не
отразилось бы на процессе дображивания пива, поскольку нормальное соотношение
возрастов клеток со временем уравновешивается.
2.6.13. Структура клеточной стенки, ее биосинтез
и функционирование (флокуляция)
а) Структура
Дрожжевая клетка полностью окружена клеточной стенкой с небольшим пери-
плазматическим пространством между стенкой и клеточной мембраной. Стенка явля-
ется крупной структурой — на ее долю приходится более 30% сухой массы клетки [62,
82]. В стационарной фазе клеточные стенки состоят примерно из 40% маннанопротеи-
на, 60% глюкана и 2% хитина. Стенка клетки не гомогенна, и ее можно разделить на
два основных слоя. Внешний состоит преимущественно из маннанопротеина, а внут-
ренний слой, расположенный сразу же за периплазматическим пространством, — из
глюкана со следами хитина. Маннанопротеиновый слой может быть удален фермен-
тами без потери клеткой своей формы, так что за морфологию клетки отвечает именно
глюкановый слой, который тоже не однороден. С внешней стороны он представлен
глюканом с р-1,6-связями, тогда как ближе к цитоплазме доминируют фибриллы
Р-1,3-глюкана. Скорее всего, эти фибриллы связаны с хитином; свободный атом С, мо-
лекул глюкана соединяется с позицией атома С6 в цепи (ЛГ-ацетил)-глюкозаминных
остатков хитина, образуя вещество с очень низкой степенью растворения.
Маннанопротеины, преобладающие во внешнем слое клеточной стенки, гликоли-
зуются с большим трудом. Короткие цепочки с О-связью с 1-5 маннозными остатка-
ми присоединяются к сериновым и треониновым остаткам в белке. Намного более
сложными являются цепочки с N-связью, присоединенные к аспарагину. Обычно
они имеют линейную цепочку, образованную из белка с 8-15 маннозными остатка-
ми, которая сильно разветвлена и содержит много а-1,6-связей. Боковые цепочки
являются обычно а-1,2-связанными с а-1,3-связью, образующей конечную цепочку.
В таких углеводных цепях может присутствовать более 200 маннозных остатков.
Кроме того, белки могут связываться с цепочками (3-1,6-глюкана, причем большин-
ство из них, скорее всего, ковалентно присоединены к внутреннему глюкановому
слою.
В 1997 г. сообщалось о выделении из клеточной стенки фракции, содержавшей все
четыре структурных компонента, ковалентно связанных с р-1,6-глюканом, который
выступал в функции связывающего компонента [63]. Редуцирующийся конец р-1,6-
глюкана был присоединен к нередуцирующемуся концу р-1,3-глюкана. р-1,6-глюкан
был связан с редуцирующимся концом цепочки хитина в-1,4- и в-1,2-связями. Ман-
нанопротеин присоединен к р-1,6-глюкану через остаточный гликозилфосфатидиль-
ный (ГФИ) якорь (этаноламин/фосфат/5 Р-связанных маннозных остатков). Эта ра-
60
Дж. Колин Слотер
бота подтверждает ту точку зрения, что клеточная стенка является гетерогенной
структурой с огромным числом промежуточных связей.
б) Биосинтез
Глюкановые и хитиновые компоненты стенки синтезируются в ходе реакций гли-
колиза непосредственно из возникающих на ранних стадиях промежуточных соеди-
нений (рис. 2.2.), и работа этой системы регулируется РКС-путем, который активи-
руется гипоосмотическими условиями и ограниченностью питательных веществ
[18]. Детали макромолекулярных процессов, происходящих при почковании и фор-
мировании клеточной стенки, изучены еще недостаточно [18, 33].
Р-глюканы образуются на метаболическом пути, начинающемся с изомеризации
глюкозо-6-фосфата до глюкозо-1-фосфата. Далее при участии УТФ образуются
УДФ-глюкоза и пирофосфат (рис. 2.2). УДФ-глюкоза является субстратом для син-
теза р-глюкана, содержащегося в клеточной мембране. В экспериментах in vitro был
проведен синтез микрофибрилл р-1,3-глюкана с помощью обогащения мембранной
фракции дрожжевой клетки УДФ-глюкозой [83]. Аналогичные микрофибриллы
можно наблюдать на поверхности клеток в ходе регенерации протопластов [82]
(р-1,6-глюкан также синтезируется на поверхности клеток [78]).
Хитин — это линейный р-1,4-связанный полимер N-ацетилглюкозамина, а непо-
средственным предшественником синтеза является УДФ-М-ацетилглюкозамин [15].
Это соединение образуется из фруктозо-6-фосфата путем аминирования С2 до
Af-ацетилглюкозамин-б-фосфата; затем при ацетилировании образуется глюкоза-
мин-6-фосфат, который изомеризуется до ЛГ-ацетилглюкозамин-1 -фосфата. После-
дний реагирует с УТФ с образованием УДФ-ЛГ-ацетилглюкозамина и пирофосфата
(рис. 2.2).
Полипептидные компоненты маннанопротеина обычно синтезируются через ДНК/
РНК/рибосомальные последовательности и гликолизируются во время их прохода
по секреторному пути. TV-связанные цепочки доставляются в эндоплазматический ре-
тикулум (ЭР) под действием долихола (липида). Сахарный субстрат представляет
собой ГДФ-маннозу, полученную аналогично образованию упоминавшихся выше
УДФ-активированных Сахаров (рис. 2.2). Фруктозо-6-фосфат изомеризуется до ман-
нозо-6-фосфата и затем — до маннозо-1-фосфата, вступающего в реакцию с ГТФ.
О-связанные цепочки доставляются в аппарат Гольджи путем непосредственного
воздействия ГДФ-маннозотрансферазы на остатки серина и треонина [119].
Последние работы показали присутствие в клеточной стенке некоторого количе-
ства белков (ранее полагали, что они присутствуют только в цитозоле). Эти белки
включают белки из семейства Hsp70 и ферментативно активную глицеральдегид-
3-фосфат-дегидрогеназу. Каким образом эти белки поступают в клеточную стенку
и какую функцию они могут выполнять, до сих пор неизвестно [25].
с) Функции
Клеточная стенка определяет форму клетки, ее «внешний вид» и сопротивляемость
физическим стрессам. Она позволяет клеткам выжить в неблагоприятных ситуациях,
которые довольно часто возникают на пивоваренном предприятии (например, внезап-
но возникающие гипоосмотические условия, перекачка и центрифугирование).
Глава 2. Биохимия и физиология роста дрожжей
61
Обычно пивные дрожжи в конце брожения образуют группы клеток (флокуля-
ты), которые легко отделяются от пива, что является одной из важнейших техноло-
гических характеристик дрожжей. Если флокуляция происходит раньше, то броже-
ние не завершается, а если позже, то время на дображивание будет потрачено
впустую или придется идти на дополнительные затраты для сбора дрожжей другими
способами (фильтрованием или центрифугированием). Способность к флокуляции
определяется свойствами внешней стороны клеточной стенки. Выделяют четыре та-
ких свойства: заряд, гидрофобность, топография и присутствие лектиноподобных
соединений [104]. Перед взаимодействием «клетка-клетка» клетке необходимо пре-
одолеть электростатические силы отталкивания. Слиянию клеток способствуют вы-
сокая гидрофобность и их гладкая поверхность, но, по-видимому, для «склеивания»
клеток требуется взаимодействие между лектиноподобным белком и маннозной це-
почкой на поверхности клеточной стенки [115]. Для флокуляции необходим также
Са2\
С поведением клетки при флокуляции связана деятельность нескольких генов
(ЛО-генов). Было высказано предположение, что они кодируют лектиноподобные
белки, и вся работа связана с FLOX. Благодаря электронной микроскопии этот белко-
вый продукт был обнаружен во внешнем маннанопротеиновом слое клеточной стен-
ки, в периплазматическом пространстве, на цитоплазматической мембране и в эндо-
плазматическом ретикуле [10]. Использование мутантов, синтезирующих усеченные
формы белков, показало, что для удержания этого белка в клеточной стенке необхо-
дима С-предельная область. Из этого следует, что работает предполагаемый ГФИ-
якорь (это подтверждается данными о том, что фосфатидилинозитолфосфолипаза С
выводит этот белок из фракций клеточной стенки). Было также показано, что для
флокуляции необходима Af-конечная область. Flo\p является очень крупным белком,
содержащим 1536 аминокислот, и поскольку 800 из них линейны, этого достаточно,
чтобы пересечь клеточную стенку [106]. В настоящее время кажется вполне вероят-
ным, что Flolp закреплен на цитоплазматической мембране и пронизывает клеточ-
ную стенку, действуя по всей ее поверхности. Действие Flolp при флокуляции под-
твердилось экспериментально — после внедрения его в нефлокулирующий штамм
был получен явно флокулентный фенотип [112].
2.6.14. Киллер-факторы
Некоторые штаммы дрожжей (штаммы-киллеры) выделяют белки, которые ток-
сичны по отношению к другим штаммам, но безвредные для штаммов-киллеров.
В цитоплазме штаммов-киллеров содержатся две двойные переплетенные молекулы
РНК, внутри которых присутствуют протеиназные оболочки, формирующие виру-
соподобные частицы. L-геном кодирует эти вирусоподобные частицы, а М-геном —
токсичный димерный белок и белок иммунитета [ 117]. 5. cerevisiae продуцируют три
различных типа киллер-факторов: К,, К2 и К28 (первые два действуют как ионофо-
ры). Kt и К2 связываются с присутствующим в клеточной стенке р-1,6-глюканом, об-
разуя канал через мембрану. Белок иммунитета предупреждает самоубийство клет-
ки-киллера, связываясь с рецепторами ее клеточной стенки. Токсин К28 связывается
с маннанопротеинами клеточной стенки и ингибирует в этой чувствительной клетке
синтез ДНК. Некоторые штаммы (так называемые нейтральные) не продуцируют
62
Дж. Колин Слотер
киллер-факторы и не подвергаются их воздействию. В таких штаммах содержатся
вирусоподобные частицы, но из М-генома синтезируется только белок иммунитета
[87, 114]. Подобное «киллер»-явление широко распространено в дрожжах из есте-
ственной среды обитания и в коллекциях культур, представляя определенный риск
для пивоваренных предприятий, использующих чувствительные штаммы.
2.7. Резюме
По ходу процесса брожения могут быть выделены три основные стадии развития
дрожжей, соответствующие в принципе традиционным микробиологическим пред-
ставлениям — лаг-фаза, фаза роста и стационарная фаза.
Лаг-фаза называется так потому, что в это время количество клеток не увеличива-
ется, а образование этилового спирта очень невелико. Тем не менее с биохимической
точки зрения это очень активный период. Семенные дрожжи обычно поступают от
уже проведенного брожения, и задержка в их развитии (лаг-фаза) связана с необхо-
димостью приспособления клеток к новой среде. Основными действующими факто-
рами здесь являются глюкоза, кислород и гиперосмотический стресс, которые при-
водят к изменению модели экспрессии гена и структуры модели ковалентной
модификации имеющихся белков (табл. 2.3). Энергия и углерод для осуществления
метаболизма образуются в ходе гидролиза гликогена. Этот процесс стимулируется
присутствием глюкозы в питательной среде.
По мере приспособления семенных дрожжей к новой среде они начинают погло-
щать глюкозу и другие питательные вещества, переходя в другую фазу клеточного
цикла — фазу роста. По мере исчерпания запасов глюкозы клетки переходят к ути-
лизации мальтозы, а затем — мальтотриозы. Аминокислоты и азот сусла также по-
следовательно поглощаются, что обеспечивает некоторое количество переключений
транспортеров и путей утилизации. Клеточный цикл повторяется до тех пор, пока он
не прекратится из-за нехватки питательных веществ или стресса. Эта фаза характе-
ризуется преобразованием углеводов в этиловый спирт и двуокись углерода, а также
продуцированием целого ряда летучих соединений, влияющих на вкусо-ароматиче-
ские свойства пива. Проблемы неполного сбраживания возникают тогда, когда в сус-
ле недостаточно усваиваемых соединений азота, витаминов и микроэлементов, не-
обходимых для метаболических процессов.
На большинстве пивоваренных предприятий рост дрожжевых клеток прекраща-
ется из-за нехватки ненасыщенных жирных кислот, эргостерина или усваиваемого
азота, и дрожжи переходят в стационарную фазу. Биосинтез липидов связан с со-
стоянием дрожжей при засеве и степенью насыщения сусла кислородом, а усваива-
емый азот — помолом и затиранием. Клетки, ощущающие нехватку питательных
веществ, переходят в фазу GQ клеточного цикла, а не в фазу Gv В стационарной фазе
наблюдается снижение транспорта Сахаров и аминокислот через цитоплазматиче-
скую мембрану, в результате чего брожение постепенно прекращается. В идеальном
случае в этой фазе сразу после завершения брожения клетки должны образовывать
хлопья (флокулировать). Стрессовые воздействия (высокая концентрация этило-
вого спирта или низкая температура) могут приводить к аналогичным реакциям,
которые наблюдаются при нехватке питательных веществ, и иметь те же послед-
ствия.
Глава 2. Биохимия и физиология роста дрожжей
63
Таблица 2.3. Действие некоторых условий окружающей среды на физиологию S. cerevisiae
Стимул
Действие
Влияние
Кислород
Глюкоза
Гиперосмотический
стресс
Позволяет синтезировать
ненасыщенные жирные кислоты
и эргостерин
Индуцирование и подавление
некоторых генов
Активация и индукция цито-
плазматической мембраны Н*
АТФазы
Подавление геновНХ7Ви7
и индукция генов НХТ1 и 3
Стимуляция RAS-генов,
повышение концентрации
цАМФ, активности
протеинкиназы А и уровня
фосфорилирования белка
Подавление Sl/C-генов
Подавление MAL-геноз
и деградация белков-
транспортеров мальтозы
Подавление митохондриальных
генов, регулирующих цикл ЦТК,
перенос е~ и окислительное
фосфорилирование
Активация посредников обмена
NaVH* в эндосомальном/
предвакуолярном отделе
Стимулирование HOG-пути
Устраняет фактор, лимитирующий рост
клеток и их размножение
Не определено. Может заканчиваться
тратой биохимической энергии
и веществ, а запасы материала
(например, кислорода) быстро
истощаются с обратным эффектом
Повышается способность поддержать
активный транспорт нутриентов путем
протонного насоса
Увеличение интенсивности и значения
Км системы транспорта глюкозы
Увеличение метаболической активности
с переходом к гликолизу и расщеплению
гликогена
Не действует на семенные дрожжи;
вновь образованные клетки будут
испытывать нехватку инвертазы
Неспособность утилизировать мальтозу
и мальтотриозу из сусла
Неполное развитие митохондрий
и неспособность дышать даже
в присутствии кислорода
Перенос солей и воды через вакуоль
в цитоплазму для обеспечения
краткосрочной сопротивляемости
Усваиваемый азот
Повышение активности
глицеральдегид-3-фосфат-
де г ид роге н азы; закрытие мембранных
пор для глицерина и увеличение
концентрации глицерина в цитоплазме
для обеспечения долгосрочной
сопротивляемости
Для аминокислот — выборочная Поддержание транспортных систем
индукция систем поглощения Сахаров в клеточной мембране.
Увеличение биосинтеза аминокислот,
нуклеотидов и белка
Литература
1. Albertyn.J., Hohmann, S., and Prior, В. А. (1994) Current Genetics, 25, 12.
2. Albertyn.J., Hohmann, S., Hevelein.J.M.and Prior, B. A. (1994) Molecular and Cell Biology,
14,4135.
3. Anderson, R.H., and Kirsop, B.H. (1975) Journal of the Institute of Brewing, 81, 111.
(4
Дж. Колин Слотер
4. Агсау-Ledezma, G.J., and Slaughter,J.C. (1984) Journal of the Institute ofBrewing90,81.
5. Benuett, F. (1998) Microbiology and Molecular Biology Reviews, 62, 249.
6. Benito, В., and Lagunas, R. (1992) Journal of Bacteriology, 174,3065.
7. Belitz, H.-D., and Grosch, W. (1999) Food Chemistry, 2nd English edn, Springer, Berlin.
8. Blomberg, A. (2000) FEMS Microbiology Letters, 182,1.
9. Boles, E., and Hollenberg, C.P. (1997) FEMS Microbiological Reviws, 21, 85.
10. Bony, M., Thines-Sempoux, D., Barre, P., and Blondin, B. (1997) Journal of Bacteriology, 179,
4929.
11. Boulton, В., Sigletion, V. L. Bisson, L.F., and Kunkee, R.E. (1996) In Principles and Practices
of Winemaking (eds B. Boulton, V.L. Singleton, L. F.Bisson and R.E. Kunkee) Chapman and
Hall, New York, p. 139.
12. Briggs, D. E., Hough, J. S., Stevens, R., and Young, T. W. (1981) Malting and Brewing Science,
Vol. 1, Malt and Sweet Wort, 2nd edn., Chapman and Hall, London.
13. Brosnan, M.P., Donnelly, D.James, T.C., and Bond, U. (20Щ JournalofApplied Microbiology, 88,
746.
14. Bryant, N.J., and Stevens, Т.Н. (1998) Microbiology and Molecular Biology Reviews, 62,230.
15. Cabib, E., Shaw, J.A., Mol, P.C., Bowers, В., and Choi, W.-J. (1996). In The Mycota III,
Biochemistry and Molecular Biology (eds R. Brambl and G.A. Marzluf). Springer, Berlin, p. 243.
16. Casey, G.P., and Ingledew, W.M. (1986) CRC Critical Rerviews in Microbiology, 13, 219.
17. Chen, S.L., and Gutmanis, F. (1976) Biotechnology andBioengineering, 18,1455.
18. Cid, V. J., Duran, A., del Rey, F. Snyder, M.P., Nombela, C, and Sanchez., M. (1995)
Microbiological Reviews, 59,345.
19. Crowe, J.H., Crowe, L.M., and Chapman, D. (1984) Science, 223,701.
20. Crumplen, R.M. (1996) Galactose Fermentation and Transport in Brewers Yeast. Ph.D. Thesis,
Heriot-Watt University, Edinburgh.
21. Crumplen, R.M., Crumplen, СМ., D'Amore, Т., Goring, R.A., and Stewart, G.G. (1990)
Journal of the American Society of Brewing Chemists, 48, 95.
22. Crumplen, R.M., Slaughter, J.C, and Stewart, G.G. (1996) Letters in Applied Microbiology, 23,448.
23. D'Amore Т., Panchal., C.J., Russell, I., and Stewart, G.G. (1990) Critical Reviews in
Biochemistry, 7, 287.
24. Debourg, A. (2000) In European Brewery Convention Monograph 28, EBC Symposium Yeast
Physiology, A New Era of Opportunity, P. 60.
25. Delgado, M.L., O'Conor, J.E., Azorin, I., Renau-lqueras, J., Gil., M.L., and Gozalbo, D. (2001)
Microbiology, 147,411.
26. Dickinson, J.R. (2000). In European Brewery Convention Mongraph 28, EBC Symposium on
Yeast Physiology, A New Era of Opportunity, p. 74.
27. Dickinson, J.R., and Schweizer, M. (1999) The Metabolism and Molecular Physiology of
Saccharomyces cervisiae. Taylor and Francis, London.
28. Dixon, N.M., and Kell, B.K. (1989) Journal of Applied Bacteriology, 67,109.
29. Doyle, A., and Slaughter, J.C. (1998) Journal ofthe Institute of Brewing, 104,147.
30. Dufour, J.-P., Carpentier, В., Kulakumba, M., van Haecht, J.-L., and Devreux, A. (1988)
Proceedings of the European Brewery Convention, Zu rick, 1998, p. 331.
31. Dufour, J.-P, Weaver, A., and Mason, B. (2000) In European Brewery Convention Monograph
28, EBC Symposium on Yeast Physiology: A New Era of Opportunity, p. 83.
32. Eraso, P., and Portillo, F. (1994) Journal of Biological Chemistry, 269,10393.
33. Field, С М., and Kellogg, D. (1999) Trends in Cell Biology, 9, 387.
Глава 2. Биохимия и физиология роста дрожжей
65
34. Francois, J., Blazquez, M.A., Arino, J., and Gancedo, C. (1997) In Yeast Sugar Metabolism (eds
FK. Zimmermann and K.-D. Entian). Technomic Publication, Lancaster PA, USA, p. 285.
35. Francois, J., and Parrou, J.L. (2001) FEMS Microbiological Reviews, 25,125.
36. Gancedo, J.M. (1998). Microbiology and Molecular Biology Reviews, 62,334.
37. Gancedo, J.M. (2001) FEMS Microbiological Reviews, 25,107.
38. Garcia-Arranz, M., Maldonaldo, A.M., Mazon, M J., and Portillo, P. (1994)Journalof Biological
Chemistry, 269,18076.
39. Goffeau, A., Barrell, B.G., Bussey, H. et al. (1996) Science, 27A, 563.
40. Granot, D., and Snyder, M. (1993) Yeast, 9,465.
41. Grivell, L.A.,de Winde,J.H.,and Mulder, W. (1993) In The Eukaryotic Genome, Organisation
and Regulation (eds P. M. A. Broda, S.G. Oliver and P F.G. Sims) (50th Symposium of the
Society for General Microbiology). Cambridge University Press, p. 326.
42. Hammond, J., Brennan, M., and Price, A. (1999) Journal ofthe Institute of Brewing, 105,113.
43. Han, E.-K., Cotty, P., Sottas, C., Jiang, H., and Michjels, C.A. (1995) Molecular Microbiology,
17,1093.
44. Hansen, J., and Kielland-Brandt, M C. (1996) Nature Biotechnology, 14,1587.
45. Hayashida, Y., Kuriyama, H., Nishimura, K., and Slaughter, J.C. (1999) Biotechnology Letters,
21,505.
46. Henschke, P.A., and Rose, A.H. (1991). In The Yeasts, 2nd Edition, Vol. 4. Yeast Organelles
(eds. A. H. Rose and J. S. Harrison). Academic Press, London, p. 297.
47. Hohmann, S., and Mager, W.H. (eds) (1997) Yeast Stress Responses. Springer, Heidelberg.
48. Holzer, H. (1976). Trends in Biochemical Sciences, 1,178.
49. Horadzovsky, B.F., Dewald, D.B., and Emr, S.D. (1995) Current Opinion in Cell Biology, 1,544.
50. Hottiger, Т., Boler, Т., and Wiemken, A. (1987) FEBS Letters, 220,113.
51. Hough, J.S., Briggs, D.E., Stevens, R., and Young, T. W. (1982) Malting and Brewing Science,
Vol. II, Hopped Wort and Beer. Chapman and Hall, London.
52. Ivorra, C, PerezJ.E., Ortin, J. E., and del Ormo, M. (1999) Biotechnology andBioengineering,
64, 698.
53. Jamieson, DJ. (1998) Yeast, 14,1511.
54. Jazwinski, S.M. (1999) Trends in Microbiology, 7, 247.
55. Jespersen, S.M., Cesar, L.B., Meaden, P.G., and Jakobsen, M. (1999) Applied and
Environmental Microbiology, 64, 450.
56. Jiang, H., Medintz, I., and Michels, C.A. (1997) Molecular and Cell Biology, 8,1293.
57. Johnston, M. (1987) Microbiological Reviews, 51,458.
58. Jones, R.P., and Greenfield, P.F. (1982) Enzyme and Hicrobial Technology, 4, 210.
59. Jordan, В., and Slaughter, J.C. (1986) Transactions of the British My cological Society, 87,525.
60. Kirschner, M. (1999) Trends in Biochemical Sciences, 24, M42.
61. Kirsop, B.H. (197r4) Journal of the Institute of Brewing, 80,252.
62. Klis, F.M. (1994) Yeast, 10,851.
63. Kollar, R., Reinhold, B.B., Petrakova, E. et al. (1997) Journal of Biological Chemistry, 272,
17762.
64. Kondo, H., Yomo, H., Furukubo, S., Fukui, N., Nakatani, K., and Kawasaki, Y (1999)Journal
of the Institute of Brewing, 195,293.
65. Krampe, S., Stamm, O., Hollenberg, СР., and Boles, E. (1998) FEBS Letters, 441,343.
66. Kumada, J., Nakajilna, S., Takahashi, Т., and Narziss, L. (1975) Proceedings of the 15th
European Brewing Convention, p. 615.
56
Дж. Колин Слотер
67. Lagunas, R., Dominguez, С., Bustaria, A., and Saez, MJ. (19S2)Journal of Bacteriology, 152,19.
68. Lentini, A. (1993). Ferment, 6,321.
69. Lodish, H., Baltimore, D., Berk, A., Zipurski, S. L., Matsudaira, P., and Darnell, I. (1995)
Molecular and Cell Biology, 3rd Edition. Scientific American, New York.
70. Lumsden, W.B., Duffus, J.H., and Slaughter, J.C. (19Ъ7) JournalofGeneral Microbiology, 133,
887.
71. Mackie, A.E., and Slaughter, J.C. (1999) Journal of the American Society of Brewing Chemists,
58,69.
72. Mackie, A.E., and Slaughter, J.C. (2000)Journalofthe Institute of Brewing, 104, 209.
73. Marcusson, E.G., Horazdovski, B.F., Cereghino, J.L., Gharakhaanian, E., and Emr, S. D.
(1994) Cell, 77, 579.
74 Medintz, I., Hang, H., and Michels, C.A. (1998) Journal of Biological Chemistry, 273, 3454.
75. Miedaner, H., Natziss, L., and Womerg, G. (1974) Brauwissenschaft, 27, 208.
76. Mitz, M.A. (1978) in Enzyme Engineering, Vol. 3 (eds E. K. Pye and H. H. Weetall). Plenum,
New York.
77. Montanari, L., Perretti, G., Natellam F., Guidi, A., and Fantozzi, P. (1999) Food Science and
Technology, 32,535.
78. Montijn, R.C., Vink, E., Muller, W.H., Verkleij, A J., van den Ende, H., Henrissat, В., and
Klis, F.M. (1999) Journal of Bacteriology, 181,414.
79. Nass, R., and Rao, R. (1999) Microbiology, 145,3221.
80. Norton, J.S., and Krauss, R.W. (1972) Plant and Cell Physiology, 13,139.
81. Ormrod, I.H.L., Laloe, E.F.,andSraarpe, F.R. (1991)Journal of the Institute of Brewing,97,AAl.
82. Osumi, M. (1998) Micron, 29, 207.
83. Osumi, M., Baba, M., and Yamaguchi, H. (1984) In Cell Wall Synthesis and Autolysis (ed С Nom-
bela). Elsevier, Amsterdam.
84. Oura, E., Haarasilta, S., and Londesborough, J.L. (1980) Journal of General Microbiology, 118,
51.
85. Ozcan, S., and Johnston, M. (1999) Microbiology and Molecular Biology Reviews, 63, 554.
86. Panchal, C.J., and Stewart, G.G. (1979) Brewers*Digest, 6,599.
87. Pretorius, I.S. (2000) Yeast, 16,675.
88. Poyton, R.O. (1999) Respiration Physiology, 115, 119.
89. Rachidi, N.. Martinez, M.J., Barre, P., and Blondin, B. (2000) Molecular Biology, 35, 1421.
90. Rasmussen, L., Christensen, S.I., Schousboe, P., and Wheatley, D.N. (1996) FEMS
Microbiology Letters, 137, 123.
91. Reifenberger, E., Boles, E., and Ciriacy, M. (1997) European Journal of Biochemistry, 245,
324.
92. Rice, J., Chicoye, E., Helbert, J.R., and Garver, J. (1977) Journal of the American Society of
Brewing Chemists, 35,35.
93. Rolland, F., de Winde, J.H., Lemaire, K., Boles, E., Thevelein, J.M., and Winderickx, F.
(2000) Molecular Microbiology, 38,348.
94. Saita, M., and Slaughter, J С (1984) Enzyme and Microbial Technology, 6,375.
95. Sales, K., Brandt, W., Rumbak, E., and Lindsey, G. (2000) Biochimica et Biophysica Acta
Biomembranes, 1463, 267.
96. Salmon, J.M., Vincent, O., Mauricio, J.C, Bely, M., and Barre, P. (1993) American Journal of
Enology and Viticulture, 44, 56.
97. Schaaf, I., Heinisch, J., and Zimmermann, F. K. (1989) Yeast, 5, 285.
Глава 2. Биохимия и физиология роста дрожжей
67
98. Schweizer, M. (1999) In The Metabolism and Molecular Physiology of Saccharomyces
cerevisiae (eds J. R. Dickinson and M. Schweizer). Taylor and Francis, London, p. 790.
99. Schwencke, J. (1991) In The Yeasts, vol. 4, 2nd ed. Yeast Organelles (eds A.H. Rose and
J.S. Harrison). Academic Press, London, p. 347.
100. Siebert, K.J. (1999) Food Quality and Preference, 10,129.
101. Singer, M.A., and Lindquist, S. (1998) Trends in Biotechnology, 16,460.
102. Slaughter, J.C., Smith, J.P., and Mitchell, WJ. (1991) Letters in Applied Microbiology, 12,
221.
103. Slaughter, J.C., and Nomura, T. (1992) Enzyme and Microbial Technology, 14, 64.
104. Smart, K.A. (2000) In European Brewery Convention Monograph 28, EBC Symposium Yeast
Physiology, a New Area of Opportunity, p. 16.
105. Spencer-Martin, I., Anjos, J., Goncalves, P, Rodrigues de Sousa, H., and Salema-Oom, M
(2000) In European Brewery Convention Monograph 28, EBC Symposium Yeast Physiology,
a New Area of Opportunity, p. 43.
106. Stratford, M. (1994). Yeast, 10,1741.
107. Strathern, J.N., Jones, E.W., and Broach, J.R. (1982) The Molecular Biology of the yeast
Saccharomyces: Metabolism and Gene Expression, Cold Spring Harbor Laboratory, New York.
108. Stryer, L. (1995) Biochemistry, 4th edn Freeman, New York.
109. Tamas, M J., Rep., M., Thevelein, J.M., and Hohmann, S. (2000) FEBS Letters, 472, 159.
110. Ter Linde, J J. M., Liang, H., Davis, R.W., Steensma, H.Y., van Dijken, J.P., and Pronk, J.T.
(1999) Journal of Bacteriology, 181,7409.
111. Thevelein, ]M. (1996) In The Mycota III, Biochemistry and Molecular Biology (eds R. Brambl
and G.A. Marzluf), Springer, Berlin, p. 395.
112. Verstrepen, K., Bauer, F., Michiels, C, Derdelinckx, G., Delvaux, F., and Pretorius, I. (2000)
In European Brewery Convention Monograph 28, EBC Symposium Yeast Physiology, a New
Area of Opportunity, p. 30.
113. Voges, D., Zwickl, P., and Baumeister, W. (1999) Annual Review of Biochemistry, 68, 1015.
114. Walker, C.M. (1998) Yeast Physiology and Biochemistry. Wiley, Chichester.
115. Weis, W.I., and Dickamer, K. (1996) Annual Review of Biochemistry, 65,441.
116. Werner-Washburne, M., Braun, E., and Johnston, G.C. (1993) Microbiological Reviews, 57,
383.
117. Wickner, R.B. (1996) Microbiological Reviews, 60, 250.
118. Zubay, G. (1998) Biochemistry, 4th Edition. Brown, Dubuque I A.
Глава 3
ГЕНЕТИКА ДРОЖЖЕЙ
Джон Р. М. Хаммонд (John R. M. Hammond)
3.1. Введение
Дрожжи в производстве алкогольных напитков применяются в течение тысячеле-
тий. Процесс брожения часто непредсказуем, и это связано с микроорганизмами,
присутствующими в исходном сырье и загрязняющими оборудование. По результа-
там анализа поведения дрожжей в ходе брожения относительно недавно были выве-
дены штаммы чистых дрожжевых культур, что позволило добиться большей воспро-
изводимости брожения и улучшения качества пива.
Генетические исследования Saccharomyces cerevisiae первыми начали проводить
Винге и его коллеги в лаборатории фирмы «Карлсберг» в Копенгагене, а в дальней-
шем их продолжил Линдегрен. Дрожжи (главным образом промышленного произ-
водства) скрещивались для получения штаммов, которые могли бы спариваться, да-
вая здоровые диплоидные клетки, способные к споруляции с образованием четырех
жизнеспособных аскоспор. Родоначальниками большинства генетически маркиро-
ванных штаммов, применяемых в лабораториях всего мира, являются штамм S288C
и его диплоидное производное Х2180. Этот штамм был получен в начале 1950-х гг.,
и более чем 85% его ядерного генома происходит из штамма винных дрожжей, обна-
руженных на гнилых плодах инжира в Калифорнии в 1938 г. [123]. Понятно, что та-
кие дрожжи генетически несколько отличаются от промышленных пивных дрож-
жей. Тем не менее для проекта по расшифровке дрожжевого генома был выбран
S228C (как наиболее изученный лабораторный штамм дрожжей), и в настоящее вре-
мя определена полная нуклеотидная последовательность ДНК этого штамма. За ис-
следованием лабораторных микроорганизмов неизбежно последовало изучение ге-
нетики штаммов пивных дрожжей, поскольку S228C и родственные ему штаммы
значительно отличаются от тех, которые используют для пивоварения.
В этой главе на общем фоне фундаментальных знаний по генетике S. cerevisiae мы
в первую очередь рассмотрим генетические особенности пивных дрожжей, опишем
ограничения при работе с ними, а также те трудности, с которыми сталкиваются уче-
ные при попытках вывести новые дрожжевые штаммы, используя так называемые
«традиционные» методы. Мы рассмотрим также возможности, связанные с появле-
нием методов манипулирования с рекомбинантной ДНК, и, наконец, познакомимся
с новыми взглядами на генетическую структуру пивных дрожжей на основе дости-
жений молекулярной биологии.
3.2. Генетические особенности Saccharomyces cerevisiae
3.2.1. Жизненный цикл и споруляция
Жизненный цикл типичного лабораторного штамма S. cerevisiae приведен на
рис. 3.1. Эти дрожжи характеризуются как гаплоидной (один набор хромосом), так и
Глава 3. Генетика дрожжей
69
мейоз и споруляция
АСК С 4 СПОРАМИ
I прорастание споры
ДИПЛОИД
А
митоз
митоз,
изменение типа спаривания
ТЕТРАДА
| а 1 и спаривание
I I (гомоталлические штаммы)
митоз
(гетероталлические штаммы)
ЗИГОТА
Рис.3.1. Жизненный цикл Saccharomyces cerevisiae
диплоидной (два набора хромосом) фазой жизненного цикла. Штаммы, у которых
гаплоидная форма стабильна и может поддерживаться в течение многих генераций,
получили название гетероталлических. Гаплоиды из таких штаммов существуют
в виде клеток одного из двух типов спаривания а или а, образуя диплоиды, когда
клетка одного типа спаривания входит в контакт с клеткой другого типа спаривания.
Штаммы, в которых слияние клеток и образование диплоидов происходит между
клетками, произошедшими от одной споры, называют гомоталлическими. Присут-
ствие в таких штаммах гена НО приводит в процессе вегетативного роста к высокой
частоте переключения типов спаривания. Под влиянием этого гена у таких штаммов
локус типа спаривания МЛ Г легко изменяется с МА 7а на МАТа и наоборот. Ген МАТ
обнаружен на хромосоме III дрожжевого генома вместе с двумя молчащими генами
70
Джон Р. М. Хаммонд
HMLql и HMRa, которые дают информацию на МЛГлокусы, разрешающую переход
от одного типа спаривания к другому. До того, как они будут способны к переключе-
нию типа спаривания, клетки гомоталлических дрожжей должны отпочковаться не
менее одного раза. После этого переключение происходит при каждом почковании
в течение многих генераций с большой частотой (подробнее об этом см. [75]).
Как у гомоталлического, так и у гетероталлического штаммов спаривание проис-
ходит, когда клетки противоположных типов спаривания вступают в тесный контакт.
Клетки с типом спаривания аа продуцируют олигопептид (получивший название
а-фактор), который останавливают рост а-клеток и вызывают прилипание клеток
а- и а-типов друг к другу. Клетки типа спаривания а продуцируют а-фактор, который
оказывает такой же эффект на ct-клетки. При наличии этих факторов клетки прили-
пают друг к другу, а их цитоплазмы сливаются с образованием гетерокариона. Затем
следует быстрое слияние ядер и образование зиготы. В результате последующего кле-
точного деления наступает диплоидная фаза жизненного цикла дрожжей, которая
может стабильно сохраняться в течение многих генераций. Мейоз и споруляция дип-
лоидных клеток запускаются истощением среды по азоту в присутствии несбражива-
емых источников углерода, но при обязательном наличии обоих генов МАТа и МАТа.
Последовательно вступая в мейоз, хромосомы дрожжевого ядра претерпевают синтез
ДНК, спаривание, рекомбинацию и сегрегацию. Стенки споры растут и охватывают
четыре гаплоидных генома (по два каждого а- и a-типов спаривания), образуя харак-
терный 4-споровый аск (сумку). Споры, помещенные в соответствующую питатель-
ную среду, дают гаплоиды, и жизненный цикл повторяется. Мейотическая рекомби-
нация, очень важная для проявления эволюционных изменений, предоставляет,
кроме того, возможность картировать хромосомы [35].
Пивные штаммы своим поведением существенно отличаются от лабораторных
дрожжей — они плохо спорулирут и редко образуют тетрады спор. Многие образо-
ванные споры нежизнеспособны даже при создании идеальных условий для спору-
ляции (например, выращивании клеток при полной катаболической дерепрессии
и при более низких температурах, чем обычно применяемые для выращивания лабо-
раторных штаммов) [9,10, 50]. В работе [4], проведенной на пивных дрожжах, было
обнаружено, что верховые дрожжи спорулировали лучше, чем низовые, но они обра-
зовывали только 2- или 3-споровые аски, причем многие из получившихся в резуль-
тате штаммов имели отклонения от нормы (например, они были способны спари-
ваться как с а-, так и с сс-гаплоидными дрожжами, или оказывались стерильными).
3.2.2. Хромосомы, плоидность и генетическая стабильность
Хромосомы S. cerevisiae локализованы в ядре и содержат в себе от 80 до 85% всей
клеточной ДНК. В гаплоидных клетках количества ДНК достаточно для размеще-
ния 15 000 генов, хотя до того, как вся цепочка ДНК была расшифрована, на 16 хро-
мосомах было картировано только около 1000 генов [124]. То, что значительная
часть молекулы ДНК не кодирует гены, стало известно только недавно. По совре-
менным данным весь дрожжевой геном состоит из 13 392 кб ДНК, которая поделена
на ряд последовательностей, среди которых идентифицирована 5901 открытая рам-
ка считывания (ген), причем только 50% из них имеют закрепленные за ними функ-
ции.
Глава 3. Генетика дрожжей
71
Каждая хромосома состоит из единственной молекулы ДНК размером от 230 до
2000 кб и молекул основного белка — гистона. Большинство генов гаплоидного гено-
ма существуют в единственных копиях. Важным исключением являются гены рибо-
сомной РНК, существующие примерно в 100 копиях на хромосоме XII, а примерно
15 копий генов каждой транспортной РНК распределены по всем хромосомам.
В дрожжах Saccharomyces имеются подвижные генетические элементы, получившие
название Ту. Около 50 копий Ту присутствует в гаплоидных дрожжевых клетках, и их
наличие наряду с их способностью менять свое местоположение на хромосоме может
вызвать реорганизацию дрожжевого генома.
Хотя лабораторные штаммы 5. cerevisiae являются гаплоидными или диплоидны-
ми, большинство пивоваренных дрожжей полиплоидны или анеуплоидны. Этот вы-
вод был сделан в результате измерения содержания ДНК в отдельных клетках
и сравнения этих результатов с полученными на гаплоидных штаммах (заведомо не-
надежной процедуры). В ходе этих исследований было установлено наличие клеток,
содержащих ДНК в количестве от 2 (диплоиды) до 7 (гептаплоиды) раз превышаю-
щем нормальное гаплоидное количество ДНК. Было выявлено также множество ане-
уплоидов, содержание ДНК в которых характеризуется средним значением между
триплоидным и тетраплоидным ее количеством. Последние исследования с привле-
чением непосредственного генетического анализа подтвердили, что штаммы пивных
дрожжей действительно полиплоидны (чаще всего три-, тетра- и анеуплоидны).
Полиплоидность промышленных дрожжей сулит значительные преимущества —
например, увеличенное количество копий важных генов (в частности, гена, ответ-
ственного за утилизацию мальтозы, MAL), могло бы улучшить бродильные способ-
ности дрожжей. Производство ct-глюкозидазы и, соответственно, степень сбражива-
ния мальтозы возрастает с числом MAL-генов [164]. Высказывалось мнение, что
полиплоидные дрожжи более стабильны, чем гаплоидные (для изменения их генома
требуются множественные мутационные события). Однако благодаря своей приро-
де полиплоидные дрожжи могут скрывать в себе нефункциональные рецессивные
мутации [31], и, следовательно, генетическая стабильность полиплоидных дрожжей
больше зависит от частоты сегрегационных событий, ведущих к экспрессии мутант-
ных генов, чем от частоты самих мутаций.
3.2.3. Внехромосомные элементы
Известно, что в дрожжах присутствуют и внехромосомные генетические элемен-
ты, наиболее важными из которых являются двухмикронная ДНК (2 мкм ДНК),
митохондриальная ДНК и двухцепочечная РНК (дцРНК).
2 мкм ДНК была обнаружена в большинстве штаммов S. cerevisiae, включая пив-
ные дрожжи [2,164,177]. В одной клетке в виде кольцевых плазмид присутствует 50-
100 копий 2 мкм ДНК, а единственной функцией, которую можно приписать этим
внехромосомным элементам, является поддержание собственного существования.
По-видимому, наличие 2 мкм ДНК не дает клетке никаких преимуществ. Прежде
считалось, что эти плазмиды являются цитоплазматическими, но в настоящее время
более детальные исследования приводят к выводу, что они имеют ядерную внехромо-
сомную организацию. Многие работы по генетической модификации пивных дрож-
жей были выполнены именно с использованием плазмид на основе 2 мкм ДНК, и этот
72
Джон Р. М. Хаммонд
факт делает эту плазмиду для нас значительно более важной, чем можно было бы
предполагать, исходя из отсутствия у него функции in vivo.
Митохондриальная ДНК состоит из кольцевых молекул размером в 75 тысяч пар
оснований (т.п.о.), причем в лабораторных штаммах на одну клетку приходится 10-
40 молекул. Митохондриальная ДНК обладает меньшей плавучей плотностью, чем
хромосомная ДНК, что облегчает разделение двух типов молекул по градиенту плотно-
сти. Митохондриальная ДНК характеризуется цитоплазматическим наследованием,
и ее репликация достаточно слабо контролируется ядром, вследствие чего происходит
в течение всего клеточного цикла. Митохондриальный геном несет генетическую ин-
формацию всего лишь для нескольких весьма важных компонентов, так как более 90%
митохондриальных белков закодированы в ядерных генах. Мутации в митохондриаль-
ной ДНК приводят к появлению штаммов petite (пти-мелкие колонии), которые не спо-
собны метаболизировать несбраживаемые субстраты*. Такие мутации, приводящие
к дыхательной недостаточности, могут быть разделены на точковые мутации (mitr), де-
леционные мутации (rho~) и мутации, приводящие к полному отсутствию митохондри-
альной ДНК (rho°). Штаммы petites 5. cerevisiae зачастую дефицитны по импорту таких
Сахаров, как мальтоза и галактоза [36,112], а о мутантах petite пивных дрожжей извест-
но, что они дефицитны по утилизации мальтотриозы, и, следовательно, не полностью
используют сусло [62]. Пивные дрожжи с разными митохондриальными геномами
дают пиво, разное по вкусу [66], и мутанты petite существенно отличаются от своих
«родителей» по флокуляционному поведению (комкованию), метаболизму липидов
и продуцированию высших спиртов [109]. Митохондриальный геном также влияет на
образование диацетила [27,29,122] и на продукцию 4-винилгваяколя [178].
Многие штаммы Saccharomyces содержат в цитоплазме линейные двухцепочечные
молекулы дцРНК, заключенные в вирусоподобные частицы. Существуют две их раз-
новидности: I-дцРНК, представленные в большинстве дрожжевых штаммов, вклю-
чая некоторые пивные дрожжи [104, 208], и М-дцРНК, присутствующие только
в киллерных штаммах Saccharomyces [197]. L-дцРНК обеспечивает кодирование бел-
ка капсул вирусных частиц, а М-дцРНК кодирует как киллер-токсин, так и иммун-
ный фактор, защищающий клетки, вырабатывающие киллер-токсин, от самоуничто-
жения. Клетки киллерных штаммов обычно содержат около 12 копий М-дцРНК
и около 100 копий I-дцРНК. Избавить клетки от М-дцРНК можно путем выращива-
ния их при повышенной температуре или обработкой циклогексимидом. Был выяв-
лен лишь один штамм пивных дрожжей, продуцирующий киллер-токсин [211],
и в основном пивные дрожжи чувствительны к его действию.
3.3. ПОТРЕБНОСТЬ В НОВЫХ ПИВНЫХ ДРОЖЖАХ
3.3.1. Природа «хороших» пивных дрожжей
Общей целью пивоварения, как и любого промышленного производства, является
максимально эффективное использование сырья и оборудования без ущерба для ка-
чества конечного продукта. Одним из путей ее достижения для пивного производ-
ства является выведение более эффективных дрожжевых штаммов. Программы по
* Субстраты, которые могут быть использованы только аэробным способом. — Примеч. пер.
Глава 3. Генетика дрожжей
73
выведению новых штаммов нацелены и на производство совершенно новых продук-
тов с использованием пивных дрожжей.
Для «хороших» пивных дрожжей наиболее важны следующие свойства:
• большая скорость брожения без чрезмерного прироста дрожжей;
• эффективная утилизация мальтозы и мальтотриозы с хорошим выходом спир-
та;
• способность переносить возникающие в процессе пивоварения стрессы, вы-
званные концентрацией спирта, температурой, осмотическим давлением;
• воспроизводимость правильного уровня вкусовых и ароматических компонен-
тов в получаемом продукте;
• идеальные для используемой технологии флокуляционные характеристики;
• хорошие технологические характеристики (сохранение жизнеспособности в про-
цессе хранения, при перекачивании насосами и т. д.);
• генетическая стабильность.
3.3.2. Улучшение пивных дрожжей
Промышленные пивные дрожжи характеризуются значительным числом недо-
статков. Во-первых, они сбраживают сусло не эффективно, поскольку превращение
углеводов в этанол лимитируется избыточным приростом дрожжей и их неспособ-
ностью сбраживать все сахара сусла. Также пивовары могут лишь в очень ограни-
ченной степени управлять продуцируемым дрожжами вкусом, причем постоянным
источником беспокойства является изменение флокуляционных свойств дрожжей.
Более того, пивные дрожжи нельзя использовать при высокой температуре или сбра-
живать с их помощью сусло с очень высоким содержанием углеводов (из-за их огра-
ниченной термостабильности и чувствительности к этанолу и осмотическому давле-
нию). И, наконец, в процессе пивного брожения постоянно существует угроза
инфицирования посторонними микроорганизмами. Уменьшить опасность инфици-
рования можно было бы использованием дрожжей, обладающих антиконтаминаци-
онными свойствами.
Очевидно, что свойства пивных дрожжей далеко не оптимальны для решения сто-
ящих перед пивоварами задач. К решению этой проблемы можно подойти благодаря
тщательной селекции дрожжей с применением ряда новых методов, но следует учи-
тывать, что спектр возможных модификаций ограничивается недостатком знаний
в области физиологии дрожжей.
3.4. ГЕНЕТИЧЕСКИЕ МЕТОДЫ
3.4.1. Мутация и селекция
В популяции дрожжей всегда присутствуют клетки с тем или иным отклонением
от нормального типа. Успешная изоляция мутантов зависит от частоты, с которой
они проявляются, и от способности экспериментатора подобрать соответствующие
методы проведения селекции.
Одной из спонтанных мутаций, с которой часто сталкиваются на пивоваренных
предприятиях, является изменение флокуляционных характеристик дрожжей. В ре-
зультате такого изменения дрожжи для производства эля после отбора среди их
74
Джон Р. М. Хаммонд
предшественников верхового типа брожения становились пригодными к низовому
брожению в ЦКТБ. Непрерывное культивирование можно легко использовать для
изоляции вариантов внутри дрожжевой популяции без проведения предваритель-
ного мутагенеза, что было продемонстрировано при выращивании стабильных ла-
герных дрожжей в течение 9 мес. [176]. По истечении этого срока более половины
изолированных дрожжевых клонов отличались, по крайней мере, по одному из важ-
ных для пивоварения свойств. Селекцию в непрерывной культуре использовали
и для получения дрожжей с повышенной устойчивостью к этанолу [15,103].
Использование мутагенов увеличивает процент мутантов внутри популяции, дает
успешный результат даже при работе с полиплоидными пивными дрожжами. В рабо-
те [120] мутагенному воздействию М-метил-М-нитро-М-нитрозогуанидина и ультра-
фиолетового света были подвергнуты как верховые дрожжи (для производства эля),
так и низовые (для лагерного пива). Отбор ауксотрофов по валину и метионину по-
зволил успешно выделить ряд штаммов, продуцировавших меньшее количество диа-
цетила и сероводорода соответственно (являющихся важными негативными состав-
ляющими вкуса пива). В той же серии экспериментов были получены и варианты
дрожжей, обладавшие различной флокуляцией. В других экспериментах были выде-
лены штаммы со сниженной способностью к образованию эфиров и высших спиртов
(как спонтанные мутанты с устойчивостью к глюкозамину) [81 ]. Были получены му-
танты, устойчивые к тиаизолейцину и дававшие пиво с более высоким содержанием
амилового спирта [93].
Относительно пивных дрожжей ценной оказалась селекция мутантов, устойчи-
вых к 2-дезоксиглюкозе (ДОГ, аналог глюкозы) [89]. При нормальном брожении
благодаря катаболитной репрессии мальтоза усваивается дрожжами только после
использования примерно половины присутствующей в сусле глюкозы. Устойчивые
к действию ДОГ мутанты дерепрессированы, утилизируют мальтозу и глюкозу од-
новременно и имеют улучшенные бродильные свойства.
Методы мутагенеза могут использоваться и для получения генетически маркиро-
ванных дрожжевых штаммов для дальнейших исследований. Для индукции ауксо-
трофных мутаций у мейотических сегрегантов промышленных лагерных дрожжей
был применен ультрафиолетовый свет и этилметансульфонат. Полученные мутан-
ты были затем использованы в программе по созданию новых штаммов-продуцентов
и для детального генетического анализа низовых дрожжей [48].
3.4.2. Гибридизация
Классическая гибридизация штаммов S. cerevisiae заключается в сочетании гапло-
идов противоположного типа спаривания для образования гетерозиготного диплои-
да. В результате споруляции диплоида возникает рекомбинантное мейотическое по-
томство, у которого восстановлено гаплоидное состояние. Этот процесс является
основой для классического подхода к генетическому картированию, называемому
тетрадным анализом из-за наличия в каждом аске, образуемом спорулирующей дип-
лоидной клеткой, четырех спор — «тетрады». Детальный анализ результатов скре-
щиваний между гаплоидными дрожжами позволяет картировать расположение от-
дельных генов на определенных хромосомах и на определенных участках этих
хромосом (подробнее об этих и других процедурах картирования см. [160]).
Глава 3. Генетика дрожжей
75
Как уже упоминалось в разделе 3.2, пивные дрожжи полиплоидны и спорулируют
весьма плохо. Как следствие, использование техники гибридизации для улучшения
пивного штамма оказалось трудоемким процессом. Чтобы выделить мейотические сег-
реганты из пивных дрожжей для последующего их использования в программах по
выведению новых штаммов, требуются упорные усилия нескольких сотрудников.
В работе [50] описано попарное скрещивание сегрегантов, полученных из одного
производственного штамма дрожжей. Хотя большинство получившихся гибридов
оказались хуже, чем родительские дрожжи, у одного из гибридов свойства оказались
лучше. Этот новый штамм был использован в производстве, и оказалось, что он быс-
трее сбраживает, хорошо флокулирует и дает пиво с лучшим букетом, чем обычные
производственные дрожжи. Изначально считалось, что сегреганты гаплоидны, но
в ходе более детального генетического анализа было показано, что они почти так же
генетически сложны, как и их полиплоидные родители, хотя и обладают более низ-
кой плоидностыо (о сложности генома лагерных дрожжей см. раздел 3.7).
Другой подход описан в работе [11 ], где из дрожжей для производства эля, а также из
низовых дрожжей были получены мейотические сегреганты. В результате их спарива-
ния был получен межвидовой гибрид, который обладал свойствами и тех и других
дрожжей, мог расти при 37 °С и потреблять мелибиозу. Ферментационные свойства
этого гибрида были такими же хорошими, как и у низовых дрожжей, а продуцирование
им этанола было выше. В полученном пиве отсутствовал сернистый привкус, характер-
ный для низовых родительских дрожжей, но присутствовала эфирная нота, более ти-
пичная для пива верхового брожения.
3.4.3. Редкое спаривание
а) Метод редкого спаривания
Пивные дрожжи, у которых не удается определить тип спаривания, могут быть
слиты с гаплоидными штаммами при помощи процедуры, известной как «редкое
спаривание». Большое число клеток родительских штаммов смешивают и для полу-
чения редких гибридов применяют жесткую процедуру позитивной селекции. Эти
гибриды обычно отбирают как достаточные по дыханию прототрофы, возникающие
в результате скрещивания между дефицитным по дыханию мутантом промышлен-
ного штамма и ауксотрофным гаплоидным штаммом (рис. 3.2).
Этот метод использовали для создания штаммов для пивоварения, способных
сбраживать декстрины [178]. Пиво, полученное с помощью этих гибридов, имело
неприемлемый фенольный привкус из-за присутствия в диастатических родитель-
ских дрожжах POF1 -генов. Получить полноценные гибриды, утилизирующие декст-
рины, удалось лишь после удаления этого гена из родительских дрожжей с помощью
техники традиционной гибридизации [54]. Применение такого подхода наряду с по-
следующими классическими процедурами генетической модификации позволило
сконструировать митотически стабильные пивные дрожжи, способные к высокому
потреблению субстрата [60].
б) Цитодукция
Раритетное спаривание можно также использовать для получения потомства (ци-
тодуктантов или гетероплазмонов, рис. 3.2), которое имеет смешанную цитоплазму
76
Джон Р. М. Хаммонд
Промышленный
штамм
Лабораторный
штамм
Индукция
недостаточности
по дыханию
Мутант petite
Гибрид
Цитодуктанты
Рис. 3.2. Редкое спаривание между промышленным и лабораторным штаммами дрожжей
обоих родителей, но сохраняет только одно ядро. При редком спаривании с исполь-
зованием гаплоидных «матерей», несущих мутацию karl (приводящей к подавлению
кариогамии, т. е. к дефекту ядерного слияния), цитодуктанты могут преобладать над
гибридами. Этот метод широко использовался для получения пивных дрожжей
с антиконтаминантными свойствами путем передачи дцРНК, кодирующей дрожже-
вые киллер-факторы от лабораторных штаммов подходящим штаммам-реципиентам
[66,208, 209]. В некоторых случаях создание киллерных дрожжей методом цитодук-
ции ухудшает пивоваренные характеристики штамма-реципиента, что, возможно,
является следствием введения «чужого» митохондриального генома [66]. Понятно,
что источник митохондрий в модифицированных пивных дрожжах может иметь
большое значение для степени сбраживания, флокуляционного поведения и вкуса
пива [27,152]. Хотя в принципе манипуляция с митохондриальным геномом посред-
Глава 3. Генетика дрожжей
77
ством цитодукции может служить способом улучшения штамма, попытки откоррек-
тировать проблему сбраживания сахара данным методом к успеху не привели [67].
в) Перенос единичной хромосомы
В процессе спаривания штаммов с низкой частотой, один из которых несет аллель
karl, образуется потомство, содержащее ядерный геном одного родителя вместе с той
или иной дополнительной хромосомой от другого родителя [55, 126]. Это явление
было использовано для переноса единичных хромосом от мейотических сегрегантов
низовых пивных дрожжей штамма М244 в лабораторные дрожжи. В результате уда-
лось провести детальный генетический анализ хромосом пивных дрожжей, в том чис-
ле изучить хромосомы III, V, X, XII и XIII (подробнее об этом см. раздел 3.7).
3.4.4. Слияние сферопластов
Другую возможность преодоления существующих у промышленных дрожжей
проблем со спариванием/споруляцией предоставляет слияние сферопластов. В от-
личие от редкого спаривания этот метод может быть использован для получения как
гибридов, так и цитодуктантов (рис. 3.3) без участия нового процесса. Сферопласты
образуются при удалении клеточной стенки подходящим литическим ферментом
в среде, содержащей для предотвращения лизиса клетки осмотический стабилиза-
тор (чаще всего 1,0М-сорбитол). Сферопласты от различных штаммов смешивают в
присутствии полиэтиленгликоля и ионов кальция, а затем, после слияния, разреша-
ют регенерацию клеточных стенок в осмотически стабилизированной агаровой сре-
де. Слияние клеток может быть также индуцировано электрическим полем высокой
интенсивности.
Главная проблема при слиянии сферопластов состоит в том, что образуется целый
ряд клеточных типов, которые зачастую оказываются митотически нестабильны
(особенно это относится к случаям межвидового и межродового слияний). Тем не
менее эту технику применяли для модификации пивных дрожжей. Сбраживающие
декстрин штаммы были созданы путем слияния 5. cerevisiae var. diastaticus и пивных
дрожжей [5,38,73,151]. Как и при изучении редкого спаривания, существовала про-
блема фенольного привкуса, которая была решена удалением гена POF1 путем пред-
варительной гибридизации диастатического штамма. Слияние сферопластов исполь-
зовали и для создания штаммов с повышенной устойчивостью к этанолу, температуре
и осмотическому давлению [28,137]. Сообщалось также о слиянии пивных дрожжей
(флокулентным лабораторным штаммом, несущем ген FL05) [180]. Образовавшиеся
сферопласты относительно ассимиляции углеводов и флокуляции занимали проме-
жуточное положение между двумя «родителями». С помощью такой техники были
созданы низовые пивные дрожжи с антиконтаминантными свойствами, продуциру-
ющие дрожжевой киллер-фактор [150], или обладающие как антидрожжевыми, так и
антибактериальными свойствами [156]. Последнее было достигнуто спариванием ла-
бораторного киллерного штамма дрожжей со штаммом, характеризующимся анти-
бактериальной активностью, и последующим слиянием гибрида с пивными дрожжа-
ми. Такие дрожжи давали пиво плохого качества (возможно из-за большой роли
генома не пивных штаммов, что всегда является проблемой в экспериментальных си-
стемах такого типа).
78
Джон Р. М. Хаммонд
Дрожжевые клетки
Фермент,
■ превращающий ■
Т клетки Т
в сферопласты >
Сферопласты
Агент слияния (ПЭГ/Са )
Слившиеся сферопласты
Среда для регенерации
клеточной стенки
Слившиеся клетки
Рис. 3.3. Слияние сферопластов у дрожжей
3.4.5 Технологии рекомбинантных ДНК
а) Методы трансформации
Трансформация заключается в использовании молекул ДНК для внесения из-
менений в реципиентный организм. Так как при этом не используется механизма
спаривания, эта техника может быть легко применима к промышленным дрожжам.
Последовавшая за ранними неподтвержденными сообщениями о трансформации
с использованием нативной ДНК [133] несомненная демонстрация дрожжевой транс-
формации стала возможной благодаря применению методов рекомбинации ДНК.
При использовании этого метода (рис. 3.4) ДНК с помощью эндонуклеазы (фермента
рестрикции) расщепляют на фрагменты, которые затем вставляют в плазмидную
ДНК, которой была придана линейная форма, чаще всего с помощью той же рестрик-
тазы. Сооружение рекомбинантных плазмид завершается сшиванием в местах соеди-
нения с помощью ДНК лигазы. Таким образом, создают пул рекомбинантных плаз-
Глава 3. Генетика дрожжей
79
Дрожжевая клетка
Трансформация
(LiCI/ПЭГ)
Рекомбинантная
плазмида
Трансформация (ПЭГ/Са )
и регенерация клеточной стенки
Сферопласт
Ренатурация
и лигирование
i? о
Расщепление ДНК Расщепление ДНК
на фрагменты плазмиды
4 Фермент f
I рестрикции!
**^ о
Донорская ДНК Плазмидная ДНК
Рис. 3.4. Методы, используемые для трансформации
мид, каждая из которых содержит маленький отрезок исходной донорской ДНК. До-
статочно большой пул случайных фрагментов ДНК, в котором существует высокая
вероятность найти любой единичный ген от донорского штамма, называется «генный
банк» или «библиотека генов». Для изоляции или «клонирования» индивидуальных
генов из такого банка существуют разные методы, а детали процедур, используемых в
исследованиях по рекомбинации ДНК, описаны в [61].
Индуцировать поглощение дрожжевыми клетками ДНК из среды, в которой они
суспендированы, можно разными способами. Одна из методик заключается в удале-
нии клеточной стенки с использованием образующего сферопласты фермента (см.
раздел 3.4.4). По другой методике используют обработку клеток солями лития или
цезия. В обоих случаях дрожжи и ДНК смешивают в условиях, подобных тем, кото-
рые используют при слиянии сферопластов. При альтернативном подходе проник-
новение ДНК в дрожжевую клетку индуцируют применением электрического заря-
да (эта техника известна как электропорация).
б) Доминантные селективные маркеры
Так как пивные дрожжи являются полиплоидами, то у них крайне трудно создать
ауксотрофные мутанты, которых обычно используют для проведения селекции в экс-
периментах по трансформации с лабораторными штаммами. Следовательно, плазми-
ды, которые используют для экспериментов по трансформации со штаммами пивных
дрожжей, должны нести доминантный маркер, выделяющийся на фоне полиплоидов
дикого типа.
80
Джон Р. М. Хаммонд
Одним из наиболее популярных способов селекции, используемых в эксперимен-
тах по трансформации на промышленных дрожжевых штаммах, является устойчи-
вость к меди, кодируемая геном CUP1 [74, 116]. Ген CUP1 выделен из 5. cerevisiae
и обнаружен у многих диких и лабораторных штаммов дрожжей. Условия для отбо-
ра создаются тем, что почти все штаммы пивных дрожжей чувствительны к меди.
Пивные дрожжи, трансформированные плазмидами, содержащими ген CUP1, выб-
раживают до такой же степени, как нетрансформированные дрожжи, и производят
пиво, не отличающееся от обычного [116].
Дрожжи Saccharomyces чувствительны к генетицину (G418) — антибиотику, род-
ственному по структуре гентамицину и канамицину. Бактериальный ген, кодирую-
щий инактивирующий фермент (аминогликозидфосфотрансферазу), экспрессиру-
ется в дрожжах, и таким образом устойчивость к G418 может быть использована как
пригодный для селекции маркер. Неудобство этой системы заключается в том, что
фактор устойчивости является бактериальным геном, который должен быть элими-
нирован до того, как трансформированный штамм будет использован для производ-
ства пива.
Следующий доминантный селективный маркер (SMRI) отвечает за устойчивость
к гербициду сульфометурон-метилу [23]. Этот маркер, как и CUP1, получен из дрож-
жей и не оказывает никакого сколько-нибудь значительного эффекта на ферментаци-
онное поведение. Этот ген на самом деле является мутантной аллелью гена 5. cerevisiae
ILV2, кодирующего фермент ацетолактатсинтетазу и особенно полезен там, где требу-
ется интеграция нового гена в дрожжевую хромосому, так как он не только является
доминантным селективным маркером, но и обеспечивает сайт (место) интеграции на
гене/1У2[22,199].
Устойчивость к хлорамфениколу также применялась для селекционной трансфор-
мации промышленных дрожжей [63]. Так как эта устойчивость является функцией
митохондрий, она может использоваться только тогда, когда дрожжевые клетки растут
на несбраживаемых субстратах (с этой оговоркой устойчивость к хлорамфениколу
может очень эффективно использоваться, и она успешно применялась при трансфор-
мации пивных дрожжей). Как и устойчивость к G418, устойчивость к хлорамфениколу
кодируется бактериальным геном и может быть элиминирована до коммерческого ис-
пользования трансформированных дрожжей.
Так как дрожжи для производства эля не могут в качестве источника углерода
использовать мелибиозу, то приобретение ими этой способности можно исполь-
зовать как селективную систему [179]. Вместе с тем ген, позволяющий усваивать
мелибиозу, МЕЫ, кодирует внеклеточный фермент, и возникает проблема кросс-
фидинга («перекрестного кормления») штаммами Mel" соседствующих с ними
штаммов Ме1~, что существенно затрудняет селекцию. С такой же проблемой стал-
киваются и при селекции штаммов, усваивающих декстрин, непосредственно на
чашках с крахмалом.
в) Стабильность и экспрессия генов
Различные варианты техники рекомбинантной ДНК (использование мультико-
пийных плазмид на основе 2 мкм-ДНК, однокопийных плазмид, несущих центроме-
ру, интегративная трансформация) описаны в [95]. В большинстве первоначальных
Глава 3. Генетика дрожжей
81
экспериментов по трансформации пивных дрожжей использовали мультикопийные
плазмиды, содержащие хромосомную ДНК дрожжей, участок дрожжевой 2 мкм-
плазмиды и ДНК из бактериальной плазмиды. Присутствие бактериальной ДНК
дает удобную возможность репликации плазмиды в Escherichia coli, без чего экспери-
менты по трансформации были бы очень утомительны. Преимущество этих мульти-
копийных плазмид состоит в том, что благодаря большому числу присутствующих
в клетке копий обычно осуществляется хорошая экспрессия гена, однако иногда это
оборачивается неудобством, так как сверхпроизводство продукта гена может ока-
заться вредным для процесса брожения [ 146]. Еще один недостаток систем на основе
плазмид заключается в том, что они относительно нестабильны. Это выражается
в том, что желаемое свойство с каждой последующей ферментацией постепенно те-
ряется [17,65,116]. Наоборот, когда требуемый ген интегрирован в дрожжевую хро-
мосому, возникающие трансформанты очень стабильны, но уровень экспрессии мо-
жет быть много ниже из-за меньшего числа копий гена [34].
Несмотря на то что имеются данные о трансформации пивных штаммов нативной
ДНК [5], более предпочтительно использовать рекомбинантные методы, так как они
обеспечивают более высокую степень специфичности наряду с возможностью уве-
личения количества производимых дрожжевым штаммом генных продуктов. Подоб-
ная амплификация может быть достигнута путем встраивания представляющего
интерес гена в мультикопийную плазмиду, интегрированием этого гена в несколько
сайтов на дрожжевой хромосоме или присоединением к гену последовательностей
высокоэффективного промотора для усиления его экспрессии. Этот последний под-
ход в настоящее время нашел универсальное применение. Типичными высокоэф-
фективными промоторами являются такие, которые вовлечены в контроль генов,
ответственных за ферменты гликолитического пути, — алкогольдегидрогеназу
(ADHI), глицеральдегид-3-фосфатдегидрогеназу (GAPDH) и фосфоглицерокиназу
(PGK1). Кроме высокоэффективных промоторов можно воспользоваться и регули-
руемыми промоторами, присоединив их к генам таким образом, чтобы они могли бы
включаться и выключаться в ответ на наружное воздействие. Это дает возможность
точно контролировать уровень экспрессии гена.
3.5. Применение методов рекомбинантной ДНК
к пивным дрожжам
Методы рекомбинантной ДНК использовались для придания пивным дрожжам
ряда новых свойств — например, способности разлагать различные углеводы и бел-
ки, так и привносить в процессы изменения, сказывающиеся на вкусе пива и флоку-
ляции во время брожения. Прежде чем рассматривать такие модифицированные
штаммы на предмет коммерческого производства пива, необходимо оценить их по
разным критериям. Чтобы желаемое фенотипическое изменение могло быть реали-
зовано, дрожжи должны быть стабильными в условиях нормального брожения,
а также производить достаточное количество нового продукта. С другой стороны,
«ферментационное поведение» дрожжей и качество продукта должны оставаться
незатронутыми (за исключением, конечно, нового желаемого свойства). И, наконец,
желательно, чтобы новые штаммы не содержали никаких излишних ДНК (кроме
необходимой для создания нового свойства). Это позволит свести к минимуму воз-
82
Джон Р. М. Хаммонд
ражения специалистов против использования генетически модифицированных
организмов (правовые основы относительно ГМО см. в разделе 3.8).
3.5.1. Пивные дрожжи, способные использовать широкий спектр
углеводов
а) Глюкоамилазы
Обычно дрожжи пивных штаммов могут утилизировать только моно-, ди- и три-
гексозы. Более крупные олигомеры (декстрины), составляющие около 25% Сахаров
сусла, не метаболизируются. Дрожжи, способные сбраживать эти дополнительные
сахара, превращают сырьевые материалы в этанол гораздо эффективнее, чем это де-
лают пивные дрожжи. Если бы не низкое качество получающегося пива, их можно
было бы использовать для производства диабетического пива с низким содержани-
ем углеводов или для приготовления низкокалорийного «легкого» пива путем раз-
ведения до нормального содержания этанола. В существующей практике такое пиво
часто получают добавлением промышленных ферментов либо перед кипячением
сусла, либо в период брожения (типичными ферментами, используемыми для этой
цели, являются грибные глюкоамилазы из Aspergillus niger).
Способность дрожжей производить собственную глюкоамилазу связана с рядом
преимуществ. Поступление фермента больше находится под контролем, исключа-
ются ошибки в дозировке, которые могут быть при искусственном введении фер-
мента, отсутствует вредная активность ферментов, зачастую свойственная промыш-
ленным ферментным препаратам. В связи с этим выведение пивных дрожжей,
способных сбраживать декстрины, представляет большой интерес. Использование
редкого спаривания и слияния сферопластов (см. разделы 3.4.3 и 3.4.4) привело
к ограниченному успеху — гораздо больше дало применение методов рекомбинант-
ной ДНК для трансформирования дрожжевых штаммов геном глюкоамилазы (а-1,4-
глюканглюкогидролаза, ЕС.3.2.1.3) — фермента, способного редуцировать обычно
несбраживаемый декстрин сусла до глюкозы. Ген, ответственный за этот фермент
(DEX\ или STA2), был клонирован из S.cerevisiae var. diastaticus [117] и вставлен
в мультикопийную плазмиду, содержащую последовательности как бактериальной,
так и дрожжевой ДНК, включая селективный маркер CUPi. Плазмида была исполь-
зована для трансформации как верховых, так и низовых штаммов пивных дрожжей
[116]. Трансформированные дрожжи производили внеклеточную глюкоамилазу, но
из-за отсутствия активности, действующей на точки сс-1,6-ветвления, сверхпотреб-
ление субстрата было ограниченным. Как и ожидалось, химерная мультикопийная
плазмида проявляла некоторую нестабильность. Кроме того, на скорость роста и бро-
жения неблагоприятно влиял излишек продукции глюкоамилазы [146]. Проблема
нестабильности плазмиды была преодолена созданием мультикопийной плазмиды,
несущей только дрожжевую ДНК [183], но степень сбраживания у трансформантов
оставалась несколько ниже, чем у родительского штамма. В позднейших исследова-
ниях с использованием той же самой плазмидной конструкции трансформации под-
вергались другие пивные дрожжи. Модифицированные дрожжи сбраживали почти
до такой же степени, как и родительский штамм, но при глубоком выбраживании
сусла производили приблизительно на 1% об. больше этанола [64]. Пиво с использо-
ванием рекомбинантных дрожжей с успехом производили на мини-пивзаводе. Бро-
Глава 3. Генетика дрожжей
83
жение выполняли в аппаратах на 100 гл, полученное пиво отфильтровывали и раз-
ливали в бутылки. Стабильность дрожжей оценивали посредством проб на гены
STA2 и CUP1. Несмотря на наблюдавшуюся нестабильность, новые дрожжи были
признаны промышленно стабильными. Хотя они постепенно теряли ген STA2, это не
оказывало заметного влияния на глубину сбраживания или вкус пива. В нормаль-
ных производственных условиях при каждом новом разведении дрожжи должны
быть введены до того, как в поведении дрожжей будет отмечено какое-либо заметное
отклонение [65].
Ген 5ГЛЗ, близкий по структуре к гену STA2, также копировался в мультикопий-
ные плазмиды и использовался для трансформации пивных дрожжей с применени-
ем обеих селекционных систем устойчивости к G418 [154] и устойчивости к меди.
Стабильность плазмиды и эффективность брожения были сравнимы с результата-
ми, полученными на STA2-трансформантах. Стабильная трансформация была до-
стигнута только при интеграции гена в дрожжевую хромосому [136].
Основная проблема всех систем, основанных на глюкоамилазах, полученных от
S. cerevisiae var. diastaticus, состоит в отсутствии активности, действующей на точки
а-1,6-ветвления, из-за чего значительное количество декстринов сусла не усваивает-
ся. Это можно преодолеть использованием генов, кодирующих глюкоамилазы из
других микробных источников. Ген GA из Aspergillus niger, который кодирует глюко-
амилазу, обладающую как а-1,4-, так и <х-1,6-гидролитической активностью, был кло-
нирован и вставлен в интегрирующий вектор [206]. Этот вектор был сконструирован
для осуществления интеграции гена GA в дрожжевой геном с тем, чтобы любая по-
следовательность бактериальной ДНК из трансформантов была бы удалена (рис. 3.5).
Для обеспечения генетической стабильности три копии гена GA были интегрирова-
ны в три различные копии дрожжевого гена НО. Хорошая экспрессия была достигнута
путем использования дрожжевого промотора одного из гликолитических ферментов,
а хорошую секрецию получили при использовании сигнальной последовательности
дрожжевой секреции. Опытные ферментации (на 100 гл) прошли очень успешно.
Были достигнуты высокие уровни секреции внеклеточной глюкоамилазы, и на регу-
лярной основе было получено глубоко выброженное пиво хорошего качества [59,65].
Использованный способ интеграции стоит отдельного изложения — модифициро-
ванные дрожжи поддерживались в нормальных лабораторных условиях в течение
многих лет без проявления любых признаков генетической нестабильности [65].
Один из недостатков глюкоамилазы из A. niger состоит в том, что она обладает
относительной тепловой стабильностью и ее активность сохраняется в пиве после
пастеризации. Тем больший интерес представляет глюкоамилаза из Schwanniomyces
occidentalis. Преимущество этого фермента в том, что хотя в настоящее время и не
применяется промышленно, он значительно менее термостабилен, чем грибной фер-
мент, и активен относительно точек ветвления. Ген GAM1, ответственный за этот
фермент, был клонирован и для трансформации пивных дрожжевых штаммов поме-
щен под контроль ADH1 промотора Saccharomyces [107]. Векторы как для мультико-
пий, так и для интегративной трансформации были сконструированы с использова-
нием в качестве селективного маркера SMR\. Оба типа трансформации привели
к продуцированию глюкоамилазы; процесс брожения протекал нормально (до мень-
шей плотности, чем обычно) с получением приемлемого пива.
i Расщепление плазмидного
вектора по линии А
Селекция по устойчивости к G418r
Рис. 3.5. Протокол трансформации для получения стабильной интеграции гена глюкоамилазы из
Aspergillus niger в пивные дрожжи. Ген GA встраивают в копию дрожжевого гена НО, содержащегося
на плазмиде, которая также обладает копиями бактериальных генов — lacZ и гена устойчивости
к G418. (Ген НО представлен в дрожжевом геноме в нескольких копиях.) Отсутствие дрожжевого
ориджина репликации гарантирует трансформацию путем интеграции. Плазмида расщепляется
по линии А и используется для трансформации пивных дрожжей. Трансформанты проходят селек-
цию по их способности к росту в присутствии G418. Рекомбинация между двумя копиями гена НО
приводит либо к полной потере вставки, либо к потере всех посторонних бактериальных ДНК с со-
хранением гена GA. Эти рекомбинантные события могут быть отслежены по росту клеток на среде,
содержащей X-gal (5-бромо-4-хлоро-3-индолил-р-0-галактопиранозид). Первичные трансформанты
имеют голубые колонии (из-за присутствия /acZ-гена). Как только этот ген теряется, колонии стано-
вятся белыми. Нужные трансформанты с глюкоамилазной активностью могут быть выделены скри-
нингом белых колоний
б) Бифункциональные амилолитические ферменты
Полная деградация крахмала в сбраживаемые сахара требует активности двух
классов ферментов — ос-амилазы и глюкоамилазы. Известны попытки сконструиро-
вать дрожжевые штаммы, которые могут производить гибридный фермент, выполня-
ющий обе функции. Было создано четыре группы конструкций, использующих ген
ot-амилазы (атуЕ) из Bacillus subtilis и глюкоамилазы кДНК (AMGa) из A. awamory
(либо по отдельности, либо в виде тандема, либо слитые в структуре одного гена).
Экспрессия этих конструкций управлялась дрожжевыми промоторами (PGK или
Глава 3. Генетика дрожжей
85
ADH1), а экскрецию белковых продуктов обеспечивали лидерные пептиды. Это были
либо пептиды дрожжей (такие как препоследовательность а-фактора), либо препо-
следовательности самих гетерологичных ферментов. Наиболее эффективная экскре-
ция фермента была получена при использовании препоследовательности а-фактора.
Анализ культурального супернатанта показал, что белок, полученный при слиянии
AmyE/AMGa, имеет наибольший уровень активности как сс-амилазы, так и глюкоа-
милазы и способствует росту дрожжей на растворимом крахмале [121]. Несмотря на
то что слияние AmyE/AMGa оказалось эффективным в отношении растворимого и
сырого картофельного крахмала, оно не позволяло дрожжам расти на кукурузном
крахмале (сильно разветвленный субстрат, более 95% которого составляет амилопек-
тин) или глубоко выбраживать пивное сусло.
О секреции белка, результата слияния а-амилазы и глюкоамилазы, клетками
S. cerevisiae сообщали также и другие лаборатории. В одном случае гены, кодирую-
щие оба фермента, были получены от Aspergillus shirousamii [161], а в другом исполь-
зовали ген STA2 от 5. cerevisiae var. diastaticus и ген AMY1 от Bacillus amyloliquefaciens
[165]. Ни в одном из этих случаев не была протестирована способность дрожжей
сбраживать пивное сусло, хотя сообщалось, что они высоко активны относительно
растворимого крахмала. Дальнейшая модификация состояла в совместной экспрес-
сии трех ферментов — глюкоамилазы, а-амилазы и пуллуланазы, которые кодирова-
лись геном STA2 S. cerevisiae var. diastaticus, геном AMY\ Bacillus amyloliquefaciens
и геном pulA Klebsiella pneumoniae соответственно. В этом случае была достигнута
99%-ная ассимиляция крахмала [85].
в) р-Глюканазы
Р-Глюканаза ячменя термолабильна и легко разрушается в процессе солодораще-
ния. В результате р-глюканы ячменя часто обнаруживаются в пиве, создавая трудно-
сти при фильтрации и вызывая образование мути, осадков и гелей. Для преодоления
этих трудностей к затору или в сусло часто добавляют микробные р-глюканазы. Со-
ответственно, перенос генов, кодирующих р-глюканазы, в пивные дрожжи представ-
ляет значительный интерес. Гены были клонированы из Bacillus subtilis [16, 76,106],
из Trichoderma reesei [96] и из ячменя [84]. Первые попытки экспрессии гена В. subtilis
в дрожжах были разочаровывающими, принеся только низкие уровни внутри-
клеточной активности [77]. Экспрессия была заметно увеличена помещением гена
Р-глюканазы под контроль дрожжевого промотора ADH1 [17]. Трансформированные
пивные дрожжи внутриклеточно продуцировали высокие уровни р-глюканазы, но в
пиве определялось только очень низкое содержание этого фермента (возможно, как
следствие лизиса клеток). Значительные уровни внеклеточной р-глюканазы были
получены лишь при введении сигнальной последовательности для дрожжевой сек-
реции [106]. В этой последней работе бактериальный ген был помещен под контроль
дрожжевого промотора MFa и сигнальной последовательности а-фактора спарива-
ния. Селекцию трансформантов проводили на основе устойчивости к хлорамфени-
колу. Процесс брожения с использованием трансформированных дрожжей был
идентичен брожению с применением родительских пивных дрожжей, однако плот-
ность экспериментального пива и содержание в нем р-глюкана были значительно
меньше, а фильтруемость пива — гораздо лучше.
86
Джон Р. М. Хаммонд
Все упомянутые работы по трансформации пивных дрожжей генами бактериальных
глюканаз включали в себя использование мультикопийных плазмид, что сопровож-
далось неизбежными проблемами нестабильности. Однако оказалось, что у трансфор-
мированных дрожжей верхового брожения нестабильность была гораздо выше, чем
у дрожжей низового брожения [17]. Это было подтверждено в работе [146] с использо-
вании других плазмид. Если окажется, что в большинстве случаев это действительно
так, то данный факт является еще одним свидетельством, подтверждающим фундамен-
тальное различие двух типов дрожжей.
Чтобы гарантировать адекватную экспрессию в трансформированных дрожжах,
ген р-глюканазы из Т. reesei был помещен в дрожжевой модуль экспрессии (кассету)
PGK, который, в свою очередь, был вставлен и в мультикопийную, и в интегрирую-
щую плазмиды [34]. Так как грибные внеклеточные ферменты, в отличие от своих
бактериальных аналогов, эффективно экскретируются дрожжами, то в этом случае
не требовалось введения специфических сигнальных последовательностей для
дрожжевой секреции. Селекцию трансформантов проводили на базе устойчивости
к меди. р-Глюканы сусла эффективно расщеплялись трансформантами обоих типов,
фильтруемость пива была значительно лучше, а процесс брожения и характеристи-
ки пива в основном не менялись [34, 145]. Несмотря на то что конструкции на базе
мультикопийной плазмиды были менее стабильны, чем интегрированные трансфор-
манты, они продуцировали значительно более высокие уровни р-глюканазной ак-
тивности.
Р-Глюканазы из ячменя, обычно в пивоварении отвечающие за расщепление р-глю-
кана, демонстрируют наивысшую активность при рН 4,7 (в отличие от бактериаль-
ных ферментов, которые наиболее активны при рН 6,7). Таким образом, они больше
годятся для производства пива и введения в пивные штаммы. Чтобы клонировать
гены для этого фермента, были соединены две отдельные последовательности ДНК,
изолированные из алейронового слоя ячменя и составляющие вместе ген р-глюкана-
зы ячменя. Затем этот ген был присоединен к сигнальной последовательности секре-
ции ct-амилазы мыши и вставлен в вектор экспрессии между дрожжевым промотором
ADHX и терминальными последовательностями [84]. Далее конструировали интегра-
тивный вектор по той же схеме, которая использовалась для экспрессии глюкоами-
лазы A. niger (рис. 3.5). Используя в качестве селективного маркера устойчивость
к G418, был получен ряд дрожжевых трансформантов, и все они продуцировали вне-
клеточную р-глюканазу [175]. Подобный интегративный трансформант пивных
дрожжей был использован для производства пива на опытной установке — содержа-
ние р-глюкана в пиве оказалось значительно ниже нормы, вкус и стойкость пены не
изменились, а скорость фильтрования заметно увеличилась [7].
3.5.2. Повышение эффективности брожения
Наиболее важным фактором, определяющим степень сбраживания сусла, являет-
ся скорость, с которой утилизируется мальтоза. Для сбраживания мальтозы требу-
ются продукты по крайней мере одного из 5 MAI-локусов (MAL1-4 и МЛ16), каж-
дый из которых состоит из трех генов — MAL 5, (а-глюкозидаза), MAL T (пермеаза)
и MAL R (активатор, регулирующий другие гены). У различных дрожжевых штам-
мов имеются различные комбинации МЛ£-генов. Все они находятся около хромо-
Глава 3. Генетика дрожжей
87
сомных теломеров или поблизости, что говорит об их продуцировании путем дупли-
кации и перераспределения. Детальный анализ генов, ответственных в пивных
дрожжах за транспорт мальтозы (MAL) и мальтотриозы (A GT1), обнаружил их слож-
ную организацию [86]. Все 25 низовых и 5 верховых штаммов исследованных дрож-
жей содержали копии MALI и МЛ13, причем все они (за исключением одного) со-
держали MALA. MALI отсутствовал во всех верховых дрожжах и в 12 штаммах
низовых, тогда как ни один штамм не содержал МА16. AGTI присутствовал во всех
дрожжах (за исключением одного); кроме того, имелось свидетельство существова-
ния семейства генов AGT. Как ни странно, было обнаружено, что в пивных дрожжах
гены транспортера мальтозы расположены не на тех хромосомах, на которых они
находятся в лабораторных штаммах дрожжей.
Регуляция экспрессии MAL S и MAL T сводится к индуцирующему действию
мальтозы и репрессирующему — глюкозы. В контроль вовлечены и MAL R, и MIG1
[94]. Когда концентрация глюкозы высока, > 1% (масс/об.), гены MAL репрессиро-
ваны и, таким образом, в пивном брожении включение мальтозы начинается обычно
после использования дрожжами 50% глюкозы.
Не так давно, пивные дрожжи были улучшены путем использования генетической
модификации, приводящей к увеличению количества генов MAL T, экспрессия у ко-
торых конститутивна. Это привело к значительному увеличению скорости броже-
ния по сравнению с родительскими штаммами [101]. Аналогичным образом разру-
шением гена была преодолена репрессия, вызываемая MIG1 [94].
Контроль утилизации мальтозы осуществляется на трех уровнях (рис. 3.6):
1. Мальтоза индуцирует, а глюкоза репрессирует транскрипцию MAL S и MAL Т.
Это осуществляется конститутивно экспрессируемым регуляторным белком
MalRp, который связывается рядом с промоторами этих двух генов.
2. Посттранскрипционный контроль — добавление глюкозы к индуцированным
клеткам вызывает 70%-ное увеличение лабильности мРНК, транскрипта MAL 5.
Это свидетельствует о наличии предотвращающих деградацию факторов, свя-
занных с мРНК при отсутствии глюкозы.
3. Посттрансляционная модификация — в присутствии глюкозы пермеаза маль-
тозы либо обратимо переходит в форму с уменьшенным сродством, либо под-
вергается деградации (глюкозная инактивация).
Было также показано, что ген MIGX кодирует белок-репрессор, подавляющий все
три гена MAL. Эта активность индуцируется глюкозой [83].
Еще одна стратегия повышения эффективности брожения — получение ядерных
мутантов, дефицитных по дыханию (petites), путем делетирования необходимых для
дыхания (но не для брожения) ядерных генов. Из-за дыхательной недостаточности
такие petites не подвержены действию эффекта Пастера и, следовательно, должны
демонстрировать более высокие скорости брожения. Так, с использованием инте-
гративной трансформации был получен ядерный petite диплоидных винных дрож-
жей путем делетирования аллелей Р£П91, необходимых для дыхания [135]. При ис-
пользовании в мелкомасштабном производстве у этих дрожжей скорость объемного
продуцирования этанола была на 40% выше, и производили они на 9% больше этано-
ла, чем родительские дрожжи.
88
Джон Р. М. Хаммонд
Глюкоза •
Рис. 3.6. Генетика мальтозного метаболизма:
M/G1 — белок, являющийся посредником для глюкозной репрессии, MaIR — белок-активатор, MALS —
а-глюкозидаза, MALT—пермеаза мальтозы (точечные линии соответствуют синтезу, пунктирные пред-
ставляют ферментную активность, а сплошные обозначают контроль (со стрелками — индукцию,
с палочками — репрессию)
3.5.3. Пивные дрожжи с протеолитической активностью
Наименее успешным оказалось применение методов рекомбинированных ДНК
для создания протеолитических дрожжевых штаммов. Известно, что для предотвра-
щения образования мути при охлаждении и в процессе хранения существует необхо-
димость сократить в пиве содержание полипептидов. Традиционно такая стабилиза-
ция мутности производится с использованием папаина. Ген для внеклеточной
протеазы клонировали и вставляли в центромерную плазмиду [210]. Трансформа-
ция низовых дрожжей была с успехом осуществлена при селекции с использованием
устойчивости к G418, однако хотя бродильные характеристики новых дрожжей
оказались приемлемы, вкус полученного пива был не удовлетворительным [168].
О дальнейших работах в этой области не известно — возможно, из-за того, что вне-
дрение в дрожжи протеолитической активности создало бы проблему в связи с гид-
ролизом в сусле и пиве полипептидов, способствующих пенообразованию.
3.5.4. Модификация флокуляционных свойств пивных дрожжей
Флокуляция пивных дрожжей — явление сложное, и генетика его далеко еще не
ясна [166]. Показано, что к флокуляции имеет отношение ряд генов (Л01, FL05,
FL08t FL011 и tup\), но их присутствие в пивных дрожжах до сих пор является пред-
метом научного интереса.
FLOW состоит в сродстве с частью генов STA, кодирующих способность к секре-
ции. Белковый продукт является типичным белком клеточной стенки и обнаружи-
Глава 3. Генетика дрожжей
89
вается на поверхности дрожжевой клетки. Если этот ген разрушить, то флокуляции
не будет [НО]. FL08 (как и FL01 1 и STA1) выполняет контрольные функции (скорее
всего, активации FLOi) [98,100]. Несущие FL08 клетки не только не флокулируют,
но и не производят глюкоамилазы. FL05 гомологичен FL01 [8], и трансформация
этим геном нефлокулирующих пивных дрожжей приводит к усилению флокуляци-
онного поведения [181,182].
Большинство работ по промышленным дрожжам сосредоточено на FLOi и род-
ственных ему генах. В работе [167] исследовались 42 флокулентных дрожжевых
штамма, и был сделан вывод, что эти дрожжи демонстрируют два типа флокуляцион-
ного поведения. Флокуляционное поведение лагерных штаммов низового брожения
и лабораторных штаммов, несущих известные гены, отвечающие за флокуляцию,
явно отличалось от флокуляционного поведения штаммов дрожжей верхового бро-
жения для производства эля. Исследования по гибридизации вначале подтвердили
предполагаемое участие FLOI во флокуляции дрожжей низового брожения [195], но
более новые данные позволили обнаружить присутствие в низовых дрожжах моди-
фицированную версию FI01, обозначаемую как LgFLOi [99]. Непосредственное
исследование дрожжей на пивзаводе выявило, что по мере потери при последователь-
ных промышленных ферментациях флокуляционного поведения наблюдается деле-
ция LgFLOi на дрожжевой хромосоме VIII [196].
Ген FLOi был клонирован [191] и включен в последовательность, которая была
вставлена в мультикопийную плазмиду и использована для трансформации не-
флокулирующих дрожжей как низового, так и верхового брожения [195]. Трансфор-
мированные дрожжи оказались более флокулентными, чем их родители, но из-за
кодирования этого признака на мультикопийной плазмиде новое свойство легко ут-
рачивалось. Тем не менее брожение трансформированных дрожжей происходило
удовлетворительно [192]. Тот же ген был интегрирован в геном нефлокулирующих
дрожжей низового брожения [194], и модифицированные дрожжи стабильно прояв-
ляли значительно более сильную флокуляцию, чем родительский штамм. Кроме это-
го, ген низовых дрожжей LgFLOi был клонирован и экспрессирован в нефлокулиру-
ющих дрожжах [97]. В этом случае трансформированные дрожжи не флокулировали,
пока большая часть мальтозы сусла не была сброжена (то есть перед окончанием
брожения) — в противоположность дрожжам, трансформированным геном FLOI, ко-
торые постоянно демонстрировали сильную флокуляцию. Спектр подавления фло-
куляции сахарами для этих двух генетических типов дрожжей также различен:
флокуляция, индуцированная FL01, подавляется только маннозой, а флокуляция,
индуцированная LgFLOi, подавляется маннозой, глюкозой, фруктозой и сахарозой.
Это было непосредственно продемонстрировано путем переключения одного и того
же дрожжевого штамма на функционирование или гена FLOi, или LgFLOi [99].
Существуют данные об альтернативном подходе к регулируемой экспрессии пу-
тем использования гена FLOi [186]. Ген связывали с промотором HSP30 (из гена,
отвечающего за белок теплового шока), и эту генную конструкцию использовали для
трансформации нефлокулирующих дрожжей. При этом экспрессия FLOi наблюда-
лась только тогда, когда клетки подвергали действию теплового шока. Такой подход
позволяет контролировать флокуляцию дрожжей с помощью внешних стимулов, что
в промышленных условиях связано с очевидными выгодами.
90
Джон Р. М. Хаммонд
3.5.5. Дрожжи с антиконтаминантными свойствами
На смену выведению киллерных дрожжей с помощью цитодукции (см. раз-
дел 3.4.3) пришла другая техника — из киллерных дрожжей изолировали дцРНК
и вводили ее путем электроинжекции непосредственно в протопласты 5. cerevisiae
[155]. Трансформанты стабильно сохраняли свою заново приобретенную киллерную
активность в течение многих поколений.
Киллерные винные дрожжи были также получены с помощью более привычных
методов трансформации. Была клонирована ДНКовая копия киллерного гена К\,
которую поместили в кассету экспрессии ADHX и затем интегрировали в геном
дрожжей. Родительские винные дрожжи, использованные для этих экспериментов,
уже содержали К2 дцРНК, и получившиеся трансформанты вырабатывали как /С1-,
так и /<С2-киллер-факторы [ 13]. Такие двойные киллерные штаммы в норме не могут
существовать, так как оказывается, что К\- и /С2-дцРНК взаимно несовместимы. Эти
трансформанты стабильны и сбраживают виноградное сусло так же, как и родитель-
ские дрожжи. На пивных дрожжах такие трансформанты до сих пор не получены, но
эта схема может применяться и для них.
В последнее время методы молекулярной биологии были использованы для по-
лучения дрожжей с антибактериальной активностью. Оперон из четырех генов, тре-
буемых для продукции педиоцина, клонировали из Peddiococcus acidilactici и экс-
прессировали в дрожжах с использованием подходящих дрожжевых промоторов,
терминаторов и сигнальных последовательностей [157]. Хотя эта техника только
недавно была испробована на лабораторных штаммах, мы не видим особых причин,
по которым этот подход не мог бы привести к получению антиконтаминантных про-
мышленных штаммов дрожжей.
3.5.6. Избавление от необходимости вкусового созревания пива
а) Дрожжи с пониженным продуцированием диацетила
Главные «виновники» возникновения в готовом пиве нежелательного вкуса —
вицинальные дикетоны (особенно диацетил). Диацетил образуется в процессе бро-
жения путем химического окисления а-ацетолактата, который диффундирует
в бродящее сусло из дрожжевых клеток. Его присутствие в зеленом пиве является
основной причиной необходимости дорогого, требующего времени периода вкусо-
вого созревания в конце брожения. Чтобы уменьшить или исключить образование
диацетила, для ускорения процесса производства пива применялись различные ге-
нетические подходы. Поскольку стадией, лимитирующей скорость, является про-
цесс превращения а-ацетолактата в диацетил, лучшими подходами к решению этой
проблемы считались либо предотвращение образования а-ацетолактата, либо его
быстрое удаление еще до того, как он превратится в диацетил (рис. 3.7; см. также
рис. 2.14 в главе 2).
Фермент ацетолактатдекарбоксилаза (АЛДК), присутствующий у ряда бактерий,
катализирует превращение а-ацетолактата в ацетоин, предотвращая таким образом
его окисление в диацетил. Ген, отвечающий за этот фермент, был клонирован из
Enterobacter aerogenes [ 163], Klebsiella terrigena [12], Lactococcus lactis [52], Acetobacter
pasteurianus [189] и из Acetobacter aceti var. xylinum [201].
Глава 3. Генетика дрожжей
91
Пировиноградная
кислота
ILV2 А Блок
а-ацетомолочная
>М(
:л<
ILV5 ш Т Возрастание
SOI
♦
iai
:л<
кислота ► Диацетил
_ Удаление
Дигидроксииэовалерьяновая АЛДК
кислота
ILV3
а-кетоизовалерьяновая
кислота
ВАП,ВАТ2
Валин
Рис. 3.7. Ферменты и гены на пути синтеза валина у Saccharomyces cerevisiae.
Приведены варианты уменьшения продуцирования диацетила и сайт активности декарбоксилазы
а-ацетолактата. ILV2 — ацетолактат синтетаза, ILV3 — дигидроксиациддегидратаза, ILV5 — редукто-
изомераза, ВАЛ и ВАТ2 — трансаминазы, АЛДК — декарбоксилаза а-ацетолактата
В первых экспериментах ген Ent. aerogenes был экспрессирован при помощи дрож-
жевого промотора ADHI на мультикопийной плазмиде, использовавшейся для транс-
формации пивных штаммов. В экспериментальных ферментациях с использованием
модифицированных дрожжей в условиях как периодического, так и непрерывного
культивирования наблюдалось значительное уменьшение уровня диацетила [162].
Никакого влияния на другие стороны дрожжевого метаболизма выявлено не было,
так как произведенная дрожжами АЛДК локализовалась в цитоплазме, а-Ацетолак-
тат производится в дрожжевых митохондриях и, таким образом, в ацетоин превраща-
лось только то вещество, которое поступало в цитоплазму. Весь а-ацетолактат, требу-
емый для синтеза валина, оставался в митохондриях, где он был недоступен для
действия декарбоксилазы.
Впоследствии ген АЛДК был интегрирован в рибосомную ДНК (рДНК) дрож-
жей. Благодаря природе рДНК, состоящей из тандемных повторяющихся последо-
вательностей, было интегрировано более 20 копий гена АЛДК. Все трансформанты
показали высокую ферментную активность [39]. Так как новые гены были интегри-
рованы, трансформанты оказались крайне стабильны даже при отсутствии селектив-
ного отбора. Готовое пиво, полученное на лабораторной опытной установке, харак-
теризовалось очень низкой концентрацией диацетила. В продолжение этой работы
клонированные гены АЛДК от двух штаммов Е. aerogenes и от одного штамма
К. terrigena были помещены под контроль ADH\ - и PGK-промоторов и терминаторов
и были использованы для трансформации пивных дрожжей путем интеграции
врДНК,АЬН1- и PGK-локусы. Все трансформанты характеризовались хорошим бро-
жением, и у двух из них (оба интегрированы в сайт PGK и под контроль PG/C-промо-
тора и терминатора) вообще не требовалось созревания, так как концентрация диа-
цетила в пиве в конце главного брожения была ниже вкусового порога. В пиве,
92
Джон Р. М. Хаммонд
произведенном другими штаммами, уровень диацетила также был значительно
меньше. Трансформированные дрожжи оказались совершенно стабильными, а каче-
ство готового пива — стабильно хорошим [12,169]. Использование ALHI-промотора
и терминатора дало худшие результаты (позже это объяснилось частичным ингиби-
рованием, исходившим от расположенного перед геном сайта транскрипции; при
брожении, проводимом с использованием трансформантов дрожжей для лагерного
пива, после удаления этого сайта наблюдалась хорошая продукция АЛДК и удале-
ние диацетила) [132].
Что касается разрешения их применения в пищевых продуктах, гены АЛДК от
Lactococcus lactis или Acetobacter были бы предпочтительнее генов других микроорга-
низмов, так как их уже использовали для получения пищевых продуктов [52]. Такой же
статус был заявлен для Е. aerogenes, так как они являются частью натуральной флоры
бельгийского пива «Ламбик» [12]. С этой целью ген АЛДК из Acetobacter aceti ssp.
xylinum был клонирован в кассету экспрессии PGK и интегрирован в геном промыш-
ленных пивных дрожжей [202, 203]. При проведении экспериментальной фермента-
ции генетически модифицированные дрожжи ничем не отличались от родительского
штамма, кроме значительно меньшего уровня продуцирования диацетила [204]. Те же
самые дрожжи были использованы для получения пива на лабораторной установке
в ряде последовательных ферментации. Пиво стабильно получалось хорошего качества
и в значительно более короткие сроки, чем с обычными пивными дрожжами [171].
Из-за важности диацетила для вкуса пива усилия большинства исследователей
были сконцентрированы на пути биосинтеза аминокислоты, ведущему к образова-
нию ос-ацетолактата (рис. 3.7). Ферменты этого пути регулируются достаточно слож-
ным контрольным механизмом. В частности, синтетаза ацетолактата находится под
очень строгим контролем по типу обратной связи и подавляется валином. Так как
этот путь был детально изучен, и были клонированы гены ILV, кодирующие различ-
ные ферменты, [140], предпринималось много попыток контролировать уровень диа-
цетила в пиве путем манипуляций этими генами в пивных дрожжах. Продуцирова-
ние диацетила может быть полностью исключено у мутантов, в которых отсутствует
треониндиаминаза, и ацетолактатсинтетаза, но из-за их неспособности синтезировать
некоторые аминокислоты (включая валин) брожение таких дрожжей происходит
плохо [153]. Частичное уменьшение активности синтетазы ацетолактата может быть
достигнуто благодаря доминантной мутации. Ацетолактатсинтетазная активность
подавляется сульфометуронметилом, а доминантные мутации гена ILV2 известны
тем, что приводят к устойчивости к этому гербициду (путем уменьшения сродства
фермента к гербициду) [37]. Некоторые из устойчивых форм фермента менее актив-
ны. Были выделены спонтанные доминантные мутанты этого типа, но уменьшение
содержания диацетила в этом случае было почти не заметно [46, 51].
Впоследствии был изобретен способ получения рецессивных мутаций пивных
дрожжей в локусе ILV2 [93]. Этот способ включает в себя мутагенную обработку
спонтанных, устойчивых к гербицидам мейотических сегрегантов пивных дрожжей
с последующим скринингом по слабому росту на среде, не содержащей изолейцина
и валина. Так, получены штаммы с очень низкой активностью синтетазы ацетолакта-
та. Спаривание этих штаммов приводит к образованию гибридов, дающих хорошее
брожение и приемлемое пиво с небольшим содержанием диацетила.
Глава 3. Генетика дрожжей
93
Другой способ уменьшения активности синтетазы ацетолактата описан в [184].
Фрагмент гена ILV2 использовали для трансформации пивных дрожжей таким обра-
зом, что образовывалась «антисмысловая* мРНК (РНК, комплементарная мРНК).
Это приводило к эффекту уменьшения содержания нормальной ацетолактатсинте-
тазной мРНК и, следовательно, к уменьшению количества синтезированного фермен-
та. Хотя при этом в процессе брожения образовывалось меньше диацетила, трансфор-
мированные дрожжи сбраживали сусло гораздо слабее.
Альтернативным подходом к уменьшению содержания диацетила является уве-
личение нагрузки на биохимический путь синтеза валина. Это достигается транс-
формацией дрожжей мультикопийными плазмидами с копиями генов ILV3 и ILV5.
Дрожжи, трансформированные ILV5 (либо в составе мультикопийные плазмиды [32,
57,58,188], либо интегрированным в дрожжевой геном [119]) демонстрировали воз-
растание ацетолактатредуктоизомеразнои активности и значительное уменьшение
содержания диацетила. В то же время дрожжи, трансформированные IL V3, не оказы-
вали никакого воздействия на содержание диацетила, несмотря на значительное воз-
растание соответствующей ферментной активности [56]. Если в одной плазмиде
присутствовали оба гена (Л V3 и IL V5), влияние на продуцирование диацетила ока-
зывалось даже несколько слабее, чем при наличии одного ILV5 [187].
б) Дрожжи с пониженной способностью к продуцированию H2S
В процессе брожения многие дрожжи продуцируют сероводород, который, как
и диацетил, следует удалять в процессе дозревания. Чем меньше дрожжи будут обра-
зовывать H2S, тем быстрее они будут производить пиво. Синтез цистатионина уве-
личивается клонированным геном STAA (рис. 3.8), и тем самым удаляется излишек
H2S, который в противном случае поступает из дрожжей в пиво. При испытании на
S04
МЕ73 1
APS
МЕТЛА \
S02 Гомосерин
МЕЛО I I МЕ72
н2^ О-Ацетилгомосерин
| МЕ725 |
?
Гомоцистеин
МЕ7Б 1 1 STRA
Метионин Цистатионин
Рис. 3.8. Гены, кодирующие сульфатный метаболический путь у Saccharomyces cerevisiae:
МЕТ2, гомосеринацетилтрансфераза; МЕ73, АТФсульфурилаза; МЕТЬ, гомоцистеин мети лтрансфе-
раза, МЕЛО, сульфитредуктаза; МЕЛ4, АРБкиназа; МЕТ25, О-ацетилгомосерин; О-ацетилсерин-
сульфгидраза; STRA, цистатионин
94
Джон Р. М. Хаммонд
лабораторной установке дрожжи, трансформированные этим геном, образовывали
значительно меньше H2S, чем родительские нетрансформированные дрожжи [174].
Альтернативный подход заключается в клонировании гена МЕТ25 (который ко-
дирует сульфгидразу, действующую на О-ацетилгомосерин) (рис. 3.8) и помещении
его под контроль конститутивного гликолитического промотора [131]. Эту конст-
рукцию интегрировали в рДНК пивных дрожжей, и получившиеся в результате
трансформанты характеризовались в несколько раз большим уровнем экспрессии
METIS, чем родительский штамм. При экспериментальном брожении в опытной ус-
тановке трансформанты вели себя обычным образом, но образовывали гораздо мень-
ше H2S, чем нормальные дрожжи.
в) Дрожжи с пониженной способностью к продуцированию S02
Поскольку в настоящее время содержание в пиве HS02 во многих странах регули-
руется нормативными актами, то встает задача производить пиво с низким уровнем
HS02. В этих целях была предпринята попытка создания штамма 5. carlsbergensis, не
образующего S02 [88]. Все четыре копии генов МЕТЫ в дрожжах для лагерного пива
были наряду с классическими методами (устойчивость к селенатам, что обычно
обеспечивают мутанты по МЕТЬ и МЕТИ, получаемые при помощи мутагенеза ульт-
рафиолетом) были также инактивированы методом направленного генетического
разрушениея (трансформация с использованием делеций гена МЕТЫ). Полученные
дрожжи использовали для проведения низового брожения на опытной установке.
Они не продуцировали S02 и образовывали гораздо меньше ацетальдегида, а во всем
остальном брожение было нормальным. Тем не менее пиво получалось нестабиль-
ным и при хранении быстро окислялось. Чтобы получить пиво с контролируемым
низким уровнем S02, более стойкий продукт производили смешиванием этого пива
с другим, с более высоким содержанием S02.
г) Дрожжи с пониженной способностью продуцировать диметилсульфид (ДМС)
Для вкуса пива важно регулирование уровня ДМС. Хотя основное количество
ДМС пива образуется в процессе солодоращения и выращивания дрожжей, в послед-
них содержится фермент (метионинсульфоксидредуктаза), который катализирует
превращение диметилсульфоксида в ДМС. Ген, отвечающий за этот фермент
(MXR1), был клонирован, после чего в одном из лабораторных штаммов была полу-
чена разрушенная форма гена (дизруптант) тхг\ [68], и было показано, что такие
дрожжи не продуцируют ДМС. Так как аналогичные гены присутствуют и в пивных
дрожжевых штаммах, подобный эффект должен быть получен и с ними.
3.5.7. Повышенное продуцирование вкусо-ароматических
соединений
а) Повышенное продуцирование HS02
Для вкусовой стабильности готового пива очень важен уровень содержания S02,
поскольку HS02 действует и как антиоксидант, и как компонент, связывающий кар-
бонильные соединения, придающие пиву привкус затхлости. Для регулирования
уровня S02 используют несколько стратегий. Например, клонируют и экспрессиру-
Глава 3. Генетика дрожжей
95
ют в пивных дрожжах на мультикопийных плазмидах гены МЕТЬ и М£Т14, кодирую-
щие АТФ-сульфурилазу и APS-киназу соответственно [102]. Предполагалось, что
увеличение активности этих ферментов повышает поток через сульфатный метабо-
лический путь (рис. 3.8) и, таким образом, повышает содержание S02. Это было под-
тверждено при использовании этих дрожжей для брожения.
Известен и другой подход, использующий разрушение (дизрупцию) гена, а не
сверхэкспрессию. Для разрушения генов МЕТ2 [70] и METiO [71] на двух разных
видах дрожжей была применена техника рекомбинантной ДНК (рис. 3.8). В обоих
случаях ожидалось, что это уменьшит синтез метионина, что, в свою очередь, приве-
дет к дерепрессии сульфатного пути и к увеличению концентрации HS02. При про-
ведении брожения дрожжами с разрушенным геном METiO наблюдалось увеличе-
ние концентрации HS02, с этим совпало снижение уровня H2S. При использовании
дрожжей с разрушенным геном МЕТ2 уровень S02 повышался, но вследствие нор-
мальной функции сульфатредуктазы (кодируемой геном METiO) то же происходило
и с уровнем H2S.
б) Повышенное содержание эфиров уксусной кислоты
Изоамилацетат очень важен для саке-подобного вкуса и аромата. Этот эфир проду-
цируется дрожжами из изоамилового спирта — сопутствующего продукта синтеза лей-
цина. Увеличением числа копий одного из генов, ответственных за биосинтез лейцина
(LEU4), были созданы модифицированные дрожжи, продуцировавшие больше изоа-
милового спирта, чем их родители [79], что, в свою очередь, придавало пиву саке-по-
добный привкус. Та же схема может подойти и для обычных пивных дрожжей.
Регулирование содержания в пиве эфиров включает клонирование одного из фер-
ментов, ответственных за синтез эфиров уксусной кислоты. Общеизвестно, что эти
эфиры образуются дрожжами из ацетилСоА и соответствующих спиртов под дей-
ствием нескольких алкогольацетилтрансфераз (ААТ). Эти ферменты были очище-
ны и была определена аминокислотная последовательность их внутренних пептидов
[118]. Полученные данные использовались для приготовления олигонуклеотидных
проб и клонирования генов, кодирующих ААТ-ферменты. К настоящему времени
клонировано три отдельных гена ААТ: ATFI [40], LgATFi [41], и ATF2 [125].
Продукт гена ATF\ (и LgATFi) катализирует реакцию образования алифатических
эфиров с короткими и средними по размерам цепями из изоамилового спирта, этанола
и ацетил Со А. Клонированный ген ATFi, обнаруженный в лабораторных дрожжевых
штаммах, гибридизируется в лагерных дрожжах с двумя нетождественными генами.
По аминокислотной последовательности один ген идентичен на 99,4%, а второй (на-
званный LgATFi) — только на 81%. Каждый из этих генов, будучи введен в дрожжи
в виде множества копий, заставляет клетки-реципиенты проявлять высокий уровень
активности ААТ и продуцировать больше эфиров уксусной кислоты, чем контрольные
дрожжи [40]. Оба гена увеличивают продуцирование изоамилацетата сильнее по срав-
нению с этилацетатом, но при этом разница между содержанием данных двух эфиров
в клетках, трансформированных LgATFi, более заметна, чем в клетках, трансформиро-
ванных ATFi. Это было подтверждено на клетках с разрушенным геном ATFi. В дан-
ном случае содержание ААТ в них было гораздо меньше, но при этом они сохраняли
некоторую активность с гораздо большим влиянием на продуцирование изоамилаце-
96
Джон Р. М. Хаммонд
тата, чем этилацетата [42]. Такие результаты позволяют предположить не только то,
что главная роль A TF\ состоит в продуцировании изоамилацетата, но и то, что дрожжи
должны иметь более одного фермента АТТ. Другая же группа исследователей выска-
зала предположение, что ATFI ответственен за продуцирование этилацетата, а не изо-
амилацетата [111]. Возможно, что это очевидное противоречие связано с тем, что эти
две группы работают с различными генами, так как в последнем случае ген был неза-
висимо клонирован из винного штамма дрожжей.
Ген A TF2 представлен во всех дрожжах Saccharomyces, за исключением 5. bay anus
[125]. Двойной мутант ATF1/ATF2 вообще не производит изоамилацетата, а это оз-
начает, что фермент, кодируемый ATF2, должен отвечать за остаточный синтез изо-
амилацетата. Так как какое-то количество этилацетата продуцировалось, эти резуль-
таты позволяют предположить, что должен присутствовать по крайней мере еще
один фермент, синтезирующий этилацетат.
До сих пор далеко не ясно, какие функции в дрожжевом метаболизме выполняют
ATF\ wATFl, хотя можно высказать некоторые соображения по этому поводу. И ATF\%
и ген, кодирующий D-9-десатуразу жирных кислот, которая образует ненасыщенные
жирные кислоты (01£1), транскрипционно регулируются ненасыщенными жирны-
ми кислотами [44]. В обоих случаях степень транскрипционной репрессии связана
с точкой плавления ненасыщенной жирной кислоты (то есть плавкостью клеточной
мембраны in vivo). Замещение ATF1 промотора конститутивным GAPDH-промото-
ром полностью освобождает ААТ-активность от регулирования ненасыщенной жир-
ной кислотой [43]. КакЛГЛ, так и OLE1 являются гипоксидными генами — их инду-
цирование проходит в условиях пониженного содержания кислорода. Все эти данные
заставляют думать о давно предполагавшейся роли продукта гена А774 в метаболиз-
ме жирных кислот (подробнее об этом см. [ 114]). Интересно, что ATF1 также чувстви-
телен к тепловому шоку (клетки, подвергнутые действию теплового шока, характери-
зуются более высокой АДГ-активностью и продуцируют более высокий уровень
изоамилацетата, чем нормальные клетки) [91].
Оказалось, что A TF2 отличается от А 774, так как этот ген относительно независим
от ненасыщенных жирных кислот, хотя и подвергается транскрипционной репрес-
сии кислородом [207]. Неожиданно для ученых продукт гена ATF1 оказался ключе-
вым ферментом в механизме детоксификации стероидов, особенно этерификации
прегненолона и родственных Зр-гидрокси-стероидов [25]. Вполне возможно, что
этот фермент может играть роль защитного механизма относительно флавоноидов
растительного происхождения.
Хотя большинство работ посвящено синтезирующим эфиры ферментам, очевид-
но, что очень важен баланс между ними и эстеразами. Когда дрожжевые штаммы
с различным количеством копий генов ATF1 и 1АН\ (изоамилацетатэстераза) ис-
пользуются в маломасштабных ферментациях, продуцирование изоамилацетата воз-
растает с увеличением отношения ААТ: эстераза [45].
Хотя промышленных дрожжей с модифицированной эстерсинтетазной активно-
стью было получено немного, в последние годы увеличилось количество данных
о синтезе эфиров в дрожжах. Тем не менее многое еще предстоит узнать, и наиболее
перспективным подходом к выяснению механизмов, лежащих в основе синтеза эфи-
ров, нам представляется развитие методов молекулярной биологии.
Глава 3. Генетика дрожжей
97
3.5.8. Метаболическая инженерия
Дрожжи Saccharomyces принято в большинстве случаев считать безопасными
организмами (GRAS, Generally Regarded As Safe), так как они не патогенны и имеют
длительную историю применения в производстве пищевых продуктов — хлеба, вина
и пива. Поскольку их бродильные и технологические свойства хорошо изучены, они
очень привлекательны также для биотехнологии и метаболической инженерии вне
обычной сферы их применения [134]. С использованием дрожжей были получены
первый рекомбинантный белок (человеческий интерферон) и первая генетически
модифицированная вакцина против гепатита В. В настоящее время около половины
производящегося в мире инсулина получают из дрожжей.
Расширение субстратного ряда дрожжей Saccharomyces идет часто параллельно усо-
вершенствованиям в практике пивоварения. В качестве примеров можно привести:
• метаболизм лактозы; введение термостабильной внеклеточной р-галактозидаз-
ной активности из Aspergillus niger в дрожжи позволяет продуцировать этанол из сы-
воротки, попадающей в отходы [105]. Аналогично сыворотка может быть использо-
вана для размножения хлебопекарных дрожжей (после их трансформирования
генами, кодирующими пермеазу лактозы и р-галактозидазу) [1];
• метаболизм ксилозы; ксилоза, вторая по распространенности в природе моноза,
присутствует в растительной лигноцеллюлозе и является превосходным потенци-
альным источником углеводов для продуцирования этанола. Сложной серией гене-
тических манипуляций, включающих встраивание генов XYL1 (ксилозаредуктаза)
и XYL2 (ксилитолдегидрогеназа) из Pichia stipitis в 5. cerevisiae вместе с инженирин-
гом сверхэкспрессии нативного гена XKS\ (ксилулокиназа) была достигнута кон-
версия ксилозы в этанол (63% от теоретического результата) [80].
3.6. Молекулярно-биологические подходы
к определению дрожжей
Традиционно дрожжевые штаммы отличают друг от друга по комплексу их био-
химических, морфологических и физиологических параметров, но с разработкой
методов рекомбинирования ДНК стало возможным детально анализировать ДНК
и различать штаммы по «отпечаткам пальцев» ДНК.
Первая примененная методика заключалась в расщеплении ДНК с использовани-
ем специфических эндонуклеаз рестрикции, разделении фрагментов электрофорезом
в агаровом геле и затем либо в непосредственном анализе наборов образующихся
полос (бэндов), либо в анализе наборов полос, полученных гибридизацией фрагмен-
тов ДНК с мечеными зондами. Зонды представляют собой короткие кусочки ДНК,
несущие либо радиоактивную метку, либо какую-либо другую легко определяемую
метку. По соображениям безопасности стандартными для установленного контроля
качества стали нерадиоактивные методы [115]. Непосредственный анализ митохонд-
риальной ДНК без использования маркеров позволяет дифференцировать дрожжи
для производства эля и дрожжи для лагерного пива [24,108,113], но не может разли-
чить штаммы дрожжей для лагерного пива [2, 24, 113] (за исключением тех, которые
отличаются по флокуляции [33]). Прямой анализ общей ДНК после расщепления
ферментом рестрикции Hpal также был использован для разделения верховых и ни-
зовых дрожжей, но обычно используют зонды.
98
Джон Р. М. Хаммонд
Детальное исследование широкого ряда промышленных дрожжей было проведе-
но с использованием меченых зондов. С зондом RDN1 было выявлено три основных
набора полос, но при этом все исследованные пивные дрожжи не проявляли никаких
различий, а при использовании зонда Я/54 верховые дрожжи отличались от низо-
вых [140,141]. Аналогичные результаты были получены и при использовании зонда
LEVI, хотя в этом случае среди верховых штаммов наблюдалась большая гетероген-
ность [142-144]. Результаты, полученные на низовых дрожжах, были достаточно
однородны, чтобы говорить о тесном сродстве штаммов, тогда как у верховых штам-
мов наблюдалась значительная вариабельность. Этот вывод в дальнейшем был под-
твержден экспериментом с использованием в качестве зонда элемента Tyl, способ-
ного к перемещению в геноме. Было выявлено, что Ту\ распределен по дрожжевой
хромосомной ДНК в количестве 30-35 копий на гаплоидный геном, и, по-видимому,
этот элемент является хорошим кандидатом для получения «отпечатков пальцев»
ДНК, поскольку изменения в его количестве и локализации должны приводить
к изменению в получающихся рестрикционных фрагментах. Большая гетероген-
ность наблюдается среди верховых дрожжей, кодифференцирование низовых дрож-
жей также возможно с помощью Гг/1-зондов [30, 113, 142-144, 158, 198]. Некоторое
беспокойство вызывало то, что если элементы Ту\ перемещаются по дрожжевому
геному, то образованные этими зондами фрагменты могут со временем варьировать,
но сравнение 15-летней лабораторной и современной промышленной культуры тех
же самых дрожжей таких вариаций не выявило [158].
Гетерогенность верховых штаммов была подтверждена использованием зонда
CUP1 для распознавания двух штаммов низовых дрожжей, находящихся в очень
близком родстве [173]. Также очень полезным для анализа пивных дрожжей оказал-
ся ген DEXI (5ГЛ2), так как он способен перекрестно реагировать с другими обнару-
женными в пивных дрожжах родственными последовательностями с образованием
сложных фрагментов, которые могут служить «отпечатками пальцев» ДНК [158,
173].
Техника «отпечатков пальцев» ДНК хотя и широко использовалась ранее, в на-
стоящее время быстро вытесняется применением цепной реакции полимеразы
(УРП), которая позволяет специфически амплифицировать определенные последо-
вательности ДНК так, что их можно увидеть непосредственно в гелях без использо-
вания зондов. Используя праймеры, предназначенные для амплификации опреде-
ленных участков дрожжевого генома, можно выделить различающиеся у разных
штаммов области — во многом так же, как при использовании описанной выше тех-
ники зондирования (более подробно о технике ЦРП см. в главе 7). Главное преиму-
щество метода ЦРП — скорость, с которой может быть получен ответ (обычно в те-
чение рабочего дня). В пивоварении до сих пор наиболее активно исследовали
методы ускоренной идентификации вредных для пива микроорганизмов, но были
описаны и несколько методов для определения S. cerevisiae var. diastaticus в присут-
ствии пивных дрожжей [205], для распознавания пивных и не пивных дрожжей
[200], а также для различения штаммов низовых дрожжей [139]. В последнем случае
в качестве индукторов служили терминальные повторяющиеся 8-последовательно-
сти области 7у1, которые использовали и в более традиционной технике «отпечат-
ков пальцев» ДНК.
Глава 3. Генетика дрожжей
99
Еще одним методом, использующимся для исследования структуры дрожжевого ге-
нома, является пульс-элекрофорез — электрофорез целых хромосом в пульсирующем
поле (ППГЭ). Этот метод определения кариотипа — кариотипирование — широко
применялся к пивным дрожжам и показал себя мощным инструментом (особенно для
распознавания штаммов дрожжей низового брожения). Как электрофорез в КОЭП,
клампированном однородном электрическом поле* [26], так и поперечный электро-
форез в переменном пульсирующем поле [47] получили широкое признание (см. гла-
ву 7). Из детального анализа ППГЭ-гелей пивных дрожжей стало ясно, что они содер-
жат намного больше полос, чем гели лабораторных штаммов, причем интенсивность
полос варьирует. Для пивных дрожжей типично проявление в КОЭП-гелях 18-21 хро-
мосомных полос (у лабораторных штаммов — 16 полос). Можно предположить, что
это является отражением полиплоидной природы дрожжей и обладания ими смесью
различных, но подобных хромосом (см. ниже раздел 3.7). Большое количество и раз-
нообразие полос дает возможность использовать определение кариотипа для распоз-
навания многих близкородственных промышленных дрожжевых штаммов [20, 24,
129, 159]. Самая большая изменчивость была выявлена среди меньших хромосом
(5. cerevisiae по обилию маленьких хромосом — уникален среди дрожжей). Как ни
странно, но у большинства промышленных низовых дрожжей в этой области выявля-
ется один из двух наборов — набор «Карлсберг» (маленькая хромосома I) или набор
«Туборг» (маленькая хромосома X) [20]. Кариотипирование подтвердило гетероген-
ную природу верховых и гомогенную природу штаммов низовых дрожжей, а также
помогло провести различие между сморщенными (rough) и гладкими колониями од-
ной и той же культуры. Для демонстрации удивительной нестабильности промыш-
ленных дрожжевых культур в течение времени был использован анализ фрагментов
хромосом. При исследовании глубоко замороженных культур одних и тех же промыш-
ленных дрожжей в течение 30 лет было выявлено 7 различных «отпечатков пальцев»
хромосом [20].
3.7. Природа генома пивных дрожжей
3.7.1. Проект определения нуклеотидной последовательности
дрожжевого генома
В последние годы наши знания о генетическом строении дрожжевых штаммов су-
щественно увеличились. Наиболее значительным событием стало определение пол-
ной последовательности ДНК штамма S288C [53]. Путем прямого анализа была ус-
тановлена последовательность 5901 гена (несмотря на то что функции 50% из них
неизвестны). Основные усилия ученых всего мира в настоящее время направлены
на выяснение их функций [130]**.
Чтобы понять, в чем состоят различия пивных дрожжей, требуется их детальное
изучение, причем особенно необходимо знание деталей организации структуры
и функций генома пивных дрожжей и понимание механизма функциональной экс-
прессии генов в процессе цикла пивного брожения. Если первый аспект уже давно
* Кламп — прямоугольный импульс напряжения. — Примеч. пер.
** Более подробно о последовательности дрожжевого генома см. http://genorn-X0wwstanford.edu/
Saccharomyces/'sequencejdonehtml и http://www.mips.biochem. mpg.de. — Примеч. авт.
100
Джон R М. Хаммонд
и активно изучается (см. разделы 3.7.2 и 3.7.3), то работы по второму аспекту нахо-
дятся в самом начале.
3.7.2. Метод переноса единичной хромосомы
Еще до того, как были получены детальные данные о последовательности дрож-
жевого генома, его структура была подробна изучена путем переноса единичной хро-
мосомы (см. раздел 3.4.3). Были идентифицированы две формы хромосомы III —
одна была структурно и функционально идентична хромосоме III, обнаруженной
в лабораторных штаммах, а другая была функционально гомологична хромосоме ла-
бораторного штамма, но отлична от нее по структуре [82,127]. Существование двух
форм хромосомы III было подтверждено исследованием структуры гена!£[/2, обна-
руженного на этой хромосоме. В штамме низовых дрожжей присутствуют два раз-
личных гена LEU2 [143], и один из них по своей рестрикционной карте (карте рест-
рикционных фрагментов) значительно отличается от гена классических штаммов
S. cerevisiae [21].
Подобным образом были идентифицированы две формы хромосомы V, одна из ко-
торых и структурно, и функционально гомологична хромосоме, обнаруженной в лабо-
раторных штаммах S. cereznsiae, а другая форма была неспособна к рекомбинации, хотя
функционально была гомологична [128] (такие хромосомы называют гомеологичны-
ми). Хромосома X исследовалась с помощью пульс-электрофореза (см. раздел 3.6),
в результате чего были идентифицированы три независимо мигрирующих структуры,
две из которых не были гомологичны хромосоме X из 5. cerevisiae, и рекомбинация
происходила только с частью хромосомы [18,19]. В работе [148] были проанализиро-
ваны хромосомы XII и XIII и выделены два различных типа хромосомы XII, одна из
которых была гомологична такой же хромосоме из лабораторных штаммов, а другая —
гомеологична. Из трех выделенных различных хромосом XIII одна была гомологична
хромосоме из S. cerevisiae, другая оказалась гомеологичной, не способной к рекомби-
нированию с этой хромосомой, а третья — мозаичная — демонстрировала частичную
рекомбинацию.
Таким образом, в штаммах низовых пивных дрожжей М244 присутствует три типа
хромосом:
• хромосомы, функционально и структурно гомологичные эквивалентной хромо-
соме S. cerevisiae и представленные одной формой каждой из хромосом III, V,
XII и XIII;
• гомеологичные хромосомы, функционально, но не структурно гомологичные
эквивалентным хромосомам 5. cerevisiae и представленные одной формой каж-
дой из хромосом V, XII и XIII;
• мозаичные хромосомы, рекомбинирование которых с хромосомами 5. cerevisiae
ограничено лишь отдельными участками хромосом, представленные одной
формой каждой из хромосом III и XIII и обеими идентифицированными фор-
мами хромосомы X.
Очевидно, что дрожжи М244 имеют два рекомбинационно несовместимых генома.
При использовании делегированных по ilv2 мутантов было выявлено, что пивные
дрожжи содержат по две копии каждой из двух версий области ILV2 [51]. Из этого
и других доказательств следует, что пивные дрожжи являются аллотетраплоидными
Глава 3. Генетика дрожжей
101
и содержат четыре набора хромосом от (по крайней мере) двух различных геномов,
хотя аллоплоидия является очевидно неравномерной с наличием большого количе-
ства мозаичных хромосом. Кроме того, у некоторых хромосом отсутствуют опреде-
ленные гены [19, 128]. Если все пивные дрожжи являются аллоплоидами с нерегу-
лярными хромосомными структурами и утерянными или дефектными генами, то это
объясняет их низкую частоту споруляции и слабую жизнеспособность спор.
3.7.3. Анализ нуклеотидной последовательности генома
Из данных, приведенных в разделе 3.7.2, следует, что низовые пивные дрожжи яв-
ляются не обычными дрожжами 5. cerevisiae, а аллоплоидами, содержащими части
(по крайней мере) двух разных эволюционно разошедшихся геномов, образовавшихся
в результате дивергенции. Один из этих геномов почти идентичен геному S. cerevisiae,
а другой отличен от него. Определение последовательностей ряда генов показало, что
дивергенция нуклеотидов между двумя геномами, приводящая к возникновению пив-
ных дрожжей, в кодирующих районах (то есть в генах) составляет обычно 10-20%, а за
пределами этих областей оказывается еще выше. Были проанализированы гены ILV1,
ILV2, URA3 [48], Я/54 [149], АСВ\ [14], МЕТЫ [87], МЕТ2 [69], МЕПО [72] и ATFI
[42]. Эксперименты по замещению генов показали, что в большинстве случаев в низо-
вых дрожжах М24 имеется две копии каждой из двух версий дивергентных последова-
тельностей конкретного гена, и это подтверждает аллотетраплоидность этих дрожжей
(см. раздел 3.7.2). В дальнейшем это было подтверждено измерением содержания ДНК
методом проточной цитометрии. Тем не менее детальное исследование хромосомы III
с использованием различного замещения Я/54 показало, что дрожжи М244 должны
иметь пять копий HISA, только одна из которых идентична гену S. cerevisiae [3]. Итак,
хотя бы по одному гену лагерные дрожжи, судя по всему, являются пентасомальными.
Один из двух геномов, содержащихся в лагерных дрожжах, несомненно происходит
их S. cerevisiae, а происхождение другого менее ясно. Первоначально считалось, что
низовые дрожжи являются гибридами S. cerevisiae и S.bayanus и, следовательно,
S. carlsbergensis следует переименовать в 5. pastorianus [185]. Эта точка зрения подтвер-
ждается некоторыми последними данными относительно определения нуклеотидной
последовательности и использования молекулярных зондов [41,172], однако некото-
рые детали позволяют считать более подходящим партнером по гибридизации
S. monacensis [14, 69,144]. Детальный анализ всех хромосом с помощью ЦРП, исполь-
зуя ДНК из 5. cerevisiae, S. monacensis и 5. pastorianus, усложнил этот вопрос еще боль-
ше. S. monacensis, S. pastorianus и 5 carlsbergensis являются, по-видимому, все разными
неполными гибридами, содержащими части генома 5. cerevisiae [3].
Иной подход к этой проблеме приведен в [90], где была проанализирована протеома
(полный спектр белков) различных дрожжей, синтезированная дрожжами в стандарт-
ных условиях. Полученные данные свидетельствуют о том, что протеомы (и, следова-
тельно, геномы) S. monacensis, S. pastorianus и S. carlsbergensis являются результатом на-
ложения двух спектров белков, происходящих от S. cerevisiae и 5. pastorianus NRRL
У-1551, а набор белков S. bay anus в наложение вообще не вовлечен. Было высказано
предположение, что NRRL У-1551 был неправильно идентифицирован, так как у него
мало сходства с другими штаммами S. pastorianus. Все штаммы S. monacensis, S. pasto-
rianus и S. carlsbergensis являются, по-видимому, гибридными, но отличаютс от промыш-
102
Джон Р. М. Хаммонд
ленных дрожжей, так как содержат уменьшенное количество белков 5. cerevisiae.
По мнению исследователей, они являются штаммами, находящимися на различных
стадиях дегенерации родительского аллотетраплоида (гибрид 5. cerevisiae и штамма,
родственного NRRL У-1551), а низовые пивные дрожжи находятся на ранней стадии
подобного вырождения.
Таким образом, хотя данные традиционных генетических методов и полученные
путем определения последовательностей неоднозначны, и все детали далеко не ясны,
вполне возможно, что низовые дрожжи ведут свое происхождение от гибрида
5. cerevisiae (возможно, дрожжей для производства эля) и более древнего типа дрож-
жей, которые еще не идентифицированы.
3.8. Коммерческое использование генетически
модифицированных пивных дрожжей
3.8.1. Соображения безопасности
Когда методы генетической модификации только начали развиваться, ученые вы-
ражали обеспокоенность по целому ряду вопросов генной инженерии [6]. Их беспо-
коили возможная колонизация окружающей среды генетически модифицированны-
ми организмами, нежелательный перенос генов другим организмам в дикой природе,
а также возможное неумышленное создание новых патогенных микроорганизмов.
Со временем большинство исследователей согласилось, что эти потенциальные про-
блемы были сильно преувеличены, однако в результате этого беспокойства во всем
мире возникли разнообразные нормативные акты относительно этого вопроса. По-
явившиеся инструкции касаются главным образом лабораторных экспериментов,
и несмотря на различия в деталях, в принципе они одинаковы в большинстве стран.
Повсеместно признана необходимость вести работы с генетически модифицирован-
ными организмами в отдельных изолированных помещениях. Меры предосторож-
ности при работах в области генной инженерии обусловливаются степенью риска,
и работы по генетической модификации пивных дрожркей всегда относились к наи-
более низкому уровню риска, требовавшему лишь условий, имеющихся в любой хо-
рошей микробиологической лаборатории. В большинстве стран правила обращения
с генетически модифицированными организмами исходят из заботы о защите окру-
жающей среды, здоровья и безопасности человека. В Великобритании все подобные
работы регулируются нормативными актами 2000 г. (Genetically Modified Organisms
(Contained Use) Regulations). В случае распыления на полях или применения генети-
чески модифицированных организмов в составе кормов для животных применяют-
ся другие нормативные акты.
3.8.2. Утверждение и допуск новых пищевых продуктов
Для запуска в производство и продажи пива, полученного с применением генети-
чески модифицированных дрожжей, в Великобритании требуется разрешение Ко-
митета по новым пищевым продуктам и технологиям (ACNFP). Этот комитет оцени-
вает заявки на запуск пищевых продуктов в соответствии с Директивой ЕС по новым
пищевым продуктам (№ 258/97), составленной независимыми экспертами. В состав
Комитета входят эксперты, отобранные по их персональным заслугам и не представ-
Глава 3. Генетика дрожжей
103
ляющие какие-либо организации. Кроме экспертов по генной инженерии, вопросам
питания, микробиологии, токсикологии и пищевых технологий в состав комитета
введены также представитель потребителей и специалист по этике.
В пивоваренной промышленности коммерческое использование генетически моди-
фицированных дрожжей довольно невелико (из-за повышенного внимания обществен-
ности и негативного освещения в печати). Допуск на использование для коммерческо-
го применения был получен для пивных дрожжей, генетически модифицированных
геном STA2 и получивших способность продуцировать внеклеточную глюкоамилазу.
До сих пор этот допуск остается единственным в мире. Подробнее о правовых аспектах
вопросов здоровья, безопасности и окружающей среды см. [65].
3.9. Краткое резюме
В последние годы применение современных методов молекулярной генетики для
создании новых штаммов дрожжей несколько приостановилось. Эти методы были
использованы при создании новых штаммов дрожжей для более эффективного про-
изводства пива, и многие из новых дрожжей успешно прошли испытания на опытных
установках. До сих пор, однако, они не нашли промышленного применения — прежде
всего потому, что генная инженерия, на которую когда-то смотрели как на эффектное
научное достижение, с разных сторон была подвергнута нападкам, чаще всего эмоци-
ональным. Население стало относиться к генетически модифицированным продук-
там настороженно, и производители пищевых продуктов и напитков перестали их
производить, что и не удивительно. Можно надеяться, что с течением времени благо-
даря просвещению населения и представителей средств массовой информации эта
тенденция будет изменена.
С момента выхода предыдущего издания этой книги в применении методов ген-
ной инженерии в области таксономии и физиологии дрожжей были достигнуты ог-
ромные успехи. Была установлена последовательность полного генома лаборатор-
ных дрожжей, постепенно поддается разгадке строение генома пивных дрожжей.
Начинают изучаться детали генетического регулирования метаболических процес-
сов. Очевидно, что в настоящее время мы в состоянии применять достижения совре-
менной генной инженерии, значительно увеличивая наше понимание физиологии
дрожжей в условиях пивного брожения, а это; в свою очередь, неизбежно приведет
к изменениям в технологиях.
Литература
1. Adam, A.N., Prieto, J.A., Rubio-Texeira, M., and Polaina, J. (1999) Yeast, 15,1299.
2. Aigle, M, Erbs, D., and Moll, M. (\984)Journal of the American Society of Brewing Chemists, 42,1.
3. Andersen, Т.Н., Hoffman, L.f Grifone, R.f Nilsson-Tillger, Т., and Kielland- Brandt, M.C.
(2000) European Brewery Convention Monograph, 28,140.
4. Anderson, E., and Martin, P.A. (1975) Journal ofthe Institute of Brewing, 81, 242.
5. Barney, M.C, Jansen, G.P., and Helbert, J.R. (1980) Journal of the American Society of
Brewing Chemists, 38,1.
6. Berg, P., Baltimore, D., Boyer, H.W., Cohen, S.N., Davis, R.W., Hogness, D.S., Nathans, D.,
Roblin, R., Watson, J.D., Weisssman, S., and Zinder, N.D. (1974) Proceedings of the National
Academy of Sciences, U.SA., 71, 2593.
7. Berghof, K., and Stahl, U. (1991) BioEngineering, 7, 27.
104
Джон Р. М. Хаммонд
8. Bidard, E, Blondin, В., Dequin, S., Vezinhet, E, and Barre, P. (1994) Current Genetics, 25,196.
9. Bilinski, C.A., Russell, L, and Stewart, G.G. (\9S6)Journalofthe Institute of Brewing, 92,594.
10. Bilinski, C.A., Russell, 1., and Stewart, G.G. (1987a) Journalofthe Institute of Brewing, 93,216.
11. Bilinski, C.A., Russell, 1., and Stewart, G.G. (1987b) Proceedings of the 21st Congress of the
European Brewery Convention, Madrid, p. 497.
12. Blomqvist, K., Suihko, M.-L., Knowles, J., and Penttila, M. (1991) Applied andEnvironmental
Microbiology, 57, 2796.
13. Boone, C, Sdicu, A.-M., Wagner, J., Degre, R., Sanchez, C, and Bussey, H. (1990) American
Journal of Enology and Viticulture, 41,37.
14. Borsting, C, Hummel, R., Schultz, E.R., Rose, T.M., Pedersen, M.B., Knudsen, J., and
Kristiansen, K. (1997) Yeast, 13,1409.
15. Brown, S.W., and Oliver, S.G. (1982) European Journal of Applied Microbiology and
Biotechnology, 16,119.
16. Cantwell, B.A., and McConnell, D.J. (1983) Gene, 23,211.
17. Cantwell, В., Brazil, G., Hurley, J., and McConnell, D. (1985) Proceedings of the 20th
Congress of the European Brewery Convention, Helsinki, p. 259.
18. Casey, G.P. (1986a) Carlsberg Research Communications, 51,327.
19. Casey, G.P. (1986b) Carlsberg Research Communications, 51,343.
20. Casey, G.P. (1996) Technical Quarterly of the Master Brewers Association of the Americas, 33,1.
21. Casey, G.P., and Pedersen, M.B. (1988) Carlsberg Research Communications, 53, 209.
22. Casey, G.P., Xiao, W., and Rank, G.H. (1988а)Уош72а/ of the American Society of Brewing
Chemists, 46, 67.
23. Casey, G.P., Xiao, W., and Rank, G.H. (\9Ш) Journal of the Institute of Brewing, 94,93.
24. Casey, G.P, Pringle, A.T. Erdmann, P.A. (\990) Journal of the American Society of Brewing
Chemists, 48,100.
25. Cauet, G., Degryse, E., Ledoux, C, Spagnoli, R., and Achstetter, T. (1999) European Journal
of Biochemistry, 261, 317.
26. Chu, G., Vollrath, D., and Davis, R.W. (1986) Science, 234,1582.
27. Conde, J., and Mascort, J.L. (1981) Proceedings of the 18th Congress of the European
Brewery Convention, Copenhagen, p. 177.
28. Crumplen, R.M., D'Amore, Т., Russell, 1., and Stewart, G.G. (1990) Journal of the American
Society of Brewing Chemists, 48, 58.
29. Debourg, A., Goossens, E., Villanueba, K.D., Masschelein, C.A., and Pierard, A. (1991)
Proceedings of the 23rd Congress of the European Brewery Convention, Lisbon, p. 265.
30. Decock, J.P., and Iserentant, D. (1985) Proceedings of the 20th Congress of the European
Brewery Convention, Helsinki, p. 195.
31. Delgado, M.A., and Conde, J. (1983) Proceedings of the 19th Congress of the European
Brewery Convention, London, p. 465.
32. Dillemans, M., Goossens, E., Goffin, O., and Masschelein, С .А. (1987) Journal ofthe American
Society of Brewing Chemists, 45, 81.
33. Donhauser, S., Vogeser, G., and Springer, R. (1989) Monatsschrift furBrauwissenschaft, 42,4.
34. Enari, T.M., Knowles,J., Lehtinen, U.,Nikkola, M., Penttila, M., Suihko, M.L., Home, S., and Vilpola,
A. (1987) Proceedings of the 21st Congress of the European Brewery Convention, Madrid, p. 529.
35. Esposito, R.E., and Klapholz, S. (1981) In: The Molecular Biology of the Yeast Saccharomyces,
Life Cycle and Inheritance (J.N. Strathern, E.W. Jones and J.R. Broach, eds), Cold Spring
Harbour Laboratory, p. 211.
36. Evans, I.H., and Wilkie, D. (1976) Genetic Research, 27,89.
Глава 3. Генетика дрожжей 105
37. Falco, S.C., and Dumas, K.S. (1985) Genetics, 109,21.
38. Freeman, R.F (1981) Proceedings of the 18th Congress of the European Brewery
Convention, Copenhagen, p. 497.
39. Fujii, Т., Kondo, K., Shimizu, F., Sone, H., Tanaka, J.-I., and Inoue, T. (1990) Applied and
Environmental Microbiology, 56,997.
40. Fujii, Т., Nagasawa, N., Iwamatsu, A., Bogaki, Т., Tamai, Y., and Hamachi, M. (1994) Applied
and Environmental Microbiology, 60, 2786-2792.
41. Fujii, Т., Yoshimoto, H., Nagasawa, N., Bogaki, Т., Tamai, Y., and Hamachi, M. (1996) Yeast,
12,593.
42. Fujii, T, Yoshimoto, H., and Tamai, Y (\996)Journal of Fermentation and Bioengineering, 81,538.
43. Fujii, T, Kobayashi, O., Yoshimoto, H., Furukawa, S., and Tamai, Y (1997) Applied and
Environmental Microbiology, 63, 910.
44. Fujiwara, D., Yoshimoto, H., Sone, H., Harashima, S., and Tamai, Y. (1998) Yeast, 14,711.
45. Fukuda, K., Yamamoto, N., Kiyokawa, Y., Yanagiuchi, Т., Wakai, Y., Kitamoto, K., Inoue, Y.,
and Kimura, A. (1998) Applied and Environmental Microbiology, 64,4076.
46. Galvan, L., Perez, A., Delgado, M., and Conde, J. (1987) Proceedings of the 21st Congress of
the European Brewery Convention, Madrid, p. 385.
47. Gardiner, K., Laces, W and Patterson, D. (1986) Somatic Cell and Molecular Genetics, 12,185.
48. Gjermansen, С (1983) Carhberg Research Communications, 48,557.
49. Gjermansen, С (1991) PhD thesis, University of Copenhagen.
50. Gjermansen, C, and Sigsgaard, P. (1981) Carhberg Research Communications, 46,1.
51. Gjermansen, C, Nilsson-Tillgren, T, Petersen, J.G.L., Kielland-Brandt, M.C., Sigsgaard, P.,
and Holmberg, S. (1988) Journal of Basic Microbiology, 28,175.
52. Goelling, D., and Stahl, U. (1988) Applied and Environmental Microbiology, 54,1889.
53. Goffeau, A., Barrell, B.G., Bussey, H., and 13 others (1996) Science, 27A, 546.
54. Goodey, A.R., and Tubb, R.S. (1982) Journal of General Microbiology, 128,2615.
55. Goodey, A.R., Brown, A.J.P., and Tubb, R.S. (19Sl)Journalofthe Institute of Brewing, 87,239.
56. Goossens, E., Dillemans, M., Debourg, A., and Masschelein, C.A. (1987) Proceedings of the
21st Congress of the European Brewery Convention, Madrid, p. 553.
57. Goossens, E., Debourg, A., Villanueba, K.D., and Masschelein, C.A. (1991) Proceedings of the
23rd Congress of the European Brewery Convention, Lisbon, p. 289.
58. Goossens, E., Debourg, A., Villanueba, K.D., and Masschelein, C.A. (1993) Proceedings of the
24th Congress of the European Brewery Convention, Oslo, p. 251.
59. Gopal, C.V., and Hammond, J.R.M. (1992) Proceedings of the 5th International Brewing
Technology Conference, Harrogate, Brewing Technology Services Ltd, London, p. 297.
60. Guinova-Stoyanova, T.A., and Lahtchev, K.L. (1991) Proceedings of the 23rd Congress of
the European Brewery Convention, Lisbon, p. 313.
61. Guthrie, C, and Fink, G.R. (eds) (1991) Methods in Enzymology, Vol. 194, Academic Press,
London.
62. Gyllang, H., and Martinson, E. (1971), Proceedings of the 13th Congress of the European
Brewery Convention, Estoril, p. 265.
63. Hadfield, C, Cashmore, A.M., and Meacock, P.A. (1986) Gene, 45,149.
64. Hammond, J.R.M. (1994) In: Proceedings of the 4th Aviemore Conference on Malting, Brewing
and Distilling (F G. Priest and I. Campbell, eds) Institute of Brewing, London, p. 85.
65. Hammond, J. (1998) In Genetic Modification in the Food Industry (S. Roller and S. Harlander,
eds) Blackie, London, p. 129.
66. Hammond, J.R.M., and Eckersley, К W. (\984)Journalofthe Institute of Brewing, 90, 167.
106
Джон Р. М. Хаммонд
67. Hammond, J.R.M., and Wenn, R.V. (1985) Proceedings of the 20th Congress of the European
Brewery Convention, Helsinki, p. 315.
68. Hansen, J. (1999) Applied and Environmental Microbiology, 65,3915.
69. Hansen, J., and Kielland-Brandt, M.C. (1994) Gene, 140,33.
70. Hansen, J., and Kielland-Brandt, M.C. (1996a) Journal of Biotechnology, 50, 75.
71. Hansen, J., and Kielland-Brandt, M.C. (1996b) Nature Biotechnology, 14,1587.
72. Hansen, J., Cherest, H., and Kielland-Brandt, M.C. (1994) Journal of Bacteriology, 176,6050.
73. Hansen, M., Rocken, W., and Emeis, C.C. (1990) Journal of the Institute of Brewing, 96,125.
74. Henderson, R.C.A., Cox, B.S., and Tubb, R.S. (1985) Current Genetics, 9,133.
75. Herskowitz, I., and Oshima, Y. (1981) In: The Molecular Biology of the Yeast Saccharomyces,
Life Cycle and Inheritance (J.N. Strathern, E.W. Jones and J.R. Broach, eds), Cold Spring
Harbour Laboratory, p. 181.
76. Hinchliffe, E., and Box, W.G. (1984) Current Genetics, 8,471.
77. Hinchliffe, E., and Box, W.G. (1985) Proceedings of the 20th Congress of the European
Brewery Convention, Helsinki, p. 267.
78. Hinchliffe, E., and Daubney, CJ. (19S6)Journalofthe American Society of Brewing Chemists, 44,98.
79. Hirata, D., Aoki, S., Watanabe, K., Tsukioka, M., and Suzuki, T. (1992) Bioscience,
Biotechnology and Biochemistry, 56,1682.
80. Ho, N.W.Y., Chen, Z., and Brainord, A.P. (1998) Applied and Environmental Microbiology, 64,1852.
81. Hockney, R.C., and Freeman, R.F. (1980) Journal of General Microbiology, 121,479.
82. Holmberg, S. (1982) Carlsberg Research Communications, 47, 233.
83. Hu, Z., Nehlin, J.O., Ronne, H., and Michels, С A. (1995) Current Genetics, 28, 258.
84. Jackson, E.A., Ballance, G.M., and Thomsen, K.K. (1986) Carlsberg Research Communi-
cations, 51,445.
85. Janse, B.J., and Pretorius, I.S. (1995) Applied Microbiology and Biotechnology, 42,878.
86. Jespersen, L., Cesar, L.B., Meaden, P.G., and Jakobsen, M. (1999) Applied and Environmental
Microbiology, 65,450.
87. Johannesen, P.F. (1999) PhD Thesis, University of Copenhagen.
88. Johannesen, P.F., Nyborg, M., and Hansen, J. (1999) Proceedings of the 27th Congress of the
European Brewery Convention, Cannes, p. 655.
89. Jones, R.M., Russell, I., and Stewart, G.G. (1986) Journal of the American Society of Brewing
Chemists, 44,161.
90. Joubert, R., Brignon, P., Lehmann, C, Monribot, C, Gendre, F., and Boucherie, H. (2000)
Yeast, 16,511.
91. Kajiwara, Y., Ogawa, K., Takashita, H., Omori, Т., Shimoda, M., and Wada, H. (1997)Journal
of Fermentation and Bioengineering, 84, 594.
92. Kielland-Brandt, M.C, Peterson, J.G.L., and Mikkelsen, J.D. (1979) Carlsberg Research
Communications, 44, 27.
93. Kielland-Brandt, M.C, Gjermansen, C, Nilsson Tillgren, Т., and Holmberg, S. (1989)
Proceedings of the 22nd Congress of the European Brewery Convention, Zurich, p. 37.
94. Klein, C.J.L, Olsson, L., Ronnow, В., Mikkelsen, J.D., and Nielsen, J. (1996) Applied and
Environmental Microbiology, 62,4441.
95. Knowles, J.K.C, and Tubb, R.S. (1986) European Brewery Convention Monograph, XII, 169.
96. Knowles, J.K.C, Penttila, M., Teeri, T.T., Andre, L., Salovuori, I., and Lehtovaara, P (1985)
Proceedings of the 20th Congress of the European Brewery Convention, Helsinki, p. 251.
97. Kobayashi, O., Hayashi, N., and Sone, H. (1995) Proceedings of the 25th Congress of the
European Brewery Convention, Brussels, p. 361.
Глава 3. Генетика дрожжей
107
98. Kobayashi, О., Suda, H., Ohtani, Т., and Sone, H. (1996) Molecular and General Genetics, 251,707.
99. Kobayashi, O., Hayashi, N.. Kuroki, R„ and Sone, H. (199S)Journalof Bacteriology, 180,6503.
100. Kobayashi, O., Yoshimoto, H., and Sone, H. (1999) Current Genetics, 36,256.
101. Kodama, Y., Fukui, N., Ashikara, Т., Shibano, Y, Morioka-Fujimoto, K., Hiraki, Y, and
Nakatani, K. (1995) Journal of the American Society of Brewing Chemists, 53, 24.
102. Korch, C., Mountain, H.A., Gyllang, H., Winge, M., and Brehmer, P. (1991) Proceedings of
the European Brewery Convention Congress, Lisbon, p. 201.
103. Korhola, M. (1983) In: Gene Expression in Yeast, Proceedings of the Alko Yeast Symposium
(M. Korhola and E. Vaisanen, eds), Foundation for Biotechnical and Industrial Fermentation
Research, Helsinki, p. 231.
104. Kreil, H., Kleber, W., and Teuber, M. (1975) Proceedings of the 15th Congress of the
European Brewery Convention, Nice, p. 323.
105. Kumar, V., Ramakrishnan, S., Teeri, T.T., Knowles, J.K.C., and Hartley, B.S. (1992) Bio/
Technology, 10,82.
106. Lancashire, W.E., and Wilde, R.J. (1987) Proceedings of the 21st Congress of the European
Brewery Convention, Madrid, p. 513.
107. Lancashire, W.E., Carter, A.T., Howard, J.J., and Wilde, R.J. (1989) Proceedings of the 22
Congress of the European Brewery Convention, Zurich, p. 491.
108. Lee, S.Y., Knudsen, F.B., and Poyton, R.O. (1985) Journal ofthe Institute of Brewing, 91,169.
109. Lewis, C.W.Johnston, J.R., and Martin, P.A. (1976) Journalojthe Institute of Brewing, 82,158.
110. Lo, W-S., and Dranginis, A.M. (1996) Journal of Bacteriology, 178,7144.
HI. Lyness, C.A., Steele, G.M., and Stewart, G.G. (1997) Journal of the American Society of
Brewing Chemists, 55, 141.
112. Mahler, H.R., and Wilkie, D. (1978) Plasmid, 1,125.
113. Martens, F.B., van den Berg, R., and Harteveld, P.A. (1985) Proceedings of the 20th Congress
of the European Brewery Convention, Helsinki, p. 211.
114. Mason, A.B., and Dufour, J.-P. (2000) Yeast, 16,1287.
115. Meaden, P. (1990) Journal of the Institute of Brewing, 96,195.
116. Meaden, P.G., and Tubb, R.S. (1985) Proceedings of the 20th Congress of the European
Brewery Convention, Helsinki, p. 219.
117. Meaden, P., Ogden, K., Bussey, H., and Tubb, R.S. (1985) Gene, 34,325.
118. Minetoki, Т., Bogaki, Т., Iwamatsu, A., Fujii, Т., and Hamachi, M. (1993) Bioscience,
Biotechnology and Biochemistry, 57,2094.
119. Mithieux, S.M., and Weiss, A.M. (1995) Yeast, 11,311.
120. Molzahn, S.W. (1977) Journal of the American Society of Brewing Chemists, 35,54.
121. Moraes, L.M.P., Astolfi-filho, S., and Oliver S.G. (1995) Applied Microbiology and
Biotechnology, 43,1067.
122. Morrison, K.B., and Suggett, A. (1983) Proceedings of the 19th Congress of the European
Brewery Convention, London, p. 489.
123. Mortimer, R., and Johnson, J. (1986) Genetics, 113,35.
124. Mortimer, R.K., Contopoulou, C.R., and King, J.S. (1992) Yeast, 8,817.
125. Nagasawa, N.. Bogaki, Т., Iwamatsu, A., Hamachi, M., and Kumagai, C. (1998) Bioscience,
Biotechnology and Biochemistry, 62, 1852.
126. Nilsson-Tillgren, Т., Petersen, J.G.L., Holmberg, S., and Kielland-Brandt, M.C. (1980)
Carbberg Research Communications, 45,113.
127. Nilsson-Tillgren, Т., Gjermansen, C, Kielland-Brandt, M.C, Petersen, J.G.L., and Holmberg,
S. (1981) Carhberg Research Communications, 46, 65.
108
Джон Р. М. Хаммонд
128. Nilsson-Tillgren,T., Gjermansen, С, Holmberg, S., Petersen, J.G.L., and Kielland-Brandt,
M.C. (1986) Carlsberg Research Communications, 51,309.
129. Oakley-Gutowski, K.M., Hawthorne, D.B., and Kavanagh, Т.Е. (1992; Journal of the
American Society of Brewing Chemists, 50,48.
130. Oliver, S.G. (1996) Trends in Genetics, 12,241.
131. Omura, F., Shibano, Y., Fukui, N., and Nakatani, K. (1995) Journal of the American Society of
Brewing Chemists, 53,58.
132. Onnela, M.-L, Suihko, M.-L. Penttila, M, and Keranen, S.(1996)Journal of Biotechnology, 49,101.
133. Oppenoorth, W.F.F. (1959) Proceedings of the 7th Congress of the European Brewery
Convention, Rome, p. 29.
134. Ostergaard, S., Olsen, L, and Nielsen, J. (2000) Microbiology and Molecular Biology Reviews, 64,34.
135. Panoutsopoulou, K., Hutter, A., Jones, P., Gardner, D.CJ., and Oliver, S.G. (2001) Journal of
the Institute of Brewing, 107,49.
136. Park, C.S., Park, Y.J., Lee, Y.H., Park, K.J., Kang, H.S., and Рек, U.H. (1990) Technical
Quarterly of the Master Brewers Association of the Americas, 27,112.
137. Panchal, C.J., Peacock, L., and Stewart, G.G. (1982) Biotechnology Letters, 4,639.
138. Panchal, С J., Bast, L., Dowhanick, Т., and Stewart, G.G. (1987) Journal of the Institute of
Brewing, 93,325.
139. Pecar, M., Tonissen, K., and Rogers, P. (1999) Journal of the American Society of Brewing
Chemists, 57, 94.
140. Pedersen, M.B. (1983a) Proceedings of the 19th Congress of the European Brewery
Convention, London, p. 457.
141. Pedersen, M.B. (1983b) Carlsberg Research Communications, 48,485.
142. Pedersen, M.B. (1985a) Proceedings of the 20th Congress of the European Brewery
Convention, Helsinki, p. 203.
143. Pedersen, M.B. (1985b) Carlsberg Research Communications, 50, 263.
144. Pedersen, M.B. (1986) Carlsberg Research Communications, 51,163.
145. Penttila, M.E., Suihko, M., Lehtinen, U., Nikkola, M., and Knowles, J.K.C. (1987) Current
Genetics, 12,413.
146. Perry, C, and Meaden, P. (1988)Journalofthe Institute of Brewing, 94, 64.
147. Petersen, J.G.L., Holmberg S., Nilsson-Tillgren, Т., Kielland-Brandt, M.C, and Gjermansen, С
(1983) European Brewery Convention Monograph, IX, 30.
148. Petersen, J.G., Nilsson-Tillgren, Т., Kielland-Brandt, M.C, Gjermansen, C, and Holmberg,
S. (1987) Current Genetics, 12,167.
149. Porter, G., Westmorland, J., Priebe, S., and Resnick, M.A. <1996) Genetics, 143,755.
150. Rocken, W. (1984) Monatschrift fur Brauwissenschaft, 37, 384.
151. Russell, I., Hancock, I.F., and Stewart, G.G. (1983) Journalojrthe American Society of Brewing
Chemists, 41,45.
152. Russell, I., Jones, R., and Stewart, G.G. (1985) Proceedings of the 20th Congress of the
European Brewery Convention, Helsinki, p. 235.
153. Ryder, D.S., and Masscheiein, C.A. (1983) European Brewery Convention, Monograph, IX, 2.
154. Sakai, K., Fukui, S., Yabuuchi, S., Aoyagi, S., and Tsumura, Y. (1989) Journal of the American
Society of Brewing Chemists, 47, 87.
155. Salek, A., Schnettler, R., and Zimmermann, U. (1990) FEMS Microbiological Letters, 70,67.
156. Sasaki, Т., Watari J., Kohgo, M., Nishikawa, N., and Matsui, Y. (1984) Journal of the American
Society of Brewing Chemists, 42,164.
157. Schoeman, H., Vivier, M.A., Du Toit, M., Dicks, L.M.T, and Pretorius, I.S. (1999) Yeast, 15,647.
Глава 3. Генетика дрожжей
109
158. Schofield, M.A., Rowe, S.M., Hammond, J.R.M., Molzahn, S.W., and Quain, D.E. (1995)
Journal of the Institute of Brewing, 101,75.
159. Sheehan, C.A., Weiss, A.S., Newsom, I.A., Flint, V.P., and O'Donnell, D.C. (1991) Journal of
the Institute of Brewing, 97,163.
160. Sherman, F., and Wakem, P. (1991) In: Methods in Enzymology, Vol. 194 (C. Guthrie and
G. Fink, eds), Academic Press, London, p. 38.
161. Shibuya, I., Tamura, G., Shima, H., Ishikawa, Т., and Нага, S. (1992) Bioscience,
Biotechnology and Biochemistry, 56,884.
162. Shimizu, F., Sone, H., and Inoue, T. (1989) Technical Quarterly of the Master Brewers
Association of the Americas, 26,47.
163. Sone, H., Kondo, K., Fujii, Т., Shimizu, F., Tanaka, J., and Inoue, T. (1987) Proceedings of the
21st Congress of the European Brewery Convention, Madrid, p. 545.
164. Stewart, G.G., Russell, I., and Panchal, C. (1981) In: Current Developments in Yeast Research
(G.G. Stewart and I. Russell, eds), Pergamon Press, Toronto, p. 17.
165. Steyn, A.J.C., and Pretorius, I.S. (1991) Gene, 100,85.
166. Stratford, M. (1996) Cerevisia, Belgiatt Journal of Brewing and Biotechnology, 21,38.
167. Stratford, M., and Assinder, S. (1991) Yeast, 7,559.
168. Sturley, S.L., and Young, T.W. (1988)Journalofthe Institute of Brewing, 94,133.
169. Suihko, M.-L., Penttila, M., Sone, H., Home, S.f Blomqvist, K., Tanaka, J., Inoue, Т., and
Knowles, J. (1989) Proceedings of the 22nd Congress of the European Brewery Convention,
Zurich, p. 483.
170. Suihko, M.-L., Blomqvist, K., Penttila, M., Gisler, R., and Knowles, J. (1990) Journal of
Biotechnology, 14,285.
171. Tada, S., Takeuchi, T, Sone, H., Yamano, S., Schofield, M.A., Hammond, J.R.M., and Inoue, T.
(1995) Proceedings of the 25th Congress of the European Brewery Convention, Brussels, p. 369.
172. Tamai, Y, Momma, Т., Yoshimoto, H., and Kaneko, Y (1998) Yeast, 14,923.
173. Taylor, N.R., Hammond, J.R.M., and Meaden, P.G. (1990) In: Proceedings of the 3rd Aviemore
Conference on Malting, Brewing andDistilling (I. Campbell, eds) p. 403, Institute of Brewing, London.
174. Tezuka, H., Mori, Т., Okumura, Y., Kitabatake, K., and Tsumura, Y. (1992) Journal of the
American Society of Brewing Chemists, 50,130.
175. Thomsen, K.K., Jackson, E.A., and Brenner, K. (1988) Journal of the American Society of
Brewing Chemists, 46, 31.
176. Thorne, R.S.W. (1970) Process Biochemistry, 4,15.
177. Tubb, R.S. (1980) Journal of the Institute of Brewing; 86,76.
178. Tubb, R.S., Searle, B.A., Goodey, A.R., and Brown A.J.P. (1981) Proceedings of the 18th
Congress of the European Brewery Convention, Copenhagen, p. 487.
179. Tubb, R.S., Liljestrom, P.L., Torkkeli, Т., and Korhola, M. (1986) In: Proceedings of the 2nd
Aviemore Conference on Malting, Brewing and Distilling (EG. Priest and I. Campbell, eds),
p. 298, Institute of Brewing, London.
180. Urano, N., Nishikawa, N., and Kamimura, M. (1990) Proceedings of the Institute of Brewing
(Australia and New Zealand Section) Convention, Auckland, p. 154.
181. Urano, N., Sahara, H., and Koshino, S. (1993)Journalof Biotechnology, 28, 237.
182. Urano, N., Sato, M., Sahara, H., and Koshino, S. (1993) Journal of Biotechnology, 28, 249.
183. Vakeria, D., and Hinchliffe, E. (1989) Proceedings of the 22nd Congress of the European
Brewery Convention, Zurich, p. 475.
184. Vakeria, D., Box, W.G., and Hinchliffe, E. (1991) Proceedings of the 23rd Congress of the
European Brewery Convention, Lisbon, p. 305.
110
Джон Р. М. Хаммонд
185. Vaughan-Martini. A., and Martini, A. (1987) Antonie van Leeuwenhoek, 53, 77.
186. Verstrepen, K., Bauer, F.F., Michiels, С Delvaux, E, and Pretorius, I.S. (2000) European
Brewery Convention Monograph, 28, 30.
187. Villa, K.D., Lee, S., Goossens, E., Debourg, A., and Masschelein, C.A. (1995) Journal of the
American Society of Brewing Chemists, 53,49.
188. Villanueba, K.D., Goossens, E., and Masschelein, C.A. (1990) Journal of the American Society
of Brewing Chemists, 48,111.
189. Vogel, J., Wackerbauer, K., and Stahl, U. (1995) Genetically Modified Foods: Safety Aspects.
ACS Symposium Series, 605,160.
190. von Wettstein, D. (1983) Proceedings of the 29th Congress of the European Brewery
Convention, London, p. 97.
191. Watari, J., Takata, Y., Ogawa, M., Nishikawa, N., and Kamimura, M. (1989) Agricultural and
Biological Chemistry, 53, 901.
192. Watari, J., Takata, Y., Murakami, J., and Koshino, S. (1991) Proceedings of the 23rd Congress
of the European Brewery Convention, Lisbon, p. 297.
193. Watari, J., Takata, Y., Ogawa, M., Murakami, J., and Koshino, S. (1991) Agricultural and
Biological Chemistry, 55,1547.
194. Watari, J..Nomura, M., Sahara, H., Koshino, S.,and Keranen, S. (1994) Journalofthe Institute
of Brewing, 100,73.
195. Watari, J., Takata, Y., Ogawa. M., Sahara, H., Koshino, S., Onnela, M.-L., Airaksinen, U.,
Jaatinen, R., Penttila, M., and Keranen, S. (1994) Yeast, 10, 211.
196. Watari, J., Sato, M., Ogawa, M., and Shinotsuka, K. (2000) European Brewery Convention
Monograph, 28,148.
197. Wickner, R.B. (1983) Archives of Biochemistry and Biophysics, 222,1.
198. Wightman, P., Quain, D.E., and Meaden, P.G. (1996) Letters in Applied Microbiology, 22,90.
199. Xiao, W., and Rank, G.H. (1989) Gene, 76,99.
200. Yamagishi, H., Otsuta, Y., Funahashi, W., Ogata, Т., and Sakai, K. (1999) Journal of Applied
Microbiology, 86, 505.
201. Yamano, S., Tanaka, J., and Inoue, T. (1994) Journal of Biotechnology, 32,165.
202. Yamano, S., Kondo, K., Tanaka, J., and Inoue, T. (1994) Journal of Biotechnology, 32,173.
203. Yamano, S., Tomizuka, K., Tanaka, J., and Inoue, T. (1994) Journal of Biotechnology, 37,45.
204. Yamano, S., Tomizuka, K., Sone, H., Imura, M., Takeuchi, Т., Tanaka, J., and Inoue, T. (1995)
Journal of Biotechnology, 39, 21.
205. Yamauchi, H., Yamamoto, H., Shibano, Y. Amaya, N., and Saeki, T. (1998) Journal of the
American Society of Brewing Chemists, 56, 58.
206. Yocum, R.R. (1986) Proceedings of BioExpo86,171.
207. Yoshimoto, H., Fujiwara, D., Momma, T, Tanaka, K., Sone, H., Nagasawa, N., and Tamai, Y
(1999) Yeast, 15,409
208. Young, T.W. (1981)Уошт2я/ of the Institute of Brewing, 87, 292.
209. Young, T.W. (1983) Journal of the American Society of Brewing Chemists, 41,1.
210. Young, T.W., and Hosford, E.A. (1987) Proceedings of the 21st Congress of the European
Brewery Convention, Madrid, p. 521.
211. Young, T.W, and Yagiu, M. (1978) Antonie van Leeuwenhoek, 44, 59.
Глава 4
МИКРОБИОТА ЯЧМЕНЯ И СОЛОДА
Брайен Флэнниган (Brian Flannigan)
Издательство выражает признательность
канд. с 'X. паук, доц. И. В. Матвееву,
специалисту по зерновым культурам
ОАО «Пивоваренная компания Балтика"»
за ценные советы и замечания.
4.1. Микробиота ячменя
4.1.1. Введение
Зерно ячменя является переносчиком ряда микроорганизмов, которые ранее назы-
вали его природной микрофлорой. В последние годы от этого понятия отошли, по-
скольку оно подразумевает, что эти микроорганизмы принадлежат к царству растений
(на самом деле к нему относятся лишь некоторые микроводоросли). В настоящее время
преимущестенно используется термин «микробиота», так как в нем отражено наличие
различных форм жизни. Микробиота ячменя в основном включает в себя бактерии
(Eubacteria и мицелиальные Actinomycetes), мицелиальные грибы и дрожжи.
Степень контаминации или колонизации зерна микроорганизмами зависит от ус-
ловий произрастания и переработки зерна после сбора. К микробиоте относятся
виды микроорганизмов, обсеменяющих и контаминирующих зерно на полях, а так-
же другие микроорганизмы, в первую очередь мицелиальные грибы, развивающиеся
при хранении зерна. Понятие «мицелиальные грибы» («плесени») обычно относят к
полевым грибам — они включают в себя виды Alternana, Cladosporium, Epicoccum,
Fusarium и некоторых других родов. К плесеням относят также грибы хранения —
в основном это виды Aspergillus, Eurotium и Penicillium. Несмотря на то что в работе
[216] приведен широкий ряд микроорганизмов, выделенных с зерен ячменя (после-
дующие публикации пополнили этот список), микробиота разных сортов ячменя и
других злаков в большой степени схожа, причем обычно преобладает ограниченное
число видов. Здесь необходимо упомянуть, что по сравнению с [216] в настоящее
время в номенклатуре грибов произошли значительные изменения. К сожалению, в
более позднем списке, приведенном как часть обзора микробиоты ячменя и солода,
ее влияния и контроля над ней [202], не были учтены некоторые важные изменения.
В настоящей главе произошедшие изменения в номенклатуре учтены, причем со-
временные названия микроорганизмов, если авторами цитируемых работ они при-
водились по-старому, сопровождаются старыми названиями, заключенными в круг-
лые скобки. Учтено также правило Международной комиссии по ботанической
номенклатуре (ICBN), согласно которому в случаях если грибы имеют как половые
(телеоморфные), так и бесполые (анаморфные) фазы, то в качестве приоритетного
названия должно приводиться телеоморфное. Следовательно, в этой главе к анамор-
фным родам, имеющим половые стадии {Aspergillus, Fusarium, Penicillium) применя-
ются телеоморфные имена, а анаморфное название приводится в круглых скобках
после аббревиатуры «ana». Helminthosporium является анаморфным родом, от кото-
рого образовались три других анаморфных рода Bipolaris, Drechslera и Exserohilum с
различными телеоморфными стадиями (Cochliobolus, Pyrenophora и Septosphaeria),
112
Брайен Флэнниган
причем для используемых в пивоварении злаков значение имеют лишь первые два
из них. В эти два рода входят патогенные микроорганизмы растений С. sativus (ana.
Bipolaris sorokiniana — наименования Drechslera sorokiniana, Helminthosporium sow—
kinianum, и H. sativum являются анаморфными синонимами и более не применяют-
ся) и P. teres (ana. D. teres, устаревшее название — Н. teres).
4.1.2. Полевая микробиота
а) Контаминация и колонизация
Как и у пшеницы [88], зерна ячменя вскоре после раскрытия колосьев подвергают-
ся контаминации переносимыми по воздуху бактериями, дрожжами и плесенью
[130]. Развивающаяся в открытом цветке зерновка подвергается контаминации с воз-
духа так же, как и внутренняя поверхность лемм и палей, позднее формирующих мя-
кинную оболочку. По мере роста и созревания зерновка заполняет пространство меж-
ду двумя брактеолами так, что дальнейшая контаминация с воздуха предотвращается,
хотя внешняя поверхность лемм и палей остается уязвимой. Важную роль в степени
контаминации зерен ячменя микроорганизмами играют климатические условия.
Было установлено [277], что количество спор Cladosporium на внешней поверхности
лемм и палей коррелирует с количеством спор в атмосфере, причем их количество
существенно увеличивается после дождя. Количество спор, прорастающих вне брак-
теол, также повышается после дождя, но остается небольшим при условии проникно-
вения основных тканей из внешней поверхности этих органов.
Тем не менее среда между зерновкой и брактеолами благоприятна для роста мик-
роорганизмов, способных впоследствии проникать в соседние ткани. Примером мо-
гут служить споры Cladosporium. Сначала темные гифы, развивающиеся из этих спор,
формируют псевдомицелий, который позднее проникает в паренхиматозные волок-
нистые слои лемм и палей [277]. На внутренних поверхностях и в пределах брактеол
был замечен также мицелий других полевых грибов — таких, как Alternaria и Cock-
liobolus sativus (ana. Bipolaris sorokiniana, Helminthosporium sativum) [183, 278]. Суще-
ствует возможность развития мицелия в перикарпе зерновки [183, 279], правда,
в меньшей степени, чем в леммах и палеях [266]. Хотя в большинстве работ отмечает-
ся увеличение степени колонизации при прорастании спор на внутренней поверхно-
сти брактеол и зерновки, существуют данные о том, что мицелий Cladosporium, про-
никающий в брактеолы и внешний слой зерновки, может развиваться в закрытых
пыльниках, которые ранее были колонизированы и контаминированы [277].
Климатические условия произрастания ячменя влияют как на колонизацию внеш-
ней поверхности зерна, так и самого зерна. Распространенность фитопатогенных мик-
роорганизмов в восточной Канаде объясняется, в частности, более влажным, чем
в других регионах страны, климатом [173]. Патогенные микроорганизмы включают
в себя различные виды Cochliobolus (ana. Bipolaris) и Pyrenophora (ana. Drechslera), ко-
торые ранее причислялись к анаморфному роду Helminthosporium. Присутствие боль-
шого числа микроорганизмов, включая реснитчатую протозоа и плесневый грибок
Physarum polycephalum в потемневшем и подвергшемся атмосферным воздействиям
ячмене [152], связывают с высоким уровнем относительной влажности (RH) или
большим количеством осадков после обмолота [97]. Зачастую к росту плесени приво-
дят условия хранения урожая — высокий уровень RH в течение продолжительного
Глава 4. Микробиота ячменя и солода
113
времени может привести к прорастанию на поверхности зерна спор, образующих тем-
ные колонии (особенно Cladosporium). Вместе с тем число жизнеспособных микроор-
ганизмов в потемневшем ячмене (подвергшемся атмосферному воздействию) не обя-
зательно будет выше, чем в светлом. Причиной этого могут быть несовершенство
методов исследования и/или гибель темного мицелия или спор.
Определение степени зараженности зерна патогенными микроорганизмами тре-
бует кропотливого микроскопического исследования разных срезов и органов. По-
пытки получения количественной оценки грибного мицелия описаны в работах [271,
279]. В первой из них детально исследовались 20 зерен, и общая длина гифов в каж-
дом зерне составляла в среднем 19-177 см со средним значением 60-74 см. Их масса
примерно равна 1,5-1,9 мкг, причем несмотря на то, что споры полевых грибов
(включая Cladosporium) [277] вполне идентифицируемы и могут быть подсчитаны,
мицелий одного вида редко отличается от мицелия другого вида. Для определения
происхождения мицелия того или иного вида следует применять методику флуорес-
центного анализа с помощью антител в сочетании с внимательным микроскопичес-
ким исследованием [276, 278]. Помимо больших затрат времени на проведение этих
анализов возникает еще одна проблема: невозможно различить живые и мертвые
споры и мицелий. Более того, хотя на внутренней поверхности лемм и палей и отме-
чаются скопления дрожжевых клеток [266], идентифицировать их не представляет-
ся возможным. Основная информация о составе микробиоты получена при исследо-
ваниях жизнеспособности микроорганизмов с применением метода прямого
подсчета (с разведением или без него).
б) Бактерии
Подсчет жизнеспособных микроорганизмов с использованием разведения пока-
зывает, что даже в ранней стадии развития зерна в микробиоте ячменя численно пре-
обладают бактерии [97, 130,152]. Так, на стадии восковой спелости в 1 г ячменя было
выделено 108 клеток бактерий [152]. Данных о более подробном исследовании этих
бактерий ячменя нет, однако известно, что в готовом к сбору ячмене преобладают
Erwinia herbicola и Xanthomonas campestris [48, 91], хотя, вероятно, до момента сбора
урожая на ячмене присутствуют и другие бактерии — в частности, псевдомонады,
микрококки и Bacillus spp., которые были выделены из сухого ячменя, предназначен-
ного для солодоращения [121]. Как правило, количество актиномицетов на ячмене
в поле относительно невелико [48, 130], и большая их часть относится к Septomyces
spp. [130] с преобладанием S.griseus, хотя довольно часто встречаются и S. albust и
S. thermoviolaceus. Наиболее частой причиной респираторных заболеваний фермеров
является Thermoactinomyces vulgaris: он может присутствовать как в созревающем [130]
и в готовом к уборке ячмене [48], так и в зернах недавно убранного ячменя [79].
в) Дрожжи
Второе после бактерий место по количеству жизнеспособных микроорганизмов
в еще не собранном ячмене занимают дрожжи, хотя на поздней стадии созревания их
количество повышается за счет мицелиальных грибов. К моменту сбора ячменя ко-
лонии дрожжей могут присутствовать на 50-85% зерен [130]. Чаще всего преоблада-
ют розовые дрожжи Sporobolomyces и Rhodotorula [48,49,80,130,167], однако из дат-
114
Брайен Флэнниган
ского ячменя были выделены также Hansenula, Torulopsis и Candida [167]. По данным
[152], в штате Миннесота в ячмене до сбора урожая были выделены Saccharomyces,
однако дрожжи этого рода в ячмене обычно встречаются редко [216]. Учитывая об-
щее сходство микробиоты ячменя и пшеницы, вполне вероятно, что в обеих зерно-
вых культурах присутствуют также виды Cryptococcus и Trichosporon, выявленные
в пшенице [88].
г) Мицелиальные грибы
Из результатов упоминавшихся выше микробиологических исследований можно
было бы ожидать, что жизнеспособные полевые грибы находятся в основном на лем-
ме и палеях, доказательством чему служат исследования очищенных от оболочек
ячменей [80]. В данном случае брактеолы (лемма и палеи) отделяются при молотьбе
примерно от 60 до 85% зерен [5]. В Шотландии до сбора урожая примерно две трети
инокулята ячменя без оболочки связаны с брактеолами, а одна треть — с зерновкой
[80]. В южной части канадской провинции Монитоба в ходе лущения при сборе уро-
жая отделяется в среднем 95% колониеобразующих единиц (КОЕ) Fusarium
graminearum, присутствующих в неповрежденных зернах очищенного ячменя.
Подтверждением присутствия полевых грибов в активной форме является тот
факт, что после дезинфекции собранного ячменя наблюдается рост колоний на среде
с агаром [78, 97, 121,173].
В Европе [49, 78, 79, 121, 138], в Северной [42, 97, 173] и в Южной Америке [6]
наиболее распространенным в зернах полевым грибом является Alternaria alternata
{Alt. tenuis). В большом количестве зерен могут также присутствовать Cladosporium
spp. (в основном Clad, cladosporioides и Clad, herbarum). Например, было обнаружено
[130], что в некоторых партиях готового к сбору урожая 90% зерен заражены Clado-
sporium, и все 100% — Alt. alternata, К другим часто встречающимся сапрофитам
(но все же в меньшем количестве, чем Alt. alternata и Cladosporium spp.) относятся
Epicoccum nigrum (E, purpurascens) и Aureobasidium (Pullularia) pullulans [78, 79, 173].
Отмечено также присутствие Acremonium (Cephalosporium) spp, [79, 121, 287], а гриб
Verticillium lecanii в некоторых партиях может присутствовать в каждом зерне [130].
Хотя большинство полевых грибов, находящихся на зерне ячменя, не являются
патогенными или условно патогенными, все же некоторые виды патогенных грибов
переходят от одного поколения зерна ячменя к другому [182, 227]. К таким развива-
ющимся на зерне фитопатогенам можно отнести Cochliobolus sativus {ana. Bipolaris
sorokiniana, Helminthosporium sativum), чаще встречающийся в континентальной Ев-
ропе и Северной Америке, а также Pyrenophora graminea {ana. Drechslera graminea,
H.gramineum) и P. teres {ana. D. teres, H. teres), которые наблюдались и на британских
островах [79]. Как и P. graminea, Ustilago segetum var. tritici (U. nuda) проникает в зер-
новку и является причиной появления пятен. Fusarium spp., вызывающие гибель
части растений без загнивания или образование корки [212], также могут проникать
в зерновку через ранее колонизированные лемму и палеи. Поскольку в последние
годы отмечается рост числа заболеваний, связанных с фузариями, мы рассмотрим
эту проблему ниже.
При оценке количества жизнеспособных организмов методами подсчета КОЕ на
пластинке обычно оказывается, что в США среди плесеней непосредственно перед
Глава 4. Микробиота ячменя и солода
115
сбором урожая доминирует Alt. alternate. [97], тогда как в Европе основная масса зер-
на бывает контаминирована Cladosporium spp. [80,130]. Исследования ячменя запад-
ной Канады [54] подтверждают, что в Северной Америке преобладает Alt. alternata
(на втором месте — Cladosporium spp). Необходимо отметить, что по сравнению с се-
рединой XX века в последнее время возросло число случаев заражения помимо
Cladosporium spp. другими фитопатогенами (например, Cochliobolus sativus, P. teres,
Stagonospora (Septoria) nodorum и F. graminearum) [111, 173]. Это может отражать как
изменения в агрономической практике и сортах ячменя, так и в степени доминиро-
вания тех или иных патогенных популяций. Было показано [239], что в Дании анти-
плесеневая фунгицидная обработка ячменя не оказала никакого влияния на боль-
шинство полевых грибов, однако в результате увеличилось число микроорганизмов
вида Fusarium. Было высказано предположение, что при задержке созревания подоб-
ная обработка могла увеличить период, во время которого зерно подвергается зара-
жению плесенями Fusarium.
Из данных, полученных при изучении развития микробиоты пшеницы [88], мож-
но сделать вывод, что в Европе наиболее ранними контаминантами ячменя являют-
ся Aureobasidium pullulans и Cladosporium spp, и количество их быстро растет после
цветения. За ними следуют Alt. alternate, Verticillium lecanii и, наконец, Epicoccum nig-
rum. На этой стадии в зерне может присутствовать следующие количество КОЕ: бак-
терий — 1,6 х 104, дрожжей — 8 х 103, полевых грибов — 2,5 х 103 [80].
д) Грибы Fusarium
Как мы уже отмечали выше, в настоящее время основной проблемой при выращи-
вании ячменя является его заражение Fusarium [260], поражающим во время созре-
вания колосья мелкозерных злаков при влажных климатических условиях (это час-
то случается во влажных регионах Северной Америки с высокой влажностью [38,97,
173], а также в Северной Европе, где сбор урожая происходит позже [89, 121, 270,
287]). При интенсивных колонизации и развитии Fusarium зерно приобретает розо-
ватый цвет [130]. Преобладающие в европейских ячменях Fusarium spp. представле-
ны видами, вызывающими корневую гниль (F. culmorum [121] и F. avenaceum [287]),
а в более теплых регионах преобладают F. graminearum и F.poae. Белая плесень Micro-
dochium (Monographella) nivalis (ana. F. nivale), отмеченная в работах [78,79,138], по-
видимому, преобладает в более холодных районах [137], a F. sporotrichioides (F. tricin-
ctum) более распространены в финском ячмене [287]. В исследованиях канадского
ячменя 1951 г. наиболее частыми видами являлись F.poae, F. equiseti и F. acuminatum
(F. scirpi var. acuminatum) [173], однако современные исследования свидетельствуют,
что из одиннадцати видов Fusarium, выделенных из ячменя, наиболее распространен
F. graminearum [52] (средняя контаминация зерен — 71% у образцов из центральной
части провинции Манитоба и лишь 2% — у образцов из северо-западных областей
этой провинции). В западной Канаде, согласно последним данным, наравне с F. gra-
minearum очень распространены еще три вида, а именно F. avenaceum, F. sporotrichi-
oides и F. роае, ставшие наиболее часто встречаемыми представителями этого рода
в ячмене [54]. В Японии наиболее распространенным заболеванием является зара-
жение ячменя F. graminearum [135]. Широко распространено также его заражение
F. equiseti и F. sambucinum [137].
116
Брайен Флэнниган
Визуальные характеристики зараженности Fusarium на колосе зависят от домини-
рования того или иного вида микроорганизмов. Так, например, F. culmorum вызывает
преждевременное появление бесцветных пятен, а при сильном росте мицелий визу-
ально различим в колосьях. F. роае, напротив, повреждает оболочку зерна, образуя
светлые пятна с темно-коричневыми краями [65]. Род Fusarium очень важен не только
с точки зрения предрасположенности вызывать болезни колоса, стебля и корневой
гнили злаковых культур, но и из-за того, что в него входят и другие виды, обсеменяю-
щие хлопок, лен, бананы и помидоры, что приводит к значительным экономическим
потерям. Так как грибы рода Fusarium поражают урожай и заражают растения на кор-
ню, то их можно причислить к полевым грибам. Тем не менее, как будет показано
ниже, они могут развиваться и в зерне после ненадлежащей сушки и хранения, а так-
же во время солодоращения. С начала XIX века, когда случаи заболевания домашнего
скота на фермах в штате Небраска приписывали зерновому корму, инфицированному
F. moniliforme, было зарегистрировано много вспышек заболеваний вследствие зара-
жения кормов Fusarium spp. и их микотоксинами [177]. Такие микотоксины, как зеа-
раленон, трихотецены и фумонизины [85], могут вызывать серьезные проблемы со
здоровьем животных и сказываться на здоровье человека [184].
Очевидно, что степень обсемененности грибами сказывается на стоимости зерна.
Существует отрицательная корреляция между дезоксиниваленолом (DON, трихо-
теценовый микотоксин, продуцируемый F. graminearum, F. culmorum и F. cerealis
(F. crookwellense)), и весом зерна в единице объема [240], причем поражается не все
зерно. К примеру, существуют зерна пшеницы, пораженные Fusarium, с пониженным
количеством запасного белка [200]. Тем не менее присутствие микотоксинов
Fusarium в зерне и их потенциальный риск для здоровья требуют повышенного вни-
мание к болезням ячменя. Особенно это касается Северной Америки, где в после-
днее время отмечается значительный рост зараженности растений грибами Fusarium.
В настоящее время ячмень подвержен этой болезни в той же степени, что и пшеница
[263]. Так, 72% образцов ячменя из урожаев 1990-1998 гг. в восточной Канаде содер-
жали DON [38]. Было установлено влияние климатических условий на содержание
DON в зерне из центральной части Миннесоты и северной Дакоты (образцы ячменя
содержали до 22 мкг DON/r), причем сорта шестирядного ячменя подвержены его
негативному воздействию сильнее, чем двухрядного [241]. На востоке Миннесоты,
где климат более влажный, было отмечено самое высокое содержание DON (зараже-
но было большинство образцов). В центральной части северной Дакоты контамина-
ции было подвержено меньшее количество образцов, а уровень концентрации DON
был ниже; на западе этого штата, где климат более сухой, заражение отмечалось ред-
ко. Была изучена взаимосвязь между фузароиозмом колоса и накоплением DON
в ячмене [75]. При этом два сорта ячменя, из которых один был восприимчивым к
этой болезни (Robust), а другой (Chevron) — устойчивым, специально обсеменяли
спорами F. graminearum во время цветения, и вскоре плесень стала продуцировать
микотоксины. В ячмене, восприимчивом к этой болезни, через 24 ч был обнаружен
трихоцетин 15-0-ацетил-4-дезоксиниваленол (15-ADON), а через 48 ч у обоих сор-
тов ячменя были выявлены DON и 15-ADON. Через 72 ч концентрации этих токси-
нов в цветках в среднем составляли соответственно 7,19 и 1,07 ррт. Через 120 ч были
выявлены два других соединения — 3-ADON и 7-ADON. Стал ли трихотецен причи-
Глава 4. Микробиота ячменя и солода
117
ной развития заболевания и вирулентности зерна, представляется до сих пор спор-
ным, однако было высказано предположение [75], что это вполне возможно. После
анализа собранного урожая ячменя было установлено присутствие в нем эргостеро-
ла (основной стерол грибных мембран, который также является индикатором нали-
чия биомассы грибов) и DON, количество которых составляло соответственно 45
и 12 ррт [46]. Это соотношение не является величиной постоянной, поскольку ви-
довой состав грибов от образца к образцу варьирует, и определить, какое количество
этого эргостерола ввыделено именно Fusarium spp., невозможно.
В Японии, напротив, из ячменя и пшеницы выделяют преимущественно виды,
синтезирующие ниваленол (NIV). Присутствием DON и 15-ADON в естественно
контаминированном ячмене связано главным образом с внешними слоями зерна.
Бблыиая часть жизнеспособных спор F. graminearum в очищенном ячмене локализо-
вана в оболочке и именно в оболочке наблюдается наибольшая концентрация выше-
упомянутых токсинов. Обрушивание зерен при сборе урожая приводит к уменьше-
нию концентрации DON на 59%; это дает возможность предположить, что решением
проблем, связанных с фузариозом колоса, станут голозерные культуры. Использова-
ние для солодоращения сортов, не имеющих оболочек, предлагалось и ранее, по-
скольку при испытаниях солод из таких сортов ячменя по сравнению с сортами, име-
ющими оболочки, отличался более высоким качеством [13].
Рутинные исследования микотоксинов оправданы при частом обнаружении
F. graminearum в определенных регионах, особенно при сильной контаминации и ис-
пользовании злаков для солодоращения [52]. Несмотря на то что в работе [69] с по-
мощью спектроскопии в близкой к инфракрасной области спектра было выявлено,
что все зерна пшеницы с видимыми признаками повреждения вследствие фузариоза
колоса содержат DON на уровне 120-700 ррт, хорошо известно, что этот токсин мо-
жет присутствовать и в зерне без видимых признаков заражения. Также необходимо
помнить, что в полевых условиях F. graminearum и другие представители этого рода
могут присутствовать бессимптомно, как это было в 1993-1994 гг. в канадской про-
винции Манитоба, когда эпидемия фузариоза колоса распространилась по северной
части этой провинции [52]. Ячмень урожая 1994 г. содержал DON, 15-ADON,
3-ADON, и 3,15^Ha4emn-DON в соотношении 47 : 4 : 1:1 [4]. Так как 3-й 15-ADON
имеют более высокую токсичность при употреблении с пищевыми продуктами, чем
DON, было предложено анализировать образцы, в которых обнаруживается DON,
на присутствие в их молекулах ацетатных групп.
Общие потери ячменя и пшеницы вследствие фузариоза колоса в США в 1991 —
1996 гг. оцениваются в 3 млрд долларов. Кроме финансовых потерь из-за более низ-
ких урожаев, цена на зерно по причине повреждения урожая понижалась в соответ-
ствии с изменением внешнего вида и присутствием DON (табл. 4.1). В Европе
фузариоз колоса также стал проблемой — особенно в 1980-1990-х гг. в северо-запад-
ной части Германии [162], так как в зернах помимо DON были обнаружены другие
трихотецены 3-ADON, 15-ADON, диацетоксискрипенол (DAS), NIV, HT-2, Т-2 и
фузаренон-Х [162,192,193]. На протяжении 5 лет в урожаях 1987-1992 гг. DON был
выявлен в 71-98% образцов ячменя, предназначенных для потребления (в среднем
42-400 мкг/кг). Отмечено меньшее содержание других трихотеценов (3-ADON —
7-48%, NIV - 11-41%, НТ-2 - 0-9%, токсина Т-2 - 2-29%), а также несвязанного
118
Брайен Флэнниган
эстрогенного токсина зеараленона ZEA (7-68%) [193]. В юго-восточной Польше сре-
ди грибов рода Fusarium доминирует F. sporotrichioides — концентрация его токсина
Т-2 во всех 12 образцах составила 0,02-2,4 мг/кг. НТ-2 был обнаружен в четырех
образцах, а Т-2-тетраол — в двух [215].
Таблица 4.1. Снижение цен на пивоваренный ячмень, содержащий дезоксиниваленол,
в 1994 г. в северной Дакоте
Концентрация DON, ppm
1
1-2,5
2,5-3
>3
Снижение цены (центов на бушель)
5
10
15
50
4.1.3. Микробиота хранения
а) Бактерии, присутствующие в хранящемся ячмене
При условии отсутствия обширной контаминации экскреторными продуктами гры-
зунов, насекомых или клещей бактерии, присутствующие в хранящемся ячмене, явля-
ются более устойчивыми, чем полевые бактерии. В работе [217] отмечается, что в Анг-
лии среди бактерий хранящегося ячменя, предназначенного для солодоращения, было
выявлено 13 таксонов, в основном грамположительные микроорганизмы. К грамполо-
жительным бактериям относятся Aureobacterium flavescens, Bacillus spp., Brevibacterium
linens, Corynebacterium spp.f Clavibacterium iranicum, Microbacterium imperiale и Oerskovia
xanthineolytica, а к фамотрицательным — Erwinia herbicola, Pseudomonas fluorescens
и Chromobacterium sp. Наиболее распространены виды Corynebacterium sp. (18% от об-
щего количества) и Ps. fluorescens (16%). Сообщается, что 1,6-20% жизнеспособных ге-
теротрофных бактерий хранящегося ячменя, предназначенного для солодоращения, от-
носятся к Enterobacteriaceae, а грамотрицательные бактерии включают в себя виды,
типично связанные с растительными тканями (Е. nigrificanst Enterobacter agglomerans
и Serratia odorifera) [208]. Pseudomonas spp., в основном Ps. fluorescens, Ps. cepacia и Ps.pu-
tidat составляют 1,6-3,9% общего числа жизнеспособных бактерий, а молочнокислые
бактерии, включая Leuconostoc mesenteroides, Lactococcus lactis, Lactobacillus coprophilus
и Lb. plantarum, составляют менее 0,01%.
б) Источник грибов, развивающихся при хранении ячменя
Грибы, развивающиеся при хранении ячменя, обнаруживаются не только в зерно-
хранилищах, но и (хотя и очень редко) в зерне еще в поле. В ходе исследований, опи-
санных в [48, 50], поверхность зерен дезинфицировалась так, как это обычно делают
исследователи патологии семян, в результате чего был сделан вывод, что эти грибы
фактически отсутствуют. Когда же посевной материал был высеян на агаровую сре-
ду без предварительной дезинфекции поверхности зерна, некоторое количество зе-
рен содержали пенициллы и аспергиллы. Чаще всего аспергиллы относят к роду
Asp. glaucus, то есть к анаморфам Eurotium spp. [82, 130, 267]. На определенных сре-
дах можно увидеть характерные анаморфные конидиоспоры (безполовое размноже-
ние) и телеоморфные клейстотеции (плодовые тела, половое размножение). Иногда
Глава 4. Микробиота ячменя и солода
119
в поле Eurotium spp. может быть контаминировано до 20% зерен [130], однако зара-
женность свыше 5% встречается очень редко [42]. Во время сбора урожая уровень
контаминации Eurotium не высок, однако при этом происходит сильное контамини-
рование грибами Penicillium spp. В уборочном комбайне количество зерен, контами-
нированных пенициллами, может составлять от 1 до 60% [130]. Источником такого
инфицирования могут быть земля, стебли и листья, перемалывающиеся в барабане
вместе с зерном, а также остатки прежнего урожая на шнеке и в бункере комбайна.
Если поверхность вновь собранного зерна обработать дезинфиктантом, грибами хра-
нения будут обсеменены менее 0,5% зерен [42]. Это подтверждает, что на этой ста-
дии контаминация почти полностью поверхностна, и Eurotium spp. и Penicillium spp.
активно колонизируют лишь небольшое количество зерна.
Несмотря на то что род Eurotium, а именно виды Е. amstelodami, E. chevalieri,
Е. repens и Е. rubrum (ana. Asp. amstelodami, Asp. chevalieri, Asp. repens, и Asp. ruber)
привлекают большое внимание, они не являются единственными аспергиллами,
контаминирующими ячмень в поле, — на зерне могут присутствовать также Asp. candi-
duSy Asp.flavus [130], Asp.fumigatus, Asp. nidulans, Asp. niger, Asp. ochraceus и Asp. ver-
sicolor [82]. Термоустойчивым видом, вызывающим порчу хранящегося во влажных
условиях кормового ячменя, является Asp. fumigatus [48, 83, 155], который широко
распространен в ячмене, готовом к жатве. В зерне присутствуют и другие аналогич-
ные контаминанты (например, Penicillium piceum и Pen. roqueforti) [83]. Виды Реп.
aurantiogriseum и нефротоксичный Pen. verrucosum могут контаминировать зерна яч-
меня на стадии цветения [163]. В работе [184] сделан вывод, что Pen. verrucosum
обычно встречается при жатве зерна, а степень контаминации меняется в зависимо-
сти от времени года и региона. Термочувствительные виды Rhizomucor (Mucor) pusil-
lus, Talaromyces thermophilus (ana. Pen. dupontii) и Thermomyces lanuginosus (Humicola
lanuginosa) могут встречаться уже в поле, в ячмене, готовом к сбору [130].
в) Колонизация грибов после сбора урожая
Содержание влаги в ячмене во время сбора урожая может быть < 10% в сухих рай-
онах Северной Америки и Австралии [169] и до 25-30% в Северной Европе [129].
Зерно с высоким содержанием влаги, предназначенное для хранения, должно быть
высушено до содержания влаги < 14%, а для исключения возможности развития пле-
сени во время хранения — до < 12,5%. Не смотря на то что необходимость сушки
зерна очевидна, зачастую скорость сушки бывает недостаточна по сравнению с тем-
пами сбора урожая. В результате развиваются микроорганизмы и повышается тем-
пература зерна. Один из методов уменьшения количества микроорганизмов и ох-
лаждения зерна является продувка воздуха той же температуры, что и окружающая
среда, сквозь всю массу зерна, то есть слабая вентиляция. Иногда для подсушки зер-
на используют горячий воздух, что отрицательно сказывается на качестве ячменя.
Поскольку возможность осуществить должным образом сушку зерна для дальней-
шего солодоращения имеют не многие фермеры, поставщики зерна и специалисты
по солодоращению предпочитают сушить зерно сами. «Зерно должно быть здоро-
вым, сладким, не горячим и не зараженным (на вид) плесенью и паразитами» [60], но
несмотря на то что производители солода пытаются отстоять свои интересы, от фер-
меров может все же поступать перегретое зерно, охлажденное лишь с помощью ела-
120
Брайен Флэнниган
бой вентиляции. Специалисты совершенно правильно рекомендуют «остерегаться
ячменя, хоть какое-то время до сушки пробывшего на ферме» [89].
Рост полевых грибов на собранном ячмене зависит от содержания в нем влаги:
так, при несвоевременной сушке могут развиваться фузарии. Несвоевременная суш-
ка всегда приводит к развитию грибов хранения. В [195] утверждается, что при хра-
нении зерна на ферме в течение нескольких дней, пока оно не попадет на солодовню,
количество плесеней увеличивается с 3 х 103 до 1,3 х 104 КОЕ на зерно. По сравне-
нию с ячменем, поступившем на солодовенное предприятие сразу же после сбора,
предварительно хранившееся на ферме зерно сильнее контаминировано видами
Eurotium, Penicillium и особенно Absidia, Mucor и Rhizopus. Количество дрожжей мо-
жет увеличиваться с 5 х 103 до 2,2 х 104 клеток на 1 зерно. Обычно при развитии гри-
бов хранения происходит уменьшение количества полевых видов. В [186] обращено
внимание на то, что количество зерен с преобладанием контаминации полевыми гри-
бами (Alt. alternata и Cladosporium spp.) уменьшается так же, как и при контаминации
Eurotium spp. (ana. Asp. glaucus) и Pen. aurantiogriseum (Pen. verrucosum var. cyclopium),
если влажное зерно не было высушено после сбора урожая. В Великобритании было
обнаружено, что невысушенный ячмень, полученный в «горячем» состоянии или
«с запахом», характеризовался пониженным уровнем контаминции полевыми гри-
бами (особенно Cladosporium spp.) и повышенной зараженностью грибами хранения
(особенно Eurotium spp.) [89].
Даже если сушка проводится незамедлительно, количество зерен, контаминиро-
ваных грибами хранения, повышается к тому моменту, когда зерно поступает на хра-
нение. Увеличение уровня контаминации преимущественно связано с перекрестным
загрязнением по мере прохождения технологических операций после сбора урожая
(включая сушку и очистку), однако иногда микроорганизмы могут размножаться
и в течение начальной стадии процесса сушки. В ходе сушки количество зерен, явля-
ющихся носителями миксомицетов, может уменьшаться, а уровень Absidia, Eurotium
и Penicillium — увеличиваться [186]. Если из-за низкого содержания влаги при сборе
урожая нет необходимости в сушке зерна, от уборочного комбайна до элеватора все
равно происходит увеличение уровня контаминации Eurotium spp. [267]. В работе
[42] было обращено внимание на большое количество спор грибов хранения, обычно
присутствующих на элеваторах в пыли и воздухе и контаминирующих вновь посту-
паемое зерно. Простого метода снижения количества этих спор не существует, как
не существует и способов их полного уничтожения, в связи с чем контроль за разви-
тием грибов хранения, способных вызвать порчу высушенного зерна, основан на
поддержании таких условий хранения, которые предотвращали бы их размножение.
г) Амбарные грибы как причина порчи
Несмотря на то что готовый к хранению ячмень контаминируется или колонизи-
руется широким спектром микроорганизмов, при заданных условиях хранения в зер-
не способны развиваться лишь определенные организмы. Содержание влаги в зерне,
конечно, важно, однако большую роль в преобладании определенных микроорганиз-
мов играет и взаимодействие других факторов (температуры, аэрации, повреждения
зерна, наличие соломы и иных инородных материалов, зараженность насекомыми
и клещами).
Глава 4. Микробиота ячменя и солода
121
Что касается ячменя, подвергшегося атмосферным воздействиям, и защищенного
от действия бактерий и грибов, то сельхозпредприятия, специалисты солодовен и по-
ставщики зерна обычно обращают внимание на содержание влаги, а микробиологи —
на активность воды aw% то есть на показатель, влияющий на развитие микроорганиз-
мов. В физиологии и патологии растений принят еще один показатель доступности
воды — так называемый водный потенциал (vj/). Для гигроскопичных или пористых
материалов aw определяют как отношение давления водяного пара в материале к дав-
лению пара чистой воды при тех же температуре и давлении. В численных значениях
aw равен 1/100 равновесной относительной влажности (РОВ). Например, если зерно
хранится в атмосферных условиях при 80% РОВ, его влажностьв конечном счете
сравняется с влажностью окружающей среды, например 0,80. Содержание влаги
в зерне зависит от его химической природы. Богатые липидами зерна характеризуют-
ся более низким содержанием влаги, чем зерна, содержащие много крахмала при той
же aw (например, содержание влаги в арахисе при aw 0,80 будет составлять примерно
9,2%, тогда как в ячмене оно составит 16,6%). Активность воды зерна можно опреде-
лить косвенным методом путем определения ОВ в герметичном контейнере, в кото-
ром содержание влаги в зерне достигает значения равновесия (с помощью измерите-
ля точки росы). Относительная влажность в этой равновесной системе является
равновесной относительной влажностью (РОВ).
Ряд зависимостей между содержанием влаги, дв,, и РОВ ячменя, влияющих на рост
плесеней, приведен в табл. 4.2, где также даны значения vj/, соответствующие aw = 0,6-1,0.
На рис 4.1 показаны зависимости между содержанием влаги и яа, для ячменя и солода.
При aw = 1,0 зерно полностью гидратированно, то есть при наличии других необходимых
условий в нем могут развиваться все бактерии и плесени; при aw = 0,6 не способна разви-
ваться даже плесень, для роста которой необходимо наименьшее количество влаги.
Таблица 4.2. Зависимость между РОВ, аг, ц/ и содержанием влаги в ячмене
РОВ,%
60
70
80
90
95
К
0,6
0,7
0,8
0,9
0,95
vj/, МПа
-69
-47
-30
-14
17
Содержание влаги
(примерно), %
12,3
14,0
16,6
20,3
24,8
Как и aw% vj/ является показателем доступности воды, которая выражается в едини-
цах давления, например в барах (1 бар = 0,987 атм) или мегапаскалях (1 МПа =
=10 бар), и мерой энергии на единицу объема воды. Водный потенциал чистой воды
равен нулю, а так как водопоглощение из водного раствора требует расхода энергии,
растворение с точки зрения потребления является отрицательным. Например, у на-
сыщенного раствора NaCl \\f составляет -40 МПа (aw = 0,75), что оносительно мор-
ской воды (vj/ = -2,8 МПа, av = 0,55) отражает увеличение работы, необходимой для
экстрагирования воды из раствора.
Для тканей растений, использующих фотосинтез, водный потенциал составляет
примерно от -0,5 до -4 МПа [210]. Водный потенциал можно выразить формулой
122
Брайен Флэнниган
4 = -\naJRT/VJ,
где R — газовая постоянная; Т— температура; Vw — молярный объем воды.
Взаимосвязанные параметры aw (или vj/) и температура определяют, будут ли споры
различных микроорганизмов прорастать и с какой скоростью. В табл. 4.3 приведены
пределы температур и минимальные значения aw, при которых способны развиваться
некоторые из основных видов актиномицетов и плесеней, выделенных из хранящего-
ся ячменя (согласно физиологической классификации, приведенной в [157]). Наи-
большей ксерофильностью среди плесеней характеризуется Asp. restrictus: в работе
[131] был зарегистрирован медленный ее рост в ячмене при aw = 0,65-0,70 (v|/ от -60
до -47 МПа). К ксерофилам относится также Wallemia sebi, впервые обнаруженная в
соленой рыбе (в злаках ее обнаружили лишь тогда, когда исследователи стали переме-
шивать агар с низким av так, как обычно его готовят для определения грибов) [230].
W. sebi размножается при aw 0,69 (ц/ = -49 МПа). Eurotium spp.t в отличие от Asp. res-
trictus, не является строгим ксерофилом, но все-таки размножаются в условиях малой
влажности. Большинство других аспергилл, развивающихся при хранении ячменя,
относится к умеренным ксерофилам, а термотолерантные виды Asp. fumigatus (как
и пенициллы) являются слабыми ксерофилами. Как уже отмечалось выше, сушка яч-
меня до содержания влаги в 12% (дг = 0,6, vj/ = -69 МПа) предотвращает рост любых
бактерий. Сушка до 14% (aw = 0,7, ц/ = -47 МПа) достаточна для предотвращения рос-
та почти всех микроорганизмов, за исключением наиболее ксерофильных плесеней,
и делает невозможным размножение полевых грибов, для роста которых минималь-
ное значение дг составляет в среднем 0,90 и выше (ц/ = -14 МПа). Естественно, исклю-
30
се
5
О)
!
с! 10
0,2 0,4 0,6 0,8 1,0
Рис. 4.1. Зависимость между содержанием влаги и аг при 25 °С: в ячмене [221 ] и в солоде [220]
Ячмень
Готовый солод
Глава 4. Микробиота ячменя и солода
123
чается размножение дрожжей (aw для которых имеет минимальное значение порядка
0,88 (v|/ = -17,6 МПа) и бактерий (для большинства из которых минимальная aw со-
ставляет 0,97 (v|/ = -4 МПа)).
Некоторые полевые грибы, включая Fusarium и Cladosporium [281], способны расти
в зерне с высоким уровнем aw, которое хранилось при низких температурах. К таким
грибам, безусловно, относятся психротолерантные пенициллы (предельные температу-
ры роста -10 ... -35 °С), например, Pen. brevicompactum, Pen. chrysogenum, Pen. aurantiogri-
seum (Pen. verrucosum var. q/clopium) и Pen. verrucosum (Pen. verrucosum var. verrucosum).
В процессе жизнедеятельности микроорганизмов образуется вода и выделяется
энергия, в результате чего повышается aw и температура хранящегося зерна, харак-
теризующегося слабой теплопроводностью. Как уже упоминалось выше, рост строго
ксерофильных грибов при aw = 0,65-0,70 (v|/ = -60... - 47 МПа) незначителен, поэто-
му вырабатывается небольшое количество теплоты, которая рассеивается, и темпе-
ратура зерна не поднимается. Выделяя влагу, эти микроорганизмы постепенно под-
нимают уровень влажности зерна, тем самым позволяя развиваться менее
термофильным видам. При росте других видов микроорганизмов накопление тепло-
Таблица 4.3. Физиологическая классификация плесеней хранения и актиномицетов по их
предельным температурам, минимальным значениям aw и ц/ для размножения (по [157])
Низшие Высшие Термотолерантные/ Строго
Категория мезофилы, мезофилы, термофильные, термофильные,
2-37°С 5-50°С 10-57°С 25-70°С
Строго
ксерофильные,
(минимальное
значение aw
для роста < 0,75
(у = -40 МПа))
Умеренные
ксерофилы
(минимальное
значение aw
для роста = 0,75-0,79
(ц/ =-40... -31 МПа))
Слабые ксерофилы
(минимальное
значение aw
для роста = 0,80-0,89
(Ч/ -30 ...-16 МПа))
Asp.versicolor
Penicillium
glabrum
(P.frequentans)
P. rugulosum
P. piceum
Aspergillus
resthctus1
Eurotium spp.'
Asp.candidus
Asp. flavus
Asp. niger
Asp. ochraceus
Asp.terreus Asp. fumigatus
P. capsulatum
P. citrinum
P.funiculosum
Гидрофилы
минимальное
значение aw
для роста = 0,90
(М/ =-14 МПа)
Fusarium spp. Absidia
Mucor hiemalis
M. racemosus
R. stolonifer
S. aureofaciens
S. olivaceus
corymbifera
Rhizopus
arrhizus
Streptomyces
griseus
Rhizomucor pusilius Thermomyces
Thermoascus
crustaceus
S. albus
lanuginosus
P. dupontii
Saccharopolyspora
(Faenia)
rectivirgula
Thermoactinomyces
vulgaris
'2-504:.
124
Брайен Флэнниган
ты обеспечивает быстрый рост термофильных видов (температура зерна может дос-
тигать 65 °С и выше).
В ходе экспериментов с зерном в условиях хранения было установлено, что через
9-12 мес. рост Asp. restrictus в ячмене при aw = 0,65-0,70 (v|/ = -60... -47 МПа) позво-
лил развиться виду Eurotium spp. (группа Asp. glaucus) при aw = 0,75 (v|/ = -40 МПа,
содержание влаги >14,4%) с ускорением порчи зерна (по оценке процента прораста-
ния) [131]. Эта группа микроорганизмов продолжала развиваться при увеличении
значения ак до тех пор, пока не было достигнуто максимального aw, составившего
0,90-0,93 (vj/ = -14 ... -10 МПа, содержание влаги 20,0-22,3%), хотя эти микроорга-
низмы уже не были доминирующими. При aw более 0,85 (1/2 = -22 МПа, содержа-
ние влаги - 17,2%) происходит самопроизвольное нагревание, в результате чего
в количественном отношении начинают преобладать виды Pen. aurantiogriseum {Pen.
verrucosum var. cyclopium) и Asp. candidus. При aw = 0,90-0,95 (v|/ = -14 ... -7 МПа,
содержание влаги 20,0-25,3%), температура достигает 50 °С, и, как следствие, преоб-
ладают Pen. funiculosum, Pen. capsulatum, Asp. flavus, Asp. nidulans и стрептомицеты.
Вместе с респираторным патогеном Asp.fumigatus увеличивается количество микро-
организмов видов Absidia corymbifera, но лишь при достижении максимального aw
в 0,95 (\|/ = -7 МПа), когда температура повышается до 65 °С, в зерне присутствуют
в больших количествах термофильные организмы. К ним относятся бактерии
Thermoactinomyces vulgaris и Micropolyspora faeni (которые вызывают легочные забо-
левания у работников сельхозпредприятий) и грибы — такие, как Rhizomucorpusillus
и Thermomyces lanuginosus.
Хотя размножение микроорганизмов, достигающее своего пика с массовым рос-
том термофильных микроорганизмов, обычно ассоциируется с неправильным режи-
мом хранения кормового ячменя [48, 50, 51,155], высокая температура в сухом хра-
нящемся зерне может достигаться и при развитии так называемых «горячих зон»,
наличие которых связано с очагами инфекции. Зимой в Канаде в подобных «горячих
зонах» были зафиксированы температуры зерна в пределах 53 °С [275], а в мае была
отмечена «горячая зона» с температурой 64 °С [253]. В последнем случае причиной
нагрева стало, по всей вероятности, развитие видов Pen. aurantiogriseum {Pen. ver-
rucosum var. cyclopium) и Pen. funiculosum зимой при температуре -5... 8 °С. По мере
роста температуры начинают развиваться также Asp. flavus, Asp. versicolor, Absidia
spp. и Septomyces spp. В других горячих зонах, помимо Asp. flavus и Asp. versicolor,
были выделены Asp.fumigatus [275]. Поскольку в лабораторных экспериментах было
установлено, что менее чем за одну неделю Asp. flavus и Asp.fumigatus способны по-
высить температуру ячменя, овса или пшеницы до 26 °С, то, по всей видимости, эти
аспергиллы играют важную роль в ускорении развития горячих зон.
Было также обнаружено, что после достижения максимальной температуры тем-
пература в «горячих зонах» примерно за три недели снижается до температуры ок-
ружающей среды и более не повышается [253]. Можно предположить, что снижение
температуры происходит из-за замедления развития микроорганизмов, причина
которого заключается во взаимодействии повышения температуры и сушки зерна.
В той же работе было показано, что содержание влаги в центре «горячей зоны» за
четыре недели снижается с максимальных 20,0-23,5% до 16,0-18,9%, а размер этого
центра при содержании влаги более 16,0% между 2-й и 4-й неделями уменьшается
Глава 4. Микробиота ячменя и солода
125
вдвое. Развитие микроорганизмов в пределах «горячей зоны» может приостановить-
ся, но оставшиеся споры при их попадании в организм человека при вдыхании могут
представлять опасность [156]. Грибы хранения выживают в виде спор [253], а поле-
вые грибы — нет, хотя в течение нескольких лет и присутствуют в небольшом коли-
честве в сухом хранящемся зерне [172].
Развитие крупного очага инфекции может начинаться с роста плесеней в очень
маленьком объеме влажного зерна. При этом влага мигрирует в другие слои зерна,
что способствует дальнейшему размножению грибов и образованию «горячих зон».
Существуют несколько причин появления очагов зерна с более высокой по сравне-
нию с остальной частью влажностью, где возможно развитие плесеней. Во-первых,
зерно могло быть не высушено до безопасного уровня. Результаты измерений содер-
жания влаги являются средними значениями — партии зерна не одинаковы, и одно
зерно может отличаться по влажности от другого. Может оказаться так, что в партии
зерна, подвергшегося сушке на основе данных о средней влажности и собранного
днем, были зерна, оставшиеся от вечернего сбора, и, следовательно, с более высоким
содержанием влаги. Может быть также, что часть зерна после сушки не была долж-
ным образом охлаждена и охлаждалась в бункере или силосе, в результате чего на
поверхности зерен образовался конденсат. Влага, достаточная для развития плесе-
ни, может появиться на поверхности зерна и в результате ежедневных процессов ис-
парения/конденсации, вызванных действием солнечных лучей на поверхность бун-
кера хранения. Кроме того, при сооружении бункера хранения или силоса могли
быть допущены просчеты, и в результате в зерно может проникать влага.
Зачастую существует связь между грибами порчи и присутствием клещей и насе-
комых [134, 252]. Если насекомые присутствуют в больших количествах, они могут
увеличить влажность зерна и этим инициировать образование «горячих зон». Кле-
щи и насекомые, включая зернового долгоносика, могут питаться плесенью и явля-
ются ее переносчиками (при миграции они переносят споры плесени на своих те-
лах). При инвазии насекомых температура в горячих пятнах может достигать 39 °С
(взрослые насекомые движутся по направлению вверх [136]). По этой причине
влажность также увеличивается по направлению вверх, и ячмень, расположенный
в верхней части всего объема, приобретает влажность, достаточную для прорастания
и обильного роста плесеней.
Какой бы ни была причина развития грибов хранения, при увеличении температу-
ры резко падает способность зерна к прорастанию [131,168, 253]. Было установлено,
что если содержание влаги в ячмене составляет 15-18% и более, даже при отсутствии
самонагрева при хранении способность к прорастанию зерна уменьшается, и проис-
ходит ассоциированное с этим накопление ксерофильных плесеней, особенно Euro-
tium spp. [12,97, 266]. Исходя из многочисленных экспериментов (см. [41-43]), в ко-
торых зерно было обильно обсеменено Eurotium spp. (группа Asp. glaucus), был сделан
вывод, что грибы хранения непосредственно ответственны за уменьшение способно-
сти зерна к прорастанию. Бесспорно, что в подобных эксперементах и во многих дру-
гих случаях, где наблюдалось уменьшение способности к прорастанию, имело место
развитие Eurotium spp. из зародыша и внешних слоев зерна при условии его термоста-
тирования во влажной камере. Тем не менее в [126] были отмечены различные нега-
тивные изменения эндогенного происхождения с увеличением грибного внедрения,
126
Брайен Флэнниган
и сделан вывод, что хотя количество Eurotium repens (Asp. repens), Pen. aurantiogriseum
(Pen. cyclopium), а при высоких уровнях влажности и Fusarium culmorum увеличивает-
ся, они не являются непосредственными причинами порчи.
Было также обращено внимание на свойства зародышей, которые обусловливают
их колонизацию грибами [86]. В зародыше и алейроновом слое содержится большое
количество липидов и растворимых в этиловом спирте Сахаров и олигосахаридов,
в том числе сахароза, раффиноза и фруктозаны. Как показали экспериментальные
работы, Eurotium amstelodami, E. chevalieri, E. repens и Е. rubrum (Asp. amstelodami, Asp.
chevalieri, Asp repens и Asp. sejunctus) обладают липолитической активностью и могут
утилизировать сахарозу и раффинозу как единственный источник углерода, но име-
ют слабую амилолитическую активность, либо ее не имеют вообще. Развитию плесе-
ней способствует не только легкодоступный ассимилируемый источник углерода, но
и более высокое по сравнению с эндоспермом содержание влаги в зародыше, которую
он поглощает из атмосферы. В правильно высушенном зерне содержание влаги в за-
родыше почти такое же, как и у всего зерна, а при нарушении условий хранения зерна
содержание влаги в зародыше будет выше. Увеличение содержания влаги в зародыше
теоретически делает его более восприимчивым к инфицированию грибами хранения,
однако для этого необходимо, чтобы зародыш до определенной степени ослаб.
д) Нефротоксигенные пенициллы
Выше мы упоминали Pen. aurantiogriseum как вид, активно размножающийся в мас-
се невысушенного зерна после влажной жатвы в провинции Манитоба [ 186]. В более
поздних исследованиях было отмечено присутствие морфологически сходных видов
в пшенице, ячмене и других злаках, хранящихся на фермах в канадских провинциях
Манитоба, Саскачеван и Алберта [187]. Эти виды, в которых конидиофора (кистеоб-
разные пенициллы) имеет двухступенчатые ответвления, продуцируют микотокси-
ны, связанные с нефропатией свиней, питающихся контаминированным ячменем
(например, в Дании) [153]. Было обнаружено, что 102 из 142 изолятов, выделенных
в Канаде, продуцировали микотоксины, из них 61 относились к Pen. aurantiogriseum,
21 — к Pen. freii, 6 — к Pen. tricolor, 4 — к Pen. verrucosum, и 4 — к Pen. viridicatum. Эти
числовые соотношения нефротоксигенных пенициллов справедливы для Западной
Канады и отличаются от подобных показателей в Дании, где преобладают Pen. verru-
cosum, Pen. cyclopium, Pen.freii и (в меньшей степени) Pen. aurantiogriseum, Pen. poloni-
cum и Pen. viridicatum.
Наиболее мощный из нефротоксичных микотоксинов, охратоксин А (ОА), проду-
цируется видом Pen. verrucosum, который выделяет еще один нефротоксин — цитри-
нин. Последний также продуцируется видом Pen. citrinin, обнаруженным в злаках, но
не присутствующим у Pen. aurantiogriseum, которые характеризуются скорее односту-
пенчатым разветвлением, а не двухступенчатыми конидиоформами. ОА и цитринин
время от времени встречаются совместно в пшенице и особенно в ячмене в Северной
Америке [290], Дании [153], Великобритании [249] и других местах [290]. Реп.
aurantiogriseum и Pen. polonicum продуцируют ряд нефротоксичных гликопептидных
метаболитов, a Pen. cyclopium, Pen. freii, Pen. tricolor, и Pen. viridicatum продуцируют
нафтаквиноны, включая ксантомегнин и виомеллеин [99], которые в образцах зерна
могут дополнять ОА и цитринин [249], а также карциноген и стеригматоцистин, про-
Глава 4. Микробиота ячменя и солода
127
дуцируемые главным образом видом Asp. versicolor [36, 249]. В Канаде было обнару-
жено, что в ячмене, хранящемся при содержании влаги 20%, О А образуется по проше-
ствии 6 нед., а стеригматоцистин — после 20 нед., тогда как при содержании влаги 16%
стеригматоцистин был определен лишь после 62 нед., а ОА полностью отсутствовал
[2]. Позднее, когда очищенный ячмень (cv. Condor), выросший в данной местности,
хранили при содержании влаги 19%, было обнаружено, что после 20 нед. хранения
преобладали пенициллы и Asp. versicolor, a OA, цитринин и стеригматоцистин при-
сутствовали в концентрациях 24, 38 и 411 мкг/кг зерна соответственно [5]. Из более
ранних экспериментов известно, что в этом же ячмене при хранении с содержанием
влаги 15% на протяжении того же времени микотоксинов обнаружено не было. Из
табл. 4.2 и 4.3 можно видеть, что меньшие уровни влажности позволяют развиваться
умеренным ксерофилам (таким, как Asp. versicolor), но не пенициллам, являющимся
слабыми ксерофилами.
4.2. Микробиота солода
4.2.1. Микробиота в ходе солодоращения
Во время замачивания зерна микроорганизмы, находящиеся в состоянии покоя,
активизируются: споры плесени прорастают, а дрожжи и бактерии начинают раз-
множаться. В лабораторных исследованиях количество бактерий во время замачи-
вания увеличивалось в 5-36 раз [91,97,152], а количество дрожжей в темном и под-
вергшемся атмосферному воздействию ячмене — в 1,1 раза, в здоровом — в 5 раз
[152], а в финском ячмене — в 200 раз [121]. На производстве при солодоращении
было обнаружено, что при прерывании замачивания воздушными паузами к концу
первого этапа замачивания количество бактерий в зернах увеличивается в 4-25 раз,
а к моменту прорастания зерна — в 35-150 раз [67]. Вместе с тем при том же режиме
солодоращения в разные годы количество гетеротрофных бактерий в зерне во время
первого этапа замачивания падает (табл. 4.4), а к концу второго этапа повышается
в 4 раза [217]. Разнообразие бактерий в ячмене при первом этапе замачивания не так
широко, как в сухом ячмене — это Aur.flavescens, Alcaligenes sp., Clav. iranicum и Clav.
michiganense, Flavobacterium esteroaromaticum, M. imperiale, Erw. herbicola, Ps. fluore-
scein и Ps. putida. К концу второго этапа замачивания разнообразие микроорганиз-
мов увеличивается в основном за счет грамположительных бактерий. В значитель-
ной степени увеличивается количество лактобацилл (приблизительно в 400 раз,
см. табл. 4.4), что гораздо выше, чем у остальных бактерий [217]. Исходя из более
ранних оценок [250], количество мезофильных молочнокислых бактерий во время
замачивания увеличивается с 0-Ю2до > 5 х 105 КОЕ/г, тогда как общее количество
аэробных бактерий увеличивается всего лишь с 106/г до 7 х 106/г.
Согласно более современным данным [208], на крупной пневматической солодовне
при 48-часовом замачивании, включающем две воздушные паузы по 8 ч каждая, про-
исходит 2000-кратное увеличение числа гетеротрофных бактерий— до 1,3 х 109/г.
Более всего возрастает число молочнокислых бактерий (с 40 КОЕ/г до замачивания
до 1 х 108Д после замачивания) с преобладанием видов Leuc. lactis и Leuc. mesenteroides
и присутствием Lb. paracasei, Lb. plantarum и Enterococcus faecalis. Несмотря на то что
количество псевдомонад увеличивается примерно в 29 000 раз (до 3,6 х 108/г), количе-
ство Enterobacteriaceae возрастает лишь в 23 раза (до Зх 107/г). Общее количество
128
Брайен Флэнниган
Таблица 4.4. Количество жизнеспособных микроорганизмов (г) в зерне во время коммерческого
производства сульфитированного солода (по [217])
Аэробные
Стадия гетеротрофные
бактерии
Хранящийся ячмень
Первый этап замачивания
Второй этап замачивания
Зеленый солод (5 дней)
Высушеный солод
Отсортированный солод
1,8 хЮ6
6,7x105
6,6x106
5,7x107
5,6x106
5,5x106
Лактобациллы
2,0x102
4,2 хЮ3
7,8x104
8,7x106
1,6 хЮ5
5,7х 10*
Плесени
2,0x102
8,0x102
1.7Х103
1,5 хЮ2
2,0x102
8,3x102
Дрожжи
4.7Х103
4,6x105
1,1 хЮ6
3,9x106
3,2x104
1,8 хЮ4
жизнеспособных бактерий в сливаемой после замачивания воде при таком солодораще-
нии составило 1,2 х КР/мл, псевдомонад — 6 х 106/мл, Enterobacteriaceae — 1,3 х 108/мл,
а молочнокислых бактерий — 5,1 х 107/мл. В [208] отмечается возможность того,
что оставшаяся на дне замочного чана вода способна инокулировать вновь поступив-
ший ячмень и вызвать резкий всплеск развития микроорганизмов при замачивании.
На небольшой токовой солодовне после замачивания в течение 48 ч количество
Enterobacteriaceae в ячмене оказалось примерно тем же, что и на крупной пневматиче-
ской солодовне, однако общее количество всех гетеротрофных аэробов, псевдомонад
и молочнокислых бактерий было на порядок или два ниже [208].
При замачивании увеличивается и количество дрожжей. Так, утверждается, что по
отношению к сухому ячменю количество дрожжей увеличивается к концу первого эта-
па замачивания в 3-20 раз, а к концу второго — в 5-1300 раз [67]. При оценке КОЕ
в сухом и замоченном ячмене оказалось, что после первого этапа замачивания количе-
ство дрожжей (4,7 х 103 КОЕ в сухом зерне) увеличилось в 100 раз, а после второго —
более чем в 230 раз (табл. 4.4) [208]. Для сравнения: после соответствующих процессов
количество мицелиальных грибов увеличилось с исходных 2 х 102 КОЕ в сухом зерне
в 4 и 8 раз.
Кроме развития плесеней, находящихся при хранении в состоянии покоя, во время
замачивания происходит смывание находящихся на поверхноси зерна контаминан-
тов [127, 208], например, таких плесеней, как Aureobasidium, Cladosporium, Mucor и
Penicillium [127]. При солодоращении небольшого количества зерна в микросолодов-
не происходит увеличение содержания Fusarium spp. на 15-90% [121], хотя ранее от-
мечалось, что при замачивании происходит снижение инфицирования Cladosporium
spp. от 47 до 3% [97]. Конечно, причиной увеличения количества микроорганизмов
может стать и рост мицелия, который переходит с одного зерна на другое, однако что-
бы вызвать перекрестную контаминацию, эта причина кажется маловероятной [121].
Отмечается, что увеличение количества контаминированных Fusarium spp. зерен
к концу первого этапа замачивания на некоторых промышленных солодовнях может
служить индикатором быстрого увеличения общего количества микроорганизмов
[67]. В [127] отмечается, что во время замачивания усиливается контаминация
F. avenaceum u F. culmorum, а также обнаруживаются jF. poae и другие фузарии, котрые
отсутствовали (или присутствовали лишь в небольшом количестве зерен) в сухом
Глава 4. Микробиота ячменя и солода
129
ячмене. Был отмечен рост Aureobasidium pullulans и Cladosporium spp. как в количе-
ственном, так и в относительном (в %) составе [68]. Дрожжеподобные виды, как
и Trichosporon beigelii (Т. cutaneum), редко встречаются в сухом ячмене [216], а на за-
моченном зерне было обнаружено большое количество Geotrichum candidum [127].
Несмотря на то что в [ 121] говорится об увеличении процентного содержания наибо-
лее распространенного полевого гриба Alt. alternata, основываясь на лабораторном за-
мачивании, можно отметить уменьшение его количества во время замачивания при
солодоращении на крупном солодовенном предприятии. В некоторых случаях про-
исходит небольшое изменение, а в других — сокращение процента зерен, содержащих
Alt. alternata, даже если общий количественный показатель указывает на рост общего
количества инокулята этого микроорганизма [67]. Отмечается увеличение процента
зерен с содержанием аспергиллов и пенициллов [116,121], и в [116] сделан вывод, что
при замачивании может происходить как увеличение, так и уменьшение количества
представителей этих двух родов микроорганизмов.
И в лабораторных, и в промышленных условиях солодоращения количество бак-
терий и дрожжей на зеленом солоде неизменно выше, чем в сухом ячмене. Несмотря
на то что в [97] указываются меньшие цифры, в [121] утверждается, что количество
бактерий в проросшем ячмене увеличивается в 400 раз относительно сухого ячменя,
а дрожжей — в 100 раз (исходя из лабораторных исследований, говорят об увеличе-
нии в 4300 и 79 раз соответственно [152 ]). Указывается, что максимальное количе-
ство бактерий на зеленом солоде было отмечено через 5 сут [250]. При содержании
бактерий 7 х 108Д среднее количество КОЕ оказалось в 700 раз больше, чем в исход-
ном ячмене. Количество мезофильных молочнокислых бактерий увеличилось па-
раллельно с общим количеством, однако оказалось на 2% меньше. При солодораще-
нии в ящиках отмечается также увеличение числа бактерий в зеленом солоде по
сравнению с сухим ячменем в 85-440 раз, а для дрожжей этот показатель увеличил-
ся в 40-1800 раз [67]. Соответствующий рост (см. табл. 4.4) отмечался наряду с уве-
личением количества и видов выделенных грамотрицательных бактерий [217]. До-
минирующим видом оказался Flav. esteroaromaticum (26% от общего количества);
также было отмечено присутствие Erw. herbicola, Ps. fluoresceins, Ps. putida и Serratia
plymuthica. По сравнению с моментом завершения второго этапа замачивания про-
изошло 110-кратное увеличение лактобацилл, причем было зарегистрировано при-
сутствие Lb. alimentarius и Lb. plantarum.
Несмотря на данные о том, что количество бактерий достигает своего максимума
при проращивании ячменя, при исследовании современной пневматической соло-
довни было обнаружено, что количество бактерий к концу замачивания немного
больше, чем после проращивания в течение 3 сут (табл. 4.4). К концу проращивания
(через 5 сут) происходит дальнейшее уменьшение КОЕ, в частности, общее количе-
ство бактерий, энтеробактерий и молочнокислых бактерий составило соответствен-
но 33, 55, и 65% от их числа после замачивания, а количество псевдомонад незначи-
тельно уменьшилось (92%). Применительно к высушенному ячменю эти изменения
отражают общую тенденцию роста — для гетеротрофных бактерий примерно в 670,
для Pseudomonas spp. в 2600, а для Enterobacteriaceae в 127 раз. На этом этапе количе-
ство КОЕ молочнокислых бактерий в ячмене составило 6,5 х 107Д (в исходном яч-
мене — 40/г). Среди Enterobacteriaceae во время проращивания преобладает вид
130
Брайен Флэнниган
Klebsiella pneumoniae, присутствуют также Rahnella aquitilis, Citrobacter freundii,
Enterobacter aerogenes и 5. plymuthica. Несмотря на то что Ps. putida после замачива-
ния были доминирующими псевдомонадами, в ходе проращивания количественно
стал преобладать вид Ps. chlororaphis. При токовом солодоращении было определено,
что после проращивания в течение 5 сут количество всех бактерий, псевдомонад
и энтеробактерий оказалось таким же или немного меньшим, чем в конце 48-часово-
го замачивания, и относительно ячменя их увеличение составило в 75, 40 и 90 раз
соответственно. Тем не менее количество КОЕ молочнокислых бактерий во время
этапа проращивания увеличилось в 57 раз (в сравнении с исходным значением 80/г),
достигнув значения 5,1 х 107 КОЕ/г. В этом цикле солодоращения среди грамотри-
цательных бактерий были обнаружены представители таких родов, как Chromobacter,
Enterobacter, Klebsiella, Pseudomonas, Rahnella и Serratia. Основными представителя-
ми рода Pseudomonas spp. были Ps. fluorescens, Ps. cholororaphis и Ps. aureofaciens. Не-
смотря на то что во время замачивания доминирующим видом был Leuconostoc,
в зеленом солоде среди молочнокислых бактерий стал преобладать Lb. plantarum
(70%).
Необходимо подчеркнуть, что несмотря на неизменный рост общего количества
бактерий и дрожжей в ходе проращивания, при различных способах солодоращения
соотношения между их ростом могут быть различными [91]. Увеличение числа бак-
терий в конце и середине этапа проращивания пропорционально выше в токовых
солодовнях, чем в ящичных солодовнях Саладина, а в емкостях для проращивания
изменений нет или почти нет. Соответствующее увеличение количества дрожжей,
тем не менее, в ящичных солодовнях выше, чем в токовых, однако в емкостях для
проращивания увеличение гораздо меньше.
При лабораторном солодоращении было обнаружено, что при проращивании здо-
рового ячменя изменений в количестве жизнеспособных плесеней не происходит
[152], хотя в сухом (темном и подверженным атмосферному влиянию) ячмене на-
блюдается четырехкратный рост их присутствия. По данным [97], в некоторых слу-
чаях наблюдался примерно шестикратный рост недостаточно высушенного ячменя;
в других же случаях изменений вообще не наблюдалось или они были незначитель-
ными. В работе [91] также отмечен шестикратный рост плесеней во время проращи-
вания, однако в токовой солодовне наблюдался 13-кратный рост, а в некоторых
ящичных солодовнях Саладина и емкостях для проращивания рост числа плесеней
составлял 20-70% и 60-90% соответственно. Иногда в зеленом солоде, прорастав-
шем в ящищных солодовнях Саладина, отмечалось меньшее количество плесеней,
чем в исходном ячмене; также было обнаружено, что во время одного из циклов со-
лодоращения И-кратный рост плесеней произошел в результате развития Fusatium
spp. [67].
Таким образом, опираясь на литературные данные, довольно трудно построить об-
щую модель развития плесеней. При проращивании в присутствии Fusaiium spp. на
90% зерен наибольший рост плесеней после замачивания наблюдался в зернах, явля-
ющихся носителями Penicillium spp. (от 30 до 77%) [121]. Меньший рост плесеней
отмечался в зернах, контаминированиых Mucor, Eurotium (Asp. glaucus), Alt. alternata
и Rhizopus (в убывающем порядке). При солодоращении в промышленных условиях
наибольший рост в процентном соотношении наблюдался в зернах, инфицирован-
Глава 4. Микробиота ячменя и солода
131
ных Penicillium spp., затем Pyrenophora teres (Н. teres) и Alt. alternate [116]. Согласно
[67], в ходе проращивания наибольший рост наблюдался у Geotrichum candidum
и Mucor spp., а в одном случае — Alt. alternata. По данным [6], подтверждается, что
к концу проращивания уровень контаминации G. candidum и Мисог очень высок.
Анализ на пластинке и посев при помощи разведения показали, что уровень конта-
минации ксерофильными аспергиллами и пенициллами при производстве солода
в ящичных солодовнях Саладина может уменьшаться [67,68]. Уменьшение количе-
ства ксерофильных грибов было отмечено и в других солодовнях [127], но микроби-
ота зеленого солода может развиваться более интенсивно в условии повышенного
уровня содержании влаги в исходном ячмене [259]. Кроме того, рост таких видов,
как Eurotium amstelodami (Asp. amstelodami) и Asp.fumigatus может наблюдаться при
чрезмерно высокой температуре на грядке зеленого солода [115,116]. Ниже мы уви-
дим, что повышенная температура благоприятна для роста грибов, вызывающих рес-
пираторные заболевания у работников солодовен (Asp. clavatus) [92, 228].
Несмотря на то что уровень полевых грибов, таких как Cladosporium, Epicoccum,
а иногда и Alte?na?ia во время производства солода в ящичных солодовнях Саладина
может уменьшаться [92], в производственных условиях может наблюдаться также
рост Cladosporium, Alternaria и Fusarium [127]. Утверждается, что наблюдаемая при
солодоращении в Южной Африке тенденция [6] схожа с тенденцией, наблюдаемой
в Великобритании [68]. Тем не менее наибольшее развитие контаминации Fusarium
происходит к концу замачивания и при дальнейшем проращивании их количество
не увеличивается [6]. Указывается также, что при производстве зеленого солода для
определения степени колонизации других зерен необходимо знать первоначальный
уровень контаминации сухого ячменя.
Перед тем как приступить к рассмотрению вопроса о влиянии сушки на микробио-
ту зеленого солода, необходимо упомянуть о возможном влиянии повторного приме-
нения замочной воды на рост микроорганизмов. Тот факт, что использованная для
замачивания вода содержит 1,2 х 109 клеток аэробных бактерий/мл и 5,7 х 104 КОЕ
грибов/мл [208], говорит в пользу применения для каждого этапа замачивания све-
жей воды. В той же работе указывается, что даже вода, остающаяся на дне замочного
чана, может контаминировать вновь поступающее зерно. Вместе с тем из-за большого
расхода воды все-таки возможно сохранение замочной воды с последнего этапа зама-
чивания и использование ее для замачивания следующей партии ячменя на этапе пер-
вого замачивания. В [ИЗ, 114] отмечается, что подобное повторное использование
воды может иметь и положительный эффект. После первого этапа замачивания уже
использовавшейся замочной водой усиливается контаминация плесенью, и домини-
рующие в ячмене виды Aureobasidium pullulans и G. candidum ингибируют развитие
аспергиллов, пенициллов и фузарий. Из-за повторного использования воды для за-
мачивания увеличивается количество других присутствующих в ячмене микроорга-
низмов, однако бесспорен факт, что причиной ингибирования выше перечисленных
трех категорий плесеней являются виды Aureobasidium и Geotrichum. Существуют
основанные на лабораторных и промышленных экспериментах данные, что добавле-
ние конкретного штамма G. candidum в воду, используемую для замачивания ячменя,
искуственно инокулированного фузариями, ингибирует развитие дрожжей, фузарий
и других нежелательных мицелиальных грибов, и в то же время стимулирует рост
132
Брайен Флэнниган
молочнокислых бактерий [24, 25]. В промышленных условиях количество зерен со-
лода, контаминированных Fusarium, DON и ZEA, было меньше, чем в контрольных
образцах [25].
Известно, что замочная вода может содержать 5,1 х 107 молочнокислых бактерий/мл
[208]. Было показано, что добавление различных видов Lactobacillus и Pediococcus
может привести к уменьшению инфицирования зеленого солода фузариями и три-
хотеценом DCW[120, 122, 262]. В этих работах в качестве контрольных агентов ис-
пользовались Lb.plantarum, Lb. acidophilus и Pediococcuspentosaceus, а в работе [207]
исследовались разные виды микроорганизмов на их способность контролировать
негативные свойства грамотрицательных бактерий.
На количество бактерий в солоде существенное влияние оказывает сушка. Было
определено, что число бактерий на зеленом солоде по сравнению с ячменем до зама-
чивания уменьшилось приблизительно до 63% от количества КОЕ перед замачива-
нием и примерно в 8 раз — по сравнению с их количеством в исходном ячмене [97].
Было также зарегистрировано уменьшение КОЕ на 95%, хотя в незамеченном ячмене
количество КОЕ по-прежнему было в 20 раз больше [121]. Вместе с тем уменьшения
количества дрожжей не произошло — их количество по сравнению с ячменем было
в 100 раз больше. В противоположность последнему наблюдению, в работе [97] было
отмечено сокращение количества дрожжей в 6-27 раз. При исследовании двух сис-
тем солодоращения было обнаружено, что наибольшая степень сокращения количе-
ства микроорганизмов наблюдалась в традиционной токовой солодовне при сушке,
основанной на сжигании антрацита (по сравнению с газовой сушкой на современной
пневматической солодовне, см. табл. 4.5) [208]. В последнем случае процент уничто-
женных при сушке бактерий на зеленом солоде составлял от 92% (для Entero-
bacteriaceae и аэробных бактерий) до 99,95% (для псевдомонад), тогда как в первом
случае этот показатель для всех пяти категорий был > 99,8%. Как показано в табл. 4.5,
при сушке солод содержит большее количество всех видов бактерий, грибов, плесе-
ней и дрожжей по сравнению с исходным несоложеным ячменем. Для сравнения,
в солоде, высушенном в сушилке, работающей на антраците, общее количество аэроб-
ных и грамотрицательных бактерий составило на 82-92% меньше, чем в исходном
ячмене. Значительно выше, чем в ячмене до соложения, оказалось только содержание
молочнокислых бактерий (Lb. brevis, Lb. buchneri, Lb.fermentum и Lb. plantarum).
В ящичных солодовнях Саладина в ходе солодоращения было зарегистрировано
присутствие 15 видов восьми родов дрожжей (в большинстве случаев— Candida,
Cryptococcus, Debaryomyces, Pichia и Rhodotorula), и в работе [127] был сделан вывод,
что в результате сушки первоначальные уровни уменьшились на 10%. В другой си-
стеме солодоращения, где одна емкость использовалась для подсушивания зерна, его
замачивания, прорастания и сушки солода («все в одной грядке»), было выделено
22 вида дрожжей (включая Kluyveromyces, не выделенных в ящичной солодовне Са-
ладина). Общее количество дрожжей в этом случае было в 2,5 раза больше, чем в не-
соложеном ячмене, и примерно вдвое меньше, чем в солоде, прошедшем сушку раз-
личной продолжительности.
В работе [217] было выделено лишь 8 видов, причем в зеленом солоде доминиро-
вали Candida catenulata и Debaryomyces hansenii, а в солоде после триера — виды
С. catenulata и Rhodotorula mucilaginosa.
Глава 4. Микробиота ячменя и солода
133
Таблица 4.5. Сравнение воздействия различных типов сушки на популяции бактерий и грибов
в сушеном солоде (по сравнению с зеленым солодом и несоложеным ячменем)
Тип сушки Разница Все аэробные Псевдо- Энтеро- Молочно- Грибы
в КОЕ бактерии монады бактерии кислые (дрожжи
между бактерии и плесени)
Высушенным -92% -99,95% -92% -99,6% -98,4%
и зеленым
солодом
Высушенным х54 х13 хЮ >х6000 >х400
солодом
и ячменем
Высушенным -99,8% -99,8% -99,8% -99,8% -99,6%
и зеленым
солодом
Высушенным -82% -92% -90% хЮОО х1,3
солодом
и ячменем
Сульфитирование, осуществляемое при сушке светлого солода, приводит к умень-
шению количества бактерий [108]. Количество бактерий в готовом солоде примерно
совпадает с их количеством в исходном ячмене [250]. Когда в Великобритании в су-
шилках в качестве топлива вместо угля стали применять природный газ и сульфити-
рование, в результате чего в высушенном солоде повысилось содержание аминного
азота, было обнаружено, что уровень контаминации бактериями при сульфитирова-
нии солода понизился [83]. Отмечается, что в сульфитированном солоде количество
бактерий по сравнению с ячменем больше лишь в 0,5-2 раза [67]. Позже в работе
[217] было зарегистрировано сокращение количества бактерий более чем на поря-
док (как для аэробных гетеротрофных, так и для молочнокислых бактерий). На вы-
сушенном солоде преобладают грамположительные бактерии, а именно Clavibacter
iranicum, Flav. esteroaromaticum, Arthrobacter globiformis, а среди молочнокислых —
Lb. alimentarius. В лабораторных условиях было обнаружено, что сульфитирование
также влияет на количество дрожжей [83], а в промышленных условиях количество
дрожжей уменьшается до уровня, меньшего (на 1-20%), чем у ячменя [67]. Тем не
менее более поздние данные [217] свидетельствуют о шестикратном увеличении ко-
личества дрожжей по сравнению с ячменем (см. табл. 4.4). Причина того, что сушил-
ка на антраците уничтожает большее количество микроорганизмов, чем газовая, зак-
лючается в большем сульфитировании солода или в различии температурных
режимов (роль других факторов не ясна) [208].
Отмечается, что в целом сушка приводит к уменьшению количества плесеней на
проросшем зерне (окончательное количество составило 63-170% от исходного), а
в солоде, произведенном из ячменя, подвергшегося после сушки атмосферному воз-
действию, количество плесеней по сравнению с исходным возросло в 5-7 раз [97].
Поскольку процент контаминированного зерна зависит от видов плесеней, был сде-
лан вывод, что после сушки наблюдается значительное увеличение уровня конта-
минации Mucor spp. и Rhizopus spp, менее сильное — Penicillium spp., Eurotium spp.
(группа Asp. glaucus) и наименьшее — Cladosporium spp. [121]. Изменений в количе-
Газовые
сушилки
Сушилки,
обогреваемые
антрацитом
134
Брайен Флэнниган
стве Alt. alternate и Fusarium spp. не наблюдается. В [6] было показано, что в резуль-
тате сушки в большинстве случаев уровень контаминации плесенями уменьшился,
хотя сокращение количества G. candidum, Mucorw Rhizopus оказалось меньшим, чем
для других типов плесеней. При сушке процент зерен, контаминированных Clado-
sporium, достиг уровня, первоначально отмеченного при сборе урожая. Ранее отме-
чалось увеличение количества Cladosporium spp. после сушки при солодоращении
в течение суток, а также рост Rhizopus spp. и болезнетворных респираторных Asp.fumi-
gatus [116].
Как и у бактерий, сушка с сульфитированием обеспечивает существенное умень-
шение количества плесеней. Процент зерен, пораженных плесенью, по сравнению
с несульфитированным солодом уменьшается. Отмечается, что в целом уровень
полевых грибов и пенициллов хранения часто понижался ниже пределов, позволя-
ющих определить их присутствие посевом методом разведения. Методом прямого
посева присутствие полевых грибов и пенициллов можно определить в небольшом
числе зерен. Тем не менее, по-видимому, на Eurotium spp. сушка с сульфитировани-
ем оказывает намного меньше воздействие, а количество зерен с Mucorspp. может
даже увеличиваться. Рост Mucorspp. при сушке может стать причиной общего воз-
растания КОЕ плесеней по сравнению с исходным ячменем, хотя обычно это коли-
чество ниже [67]. Несмотря на преобладание Geotrichum candidum, которое может
привести к контаминации почти всех зерен зеленого солода, отмечается, что при
сушке с сульфитированием жизнеспособные колонии этого вида плесеней могут
быть практически уничтожены [67, 68], хотя по данным [127] они все-таки могут
оставаться в солоде.
Необходимо отметить, что на возможность выживания плесеней может влиять
конструкция сушилки. Было показано [128], что после сушки при температурном
режиме в 70 °С выжили Phoma и два вида рода Fusarium с максимальными темпера-
турами роста 40-45 °С. Как оказалось, причиной тому стал дефект окрашенной
стенки бетонной солодовенной башни. По всей видимости, на протяжении зимних
месяцев в большинстве циклов сушки температура плохо изолированной стены
сушилки была ниже 40 °С, а в летний период температура воздуха в сушилке до-
стигала 70 °С в течение непродолжительного времени. Хотя высеянные на агар
культуры этих микроорганизмов при помещении в центр сушилки полностью те-
ряют свою жизнеспособность, достоверно не известно, достигает ли температура
зерна необходимых значений у стенки сушилки и выживают ли грибы, находящи-
еся в этих зонах.
4.2.2. Микробиота готового солода
По некоторым данным, общее количество жизнеспособных бактерий в солоде,
предназначенном для получения спирта составляет около 0,7-7,7 х 106Д для ячмен-
ного солода и 1,6-4,6 х 106Д — для ржаного [26]. Тем не менее для ячменного солода
также называют значение 1,7 х 107Д [208] при максимальном значении 9,8 х 107/г
[91]. В пивоваренном солоде было зарегистрировано значение 1,4-7,0 х 106Д [250],
а количество молочнокислых бактерий составило 1,4 х 104/г (на порядок меньше,
чем поданным [208]). Доминирующими мезофильными молочнокислыми бактери-
ями оказались Lb. leishmanii [250]. Несмотря на свою малочисленность, наиболее
Глава 4. Микробиота ячменя и солода
135
представительными среди термофильных видов оказались Pediococcus acidilactici
и Lb. delbrueckii. Лабораторные исследования [121] показали, что основными грамот-
рицательными бактериями являются Erwinia herbicola и Pseudomonas spp., а основны-
ми грамположительными — микрококки и Bacillus spp.
Количество дрожжей в готовом солоде находится в пределах 7,2 х 102—1,1 х 104/г
[91 ] (преобладают розовые дрожжи родов Sporobolomyces и Rhodotorula). Также при-
сутствуют и другие дрожжи, в том числе обнаруженные в зерне (см. раздел 4.1.2).
Количество плесеней, включая дрожжеподобные виды Aureobasidium pullulans.
Geotrichum candidum и мицелиальные грибы рода Trichosporon, может находиться
в пределах 103-10Уг [91]. При обследовании готового солода наиболее часто из зерна
выделяли плесени Eurotium {Aspergillus) amstelodami, Asp. fumigatus и Rhizopus spp.
[ 116]. В этой же работе приводятся данные о том, что процент зерен солода, поражен-
ных вышеперечисленными тремя видами, на одной шведской солодовне был значи-
тельно выше, чем на других, где наиболее часто обнаруживаемыми видами являлись
Penicillium spp. и Alt. alternata. В некоторых типах скандинавского солода относитель-
но часто встречались Alt. alternata и Fusarium spp. [118], а в солоде, предназначенном
для спиртовых производств,— Cochliobolus sativus (#.sativum) [91].Тем не менее
в сульфитированном солоде на зернах чаще всего встречается плесень типа Мисог,
реже — Eurotium spp., Penicillium spp., а полевые грибы — в очень незначительных ко-
личествах [67]. Можно ожидать, что на конечную обсемененность микроорганизма-
ми (микробиоту) в значительной степени влияет температура сушки и сама ее техно-
логия. При использовании низких температур, применяемых при производстве
солода, предназначенного для производства спирта, а также для высокодиастатиче-
ского солода, жизнеспособными остается большее количество микроорганизмов.
Микробиологическое состояние солода, предназначенного для производства спир-
та и пива, существенно зависит от обращения с ним в ходе его последующей обработ-
ки (от возможностей перекрестного и аэробного контаминирования). Кроме того, при
транспортировке влажность солода обычно повышается. Было отмечено, что при
транспортировке солода в Нигерию в поврежденных мешках количество грибов хра-
нения существенно возросло по сравнению с солодом той же партии, оставшемся в
Великобритании [94]. Уровень контаминации грибами хранения возрастает также в
солоде, хранящемся в ненадлежащих условиях. При ОВ солода > 79% колонизация
аспергиллами хранения (Asp. candidus и Asp. versicolor) прогрессивно увеличивается
[91], а также может наблюдаться рост токсикогенных грибов Asp.flavus [94].
4.3. Влияние микроорганизмов на солодоращение
4.3.1. Водочувствительность ячменя и состояние покоя
Одним из объяснений гидрофильности ячменя является присутствие в лемме
(нижняя цветковая оболочка зерна), палее (верхняя цветковая оболочка зерна), тес-
те и перикарпе (плодовой и семенной оболочке) огромных популяций полевых мик-
роорганизмов, конкурирующих за доступ к кислороду во время и сразу же после сбо-
ра урожая. Так как со временем жизнеспособность полевой микробиоты падает
[169], снижается и гидрофильность. Если гидрофильный (водочувствительный) яч-
мень поместить в условия с избытком воды, результатом станет ограничение поступ-
ления кислорода к зародышу зерна либо замедление/прекращение процесса прора-
136
Брайен Флэнниган
щивания. При таких условиях некоторые микроорганизмы способны проникать в
зародыш, следствием чего становится потеря жизнеспособности зерна.
При оценке различных способов снижения водочувствительности зерна в работе
[102] указывается, что для преодоления эффекта ингибирования процесса проращи-
вания эффективны комбинации антимикробных и антигрибковых антибиотиков.
Был сделан вывод, что необходимо пресекать активность как бактерий, так и грибов,
но в [181] было показано, что антимикробные соединения не устраняют разницу
в потреблении кислорода у водочувствительных и контрольных образцов ячменя.
Хотя водочувствительность в некоторой степени удалось снизить, это можно отнес-
ти скорее к свойствам зерна, чем к присутствию микроорганизмов, которые были
выделены независимо от того, был ячмень водочувствительным или нет. Тем не ме-
нее в экспериментах по проращиванию ячменя в присутствии Gliocladium roseum
(сапротрофной плесени, выделенной из ячменя [170]), было отмечено, что влияние
недостатка кислорода на прорастание и жизнеспособность усиливается присутстви-
ем гриба [216]. Позже было выявлено, что G. roseum развивается на конце зародыша
зерна, то есть в точке поступления кислорода [124]. На основе данных по потребле-
нию кислорода зерном и выделенными плесенями был сделан вывод, что если под
оболочкой влажного ячменя присутствует 100 мкг мицелия G. roseum, то потреб-
ность в кислороде у грибов в два раза превышает потребность зародыша. При этом
показано, что у быстрорастущих Mucor hiemalis потребление кислорода увеличива-
ется в четыре раза, а у медленнорастущих Pemcillium sp. составляет примерно две
трети от потребления кислорода зародышем. Ранее было продемонстрировано, что
азотфиксирующие бактерии Azotobacter chroococcum могут ингибировать процесс
прорастания, усваивая необходимый зародышу кислород, причем их влияние тем
больше, чем ниже содержание кислорода в воде [123]. Поэтому на водочувствитель-
ность могут влиять и бактерии, и грибы, однако сведения о том, что только они могут
вызывать изменения гидрофильности, неокончательны.
В 1990-е гг. были произведены дополнительные исследования роли микроорга-
низмов при солодоращении и высказано предположение о том, что проращивание
невысушенного ячменя, находящегося в состоянии покоя, сопровождается увеличе-
нием роста микроорганизмов вследствие аэрирования и перемешивания зерна [34,
66, 141, 142]. В этом случае можно увеличить энергию и способность прорастания,
а также повысить активность ос-амилазы путем обработки зерна антимикробными
средствами. Эксперименты с зерном, в котором был удален зародыш, свидетельству-
ют, что одним из факторов, влияющим на активацию ферментов в алейроновом слое
гибберелиновой кислотой является поверхностная микробиота. Эти исследования
подтвердили также, что замачивание зерна с антибиотиками улучшает прорастание
(особенно ячменя в состоянии покоя), а поскольку микроорганизмы на поверхности
зерна потребляют большое количество кислорода, был сделан вывод, что именно они
являются основной причиной того, что ячмень находится в состоянии покоя.
4.3.2. Грибы, повреждающие всходы
Хорошо известно, что в полевых условиях повреждение всходов и корневая гниль
вызываются жизнедеятельностью Fusanumspp. и Cochliobolus sativus. В Дании на про-
тяжении 15 лет наиболее значительными патогенными для ячменя микроорганизма-
Глава 4. Микробиота ячменя и солода
137
ми, развивающимися в зерне, были С. sativus (Я. sativum), F. avenaceum, F. culmorum,
F. graminearum и Microdochium nivalis (F. nivale), а также Pyrenophora graminea (Я. gra-
mineum) [139]. Следует иметь в виду, что если более 15% зерен заражены С. sativus, то
зернам ячменя необходима специальная обработка. Еще в 1930-х гг. было выявлено,
что в штате Айова и северной части штата Миннесота в некоторых партиях зерна до
91% зерен ячменя было заражено С. sativus (Я. sativum) и до 54% — Fusarium spp. [44].
Существует отрицательная корреляция между процентом зараженного зерна и степе-
нью прорастания. Для выявления влияния сильной зараженности ячменя на солодо-
ращение зерно было помещено для прорастания на влажную бумагу при 16 °С. При
этом проросло лишь чуть более двух третей семян, а у более чем 25% корешки ока-
зались чахлыми, гнилыми или недоразвитыми, зародышевые листки деформиро-
ванными или слишком короткими. Из этих двух видов полевых грибов наиболее не-
гативное влияние оказали С. sativus. Fusarium spp. также способствовали снижению
скорости прорастания зерна, а на токовых солодовнях в присутствии фузарий наблю-
дался неравномерный рост зерна [179]. При введении Fusarium spp. в замачиваемое
зерно большинство видов не вызвали значительного уменьшения роста зародыше-
вых корешков, за исключением единственного изолята культуры F. oxysporum, пара-
зитирующего на томатах, а именно F. oxysporum f.sp. lycopersici (F. bulbigenum var.
lycopersici) [255]. Выделенные виды F. graminearum, Microdochium nivalis (F. nivale),
а также некоторые другие виды вызывают значительное снижение роста зародыше-
вых корешков. Присутствие в пораженном и подвергшемся атмосферным воздей-
ствиям зерне Fusarium spp. и С. sativus (Я. sativum), а также Alt. alternata и Cladosporium
spp. может привести к уменьшению процента проросших зерен и веса сухих корешков
по сравнению с качественным ячменем [152].
При инокуляции ячменя в поле несколькими видами F. avenaceum и F. culmorum
было продемонстрировано, что последующее уменьшение скорости и энергии прора-
стания контаминированных зерен меньше зависит от штамма, а больше от погодных
условий в период между цветением и сбором урожая. Например, в присутствии одно-
го и того же штамма F. culmorum степень прорастания у ячменя, росшего в сухое время
года, составила 99,5%, в то время как при созревании ячменя в дождливую погоду —
48%. Влияние этого вида микроорганизмов на прорастание зерна выражено сильнее,
чем это наблюдается при контаминации ячменя F. avenaceum. В некоторых случаях
наблюдалась ббльшая разница между показателями способности и энергии прораста-
ния, что свидетельствует об ослаблении зерен грибами до такой степени, что прорас-
тание становится возможным лишь при определенных оптимальных условиях [119].
Возможным объяснением подобного влияния на прорастание может быть проду-
цирование такими грибами токсичных метаболитов (микотоксинов). Например,
С. sativus продуцирует токсичные вещества, к которым ячмень более восприимчив,
чем пшеница или овес [166, 203]. Было показано, что трихотеценовый токсин Т-2,
который продуцируется видами F. sporotrichioides (F. tricinctum), F. avenaceum, F. cul-
morum и другими грибами этого рода [256], замедляет рост зародышего листка и ко-
решка, хотя в работах других исследователей [ 119] не было обнаружено присутствия
трихотеценов ни в ячмене, ни в солоде. Тем не менее в тех случаях, когда хранится
невысушенный ячмень, в зерне наблюдалось десятикратное увеличение уровня ZEA
(ранее называвшегося F-2), а также уменьшение способности к прорастанию. С этим
138
Брайен Флэнниган
нельзя не считаться, так как показано, что низкий уровень этого токсина ингибирует
прорастание кукурузы [35].
Как уже отмечалось выше, при наличии большого количества спор на зерне при
солодоращении происходит интенсивное развитие фузарий, которые образуют «ро-
зовый мицелий», причем известны случаи, когда эта плесень развивалась настолько,
что получить солод удовлетворительного качества становилось невозможным,
и производство временно останавливали для дезинфекции. Развитие Fusarium spp.
может сопровождаться обесцвечиванием корешков, что заметно при тестовом про-
ращивании на влажной бумаге [139].
4.3.3. Стимулирование прорастания
Было обнаружено, что некоторые микроорганизмы, находящиеся на злаках, про-
дуцируют вещества, известные как растительные гормоны, которые способны вли-
ять на процесс солодоращения. Так, индол-3-уксусная кислота (IAA) обычно проду-
цируется как бактериями, так и мицелиальными грибами, а гиббереллиновая и
абсцизовая кислоты продуцируются более ограниченным числом грибов [268]. Не-
смотря на то что некоторые виды рода Fusarium, исследованные в [255] в связи с га-
шинг-эффектом, оказывают вредное влияние на рост зародышевых корешков во вре-
мя солодоращения, существует вид F. culmorum, который усиливает рост корешков.
В экспериментах с ячменем, зараженным в поле видами F. avenaceum и F. culmorum,
было показано, что у зерна, выросшего в условиях более влажного климата, во время
солодоращения наблюдается усиление роста корешков по сравнению с контрольны-
ми (незараженными) образцами, хотя до этого в солоде, выращенного а засушливый
год, наблюдалось ослабление роста корешков [119]. Такой же эффект наблюдается
при контаминировании зерна F. moniliforme (телеоморф Gibberella fujikuroi) [37], ко-
торый продуцирует гиббереллиновую кислоту, способствующую ускорению соло-
доращения. Если этот вид будет присутствовать в зерне в больших количествах, то
может произойти стимуляция процесса прорастания. Было отмечено, что при добав-
лении чистой культуры F. moniliforme при замачивании зерна происходит стимуля-
ция роста корешков[105], хотя в условиях реального производства количество выде-
ляемых этим грибом гиббереллиновой и абсцизовой кислот незначительно [268].
Поэтому значимость гиберреллиновой кислоты, продуцируемой фузариями, по-ви-
димому, завышена, особенно если учитывать, что некоторые другие виды, не проду-
цирующие гибберелиновую кислоту, дают тот же эффект, что и продуцирующие ее
[105]. В любом случае влияние этих растительных гормонов может нивелироваться
другими факторами — известно, например, что F. moniliforme продуцирует разные
токсины, включая фузаровую кислоту, вредную для клеточных мембран [71].
Несмотря на свои фитотоксичные свойства [166], С. sativus (Я. sativum) продуци-
рует два метаболита, стимулирующих высвобождение Сахаров в ячмене, у которого
отделен зародыш [33]. Также было отмечено, что живой мицелий и экстракт Alt. alter-
nate стимулирует удлинение колеоптиля пшеницы [222]. Clad, herbarum выделяет
IAA и индол-3-ацетонитрил [273] и, вероятно, стимулирует рост кукурузы [218].
По всей видимости, два последних вида, которые являются полевыми грибами, час-
то преобладающими на ячмене, могут оказывать сходное влияние на процесс соло-
доращения, хотя на этот процесс также может влиять присутствие других видов-
Глава 4. Микробиота ячменя и солода
139
антагонистов. Кроме того, определенное физиологическое значение имеет и индол-
3-уксусная кислота, продуцируемая бактериями [268].
4.3.4. Анализ солода
Ячмень, подвергшийся атмосферному воздействию, не только характеризуется
низкой способностью к прорастанию, но и дает солод с нежелательными свойствами,
одним из которых является высокий уровень содержания модифицированного белка
и, как следствие, — высокий уровень азота в сусле [148]. Оценивая влияние микроби-
оты ячменя на солод и готовое пиво, в работе [74] отмечают, что солод, произведен-
ный из ячменя с высокой влажностью, по своим свойствам резко отличается от соло-
да из ячменя, хранившегося в течение 1 мес. Экстрактивность сусла и уровень азота
в нем оказались выше, однако количество а-амилазы и диастатическая сила (ДС) —
гораздо ниже. Искусственная инокуляция ячменя грибами Fusarium spp. в поле [119]
и при замачивании [105, 148, 223, 255] показали, что это влияет на свойства солода.
В 1960 г. было обнаружено, что культуры F. graminearum и F. moniliforme, продуциру-
ющие гиббереллиновую кислоту, повышают уровень как а-амилазы, так и ДС [223].
Позднее было показано, что при солодоращении ячменя, инокулированого вышепе-
речисленными видами, а также F. culmorum, F. equiseti, F. роае и другими неидентифи-
цированными микроорганизмами, наблюдаются более высокие уровни а-амилазы
и экстрактивное™. С помощью указанных выше штаммов и некоторых других, выде-
ленных из датского ячменя, было подтверждено, что в большинстве случаев происхо-
дит повышение уровня а-амилазы, а иногда и ДС [105]. Неидентифицированные
виды Fusarium spp. дают солод для производства спирта с большей ДС [148]. Более
того, в [119] утверждается, что солод, изготовленный из ячменя, зараженного F. ave-
пасеит и F. culmorum, характеризуется высокой степенью модификации, хотя в неко-
торых случаях а-амилазная активность и ДС были ниже, чем в контрольных образ-
цах. Это было приписано активности грибных ферментов, которые не удалось
определить с помощью применявшихся аналитических методов. В упоминавшихся
выше работах [223, 255] также были отмечены повышенная модификация белков
и высокий уровень азота в сусле, особенно с применением F. graminearum и F. monili-
forme.
На качество солода влияют и другие микроорганизмы, которые выявляются на
зерне. В работе [223] исследовались около 100 бактерий, дрожжей и плесеней; было
убедительно показано, что за исключением фузарий на содержание азота в сусле
влияет относительно небольшое количество микроорганизмов, причем никакие из
них не влияют на активность а-амилазы или ДС. Среди бактерий, повышающих уро-
вень азота в сусле, можно выделить несколько родов (включая Pseudomonas spp.),
а также два неидентифицированных вида Aspergillus и Мисог. В [ 148] отмечается, что
такое же влияние оказывают Asp. niger, Rhizopus arrhizus и неидентифицированные
виды Absidia, Trichothecium (Cephalothecium), Coniothyrium, Helminthosporium и
Rhizopus. Развивающиеся в ходе солодоращения Eurotium {Aspergillus) amstelodami и
Asp.fumigatus [ 116] также повышают уровень азота и экстрактивность в сусле [117].
Степень влияния микотоксинов на рассматривавшиеся выше эффекты до сих пор
не ясна. В лабораторных исследованиях было обнаружено, что трихотеценовый ток-
син Т-2, хорошо известный как сильный ингибитор синтеза белков, в ходе солодора-
140
Брайен Флэнниган
щения подавляет синтез а-амилазы [93, 203]. Отмечается также уменьшение содер-
жания в сусле а-аминного азота, хотя и недостаточное для изменения плотности сус-
ла. В других лабораторных экспериментах было доказано, что на прорастание ячменя
и образование ферментов в ходе солодоращения способны влиять DAS [77] и (в мень-
шей степени) DCW[232]. Как и в случае токсина Г-2, ингибируется рост колеоптиля и
корешков, а уровни а-амилазы и а-аминного азота сокращаются. На это можно воз-
разить, что хотя отдельные микотоксины явно влияют на солодоращение, уровни ток-
сина, используемого для проращивания зерна, выше, чем их уровень в злаках, пред-
назначенных для коммерческого солодоращения. Тем не менее в зерне присутствует
смесь микотоксинов — не только в связи с присутствием разных видов плесеней, но
и потому, что разные виды продуцируют разные токсины. Например, в [119] утверж-
дается, что на скорость прорастания ячменя и свойства солода значительное влияние
оказывает F. culmorum, который в ходе солодоращения продуцирует наибольшее ко-
личество эстрогенного микотоксина ZEA, однако продуцирование этим видом токси-
на DON исследовано не было. ZEA, DON и другие природные токсины характеризу-
ются абсолютно разными механизмами действия и разным метаболизмом. Поэтому
не удивительно, что при экспериментах на животных были получены данные о том,
что природные смеси микотоксинов характеризуются более сильными эффектами,
чем отдельно взятые микотоксины [70]. Подобный синергический эффект комби-
нации небольшого количества разных токсинов может существенно влиять на про-
цесс солодоращения, и это еще сильнее подчеркивает тот факт, что реальный ре-
зультат влияния отдельных видов микроорганизмов или митоксинов — явление
очень сложное.
Продуцирование микотоксинов грибами рода Fusarium исследовалось в [241]
в ходе солодоращения ячменя, зараженного в поле фузариями, среди которых доми-
нировал F. graminearum. В четырех различных сортах ячменя потери присутствовав-
шего в зерне DON составили в ходе замачивания > 89% (рис. 4.2). По всей видимос-
ти, причиной этих потерь стало сочетание вымывания из зерна DCW-содержащих
частиц и растворения данного токсина в замочной воде. Как показано на рис. 4.3,
развитие грибов оценивается по увеличению содержания эргостерола во время про-
ращивания и сушки, что происходит, скорее всего, в течение ранних стадий сушки.
Усиление синтеза DON наблюдалось после проращивания ячменя в течение 3 дней.
Впоследствии изменение концентрации DON в ходе проращивания по сравнению
с исходным уровнем составило от 18 до 114%. Сушка пятидневного зеленого солода
приводит либо к небольшому изменению уровня содержания этого термостабильно-
го токсина, либо содержание токсина остается неизменным. Повышение уровня ZEA
и 15-ADON6bmo примерно таким же (рис. 4.4). К концу замачивания концентрации
этих токсинов в исходном ячмене упали ниже пределов возможности количествен-
ного определения, а синтез происходил в ходе проращивания. Следовательно, вы-
деление ZEA и 15-ADON, по-видимому, увеличивается во время сушки (как и биомассы,
рис. 4.3), но только на начальных ее стадиях. Концентрация 3-/ШОЛГ-токсина, содер-
жащегося в предназначенном для солодоращения ячмене, наоборот, существенно не
изменяется по сравнению с исходным уровнем. Тем не менее, как отмечается в [243],
DON может содержаться в солоде в большем количестве, чем в несоложеном ячмене,
из которого он производится.
Глава 4. Микробиота ячменя и солода
141
25-
S 20-
§
15-
о.
i 5 -
5
От-
Сухой Замоченный 5-дневный Высушенный
ячмень ячмень зеленый солод солод
Рис. 4.2. Развитие диоксиниваленола {DON) в ходе солодоращения двух сортов культурного
ячменя сразу после сбора урожая. По [241]
Замачивание 1-й 2-й 3-й 4-й 5-й Сушка
день день день день день
Рис. 4.3. Развитие диоксиниваленола {DON) и грибной биомассы, измеряемой по эргостеролу,
в ходе солодоращения ячменя сорта Robust По [241]
Как уже отмечалось выше, в ходе хранения полевая микробиота постепенно поги-
бает. Количество зерен, инфицированных доминирующими при сборе урожая
Altemaria alternata, а также Fusarium spp., значительно уменьшается [169]. По этой
причине в работе [14] было исследовано влияние на Fusarium и содержание DON раз-
142
Брайен Флэнниган
5-i
4,5-
4-
3,5-
3-
2,5-
2-
1,5-
1-
0,5-
о-
Л
А
А\
А
А
А\
А\
л
А\
А\
л
Сухой Замоченный 5-дневный Высушенный
ячмень ячмень зеленый солод солод
Рис. 4.4. Развитие зеараленона (ZEA) и 15-ацетилдиоксиниваленола (ADON) в ходе
солодоращения ячменя сорта Excel. По [241]
личных температур и режимов вентиляции при хранении сильно зараженного ячме-
ня. Как и в [169], была выявлена значительная потеря жизнеспособности Fusarium,
однако концентрации DON в ячмене остались неизменными. При более высоких
температурах хранения продуцирование микотоксинов в ходе солодоращения
уменьшалось. В работе [194] установлено, что хранение ячменя несущественно вли-
яет на уменьшение образования токсинов в ходе солодоращения, однако при этом в
готовом солоде значительно снижается риск проявления гашинг-эффекта. Как и ос-
тальные исследованные микотоксины, DON является очень стабильным соединени-
ем. Считается, что более долгое хранение ячменя на сельхозпредприятиях приводит
к существенному уменьшению жизнеспособности Fusarium [14]. Так как основное
количество DON во время замачивания теряется (см. рис. 4.2), имеет смысл в ходе
солодоращения предпринимать любые меры по снижению количества жизнеспособ-
ных Fusarium, способных продуцировать DON.
Фузарии — отнюдь не единственные токсигенные грибы, способные размножаться
в ходе солодоращения. Ниже мы увидим, что некоторые микотоксины могут проду-
цироваться также грибами Aspergillus clavatus, выделенными из органов дыхания ра-
бочих солодовен. Речь идет о микотоксинах патулине и цитохалазине Е, которые, по
данным [164], были синтезированы при опытном солодоращении ячменя и пшеницы,
инокулированных Asp. clavatus. Еще одним представителем рода Aspergillus, способ-
ным образовывать микотоксины в ходе солодоращения злаков, является Asp. flavus.
Было обнаружено, что 75% из 50 образцов сухого сорго, предназначенного для соло-
доращения, были инфицированы Asp. flavus, а в 10% было выявлено присутствие аф-
латоксина Вх (он содержался более чем в 50% солода, произведенного из этих образ-
цов в концентрации до 175 мкг/кг) [72].
Глава 4. Микробиота ячменя и солода
143
4.4. Влияние микробиоты на пиво и спирт
4.4.1. Пиво
Наиболее известным эффектом влияния микробиоты ячменя и солода является
эффект гашинга. Этот эффект особенно присущ урожаям зерновых, собираемых по-
здней осенью (например, в странах Скандинавии) или произрастающих в условиях
повышенной влажности. Обзор первых работ по этой теме представлен в [104], где
исследовался эффект гашинга в датском пиве и был сделан вывод, что проблема свя-
зана с использованием солода, произведенного из ячменя, подвергшегося атмосфер-
ному воздействию или хранившегося в ненадлежащих условиях. В дальнейших экс-
периментах солод при замачивании инокулировали разными микроорганизмами,
что дало возможность назвать основной причиной эффекта гашинга присутствие
фузарий. Дальнейшая работа с тридцатью видами фузарий показала, что многие из
них приводят к увеличению содержания азота в сусле и формольного азота в сусле и
пиве (наиболее явными причинами гашинга считаются F. graminearum и F. monili-
forme) [223].
При работе с некоторыми выделенными штаммами было установлено, что эффект
гашинга зависит не от замачивания, а является результатом развития плесеней на про-
растающем ячмене [105]. Позднее было продемонстрировано, что эффект гашинга вы-
зывается солодом, приготовленным из ячменя, зараженного в поле. На гашинг, вызы-
ваемый F.avenaceum и Fculmorum, оказывают влияние атмосферные условия и
особенности тех или иных штаммов [119]. По-видимому, существует зависимость
между эффектом гашинга и способностью того или иного вида микроорганизма про-
дуцировать микотоксин ZEA. Было отмечено, что гашинг, вызванный солодом, конта-
минированным F. graminearum, является непредсказуемым и может проявиться как
сразу после розлива в бутылки, так и через несколько недель [61]. Было также под-
тверждено, что в Германии эффект гашинга может вызываться F. graminearum и F. cul-
тогит, причем он связан с присутствием DON в соложеных ячмене и пшенице [198].
Несмотря на то что в некоторых случаях при гашинге присутствие DON доказано не
было, а в газостабильном пиве этот токсин был выделен, среднее значение концентра-
ции DON в пиве с эффектом гашинга намного выше. По данным [241 ], эффект гашинга
в пиве, приготовленном из солода, контаминированного F. graminearum и DON, был
настолько разным, что различие между экспериментальными и контрольными образ-
цами было статистически незначимым. Позднее в [242] сообщалось о явной корреля-
ции между концентрацией DON и биомассой грибов (количество которой оценивали
по уровню эргостерола) в солоде и связанным с ним эффектом гашинга. В 1997 г. было
высказано предположение [194], что содержание DON — это не абсолютный индика-
тор возможности эффекта гашинга; можно лишь утверждать, что ячмень и солод с вы-
соким содержанием DON могут являться причиной возникновения гашинга в пиве.
Например, эффект гашинга может возникать при содержании DON в солоде в количе-
стве 0,5 мг/кг, но не проявляться — при 2,56 мг/кг. Было показано, что в несоложеном
сырье присутствуют некие вещества, которые также вызывают гашинг, причем эти со-
единения исчезают одновременно с DON при замачивании ячменя, а при солодораще-
нии они проявлялись снова. В том случае, когда эти соединения, вызывающие эффект
гашинга, отсутствуют в ячмене, он проявляется еще до увеличения концентрации
144
Брайен Флэнниган
DON, достигающего своего максимума при окончании сушки [ 194]. До сих пор неясно,
какие именно соединения в зерне и солоде, контаминированных фузариями, вызыва-
ют гашинг, хотя в [9] приводятся сведения о том, что неидентифицированный вид
Fusarium продуцирует не менее двух инициаторов данного эффекта, одним из которых
является некое пептидосодержащее вещество с низкой молекулярной массой.
Выявлены и другие грибы, способные вызывать эффект гашинга — так, он прояв-
ляется при добавлении в пиво фильтратов Alternaria spp.f Nigrospora spp. и Stem-
phylium spp. [6, 289]. Из культуральных фильтратов и зерна, контаминированного
Nigrospora spp. (которые изначально были неверно идентифицированы как Rhizopus
spp.), был выделен некий полипетид (молекулярная масса 15 000), который в чистом
виде при концентрации 0,05 ррт вызывает сильный гашинг-эффект [9, 10]. Гриб
Nigrospora spp. морфологически очень схож с N. oryzae, также вызывающим гашинг
[10, 146], а из Stemphylium spp. был выделен пептидоглюкан, вызывающий гашинг
при концентрации 4 ррт [9,147].
Этот эффект может вызываться различными грибами хранения, а именно Eurotium
spp. (группа Asp. glaucus), Pen. chrysogenum (включая виды, прежде называвшиеся Реп.
notatum), Pen. griseoroseum {Pen. cyaneofulvum) и Rhizopus spp. [9,10,101,289], а также
присоединившиеся к ним при замачивании Е. amstelodami и Asp.fumigatus [115] (пред-
полагается, что являясь доминирующими видами в солоде, именно они стали причи-
ной нескольких случаев гашинга на одном из шведских пивзаводов).
Ранее мы уже говорили, что причиной повышенного содержания азота в пиве яв-
ляются Fusarium spp.t однако в [ 148] показано, что этому способствуют также Asp. niger
и Rhizopus arrhizus. Эти виды, особенно Eurotium rubrum (Asp. ruber) и Asp. ochraceus,
вызывают снижение коллоидной стойкости пива, а неидентифицированные виды
Alternaria, Penicillium и Geotrichum — ее повышение. Кроме того, Asp. ochraceus инги-
бирует действие папаина (фермента, добавляемого в пиво для его стабилизации),
a Asp.fumigatus и R. oryzae повышают содержание в пиве ct-аминного и растворимого
азота [117].
При исследовании влияния плесеней на органолептические свойства пива было
показано, что присутствие Asp. niger, Asp. ochraceus, R. arrhizus и не идентифициро-
ванных видов Cladosporium, Coniothyrium и Fusarium вызывают значительные изме-
нения его органолептических свойств [148]. Микроорганизмы первой группы при-
дают пиву привкус жженой мелассы, а второй — грубоватый винный привкус.
Культуры Absidia, Trichothecium (Cephalothecium), Cladosporium (Hormodendron) и
Rhizopus способствуют появлению в пиве слабого постороннего привкуса. По дан-
ным [117], в пиве, изготовленном из солода, зараженного R. oryzae, отсутствуют по-
сторонние вкусы и ароматы, тогда как Asp.fumigatus придает пиву выраженный тер-
пкий, затхлый привкус.
Присутствие плесеней влияет и на цвет пива. В [148] отмечается, что пиво, сварен-
ное на солоде, произведенном из подвергшегося атмосферному воздействию ячменя,
характеризуется высокими показателями цветности; это же относится и к пиву, изго-
товленному из солода, зараженного Asp. niger, Trichothecium (Cephalothecium), Rhizopus
и особенно Fusarium spp. или R. arrhizus. Впоследствии увеличение цветности было
отмечено в присутствии Asp. fumigatus, R. oryzae [117], F. avenaceum и F.culmorum
[119].
Глава 4. Микробиота ячменя и солода
145
Ранее мы уже упоминали о вероятной связи между двумя микотоксинами, обра-
зуемыми фузариями, и эффектом гашинга. Здесь мы рассмотрим возможность их
влияния и на процесс брожения, поскольку известно, что отдельные микотоксины
токсичны для широкого ряда микроорганизмов (включая дрожжи). Тот факт, что
в западных странах для солодоращения используют высококачественные зерновые
культуры, свидетельствует о стремлении исключить возможность попадания боль-
шого количества микотоксинов в сусло, предназначенное для промышленного бро-
жения. Тем не менее зерно, используемое в качестве дешевого крахмалистого сырья
(например, кукуруза), может оказаться значительно более низкого качества и стать
источником появления в сусле микотоксинов. Было отмечено, что такие микотокси-
ны, как ZEA и трихотецены, могут по-разному влиять на рост дрожжей в зависимо-
сти от концентрации и температуры [93, 233, 234]. Несмотря на то что в злаках Г-2
встречается реже, чем DON, его ингибирующее влияние на рост дрожжей изучено
лучше. Г-2 и другие трихотецены ингибируют функции митохондрий [235], а в [150]
было показано, что потребление кислорода всей клеткой S. cerevisiae и отдельно ми-
тохондриями ингибируется путем воздействия Г-2 на сукцинатдегидрогеназу и на
перенос электронов в дыхательной цепи.
Воздействие различных трихотеценовых токсинов на лаг-фазу роста S. cerevisiae от-
ражает их возможности действия на животных (табл. 4.6) [93]. При сравнительно оди-
наковых концентрациях Г-2, DAS и DON установлено, что более других ингибирует
рост дрожжей Г-2 [282]. Присутствие нескольких трихотеценов в зависимости от доли
каждого из них может оказывать различное влияние на живые системы (от взаимного
ослабления до усиления) [149]. При исследовании воздействия трихотеценового DON
и нетрихотеценовых ZEA и фумонизина Вх (FBX) при низких концентрациях (0,1-
2 ррт) на развитие S. cerevisiae, аналогичных наблюдающимся в естественно контами-
нированных злаках, статистически значимых отличий с контрольными образцами,
содержавшими каждый из токсинов в отдельности, два из них или все три одновремен-
но, обнаружено не было. Единственным токсином, давшим значимое отличие от конт-
рольных значений, был Г-2 при концентрации 2 ррт, причем его влияние проявилось
лишь на Kluyveromyces marxianus и Schizosaccharomyces pombe, и не проявилось на
5. cerevisiae, Pichia membranaefaciens или Hansenula anomala. Что касается Sch. pombe,
было отмечено усиление ингибирующего воздействия Г-2 в присутствии ZEA в концент-
рации 2 ррт (в присутствии DON или FBX этот эффект отмечен не был). При более
Таблица 4.6. Относительная токсичность некоторых трихотеценов, образуемых фузариями
(по экспериментам на мышах, [269])
Трихотецены ЛД^мг/кг массы тела)
Фузаринон-Х 3,4
Ниваленон 4,1
Токсин Г-2 5,2
Токсин ЯГ-2 9,0
Неосоланиол 14,5
Диацетоксисцирпенол 23,0
Дезоксиниваленол 70,0
* Доза, вызывающая летальный исход у подопытных мышей в 50% случаев.
146
Брайен Флэнниган
высоких концентрациях DONwZEA, достаточных для ингибирования роста дрожжей,
было обнаружено их воздействие на развитие двух пивоваренных штаммов, которое
может быть как отрицательным, так и положительным в зависимости от доли каждого
из токсинов [22].
Что касается К. marxianus, ингибирование, вызываемое токсином Г-2, которое
проявляется в уменьшении сухой массы относительно контрольных образцов без
токсинов по истечении 6 ч при 25 °С, примерно в 13 раз сильнее, чем ингибирование,
вызываемое DAS. Разница в силе действия трихотеценов наблюдается также при пе-
реходе роста дрожжей в стационарную фазу. Например, при очень высокой концен-
трации токсина (50 мкг DON/мл культуры) сухая масса дрожжей уменьшается лишь
на 10% по сравнению с контрольными образцами без токсинов, что составляет не-
много больше, чем половина от снижения сухой массы, наблюдаемого при концент-
рации Г-2 2,5 мкг/мл. По данным исследований той же лаборатории, наименьшей
концентрацией DON, вызывающей заметное замедление роста штамма 5. cerevisiae,
использующегося для производства эля, является 50 мкг/мл в растворе солодового
экстракта с добавлением глюкозы [21]. Для штамма, применяющегося для производ-
ства лагерного пива, эта концентрация составила 100 мкг/мл. Концентрация нива-
ленола (NIV) в 50 мкг/мл существенно замедляет рост штамма верховых дрожжей,
однако почти никак не сказывается на развитии низовых дрожжей. На жизнеспособ-
ность дрожжей влияют наличие того или иного типа токсина и их концентрации.
Было отмечено, что по сравнению с Г-2 DON слабо влияет на жизнеспособность
дрожжей [84, 282] (при воздействии на штамм верховых дрожжей токсина концент-
рацией 200 мкг DON/мл никакого влияния на жизнеспособность дрожжей даже
в течение 24 ч практически не проявляется), и хотя при воздействии на штамм низо-
вых дрожжей слабое влияние все-таки имело место, его нельзя считать статистиче-
ски значимым. Не было отмечено существенного влияния и при воздействии на
дрожжи токсина NIV(b концентрации 50 мкг/мл) [21]
Подобно трихотеценам DAS, DON и Г-2, токсичные свойства в отношении дрожжей
проявляет ZEA [171]. Утверждается, что существует обратная линейная зависимость
между ростом 5. cerevisiae и концентрацией токсина в пределах 5-50 мкг ZEA/мл [93].
Вместе с тем было обнаружено, что наименьшей концентрацией, вызывающей суще-
ственное замедление роста двух штаммов пивоваренных дрожжей, является 50 мкг
ZEA/мл [20]. Эти штаммы отличались способностью переносить первоначальное (шес-
тичасовое) воздействие токсина, через 24 ч штамм низовых дрожжей полностью вос-
становил свою способность размножаться, в то время как штамм верховых дрожжей —
лишь частично. В свою очередь, токсин FB1 проявлет свой токсичный эффект на дрож-
жи в основном при продолжительности воздействия от 6 до 24 ч, причем штамм низо-
вых дрожжей, по-видимому, более чувствителен к его влиянию, чем верховые дрожжи
(концентрации FBV необходимые для оказания заметного эффекта, составляют, соот-
ветственно, 10 и 50 мкг/мл).
Хотя по данным [158] Г-2 и DAS сильнее влияют на образование диоксида угле-
рода штаммом S. carlsbergensis, чем афлатоксин В, и патулин. Фактические данные
относительно Г-2 и DAS свидетельствуют, что скорость газообразования начинает
восстанавливаться лишь к концу четырехчасового периода (даже при концентра-
ции 50 мкг токсина/мл). В лабораторных экспериментах со штаммами S. cerevisiae
Глава 4. Микробиота ячменя и солода
147
и К. marxianus токсин Г-2 замедлял брожение, что вызывало зависимую от концент-
рации глюкозы лаг-фазу при сбраживании сусла и образовании этанола в среде Ви-
керхэма (Wickerham) [87, 94]. При высоком содержании в среде (10 мкг/мл) этот
токсин удлиняет лаг-фазу по сравнению с контрольным образцом с 42 до 120 ч
[231]. Несмотря на удлинение лаг-фазы скорость сбраживания восстанавливается
примерно так же, как и в контрольном образце [94]. Это восстановление увязывают
с зависимым от времени увеличением количества жизнеспособных клеток [231].
Способность клеток 5. cerevisiae преодолевать ингибирующее действие Г-2 была
подтверждена в [ 151 ], где указывается, что замедление образования этилового спир-
та является результатом замедления роста дрожжей, а не влияния токсина Г-2.
Было предположено, что Г-2 замедляет окислительный, а не ферментативный мета-
болизм.
Как и в лабораторных условиях солодоращения, DAS влияет на брожение схоже,
но менее сильно, чем Г-2 [84, 231]. В [282] обращается внимание на то, что концент-
рация токсина DON в размере 20 мкг/мл незначительно влияет на истощение дрож-
жей и образование этилового спирта. Отмечается, что хотя дрожжи верхового бро-
жения более подвержены влиянию DON, чем штаммы дрожжей низового брожения;
его негативное влияние на брожение сказывается лишь тогда, когда он присутству-
ет в сусле в концентрации 50 мг/л, что влечет сокращение потребления а-аминного
азота (FAN), снижение концентрации сусла и образование этилового спирта [22].
Токсичный эффект нетрихотеценового ZEA заметен лишь тогда, когда содержание
ZEA составляет 50 мг/л; при этом увеличивается образование изоамилацетата. FB{
влияет на процесс брожения при концентрациях в сусле 2 и 50 мг/л. При использо-
вании штаммов верховых дрожжей наблюдалось более быстрое истощение сусла,
уменьшение рН и сокращение потребления FAN чем при использовании штаммов
низовых дрожжей, и в обоих случаях — уменьшение образования этилгексаноата.
Кроме того, почти во всех случаях концентрации этих токсинов, приводящие
к вышеперечисленным эффектам, существенно выше, чем даже в самом контамини-
рованном зерне. Тем не менее в работе [84] было высказано предположение, что вы-
зывать замедление процесса брожения могут сочетания более низких концентраций
совместно действующих токсинов. Эксперименты свидетельствуют, что этому мо-
жет препятствовать увеличение количества вносимых засевных дрожжей [231].
4.4.2. Дистиллированный спирт
При затирании кукурузы и слегка подсушенного солода в отношении 90 : 10 при-
сутствие плесени не существенно влияет на спиртообразование [148]. Тем не менее
отмечается, что использование даже 10% сильно зараженного плесенью солода может
придать дистилляту нехарактерный привкус. Выраженные посторонние привкусы
обязаны своим появлением культурам Cladosporium, Fusarium, Coniothyrium и дрож-
жам Rhodotorula, в меньшей степени на это влияют — Asp. niger и неидентифициро-
ванные виды Alternaria. Между результатами, полученными при перегонке спирта
и при пивоварении, строгой корреляции нет — например, Rhizopus arrhizus влияет на
аромат пива, а на спирт не влияет.
Хотя в [125] утверждается, что для создания конкуренции дрожжам во время бро-
жения требуется очень высокая контаминация сусла (около 108 бактерий/мл), в [60]
148
Брайен Флэнниган
отмечается необходимость отдельного помещения для помола (из-за возможности
контаминации микроорганизмами, присутствующими в переносимой по воздуху со-
лодовой пыли).
4.5. Риски для здоровья
4.5.1. Риск респираторных заболеваний
Риск для здоровья персонала, работающего с зерном, связан с вдыханием в тече-
ние долгого времени воздуха с большой концентрацией пыли [56]. Масштабы про-
блемы можно представить исходя из того, что в канадской провинции Саскатчеван у
54% из 500 сотрудников были выявлены хронический кашель, отдышка, дерматиты,
прерывистое дыхание или «зерновая лихорадка» [283]. Под воздействием элеватор-
ной пыли у работников на протяжении нескольких лет развиваются хронический
бронхит, фиброз и эмфизема легких.
Зерновая пыль состоит не только из частиц зерна и соломы — в ней также присут-
ствуют частицы грунта, бактерии, дрожжи, споры и мицелий плесеней и актиноми-
цетов, клещи, насекомые, а также их фрагменты и продукты жизнедеятельности.
Понятно, что работающий с зерном персонал становится более чувствительным
к присутствию в нем микроорганизмов [156] и клещей [56,286] — иммунный механизм
настраивается на заведомо высокий уровень защиты, что вместо пользы приносит вред,
поскольку избыточная иммунная реакция приводит к аллергическим проявлениям,
которые становятся заметны на коже, но чаще всего их действие затрагивает респира-
торную систему. Если подобная гиперреакция проявляется в легких, то повторное воз-
действие антигена или аллергена, ее вызыващего, приводит к дегенеративным измене-
ниям легочной ткани и серьезным респираторным нарушениям.
Споры некоторых грибов и актиномицетов являются потенциальными источни-
ками сильных аллергенов, часто ассоциируемых со стенкой споры. При вдыхании
спор размером более 10 мкм они оседают преимущественно на слизистой носоглот-
ки. Вызываемая ими аллергическая реакция проявляется в виде ринита или сенной
лихорадки. Споры размерами 4-10 мкм оседают в основном в бронхах (чаще —
в бронхиолах) и вызывают астматическую реакцию, при которой наблюдаются за-
труднения в дыхании (удушье). В обоих случаях реакции на аллерген относятся
к типу I, то есть реакция проявляется, как правило, сразу же после попадания в орга-
низм аллергена и длятся нескольких часов. Реакции этого типа характерны для 10%
людей, склонных к аллергии, — у них аллергические реакции возникают обычно на
широкий спектр аллергенов, причем проявляются при концентрациях спор, обычно
не действующих на оставшуюся часть населения (менее 104-106/м3 воздуха).
Наибольшее количество спор (размером менее 4 мкм) оседают на границе бронхи-
ол и альвеол; если эти споры вызывают аллергическую реакцию, то это является или
внешнеобусловленным аллергическим альвеолитом (ЕАА), или аллергической пнев-
монией (ЯР). Оба заболевания сочетают в себе аллергические реакции III и IV типов
и обычно встречаются у неаллергиков, подвергаемых действию больших концентра-
ций (более 106/м3) спор определенного типа, содержащих только один специфичес-
кий аллерген. В отличие от реакции типа I, реакция типа III является опосредован-
ной антителами и в течение 4 ч не проявляется, продолжаясь в течение 48 ч и более.
Кроме того, при острой реакции на антиген наблюдается сильное повреждение легоч-
Глава 4. Микробиота ячменя и солода
149
ной ткани и периваскулярная воспалительная реакция в легких. Явные симптомы —
жар, слабость, сухой кашель и «нехватка воздуха». Постоянное вдыхание аллергенов
приводит к клеточной гиперчувствительности типа IV — образуется гранулема, про-
грессирует фиброз легких, легкие повреждаются и их функция понижается. Пример-
но в 5% случаев хронического ЕАА может произойти разрыв стенок альвеол; альвео-
лы и бронхиолы образуют кисту в сочетании с прогрессирующим фиброзом, что
приводит к сильнейшим респираторным нарушениям. Здесь можно добавить, что при
всей редкости острых реакций на аллергены, вызывающие реакции типов I и III,
у некоторых людей наблюдается острая респираторная недостаточность.
К спорам, присутствующим в ячмене и обычно вызывающим реакцию типа I, отно-
сятся полевые грибы A. alternata и Clad, herbarum, а также Epicoccum nigrum (£. ригри-
rascens), являющиеся причиной ринита. Реакции типа III могут вызываться спорами
Penicillium spp. и термофильными актиномицетами Saccharopolyspora (Faenia) rectivir-
gula, ранее известными как Micropolyspora faeni и Thermoactinomyces vulgaris. Оба этих
вида связаны с самонагреванием ячменя и кормового зерна [156] и являются возбуди-
телями легочных заболеваний сельхозрабочих. Несмотря на то что споры Asp. fumi-
gatus по своим размерам должны вызывать аллергические реакции типа III, они могут
вызывать реакции обоих типов. Скопление спор и их оседание в верхних дыхательных
путях может проявляться и в реакциях типа I.
4.5.2. Легочные заболевания работников солодовен
Несмотря на то что у работников солодовен случаи хронических респираторных
заболеваний (бронхита и эмфиземы легких) были описаны еще в 1930-х гг [31], до
1968 г. не было известно такого заболевания, как «легкое солодовщика» [228], похо-
жего на внешнеобусловленный аллергический альвеолит (ЕАА) — заболевание, при-
знанное профессиональным и вызываемое воздействием высоких концентраций
спор Asp. clavatus. Этот микроорганизм редко встречается в сухом ячмене, однако его
выделили из хранящегося ячменя в Канаде [274], Египте [7] и Румынии [258].
После первых сообщений об обнаружении этого аллергического альвеолита среди
рабочих токовых солодовен [40, 228] были обследованы 56 шотландских солодовен
[ПО], и на 12 из них было выявлено присутствие Asp. clavatus. Из 711 работников
56 солодовен этим заболеванием на солодовнях ящичного типа страдали почти
столько же человек (6,2%), сколько и на токовых солодовнях (6,8%). В целом симп-
томы легочных заболеваний были выявлены у 5,2% осмотренных работников, при-
чем на солодовнях, где использовались современные механические системы солодо-
ращения (например, барабанные), заболеваемость была наименьшей (1,1%).
Если Asp. clavatus заражает токовые солодовни, его споры заметны на поверхно-
сти зерен. Впоследствии во время ворошения зеленого солода эти споры переходят
в атмосферу [228]. При загрузке и разгрузке сушильной печи, а также при отбивании
ростков и корешков количество спор в атмосфере еще более возрастает. Следует
ожидать, что можно добиться сокращения концентрации спор герметизацией ячме-
ня при солодоращении (например, в барабанах). Особенно богаты аллергенными
веществами, вызывающими альвеолит, стенки спор [16]. Хотя считается, что заболе-
вание «легкое солодовщика» возникает в результате реакций типов III и IV, предпо-
лагают, что эти споровые аллергены провоцируют и реакцию типа I [110].
150
Брайен Флэнниган
Так как Asp. clavatus в сухом ячмене встречается довольно редко, основной источ-
ник контаминации остается неизвестным. Предполагается, что при солодоращении
одной партии виновниками могли стать голуби, контактировавшие с зерном, а это
зерно затем было смешано с другими партиями [40, 228]. Какой бы ни была причина
контаминации, ясно, что при попадании в солодовню, Asp. clavatus приобретает
комфортные условия для развития и спорообразования. Хотя этот микроорганизм
растет в зерне только во время проращивания и (возможно) на ранних стадиях суш-
ки, его споры легко распространяются по помещениям. Было четко показано, что этот
микроорганизм присутствует не только на всех этапах производства солода, предназ-
наченного для получения спирта, но и в заторном отделении, а также в слюне работ-
ников, не имевших дело с солодом [40].
Рост Asp. clavatus становится большой проблемой во время проращивания зерна
при повышенных температурах, то есть когда температуру сознательно повышают
для ускорения проращивания [228] или при отсутствии средств ее понижения до
нормальной (16 °С) в теплое время года. В ходе экспериментального солодоращения
было установлено, что при увеличении температуры с 16 до 25 °С (оптимальной для
роста этого гриба) возможен 10-кратный рост этого микроорганизма [92]. Поэтому
неудивительно, что в Южной Африке этот гриб является наиболее распространен-
ным токсигенным грибом в соложеном сорго [225, 226], так как температура солодо-
ращения там может достигать и 28 °С. Присутствие поврежденных зерен [228], зер-
на, готового к прорастанию, или готового солода, случайным образом попавшего
в данную партию [92], могут привести к быстрой колонизации, распространению за-
ражения и ускоренному развитию этого гриба в ходе проращивания.
Если рассматривать солодовенную промышленность в целом, то очевидно, что
данный гриб встречается довольно редко, но как только заражение производства
происходит, контролировать спорообразование становится очень трудно из-за высо-
кой скорости его распространения. Контаминации спорами подвержено даже сухое
зерно, находящееся на хранении, а добавление в замочную воду гипохлорита унич-
тожает эти споры недостаточно эффективно [92]. Было высказано предположение,
что раствор гипохлорита может напрямую стимулировать рост Asp. clavatus [228],
однако более вероятно, что уничтожение других микроорганизмов приводит к уст-
ранению конкуренции. Применение более высоких концентраций гипохлорита при
мойке оборудования или помещений приводит лишь к временному решению данной
проблемы, поскольку споры сохраняются в труднодоступных местах (щелочные мо-
ющие средства более эффективны, чем гипохлорит).
Министерство здравоохранения Великобритании в инструкции по борьбе с зер-
новой пылью на солодовенных предприятиях установило максимально допустимый
предел ее вдыхания — 10 мг/м3 в течение 8 ч. В этом же документе устанавливается
необходимость проведения контрольных инженерных и оперативных мероприятий,
благодаря которым наличие зерновой пыли должно быть уменьшено (например, при
заполнении замочного чана). Согласно указаниям Министерства здравоохранения,
в случаях невозможности обеспечить соответствующий контроль при уходе за обо-
рудованием и его мойке необходимо использовать средства защиты органов дыха-
ния, причем подчеркивается, что применение индивидуальных средств защиты —
это лишь последний способ борьбы с зерновой пылью [109]. Не смотря на то что эта
Глава 4. Микробиота ячменя и солода
151
инструкция не относится конкретно к Asp. clavatus или другим аллергенам, в ней
подчеркивается важность медицинской профилактики и обязанность предприятий
уведомлять Министерство здравоохранения о случаях профессиональных заболева-
ний астмой или аллергическим альвеолитом.
Хотя применение рекомендуемых технологических режимов (использование
только высококачественного зерна, замкнутых систем солодоращения с эффектив-
ными системами контроля за температурами) не дает гарантии полного удаления
Asp. clavatus на солодовенных предприятиях, однако в сочетании с тщательным конт-
ролем содержания пыли они минимизируют воздействие этой плесени на организм
человека, и, следовательно, снижают количество случаев респираторных заболева-
ний легких у персонала. Меры по профилактике аллергических заболеваний, свя-
занных с Asp. clavatus, должны привести к сокращению числа других находящихся
в воздухе грибов, которые обнаруживаются в слюне работников солодовен и могут
являться аллергенами [18].
4.5.3. Микотоксины
В предыдущих разделах мы уже упоминали о грибах, присутствующих в ячмене и
выделяющих микотоксины, и также о влиянии, которое оказывают микотоксины и дру-
гие метаболиты плесени на проращивание и свойства солода, и, соответственно, на здо-
ровье человека. Несмотря на то что на настоящий момент определено уже довольно
большое количество микотоксинов, лишь пять из них важны с точки зрения сельского
хозяйства. К ним относятся афлатоксины, О А, фузариотоксины DON (в некоторых ре-
гионах — NIV), TEA и фумонизин [184]. Наиболее значимыми и хорошо изученными
микотоксинами злаков являются афлатоксины, продуцируемые Asp.flavus и Asp. para-
siticus [85], которые не только могут вызывать сильный токсикоз у человека и живот-
ных, но и обладают канцерогенными свойствами. Как уже отмечалось выше, к нефро-
токсинам, образуемым присутствующими в ячмене и пшенице пенициллами, относятся
О А и цитринин. Помимо заболеваний почек, О А может вызывать онкологические забо-
левания мочевыводящих путей [257].
Главным источником поступления охратоксина A (Q4) в организм человека явля-
ются злаки [257], хотя иногда О А может присутствовать и в свинине. Другие значимые
микотоксины выделяются различными видами микроорганизмов рода Fusarium spp.
(табл. 4.6). Сильными ингибиторами синтеза белка и ДНК, подавляющими также им-
мунную систему, являются DON и другие трихотецены [85]. У человека и крупного
рогатого скота действие трихотеценовых микотоксинов проявляется в таких симпто-
мах, как рвота, некроз кожи, кровотечения и разрушение костного мозга (из-за рвотно-
го симптома DON сначала называли «вомитоксином»). TEA характеризуется эстроген-
ными свойствами и вызывает у свиней преждевременное прекращение беременности
и бесплодие, а для человека считается канцерогеном [85, 257]. Фумонизины — это
токсичные длинноцепочечные полигидроксилалкиламины, вьщеляемые F. moniliforme
и аналогичными видами микроорганизмов. Эти токсины стали активно исследоваться
с 1988 г., когда их впервые обнаружили в южноафриканской кукурузе [178]. В настоя-
щее время известно, что они широко распространены в кукурузе, возделываемой в Ев-
ропе, Австралии и США. Даже в пищевой кукурузе концентрации фумонизина бывают
более 5мг/кг (известен случай, когда в заплесневелой кукурузе, применявшейся
152
Брайен Флэнниган
для пивоварения в Южной Африке, его концентрация составила 117,5 мг/кг) [59]. Фу-
монизин может вызывать летальный микотоксикоз у свиней и лошадей, а для человека
он считается потенциальным канцерогеном [257].
В предыдущем разделе мы уже отмечали, что Asp. clavatus является не только ток-
сигенным микроорганизмом, но и аллергеном. Поэтому важно понимать, что вдыха-
ние спор этого гриба, а также других токсигенов, присутствующих в зерне или солоде,
является респираторным путем их попадания в организм человека. Поэтому неуди-
вительно, что известны случаи проявления у работников солодовенных предприятий
неврологических симптомов, включая тремор. К известным микотоксинам, выделяе-
мым этим грибом, относятся патулин, цитохалазин Е и два соединения, вызывающие
тремор, — триптоквивалин и триптоквивалон [47, 107]. Патулин и цитохалазин Е
продуцируются в ходе солодоращения ячменя и пшеницы [164]. Количественные со-
отношения этих токсинов в контаминированном зерне могут оставаться неизменны-
ми при сушке до температур 80 °С, причем не исключено, что при солодоращении
возможно продуцирование и других токсинов, которые могут сохраняться на солоде
и ростках. Какое влияние оказывает присутствие этих токсинов на организм челове-
ка, точно не известно, но в экспериментах на мышах (введение спор через нос) наблю-
дался микотоксикоз и опухолеобразование [17]. Эти данные дают еще ббльшие осно-
вания для мер по предотвращению попадания Asp. clavatus в организм человека.
Существует также риск для скота, на корм которому используют отходы производ-
ства солода, зараженные этим микроорганизмом. Такая плесень была выделена из от-
битых ростков и корешков [18], а при изучении микотоксикозов в Великобритании
[103] в ростках была выявлена зараженность 15 х 106 КОЕ/г. Использование ростков
от солода, предназначавшегося для производства спирта, в качестве основной добав-
ки к кормам привело к гибели крупного рогатого скота, однако у овец летальных ис-
ходов не было. Вместе с тем в начале 1990-х гг. у овец, для которых кормом служило
зерно проросшего ячменя с одного израильского завода по производству солодового
экстракта, смертность овец составила 96% [251]. Помимо того, что Asp. clavatus раз-
множается в ходе солодоращения и заражает колеоптили и корешки, этот микроорга-
низм может случайно контаминировать ростки после сушки, а затем развиваться при
хранении в условиях повышенной влажности. Как уже отмечалось, Asp. clavatus спо-
собен расти на ростках при относительной влажности 92,5% и выше, и таким образом
ростки с av 0,925 (\|/ = -10 МПа) и выше способствуют росту плесени и образованию
токсинов [90].
Причиной микотоксикоза бывают не только ростки или проросшее зерно. При про-
изводстве пива на основе сорго влажные остатки солода, предназначенные для сушки
и последующей передачи на корм скоту, также бывают контаминированы Asp. clavatus
и могут стать причиной падежа крупного рогатого скота. Присутствовала ли эта пле-
сень до сушки или заражение произошло во время нее, точно не известно, но как бы то
ни было, практика передачи отходов солодоращения на сушку может усиливать раз-
витие этой плесени [140]. В ходе лабораторных исследований было обнаружено, что
Asp. clavatus способны расти на пивной дробине [90], но ее обработка пропионовой
кислотой (ее применяют для обработки ячменя, хранящегося в условиях повышен-
ной влажности и предназначенного на корм скоту) может предотвратить развитие
этого плесневого гриба.
Глава 4. Микробиота ячменя и солода
153
Что касается пива, то хотя давно признано, что на него влияют некоторые природ-
ные токсины, само их присутствие определить долгое время не могли [84]. К приме-
ру, во Франции еше в XIII веке во времена царствования Людовика IX было запреще-
но использование травы Lolium temulentum (temulentia — опьянение), применявшейся
для придания пиву крепости и усиления его воздействия. Существует документаль-
ное свидетельство 1669 г., что присутствие этой травы в урожае ячменя в Западной
Шотландии произвело такой эффект, что «четверть пинты выпитого эля или пива
с этой травой опьяняло человека больше, чем целый галлон другого напитка» [261].
Хотя это еще не доказано, но существует возможность того, что токсины, продуциру-
емые I. temulentum, являются алкалоидными микотоксинами эндофитных грибов,
аналогичных тем, что вызывают микотоксикоз скота, на корм которому используют
траву с зараженных пастбищ. В 1980-е гг. в США был зарегистрирован случай остро-
го заболевания у человека, и косвенные данные свидетельствуют, что его причиной
могло стать присутствие в пиве микотоксинов (у человека, выпивший одну банку
пива, в течение более суток наблюдались неврологические и иные симптомов токси-
коза) [55]. Впоследствии в пустой банке из-под пива было обнаружено присутствие
микроорганизмов Pen. crustosum. При развитии в пивосодержащей среде этот гриб
продуцировал четыре алкалоидных микотоксина, действующих на центральную
нервную систему (фестуклавин и три разновидности рокфортина). Так как банка при
открывании не была дефектной, обстоятельства, при которых этот микроорганизм
в нее проник, развивался и продуцировал токсин, остаются загадкой.
Из многих нижеуказанных работ становится ясно, что в пиве могут присутство-
вать различные микотоксины, однако обычно в небольших концентрациях. В резуль-
тате экспериментов с добавлением токсина на различных этапах солодоращения
и пивоварения было выявлено присутствие в пиве небольших количеств афлатокси-
на Bv цитринина и ОА [45, 106, 154, 201]. Оказалось, что примерно 40% ОА солода
остается в дробине, еще треть деградирует, а 20% удаляется после брожения вместе
с дрожжами [201]. Зерно с высоким естественным содержанием ОА и цитринина не
подходит для солодоращения из-за своего внешнего вида и, кроме того, оно не спо-
собно к прорастанию [106,154]. С развитием аналитических методов появилась воз-
можность определять очень низкие концентрации ОА (менее 1 мкг/л) и оказалось,
что в пиве этот токсин присутствует чаще, чем предполагалось ранее. Наибольшая
его концентрация была отмечена в немецком пиве (1,53 мкг/л) [243].
На основе анализа работ по токсинам, присутствовавшим в ячмене, был сделан
вывод, что большая часть ZEA и трихотеценового токсина Г-2 теряется или дегради-
рует при солодоращении [93], а 77% добавленного в ячмень трихотеценового DON
исчезло при проращивании [73]. При использовании солода из ячменя, сильно кон-
таминированного F. culmorum, в пиво не попало ни ZEA, ни Г-2 [176], однако в корей-
ском солоде были обнаружены ZEA и трихотеценовые DON и NIV [159, 160], а в до-
машнем кукурузном замбийском пиве было выделено до 4,6 мг ZEA/л [165]. При
исследовании нигерийского безалкогольного пива, приготовленного из проса и/или
красной гвинейской кукурузы, на 28 из 46 пивоварен был выделен токсин ZEA (пусть
и в небольших по сравнению с Замбией количествах — 12,5-200 мкг/л) [204]. Впо-
следствии было обнаружено, что 51% содержащегося в солоде ZEA перешло в гото-
вый продукт [205].
154
Брайен Флэнниган
Данные [204] подтвердили более ранние сведения о том, что контаминация афла-
токсинами широко распространена [206]. Все 23 исследованных образца пива содер-
жали афлатоксин В, концентрацией от 1,7 до 137 мкг/л, что сравнимо с 92-262 мкг/л,
то есть с теми концентрациями, которые приведены в [8] для традиционных нигерий-
ских сортов пива. Эти концентрации отличаются от показателей, полученных в ходе
пятилетнего исследования коммерческих сортов южноафриканского пива на основе
сорго [265], по которым среднее содержание афлатоксина Вх в солоде из сорго соста-
вило 2,18 мкг/кг, причем 68% солода содержало > 1 мкг/кг, 20% — 1 -3 мкг/кг и лишь
в 4,5% солода афлатоксина Bt содержалось более 10 мкг/кг. Вместе с тем в 39% образ-
цов сусла, отобранных до брожения и розлива, и затем высушенного, этот токсин при-
сутствовал в порошке (0,3-6,0 мкг/кг), а в пиве на основе сорго он содержался лишь
в 5% образцов (в концентрациях 0,05-0,13 мкг/кг). Из этих результатов был сделан
вывод, что потребление пива на основе сорго для здоровья населения Южной Афри-
ки риска не представляет. В Европе при исследовании 86 образцов пива из разных
стран и 88 проб зерна, солода, гранул хмеля и другого пивоваренного сырья присут-
ствие афлатоксинов обнаружено не было [285]. Тем не менее иммунохимическим
методом, позволяющим определить концентрации в пределах 0,2-1,0 мкг/кг, афла-
токсины были выявлены в одной трети из 37 образцов ячменя, предназначенного для
солодоращения, и в 20% из 42 образцов солода (в 34 пробах пива никаких афлатокси-
нов обнаружено не было).
По сравнению с широко распространенными случаями обнаружения ZEA в мест-
ных африканских сортах пива в Европе этот токсин был обнаружен лишь в ходе одно-
го из четырех исследований, и только в одном образце [214]. В этом исследовании
анализировались 49 образцов европейского лагерного светлого пива, и фузариоток-
сины (трихотецены DON, DAS и Г-2) были выявлены всего в нескольких образцах
(в одном, двух и трех образцах соответственно). В рамках другого исследования ZEA
был выявлен лишь в одной из 23 проб пива [292]. Ранее, при анализе 24 проб пива,
импортированного в Италию, методом тонкослойной хроматографии не было обна-
ружено присутствия ни ZEA, ни других фузариотоксинов [39] (не было выявлено так-
же присутствия афлатоксинов, стеригматоцистина, цитринина и ОА). Тем не менее
последний из вышеуказанных токсинов, продуцируемый, по-видимому, присутству-
ющим на зерне Pen. verrucosum или другим пенициллом, а возможно и Asp. ochraceus,
был выявлен в 5 образцах лагерного пива [214]. Методом жидкостной хроматогра-
фии высокого разрешения было выявлено присутствие в ячмене, солоде и пиве охра-
токсина (предел обнаружения во всех трех образцах был 5 мкг/кг).
Европейское происхождение ZEA подтверждается канадскими исследованиями
50 образцов пива (как местных, так и импортных) [245]. Присутствие ZEA в них об-
наружено не было, DON содержался в 29 образцах (концентрация 0,33-50,3 мкг/мл),
a NIV— в трех (концентрация 0,10-0,84 мкг/мл). Из-за участившихся случаев обна-
ружения DON в канадских злаковых культурах было проведено экспериментальное
брожение с использованием сусла с внесенным токсином, и в результате было пока-
зано, что 85-96% добавленного DON удаляется из пива при брожении вместе с дрож-
жами S. cerevisiae [245]. Сообщается также, что ни винные штаммы 5. cerevisiae, ни
протестированные штаммы других дрожжей не способны уменьшать содержание
DON в среде, контаминированной им в концентрации до 2,0 мкг/мл.
Глава 4. Микробиота ячменя и солода
155
В Германии, когда эффект гашинга связывали с присутствием в злаках большего ко-
личества DON, было установлено, что этот выделяемый Fusarium токсин в пораженных
ячмене и пшенице является не единственным [162, 192, 198]. К другим выявленным
микотоксинам относятся трихотецены 3-ацетилдезоксиниваленол (3-AcDON), DAS,
ниваленол и Г-2, а также неакетидный ZEA [162,192]. При исследовании 196 образцов
пива с разных пивзаводов было показано, что 75% образцов светлого пива, изготовлен-
ного из пшеничного солода, и около 25% образцов пива, изготовленного из ячменного
солода, содержали DON Так как эти пивзаводы находились в основном в Южной Гер-
мании, а примерно 20% образцов пива было отобрано с подозрением на наличие га-
шииг-эффекта, результаты относительно количества токсина в пиве дали несколько
искаженную картину. Тем не менее содержание этого токсина в пшеничном пиве (в сред-
нем 0,25 мкг/мл, максимальное значение — 0,57 мкг/мл) было значительно выше, чем
в пиве, сваренном из ячменного солода (0,15 мкг/мл и 0,48 мкг/мл соответствено).
Исследования содержания DON в естественно контаминированных ячменном и
пшеничном солодах было продолжено в [ 198,245]; показано, что концентрации DON
во время брожения остаются постоянными, а в готовом пиве его концентрация ока-
залась примерно такой же, что и в исходном солоде. В работе же [23], напротив, дока-
зыватся, что при брожении сусла происходит существенное изменение концентра-
ции. После засева дрожжей при низовом и верховом брожении наблюдалось трех-
и четырехкратное увеличение соответственно, однако к 20-му часу концентрации
упали ниже исходных, к 90-му часу они оказались минимальными, а затем постепен-
но росли вплоть до завершения брожения (5 сут). В зеленом пиве верхового броже-
ния концентрация DON оказалась примерно такой же, как в исходном сусле, а в пиве
низового брожения она увеличилась примерно в 2 раза. При анализе имеющихся
данных был сделан вывод, что среди токсинов, прошедших через весь процесс пиво-
варения, наиболее стабильным и переносящим этот процесс лучше всех является
DON [243]. Относительно недавно поступило сообщение об обнаружении DON
в 44% образцах аргентинского пива (концентрация 4-221 мкг/мл; причем примерно
у 20% образцов концентрация составила более 20 мкг/мл), однако был сделан вы-
вод, что такие концентрации не представляют риска для здоровья.
Исследования, проведенные в лаборатории бродильных производств Министер-
ства сельского хозяйства США [29] на двух партиях обработанной а-амилазой куку-
рузы с сильной естественной контаминацией FB{ (15 и 16 мкг/г соответственно) по-
казали, что при производстве этилового спирта произошло небольшое уменьшение
содержания этого токсина. Примерно 85% его сохранилось: основная часть — в вы-
сушенном зерне, предназначенном для дистиллирования, намного меньше — в филь-
трате барды и дистиллированнном растворе. В 9 из 41 образца пива, в котором при
приготовлении сусла в качестве крахмалистого несоложеного сырья была добавлена
кукуруза, был выявлен фумонизин (в концентрации 0,42-103 мкг/кг) [244]. Позже
стало известно о присутствии фумонизина в 64% канадского пива и 24% импортного
[248]. При добавлении в зараженное сусло дрожжей 5. cerevisiae токсин FBX показал
достаточную стабильность (как и FB2) [247]. В зависимости от штамма дрожжей со-
держание FBX в сусле уменьшается от 3 до 28%, a FB2 — от 9 до 17%, причем один из
штаммов утилизировал менее 1% FBX и 2% FBY Информация о том, что накопление
токсина происходит в дробине, а не в дистиллированном спирте [29], согласуется
156
Брайен Флэнниган
с более ранними данными по исследованию кукрузы, зараженной афлатоксином и
ZEA. Учитывая все это, становится ясно, что микотоксины в дистиллированный
спирт попасть не могут.
Реальное влияние на организм человека микотоксинов, находящихся в пиве, оценить
невозможно, так как в процессе брожения дрожжи метаболизируют их с образованием
веществ, которые могут обладать как большим, так и меньшим токсикогенным эффек-
том. В качестве примера можно привести TEA. Этот токсин часто встречается в ячмене,
а также накапливается в процессе солодоращения, однако в пиве он встречается редко
[237]. При этом обнаружено его производное — а-зеараленол, который образуется в ре-
зультате деятельности дрожжей при брожении. Это соединение в 3-4 раза более токсич-
но, чем ZEA, и представляет опасность для здоровья людей. При анализе 23 образцов пива
[292] только в одном был выявлен а-зеараленол, а во всех остальных случаях идентифи-
цировали его эстрогенный изомер — р-зеараленол.
Как уже упоминалось выше, ZEA в ходе брожения быстро превращается в зеарале-
нол. При экспериментальной ферментации сусла тремя промышленными штамма-
ми S. cerevisiae с искусственно внесенным ZEA было обнаружено, что после 7-9 сут
остается лишь 3% от начального содержания ZEA [245]. При этом в сброженном сус-
ле в основном присутствовал не а-зеараленол, а р-зеараленол, изомер с меньшими
эстрогенными свойствами, чем ZEA. Несколько раньше сообщалось, что 95% зеара-
ленола, образуемого из ZEA пивоваренным штаммом S. cerevisiae, представлено его
а-изомером. Позже по данным [28] выяснилось, что хотя ZEA в зависимости от
штамма Saccharomyces превращался как в а- так и в (J-зеараленол, в питательной сре-
де преобладал р-зеараленол. В то же время в клетках штамма верховых дрожжей
одержалось больше ZEA и а-зеараленола.
В настоящее время принято считать, что микотоксины, ассоциируемые с процес-
сом пивоварения, представляют больший риск для здоровья животных, чем челове-
ка. Как уже отмечалось выше, в дробине аккумулируются афлатоксины, фумонизи-
ны и ZEA [29]. По данным [241], в пиве, приготовленном из контаминированного
ZEA ячменя, не было выявлено присутствия этого токсина, тогда как в отработанной
дробине присутствовало примерно 60% начального количества токсина. В значи-
тельных количествах в дробине обнаруживаются трихотецены [176] и ОА [201]. Как
отмечается в [29], отработанную и содержащую большое количество микотоксинов
дробину перед ее использованием на корм скоту следует обязательно подвергать де-
токсикации (например, формальдегидом или аммонийными соединениями).
4.6. Оценка плесневой контаминации
Перед тем как рассмотреть методы получения детальной информации по качествен-
ному и количественному составу грибов, контаминирующих зерно, следует уделить
некоторое внимание экспресс-методам, позволяющим определить активность грибов
в зерне еще до явных проявлений порчи. Одним из таких давно известных методов
является измерение количества свободных жирных кислот, выделяемых в ходе липо-
литической активности грибов при их инвазии в зерно [42, 174]. В этих же работах
рассмотрены и другие методы — в частности, определение содержания редуцирующих
Сахаров и амилолитической активности, хотя последняя не проявляется до тех пор,
пока плесень не становится заметной невооруженным глазом. В [174] описаны также
Глава 4. Микробиота ячменя и солода
157
эксперименты, проводившиеся на зерновых складах и показавшие, что уровни N-аце-
тил-р-глюкозаминидазы, р-£>-галактозидазы и p-D- глюкозидазы в контаминирован-
ном зерне существенно повышаются еще до того, как плесень становится заметна
невооруженным глазом. К другим тестам, использовавшимся в экспериментах и пока-
завшим разный уровень корреляции с размножением грибов или накоплением их био-
массы, можно отнести измерение дыхательной активности (выход С02, потребление
02 или выделение тепла), уровня аденозинтрифосфата (АТФ) и эргостерола [174].
В работе [ 1 ] было высказано предположение, что своевременный сигнал о росте
грибов и потенциальной возможности образования в партии зерна токсинов может
дать присутствие летучих органических соединений (ЛОС). В настоящее время су-
ществует множество публикаций, посвященных образованию веществ, формирую-
щих вкус и аромат. Эти вкусо-ароматические вещества, вырабатываемые грибами,
придают продуктам (например, голубым сырам) определенные качественные харак-
теристики. Довольно неполный список спиртов, альдегидов, кетонов, эфиров, пира-
зинов и некоторых видов микроорганизмов, продуцирующих эти ЛОС, представлен
в [175]. У различных соединений формируется разный профиль ЛОС, который так-
же зависит от температуры и типа субстрата. Например, в [213] сообщается, что сре-
ди ЛОС, выделяемых продуцентом трихотеценов F. sporotrichioides, преобладают
терпены — сами трихотецены относятся к сесквитерпенам, они не летучи. В то же
время у Pen. verrucosum (продуцент О А) преобладают летучие кетоны (охратоксины
являются нелетучими пентакетидами). Различия заметны и на подвидовом уровне —
например, с помощью компонентного анализа ЛОС, продуцируемых чистыми куль-
турами, удалось отличить микотоксигенные штаммы от миконетоксигенных, хотя
оба они относились к Fusarium spp. [145]. Для ячменя, контаминированного есте-
ственным путем и содержащего 16% влаги, было показано, что основными ЛОС яв-
ляются З-метил-1-бутанол, 3-октанон, 1- октанол и 1-октен-З-ол (высшие спирты)
[2]. Их содержание над поверхностью ячменя достигло максимума через шесть не-
дель, а затем уменьшилось. Последнее из указанных соединений в ячмене с содержа-
нием влаги в 20% определено не было, но в целом уровень ЛОС в этом случае оказал-
ся выше, чем в ячмене с меньшим содержанием влаги (это касалось и других
индикаторов порчи — температуры, объема С02 над поверхностью культуры свобод-
ных жирных кислот и КОЕ).
Несмотря на то что к методам раннего обнаружения роста плесеней проявляется
большой интерес, методы газовой хроматографии и масс-спектроскопии (ГХ-МС)
для обнаружения и идентификации ЛОС требуют больших затрат времени и средств
(дорогое оборудование, большие эксплуатационные затраты, расходы на заработную
плату). Вместе с тем развитие новых технологий (в частности, «электронного носа»)
открывает новые возможности по обнаружению порчи и их применения в органолеп-
тическом анализе. Так, с помощью «электронного носа» с 14 пластинами на основе
полимерных датчиков были исследованы ЛОС над чистой культурой. Было получе-
но хорошее воспроизведение данных по штаммам некоторых видов плесеней, а мето-
ды анализа основного компонента, дискриминантой функции и кластерного анализа
позволили различить три вида Eurotium spp., Penicillium spp. и ксерофильные Wallemia
sebi. [ 144]. Упоминавшееся выше исследование профилей ЛОС токсигенных и неток-
сигенных штаммов Fusarium [145] было выполнено при помощи аналогичного «элек-
158
Брайен Флэнниган
тронного носа». Для оценки корреляции результатов анализа с помощью «электрон-
ного носа» образцов, искусственно обсемененных плесенью, и коммерческой пшени-
цы, и распознавания посторонних запахов человеком использовалась искусственная
нейронная сеть, модифицированная для ускоренной классификации запахов [76].
Прогноз, осуществленный с помощью такой нейронной сети, был успешен на 92,3%,
причем ни один заведомо плохой образец не был отнесен к «хорошим». Результаты
анализа с применением других электронных методов приведены в [ 175], где высказа-
но предположение, что скоро станет реальностью разработка системы мониторинга
качества зерна. Технология «электронного носа» может применяться и в других обла-
стях солодоращения и пивоварения — так, в [280] рассмотрено применение этой тех-
нологии не только для определения посторонних запахов в злаковых культурах, пред-
назначенных для солодоращения, но и в несоложеном сырье, солоде и пиве.
Поскольку наиболее значимой с точки зрения микробиологии пивоварения являет-
ся оценка контаминации ячменя и солода грибами, стоит отметить, что методы оценки
контаминации зерен (в %) различными плесенями изложены в Analitica Microbiologic!
ЕВС, Часть II [189]. Помимо прямого посева без дезинфекции поверхности в работе
[81] для определения количества жизнеспособных плесеней описывается посев мето-
дом разведения. Полезным для идентификации плесеней является и работа [230], где
приведены советы по идентификации микроорганизмов, подкрепленные рисунками и
черно-белыми фотографиями многих видов грибов, поражающих зерновые культуры.
Отдельные разделы посвящены выявлению и количественному анализу плесеней
и микотоксинов, а также тем или иным средам (селективным и общего назначения).
Полезные советы по идентификации грибов приведены и в [96] — эта работа имеет то
преимущество, что приводятся цветные иллюстрации, описывающие культуральные
и микроскопические признаки около 90 наиболее часто встречающихся видов грибов,
большинство из которых были выделены из ячменя.
Следует отметить, что количество систематиков, на которых можно ссылаться при
идентификации представителей крупных родов Aspergillus, Penicillium и Fusarium,
относительно невелико. Основываясь на количестве неправильно идентифициро-
ванных видов Fusarium (по мнению д-ра П. Нельсона, мирового авторитета по
Fusarium), в работе [185] утверждается, что около 50% идентификаций, приводимых
в различных изданиях, являются некорректными. Хотя количество ошибок в опре-
делениях может быть и не так велико, очевидно, что проводимые на местах иденти-
фикации микроорганизмов необходимо верифицировать. Следует также проявлять
осторожность в работе с изданиями, где списки идентифицированных микроорга-
низмов не выверены специалистами, имеющими авторитет в этой области.
Что касается современной номенклатуры грибов, наиболее полезными справоч-
никами являются American Type Culture Collection (ATCCt США), Centraalbureau voor
Schimmelcultures (CBS, Нидерланды) и CAB InternationalMycological Institute (Вели-
кобритания). Полезен также интернет-сайт этого института с указателем названий
грибов (Funindex) (http://194.131.255J/cabipages/Names/Names.asp). База данных
по наименованиям грибов содержит все когда-либо опубликованные названия и спи-
сок наиболее авторитетных специалистов по данному микроорганизму. Поиск мож-
но производить как по родам, так и по видам. Например, в списке микроорганизмов,
выделенных из ячменя и солода, в работе [202] указывается, что Helminthosporium
Глава 4. Микроб йота ячменя и солода
159
graminearum был обнаружен Флэнниганом и описан в [79]. В результате поиска
в этой базе данных по «Helminthosporium» появляется 714 наименований, но Helmin-
thosporium graminearum среди них нет; при поиске по «graminearum» появляется во-
семь названий, включая Fusarium graminearum, но Н. graminearum по-прежнему от-
сутствует. Тем не менее в Funindex H.gramineum присутствует, но оказывается
анаморфом применяющегося в настоящее время наименования Pyrenophora grami-
пеа. Упоминавшаяся ссылка на [79] свидетельствует, что в работе [202] неправильно
назван микроорганизм, о котором шла речь в 1970 г. {H.gramineum).
В течение обозримого времени будут использоваться в основном традиционные
методы обнаружения грибов, количественного анализа и идентификации плесеней,
но все шире начинают применяться и новые ускоренные методы анализа. Так, на
пивоваренном предприятии Carlsberg для обнаружения Fusarium в ячмене и солоде
уже применялся метод ELISA, основанный на энзимологическом иммуносорбентном
анализе [271,272], который показал высокий уровень присутствия антигена Fusarium
с высокой вероятностью эффекта гашинга. Еще один иммунологический метод при-
менялся в [238, 239], в котором для определения преобладания в ячмене микроорга-
низмов рода Fusarium и определения количественной корреляции результатов дан-
ного теста и уровней DON/ADON использовался тест на агглютинацию латекса на
базе антител экзополисахаридов (ЭПС). Несмотря на то что эти методы специфич-
ны для каждого рода, существует возможность их усовершенствования до различи-
мости видов. Высокоспецифичный метод ELISA, основанный на моноклональных
антителах, и методы определения содержания специфичного гриба, развивающегося
на зерне при хранении {Penicillium islandicum) были разработаны на рубеже 1990-х гг.
Дьюи {Dewey) и др. [57]. Примеры использования метода ELISA приводятся в [58],
где дается оценка микоиммунодиагностики в сельском хозяйстве.
Иммунологические методы могут также использоваться для обнаружения и кали-
чественной оценки микотоксинов. Кроме того, в качестве более быстрых средств (по
сравнению с методами газовой и жидкостной хроматографии) широко начали приме-
няться промышленные иммуноаффинные колонки и наборы для £Х/5Л-анализа на
афлатоксин, ОА, DON, Г-2, фумонизин и ZEA [62, 63, 132, 133]. Данные по примене-
нию наборов для £1/5Л-анализа на DON, ZEA и ОА в условиях пивоваренных пред-
приятий приведены в [27], а использование иммуноаффинной колонки для анализа
на ОА в ячмене и пиве — в [62]. Метод ELISA применялся также для определения
цитринина (часто присутствующего в злаках вместе с ОА) [3]. Хотя при исследова-
нии пива метод ELISA дает заниженную оценку фумонизина [248], но его все-таки
можно считать полезным и быстрым методом.
Кроме указанных иммунологических методов в лабораториях Европы и Северной
Америки, исследования направлены и на патологию растений и пищевую микробио-
логию. В них широко применяются высокочувствительные молекулярные методы,
основанные на продуцировании цепной реакцией полимеразы (ЦРП, PCR) милли-
онов копий молекулы ДНК. Один из подходов направлен на разработку ускоренно-
го метода образования полиморфной молекулы ДНК {RAPD) для идентификации
микроорганизмов [32] (подробнее об этом см. главу 8), и по экономическим причи-
нам особое внимание привлекает Fusarium spp. В работе [209], к примеру, метод
RAPD-PCR использовали для отличения F. graminearum, вызывающего болезни яч-
160
Брайен Флэнниган
меня, от других видов фузарий, и распознавания этого гриба в полевых условиях.
Метод RAPD-PCR был усовершенствован для обнаружения F.poae в пробах семян
[211]. Отмечается, что степень изоцима и &4РО-РСЯ-полиморфизма в фузариях,
включая F. avenaceum, F. culmorum, F. equiseti и F. graminearum, таковы, что сочетание
пилиакрилимидного и агарозогелевого электрофореза с RAPD-PCR обеспечивает
мощное средство идентификации (как вида, так и штамма). Методы определения
специфичных видов F. avenaceum, F. culmorum и F. graminearum на основе PCR описа-
ны в [236]. Они позволяют определить < 10"12 г грибной ДНК и применяются для
обнаружения отдельных фузарий в экстрактах из тканей стеблей и зерен, где обна-
ружены соответствующие симптомы заражения. Разработан также PCR-метод, по-
зволяющий селективно определять F. graminearum и F. culmorum с минимальными
перекрестными реакциями с некоторыми другими видами этого рода.
Для обнаружения фузарий в пшенице, ячмене и солоде были разработаны три
РС/?-метода [199]. Первый для определения галактозооксидазы в F. graminearum оп-
ределяет последовательность ДНК в кодировке гена. Второй метод специфичен для
генной последовательности tri5, кодирующей триходиенсинтазу (первый фермент,
используемый для синтеза трихоцетина) в F. graminearum и F. culmorum (два основ-
ных продуцента DON). Третий метод также направлен на ген tri5, но на этот раз вы-
является последовательность, общая для всех видов данного рода, продуцирующих
трихотецен. После исследований на пшенице, в которых PCR-сигнал был получен
у всех образцов, содержащих более 500 мкг DON/кг, и в которых интенсивность это-
го сигнала коррелировала с концентрацией DON, был сделан вывод [199], что наи-
лучшим для гарантии качества в солодоращении и пивоварении является третий
метод. Была предложена несложная и быстрая процедура экстракции ДНК из
Fusariumt контаминирующего пшеницу и солод, и отмечен положительный PCR-сиг-
нал в образцах, содержащих более 0,2 г DON/кг [191]. В будущем предполагается,
что время, необходимое для анализов образцов, сократится до 30 мин (для традици-
онных методов выявления и идентификации фузарий требуется намного больше
времени). Видоспецифичная PCR использовалась в [65] в качестве инструмента для
исследования степени распространености F. avenaceum, F. culmorum, F. graminearum,
F. poae и Microdochium nivale (ana. F. nivale) в пораженных колосьях пшеницы. Была
установлена хорошая корреляция между визуальной оценкой этой болезни и резуль-
татами PCR, а также отмечено заметное преобладание F. culmorum. Позднее количе-
ственный РСР-метод применялся в [65], и было отмечено, что степень поражения
F. роае по сравнению с F. culmorum меньше. Кроме того, PCR-ELISA-метол применялся
для определения видов фузарий, продуцирующих фумонизин [112], и было установ-
лено, что хотя /Г51-области рибосомных ДНК были очень однородны (см. главу 9),
некоторые минимальные различия позволили отделить продуцентов фумонизина от
непродуцентов.
Тем не менее фузарий — это не единственный гриб, для обнаружения которого
применяются методы, основанные на PCR. Например, в [15] РСЯиспользовалась для
исследования патогенов, присутствующих в тканях листьев пшеницы и переносимых
с семенами (Stagonospora (Septoria) nodorum и Septoria tritici), а в [98] PCR применя-
лась для отслеживания развития заболеваний пшеницы в поле. Еще одним примером
может служить молекулярная идентификация видов группы Pen. roqueforti — они ас-
Глава 4. Микробиота ячменя и солода
161
социируются с порчей зерна [30]. Последним примером использования РСЙявляется
определение Ustilago kordei, являющегося причиной поражения головней ячменя
[284]. Хотя ни один из перечисленных методов не разрабатывался специально для
исследований состава микробиоты ячменя и в ходе солодоращения, очевидно, что они
вполне применимы и в этих целях.
Литература
1. Abramson, D., Sinha, R.N., and Mills, J.T. (1980) Cereal Chemistry, 57,346.
2. Abramson, D., Sinha, R.N,., and Mills, J.T. (1983) Cereal Chemistry, 60, 350.
3. Abramson, D., Usieber, E., and Martlbaur, E. (1996) Journal of AOAC International, 76,1325.
4. Abramson, D., Clear, P.M., Usieber, E., Geissler, R., Nowicki, T.W., and Martlbaur, E. (1998)
Cereal Chemistry, 75,137.
5. Abramson, D., Hulasare, R., White D.G., Jayas, D.S., and Marquardt, R.R. (1999) Journal of
Stored Products Research, 35,297.
6. Ackerman, A. (1998) Journal of the American Society of Brewing Chemists, 56,169
7. Abdel-Kader, M.I.A., Moubasher, A.H., and Abdel-Hafez, S.I.I. (1979) Mycopathologia, 68,143.
8. Alozie, T.C., Rotimi, C.N., and Oyibo, B.B. (1980) Mycopathologia, 70,125.
9. Amaha, M., Kitabatake, K., Nakagawa, A., Yoshido, J., and Harada, T. (1973) Proceedings of
the 14th Congress of the European Brewery Convention, Salzburg, pp.381.
10. Amaha, M., Kitabatake, K., Nakagawa, A., Yoshido, J., and Harada, T. (1974) Bulletin of
Brewing Science, 20, 35.
11. Andersen, K., Gjertsen, P., and Trolle, B. (1967) Brewers Digest, 42,76.
12. Armolik, N.. Dickson, J.G., and Dickson, A.D. (1956) Phytopathology, 46,457.
13. Ballestros, G., and Piendl, A. (1977) Brewers' Digest, 17, 36.
14. Beattie, S., Schwarz, P.B., Horley, R., Barr, J., and Casper, H.H. (1998) Journal of Food
Protection, 61,103.
15 Beck, J.J., and Ligon, J.M. (1995) Phytopathology, 85,319.
16. Blyth, W. (1978) Clinical and Experimental Immunology, 32,272.
17. Blyth, W., and Hardy, J.C. (1982) British Journal of Cancer, 45,105.
18. Blyth, W., Grant, I.W.B., Blackadder, E.S., and Greenberg, M. (1977) Clinical Allergy, 7,549.
19. Boeira, L.S. (2000) Effects of Fusariotoxins on the Performance of Brewing Yeast strains,
Ph.D. Thesis, Heriot-Watt University, Edinburgh, U.K.
20. Boeira, L.S., Bryce, J.H., Stewart, G.G., and Flannigan, B. (1999a) Journal of the Institute of
Brewing, 105,366.
21. Boeira, L.S., Bryce, J.H., Stewart, G.G., and Flannigan, B. (1999b) Journal of the Institute of
Brewing, 105,376.
22. Boeira, L.S., Bryce, J.H., Stewart, G.G., and Flannigan, B. (2000) Journal of Applied
Microbiology, 88,388.
23. Bohm-Schramml, M., Stettner, G., Geiger, E. (1997) Cereal Research Communications, 25,729.
24. Boivin, P., and Malanda, M. (1993) Proceedings of the 24th Congress of the European
Brewery Convention, Oslo, p. 95.
25. Boivin, P., and Malanda, M. (1997) Proceedings of the 26th Congress of the European
Brewery Convention, Maastricht, p. 117.
26. Boruff, C.S., Claassen, R.I., and Sotier, A.L. (1938) Cereal Chemistry, 15,451.
27. Bosch, H., Tessin, N., Bellner, H.-G., and Вав1ег, H.M.S. (1994) Monatsschrift fur
Brauwissenschaft, 47,196.
162
Брайен Флэнниган
28. Boswald, С, Engelhardt, G., Vogel, H., and Wallnofer, PR. (1995) Natural Toxins, 3,138.
29. Bothast, R.J., Bennett, G.A., Vancauwenberge, J.E., and Richard, J.L. (1992) Applied and
Environmental Microbiology, 58, 233.
30. Boysen, M.E., Jacobson, K.-G., and Schniirer, J. (2000) Applied and Environmental
Microbiology, 66,1523.
31. Bridge, J.C. (1932) In: Annual Report of the Chief Inspector of Factories, HMSO, London, p. 41.
32. Bridge, P.O., Arora, D.K., Reddy, C.A., and Blander, R.P. (1998) Applications of PCR in
Mycology, CAB International, Wallingford, U.K.
33. Briggs, D.E. (1966) Nature, 210,418.
34. Briggs, D.E., and McGuiness, G. (1993) Journal of the Institute of Brewing, 99, 249.
35. Brodnik, T. (1975) Seed Science and Technology, 3,691-696.
36. Buckle, A.E. (1983). Veterinary Research Communications, 7,171.
37. Bullock, J.D. (1984) In: The Applied Mycology of Fusarium (M.O. Moss and J.E. Smith, eds),
Cambridge University Press, Cambridge, p. 215.
38. Campbell, H., Choo, T.M., Vigier, В., and Underbill, L. (2000) Canadian Journal of Plant
Science, SO, 977.
39. Cerrutti, G., Vecchio, A., Finoli, C, and Trezzi, A. (1987) Monatsschrift fur
Brauwissenschaft, 40,455.
40. Channell S., Biyth, W., Lloyd, M., Weir, D.M., Amos, W.M.G., Littlewood, A.P, Riddle,
H.F.V., and Grant, I.W.B. (1969) Quarterly Journal of Medicine, 38, 35.
41. Christensen, CM. (1973) Seed Science and Technology, 1,547.
42. Christensen, СМ., and Kaufmann, H.H. (1969) Grain Storage, The Role of Fungi in Quality
Loss, University of Minnesota Press, Minneapolis.
43. Christensen, СМ., and Kaufmann, H.H. (1974) In: Storage of Cereal Grain and its Products
(ed. С М. Christensen), American Association of Cereal Chemists, St Paul, p. 158.
44. Christensen, J.J., and Stakman, B.C. (1935) Phytopathology, 25,309.
45. Chu, F.S., Chang C.C., Ashoor, S.H., and Prentice, N. (1975) Applied Microbiology, 29,313.
46. Clamagirand, V., and Boivin, P. (1997) Proceedings of the 26th Congress of the European
Brewery Convention, MaaSicht, p. 109.
47. Clardy, J., Springer, J.P, Buechi, G., Matsuo, K., and Wightman, R. (1975) Journal of the
American Chemical Society, 97, 663.
48. Clarke, J.H., and Hill, S.T. (1981) Transactions of the British Mycological Society, 77,557.
49. Clarke, J.H., Hill, S.T, and Niles, E.V. (1966) Pest Infestation Research, 1965,13.
50. Clarke, J.H., Niles, E.V., and Hill, S.T. (1967) Pest Infestation Research, 1966,14.
51. Clarke, J.H., Hill, S.T, Niles, E.V., and Howard, M.A.R. (1969) Pest Infestation Research,
1968,17.
52. Clear, R.M., Patrick, S.K., Platford, S.K., and Desjardins, M. (1996) Canadian Journal of
Plant Pathology, 18,409.
53. Clear, R.M., Patrick, S.K., Nowicki, T, Gaba, D., Edney, M., and Babb, J.C. (1997) Canadian
Journal of Plant Science, 77,161.
54. Clear, R.M., Patrick, S.K., and Gaba, D. (2000) Canadian Journal of Plant Pathology, 22,44.
55. Cole., R.J., Dorner, J.W., Cox, R.H. and Raymond, L.W. (1983) Journal of Agricultural and
Food Chemistry, 31, 655.
56. Dennis, C.A.R. (1973) In: Grain Storage: Part of a System (eds R.N. Sinha and WE. Muir),
Avi, Westport, Connecticut, p. 367.
57. Dewey, P.M., MacDonald, M.M., Phillips, S.I., and Priestley, R.A. (1990) Journal of General
Microbiology, 136,753.
Глава 4. Микробиота ячменя и солода
163
58. Dewey, KM., and Thornton, С. (1995) In: New Diagnostics in Crop Scienc, (eds J.H. Skerritt
and R. Appels), CAB International, Wallingford, U.K., p. 151.
59. Doko, M.B., Canet, C, Brown, N., Sydenham, E.W, Mpuchane, S., and Siame, B.A. (1996)
Journal of Agricultural and Food Chemistry, 44, 3240-3243.
60. Dolan, T.C.S. (1979) The Brewer, 65,60.
61. Donhauser, S.,Weideneder, A., Winnewisser, W., and Geiger, E. (1989) Brauwelt, 129,1658.
62. Donnelly, С (1996) In: Mycotoxins in Cereals (ed. J.P.F. D'Mello), Handbook for Fourth
SAC Conference, Scottish Agricultural College, Edinburgh, p. 62
63. Donnelly, С (1997) In: Mycotoxins in Cereals (ed. J.P.F. D'Mello), Handbook for Fifth SAC
Mycotoxin Conference, Scottish Agricultural College, Edinburgh, p. 96.
64. Doohan, P.M., Parry, D.W., Jenkinson, P., and Nicholson, P. (1998) Plant Pathology, 47,197.
65. Doohan, P.M., Parry, D.W., and Nicholson, P. (1999) Plant Pathology, 48, 209.
66. Doran, P.J., and Briggs, D.E. (1993) Journal of the Institute of Brewing, 99,165.
67. Douglas, P.E. (1984) A Microbiological Investigation of Industrial Malting of Barley, MSc
Thesis, Heriot-Watt University.
68. Douglas, P.E., and Flannigan, B. (1988) Journal of the Institute of Brewing, 94, 85.
69. Dowell, F.E., Rana, M.S., and Seitz, L.M. (1999) Cereal Chemistry, 76,573.
70. Dowd, P.R., Miller, J.D., and Greenhaigh, R. (1989) Mycologia, 81, 646.
71. Drysdale, R.B. (1984) In: The Applied Mycology of Fusarium (eds M.O. Moss and J.E. Smith),
Cambridge University Press, Cambridge, p. 95.
72. Dufour, J.P., and Melotte, L. (1992) Journal of the American Society of Brewing Chemists, 50,110.
73. El-Banna, A.A. (1987) Mycotoxin Research, 3,37.
74. Etchevers, G.C, Banasik, O.J., and Watson, C.A. (1977) Brewers' Digest, 52,46.
75. Evans, C.K., Kolaczkowski, E.K., Mirocha, С J., and Dill-Macky, R. (1997) Phytopathology,
87 (Supplement), S29.
76. Evans, P., Persaud, K.C., McNeish, A.S., Sneath, R.W., Hobson, N., and Magan, N. (2000)
Sensors and Actuators B, 69,348.
77. Ferguson, P.E., Flannigan, В., and Schapira, S.F.D. (1984) SJM News 34 (4), 45.
78. Flannigan, B. (1969) Transactions of the British Mycological Society, 53, 371.
79. Flannigan, B. (1970) Transactions of the British Mycological Society, 55, 277.
80. Flannigan, B. (1974) Transactions of the British Mycological Society, 62,51.
81. Flannigan, B. (1977) In: Biodeterioration Investigation Techniques (ed. A.H. Walters),
Applied Science, London, p. 185.
82. Flannigan, B. (1978) Transactions of the British Mycological Society, 71, 37.
83. Flannigan, B. (1983) Journal of the Institute of Brewing, 89, 364.
84. Flannigan, B. (1989) In: Biodeterioration Research II (eds G.C. Llewellyn and C.E. O'Rear),
Plenum, New York, p. 191.
85. Flannigan, B. (1991) In: Toxic Substances in Crop Plants (eds J.P.F. D'Mello, CM. Duffus
and J.H. Duffus), Royal Society of Chemistry, London, p. 226.
86. Flannigan, В., and Bana, M.S.O. (1980). In: Biodeterioration, Proceedings of the Fourth
International Symposium, Berlin (eds T.A. Oxiey, D. Allsopp and G. Becker), Pitman,
London, p. 229.
87. Flannigan, В., and Barnes, S.D. (1990) Proceedings of the Japanese Association of
Mycotoxicology, 31, 25.
88. Flannigan, В., and Campbell, 1. (1977) Transactions of the British Mycological Society, 69,
485.
89. Flannigan, В., and Healy, R.E. (1983) Journal of the Institute of Brewing, 89, 341.
164
Брайен Флэнниган
90. Flannigan, В., and Реагсе, A.R. (1994) In: Biology of Aspergillus (eds K.A. Powell, J. Peberdy
and E. Renwick), Plenum, New York, p. 115.
91. Flannigan, В., Okagbue, R.N., Khalid, R., and Teoh, C.K. (1982) Brewing and Distilling
International, 12,3134, and 37.
92. Flannigan, В., Day, S.W., Douglas, P.E., and McFarlane, G.B. (1984) In: Toxigenic Fungi-Their
Toxins and Health Hazard (eds K. Kurata and Y. Ueno), Kodansha/Elsevier, Tokyo, p. 52.
93. Flannigan, В., Morton, J.G., and Naylor, RJ. (1985) m: Trichothecenes and Other
Mycotoxins (ed. J. Lacey), Wiley, New York, p. 171.
94. Flannigan, В., Healy, R.E., and Apta, R. (1986) In: Biodeterioration 6 (eds S. Barry, D.R. Hough-
ton, G.C. Llewellyn and C.E. O'Rear), Commonwealth Agricultural Bureaux International,
Farnham Royal, p. 300.
95. Flannigan, В., Naylor, R.J., Prescott, G.M., and Schapira, S.F.D. (1986) In: Biodeterioration
6 (eds S. Barry, D.R. Houghton, G.C. Llewellyn and C.E. O'Rear), Commonwealth
Agricultural Bureaux International, Farnham Royal, p. 238.
96. Flannigan, В., Samson, R.A., and Miller, J.D. (eds) (2001) Microorganisms in Home and
Indoor Work Environments, Harwood, Reading, Berks, published in 2001.
97. Follstad, M.N., and Christensen, CM. (1962) Applied Microbiology, 10, 331.
98. Fraaije, B.B., Lowell, D.J., Rohel, E.A., and Hollomon, D.W. (1999) Journal of Applied
Microbiology, 86, 701.
99. Frisvad, J.C., and Thrane, U. (2000) In: Introduction to Food- and Airborne Fungi, 6th ed,
(eds R.A. Samson, E.S. Hoeksa, J.C. Frisvad and O. Filtenborg), Centraalbureau voor
Schimmelcultures, Utrecht, p. 321.
100. Fukal, L., Prosek, J., and Rakosova, A. (1990) Monatsschrift fur Brauwissenschaft, 43, 212.
101. Fukushima, S., Kitabatake, K., and Amaha, M. (1976) Bulletin of Brewing Science, 22, 37.
102. Gaber, S.D., and Roberts, E.H. (1969) Journal of the Institute of Brewing, 75,303.
103. Gilmour, J.S., Inglis, D.M., Robb, J., and Maclean, M. (1989). Veterinary Record, 124,133-135.
104. Gjertsen, P., Trolle, В., and Andersen, K. (1963) Proceedings of the 9th Congress of the
European Brewery Convention, Stockholm, pp. 320.
105. Gjertsen, P., Trolle, В., and Andersen, K. (1965) Proceedings of the 10th Congress of the
European Brewery Convention, Brussels, pp. 428.
106. Gjertsen, P., Myken, R., Krogh, P., and Hald, B. (1973) Proceedings of the Uth Congress of
the European Brewery Convention, Salzburg, p. 373.
107. Glinsukon, Т., Yuan, S.S., Wightman, R., Kitaura, Y., Buechi, G., Shank, R.C., Wogan, G.N.,
and Christensen, CM. (1974) Plant Foods for Man, 1,113.
108. Graff, A.R. (1972) Technical Quarterley of the Master Brewers Association of America, 9,18.
109. Grain Dust in Makings (Maximum Exposure Limit), Guidance Note EH 67, HSE Books,
Sudbury, Suffolk, U.K. (1993)
110. Grant, I.W.B., Blackadder, E.S., Greenberg, M., and Biyth, W. (1976) British Medical
Journal, 1,490-493.
111. Greaney, F.J., and Machacek, J.E. (1942) Scientific Agriculture, 22,419.
112. Grimm, C, and Geisen, R. (1998) Letters in Applied Microbiology, 26,456.
113. Gunkel.J. (1998a) Brau Forum, 13,4.
114. Gunkel.J. (1998b) Monatsschrift fur Brauwissenschaft, 51, 72.
115. Gyllang, H., and Martinson, E. (1976a) Journal of the Institute of Brewing, 82,182.
116 Gyllang, H., and Martinson, E. (1976b) Journal of the Institute of Brewing, 82,350.
117 Gyllang, H., Satmark, L., and Martinson, E. (1977) Proceedings of the 16th Congress of the
European Brewery Convention, Amsterdam, p. 245.
Глава 4. Микробиота ячменя и солода
165
118. Gyllang, H., Kjellen, К., Haikara, A., and Sigsgaard, P. (1981) Journal of the Institute of
Brewing, 87, US.
119. Haikara, A. (1983) Proceedings of the 20th Congress of the European Brewery Convention,
London, p. 401.
120. Haikara, A., and Laitila, A. (1995) Proceedings of the 25th Congress of the European Brewery
Convention, Brussels, p. 249.
121. Haikara, A., Makinen, V., and Hakulinen, R. (1977) Proceedings of the 16th Congress of the
European Brewery Convention, Amsterdam, p. 35.
122. Haikara, A., Uljas, H., and Suurrnakki, A. (1993) Proceedings of the 24th Congress of the
European Brewery Convention, Oslo, p. 163.
123. Harper, S.H.T., and Lynch, J.M. (1979) Journal of General Microbiology, 112,45.
124. Harper, S.H.T., and Lynch, J.M. (1981) Journal of General Microbiology, 122,55.
125. Harrison, J.S., and Graham, J.C.J. (1970) In: The Yeasts, Vol. 3, Yeast Technology (eds A.H. Rose
and J.S. Harrison), Academic Press, London, p. 283.
126. Harrison, J.G., and Perry, D.A. (1976) Annals of Applied Biology, 84,57.
127. Healy, R.E. (1985) Effects of the Microflora of Barley on Malt Characteristics, PhD Thesis,
Heriot-Watt University.
128. Heaton, P.E., Callow, M.E., and Butler, G.M. (1992) International Biodeterioration and
Biodegradation, 29,135.
129. Hellberg, A., and Kolk, H. (1972) Acta Agriculturae Scandinavica, 22,137.
130. Hill, R.A., and Lacey, J. (1983a) Annals of Applied Biology, 102,455.
131. Hill, R.A.,and Lacey, J. (1983b) Annals of Applied Biology, 103,467.
132. Holmes, S.J. (1996) In: Mycotoxins in Cereals (ed J.P.F. D'Mello), Handbook for Fourth
SAC Conference, Scottish Agricultural College, Edinburgh, p. 70.
133. Holmes, S.J. (1997) In: Mycotoxins in Cereals (ed J.P.F. D'Mello), Handbook for Fifth SAC
Mycotoxin Conference, Scottish Agricultural College, Edinburgh, p. 69.
134. Howe, R.V. (1973) Seed Science and Technology, 1,563.
135. Ichinoe, M., Hagiwara, H., and Kurata, H. (1984) In: Toxigenic Fungi — Their Toxins and
Health Hazard (eds H. Kurata and Y Ueno), Kodansha/Elsevier, Tokyo, p. 190.
136. Jacobson, R.J., and Thomas, K.P. (1981) Plant Pathology, 30, 54.
137. Jenkins, J.E.E., Clarke, W.S., and Buckle, A.E. (1988) Fusarium Diseases of Cereals, HGCA
Research Review No. 4, Home Grown Cereals Authority, London.
138. Jorgensen, J. (1969) Friesia, 9,97.
139. Jorgensen, J. (1983) Seed Science and Technology, 11, 615.
140. Kellerman, T.S., Pienaar, J.G., van der Westhuizen, G.C.A., Anderson, L.A.P., and Naude,
T.W. (1976) Onderstepoort Journal of Veterinary Research, 43,147.
141. Kelly, L., and Briggs, D.E. (1992a) Journal of the Institute of Brewing, 98, 329.
142. Kelly, L., and Briggs, D.E. (1992b) Journal of the Institute of Brewing, 98, 395.
143. Kelly, L., and Briggs, D.E. (1993) Journal of the Institute of Brewing, 99, 57.
144. Keshri, G., Magan, N., and Voysey, P. (1998) Letters in Applied Microbiology, 27, 261.
145. Keshri, G., and Magan, N. (2000) Journal of Applied Microbiology, 89, 825.
146. Kitabatake, K., and Amaha, M. (1974) Bulletin of Brewing Science, 20,1.
147. Kitabatake, K., and Amaha, M. (1976) Bulletin of Brewing Science, 22,37.
148. Kneen, E. (1963) Proceedings of the Irish Maltsters Technical Conference, 1963, p. 51.
149. Koshinsky, H.A., and Khachatourians, G.G. (1993) Natural Toxins, 1, 38-47.
166
Брайен Флэнниган
150. Koshinsky, H., Honour, S., and Khachatourians, G. (1988) Biochemical and Biophysical
Research Communications, 151,809.
151. Koshinsky, H.A., Cosby, R.H., and Khachatourians, G.G. (1992) Biotechnology and Applied
Biochemistry, 16, 275.
152. Kotheimer, J.B., and Christensen, CM. (1961) Wallerstein laboratory Communications, 24,21.
153. Krogh, P., Hald, В., and Pedersen, EJ. (1973) Acta Pathologia et Microbiologia Scandinavica,
Section B, 28,31.
154. Krogh, P., Hald, В., Gjertsen, P., and Myken, F. (1974) Applied Microbiology, 28, 31.
155. Lacey, J. (1971) Annals of Applied Biology, 69,187.
156. Lacey, J. (1975) Transactions of the British Mycological Society, 81, 689.
157. Lacey, J., Hill, ST., and Edwards, M.A. (1980) Tropical Stored Products Information, 39,19.
158. Lafont, J., Romand, A., and Lafont, P. (1981) Mycopathologia, 74,119.
159. Lee, U.-S, Jang, H.-S., Tanaka, T, Hasegawa, A., Oh, Y.-J., and Ueno, Y. (1985) Food Additives
and Contaminants, 2,185.
160. Lee, U.-S., Jang, H.-S., Tanaka, Т., Hasegawa, A., Oh, Y.-J., Cho, C.-M., Sugiura, Y., and Ueno,
Y. (1986) Food Additives and Contaminants, 3,253.
161. Leiener, C.E.W., Niessen, M.L., and Vogel, R.F. (1997) Proceedings of the 26lb Congress of
the European Brewery Convention, MaaSicht, p. 69.
162. Lepschy-von Gleissenthal, J., Dietrich, R., Martlbauer, E., Schuster, M., Suess, A, and
Terplan, G. (1989) Zeitschrift fur Lebensmittel Untersuchung und Forschung, 188, 521.
163. Lillehoj, E.B., and Goransson, B. (1980) Acta Pathologia et Microbiologia Scandinavica,
Sections, 88,133.
164. Lopez-Diaz, T.M., and Rannigan, B. (1997) Food Microbiology, 35,129.
165. Lovelace, C.E.A., and Nyathi, C.B. (1977) Journal of the Science of Food and Agriculture, 28,288.
166. Ludwig, R.A. (1957) Canadian Journal of Botany, 35, 291.
167. Lund,A.(1956)Friesia,5,297.
168. Lund, A., Pedersen, H., and Sigsgaard, P. (1971) Journal of the Science of Food and
Agriculture, 22,458.
169. Lutey, R.W., and Christensen, CM. (1963) Phytopathology, 53,713.
170. Lynch, J.M., and Prynn, SJ. (1977) Journal of General Microbiology, 103,193.
171. McLean, M. (1996) Mycopathologia, 133,163.
172. Machacek, J.E., and Wallace, H.A.H. (1952) Canadian Journal of Botany, 30, 164.
173. Machacek, J.E., Cherewick, W.J., Mead, H.W., and Broadfoot, W.C. (1951) Scientific
Agriculture, 31,193.
174. Magan, N. (1993) International Biodeterioration and Biodegradation, 32,145.
175. Magan, N., and Evans, P. (2000) Journal of Stored Products Research, 36, 319.
176. Mannio, M., and Enari, T. (1973) Brauwissenschaft, 26,134.
177. Marasas, W.F.O., Nelson, P.E., and Tousson, T.A. (1984) Toxigenic Fusarium Species:
Identity and Mycotoxicology. Pennsylvania State University Press, University Park,
Pennsylvania.
178. Marasas, W.F.O., Miller, J.D., Riley, R.T., and Visconti, A. (2001) In: Fusarium: Paul E. Nelson
Memorial Symposium, (eds B.A. Summerell, D. Backhouse, W.L. Bryden and L.W. Burgess),
APS Press, St Paul, Minnesota.
179. Mason, FA. (1923) Bulletin of the Bureau of Biotechnology, 11/12, 78.
180. Matsuura, Y, and Yoshizawa, T. (1985) Shokuhin Eiseigaku Zasshi, 26, 24.
181. Matthews, S., and Collins, M.T. (1975) Seed Science and Technology, 3,863.
Глава 4. Микробиота ячменя и солода
167
182. Maude, R.B. (1996) Seedborne Diseases and Their Control: Principles and Practice. CAB
International, Wallingford, U.K..
183. Mead, H.W. (1943) Wallerstein Laboratory Communications, 6, 26.
184. Miller, J.D. (1995) Journal of Stored Products Research, 31,1.
185. Miller, J.D. (2001) Health and Safety Issues Relating to Mold Contamination of Wood Chips
in the Wood Fiberlndustries, NCASI Technical Bulletin 823, National Council for Air and
Seam Improvement, Research Triangle Park, North Carolina.
186. Mills, J.T., and Wallace, H.A.H. (1979) Canadian Journal of Plant Science, 59, 645.
187. Mills, J.T., Seifert, K.A., Frisvad, J.C., and Abramson, D. (1995) Mycopathologia, 130,23.
188. Ministry of Agriculture, Fisheries and Food Surveillance Paper no. 36 (1993), Mycotoxins;
Third Report, Her Majesty's Stationary Office, London.
189. Moll, M. (1981) Journal of the Institute of Brewing, 87,303.
190. Molto, G., Samar, M.M., Resnik, S., Martinez, E.J., and Pacin, A. (2000) Food Additives and
Contaminants, 17,809.
191. Mulfinger, S., Niessen, L., and Vogel, Rudi, F. (1999) Proceedings of the 27th Congress of the
European Brewery Convention, Cannes, p. 567.
192. Muller, H-M., and Schwadorf, K. (1993) Mycopathologia, 121,115.
193. Muller, H-M., ReimannJ., Schumacher, U., and Schwadorf, K. (1997) Mycopathologia, 137,185.
194. Munar, M.J., and Sebree, B. (1997) Journal of the American Society of the Brewing Chemists,
55,119.
195. Murphy, B. (1980) Unpublished results, cited in Flannigan and Healy (1983).
196. Niessen, L., and Donhauser, S. (1993) In K.A. Scudamore (ed). Occurrence and Significance
of Mycotoxins., Central Science Laboratory, Ministry of Agriculture, Fisheries and Food,
London, p. 203.
197. Niessen, L., Donhauser, S., Weideneder, A., Geiger, E., and Vogel, H. (1992) Brauwelt, 132,702.
198. Niessen, L., Bohm-Schraml, M., Vogel, H., and Donhauser, S. (1993) Mycotoxin Research, 9,
99-109.
199. Niessen, L., Mulfinger, S., and Vogel., Rudi, F. (1999) Proceedings of the 27th Congress of the
European Brewery Convention, Cannes, p. 541.
200. Nightingale, M.J., Marchylo, B.A.,Clear, P.M., Dieter, J.E., and Preston, K.R. (1999) Cereal
Chemistry, 76, 150.
201. Nip, W.K., Chang, C.C., Chu, F.S., and Prentice, N. (1975) Applied Microbiology, 30,1048.
202. Noots, I., Delcour,J.A.,and Michiels, C.W. (1999) Critical Reviews in Microbiology, 25,121.
203. Nummi, M., Niku-Paavola, M.-L., and Enari, T.-M. (1975) Brauwissenschaft, 28,130.
204. Okoye, Z.S.C. (1986) Journal of Food Safety, 7, 233.
205. Okoye, Z.S.C. (1987) Food Additives and Contaminants, 4, 57.
206. Okoye, Z.S.C, and Ekpenjong (1984) Transactions of- the Royal Society of Tropical
Medicine and Hygiene, 78,417.
207. O'Mahony, A., O'Sullivan, T.F, Walsh, Y., Maher, M., and Fitzgerald, G.F. (2000) Journal of
the Institute of Brewing, 106,403.
208. O'Sullivan, T.F, Walsh, Y, O'Mahony, A., Fitzgerald, G.F, and van Sinderen, D. (1999)
Journal of the Institute of Brewing, 105,55.
209. Ouellet, Т., and Seifert, K.A. (1993) Phytopathology, 83,1003.
210. Papendick, R.I., and Mulla, D.J. (1986) In: Water, Fungi and Plants, (eds PC. Ayres and L.
Boddy), Cambridge University Press, Cambridge, p. 1.
211. Parry, D.W., and Nicholson, P. (1996) Plant Pathology, 45, 383.
168
Брайен Флэнниган
212. Parry, D.W., Jenkinson, P., and McLeod, L. (1995) Plant Pathology, 44, 207.
213. Pasanen, A.-L., Lappalainen, S., and Pasanen, P. (1996) Analyst, 121,1949.
214. PayenJ., Girard.T., Gaillardin, M.,and Lafont, P. (1983) Microbiologic-Aliments-Nutrition, 1,143.
215. Perkowski, ]., Jelen, H., Kiecana, I., and Golinski, P. (1997) Food Additives and Con-
taminants, 14,321.
216. Pepper, E.H., and Kiesling, R.L. (1963) Proceedings of the Association of Official Analytical
Chemists, 53,199.
217. Petters, H.I., Flannigan, В., and Austin, B. (1988) Journal of Applied Bacteriology, 65, 279.
218. Pidoplichko, M.N., Moskovels, V.S., and Zholanova, N.M. (1960) Mikrobiolohichnyi
Zhurnal, 22,15.
219. Pineiro, M.S., Scott, P.M., and Kanhere, S.R. (1996) Mycopathologia, 132,167.
220. Pixton, S.W., and Henderson, S. (1981) Journal of Stored Products Research, 17, 191.
221. Pixton, S.W., and Warburton, S. (1971) Journal of Stored Products Research, 7, 261.
222. Ponchet, J. (1966) Etude des Communautes Mycopericarpiques du Caryopse de Ble, D.Sc
Thesis, University of Paris.
223. Prentice, N.. and Sloey, W. (1960) Proceedings of the American Society of Brewing Chemists, 28.
224. Publications of the Malt Research Institute (1955), 12, 2.
225. Rabie, C.J., and Lubben, A. (1984) South African Journal of Botany, 3, 251.
226. Rabie, C.J., Thiel. P.G., and Marasas, W.F.O. (1983) Toxicity of fungi occurring in sorghum
malt. Third International Mycological Congress, Tokyo, Abstracts, p. 599.
227. Richardson, M.J. (1996) Mycological Research, 100, 385.
228. Riddle, H.F.V, Channell, S., Biyth, W., Weir, D.M., Lloyd, M., Amos, W.M.G., and Grant,
I.W.B. (1968) Thorax, 23, 271.
229. Riis, P., Vaag, P., and Peetz, J. (1995) Proceedings of the 25th Congress of the European
Brewery Convention, Brussels, p. 117.
230. Samson, R.A., Hoekstra, E.S., Frisvad, J.C., and Filtenborg, 0., (eds) (2000) Introduction to
Food- and Airborne Fungi, Sixth Edition, Centraalbureau voor Schimmelcultures, Baarn,
The Netherlands.
231. Schapira, S.F.D. (1985) The Effect of Trichothecene Mycotoxins on Yeast and Molting
Barley, MSc Thesis, Heriot-Watt University.
232. Schapira, S.F.D, Whitehead, M.P., and Flannigan, B. (1989) Journal of the Institute of
Brewing, 95, 415.
233. Schappert, K.T., and Khachatourians, G.G. (1983) Applied and Environmental Microbiology, 45, 862.
234. Schappert, K.T., and Khachatourians, G.G. (1984) Applied and Environmental
Microbiology, 47, 681.
235. Schappert, K.T., Koshinsky, H.A., and Khachatourians, G. G. (1986) Journal of the American
College of Toxicology, 5,181.
236. Schilling, A.G., Moller, E.M., and Geiger, H.H. (1996) Phytopathology, 86, 515.
237. Schoental, R. (1984) Proceedings of the Fifth Meeting on Mycotoxins in Animal and Human
Health, Edinburgh, August 1984, (eds M.O. Moss and M. Frank), University of Surrey,
Guildford, p. 62.
238. Schwabe, M., Rath, F., Golomb, A., Engels, R., and Kramer, J. (1993) Monatsschrift fuer
Brauwissenschaft, 46,408.
239. Schwabe, M., Fenz, R., Engels, R., Kramer, J., and Rath, F. (1994) Monatsschrift fuer
Brauwissenschaft, 47,160.
240. Schwarz, P.B., Casper, H.H., and Bar, J.M. (1995) Technical Quarterly of the Master Brewers
Association of America, 32, 190.
Глава 4. Микробиота ячменя и солода
169
241. Schwarz, P.B., Casper, Н.Н., and Beattie, S. (1995) Journal of the American Society of
Brewing Chemists, 54, 121.
242. Schwarz, P.B., Beattie, S.f and Casper, H.H. (1996) Journal of the Institute of Brewing, 102,93.
243. Scott, P.M. (1996) Journal of AOAC International, 79,875.
244. Scott, P.M., and Lawrence, G.A. (1995) Journal of Food Protection, 58,1379.
245. Scott, P.M., Kanhere, S.R., Daley, E.F., and Farber, J.M. (1992) Mycotoxin Research, S. 58.
246. Scott, P.M., Kanhere, S.R., and Weber, D. (1993) Food Additives and Contaminants, 10, 381-389.
247. Scott, P.M., Lawrence, G.A., Daley, E.F., and Farber, J.M. (1995) Food Additives and
Contaminants, 12,31.
248. Scott, P.M., Yeung, J.M., Lawrence, G.A., and Prelusky, D.B. (1997) Food Additives and
Contaminants, 15,445.
249. Scudamore, K.S., Atkin, P.M., and Buckle, A.E. (1986) Journal of Stored Product Research,
22,81.
250. Sheneman, J.M., and Hollenbeck, CM. (1960) Proceedings of the American Society of
Brewing Chemists, p. 22.
251. Shlosberg, A., Zadikov, I., Peri, S., Yakobson, В., Varod, Y., Elad, D., Rapoport, E., and Handji,
V. (1991) Mycopathologia, 114, 35-39.
252. Sinha, R.N. (1973) In: Grain Storage: Part of a System (R.N. Sinha and W.E. Muir, eds), Avi,
Westport, Connecticut, p. 15.
253. Sinha, R.N., and Wallace, H.A.H. (1965) Canadian Journal of Plant Science, 45, 48.
254. Skoulas, A., Williams, N.. and Merriman, J.E. (1964) Journal of Occupational Medicine, 6,359.
255. Sloey, W., and Prentice, N. (1962) Proceedings of the American Society of Brewing Chemists, 24.
256. Smith, J.E., Mitchell, I., and Chiu, M.L.C. (1984) In: The Applied Mycology of Fusarium (eds
M.O. Moss and J.E. Smith), Cambridge University Press, Cambridge, p. 157.
257. Some Naturally, Occurring Substances: Food Items and Constituents, Heterocyclic Aromatic
Amines and Mycotoxins (1993), Monographs on the Evaluation of Carcinogenic Risks to
Humans, Vol. 56, International Agency for Research on Cancer, Lyon, France.
258. Stankushev, K. (1969). Mikologia i Fitopatolbgia, 3, 268.
259. Stars, A.C., South., J.B., and Smith, N.A. (1993) Proceedings of the 24th Congress of the
European Brewery Convention, Oslo, p. 103.
260. Steffenson, В J. (1999) Proceedings of the 27th Congress of the European Brewery
Convention, Cannes, p. 531.
261. Stones, E.L.G. (1984) In: Miscellany II (D. Sellar, ed.). The Stair Society, Edinburgh, pp. 148.
262. Taponi, K.-M., Laitila, A., and Haikara, A. (1997) Mallas Olut, 3, 68.
263. Tekauz, A., McCallum, В., and Gilbert, J, (2000) Canadian Journal of Plant Pathology, 22,9
264. Tressl, R., Hommel, E., Helak, B. (1989) Monatsschrift fur Brauwissenschaft, 42,331.
265. Trinder, D.W. (1988) Journal of the Institute of Brewing, 95, 307.
266. Tuite, J.R. and Christensen, CM. (1955) Cereal Chemistry, 32, 1.
267. Tuite, J.R. and Christensen, CM. (1957) Phytopathology, 47, 265.
268. Tuomi, Т., Laakso, S., and Rosenqvist, H. (1995) Journal of the Institute of Brewing, 101,351.
269. Ueno, Y. (1987). In: Mycotoxins in Food, (ed P. Krogh), Academic Press, London, p. 123.
270. Uoti, J., and Ylimaki, A. (1974) Annales Agriculturae Pennine, 13, 5.
271. Vaag, P. (1991) Proceedings of the 23rd Congress of the European Brewery Convention,
Lisbon, p. 553.
272. Vaag, P., and Pedersen, S. (1993) Proceedings of the 24th Congress of the European Brewery
Convention, Oslo, p. 111.
170
Брайен Флэнниган
273. Valadon, L.R.G., and Lodge, E. (1970) Transactions of the British Mycological Society, 55,9.
274. Wallace, H.A.H. (1973) In: Grain Storage: Part of a System (eds R.N. Sinha and WE. Muir),
Avi, Westport, Connecticut, p. 71.
275. Wallace, H.A.H., and Sinha, R.N. (1962) Canadian Journal of Plant Science, 42,130.
276. Warnock, D.W. (1971) Journal of General Microbiology, 67,197.
277. Warnock, D.W. (1973a) Transactions of the British Mycological Society, 61, 49.
278. Warnock, D.W. (1973b) Transactions of the British Mycological Society, 61,547.
279. Warnock, D.W, and Preece, T.F. (1971) Transactions of the British Mycological Society, 56,267.
280. Weber, K., and Poling, J. (1997) Technical Quarterly of the Master Brewers Association of
America, 34,127.
281. Welling, B. (1969) Tidsskrift for Planteavl, 73, 291.
282. Whitehead, M.P., and Flannigan, B. (1989) Journal of the Institute of Brewing, 95,411.
283. Williams, N.. Skoulas, A., and Merriman, J.E. (1964) Journal of Occupational Medicine, 6,319.
284. Willits, D.A., and Sherwood, J.E. (1999) Phytopathology, 89, 212.
285. Woller, R., and Majerus, P. (1982) Monatsschrift fur Brauwissenschaft, 35,88.
286. Wraith, D.G., Cunnington, A.M., and Seymour, WM. (1979) Clinical Allergy, 9,545.
287. Ylimaki, A., Koponen, H., Hintikka, E., Nummi, M., Niku-Paavola, M., Ilus, T, and Enari, T
(1979) Technical Research Centre of Finland, Materials and Processing Technology,
Publication 21.
288. Yli-Mattila, Т., Paavanen, S., Hannukkala, S., Parikka, P., Tahvonen, R., and Karjalainen, R.
(1996) Plant Pathology, 45,126
289. Yoshida, J., Nakagawa, A., Eto, M., Kitabatake, K., and Amaha, M. (1975) Journal of
Fermentation Technology, 53,184.
290. Yoshizawa, T. (1991) In: Mycotoxins and Animal Foods (eds J.E. Smith and R.S. Henderson),
CRC Press, Boca Raton, Florida, p. 301.
291. Zadoks, J.C., Chang, T.T., and Konzak, C.F. (1974) Weed Research, 14,415.
292. Zollner, P., Beroer, D., Jodlbauer, J., and Lindner, W. (2000) Journal of Chromatography, B,
728,233.
Глава 5
ГРАМПОЛОЖИТЕЛЬНЫЕ БАКТЕРИИ
В ПИВОВАРЕНИИ
Фергус Г. Прист (Fergus G. Priest)
5.1. Введение
Бактерии были признаны важнейшим агентом порчи пива в конце XIX в. Сравне-
ние описанных тогда бактерий, преобладавших на пивоваренных предприятиях и
в пиве в те времена с бактериями, обнаруживаемыми в настоящее время, свидетель-
ствует, что некоторые из них одни и те же, хотя с годами названия их зачастую меня-
ются. Относительно недавно с внедрением новых технологий (особенно укупорки
пива с очень малым содержанием кислорода) методы микробиологического анализа
настолько усовершенствовались, что стало возможным выявление в пиве «новых»
возбудителей его порчи. К ним можно отнести строго анаэробные штаммы Pectinatus
и Megasphaera (см. главу 6), но в основном пивовары сталкиваются по-прежнему
с теми же бактериальными контаминантами, что и в прошлом веке.
Бактерии традиционно в зависимости от их реакции на различные процедуры ок-
рашивания, в частности, на окраску по Граму делят на грамположительные и грам-
отрицательные. Клетки, окруженные относительно толстым одним слоем глюкопеп-
тида — муреина, представляющего собой гетерополимер и удерживающего комплекс
«кристаллический фиолетовый-йод» после промывки препарата спиртом или ацето-
ном (при окраске по Граму) относят к грамположительным. Под микроскопом такие
клетки кажутся фиолетово-красными. Напротив, у грамотрицательных бактерий му-
реиновая сеть многослойная. У них четко обозначается трехслойность структуры кле-
точной стенки: внешняя гидрофобная мембрана, далее следует периплазматическое
пространство и цитоплазмическая мембрана. Такие клетки не могут удерживать ком-
плекс «кристаллический фиолетовый-йод» при промывке спиртом или ацетоном
и под микроскопом при окрашивании по Граму имеют розовую окраску. Первое сооб-
щение о значении окраски по Граму для микробиологии пивоварения появилось
в 1945 г. [117] — было привлечено внимание к тому, что рост большинства грамполо-
жительных бактерий в отличие от грамотрицательных тормозится горькими веще-
ствами хмеля. Такое антисептическое действие хмеля наряду с обедненностью пива
питательными веществами, его низким рН и присутствием этанола сокращает круг
бактерий, способных размножаться в готовом пиве. Что касается грамположитель-
ных микроорганизмов, наиболее часто встречаются молочнокислые бактерии родов
Lactobacillus и Pediococcus, и у некоторых штаммов развита толерантность к хмелю
[45]. В пиве могут выживать и некоторые представители родов Micrococcus и Staphy-
loccus, а при определенных условиях Micrococcus kristinae размножается и вызывает
порчу продукта. В редких случаях проблемы создаются аэробными спорообразующи-
ми бактериями, относящимися к роду Bacillus, особенно в неохмеленном сусле [54],
172
Фергус Г. Прист
но подобно микрококкам под воздействием тормозящего эффекта компонентов хме-
ля [122] они не обнаруживают способности к размножению, и поэтому обычно не
представляют большой угрозы. В этой главе мы рассмотрим проблемы физиологии,
таксономии, выделения и подсчета этих бактерий, а также их влияние на качество
пива.
5.2. Молочнокислые бактерии
5.2.1. Основные характеристики
Молочнокислые бактерии — это грамположительные бактерии, к которым отно-
сятся также бактерии, образующие эндоспоры (как родов Bacillus и Clostridium, так
и бактерии других родов). Они входят в крупный подраздел, известный как бактерии
с низким показателем G + С (Г + Ц), поскольку все они обладают относительно низ-
ким (< 55%) содержанием гуанина и цитозина в их хромосомной ДНК. Молочнокис-
лые бактерии в значительной степени генетически и молекулярно гомологичны,
и долгое время считались естественной группой [61]. Тем не менее по вопросам так-
сономии молочнокислых бактерий не существует единого мнения, и в настоящее вре-
мя до создания окончательного их описания еще довольно далеко. Вместе с тем ти-
пичные молочнокислые бактерии — это грамположительные не образующие споры
палочки или кокки. Они не имеют каталазной активности, характеризуются бродиль-
ным типом метаболизма с образованием в качестве конечного метаболита расщепле-
ния Сахаров либо смеси молочной кислоты с С02, уксусной кислотой и/или спиртом
(гетероферментация), либо почти исключительно молочной кислоты (гомофермен-
тация). Эти бактерии толерантны к кислоте и требовательны к составу питательной
среды. Молочнокислые бактерии обычно развиваются на средах, богатых питатель-
ными веществами, — например, на молоке и молочных продуктах, овощах и фруктах,
причем многие такие бактерии присутствуют в естественной микрофлоре млекопи-
тающих (ротовой полости, кишечнике и влагалище).
5.2.2. Таксономия
Первой работой в этой области является [99], где группа молочнокислых бактерий
делилась на четыре рода — Lactobacillus для палочковидных организмов, Streptococcus —
для гомоферментативных, факультативно анаэробных кокков, a Betacoccus и Tetra-
coccus — других. С тех пор классификация и идентификация молочнокислых бакте-
рий изменилась, особенно под влиянием современных молекулярных методов систе-
матики (в частности, использования в качестве индикатора эволюционных или
филогенетических взаимосвязей тех или иных нуклеиновых кислот) [145]. Такие
молекулярные классификации по большей части основаны на сравнениях последова-
тельностей малых субъединиц (165) рибосомальных (р) генов РНК. В ходе эволюции
мутации в геномах накапливаются, и чем больше различия между двумя генами двух
микроорганизмов, тем больше времени прошло с тех пор, как они отделились от об-
щего предка, и наоборот, чем более схожи две последовательности, тем теснее связи
между этими микроорганизмами.
Такой филогенетический подход к классификации может быть основан на анали-
зе любого гена или их комбинации, но оказывается, что некоторые гены для этого
Глава 5. Грамположительные бактерии в пивоварении
173
подходят лучше других. Особенно важно, чтобы ген являлся достаточно большим
и содержал достаточно информации, но при этом был не слишком велик, иначе на
выделение последовательностей понадобится слишком много времени. В идеале от-
дельные участки гена должны меняться (мутировать) с постоянной скоростью, и он
должен быть широко представлен. Наконец, в таком гене не должно быть слишком
много горизонтальных трансформаций (переносов). Например, ген рРНК 165, коди-
рующий молекулу РНК, функционирующую в субъединице прокариотической ри-
босомы, и ген для несколько более крупной молекулы 185, входящей в эукариоти-
ческую рибосому, служат хорошими индикаторами филогенетических связей,
поскольку они соответствуют вышеприведенным критериям. И действительно, сис-
тематика бактерий выше уровня видов в настоящее время основывается преимуще-
ственно на сравнении последовательностей рРНК-генов 165 [18,113].
Со времени описания первых видов в [99] современные таксономические анализы
прошли большой путь, и в результате Streptococcus ныне делится на несколько видов —
Enterococcus (Streptococcus faecalis и родственные им), Lactococcus (5. lactis и родствен-
ные им) и Vagococcus (некоторые подвижные организмы, напоминающие лактококки,
например Streptococcussensu stricto). Род Betacoccus переименован в Leuconostoc и вклю-
чает гетероферментативные кокки, которые встречаются парами или в виде коротких
цепочек. Этот род не ускользнул от внимания «новых систематиков», и данные иссле-
дований генетической последовательности рРНК свидетельствуют, что в род Leuco-
nostoc входят три филогенетически разных рода: a) Leuconostoc sensu stricto, б) Leuc. oenos
(в настоящее время называют Oenococcus oenos, поскольку у них иное филогенетиче-
ское происхождение) [34] и в) новый род Weissella, куда входят Leuc. paramesenteroides
и некоторые близкородственные гетероферментативные лактобактерии (например,
Lb. confusus и Lb. kandleri, которые в настоящее время переклассифицированы соответ-
ственно в W. confusa и W. kandleri) [25,83].
Tetracoccus ныне называют Pediococcus. В него входят гомоферментативные кокки,
которые делятся в двух плоскостях с образованием пар или тетрад. Один из видов
этого рода, P. halophilus, благодаря изучению рРНК-последовательности получил ро-
довое название Tetragenococcus [22]. В род Aerococcus входят два вида, не представля-
ющих большого интереса для пищевой промышленности, а еще один род, Globica-
tella, был недавно выделен по результатам клинических исследований у человека —
они хотя и родственны стрептококкам, но филогенетически отличны от них [24]. За
исключением Lactobacillus и Pediococcus, остальные молочнокислые бактерии редко
встречаются на пивоваренных предприятиях. Основные признаки молочнокислых
бактерий приведены в табл. 5.1.
Хотя большинство новых филогенетических групп молочнокислых бактерий со-
впадают с традиционными родами, существуют и некоторые несоответствия, особен-
но по микроорганизмам, встречающимся на предприятиях, применяющих бродиль-
ные процессы [113]. Виды в рамках родов Lactobacillus, Leuconostoc и Pediococcus
отнесены к трем филогенетическим группам, которые не соответствуют их родам
(табл. 5.2). Первая филогенетическая группа включает Lb. delbrueckii и другие стро-
го гомоферментативные лактобактерии, которые относительно редко встречаются
на пивоваренных предприятиях. Вторая, самая большая группа, включает Lb. casei
и свыше 30 других видов Lactobacillus, представляющих все три ферментативных
174
Фергус Г. Прист
Таблица 5.1. Основные представители рода молочнокислых бактерий и их признаки
Род
Carnobactehum
Lactobacillus
Aerococcus
Enterococcus
Globicatella
Lactococcus
Leuconostoc
Oenococcus
Pediococcus
Streptococcus
Tetragenococcus
Vagococcus
Weissella
Признаки, по [2, 24,
Форма Тетрады
Палочки
Палочки
Кокки
Кокки
Кокки
Кокки
Кокки
Кокки
Кокки
Кокки
Кокки
Кокки
Маленькие
палочки/
кокки
_
-
+
-
-
-
-
-
+
-
+
-
со2
из
глюкозы
—
d
-
-
-
-
+
+
-
-
-
-
+
Рост
при
10 °С
+
d
+
+
-
+
+
+
d
-
+
+
+
25]
Рост
при
45 °С
_
d
-
+
-
-
-
-
d
d
-
-
Рост
в 6,5%
NaCI
.
D
+
+
+
-
d
d
d
-
+
-
d
Образование
молочной
кислоты
L
D, L, DL1
L
L
•
L
D
D
L, DL1
L
L
L
D.DU
+ — положительные; отрицательные; d — реакция меняется; • — нет данных.
1 Продуцирование D-, L- или DL-изомеров молочной кислоты у разных видов разное.
Таблица 5.2. Филогенетические группы некоторых молочнокислых бактерий
Филогенетические группы
II
III
Lactobacillus
delbrueckii
Lb. acidophilus
Lb. amylophilus
Lb. amylovorus
Lb. delbrueckii
Lactobacillus casei-
Pediococcus
Lb. brevis
Lb. buchneri
Lb. casei
Lb. coryneformis
Lb. fermentum
Lb. lindneri
Lb. malefermentans
Lb. parabuchneri
P. damnosus
P. dextrinicus
P. inopinatus
P. parvulus
P. pentosaceus
Leconostoc
Leuc. lactis
Leuc. mesenteroides
Weissella confusa
W. kandleri
W. paramesenteroides
типа, но с преобладанием факультативно гетероферментативных видов. В эту груп-
пу входят также некоторые распространенные в пивоварении бактерии (например,
Lb. brevis, Lb. buchneri и Lb. lindneri). Как ни странно, в этой группе педиококки объе-
Глава 5. Грамположительные бактерии в пивоварении
175
динены в группу с 4 видами иного происхождения, хотя P. dextrinicus более тесно
связан с Lb. coryneformis, чем с другими педиококками [23]. В третью группу включе-
ны все представители рода Leuconostoc и некоторые облигатные гетероферментатив-
ными лактобациллы, редко выявляемые на пивоваренных предприятиях, а также
Oenococcus oenos. Таким образом, в этих филогенетических группах смешана морфо-
логическая и физиологическая природа взаимосвязи этих бактерий, и теперь оче-
редь систематиков разработать такую новую стабильную классификацию (объеди-
няющую и филогенетические, и фенотипические критерии), которая сможет
упростить идентификацию этих микроорганизмов.
5.2.3. Метаболизм углеводов
Хотя молочнокислые бактерии редко участвуют в гидролизе полисахаридов, не-
которые их виды гидролизуют крахмал — в частности, Lb. amylophilus и Lb. amylo-
vorus, которые были выделены из продуктов брожения навоза крупного рогатого ско-
та [96], Lb. amylolyticus, выделенные из пивного сусла [17], и Lb.manihotivorans,
выделенные из продуктов брожения крахмала маниоки [93]. Такие лактобактерии,
обладающие амилолитической активностью, обычно участвуют в брожении пище-
вых продуктов, особенно зерна [30]. Вместе с тем они катаболизируют некоторые
дисахариды, в частности мальтозу, которая (по крайней мере, в случае лактококков)
с помощью пермеазы поступает в клетки, а затем расщепляется в них мальтозо-фос-
форилазой на глюкозу и глюкозо-1 -фосфат [75]. И действительно, большинство Са-
харов ассимилируются специфическими пермеазами, приводимыми в действие
энергией протонов, и фосфорилируются в цитоплазме АТФ-зависимой киназой.
Некоторые виды используют фосфоэнолпируват (ФЭП)-зависимую фосфотранс-
феразную систему (ФТС), фосфорилирующую сахара при помощи ФЭП по мере их
поступления в клетку.
Два основных пути сбраживания гексозы молочнокислыми бактериями различа-
ются цепью реакций расщепления шестиуглеродного скелета С6, и это приводит
к образованию различных конечных продуктов (рис. 5.1). Гомоферментация, харак-
терная для стрептококков, педиококков и некоторых лактобактерии, подразумевает
расщепление фруктозо-1,6-дифосфата ферментом альдолазой на два триозофосфата,
которые через пируват превращаются в лактат. Это традиционный способ называют
гликолизом по пути Эмбдена-Мейергофа. Гетероферментация осуществляется лей-
коностоками и лактобактериями группы III (облигатно гетероферментативными),
энококками и вейзеллами. В этом случае глюкозо-6-фосфат окисляется с образова-
нием глюконат-6-фосфата и декарбоксилируется. Получающийся в результате этой
реакции ксилулозо-5-фосфат расщепляется фосфокетолазой до триозофосфата, ко-
торый в свою очередь преобразуется в лактат, и ацетилфосфата (предшественника
спирта или ацетата в зависимости от редокс-потенциала системы). Таким образом, из
глюкозы получаются эквимолекулярные количества С02, лактата и ацетата/этанола.
При наличии дополнительного акцептора водорода в виде фруктозы или доступного
02 и происходит редукция (до маннита или Н202 соответственно) (см. раздел 5.2).
Этот путь называют по-разному — пентозофосфатным или пентозофосфокетолаз-
ным, однако предпочтительное называть его 6-фосфоглюконат/фосфокетолазным
путем - 6-ФГ/ФК.
176
Фергус Г. Прист
Глюкоза
Фруктоза-1,6-дифосфат
Альдолаза
Глюкоза-6-фосфат
i
6-фосфоглюконат
h
-► С02
Триозо-3-фосфат
АДФ
АТФ
Пируват
Лактат
Ксилулозо-5-фосфат
Фосфокетолаза I
Триозо-3-фосфат + ацетилфосфат
,АДФ*
*АТФ*
Пируват
Лактат
Ацетат
(этанол)
Гликолиз (гомофермвнтация) 6-фосфоглюконатный (фосфокетолазный)
путь (гвтероферментация)
Рис. 5.1. Основные пути сбраживания глюкозы молочнокислыми бактериями. По [68]
Что касается использования терминов гомоферментация и гетероферментация, то
здесь возможна путаница. Термин «гомоферментация» принято использовать для мо-
лочнокислых бактерий, использующих для катаболизма глюкозы гликолитический
путь и, следовательно, в качестве конечного продукта эти бактерии преимущественно
продуцируют лактат, а «гетероферментация» — для молочнокислых бактерий, исполь-
зующих 6-ФГ/ФК-путь. Тем не менее следует отметить, что одни молочнокислые бак-
терии при гликолизе образуют различные конечные продукты, а другие, использую-
щие на определенных субстратах гликолиз для переключения катаболизма глюкозы
на 6-ФГ/ФК-путь, — преимущественно пентозные сахара.
Гетероферментативные молочнокислые бактерии обычно сбраживают пентозы,
хотя встречаются и исключения [68]. Различные пентозы переносятся в клетки спе-
цифическими пермеазами и далее при участии соответствующих ферментов превра-
щаются в промежуточный продукт D-ксилулозо-б-фосфат, который преобразуется
по фосфокетолазному пути. Некоторые молочнокислые бактерии через D-ксилуло-
Глава 5. Грамположительные бактерии в пивоварении
177
зо-5-фосфат сбраживают и пятиуглеродные спирты. Так как для пентозного метабо-
лизма гетероферментативными молочнокислыми бактериями требуется фосфокето-
лазный путь, можно было бы ожидать, что гомоферментативные штаммы не способ-
ны утилизировать эти сахара. Тем не менее не способны их утилизировать лишь
строго гомоферментативные лактобактерии группы I (Lb. delbrueckii группы рРНК).
Лактобактерии группы II и большинство видов Enterococcus, Lactococcus и Pediococcus
факультативно гетероферментативны. В них присутствует фосфокетолаза и в резуль-
тате эти микроорганизмы на субстратах, содержащих пентозы, функционируют гете-
роферментативно, хотя если в среде присутствовала только глюкоза, они были бы го-
моферментативными. Как мы уже отмечали выше, Lactobacillus III группы брожения
и лейконостоки ограничены 6-ФГ/ФК-путем и считаются строго гетерофермента-
тивными.
Молочнокислые бактерии продуцируют как £>(-), так и 1(+)-лактат, а иногда и оба
изомера. Сначала ответственной за образование рацемической смеси из 1(+)-лактата
считали лактат-рацемазу, но оказалось, что этот фермент распространен не слишком
широко. На самом деле за образование смеси I- и D-лактатов ответственны две НАД-
зависимые лактатдегидрогеназы с различной стереоспецифичностью. Кроме того,
существуют и другие второстепенные пути диссимиляции пирувата в молочнокис-
лых бактериях, которые приводят к образованию летучих ароматических соединений
типа диацетила, что является очень важным фактором для пивоваров. Этот вопрос
мы рассмотрим в разделе 5.3.3, пункт б).
5.2.4. Метаболизм азота
Молочнокислые бактерии весьма прихотливы и нуждаются для роста в различных
аминокислотах и витаминах. Похоже, что в разных средах они получают эти амино-
кислоты путем действия протеаз, хотя по сравнению с бациллами или псевдомонада-
ми молочнокислые бактерии имеют низкую протеолитическую активность. Протео-
лиз довольно хорошо изучен применительно к росту лактококков в молоке, где они
преимущественно отвечают за развитие аромата в ходе производства сыра. В этом
случае работает сложная система, включающая в себя связанную с клеточными мем-
бранами серин-протеазу (PrtP), системы транспорта аминокислот и пептидов, а так-
же внутриклеточные пептидазы [76, 79]. Хотя протеолитическая активность лак-
тококков и низка, такая общая система довольно эффективна для обеспечения
аминокислот для роста в молоке, а PrtP-подобные протеазонедостаточные мутанты
вскоре останавливаются в росте. Все пептидазы являются внутриклеточными.
Некоторые аминокислоты типа аргинина для обеспечения энергией могут катабо-
лизироваться анаэробными/ферментативными бактериями путем фосфорилирова-
ния на субстратном уровне. Многие гетероферментативные штаммы (включая
Lb. brevis и О. oeni) реализуют аргинин-деиминазный путь, где аргинин гидролизует-
ся до цитруллина и аммиака, а цитруллин в свою очередь распадается до орнитина
и карбамилфосфата. Последний при помощи карбаматкиназы распадается до аммо-
ния и С02 с продуцированием АТФ из АДФ [82,106]. Группа генов Lb. sake, кодиру-
ющая аргинин-деиминазный путь была детально изучена [150], и показано, что энер-
гия, продуцируемая Lb. buchneri из аргинина, может быть использована для роста
и что образование аммиака повышает рН среды [92]. Кроме того, некоторые бактерии
178
Фергус Г. Прист
в богатой аргинином среде выделяют в качестве промежуточного метаболита цитрул-
лин, являющийся предшественником канцерогенных соединений этилкарбамата [91 ].
Декарбоксилирование тирозина педиококками связывается с высокими концент-
рациями тирамина в пиве (см. раздел 5.4.3, б); кроме того, метионин может преобразо-
вываться лактобациллами и лактококками в тиолы (например, в метантиол (метил-
меркаптан)) [33], хотя это имеет место чаще при созревании сыра, чем в пивоварении.
5.2.5. Потребность в кислороде
Важной характеристикой молочнокислых бактерий является их отношение к кисло-
роду. Эти бактерии не имеют цитохромных систем или аппарата для анаэробного дыха-
ния. Поскольку они не могут использовать кислород, их относят к аэротолерантным
анаэробам, но в отличие от строгих анаэробов наличие кислорода в среде не приводит
к их гибели. Они продуцируют энергию брожением, включающим фосфорилирование
на субстратном уровне, и должны регенерировать НАД+ из восстановленной НАДН,
которая накапливается в результате диссимиляции сахара. При гомоферментативном
метаболизме этот процесс происходит при участии лактатдегидрогеназы, а при гетеро-
ферментативном — при помощи ацетальдегиддегидрогеназы и алкогольдегидрогеназы.
В отсутствие внешних акцепторов электронов, таких как кислород, углеродные цепи
катаболизма прочно связаны, что помогает достичь баланса между реакциями проду-
цирования и потребления НАДН. Тем не менее множество молочнокислых бактерий
также содержат НАДН-оксидазы, функционирование которых обусловливается нали-
чием кислорода [26]. Окисление НАДН дает как НАД* и Н202, так и НАД+ и Н20
(в зависимости от того, переносятся два или четыре электрона). Тем самым разрывает-
ся катаболизм углерода, что находит промышленное применение, в частности, активи-
зирует при сбраживании молока синтез вторичных метаболитов (например, диацети-
ла). И действительно, незначительные количества кислорода могут существенно
влиять на концентрацию таких метаболитов.
В отличие от строгих анаэробов молочнокислые бактерии не гибнут под воздей-
ствием кислорода. Считается, что токсичные формы кислорода — пероксид (02 ")
и особенно супероксид (О") — образуются клетками в присутствии воздуха. Аэроб-
ные бактерии для удаления этих радикалов продуцируют соответственно ферменты
каталазу и супероксиддисмутазу, а строгие анаэробы эти ферменты не синтезируют.
Молочнокислые бактерии не способны синтезировать гем и, следовательно, не могут
продуцировать каталазу без образования гематина. Тем не менее они синтезируют
псевдокаталазу, которая для удаления пероксидов нуждается в восстановителях
(обычно эту роль выполняет НАДН). Впервые псевдокаталаза была обнаружена
у педиококков [32], а вскоре — и у лактобацилл, лейконостока и стрептококков [66];
она может искажать результаты простого каталазного теста с добавлением в культуру
пероксида водорода, особенно если культуры выращиваются на среде с низким со-
держанием глюкозы.
Лактобациллы, лейконостоки и педиококки для защиты от супероксидных ради-
калов не синтезируют супероксиддисмутазу [1]. Вместо этого в них имеется высокое
содержание Мп2+, который неферментативным путем преобразует супероксид в пе-
роксид водорода (Н202). Между внутриклеточной концентрацией Мп2+ и толерант-
ностью этих бактерий к кислороду наблюдается хорошая корреляция. Тем не менее
Глава 5. Грамположительные бактерии в пивоварении
179
выращивать эти бактерии рекомендуется в анаэробных или частично анаэробных
условиях (особенно при первичном выделении).
5.3. Лактобактерии
5.3.1. Классификация
В работе [99] Lactobacillus подразделяются на три подрода, главным образом на
основе температурной области роста и способа ферментации. Гетероферментатив-
ные лактобактерии были отнесены к Betabacterium, гомоферментативные штаммы,
растущие при 45 °С (а при 15 °С не размножающиеся) — к Termobacterium, а осталь-
ные — к Streptobacterium. Такое деление на подроды применяется до сих пор, хотя
эти названия не входят в официальную номенклатуру.
После выхода этой работы, несмотря на экономическую и экологическую важ-
ность этой группы, таксономия лактобактерии развивалась довольно медленно [80].
Эти три подвида прочно укоренились и явились основой для основополагающей ста-
тьи по классификации этих бактерий [115]. Затем стало очевидным, что гетерофер-
ментативные бета-бактерии могут быть разделены на две группы: одну, содержащую
в себе метаболически инертные штаммы, в большой степени толерантные к этанолу
и часто встречающиеся в винах, и группу более широко распространенных физиоло-
гически изменчивых видов. Эта классификация включена в пересмотренную схему
классификации [114], но в [69] она была слегка изменена. Эти подвидовые названия
больше не используются: термобактерии стали обозначать как группу I (облигатные
гомоферментативные штаммы), стрептобактерии (факультативные гетерофермен-
тативные штаммы) — как группу II, а толерантные к этанолу бета-бактерии и другие
типы составили облигатно гетёроферментативную группу III. В идентификацион-
ных целях эти три группы также рассмотрены во втором издании работы The Pro-
caryotes [140].
Такое разделение на группы полезно для целей идентификации, но возможность
его применения для классификации этих бактерий довольно сомнительна. Здесь
следует подчеркнуть, что классификация и идентификация — это различные дис-
циплины с различными целями. Классификация — это распределение микроорга-
низмов по группам на основе их родства, которая может быть как эволюционной
(филогенетической), так и фенетической (основанной на подобиях свойств организ-
мов без учета эволюционных аспектов). По разным причинам основанные на этих
двух различных подходах классификации не всегда совпадают (см. [102]). С другой
стороны, идентификация — это нахождение определенного места неизвестного мик-
роорганизма в уже существующей классификации, то есть идентификация не связа-
на с процессом классификации.
При современном интересе к филогенетическим классификациям, основанным на
генных последовательностях 165, рРНК, традиционная (фенетическая) классифика-
ция лактобацилл была поставлена под сомнение (см. раздел 5.2.2). Изначально неко-
торые атипичные лактобациллы {Lb. carnis, Lb. divergens, Lb. maltaromicus и Lb.pisci-
cola), выделенные из замороженного мяса в вакуумной укаповке, были отнесены
к новому роду Carnobacterium. В пивоварении эти бактерии не встречаются. Осталь-
ные лактобациллы были распределены по трем группам (табл. 5.3), сходным, но не
идентичным физиологическим группам. Хотя эта классификация и описывает моле-
180
Фергус Г. Прист
кулярные эволюционные пути, приводящие к появлению лактобацилл и родствен-
ных им микроорганизмов, до сих пор не ясно, насколько она согласуется с признан-
ной физиологической классификацией.
Таблица 5.3. Некоторые виды лактобацилл, обнаруженные в напитках брожения, и их отнесение
к таксономическим группам
Виды РНК-группа1 Ферментативная Среда обитания
группа2
Lb. delbrueckii
Lb. mali
Lb. casei
Lb. coflinoides
Lb. coryneformis
Lb. curvatus
Lb. homohiochii
Lb. paracasei
Lb. sake
Lb. brevis
Lb. buchneri
Lb. fermentum
Lb. fructivorans
Lb. hilgardii
Lb. lindneri
Lb. matefermentans
Lb. parabuchneri
Weissella confuse
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
3
I
I
II
II
II
II
II
II
II
III
III
III
III
III
III
III
III
III
Зерно, затор, растительное сырье
Вино, сидр
Молоко и молочные продукты
Сидр
Ферментированные овощи, силос,
квашеная капуста
Молоко, силос, кислая капуста
Вино
Пиво, продукты брожения виски
Вино (сакэ)
Пиво, вино, молоко, сыр
Пиво, вино, молоко, сыр
Ферментированные овощи,
продукты брожения виски
Вина, пресервы с уксусом
Вино
Пиво
Пивные дрожжи
Слюна, сыр, пивные дрожжи
Ферментированные овощи
1 Группа I — строго гомоферментативные микроорганизмы; группа II — факультативно
гетерофер-ментативные микроорганизмы (гомоферментативные относительно к гексозам);
группа III — строго гетероферментативные микроорганизмы.
2 Группы рРНК: 1 — группа Lactobacillus delbrueckii; 2 — группа Lactobacillus casei / Pediococ-
cus\ 3 — группа Leuconostoc/Weissella (см. табл. 5.2).
Хотя видовая структура лактобацилл по-прежнему до конца не оформлена, про-
цесс отнесения микроорганизмов к тому или иному виду не очень сложен. Виды бак-
терий в основном определяются на основе гибридизации хромосомальной ДНК —
меры сходства последовательностей бактериальных хромосом. Если две бактерии
характеризуются более чем 70%-ной гибридизацией ДНК, то они считаются принад-
лежащими к одному и тому же виду, а менее чем 70%-ная гибридизация является
признаком их принадлежности к разным видам (подробнее об этом см. [102]). Такое
«геномное» определение лучше всего подтверждается с помощью отличительных
фенотипичных признаков и другими показателями в рамках так называемого «мно-
гофазного» метода [132]. Более того, в настоящее время в дополнение к традицион-
ным способам известны многочисленные методы типирования и снятия «отпечат-
ков пальцев» молекул (см. главы 8 и 9). В случае лактобактерий новая систематика
на основе молекулярных методов помогла идентифицировать многие виды микро-
организмов и предоставляет возможность производить специфическое типирование
и прослеживать происхождение контаминации в эпидемиологическом аспекте. По-
Глава 5. Грамположительные бактерии в пивоварении
181
добный подход не так давно был применен для описания лактобактерий на ряде шот-
ландских предприятий по производству солодового виски [119].
В заключение следует отметить, что классификация лактобацилл постоянно меняет-
ся. Классификация на уровне родов и выше будет основываться на рРНК-по-
следовательностях с учетом при необходимости хемотаксономических аспектов (на-
пример, структуры клеточной стенки и физиологических особенностей). Видовая
классификация будет основываться преимущественно на гомологии ДНК-последова-
тельностей и методиках снятия «отпечатков» нуклеиновых кислот, обеспечивающих
четкие критерии распознавания видов. Это ставит в сложное положение микробиоло-
гов, желающих идентифицировать некий неизвестный штамм — хотя традиционные
таблицы, представленные в [69], обеспечивают четкие критерии для неспециализиро-
ванных лабораторий, применение молекулярных методов должно повлечь определен-
ные поправки. К счастью, микробиологи пивоваренных предприятий сталкиваются
в своей работе с весьма ограниченным количеством лактобактерий, что упрощает их
идентификацию (см. раздел 5.9).
5.3.2. Лактобактерий в пиве и на пивоваренном производстве
Проблемы в идентификации видов лактобактерий отодвинули на второй план
экологические исследования, направленные на определение видов, выявляемых на
пивоваренных производствах. Большинство таких исследований посвящено порче
пива, где наиболее типичным контаминантом является Lb. brevis. Эти облигатно ге-
тероферментативные бактерии (ферментативная группа III) обычно толерантны
к хмелю; оптимальные усдовия для их размножения — 30 °С и рН 4-5. Описаны
и другие виды лактобактерий, в частности, Lb. diastaticus (амилолитическая бакте-
рия, ответственная за гидролиз декстринов в пиве) и Lb. pastorianus (продуцирую-
щая внеклеточный полисахарид или слизь). Эти атипичные свойства не являются
достаточными для присвоения видового статуса, и оба эти микроорганизма относят
к Lb. brevis. Следует помнить, что Lb. brevis физиологически многообразны и могут
вызывать в пиве проблемы разного рода.
Название Lb. lindneri первоначально использовали для обозначения штаммов, вы-
деленных из пива низового брожения, оптимальная температура для размножения
которых была 19 °С, но затем его стали использовать как синоним Lb. brevis [ 108]. Тем
не менее позже было показано, что штаммы Lb. lindneri существенно отличаются от
Lb. brevis по ферментации Сахаров и молекулярным характеристикам [5, 6]; с другой
стороны, сравнение последовательностей 165 в рРНК у Lb. lindneri показали близкое
их родство с Lb. brevis [147]. Lb.frigidus и Lb. parvus считаются синонимами Lb. buch-
neri, родственных Lb. brevis и отличающимися только по способности сбраживать ме-
лецитозу, а также тем, что некоторые штаммы нуждаются в рибофлавине [5, 114].
Из испорченного пива была выделена новая молочнокислая бактерия, существенно
отличающаяся от Lb. brevis и Lb. lindneri по ферментации Сахаров и составу ДНК, что
дало возможность присвоить ей статус вида и дать имя Lb. brevisimilis [7]. Эту бакте-
рию сложно культивировать; она не вызывает серьезных проблем в бутилированном
пиве, так как в этой среде быстро погибает. Кроме того, из солода и сусла была выделе-
на Lb. amylolyticus, которая также серьезных проблем с порчей пива не вызывает [17].
К другим лактобактериям, довольно редко обнаруживаемым в пиве и на пивоварен-
182
Фергус Г. Прист
ных производствах, относятся Lb. casei [35, 40], Lb. coryneformis, Lb. coryneformis под-
вид torquens, Lb. curvatus [5, 41, 81], Lb. delbrueckii [89], Lb.fermentum, Lb.fructivorans
[78], Lb. malefermentans, Lb.parabuchneri [44] и Lb.plantarum [5,138].
Одно из наиболее обширных исследований лактобактерий пивоваренных произ-
водств было проведено Эшенбахером [40,41], изучившим 660 культур Lactobacillus,
полученных с 81 пивзавода и способных вызывать порчу пива. Путем тестов на
сбраживание Сахаров и других стандартных методов их штаммы были отнесены к
пяти видам. Из 660 штаммов 185 были идентифицированы как Lb. casei, 97 — как
Lb. casei подвид fusiformis, 6 — как Lb. plantarum var. arabinosus, 56 — как Lb. cory-
neformis, 4 — как Lb. coryneformis подвид torquens, 250 — как Lb. brevis, 14 — как
Lb. brevis var. lindnen и 48 — как Lb. buchneri. Было показано, что в сильно охмелен-
ном пиве бактерии группы II (стрептобактерии) встречаются чаще, чем бактерии,
относящиеся к группе III (гетероферментативные бактерии): это противоречит
обычному представлению, что хмелетолерантным видом является лишь Lb. brevis
(следовательно, в этой области требуются дополнительные исследования). Отлич-
ный обзор таксономии пивоваренных молочнокислых бактерий представлен в [5, 6],
где изоляты из пивоваренного производства отнесены к видам, явно сходным с ви-
дами, выделенными Эшенбахером, причем частота их встречаемости также оказа-
лась довольно близкой. Помимо видов, описанных в [40, 41], в [5] добавились
Lb. cuivatus и две не названных группы, включающих виды группы 8 и виды группы
9. Таким образом, в пиве и на пивзаводах количество видов молочнокислых бакте-
рий значительно больше, чем обычно предполагают, и до сих пор выделяют новые
лактобактерий с выраженной способностью к порче пива, которые с трудом вписы-
ваются в существующую классификацию и могут относиться к новым видам [46].
Возможно, пришло время пересмотреть весь спектр пивоваренных молочнокислых
бактерий с применением новых методов таксономической классификации, что по-
может разработке адекватных схем и процедур описания контаминации, обладаю-
щих прогностической силой.
5.3.3. Порча пива молочнокислыми бактериями
а) Размножение лактобактерий в пиве
Так как в пиве и на пивоваренных заводах можно обнаружить штаммы многочис-
ленных видов Lactobacillus, традиционная точка зрения, что все лактобактерий явля-
ются вредными микроорганизмами, может быть ошибочной (некоторые из них не
способны размножаться в пиве). К сожалению, информация в этой области ограни-
чена. Например, в [6] считается, что молочнокислые бактерии почти всегда являют-
ся причиной порчи пива и что при наличии следов их присутствия в пиве требуется
немедленная очистка. Тем не менее различные виды по своей способности размно-
жаться в пиве и толерантности к компонентам хмелевой горечи весьма разноообраз-
ны. На основе пяти различных образцов пива было показано [6], что штаммы
Lb. curvatus, Lb. brevis, Lb. lindneri и виды 8-й и 9-й групп Lactobacillus могли размно-
жаться во всех исследованных образцах, штаммы Lb. casei росли только в трех образ-
цах, a Lb. buchneri, Lb. coryneformis и Lb. plantarum размножались лишь в одном. Оче-
видно, что присутствие в пиве некоторого микроорганизма, который не может в нем
размножаться, не представляет серьезной угрозы, но если микроорганизмы выявля-
Глава 5. Грамположительные бактерии в пивоварении
183
ются и в других сортах пива, то это может стать свидетельством того, что некоторые
лактобактерии могут остаться незамеченными как агенты порчи.
Размножение молочнокислых бактерий в пиве существенно зависит от типа пива,
от того, как оно влияет на данный микроорганизм. Это было отмечено довольно дав-
но, а при исследовании 13 лактобактерии, внесенных в 31 образец пива различных
типов, было обнаружено, что все эти микроорганизмы могли размножаться только
в трех сортах пива [38]. В пяти образцах не развивался ни один микроорганизм, а для
остальных 23-х образцов результаты были разными. Причины стойкости некоторых
типов пива к контаминации остаются неясными. Между обычно анализируемыми
параметрами (такими, как рН, содержание спирта, содержание общего и аминного
азота, количество сбраживаемых углеводов или диоксида серы, способности лакто-
бактерии к пролиферации) корреляции не наблюдалось. Также не было выделено
каких-либо особых признаков у бактерий, способных к размножению в разных ти-
пах пива, хотя метаболическое разнообразие, судя по видам ферментируемых Саха-
ров, коррелировало со способностью микроорганизмов вызывать порчу пива. Это
противоречит данным [6], так как виды Lactobacillus, относящиеся к 8-й и 9-й груп-
пам, сбраживают лишь некоторые сахара и тем не менее являются потенциально
вредными для пива микроорганизмами.
Рост бактерий в пиве зависит от способности утилизировать питательные веще-
ства, которые остались после роста дрожжей, и толерантности к относительно небла-
гоприятной среде, создаваемой при брожении. Эти питательные вещества, обеспечи-
вающие размножение молочнокислых бактерий в пиве, исследовались путем
внесения в пиво молочнокислых бактерий и последующего анализа изменений в нем
содержания Сахаров и аминокислот [100]. Оказалось, что в большинстве случаев ме-
таболизировались небольшие количества сахарозы наряду с разными количествами
мальтозы, мальтотриозы и мальтотетрозы. В некоторых случаях гидролизовались
декстрины с количеством глюкозных остатков до 14-15. Среди утилизируемых лак-
тобактериями аминокислот преобладали аргинин, лизин и тирозин.
Основные ингибиторы роста молочнокислых бактерий в пиве поступают из хме-
ля и содержат транс-гумулон и связанный с ним колу пул он [136]. Эти вещества
действуют наподобие ионофореза и изменяют трансмембранный рН-градиент чув-
ствительных бактерий [45]. Стойкие к хмелю лактобактерии могут поддерживать
больший трансмембранный рН-градиент и запас АТФ, чем чувствительные к хме-
лю микроорганизмы [120]. Чувствительность лактобактерии к тгср^с-гумулону ва-
рьирует более чем в 10 раз, тогда как микроорганизмы-вредители пива характери-
зуются постоянно высокой к нему толерантностью. В Lb. brevis был выделен ген
(horA)% ответственный за стойкость к действию хмеля [110]. Этот ген кодирует
АТФ-связывающую кассету {ABC, ATP-Binding Casette) — белок, подобный транс-
портеру. Эти трансмембранные белки для переноса молекул через мембраны ис-
пользуют АТФ (в данном случае для удаления компонентов хмеля). Последующий
анализ штаммов Lactobacillus выявил, что horA связан исключительно с микроорганиз-
мами-вредителями пива [111].
Стойкость отдельных видов пива к их порче лактобактериями одно время припи-
сывалась присутствию определенных метаболитов дрожжей [38], но при исследова-
нии четырех образцов дрожжей не удалось выявить какие-либо внеклеточные веще-
184
Фергус Г. Прист
ства, которые ингибировали бы размножение бактерий [148]. Интересный подход
к этой проблеме представлен в [94], где исследовались различные дипептиды на их
способность подавлять размножение молочнокислых бактерий. Было обнаружено,
что потенциальными ингибиторами роста являются некоторые аланиловые дипеп-
тиды. Стойкость к контаминации приписывалась также действию ко-седиментации
(совместному осаждению) некоторых бактерий с пивоваренными дрожжами [141].
Возможно, что на подверженность пива к порче различными бактериями влияет со-
четание всех этих факторов.
б) Влияние контаминации на качество пива
Лактобактерии наиболее опасны в период кондиционирования пива и после уку-
порки. Порча характеризуется «шелковистым помутнением», иногда перед этим по-
является маслянистый привкус диацетила. Хотя основным продуктом метаболизма
этих бактерий является молочная кислота, ее высокий вкусо-ароматический порог
(более 300 ррт) по сравнению с низким пороговым значением для диацетила (около
0,15 ррт) [56] обусловливает важность последнего как соединения, изменяющим
вкус и аромат пива.
Диацетил и 2,3-пентандион образуются при нормальном брожении. Во время рос-
та дрожжи синтезируют а-ацетолактат (как промежуточный продукт биосинтеза ва-
лина). Некоторое количество а-ацетолактата выделяется дрожжами и в бродящем
сусле неферментативным путем преобразуется в диацетил. Затем последний восста-
навливается дрожжами до образования ацетоина и, наконец, до относительно без-
вредного 2.3-бутандиола (рис. 5.2, а). Преждевременное удаление дрожжей из пива
приводит к тому, что в нем остается а-ацетолактат, впоследствии подвергающийся
окислительному декарбоксилированию с образованием диацетила, который накап-
ливается и формирует неприятный вкус и аромат [62]. К накоплению диацетила при-
водит и контаминация лактобактериями, но несколько иным способом (рис. 5.2, б).
Синтез ацетолактата с последующим ферментативным окислением до диацетила сна-
чала считался единственным результатом действия лактобактерии, но позднее был
выявлен его синтез из ацетил-СоА и ацетальдегид-ТПФ [125, 126]. Оказалось, что
оба этих способа могут быть свойственны одному и тому же микроорганизму [67].
Таким образом, даже при очень незначительной контаминации пива в отсутствие
дрожжей при определенных условиях может происходить накопление диацетила до
высокого уровня (особенно в присутствии следовых количеств кислорода).
Лактобактерии также участвуют в синтезе 3-гидроксипропиональдегида, предше-
ственника горького соединения акролеина. Фермент глицерингидратаза присут-
ствует в различных видах лактобактерии, включая Lb. collinoides и Lb. hilgardii, и мо-
гут преобразовывать глицерин в 3-гидроксипропиональдегид [21].
Многие лактобактерии, включая выделяемые обычно из продуктов брожения со-
лодового виски, могут декарбоксилировать замещенные коричные кислоты [131].
Эти соединения (например, р-кумариновая и феруловая кислоты) входят в состав
клеточной стенки ячменя. Декарбоксилирование приводит к продуцированию про-
изводных 4-винила (соответственно, 4-винилфенола и 4-винилгваякола), придаю-
щих пиву заметный фенольный привкус [90]. Эти реакции могут осуществлять также
некоторые грамотрицательные бактерии (см. главу 6).
Глава 5. Грамположительные бактерии в пивоварении
185
а) Брожение дрожжей б) Lactobacillus
2 х пируват
J
Гидроксиэтил-ТПФ
а-ацетолактат
!(1)
♦
Диацетил
Ацетоин
2,3-бутандиол СН3- СНОН-СНОН-СН3 2,3-бутандиол
Рис. 5.2. Пути образования диацетила и ацетоина при брожении дрожжей и у Lactobacillus:
ТПФ—тиаминпирофосфат; (1) окислительное декарбоксилирование в сбраживаемом сусле;
(2) ферментативное декарбоксилирование а-ацетолактата; (3) альтернативный путь синтеза
диацетила
И, наконец, некоторые лактобактерии участвуют в образовании внеклеточных
полисахаридов или «слизи» (тягучих, липких нитей), но в случае лактобактерии это
серьезной проблемы не представляет — чаще это явление приписывают действию
педиококков или уксуснокислых бактерий [106].
5.3.4. Среда для выделения лактобактерии
Пожалуй, ничто в микробиологии пивоварения не вызывает столько споров, как раз-
работка культуральных сред для селективного выделения и подсчета лактобактерии
и педиококков. В прекрасной работе на эту тему ([20]) приводится список 23 сред для
выращивания молочнокислых бактерий (некоторые наиболее важные из них представ-
лены в табл. 5.4). В более новом списке [55] представлена 31 среда для выращивания
лактобактерии и родственных им микроорганизмов (не только связанных с пивоваре-
СНз-С-СООН
* -ТПФ
-г
со2
СНз-СНО-ТПФ —|
L— Пируват
f-^ТПФ
о
сн3-с-сон-сн3
■ I
соон
ТПФ
со-
1
V
Пируват
АцетальдегидТПФ —■
(3)
Ацетилко-
ферментА
1=
Пируват
С02
а-ацетолактат
к
HS-CoA
О О
II II
СНз"~ С —* С—СНз *
FHAflH2
НАД
II
снэ-снон-с-сн3
НАД
(2)
Диацетил -*-1
Ацетоин
(3)
186
Фергус Г. Прист
нием) — этот полный перечень сред для размножения молочнокислых бактерий может
помочь выработке новых подходов, специфичных для лактобактерий, встречающихся
в пивоваренном производстве. В работе [65] представлен обзор сред для микроорганиз-
мов, вызывающих порчу пива (включая и молочнокислые бактерии).
Таблица 5.4. Некоторые типичные среды, пригодные для культивирования молочнокислых
бактерий, встречающихся на пивоваренных предприятиях
Среда Комментарии Источник
Cinnamond 2 (СМ2) Источником углерода служит фруктоза [53]
Индикатор — бромокрезол зеленый
КОТ-среда Повышенный рост педиококков [129]
Среда de Man, Rogosa Источник углерода — глюкоза [31 ]
and Sharpe (MRS)1
Модифицированная С добавкой мальтозы [78]
среда MRS2
MRS и пиво Улучшенная MRS-среда для микробиологии пивоварения [3]
Модифицированная Основная среда, используемая для заквасок, [70]
среда Homohiochi овощей и вин
Среда, селективная для Для различения роста гомо- и гетероферментативных [87]
гомо- и гетерофермента- лактобактерий
тивных бактерий
Усовершенствованная Полутвердый или твердый агар; источник углерода — [43]
среда Nakagawa глюкоза
Среда для размножения Комплексная среда с глюкозной основой, [133]
лактобактерий (LGM) дополненная витаминами
NBB Быстрое размножение Lactobacillus и Pediococcus [4]
Модифицированная NBB Улучшенный вариант NBB [97]
Raka-Ray №32 Комплексная среда с мальтозой и фруктозой в качестве [ 109]
источника углерода
Сахарозный агар23 Среда с сахарозой, подобная MRS [16]
VLB-L41 Среда на пивной основе с добавлением питательных [ 137]
веществ, мальтозы и ксилозы
VLB-S7 Предназначена для выделения и идентификации [39]
педиококков
1 Рекомендована Международным комитетом по бактериологической систематике (подкомитет
по таксономии рода Lactobacillus)', предназначена для выращивания лактобактерий.
2Рекомендована ЕВС (подкомитет по микробиологическим методам анализа).
3 Рекомендована Институтом пивоварения (Institute of Brewing), комитет по методам анализа.
Сколько существует сред для размножения лактобактерий, столько известно и ис-
следований их эффективности. Увы, разных выводов сделано столько же. Не следует
забывать, что эти среды часто (хотя и не всегда явно) испытываются по двум крите-
риям: степени выявления микроорганизмов и селективности относительно них.
Обычно среды, эффективные для выявления большинства лактобактерий из некото-
рой пробы, характеризуются низкой селективностью относительно других бактерий,
обнаруживаемых в пивоваренном производстве (например, энтеробактерий), а сре-
ды, высокоселективные для лактобактерий, характеризуются низкой степенью их
выявления. Тем не менее некоторые обобщения все-таки возможны.
Глава 5. Грамположительные бактерии в пивоварении 187
Для выявления лактобактерий наиболее предпочитаемым источником углерода
является мальтоза. Многие молочнокислые бактерии не могут использовать глюко-
зу в качестве источника углерода в начале выделения: после добавки мальтозы
в стандартную среду MRS она стала превосходить по эффективности сахарозный
агар, универсальный пивной агар, MRS-arap и дифференциальный агар Wallerstein
Laboratories [78]. Для выделения лактобактерий в работе [57] предпочитают MRS-
arap и усовершенствованный агар Nakagawa, а в работе [58] при сравнении шести
сред был сделан вывод, что наиболее эффективными для выявления лактобактерий
являются MRS и Raka-Ray-3 (RR-3). К такому же выводу пришли в [85], но было
продемонстрировано, что эти среды характеризуются низкой селективностью (на
них могут размножаться и бактерии сусла, и Escherichia coli), что ограничивает их
применимость для подсчета молочнокислых бактерий в дрожжах и пробах пива. Для
повышения селективности добавляют фенилэтанол и циклогексимид, но тогда
уменьшается рост лактобактерий, и при сравнении с VLB-S7 последняя среда ока-
зывается более предпочтительной. В работе [133] сделан вывод, что среда RR-3 яв-
ляется хорошей средой общего назначения для молочнокислых бактерий, и описана
специальная среда LGM, которая оказалась не только столь же эффективной отно-
сительно выявления молочнокислых бактерий, как и RR-3, но и способствовала их
ускоренному росту. Относительно новой средой общего назначения, способствую-
щей быстрейшему росту лактобактерий и педиококков, является NBB-arap [4, 29],
впоследствии модифицированный [98]. При сравнении со средами MRS и VLB-S7
было установлено, что молочнокислые бактерии значительно быстрее выявляются
именно на NBB-arape [10, 139]. Вместе с тем недавние испытания показали, что су-
щественных различий между тремя средами (NBB, модифицированная NBB-среда
и универсальная пивная среда) по числу КОЕ штаммов Lactobacillus и Pediococcus не
наблюдается, и, таким образом, нет оснований к предпочтению какой-либо одной из
них [28].
В зависимости от цели и желаемой селективности наиболее приемлемы для выяв-
ления и подсчета лактобактерий среды MRS, модифицированная MRS, RR-3, VLB-
S7 и NBB. Что касается условий выращивания, наиболее подходящей является тем-
пература 30 °С и анаэробные или полуанаэробные условия.
5.3.5. Идентификация лактобактерий
Фактически любая неспорообразующая палочкообразная бактерия, являющаяся
грамположительной и каталазоотрицательной, выделенная из семенных дрожжей,
пива или пивоваренного оборудования, является молочнокислой, а поскольку такие
бактерии обычно вызывают порчу пива, идентифицировать их далее совершенно не
обязательно. Тем не менее для некоторых целей может оказаться желательным иден-
тифицировать изолят до видового уровня — в частности из-за того, что различные
виды характеризуются разной степенью влияния на качество пива [5]. Информация
по идентификации лактобактерий, встречающихся в пивоваренном производстве,
приведена в табл. 5.5 (по данным [5, 40, 41, 52, 69, 114]). Поскольку многие из этих
бактерий фенотипически подобны, точная идентификация часто бывает затруднена.
Основные методы проведения этих тестов изложены в [51] и в большинстве руко-
водств по микробиологическому анализу.
188 Фергус Г. Прист
Таблица 5.5. Фенотипические особенности Lactobacillus, выявленные на пивоваренных
предприятиях
1
2 ? to С 0)
I « I J - 1 1 I 1 ! S | I I
I 1 | | I I I 1 | 1 | | | I
(О -О -Q -О О О О Ъ «2 £ :« С Q.Q.
Кислота из:
арабинозы _ + + + -___d--- + d
целлобиозы ---- + - + dd---- +
декстрина + - • - + d d • • • - - . d
лактозы -d-dddd- + --«- +
мальтозы + + + + + + + d + d + + + +
маннита __._ + + _____. .+
маннозы +- • _ + + + + w___ . +
мелецитозы --- + + ------- + d
мелибиозы d + - + -d-- + --- + +
рамнозы -_--- + ----.. .-
рибозы _ + + + + - + - +W- + + +
сорбита --__ + d-----"- +
сахарозы +d-d + + - + + d • _ + +
трегалозы _-__ + __dd---- +
ксилозы -d + d----d-- • - d
Газ из глюкозы - + + + ---- + + + + + _
Ростпри15°С • + + + + + + __ + . + + +
Аммиак - + _ + _. _d + + - + + -
из аргинина
Изомер лактата DL DL DL DL L D(L) DL D DL DL DL • • DL
Обозначения: (+) — 90% и более штаммов с положительной реакцией; (-) —90% и более штаммов
с отрицательной реакцией; (d) — 11-89% штаммов с положительной реакцией; (w) — слабая
положительная реакция; (•) - не определяется.
а) Серологическая идентификация молочнокислых бактерий
Серологические методы для идентификации молочнокислых бактерий привлека-
тельны благодаря специфичности и скорости реакции антитело/антиген, но этот метод
применяется не слишком широко. Вероятно, это является следствием таксономической
сложности данной группы микроорганизмов и трудностей, возникающих при перекре-
стных реакциях многовалентных сывороток [138]. Поданным [35], в сыворотках суще-
ствуют по крайней мере два компонента антител, вступающие во взаимодействие с лак-
тобактериями из пива: один реагирует с видовым специфическим антигеном, а второй
(неспецифическое антитело) реагирует с педиококками и дрожжами. После адсорбции
этих препаратов возможна быстрая идентификация лактобактерий, включая Lb. casei
и Lb. brevis, но возникают трудности с подсчетом Lb. plantarum. Аналогичным образом
в работе [97] для обнаружения Lb. brevis в пиве использовалась антисыворотка, а в [107]
среди других лактобактерий серологически были определены Lb. lindneri.
Изучение моноклональных антител (МАВ) возродило интерес к серологическому
определению и идентификации бактерий, вызывающих порчу пива [ 142]. Обычной це-
Глава 5. Грамположительные бактерии в пивоварении
189
лью при этом является определение антигена, специфического для лактобактерии —
вредителей пива, так что одно и то же моноклональное антитело может быть использо-
вано для выявления если не всех бактерий порчи, то их некоторого диапазона. Особен-
но удачно антитела, специфично реагирующие со штаммами бактерий порчи Lb. brevis
и Pediococcus damnosus, были описаны в [130]. Подготовлено и другое моноклональное
антитело, реагирующее с Lb. lindneri. По-видимому, строгими антигенами здесь высту-
пают компоненты липотейхоевой кислоты, содержащиеся в клеточной стенке [146,
149].
б) Набор для идентификации лактобактерии
Одним из наиболее значительных достижений в диагностической микробиологии
является внедрение миниатюрных наборов для идентификации микроорганизмов.
Обычно в них входят лотки со средой для тестирования около 20 фенотипических
признаков (см. главу 9). Затем результаты сравниваются с эталонами для тестируе-
мых микроорганизмов и происходит идентификация. Наряду с подобными набора-
ми разработаны компьютерные базы данных и вероятностные модели идентифика-
ции [105]. Такие системы были разработаны для важных с медицинской точки
зрения бактерий (в частности, энтеробактерий) и применяются для идентификации
энтеробактерий, встречающихся на пивоваренных производствах и в аналогичных
средах [60, 134, 135]. Чтобы получить результаты идентификации фенотипической
однородности лактобактерии, необходимо провести не менее 50 тестов (например,
с помощью набора API 50 CHL, разработанного фирмой ЫоМёпеих), но и в этом слу-
чае результаты могут оказаться не вполне достоверными (зачастую из-за изменчи-
вости штаммов при хранении микроорганизмов). Так, на этапе первичного выделе-
ния некий штамм был идентифицирован как Lb. brevis, но через 15 недель хранения
он был заново идентифицирован как Lb. plantarum. В этой связи необходимо по-
мнить, что лактобактерии окружены множеством плазмид, многие из которых несут
коды определенных путей утилизации углеводов [88], и, возможно, причиной изме-
нения фенотипа является утрата плазмид.
Вторая причина трудностей в работе с наборами для идентификации заключается
в том, что они используются в пивоваренной промышленности настолько редко, что
результаты по таким пивоваренным бактериям, как Lb. brevisimius или Lb. lindneri
просто еще не внесены в базы данных, хотя первая из них не так давно была успешно
описана с помощью набора API 50 CHL [128]. Более того, система Minitek была ус-
пешно применена для идентификации лактобактерии [49], и, как утверждается, для
получения результатов, совместимых с традиционными анализами, требуется лишь
несложная ее модификация [14].
5.4. Педиококки
5.4.1. Классификация
Педиококки — это гомоферментативные кокки, которые из-за деления в двух плос-
костях встречаются в виде дипло- и тетракокков. Они уже довольно давно связаны
с микробиологией пива и первоначально были известны под названием сарцины
(sarcinae), так как их путали с кубическими пакетами из восьми клеток истинных cap-
190
Фергус Г. Прист
цин. Впервые было показано, что кокки пивоваренного производства являются мо-
лочнокислыми бактериями, но в работе [118] их отнесли к роду Streptococcus, вид
S. damnosus [116]. Эта классификация не была принята (хотя часто подчеркиваются
тесные взаимоотношения педиококков и стрептококков, [144]), и эти бактерии были
отнесены к роду Pediococcus, который Клауссеном использовался для обозначения
штаммов, выделенных им ранее из европейских типов пива. Тем не менее классифи-
кация и номенклатура педиококков продолжала вызывать путаницу — главным об-
разом из-за того, что в работе [95] для описания типичных пивных кокков использо-
валось наименование P. cerevisiae, а не P. damnosus, как в [27] и [50]. На то, что эти два
названия используются для описания одной и той же бактерии, было обращено вни-
мание в [123], и в ответе на запрос [47] Палата по разрешению споров Международ-
ного комитета по бактериологической систематике постановила, что наименование
P. cerevisiae использовалось неправомерно — следует применять термин P. damnosus.
Таким образом, P. damnosus и P. cerevisiae — синонимы, причем для описания кокков
пивоваренного производства должно применяться первое [101,114].
Большое сходство педиококков с Lactobacillus подтвердилось в результате исследо-
ваний рРНК, которые показали, что большинство педиококков относится к группе
Lb. casei — строго гомоферментативиых и гетероферментативных лактобактерий, куда
входят и другие лактобактерии-вредители производства пива (такие, как Lb. brevis).
К наиболее филогенетически близким микроорганизмам относят Lb. buchneri и Lb. kefiri
[23]. Исследования рРНК позволили также более четко очертить границы рода Pedio-
coccus и определить его как таксон, гомогенный P. dextrinicus — самому дальнему «род-
ственнику» истинных Pediococcus, образующему независимую «линию родословной».
В таксоне педиококков одну группу образуют P. damnosus и P. parvulus, другую —
P. acidilactici и P. pentosaceus [23], что очевидно также из результатов физиологических
тестов (например, из реакции аргининдегидролазы, см. табл. 5.6). Микроаэрофильный
кислотонеобразующий вид P. urinae-equi — это синоним Aerococcus viridans, а кислото-
необразующий вид, для размножения которого необходима соль (P. halophilus), был пе-
ремещен в отдельный род Tetragenococcus [22].
Обширное исследование 840 кокков, полученных из различных источников (вина,
пива, оборудования пивоваренных предприятий) на основе фенотипических тестов
и изучения гомологии последовательностей ДНК, подтвердило правильность объе-
динения шести установленных видов, а именно P. acidilactici, P. damnosus, P. dextri-
nicus, P. parvulus, P. pentosaceus и Т. halophilus [3,9]. Некоторые штаммы, полученные
преимущественно из растительного материала, которые ранее относили к P. damno-
sus (из-за их неспособности сбраживать пентозы), продемонстрировали высокую
степень гомологичное™ их ДНК с ДНК типичных штаммов P. pentosaceus, и были
отнесены к P. pentosaceus, подвид intermedius. Кроме того, некоторые пивоваренные
штаммы продемонстрировали лишь 40%-ную гибридизацию с ДНК от P. damnosus
или P. parvulus, их «ближайшими родственниками», и были отнесены к новому виду
P. inopinatus [3]. Количественный таксономический анализ 96 грамположительных
кокков, полученных из пива и с пивоваренных производств, и эталонных штаммов
подтвердил видовой статус P. damnosus, P. dextrinicus, P. parvulus и Т. halophilus. Хотя
в этом исследовании штаммы P. inopinatus выделены не были, в основном все изоля-
ты из пива были идентифицированы как P. damnosus [79]. Аналогичные результаты
Глава 5. Грамположительные бактерии в пивоварении
191
Таблица 5.6. Фенотипические особенности видов Pediococcus, выделенных на пивоваренных
предприятиях
«о
s s
1 S „ 8 8§
5 § £ s sg
•о .5 о. о. а£
о: о: о: о: о: .с
+ +
+ + + + +
d + + + +
+ + - + +
+ +
d
d
- - + + +
Тест
Кислота из:
арабинозы
целлобиозы
декстрина
лактозы
мальтозы
мальтотриозы
мелибиозы
раффинозы
рибозы
сорбита
крахмала
сахарозы
трегалозы
ксилозы
Рост при:
35 °С
50 °С
6,5% NaCI
15%NaCI
рН4,5
РН7.5
Аргининдегидролаза
Псевдокаталаза
Изомер лактата
tici
lac
!5
о
(0
о:
+
+
-
-
+
+
-
-
+
-
-
+
+
-
+
-
+
+
-
+
+
+
L(+)
3
со
о
с
Е
.3
43
о:
-
+
-
-
+
-
-
-
-
-
-
d
+
-
-
-
-
-
+
-
-
-
DI
+ - - d d
+ d + +
+ d-
+ + + + +
+ + + +
+ + + + +
+ + + + +
- - - + +
- . _ +
L(+) DL DL DL DL
Все виды растут при 10 °C и рН 5,5, продуцируют кислоту из глюкозы, фруктозы и маннозы и
расщепляют эскулин; обозначения приведены в сноске к табл. 5.5.
были получены в ходе новейших молекулярных таксономических исследований на
основе риботипирования 41 изолята из пива (см. главу 9), где большинство их было
идентифицировано как P. damnosus, два — как P. acidilactici, один — как штамм
P. parvulus, а два изолята оказались вообще не идентифицированными с известными
видами [12].
5.4.2. Распространение педиококков в пиве и пивоваренных
производствах
Из выявленных в пиве педиококков, несомненно, наиболее широко распростра-
нен и опасен P. damnosus [3,79,123]. Особый интерес представляет то, что этот мик-
роорганизм явным образом обнаруживается лишь в пиве, пивных дрожжах и винах,
в то время как в пивоваренном сырье и растительных материалах он не встречается.
P. inopinatus был выделен из вина, пива и пивных дрожжей, но присутствует также
192
Фергус Г. Прист
в сброженных овощах и молоке [3]. P. dextrinicus и P. pentosaceus выделяются из пива
и с пивоваренного оборудования, но гораздо реже, чем P. damnosus.
Распространение педиококков на пивоваренном предприятии изучалось в ходе
исследования 200 изолятов [86]. P. damnosus обычно обнаруживался в пиве и в кон-
це брожения, зато в семенных дрожжах он выявлялся довольно редко. P. damnosus
var. I (возможно, P. inopinatus) и Р. pentosaceus часто обнаруживались в семенных
дрожжах (соответственно 44 и 35% от выявленных кокков), но в конце брожения
или в конечном продукте их выявляли довольно редко. Что касается педиококков,
обнаруженных в сброженных кормах и пищевых продуктах (в силосе, огурцах или
оливках), были выделены P. parvulus, P. inopinatus и P. dextrinicus.
5.4.3. Порча пива педиококками
а) Размножение педиококков в пиве
В пиве могут расти только P. damnosus и в меньшей степени — P. inopinatus, хотя
другие виды в нем выживают в течение продолжительного времени [3,79]. Эти другие
виды ингибируются не только низким рН — они заметно менее толерантны к хмелю,
чем P. damnosus, который особенно стоек к антисептическому действию хмелевых ком-
понентов [45]. Как и в случае лактобактерий, имеются данные, что некоторые типы
пива более устойчивы к вредоносному действию P. damnosus, чем другие (из-за нали-
чия необходимых условий для размножения). Относительно витаминов, якобы необ-
ходимых для роста этих бактерий, существуют противоречивые мнения, однако явно
способствуют размножению большинства штаммов P. damnosus биотин и рибофлавин,
а пантотенат кальция для роста этого микроорганизма просто необходим [124]. Панто-
тенат кальция может быть заменен р-глюкозидом патонтената (соединением, которое
встречается в томатном соке и необходимо для роста О. oenos) [42,43].
б) Влияние педиококков на качество пива
Для педиококков, традиционно ассоциируемых с «сарциновой болезнью», харак-
терно образование кислоты и маслянистого аромата диацетила. Метаболизм диаце-
тила в принципе сходен с приведенным на рис. 5.2 для лактобацилл, но количество
синтезируемого диацетила у разных видов разное. P. pentosaceus вообще не продуци-
рует диацетил, а Р. inopinatus не может производить в тех же количествах, что
P. damnosus [86]. В экспериментах заражение как P. damnosus, так и P. inopinatus уве-
личивало продолжительность брожения, на 30% снижало количество дрожжей в сус-
пензии и приводило к образованию в пиве большого количества диацетила, причем
в случае заражения P. damnosus концентрация диацетила была значительно выше.
Вязкость пива может быть обусловлена наличием педиококков, причем она зави-
сит от присутствия некоторых сбраживаемых Сахаров. Образование слизи чаще при-
писывают действию P. acidilactici, чем P. damnosus [12]. Внеклеточная слизь, образу-
емая этими бактериями, является тиксотропной и представляет собой сложный
гетерополимер глюкозы, маннозы и нуклеиновой кислоты.
Педиококки принимают участие также в образовании тирамина из тирозина. Коли-
чество образуемого тирамина варьирует от менее 5 до 20 мг/л, зависит от количества
присутствующих бактерий и не зависит от концентрации в пиве тирозина [64].
Глава 5. Грамположительные бактерии в пивоварении
193
5.4.4. Среда для выделения педиококков
Для выделения педиококков может быть использована среда, предназначенная
для культивирования лактобактерий, однако важность педиококков применительно
к вызываемой ими порче пива и низкая скорость их роста привели к разработке осо-
бой среды для их выделения. Среда Nakagawa состоит из неохмеленного пивного
полужидкого агара, в котором педиококки через пять дней инкубации при 25 °С ста-
новятся заметны в виде зернистых колоний. Для использования этой среды для всех
молочнокислых бактерий ее модифицировали (см. табл. 5.4). Среда VLB-S7 [39]
была специально разработана для выделения пивных педиококков (ее признали пре-
восходящей другие среды), а МВЯ-среда и ее модифицированный вариант не облада-
ют особыми преимуществами относительно размножения и выявления педиококков
по сравнению с универсальным пивным агаром [28].
5.4.5. Идентификация педиококков
Педиококки — это типичные каталазо-отрицательные микроорганизмы, которые
можно отличить от лейконостоков по их способности к гомоферментативному типу
метаболизма Сахаров и характерному образованию тетракокков (тетрад). Тем не ме-
нее каталазный тест не всегда надежен, поскольку многие штаммы P. pentosaceus при
росте на среде с низким содержанием сахара продуцируют псевдокаталазу, которая
разрушает Н202, но отличается от каталазы чувствительностью к азиду и тем, что не
содержит гемовой группы [144]. Таким образом, эти штаммы можно спутать с катала-
зо-позитивными микрококками, но на питательном агаре при рН 7,0 растут только
последние. Схема идентификации рода Pediococcus приведена в конце этой главы,
а настоящий раздел посвящен их идентификации лишь на уровне видов.
Так как педиококки различаются по их способности к порче пива, иногда бывает
важно точно определить их видовую принадлежность. Данные табл. 5.6 приведены
по [3, 6, 79, 114, 140], причем на пивоваренных предприятиях встречаются лишь
P. damnosus, P. inopinatus, P. pentosaceus, P. pentosaceus подвида intermedius и P. dextri-
nicus, а данные для определения P. acidilactici и P. parvulus включены для полноты
картины. Методики проведения тестов те же, что для лактобактерий (они приведе-
ны в конце главы). Другие подходы к идентификации педиококков были с успехом
использованы в наборах API 50CHL [37].
Серологические методы для идентификации педиококков впервые были пред-
ставлены в [36] и получили дальнейшее развитие с появлением МАВ. Был разрабо-
тан тест на основе мембранного фильтрования иммунофлуоресцентных антител, по-
зволяющий определить степень контаминации педиококками в 0,001% семенных
дрожжей за менее чем 4 ч [142]. Антигенная мишень состоит из полимеров клеточ-
ной стенки [143]. Многообещающим методом идентификации педиококков может
стать и анализ жирных кислот [15].
5.5. Лейконостоки
Гетероферментативные кокки, иногда овальной формы, а чаще в форме коротких
палочек, встречающиеся парами или короткими цепочками, относят к роду
Leuconostoc. Эти микроорганизмы обнаруживаются в основном на овощах, фруктах
и в бродящих овощных материалах (на пивоваренных предприятиях они встречают-
194
Фергус Г Прист
ся редко). Лейконостоки и облигатные гетероферментативные лактобактерий харак-
теризуются сходными питательными потребностями, они растут на одинаковых сре-
дах и их часто путают, поскольку некоторые лактобактерий по внешнему виду напо-
минают кокки. Тем не менее исследования рРНК ясно показали различие между
лейконостоками и Lactobacillus [84]. От большинства лактобактерий лейконостоки
можно отличить по их неспособности к продуцированию аммиака из аргинина и по
формированию из глюкозы D(-), а не DI-лактата [114]. Лейконостоки образуют три
основные филогенетические линии:
• Leuconostoc sensu stricto, включающую Leuc. mesenteroides и большинство других
видов Leuconostoc, а также Lactobacillus fructosus;
• группу Leuc. paramesenteroides, которая в настоящее время переклассифициро-
вана в Weissella; в нее входят один вид Leuconostoc (W. paramesenteroides),
W. confusa (ранее — Lactobacillus confusus) и некоторые другие гетерофермента-
тивные лактобактерий;
• Leuc. oenos, образующую разные филогенетические линии, которые в настоя-
щее время переименованы в Oenococcus oenos [34]; этот микроорганизм также
характеризуется атипичными физиологическими свойствами, в частности, то-
лерантностью к 10%-ному этиловому спирту, размножением при низком рН
(около 3,5) и отсутствием НАД-зависимой глюкозо-6-фосфатдегидрогеназы.
Лейконостоки (и, возможно, вейселлы) встречаются на ранних стадиях брожения
шотландского виски [ 19], и современные количественные таксономические анализы
относят большинство изолятов этих организмов к двум группам: Leuc. mesenteroides
и к каким-то новым видам [103,104]. Данных о том, что Leuc. oenos (бактерия, вызы-
вающая молочное брожение вина) может встречаться на спиртовых заводах, нет.
Единственным выявленным на пивоваренных предприятиях видом оказался Leuc.
mesenteroides [6], но он не связан с порчей пива. Из фруктовых смесей были выделе-
ны лишь кислототолерантные штаммы Leuc. mesenteroides] их иногда ассоциируют
с некоторыми традиционными африканскими напитками [112]. Данные по иденти-
фикации лейконостоков приведены в табл. 5.7.
5.6. Гомоферментативные кокки
Грамположительные гомоферментативные кокки, встречающиеся парами или
в виде цепей, относят к родам Enterococcus, Lactococcus, Streptococcus и Vagococcus.
Эти бактерии часто встречаются в сыром молоке и молочных продуктах, на расти-
тельных материалах, в ротовой полосе и кишечнике человека и животных [114].
Единственный представитель этой группы, иногда встречающийся на пивоваренных
предприятиях, — Lactococcus lactis, который обычно загрязняет оборудование, но бо-
лее известен продуцированием диацетила из цитрата и своей ролью в производстве
сливочного масла. Lactococcus lactis, встречающийся в пивоваренной промышленно-
сти довольно редко [6], можно спутать с другими каталазо-отрицательными грам-
положительными кокками, размножающимися на средах, предназначенных для
культивирования молочнокислых бактерий. От лейконостоков их можно отличить
по гомоферментативному метаболизму Сахаров, а от пивоваренных педиококков —
по морфологии клеток (цепи вместо тетрад) и по росту при рН 9,2 (при высоком рН
педиококки расти не могут). Более точная идентификация получается при псполь-
Глава 5. Грамположительные бактерии в пивоварении
195
Таблица 5.7. Ключ к идентификации родов грамположительных бактерий, выявляемых на
пивоваренных предприятиях
(1)Каталаза'
(2) Морфология клетки
(3) Образование газа из глюкозы
(4) Клетки в форме тетрад
Клетки парами/цепочками
(5) Палочки, образующие эндоспоры
(6) Анаэробный рот
(7) Лизис при помощи лизостафина
Положительная: -> (5)
Отрицательная: -> (2)
Палочки: Lactobacillus
Кокки2: -► (3)
Положительная: Leuconostoc/Weissella2
Отрицательная: -> (4)
Pediococcus
Lactococcus
Положительная: Bacillus
Отрицательная: ->• (6)
Положительная: -> (7)
Отрицательная: Kocuria/Micrococcus
Положительная: Staphylococcus
Отрицательная: К. kristinae
1 Некоторые педиококки могут быть каталазо-положительными на среде с низким содержанием
сахара. Если данные сомнительны, повторите тест, используя культуру со среды с содержанием не
менее 1 % глюкозы или тест на чувствительность к азиду при концентрации 0,01 М; каталаза ингиби-
руется, а псевдокаталаза нет [144].
2 Некоторые лейконостоки имеют удлиненную форму и могут быть спутаны с гетерофермента-
тивными лактобактериями, см. раздел 5.5.
3 Выявление различий между Leuconostoc и Weissella затруднено; для отдельных видов необхо-
димо комбинирование (см. [25]).
зовании известной сыворотки Group N для определения лактококков, но при этом не
следует забывать о возможных перекрестных реакциях между ними и педиококками
[36]. О размножении Lactococcus lactis в пиве данных нет.
5.7. Кокурии, микрококки и стафилококки
К родам Micrococcus и Staphylococcus относят грамположительные кокки, образую-
щие каталазу и не характеризующиеся метаболизмом типа молочного брожения. Эти
бактерии формируют скопления клеток, которые не всегда заметны, в связи с чем эти
микроорганизмы фактически неотличимы от молочных кокков. Вместе с тем их легко
различить по способности к размножению на питательном агаре при рН 7,0 и по ката-
лазному тесту (см. раздел 5.9). Хотя отдельные штаммы Micrococcus и Staphylococcus
сильно отличаются по рРНК-последовательностям, надежных тестов для их различе-
ния практически нет. Наиболее полезным критерием является то, что стафилококки —
это факультативные анаэробы, хотя Staph, saprophytics и родственные ему виды в ана-
эробных условиях размножаются плохо или вообще не размножаются [71, 72], тогда
как микрококки (за малым исключением) — это строгие аэробы. Более того, стафило-
кокки характеризуются стойкостью к эритромицину и под действием лизоцима не под-
вергаются лизису, а большинство микрококков к ним чувствительны. Наконец, стафи-
лококки в отличие от микрококков чувствительны к лизостафину.
196
Фергус Г. Прист
Род Micrococcus филогенетически разнообразен (судя по 165 рРНК-последова-
тельностям) и подразделяется на 4 вида. Бактерии, обычно обнаруживаемые в пиво-
варении (Micrococcus varians и Micrococcus kristinae), относят к Kocuria [127].
В пивоваренной промышленности эти бактерии обычно важными не считают, но
недавние исследования показали, что в пиве и на пивоваренных предприятиях они
широко распространены и в некоторых случаях могут приводить к порче пива. Количе-
ственное таксономическое исследование 96 кокков, выделенных из окружающей среды
пивоваренного производства, показало, что пленка, образуемая Staph, epidermidis, Staph,
saprophytics и широко распространенными М. varians (в настоящее время К. varians),
одинакова и в пиве, и на производстве, причем последние иногда выделяются из семен-
ных дрожжей [79]. Как бы то ни было, эти бактерии слабо размножаются при рН 4,5
и ниже, чувствительны к компонентам хмеля и в случае К. varians облигатно аэробны.
Следовательно, они не способны быть причиной порчи пива, и, вероятно, случайно по-
падают в него от людей или из сырья. Многие подобные микроорганизмы тем не менее
способны выживать в пиве в течение длительного времени, и в контрольных пробах на
качество их можно спутать с микроорганизмами-вредителями (особенно из-за того, что
некоторые штаммы К. kristinae в окрашенных по Граму препаратах образуют тетрадо-
подобные скопления клеток).
Kocuria kristinae представляет собой нетипичный микрококк (он является факуль-
тативным анаэробом) [73]. Штаммы этого микроорганизма, сравнительно кислото-
и хмелестойкие, могут вызывать порчу пива (особенно в продуктах с высоким рН
и низком содержании горечи) [5, 79]. Интенсивность их роста зависит от содержа-
ния кислорода в пиве, но даже следовой их рост в анаэробных условиях может при-
вести к образованию побочного фруктового аромата и неспецифического вкуса [5].
Это подчеркивает важность различения К. kristinae от безвредных К. varians, что про-
ще всего достигается с учетом способности К. kristinae к анаэробному размножению.
Фенотипические признаки К. kristinae см. в [5] и [127].
5.8. Бактерии, образующие эндоспоры
Известны случаи, когда проблемы в производстве пива были вызваны аэробными
бактериями, образующими эндоспоры и относящимися к роду Bacillus. Споры этих
бактерий присутствуют в солоде и в зерновых добавках; они выживают при кипяче-
нии сусла, но после этого не способны к росту из-за низких значений рН бродящего
сусла и пива. Более того, все виды Bacillus чувствительны к хмелю, так что в пиве
с ними проблем не бывает [122]. Тем не менее существует серьезная опасность, что
в современной пивоваренной промышленности серьезные проблемы могут возник-
нуть со спорообразующим вариантом Lb. brevis.
Из пивоваренного оборудования, солода и сусла после кипячения были выделены
термофильные бациллы, образующие эндоспоры [54, 89, 122]. Идентифицирован-
ные как В. coagulans и промежуточный вид В. coagulans-B. stearothermophilus, эти
бактерии в сусле, выдерживающемся при 55-70 °С более 2 ч, продуцируют большое
количество молочной кислоты. Хотя обычно подкисление считается вредным, конт-
ролируемое подкисление сусла может оказаться полезным, так как улучшает вкусо-
ароматический баланс и микробиологическую стабильность пива [8]. Тем не менее
одна из настораживающих особенностей штаммов В. coagulans заключается в их спо-
Глава 5. Грамположительные бактерии в пивоварении
197
собности участвовать в образовании нитрозамина путем восстановления нитратов
до нитритов [122].
5.9. Идентификация родов грамположительных бактерий,
встречающихся в пивоваренном производстве
Схема ускоренной идентификации грамположительных бактерий, выделенных из
окружающей среды на пивоваренном предприятии, до родового уровня представле-
на в табл. 5.7. Обычно этого оказывается достаточно, чтобы предвидеть потенциал
данного микроорганизма относительно порчи, но в некоторых случаях может потре-
боваться их идентификация до видового уровня (таблицы и методики такой иденти-
фикации см. в соответствующих разделах данной главы).
5.9.1. Методики тестирования
Тесты, указанные в идентификационном ключе, проводятся по традиционным
микробиологическим методикам, однако ниже мы приведем некоторые их детали
(некоторые читатели могут не знать правила идентификации микроорганизмов). Бо-
лее подробные сведения общего характера приведены в [13], по методикам опреде-
ления молочнокислых бактерий — в [52] и [114], а относительно микро- и стафило-
кокков — в [74].
а) Каталазный тест
Метод 1
Микроорганизм выращивается на соответствующей среде, помещается на пласти-
ку и добавляется 1 мл 3%-ного (% об.) Н202. Сразу же проверяется выделение газа
(свидетельство каталазной активности). Анаэробно выращиваемые культуры перед
добавлением Н202 должны быть выдержаны на воздухе не менее 30 мин.
Метод 2
Микроорганизм выращивается на соответствующем бульоне и после инкубации
добавляется 1 мл 3%-ного (% об.) Н202. Контролируется выделение газа.
Контроль: положительная реакция — Staphylococcus epidermidis или Kocuria
varians, отрицательная — Lactobacillus brevis.
б) Образование газа при метаболизме глюкозы
Метод 1
Пробирка с М/?5-бульоном и добавкой глюкозы (0,5%) со вставленной в нее труб-
кой Дурхэма засеивается микроорганизмом и выдерживается до 14 сут. Положи-
тельный результат — накопление пузырьков газа. Помимо проблем с размножением
микроорганизмов, этим методом не всегда обнаруживается образование газа лейко-
ностоками и некоторыми другими молочнокислыми бактериями, в связи с чем более
предпочтительным представляется метод 2.
Метод 2
Если количество образующегося газа мало, используют метод Гибсона и Абд-эль-
Малека [48]. Применяется полужидкая питательная среда следующего состава: мяс-
ной экстракт (Lab-Lemco) — 0,5 г; триптон — 0,5 г; дрожжевой экстракт — 0,5 г;
твин 80 — 0,05 мл; агар — 0,2 г; вода — до 100 мл. Глюкозу стерилизуют отдельно
198
Фергус Г. Прист
и добавляют из расчета до 5% масс/об Среду подкисляют до рН 6,0. Может исполь-
зоваться также МЯ5-среда. Испытуемой материал вносят иглой в пробирки со сре-
дой, используя массивную иглу, или несколько капель активной культуры смешива-
ют с охлажденной расплавленной средой. Культуры пересевают в расплавленный
агар с последующей герметизацией и пос ле инкубации накопившиеся внизу пузырь-
ки газа свидетельствуют о гетерофермен гативном росте микроорганизмов.
Контроль: положительная реакция — Lactobacillus brevis; отрицательная — Pedio-
coccus damnosus.
в) Анаэробный рост
Используется модифицированный тест на окисление/брожение (О/Б) [59]. Бе-
рут две одинаковые пробирки, содержащие: триптон — 1 г; дрожжевой экстракт —
0,1 г; глюкозу — 1 г; бромкрезол-красный — 0,004 г; агар — 0,2 г; вода (рН 7,0) —
100 мл, и засевают иглой определяемый организм. Одну пробирку заливают парафи-
новым маслом, обеспечивая анаэробные условия. Размножение микроорганизма
и образование кислоты (желтая окраска) в обеих пробирках означает ферментатив-
ный метаболизм; размножение и образование кислоты лишь в открытой пробирке
указывает на строго окислительный метаболизм.
Контроль: ферментативный метаболизм —Staphylococcus epidermidis; окислитель-
ный метаболизм — Micrococcus varians.
г) Лизис лизостафином и лизоцимом
Стерильный профильтрованный лизостафин (конечная концентрация — 200 мкг/мл)
или лизоцим (конечная концентрация 25 мкг/мл) добавляют к стерильной среде на
основе агара, содержащей 1% расплавленного пепточа, 0,1% дрожжевого экстракта,
1,0% глюкозы и 0,5% хлористого натрия; рН среды — 7,0. Испытуемый материал маз-
ками помещается на твердую среду и инкубируется в течение 2 сут.
Контроль: чувствительность к лизостафину и стойкость к лизоциму — Staphy-
lococcus epidermidis; стойкость к лизостафину, чувствительность к лизоциму —
Micrococcus varians.
5.10. Краткое резюме
В данной главе мы подчеркнули разнообразие грамположительных бактерий, кото-
рые могут быть выделены из пива. Очевидно, что причиной порчи пива могут являть-
ся не только «молочнокислые палочки», но по крайней мире 10 видов Lactobacillus.
Аналогично «молочнокислые кокки» объединяют в себе несколько видов педиокок-
ков и, возможно, М. kristinae. В связи с этим настоятельно необходимо проанализиро-
вать способы ускоренной идентификации описанных в предыдущих главах микроор-
ганизмов применительно как к контролю качества продукции, так и к текущему
микробиологическому контролю. Только в этом случае мы будем знать весь спектр
бактерий, присутствующих на пивоваренном производстве, и понимать их роль в пор-
че пива. Хотя затраты на это могут оказаться весьма велики, но готенциальная эконо-
мия также очевидна (например, если будет доказано, что пиво, обсемененное Lacto-
bacillus X, можно поставлять в торговлю, а не уничтожать или пер срабатывать, так как
его штаммы не могут в нем размножаться и, следовательно, быть причиной порчи кон-
Глава 5. Грамположительные бактерии в пивоварении
199
кретного продукта). Помимо этого конкретного вопроса, подробное изучение данной
проблемы представляет большой интерес для отрасли в целом.
Литература
1. Archibald, F.S., and Fridovich, 1. (1981) Journal of Bacteriology, 146, 928.
2. Axelsson, L.T. (1998) In: Lactic Acid Bacteria, Microbiology and Functional Aspects, 2nd edn
(eds S. Salminen and A. von Wright), Marcel Dekker Inc., New York, p.l.
3 Back, W. (1978) Brauwissenschaft, 31, 237,312 and 336.
4. Back, W. (1980) Brattwelt, 120,1562.
5 Back, W. (1981) Monatsschrift fur Brauerei, 34, 267.
6 Back, W. (1982) Brauwelt, 45,1562 and 2090.
7. Back, W. (1987) Monatsschrift fur Brauwissenschaft 40,484.
8. Back, W (1988) Monatsschrift fur Brauwissenschaft 41,152.
9. Back, W., and Stackebrandt, E. (1978) Archives of Microbiology, 118,79.
10. Back, W., Durr, P., and Anthes, S. (1984) Monatsschrift fur Brauwissenschaft, 37,126.
11. Baird Parker, A.C. (1979) In Identification Methods for Microbiologists, 2nd edn (eds
F.A. Skinner and D.W. Lovelock), Academic Press, London and New York, p. 201.
12. Barney, M., Volgyi, A., Navarro, A., and Ryder, D. (2001) Applied and Environmental
Microbiology, 67, 553.
13. Barrow, G.I., and Feltham, R.K.A. (eds) (1993) Cowan and Steel's Manual for the
Identification of Medical Bacteria, 3rd edn Cambridge University Press, Cambridge.
14. Benno, Y., and Mitsuoka, T. (1983). Systematic and Applied Microbiology, 4,123.
15. Beverly, M.B., Basile, F.,and Voorhees, K.J. (1997)Journaloj'the American Society oj'Brewing
Chemists, 55, 79.
16. Boatwright, J., and Kirsop, B.H. (197 6). Journal of the Institute of Brewing, 82, 343.
17. Bohak, I., Back, W., Richter, L., Ehrmann, M., Ludwig, W., and Schleifer, K.H. (1998).
Systematic and Applied Microbiology, 21, 360
18. Brown, J.R., and Koretke, K.K. (2000) In Applied Microbial Systematics (eds F.G. Priest and
M. Goodfellow), Kluwer Academic publishers, Dordrecht, The Netherlands, p. 19.
19. Bryan Jones, G. (1975) In Lactic Acid Bacteria in Beverages and Food (eds J.G. Carr,
C.V. Cutting, and G.C. Whiting), Academic Press, London, p. 165.
20. Casey, G.P., and Ingledew, WM. (1981) Brewers'Digest, 55 (March), 38.
21. Claisse, O., and Lonvaud-Funel, A. (2001) Lait, 81,173.
22. Collins, M.D., Williams, A.M., and Wallbanks, S. (1990) FEMS Microbiology Letters, 70, 255.
23. Collins, M.D. Rodrigues, U. Ash, C, Aguirre, M., Farrow, J.A.E., Martinez Murcia, A., Phillips,
B.A., Williams, A.M., and Wallbanks, S. (1991). FEMS Microbiology Letters, 11,5-12.
24. Collins, M.D., Aguirre, M., Facklam, R.R., Shallcross, J., and Williams, A.M. (1992) Journal
of Applied Bacteriology, 73,433.
25. Collins, M.D., Samelis, J., Metaxopoulos, J., and Wallbanks, S. (1993) Journal of Applied
Bacteriology, 75, 593.
26. Condon, S. (1987) FEMS Microbiology Reviews, 46, 269.
27. Coster, E., and White, H. (1964) Journal of General Microbiology, 37,15.
28. Crumplen, R. (1988) Journal of American Society of Brewing Chemists, 46,129.
29. Dachs, E. (1981) Brauwelt, 121,1778.
30. Damelin, L.H., Dykes, G., and von Holy, A. (1995) Microbios, 83,13.
31. De Man, J.C., Rogosa, M., and Sharpe, M.E. (1960)Journal of AppliedBacteriology, 23, 130.
Фергус Г. Прист
32. Delwiche, E.A. (1961) Journal of Bacteriology, 81,416.
33. Dias, В., and Weimer, В. (1998) Journal of Bacteriology, 64,3320.
34. Dicks, L.M.T., Dellaglio, F, and Collins, M.D. (1995). International Journal of Systematic
Bacteriology 45, 395.
35. Dolezil, L., and Kirsop, B.H. (1975)Journalofthe Institute of Brewing, 81, 281.
36. Dolezil, L., and Kirsop, B.H. (1976)Journaloftke Institute of Brewing, 82, 93.
37. Dolezil, L., and Kirsop, B.H. (1977) Journal of Applied Bacteriology, 42, 213.
38. Dolezil, L., and Kirsop, B.H. (1980) Journal ofthe Institute of Brewing, 86,122.
39. Emeis, C.C. (1969) Monatsschrift fur Brauerei, 22,8.
40. Eschenbecher, F. (1968) Brauwissenschaft, 21,424 and 464.
41. Eschenbecher, F. (1969) Brauwissenschaft, 22,14.
42. Eto, M., and Nakagawa, A. (1974) Bulletin of Brewing Science, 20, 37.
43. Eto, M., and Nakagawa, A. (1915) Journal of the Institute of Brewing, 81, 232.
44. Farrow, J.A.E., Philips, B.A., and Collins, M.D. (1988) FEMS Microbiology Letters, 55,163.
45. Fernandez, J.L., and Simpson, W.J. (1993) Journal of Applied Bacteriology, 75, 369.
46. Funahashi, W., Suzuki, K., Ohtake, Y., and Yamashita, H. (1998) Journal of the American
Society of Brewing Chemists, 56, 64.
47. Garvie, E.l. (1974) International Journal of Systematic Bacteriology, 24, 301.
48. Gibson, Т., and Abd-el-Malek, Y. (1945) Journal of Dairy Research, 14, 35.
49. Gilliland, S.E., and Speck, M.L. (1977) Applied and Environmental Microbiology, 30,1289.
50. Gunther, H.L., and White, H. (1961) Journal of General Microbiology, 26, 199.
51. Harrigan, W.F., and McCance, M.E. (1976) Laboratory Methods in Food and Daiiy
Microbiology, Academic Press, London and New York.
52. Hammes, W.P., Weiss, N., and Holzapfel, W. (1991) In The Prokaryotes, 2nd edn (eds A.
Balows, H.G. Truper, M. Dworkin, W. Harder and K.-H. Schleifer), Springer-Verlag, New
York, p. 1535.
53. Harrison, L. (1979) Brewers' Guardian, 108 (September), 47.
54. Healy, P., and Armitt, J. (1980)Journalofthe Institute of Brewing, 86, 169.
55. Holzapfel, W.H. (1992) International Journal of Food Microbiology, 17, 113.
56. Hough, J.S., Briggs, D.E., Stevens., R., and Young, T.W. (1982) Malting and Brewing Science,
Vol. 2,2nd edn, Chapman and Hall, London.
57. Hsu, W.P., and Taparowsky, J.A. (1977) Brewers' Digest, 52 (February), 48.
58. Hug, H., Schlienger, E., and Pfenninger, H. (1978) Schweizer Brauerei-Rundschau, 89, 145.
59. Hugh, R., and Leifson, E. (1953) Journal of Bacteriology, 66, 24.
60. Ingledew, W. M., Sivaswamy, G , and Burton, J D. (1980) Journal ofthe Institute of Brewing
86,165.
61. Ingram, M. (1975) In Lactic Acid Bacteria in Beverages and Food (eds J.G. Carr, C.V. Cutting
and G.C. Whiting), Academic Press, London, p. 1.
62. Inoue.T. (1981) Technical Quarterly of the Master Brewers Association of the Americas, 18,62.
63. Izquerido-Pulido, M., Carcella-Rosa, J.M., Marine-Font, A., and Vidal-Carou, M.C. (1997)
Journal of Food Protection, 60, 831.
64. Izquerido-Pulido, M., Marine-Font, A., and Vidal-Carou, M.C. (2000) Food Chemistry, 70,329.
65. Jespersen, L., and Jakobsen, M. (1996) International Journal of Food Microbiology, 33,139.
66. Johnston, M.A., and Delwiche, E.A. (1965) Journal of Bacteriology, 90, 347.
67. Jonsson, H., and Pettersson, H.-E. (1977) Milchwissenschaft, 32, 587.
68. Kandler, O. (1983) Antonie van Leeuwenhoek, 49, 209.
Глава 5. Грамположительные бактерии в пивоварении
201
69. Kandler О., and Weiss, N. (1986) In Bergeys ManualofSystematic Bacteriology, Vol. 2 (eds P.H.A.
Sneath, N.S. Mair, M.E. Sharpe, and J.G. Holt), Williams and Wilkins, Baltimore, p. 1208.
70. Kleynmans, U.f Heinzl, H., and Hammes, W.P. (1989) Systematic and Applied Microbiology,
11,267.
71. Kloos, W.E., and Schleifer, K.-H. (1975Ъ) Journal of Clinical Microbiology, 1, 82.
72. Kloos, W.E., and Schleifer, K.-H. (1975a) Internationa/Journal of Systematic Bacteriology, 25,62.
73. Kloos, W.E., Tornabene, T.G., and Schleifer, K.-H. (1974) International Journal of Systematic
Bacteriology, 24, 79.
74. Kocur, M., Kloos, W.E., and Schleifer, K.H. (1991). In The Prokaryotes, 2nd edn (eds
A. Balows, H.G. Truper, M. Dworkin, W. Harder, and K.-H. Schleifer), Springer-Verlag, New
York, p. 1301.
75. Konings, W.N., Poolman, В., and Driessen, A.J.M. (1989) CRC Critical Reviews in
Microbiology, 16, 419.
76. Kunji, E.R.S., Mierau, I., Hagting, A., Poolman, В., and Konings, W.N. (1996) Antonie van
Leeuwenhoek, 70, 187.
77. Law, J., and Haandrikman, A. (1997) International Dairy Journal, 7,1-11.
78. Lawrence, D.R., and Leedham, P.A. (\919)Journalofthe Institute of Brewing, 85, 119.
79. Lawrence, D.R., and Priest, F.G. (1981) Proceedings of the 18th Congress of the European
Brewery Convention, Copenhagen, p. 217.
80. London, J. (1976) Annual Review of Microbiology, 30, 279.
81. Makinen, V., Tanner, R., and Haikara, A. (1981) Brauwissenschaft, 34,173.
82. Manca de Nadre, M.C., Pesce de Ruiz Holgado, A.A., and Oliver, G. (1988) Biochemief 70,367.
83. Martinez Murcia, A.J., and Collins, M.D. (1990) FEMS Microbiology Letters, 70, 73.
84. Martihez-Murcia, A.J., Harland, N.M., and Collins, M.D. (1993) Journal of Applied
Bacteriology 74, 532.
85. Matsuzawa, K., Kirchner, G., and Wackerbauer, K. (1979) Monatsschrift fur Brauerei, 32,
312.
86. McCaig, R., and Weaver, R.. (1983) Technical Quarterly of the Master Brewers Association of
the Americas, 20, 31.
87. McDonald, L.C., McFeeters, R.F., Daeschiel, M.A., and Fleming, H.P. (1987) Applied and
Environmental Microbiology 53,1382.
88. McKay, L.L. (1983) Antonie van Leeuwenhoek, 49, 259.
89. McMurrough, I., and Palmer, V. (1979) Journal of the Institute of Brewing, 85, 11.
90. McMurrough, I., Madigan, D., Donnelly, D., Hurley,J., Doyle, A.M., Hennigan, G., McNulty,
N., Smyth, M.R. (l996).Journalofthe Institute of Brewing, 102,327.
91. Mira de Orduna, R., Liu, S.-Q., Patchett, M., and Pilone, G.J. (2000) FEMS Microbiology
Letters, 183,31.
92. Mira de Orduna, R., Patchett, M.L.,Liu, S.-Q., and Pilone, G.J. (2001). Applied and
Environmental Microbiology, 67,1657.
93. Morlon-Guyot, J., Pot, В., Jacobe de Haut, I., and Raimbault, M. (1998) International Journal
of Systematic Bacteriology, 48,1101.
94. Munekata, M. (1973) Bulletin of Brewing Science, 19, 27.
95. Nakagawa, A., and Kitahara, K. (1959) Journal of General and Applied Microbiology, 5,95.
96. Nakamura, L.K. (1981) International Journal of Systematic Bacteriology, 31, 56.
97. Nishikawa, N.. Kohgo, M., and Karakawa, T. (1979) Bulletin of Brewing Science, 25,13,17 and 23.
98. Nishikawa, N.. and Kohgo, M. (1985) Technical Quarterly of the Master Brewers Association of
the Americas, 22, 61.
202
Фергус Г. Прист
99. Orla-Jensen, S. (1919) Lactic Acid Bacteria, Andre Fred Host, Copenhagen.
100. Pfenninger, H.B., Schur, F, Anderegg, P., and Schlienger, E. (1979) Proceedings of the 17th
Congress of the European Brewery Convention, Berlin, p. 491.
101. Priest, F.G. (\98\)Journalofthe Institute of Brewing, 87, 279
102. Priest, F.G., and Austin, B. (1993) Modern Bacterial Taxonomy, 2nd edn, Chapman & Hall,
London.
103. Priest, F.G., and Barbour, E.A (1985) In: Computer-Assisted Bacterial Systematics (eds
M. Goodfellow, D.Jones and F.G. Priest), Academic Press, London, p. 137.
104. Priest, F.G., and Pleasants, J.G. (1988) Journal of Applied Bacteriology, 64, 379.
105. Priest, F.G., and Williams, ST. (1993) In, Handbook of New Bacterial Systematics (eds M.
Goodfellow and A.G. O'Donnell), Academic Press, London, p. 361.
106. Rainbow, C. (1981) In: Brewing Science, Vol. 2 (J-R-A. Pollock, ed.), Academic Press, London
and New York, p. 491.
107. Rinck, M., and Wackerbauer, K. (1987) Monatsschrift fur Brauwissenschaft, 40, 324.
108. Rogosa, M. (1974) In Bergeys Manual of Determinative Bacteriology, 8th edn (eds R.E Buchanan
and N.E. Gibbons), Williams and Wilkins, Baltimore, p. 576.
109. Saha, R.B., Sonda, R.J., and Middlekauf, J.E. (1974) Proceedings of the American Society of
Brewing Chemists, 32, 9.
110. Sami, M., Yamashita, H., Hirono, Т., Kadokura, H., Kitamoto, K., Yoda, K., and Yamasaki,
M. (1997a) Journal of Fermentation and Bioengineering, 84, 1.
111. Sami, M.t Yamashita, H., Kadokura, H., Kitamoto, K., Yoda, K., and Yamasaki. M (1997b)
Journal of the American Society of Brewing Chemists, 55,137.
112. Sanni, А.1., and Oso, B.A. (1988) Nahrung, 32, 319.
113. Schleifer, K.-H., and Ludwig, W. (1995) Systematic and Applied Microbiology, 18,461.
114. Sharpe, M.E. (1979). In Identification Methods for Microbiologists, 2nd edn (eds F.A. Skinner,
and D.W. Lovelock), Academic Press, London, p. 233.
115. Sharpe, M.E., Fryer, T.F., and Smith, D.G. (1966) In Identification Methods for
Microbiologists Part A (eds B.M. Gibbs and FA. Skinner), Academic Press, London, p. 65.
116. Shimwell, J.L. (1941) Wallerstein Laboratories Communications, 4, 41.
117. Shimwell, J.L. (1945) Wallerstein Laboratories Communications, 8, 23.
118. Shimwell, J.L., and Kirkpatrick, W.F. (\939)Journalofthe Institute of Brewing,^, 137
119. Simpson, K.L., Pettersson, B. and Priest, F.G.(2001). Microbiology, 147, 1007
120. Simpson, W.J. (1993) Journaloj'the Institute of Brewing, 99, 405.
121. Smith, N.A., and Smith, P. (\992)Journalofthe Institute of Brewing, 98, 409
122. Smith, N.A., and Smith, P (1993) Journal of the Institute of Brewing, 99, 43.
123. Solberg. O., and Claussen, O.G. (1973a) Journal of the Institute of Brewing, 79, 227
124. Solberg, O., and Claussen, O.G. (1973b) Journal of the Institute of Brewing, 79, 231
125. Speckman, R.A., and Collins, E.B. (1968) Journal of Bacteriology, 95, 174.
126. Speckman, R.A., and Collins, E.B (1973) Applied Microbiology, 26, 744
127. Stackebrandt, E., Koch, C, Gvozdiak, O., and Schumann, P. (1995) InternatiuonalJournal of
Systematic Bacteriology, 45, 682.
128. Storgards, E., Suihko, M.L., Pot, В., Vanhonacker, K.f Janssens, D., Broomfield, P L.E., and
Banks, J.G. (1998) Journal of the Institute of Brewing, 104, 47.
129. Taguchi, H., Ohkochi, M., Vehara, H., Kojima, K., and Mawatri, M. (1990) Journal of the
American Society of Brewing Chemists, 48, 72.
130. Tsuchiya, Y, Nakakita, Y., Watari, J , and Shinotsuka, К (2000) Journal of the American
Society of Br awing Chemists, 58, 89
Глава 5. Грамположительные бактерии в пивоварении
203
131. Van Beek, S., and Priest, F. G. (2000). Applied and Environmental Microbiology, 66, 5322.
132. Vandamme, P., Pot, В., Gillis, M., deVos, P., Kersters, K., and Swings, J. (1996) Microbio-
logical Reviews 60, 407-438
133. Van Keer, C, Van Melkebeke, L., Vertriest, W., Hoozee, G., and Van Schoonenberghe,
E (1983) Journal of the Institute of Brewing, 89, 361.
134. Van Vuuren, H.J J., Kersters, K., De Ley, J., Toerien, D.F., and Meisel, R. (1978) Journal of
the Institute of Brewing, 84, 315.
135. Van Vuuren, H.J.J., Kersters, K., De Ley, J., and Toerien, D.F. (1981) Journal of Applied
Bacteriology, 51,51.
136. Verzele, M. (1986) Journal of the Institute of Brewing, 92, 32.
137. Wackerbauer, K., and Emeis, C.C. (1967) Monatsschrift fur Brauerei, 20, 160.
138. Wackerbauer, K., and Emeis, C.C. (1968) Monatsschrift fur Brauerei, 22, 3.
139. Wackerbauer, K., and Rinck, M. (1983) Monatsschrift fur Brauwissenschaft, 36, 392.
140. Weiss, N. (1991) In The Prokaryotes, 2nd edn (eds A. Balows, H.G. Truper, M. Dworkin,
W. Harder and K.-H. Schleifer), Springer-Verlag, New York, p. 1502.
141. White, F H., and Kidney, E (1979) Proceedings of the 17th Congress of the European Brewery
Convention, Berlin, p. 801.
142. Whiting, M., Crichlow, M., Ingledew, W.M., and Ziola, B. (1992) Applied and Environmental
Microbiology, 58, 713.
143. Whiting, M., Ingledew, W.M., Lee, S.Y., and Ziola, B. (1999) Canadian Journal of
Microbiology, 45, 670.
144. Whittenbury, R. (1978) In Streptococci (eds F.A. Skinner and L.B. Quesnel), Academic Press,
London, p. 51.
145. Woese, C.R. (1987) Microbiological Reviews, 51, 221.
146. Yasui, T, and Yoda, K. (1997) FEMS Microbiology Letters, 151,169/
147. Yasui, Т., Okamoto, T, and Taguchi, H. (1997) Canadian Journal of Microbiology, 43,157.
148. Young, T.W., and Talbot, N.P.( 1979) Proceedings of the 17th Congress of the European Brewery
Convention, Berlin, p. 817.
149. Ziola, В., Ulmer, M., Bueckert, J., Giesbrecht, D., and Le, S.Y (2000) Journal ofthe American
Society of Brewing Chemists, 58, 63.
150. Zuniga, M., Champomier-Verges, M, Zagorec, M., and Perez-Martinez, G. (1988) Journal of
Bacteriology, 180, 4154.
Глава 6
ГРАМОТРИЦАТЕЛЬНЫЕ БАКТЕРИИ
В ПИВОВАРЕНИИ
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
(Hennie J. J. Van Vuuren, Fergus G. Priest)
6.1. Введение
Рождением бактериологии пивоварения считается момент, когда Луи Пастер в XIX в.
исследовал микроорганизмы, приводящие к порче пива (его пригласили, чтобы опреде-
лить, почему французское пиво хуже немецкого). Пастер выделил из французского пива
и солодового сусла некоторое количество микроорганизмов и в 1876 г. опубликовал
свою знаменитую работу «Etudies sur la Biere, ses Maladies, Causes qui les Provoquent.
Proceespourla Rendre Inaltderable, avec une Theorie Nouvelle de la Fermentqtion» («Исследо-
вание пива, его болезней и вызывающих их причин. Способы сохранения качества пива
и новая теория брожения»).
Окраска бактерий по Граму появилась в 1884 г. благодаря работам датского врача
Кристиана Грама и позже была усовершенствована [97]. Реакция Грама основана на
некоторых структурных особенностях клеточной стенки бактерий, и различие между
грамположительными и грамотрицательными микроорганизмами играет первосте-
пенную роль в их таксономической классификации. К порче пива причастны и грам-
положительные, и грамотрицательные бактерии, но в этой главе мы будем рассматри-
вать только последние.
Принципы идентификации бактерий-вредителей пива были разработаны выдаю-
щимся специалистом по микробиологии пивоварения Дж. Шимвеллом (Shimwell)
[88]. Впоследствии они были несколько упрощены [3] и сведены лишь к бактериям,
которые чаще всего встречаются в пивоваренном производстве. В работе [115] эти
принципы были переработаны применительно к микроорганизмам, вызывающим
порчу пива. В 1980-х гг. было опубликовано довольно много работ, посвященных
определению микроорганизмов [4, 12, 14, 46, 50]. Одна из несложных схем иденти-
фикации приведена на рис. 6.1 — ее можно использовать для определения грамотри-
цательных бактерий, приводящих к порче пива (включая не так давно выделенные
Selenomonas и Zymophilus. Энтеробактерии, выделяемые на пивоваренных производ-
ствах, могут далее идентифицироваться с помощью специальных диагностических
наборов типа API 20£ [50, 121] (см. главу 9).
В целом, присутствие в ходе пивоварения грамотрицательных бактерии считается
нежелательным. В настоящей главе мы рассмотрим основные грамотрицательные бак-
терии порчи — уксуснокислые бактерии и микроорганизмы родов Enterobacteiiaceae,
Zymomonas, Pectinatus cerevisiiphilus, Pectinatus frisingensis, Selenomonas lacticifex, Zymo-
philus raffinosivorans, Zymophilus paucivorans, а также Megasphaera. Мы затронем вопрос
и о некоторых неферментативных бактериях, встречающихся в пиве.
Глава 6. Грамотрицательные бактерии в пивоварении
205
Грамотрицательные бактерии
Рост на твердой среде
(аэробные условия)
Рост на твердой среде
(анаэробные условия)
Не образуют
уксусную кислоту
из этанола
Образуют Кокки
уксусную кислоту Megasphaera
из этанола
Acetobacter
Gluconobacter
Палочки
Pectinatus
Selenomonas
Zymophilus
Нет роста
на селективной
для Zymomonas среде
Enterobacteriaceae
Рост
на селективной
для Zymomonas среде
Zymomonas
Рис. 6.1. Схема идентификации грамотрицательных бактерий, приводящих к порче пива
Тем самым мы подошли к понятию «инфекция», которое зачастую микробиолога-
ми пивоваренных производств применяется неправильно. Бактерии инфицируют
людей, животных и растения, но субстраты (пиво, другие напитки, пищевые продук-
ты) они «контаминируют». Следовательно, для пива они являются контаминанта-
ми, и вместо термина «инфекция» следует применять термин «контаминация».
6.2. Уксуснокислые бактерии
Уксуснокислые бактерии образуют важную группу грамотрицательных палочко-
образных бактерий, способных превращать спирт в уксусную кислоту. Они исполь-
зуются для промышленного производства уксуса [98] и могут приводить к порче пи-
щевых продуктов, безалкогольных и алкогольных напитков (пива, вина, сидра) —
подробнее см. [106]. Уксуснокислые бактерии традиционно подразделяются на роды
Acetobacter и Gluconobacter (ранее — Acetomonas) и входят в семейство Acetobacteria-
сеае [37]. Результатом интенсивных исследований промышленного производства ук-
суса и хемотаксономического анализа явился отнесение некоторых видов этих бакте-
рий к новому роду Gluconacetobacter [134]. Первоначально роды Gluconacetobacter и
Acetobacter различали по структуре убихинона, причем последующие анализы 16S
(р)РНК рибосом (об основах филогенетического анализа на основе РНК-последова-
тельностей см. главы 5 и 9) подтвердили правомерность такого разграничения [33,
134]. Тем самым некоторые виды Acetobacter, в частности Acetobacter hansenii и Aceto-
bacterliquefaciens, были отнесены к этому новому роду (род Gluconobacter нововведе-
ния не затронули). Для этих трех родов существуют некоторые диагностические при-
знаки, и наиболее явно они проявляются в ходе анализа рРНК-последовательности.
206
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
6.2.1. Acetobacter
а) Основные характеристики
Клетки Acetobacterбывают грамотрицательными или грамвариабельиыми, имеют
эллипсоидальную или палочкообразную форму (продолговатую или слегка изогну-
тую) и размер 0,6-0,8 мкм х 1,0-4,0 мкм. Встречаются они по отдельности, парами
или цепочками. Встречающиеся плеоморфные формы могут быть сферической, уд-
линенной, «распухшей» и нитевидной формы. Они могут быть подвижными или не-
подвижными; у подвижных присутствуют перетрихиальные или боковые жгутики.
Виды Acetobacter являются строгими аэробами (кислород — конечный акцептор
электронов), каталазо-положительными и оксидазо-отрицательнымп и окисляют
этиловый спирт до уксусной кислоты и затем — до С02 и воды. Эти бактерии часто
называют «сверхокислителями»; в жидкой среде штаммы ацетобактерий формиру-
ют кольца или пленки на поверхности, причем иногда это происходит одновременно
[27]. Обширные таксономические исследования рода Acetobacter привели к описа-
нию около 10 видов и нескольких подвидов микроорганизмов.
б) Метаболизм
Виды A cetobacter обладают дыхательным метаболизмом [25,60] и непосредствен-
но окисляют сахара и другие углеводные субстраты (подробнее см. [2, 26]). Напри-
мер, глюкоза окисляется до глюконовой, 2- и 5-оксиглюконовых кислот, глицерин —
до дигидроксиацетона, а сорбит — до сорбозы. Эти микроорганизмы метаболизиру-
ют сахара посредством гексозмонофосфатного пути, а также в цикле трикарбоновых
кислот [3,79]. У некоторых штаммов Acetobacterpasteurianus путь Энтнера-Дудоро-
ва, по-видимому, более активен, чем гексозомонофосфатный шунт [129,130]. Штам-
мы, в качестве единственного источника углерода утилизирующие этанол, а един-
ственного источника азота — сульфат аммония, используют ферменты побочного
глиоксилатного пути [60, 101].
Бактерии рода A cetobacter хорошо размножаются в средах, содержащих в качестве
единственного источника углерода этиловый спирт, глицерин и DL-лактат натрия.
Некоторые штаммы способны размножаться, используя в качестве единственного
источника азота и углерода соответственно аммиак и этиловый спирт. Лишь немно-
гочисленные штаммы способны утилизировать в качестве источника азота отдель-
ные аминокислоты. В зависимости от утилизируемых углеродсодержащих веществ
требуются те или иные факторы роста. Некоторые штаммы Acetobacterpasteurianus и
Gluconacetobacterpasteurii продуцируют внеклеточную целлюлозу.
6.2.2. Gluconobacter
а) Основные характеристики
Морфология Gluconobacter очень схожа с морфологией Acetobacter, но у подвиж-
ных штаммов наблюдается от 3 до 8 полярных жгутиков (один жгутик встречается
очень редко). Виды микроорганизмов данного рода являются строгими аэробами,
они каталазо-положительны и оксидазо-отрицательны, не редуцируют нитраты до
нитритов, однако редуцируют этиловый спирт до уксусной кислоты. Более того,
Gluconobacter не окисляет ацетат или лактат до С02 и Н20. При низком рН (рН < 4,5)
Глава 6. Грамотрицательные бактерии в пивоварении
207
наблюдается сильный кетогенез и образование кислоты из D-глюкозы и L-ксилозы.
Некоторые штаммы продуцируют розовый недиффундирующий пигмент, тогда как
другие могут продуцировать растворимый темно-коричневый пигмент и А.-пирон.
Путь для образования Х-пирона описан в [3]; предполагается, что продуцирование
коричневого пигмента связано с синтезом А.-пирона [79]. Образующаяся уксусная
кислота в спиртовой среде Фратера [34] растворяет карбонат кальция, который впо-
следствии не осаждается. Этот метод (а также метод Карра [13]) может применяться
для определения различий между Acetobacterи Gluconobacter. В пиве, сусле или жид-
ких глюкозосодержащих средах на поверхности образуется легкая пленка или налет.
Некоторые штаммы при росте в пиве благодаря образованию декстранов и леванов
продуцируют липкие вещества [27]. Для пивоварения наиболее важными видами
являются представители Gluconobacteroxydans.
б) Метаболизм
Виды Gluconobacter характеризуются дыхательным метаболизмом (конечный ак-
цептор электронов — кислород). Наиболее важный путь распада Сахаров до С02
и Н20 — гексозомонофосфатный шунт. У Gluconobacter не задействованы полный
гликолитический путь и цикл трикарбоновых кислот [25, 39, 131], но присутствуют
ферменты пути Энтнера-Дудорова [55, 60]. Эти микроорганизмы способны окис-
лять сахара, стероиды, алифатические и циклические спирты; они хорошо размно-
жаются в присутствии фруктозы, глюкозы, глицерина, маннита и сорбита. У многих
штаммов Gluconobacter в качестве источника азота используются ионы аммония, а
также отдельные аминокислоты.
6.2.3. Gluconacetobacter
а) Основные характеристики
В род Gluconacetobacter первоначально включали те виды Acetobacter, которые
в своей респираторной цепи содержат убихиноны, содержащие 10 остатков изопре-
на, а не 9 (как у истинных Acetobacter). Это различие было впоследствии подтверж-
дено исследованиями 165-рРНК [33,134]. Эти бактерии сходны с видами Acetobacter
и по другим аспектам метаболизма: они окисляют ацетат до диоксида углерода
и воды и размножаются в средах, применяемых для Acetobacter. Подобное разделе-
ние представляет собой скорее таксономическое изощрение, чем служит показате-
лем морфологических или функциональных отличий. Типичный вид данного рода
микроорганизмов — Gluconacetobacterliquefaciens.
6.2.4. Порча пива
Окисление пива изучалось еще основоположниками микробиологии — Персуном
(Persoon) (см. [79]), Пастером, Хансеном, Хеннебергом и Бейеринком (см. [106]).
Уксуснокислые бактерии были выделены из окружающей среды пивоваренных
предприятий [47,72,115], а поскольку они характеризуются стойкостью к бактерио-
статическим свойствам хмеля, к кислотам и к этиловому спирту [47, 65], то способ-
ны размножаться в пиве и его портить. Тем не менее, будучи строгими аэробами, они
не должны размножаться в сусле или пиве в анаэробных условиях, хотя пивные
208
Хенни Дж. Дж. Ван Вуурен, Фергус Г Прист
штаммы могут размножаться при микроаэрофильных условиях и были выделены из
пива с низким содержанием кислорода. Лабораторные штаммы уксуснокислых бак-
терий не размножаются в инкубационной среде с введенным диоксидом углерода, но
аналогичные штаммы, выделенные из пива, разливаемого на предприятиях обще-
ственного питания, в такой среде размножаются [45].
Уксуснокислые бактерии чаще всего присутствуют в пиве, разливаемом из бо-
чек, — оно быстро окисляется под влиянием проникающего в бочки воздуха. Эти
бактерии портят пиво, придавая ему кислый вкус, посторонние привкусы и ароматы,
вызывают появление мути и образование слизи [17,18, 65,86, 89,113,125]. Возник-
новение посторонних привкусов и ароматов без подкисления возможно в случае
окисления полиспиртов (например, глицерина) до дигидроксиацетона. Образование
слизи часто наблюдается в виде покрытия поверхности пива маслянистой пленкой.
Степень порчи пива уксуснокислыми бактериями зависит от штамма и содержания
спирта. Было обнаружено, что при концентрации спирта выше 6% размножение этих
бактерий полностью подавляется [16, 86]. Тем не менее некоторые штаммы способ-
ны к росту в средах с 10%-ным содержанием этилового спирта [28]. Штаммы
Acetobacter sp. (BS05) и Gluconobacter oxydans (NCIB 9013) способны выживать при
12-13%-ном содержании этилового спирта, что иногда встречается в высокоплот-
ных сортах пива [63]. Было показано [36], что штаммы Acetobacter sp. продуцируют
какое-то токсическое для дрожжей соединение.
В ячмене и хмеле обнаружить уксуснокислые бактерии не удалось [72], однако не-
которые образцы солода, сусла, дрожжей и воздуха оказались ими контаминированы,
причем наиболее сильно контаминированными оказались емкости для хранения и
клапаны регулирования давления. Тем не менее редкое обнаружение уксуснокислых
бактерий в пробах воздуха весьма неожиданно, так как в пивоваренном производстве
они встречаются повсеместно, а пиво, подвергающееся воздействию воздуха, быстро
окисляется. Уксуснокислые бактерии встречаются на многих видах растений, и, сле-
довательно, нельзя не учитывать возможность их попадания в пиво с растительных
материалов и из воздуха [47, 49]. Acetobacter отлично размножается в обогащенных
спиртом средах, тогда как Gluconobacter предпочитает в качестве источника углерода
сахара. Уксуснокислые бактерии характеризуются стойкостью к антисептическому
действию хмеля и кислых сред, а также толерантны к этиловому спирту, в связи с чем
в присутствии кислорода они могут размножаться и портить пиво.
6.3. Энтеробактерии
6.3.1. Основные характеристики
Семейство Enterobacteriaceae включает в себя большое количество родов бактерий,
выделяемых из различных источников. Некоторые виды являются безвредными, тог-
да как другие — патогенны для людей, животных, насекомых и растений. В данное
семейство входят многочисленные роды, из которых на пивоваренных предприятиях
встречаются следующие: Citrobacter, Enterobacter, Hafnia, Klebsiella, Obesumbacterium,
Proteus, Rahnella и Serratia. Следует отметить, что о выявлении на пивоваренных пред-
приятиях Esherichia и патогенных родов Salmonella и Shigella до сих пор сообщений не
появлялось.
Глава 6. Грамотрицательные бактерии в пивоварении
209
Представители этого семейства— грамотрицательные палочки размером 0,3-
1,0 х 1,0-6,0 мкм. Встречаются как подвижные, так и неподвижные виды. Подвиж-
ные штаммы имеют перитрихиальные жгутики. Они являются факультативными
анаэробами, устойчивы к желчным солям и способны расти в основном на средах из
минеральных солей, содержащих в качестве единственного источника углерода
(и энергии) глюкозу. Тем не менее некоторые штаммы нуждаются в витаминах или
аминокислотах (либо и в тех и в других). В процессе ферментации глюкозы часто
образуются кислота и улавливаемый газ. Все разновидности бактерий, имеющих
значение для пивоварения, являются каталазо-положительными и оксидазо-отри-
цательиыми. В анаэробных условиях нитрат, восстанавливаясь до нитрита, пред-
ставляет собой конечный акцептор электронов, что является причиной образования
N-нитрозаминов [96].
6.3.2. Метаболизм
Энтеробактерии сбраживают глюкозу по пути Эмбдена-Мейергофа-Парнаса
и гексозомонофосфатному пути с образованием различных количеств муравьиной,
молочной и янтарной кислот, этилового спирта, ацетона и 2,3-бутандиола. Концент-
рация этих метаболитов в значительной степени зависит от видовой принадлежности
бактерий и от условий их роста [114,120]. Существует два основных типа фермента-
ции. В смешанно-кислотном брожении, типичном для Escherichia coli, образуется эти-
ловый спирт и кислота с небольшим количеством (или без) ацетона и 2,3-бутандиола.
Напротив, виды Klebsiella продуцируют сравнительно большие количества ацетона
и 2,3-бутандиола с меньшим количеством кислот (через 2,3-бутандиоловый путь).
Для идентификации смешанного кислотного и 2,3-бутандиолового брожения часто
используют соответственно тест с метиловым красным и тест Вога-Проскауэра (Vo-
ges-Proskauer). Соотношение конечных продуктов влияет на полученные результа-
ты, и поэтому, если целью анализа является идентификация микроорганизмов, на это
при анализе необходимо обращать особое внимание.
Газохроматографический анализ конечных продуктов метаболизма 60 энтеробак-
териальных контаминантов пива показывает, что Citrobacter freundii, Proteus mirabilis
и Klebsiella oxytoca сбраживают глюкозу через смешанно-кислотный путь (гомофер-
ментативное брожение), a Enterobacter cloacae, Hafnia alvei, Klebsiella pneumonia
Pantoea agglomerans (ранее — Enterobacter agglomerans) и Serratia marcescens продуци-
руют большое количество 2,3-бутандиола [120]. Хотя считается, что Н. alvei сбражи-
вают глюкозу по 2,3-бутандиоловому пути, в работе [114] показано, что этому микро-
организму присущ смешанный метаболизм: некоторые штаммы Я. alvei сбраживают
глюкозу путем смешанно-кислотного брожения, а другие продуцируют большие ко-
личества 2,3-бутандиола. Obesumbacterium proteus осуществляет смешанное кислот-
ное брожение.
Семейство Enterobacteriaceae постоянно таксонометрически пересматривается
(отчасти из-за важности этих микроорганизмов в медицине и тщательного их иссле-
дования в клиниках). Так, Enterobacter agglomerans были отнесены к новому роду
Pantoea как Pantoea agglomerans [35]. Результаты недавнего филогенетического ана-
лиза отдельных штаммов многих родов, имеющих отношение к пивоварению, приве-
дены на рис. 6.2, где наглядно видна взаимосвязь между этими организмами [99].
210
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
90
• Escherichia coli
— Salmonella typhimurlum ATCC 19430т
- Pantoea agglomerans DSM 3493T
Erwinia tracheiphila LMG29061
94 i
7yipOr—
Pectobacterium cypripedii DSM 3873T
- Erwinia mallotivora DSM 4565*
- Erwinia psidii LMG 7034T
Erwinia amylovora DSM 30165T
Erwinia rhapontici DSM 4484T
Erwinia persicinus ATCC 35998T
Tatumella ptyseos DSM 5000f
Erwinia cluster I
Erwinia cluster II
Klebsiella pneumoniae DSM 30104T
- CitrobacterfreundiiDSM30039T
- Buttiauxella agrestis DSM 4586T
Brenneria quercina DSM 4561T
• Pectobacterium carotovorum subsp. carotovorum DSM 30168
Pectobacterium cacticidum LMG 179361
4
ч:
■ Pectobacterium chrysanthemi DSM 4610T
Brenneria alni DSM 11811'
Brenneria nigrifluens DSM 30175T
Brenneria salicis DSM 30166T
Brenneria rubrifaciens DSM 4483T
— Budvicia aquatica DSM 5075T
— Pragiafontium DSM 5563T
— Leminorella grimontii DSM 5078T
65
Serratia odorifera DSM 4582T
— Serratia marcescens DSM 30121T
Serratia rubidaea DSM 4480T
lOOr Hafniaalvei ATCC 13337T
]
]
]
Erwinia cluster II
Erwinia cluster IV
Serratia cluster I
60
Obesumbacterium proteus DSM 2777T
72 r- Serratia entomophila DSM 12358T
' ■" Serratia ficaria DSM 4569'
Serratia fonticola DSM 4576T
Serratia plymuthica DSM 4540T
г Serratia proteamaculans DSM 4543T
1 Serratia grimesii DSM 30063T
u—s<
TJ-S,
Serratia cluster II
l-i=E
■ Yersinia pestis D-28
100
100
Rahnella aquatica DSM 4594T
- Ewingella americana NCPPB 3905
Proteus vulgaris DSM 30118
681 Xenorhabdus nematophilus DSM 3370T
Photorhabdus luminescens DSM 3368T
Plesiomonas shig el I о ides ATCC 14029r
2%
Рис. 6.2. Филогенетическое дерево различных видов семейства Enterobacteriaceae (по гену 16S
рРНК;. Числа обозначают встречаемость (в %) данных ответвлений в 200 самостоятельных ветвях
(приведены только встречаемости, превышающие 60%). Градуировка шкалы отражает 2 нуклеотид-
ных замещения на 100 нуклеотидов (по [99])
Глава 6. Грамотрицательные бактерии в пивоварении
211
Очевидно, что виды, встречающиеся в пиве и на пивоваренных предприятиях, рас-
пределены по всему филогенетическому дереву.
6.3.3. Порча пива
Энтеробактериальные контаминанты в пивоваренном производстве называют тер-
мобактериями [61], бактериями сусла [3,19,64], а также coli-aerogenes или колиформа-
ми [49, 54, 68]. Термин «термобактерии» не является научным, в понятие «бактерии
сусла» входят и другие микроорганизмы, не являющиеся представителями энтеробак-
терий, а в разряд coli-aerogenes или «колиформ» не попадает такой важный вредитель
пива, как О. proteus. Более корректными наименованиями этих контаминантов являют-
ся Enterobacteriaceae или энтеробактерии.
Считается, что первым, кто описал контаминацию и порчу пива энтеробактериями,
был П. Линднер [61 ] (1895). Впоследствии на пивоваренных предприятиях были выде-
лены отдельные виды этого семейства — C.freundii, Enterobacter aerogenes, E. cloacae,
II. alvei, К. oxytoca, К. pneumoniae, О. proteus, P. agglomerans, R. ^quatilis, а также штаммы
Serratia[\,7,i9,32,44,66,70,75,78,112,117,121,122].
Патогенные виды, встречающиеся в пиве, до сих пор не описаны. Авторы работ [3,
83, 90] считают, что представители семейства Enterobacteriaceae большого значения
для пивоваренной промышленности не имеют. Тем не менее в настоящее время
хорошо известно, что энтеробактерии тормозят или ускоряют процесс брожения
и существенно влияют на вкус и аромат готового продукта. Обычно полагают, что
энтеробактерии (не считая О. proteus и R. aquatilis) не могут выживать в неблагопри-
ятных условиях брожения [44, 76]. Однако бактерии могут существовать в «необна-
руживаемом» состоянии [133] (то есть когда на стандартных лабораторных средах их
размножения не наблюдается), но они жизнеспособны и находятся в «спящем» состо-
янии. Такие «необнаруживаемые» бактериальные контаминанты могут поставить пе-
ред пивоваренной промышленностью сложные проблемы и подвергнуть сомнению
общепринятую точку зрения, что многие энтеробактерии не выживают в неблагоприят-
ных условиях брожения. При их присутствии в многократно используемых засевных
дрожжах они практически не обнаруживаются стандартными методами на стандарт-
ных культуральных средах, и, следовательно, при их размножении в благоприятных
условиях в ходе повторного брожения может произойти контаминация и порча
пива.
a) Obesumbacterium proteus
Наиболее известный представитель энтеробактериальных контаминантов — О. pro-
teus. Эта бактерия впервые была описана П. Линднером как Termobacterium lutescens
[75]. Дж. Шимвелл, назвавший ее в 1936 г. Bacterium Y [86], затем переименовал ее
в Flavobacterium proteus [94] и в конце концов выделил новый род Obesumbacterium
с единственным видом О. proteus [92, 93]. Обширные исследования [76, 77] показали,
что О. proteus весьма схожи с Hafnia и, таким образом, входят в семейство Enterobacter-
iaceae. Было предложено расчленить род Obesumbacteiium так, чтобы переместить
О. proteus в Hafnia под именем Hafniaprotea. Близкое родство между О. proteus и //. alvei
наглядно продемонстрировано на рис. 6.2. И действительно, эти два микроорганизма
имеют по существу идентичные рРНК-последовательности [99], но при этом сохраня-
ZIZ
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
ется их родовая принадлежность к Obesumbactenum [95]. Две генетические группы
H.pwtea выделяются в [72], что подтверждается в [8], однако для определения видов
в рамках этих двух групп необходимы дальнейшие исследования.
До сих пор O.proteus на пивоваренном производстве выделен только из экзоген-
ных источников. Его часто обнаруживают в засевных дрожжах в виде «коротких тол-
стых палочек». O.proteus чрезвычайно плеоморфен, хорошо растет в охмеленном
и неохмеленном сусле и толерантен к этиловому спирту вплоть до его концентрации
в 6% об., однако ингибирующая концентрация этилового спирта зависит от рН.
О. proteus может размножаться в неохмеленном сусле при интервале рН от 4,4 до 9,0.
В работе [9] этот микроорганизм считался безвредным контаминаитом дрожжей,
тогда как в [100] сделан вывод, что он может портить пиво, если присутствует
в семенных дрожжах в концентрациях, превосходящих 1,5%. Как бы то ни было,
О. proteus — важный вредитель пива, способный размножаться вместе с дрожжами
в ходе брожения, тормозить процесс ферментации, и в результате пиво приобретает
высокие значения плотности и рН [76]. О. proteus отвечает также за рост содержания
диметилсульфида, диметилдисульфида, я-пропанола, изобутанола, изопентанола,
2,3-бутандиола и диацетила [19,76]. Конечная концентрация этих соединений зача-
стую зависит от штамма. Пиво, полученное с применением контаминированных
O.proteus дрожжей, характеризуется побочным вкусом и ароматом пастернака и
фруктов. Основным источником контаминации пивоваренного производства этим
микроорганизмом являются засевные дрожжи.
б) Rahnella aquatilis
Enterobacteragglomeransкак важный вредитель пивоваренного производства впер-
вые был отмечен в [120]. Этот вывод был подтвержден позднее в [64,66]. В то время
(в конце 1970-х гг.) Е. agglomerans включал в себя большую и разнородную группу
бактерий, а их номенклатура и классификация находились еще на стадии формиро-
вания [120]. Выделенные на пивоваренных производствах 18 аэрогенных штаммов
Е. agglomerans [121] были переопределены как штаммы вида Rahnella aquatilis [44],
но таксономия штаммов вида Е. agglomerans, описанных в [64,66], не стала более яс-
ной. Ниже мы будем рассматривать все выделенные на пивоваренных производствах
штаммы Е. agglomerans как штаммы R. aquatilis.
Клетки Rahnella aquatilis представляют собой маленькие палочковидные клетки
размером 0,5-0.7 х 2,0-3,0 мкм. При температуре 25 °С они подвижны, но при 37 °С
их подвижность снижается. Сбраживание глюкозы происходит с образованием кис-
лоты, причем большинство штаммов выделяют газ. Сбраживаются также лактоза,
мальтоза, раффиноза, рамноза и салицин. R. aquatilis негативны к лизин- и орнитин-
декарбоксилазам, а также к аргининдегидролазе. Все штаммы позитивны по Вогу-
Проскауэру (см. выше), а также большинство штаммов позитивны к метиловому
красному и слабо позитивны к фенилаланиндеаминазе. Содержание Г+Цв ДНК
составляет 51-56 моль% [8, 52, 53]. R. aquatilis встречаются главным образом в сы-
рой воде, но иногда их выделяют и из клинических анализов человека.
R. aquatilis хорошо размножаются на охмеленном и неохмеленном сусле незави-
симо от присутствия дрожжей. При нормальной плотности сусла они выживают
в ходе процесса пивоварения и, подобно O.proteus, аккумулируются в повторно ис-
Глава 6. Грамотрицательные бактерии в пивоварении
213
пользуемых засевных дрожжах [63, 118], однако в высокоплотном пиве R. aquatilis
погибают при концентрации этилового спирта в 11-12% об [63].
При брожении эля O.proteus поднимаются на поверхность сусла с верховыми
дрожжами и остаются жизнеспособными в течение 60-70 ч, тогда как другие энтеро-
бактерии остаются суспендированными в сусле и погибают в неблагоприятных ус-
ловиях (в частности, при низких рН и высокой концентрации этилового спирта)
[76], однако в ходе брожения лагерного пива такие контаминанты, как /?. aquatilis,
оседают или флокулируют вместе с дрожжами. Эти бактерии, аккумулирующиеся
в собранных засевных дрожжах, являются серьезным источником контаминации,
причем получить точные данные об их количестве в ходе брожения невозможно.
Когда R. aquatilis присутствует в бродящем сусле, они существенно влияют на
процесс брожения, а также на вкус и аромат пива [66, 118]. Хотя энтеробактерии
тормозят процесс брожения [19], присутствие R. aquatilis в ходе брожения лагерного
пива в начальной стадии повышает скорость брожения, но удельная плотность кон-
таминированного пива бывает выше, чем у контрольных проб [118]. В то же время
при изготовлении эля плотность конечного продукта в присутствии R. aquatilis ниже
[66]. Конечное значение рН бродящего сусла, контаминированного R. aquatilis,
выше, чем обычно (вероятно, благодаря образованию в ходе брожения нейтральных
метаболитов). R. aquatilis сбраживает глюкозу по пути 2,3-бутандиола [118], однако
при брожении эля конечный рН контаминированного пива сходен с контрольными
пробами [66].
В пиве, полученном из сусла, содержащего 106 КОЕ R. aquatilis /мл, обнаружен
ненормально высокий уровень диацетила (0,7 мг/л) и диметилсульфида (143 мкг/л).
Концентрация этих соединений в неконтаминированной контрольной пробе пива
была значительно ниже (0,04 мг/л и 54,6 мкг/л соответственно). Количество этих
соединений зависит от степени контаминации пива. Существенное увеличение их
концентрации зафиксировано лишь при количестве КОЕ контаминирующих бакте-
рий в 106/мл; при концентрации 103 КОЕ/мл наблюдается лишь слабое увеличение
концентрации этих соединений [118]. Количество образуемого R. aquatilis диме-
тилсульфида зависит от штамма микроорганизма. Продуцирование бактериями
R. aquatilis избыточных вицинальных дикетонов было подтверждено в [66]. Было
высказано предположение, что за синтез диацетила, связанного с образованием боль-
шого количества а-ацетолактата (предшественника диацетила), косвенно ответ-
ственны другие энтеробактерии [51, 75, 102]. Механизм, с помощью которого
R. aquatilis образуют диацетил в ходе брожения, до сих пор не ясен. Контаминация
R. aquatilis ведет также к повышению содержания ацетальдегида и метилацетата, тог-
да как концентрация этилацетата, n-пропанола, изобутанола, изоамилацетата и изо-
амилового спирта снижается. Пиво, контаминированное R. aquatilis, неприятно на
вкус и характеризуется побочными фруктовым, молочным и сернистым вкусом
и ароматом. Источниками контаминации могут выступать также ячмень, солод,
хмель и засевные дрожжи [118].
в) Citrobacter freundii
Засеянное сусло иногда может быть контамировано Citrobacter freundii [19,32,76,
121]. Эта бактерия является более близким «родственником» Е. coli, чем O.proteus
214
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
(рис. 6.2). Подобно всем энтеробактериям, C.freundii — факультативный анаэроб, ок-
сидазо-отрицательный и каталазо-положительный. В качестве единственного источ-
ника углерода этот микроорганизм может утилизировать цитрат, однако на пивова-
ренных предприятиях обнаружены штаммы, неспособные утилизировать цитрат
[121]. Сбраживание глюкозы происходит путем смешанно-кислотного брожения
с образованием газа. C.freundii обнаруживаются у человека, животных, в почве,
в воде, сточных водах, клинических анализах и рассматриваются как вторичный па-
тогенный микроорганизм.
Влияние C.freundii на брожение пива и его вкус изучалось в [54]. Этот микроорга-
низм понижает жизнеспособность дрожжей и влияет на изменения редокс-потенци-
ала сбраживаемого сусла. Контаминация такого сусла С. freundii ускоряет брожение.
Сходные результаты были получены с R.aquatilis [118]. Присутствие C.freundii
в ходе брожения существенно повышает концентрации в готовом пиве лактата, пи-
рувата, сукцината, изоцитрата и диметилсульфида. Пиво может испортить даже не-
большое количество клеток C.freundii, жизнеспособных лишь в течение короткого
периода брожения [54], однако C.freundii чувствительны к высоким концентрациям
этилового спирта и не выживают в ходе приготовления пива [63].
г) Klebsiella
Klebsiella spp. были выделены на различных стадиях производства пива и ассоци-
ируются с порчей пива [1, 65]. Клетки Klebsiella неподвижные, зачастую капсулиро-
ванные; они факультативно анаэробны и дают отрицательную оксидазную реакцию.
Изоляты пивоваренного производства сбраживают глюкозу по путям смешанного
кислотного или 2,3-бутандиолового брожения [120], продуцируют кислоту и газ, но
встречаются и неаэрогенные штаммы. Klebsiella spp. выделили также из фекалий
и клинических анализов человека, почвы, воды и растений.
Klebsiella pneumoniae для человека патогенны и вызывают воспалительный про-
цесс в легких. Этот патоген вряд ли можно обнаружить в пробах, взятых на пивова-
ренных предприятиях. Относительно новые виды К. terrigena, встречающиеся в вод-
ных и почвенных средах, были описаны в [53] — они отличаются от К. pneumoniae по
способности к размножению при 10 °С и неспособности продуцировать из лактозы
газ при 44,5 °С. Klebsiella, выделяемые на пивоваренных предприятиях, обладают
свойствами, характерными именно для этих новых видов [121], так что скорее всего
основным контаминантом на пивоваренных предприятиях являются все-таки
К. terrigena , а не К. pneumoniae.
Пиво, получаемое из сусла, контаминированного штаммами индол-негативных
Klebsiella (скорее всего, К. terrigena), имеет характерный фенольный побочный при-
вкус. В пиве этот выраженный фенольный привкус дают только индол-отрицатель-
ные энтеробактерии [78,122,128]. Было высказано предположение [19], что появле-
ние этого привкуса связано с дезаминированием тирозина этими бактериями
(рис. 6.3). Тем не менее в пиве с фенольным привкусом была выявлена необычно
высокая концентрация 4-этилгваякола [43]. Klebsiella sp. декарбоксилируют обычно
присутствующие в пиве р-кумариновую и феруловую кислоты до 4-винилфенола
и 4-винилгваякола соответственно (рис. 6.4). Фенольный привкус пиву придают как
4-винилгваякол [24], так и редуцированная форма 4-этилгваякола [43].
Глава 6. Грамотрицательные бактерии в пивоварении
215
СНо-СН-СООН
I
он
СНо-СН-СООН
I
NH2
сн2-сн2-соон
р-гидроксифенил молочная кислота Тирозин р-гидроксифенилуксусная кислота
*
ОН
сн=сн-соон
р-гидроксифенилакриловая кислота/
Летучие
фенолы
Рис. 6.3. Образование летучих фенолов из тирозина
Н. [ОСН3]
Z
декарбоксилаза
ОН
Н, [ОСН3] н2
редуктаза
М
fV
Н-С = СНСООН Н-С = СН2
Производные Производные
оксикоричной кислоты 4-винилфенолов
р-кумариновая (ферулиновая) кислота 4-винилфенол (гваякол)
Н, [ОСН3]
v
СН2СН3
Производные
4-этилфенолов
4-этилфенол (гваякол)
Рис.6.4. Пути образования 4-винил- и 4-этилфенолов из замещенных оксикоричных кислот
Индол-положительные штаммы К. pneumoniae в 1980-х гг. были перекласснфици-
рованы в К. oxytoca [8], причем штаммы этих видов выделены из бродящего сусла на
двух разных пивзаводах [121]. Хотя данный микроорганизм в настоящее время и от-
носят к контаминантам пива, до сих пор точно не известно, каково его влияние на
процесс брожения, вкус и аромат. К. oxytoca чувствительны к этиловому спирту и не
выживают в ходе производства пива [63].
Klebsiella spp. также участвуют в чрезмерном образовании органических серных
соединений, таких как диметилсульфид [1, 123], которые неблагоприятно воздей-
ствуют на качество пива. Использование 355-меченной серы показало, что менее 2%
образуемой Klebsiella серы получается из метионина, цистеина, цистина или суль-
фата [124]. Недавно было показано, что R. aquatilis в основном образует диметил-
сульфид путем восстановления диметилсульфоксида [66].
216
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
д) Прочие энтеробактериальные контаминанты
К прочим энтеробактериальным контаминантам пивоваренного сусла относятся
Е. aerogenes, E. cloacae, H. alvei, некоторые штаммы Serratia и P. mirabilis. E. cloacae
и Е. aerogenes продуцируют в пиве соответственно фенольные соединения и диме-
тилсульфид. Инфицирование Н. alvei приводит к повышению концентрации я-про-
панола и диметилсульфида (подробнее см. [76]). О порче пива бактериями Serratia
и P. mirabilis данных нет.
Энтеробактериальная контаминация сусла чаще всего происходит на этапе предва-
рительного брожения и ассоциируется с начальными стадиями ферментации, однако
большинство подобных микроорганизмов распространено гораздо шире, чем полага-
ли ранее [120]. Они продолжают размножаться в ходе брожения сусла и продуцируют
метаболиты, вредно влияющие на качество пива. Свидетельством энтеробактериаль-
ной контаминации могут быть побочные привкусы пива (сернистый или фенольный).
Еще одной характерной чертой энтеробактерий является их способность в ана-
эробных условиях бродящего сусла редуцировать нитрат до нитрита. Если в пивова-
ренном производстве используется вода, содержащая нитраты, то в пиве под влия-
нием энтеробактерий может накопиться нежелательное количество нитритов [47,
126]. В конце 1980-х гг. было показано, что в O.proteus, как и практически во всех
энтеробактериях, присутствует фермент нитратредуктаза, преобразующий нитрат
в нитрит [ 10,11 ]. В результате восстановления нитрата в ходе брожения при участии
энтеробактерий (пивные дрожжи восстанавливать нитрат не способны) образуется
нитрит, реагирующий с аминами и амидами сусла с образованием N-нитрозаминов
(рис. 6.5). В экспериментах общее содержание N-нитрозных компонентов в конце
брожения зависело от начального содержания нитрата в сусле и от исходного коли-
N03 изводы
I Восстановление
при участии бактерий
I (нитратредуктаза)
N02
Химическое
восстановление
Т
Предшественники /V-нитросоединений
N02, N203, N204, H2N03+
Химический
или бактериальный
катализ
(нитритредуктаза)
N-нитрозосоединение
Вторичный амин
N
Рис. 6.5. Путь образования нитрозаминов в сбраживаемом сусле
Глава 6. Грамотрицательные бактерии в пивоварении
217
чества бактерий в засевных дрожжах [96]. Понимание того, что O.proteus может
играть роль в образовании нитрозаминов, привело пивоваров к осознанию необхо-
димости более тщательной обработки дрожжей и более частому применению кис-
лотной мойки для более эффективного удаления О. proteus из дрожжей для произ-
водства эля.
6.4. Zymomonas
6.4.1. Основные характеристики
Клетки Zymomonas — это короткие толстые грамотрицательные палочки размером
1,0-1,4 х 2,0-6,0 мкм. Встречаются они преимущественно парами, но бывают иногда
и одиночные клетки. Некоторые штаммы образуют цепи, розетки, а у многих штам-
мов заметны нитевидные (гифоподобные) клетки. Большинство штаммов непод-
вижны. У клеток подвижных штаммов от одного до четырех полярных жгутиков.
Глюкоза и фруктоза сбраживаются этими микроорганизмами с образованием спирта
почти до эквимолярных количеств (мальтоза ими не сбраживается). Zymomonas ок-
сидазо-отрицательны и анаэробны, но толерантны к небольшому количеству кисло-
рода. На питательном агаре их размножения не наблюдается. Содержание Г + Ц
у Zymomonas составляет от 47,5 до 49,5 моль% [107].
На основе изучения большого числа штаммов было высказано предположение, что
в роду Zymomonas выделяется лишь один вид с двумя подвидами: Zymomonas mobilis
может существовать в подвидах Z mobilis subsp. mobilis и Z. mobilis subsp. pomaceae. Пос-
ледний был создан специально для сидра [105].
6.4.2. Метаболизм
Отличительной чертой микроорганизмов рода Zymomonas является интенсивное
сбраживание глюкозы и фруктозы с образованием спирта и С02 через модифициро-
ванный путь Энтнера-Дудорова. При этом образуются небольшие количества аце-
тальдегида, ацетона, уксусной и молочной кислот, а также глицерина [82].
Способность Zymomonas к размножению и метаболизму в присутствии высоких
концентраций этилового спирта вообще-то необычна для бактерий и подчеркивает
важность Zymomonas как контаминанта предприятий, выпускающих спиртные на-
питки. Хотя были сообщения, что размножение Zymomonas ингибируется концент-
рацией этилового спирта в 8%об. [16], однако почти половина штаммов размножает-
ся при концентрации этилового спирта в 10%об. [105], а штамм Z. mobilis BS057
выдерживает концентрацию этилового спирта 12-13%об., достигаемую в процессе
высокоплотного пивоварения [63]. Хотя рост некоторых штаммов Zymomonas может
быть задержан при концентрации этилового спирта 8-10%об., они остаются метабо-
лически активными и могут продуцировать до 15%об. этилового спирта. Таким об-
разом, Zymomonas представляет интерес с точки зрения его использования для про-
мышленного производства спирта.
6.4.3. Порча пива
Впервые Zymomonas были выделены из пива Дж. Шимвеллом в 1937 г., который
назвал этот микроорганизм Achromobacter anaerobium [87]. Изученные им Zymomonas
218
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
продуцируют в пиве сероводород и ацетальдегид, что было подтверждено в [1, 20, 21,
124]. Продуцируются также следовые количества диметилсульфида и диметилди-
сульфида [21]. В 1930-х гг. Zymomonas считались наиболее вредными микроорганиз-
мами, вызывающим порчу пива. Пиво, инфицированное Zymomonas, характеризуется
привкусом гнилых яблок [91] или фруктов [21]. Zymomonas — важный контаминант
в производстве эля, особенно в Великобритании (подробнее см. [21]).
В производстве лагерного пива Zymomonas обнаружены не были. Скорее всего,
относительно высокие потребности этого микроорганизма в углеводах ограничива-
ют его присутствие лишь производством эля [20], но, согласно [105], его возможное
присутствие в ходе производства лагерного пива игнорировать не следует, хотя
и предполагается, что низкая температура (8-12 °С) лагерного брожения для разви-
тия Zymomonas неблагоприятна.
Zymomonas были также выделены из почвы вблизи пивоваренных заводов и из
щеток бочкомоечных машин [87, 91], воды из скважин [23], сброженного яблочного
сока (сидра) [6, 68] и грушевого сока (перри) [67], а также из созревающего меда
[80]. Штаммы Zymomonas также ответственны за спонтанное спиртовое брожение
сока агавы (пульке) [62], пальмового вина [105] и сока из сахарного тростника [38].
6.5. Анаэробные грамотрицательные палочки
Микробиологи, работающие в пивоварении, традиционно считали, что бактерии,
вызывающие порчу пива, ограничены аэробными или факультативно анаэробными
видами, однако стали поступать сообщения о порче фасованного пива палочками
строгих анаэробов [57,59]. В первом из этих сообщений новый род и виды этих стро-
го анаэробных палочек были названы Pectinatus cerevisiiphilus. За прошедшее с тех
пор время в Германии [5,85], скандинавских странах [40,42] и Японии [108] из пива
были выделены бактериальные контаминанты, сходные с P. cerevisiiphilus. В рамках
обширного исследования таксономии анаэробных палочек, выделенных на пивова-
ренных предприятиях, были идентифицированы новый вид рода Pectinatus (P.ftisi-
gensis), новый вид рода Selenomonas (5. lacticifex) и новый род Zymophilus, в который
входят два вида — Z. raffinosivorans и Z. paucivorans [81 ].
6.5.1. Pectinatus cerevisiiphilus
Приводимое ниже описание Pectinatus cerevisiiphilus базируется на данных, приве-
денных в работе [81]. Клетки P. cerevisiiphilus представляют собой слегка изогнутые
палочки размером 0,7-0,9 х 2,0-30 мкм с закругленными концами; встречаются они
по одиночке, парами и иногда в виде коротких цепочек. Наличие удлиненных спира-
левидных гифов характерно для более старых клеток. Перемещаются такие клетки
при помощи жгутика, исходящего с одной из сторон клетки. Данный микроорганизм
является облигатным анаэробом и неспорообразующим мезофилом. Он не размно-
жается на агаровых средах в аэробных условиях или в атмосфере С02, однако его
можно культивировать на тиогликолатном агаре с помощью трубочек Хангейта [48]
или в модифицированной МЯ5-среде в анаэробных условиях [81]. Колонии круг-
лые, плотные, от светло-бежевого до белого цвета, они блестящие и непрозрачные.
Глюкоза сбраживается до уксусной и пропионовой кислот. Содержание Г + Ц в ДНК
составляет 38-41 моль%.
Глава 6. Грамотрицательные бактерии в пивоварении
219
Недавно опубликованные результаты молекулярных исследований показали, что
виды (например, P. cerevisiiphilus), идентифицированные с помощью обычных тес-
тов, могут быть гетерогенными, так что в этом случае возможно их отнесение к ка-
ким-то новым видам [69, 104].
6.5.2. Pectinatus frisingensis
Морфологически P.frisingensis подобны P.cerevisiiphilus. Колонии, выращенные
на М/?5-модифицированной агаровой среде, после трех дней культивирования при
30 °С были блестящими, непрозрачными, круглой формы и слегка желтоватыми,
размером 1-2 мм. У этих двух видов основными метаболитами являются уксусная
и пропионовая кислоты; в условиях брожения иногда из глюкозы образуются ацето-
ин и незначительные количества янтарной кислоты [ПО]. Содержание Г + Ц в ДНК
составляет 38-41 моль%. P.ffisingensis могут отличаться от P.cerevisiiphilus по их
способности к сбраживанию целлобиозы, инозита и N-ацетилглюкозамина, а также
неспособностью утилизировать ксилозу и мелибиозу [81]. Существуют сведения,
что штаммы P. cerevisiiphilus размножаются быстрее, чем штаммы P. frisingensis, при-
чем последние более стойки к этиловому спирту [111]. Штаммы этих двух видов так-
же можно отличить с помощью методов молекулярного анализа [69, 104].
6.5.3. Selenomonas lacticifex
Из засевных дрожжей были выделены четыре штамма S. lacticifex. Клетки этих штам-
мов— облигатные анаэробы; как правило, они подвижны, палочковидной формы,
и имеют размер 0,6-0,9 х 5,0-15 мкм. Клетки изогнуты в форме полумесяца и встреча-
ются преимущественно по одиночке или (реже) парами. Оптимальная температура для
размножения — 30 °С. Колонии, полученные на модифицированном М/?5-агаре, выг-
лядят гладкими, непрозрачными, округлой формы, желтоватого цвета, и после трех су-
ток культивирования при 30 °С имеют в диаметре 2-3 мм. D-глюкоза сбраживается
ими до образования уксусной, молочной и пропионовой кислот. Содержание Г + Ц
в ДНК — 51-52 моль% [81]. В ходе исследования [104] три штамма были риботипиро-
ваны, в результате чего были получены два различных «отпечатка пальцев» молекул.
6.5.4. Zymophilus raffinosivorans
Zymophilus raffinosivorans были выделены из засевных дрожжей и отходов пивова-
ренного производства. Клетки этого микроорганизма представляют собой прямые или
слегка изогнутые палочки размером 0,7-0,9 х 3,0-15 мкм и встречаются преимуще-
ственно в виде отдельных клеток, хотя иногда можно наблюдать пары или короткие
цепочки [81]. Хотя эти неспорообразующие палочки подвижны, их подвижность после
нескольких культивации может утрачиваться. Колонии, выращенные на модифициро-
ванной MRS-среде, — округлые, гладкие, непрозрачные, слегка желтоватые, размером
1-2 мм (после трех суток культивирования при 30 °С). Глюкоза сбраживается ими до
уксусной и пропионовой кислот. Содержание Г +Ц в ДНК составляет 38 моль%.
6.5.5. Zymophilus paucivorans
Zymophilus paucivorans были выделены из засевных дрожжей. В отличие от
Z. raffinosivorans, клетки Z. paucivorans имеют изогнутую или спиралевидную фор-
220
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
му, они палочкообразны (размер 0,8-1,0 мкм х 5,0-30 мкм) и встречаются по оди-
ночке, парами или в виде коротких цепочек. Они подвижны, однако подвижность
может быть утрачена после субкультивирования. Колонии, получаемые на Af^-мо-
дифицированной среде, имеют округлую форму, гладкие, слегка желтоватые, 1 -2 мм
в диаметре после трех суток выращивания при 30 °С. Глюкоза сбраживается ими до
уксусной и пропионовой кислот и следовых количеств молочной кислоты. Z raffino-
sivorans и Z paucivorans различаются по их способности утилизировать ксилозу, рам-
нозу, ксилит, раффинозу, мелибиозу и инозит [81], у них различные риботипические
модели [104]. Содержание Г + Ц в ДНК Z paucivorans составляет 39-41 моль%.
6.5.6. Порча пива
Строго анаэробные палочкообразные бактерии составляют важную группу микро-
организмов-вредителей укупоренного пива. Выделенные бактерии, которые относят
к штаммам Pectinatus, продуцируют в сусле и фасованном пиве значительные количе-
ства уксусной и пропионовой кислот, а также ацетоина [15,59,84,109]. В пиве, конта-
минированном штаммами Pectinatus, достигаются высокие концентрации H2S. Такое
пиво мутнеет и дает запах тухлых яиц. Предполагается, что в испорченном пиве мо-
гут преобладать P. frisingensis [111]. В работе [85] S. lacticifex считается микроорга-
низмом, вызывающим порчу пива, Z raffinosivorans — потенциальным вредителем,
a Z paucivorans не относится к микроорганизмам, вызывающим порчу.
Штаммы Pectinatus были выделены из смазочных масел в смеси с водой и пивом,
а также из дренажных систем [59]. Тем не менее источник попадания анаэробных
палочек на пивоваренные производства до сих пор не установлен (им вполне могут
выступать контаминированные засевные дрожжи).
6.6. Megasphaera
Из готового испорченного мутного пива с неприятным запахом были выделены
строго анаэробные грамотрицательные кокки [127]. Эти изоляты были фенотипи-
чески подобны Megasphaera elsdenii, но с достаточно существенными отличиями, по-
зволяющими сформировать самостоятельный таксон, и поэтому их назвали Mega-
ярйдега-штаммами 1 и П. Таксономия 12 штаммов Megasphaera, выделенных из пива,
исследовалась в [31] — эти штаммы были генетически родственными, и из них со-
ставили новый вид М. cerevisiae семейства Veilonellaceae. Генетический анализ
165 рРНК-последовательности подтвердил, что М. cerevisiae родственны М. elsdenii
[30], а риботипирование 13 штаммов выявило лишь один атипичный микроорга-
низм, который может быть представителем другого вида [104].
Клетки Megasphaera cerevisiae грамотрицательны и представляют собой слегка
удлиненные кокки размером 1,3-1,6 мкм, встречающиеся парами и (иногда) корот-
кими цепочками. Они неподвижны и не образуют спор, являются строгими анаэро-
бами; их колонии на основной среде с фруктозой или лактатом выглядят беловаты-
ми, гладкими и однородными (размер колоний — 2-3 мм). Размножение происходит
при температурах от 15 до 37 °С (оптимальная температура — 28 °С). М. cerevisiae
каталазо-отрицательны и продуцируют H2S, не редуцируют нитрат до нитрита и яв-
ляются индол-отрицательными. Фруктоза сбраживается всеми штаммами, а араби-
ноза — только некоторыми [31].
Глава 6. Грамотрицательные бактерии в пивоварении
221
В пиве штаммы Megasphaera продуцируют значительное количество масляной кис-
лоты. В меньших количествах продуцируются уксусная, изовалериановая, валериано-
вая, капроновая кислоты и ацетоин [84]. В сусле продуцируются большие количества
масляной и капроновой кислот и меньшие — уксусной, изовалериановой и валериано-
вой кислот. Ацетоин в сусле не продуцируется. Считается, что Megasphaera — вреди-
тель пива [84], хотя М. cerevisiae чувствительны к спирту и низким значениям рН [41].
Размножение этого контаминанта в пиве ограничивается при содержании алкоголя
в 2,8% масс/об.
6.7. Прочие бактерии, неспособные к брожению
Из сусла и пива были выделены Alcaligenes, Acinetobacter, Flavobacterium и Pseu-
domonas spp., которые характеризуются строго дыхательным типом метаболизма [32,
65,73]. О порче пива этими редко встречающимися бактериями не сообщалось.
6.8. Обнаружение, подсчет и выделение
Способность некоторых грамотрицательных бактерий к порче пива в настоящее вре-
мя общепризнана. Чтобы предотвратить либо свести к минимуму такую порчу,
необходим эффективный микробиологический контроль, и для обнаружения бактери-
альных контаминантов в пиве существует ряд методов. Традиционно бактерии обнару-
живают с помощью наблюдения под микроскопом и их культивирования на соответ-
ствующих питательных средах. Поскольку существует потребность в более быстром
выявлении бактерий, применяются некоторые иные ускоренные методы, к которым от-
носятся методы на основе АТФ, изменения рН, различные приемы молекулярной био-
логии, применение Сом/^г-счетчика, методы флуоресцентной микроскопии, серологи-
ческие методы, применение оптических подсветок и техники окрашивания (подробнее
о них см. главу 8). Ниже мы рассмотрим лишь методы микроскопии и некоторые при-
емы культивирования грамотрицательных бактерий порчи.
6.8.1. Микроскопическое исследование
Для обнаружения бактериальных контаминантов широко используется непосред-
ственное микроскопическое исследование суспензии или окрашенных мазков. Та-
кие ускоренные методы дают ценную информацию относительно наличия, морфо-
логии и подвижности бактерий. При их применении в сочетании с окраской по Граму
можно различать грамположительные и грамотрицательные бактерии, однако эти
методы можно использовать только в том случае, если количество бактерий превы-
шает 30 000 клеток/мл. Эти методы не позволяют различать живые и мертвые клет-
ки и, кроме того, иногда трудно отличить неподвижные бактерии от нерастворимых
частиц вещества.
Для определения числа КОЕ в суспензии можно пользоваться счетной камерой
Петрова-Хауссера, однако у нее три существенных недостатка: невозможность от-
личить живые клетки от мертвых; невозможно подсчитать небольшие колонии без
предварительного центрифугирования суспензии; утомительность процедуры под-
счета КОЕ. С учетом этих недостатков регулярное микроскопическое исследование
проб, взятых с пивоваренного производства, следует признать правильной произ-
водственной практикой.
222
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
6.8.2. Культуральные среды
Многие виды грамотрицательных бактерий хорошо растут на простейших лабора-
торных средах, тогда как другие требуют специфических нутриентов — витаминов
и различных веществ, стимулирующих размножение микроорганизмов. Следова-
тельно, чтобы облегчить обнаружение, подсчет и выделение некоторых типов бакте-
рий, требуется специфическая культуральная среда.
Вопросы применения тех или иных сред в бактериологии пивоваренных произ-
водств подробно рассмотрены в работе [14] (к сожалению, после 1980-х гг. нам не
известны аналогичные работы). Ниже мы подробнее рассмотрим среды, лучше всего
подходящих для ускоренного культивирования уксуснокислых бактерий, E?ite-
robacteriaceae и Zymomonas. Кроме того, мы обсудим вопросы обнаружения строго
анаэробных контаминантов Pectinatus, Selenomonas, Zymophilus и Megasphaera.
Для селективного ингибирования роста дрожжей к культуральным средам реко-
мендуется добавлять актидион (циклогексимид) (около 20-100 мкг/мл). Более низ-
кие его концентрации будет ингибировать пивные дрожжи, а более высокие — пре-
дотвращать рост большинства «диких» дрожжей.
При незначительном количестве бактерий в суспензии для их подсчета наиболее
применимо мембранное фильтрование. В этом случае относительно большой объем
жидкости пропускают через фильтр, который затем помещают в подходящую агаро-
вую среду, а после соответствующего инкубационного периода подсчитывают раз-
вившиеся на поверхности фильтра колонии.
а) Уксуснокислые бактерии
Питательные потребности уксуснокислых бактерий зависят от источника углеро-
да [28,29]. Специфическая среда для обнаружения и выделения уксуснокислых бак-
терий в пивоваренном производстве описана в [ 132], хотя Acetobacter хорошо растут
на стандартных средах, содержащих 0,5% бактодрожжевого экстракта (Difco), 1,5%
этилового спирта и 2,5% агара [103]. Способы обогащения среды и приемы для выде-
ления Gluconobacter см. в [27].
б) Enterobacteriaceae
Enterobacteiiaceae — это крупное гетерогенное семейство бактерий с различными пи-
тательными потребностями. Для размножения этих микроорганизмов разработано мно-
жество сред, включая несколько селективных (см. [14]). Для обнаружения штаммов
Citrobacter, Enterobacter, Rahnella и Klebsiella используют лактозный бульон, a ULM
{Universal Liquid Medium, универсальная жидкая среда) обеспечивает хороший рост
большинства бактериальных контаминантов (включая энтеробактерии) пивоваренного
производства [119]. Большинство энтеробактерии без большого труда культивируются
при 30 СС на селективной среде типа агара МакКонки (MacConkey). Лактозо-положи-
тельные штаммы Ctirobacter, Enterobacterw Klebsiella образуют на нем красные колонии,
тогда как колонии O.proteus и Н. alvei имеют окраску от розовой до бесцветной. Для
размножения О. proteusтребуется более длительный период инкубации (36-48 ч) [74].
в) Zymomonas
Среда, пригодная для выявления Zymomonas, описана в [20]. На присутствие
Zymomonas указывает обильное газообразование при 30 °С через 2-6 сут. Ошибоч-
Глава 6. Грамотрицательные бактерии в пивоварении
223
ный положительный результат может быть следствием роста молочнокислых бакте-
рий или диких дрожжей. Перечни сред, удобных для культивирования и выделения
Zymomonas, приведены в [105, 107].
г) Pectinatus, Selenomonas и Zymophilus
Для изоляции и дифференциации Pectinatus разработана селективная среда (LL-
агар, lactate-lead acetate) [58]. Для обнаружения и выделения строгого анаэроба
Pectinatus можно использовать трубки Ли с 11-агаром [71]. Pectinatus, Selenomonas
и Zymophilus spp. можно культивировать в анаэробных условиях при 30 °С на моди-
фицированной М/?5-среде, содержащей MRS-бульон с солевым раствором следую-
щего состава (на 1 л); СаС12 - 2 г, MgSO, - 0,2 г, К2НР04 - 1 г, КН2Р04 - I г,
NaHC03 — 10 г, NaCl — 2 г [81]. Относительно недавно для выборочного выделения
Pectinatus и Megasphaera была разработана специальная 5ММР-среда, содержащая в
качестве единственного источника углерода лактат, а для стимулирования роста ана-
эробов — восстанавливающие вещества [56].
6.8.3. Краткое резюме
Многие пивоваренные предприятия полагаются на свои собственные среды и ме-
тоды микробиологического анализа, и мы не имеем возможности рассмотреть их все,
многие из которых, несомненно, имеют свои достоинства.
Питательные потребности грамотрицательных бактериальных контаминантов
очень разнообразны, и вряд ли найдется какая-либо универсальная среда, удовлет-
воряющая все их потребности. В связи с этим рекомендуется применять разные сре-
ды. Более того, полезно иногда использовать среды другого типа, что позволит более
надежно выявлять все бактериальные контаминанты.
6.9. Заключение
Пиво портят разные грамотрицательные бактерии, включая уксуснокислые, неко-
торые энтеробактерии, Megasphaera, Pectinatus, Selenomonas и Zymomonas. Присут-
ствие этих контаминантов на разных стадиях производства пива или в уже готовом
пиве влияет на концентрацию некоторых летучих веществ, которая иногда зависит
от степени инфицированное™. Сложный и тонкий баланс вкусо-ароматических со-
единений определяет вкус, аромат и качество пива. Повышенная концентрация не-
которых летучих веществ отрицательно сказывается на качестве пива, а их низкая
концентрация может привести к появлению побочных привкусов и ароматов (тем
самым доминирующий вкус и аромат определяется другими соединениями). Чтобы
гарантировать постоянство вкуса и аромата пива, в пивоваренном производстве дол-
жно быть исключено присутствие бактериальных контаминантов (или их количе-
ство должно поддерживаться на возможно низком уровне). Следует полностью ис-
ключить возможность асептических условий производства, причем особое внимание
следует уделять обеспечению надлежащей мойки и дезинфекции оборудования
и помещений.
С момента выхода предыдущих изданий этой книги знания относительно грам-
отрицательных бактерий, вызывающих порчу пива (особенно анаэробных палочек
и кокков), значительно расширились, причем продолжается выделение и описание
224
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
новых бактерий. С усовершенствованием методов микробиологического анализа
вполне вероятно, что из пива могут быть выделены не описанные выше грамотрица-
тельные бактерии, в связи с чем микробиологи пивоваренных производств в каче-
стве одной из своих задач должны ставить также выделение и классификацию подоб-
ных штаммов (наряду с определением степени их воздействия на брожение пива).
Литература
1. Anderson, R.J., Howard, G.A.,and Hough, J.S. (1971) Proceedings of the 13th Congress of the
European Brewery Convention, Estoril, IRL Press, Oxford, p. 253.
2. Asai, T. (1968) Acetic Acid Bacteria. Classification and Biochemical Activities, University of
Tokyo Press. Tokyo and University Park Press, Baltimore, p. 103.
3. Ault, R.C. (1965)Journalofthe Institute of Brewing, 71, 376.
4. Back, W. (1980) Brauwelt, 43,1562.
5. Back, W., Weiss, N.. and Seidel, H. (1979) Brauwissenschaft, 32, 233.
6. Barker, B.T.P., and Hillier, V.F. (1912) Journal of Agricultural Science, 5, 67.
7. Bernstein, L., Blenkinship, B.K., and Brenner, M.W. (1968) Proceedings of the Annual
Meeting of the American Society of Brewing Chemists. St Paul, MN, p. 150.
8. Brenner, D.J. (1984) In Bergey's Manual of Systematic Bacteriology, 9th edn, Vol. 1 (eds
N.R. Krieg and J.G. Holt), Williams and Wilkins, Baltimore, p. 408.
9. Brown, H.T. (\9\6)Journalofthe Institute of Brewing, 22, 265.
10. Calderbank, J., and Hammond, J.R.M. (l989Journal of the Institute of Brewing, 95, 277.
11. Calmells, S., Oshima, H., and Bartsch, H. (1988) Journal of General Microbiology, 134, 221.
12. Campbell, I. (1983) The Brewer (October), 414.
13. Carr, J.G. (1968) In Identification Methods for Microbiologists, Part В (eds B.M. Gibbs and
D A. Shapton), Academic press, London, p. 1.
14. Casey, СР., and Ingledew, W.M. (1981) Brewers'Digest (February), 26.
15. Chowdhury, I., Watier, D., Leguerinel, I., and Hornez, J.P. (1997) Food Microbiology, 14,265.
16. Comrie, A.A.D. (1939) Journal ofthe Institute of Brewing, 45, 342.
17. Cosbie, A.J.C., Tosic, J., and Walker, Т.К. (1942) Journal of the Institute of Brewing, 48,82
18. Cosbie, A.J.C., Tosic, J., and Walker, Т.К. (1943) Journal ofthe Institute of Brewing, 49,88.
19. Cowbourne, M.A., Priest, F.G., and Hough, J.S. (1972) Brewers'Digest, 47, 76.
20. Dadds, M.J.S. (1971) In Isolation of Anaerobes, Technical Series No. 5 (eds D.A. Shapton and
R.C. Board), Academic Press, London, p. 219.
21. Dadds, M.J.S., and Martin, P A. (1973) Journal of the Institute of Brewing, 79, 386.
22. Dadds, M.J.S., MacPherson, A.L., and Sinclair, A. (1971) Journal of the Institute of the
Institute of Brewing, 11, 453.
23. Dadds, M.S., Martin, P.A., and Carr, J.G. (1973) Journal of Applied Bacteriology, 36, 531.
24. Dadic, M., van Gheluwe, J.E.A., and Valyi, Z. (1971) Wallerstein Laboratories
Communications, 34, 5.
25. De Ley, J. (1961) Journal of General Microbiology, 24, 31.
26. De Ley, J., and Kersters, K. (1964) Bacteriological Reviews, 28,164.
27. DeLey.J., and Swings,J.( 1984) In Bergey's Manual ofSystematic Bacteriology, 9th edn, Vol. 1
(eds N.R. Krieg and J.G. Holt), Williams and Wilkins, Baltimore, p. 275.
28. De Ley, J.,Gillis, M., and Swings, J. (1984) InBergey's Manual of Systematic Bacteriology, 9th
edn. Vol. 1 (eds N.R. Krieg and J.G. Holt), Williams and Wilkins, Baltimore, p. 267.
Глава 6. Грамотрицательные бактерии в пивоварении
225
29. De Ley, J., Swings, J., and Gossele, F. (1984) In Bergey's Manual of Systematic Bacteriology,
9th edn. Vol. 1 (eds N.R. Krieg and J.G. Holt), Williams and Wilkins, Baltimore, p. 268.
30. Doyle, L.M., Mclnerey, J., Mooney, J. etal. (1995) Journal of Industrial Microbiology\ 15,67.
31. Engelmann, U., and Weiss, N. (1985) Systematic and Applied Microbiology, 6, 287.
32. Eschenbecher, F., and Ellenrieder, M. (1975) Proceedings of the 15th Congress of the European
Brewery Convention, Nice, IRL Press, Oxford, p. 497.
33. Franke, I.H., Fegan, M. Hayward, C, et ai (1999) International Journal of Systematic
Bacteriology, 49,1681
34. Frateur, J. (1950) La Cellule, 53,287.
35. Gavini, R., Mergaert, J., Beji, A. et ai (1989). International Journal of Systematic Bacteriology,
39,337.
36. Gilliland, R.B., and Lacey, J.P. (1966) Journal ofthe Institute of Brewing, 72, 291.
37. Gillis, M, and De Ley, J. (1980) International Journal of Systematic Bacteriology, 30, 7.
38. Goncalves de Lima, 0., De Araujo, J.M., Schumacher, E., and Cavaleanti Da Silva, E. (1970)
Revista do Institute de Antibioticos Universidade do Recife, 10, 3.
39. Greenfield, S., and Claus, G.W. (1972)Journalof Bacteriology, 112,1295.
40. Haikara, A. (1985) Brauwissenschaft, 38, 239.
41. Haikara, A., and Lounatmaa, K. (1987) Proceedings of the 21st Congress of the European
Brewery Convention, Madrid, IRL Press, Oxford, p. 473.
42. Haikara, A., Penttila, L., Enari, T.M., and Lounatmaa, K. (1980) Applied and Environmental
Microbiology, 41,511.
43. Halcrow, R.M., Clenister, P.R., Brumsted, D.D., and Lautenbach, A.F. (1966) Proceedings of
the 9th Convention of the Institute of Brewing (Australian Section), Institute of Brewing,
London, p. 273.
44. Hamze, M., Mergaert, J., Van Vuuren, H.J.J, et ai (1991) International Journal of Food
Microbiology, 13, 63.
45. Harper, D.R. (1980) Process Biochemistry, (December/January), 2.
46. Harper, D.R. (1981) Brewers' Guardian (August), 23.
47. Hough, J.S., Briggs, D.E., Stevens, R., and Young, T.W. (1982) In Malting and Brewing
Science, Vol. 2, Chapman & Hall, London, p. 741.
48. Hungate, R.E. (1969) In Methods in Microbiology, Vol. 3B (eds J.R. Norris and D.W.
Ribbons), Academic Press, London, p. 117.
49. Ingledew, W.M. (1979) Journal ofthe American Society of Brewing Chemists, 37,145.
50. Ingledew, W.M., Sivaswarmy, G., and Burton, J. D. (1980)Journalofthe Institute of Brewing,
86,165.
51. Inoue, Т., Masuyama, K., Yarnamoto, Y. et ai (1968) Proceedings of the Annual Meeting of the
American Society of Brewing Chemists, St Paul, MN, p. 158.
52. Izard, D., Gavini, F., Trinel, P. A., and Leclerc, H. (1979) Annales de Microbiologic (Paris),
130,163.
53. Izard, D., Ferragut, C, Gavini, F. et ai (1981) International Journal of Systematic
Bacteriology, 31, 116.
54. Keevil, W.J., Hough, J.S., and Cole, J.A. (\979)Journalofthe Institute of Brewing, 85, 99.
55. Kersters, K., and De Ley, J. (1968) Antonie van Leeuwenhoek, 34, 393.
56. Lee, S.Y. (1994) Journal of the American Society of Brewing Chemists, 52, 115.
57. Lee, S.Y., Mabee, M.S., and Jangaard, N.O. (1978) International Journal of Systematic
Bacteriology, 28, 582.
226
Хенни Дж. Дж. Ван Вуурен, Фергус Г Прист
58. Lee, S.Y., Moore, S.E., and Mabee, M.S. (1981) Applied and Environmental Microbiology, 41,
386.
59. Lee, S.Y., Mabee, M.S., Jangaard, N.O., and Horiuchi, E.K. (1980) Journal of the Institute of
Brewing, 86, 28.
60. Leisinger, T. (1965) Zentralbiatt fiir Bakteriologie, Parasitenkunde, Infektionskrankheiten und
Hygiene, Abt. 11,119,329.
61. Lindner, P. (1895) Mikroskopische Betriebskontrolle in den Cdrungsgewerben mit einer
Einfiihrung in die technische Biologie, Hefenreinkultur und Infektionslehre, lsl Aufl., Parey,
Berlin, p. 1.
62. Lindner, P. (1928) Berichtdes Westpreussischen botanisch-zoologischen Vereins, 50, 253
63. Magnus, C.A., Ingledevv, W.M., and Casey, C.P. (1986) Journal of the American Society of
Brewing Chemists, 44, 158.
64. Makinen, V., Tanner, R., and Haikara, A. (1981) Brauwissenschaft, 34, 173.
65. Masschelein, С A. (1973) Brewers'Digest, 48, 54.
66. McCaig, R., and Morrison, M. (1984) Journalojthe American Society of Brewing ChemistsAl, 23.
67. Millis, N.F. (1951) PhD Thesis, University of Bristol, Bristol, UK.
68. Millis, N.F. (1956) Journal of General Microbiology, 15, 521.
69. Motoyama, Y, Ogata, Т., and Sakai, K. (1998) Journal of the American Society of Brewing
Chemists, 56,19.
70. Niefind, H.J., and Spath, G. (1971) Proceedings of the 13th Congress of the European Brewery
Convention, Estoril, IRL Press, Oxford, p. 459.
71- Ogg, J.E., Lee, S.Y., and Ogg, В J. (1979) Canadian Journal of Microbiology, 25, 987.
72. Ploss, M., Erber, J., and Eschenbecher, F. (1979) Proceedings of the 17th Congress of the
European Brewery Convention, West Berlin, IRL Press, Oxford, p. 39.
73. Priest, E.G. (\98\a)Journalofthe Institute of Brewing, 87, 299.
74. Priest, E.G. (1981b) In An Introduction to Brewing Science and Technology, Pan II,
Contamination, Institute of Brewing, London, p. 23.
75. Priest, E.G., and Hough, J.S. (1974) Journal,of the Institute of Brewing, 80, 370.
76. Priest, E.G., Cowbourne, M.A., and Hough, J.S. (1974) Journalofthe Institute of Brewing, 80,
342.
77. Priest, E.G., Somerville, H.J., Cole, J.A., and Hough, J.S. (1973) Journal of General
Microbiology, 75, 295.
78. РгьсЬа, J., and Scheible, E. (1970) Brauwelt, 110,1233.
79. Rainbow, С (1981) In Brewing Science, Vol. 2 (ed.J.R.A.Pollock), Academic Press, London,
p. 491.
80. Ruiz-Argueso, Т., and Rodriques-Navarro, A. (1975) Applied Microbiology, 30,893.
81. Schleifer, K.H., Leuteritz, M., Weiss, N. et al. (1990) International Journal of Systematic
Bacteriology, 40,19.
82. Schreder, K., Brunner, R., and Hampe, R. (1934) Biochemische Zeitschrift, 273, 223.
83. Seidel, H. (1980) Brauwelt, 43,1216.
84. Seidel, H., Back, W., and Weiss, N. (1979) Brauwissenschaft, 3, 262.
85. Seidel-Rufer, H. (1990) Brauwissenschaft, 32, 101.
86. Shimwell, J.L. (1936) Journal of the Institute of Brewing, 42, 585.
87. Shimwell, J.L. (1937) Journal of the Institute of Brewing, 43,507.
88. Shimwell, J.L. (1947) Wallerstein Laboratories Communications, 10, 195.
89. Shimwell, J.L. (1948a) Wallerstein Laboratories Communications, 11, 27.
Глава 6. Грамотрицательные бактерии в пивоварении
227
90. Shimwell, J.L. (1948b) Wallerstein Laboratories Communications, 11,135.
91. Shimwell J.L. (1950) Journal ofthe Institute of Brewing, 56,179.
92. Shimwell, J.L. (1963) Brewers Journal, 99, 759.
93. Shimwell, J.L. (ША) Journal of the Institute of Brewing, 70, 247.
94 Shimwell, J.L., and Grimes, M. (1936) Journal ofthe Institute of Brewing, 42, 348.
95. Skerman, V.D.B., McCowan, V., and Sneath, P.H.A. (1980) International Journal of Systematic
Bacteriology, 30, 225.
96. Smith, N.A. (1994) Journal ojthe Institute of Brewing, 100, 347.
97. Society of American Bacteriologists (1957) Manual of Microbiological Methods, McGraw-
Hill, New York, p. 15.
98. Sokollek, S J., and Hammes, W.P. (1997). Systematic and Applied Microbiology, 20,481.
99. Sproer, C, Mendrock, U., Swiderski, J., et al., (2001) IntenationalJournal of Systematic and
Evolutionary Microbiology, 49,1433.
100. Strandskov, F.B. (1965) Wallerstein Laboratories Communications, 28, 29.
101. Stouthamer, A.H., Van BoomJ.H., and Bastiaanse, A J. (1963) Antonie van Leeuwenhoek, 29,393.
102. Soumalainen, H., and Ronkainen, P. (1968) Nature, 220, 792.
103. Soumalainen, H., Кегдпеп, E.J.A., and Kangasperko, J. (1965) Journal of the Institute of
Brewing, 71,41.
104. Suihko, M-L., and Haikara, A. (2001)Journalofthe Institute of Brewing, 107, 175.
105. Swings, J., and De Ley, J. (1977) Bacteriological Reviews, 41, 1.
106. Swings, J., and De Ley, J. (1981) In The Prokaryotes, Vol. 1 (eds M.P. Starr, H. Stolp, K.G.,
Truper, A. Balows and H.G. Schlegel), Springer, Berlin, p. 771.
107. Swings, J., and De Ley, J. (1984) In Bergey's Manual of Systematic Bacteriology, 9th edn. Vol.
1 (eds N.R. Krieg and J.C, Holt), Williams and Wilkins, Baltimore, p. 576.
108. Takahashi, N. (1983) Bulletin of Brewing Science, 28,11.
109. Tholozan, J.L., Grivet, J.P., and Vallet, C. (1994) Archives of Microbiology 162, 401.
110. Tholozan, J.L., MembreJ.M., and Kubaczka (1996) Journal of Applied Microbiology, 80, 418
111. Tholozan, J.L., Membre, J.M., and Grivet, J.P. (1997) International Journal of Food
Microbiology, 35, 29
112. Thorwest, A. (1965) Brauwelt, 105, 845.
113. Tosic, J., and Walker, Т.К. (1944) Journal of the Institute of Brewing, 50, 296.
114. Tracey, R.P. (1984) MSc Thesis, University of the Orange Free State, Bloemfontein, South
Africa.
115. Van Vuuren, H.J.J. (1976) MSc Thesis, University of Stellenbosch, Stellenbosch, South
Africa.
116. Van Vuuren, H.J.J. (1978) PhD Thesis, Rijksuniversiteit-Gent, Gent, Belgium.
117. Van Vuuren, H.J J., and Toerien, D.F. (\981)Journalofthe Institute of Brewing, 87, 229.
118. Van Vuuren, H.J.J., Cosser, K., and Prior, B.A. (1980)Journalofthe Institute of Brewing, 86,31.
119. Van Vuuren, H.J.J., Louw, H.A., Loos, M.A.,and Meisel, R. (1977) Applied and Environmental
Microbiology, 33, 246.
120. Van Vuuren, H J.J., Kersters, K., De LeyJ.etal. (1978) Journal of the Institute ofBrewing, 84,315.
121. Van Vuuren, H.J.J., Kersters, K., De Ley, J., and Toerien, D.F. (1981) Journal of Applied
Bacteriology, 51,51.
122. Von Riemann, J., and Scheible, E. (1969) Brauwelt, 109,1074.
123. VirkajArvi, I., Vauhkonen, Т., and Storgerds, E. (2001) Journal of the American Society of
Brewing Chemists, 59, 63.
228
Хенни Дж. Дж. Ван Вуурен, Фергус Г. Прист
124. Wainwright, Т. (1972) Brewers'Digest, 47,78.
125. Walker, Т.К., and Tosic, J. (1945) Journalofthe Institute of Brewing, 51, 245.
126. Weiner, J.P., Rolph, D.J., and Taylor, R. (1975) Proceedings of the 15th Congress of the
European Brewery Convention, Nice, IRL Press, Oxford, p. 565.
127. Weiss, N.. Seidel, H., and Back, W. (1979) Brauwissenschaft, 32,189.
128. West, D.B., Lautenbach, A.F., and Brumsted, D.D. (1963) Proceedings of the Annual Meeting
of the American Society of Brewing Chemists, St Paul, MN, p. 194.
129. White, G.A., and Wang, C.H. (1964a) Biochemical Journal, 90,408.
130. White, G.A., and Wang, C.H. (1964b) Biochemical Journal, 90,424.
131. Williams, P.J. le В., and Rainbow, С (1964) Journal of General Microbiology, 35, 237.
132. Williamson, D.H. (1959) Journal ofthe Institute of Brewing, 65,154.
133. Xu, H.S., Roberts, N., Singleton, F.L. et al. (1982) Microbial Ecology, 8,313.
134. Yamada, Y., Hoshino, K., and Ishikawa, T. (1997). Bioscience, Biotechnology and Biochemistry,
61,1244.
Глава 7
ДИКИЕ ДРОЖЖИ В ПИВОВАРЕНИИ И СПИРТОВОЙ
ПРОМЫШЛЕННОСТИ
Йен Кэмпбелл (lain Campbell)
7.1. Введение
На протяжении всей истории отрасли дикие дрожжи представляли проблему для
пивоваров и виноделов, являясь предметом многочисленных дискуссий с тех пор,
как стала известной их микробиологическая природа. Всесторонний обзор культу-
ральных методов обнаружения и выделения диких дрожжей, определенных как
«дрожжи, не играющие существенной роли в нормальном брожении», представлен
в [11,12]. В прежних изданиях этой книги дикие дрожжи рассматривались преиму-
щественно согласно определению «дрожжи, использованные без надлежащего конт-
роля» [7], которого мы будем придерживаться и здесь, чтобы указать случайный и
второстепенный характер загрязнения дикими дрожжами.
7.2. Систематика дрожжей
Начнем с обзора систематики культурных и диких дрожжей, которая охватывает
не только классификацию и номенклатуру, но и общие принципы идентификации
дрожжей.
Что такое дрожжи? Четкого определения этого понятия не существует. Как полагают,
спиртовое брожение и деление путем почкования являются безусловными особенностя-
ми дрожжей, но фактически эти свойства присущи лишь примерно половине известных
разновидностей дрожжей. Общепринято, что дрожжи — это микроскопические грибы,
являющиеся преимущественно одноклеточными микроорганизмами, тогда как плесе-
ни — многоклеточны и имеют мицелий, состоящий из переплетений гиф с поперечными
перегородками, но существуют и пограничные дрожжеподобные грибы. Кроме того, мно-
гие дрожжи способны при соответствующих условиях культивирования расти в мице-
лиальной форме, образуя как истинный мицелий, так и псевдомицелий, состоящий из
цепи удлиненных дрожжевых клеток. Три из четырех групп грибов (табл. 7.1) включают
дрожжи Ascomycetes, Bosidiomycetes и Deuteromycetes. Обычно считается, что дрожжи —
это выродившиеся грибы, утратившие способность расти, образуя гифы, разделенные
поперечными перегородками, но возможно, что грибы эволюционировали от своих одно-
клеточных предшественников. Едва ли можно предполагать, что Zygomycetes
с неразделенными гифами (то есть не разделенные на отдельные клетки) могли произве-
сти одноклеточные варианты, но при необычных условиях культивирования некоторые
зигомицеты могут размножаться почкованием подобно дрожжам.
В течение XX в. основополагающими считались работы голландской группы иссле-
дователей таксономиии дрожжей [13,18,19,41]. В более позднем издании [16], пусть
и не относящимся к голландской школе, чувствуется их влияние, хотя и признаются
недавние изменения в отношении к таксономическим испытаниям [3,4, 14,15,17].
230
Йен Кэмпбелл
Таблица 7.1. Классификация грибов (эумицетов)
1. Гифы не имеют перегородок Phycomycetes (фикомицеты)
2. Гифы разделены поперечными перегородками:
а) основные эндогенные споры, в асках Ascomycetes (аскомицеты)
б) основные экзогенные споры, на базидиях Basidiomycetes (базидиомицеты)
в) никаких асков или базидий, размножение Deuteromycetes {Fungi Imperfecta
только неполовым путем (дейтеромицеты или несовершенные грибы)
Традиционная классификация грибов в значительной степени основывалась на
типе вегетативного роста и природы образующихся спор, и было естественно приме-
нить ту же самую систему для дрожжей. Однако многие спорообразующие дрожжи
при хранении в лабораторной культуре быстро теряют способность к спорообразова-
нию; кроме того, диплоидные клетки, становясь по какой-либо причине гаплоидны-
ми или триплоидными, споры больше не образуют. Таксономисты дрожжей пришли
к выводу, что какими бы полезными для таксономии грибов ни были характеристики
спор, спорообразование слишком ненадежно для формирования серьезной базы так-
сономии дрожжей. Это можно заметить по каждому очередному изданию классиче-
ского справочника «Дрожжи» [3, 4] — роль спор в классификации становится все
меньше и меньше.
Физиологические свойства, широко применяемые в бактериологии, в идентифи-
кации мицелиальных грибов не используются, однако для одноклеточных дрожжей
могут быть использованы те же способы культивирования, что и для бактерий, хотя
для этого требуются среды с более низким значением рН. В более ранних схемах
классификации физиологические признаки в таксономии дрожжей применялись
в основном для идентификации видов, и только иногда — для идентификации родов.
В последнем случае прежде использовалась способность дрожжей утилизировать
нитраты (в качестве источника азота для роста) [13, 18], но после того, как ДНК-
анализ показал, что виды Hansenula и Pichia, отличающиеся по использованию нит-
рата, идентичны в других отношениях [15], «нитрат-положительный» род Hansenula
из классификации был исключен. Бывшие Hansenula spp., некоторые из которых яв-
ляются потенциальными контаминантами пивоваренного производства, в настоя-
щее время включают в роды Pichia, Williopsis и некоторые другие родственные им
роды [16]. В настоящее время единственным применяемым физиологическим тес-
том является тест на способность к ферментации углеводов, по которой роды разде-
ляют на ферментирующие и неферментирующие дрожжи.
Относительно недавно в идентификации родов и видов стали применять методы
молекулярной биологии [21, 29]. Характеристики основных родов дрожжей, встре-
чающихся при производстве пива или как культурные дрожжи, или как контами-
нанты, сведены в табл. 7.2, а морфологические особенности вегетативных клеток
и спор показаны на рис. 7.1-7.3.
Хансен {Hansen), пионер в области таксономии дрожжей, применил название
Saccharomyces cerevisiae к традиционным в британском и немецком пивоварении дрож-
жам верхового брожения. Так как лагерные дрожжи отличались от других видов дрож-
жей, их отнесли к виду Saccharomyces carlsbergensis. Другие специфичные названия ви-
дов применялись к дрожжам в соответствии с тем, каким путем сбраживаются сахара,
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности
231
Таблица 7.2. Характеристики пивоваренных дрожжей, относящихся к классу аскомицетов
(по [4,16]). Пояснения по вегетативному росту и морфологии спор см. на рис. 7.1 и 7.2
Saccharomycetaceae
Debaryomyces
Dekkera
Issatchenkia
Kluyveromyces
Pichia
Saccharomyces
Torulaspora
Williopsis
Zygosaccharomyces
(вегетативное размножение путем мультилатерального почкования)
Сбраживание Сахаров слабое или отсутствует; споры (округлые,
овальные или бородавчатые) образуются в результате конъюгации
между материнской клеткой и почкой с образованием аска с круглыми
спорами; не высвобождаются из аска
Сбраживание Сахаров (только в аэробных условиях); споры имеют
шляповидную форму; освобождаются из аска после созревания;
некоторые разновидности способны в качестве единственного
источника азота утилизировать нитрат
Сбраживание Сахаров слабое; образуют псевдомицелий и поверхностную
пленку; круглые споры, находящиеся в аске, не высвобождаются
Сбраживание Сахаров (обычно бурное). Аскоспоры округлые, овальные
или бобовидные; легко высвобождаются из аска
Сбраживание Сахаров слабое или отсутствует; большинство дрожжей
образуют истинный или псевдомицелий и поверхностную пленку.
Споры округлые, шляповидные или сатур нови дные; при нагревании
легко высвобождаются из аска; некоторые виды в качестве
единственного источника азота способны утилизировать нитрат
Сбраживание Сахаров бурное, без образования пленки; споры
округлые или овальные, при созревании не высвобождаются из аска
Сбраживание Сахаров бурное; споры (округлые, овальные или
бородавчатые) при созревании не высвобождаются из аска;
спорообразованию предшествует конъюгация
Сбраживание Сахаров слабое или отсутствует; сатурновидные споры,
которые высвобождаются из асков после созревания; все виды в ка-
честве единственного источника азота способны использовать нитрат
Сбраживание Сахаров бурное; аскообразованию предшествует конъюгация
клеток; споры округлые или овальные, не высвобождаются из асков
Nadsonioideae (вегетативное размножение биполярным почкующимся делением)
Hanseniaspora Сбраживание Сахаров; споры округлые, шляпо- или сатурновидные;
могут высвобождаться или не высвобождаться из аска
Saccharomycodes Сбраживание Сахаров; споры (округлые или шляповидные) при
созревании не высвобождаются из асков
(Род Nadsonia, по которому было названо соответствующее подсемейство, не зарегистрирован
в качестве контаминанта пивоваренного производства)
Schizosaccharomycetoideae (вегетативные размножение путем деления клеток пополам или
путем распада гиф на артроспоры)
Schizosaccharomyces Сбраживание Сахаров; споры округлые, овальные или бобовидные
(гладкие или шероховатые); высвобождаются из аска
какими промышленно важными свойствами обладают дрожжи или в соответствии с
морфологией клетки. Например, дрожжи для эля (сферические или почти сферичес-
кие) и винные дрожжи Saccharomyces ellipsoideus (эллипсоидальные) характеризова-
лись Хансеном частично по форме, а частично — по различному поведению при броже-
нии, хотя винные дрожжи очень скоро отнесли к виду S. cerevisiae [19]. В литературе
появилось большое количество незначительно отличающихся между собой видов с раз-
личными латинскими названиями (см. табл. 7.3), и в работах [13,16] они были отнесе-
ны в раздел Saccharomyces как синонимы S. cerevisiae. Кроме того, гибридизация этих
прежних «видов» для создания полезных для промышленного использования гибри-
232
Йен Кэмпбелл
а) б) в)
Рис. 7.1. Вегетативное размножение дрожжей: а — мультилатеральное почкование (как
у Saccharomyces), то есть почкование от различных участков внешней поверхности клеток (обрати-
те внимание на типичную узкую основу развивающейся почки); б — биполярное почкование (как
у Hanseniaspora), последовательное почкование от каждого полюса клетки поочередно (обратите
внимание на широкую основу развивающейся почки, характерную для этого способа роста). При
следующей генерации две помеченные клетки будут образовывать почку с конца X.
в — бинарное деление (как у Schizosaccharomyces). Материнская клетка удлиняется и затем, после
разделения ядра и перемещения новых ядер к разным концам клетки, эти две почки разделяются
перегородкой, завершающей формирование стенок и разделение их на самостоятельные клетки.
а) б) в) г) д) е)
\®
&
сь
S
<ж>
®я
<6В)
С2)
(§)
;^
<№
<D.
%
(2У
<Щк)
(щр
1
Рис. 7.2. Споры дрожжей, встречающихся в производстве пива: а — споры Saccharomyces. Для
образования четырех гаплоидных спор внутри первоначальной клетки гетерозиготные диплоидные
клетки подвергаются двум последовательным мейотическим делениям ядра. Споры в аске иногда
представляют собой тетраэдр. Из-за нарушений при делении ядра зачастую формируются лишь
2-3 споры; б) споры Debaryomyces или Torulaspora. При условиях, стимулирующих спорообразова-
ние, ядро гаплоидной клетки сливается с ее почкой, в которой есть ядро, хотя почка еще и не полно-
стью развита. Так образуется временная диплоидная клетка, а затем две гаплоидные споры. Споры
по форме напоминают каплю масла, что свойственно некоторым штаммам Debaryomyces spp/,
в) споры Zygosaccharomyces. Спорообразованию предшествует изо- или гетерогамная копуляция
(соединение) клеток. В аске содержится от 1 до 4 гаплоидных спор (соответственно числу мейоти-
ческих делений); г) шляповидные споры показаны и в аске, и свободными. Образование «шляпы»
происходит через тангенциальную пластинку или кольцо на сферической или полусферической спо-
ре. Такой тип споры образуют Pichia membranaefaciens, пивоваренный контаминант, д) сатурновид-
ные споры — например, некоторые Pichia spp. и Williopsis satumus. Кольцо расположено экватори-
ально на сферической споре или споре, по форме напоминающей линзу, так что при некотором во-
ображении можно представить планету Сатурн, е) бобовидные споры (у Kluyveromyces marxianus).
Клеточная стенка менее плотная, чем у Saccharomyces (см. а), и позволяет образовать линейный
аск (верхний на рисунке). Линейные аски формируют также Schizosaccharomyces spp.
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 233
Вегетативный рост путем:
мультилатерального почкования полярного почкования деления пополам
i i i
Хорошее сбраживание Hanseniaspora* Schizosaccharomyces
глюкозы (и Kloeckera)
+ | 1 1 w/-
Saccharomyces (Брожение слабое
Kluyveromyces или отсутствует)
Torulaspora \
Zigosaccharomyces Образование
(и Candida) уксусной кислоты
(с ощутимым запахом)
Dekkera Debaryomyces
(и Brettanomyces) Issatchenkia, Pichia,
Williopsis (и Candida)
* Новый вид.
Рис. 7.3. Упрощенная схема идентификации обычных дрожжей-контаминантов
дов типа хлебопекарных и спиртовых дрожжей подтвердила, что отнесение этих видов
дрожжей к S. cerevisiae было выполнено корректно. Тем не менее при наличии такого
большого числа культурных и диких дрожжей, называемых теперь S. cerevisiae, для мик-
робиолога на производстве возникает проблема, как описать различия между этими
организмами по их промышленным свойствам без помощи официально признанных
отличительных названий. По мере того как каждый микробиолог разрабатывал свои
схемы классификации различных культурных и контаминантных дрожжей, относимых
к одному виду 5. cerevisiae, были утеряны преимущества стандартизированной номенк-
латуры.
Альтернативная система идентификации дрожжей по их физиологическим свой-
ствам предложена в [3,4]. Несмотря на свою сложность, подобная система имеет то
преимущество, что игнорируя характеристики спор (если таковые вообще имеют-
ся), идентификация может быть проведена за нескольких дней. Известно, что споро-
образование — свойство весьма ненадежное, и для определения того, что дрожжи
являются действительно неспорообразующими, может понадобиться их инкубация
в течение более 2 недель. Упрощенная версия этой системы является основой серий-
но производимого аналитического набора API для идентификации дрожжей (постав-
ляемого фирмами ЫоМёпеих, Великобритания, г. Бэзингсток, или API, Франция,
г. Монталье-Версье).
Различие между штаммами S. cerevisiae для эля, лагерными и непивоваренными
дрожжами было еще раз показано при помощи «отпечатков пальцев» ДНК [28, 29].
На основе аналогичных исследований предыдущее объединение винных дрожжей
штаммов Saccharomyces bay anus и Saccharomyces pastorianus c S. cerevisiae было пере-
234
Йен Кэмпбелл
смотрено [3, 20]. История переименований различных видов дрожжей рода Saccha-
romyces по их способности к брожению и спиртообразованию за последние 40 лет
представлена в табл. 7.3 (более подробно об этом см. [2]).
Таблица 7.3. Изменения в номенклатуре важнейших видов пивоваренных дрожжей, 1952-1992
По [19]
По [18]
По [13]
По [2]
Saccharomyces bayanus
S. pastorianus
S. oviformis
S. cerevisiae
S. cerevisiae var. elfipsoideus
S. willianus
S. carlsbergensis
S. logos
S. uvarum
S. chevalieri
S. italicus
S. delbrueckii
S. fermentati
S. rosei
S. acidifaciens
S. bailii
S. fragilis
S. marxianus
S. lactis
S. bayanus
S. cerevisiae
S. uvarum
S. chevalieri
S. italicus
S. diastaticus*
S. delbrueckii
S. fermentati
S. rosei
S. vafer*
S. bailii
Kluyveromyces
marxianus
K. lactis
S. cerevisiae
Torulaspora
delbrueckii
-»S. bayanus
->S. pastorianus
S. cerevisiae
T. delbrueckii
Zygosaccharomyces Z. bailii
bailii
K. marxianus
К marxianus
* Новые виды.
7.3. Свойства дрожжей, необходимые для их идентификации
К свойствам дрожжей, используемым в голландской таксономии, относятся
и морфологические, и физиологические признаки (см. табл. 7.4). Большое количе-
ство тестов, характеризующих рост дрожжей, приведены в [18] и включают более 30
источников углерода или азота (в [13, 16] их количество было сокращено до 18).
Классификация Барнетта [4] подразумевает почти 60 тестов на сбраживание Саха-
ров и аэробной рост в углерод- или азотсодержащих средах, но для рутинной иден-
тификации обычно требуется существенно меньше тестов: реальное их количество
зависит от той или иной группы дрожжей. Между процедурой идентификации, раз-
работанной голландской и барнеттовской школами [3,4] существует фундаменталь-
ное отличие: первая идентифицирует дрожжи строго иерархически (то есть семей-
ство, род, вид), а вторая сначала подразделяет дрожжи на относительно несвязанные
между собой группы. Идентификация дрожжей учеными барнеттовской школы ба-
зируется на небольшом количестве ключевых тестов, предназначенных для деления
всех известных дрожжей на группы, примерно равные по количеству видов. Затем
эти группы подвергают небольшому количеству тестов, выбранных специально для
идентификации разновидностей в данной группе — для разных групп используются
различные тесты. Сравнение указанных трех систем приведено в табл. 7.4. Если
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности
235
идентификация требуется только на уровне родов (что чаще всего и бывает в лабора-
ториях пивоваренных предприятий), достаточно простого ключа, приведенного
в табл. 7.4. Идентификация видов необходима лишь тогда, когда контаминанты от-
носятся к группе Saccharomyces (см. раздел 7.5).
Таблица 7.4. Принципы идентификации дрожжей
Идентификация
по «классической»
системе [13]
Идентификация только
по физиологическим
тестам [3, 4]
Промышленный набор
тестов API
Выделение
I
Наблюдение за морфологией
вегетативных клеток и спор
и за сбраживанием глюкозы
(см. табл. 7.2)
I
Идентификация семейства
ирода
Выделение
I
Тестирование аэробного роста
на различных углерод- и
азотсодержащих средах
Выделение
I
Тестирование аэробного роста
на различных
углеродсодержащих средах
Размещение в физиологическую Идентификация
группу рода и вида
Изучение брожения
и аэробного роста (см. ниже)
Идентификация видов
Соответствующие тесты
для данной группы (обычно
больше дополнительных
тестов роста)
I
Идентификация рода и видов
Тесты по идентификации вида: на сбраживание моно-, ди- и трисахаридов; аэробная утилизация
Сахаров, кислот и спиртов.
Для классификации, идентификации или того и другого было предложено исполь-
зовать многочисленные биохимические свойства, отличные от брожения или иссле-
дования аэробного роста (табл. 7.5). Из этих свойств для классификации до сих при-
меняется лишь определение общего содержания (в %) гуанина и цитозина (G + С, %)
[4, 16], однако оно не помогает в идентификации новых изолятов, так как такое же
значение может быть свойственно различным видам и даже родам дрожжей (напри-
мер, G + С в 40% характеризует различные дрожжи — Brettanomyces anomalus, Pichia
quercuum и 5. cerevisiae) [13]. Эта ситуация встречается настолько часто, что опреде-
лением общего содержания гуанина и цитозина невозможно идентифицировать не-
известную культуру (но если значение G + С (%) сильно отличается от значения,
свойственного основной культуре, можно признать, что идентификация неверна).
Например, изоляты, выделенные из кактусов, первоначально на основании физиоло-
гических признаков идентифицировали как P. membranaefaciens, но в конечном счете
они были классифицированы как различные виды из-за существенно отличающегося
значения G + С [32]. Относительно недавно была восстановлена классификация
видов S. bayanus и S. pastorianus (частично из-за отличного от других штаммов
S. cerevisiae содержания G + С) [2, 20]; обоснованность этого впоследствии была под-
236
Йен Кэмпбелл
тверждена электрофорезом [22]. Значение этих различных, связанных с составом
нуклеиновых кислот аспектов с учетом представленного деления на роды и виды до-
вольно полно рассмотрено в [17,43].
Таблица 7.5. Альтернативные пробы для классификации или идентификации дрожжей (по [3,13])
Клеточная стенка Химический состав, включающий протонно-магнитный резонанс
спектра выделенного маннана /галактоманнана
Иммунология: эффективные антигены — маннан/галактоманнан или
белок
Ферменты или белки Наличие или отсутствие специфических ферментов
Электрофоретические копии ферментов (изоферментов)
«Кофермент Q»: количество изопреновых остатков — 6-10
Мембранная структура Наличие или отсутствие специфических липидов (определяемое,
например, методом газожидкостной хроматографии)
ДНК Общее содержание гуанина и цитозина (G + С, %)
Генетическая гомология
«Отпечатки пальцев» ДНК
Цепная реакция полимеразы (ЦРП)
КоферментО: аскомицеты — 6,7 или 8; базидиомицеты — 9 или 10; G + С (%): аскомицеты < 50%;
базидиомицеты > 50% [13].
Конечно, как бы близки не были суммарные значения G+ С,%, два различных
штамма могут считаться одним и тем же видом только в том случае, если происходит
соединение комплементарных нитей ДНК. Реассоциирование ДНК возможно толь-
ко тогда, когда на протяжении всей молекулы ДНК основания расположены в той
же самой последовательности. Требованием для отнесения к одному виду считается
не менее 80%-ная реассоциация [17], хотя некоторые считают, что можно применять
и более низкое значение [43].
Применением этого принципа является определение полной последовательности
ДНК-оснований дрожжей. Хотя этого вряд ли можно добиться для всех дрожжей,
тем не менее метод «снятия отпечатков пальцев» штаммов при помощи фрагментов
ДНК доказал свою полезность в определении промышленных штаммов (см. главы 3
и 9) и может применяться для классификации и идентификации дрожжей [24].
7.4. Выявление диких дрожжей
Тест на отсутствие «диких» дрожжей на всех критических стадиях процесса пивова-
рения считается хорошей микробиологической практикой. Это является одним из
принципов НАССР (анализа рисков и критических контрольных точек). Критические
контрольные точки в пивоварении определены в работах Института Пивоварения (IoB,
Великобритания) [ 1] и Американского общества химиков-пивоваров (ASBC)[42].
На пивоваренных предприятиях стадии, предшествующие кипячению сусла с хме-
лем, как источник диких дрожжей не очень важны, поскольку дрожжи недостаточно
термоустойчивы, чтобы пережить даже кратковременное кипячение. С другой сторо-
ны, причиной микробиологических проблем может стать неправильное местополо-
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 237
жение предприятия, так как пыль может попасть в танки брожения. До сих пор акту-
альна работа [45], где показано, что в том случае, когда в солоде, хмеле и другом сырье
мало «диких» дрожжей, то эти контаминанты отсутствуют и в пиве.
Больший риск из-за наличия дрожжевых контаминантов в солоде (см. главу 4)
представляет собой некипяченое сусло на предприятиях по производству спиртных
напитков. Однако даже те дрожжи, которые остались после затирания, обычно не
оказывают отрицательного воздействия на брожение. За некоторым исключением
(и только в очень небольшом количестве) дрожжи, обнаруживаемые в солоде, явля-
ются строго аэробными (см. главу 4), и поэтому, даже выдержав температуры зати-
рания, они неспособны к росту во время дальнейшего брожения, так как культурные
дрожжи быстро потребляют 02 из среды, в результате чего создаются анаэробные
условия.
И на пивоваренных, и на спиртовых заводах перед каждым брожением должны
отбираться пробы из продизенфицироваиного танка брожения и пробы охлажден-
ного аэрированного сусла, и хотя результаты будут получены только через трое су-
ток, в связи с чем прерывать брожение будет уже поздно, эти пробы являются важ-
ным аспектом оценки качества продукта. Так как в этих образцах дрожжи должны
отсутствовать, любое их обнаружение заслуживает пристального внимания — даже
если они окажутся безвредными, их присутствие указывает на недостаточную стери-
лизацию. Обнаружение любых диких, культурных дрожжей или бактерий свиде-
тельствует о недостаточных санитарно-гигиенических мероприятиях и возможных
микробиологических проблемах. Стандартные средства и методы микробиологиче-
ского анализа мы рассмотрим в главе 12.
Недостатком традиционных методов культивирования на агаре является их 3-су-
точная инкубация для достижения колониями видимых размеров, но в настоящее
время доступны ускоренные методы культивирования — например, с помощью ана-
лизаторов роста, измеряющих импеданс растущих культур через 6-18 ч (см. гла-
ву 8). Иммунологические методы мы подробно описали в первом издании этой кни-
ги [5]. Стандартным рекомендуемым методом является иммунофлуоресценция
(ИФ) [1,31], полезная для быстрого обнаружения и подсчета микробных контами-
нантов, включая дрожжи. Особенно она важна для выявления в задаваемых дрож-
жах и сбраживаемых пробах контаминантов рода Saccharomyces [5]. Хотя некоторые
новейшие методы микробиологического анализа еще не утверждены в качестве ре-
комендуемых, некоторые из них — ELISA {Enzyme-linked Immunosorbent Assay)
и DEFT {Direct Epifluorescence Filter Technique) уже широко применяются в пищевой
промышленности и в индустрии напитков [30]. Широко используемая версия мето-
да DEFT основана на ферментативном гидролизе нефлуоресцирующего диацетата
флуоресцеина до флуоресцирующего флуоресцеина [1], что позволяет выявить мер-
твые клетки.
Современное развитие молекулярной биологии позволяет разработать новые ме-
тоды для обнаружения определенных контаминантов. Так, для выявления различ-
ных патогенов и бактерий, вызывающих порчу пищевых продуктов и напитков был
предложен метод, основанный на цепной реакции полимеразы (ЦРП). Не так давно
опубликованы имеющие отношение к дрожжам методы — обнаружение диастатиче-
ских диких дрожжей (ранее называвшихся S. diastaticus) [46] и быстрое распознава-
238
Йен Кэмпбелл
ние различных видов культурных дрожжей [27]. Как и при методе ИФ, требующем
конкретной сыворотки, ЦРП-определение конкретного контаминанта возможно
только тогда, когда имется конкретный праймер, реагирующий с фрагментами ДНК
контаминанта, но не с культурными дрожжами. Серьезное неудобство метода ЦРП
и стандартного ИФ-метода заключается в невозможности отличить живые клетки от
мертвых: нуклеиновые кислоты и структуры клеточной стенки, обнаруживаемые при
этих тестах, сохраняются и после гибели клеток. Кроме того, все эти методы огра-
ничиваются обнаружением и подсчетом; для дальнейшего анализа культура не до-
ступна.
7.5. Идентификация диких дрожжей
Общие принципы классификации и идентификации дрожжей были проанализи-
рованы в разделах 7.2 и 7.3, и ниже мы рассмотрим требования к микробиологиче-
ской лаборатории пивоваренного предприятия.
Многие контаминантные дрожжи в производстве пива и в других смежных отрас-
лях пищевой промышленности являются штаммами S. cerevisiae, но могут встречать-
ся и другие виды Saccharomyces, а также роды дрожжей, способные как ферментиро-
вать, так и не ферментировать сахара. В табл. 7.6 приведен список видов дрожжей,
которые, согласно [3, 4], представляют собой контаминанты пивного брожения, —
он, конечно, неполный, поскольку многие случаи контаминации невозможно иден-
тифицировать полностью; но даже если это и происходит, эта информация может
быть не опубликована в научной литературе. При спиртовом брожении лишь немно-
гие контаминанты из этого списка могут конкурировать со спиртовыми дрожжами —
только если они составляют существенную долю данной культуры. Следовательно,
если спиртовые дрожжи характеризуются неудовлетворительным качеством, то ве-
роятными источниками их контаминации дикими дрожжами являются или танки
брожения, плохо обработанные после предыдущего брожения, или сильно заражен-
ные пивоваренные дрожжи, используемые для дополнительного внесения.
Насколько важно полностью идентифицировать все дрожжевые контаминанты?
Очевидно, это необходимо для определения рода и вида контаминанта с последую-
щим поиском в литературе сведений о влиянии данных дрожжей на качество про-
дукта, а также для выявления способов устранения последствий. С другой стороны,
достаточная информация содержится в несложной схеме определения основного
рода дрожжей, позволяющей предположить возможные источники загрязнения
и подобрать соответствующие условия для их устранения (см. рис. 7.3 и раздел 7.7).
Одним из несложных методов, позволяющим определить род отдельных изолятов,
является выявление их устойчивости к антибиотикам и другим ингибиторам с помо-
щью мультидействующего агента «yeastar» [36], причем степень ингибирования лег-
ко выражается количественно, что позволяет осуществлять обмен информацией
между лабораториями. К сожалению, для идентификации этот метод непригоден.
В последние годы комплекты для идентификации API упростили процедуру опре-
деления бактерий и дрожжей. Комплект API 20C для дрожжей с 20 средами первона-
чально был предназначен для идентификации патогенных штаммов Candida spp.
и их отличий от непатогенных дрожжей. Эта система в равной степени применима
к промышленным дрожжам, а прилагаемое руководство позволяет идентифицпро-
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности
239
Таблица 7.6. Виды дрожжей, считающиеся контаминантами
пивоваренного производства (по [3])
Brettanomyces anomalus, В. claussenii, В. custersii, В. lambicus
Candida beechii, С. intermedia, parapsilosis, С. sake, С. stellata, С. tenuis, С. tropicalis, С. versatilis
Dekkera bruxellensis, Dek. intermedia
Debaryomyces hansenii. Deb. marama
Hanseniaspora uvarum, H. valbyensis (известны также как Kloeckera apiculata в неспорообразующей
форме), Н. vineae
Issatchenkia orientalis (ранее Candida krusei)
Kluyveromyces marxianus
Pichia anomala, P. fabianii, P. farinosa, P. fermentans, P. guilliermondii, P. ohmeri, P. onychis,
P. orientalis, P. membranaefaciens (известны также как Candida krusei в неспорообразующей
форме), Р. subpelliculosa
Saccharomyces bayanus, S. cerevisiae, S. exiguus, S. pastorianus, S. unisporus
Schizosaccharomyces pombe
Torulaspora delbrueckii
Zygosaccharomyces bailii, Z. bisporus
Все роды — спорообразующие, кроме Brettanomyces, Candida и Kloeckera
вать и культурные дрожжи, и обычные контаминанты пивоваренной и спиртовой
промышленности. Поставщики поддерживают базу данных по свойствам всех извес-
тных дрожжей и предоставляют консультации по идентификации необычных изо-
лятов. В частности, относительно недавно была представлена полуавтоматическая
компьютерная система для промышленных дрожжей («Biolog»), но для нее необхо-
дим 96-ячеистый лоток микротитров источников углерода для каждой культуры, что
затрудняет (по сравнению с API20Q его применение в широких масштабах [33].
Хотя готовые к применению комплекты типа API20C удобны для нерегулярной
идентификации контаминаитов, они довольно дороги при больших количествах изо-
лятов. В такой ситуации более экономичным представляется использование про-
мышленной углеводной основы с автолизатом дрожжей и азотной основой.
Если дрожжи выделяют из семенных дрожжей или на стадии брожения, то это
почти наверняка будут дрожжи S. cerevisiae. Если изоляты получают из дображивае-
мого пива, для определения, являются ли они культурными дрожжами или контами-
нантами, необходим дальнейший анализ. Хотя все штаммы 5. cerevisiae сбраживают
глюкозу, сахарозу и мальтозу, но не сбраживают лактозу, они отличаются по отно-
шению к сбраживанию других Сахаров (например, галактозы, мелибиозы, мелицито-
зы, (3-метилглюкозида и трегалозы) [13]. Уже после 6 ч инкубации на этих сахарах
становится очевидно, сбраживают ли дрожжи тот или иной сахар, и в результате ста-
240
Йен Кэмпбелл
новится возможным определить отличия или идентичность известным культурным
дрожжам. Кроме того, для этой же цели можно применить тест с «yeastar» (см.
выше).
Очень важно иметь возможность воспользоваться ускоренным тестом, с помощью
которого можно четко разделить культурные штаммы дрожжей в различных марках
пива. Это может быть вариант, когда штаммы отличаются по способности сбражи-
вать галактозу, мелибиозу и т. д. (см. выше), но относительно недавно появилась но-
вая техника определения. Метод «отпечатков пальцев» ДНК [28], хотя до сих пор не
доступен всем лабораториям пивоваренных предприятий, позволяет быстро иденти-
фицировать различные штаммы культурных дрожжей даже в наиболее трудной си-
туации [24]. «Отпечаток» может совпадать с «отпечатками» известных видов, но не
подходить для идентификации неизвестной культуры. Недавнее восстановление
прежних названий S. bayanus и S.pastorianus было подтверждено анализом ДНК:
путем традиционного, то есть культурального тестирования отличить их от S. cerevi-
siae не представляется возможным [2,22] — для этого необходим анализ путем элек-
трофореза или снятие «отпечатков пальцев» ДНК.
7.6. Влияние диких дрожжей на пивоваренное производство
Определение «дрожжи, использованные непреднамеренно и при полном контроле»
охватывает четыре основных типа диких дрожжей-контаминантов: а) контаминанты,
ферментирующие сахара, б) дрожжи-киллеры, в) «дикий» тип культурных дрожжей
и г) «аэробные» (неферментирующие сахара) дрожжи. За исключением особого слу-
чая дрожжей-киллеров, обычно дикие дрожжи являются причиной появления в пиве
одного или нескольких посторонних ароматов, мути, поверхностной пленки, хлопье-
видного или гранулированного осадка (табл. 7.7). Метаболизм некоторых диких дрож-
жей мало отличается от метаболизма культурных дрожжей — в результате при сред-
них уровнях контаминации они не могут стать причиной значительного изменения
вкуса, однако роды Brettanomyces и Dekkera продуцируют большое количество уксус-
ной кислоты, а некоторые виды Pichia и Williopsis — эфиры, что существенно изменяет
органолептический профиль пива. Кроме того, осветление пива основано на флокули-
рующей способности пивных дрожжей, что не является характерным свойством ди-
ких дрожжей, вследствие чего они могут стать причиной мутности пива. Ниже мы ос-
тановимся на этом более подробно.
7.6.1. Ферментирующие дрожжи
Дрожжи родов Saccharomyces, Kluyveromyces, Torulaspora и Zygosaccharomyces име-
ют общие биохимические признаки, и поэтому некоторое время их относили к одно-
му роду Saccharomyces. Следовательно, они могут успешно конкурировать с куль-
турными видами S. cerevisiae. За исключением дрожжей-киллеров (см. раздел 7.6.2),
дрожжи-контаминанты оказывают небольшое или не оказывают никакого ингиби-
торного действия на культурные дрожжи, однако в том случае, когда они растут
с более высокой скоростью, при последующих ферментациях их количество относи-
тельно культурных дрожжей увеличится. Дикие контаминанты Saccharomyces обла-
дают большей продуктивностью, а потому и более высокой скоростью утилизации
нутриентов, а также более простым обменом веществ (например, неспособностью
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 241
Таблица 7.7. Действие диких дрожжей, вызывающее порчу пива
Hanseniaspora/Kloeckera, Saccharomyces/Kluyveromyces/Torulaspora/Zygosaccharomyces и виды,
аналогичные Candida spp., Schizosaccharomyces: неконтролируемое брожение, образование мути
и постороннего привкуса
Dekkera/Brettanomyces: накопление в пиве уксусной кислоты, образование мути и (возможно)
поверхностной пленки
Debaryomyces/tssatchenkia/Pichia и виды, подобные Candida spp: муть, дрожжевой или эфирный
посторонний привкус, зачастую с образованием поверхностной пленки, распадающейся на
хлопьевидные частицы или осадок
утилизировать мальтотриозу), и все они потенциально могут расти намного быстрее
культурных дрожжей, в результате чего их содержание в семенных дрожжах посте-
пенно увеличивается.
Контаминация засеваемых дрожжей, даже первоначально чистых, после некото-
рого числа ферментации и пересевов, по всей видимости, в традиционных открытых
емкостях является неизбежной, однако ее можно стабилизировать на относительно
низком и поэтому безопасном уровне. При использовании закрытых емкостей риск
контаминации уменьшается, но не устраняется полностью. Увеличивается ли конта-
минация при дальнейшем брожении или падает, зависит от различных технологи-
ческих факторов и характеристик культурных и диких видов дрожжей. Например,
при традиционном брожении эля дрожжи, формирующие «шапку», снимаются с по-
верхности бродящего пива. Если контаминанты не обладают способностью культур-
ных дрожжей образовывать шапку, то их содержание в семенных дрожжах мало ве-
роятно.
Важным свойством пивных дрожжей является флокуляция (способность дрож-
жей собираться в хлопья и быстро осаждаться из среды, в которой они суспензиро-
ваны) [40]. В этом случае происходит естественный процесс осветления пива, что
позволяет избежать таких дорогостоящих технологических операций, как фильтро-
вание или центрифугирование пива. Хорошие пивные дрожжи так себя и ведут, но
многие дикие дрожжи не флокулируют, и, таким образом, помимо искажения вкуса
и аромата, пиво становится мутным.
Обнаружение контаминантов или интенсивно флокулирующих и нефлокулиру-
ющих мутантов дрожжей только при помощи селективных сред затруднено или не-
возможно, однако по изменению флокуляционных свойств клеток уже можно су-
дить о наличии контаминантов. Нужная степень флокуляции — важное свойство
пивных дрожжей [38]. Если происходит изменение флокуляции по сравнению с фло-
куляционной способностью первоначальной культуры, то это указывает либо на
контаминацию (в этом случае культуральные свойства будут отличаться), либо на
появление мутантов с другой флокулирующей способностью (у которых остальные
свойства остаются неизменными). Как уже упоминалось выше, быстро идентифици-
ровать различные виды дрожжей позволяют несложные тесты на сбраживание Саха-
ров или на устойчивость к ингибиторам.
Изменения в флокуляции, пусть и генетического происхождения [40], выражают-
ся в изменениях структуры клеточной стенки. К другим изменениям клеточной стен-
242
Йен Кэмпбелл
ки дрожжей, также воздействующим на их поведение при брожении, относятся ос-
ветление и способность к формированию шапки, которые также, по всей видимости,
имеют генетическое происхождение [5]. Для пива, подвергаемого оклейке или обра-
ботке другими осветляющими веществами, присутствие контаминантов может яв-
ляться причиной опалесцирующей мути. Помутнение пива также может быть след-
ствием того, что многие из контаминантов меньше по размеру, чем культурные
дрожжи, которые при процессах фильтрации или центрифугирования были удалены.
Хотя бродящие диастатические дрожжи представляют собой потенциальный ис-
точник контаминации при брожении, они также являются возможными контами-
нантами дображивания, так как они обладают способностью утилизировать декст-
рины. Даже при низких уровнях контаминации 5. diastaticus при дображивании
(вплоть до одной жизнеспособной клетки) порча может привести к появлению мути,
образованию фенольного и других посторонних запахов и привкусов, а также к умень-
шению вязкости пива из-за гидролиза декстринов [5,8].
Штаммы 5. diastaticus часто флокулируют, и, возможно, что при пастеризации
клетки в центре агломератов оказываются изолированными от внешних воздей-
ствий (именно этим иногда объясняют неудачи пастеризации), маловероятно, что
такие агломераты не будут удалены из пива на стадии предварительного фильтро-
вания. Более вероятная причина неудач пастеризации — это устойчивость дрожже-
вых спор к действию высоких температур. Хотя пивные дрожжи спорулируют до-
вольно редко, и маловероятно что они образуют споры в богатых культуральных
средах, таких как сусло или пиво (см. главу 3), большинство потенциальных конта-
минантов пивоваренного производства споры образуют (см. табл. 7.6) (это ценней-
шее свойство выживания в живой природе). Дрожжевые споры более теплостойки,
чем вегетативные клетки [34], но поскольку программы пастеризации предназначе-
ны прежде всего для уничтожения тех неспорообразующих культурных дрожжей,
которые переносят стадию фильтрования, спорообразующие контаминанты при
пастеризации могут выжить.
7.6.2. Дрожжи-киллеры
Обычно при брожении дрожжи-контаминанты или бактерии конкурируют с куль-
турными дрожжами и, в худшем случае, с каждым повторным использованием семен-
ных дрожжей при последующих циклах брожения происходит увеличение их доли
в популяции. Дрожжи-киллеры [47] — это крайняя форма контаминанта, убивающая
чувствительные культурные дрожжи, после чего дрожжи-киллеры становятся при бро-
жении доминирующими. В работе [23] приводится подробное описание одного из
самых ранних подтвержденных примеров контаминирования пива дрожжами-«килле-
рами», заменивших собой культурные дрожжи и сформировавших неприятный по-
сторонний запах и другие дефекты. Известны различные зимоцины (так часто назы-
вают «киллерные» факторы), продуцируемые дрожжами разных родов [47], но
в условиях пивоваренного или спиртового брожения наиболее вероятными штаммами
дрожжей-киллеров является собственно Saccharomyces spp. Вполне вероятно, что кил-
лерный штамм Saccharomyces, недавно попавший на производство из окружающей сре-
ды, будет хорошо образовывать споры и его можно обнаружить путем селективной
тепловой обработки. В противном случае существует немного шансов подобрать соот-
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 243
ветствующую селективную среду для раннего его выявления, и загрязнение не удастся
обнаружить до тех пор, пока киллерный штамм не станет превалирующим и его можно
будет выявить с помощью неселективной среды (например, благодаря иной окраске
колонии и/или по изменению морфологии клеток). Путем переноса в культуры дрож-
жей определенных резистентных или даже киллерных факторов вполне возможно со-
здать новые резистентные виды дрожжей [47], однако таких факторов настолько много,
что получить новые штаммы с заданными свойствами очень трудно. Кроме того, такая
обработка может привести к изменению полезных свойств дрожжевой культуры, а если
учитывать современное негативное отношение к генной инженерии, применение по-
добных дрожжей будет нежелательным, так как придется сталкиваться с неприятием
их заказчиками.
7.6.3. Культурные дрожжи
Для большинства сортов пива тот или иной штамм дрожжей или их смесь имеют
очень большое значение. Замена одного штамма дрожжей другим может привести
к выпуску неудовлетворительного пива. Этот риск постоянно присутствует на тех
предприятиях, где производятся различные сорта или марки пива. Скорость броже-
ния, снижение физиологической активности дрожжей, характер и количество побоч-
ных ароматических продуктов брожения, флокуляция и формирование пенной шап-
ки — важные свойства отдельных дрожжевых штаммов [25,26]. Очевидно, что после
случайной замены одной культуры на другую все вышеупомянутые характеристики
пива будет отличаться от требуемых. Наиболее эффективная мера предосторожно-
сти — это тщательное документирование технологических процессов, и в случае не-
обходимости идентификация штамма должна подтверждаться ускоренными генети-
ческими методами (см. раздел 7.4).
7.6.4. Аэробные дрожжи
Наиболее часто встречающимися неферментирующими дрожжами, вызывающи-
ми порчу пива, являются дрожжи рода Pichia, особенно P. membranaefaciens. В лите-
ратуре по микробиологии пива (например, [35]) и вина (например, [39]) эти нефер-
ментирующие или слабо ферментирующие дрожжи рассматриваются как аэробные
организмы, но это не совсем верно. В чистой культуре контаминанты Pichia spp. при
культивировании их в сусле способны к росту в полностью анаэробных условиях
[6], однако при определенных концентрациях кислот и этилового спирта в пиве эти
дрожжи теряют способность к анаэробному росту, и, как правило, ведут себя как пол-
ностью аэробные организмы. Также нуждаются в кислороде дрожжи, относящиеся
к родам Brettanomyces и Dekkera spp., продуктом обмена которых является уксусная
кислота. Эти микроорганизмы являются важным компонентом дрожжевой флоры
при брожении бельгийского пива «Ламбик» [44], но подобно уксуснокислым бакте-
риям Acetobacter и Gluconobacter, при попадании воздуха они могут размножаться
при дображивании.
На характер контаминирующей микрофлоры пива значительное влияние оказы-
вает воздух. Такой воздух сам по себе может быть источником дрожжей или бактери-
ального загрязнения, а его доступ к укупоренному пиву обусловливает рост любых
аэробных дрожжей, уцелевших после фильтрования и пастеризации. При этом акти-
244
Йен Кэмпбелл
визируется рост выживших факультативных анаэробов. Для всех контаминантов,
приведенных в табл. 7.6 и 7.7, характерно стимулирование роста атмосферным кис-
лородом, однако дрожжи родов Debaryomyces, Dekkera, Issatchenkia, Pichia и Williopsis
размножаются в пиве лишь в аэробных условиях [6]. То же относится и к многим
контаминантам рода Candida (результат действия этих контаминантов приведен
в табл. 7.7).
7.7. Устранение диких дрожжей
Очевидно, что для устранения диких дрожжей из сбраживаемого или готового
пива, пивовар должен знать источник заражения. Всегда приходится считаться с тем,
что источник повторного инфицирования дикими дрожжами, как правило, находит-
ся вне предприятия, однако случаи заражения на последовательных стадиях техно-
логического процесса могут иметь внутренний источник, будь то семенные дрожжи,
поверхности оборудования, воздух или вода. Непосредственно вносимое сырье (са-
хар, сухой хмель) является причиной инфицирования довольно редко [45]. Выявить
источник инфицирования иногда помогает природа диких дрожжей (ферментатив-
ная или оксидативная) — например, появление аэробных дрожжей в пиве часто свя-
зано с переносимой по воздуху зерновой пылью или с ростом на разбавленной про-
мывной воде, оставшейся после мойки трубопроводов пива или сусла.
Кипяченое и охлажденное сусло вряд ли может быть источником загрязнения (ис-
ключение составляет неудачное стечение обстоятельств — повреждение пластины
теплообменника и подача зараженной воды). Наиболее вероятным является бакте-
риальное загрязнение, хотя возможно и внесение диких дрожжей. Потенциальными
источниками инфекции от предыдущего брожения являются трубопроводы, веду-
щие к бродильной емкости (ферментеру), или непосредственно стенки бродильных
емкостей. Внутренние поверхности сварных швов установок должны быть совер-
шенно гладкими, трубопроводы и емкости должны промываться и стерилизоваться
сразу же после завершения каждого брожения (см. главу 11), а качество мойки и де-
зинфекции должно подтверждаться микробиологическим анализом (см. главу 12).
Очевидно, что при обычных микробиологических анализах каждой партии семен-
ных дрожжей их можно использовать в течение длительного времени, прежде чем
они будут содержать «недопустимый уровень» контаминантов. Понятие «недопус-
тимый уровень» загрязнения дикими дрожжами интерпретируется на разных пред-
приятиях по-разному; кроме того, следует также учитывать способность данного
контаминанта к вытеснению культурных дрожжей. Хотя дрожжи задают раньше, чем
получают результаты микробиологического анализа, контаминанты (за исключени-
ем киллерных дрожжей) развиваются от одного брожения к другому довольно мед-
ленно. Чтобы предотвратить существенное увеличение контаминации, на большин-
стве пивоваренных предприятий дрожжевые культуры заменяют обычно после
некоторого заданного количества последовательных брожений (генераций). Для
снижения степени зараженности семенных дрожжей часто применяют кислотную
обработку с использованием фосфорной или другой кислоты [37]. Для этого рИ
дрожжей снижают до 2,1-2,8 и выдерживают максимум 2 ч, однако в случае зараже-
ния дикими дрожжами это может причинить больше вреда, чем пользы. Бактериаль-
ные контаминанты по сравнению с 5. cerevisiae менее стойки к низким значениям
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 245
рН, но, увы, многие дикие дрожжи столь же толерантны к низким значениям рН, как
и пивные дрожжи. В связи с этим налицо риск, что их содержание в результате кис-
лотной обработки может повыситься. Зачастую бывает предпочтительнее допустить
низкий, но устойчивый уровень загрязнения, чем предпринять потенциально риско-
ванное устранение диких дрожжей, но даже с учетом этого необходимо, чтобы благо-
даря санитарно-гигиеническим мероприятиям загрязнение сохранялось на допусти-
мо низком уровне.
Появление контаминантов после дображивания может происходить разными пу-
тями, и для гарантии качества следует брать микробиологические пробы на каждой
стадии процесса после дображивания пива [10] (см. также главу 12). Основная роль
здесь принадлежит пастеризации, которая призвана устранять не столько вредные
микроорганизмы, сколько остаточные выжившие культурные дрожжи. Если в пиве,
поступающем в пастеризатор, содержится большое количество дрожжей, то некото-
рая их часть выживет после тепловой обработки и станет контаминантами. Микро-
биологическое качество пива после прохождения через фильтры и пастеризаторы
должно быть проверено с помощью мембранного фильтрования; в кегах, бутылках,
банках, на крышках и кронен-пробках, в форсунках для мойки и ополаскивания не
должны присутствовать вредные микроорганизмы, а качество расфасованного про-
дукта должно контролироваться с применением метода мембранного фильтрования.
И, наконец, возможными источниками заражения служат установки розлива в сис-
теме общественного питания, которые также требуют тщательного контроля [9].
Устранение обнаруженных вредных микроорганизмов зачастую требует широких
исследований возможных источников заражения, но в конечном счете устранение заг-
рязнения дикими дрожжами зависит от опыта и здравого смысла пивоваров и микро-
биологов.
Литература
1. Baker, CD. (1991) Recommended Methods of Analysis. Institute of Brewing, London.
2. Barnett.J.A. (1992) Yeast, 8, 1.
3. Barnett.J.A., Payne, R.W., and Yarrow, D. (1990) Yeasts, Characteristics and Identification,
2nd edn, Cambridge University Press, Cambridge.
4. Barnett.J.A., Payne, R.W., and Yarrow, D. (2000) Yeasts, Characteristics and Identification,
3rd edn, Cambridge University Press, Cambridge.
5. Campbell, I. (1987) In Brewing Microbiology, (eds F.G. Priest and I. Campbell), Elsevier,
London.
6. Campbell, I., and Msongo, H.S. (1991) J. of the Institute of Brewing, 97, 279.
7. Gilliland, R.B. (1967) Brewers Guardian, 96 (12), 37.
8. Gilliland, R.B. (1971) J. of the Institute of Brewing, 77, 276.
9. Harper, D.R. (1981) Brewers Guardian, 110 (7), 23.
10. Hjortshoj, B. (1984) European Brewery Convention Symposium on Quality Assurance,
Zoeterwoude, IRL Press, Oxford, p. 65.
11. Ingledew, W.M., and Casey, G.P. (1982a) Brewer's Digest, 57(3), 18.
12. Ingledew, W.M., and Casey, G.P. (1982b) Brewer's Digest, 57 (4) 22.
13. Kreger-van Rij, N.J.W. (1984) The Yeasts, a Taxonomic Study, 3rd edition, Elsevier, North-
Holland, Amsterdam.
246
Йен Кэмпбелл
14. Kreger-van Rij, N.J.W. (1987) In The Yeasts, Vol. l,2ndedn,(eds A.H. Rose and J.S. Harrison).
Academic Press, London, p. 5.
15. Kurtzman, C.P. (1984) Antonie van Leeuwenhoek, 50, 209.
16. Kurtzman, СР., and Fell, J.W. (1998) The Yeasts, a Taxonomic Study, 4th edn, Elsevier,
Amsterdam.
17. Kurtzman, C.P, and Phaff, H.J. (1987) In The Yeasts, Vol. 1, 2nd edn (eds A.H. Rose and
J.S. Harrison). Academic Press, London, p. 63.
18. Lodder, J. (1970) The Yeasts, a Taxonomic Study, 2nd edn, North-Holland, Amsterdam.
19. Lodder, J., and Kreger-van Rij (1952) The Yeasts, a Taxonomic Study, North-Holland,
Amsterdam.
20. Martini, A.V., and Kurtzman, С Р. (1988) Mycologia, 80, 241.
21. Martini, A.V., and Martini, A. (1993) Yeast
22. Martini, A.V, Martini, A., and Cardinali, G. (1993) Antonie van Leeuwenhoek, 63,145.
23. Maule, A.P., and Thomas, P.D. (1973) J. of the Institute of Brewing, 79,137
24. Meaden, P.G. (1990) J. of the Institute of Brewing, 96,195.
25. Molzahn, S W. (1993) Proceedings of the 25th Congress of the European Brewery
Convention, Oslo. IRL Press, Oxford, p. 203.
26. Nykanen, L., and Suomalainen, H. (1983) Aroma of Beer, Wine and Distilled Beverages,
Riedel, Dordrecht, New York and London.
27. Pecar, M., Tonissen, K., and Rogers, P. (1999) Journal of the American Society of Brewing
Chemists, 57, 94.
28. Pedersen, M.B. (1983) Proceedings of the 19th Congress of the European Brewery
Convention, London. IRL Press, Oxford, p. 457.
29. Pedersen, M.B. (1994) J. of the American Society of Brewing Chemists, 52, 23.
30. Pettipher, G.L., Mansel, R., McKinnon, C.H., and Cousins, CM (1980) Applied and
Environmental Microbiology, 39,423.
31. Pfenninger, H.B. (1977) J. of the Institute of Brewing, 83,109.
32. Phaff, H.J., and Starmer, W.T (1987) In The Yeasts, Vol. 1, 2nd edn (eds A.H. Rose and
J.S. Harrison). Academic Press, London, p. 123.
33. Praphailong, W., van Gestel, M., Beet, G.H., and Heard, G.M. (1997) Letters in Applied
Microbiology, 24,455.
34. Put, H.M.C, and de Jong, J. (1980) In Biology and Activities of Yeasts (eds F.A. Skinner,
S.M. Passmore and R.R. Davenport), Academic Press, London, p. 181.
35. Rainbow, С (1981) In Brewing Science, Vol. 2 (ed J.R.A. Pollock), Academic Press, London,
p. 491.
36. Simpson, W.J., Fernandez, J.L., and Hammond, J.R.M. (1992) J. of the Institute of Brewing,
98,33.
37. Simpson, W.J., and Hammond, J.R.M. (1989) J. of the Institute of Brewing, 95,347.
38. Speers, R.A., Tung, M.A., Durance, T.D., and Stewart, G.G. (1992) J. of the Institute of
Brewing, 98,525.
39. Sponholz, W.-R. (1993) In Wine Microbiology and Biotechnology (ed G.H. Fleet) Harwood,
Chur, p. 395.
40. Stratford, M. (1992) Advances in Microbial Physiology, 33,1.
41. Stelling-Dekker, N.M. (1931) Die sporogenen Hefen. Royal Academy of Sciences,
Amsterdam.
42. Thorn, J.A. (1992) Methods of Analysis, 8th ed., American Society of Brewing Chemists,
St Paul, MN, USA.
Глава 7. Дикие дрожжи в пивоварении и спиртовой промышленности 247
43. van der Walt, J. P. (1987) In The Yeasts, Vol. 1, 2nd edn (eds A.H. Rose and J.S. Harrison).
Academic Press, London, p. 95.
44. Van Oevelen, D., Spaepen, M, Timmermans, P., and Verachtert, H. (1977) J. of the Institute
of Brewing, 83,356.
45. Wiles, A.E. (1953) J. of the Institute of Brewing, 59,265.
46. Yamauchi, H., Yamamoto, H., Shibano, Y, Amaya, N., and Saeki, T. (1998) J. of the American
Society of Brewing Chemists, 56,58.
47. Young, T.W. (1987) In The Yeasts, Vol. 2,2nd edn (eds A.H. Rose and J.S. Harrison). Academic
Press, London, p. 131.
Глава 8
БЫСТРЫЕ (УСКОРЕННЫЕ) МЕТОДЫ
ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ
МИКРОБИОЛОГИЧЕСКИХ ЗАГРЯЗНЕНИЙ
Инге Рассел, Роберт Стюарт (Inge Russell, Robert Stewart)
8.1. Введение
Ускоренное обнаружение — термин неоднозначный, имеющий два различных, но
одинаково важных значения: ускоренное в том смысле, что для получения результа-
та требуется меньше времени, и ускоренное потому, что в тот же период времени
может быть выполнено большее количество анализов. Скорость и правильность ре-
зультатов важны здесь так же, как и их точность и специфичность. Ошибочные нега-
тивные результаты могут привести к отзыву продукта и, соответственно, к экономи-
ческим потерям и нанесению ущерба «брэнду», а ошибочные положительные — к не
обязательным и дорогостоящим задержкам в выпуске продукта и к повторным его
анализам. Для расчета экономической эффективности анализов необходимо произ-
вести расчет времени, которое требуется для работы специалиста-аналитика (вклю-
чая планирование, приготовление реактивов, подготовку к анализу и его выполне-
ние, а также последующую уборку), а также расчет затрат на оборудование. Чем
легче использовать тест-систему, тем лучше, особенно в связи с современной тен-
денцией, делегировать полномочия по проведению анализов непосредственно про-
изводителям.
Во всей индустрии напитков по мере сокращения времени на производственные
циклы и при стремлении к сокращению складских запасов с внедрением планирова-
ния выпуска по потребности (J77', just-in-time) лаборатории контроля качества стал-
киваются с проблемой (и настоятельными требованиями руководства) сокращения
сроков микробиологических анализов. Первостепенной задачей является сведение
к минимуму риска и затрат, связанных с возможной контаминацией сырья и продук-
тов на различных стадиях производства и риском отзыва продукта. Ускоренные мик-
робиологические методы нашли широкое применение в технологическом контроле,
осуществляемом по принципам НАССР (Hazard Analysis of Critical Control Points,
Анализ рисков и критические контрольные точки). Для пивоварения быстрое полу-
чение сведений о микробиологическом состоянии очень важно, так как полученная
на ранних этапах производства информация может существенно повысить произво-
дительность, ускорить принятие решений относительно данного продукта и сокра-
тить затраты.
В последнее время в пивоваренной промышленности мы стали свидетелями появ-
ления большого числа новых или модифицированных методов обнаружения микро-
биологического загрязнения. Причинами тому послужили:
• возросший уровень осведомленности потребителя относительно качества про-
дукта и пищевой безопасности;
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 249
• жесткий контроль со стороны государственных органов;
• возросшая конкуренция из-за сокращения потребления пива в западных стра-
нах и консолидация промышленности;
• растущий рынок непастеризованного пива в банках и бутылках;
• увеличение доли безалкогольного пива и пива с пониженным содержанием
спирта;
• рост числа ароматизированных подслащенных напитков типа «алкопоп»
(alcopop)]
• технологические новации.
Очень важно максимально уменьшить время, требуемое для обнаружения присут-
ствия загрязняющих микроорганизмов, так как это облегчает применение оптимизи-
рованных процедур устранения существующих и предотвращения возможных конта-
минантов. Неспособность удерживать содержание контаминантов на минимальном
уровне может привести к значительным экономическим потерям, включая отзыв про-
дукта, уменьшение сроков его хранения и нестабильности качества и вкуса готового
продукта. К счастью для пивоваров, использующих традиционные методы пивоваре-
ния, многие загрязняющие микроорганизмы (в частности, патогенные для людей),
в обычном пиве не выживают из-за присутствия этилового спирта (обычно в пределах
4-5,5%), низких концентраций ассимилируемых нутриентов, значений рН ниже тре-
буемых для размножения этих микроорганизмов, антимикробного действия компо-
нентов хмеля, относительно низкой температуры хранения и потребления, содержа-
ния двуокиси углерода и анаэробных условий. Вместе с тем низкоалкогольное пиво
и слабоалкогольные напитки типа «алкопоп» более подвержены контаминации из-за
более высоких содержания сахара и значений рН, что несет с собой повышение риска
контаминации потенциально патогенными организмами [101].
Диапазон микроорганизмов, выделяемых на пивоваренных предприятиях, по срав-
нению с огромным числом микроорганизмов, обнаруживаемых в медицине, в косме-
тической и пищевой промышленности, в растениеводстве и животноводстве, а также
при экологических исследованиях окружающей среды, относительно невелик. Пере-
чень родов грамположительных и грамотрицательных бактерий, а также «диких»
дрожжей, которые для пивоварения считаются контаминантами, приведен в табл. 8.1
[5, 17, 40, 82, 120, 141, 161] (подробнее о них см. главы 5-7). Следует, однако, заме-
тить, что физиологическое и генетическое разнообразие бактерий может привести
к появлению в будущем новых проблемных штаммов. Пристального внимания пиво-
варов заслуживает и недавняя вспышка активности новых штаммов, подобных ток-
синогенному штамму Escherichia coli% имевшая место в производстве новых пищевых
продуктов и напитков (включая безалкогольный сидр).
Для обнаружения может потребоваться (а может и нет) выращивание микроорга-
низмов. В тех случаях, когда выращивание микроорганизмов необходимо, может
возникнуть потребность в создании селективных сред, чтобы подавить рост куль-
турных микроорганизмов (например, пивных дрожжей), и на этом фоне выявить
присутствие нежелательных посторонних микроорганизмов (например, портящих
пиво). Кроме того, некоторые трудности могут возникать из-за того, что посторон-
ние микроорганизмы находятся в состоянии стресса, что может привести к длитель-
ному инкубационному периоду при их выделении.
250
Инге Рассел, Роберт Стюарт
Таблица 8.1. Основные роды бактерий и дрожжей, встречающиеся в практике пивоварения
Грамположительные бактерии Грамотрицательные бактерии Дикие дрожжи
Bacillus
Enterococcus
Lactobacillus
Leuconostoc
Micrococcus
Pediococcus
Streptococcus
Acetobacter
Acinetobacter
Alcaligenes
Citrobacter
Enterobacter
Flavobacterium
Gluconobacter
Hafnia
Klebsiella
Megasphaera
Obesumbacterium
Pectinatus
Proteus
Pseudomonas
Selenomonas
Zymomonas
Zymophilus
Brettanomyces
Candida
Cryptococcus
Debaryomyces
Dekkera
Endomyces
Filobasidium
Hansenula
Hanseniaspora
Kloeckera
Kluyveromyces
Pichia
Rhodotorula
Saccharomyces
Torulopsis
Zygosaccharomyces
В технологии пивоварения существуют две большие группы критических конт-
рольных точек (ККТ) для отбора микробиологических проб [98]. Первая группа
ККТ охватывает места, в которых присутствуют пивные дрожжи, и для этой группы
проб при выявлении контаминантов требуются селективные условия (исключаю-
щие рост данного пивного штамма дрожжей). Примерами таких ККТ являются
дрожжевая суспензия и резервуары для хранения дрожжей, бродильные чаны и ем-
кости для созревания пива. Ко второй группе ККТ относятся те участки производ-
ства, где вообще не должно быть никаких микроорганизмов, или они должны при-
сутствовать лишь в очень маленьких количествах. К ним относится сырье, готовый
продукт и важнейшие участки технологического оборудования (например, налив-
ные трубки аппаратов розлива), и для проб в этой группе ККТ применяют менее
селективные условия для выявления как можно большего разнообразия микроорга-
низмов.
Обнаружение микроорганизмов подразумевает установление их наличия или от-
сутствия. Традиционно в пивоварении микробиологические методики обнаружения
чаще всего начинаются с посева штрихом или с посева на селективную среду. Далее
следует инкубация среды при необходимых температуре и условиях (аэробных, ана-
эробных или с насыщением С02) в течение длительного, но определенного периода
времени. Классические методы обнаружения, хотя обычно и приводят к получению
необходимой информации, требуют слишком много времени, что затрудняет реаль-
ную помощь пивовару в принятии своевременных мер. Именно поэтому микробио-
логические процедуры выявления и идентификации стараются ускорить, хотя к тер-
мину «ускоренный» применительно к методам обнаружения микроорганизмов
следует относиться осторожно. Всегда, когда для обнаружения требуется некоторый
период роста, чтобы микроорганизмы достигли определенного титра, следует по-
мнить, что каждый микроорганизм имеет свою собственную скорость размножения.
Эти скорости могут сильно отличаться от тех, с которыми обычно сталкиваются
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 251
в медицине (например, Е. coli). Если ускоренное обнаружение Е. coli, у которых сред-
нее время генерации составляет 20-30 мин, может потребовать нескольких часов
инкубации, то для такого же ускоренного обнаружения бактерий типа Pediococcus
damnosus или Lactobacillus lindneri, у которых время удвоения составляет более 5 ч,
может потребоваться нескольких суток. Кроме того, как мы уже отмечали выше,
микроорганизмы в состоянии стресса до начала активного роста могут иметь значи-
тельную лаг-фазу [7].
Последние достижения молекулярной биологии и ДНК-биотехнологии позволи-
ли разработать множество методов для характеристики микроорганизмов на моле-
кулярном уровне и для изучения их генетической природы в самых разных услови-
ях. Эти методы уже применяются в клинической и судебной медицине, в пищевой
промышленности, в производстве напитков и в области охраны окружающей среды
(либо для обнаружения тех или иных конкретных микроорганизмов, либо для обна-
ружения и идентификации и/или дифференциации микроорганизмов на уровне
рода, вида или подвида).
В настоящей главе мы рассмотрим несколько методов обнаружения микроорга-
низмов, некоторые из которых могут служить и методами идентификации. Напри-
мер, такие специфические исследования, как тесты с моноклональными антителами
или олигонуклеотидами, не только обнаруживают присутствие определенных мик-
роорганизмов в дрожжевой суспензии, но и позволяют идентифицировать конкрет-
ные микроорганизмы (благодаря высокой специфичности выявления). Аналогично,
можно считать, что идентификация некоторого контаминанта в дрожжевой суспен-
зии означает обнаружение этого контаминанта. Этот тип методик является полной
противоположностью методам с использованием идентификационных наборов типа
API фирмы bioMerieux и других, требующих для проведения идентификации выде-
ления отдельных колоний.
8.2. Методы, основанные на измерении импеданса
(электропроводности и емкостного сопротивления)
Методы, основанные на измерении импеданса, отнюдь не новы. Одно из первых
сообщений об использовании импеданса было сделано на съезде Британской меди-
цинской ассоциации в г. Эдинбурге в 1898 г., где прозвучал доклад, позднее опубли-
кованный в Журнале экспериментальной медицины (The Journal of Experimental
Medicine) под названием «Изменения концентрации молекул и электрической про-
водимости культуральной среды в результате роста бактерий». На представленном
графике кривые электрической реакции отражали эффект разложения бактериями
белков крови и жиров. Эти результаты очень схожи с современными, получаемыми
с помощью систем, основанных на явлении импеданса; различие лишь в том, что
в настоящее время импедансные методики считаются быстрыми методами микроби-
ологического анализа (в конце XIX в. изменения электропроводности измеряли че-
рез более чем 30 сут). Несмотря на эту раннюю работу, до середины 1970-х гг. этот
метод не использовали, и когда о ней снова вспомнили, проведенные исследования
привели к созданию системы Мальтуса —Malthus System (фирма Malthus Diagnos-
tics, http://www.idgplc.com) и бактометра — Bactometer (фирма ЫоМепеих, http://
biomerieux.fr).
252
Инге Рассел, Роберт Стюарт
Методы измерения импеданса основаны на том наблюдении, что динамика мик-
робиологической активности по мере размножения микроорганизмов может быть
измерена путем слежения за изменениями химического и ионного состава культу-
ральной среды [1, 2, 7,49, 50, 52, 53, 66, 92, 98, 125,137,151,178].
Изменение электропроводности можно измерять прямо или косвенно. Косвенный
метод измерения импеданса применяется относительно недавно и основан на монито-
ринге продуцирования двуокиси углерода размножающимися микроорганизмами.
Двуокись углерода абсорбируется щелочным раствором, и измеряется уменьшение его
электропроводности [123], что позволяет сократить время и повысить чувствитель-
ность определения [29]. Кроме того, такая среда для получения результатов по измене-
нию электропроводности совсем не обязательно должна быть оптимизирована, и это
позволяет использовать среды, считавшиеся непригодными для измерения импеданса.
Косвенные импедансные методы применялись главным образом при исследовании со-
ков и напитков с низкими уровнями контаминации (при предварительной инкубации
проб можно достичь нижнего предела определения в 1 клетку на 10 мл) [30,183].
Для методов прямого определения импеданса обычно требуется специфическая
культуральная среда. Здесь важно помнить, что среда должна быть такой, чтобы она
обеспечивала размножение данного микроорганизма, и в то же время ее необходимо
оптимизировать для получения ответного электрического сигнала. Когда такое веще-
ство, как культуральная среда, подвергается действию переменного электрического
тока, на импеданс (сопротивление прохождению тока через среду) влияет электро-
проводность (способность проводить ток) и емкостное сопротивление (способность
сохранять электрический заряд). Для определения общего импеданса (который зави-
сит как от электропроводности, так и от емкостного сопротивления) пару электродов
погружают в проводящую культуральную среду. Электропроводность зависит от из-
менения общего ионного состава среды, а емкостное сопротивление — от изменений
в непосредственной близости от электродов [151].
В процессе своего метаболизма микроорганизмы создают в среде новые продукты
распада, и в результате обычно незаряженные или слабо заряженные субстраты
трансформируются в сильно заряженные продукты распада. Например, белки рас-
щепляются до аминокислот, углеводы — до лактата, а жиры — до ацетата, и все они
увеличивают электропроводность данного раствора.
Крупные молекулы (такие, как углеводы) не несут электрического заряда, что уве-
личивает импеданс среды, одновременно уменьшая и электропроводность, и емкост-
ное сопротивление. Так как эти незаряженные макромолекулы расщепляются мик-
роорганизмами на меньшие субъединицы (такие, как заряженные бикарбонат-ионы),
емкостное сопротивление и электропроводность начинают возрастать, а импеданс —
уменьшаться. Таким образом, размножение микроорганизмов в культуральной среде
может отслеживаться либо по уменьшению общего импеданса, либо по возрастанию
и электропроводности, и емкостного сопротивления.
Рост некоторых организмов, в частности дрожжей, не приводит к изменению элек-
тропроводности, так как они не производят сильно ионизированные метаболиты,
а только неионизированные метаболиты, такие как этанол. К тому же дрожжи могут
адсорбировать ионы из среды, что приводит к падению остаточной электропровод-
ности среды.
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 253
При мониторинге некоторой культуры микроорганизмов с помощью соответству-
ющей среды график зависимости импеданса или электропроводности от времени
имеет вид кривой, сходной, но не полностью совпадающей с кривой роста этой куль-
туры. Для использования методов, основанных на измерении импеданса, необходи-
мо увеличение числа микроорганизмов до некоторого порогового значения (его до-
стижение может быть точно определено благодаря компьютерным технологиям, при
использовании которых пороговые значения или время обнаружения обычно соот-
ветствует концентрации микроорганизмов в 105-106 КОЕ/мл). Так как время обна-
ружения рассчитывают по достижению пороговых значений, на время обнаружения
здоровых клеток, внесенных в соответствующую среду, существенно влияют два
фактора: количество изначально внесенных клеток и естественная скорость роста
(время генерации) той или иной культуры. Чем больше число изначально внесен-
ных жизнеспособных микроорганизмов и чем меньше время генерации (необходи-
мое для удвоения числа микроорганизмов), тем меньше время обнаружения.
Время генерации зависит от температуры, и поэтому путем изменения температу-
ры можно влиять на время обнаружения. Так как оба составляющих импеданса
(электропроводность и емкостное сопротивление) зависят от температуры, необхо-
димо, чтобы температура поддерживалась постоянной — иначе кривая импеданса
будет отражать скорее изменения в температуре, чем результат метаболизма микро-
организмов.
Гипотетический рост и изменения электропроводности среды для двух микроор-
ганизмов, внесенных в одинаковых начальных концентрациях, но обладающих раз-
личными скоростями роста, приведены на рис. 8.1. В 1998 г. измерение импеданса
позволило сделать вывод, что данный метод является быстрым, чувствительным,
а присутствие Е. coli в пищевых продуктах может быть определено в течение 4-24 ч
с пределом обнаружения в 1 КОЕ/мл [84].
Методы измерения импеданса могут применяться и в лабораториях пивоварен-
ных предприятий, заменяя стандартные тесты по обнаружению бактериального за-
грязнения. Пробу пива фильтруют, после чего фильтр помещают в пивное сусло, на-
ходящееся в бактометре [48]. Результаты стандартного теста и измерения импеданса
хорошо коррелируют между собой, но результаты последнего получают в течение
2-4 суток (в отличие от 2-3 недель при использовании традиционных тестов). Еще
одно возможное применение методов измерения импеданса в пивоварении — это
определение бактериальной контаминации засевных дрожжей [92]. Селективность
для размножения бактерий достигается путем внесения образцов засевных дрожжей
в WUV-бульон, содержащий циклогексимид, предотвращающий размножение дрож-
жей. С использованием прибора Мальтуса размножение бактерий в данном случае
обнаруживается менее чем через 18 ч, причем количество 106-107 клеток/мл обнару-
живается немедленно, а для определения концентрации 10 клеток/мл требуется
18 ч. На практике такая чувствительность позволяет определять в течение 18 ч
100 бактерий на миллион дрожжевых клеток, что выгодно отличается от традицион-
ных методов и приводит к 50%-ной экономии времени до получения результатов.
Методы, основанные на измерении импеданса, имеют ряд преимуществ, в частности:
1) по сравнению со стандартным чашечным методом даже для самых привередли-
вых микроорганизмов время обнаружения сокращается на дни;
254
Инге Рассел, Роберт Стюарт
8"
8 7-
н
Ф
5
о
§ 6-
S
т
z"
ч
о> 5 -
3
2
—i—
4
—V™
6
AN1
AGi
1—
8
1—
10
—i—
12
—i—
14
V
AN2
AG2
"100 i
о
<
и
о
X
§
00
-so §.
с
о
1
ф
(нение:
—i г «
16 18 i
Время, ч
Рис.8.1. Гипотетический рост и электропроводность двух микроорганизмов, внесенных
в одинаковых начальных концентрациях, но с различной скоростью роста
2) селективность относительно размножения микроорганизмов в зависимости от
используемой культуральной среды;
3) наличие «дружественной пользователю» автоматизации, которая позволяет
увеличить число образцов.
К недостаткам этой методики можно отнести:
1) дороговизну приборов и инструментария;
2) не все типы сред годятся для электрометрических анализов из-за их собствен-
ной ионной проводимости;
3) пороговые уровни обнаружения обычно значительно выше, чем принятые в пи-
воварении стандарты при подсчете колоний на чашках (которые могут состав-
лять около 100 КОЕ/мл в зависимости от того, откуда взята проба).
8.3. Микрокалориметрия
Все химические, физические и биологические процессы сопровождаются выделе-
нием тепла. Микрокалориметрия — это комплекс методов, применяющихся для изме-
рения малейших тепловых потоков (вплоть до нановатт), для которых не требуется ни
разрушения образца, ни проникновения в него. Такие методы широко применяются
в медицине, биологии и исследованиях пищевых продуктов — образующееся при раз-
личных процессах тепло создает перепад температур между образцом в калориметре
и его окружением.
Калориметры выявляют изменения в количестве тепла путем измерения термо-
электрического эффекта, возникающего в термоэлементах в результате теплопере-
носа. Рост микроорганизмов в культуральной среде порождает слабое, но измеряе-
мое количество теплоты (главным образом вследствие биохимических реакций
катаболизма), и количество выделенного тепла является индикатором числа при-
сутствующих микроорганизмов.
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 255
Эти тепловые микрофлуктуации (обычно измеряемые в микроваттах) через неко-
торое время могут быть измерены и зарегистрированы с помощью микрокалоримет-
ров, сконструированных специально для микробиологических измерений. Теплота,
воздействуя на термопары, продуцирует электрический ток, который пропорциона-
лен тепловому потоку. Разность потенциалов, которая образуется на термопарах
(в мВ), усиливается и считывается регистрирующим устройством (информация вы-
дается в виде термограммы). Начальная точка термограммы обычно приходится на
экспоненциальный рост культуры микроорганизмов, и в дальнейшем она возрастает
по мере их размножения. Как только экспоненциальный рост сменяется стационар-
ной фазой, метаболическая активность хмикроорганизмов снижается, и выделение
тепла уменьшается [137].
Микрокалориметры способны выявлять активно растущие бактериальные клет-
ки в количествах порядка 103/мл, что позволяет широко использовать в клиниче-
ской практике. Что касается пищевой промышленности, исследований в этой обла-
сти выполнено немного, и касались они в основном анализов сырого молока
и говяжьего фарша [8, 12, 59, 70, 100, 145]. Широкое внедрение практики микрока-
лориметрии в пищевой промышленности сдерживалось по разным причинам, в том
числе из-за влияния на количество теплоты, выделяющейся при росте микроорга-
низмов, многочисленных посторонних факторов. Хотя имеются сведения о приме-
нении микрокалориметрии и в пивоварении [72], серьезной проверке этот метод не
подвергался и большого распространения на пивоваренных предприятиях не полу-
чил.
В 1977 г. появилось сообщение об использовании микрокалориметрии для опре-
деления в пиве протеазной активности [136]. Микрокалориметр в данном случае
применялся для получения данных о ферментативных процессах в созревающем
пиве, причем оказалось, что данный способ превосходит традиционные анализы про-
теазной активности. Калориметрические методы были применены также для изуче-
ния кинетики АТФ, способности этилового спирта подавлять брожение дрожжей
и для анализа скорости размножения Saccharomyces cerevisiae.
8.4. Турбидиметрия
Рост микроорганизмов в прозрачном жидком бульоне приводит к увеличению
мутности бульона и его абсорбции. Эти изменения можно обнаружить и измерить
с помощью спектрофотометра и турбидиметра. Если начальное количество микро-
организмов мало и бульон достаточно прозрачный, то полученная кривая роста ока-
жется подобна той, которую получают при измерении импеданса [51]. С использова-
нием автоматического турбидиметра Bioscreen Analysis System ("фирма Labsystems,
г. Хельсинки) изучают размножение микроорганизмов в самых разных пищевых
продуктах, включая молоко [89,109, ПО] и пиво [65].
Применение автоматической турбидиметрии для обнаружения контаминантов
(Lactobacillus casei, Enterobacter agglomerans, Pediococcus damnosus, Pectinatus cerevisii-
philus и Saccharomyces diastaticus) в засевных дрожжах описано в [65]. Как и ожида-
лось, для микроорганизмов, по природе своей характеризующихся разными скорос-
тями роста, время обнаружения разных видов существенно отличалось. В среднем
при использовании автоматического турбидиметра время обнаружения было на сут-
256
Инге Рассел, Роберт Стюарт
ки короче, чем время, необходимое для зрительного обнаружения мутности, а предел
обнаружения составил примерно 10е клеток/мл. Экономия времени по сравнению
со стандартным выращиванием на чашках в зависимости от вида может составить
от 2 до 8 раз или от 2 до 4 сут.
Автоматические приборы (типа «Bioscreen С») используют формат микротитро-
вания. Мониторинг нарастания мутности (то есть роста микроорганизмов) одновре-
менно производится в 200 ячейках, и кривые роста (график зависимости мутности
от времени) отображаются на мониторе компьютера. Кроме того, такой прибор мо-
жет выполнять многоцелевые научные расчеты. Об интенсивности роста микроорга-
низмов судят по времени, необходимом для достижения заранее определенного зна-
чения мутности. Образцы вносят в пустые стерильные ячейки, и в автоматическом
режиме вычерчиваются 200 кривых роста (по количеству ячеек). Экономия труда,
времени и высокая эффективность анализов достигается стерильными условиями
внесения, встряхиванием, инкубацией большого числа проб и мониторингом роста
микроорганизмов по оптической плотности в аэробных и анаэробных условиях,
а также использованием компьютерных методов обработки данных.
8.5. Проточная цитометрия
Проточная цитометрия используется для измерения определенных физических
и химических характеристик клеток и может рассматриваться как автоматизирован-
ный вариант специализированной флуоресцентной микроскопии. Преимущество
проточной цитометрии состоит в том, что для измерения числа микроорганизмов
в жидких средах она объединяет в себе микроскопирование и биохимический ана-
лиз. Клетки вводятся в центр быстро перемещающегося потока жидкости и вынуж-
дены проникать через отверстие размером 50-100 мкм с постоянной скоростью
(обычно 1-10 м/с). Измерения проводятся на скорости \0A-i0(i клеток/мин при про-
хождении клеток через точку, освещенную источником света (лазером). По мере
прохождения микроорганизмов через световой пучок клетки отражают свет, и ин-
тенсивность светопоглощения и его рассеивания под различными углами дает ин-
формацию о размере клеток, их форме, жизнеспособности, плотности и структуре
поверхности [97, 118, 147,172].
Типичный проточный цитометр состоит из светового источника, кюветного узла,
электроники и компьютера для преобразования электрических сигналов в регистри-
руемые данные. В качестве светового источника обычно используется лазер. Чаще
всего применяют аргоно-ионные, гелий-неоновые, криптоновые лазеры и лазеры на
красителе. Выбор используемого флюоресцирующего вещества зависит как от по-
ставленной задачи, так и от используемой длины волны возбуждения. Излучаемый
и отраженный свет собирается двумя линзами (одна находится непосредственно пе-
ред источником света, а другая стоит под прямым углом к нему), и после прохожде-
ния его через специальную оптическую схему, делитель световых пучков и фильтры
можно измерить специфические полосы флюоресценции. Такой метод позволяет
оценить как физические свойства клетки (размер, форму и внутреннее строение),
так и состояние любых клеточных компонентов или функций, которые могут быть
выявлены с помощью флюоресцирующего соединения. Проточный цитометр может
сортировать или физически выделять из гетерогенной популяции клетки, представ-
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 257
ляющие интерес для исследователя (разработаны приборы, способные выделять че-
тыре разные популяции) [80].
Одним из наиболее важных преимуществ цитометра является его высокая чув-
ствительность, а основными недостатками — медленная обработка больших объемов
данных и зависимость результатов анализа от наличия в пробе мелких посторонних
примесей. К недостаткам можно отнести также высокую стоимость многоцелевых
цитометров и требующийся высокий уровень подготовки оператора для работы на
нем. До настоящего времени одним из основных видов применения проточных цито-
метров в пищевой промышленности и производстве напитков был поиск патоген-
ных видов Listeria и Е. coli. Сконструированный специально для пищевой промыш-
ленности проточный цитометр использовали для быстрого обнаружения в молочных
продуктах дрожжевых и плесневых контаминантов, а применение проточного цито-
метра в сочетании со специфическими флуоресцентными маркерами является од-
ним из наиболее быстрых способов обнаружения роста бактерий в молоке [63, 88].
Продуманное приборное оснащение позволяет использовать для отбора проб в про-
цессе переработки пищевых продуктов режим реального времени. В проточной ци-
тометрии помимо иммунофлуоресцентных зондов для изучения смешанных попу-
ляций микроорганизмов можно использовать и олигонуклеотидные зонды.
Существуют различные типы флуоресцентных зондов, применяющихся для изу-
чения биологии дрожжевых клеток. К ним относятся соединения, позволяющие оп-
ределить состояние клеточной мембраны, ферментативную активность, рН клетки
и многие* другие важные физиологические свойства. Использование этих зондов
в проточной цитометрии позволяет детально изучить дрожжевую популяцию в про-
цессе брожения, проводить ускоренный мониторинг физиологического состояния
дрожжей и отбирать варианты внутри популяции сортировкой клеток по уровню их
флуоресценции (FACS, Fluorescent-Activated Cell Sorting). Использование флуорес-
центных красителей, позволяющих определить жизнеспособность и физиологиче-
скую активность дрожжевых клеток, в сочетании с проточным цитометром позволя-
ет провести объективный количественный анализ миллионов дрожжевых клеток
в течение нескольких минут.
Примеры использования проточной цитометрии в пивоварении описаны в работах
[3,18,39,75,77,86,102]. Чтобы пометить клетки определенных видов микроорганиз-
мов для облегчения их идентификации и подсчета может быть использовано имму-
нофлуоресцентное окрашивание. На первых этапах этот способ позволял за один раз
подсчитать клетки только одного вида микроорганизмов, что ограничивало полез-
ность данного метода для пивоварения. Современные достижения в области флуо-
ресцирующих красителей и коньюгатов «краситель-антитело» наряду с успехами в
области методов распознавания и спектрального разделения флуоресцирующего све-
та позволяют за одну процедуру окрасить и сосчитать несколько видов микроорга-
низмов [78]. При работе с видоспецифическими антителами методом проточной ци-
тометрии для определения и идентификации нескольких видов контаминантных
микроорганизмов в пиве используют одновременно до четырех различных флуорес-
центных красителей, каждый из которых связан с отдельным антителом [79]. Длина
волны возбуждения (одна для всех использовавшихся красителей) подбирается так,
что каждый вид микроорганизмов светился своим цветом. В смешанной культуре
258
Инге Рассел, Роберт Стюарт
ясно различаются и подсчитываются 4 вида (Saccharomyces cerevisiae, Schizosac-
charomyces pombe, Lactobacillus brevis и Pediococcus damnosus). Антитела к индивиду-
альным видам микроорганизмов получают от лабораторных животных и прямым или
косвенным образом помечают флуоресцентными красителями, что позволяет при их
связи с клетками исследуемых микроорганизмов обнаружить данные клетки и сосчи-
тать их методом проточного цитометрирования. Так как красители непосредственно
связаны с видоспецифическими антителами, это позволяет одновременно определять
и идентифицировать несколько видов [80]. Проточный цитометрический анализ при-
менялся также на пивоваренных предприятиях при разработке метода обнаружения
диких дрожжей с использованием флуоресцентных красителей [85].
Разработаны также методы применения проточной цитометрии для облегчения
определения выживаемости клеток дрожжей и проверки их на жизнеспособность
[16], а также для оценки физиологического состояния дрожжей и проведения селек-
ции штаммов [3,11,18,32]. Поведение промышленных штаммов дрожжей в услови-
ях, которые имитируют коммерческое применение дрожжей, и методы проточной
цитометрии для отбора гибридов в программах по выведению новых штаммов опи-
саны в [11, 32].
Использование микроскопических бусин с парамагнитной сердцевиной, покрытых
видоспецифическими антителами, для обнаружения малых количеств контаминан-
тов или других инородных частиц описано в [45]. При смешивании бусин с пробой
антитела захватывают клетки микроорганизма соответствующего вида, когда они
входят в контакт с бусинами. Затем бусины с помощью магнита удаляют из пробы,
и выделенные таким образом микроорганизмы перед проточным цитометрировани-
ем метят красителем, связанным с антителами. Теоретически также можно пометить
таким красителем фильтровальные мембраны для дальнейшего флуоресцентного
микроскопирования, но при этом следует проявлять осторожность, так как могут воз-
никнуть помехи, вызванные адсорбцией антител поверхностью мембраны.
По мере совершенствования приборов и методик ускоренного обнаружения
и идентификации микроорганизмов технология поточной цитометрии в пищевой
промышленности и индустрии напитков будет приобретать все большее значение.
8.6. АТФ-биолюминесценция
АТФ-биолюминесценция основана на реакции, которая в природе наблюдается
у североамериканского светлячка Photinus pyralis. Биохимия этой реакции была
впервые описана в 1940-х годах [111]. Аденозин-5'-трифосфат (АТФ) является вы-
сокоэнергетической молекулой, присутствующей во всех живых организмах, но
в мертвых клетках количество этих молекул резко сокращается. Метод обнаружения
основан на определении присутствия в пробах АТФ по свету, образующемуся под
действием фермента (то есть по явлению биолюминесценции). АТФ-биолюминес-
ценция сокращает время обнаружения живых микроорганизмов в пробе с несколь-
ких дней до нескольких минут.
В 1960-е гг. техника АТФ-биолюмииесцеиции использовалась учеными NASA
в исследованиях по обнаружению жизни на других планетах, а также в клинической
практике [24]. Впоследствии этот метод был упрощен, и в 1970-е гг. его применили
для обнаружения присутствия микроорганизмов в пищевых продуктах, но оказалось,
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 259
что высокое содержание АТФ из немикробиологических источников существенно
уменьшает чувствительность данного метода. Тем не менее к началу 1990-х гг. основ-
ные трудности его применения были преодолены, и метод начал широко применять-
ся в пищевой промышленности и производстве напитков.
В пивоварении АТФ-биолюминесценция была признана удобной и практически
применимой методикой обнаружения дрожжей и бактерий в непастеризованном пиве
или на некоторых этапах его производства [4, 7, 27, 36, 42, 67, 81, 92, 95, 113, 152, 156,
163, 168, 169]. Первоначальные недостатки этой методики заключались в ее низкой
специфичности, недостаточной стабильности и высокой стоимости реагента, а также
в дороговизне основного оборудования. Довести ее до коммерческого успеха в пище-
вой промышленности и производстве напитков позволили разработка реагентов, выра-
батывающих относительно стабильные световые сигналы, уменьшение стоимости лю-
минометров, а также обучение персонала и соответствующая техническая поддержка.
Были разработаны также более эффективные реактивы для экстракции АТФ из
микроорганизмов, присутствующих в пивоваренном производстве [83,155], и более
чувствительные люминометры. В начале 1990-х гг. были известны более чем 90 лю-
минометров более чем 60 фирм [158], а сравнительная оценка некоторых из наибо-
лее широко используемых реагентов и люминометров приведена в [61, 62]. Попу-
лярность этого метода возросла с появлением тест-наборов типа «все в одном» от
таких фирм, как Biotrace (www.biotrace.com) и Lumac (www.celsis.com), так как стало
возможно проводить проверки санитарно-гигиенического состояния с помощью ма-
логабаритных портативных аппаратов.
АТФ обнаруживается во всех живых клетках — они постоянно ее продуцируют
и утилизируют. Если клетка мертва, АТФ быстро расщепляется внутриклеточными
ферментами, а новая АТФ уже не синтезируется. Хотя содержание АТФ в живых
клетках может в определенной степени варьировать в зависимости от окружающих
условий, количество АТФ в нормальных клетках является постоянным, и клеточная
АТФ может использоваться в качестве хорошего индикатора биомассы [159].
Измерить содержание АТФ можно с помощью двухступенчатой люциферин-лю-
циферазной ферментной реакции, которая лежит в основе биолюминесценции свет-
лячков:
1. Люциферин + Люцифераза + АТФ + Mg2+ ->
(Люциферин - Люцифераза - АМФ) - Пирофосфат
2. (Люциферин - Люцифераза - АМФ) + 02 ->
Оксилюциферин + Люцифераза + С02 + АМФ + Свет
Количество выделенного света коррелирует с количеством АТФ в образце. Мак-
симальное продуцирование света длится 0,3 с, и на каждую израсходованную моле-
кулу АТФ испускается около одного фотона. В широком диапазоне концентраций
АТФ между ее концентрацией и световым излучением существует линейная зависи-
мость. АТФ-биолюминесцентные системы в образце объемом 100 мкл имеют чув-
ствительность в 1 пкг (10",2г) АТФ, что соответствует приблизительному количе-
ству АТФ в 1000 бактериальных клеток [159].
При правильно поставленном анализе большинство обнаруженной АТФ (не обя-
зательно все количество) непосредственно свидетельствует о присутствии в пробе
260
Инге Рассел, Роберт Стюарт
живых организмов. Существуют коммерческие наборы реактивов, с помощью кото-
рых можно обнаружить даже 100 дрожжевых клеток на пробу без предварительной
инкубации. Для этого люминометры должны иметь предел обнаружения до 1-2
дрожжевых клеток на пробу, и таким образом одна дрожжевая клетка в пробе с пери-
одом удвоения в 2-3 ч может быть обнаружена через 20 ч инкубации. В результате
для обнаружения живых микроорганизмов требуется значительно меньше времени,
чем для стандартного чашечного метода. По себестоимости эта техника сравнима со
стандартным чашечным методом (если включать в затраты заработную плату и ис-
пользование приспособлений типа анаэробных системных пакетов для скрининга
микроаэрофильных или анаэробных микроорганизмов).
При использовании этой методики для мониторинга санитарно-гигиенического
состояния проверяемую поверхность протирают тампоном, попавшую на него АТФ
экстрагируют и определяют добавлением системы «люцифераза/люциферин». Для
этого пригодны и более крупные лабораторные люминометры, и небольшие порта-
тивные, а также тест-наборы, позволяющие проводить анализ в полевых условиях
с использованием пробирок со стерильными тампонами и всеми необходимыми ре-
активами. Количество излучаемого света является показателем степени загрязненно-
сти поверхности — чем больше света испускается, тем поверхность грязнее. Так как
результаты могут быть получены в течение нескольких минут, то если анализ пока-
зывает, что поверхность грязная, меры могут быть предприняты немедленно (этот
тест можно считать идеальным для применения в рамках методики НАССР). По-
скольку АТФ присутствует во всех клетках, то обнаруживаются не только микроор-
ганизмы, но и любое загрязнение в виде пищевых остатков. К недостаткам подобной
системы гигиенического мониторинга можно отнести то, что световая реакция может
быть приглушена секвестрантами (отшелушивающими веществами), ПАВами (по-
верхностно-активными веществами), солями и ионами металлов. Кроме того, на ре-
зультаты могут влиять рН и температура. Многие из этих проблем устраняются при
использовании разведения. Очень важное значение имеет состав коммерческих пре-
паратов для экстракции — обычно они используются вместе с буферным раствором,
содержащим необходимые для реакции двухвалентные ионы, причем в состав неко-
торых из них входят нейтрализаторы дезинфектантов, например, Tween 80 или леци-
тин [61].
Так как все живые клетки содержат АТФ, а люциферазно/люцифериновая реак-
ция не различает АТФ из соматических клеток, свободную АТФ или микробную
АТФ, то для обнаружения только микробной АТФ необходимо прежде удалить не-
микробную. Для удаления немикробной АТФ клетки лизируют с помощью детер-
гентов. Этот метод использует иную чувствительность к лизису прокариотических
клеток под действием детергентов. При необходимости анализа большого числа проб
использование автоматических люминометров повышает эффективность данного
метода.
Многие пивоваренные предприятия используют АТФ-биолюминесценцию как
метод контроля качества мойки поверхностей технологического оборудования. Кро-
ме того, биолюмииесцентные методы удобны для оценки качества промывной воды.
Эта методика находит все большее применение в определении санитарно-гигиени-
ческих условий приготовления и раздачи блюд в предприятиях общественного пи-
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 261^
тания. Разработка таких систем, как Autotrack [19, 139], позволило проводить не-
прерывный мониторинг АТФ в процессе безразборной мойки (CIP). АТФ-люминесцент-
ный анализ может использоваться для выявления либо микробной, либо немикроб-
ной АТФ, обеспечивая получение скорее качественных, чем количественных
результатов. Это объясняется тем, что исследуемые неизвестные пробы могут содер-
жать разные виды микроорганизмов, которые сильно отличаются друг от друга по
содержанию АТФ (например, дрожжи или бактерии). Сопоставление количествен-
ных результатов с полученными при использовании чашечного метода возможно
только при проведении испытаний на чистых культурах микроорганизмов в услови-
ях, способствующих их размножению. Различные микроорганизмы в разных фазах
своего роста содержат разные количества АТФ в расчете на одну клетку — напри-
мер, типичная дрожжевая клетка содержит в 100 раз больше АТФ, чем бактериаль-
ная [81]. Бактерии могут существенно различаться размерами (например, изолят
Lactobacillus plantarum по сравнению с Pediococcus damnosus) и, соответственно, по
содержанию АТФ на одну клетку. Клетки в состоянии стресса и в стационарной фазе
содержат меньшее количество АТФ, что, соответственно, понижает чувствитель-
ность определения.
При проведении санитарно-гигиенической проверки поверхностей или анализа
воды не все организмы, из которых экстрагируется АТФ, будут образовывать коло-
нии при посеве на чашки с твердой средой. Следовательно, использование биолюми-
несценции для текущего контроля наличия микробной или немикробной АТФ
в процессепроизводства пива полезно как в виде качественного, так и в виде «полу-
количественного» анализа.
Вопрос чувствительности этого метода и особенно возможность использования
его в качестве индикатора эффективности мойки был изучен в [ 139]. Так как тради-
ционные микробиологические методы позволяют обнаружить 1 микроорганизм в 1 л
пробы, а чувствительность биолюминесцентного метода составляет приблизительно
5 дрожжевых клеток или 30 клеток Lactobacillus brevis, то стоит ли достигнутый вы-
игрыш во времени снижения чувствительности при сертификации устройств CIP-
мойки? Приведенные данные показывают, что АТФ-биолюминесценция пригодна
для контроля качества выполнения операций мойки в пивоварении. При санитарно-
гигиеническом контроле метод АТФ позволяет оценить чистоту рабочих поверхно-
стей в режиме реального времени, что дает возможность провести повторную мойку.
Непосредственное использование прямого определения АТФ для оценки способно-
сти проверяемых поверхностей сохранять чистоту описано в [164,165], причем с по-
мощью такого анализа было изучено изменение способности материалов прокладок
к сохранению чистоты при их старении.
Анализ готового пива лимитируется нижней границей чувствительности метода
и доступностью имеющихся тест-наборов типа Bev-trace™ фирмы Biotrace. Такие на-
боры, использование которых связано с обогащением и этапом размножения микро-
организмов, специально сконструированы для быстрого обнаружения наличия или
отсутствия аэробных или анаэробных контаминантов в напитках, подвергнутых сте-
рилизации или пастеризации.
В 1995 г. появилась новая «система ускоренного определения микроорганизмов»
(RMDS, Rapid Micro Detection System) фирмы Millipore (www.millipore.com), которая
262
Инге Рассел, Роберт Стюарт
применяется в пивоварении при контроле качества жидких сред. Эта система осна-
щена автоматизированным или ручным устройством диспергирования экстрагируе-
мых веществ и ферментов, CCD-камерой высокого разрешения (изображение в ре-
жиме реального времени) для быстрого сканирования, волоконно-оптическим
усилителем изображения и цветным принтером для получения на бумаге изображе-
ний высокого качества с возможностью компьютерного анализа данных. Этот аппа-
рат, использующий АТФ-биолюминесценцию в люциферин/люциферазной реак-
ции, позволяет за менее чем 10 мин обнаруживать и количественно оценивать от
1 до 200 жизнеспособных дрожжевых клеток, диспергированных на специальной
47-миллиметровой гидрофобной сетчатой мембране. Испытания аппарата показали
приемлемую корреляцию результатов, полученных с помощью RMDS и традицион-
ным чашечным способом.
Система RMDS высокочувствительна, обнаруживает АТФ независимо от ее про-
исхождения и сконструирована для промышленного применения (то есть для ана-
лиза больших количеств образцов за короткий период времени с высокой оператив-
ной стабильностью). RMDS способна обнаруживать молочнокислые бактерии,
образовывающие колонии на чашке в течение 24 ч, то есть 2-4 раза быстрее, чем тра-
диционные методы.
Хотя система Microstar RMDS дает возможность обнаруживать и определять ко-
личество задержанных мембранным фильтром микроорганизмов с помощью метода
АТФ-биолюминесценци, она не дает информации о том, что это за контаминанты, то
есть не делает различия между колониями микроорганизмов и другими мельчайши-
ми частицами, из-за чего возможно неверное толкование результатов [192]. Чтобы
уменьшить риск ошибки, фирмой Nihon Millipore Ltd. в 2000 г. эта технология была
усовершенствована путем объединения методов RMDS и флуоресцентной микроско-
пии [167]. Благодаря использованию флуоресцентного микроскопа с автоматиче-
ским предметным столиком удается различать морфологию неизвестных контами-
нантов, обнаруживаемых в пищевых продуктах методом RMDS. Для наблюдения за
контаминантами использовали флуоресцентный микроскоп (MicroScanner). Коор-
динаты полученного с помощью RMDS изображения переводятся в координаты
предметного столика микроскопа, после чего наблюдаются колонии из 20-30 молоч-
нокислых бактерий или единичные дрожжевые клетки. Такая система, способная
обнаруживать контаминанты после розлива в бутылки или банки в течение 24 ч,
в настоящее время используется на нескольких пивзаводах в г. Саппоро (Япония).
Появление компьютерных технологий и возросшие возможности компьютериза-
ции лабораторного оборудования будут и в дальнейшем способствовать развитию
систем типа RMDS, делая их более доступными по цене, степени автоматизации
и удобствам для пользователя.
8.7. Микроскопический метод обнаружения микроколоний
Микроскопический метод применяется для обнаружения размножающихся кле-
ток микроорганизмов, которые еще не образовали КОЕ, различимые невооружен-
ным глазом. Этот ускоренный метод по существу является модификацией метода
мембранной фильтрации пробы с последующей инкубацией мембраны на питатель-
ной среде. Чтобы не ждать несколько дней, пока образуются КОЕ, различимые нево-
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 263
оружейным глазом, микроколонии селективно окрашивают, что позволяет наблю-
дать их в микроскоп уже через 24 ч. На ранних этапах развития этого метода для
быстрого обнаружения дрожжей использовали такие красители, как пунцовый 5,
янус зеленый, метиленовый синий и сафранин [6,114,138, 143, 191]. После окраши-
вания микроколоний мембрану сушат, нагревают и просветляют (обычно с помо-
щью иммерсионного масла), а затем исследуют под пучком света в микроскопе. При
ином методе подсчета микроколоний с использованием красителей селективно ок-
рашивают как сами мембранные фильтры, так и клетки [173]. В этом случае фильт-
ровальные мембраны с микроколониями окрашивают бромкрезоловым зеленым
и метиловым красным. Данный метод первоначально разрабатывался для облегче-
ния выявления микроколоний бактерий в пробах воды. Колонии бактерий окраши-
вались темно-синим цветом, а мембранный фильтр — розовым. Как и в случае непо-
средственного окрашивания дрожжевых клеток, здесь существенный недостаток
метода заключается в том, что обработка мембраны после окрашивания становилась
летальной для микроколоний, в связи с чем исключается возможность реинкубации
фильтровальной мембраны для дальнейших исследований.
Применение флуоресцентного микроскопирования в отраженном свете, позво-
ляющее использовать флуоресцентные красители, добавляя их прямо в питатель-
ную среду, значительно усовершенствовало технику подсчета микроколоний. Такие
красители, будучи захваченными дрожжевыми клетками или другими микроорганиз-
мами, дают возможность обнаруживать живые клетки по их флуоресценции непо-
средственно (без последующей обработки мембраны). Несмотря на начальные труд-
ности, связанные с подбором красителей (многие флуоресцентные красители либо не
захватывались клетками, либо подавляли их рост), в дальнейшем оказалось, что оп-
ределенные оптические отбеливатели (то есть флуоресцентные отбеливающие веще-
ства, входящие в состав большинства стиральных порошков и мыла) легко поглоща-
ются микроорганизмами [126]. В работе [66] описано применение оптических
отбеливателей (производных 4,4/-диамино-стильбен-дисульфоновой кислоты) для
разработки метода подсчета микроколоний дрожжей и плесеней. С помощью опти-
ческого отбеливателя Uvitex 2B (фирма Ciba-Geigy) удалось не только обнаружить
флуоресцирующие микроорганизмы на фоне черной фильтровальной мембраны, но
и дифференцировать живые и мертвые клетки. Мертвая клетка флуоресцирует рав-
номерно, а живые — преимущественно в местах почкообразования, где концентрация
хитина максимальна. Такие оптические отбеливатели не подавляют размножения
клеток ни дрожжей, ни плесеней, а фильтровальные мембраны можно подвергать по-
следующей реинкубации, что дает возможность исследования проб в течение не-
скольких дней и/или дальнейшей идентификации микроорганизмов (для окрашива-
ния бактерий подобные оптические отбеливатели не пригодны).
Микроскопический метод подсчета микроколоний был в дальнейшем усовершен-
ствован. Использование оптического отбеливателя Tinopal CBS-X (фирма Ciba-
Geigy), производного дистрил-р-фенила, позволяет обнаруживать дрожжи (и пивные,
и «дикие») и бактерии, встречающиеся на пивоваренных производствах (включая
роды Lactobacillus, Pediococcus, Bacillus, Pectinatusy Hafnia и Escherichia) [64]. Хотя
в сопоставлении подсчета микроколоний аэробных бактерий с традиционным мето-
дом счета наблюдались некоторые трудности, корреляция результатов этих двух ме-
264
Инге Рассел, Роберт Стюарт
тодов для дрожжей и анаэробных бактерий была очень высокой. Несмотря на то что
метод подсчета микроколоний полезен для быстрого обнаружения очень низкого со-
держания микроорганизмов, исследование микроорганизмов под микроскопом явля-
ется и трудоемким, и утомительным занятием, быстро приводящим к усталости глаз
[7,64,69, 154], причем как и при стандартном чашечном методе результаты не всегда
отражают способность микроорганизмов к размножению в пиве и его порче [72].
В большинстве случаев на смену этому методу пришли более современные.
8.8. Метод DEFT
Метод эпифлуоресцентного фильтра {DEFT) применяется для подсчета общего
числа КОЕ и состоит в мембранном фильтровании проб (для концентрирования
микрофлоры) в сочетании с эпифлуоресцентной микроскопией и/или анализом
цифрового изображения, позволяющего наблюдать индивидуальные окрашенные
флуорохромом клетки [7,52,56,92,121,132,133,153,183]. Вместо стандартных аце-
татцеллюлозных мембран используются поликарбонатные мембраны с более глад-
кой поверхностью, которая лучше подходит для микроскопирования [133].
Метод DEFT, значительно более чувствительный и быстрый, чем метод подсчета
микроколоний, первоначально разрабатывался для подсчета числа бактерий в сыром
молоке как метод контроля качества [132]. Использовали его для контроля
качества говяжьего фарша [34]. С помощью этого метода результаты могут быть по-
лучены примерно через 30 мин, так как не требуется стадии предварительного раз-
множения микроорганизмов. Более того, он позволяет обнаруживать на мембранном
фильтре единичные клетки. В новейшем варианте этого метода, названном Ab-DEFT
(от Antibody — антитело), для специфической флуоресценции микроорганизмов-ми-
шеней используются окрашенные флуоресцентным красителем антитела. Примене-
ние Ab-DEFT позволяет провести быстрый скрининг говядины на присутствие в ней
Е. coli 0157:Я7 через 10 часов обогащения в пептонной воде с буферными свойствами.
Анализ по методике Ab-DEFT, включая мембранное фильтрование, окрашивание
флуоресцентными антителами и эпифлуоресцентное микроскопирование, занимает
менее 1 ч [171].
Наиболее широко используемым в методике DEFT красителем является акриди-
новый оранжевый (благодаря его способности связывать нуклеиновые кислоты
и дифференцировать метаболизм активных живых клеток, окрашиваемых в оранже-
вый цвет, от неактивных мертвых клеток, которые приобретают зеленую окраску).
Причина наблюдаемой разницы в окраске между живыми и мертвыми клетками за-
ключается в том, что акридиновый оранжевый дает оранжевую окраску при связы-
вании с односпиральными ДНК или с молекулами РНК (которых относительно
много в метаболически активных клетках). Когда клетки погибают, эти односпи-
ральные молекулы нуклеиновых кислот быстро разрушаются нуклеазами, а двух-
спиральные молекулы ДНК, естественно флуоресцирующие в зеленом свете, более
стабильны и живут дольше. Тем не менее в исследованиях, выполненных на отфиль-
трованных пробах, взятых в процессе производства пива, не было получено удовлет-
ворительного различия между живыми и мертвыми клетками; кроме того, особую
проблему составляли неопределенно окрашенные примеси [7, 92, 121]. Лучший ре-
зультат при использовании акридинового оранжевого был достигнут путем добавле-
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 265
ния второго красителя (берберина сульфат), который избирательно присоединяется
к двухспиральной молекуле ДНК мертвых клеток, придавая им зеленую окраску,
а в живые клетки он проникать не способен. Сообщается, что жизнеспособные и не-
жизнеспособные клетки можно легко и надежно различать при использовании та-
ких флуоресцентных красителей, как анилиновый синий, viablue и некоторых про-
изводных тетразолия [14, 68, 69, 73, 94]. Кроме того, часть неопределенно
окрашенных примесей может быть удалена путем предварительной фильтрации про-
бы через поликарбонатные мембраны с размером пор 12 мкм [121].
При выполнении вручную анализ по методу DEFT (как и метод подсчета микроко-
лоний) очень утомителен (особенно при проведении скрининга небольшого числа
клеток на крупных мембранных фильтрах) и приводит к быстрой усталости опера-
тора. Полуавтоматическая методика подсчета общего числа бактерий в молоке дает
близкие к стандартному методу результаты [71].
Автоматизированные методы Df/T-анализа основаны на компьютерном микро-
сканировании фильтровальной мембраны и компьютерном анализе изображений [7,
52,92,123, 134,153]. Такая автоматизация довольно недешева, и, кроме того, прове-
дение компьютерной обработки занимает довольно продолжительное время, так как
связано со сканированием фильтра, разделением по размерам и исключением при-
месей, распознаванием цвета и т. д. Тем не менее системы автоматического подсчета
поставляются фирмой Micro-Measurements Ltd. (г. Саффрон Уолден, графство Эс-
секс, Великобритания). Такие системы снимают проблемы, связанные с усталостью
глаз и, по некоторым сведениям, их результаты хорошо согласуются с визуальным
подсчетом микроорганизмов. Более того, полностью автоматизированная система
DEFT (фирмы Biocom Cobra 2024, www.biocom.fr) имеет в своем составе три компью-
тера, контролирующих процедуры обработки пробы (фильтрование, окрашивание,
сушку и анализ изображения) и может обеспечивать скорость обработки в 150 проб/ч.
Кроме того, она обеспечивает высокую воспроизводимость результатов и более низ-
кие пределы обнаружения, чем системы с ручным управлением.
В работе [170] описан метод прямого подсчета клеток для анализа напитков на
мембранном фильтре с использованием флуоресцентного олигонуклеотидного зон-
да, комплементарную известной последовательности 165 рРНК Е. coli, для гибриди-
зации in situ. Вместо традиционного окрашивания акридиновым оранжевым прово-
дится двухчасовая олигонуклеотидная гибридизация с интактными клетками,
собранными на поверхности мембранного фильтра (oligo-DEFT). Фильтр исследует-
ся с помощью эпифлуоресцентной микроскопии и анализируется полученное циф-
ровое изображение.
Очевидно, что в совершенствовании нуждается как собственно методика DEFT,
так и ее приборное оснащение. Увеличению возможностей использования этого ме-
тода в пивоваренном производстве будут способствовать модификация методики
и удешевление оборудования.
8.9. Chemscan
ChemScan RDFM — это новейшая технология, которую продвигает фирма
Chemunex (chemunex.com), объединяющая лазерное сканирование и метод меченых
клеток, что позволяет одновременно выполнять ускоренное обнаружение и иденти-
266
Инге Рассел, Роберт Стюарт
фикацию микроорганизмов без предварительного их размножения. Система лазер-
ного сканирования позволяет в течение нескольких минут находить единичные жи-
вые клетки бактерий, дрожжей, плесеней или споры в небольшом объеме жидкости,
не подвергая их инкубации, так как размножения клеток для анализа не требуется.
Проба фильтруется через мембранный фильтр и метится флуоресцеином, который
в возбужденном состоянии светится голубым светом. Затем поверхность мембраны
сканируют лазером с голубым пучком света, причем чувствительность прибора по-
зволяет выявлять десять единичных бактерий из более чем миллиарда точек, полу-
чаемых при одном сканировании. Данные обрабатываются в режиме реального вре-
мени, так что результат доступен уже через 10 с после завершения сканирования
(время сканирования составляет менее 3 мин). Локализация бактерий отображается
на мониторе компьютера. Если требуется визуальное подтверждение, бактерии мож-
но наблюдать под автоматическим микроскопом, так как данный метод их не разру-
шает. В пределах от 1 до 5 тыс. клеток без разведения соблюдается линейная зависи-
мость результатов, причем идентификации способствует наблюдение объекта
исследования. Разработка была выполнена центром TEPRAL (Центром исследова-
ния пива группы «Данон», Danone), занимающимся изучением возможностей при-
менения аналитических методов в пивоварении. Проблемы, с которыми столкнулись
разработчики, заключались в отсутствии у бактерий-вредителей пива специфично-
сти (характерных особенностей) и дороговизне приборного оснащения (если ис-
пользовать его лишь для определения общей бактериальной флоры в пиве или про-
мывных водах). Не так давно этот метод с применением специфических маркеров
был использован для обнаружения Е. coli и Cryptosporidium в пищевой промышлен-
ности, индустрии напитков и в фармацевтических изделиях, а также фирмами, зани-
мающимися водоподготовкой [26].
8.10. Метод белковых «отпечатков пальцев»
при электрофорезе в полиакриламидном геле
В микроорганизмах обычно присутствуют две группы белков: к первой относятся
белки, которые синтезируются конститутивно — структурные или «вспомогатель-
ные» регуляторные белки, а ко второй — полипептиды, синтез которых либо инду-
цируется, либо репрессируется в зависимости от воздействия внешних факторов.
Первая группа белков может быть обнаружена в условиях, благоприятных для кле-
точной жизнедеятельности и роста, тогда как вторая группа зависит от таких факто-
ров, как состав питательной среды, температура роста, газовый состав внешней сре-
ды и фаза роста к моменту съема. Эти факты легли в основу классификации
и идентификации дрожжей и других микроорганизмов методом электрофореза кле-
точных белков в полиакриламидном геле (PAGE) [41,44,91,122, 131,162, 179-182];
см. также главу 7.
Растворимые белки последовательно экстрагируют из предварительно выращен-
ных клеток и подвергают электрофоретическому разделению. Электрофоретическое
разделение может быть одномерным (основанным на различии белков по размерам
с использованием додецилсульфата натрия, (SDSPAGE), или исходного PAGE, либо
основанным на различии белков по их ионным зарядам путем изоэлектрического
фокусирования). Разделение может быть также двухмерным, объединяющим разде-
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 267
ления по размеру и по заряду в геле. Результаты разделения (так называемые «бел-
ковые отпечатки пальцев») являются специфическими для экспрессии генов изуча-
емого штамма и могут быть использованы для анализа их сходства или различия
с другими штаммами. На основе этой информации микроорганизмы могут быть сис-
тематизированы. Результаты электрофореза можно сравнивать визуально или ис-
пользовать сопряженный с компьютером денситометр для получения цифровых зна-
чений, по которым можно сгруппировать близкородственные штаммы.
При определении идентичности двух изолированных культур очень важно, чтобы
соответствующие изоляты прошли одинаковую процедуру подготовки к анализу,
так как состав генной продукции в клетке (и соответствующее ее количество) может
существенно различаться в зависимости от условий роста. Сравнение белковых про-
филей двух микроорганизмов должно включать в себя общие этапы выращивания
непосредственно перед съемом и подготовкой клеток. По окончании выращивания
экстрагирование, электрофоретическое разделение и окрашивание белков может
быть выполнено в течение нескольких часов.
Требования, предъявляемые к предварительному выращиванию клеток, а также
необходимость иметь чистые колонии культур ограничивают возможность приме-
нения техники электрофореза белков для рутинных анализов. Хотя этим методом
можно идентифицировать штаммы и подштаммы, а также достаточно просто осуще-
ствить видовую идентификацию, уровень технического мастерства, который требу-
ется для выполнения этого метода, позволяет использовать его только в специализи-
рованных лабораториях. При этом следует учитывать, что с ростом осознания
важности безопасности пищевых продуктов увеличивается и число аналитических
лабораторий, куда можно отдать образцы для проведения идентификации дрожже-
вых и бактериальных штаммов.
8.11. Кариотипирование
(снятие хромосомных «отпечатков пальцев»)
Кариотипирование — это определение размера и числа хромосом. В течение мно-
гих лет его использовали для характеристики, различения или идентификации мик-
роорганизмов-эукариотов. У высших эукариотов (таких, как животные и растения)
кариотипирование может быть легко выполнено селективным окрашиванием ДНК
in situ (например, с использованием реакции Фельгена) с последующим наблюдени-
ем ярко различимых хромосом под микроскопом. Индивидуальные хромосомы за-
тем можно рассортировать микроманипулированием и идентифицировать. У низ-
ших эукариотов (к которым относятся дрожжи) хромосомы, хотя и считаются очень
крупными, все-таки слишком малы, чтобы проводить их кариотипирование путем
селективного окрашивания с последующей микроскопией. У дрожжей кариотипи-
рование выполняется электрофоретическим разделением в агарозном геле. Конвек-
ционный одномерный электрофорез в агарозном геле, при котором фрагменты ДНК
размером от 0,01 до 0,001 дрожжевой хромосомы двигаются в однородном электри-
ческом поле, не может разделить крупные молекулы ДНК типа дрожжевых хромо-
сом, поскольку эти крупные молекулы проявляют тенденцию к миграции независи-
мо от размеров. Кариотипирование дрожжевых хромосом возможно при смене
ориентации электрического поля, так как чем меньше хромосома, тем быстрее она
268
Инге Рассел, Роберт Стюарт
способна реагировать на изменения его ориентации [20]. Такие изменения электри-
ческого поля, используемые для разделения крупных молекул ДНК по размерам,
лежат в основе гель-электрофореза в пульсирующем поле (PFGE).
При окрашивании разделенных с помощью PFGE хромосом бромистым этидием
они проявляются как отдельные полосы, видные в УФ-свете. Для получения «отпе-
чатков пальцев» хромосом с помощью электрофореза существует ряд методов, глав-
ное различие которых состоит в ориентации переменных электрических полей
(рис. 8.2). Как и для снятия «отпечатков пальцев» белков, для различения и/или
идентификации видовой принадлежности исследуемых образцов дрожжей можно
использовать компьютерный кластерный анализ.
Данные о кариотипировании дрожжей Saccharomyces представлены в [22, 23, 28,
33, 47, 87, 140, 184]. Эта процедура использовалось в пивоваренной промышленно-
сти не только для научных исследований и разработок, но и для контроля качества
(как средство различения или снятия «отпечатков пальцев» штаммов дрожжей для
производства эля и лагерного пива). Благодаря способности выявлять полиморфизм
хромосом, эта методика оказалась полезной при различении близкородственных
штаммов низовых дрожжей, которые зачастую было трудно или даже невозможно
дифференцировать классическими методами (такими, как морфология гигантских
колоний, споруляция, ростовые характеристики) [22, 58]. Хромосомный полимор-
физм является результатом вставок, делеций и транслокаций фрагментов ДНК, до-
статочно крупных для того, чтобы их можно было различить электрофоретически
(обычно 10 тысяч пар оснований или крупнее). С использованием PEGE выращен-
ные клетки можно подготовить и электрофоретически разделить в течение 48 ч, хотя
для оптимального отделения хромосом схожего размера может потребоваться не-
сколько сеансов.
8.12. Иммуноанализ
Иммуноанализ считается удобным способом идентификации микроорганизмов-
контаминантов пивоваренного производства благодаря возможности их выявлять
и идентифицировать количественно [24, 38, 76, 174]. На основе поли- и монокло-
нальных антител разработаны различные методы различения микроорганизмов и их
идентификации.
Ускоренный «полуколичественный» иммунологический «сэндвич»-тест может
быть использован для колориметрического различения или идентификации относи-
тельно большого числа (> 104) интактных клеток. В этом методе используются вто-
ричные антитела с присоединенными ферментами (например, щелочной фосфата-
зой или пероксидазой хрена). На рис. 8.3 графически представлен «сэндвич»-тест
с иммуноферментным комплексом на носителе (ELISA). В типовом методе ELISA ис-
пользуют некоторый матрикс (например, фильтровальную мембрану), погружную
палочку, пробирку или плату для микротитрования с нанесенными антителами, спе-
цифичными к антигену, который подлежит обнаружению. Образец приводят в кон-
такт с иммобилизованным антителом, и антиген получает возможность связаться
с закрепленным в матриксе антителом. Матрикс промывают (связавшийся антиген
остается прикрепленным), и вторичное антитело, специфичное к антигену и соеди-
ненное с ферментом, получает возможность связаться с прикрепленным к матриксу
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 269
в-:
А+
А-
~|
"
PFGE (гель-электрофорез в пульсирующем поле)
В+ Используются 2 переменных поля,
однородное и неоднородное
В-
А>
Д
А-
/в+
OFAGE (гель-электрофорез в ортогональных переменных полях)
Используются два неоднородных переменных поля
TAFE (поперечный электрофорез в переменном поле)
Электрическое поле ориентировано поперечно гелю
АА
FIGE (гель-электрофорез в поле с инверсией полюсов)
Однородное электрическое поле периодически меняет свою одномерную
ориентацию на 180°
• • • •
А- • . • В-
• CHEF (клампированное однородное электрическое поле)
>• В гексагональном контуре располагаются 24 электрода,
В+ • • А+ позволяющие менять ориентацию поля на 60° или 120°
Электрофорез в скрещивающихся полях и во вращающемся поле
Используется одно однородное поле; изменение ориентации
по отношению к гелю происходит периодическим вращением самого геля
-\+
• —| • PHOGE (гель-электрофорез в пульсирующих ортогональных
J |—■ J +V" однородных электрических полях)
Используется угол ориентации поля 90°
Рис. 8.2. Примеры систем кариотипирования дрожжей на основе гель-электрофореза
антигеном. Несвязавшиеся вторичные антитела удаляются, и к матриксу добавляют
субстрат. Этот субстрат колориметрически изменяется ферментом, соединенным
с вторичным антителом. Результат проявляется в полуколичественном колоримет-
рическом изменении матрикса в присутствии специфического антигена (например,
микроорганизма, контаминирующего пиво). Наборы ELISA были разработаны для
270
Инге Рассел, Роберт Стюарт
Этап 1. Первичное антитело перед использованием адсорбируют
на твердом носителе (например, пробирка, погруженная палочка и т. п.)
Этап 2. Бактерии в пробе связываются с первичным антителом
Этап 3. Пробу промывают и нагруженное ферментом вторичное антите-
ло связывают с другими сайтами на бактериях
Этап 4. Избыток вторичных антител вымывают и добавляют окра-
шиваемый субстрат. В результате фермент-субстратного взаимодей-
ствия окраска развивается пропорционально количеству связавшихся
бактерий
Рис. 8.3. Иммуноферментный анализ
тестирования окружающей среды (на наличие пестицидов и других вредных соеди-
нений), для домашних тестов на беременность, для скрининга лекарственных препа-
ратов на рабочем месте и для тестирования на СПИД. В пищевой промышленности
и производстве напитков основное применение наборы ELISA нашли при скрининге
таких микроорганизмов, как Е. coli 0157:H7, Campylobacter, Listeria и Salmonella. Не-
которые из этих тестов требуют предварительного инкубационного периода (до
48 ч), но все равно они быстрее, чем стандартная методика инкубации на селектив-
ной среде. Современные готовые наборы для определения микроорганизмов-вреди-
телей пива еще не очень распространены из-за относительно небольших масштабов
пивоваренной промышленности по сравнению с пищевой отраслью в целом, хотя
исследования в этой области продолжаются [177]. Основными преимуществами по-
добных наборов является их относительно низкая стоимость, быстрота обнаруже-
ния микроорганизмов и портативность.
Были разработаны специальные антитела для идентификации микроорганизмов,
встречающихся в пивоварении [57, 78, 79, 103, 104, 135, 185, 189, 193]. При их ис-
пользовании посредством иммунофлуоресцентной микроскопии наблюдаются еди-
ничные клетки или небольшое их число (включая микроколонии). Не так давно
были разработаны специфические тесты с использованием моноклональных анти-
тел для различения штаммов Lactobacillus и Pediococcus [176, 194].
Обычно специфические антитела связываются с микроорганизмами-контамината-
ми. После удаления несвязавшихся специфических или первичных антител добав-
2£
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 271
ляются вторичные антитела-индикаторы (такие, как антитела, специфические к типу
иммуноглобулина, из которого были получены первичные антитела), соединенные
с флуорохромом (например, флуоросцеинтиоцианатом). Несвязавшиеся вторичные ан-
титела удаляют, и пробы просматривают под микроскопом в ультофиолетовом свете для
обнаружения присутствия ярко флуоресцирующих клеток микроорганизмов-мишеней.
Как и при других методах с использованием микроскопа, обычной проблемой яв-
ляется усталость глаз лаборанта. Кроме того, необходимо выбирать антитела, кото-
рые специфичны к легко доступным клеточным компонентам (обычно поверхност-
ным), имеющимся в избытке независимо от условий выращивания клеток (так,
например, антитела, выработанные против содержащихся в цитозоле генных про-
дуктов, индуцированных стрессом или глюкозной репрессией, будут иметь ограни-
ченное применение). Тем не менее эта методика, как и любая другая с использовани-
ем зондов, позволяет получить быстрый качественный и количественный анализ
проб пива при условии, что решены потенциальные проблемы перекрестного влия-
ния антител из других источников, причем для получения пороговых значений об-
наружения не требуется выращивания микроорганизмов.
8.13. Гибридизация с использованием ДНК-зондов
Дезоксирибонуклеиновая кислота (ДНК) присутствует почти во всех живых орга-
низмах, за исключением некоторых вирусов, где генетическим материалом является
рибонуклеиновая кислота (РНК). Проявление биологических свойств, составляю-
щих сущность каждого организма, определяется последовательностями нуклеотидов,
состоящих из четырех оснований: аденина, цитозина, гуанина и либо тимина для
ДНК, либо урацила для РНК. Последовательности нуклеотидов, обнаруженные
у штаммов различных видов, высоко специфичны и остаются преимущественно по-
стоянными от поколения к поколению. С учетом около миллиона оснований ДИК,
выявленных в типичных дрожжах или бактериях, данный метод обнаружения и иден-
тификации позволяет легко распознавать специфические последовательности разме-
ром от менее чем 100 нуклеотидов до нескольких тысяч нуклеотидов в любом геноме
(см. также главу 9).
Гибридизациия (см. обзор [188]) — это образование двухцепочечных молекул нук-
леиновых кислот (либо ДНК с ДНК, либо ДНК с РНК) путем создания пар основа-
ний между одноцепочечными нуклеиновыми кислотами, происходящими обычно из
разных источников. Техника ДНК-ДНК- и ДНК-РНК-гибридизации была разрабо-
тана и использовалась в первую очередь специалистами молекулярной биологии для
выявления, описания и изучения экспрессии генов (ДНК) и их транскрипции (РНК).
При выполнении гибридизации особый интерес представляет возможность контро-
лировать уровень специфичности спаривания оснований путем изменения условий
гибридизации (температуры и концентрации солей). При соблюдении максимально
строгих условий проведения реакции гибридизация становится высокоселективным
методом. С ее помощью можно обнаруживать мельчайшие различия в последователь-
ностях ДНК, которые могут быть внутри- или межвидовыми, а также определять
последовательности-мишени, специфически обнаруживаемые среди генетического
материала конкретных организмов. ДНК-зонды обладают высокой чувствительно-
стью и могут обнаруживать 104-107 микроорганизмов на один исследуемый образец.
272
Инге Рассел, Роберт Стюарт
Проблемы, связанные с перекрестной реактивностью, решаются оптимизацией сис-
темы гибридизации. Преимущество метода гибридизации ДНК-ДНК по сравнению
с методом PAGE или иммуноанализом состоит в том, что обнаружение микроорганиз-
ма-мишени не зависит от продуктов экспрессии генов, которые, как уже отмечалось
выше, могут варьировать в зависимости от условий роста, физиологического состоя-
ния организмов в исследуемой пробе и т. п.
Материал для гибридизации получают с использованием единичных колоний
культур, клеток, собранных на мембранных фильтрах или очищенной нуклеиновой
кислоты в виде фрагментов, полученных путем рестрикции с помощью эндонуклеаз
и разделенных по размерам гель-электрофорезом (когда используется полиморфизм
по длине фрагментов ДНК—RFLPs, Restriction Fragment Length Polymorphisms).
Тесты для диагностики на основе ДНК-гибридизации включают:
• размножение (до требуемого титра) организмов, выделенных из исследуемой
пробы;
• выделение ДНК из организмов-мишеней;
• выбор ДНК-зонда, специфичного для данного микроорганизма;
• выбор системы гибридизации;
• мечение ДНК-зондов и обнаружение образовавшихся гибридов.
Типовой анализ приведен на рис. 8.4, а результаты такого тестирования — на
рис. 9.1 (глава 9). Для идентификации, дифференциации или характеристики дрож-
жей и бактерий, встречающихся в пивоваренном производстве, использовались раз-
нообразные ДНК-зонды. Такими зондами могут быть гены, выделенные из опреде-
ленных микроорганизмов (например, Я/54 или LEU2 из 5. cerevisiae или ген белка
5-слоя из Lactobacillus brevis), эндогенные плазмиды (например, обнаруживаемые
в Pediococcus damnosus), транспозоны или ^-элементы, произвольные повторяющи-
еся последовательности типа поли-СГи даже вирусная ДНК типа одноцепочечного
еь
Этап 1
Сбор
микроорганизмов
на фильтровальном
матриксе
Этап 2
Лизис клеток
и разделение
цепочек ДНК
ЭтапЗ
Связывание ДНК
с фильтровальным
матриксом
+**** m*J
Этап 4
Добавление
маркированных
ДНК-зондов
Этап 5
Гибридизация маркированных
зондов с комплементарной ДНК
из микроорганизмов выявляет
наличие микроорганизма-мишени
Рис. 8.4. Тест ДНК-ДНК-гибридизации
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 273
фагаМ13 [25, 31, 35, 54, 105, 106,108, 112,115,116, 127-129,142,157, 160, 185, 186].
Этот метод еще не вполне удобен для обычного пользователя, чтобы применяться
при рутинном контроле качества в лабораториях, контролирующих технологичес-
кий процесс на пивоваренных предприятиях, однако наборы для гибридизации уже
производятся. Несколько подобных промышленных диагностических наборов (для
определения таких микроорганизмов, как Salmonella или Listeria с высокой степенью
специфичности) на основе техники гибридизации и ДНК-зондов уже поставлены на
предприятия пищевой промышленности.
8.14. Цепная реакция полимеразы
Цепная реакция полимеразы (ЦРП) стала научным инструментом более четверти
века назад [119]. В медицине и пищевой промышленности она зарекомендовала себя
очень эффективным диагностическим средством. На самом деле этот метод возник
как способ решения спорных вопросов криминалистики. ЦРП представляет собой
одну из наиболее многообещающих технологий, позволяющих быстро обнаруживать
присутствие микробиологических контаминантов в пивоварении, но до сих пор она
еще недостаточно широко применяется в рутинных анализах. ЦРП — метод, который
используется in vitro для амплификации (на несколько порядков) очень небольших
количеств избранных участков нуклеиновых кислот (ДНК или РНК) за короткий
период времени (порядка нескольких часов). ЦРП революционизировала ДНК-тех-
нологии и сделала доступным относительно простое, быстрое и недорогое производ-
ство in vitro дискретных участков нуклеиновой кислоты любой длины и в любом
количестве. Примеры использования ЦРП для идентификации чистых культур пато-
генов пищевых продуктов приведены в [9,13, 15], хотя когда с помощью ЦРП пыта-
ются анализировать непосредственно пищевые продукты, возникают проблемы
с чувствительностью данного метода [60].
На молекулярном уровне процедура ЦРП состоит из повторяющихся циклов де-
натурации ДНК, реассоциации (отжига) с праймером (затравкой) и удлинения ее
термостабильной ДНК-полимеразой (см. рис. 8.5). Два коротких ДНК-праймера,
обычно содержащие 15-25 нуклеотидов, располагаются на флангах сегмента ДНК,
который подлежит амплификации, и многократно подвергаются тепловой денатура-
ции, гибридизации с комплементарными им последовательностями ДНК и нара-
щиванию цепи с помощью ДНК-полимеразы. Эти два праймера гибридизируются
с противоположными цепями последовательности-мишени таким образом, чтобы
синтез протекал на участке между праймерами, копируя этот сегмент ДНК. Продукт
каждого цикла ЦРП комплементарен праймерам и способен связываться с ними; та-
ким образом, количество синтезированной ДНК удваивается в каждом последую-
щем цикле. Исходная шаблонная (матричная) ДНК может находиться в чистом виде
как отдельная молекула или являться редким компонентом сложной смеси биологи-
ческих субстанций. После 20 циклов репликации ДНК-мишень (теоретически) раз-
множается в миллион раз. Амплифицированные образцы разделяют по размерам
одномерным гель-электорофорезом в агарозном или полиакриламидном геле и ок-
рашивают бромистым этидием, после чего они становятся видимыми в ультрафио-
летовом свете.
274
Инге Рассел, Роберт Стюарт
ДНК-мишень
В Цикл1
Денатурация при 94 °С
5' 3'
С Отжиг праймера при 55 °С
денатурация
1 мин 1 мин 2 мин 1 мин
-*— Цикл 1 —*»
3'-
D Наращивание праймера при 72 °С
3'-
3'-
5'-
Е Цикл 2
5'
3'-
5'-
5'
з-
Число циклов
*
25-40 циклов
Рис.8.5. Полимеразная цепная реакция. ДНК-мишень (А) подвергается тепловой денатурации (В)
при 94 *С. Праймеры отжигают (С) при 55 °С и затем наращивают (D) при 72 °С. Цикл A-D затем по-
вторяется (Е) 25-40 раз. (F) Температурно-временная зависимость типичного цикла ЦПР. (G) Рост
количества амплифицированной ДНК: с увеличением числа циклов число копий амплифицирован-
ной ДНК возрастает экспоненциально
Чтобы дифференцировать такие микроорганизмы, как дрожжи или бактерии по
родам, видам или подвидам праймеры конструируют исходя из сравнительного ана-
лиза последовательностей вариабельных или высоко стабильных видов ДНК, чаще
всего рибосомнойРНК (рРНК). Можно сконструировать разнообразные праймеры,
позволяющие получать продукты ЦРП различного размера. Тогда в результате элек-
трофоретического разделения по размерам, наличию или отсутствию полос можно
судить о наличии или отсутствии тех или иных родов (видов) микроорганизмов в
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 275
испытуемом образце. К ДНК-зондам может быть также прикреплена хромогенная
«метка», благодаря которой производятся ЦРП-продукты, окрашенные в различные
цвета, что позволяет визуально дифференцировать разновидности микроорганизмов
лишь по одному тесту с множеством разных меток [46, 96]. Специфичность ЦРП
такова, что по одному сценарию можно различать грамположительные и грамот-
рицательные бактерии, по другому — выявлять такие виды, как Pediococcus damnosus
и Obesumbacterium proteus, причем и то и другое в ходе одного анализа. Использова-
ние такой высокоспецифичной методики идентификации оправдано применитель-
но к засевным дрожжам, где контаминация может присутствовать на уровне единич-
ных клеток, или применительно к любому объекту, для которого контаминация
микроорганизмами не допустима в принципе.
Первоначально для идентификации контаминантов пивоваренного производства
(как в засевных дрожжах, так и в готовом продукте) было разработано большое чис-
ло ЦРП-тестов, однако ни один из них не достиг уровня надежности подсчета на
чашках, что не компенсируется даже преимуществом выигрыша во времени (часы
вместо дней). Главными проблемами остаются большая чувствительность метода,
что увеличивает число «ложноположительных» показаний, его высокая стоимость,
а также относительная трудность выполнения анализов. Кроме того, по сравнению
с подсчетом на чашках достоверность выделения незначительных количеств микро-
организмов в готовых непастеризованных продуктах уменьшается (особенно отно-
сительно загрязняющих бактерий). К имеющимся сейчас в употреблении тестам от-
носятся тесты по идентификации различных пивоваренных контаминантов (в том
числе молочнокислых бактерий) и специфические тесты на такие контаминанты, как
Obesumbacterium, Pediococcus и Lactobacillus [37,90,93,99,117,144,146,148,150,166,
175], позволяющие даже различать молочнокислые бактерии по их устойчивости
к хмелю [148].
Дальнейшее совершенствование ЦРП-методов было направлено на тестирование
ингредиентов сырья относительно наличия генетически модифицированных про-
дуктов, особенно кукурузы [74], и хотя такое применение ЦРП-технологии прямо не
связано с микробиологической контаминацией, оно предствляет определенную цен-
ность для пивоварения. В новых более автоматизированных технологиях (например,
как Light Cycler™ фирмы Roche) достоверность и надежность ЦРП-методов была
увеличена, и дальнейшее развитие в этой области несомненно будет способствовать
более широкому их применению в пивоваренной промышленности.
8.15. Полимеразная цепная реакция полиморфной ДНК,
амплифицированной случайным образом
Специфические ЦРП-праймеры, которые тщательно конструируются для ампли-
фикации последовательности-мишени, обычно имеют размер от 15 до 25 нуклеоти-
дов, и для этого необходимо предварительное знание интересующей исследователя
последовательности ДНК. Альтернативой является использование меньших неспе-
цифических или имеющих случайный состав праймеров с размерами от 9 до 12 нук-
леотидов. Благодаря своим меньшим размерам эти «случайные» праймеры связыва-
ются с несколькими различными сайтами ДНК на последовательности ДНК любого
микроорганизма. Использование таких меньших по размеру случайно составленных
276
Инге Рассел, Роберт Стюарт
или неспецифичных праймеров для ЦРП-диагностики назвали методом ЦРП поли-
морфной ДНК, амплифицированной случайным образом (RAPD, Random Amplified
Polymorphic DNA).
В ходе RAPD-PCR из-за связывания со значительно большим числом участков в
геноме обычно образуется несколько ЦРП-продуктов, которые затем разделяют
электрофорезом в агарозном геле и получают «отпечатки пальцев» ДНК или профи-
ли, специфические для рода или даже вида микроорганизма [99, 187, 190]. RAPD-
отпечатки зависят от составляющих праймеры последовательностей, условий реак-
ции в каждом цикле амплификации (которые, как правило, менее строгие, чем при
специфическом ЦРП-тесте, для максимального увеличения числа сайтов связыва-
ния) и источника ДНК. Типичные примеры RAPD для бактериальной ДНК описаны
в главе 9.
Эту технологию использовали для описания свойств и дифференцирования пиво-
варенной микрофлоры, включая виды Pediococcus, Lactobacillus и Obesumbacterium,
а также штаммов дрожжей для эля и лагерного пива [149, 150]. Вместо смеси олиго-
нуклеотидов для выполнения RAPD-PCR можно использовать многократно повторя-
ющиеся специфические последовательности (полиСГ-олигонуклеотиды). В дрожжевом
геноме полиСГ-последовательности локализованы на концах хромосом и рассматри-
ваются как «горячие точки» генетической рекомбинации [186].
Эта методика крайне полезна для идентификации отдельных видов и разновидно-
стей штаммов и для ускоренной идентификации штаммов ее можно включить в со-
став баз данных. С практической точки зрения такая методика требует наличия ко-
лоний чистых культур. Если культура смешана с одним или несколькими штаммами
бактерий или дрожжей, получаются аномальные образцы, которые невозможно со-
поставить с имеющимися штаммами. В частности, эта методика не подходит для вы-
явления бактериальной контаминации дрожжей.
8.16. Краткое резюме
В области разработки ускоренных методов микробиологического анализа наблю-
дается значительный прогресс, однако для применения некоторых из обсуждавших-
ся выше ускоренных методов до сих пор необходимо размножение микроорганизмов
до достижения некоторого определенного порогового значения. При использовании
таких методов необходимо помнить, что понятие «ускоренный» ограничивается та-
кими факторами, как скорость роста, условия размножения и начальное количество
внесенных микроорганизмов. Главное преимущество использования этих техноло-
гий состоит в том, что обнаружение микробиологических контаминантов в настоя-
щее время может занимать намного меньше времени, чем ранее (при использовании
классических методов выращивания на чашках). Некоторые технологии позволяют
не только обнаруживать, но и быстро проводить верификацию и идентификацию
основных контаминатов пива — Lactobacillus, Pediococcus, Obesumbacterium, Pectina-
tus и других потенциально опасных микроорганизмов (на уровне рода и вида).
Для микробиологических лабораторий пивоваренных предприятий применение
автоматизации и ускоренных методов анализа предоставляет большие возможности,
и в ближайшие годы можно ожидать появления новых надежных модификаций этих
методов. В настоящее время некоторые методы все еще более подходят для научно-
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 277
исследовательских лабораторий, чем для лабораторий контроля качества пивова-
ренных предприятий, однако постепенно вместе с новыми методиками появляются
приборы и тест-наборы, которые удовлетворяют потребности и новых, и старых
клиентов, обеспечивая прогресс в области обнаружения и идентификации микроор-
ганизмов. Благодаря сведению к минимуму порчи из-за микробиологической конта-
минации они быстро, эффективно и по доступной цене помогают пивоварам произво-
дить пиво высочайшего качества.
Выражение признательности
Авторы благодарят д-ра Т. М. Dowhanick (пивзавод Labatt Breweries, Канада) за его
вклад в работу над этой главой.
Литература
1. Adams, M.R. (1988) Analytical Proceedings, 25, 325.
2. Adams, M.R., Bryan, J J. and Thurston, PJ. (1989) Letters t Applied Microbiology, 8, 55.
3. Attfield, P.V., Kletsas, S., Veal, D.A., van Rooijen, R., and Bell, PJ.L. (2000) Journal of
Applied Microbiology, 89, 207.
4. Avis, J.W. and Smith, P. (1989) In Rapid Microbiological Methods for Foods, Beverages and
Pharmaceuticals (eds CJ. Stannard, S.B. Petitt and F.A. Skinner), Blackwell Scientific
Publications, Oxford, England, p. 1.
5. Back, W. (1987) Brauwelt International, 2,17 A.
6. Barney M.C. and Helbert, J.R. (1975) Master Brewers Association of the Americas Technical
Quarterly, 12, 23.
7. Barney, M. and Kot, E. (1992) Master Brewers Association of the Americas Technical
Quarterly, 29,91.
8. Beezer, A.E., Bettelheim, K.A., Al-Salihi, S. and Shaw, EJ. (1978) Science Tools, 25, 6.
9. Bej, A.K., Mahbubani, M.H., Miller, R., Dicesare, J.L., Haff, L. and Atlas, R.M. (1990a)
Molecular Cellular Probes, 4, 353.
10. Bej, A.K., Steffan, R.J., Dicesare, J.L., Haff, L. and Atlas, R.M. (1990b) Applied and
Environmental Microbiology, 56, 307.
11. Bell, P.J.L., Deere, D., Shen, J., Chapman, В., Bissinger, P.H., Attfield, P.V. and Veal, D.
(1998) Applied and Environmental Microbiology, 64,1669.
12. Berridge, N.J., Cousins, CM. and Cliffe, A.J. (№1 A) Journal of Dairy Research, 41, 203.
13. Bessesen, M.T., Luo, Q., Rotbart, H.A., Blaser, M.J. and Ellison, R.T. (1990) Applied and
Environmental Microbiology, 56, 2930.
14. Betts, R.P., Bankes, P. and Banks, J.G. (1989) Letters in Applied Microbiology, 9, 199.
15. Boddinghaus, В., Rogall, Т., Flohr, Т., Blocker, H. and Bottger, E.C. (1990) Journal of
Clinical Microbiology, 28,1751.
16. Boswell, CD., Nienow, A.W. and Hewitt, С J. (2001) Poster 20, ASBC Annual Meeting,
Victoria, ВС
17. Boulton, C.and Quain, D. (2001) Brewing Yeast and Fermentation. Blackwell Science U.K. p 664.
18. Boyd, A., Attfield, P.V., Veal, D.A. and Vincent, S. (2000) Journalofthe Institute of Brewing,
106,319.
19. Brady, P. (1999) The Btewet, March, 130.
20. Bustamante, C, Gurrieri, S. and Smith, S.V. (1993) Trends in Biotechnology, 11, 23.
21. Campbell, I. and Allan, A.M. (ША) Journal of the Institute of Brewing, 70, 316.
278
Инге Рассел, Роберт Стюарт
22. Casey, G.P, Pringle, A.T. and Erdmann, PA. (1990)Journal ofthe American Society of Brewing
Chemists, 48,100.
23. Casey, G.P, Xiao, W. and Rank, G.H. (1988) Journal of Institute of Brewing, 94, 239.
24. Chappelle, E.W. and Levin. G.V. (1968) Biochemical Medicine 2,41.
25. Colmin, C, Pebay, M., Simonet, J.M. and Decaris, B. (1991) FEMSMicrobiology Letters, 81,123.
26. CPL Scientific Report. (1999) The commercial success of Eclair programme — New methods for
the selection of raw materials and the control and monitoring of microbiological parameters
within the brewing industry. AGRE 0014 - under contract FAIR- CT98-4822.
27. Davies, A.M., Clements, G.J., Derwent, L. and Brennan, M. (1995) Proceedings of 25th
Congress of the European Brewery Convention, Brussels, IRL Press, Oxford, p. 637
28. De Jong, P., De Jong, СМ., Meijers, R., Steemsa, R. and Scheffers, W.A. (1986) Yeast, 2,193.
29. Deak, T. and Beuchat, L.R. ( 1993) Food Microbiology, 10, 255.
30. Deak, T. and Beuchat, L.R. ( 1995) Food Microbiology, 12, 165
31. Decock, J.P. and Iserentant, D. (1985) Proceedings of the 20th Congress of the European
Brewery Convention, Helsinki, IRL press, Oxford, p. 195.
32. Deere, D., Shen J., Vesey, G., Bell, P., Bissinger, P. and Veal, D. (1998) Yeast, 14,147.
33. Degre, R., Thomas, D.Y., Ash, J., Mailhiot, K., Morin, K. and Dubord, С (1989) American
Journal of Enology and Viticulture, 40, 309.
34. Deibel, J , Paulsen, P. and Bauer, F. (1998) Wiener Tieraerztliche Monatsschrift, 85,327.
35. Delley, M., Mollet, B. and Hottinger, H. (1990) Applied and Environmental Microbiology, 56,
1967.
36. Dick, E., Wiedman, R., Lempart, K. and Hammes, W.P. (1986) Chemie Mikrobiologie
Technologie der Lebensmittel, 10, 37.
37. DiMichele, L.J. and Lewis, M.J. (1993) Journal of the American Society of Brewing Chemists,
51,63.
38. Dolezil, L. and Kirsop, B.H. (\915)Journalofthe Institute of Brewing, 81, 281.
39. Donhauser, S., Eger, C, Hubl, Т., Schmidt, U. and Winnewisser, W. (1992) Brauwelt, 132,
1301.
40. Dowhanick, T.M. (1990) Brewers Digest, 65, 34.
41. Dowhanick, Т., Sobczak, J., Russell, I. and Stewart, G.G. (\990) Journal of the American
Society of Brewing Chemists, 48, 75.
42. Dowhanick, T.M. and Sobczak, J. (1994) Journal of the American Society of Brewing Chemists,
52,19.
43. Dowhanick, T.M., Sobczak, J., Presente, E. and Russell, I. (1995) Proceedings of 25th Congress
of the European Brewery Convention, Brussels, IRL Press, Oxford, p. 645
44. Drawert, F. and Bednar, J. (1983) Journal of Agriculture and Food Chemistry, 31, 848.
45. Eger, C, Donhauser, S. and Winnewisser, W. (1993) Brauwelt, 133, 2087.
46. Embury, S.H., Kropp, G.L., Stanton, T.C., Warren, T.C., Cornett, P.A. and Chehab, E F
(1990) Blood, 76, 619.
47. Esteve Zarzoso, В , Peris-Toran, M.J., Garcia-Maiquez, E., Uruburu, F and Querol, A. (2001)
Applied and Environmental Microbiology, 67, 2056.
48. Evans, H. A.V. (\9S2) Journal of Applied Bacteriology, 53,423.
49. Evans, H.A.V. (1985) Food Microbiology, 2,19.
50. Firstenberg-Eden, R. and Eden, G. (1984) Impedance Microbiology, Research Studies Press
Ltd John Wiley and Sons Inc., Toronto.
51. Firstenberg-Eden, R. and Sharpe, A.N. (1991) In Biotechnology and Food Ingredients (eds I.
Golgberg, and R. Williams), Van Nostrand Reinhold Publishers, New York, p. 507.
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 279
52. Fleet, G. (1992) Critical Reviews in Biotechnology, 12,1.
53. Foster, A. (\996) Journal of the American Society of Brewing Chemists, 54, 76.
54. Funahashi, W., Suzuki, K., Ohtake, Y. and Yamashita, H. (1998) Journal of the American
Society of Brewing Chemists, 56, 64.
55. Fung, D.Y.C. (1994) Food Rev. International 10,357.
56. Fung, D.Y.C. (2000) Irish Journal of Agricultural and Food Research, 39, 301.
57. Gares, S.L., Whiting, M.S., Ingledew, W.M. and Ziola, B. (1993) Journal of the American
Society of Brewing Chemists, 51,158.
58. Good, L., Dowhanick, T.M., Ernandes, J.E., Russell, I. and Stewart, G.G. (1993)Journalof the
American Society of Brewing Chemists, 51,35.
59. Gram, L. and Soggaro, H. (1985) Journal of Food Protection, 48,431.
60. Grant, K.A., Dickinson, J.H., Payne, M.J., Campbell, S., Collins, M.D. and Kroll, R.G. (1993)
Journal of Applied Bacteriology, 74, 260.
61. Griffith, J., Blucher, A., Fieri, J. and Fielding, L. (1994) Food Science and Technology Today, 8,209.
62. Griffiths, M.W. and Phillips, J.D. (1989) In Rapid Microbiological Methods for Foods,
Beverages and Pharmaceuticals (eds С J. Stannard, S.B. Petitt and F.A. Skinner), Blackwell
Scientific Publications, Oxford, England, p. 13.
63. Gunasekera, Т., Attfield, P.V. and Veal, D.A. (2000) Applied and Environmental Microbiology,
66,1228.
64. Haikara, A. and Boije-Backman, S. (1982) Brauwissenschaft, 35,113.
65. Haikara, A., Mattila-Sandholm, T. and Manninen, M. (1990) Journal of the American Society
of Brewing Chemists, 48,92.
66. Harrison, J. and Webb, T.J.B. (1979)Journalofthe Institute of Brewing, 85, 231.
67. Harrison, M., Theaker, P.D. and Archibald, H.W. (1987) Proceedings of the 21st Congress of
the European Brewery Convention, Madrid, IRL press, Oxford, p. 168.
68. Heggart, H.M., Margaritis, A., Pilkington, H., Stewart, R.J., Dowhanick, T.M and Russell, I.
(1999) Master Brewers Association of the Americas Technical Quarterly, 36, 383.
69. Heggart, H., Margaritis, A., Stewart, R., Pilkington, H., Sobczak, J. and Russell, I. (2000)
Master Brewers Association of the Americas Technical Qurrterly, 37,409.
70. Herman, J.P.M., Jakubczak, E., Izard, D. and Leclerc, H. (1980) Canadian Journal of
Microbiology, 26,413.
71. Hermida, M., Taboada, M., Menendez, S. and Rodriguez-Otero J. L. (20Щ Journal of АО AC
International, 83,1345.
72. Hope, C.F.A. and Tubb, R.S. (\9S5)Journaloftke Institute of Brewing, 91, 12.
73. Hutcheson, T.C., McKay, Т., Farr, L. and Seddon, B. (1988) Letters Applied Microbiology, 6,85.
74. Hubner, P., Waiblinger, H.U., Pietsch, K. and Brodmann, P. (200A) Journal of АО А С
International, 84,1855.
75. Hutter, K.-J., Runessen, U. and Eipel, H.E. (1975)Journalofthe Institute of Brewing, 85, 21.
76. Hutter, K.-J. (1978) Brauwissenschaft, 31, 278.
77 Hutter, K.-J. (1991) Brauwissenschaft, 44, 216.
78. Hutter, K.-J. (1992a) Brauwelt International, 2,183.
79. Hutter, K.-J. (1992b) Monatsschrift fur Brauerei, 45, 280.
80. Hutter, K.-J. (1994) Brauwelt International, 12,334.
81. Hysert, D.W., Kovecses, F. and Morrison, N.M. (1976) Journal of the American Society of
Brewing Chemists, 34, 145.
82. Ingledew, W.M. (1979) Journal of the American Society of Brewing Chemists, 37, 145.
280
Инге Рассел, Роберт Стюарт
83. Jago, P.H., Stanfield, G., Simpson, WJ. and Hammond, J.R.M. (1989) In ATP Luminescence -
Rapid Methods in Microbiology (eds P.E. Stanley, B.J. McCarthy and R. Smither), Blackwell
Scientific Publications, Oxford, p. 53.
84. Javvad, G.M., Marrow, T. and Odumeru, J.A. (1998) JournalofRapid Methods and Automation
in Microbiology, 6, 297.
85. Jespersen, L., Lassen, S. and Jakobsen, M. (1993) International Journal of Food Microbiology,
17,321.
86. Jesperson, L. (199A)Journalofthe Institute of Brewing, 100,399.
87. Johnston, J.R. and Mortimer, R.K. (1986) International Journal of Systematic Bacteriology,
36, 569.
88. Joosten, H.M.L.J., Van Djjck, W.G.F.M., Spikker, J.W.M. and Traa, H.M. (1996)
Milchwissenschaft, 51, 202.
89. Jorgensen, H.L. and Schultz, E. (1985) International Journal of Food Microbiology, 2,177.
90. Juvonen, R., Satokari, R., Mallison, K. and Haikara, A. (1999)Journal of the American Society
of Brewing Chemists, 57, 99.
91. Kersters, K. and De Ley, J (1975) Journal of General Microbiology, 87,333.
92. Kilgour, WJ. and Day, A. (1983) Proceedings of the 19th Congress of the European Brewery
Convention, London, IRL press, Oxford, p. 177.
93 Klijn, N.. Weerkamp, A.H. and de Vos, W.M. (1991) Applied and Environmental Microbiology,
57, 3390.
94. Koch, H.A., Bandler, R. and Gibson, R.R. (1986) Applied and Environmental Microbiology, 52,599.
95. Krause, J.A. and Barney, M.C. (1987) Paper presented at the 53rd Annual Meeting of the
American Society of Brewing Chemists, Cincinnati, Ohio.
96. Kropp, G.L., Fucharoen, S. and Embury S.H. (1991) Blood, 78, 26.
97. Kruth, H.S. (1982) Analytical Biochemistry, 125, 225.
98. Kyriakides, A.L. and Thurston, P.A. (1989) In Rapid Microbiological Methods for Foods,
Beverages and Pharmaceuticals (eds C.J. Stannard, S.B. Pettit and F.A. Skinner), Blackwell
Scientific Publications, Oxford, p. 101.
99. Laidlaw, L., Tompkins, T. A., Savard, L. and Dowhanick, T M. (1996) Journal of the American
Society of Brewing Chemists, 54, 97.
100. Lampa, RA., Mikelson, D.A., Rowley, D.B., Previte, J.J. and Wells, R.W. (1974) Food
Technology, 28,52.
101. L'Anthoen, N. and Ingledew W.M. (1996) Journal of the American Society of Brewing
Chemists, 54, 32.
102. Laplace-Buihe, C, Hahne, K., Hunger W., Tirilly, Y. and Dorcourt, J.L. (1993) Biology of the
Cell, 78,123.
103. Laurent, F., Drocourt, J.L., Jakobsen, M., Peladan, F., Meersman, E., de Vasconcelos, L. and
Timmermans, P. (1993) Proceedings of the 24th Congress of the European Brewery Convention,
Olso, IRL press, Oxford, p. 487.
104. Legrand, M. and Ramette, P (1986) Cerevisia, 11, 173.
105. Lonvaud-Funel, A., Fremaux, C, Biteau, N. and Joyeux, A. (1991) Food Microbiology, 8, 215.
106. Lonvaud-Funel, A., Joyeux, A. and Ledoux, O. (1991) Journal of Appleid Bacteriology, 71,501.
107. Lonvaud-Funel, A., Guilloux, Y. and Joyeux, A. (1993) Journal of Appleid Bacteriology, 74,41.
108. Martens, F.B., van den Berg, R. and Harteveld, P.A. (1985) Proceedings of the 20th Congress
of the European Brewery Convention, Helsinki, IRL press, Oxford, p. 211.
109. Mattila, T. (1987) Journal of Food Protection, 50, 640.
110. Mattila, T. and Alivehmas, T. (1987) International Journal of Food Microbiology, 4, 157.
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 281
111. McElroy,W.D.(1947)Zoology,,342.
112. Meaden, P. (1990) Journalofthe Institute of Brewing, 96, 195.
113. Miller, R. and Galston, G. (1989)Journalofthe Institute of Brewing, 95, 317.
114. Millipore Technical Bulletin AB807, (1975).
115. Miteva, V.I., Abadjieva, A.N. and Stefanova, TzJ.(\992) JournalofApplied Bacteriology, 73,349.
116. Motoyama, Y., Ogata, Т., and Sakai, К. (Х997) Journal of the American Society of Brewing
Chemists, 56, 19.
117. Motoyama, Y., Funahashi, W. and Ogata, T. (2000) Journal of the American Society of
Brewing Chemists, 58,1.
118. Muirhead, K.A. and Horan, P.K. (1984) In Advances in Cell Culture, Vol. 3, (ed K. Maramorosch),
Academic Press, Inc., New York.
119. Mullis, K.B., Faloona, S.J., Scharf, S.J., Saiki, R.K., Horn, G.T. and Erlich, H.A. (1986) Cold
Spiing Harbor Symposium on Quantitative Biology, 51, 263.
120. Nakakita, Y., Takahashi, Т., Sugiyama, H., Shigyo, T. and Shinotsuka, K.(1998)Journalof the
American Society of Brewing Chemists, 56,114.
121. Navarro, A. Moreno, P. Carbonell, J.V. and Pinaga, F. (1987) Proceedings of the 21st Congress
of the European Brewery Convention, Madrid, IRL press, Oxford, p. 465.
122. Newsom, I.A., O'Donnell, D.C. and Mcintosh, J. (1992) Proceedings of the 22nd Convention
of the Institute of Brewing (Australian and New Zealand Section), Melbourne, 189.
123. Niwa, M. (1993) Brauwelt International, 11,149.
124. Owens, J.D., Thomas, D.S., Thompson, PS. and Timmerman, J.W. (1989) Letters in Applied
Microbiology, 9, 245.
125. Owens, J.D., Konirova, L. and Thomas, D.S. (1992) Journal of Applied Bacteriology, 72, 32.
126. Paton, A.M. and Jones, S.M. (1971) In Methods in Microbiology, Vol. 5A, (eds J.R. Norris and
D.W. Ribbons), Academic Press, London, p. 135.
127. Pedersen, M.B. (1983) Carlsberg Research Communications, 48,485.
128. Pedersen, M.B. (1985) Carlsberg Research Communications, 50, 263.
129. Pedersen, M.B. (1986) Carlsberg Research Communications, 51,163.
130. Peladan, F. and Leitz, R. (1991) Proceedings of the 23t Congress of the European Brewery
Convention, Lisbon, IRL press, Oxford, p. 481.
131. Perez, G., Cardell, E. and Zarate, V. (2000) Lait, 80,589.
132. Pettipher, G.I., Mansell, R., McKinnon, C.H. and Cousins, CM. (1980) Applied and
Environmental Microbiology, 39,423.
133. Pettipher, G.L. (1985) In Rapidmethods and Automation Microbiology and Immunology (ed
K.-O. Habermehl), Springer-Verlag, New York, p. 629.
134. Pettipher, G.L., Kroll, R.G., Farr, L.J. and Betts, R.P. (1989) In Rapid Microbiological
Methods for Foods, Beverages and Pharmaceuticals (eds C.J. Stannard, S.B. Pettit and F.A.
Skinner), Blackwell Scientific Publications, Oxford, p. 33.
135. Phillips, A.P. and Martin, K.L. (1988) Journal о 1 Applied Bacteriology, 64,47.
136. Philpott, J., Taylor, D.M. and Williams, D.R. (1977) Journal of the American Society of
Brewing Chemists, 55,99.
137. Pishawikar, M.S., Sinhal, R.S. and Kulkarni, P.R. (1992) Trends in Food Science and
Technology, 3,165.
138. Portno, A.D. and Molzahn, S.W. (1975) Brewers Digest, 3,44.
139. Quain, D. (1999,) Proceedings of the 27th Congress of the European Brewery Convention,
Cannes, IRL Press, Oxford, p. 239.
282
Инге Рассел, Роберт Стюарт
140. Querol, A., Barrio, E. and Ramon, D. (1992) Systematic and Applied Microbiology, 15,439.
141. Rainbow, С (1981) I Brewing Science, Vol. 2 (ed J.R.A. Pollock), Academic Press, London,
p. 491.
142. Reyes-Gavilan, C.G. de los, Limsowtin, K.Y., Tailliez, P., Sechaud, L. and Accolas, J.-P
(1992) Applied and Environmental Microbiology, 58, 3429.
143. Richards, M. (1970) Wallerstein Laboratory Communications, 33, 97.
144. Russell, I., Dowhanick, T.M. and Stewart R. (2000) US Patent 6.103468.
145. Russell, W.J., Farling, S.R., Blanchard, G.C. and Boling, E.A. (1975) In Microbiology (ed D.
Schlessinger), American Society for Microbiology, Washington, DC, p. 22.
146. Sakamoto, K., Funahashi, W., Yamashita, H. and Eto, M. (1997) Proceedings of Congress of
the 26th Congress of the European Breweiy Convention, Maastricht, IRL Press, Oxford, p 631.
147. Salzman, G.C. (1982) In Cell Analysis, Vol. 1, (ed N. Catsimpoolas), Plenum Publishing
Corporation, New York, p. 111.
148. Sami, M., Yamashita, H., Kadokura, K., Kitamoto, K., Yoda, K. and Yamasaki, M. (1997)
Journal of the American Society of Brewing Chemists, 55, 137.
149. Savard, L. and Dowhanick, T.M. (1993) Presented at the 59th Annual Meeting of the American
Society of Brewing Chemists, Tucson, June 12-16.
150. Savard, L., Hutchinson, J. and Dowhanick, T.M. (199A) Journal of the American Society of
Brewing Chemists, 52, 62.
151 Schaertel, B.J., Tsang, N. and Firstenberg-Eden, R. (1987) Food Microbiology, 4, 155.
152. Simpson, W.J. (1989) Brewers' Guardian, 118, 20.
153. Simpson, W.J. (1990) In Proceedings of the Third Aviemore Conference on Malting, Brewing
and Distilling (ed I. Campbell), Institute of Brewing, London, p. 161.
154. Simpson, W.J. (1991) Brewers' Guardian, 120, 30.
155. Simpson, W.J. and Hammond, J.R.M. (1989) In ATP Luminescence — Rapid Methods in
Microbiology (eds, Р.Е. Stanley, B.J. McCarthy and R. Smither), Blackwell Scientific
Publications, Oxford, p. 45.
156. Simpson, W.J., Hammond, J.R.M., Thurston, Р.А. and Kyriakides, A.L. (1989) Proceedings of
the 22ml Congress of the European Brewery Convention, Zurich, IRL press, Oxford, p. 663.
157. Sohier, D. and Lonvaud-Funel, A. (1998) Food Microbiology, 15,391.
158. Stanley, Р.Е. (1992) Journal of Bioluminescence and Chemiluminescence, 7,11.
159. Stanley. Р.Е. (1989) In ATP Luminescence: Rapid Methods in Microbiology (eds Р.Е. Stanley,
B.J. McCarhey, and R. Smither) Blackwell Scientific Publications, Oxford, p. 1
160. Steffan, R.J., Breen, A., Atlas, R.M. and Sayler, G.S. (1989) Canadian Journal ofMicrobiology,
35,681.
161. Steniuse, V., Majamaa, E., Haikara, A., Henriksson, E. and Virtanen, H. (1991) Proceedings of
the 23rd Congress of the European Brewery Convention, Lisbon, IRL press, Oxford, p. 529.
162. Storgards, E. (2000) In Process Hygiene Control in Beer Prvduction and Dispensing. VTT
Publication 410, Espoo, pp. 105.
163. Storgards, E., Suihko, M-L, Pot, В., Vanhonacker, K., Janssens, D., Broomfield, P.L.E. and
Banks, J.G. (1988) Journal ofthe Institute of Brewing, 104, 47.
164. Storgards, E., Simolar, H. Sjoberg, A-M. and Wirtanen, G. (1999a) Part C: Food
Bioproduction. Proceeding and Transactions of the Institute of Chemical Engineers, 11, 137.
165 Storgards, E., Yli-Juuti, P., Salo, S., Wirtanen, G. and Haikara, A. (1999b; Proceedings of the
27h Congress of the European Brewery Convention, IRL Press, Oxford, p. 249.
166. Taidi B. and Hodgson, J. (2000) In Brewing Yeast Fermentation Performance (ed К Smart)
Blackwell Science, U.K. p. 136.
Глава 8. Быстрые (ускоренные) методы обнаружения и идентификации ... 283
167. Takahashi, Т., Nakakita, Y, Watari, J. and Shinotsuka К. (2000) Journal of Bioscience a
Bioengineering, 89, 509.
168. Takamura, O., Nakatani, K., Taniguchu, T. and Murakami M. (1989) Proceedings of the 22nd
Congress of the European Brewery Convention, Zurich, IRL press, Oxford, p. 148.
169. Thompson, A.N. and Jones, H.L. (1997) In A Practical Guide to Industrial Uses of ATP
Bioluminescence in Rapid Microbiology, (eds P.E. Stanley, R. Smither and W.J. Simpson),
Сага Technology limited, Lingfield, Surrey UK, p. 125.
170. Tortorello, M.L. and Reineke, K.F. (2000) Food Microbiology, 17,305.
171. Tortorello, M.L., Stewart, D.S. and Cray, W.C. Jr. (1996) Veterinary Microbiology, 51, 343.
172. Traganos, F. (1984) Cancer Investigation, 2,149.
173. Tse, K-M. and Lewis, CM. (1984) Applied and Environmental Microbiology, 48,433.
174. Tsuchiya, Т., Fukazawa, Y. and Kawakita, S. (1965) Mycopathologia et Mycologia Applicata,
26,1.
175. Tsuchiya, Y., Kaneda, H., Kano, Y. and Koshino, S. (\992) Journal of the American Society of
Brewing Chemists, 50, 64.
176. Tsuchiya, Y., Yasukazu Nakakita, Y., Watari, J. and Shinotsuka, K. (2002) Journal of the
American Society of Brewing Chemists, 58,89.
177. Umesh-Kumar, S. and Nagarajan, L. (1991) Folia Microbiologica, 36,305.
178. Unkel, M. (1990) Brauwelt, 4,100.
179. Van Vuuren, HJJ. and Van Der Meer, LJ. (1987) American Journal of Enology and
Viticulture, 38,49.
180. Van Vuuren, HJJ. and Van Der Meer, LJ. (19SS)Journalofthe Institute of Brewing, 94,245.
181. Van Vuuren, HJJ., Kersters, K., De Ley, J. and Toerien, D.F. (1981) Journal of Applied
Bacteriology, 51,51.
182. Vancanneyt, M., Pot, В., Hennebert, G. and Kersters, K. (1991) Systematic and Applied
Microbiology, 14,23.
183. Vanne, L., Karwoski, M., Karppinen, S. and Sjoberg, A.M. (1996) Food Control, 1, 263.
184. Vezinhet, F., Blondin, B. and Hallet, J.N. (1990) Applied Microbiology and Biotechnology, 32,
568.
185. Vidgren G., Palva, I., Pakkanen, R., Lounatmaa, K. and Palva, A. (1992) Journal of
Bacteriology, 174,7419.
186. Walmsley, R.M., Wikinson, B.M. and Kong, Т.Н. (1989) Bio/Technology, 7,1168.
187. Waugh, R. and Powell, W. (1992) Trends in Biotechnology, 10,186.
188. Wetmur, J.G. (1991) Critical Reviews in Biochemistry and Molecular Biology, 26, 227.
189. Whiting, M., Crichlow, M., Ingledew, W.M. and Ziola, B. (1992) Applied and Environmental
Microbiology, 58,713.
190. Williams, J.G.K., Kubelik, A.R., Livak, K.J., Rafolski, J.A. and Tingey, S.V. (1991) Nucleic
Acid Research, 18, 6531.
191. Winter, F.H., York, G.K. and EI-Nakha, H. (1971) Applied Microbiology, 22,89.
192. Yasui. T. (1996) Proceedings of the 24th Convention of the Institute of Brewing, (March/AP
Section), Singapore, 24, p. 228.
193. Yasui,T.,Taguchi, H.and Kamiya,T. (1989) Proceedings of the 22nd Congress of the European
Brewery Convention, Zurich, IRL press, Oxford, p. 190.
194. Ziola, В., Ulmer, M., Bueckert, J. and Giesbrecht, D. (2000) Journal of the American Society
of Brewing Chemists, 58(2), 63.
Глава 9
БЫСТРАЯ (УСКОРЕННАЯ) ИДЕНТИФИКАЦИЯ
МИКРООРГАНИЗМОВ
Фергюс Г. Прист (Fergus G. Priest)
9.1. Что такое идентификация?
Присвоение названия микроорганизму — задача самоценная, позволяющая в те-
чение длительного времени проводить сравнение дрожжей и бактерии, определять
пути контаминации и удовлетворять обычное научное любопытство. Хотя иденти-
фикация бактерий и дрожжей становится в принципе все легче, для обычной микро-
биологической лаборатории, увы, она до сих пор остается довольно сложной.
Идентификация — это отнесение некоторого неизвестного микроорганизма к оп-
ределенной ячейке существующей классификации. Классификация может быть об-
щей — классификацией микроорганизмов, предназначенной для широкого исполь-
зования в микробиологии и основанной на молекулярных и фенотипических
критериях, а может быть специальной классификацией, созданной для использова-
ния лишь в микробиологии пивоварения и включающей только те микроорганизмы,
которые к нему имеют отношение. В последнем случае классификация должна со-
гласовываться с общей классификацией и просто представлять собой отдельный ее
раздел. В настоящее время различные классификации представлены в виде компью-
терных баз данных и позволяют быстро и эффективно получить ответ на вопрос
о принадлежности микроорганизма к тому или иному роду или виду.
Что касается общих классификаций, открытые базы данных нуклеиновых кислот
ведутся организациями под названиями GenBank и European Molecular Biology
Organization. Эти базы данных становятся важнейшим хранилищем информации по
геномам микроорганизмов и предоставляют широкие возможности для их идентифи-
кации. Альтернативные коммерческие компьютерные базы данных для идентифика-
ции микроорганизмов включают информацию по молекулярному типнрованию (для
использования при риботипировании, см. раздел 9.3.2), информацию по фенотипам
(поддерживаемую такими фирмами, как Biolog и API, в целях их использования
с идентификационными тест-наборами данных фирм, см. раздел 9.6.1) и информа-
цию по составу жирных кислот (которая используется в идентификационной систе-
ме MIDI, см.раздел 9.5.1). Каждая из этих баз данных может быть использована для
идентификации микроорганизмов пивоваренного производства.
Хотя пищевая промышленность и индустрия напитков тратят ежегодно миллионы
долларов на микробиологические анализы, они касаются в основном определения
численности микроорганизмов, но также включают и выявление либо потенциаль-
ных патогенов, либо микроорганизмов, участвующих в порче продукта и ухудшении
его качества. Если микробиолога, работающего в пищевой промышленности, освобо-
дить от необходимости подсчета микроорганизмов, то он сможет выполнять больше
работ по их идентификации [30]. Из детального изучения микроорганизмов в про-
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 285
цессе переработки пищевых продуктов или в изготовления пива можно извлечь мно-
го полезного, но такие исследования ведутся очень редко из-за отсутствия ресурсов.
Тем не менее правильная идентификация загрязняющих продукт микроорганизмов
и микробиологическое обследование предприятия и сырья могут определить источни-
ки контаминации и предложить решение проблемы микробиологической стабильно-
сти. В этой главе мы рассмотрим наиболее эффективные, недорогие, быстрые проце-
дуры, доступные в настоящее время для проведения идентификации микроорганизмов
на пивоваренном предприятии.
9.2. Разные подходы к идентификации
Для сбора информации и создания баз данных для идентификации микроорганиз-
мов они могут быть подвергнуты анализу на различном уровне. «Верхний» уровень —
это геном и его копия в виде РНК. Нуклеиновые кислоты являются информационны-
ми макромолекулами, а это означает, что они характеризуются определенной после-
довательностью, являющейся своего рода «руководством» для клетки и управляю-
щей синтезом клеточных белков. Абсолютную идентификацию могло бы обеспечить
определение полной последовательности нуклеотидов клеточного генетического ма-
териала, но хотя это и было выполнено для Saccharomyces cerevisiae и большого числа
бактерий, проводить такое определение в целях идентификации, конечно, нецелесо-
образно. С другой стороны, возможность быстрой и эффективной идентификации
предоставляет секвенирование (определение первичной структуры) специфических
генов.
Для определения степени сходства последовательностей оснований ДНК различ-
ных микроорганизмов может быть проведено разделение молекулы ДНК на одиноч-
ные цепи с последующей их гибридизацией с одноцепочечными участками ДНК из
других микроорганизмов. Это позволяет непосредственно определить степень род-
ства при отсутствии информации о структуре самой последовательности. Гибриди-
зация ДНК создает базу для общепринятого определения видов в систематике бак-
терий; при проведении этого анализа штаммы одного и того же вида будут
гибридизировать более чем на 70% [27]. Подобную методику можно использовать
для сравнения ДНК и РНК. Начиная с 1980-х гг. методы гибридизации внесли важ-
ный вклад в таксономию микроорганизмов, положив начало развитию генетическо-
го зондирования. ДНК-зонды представляют собой уникальные последовательности
нуклеотидов, которые гибридизируются только с данным специфическим геном или
генами. При грамотном выборе последовательности ее обнаружение в геноме микро-
организма может использоваться как точный способ идентификации [20, 47].
Наконец, революцию в использовании нуклеиновых кислот для генетического
анализа произвела цепная реакция полимеразы (ЦРП), описанная в главе 8. Она
легла в основу многих методов идентификации, фактически обеспечивая специфич-
ность подхода самой своей природой. Генетическая информация экспрессируется
в виде белков. Определение аминокислотной последовательности является дорого-
стоящей и требующей продолжительного времени процедурой, применять которую
для проведения ускоренной идентификации не целесообразно. Наоборот, электро-
форез, то есть определение способности белковых молекул мигрировать под влия-
нием электрического поля через гель, — широко распространенный метод для реше-
286
Фергюс Г. Прист
ния проблем таксономии и идентификации. Как способ идентификации может быть
использован также электрофорез экстракта всех белков микроорганизма, который
может считаться эффективным с точки зрения расхода проб несмотря на то, что он
недостаточно быстр [32]. Важным инструментом диагностики являются иммуноло-
гические методы, часто ориентированные на белки.
Общий состав клетки может быть проанализирован разными методами, которые
применяются к целым клеткам или к отдельным клеточным экстрактам. Например,
профиль внутриклеточных и мембранных липидов может быть получен методом га-
зовой хроматографии (ГХ). Целые клетки могут быть подвергнуты пиролизу, а про-
дукты распада определены с помощью масс-спектрометрии (МС) для получения
«отпечатков пальцев» микроорганизмов. Наконец, после исследования целого ряда
физических методов на предмет их применения для характеристики микроорганиз-
мов особенно ценной оказалась инфракрасная спектроскопия Фурье (FT-IR, Fourier
transform-infrared spectroscopy), которая будет рассмотрена ниже.
Большинство обычных методов идентификации основаны на морфологии и фи-
зиологии. В имеющихся наборах для микробиологических анализов определяется
наличие или отсутствие тех или иных ферментов или использование тех или иных
путей метаболизма. Для обеспечения ускоренной идентификации неизвестных
культур с использованием этого подхода могут быть созданы специализированные
компьютеризированные базы данных.
Ниже мы более детально рассмотрим некоторые новые методы идентификации
микроорганизмов, их описания (часто называемого «снятием отпечатков пальцев»
или «профилированием»), а также применения этих «отпечатков» в целях иденти-
фикации.
9.3. Идентификация микроорганизмов по нуклеиновым
кислотам
9.3.1. Гены рибосомной РНК
В большинстве современных молекулярных систем классификации используются
гены, кодирующие молекулы РНК, которые обеспечивают структурные и функцио-
нальные характеристики рибосомы. Эти рибосомные РНК расположены в малых
субъединицах (ssu) рибосом и относятся к 165рРНК у прокариотов и к 185рРНК для
эукариотои, d маетности, дрожжей. В большой субъединице (Isu) рибосом содержатся
соответственно более крупные молекулы (235 и от 25-285у прокариотов и эукариотов
соответственно; 5 означает скорость седиментации при центрифугировании и исходно
используется для определения размеров этих частиц). Важность этих генов рибосом-
ной РНК обусловлена тем, что:
• они распространены повсеместно, то есть рибосомы содержатся во всех клет-
ках;
• в этих генах имеются неизменные участки, которые прослеживаются по всему
эволюционному спектру — от Escherichia сой до человека, а также участки, кото-
рые в эволюционном смысле меняются довольно быстро. Следовательно, такие
последовательности можно использовать для сравнения видов разной степени
сходства;
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 287
• подобные неизменные участки последовательностей представляют собой пре-
восходные сайты-мишени для ЦРП- праймеров;
• рибосомная РНК малых субъединиц содержит в своих примерно 1800 нуклео-
тидах достаточно информации, чтобы обеспечить надежную классификацию
и эффективную идентификацию; определение последовательностей много вре-
мени не занимает.
Последовательности рРНК легли в основу современной молекулярной филоге-
нетической (эволюционной) классификации. Были определены и проанализирова-
ны многие тысячи последовательностей рРИК для всех типов микроорганизмов.
Ключевая идея такой классификации заключается в том, что гены по мере своей
эволюции аккумулируют мутации. Чем больше различаются два гена из разных ис-
точников, тем больше времени прошло с тех пор, как они отделились от общего
предка, и тем больше времени было для накопления различий. Таким образом, ДНК
может считаться своего рода молекулярными часами, на которых время эволюции
отсчитывается по количеству аккумулированных мутаций и различий в последова-
тельности нуклсотидов. Следовательно, можно сравнить последовательности от
двух организмов и оценить, насколько давно они отделились от общего предка или,
другими словами, насколько дальними родственниками они являются (подробнее
об этом см. [9]). В базе данных рРНК (RDP, rRNA Database Project) имеются сведе-
ния о последовательностях всех рРНК (http://rdp.cme.msu.edu/html/) с возможнос-
тью проанализировать эти последовательности и скачать с сайта различные
классификации.
9.3.2. Идентификация микроорганизмов с использованием
рибосеквенирования (филотипирование)
База данных ssu рРНК-последовательностей — самая обширная база данных по
любому из генов и является отличным ресурсом для идентификации микроорганиз-
мов. Для высвобождения достаточного количества ДНК для амплификации (см. гла-
ву 8) неизвестные микроорганизмы могут быть подвергнуты кипячению, а для при-
готовления матрицы ДНК можно использовать экстракцию ДНК из малых объемов.
Праймеры для амплификации ssu рРНК из любых организмов хорошо известны [34],
а участок данной ssu рРНК секвенируют из ЦРП-продукта. Современные капилляр-
ные ДНК-секвенаторы дают за один проход последовательность из около 500 пар
оснований (bp, base pairs), что обычно бывает достаточно для приемлемой иденти-
фикации. Как только последовательность получена, она подвергается BLAST-nowc-
ку [1] по какому-либо открытому сайту типа NCBI (http://www3.ncbi.nlm.nih.gov/
Entrez/index.html) или RDP(o нем см. выше). По существу идентификация заключа-
ется в сравнении анализируемой последовательности с последовательностями из
базы данных, и результатом являются названия микроорганизмов, чьи ssu pPHK-
генов образуют наиболее близкое соответствие. Как правило, идентификацию обес-
печивает сходство на 99 или 100%. Эта технология была поставлена на коммерче-
скую основу фирмой Perkin-Elmer Biosystems (г. Фостер Сити, штат Калифорния),
создавшей систему идентификации бактерий MicroSeq 500 (с базой данных, про-
граммным обеспечением и наборами реактивов для микробиологического анализа).
Обычно для проведения идентификации требуется от 15 до 18 ч. Существенным пре-
288
Фергюс Г. Прист
имуществом этой системы является возможность создать специализированную базу
данных для бактерий, имеющих значение для пивоваренного производства.
Одним из ключевых моментов для рибосеквенирования является выбор участка
ssu гена рРНК, где будет определяться последовательность. Чтобы обеспечить макси-
мальное разделение, лучше всего выбрать 500 оснований наиболее изменчивой обла-
сти. У разных бактерий эти участки могут быть различными. Относительно недавно
таким образом исследовали целый ряд молочнокислых бактерий, участвующих в бро-
жении при производстве шотландского виски. Их штаммы были идентифицированы
по первым 500 основаниям, но в некоторых случаях для точного различения близко-
родственных видов требовались данные почти для 900 оснований. Были выделены
такие бактерии, как Lactobacillus brevis, Lactobacillus fermentum, Lactobacillus paracasein
Lactobacillus plantarum и новый микроорганизм, названный Lactobacillus ferintoshensis
(по названию поместья в Шотландии, где появился древний «брэнд» виски Ferintosh)
[50]. Аналогичным образом для различения бактерий рода Bacillus, формирующих
эндоспоры, удобен участок 5'-конца [25], а для исследования бактерий, встречающих-
ся в клинической практике, методом рибосеквенирования последовательности из
примерно 370 пар оснований был использован дистальный конец гена [59]. Более
широко этот подход был использован в клинической лаборатории, где для идентифи-
кации бактерий применялась система MicroSeq 500, доказавшая свою высокую точ-
ность [54]. Наборы для идентификации «MicroSeq 500» и базы данных могут также
применяться для идентификации дрожжей и плесеней (о соответствующих услугах
в этой области см. сайт фирмы Accugenix — www.accugenix.com).
Однако в использовании рибосеквенирования есть свои неудобства. Во-первых,
некоторые бактерии, принадлежащие к различным видам, эволюционно разошлись
относительно недавно, и их ssu рРИК-генов идентичны или почти идентичны. Хотя
такие примеры редки, такие бактерии, конечно, не могут быть различимы сравнени-
ем последовательностей. Например, Lb. casei и Lb. paracasei трудно различить с по-
мощью лишь последовательности рРНК [50]. Еще одним лимитирующим фактором
является цена. Эксплуатация системы Microseq обходится в $ 84 за один анализ,
включая наборы, реактивы и стоимость рабочей силы [54], однако эта стоимость мо-
жет быть существенно снижена путем исключения тест-наборов и использования
открытых баз данных.
9.3.3. Гибридизация ДНК
Для образования двойной молекулы одноцепочечная ДНК (оцДНК) гибридизи-
руется с комплементарной 5$ДНК. Если в одну из этих цепей ввести радиоактивную
или цветную метку, гибрид можно будет идентифицировать (см. рис. 8.3 в главе 8).
Этот прием лежит в основе одной из самых эффективных технологий молекулярной
биологии, широко используемой для идентификации в форме ДНК-зонда. Привле-
кательность этого метода для решения проблем идентификации микроорганизмов
заключается в том, что ДНК-зонд, состоящий из более чем 20 нуклеотидов, является
статистически уникальным, и если он гибридизируется с некоторой частью генома
микроорганизма, это позволяет очень точно его идентифицировать. Основными эта-
пами при выполнении такого анализа являются а) создание зонда, б) внесение в зонд
метки, в) приготовление ДНК-мишени, г) гибридизация и д) выявление гибридов.
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 289
Ниже мы кратко рассмотрим эти этапы, чтобы дать представление о происходя-
щих процессах и подчеркнуть, что они все более упрощаются. Подробнее об этом см.
[3,48].
а) Зонд
Существуют два широких класса зондов: зонды, направленные на неизвестные
участки хромосомы, и зонды, нацеленные на специфические гены. Зонды первой
группы в настоящее время используются редко, и наиболее типичным примером яв-
ляется использование собственно хромосомной ДНК. Для микроорганизмов, подпа-
дающих под геномное определение видов (то есть штаммов с более чем 70%-ным
сходством последовательностей ДНК), в качестве зонда может быть использована
хромосомная ДНК, так как она должна обладать менее чем 70%-ным сходством (на
практике обычно менее 30%) с последовательностями ДНК микроорганизмов дру-
гих видов. Таким образом, эта ДНК будет сильно гибридизироваться с ДНК от пред-
ставителей своего вида и слабо — со всеми другими образцами ДНК (рис. 9.1). Обыч-
но так и происходит, поэтому используя соответствующие контрольные образцы
ДНК можно точно идентифицировать, например, Campylobacter — бактерию, инфи-
цирующую пищевые продукты [11].
Для точной идентификации близкородственных бактерий специфичности хромо-
сомной ДНК недостаточно, и их идентификация требует определенных генных
фрагментов. Например, можно клонировать случайные участки ДНК и исследовать
Рис. 9.1. Пример реакции гибридизации «слот-блот». Образцы хромосомной ДНК наносятся на
нитроцеллюлозную мембрану с помощью «слот-блот»-матрицы и гибридизируются с нерадиоак-
тивно помеченным (дигоксигенином) хромосомным ДНК-зондом. Положительные реакции прояв-
ляются в виде темных полос и свидетельствуют о видовой идентификации. Негативные реакции —
более светлые (не отличающиеся от фона) полосы, свидетельствующие о видовой принадлежно-
сти, отличной от ДНК-зонда
290
Фергюс Г. Прист
их на специфичность. Такой подход успешно использовался для идентификации
Lactobacillus [14,40] и Streptococcus [49].
Гораздо чаще зонды специфичны определенным локусам ДНК-мишени. Таким
локусом может быть ген, ответственный за некую метаболическую особенность, за
фактор вирулентности (что часто применяется в диагностической клинической
практике) или, например, ген, кодирующий рРНК. Зонды, специфичные кодирую-
щим белки генам, могут быть созданы из клонированного гена или, если это невоз-
можно, а последовательность такого гена известна, может быть синтезирован олиго-
нуклеотид, комплементарный части этого гена. Самый простой способ изготовить
зонд к любой известной последовательности гена — это амплифицировать ген из
хромосомной ДНК, используя ЦРП, и включить в реакцию меченый нуклеотид. Та-
ким образом, в ходе одной ЦРП может быть создано большое число меченых зондов.
Особенно хорошо подходят в качестве мишеней для зондов молекулы ssu и Isu
рРНК, так как они существуют в виде большого числа копий (104-105 молекул на
одну бактериальную клетку), значительно увеличивая, таким образом, чувствитель-
ность гибридизации. Внутри этих генов есть высоко вариабельные участки, сильно
различающиеся у разных видов микроорганизмов, и, соответственно, ценные для
идентификации видов. Другие области генов более консервативны, и их последова-
тельности идентичны для всех видов данного рода. Такие участки, следовательно,
удобны для создания зондов, определяющих родовую принадлежность. В результате
путем комбинации этих факторов создаются зонды для гена рРНК, применяющиеся
для идентификации бактерий. О возможностях применения этой технологии см. [48].
б) Мечение и детекция зонда
Единственным препятствием для широкого внедрения методов гибридизации
ДНК в пищевую промышленность являлось то, что первоначально зонды метили ра-
диоизотопами. Хотя до сих пор иногда отдают предпочтение радиоизотопам, обеспе-
чивающим большую чувствительность, для рутинного применения обычно исполь-
зуют простые и надежные системы введения и обнаружения нерадиоактивной метки.
Популярные системы, доступные в виде промышленно выпускаемых наборов, осно-
ваны на включении в зонд биотина и дигоксигенина (растительного стероида). После
проведения гибридизации меченые зонды определяют с помощью ферментных реак-
ций, в которых фермент (например, щелочная фосфатаза) связан с авидином или ан-
тителом. Связанный фермент затем определяется колориметрически. В настоящее
время модифицированная технология этой системы позволяет обеспечить большую
чувствительность, простоту применения и отсутствие рисков, связанных с радиоак-
тивностью.
в) Приготовление ДНК-мишени
ДНК-мишень может быть получена в относительно чистом виде прямо из колоний
на чашке. При такой «гибридизации колонии» микроорганизмы переносят на нитро-
целлюлозную или нейлоновую мембрану, подвергают лизису, и ДНК частично очи-
щают путем обработки мембраны протеазой и детергентом. Затем ДНК связывают
с мембраной тепловой или УФ-обработкой и гибридизируют с меченым зондом. Пос-
ле проведения реакции выявляют колонии, в которых прошла гибридизация.
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 291
Процедуре гибридизации колонии часто мешает сильный фон, возникающий в
результате неспецифического связывания клеточного материала с зондом. При та-
ких обстоятельствах лучше очистить ДНК из культур микроорганизмов, используя
обычную процедуру. Затем ДНК денатурируют и наносят штрихом на мембрану,
используя «дот-блот» или «слот-блот»-матрицу. Эти приспособления позволяют
проводить иммобилизацию на мембране большого числа образцов ДНК в ограни-
ченных областях — «дотах» (точках)) или «слотах» (полосках или щелях). Затем
мембрана может быть гибридизирована со специфическим ДНК-зондом, после чего
отслеживают положительный результат реакции гибридизации (рис. 9.1).
Инновационной процедурой идентификации, которая больше подходит для при-
менения в пищевой промышленности и индустрии напитков, является метод обрат-
ной гибридизации, предоставляющий особые возможности при контроле качества.
В этом случае следует взять, например, пробу пива и отфильтровать его, чтобы полу-
чить биомассу микроорганизмов. Затем приготавливают общую ДНК и вводят в нее
нерадиоактивную метку путем ПЦР-амплификации. Эталонная мембрана или пла-
та для микротитрования заполнена пятнышками проб различных денатурированных
ДНК известных микроорганизмов (например, типичных представителей молочно-
кислых бактерий или дрожжей). Помеченная ДНК из образца гибридизируется со
всем рядом проб, и затем выявляют все связавшиеся ДНК. Любые гибриды, выяв-
ленные в результате гибридизации, например, с пробами ДНК Lb. brevis и Pectinatus,
будут свидетельствовать, что эти бактерии присутствуют в исходной пробе. Данный
подход был разработан для обнаружения в пищевых продуктах и идентификации
листерий [35], а в питьевой воде — энтерококков [6], но его можно использовать
и для идентификации других микроорганизмов.
Основным препятствием для внедрения техники гибридизации в работу систем
контроля качества или научно-исследовательских лабораторий — это трудности в
работе на молекулярном уровне. Многие проблемы были устранены с внедрением
наборов для внесения и обнаружения меток, производящихся большинством круп-
ных фирм, работающих в области биотехнологий. Как только специфическая ми-
шень идентифицирована, зонд можно быстро приготовить с помощью ПЦР при ус-
ловии доступности данной последовательности ДНК.
9.3.4. Гибридизация флуоресценцией in situ (FISH)
Гибридизация флуоресценцией in situ {FISH, Fluorescence In Situ Hybridization), ис-
пользующая специфические рРНК олигонуклеотидные зонды, дает возможность бы-
строй и специфической идентификации клеток микроорганизмов в их естественной
среде [3]. При этом методе гибридизации флуоресцентно меченый зонд, специфич-
ный для внутриклеточной рРНК, используется для гибридизации с таксон-специ-
фичными участками рРНК. Специфичность реакции приводит к тому, что гибриди-
зацию показывают только штаммы определенных видов или родов и, таким образом,
под микроскопом флуоресцируют именно они. Четыре стадии FISH — фиксация и
пермеабилизация (придание пробе проницаемости), гибридизация, промывка дл
я удаления не связавшегося зонда и обнаружение под микроскопом или путем про-
точной цитометрии — занимают всего несколько часов. Этот метод был с энтузиаз-
мом воспринят специалистами-микробиологами в области экологии [4] и применен
292
Фергюс Г. Прист
в пивоваренной и винодельческой промышленности. Было показано, что метод FISH
можно использовать для анализа пива на присутствие Pectinatus без обязательной
стадии предварительного культивирования [64]. Проведенное таким образом опреде-
ление бактерий было завершено в течение 5 ч (вместо нескольких суток, необходи-
мых при обычном анализе). Этот метод был также отработан и для обнаружения
в винах дрожжей Dekkera bruxellensis (Brettanomyces) [51 ]. Оказалось, что он характе-
ризуется высокой чувствительностью и позволяет достоверно идентифицировать
вредные дрожжи в присутствии других дрожжевых штаммов. Предварительное куль-
тивирование образцов на мембранном фильтре для получения микроколоний облег-
чает обнаружение как дрожжей, так и бактерий [39].
9.3.5. Некоторые ЦРП-методы
Применение реакции ЦРПдля обнаружения микроорганизмов в пивоваренном
производстве описано в разделе 8.14, и здесь мы лишь кратко опишем ее использова-
ние для идентификации этих микроорганизмов. Идентификация видов бактерий
и дрожжей посредством ЦРПзависит от выбора олигонуклеотидных праймеров, ис-
пользуемых в реакции ЦРП, которые будут связываться со специфическими после-
довательностями ДНК в геноме микроорганизма. В основе этого, как мы уже отмеча-
ли выше, лежит реакция гибридизации. На идентификацию микроорганизма в этом
случае указывают положительная реакция или продукты реакции характерного раз-
мера. Эти продукты можно визуализировать путем гибридизации, но они также про-
являются в виде полос в агарозном геле после электрофореза.
а) Методы с использованием генов рРНК
В качестве мишени для ЦРПпраймеров обычно используют гены, отвечающие за
рРНК (в том числе и из-за наличия крупных баз данных по последовательностям,
что позволяет легко конструировать праймеры). Специфические реакции ЦПР с ис-
пользованием рРНК были разработаны для различных бактерий, включая Lb. brevis
[31], Lb. lindneri [31, 65], Megasphaera cerevisiae и видов Pectinatus [31, 45]. В [46] в
качестве мишени для выявления лишь загрязняющих бактерий был выбран ген fiorA,
ответственный за устойчивость лактобактерий к хмелю.
Если обычная ЦРПдля визуализации результатов реакции требует проведения
электрофореза в агарозном геле, ЦРПв режиме реального времени дает возможность
наблюдать реакцию в процессе развития. Таким образом, может контролироваться
образование продуктов реакции и визуализироваться положительные реакции. Та-
кой подход был использован в медицине, например, для идентификации стафило-
кокков, однако вместо обычного контроллера температуры ЦПР он требует исполь-
зования дорогостоящего оборудования [17].
б) Метод использования промежуточных последовательностей
Другим популярным сайтом рРНК-генов для адресования праймера является
промежуточная область между генами ssun Isu рРНК. Этот участок с несколькими
сотнями пар оснований у эукариотов больше, чем у прокариотов (рис. 9.2) и может
быть амплифицирован использованием праймеров для консервативных участков ssu
и Isu рРНК, которые дают продукты ЦРП, включающие концы генов и находящуюся
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов
293
между ними последовательность (см. рис. 9.2). Внутренние транскрибированные
спейсеры (ITS) из-за того, что они не кодируют продукты функциональных генов,
накапливают мутации быстрее, чем гены, ответственные за сами рРНК, в связи с чем
их использование для идентификации дает хорошую возможность для различения
штаммов близкородственных видов. Продукты этих участков спейсеров могут вклю-
чать несколько отличающихся по размерам классов, и в этом случае их можно разде-
лить в геле и получить наборы полос, пригодные для идентификации видов (для
многих микроорганизмов, к сожалению, разрешение оказывается недостаточным).
А
NTS2 5* ETS -► ITS1 1TS2 ^- 3' ETS NTS1
%кь£К1 1—ESSSSS2S3 БЗЭ—EK2SSE2S3 1 Б&2ШЕ S. cerevisiae
5S 18S 5.8S 25S 5S
В
—ВВВЬЯЗ КЗ—КЗ—^—БШЗ Бактерии
16S tRNAl,etRNAa,a 23S 5S
Рис. 9.2. Структура оперонов рибосомной РНК: А) у дрожжей (S. cerevisiae; по [62]) и В) у бактерий.
Обозначения: A: NTS — нетранскибируемый спейсер; ETS — внешний транскибируемый спейсер;
ITS — внутренний транскибируемый спейсер; 5S, 5.8S, 18S и 25S — гены рРНК; линиями обозначены
спейсеры. В: у некоторых бактерий имеется два гена транспортной РНК, как показано на рисунке,
у других же либо один (тРНК°,и, тРНК1* или тРНКа,а), либо ни одного. 5S, 18S и 23S — гены рРНК, линиями
обозначены спейсеры. Расположение праймеров для амплификации участков ITS обозначено
стрелками
Для получения «отпечатков пальцев» полиморфных по длине фрагментов рест-
рикции (RFLP), по которым различили 132 штамма дрожжей 25 различных родов,
была проведена обработка продуктов ЦРП области ITS ферментом рестрикции [19].
Более того, тем же способом были идентифицированы бактерии, загрязняющие
пиво, и описаны их свойства [8]. Тем не менее для качественного различения должна
быть определена последовательность нуклеотидов, которая позволит судить о фило-
генезе. Для идентификации дрожжей рода Saccharomyces использовали RFLP-гнг-
лиз и секвенирование ITS. Применение этого метода позволило разделить новые,
производные от S. cerevisiae виды, а именно S. kunashirensis, S. martinae, S. rosinii,
S. spencerorum и S transvaalensis, в том числе и хересные дрожжи [21 ]. Винные дрож-
жи из двух областей произрастания винограда в Греции были исследованы с приме-
нением ДЛР-анализа /Г5-последовательностей [44]. Анализ последовательностей
ITS2 дал возможность построить филогенетическое дерево, на котором видна взаи-
мосвязь 38 дрожжевых культур, включая 26 типовых штаммов, а также локализация
S. cerevisiae внутри ветви Candida [10].
в) Метод RAPD
О методе RAPD см. главу 8 (раздел 8.15). В нем для амплификации продуктов хро-
мосомной ДНК используются небольшие праймеры без специфической последова-
тельности, причем место нахождения мишеней никакой роли не играет. Продукты
294
Фергюс Г. Прист
разделяют электрофорезом в агарозном геле для получения характерных эталонов.
Этот метод может быть применен для идентификации дрожжей [33], но особенно
он полезен для идентификации бактерий. С использованием четырех различных
праймеров была получена видовая идентификация лактобактерий, лейконостоков
и педиококков [57|, а недавно такой метод применили для различения лактобакте-
рий, выделенных на предприятиях по производству шотландского виски. Высокая
разрешающая способность одного ираймера позволяет разделить несколько их ви-
дов (включая Lb.brevis, Lb.fermentum и Lb.paracasei) на различные /MPD-типы
(рис. 9.3), обеспечивая возможность установить пути контаминации производств [50].
Размер, Ьр 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
2000
1500
1000
Рис. 9.3. Несколько типичных образцов ЯДРО-профилей лактобактерий, выделенных в процессе
производства шотландского виски. Дорожки: 1 — молекулярный размер маркеров; 2 — Lb. brevis\
3 — Lb brevis] Л— Lb. fermentum; 5— Lb. fermenturrr, 6 — нет данных; 7 — Lb. brevis\ 8 — Lb. brevis;
9 — Lb. brevis; 10-17 — штаммы L. paracasein 18 — молекулярный размер маркеров (по [50]).
Обратите внимание, что у штаммов одних и тех же видов не обязательно одинаковые профили,
допускающие типирование штаммов и эпидемиологические исследования
г) Метод с использованием градиента денатурации при гель-электрофорезе
(DGGE) и гель-электрофореза с температурным градиентом (TGGE)
Методы DGGE и TGGE позволяют обеспечить высокую разрешающую способность
систем гель-электрофореза для различения фрагментов ЦРП, полученных от генов-
мишеней (обычно генов рРНК). И в том и в другом методе используют фрагмент
ЦРП со специальным «хвостом», содержащим последовательность, очень богатую гу-
анином и цитозином («Г+ Ц-замбк»). Когда ДНК подвергается электрофорезу
с градиентом денатурации или с денатурацией при градиенте температуры, исследуе-
мый фрагмент диссоциирует на одиночные цепочки ДНК в некоторой точке, завися-
щей от размера фрагмента и его нуклеотидного состава. Тем не менее «Г + Ц-замбк»
удерживает ее как одну молекулу, и фактически фрагмент в этой точке прекращает
мигрировать. Следовательно, расстояние миграции зависит от последовательности,
определяемой видом микроорганизма, который продуцировал данный фрагмент.
Этот метод облегчает выделение суммарной ДНК из образца, осуществление
ЦРП-амплификации ДНК определенного вида с использованием видовых прайме-
ров (например, молочнокислых бактерий) и делает возможным обнаружение и иден-
тификацию микроорганизмов при отсутствии их роста. Его использовали для оире-
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 295
деления дрожжевой популяции при винном брожении [ 12,131 и молочнокислых бак-
терий в производстве шотландского виски [611. Анализ методом DGG£ проб, взятых
в процессе брожения, позволил обнаружить штаммы Weisella (прежде Leuconostoc,
см. главу 5) и Lactobacillus, которые ранее не связывали с производством виски. Бо-
лее того, когда из проб сусла и засевных дрожжей выделили ДНК, DGGE-mm пока-
зали, что они являются источниками молочнокислых бактерий в процессе брожения
(рис. 9.4).
Рис.9.4. Гель-электрофорез с градиентом денатурации {DGGE) продуктов ЦПР-амплификации фраг-
ментов генов 16S рРНК из молочнокислых бактерий и родственных им микроорганизмов, выделен-
ных в процессе производства солодового виски на заводе Speyside. Образцы были выделены из
пивных дрожжей (BY), культуры спиртовых дрожжей (DV), сусла перед засевом (И/) и в процессе бро-
жения после 1,12, 24, 36, 48 и 60 ч. В качестве матрицы была выделена и использовалась общая
ДНК Полосы, помеченные справа строчными буквами, путем анализа последовательностей были
экспериментально идентифицированы как: а— виды Weisella; b — Weisella confusa; c— Weisella
kimchii; d— виды Weisella; e— нет данных; f— Lactococcus lactis или Lactococcus cremorus; g —
Bacillus smithii. L1 и L2 — наборы фрагментов ДНК от эталонных штаммов Lactobacillus: L1 — со дна;
Lb. fermentum, Lb. ferintoshensis и Lb. paracasei. L2 —со дна; Lb. brevis, Lactobacillus sp. 19-2
и Lactobacillus sp. V10
9.3.6. Метод риботипирования
Изначально под риботинированием (называемом также снятием рибоотпечатков)
подразумевали анализ /?ЛР-профилей ssu и/или Isu генов рРНК и их оперонов [26].
В бактериях имеются многочисленные опероны рРНК, каждый из которых содер-
жит гены 165 и 235 рРНК. Хромосомную ДНК подвергают действию ферментов ре-
стрикции, затем электрофорезу в геле, наносят на мембрану и исследуют ее реакцию
гибридизации с зондом, полученным на основе рРНК (обычно гена 165 рРНК).
В результате гибридизации зонда с комплектом рРНК-оперонов получается про-
филь, содержащий до 10 полос. Такие профили обладают видовой, а зачастую
и штаммовой специфичностью. Риботипирование по всем реакциям было автомати-
зировано и в настоящее время выполняется роботом. Специальное программное
обеспечение позволило получить воспроизводимые «отпечатки пальцев» и создать
296
Фергюс Г. Прист
базу данных для идентификационных целей (Ribo Printer Microbial Characterization
System, Qualicon, г. Уиллингтон, штат Делавэр, США).
Риботипирование использовали для распознавания бактериальных контаминан-
тов производства пива и спиртных напитков: лактобактерии [50, 53], Megasphera
[52], Pectinatus [37, 52] и Pediococcus [5]. Типичные образцы рибоотпечатков для пе-
диококков приведены на рис. 9.5, из которых видно, что у некоторых видов несколь-
ко риботипов, а другие геномно гомогенны. По этой причине риботипирование было
рекомендовано в качестве полезной процедуры для поиска источников контамина-
ции пивоваренных производств [5].
P. damnosus
P. damnosus
Р damnosus
Р damnosus
Р damnosus
Р damnosus
Р parvulus
Р pentosaceus
Р pentosaceus
Р pentosaceus
Р pentosaceus
Р acsidiiactici
Р inopinatus
P. dextrinicus
1kbd
_ in м
Рис. 9.5. Образцы риботипов для некоторых эталонных штаммов Pediococcus, полученные с ис-
пользованием «Рибопринтера», автоматического устройства для приготовления и анализа образ-
цов риботипов (по [5]). Обратите внимание, что у штаммов одного и того же вида не обязательно
будет одинаковый риботип, допускающий типирование штаммов и эпидемиологические исследо-
вания
Небольшая модификация идеи риботииирования состоит в том, что ген рРНК
амплифицируют путем ЦРП, а полученный продукт используют в реакции с фер-
ментом рестрикции для образования последовательности фрагментов. Такие RFLP-
фрагменты менее характерны, чем исходный риботип, так как они исключают вари-
абельные промежуточные последовательности, но могут оказаться полезны как
вспомогательное средство идентификации. При недавнем широком исследовании
169 штаммов дрожжей, выделенных на пищевых и пивоваренных производствах, их
ssu рРНК для получения характерных профилей была обработана четырьмя фермен-
тами; эти профили затем были проанализированы в целях создания филогенетиче-
ского дерева [16]. Этот способ был также использован для идентификации уксусно-
кислых бактерий [41 ].
Многообразие методов молекулярной биологии не исчерпывается перечислен-
ными — существуют многочисленные их модификации. Здесь мы коснулись лишь
тех, которые уже использовались в микробиологии пивоварения или тех, которые
могли бы применяться в лабораториях пивоваренных предприятий. Многие из опи-
санных процедур постепенно автоматизируют, и хочется надеяться, что такие фир-
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов
297
мы, как, например, Miller Brewing Company, смогут усовершенствовать, в частности,
метод RiboPrinter или другие аналогичные методы, что повысит их применимость
в исследовательских целях и при проверке качества продукта [5].
9.4. Методы исследования белков
9.4.1. Иммунологические методы
Иммунологические методы применимы не только для исследования белков, но
в этой главе мы рассматриваем их потому, что многие наиболее удачные иммунологи-
ческие идентификационные системы обнаруживают именно специфические белки.
Технология моноклональных антител позволяет в больших количествах производить
антитела с определенной специфичностью, что нашло свое применение и в пивоваре-
нии [23,58,63,67]. Обычный способ использования подобных технологий — это про-
фильтровать пиво и идентифицировать контаминанты на фильтре с применением
флуоресцентно меченых антител, что позволяет обнаружить в 10 мл пива 2-4 клетки
Pectinatus cerevisiiphilus менее чем за 3 часа [23]. Иммунологические методы широко
применяются для выявления лактобактерий и педиококков, а также для идентифика-
ции штаммов этих микроорганизмов-загрязнителей пива [58]. Утомительной проце-
дуры флуоресцентного микроскопирования можно избежать при использовании для
анализа клеток Lb. brevis, фиксированных на мембране, сверхчувствительного хеми-
люминесцентного иммуноанализа при помощи высокочувствительной CCD-камеры.
При этом в 630 мл пива за 4 ч было обнаружено примерно 20 клеток Lb. brevis. Хотя
в 1990-х гг. иммунологические методы из-за появления молекулярных технологий ото-
шли на второй план, по-видимому, они еще далеко не исчерпали своих возможностей.
9.4.2. Метод электрофореза общего белка клетки
Еще одним методом, нашедшим широкое применение в исследованиях по таксо-
номии и характеристике штаммов микроорганизмов, является электрофорез экст-
рактов общего белка клетки, который используется также в целях ускоренной иден-
тификации микроорганизмов. Результатом экспрессии генома микроорганизма
является продуцирование в клетке более чем 2000 белковых молекул. Эти белки лег-
ко экстрагируются кипячением и подвергаются одномерному электрофорезу в геле.
После окрашивания образцы со сложным набором полос, каждая из которых пред-
ставляет отдельный вид белка, сканируют с помощью денситометра. Показания ден-
ситометра затем подвергаются компьютерному таксономическому анализу с ис-
пользованием набора «отпечатков пальцев» разных видов микроорганизмов,
которые можно хранить в памяти компьютера. Для идентификации неизвестных
микроорганизмов можно использовать сравнение их «отпечатков пальцев» с имею-
щейся библиотекой эталонов [43, 60].
О таксономических исследованиях с применением электрофореза см. [32]. Глав-
ное в них то, что электрофоретические профили наиболее приемлемы для подразде-
ления на уровне вида, подвида и биотипа. Основные преимущества метода электро-
фореза заключаются в его производительности, благодаря чему можно сравнивать
большое число штаммов, а также в том, что при наличии способа разрушения клеток
он применим к различным типам микроорганизмов. Главным же недостатком таких
298
Фергюс Г. Прист
методов является потребность в большом количестве клеток для приготовления ис-
ходного экстракта.
В практике пивоварения электрофорез белков удобен для идентификации молоч-
нокислых бактерий и доказал свою полезность для идентификации L. acidophilus [22,
42], группы L. casei [29], а также лейконостоков [15].
9.5. Методы исследования особенностей клеточного состава
Существует множество аналитических методов изучения клеточного состава мик-
роорганизмов, но лишь три из них пригодны для исследования компонентов клеток
или целых микроорганизмов в условиях лабораторий контроля качества: анализ
жирных кислот [18], пиро-масс-спектрометрия (PyMS) [24] и инфракрасная спект-
роскопия Фурье (7Т-/#-спектроскопия) [38].
9.5.1. Анализ состава жирных кислот
Анализ метиловых эфиров жирных кислот (МЭЖК) с помощью газовой хрома-
тографии (ГХ) является универсальным методом хемотаксономического исследова-
ния бактерий. ГХ положена в основу промышленной системы Sherlock Microbial
Identification System (фирма MIDI Inc., г. Ныоарк, штат Делавэр, США), в которой
используется стандартное культивирование микроорганизмов и приготовление пре-
паратов МЭЖК. Бактерии выращиваются в течение 24 ч на чашках, а затем клетки
омыляют сильным основанием. После этого раствор подкисляют, и освободившиеся
жирные кислоты метилируют, увеличивая их летучесть для ГХ. Метиловые эфиры
экстрагируют, и 1 мл очищенного экстракта вводят в 50-метровую капиллярную ко-
лонку с метилсиликоновым кремнеземом. В данную систему входит также компью-
тер и программное обеспечение для сравнения хроматографических профилей
МЭЖК со справочной библиотекой эталонов.
В библиотеках данных хранятся сведения по дрожжам, а также по грамотрицатель-
ным и грамположительным бактериям. Этот метод применим к любому микроорга-
низму; кроме того, существует возможность создания индивидуальной справочной
библиотеки. Дрожжевая библиотека MIDI, к примеру, охватывает 200 видов дрож-
жей, но лишь три вида Saccharomyces — S. cerevisiae, S. dairensis и S. kluyven. Получе-
ние хроматографических МЭЖК-профилей занимает примерно 60-90 мин (время
подготовки образца — 60 мин). Как инструмент для идентификации метод МЭЖК-
профилей характеризуется широким диапазоном возможностей, что было доказано
успешным применением системы MIDI и ее наличием в списке услуг по идентифи-
кации микроорганизмов, предлагаемых фирмами Microcheck {www.microcheck.com)
и Microtest (www.microtestlabs.com). Единственным недостатком подобной системы
является недостаточное различение внутри видов, в связи с чем МЭЖК-профили не-
возможно использовать для типирования отдельных штаммов.
9.5.2. Метод FT-IR
Некоторые аналитические методы применимы непосредственно к целым клеткам,
и для них не требуется клеточного экстракта. Таким методом, в частности, является
/Т-//?-метод, представляющий собой несложный способ получения «отпечатков
пальцев» микроорганизмов [38].
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов
299
Известно, что инфракрасный спектр любого соединения является уникальным,
и именно эта особенность позволяет использовать для идентификации инфракрас-
ную спектроскопию на базе библиотеки спектральных данных. Новое применение
этого метода в микробиологии основано на преобразованиях Фурье спектров целых
клеток с волновыми характеристиками всех клеточных компонентов — ДНК/РНК,
белков, мембраны и компонентов клеточной стенки [28]. /Т-77?-метод позволяет ис-
следовать весь состав клетки конкретного микроорганизма в одном эксперименте,
причем его селективность чрезвычайно высока (до уровня штамма или даже сероти-
па). Более того, поскольку исследованию подвергаются целые клетки, исключается
сложное и требующее времени приготовление клеточных составляющих. Типичные
7Т-/Д-спектры для пивных дрожжей приведены на рис. 9.6. Незначительные разли-
чия в спектрах могут накапливаться и анализироваться на компьютере для получе-
ния дендрограмм или диаграмм рассеивания.
2
| 0,6
со
со
S
о
% 0,4
Р
1 0,2
а>
s
| 0
о
о
с-0,2
4000 3500 3000 2500 2000 1500 1000 500
Длина волны, см-1
Рис. 9.6. П"-/Я-спектры штаммов S. cerevisiae для производства эля и лагерного пива (по [55])
9.5.3. Метод пиро-масс-спектроскопии (ПМС, PyMS)
В результате пиролиза, обусловленного термической деградацией соединений (в дан-
ном случае микробной биомассы) в атмосфере инертного газа, образуется сложная
смесь летучих соединений с низкой молекулярной массой. Эта смесь может быть про-
анализирована для получения «отпечатков пальцев» микроорганизмов с помощью масс-
спектрометрии. Использование метода ПМС существенно сокращает время прове-
дения анализа и позволяет проанализировать колонию микроорганизма, взятую
непосредственно с поверхности среды. Тем самым минимизируются подготовительные
процедуры, а возможности метода позволяют различать микроорганизмы на уровне
видов и даже получать «отпечатки пальцев» отдельных их штаммов.
Метод ПМС был успешно применен для различения штаммов пивных дрожжей
для производства эля и лагерного пива [55] и для различения близкородственных
видов Candida [56]. Типичные масс-спектры штаммов S. cerevisiae приведены на
рис. 9.7, а дендрограмма, полученная с их использованием, — на рис. 9.8. В этом ис-
300
Фергюс Г. Прист
следовании фенотипические методы (FT-IR и ПМС) дали результаты, хорошо кор-
релирующие с выводами о родстве этих штаммов, полученными при анализе их ге-
нома [55]. Метод ПМС использовали и при анализе бактериальных МЭЖК для по-
лучения «отпечатков пальцев» микроорганизмов, загрязняющих пиво [7]. Бактерии
можно проанализировать в пиве без проведения экстракции жирных кислот или хро-
матографии.
Неудобство использования ПМС для идентификации микроорганизмов связано
с не очень высокой стабильностью масс-спектрометров во времени и с проблемой,
которая в связи с этим возникает при создании справочной библиотеки основных
спектров. Эти проблемы можно обойти, если в анализ всегда включать соответству-
ющие эталонные штаммы. Кроме того, был разработан новый способ получения «от-
печатков пальцев», который позволяет брать молекулы с поверхности бактерии
и характеризовать их. Образец клеток с поверхности агара помещают в масс-спект-
рометр MALDI-TOF и подвергают действию пульсирующего лазерного света. Мак-
ромолекулы с поверхности бактерий десорбируются, подвергаются масс-анализу,
.■■|Н"'Н1|.—...р.-
60 80 100 120 140 160 180 200
Масса, m/z
Штамм ВВ27
для лагерного пива
100 120 140
Масса, m/z
200
Рис. 9.7. Стандартизированные пиро-масс-спектры штаммов S. cerevisiae для производства эля
и лагерного пива (по [55])
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов
301
Относительное сходство,
100 90
%
80
+
70
60
50
^
ВВ1б(А)
ВВ18(А)
ВВЮ(А)
8826 (А)
ВВ1 (А)
ВВ15(А)
ВВ11 (L)
ВВ17 L
8827 L
ВВ14(А
BB9JL
ВВ20 (А)
ВВ13(А)
ВВ6
ВВ12
ВВ19
ВВ24(А) ^
ВВ2 А Ш-
ВВЗ(А) V
ВВ2НА) Г"
8822 А Ь-
8823 А ^
Кластер 1
к
Кластер 2
Кластер 3
Кластер 4
Рис. 9.8. Дендрограмма на основе данных ПМС свидетельствует о родственных связях штаммов
S. cerevisiae для производства эля (А) и лагерного пива (Л). SMC — одночленный кластер
и результаты получают в виде масс-спектра. Этот «масс-отпечаток» воспроизводим
и специфичен, что позволяет сопоставлять новые штаммы с имеющейся библиоте-
кой известных микроорганизмов. В промышленном варианте этот метод реализован
в виде системы MicrobeLynx (www.micromass.co.uk).
9.6. Методы изучения морфологии и поведения
микроорганизмов
9.6.1. Миниатюрные комплекты для тестирования и промышленные
наборы
Главным направлением в области ускоренной идентификации микроорганизмов
с начала 1980-х гг. стала миниатюризация обычных биохимических тестов и тестов
с использованием питательных сред, позволившая разработать промышленные наборы
для микробиологического анализа. Подавляющее большинство подобных наборов
предназначено для выявления микроорганизмов, встречающихся в клинической прак-
тике. Для идентификации бактерий семейства Enterobacteriaceae и других грамотрица-
тельных бактерий существует несколько систем, из которых наиболее известна система
API20E (фирма ЫоМёпеих, г. Бейсингсток, Великобритания, www.biomerieux-USA.com).
Результаты обычно получаются за 24 ч и даже быстрее (в зависимости от вида бакте-
рии). Главным преимуществом таких наборов является простота их использования
и стандартизированное производство реактивов, способствующее воспроизводимости
результатов идентификации.
Последние разработки в области таких миниатюрных систем проводятся в двух
противоположных направлениях. С одной стороны, созданы наборы для анализа от-
302
Фергюс Г. Прист
дельных групп микроорганизмов (например, API20C), включая дрожжи, имеющие
клиническое значение, а с другой — такие системы, как API50CH, позволяющие про-
изводить профилирование путей ассимиляции углеводов любого микроорганизма,
для которого можно разработать соответствующий протокол засева и инкубации.
9.6.2. Автоматизированные системы
С технической точки зрения миниатюрные системы развиваются также в двух на-
правлениях: автоматизация для обеспечения быстрой и воспроизводимой обработки
образца и переход на тесты, в основе которых лежат ферментные или метаболические
реакции (во избежание задержек, свойственных традиционным тестам, основанным
на выращивании микроорганизмов). Принципами, положенными в основу системы
VITEK, выпускаемой в Великобритании фирмой ЫоМепеих, являются миниатюриза-
ция биохимических тестов и фотооптическое обнаружение развития микроорганиз-
мов. Система VITEK дает возможность автоматизировать в лабораторных условиях
скрининг, идентификацию и антимикробную оценку. Прозрачные пластиковые ис-
пытательные платы поступают уже с химическими субстратами. В лаборатории эти
испытательные платы увлажняют суспензией неизвестных микроорганизмов и инку-
бируются. Обнаружение роста происходит в автоматическом режиме путем слеже-
ния за изменением оптической плотности. Расчет вероятности идентификации осу-
ществляется компьютером путем сравнением данных с библиотекой стандартных
профилей. Широкое распространение получили три стандартных испытательных
платы: для грамотрицательных и грамположительных бактерий и для дрожжей. Осо-
бое внимание уделяется микроорганизмам клинического значения, в связи с чем
в дрожжевые платы охватывают главным образом виды Candida и Cryptococcus. Вме-
сте с тем фирма ЫоМёпеих продолжает работы по расширению сферы применения
наборов VITEK в лабораториях предприятий пищевой промышленности.
Фирма Biolog (г. Хейвуд, штат Калифорния, США, www.biolog.com) предложила
методику идентификации микроорганизмов, в которой об утилизации углеродного
субстрата судят по включению вместе с субстратом индикатора дыхания на основе
тетразолия. Источники углерода, специфичные для грамотрицательных, грамполо-
жительных бактерий и для дрожжей, и соль тетразолия распределяют на платах для
микротитрования, которые поступают в комплекте. Стандартный засев микробной
суспензией осуществляется в 96 ячеек; инкубация в течение 4-16 ч приводит к по-
лучению биохимических «отпечатков пальцев» микроорганизмов в 95 субстратах
(1 ячейка— контрольная). Полученные результаты можно просмотреть или снять
с помощью автоматического устройства считывания и сравнить с базой данных, ис-
пользуя стандартные компьютерные алгоритмы. Фирма Biolog владеет одной из наи-
более продвинутых баз данных по идентификации микроорганизмов, а выпуск плат,
специфичных для лактобактерий и дрожжей, может сделать эту систему особо при-
влекательной для микробиологии пивоварения.
9.6.3. Системы анализа, основанные на ферментной активности
Существуют и другие, более быстрые методы идентификации клинических куль-
тур микроорганизмов, в которых для их характеристики используются ферментные
тесты [36]. Традиционные методы основаны на росте микроорганизмов, и с учетом
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов 303
разведения популяции бактерий при засеве, для того чтобы число клеток возросло
до уровня, при котором продуцируется достаточно метаболитов для запуска систе-
мы обнаружения (например, чтобы падение рН привело к изменению цвета), требу-
ется время (по крайней мере, 10-17 генераций). Методы, направленные на обнару-
жение ферментов или их непосредственных продуктов, намного быстрее и более
специфичны, чем методы, основанные на росте микроорганизмов.
Для идентификации используются главным образом ферменты катаболизма, вклю-
чая эстеразы, глюкозидазы, липазы, фосфатазы, пептидазы и протеазы [36]. Обнаруже-
ние существенно упростилось с появлением разнообразных синтетических хромоген-
ных или флуорогенных субстратов. Для получения такого субстрата хромоген или
флуороген связывается с простой группировкой (аминокислотой, моносахаридом,
жирной кислотой, фосфатом или ионом сульфата). При проведении большого числа
определений количественные измерения активности микроорганизмов требуют опре-
деленной степени автоматизации.
9.7. Заключительные замечания
Характеристика микробиологических штаммов и их идентификация занимают
важное место в работе лабораторий пивоваренных предприятий, будь то мониторинг
и подтверждение идентичности пивных штаммов или идентификация контамини-
рующих бактерий и дрожжей. В таких лабораториях нагрузка не так высока, как
в клинической диагностике, в связи с чем не так велики требования к автоматизации
работ. С другой стороны, очень важно поддерживать базу данных соответствующих
микроорганизмов, что существенно облегчает идентификацию неизвестных штам-
мов, а для этого требуется воспроизводимость результатов, которая не всегда легко
достижима при использовании некоторых методов молекулярного типирования.
К примеру, результаты анализа по ЦРП-методу RAPD очень трудно воспроизвести
даже в той же лаборатории.
Аппарат RiboPrinter дает и хорошую воспроизводимость результатов, и большие
возможности для определения различий, в связи с чем он особенно полезен для
идентификации бактерий. Из немолекулярных методов широкое применение в пи-
щевой промышленности и производстве напитков нашел метод FT-IR (для иденти-
фикации как бактерий, так и дрожжей). Свои приверженцы имеются и у метода
ПМС (PyMS), который представляет собой ценный инструмент для получения «от-
печатков пальцев» бактерий и дрожжей. Мы, например, предпочитаем молекуляр-
ные методы, основанные на определении последовательности, поскольку они обла-
дают точностью цифровых систем (индивидуальные основания), а не аналоговых
(полосы в геле). Базы данных постоянно увеличиваются и становятся открытым ис-
точником данных по генетическим последовательностям, инструменту окончатель-
ной идентификации.
Надежной базой всех работ по идентификации микроорганизмов в течение мно-
гих лет являлись фенотипические исследования. Они и в настоящее время продол-
жают использоваться в не слишком сложных случаях, хотя иногда их результаты
могут быть не вполне достоверны (особенно при исследовании неклинических мик-
роорганизмов, когда справочные базы данных не достаточны). Тем не менее для ла-
бораторий, столкнувшихся с необычной идентификацией, простую и удобную воз-
304
Фергюс Г. Прист
можность определить характеристики микроорганизма и идентифицировать его
предоставляют наборы фирм API или Biolog. По-видимому, несмотря на все дости-
жения современной молекулярной биологии, традиционные фенотипические иссле-
дования еще некоторое время будут вестись по-прежнему.
Выражение признательности
Мы признательны всем, кто предоставил нам материалы для данной главы, осо-
бенно Ройстону Гудакру (Royston Goodacre) (Institute of Biological sciences, Универ-
ситет Уэльса, г. Эбериствит) за предоставленные новейшие данные по методам FT-
IR и PyMS.
Литература
1. Altschul, S.F., Madden, T.L., Schaffer, A.A., et al. (1997) Nucleic Acids Research, 25, 3389.
2. Amann, R. & Ludwig, W. (1994) In Microbial Diversity and Systematic (eds EG. Priest.,
A. Ramos-Cormenzana & B. Tindall) Plenum Press, New York, p. 115.
3. Amman, R., Fuchs, B. and Behrens, S. (2001) Current Opinion in Biotechnology, 12, 231
4. Amman, R. and Ludwig, W. (2000) FEMS Microbiology Reviews, 24, 555
5. Barney, M., Volgyi, A., Navarro, A. and Ryder, D. (2001) Applied and Environmental
Microbiology, 67, 553.
6. Behr, Т., Koob, C, Schedl, M. et al. (2000) Systematic and Applied Microbiology, 23, 563.
7. Beverly, M.B., Basile, F. and Voorhees, K.J. (\997)Journal ofthe American Society of Brewing
Chemists, 55, 79.
8. Bischoff, E., Bohak, I., Back, W. and Leibhard, S. (2001) Monatsschrift fur Brauwissenschaft,
54,4.
9. Brown, J., R. and Koretke, K. K. (2000) In Applied Microbial Systematics (eds F.G. Priest and
M. Goodfellow), Kluwer Academic Publishers, Dordrecht, p. 19.
10. Chen, Y.C., Eisner, J. D., Kattar, M., et al. (2000) Journal of Clinical Microbiology, 38, 2302.
11. Chevrier, D., Larzul, D., Megrand, F. and Guesden J.L. (1989) Journal of Clinical Micro-
biology, 27, 321.
12. Cocolin, L., Bisson, L. F. and Mills, A.D. (2000) FEMS Microbiology Letters, 189, 81.
13. Cocolin, L., Heisey, A. and Mills, A.D. (2001) American Journal ofEnology and Viticulture, 52,49.
14. Delley, M., Mollet, B. and Holtinger, H. (1990) Applied and Environmental Microbiology, 56,169.
15. Dicks, L.M.T., van Vuuren, H.J.J, and Dellaglio, F. (1990) International Journal of Systematic
Bacteriology, 40, 83.
16. Dlauchy, D., Tornai-lehoczki, J. and Peter, G. (1999) Systematic and Applied Microbiology,
22,445.
17. Edwards, K.J., Kaufmann, M.E. and Saunders, N.A. (200\) Journal of Clinical Microbiology,
39, 3047.
18. EmbleyT.M. & Wait, R. (1994) In Chemical Methods in Ptvkaryotic Systematics (eds M. Goodfellow
& A.G. O'Donnell), John Wiley, Chichester, p. 121.
19. Esteve-Zarzoso, В., Belloch, C, Uruburu, F. and Querol, A. (1999) International Journal of
Systematic Bacteriology, 49, 329.
20. Falkow, S. (1985) In Rapid Methods and Automation in Microbiology and Immunology
(ed K.-O. Habermehl), Springer, Berlin, p. 30.
21. Fernandez-Espinar, M.T, Esteve-Zarzoso, В., Querol, A. and Barrio, E. (2000) Antomie van
Leeuwenhoek, 78, 87.
Глава 9. Быстрая (ускоренная) идентификация микроорганизмов
305
22. Gancheva, A., Pot, В., Vanhonaker, К. et al. (1999) Systematic and Applied Microbiology, 22,
573.
23. Gares, S.L., Whiting, M.S. Ingledew, W.M. and Ziola, B. (1993) Journal of the Ameiican
Society of Brewing Chemists, 51,158.
24. Goodacre, R. and Kell, D.B. (1996) Current Opinion in Biotechnology, 7, 20.
25. Goto, K., Omura, Т., Нага, Y. and Sadaie, Y. (2000) Journal of General and Applied
Microbiology, 46,1.
26. Grimont, PA.D.and Grimont,?. (1986)AnnatesdeL'InstitutPastnur/Mikrobilogie, 137B, 165.
27. Grimont, P.A.D. (1988) Canadian Journal of Microbiology, 34,541.
28. Helm, D. Labischinski, H., Schallehn, G. and Naumann, D. (1991) Journal of General
Microbiology, 137, 69.
29. Hertel, C., Ludwig, W., Pot, В., et al. (1993) Systematic and Applied Microbiology, 16,463.
30. Jarvis, B. (1985) In Rapid Methods and Automation in Microbiology and Immunology (ed
K.-O. Habermehl), Springer, Berlin, p. 593.
31. Juvonen, R., Satakari, R., Mallison, K. and Haikara, A. (1999) Journal of the American Society
of Brewing Chemists, 57,99
32. Kersters, K., Pot, В., Dewettinck, D., et al. (1994) In Microbial Diversity and Systematics (eds
F.G. Priest., A. Ramos-Cormenzana and B. Tindall), Plenum Press, New York, p. 51.
33. Laidlaw, L., Tomkins, T. A., Savard, L., and Dowhanick, Т. М. (1996) Journal of the American
Society of Brewing Chemists, 54,97.
34. Lane, D.J. (1991) In Nucleic Acid Techniques Bacterial Systematics (eds E. Stackebrandt and
M. Goodfellow), John Wiley and Sons, Chichester, p. 115
35. Manzano, M., Cocolin, L., Cantoni, C. and Comi, G. (1998) Food Microbiology, 15, 651.
36. Manafi, M, Kneifel, W. and Bascomb, S. (1991) Microbiological Reviews, 55, 335-348.
37. Motoyama, Y, Ogata, T. and Sakai, K. (1998) Journal of the Institute of Brewing, 56, 19.
38. Naumann, D., Helm, D. and Schultz, C. (1994) Microbial Diversity and Systematics (eds F.G. Priest.,
A. Ramos-Cormenzana and B. Tindall), Plenum Press, New York, p. 67.
39. Perry-O'Keefe, H. Stender, H., Broomer, A. et al. (2001) Journal of Applied Microbiology, 90,
180.
40. Pilloud, N. and Mollet, B. (1990) Systematic and Applied Microbiology, 13,345.
41. Poblet, M., Rozes, J. M. Guillamon, J.M. and Mas, A. (2000) Letters in Applied Microbiology,
31,63.
42. Pot, В., Hartel, C.f Ludwig, W., et al. (1993) Journal of General Microbiology, 139, 513.
43. Pot, В., Vandamme, P. and Kersters, K. (1994) In Chemical Methods in Prokaryotic Systematics
(eds M. Goodfellow and A.G. O'Donnell), John Wiley & Sons Ltd, Chichester, p. 493.
44. Pramateftaki, P.V., Lanaridis, P. and Typas, M.A. (2000) Journal of Applied Microbiology, 89,
236
45. Satotari, R.Juvonen, R., Malison, K.,etal. (1998) International JournalofFoodMicrobiology\
45,119
46. Sami, M., Yamashita, H., Kadokura, H. et al. (1991) Journal of the American Society of
Brewing Chemists, 55,137.
47. Schleifer, K.H. (1990) Food Biotechnology, 4,585.
48. Schleifer, K.H., Ludwig, W.and Amann, R. (1993) In Handbook of New Bacterial Systematics
(eds M. Goodfellow and A.G. O'Donnell, eds), Academic Press, London, p. 464.
49. Schmidhuber, S., Ludwig, W. and Schleifer, K.-H. (1988) Journal of Clinical Microbiology, 26,
1042.
50. Simpson, K., Pettersson, B. and Priest, F.G. (2001) Microbiology, 147,1007.
Ю6
Фергюс Г. Прист
51. Stender, H., Kurtzman, С, Hyldig-Nielsen, J.J., et al. (2001) Applied and Environmental
Microbiology, 67, 938.
52. Suihko, M.-L. and Haikara, A. (200\)Jownalofthe Institute of Brewing, 107, 175.
53. Storgards, E. Suihko, M.L., Pot, В., et al. (\998)Journalofthe Institute of Brewing, 104,47.
54. Tang, Y.-T., von Graevenitz, A., Waddington, M.G. et al. (2000) Journal of Clinical Miao-
biology,38,i676.
55. Timmins, E.M., Quain, D.E. and Goodacre, R. (1998) Yeast, 14,885.
56. Timmins, E.M., Howell, S.A., Alsberg, B.K., et al. (1998) Journal of Clinical Microbiology, 36,
367.
57. Tomkins, T.A., Stewart, R., Savard, L., et al. (1996) Journalojthe American Society of Brewing
Chemists, 54, 91.
58. Tsuchiya, Y., Nakakita, Y., Watari.J and Shinotsuka, K. (2000)Journal of the Ametica Society
of Brewing Chemists, S8, 89.
59. Trotha, R., Hanck, Т., Konig. W. and Konig, B. (2001) Infection, 29, 12.
60. Vauterin, L , Swings, J. and Kersters, K. (1993) In Handbook of New Bacterial Systematics
(M. Goodfellow and A.C. O'Donnell eds.), Academic Press, London, p. 251.
61. Van Beck, S. and Priest, F.G. (2002) Applied and Environmental Microbiology, 68, 297.
62. Venema, J. and Tollervey, D. (1999) Annual Review of Genetics, 33, 261
63. Whiting, M.S., Ingledew, W.M., Lee, S.Y. and Ziola, B. (1999) Canadian Journal of
Microbiology, 45, 670
64. Yasuhara, Т., Yuuki, T. and Kagami, N. (2001) Journal of the American Society of Brewing
Chemists, 59, 117.
65. Yasui, T. and Yoda, K. (1997) Applied and Environmental Microbiology, 63, 4528.
66. Yasui, Т., Okamoto, T. and Taguchi, H. (1997) Canadian Journal of Microbiology, 43,157.
67. Ziola, В., Ulmer, M., Bueckert, J. et al. (2000) Journal of the American Society of Brewing
Chemists, 58, 63.
Глава 10
МИКРОБИОЛОГИЯ И САНИТАРИЯ
НА МИНИ-ПИВЗАВОДАХ США
Майкл Дж. Льюис (Michael J. Lewis)
10.1. Введение
Микробиологическое состояние пива зависит от трех факторов: 1) микробиоло-
гического состояния используемого сырья, особенно дрожжей; 2) типа технологии
и продукта, в частности, применения пастеризации; 3) санитарно-гигиенического со-
стояния контактирующих с пивом поверхностей, то есть чистоты оборудования
и производственных помещений.
Эти три фактора определяют санитарно-гигиеническое и микробиологическое ка-
чество любого пива независимо от типа предприятия — крупного или минипивзаво-
да — и соответствуют разделам данной главы. Так как основные принципы санитар-
но-профилактических мероприятий будут рассмотрены в главе 11, здесь мы обсудим
лишь некоторые характерные аспекты и виды санитарно-гигиенической обработки,
имеющие особое значение для мини-пивзаводов и качества производимого ими
пива.
10.2. Сырье
На мини-пивзаводах, как правило, используют то же сырье, что и на крупных пи-
воваренных предприятиях, в связи с чем присутствующие в нем микроорганизмы
практически те же. Производство пива на чисто солодовом сусле и высокие концен-
трации хмеля существенно не влияют на содержание микроорганизмов в сусле
и пиве, поскольку затирание солода и кипячение сусла практически исключает его
контаминацию. Тем не менее обращение с сырьем на мини-пивзаводах менее регла-
ментировано, чем на большинстве крупных предприятий; например, хмель иногда
добавляют не только в сусловарочный котел, но и в вирпул. На некоторых мини-
пивзаводах горячее сусло перекачивают из вирпула в ферментер через хмелеотдели-
тель, где хмеля может быть 2,5 фунта на баррель. Гранулы хмеля часто добавляют
в ферментер, когда до сбраживаемой плотности остается несколько градусов Бал-
линга; также распространено традиционное сухое охмеление.
Тем не менее сама природа горячего сусла, условие брожения и состав пива при
такой практике позволяют выживать лишь немногим микроорганизмам [ 1 ], хотя это
отнюдь не означает полное отсутствие рисков. Другое дело — дрожжи, и практика
работы с ними на разных мини-пивзаводах существенно отличается. Одни произво-
дители соблюдают общепринятые стандарты пивоварения, а другие поступают не
всегда разумно (если судить по этим стандартам).
Хотя основным сырьем для мини-пивзаводов при пивных ресторанах являются
промышленные сухие дрожжи, при грамотном использовании которых не возникает
серьезных проблем, у многих мини-пивзаводов нет средств контроля засевных дрож-
308
Майкл Дж. Льюис
жей. Несмотря на то что на большинстве мини-пивзаводов используются ферменте-
ры с коническим дном, дрожжи часто не собирают из конуса в сборники для хране-
ния, переработки (при необходимости) и анализа, а засевают непосредственно из
конуса в конус. Из-за этого зачастую контроль количества внесенных дрожжей и их
состояния отсутствует, не определяется также степень обсемененности бактериями
или другими дрожжами. В таких случаях замена дрожжей обусловливается двумя
факторами: качеством произведенного пива и числом брожений. И в том и в другом
случае стандарты могут быть очень гибкими. Даже там, где для засевных дрожжей
используют приемные сборники, их часто вносят по массе или объему без измерения
плотности дрожжей (без подсчета дрожжевых клеток), и засев осуществляется в ос-
новном по опыту конкретного пивовара.
Такая практика свойственна буквально каждому пивзаводу, и хотя засев из кону-
са в конус — практика вполне обычная, некоторые пивовары осуществляют гораздо
более скрупулезный контроль качества и количества дрожжей. Например, на одном
пивзаводе при приготовлении известного пшеничного пива используют разведение
дрожжей от культуры на скошенном агаре, а не от единичной колонии (КОЕ или
клетки), так как пивовар видит, что дрожжи характеризуются разным качеством
и поведением. Такие дрожжи используются затем только три раза. Если дрожжи ис-
пользуют для большего числа варок, то для этого сорта пива снижается флокуляция
клеток, и пиво становится мутным, а его вкусовые качества ухудшаются. Использо-
вание столь малого числа генераций дрожжей является нетипичным — на большин-
стве пивзаводов до замены дрожжей используют от 5 до 15 генераций, то есть в зави-
симости от графика варок новые дрожжи вводят через 2-6 мес, а на некоторых
предприятиях продолжают варки до возникновения проблем.
При более тщательном контроле дрожжи обычно подвергают микробиологическим
анализам с использованием обычных питательных сред, как правило, универсального
пивного агара (UBA) или солодово-дрожжевого-глюкозопептонного (MYGP) агара
с циклогексимидом или без него. Для обнаружения бактерий инкубацию обычно про-
водят аэробно или анаэробно. Для обнаружения диких дрожжей Saccharvmyces исполь-
зуется среда на основе лизина, а для диких дрожжей других родов — среда с медью (на-
пример, среда Линя). Подробнее о питательных средах см. главу 12.
Лишь на немногих пивзаводах всегда придерживаются только одной культуры
дрожжей (специальные дрожжи применяются лишь для новых продуктов и для не-
больших партий). На мини-пивзаводах обычно прельщаются тем огромным диапа-
зоном возможностей, который предоставляет им использование различных штам-
мов дрожжей, не понимая, что один штамм дрожжей способен обеспечить
производство всей желаемой номенклатуры. Здесь сказывается преданность «пив-
ному стилю» —конкретные дрожжи (и соответствующая практика пивоварения) ис-
торически ассоциируются с определенными сортами пива, так что именно они счи-
таются необходимыми для производства данного пива. Из-за этого на некоторых
предприятиях велика вероятность перекрестного загрязнения одних дрожжей дру-
гими. Можно привести один достаточно необычный пример, когда на одном пивза-
воде основными являются дрожжи для производства эля, а для пива, разливаемого
в бутылки, используют дрожжи для лагерного пива. Такие дрожжи морфологически
совершенно разные и моментально распознаваются под микроскопом. В этом случае
Глава 10. Микробиология и санитария на мини-пивзаводах США 309
дрожжи хранят с особой тщательностью, по отдельности на расстоянии сотен метров
друг от друга, благодаря чему не было ни одного случая перекрестной контамина-
ции. На большинстве мини-пивзаводов регулярно используют не менее двух типов
дрожжей (для производства лагерного пива и для производства эля), причем и те
и другие как маточные дрожжи. Избежать перекрестного загрязнения в таком случае
позволяет тщательная мойка оборудования и помещений и аккуратность в работе.
На некоторых пивзаводах стараются по возможности избежать разведения дрож-
жей и заключают на такую услугу договора подряда. При этом получаемые дрожжи
предварительно активируют в сборниках для засевных дрожжей. Эти дрожжи долж-
ны характеризоваться вполне определенными параметрами, например, продолжи-
тельностью брожения до достижения конечной плотности, флокуляционной способ-
ностью, формированием органолептического профиля пива. В случае негативных
данных по вкусу пива или выявления контаминации дрожжей проводят кислотную
обработку дрожжей. Промывка дрожжей осуществляется повсеместно и в большин-
стве случаев обычным способом с использованием фосфорной кислоты при рН 2,2-
2,4 в течение примерно 2 ч перед засевом.
Работа с дрожжами является своего рода «пробным камнем» на уровень квалифи-
кации сотрудников и финансовые возможности мини-пивзавода (так как для пра-
вильного ее осуществления необходима лаборатория), и от нее зависит стабильность
свойств и место выпускаемого пива на рынке.
10.3. Технология и готовый продукт
Почти все технологические процессы на мини-пивзаводе занимают относительно
непродолжительное время. На этих заводах используется высокоплотное и высоко-
сбраживаемое сусло, пиво производится алкогольное, с разным содержанием изо-а-
кислот (30-50 ед., IBU), причем некоторая его часть разливается в бутылки. Эти осо-
бенности частично предохраняют готовый продукт от возможной контаминации
микроорганизмами. С другой стороны, практически все пиво варится исключительно
на солоде, что приводит к более высокому рН в период брожения и готового пива и
к существенно более высокому содержанию питательных компонентов (аминокис-
лот, витаминов и ионов металлов), чем в пиве, приготовленном на сырье с добавками.
Следовательно, если микроорганизмы-вредители попадают в пиво, сваренное на ми-
нипивзаводе (предполагается, что они устойчивы к ингибирующему действию кис-
лот хмеля), то они способны быстро испортить вкус пива и сказаться на его
прозрачности. На некоторых мини-пивзаводах к пиву добавляют специальные мате-
риалы типа малинового сока или меда, а также иные вкусовые добавки. Обычно пе-
ред добавлением их подвергают тепловой обработке либо в котле (как часть сусла),
либо отдельно, и таким образом микроорганизмы не вносятся с ними в сусло или
пиво, но, тем не менее, они могут повысить подверженность пива порче.
В борьбе между этими двумя факторами, по-видимому, побеждает фактор защиты,
так как пиво, сваренное на мини-пивзаводах, занимает на рынке довольно стабильное
положение. Очень немногие мини-пивзаводы используют пастеризаторы, и там, где
они применяются, почти всегда проводятся пастеризация в потоке или мгновенная
пастеризация. Хотя представители многих мини-пивзаводов и утверждают, что они
работают с установками для стерильной фильтрации и асептического розлива, и не-
310
Майкл Дж. Льюис
которые из них действительно используют современное фильтровальное оборудова-
ние (в основном на основе пластинчатых фильтров или регенерируемых намывных
фильтров), их оборудование и используемые технологические стандарты значитель-
но уступают аналогичным установкам и технологиям, применяемым на крупных пи-
воваренных производствах.
Тем не менее существующая технология для данных типов и сортов пива оказыва-
ется достаточной, и сваренное на мини-пивзаводах пиво вполне соответствует по-
требностям местных рынков и успешно продается даже на более крупных рынках,
охватывающих нескольких ближайших штатов (а иногда даже всю страну с выходом
на международный рынок, но это лишь как исключение). Срок годности такого пива
обычно составляет около 120 сут (типичные сроки хранения американских сортов
пива). Большинство мини-пивзаводов поддерживают «пивной архив», образцы пива
из которого каждый месяц в течение срока хранения дегустируются. На всех пред-
приятиях действует некая система установления срока годности продукта (хотя эта
информация редко бывает открытой), и зачастую пиво с превышением сроков год-
ности может быть отозвано с рынка. По утверждению пивоваров, такое пиво редко
характеризуется микробиологической порчей, но может обладать посторонним при-
вкусом.
Сусло аэрируют главным образом стерильным кислородом. Пробы сусла для мик-
робиологического анализа берутся не на всех мини-пивзаводах. Там, где это делают,
для определения общего числа всех присутствующих микроорганизмов используют
обычную питательную среду. Тем не менее обычно практикуют круглосуточный от-
бор проб пива во время брожения и, кроме того, из танка со светлым пивом и/или из
аппарата розлива. Основное внимание всегда уделяется обнаружению микроорганиз-
мов порчи, которые распознаются по их поведению на селективной среде, по их мор-
фологии (под микроскопом) или (в случае сомнений) по окраске по Граму и по тесту
с использованием перекиси водорода (каталазному тесту). Присутствие грамотрица-
тельных микроорганизмов считается серьезным признаком неудовлетворительного
санитарно-гигиенического состояния и сигналом к необходимости улучшения техно-
логии производства. Эти микроорганизмы не снижают качества продукта, хотя дрож-
жи после такого брожения недостаточно активны при последующем использовании.
Грамположительные микроорганизмы-вредители пива требуют принятия более ра-
дикальных мер в зависимости от уровня контаминации (вплоть до слива продукта
в канализацию). К счастью, на практике такие случаи редки.
Многие мини-пивзаводы оснащаются ферментерами, для наполнения которых
требуются несколько варок (две, три или более), что занимает обычно (но не всегда)
около 12 ч. Неизменным в практике пивоварения остается внесение всех требуемых
дрожжей в первую порцию сусла, что довольно быстро создает своего рода антимик-
робную среду.
Готовое пиво после розлива в бутылки снова проверяют на контаминацию микро-
организмами с особым вниманием к наличию грамположительных бактерий. На не-
которых мини-пивзаводах прежде чем пустить пиво в продажу ожидают завершения
микробиологических анализов, другие же полагаются на широкий спектр показате-
лей, позволяющих пускать продукт в продажу (вкус, рН, цвет, прозрачность, нор-
мальный ход брожения и т. д.) и используют микробиологические данные в качестве
Глава 10. Микробиология и санитария на мини-пивзаводах США 311
своего рода технологической «истории» продукта. С другой стороны, характерной
чертой передовых производств является успешное применение (и капиталовложе-
ния) в системы управления качеством продукции, включая микробиологические ас-
пекты.
10.4. Поверхности, контактирующие с пивом
Условия на мини-пивзаводах могут быть самыми разными — от современного,
прекрасно обслуживаемого оборудования, размещенного в специально предназна-
ченных для этого помещениях, до устаревшего оборудования плохого качества, не-
правильно размещенного в исторических зданиях с очевидным пренебрежением ко
всем санитарно-гигиеническим тонкостям. Имеющийся опыт свидетельствует, что
наилучшим материалом для изготовления поверхностей, контактирующих с пивом,
является нержавеющая сталь (за исключением небольшого числа пивзаводов, где ис-
пользуют медные варочные аппараты). Все оборудование должно быть закрыто (ни-
каких антикварных коллекторов для сусла и как можно меньше открытых фермен-
теров!), а система мойки и дезинфекции должна быть хорошо продумана. Системы
мойки и дезинфекции требуют хорошо спроектированной системы трубопроводов и
резервуаров рециркуляции моющих растворов, а иногда и автоматизированной сис-
темы безразборной мойки (CIP) с регенерацией моющего раствора и промывных
вод. Для мини-пивзаводов в США всегда были характерны понимание необходимо-
сти тщательной мойки и приверженность жестким санитарно-гигиеническим мерам,
благодаря чему и достигается микробиологическая стабильность и успех продукции
многих минипивзаводов на рынке (несмотря на отсутствие современного оборудо-
вания и этапа пастеризации). Следует отметить, что многие специалисты придержи-
ваются мнения, что пастеризация ухудшает вкус производимого пива, и они охотно
обошлись бы без нее.
Наиболее широко используемым моющим средством является горячая каустиче-
ская сода, обычно входящая в состав промышленных моющих средств. Используется
она стандартным образом: предварительное ополаскивание, щелочная мойка, ополас-
кивание. Концентрация щелочи составляет от 1,5 до 4% (в зависимости от режима
мойки). Более высокие концентрации и/или температуры используются для мойки
сильно загрязненных резервуаров (например, варочных агрегатов или ферментеров).
На большинстве пивоваренных предприятий используют раздельные системы мойки
для оборудования розлива/фасования и для остального оборудования (лишь немно-
гие заводы имеют отдельные системы для варочного цеха, для лагерного отделения
и для цеха розлива).
В качестве примера режима мойки можно привести следующий: ферментер сна-
чала ополаскивают, а затем промывают горячим 2,5%-ным щелочным раствором
в течение 20 мин с использованием системы низкого давления и высокого расхода.
После охлаждения и ополаскивания аппараты проверяют на чистоту, после этого
следует ополаскивание йодсодержащим раствором (концентрация 25 ррт). После
сушки (и без последующего ополаскивания) аппараты готовы для использования.
Такой же режим используют при обработке танков для светлого пива, но только пос-
ле трех варок; после каждой варки танки светлого пива подвергают горячей промыв-
ке (водой с температурой 71 °С). Ежедневно таким же образом моются варочное от-
312
Майкл Дж. Льюис
деление и трубопроводы, по которым подается сусло, с последующей обильной про-
мывкой йодсодержащим раствором. Вода, которая поступает на этот пивзавод, мяг-
кая, и поэтому не возникает проблем с пивным камнем и кислотной мойкой, которая
в данном случае не применяется.
Существует, конечно, множество вариантов мойки, так как ее эффективность за-
висит от прикладываемой энергии [2], которая является функцией времени, темпе-
ратуры и концентрации моющего средства (причем все элементы частично взаимо-
заменяемы). Самым «экстремальным» вариантом для мини-пивзавода может быть
применение 3,5-4%-ного холодного (с температурой окружающей среды) щелочно-
го раствора в течение примерно 1 ч с последующей кислотной мойкой (2%-ный ра-
створ фосфорной кислоты).
На большинстве мини-пивзаводов аппараты и/или трубопроводы промывают
сразу же после использования и подвергают санитарной обработке непосредственно
перед использованием. Если две этих процедуры (опорожнение резервуара и его на-
полнение) отделены друг от друга более чем на сутки, аппарат моют заново и затем
перед использованием дезинфицируют. При этом либо предполагается, что чистота
поверхностей достигнута, либо проводится санитарно-гигиеническая их проверка
с применением биолюминесценции.
На мини-пивзаводах для обработки аппаратов и трубопроводов чаще всего приме-
няют горячую воду или пар, йодсодержащий раствор (концентрацией обычно 25 ррт)
или надуксусную кислоту (обычно 1000-2000 ррт). Обработанное оборудование вы-
сыхает примерно в течение часа и затем может использоваться без последующего опо-
ласкивания, что является большим преимуществом. Дезинфицирующие средства на
основе хлора, по мнению пивоваров, как правило, требуют последующего ополаскива-
ния (хотя, возможно, это и ошибочное представление, связанное с возможностью кор-
розии и образующихся, особенно при использовании вместе с кислотной мойкой,
вредных газообразных продуктов; подробнее об этом см. главу 11).
Большинство мини-пивзаводов в настоящее время использует для розлива одно-
разовые бутылки, которые моют и дезинфицируют озоновой водой, раствором над-
уксусной кислоты (125 ррт) или диоксидом хлора или раствором йода (2 ррт), пос-
ле чего ополаскивают чистой водой и затем наполняют. Готовое пиво в бутылках
подвергают микробиологическому анализу, хотя (как мы отмечали выше) результа-
ты не всегда бывают известны до отгрузки продукции. Обычно осуществляют мемб-
ранное фильтрование 100 мл пива из одной бутылки. Мембраны помещают на по-
верхность питательной среды с гексимидом или без него и инкубируют в аэробных
или анаэробных условиях при 27 °С для последующего анализа на наличие микро-
организмов, включая микроорганизмы-вредители пива.
10.5. В заключение
На мини-пивзаводах в США производится много сортов пива (при огромном раз-
нообразии условий, оборудования и технологий). Во многих случаях условия произ-
водства далеки от идеальных, и пивовары стараются изо всех сил соответствовать тре-
бованиям, которые предъявляются к производимым ими продуктам и применяемым
технологиям. Обычно они достаточно грамотны, чтобы понимать, какие микробиоло-
гические/санитарно-гигиенические проблемы и где могут возникать на их заводах,
Глава 10. Микробиология и санитария на мини-пивзаводах США 313
и предпринимают меры по обеспечению чистоты продукта вопреки неблагоприят-
ным условиям производства. Обычно эти меры включают в себя использование пол-
ностью закрытого оборудования из нержавеющей стали и тщательную санитарно-
гигиеническую обработку контактирующих с пивом поверхностей. Это характерно
для всех мини-пивзаводов, поскольку тщательная мойка и санитарно-гигиеническая
обработка — это именно то, что можно делать основательно с минимальным исполь-
зованием техники. Те пивовары, которым посчастливилось работать в постоянном
контакте с лабораторией, используют ее в основном для микробиологических анали-
зов дрожжей (отбирая пробы в процессе производства, с контактирующих с пивом
поверхностей и из готового продукта). В результате пиво, произведенное на пивза-
водах, успешно продается на самых разных рынках, даже достаточно удаленных от
заводов.
Литература
1. Guinard, J.-X., and Lewis, M J. (1990) Master Brewers Association of the Americas Technical
Quarterly, 27,83.
2. Lewis M.J., and Young, T.W. (2002) Brewing. Second Edition. Aspen Publishers, Inc.,
Gaithersburg, Maryland.
Глава 11
МОЙКА И ДЕЗИНФЕКЦИЯ В ПИВОВАРЕНИИ
Манджит Сингх, Джекки Фишер {Manjit Singh, Jackie Fisher)
11.1. Введение
Вопросы мойки и дезинфекции в пивоварении касаются настолько обширной об-
ласти, что было бы невозможно рассмотреть все их аспекты детально. При мойке и
дезинфекции применяются щелочные и кислотные моющие средства, ферменты,
постоянно изучаются активные компоненты дезинфицирующих составов. Те или
иные недостатки свойственны всем системам мойки и дезинфекции, и технология
еще не достигла уровня, когда можно было бы применить некое универсальное сред-
ство. Выбор моющего средства и дезинфектанта должен осуществляться на основе
тщательно продуманного компромисса.
В данной главе мы рассмотрим широкий спектр моющих и дезинфицирующих
средств с точки зрения методов их применения и типов используемых химических
соединений, не ставя перед собой задачи дать четкое изложение теории мойки и де-
зинфекции.
11.2. Определения
Прежде всего следует остановиться на терминологии. Некоторые применяемые
нами термины являются стандартизованными [3], а некоторые появились в самой
промышленности и иногда применяются неправильно. Список наиболее важных
терминов приведен ниже.
1. Физическая чистота — чистота при визуальном осмотре.
2. Химическая чистота — такая чистота, когда чтобы то ни было (например, про-
дукт) при контакте с вымытой поверхностью не подвергается загрязнению
(контаминации). Ее можно представить как результат такой мойки, когда при
смачивании поверхности чистой водой она стекает непрерывной пленкой, не
образуя ручейков и капель.
3. Микробиологическая чистота — отсутствие физических и микробиологических
загрязнений.
4. Детергент — моющее средство, которое благодаря физическим и химическим
процессам удаляет загрязнение с моющейся поверхности.
5. Загрязнение — любое вещество, находящееся в ненадлежащем месте; например,
хотя пиво — это напиток, но если его пролить на костюм, оно становится загряз-
нением, вполне достаточным, чтобы оставить пятно.
6. Дезинфекция — разрушение микроорганизмов (но, как правило, не спор бакте-
рий). Не требуется уничтожать все микроорганизмы — достаточно лишь умень-
Глава 11. Мойка и дезинфекция в пивоварении
315
шить их количество до уровня, безопасного для здоровья человека и не влияю-
щего на качество продукта. Химикаты, используемые для дезинфекции, назы-
вают дезинфектантами.
7. Химическое обеспложивающее вещество или стерилизатор — неправильное обо-
значение дезинфектантов. Стерилизация подразумевает под собой полное
уничтожение или удаление микроорганизмов, что не достижимо химическими
средствами.
8. Санитарная обработка — термин, использующийся в основном в пищевой про-
мышленности и системе общественного питания для обозначения процесса
мойки и дезинфекции приспособлений и оборудования (дезинфицирующее
средство — химическое вещество, используемое для санитарной обработки).
9. CIP (Cleaning In Place) — безразборная мойка, иногда автоматизированная.
11.3. Стандарты мойки и дезинфекции
в пивоварении
На каждом этапе производства пива важно понять, что именно нуждается в мойке
и к каким ее результатам необходимо стремиться. Даже упростив весь процесс пиво-
варения, сведя его к нескольким отдельным стадиям, мы получим их более десятка,
для каждого из которых существует «свое» оборудование, «свой» тип загрязнения и
«свой» допустимый уровень чистоты (табл. 11.1). Как свидетельствует эта таблица,
мойка на пивоваренном производстве представляет собой комплекс технологиче-
ских операций, направленных на устранение самых разнообразных загрязнений.
Требуемый результат зависит от конкретной стадии производства, но в целом для
достижения микробиологической чистоты оборудования используется мойка CIP.
Существенно облегчает процесс вода стабильно высокого качества для ополаскива-
ния, от которой зависят результаты мойки.
Чтобы выработать рекомендации относительно выбора типа моющего средства,
помимо технологии мойки, типа загрязнений и способов их удаления необходимо
иметь точную информацию о качестве воды (как минимум, о ее жесткости — времен-
ной и постоянной, общем содержании растворенных солей, рН и микробиологиче-
ском составе). В табл. 11.2 приведены данные Водного управления графства Юж-
ный Стаффордшир по анализам местной водопроводной воды и воды из скважины.
Необработанная вода из скважины при нагревании или обработке щелочными или
каустическими моющими средствами образует осадок (хлопья). Высокое содержа-
ние растворенных солей может вызвать проблемы с ополаскиванием. Таким обра-
зом, вода из скважины для мойки не подходит, хотя она относительно дешева и легко
доступна. Водопроводная вода тоже относительно жесткая, и хотя она может подхо-
дить для мойки, при использовании некоторых моющих средств ее следует умягчать.
Обычно наиболее эффективным в финансовом плане способом является умягчение
воды методом ионного обмена.
Многие проблемы, возникающие из-за жесткости воды, можно устранить приме-
нением кислотных моющих и дезинфицирующих средств, однако их использование
связано с некоторыми Офаничениями (в отличие от щелочных) и ограничивается
легким и средним режимом мойки.
316
Манджит Сингх, Джекки Фишер
Таблица 11.1. Уровни необходимой чистоты и способы мойки для разных операций
в пивоварении
Технологический Л-г
процесс
Сол одо ращение
Дробление
Затирание
Фильтрование
Кипячение
Сепарирование
Охлаждение
Брожение
ъ/иируАовамие
Полы
Сита
Мельницы
Вальцы
Заторный чан
Заторный чан
Фильтр-чан
Заторный
фильтр
Фильтрующие
элементы
Сусловарочный
котел
Фильтр хмеля
Хмелеотде-
литель
Вирпул
Теплообменник
Открытые или
закрытые
бродильные
аппараты
(ферментеры)
Тип
' загрязнения
Инородные
частицы
Инородные
частицы
Инородные
частицы
Крахмал
Сахара
Белок
Минеральные
отложения
Таннины
Инородные
частицы
Крахмал
Сахара
Белок
Инородные
частицы
Крахмал
Сахара
Белок
Таннины
Минеральные
отложения
Хмель
Осадок
взвесей
сусла (труб)
Таннины
Белок
Желаемый
i результат
Физическая
чистота
Физическая
чистота
Химическая
чистота
Химическая
чистота
Химическая
чистота
Микробиологическая
чистота
Микробиологическая
Минеральные чистота
отложения
Ржавчина
Инородные
частицы
Дрожжи
Белок
Продукты
окисления
Таннины
Сахара
Минеральные
отложения
Микробиологическая
чистота
Способ
мойки
Ручной
Ручной
Ручной или CIP
Ручной или CIP
Ручной или CIP
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
Ручной
с последующим
дезинфицирующим
ополаскиванием
Глава 11. Мойка и дезинфекция в пивоварении
317
Таблица 11.1 (окончание)
Технологический ^ Тип Желаемый
процесс Оборудование загрязнения результат
Способ
мойки
Сепарация Фильтры Дрожжи Микробиологическая
Центрифуга Белок чистота
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
Ручной с последующим
дезинфицирующим
ополаскиванием
Стабилизация
Осветление
Хранение,
транспортировка
Пастеризация
Розлив
(в кеги)
Закрытые
емкости
(буферные
танки)
Фильтры
Центрифуги
Форфасы
Автомобильные
цистерны
Теплообменник
Кеги
Бочонки
Филлеры
Дрожжи
Белок
Минеральные
отложения
Дрожжи
Белок
Дрожжи
Белок
Микробиологическая
чистота
Микробиологическая
чистота
Микробиологическая
чистота
Минеральные Микробиологическая
отложения
Белок
чистота
Микробиологическая
Минеральные чистота
отложения
Осадок из
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
Ручной
с последующим
дезинфицирующим
ополаскиванием
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
Пастеризация
в бутылках
Бутылки
Установка
розлива
Лента
транспортера
Подогрев
жестяных банок
инородных
Бумага
Клей
Плесень
Водоросли
Минеральные
отложения
Осадок из
инородных
частиц
Микробиологическая
чистота
В установке розлива —
путем повышения
температуры
и применения
щелочи;
CIP с детергентами/
дезинфектантами или
дезинфицирующими
средствами
Дозирование
биоцидных средств
Микробиологическая Контроль осадка
чистота инородных частиц
318
Манджит Сингх, Джекки Фишер
Таблица 11.2. Анализ местной водопроводной и воды из скважины на пивоварне Burton-on-Trent
(Великобритания)
Вода из скважины Водопроводная вода
Общая жесткость (в ррт СаС03) 791 232
Са2+ (в ррт СаС03) 473 160
Мд2* (в ррт МдС03) 318 72
Общее количество растворенных сухих веществ (ррт) 1060 375
Общая щелочность (в ррт СаС03) 516 103
рН 8,3 7,2
11.4. Способы мойки
На пивоваренных предпрятиях применяют разные способы мойки, большинство
из которых представляют собой разновидности следующих операций:
1. Ручная мойка (с помощью швабры и ведра).
2. Мойка замачиванием (ванны для замачивание инвентаря и съемных колен).
3. Струйная мойка под высоким давлением (например, стен и полов).
4. Пенная мойка, мойка с применением гелей (установки розлива, небольшие бро-
дильные аппараты).
5. Циркуляционная С/Р-мойка (емкостей и трубопроводов) при помощи уст-
ройств высокого и низкого давления.
Процесс пивоварения включает в себя перемещение жидкостей из одной произ-
водственной емкости в другую. На каждом этапе состав этих жидкостей меняется в
результате сложных реакций, они нагреваются, охлаждаются и фильтруются. Вслед-
ствие этих процессов состав загрязнений меняется (см. табл. 11.1).
Ббльшая часть оборудования современных пивоваренных предприятий представ-
ляет собой большие закрытые емкости с ограниченным доступом. Поэтому не уди-
вительно, что для мойки высоких ЦКТ и километров трубопроводов на современ-
ных пивзаводах используют С/Р-мойку. Детальное рассмотрение ее технических
аспектов не входит в задачи нашей книги, однако необходимо понимать основные
принципы С/Р-мойки и применяемых систем, которые мы и рассмотрим ниже.
Для мойки емкостей (резервуаров, танков) применяют два основных метода нане-
сения моющих средств: с помощью устройств низкого давления (распылительных
головок, размещенных так, чтобы они обеспечивали мойку всей поверхности аппа-
ратов, рис. 11.1 и 11.2) и с помощью вращающихся форсунок высокого давления (рис
11.3). Хотя мощный поток жидкости из такой форсунки обеспечивает наиболее эф-
фективную мойку, при наличии не слишком большого загрязнения моечный цикл в
этом случае невозможно сократить. Чтобы охватить всю внутреннюю поверхность
резервуара, форсунка должна закончить оборот в течение полного цикла мойки (же-
лательно предусмотреть внешний контроль за вращением форсунки). Более тонкие
струи из распылительной головки обеспечивают лишь химическое воздействие мо-
ющего средства, но распыление жидкости на всю внутреннюю поверхность танка
ведется непрерывно, и в случае не очень загрязненных поверхностей цикл мойки
можно сократить. В этом случае необходимо предотвращать засорение отверстий
Глава 11. Мойка и дезинфекция в пивоварении
319
(например, установив на линию подачи растворов фильтр, задерживающий твердые
частицы). Мойка трубопроводов осуществляется путем подачи в трубы моющего
раствора. Скорость мойки и связанный с этим расход моющих средств представлены
в табл. 11.3, из которой видно, что для достижения наилучшего результата мойки
существует некоторые оптимальные диапазоны расхода. Требования к мойке следу-
ет учитывать еще при проектировании обвязки трубопроводов, но если в соответ-
ствии с требованиями технологии диаметр труб должен быть больше, то требуемые
скорости перемещения моющего расхода могут оказаться неэффективными. Кроме
того, производственная схема может предусматривать необходимость движения мо-
ющего раствора в противоток движению продукта.
Разработаны самые разные системы CIP, обеспечивающие совместимость станций
CIP с технологическим оборудованием. Они делятся на три основных типа: системы
ШШШШШЙШШ
А-
Рис. 11.1. Расположение моющих головок в емкостях варочного отделения
Рис. 11.2. Расположение моющих головок в буферных танках
320
Манджит Сингх, Джекки Фишер
Рис. 11.3. Вращающаяся форсунка в бродильном чане
Таблица 11.3. Скорость движения моющих средств и связанный с этим их расход
Диаметр
трубы,
см
2,5
5,0
7,5
10,0
15,0
21,0
0,9
28
111
250
445
1001
1779
А
1.2
37
148
334
593
1334
2372
Скорость
1,5
46
185
417
741
1668
2964
моющего средства в
1.8
56
222
500
889
2001
3557
Б
2,1
65
259
584
1038
2335
4150
трубопроводе
2,4
74
296
667
1185
2668
4731
,м/с
2,7
83
334
750
1334
3002
5336
В
3,0
93 (л/м)
371 (л/м)
834 (л/м)
1482(л/м)
3335(л/м)
5929 (л/м)
Диапазоны: А — ополаскивание; Б — активная мойка; В — без улучшения эфективности мойки с
увеличением риска гидравлических ударов, приводящих к повреждению трубопроводов и
оборудования.
без повторного использования моющих средств, системы с частичным восстановлени-
ем моющего средства и системы с его полным восстановлением (см. соответственно
рис. 11.4,11.5 и 11.6). Основное отличие между ними заключается в том, что в первом
случае не предусматривается повторное использование моющего средства и воды для
ополаскивания, а в двух других системах CIP собирают и используют повторно мою-
щие растворы и воду после ополаскивания, которая далее используется для предвари-
тельной мойки оборудования. При этом экономят как моющие средства, так и воду.
В любом случае цикл мойки включает в себя предварительную промывку (опо-
ласкивание), предназначенную для удаления основных крупных загрязнений, и ре-
циркуляцию моющего средства для мойки емкостей и трубопроводов. После слива в
канализацию или сбора для повторного использования моющего средства емкость
промывается чистой водой (к этой чистой воде может быть добавлен дезинфектант).
Глава 11. Мойка и дезинфекция в пивоварении
321
Подача
промывной
воды
Подача CIP
Насос подачи
CIP-раствора
Q-
1
К
Буферный
танк
Насос
дозирования
дезинфектанта
Л
и
-&L
Подача
детергента
*< ВозвратCIP <ш7~\
Насос возврата
ОР-раствора
г
Емкость с моющим средством
в объеме суточной потребности
Рис. 11.4. Система мойки без повторного использования моющих средств
Подача
Подача промывной
детергента воды
Подача CIP
Насос подачи
С/Р-раствора
i
£1
Емкость для
разбавления
детергента
Емкость с
промывочной
водой
-« Возврат С/Р
Насос
дозирования
дезинфектанта
СП
Li 1 Емкость с моющим средством
в объеме суточной потребности
Рис. 11.5. Система с частичным возвратом моющего средства
322
Манджит Сингх, Джекки Фишер
Подача
детергента
v
Подача
промывной
воды
V
I ^ Возврат
Подача CIP
Насос
подачи
С/Р-раствора
Насос
дозирования
дезинфектанта
Емкость
с моющим средством
в объеме суточной потребности
Рис. 11.6. Система с повторным использованием моющего средства
Для более эффективной промывки иногда применяют пульсирующую подачу воды
(«ударная промывка»).
Безвозвратные системы чаще используют в случаях, когда оборудование сильно
загрязнено и повторное использование моющего средства может привести к загрязе-
нию другого оборудования (например, установки регенерации дрожжей). При мойке
не очень загрязненного оборудования (например, форфасов, буферных танков и ав-
тоцистерн) лучше использовать системы с восстановлением моющего раствора.
Процесс мойки с использованием моющего средства является сложным сочетани-
ем химических и физических воздействий. Для достижения удовлетворительных
результатов мойки необходимо учитывать все факторы: химическое и механическое
воздействие а также температуру, то есть
Требуемые затраты Химическая Механическая Тепловая
энергии на мойку "~ энергия + энергия энергия
Как правило, установки, используемые для осуществления процессов, протекающих
при высоких температурах (затирание, пастеризация) моют горячими растворами,
а при низких температурах — холодными. В любом случае, чтобы убедиться в достаточ-
ности общей требуемой для мойки энергии, после установления удовлетворительного
режима мойки необходимо учитывать уравнение энергетического баланса.
11.5. Состав загрязнений
Очень важно знать, как изменяется состав загрязнений в ходе технологического
цикла производства пива (от варочного отделения до бродильного и лагерного), по-
скольку денатурированные белки постепенно заменяются таннинами и минераль-
Глава 11. Мойка и дезинфекция в пивоварении
323
ными веществами. Физический объем загрязнений меняется от участка к участку, и
под влиянием продолжительности цикла и температуры загрязнения модифициру-
ются. Для достижения приемлемого стандарта мойки выбранное для определенной
мойки моющее средство должно быть химически активно по крайне мере к части
загрязнений.
11.6. Моющая способность
Моющая способность того или иного средства определяется, по меньшей мере,
четырьмя процессами:
1. Смачивание поверхности для улучшения контакта моющего средства с загряз-
нением.
2. Химическое воздействие на загрязнение. Здесь возможны как минимум три вза-
имодействия:
• воздействие кислот на минеральные вещества (происходит растворение
неорганических минеральных отложений);
• реакции гидролиза, в ходе которых растворяются белки;
• омыление компонентов масел под воздействием щелочи.
3. Диспергирование крупных частиц в более мелкие.
4. Образование суспензии.
На пивоваренном предприятии мойка замачиванием, распылением и циркуляци-
онная мойка так или иначе включает в себя все вышеперечисленные физические и
химические процессы. Тип моющего средства и метод его применения определяют,
насколько эффективно будут удалены загрязнения. Ниже мы рассмотрим химичес-
кую природу детергентов применительно к удалению загрязнений в пивоваренном
производстве.
11.7. Принципы действия моющих средств на загрязнения
На пивоваренных предприятиях почти во всех процессах мойки применяются
сильные либо кислотные, либо щелочные средства (рис. 11.7) по одной простой при-
чине: наилучшим образом устранение загрязнений происходит при химическом воз-
действии, а две основные реакции — растворение неорганических загрязнений и
органических остатков — происходят в области высоких концентраций ионов Н+
(сильнокислые среды) или ОН" (сильно щелочные среды).
Эти реакции можно представить следующим образом:
растворение минеральных веществ кислотами
CaC03+ 2HC1 -> СаС12+ Н20 + Ш2Т
+ растворение белков
Белковый коплекс или S„L ~> -NH CH2CO NH CH2 CO NH-
Растворение масел и жирных кислот
R-COOH + NaOH => R-COOH + Н20,
где R — линейная насыщенная или ненасыщенная алкилгруппа > С8.
324
Манджит Сингх, Джекки Фишер
в
Слабые
кислотные
моющие средства
Применение
растворов кислот
«ПОЧТИ» НЕЙТРАЛЬНЫЕ
МОЮЩИЕ СРЕДСТВА
Пиво
Применение
щелочных
растворов
Слабые щелочные
моющие средства
Применение
растворов каустика
0 12 3 4
Увеличение КГ
5 6 7 8 9 10 11 12 13 14
Шкала рН
Увеличение "ОН
Рис. 11.7. Шкала рН, отражающая относительные положения щелочных, «нейтральных»
и кислотных моющих средств
С точки зрения обработки, хранения и удаления отходов предпочтительнее ис-
пользовать почти нейтральные моющие средства. В настоящее время применение
этого типа моющих средств ограничено главным образом ручными операциями (хи-
мический эффект дополняется физическим воздействием). Применяемые в боль-
шинстве С/Р-операций моющие средства являются разновидностями каустической
соды, однако все большее распространение получают всевозможные кислотные мо-
ющие и дезинфицирующие средства.
11.8. Щелочные моющие средства и каустик
NaOH — сильнодействующее химически активное вещество, служащее основой
для большинства сильных детергентов, используемых в пивоваренном производ-
стве. NaOH имеет ряд преимуществ по сравнению с другими веществами, способ-
ными служить основой для моющих средств. Антимикробное воздействие NaOH
доказано в [5], а его летальное воздействие на споры Bacillus subtilis показано
в табл. 11.4.
Основными недостатками NaOH как компонента моющих средств является его
чувствительность к жесткости воды и содержащемуся в атмосфере С02. Осаждение
солей жесткости воды происходит по следующим реакциям:
(a) Са(НС03)2 + 2 NaOH => СаСО^ + Na2C03 + Н20 ;
(b) MgS04 + 2 NaOH => Mg(OH)2l + Na2S04;
(c) CaS04 + Na.2C03 => CaC03>L + Na2S04
Реакция с двуокисью углерода происходит следующим образом:
2 NaOH +C02=> Na2C03 + Н20 .
Предотвратить эти реакции химическим путем невозможно, однако вредное вли-
яние жесткой воды может быть предотвращено путем добавления к каустической
соде тщательно подобранных добавок, основными из которых являются добавки-
комплексообразователи. За последние годы технология применения этих добавок
существенно продвинулась вперед, и мы рассмотрим их в следующем разделе.
Глава 11. Мойка и дезинфекция в пивоварении
325
Таблица 11.4. Концентрация NaOH (% масс
Температура,
49,0
54,5
60,0
65,5
71,0
°С
1
2,44
2,15
1,90
1,66
1,46
.), достаточная для уничтожения 25% популяции спор
Bacillus subtilis при различных температурах
2
1,64
1,44
1,28
1.12
0,89
Время, мин
4
1.10
0,97
0,86
0,75
0,66
8
0,74
0,65
0,58
0,51
0,45
16
0,50
0,44
0,39
0,34
0,30
11.9. Комплексообразователи
Применяемые в настоящее время в моющих средствах комплексообразователи по
способу их действия можно разделить на две основные категории.
11.9.1. Стехиометричные комплексообразователи
Стехиометрические комплексообразователи действуют посредством комплексо-
образования — процесса, в котором ионы металла удерживаются комплексообразо-
вателями в стабильной структуре, обычно в определенном соотношении ионов ме-
талла к комплексообразователю.
Обычно для процесса мойки на пивоваренном предприятии применяют:
• аминокарбоновые кислоты, нитрилотриуксусную кислоту (NTA) и этилендиа-
мин-тетрауксусную кислоту (EDTA);
• гидроксикарбоновые кислоты (глюконовая кислота и ее производные);
• полифосфаты (триполифосфат натрия, гексаметафосфат натрия).
В составе моющих средств часто используются три- и тетранатриевые соли ами-
нокарбоновых кислот NTA и EDTA (например, NagNTA и Na4EDTA). Поскольку эти
комплексообразователи способны образовывать стабильные хелаты с ионами метал-
ла, применение обоих видов добавок способствует устранению загрязнений, содер-
жащих в своем составе неорганические соединения. Действие хелатов приводит к
связыванию ионов металлов, облегчая удаление минеральных веществ. Чем больше
значение константы стабильности (табл. 11.5) хелатов NTA и EDTA с ионами метал-
лов, тем выше термодинамическая стабильность [1]. Константа стабильности иона
металла к комплексообразователю MZ задается выражением:
KMZ=[M+][Z-]/[MZ].
Как следует из табл. 11.5, logKM7 сродства кальция к NTA и EDTA составляют
6,4 и 10,6 соответственно, в связи с чем отношения концентрации недиссоцииро-
ванного комплекса [MZ] и диссоциированного комплекса [М+] [Z] составляют
10w: 1 и 1010'6:1 (соответственно для NTA и EDTA). Известно, что EDTA образует
более стабильный комплекс и поэтому эта кислота более предпочтительна для уда-
ления минеральных осадков с большим содержанием солей кальция.
В табл. 11.6 приведена эффективность комплексообразования двух соединений —
Na3NTA и Na4EDTA — при определенных значениях рН. При этом очевидно, что
326
Манджит Сингх, Джекки Фишер
Таблица 11.5. Логарифм констант стабильности нитрилотриуксусной (NTA) и этилендиамин-
тетрауксусной (EDTA) кислот
Ион металла NTA EDTA
Mg24 5,4 8,7
Са2* 6,4 10,6
Мп2* 7,4 13,8
AI3* - 16,1
Fe2* 8,8 14,3
Zn2* 10,7 16,5
Pb2+ 11,4 18,0
Ni2* 11,5 18,6
Си2* 13,0 18,8
Fe3» ^9 25J
Na3NTA более эффективно (больше связанных ионов металла на 1 г активного комп-
лексообразователя) [1]. Состав используемых на пивоваренных предприятиях мою-
щих средств на основе этих комплексообразователей можно оптимизировать в зави-
симости от цели применения. К примеру, если необходимо лишь смягчить воду,
образуя при этом растворимые хелаты, то NTA более эффективна, чем EDTA, но для
удаления сильного налета в теплообменнике более эффективна EDTA.
Таблица 11.6. Эффективность комплексообразования 1 г солей натрия нитрилотриуксусной
и этилендиамин-тетрауксусной кислот при 25 СС
Ион металла Na3NTA, мг
Са2* 140-156
(рН 9,0-12,0)
Мд2+ 78
(рН<10,0)
Си2* 247
(рН 3,0-12,0)
Fe3* 217
(рН 1,5-3,0)
Что касается комплексообразователей типа гидроксикарбоновой кислоты, наибо-
лее часто применяют глюконовую кислоту, которая хорошо растворима в каустиче-
ской соде и характеризуется высокой стабильностью в условиях длительного хра-
нения и повышенных температур. Для более эффективного хелатообразования
глюконовую кислоту следует использовать в присутствии каустической соды. При
рН И один г глюканата натрия связывает всего 25 мг СаС03, тогда как в 3%-ном ра-
створе NaOH (рН 14) — 325 мг. Глюканат натрия можно вводить в рецептуру мою-
щих растворов в основном в качестве жидких смесей, что широко применяется при
мойке в варочном отделении. Его также используют при мойке в условиях нафевания
до кипения при концентрациях NaOH до 5% масс.
Глюканат натрия является также эффективным комплексообразователем для Fe3+
и А13*, и поэтому его рекомендуют для мойки пивных бутылок, так как при наличии
Na4EDTA, мг
110
(рН 8,5-11,5)
64
(рН 8,0-10,5)
167
(рН 1,5-13,0)
147
(рН 1,0-6,0)
Глава 11. Мойка и дезинфекция в пивоварении
327
фольги вокруг горлышка бутылки и на этикетке необходимо суспензировать и удалять
алюминий. Кроме того, глюканат натрия удаляет кольца ржавчины с горлышка бутылки.
Большой и разнообразной группой комплексообразователей являются полифос-
фаты, но из-за их недостаточной растворимости и стабильности в растворе каусти-
ческой соды их чаще применяют в порошкообразных моющих средствах. Полифос-
фаты в высоких концентрациях проявляют себя не только как стехиометрические
комплексообразователи, но и обладают пороговым эффектом. Более того, они спо-
собствуют повышению моющей способности благодаря улучшению дисперигирова-
ния и ополаскивающих свойств.
11.9.2. Пороговые комплексообразователи
Пороговые комплексообразователи действуют на достехиометрическом уровне.
Относительно небольшое количество пороговых комплексообразователей может
предотвратить отложение солей жесткости воды. В отличие от стехиометричеких
секвестрантов, образующих растворимые хелаты, пороговые секвестранты модифи-
цируют физические свойства осадка. Так как они могут деформировать кристалли-
ческую решетку, то в этом отношении они ведут себя как модификаторы роста крис-
таллов. Фактически они не предотвращают осаждение нерастворимых солей.
Пороговые секвестранты находят применение в моющих средствах для С/Р-мой-
ки и в средствах, предназначенных для мойки бутылок (обычно в сочетании со сте-
хеометрическими секвестрантами).
Пороговый эффект у полифосфатов проявляется на достехиометрическом уров-
не, причем наиболее заметен он у производных фосфоновой кислоты — например,
у метиленфосфоновой (АТМР) и 1-гидроксиэтан-дифосфоновой кислоты (HEDP).
Производные полиакриловой кислоты могут вести себя и как пороговые вещества,
и как диспергаторы, зачастую являясь составной частью моющих средств для CIP-
мойки на основе каустика и щелочи.
Комплексообразователи играют важную роль в составе щелочно-кислотных мою-
щих средств. Среди прочих параметров, влияющих на состав моющего средства, при-
меняемого на пивоваренном предприятии, можно выделить качество воды и состав
загрязнения. Хорошо подобранная рецептура моющего средства при правильном
сочетании свойств стехиометрических и пороговых комплексообразователей допус-
кает небольшие изменения этих параметров.
11.10. Кислоты
Кислоты входят в состав применяемых на пивоваренных предприятиях моющих
средств уже много лет — сначала как средства в основном против накипи, а впослед-
ствии они стали все шире использоваться для С/Р-мойки емкостей и трубопроводов.
Одной из основных причин применения кислот является их совместимость с С02.
Использование совместимых с С02 моющих средств позволяет экономить время,
моющие средства и С02. В работе [4] приведены экспериментальные данные относи-
тельно потерь С02 при использовании детергента на основе каустика (табл. 11.7),
и из них следует, что С02 существенно влияет на каустик даже приД5%-ной концен-
трации С02. Перед мойкой каустическим моющим средством желательно удалить
С02 из емкости, однако в условиях дефицита времени это может быть не совсем
328
Манджит Сингх. Джекки Фишер
практично, поскольку для удаления С02 через люк, не приводящего к изменению
концентрации каустика, необходимо примерно 5 ч (табл. 11.8).
На пивовареном предприятии чаще всего использут фосфорную кислоту. При до-
бавлении в фосфорную кислоту соответствующих (ПАВ) получают хорошее мою-
щее средство для системы CIP, часто использующееся для мойки кегов. При смеши-
вании ПАВ с азотной кислотой получается более агрессивное моющее средство,
обладающее при достаточном количестве азотной кислоты бактериостатическими
свойствами. Азотная кислота дешевле фосфорной и на нержавеющую сталь оказы-
вает пассивирующее действие, но она может разрушать арматуру, изготовленную из
меди, латуни и фосфористой бронзы.
Серная кислота в чистом виде вызывает коррозию нержавеющей стали, и ее сле-
дует применять в сочетании с ингибиторами коррозии. Серная кислота — самая де-
Таблица 11.7. Потери С02 и NaOH при применении моющего средства на основе каустика
с концентрацией 2% NaOH
Начальное
содержание
С02,%
97
50
40
32
23
5
0
После
едварительной
промывки, %
а
с
85
34
32
25
13
12
—
со,
После
промывки
моющим
средством, %
66
15
18
9
4
5
—
После
кончательного
поласкивания,
%
О 0
57
13
16
7
3
5
—
Потери
> всем цикле
мойки, %
в
40
37
24
25
20
10
—
Уменьшение
онцентрации
NaOH, %
ж
1,00
1,15
0,75
0,75
0,70
0,70
0,15
Таблица 11.8. Скорость удаления С02 из бродильной емкости
Время,ч
Содержание С02,%
ф 1
И*
Z 1- О
с z О
S 5«
> о
*
0,90
0,95
0,60
0,55
0,45
0,60
0,09
0,0 98
0,5 45
1,0 25
1,5 20
2,0 13
2,5 9
3,0 7
3,5 6
4,0 5
4,5 4
5,0 3
5,5 3
Глава 11. Мойка и дезинфекция в пивоварении
329
шевая, но ее моющая способность меньше, чем у фосфорной. Применяют ее в составе
некоторых дезинфицирующих средств, когда для более эффективного действия био-
цидов предпочтительно более низкое значение рН.
Действие соляной кислоты на низкоуглеродистую сталь может быть устранено
применением катионактивных ингибиторов коррозии. В подобном сочетании мою-
щее средство используется для удаления солей жесткости воды в бутылкомоечной
машине. Соляная кислота является хорошим средством против минер,альных отло-
жений. Так как соляная кислота относительно недешева, а по свойствам не превос-
ходит фосфорную, применяется она в ограниченных масштабах.
При рассмотрении любой кислоты большое значение имеют ее коррозионные
свойства. Неорганические кислоты, обычно применяемые в моющих средствах на
пивоваренных предприятиях, обладают высокими коррозионными свойствами от-
носительно низкоуглеродистых сталей и не должны использоваться без ингибито-
ров коррозии. Коррозионные свойства соляной, азотной, фосфорной и серной кис-
лот по отношению к нержавеющей стали марок 304 и 316 приведены на рис. 11.8
и 11.9, и из них ясно, что азотная и фосфорная кислоты гораздо более совместимы
с этими металлами и могут использоваться без проблем [4]. При выборе какого-либо
кислотного моющего средства из-за возможности коррозии всегда необходимо про-
верять содержание хлора в водном растворе моющего средства.
Органические кислоты (лимонная, глюконовая или винная) менее эффективны
при удалении пивного камня и намного дороже, чем неорганические, в связи с чем на
пивоваренных предприятиях их применяют достаточно редко.
11.11. Поверхностно-активные вещества
Поверхностно-активные вещества (ПАВ) используются в моющих средствах на
пивоваренных предприятиях лишь в особых целях — например, определенный тип
ПАВ часто применяют при мойке бутылок в качестве антивспенивателя и в составе
моющего средства для кислотной CIP- мойки для повышения его моющей способно-
сти. Входящие в состав моющих средств ПАВ выполняют четыре основные функции:
• уменьшение поверхностного натяжения жидкости, что улучшает смачивание;
• образование пены вследствие уменьшения поверхностного натяжения и физи-
ческого захвата воздуха. На стабильность образуемой пены влияют другие по-
верхностные эффекты. В системах CIP пенообразование не желательно, хотя
зачастую оно необходимо для пенной мойки;
• некоторые нерастворимые в воде ПАВы могут использоваться в моющих ра-
створах для пеногашения, и это их свойство широко применяется в средствах
для мойки бутылок;
• помимо улучшения моющей способности путем уменьшения поверхностного
натяжения, ПАВы также могут предотвращать повторную адгезию загрязне-
ний, ранее удаленных путем диспергирования и мицеллообразованием.
Все молекулы ПАВов имеют гидрофильную и гидрофобную структуру. При до-
бавлении в воду молекулы собираются на поверхности таким образом, чтобы у гид-
рофобной части контакт с водой был минимальным. По достижении определенной
концентрации молекулы, не способные найти пространство на поверхности раство-
330
Манджит Сингх, Джекки Фишер
о
то
а
а)
с
Сталь
Фосфорная кислота марки 304
Сталь
марки 316
20 40 60 80
Масса кислоты, %
Сталь
Азотная кислота марки 304
20 40 60 80
Масса кислоты, %
Сталь
марки 316
100
100-
80-
60-
40-
20-
он
^<^%
'li
Ч'Д
1 1 1 1 —'
20 40 60 80
Масса кислоты, %
100
20 40 60 80
Масса кислоты, %
100
| | < 0,03 мм/год | | 0,03-0,13 мм/год
ШИШ < 0,13-0,75 мм/год [$$$$$! >0,75 мм/год
Рис. 11.8. Рост коррозии, вызываемой фосфорной и азотной кислотами
ра, формируют в растворе мицеллы, способные удерживать загрязнения в суспензии
и даже их растворять.
ПАВы классифицируют по заряду диссоциированных частиц: анионы заряжены
отрицательным зарядом, а катионы — положительным. Неионные ПАВы не имеют
суммарного заряда, и эта амфотерная группа может иметь любой заряд в зависимо-
сти от значения рН. К анионной группе относят мыла, являющиеся хорошими детер-
гентами и смазывающими веществами, а щелочные соли (сульфонаты и сульфаты)
используются в сильно пенящихся нейтральных детергентах или моющих жидко-
стях. Мыла зачастую применяют на пивоваренных предприятиях как смазочные ве-
щества для конвейерных лент.
К катионным ПАВам относят соли аминов жирных кислот, которые используют-
ся в качестве ингибиторов коррозии (особенно при водоподготовке). Четвертичные
аммонийные соединения (QAC) примечательны своими биоцидными свойствами.
Большинство этих соединений (но не все) оказывают нежелательное влияние на пе-
ностойкость пива и поэтому применяются на пивоваренных предприятиях в ограни-
ченных количествах. Значимую роль в мойке играют неионные ПАВы, обладающие
Глава 11. Мойка и дезинфекция в пивоварении 331
Сталь Сталь
Соляная кислота марки 304 марки 316
120 п 1 т 1
< 0,13-0,75 мм/год R$$^j > 0,75 мм/год
Рис. 11.9. Рост коррозии, вызываемой соляной и серной кислотами
хорошими моющими свойствами при обработке твердых поверхностей и используе-
мые как смазочные материалы и как средства для системы CIP. Некоторые неионные
ПАВы находят применение в качестве пеногасителей.
Группа амфотерных соединений очень разнообразна, причем они довольно неде-
шевы. Некоторые амфотерные соединения обладают биоцидными свойствами,
а другие благодаря своей мягкости применяются в шампунях и пенках для ванн, а на
пивоваренных предприятиях не находят широкого применения. Предполагается, что
в будущем применение специальных ПАВ в моющих средствах на пивоваренных
предприятиях возрастет вследствие повышения требований к охране окружающей
среды с ограничением использования сильнодействующих щелочных и кислотных
растворов.
11.12. Дезинфектанты и дезинфицирующие вещества,
используемые на пивоваренных предприятиях
Моющие средства используются в системах CIP, при замачивании, распылитель-
ной и ручной мойке. Подобным же образом используются и дезинфектанты, а для
обработки рециркуляционной воды в башенных охладителях и пастеризаторах ис-
332
Манджит Сингх, Джекки Фишер
пользуются особые их виды (о биоцидных средствах, используемых при обработке
воды, см. раздел 11.15).
Требуемые уровни чистоты на разных этапах пивоваренного производства были
приведены в табл. 11.1. Ниже мы рассмотрим эти этапы с точки зрения применения
дезинфицирующих веществ (начиная с варочного участка и заканчивая упаковкой
готового продукта). Этап дезинфекции служит залогом гарантированной чистоты
(например, при мойке CIP), а также применяется для дезинфекции и предотвраще-
ния повторного заражения (например, при отмочке в ваннах). Дезинфекция не ком-
пенсирует некачественную мойку, плохо составленную программу мойки или недо-
статки оборудования и может рассматриваться как процесс уменьшения количества
микроорганизмов до определенного приемлемого уровня. Уровень чистоты обычно
определяется для каждого отдельного участка с помощью отбора смывов после мой-
ки CIP или мазков с поверхности вымытого оборудования. На пивоваренных заво-
дах продукт обычно исследуют на присутствие бактерий и диких дрожжей на разных
стадиях технологического процесса.
В идеальном случае дезинфектант, используемый на пивоваренном предприятии,
должен обладать следующими свойствами:
• совместимостью с другими химическими веществами;
• совместимостью с материалами оборудования;
• толерантностью к жесткой воде;
• толерантностью к загрязнениям;
• низкой пенообразующей способностью или ее отсутствием;
• безопасностью при использовании, не раздражающим воздействием на кожу;
• способностью к длительному хранению;
• не оказывать влияние на головки распылительных устройств;
• широким диапазоном антимикробной активности при низких концентрациях и
температурах;
• экономичностью в использовании;
• слабым воздействием на окружающую среду.
К сожалению, ни один из дезинфектантов не обладает всеми вышеперечисленны-
ми свойствами. Ниже мы рассмотрим химические свойства, преимущества и недо-
статки применения дезинфектантов в пивоваренной промышленности.
Дезинфектанты подразделяют на окисляющие и неокисляющие.
11.13. Окисляющие дезинфектанты
11.13.1. Галогены: хлор
Обычно используются хлор- или йодсодержащие дезинфектанты, однако в послед-
нее время стали использоваться и бромсодержащие дезинфектанты. Газообразный
хлор применялся для дезинфекции больниц еще с 1791 г. [9], однако такое его приме-
нение — огромный недостаток, так как хлор очень ядовит.
Активный хлор применяется в двух видах:
1) неорганические соединения, содержащие ионы гипохлорита, как в жидком виде
(например, NaOCl), так и в виде порошка (например, хлорированный фосфат
натрия (Na3P(V ИН20)4- NaOCl • NaCl);
Глава 11. Мойка и дезинфекция в пивоварении
333
2) органические хлорсодержащие вещества в виде порошка (например, трихлори-
зоцианурат
CI
О
N
Трихлоризоциануровая кислота
N
С1
N
С1
О
В растворе все эти соединения гидролизуются до образования хлорноватистой
кислоты и/или ионов гипохлорита в зависимости от значения рН.
Кислота Щелочь
С12
газообразный хлор
<=> НОС1 «
хлорноватистая кислота
ОС1-
ион гипохлорита
В пивоваренном производстве обычно используется NaOCl. Это соединение наибо-
лее стабильно в слабом растворе щелочи, поэтому концентрат этого средства
поставляется на завод в стабильном состоянии с NaOH при значении рН до 12. В ис-
пользуемых растворах при 50-300 ррт значения рН составляют 7-9. При оптималь-
ном для дезинфекции рН 5,0 раствор менее стабилен. При рН менее 5,0 выделяется
газообразный хлор. NaOCl гидролизует протеины, делая их более растворимыми
и легко удаляемыми. Это соединение имеет много преимуществ, среди которых —
отсутствие пенообразования, толерантность к жесткой воде, отсутствие остатков
в виде активных компонентов и широкий антимикробный диапазон (включая действие
против вирусов и спор бактерий). Оно действует быстро и в использовании экономич-
но. К недостаткам можно отнести то, что это соединение при высоких концентрациях
оказывает корродирующее воздействие, приводит к раздражению кожи, а рабочий ра-
створ не стабилен, на него влияют загрязнения органической природы, а при хранении
возможно образование хлорфенола, хлораминов и связанных с ними проблем.
В последнее время для дезинфекции используемой для пивоварения воды приме-
няют хлор в виде двуокиси. Дезинфицирующая сила СЮ2 (не стабильного, потен-
циально взрывоопасного и ядовитого газа) известна с 1920-х гг. Двуокись хлора ра-
334
Манджит Сингх, Джекки Фишер
створима в воде, но в растворе не стабильна. СЮ2 может быть получена следующим
образом:
2NaC102 + 4НС1 => 4СЮ2 + 5NaCl + 2Н20.
Хлорит натрия взрывоопасен, и поэтому при необходимости получения С102 его
поставляют в растворе и смешивают с НС1. По причине опасности реагентов и про-
дукта для производства С102 на месте использования необходимо дорогостоящее
оборудование. Для дезинфекции чаще всего достаточны концентрации в пределах
0,1-0,5 ррт, но для дезинфекции поверхностей необходимы более высокие концент-
рации. В рабочем растворе С102 по сравнению с NaOCl имеет лучшие характеристи-
ки — соединение не портится, не оказывает корродирующего воздействия и не ток-
сично. Продукты реакции С102 с органическими веществами гораздо менее токсичны
по сравнению с соединениями NaOCl.
11.13.2. Галогены: йод
Йод не очень хорошо растворим в воде, его пары раздражают глаза, и это делает
его применение довольно трудоемким. Йод химически очень активен, и эта актив-
ность делает его хорошим дезинфектантом. Соединения, применяемые в пивоварен-
ной промышленности, содержат йод в сочетании с ПАВами, действующим как носи-
тели или солюбилизаторы. Подобные комплексы (йодофоры) впервые были
внедрены в 1949 г. [8] — они водорастворимы и легче в работе, чем 12, причем дезин-
фицирующая способность остается той же. Дезинфицирующим веществом является
свободный йод, выделяемый йодофором в раствор. Оптимальное для антимикроб-
ной активности значение рН составляет около 5,0.
Кислота Щелочь
12 <=> HOI О 01- <» Юз-
наибольшая небольшая отсутствие отсутствие
активность активность активности активности
П АВы обеспечивают лучшее смачивание и проникновение в органическое загряз-
нение, в связи с чем йодофоры более эффективны, чем гипохлориты.
Йодофоры, как и гипохлорит, воздействуют на широкий спектр микроорганиз-
мов, однако они менее активно действуют на споры бактерий. Как и гипохлорит, они
действуют быстро, но обходятся гораздо дороже. Йодофоры используют для ванн
отмочки, при распылении в концентрациях до 10 ррт свободного 12, однако в систе-
мах CIP используются только малопенящиеся йодофоры. В растворе йодофоры име-
ют желто-коричневатую окраску, и их окрашенность можно рассматривать как пре-
имущество — например, цвет указывает на присутствие активного йода в ванне для
замачивания. Рабочие растворы не стабильны, и по мере исчезновения йода проис-
ходит обесцвечивание. Окрашенность растворов можно считать и недостатком, так
как могут окрашиваться поверхности (особенно из пластика), или это может приво-
дить к окрашиванию и понижению пеностойкости пива. В отличие от гипохлорита
йод не реагирует с аминами. Йодофоры могут оказывать корродирующее воздей-
ствие, и поэтому при их использовании необходимо проверять концентрации. При
ручной мойке может иметь место раздражение кожи.
Глава 11. Мойка и дезинфекция в пивоварении
335
11.13.3. Галогены: бром
Из-за сложностей в применении и отсутствия выраженных преимуществ перед
хлором на пивоваренных предприятиях бром в качестве дезинфектанта не применя-
ют (за исключением обработки оборотной воды, см. раздел 11.15.1). Бром в воде гид-
ролизуется, образуя слабую бромоватистую кислоту (НОВг), которая является ос-
новным веществом, воздействующим на микроорганизмы.
11.13.4. Соединения, высвобождающие кислород:
надуксусная кислота
Надуксусная кислота впервые была применена в качестве дезинфектанта в 1955 г.
[6]. Это вещество поставляется в растворе следующего состава:
у /
СН.С + Н,0 => СН, С + Н,0,
Ъ-он он
надуксусная кислота уксусная кислота перекись водорода
Как следует из вышеприведенного уравнения, надуксусная кислота растворима
в воде, а продукты ее распада безвредны.
CH3Cv => СН3С +1/202
У
о-он он
Иногда можно встретить озабоченность по поводу образования кислорода в ре-
зультате распада надуксуснои кислоты, однако в тех концентрациях, при которых она
используется, это проблемой не является. Надуксусная кислота обладает очень не-
приятным запахом, при высоких концентрациях она вызывает коррозию, химически
активна и действует как сильный окислитель. По этим причинам она не рекомендует-
ся для ручной мойки. В основном ее использование ограничивается системами CIP
в качестве завершающего дезинфицирующего средства. Растворы надуксуснои кис-
лоты не очень стабильны и реагируют с органическими веществами. Надуксусная
кислота может воздействовать на оборудование (например, на резиновые проклад-
ки), а при высоких концентрациях в воде с высоким содержанием С1' может вызы-
вать точечную коррозию.
Надуксусная кислота воздействует на широкий спектр микроорганизмов, вклю-
чая вирусы и споры бактерий, однако имеются данные о выживании дрожжей. Ее
действие проявляется быстро при температурах, ниже температуры окружающей
среды, что имеет особое значение для дезинфекции форфасов и лагерных танков.
336
Манджит Сингх, Джекки Фишер
11.13.5. Соединения, высвобождающие кислород:
перекись водорода
Н202 впервые была использована в качестве дезинфектанта в 1887 г. [6]. Она по-
ставляется в растворе, имеющем тенденцию к распаду:
Н202=>Н20+1/202
Использование Н202 для дезинфекции вручную не рекомендуется. Это вещество
используется главным образом для распрыскивания из моющих головок (например,
при асептическом розливе). Перекись водорода является бактерицидным и фунги-
цидным средством, однако некоторые бактерии и грибы проявляют к ней меньшую
чувствительность, так как способны продуцировать фермент каталазу, разрушаю-
щую перекись водорода. Так как она действует довольно медленно, то для хорошего
антимикробного эффекта необходимы продолжительный контакт и/или повышение
температуры.
11.14. Дезинфектанты неокислительного действия
11.14.1. Четвертичные соединения аммония
Четвертичные аммонийные соединения (QAC) впервые были использованы для
дезинфекции в 1916 г. [6] и являются наиболее изученными из катионных ПАВов.
Их обобщенная формула выглядит следующим образом:
R.
L.V
N'
Ro
R,
х-,
где X — обычно галоген, но иногда S042+, a Rt, R2, R3h R4 могут быть различными
алкильными или арильными группами.
В целом QA С является довольно плохим моющими средствами, но хорошо смачи-
вают поверхности, что увеличивает эффиктивность мойки. В растворе они ионизи-
руются, образуя катион с замещением азотной части молекулы, что обеспечивает
паверхностно-активные свойства. На дезинфицирующую способность влияет длина
углеродной цепочки (обычно наиболее эффективна цепочка С8-С18). Q4C, являю-
щиеся эффективными дезинфектантами, образуют обильную пену, что не соответ-
ствует требованиям к С/Р-мойке. Соединения, образующие небольшое количество
пены, обладают меньшей антимикробной активностью и труднорастворимы в воде.
Главным образом они используются для отмачивания и ручной мойки при концен-
трациях активных QACболее 200 ррт. Оптимальный антимикробный эффект наблюда-
ется при нейтральном рН, однако в целом их способность проявляется при рН 3,0-10,0.
Рабочий раствор стабилен даже в высоких концентрациях, органические загрязне-
ния влияют на QAC меньше, чем на галогены, однако в присутствии таннина пива
может образовываться осадок.
Глава 11. Мойка и дезинфекция в пивоварении
337
Катионная природа этих соединений означает, что они могут поглощаться поверх-
ностями, что приводит к затруднениям при ополаскивании. Используемые на пиво-
варенных предприятиях средства должны легко смываться, иначе будет понижаться
качество пива и ухудшаться его пеностойкость.
Спектр воздействия на микроорганизмы у QAC меньше, чем у других дезинфек-
тантов окислительного действия, а эффективность относительно грамотрицатель-
ных бактерий меньше, чем относительно грамположительных. При длительном ис-
пользовании существует возможность «привыкания» микроорганизмов к этим
веществам. QAC ограниченно воздействуют на споры бактерий и совершенно не дей-
ствуют на вирусы. При повышенных концентрациях их эффективность относитель-
но дрожжей и плесеней увеличивается. По сравнению с галогенами эксплуатацион-
ные затраты на QAC выше.
11.14.2. Бигуанидины
Антимикробное влияние бигуанидинов впервые было отмечено в 1950-х г. [6].
Бигуанидины являются производными от гуанидина — натурального вещества, об-
наруженного в злаках и в овощах (например, в репе и турнепсе).
NH
II
С
/\
H2N NH2
Гуанидин
Бигуанидины обычно поставляются в виде полимеров и солей (гидрохлорида).
Оптимальная химическая активность наблюдается в диапазоне рН от 3,0 до 9,0. При
рН ниже 3,0 бигуанидины относительно микроорганизмов не активны, а при рН
выше 9,0 они выпадают в осадок, в связи с чем необходимо обращать внимание на
ополаскивание после мойки с применением каустика. Бигуанидины имеют катион-
ную природу, однако не относятся к ПАВам. При соответствующем ополаскивании
их влияния на пеностойкость пива не наблюдается. Так как они не образуют пену, то
их можно применять в системах CIP. Кроме того, бигуанидины используются для
отмачивания, при ручной мойке и в качестве биоцида для туннельных пастеризато-
ров. Большинство бигуанидинов обладают одинаковым антимикробным эффектом
как относительно грамположительных, так и грамотрицательных бактерий. Они ме-
нее эффективны против плесеней и дрожжей (особенно в кислом диапазоне рН),
а также не эффективны против спор бактерий и вирусов.
11.14.3. Амфотерные вещества
Амфотерные вещества используются в качестве дезинфектантов с начала 1950-х гг.
[2] и представляют собой ту или иную аминокислоту (обычно глицин) с заместителя-
ми. Иногда к ним применяют термин «амфолиты», так как в растворе в зависимости от
значения рН они ионизируются с образованием катионов, анионов или цвиттер-ионов
(амфотерных ионов).
338
Манджит Сингх, Джекки Фишер
Н Н Н О
I I I II
R-N-C-C-C- ОН катион кислоты
i i i
н н н
н н н о
I I I II
R*- С-С-С-С-О" цвиттер-ион
i i i
н н н
н н н о
I I I II
R-N-C-C-C-0 анион щелочи
I I I
н н н
Дезинфицирующими и поверхностно-активными свойствами обладают лишь не-
которые амфотерные соединения, причем дезинфицирующая способность увеличи-
вается с количеством основных групп. Амфотерные вещества имеют хорошие сма-
чивающие свойства, однако не способны к растворению протеинов и пивного камня.
Несмотря на свою вязкость, они легко растворимы в воде. Благодаря поверхностной
активности они мало токсичны относительно млекопитающих и вызывают незначи-
тельные кожные раздражения, что может оправдать их сравнительно высокую цену.
В целом их применяют для отмачивания, распылительной и ручной мойки. Опти-
мальная активность амфотерных соединений находится в пределах рН 3,0-9,0, одна-
ко зависит от состава. Они одинаково эффективны против грам положительных и
грамотрицательных бактерий, эффективны против вирусов и спор бактерий и менее
эффективны против дрожжей и плесеней. Толерантность к типу загрязнения и
корродирующая способность различны в зависимости от амфотерного соединения,
хотя обычно проблем с коррозией не возникает. Обычно рабочий раствор в концент-
рации 1000 ррт достаточно стабилен.
11.14.4. Анионные кислотные средства
Активные молекулы в анионных кислотных средствах могуть быть самыми раз-
ными. Существует два их основных типа:
• основанные на анионных поверхностно-активных веществах в сочетании с ми-
неральной кислотой:
О
II
R-S-0-H+
II
О
Глава 11. Мойка и дезинфекция в пивоварении
339
• основанные на карбоновых кислотах, включая жирные кислоты и их производ-
ные:
О
R-C
\
ОН
Анионные кислотные средства чаще всего являются рецептурными продуктами с
добавками для повышения активности и/или стабильности, которые меняются от
средства к средству. Такие средства обладают определеной моющей и смачивающей
способностью. Вещества с высокой способностью к пенообразованию не пригодны
для использования в системах С1Р% их обычно применяют для распылительной мой-
ки. Для ручной мойки они не подходят из-за низкого значения рН (2,0), необходи-
мого для оптимального антимикробного воздействия. В целом анионные кислотные
средства отличаются хорошим антимикробным действием относительно бактерий,
но эффективность относительно спор бактерий и вирусов не очень велика. Против
дрожжей и плесеней действуют лишь некоторые типы средств на основе карбоновых
кислот.
11.15. Обработка воды
Обработка рециркуляционной воды в башенных охладителях (градирнях) и тун-
нельных пастеризаторах является особой областью, и для предотвращения развития
слизи вследствие роста микроорганизмов используют различные биоцидные сред-
ства. В туннельных пастеризаторах слизь забивает фильтры и сетки распылителей,
влияя на эффективность пастеризации, что может привести к проблемам с готовым
продуктом. Слизеобразование в оборотной воде приводит к возникновению непри-
ятного запаха, коррозии и потенциальным проблемам со здоровьем человека (на-
пример, вследствие легочной инфекции, вызываемой Legionella spp.)
Биоциды, используемые в туннельных пастеризаторах, не должны оказывать воз-
действия на печать, нанесенную на банки или кронен-пробки, и должны быть совме-
стимы с другими применяемыми химическими веществами (например, ингибитора-
ми образования накипи или коррозии). В системе рециркуляции воды применяются
некоторые упомянутые выше дезинфектанты (Q4C, бигуанидины и бром; о свойствах
QAC и бигуанидинов см. выше, а применять бром начали относительно недавно).
11.15.1. Бром
Бромноватистая и хлорноватистая кислоты могут быть образованы растворением
бром-хлор-диэтилхидантоина (поставляемого в твердом виде или в порошке) в воде
с помощью броматора:
C5H6BrClN202 + 2Н20 => C5H8N202 + HOBr + HOC1
Поток воды в броматоре регулируется так, чтобы остаточный уровень брома со-
ставлял 0,5 ррт. В этой концентрации бром характеризуется меньшей корродирую-
340
Манджит Сингх, Джекки Фишер
щей способностью, чем гипохлорит. Бром-хлор-диэтилхидантоин — вещество срав-
нительно безопасное.
11.15.2. Альдегиды
Антимикробные свойства данной группы биоцидов связаны с высокоактивными
альдегидными группами. Основными альдегидами-дезинфектантами являются фор-
мальдегид и глутаральдегид:
R-C
//
\
формальдегид
R = H
глутаральдегид R = СНО - (СН2)3-
Оптимальное значение рН для альдегидов находится в диапазоне от щелочного до
слабокислого. Для хорошей антимикробной активности необходима продолжитель-
ность контакта (в зависимости от концентрации) не менее 15 мин (зачастую он со-
ставляет несколько часов).
Впервые формальдегид для дезинфекции был использован в 1886 г. [6], однако
в настоящее время на пивоваренных предприятиях он применяется довольно редко
из-за своей токсичности при вдыхании и контакте с кожей (существуют данные
и о его канцерогенности). Безопасность применения в качестве консерванта и био-
цида обеспечивается образованием комплекса формальдегида с веществами, высво-
бождающими формальдегид.
Глутаральдегид в настоящее время применяется в качестве биоцида в туннельных
пастеризаторах (впервые его использовали в 1957 г. [6]). Иногда глутаральдегид ис-
пользуют совместно с Q4C, что повышает их антимикробное действие.
11.15.3. Изотиазолиноны
В качестве консервантов и биоцидов применяют несколько изотиазолинонов — в ос-
новном, смесь из 2-метил-4-изотиазолин-3-она и 5-хлор-2-метил-4-изотиазолин-3-она:
-О п ^О
Чс/
N-CH,
N-CH,
2-метил-4-изотиазолин-3-он 5-хлор-2-метил-4-изотиазолин-3-он
Эти вещества используются в туннельных пастеризаторах и башенных охладителях,
оказывая антимикробное действие, а также добавляются в емкость с раствором моюще-
го средства для системы CIP для увеличения срока действия моющего средства. В очень
низких концентрациях изотиазолиноны обладают бактериостатическими свойствами,
однако их бактериоцидность проявляется после продолжительного (в течение несколь-
ких часов) контакта. Антимикробная активность включает в себя воздействие на расту-
щие в туннельных пастеризаторах сульфатредуцирующие бактерии, которые могут
привести к коррозии, проявлению постороннего запаха и черной слизи.
Глава 11. Мойка и дезинфекция в пивоварении 341
11.15.4. БНПД
БНПД (2-бром-2 нитропропан-1,3-диол) изначально был разработан как консер-
вант для косметических, фармакологических изделий и туалетных принадлежно-
стей. Несмотря на то что БНПД является медленно действующим биоцидом, ему
нашли применение и для обработки рециркуляционной воды.
Вг
I
но н2с - с - сн2 он
N02
БНПД
Лабораторные и производственные эксперименты показали, что БНПД эффекти-
вен против широкого спектра микроорганизмов, включая Legionella spp. БНПД ра-
створим в воде, в кислой среде он более стабилен, а в рабочем растворе не токсичен
и разлагается под действием микроорганизмов.
11.16. Пар
Пар очень эффективен для стерилизации оборудования, эффективен при уничто-
жении бактерий, плесеней, спор бактерий и вирусов, однако на пивоваренном произ-
водстве он используется в ограниченных масштабах, будучи вытесненным на мно-
гих участках химическими дезинфектантами. Пар должен быть влажным и не
содержать воздуха. Эффективная стерилизация паром на пивоваренном производ-
стве может занять до 1,5 ч. Пар дорог в производстве, опасен при использовании
и позволяет некоторым типам загрязнений затвердевать, что затрудняет их удале-
ние. Очевидно, что чувствительные к нагреванию материалы стерилизации паром
подвергаться не должны.
11.17. Заключение
В варочном отделении дезинфектанты не применяют. Мойку проводят вручную
или с помощью системы CIP, полагаясь в основном на воздействие горячего каусти-
ка, благодаря которому достигается удовлетворительный уровень чистоты. В бро-
дильном отделении и на участке хранения семенных дрожжей мойку и дезинфекцию
проводят вручную или с помощью систем CIP, используя моющие средства, а затем
дезинфектанты (возможно их комбинированное применение).
Основными критериями для С/Р-дезинфектанта являются: отсутствие вспенива-
ния, совместимость с другими химическими веществами и материалами оборудова-
ния, широкий диапазон антимикробной активности при низких температурах и кон-
центрациях, отсутствие негативного влияния на продукт.
К дезинфектантам, обычно используемым в С/Р-системах, относятся гипохлорит
натрия, надуксусная кислота и йодофоры. Сочетание «моющее средство-дезинфек-
тант» обычно применяют в виде анионного кислотного моющего средства, причем его
эффективность увеличивается при низких температурах. Для ручной мойки главное —
342
Манджит Сингх, Джекки Фишер
безопасность, вследствие чего в качестве дезинфектанта зачастую применяют амфо-
терные вещества. Часто используемыми дезинфектантами являются йодофоры (бла-
годаря их широкому антимикробному диапазону и окраске, свидетельствующей
о присутствии свободного йода). Для мойки емкостей и форфасов необходимо, чтобы
дезинфектант был эффективен при низких температурах и не оказывал негативного
влияния на готовый продукт. В этих условиях часто примеют надуксусную кислоту.
Антимикробные вещества, используемые для обработки рециркуляционной воды,
химически более агрессивны, поэтому активные компоненты должны обрабатывать
всю массу загрязнений. Очевидно, что наряду с диапазоном антимикробного воздей-
ствия здесь важна химическая совместимость с оборудованием и упаковкой.
Литература
1. BASF Handbook—the «Trilon» range of sequestrants, (1972) p. 10.
2. Block, S. S. (1977), Disinfection, Sterilisation and Preservation. Lea & Febigel.
3. BS 5283: Glossary of terms relating to disinfection, p. 4 (1976). British Standards Institute,
London.
4. Elmore, D. G. (1980) Proceedings of the Brewing Technology Conference. Harrogate, 8.
5. Hobbs, G., and Wilson, G.S. (1942) Journal of Hygiene. 42,436.
6. Hugo, W. B. (1971) Inhibitors and Destruction of the Microbial Cell. Academic Press,
London.
7. Hugo, W.B. (1991) Journal of Applied Bacteriology, 71,9.
8. Kelley, F.C. (1961). Proceedings of the Royal Society of Medicine. 54,831.
9. Sykes, G. (1972). Disinfection and Sterilisation. Spon, London.
Глава 12
МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
В ПИВОВАРЕНИИ
Йен Кэмпбелл (lain Campbell)
12.1. Введение
Стандартные методы микробиологического анализа в пивоварении и индустрии
напитков описаны в сборниках Analytica Microbiologica EBC (континентальная Евро-
па) [10], Recommended Methods of Analysis of the Institute of Brewing (Великобритания,
Ирландия и страны Британского содружества) [1] и Official Methods of the American
Society of Brewing Chemists (Северная и Южная Америка) [18]. Несмотря на то что
сборники созданы в некотором сотрудничестве между этими организациями (Евро-
пейской пивоваренной конвенцией, Институтом пивоварения Великобритании
и Американским обществом химиков, работающих в пивоварении), не факт, что при-
веденные в них методы идентичны. Хотя сами по себе методы представлены доста-
точно подробно для их использования на разных пивзаводах и в лабораториях, не
всегда в описаниях приводятся научные основы проведения анализа, необходимые
для персонала, не имеющего опыта работы в области микробиологии пивоварения.
На это иногда возражают, что микробиологические анализы должны выполняться
лишь персоналом с соответствующей подготовкой в области микробиологии, но та-
кая практика отнюдь не всегда возможна, и поэтому целью данной главы является
анализ теоретических основ наиболее важных микробиологических методов, приме-
няемых в лабораториях пивоваренных заводов, и разъяснение используемых прин-
ципов.
Микробиологические методы контроля качества в пивоваренной промышленно-
сти делятся на три основных типа:
• обеспечение стерильности таким образом, чтобы в пробе не было признаков
восстановления жизнеспособности микроорганизмов;
• контроль соблюдения заданных пределов по численности микроорганизмов;
• обнаружение присутствия конкретных микроорганизмов порчи.
В этой главе мы рассмотрим применение этих стратегий на отдельных этапах произ-
водства пива: работа с сырьем, брожение и послебродильные процессы и готовое пиво.
Здесь полезно остановиться на температуре инкубации микробиологических проб.
Для рутинных проб, берущихся в ходе производства, эта температура является своего
рода компромиссом. Температура брожения обычно составляет от 10 до 20 °С, но по-
скольку результаты микробиологических тестов всегда нужны срочно, размножение
микроорганизмов даже при 20 °С будет слишком медленным. Их размножение уско-
ряется с повышением температуры. Некоторые микроорганизмы, встречающиеся
в производстве пива, термолабильны, но большинство бактерий и дрожжей, присут-
ствующих в пивоваренном производстве, образуют видимые колонии через 3 сут ин-
344
Йен Кэмпбелл
кубации при 25-27 °С. При температурах инкубации выше или ниже указанных раз-
множение большинства бактерий, плесеней и дрожжей замедляется. Несмотря на то
что колонии становятся заметны уже через 3 сут, для проб, взятых после химической
стерилизации или пастеризации, рекомендуется дать еще сутки инкубации, что по-
зволит восстановить жизнеспособность поврежденных микроорганизмов.
Еще один аспект микробиологических анализов — это анализ рисков в критических
контрольных точках (НАССР), основной метод контроля качества в пищевой про-
мышленности и индустрии напитков, включая пивоваренную промышленность [7].
Хотя многие критические контрольные точки не являются «микробиологическими»
(например, точки контроля попадания кусочков битого стекла в бутылки с пивом),
очевидно, что микробиологические аспекты НАССР очень важны, и их мы также за-
тронем в этой главе. Значение микробиологических анализов приведено на рис. 12.1.
12.2. Микробиологический анализ сырья
12.2.1. Вода
Важнейшим сырьем является вода — вода для замачивания солода, пивоваренная
вода, вода для высокоплотного пивоварения и даже вода, используемая для ополас-
кивания в ходе мойки оборудования и тары, может попасть в организм потребителя
с пивом и должна соответствовать микробиологическим стандартам на питьевую
воду. Кроме того, для затирания, кипячения с хмелем, брожения и органолептиче-
ских свойств пива важен ионный состав воды. Многие наиболее известные центры
пивоварения достигли своего статуса именно благодаря высокому качеству воды их
местных источников. Так как настоящая глава посвящена микробиологии, здесь мы
рассмотрим лишь один аспект качества воды (микробиологический).
Вода, предназначенная для потребления человеком, будь то питьевая вода или
вода в составе пищевых продуктов или напитков, должна быть чистой, без запаха
и посторонних привкусов, не содержать опасных для здоровья химических веществ
(например, аммиака, нитратов, галогенов, пестицидов и токсичных ионов неоргани-
ческих веществ), а также удовлетворять принятым международным микробиологи-
ческим стандартам. Необходимо осознавать, что вода, загрязненная бытовыми
и сельскохозяйственными канализационными стоками, может содержать патоген-
ные кишечные бактерии. В соответствии с [3], выполнять соответствующие анализы
«на предприятиях со вторым уровнем загрязнения»* могут только специально под-
готовленные микробиологи.
Целью рутинных микробиологических анализов является проверка отсутствия
патогенных бактерий в воде [17]. Так как наиболее опасные микроорганизмы — Sal-
monella spp. (пищевые отравления и брюшной тиф), Shigella spp. (дизентерия) и Vibno
cholerae (холера) — в контаминированной воде могут появляться нерегулярно
и в небольших количествах, обычно их не выявляют. В качестве показателя загряз-
ненности фекальными стоками используются бактерии Escherichia coli, которые пре-
обладают в кишечном тракте теплокровных животных. В обычных условиях Е. coli
* В микробиологии микроорганизмы делят на группы патогенности — например, Sal-
monella, Shigella — III группа патогенности, E.coli и остальные БКГП — IV группа патогенно-
сти — Примеч. науч. ред.
Глава 12. Микробиологические методы анализа в пивоварении
345
Солод
и несоложеные
материалы
(12.2.2)
Сахар
и сахаросодержащие
несоложеные
материалы
(12.2.3)
Воздух
(12.5.3)
-► Производство <-
солодового сусла
Вода
(12.2.1)
-► Кипячение с хмелем
-> (Сусло 12.4.1) ««-
СТЕРИЛИЗАЦИЯ
ЕМКОСТЕЙ
ИТРУДОПРОВОДОВ
(12.5.1)
ЗАСЕВНЫЕ
ДРОЖЖИ
(12.3.25)
(повторное
использование
дрожжей)
t
ПРОИЗВОДСТВО СО,
(12.5.3.)
t
Брожение
(12.4.2)
Т
Дображивание
ФИЛЬТРАЦИЯ
Удаление сахара (12.2.3.)
(ККТ для пива,
разливаемого в бочки)
Стерилизация танков
дображивания
(12.5.4)
СТЕРИЛИЗАЦИЯ
ФИЛЬТРА
(12.5.4)
РАЗБАВЛЕНИЕ
ВЫСОКОПЛОТНОГО
ПИВА
Вода (12.2.1)
ПАСТЕРИЗАЦИЯ
(12.6.13)
t
Готовое пиво
(12.6.13)
Рис. 12.1. Схема производства пива с указанием соответствующих микробиологических
анализов (цифры соответствуют номерам разделов данной главы). Критические контрольные
точки выделены полужирным шрифтом прописными буквами
346
Йен Кэмпбелл
безвредны, но некоторые их штаммы (например, 0-55, 0-111, О-157) продуцируют
вредные токсины.
Для отбора проб используются стерильные полулитровые бутылки с навинчива-
ющимися крышками, при этом для обеспечения стерильности во время транспор-
тировки крышка и горлышко покрывают алюминиевой фольгой. Для проверки
водопроводной хлорированной воды до стерилизации в бутылку для отбора проб до-
бавляется кристаллический тиосульфат натрия. Более предпочтителен отбор пробы
из пробоотборного крана, чем ее отбор погружением бутылки непосредственно в ре-
зервуар с водой. Пробоотборные краны должны быть перед использованием про-
стерилизованы пламенем горелки или горящим этиловым спиртом, после чего сле-
дует пропустить воду из крана, чтобы металлические поверхности охладились.
Иногда необходимо бывает слить некоторое количество воды, застоявшейся в трубе
между краником и резервуаром (трубопроводом). Для отбора проб вне помещений
во избежание контаминации с рук лаборанта бутылка, куда отбирается проба, долж-
на забирать воду, перемещаясь по поверхности воды горлышком вперед. Так как
в отобранной воде могут развиваться бактерии, анализ необходимо проводить по
возможности сразу же. Если предполагается, что между отбором и анализом пробы
пройдет более 3 ч, бутылки следует хранить во льду в герметизированных ящиках.
Анализ должен проводиться не более чем через сутки. Согласно нормативным актам
предусматривается встряхивание бутылок для перевода во взвешенное состояние
осевших во время хранения или транспортировки бактерий.
Анализ разбивается на три части:
1. Подсчет жизнеспособных бактерий при 22 и 37 °С. Старый метод, используемый
до сих пор, предполагает подсчет микроорганизмов из 1 мл воды, введенного
в пептонно-дрожевой агар, однако в настоящее время вместо него может ис-
пользоваться мембранное фильтрование 100 мл воды. Требуются дубликатые
пробы; одна проба инкубируется при 22 °С в течение 3 сут, а вторая — при 37 °С
в течение 24 ч (не дольше). Бактерии в природных условиях хорошо развива-
ются в воде при 22 °С, но лишь паразитические бактерии кишечного происхож-
дения образуют видимые колонии при 37 °С в течение 1 сут. Следовательно,
любой подсчет КОЕ при 37 °С предполагает наличие фекальных контаминан-
тов. Эта температура является критической контрольной точкой, и для анализа
воды необходимы термостаты, точно на нее настроенные.
2. Подсчет колиформ: выявляются на селективных средах при 37 °С. Обычно ис-
пользуется среда МакКонки (MacConkey), но допускаются и другие сходные
с ней среды. При не очень сильной контаминации воды (то есть она соответ-
ствует стандартным показателям по цвету или запаху), количество колиформ в
1 мл воды при прямом подсчете (на чашах Петри) будет слишком мало, чтобы
их можно было обнаружить. Следовательно, применяют либо статистический
метод с жидкой средой, либо мембранное фильтрование. Статистический метод
«наиболее вероятного числа» (MPN-тест) является наследием старых методов,
существовавших еще до изобретения агаровых сред: если сильно разбавленную
суспензию микроорганизмов добавить в определенное количество пробирок со
стерильной средой, размножение микроорганизмов будет наблюдаться только
в некоторых пробирках. По количеству пробирок с положительными и отрица-
Глава 12. Микробиологические методы анализа в пивоварении 347
тельными результатами можно определить количество микроорганизмов в пре-
делах от 0 до 180 на 100 мл. Несмотря на то что все более широкое распростра-
нение получает метод мембранного фильтрования, метод НВЧ также все еще
применяется.
3. Тест, подтверждающий наличие Е. coli. Понятие «колиформы» включает не
только Е. coli, но и целый ряд родственных энтеробактерий, способных размно-
жаться не только в кишечном тракте птиц и млекопитающих. Следовательно,
при обнаружении колиформ необходимо определить собственно Е. coli или при-
сутствие другого менее важного микроорганизма. До тех пор, пока количество
колиформ не достигнет критической концентрации, выше которой вода счита-
ется непригодной для использования в производстве напитков, каждую подо-
зрительную колонию (после мембранного фильтрования) или культуру с буль-
она (после M/W-теста) для проведения дальнейшего анализа необходимо
инкубировать отдельно. Существует два стандартных теста на наличие Е. coli
и, как следствие, для официального признания воды непригодной: а) сбражи-
вание лактозы с образованием кислоты и газа на среде МакКонки при 44 °С
и б) положительный тест на индол с реактивом Ковача (Kovacs): красный цвет
указывает на ферментативный распад триптофана триптонового бульона до ин-
дола, подтверждает наличие Е. coli. Температура тела человека приблизительно
37 °С, а у птиц и некоторых млекопитающих — обычно не менее 39 °С. Таким
образом, температура 44 °С попадает в диапазон температур для размножения
Е. coli как облигатного (хотя и обычно безвредного) кишечного паразита, но при
которой размножение родственных сапрофитных видов невозможен. Воздуш-
ный термостат не подходит для инкубации при 44 °С, в связи с чем проводят
пробирочный тест на бульоне МакКонки в водяной ванне с точной регулиров-
кой температуры.
При оценке результатов наличие хотя бы одного положительного теста при 44 °С
указывает на присутствие фекального загрязнения, то есть на непригодность воды
для питья или использования ее в пищевой промышленности и индустрии напитков.
С другой стороны, единичного анализа путем чашечного посева недостаточно: необ-
ходим регулярный отбор проб с учетом влияния обильных атмосферных осадков,
из-за которых в отбираемую воду могут попадать поверхностные стоки. В чистой
воде содержится небольшое количество нутриентов, а количество КОЕ при 22 °С не
должно превышать 100 ед./мл. К ним относятся естественно присутствующие в воде
микроорганизмы, развитие которых зависит от количества растворенных в воде нут-
риентов (питательных веществ). Большое их количество свидетельствует о загряз-
нении воды органическими веществами, в которых могут содержаться вредные мик-
роорганизмы. В пробе, культивируемой при 37 °С, выявляются микроорганизмы
преимущественно животного происхождения, и серьезным сигналом является по-
казатель уже в 10 КОЕ/мл при 37 °С. Количество колиформ, обнаруженных с по-
мощью M/W-теста, более информативно, и их содержание в 10 КОЕ/100 мл для
необработанной воды уже является неудовлетворительным. Водопроводная хлори-
рованная вода должна иметь очень низкое содержание колиформ при 22 и 37 °С
(предпочтительно нулевое), то есть они не должны обнаруживаться в пробах объе-
мом 1, 10 и 100 мл соответственно.
348
Йен Кэмпбелл
Для идентификации кишечных патогенных микроорганизмов можно отфильтро-
вать большой объем (не менее 1 л) воды на мембранном фильтре, а затем изолировать
и идентифицировать патогенные микроорганизмы на селективной среде, но такой
анализ должен производиться только в государственных медицинских лабораториях
(то есть не в лабораториях солодовенных или пивоваренных предприятий). Обнару-
жить патогенные микроорганизмы в воде можно даже стандартными аналитически-
ми методами, причем все положительные результаты анализов следует рассматри-
вать как свидетельство реального загрязнения воды. Е. coli — не единственный
микроорганизм, свидетельствующий о загрязнении воды кишечной микробиотой: ее
присутствие связывают также с наличием Clostridium perfringens и Enterococcus (ранее
Streptococcus) faecalis. Для их обнаружения и количественной оценки применяют
стандартные методы [17], однако их результаты не всегда точны. Так как Е. coli при-
надлежит к тому же семейству, что и кишечные патогены Salmonella и Shigella, и ха-
рактеризуется схожей выживаемостью, этот микроорганизм служит идеальным ин-
дикатором, в том числе указывающем на наличие кишечных вирусов (например,
полиомиелита). Enterococcus faecalis погибают быстрее, что зачастую приводит к лож-
ным отрицательным результатам. И наоборот, спорообразующие бактерии С. perfrin-
gens способны оставаться в воде после того, как все патогенные организмы погибли
или были уничтожены хлорированием. Тем не менее подсчет количества колиформ/
Е. coli не всегда дает адекватную оценку наличия патогенных простейших микроорга-
низмов. В Великобритании единственным патогенным микроорганизмом сельскохо-
зяйственного происхождения является Cryptosporidium, цисты которого способны
выживать в речной воде дольше, чем Е. coli, и стойки к хлорированию. Следователь-
но, при подозрении на контаминацию необходимо проводить специальный анализ на
наличие цист с помощью фильтрования и последующего микроскопического иссле-
дования [19].
Вероятное наличие небольшого количества Legionella spp. в питьевой воде являет-
ся безопасным и не требует рутинных анализов, однако рекомендуется проводить
регулярные анализы воды в башенных охладителях или в другом оборудовании, где
может поддерживаться их рост и образуются аэрозоли. Легионеллы характеризуют-
ся селективностью относительно питательных веществ и стойкостью к обычным ме-
дицинским антибиотикам. Методы их культивирования обычно основываются на
мембранном фильтровании «подозрительных» проб воды, причем для подавления
размножения микроорганизмов с большей скоростью размножения применяются
антибиотики. Поскольку Legionella spp. при вдыхании могут являться причиной воз-
никновения пневмонии, а для их выявления необходимо специальное оборудование
и методы анализы, то выявление их наличия лучше предоставить специалистам.
12.2.2. Злаковые культуры
Процесс кипячения сусла предохраняет его от влияния контаминированного сы-
рья, но лишь до определенных пределов. Плесени могут продуцировать термоста-
бильные микотоксины; кроме того, контаминанты сырья могут являться причиной
появления гашинг-эффекта, связанного прежде всего с определенным видом Fusarium
spp. Несмотря на то что сами грибы во время кипячения с хмелем погибают, их мета-
болиты разрушаются не полностью и могут сохраняться в готовом пиве (см. главу 4).
Глава 12. Микробиологические методы анализа в пивоварении
349
Теоретически возможно, что при высоком уровне контаминации некоторые бакте-
рии из солода могут не погибнуть при кипячении сусла с хмелем и контаминировать
его, однако более вероятна ситуация, когда контаминирующие микроорганизмы пе-
реносятся из дробильного отделения в бродильный цех по воздуху. Для производ-
ства качественного пива необходимо хорошее микробиологическое качество сырья,
причем спецификация его должна быть включена в аккредитацию предприятия по
ISO и аналогичным типам сертификации. Зерно признается хорошего качества, если
общее количество КОЕ составляет менее чем 105/г. Необходимость подсчета общего
количества КОЕ до сих пор является предметом дискуссий, поскольку некоторые
бактерии порчи (например, молочнокислые) следует подсчитывать на соответству-
ющей селективной среде. Для предприятий по производству спирта из-за использо-
вания некипяченого сусла риск контаминации оправдывает проведение специаль-
ного подсчета лактобактерий, но их подсчет на ячмене, предназначенном для
пивоварения, менее очевиден.
Как мы уже отмечали в главе 4, злаки с существенным поражением плесенью
и вследствие этого содержащие опасное количество микотоксинов, характеризуют-
ся наличием плесени на их поверхности и соответствующим запахом, и бракуются
задолго до получения результатов микробиологических анализов. Кроме того, такой
уровень контаминации ячменя плесенью ингибировал бы его прорастание. Следова-
тельно, единственным рутинным лабораторно-микробиологаческим анализом на
плесневую контаминацию солода и ячменя для солодоращения является анализ на
наличие гриба Fusarium, продукты метаболизма которого являются основной причи-
ной возникновения в пиве гашинг-эффекта (см. главу 4). Такой анализ особенно не-
обходим для зерна, созревающего или собранного в условиях повышенной влажно-
сти. Существует два метода анализа, результаты которых не всегда совпадают [5]:
а) замачивание зерна и подсчет количества КОЕ; б) инкубация цельного зерна и оп-
ределение степени контаминации по присутствию нежелательных грибов.
При использовании посевов на чашках Петри требуется тщательное разделение
проб зерна. Большое число исследований посвящено развитию методов эффектив-
ной мацерации зерна без повреждения микроорганизмов или сильного нагревания
суспензии, что особенно важно при мацерации твердых несоложеных злаковых куль-
тур. Подсчет КОЕ плесеней и дрожжеподобных грибов из таких проб достаточно
сложен в интерпретации результатов, поскольку относительно небольшое количе-
ство спорообразующего грибного мицелия может быть повреждено и давать боль-
шое число КОЕ из фрагментов мицелия и отдельных спор.
Таким образом, имеются существенные причины для «высевания» зерна на куль-
туральную среду и последующего наблюдения за долей инфицированных зерен.
Важно отличать грибные контаминанты, хорошо закрепленные на зерне, от случай-
ных поверхностных микробных контаминантов, неизбежно присутствующих на лю-
бом растительном материале. Первые проникают сквозь оболочку зерна и способны
выживать после промывки зерна раствором гипохлорита, губительным для поверх-
ностных контаминантов.
В качестве культуральной среды можно использовать само зерно, разместив зерна
на влажной стерильной фильтровальной бумаге в чашке Петри и поддерживая тем-
пературу 25 °С. При ином способе зерно «засевается» в микробиологическую куль-
350
Йен Кэмпбелл
туральную среду — это дает то преимущество, что путем выбора соответствующей
питательной среды можно дифференцировать отдельные грибы. «Полевые грибы»,
включая Fusarium spp., приводящие к гашинг-эффекту, размножаются на влажном
проросшем зерне, тогда как «грибы хранения», особенно Aspergillus и Penicillium spp.,
хорошо размножаются при меньшей влажности сухого зерна (см. главу 4). Таким
образом, путем выбора соответствующей среды (с добавкой 10% соли или без соле-
вой добавки) можно дифференцировать те или иные грибы. Применяются различ-
ные питательные среды: для полевых грибов в промышленности используются агар
Чапека-Докса (Czapek-Dox) и агар с картофельной декстрозой (микробиологиче-
ские среды широкого применения). Для грибов хранения удобен солодовый солевой
агар — это промышленный агар на солодовом экстракте, к которому до стерилиза-
ции добавляется 10% поваренной соли.
Неприятным осложнением при таких микробиологических анализах может стать
прорастание зерна, чему способствуют влажные условия инкубации. По возможности
следует проводить анализ не сырьевого зерна, а высушенного соложеного ячменя. Тем
не менее даже если зерно во время анализа проросло, может наблюдаться не только
размножение грибов, но и характерная розовая окраска колоний фузарий.
Грибные споры легко распространяются по воздуху, в результате чего у некото-
рых восприимчивых людей могут проявляться сильные аллергические реакции.
A.fumigatus, плесневый гриб хранения, является потенциальным патогеном и при
вдыхании может стать причиной легочной инфекции. При работе с грибными куль-
турами необходимо соблюдать меры предосторожности. Полная идентификация
мицелиальных грибов требует специальных знаний, и помимо осознания возможно-
сти присутствия грибов с характерной для Fusarium розовой окраской (и проявления
в готовом пиве гашинг-эффекта), рекомендуется проводить более углубленные мик-
робиологические обследования для определения степени контаминации зерна «по-
левыми грибами» или «грибами хранения».
12.2.3. Внесение Сахаров
Несмотря на то что большинство присущей зерновому сырью микрофлоры при
кипячении уничтожается, в конечной стадии производства пива добавляются сахара
(либо в качестве добавки в конце кипячения с хмелем, либо в пиво для созревания),
в связи с чем необходимо высокое микробиологическое качество сырья. Концентри-
рованные сахарные сиропы, добавляемые в сусловарочный котел, защищены низкой
активностью воды, однако сильно разбавленные растворы такой защиты не имеют и
поэтому должны использоваться незамедлительно.
Ожидать стерильности сахарного сиропа или пудры не стоит, однако содержание
КОЕ должно быть минимальным, например, 2000-3000 КОЕ/1 г пробы. Подсчет
осуществляется путем стандартного микробиологического чашечного метода на ага-
ре солодового экстракта или сходной среде (см. раздел 12.3.4): 1 г пробы разводится
до 10 мл, и максимально допустимое содержание КОЕ должно составлять 200—
300 КОЕ/1 мл пробы. Обычно не стремятся к обнаружению конкретных контами-
нантов: достаточно подсчитать общее число колоний. Тем не менее если необходимо
найти источник контаминации, то используют селективные для конкретных конта-
минантов среды.
Глава 12. Микробиологические методы анализа в пивоварении 351
Хмель или его экстракты при позднем внесении теоретически также несут в себе
риск микробиологического инфицирования, однако реальных случаев контамина-
ции до сих пор не отмечалось, и обычно микробиологический контроль хмелевых
продуктов не проводится.
12.3. Дрожжи
12.3.1. Пивоваренные свойства культурных штаммов
В настоящее время семенные дрожжи периодически обновляют свежей культу-
рой из пропагатора. Охлажденная или сублимированная (замороженная методом
сублимационной сушки) лабораторная чистая культура проходит этапы увеличения
объема, чтобы в конечном счете в соответствии с принятой на данном предприятии
практикой полностью заменить использовавшиеся дрожжи через 10-20 последова-
тельных брожений.
Многие предприятия, где варят традиционный эль, используют одну и ту же культу-
ру дрожжей в течение нескольких лет. Такой штамм дрожжей (скорее, смесь штаммов)
важен для обеспечения традиционного вкуса данного пива. В качестве страховки от
потери такой культуры при ее контаминации рекомендуется сохранять культуру дан-
ных дрожжей (или все используемые штаммы по отдельности) на соответствующей
культуральной среде (см. раздел 12.3.4). Такие культуры при необходимости замены
дрожжей можно размножить. На других предприятиях иногда стремятся улучшить го-
товый продукт путем использования новых дрожжей или варить по лицензии пиво дру-
гих фирм, и для обеспечения «фирменного» вкуса и аромата необходимы дрожжи той
фирмы, которая предоставляет лицензию на производство своего пива.
В таких случаях для производства пива обычно применяют свежие культуры
дрожжей, причем необходимо удостовериться, что выбран нужный штамм. Эксп-
ресс-методы исследования для идентификации различных промышленных культур
дрожжей при помощи известных «маркеров» были рассмотрены в главах 7 и 9, одна-
ко они не могут подтвердить, что данная культура обеспечит получение нужных вку-
со-ароматических свойств и т. д. Ферментер, схема которого приведена на рис. 12.2,
позволяет в лабораторных условиях оценить поведение дрожжей и образование вку-
са и аромата.
Хотя при этом используют лишь 2 л сусла, начальная глубина жидкости составля-
ет 1,1 м. При введении трубок [4] для обеспечения нормального взаимодействия пу-
зырьков С02 и дрожжей эта глубина близка к глубине бродильных емкостей (при-
мерно 2 м). В сущности, £ВС-ферментер представляет собой экспериментальный
цилиндр диаметром 5 см. В нем могут быть измерены не только вкусо-ароматиче-
ские свойства, но и формирование (или неформирование) деки, флокуляция, освет-
ление, а также количество и скорость роста дрожжей. В настоящее время с появле-
нием современных более глубоких ЦКТ £ВС-ферментер стал менее адекватным
устройством для проведения анализа, но он по-прежнему остается популярным при
предварительной оценке технологии пивоварения, так как дает достаточно данных
для органолептического анализа.
Размер полутораметровой стеклянной трубки превышает размеры большинства
автоклавов, и поэтому может оказаться невозможным провести стерилизацию ост-
352
Йен Кэмпбелл
Взятие пробы
(шприцем)
Рис. 12.2. Трубчатый ферментер ЕВС(по [14]). Поскольку изображенный слева резервуар для кон-
троля температуры оснащен водяной рубашкой, пробы берутся из трубки, погруженной в сусло (2 л)
не менее чем на 30 см. Резервуар, изображенный справа (для использования в камере кондициони-
рования), имеет отверстие для взятия пробы, герметично закрываемое пробкой
рым паром. Тем не менее в качестве альтернативы можно предложить пропарку пус-
той емкости при атмосферном давлении в течение 30 мин. После добавления кипя-
ченого сусла в стерильных условиях емкость можно аэрировать или продувкой воз-
духа, или путем вставки временной пробки и 20-кратного переворачивания,
в результате чего воздух над жидкостью до внесения дрожжей растворится. В ходе
брожения для герметизации теоретически достаточно покрытия алюминиевой фоль-
гой или стерильной перевернутой колбой, однако большинство специалистов пред-
почитают установку специального затвора.
Глава 12. Микробиологические методы анализа в пивоварении 353
12.3.2. Анализы жизнеспособности засевных дрожжей
Наиболее простым для проверки жизнеспособности дрожжевых клеток в суспен-
зии является метод с использованием метиленового синего (МС). Этот метод обус-
ловлен тем, что МС благодаря дыхательной активности клеток быстро редуцируется
и теряет окраску. При отмирании клетки становятся более проницаемы для метиле-
нового синего и при отсутствии дыхательной активности цвет остается синим. Коро-
че, МС указывает на отсутствие у клеток дыхательного метаболизма, а не на их ги-
бель как таковую, причем существует возможность, что некоторые метаболически
активные клетки оказываются не способными к размножению, в связи с чем они бу-
дут отнесены к мертвым. Если число жизнеспособных клеток превышает 90%, этим
можно пренебречь, но при снижении числа таких клеток менее чем до 90% эта по-
грешность становится все более значимой. Общее количество клеток в 1 мл и коли-
чество «синих» клеток измеряется в камере для подсчета (гемацитометре). Для из-
мерения процента жизнеспособных клеток с точностью 0,5% необходимо насчитать
не менее 200 клеток на 20 мкм2. Для получения большей точности необходимо нали-
чие не менее 600 клеток на площади 60 мкм2, причем не менее чем в двух отдельных
пробах. Использовать два раздельных анализа следует потому, что поверхность по-
кровного стекла может оказаться не идеально ровной, и среднее из двух результатов
обеспечит большую точность результатов [12].
Сообщается, что другие красители дают лучшие результаты — например, метиле-
новый фиолетовый [15]. До некоторой степени снизить погрешность ошибки помо-
гает метод микрокопирования культуры, описанный в сборнике ЕВС [10], но этот
метод не включен в сборник Института пивоварения [1] (возможно потому, что для
получения значимых результатов требуется инкубация в течение не менее 16 ч).
Преимуществом анализов с использованием МС и подобных является то, что ре-
зультаты могут поступать на производство уже через 20-30 мин.
Как бы то ни было, в настоящее время общепризнано, что информация о проценте
жизнеспособных клеток не позволяет гарантировать приемлемое состояние засев-
ных дрожжей. Термин «жизнеспособность» отражает способность дрожжей к быст-
рому и эффективному сбраживанию, а не состояние «быть живым» (здесь можно
провести аналогию с состоянием «быть в форме» у человека). В качестве индикато-
ров жизнеспособности предложены самые разные методы, включая содержание гли-
когена, АТФ или стерола, а также скорость выделения определенных ионов, образо-
вание С02 или потребление 02 из раствора глюкозы. Наиболее удобным методом
для определений, которые должны быть выполнены в кратчайшее время, является
выделение ионов Н+, то есть снижение значения величины рН, при введении дрож-
жей в сбраживаемый субстрат.
Для определения жизнеспособности дрожжей по степени окисления [9] дрожжи
промывают центрифугированием и затем тщательно перемешивают в 100 мл дис-
тиллированной воды. Через 10 мин добавляют 5 мл 20%-ного (масс/об.) раствора
глюкозы и перемешивают еще 10 мин. В ходе инкубации в течение 20 мин каждую
минуту измеряют рН суспензии. Резкое снижение значения рН сразу же и после до-
бавления раствора глюкозы до < 4 свидетельствует об активности дрожжей, а сте-
пень окисления коррелирует с изменением величины рН. Как и метод с использова-
нием МС, данный метод достаточно быстр и позволяет получить результаты до
354
Йен Кэмпбелл
внесения дрожжей. Схожий принцип использован в методе измерения потери ионов
Mg++ [13], который, по некоторым данным, является лучшим средством измерения
жизнеспособности дрожжей, но является более сложным, чем измерение Н+ с ис-
пользованием рН-метра.
12.3.3. Количественные методы
В научно-исследовательских работах принято регистрировать ход брожения пива
по количеству жизнеспособных клеток в 1 мл сбраживаемого сусла, однако в про-
мышленных условиях более практично использовать массу дрожжей, а не число
жизнеспособных клеток. В целях контроля концентрация собранных после центри-
фуги или фильтр-пресса дрожжей должна быть относительно постоянной, но время
от времени ее следует проверять. Наиболее точным является гравиметрический ме-
тод: заданный объем суспензии дрожжей концентрируют центрифугированием, про-
мывают в целях удаления загрязнений органической природы 5%-ным раствором
аммония (он представляет собой летучее моющее средство, не оказывающее влия-
ния на сухую массу) и высушивают до постоянной массы при 105 °С. Результаты
становятся известными на следующий день. Намного быстрее и проще турбидимет-
рический метод: спектрофотометром измеряют светопоглощение точного раствора
дрожжевой суспензии при длине волны в 450 нм и соотносят его с заранее подготов-
ленным калибровочным графиком зависимости биомассы от мутности. Кстати, мут-
ность фактически является показателем концентрации биомассы в суспензии, а не
количества клеток. Для оценки количества клеток следует измерять отражение све-
та с помощью нефелометра или аналогичного прибора [12].
12.3.4. Культуральные среды, применяемые
в микробиологии пивоварения
Стандартные микробиологические среды мы рассмотрели выше в разделах, посвя-
щенных анализу воды и злаковых культур. Для выполнения конкретных анализов,
используемых в микробиологии пивоварения, требуются специальные среды. Так, ба-
зовой питательной средой в микробиологии пивоварения является собственно ис-
пользуемое на данном предприятии сусло с добавлением агара. Преимуществом ис-
пользования охмеленного сусла является то, что благодаря ингибирующему действию
хмеля в ней способны размножаться лишь потенциальные контаминанты пива, но та-
кая среда намного богаче, чем это необходимо для лабораторных исследований, и на
разных предприятиях разная, что препятствует стандартизации.
В настоящее время широко используется солодовый экстракт (ME), который про-
дается в обезвоженном виде и по сравнению с суслом менее богат, однако содержит
достаточное количество питательных веществ для всех дрожжей и большинства бак-
терий. Тем не менее содержание солода в нем от партии к партии разное, в связи с
чем состав его также не постоянен. В американской лаборатории Уоллерштейиа
( Wallerstein Laboratories, WL) была разработана синтетическая среда, по питательной
ценности схожая с М£, но с тем преимуществом, что ее состав постоянен [6]. Пита-
тельный агар WL по сравнению с ME обладает и двумя другими преимуществами.
Во-первых, в его состав входит рН-индикатор (бромкрезол зеленый). Колонии раз-
личных дрожжей и бактерий отличаются не только размерами и формой клеток,
Глава 12. Микробиологические методы анализа в пивоварении
355
но и рН (соответственно и количеством поглощаемого красителя), в связи с чем ок-
раска колоний бывает разной — желтая, зеленая, голубая... По этой причине среда
WL идеально подходит для обнаружения в культуре пивоваренных дрожжей различ-
ных их штаммов. Во-вторых, ее питательная ценность выше, чем у ME, и таким обра-
зом WZJV-arap (WL-питательная среда) больше пригоден для выявления культур
молочнокислых бактерий. Основная проблема в работе с ними заключается в труд-
ностях первого выделения — даже в атмосфере, обогащенной С02 (которая, по неко-
торым данным, способствует размножению этих микроорганизмов), ни ME, ни WLN-
агар не надежны, в связи с чем было предложено большое число различных сред (см.
главу 5 и [8]).
ME и IVZJV-arap не являются селективными средами: на них способны размножать-
ся все контаминанты пивоваренного производства, а также культурные дрожжи. Эти
среды позволяют расти и некоторым случайным контаминантам, которые иногда
могут выживать в пиве, однако не способны вызывать его порчу (например, Bacillus
и Micrococcus spp., см. главу 5). Для подавления роста культурных дрожжей и роста
всех контаминантов в пробах засевных дрожжей используются селективные среды.
Увы, единой среды, которая подавила бы рост культурных пивоваренных дрожжей
и позволила размножаться всем контаминантам, не существует. К селективным сре-
дам, обычно применяемым для культивирования и выделения контаминантов пиво-
варенного производства, относятся следующие.
1. Актидионовый агар. Может быть использована любая подходящая бактериаль-
ная культуральная среда с добавлением для подавления роста дрожжей анти-
грибковых антибиотиков. После первых испытаний разных антибиотиков стан-
дартным ингибитором был выбран циклогексимид, ставший известным под
фирменным названием актидион [6]. Промышленный актидионовый агар (на-
пример, фирм Oxoid, Difco) представляет собой WIN-arapc 100 мгактидиона/мл;
это количество достаточно для ингибирования роста всех пивоваренных дрож-
жей 5. cerevisiae и большинства других дрожжей. Циклогексимид является анти-
грибковым веществом, однако он токсичен и для человека, в связи с чем при об-
ращении с ним необходима осторожность. При работе с кристаллами чистого
антибиотика важно не допустить его вдыхания и контакта с кожным покровом и
глазами, то есть работать в перчатках, очках и маске. Эта среда изначально была
задумана как селективная к бактериям пивоваренного производства и для этого
практически идеальна, но в ней способны размножаться и некоторые высоко-
стойкие дрожжи. Тем не менее при концентрации уже 10 мг актидиона /мл рост
большинства культурных штаммов S. cerevisiae ингибируется, но по-прежнему
многие стойкие штаммы дрожжей способны размножаться, и обнаруживаемые
с помощью актидиона эти стойкие штаммы будут представлять собой лишь часть
всей популяции диких дрожжей. Промышленный актидионовый агар в лабора-
торных условиях более безопасен, чем чистый циклогексимид; он продается
в 100-мл флаконах с готовой стерильной средой (концентрация актидиона —
100 мкг/мл), которую для приготовления чашечной разводки следует расплавить
при 100 °С (более высокие температуры разрушат часть антибиотиков). Неслож-
но приготовить среды с более низкой концентрацией актидиона (путем смеше-
ния перед внесением в чашку Петри WIN-arapa с актидионом и без него).
356
Йен Кэмпбелл
2. Лизиновый агар (поставщики — те же фирмы Difco и Oxoid) представляет собой
синтетическую среду, состоящую из глюкозы, витаминов, неорганических солей
и I-лизина в качестве единственного источника азота. Saccharomyces spp. на этой
среде расти неспособны, а все вызывающую порчу дрожжи других родов раз-
множаются, используя для удовлетворения потребности в азоте -ЫН2-группы
лизина. Следовательно, образовывать колонии нормальных размеров могут
лишь дрожжи-несахаромицеты. У лизииового агара два основных недостатка:
во-первых, селективность по принципу голодания и наличие вне- и внутрикле-
точного питательного вещества, допускающего слабый рост Saccharomyces spp.
с образованием видимых колоний, и, во-вторых, Saccharomyces spp. биохими-
чески приспособлены к размножению в ходе брожения на пивоваренных и спир-
товых заводах, в связи с чем большинство контаминантов в этих условиях опре-
делить невозможно. Следовательно, из перечисленных в табл. 7.6 главы 7
контаминантов пивоваренных производств не способны размножаться на лизи-
новой среде S. bayanus, S. cerevisiae, S. exiguus, S. pastorianus и S. unisporus, и не-
возможность их определения представляет собой серьезную проблему.
Для амилолитических дрожжей селективной является дрожжевая азотная основа
(YNB) фирмы Difco с полупроцентным содержанием декстрина или крахмала в ка-
честве источника углерода. Может использоваться также М£-агар с полупроцент-
ным содержанием крахмала, но в этом случае после инкубации необходимо залить
чашку для посевов раствором йода, что позволит оценить зону гидролиза крахмала
вокруг колоний амилолитических дрожжей.
Лизиновые и декстриновые УМЗ-среды проявляют свои селективные свойства
при голодании клеток. В идеальном случае для ограничения вымывания питатель-
ных веществ из предыдущей среды необходимо неоднократное центрифугирование,
однако, по нашему мнению, большинство микробиологов производят посев на дек-
стриновых или лизиновых средах без центрифугирования проб, тем самым допуская
слабый рост культурных дрожжей на остатках питательных веществ, попавших вме-
сте с посевным материалом. Дополнительные работы по центрифугированию оправ-
даны при исследованиях в области питания дрожжей и не обязательны для рутин-
ных анализов наличия контаминантов. Актидионовые и другие ингибирующие
среды подавляют рост культурных дрожжей, однако здесь важно не забывать, что
при этом клетки не погибают и что колонии диких дрожжей могут быть «контамини-
рованы» клетками культурных дрожжей. По этой причине колонии не следует высе-
вать напрямую на селективную среду — посев необходимо сделать сначала на несе-
лективной среде (например, на М£-агар), что поможет удостовериться в чистоте
культуры.
Многочисленные попытки создать селективные среды, подавляющие рост штаммов
пивоваренных дрожжей S. cerevisiae и допускающей размножение диких штаммов
Saccharomyces, особенно видов S. cerevisiae, оказались неудачными и не позволили ис-
пользовать полученные среды в качестве типовых (несмотря на то что в лабораториях-
разработчиках декларировался их успех в работе с имеющимися в лабораториях штам-
мами). Обзор таких сред, многие из которых несмотря на их не слишком большую
селективную силу хорошо применимы к некоторым пивоваренным штаммам культур-
ных и диких дрожжей и могут работать не хуже лизиновых, актидионовых или декст-
Глава 12. Микробиологические методы анализа в пивоварении 357
риновых сред, приведен в работе [8]. Позднее в [16] было высказано предположение,
что концентрация CuS04 в 6 мг/л в Л/£-агаре (или WZJV-arape) ингибируют чувстви-
тельные к меди культурные дрожжи, однако не подавляет рост диких штаммов Saccha-
romyces. Затем в [И] появились заявления, что модификацией лизинового агара мо-
жет служить CLEN-средд (с кадаверином, лизином, этиламином и нитратом; ни один
из этих компонентов не может утилизироваться пивоваренными дрожжами в каче-
стве источника азота), так как на ней могут расти дикие дрожжи Saccharomyces. После
этого основное внимание уделялось разработке новых селективных сред, чему способ-
ствовало совершенствование молекулярно-биологических методов обнаружения кон-
таминантов (см. главу 7).
Для некоторых микробиологических целей полезными оказываются индикатор-
ные агаровые среды: в них формируются особые колонии, например, для определе-
ния уксуснокислых бактерий и Brettanomyces/Dekkera — меловый агар (М£-агар
плюс 0,5% СаС03), чему способствуют крупные просветленные уксусной кислотой
зоны. В ходе подготовки среды а) используйте емкости, по объему в два раза превы-
шающие объем среды, что позволит агару вспениваться под воздействием воздуха,
захваченного меловым порошком и б) охладите агар до 45-50 °С, аккуратно попере-
ворачивайте емкость несколько раз, чтобы суспендировать мел, и вылейте массу
в чашку. Агар немедленно затвердеет, сохранив мел в суспендированном состоянии.
Агар MacConkey, включающий лактозу, рН-индикатор и желчные соли, обычно
считают селективной и индикаторной средой для Enterobacteriaceae, но поскольку на
нем способны размножаться и пивоваренные дрожжи, для эффективного использо-
вания в пивоварении в него следует добавлять актидион.
Для толерантных к спирту контаминантов рода Zymomonas используют обогащен-
ную селективную среду, представляющую собой стерильно отфильтрованное пиво с
добавлением 1% глюкозы. В качестве альтернативы может применяться среда с до-
бавлением после стерилизации Л/£-бульона с этиловым спиртом (до 4% об.), кото-
рую легче готовить (так как концентрированный раствор этилового спирта является
самостерилизующимся), а селективный эффект у нее тот же. В эту среду добавляют
20 мг актидиона/мл (для подавления культурных дрожжей), а для улавливания С02,
подтверждающего наличие Zymomonas, необходимо наличие трубки Дурхэма. В этой
среде могут развиваться и молочнокислые бактерии, однако при наличии Zymomonas
они не выдерживают конкуренции.
12.3.5. Анализы микробиологической чистоты дрожжей
Перед использованием в производстве пробы засевных дрожжей должны пройти
проверку на жизнеспособность (см. раздел 12.3.1), что соответствует критической
контрольной точке на рис. 12.1. Считается правильным проверять каждую партию
семенных дрожжей на допустимое количество (а лучше всего вообще отсутствие)
контаминирующих бактерий и диких дрожжей. Для бактерий рекомендуется ис-
пользовать в основном актидионовый WL-arap, а для диких дрожжей (не Saccharo-
myces) — лизиновый агар, но если контаминанты Saccharomyces окажутся стойкими
к циклогексимиду (что встречается довольно редко), определить их будет невозмож-
но. Как мы уже отмечали выше, не существует такой селективной среды, которая бы
одновременно подавляла рост культурных пивоваренных и спиртовых дрожжей
358
Йен Кэмпбелл
и допускала бы развитие всех присутствующих контаминантов. Тем не менее дикие
дрожжи рода Saccharomyces образуют споры и могут быть выделены благодаря своей
теплостойкости (сравнительно с неспорообразующими культурными дрожжами).
При этом, однако, для инкубации требуется не менее 3 сут, а задерживать на это вре-
мя внесение дрожжей непрактично. Таким образом, этот анализ может служить
лишь для проверки качества постфактум.
12.3.6. Идентификация контаминантов
В описании каждого из рекомендованных методов
рукции по идентификации типичных бактерий порчи
аспекты анализы уже рассматривались в главах 5-7,
ваться не будем.
12.4. Сусло и брожение
12.4.1. Микробиологический анализ сусла
В анализе каждой варки необходимости нет, поскольку после кипячения с хмелем
выживает лишь немногие теплостойкие споры Bacillus и Clostridium spp., сусло засева-
ется в ходе или в конце перекачки, и начало брожения предотвращает развитие этих
спор и их прорастание. Тем не менее в случае инфицирования варок сусло необходи-
мо проверить — оно может стать источником контаминации. Микроорганизмы порчи
не должны выживать после кипячения сусла, и наиболее вероятным источником кон-
таминации являются трубопроводы, загрязненный или негерметичный теплообмен-
ник, бродильная емкость и воздух, попадающий в сусло при аэрации либо атмосфер-
ный воздух бродильного помещения.
Если сусло на некоторое время оставить неинокулированным, то количество клеток
контаминантов будет недостаточно для определения путем стандартной чашечной раз-
водки или подсчета КОЕ под микроскопом. Применяют два типа анализов: а) мемб-
ранное фильтрование не менее 100 мл и культивирование на неселективной среде
и б) «анализ со стимуляцией» (см. раздел 12.6.1), то есть инкубирование асептически взя-
той пробы в стерильную емкость для размножения любых присутствующих контами-
нантов. Недостатком обоих методов является то, что при их наличии могут развиваться
и бактерии, и дрожжи, не являющиеся причиной порчи пива, в связи с чем необходимо
их культивировать отдельно и идентифицировать. Для исключения коитаминирова-
ния воздухом важно обеспечить герметичность фильтра во время анализа.
12.4.2. Анализы в ходе брожения
Несмотря на то что в обязанности пивовара входит регулярный отбор проб в ходе
брожения, обычно единственным полезным (но не очень существенным) микробио-
логическим анализом является проверка количества дрожжей. Как правило, доста-
точно провести несложные анализы плотности, рН и вкусо-ароматических свойств.
Необычный привкус может служить сигналом о возникновении микробиологиче-
ских проблем, и в этом случае лучше провести анализ. При большом количестве за-
севных дрожжей микроскопия не эффективна, и образец следует высевать на селек-
тивную среду, используемую для проверки засевных дрожжей, но в этом случае
приводятся подробные инст-
и дрожжей, но поскольку эти
здесь мы на этом останавли-
Глава 12. Микробиологические методы анализа в пивоварении 359
результат станет известен опять же лишь через 3 сут. Главным преимуществом ана-
лиза «подозрительной» варки является заблаговременное получение информации
о возможности повторного использования данных засевных дрожжей или необходи-
мости их кислотной промывки (или отказа от их использования).
12.5. Стерильность оборудования
12.5.1. Бродильные емкости
Подтверждение стерильности бродильных емкостей после мойки и дезинфекции
трубопроводов и арматуры на рис. 12.1 обозначено как «критическая контрольная
точка» (ККТ). Хотя в данном контексте подразумевается «микробиологическая»
ККТ, она одновременно является и «химической»: необходимо гарантировать опо-
ласкивание, достаточное для полного удаления моющих и дезинфицирующих
средств.
Традиционно для выявления остаточной контаминации на оборудовании после
мойки и дезинфекции использовались отборы мазков с вымытой поверхности. Этот
метод не пригоден для закрытых емкостей, так как при открывании стерилизован-
ной емкости и отборе пробы нарушается микробиологический состав (кроме того, он
опасен из-за присутствия после кислотной мойки остаточного С02). Тем не менее
поскольку традиционные бродильные танки представляют собой открытые емкости,
существует возможность взять мазок с тестируемой поверхности площадью 30 х 30 см
(около 1000 см2) при помощи стерильного ватного тампона (наиболее подходит для
этой цели медицинский тампон для взятия мазка из горла). Также необходима сте-
рильная бутылка (или пробирка) с 5 мл воды. Тампон извлекают из контейнера, ув-
лажняют стерильной водой (или, лучше, раствором Рингера; считается, что тем са-
мым улучшается способность контаминантов переносить транспортировку от места
отбора пробы до лаборатории), протирают им поверхность оборудования, а затем
возвращают в бутылку, после чего палочку, на которой держали тампон, ломают
ниже места соприкосновения с пальцами. Пробу следует анализировать незамедли-
тельно (в течение не более 2 ч); в лаборатории тампон в бутылке сильно встряхива-
ют, что позволяет переместить микроорганизмы в воду. 1 мл пробы высевают на
МЕ-агар, и количество КОЕ, умноженное на 5, дает число микроорганизмов на по-
верхности, с которой был взят мазок.
Для закрытых емкостей показателем остаточной контаминации после мойки и
дезинфекции является проба последней промывной воды (после ополаскивания).
Не менее 250 мл фильтруют через мембрану с размером пор 0,45 мкм и подсчитыва-
ют через 3 сут инкубации количество КОЕ на ME- или WL/V-агаре. WLN-arap имеет
то преимущество, что по цвету колоний можно дифференцировать различные кон-
таминанты. Еще раз следует повторить, что для исключения воздушной контамина-
ции очень важно обеспечить герметичность фильтра во время анализа.
12.5.2. Оценка дезинфицирующих веществ
Моющие и дезинфицирующие средства могут применяться как в системах с пол-
ным сливом, так и в системах с частичной или полной рециркуляцией (см. главу 11).
Восстановленные и рециркулирующие кислотные и щелочные моющие средства при
360
Йен Кэмпбелл
недостаточной концентрации сами по себе могут стать источниками контаминации.
Для анализа большинства растворов имеется ускоренный химический метод, подтвер-
ждающий достижение нужной концентрации или активности средства, информация
о котором приводится в документации фирмы-поставщика данного средства. Чтобы
удостовериться в способности восстановления поврежденных, но жизнеспособных
клеток, для альтернативного микробиологического анализа требуется 3-4 сут. Коли-
чество жизнеспособных клеток даже в контаминированном дезинфицирующем сред-
стве будет очень невелико для подсчета КОЕ на фильтрах. Перед мембранным фильт-
рованием рекомендуемых 250 мл исследуемого раствора важно удостовериться в том,
что все части фильтра и сама мембрана совместимы с данным моющим средством
(некоторые щелочные соединения могут стать источником проблем). Сразу же после
мембранного фильтрования пробы остаток дезинфицирующего средства должен быть
смыт с мембраны путем пропускания через нее 100 мл стерильного физиологическо-
го раствора, и до помещения мембраны на неселективную среду (ME- или IVZJV-arap)
для инкубации другие нейтрализующие вещества не требуются.
Существует еще один важный аспект дезинфицирующих средств, который иногда
игнорируют, а именно: эффективны ли они для данной цели? В документации фирм-
изготовителей биоцидов зачастую приводятся экспериментальные данные, доказы-
вающие эффективность данного средства относительно тех или иных микроорганиз-
мов, но отдельные их штаммы характеризуются разной стойкостью к конкретным
веществам. Следовательно, даже если в анализах на фирме-производителе в каче-
стве контаминантов, присутствующих в производстве пива и в оборудовании для его
розлива, использовались те же виды бактерий и дрожжей, важно получить экспери-
ментальное подтверждение о чувствительности конкретного штамма контаминанта
к используемому раствору моющего средства. Несколько раз нам приходилось стал-
киваться с совершенно разной чувствительностью штаммов контаминантов одно и
того же вида микроорганизмов. С микробиологической точки зрения этим легко
объяснить некоторые проблемы с контаминацией на производстве, и решение здесь
простое: необходимо сменить данное моющее или дезинфицирующее средство на
более эффективное. С другой стороны, контаминирование может произойти вслед-
ствие человеческого фактора — например, из-за слишком быстрого проведения мой-
ки и дезинфекции, так что оно не успевает воздействовать на микроорганизмы. Здесь
можно вспомнить пример контаминации системы розлива в баре из-за того, что мо-
ющему раствору приписывались дезинфицирующие свойства
Большинство дезинфицирующих средств можно оценить с помощью одного из
вариантов анализа, изначально предназначавшегося для четвертичных аммонийных
соединений типа BSI3286 [2]. Тестируемый микроорганизм должен принадлежать
контаминирующему штамму. Имея его чистую культуру, нет необходимости в его
идентификации, и начальная концентрация 1-3-106 мл позволяет не производить
разбавление для дальнейшего подсчета выживших микроорганизмов. Нормальный
рабочий раствор соединения (в стерильной воде) следует использовать в течение
0, 10, 20 и 30 мин, после чего до подсчета его разбавляют в 10 раз в нейтрализующем
растворе, и 0,1 мл пробы высевают на ME- или WLN-гггр. Графическое представле-
ние логарифма количества выживших микроорганизмов может быть использовано
для сравнения различных моющих и дезинфицирующих средств.
Глава 12. Микробиологические методы анализа в пивоварении 361
12.5.3. Анализы газов
Необходимо удостовериться в стерильности газов, а именно воздуха или кислоро-
да, используемых для аэрации сусла, и С02, N2, вводимых в пиво. Для обеспечения
стерильности воздуха адиабатического нагрева в компрессоре не достаточно, и поэто-
му сжатый воздух пропускают через стерилизующий фильтр. Считается, что сжатые
газы в баллонах высокого давления стерильны. Микробиологические риски заключа-
ются не столько в самих газах, сколько в их способности переносить контаминанты
по трубопроводам, инфицируя тем самым продукт на отдельных этапах технологи-
ческого процесса.
Таким образом, важно, чтобы места отбора проб находились в непосредственной
близости от места поступления газа. Контаминация может быть спорадической (на-
пример, лишь в начале введения газа), и поэтому необходимо обеспечить медленный
поток газа в течение достаточно длительного времени (например, целой смены), что
достигается путем установки расходомера на выходе пробоотборника (во избежание
проблем с его стерилизацией). Для анализа нужен также прибор для снижения дав-
ления до чуть выше атмосферного с защитой операторов от случайных скачков дав-
ления. Пробоотборник должен быть без изгибов (колен), в которых могли бы задер-
живаться крупные частицы или микроорганизмы.
Для количественного анализа известного объема газа применяют три основных
метода:
1. Прямой посев на агаровую среду. В настоящее время используют различные
модификации пробоотборников с питанием от батареек и известным расходом
газа в точке отбора проб; газ проходит поверх чашки Петри с неселективной
культуральной средой, находящейся в приборе.
2. Мембранное фильтрование (аналогичное фильтрованию жидкости) с помощью
соответствующего стерильного соединения с точкой отбора проб и расходомера
(или других устройств для измерения объема пробы).
3. Пропускание пузырьков сквозь капиллярную трубку через известный объем сте-
рильной воды и подсчет в ней контаминантов. Капиллярное устройство состоит
из стеклянной трубки и колбы Бюхнера, и позволяет пробе газа пройти с опреде-
ленной скоростью (известной по расходомеру) через 200 мл стерильной воды.
Затем эти 200 мл воды проходят мембранное фильтрование; до тех пор, пока не
найдется возможности подсоединения мембранного фильтра непосредственно
к месту отбора проб, проще использовать мембранное фильтрование отдельно.
В случае сильной контаминации количество колоний будет слишком велико для
подсчета с помощью вышеперечисленных систем, однако необходимый тревожный
сигнал будет получен.
12.5.4. Контроль послебродильного оборудования
Как и бродильные емкости, все оборудование пивоваренных предприятий, ис-
пользуемое для созревания, осветления и розлива пива, должно быть перед исполь-
зованием вымыто и продизенфицировано. Здесь нельзя брать мазки, и обычно ис-
пользуется мембранное фильтрование последней промывной воды (см. раздел
12.5.1). Можно также использовать анализ пробы (250 мл) последней промывной
воды с оборудования и трубопроводов с помощью мембранного фильтрования.
362
Йен Кэмпбелл
Здесь исходят из того, что тестируемая жидкость (обычно пиво) до соприкоснове-
ния с поверхностью оборудования стерильна или содержит весьма незначительное
количество микроорганизмов. В случае присутствия большого их числа необходимо
провести дальнейшие анализы, так как пиво, поверхность оборудования или то и
другое может быть уже контаминировано. Кроме того, трубопроводы, клапаны и дру-
гая арматура проверяются путем анализа мембранным фильтрованием пропущен-
ной через них стерильной воды срезу после дезинфекции.
12.5.5. Анализ тары
Кеги, ПЭТ-бутылки, банки или стеклянные бутылки, используемые для стерильно-
го розлива пива, пастеризованного в потоке или стерильно отфильтрованного, долж-
ны сами по себе быть стерильными. Для бутылок и банок, подвергаемых пастеризации
после розлива, могут применяться менее строгие микробиологические стандарты.
На оборудовании розлива в кеги каждый кег сразу же после пропаривания запол-
няется охлажденным пивом. Кег, отобранный для микробиологического анализа
(рис. 12.3), остается горячим несколько дольше. Для сокращения дополнительной не-
Танк
для дображивания
Вспомогательный
фильтр
Фильтр
*
Танк
для осветления
пива
(ККТ)
1: Распылительная
головка
(ККТ)
1
Установка
розлива
К
2: Укупорочное
устройство,
3: Филлер
Пастери-
затор,
Карбонизация
2:Со0
1: Подтверждение
стерильности
/ГТх (ККТ)
D3
Рис. 12.3. Точки отбора проб на участках от созревания до пастеризации бутылочного пива. Для
точек, обозначенных 1, необходим частый отбор проб (не реже 1 раза в 4 ч); для точек, обозначен-
ных 2, достаточно ежедневного отбора проб, а в точках 3 необходимо лишь выяснять источник кон-
таминации. Проводят анализы пива, распылительной головки для воды и С02с помощью мембран-
ного фильтрования; бутылок, поступающих из бутылкомоечной машины, путем промывки стериль-
ной водой и подсчета КОЕ на чашках или путем мембранного фильтрования; кронен-пробок и пра-
вильности работы укупорочного автомата — путем мембранного фильтрования пробных бутылок
стерильным раствором
Глава 12. Микробиологические методы анализа в пивоварении
363
типичной термообработки до добавления стерильной охлажденной воды необходимо
выполнить анализ как можно быстрее. Объем воды для отбора пробы должен быть ком-
промиссным: наибольший возможный объем для эффективного охлаждения несовмес-
тим с возможностями мембранного фильтрования. Таким образом, добавляют в кег 500
мл воды, который, вращаясь, охлаждается, а его внутренняя поверхность промывается.
Затем эта вода проходит мембранное фильтрование, после чего проводится подсчет
КОЕ на ME- или WLN-arape. Для добавления в кег или удаления из него этой промыв-
ной воды необходимо наличие специальной стерилизуемой арматуры.
Метод ополаскивания пригоден для бутылок, отбираемых случайным образом
с конвейера между бутылкомоечной машиной и установкой разлива (рис. 12.4). 06-
Танк
для осветления
пива
Подтверждение
стерильности
(ККТ)
Пиво
после фильтрации
Подтверждение
стерильности
А (ККТ)
Пастеризатор
Подтверждение стерильности (ККТ)
СОг
I
Подтверждение стерильности
Рис. 12.4. Точки микробиологического контроля для линии розлива в кеги. Пастеризованное в по-
токе пиво и С02 фильтруют через мембрану; простерилизованные кеги охлаждают и ополаскивают
стерильной водой, которая затем подвергается мембранному фильтрованию. «Тест со стимуляци-
ей» и мембранное фильтрование выполняются на пробах из наполненных кегов
364
Йен Кэмпбелл
разец накрывают стерильной алюминиевой фольгой или стерильным лабораторным
стаканом для транспортировки в лабораторию. Применяются разные методы микро-
биологического анализа: а) для стерильного розлива и б) для пастеризации после
розлива. В первом случае для анализа ПЭТ-бутылок, банок и стеклянных бутылок
для стерильного розлива добавляют 100 мл стерильной воды, бутылку со стериль-
ной водой, закупоренную стерильной пробкой, встряхивают, чтобы перевести мик-
роорганизмы в воду, и пропускают все 100 мл через мембранный фильтр. Количе-
ство КОЕ на А/£- или WLN-arape должно быть равно нулю. Во втором случае
допускается не более 100 КОЕ со всей внутренней поверхности бутылки, однако
в идеале их количество также должно быть нулевым. Еще одним методом для второ-
го случая является промывка бутылки 10 мл стерильной воды и посев 1 мл на чашки
Петри; в этом случае количество КОЕ более 10 свидетельствует о наличии серьез-
ных проблем с мойкой бутылки.
12.6. Пиво
12.6.1. Тест с форсированием
Микробиологический тест с форсированием (или ускоренный тест) заключается
в термостатировании пива в укупоренных бутылках или банках продолжительно-
стью до 3 недель (обычно при 25-27 °С), в результате чего происходит ускоренное
размножение любых присутствующих микроорганизмов порчи. Каждая неделя их
размножния в термостате при 25 °С эквивалентна 2-3 месяцам хранения в погребе.
Для кегов рекомендуется следующий тест: 1 л образца асептически отбирают с
помощью стерильной арматуры — 750 мл для теста со стимуляцией, а остальные 250 мл
для немедленного мембранного фильтрования. Форсирование (ускорение) — это
давно известный микробиологический тест, существовавший еще до разработки
культуральных сред, и применяется он для выявления контаминации пива микроор-
ганизмами-вредителями. Пиво хорошего качества может быть и не стерильно, но
только в том случае, если микроорганизмы в пиве не способны размножаться. При
наличии в пиве микроорганизмов порчи они будут размножаться, и в результате их
можно выявить микроскопированием или путем посева на культуральную среду.
Рост числа микроорганизмов свидетельствует о том, что в продаже пиво может ис-
портиться.
Данный метод потенциально опасен, так как бутылки под давлением С02 могут
взорваться. Их следует термостатировать и подвергать анализу в отдельных прово-
лочных клетках, работая в перчатках и защитных очках. В ходе термостатирования
пиво анализируют на мутность и наличие осадка, и при наличии какого-либо дефек-
та присутствие микробной контаминации выявляется окрашиванием по Граму,
и при необходимости следует провести идентификацию контаминантов биохимиче-
ским анализом микроорганизмов, изолированных на М£-агаре.
Этот метод также может применяться для анализа пива в бочках — стерильная
275-мл бутылка заполняется осветленным пивом с добавкой сахара. В этой бутылке
происходит вторичная ферментация пива, и при термостатировании при 25-27 °С
микробная порча будет замечена уже в лаборатории еще до возникновения проблем
в торговле.
Глава 12. Микробиологические методы анализа в пивоварении
365
12.6.2. Подсчет числа микроорганизмов
После фильтрования подсчитать немногочисленные колонии микроорганизмов
в отфильтрованном пиве можно лишь с помощью мембранного фильтрования. Хотя
для стерилизованного в потоке или пастеризованного пива (которое должно быть сте-
рильно) можно применять форсированный метод, их проверяют также с помощью
мембранного фильтрования полного объема упаковки (банки или стеклянной бутыл-
ки) или 0,5-1 л пробы, взятой из более крупной емкости. Результат после мембранно-
го фильтрования можно получить через 3 сут, однако из-за развития на неселективной
культуральной среде бактерий, не вызывающих порчу пива, возможен ошибочный по-
ложительный результат. Для отбора пробы пива в ходе технологического процесса
оборудование в соответствующих точках должно быть оснащено мембранными про-
боотборниками для асептического отбора пива из трубопроводов (рис. 12.5). Отбор
проб через клапаны не приемлем, если только их перед взятием проб и после него не
стерилизовать с помощью горящего факела или пара. Силиконовые мембраны осна-
щены внутренними дисками из нержавеющей стали (или так, как показано на схеме,
или с 4-8 круглыми отверстиями). При продолжительном использовании некоторые
участки мембраны начинают протекать, и поэтому они подлежат регулярной замене.
Для отбора пробы необходимо наличие стерильной иглы, трубки и приемника объе-
мом не менее 500 мл; кроме иглы с широким отверстием, это оснащение напоминает
отбор донорской крови. Не использовавшийся участок мембраны протирается 76-
96%-ным этиловым спиртом и протыкается иглой.
Хотя иногда желательно отбирать всю пробу сразу, зачастую бывает полезно со-
бирать пробу «по частям» в течение более длительного времени. Непрерывный рас-
ход можно регулировать с помощью хомута с винтовой нарезкой или автоматиче-
ского клапана с контролем по времени (электромагнитного); такую систему можно
настроить на взятие проб через 8 ч (то есть после смены). После мембранного филь-
трования объем пробы измеряется мерным цилиндром.
Силиконовая мембрана
АЛЛА . р-j—| ±ЛАЛЛ
ЛЛ/W
Рама для мембраны
из нержавеющей стали
Защитная
крышка
мембраны
Рис. 12.5. Мембранный пробоотборник, встроенный в трубопровод или стенку емкости
366
Йен Кэмпбелл
Обычно мембрана помещается в неселективную питательную среду — подходят
как МЕ-, так и WL/V-arap, поскольку на мембране не различимы цвета колоний, раз-
вившихся на WLN-arape. При поиске какого-либо конкретного контаминанта лучше
использовать селективную среду.
12.6.3. Типичный микробиологический анализ
Наиболее значимы для качества пива последние этапы производства и розлива
(см. рис. 12.1). На рис. 12.3 и 12.4 представлены схемы процесса дображивания кего-
вого и бутылочного пива и точки отбора проб для микробиологического анализа.
На линии розлива в кеги (рис. 12.3) критическими контрольными точками (ККТ)
являются пиво после пастеризации и стерильность вымытых кегов, а если кеги на-
полняют пивом с противодавлением С02, стерильность газа также является ККТ.
Так как источником контаминации может быть собственно розлив, необходимо
брать пробы и из заполненных кегов (то есть проводить скорее контроль качества,
чем анализ ККТ) и подтверждать стерильность путем мембранного фильтрования
не менее 250 мл асептически отобранного образца.
Из рис. 12.1 видно, что между созреванием и отгрузкой разлитого пива необходимо
провести несколько важных микробиологических анализов. Эту же схему можно при-
менить к банкам и одноразовым стеклянным бутылкам. Целью является подтвержде-
ние стерильности всех проб, но для светлого отфильтрованного непастеризованного
пива допускается наличие в 1 л до 100 клеток микроорганизмов. За исключением гото-
вого пива стерильность сама по себе не обязательна, однако микробиологические ана-
лизы (особенно ККТ) должны подтверждать, что присутствующие микроорганизмы
содержаться в таких количествах, что в ходе пастеризации они не выживут. Рекоменду-
ют такую систему проверки стерильности кронен-пробок и укупорочной машины, при
которой машины останавливают и загружают на этапе между аппаратом розлива и уку-
порочной машиной четко помеченной партией бутылок со стерильным соляным ра-
створом. Укупоренные бутылки отбирают до пастеризации, и содержимое каждой бу-
тылки подвергают мембранному фильтрованию. Такая система пригодна и для банок;
сходный анализ может применяться для бутылок и банок при подозрении на контами-
нацию устройства розлива: на мембранное фильтрование бутылки берут из точки 3
конвейера. Другая точка отбора проб, отмеченная 3, необходима для выявления источ-
ника контаминирования и относится к анализу суспензии фильтрующего материала.
В случае необычно высокого уровня контаминации отфильтрованного пива источни-
ком ее может быть либо само устройство розлива, либо фильтрующий материал.
12.6.4. Экспресс-методы
Так как микробиологические анализы требуют длительного времени, останавли-
вать производство до получения приемлемых результатов нереально. Стратегия
микробиологических анализов — это ретроспективный контроль качества и под-
тверждение того, что пивовар может ожидать получения пива хорошего качества.
Тем не менее при получении неприемлемых результатов анализов пиво может быть
отозвано из торговли. Привлекательность микробиологических экспресс-методов
анализа, описанная в главе 8, в том, что результаты могут быть получены до отгрузки
продукта, и в торговлю не поступает лишь та партия пива, которая не прошла микро-
Глава 12. Микробиологические методы анализа в пивоварении 367
биологический контроль (она подвергается дальнейшему исследованию с помощью
традиционных методов).
Еще одной возможностью является использование немикробиологических мето-
дов анализа. Эффективность пастеризации можно подтвердить тестом на инвертазу.
Инвертаза дрожжей, выделяемая в пиво в ходе брожения, при пастеризации инакти-
вируется, и положительный тест на инвертазу указывает на неудовлетворительную
пастеризацию. Этот тест можно выполнить быстро, добавив к пиву сахарный ра-
створ, термостатировать его 1 ч при 55 °С, и затем нагреть до 70 °С для прекращения
реакции, после чего определить содержание глюкозы (пурпурная окраска) с помо-
щью полосок, используемых медиками для диагностики диабета. В пиве не должно
содержаться начальной глюкозы из сусла (по понятным причинам этот анализ
нельзя использовать для пива с добавлением глюкозного сиропа).
Еще проще использовать данные о температуре. Несмотря на целесообразность
использования микробиологических тестов, при условии соблюдения нужных тем-
пературы и времени пастеризации, а также при отсутствии серьезных проблем с кон-
таминацией в ходе производства, пиво можно отгружать на реализацию.
12.7. Заключение
В данной главе мы не ставили целью полностью рассмотреть все рекомендуемые
микробиологические методы, применяемые в пивоваренной промышленности — неко-
торые из них в достаточной мере изложены в других главах. Описанные здесь методы
были выбраны для иллюстрации общих принципов микробиологического анализа и
представляют собой типичные примеры методов, широко используемых для проверки
качества пива. Тем не менее хорошее пиво можно приготовить и без использования
большинства из этих анализов. Даже самое маленькое пивоваренное предприятие, ра-
ботающее по традиционным технологиям, для подтверждения жизнеспособности куль-
туры дрожжей должна иметь микроскоп и хемоцитометр (см. главу 10). Несмотря на
затраты на оборудование, цена приборов для микробиологического анализа меньше,
чем партия испорченного пива.
Необходимы также приборы для измерения температуры, плотности и рН (они
относительно дешевы); с другой стороны, опытный пивовар может обходиться свои-
ми обонянием, осязанием и зрением, и более 6000 лет этого было достаточно. Мик-
робиологические методы наиболее важны в современных крупномасштабных пиво-
варенных технологиях, где возможности солода и дрожжей возросли до пределов, о
которых еще 50 лет назад даже представить себе было нельзя. Вместе с другими на-
уками микробиология позволяет заблаговременно получить предупреждение о воз-
никновении проблем, и их можно предотвратить или по крайней мере минимизиро-
вать еще до их нежелательного воздействия на качество пива и, как следствие, на
репутацию пивоваренного предприятия.
Литература
1. Baker, CD. (1991) Recommended Methods of Analysis, Institute of Brewing, London.
2. BSI 3286: Assessment of quaternary ammonium compounds (1960). British Standards
Institute, London.
368 Йен Кэмпбелл
3. Categorisation of pathogens according to hazard and categories of containment. (1984)
Advisory Committee on Dangerous Pathogens, H.M.S.O., London.
4. Cook, A.H. (1963) Proceedings of the European Brewery Congress, Brussels, 477.
5. Flannigan, B. (1983) Journal of the Institute of Brewing, 89, 364.
6. Green, S.R., and Gray, P.P. (1950) Wallerstein Laboratories Communications, 13, 357.
7. Hargreaves, L. (1996) Brewers' Guardian, (5), 31.
8. Ingledew, W.M., and Casey, G.P. (1982) Brewers Digest, 57 (3), 18 and 57 (4), 22.
9. Kara, B.V., Simpson, WJ. & Hammond, J.R.M. (1988) Journal of the Institute of Brewing,
94,153
10. Kennedy, A. (editor) (2001) Analytica Microbiologica EBC, Fachverlag Hans Karl,
Nuimberg.
it. Martin, C.P and Siebert, K.J. (1992) Journal of the American Society of Brewing Chemists,
50,134,
12. Meynell, G.G. and Meynell, E. (1965) Theory and practice in experimental bacteriology.
CUP., Cambridge.
13. Mochaba, R, O'Connor-Сох, E.S.C. and Axcell, B.C. (1998) Journal of the American Society
of Brewing Chemists, 56,1.
14. Pfenninger, H.B. (1977) Journal of the Institute of Brewing, 83,109.
15. Smart, K. A., Chambers, KM., Lambert, I.Jenkins, C. and Smart, C.A. (1999). Journal of the
American Society of Brewing Chemists, 57,18,
16. Taylor, G.T and Marsh, A.S. (1984) Journal of the Institute of Brewing, 90,134.
17. The bacteriological examination of drinking water supplies (1998) H.M.S.O., London
18. Thorn, J.A. (ed) (1992) Methods of Analysis, 8th Edition, American Society of Brewing
Chemists, St. Paul, MN.
19. Vesey, G, Slade, J.S., Byrne, M., Shepherd, K. and Fricker, C.R. (1993) Journal of Applied
Bacteriology, 75, 82.
Ф. Дж. Прист, И.Кэмпбелл (ред.)
Микробиология пива
Пер. с англ. 3-го изд. под общ. ред Т. В. Мелединой и Тыну Сойдла
Ответственный редактор Д. К. Рапопорт
Дизайн и верстка В. В. Земских
Дизайн обложки Р. В. Бабкина
Корректор О. Д. Камнева
Лицензия № ИЛ 00469 от 25.11.1999 г.
Подписано к печати 31.08.2005. Формат 70x100/16. Печ. л. 23, Бумага офсетная. Печать офсс-Ti[ая
Издательство 4Профессия». Самкт-Пстербург, 191002, а/я 600.
Тел./факс (812)740-12-60. www.professija.ru. e-mail: bookpost@>profcssija.ru
ISBN 5-93913-087-9