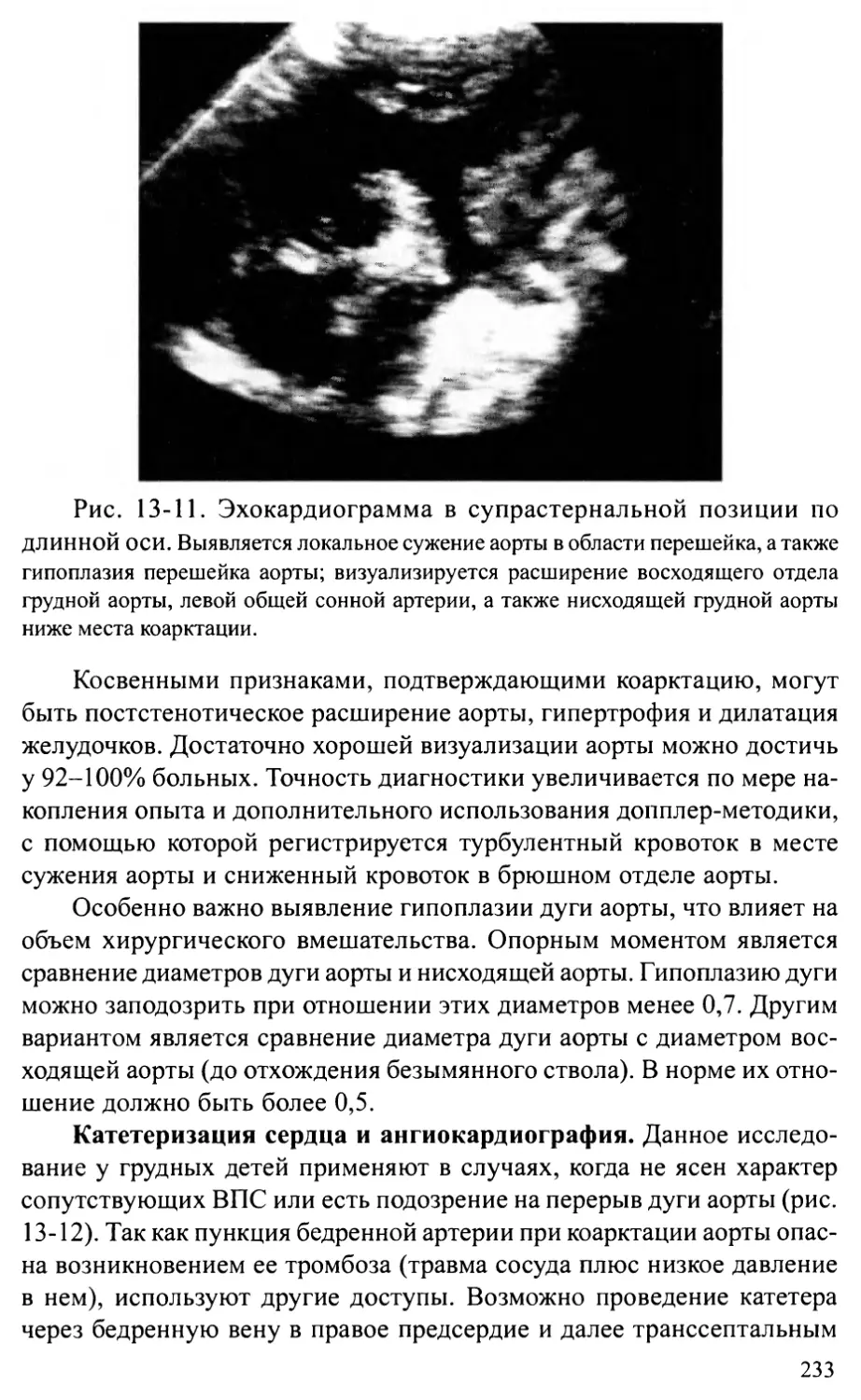
Автор: Шарыкин А.С.
Теги: патология сердечно-сосудистой системы сердечно-сосудистые заболевания внутренние болезни медицина
ISBN: 978-5-9518-0368-9
Год: 2009
Текст
БИНОМ
i fl.С. Шзрыкин
ВРОЖДЕННЫЕ
I пороки сердца
$$$
руководство для педиатров,
кардиологов, неонатологов
i:k. h’/A*
А С. Шарыкин
ВРОЖДЕННЫЕ
пороки сердца
руководство для педиатров,
кардиологов, неонатологов
второе издание
Издател ьство Б ИНОМ
Москва
2009
УДК 616.12
ББК 54.101
Ш26
Рецензент:
Ю.М. Белозеров - руководитель отдела патологии сердечно-сосудистой
системы Московского НИИ педиатрии и детской хирургии М3 РФ,
доктор медицинских наук, профессор
ISBN 978-5-9518-0368-9
А.С. Шарыкин. Врожденные пороки сердца. Руководство для
педиатров, кардиологов, неонатологов. 2 изд. - М.: Издательство
БИНОМ, 2009.- 384 с., 150 иллюстр.
Книга посвящена одному из важнейших разделов детской кардиологии - врожденным
порокам сердца. В общей части рассмотрены особенности нормального кровообращения у
плода и новорожденного, а также его изменения при врожденной патологии сердца; кроме
того, читатель знакомится со специальной терминологией. В разделе частной патологии
подробно представлены все основные пороки, встречающиеся в практике детских врачей,
алгоритмы их диагностики, современные возможности терапевтического и хирургического
лечения; изложены вопросы послеоперационного наблюдения за пациентами. Издание
содержит более 140 рисунков и схем, иллюстрирующих ключевые расстройства
гемодинамики, методы исследования сердца и наиболее распространенные операции.
Руководство может быть рекомендовано как опытным врачам, так и начинающим
педиатрам, кардиологам, неонатологам, специалистам ультразвуковой диагностики, а также
студентам медицинских учебных заведений.
ISBN 978-5-9518-0368-9
© Шарыкин А.С., 2009
© Издательство БИНОМ, 2009
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ......................................5
ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ.....................................7
Глава 1. ЧАСТОТА И СТРУКТУРА ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА............8
Частота врожденных пороков сердца.......7..................8
Естественное течение врожденных пороков сердца............. 1 О
Глава 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ КРОВООБРАЩЕНИЯ
И ТЕРМИНОЛОГИЯ ...........................................15
Глава 3. КРОВООБРАЩЕНИЕ ПЛОДА
И НОВОРОЖДЕННОГО..........................................26
Кровообращение плода......................................26
Кровообращение новорожденного.............................29
Глава 4. АЛГОРИТМЫ И МЕТОДЫ ДИАГНОСТИКИ
ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА.................................35
Пренатальная диагностика.................................3 5
Постнатальная диагностика.................................46
Отложенная диагностика...................................7 2
Глава 5. ОСНОВНЫЕ СИНДРОМЫ, КОТОРЫМИ ПРОЯВЛЯЮТСЯ
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ДЕТЕЙ, И ИХ ТЕРАПИЯ ...........75
Синдром артериальной гипоксемии...........................77
Синдром сердечной недостаточности.........................83
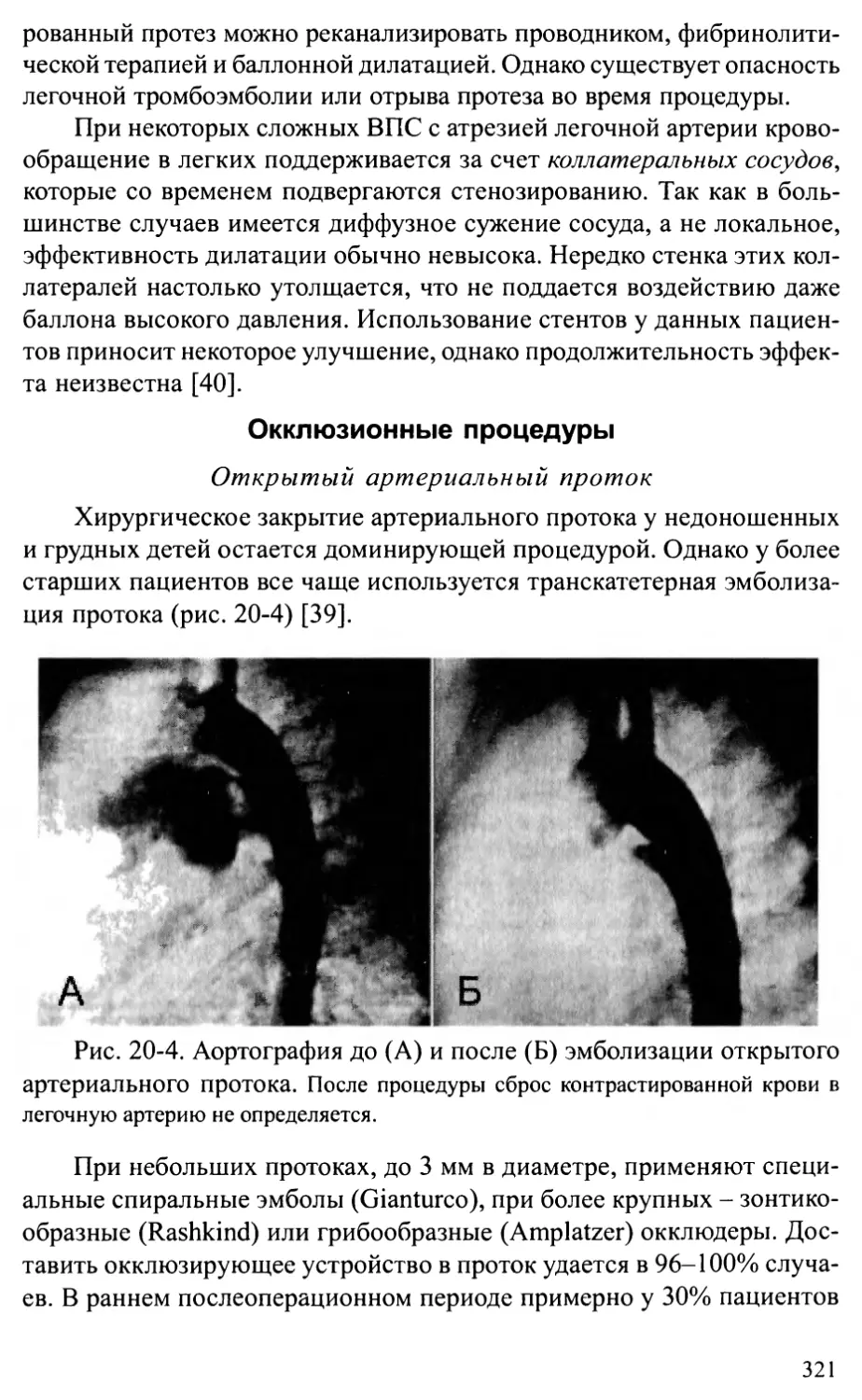
Глава 6. ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК ...........................97
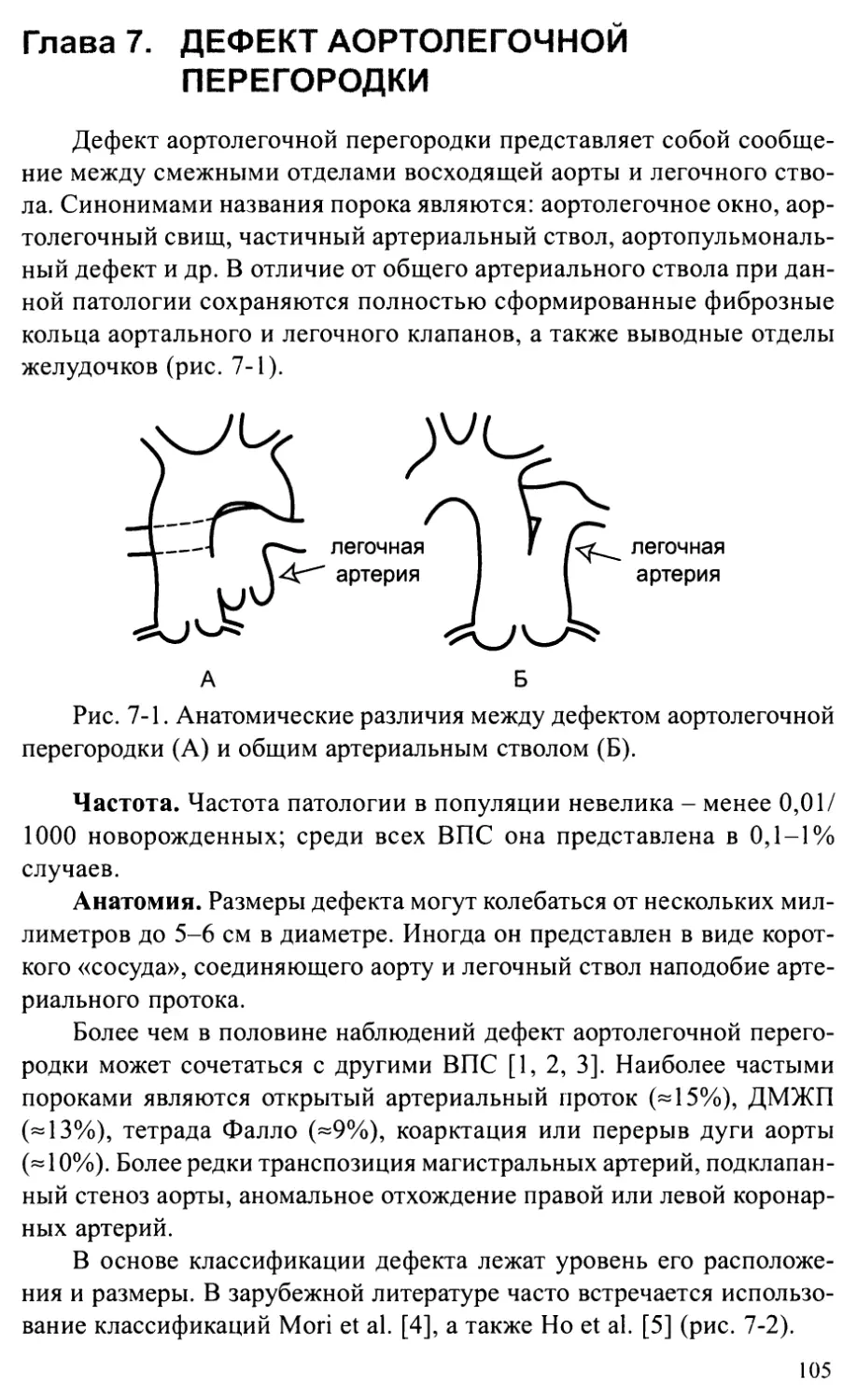
Глава 7. ДЕФЕКТ АОРТОЛЕГОЧНОЙ ПЕРЕГОРОДКИ.......................105
Глава 8. ПОРОКИ РАЗВИТИЯ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
И АНОМАЛИИ ВПАДЕНИЯ ЛЕГОЧНЫХ ВЕН ...........................111
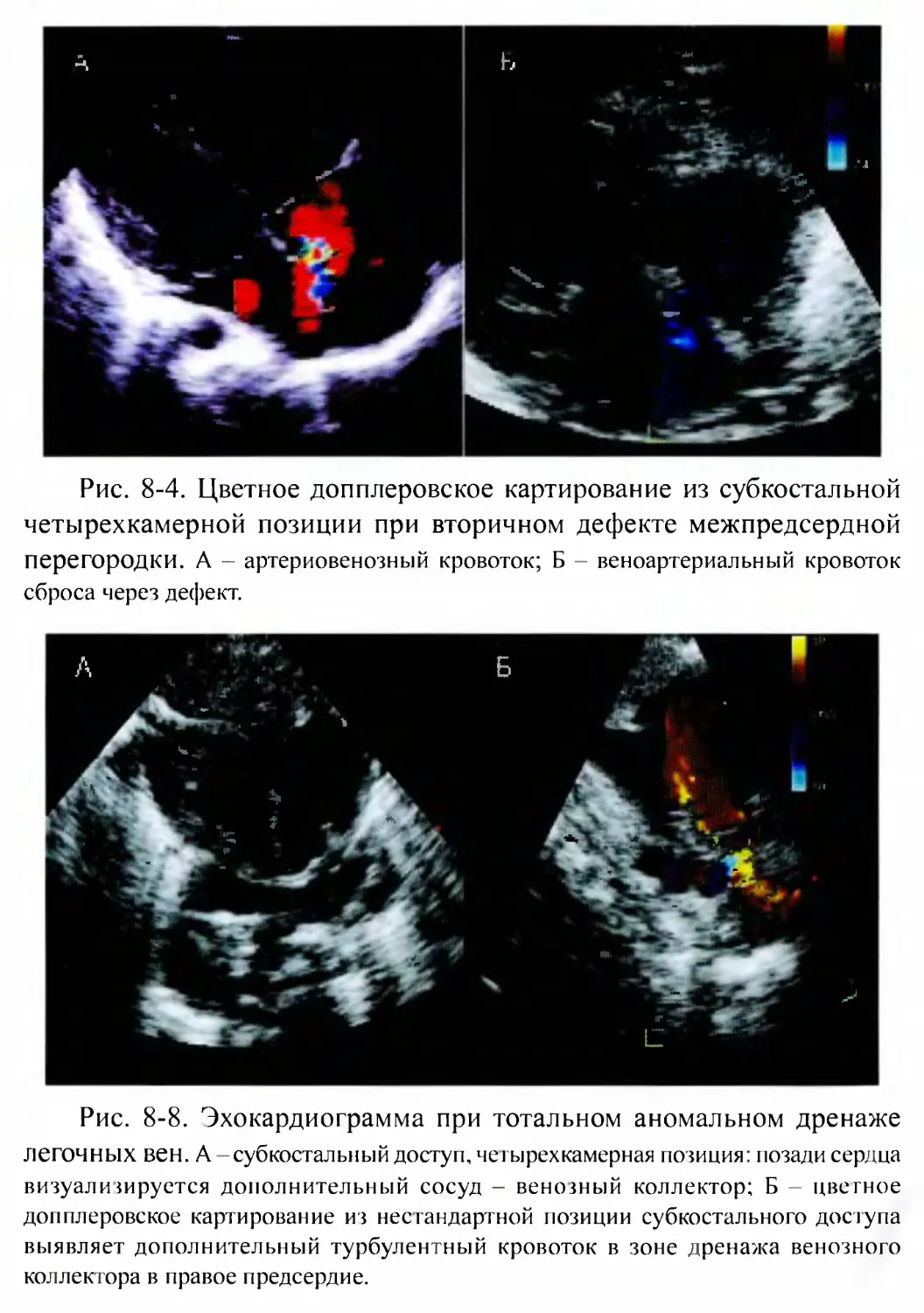
Дефект межпредсердной перегородки.......................... 1 1 1
Аномалии легочных вен....................................... 1 22
Частичный аномальный дренаж легочных вен ................122
Тотальный аномальный дренаж легочных вен................ 125
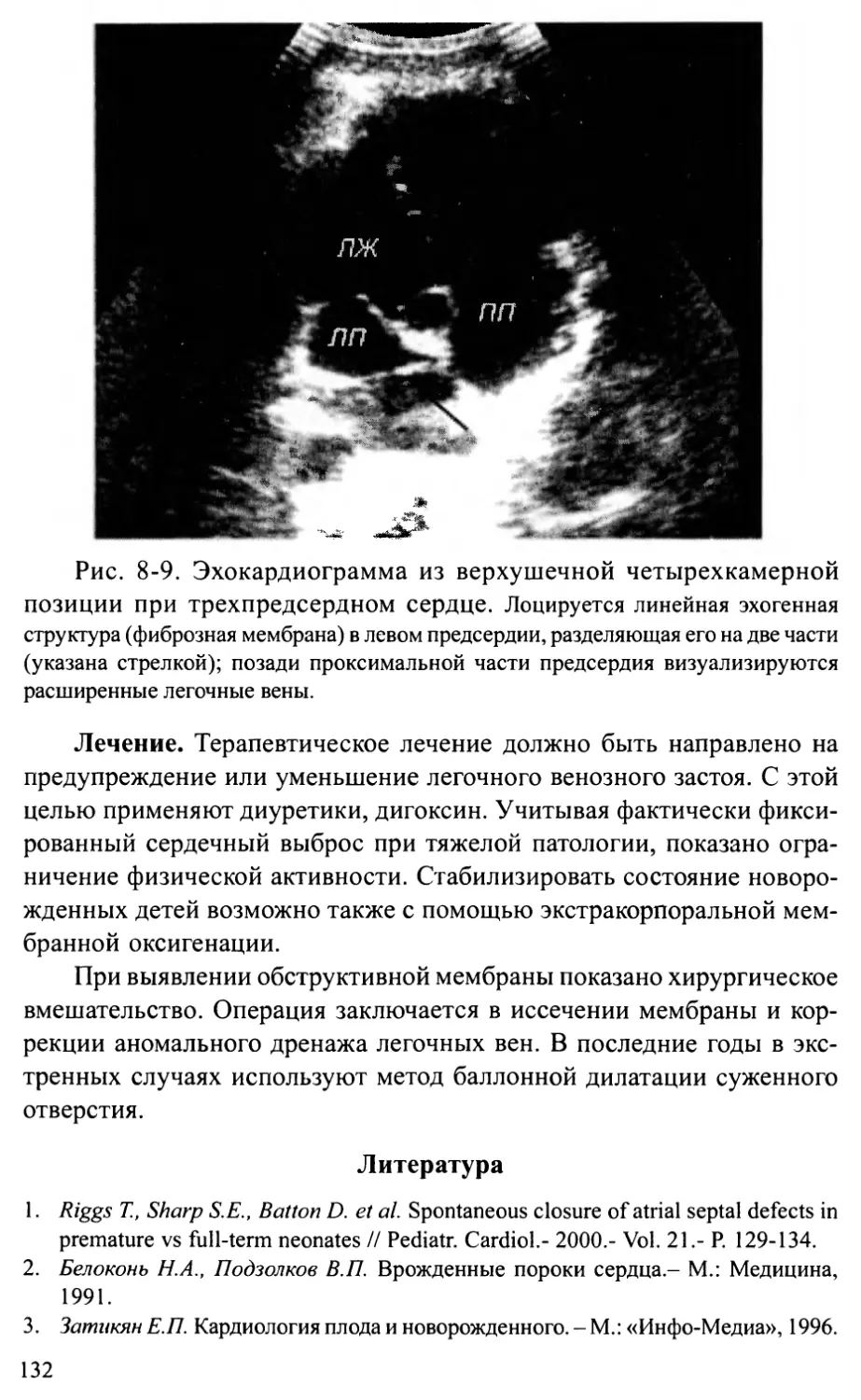
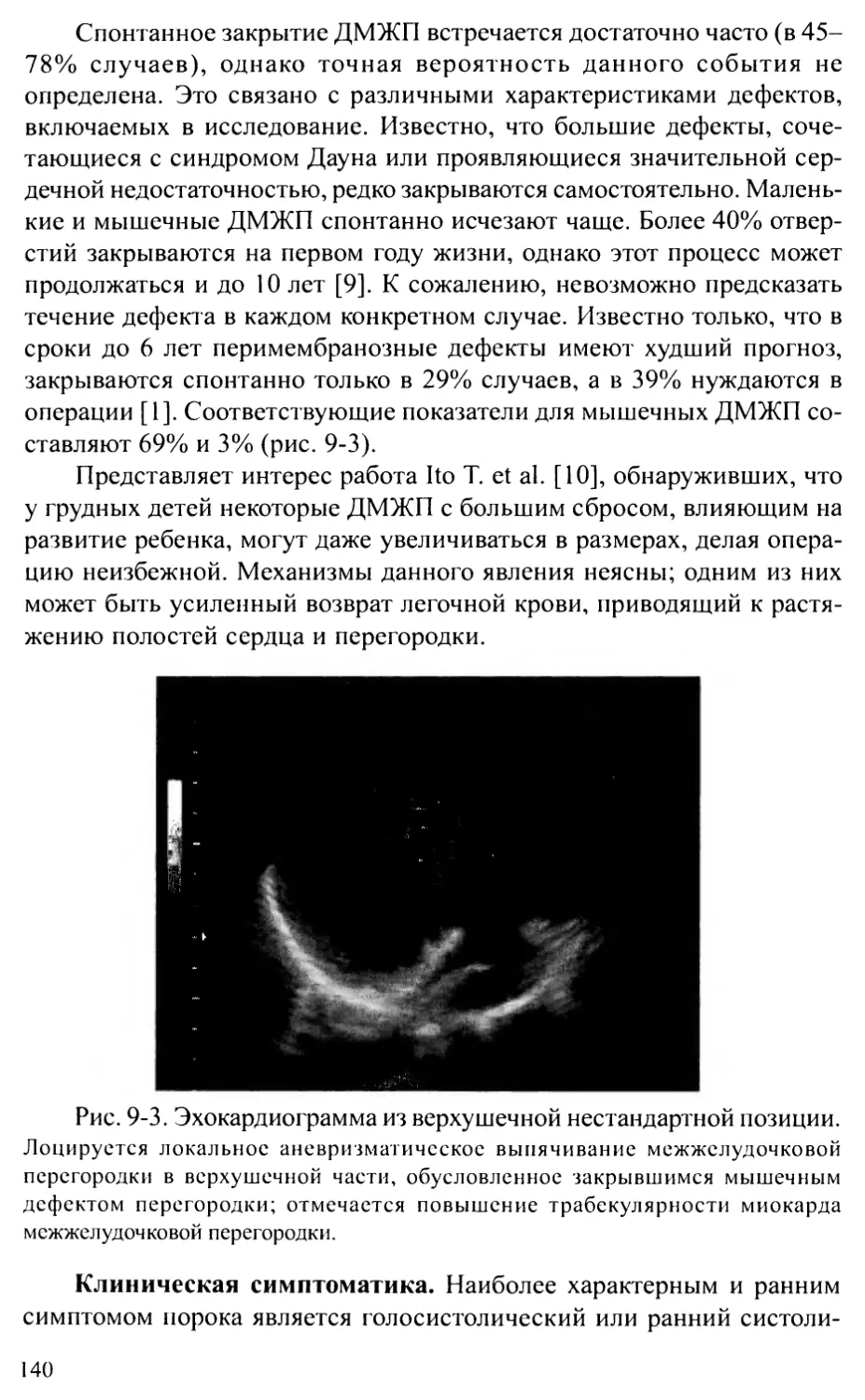
Трехпредсердное сердце.................................. 130
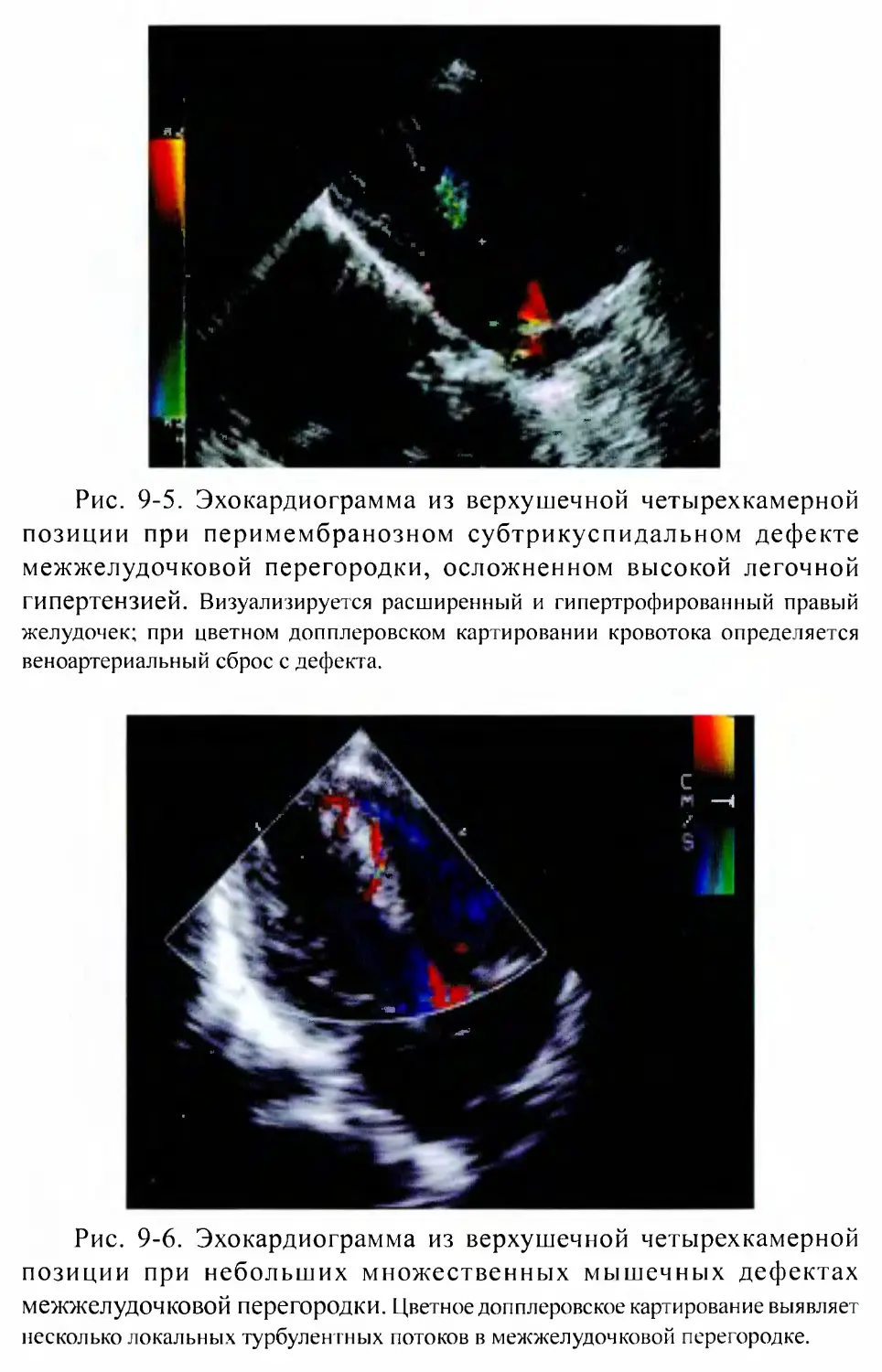
Глава 9. ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ.....................135
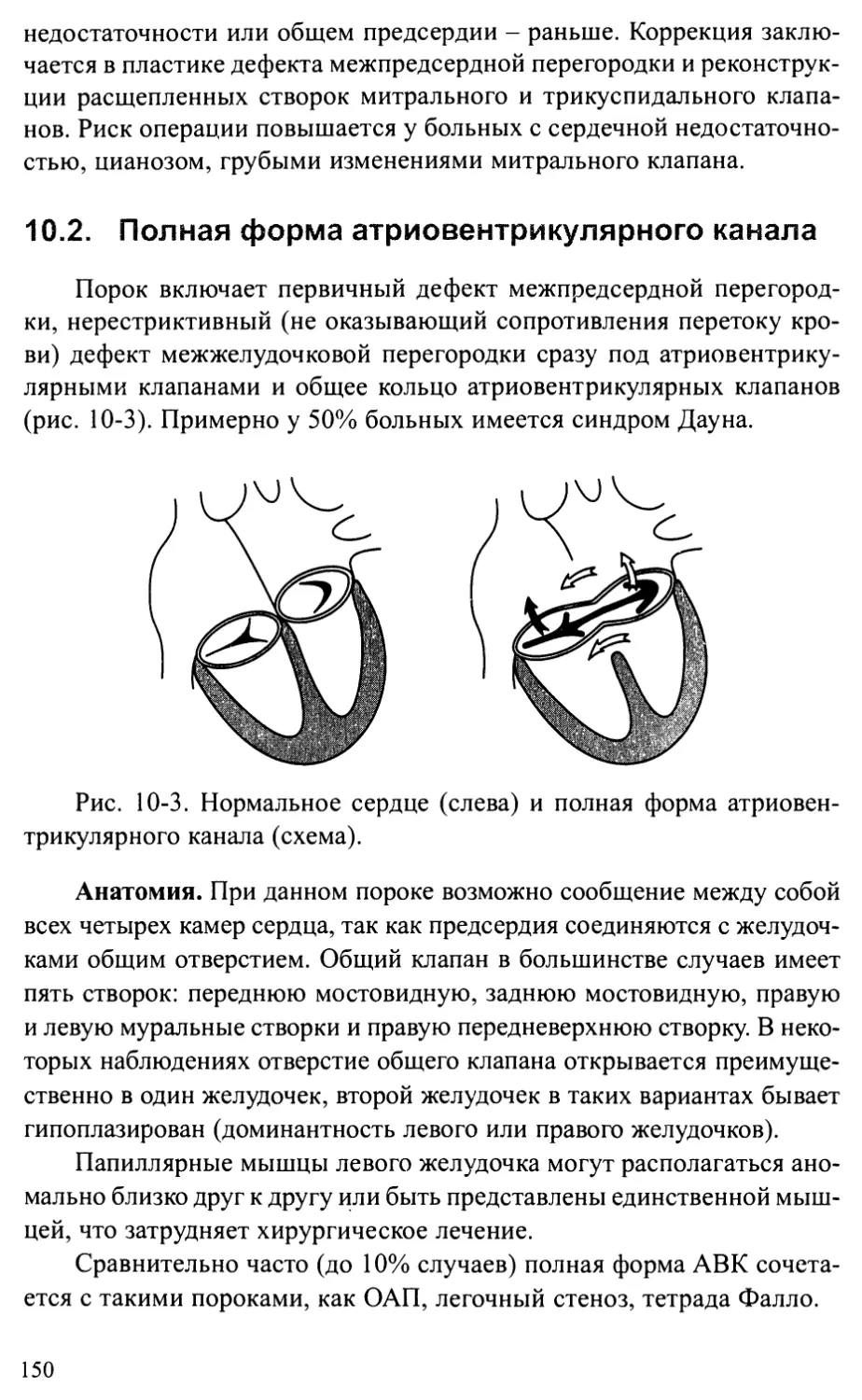
Глава 10. ОТКРЫТЫЙ АТРИОВЕНТРИКУЛЯРНЫЙ КАНАЛ................... 146
Частичная (неполная) форма атриовентрикулярного канала.. 146
Полная форма атриовентрикулярного канала................ 150
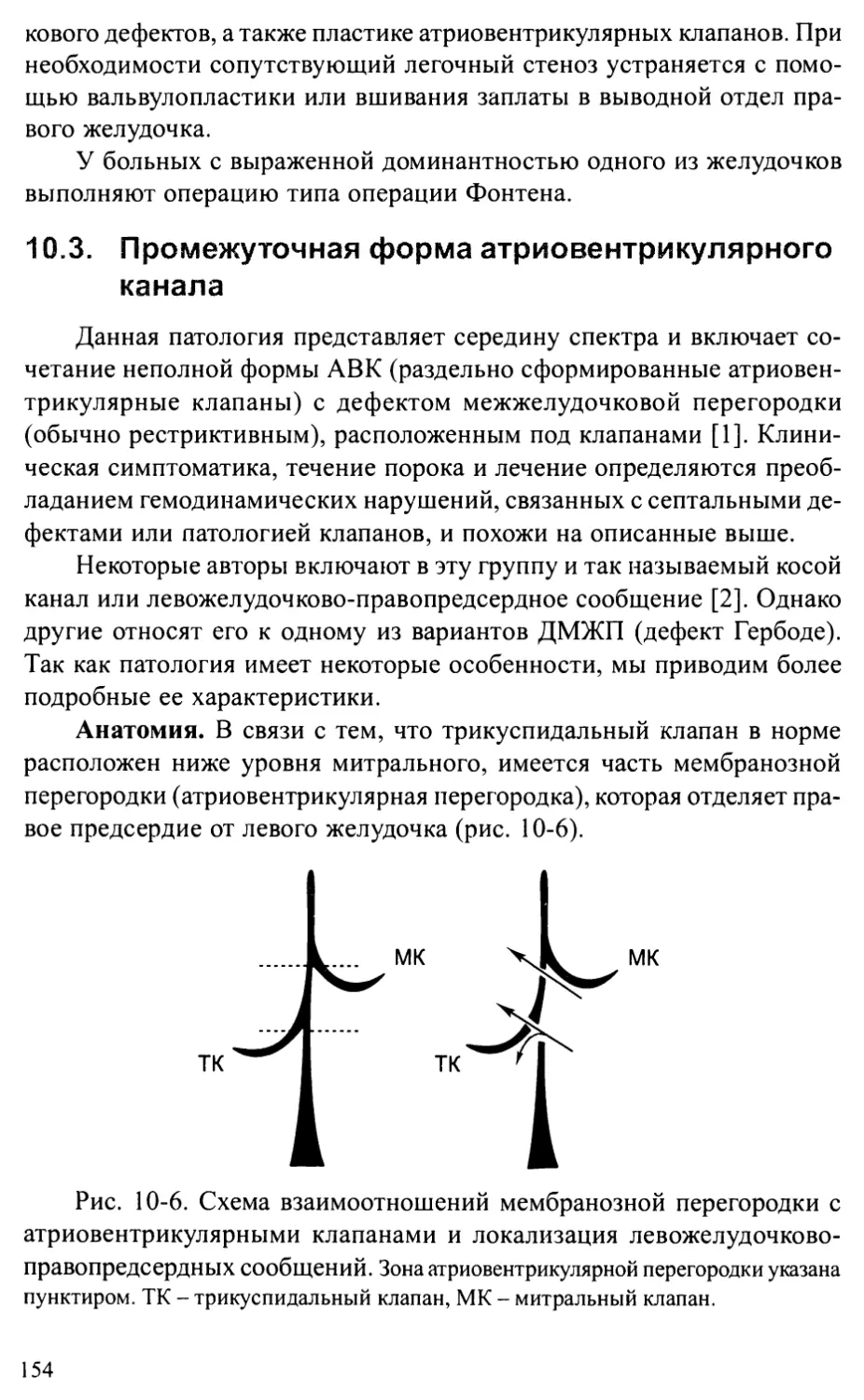
Промежуточная форма атриовентрикулярного канала......... 154
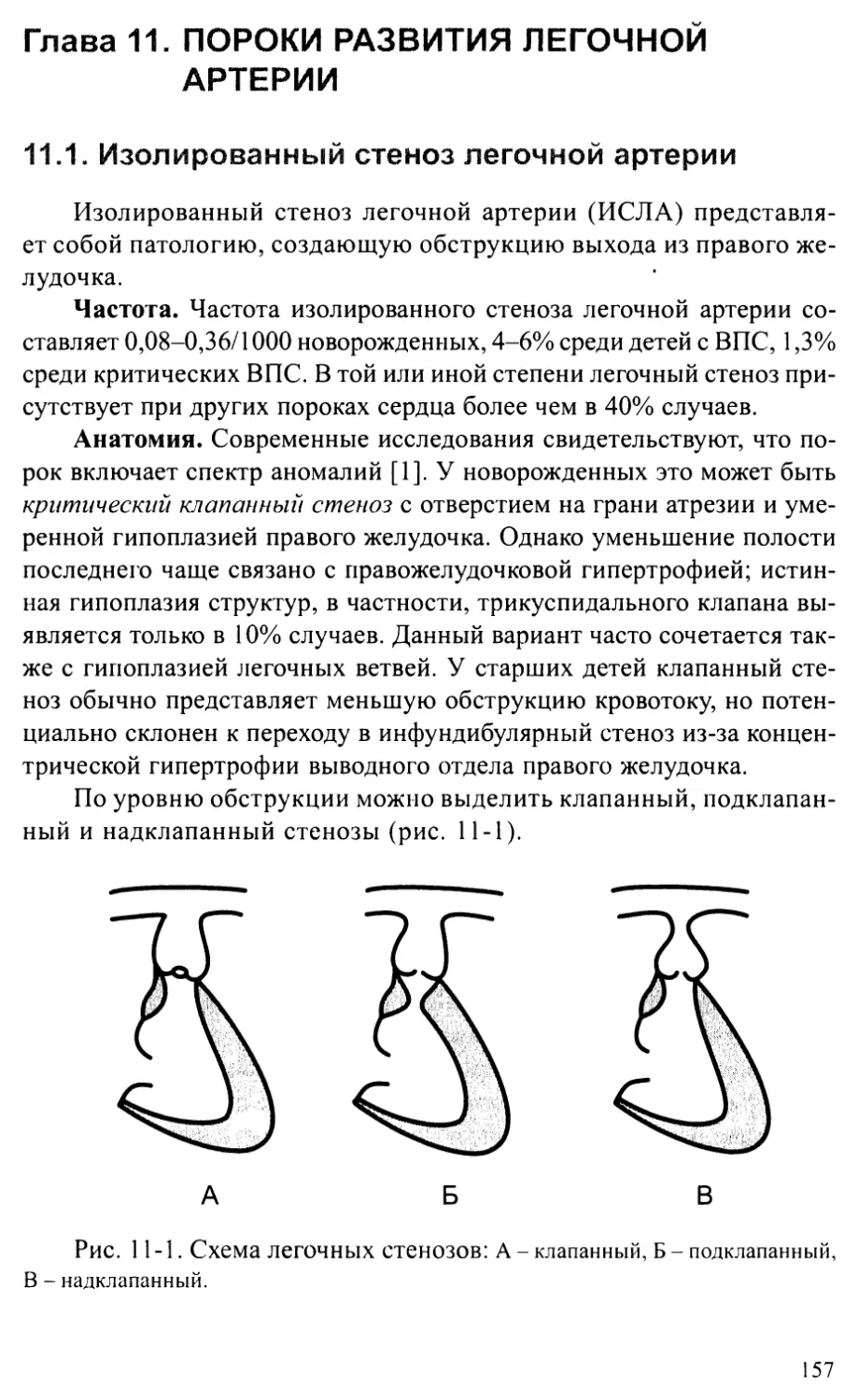
Глава 11. ПОРОКИ РАЗВИТИЯ ЛЕГОЧНОЙ АРТЕРИИ......................157
Изолированный стеноз легочной артерии..................1 5 7
Периферические стенозы легочных артерий................. 161
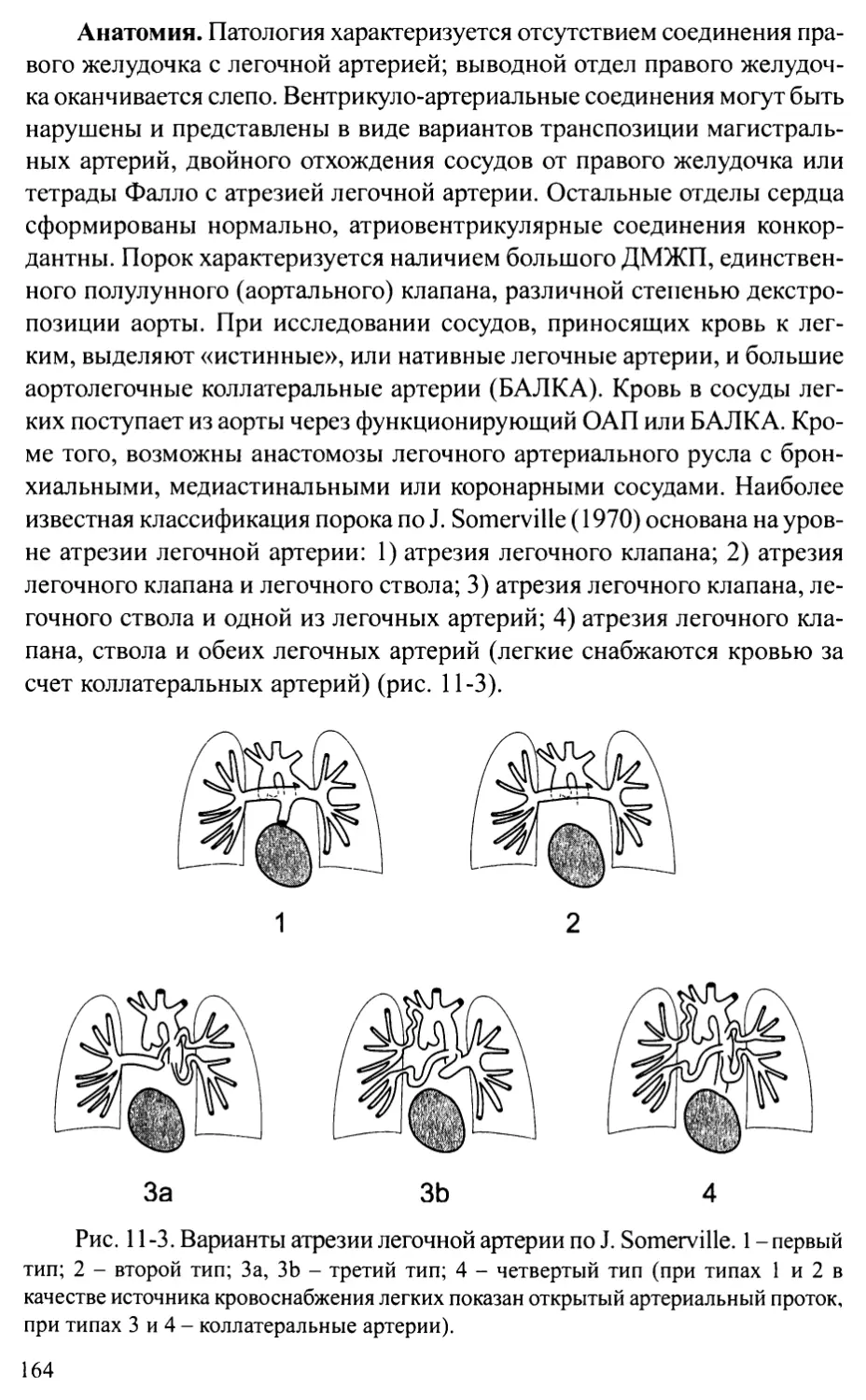
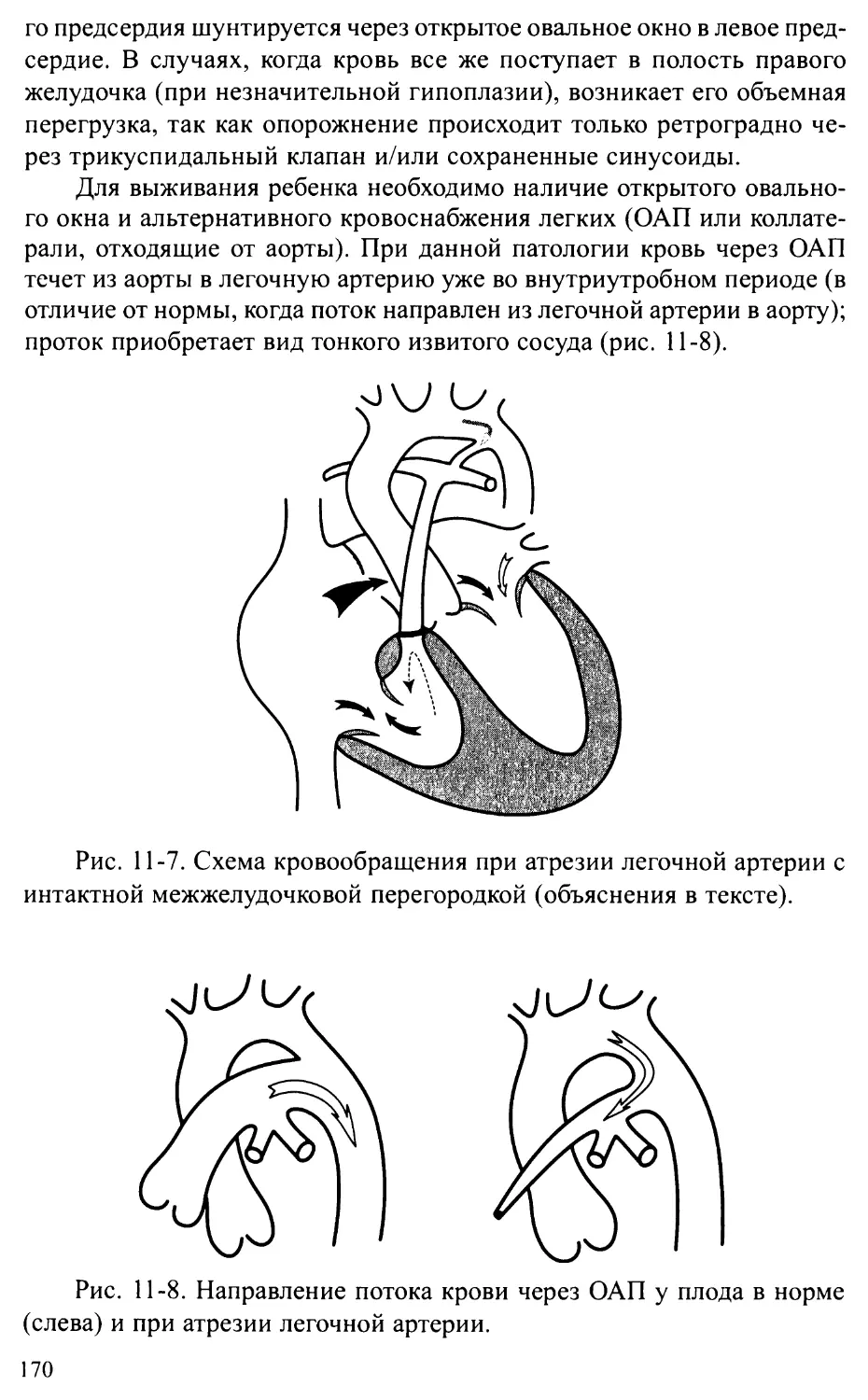
Атрезия легочной артерии.................................163
Атрезия легочной артерии в сочетании с ДМЖП ............ 163
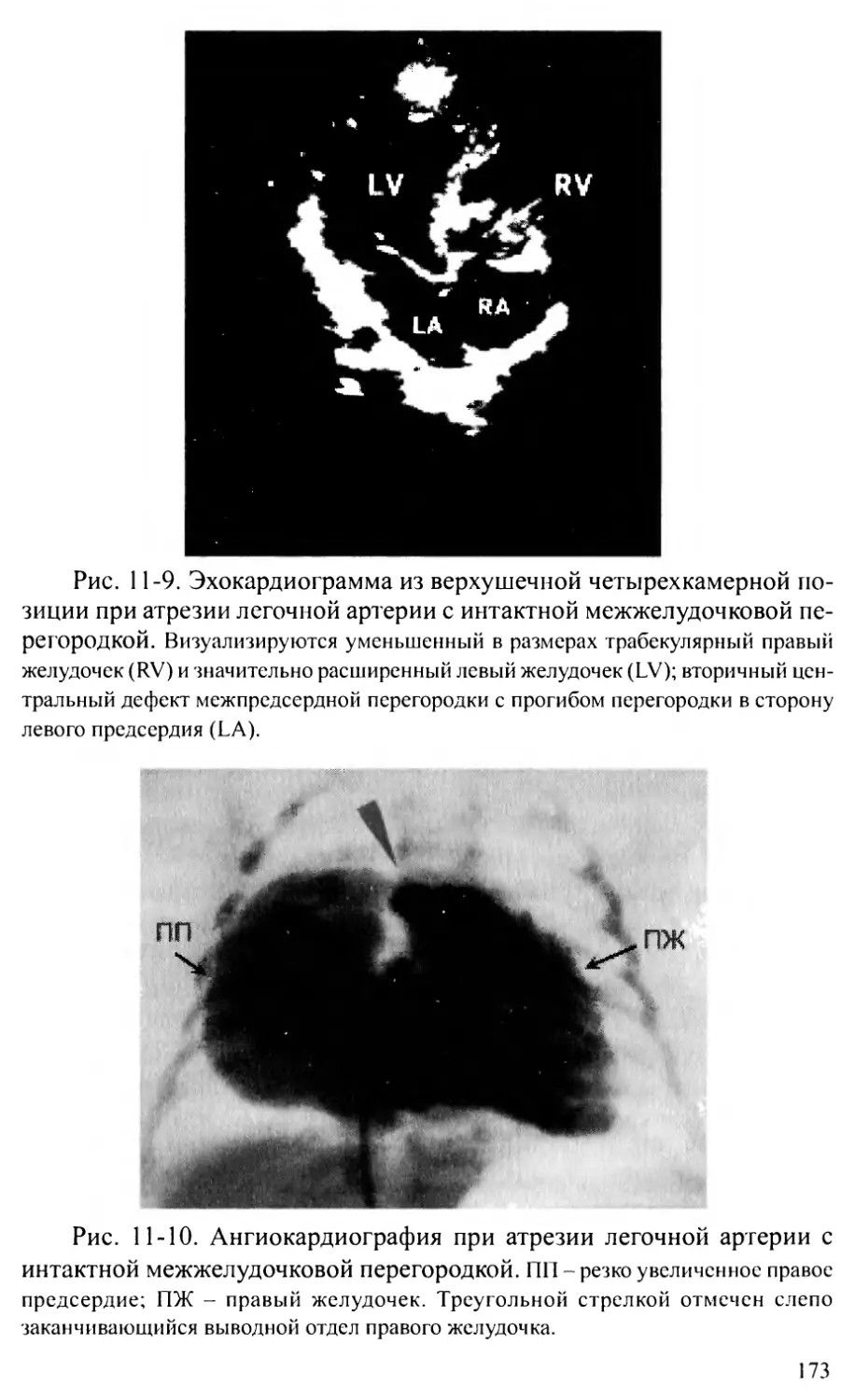
Атрезия легочной артерии с интактной межжелудочковой перегородкой ... 169
Идиопатическая дилатация легочной артерии............... 175
Глава 12. ПОРОКИ КОНОТРУНКУСА ................................. 178
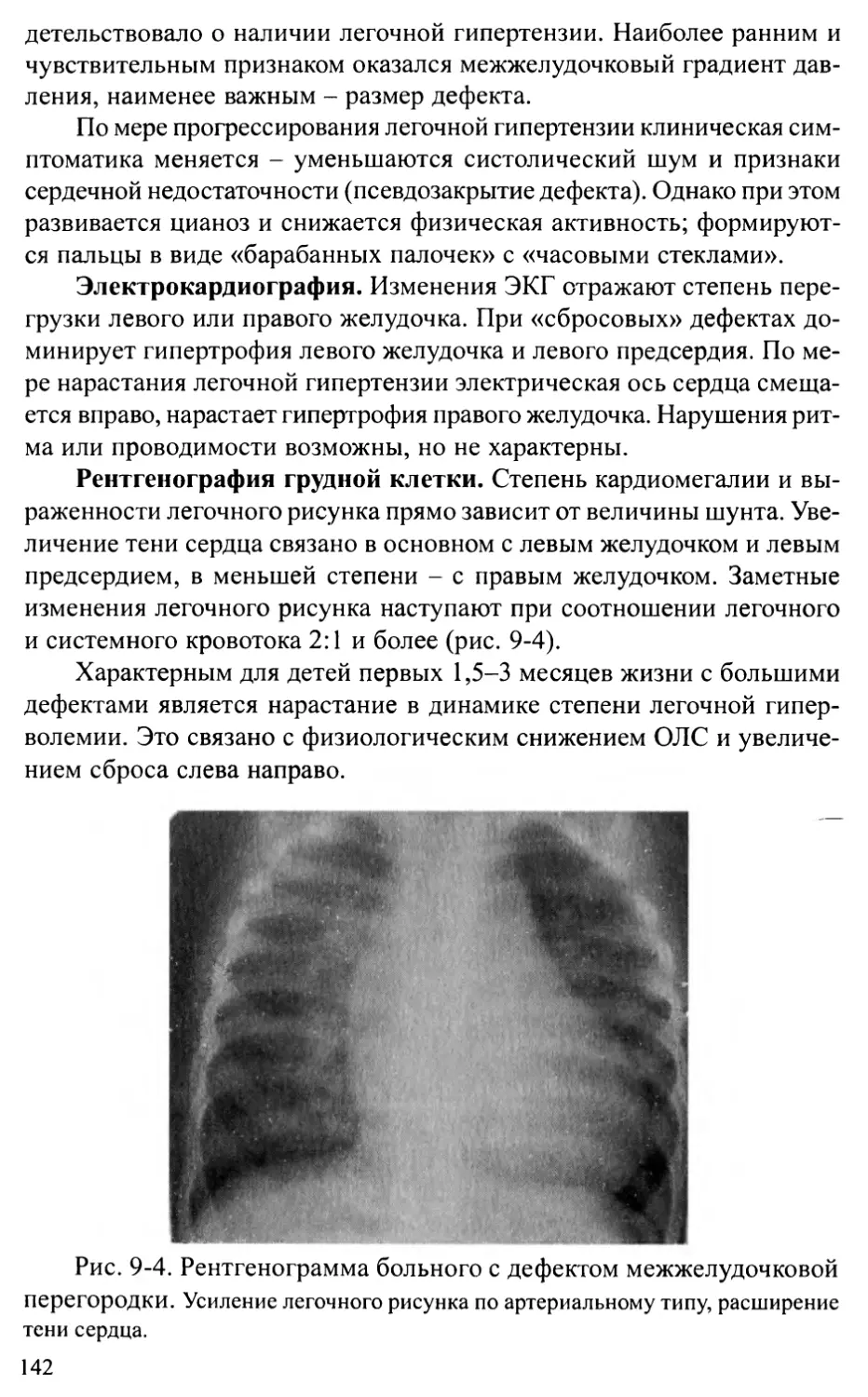
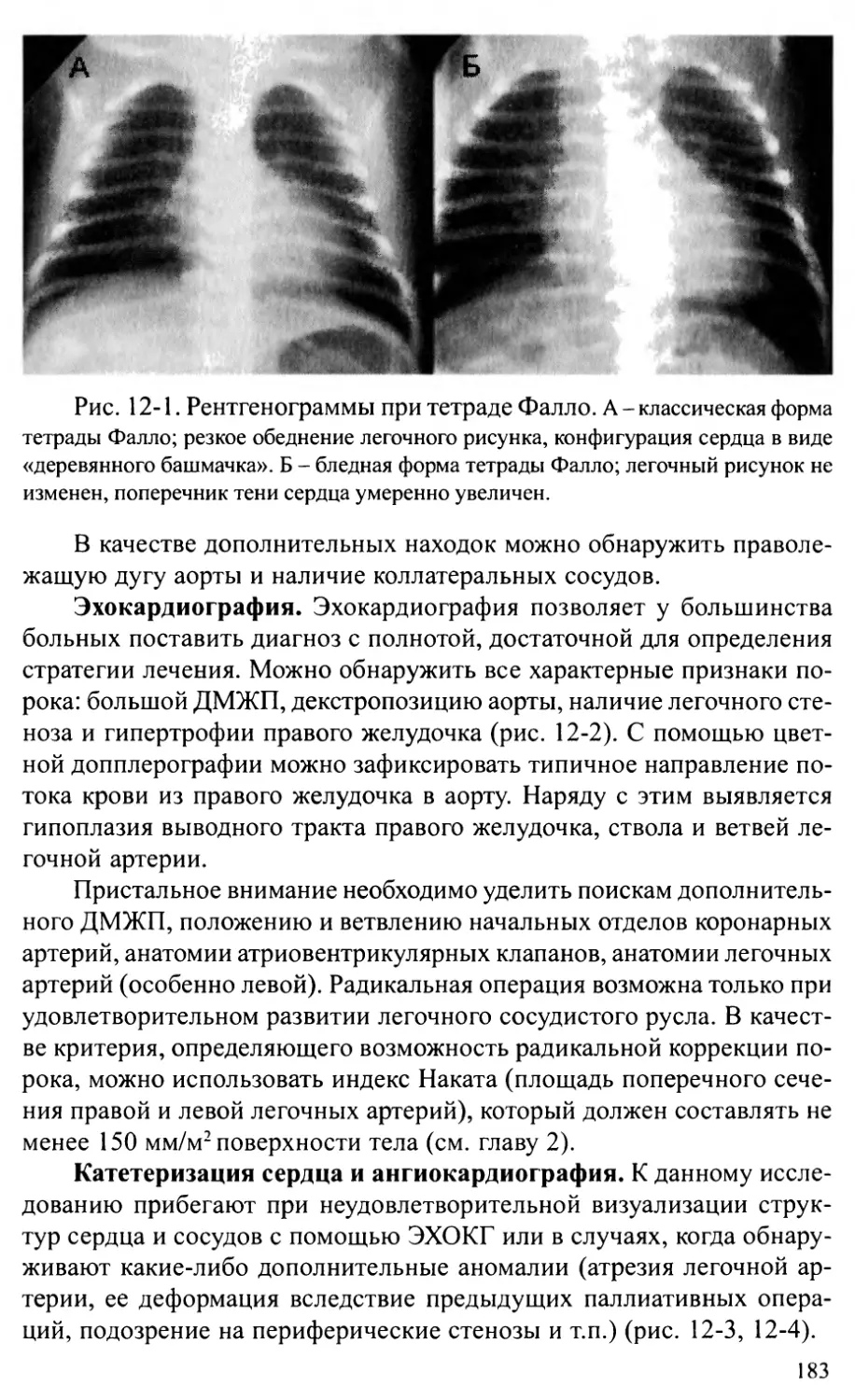
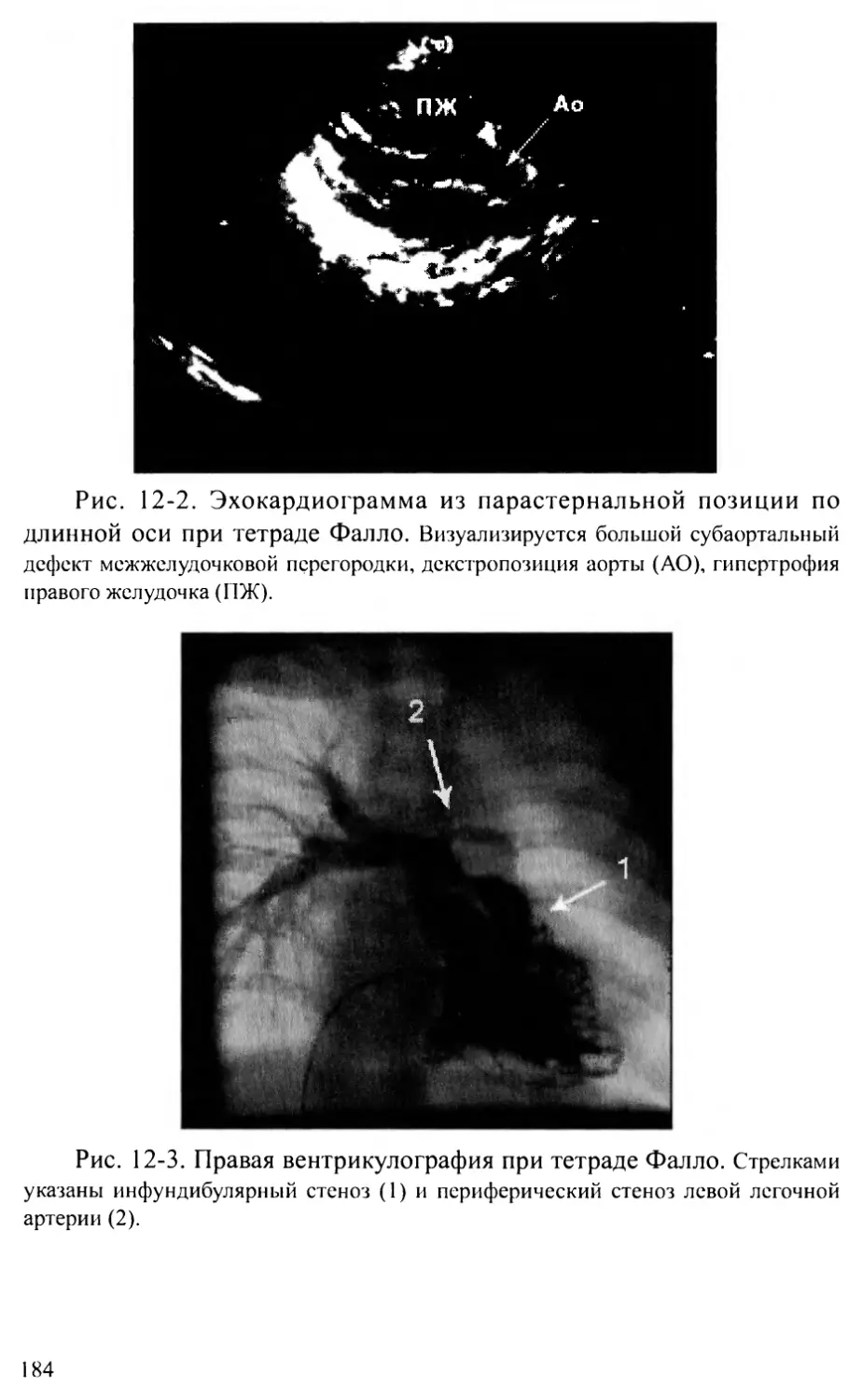
Тетрада Фалло............................................178
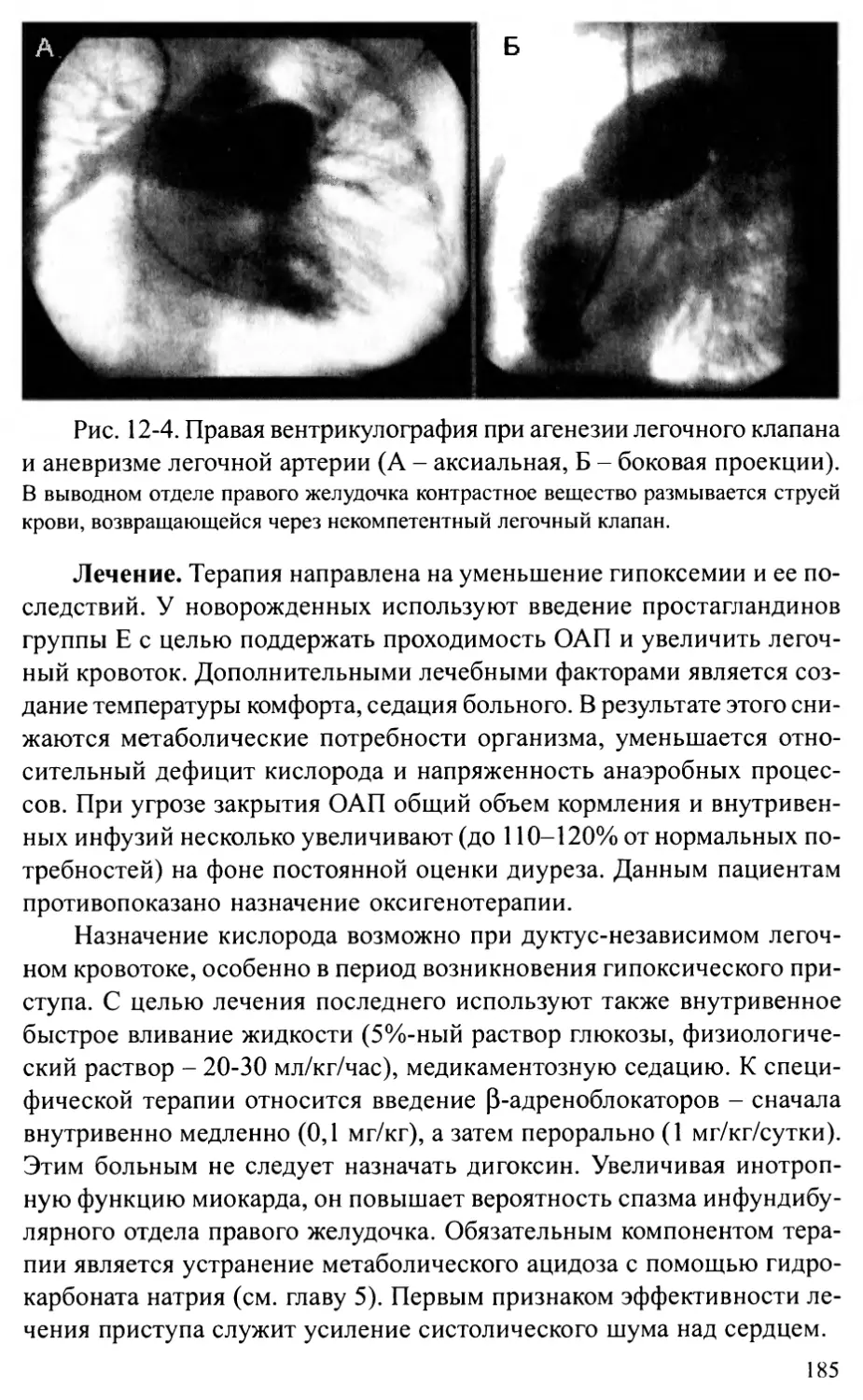
Отхождение аорты и легочной артерии от правого желудочка.186
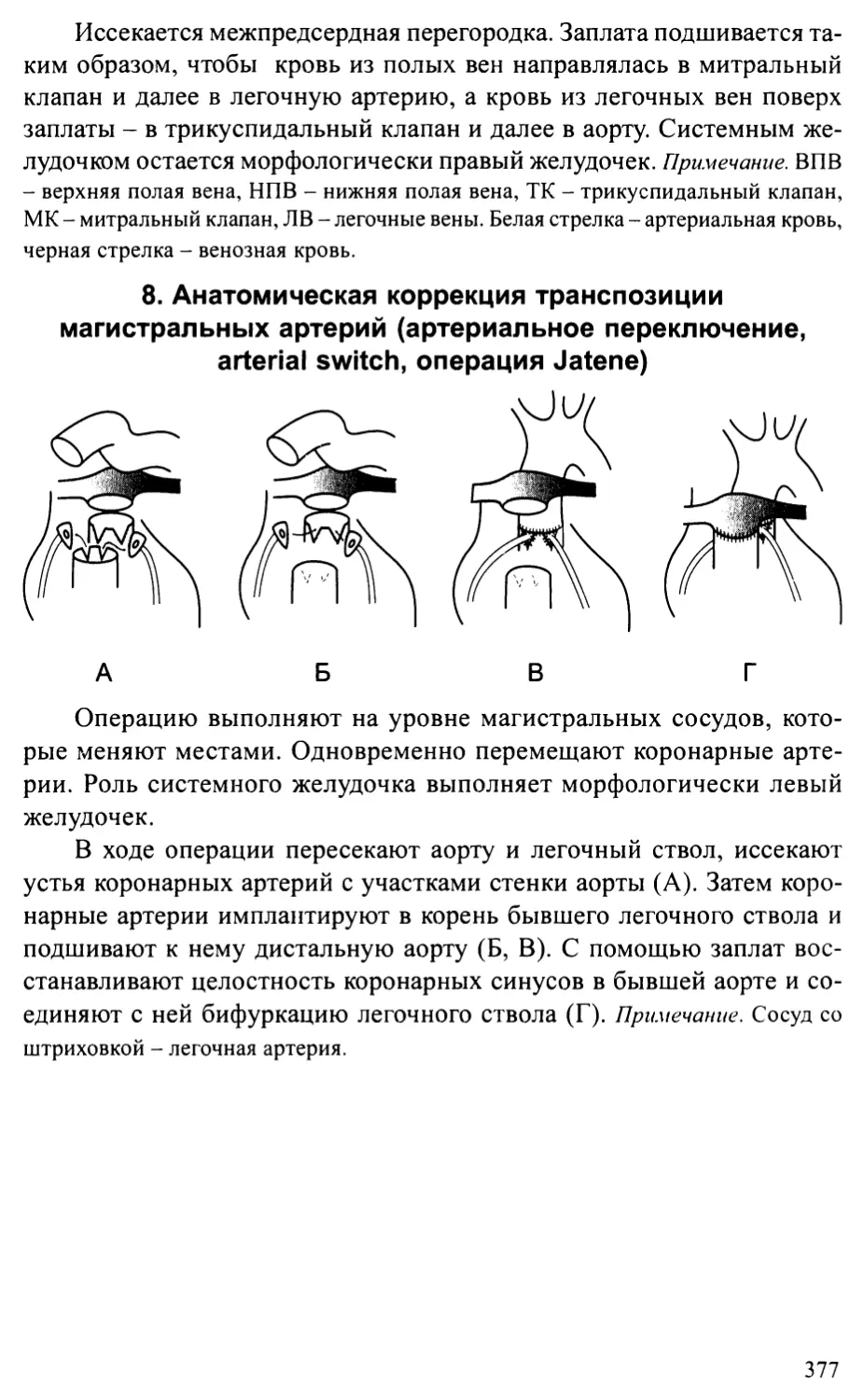
Транспозиция магистральных артерий.......................193
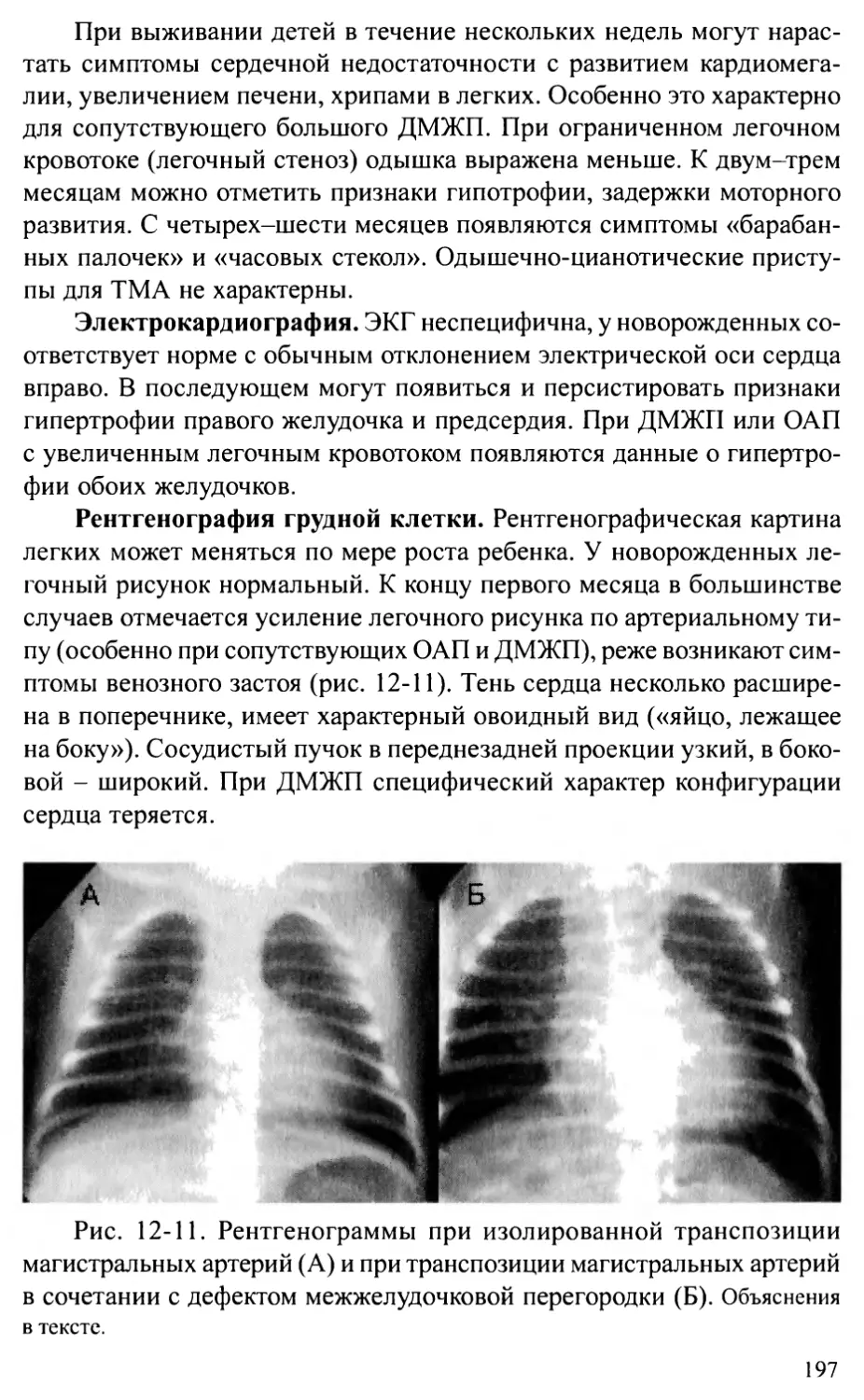
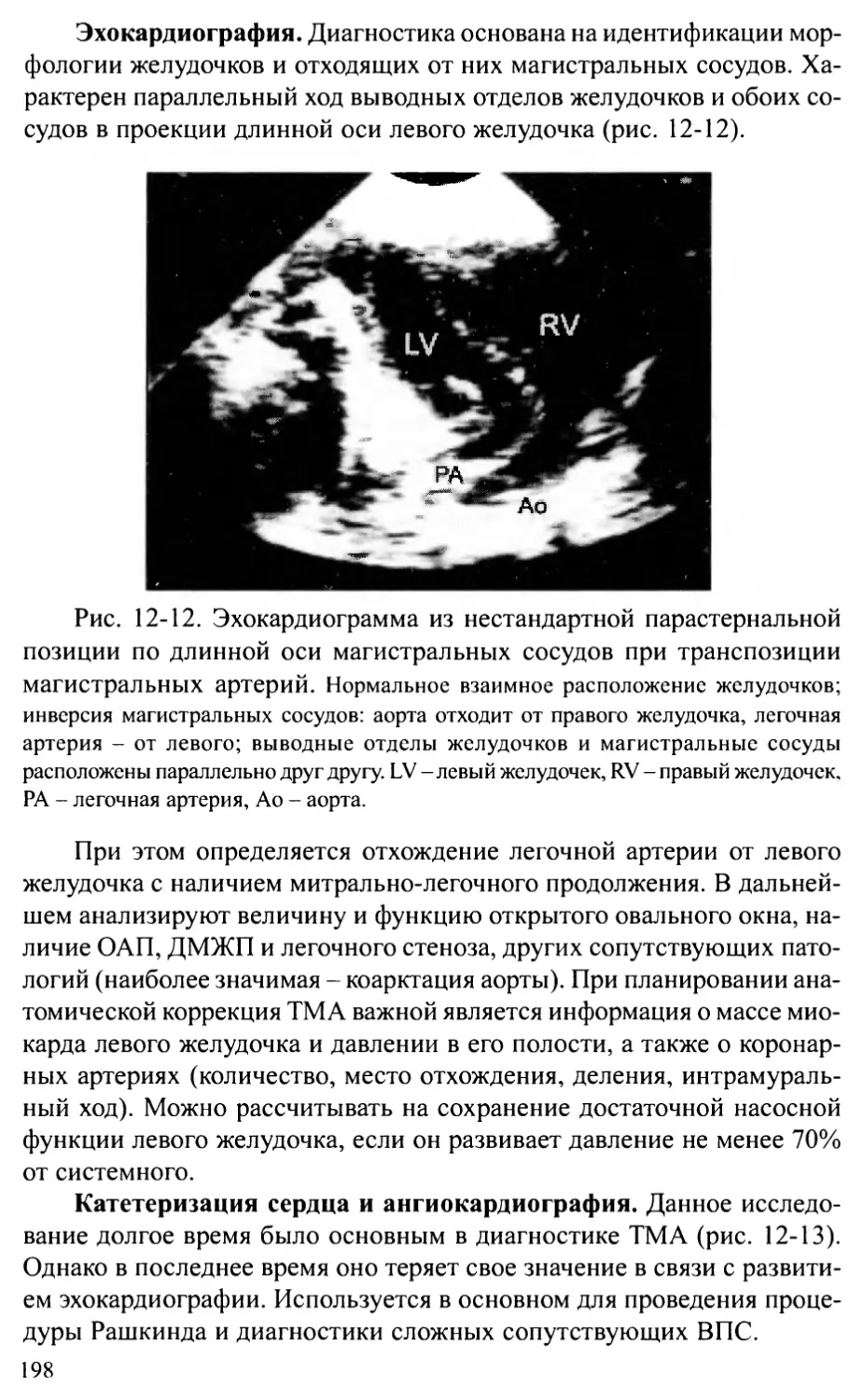
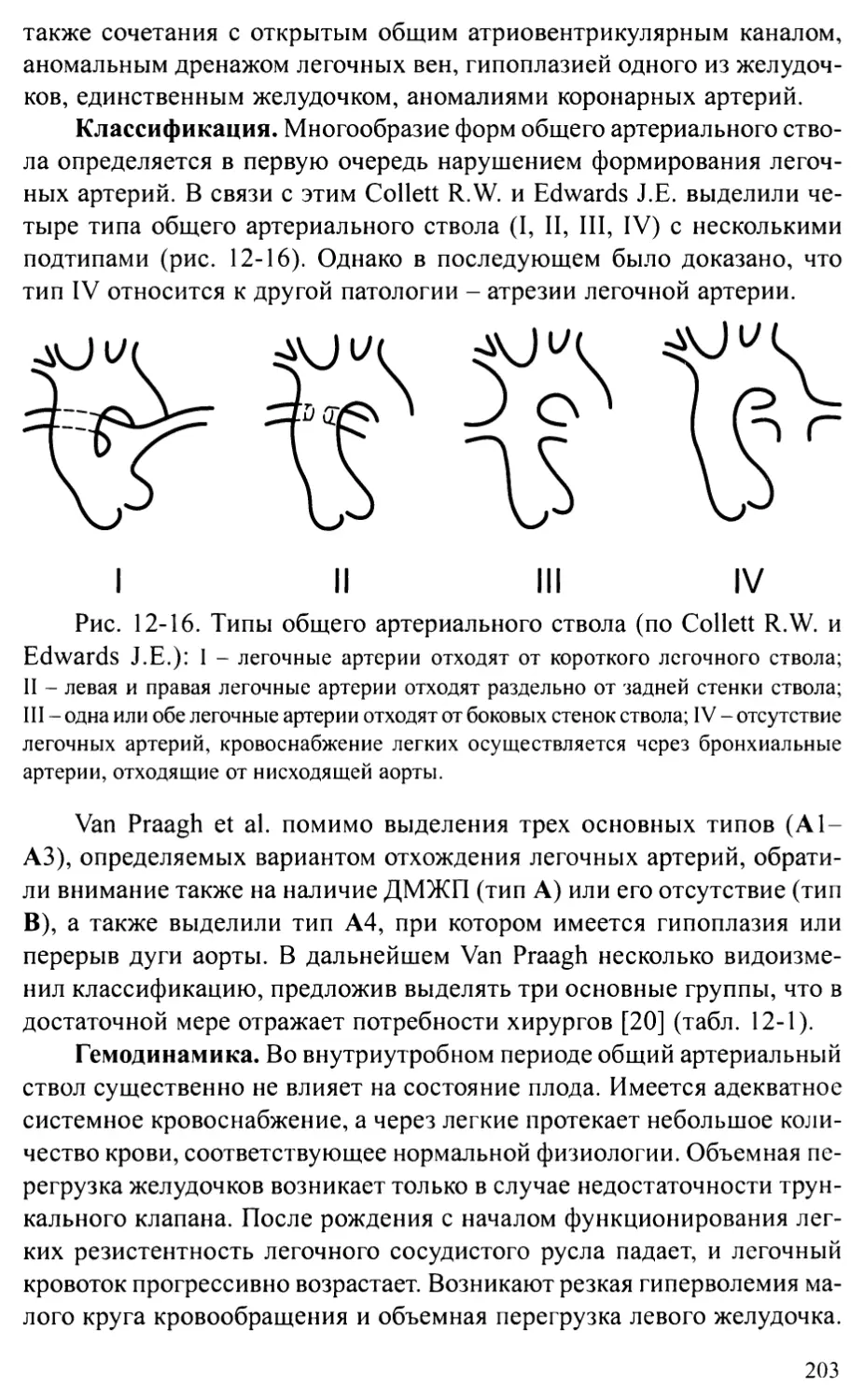
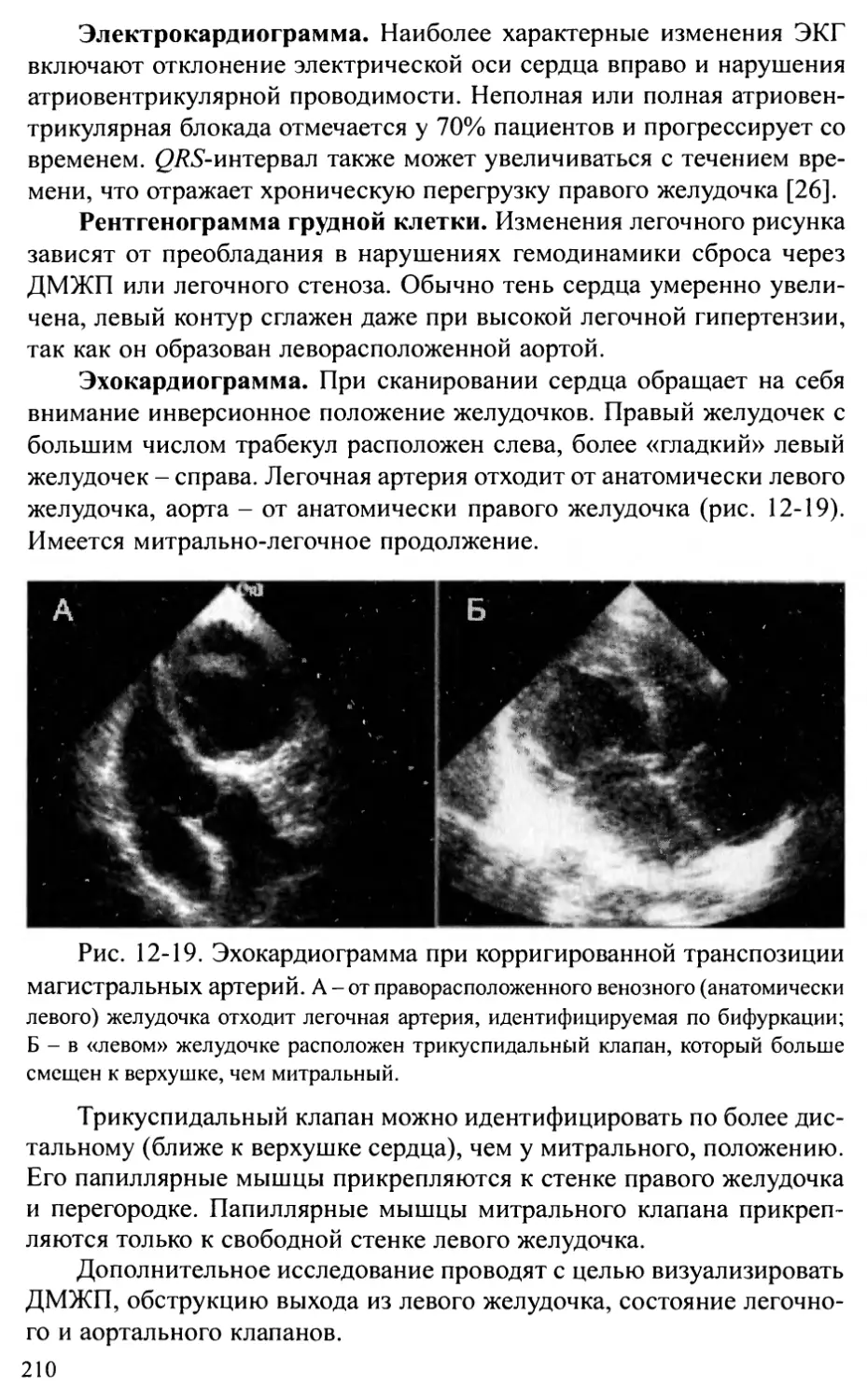
Общий артериальный ствол.................................202
Корригированная транспозиция магистральных артерий.......207
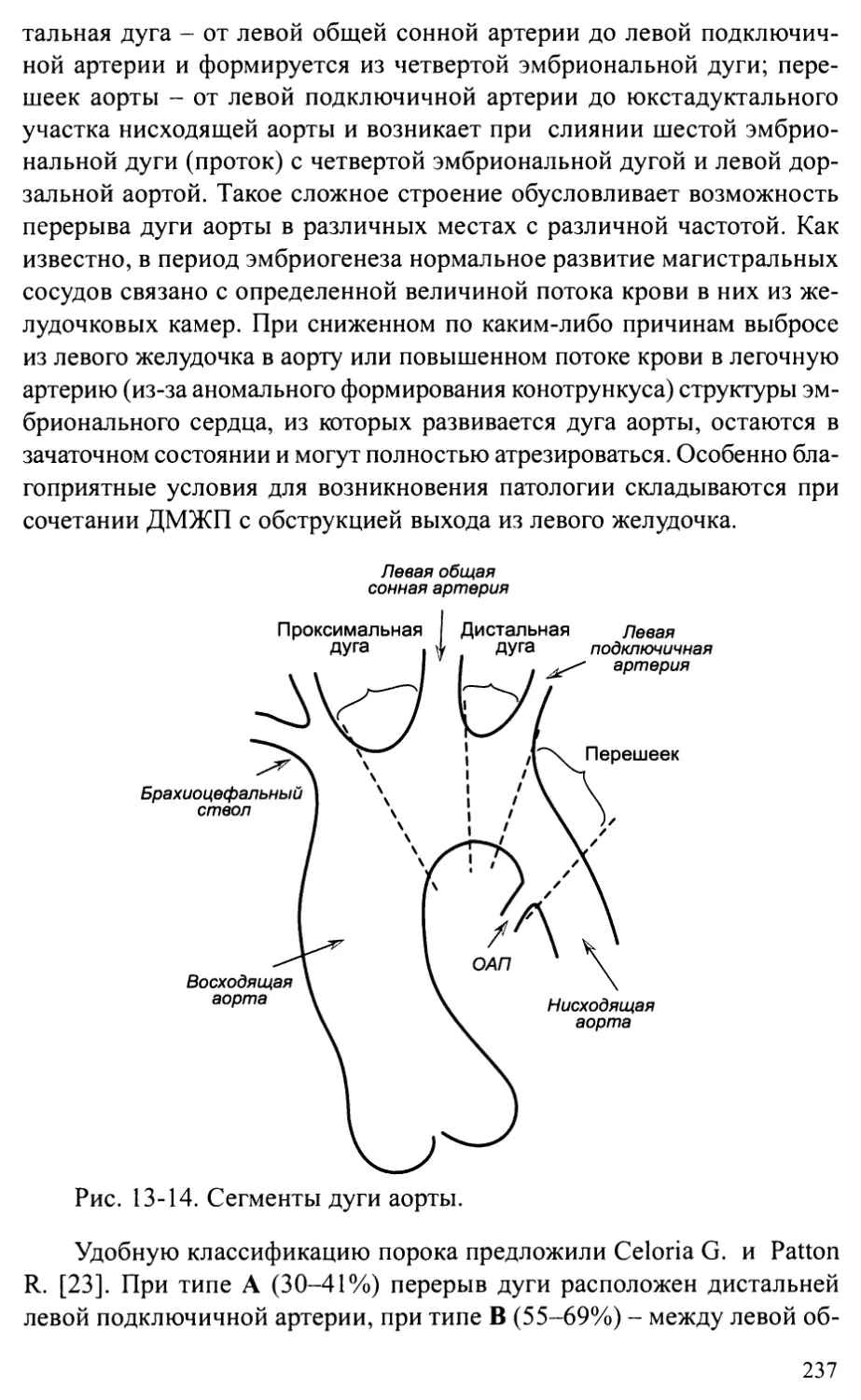
Глава 13. ПОРОКИ РАЗВИТИЯ АОРТЫ .....................................214
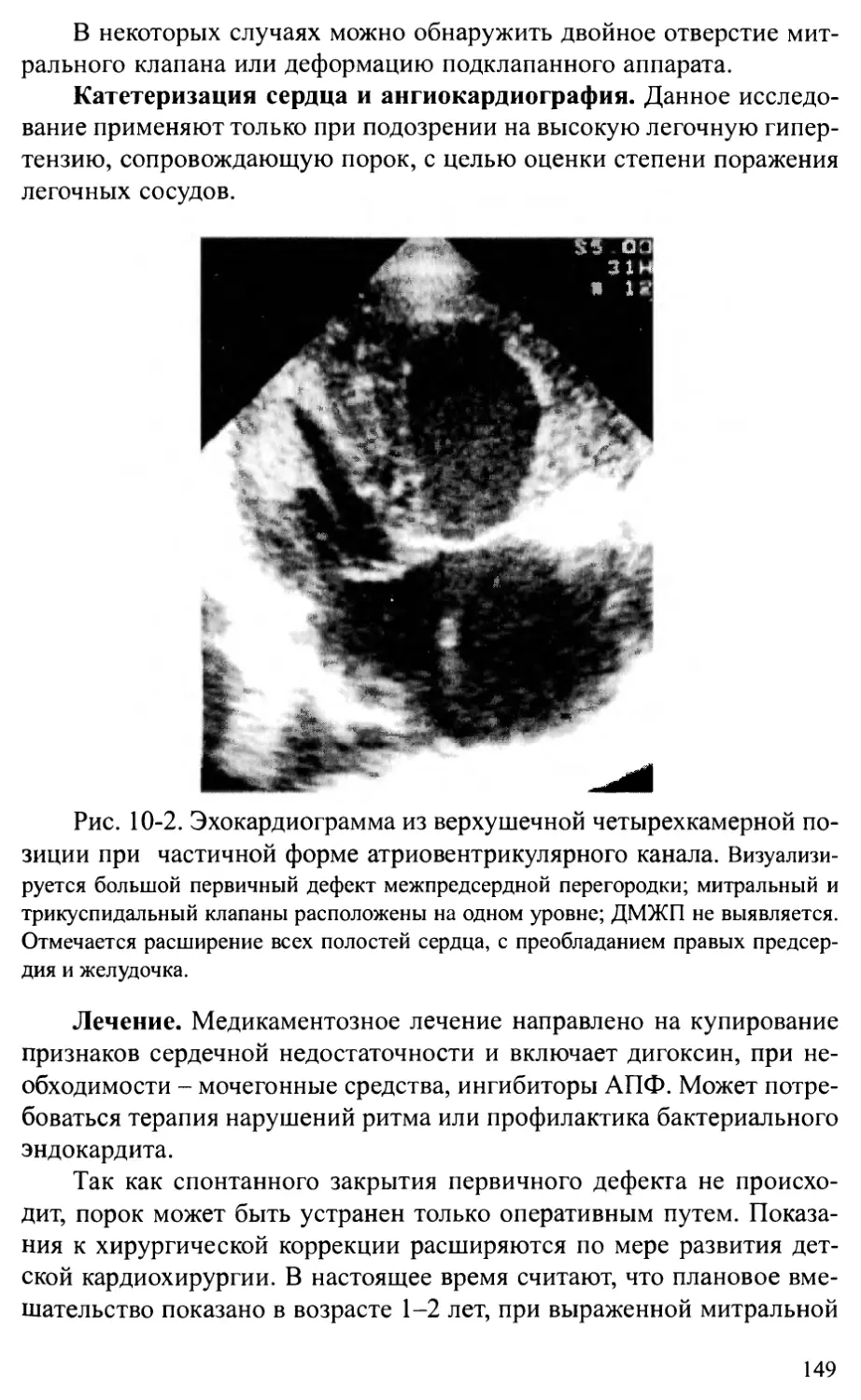
Стеноз аорты................................................2 14
Коарктация аорты ............................................224
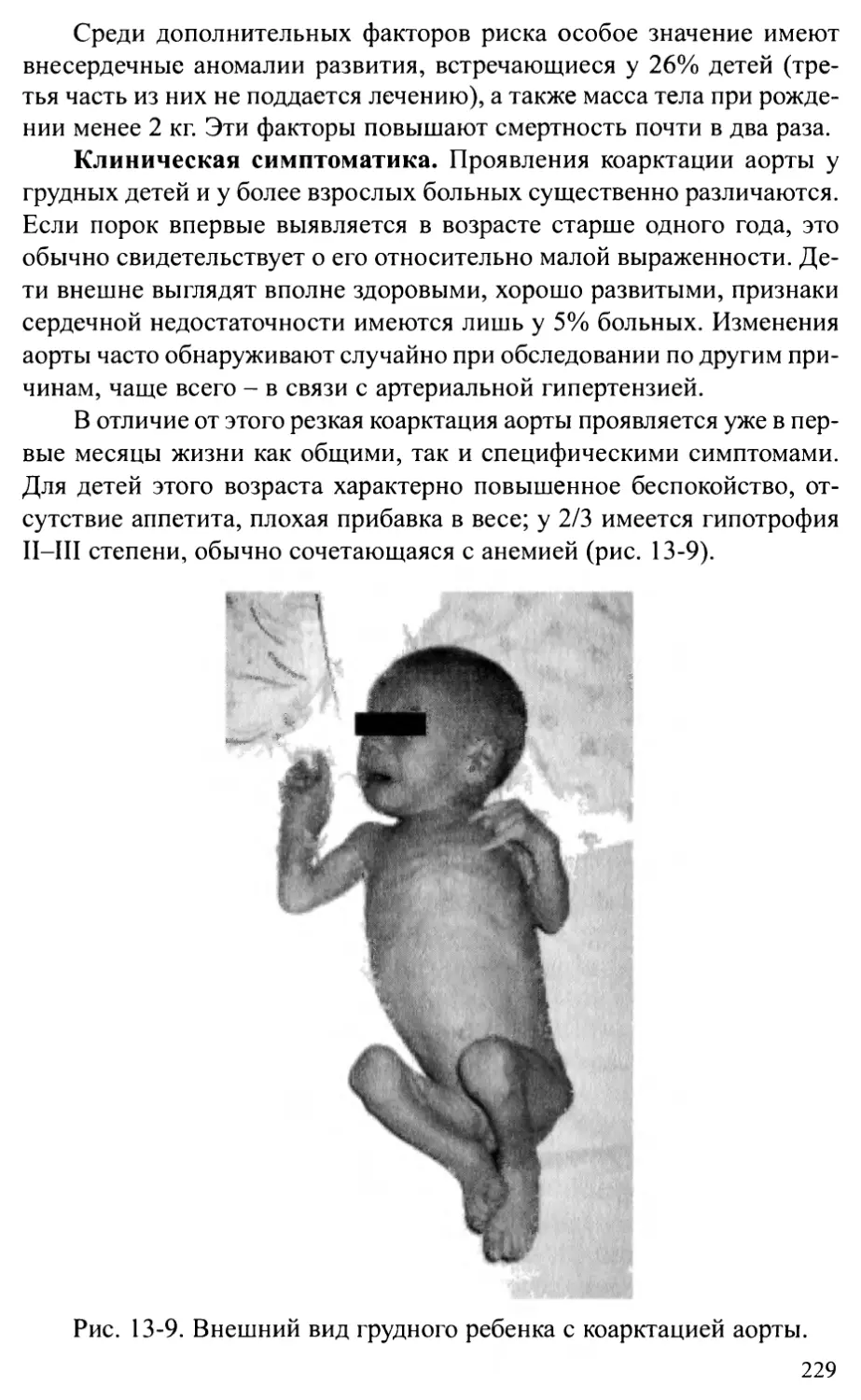
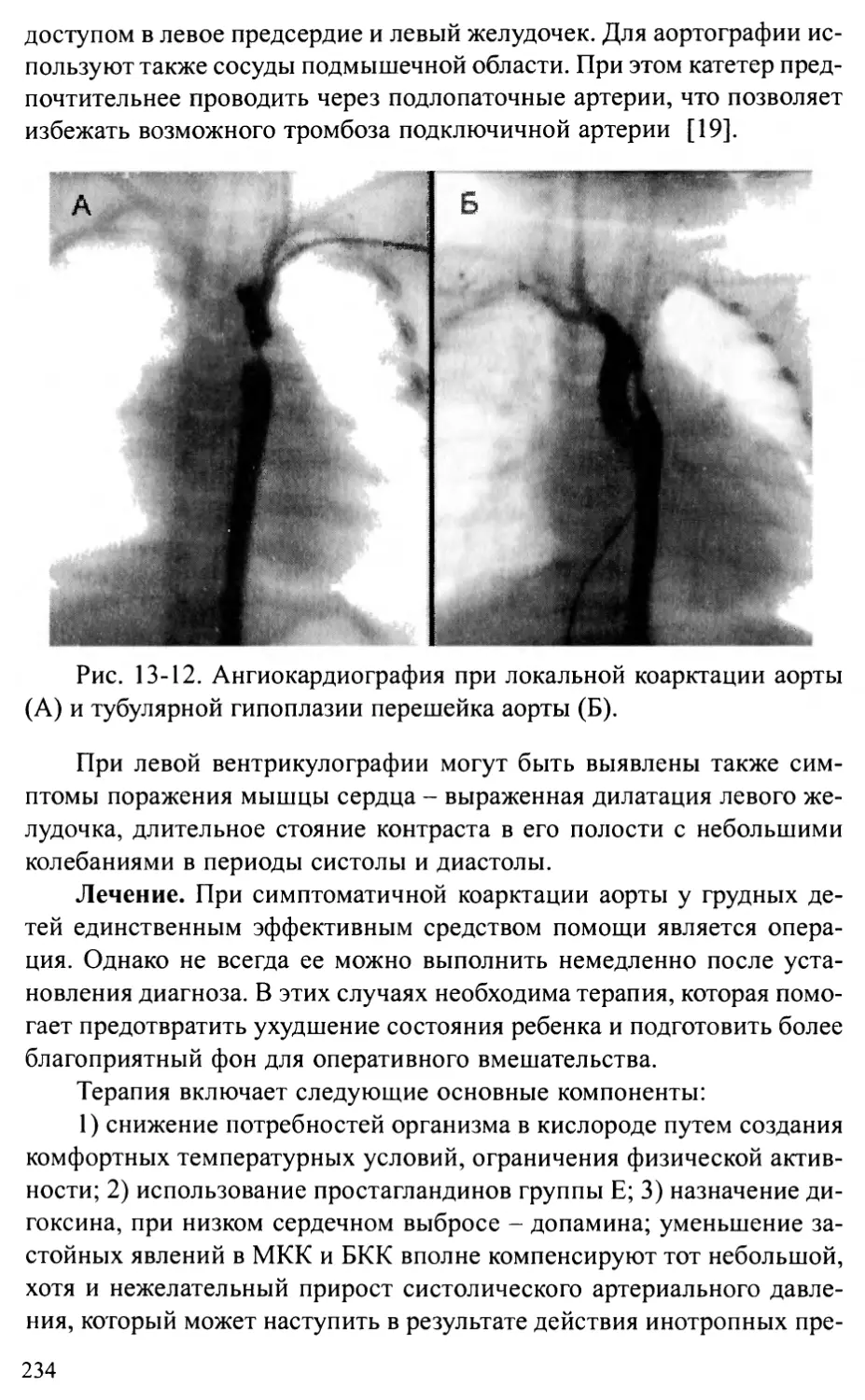
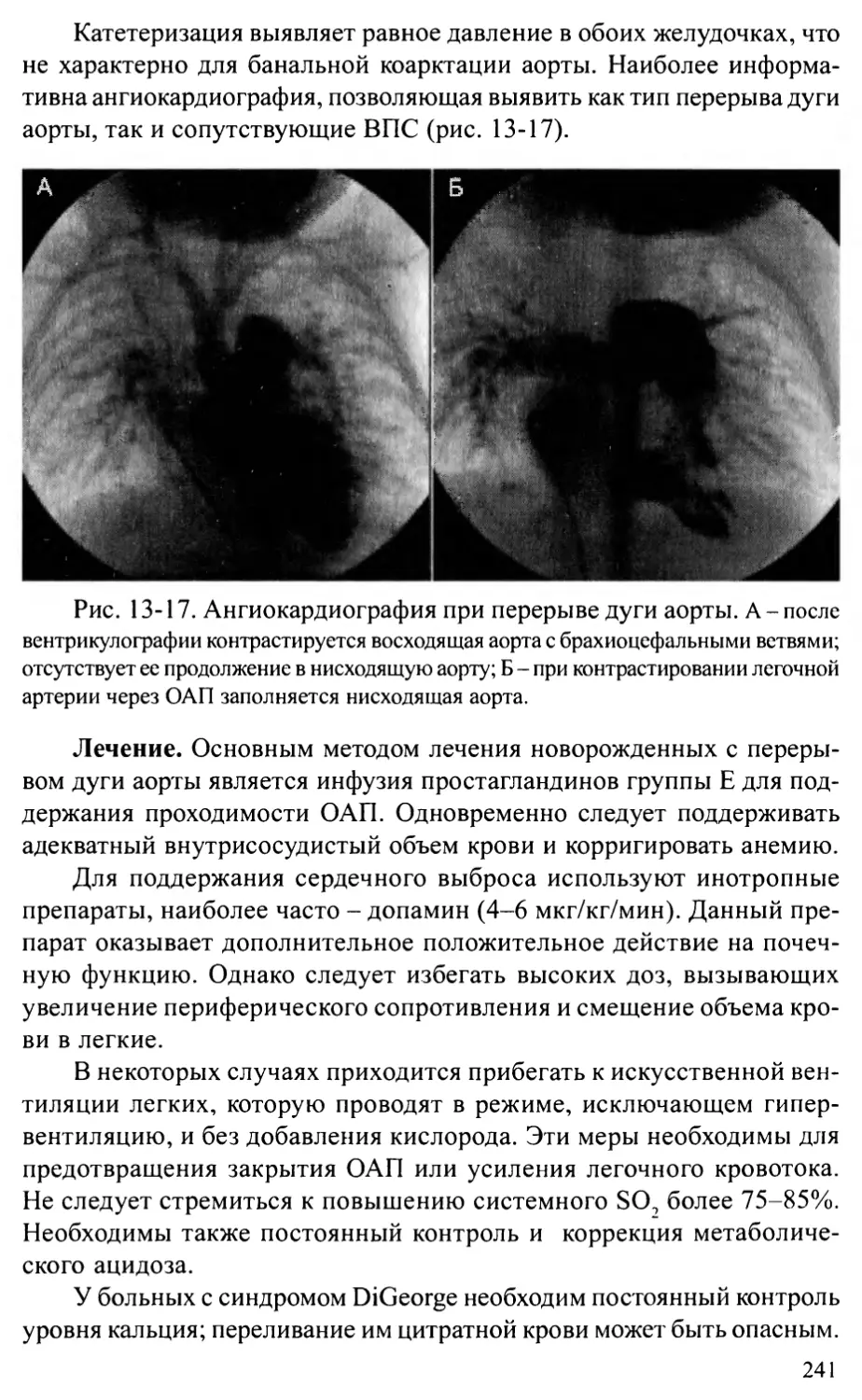
Перерыв дуги аорты...........................................236
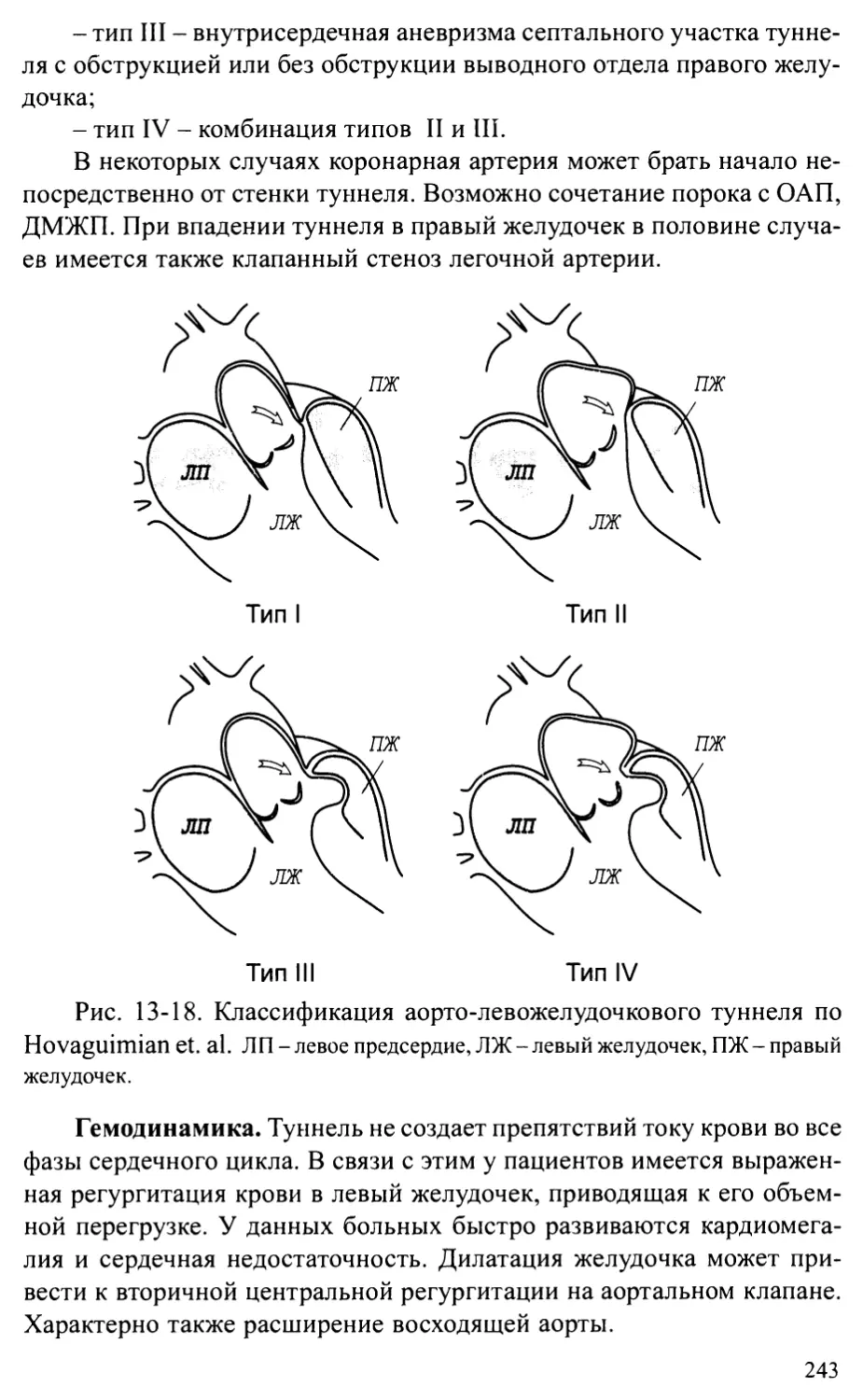
Аорто-желудочковый туннель...................................242
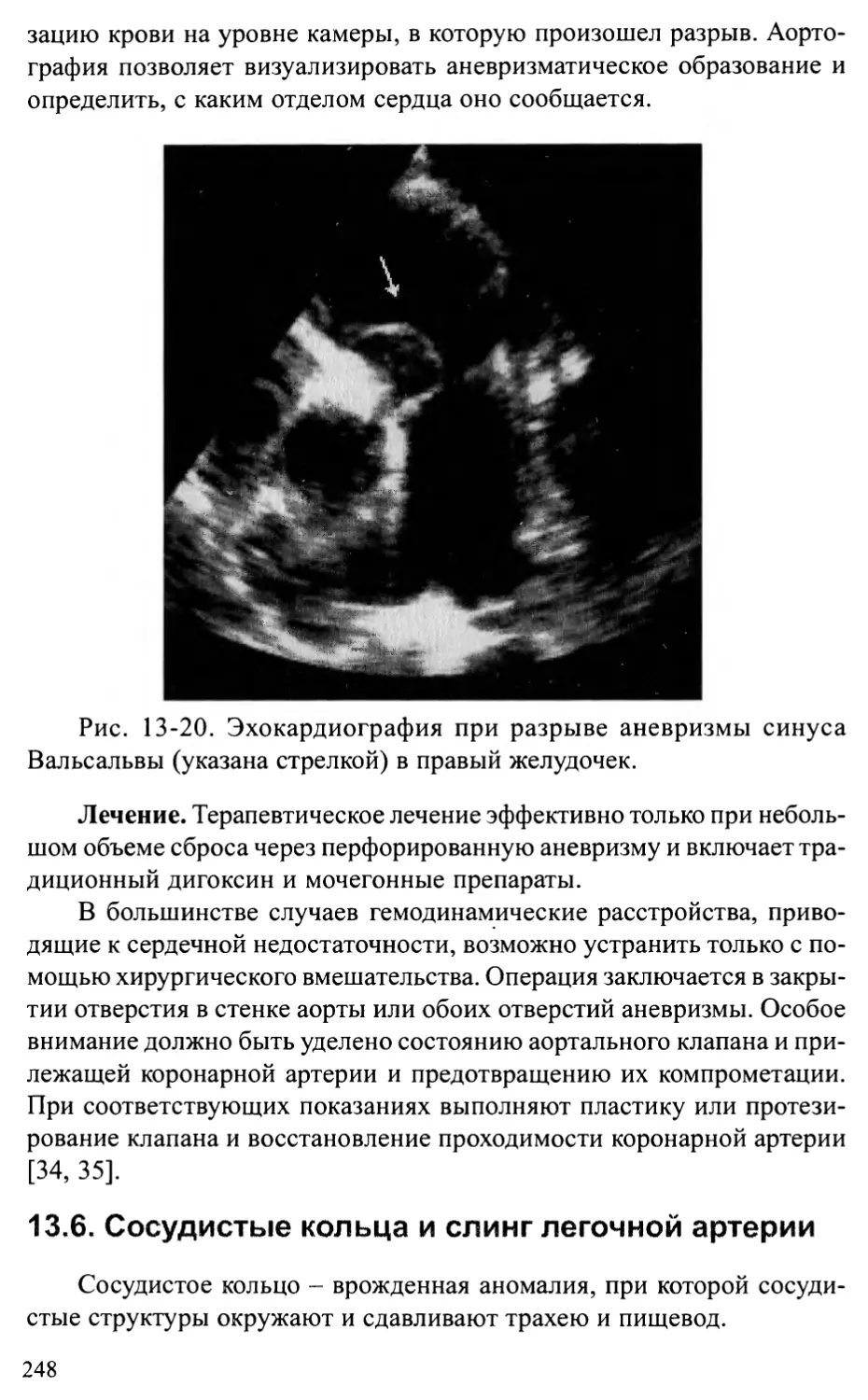
Врожденная аневризма синуса Вальсальвы.......................245
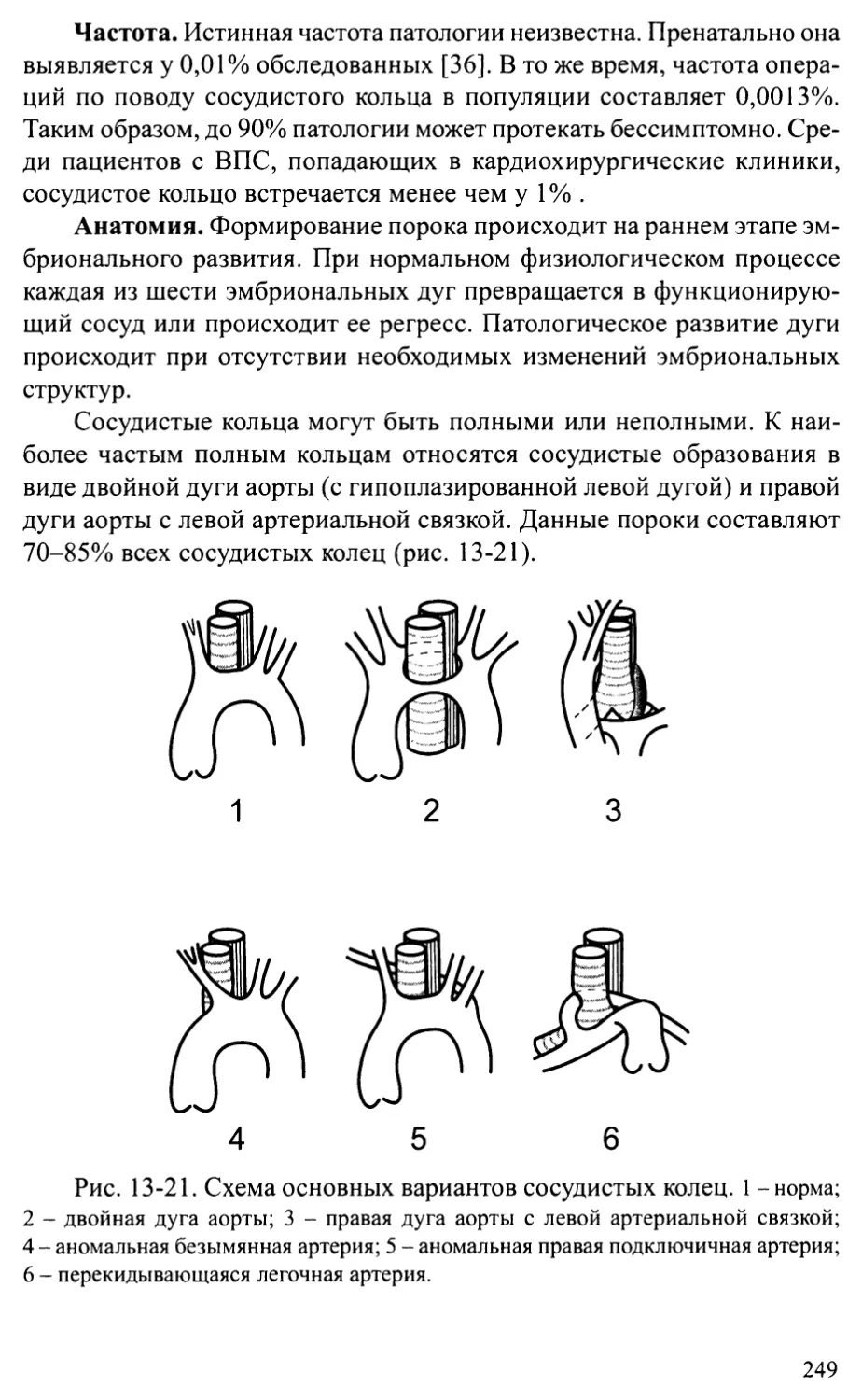
Сосудистые кольца и слинг легочной артерии...................248
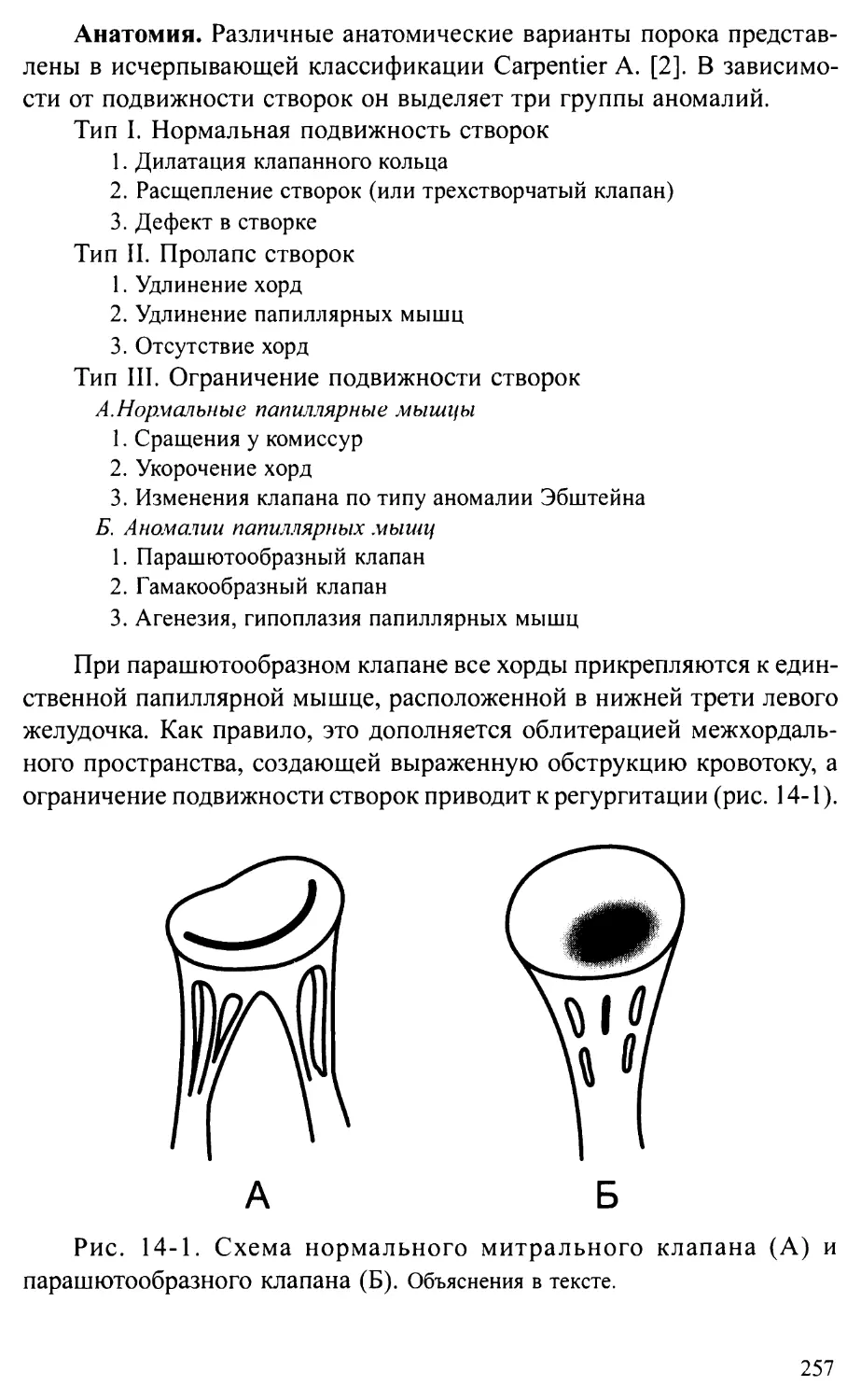
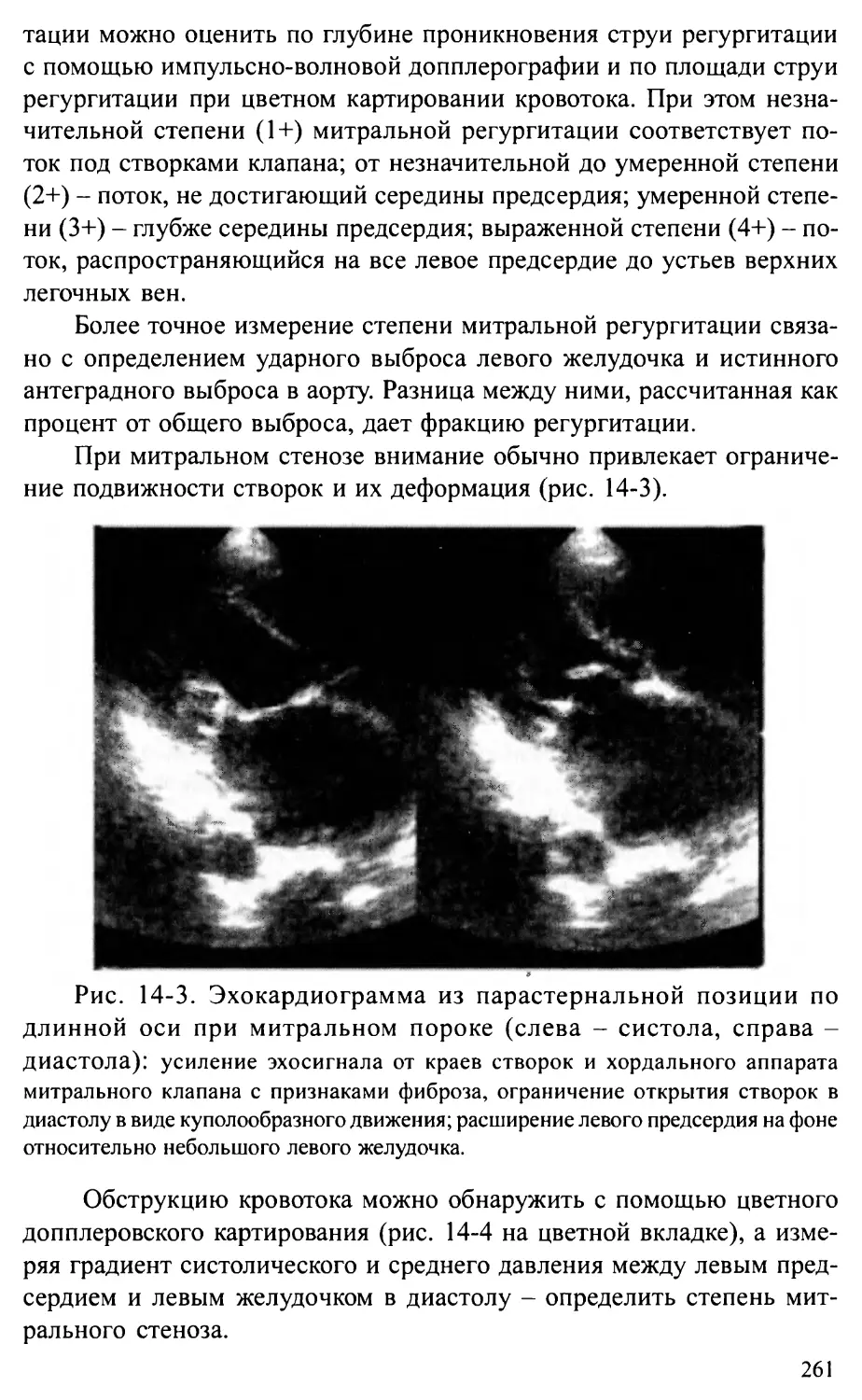
Глава 14. ВРОЖДЕННЫЕ АНОМАЛИИ МИТРАЛЬНОГО КЛАПАНА ...................256
Врожденные недостаточность и стеноз митрального клапана .....256
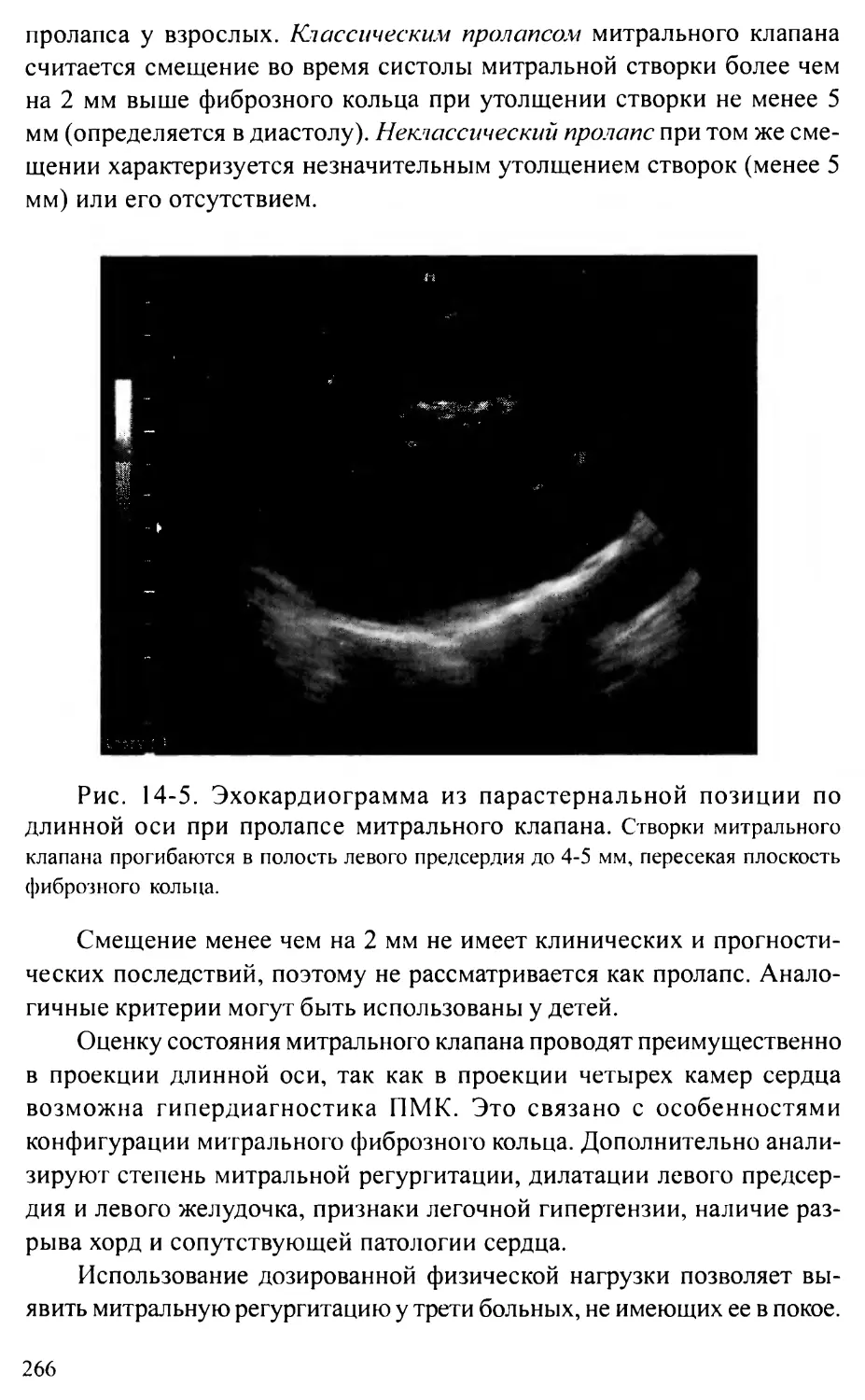
Пролапс митрального клапана..................................262
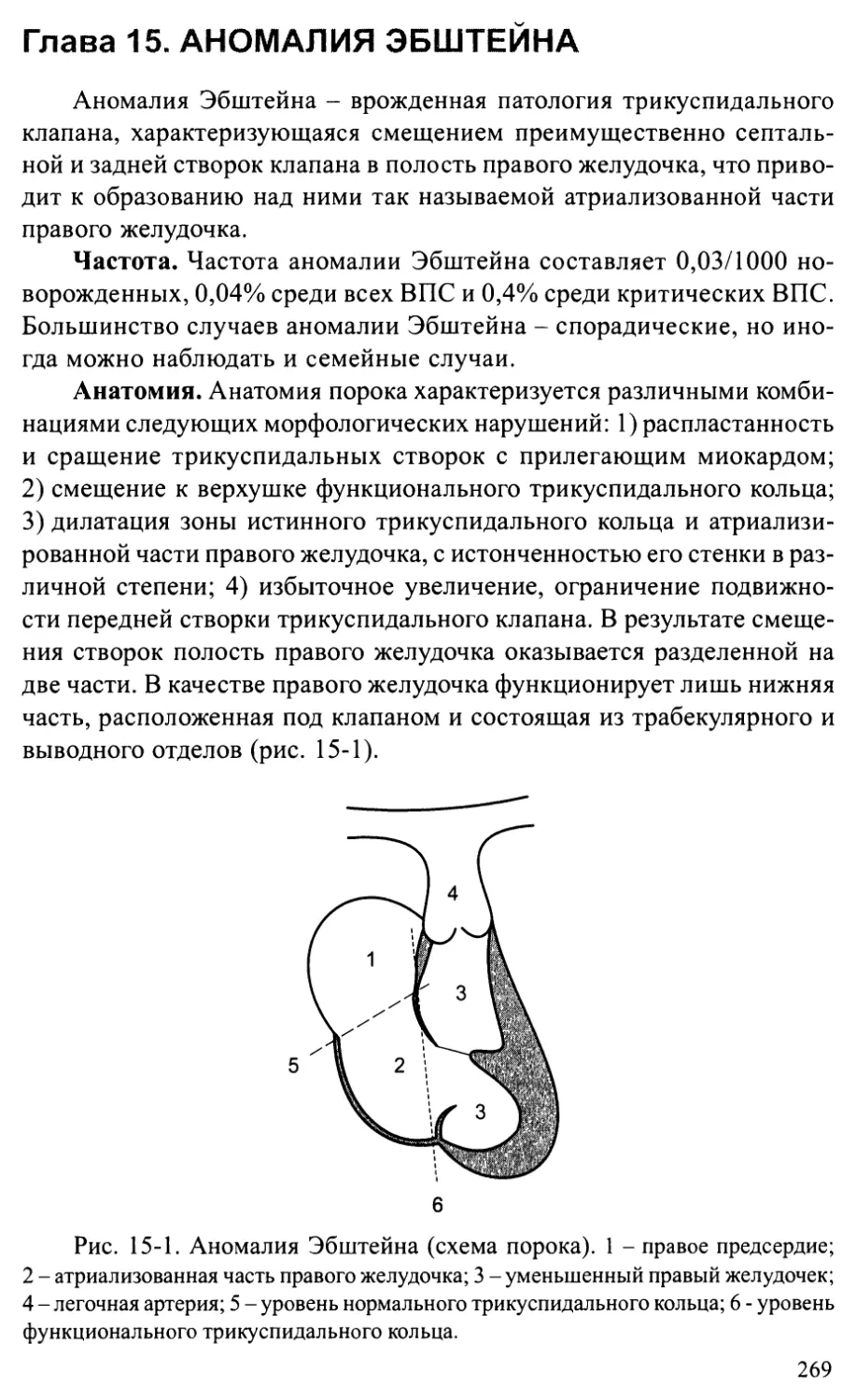
Глава 15. АНОМАЛИЯ ЭБШТЕЙНА..........................................269
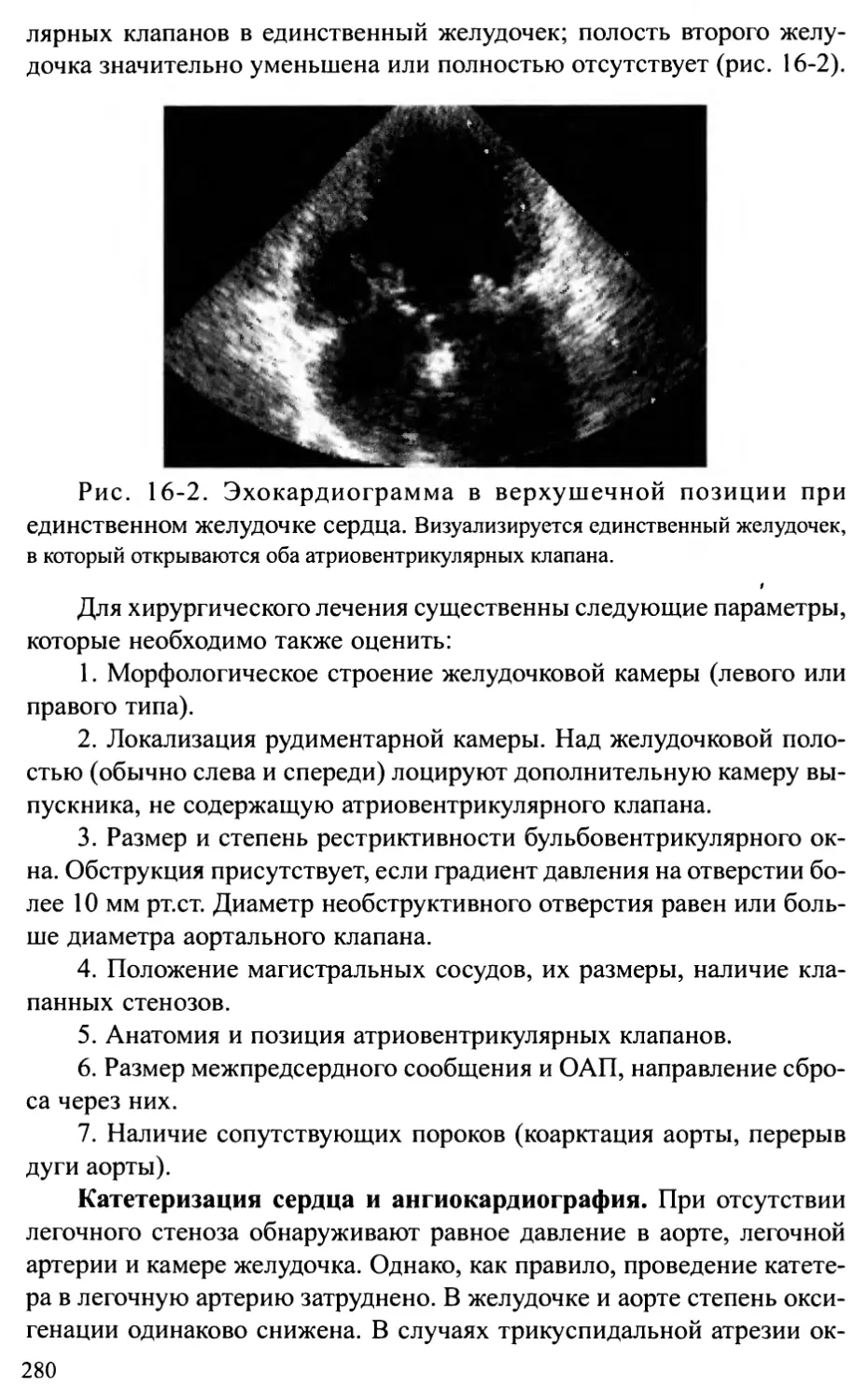
Глава 16. ЕДИНСТВЕННЫЙ ЖЕЛУДОЧЕК И АТРЕЗИЯ
ТРИКУСПИДАЛЬНОГО КЛАПАНА...........................................275
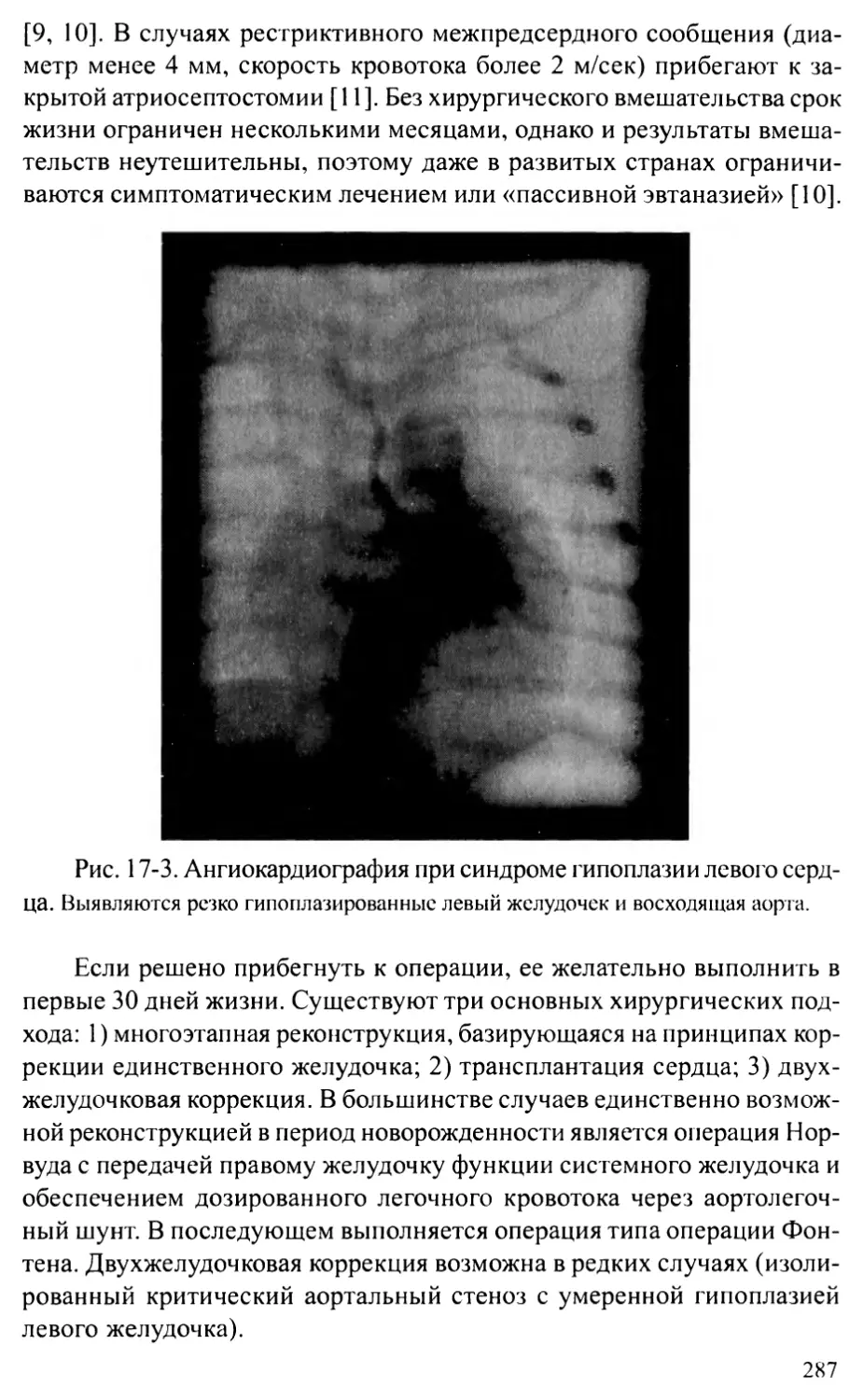
Глава 17. СИНДРОМ ГИПОПЛАЗИИ ЛЕВОГО СЕРДЦА...........................283
Глава 18. АНОМАЛИИ КОРОНАРНЫХ АРТЕРИЙ................................289
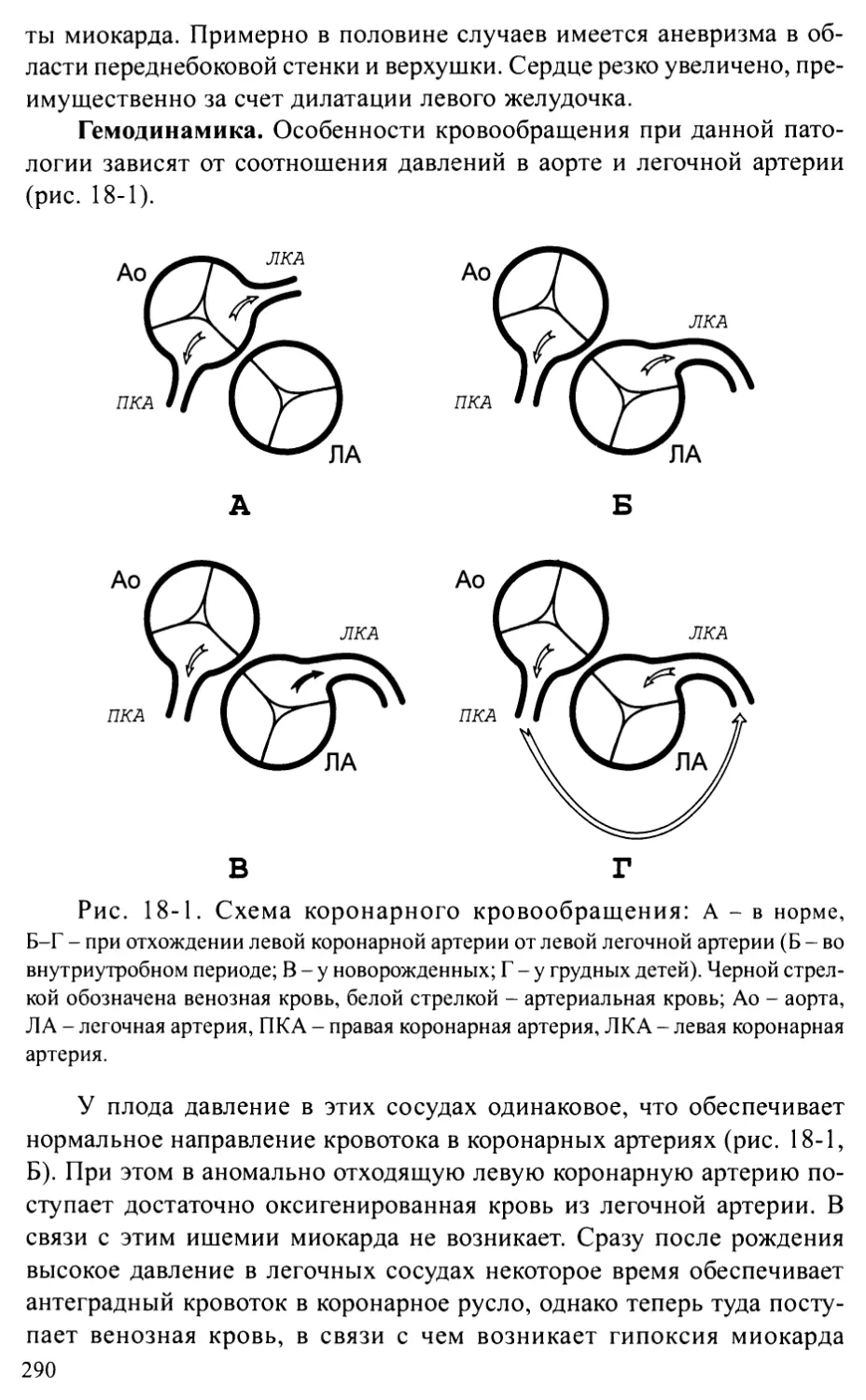
Аномальное отхождение коронарной артерии от легочной артерии.289
Коронарные фистулы...........................................294
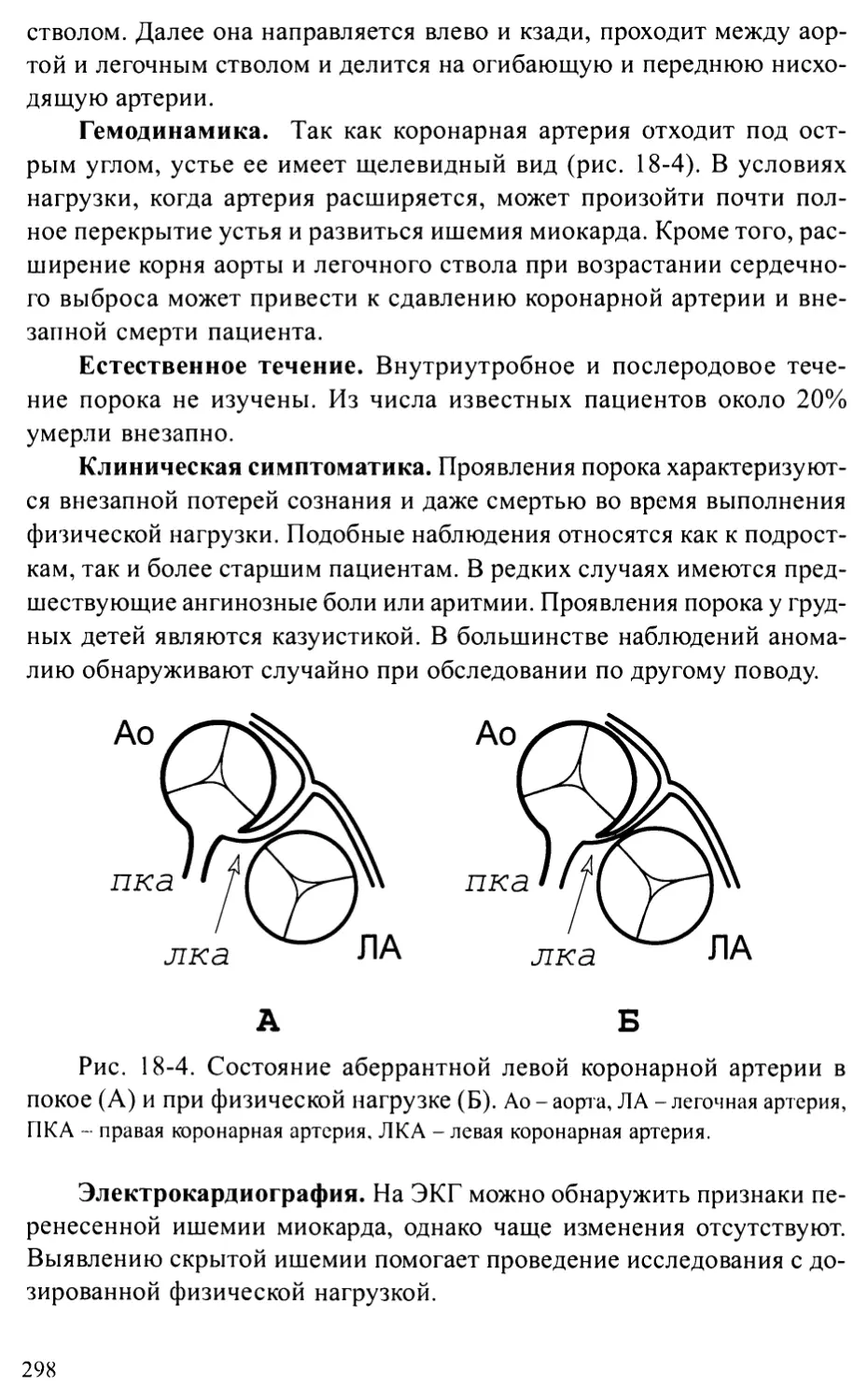
Аберрантная левая коронарная артерия.........................297
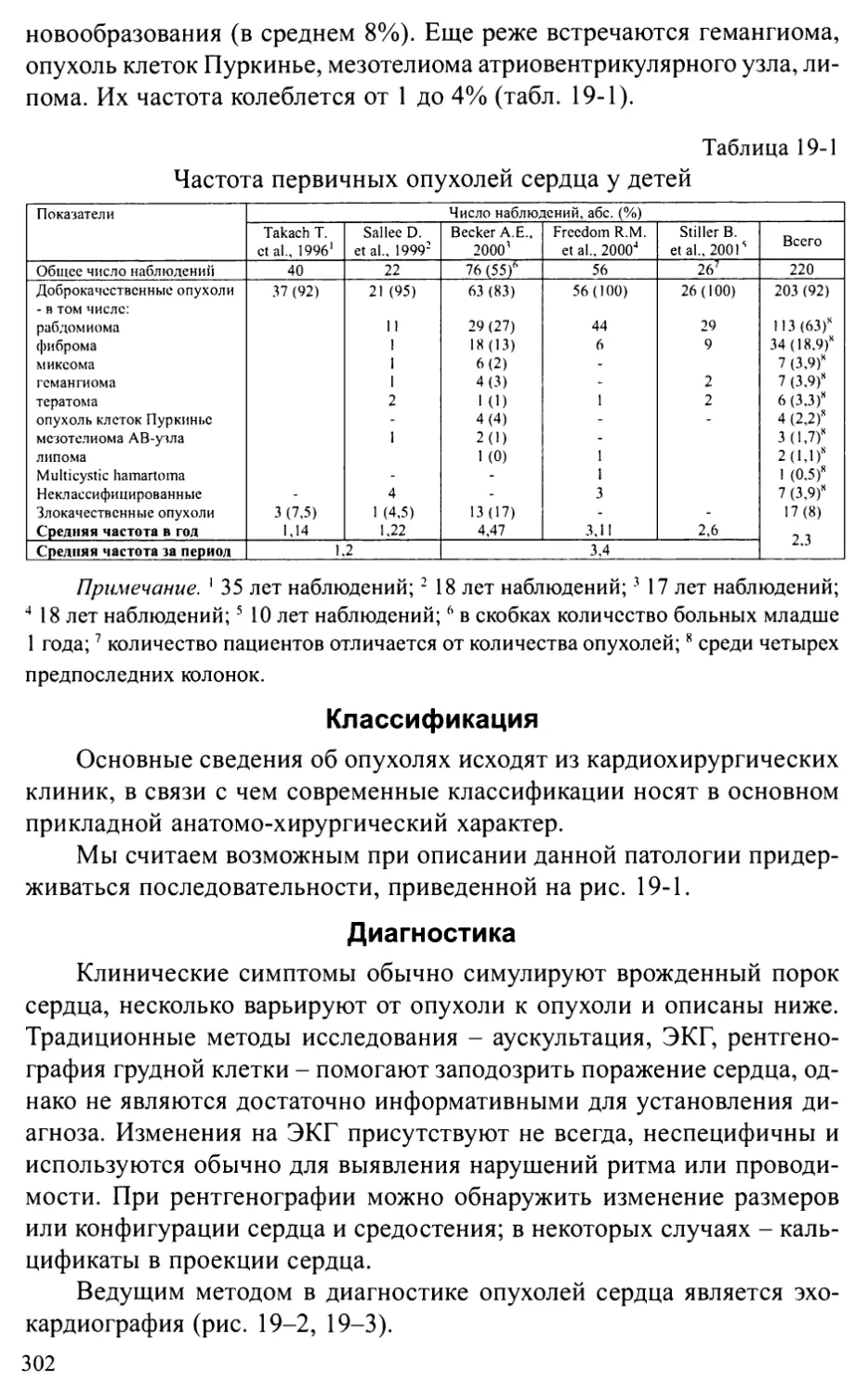
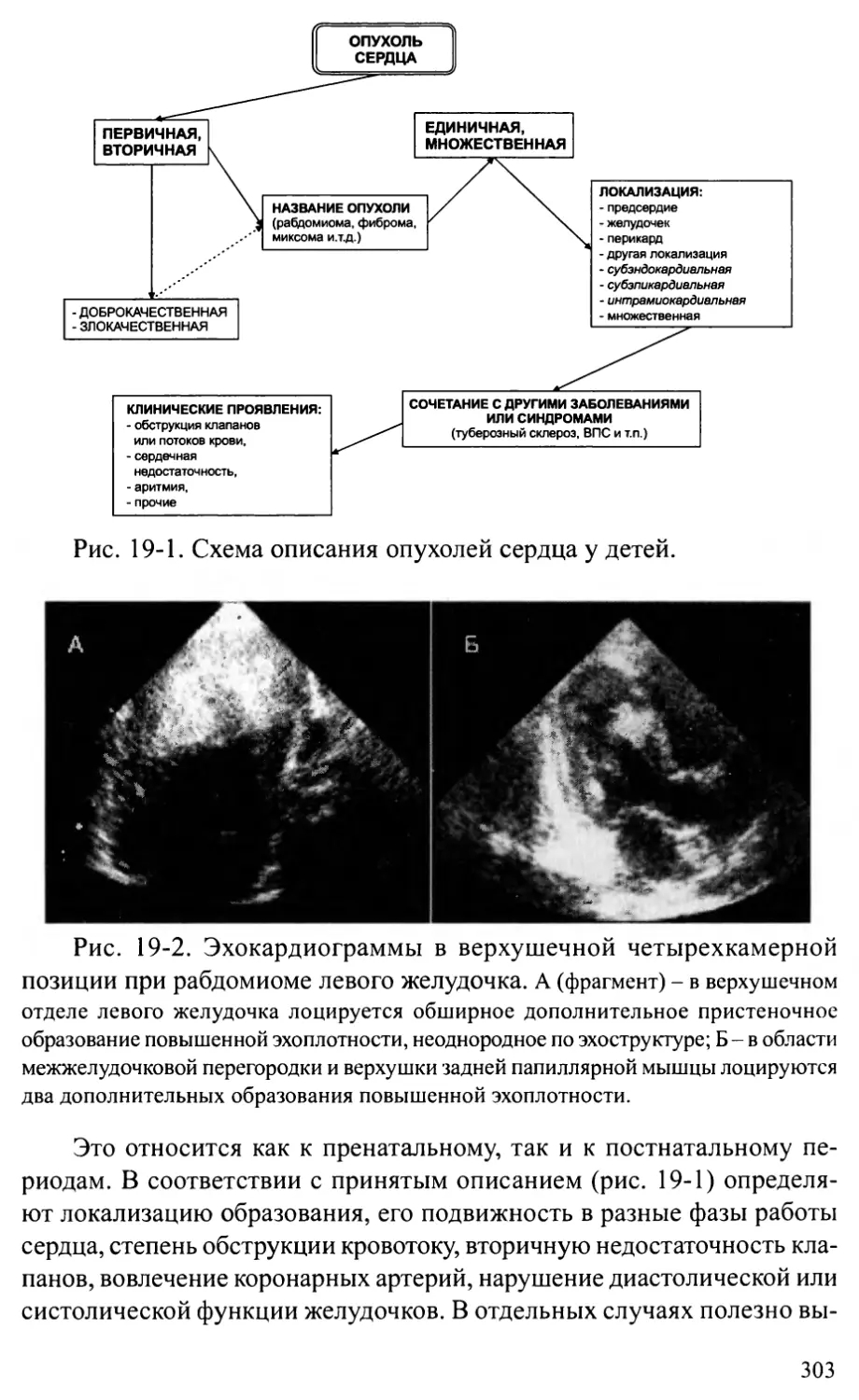
Глава 19. ОПУХОЛИ СЕРДЦА ............................................301
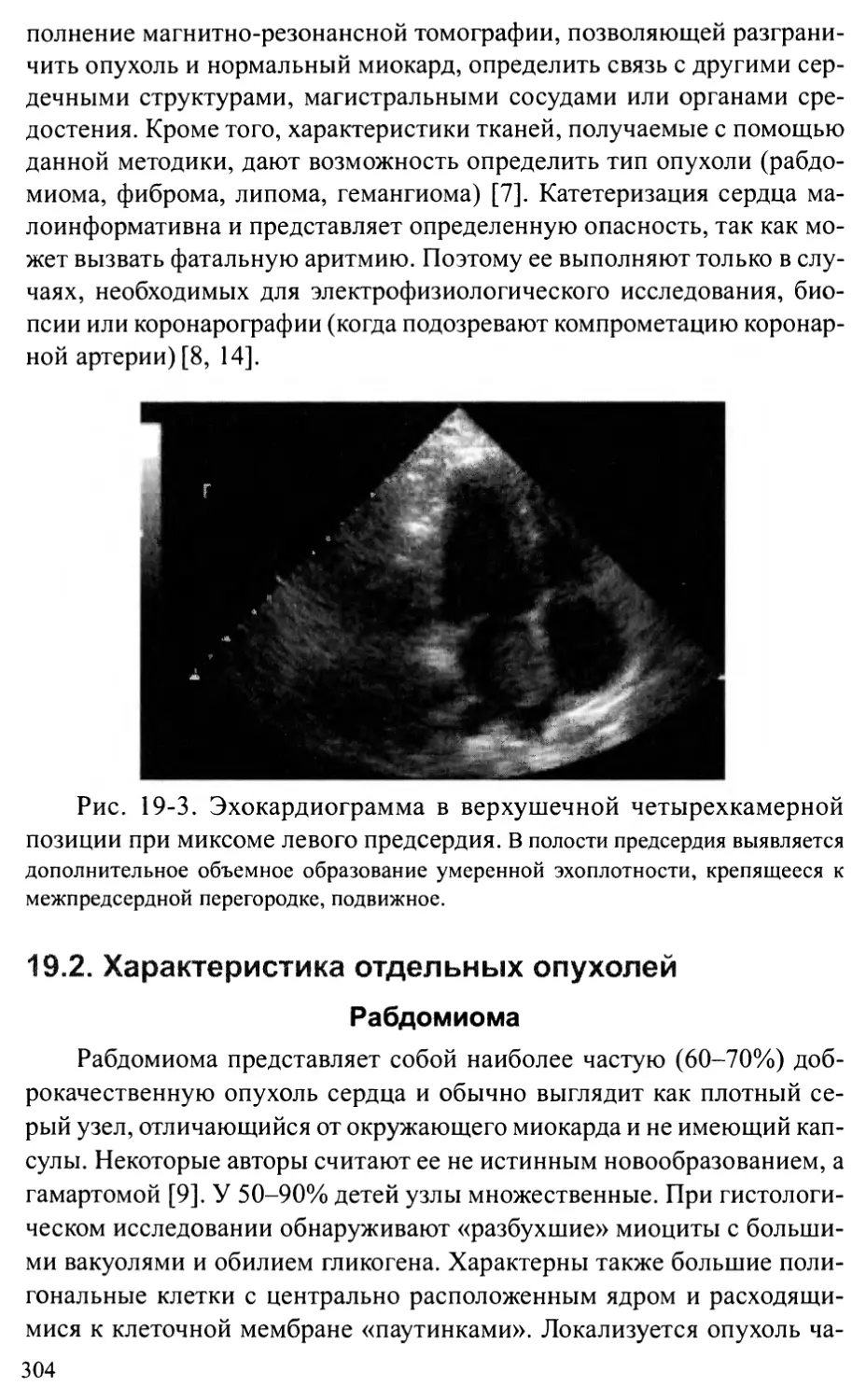
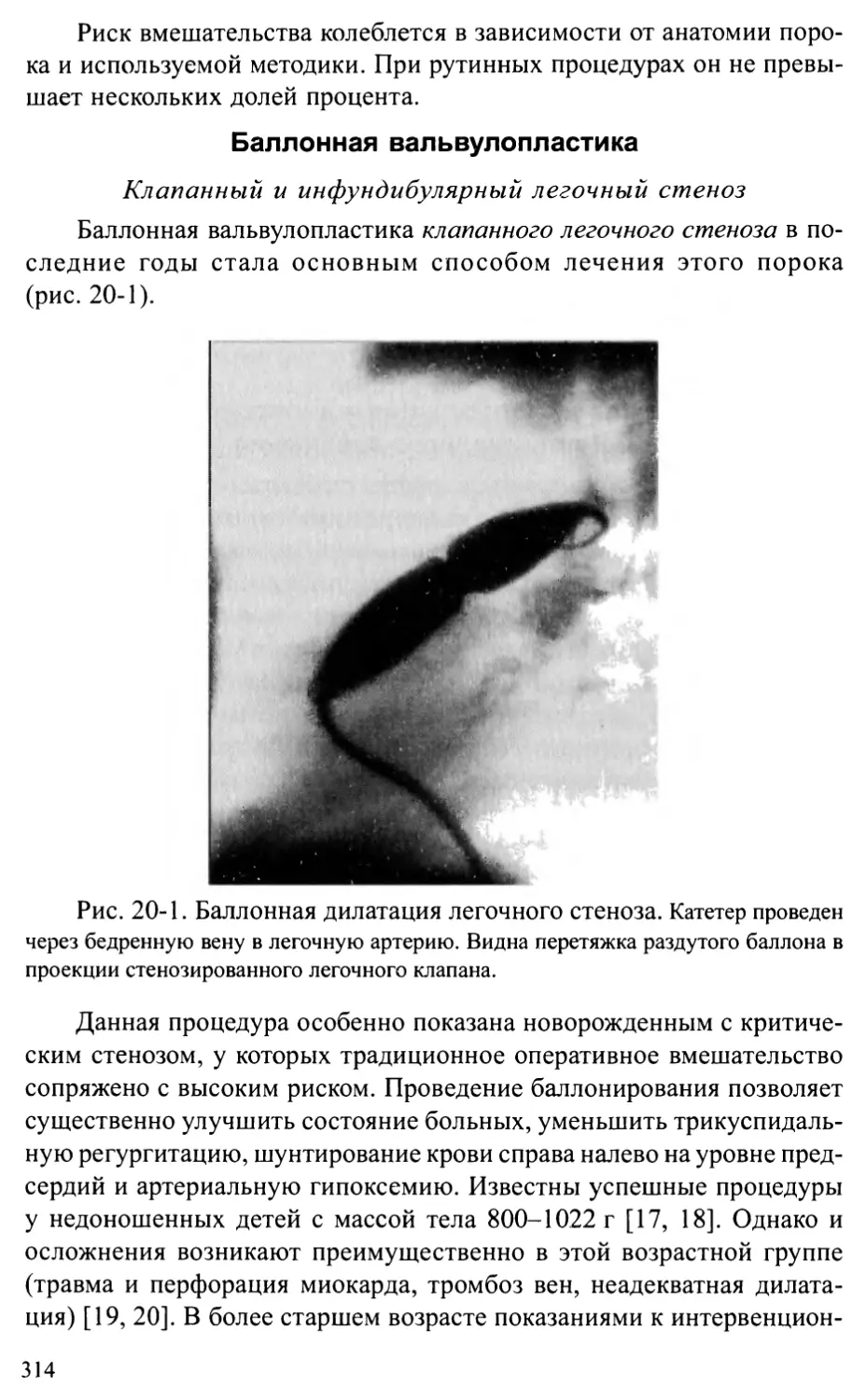
Общие положения .............................................301
Характеристика отдельных опухолей............................304
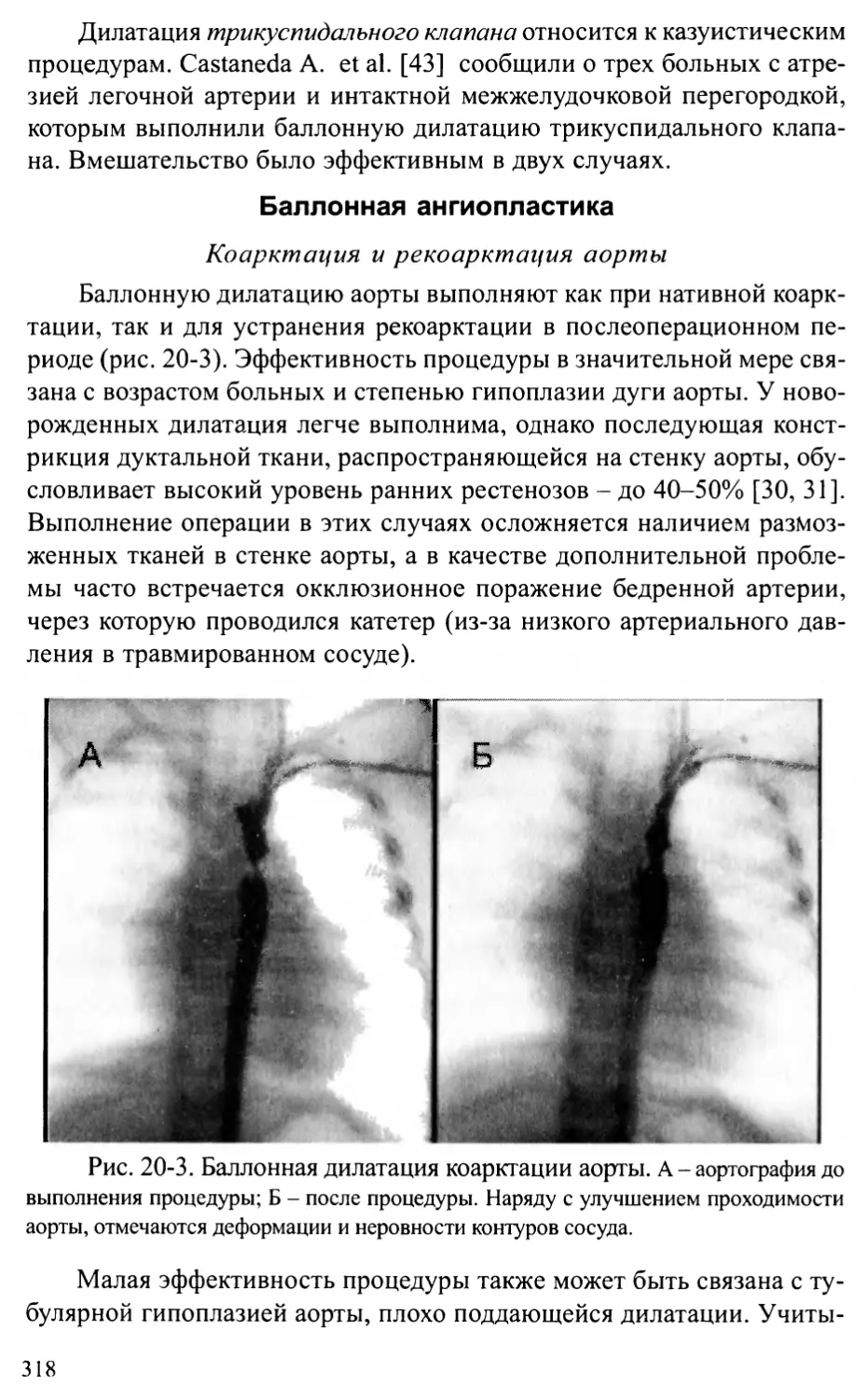
Глава 20. ИНТЕРВЕНЦИОННЫЕ ПРОЦЕДУРЫ
ПРИ ВРОЖДЕННЫХ ПОРОКАХ СЕРДЦА И СОСУДОВ............................311
Общие положения ............................................311
Частные процедуры............................................313
Глава 21. СОЧЕТАНИЕ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА
С НАСЛЕДСТВЕННЫМИ ЗАБОЛЕВАНИЯМИ......................................329
Беременность и периоды опасности.............................329
Причины нарушения развития плода.............................330
Диагностика наследственных заболеваний.......................333
Особенности пациентов с синдромальными формами
врожденных пороков сердца....................................333
Глава 22. ОСОБЕННОСТИ НАБЛЮДЕНИЯ ЗА БОЛЬНЫМИ,
ОПЕРИРОВАННЫМИ ПО ПОВОДУ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА ....341
Глава 23. ПРОБЛЕМЫ ДЛИТЕЛЬНОГО ВЫЖИВАНИЯ ПАЦИЕНТОВ
С ВРОЖДЕННЫМИ ПОРОКАМИ СЕРДЦА......................................355
Основные группы пациентов с ВПС..............................355
Остаточные проблемы после коррекции ВПС......................357
Последствия операций.........................................359
Организация специальных центров для оказания помощи взрослым
с врожденными пороками сердца................................362
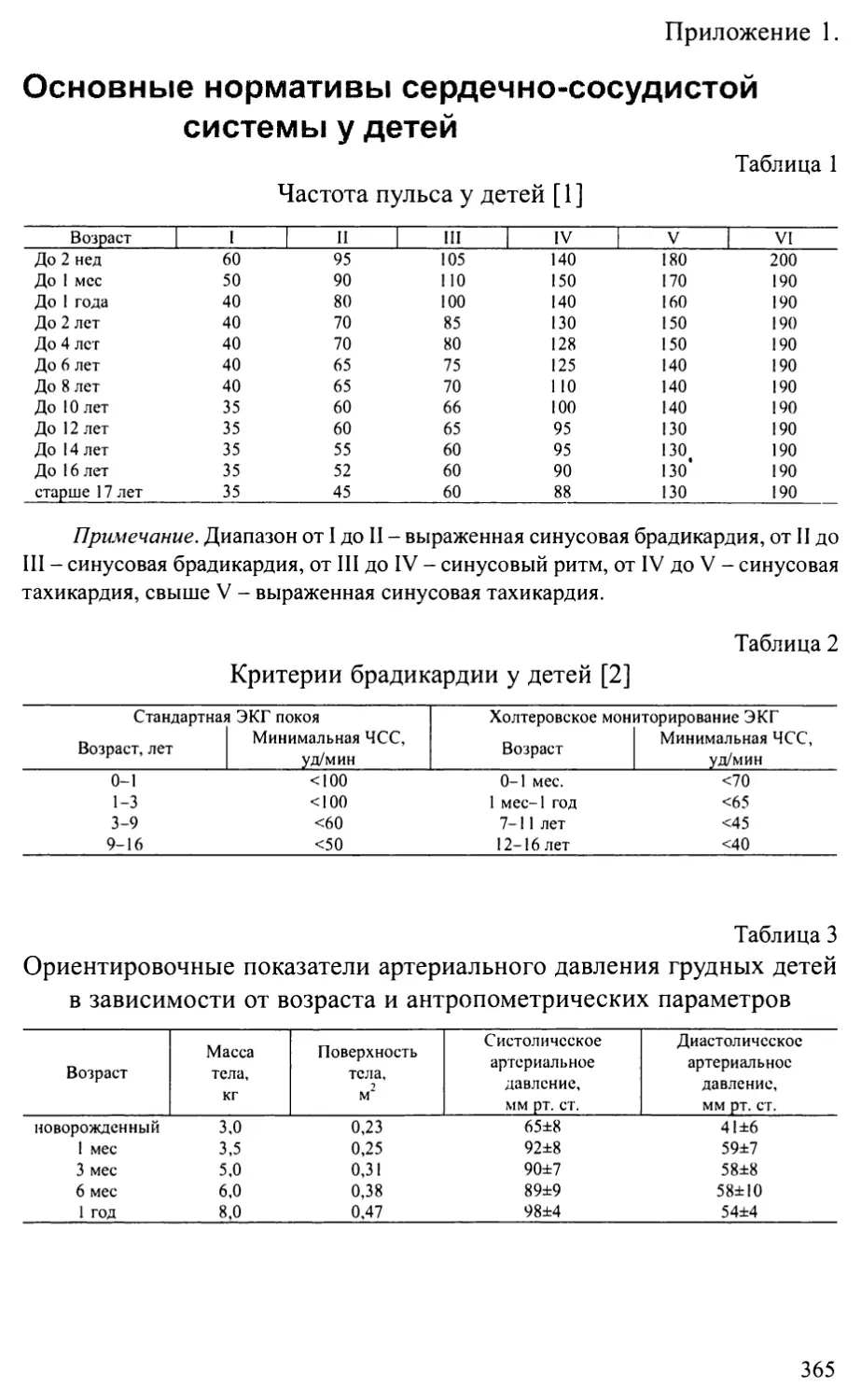
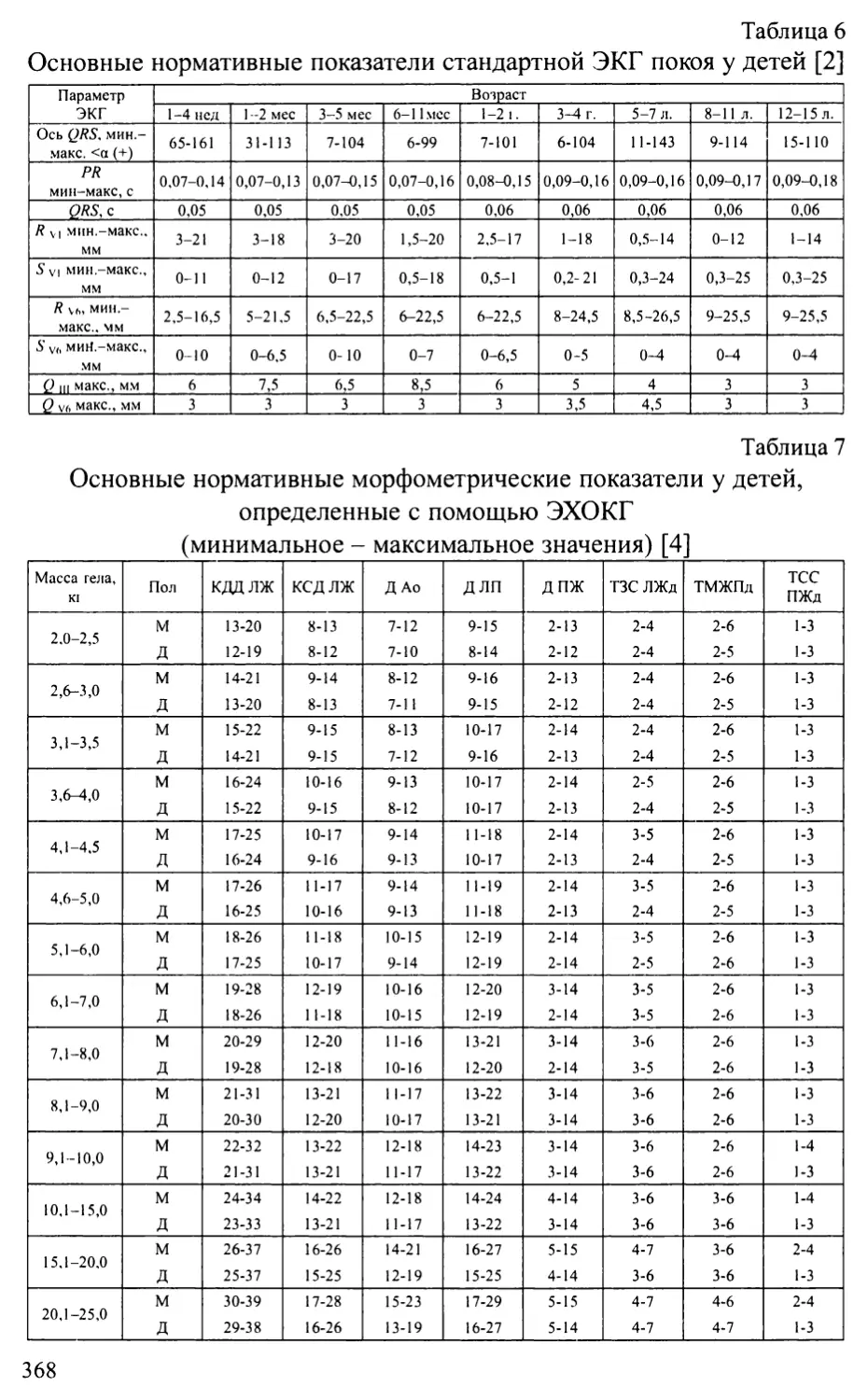
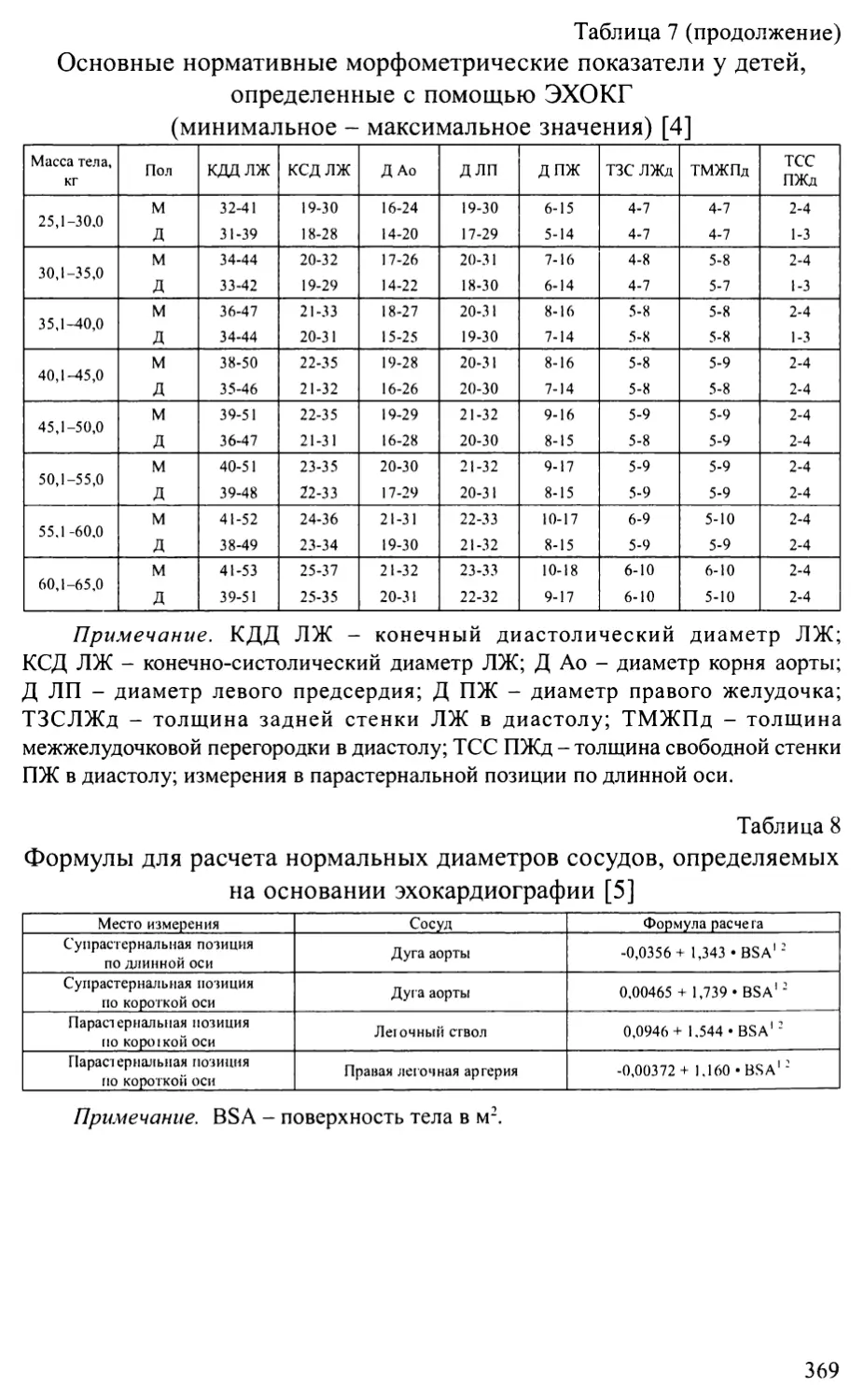
Приложение 1. Основные нормативы сердечно-сосудистой системы у детей.365
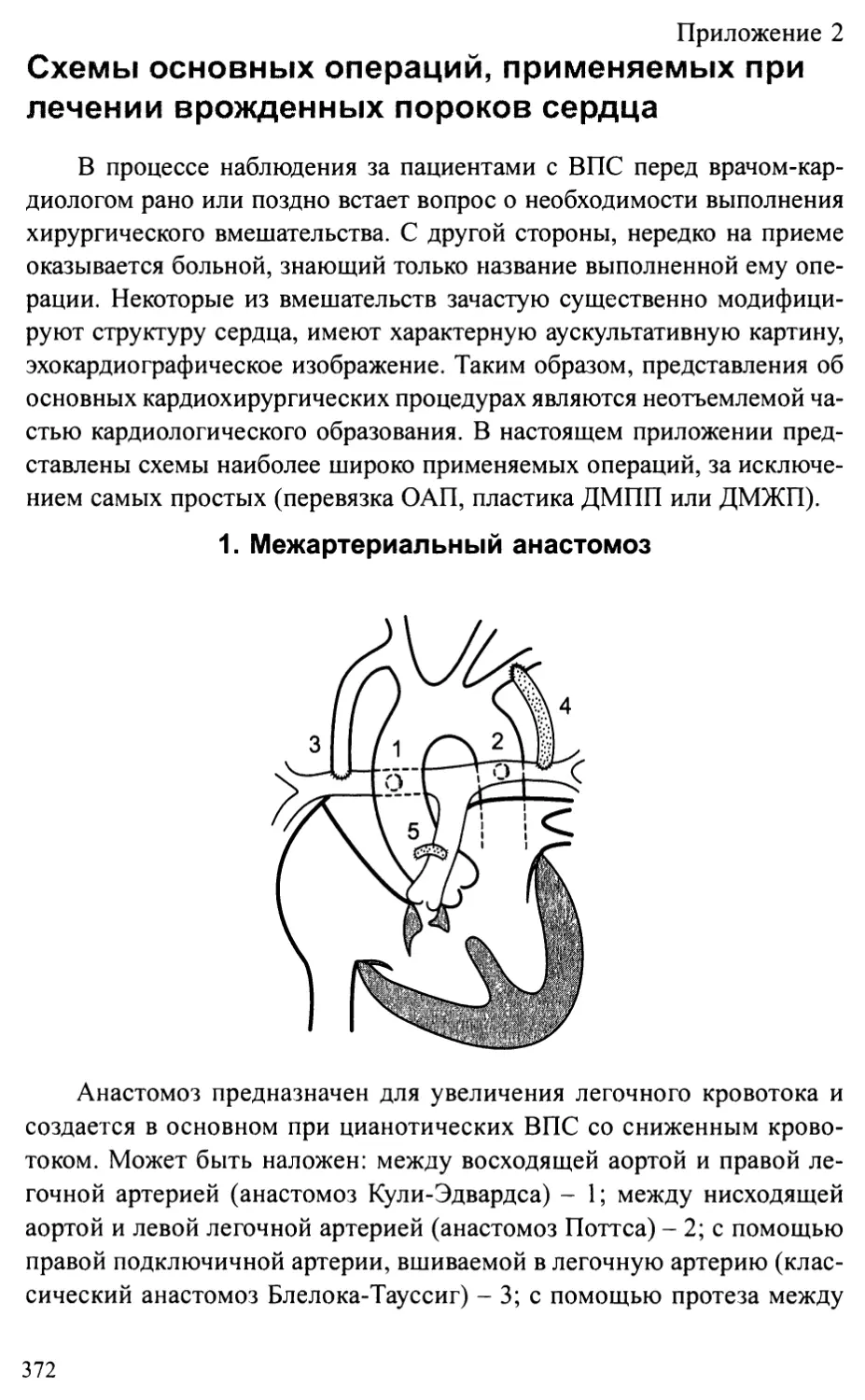
Приложение 2. Схемы основных операций, применяемых при лечении
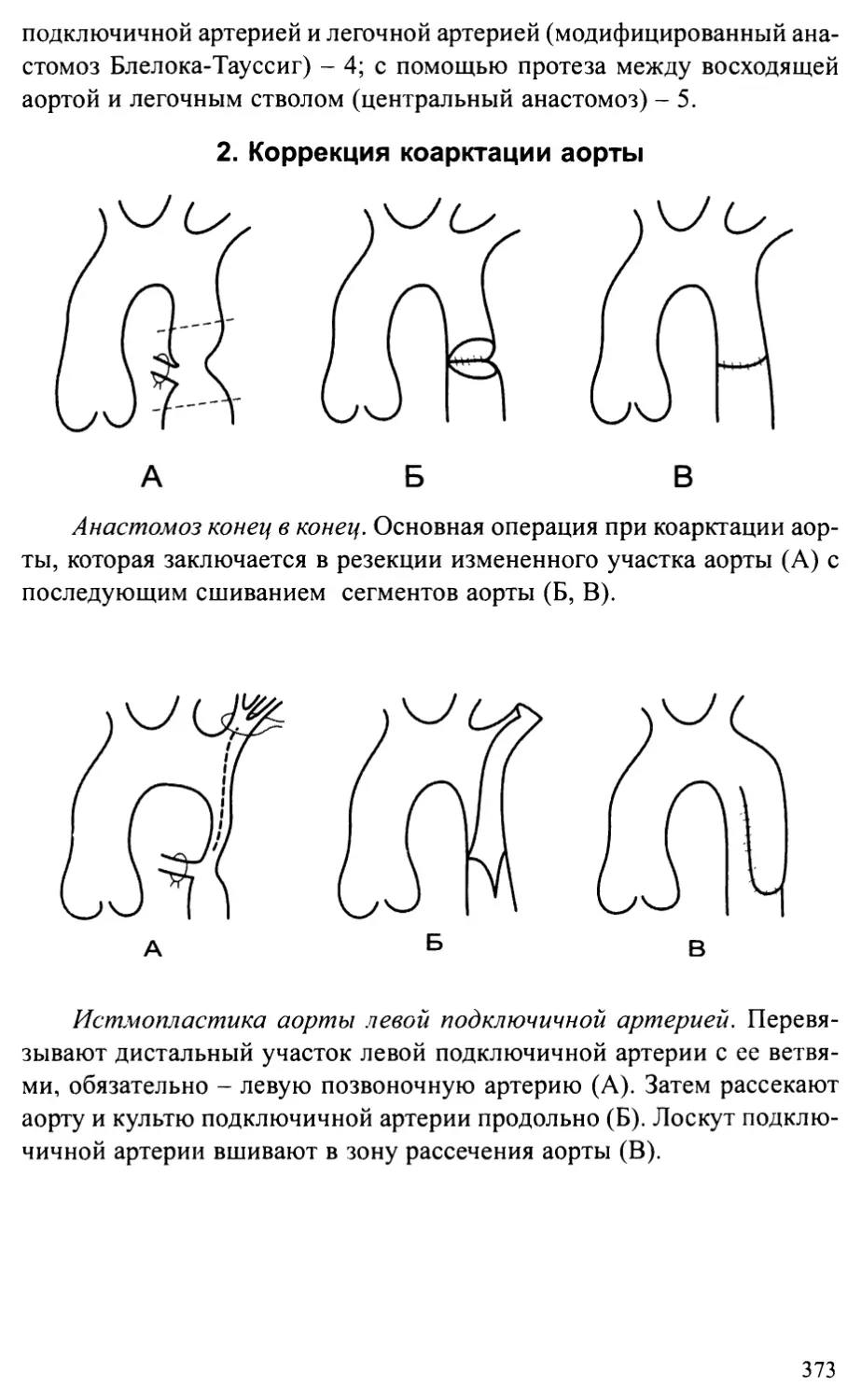
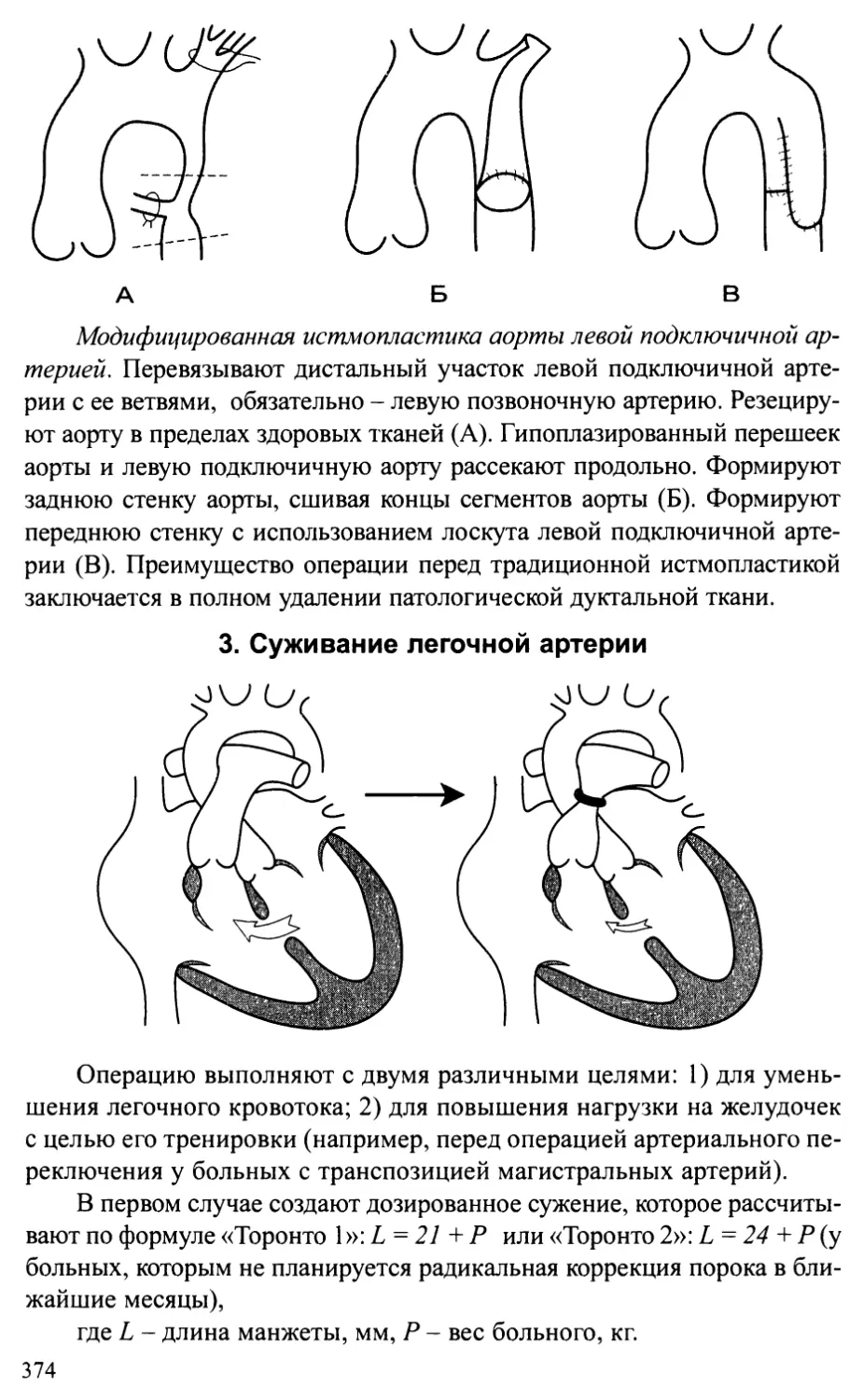
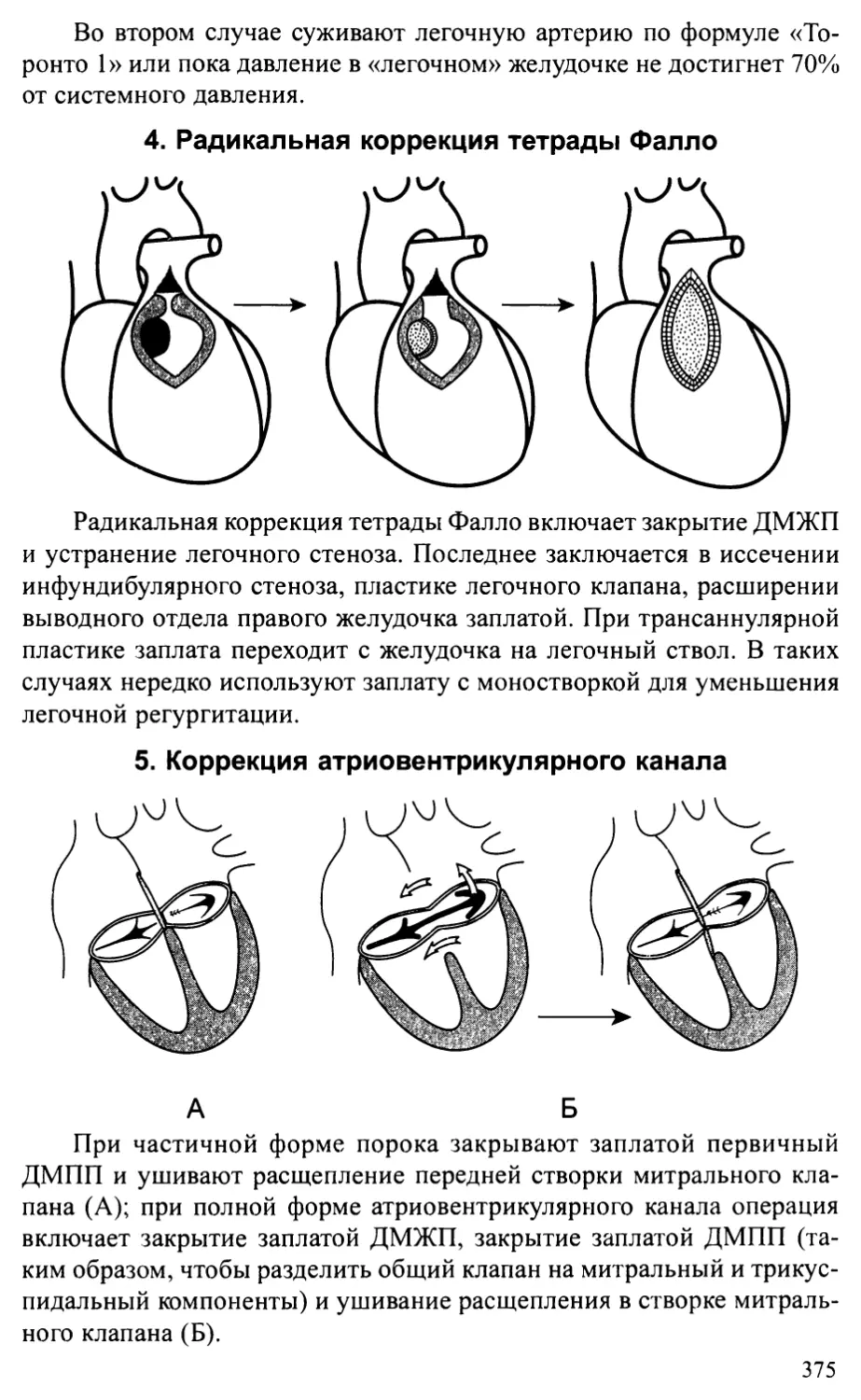
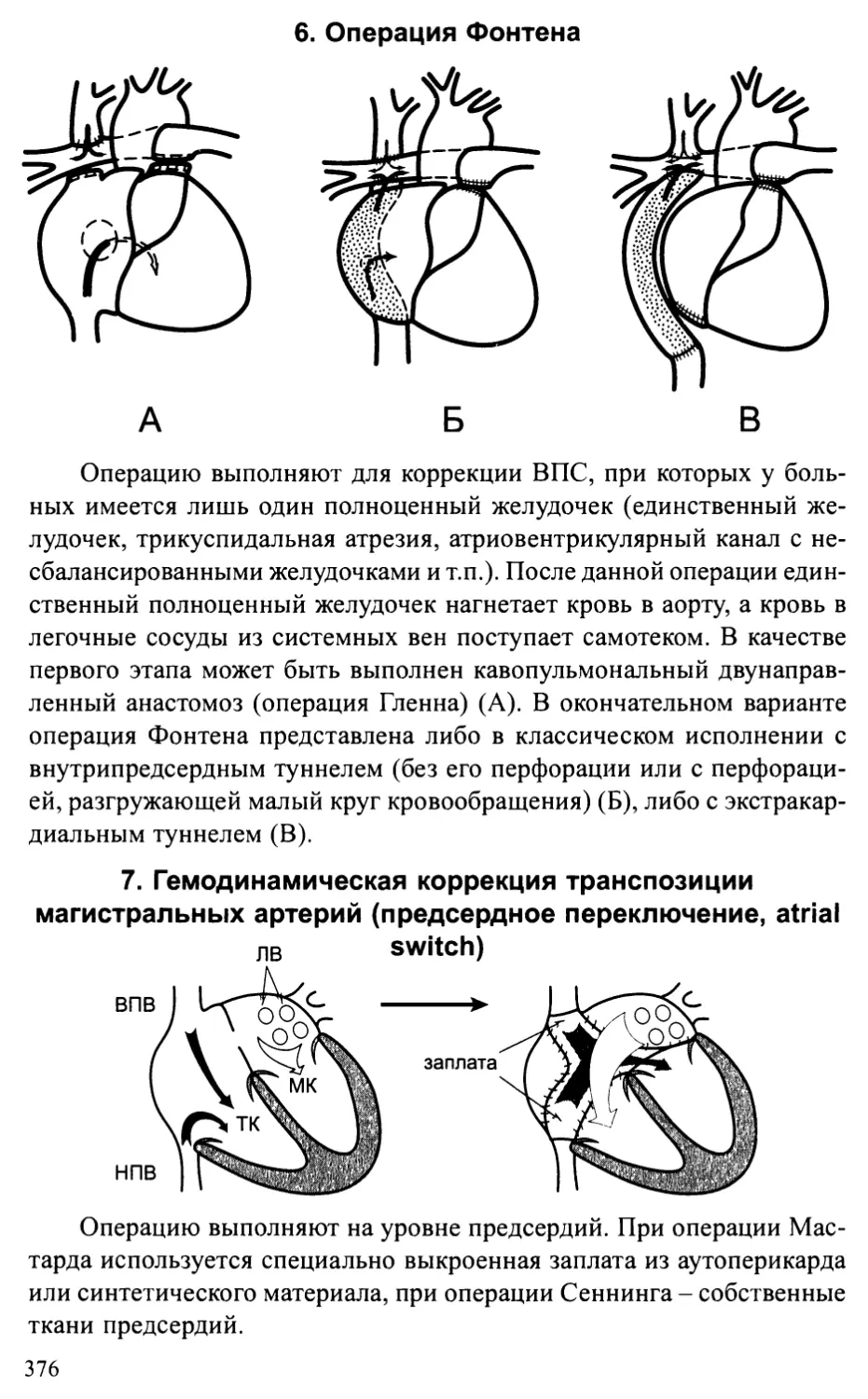
врожденных пороков сердца...........................................372
ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
Среди заболеваний сердечно-сосудистой системы у детей грудно-
го возраста врожденные пороки сердца и сосудов занимают главенст-
вующее место, с удивительным постоянством встречаясь среди ново-
рожденных всех стран, независимо от географического положения
последних, уровня социальной защиты населения, качества медицин-
ского обеспечения. Характерным примером является Великобритания,
где успешно ликвидирован ревматизм и практически не выявляются при-
обретенные пороки сердца ревматической этиологии. В то же время в
этой стране для расчета объема помощи при врожденных пороках про-
должают использовать их среднемировую встречаемость (0,8% среди
новорожденных детей) [1].
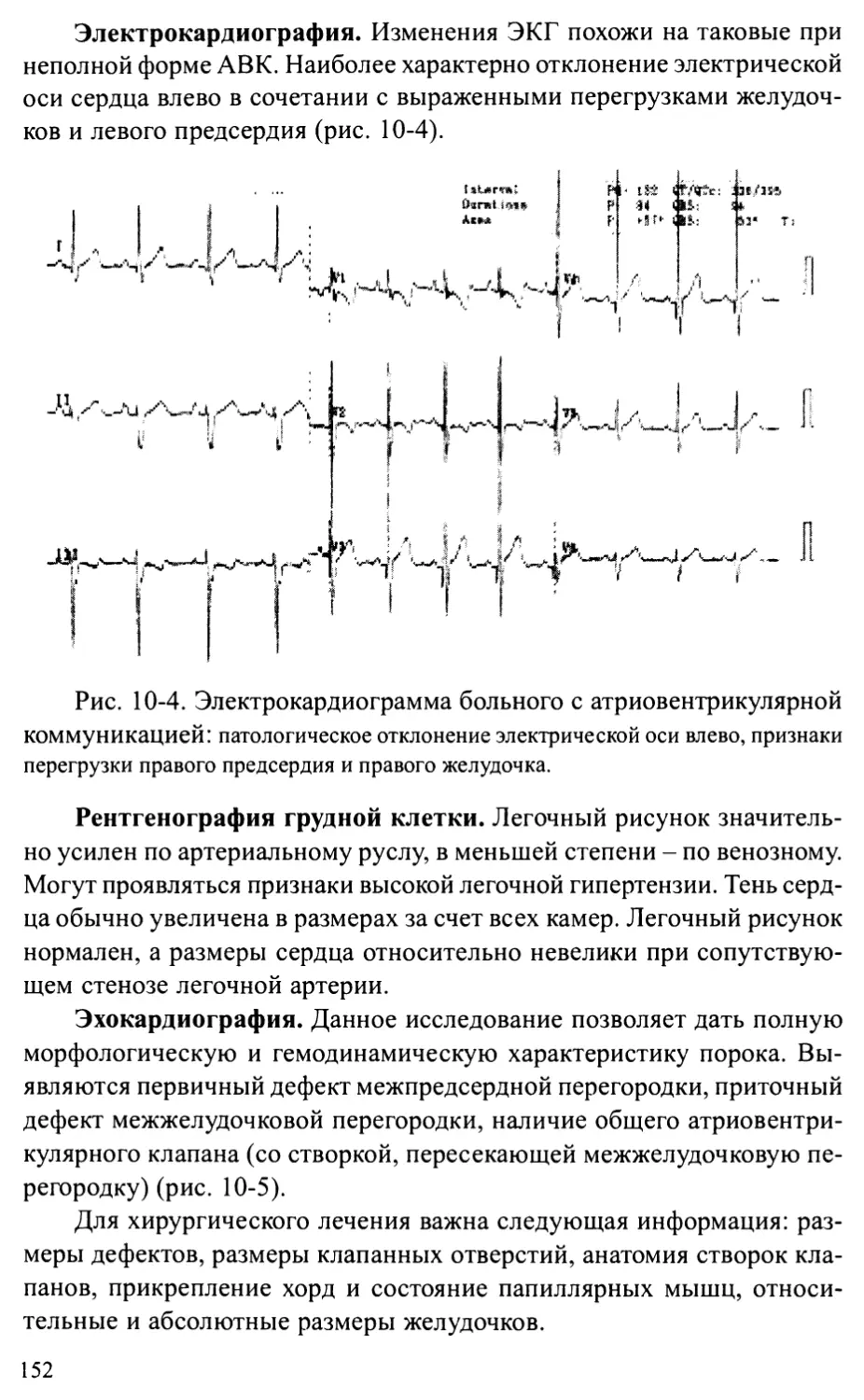
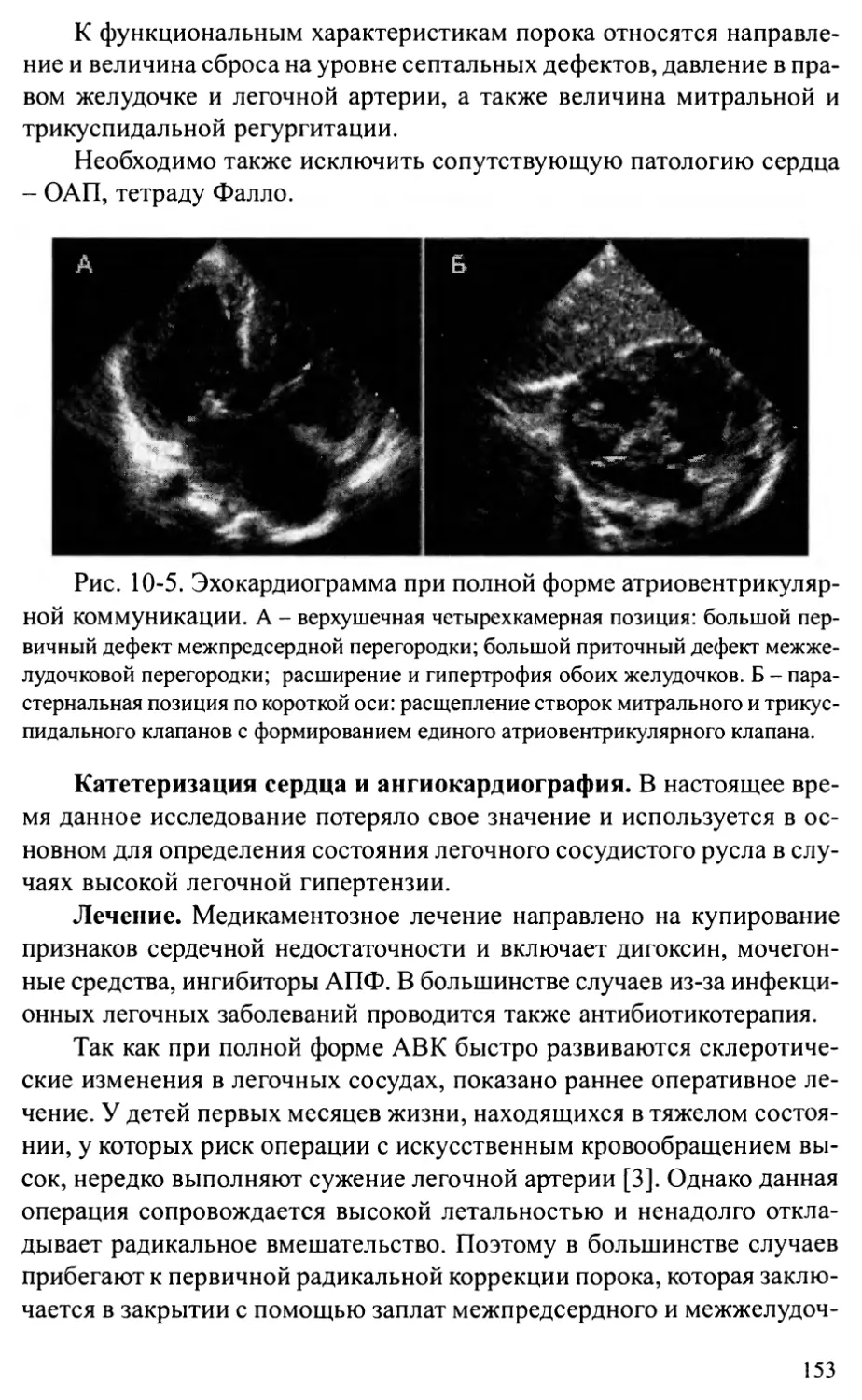
Несмотря на то, что количество врожденных аномалий развития в
развитых странах прогрессивно снижается, их роль в младенческой
смертности остается высокой. Так, в Северной Америке патология сердца
является причиной смерти у 37% младенцев, в Западной Европе -
у 45% [2]. Согласно статистическим данным для Российской Федера-
ции врожденные пороки сердца (ВПС) составляют не менее 30% всех
врожденных пороков развития и их удельный вес возрастает с течением
времени [3]. Постоянно увеличивается и абсолютное число детей с этой
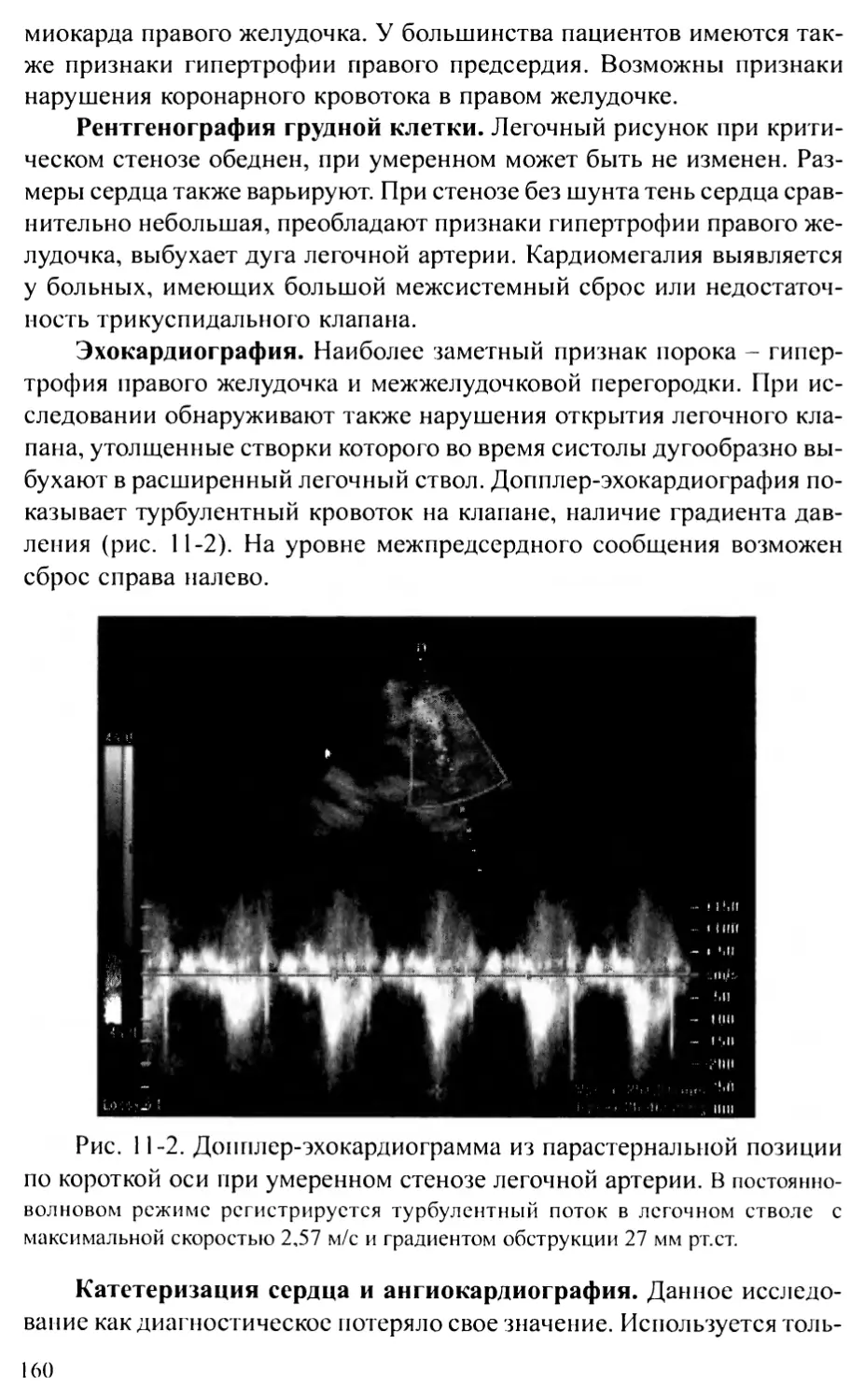
патологией, например, в 2001 г. оно увеличилось по сравнению с 2000 г.
на 5%. При этом врожденные пороки сердца становятся причиной при-
мерно 11% младенческих смертей и до 50% всех смертей, связанных
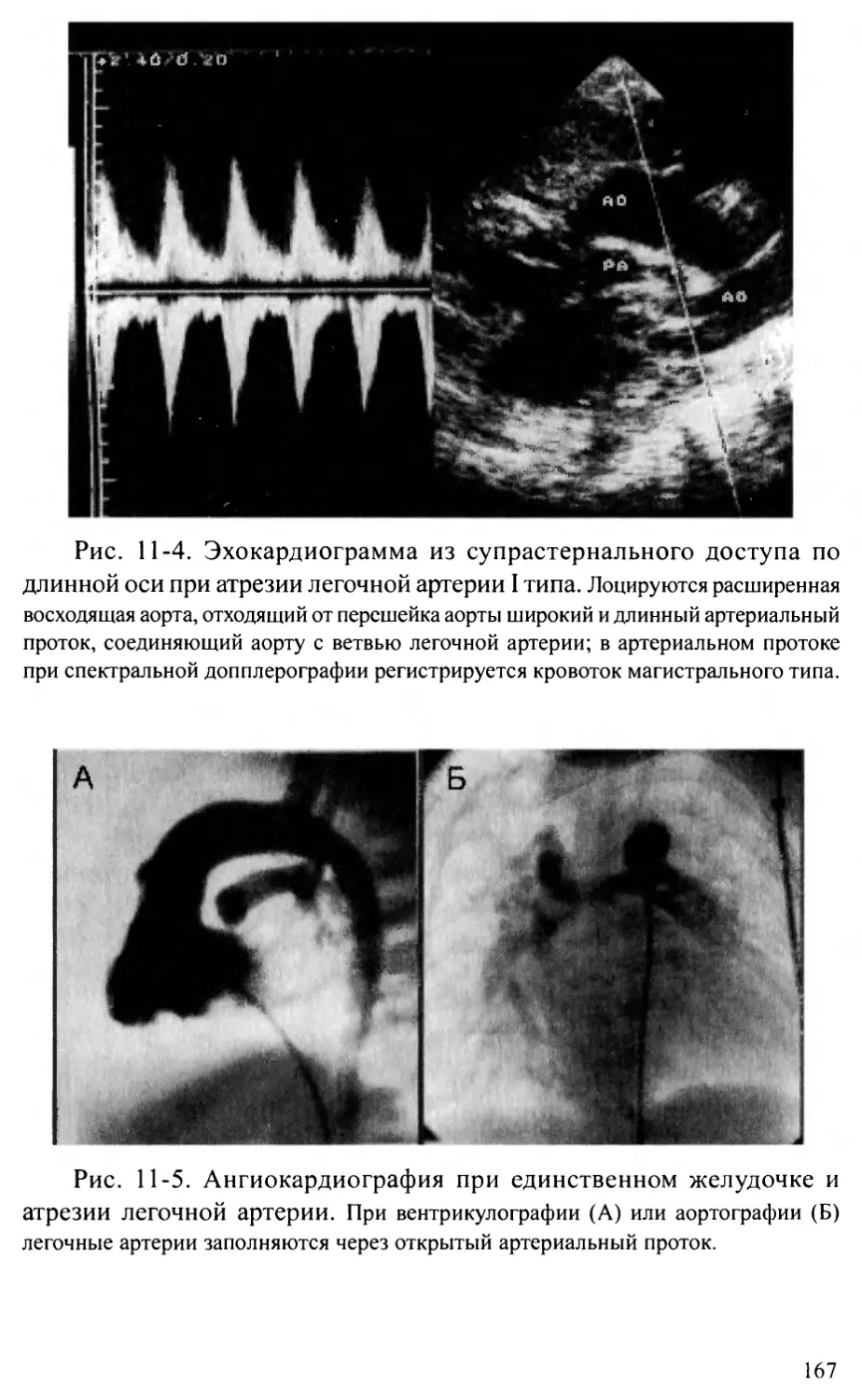
с пороками развития [4]. В то же время при пересчете на детей соот-
ветствующего возраста, суммарное количество зарегистрированных
пороков в нашей стране не превышает 0,6%. Лишь в Москве и Санкт-
Петербурге выявляемость детей с патологией сердца соответствует сред-
неевропейской - около 1,3% [5]. Можно предположить, что значитель-
ная часть пациентов с поражениями сердца врожденной этиологии
остается без внимания и судьба их неясна. Так как,врожденный порок
сердца - это заболевание, уже имеющееся при рождении, первичное
выявление его в старшем, нередко школьном возрасте свидетельствует
прежде всего о недостаточной квалификации медицинского персонала,
осматривающего детей в первые дни и месяцы жизни. Таким обра-
зом, улучшение подготовки врачей широкого профиля является крае-
угольным камнем в организации полноценной помощи при данной
патологии.
Значительные успехи клинической медицины и технический про-
гресс приводят к более глубокому пониманию процессов нарушения
кровообращения при врожденной патологии сердца, возникновению
5
новых возможностей лечения. В настоящее время диагностику анома-
лий сердца можно проводить как в пренатальном периоде, так и сразу
после рождения ребенка. Появились методы лечения, не связанные со
вскрытием грудной клетки, а традиционная хирургия врожденных по-
роков сердца смещается в сторону все более раннего возраста. К сожа-
лению, сведения об основных методах и алгоритмах диагностики, ле-
чебных мероприятиях остаются вне сферы внимания большинства оте-
чественных специалистов. В то же время наш опыт сотрудничества
с роддомами, отделениями интенсивной терапии новорожденных, дет-
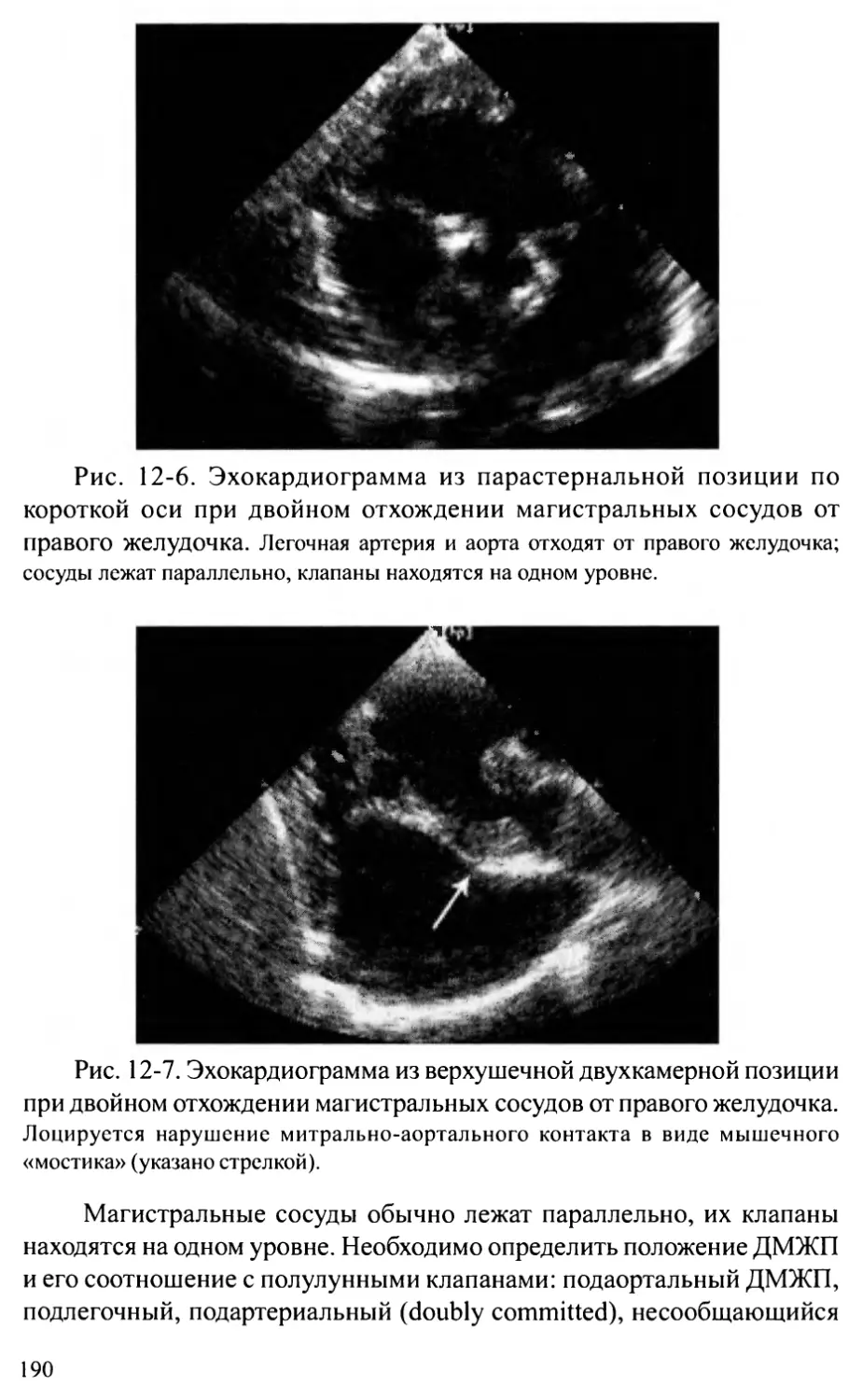
скими терапевтическими отделениями свидетельствует о большом ин-
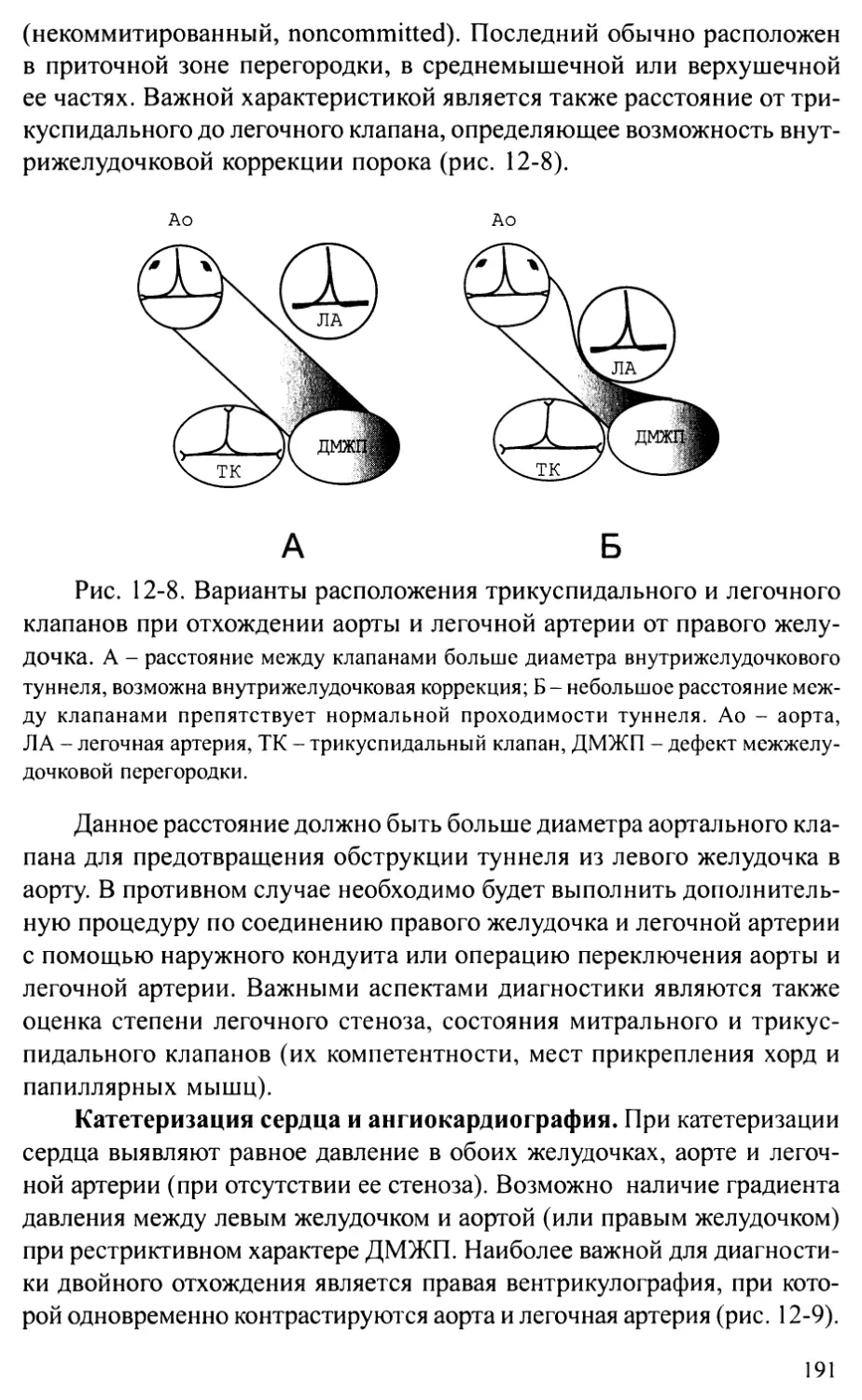
тересе их сотрудников к врожденным порокам сердца. С целью удов-
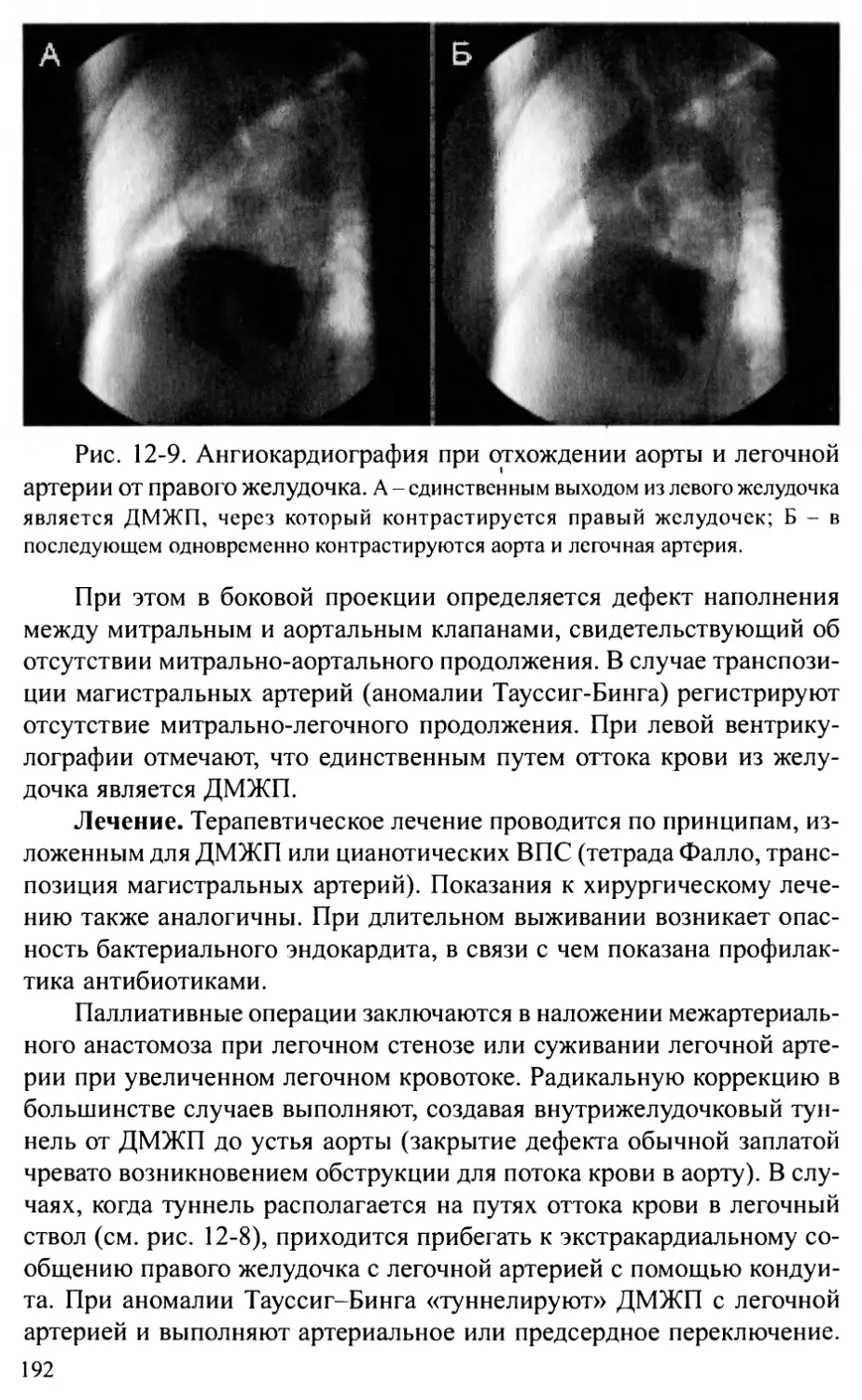
летворить этот интерес написана данная книга.
Монография содержит главы, посвященные как общим вопросам,
так и отдельным патологиям, наиболее часто встречающимся в прак-
тике детских врачей. Основные акценты сделаны на грудной возраст.
Мы считаем, что детские кардиологи должны говорить с кардиохирур-
гами на одном языке, поэтому наряду с общепринятыми классифика-
циями отдельных пороков приводятся их систематизации, отвечающие
современным хирургическим потребностям, а также схемы операций.
Специальные главы посвящены также пренатальной диагностике и ин-
тервенционным процедурам, использующимся в лечении врожденной
патологии сердца. Учитывая неуклонно увеличивающееся число па-
циентов, обращающихся к кардиологам после оперативных вмеша-
тельств, нам показалось целесообразным ввести главу, посвященную
принципам наблюдения за такими детьми.
Мы надеемся, что настоящее издание окажется полезным не толь-
ко для кардиологов, но и для акушеров, педиатров, врачей других про-
филей, так или иначе сталкивающихся с проблемой врожденных поро-
ков сердца, и будет способствовать обучению основам их диагностики
и терапии, расширению знаний о современных возможностях кардио-
хирургии.
Литература
1. The future of pediatric cardiology in the United Kingdom. 11 Br. Heart J.- 1992.-
Vol. 68. - P. 630-633
2. Rosano A., Botto L.D., Batting B., Mastroiacovo P Infant mortality and congenital
anomalies from 1950 to 1994: An international perspective // J. Epidemiol. Com-
munity Health.- 2000,- Vol. 54.- P. 660-666.
3. Бокерия Л.А., Гудкова Р.Г Сердечно-сосудистая хирургия - 2001. Болезни и
врожденные аномалии системы кровообращения.- М.: Изд-во НЦССХ
им. А.Н.Бакулева РАМН, 2002.
6
4. Осокина Г.Г., Абдулатипова И.В., Корсунский А.А. Структура заболеваемости
и смертности у детей первого года жизни // Физиология и патология сердечно-
сосудистой системы у детей первого года жизни / Под ред. М.А. Школьнико-
вой, Л.А. Кравцовой - М.: ИД «Медпрактика-М», 2002.- С. 146-160.
5. Школьникова М.А., Абдулатипова И.В., Осокина Г.Г. Болезни сердечно-сосу-
дистой системы у детей в Российской Федерации // Врожденные и приобре-
тенные пороки сердца / Под ред. В.И. Макарова - Архангельск, 2003.- С. 3-9.
ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
Годы, прошедшие после первого издания настоящей моно-
графии, показали неизменно растущий интерес российских педиатров
к патологии сердца у детей, в том числе врожденной. Благодаря
усилиям Ассоциации детских кардиологов России и ее бессменного
президента М.А. Школьниковой проведено уже пять национальных
Конгрессов и всероссийских семинаров, посвященных проблемам
детского возраста, в номенклатуру медицинских специальностей
введена специальность «детская кардиология». Значительно увели-
чилась выявляемость врожденных пороков сердца, особенно в ран-
нем детском возрасте, а также количество медицинских учреждений,
проявляющих не только «хирургический», но и «терапевтический»
интерес к этой проблеме. Авторы надеются, что внесли опреде-
ленный вклад в этот процесс, написав научно-практическое руко-
водство, отвечающее современному уровню медицины и оказавшееся
широко востребованным. Благодаря замечаниям и пожеланиям наших
читателей подготовлено исправленное и дополненное издание книги,
Мы благодарим всех за проявленное внимание и надеемся, чтс
наши совместные усилия позволят оказывать более эффективную
помощь детям с врожденными пороками сердца.
7
Глава 1. ЧАСТОТА И СТРУКТУРА ВРОЖДЕННЫХ
ПОРОКОВ СЕРДЦА
1.1. Частота врожденных пороков сердца
Причины возникновения врожденных пороков сердца (ВПС) до конца
не ясны. Известно только, что период закладки и формирования его
структур (со 2-й по 7-ю неделю беременности) является наиболее уяз-
вимым для целого ряда неблагоприятных воздействий на развиваю-
щееся сердце. К ним относят врожденные и приобретенные заболева-
ния матери (отца) и плода, а также тератогенные факторы внешней сре-
ды. Естественно, эти воздействия могут комбинироваться. Потенци-
ально опасные для плода состояния настолько многочисленны, что од-
но их перечисление займет несколько страниц. Наиболее важными яв-
ляются наследственные заболевания (хромосомные аномалии и деле-
нии, свежие мутации), инфекционные заболевания (в первую очередь
- вирусные), хронические нарушения обмена веществ, гормональные
нарушения, алкоголизм и прием наркотиков [1].
Согласно зарубежным данным, частота встречаемости ВПС в по-
пуляции варьирует в широких пределах - от 2,4 до 14,15/1000 новоро-
жденных. Столь же широко меняется удельный вес отдельных нозоло-
гических единиц. Колебания этих параметров связаны с различиями в
отборе материала для анализа. В некоторых исследованиях учитывают
только оперированных пациентов, в других - всех детей, прошедших
консультативный прием, в третьих - секционные данные за опреде-
ленный временной период и т.п. Также варьирует и возраст больных,
подвергающихся анализу. Наиболее репрезентативными представля-
ются данные, учитывающие все случаи регистрации детей с ВПС за
определенный период времени на определенной территории [2, 3, 4,
5]. В соответствии с этими исследованиями средние показатели часто-
ты различных ВПС представляются следующими (табл. 1-1).
Наиболее распространенными являются пороки так называемой
«большой шестерки»: дефект межжелудочковой перегородки, откры-
тый артериальный проток, транспозиция магистральных артерий, де-
фект межпредсердной перегородки, тетрада Фалло, коарктация аорты.
Сюда можно добавить сводную группу стеноза и атрезии легочной ар-
терии. Вместе они составляют более 66% всех ВПС.
С учетом внутриутробных смертей плода или ранних выкидышей
удельный вес ВПС среди пороков развития может достигать 39,5% (в
среднем 7,3%). Колебания этого показателя определяются в основном
8
сроком гестации (чем меньше срок, тем чаще присутствует ВПС). Боль-
шинство плодов погибает к концу беременности из-за сопутствующих
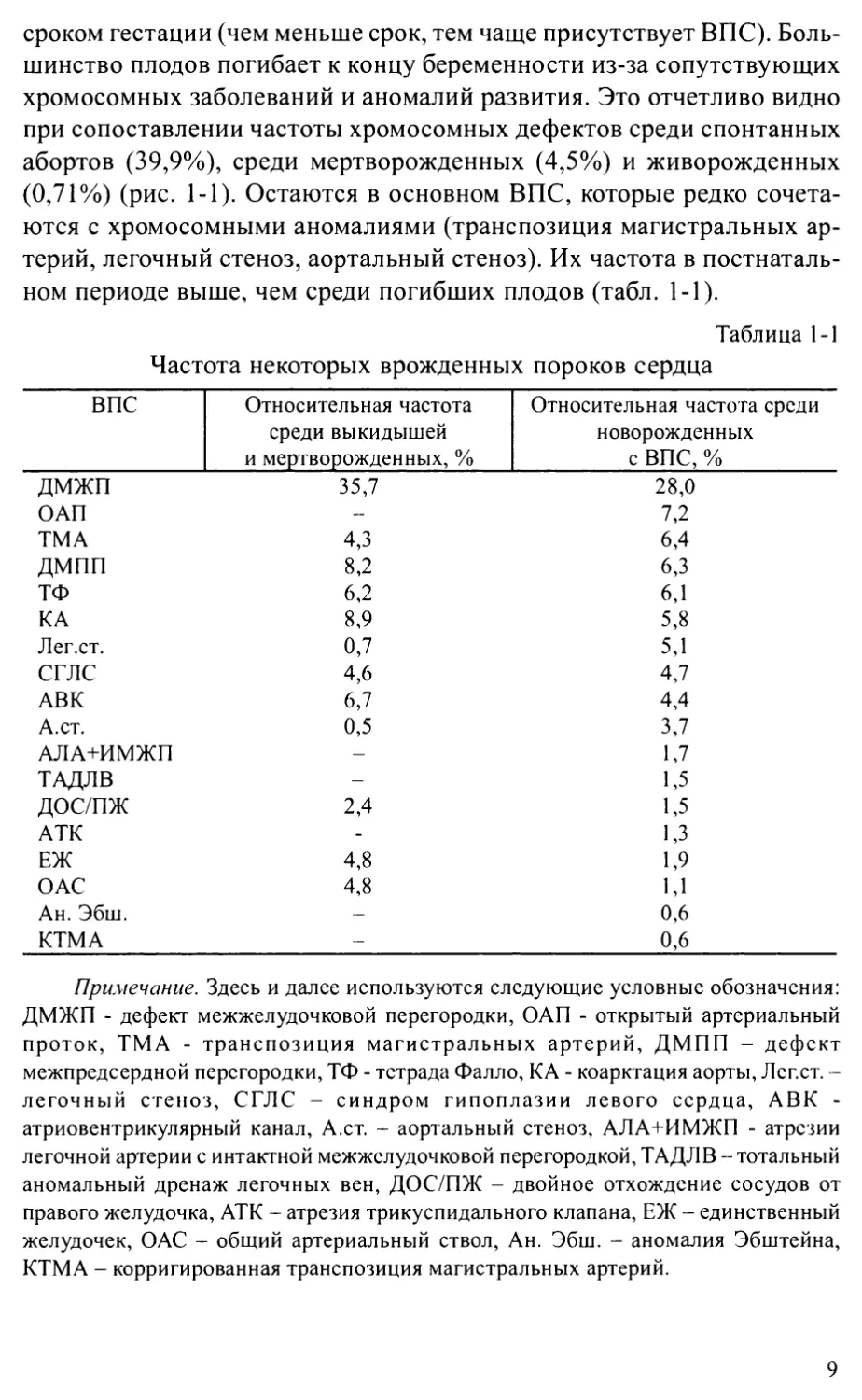
хромосомных заболеваний и аномалий развития. Это отчетливо видно
при сопоставлении частоты хромосомных дефектов среди спонтанных
абортов (39,9%), среди мертворожденных (4,5%) и живорожденных
(0,71%) (рис. 1-1). Остаются в основном ВПС, которые редко сочета-
ются с хромосомными аномалиями (транспозиция магистральных ар-
терий, легочный стеноз, аортальный стеноз). Их частота в постнаталь-
ном периоде выше, чем среди погибших плодов (табл. 1-1).
Таблица 1-1
Частота некоторых врожденных пороков сердца
ВПС Относительная частота среди выкидышей и мертворожденных, % Относительная частота среди новорожденных с ВПС, %
ДМЖП 35,7 28,0
ОАП - 7,2
ТМА 4,3 6,4
ДМПП 8,2 6,3
ТФ 6,2 6,1
КА 8,9 5,8
Лег.ст. 0,7 5,1
СГЛС 4,6 4,7
АВК 6,7 4,4
А. ст. 0,5 3,7
АЛА+ИМЖП — 1,7
ТАДЛВ - 1,5
ДОС/ПЖ 2,4 1,5
АТК - 1,3
ЕЖ 4,8 1,9
ОАС 4,8 1,1
Ан. Эбш. - 0,6
КТМА - 0,6
Примечание. Здесь и далее используются следующие условные обозначения:
ДМЖП - дефект межжелудочковой перегородки, ОАП - открытый артериальный
проток, ТМА - транспозиция магистральных артерий, ДМПП - дефект
межпредсердной перегородки, ТФ - тетрада Фалло, КА - коарктация аорты, Лсг.ст. -
легочный стеноз, СГЛС - синдром гипоплазии левого сердца, АВК -
атриовентрикулярный канал, А.ст. - аортальный стеноз, АЛА+ИМЖП - атрезии
легочной артерии с интактной межжелудочковой перегородкой, ТАДЛВ - тотальный
аномальный дренаж легочных вен, ДОС/ПЖ - двойное отхождение сосудов от
правого желудочка, АТК - атрезия трикуспидального клапана, ЕЖ - единственный
желудочек, ОАС - общий артериальный ствол, Ан. Эбш. - аномалия Эбштейна,
КТМА - корригированная транспозиция магистральных артерий.
9
Для практического здравоохранения важно ориентироваться на
встречаемость ВПС у живорожденных. В этой группе частота пораже-
ний сердца колеблется от 0,6 до 1,2%. В Англии для демографических
расчетов используют средний показатель 8/1000 [6]. В США он варьи-
рует от 1,5 (для тяжелых пороков) до 2,5/1000 (для умеренно выражен-
ных пороков) [7], но имеет тенденцию к подъему. Так, в одном из иссле-
дований с начала 70-х годов до конца 90-х средняя частота ВПС возрос-
ла в полтора раза и составила 9/1000 [4]. Причины роста могут быть
связаны с улучшением диагностики (из-за появления ЭХОКГ), улучше-
нием выявляемое™ и снижением возраста диагностики (вследствие рас-
пространения знаний о ВПС среди медработников), улучшением реги-
страции аномалий. Однако эти факторы не объясняют преобладания от-
дельных нозологических единиц в разные периоды исследования, роста
частоты одних тяжелых пороков (тетрада Фалло) при снижении других
(транспозиция магистральных артерий), расовых вариаций в частоте
ВПС. Таким образом, можно предполагать истинное увеличение пора-
жений сердца с течением времени.
Рис. 1-1. Сцепленность хромосомных аномалий с ВПС
1.2. Естественное течение врожденных пороков сердца
Для планирования помощи при ВПС важно оценить гемодинами-
ческую значимость заболеваний и вероятность развития критических
состояний при них. Нередко пороки с почти одинаковой частотой встре-
чаемости совершенно по-разному будут представлены в структуре боль-
ных, поступающих в кардиоцентры, что связано с их различной угро-
10
зой для жизни или здоровья ребенка (например, ДМПП и транспози-
ция магистральных артерий). Значение ВПС для практического здра-
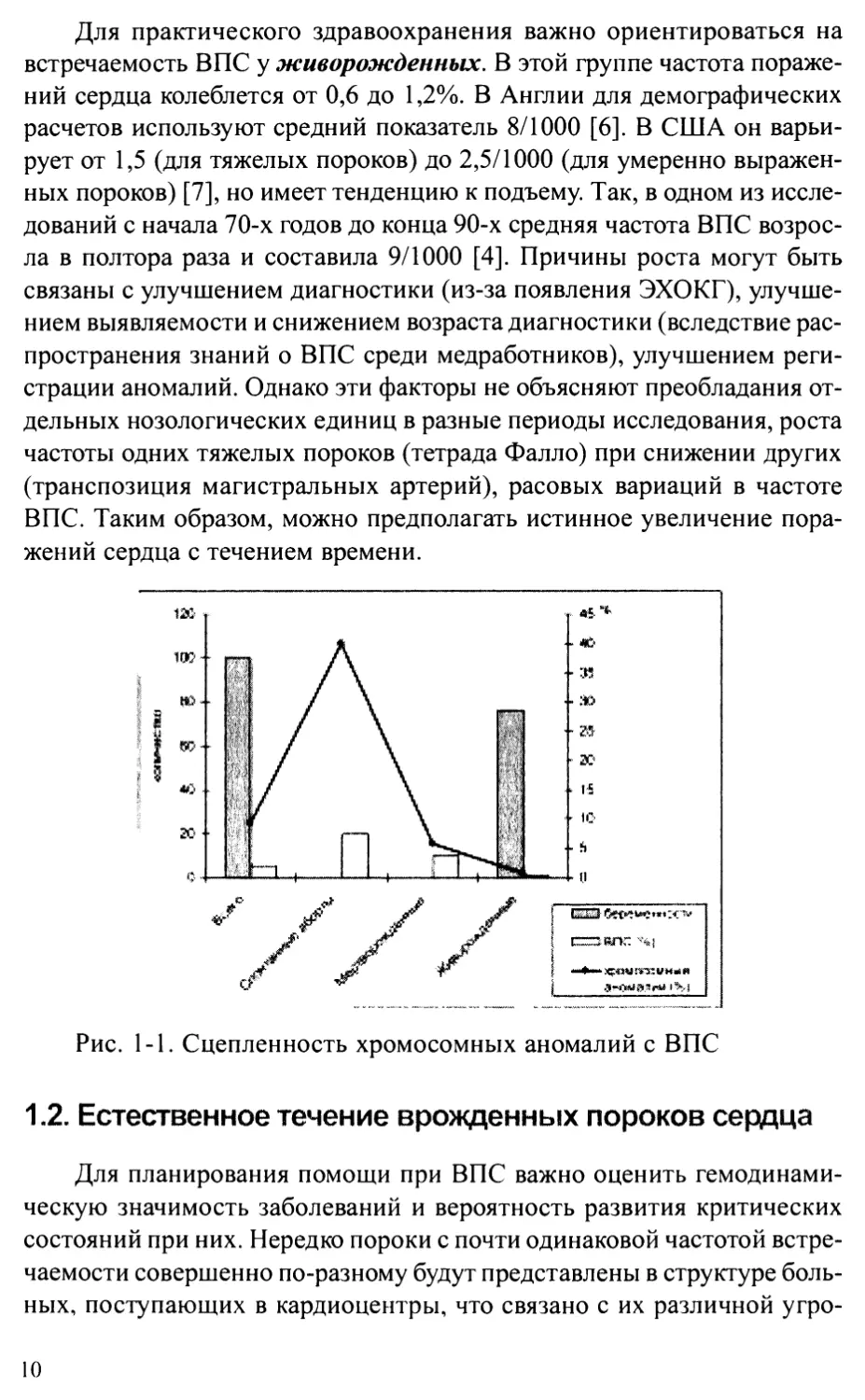
воохранения можно оценить по условному «индексу раннего обраще-
ния» (ПРО). Индекс представляет собой произведение частоты порока
на частоту критических состояний при нем (возникновение симптомов,
угрожающих жизни, в течение первого года жизни), деленное на 100
(табл. 1-2). Видно, что при такой оценке первую шестерку с ИРО =
4,0±1,8 составят несколько иные пороки по сравнению с приведенны-
ми в таблице 1-1. Средний ИРО для остальных аномалий равен 1,0±0,5.
При сложении всех ИРО можно получить число детей, которые ока-
жутся в клинике в связи с критическим состоянием в течение первого
года жизни (в процентах от числа родившихся с ВПС).
Таблица 1-2
Частота критических состояний и индекс раннего обращения
у новорожденных детей с ВПС
ВПС Частота критических состояний,% Индекс раннего обращения (ИРО)
ТМА 100,0 6,4
ДМЖП 21,0 5,9
СГЛС 92,4 3,9
КА 63,8 3,7
ОАП 29,8 2,2
ТФ 34,9 2,1
АЛА+ИМЖП 98,7 1,6
ЕЖ 87,8 1,6
АВК 32,2 1,4
ДОС/ПЖ 92,1 1,4
ТАДЛВ 77,3 1,2
ОАС 97,4 1,1
АТК 77,8 1,0
А.ст. 12,2 0,5
Лег.ст. 7,0 0,4
ДМПП 6,6 0,4
Отметим, что частота отдельных нозологических форм может ко-
лебаться в различные возрастные периоды. К примеру, у детей в воз-
расте более двух недель крайне редко встречаются такие пороки, как
атрезия легочной артерии с интактной межжелудочковой перегород-
кой, синдром гипоплазии левого сердца (табл. 1-3). Это связано с вы-
сокой ранней смертностью при данных заболеваниях. Понятно, что воз-
можность оказания помощи при подобных патологиях определяется
их выявляемостью в первые недели жизни.
11
Таблица 1-3
Частота заболеваний в зависимости от времени поступления
больных в специализированный стационар (Fyler D., 1980)
Место, соответствующее частоте порока 0-6 дней 7-13 дней 13-20 дней 180-365 дней
1 ТМА КА ДМЖП ДМЖП
2 сглс ДМЖП ТМА ОАП
3 ТФ СГЛС КА ТФ
4 КА ТМА ТФ ДМПП
5 ДМЖП ТФ АВК АВК
6 АЛА+ИМЖП Гетеротаксия Гетеротаксия Л.С1.
7 Гетеротаксия ОАС ОАП КА
8 Прочие ВПС ЕЖ ТАДЛВ Прочие ВПС
Несмотря на более благоприятное течение остальных ВПС, сум-
марная летальность чрезвычайно высока. К концу 1-й недели умирают
29% новорожденных, к 1 мес. - 42%, к 1 году - 87% детей. Средний
срок гибели большинства больных - 59±73 дня (рис. 1-2) [8].
Рис. 1-2. Выживаемость детей с врожденными пороками сердца
Современные возможности оперативных вмешательств достаточ-
но велики. Практически при всех ВПС можно выполнить операцию
новорожденному ребенку, широко применяются транслюминальные
баллонные процедуры. Однако не всем необходимо вмешательство сра-
зу по выявлении «сердечной проблемы». Как свидетельствуют данные
крупных детских центров, почти у 23% детей с подозрением на ВПС
поражения сердца носят функциональный, преходящий характер или
вообще имеется внесердечная патология [9]. Другие не подлежат опе-
рации из-за незначительности анатомических нарушений, или наобо-
12
рот, невозможности коррекции порока и тяжелой внесердечной пато-
логии. Несмотря на то что доля последних пациентов постепенно сни-
жается, все же необходимо учитывать такие факторы риска, как глубо-
кая недоношенность, не поддающиеся лечению аномалии развития ске-
лета, центральной нервной системы и т.п. Для определения тактики
лечения оправданно разделение всех детей на три следующие основ-
ные группы:
1. Пациенты, которым операция по поводу ВПС необходима и воз-
можна (-52,0%).
2. Пациенты, которым операция не показана из-за незначитель-
ных нарушений гемодинамики (-31,0%).
3. Пациенты с некорректабельными ВПС или неоперабельные по
соматическому состоянию (-17,0%).
Для первой группы существенны такие моменты, как раннее вы-
явление ВПС, адекватная первичная терапия для стабилизации состоя-
ния больного, своевременная транспортировка в кардиохирургический
стационар для проведения топической диагностики и операции.
Пациенты второй группы не требуют интенсивной терапии и мо-
гут быть в плановом порядке направлены к детскому кардиологу для
топической диагностики и последующего диспансерного наблюдения.
Самую сложную, третью группу составляют больные, у которых
помимо тяжелого ВПС имеются грубые поражения ЦНС, тяжелые по-
следствия диафрагмальной грыжи и другие аномалии, не позволяю-
щие надеяться на хороший прогноз жизни. Желательно, чтобы при-
надлежность ребенка к этой группе была определена уже в первичном
медицинском учреждении. При множественных пороках развития це-
лесообразно провести консилиум соответствующих специалистов с це-
лью определения оптимальной тактики лечения. К примеру, вопрос об
устранении врожденной атрезии пищевода должен быть решен до вме-
шательства по поводу ВПС и т.п. Возможно, что для безнадежных де-
тей необходима организация стационара типа хосписа.
Подводя итоги, можно сформулировать следующие задачи, кото-
рые возникают перед врачом, впервые заподозрившим ВПС у новоро-
жденного:
1) установить симптомы, свидетельствующие о наличии ВПС;
2) провести дифференциальную диагностику с другими заболева-
ниями, дающими симптоматику, сходную с ВПС;
3) определить показания к неотложной консультации специалиста
(детского кардиолога, кардиохирурга, генетика и др.);
13
4) провести первичную патогенетическую терапию с целью ста-
билизации состояния ребенка и подготовки к переводу в кардиологи-
ческое или кардиохирургическое отделение.
Решение этих задач позволяет оказать эффективную и своевремен-
ную помощь при большинстве ВПС.
Литература
1. Белозеров Ю.М., Страхова О. С. Врожденные пороки сердца у детей (генети-
ческие и средовые факторы возникновения). - М.: МНИИ педиатрии и детской
хирургии М3 РФ, 2002.
2. Fyler D.C Report of New England Regional Infant Cardiac Program // Pediatrics.-
1980.-Vol. 65, № 2 (pt 2).- Suppl.
3. Samanek M., Voriskova M. Infants with critical heart disease in a territory with cen-
tralised care 11 Int. J. Cardiol.-1986.-Vol. 11.-P. 63-74.
4. Botto L., Correa A., Erickson D. Racial and temporal variations in the prevalence of
heart defects // Pediatrics.- 2001.- Vol. 107.- P. e32.
5. Hoffman J.I.E. Incidence of Congenital Heart Disease: II.Prenatal Incidence H Pedi-
atr. Cardiol.- 1995.- Vol. 16.- P. 155-165
6. The future of pediatric cardiology in the United Kingdom. // Br. Heart J.- 1992.-
Vol. 68.- P. 630-633.
7. Task Force 1: The changing profile of congenital heart disease in adult life // J. Am.
Coll. Cardiol.- 2001.- Vol. 37.- P. 1170-1175.
8. Samanek M., Voriskova M. Infants with critical heart disease in a territory with cen-
tralized care H Intemat. J. Cardiol.- 1987.- Vol. 16.- P. 75-91.
9. Dickinson D.F. Arnold R., Wilkinson J.L. Outcome of treatment for neonates re-
ferred to a supraregional cardiac centre 1976-1978 // Arch. Dis. Childh.-1982.-
Vol. 57.- P. 328-333.
14
Глава 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ
КРОВООБРАЩЕНИЯ И
ТЕРМИНОЛОГИЯ
При рассмотрении врожденных пороков сердца используются
многочисленные специальные понятия, наиболее важные из которых
освещены в настоящей главе.
Гемодинамическая теория развития сердечных структур
Кровообращение как плода, так и новорожденного подчиняется
ряду основных закономерностей физического и биологического свой-
ства. Так, потоки крови движутся из области высокого давления в
область низкого давления. При большом потоке крови через полости
сердца и сосудов происходит их хорошее развитие, при низком кро-
вотоке возникает гипоплазия соответствующих отделов [1]. В соот-
ветствии с этим, например, гипоплазия и коарктация аорты часто со-
провождают пороки со сниженным выбросом в аорту (аортальный
стеноз, дефект межжелудочковой перегородки - ДМЖП) и практиче-
ски не встречаются при тетраде Фалло, когда в аорту устремляется
кровь и из левого, и из правого желудочков.
Дуктус-зависимое кровообращение
При некоторых пороках у новорожденных открытый артериаль-
ный проток (дуктус) может быть основным источником поступления
крови в легочную артерию или аорту. В этих случаях закрытие про-
тока приводит к значительному ухудшению состояния, часто не со-
вместимому с жизнью. При других патологиях наличие открытого
артериального протока (ОАП) может усугублять гемодинамические
проблемы, однако не является ведущим фактором. В связи с этим оп-
ределяют принадлежность порока к дуктус-зависимым или дуктус-
независимым аномалиям.
1. Дуктус-зависимые ВПС (рис. 2-1):
- с обеспечением через ОАП легочного кровотока (пороки с ат-
резией легочной артерии или с критическим легочным стенозом,
транспозиция магистральных артерий)
- с обеспечением через ОАП системного кровотока (перерыв ду-
ги аорты, резкая коарктация аорты, критический аортальный стеноз,
синдром гипоплазии левого сердца).
2. Дуктус-независимые ВПС\ ДМЖП, ДМПП, аномальный дре-
наж легочных вен, и т.п.
15
Рис. 2-1. Дуктус-зависимые ВПС. А - схема кровообращения при атрезии
легочной артерии. Антеградный кровоток в легочную артерию отсутствует;
источником кровотока в легкие является ОАП. Б - схема кровообращения при
предуктальной коарктации аорты. Кровоток в нисходящую аорту осуществляется
через ОАП.
Критический порок сердца
Критическое состояние характеризуется острым дефицитом сер-
дечного выброса, быстрым прогрессированием сердечной недостаточ-
ности, кислородным голоданием тканей с развитием декомпенсирован-
ного метаболического ацидоза и нарушением функций жизненно важ-
ных органов. Основное количество критических состояний при ВПС
возникает в период перехода от пренатального к постнатальному типу
кровообращения.
К основным причинам развития критического состояния относят-
ся:
1. Резкая обструкция кровотока (легочный стеноз, аортальный сте-
ноз, коарктация аорты, синдром гипоплазии левого сердца).
2. Неадекватный возврат крови к левому сердцу (тотальный ано-
мальный дренаж легочных вен, атрезия легочной артерии с интактной
межжелудочковой перегородкой).
3. Закрытие ОАП при дуктус-зависимом кровообращении.
4. Выраженная гиперволемия малого круга кровообращения и объ-
емная перегрузка сердца (общий артериальный ствол, большой ДМЖП,
недостаточность атриовентрикулярных клапанов).
5. Выраженная артериальная гипоксемия (транспозиция магист-
ральных артерий, атрезия легочной артерии).
6. Ишемия или гипоксия миокарда (аномальное отхождение левой
коронарной артерии от легочной артерии, транспозиция магистраль-
ных артерий).
16
Некоторые из этих причин могут комбинироваться. Характерной
особенностью критических ВПС является отсутствие или слабая вы-
раженность компенсаторных реакций (гипертрофии миокарда, колла-
терального кровообращения и т.п.). Если не проводится экстренная те-
рапия, например, простагландинами или не выполняется оперативное
вмешательство, ребенок погибает в течение первых дней или недель
жизни. Некоторые исследователи расценивают ВПС как критический,
если он приводит к смерти в течение первого года жизни.
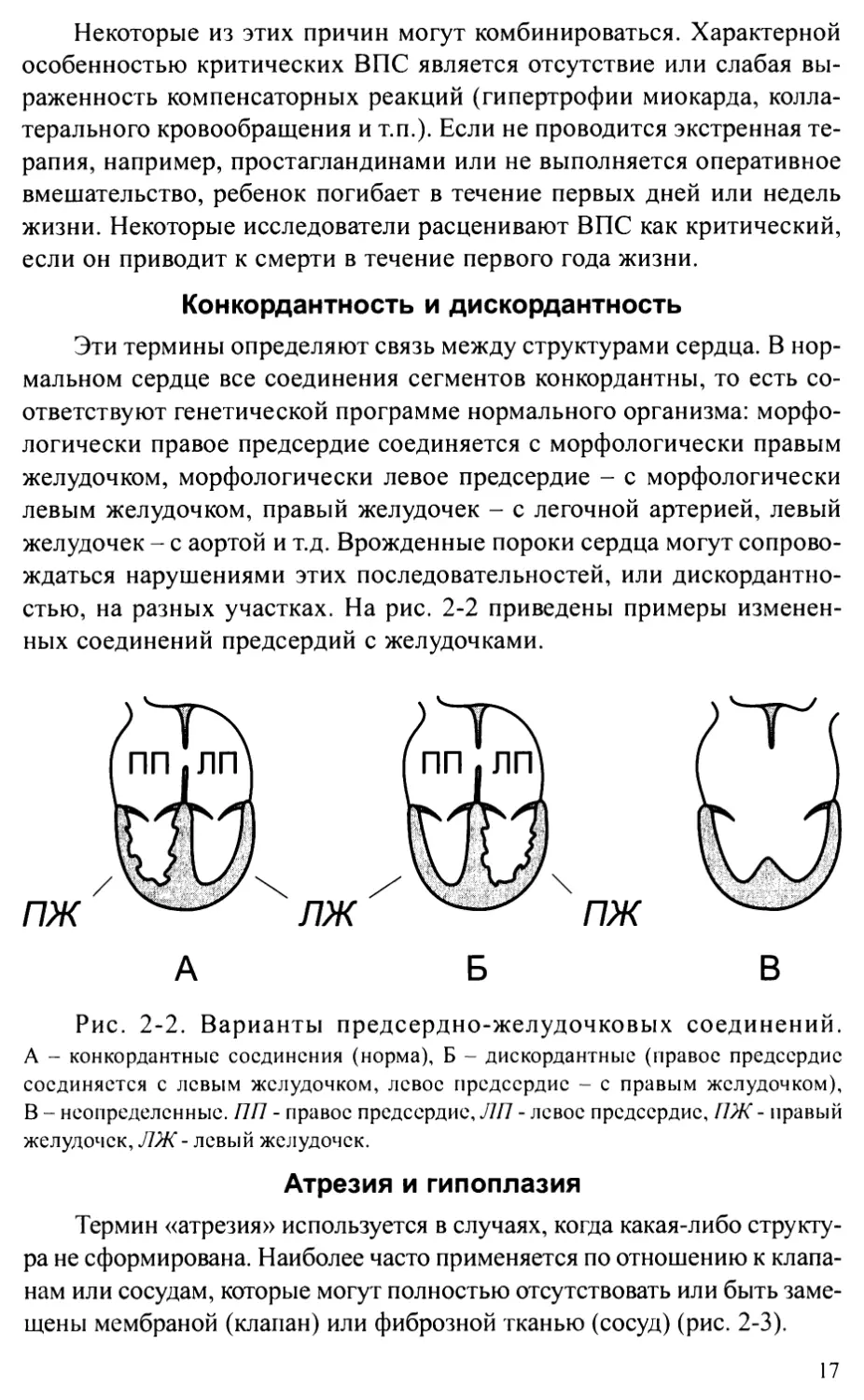
Конкордантность и дискордантность
Эти термины определяют связь между структурами сердца. В нор-
мальном сердце все соединения сегментов конкордантны, то есть со-
ответствуют генетической программе нормального организма: морфо-
логически правое предсердие соединяется с морфологически правым
желудочком, морфологически левое предсердие - с морфологически
левым желудочком, правый желудочек - с легочной артерией, левый
желудочек - с аортой и т.д. Врожденные пороки сердца могут сопрово-
ждаться нарушениями этих последовательностей, или дискордантно-
стью, на разных участках. На рис. 2-2 приведены примеры изменен-
ных соединений предсердий с желудочками.
Рис. 2-2. Варианты предсердно-желудочковых соединений.
А - конкордантные соединения (норма), Б - дискордантные (правое предсердие
соединяется с левым желудочком, левое предсердие - с правым желудочком),
В - неопределенные. 7171 - правое предсердие, Л17 - левое предсердие, 71Ж - правый
желудочек, ЛЖ - левый желудочек.
Атрезия и гипоплазия
Термин «атрезия» используется в случаях, когда какая-либо структу-
ра не сформирована. Наиболее часто применяется по отношению к клапа-
нам или сосудам, которые могут полностью отсутствовать или быть заме-
щены мембраной (клапан) или фиброзной тканью (сосуд) (рис. 2-3).
17
А Б В
Рис. 2-3. Атрезия клапана или дуги аорты. Отсутствие правого (А) или
левого (Б) предсердно-желудочкового соединения (атрезия клапана). В - атрезия
дуги аорты (указана стрелкой).
Термин «гипоплазия» отражает уменьшение диаметра, длины или
объема сердечной структуры.
Растяжимость, дилатация, гипертрофия желудочков
Растяжимость определяет степень сопротивления притоку крови
в полости желудочков. У новорожденных менее податлив правый же-
лудочек, что определяет большое сопротивление поступлению в него
крови из правого предсердия и относительно высокое диастолическое
давление в нем. Дилатация представляет собой увеличение полости в
ответ на острую или хроническую объемную перегрузку. Гипертрофия
характеризует степень увеличения общей массы миокарда или внутри-
клеточных структур по сравнению с нормой. Внешне она проявляется
утолщением стенки сердечной камеры, иногда в ущерб ее объему.
У здоровых детей наиболее интенсивный рост кардиомиоцитов
происходит в первые два года жизни. При наличии постоянной нагруз-
ки гипертрофия миокарда может развиваться двумя путями [2, 3]. В
течение первых трех лет жизни (особенно в грудном возрасте) она обу-
словлена преимущественно ускорением онтогенетического роста кар-
диомиоцитов, мышечная масса возрастает за счет их гиперплазии. Па-
раллельно усиливается и коронарный ангиогенез с сохранением меж-
капиллярных расстояний. В старшем возрасте включается гипертро-
фический рост кардиомиоцитов; рост коронарных сосудов и их коли-
чество отстают от массы миокарда. Возникают условия для дистрофи-
ческих изменений в миокарде.
Дилатация и гипертрофия могут сочетаться в различных комбина-
циях и постоянно сопровождают ВПС.
18
Гипоксия и ишемия
Оба этих термина отражают нарушение питания органов и тканей,
однако имеют различный физиологический смысл. При гипоксии сни-
жено содержание кислорода в притекающей к тканям крови, при ише-
мии - снижен объем притекающей крови. Врожденные пороки могут
сопровождаться обоими этими механизмами нарушения кровообраще-
ния, причем они касаются как самого сердца, так и других органов. В
частности, при аортальном стенозе и значительной гипертрофии мио-
карда рост мелких коронарных сосудов отстает от потребностей, нару-
шается кровоток преимущественно в субэндокардиальных слоях мио-
карда и возникает ишемия этой зоны. При транспозиции магистраль-
ных артерий в коронарное русло из аорты поступает кровь с резко сни-
женным содержанием кислорода, что приводит к гипоксии миокарда.
Объем циркулирующей крови
Данное понятие используется применительно как к большому
(БКК), так и к малому кругу кровообращения (МКК). Состояние здо-
рового ребенка характеризуется нормоволемией - нормальным объе-
мом циркулирующей крови. При врожденных пороках сердца измене-
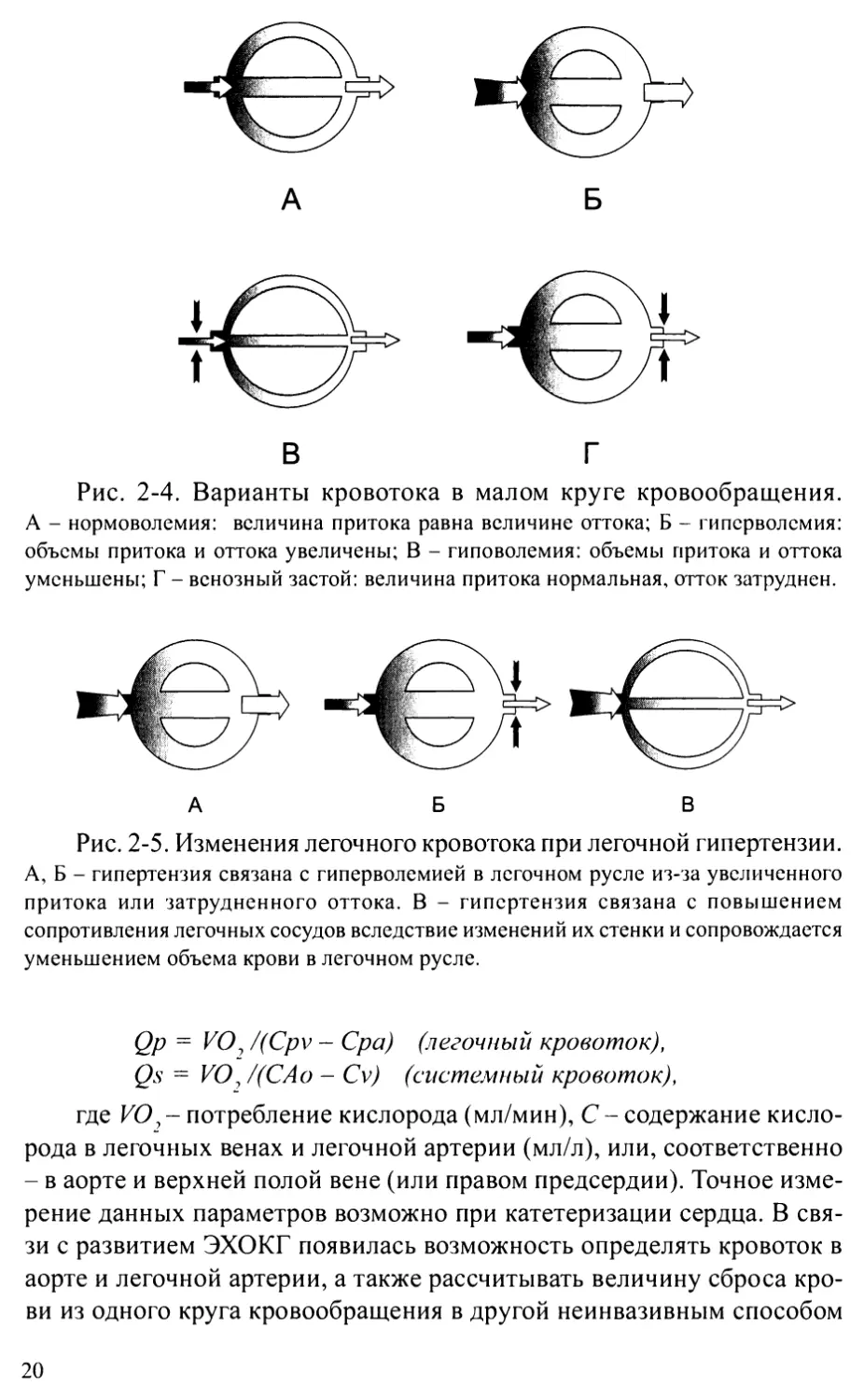
ния чаще всего касаются легочного кровотока (рис. 2-4). Избыточное
поступление крови в систему легочной артерии сопровождается гипер-
волемией МКК, сниженный кровоток - гиповолемией. Нормальный при-
ток в сочетании с затрудненным оттоком приводит к гиперволемии МКК
застойного характера.
Повышение давления в системе легочной артерии обозначается как
гипертензия МКК. Она может быть артериального происхождения (из-
быточный кровоток), следствием венозного застоя (затруднения оттока)
или поражения стенки легочных сосудов обструктивным процессом.
Даже значительная гиперволемия МКК может не приводить к вы-
сокой гипертензии (например, при дефекте межпредсердной перего-
родки - ДМПП), а гипертензия, в свою очередь, может не сопровож-
даться гиперволемией, и даже наоборот, приводить к гиповолемии (в
случаях, когда высокое сопротивление легочных сосудов ограничива-
ет объемный кровоток через легкие) (рис. 2-5). Четкое разграничение
этих понятий важно для анализа процессов, происходящих при разви-
тии патологических состояний у новорожденных и грудных детей.
Объем кровотока, резистентность сосудов
и величина шунта
Данные параметры используют при характеристике ВПС и бас-
сейнов малого и большого кругов кровообращения. Объем кровотока
определяется по формулам:
19
A
Б
Рис. 2-4. Варианты кровотока в малом круге кровообращения.
А - нормоволемия: величина притока равна величине оттока; Б - гиперволемия:
объемы притока и оттока увеличены; В - гиповолемия: объемы притока и оттока
уменьшены; Г - венозный застой: величина притока нормальная, отток затруднен.
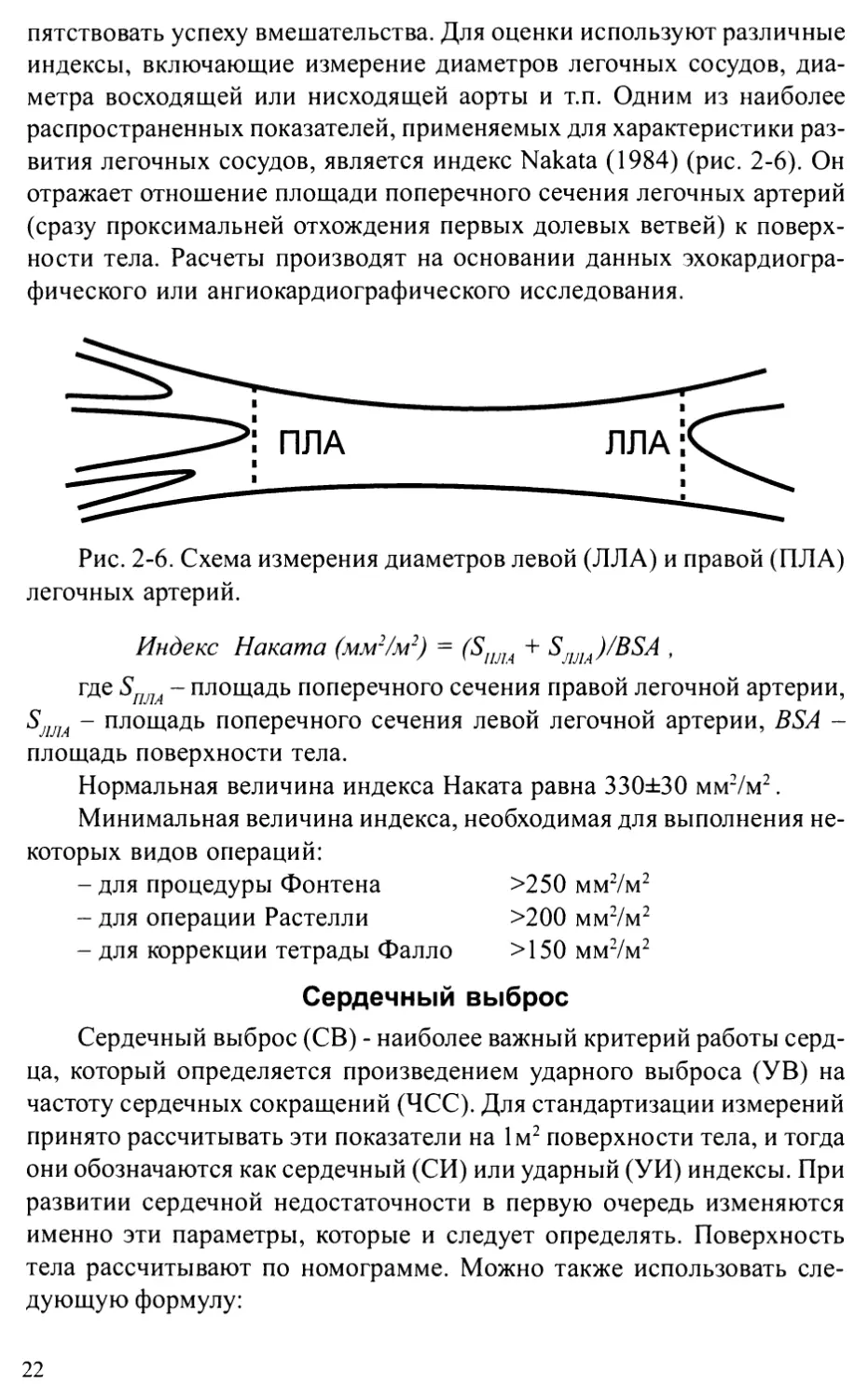
Рис. 2-5. Изменения легочного кровотока при легочной гипертензии.
А, Б - гипертензия связана с гиперволемией в легочном русле из-за увеличенного
притока или затрудненного оттока. В - гипертензия связана с повышением
сопротивления легочных сосудов вследствие изменений их стенки и сопровождается
уменьшением объема крови в легочном русле.
Qp = VO, /(Cpv - Сра) (легочный кровоток),
Qs = VO, /(CAo - Cv) (системный кровоток),
где VOy- потребление кислорода (мл/мин), С - содержание кисло-
рода в легочных венах и легочной артерии (мл/л), или, соответственно
- в аорте и верхней полой вене (или правом предсердии). Точное изме-
рение данных параметров возможно при катетеризации сердца. В свя-
зи с развитием ЭХОКГ появилась возможность определять кровоток в
аорте и легочной артерии, а также рассчитывать величину сброса кро-
ви из одного круга кровообращения в другой неинвазивным способом
20
(см. главу 5). У здоровых детей нормализованный системный крово-
ток составляет 3,1 ±0,4 л/мин/м2.
Объем изолированного шунта определяется по формулам:
шунт слева-направо = Qp - Qs;
шунт справа-налево = Qs - Qp
Так как на практике точное измерение потребления кислорода, не-
обходимое для вычислений, затруднено, чаще используют соотноше-
ние легочного и системного кровотоков (Qp/Qs). При их отношении
1:1 шунт отсутствует или он одинаков в обоих направлениях. При циа-
нотических пороках Qp/Qs может составлять, например, 0,8:1, т.е. ле-
гочный кровоток снижен. При сбросах слева-направо Qp/Qs возраста-
ет, может достичь 2:1 и более, определяя показания к операции.
Общее легочное сопротивление (ОЛС) и общее
периферическое сопротивление (ОПС)
Сопротивление кровотоку определяется тонусом сосудов и сум-
марным их объемом. Реально оно связано с давлением в начале круга
кровообращения и в его конце, а также с объемом содержащейся в нем
крови. Сопротивления рассчитывают по формулам:
ОЛС = (ЛАср-ЛПср) / Qp
ОПС = (АоР - ПП ) / Qs
' ср ср7
Показатели в скобках - среднее давление в соответствующих по-
лостях сердца (ЛА - легочная артерия, ЛП - левое предсердие, Ао -
аорта, ТУЯ - правое предсердие). В норме ОПС составляет 15-30 ед/м2,
а ОЛС - 1-3 ед/м2. У новорожденных ОЛС высокое и достигает нор-
мальных величин лишь к 2-4-м месяцам. В старшем возрасте точный
расчет сосудистых сопротивлений может быть необходим для опреде-
ления необратимости легочной гипертензии.
Так как в норме величина ОЛС невелика, даже небольшие его ко-
лебания приводят к заметным изменениям легочного кровотока и на-
грузки на правый желудочек. Однако при значительном или длитель-
ном повышении ОЛС может резко упасть приток крови к левым отде-
лам сердца, что сопровождается нарушениями функции уже левого же-
лудочка, в частности снижением сердечного выброса. Большинство те-
рапевтических мероприятий у новорожденных и грудных детей связа-
ны с воздействием на ОЛС, в меньшей степени - на ОПС.
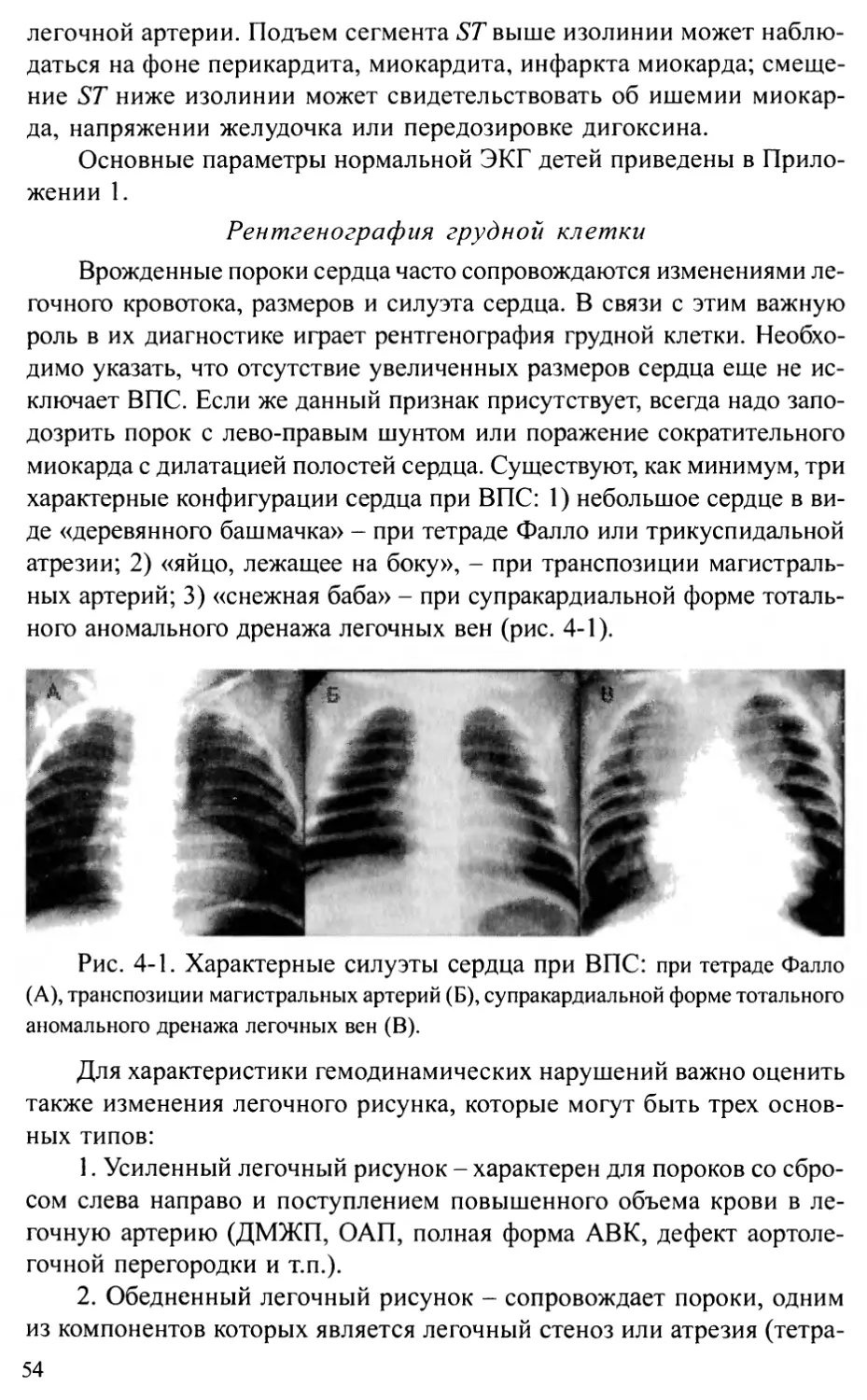
Индекс развития легочных сосудов
При радикальной коррекции некоторых ВПС необходимо оценить
степень гипоплазии легочного сосудистого русла, которая может пре-
21
пятствовать успеху вмешательства. Для оценки используют различные
индексы, включающие измерение диаметров легочных сосудов, диа-
метра восходящей или нисходящей аорты и т.п. Одним из наиболее
распространенных показателей, применяемых для характеристики раз-
вития легочных сосудов, является индекс Nakata (1984) (рис. 2-6). Он
отражает отношение площади поперечного сечения легочных артерий
(сразу проксимальней отхождения первых долевых ветвей) к поверх-
ности тела. Расчеты производят на основании данных эхокардиогра-
фического или ангиокардиографического исследования.
Рис. 2-6. Схема измерения диаметров левой (ЛЛА) и правой (ПЛА)
легочных артерий.
Индекс Наката (мм2/м2) = (SUJ1A + Sjijia)/BSA ,
где SnjlA - площадь поперечного сечения правой легочной артерии,
SJ1JJA ~ площадь поперечного сечения левой легочной артерии, BSA -
площадь поверхности тела.
Нормальная величина индекса Наката равна ЗЗО±ЗО мм2/м2.
Минимальная величина индекса, необходимая для выполнения не-
которых видов операций:
- для процедуры Фонтена >250 мм2/м2
- для операции Растелли >200 мм2/м2
- для коррекции тетрады Фалло >150 мм2/м2
Сердечный выброс
Сердечный выброс (СВ) - наиболее важный критерий работы серд-
ца, который определяется произведением ударного выброса (УВ) на
частоту сердечных сокращений (ЧСС). Для стандартизации измерений
принято рассчитывать эти показатели на 1м2 поверхности тела, и тогда
они обозначаются как сердечный (СИ) или ударный (УИ) индексы. При
развитии сердечной недостаточности в первую очередь изменяются
именно эти параметры, которые и следует определять. Поверхность
тела рассчитывают по номограмме. Можно также использовать сле-
дующую формулу:
22
BSA= (Рост • Bec)l/2 • 0,0165 ,
где BSA - поверхность тела в м2; рост измерен в сантиметрах, вес
в кг.
Необходимо предостеречь от использования у больных с ВПС в
качестве основного показателя сердечной деятельности фракции вы-
броса (ФВ) левого или правого желудочка (т.е. долю от содержащейся
в желудочке крови, которую он в состоянии изгнать в сосуды). Данный
параметр определяют по формуле:
ФВ = (КДО - КСОДКДО,
где КДО - конечный диастолический объем, КСО - конечный сис-
толический объем желудочка.
ФВ является производной многих факторов. В частности, на ее
величину влияет регургитация через атриовентрикулярный клапан или
сброс через ДМЖП. При этом, при наличии формально высокой ФВ,
антеградный кровоток в магистральные сосуды (ударный выброс) мо-
жет быть значительно снижен. В качестве примера рассмотрим сле-
дующие ситуации:
1) у пациента с КДО ЛЖ 60 мл, ФВ=65%, ЧСС= 100 уд/мин; регур-
гитации на митральном клапане нет; СВ = 60 • 0,65 • 100 = 3,9 л/мин;
2) у пациента с КДО ЛЖ 60 мл, ФВ 65%, ЧСС=100/мин, фракция
регургитации на митральном клапане 30%; СВ = [(60 • 0,65) - (60 •
0,65 • 0,3)] • 100 = 2,7 л/мин.
В данном примере у пациента с митральной недостаточностью эф-
фективный сердечный выброс ниже на 30%.
При ВПС возможны значительные колебания конечных диастоли-
ческих объемов желудочков, связанные как с анатомическими причи-
нами, так и с изменениями венозного возврата. В этом случае также
измерение одной только ФВ может привести к ошибкам в трактовке
состояния сердца:
1) у пациента с КДО ЛЖ 60 мл, ФВ =65%, ЧСС=100 уд/мин;
СВ = 60 • 0,65 • 100 = 3,9 л/мин;
2) у пациента с КДО ЛЖ 80 мл, ФВ =65%, ЧСС=100 уд/мин;
СВ = 80 • 0,65 • 100 = 5,2 л/мин.
На данном примере видно, что, при одинаковой ФВ и частоте сер-
дечных сокращений у второго пациента сердечный выброс в 1,3 раза
выше, чем у первого. Аналогично этому критически низкий СВ может
иметь место при формально удовлетворительной ФВ.
В связи с вышеуказанным основными показателями, отражающи-
ми насосную функцию сердца в аспекте обеспечения системного кро-
вообращения, следует считать эффективный (антеградный) ударный
23
выброс крови в аорту и СИ, рассчитываемый на его основе. При эхо-
кардиографическом исследовании эти показатели целесообразно вы-
числять по объемному кровотоку в восходящей аорте [4].
Систолическая сердечная недостаточность
Данная форма сердечной недостаточности обычно связана с нару-
шенной сократимостью миокарда и проявляется снижением выброса
крови в магистральные сосуды. В этом случае сердце не может адек-
ватно (по закону Франка-Старлинга) увеличить ударный объем в от-
вет на увеличение преднагрузки. При ВПС могут присутствовать как
ишемические, так и гипоксические механизмы первичного поражения
сократительного миокарда. В некоторых случаях эти повреждения яв-
ляются следствием внутриутробной гипоксии плода.
С другой стороны сердечная недостаточность может развиться при
нормальной контрактильной функции миокарда из-за наличия механи-
ческого препятствия выбросу (аортальный стеноз, коарктация аорты, ле-
гочный стеноз). В этих случаях ударный объем возрастает непосредст-
венно после хирургического устранения препятствия [5]. Однако если
операцию не выполняют, постоянная высокая постнагрузка в итоге при-
водит к нарушению сократимости миокарда и развитию застойной сер-
дечной недостаточности. В этой фазе сердце, в отличие от здорового,
становится чувствительным даже к малым изменениям постнагрузки,
легко нарушающим его функцию. Расчет показателей, характеризующих
систолическую дисфункцию миокарда, приводится в главе 4.
Диастолическая сердечная недостаточность
Диастолическая сердечная недостаточность отражает ситуацию, при
которой сердце не в состоянии принять необходимый венозный возврат.
Это может быть связано с препятствиями наполнению (стенозы атрио-
вентрикулярных клапанов или коллекторов легочных вен, трехпредсерд-
ное сердце) или плохой релаксацией желудочков. При диастолической
дисфункции, как правило, требуется повышенное венозное давление для
поддержания адекватного сердечного выброса. У новорожденных часто
наблюдается временная физиологическая «жесткость» правого желудоч-
ка. Сочетание последнего фактора с повышенной постнагрузкой (вслед-
ствие стеноза полулунных клапанов или высокого ОЛС) приводит к бы-
строму развитию синдрома низкого сердечного выброса вскоре после
рождения. Расчет показателей, характеризующих диастолическую дис-
функцию миокарда, приводится в главе 4.
В большинстве случаев нарушения систолической и диастоличе-
ской функций сердца сочетаются.
24
Литература
1. Rudolph А.М., Неутапп М.А., Spitznas U. Hemodynamic considerations in the de-
velopment of narrowing of the aorta // Am. J. Cardiol.- 1972.- Vol. 30.- P. 514-525.
2. Егорова И.Ф., Шарыкин А.С., Туманян М.Р. и др. Жировая дистрофия миокар-
да у больных с тетрадой Фалло // Архив патологии.- 2003.- № 4,- С. 40-42.
3. Castaneda A.R., Jonas R.A., Mayer J.E., Hanley F.L. Cardiac surgery of the neonate
and infant. - Philadelphia: W.B.Saunders Comp., 1994.
4. Иваницкий А.В., Константинова B.M., Косенко А.И., Горбачевский С.В. Оцен-
ка показателей гемодинамики у больных с врожденными пороками сердца и
легочной гипертензией с помощью допплерэхокардиографии: Пособие для вра-
чей. - М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2001.
5. Шарыкин А.С., Ильин В.Н., Рогова ТВ, Ильина О.Н. Результаты хирургическо-
го лечения коарктации аорты у грудных детей с резким снижением насосной
функции левого желудочка // Грудная и серд.-сос. хир.- 1992.- № 9-10.- С. 9-11.
25
Глава 3. КРОВООБРАЩЕНИЕ ПЛОДА
И НОВОРОЖДЕННОГО
Как известно, циркуляция крови у плода организована по принци-
пам, отличающимся от постнатального периода. После рождения про-
исходят процессы перестройки кровообращения, определяемые гене-
тической программой. При наличии ВПС реализуются отклонения от
данной программы, приводящие к перегрузкам различных отделов серд-
ца, гипоксии или ишемии органов и тканей. Их комбинации влияют на
развитие критических состояний, прогноз заболевания, терапевтиче-
скую и хирургическую тактику. Представление об этих процессах яв-
ляется необходимым для врачей, осуществляющих диагностику и ле-
чение ВПС. Основные особенности естественной перестройки крово-
обращения приводятся в настоящей главе, патологической - в главах,
посвященных соответствующим ВПС.
3.1. Кровообращение плода
Принципиальной особенностью плода является то, что легкие не
участвуют в оксигенации крови, они заполнены жидкостью и облада-
ют высоким сопротивлением кровотоку. Функцию газообмена выпол-
няет плацента. Несмотря на то что парциальное давление кислорода
(рО2) в крови пуповины почти в два раза ниже, чем у матери (55±7 и
100±15 мм рт. ст. соответственно), ткани плода получают достаточное
количество кислорода за счет фетального гемоглобина (обладающего
повышенной способностью связывать кислород) и ускоренного кро-
вотока в фетоплацентарной системе [1].
Оксигенированная кровь от плаценты по венозному протоку по-
ступает в нижнюю полую вену (НПВ), однако туда же собирается и
венозная кровь из печени и нижней половины туловища (рис. 3-1).
Таким образом, при впадении в правое предсердие кровь уже не
является сугубо артериальной. В свою очередь, в систему верхней по-
лой вены (ВПВ) собирается венозная кровь от верхней половины ту-
ловища, головы. Оба потока крови впадают в правое предсердие, где
неизбежно перемешиваются. Считается, что около трети более оксиге-
нированной крови из НПВ в дальнейшем направляется через откры-
тое овальное окно преимущественно в левое предсердие, а смесь ме-
нее оксигенированной (из ВПВ) и двух третей оксигенированной кро-
ви из НПВ - в правый желудочек. Так как к потоку крови в левом пред-
сердии дополнительно примешивается небольшой объем венозной кро-
26
ви из нефункционирующих легких, разница в рО2 между потоками не
может быть значительной. Это подтверждается и отсутствием гипок-
сии соответствующих отделов организма. Как было указано выше, плод
и так развивается на предельно допустимой величине рО2. Таким об-
разом, одной из характерных особенностей внутриутробного кровооб-
ращения является то, что в аорту и легочный ствол поступает сме-
шанная артериовенозная кровь с примерно одинаковым парциаль-
ным давлением кислорода. При этом насыщение гемоглобина кисло-
родом в правом и левом желудочках также различается незначительно,
составляя около 50 и 60% соответственно [2]. Это определяет толе-
рантность плода к некоторым порокам сердца.
Рис. 3-1. Схема кровообращения плода. ПЖ - правый желудочек,
ЛЖ - левый желудочек, ВПВ - верхняя полая вена, ПП - правое предсердие,
ЛП - левое предсердие, НПВ - нижняя полая вена, нисх. аорта - нисходящая аорта.
Белые стрелки - артериальная кровь, черные стрелки - венозная кровь, серые
стрелки - смешанная кровь.
27
Для нормального кровоснабжения всех отделов организма плода
необходимо наличие так называемых фетальных коммуникаций - от-
крытого овального окна и открытого артериального протока (ОАП).
Через первое кровь из правого предсердия попадает последовательно
в левое предсердие, левый желудочек и далее в восходящую аорту, рас-
пределяясь в коронарные артерии, в сосуды головы и верхних конеч-
ностей. Небольшой остаточный объем крови (около 10%) направляет-
ся в нисходящую аорту через ее перешеек (зона между левой подклю-
чичной артерией и ОАП).
Другая часть крови из правого предсердия попадает в правый же-
лудочек и легочный ствол. В дальнейшем этот поток разделяется на
основной, направляющийся через ОАП в нисходящую аорту, и неболь-
шой (из-за высокого сопротивления) второстепенный, направляющийся
в легочные артерии (около 4-10%). Таким образом, кровообращение в
нижней половине туловища плода и плаценте осуществляется в основ-
ном правым желудочком, на который внутриутробно выпадает боль-
шая нагрузка, чем на левый. Данный факт подтвержден многочислен-
ными эхокардиографическими исследованиями плода, показывающи-
ми преобладание размеров правого желудочка над размерами левого
(отношение размеров полости правого желудочка к полости левого же-
лудочка в норме составляет 1,2:1) [3]. Для того чтобы в аорту могла
попадать кровь, изгоняемая как левым, так и правым желудочками, они
должны развивать практически одинаковое давление и работать син-
хронно. В связи с этим понятие «сердечный выброс» плода подразуме-
вает суммарный выброс обоих желудочков (в постнатальном периоде
понятие сердечного выброса относится к левому желудочку). При этом
доля левого и правого желудочков для плодов животных составляет 33
и 67% соответственно, для плода человека - 45 и 55% (из-за большей
массы головного мозга) [4]. Распределение кровотока по органам в про-
центах от суммарного сердечного выброса, полученное при исследо-
вании плодов животных, представлено в таблице 3-1.
Характерно, что сердце плода не может увеличить ударный объем
при снижении частоты сердечных сокращений. Это связано с незрело-
стью миокарда, повышенной его жесткостью. Таким образом, бради-
кардия при каком-либо дистрессе приводит к существенному падению
сердечного выброса.
Суммарный сердечный выброс увеличивается с ростом плода, при
этом меняется доля крови, притекающей к различным отделам. В част-
ности, кровоснабжение плаценты уменьшается, а мозга, легких, желу-
дочно-кишечного тракта - увеличивается. Как показывают современные
28
Таблица 3-1
Распределение органного кровотока в процентах от суммарного
сердечного выброса у нормальных плодов животных [1]
(с сокращениями)
Орган % от сердечного выброса Объемый кровоток (мл/мин/100 г массы)
Сердце 3 180
Мозг 3 125
Верхняя половина туловища 18 25
Легкие 8 100
ЖКТ 4 70
Почки 2 150
Надпочечники 0,1 200
Селезенка 1 200
Печень 1,5 20
Нижняя половина туловища 16 25
Плацента 45 -
ультразвуковые исследования, в норме потоки крови через овальное ок-
но и легочное русло возрастают по экспоненте по мере развития бере-
менности, достигают 20-25% от суммарного выброса желудочков и ос-
таются неизменными на протяжении второго и третьего триместров [5].
Важным является тот факт, что существуют два параллельных, а
не последовательных круга кровообращения, как в постнатальном пе-
риоде. Это позволяет легко перераспределять, при необходимости, по-
токи крови между правой и левой половинами сердца. Данный меха-
низм позволяет быстро реагировать на изменения сосудистого сопро-
тивления в различных отделах организма и компенсировать большин-
ство нарушений кровообращения, возникающих при развитии ВПС.
3.2» Кровообращение новорожденного
Рассмотрим основные процессы, происходящие после рождения
ребенка. В этот период прекращается плацентарный кровоток, функ-
ция газообмена переходит к легким, и закрываются фетальные комму-
никации. Малый и большой круги кровообращения становятся после-
довательными. Сопротивление легочных сосудов прогрессивно сни-
жается из-за их раскрытия, а в артериальном русле - повышается (из-
за потери плаценты, обладающей низким сопротивлением).
После первого вдоха и начала легочной вентиляции резко возрас-
тает легочный кровоток, происходит перераспределение сердечного вы-
броса, меняется нагрузка на правый и левый желудочки. Весь поток
крови из легких теперь возвращается в левый желудочек, существенно
29
превышая объем, попадавший в него внутриутробно. Как показали ис-
следования на животных, сразу после рождения увеличение выброса
правого желудочка составляет около 17%, в то время как левого - до
130%. Это сопровождается почти двухкратным возрастанием потреб-
ления кислорода (доставку которого к тканям обеспечивает левый же-
лудочек). Механизмы данного явления до последнего времени не ясны,
учитывая, что миокард плода не располагает резервами для существен-
ного увеличения работы в ответ на объемную нагрузку [2]. Возможную
роль в данных процессах играют катехоламины и тиреоидные гормоны,
концентрация которых высока в сыворотке новорожденных.
При нормальном течении послеродового процесса сердечный вы-
брос и потребление кислорода постепенно снижаются к 6-й неделе.
Устанавливаются нормальные гемодинамические режимы работы же-
лудочков - правого, нагнетающего кровь в легочные сосуды с относи-
тельно низким сопротивлением, и левого, нагнетающего кровь в боль-
шой круг кровообращения с высоким сосудистым сопротивлением.
Окончательные формальные параметры работы правого и левого отде-
лов сердца приведены на рис. 3-2.
полые
вены
(70%)
легочные
вены
(100%)
Рис. 3-2. Нормальное давление и SO2 (в скобках) в полостях сердца.
ЛА - легочная артерия, Ао - аорта, ПЖ - правый желудочек, ЛЖ - левый желудочек,
ПП - правое предсердие, ЛП - левое предсердие, Рср. - среднее давление.
30
В норме давление в правом желудочке и легочной артерии состав-
ляет 20-30% от системного давления, насыщение в правых отделах серд-
ца колеблется от 65 до 80%, в левых - от 95 до 98%. У новорожденных
или седатированных детей оно может быть ниже.
Общее легочное сопротивление
Общее легочное сопротивление (ОЛС) в первые 24 часа после ро-
ждения уменьшается на -70% по сравнению с исходным, однако дав-
ление в легочной артерии все еще остается на уровне 60-85% от сис-
темного. Постепенная его нормализация происходит к 14 суткам, а мо-
жет затягиваться и до 1,5 мес. Что касается морфологической постна-
тальной перестройки легочных сосудов, то она заканчивается к 2-3
месяцам [6].
В процессе быстрого снижения ОЛС важную роль играют кисло-
род и ряд вазоактивных субстанций, вырабатываемых в родах. Как из-
вестно, внутриутробно рО2 в легочной артерии животных составляет
не более 20 мм рт. ст., что поддерживает констрикцию легочных сосу-
дов. Как показали опыты на новорожденных телятах, искусственное
снижение у них рО2 до такой величины приводит к значительному по-
вышению ОЛС и уменьшению кровотока [7]. И наоборот, повышение
рО2 сопровождается увеличением легочного кровотока. На резистент-
ность легочных сосудов влияют также продукты метаболизма арахи-
доновой кислоты, наиболее важными из которых являются простаг-
ландины (PGE, PGD) и простациклин (PGI2). К повышению продук-
ции последнего приводят растяжение легких или их механическая сти-
муляция, действие брадикинина и ангиотензина-П. Кроме того, при де-
грануляции тучных клеток высвобождаются гистамин и PGD, которые
у новорожденных вызывают снижение давления и сопротивления в ле-
гочных сосудах [2]. Интересно, что гистамин и PGD в последующем
действуют иначе и у взрослых вызывают вазоконстрикцию.
Помимо релаксации стенки сосудов происходят и структурные ее
изменения. Вплоть до 8 недель жизни уменьшение резистентности лег-
ких продолжается вследствие утончения медиального слоя легочных
артериол. Процесс снижения ОЛС может длиться и в последующие
годы, когда основным механизмом становится увеличение количества
функционирующих легочных альвеол и связанных с ними сосудов.
Функция открытого овального окна
В результате начала дыхания легочный кровоток после рождения
возрастает в 8-10 раз, что сопровождается повышением венозного воз-
врата к левому предсердию и давления в нем. В сочетании со сниже-
31
нием венозного возврата к правому предсердию (из-за прекращения
плацентарного кровотока) это приводит к выравниванию давления ме-
жду предсердиями и закрытию овального окна посредством клапана,
образованного первичной перегородкой со стороны левого предсер-
дия. У нормальных новорожденных кровоток через открытое оваль-
ное окно в 92% случаев продолжает регистрироваться в течение пер-
вого часа после рождения, но быстро уменьшается к 24 часам [8]. К 4-
5-му дню жизни он сохраняется у 47% детей. Основное направление
потока - слева направо, однако в 64% случаев имеется также неболь-
шой поток справа налево в период диастолы. Направление и величина
шунта определяются градиентом давления между предсердиями. Так
как давление в этих камерах в норме низкое, изменение даже на 1 мм
рт. ст. сказывается на направлении потока крови. На давление в пред-
сердиях, помимо притекающей крови, влияют растяжимость желудоч-
ков, емкость венозных систем малого и большого кругов кровообра-
щения, наличие сброса на уровне ОАП. Так как у новорожденных пра-
вый желудочек менее растяжим, чем левый, это может приводить к
более высокому давлению в правых отделах и шунту справа налево
именно в период диастолы.
Механизм шунтирования крови через открытое овальное окно ва-
жен для «разгрузки» предсердий при некоторых ВПС или патологии
легких. Так, у детей с персистирующей фетальной циркуляцией высо-
кая резистентность легочных сосудов приводит к повышенному дав-
лению в правых отделах и преобладанию сброса крови справа-налево.
Такой же сброс кратковременно возникает при плаче или кормлении
ребенка, что может проявляться легким цианозом. Сброс через оваль-
ное окно слева направо может сопровождать ОАП, который создает
повышенный венозный возврат к левому предсердию.
Анатомическое закрытие овального окна наступает к 1-2-м годам
жизни. Однако при дисбалансе развития различных частей межпред-
сердной перегородки может иметь место некомпетентность клапана и
сохранение отверстия открытым [9]. Другой причиной персистирую-
щего открытого овального окна (вплоть до взрослого возраста) являет-
ся неполное слияние первичной и вторичной перегородок с остаю-
щимся косым расщеплением между двумя предсердиями [2].
Функция открытого артериального протока
Функционирование артериального протока после рождения в нор-
ме может сохраняться в течение нескольких часов или дней. Сброс
крови справа налево, обычный для внутриутробного периода, значи-
тельно уменьшается после окклюзии пуповины [10]. По мере падения
32
ОЛС и давления в легочной артерии возникает двунаправленный, а за-
тем преимущественно лево-правый поток крови через ОАП. Закрытие
его проходит два этапа: первичное функциональное закрытие, связан-
ное с сокращением гладких мышц в стенке протока, и окончательное
закрытие, определяемое деструкцией эндотелия, пролиферацией кле-
ток под интимой сосуда и формированием соединительной ткани.
Среди многих моментов в данном процессе можно выделить два
ведущих фактора. Стенка протока, состоящая из так называемой дук-
тальной ткани, высокочувствительна к простагландинам группы Е и
кислороду, которые оказывают на нее разнонаправленное действие. Как
известно, проходимость ОАП - не пассивное состояние, оно поддер-
живается высокой концентрацией в крови плода PGE, которые выра-
батывает преимущественно плацента. После родов плацента теряется
в качестве источника этих веществ. Кроме того, усиление легочного
кровотока приводит к их повышенному метаболизму в легких. Дан-
ные процессы сопровождаются выраженным падением концентрации
простагландинов в крови ребенка и спазмом протока. Кислород обла-
дает дополнительным и существенным действием на рецепторы глад-
комышечных волокон в стенке протока, вызывая их сокращение. В связи
с этим повышение рО2 в крови после перехода к постнатальному кро-
вообращению является одним из механизмов закрытия протока. Дру-
гие вазоактивные субстанции играют значительно меньшую роль в про-
цессе закрытия ОАП; повышенный объем циркулирующей крови спо-
собствует более длительному функционированию протока.
Таким образом, кровообращение новорожденного отличается вы-
соким динамизмом, постоянным чутким «откликом» на происходящие
изменения во внешней и внутренней средах. Требования к работе сердца
могут меняться в зависимости от температуры воздуха, перенесенной
гипоксии, наличия ВПС и т.д. Инфузия дополнительного объема жид-
кости в организм ребенка может поддерживать проходимость феталь-
ных коммуникаций, а дыхание смесями с высоким содержанием ки-
слорода - вызывать ускоренное закрытие ОАП. Все это необходимо
учитывать при планировании терапии проблемных состояний, возни-
кающих у новорожденных с ВПС.
Литература
1. Soothill P.W. et al- 1986 (цит. по: Дементьева ГМ. Профилактическая и пре-
вентивная неонатология. Низкая масса тела при рождении. Гипоксия плода и
новорожденного. - М., 1999).
2. Moss & Adams. Heart disease in infants, children, adolescents, including the fetus
and young adult. 5,h ed. - Williams&Wilkins, 1989.
33
3. Затикян Е.П. Кардиология плода и новорожденного. - М.: Инфо-Медиа, 1996.
4. Эммануилидис F.K., Байлен Б.Г Сердечно-легочный дистресс у новорожден-
ных. - М.: Медицина, 1994.
5. Sutton M.S., Groves A, MacNeill A. et al. Assessment of changes in blood flow
through the lungs and foramen ovale in the normal human fetus with gestational
age: a prospective Doppler echocardiographic study // Brit. Heart J.- 1994.- Vol. 71.-
P. 232-237.
6. Есипова И.К., Кауфман О.Я. Постнатальная перестройка малого круга крово-
обращения и ателектаз новорожденных. - Л., 1968.
7. Rudolph А.М., Yuan S. Response of the pulmonary vasculature to hypoxia and H+ ion
concentration changes // J. Clin. Invest.- 1966.-Vol. 45.- P. 399-411.
8. Hiraishi S., Agata Y., Saito K. et al. Interatrial shunt flow profiles in newborn in-
fants: A colour flow and pulsed Doppler echocardiographic study // Brit. Heart J.-
1991.- Vol. 65.- P. 41-45.
9. Pagtakhan R.D., Hartmann A.F.Jr., Goldring D., Kissane J. The vavlve-incompe-
tent foramen ovale: a report on seven infants with left-to-right atrial shunt // J. Pedi-
atr.- 1967.-Vol. 71.- P. 848-854.
10. Teitel D.F., Iwamoto H.S., Rudolph A.M. Effects of birth-related events on central
blood flow patems // Pediatr. Res.- 1987.- Vol. 22.- P. 557-566.
34
Глава 4. АЛГОРИТМЫ И МЕТОДЫ ДИАГНОСТИКИ
ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА
А.С. Шарыкин, Е.Г. Верченко
Своевременная помощь больным с врожденными пороками серд-
ца может быть оказана только при ранней диагностике заболевания, а
ее эффективность прямо коррелирует с эффективностью взаимодейст-
вия акушеров, неонатологов, реаниматологов, детских кардиологов,
контролирующих процесс беременности, родов и состояние детей.
Оптимальная диагностика в детской кардиологии складывается из
трех основных этапов: пренатальная диагностика (женская консульта-
ция, роддом), постнатальная диагностика (роддом, отделение детской
кардиологии), отложенная диагностика (детские медицинские учреж-
дения, участковый педиатр).
4.1. Пренатальная диагностика
Общие вопросы пренатальной диагностики
В основе раннего выявления любого врожденного порока разви-
тия лежит хорошо организованный скрининг беременных женщин.
Учитывая тот факт, что систематическое ультразвуковое акушерское
обследование существует далеко не во всех странах, а эксперты прена-
тальной кардиологии работают только в крупных научно-практических
центрах, были определены соответствующие показания для направле-
ния на квалифицированную фетальную эхокардиографию (ФЭХОКГ).
К настоящему времени в факторы риска для женщин включают: 1) на-
личие в семейном анамнезе ВПС, синдромальной патологии или арит-
мий; 2) контакт матери с тератогенными факторами или инфекция на
ранних сроках беременности (особенно вирусная); 3) диабет или забо-
левания соединительной ткани у матери; 4) прием лекарств (ингибито-
ры синтеза простагландинов, антиконвульсанты); 5) первые роды в воз-
расте старше 37 лет. Кроме того, существуют факторы риска, относя-
щиеся к самому плоду: 1) нестандартная картина четырех камер серд-
ца при ультразвуковом исследовании; 2) выявленные экстракардиаль-
ные аномалии плода (правостороннее расположение желудка, омфало-
целе, генитально-уринарная патология, гидроцефалия, диафрагмаль-
ная грыжа); 3) неиммунная водянка плода; 4) задержка развития или
аритмия плода; 5) нарушения кариотипа плода.
Как правило, основное количество пациенток («55%) на ФЭХОКГ
направляют акушеры, обнаружившие отклонения при плановом ульт-
35
развуковом скрининге (необычная картина четырех камер сердца или
наличие экстракардиальных проблем). Однако, как показывает опыт
западной Европы и США, даже при грубых изменениях четырехка-
мерной проекции, сопровождающих полную форму атриовентрикуляр-
ного канала или гипоплазию левого сердца, подозрение на ВПС воз-
никает только в половине случаев. В целом же среди всех новорожден-
ных, у которых коррекция ВПС необходима на первом году жизни, толь-
ко в 18% случаев диагноз ставится пренатально [1]. Еще хуже обстоят
дела среди беременных без факторов риска, например, в Нидерландах
этот показатель составляет всего 4,5% [2]. Такой низкий процент вы-
являемое™ ВПС связывают с невысокой квалификацией врачей в об-
ласти неонатальной и фетальной кардиологии, несовершенством ис-
пользуемой аппаратуры, недостаточным охватом беременных система-
тическим ультразвуковым скринингом. Редкие специалисты могут по-
лучить достаточный опыт пренатальной диагностики, так как случаи с
ВПС «размываются» по различным учреждениям. Не случайно для на-
учных публикаций используют совместные данные нескольких цен-
тров. За последние годы наметился определенный прогресс в области
ФЭХОКГ, однако результаты все еще далеки от идеальных. Средний
уровень выявляемое™ ВПС в Западной Европе составляет 19-48%, в
Восточной - 8% [3]. Для изолированных аномалий уровень диагно-
стики не превышает 16%, в то время как для ВПС, ассоциированных с
экстракардиальной патологией, он значительно выше. Однако и в по-
следней группе имеется значительный разброс данных: в странах, где
не используют обязательный ультразвуковой скрининг беременных, до-
ля диагностированных пороков составляет 17,9%, при рутинном одно-
кратном сканировании плода - 46,0%, при двух - трехкратном иссле-
довании - 55,6% [4]. Точную диагностику ВПС обычно проводят в уч-
реждениях, имеющих специалистов по пренатальной кардиологии; при
этом результаты существенно улучшаются, приближаясь к 100%.
Каковы же возможности внутриутробной диагностики? Сущест-
вуют четыре основные группы патологий сердца, которые можно иден-
тифицировать: 1) врожденные пороки сердца; 2) нарушения ритма;
3) опухоли сердца; 4) поражения миокарда.
Считают, что на результат пренатального исследования влияют в
основном технические причины (разрешающая способность прибора,
срок беременности, толщина передней брюшной стенки матери, поло-
жение и размер плода, накопленный опыт). Однако значительная роль
принадлежит также особенностям формирования и гемодинамики раз-
личных ВПС. Несмотря на то, что анатомические детали сердца плода
36
можно видеть с 12-14недель, проявления различных ВПС могут зна-
чительно отличаться, что определяет сроки их диагностики. Пороки,
при которых изменяются размеры желудочков (синдром гипоплазии
левого сердца, трикуспидальная атрезия, единственный желудочек),
пренатально выявляют значительно чаще, чем прочие (46,0% и 24,0%
соответственно, р <0,001). Некоторые пороки - транспозиция магист-
ральных артерий, атриовентрикулярный канал, двойное отхождение со-
судов от правого желудочка, общий артериальный ствол, аномалия Эб-
штейна - имеют характерные анатомические признаки, существующие
с момента возникновения, что позволяет обнаруживать их сравнитель-
но рано. При других патологиях возможность диагностики меняется
со сроком беременности. В частности, изолированный небольшой
ДМЖП может закрыться спонтанно. С другой стороны, из-за отсутст-
вия во время внутриутробного развития градиента давления между же-
лудочками, невозможно зарегистрировать сброс крови через неболь-
шой дефект. Поэтому до 68% ДМЖП не диагностируют пренатально.
Тетрада Фалло вплоть до момента рождения нередко трактуется как
подаортальный ДМЖП. Развитию существенного градиента давления
в местах сужения выводных отделов желудочков и крупных сосудов
препятствуют внутрисердечные физиологические шунты. Это затруд-
няет диагностику в первой половине беременности таких патологий,
как стенозы легочного и аортального клапанов, коарктация аорты.
При наличии обструкции в выводных отделах желудочков их раз-
витие, как и развитие магистральных сосудов, обычно замедляется, что
можно обнаружить с помощью динамических исследований. Задерж-
ка развития легочных ветвей, преждевременное закрытие открытого
овального окна - процессы, которые обычно обнаруживают в третьем
триместре беременности. Позднее начало имеют такие заболевания,
как фиброэластоз эндокарда, опухоли, кардиомиопатия, аневризма же-
лудочка. Это подчеркивает необходимость повторного контроля при
наличии каких-либо подозрительных отклонений в изображении сердца
плода. Оптимальными считают исследования при сроках 18-20 и
26-28 недель [5].
Трансвагинальное УЗИ в период 11-14 недель - альтернатива тра-
диционному трансабдоминальному исследованию. При этом основную
проекцию 4-х камер удается получить в 90-100% случаев, однако чис-
ло выявленных ВПС составляет не более 41-64% [6, 7]. Этот метод
может быть полезен при тяжелых пороках, которые выявляют в 73-85%
случаев, что дает возможность рано ставить показания к прерыванию
беременности. Однако для большинства пороков чувствительность его
недостаточно высока, и это не позволяет полностью исключить более
позднее трансабдоминальное исследование.
37
При обнаружении ВПС беременность ведут, ориентируясь на дан-
ные о естественном течении отдельных пороков и другие факторы рис-
ка. Анализ публикаций на эту тему свидетельствует, что среди сохра-
няемых плодов с ВПС средняя смертность довольно высока - 11-12%.
А вскоре после родов умирают еще от 19 до 43% детей. Это оправды-
вает решение родителей о прерывании беременности более чем в 60%
случаев диагностики ВПС. Однако при этом надо стремиться к ранней
идентификации патологии плода, так как относительно безопасное вме-
шательство возможно только до 24-х недель.
Факторами, оказывающими негативное влияние на прогноз, явля-
ются сердечная недостаточность и комплексный характер ВПС. Как
показывает анализ внутриутробного течения различных ВПС, наибо-
лее часто тяжелую сердечную недостаточность, проявляющуюся во-
дянкой плода, дают патологии, при которых развивается несостоятель-
ность клапанов (атриовентрикулярный канал, аномалия Эбштейна, об-
щий артериальный ствол и т.п.), поражается сократительный миокард
(дилатационная кардиомиопатия, фиброэластоз эндокарда) или имеет-
ся полный атриовентрикулярный блок. Как правило, данные заболева-
ния сопровождаются увеличением кардиоторакального индекса, и этот
показатель является одним из наиболее заметных для акушеров, вы-
полняющих фетальную эхокардиографию.
Влияние пренатальной диагностики
на течение некоторых ВПС
Потенциальное влияние пренатальной диагностики на состояние
детской кардиологии может быть достаточно серьезным. Основной эф-
фект, как указано выше, касается снижения количества ВПС (вследст-
вие прерывания беременностей), особенно тяжелых форм, которые хо-
рошо диагностируются внутриутробно. Существует, однако, еще одна
область влияния - постнатальная терапия, от своевременности кото-
рой в ряде случаев зависит судьба детей, все же родившихся с крити-
ческими ВПС. Пренатальное выявление пороков позволяет организо-
вать роды в специализированных центрах, располагающих возможно-
стями для такой терапии или хирургического вмешательства, избежать
опасностей транспортировки, углубления гипоксии или ацидоза и свя-
занных с ними неврологических осложнений. Ускоряется также обсле-
дование детей после рождения. Более детальный анализ отдельных па-
тологий показывает, однако, что эффект от пренатальной диагностики
не настолько велик, как ожидалось. В публикациях, посвященных это-
му вопросу, наибольшее внимание уделяют порокам, сопровождающим-
ся высоким процентом критических состояний после рождения (транс-
позиция магистральных артерий, обструктивные поражения левых или
правых отделов сердца, опухоли сердца).
38
Обструктивные поражения левого сердца
с интактной межжелудочковой перегородкой
В данную группу включают синдром гипоплазии левого сердца
(СГЛС), критический аортальный стеноз, атрезию аорты. Несмотря на
то, что патология характеризуется серьезными изменениями структур
сердца, в силу особенностей внутриутробного кровообращения это
обычно не приводит к нарушениям развития плода. Как правило, не-
достаточная функция левого желудочка компенсируется работой пра-
вого желудочка. Однако вскоре после рождения развивается критиче-
ская недостаточность кровообращения, которая приводит к быстрой
гибели ребенка. В связи с этим было бы заманчиво рано диагностиро-
вать порок, заранее выстроить схему лечения и оказать эффективную
помощь. Внутриутробная диагностика выявляет от 18 до 40% плодов с
СГЛС, причем этот процент, благодаря накоплению опыта растет со
временем. От 11 до 60% беременностей прерывают; еще в 12-24% слу-
чаев родители отказываются от операции после рождения ребенка.
Наиболее ранним симптомом формирования СГЛС является ог-
раниченная подвижность створок митрального клапана. Среди харак-
терных признаков атрезии аорты отмечают ретроградное направление
кровотока в дуге аорты. К плохим прогностическим признакам отно-
сят резкое снижение насосной функции левого желудочка, выражаю-
щееся в малых изменениях его объема в систолу и диастолу, а также
развитие фиброэластоза. Все подобные больные умирают в пределах
одной недели, несмотря на попытки хирургического вмешательства [8].
Может ли фетальная диагностика повлиять на прогноз при СГЛС?
Так как дети с такой диагностикой подвергаются более ранней тера-
пии после рождения, это обеспечивает несколько лучшие показатели
pH, мочевины и креатинина сыворотки крови; более редки случаи по-
ражения головного мозга из-за метаболических расстройств по срав-
нению с группой, в которой диагноз поставлен постнатально. Счита-
ется, что ранняя терапия снижает количество послеоперационных нев-
рологических осложнений (судороги, коматозное состояние) и улуч-
шает неврологический статус в отдаленном периоде. Однако сущест-
венно изменить течение порока не удается. Среди всех выявленных
внутриутробно больных с СГЛС суммарная выживаемость не превы-
шает 14^40%. Результаты операций определяются в основном хирур-
гической техникой и анатомическими подтипами сердца.
Коарктация аорты
Коарктация аорты (КА) может входить в синдром гипоплазии ле-
вого сердца или быть самостоятельным заболеванием. Пренатальная
39
диагностика изолированной КА представляет сложную задачу, так как
и в норме имеется определенное сужение аорты на уровне перешейка.
В связи с этим для выявления патологических отклонений необходима
количественная характеристика диаметра аорты. Исследования Horn-
berger L.K. et al. [9] на нормальных плодах показали, что для каждого
гестационного срока отношения внутренних диаметров дуги, перешей-
ка, нисходящей аорты и корня аорты к восходящей аорте являются по-
стоянными величинами (0,94; 0,81; 0,96 и 1,13 соответственно). При
развитии коарктации аорты диаметры дуги и перешейка становятся ни-
же трех перцентилей. Наряду с этим увеличивается отношение разме-
ров левой сонной артерии к дуге аорты (с 0,48 до 0,77). При измерении
скорости кровотока отмечают ее увеличение в нисходящей аорте и сни-
жение в восходящей [10]. Наряду с этим диаметр легочного ствола в
два раза превышает диаметр дуги аорты.
Среди других патогномоничных для коарктации симптомов харак-
терным является значительное преобладание размеров правого желудоч-
ка над размерами левого. Обычно обнаружив подобную 4-камерную про-
екцию, акушеры рекомендуют провести экспертное исследование плода,
в том числе на коарктацию аорты. Однако диспропорция желудочков мо-
жет сопровождать другие аномалии сердца, также как и внесердечную
патологию (триплоидия, аневризма вены Галена, гидронефроз и др.) [11],
поэтому прямая визуализация аорты более предпочтительна.
Пренатальная диагностика может существенно улучшить прогноз у
детей с коарктацией аорты, так как позволяет рано прибегнуть к терапии
простагландинами и оперативному вмешательству. Учитывая хорошие
результаты хирургического лечения порока, показания к прерыванию
беременности обычно ограничены.
Транспозиция магистральных артерий сердца
Транспозиция магистральных артерий сердца (ТМА) - патология,
диагностировать которую с помощью только одной проекции четырех
камер невозможно: сердце практически не изменяется в размерах, сер-
дечная недостаточность не развивается, гипоксии плода нет. Так как
порок не мешает развитию плода и сравнительно редко сочетается с
хромосомными аномалиями, существует мало причин, по которым аку-
шеры направляют беременных на фетальную эхокардиографию. В ре-
зультате частота пренатальной диагностики ТМА составляет не более
4%. Введение в широкую практику визуализации выводных отделов
желудочков может существенно повысить выявляемость этого порока
и повлиять на прогноз. Большую роль играет также диагностика от-
клонений в формировании структур, жизненно необходимых при ТМА.
40
Существует немало наблюдений, в которых новорожденные с ТМА уми-
рали вскоре после рождения (в сроки от нескольких часов до 5 дней)
от выраженной гипоксемии, легочного дистресс-синдрома или внезап-
но. Как оказалось, это связано с выраженным сужением открытого
овального окна в конце беременности и/или преждевременной конст-
рикцией ОАП, которые поддаются пренатальной диагностике. Родо-
разрешение в специализированном центре, немедленное выполнение
процедуры Рашкинда и инфузия простагландинов могут спасти боль-
шинство таких пациентов.
О влиянии пренатальной диагностики на результаты оперативно-
го вмешательства мнения расходятся. Так, Kumar R.K. et al. [12] счита-
ют, что ранняя диагностика снижает риск дооперационной смерти, ус-
коряет поступление больных в стационар и выполнение операции, од-
нако, результат самой операции определяет только коронарная анато-
мия. В то же время, Bonnet D. et al. [13] получили существенное сни-
жение послеоперационной летальности в сравнении с группой, в кото-
рой ТМА была диагностирована постнатально (0 и 8,5% соответствен-
но, р<0,01). Так как максимальное количество операций незначитель-
но (68), окончательно этот вопрос может быть решен только после на-
копления большого объема наблюдений.
Критическая обструкция выводного отдела правого
желудочка с интактной межжелудочковой перегородкой
В данную группу традиционно включают атрезию легочной артерии
с интактной межжелудочковой перегородкой (АЛА+ИМЖП) и критиче-
ский легочный стеноз, так как последний может трансформироваться
внутриутробно в АЛА+ИМЖП. Кроме того, тактика лечения при обоих
пороках практически идентична. Несмотря на сравнительную редкость
данных патологий (около 3,0% всех ВПС), они сопровождаются быст-
рым ухудшением состояния вскоре после родов, в связи с чем привле-
кают внимание исследователей.
На прогноз при АЛА+ИМЖП большое влияние оказывают сте-
пень гипоплазии правого желудочка и наличие правожелудочково-ко-
ронарных сообщений (так называемых «синусоидов»). В связи с этим
делаются попытки уже внутриутробно оценить данные аномалии.
Гипоплазию правого желудочка оценивают по гипоплазии трикуспи-
дального клапана (уменьшение его диаметра на два стандартных от-
клонения и более по сравнению с нормой для данного гестационного
возраста). При атрезии легочной артерии она более выражена и про-
грессирует со временем, в отличие от критического легочного стеноза.
41
Так как это приводит к заметному изменению проекции четырех камер,
ранняя выявляемость порока достигает 36%.
Значительное уменьшение диаметра легочного ствола и сигмовид-
ная форма ОАП свидетельствуют о тяжести порока и часто сочетаются
с правожелудочково-коронарными сообщениями. Цветное допплеров-
ское картирование у этих плодов выявляет характерное направление
кровотока через синусоиды из желудочка в аорту в период систолы и
из аорты в желудочек - в диастолу.
Так как АЛА+ИМЖП является типичной дуктус-зависимой пато-
логией, применение простагландинов сразу после рождения позволя-
ет значительно улучшить раннюю выживаемость детей. Однако в свя-
зи с плохим последующим прогнозом обычной рекомендацией являет-
ся прерывание беременности. Это может приводить к существенному
снижению частоты порока среди живорожденных, что, например, на-
блюдают в Англии [14].
Опухоли сердца
Единичные случаи внутриутробной диагностики опухолей известны
с начала 80-х годов, в нашей стране - с начала 90-х [15]. На экспертную
фетальную эхокардиографию пациентов обычно направляют в связи с об-
наружением дополнительного образования в полости сердца или пери-
карде. Доля пренатальных диагнозов среди всех опухолей детского воз-
раста составляет 21% - 27%, т.е. соответствует среднему уровню выяв-
ления других ВПС (табл. 4-1). Срок диагностики варьирует в широких
пределах, но первые симптомы появляются обычно не ранее 20 недель
беременности. Наиболее частым вариантом является рабдомиома (84-
89%), следующие по частоте - фиброма, тератома, гемангиома; чрезвы-
чайной редкостью являются миксома или злокачественные опухоли.
Таблица 4-1
Частота пренатально выявляемых опухолей сердца
Авторы Год Число обследованных/ Число больных с ВПС Колич. опухолей/ % от числа обследованных / % от ВПС
Holley D.G. ct al. 1995 14000/ - 19/0,14/ -
Yagel S. et al. 1997 22050/ 168 4/0,02/2.4
Fesslova V. et al. 1999 -/847 16/-/ 1,9
Sklansky M. et al. 2000 1382/ 127 2/0,15/ 1,6
Как было показано в работе Nir A. et al. [16], рабдомиома растет
особенно быстро по абсолютным размерам и относительно размеров
желудочка в период от 22 до 32 недель гестации. Затем рост значительно
42
замедляется, хотя может продолжаться вплоть до родов. Рабдомиома
чаще локализуется в стенке желудочков или межжелудочковой перего-
родке, однородна по структуре. При множественных узлах велика ве-
роятность синдромного заболевания - туберозного склероза. В этом
случае прогноз будет определяться в основном степенью поражения
головного мозга и почек.
Единичные большие опухоли, компрометирующие кровообраще-
ние или приводящие к аритмии, могут вызывать гибель плода или ран-
нюю неонатальную смерть. Однако в большинстве наблюдений, осо-
бенно относящихся к рабдомиоме, прогноз благоприятен. Своевремен-
ные хирургические вмешательства, как правило, также сопровожда-
ются хорошим результатом, в связи с чем показания к прерыванию бе-
ременности должны рассматриваться индивидуально [17].
Подводя итоги, можно заключить, что фетальная эхокардиография
играет все большую роль при ВПС. Во-первых, пациентки получают
своевременную информацию о прогнозе заболевания, возможных ва-
риантах лечения и направляются для оказания квалифицированной по-
мощи в соответствующее учреждение. Во-вторых, выявление ВПС ини-
циирует исследования, направленные на выявление наследственной,
генетической патологии, так как эти аномалии часто сочетаются. В
третьих, ставится вопрос о прерывании беременности. Частота абор-
тов колеблется от 4 до 60% и зависит от тяжести выявленной патоло-
гии, времени диагностики, социально-экономического статуса и рели-
гиозных воззрений матери, уровня медицинской помощи в данном ре-
гионе. Более раннее выявление ВПС (до 24 недель) увеличивает коли-
чество вмешательств почти в два раза.
Менее изучено влияние ФЭХОКГ на прогноз при отдельных пато-
логиях. Общий итог исследований можно было бы сформулировать та-
ким образом: пренатальное выявление ВПС (особенно дуктус-зависи-
мых пороков) улучшает их течение в первые дни после рождения вслед-
ствие своевременной кардиологической помощи, но в меньшей степе-
ни влияет на результаты последующего хирургического вмешательства.
К сожалению, широкому распространению ультразвукового скри-
нинга препятствует высокая стоимость исследования и трудности про-
цесса обучения. Учитывая ограниченное количество специалистов вы-
сокой квалификации, пренатальная диагностика может быть разделе-
на на два этапа:
1) традиционный акушерский скрининг беременных, в том числе
относящихся к группам риска, во время которого выявляются анома-
лии сердца или другие заболевания, сочетающиеся с ВПС; пациентка
направляется на квалифицированную эхокардиографию плода;
43
2) экспертная диагностика, осуществляемая в специализирован-
ном кардиологическом отделении, во время которой подтверждается
или отвергается диагноз ВПС, определяются прогноз и варианты ле-
чения.
На первом этапе дается общая характеристика сердца (нормаль-
ное, с отклонениями, оценка затруднена), оцениваются факторы рис-
ка возникновения порока. Вероятность ВПС высока (20-100%) при
аномальном изображении четырех камер сердца, постоянной бра-
дикардии, праворасположенном желудке, нарушенном кариотипе,
омфалоцеле. Значительно реже (в 7-10%) подтверждается ВПС при
наличии таких факторов риска, как диабет, алкоголизм и прием анти-
конвульсантов матерью, ВПС в семье, диафрагмальная грыжа плода.
На втором этапе проводится более детальная характеристика па-
тологии, основанная на сегментарном подходе, с определением висце-
рального ситуса, количественная оценка параметров сердца,
изучение характера и направлений потоков крови. Идентификация
пороков, имеющих плохой прогноз, обычно определяет решение ро-
дителей о прерывании беременности.
При оценке тяжести ВПС в качестве рабочей может быть ис-
пользована следующая классификация (табл. 4-2). В основу ее по-
ложена возможность нормального двухжелудочкового кровооб-
ращения (естественного или после оперативного вмешательства).
Наиболее тяжелую, первую категорию, составляют такие слож-
ные ВПС, как СГЛС, полная форма АВК с дисбалансом желудоч-
ков, атрезия легочной артерии, трикуспидальная атрезия, общий
артериальный ствол, митральная атрезия, атрезия аорты, двупри-
точный левый желудочек. При данных пороках невозможно вы-
полнить полноценную двухжелудочковую коррекцию; они сопро-
вождаются высокой естественной и послеоперационной летально-
стью. Если выявлены пороки первой категории, необходимо
рассмотреть вопрос о возможном прерывании беременности. К вто-
рой категории отнесены аномалии, которые без коррекции приво-
дят к высокой летальности (ДМЖП, тетрада Фалло, транспозиция
магистральных артерий, частичная форма АВК, критический аор-
тальный стеноз, тотальный аномальный дренаж легочных вен, кор-
ригированная транспозиция магистральных артерий). Для этой
категории больных прогноз зависит от эффективности выполненной
операции. Так как можно сохранить двухжелудочковое
кровообращение, в большинстве случаев вероятна нормальная
жизни пациентов. В третью категорию включены относительно
44
простые, не угрожающие жизни патологии (маленький ДМЖП,
небольшой аортальный или легочный стеноз, изолированная дек-
строкардия, двустворчатый аортальный клапан). В большинстве сво-
ем эти ВПС подлежат диспансерному наблюдению, в редких случа-
ях - плановой коррекции; прогноз благоприятный. К четвертой
категории отнесены опухоли сердца, кардиомиопатия, изолирован-
ные аритмии, то есть заболевания, возникшие на фоне анатомиче-
ски нормально сформированного сердца и подвергающиеся в ос-
новном терапевтическому лечению и/или наблюдению. К операции
прибегают только при злокачественном течении заболевания. К пя-
той категории отнесены варианты межпредсердного сообщения
(открытое овальное окно, ДМПП) и ОАП. Эти физиологические
коммуникации внутриутробного периода после рождения расцени-
ваются как патология лишь при персистировании, начиная с опре-
деленного возраста ребенка.
Таблица 4-2
Классификация тяжести пренатально выявляемых поражений сердца
Категория Морфологические характеристики Прогностические характеристики
1 Отсутствуют или гипоплазированы ка- меры сердца, магистральные сосуды или клапаны; или имеются общие кла- паны ВПС являются неоперабельными, неполно- стью коррекгабельными или подлежащими только паллиативным операциям
2 Имеются 4 камеры сердца и 4 клапана, сформированные с серьезными дефек- тами, но поддающимися коррекции ВПС без коррекции приводят к высокой ле- тальности, но могут быть оперированы и при этом сохраняется двухжелудочковос кровооб- ращение
3 Имеются 4 камеры и 4 клапана сердца, сформированные с незначительными дефектами Относительно простые пороки, не угрожаю- щие жизни
4 Заболевания, возникшие на фоне ана- томически нормально сформированно- го сердца Патологии, подвергающиеся в основном тера- певтическому лечению и/или наблюдению; к операции прибегают только при злокачест- венном течении заболевания
5 ОАП, межпредсердное сообщение Физиологические коммуникации во внутри- утробном периоде; после рождения расцени- ваются как патология в сопоставлении с воз- растом пациента
Здесь приведены только наиболее частые аномалии, диагностируе-
мые у плода. Конечно, невозможно перечислить все существующие ВПС
или их комбинации. Однако, как показывает опыт, в каждом конкрет-
ном случае удается оценить имеющиеся морфологические особенности
порока и в соответствии со схемой определить прогноз.
45
4.2. Постнатальная диагностика
Как показывает опыт развитых стран, в постнатальном периоде вы-
явление поражений сердца составляет практически 100%. В нашей стра-
не, к сожалению, эта величина не превышает 50-80% в зависимости от
нозологии. Несомненно, что в значительной мере это связано с недос-
таточной технической оснащенностью медицинских учреждений. Одна-
ко, на наш взгляд, не всегда используются все возможности традици-
онных методов исследования, с помощью которых можно заподозрить
заболевание сердца у новорожденного, а в ряде случаев и точно опи-
сать его. К таким методам относятся клиническая характеристика со-
стояния ребенка, рентгенография грудной клетки, электрокардиография,
пул ьсоксиметрия.
Клиническая оценка
Состояние ребенка определяется имеющимися синдромами арте-
риальной гипоксемии и/или сердечной недостаточности, подробная ха-
рактеристика которых приведена в главе 5. В настоящем разделе мы
приводим лишь симптомы, позволяющие ставить задачу по выявле-
нию ВПС у новорожденных:
1. Изменение поведения новорожденного (беспокойство, отказ от
еды, заторможенность).
2. Центральный цианоз с рождения или возникший через некото-
рое время.
3. Постоянная тахикардия или брадикардия, не связанные с какой-
либо соматической патологией новорожденного, ослабленный или
значительно усиленный периферический пульс.
4. Тахипноэ, в том числе во сне.
5. Олигоурия, задержка жидкости.
При осмотре необходимо обращать особое внимание на детей,
имеющих экстракардиальные пороки развития и стигмы дизэмбриоге-
неза, ввиду их нередкого сочетания с пороками сердца.
Для детей грудного и более старшего возраста опорными момен-
тами в диагностике ВПС являются следующие.
Анамнез. Собирая анамнез, в первую очередь необходимо выяс-
нить, как протекали беременность и роды, какие имелись у матери про-
изводственные вредности, инфекционные или другие заболевания. Наи-
более ранним симптомом, замечаемым родителями, является цианоз.
Необходимо выяснить, когда впервые он появился, как меняется при
нагрузке и с течением времени. Важно оценить степень активности
ребенка во время кормления или игр, наличие отставания в физиче-
46
ском развитии и время его появления. Отмечались ли избыточная пот-
ливость, одышка, отеки, увеличение печени. Какова частота и тяжесть
бронхолегочных заболеваний, особенно рецидивирующих пневмоний.
Осмотр. Экстракардиалъные пороки развития и стигмы дизэм-
бриогенеза. Данные отклонения могут быть признаками синдромаль-
ной патологии, сочетающейся с пороками сердца [18, 19, 20].
Физическое развитие. Отставание в физическом развитии характер-
но для пороков с усиленной работой дыхательной системы на фоне
выраженного артериовенозного шунтирования крови (ДМЖП, атриовен-
трикулярный канал и др.), а также при хронической артериальной гипок-
семии. У грудных детей обычно более выражен дефицит массы тела, в
последующем отстают от нормы как масса тела, так и рост ребенка.
Кожные покровы. Изменения окраски кожных покровов могут
быть в виде цианоза или бледности. При ВПС цианоз носит централь-
ный характер, т.е. связан со снижением содержания кислорода в арте-
риальной крови. Периферический цианоз возникает при шоке, холо-
довом спазме периферических сосудов, гиповолемии, сепсисе. При
этом рО2 в артериальной крови не нарушено. Следует обращать вни-
мание на все конечности больного для исключения дифференцирован-
ного цианоза, затрагивающего только пальцы ног (свидетельствует о
праволевом сбросе через персистирующий открытый артериальный
проток при предуктальной коарктрации аорты, синдроме гипоплазии
левого сердца, синдроме Эйзенменгера) или рук (наблюдается при
транспозиции магистральных артерий с высокой легочной гипертен-
зией или перерывом дуги аорты).
Бледность кожных покровов может быть следствием сердечной не-
достаточности (как проявление вазоконстрикции) или анемии.
Для выявления нарушений оксигенации крови исследуют газо-
вый состав крови и кислотно-основное состояние (pH, BE, рО2, SO2).
В повседневной практике целесообразно также проведение пульсок-
симетрии с помощью датчика, накладывемого на пальцы руки, ноги
или мочку уха.
Изменения скелета. Деформации грудной клетки могут сопрово-
ждать пороки, связанные с увеличением полостей сердца (ДМЖП, ОАП
и др.). Так называемый сердечный горб у ребенка с ВПС появляется в
возрасте 2-4 месяцев жизни. С этого же возраста можно заметить и
утолщение дистальных фаланг пальцев по типу «барабанных палочек»,
свидетельствующее о хронической гипоксемии.
Пальпация. При пальпации грудной клетки помимо характери-
стик верхушечного толчка (локализация, распространенность, сила) не-
обходимо обращать внимание на наличие дрожания (симптом «кошачь-
47
его мурлыкания») над областью сердца с определением его локализа-
ции. Систолическое дрожание в проекции основания сердца наблюдает-
ся при стенозах аорты, легочной артерии или открытом артериальном
протоке. При нарушении целостности межжелудочковой перегородки
или внутрижелудочковой обструкции кровотока систолическое дрожа-
ние чаще определяется вдоль левого края грудины ближе к верхушке
сердца. Диастолическое дрожание у верхушки сердца может указывать
на митральный стеноз.
Увеличение печени и селезенки является симптомом застойной сер-
дечной недостаточности. Кроме того, при расположении печени слева
или срединно следует исключить инверсию внутренних органов, кото-
рая может сочетаться с аномалиями положения сердца. Уточнить ди-
агноз помогает ультразвуковое иследование внутренних органов.
У больных с пороками сердца нередко можно обнаружить пери-
ферические отеки - симптом застойной сердечной недостаточности.
Для детей раннего возраста характерны периорбитальные отеки. Вы-
раженная отечность хорошо видна даже при осмотре. Незначительную
отечность можно выявить при пальпации.
Физикальное обследование
Частота сердечных сокращений. Тахикардия может быть одним
из первых симптомов сердечной недостаточности. Ввиду выраженной
лабильности пульса в детском возрасте о тахикардии или брадикардии
можно говорить при отклонении частоты пульса от возрастных норма-
тивов не менее чем на 15% (определяется в стандартных условиях -
после пробуждения ребенка, в горизонтальном положении, в спокой-
ном состоянии). Параметры пульса в различных возрастах, в том чис-
ле при суточном мониторировании ЭКГ, представлены в Приложении 1.
При тяжелом течении ВПС плохим прогностическим признаком
является синусовая брадикардия, отражающая терминальную стадию
заболевания. Брадикардия, связанная с врожденной полной атриовен-
трикулярной блокадой сердца, может значительно осложнять течение
даже относительно простых ВПС. Выраженные отклонения частоты
пульса, наличие аритмий являются основанием для углубленного об-
следования с проведением суточного мониторирования ЭКГ.
Пульс. Пальпаторно оценивают ритмичность, напряжение и на-
полнение периферического пульса. Резкое снижение наполнения пульса
(«нитевидный») на всех конечностях отражает низкий сердечный вы-
брос. Напряженный пульс отмечается при высоком артериальном дав-
лении. Высокий, альтернирующий пульс характерен для открытого ар-
териального протока и аортальной недостаточности. Пульс может быть
48
различного наполнения на отдельных конечностях из-за разного объе-
много кровотока; обычно это встречается при патологии дуги аорты и
ее ветвей.
Артериальное давление. Обязательным является измерение ар-
териального давления (АД) на обеих руках и ноге в связи с возможной
обструкцией кровотока в бассейнах ветвей аорты. У ребенка первых
трех месяцев жизни разница систолического АД между левой и пра-
вой руками не должна превышать 10 мм рт.ст., между рукой и ногой -
20 мм рт.ст. В более старшем возрасте артериальное давление на ногах
(измеренное в подколенной ямке) в норме равно или незначительно
превышает систолическое давление на руках. Определить границы нор-
мального артериального давления в зависимости от возраста можно с
помощью таблиц Приложения 1.
Аускультация. При выслушивании необходимо отдельно сосре-
доточиться на особенностях тонов, а затем на характеристиках шумов.
Усиление I тона характерно для пороков с повышением кровотока че-
рез митральный (ОАП, ДМЖП, недостаточность митрального клапа-
на) или трикуспидальный (ДМПП, аномальный дренаж легочных вен)
клапаны, повышения сердечного выброса, укорочения интервала P-R.
Снижение громкости I тона может быть связано со снижением насос-
ной функции миокарда, митральной недостаточностью, атриовентри-
кулярной блокадой I степени.
Усиление аортального компонента II тона характерно для высоко-
го сердечного выброса, повышения артериального давления, тетрады
Фалло, а ослабление - для недостаточности аортального клапана. Уси-
ленный легочный компонент II тона характерен для пороков с увели-
чением кровотока через легочный клапан (ДМЖП, ДМПП); ослаблен-
ный - для стеноза легочной артерии, тетрады Фалло, аномалии Эб-
штейна. Отсутствие физиологического расщепления II тона (слышен
один компонент тона) наблюдается при общем артериальном стволе,
выраженных стенозах или атрезии клапанов аорты или легочной арте-
рии. Раздвоение II тона наблюдается при стенозах полулунных клапа-
нов (с ослаблением компонента от пораженного клапана), а в сочета-
нии с акцентом его в проекции легочной артерии является характер-
ным признаком синдрома Эйзенменгера. Могут выслушиваться III и
IV тоны, ритм галопа, щелчки открытия (клики).
Первым признаком врожденного порока сердца может являться
сердечный шум, характер которого и динамика во времени могут быть
различными. Громкость шума принято обозначать по шестибалльной
шкале (A.R.Freeman, S.A.Levine, 1933). Согласно предложенной мето-
дике первая степень громкости диагностируется, когда шум еле слы-
49
шен даже при высокой концентрации внимания; это «шум, который не
слышат студенты». Вторая степень соответствует отчетливо слыши-
мому тихому шуму. Третья и четвертая степени громкости - шумы уме-
ренной интенсивности; при четвертой степени, в отличие от предше-
ствующей, шум сопровождается дрожанием. Пятая и шестая степени -
выраженные шумы: пятой степени громкости соответствует шум, слы-
шимый при прикладывании края насадки стетоскопа (мембраны) к пре-
кордиальной области; шестая степень - шум слышится стетоскопом
на расстоянии от поверхности грудной клетки.
По отношению к фазам сердечной деятельности различают систо-
лический и диастолический шумы. По времени появления по отноше-
нию к I и II тонам сердца систолический шум разделяют на шум изгна-
ния, пансистолический и позднесистолический. Систолический шум
изгнания появляется после четко прослушиваемого I тона, постепенно
усиливается до максимума, а затем уменьшается. Он связан с увели-
ченным кровотоком в области полулунных клапанов или их стенозом.
Пансистолический шум начинается сразу после I тона, постепенно ос-
лабевает к концу систолы и обусловлен сбросом с дефекта межжелу-
дочковой перегородки или недостаточностью атриовентрикулярных
клапанов. Позднесистолический шум начинается спустя отчетливый
промежуток времени после I тона и длится до II тона. Он выслушива-
ется, например, при позднесистолическом пролапсе митрального кла-
пана вслед за щелчком в середине систолы.
Выделяют ряд диастолических шумов. Дующий высокотональный
шум в проекции аортального и легочного клапанов связан с их недос-
таточностью. Ранний низкотональный шум в проекции легочного кла-
пана также обусловлен недостаточностью клапана легочной артерии,
но чаще встречается после вмешательств на выводном тракте правого
желудочка. Ранний диастолический шум в проекции трехстворчатого
клапана обусловлен увеличенным кровотоком через клапан при дефекте
межпредсердной перегородки. Мезодиастолический скребущий шум
на верхушке связан с относительной недостаточностью митрального
клапана при массивном артериовенозном шунтировании. Длительный
скребущий шум на верхушке характерен для органического стеноза мит-
рального клапана.
Непрерывный шум, отчетливо слышимый на протяжении двух фаз
сердечного цикла, свидетельствует о постоянном кровотоке в каком-
либо участке, например, шум при открытом артериальном протоке или
артериовенозной фистуле. При периферических легочных стенозах шу-
мы могут выслушиваться над легочными полями.
50
Органические шумы следует отличать от функциональных, или не-
винных шумов, которые выслушиваются более чем у 30% здоровых
детей. К невинным шумам относятся короткие шумы изгнания у осно-
вания сердца или в средней трети грудины, венный шум.
Шумы, являясь неотъемлемой диагностической составляющей по-
рока сердца, могут значительно изменяться во времени, характеризуя
как возрастные особенности гемодинамики, так и стадию течения по-
рока. Так, для дефекта межжелудочковой перегородки характерно позд-
нее появление (чаще после 2-3 месяцев жизни) и постепенное нараста-
ние шума. Пороки со стенозированием полулунных клапанов диагно-
стируются по грубому систолическому шуму уже в роддоме, но при
прогрессировании стеноза до критического или при значительном сни-
жении насосной функции сердца такие шумы могут ослабевать парал-
лельно ухудшению общего состояния больного. Для некоторых поро-
ков, например, для дефекта межпредсердной перегородки, отчетли-
вый шум не является характерным признаком.
При аускультации легких у пациента с ВПС могут выслушиваться
хрипы, причиной которых является как тяжелая застойная сердечная
недостаточность, так и заболевания легких.
Электрокардиография
При интерпретации ЭКГ необходимо учитывать возраст ребенка.
Значительные особенности, в частности, имеет ЭКГ новорожденных;
наиболее характерными из них являются следующие:
1. Синусовая тахикардия с ритмом до 180 ударов в минуту.
2. Отклонение электрической оси сердца вправо в среднем до
+ 125°, с максимальным отклонением +180°.
3. Относительно низкий вольтаж комплекса QRS и зубца Т.
4. Доминирование электрической активности правого желудочка
с высоким RV1 V2.
5. У 10% новорожденных регистрируется зубец QVj.
Отклонения ЭКГ от нормы могут быть в виде изменения элек-
трической оси зубца Р или комплекса QRS, признаков гипертрофии
желудочков или предсердий, нарушения предсердно-желудочковой и
внутрижелудочковой проводимости, аритмий. При некоторых ВПС из-
менения ЭКГ регистрируются уже в период новорожденности, при дру-
гих пороках необходим значительный промежуток времени для их по-
явления.
Электрическая ось зубца Р. Электрическая ось зубца Р, лежащая в
пределах от +90° до +180°, может указывать на инверсию предсердий,
51
синдром асплении или некорректное наложение электродов ЭКГ. Верх-
нее направление электрической оси зубца Р может являться признаком
эктопического предсердного ритма или синдрома полисплении.
Электрическая ось комплекса QRS. У новорожденного ребенка
электрическая ось QRS менее +30° является отклонением от нормы,
которое говорит о смещении ее влево и является признаком атриовен-
трикулярной коммуникации или атрезии трикуспидального клапана
(при сочетании с цианозом). В норме электрическая ось постепенно
смещается влево к концу первого месяца жизни. Если в этот период
сохраняется ее отклонение вправо, это может свидетельствовать о та-
ких пороках, как синдром гипоплазии левого желудочка, тотальный
аномальный дренаж легочных вен, полная транспозиция магистраль-
ных артерий, изолированный стеноз легочной артерии и др.
В более старшем возрасте отклонение электрической оси сердца
влево чаще является признаком гипертрофии левого желудочка, а впра-
во - правого желудочка.
Гипертрофия левого желудочка:
1. Смещение электрической оси QRS влево относительно возрас-
тной нормы: новорожденные - менее +60°; дети от 6 мес. до 2 лет -
менее +30°; от 2-х до 12 лет - менее 0°.
2. SV1 >22 мм для новорожденных, >24 мм у детей старше 6 мес.
3. R V6 >16 мм для новорожденных, >22 мм у детей от 6 мес до 2-х
лет, >25 мм старше 2-х лет.
4. Глубина (?V56 >3-4 мм при RV56 >16-20 мм.
5. Время внутреннего отклонения в V56 >0,04 с - до 2-х лет и
>0,045 с у детей старше 2-х лет.
6. Отрицательный Гу56 у детей старше 2-х лет.
Гипертрофия правого желудочка:
1. Отклонение электрической оси QRS вправо: у новорожденных
более +180°, в возрасте от 6 мес. до 2-х лет - более +140°, старше 2-х
лет - более +110°.
2. ^>12 мм у новорожденного.
3. 7? vr>8 мм у новорожденного, >5 мм от 6 мес до 2-х лет, >4 мм
старше 2-х лет.
4. 7?V1 >25 мм у новорожденного, >17 мм у детей старше 2-х лет.
5. 5V6>10 мм у новорожденного.
6. Преобладание зубца R над 5 в V] (для детей до 6 мес R/S >6,5, до
2-х лет R/S >5, у более старших RJS >4).
7. 7?V1 + 5V5 >10 мм у детей до 2-х лет.
8. (?7?V1 (встречается у 10% здоровых новорожденных) во всех воз-
растах.
52
9. Положительный 7V1 у ребенка старше 3-х суток жизни.
10. Время внутреннего отклонения в 2>0,04 с до 2-х лет и >0,03 с
у детей старше 2-х лет.
Гипоплазию ПЖ у новорожденного можно заподозрить, если от-
мечается снижение вольтажа R в правых грудных отведениях (R<S)
Признаки гипертрофии правого предсердия (Р-pulmonale):
1. Высокий остроконечный зубец Р н ш aVF >3 мм;
2. Увеличение положительной фазы PV1.
Признаки гипертрофии левого предсердия (P-mitrale):
1. Увеличение отрицательной фазы Р V1 >4 мс и его амплитуды
>1 мм.
2. Увеличение продолжительности Рп >0,08 с у детей до 3-х лет и
до 120 с в более старшем возрасте.
3. Двугорбые Р l aVL V5 V6.
Признаки комбинированной гипертрофии предсердий:
1. Увеличение Р п >2,5-3 мм и продолжительности Р >80 мс у де-
тей до 3-х лет и до 120 мс в более старшем возрасте;
2. Двухфазный PV1.
Нарушение внутрижелудочковой проводимости определяется при
длительности QRS, превышающей возрастные значения. Внутрижелу-
дочковая блокада часто ассоциируется с метаболическими нарушения-
ми из-за гипоксии, ацидоза, гиперкалиемии или отражает диффузные
поражения миокарда. Может наблюдаться как признак терминальной
ЭКГ у умирающего больного с ВПС.
Блокада правой ножки пучка Гиса проявляется увеличением про-
должительности QRS свыше возрастной нормы, изменением морфо-
логии QRS в V] 2 по типу rSR\ rSr\ RSR\ уширением и зазубренно-
стью зубца 5 в I, V5 6, отклонением электрической оси сердца вправо и
может наблюдаться при аномалии Эбштейна, коарктации аорты у но-
ворожденных, дефекте межпредсердной перегородки. Нередко трак-
туется как признак гипертрофии правого желудочка. Чрезвычайно редка
у здоровых новорожденных.
Синдром WPW может быть случайной находкой или выявляться
на фоне порока сердца, например аномалии Эбштейна, корригиро-
ванной транспозиции магистральных артерий, а также быть причи-
ной суправентрикулярной тахикардии.
Расширенный зубец Q, смещение сегмента ST, инверсия зубца Т
свидетельствуют о нарушениях реполяризации метаболического или
ишемического генеза, в том числе связанных с перегрузками желу-
дочков или аномальным отхождением левой коронарной артерии от
53
легочной артерии. Подъем сегмента ST выше изолинии может наблю-
даться на фоне перикардита, миокардита, инфаркта миокарда; смеще-
ние ST ниже изолинии может свидетельствовать об ишемии миокар-
да, напряжении желудочка или передозировке дигоксина.
Основные параметры нормальной ЭКГ детей приведены в Прило-
жении 1.
Рентгенография грудной клетки
Врожденные пороки сердца часто сопровождаются изменениями ле-
гочного кровотока, размеров и силуэта сердца. В связи с этим важную
роль в их диагностике играет рентгенография грудной клетки. Необхо-
димо указать, что отсутствие увеличенных размеров сердца еще не ис-
ключает ВПС. Если же данный признак присутствует, всегда надо запо-
дозрить порок с лево-правым шунтом или поражение сократительного
миокарда с дилатацией полостей сердца. Существуют, как минимум, три
характерные конфигурации сердца при ВПС: 1) небольшое сердце в ви-
де «деревянного башмачка» - при тетраде Фалло или трикуспидальной
атрезии; 2) «яйцо, лежащее на боку», - при транспозиции магистраль-
ных артерий; 3) «снежная баба» - при супракардиальной форме тоталь-
ного аномального дренажа легочных вен (рис. 4-1).
Рис. 4-1. Характерные силуэты сердца при ВПС: при тетраде Фалло
(А), транспозиции магистральных артерий (Б), супракардиальной форме тотального
аномального дренажа легочных вен (В).
Для характеристики гемодинамических нарушений важно оценить
также изменения легочного рисунка, которые могут быть трех основ-
ных типов:
1. Усиленный легочный рисунок - характерен для пороков со сбро-
сом слева направо и поступлением повышенного объема крови в ле-
гочную артерию (ДМЖП, ОАП, полная форма АВК, дефект аортоле-
гочной перегородки и т.п.).
2. Обедненный легочный рисунок - сопровождает пороки, одним
из компонентов которых является легочный стеноз или атрезия (тетра-
54
да Фалло, единственный желудочек со стенозом легочной артерии и
т.п.). Однако при достаточно большом поступлении крови в легкие
через ОАП или большие коллатерали, интенсивность легочного рисунка
может приближаться к нормальной и при перечисленных ВПС.
3. Изменения легочного рисунка по типу венозного застоя - харак-
терны для затруднений оттока крови от легких вследствие обструкции
легочных вен, стеноза митрального клапана или левожелудочковой не-
достаточности. Крайней степенью проявления последней является ин-
терстициальный отек легких.
Изменения легочного рисунка могут носить и сочетанный харак-
тер (усиление артериального рисунка плюс венозный застой; обеднен-
ный артериальный рисунок плюс венозный застой).
Бытует неверное мнение, что цианотические ВПС обязательно
должны сопровождаться обедненным легочным кровотоком. В случа-
ях, когда тяжелый легочный стеноз не является одним из компонентов
порока, легочный рисунок может быть нормальным или даже усилен-
ным, несмотря на выраженную гипоксемию (единственный желудочек,
трикуспидальная атрезия, транспозиция магистральных артерий).
Анализ газового состава крови и кислотно-щелочного состояния
Данные исследования существенно дополняют диагностику у боль-
ных с ВПС. Пробы крови берутся из артериальных, венозных или ка-
пиллярных сосудов. Анализ парциального давления кислорода (рО2) в
артериальной или капиллярной крови является наиболее точным пока-
зателем уровня гипоксемии. Однако на практике более часто применя-
ют пульсоксиметрию, отражающую насыщение гемоглобина крови ки-
слородом (SO2). Эту же методику возможно использовать для скринин-
говых исследований у асимптомных новорожденных с целью выявле-
ния потенциально цианотических ВПС [21]. Оптимальное положение
датчика - в постдуктальной зоне (на ноге). Для выявления дифферен-
цированного цианоза используют пульсоксиметрию на всех конечно-
стях.
Выявление метаболического ацидоза и его степени определяет ле-
чебную тактику при тяжелой сердечной недостаточности или артери-
альной гипоксемии. Оценка результатов данных исследований приве-
дена в главе 5.
Клиническая симптоматика в сочетании с традиционными
инструментальными методами исследования позволяет в ряде случаев
поставить точный топический диагноз еще до применения эхокардио-
графии (рис. 4-2, 4-3).
Ультразвуковые методы исследования сердца
Ультразвуковые методы являются высокоинформативными, неин-
вазивными, относительно недорогими и удобными для применения,
55
Рис. 4-2. Алгоритмы диагностики бледных ВПС. ОАП - открытый
артериальный проток, ДМЖП - дефект межжелудочковой перегородки,
АВК - открытый атриовентрикулярный канал, BWG - синдром Bland-White-Garland,
ПНПГ - правая ножка пучка Гиса, ДМПП - дефект межпредсердной перегородки,
ЧАДЛВ - частичный аномальный дренаж легочных вен, М.ст. - митральный стеноз,
КА - коарктация аорты, М.н. - митральная недостаточность, Л. ст. - легочный стеноз.
Рис 4-3. Алгоритмы диагностики цианотических ВПС. ОАС-общий
артериальный ствол, ЕЖ - единственный желудочек, ТМА - транспозиция
магистральных артерий, ТАДЛВ - тотальный аномальный дренаж легочных вен,
СГЛС - синдром гипоплазии левого сердца, АТК - атрезия трикуспидального
клапана, АЛА+ИМЖП - атрезия легочной артерии с интактной межжелудочковой
перегородкой, ТФ - тетрада Фалло, Л. ст. - легочный стеноз.
56
как в клинических, так и в амбулаторных условиях. Безопасность для
больного дает возможность проводить исследование многократно, оце-
нивать результаты лечения. Методика с успехом применяется в разные
возрастные периоды - от обследования сердца плода до пациентов пре-
клонного возраста, позволяя оценивать анатомическое строение серд-
ца и его структур, определять размеры полостей, состояние кровотока
на клапанах, систолическую и диастолическую функцию сердца. Эф-
фективно использование ЭХОКГ для контроля за результатами баллон-
ных процедур при дилатации межпредсердного сообщения или клапан-
ных стенозов. Так как ультразвуковая диагностика является основной в
практике детских кардиологов, мы приводим более детальное описание
этого метода.
Общие аспекты исследования
Режимы ультразвукового исследования сердца. В кардиологии ру-
тинно используют М- и В-режимы эхокардиографического (ЭХОКГ)
исследования и допплеровскую эхокардиографию (ДЭХОКГ). М-мо-
дальный режим (motion - движение) - одномерный, описывает движе-
ние структур сердца, которые пересекаются одним ультразвуковым
лучом в разные фазы сердечного цикла. В настоящее время эхокардио-
грамму в М-режиме практически никогда не выполняют изолирован-
но, без В- или D-режима. В-модальный режим (brightness - яркость) -
двухмерный режим отображения в серой шкале, в реальном времени.
Он представляет собой сечение сердца в одной плоскости с помощью
множества ультразвуковых лучей. ЗО-модальный режим (three-dimen-
sion mode) - получение трехмерного акустического изображения струк-
тур сердца.
Из допплеровских методов в кардиологии применяют спектраль-
ную допплеровскую эхокардиографию (D-режим) - оценку спектра ско-
ростей кровотока в сердце и сосудах с использованием импульсной (PW)
или непрерывноволновой (CW) допплерографии, и методы цветовой доп-
плеровской эхографии, основными из которых являются цветовое кар-
тирование кровотока (CFM) и допплеровская визуализация тканей (DTI).
Цветовое допплеровское картирование кровотока получают при коди-
ровании различными цветами скоростей движения отдельных элемен-
тов на фоне двухмерного режима отображения структур сердца. Доп-
плеровская визуализация тканей (или тканевой допплер) - метод цвето-
вой регистрации скорости движения стенок сердца.
Традиционно исследование сердца и магистральных сосудов про-
водят трансторакальным методом. При этом для стандартизации полу-
чаемых изображений используют следующие доступы (положение дат-
чика на поверхности грудной клетки): левый парастернальный, апи-
кальный, субкостальный, супрастернальный, правый парастернальный.
57
В каждом из доступов получают срез по длинной или короткой оси
сердца. На основании множества двухмерных изображений в стандарт-
ных и нестандартных позициях исследователь мысленно воссоздает
пространственную картину сердца и его работу.
Метод трансторакальной ЭХОКГ имеет ряд объективных ограни-
чений: наличие акустических препятствий на пути луча, как внесер-
дечных (ребра, подкожный жир, мышцы, легкие), так и в самом серд-
це (протезированные клапаны, электроды электрокардиостимулятора,
кальцинированные ткани). Более широкие возможности открываются
при использовании чреспищеводной ЭХОКГ (ЧПЭХОКГ). Помимо от-
сутствия помех от внесердечных структур, методика позволяет приме-
нять более высокие частоты датчика, что повышает разрешающую спо-
собность исследования. Кроме того, становятся более доступными для
исследования такие структуры, как предсердия, грудной отдел аорты,
правый желудочек, а также другие органы средостения. Интраопера-
ционное проведение ЧПЭХОКГ позволяет изучать гемодинамику и про-
водить промежуточную оценку результатов хирургического лечения.
Противопоказанием для проведения ЧПЭХОКГ являются заболевания
пищевода, для диагностики которых непосредственно перед исследо-
ванием проводится диагностическая эзофагоскопия или рентгеногра-
фия грудной клетки с контрастированием пищевода бариевой взвесью.
Основные позиции датчика
Различные позиции датчика позволяют визуализировать необхо-
димые структуры сердца. Ниже приводятся возможности каждой из
позиций.
Верхушечная позиция (рис. 4-4/
1) положение и пропорции камер сердца;
2) атриовентрикулярные клапаны;
3) целостность перегородок сердца.
При увеличении левых предсердия и желудочка по сравнению с
правыми отделами, ведется диагностический поиск среди таких со-
стояний, как открытый артериальный проток, ДМЖП, митральная не-
достаточность, митрализация аортального порока и др. Изолирован-
ное увеличение правых отделов, особенно правого предсердия, позво-
ляет заподозрить ДМПП, аномальный дренаж легочных вен. Смеще-
ние створки трикуспиального клапана к верхушке позволяет поставить
точный диагноз - аномалию Эбштейна, а смещение клапана в артери-
альном желудочке ближе к верхушке - корригированную транспози-
цию магистральных артерий. В этой позиции можно также диагности-
ровать дефекты межпредсердной и межжелудочковой перегородок при-
точной локализации.
58
Рис. 4-4. Эхокардиограмма из верхушечной четырехкамерной
позиции. Здоровое сердце, слева - в систолу, справа - в диастолу. Лоцируются
желудочки, предсердия; межжелудочковая и межпредсердная перегородки условно
образуют ось симметрии здорового сердца.
Рис. 4-5. Эхокардиограмма из парастернальной позиции по длинной
оси. Здоровое сердце, слева - в диастолу, справа - в систолу. Лоцируются левое
предсердие и левый желудочек, аортальный и митральный клапаны, часть выводного
отдела правого желудочка.
Левый парастернальный доступ (из третьего-четвертого межребе-
рья слева от грудины, по длинной и короткой осям) (рис. 4-5, 4-6, 4-7):
1) левое предсердие, центральная часть межпредсердной перего-
родки;
59
2) левый желудочек, митральный и аортальный клапаны;
3) выводной отдел правого желудочка, клапан и легочный ствол,
бифуркация и ветви легочной артерии;
4) межжелудочковая перегородка.
Рис. 4-6. Эхокардиограмма из парастернальной позиции по короткой
оси на уровне створок аортального клапана. Здоровое сердце, слева - в
систолу, справа - в диастолу. Лоцируются три симметричные створки аортального
клапана, левое и правое предсердия, межпредсердная перегородка, створка
трикуспидального клапана, часть выводного отдела правого желудочка.
Рис. 4-7. Эхокардиограмма из парастернальной позиции по короткой
оси на уровне легочного ствола. Здоровое сердце: лоцируются часть выводного
отдела правого желудочка, легочный ствол и створки клапана легочной артерии,
ветви легочной артерии, восходящая аорта (в ортогональном сечении).
RVOT - выводной отдел правого желудочка, РА - легочная артерия.
60
Рис. 4-8. Эхокардиограмма из субксифоидального доступа по
длинной оси. Визуализируются оба предсердия, разделенные межпредсердной
перегородкой, в которой имеется открытое овальное окно; также лоцируются
атриовентрикулярные клапаны и нижняя полая вена. LA - левое предсердие,
RA - правое предсердие.
Рис. 4-9. Эхокардиограмма из супрастернального доступа по
длинной оси аорты. Здоровое сердце: визуализируются дуга аорты и ее ветви,
перешеек и нисходящая часть грудной аорты, правая ветвь легочной артерии (в
ортогональном сечении), часть левого предсердия.
61
В этой позиции датчика диагностируют артериальный проток, де-
фекты межпредсердной и межжелудочковой перегородки в выводном
отделе, стенозы аорты, стенозы инфундибулярного отдела правого же-
лудочка и легочной артерии; исследуют проксимальные участки коро-
нарных артерий, а также производят многие обязательные измерения.
Эпигастральная (субксифоидалъная) позиция (имеет технические
ограничения у старших детей и взрослых и чрезвычайно полезна у
маленьких детей) (рис. 4-8):
1) состояние полых и легочных вен;
2) межпредсердная перегородка.
Из этого доступа хорошо выявляются дефекты межпредсердной
перегородки, аномалии полых и легочных вен.
Супрастернальный доступ (исследование проводят в положе-
нии больного лежа на спине с запрокинутой головой) (рис. 4-9):
1) грудной отдел аорты и ее ветви.
Эта позиция позволяет выявить коарктацию аорты, гипоплазию
аорты, надклапанный стеноз аорты, открытый артериальный проток,
функционирующие системно-легочные коллатерали, отходящие от груд-
ной аорты.
При необходимости используют дополнительные доступы: правый
парастернальный (визуализируется аортальный клапан и восходящая
аорта), левый и правый надключичный (визуализируются восходящая
аорта, дуга, перешеек, ветви аорты).
Рис. 4-10. Допплер-ЭХОКГ трансмитрального кровотока в постоянно-
волновом режиме из верхушечной четырехкамерной позиции. Здоровое
сердце: регистрируется двухфазный кровоток в диастолу, в систолу кровоток
отсутствует.
62
Рис. 4-11. Допплер-ЭХОКГ кровотока на трикуспидальном клапане
в постоянно-волновом режиме из верхушечной позиции по длинной
оси правого желудочка. Здоровое сердце: регистрируется двухфазный кровоток
наполнения в диастолу, незначительный кровоток регургитации в систолу.
Рис. 4-12. Допплер-ЭХОКГ кровотока на аортальном клапане в
постоянно-волновом режиме из верхушечной двухкамерной позиции.
Здоровое сердце: регистрируется кровоток изгнания в систолу.
Изучение кровотока
Митральный клапан (рис. 4-10). Нормальный диастолический
кровоток на митральном клапане состоит из потока раннего наполне-
ния за счет пассивного расслабления желудочка в раннюю диастолу
(пик Е) и потока предсердной систолы (пик А). У половины здоро-
вых людей в систолу можно зарегистрировать незначительную ре-
гургитацию крови.
63
Рис. 4-13. Допплер-ЭХОКГ кровотока в нисходящей грудной аорте
в постоянно-волновом режиме из супрастернальной позиции. Здоровое
сердце: регистрируется кровоток в систолу, незначительный кровоток в раннюю
диастолу.
Рис. 4-14. Исследование нормального кровотока в легочной артерии
в режиме постоянно-волновой допплерографии. Здоровое сердце:
регистрируются систолический кровоток изгнания и диастолический кровоток
регургитации.
Трикуспидальный клапан (рис. 4-11). Кровоток на трикуспидаль-
ном клапане, как и на митральном, в диастолу двухфазный, но с более
низкими показателями скоростей. Более чем у 65% здоровых людей в
систолу можно зарегистрировать физиологическую регургитацию.
Аортальный клапан (рис. 4-12, 4-13). Нормальный кровоток на
аортальном клапане является ламинарным, с пиком, смещенным
обычно к началу систолы. Над створками клапана после его закры-
тия можно зарегистрировать незначительный антеградный постсис-
64
толический поток. На здоровом клапане кровоток регургитации обыч-
но не наблюдается.
Клапан легочной артерии (рис. 4-14). У детей первых месяцев
жизни скорость кровотока в легочной артерии в систолу может дос-
тигать 1,5 м/с. У детей старше года в состоянии покоя он обычно не
превышает 1,10-1,20 м/с. Также важно отметить высокую лабиль-
ность скорости потока при изменении степени активности (сон, плач
и др.). У преобладающего большинства детей под легочным клапа-
ном регистрируется незначительная физиологическая регургитация
крови. Уровень давления в легочной артерии можно вычислить, из-
меряя время ускорения систолического потока (от начала до пика кро-
вотока) и время изгнания (от начала до окончания кровотока) из пра-
вого желудочка. Их отношение определяет среднее давление в легоч-
ной артерии (см. Приложение 1).
Патологические изменения, регистрирующиеся при стенозах или
недостаточности клапанов, изложены в соответствующих разделах ча-
стной патологии сердца.
Оценка систолической функции желудочков
Основными показателями насосной функции левого желудочка яв-
ляются ударный объем (УО), сердечный выброс (СВ) и фракция вы-
броса (ФВ). Определение этих параметров обычно основано на изме-
рении объемов желудочков, которое может осуществляться в М- и В-
режимах ЭХОКГ [22].
УО = КДО - КСО (мл); СВ = (УО • ЧСС)/1000 (л/мин);
ФВ = (КДО - КСО)/КДО,
где КДО - конечный диастолический объем, КСО - конечный сис-
толический объем желудочка.
Наиболее простая формула для расчета объемов левого желудоч-
ка в М-режиме предложена Teichgolz (рис. 4-15):
КДО= (7/(2,4+Dd)) • Dd3
КСО = (7/(2,4+De)) • De3,
где КДО - конечный диастолический объем ЛЖ, КСО - конечный
систолический объем ЛЖ, Dd - диаметр полости ЛЖ в диастолу и De
- диаметр ЛЖ в систолу.
Данная методика неприменима при нарушении локальной сокра-
тимости миокарда ЛЖ, так как в этом случае измерения не охватыва-
ют все сегменты и не отражают реальную сократимость миокарда. Эта
методика не используется для оценки систолической функции правого
желудочка.
65
Рис. 4-15. Измерение систолической функции левого желудочка в
парастернальной позиции по длинной оси по методу Teichgolz.
Рис. 4-16. Измерение систолической функции левого желудочка по
методу Simpson.
В В-режиме возможно вычислять объемы и выброс обоих желу-
дочков. Наиболее часто используют методику Simpson, которая осно-
вана на условном разделении полости желудочка на множество дис-
ков (обычно 20) и подсчете суммарного объема дисков (рис. 4-16).
При этом учитывают индивидуальные особенности желудочка, что
позволяет достаточно объективно вычислять его объем даже при на-
рушениях формы или локальной сократимости. Измерения проводят
в апикальной двухкамерной и четырехкамерной проекции [23]. Ис-
пользуют формулу:
66
КДО = -У ab — КСО = ,
4 20 4 У ' 20
где а- площадь поперечного сечения желудочка в двухкамерной
позиции (20 срезов), bt - площадь поперечного сечения желудочка в
четырехкамерной позиции (20 срезов), Ld и Ls - длина желудочка в
диастолу и систолу.
Другой способ измерения сердечного выброса основан на измере-
нии выброса крови в магистральные сосуды. Допплерографический
расчет ударного объема на основании уравнения непрерывности по-
тока для обоих желудочков успешно применяется при условии нор-
мальной функции полулунных клапанов сердца:
У О = ППС • ИК
ППС = л *D2/4; ИК= Vcp. • ВВ,
где ППС - площадь поперечного сечения сосуда в месте регистра-
ции кровотока; ИК - интеграл кровотока, D - диаметр сечения сосуда
в месте регистрации кровотока; Vcp. - средняя скорость кровотока;
ВВ - время выброса.
Объем легочного кровотока исследуют над створками клапана ле-
гочной артерии методом импульсной допплерографии из парастерналь-
ного доступа в проекции короткой оси аорты. Измерения кровотока в
аорте также проводят в импульсном режиме из верхушечной позиции
с визуализацией выводного тракта левого желудочка и корня аорты, и
помещением контрольного объема над створками аортального клапа-
на. Диаметр сосуда измеряют на уровне фиброзного кольца магист-
ральных артерий в систолу. Если имеет место гемодинамически значи-
мая регургитация на атриовентрикулярных клапанах, требуется кор-
ректировка расчетного УО. При этом общий УО желудочка, отражаю-
щий работу сердца, равен сумме УО на полулунном клапане и УО струи
регургитации на атриовентрикулярном клапане.
Нормальное значение ФВ рассчитанное в М-режиме, составля-
ет 60-65%, в В-режиме - 50—55% [22].
Оценка диастолической функции желудочков
Под диастолической функцией понимается способность желудоч-
ков к наполнению. Самым распространенным неинвазивным методом
исследования диастолической функции является допплеровская оцен-
ка трансмитрального кровотока в импульсно-волновом режиме с оцен-
кой основных показателей: максимальной скорости кровотока раннего
наполнения (ЕЕ), максимальной скорости потока предсердной систо-
67
лы (ИЛ), отношения VE/VA, времени изоволюметрического расслабле-
ния (ВИР), времени замедления потока раннего наполнения (ВЗ Е),
фракции предсердного наполнения (рис. 4-17).
VE
Рис. 4-17. Схематическое изображение Допплер-ЭХОКГ
трансмитрального диастолического кровотока. Основные измеряемые
параметры диастолической функции ЛЖ.
Характеристики трансмитрального потока могут существенно из-
меняться с возрастом. У плода человека скорость раннего наполнения
(VE) и отношение VE/VA на митральном и трикуспидальном клапанах
возрастают со сроком беременности. Причем для трикуспидального
клапана абсолютные величины этих показателей статистически боль-
ше, чем для митрального, в связи с доминантностью правого желудоч-
ка. В этот период наполнение желудочков зависит в основном от сис-
толы предсердий (пик А выше пика Е, отношение Е/А меньше едини-
цы), однако по мере созревания миокарда и снижения его резистентно-
сти возрастает роль пассивного наполнения и возрастает величина VE.
Данный процесс продолжается и после рождения, особенно заметно в
течение первого месяца жизни. В период от одного до 3-6 месяцев
отношение Е/А становится больше единицы.
Нормативных границ для скоростных показателей наполнения не
существует, так как они зависят от возраста пациентов, частоты ритма,
времени предсердно-желудочкового проведения (интервала Р-R ЭКГ),
условий пред- и постнагрузки на сердце и подвержены существенным
колебаниям у одного и того же человека [24, 25]. Показатель скорости
раннего диастолического наполнения для митрального клапана у де-
тей может лежать в пределах от 55 до 110 м/с, скорости предсердного
наполнения - 25-90 м/с [25]. Границы нормальных значений VE/VA
для левого желудочка более четкие и представлены в таблице Прило-
68
жения 1 (для детей с физиологичным P-R). Использование для оценки
диастолической функции детей нормативов, применяющихся во взрос-
лой практике, недопустимо.
Также меньше зависят от возраста и других условий показатели
ВИР ЛЖ и ВЗ Е. Нормальные значения ВИР ЛЖ у детей лежат в пре-
делах 43±10 мс, ВЗ Е = 101 ±38 мс. Фракция предсердного наполнения,
характеризующая отношение объема наполнения в фазу предсердной
систолы к общему объему наполнения желудочка, в норме составляет
16-44%. Этот показатель наиболее высокий у детей младшего возрас-
та и у людей зрелого возраста.
Так как величина Е зависит от активной релаксации мышцы желу-
дочка и преднагрузки, а велина А - от сократимости предсердия и рас-
тяжимости желудочка, оказалось возможным выделить различные ти-
пы нарушений трансмитрального кровотока.
При интерпретации трансмитрального кровотока выделяют ри-
гидный, псевдонормальный и рестриктивный типы. Для ригидного (или
гипертрофического) типа характерно уменьшение ниже возрастной нор-
мы соотношения VE/VA, удлинение ВЗ Е и удлинение ВИР. Любое из
этих изменений указывает на замедление в первую очередь релакса-
ции кардиомиоцитов.
Рестриктивный тип характеризуется резким преобладанием ско-
рости VE над VA (больше нормы), укорочением ВИР, укорочением ВЗ
Е. Такие изменения указывают на высокое давление наполнения желу-
дочка, которое может быть повышено либо вследствие нарушения пас-
сивных диастолических свойств желудочка, либо замедления клеточ-
ной релаксации, либо при сочетании этих патологических факторов.
При псевдонормальном варианте имеются нормальные значения
VE/VA, времени изоволюметрического расслабления и времени замед-
ления VE при пропорциональном увеличении давления в полости ЛЖ
и ЛП; данная ситуация может наблюдаться при различной степени на-
рушения клеточной релаксации, пассивных диастолических свойств и
давления наполнения. Для клинициста важно, что при псевдонормаль-
ном типе диастолической дисфункции в отличие от нормального серд-
ца обязательно имеют место нарушения систолической функции, ги-
пертрофия миокарда или какие-либо другие нарушения, а также сим-
птомы застойной сердечной недостаточности [26].
Описанные выше методы имеют ограничения при митральной или
аортальной регургитации более II степени, тахикардии более 100-120
ударов в минуту, мерцательной аритмии, митральном стенозе.
69
Дополнительную информацию о состоянии диастолической функ-
ции дают методы допплеровской оценки кровотока в легочных венах,
особенно совместно с оценкой волны предсердного наполнения, цвет-
ная одномерная допплеровская эхокардиография и тканевая импульс-
ная допплерография [27].
Оценка глобальной функции желудочков
Для оценки глобальной (систолической и диастолической) функ-
ции миокарда желудочков используют комбинированный Тей-индекс,
измеряемый по допплеровскому спектру кровотоков наполнения и из-
гнания как отношение суммы времени изоволюметрического сокраще-
ния и изоволюметрического расслабления миокарда желудочка ко вре-
мени изгнания [28] (рис. 4-18):
Изгнание крови
Рис. 4-18. Схема интервалов при вычислении Тей-индекса.
Тей-индекс = (ВИС + ВИР)/ВИ,
где ВИС - время изоволюметрического сокращения, ВИР - время
изоволюметрического расслабления, ВИ - время изгнания. На практи-
ке измеряют расстояния «а» и «Ь», а формула выглядит следующим
образом:
Тей-индекс = (а - Ь)/Ь
Индекс вычисляют как для левого, так и для правого желудочка.
Он не зависит от геометрии желудочков, частоты сердечных сокра-
щений, артериального давления, степени легочной гипертензии, не-
достаточности атриовентрикулярных клапанов. У здоровых людей он
является высоковоспроизводимым и имеет маленький статистический
разброс. Важность оценки Тей-индекса доказана его высокой про-
гностической значимостью у пациентов с застойной сердечной не-
70
достаточностью различного генеза. Нормальное значение Тей-индек-
са для левого желудочка составляет 0,36±05, для правого желудочка
- 0,24±0,04 [29, 30].
Прочие методики
Для визуализации сердца и сосудов используется целый ряд дру-
гих методов исследования, важнейшими из которых являются катете-
ризация сердца и ангиокардиография (АКТ), сверхбыстрая компьютер-
ная томография (КТ), спиральная компьютерная томография с трех-
мерной реконструкцией изображения, магнитно-резонансная томогра-
фия (МРТ), позитронно-эмиссионная томография (ПЭТ), сцинтигра-
фия миокарда. Обсуждение показаний к этим исследованиям не вхо-
дит в нашу задачу, укажем только, что каждое из них имеет определен-
ные преимущества и недостатки.
Катетеризация сердца и АКГ остаются важными методами ис-
следования ВПС, т.к. позволяют точно измерить давление в полостях
сердца и сосудах, визуализировать дистальные сегменты легочных
артерий, ветвей аорты, определить уровни сброса крови. Однако дан-
ные исследования носят инвазивный характер, в связи с чем необхо-
димо с осторожностью использовать их у тяжелых пациентов. Кроме
того, пациент подвергается облучению, что ограничивает повторные
обследования.
Компьютерная томография в различных модификациях представ-
ляет собой рентгенографическое исследование, синхронизированное
с ЭКГ пациента и позволяющее получить хорошее изображение струк-
турных аномалий сердца и сосудов, их дистальных сегментов, отложе-
ний кальция. Важно также, что процедура занимает в основном не бо-
лее 15-20 мин. Недостатками являются облучение пациента, а также
опасность использования контрастных веществ при дисфункции по-
чек у пациента.
Магнитно-резонансная томография использует магнитное поле
для изображения структур организма. Это один из наиболее точных
методов оценки структуры и функции сердца, позволяющий дополни-
тельно выявить тип ткани (например, опухолевой), региональные по-
ражения сердца. Использование контраста (более безопасного, чем при
КТ) дает возможность эффективно исследовать различные сосуды ор-
ганизма. МРТ позволяет обнаружить патологию легочной ткани, рас-
положенную позади тени сердца и недоступную для традиционной
рентгенографии, одновременно показать паренхиму органа и его сосу-
ды и т.д. Однако исследование достаточно длительное (45-90 мин),
что не всегда приемлемо для маленьких пациентов. Кроме того, воз-
71
можны такие побочные эффекты, как стимуляция нервов и мышц с их
подергиванием, а также повышение температуры. МРТ противопоказа-
на больным с искусственными водителями ритма или имеющим в ор-
ганизме другие металлические предметы. В то же время материалы
современных сосудистых стентов и окклюдеров позволяют проводить
данное исследование уже через 6-8 недель (необходимых для инкор-
порации имплантата).
Позитронно-эмиссионная томография и сцинтиграфия миокар-
да позволяют изучить состояние коронарной перфузии и метаболизма
миокарда, выявить зоны сохраненного и измененного миокарда.
4.3. Отложенная диагностика
Учитывая тот факт, что пренатальная диагностика в нашей стране
распространена недостаточно широко, определяющим периодом в вы-
явлении поражений сердца у новорожденных становится ранний по-
стнатальный период. При обнаружении данных, указывающих на ВПС,
ребенка необходимо максимально быстро направить на исследование
в специализированное кардиологическое или кардиохирургическое от-
деление, где будет поставлен точный топический диагноз и определе-
на тактика лечения.
В ряде случаев, однако, первичный диагноз ставится гораздо поз-
же, что свидетельствует о «просмотре» заболевания в период новоро-
жденное™ или относительно небольших гемодинамических наруше-
ниях в тот период. Алгоритмы диагностики в старшем возрасте суще-
ственно не отличаются от описанных выше, за исключением дополни-
тельного анализа развившихся осложнений (высокая легочная гипер-
тензия, дисфункция других органов и т.д.).
Литература
1. Allan L. Antenatal diagnosis of heart disease // Heart.- 2000.- Vol. 83.- P. 367-370.
2. Buskens E., Grobbee D.E., Frohn-Mulder I.M.E. et al. Efficacy of routine fetal ul-
trasound screening for congenital heart disease in normal pregnancy // Circulation.-
1996.- Vol. 94.- P. 67-72.
3. Game E., Stoll C., Clementi M. Evaluation of prenatal diagnosis of congenial heart
diseases by ulrtasound: experience from 20 European registries // Ultrasound Ob-
stet. Gynecol. - 2001.- Vol. 17.- P. 386-391.
4. Stoll C, Game E., Clementi M. Evaluation of prenatal diagnosis of associated con-
genital heart diseases by fetal ultrasonographic examination in Europe // Prenat.
Diagn. -2001.- Vol. 21.- P. 243-252.
5. Беспалова Е.Д. Основные аспекты ультразвуковой диагностики врожденных
пороков сердца у плода (на диспансерном этапе). Пособие для врачей / Под
ред. А.В.Иваницкого. - М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2001.
72
6. Yagel S., WeissmanA., Rotstein Z., et al. Congenital heart defects. Natural course and
in utero development // Circulation.- 1997,- Vol. 96.- P. 550-555.
7. Weiner Z., Lorber A., Shalev E. Diagnosis of congenital cardiac defects between 11
and 14 weeks gestation in high-risk patients // J. Ultrasound Med.- 2002.- Vol. 21.-
P. 23-29.
8. Sharland G.K., Chita S.K., Fagg N.L.K. et al. Left ventricular disfunction in fetus:
relation to aortic valve anomalies and endocardial fibroelastosis // Br. Heart J.-1991.-
Vol. 66.- P. 419-424.
9. Hornberger L.K., Weintraub R.G., Pesonen E. et al. Echocardiographic study of the
morphology and growth of aortic arch in the human fetus. Observations related to
the prenatal diagnosis of coarctation // Circulation.- 1992.- Vol. 86.- P. 741-747.
10. Franklin O., Burch M., Manning N. et al. Prenatal diagnosis of coarctation of the
aorta improves survival and reduces morbidity // Heart.- 2002.- Vol. 87.- P. 67-69.
11. Hornung T.S., Heads A., Hunter A.S. Right ventricular dilatation in the fetus: a study
of associated features and outcome // Pediatr. Cardiol.- 2001.- Vol. 22.- P. 215-217.
12. Kumar R.K., Newburger J.W., Gauvreau K. et al. Comparison of outcome when
hypoplastic left heart syndrome and transposition of the great arteries are diagnosed
prenatally versus when diagnosis of these two conditions is made only postnatally //
Am. J. Cardiol.- 1999.- Vol. 83.- P. 1649-1653.
13. Bonnet D., Coltri A., Butera G. et al. Detection of transposition of the great arteries
in fetuses reduces neonatal morbidity and mortality // Circulation.- 1999.- Vol. 99.-
P. 916-918.
14. Daubeney P.E.F., Sharland G.K., Coock A.C. et al. Pulmonary atresia with intact
ventricular septum ipact of fetal echocardiography on incidence at birth and postna-
tal outcome // Circulation.- 1998.- Vol. 98.- P. 562-566.
15. Медведев M.B. Пренатальная ультразвуковая диагностика врожденных поро-
ков сердца // Акуш. Гинек.- 1991.- №11.- С. 68-75.
16. Nir A., Ekstein S., Nadjari М. et al. Rhabdomyoma in the fetus: Illustration of tumor
growth during the second half of gestation // Pediatr. Cardiol.- 2001.- Vol. 22.-
P. 515-518.
17. Stiller B., Hetzer R., Meyer R. et al. Primary cardiac tumors: when is surgery neces-
sary? // Eur. J. Cardiothorac. Surg.- 2001.- Vol. 20.- P. 1002-1006.
18. Болезни сердца// Краткое рук-во по неонатологии / Под ред. П.Флеминга, Б.Спи-
деля, Н.Марлоу, П.Данна. С. 137-164.
19. Болезни органов дыхания и сердечно-сосудистой системы // Педиатрия. Рук-
во / Под ред. Р.Е.Бергмана, В.К.Вогана. Перевод с англ. - М: Медицина 1993.
20. Констант Дж. Клиническая диагностика заболеваний сердца. Кардиолог у
постели больного. Перевод с англ. - М: Бином. - 2004.
21. Koppel R.I., Druschel С.М., Carter Т. et al. Effectiveness of pulse oximetry screen-
ing for congenital heart disease in asymptomatic newborns // Pediatrics.- 2003.-
Vol. 111.- P. 451-455.
22. Фейгенбаум X. Эхокардиография: Пер.с англ. - М.: Видар, 1999.
23. Schiller N.B., Shah Р.М., Crawford М. et al. Recommendations for quantitation of
the left ventricle by two-dimensional echocardiography // J. Am. Soc. Echocardiogr.-
1989.- Vol. 2.- P. 358.
24. Arsos G., Moralidis E., Karatzas N., et al. Heart rate is the major determinant of
diastolic filling pattern during growth: a radionuclide ventriculography assessment.
// Pediatr. Cardiol. - 2002. - Vol. 23. - P. 378-387.
73
25. Schmitz L., Koch H., Bein G., Brockmeier K. Left ventricular diastolic function in
infants, children, and adolescents. Reference values and analysis of morphologic
and physiologic determinants of echocardiographic Doppler flow signals during
growth and maturation. // J. Am. Coll. Cardiol. - 1998. - Vol. 32. - P. 1441-1448.
26. Nishimura R.A., Tajic A.J. Evaluation of diastolic filling of left ventricle in health
and disease: Doppler echocardiography is the clinician’s rosetta stone. // J. Am.
Coll. Cardiol. - 1997. - Vol. 30. - P. 8-18.
27. Овчинников AT., Агеев Ф.Т., Мареев В.Ю. Методические аспекты применения
Допплер-эхокардиографии в диагностике диастолической дисфункции левого
желудочка. // Серд, недостаточность. - 2000. - Т. 1.- №2. - С. 66-70.
28. Tei С. New non-invasive index for combined systolic and diastolic ventricular func-
tion. // J. Cardiol. - 1995. - Vol. 26. - P. 135-136.
29. Ishii M., Eto G., Tei C. et al. Quantitation of the global right ventricular function in
children with normal heart andcongenital heart disease: a right ventricular myocar-
dial performance index // Pediatr. Cardiol.- 2000.- Vol. 21.- P. 416-421.
30. Клиническое руководство по ультразвуковой диагностике. Том V / Под ред.
Митькова В.В., Сандрикова В.А. - М: ВИДАР. - 1998. - 360 с.
74
Глава 5. ОСНОВНЫЕ СИНДРОМЫ, КОТОРЫМИ
ПРОЯВЛЯЮТСЯ ВРОЖДЕННЫЕ
ПОРОКИ СЕРДЦА У ДЕТЕЙ, И ИХ
ТЕРАПИЯ
Роль детского кардиолога неизмеримо возросла за последние 10
лет. Это связано с рядом изменений, произошедших в данной области,
и прежде всего с прогрессом в ранней диагностике врожденной пато-
логии сердца и сосудов, улучшением выхаживания тяжелых младен-
цев. В результате в сферу деятельности детских кардиологов все чаще
попадают новорожденные и грудные дети, требующие терапевтической
поддержки, в том числе в ожидании операции; возросло и число по-
слеоперационных больных.
При анализе состояния пациента возникает необходимость отне-
сти порок к той или иной группе, что облегчает планирование лечения
и определяет прогноз. Однако попытки создать исчерпывающую клас-
сификацию врожденных пороков сердца наталкиваются на большие
трудности. Во-первых, существует огромное количество вариантов по-
роков и их сочетаний. Во-вторых, в зависимости от задач, которые сто-
ят перед исследователями, меняются принципы, которые кладут в ос-
нову классификаций. Так, для генетиков и акушеров наиболее важны
этиологические факторы, возможность профилактики ВПС. Для хи-
рургов - морфологические изменения сердца и их влияние на гемоди-
намику. В практике детских кардиологов на первое место выходят кли-
нические проявления пороков, их осложнения. В частности, в повсе-
дневной деятельности наиболее часто используется деление ВПС на
три основные группы [1]: 1) ВПС с артерио-венозным сбросом - так
называемые пороки бледного типа (ДМЖП, ДМПП, ОАП и др.); 2) ВПС
с вено-артериальным сбросом - так называемые пороки синего типа
(ТФ, АТК и др.); 3) ВПС без сброса, но с препятствием к выбросу кро-
ви из желудочков (стенозы аорты и легочной артерии, коарктация аор-
ты). На самом деле существует целый ряд «перекрестных» состояний,
которые характеризуются и сбросом, и сопротивлением выбросу. Бо-
лее того, один и тот же порок сразу после рождения может проявить
себя как порок третьей группы, а затем «переместиться» в первую (на-
пример, ДМЖП с легочным стенозом). Существуют также патологии,
которые трудно однозначно отнести к одной из этих групп (например,
транспозиция магистральных артерий).
Список классификаций можно было бы продолжать, переходя от
специальности к специальности. Однако, адресуя монографию врачам
75
преимущественно терапевтической направленности, мы считаем бо-
лее важным акцентировать внимание на синдромах, которые сущест-
венны для быстрого выявления порока, идентификации ведущих ге-
модинамических нарушений и применения адекватной терапии.
Традиционно при ВПС нарушения гемодинамики рассматривают
как результат изменений анатомии сердца. Считается, что только ис-
правление этих аномалий приводит к излечению, и подобными паци-
ентами должны заниматься кардиохирурги. Однако часто, еще до пе-
ревода больного в кардиохирургическое отделение и выполнения опе-
рации, бывает необходимо стабилизировать состояние больного. При
этом точный топический диагноз может быть еще не известен. Таким
образом, врач прибегает к лечению не конкретного порока, а того или
иного симптомокомплекса, которым проявляется порок.
В послеоперационном периоде могут также оставаться явления
дисфункции миокарда, гипоксемии, которые требуют длительной тера-
певтической поддержки. Это связано с тем, что при некоторых ВПС
хирургическое вмешательство принципиально носит лишь паллиа-
тивный характер (например, при ВПС с «одножелудочковой» гемо-
динамикой, при гемодинамической коррекции транспозиции маги-
стральных артерий). Нередко симптоматика определяется измене-
ниями желудочков, сохраняющимися после операции (ремодели-
рование правого желудочка - при тетраде Фалло, ремоделирование
левого - при аортальном стенозе). Таким образом, и после операции
терапия также направлена на лечение симптомокомплекса, а не поро-
ка как такового.
Как было показано выше, примерно 50% больных с ВПС требует-
ся терапевтическое или хирургическое вмешательство на первом году
жизни, что составляет 0,5% среди живорожденных (при средней час-
тоте ВПС в 1,0%). В половине этих случаев критические состояния
связаны с сердечной недостаточностью (0,25% в популяции), во вто-
рой половине (0,25% в популяции) - с артериальной гипоксемией или
угрозой закрытия ОАП при дуктус-зависимых пороках. Основываясь
на этих данных, мы предлагаем для новорожденных и грудных детей
следующую рабочую классификацию врожденных пороков сердца.
Синдромальная классификация врожденных пороков сердца
у новорожденных и детей первого года жизни
1. Врожденные пороки сердца, проявляющиеся преимущественно
артериальной гипоксемией (хроническая гипоксемия, гипоксический
приступ, гипоксический статус):
76
а) вследствие сброса венозной крови в артериальное русло,
Ь) вследствие уменьшения легочного кровотока,
с) вследствие разобщения малого и большого кругов кровооб-
ращения,
d) вследствие закрытия ОАП при дуктус-зависимом легочном
кровообращении.
2. Врожденные пороки сердца, проявляющиеся преимущественно
сердечной недостаточностью (острая сердечная недостаточность, застой-
ная сердечная недостаточность, кардиогенный шок):
а) вследствие объемной перегрузки,
Ь) вследствие нагрузки сопротивлением,
с) вследствие поражения миокарда,
d) вследствие закрытия ОАП при дуктус-зависимом системном
кровообращении.
3. Врожденные пороки сердца, проявляющиеся преимуществен-
но нарушениями ритма (постоянная тахикардия, полная атриовентри-
кулярная блокада, пароксизмы тахикардии).
Естественно, данные синдромы могут сочетаться, усугубляя тяжесть
состояния детей. В настоящей главе мы остановимся на первых двух
синдромах, сопровождающих врожденные пороки сердца.
5.1. Синдром артериальной гипоксемии
Гипоксемия при ВПС характеризуется снижением парциального
давления кислорода (рО2) и насыщения гемоглобина кислородом (SO2)
в артериальной крови, что приводит к недостаточному обеспечению
им периферических тканей, т.е. гипоксии. В норме раО2 должно со-
ставлять 60-80 мм рт.ст., a SaO2 - 96-98%. Последняя величина опре-
деляется уровнем рО2 и химическим сродством гемоглобина к кисло-
роду. Артериальная гипоксемия возникает при раО2 менее 60 мм рт. ст.
и уровне насыщения гемоглобина менее 85%, у новорожденных - менее
75% [2].
При длительной и резко выраженной гипоксемии в тканях включа-
ются механизмы анаэробного гликолиза, происходит накопление кис-
лых продуктов метаболизма и развивается метаболический ацидоз. Де-
компенсированный ацидоз сопровождается появлением свободных ра-
дикалов и истощением антиоксидантной системы, что приводит к по-
вреждению различных органов на уровне клеток.
77
Следует помнить, что выраженность цианоза сама по себе отражает
не степень имеющихся нарушений, а количество восстановленного
гемоглобина в крови. Для оценки тяжести гипоксемии можно
воспользоваться следующей схемой:
1. Легкая гипоксемия - снижены рО2 и SO2; BE на нижней границе
нормы, pH не изменено (метаболический ацидоз отсутствует). Функция
органов не страдает.
2. Средняя степень гипоксемии - снижены рО2, SO2 и BE; pH не
изменено (имеется компенсированный метаболический ацидоз). Функция
органов не страдает. Терапевтические мероприятия компенсируют ацидоз.
3. Тяжелая гипоксемия - снижены рО2, SO2, BE и pH (имеется
декомпенсированный метаболический ацидоз). Транзиторные нарушения
функции органов. Терапевтические мероприятия только временно
компенсируют ацидоз.
4. Гипоксический шок - выраженные нарушения функции органов,
связанные с декомпенсированным метаболическим ацидозом, не
купирующимся терапевтическими мероприятиями.
Как указывалось выше, в формировании артериальной гипоксе-
мии при ВПС могут играть роль три основных механизма: 1) внутрисер-
дечный сброс венозной крови справа налево и ее поступление в аорту,
2) сниженный легочный кровоток и уменьшенный возврат артериаль-
ной крови к сердцу, 3) разобщение большого и малого кругов крово-
обращения (при транспозиции магистральных артерий). При большин-
стве ВПС цианотического типа артериальная гипоксемия связана с пер-
выми двумя механизмами.
Так как при некоторых пороках у новорожденных открытый арте-
риальный проток может быть основным источником поступления крови
в легочную артерию, при планировании терапии необходимо также оп-
ределить, является ли ВПС дуктус-зависимой или дуктус-независимой
патологией. Критические гипоксические состояния в первые месяцы
жизни наиболее часто развиваются при дуктус-зависимых пороках.
Клиническая симптоматика
Врожденные пороки синего типа диагностируют, как правило, рань-
ше, чем прочие пороки в связи с наличием такого явного симптома, как
центральный цианоз. Цианоз становится заметен при наличии в крови бо-
лее 5 г/100 мл восстановленного гемоглобина. Его появление в такой кон-
центрации происходит легче у новорожденного с высоким содержани-
ем общего гемоглобина (уже на уровне SO2=85%). При анемии требуется
78
Рис. 5-1. Зависимость между уровнем гемоглобина и уровнем SO2,
необходимыми для появления цианоза (образования 5 г/100 мл
восстановленного гемоглобина)
более выраженное снижение SO2 (менее 50%) для образования достаточ-
ного количества восстановленного гемоглобина (рис. 5-1). То есть, ане-
мия маскирует наличие гипоксемии, и поэтому нет прямой зависимости
между степенью цианоза и тяжестью гипоксемии.
Характерными проявлениями тяжелой артериальной гипоксемии яв-
ляются заторможенность или, наоборот, беспокойство больного вследст-
вие гипоксии центральной нервной системы. Шум над областью сердца
присутствует необязательно; в случае закрытия ОАП он даже может ис-
чезнуть в динамике. У дуктус-зависимых больных это сопровождается
усилением цианоза и тяжести состояния. У больных с метаболическим
ацидозом возникает компенсаторная гипервентиляция, направленная на
удаление из организма избытка двуокиси углерода (СО2).
Для подтверждения гипоксемии и оценки ацидоза проводят анализ
рО2, SO2,pH, BE.
При длительном существовании гипоксемии нарушается физиче-
ское и умственное развитие детей, половое созревание. Однако замет-
ное отставание веса и роста встречается лишь при сочетании гипоксе-
мии с сердечной недостаточностью.
Дифференциальная диагностика
При ВПС цианоз носит центральный характер, т.е. связан со сни-
жением содержания кислорода в артериальной крови. Периферический
цианоз возникает при шоке, холодовом спазме периферических сосу-
дов, гиповолемии. При этом концентрация кислорода в артериальной
крови не нарушена.
В первые часы после рождения синдром артериальной гипоксемии
может быть обусловлен целым рядом причин. Наиболее частые из них -
расстройства дыхания, связанные с родовой травмой, асфиксией, синдро-
79
мом дыхательных расстройств, массивным ателектазом легкого, внут-
риутробной пневмонией, пневмотораксом, диафрагмальной грыжей и т.п.
В роддоме перед врачом обычно стоит задача установить причину
цианоза, используя минимальный набор диагностических средств. Ле-
гочная патология может быть заподозрена при осложненном течении
беременности и родов. Дальнейший анализ проводят, ориентируясь на
аускультацию легких и сердца, а также рентгенографию грудной клет-
ки. По возможности используют также ЭКГ и ЭХОКГ, которые позво-
ляют обнаружить аномалии сердца.
Ценным является гипероксический тест (дыхание 100%-ным ки-
слородом). Данный тест необходимо использовать у всех пациентов,
имеющих устойчивый центральный цианоз. Оценку результатов теста
проводят через 10-15 мин дыхания 100%-ным кислородом. У больных
с «сердечным» цианозом рО2 возрастает не более чем на 10-15 мм рт.ст.,
так как изменение концентрации кислорода в легких практически не
меняет величину примеси венозной крови к артериальной на уровне внут-
рисердечных сообщений. В отличие от этого при легочных заболевани-
ях повышение парциального давления кислорода в альвеолах сопрово-
ждается пропорциональным его повышением в крови и может дости-
гать 100-200 мм рт. ст. Однако существуют исключения: при большом
легочном кровотоке (как при тотальном аномальном дренаже легочных
вен) возможен рост рО2 до 100 мм рт. ст. и выше. С другой стороны,
массивный внутрилегочный шунт при легочной патологии (и отсутст-
вии порока сердца) ограничивает рост рО2 во время проведения теста.
Следует отметить, что SO2 меняется не столь заметно, и ошибка в оцен-
ке результатов теста более вероятна.
Терапия
Общие мероприятия
Стандартная схема ведения новорожденных высокого риска вклю-
чает содержание младенца в специальном кувезе, куда подается увлаж-
ненная и подогретая дыхательная смесь. Проводят мониторинг сердеч-
ных сокращений, артериального давления, частоты дыхания. Контроли-
руют и корригируют гемоглобин, гематокрит, калий, кальций, глюкозу,
креатинин, билирубин, проводят профилактику инфекции и санацию ды-
хательных путей.
Снижение метаболических потребностей организма и
миокарда
Создание температурного (36°С на коже) и физического комфорта,
седация обеспечивают минимальную метаболическую активность и по-
требность в доставке кислорода как к тканям организма, так и к само-
80
му миокарду. Таким образом, уменьшаются относительный дефицит ки-
слорода и напряженность анаэробных процессов.
Воздействие на объем циркулирующей крови
У больных с цианотическими ВПС следует избегать выраженной
гиповолемии, которая сама по себе может привести к периферической
ишемии, усилению анаэробного гликолиза и ацидозу. Ограничение вво-
димой жидкости проводят только при сопутствующей сердечной недос-
таточности. Более того, при угрозе закрытия ОАП у дуктус-зависимых
больных общий объем инфузий (5-10% глюкоза) и кормления несколь-
ко увеличивают (до 110-120% от нормальных потребностей) на фоне
постоянной оценки диуреза. В этих случаях возможно и введение рас-
творов, улучшающих реологию крови (реополиглюкин - до 10 мл/кг/
сутки). Однако последний противопоказан при перспективе выполне-
ния операции в ближайшее время, так как может способствовать повы-
шенной кровоточивости тканей.
Эффективным средством контроля баланса жидкости является ре-
гулярное взвешивание ребенка.
Кислородотерапия
Как следует из патофизиологии артериальной гипоксемии при
ВПС, дыхание воздухом с повышенными концентрациями кислорода
не увеличивает существенно раО2 у детей с цианотическими порока-
ми, более того, кислород может быть вреден, если имеется дуктус-за-
висимая патология, так как способствует закрытию ОАП. Поэтому ки-
слородотерапию следует исключить из традиционной схемы лечения но-
ворожденных с ВПС. Ее проведение оправданно лишь в случае точно
установленного диагноза тетрады Фалло, протекающей с гипоксически-
ми приступами. Также только у этих больных используют введение 0-
адреноблокаторов (1 мг/кг/сутки).
Искусственная вентиляция легких (ИВЛ)
Показания к проведению ИВЛ при цианотических ВПС ограничены,
так как она не приводит к повышению рО2 в артериальной крови, а
опасность развития легочного инфекционного процесса значительно воз-
растает. Если все же ИВЛ необходима (например, для лечения сердеч-
ной недостаточности), концентрация кислорода во вдыхаемой смеси не
должна превышать 21% в связи с указанными выше причинами.
Сложным является вопрос о концентрации кислорода во вдыхае-
мой смеси у больных с ВПС и дыхательной недостаточностью вследст-
вие заболевания легких. Вероятно, она должна быть на минимальном уров-
не, позволяющем избегать прогрессирования метаболического ацидоза.
8 1
Коррекция метаболического ацидоза
В случаях развития метаболического ацидоза и уровне BE менее -6,0
проводят терапию 7,5%-ным раствором гидрокарбоната натрия, содер-
жащим около 1 мэкв/мл. Для простого расчета необходимого объема
(Q) раствора можно использовать формулу: Q = BE • вес • 0,3. Данную
дозу можно повторить через 30 мин. Если подозревается ацидоз, но
неизвестна величина pH и BE, в качестве первоначальной дозы можно
использовать 1 мэкв/кг веса больного. Раствор гидрокарбоната натрия
разводят в равном количестве дистиллированной воды или глюкозы и
вводят медленно в периферическую или центральную вену. Быстрое вве-
дение концентрированного раствора опасно локальным повреждением
вены, развитием гиперосмолярного состояния, снижением уровня ка-
лия в сыворотке крови, угнетением центральной нервной системы.
Простагландины группы Е
Эффективным средством терапии дуктус-зависимых пороков яв-
ляются простагландины группы Е (ПГЕ). Данные вещества избиратель-
но действуют на стенки артериального протока и легочных сосудов,
вызывая их расслабление и улучшение проходимости. Инфузию прово-
дят в центральную вену, титруя дозу от 0,002 мкг/кг/мин (обычно до
0,05-0,1 мкг/кг/мин) вплоть до стабилизации состояния больного и вы-
полнения операции. Во время терапии возможны такие осложнения, как
апноэ (40%), гиперемия кожных покровов (20%), повышение темпера-
туры тела (12% больных). Однако при переходе на более низкую дозу
или при отмене препарата они быстро проходят. Противопоказаниями
для использования ПГЕ являются респираторный дистресс-синдром, пер-
систирующее фетальное кровообращение в сочетании с ОАП, наличие
ВПС с высоким легочным кровотоком (тотальный аномальный дренаж
легочных вен). Необходимо также учитывать, что легче поддержать про-
ходимость суженного протока, чем вновь открыть закрывшийся про-
ток. Эффективность ПГЕ быстро падает с увеличением возраста ново-
рожденных (рис. 5-2), поэтому решение о применении ПГЕ следует при-
нимать в первые недели жизни ребенка.
Экстракорпоральная мембранная оксигенация (ЭКМО)
Данная методика предназначена для обеспечения достаточного
содержания кислорода в артериальной крови с помощью внешнего
оксигенатора. Показанием для проведения процедуры является
невозможность поддержания адекватного газообмена с помощью
традиционной вентиляции легких, в частности, если индекс оксигенации
составляет более 40. Забор крови у младенца производится по венозной
82
Рис. 5-2. Эффективность ПГЕ в зависимости от возраста больных
канюле, проведенной в правое предсердие, возврат - с помощью
роликового насоса через артериальную канюлю, установленную в
каротидную или бедренную артерию. Успех применения ЭКМО зависит
от степени обратимости тех патологических процессов, которые
препятствуют нормальной доставке кислорода к периферическим тканям
(персистирующая легочная гипертензия новорожденных, мекониевая
аспирация, диафрагмальная грыжа). Нередко данная методика оксигенации
используется после коррекции ВПС, протекавших с выраженной
компрометацией легочного или периферического кровообращения
(синдром гипоплазии левого сердца, атрезия легочной артерии с интактной
межжелудочковой перегородкой и др.). Так как при выполнении процедуры
требуется антикоагулянтная терапия, противопоказаниями для ЭКМО
являются геморрагические повреждения головного мозга и других
органов, гестационный возраст менее 32 недель. Данное вмешательство
мало целесообразно, если имеется некорректабельный порок сердца,
выраженная гипоплазия легких или тяжелая хромосомная патология.
5.2. Синдром сердечной недостаточности
Сердечная недостаточность - синдром, характеризующийся неспо-
собностью сердца обеспечить системный кровоток, адекватный метабо-
лическим потребностям организма, и возникающий вследствие избыточ-
ной гемодинамической нагрузки на сердце, нарушений сократимости
миокарда, чрезмерно частых или редких желудочковых сокращений.
83
Развитие сердечной недостаточности при ВПС имеет ряд особенно-
стей, в отличие от случаев, связанных с ишемической болезнью сердца
или артериальной гипертензией у взрослых. У детей наряду с дисфунк-
цией левого желудочка часто имеется, а иногда и преобладает правоже-
лудочковая недостаточность (-20% больных). Кроме того, существует
понятие недостаточности единственного желудочка, обеспечивающего
как системный, так и легочный кровоток. Среди механизмов сердечной
недостаточности при врожденных пороках сердца значительное место
занимает неадекватное внутрисердечное распределение венозного воз-
врата. Также относительно высока частота диастолической дисфунк-
ции сердца; нередко прогрессированию сердечной недостаточности спо-
собствуют врожденные нарушения ритма. При цианотических ВПС час-
то имеется крайне неблагоприятное сочетание сердечной недостаточно-
сти с артериальной гипоксемией. В этих случаях значительно усугубля-
ется дефицит кислорода в тканях, в том числе в самом миокарде, и
выраженность расстройств кровообращения.
Причины, приводящие к сердечной недостаточности при ВПС, мож-
но объединить в три основные группы:
1. Нагрузка большими объемами перекачиваемой крови (ВПС с
большими ДМЖП, ОАП, тотальный аномальный дренаж легочных вен,
недостаточность клапанов сердца).
2. Критическая нагрузка сопротивлением (аортальный стеноз, ко-
арктация аорты, легочный стеноз).
3. Гипоксическое или ишемическое повреждение миокарда (транс-
позиция магистральных артерий, аномальное отхождение коронарной
артерии).
Отдельно необходимо рассматривать критические состояния, воз-
никающие у пациентов с дуктус-зависимым системным кровообраще-
нием. Закрытие ОАП у них приводит, строго говоря, не к сердечной
недостаточности, а к остро возникающему дефициту кислорода в тка-
нях организма, протекающему по типу шока. В подобных случаях кли-
ническая картина характеризуется артериальной гипотонией, деком-
пенсированным метаболическим ацидозом, периферическим спазмом
(снижено наполнение капилляров кровью, холодные конечности, блед-
ность, мраморность), олигоурией, резким угнетением ЦНС. Наряду с
этим у дуктус-зависимых больных может быть гиперфункция протока,
приводящая к симптомам традиционной сердечной недостаточности,
описанным ниже.
Основой процесса адаптации к условиям кровообращения, возни-
кающим при ВПС, является выработка компромисса между сердечным
84
выбросом и перфузионным давлением в тканях. Как показывают мно-
гочисленные исследования сердечной недостаточности, к ее развитию
причастны различные процессы. К наиболее важным из них относятся
нарушения насосной функции сердца, сдвиги в нейроэндокринной сис-
теме, клеточные изменения, сдвиги в автономной регуляции, систем-
ный воспалительный ответ, эндотелиальная дисфункция, генетические
механизмы [3]. В исследованиях Scammell AM. et al. [4], Buchhom R. et
al. [5] было показано, что у грудных детей, как и у взрослых, имеется
высокая корреляция между активностью ренина плазмы, уровнем аль-
достерона и катехоламинов с клиническими проявлениями сердечной
недостаточности. Это создает предпосылки для использования ингиби-
торов синтеза АПФ или [3-блокаторов в данной возрастной группе.
Клиническая симптоматика
В части случаев сердечная недостаточность является следствием
процессов, протекавших внутриутробно (при недостаточности атрио-
вентрикулярных клапанов, фиброэластозе эндокарда). Однако при боль-
шинстве ВПС (ДМЖП, коарктация аорты, тотальный аномальный дре-
наж легочных вен, общий артериальный ствол) патологическая нагрузка
на сердце внутриутробно практически отсутствует, но внезапно возни-
кает и быстро нарастает при переходе к постнатальному кровообраще-
нию. Характерным примером является развитие расстройств кровооб-
ращения из-за быстрого увеличения внутрисердечного сброса слева
направо после физиологического снижения общего легочного сопро-
тивления у новорожденных.
При пороках с большим шунтом слева-направо сердечная недос-
таточность носит преимущественно застойный характер и характери-
зуется известными симптомами: устойчивая тахикардия в покое или
при небольшой нагрузке, одышка, кашель, свистящее дыхание, застой-
ные хрипы в легких, усталость при кормлении, увеличение печени, оте-
ки на лице или периферии, потливость, гипотрофия. Если такое со-
стояние возникает у ребенка впервые, может иметь место ошибочная
трактовка его причин. В частности, респираторные нарушения неред-
ко рассматривают как признаки пневмонии и проводят соответствую-
щее, как правило, необоснованное лечение. Однако истинной причиной
одышки в этих случаях является не воспалительный процесс, а задерж-
ка жидкости в малом круге кровообращения, интерстициальный отек
легких. В свою очередь повышение резистентности малых бронхов дает
картину свистящего дыхания и хрипов. Появление влажных хрипов сви-
детельствует об отеке альвеол. Если сужение дыхательных путей про-
грессирует, это может привести к развитию ателектазов, эмфиземы лег-
ких.
85
Для ВПС обструктивного характера более свойственны симптомы
низкого сердечного выброса - сниженный пульс, холодные конечно-
сти, плохое наполнение капилляров, тахикардия, гипотрофия. Часто раз-
вивается дисфункция органов, страдающих от относительной ишемии,
наиболее часто - почек.
При поражении контрактильного миокарда гипоксического или
ишемического происхождения симптоматика носит комбинированный
характер (низкий выброс в сочетании с застойными явлениями).
Аускультация сердца позволяет выявить шум, связанный с ВПС,
иногда - ритм галопа. Последний связан с быстрым наполнением не-
достаточно расслабленного желудочка.
Инструментальные методы исследования играют вспомогательную
роль в диагностике сердечной недостаточности. С помощью рентгено-
графии грудной клетки выявляют явления гиперволемии или застоя в ма-
лом круге кровообращения, расширение тени сердца. Степень кардиоме-
галии приблизительно можно определить по кардиоторакальному индек-
су (КТИ более 0,6). Однако нередко расширение сердца происходит в
переднезаднем направлении (например, при увеличении правого желу-
дочка), и КТИ изменен незначительно. Поэтому при первичном обследо-
вании желательно выполнение и бокового снймка. Увеличение тени серд-
ца на рентгенограмме отражает объемную перегрузку, гипертрофия серд-
ца лучше определяется на ЭКГ. Последнее исследование также эффек-
тивно в диагностике нарушений ритма и ишемии миокарда.
Визуальное усиление легочного рисунка наступает при отношении ле-
гочного и системного кровотоков, близком к 2:1. Рентгенография груд-
ной клетки также важна в аспекте дифференциальной диагностики с забо-
леваниями легких и средостения, вызвающими сердечную недостаточность.
Конечно, наиболее информативным исследованием является ЭХОКГ,
позволяющая определить как характер ВПС, так и степень поражения
сердца (дилатация камер сердца, изменения ударного и сердечного ин-
дексов, фракции укорочения и т.д.).
Одним из серьезных последствий ВПС является задержка физиче-
ского развития. Считается, что изменения веса отражают кратковремен-
ные нарушения питания, а изменения роста - долговременные. В соот-
ветствии с этим у новорожденных наблюдается преимущественно де-
фицит веса, в течение первого года жизни имеется отставание от нормы
как веса так и роста, а у больных старше года в большей мере страдает
рост. Наиболее заметные изменения физических параметров встречают-
ся в период от 1 мес до 3 лет [6].
Причины отставания в физическом развитии разнообразны. С од-
ной стороны, у детей с ВПС и сердечной недостаточностью примерно на
20% снижено поступление питательных веществ в организм. Это связа-
86
но с отсутствием аппетита, утомлением при кормлении, искусственным
ограничением жидкости. Кроме того, нарушаются процессы всасыва-
ния (отек кишечника, расстройства моторики, энтеропатии с потерей
белка, уменьшение объема желудка из-за гепатомегалии). С другой сто-
роны, в среднем на 40% увеличен расход энергии (из-за повышенной
работы дыхательной системы и сердца), особенно «стоимость» физи-
ческой активности [7].
Оценка тяжести СН у детей представляет сложную проблему. В за-
падных публикациях обычно ориентируются на традиционную класси-
фикацию Нью-Йоркской сердечной ассоциации с четырьмя стадиями
заболевания, пытаясь адаптировать ее к детскому возрасту:
Классификация дооперационного состояния детей (Kirklin J.K. et al.,
1981):
Класс I - отсутствие симптомов.
Класс II - хорошая физическая активность, однако при умеренной нагрузке
или плаче возникает одышка.
Класс III - постоянные симптомы в виде диспноэ при легкой нагрузке
или беспокойстве, нарушения физического развития.
Класс IV - выраженные симптомы, недавно возникшая сердечная не-
достаточность, диспноэ в покое.
Класс V - метаболический ацидоз, отсутствие периферического пульса,
зависимость от искусственной вентиляции легких.
«Индекс способности» больных (Sommerville J. 1989):
1-й уровень - нормальный образ жизни; полный рабочий день при
работе или в школе, способность к вынашиванию беременности.
2-й уровень - способность к работе сохраняется, однако образ жизни ог-
раничен, сердечное заболевание проявляется периодически; беременность воз-
можна.
3-й уровень - не способны работать; все виды активности существенно
ограничены; беременность сопряжена с высоким риском.
4-й уровень - крайняя степень ограничения всех физических возмож-
ностей; полная зависимость от постороннего ухода, «постельный больной».
В отечественной литературе классификация сердечной недостаточ-
ности у детей была предложена Н.А. Белоконь (1987) (табл. 5-1).
Мы считаем, что при оценке тяжести состояния у младенцев необ-
ходимо дополнительно ввести понятие кардиогенного шока, а также учи-
тывать перспективность терапевтического лечения [8].
Классификация сердечной недостаточности у грудных детей с учетом
проводимого лечения (Шарыкин А.С., 2000):
I степень - умеренные тахикардия и одышка (до 120% от нормы) в
покое или при небольшой нагрузке (кормление); печень до +3 см. Размеры
87
Таблица 5-1
Признаки и стадии сердечной недостаточности у детей
(по Белоконь Н.А., 1987)
Стадия Левожелудочковая недостаточность 1 Правожелудочковая недостаточность
I Сердечная недостаточность отсутствует в покое и появляется после нагрузки в виде одышки и тахикардии.
ПА Число сердечных сокращений увеличено на 15-30% в минуту. Число дыханий увеличе- но на 30-50%. Печень выступает на 2-3 см из-под края реберной дуги.
ПБ Число сердечных сокращений увеличено на 30-50% в минуту. Число дыханий увеличе- но на 50-70%. Возможны акроцианоз, навяз- чивый кашель, влажные хрипы в легких. Печень выступает на 3-5 см из-под края реберной дуги, возможны пас- тозность. набухание шейных вен.
III Число сердечных сокращений увеличено на 50-60% в минуту. Число дыханий увеличе- но на 70-100%. Клиническая картина предо- тека и отека легких. Гепатомегалия, отечный синдром, гидро пер икард, асцит.
сердца могут быть не увеличены. С помощью медикаментозной терапии
удается добиться компенсации показателей.
II степень - тахикардия и одышка до 125-150% от нормы (в покое);
печень более чем +3 см. Возможны отеки на стопах и лице, беспокойство,
затрудненное кормление, периодически прослушиваются непостоянные за-
стойные хрипы в легких. Рентгенологически или при ЭХОКГ - заметная ди-
латация полостей желудочков. Медикаментозная терапия уменьшает сим-
птомы до уровня I степени.
III степень - тахикардия и одышка достигают 160% и более, печень
плотная, увеличенная (более +3 см), периферические отеки и асцит; посто-
янные застойные хрипы в легких. Ребенок вял, заторможен. Размеры сердца
значительно увеличены. Стандартная медикаментозная терапия малоэффек-
тивна, нередко требуется проведение ИВЛ для стабилизации состояния.
IV степень (кардиогенный шок) - артериальная гипотония, декомпен-
сированный ацидоз, периферический спазм (снижено наполнение капилля-
ров кровью, холодные конечности, бледность), резкое угнетение ЦНС, оли-
гоурия. Возможна брадикардия менее 80 уд. в мин.
При I—II степени СН медикаментозная терапия, как правило, позволяет
быстро стабилизировать состояние младенцев, провести диагностические
процедуры и оперировать больных в плановом порядке. При III—IV ст. тера-
пия является по-настоящему интенсивной и нередко приобретает черты реа-
нимации. Оперативное вмешательство может быть выполнено только после
стабилизации основных гемодинамических и метаболических показателей,
в т.ч. после использования ИВЛ.
Дифференциальная диагностика
Дифференциальную диагностику необходимо проводить с сердеч-
ной недостаточностью, возникающей в отсутствие ВПС (~ 20% случаев
в грудном возрасте). Наиболее частыми ее причинами являются пораже-
88
ния миокарда общегипоксического или инфекционного генеза, нару-
шения сердечного ритма, синдром дыхательных расстройств, пневмо-
ния, циркуляторная нагрузка (чрезмерные трансфузии), полицитемия,
водянка плода, сепсис, диабетическая фетопатия, анемия.
Терапия
При лечении сердечной недостаточности необходим комплексный
подход. При этом следует избегать действий, которые могут усилить
соответствующие сбросы крови или увеличить нагрузку на желудочек,
работающий против высокого сопротивления. К основным методам те-
рапии относятся следующие:
Снижение метаболических потребностей организма
и миокарда
Наряду с седацией большое значение при лечении сердечной не-
достаточности у младенцев имеет контроль температуры тела. Как пра-
вило, поддержание температурного гомеостаза у этих больных затруд-
нено за счет сниженной мышечной активности, относительно большой
поверхности тела, ограниченной способности к усилению кровоснаб-
жения периферических тканей. Для обеспечения температуры 36°С в
подмышечной впадине температура окружающей среды должна состав-
лять от 32 до 34°С. Опасны как перегревание, так и охлаждение ребенка.
Вследствие нарушений терморегуляции увеличивается скорость обмен-
ных процессов и потребление кислорода, что предъявляет повышенные
требования к сердечному выбросу. Высокая температура (более 38,5°)
помимо неконтролируемой тахикардии опасна возникновением вазоди-
латации со снижением артериального давления вплоть до шокового со-
стояния, и судорогами. При охлаждении развивается сужение сосудов
с увеличением гипоксии, ацидозом и опасностью остановки дыхания.
Воздействия на объем циркулирующей крови (ОЦК)
Наиболее часто используют ограничение поступающей в организм
жидкости и/или стимуляцию мочеотделения с помощью диуретиков. Об-
щий объем жидкости вместе с кормлением не должен превышать 80%
от возрастной нормы. Основным используемым диуретиком является
фуросемид (лазикс), который вводят в дозе 0,5-3,0 мг/кг внутривенно,
внутримышечно или перорально. При долговременной терапии возможно
добавление верошпирона по 2-^4 мг/кг в сутки. Общим правилом при
лечении диуретиками является контроль баланса жидкости и концентра-
ции электролитов в сыворотке крови.
При лечении сердечной недостаточности необходимо обеспечить энер-
гетически адекватное питание в относительно небольшом объеме. В каче-
стве первого шага прибегают к частому кормлению небольшими порция-
89
ми, используя смеси с повышенной калорийностью. Возможны перио-
дические инфузии 10-20% глюкозы. Однако в большинстве случаев для
доставки в организм питательных веществ в достаточном объеме прихо-
дится переходить на их введение через гастродуоденальный зонд. Только
24-часовое непрерывное питание может обеспечить суточное введение
до 140-200 ккал/кг в сутки, что позволяет сохранить стабильную прибав-
ку в весе [7]. Больным, не способным усвоить достаточный объем при
зондовом питании, может потребоваться парентеральное питание с ис-
пользованием изотонических растворов аминокислот (3-3,5%), 10% глю-
козы, витаминов, минеральных веществ и электролитов.
Эффективным средством контроля за лечением является ежеднев-
ное взвешивание ребенка.
Воздействие на резистентность легочных
или периферических сосудов
Колебания общего легочного сопротивления оказывают значитель-
ное влияние на функцию сердца (табл. 5-2).
Таблица 5-2
Изменение функции сердца при изменении
общего легочного сопротивления
Изменение ОЛС Изменение сброса крови на уровне ДМЖП или ОАП Прочие изменения
уменьшение увеличение Нагрузка на ПЖ 4 Легочный кровоток Т Приток крови к ЛЖТ Сердечный выброс Т
увеличение уменьшение Нагрузка на ПЖ Т Легочный кровоток 4 Сброс крови через ООО (справа-налево) Т Приток крови к ЛЖ ? Сердечный выброс ?
Примечание. Т - увеличение, 4 - уменьшение, ? - не определено, ПЖ - правый
желудочек, ЛЖ - левый желудочек, ООО - открытое овальное окно.
Наиболее сильными дилататорами легочных сосудов являются
окись азота (NO), простагландины и кислород. Использование дан-
ных средств для искусственного снижения общего легочного сопро-
тивления может быть показано у новорожденных с правожелудочковой
недостаточностью (например, при дисфункции трикуспидального кла-
пана). Однако, как показывает опыт, необходимо отказаться от рутин-
ного использования кислорода в терапии сердечной недостаточности
при ВПС. Это может привести к развитию неконтролируемой вазоп-
легии в легочном сосудистом русле, усилению сброса крови через
90
ДМЖП или ОАП и «неожиданному» нарастанию сердечной недоста-
точности. Кроме того, в обстоятельствах, когда точный диагноз еще
не установлен, велика опасность с помощью кислорода закрыть ОАП
у дуктус-зависимых больных. Использование кислорода оправданно
только при сопутствующих расстройствах дыхания у дуктус-незави-
симых пациентов.
Искусственное снижение резистентности системных сосудов по-
казано при объемной перегрузке левого желудочка (недостаточность
аортального или митрального клапана, ДМЖП) и может быть дос-
тигнуто прямыми вазодилататорами (нитропруссид, нитроглицерин)
или ингибиторами синтеза АПФ. Внутривенное введение вазодила-
таторов используется только при острых расстройствах гемодинами-
ки и в условиях отделения интенсивной терапии. Доза наиболее час-
то используемого нитропруссида колеблется от 0,5 до 5,0 мкг/кг/мин.
Передозировка может привести к цианидной интоксикации, индикато-
ром которой является метаболический ацидоз.
Нейрогуморалъная модуляция
Основным механизмом действия препаратов данной группы являет-
ся деактивация ренин-ангиотензин-альдостероновой системы и предот-
вращение повреждения, фиброза и ремоделирования миокарда. Наряду
с этим достигается снижение постнагрузки, облегчающее работу сердца.
В современной терапии это направление развивается достаточно интен-
сивно. К лекарствам данного ряда относятся ингибиторы синтеза АПФ
(ИАПФ), Р-адреноблокаторы, антагонисты альдостерона, частично ди-
гоксин. Известны случаи успешного применения ИАПФ у детей с боль-
шими шунтами через ДМЖП и застойной сердечной недостаточностью
[9, 10], а также для создания управляемой артериальной гипотонии в
случаях послеоперационной дисфункции левого желудочка [11]. Одна-
ко в большинстве случаев данные средства используют при объемной
перегрузке сердца вследствие недостаточности митрального или аор-
тального клапана (табл. 5-3). В зависимости от поставленных целей
могут применяться кратковременные или длительные курсы лечения.
Результатом терапии является устранение острой перегрузки сердца или
длительное поддержание удовлетворительной функции левого желудоч-
ка, что позволяет отсрочить оперативное вмешательство.
Среди ингибиторов синтеза АПФ у детей наибольшее распростра-
нение получил каптоприл, который используют в дозе 1-2 мг/кг/сутки.
Управляемая артериальная гипотония достигается через двое-трое су-
ток лечения.
91
Таблица 5-3
Применение ингибиторов синтеза АПФ
при хронической объемной перегрузке левого желудочка
Автор Год Возраст пациентов Вид патологии Препарат Доза Длительность лечения
Seguchi М. et al. [12] 1992 5,9±5,6 г. АН, МН, enalapril 0,24±0,10 мг/кг/сутки 17±9 дней
Alehan D. et al. [13] 1998 14,3±2,3 г. АН captopril Ы,5 мг/кг/сутки 12 мес.
Mori Y. et al. [14] 2000 3,9 г. (4мес-16 лет) АН, МН cilazapril enalapril 0.03-0,04 мг/кг/сутки; 0,15-0,4 мг/кг/сутки 3,4 г.
Hazama K. et al. [15] 2001 5,0±3,6 г. Клапанная недостаточность после коррекции различных ВПС cilazapril 0,01-0,04 мг/кг/сутки 5-7 дней
Примечание. АН - аортальная недостаточность, МН - митральная недос-
таточность.
Первое сообщение о благоприятном действии Р-блокаторов при ВПС
с большим шунтом слева-направо у шести пациентов в возрасте 4-9 не-
дель сделали Buchhom R. et al. [16]. Авторам удалось с помощью малых
доз пропранолола (1,8 мг/кг/сутки) улучшить клиническое состояние боль-
ных с исчерпанной возможностью традиционной терапии дигоксином и
мочегонными препаратами. В последние годы изучается возможность ис-
пользования у детей с ВПС препаратов третьего поколения (карведилол,
дилатренд), дополнительно обладающих периферическим сосудорасши-
ряющим эффектом как у ингибиторов синтеза АПФ [17, 18].
Искусственная вентиляция легких (ИВЛ)
В критических ситуациях при выраженной сердечной недостаточ-
ности следует использовать ИВЛ с целью выключения из работы дыха-
тельной мускулатуры и снижения тем самым требований к сердечному
выбросу. При ВПС со сбросом крови слева направо вентиляцию необ-
ходимо проводить с нормальным содержанием кислорода (21%) в ды-
хательной смеси, чтобы избежать увеличения легочного кровотока. Для
лечения и предупреждения легочного отека используют вентиляцию с
положительным давлением в конце выдоха в 4-10 см вод.ст.
Воздействие на сократимость миокарда
Наиболее широко применяемым препаратом является дигоксин
(0,25 мг/мл раствора). Его доза насыщения составляет 0,03-0,04 мг/кг
и делится на три введения: сначала вводят ’/ дозы, через 8 часов -
V4 дозы и еще через 8 часов - оставшуюся ’/4 дозы. Затем переходят на
поддерживающую дозу из расчета 0,01 мг/кг/сутки, которую распреде-
ляют на два приема через 10-12 часов.
92
Наибольший эффект достигается при внутривенном или внутримы-
шечном введении препарата. Поддерживающая терапия может прово-
диться и перорально. Перед каждым введением препарата контролиру-
ют частоту сердечных сокращений. Следует пропустить очередную до-
зу, если у грудного ребенка частота пульса менее 110/мин. Перед во-
зобновлением терапии (через 6-8 час.) вновь ориентируются на частоту
сердцебиений. Симптомами передозировки дигоксина могут быть так-
же частые экстрасистолы и замедление атриовентрикулярной проводи-
мости на ЭКГ.
Необходимо с осторожностью подходить к применению дигоксина
при больших ДМЖП. Как показали исследования Seguchi М. [19], у та-
ких пациентов дигоксин может уменьшать влияние симпатической нерв-
ной системы на легочные сосуды, заметно повышать легочный кровоток,
давление в левом предсердии и ухудшать условия для работы сердца.
При острой сердечной недостаточности и развитии кардиогенного
шока используют более мощные адренергические препараты. Обычно
лечение проводят в условиях отделения интенсивной терапии. Наиболее
распространенным препаратом является допамин, который в дозе 2-4
мкг/кг/мин расширяет сосуды внутренних органов и стимулирует диу-
рез. Доза в 5-10 мкг/кг/мин повышает силу и частоту сердечных со-
кращений; доза, превышающая 10-15 мкг/кг/мин, вызывает прогрес-
сирующее сужение сосудов и увеличение тахикардии. Более сильное
средство - адреналин. В дозе 0,1-0,2 мкг/кг/мин он улучшает сократи-
мость и учащает сердцебиения без повышения системного сосудистого
сопротивления. Однако при увеличении дозы до 0,5-1,5 мкг/кг/мин ре-
зистентность периферических сосудов значительно возрастает.
Возможно использование и препаратов, имеющих иную точку при-
ложения, например, ингибиторов фосфодиэстераз (amrinone - 1мг/кг
разово, затем постоянная инфузия 10 мг/кг/мин).
Регуляция ритма сердечных сокращении
При проведении медикаментозной терапии неизбежно возникают
изменения частоты сердечных сокращений. При редких сокращениях
изменение фаз сердечного цикла, а также относительно большой ударный
объем сопровождаются генерацией большего давления, способствуя пре-
одолению стеноза полулунных клапанов, но увеличивает фракцию ре-
гургитации на атриовентрикулярных клапанах. Таким образом, следует
учитывать, что урежение ритма благоприятно при клапанных стенозах,
а учащение - при недостаточности атриовентрикулярных клапанов.
Искусственное учащение ритма можно вызвать атропином (0,01 —
0,02 мг/кг), изадрином (0,1-0,4 мкг/кг/мин). Для быстрого урежения
ритма используют аденозин (0,05-0,25 мг/кг), вводимый внутривенно
болюсно. Эффективен также обзидан (анаприлин) в дозе 0,01-0,2 мг/кг.
93
Препарат вводят в 10-20 мл физиологического раствора внутривенно
медленно (до 5-10 мин!) и при постоянном контроле частоты сердце-
биений и артериального давления.
Медикаментозное закрытие ОАП
Данную терапию обычно применяют у недоношенных детей с син-
дромом дыхательных расстройств. Наиболее распространенным средст-
вом является индометацин (0,2 мг/кг внутривенно трижды с интервалом
в 24 часа), после введения которого ОАП закрывается в среднем у 70-
85% больных [20, 21]. При этом необходимо контролировать функцию
почек, уровень билирубина и возможные нарушения свертываемости кро-
ви. Менее токсичным препаратом представляется ибупрофен, однако опыт
его использования ограничен [22].
Прочие препараты
Глюкокортикоиды. Роль данных препаратов при лечении СН четко
не определена. С одной стороны, известно, что пренатальное примене-
ние дексаметазона приводит к нарушению функциональных резервов
сердца, гипертрофии желудочков и снижению толерантности неонаталь-
ного миокарда к гипоксии [23, 24]. С другой стороны, при лечении
критических состояний у детей с ВПС глюкокортикоиды в относительно
низкой дозе (эквивалентной менее чем 100 мг/м2/сутки гидрокортизо-
на) снижают потребность в инотропных препаратах [25]. Вероятно, их
применение целесообразно в случаях, сопровождающихся недостаточ-
ностью коры надпочечников, особенно в послеоперационном периоде.
Аналогичная ситуация существует с тиреоидными гормонами.
Экспериментальное изучение их влияния на сердце [26] показывает, что
имеются положительные инотропный и лузитропный (расслабляющий)
эффекты. В то же время при избытке тиреоидных гормонов может ос-
лабляться чувствительность рецепторов миокарда к катехоламинам.
Использование этих гормонов может быть оправданным при лечении
сердечной недостаточности после операций с искусственным кровооб-
ращением, когда возникает их временный дефицит [27].
Необходимо продолжение исследований, направленных на анализ
механизмов действия указанных препаратов и подбор терапевтических
дозировок.
Механическая поддержка работы сердца
Наиболее часто применяемой системой у новорожденных (обычно
при сочетании сердечной недостаточности с гипоксией и легочной
гипертензией) является система экстракорпоральной мембранной
оксигенации крови (ЭКМО). Другое направление связано с
использованием механических устройств, частично заменяющих левый
94
или правый желудочек, и включаемых в контур соответствующего круга
кровообращения. Данные устройства эффективны при синдроме
гипоплазии левого сердца и прочих ВПС с физиологией единственного
желудочка, а также при остром миокардите. К отрицательным свойствам
указанных конструкций относятся необходимость проведения
антикоагулянтной терапии, травма форменных элементов крови,
опасность инфекции.
Кардиологические интервенционные процедуры
Данные вмешательства (дилатация клапанного легочного или аор-
тального стеноза, коарктации аорты, атриосептостомия) у грудных детей
позволяют быстро и при относительно небольшой травме устранить кри-
тические состояния. Как показывает международный опыт, эти манипуля-
ции не являются прерогативой кардиохирургов. Обычно их выполняют
кардиологические службы.
Планирование терапевтического лечения зависит от понимания при-
роды сердечной недостаточности при ВПС, механизмов развития крити-
ческих состояний. В каждом конкретном случае необходим оптимальный
подбор терапии, направленной как на сократимость сердца, так и на мо-
дуляцию нейроэндокринного профиля, профилактику необратимого по-
вреждения миокарда. Критериями эффективности проводимого лечения
являются: устойчивая гемодинамика при данной дозе препаратов, улуч-
шение перфузии и оксигенации органов и тканей, устранение метаболи-
ческого ацидоза, уменьшение признаков застойной сердечной недоста-
точности, восстановление адекватного диуреза, общая стабилизация со-
стояния больного. Современная патогенетически оправданная терапия по-
зволяет стабилизировать состояние приблизительно у 60% пациентов груд-
ного возраста. Дальнейший прогноз у них определяется своевременно ока-
занным хирургическим пособием, интервенционными вмешательствами и
последующим квалифицированным терапевтическим наблюдением.
Литература
1. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца - М: «Медицина», 1991.
2. Коронес Ш.Б. Новорожденные высокого риска. - М: «Медицина», 1981.
3. Auslender М. Pathophysiology of pediatric heart failure // Progr. Ped. Cardiol.- 2000.-
Vol. 11.- P. 175-184.
4. Scammell A.M., Diver M.J. Plasma rennin activity in infants with congenital heart
disease // Arh. Dis. Child.- 1987.- Vol. 62.- P. 1136-1138.
5. Buchhorn R., Bartmus D., Eigster G., Bursch J. Renin activity in infants with heart
failure related to the degree of hemodynamic alterations and clinical score // J. Heart.
Failure.- 1997.- Vol. 4.- P. 188.
6. Cameron J.W., Rosenthal A., Olson A.D. Malnutrition in hospitalized children with
congenital heart disease // Arch. Pediatr. Adolesc. Med.- 1995.- Vol. 149.- P. 1098-1102.
95
7. Leitch C.A. Growth, nutrition and energy expenditure in pediatric heart failure // Progr.
Pediatr. Med.- 2000.- Vol. 11.- P. 195-202.
8. Шарыкин A.C. Неотложная помощь новорожденным с врожденными пороками серд-
ца. - М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2000.
9. Montigny М., Davignon A., Fouron J.C. et al. Captopril in infants for congestive heart
failure secondary to a large ventricular left-to-right shunt // Am. J. Cardiol.- 1989.-
Vol. 63.- P. 631-633.
10. Фирсова H.H., Калиничева Ю.Б., Сабирова Д.Р., Миролюбов Л.М. Ингибиторы
АПФ как препараты выбора в комплексном лечении детей с врожденными порока-
ми сердца // Бюлл. НЦССХ им. А.Н. Бакулева РАМН,- 2000.- №2.- С. 257.
1 1. Шарыкин А.С.. Бутрим Ю.В., Ильина О.Н., Неталиева Г.С. Использование инги-
биторов АПФ в комплексном лечении детей раннего возраста после коррекции
врожденных пороков сердца // Бюлл. НЦССХ им. А.Н.Бакулева РАМН.- 2001.-
№ 3.- С. 149.
12. Seguchi М., Nakazawa М., Мотта К. Effect of enalapril on infants and children with
congestive heart failure // Cardiol. Young.- 1992.- Vol. 2.- P. 14-19.
13. Alehan D., Ozkutlu S. Benefical effects of 1-year captopril therapy in children with chronic
aortic regurgitation who have no symptoms // Amer. Heart J.- 1998.- Vol. 135.- P. 598-603.
14. Mori Y, Nakazawa M., Tomimatsu H., Momma K. Long-term effect of angiotensin-
converting ensime inhibitor in volume overloaded heart during growth: a controlled
pilot study // J. Am. Coll. Cardiol.- 2000.- Vol. 36.- P. 270-275.
15. Hazama K., Nakazawa M., Momma K. Effective dose and cardiovascular effects of
cilazapril in children with heart failure // Am. J. Cardiol.- 2001.- Vol. 88.- P. 801-805.
16. Buchhorn R., Bartmus D., Siekmeyer W. et al. Beta-blocker therapy of severe congestive
heart failure in infants with left to right shunts // Am. J. Cardiol.- 1998.- Vol. 81.- P. 1366-1368.
17. Bruns L.A., Chrisant M/К/, Lamour J.M. et al. Carvediol as therapy in pediatric heart
failure: An initial multicenter experience // J. Pediatr.- 2000.- Vol. 138.- P. 505-511.
18. Bruns L.A., Canter C.E. Should beta-blockers be used for the treatment of pediatric
patients with chronic heart failure? // Pediatr. Drugs.- 2000.- Vol. 4.- P. 771-778.
19. Seguchi M., Nakazawa M., Momma K. Further evidence suggesting a limited role of
digitalis in infants with circulatory congestion secondary to large ventricular septal
defect //Am. J. Cardiol.- 1999.- Vol. 83.- P. 1408-1411.
20. Эверстова Т.Н., Ситникова М.И., Гребенников В.А., Сафонов И.В. Индометацин в
лечении клинически значимого артериального протока у недоношенных детей //
Бюлл. НЦССХ им. А.Н. Бакулева РАМН.- 2000.- №2.- С. 257.
21. Quinn D., Cooper В., Clyman R.l. Factors associated with permanent closure of the
ductus arteriosus: A role for prolonged indomethacin therapy // Pediatrics.- 2002,-
Vol. НО.- P. elO.
22. Gottlieb S. Ibuprofen useful in treating babies heart defect // BMJ.- 2000.- Vol. 321.- P. 198.
23. Kauffman K.S., Seidler F.J., Slotkin T.A. Prenatal dexamethasone exposure causes loss
of neonatal hypoxia tolerance: cellular mechanisms // Pediatr. Res.- 1994.- Vol. 35.-
P. 515-522.
24. Dodie M., Samuel C., Moritz K. et al. Impaired cardiac functional reserve and left
ventricular hypertrophy in adult sheep after prenatal dexamethasone exposure // Circu-
it. Res.- 2001.- Vol. 89.- P. 623.
25. Shore S., Nelson D.P., Pearl J.M. et al. Usefulness of corticosteroid therapy in decreas-
ing epinephrine requirements in critically ill infants with congenital heart disease // Am.
J. Cardiol.- 2001.- Vol. 88.- P. 591-594.
26. Hoit B.D., Khoury S.F., Shao Y. et al. Effects of thyroid hormone on cardiac P-adrener-
gic responsiveness in conscious baboons // Circulation.- 1997.- Vol. 95.- P. 592-598.
27. Mitchell I.M., Pollock J.C.S., Jamieson M.P.G. et al. The effects of cardiopulmonary
bypass on thyroid function in infants weighin less than five kilograms // J. Thorac.
Cardiovasc. Surg.- 1992.- Vol. 103,- P. 800-805
96
Глава 6. ОТКРЫТЫЙ АРТЕРИАЛЬНЫМ ПРОТОК
Открытый артериальный проток (ОАП) - сосуд, соединяющий
грудную аорту с легочной артерией. В норме ОАП обязательно при-
сутствует у плода, но закрывается вскоре после рождения, превраща-
ясь в ligamentum arteriosum. Если же этого не происходит, говорят о
наличии порока сердца. Можно сказать, что ОАП - условно врож-
денный порок, так как становится таковым только после появления
ребенка на свет.
Частота. Точная частота встречаемости порока неизвестна, так как
неясно, с какого момента считать ОАП патологией. Условно полагают,
что в норме он должен закрыться в течение первых двух недель жизни.
При таких критериях частота изолированной патологии составляет око-
ло 0,14-0,3/1000 живорожденных, 7% среди всех ВПС и 3% среди кри-
тических пороков. Персистирование протока в значительной мере за-
висит от степени доношенности ребенка; чем меньше вес, тем чаще
встречается данная патология.
Анатомия. Обычно проток отходит напротив и на 5-10 мм ниже
устья левой подключичной артерии. Однако при аномалиях положе-
ния дуги аорты, встречается правостороннее отхождение протока или
даже двухсторонний вариант [1]. Крайне редкой является его локали-
зация в области восходящей аорты или какого-либо плечеголовного
сосуда [2]. Левосторонний ОАП в большинстве случаев впадает в ле-
вую легочную артерию у места ее слияния с легочным стволом, но так-
же возможно соединение с самим легочным стволом или правой ле-
гочной артерией. Проток обычно имеет коническую форму, суживаясь
к легочному концу. Однако вероятны и другие конфигурации - в виде
короткого и широкого или тонкого и извилистого сосуда.
Прекращение функционирования ОАП проходит два этапа: пер-
вичное функциональное закрытие, связанное с сокращением гладких
мышц его стенки, и окончательное анатомическое закрытие, опреде-
ляемое эндотелиальной деструкцией и формированием соединитель-
ной ткани. До последнего времени не ясно, какие обстоятельства при-
водят к возникновению порока. У недоношенных детей можно гово-
рить о той или иной степени незрелости дуктальной ткани, нарушаю-
щей ее нормальную эволюцию, а также о повышенной концентрации
циркулирующих простагландинов [3]. Однако не ясно, какие причины
приводят к сохранению проходимости протока у доношенных детей.
Среди факторов, способствующих этому, указывают на хроническую
гипоксию, внутриутробную задержку развития, прием матерью индо-
97
метацина [4]. Вероятно, должны произойти структурные изменения в
стенке протока, нарушающие ее взаимодействие с системой простаг-
ландинов и спастическую реакцию на кислород.
Гемодинамика. Во внутриутробном периоде ОАП является нор-
мальной физиологической коммуникацией между легочной артерией
и аортой. После рождения ребенка направление потока крови через
проток и его величина определяются разницей давления между аортой
и легочной артерией и диаметром протока. Сброс крови справа нале-
во, обычный для внутриутробного периода, значительно уменьшается
после окклюзии пуповины. По мере падения ОЛС возникает двуна-
правленный, а затем лево-правый поток крови через ОАП. В первые
месяцы жизни в связи с высокой резистентностью легочных сосудов
кровь течет в них преимущественно в систолу. В последующем, когда
и диастолическое давление в аорте начинает превышать давление в
легочной артерии, сброс слева направо приобретает постоянный сис-
толодиастолический характер. Возникает та или иная степень легоч-
ной гиперволемии. У недоношенных детей в связи с плохим развити-
ем гладких мышц в стенке легочных сосудов и слабым их сопротивле-
нием гиперволемия быстро достигает значительной степени, что при-
водит к застойной сердечной недостаточности и хроническому пора-
жению легких.
Обратный, право-левый сброс при изолированном пороке возмо-
жен в двух ситуациях: 1) в период высокого ОЛС у новорожденных,
когда возникает любое дополнительное повышение давления в систе-
ме легочной артерии (крик ребенка, пневмония); это сопровождается
кратковременной артериальной гипоксемией; 2) в случаях длительно-
го существования большого ОАП с развитием высокой легочной ги-
пертензии. При этом можно отметить первоначальное уменьшение ле-
во-правого сброса с последующим переходом его в право-левый и раз-
витием стойкой артериальной гипоксемии.
Усиленный легочный кровоток приводит к повышенному веноз-
ному возврату в левое предсердие и левый желудочек, их дилатации и
гипертрофии. В случае развития высокой легочной гипертензии объ-
ем сброса и размеры левых отделов сердца уменьшаются, однако на-
растает гипертрофия правого желудочка.
Естественное течение. При небольших протоках (диаметром до
3 мм) течение благоприятное, совместимое с длительной активной жиз-
нью. Однако имеется риск развития бактериального эндокардита.
Протоки большого диаметра могут привести к развитию тяжелого
состояния и даже гибели ребенка в первые месяцы жизни. Драматиче-
98
ские ситуации развиваются примерно у 3% больных. Основной группой
риска являются недоношенные дети с синдромом дыхательных рас-
стройств, у которых частота критических состояний достигает почти 30%.
Спонтанное закрытие протока после трех месяцев жизни встреча-
ется чрезвычайно редко. Это связано со структурными изменениями
гладких мышц его стенки. Однако возможно относительное уменьше-
ние диаметра ОАП по сравнению с диаметрами растущих магистраль-
ных сосудов, и соответственно уменьшение гемодинамической значи-
мости порока.
Бактериальный эндокардит (эндартериит, боталлит) развивается
чаще при маленьких протоках, легочная гипертензия - при больших.
Редким, но опасным осложнением является возникновение аневризмы
ОАП с ее разрывом, тромбозом или инфицированием (рис. 6-1). В то
же время аневризмы протока обнаруживают и внутриутробно (патоло-
гией считают диаметр протока более двух стандартных отклонений для
данного гестационного возраста), что указывает на самостоятельный
характер этой аномалии, связанный с врожденными структурными из-
менениями стенки протока [5, 6].
Рис. 6-1. Эхокардиограмма из супрастернальной позиции при
аневризме ОАП. Ао - аорта, ПЛА - правая легочная артерия, АОАП - аневризма
открытого артериального протока.
Среди новорожденных с ОАП аневризма встречается в 1-8,8% слу-
чаев и в 70% из них уменьшается и исчезает спонтанно в пределах
1-2 мес. Некоторые авторы считают данную аномалию вариантом нор-
мального развития или частью обычного процесса закрытия протока.
99
Клиническая симптоматика. Функционирование ОАП у ново-
рожденных детей с синдромом дыхательных расстройств представля-
ет отдельную серьезную проблему. В этих случаях проток усугубляет
нарушения газообмена в легких и сердечную недостаточность. Как пра-
вило, такие дети имеют ту или иную степень недоношенности и роди-
лись от матерей с осложненным течением беременности или родов.
Диагностика заболевания, терапия и выхаживание этих пациентов от-
носятся к сфере интенсивной терапии в специализированном реани-
мационном отделении и не являются предметом настоящей главы.
У доношенных новорожденных без дополнительных заболеваний
клинические проявления порока могут широко варьировать. Малень-
кий проток, как правило, протекает бессимптомно и обнаруживается
случайно при плановом обследовании. ОАП с большим сбросом со-
провождается частыми респираторными инфекциями, отставанием в
физическом развитии, сердечной недостаточностью. В этих случаях
тахикардия и одышка при нагрузке могут быть первыми симптомами
заболевания. При наличии высокой легочной гипертензии с обратным
сбросом можно отметить цианоз нижней половины туловища (диффе-
ренцированный цианоз).
При значительном сбросе у левого верхнего края грудины пальпи-
руется систолическое дрожание. Пульсовое артериальное давление уве-
личено за счет повышения систолического и снижения диастолическо-
го компонентов (вплоть до нулевого), что создает картину высокого и
быстрого периферического пульса. Аускультативная картина также оп-
ределяется величиной шунта. Второй тон на легочной артерии чаще
нормальный, но при большой легочной гиперволемии или гипертен-
зии становится усиленным, расщепленным. Сразу после рождения шу-
ма может не быть в связи с высокой резистентностью легочных сосу-
дов и отсутствием сброса крови через проток. Однако при его перси-
стировании к середине месяца развивается систолический шум, а к кон-
цу месяца - типичный «машинообразный» систолодиастолический
шум, выслушивающийся под левой ключицей или во втором межребе-
рье слева. При длительном существовании порока с большим сбросом
может возникнуть диастолический шум на верхушке сердца из-за от-
носительного митрального стеноза.
Сердечная недостаточность свидетельствует об ОАП с большим
сбросом и проявляется типичными симптомами - одышкой, тахикар-
дией, застойными явлениями в малом или большом круге кровообра-
щения, отставанием в физическом развитии.
100
Развитие легочной гипертензии возможно со второго полугодия
жизни, однако высокая ее степень возникает не ранее подросткового
возраста. Клиническая картина при этом характеризуется уменьшени-
ем шума, прежде всего диастолического компонента, размеров сердца,
а также легочной гиперволемии. Второй тон над легочной артерией
становится резко акцентированным. У этих пациентов снижается фи-
зическая активность, может развиться цианоз из-за возникновения об-
ратного сброса крови.
Электрокардиография. При небольших ОАП электрокардиограм-
ма не отличается от нормальной. При наличии значительного сброса
отмечают признаки перегрузки левых отделов сердца. Длительное су-
ществование большого шунта сопровождается комбинированной ги-
пертрофией желудочков. В случае развития высокой легочной гипер-
тензии доминирующей становится правожелудочковая гипертрофия.
Рентгенография грудной клетки. При небольших ОАП рентге-
нограмма может быть нормальной. Степень кардиомегалии и выражен-
ности легочного рисунка зависят от величины шунта через проток. Уве-
личение тени сердца связано в основном с левым желудочком и левым
предсердием, в меньшей степени - с правым желудочком. Возможно
расширение тени легочного ствола и аорты. Заметное усиление легоч-
ного артериального рисунка наступает при соотношении легочного и
системного кровотока более чем 2:1, что определяет показания к опе-
рации (рис. 6-2).
Рис. 6-2. Рентгенограмма больного с ОАП. Тимомегалия, умеренное
усиление легочного рисунка.
Характерным для детей первых 1,5-3 месяцев жизни с большими
протоками является нарастание степени легочной гиперволемии при
динамическом наблюдении. Это связано с физиологическим снижени-
ем ОЛС и увеличением сброса крови слева направо.
101
Эхокардиография. Эхокардиография является ведущим методом
диагностики ОАП. При сканировании из высокого парастернального
или супрастернального доступа возможно получить прямую визуали-
зацию протока или установить сброс крови в легочную артерию
(рис. 6-3 на цветной вкладке, 6-4).
Рис. 6-4. Допплер-эхокардиограмма из парастернальной позиции
по короткой оси при открытом артериальном протоке. На эхограмме слева
при цветном картировании виден локальный кровоток в стволе с началом в области
бифуркации; справа - в стволе легочной артерии регистрируется систолодиастоли-
ческий кровоток шунтирования через проток (кровоток направлен вверх от изоли-
нии) и систолический кровоток изгнания (кровоток направлен вниз от изолинии) в
постоянно-волновом режиме.
Измерение полостей левого предсердия и левого желудочка по-
зволяет косвенно судить о величине шунта (чем больше их размер, тем
больше шунт). Возможно также сопоставление поперечного размера
левого предсердия с диаметром аорты (в норме ЛП/Ао <1,17-1,2 ).
При лечении новорожденных, особенно недоношенных детей с
ОАП, чрезвычайно важно проводить динамическое эхокардиографи-
ческое исследование. С одной стороны, ЭХОКГ позволяет определить
наличие сброса при отсутствии шума (из-за низкой скорости кровото-
ка). С другой стороны, после естественного или медикаментозного за-
крытия ОАП может оставаться шум относительного стеноза легочной
артерии в месте впадения протока. В этом случае ЭХОКГ позволяет
поставить точный диагноз и избежать неоправданно длительного ле-
чения индометацином.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание показано только в случаях с критической степенью легочной ги-
пертензии для уточнения ее характера и возможностей оперативного
лечения.
102
Лечение. Специфическая терапия возможна только у недоношен-
ных детей и заключается в введении ингибиторов синтеза простаглан-
динов. Наиболее распространенным средством является индометацин,
который вводят внутривенно в трех дозах (0,2; 0,1 и 0,1 мг/кг) за 48-ча-
совой период [7]. При отсутствии эффекта через 24 часа возможно до-
полнительное трехкратное введение препарата в дозе по 0,1 мг/кг с
интервалом в 24 часа. Результативность лечения составляет в среднем
70-80%. Во время терапии необходимо контролировать выделитель-
ную функцию почек и уровень билирубина.
В последнее время появились сообщения, что ибупрофен облада-
ет меньшим токсическим действием на почки при той же эффективно-
сти в отношении ОАП [8]. Другим его преимуществом является более
слабый суживающий эффект в отношении системных сосудов. Одна-
ко опыт использования ибупрофена ограничен.
В качестве вспомогательных методов лечения сердечной недоста-
точности используют ограничение введения жидкости, мочегонные
средства, дигоксин.
Хирургическое закрытие ОАП показано при подтверждении его
проходимости. Противопоказанием может являться высокая легочная
гипертензия обструктивного характера. У маленьких детей прибегают
к клипированию сосуда, в том числе с использованием тораковидео-
скопической техники. В более старшем возрасте операцией выбора яв-
ляется перевязка или пересечение протока из левостороннего доступа.
Послеоперационная летальность составляет менее 1%.
В последние годы популярность приобретает устранение порока
эндоваскулярным методом - с помощью специальных спиралей, дос-
тавляемых к протоку эндоваскулярным катетером. Данная процедура
возможна при диаметре протока до 3 мм. При более крупных отвер-
стиях применяют несколько спиралей или особые окклюдеры. Досто-
инствами метода являются отсутствие разреза грудной клетки и общей
анестезии, а также короткий послеоперационный период. Однако не-
обходимо иметь в виду вероятность таких проблем, как остаточный
шунт, миграция спирали, гемолиз и тромбоз бедренных сосудов, через
которые проводился катетер.
Литература
1. Lenox С. С., Neches W.H., ZuberbuhlerJ.R. et al. Bilateral ductus arteriosus in d-trans-
position of the great arteries with right aortic arch // Chest.- 1978.- Vol. 74.- P. 94-96.
2. Backer C.L., Mavroudis C. Congenital heart surgery nomenclature and database
project: ductus arteriosus, coarctation of aorta, interrupted aortic arch // Ann. Tho-
rac. Surg.- 2000.- Vol. 69.- P. S298-307.
103
3. Hammerman C., Strates E., Berger S. et al. Prostaglandins and echocardiography in
the assessment of patent ductus arteriosus // Critical Care Medicine.- 1986.- Vol. 14.-
P. 462-465.
4. Hammerman C., Glaser J., Kaplan M. et al. Indomethacin tocolysis increases post-
natal patent ductus arteriosus severity // Pediatrics.- 1998.- Vol. 102.- № 5.- P. e56.
5. Jan S.-L., Hwang B., Fu Y.-C. et al. Isolated neonatal ductus arteriosus aneurysm //
JACC.- 2002.- Vol. 39.- P. 342-347.
6. Hornberger L.K. Congenital ductus arteriosus aneurysm // JACC.- 2002.- Vol. 39.-
P. 348-350.
7. Quinn D., Cooper B., Clyman R.I. Factor associated with permanent closure of the
ductus arteriosus: a role for prolonged indomethacin therapy // Pediatrics.- 2002.-
Vol. ПО.- P. elO.
8. Gottlieb S. Ibuprofen useful in treating babies’ heart defect // BMJ.- 2000.- Vol. 321 .-
P. 198.
104
Глава 7. ДЕФЕКТ АОРТОЛЕГОЧНОЙ
ПЕРЕГОРОДКИ
Дефект аортолегочной перегородки представляет собой сообще-
ние между смежными отделами восходящей аорты и легочного ство-
ла. Синонимами названия порока являются: аортолегочное окно, аор-
толегочный свищ, частичный артериальный ствол, аортопульмональ-
ный дефект и др. В отличие от общего артериального ствола при дан-
ной патологии сохраняются полностью сформированные фиброзные
кольца аортального и легочного клапанов, а также выводные отделы
желудочков (рис. 7-1).
легочная
артерия
Рис. 7-1. Анатомические различия между дефектом аортолегочной
перегородки (А) и общим артериальным стволом (Б).
Частота. Частота патологии в популяции невелика - менее 0,01/
1000 новорожденных; среди всех ВПС она представлена в 0,1-1%
случаев.
Анатомия. Размеры дефекта могут колебаться от нескольких мил-
лиметров до 5-6 см в диаметре. Иногда он представлен в виде корот-
кого «сосуда», соединяющего аорту и легочный ствол наподобие арте-
риального протока.
Более чем в половине наблюдений дефект аортолегочной перего-
родки может сочетаться с другими ВПС [1, 2, 3]. Наиболее частыми
пороками являются открытый артериальный проток (-15%), ДМЖП
(-13%), тетрада Фалло (-9%), коарктация или перерыв дуги аорты
(-10%). Более редки транспозиция магистральных артерий, подклапан-
ный стеноз аорты, аномальное отхождение правой или левой коронар-
ных артерий.
В основе классификации дефекта лежат уровень его расположе-
ния и размеры. В зарубежной литературе часто встречается использо-
вание классификаций Mori et al. [4], а также Но et al. [5] (рис. 7-2).
105
В НЦССХ им. А.Н.Бакулева РАМН выделяют пять форм дефектов
аортолегочной перегородки [6] (с сокращ.).
1. Дефект между аортой и легочной артерией находится в сред-
ней части аортолегочной перегородки и имеет выраженные края (по-
хож на ОАП).
2. Собственно аортолегочное окно, расположенное непосредствен-
но над синусами Вальсальвы (классическая форма, проксимальный де-
фект, тип I по Mori).
Рис. 7-2. Схема дефектов аортолегочной перегородки по Mori et al.
(А - В) и Но et al. (Г). А - тип 1 (проксимальный дефект); Б - тип II (дистальный
дефект); В - тип III (тотальный дефект); Г - промежуточный дефект.
3. Дефект аортолегочной перегородки, расположен дистально, од-
нако ниже устьев ветвей легочных артерий (промежуточный дефект по
Но). В проксимальном отделе выражен гребень, разделяющий устья
аорты и легочного ствола.
4. Дефект расположен дистально и захватывает область отхожде-
ния правой легочной артерии (дистальный дефект, тип II по Mori).
5. Полное отсутствие аортолегочной перегородки (тотальный де-
фект, тип III по Mori). Обе легочные артерии берут свое начало от зад-
ней поверхности общего ствола, однако отсутствие межжелудочково-
го дефекта и наличие изолированных друг от друга клапанов аорты и
легочной артерии - характерные признаки, которые отличают данную
форму порока от общего артериального ствола II типа.
106
Наиболее часто встречаются дефекты второй формы (I тип по Mori).
Гемодинамика. Нарушения гемодинамики определяются сбросом
крови из аорты в легочные сосуды. Степень нарушений связана с раз-
мерами дефекта аортолегочной перегородки, его положением, соотно-
шением сопротивлений малого и большого кругов кровообращения.
При небольших отверстиях проявления порока могут ограничиваться
только шумом над областью сердца. Большие дефекты сопровождают-
ся массивным шунтированием крови как в систолу, так и в диастолу, и
серьезными нарушениями гемодинамики, присущими и другим ВПС с
лево-правым сбросом. В период новорожденности высокое легочное
сопротивление препятствует значительному кровотоку в легких, одна-
ко это явление сохраняется непродолжительное время. По мере фи-
зиологической эволюции легочных сосудов сброс крови в малый круг
кровообращения увеличивается, возникает гиперволемия, а затем и ги-
пертензия, быстро (за 1-2 года) приобретающая склеротический ха-
рактер. В некоторых случаях даже возникает обратный, веноартери-
альный сброс крови.
При дефекте аортолегочной перегородки левый желудочек и ле-
вое предсердие испытывают объемную перегрузку в период диасто-
лы из-за большого объема крови, возвращающегося из легких. Пра-
вый желудочек не подвергается объемной перегрузке (сброс крови
происходит дистальнее него), однако в связи с работой по нагнета-
нию крови в сосуды с высоким давлением развивается умеренная на-
грузка сопротивлением. При развитии высокой легочной гипертен-
зии нагрузка на левый желудочек снижается, а на правый сохраняет-
ся или даже возрастает.
Естественное течение. Наличие порока у плода не приводит к
существенным нарушениям гемодинамики. Давление в восходящей
аорте и легочном стволе примерно одинаковое, шунт небольшой, на-
правление его неопределенное. Избыточный возврат крови к сердцу
не возникает. Единственным следствием дефекта является расшире-
ние корня аорты [7]. Точные данные о последующем течении порока
неизвестны в связи с небольшим числом наблюдающихся больных.
Редкие сообщения на эту тему свидетельствуют, что 25-30% пациен-
тов погибают в течение первого года жизни, около 15% - в школьном
возрасте [8]. Основной причиной смерти является сердечная недос-
таточность; в редких случаях - тромбоэмболия, бактериальный эн-
докардит. У больных, доживших до 20-30 лет, имеются признаки вы-
сокой легочной гипертензии и цианоз. Случаев спонтанного закры-
тия дефекта не описано.
107
Клиническая симптоматика. Клиническая симптоматика харак-
терна для пороков с большим лево-правым сбросом (одышка, тахикар-
дия, повышенное беспокойство, отсутствие аппетита, плохая прибав-
ка в весе, потливость). При развитии застойной сердечной недостаточ-
ности возникают свистящее дыхание, застойные хрипы в легких, ги-
потрофия. Нередко присоединяется пневмония.
На первых неделях жизни возможно кратковременное возникно-
вение цианоза во время крика ребенка, связанное с развитием сброса
венозной крови из легочной артерии в аорту. У детей старшего воз-
раста появление цианоза свидетельствует о развитии высокой легоч-
ной гипертензии.
Шумы при аускультации зависят от размера отверстия и объема
сброса крови. Наиболее характерен систолический шум с небольшим
диастолическим компонентом. Классический систолодиастолический
шум (как при ОАП) встречается при небольших дефектах у 15-30%
больных. Однако место максимального звучания шума расположено
несколько ниже - во втором-третьем межреберье слева. Развитие вы-
сокой легочной гипертензии приводит к изменению шума - он стано-
вится коротким, сопровождается акцентом II тона на легочной арте-
рии. Следует помнить, что дефект аортолегочной перегородки часто
сочетается с другими ВПС, что может искажать аускультативную кар-
тину данного порока.
Большой сброс крови нередко проявляется такими специфически-
ми симптомами, как систолическое дрожание во втором-третьем меж-
реберье слева, а также высоким и быстрым пульсом (из-за быстрого
оттока крови из аорты в легочную артерию). В некоторых случаях раз-
вивается относительный митральный стеноз с мезодиастолическим шу-
мом на верхушке.
Электрокардиография. Электрокардиографические нарушения
изменчивы и отражают степень нагрузки на левые или правые отделы
сердца. В первую очередь возникают признаки перегрузок левого же-
лудочка и левого предсердия. При развитии высокой легочной гипер-
тензии на фоне отклонения электрической оси сердца вправо опреде-
ляются признаки гипертрофии преимущественно правого желудочка.
Рентгенография грудной клетки. Изменения, которые регистри-
руют на рентгенограмме грудной клетки, в первую очередь характери-
зуют величину сброса через дефект аортолегочной перегородки. Ос-
новные параметры, на которые необходимо обратить внимание, - вы-
раженность легочного рисунка и размеры сердца. Признаки гиперво-
лемии МКК в период новорожденности, когда ОЛС высокое, могут
108
отсутствовать. Однако они постепенно нарастают по мере развития ре-
бенка и снижения резистентности легочных сосудов. При этом легоч-
ный рисунок усиливается по артериальному руслу; увеличиваются раз-
меры тени сердца (за счет левого желудочка и в меньшей степени -
правого желудочка). При большом артериовенозном сбросе заметно
расширяются легочные корни и мелкие ветви легочной артерии. Это
может сопровождаться выбуханием дуги легочной артерии. Характер-
ным является также увеличение амплитуды пульсации левого желу-
дочка и расширенной восходящей аорты.
Тень сердца может быть относительно небольшой, а перифери-
ческий легочный рисунок обеднен при развитии высокой легочной
гипертензии.
Эхокардиография. Ультразвуковая диагностика дефекта аортоле-
гочной перегородки является хотя и непростой задачей, однако, впол-
не решаемой. Используют продольное сечение сердца на уровне маги-
стральных сосудов, сечение по короткой оси, высокое парастерналь-
ное изображение по короткой оси [6, 7, 9]. При этом можно достичь
прямой визуализации дефекта и с помощью цветной допплерографии
определить направление сброса крови (рис. 7-3 на цветной вкладке).
Особое внимание обращают на сформированность клапанов аор-
ты и легочной артерии, позволяющую провести дифференциальный
диагноз с общим артериальным стволом. Необходимо также исклю-
чить дополнительные пороки сердца, особенно подлежащие коррек-
ции (ОАП, ДМЖП, перерыв дуги аорты, аномальное отхождение ко-
ронарной артерии).
Катетеризация сердца и ангиокардиография. Катетеризация
сердца позволяет установить степень легочной гипертензии, величину
и направление сброса крови. Диагностическое значение имеет прове-
дение катетера через правый желудочек и легочную артерию в восхо-
дящую аорту. При АКГ наибольшую информацию дает ретроградная
аортография, при которой контрастное вещество из восходящей аорты
поступает в ствол легочной артерии.
Лечение. Терапевтическое лечение направлено на уменьшение ме-
таболических потребностей организма (температурный комфорт, ог-
раничение физической активности ребенка), снижение ОЦК (диурети-
ки), резистентности системных сосудов (ингибиторы АПФ). Однако
оно может быть эффективным в течение короткого периода времени и
только при небольших дефектах.
Учитывая быстрое развитие высокой легочной гипертензии и дру-
гих осложнений при данном пороке, хирургическое лечение показано
в ранние сроки, в пределах первого года жизни. В настоящее время
109
паллиативные операции типа сужения легочной артерии практически
ушли из обихода хирургов. При сравнительно небольших сообщениях
между аортой и легочной артерией (6-36% случаев), имеющих протя-
женность (типа ОАП), выполняют простую их перевязку. В остальных
случаях делают операцию в условиях искусственного кровообраще-
ния с доступом через легочную артерию или аорту и закрытием дефек-
та с помощью заплаты. При необходимости корригируют сопутствую-
щие пороки (ОАП, ДМЖП, перерыв дуги аорты, аномальное отхожде-
ние коронарной артерии). Результаты операции зависят от полноты кор-
рекции основного и сопутствующих пороков и степени легочной ги-
пертензии.
Литература
1. Шарыкин А.С., Иваницкий А.В., Ильин В.Н. и соавт. Реконструкция дуги аор-
ты у грудных детей с помощью политетрафлюорэтиленового (Gore-tex) проте-
за // Грудная и серд.-сос. хир.- 1996.- №4.- С. 77-79.
2. Izumo И., Ishihara К., Fujii Y. et al. АР window and anomalous origin of right
coronary artery from the window//Ann. Thorac. Surg.- 1999.-Vol. 68.-P. 557-559.
3. McMahon C.J., DiBardino D.J., Undar A., Fraser C.D. Anomalous origin of left
coronary artery from the right pulmonary artery in association with type III aorto-
pulmonary window and interrupted aortic arch // Ann. Thorac. Surg.- 2002.- Vol. 74.-
P. 919-921.
4. Mori K., Ando M., Takao A. et al. Distal type of aortopulmonary window: report of
4 cases // Brit. Heart J.- 1978.- Vol. 40.- P. 681-689.
5. Ho S.Y., Gerlis L.M., Anderson C. et al. The morphology of aortopulmonary win-
dow with regard to their classification and morphogenesis // Cardiol. Young.- 1994.-
Vol. 4.- P. 146-155.
6. Сердечно-сосудистая хирургия: руководство / Под ред. В.И.Бураковского,
Л.А. Бокерия. - М.: Медицина, 1989.
7. Valsangiacomo E.R., Smallhorn J.F. Prenatal diagnosis of aortopulmonary window
by fetal echocardiography // Circulation.- 2002.- Vol. 105.- P. el92.
8. Белоконь H.A., Подзолков В.П. Врожденные пороки сердца - М.: Медицина,
1990.
9. Garver К.A., Hernandez R.J., Vermilion R.P., Goble М.М. Correlative imaging of
aortopulmonary window // Circulation.- 1997.- Vol. 96.- P. 1036-1037.
110
Глава 8. ПОРОКИ РАЗВИТИЯ
МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ И
АНОМАЛИИ ВПАДЕНИЯ ЛЕГОЧНЫХ
ВЕН
8.1. Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) представляет со-
бой сообщение между двумя предсердиями и отражает отклонения в
развитии первичной и вторичной межпредсердных перегородок.
Частота. Частота порока колеблется от 0,1 до 0,53/1000 новорож-
денных в зависимости от критериев его изолированности; среди всех
врожденных пороков он занимает около 6,3%. Преобладают пациенты
женского пола (2:1). Известны семейные случаи ДМПП, часто соче-
тающегося с нарушениями ритма сердца. Кроме того, в 30-50% случа-
ев ДМПП является одним из компонентов прочих ВПС.
Анатомия. Иногда задают вопрос, есть ли отличия между откры-
тым овальным окном (ООО) и ДМПП? Некоторые авторы используют
термин «ДМПП» в качестве родового названия всех сообщений, в том
числе для обозначения отверстия в области овальной ямки у новорож-
денных [1]. Ориентация на возрастной фактор для их разграничения
также оказывается неприемлемой, так как открытое овальное окно
встречается не только у новорожденных или грудных детей, но и у
взрослых. Белоконь Н.А. и Подзолков В.П. [2] считают, что для ДМПП
определяющим является дефицит перегородочной ткани, в то время
как для ООО характерно наличие клапана, образованного первичной
перегородкой со стороны левого предсердия, который потенциально
может закрывать отверстие. Затикян Е.П. [3] указывает на непостоян-
ность визуализации дефекта в области ООО и перекрестный сброс кро-
ви через него. Однако на практике бывает трудно оценить наличие и
функцию клапана у грудного ребенка даже с помощью современных
ультразвуковых методов исследования. Кроме того, некомпетентность
клапана может иметь место при дисбалансе развития различных час-
тей межпредсердной перегородки, т.е. их относительном дефиците. А
персистирующее овальное окно примерно в 20% случаев характеризу-
ется косым ходом отверстия, отражающим неполное слияние первич-
ной и вторичной перегородок [4]. Таким образом, существуют различ-
ные переходные варианты порока. Нам кажется целесообразным в ка-
честве общего термина, особенно в неясных случаях, использовать на-
111
звание «межпредсердное сообщение», небольшие ДМПП (до 5-6 мм),
локализующиеся в области овальной ямки, обозначать как «открытое
овальное окно», а отверстия более 6 мм или при других локализациях
- как ДМПП.
Предложены различные классификации патологии, основанные как
на анатомии порока, так и на клинических его проявлениях [5, 6], од-
нако для практических целей наиболее рациональным представляется
подразделение изолированных дефектов на первичный, вторичный и
дефект в области венозного синуса (sinus venosus defect) (рис. 8-1).
г д
Рис. 8-1. Схема расположения ДМПП. А - вид нормального правого
предсердия; показаны области овальной ямки (ОЯ) и коронарного синуса (КС);
Б - первичный ДМПП; В - общее предсердие; Г - дефекты венозного синуса;
Д - вторичный ДМПП.
Первичный ДМПП располагается непосредственно над атриовен-
трикулярными клапанами, и его нижним краем является перегородка
между клапанами; крайним вариантом патологии является общее пред-
сердие. В изолированном виде встречается чрезвычайно редко (до 15%
случаев), чаще сочетается с общим атриовентрикулярным каналом и
другими аномалиями сердца [7]. Дефект венозного синуса - также не-
частая патология (-10%), располагается он обычно в верхнезаднем от-
деле перегородки (около впадения верхней полой вены), но может ло-
кализоваться в месте впадения нижней полой вены в правое предсер-
дие. Нередко сопровождается аномальным дренажом правой легочной
вены. Вторичный ДМПП - наиболее частый тип порока (75-98%), ха-
рактеризуется обязательным наличием края межпредсердной перего-
родки между дефектом и атриовентрикулярными клапанами. При этом
отверстие может располагаться в любом отделе перегородки (средин-
112
но, кзади или кпереди, над устьем НПВ) и иметь различную величину.
Дефекты также могут носить множественный характер или сочетаться
(первичный плюс вторичный дефекты).
Редким вариантом порока является «обескрышенный» коронарный
синус, представляющий сообщение между коронарным синусом и ле-
вым предсердием и симулирующий клинику ДМПП. Примерно у 20%
больных со вторичным ДМПП или sinus venosus defect имеется сопут-
ствующий пролапс митрального клапана.
Гемодинамика. Основой нарушений кровообращения является
сброс крови через дефект из одного предсердия в другое. Направле-
ние и величина шунта определяются градиентом давления между
предсердиями, в меньшей степени размером и локализацией дефек-
та. Обычно давление в левом предсердии выше, чем в правом, что
определяет лево-правый сброс крови, приводящий к диастолической
перегрузке правого желудочка и гиперволемии малого круга крово-
обращения. В свою очередь, на давление в предсердиях влияют рас-
тяжимость правого и левого желудочков, емкость венозных систем
малого и большого кругов кровообращения, сопротивление малого и
большого кругов кровообращения, наличие сброса на уровне ОАП
или регургитация на трикуспидальном клапане. Эти параметры мо-
гут быстро изменяться даже в течение короткого временного интер-
вала и, конечно, непостоянны в различные периоды жизни. По мере
развития ребенка происходит снижение ОЛС, увеличивается подат-
ливость правого желудочка. В это же время возрастают ОПС и ри-
гидность левого желудочка. Результатом данных изменений является
нарастание сброса крови через ДМПП слева направо, и это направ-
ление остается доминирующим в последующие годы.
Локализация отверстия возле устья полой вены может сопровож-
даться забросом венозной крови в левое предсердие даже при равенст-
ве давления в предсердиях; при общем предсердии возникает полное
смешение крови. У взрослых возможно возникновение сброса справа
налево через персистирующее ООО при резком повышении давления
в правых отделах сердца (кашле, поднятии тяжестей, инфаркте право-
го желудочка).
Значительная резервная емкость и низкое сопротивление легоч-
ных сосудов позволяют длительное время избегать при ДМПП высо-
кой легочной гипертензии, так как правому желудочку не требуется
развивать высокое давление для изгнания крови в легочную артерию
(ср. с ситуацией при ДМЖП, когда в легочную артерию передается дав-
ление левого желудочка и легочная гипертензия развивается значитель-
но быстрее). Даже при объеме крови в МКК, превышающем норму в
ИЗ
три раза, в легочной артерии регистрируют небольшое повышение
давления (до 35-40 мм рт.ст.) [6]. Склеротические изменения в сосу-
дах легких возникают не ранее 2-го десятилетия и не являются обяза-
тельными. Таким образом, основными последствиями ДМПП явля-
ются объемные перегрузки правого предсердия и желудочка, а так-
же гиперволемия МКК. Правый желудочек длительное время в со-
стоянии компенсировать возникшие гемодинамические проблемы, что
сопровождается возрастанием его работы, постепенным развитием
гипертрофии и ухудшением растяжимости. Однако, как показывают
исследования японских авторов, глобальная функция желудочка зна-
чительно не нарушается [8].
Естественное течение. Как известно, во внутриутробном перио-
де наличие межпредсердного сообщения является обязательным усло-
вием нормального развития плода. Преждевременное его закрытие при-
водит к перегрузке правых и гипоплазии левых отделов сердца, сер-
дечной недостаточности и водянке плода. В такой ситуации, как пра-
вило, наступает смерть - внутриутробно или вскоре после рождения.
У нормальных новорожденных кровоток через ООО регистрируется в
92% случаев в течение первого часа после рождения, и быстро умень-
шается к 24 часам [9]. Повторные обследования новорожденных с меж-
предсердным сообщением показали, что оно сохраняется к четверто-
му-пятому дню жизни у 24-47%, к 1 мес - у 7-3%, к 1 году - у 2% из
них [9, 10]. Riggs Т. et al. [1], исследовавшие влияние различных фак-
торов на скорость закрытия ДМПП, выявили, что у детей с малым при-
током крови в левое предсердие (отсутствие ОАП) или высоким ОЛС
этот процесс задерживается до 1,5-2-х лет.
Спонтанная облитерация ДМПП в различных возрастных груп-
пах описана в 14-87% случаев, причем этот процент был тем выше,
чем раньше начинали наблюдения [И, 12, 13]. По данным аутопсий,
в здоровых сердцах межпредсердное сообщение обнаруживают в 27%
случаев, причем в первые три декады жизни частота составляет 34%,
а в последующем снижается до 20%. Это свидетельствует о длитель-
но продолжающихся процессах закрытия [14]. Механизмы этого яв-
ления не совсем ясны. Основными версиями являются уменьшение
размеров дефекта относительно растущего сердца с последующим
смыканием краев и их срастанием, а также закрытие через образова-
ние аневризмы перегородки. Маловероятно закрытие ДМПП диамет-
ром более 8 мм.
Естественное течение изолированного ДМПП благоприятное, ле-
тальность невысока. Основные осложнения - сердечная недостаточ-
ность, рецидивирующая легочная инфекция, нарушения ритма (желу-
114
дочковая тахиаритмия, фибрилляция или трепетание предсердий), про-
грессирующая легочная гипертензия, легочные, системные или мозго-
вые эмболии. Наличие даже большого изолированного ДМПП редко
сопровождается возникновением тяжелого состояния. Только у 6-7%
грудных детей с ДМПП возникают гемодинамические проблемы, тре-
бующие лечения, в том числе оперативного. В большинстве случаев
порок протекает вообще бессимптомно до 2-5 лет. В редких, запущен-
ных случаях возможна смерть пациента от правожелудочковой недос-
таточности, тромбоза легочной артерии, аритмии, парадоксальной эм-
болии сосудов головного мозга, инфекционных легочных заболеваний.
Клиническая симптоматика. Как указывалось выше, течение
ДМПП обычно благоприятное, поэтому в большинстве случаев он ра-
но не диагностируется и нередко обнаруживается случайно при ЭХОКГ,
выполненной по другим поводам. Можно отметить три основные фа-
зы преобладающей симптоматики межпредсердного сообщения (гипок-
семия сердечная недостаточность гипоксемия), обычно связан-
ные с возрастом пациентов.
У новорожденных с высоким ОЛС при дополнительном его повы-
шении во время крика, кашля или кормления ребенка может возник-
нуть право-левый (веноартериальный) сброс через межпредсердное со-
общение, что проявляется кратковременным цианозом. Нередко это яв-
ляется единственным симптомом, который привлекает внимание ро-
дителей или врача. Более выраженную артериальную гипоксемию, со
стойким снижением SO2, отмечают в случаях осложненных родов, при-
водящих к поражению легких, дисфункции трикуспидального клапа-
на, первичной легочной гипертензии. В этих случаях, к удивлению ис-
следователей, не выявляется какой-либо сложный цианотический ВПС,
а имеется всего лишь сброс крови справа налево на уровне межпред-
сердного сообщения на фоне высокого давления в правых отделах. Ран-
ней гипоксемией может проявиться и большой ДМПП типа общего
предсердия или дефект, расположенный рядом с устьем верхней по-
лой вены. В литературе описаны также два случая персистирующего
цианоза вследствие сброса крови из нижней полой вены в левое пред-
сердие при нормальном давлении в правом желудочке [15]. Такая ге-
модинамика была следствием аномально большого клапана (евстахие-
вой заслонки) нижней полой вены.
По мере снижения ОЛС и развития большого артериовенозного
сброса с гиперволемией МКК к 2-5 годам может прогрессировать сер-
дечная недостаточность с одышкой, тахикардией, гепатомегалией. Ха-
рактерны повторные бронхиты, пневмонии, повышенная утомляемость.
115
Дети хуже переносят физические нагрузки по сравнению со сверстни-
ками. Как правило, большой ДМПП сопровождается отставанием де-
тей в росте и весе по сравнению с возрастной нормой. Связь этих от-
клонений с пороком подтверждается быстрым восстановлением пара-
метров после хирургического закрытия дефекта [16, 17].
В старшем возрасте, в том числе у взрослых, в клинической сим-
птоматике вновь начинают преобладать признаки веноартериального
сброса. Это относится к пациентам с небольшими межпредсердными
сообщениями, протекавшими ранее без гемодинамических нарушений
(20-27%) и не привлекавшими врачебного внимания. В этих случаях
первыми симптомами межпредсердного сообщения могут быть тран-
зиторная гипоксемия при банальном чихании, физическом напряже-
нии типа маневра Вальсальвы (например, при поднятии тяжестей), ор-
ганическом поражении трикуспидального клапана, инфаркте правого
желудочка. Наличие открытого овального окна часто устанавливают
также при парадоксальных эмболиях из венозного русла в артериаль-
ное, возникновении декомпрессионного синдрома у ныряльщиков [18].
Естественно, в этой возрастной группе могут встретиться и пациенты
с легочной гипертензией как следствиями длительного существования
порока. Инфекционный эндокардит практически не встречается, по-
этому не требуется проведения профилактики антибиотиками.
Аускультация у грудных детей обычно неспецифична; наиболее
часто имеется небольшой систолический шум изгнания слева от гру-
дины. Iyer R.S. et al. [17] отметили отсутствие вообще какого-либо шу-
ма у 17% детей, которым потребовалась операция на первом году жиз-
ни. Характерная аускультативная картина развивается позже: расщеп-
ление II тона на легочной артерии (более позднее закрытие легочного
клапана по сравнению с аортальным) и небольшой систолический шум
слева от грудины во втором-третьем межреберье. Шум не связан непо-
средственно со сбросом крови через межпредсердный дефект, а явля-
ется результатом относительно высокого кровотока через легочный кла-
пан. Нередко впервые шум выслушивают при состояниях, когда этот
кровоток усиливается дополнительно - например, при инфекционных
заболеваниях с высокой температурой и повышением сердечного вы-
броса. Систолический шум несколько иного тембра в четвертом меж-
реберье может свидетельствовать о сопутствующей трикуспидальной
недостаточности. При больших дефектах и длительном существова-
нии порока возможно развитие недостаточности легочного клапана или
относительного стеноза трикуспидального клапана (вследствие боль-
шого потока крови через него), что сопровождается появлением не-
116
больших диастолических шумов. Наличие диастолического шума на
верхушке с акцентом I тона позволяет заподозрить достаточно ред-
кую патологию - синдром Лютембаше (сочетание ДМПП и митраль-
ного стеноза).
Электрокардиография. У новорожденных изменения ЭКГ при
изолированном вторичном ДМПП не являются специфическими, так
как и в норме регистрируется правограмма, свидетельствующая о до-
минантности правого желудочка. Насторожить врача должны длитель-
но сохраняющиеся признаки отклонения электрической оси сердца
вправо (угол отклонения от +90° до +150°), высокоамплитудный зу-
бец R в правых грудных отведениях, неполная блокада правой ножки
пучка Гиса. В отдельных случаях можно зарегистрировать также пе-
регрузку правого предсердия. Нарушения ритма (желудочковая тахиа-
ритмия, трепетание или фибрилляция предсердий) редко сопровож-
дают ДМПП в грудном возрасте. Обычно они встречаются у взрос-
лых пациентов, имеющих хроническую перегрузку правых отделов
сердца, как объемную, так и вследствие легочной гипертензии.
Рентгенография грудной клетки. Изменения, которые регист-
рируют на рентгенограмме грудной клетки, характеризуют величину
сброса через ДМПП, поэтому данное исследование чрезвычайно важ-
но в диагностике порока. Нередко именно неблагоприятная динами-
ка рентгенографической картины позволяет своевременно поставить
показания к оперативному вмешательству. Основные параметры, на
которые необходимо обратить внимание, - выраженность легочного
рисунка и размеры сердца. Признаки гиперволемии МКК в период
новорожденное™, когда ОЛС высокое, могут отсутствовать. Однако
они постепенно нарастают по мере развития ребенка и снижения ОЛС.
При этом легочный рисунок усиливается по артериальному руслу; раз-
меры тени сердца обычно изменяются незначительно. Более сущест-
венную динамику выявляют при большом артериовенозном сбросе,
когда расширяются легочные корни и периферические ветви легоч-
ной артерии, а тень сердца увеличивается в поперечнике за счет пра-
вых отделов (рис. 8-2).
В этой стадии в первой косой проекции можно обнаружить, что
ретрокардиальное пространство сужено за счет увеличения тени пра-
вого предсердия, а по переднему контуру сердечная тень примыкает
к грудной клетке. Признаки легочной гипертензии у детей раннего
возраста, как правило, отсутствуют, за исключением случаев врож-
денного поражения сосудов легких.
117
Рис. 8-2. Рентгенограмма при ДМПП. Умеренное усиление легочного
рисунка и расширение тени сердца.
Эхокардиография. Наиболее полную диагностическую информа-
цию можно получить с помощью трансторакальной двухмерной
ЭХОКГ, которая позволяет непосредственно обнаружить перерыв эхо-
сигнала в зоне МПП (рис. 8-3).
Рис. 8-3. Эхокардиограмма из верхушечной четырехкамерной
позиции при вторичном центральном дефекте межпредсердной
перегородки. Визуализируется выпадение эхосигналов в области вторичной
перегородки, выраженное расширение правого предсердия и приточного отдела
правого желудочка.
Обычно используют верхушечную четырехкамерную или субкос-
тальную позиции. Импульсно-волновая допплерография с датчиком, рас-
положенным перпендикулярно МПП, дает возможность в ряде случаев
зарегистрировать картину медленного (так как разница давления между
предсердиями небольшая) потока крови из одного предсердия в другое.
118
Цветное допплеровское картирование позволяет наиболее четко
определить наличие и направление шунта в виде мозаичного потока
через межпредсердное сообщение; а в случаях тонких, нечетких краев
отверстия - измерить его диаметр по ширине этого цветового пучка.
Так как сброс может возникать и в систолу, и в диастолу, простое изме-
рение градиента давления между предсердиями недостаточно инфор-
мативно, и исследование с цветным допплеровским картированием
должно являться непременным атрибутом диагностики ДМПП (рис. 8-4
на цветной вкладке).
Количественное определение избыточного легочного кровотока
возможно при сравнении ударного выброса левого и правого желудоч-
ков. С этой целью определяют объемный кровоток в легочном стволе и
аорте [19]. Отношение этих объемных кровотоков (Q /Q) будет харак-
теризовать степень легочной гиперволемии.
Следует отметить, что диаметр ДМПП, определенный с помощью
ЭХОКГ, практически всегда отличается от измеренного во время опе-
рации. Это связано с тем, что во время исследования сердце находится
в движении, растягивается движущейся кровью, а в период операции
расслаблено (вследствие кардиоплегии) и опорожнено. В результате
измерение фиксированных тканевых структур возможно произвести
довольно точно, а меняющихся параметров (диаметр отверстия или по-
лости) - всегда с определенной ошибкой.
При локализации дефекта у устья верхней полой вены (дефект ве-
нозного синуса) или нижней полой вены непосредственная его визуа-
лизация трансторакальным методом затруднена. В таких случаях ве-
роятный диагноз ставится на основании косвенных признаков дефек-
та: увеличения полостей правого предсердия и желудочка, гипертро-
фии последнего, высокой скорости кровотока в выводном отделе пра-
вого желудочка и легочной артерии. О повышении диастолического
объема правого желудочка свидетельствует патологическая динамиче-
ская геометрия межжелудочковой перегородки, которую хорошо мож-
но проследить в проекции короткой оси, а именно - уплощение пере-
городки в диастолу и восстановление округлой формы в систолу [20].
Минутный объем левого желудочка и его фракция выброса, как
правило, претерпевают незначительные изменения. Лишь при длитель-
ном существовании порока возможно уменьшение конечного диасто-
лического объема левого желудочка и его ударного выброса. В этих
случаях Shaheen J. et al. [21] отметили отрицательную корреляцию КДО
ЛЖ с величиной Qp/Qs и диаметром ДМПП. Подтверждением этой
связи является и тот факт, что после операции КДО ЛЖ возрастает.
119
У более старших пациентов нередко применяют транспищевод-
ную ЭХОКГ, которая считается наиболее точной методикой оценки це-
лостности МПП, особенно при дефектах венозного синуса.
В случаях, когда необходимо выявить причины возникновения
транзиторной гипоксемии или парадоксальных эмболий, а также про-
вести дифференциальную диагностику с впадением полой вены непо-
средственно в левое предсердие, используют контрастную ЭХОКГ (с
применением различных суспензий микропузырьков) [20]. Контраст
вводят в периферическую вену; его появление в левом предсердии сви-
детельствует о сбросе крови справа налево.
Катетеризация сердца и ангиокардиография. В настоящее вре-
мя данные исследования потеряли свое значение в диагностике ДМПП
у маленьких детей. Однако они могут быть целесообразны в случаях,
когда по каким-либо причинам необходимо точно измерить величину
сброса через дефект или степень легочной гипертензии (как правило,
у пациентов старших возрастных групп) или диагностировать сопут-
ствующую патологию (например, аномальный дренаж легочных вен).
Лечение. Терапия направлена на уменьшение гиперволемии МКК
и увеличение антеградного кровотока через левые отделы сердца. Это
достигается с помощью мочегонных препаратов и дигоксина. Как пра-
вило, эффект от лечения хороший, учитывая благоприятное течение
заболевания и склонность к уменьшению дефектов (или их закры-
тию) с возрастом; в ряде случаев удается избежать оперативного вме-
шательства.
Показанием к операции является неэффективность медикаментоз-
ного лечения (сохраняющаяся сердечная недостаточность, отставание
в физическом развитии, легочные заболевания). Традиционным гемо-
динамическим показанием к хирургическому вмешательству является
соотношение легочного и системного кровотоков более чем 2,0:1. В
случаях значительного сброса (отношение легочного кровотока к сис-
темному более 2,5:1) можно ожидать быстрого, иногда внезапного ухуд-
шения состояния ребенка, поэтому решение об операции может быть
принято даже при умеренно выраженных клинических симптомах. Ана-
логичная тактика может использоваться в случаях быстрого нараста-
ния легочной гиперволемии по данным динамического рентгеногра-
фического исследования.
В связи с развитием миниинвазивных вмешательств, имеющих
меньший риск для пациентов, показания к закрытию дефектов в по-
следнее время стали расширять. Некоторые авторы выполняют такие
операции при соотношении Qp/Qs более 1,5:1 даже без существенных
120
клинических проявлений порока [22]. Однако аргументы в пользу та-
ких вмешательств слабы, особенно применительно к детям. Необхо-
димость закрытия дефекта диктуется все же клинической симптомати-
кой, признаками объемной перегрузки правого желудочка и легочной
гиперволемией.
Традиционная хирургическая коррекция заключается в ушивании
дефекта или пластике его заплатой с использованием торакотомии и
искусственного кровообращения. Использование миниинвазивного или
видеоторакоскопического доступов позволяет провести операцию с
меньшей травмой, укорочением сроков лечения и хорошим космети-
ческим результатом [23, 24, 25, 26]. В настоящее время при тривиаль-
ных ДМПП послеоперационная летальность практически отсутствует,
исключение составляют случаи с врожденным поражением легких.
В последнее десятилетие интенсивно развиваются альтернативные,
эндоваскулярные методы закрытия дефектов с помощью специальных
устройств - окклюдеров [23,27,28]. Процедуру выполняют путем пунк-
ции периферических сосудов с последующей доставкой специального
«зонтика» или «пуговичного устройства» к дефекту. Однако существу-
ют определенные ограничения для проведения данной процедуры. Эн-
доваскулярное вмешательство возможно только в случаях вторичного
дефекта размером до 25-40 мм, вокруг которого имеется кайма пере-
городки в около 10 мм, и расположенного достаточно далеко от коро-
нарного синуса, атриовентрикулярных клапанов, устьев легочных и по-
лых вен. Отдельную проблему представляет сочетание межпредсерд-
ного сообщения с аневризмой МПП. Успешное его закрытие выполни-
мо, как правило, только в случаях одиночного отверстия; при больших
или множественных дефектах аневризмы успех становится сомнитель-
ным и часто приходится прибегать к «открытой» операции [29]. Таким
образом, кардиолог перед направлением пациента на то или иное вме-
шательство должен проанализировать все перечисленные выше пара-
метры дефекта.
В качестве осложнений транскатетерной процедуры рассматрива-
ются: невозможность установить окклюдер из-за анатомических осо-
бенностей дефекта, смещение его в правый желудочек, возникновение
аритмий и атриовентрикулярной блокады, сохранение значительного
остаточного шунта. Полноценный успех достигается в среднем у 90%
пациентов. Исследователи, располагающие значительным опытом
транскатетерных вмешательств, отмечают быстрое (в пределах 24 ча-
сов) уменьшение полости правого желудочка, возрастание объема ле-
вого желудочка и его сократимости. При трансторакальной операции
подобные сдвиги отмечают только через несколько месяцев [30, 31].
121
Есть сообщения о том, что закрытие ДМПП даже с небольшим шун-
том (Q/QK от 1,4) приводит к повышению максимального потребления
О2 и функциональных способностей пациентов [32]. Несмотря на боль-
шие демографические вариации больных, эти результаты могут свиде-
тельствовать об определенных преимуществах «закрытых» процедур.
8.2» Аномалии легочных вен
Аномалии легочных вен представляют собой широкий спектр от-
клонений в развитии сердца. В основу их классификации положены
работы Lucas et al. [33], которые базировались на эмбриологических
нарушениях, приводящих к формированию пороков:
I. Атрезия общей легочной вены (ранняя) при персистировании легоч-
но-системного венозного сообщения:
А. Частичный аномальный дренаж легочных вен.
Б. Тотальный аномальный дренаж легочных вен.
II. Атрезия общей легочной вены (поздняя) после облитерации легочно-
системного венозного сообщения.
III. Стеноз общей легочной вены:
А. Трехпредсердное сердце.
IV. Патологическая абсорбция общей легочной вены при впадении в ле-
вое предсердие:
А. Стеноз отдельных легочных вен.
Б. Отклонения в количестве легочных вен.
В зарубежной литературе вместо термина «дренаж», который от-
ражает физиологическую или гемодинамическую характеристику по-
рока, нередко используют термин «соединение» (connection), характе-
ризующий анатомические взаимоотношения. В настоящем разделе рас-
сматриваются наиболее частые и гемодинамически значимые вариан-
ты патологии.
8.3. Частичный аномальный дренаж легочных вен
При частичном (неполном) аномальном дренаже одна или несколько
легочных вен (но не все) соединяются с правым предсердием или его
венозными притоками.
Частота. Частичный аномальный дренаж легочных вен встреча-
ется менее чем в 1% случаев среди всех ВПС. Однако истинная часто-
та порока может быть выше, поскольку он нередко протекает без кли-
нических проявлений.
Анатомия. Варианты соединения легочных вен с правыми отде-
лами могут быть весьма многочисленными (рис. 8-5). Известны слу-
чаи впадения в верхнюю и нижнюю полые вены, коронарный синус,
122
левую безымянную вену. Правые легочные вены дренируются аномаль-
но почти в два раза чаще, чем левые. Дефект межпредсердной перего-
родки может участвовать в формировании порока, но может и отсутст-
вовать, в отличие от тотального аномального дренажа. Частым являет-
ся сочетание частичного аномального дренажа правых легочных вен с
дефектом венозного синуса.
Одной из модификаций порока является синдром «турецкой саб-
ли», в который входят гипоплазия правого легкого, его аномальное под-
диафрагмальное кровоснабжение непосредственно от аорты, гипопла-
зия правой легочной артерии, декстропозиция сердца. При этом син-
дроме правая легочная вена впадает в нижнюю полую вену или в пра-
вое предсердие на стыке с нижней полой веной, образуя характерную
тень на рентгенограмме грудной клетки.
А Б В Г
Рис. 8-5. Варианты частичного аномального дренажа легочных вен.
А, Б - правые легочные вены дренируются в верхнюю или нижнюю полые вены;
В, Г -левые легочные вены дренируются в верхнюю полую вену или коронарный синус.
Гемодинамика. Аномально впадающие легочные вены увеличи-
вают объемную нагрузку на правые отделы сердца. При длительном
существовании порока в результате рециркуляции повышенного объе-
ма крови через легкие (как при обычных пороках со сбросом слева
направо) возрастает объемная нагрузка и на левые отделы. Величина
легочной гиперволемии определяется количеством аномальных вен, на-
личием и размером ДМПП, резистентностью легочных сосудов. Ощу-
тимые нарушения гемодинамики возникают при увеличении легочно-
го кровотока в 1,5 раза и более. Высокая легочная гипертензия для
данного порока не характерна.
Естественное течение. Внутриутробно порок не представляет про-
блемы в силу особенностей кровообращения плода. Естественное те-
чение в постнатальном периоде неизвестно; может быть условно при-
равнено к течению ДМПП.
123
Клиническая симптоматика. При аномальном дренировании од-
ной легочной вены и отсутствии дефекта межпредсердной перегород-
ки порок может не сопровождаться клиническими проявлениями. Ино-
гда частичный аномальный дренаж выявляется случайно при обследо-
вании ребенка по поводу ДМПП.
Постепенно при прогрессировании легочной гиперволемии и ар-
териальной гипертензии появляется такая симптоматика, как плохая
переносимость физических нагрузок, повышенная утомляемость,
одышка, повторные пневмонии, умеренная сердечная недостаточность.
Аускультативная картина похожа на ДМПП: расщепление второго
тона, систолический шум изгнания в проекции легочной артерии.
Электрокардиография. Изменения ЭКГ не имеют характерной
картины. Электрическая ось расположена нормально или отклонена
вправо. Могут быть признаки перегрузки правых отделов, неполная
блокада правой ножки пучка Гиса.
Рентгенография грудной клетки. Изменения, которые регистри-
руют на рентгенограмме грудной клетки, характеризуют величину из-
быточного кровотока через правые отделы. Признаки гиперволемии
МКК в период новорожденности, когда ОЛС высокое, могут отсутст-
вовать. Однако они постепенно нарастают по мере развития ребенка и
снижения ОЛС. При этом легочный рисунок усиливается по артери-
альному руслу; размеры тени сердца обычно изменяются незначитель-
но. При инфракардиальном частичном аномальном дренаже в нижнюю
полую вену можно отметить симптом «турецкой сабли»: овальной фор-
мы тень вдоль правой границы сердца. Расширенная верхняя полая
вена (справа) или вертикальная вена (слева) также могут указывать на
место аномального дренажа.
Эхокардиография. Диагноз данного порока возможен, если ру-
тинно исследуют все четыре легочные вены и выявляют Аномальное
впадение какой-либо из них. Показанием для такого исследования
должны стать дилатация правых предсердия и желудочка, а также на-
личие ДМПП или добавочной верхней полой вены. Высока вероят-
ность частичного аномального дренажа легочных вен при дефекте
венозного синуса.
Катетеризация сердца и ангиокардиография. Связь легочных
вен с полыми венами может быть заподозрена при повышении насы-
щения крови кислородом на уровне верхней, нижней полой или безы-
мянной вены. Подобные изменения насыщения на уровне правого пред-
сердия не являются характерными для порока, так как обычно присут-
ствуют при простом ДМПП. Наиболее точным исследованием являет-
124
ся введение контрастного вещества в легочную артерию. После его про-
хождения через легочное сосудистое русло выявляются места впаде-
ния всех легочных вен в полости сердца или крупных сосудов.
Лечение. При развитии симптомов сердечной недостаточности
применяют дигоксин и мочегонные препараты.
Хирургическое лечение показано при соотношении легочного и
системного кровотоков более чем 1,5:1. Обычно к коррекции порока
прибегают в возрасте от 2-х до 5 лет. Целью операции является пере-
направление потока крови в левые отделы сердца. Это достигается пу-
тем создания внутрисердечных «туннелей» с использованием заплат.
Особое внимание необходимо уделять профилактике стенозов на пу-
тях притока, особенно в области верхней полой вены. При синдроме
«турецкой сабли» в некоторых случаях прибегают к резекции изменен-
ной доли правого легкого.
8.4. Тотальный аномальный дренаж легочных вен
При тотальном (полном) аномальном дренаже легочных вен все
легочные вены соединяются с правым предсердием или его венозны-
ми притоками. Ни одна из них не впадает, как в норме, в левое пред-
сердие. Таким образом, межпредсердное сообщение является обяза-
тельным для предотвращения изолированной легочной циркуляции.
Частота. Частота порока составляет 0,06/1000 живорожденных,
около 1,5% среди всех ВПС, около 1,5% среди критических ВПС. По-
рок нередко сочетается с другими врожденными патологиями (общее
предсердие, единственный желудочек, аномалии положения сердца, экс-
тракардиальные пороки развития).
Анатомия. Варианты соединения легочных вен с правыми отде-
лами могут быть весьма разнообразными. Столь же многочисленны
классификации порока, основывающиеся на его эмбриологических,
анатомических, гемодинамических характеристиках. Наиболее распро-
страненная классификация предложена Darling et al. (рис. 8-6) [34]:
Тип I - аномальный дренаж на супракардиальном уровне (в пер-
систирующую левую верхнюю полую вену или в правую верхнюю по-
лую вену).
Тип II - аномальный дренаж на кардиальном уровне (в правое пред-
сердие или в коронарный синус).
Тип III - аномальный дренаж на инфракардиальном уровне, ниже
диафрагмы (в нижнюю полую вену, портальную вену, печеночные ве-
ны, венозный проток).
Тип IV - смешанная форма, включающая предшествующие ва-
рианты.
125
Рис. 8-6. Варианты тотального аномального дренажа легочных вен.
А - супракардиальный дренаж; Б, В - кардиальный дренаж; Г - инфракардиальный
дренаж.
Первый тип встречается наиболее часто (до 50% всех случаев),
типы II и III - по 20% каждый, на долю смешанного типа приходится
около 10%.
Легочные вены могут соединяться с сердцем отдельными устьями
или сливаясь в общий коллектор. При инфрадиафрагмальном вариан-
те они проходят через пищеводное отверстие в диафрагме.
Обязательным компонентом порока является межпредсердное со-
общение. Правые отделы сердца и легочная артерия расширены. Ле-
вые отделы сердца, как правило, уменьшены из-за низкого кровотока
через них.
При тотальном аномальном дренаже легочных вен большое зна-
чение имеют анатомические обструкции, определяющие физиологию,
клинику и прогноз порока. Они могут иметь место на уровне самих
коллекторов, на уровне межпредсердной перегородки или быть связа-
ны с внешним сдавлением. К последним относятся обструкции в мес-
те впадения в верхнюю полую вену, при прохождении коллектора ме-
жду левой легочной артерией и левым бронхом или правой легочной
артерией и трахеей, на уровне диафрагмы, печеночных синусоидов или
венозного протока. Нарушения оттока из легочных вен могут встре-
чаться при любом типе дренажа, однако в 80% случаев сопровождают
инфракардиальный тип.
Гемодинамика. При данном пороке вся кровь из большого и ма-
лого кругов кровообращения поступает в правое предсердие, опреде-
ляя объемную перегрузку правых отделов сердца. В последующем мень-
шая часть смешанной венозно-артериальной крови через межпредсерд-
ное сообщение сбрасывается в левое предсердие и направляется в боль-
шой круг кровообращения. Остальная часть, проходя через правый
126
желудочек, поступает в легочное русло, обусловливая значительную
легочную гиперволемию. Величина и направление сбросов определя-
ются многими факторами, представляющими тонко сбалансированную
систему. В нее входят резистентность легочных и периферических со-
судов, степень диастолического расслабления желудочков, диаметр
межпредсердного сообщения, наличие обструкций на путях оттока из
легочных вен. При затруднениях оттока быстро развиваются венозный
застой и легочная гипертензия.
Возможно также врожденное поражение легочного сосудистого рус-
ла (первичная легочная гипертензия), ухудшающее течение порока.
Естественное течение. Во внутриутробном периоде порок не име-
ет большого гемодинамического значения, так как легочный кровоток
минимален, оксигенация системной крови не нарушена, а правый же-
лудочек и в норме играет ведущую роль. В постнатальном периоде у
большинства детей развивается критическое состояние, приводящее к
смерти 33% из них на первом месяце жизни. До 6 мес. доживают в
среднем 55%. В последующем вероятность гибели снижается; 50%
больных достигают 15 лет. Чем позже появляются первые симптомы
порока, тем лучше прогноз. Инфракардиальный тип имеет более тяже-
лое течение, большинство больных без операции погибают в первые
два месяца жизни.
Клиническая симптоматика. Симптомы порока определяются с
момента рождения ребенка. Наиболее часто имеются признаки сердеч-
ной недостаточности (одышка, тахикардия, увеличение печени), ка-
шель, связанный с застойными явлениями в легких, крепитация, уме-
ренный цианоз, усиливающийся при крике или кормлении. Послед-
ний симптом характерен для инфрадиафрагмального типа дренажа и
возникает вследствие сдавления коллектора расширенным пищеводом.
При значительном препятствии оттоку крови от легких цианоз стано-
вится более выраженным и постоянным.
В последующем дети отстают в физическом развитии, часто боле-
ют респираторными инфекциями; это сочетается с постоянным уме-
ренным цианозом.
Аускультативная картина не имеет характерных признаков, напо-
минает таковую при ДМПП (небольшой систолический шум изгнания
во втором межреберье слева). При наличии легочной гипертензии до-
бавляются акцент и расщепление второго тона на легочной артерии. В
случае стеноза в месте впадения коллектора в полую вену можно вы-
слушать характерный систолический шум над или под ключицей.
127
Электрокардиография. Типичным признаком порока является от-
клонение электрической оси сердца вправо. Это сочетается с призна-
ками увеличения правого предсердия и правого желудочка. Выражен-
ная перегрузка правого желудочка может сопровождаться смещением
сегмента ST ниже изолинии и глубокими зубцами Т в отведениях II, III,
aVF, V,-V4 [2].
Рентгенография грудной клетки. Легочный рисунок характери-
зуется значительным усилением по артериальному и венозному руслу.
При тяжелом течении порока возможна картина интерстициального оте-
ка легких. Нередко изменения в легких расценивают как пневмонию
или болезнь гиалиновых мембран.
Сердце увеличено за счет правых отделов, нередко видна расши-
ренная верхняя полая вена. Для супракардиального типа типичной яв-
ляется форма сердца в виде «снежной бабы», когда верхняя часть тени
(в зоне сосудистого пучка) формируется расширенным коллектором и
верхней полой веной. Это хорошо видно при сопоставлении рентгено-
граммы и ангиокардиограммы (рис. 8-7).
Рис. 8-7. Супракардиальный тип тотального аномального дренажа
легочных вен. А - рентгенограмма грудной клетки; Б - ангиокардиограмма.
Эхокардиография. Эхокардиография является эффективным мето-
дом диагностики тотального аномального дренажа легочных вен. Ос-
новными признаками патологии являются расширенный правый желу-
дочек и как бы сдавленный (уменьшенный) левый желудочек. Правое
предсердие существенно увеличено, межпредсердная перегородка про-
гибается в левое предсердие. У 70% детей имеется небольшое открытое
овальное окно, у 30% - ДМПП. Легочная артерия расширена. При тща-
тельном исследовании сердца можно обнаружить позади левого пред-
128
сердия венозный коллектор (рис. 8-8 на цветной вкладке). В зоне дрена-
жа и в легочной артерии кровоток ускорен. Возможно значительное по-
вышение давления в правом желудочке и легочной артерии.
При супракардиальной форме возможно выявить аномальный кро-
воток в верхней полой вене. При кардиальной форме дренажа обычно
хорошо виден расширенный коронарный синус. Инфракардиальный
тип возможно визуализировать из субкостального доступа. При невоз-
можности идентифицировать все четыре легочные вены следует по-
дозревать смешанный тип аномального дренажа. Наиболее распростра-
ненным является следующее сочетание: впадение вен от верхней доли
левого легкого в левую верхнюю полую вену, а остальных - в коронар-
ный синус.
Катетеризация сердца и ангиокардиография. Катетеризация вы-
являет высокое насыщение крови кислородом во всех отделах сердца.
Давление в правом предсердии и легочной артерии повышено. Точ-
ный диагноз позволяет поставить введение контрастного вещества в
легочный ствол или селективно в легочные артерии. При этом стано-
вится виден коллектор легочных вен или отдельные вены, впадающие
тем или иным способом в правое предсердие (рис. 8-7).
Лечение. Базовая терапия направлена на снижение потребностей
организма в кислороде и коррекцию метаболических нарушений. Ре-
бенку необходимо создать комфортные температурные условия, огра-
ничить его физическую активность. Эффект от оксигенотерапии со-
мнителен. При застойной сердечной недостаточности прибегают к тра-
диционному лечению дигоксином и диуретиками.
В случаях отека легких показано проведение искусственной вен-
тиляции легких с положительным давлением в конце выдоха. Если при-
чиной отека является обструкция на уровне межпредсердного сообще-
ния, а корригирующая операция по каким-либо причинам невозмож-
на, целесообразно выполнение закрытой баллонной атриосептостомии.
Операция показана всем детям с данной патологией. Сроки вме-
шательства зависят от степени гемодинамических нарушений. При на-
личии обструкций оттоку хирургическое вмешательство выполняют
сразу после установления диагноза. В остальных случаях оптималь-
ный возраст - 2-6 месяцев. Вид операции варьирует в зависимости от
типа дренажа, однако целью ее является перенаправление потока кро-
ви в левое предсердие. Кроме того, необходимо устранить стенозы ле-
гочных вен и коллектора, что во многом определяет хороший после-
операционный результат [35].
129
8.5. Трехпредсердное сердце
Трехпредсердное сердце - врожденный порок развития общей
легочной вены, при котором левое предсердие оказывается разделе-
но фибромышечной мембраной на две (проксимальную и дисталь-
ную) камеры.
Частота. Трехпредсердное сердце является редкой врожденной
аномалией и наблюдается примерно в 0,1-0,4% среди всех врожден-
ных пороков сердца у новорожденных.
Анатомия. Во время эмбрионального развития общая легочная ве-
на в норме внедряется в левое предсердие и абсорбируется. При неза-
вершенной абсорбции остается фибромышечная мембрана, которая раз-
деляет левое предсердие на две камеры. В проксимальной находятся ле-
гочные вены, в дистальной - ушко левого предсердия и митральный кла-
пан. Камера легочных вен в большинстве случаев соединяется с собст-
венно левым предсердием через отверстие в мембране. Но возможно
также соединение с правым предсердием - прямое (это соединение не
является ДМПП!) или через аномальный дренаж (вертикальная вена).
Lucas et al. [36] выделяют три основных варианта трехпредсерд-
ного сердца.
I. Добавочная камера принимает все легочные вены и соединяется с ле-
вым предсердием:
А - без других коммуникаций (классическая форма порока);
Б - с дополнительными аномальными коммуникациями (непосредствен-
ное соединение с правым предсердием или соединение посредством ТАДЛВ).
II. Добавочная камера принимает все легочные вены и не соединяется с
левым предсердием:
А - прямо соединяется с правым предсердием;
Б - соединяется с правым предсердием посредством ТАДЛВ.
III. Неполная форма трехпредсердного сердца (часть легочных вен непо-
средственно впадает в левое предсердие, часть - в добавочную камеру):
А - добавочная камера соединяется с левым предсердием;
Б - добавочная камера соединяется с правым предсердием.
Межпредсердная перегородка интактна в половине случаев. При
наличии межпредсердного дефекта он располагается в дистальной
камере.
Гемодинамика. Нарушения гемодинамики определяются величи-
ной отверстия в мембране и наличием аномального дренажа легочных
вен. Узкое отверстие сопровождается застойными явлениями в легких,
легочной гипертензией и правожелудочковой недостаточностью. Ле-
гочной гиперволемии способствует и аномальный дренаж в правое
предсердие, который имеется примерно у 10% больных.
130
При полном отсутствии отверстия в мембране наличие межпред-
сердного сообщения становится жизненно необходимым. В таких слу-
чаях возникает переток крови сначала в правое предсердие, а затем
через дефект межпредсердной перегородки - в левое. Естественно, что
подобная гемодинамика сопровождается дополнительной артериаль-
ной гипоксемией из-за примеси венозной крови.
Естественное течение. Течение порока в пренатальном и постна-
тальном периодах не изучено. Однако известно, что рано возникшая
легочная гипертензия без хирургической коррекции порока приводит
к быстрой гибели пациентов (в первые 6 месяцев жизни).
Клиническая симптоматика. Клинические проявления порока и
прогноз зависят от размера отверстия в мембране. При резком стенозе
с первых дней жизни возникают одышка, кашель, застойные хрипы в
легких, цианоз. Нередко больных лечат по поводу пневмонии, и толь-
ко эхокардиографическое исследование помогает выявить порок. Дру-
гие симптомы относятся к правожелудочковой недостаточности - ге-
патомегалия, отеки на лице и ногах. Отмечаются трудности при корм-
лении, плохая прибавка в весе.
При большом отверстии в диафрагме порок может впервые про-
явиться гораздо позже и симулировать митральный стеноз.
Аускультативная картина нехарактерна, в некоторых случаях шу-
мы полностью отсутствуют. Наиболее часто отмечается акцент второ-
го тона. При дилатации правых отделов возможно возникновение сис-
толического шума трикуспидальной недостаточности.
Электрокардиография. На ЭКГ не имеется специфических при-
знаков. Обычно определяют небольшое отклонение электрической оси
сердца вправо, дилатацию правого предсердия и гипертрофию право-
го желудочка.
Рентгенография грудной клетки. Типичным симптомом порока
является застой в легких, вплоть до их отека. Сердечная тень увеличе-
на умеренно, обычно за счет дилатации правого желудочка.
Эхокардиография. Данное исследование является ведущим в ди-
агностике порока. Как правило, удается визуализировать диафрагму,
разделяющую левое предсердие (рис. 8-9).
Устья легочных вен находятся в проксимальной камере, ушко и
отверстие митрального клапана - в дистальной. Последующая диагно-
стика направлена на выявление дефекта межпредсердной перегородки
и направление сброса через него, а также локализацию устьев легоч-
ных вен для исключения их аномального дренажа.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание эффективно при определении типа аномального дренажа легоч-
ных вен и степени легочной сосудистой обструкции.
131
Рис. 8-9. Эхокардиограмма из верхушечной четырехкамерной
позиции при трехпредсердном сердце. Лоцируется линейная эхогенная
структура (фиброзная мембрана) в левом предсердии, разделяющая его на две части
(указана стрелкой); позади проксимальной части предсердия визуализируются
расширенные легочные вены.
Лечение. Терапевтическое лечение должно быть направлено на
предупреждение или уменьшение легочного венозного застоя. С этой
целью применяют диуретики, дигоксин. Учитывая фактически фикси-
рованный сердечный выброс при тяжелой патологии, показано огра-
ничение физической активности. Стабилизировать состояние новоро-
жденных детей возможно также с помощью экстракорпоральной мем-
бранной оксигенации.
При выявлении обструктивной мембраны показано хирургическое
вмешательство. Операция заключается в иссечении мембраны и кор-
рекции аномального дренажа легочных вен. В последние годы в экс-
тренных случаях используют метод баллонной дилатации суженного
отверстия.
Литература
1. Riggs Т, Sharp S.E., Batton D. et al. Spontaneous closure of atrial septal defects in
premature vs full-term neonates // Pediatr. Cardiol.- 2000.- Vol. 21.- P. 129-134.
2. Белоконь H.A., Подзолков В.П. Врожденные пороки сердца - М.: Медицина,
1991.
3. Затнкян Е.П. Кардиология плода и новорожденного. - М.: «Инфо-Медиа», 1996.
132
4. Moss&Adams. Heart disease in infants, children, adolescents, including the fetus
and young adult. 5th ed. - Williams&Wilkins, 1989.
5. Банкл Г. Врожденные пороки сердца и крупных сосудов: пер. с англ.- М.: Ме-
дицина, 1980.
6. Сердечно-сосудистая хирургия. / Под ред. В.И. Бураковского и Л. А. Бокерия-
ми Медицина, 1989.
7. Горбачевский С.В., Шарыкин А. С., Бузинова Л.А. Особенности хирургической
коррекции общего предсердия у детей раннего возраста // Грудная и серд.-сос.
хир.- 1997.-№2.- С. 24.
8. Ishii М., Eto G., Tei С. et al. Quantitation of the global right ventricular function in
children with normal heart and congenital heart disease; a right ventricular myocar-
dial performance index // Pediatr.CardioL- 2000.-Vol. 21.-P. 416-421.
9. Hiraishi S., Agata Y., Saito K. et al. Interatrial shunt flow profiles in newborn in-
fants: a colour flow and pulsed Doppler echocardiographic study // Brit. Heart J.-
1991.-Vol. 65.-P. 41-45.
10. Fukazawa M., Fukushige J., Ueda K. Atrial septal defects in neonates with refer-
ence to spontaneous closure // Am. Heart J.- 1988.- Vol. 116.- P. 123-127.
11. Radzik D., Davignon A., van Doesburg N. et al. Predictive factors for spontaneous
closure of atrial septal defects diagnosed in the first 3 months of life // J. Am. Coll.
Cardiol.- 1993.- Vol. 22.- P. 851-853.
12. Gisla R.P., Hannon D.W., Meyer R.A., Kaplan S. Spontaneous closure of isolated
secundum atrial septal defects in infants: an echocardiographic study // Am. Heart
J.- 1985.- Vol. 109.- P. 1327-1333.
13. Cockerham J.T., Martin T.C., Gutierrez F.R. et al. Spontaneous closure of secun-
dum atrial septal defect in infants and young children // Am. J. Cardiol.- 1983.-
Vol. 52.- P. 1267-1271.
14. Hagen P.T., Scholz D.G., Edwards W.D. Incidence and size of patent foramen ovale
during the first 10 decades of life: an autopsy study of 965 normal hearts // Mayo
Clin. Proc.- 1984.- Vol. 59.- P. 17-20.
15. Morishita Y., Yamashita M., Yamada K. et al. Cyanosis in atrial septal defect due to
persistent eustashian valve // Ann. Thorac. Surg.- 1985.- Vol. 40.- P. 614-616.
16. Rhee E.K., Evangelista J.K., Nigrin D.J., Erikson L.C. Impact of anatomic closure
on somatic growth among small, asymptomatic children with secundum atrial septal
defect // Am. J. Cardiol.- 2000.- Vol. 85.- P. 1472-1475.
17. Iyer R.S., Hoschtitzky A., Jacobs J. et al. Closure of isolated secundum atrial septal
defects in infancy // Asian Cardiovasc. Thorac. Ann.- 2000.-Vol. 8.- P. 38-40.
18. Alp N., Clarke N., Banning A. How should patients with foramen ovale be man-
aged? // Heart.- 2001.- Vol. 85.- P. 242-244.
19. Алехин M.H., Седов В.П. Допплер-эхокардиография - М.: 1996.
20. Фейгенбау.м X. Эхокардиография Пер. с англ. / Под ред. Митькова В.В.- М.: Ви-
дар, 1999.
21. Shaheen J., Alper L., Rosenmann D. et al. Effect of surgical repair of secundum-
type atrial septal defect on right atrial, right ventricular, and left ventricular volumes
in adults // Am.J.Cardiol.- 2000.-VoL 86.-P. 1395-1397.
22. Ward C. Secundum atrial septal defect: routine surgical treatment is not of proven
benefit // Brit. Heart J.- 1994,- Vol. 71.- P. 219-223.
133
23. Эндоваскулярная и минимально инвазивная хирургия сердца и сосудов у де-
тей. / Под ред. Бокерия Л.А., Алекяна Б.Г., Подзолкова В.П.- М.: Изд-во НЦССХ
им. А.Н. Бакулева РАМН, 1999.
24. Yoshimura N., Yamaguchi М., Oshima Y. et al. Repair of atrial septal defect through
riht posterolateral thoracotomy: a cosmetic approach for female patients // Ann.
Thorac. Surg.- 2001.-Vol. 72.-P. 2103-2105.
25. TorraccaL., Ismeno G., Alfieri O. Totally endoscopic computer-enhanced atrial septal
defect closure in six patients // Ann. Thorac. Surg.- 2001.-Vol. 72.-P. 1354-1357.
26. Bichell D.P., Geva T, Bacha E.a. et al. Minimal access approach for the repair of
atrial septal defect: the initial 135 patients//Ann. Thorac. Surg.- 2000.-Vol. 70.-
P. 115-118.
27. Ewert P, Berger F, Daehnert I. et al. Transcatheter closure of atrial septal defects
without fluoroscopy. Feasibility of a new method // Circulation.- 2000.-Vol. 101.-
P. 847.
28. Garcia E., Maroto E., Moreno R. et al. Percutaneous closure of atrial septal defect
under intracardiac ultrasound guidance: comparison with procedures guided by trans-
esophageal echocardiography//Am. Coll. Cardiol.-2002.-Vol. 39.- Suppl., P. 405A.
29. Ewert P, Berger F, Vogel M. et al. Morphology of perforated atrial septal aneurysm
suitable for closure by transcatheter device placement // Heart.- 2000.-Vol. 84.-
P. 327-331.
30. Du Z.-D., Cao Q.-L., Koenig P. et al. Speed of normalization of right ventricular
volume overload after transcatheter closure of atrial septal defect in children and
adults // Am. J. Cardiol. - 2001.- Vol. 88.- P. 1450-1453.
31. Durongpisitkul K., SoongswangJ., Laohaprasitiporn D. et al. Comparison of atrial
septal defect closure using Amplatzer septal occluder with surgery // Pediatr. Car-
diol.- 2002.- Vol. 23.- P. 36-40.
32. Brochu M-С., Baril J.-F., Dore A. et al. Improvement in exercise capacity in asymp-
tomatic and midly symptomatic adults after atrial septal defect percutaneous closure
// Circulation.-2002.-Vol. 106.- P. 1821.
33. Herlong J.R., Jaggers J.J., Ungerleider R.M. Congenital heart surgery nomencla-
ture and database project: Pulmonary venous anomalies // Ann. Thorac. Surg.- 2000.-
Vol. 69.- P. S56-S69.
34. Darling R.C., Rothney W.B., Craig J.M. Total pulmonary venous drainage into the
right side of the heart: report of 17 autopsied cases not associated with other major
cardiovascular anomalies // Lab. Invest.- 1957,- Vol. 6.- P. 44-64.
35. Ricci M., Elliot M., Cohen G.A. et al. Management of pulmonary venous obstruc-
tion after correction of TAPVC: risk factors for adverse outcome /7 Eur. J. Cardio-
Thorac. Surg.- 2003,- Vol. 24.- P. 28-36.
36. KrahillK.A., Lucas R. V. Abnormal pulmonary venous connections. // Emmanoulides
G.C., Rimenschneider T.A., Allen H.D., cds. Heart disease in infants, children, and
adolescents including the fetus and young adult. - Baltimore: Williams and Wilkins,
1995,- P. 838-874.
134
Глава 9. ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ
ПЕРЕГОРОДКИ
Дефект межжелудочковой перегородки представляет собой врож-
денный порок ее развития, в результате чего возникает сообщение ме-
жду правым и левым желудочками. При изолированном дефекте меж-
желудочковой перегородки остальные отделы сердца развиты нормаль-
но, а все сегменты соединены конкордантно.
Частота. Дефект межжелудочковой перегородки (ДМЖП) явля-
ется самой распространенной врожденной аномалией сердца, сравни-
тельно легко диагностируемой с помощью традиционных методов ис-
следования. Однако истинная частота его встречаемости, как ни стран-
но, неизвестна. Так, введение эхокардиографической методики суще-
ственно увеличило частоту диагностики ДМЖП среди живорожден-
ных (с 1,35—4,0/1000 до 3,6-6,5/1000) [1]. Дальнейший рост частоты
выявления ДМЖП среди «здоровых» новорожденных был связан с по-
явлением цветного допплеровского сканирования, которое позволило
обнаруживать маленькие дефекты [1, 2]. Вероятно, широкое внедре-
ние пренатальной эхокардиографии также повлияет на эти показатели.
В среднем, среди всех врожденных пороков сердца ДМЖП встречает-
ся в 20-41% случаев (в зависимости от критериев его «изолированно-
сти»), среди критических пороков - у 18-20% больных.
Анатомия. Дефект может располагаться в любой зоне межжелу-
дочковой перегородки. Сама перегородка состоит из двух основных
компонентов: небольшого мембранозного и остального мышечного. По-
следний, в свою очередь, имеет три части: приточную, трабекулярную,
отточную (инфундибулярную) (рис. 9-1).
В трабекулярной области выделяют такие отделы, как централь-
ный, краевой, верхушечный. В соответствии с этим ДМЖП может быть
перимембранозным, приточным, отточным, центральным мышечным,
краевым, верхушечным и т.д.
Предложенные многочисленные классификации дефектов основа-
ны в основном на их анатомических характеристиках; наиболее извест-
ные из них - классификация Anderson R. и Van Praagh. В 2000 г. Jacobs
J.P. et al. [3] для унификации терминологии и возможности сравнения
данных различных клиник предложили следующую номенклатуру
(рис. 9-2).
Тип 1. ДМЖП, расположенный ниже полулунных клапанов в вы-
водном отделе перегородки (синонимы, субартериальный, супракри-
стальный, кональный, инфундибулярный) - 5-7% всех дефектов (до
30% в странах Востока).
135
4
Рис. 9-1. Части межжелудочковой перегородки (вид со стороны
правого желудочка): 1 - мембранозная, 2 - приточная, 3 - трабекулярная,
4 - отточная.
Рис. 9-2. Основные типы дефектов межжелудочковой перегородки.
Объяснения в тексте.
Тип 2. ДМЖП, расположенный в мембранозной части перегород-
ки и ограниченный атриовентрикулярным клапаном (синонимы’, пери-
мембранозный, парамембранозный, коновентрикулярный) - до 70%
всех дефектов. Так как сама мембранозная перегородка небольшая, де-
фект обычно захватывает некоторое количество прилегающей мышеч-
ной ткани.
136
Тип. 3. ДМЖП, расположенный в приточной части межжелудоч-
ковой перегородки сразу ниже клапана (синонимы', приточный, дефект
типа атриовентрикулярного канала) - 5-8% всех дефектов. В сравне-
нии с перимембранозным дефектом он находится кзади и ниже, под
септальной створкой трикуспидального клапана.
Тип 4. ДМЖП, полностью окруженный мышечной тканью (сино-
нимы'. мышечный) - 5-20% всех дефектов.
Тип Gerbode. Редкий вариант ДМЖП, представляющий сообще-
ние между левым желудочком и правым предсердием в мембранозной
части перегородки (синонимы', фистула между левым желудочком и пра-
вым предсердием).
При необходимости возможно более подробное описание анато-
мии дефекта. Однако авторы считают, что все их разнообразие вполне
укладывается в приведенные типы.
Дефекты могут быть единичными или множественными. Крайней
степенью проявления множественных мышечных дефектов является
перегородка в виде «швейцарского сыра».
Конфигурация и размеры дефектов чрезвычайно многообразны. Они
могут быть круглой или эллипсовидной формы, с фиброзно-измененны-
ми или мягкими краями. Размер ДМЖП, помимо абсолютной величи-
ны, необходимо оценивать в сопоставлении с диаметром аортального
клапана: большой дефект равен или превышает его диаметр, средний -
примерно равен половине диаметра аорты, маленький составляет 1-3
миллиметра. Соответственно этому сформировались и эхокардиографи-
ческие критерии: большой ДМЖП равен или больше диаметра аорталь-
ного отверстия, маленький - виден только в некоторые периоды сердеч-
ного цикла, все остальные дефекты - средних размеров [1].
У 60% больных кроме ДМЖП обычно имеются сопутствующие ано-
малии сердца: ДМПП, ОАП, коарктация аорты, стеноз легочного или
аортального клапана, аортальная недостаточность. Последняя патоло-
гия наиболее часто сочетается с инфундибулярным дефектом (пролапс
аортального клапана - 21%, недостаточность - 16,7%) в отличие от пе-
римембранозного дефекта (пролапс - 10,6%, недостаточность - 6,8%)
[4]. Различен и генез аортальной недостаточности. При инфундибуляр-
ном дефекте отсутствует поддержка аортальных створок в области пе-
регородки, при перимембранозном - имеется дефект формирования ко-
миссуры между некоронарной и правой коронарной створками в соче-
тании с деформацией самих створок [5]. Данная патология сопровожда-
ется пролабированием правой коронарной створки в отверстие межже-
лудочкового дефекта, что может ограничивать сброс через него.
137
Механизм формирования ДМЖП не совсем ясен. Считается, что
перимембранозный дефект возникает из-за нарушенного слияния от-
делов сердца вследствие транзиторного нарушения кровообращения в
развивающейся перегородке; мышечные дефекты - следствие гибели
клеток в перегородке. В связи с этим некоторые авторы предлагают
рассматривать маленькие мышечные дефекты как маркеры нераспо-
знанного внутриутробного стресса [2].
В то же время не удается прямо связать возникновение порока с
какими-либо известными факторами риска (возраст родителей, диа-
бет, курение, инфекция, лекарственное воздействие). Слабая корреля-
ция выявлена также с генетическими нарушениями. Тем не менее, в
семьях с ВПС ДМЖП обнаруживают в три раза чаще, чем в целом в
популяции; делеция хромосомы 22ql 1 встречается у 10% больных с
дефектами 1-2 типов (субартериальными или коновентрикулярными)
[6]. У этих пациентов также чаще отмечают аномалии дуги аорты, со-
судистое кольцо, нарушения формирования легочных артерий.
Интересно, что частота ДМЖП меньше среди детей, родившихся
в летние месяцы [2].
Гемодинамика. Во внутриутробном периоде ДМЖП не оказыва-
ет влияния на гемодинамику и развитие плода. После рождения ребен-
ка направление сброса и его величина определяются размером ДМЖП
и разницей давления между левым и правым желудочками. Последняя
зависит от соотношения общего легочного и общего периферического
сопротивлений, растяжимости желудочков, венозного возврата в них.
В связи с этим при прочих равных условиях можно выделить три фазы
развития заболевания.
1. У новорожденных с высоким ОЛС и «жестким» правым желу-
дочком сброс крови слева направо может отсутствовать или быть пе-
рекрестным. Объемная нагрузка на левый желудочек повышена незна-
чительно. Размеры сердца в пределах возрастных колебаний.
2. После обычного эволюционного снижения ОЛС оно становит-
ся в несколько раз ниже ОПС. Это приводит к нарастанию лево-право-
го сброса и объемного кровотока через малый круг кровообращения
{гиперволемия малого круга кровообращения). При этом кровь, проте-
кающая через легкие, делится на неэффективную и эффективную час-
ти. Эффективную часть легочного кровотока представляет кровь, по-
падающая из легких в левые отделы сердца и далее в системные сосу-
ды. Кровь, поступающая из легких в левые отделы и затем вновь в
легкие - неэффективная доля кровотока. В связи с повышенным воз-
вратом крови в левые отделы развивается объемная перегрузка левого
138
предсердия и левого желудочка. В случаях большого шунта появляет-
ся также умеренная систолическая перегрузка правого желудочка. Раз-
меры сердца увеличиваются. Если нарастает перераспределение кро-
вотока в пользу неэффективного легочного и становится невозможным
обеспечить потребности периферических органов и тканей, возникает
сердечная недостаточность. Давление в легочных сосудах в это период
зависит от объема шунта и обычно определяется тем или иным уров-
нем их компенсаторного спазма («сбросовая» гипертензия).
3. При длительно существующем пороке формируется склероти-
ческая фаза легочной гипертензии, связанная с морфологическими из-
менениями в стенке легочных артериол. Это приводит к редукции со-
судистого русла, существенному возрастанию общего легочного сопро-
тивления. Давление в правом желудочке повышается и может стать
больше, чем в левом. Соответственно и сброс крови слева направо
постепенно уменьшается, становится перекрестным, а затем и право-
левым. Уменьшаются возврат в левое сердце, объемная перегрузка ле-
вого и правого желудочков. Однако возрастает нагрузка давлением на
правый желудочек и развивается артериальная гипоксемия. Размеры
сердца уменьшаются, гипертрофия правого желудочка возрастает.
Большие дефекты не создают препятствия сбросу крови, который
происходит как в систолу, так и, в меньшей степени, в диастолу. При
этом давление из левого желудочка передается непосредственно в пра-
вый желудочек и в легочную артерию, градиент между ними в течение
систолы фактически отсутствует. При малых дефектах сброс неболь-
шой, однако происходит на протяжении всей систолы в связи со значи-
тельным градиентом давления между желудочками.
Естественное течение. Во внутриутробном периоде ДМЖП не
оказывает влияния на кровообращение плода. Кроме того, часть де-
фектов, диагностированных внутриутробно, может закрыться к момен-
ту рождения. Однако детально этот процесс не изучен. В постнаталь-
ном периоде при небольших дефектах течение благоприятное, совмес-
тимое с длительной активной жизнью. Однако имеется риск развития
бактериального эндокардита, в связи с чем при дентальных или мик-
рохирургических процедурах необходима антибиотикотерапия.
Большие ДМЖП могут привести к гибели ребенка в первые меся-
цы жизни. Критические состояния в этой группе развиваются у 18-20%
больных. Однако в настоящее время летальность на первом году жизни
не превышает 9%. В последующие два года погибает еще около 2% боль-
ных [7]. В период от трех до 15 лет кривая выживаемости стабилизиру-
ется. Последующие осложнения и смерти связаны в основном с разви-
тием высокой легочной гипертензии у нелеченых больных [8].
139
Спонтанное закрытие ДМЖП встречается достаточно часто (в 45-
78% случаев), однако точная вероятность данного события не
определена. Это связано с различными характеристиками дефектов,
включаемых в исследование. Известно, что большие дефекты, соче-
тающиеся с синдромом Дауна или проявляющиеся значительной сер-
дечной недостаточностью, редко закрываются самостоятельно. Малень-
кие и мышечные ДМЖП спонтанно исчезают чаще. Более 40% отвер-
стий закрываются на первом году жизни, однако этот процесс может
продолжаться и до 10 лет [9]. К сожалению, невозможно предсказать
течение дефекта в каждом конкретном случае. Известно только, что в
сроки до 6 лет перимембранозные дефекты имеют худший прогноз,
закрываются спонтанно только в 29% случаев, а в 39% нуждаются в
операции [1]. Соответствующие показатели для мышечных ДМЖП со-
ставляют 69% и 3% (рис. 9-3).
Представляет интерес работа Ito Т. et al. [10], обнаруживших, что
у грудных детей некоторые ДМЖП с большим сбросом, влияющим на
развитие ребенка, могут даже увеличиваться в размерах, делая опера-
цию неизбежной. Механизмы данного явления неясны; одним из них
может быть усиленный возврат легочной крови, приводящий к растя-
жению полостей сердца и перегородки.
Рис. 9-3. Эхокардиограмма из верхушечной нестандартной позиции.
Лоцируется локальное аневризматическое выпячивание межжелудочковой
перегородки в верхушечной части, обусловленное закрывшимся мышечным
дефектом перегородки; отмечается повышение трабекулярности миокарда
межжелудочковой перегородки.
Клиническая симптоматика. Наиболее характерным и ранним
симптомом порока является голосистолический или ранний систоли-
140
ческий шум различной интенсивности у левого нижнего края груди-
ны. Остальные симптомы менее постоянны. Следует отметить, что на
первом месяце жизни шум может полностью отсутствовать в связи с
высокой резистентностью легочных сосудов и отсутствием сброса кро-
ви через дефект.
По мере развития большого сброса можно заметить формирова-
ние сердечного горба. Второй тон на легочной артерии становится уси-
ленным и расщепленным. Выслушивается мезодиастолический шум
на верхушке, связанный со стенозирующим характером митрального
отверстия относительно увеличенного объема крови, возвращающей-
ся из легких в левое предсердие.
В целом клиническая картина определяется величиной и направ-
лением сброса крови через дефект. При маленьких дефектах (болезнь
Толочинова-Роже) пациенты кроме шума практически не имеют сим-
птомов, нормально развиваются и растут. Дефекты с большим сбро-
сом слева направо обычно проявляются клинически с 4-8 недель, со-
провождаются задержкой роста и развития, повторными респиратор-
ными инфекциями, снижением толерантности к физической нагрузке,
сердечной недостаточностью со всеми классическими симптомами -
потливостью, учащенным дыханием (в том числе с участием мышц
живота), тахикардией, застойными хрипами в легких, гепатомегалией,
отечным синдромом.
Легочная гипертензия при ДМЖП обычно развивается со второго
полугодия жизни. Однако критическая ее степень, приводящая к об-
ратному сбросу, достигается в большинстве случаев не ранее подрост-
кового возраста. В то же время повышение среднего легочного давле-
ния более 20 мм рт. ст. уже является плохим прогностическим призна-
ком, сочетающимся с повышенной летальностью при естественном те-
чении порока [8]. Поэтому задачей кардиолога является раннее выяв-
ление признаков легочной гипертензии. К сожалению, ни одно неин-
вазивное исследование не дает полноценного ответа на вопрос о дос-
тижении опасной границы. В связи с этим целесообразно использо-
вать комплексную оценку четырех параметров, предложенных Liber-
man L. et al [11]. Их факторы риска включают: 1) признаки правожелу-
дочковой гипертрофии (по ЭКГ и ЭХОКГ); 2) эхокардиографические
данные о наличии большого ДМЖП; 3) выравнивание кривизны меж-
желудочковой перегородки в систолу; 4) систолический градиент дав-
ления между желудочками более 35 мм рт. ст. Как оказалось, электро-
кардиографические изменения или каждый по отдельности эхокардио-
графический признак не коррелировали с повышением легочного дав-
ления. Однако присутствие трех и более параметров у больного сви-
141
детельствовало о наличии легочной гипертензии. Наиболее ранним и
чувствительным признаком оказался межжелудочковый градиент дав-
ления, наименее важным - размер дефекта.
По мере прогрессирования легочной гипертензии клиническая сим-
птоматика меняется - уменьшаются систолический шум и признаки
сердечной недостаточности (псевдозакрытие дефекта). Однако при этом
развивается цианоз и снижается физическая активность; формируют-
ся пальцы в виде «барабанных палочек» с «часовыми стеклами».
Электрокардиография. Изменения ЭКГ отражают степень пере-
грузки левого или правого желудочка. При «сбросовых» дефектах до-
минирует гипертрофия левого желудочка и левого предсердия. По ме-
ре нарастания легочной гипертензии электрическая ось сердца смеща-
ется вправо, нарастает гипертрофия правого желудочка. Нарушения рит-
ма или проводимости возможны, но не характерны.
Рентгенография грудной клетки. Степень кардиомегалии и вы-
раженности легочного рисунка прямо зависит от величины шунта. Уве-
личение тени сердца связано в основном с левым желудочком и левым
предсердием, в меньшей степени - с правым желудочком. Заметные
изменения легочного рисунка наступают при соотношении легочного
и системного кровотока 2:1 и более (рис. 9-4).
Характерным для детей первых 1,5-3 месяцев жизни с большими
дефектами является нарастание в динамике степени легочной гипер-
волемии. Это связано с физиологическим снижением ОЛС и увеличе-
нием сброса слева направо.
Рис. 9-4. Рентгенограмма больного с дефектом межжелудочковой
перегородки. Усиление легочного рисунка по артериальному типу, расширение
тени сердца.
142
При обструктивном поражении легочных сосудов типично выбу-
хание легочного ствола и корней легких; периферический рисунок ста-
новится обедненным, а размеры сердца уменьшаются (вплоть до нор-
мальных). Следует дифференцировать эти изменения с истинной нор-
мализацией рентгенологической картины, которая наступает только при
спонтанном закрытии или после хирургической коррекции дефекта.
Эхокардиография. Двухмерная эхокардиография является веду-
щим методом диагностики ДМЖП. Основным диагностическим при-
знаком является непосредственная визуализация дефекта. Для иссле-
дования различных отделов перегородки необходимо использовать ска-
нирование сердца в нескольких сечениях, по продольной и короткой
осям. При этом определяют размер, локализацию и количество дефек-
тов. Установить сброс и его направление можно с помощью спектраль-
ного и цветного допплеровского картирования (рис. 9-5 на цветной
вкладке). Последняя методика чрезвычайно полезна для визуализации
небольших дефектов, в том числе в мышечной части перегородки
(рис. 9-6 на цветной вкладке).
После выявления порока анализируют степень дилатации и гипер-
трофии различных отделов сердца, определяют давление в правом же-
лудочке и легочной артерии. В последнее время делаются попытки с
помощью трехмерной реконструкции потока крови через ДМЖП ко-
личественно характеризовать величину сброса [12]. При этом получе-
на высокая корреляция между измеряемыми показателями и данными
катетеризации (г = 0,97; /?<0,001).
При наличии дефектов 1 или 2 типов (субартериальный или мем-
бранозный) необходимо также провести оценку состояния аортально-
го клапана, так как вероятны его пролапс или недостаточность.
Катетеризация сердца и ангиокардиография. При простых
ДМЖП данное исследование потеряло свое значение. К нему прибега-
ют в основном для более точной характеристики состояния малого круга
кровообращения у пациентов с высокой легочной гипертензией или
при наличии сопутствующей патологии, плохо выявляемой с помощью
ЭХОКГ.
Лечение. Тактика лечения определяется гемодинамической зна-
чимостью дефекта и известным для него прогнозом. Учитывая высо-
кую вероятность спонтанного закрытия дефектов (40% на первом году
жизни) или их уменьшения в размерах, у пациентов с сердечной не-
достаточностью целесообразно сначала прибегнуть к терапии диуре-
тиками и дигоксином. Возможно также использование ингибиторов
синтеза АПФ, облегчающих антеградный кровоток из левого желудочка
и тем самым уменьшающих сброс через ДМЖП [13]. Параллельно
143
проводят коррекцию сопутствующих заболеваний (анемия, гипотро-
фия, инфекционные процессы). Необходимо также обеспечить энерге-
тически адекватное питание (см. главу 5).
Для детей, поддающихся терапии, возможна отложенная операция.
Дети с маленькими ДМЖП, достигшие 6 месяцев без признаков сердеч-
ной недостаточности, легочной гипертензии или задержки развития,
обычно не являются кандидатами на операцию. Коррекция порока, как
правило, не показана при соотношении Qp/Qs менее чем 1,5:1 [14].
Показаниями к хирургическому вмешательству служат сердечная
недостаточность и задержка физического развития у детей, не поддаю-
щихся терапии. В этих случаях к операции прибегают начиная с пер-
вого полугодия жизни. У детей старше одного года хирургическое вме-
шательство показано при соотношении легочного и системного крово-
токов (Qp/Qs) более чем 2:1. При признаках развития легочной гипер-
тензии операцию необходимо выполнить до двухлетнего возраста. В
старшем возрасте для уточнения показаний к коррекции порока обыч-
но выполняют катетеризацию сердца. Соотношение сопротивлений ле-
гочного и системного русла > 0,5 или наличие обратного сброса кро-
ви ставят возможность операции под сомнение.
Оперативные вмешательства подразделяются на паллиативные и
радикальные. В настоящее время к суживанию легочной артерии для
ограничения легочного кровотока прибегают только при наличии со-
путствующих пороков и аномалий, затрудняющих коррекцию ДМЖП.
Операцией выбора является закрытие дефекта в условиях искусствен-
ного кровообращения. При современной технике выполнения опера-
ции хирург использует доступ к дефекту через правое предсердие или—
легочный ствол, не вскрывая правый желудочек. При этом нередко при-
бегают к минимально инвазивной технике, обеспечивающей меньшую
травму, укорочение сроков лечения и хороший косметический резуль-
тат. Госпитальная летальность не превышает 2-5%. Риск операции воз-
растает у детей в возрасте до 3 мес, при наличии множественных
ДМЖП или сопутствующих серьезных аномалий развития (пораже-
ния ЦНС, легких, почек, генетические заболевания и т.п.).
В последние годы популярной становится методика чрескатетер-
ного закрытия ДМЖП с помощью окклюдера Amplatzer [15, 16]. Наи-
более пригодны для выполнения процедуры приточные мышечные де-
фекты, однако возможно закрытие и перимембранозных отверстий. Ос-
новным показанием для процедуры является наличие множественных
мышечных дефектов, когда операция технически трудна. Эффектив-
ность вмешательства составляет около 87%, однако окончательные вы-
воды о роли таких процедур в лечении ДМЖП можно будет сделать
только при накоплении большого количества наблюдений.
144
Литература
1. Turner S. W., Hunter S., Wyllie J.P. The natural history of ventricular septal defects /
/Arch. Dis. Child.- 1999.- Vol. 81.- P. 413-416.
2. Sands A.J., Casey F.A., Craig B.G. et al. Incidence and risk factors for ventricular
septal defect in “low risk” neonates // Arch. Dis. Child Fetal Neonatal Ed.- 1999.-
Vol. 81.- P. F61-F63.
3. Jacobs J.P, Burke R.P., Quintessenza J.A., Mavroudis C. Congenital heart surgery
nomenclature and database project: Ventricular septal defect // Ann. Thorac. Surg.-
2000.- Vol. 69.- P. S25- S35.
4. Troglu A.G., Oztunc F, Saltic L. et al. Aortic valve prolapse and aortic regurgitation
in patients with ventricular septal defect // Pediatr. Cardiol.- 2002.- Vol. 24.- P. 36-39.
5. Graham T.P., Kavanaugh-McHugh A. Ventricular septal defect and aortic regurgita-
tion // Progr. Pediatr. Cardiol.- 2001.- Vol. 14.- P. 163-173.
6. McElhinney D.B., Driscoll D.A., Levin E.R. et al. Chromosome 22q 11 deletion in
patients with ventricular septal defect: frequency and associated cardiovascular
anomalies // Pediatrics.- 2003.- Vol. 112.- P. e472-e476.
7. Samanek M., Voriskova M. Congenital Heart disease among 815.569 children born
between 1980 and 1990 and their 15-year survival: A prospective Bohemia survival
study // Pediatr. Cardiol.- 1999.-Vol. 20.- P. 411-417.
8. Kidd L., Driscoll D.J., Gersony W.M. etal. Second natural history study of congeni-
tal heart defects. Results of treatment of patients with ventricular septal defect //
Circulation.- 1993.- Vol. 87 (Suppl I).- P. 1-38 - 1-51.
9. Krovetz L.J. Spontaneous closure of ventricular septal defect // Am. J. Cardiol.-
1998.- Vol. 81.- P. 100-101.
10. Ito T, Okubo T, Kimura M. et al. Increase in diameter of ventricular septal defect
and membranous septal aneurysm formation during the infantile period // Pediatr.Car-
diol.- 2001.- Vol. 22.- P. 491-493.
11. Liberman L., Kaufman S., Alfayyadh M. et al. Noninvasive prediction of pulmonary
artery pressure in patients with isolated ventricular septal defect // Pediatr. Cardiol.-
2000.- Vol. 21.- P. 197-201.
12. Ishii M., Hashino K, Eto G. et al. Quantitative assessment of severity of ventricular
septal defect by three-dimensional reconstruction of color Doppler-imaged vena con-
tracta and flow convergence region // Circulation.- 2001.- Vol. 103.- P. 664-669.
13. Montigny M., Davignon A., Fouron J.C. et al. Captopril in infants for congestive
heart failure secondary to a large ventricular left-to-right shunt // Am. J. Cardiol.-
1989.- Vol. 63.- P. 631-633.
14. Gabriel H.M., Heger M., Innerhofer P. et al. Long-term outcome of patients with
ventricular septal defect considered not to require surgical closure during childhood
// J. Am. Coll. Cardiol.- 2002.- Vol. 39.- P. 1066-1071.
15. Holzer R., Batzer D., Cao Q.-L. et al. Device closure of muscular ventricular septal
defects using the Amplatzer muscular ventricular septal defect occluder//J. Am. Coll.
Cardiol.- 2004.- Vol. 43.- P. 1257-1263.
16. Thanopoulos B.D., Tsaousis G.S., Karanasios E. et al. Transcatheter closure of pe-
rimembranous ventricular septal defects with the Amplatzer asymmetric ventricular
septal defect occluder: Preliminary experience in children // Heart.- 2003.- Vol. 89.-
P. 918-922.
145
Глава 10. ОТКРЫТЫЙ АТРИОВЕНТРИКУЛЯРНЫЙ
КАНАЛ
Открытый атриовентрикулярный канал (АВК) характеризуется не-
доразвитием перегородок, прилежащих к атриовентрикулярным кла-
панам, и аномалиями самих клапанов. Таким образом, в патологию вхо-
дят дефект задненижней части межпредсердной перегородки (первич-
ный дефект), дефект приточной части межжелудочковой перегородки
и дефекты формирования левого и правого атриовентрикулярного кла-
панов [1].
В зарубежной литературе приняты также термины «дефект атрио-
вентрикулярного канала», «дефект эндокардиальных подушек», «де-
фект атриовентрикулярной перегородки», «персистирующий общий ат-
риовентрикулярный канал», «атриовентрикулярная коммуникация». Все
они отражают один и тот же патологический комплекс.
Так как степень недоразвития структур может быть различной, су-
ществует целый спектр отклонений, из которого выделяют частичную
(неполную) форму, промежуточную и полную форму атриовентрику-
лярного канала (АВК).
Частота порока составляет 0,25/1000 живорожденных, около 4%
среди всех ВПС и 6% среди критических ВПС.
10.1. Частичная (неполная) форма
атриовентрикулярного канала
Порок включает первичный дефект межпредсердной перегородки
и нарушения развития атриовентрикулярных клапанов, приводящие к
их недостаточности различной степени. При этом имеются два разде-
ленных атриовентрикулярных кольца, ДМЖП отсутствует (рис. 10-1).
Анатомия. Патология характеризуется первичным межпредсерд-
ным дефектом, который может быть различных размеров, вплоть до
формирования общего предсердия. Атриовентрикулярные клапаны
сформированы на одном уровне (в норме трикуспидальный клапан сме-
щен к верхушке сердца) и прикрепляются к верхнему краю межжелу-
дочковой перегородки. Расщепление передней створки митрального
клапана может быть в виде небольшого краевого диастаза или дохо-
дить до ее основания [2]. От краев расщепления нередко отходят до-
полнительные хорды, крепящиеся к межжелудочковой перегородке; воз-
можны и аномалии папиллярных мышц. В редких случаях отмечают
также расщепление септальной створки трикуспидального клапана.
146
Рис. 10-1. Нормальное сердце (слева) и неполная форма атриовен-
трикулярного канала (схема).
При данном пороке имеется недоразвитие приточной части меж-
желудочковой перегородки и удлинение инфундибулярной перегород-
ки. Данные отклонения в сочетании с низким положением передней
створки митрального клапана приводят к характерному умеренному
сужению выводного отдела левого желудочка в виде «гусиной шеи»,
выявляемому при эхокардиографическом исследовании или ангиокар-
диографии.
Гемодинамика. Нарушения гемодинамики определяются регур-
гитацией на митральном клапане и шунтированием крови через де-
фект межпредсердной перегородки. В большинстве случаев имеется
большой сброс слева направо, гиперволемия малого круга кровообра-
щения и объемная перегрузка обоих желудочков. Высокая легочная ги-
пертензия, как правило, не развивается. Умеренная гипертензия может
быть следствием как постоянной гиперволемии, так и венозного за-
стоя при малых размерах ДМПП, приводящих к повышенному давле-
нию в левом предсердии.
Естественное течение. Во внутриутробном периоде порок имеет
небольшое гемодинамическое значение. Даже при выраженной регур-
гитации на митральном клапане потоки крови успешно перераспреде-
ляются между желудочками; легочная гиперволемия не возникает по
естественным причинам. После рождения прогноз определяется раз-
мерами ДМПП и степенью митральной недостаточности. В большин-
стве случаев пациенты доживают до зрелого возраста, сохраняя трудо-
способность. Однако при выраженных формах порока высока вероят-
ность развития осложнений (сердечная недостаточность, нарушения
ритма, бактериальный эндокардит), а продолжительность жизни со-
ставляет не более 20-30 лет.
147
Клиническая симптоматика. Клиническая симптоматика опре-
деляется в первую очередь степенью митральной недостаточности. При
ее небольшой величине порок протекает как простой ДМПП, но про-
является в более ранние сроки. При значительной регургитации на кла-
пане состояние пациентов может значительно ухудшиться уже вскоре
после рождения. Быстро развиваются симптомы сердечной недоста-
точности (одышка, тахикардия, увеличение печени, застойные хрипы
в легких), больные склонны к повторным респираторным заболевани-
ям, отстают в физическом развитии. При гемодинамике общего пред-
сердия клиническая картина может дополняться умеренным цианозом.
Второй тон на легочной артерии обычно расщеплен. На верхушке
и вдоль левого края грудины выслушивается систолический шум мит-
ральной недостаточности. Может быть самостоятельный шум изгна-
ния в легочную артерию во втором межреберье слева от грудины.
Электрокардиография. Электрокардиограмма имеет характерные
изменения. Аномалии проводящей системы при АВК определяют в
большинстве случаев отклонение электрической оси сердца влево. Осо-
бенно ценен данный симптом у новорожденных, для которых в норме
характерно наличие правограммы. Левограмма обычно сочетается с
признаками перегрузки правого желудочка, неполной блокадой пра-
вой ножки пучка Гиса. При значительной недостаточности митраль-
ного клапана начинают преобладать признаки перегрузки левого пред-
сердия и левого желудочка.
Рентгенография грудной клетки. Легочный рисунок варьирует;
характерно его усиление как по артериальному, так и венозному руслу.
Форма сердца различна. Выраженная митральная недостаточность со-
провождается увеличением левого предсердия и левого желудочка. При
ее небольшой степени чаще преобладают признаки увеличения право-
го предсердия.
Эхокардиография. Данное исследование является основным при
постановке диагноза. При сканировании сердца выявляется первич-
ный ДМПП различного размера (вплоть до полного отсутствия меж-
предсердной перегородки). Атриовентрикулярные клапаны располо-
жены на одном уровне, в отличие от нормы, когда трикуспидальный
клапан несколько смещен в сторону верхушки. Определяются расщеп-
ление передней створки митрального клапана и регургитация на нем.
Дополнительными признаками порока являются дилатация полостей
сердца, и сужение выводного тракта левого желудочка. Однако ДМЖП
выявить не удается (рис. 10-2).
Количественной оценке подлежат давление в правом желудочке и
легочной артерии и степень митральной недостаточности.
148
В некоторых случаях можно обнаружить двойное отверстие мит-
рального клапана или деформацию подклапанного аппарата.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание применяют только при подозрении на высокую легочную гипер-
тензию, сопровождающую порок, с целью оценки степени поражения
легочных сосудов.
Рис. 10-2. Эхокардиограмма из верхушечной четырехкамерной по-
зиции при частичной форме атриовентрикулярного канала. Визуализи-
руется большой первичный дефект межпредсердной перегородки; митральный и
трикуспидальный клапаны расположены на одном уровне; ДМЖП не выявляется.
Отмечается расширение всех полостей сердца, с преобладанием правых предсер-
дия и желудочка.
Лечение. Медикаментозное лечение направлено на купирование
признаков сердечной недостаточности и включает дигоксин, при не-
обходимости - мочегонные средства, ингибиторы АПФ. Может потре-
боваться терапия нарушений ритма или профилактика бактериального
эндокардита.
Так как спонтанного закрытия первичного дефекта не происхо-
дит, порок может быть устранен только оперативным путем. Показа-
ния к хирургической коррекции расширяются по мере развития дет-
ской кардиохирургии. В настоящее время считают, что плановое вме-
шательство показано в возрасте 1-2 лет, при выраженной митральной
149
недостаточности или общем предсердии - раньше. Коррекция заклю-
чается в пластике дефекта межпредсердной перегородки и реконструк-
ции расщепленных створок митрального и трикуспидального клапа-
нов. Риск операции повышается у больных с сердечной недостаточно-
стью, цианозом, грубыми изменениями митрального клапана.
10.2. Полная форма атриовентрикулярного канала
Порок включает первичный дефект межпредсердной перегород-
ки, нерестриктивный (не оказывающий сопротивления перетоку кро-
ви) дефект межжелудочковой перегородки сразу под атриовентрику-
лярными клапанами и общее кольцо атриовентрикулярных клапанов
(рис. 10-3). Примерно у 50% больных имеется синдром Дауна.
Рис. 10-3. Нормальное сердце (слева) и полная форма атриовен-
трикулярного канала (схема).
Анатомия. При данном пороке возможно сообщение между собой
всех четырех камер сердца, так как предсердия соединяются с желудоч-
ками общим отверстием. Общий клапан в большинстве случаев имеет
пять створок: переднюю мостовидную, заднюю мостовидную, правую
и левую муральные створки и правую передневерхнюю створку. В неко-
торых наблюдениях отверстие общего клапана открывается преимуще-
ственно в один желудочек, второй желудочек в таких вариантах бывает
гипоплазирован (доминантность левого или правого желудочков).
Папиллярные мышцы левого желудочка могут располагаться ано-
мально близко друг к другу или быть представлены единственной мыш-
цей, что затрудняет хирургическое лечение.
Сравнительно часто (до 10% случаев) полная форма АВК сочета-
ется с такими пороками, как ОАП, легочный стеноз, тетрада Фалло.
150
Гемодинамика. Гемодинамические изменения связаны с шунти-
рованием крови на уровне межпредсердной и межжелудочковой пере-
городок, и с недостаточностью атриовентрикулярных клапанов. В ре-
зультате порока возникает большой лево-правый сброс крови, которая
затем поступает в легочную артерию. Развивается объемная перегруз-
ка правых и левых отделов сердца. Давление в правом и левом желу-
дочках быстро становится равным, что приводит к раннему развитию
высокой легочной гипертензии. Наличие легочного стеноза ограничи-
вает легочный кровоток и уменьшает величину сброса слева направо.
Естественное течение. Полная форма АВК создает нагрузку на
сердце уже внутриутробно и может приводить к сердечной недоста-
точности и водянке плода. После рождения порок характеризуется так-
же тяжелым течением: в течение шести месяцев погибают до 27% боль-
ных, до конца первого года жизни - 40%. В течение последующих че-
тырех лет умирают еще 10%. Причинами смерти являются сердечная
недостаточность, высокая легочная гипертензия, аритмии. В единич-
ных случаях больные доживают до зрелого возраста, однако являются
тяжелыми инвалидами.
Легочная гипертензия достигает высокой степени уже к концу пер-
вого года жизни, а к концу второго возникают необратимые морфоло-
гические изменения в легочных сосудах. Особенно подвержены этим
изменениям больные с синдромом Дауна.
Клиническая симптоматика. Порок характеризуется тяжелым те-
чением вскоре после рождения ребенка. В качестве первых симптомов
отмечают быструю утомляемость при кормлении, потливость. Основ-
ное ухудшение-наступает к концу первого месяца, когда снижается ре-
зистентность легочных сосудов и нарастает легочный кровоток. В этот
период увеличиваются симптомы сердечной недостаточности (тахи-
кардия, одышка, застойные хрипы в легких, гепатомегалия). Дети от-
стают в развитии, нередки повторные респираторные заболевания и
пневмонии. При нагрузке может возникать цианоз, связанный с крат-
ковременным сбросом крови справа налево на уровне предсердий. Бо-
лее стойкий цианоз сопровождает варианты порока со стенозом легоч-
ной артерии. Как правило, рано формируется сердечный горб.
При пальпации грудной клетки определяется систолическое дро-
жание. Тоны сердца усилены, при высокой легочной гипертензии вто-
рой тон акцентирован. Вдоль левого края грудины выслушивается гру-
бый систолический шум дефекта межжелудочковой перегородки. На
верхушке - систолический шум митральной недостаточности, прово-
дящийся в подмышечную область. Однако он может быть перекрыт
шумом ДМЖП. В случае стеноза легочной артерии имеется систоли-
ческий шум изгнания во втором межреберье слева.
151
Электрокардиография. Изменения ЭКГ похожи на таковые при
неполной форме АВК. Наиболее характерно отклонение электрической
оси сердца влево в сочетании с выраженными перегрузками желудоч-
ков и левого предсердия (рис. 10-4).
Рис. 10-4. Электрокардиограмма больного с атриовентрикулярной
коммуникацией: патологическое отклонение электрической оси влево, признаки
перегрузки правого предсердия и правого желудочка.
Рентгенография грудной клетки. Легочный рисунок значитель-
но усилен по артериальному руслу, в меньшей степени - по венозному.
Могут проявляться признаки высокой легочной гипертензии. Тень серд-
ца обычно увеличена в размерах за счет всех камер. Легочный рисунок
нормален, а размеры сердца относительно невелики при сопутствую-
щем стенозе легочной артерии.
Эхокардиография. Данное исследование позволяет дать полную
морфологическую и гемодинамическую характеристику порока. Вы-
являются первичный дефект межпредсердной перегородки, приточный
дефект межжелудочковой перегородки, наличие общего атриовентри-
кулярного клапана (со створкой, пересекающей межжелудочковую пе-
регородку) (рис. 10-5).
Для хирургического лечения важна следующая информация: раз-
меры дефектов, размеры клапанных отверстий, анатомия створок кла-
панов, прикрепление хорд и состояние папиллярных мышц, относи-
тельные и абсолютные размеры желудочков.
152
К функциональным характеристикам порока относятся направле-
ние и величина сброса на уровне септальных дефектов, давление в пра-
вом желудочке и легочной артерии, а также величина митральной и
трикуспидальной регургитации.
Необходимо также исключить сопутствующую патологию сердца
- ОАП, тетраду Фалло.
Рис. 10-5. Эхокардиограмма при полной форме атриовентрикуляр-
ной коммуникации. А - верхушечная четырехкамерная позиция: большой пер-
вичный дефект межпредсердной перегородки; большой приточный дефект межже-
лудочковой перегородки; расширение и гипертрофия обоих желудочков. Б - пара-
стернальная позиция по короткой оси: расщепление створок митрального и трикус-
пидального клапанов с формированием единого атриовентрикулярного клапана.
Катетеризация сердца и ангиокардиография. В настоящее вре-
мя данное исследование потеряло свое значение и используется в ос-
новном для определения состояния легочного сосудистого русла в слу-
чаях высокой легочной гипертензии.
Лечение. Медикаментозное лечение направлено на купирование
признаков сердечной недостаточности и включает дигоксин, мочегон-
ные средства, ингибиторы АПФ. В большинстве случаев из-за инфекци-
онных легочных заболеваний проводится также антибиотикотерапия.
Так как при полной форме АВК быстро развиваются склеротиче-
ские изменения в легочных сосудах, показано раннее оперативное ле-
чение. У детей первых месяцев жизни, находящихся в тяжелом состоя-
нии, у которых риск операции с искусственным кровообращением вы-
сок, нередко выполняют сужение легочной артерии [3]. Однако данная
операция сопровождается высокой летальностью и ненадолго откла-
дывает радикальное вмешательство. Поэтому в большинстве случаев
прибегают к первичной радикальной коррекции порока, которая заклю-
чается в закрытии с помощью заплат межпредсердного и межжелудоч-
153
кового дефектов, а также пластике атриовентрикулярных клапанов. При
необходимости сопутствующий легочный стеноз устраняется с помо-
щью вальвулопластики или вшивания заплаты в выводной отдел пра-
вого желудочка.
У больных с выраженной доминантностью одного из желудочков
выполняют операцию типа операции Фонтена.
10.3. Промежуточная форма атриовентрикулярного
канала
Данная патология представляет середину спектра и включает со-
четание неполной формы АВК (раздельно сформированные атриовен-
трикулярные клапаны) с дефектом межжелудочковой перегородки
(обычно рестриктивным), расположенным под клапанами [1]. Клини-
ческая симптоматика, течение порока и лечение определяются преоб-
ладанием гемодинамических нарушений, связанных с септальными де-
фектами или патологией клапанов, и похожи на описанные выше.
Некоторые авторы включают в эту группу и так называемый косой
канал или левожелудочково-правопредсердное сообщение [2]. Однако
другие относят его к одному из вариантов ДМЖП (дефект Гербоде).
Так как патология имеет некоторые особенности, мы приводим более
подробные ее характеристики.
Анатомия. В связи с тем, что трикуспидальный клапан в норме
расположен ниже уровня митрального, имеется часть мембранозной
перегородки (атриовентрикулярная перегородка), которая отделяет пра-
вое предсердие от левого желудочка (рис. 10-6).
Рис. 10-6. Схема взаимоотношений мембранозной перегородки с
атриовентрикулярными клапанами и локализация левожелудочково-
правопредсердных сообщений. Зона атриовентрикулярной перегородки указана
пунктиром. ТК - трикуспидальный клапан, МК - митральный клапан.
154
В связи с этим возможно возникновение двух типов косого кана-
ла: надклапанного и подклапанного. Последний всегда сочетается с
отверстием в септальной створке трикуспидального клапана.
Гемодинамика. Нарушения гемодинамики при косом канале свя-
заны со сбросом крови из левого желудочка в правое предсердие. Ос-
новной объемной нагрузке подвергаются правое предсердие и правый
желудочек. Это сопровождается легочной гиперволемией; высокая ле-
гочная гипертензия, как правило, не развивается.
Клиническая симптоматика. Клиническая симптоматика напо-
минает таковую при изолированном большом ДМПП, однако сопрово-
ждается шумом ДМЖП, эпицентр которого смещен в правую сторону
от грудины. В некоторых случаях могут преобладать частые респира-
торные инфекции, снижение толерантности к физической нагрузке.
Проявления сердечной недостаточности умеренные.
Электрокардиография. В отличие от других форм АВК левограм-
ма не является типичным признаком порока. Более частым и характер-
ным симптомом является перегрузка правого предсердия. Имеются так-
же признаки гипертрофии правого и левого желудочков.
Рентгенография грудной клетки. Определяется умеренное уси-
ление легочного рисунка по артериальному типу. Тень сердца увеличе-
на за счет правого предсердия и обоих желудочков.
Эхокардиография. Данное исследование позволяет выявить сеп-
тальный дефект, через который осуществляется сброс крови в правое
предсердие. Дополнительно может быть выявлено расщепление створ-
ки трикуспидального клапана.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание в последнее время потеряло свое значение в связи с развитием
эхокардиографии.
Лечение. При появлении симптомов сердечной недостаточности
прибегают к медикаментозному лечению по обычной схеме (дигоксин,
мочегонные препараты, ингибиторы АПФ).
Так как спонтанное закрытие дефекта не описано, рано или позд-
но приходится прибегать к его оперативному устранению. Коррекция
порока заключается в закрытии отверстия путем его ушивания или пла-
стике заплатой и пластике трикуспидального клапана.
Литература
1. Jacobs J.P., Burke R.P., Quintessenza J.A., Mavroudis С. Congenital nomenclature
and database project: Atrioventricular canal defect // Ann. Thorac. Surg.- 2000.-
Vol. 69.- P. S36-S43.
155
2. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца - М.: Медицина,
1991.
3. Шарыкин А.С., Фальковский ГЭ. Первый опыт операции сужения легочной
артерии у детей раннего возраста с открытым общим атриовентрикулярным
каналом // Грудная хир.- 1983.- № 3.- С. 16-19.
156
Глава 11. ПОРОКИ РАЗВИТИЯ ЛЕГОЧНОЙ
АРТЕРИИ
11.1. Изолированный стеноз легочной артерии
Изолированный стеноз легочной артерии (ИСЛА) представля-
ет собой патологию, создающую обструкцию выхода из правого же-
лудочка.
Частота. Частота изолированного стеноза легочной артерии со-
ставляет 0,08-0,36/1 000 новорожденных, 4-6% среди детей с ВПС, 1,3%
среди критических ВПС. В той или иной степени легочный стеноз при-
сутствует при других пороках сердца более чем в 40% случаев.
Анатомия. Современные исследования свидетельствуют, что по-
рок включает спектр аномалий [1]. У новорожденных это может быть
критический клапанный стеноз с отверстием на грани атрезии и уме-
ренной гипоплазией правого желудочка. Однако уменьшение полости
последнего чаще связано с правожелудочковой гипертрофией; истин-
ная гипоплазия структур, в частности, трикуспидального клапана вы-
является только в 10% случаев. Данный вариант часто сочетается так-
же с гипоплазией легочных ветвей. У старших детей клапанный сте-
ноз обычно представляет меньшую обструкцию кровотоку, но потен-
циально склонен к переходу в инфундибулярный стеноз из-за концен-
трической гипертрофии выводного отдела правого желудочка.
По уровню обструкции можно выделить клапанный, подклапан-
ный и надклапанный стенозы (рис. 11-1).
Рис. 11-1. Схема легочных стенозов: А - клапанный, Б - подклапанный,
В - надклапанный.
157
Более чем в 90% случаев наблюдается стеноз клапана легочной
артерии, створки которого сращены по комиссурам, утолщены, дефор-
мированы. Клапан может быть двухстворчатым или диспластичным
(как, например, у больных с синдромом Нунана).
Изолированный инфундибулярный стеноз, представленный гипер-
трофией миокарда, наблюдается очень редко, обычно комбинируется с
клапанным стенозом или с такими ВПС, как ДМЖП или тетрада Фал-
ло. Форма мышечного стеноза может быть различной: в виде песоч-
ных часов, конической или в виде тубулярного сужения [2].
Низкий инфундибулярный стеноз, представленный гипертрофи-
рованным мышечным тяжом между передней стенкой желудочка и меж-
желудочковой перегородкой, формирует так называемый двухкамер-
ный правый желудочек. В проксимальную камеру с высоким давлени-
ем входят приточный и трабекулярный отделы правого желудочка. Дис-
тальная камера включает инфундибулярный отдел; давление в ней низ-
кое. Отверстие между камерами может быть менее 5 мм в диаметре, по
краю его располагается фиброзная ткань. Примерно в двух третях слу-
чаев имеются закрывающиеся, нередко множественные ДМЖП.
Редким вариантом является изолированный надклапанный стеноз,
который называют также стенозом легочного ствола. Как правило, он
сопровождает синдром Williams или краснушный синдром.
Миокард правого желудочка при ИСЛА гипертрофирован, при
длительном существовании порока - диффузно склерозирован. Три-
куспидальный клапан часто диспластичен, склонен к развитию ре-
гургитации. В большинстве случаев при ИСЛА имеется открытое
овальное окно, истинный ДМПП («триада Фалло») встречается лишь
в 10% случаев.
Гемодинамика. Препятствие выходу из правого желудочка при-
водит к значительному повышению в нем давления. Градиент давле-
ния на клапане отражает усиленную работу желудочка по обеспече-
нию достаточного сердечного выброса. При умеренном стенозе легоч-
ный кровоток остается адекватным определенный период времени. Од-
нако при тяжелой форме порока развивается значительная гипертро-
фия правого желудочка, повышаются его ригидность, систолическое и
конечное диастолическое давление. В ответ на это возрастает давле-
ние в правом предсердии и может возникнуть право-левый сброс кро-
ви через межпредсердное сообщение, приводящий к снижению насы-
щения кислородом артериальной крови. В этой фазе заболевания анте-
градный кровоток из правого желудочка уменьшается.
158
При критическом легочном стенозе подобные изменения гемоди-
намики наблюдаются сразу после рождения, сопровождаясь выражен-
ной правожелудочковой недостаточностью и артериальной гипоксе-
мией. Так как легочный кровоток и возврат крови к левым отделам
резко уменьшены, снижается и системный выброс. Последний может
сохраняться на удовлетворительном уровне при адекватном перетоке
крови в левые отделы через открытое овальное окно.
Естественное течение. Во внутриутробном периоде порок не при-
водит к существенным нарушениям гемодинамики. Оксигенация кро-
ви не страдает, правый желудочек может быть гипертрофирован не-
сколько больше, чем обычно. В постнатальном периоде изолирован-
ный стеноз легочной артерии имеет один из самых благоприятных про-
гнозов среди ВПС. В первые шесть месяцев умирают лишь 4% боль-
ных, имеющих критическую обструкцию клапана. До 15 лет дожива-
ют не менее 95% детей. Последующее течение порока зависит от воз-
никающих осложнений: сердечной недостаточности, нарушений рит-
ма, бактериального эндокардита, и подробно не изучено.
Клиническая симптоматика. Клинические симптомы и время их
появления зависят от степени стеноза. При небольшой обструкции у
ребенка отсутствуют жалобы, развитие его не страдает, цианоза не воз-
никает. Нередко патология сердца проявляется лишь шумом, который
обнаруживают случайно.
Выраженная обструкция сопровождается одышкой, снижением то-
лерантности к нагрузке, в последующем - правожелудочковой недос-
таточностью и цианозом. С возрастом могут появиться симптомы «ча-
совых стекол» и «барабанных палочек». В некоторых случаях возника-
ют головокружения и синкопальные состояния, которые связаны с арит-
миями или ригидным сердечным выбросом в ответ на физическую на-
грузку.
Критический легочный стеноз характеризуется ранней правоже-
лудочковой недостаточностью (увеличенная плотная печень, отечность
тканей), одышкой, центральным цианозом, синдромом низкого сердеч-
ного выброса (угнетение ЦНС, холодные цианотичные конечности, ме-
таболический ацидоз). Симптомы рефрактерны к медикаментозной те-
рапии.
В аускультативной картине преобладает грубый систолический шум
вдоль левого края грудины с максимумом во втором-третьем межребе-
рье, второй тон ослаблен. Возможен дополнительный шум трикуспи-
дальной недостаточности в четвертом межреберье.
Электрокардиография. Электрокардиограмма характеризуется
резким отклонением электрической оси сердца вправо, гипертрофией
159
миокарда правого желудочка. У большинства пациентов имеются так-
же признаки гипертрофии правого предсердия. Возможны признаки
нарушения коронарного кровотока в правом желудочке.
Рентгенография грудной клетки. Легочный рисунок при крити-
ческом стенозе обеднен, при умеренном может быть не изменен. Раз-
меры сердца также варьируют. При стенозе без шунта тень сердца срав-
нительно небольшая, преобладают признаки гипертрофии правого же-
лудочка, выбухает дуга легочной артерии. Кардиомегалия выявляется
у больных, имеющих большой межсистемный сброс или недостаточ-
ность трикуспидального клапана.
Эхокардиография. Наиболее заметный признак порока - гипер-
трофия правого желудочка и межжелудочковой перегородки. При ис-
следовании обнаруживают также нарушения открытия легочного кла-
пана, утолщенные створки которого во время систолы дугообразно вы-
бухают в расширенный легочный ствол. Допплер-эхокардиография по-
казывает турбулентный кровоток на клапане, наличие градиента дав-
ления (рис. 11-2). На уровне межпредсердного сообщения возможен
сброс справа налево.
Рис. 11-2. Допплер-эхокардиограмма из парастернальной позиции
по короткой оси при умеренном стенозе легочной артерии. В постоянно-
волновом режиме регистрируется турбулентный поток в легочном стволе с
максимальной скоростью 2,57 м/с и градиентом обструкции 27 мм рт.ст.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание как диагностическое потеряло свое значение. Используется толь-
160
ко в случаях, когда проводят баллонную вальвулопластику стеноза. Из-
мерение давления в разных отделах и правая вентрикулография могут
быть полезны для изучения гемодинамики двухкамерного желудочка.
Лечение. Медикаментозное лечение малоэффективно. У новоро-
жденных для поддержания достаточного легочного кровотока и окси-
генации возможно использование простагландинов. Хирургическое ле-
чение клапанного легочного стеноза приобрело новый характер с раз-
витием транслюминальной баллонной вальвулопластики. Данное вме-
шательство выполняют с высокой эффективностью в любом возрасте.
Относительная простота и безопасность процедуры позволяют прово-
дить ее повторно и неоднократно. Операции на открытом сердце пока-
заны при выраженной дисплазии клапана, наличии инфундибулярного
стеноза, требующего резекции, или двухкамерного правого желудоч-
ка. В некоторых случаях выводной отдел желудочка расширяют с по-
мощью заплаты. При наличии ДМПП его также закрывают.
11.2. Периферические стенозы легочных артерий
Данная патология представляет собой врожденное сужение вет-
вей системы легочной артерии.
Частота. Точная частота неизвестна, так как во многих случаях
порок протекает без симптомов.
Анатомия. Морфологические изменения чрезвычайно многооб-
разны: возможны одно- или двухстороннее поражение, с наличием су-
жения в области бифуркации или без него, стенозы сегментарных ар-
терий. Сужение может быть локальным, протяженным или в виде ги-
поплазии сосуда, вплоть до его атрезии [3].
Патология может быть изолированной или сочетаться с другими
поражениями (до 60%), такими, как клапанный легочный стеноз, тет-
рада Фалло. Кроме того, периферические легочные стенозы часто со-
четаются с наследственными заболеваниями - синдромом Williams, син-
дромом Alagille, синдромом Beuren, делецией 22ql 1 хромосомы.
Гемодинамика. Нарушения гемодинамики определяются степе-
нью препятствия выбросу из правого желудочка. В большинстве слу-
чаев выброс не нарушен, давление в желудочке не повышено. Гипо-
перфузия отдельных областей легких редко приводит к заметному сни-
жению оксигенации системной крови.
При тяжелых, особенно множественных периферических стено-
зах возникает повышенное давление в бассейне легочной артерии, пра-
вом желудочке. Постепенно развиваются изменения, аналогичные из-
менениям при изолированном легочном стенозе. Более серьезные на-
рушения гемодинамики связаны с наличием сопутствующих ВПС.
161
Естественное течение. Естественное течение порока не изучено,
так как он часто протекает бессимптомно. Тяжелый стеноз рано при-
водит больных в хирургическую клинику. Наличие периферических
стенозов может осложнять течение других ВПС.
Клиническая симптоматика. При одностороннем или небольшом
двухстороннем поражении симптомы заболевания могут полностью от-
сутствовать. Значительные обструкции сопровождаются повышенной
утомляемостью, снижением толерантности к физической нагрузке. Циа-
ноз возникает при правожелудочковой недостаточности и сбросе на
уровне межпредсердного сообщения.
При аускультации определяются сохраненный второй тон и систо-
лический шум изгнания. Последний локализуется на стороне пораже-
ния, может проводиться в подмышечную область, на спину. Второй
тон приобретает акцентированный характер при множественных сте-
нозах и высоком давлении в проксимальных отделах сосудов. При этом
описаны также специфические систоло-диастолические шумы над ле-
гочными полями [3].
Электрокардиография. Изменения ЭКГ неспецифичны, при вы-
раженных обструкциях аналогичны изменениям при изолированном
клапанном легочном стенозе.
Рентгенография грудной клетки. Рентгенологическая симпто-
матика скудная. Легочный рисунок нормальный или слегка обеднен.
Возможна асимметрия рисунка при атрезии одной из артерий. Серд-
це, как правило, увеличено незначительно, дуга легочной артерии не
выбухает.
Эхокардиография. Данное исследование не позволяет поставить
полноценный диагноз. Обычно обнаруживают умеренную гипертро-
фию правого желудочка и повышение давления в нем; возможна ви-
зуализация стенозов основных легочных ветвей. Ультразвуковое ис-
следование более ценно для выявления дополнительных пороков серд-
ца, в том числе межпредсердного сообщения.
Катетеризация сердца и ангиокардиография. Исследование вы-
сокоинформативно, так как позволяет выявить локализацию, протяжен-
ность и степень сужения легочных ветвей. Для выявления уровня су-
жения медленно выводят катетер из периферических отделов легоч-
ной артерии при непрерывной регистрации давления; во время прохо-
ждения кончика катетера через место стеноза регистрируется подъем
давления [3]. Характерным является практически равное повышение
давления в правом желудочке и в легочном стволе. При АКГ можно
обнаружить постстенотические расширения сосудов.
162
Лечение. Медикаментозное лечение неизвестно. Хирургической
коррекции подлежат сужения более 50% от диаметра сосуда или с гра-
диентом систолического давления более 30 мм рт.ст. Операция заклю-
чается в рассечении суженного участка и вшивания в него заплаты из
аутоперикарда. Вмешательства не показаны при множественных пе-
риферических сужениях.
В последние годы прибегают к баллонной дилатации суженных
участков и их стентированию. Однако к настоящему времени нет дан-
ных, свидетельствующих об улучшении выживаемости таких больных
или значительном облегчении их состояния в течение длительного вре-
мени. Кроме того, следствием процедуры может быть локальная гипе-
ремия легочной доли и ее отек.
11.3. Атрезия легочной артерии
Атрезия легочной артерии (АЛА) характеризуется отсутствием нор-
мального сообщения между желудочками сердца и легочной артерией.
Истинная частота патологии неясна, так как в исследования вклю-
чают различный статистический материал (хирургический, патолого-
анатомический, демографический) и пользуются различной иерархи-
ей пороков сердца. Литературные данные свидетельствуют о значи-
тельной вариабельности порока среди новорожденных - от 0,0065%
до 0,02% [4, 5]. Среди всех ВПС доля АЛА колеблется от 1,1 до 3,3%,
повышаясь среди «критических» ВПС до 6,3% [6, 7].
Данная патология существует в двух основных вариантах: 1) атре-
зия легочной артерии с ДМЖП (АЛА+ДМЖП); 2) атрезия легочной
артерии с интактной межжелудочковой перегородкой (АЛА+ИМЖП).
Кроме того, атрезия легочной артерии может быть одним из компонен-
тов других сложных ВПС (аномалия Эбштейна, полная форма АВК,
трикуспидальная атрезия, единственный желудочек, митральная атре-
зия, корригированная ТМА).
Наиболее часто встречается атрезия легочной артерии в сочета-
нии с ДМЖП, остальные комбинации - в два раза реже. В настоящей
главе приведены два основных типа порока.
11.4. Атрезия легочной артерии в сочетании с ДМЖП
Частота. Частота атрезии легочной артерии с ДМЖП составляет
около 0,07/1000 новорожденных, 1% среди всех ВПС и около 3,5% сре-
ди критических ВПС. Однако данная аномалия может являться состав-
ной частью других сложных пороков, поэтому истинная ее встречае-
мость не ясна.
163
Анатомия. Патология характеризуется отсутствием соединения пра-
вого желудочка с легочной артерией; выводной отдел правого желудоч-
ка оканчивается слепо. Вентрикуло-артериальные соединения могут быть
нарушены и представлены в виде вариантов транспозиции магистраль-
ных артерий, двойного отхождения сосудов от правого желудочка или
тетрады Фалло с атрезией легочной артерии. Остальные отделы сердца
сформированы нормально, атриовентрикулярные соединения конкор-
дантны. Порок характеризуется наличием большого ДМЖП, единствен-
ного полулунного (аортального) клапана, различной степенью декстро-
позиции аорты. При исследовании сосудов, приносящих кровь к лег-
ким, выделяют «истинные», или нативные легочные артерии, и большие
аортолегочные коллатеральные артерии (БАЛКА). Кровь в сосуды лег-
ких поступает из аорты через функционирующий ОАП или БАЛКА. Кро-
ме того, возможны анастомозы легочного артериального русла с брон-
хиальными, медиастинальными или коронарными сосудами. Наиболее
известная классификация порока по J. Somerville (1970) основана на уров-
не атрезии легочной артерии: 1) атрезия легочного клапана; 2) атрезия
легочного клапана и легочного ствола; 3) атрезия легочного клапана, ле-
гочного ствола и одной из легочных артерий; 4) атрезия легочного кла-
пана, ствола и обеих легочных артерий (легкие снабжаются кровью за
счет коллатеральных артерий) (рис. 11-3).
Рис. 11-3. Варианты атрезии легочной артерии по J. Somerville. 1 - первый
тип; 2 - второй тип; За, ЗЬ - третий тип; 4 - четвертый тип (при типах 1 и 2 в
качестве источника кровоснабжения легких показан открытый артериальный проток,
при типах 3 и 4 - коллатеральные артерии).
164
В последние годы предложена классификация, основанная на ти-
пе кровоснабжения легких: тип А - имеются истинные легочные арте-
рии, БАЛКА не выявляются; тип В - представлены как истинные ле-
гочные артерии, так и БАЛКА; тип С - истинные легочные артерии
отсутствуют, имеются только БАЛКА [8]. Легочные артерии могут со-
единяться друг с другом (конфлюэнтные артерии) или быть неконфлю-
энтными.
Гемодинамика. При данной патологии вся кровь из правого (че-
рез ДМЖП) и левого желудочков поступает в восходящую аорту. В ре-
зультате возникает артериальная гипоксемия, степень которой обрат-
но пропорциональна величине легочного кровотока. В свою очередь,
легочный кровоток определяется диаметром ОАП или системных кол-
латеральных артерий. При их стенозировании или гипоплазии возврат
оксигенированной крови в левое предсердие невелик и гипоксемия мо-
жет достигать критический степени. При адекватном легочном крово-
токе уровень гипоксемии может быть минимальным, а в редких случа-
ях даже развивается легочная гипертензия.
Естественное течение. Внутриутробное развитие плода обычно
не претерпевает серьезных изменений. Содержание кислорода в сис-
темном и коронарном русле существенно не нарушается, так как не
зависит от кровотока через легкие. Оба желудочка работают синхрон-
но, изгоняя кровь в аорту и обеспечивая необходимое кровообраще-
ние. После рождения с разделением кругов кровообращения возника-
ет сброс венозной крови в большой круг с развитием артериальной
гипоксемии. Смерть обычно связана с выраженной гипоксемией из-за
недостаточного легочного кровотока, наступающей вследствие закры-
тия ОАП или прогрессирующего сужения коллатеральных артерий. Ес-
тественное течение порока малоизучено, так как обычно рано прибе-
гают к оперативному вмешательству для спасения жизни детей. Из-
вестно, что до шести месяцев доживают лишь около 62% больных [5].
Суммарная смертность среди оперированных и неоперированных па-
циентов, даже при современном уровне кардиохирургии, велика и дос-
тигает в течение первого года жизни 25%. В последующие 5 лет уми-
рают еще 22% больных [9]. В случаях когда имеется адекватное допол-
нительное кровоснабжение легких, больные длительно находятся в со-
стоянии компенсации. У этих детей гипоксемия нарастает пропорцио-
нально отставанию роста коллатералей от роста ребенка.
Клиническая симптоматика. Основной симптом порока - цен-
тральный цианоз. Так как атрезия легочной артерии является типич-
ной дуктус-зависимой патологией, резкое нарастание цианоза, беспо-
165
койства или вялости ребенка, а также потеря сознания свидетельству-
ют о закрытии ОАП. Одышечно-цианотических приступов, как при тет-
раде Фалло, не возникает. По мере роста ребенка, начиная со второго
полугодия, развиваются симптомы «барабанных палочек» и «часовых
стекол».
Аускультативная картина неспецифична. Так как кровоток через
легочный клапан отсутствует, может быть «ашумовая» картина поро-
ка. При функционирующем ОАП имеется мягкий дующий шум. При
крупных коллатералях можно выслушать систолический или систоло-
диастолический шум, локализующийся слева или справа от грудины и
проводящийся на спину.
Электрокардиограмма. ЭКГ характеризуется отклонением элек-
трической оси сердца вправо, гипертрофией правого желудочка и пра-
вого предсердия.
Рентгенография грудной клетки. Легочный рисунок чаще обед-
нен; при большом ОАП или коллатералях может быть нормальным или
даже усиленным, нередко - асимметричным. Размеры сердца умерен-
но увеличены, дуга легочной артерии западает.
Эхокардиография. При эхокардиографии выявляют большой
ДМЖП, являющийся единственным выходом из правого желудочка.
Кровоток через легочный клапан отсутствует. Восходящая аорта рас-
ширена. В зависимости от типа атрезии определяют наличие или от-
сутствие легочного ствола и ветвей. В большинстве случаев в качестве
источника кровоснабжения легочной артерии можно обнаружить от-
крытый артериальный проток (рис. 11-4).
Катетеризация сердца и ангиокардиография. Данное исследо-
вание более информативно, чем ЭХОКГ, в связи с возможностью де-
тального анализа кровоснабжения легких.
При катетеризации сердца обнаруживают равное давление в обо-
их желудочках и аорте, низкое насыщение системной крови кислоро-
дом. Контрастирование правого или единственного желудочка выяв-
ляет отсутствие его сообщения с легочной артерией; контрастное ве-
щество через ДМЖП заполняет восходящую аорту и через ОАП - ле-
гочную артерию (рис. 11-5, А). При выполнении аортографии можно
определить наличие ОАП, состояние легочных артерий и аортально-
легочных коллатералей (рис. 11-5, Б; 11-6).
Для оценки хода, распределения БАЛКА в легких и их проходи-
мости выполняют селективную артериографию и измеряют давление
в этих сосудах [10].
Лечение. Базовая терапия направлена на снижение потребностей
организма в кислороде и коррекцию метаболических нарушений. В пе-
риод новорожденности увеличение легочного кровотока возможно с
166
Рис. 11-4. Эхокардиограмма из супрастернального доступа по
длинной оси при атрезии легочной артерии I типа. Лоцируются расширенная
восходящая аорта, отходящий от перешейка аорты широкий и длинный артериальный
проток, соединяющий аорту с ветвью легочной артерии; в артериальном протоке
при спектральной допплерографии регистрируется кровоток магистрального типа.
Рис. 11-5. Ангиокардиография при единственном желудочке и
атрезии легочной артерии. При вентрикулографии (А) или аортографии (Б)
легочные артерии заполняются через открытый артериальный проток.
167
Рис. 11-6. Ангиокардиография при атрезии правой легочной
артерии. Кровоснабжение правого легкого осуществляется через аномальный сосуд,
отходящий от нисходящей аорты.
помощью инфузии простагландинов Е, поддерживающих проходимость
ОАП. Следует помнить, что ингаляция кислорода детям с данным по-
роком противопоказана, так как может спровоцировать закрытие ОАП.
Более эффективно оперативное лечение. В раннем возрасте при
прогрессирующем цианозе и небольших размерах легочных артерий
выполняют паллиативную операцию, направленную на увеличение ле-
гочного кровотока и создающую предпосылки для роста легочных со-
судов. Наиболее частая операция - модифицированный подключично-
легочный анастомоз, создаваемый с помощью синтетического проте-
за. В случаях кровоснабжения отделов легких одновременно истинны-
ми и коллатеральными сосудами, последние устраняют с помощью их
перевязки или транскатетерной эмболизации.
Радикальная коррекция порока, как правило, многоэтапная. Важ-
ным компонентом операции является унифокализация сосудов, при-
носящих кровь к легким. Цель процедуры - исключить внесердечные
источники поступления крови в легкие, соединить в единый комплекс
сегментарные, лобарные и другие сосуды, несущие кровь в легкие, соз-
дать центральный источник легочного кровоснабжения.
Характер последующих вмешательств зависит от состояния легоч-
ного артериального русла (сопротивления в нем) и способности МКК
принять весь необходимый для нормального кровообращения объем
крови. Если развитие легочных артерий недостаточное, выполняют еще
168
одну паллиативную операцию - вшивание кондуита (с клапаном или
без него) между правым желудочком и легочной артерией; при этом
ДМЖП не закрывают. Его коррекцию производят в последующем, по-
сле адекватного развития легочных артерий. В редких случаях возможна
первичная радикальная операция.
11.5. Атрезия легочной артерии с интактной
межжелудочковой перегородкой
Частота. Частота патологии составляет около 0,06-0,07/1000 но-
ворожденных, 1-3% среди всех ВПС, 3-5% среди критических ВПС.
Анатомия. Данный вариант порока характеризуется нормально
сформированными предсердиями и конкордантными атриовентрику-
лярными соединениями, межжелудочковая перегородка интактна. Вы-
ход из правого желудочка полностью отсутствует: приблизительно в
75% случаев - за счет полного слияния створок легочного клапана, в
25% - из-за мышечной облитерации инфундибулярной части желудоч-
ка [11]. В редких случаях возможна атрезия легочного ствола. У 90%
больных правый желудочек гипоплазирован. В зависимости от его мор-
фологии выделяют три основных анатомических варианта (по Bull С.
et al. [12]): 1) сохранены все основные отделы правого желудочка (при-
точный, трабекулярный, инфундибулярный) - 50-58% всех случаев;
2) отсутствует трабекулярный отдел правого желудочка - 30-34%;
3) отсутствуют трабекулярный и инфундибулярный отделы правого же-
лудочка - 7,7-20%.
Так как диаметр трикуспидального клапана, длина приточного от-
дела и объем правого желудочка хорошо коррелируют, это позволяет
определять наличие гипоплазии желудочка по одному из этих пара-
метров [11].
Аномалии коронарных артерий (фистулы, стенозы, перерывы, эк-
тазии) обнаруживают более чем у 45% больных. Наибольшее значение
имеют эмбриональные сообщения между коронарными артериями и
синусоидами правого желудочка, приводящие к аномальному коронар-
ному кровотоку. Возможно также развитие фиброэластоза эндокарда
правого желудочка.
Гемодинамика. Нарушения гемодинамики определяются отсут-
ствием антеградного поступления крови из правого желудочка в ле-
гочную артерию при невозможности сброса этой крови через ДМЖП
в левые отделы (рис. 11-7).
При выраженной гипоплазии желудочка (и трикуспидального кла-
пана) его наполнение незначительно, практически вся кровь из право-
169
го предсердия шунтируется через открытое овальное окно в левое пред-
сердие. В случаях, когда кровь все же поступает в полость правого
желудочка (при незначительной гипоплазии), возникает его объемная
перегрузка, так как опорожнение происходит только ретроградно че-
рез трикуспидальный клапан и/или сохраненные синусоиды.
Для выживания ребенка необходимо наличие открытого овально-
го окна и альтернативного кровоснабжения легких (ОАП или коллате-
рали, отходящие от аорты). При данной патологии кровь через ОАП
течет из аорты в легочную артерию уже во внутриутробном периоде (в
отличие от нормы, когда поток направлен из легочной артерии в аорту);
проток приобретает вид тонкого извитого сосуда (рис. 11-8).
Рис. 11-7. Схема кровообращения при атрезии легочной артерии с
интактной межжелудочковой перегородкой (объяснения в тексте).
Рис. 11-8. Направление потока крови через ОАП у плода в норме
(слева) и при атрезии легочной артерии.
170
После рождения в большинстве случаев также имеется дуктус-
зависимое легочное кровообращение. При этом левый желудочек на-
гнетает кровь в оба круга кровообращения.
При наличии выраженных синусоидов значительная часть крови
в коронарное русло поступает из правого желудочка, давление в кото-
ром нередко значительно превышает системное. При обструкции про-
ксимальной части коронарной артерии по ней течет сугубо венозная
кровь. В связи с этим высока вероятность развития ишемии и инфарк-
та миокарда.
Естественное течение. Внутриутробное развитие плода обычно
не претерпевает серьезных изменений. Содержание кислорода в сис-
темном и коронарном русле существенно не нарушается, так как не
зависит от легочного кровотока. Левый желудочек обеспечивает необ-
ходимое кровообращение, заметно преобладая над правым. Сразу по-
сле рождения с разделением кругов кровообращения возникает мас-
сивный сброс венозной крови в БКК, артериальная гипоксемия, пра-
вожелудочковая недостаточность.
Точных данных о естественной смертности нет, так как для спасе-
ния жизни пациентов рано прибегают к оперативному лечению. Одна-
ко и суммарный (естественный + модифицированный операцией) про-
гноз при данном пороке плохой, несмотря на достижения детской кар-
диохирургии. В 80-е годы в течение первого месяца умирали 57%, к
концу первого года жизни - 77% больных [7]. Спустя 20 лет соответст-
вующая летальность составляет 12 и 52% [4]. Шансы на выживание
выше при адекватно функционирующем межпредсердном сообщении
и ОАП, а также незначительной гипоплазии правого желудочка.
Клиническая симптоматика. Основные симптомы порока - на-
растающий с рождения цианоз, одышка и правожелудочковая недоста-
точность, рефрактерная к медикаментозной терапии. Выраженная ге-
патомегалия обычно свидетельствует о малом диаметре межпредсерд-
ного сообщения. Так как атрезия легочной артерии является типичной
дуктус-зависимой патологией, закрытие ОАП сопровождается катаст-
рофическим нарастанием цианоза, беспокойством или вялостью ги-
поксического генеза, потерей сознания. При коронарных расстройствах
возможен «крик боли».
Аускультативная картина неспецифична. Наиболее часто выслу-
шивается шум ОАП. При незначительной гипоплазии правого желу-
дочка возможно возникновение небольшого систолического шума три-
куспидальной недостаточности на основании грудины слева.
Электрокардиограмма. Наиболее характерной особенностью
ЭКГ у новорожденных с атрезией легочной артерии и интактной
171
межжелудочковой перегородкой является отклонение электрической
оси сердца влево. Имеются также признаки увеличения правого пред-
сердия (высокий Ри, V1), гипертрофии левого желудочка, иногда - обо-
их желудочков.
Рентгенограмма. Легочный рисунок чаще обеднен; при большом
ОАП или коллатералях может быть нормальным или даже усиленным.
Размеры сердца увеличены в основном за счет правого предсердия и
левого желудочка. Кардиомегалия нарастает в случаях длительной вы-
живаемости больных. Описана диагностически значимая «скошен-
ность» переднего контура сердца во II косом положении, отражающая
гипоплазию правого желудочка [13].
Эхокардиография. ЭХОКГ в последние годы приобрела решаю-
щее значение в диагностике атрезии легочной артерии с интактной меж-
желудочковой перегородкой, так как позволяет избежать потенциаль-
но опасного инвазивного исследования у этих новорожденных, нахо-
дящихся в критическом состоянии.
Выявляют уменьшение полости правого желудочка с гипертро-
фией его миокарда, увеличение правого предсердия и левого желу-
дочка (рис. 11-9). Диаметр трикуспидального клапана уменьшен, од-
нако движения створок сохранены. Легочная артерия может быть нор-
мальных размеров или гипоплазирована; кровоток через клапан не
регистрируется.
Через открытое овальное окно поток крови направлен справа на-
лево. Как правило, имеется функционирующий ОАП.
Для оценки степени гипоплазии правого желудочка использова-
лись многочисленные параметры (относительные размеры трикуспи-
дального и митрального клапанов, приточного и выводного отделов
желудочков, конечный диастолический объем и другие, вычисляемые
по более сложным формулам). Однако для практических целей наибо-
лее удобной оказалась оценка диаметра трикуспидального клапана в
сравнении с нормальным диаметром для данной поверхности тела. Сте-
пень гипоплазии правого желудочка считают небольшой, если диаметр
трикуспидального клапана находится в пределах (-2) стандартных от-
клонений, умеренной - в пределах от (-2) до (-4), выраженной - более
(-4) стандартных отклонений [14].
Наличие коммуникаций между правым желудочком и коронарны-
ми артериями подтверждается ретроградным систолическим или би-
направленным кровотоком в коронарных артериях и током крови из
них в восходящую аорту, а также аномальным потоком крови от мио-
карда правого желудочка в его полость [15].
172
Рис. 11-9. Эхокардиограмма из верхушечной четырехкамерной по-
зиции при атрезии легочной артерии с интактной межжелудочковой пе-
регородкой. Визуализируются уменьшенный в размерах трабекулярный правый
желудочек (RV) и значительно расширенный левый желудочек (LV); вторичный цен-
тральный дефект межпредсердной перегородки с прогибом перегородки в сторону
левого предсердия (LA).
Рис. 11-10. Ангиокардиография при атрезии легочной артерии с
интактной межжелудочковой перегородкой. ПП-резко увеличенное правое
предсердие; ПЖ - правый желудочек. Треугольной стрелкой отмечен слепо
заканчивающийся выводной отдел правого желудочка.
173
Катетеризация сердца и ангиокардиография. При данном ис-
следовании обнаруживают повышенное давление в правом предсер-
дии и желудочке, наличие право-левого сброса на уровне предсердий
и низкое насыщение системной крови кислородом. При наличии вы-
сокого градиента давления между предсердиями показано выполнение
закрытой атриосептостомии (процедуры Рашкинда). Контрастирова-
ние правого желудочка выявляет отсутствие его сообщения с легочной
артерией и резко увеличенное правое предсердие (рис. 11-10). При на-
личии синусоидов через них заполняются коронарные артерии.
Характерно также забрасывание контрастного вещества из право-
го желудочка в полость правого предсердия и через овальное окно - в
левое предсердие. При выполнении аортографии можно определить
наличие ОАП, оценить состояние легочных артерий и аортально-ле-
гочных коллатералей.
Лечение. Базовая терапия направлена на снижение потребностей
организма в кислороде и коррекцию метаболических нарушений. Сред-
ством неотложной помощи является инфузия простагландинов Е,
поддерживающих проходимость ОАП и увеличивающих легочный кро-
воток. Следует напомнить, что ингаляция кислорода детям с данным
пороком противопоказана, так как может спровоцировать закрытие
ОАП.
Надежду на длительное выживание больных дает только опера-
тивное лечение. В качестве неотложной помощи при обструктивном
овальном окне и правожелудочковой недостаточности возможно вы-
полнение процедуры Рашкинда. Однако в последние годы большинст-
во хирургов предпочитает прибегать к более радикальным вмешатель-
ствам, в том числе в условиях искусственного кровообращения. Целя-
ми операции являются: 1) декомпрессия правого желудочка и создание
условий для его развития; 2) восстановление эффективного (в том чис-
ле антеградного) легочного кровотока. В случаях перевода «застойно-
го» правого желудочка в «проточный» повышается вероятность его рос-
та и последующей радикальной операции [16]. Как правило, вмеша-
тельства носят многоэтапный характер. На первых этапах выполняют
межсистемные анастомозы, легочную вальвулотомию. Завершающи-
ми вмешательствами являются радикальная двухжелудочковая коррек-
ция - при адекватных размерах правого желудочка (около 30% боль-
ных) или операции типа операции Фонтена. На послеоперационный
прогноз в значительной мере влияет степень зависимости коронарно-
го кровотока от правожелудочковых синусоидов. При высокой зависи-
мости декомпрессия желудочка приводит к снижению давления в сис-
174
теме коронарного кровообращения, возникают синдром обкрадывания,
ишемия миокарда и гибель больных. В связи с этим в процессе опера-
ции необходимо закрытие желудочково-коронарных сообщений.
11.6. Идиопатическая дилатация легочной артерии
Идиопатическая дилатация легочной артерии (ИДЛА) характери-
зуется врожденным расширением ствола легочной артерии, а иногда и
ее ветвей при отсутствии патологии самого сердца или легких.
Частота. Частота патологии в популяции значительно колеблется
в зависимости от материалов, включаемых в исследование, и состав-
ляет от 0,6 до 27%, среди всех ВПС - 0,6%.
Анатомия. В основе порока лежит врожденная неполноценность
соединительной ткани, однако нельзя исключить и нарушения деле-
ния трункуса. Диаметр легочной артерии превышает верхнюю грани-
цу нормы для данного возраста. Аневризмы основного ствола легоч-
ной артерии составляют 80% всей патологии; возможно расширение и
ветвей легочной артерии.
Гемодинамика. Небольшое расширение легочного ствола не при-
водит к нарушениям гемодинамики. Однако дилатированная легочная
артерия может подвергнуться пристеночному тромбозу с последующи-
ми тромбоэмболиями. Значительная дилатация артерии может сопро-
вождаться сдавлением левого бронха или ствола левой коронарной ар-
терии.
Редким, но опасным осложнением является трансформация идио-
патической дилатации в расслаивающую аневризму легочной артерии.
Провоцирующими факторами при этом являются активная физическая
нагрузка, вторичная легочная гипертензия, повторные бронхолегочные
заболевания.
Естественное течение. Естественное течение порока не изучено.
Описаны случаи наблюдения за больными в течение 12-46 лет без су-
щественного прогрессирования дилатации [17]. В связи с редко возни-
кающими осложнениями можно предположить благоприятный прогноз
заболевания.
Клиническая симптоматика. В раннем возрасте заболевание про-
текает бессимптомно. У детей школьного возраста и взрослых пациен-
тов могут быть жалобы на усталость, ухудшение самочувствия после
физической нагрузки. В редких случаях сдавления бронха возможны
дыхательные расстройства; при сдавлении коронарной артерии - боли
в области сердца.
Аускультативная картина напоминает дефект межпредсердной пе-
регородки: второй тон сердца расщеплен, иногда акцентирован. У поло-
175
вины детей имеется небольшой систолический шум изгнания. Его ин-
тенсивность изменяется при проведении позиционных проб: нараста-
ет после физической нагрузки и в ортостатическом положении (при
приближении легочной артерии к передней грудной стенке). Систоли-
ческий шум связан с возникновением турбулентного потока крови в
расширенном стволе. При сопутствующей дилатации фиброзного коль-
ца легочной артерии можно выслушать и диастолический шум
регургитации.
При сочетании с пролапсом митрального клапана возможен не-
большой систолический шум на верхушке сердца.
Электрокардиография. На ЭКГ, как правило, изменений не от-
мечается. Специфическая симптоматика может появиться при сдавле-
нии коронарной артерии расширенным легочным стволом.
Рентгенография грудной клетки. Рентгенограмма характерна со-
четанием небольших размеров сердца с резким выбуханием дуги ле-
гочной артерии. Так как картина напоминает рентгенограмму при вы-
сокой легочной гипертензии, последующее обследование должно быть
направлено на исключение этого состояния.
Эхокардиография. При эхокардиографии обнаруживают широкую
легочную артерию с нормальными легочными клапанами. Возможны
небольшие отклонения в структуре створок клапанов, тривиальная ре-
гургитация на них. В легочном стволе можно выявить добавочные вих-
ревые потоки. Другой патологии сердца нет. Давление в правом желу-
дочке нормальное. Важным диагностическим моментом является вы-
явление пристеночного тромбоза легочной артерии.
Катетеризация сердца и ангиокардиография. Катетеризация
сердца целесообразна для исключения высокой легочной гипертензии
вследствие обструктивного поражения легочных сосудов. Ангиокар-
диография выявляет характер и протяженность аневризматического рас-
ширения легочной артерии.
При данной патологии целесообразно проведение .магнитно-ре-
зонансной томографии, позволяющей выявить взаимоотношения ле-
гочной артерии и прилежащих структур (трахея, бронхи, коронарные
артерии).
Лечение. В связи с благоприятным естественным течением боль-
ных ведут консервативно. К хирургическому лечению прибегают при
возникновении отягощающих факторов - образовании аневризмы, ее
тромбировании. Операция заключается в аневризмэктомии - резеци-
ровании аневризматического образования и пластике образовавшего-
ся дефекта, или аневризморрафии (ушивании аневризмы). В редких
случаях, при дистальной множественной патологии выполняют лобэк-
томию или пневмонэктомию.
176
Литература
1. Lacour-Gayet F. Congenital heart surgery nomenclature and database project: right
ventricular outflow tract obstruction - intact ventricular septum // Ann. Thorac.
Surg.- 2000.- Vol. 69.- P, S83-S96.
2. Алекян Б.Г., Подзолков В.FL, Зуфаров M.M. и соавт. Ближайшие и отдаленные
результаты эндоваскулярного лечения больных с комбинированным стенозом
легочной артерии // Грудная и серд.-сос. хир.- 1998.- №1.- С. 59-64.
3. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца - М.: «Медицина»,
1991.
4. Leonard Н., Derrick G., O'Sullivan J., Wren C. Natural and unnatural history of
pulmonary atresia // Heart.- 2000.-Vol. 84.- P. 499-503.
5. Samanek M., Voriskova M. Congenital Heart disease among 815.569 children born
between 1980 and 1990 and their 15-ycar survival: A prospective Bohemia survival
study // Pediatr. Cardiol.- 1999.-Vol. 20,- P. 411-417.
6. Samanek M., Voriskova M. Infants with critical heart disease in a territory with cen-
tralized care // Internal. J. Cardiol.- 1986.- Vol. 11.- P. 63-74.
7. Fyler D.C. Report of New England Regional Infant Cardiac Programm // Pediat-
rics.-1980.-Vol. 65.-№2.-Part 2.- Suppl.
8. Tchervenkov C.L, Roy N. Congenital heart surgery nomenclature and database pro-
ject: Pulmonary atresia-ventricular septal defect // Ann Thorac. Surg.- 2000.- Vol. 69.-
P. S97-105.
9. Leonard H., Derrick G., O'Sullivan J., Wren C. Natural and unnatural history of
pulmonary atresia // Heart.- 2000.-V. 84.- P. 499-503.
10. Бабаев О.Д. Ангиокардиографическая диагностика различных типов коллате-
рального кровоснабжения легких у больных с резким ограничением легочного
кровотока. - Дисс...канд. мед. наук. - М., 2002.
11. Daubeney P.E.F., Delany D.J., Anderson R.H. et al. Pulmonary atresia with intact
ventricular septum. Range of morphology in a population-based study // J. Am. Coll.
Cardiol.- 2002.- V. 39.- P. 1670-1679.
12. Bull C., de Leva! M.R., Mercanti C. et al. Pulmonary atresia and intact ventricular
septum: a revised classification // Circulation.- 1982.- V. 66.- P. 266-271.
13. Голонзко P.P., Беришвили И.И., Джиоев А.Н. Атрезия легочной артерии с ин-
тактной межжелудочковой перегородкой// Вестн. рентгенол.- 1985,- № 1.-
С. 46-50.
14. Laks Н. In Discussion to Jahangiri M. et al. Improved results with selective man-
agement in pulmonary atresia with intact ventricular septum // J. Thorac. Cardio-
vasc, Surg.- 1999.- Vol. 118.- P. 1046-1055.
15. Garcia J.A., Zellers T.M., Weinstein E.M., Mahony L. Usefulness of Doppler echo-
cardiography in diagnosing right ventricular coronary arterial communications in
patients with pulmonary atresia and intact ventricular septum and comparison with
angiography//Am. J. Cardiol.- 1998.- Vol. 81.- P. 103-104.
16. Шарыкин А. С. Неотложные операции при врожденных пороках сердца у боль-
ных первых трех месяцев жизни. - Дисс...докт.мед.наук. - М., 1992.
17. Ring N.J., Marshall A.J. Idiopathic dilatation of the pulmonary artery // Br. J. Ra-
diol.- 2002.- Vol. 75.- P. 532-535.
177
Глава 12. ПОРОКИ КОНОТРУНКУСА
Термин «конотрункус» применяется для обозначения двух тесно
связанных структур эмбрионального сердца - конуса и артериального
трункуса. Данные структуры ответственны за формирование аорты и
легочной артерии, а также выводных отделов желудочков. В зависимо-
сти от степени нарушения абсорбции и ротации конотрункуса образу-
ется широкий спектр пороков, часть из которых представлена в на-
стоящем разделе.
12.1. Тетрада Фалло
В основе формирования тетрады Фалло лежит недоразвитие ин-
фундибулярного отдела правого желудочка или конуса, в результате
которого возникают четыре ее классических признака: большой
ДМЖП, обструкция выводного тракта правого желудочка, гипертро-
фия правого желудочка и декстропозиция аорты [1].
Частота. Тетрада Фалло входит в десятку наиболее распростра-
ненных пороков сердца. У детей старше года это самый частый циано-
тический порок. Частота патологии составляет 0,21-0,26/1000 новоро-
жденных, 6-7% среди всех ВПС и 4% среди критических ВПС.
Анатомия. Морфологической основой порока являются большой
ДМЖП, создающий условия для равного давления в обоих желудоч-
ках, и обструкция выхода из правого желудочка. Гипертрофия желу-
дочка является следствием этой обструкции, а также его объемной пе-
регрузки. Позиция аорты может варьировать в значительной степени.
Дефект обычно имеет перимембранозную локализацию с распро-
странением в подлегочную зону. Обструкция выхода из правого желу-
дочка чаще всего представлена инфундибулярным стенозом (45%), в
том числе за счет смещения конусной перегородки кпереди и влево. В
10% случаев стеноз существует на уровне легочного клапана, в 30%
случаев он является комбинированным. У 15% больных имеется атре-
зия легочного клапана. Редкий вариант представляет тетрада Фалло с
агенезией легочного клапана (синдром отсутствия легочного клапана).
Вместо клапана имеются лишь рудиментарные валики; стеноз созда-
ется гипоплазированным легочным кольцом. Данный вариант часто со-
четается с делецией 22q 11 хромосомы.
При тетраде Фалло легочное клапанное кольцо, легочный ствол и
ветви в подавляющем большинстве случаев гипоплазированы; возмож-
ны периферические стенозы легочных артерий. Особенно подвержено
178
стенозированию (вплоть до атрезии) устье левой легочной артерии. При
тяжелых формах порока развиваются аортолегочные коллатерали, ком-
пенсирующие недостаточный кровоток в легкие.
У 40% больных встречаются дополнительные пороки - ОАП, вто-
ричный ДМПП, сосудистое кольцо, открытый общий атриовентрику-
лярный канал, частичный аномальный дренаж легочных вен, добавоч-
ная левостороння верхняя полая вена. Примерно у 3% больных обна-
руживают второй мышечный ДМЖП. В 25% случаев имеется право-
сторонняя дуга аорты. Однако такая патология, как коарктация аорты,
- скорее казуистика. Это связано с высоким кровотоком во внутриут-
робном периоде через перешеек аорты и хорошим развитием послед-
него. У 5%-14% пациентов существуют аномалии коронарных арте-
рий [2]. Наиболее частые и важные из них - отхождение от правой
коронарной артерии аберрантных артерий (особенно передней меж-
желудочковой артерии), пересекающих выводной тракт правого желу-
дочка. Подобное положение сосудов препятствует манипуляциям в под-
легочной зоне, осложняя операцию.
Гемодинамика. Можно выделить четыре основных варианта по-
рока, определяемых в основном степенью нарушения антеградного кро-
вотока из правого желудочка: 1) бледная форма тетрады Фалло; 2) клас-
сическая форма тетрады Фалло; 3) тетрада Фалло с атрезией легочной
артерии (так называемая крайняя форма тетрады Фалло); 4) тетрада
Фалло с агенезией легочного клапана.
При бледной форме сопротивление выбросу крови в легкие ниже,
чем в аорту, имеется лево-правый сброс, легочный кровоток не сни-
жен. Данный вариант аналогичен гемодинамике ДМЖП в сочетании с
легочным стенозом. У этих больных возможно нарастание со време-
нем степени обструкции (гипертрофии инфундибулярного отдела пра-
вого желудочка), что приводит к перекрестному, а затем стойкому пра-
во-левому сбросу и переходу порока в цианотическую форму.
При классической форме тетрады Фалло во время систолы кровь
в аорту изгоняется обоими желудочками; минутный объем большого
круга кровообращения увеличен. В то же время кровоток в малом кру-
ге ограничен. Так как в аорту поступает венозная кровь, возникает ар-
териальная гипоксемия, которая коррелирует со степенью легочного
стеноза. Из-за большого ДМЖП и «верхом сидящей» над ним аорты
препятствие для выброса крови из правого желудочка отсутствует, по-
этому правожелудочковая сердечная недостаточность долгое время не
возникает. Оснований для развития сердечной недостаточности лево-
желудочкового типа также нет, поскольку левые отделы сердца недогру-
179
жены. В некоторых случаях отмечают даже относительную гипопла-
зию левого желудочка. Вероятность сердечной недостаточности появ-
ляется при длительном существовании некорригированного порока из-
за высокого давления в правом желудочке и развития дистрофических
изменений в миокарде (обычно после 3-6 лет).
При крайней форме тетрады Фалло гемодинамика подобна та-
ковой при атрезии легочной артерии с ДМЖП; кровоток в легкие осу-
ществляется через ОАП или коллатеральные сосуды. В связи с этим
диагностика, терапия и хирургическое лечение также аналогичны (см.
главу 11).
Тетрада Фалло с агенезией легочного клапана характеризуется до-
полнительной объемной перегрузкой правого желудочка из-за возвра-
та крови из легочного ствола. Это способствует ранней сердечной не-
достаточности. Кроме того, увеличенный ударный объем правого же-
лудочка в сочетании с недостаточностью легочного клапана приводит
к аневризматическому расширению легочного ствола. В результате воз-
никает сдавление расположенных рядом структур (бронхов, предсер-
дий, нервов), что сопровождается нарушениями их функции.
Естественное течение. Во внутриутробном периоде тетрада Фалло
не оказывает влияния на развитие плода. Синхронная работа обоих
желудочков обеспечивает адекватный системный кровоток, а плацен-
та - оксигенацию. Степень легочного стеноза и гипоплазии легочных
артерий варьирует в значительной степени, а процесс их формирова-
ния продолжается вплоть до родов и в первые месяцы жизни ребенка.
Это определяет необходимость повторных эхокардиографических ис-
следований плода.
Основным прогностически неблагоприятным фактором в постна-
тальном периоде является артериальная гипоксемия, воздействующая
как на общее состояние пациента, так и на миокард. В соответствии с
этим течение бледной формы тетрады Фалло более благоприятно. Од-
нако у этих пациентов нельзя исключить развитие сердечной недоста-
точности.
Классическая форма тетрады Фалло протекает более тяжело. Хро-
ническая гипоксия органов приводит к их дисфункции, отставанию ре-
бенка в физическом и умственном развитии, ранней смертности. Уже к
3-6 годам можно выявить жировую дистрофию миокарда [3]. Длитель-
ное существование порока сопровождается тромбозом легочных арте-
риол с редукцией легочного кровотока. Редкими осложнениями явля-
ются коагулопатии, абсцесс головного мозга или кровоизлияние, бак-
териальный эндокардит.
180
Наиболее тяжелое течение отмечают при варианте порока с агене-
зией легочного клапана. У некоторых из этих пациентов сердечная не-
достаточность развивается еще внутриутробно; 60% из них умирают в
перинатальном периоде от водянки, респираторных проблем или со-
путствующей врожденной патологии [4].
Всего на первой неделе жизни погибают около 6% больных с тет-
радой Фалло, к 6 мес - 14%, к концу года - до 25%, к 40 годам - 95% [5,
6]. Высокая смертность в первые недели жизни обычно отмечается при
выраженной гипоплазии легочного сосудистого русла. В старшем воз-
расте основные причины смерти - сердечная недостаточность, арит-
мии, внезапная смерть. Средняя продолжительность жизни неопери-
рованных больных с классической формой порока - 12 лет [7].
Клиническая симптоматика. Дети с тетрадой Фалло обычно име-
ют нормальные показатели развития при рождении. Однако у боль-
шинства вскоре развивается умеренный центральный цианоз. Выра-
женный цианоз свидетельствует о крайней степени обструкции легоч-
ного кровотока, в частности - об атрезии легочной артерии. Из ранних
симптомов следует отметить продолжительный систолический шум из-
гнания, выслушивающийся на основании сердца слева от грудины. При
нарастании стеноза шум становится короче и мягче. У больных с атре-
зией легочной артерии шум может полностью отсутствовать или слы-
шен функционирующий ОАП. В случаях с большими коллатералями
можно выслушать их шум на спине.
При агенезии легочного клапана шум имеет пансистолический ха-
рактер с низкочастотным диастолическим компонентом слева от гру-
дины, а клиническая картина характеризуется триадой: затруднение ды-
хания, сердечная недостаточность и цианоз. У этих больных легко раз-
виваются ателектазы и пневмонии вследствие сдавления легочными
артериями прилегающих бронхов. В некоторых случаях может потре-
боваться искусственная вентиляция легких для компенсации дыхатель-
ной недостаточности.
Общим правилом является то, что раннее появление выраженной
симптоматики при тетраде Фалло свидетельствует о неблагоприятной
анатомии порока (гипоплазия легочной артерии, атрезия легочного
клапана, выраженный инфундибулярный стеноз, гипоплазия левого же-
лудочка). Пациенты с такой анатомией составляют группу критических
больных (около 35%), которым требуется проведение интенсивной те-
рапии и оперативного вмешательства вскоре после рождения.
В более старшем возрасте к цианозу добавляются одышка при на-
грузке, гипоксические приступы, тахикардия, задержка роста и разви-
181
тия, снижение толерантности к физической нагрузке. Следует отме-
тить, что диспноэ и тахикардия при данном пороке являются следст-
вием не сердечной недостаточности, а гипоксемии. Больные склонны
к сидению на корточках, у них развиваются симптомы «барабанных
палочек» и «часовых стекол».
Спектр проявлений гипоксемии достаточно широк: от умеренно-
го цианоза до гипоксических приступов или затяжного гипоксическо-
го статуса. Характерными для тетрады Фалло являются одышечно-циа-
нотические (гипоксические) приступы. Приступ начинается часто по-
сле крика, кормления или дефекации. Ребенок становится беспокой-
ным, усиливаются одышка и цианоз, затем нарастает вялость, пропа-
дает шум над областью сердца. В тяжелых случаях возможны апноэ и
потеря сознания, судороги [7]. Развитие приступов связано со спазмом
инфундибулярного отдела правого желудочка, в результате чего воз-
растает сброс венозной крови в аорту и усиливается гипоксия ЦНС.
Исходя из такого механизма понятно, что при атрезии легочной арте-
рии нет основы для возникновения приступов. У этих больных усиле-
ние цианоза связано с закрытием или относительным стенозом сосу-
дов, кровоснабжающих легкие (ОАП, коллатерали) и обычно перехо-
дит в гипоксический статус, редко купирующийся самостоятельно.
Следует отметить, что анемия играет существенную роль в клини-
ческой симптоматике заболевания. С одной стороны, она уменьшает ви-
димый цианоз, скрывая тяжесть заболевания, а с другой - уменьшает
возможность доставки кислорода к органам. В результате гипоксиче-
ские приступы у пациентов с анемией возникают чаще, протекают тяже-
лее и чреваты мозговыми осложнениями. У этих больных необходимо
также контролировать возникновение железодефицитного состояния.
Электрокардиография. Изменения ЭКГ неспецифичны. Обыч-
но выявляют отклонение электрической оси вправо, гипертрофию пра-
вого желудочка, замедление внутрижелудочковой проводимости. При
«бледной» форме порока возможны дополнительные признаки пере-
грузки левого желудочка.
Рентгенография грудной клетки. В типичную рентгенографиче-
скую картину грудной клетки при тетраде Фалло входят обедненный ле-
гочный рисунок и небольшое сердце с характерной конфигурацией (в
виде «деревянного башмачка») за счет закругленной, приподнятой над
диафрагмой верхушки и западения дуги легочной артерии (рис. 12-1).
Имеются признаки гипертрофии правого желудочка, левый представ-
лен в виде небольшой «шапочки» во II косой проекции [7].
При бледной форме порока легочный рисунок может быть нор-
мальным или даже усиленным по артериальному руслу с увеличением
тени сердца.
182
Рис. 12-1. Рентгенограммы при тетраде Фалло. А - классическая форма
тетрады Фалло; резкое обеднение легочного рисунка, конфигурация сердца в виде
«деревянного башмачка». Б - бледная форма тетрады Фалло; легочный рисунок не
изменен, поперечник тени сердца умеренно увеличен.
В качестве дополнительных находок можно обнаружить праволе-
жащую дугу аорты и наличие коллатеральных сосудов.
Эхокардиография. Эхокардиография позволяет у большинства
больных поставить диагноз с полнотой, достаточной для определения
стратегии лечения. Можно обнаружить все характерные признаки по-
рока: большой ДМЖП, декстропозицию аорты, наличие легочного сте-
ноза и гипертрофии правого желудочка (рис. 12-2). С помощью цвет-
ной допплерографии можно зафиксировать типичное направление по-
тока крови из правого желудочка в аорту. Наряду с этим выявляется
гипоплазия выводного тракта правого желудочка, ствола и ветвей ле-
гочной артерии.
Пристальное внимание необходимо уделить поискам дополнитель-
ного ДМЖП, положению и ветвлению начальных отделов коронарных
артерий, анатомии атриовентрикулярных клапанов, анатомии легочных
артерий (особенно левой). Радикальная операция возможна только при
удовлетворительном развитии легочного сосудистого русла. В качест-
ве критерия, определяющего возможность радикальной коррекции по-
рока, можно использовать индекс Наката (площадь поперечного сече-
ния правой и левой легочных артерий), который должен составлять не
менее 150 мм/м2 поверхности тела (см. главу 2).
Катетеризация сердца и ангиокардиография. К данному иссле-
дованию прибегают при неудовлетворительной визуализации струк-
тур сердца и сосудов с помощью ЭХОКГ или в случаях, когда обнару-
живают какие-либо дополнительные аномалии (атрезия легочной ар-
терии, ее деформация вследствие предыдущих паллиативных опера-
ций, подозрение на периферические стенозы и т.п.) (рис. 12-3, 12-4).
183
Рис. 12-2. Эхокардиограмма из парастернальной позиции по
длинной оси при тетраде Фалло. Визуализируется большой субаортальный
дефект межжелудочковой перегородки, дскстропозиция аорты (АО), гипертрофия
правого желудочка (ПЖ).
Рис. 12-3. Правая вентрикулография при тетраде Фалло. Стрелками
указаны инфундибулярный стеноз (1) и периферический стеноз левой легочной
артерии (2).
184
Рис. 12-4. Правая вентрикулография при агенезии легочного клапана
и аневризме легочной артерии (А - аксиальная, Б - боковая проекции).
В выводном отделе правого желудочка контрастное вещество размывается струей
крови, возвращающейся через некомпетентный легочный клапан.
Лечение. Терапия направлена на уменьшение гипоксемии и ее по-
следствий. У новорожденных используют введение простагландинов
группы Е с целью поддержать проходимость ОАП и увеличить легоч-
ный кровоток. Дополнительными лечебными факторами является соз-
дание температуры комфорта, седация больного. В результате этого сни-
жаются метаболические потребности организма, уменьшается отно-
сительный дефицит кислорода и напряженность анаэробных процес-
сов. При угрозе закрытия ОАП общий объем кормления и внутривен-
ных инфузий несколько увеличивают (до 110-120% от нормальных по-
требностей) на фоне постоянной оценки диуреза. Данным пациентам
противопоказано назначение оксигенотерапии.
Назначение кислорода возможно при дуктус-независимом легоч-
ном кровотоке, особенно в период возникновения гипоксического при-
ступа. С целью лечения последнего используют также внутривенное
быстрое вливание жидкости (5%-ный раствор глюкозы, физиологиче-
ский раствор - 20-30 мл/кг/час), медикаментозную седацию. К специ-
фической терапии относится введение Р-адреноблокаторов - сначала
внутривенно медленно (0,1 мг/кг), а затем перорально (1 мг/кг/сутки).
Этим больным не следует назначать дигоксин. Увеличивая инотроп-
ную функцию миокарда, он повышает вероятность спазма инфундибу-
лярного отдела правого желудочка. Обязательным компонентом тера-
пии является устранение метаболического ацидоза с помощью гидро-
карбоната натрия (см. главу 5). Первым признаком эффективности ле-
чения приступа служит усиление систолического шума над сердцем.
185
В период относительного благополучия следует обратить внима-
ние на наличие анемии и ее коррекцию.
Хирургическое лечение показано при прогрессирующей гипоксе-
мии, гипоксических приступах, нарушении развития детей. В качестве
экстренной помощи или при плохих анатомических вариантах порока
(выраженная гипоплазия легочных ветвей) прибегают к паллиативным
процедурам. К ним относятся межартериальные анастомозы различ-
ных типов (обычно - модифицированный подключично-легочный ана-
стомоз с использованием протеза Гор-Текс), баллонная дилатация ле-
гочного клапанного стеноза (при отсутствии выраженного инфундибу-
лярного), реконструкция выводного отдела правого желудочка без за-
крытия ДМЖП. В результате достигаются уменьшение артериальной
гипоксемии и рост легочно-артериального дерева [8].
Радикальную операцию выполняют, как правило, после 6 мес, но
до 3-х лет. Цель операции - закрыть ДМЖП и устранить обструкцию
выхода из правого желудочка, избежав при этом возникновения значи-
тельной регургитации, приводящей к дилатации и дисфункции желу-
дочка. Послеоперационная выживаемость к 36 годам составляет не ме-
нее 85% [6]. Основными причинами смертей (30-50%) в этот период
являются застойная сердечная недостаточность и аритмии. Последние
встречаются у 0,5-6% больных. Отдаленные результаты вмешательств
хуже при их выполнении в старшем возрасте (особенно после 20 лет).
Некоторые центры прибегают к ранним радикальным операциям (до
3-6 мес), независимо от симптоматики, обосновывая это большей со-
хранностью правого желудочка (профилактика его гипертрофии и фиб-
роза), нормальным развитием легочных сосудов и альвеол, снижением
частоты послеоперационных аритмий и внезапных смертей [9, 10, 11].
У пациентов с агенезией легочного клапана показано раннее вы-
полнение операции, до развития компрессии трахеобронхиального де-
рева и дыхательной недостаточности. Это позволяет обеспечить нор-
мальное развитие дыхательных путей. Традиционную при тетраде Фал-
ло операцию дополняют пластикой легочных артерий с целью умень-
шения их размера. Некоторые авторы считают необходимым также им-
плантировать искусственный клапан в легочную позицию, однако дру-
гие этого избегают [12].
12.2. Отхождение аорты и легочной артерии от
правого желудочка
Отхождение аорты и легочной артерии от правого желудочка сердца
(двойное отхождение сосудов от правого желудочка, двуотточный пра-
вый желудочек, double outlet right ventricle) - врожденная аномалия серд-
186
ца, которую связывают с отсутствием у плода процесса резорбции буль-
бовентрикулярного гребня, что не позволяет аорте после деления обще-
го артериального ствола переместиться в левый желудочек. Этот гре-
бень в виде мышечной ткани часто вклинивается между аортальным и
митральным клапанами, прерывая митрально-полулунное фиброзное
продолжение. В результате оба магистральных сосуда отходят полно-
стью или преимущественно от правого желудочка (ДОС/ПЖ). Единст-
венным выходом из левого желудочка является дефект межжелудочко-
вой перегородки.
Частота. Частота порока - 0,034-0,08/1000 новорожденных, или
1,5% от всех ВПС. Среди критических ВПС она составляет приблизи-
тельно 3,0%.
Анатомия. Данная патология включает широкий спектр анатоми-
ческих и патофизиологических нарушений. На одном конце спектра
находится большой ДМЖП с «верхом сидящей» над ним аортой (при
отсутствии легочного стеноза) или порок, напоминающий по гемоди-
намике тетраду Фалло (при наличии легочного стеноза), на другом -
транспозиция магистральных артерий с ДМЖП. Кроме того, двойное
отхождение сосудов может встретиться при некоторых вариантах един-
ственного желудочка или корригированной транспозиции магистраль-
ных артерий.
ДМЖП в большинстве случаев находится в коновентрикулярной
зоне; значительно реже - в приточной части перегородки или трабеку-
лярной зоне. В 50% случаев он расположен в субаортальной позиции,
в 30% - в подлегочной, в 10% - прилежит одновременно к аортально-
му и легочному клапанам (субартериальный дефект, doubly committed)
[13, 14]. У 10-20% больных ДМЖП расположен на удалении от полу-
лунных клапанов (несообщающийся дефект, noncommitted), обычно в
приточной части межжелудочковой перегородки. Как правило, такой
дефект сопровождает двойное отхождение сосудов в сочетании с пол-
ной формой атриовентрикулярного канала.
В значительном числе случаев (до 60%) отхождение аорты и ле-
гочной артерии от правого желудочка сочетается с другими сердечны-
ми аномалиями - открытым общим атриовентрикулярным каналом, ано-
малиями коронарных артерий, аномальным дренажом легочных вен,
аномалиями атриовентрикулярных клапанов и т.п.
Гемодинамика. Состояние гемодинамики определяется в основ-
ном положением дефекта в межжелудочковой перегородке и наличием
легочного стеноза (рис. 12-5).
187
А Б В Г
Рис. 12-5. Отхождение аорты и легочной артерии от правого
желудочка. Направление потоков крови в зависимости от топографии дефекта
межжелудочковой перегородки и наличия легочного стеноза. А - подаортальный
ДМЖП; Б - подлегочный ДМЖП; В - несообщающийся ДМЖП; Г - ДМЖП с
легочным стенозом (белая стрелка - артериальная кровь, черная стрелка - венозная
кровь).
Подаортальное положение дефекта определяет попадание артери-
альной крови из левого желудочка преимущественно в аорту, а потока
венозной крови из правого желудочка - в легочную артерию. В этом
случае минимальная артериальная гипоксемия сочетается с легочной
гиперволемией, а в последующем и с легочной гипертензией.
При ДМЖП, расположенном под легочной артерией (аномалия Та-
уссиг-Бинга), в нее нагнетается преимущественно артериальная кровь
из левого желудочка, а в аорту - венозная кровь из правого желудочка.
В этом случае гемодинамика сходна с таковой при транспозиции маги-
стральных артерий, сочетающейся с ДМЖП. У этих больных наряду с
выраженной гипоксемией быстро развивается и высокая легочная ги-
пертензия.
Значительный легочный стеноз или повышенное легочное сопро-
тивление уменьшают кровоток в малом круге кровообращения и воз-
врат оксигенированной крови к сердцу, что приводит к усилению ги-
поксемии.
Остальные (промежуточные) варианты гемодинамических нару-
шений зависят от степени смешивания потоков крови в полости пра-
вого желудочка и ограничения легочного кровотока.
Естественное течение. Во внутриутробном периоде порок суще-
ственно не влияет на развитие плода. Одновременная работа желудоч-
ков позволяет обеспечить адекватный системный кровоток. После ро-
ждения прогноз зависит от анатомического варианта порока. При на-
личии легочного стеноза течение похоже на тетраду Фалло, без стено-
за - на ДМЖП. При аномалии Тауссиг-Бинга прогноз ухудшается из-
188
за выраженной гипоксемии и быстрого развития легочной гипертен-
зии. Также ухудшается прогноз при сопутствующих пороках - коарк-
тации аорты или гипоплазии левого желудочка. В целом, приблизи-
тельно у 90% больных тяжелое состояние развивается на первом году
жизни.
Клиническая симптоматика. Клиническая картина может варь-
ировать в широких пределах. Двойное отхождение сосудов с подаор-
тальным дефектом напоминает изолированный большой ДМЖП: за-
стойная сердечная недостаточность (одышка, тахикардия, увеличение
печени), рецидивирующие пневмонии, гипотрофия. У новорожденных
с повышенным ОЛС может возникать и небольшой цианоз, преходя-
щий со временем.
Сопутствующий стеноз легочной артерии смещает симптоматику
в сторону тетрады Фалло - менее выраженная сердечная недостаточ-
ность, значительная артериальная гипоксемия, редкие гипоксические
приступы.
Клиническая картина при аномалии Тауссиг-Бинга характеризу-
ется цианозом, сердечной недостаточностью и легочной гипертензи-
ей, представленными в различных комбинациях.
В соответствии с анатомическими вариантами представлена и ау-
скультативная картина порока (см. соответствующие главы).
Электрокардиография. Электрокардиограмма малоспецифична.
Наиболее часто отмечают отклонение электрической оси сердца впра-
во с признаками гипертрофии правого желудочка, замедлением атрио-
вентрикулярной проводимости. Гипертрофия левого желудочка с со-
ответствующими изменениями на ЭКГ возникает при его повышен-
ной работе, в частности при небольшом ДМЖП, создающем препятст-
вие для опорожнения желудочка.
Рентгенография грудной клетки. Рентгенологическая картина не-
специфична и может соответствовать всему перечисленному спектру
пороков: ДМЖП, тетраде Фалло, транспозиции магистральных арте-
рий с ДМЖП. Оценка величины легочного кровотока может быть по-
лезна при определении тактики лечения.
Эхокардиография. Проблемы диагностики в основном связаны с
невозможностью одновременного выведения обоих магистральных со-
судов и межжелудочковой перегородки (рис. 12-6). Таким образом, ди-
агноз складывается из информации, полученной из разных сечений
сердца. Характерным признаком двойного отхождения сосудов от пра-
вого желудочка является отсутствие митрально-аортального продол-
жения (рис. 12-7).
189
Рис. 12-6. Эхокардиограмма из парастернальной позиции по
короткой оси при двойном отхождении магистральных сосудов от
правого желудочка. Легочная артерия и аорта отходят от правого желудочка;
сосуды лежат параллельно, клапаны находятся на одном уровне.
Рис. 12-7. Эхокардиограмма из верхушечной двухкамерной позиции
при двойном отхождении магистральных сосудов от правого желудочка.
Лоцируется нарушение митрально-аортального контакта в виде мышечного
«мостика» (указано стрелкой).
Магистральные сосуды обычно лежат параллельно, их клапаны
находятся на одном уровне. Необходимо определить положение ДМЖП
и его соотношение с полулунными клапанами: подаортальный ДМЖП,
подлегочный, подартериальный (doubly committed), несообщающийся
190
(некоммитированный, noncommitted). Последний обычно расположен
в приточной зоне перегородки, в среднемышечной или верхушечной
ее частях. Важной характеристикой является также расстояние от три-
куспидального до легочного клапана, определяющее возможность внут-
рижелудочковой коррекции порока (рис. 12-8).
А Б
Рис. 12-8. Варианты расположения трикуспидального и легочного
клапанов при отхождении аорты и легочной артерии от правого желу-
дочка. А - расстояние между клапанами больше диаметра внутрижелудочкового
туннеля, возможна внутрижелудочковая коррекция; Б - небольшое расстояние меж-
ду клапанами препятствует нормальной проходимости туннеля. Ао - аорта,
ЛА - легочная артерия, ТК - трикуспидальный клапан, ДМЖП - дефект межжелу-
дочковой перегородки.
Данное расстояние должно быть больше диаметра аортального кла-
пана для предотвращения обструкции туннеля из левого желудочка в
аорту. В противном случае необходимо будет выполнить дополнитель-
ную процедуру по соединению правого желудочка и легочной артерии
с помощью наружного кондуита или операцию переключения аорты и
легочной артерии. Важными аспектами диагностики являются также
оценка степени легочного стеноза, состояния митрального и трикус-
пидального клапанов (их компетентности, мест прикрепления хорд и
папиллярных мышц).
Катетеризация сердца и ангиокардиография. При катетеризации
сердца выявляют равное давление в обоих желудочках, аорте и легоч-
ной артерии (при отсутствии ее стеноза). Возможно наличие градиента
давления между левым желудочком и аортой (или правым желудочком)
при рестриктивном характере ДМЖП. Наиболее важной для диагности-
ки двойного отхождения является правая вентрикулография, при кото-
рой одновременно контрастируются аорта и легочная артерия (рис. 12-9).
191
Рис. 12-9. Ангиокардиография при отхождении аорты и легочной
артерии от правого желудочка. А - единственным выходом из левого желудочка
является ДМЖП, через который контрастируется правый желудочек; Б - в
последующем одновременно контрастируются аорта и легочная артерия.
При этом в боковой проекции определяется дефект наполнения
между митральным и аортальным клапанами, свидетельствующий об
отсутствии митрально-аортального продолжения. В случае транспози-
ции магистральных артерий (аномалии Тауссиг-Бинга) регистрируют
отсутствие митрально-легочного продолжения. При левой вентрику-
лографии отмечают, что единственным путем оттока крови из желу-
дочка является ДМЖП.
Лечение. Терапевтическое лечение проводится по принципам, из-
ложенным для ДМЖП или цианотических ВПС (тетрада Фалло, транс-
позиция магистральных артерий). Показания к хирургическому лече-
нию также аналогичны. При длительном выживании возникает опас-
ность бактериального эндокардита, в связи с чем показана профилак-
тика антибиотиками.
Паллиативные операции заключаются в наложении межартериаль-
ного анастомоза при легочном стенозе или суживании легочной арте-
рии при увеличенном легочном кровотоке. Радикальную коррекцию в
большинстве случаев выполняют, создавая внутрижелудочковый тун-
нель от ДМЖП до устья аорты (закрытие дефекта обычной заплатой
чревато возникновением обструкции для потока крови в аорту). В слу-
чаях, когда туннель располагается на путях оттока крови в легочный
ствол (см. рис. 12-8), приходится прибегать к экстракардиальному со-
общению правого желудочка с легочной артерией с помощью кондуи-
та. При аномалии Тауссиг-Бинга «туннелируют» ДМЖП с легочной
артерией и выполняют артериальное или предсердное переключение.
192
В редких случаях, связанных с гипоплазией одного из желудочков или
множественными ДМЖП, выполняют операцию гемодинамической
коррекции по принципу Фонтена.
В связи с многообразием анатомических вариаций при отхожде-
нии аорты и легочной артерии от правого желудочка разработаны со-
ответствующие варианты радикальных хирургических вмешательств
(операция Damus-Kaye-Stansel, Abe и Doty и т.д.). Однако они исполь-
зуются сравнительно редко и соответственно редко встречаются в прак-
тике детского кардиолога.
12.3. Транспозиция магистральных артерий
Транспозиция магистральных артерий (ТМА) представляет собой
порок, при котором аорта отходит от морфологически правого желу-
дочка и несет венозную кровь к тканям организма, а легочная артерия
отходит от морфологически левого желудочка и несет артериальную
кровь к легким. В литературе встречаются также термины «простая
транспозиция», «полная транспозиция магистральных сосудов»,
«d-транспозиция», «физиологически некорригированная транспози-
ция».
Частота. Среди новорожденных частота ТМА составляет 0,22-
0,33/1000, среди всех ВПС - 6-7%, среди критических ВПС - до 23%.
У мальчиков порок встречается в 2-3 раза чаще, чем у девочек.
Анатомия. При данной патологии существуют нормальные (кон-
кордантные) соединения полых вен с правым предсердием, легочных
вен - с левым предсердием и предсердий - с желудочками. Однако
между желудочками и магистральными сосудами имеется дискордант-
ность; в результате этого выводные отделы желудочков не пересека-
ются, в контакте с митральным клапаном находится легочный клапан
(в нормальном сердце - аортальный клапан). В большинстве случаев
аорта расположена кпереди от легочной артерии, чаще справа (D-транс-
позиция), реже лежит прямо перед легочным стволом (0-транспози-
ция) или слева от него (L-транспозиция). Однако описаны случаи с их
положением бок о бок и с «задней» аортой. Коронарные артерии также
имеют свои особенности. У 99% пациентов доминирует правый тип
коронарного кровообращения. В 20% случаев артерии отходят танген-
циально (под острым углом) от стенки аортального синуса, а в 3-5% -
идут интрамурально. Кроме того, возможна единственная коронарная
артерия с относительно узким устьем. При двух последних патологиях
высок риск ишемии миокарда и внезапной смерти; кроме того, в этих
случаях затруднено оперативное вмешательство [15].
193
Наличие открытого овального окна является обязательным для вы-
живания больных; настоящий дефект межпредсердной перегородки
встречается у 10-20% из них. В большинстве наблюдений межжелу-
дочковая перегородка интактна. В 35-45% случаев имеется ДМЖП,
однако в трети случаев он небольшой и гемодинамически малозначим.
Сужение выводного отдела левого желудочка встречается у 25%
больных, в том числе у 5% при интактной межжелудочковой перего-
родке и у 30% при сопутствующем ДМЖП. Примерно у 20% новорож-
денных с высокой резистентностью легочных сосудов сужение носит
динамический характер (за счет смещения межжелудочковой перего-
родки) и может исчезать через несколько недель.
Из сопутствующих ВПС наиболее часто встречаются ОАП (50%),
коарктация или перерыв дуги аорты (5%), аномалии трикуспидально-
го клапана (4%), реже - аномальный дренаж легочных вен и некоторые
другие пороки.
Гемодинамика. Нарушения гемодинамики во многом определя-
ются конкретно представленным вариантом порока:
1) ТМА с интактной межжелудочковой перегородкой;
2) ТМА с интактной межжелудочковой перегородкой и сужением
выводного отдела левого желудочка;
3) ТМА с ДМЖП;
4) ТМА с ДМЖП и сужением выводного отдела левого желудочка.
Однако основой нарушений является анатомическое разделение
малого и большого кругов кровообращения. Венозная кровь, приходя-
щая в правый желудочек, поступает в аорту и, пройдя большой круг
кровообращения, через полые вены вновь возвращается в правые от-
делы сердца. Артериальная кровь, приходящая в левый желудочек, по-
ступает в легочную артерию и, пройдя малый круг кровообращения,
через легочные вены вновь возвращается в левые отделы сердца (рис.
12-10). Таким образом, в БКК постоянно циркулирует кровь с низким
содержанием кислорода, а в МКК - с высоким.
Естественно, при таких обстоятельствах длительное существова-
ние организма невозможно. Условием его выживания является нали-
чие коммуникаций между кругами кровообращения, наиболее часто -
открытого овального окна. При этом необходимо наличие двухсторон-
него сброса (так как односторонний сброс привел бы к переполнению
одного из кругов кровообращения); от объема потоков, которыми «об-
мениваются» правые и левые отделы сердца, зависит уровень систем-
ной гипоксемии. В наилучшей степени двухсторонний кровоток обес-
печивает межпредсердное сообщение, так как давление в предсердиях
в норме низкое, и его изменение даже на 1 мм рт. ст. сказывается на
направлении потока крови.
194
Рис. 12-10. Схема кровообращения при простой транспозиции
магистральных артерий (А) и в сочетании с открытым артериальным
протоком (Б). Объяснения в тексте.
Выживание пациентов возможно и в отсутствие межпредсердно-
го сообщения, но при наличии ОАП или ДМЖП. При этом направле-
ние движения крови сильно зависит от фаз сердечного цикла, сбалан-
сированность давлений очень тонкая и состояние больных легко ухуд-
шается при малейшем напряжении. Оптимальным для гемодинамики
является сочетание открытого овального окна с небольшим ОАП
(рис. 12-10). При этом приток венозной крови в легкие осуществляет-
ся преимущественно через ОАП, а артериальной в большой круг кро-
вообращения - через открытое овальное окно.
У больных с ТМА существует резкий контраст между газовым со-
ставом крови в легочных венах и аорте. Так как газообмен в легких не
нарушен, в оттекающей от них крови рО2 может достигать НО мм рт.
ст., рСО2 составляет 15-25 мм рт. ст. В системной «артериальной» кро-
ви рО2 редко превышает 35 мм рт. ст., рСО2 - около 45 мм рт.ст. При
дыхании 100% кислородом системное рО2 обычно поднимается не бо-
лее чем на 5-10 мм рт.ст. и отражает величину межциркуляторного
смешивания крови.
Так как величина сообщения между большим и малым кругами
кровообращения обычно недостаточна для компенсации гипоксемии,
организм пытается возместить недостаток кислорода за счет увеличе-
ния минутного объема, что приводит к умеренному усилению легочно-
го кровотока. Значительная гиперволемия МКК возникает при большом
диаметре ОАП или ДМЖП. У пациентов с некорригированной ТМА и
ДМЖП высокая легочная гипертензия развивается быстрей, чем при
бледных пороках с усиленным легочным кровотоком. При сужении вы-
хода из левого желудочка и уменьшении легочного кровотока уровень
гипоксемии существенно не меняется, однако легочные сосуды оказы-
ваются защищены от развития высокой гипертензии.
195
Другой чертой ТМА является доминирующее кровоснабжение пра-
вого легкого, что постепенно приводит к относительной гипоплазии
системы левой легочной артерии.
Естественное течение. В силу особенностей внутриутробного кро-
вообращения ТМА практически не влияет на развитие плода, верхняя
и нижняя половины тела оксигенируются адекватно. Ребенок рожда-
ется в срок, с хорошим весом. В первые часы после рождения давле-
ние в правом предсердии сохраняется высоким, так как не возникает
обычного для новорожденных резкого перераспределения крови в сто-
рону легких. В связи с этим, а также из-за отсутствия большого воз-
врата из легких в левое предсердие не происходит быстрого закрытия
клапана овального окна. Кроме того, через ОАП существует двунаправ-
ленный поток крови (в систолу - из легочной артерии в нисходящую
аорту, в диастолу - из аорты в легочную артерию). Эти механизмы под-
держивают некоторое время удовлетворительную системную оксиге-
нацию крови. Однако уже через несколько часов развивается дефицит
кислорода, возрастают анаэробный метаболизм и продукция лактата,
истощаются запасы гликогена. Развиваются метаболический ацидоз и
нарушения функции клеток. Это сопровождается быстрой гибелью
больных: 30% умирают на первой неделе жизни, 50% - в периоде но-
ворожденное™ и 90% - в течение первого года жизни.
Относительно благоприятный прогноз имеют больные с большим
межпредсердным сообщением или при комбинации ДМЖП с умерен-
ным легочным стенозом. При изолированном большом ДМЖП легоч-
ная гипертензия определяется уже к 3-4 мес и быстро приобретает скле-
розирующий характер. В связи с этим операцию рекомендуют выпол-
нять в грудном возрасте.
Клиническая симптоматика. Диагноз транспозиции магистраль-
ных артерий, как правило, возможно поставить уже в роддоме. Основа-
нием служит появление выраженного цианоза, одышки, тахикардии че-
рез 1-2 часа после пережатия пуповины у ребенка, которого первона-
чально расценивали как нормального. Шум в сердце выслушивается в
редких случаях (около 25% больных) и обычно отражает наличие других
ВПС - легочного стеноза, ОАП, ДМЖП. Прогрессирующее ухудшение
состояния обычно связано с закрытием ОАП и недостаточным диамет-
ром межпредсердного сообщения. Состояние таких детей характеризу-
ется вялостью, заторможенностью; они легко охлаждаются. В некото-
рых наблюдениях, наоборот, отмечают повышенное беспокойство па-
циентов, связанное с гипоксией ЦНС. При сочетании ТМА с предук-
тальной коарктацией аорты и ОАП возможен дифференцированный циа-
ноз (нижняя половина туловища более розовая, чем верхняя).
196
При выживании детей в течение нескольких недель могут нарас-
тать симптомы сердечной недостаточности с развитием кардиомега-
лии, увеличением печени, хрипами в легких. Особенно это характерно
для сопутствующего большого ДМЖП. При ограниченном легочном
кровотоке (легочный стеноз) одышка выражена меньше. К двум-трем
месяцам можно отметить признаки гипотрофии, задержки моторного
развития. С четырех-шести месяцев появляются симптомы «барабан-
ных палочек» и «часовых стекол». Одышечно-цианотические присту-
пы для ТМА не характерны.
Электрокардиография. ЭКГ неспецифична, у новорожденных со-
ответствует норме с обычным отклонением электрической оси сердца
вправо. В последующем могут появиться и персистировать признаки
гипертрофии правого желудочка и предсердия. При ДМЖП или ОАП
с увеличенным легочным кровотоком появляются данные о гипертро-
фии обоих желудочков.
Рентгенография грудной клетки. Рентгенографическая картина
легких может меняться по мере роста ребенка. У новорожденных ле-
гочный рисунок нормальный. К концу первого месяца в большинстве
случаев отмечается усиление легочного рисунка по артериальному ти-
пу (особенно при сопутствующих ОАП и ДМЖП), реже возникают сим-
птомы венозного застоя (рис. 12-11). Тень сердца несколько расшире-
на в поперечнике, имеет характерный овоидный вид («яйцо, лежащее
на боку»). Сосудистый пучок в переднезадней проекции узкий, в боко-
вой - широкий. При ДМЖП специфический характер конфигурации
сердца теряется.
Рис. 12-11. Рентгенограммы при изолированной транспозиции
магистральных артерий (А) и при транспозиции магистральных артерий
в сочетании с дефектом межжелудочковой перегородки (Б). Объяснения
в тексте.
197
Эхокардиография. Диагностика основана на идентификации мор-
фологии желудочков и отходящих от них магистральных сосудов. Ха-
рактерен параллельный ход выводных отделов желудочков и обоих со-
судов в проекции длинной оси левого желудочка (рис. 12-12).
Рис. 12-12. Эхокардиограмма из нестандартной парастернальной
позиции по длинной оси магистральных сосудов при транспозиции
магистральных артерий. Нормальное взаимное расположение желудочков;
инверсия магистральных сосудов: аорта отходит от правого желудочка, легочная
артерия - от левого; выводные отделы желудочков и магистральные сосуды
расположены параллельно друг другу. LV - левый желудочек, RV - правый желудочек,
РА - легочная артерия, Ао - аорта.
При этом определяется отхождение легочной артерии от левого
желудочка с наличием митрально-легочного продолжения. В дальней-
шем анализируют величину и функцию открытого овального окна, на-
личие ОАП, ДМЖП и легочного стеноза, других сопутствующих пато-
логий (наиболее значимая - коарктация аорты). При планировании ана-
томической коррекция ТМА важной является информация о массе мио-
карда левого желудочка и давлении в его полости, а также о коронар-
ных артериях (количество, место отхождения, деления, интрамураль-
ный ход). Можно рассчитывать на сохранение достаточной насосной
функции левого желудочка, если он развивает давление не менее 70%
от системного.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание долгое время было основным в диагностике ТМА (рис. 12-13).
Однако в последнее время оно теряет свое значение в связи с развити-
ем эхокардиографии. Используется в основном для проведения проце-
дуры Рашкинда и диагностики сложных сопутствующих ВПС.
198
Рис. 12-13. Ангиокардиография при транспозиции магистральных
артерий. А - от левого желудочка отходит легочная артерия; Б - от правого желудочка
отходит аорта.
Лечение. Терапия направлена на снижение потребностей организ-
ма в кислороде, коррекцию метаболических нарушений и концентра-
ции гемоглобина, а также улучшение межсистемного смешивания кро-
ви. Ребенку необходимо создать комфортные температурные условия,
ограничить его физическую активность. Важными элементами явля-
ются обеспечение нормального объема циркулирующей крови (с по-
мощью инфузионной терапии). При наличии симптомов сердечной не-
достаточности, наоборот, применяют дигоксин и диуретики. Оксиге-
нотерапия малоэффективна.
Последующее лечение направлено на создание и поддержание меж-
системных коммуникаций. С этой целью используют инфузию простаг-
ландинов группы Е для улучшения проходимости ОАП, а также за-
крытую атриосептостомию с помощью специального баллона (проце-
дуру Рашкинда) для увеличения межпредсердного сообщения. Послед-
нюю процедуру по классической методике проводят в рентгеноопера-
ционной под радиологическим контролем. В современных условиях
более целесообразно выполнять ее в условиях палаты интенсивной те-
рапии под контролем ультразвука, что позволяет исключить рентгенов-
ское облучение, четко визуализировать положение баллона относитель-
но внутрисердечных структур, предотвращая их повреждение, и оце-
нивать анатомический эффект непосредственно во время септостомии
[16] (рис. 12-14).
Проведение процедуры без интубации дает возможность быстро
активизировать больных. Эффективной считают процедуру, после ко-
199
торой SO2 повысилось на 10% и более и не развивается метаболиче-
ский ацидоз. Косвенными признаками успешной процедуры являют-
ся: увеличение потока через межпредсердное сообщение, определяе-
мое с помощью цветной допплерографии, появление флотирующих кра-
ев перегородки в области отверстия, изменение относительных разме-
ров предсердий.
Рис. 12-14. Этапы процедуры Рашкинда. 1 - небольшое межпредсердное
сообщение (указано стрелкой); 2 - в полость левого предсердия проведен баллон и
заполнен физиологическим раствором; 3, 4 - после разрыва определяются
флотирующие края межпредсердной перегородки (отмечены стрелками).
В случаях ригидной межпредсердной перегородки возможно при-
менение ножевой атриосептостомии или дилатации отверстия балло-
ном высокого давления [17, 18].
Следует отметить, что активное применение простагландинов в
условиях малого межпредсердного сообщения может быть опасным.
Это связано с тем, что большой сброс через ОАП, приводящий к уве-
личенному возврату крови из легких в левое предсердие, сопровожда-
ется неадекватным опорожнением последнего и чреват развитием оте-
ка легких [19].
Показанием к оперативной коррекции служит само наличие ТМА,
сопровождающейся выраженной гипоксемией. Существуют вмешатель-
200
ства, лишь улучшающие смешивание крови между кругами кровооб-
ращения: 1) операция Блелока-Ханлона (иссечение межпредсердной
перегородки); 2) наложение межартериального анастомоза (наиболее
часто применяется при ТМА с ДМЖП и легочным стенозом). К вме-
шательствам, полностью устраняющим гипоксемию, относятся опера-
ции Мастарда и Сеннинга (предсердное переключение, или гемодина-
мическая коррекция), а также операция анатомической коррекции по-
рока (артериальное переключение, операция Jatene). Последняя пред-
почтительнее, так как в качестве системного используется левый же-
лудочек сердца. Следует, однако, помнить, что при естественном тече-
нии ТМА левый желудочек быстро теряет свою мощную насосную
функцию, так как нагнетает кровь в легочные сосуды с низким сопро-
тивлением. Поэтому артериальное переключение возможно только в
пределах первого месяца жизни. При наличии ДМЖП или легочного
стеноза нагрузка на левый желудочек сохраняется, анатомическая кор-
рекция (с закрытием ДМЖП) допустима и в более поздние сроки. Про-
тивопоказанием к такой операции служит выраженная дисфункция ле-
гочного клапана, который должен будет исполнять роль аортального.
После гемодинамической коррекции (предсердное переключение)
системным желудочком остается правый. Так как филогенетически он
не предназначен для работы в условиях высокого давления, его насос-
ная функция и функция трикуспидального клапана постепенно ухуд-
шаются, часто развиваются нарушения ритма сердца. Это не позволя-
ет надеяться на долговременный хороший результат при данном типе
операций.
У пациентов старшего возраста с выраженным легочным стено-
зом и ДМЖП выполняют операцию Растелли. Коррекция включает соз-
дание внутрисердечного «туннеля» для оттока крови из левого желу-
дочка в аорту, разобщение левого желудочка и легочного ствола и им-
плантацию кондуита между правым желудочком и легочным стволом.
В варианте Lecompte правый желудочек непосредственно соединяют с
легочным стволом.
Транспозицию магистральных артерий с ДМЖП и выраженным
субаортальным стенозом корригируют с помощью операции Damus-
Kaye-Stansel. При этом соединяют проксимальную часть легочного
ствола с восходящей аортой, закрывают ДМЖП и соединяют кондуи-
том правый желудочек с дистальной частью легочной артерии.
В случаях большого ДМЖП с гипоплазированным правым желу-
дочком или «верхом сидящим» атриовентрикулярным клапаном выпол-
няют операцию типа операции Фонтена.
201
12.4. Общий артериальный ствол
Общий артериальный ствол (ОАС) - это врожденный порок серд-
ца, при котором от основания сердца отходит один сосуд, обеспечи-
вающий системное, легочное и коронарное кровообращение
(рис. 12-15). Другое название порока - персистирующий артериальный
ствол (persistent truncus arteriosus).
легочная
артерия
коронарные
артерии
общий
клапан
Рис. 12-15. Схема общего артериального ствола.
Частота. Частота патологии составляет 0,03-0,07/1000 живорож-
денных, а среди всех ВПС - около 1,1%. В то же время, среди критиче-
ских пороков у грудных детей частота общего артериального ствола
повышается до 3%, что свидетельствует о тяжести гемодинамических
расстройств при этой патологии.
Анатомия. Ствол имеет единственный клапан, в котором насчи-
тывают от двух до шести створок (наиболее часто - четыре). Створки
могут быть нормальными, утолщенными или дисплазированными. Не-
редко уже в периоде новорожденности имеется выраженная недоста-
точность клапана. С возрастом деформация створок нарастает, возмож-
но развитие кальциноза. ДМЖП присутствует в подавляющем боль-
шинстве наблюдений, располагаясь непосредственно под клапаном.
Ствол как бы «сидит верхом» над дефектом, отходя преимущественно
от правого желудочка или в равной мере от обоих (более 80% случаев),
и лишь примерно в 16% случаев смещен в сторону левого желудочка.
Однако описаны случаи и отсутствия ДМЖП. При этом аортальный и
легочный клапаны сформированы раздельно, но объединены в общий
клапан (тип В по Van Praagh).
Порок часто сопровождается аномалиями дуги аорты: праворас-
положенной дугой, коарктацией аорты, сосудистым кольцом. Наибо-
лее важной из них является перерыв дуги аорты (10-20%). Возможны
202
также сочетания с открытым общим атриовентрикулярным каналом,
аномальным дренажом легочных вен, гипоплазией одного из желудоч-
ков, единственным желудочком, аномалиями коронарных артерий.
Классификация. Многообразие форм общего артериального ство-
ла определяется в первую очередь нарушением формирования легоч-
ных артерий. В связи с этим Collett R.W. и Edwards J.E. выделили че-
тыре типа общего артериального ствола (I, II, III, IV) с несколькими
подтипами (рис. 12-16). Однако в последующем было доказано, что
тип IV относится к другой патологии - атрезии легочной артерии.
II III IV
Рис. 12-16. Типы общего артериального ствола (по Collett R.W. и
Edwards J.E.): I - легочные артерии отходят от короткого легочного ствола;
II - левая и правая легочные артерии отходят раздельно от задней стенки ствола;
III - одна или обе легочные артерии отходят от боковых стенок ствола; IV - отсутствие
легочных артерий, кровоснабжение легких осуществляется через бронхиальные
артерии, отходящие от нисходящей аорты.
Van Praagh et al. помимо выделения трех основных типов (А1-
АЗ), определяемых вариантом отхождения легочных артерий, обрати-
ли внимание также на наличие ДМЖП (тип А) или его отсутствие (тип
В), а также выделили тип А4, при котором имеется гипоплазия или
перерыв дуги аорты. В дальнейшем Van Praagh несколько видоизме-
нил классификацию, предложив выделять три основные группы, что в
достаточной мере отражает потребности хирургов [20] (табл. 12-1).
Гемодинамика. Во внутриутробном периоде общий артериальный
ствол существенно не влияет на состояние плода. Имеется адекватное
системное кровоснабжение, а через легкие протекает небольшое коли-
чество крови, соответствующее нормальной физиологии. Объемная пе-
регрузка желудочков возникает только в случае недостаточности трун-
кального клапана. После рождения с началом функционирования лег-
ких резистентность легочного сосудистого русла падает, и легочный
кровоток прогрессивно возрастает. Возникают резкая гиперволемия ма-
лого круга кровообращения и объемная перегрузка левого желудочка.
203
Правый желудочек, в свою очередь, вынужден преодолевать систем-
ное сопротивление, нагнетая кровь в общий ствол, что приводит к его
гипертрофии и дилатации. Объемная нагрузка на желудочки еще боль-
ше возрастает при недостаточности трункального клапана. Все это при-
водит к развитию застойной сердечной недостаточности.
Таблица 12-1
Классш )икация общего артериального ствола.
Collet and Edvards Van Praagh Модифицированная классификация Van Praagh
Типы I, II, III Типы Al, А2 ОАС со сливающимися или близко расположенными легочными артериями
- Тип АЗ ОАС с отсутствием одной легочной артерии*
- Тип А4 ОАС с перерывом дуги аорты или выраженной коарктацией аорты
Примечание. * одна из истинных легочных артерий отходит не от ОАС, а оз
дистальной части аорты, или от ОАП.
В связи с высоким легочным кровотоком оксигенация крови су-
щественно не нарушается, SO2 составляет 90-96%. Однако течение та-
кого варианта порока характеризуется быстрым развитием высокой ле-
гочной гипертензии с переходом в склеротическую фазу.
При наличии сужения легочных артерий, сопровождающегося нор-
мальным или даже уменьшенным легочным кровотоком, сердечная не-
достаточность обычно слабо выражена, сосуды легких относительно
защищены. Однако в этих случаях быстро возникает артериальная ги-
поксемия.
Естественное течение. Общий артериальный ствол в 97% случа-
ев сопровождается развитием критических состояний у грудных де-
тей. Около 40% из них умирают в течение первой недели жизни. К
концу первого года в живых остаются не более 13% пациентов. Отно-
сительно длительная выживаемость наблюдается при нормальном ле-
гочном кровотоке, что обычно сопряжено с выраженными стенозами
легочных артерий или рано (в 4-6 мес) возникшими склеротическими
изменениями сосудов.
Клиническая симптоматика. По клиническим проявлениям по-
рок похож на большой ДМЖП. Первыми симптомами являются одыш-
ка, тахикардия. Возможен цианоз, степень которого варьирует в зави-
симости от степени ограничения легочного кровотока. Тоны сердца
громкие, II тон никогда не расщеплен. Имеется систолический шум в
третьем-четвертом межреберьях слева от грудины.
204
При большом легочном кровотоке быстро развиваются кардиоме-
галия и сердечный горб. При этом аускультативная картина несколько
меняется: возникает ритм галопа, мезодиастолический шум относитель-
ного митрального стеноза на верхушке, иногда определяется дрожа-
ние на верхушке.
Недостаточность трункального клапана характеризуется протодиа-
столическим шумом вдоль левого края грудины, высоким перифери-
ческим пульсом, увеличенным пульсовым давлением. Для порока ха-
рактерно быстрое развитие бивентрикулярной сердечной недостаточ-
ности.
Электрокардиография. ЭКГ неспецифична. Электрическая ось
сердца отклонена вправо или расположена нормально. В большинстве
случаев преобладают признаки комбинированной гипертрофии желу-
дочков и левого предсердия. Изолированные перегрузки правого или
левого желудочков встречаются реже.
Рентгенография грудной клетки. На рентгенограмме грудной
клетки обычно выявляется усиленный легочный рисунок. Тень сердца
умеренно увеличена, сосудистый пучок узкий. Определенное диагно-
стическое значение имеет высокое положение левой легочной артерии.
Примерно у трети пациентов имеются признаки правостороннего рас-
положения дуги аорты.
Сосудистый рисунок легких может быть нормальным или умень-
шенным при стенозе легочных артерий. При длительном выживании
больных и развитии склеротической фазы легочной гипертензии воз-
никает обеднение рисунка по периферии при его усилении в прикор-
невых зонах.
Эхокардиография. При данном исследовании в первую очередь
обнаруживают большой подартериальный ДМЖП и расширенный,
«верхом сидящий» на нем единственный сосуд. Второй полулунный
клапан отсутствует. При продолжении исследования возможно просле-
дить легочные артерии, отходящие от задней или боковой стенки арте-
риального ствола (рис. 12-17).
Необходимо оценить состояние трункального клапана: количест-
во створок, наличие их дисплазии, регургитации или стеноза на клапа-
не. Важно также исключить гипоплазию какого-либо из желудочков. В
последующем определяют наличие сопутствующих ВПС (патология
дуги аорты, ее ветвей, коронарных артерий, ДМПП и т.д.).
Катетеризация сердца и ангиокардиография. При катетериза-
ции сердца определяется равное давление в левом и правом желудоч-
ках и артериальном стволе. Так как имеется ДМЖП, повышение насы-
205
щения крови кислородом начинается с правого желудочка. В стволе
SO2 составляет 90-96%. Снижение этого насыщения менее 80% свиде-
тельствует о выраженном легочном стенозе или склеротических изме-
нениях легочных сосудов.
Рис. 12-17. Эхокардиограмма из высокой парастернальной позиции
по короткой оси при общем артериальном стволе. Визуализируется
отхождение главной легочной артерии позади общего артериального ствола с
последующим делением ее на ветви.
Правая вентрикулография или аортография (трункография) позво-
ляют определить тип общего артериального ствола, ход коронарных
сосудов, степень недостаточности трункального клапана.
Лечение. Терапевтическое лечение малоэффективно, особенно при
недостаточности полулунных клапанов. Мероприятия должны быть на-
правлены на снижение метаболических потребностей организма (тем-
пературный комфорт, ограничение физической активности ребенка),
снижение ОЦК (диуретики) и резистентности системных сосудов (ин-
гибиторы АПФ). Однако, как правило, эти меры результативны лишь в
течение короткого периода времени. Лучше поддаются терапии боль-
ные со стенозами легочных артерий. При длительном выживании по-
казана профилактика бактериального эндокардита с помощью анти-
биотиков.
В качестве оперативного лечения у маленьких детей ранее прибе-
гали к различным вариантам сужения легочных артерий с целью умень-
шения легочного кровотока и предотвращения развития склероза ле-
гочных сосудов. Однако это приводило к деформации легочных арте-
рий, не всегда предотвращало прогрессирование легочной гипертен-
206
зии и сопровождалось высокой летальностью. Поэтому данная опера-
ция в настоящее время выполняется только как вынужденное вмеша-
тельство. В большинстве клиник предпочитают выполнять радикаль-
ную коррекцию порока начиная с периода новорожденности. Опера-
ция заключается в отделении легочных артерий от артериального ство-
ла, их соединении с правым желудочком, часто (но не всегда) с исполь-
зованием кондуита, и закрытии ДМЖП. У 12-23% больных необходи-
ма также пластика или протезирование трункального клапана
вследствие его недостаточности [21, 22]. Успех операции зависит от
массы тела больного, степени легочной гипертензии, наличия анома-
лий коронарных артерий, других сопутствующих ВПС.
Летальность после операций остается высокой даже в ведущих
клиниках мира. Так, по данным пяти центров Великобритании, смерт-
ность после коррекции ОАС в среднем в 7,8 раза выше, чем после кор-
рекции ДМЖП, АВК, тетрады Фалло или ТМА [23].
12.5. Корригированная транспозиция
магистральных артерий
Корригированная транспозиция магистральных артерий (КТМА)
- врожденный порок сердца, характеризующийся предсердно-желудоч-
ковой и желудочково-артериальной дискордантностью. В зарубежной
литературе также встречаются термины «двойная дискордантность»,
«инверсия желудочков», «физиологически корригированная транспо-
зиция», «атриовентрикулярная дискордантность с транспозицией».
Частота. Частота порока составляет 0,02-0,03/1000 новорожден-
ных или 0,04-0,7% среди всех ВПС.
Анатомия. При данном пороке предсердие системных вен (пра-
вое предсердие) соединяется с морфологически левым желудочком, со-
держащим митральный клапан, а предсердие легочных вен (левое пред-
сердие) соединяется с морфологически правым желудочком, содержа-
щим трикуспидальный клапан. Соединения желудочков с магистраль-
ными артериями также дискордантны: аорта отходит от правого, а ле-
гочная артерия - от левого желудочка (рис. 12-18).
Сосуды идут параллельно, не перекрещиваясь, как в норме. Наи-
более часто аорта расположена спереди и слева, легочная артерия -
сзади и справа.
Так как при КТМА имеются изменения в топографии межжелу-
дочковой перегородки, это сопровождается изменениями в проводя-
207
щей системе сердца, предрасполагающими к нарушениям ритма. Час-
тое развитие фиброза в области пучка Гиса приводит к полной атрио-
вентрикулярной блокаде.
Рис. 12-18. Схема корригированной транспозиции магистральных
артерий (объяснения в тексте).
Более чем 90% пациентов имеют отклонения в развитии систем-
ного или «левого», (трикуспидального) клапана. Это может быть де-
формация створок или смещение клапана по типу аномалии Эбштей-
на. Однако значительная регургитация на клапане встречается лишь в
третьей части случаев. Другими частыми сопутствующими патология-
ми являются ДМЖП (75-90%) и обструкция выхода из левого желу-
дочка в легочную артерию (50%). Стеноз чаще подклапанный, реже -
клапанный. Таким образом, возможны различные комбинации порока
(КТМА плюс ДМЖП, КТМА плюс легочный стеноз, КТМА плюс
ДМЖП, плюс легочный стеноз, КТМА плюс недостаточность систем-
ного клапана и т.п.).
Распределение коронарных артерий конкордантно желудочкам.
Среди прочих сопутствующих пороков встречаются ДМПП, ОАП,
коарктация аорты, субаортальный стеноз (в морфологически правом
желудочке). КТМА может сочетаться с нормальным положением внут-
ренних органов или их инверсией.
Гемодинамика. В изолированном виде порок долго не приводит
к нарушениям гемодинамики, так как венозная кровь из системных
вен в итоге направляется в легочную артерию, а артериальная - в аор-
ту, и гипоксии не возникает. Фактором, постепенно приводящим к
208
расстройствам гемодинамики, является инверсия желудочков. Прогрес-
сирующая гипертрофия правого желудочка сопровождается ухудше-
нием его кровоснабжения, хронической субэндокардиальной гипопер-
фузией и ишемией миокарда [24]. К 30-40 годам формируется дис-
функция правого желудочка с сердечной недостаточностью. Кроме то-
го, развивается некомпетентность трикуспидального клапана, который
филогенетически не предназначен для работы в условиях высокого
давления. Это сопровождается дополнительной объемной перегруз-
кой правого (системного) желудочка, усугубляющей сердечную недос-
таточность.
При наличии ДМЖП или легочного стеноза нарушения гемодина-
мики такие же, как при пороках с нормальным положением желудоч-
ков. В картине заболевания могут доминировать симптомы легочной
гипертензии или, наоборот, сниженного легочного кровотока с явле-
ниями гипоксемии.
Естественное течение. Естественное течение порока изучено ма-
ло в связи с его редкостью. Samanek М.и Voriskova М. [5], проследив-
шие судьбу 22 больных, отметили, что до 6 месяцев дожили 82,3% из
них, до 3 лет - 72,7%. За последующие 12 лет смертей не было. Одна-
ко известно, что на продолжительность жизни влияют недостаточность
артериального атриовентрикулярного клапана, полная атриовентрику-
лярная блокада, легочная гипертензия. Среди больных с развившейся
сердечной недостаточностью смертность в девять раз выше, чем среди
асимптоматичных пациентов [25].
Клиническая симптоматика. У больных с изолированной фор-
мой КТМА первыми симптомами могут быть нарушения ритма (при-
ступы пароксизмальной тахикардии, атриовентрикулярная блокада раз-
личной степени). Другим частым симптомом является систолический
шум. В большинстве случаев он связан с постепенно развивающейся
недостаточностью системного (трикуспидального) клапана.
На первом году жизни порок проявляется в случаях выраженного
легочного стеноза и гипоксемии или, наоборот, в случаях большого
легочного кровотока (при ДМЖП) с застойной сердечной недостаточ-
ностью. Клиническая симптоматика аналогична соответствующим по-
рокам без инверсии желудочков.
В старшем возрасте симптомы комбинируются преимущественно
из признаков сердечной недостаточности, связанной с большим сбро-
сом через ДМЖП или трикуспидальной регургитацией, и нарушений
ритма (чаще - атриовентрикулярной блокады). У больных снижается
толерантность к физической нагрузке, в редких случаях могут быть
ангинозные боли.
209
Электрокардиограмма. Наиболее характерные изменения ЭКГ
включают отклонение электрической оси сердца вправо и нарушения
атриовентрикулярной проводимости. Неполная или полная атриовен-
трикулярная блокада отмечается у 70% пациентов и прогрессирует со
временем. 0/^-интервал также может увеличиваться с течением вре-
мени, что отражает хроническую перегрузку правого желудочка [26].
Рентгенограмма грудной клетки. Изменения легочного рисунка
зависят от преобладания в нарушениях гемодинамики сброса через
ДМЖП или легочного стеноза. Обычно тень сердца умеренно увели-
чена, левый контур сглажен даже при высокой легочной гипертензии,
так как он образован леворасположенной аортой.
Эхокардиограмма. При сканировании сердца обращает на себя
внимание инверсионное положение желудочков. Правый желудочек с
большим числом трабекул расположен слева, более «гладкий» левый
желудочек - справа. Легочная артерия отходит от анатомически левого
желудочка, аорта - от анатомически правого желудочка (рис. 12-19).
Имеется митрально-легочное продолжение.
Рис. 12-19. Эхокардиограмма при корригированной транспозиции
магистральных артерий. А-от праворасположенного венозного (анатомически
левого) желудочка отходит легочная артерия, идентифицируемая по бифуркации;
Б - в «левом» желудочке расположен трикуспидальный клапан, который больше
смещен к верхушке, чем митральный.
Трикуспидальный клапан можно идентифицировать по более дис-
тальному (ближе к верхушке сердца), чем у митрального, положению.
Его папиллярные мышцы прикрепляются к стенке правого желудочка
и перегородке. Папиллярные мышцы митрального клапана прикреп-
ляются только к свободной стенке левого желудочка.
Дополнительное исследование проводят с целью визуализировать
ДМЖП, обструкцию выхода из левого желудочка, состояние легочно-
го и аортального клапанов.
210
Катетеризация сердца и ангиокардиография. Данное исследо-
вание не имеет каких-либо преимуществ перед ультразвуковым мето-
дом и используется в основном для изучения характера легочной ги-
пертензии.
Лечение. К медикаментозному лечению прибегают при развитии
осложнений порока - сердечной недостаточности, гипоксемии, нару-
шений ритма. Однако эффективность его невелика. Удовлетворитель-
ный результат можно получить только при корригирующих операци-
ях. До последнего времени прибегали к «обычным» вмешательствам,
направленным на закрытие ДМЖП или резекцию легочного стеноза.
Однако в послеоперационном периоде возникало значительное число
осложнений - полная атриовентрикулярная блокада, требующая им-
плантации искусственного водителя ритма, прогрессирующее ухудше-
ние функции системного клапана и желудочка [27]. В связи с этим раз-
работаны операции, направленные на оставление левого желудочка в
системном кровообращении, а правого желудочка - в легочном [28]. К
основным из них относятся одновременное переключение на уровне
предсердий и магистральных артерий (double-switch), а также опера-
ция Сеннинга-Растелли или Мастарда-Растелли при легочном стено-
зе. К сожалению, полностью исключить нарушения ритма не удается и
после таких операций.
Литература
1. Castaneda A. R., Jonas R.A., Mayer J.E., Hanley F.L. Cardiac surgery of the neonate
and infant. - W.B.Saunders Comp., Philadelphia, 1994.
2. Li J., Soukias N.D., Carvalho J.S., Yen Ho S. Coronary arterial anatomy in tetralogy
of Fallot: morphological and clinical con'elation//Heart.- 1998.-Vol. 80.-P. 174-183.
3. Егорова И.Ф., Шарыкин A.C, Туманян M.P., Плотникова Л.P. Жировая дис-
трофия миокарда правого желудочка больных тетрадой Фалло разных возрас-
тных групп // Бюлл. НЦССХ им. А.Н.Бакулева РАМН.- 2001.- №3.- С.151.
4. Sleurus Е., De Catte L., Benatar A. Prenatal diagnosis of absent pulmonary valve
syndrome in asssociation with 22q 11 deletion // J. Ultrasound Med.- 2004.- Vol. 23.-
P. 417-422.
5. Samanek M., Voriskova M. Congenital Heart disease among 815.569 children born
between 1980 and 1990 and their 15-year survival: A prospective Bohemia survival
study // Pediatr. Cardiol.- 1999.-Vol. 20.- P. 411-417.
6. Gatzoulis M.A. Tetralogy of Fallot. // Gatzoulis M.A., Webb G,D., Daubency P. Di-
agnosis & Management of adult congenital heart disease. - Chuchill Livingstone,
2003,- P. 122-138.
7. Белоконь H.A., Подзолков В.П. Врожденные пороки сердца. - М.: Медицина,
1990.
8. Фальковский Г.Э., Ильин В.Н., Хамидов Ф.В. и др. Влияние операции Блелока-
Тауссиг на развитие легочной артерии у больных с тетрадой Фалло // Грудная и
серд.-сос. Хир.- 1990.- № 4.- С. 3-8.
211
9. Pigula F.A., Khalil P.N., Mayer J.E. et al. Repair of tetralogy of Fallot in neonates
and young infants // Circulation.- 1999.- Vol. 100 (Suppl II).- P. 157-161.
10. Parry A. J., McElhinney D.B., Kung G.C. et al. Elective primary repair of acyanotic
tetralogy of Fallot in early infancy: overall outcome and impact on the pulmonary
valve // JACC.- 2000.- Vol. 36.- P. 2279-2283.
11. Van Arsdell G.S., Maharaj G.S., Tom J. et al. What is the optimal age for repair of
tetralogy of Fallot? // Circulation.- 2000.- Vol. 102 (Suppl III).- P. 123-129.
12. Hew C.C., Daebritz S.H., Zurakowski D. et al. Valved homograft replacement of
aneurysmal pulmonary arteries for severely symptomatic absent pulmonary valve
syndrome // Ann. Thorac. Surg.- 2002.- Vol. 73.- P. 1778-1785.
13. Lev M., Bharati S., Meng C.C.L. et al. A concept of double-outlet right ventricle //
J. Thorac. Cardiovasc. Surg.- 1972.- Vol. 64.- P. 271-281.
14. Walters III H.L., Mavroudis C, Tchervenkov C. et al. Congenital heart surgery no-
menclature and database project: double outlet right ventricle // Ann. Thorac. Surg.-
2000.- Vol. 69.- P. S249-263.
15. Li J., Tulloh R.M.R., Cook A. et al. Coronary arterial origins in transposition of the
great arteries: factors that affect outcome. A morphological and clinical study //
Heart.- 2000.- Vol. 83.- P. 320-325.
16. Шарыкин A.C., Иваницкий А.В., Андерсон Ф.Г. и др. Сравнительная характе-
ристика закрытой атриосептостомии под ультразвуковым контролем и класси-
ческой процедуры Рашкинда при транспозиции магистральных артерий // Груд-
ная и серд.-сос. хир.- 2002.- № 6.- С.13-17.
17. Thanopoulos B.D., Georgakopoulos D., Tsaousis G.S., Simeunovic S. Percutaneous
balloon dilatation of atrial septum: immediate and midterm results // Heart.- 1996.-
Vol. 76.- P. 502-506.
18. Алекян Б.Г., Гарибян B.A., Шарыкин А.С. и др. Транслюминальная баллонная
дилатация межпредсердной перегородки у новорожденных и грудных детей с
транспозицией магистральных сосудов, находящихся в критическом состоя-
нии // 4-я ежегод. сессия НЦССХ им. А.Н. Бакулева с Всеросс. конф, молодых
ученых.- М., 2000.- С.96.
19. Soongswang J., Adatia L, Newman C. et al. Mortality in potential arterial switch
candidates with transposition of the great arteries // J. Am. Coll. Cardiol.- 1998.-
Vol. 32.- P. 753-757.
20. Jacobs M.L. Congenital heart surgery nomenclature and database project: Truncus
arteriosus // Ann. Thorac. Surg.- 2000.- Vol. 69.- P. S50-55.
21. Brown J. W., Ruzmetov M., Okada Y. et al. Truncus arteriosus repair: outcomes, risk
factors, reoperation and management // Eur. J. Cardiothorac. Surg.- 2001.- Vol. 20.-
P. 221-227.
22. Thompson L.D., McElhinney D.B., Reddy V.M. et al. Neonatal repair of truncus
arteriosus: continuing improvement in outcomes // Ann. Thorac. Surg.- 2001.-
VoL 72.- P. 391-395.
23. Stark J.E, Gallivan S., Davis K. et al. Assessment of mortality rates for congenital
heart defects and surgeons’ performance // Ann. Thorac. Surg.- 2001.-Vol. 72,-
P. 169-175.
24. Hauser M., Bengel F.M., Hager A. et al. Impaired myocardial blood flow and coro-
nary flow resere of the anatomical right systemic ventricle in patients with congeni-
tally corrected transposition of the great arteries // Heart.- 2003.- Vol. 89.-
P. 1231-1235.
212
25. Piran S., Veldtman G., Siu S. et al. Heart failure and ventricular disfunction in pa-
tients with single or systemic right ventricles // Circulation.- 2002.- Vol. 105.-
P. 1189-1194.
26. Nejfke J.GJ., Tulevski 1.1., van der Wall E.E. et al. ECG determinants in adult pa-
tients with chronic right ventricular pressure overload caused by congenital heart
disease: relation with plasma neurohormones and MRI parameters // Heart.- 2002,-
Vol. 88.- P. 266-270.
27. Biliciler-Denktas G., Feldt R.H., Connolly H.M. et al. Early and late results of op-
erations for defects associated with corrected transposition and other anomalies with
atrioventricular discordance in a pediatric population //J. Thorac. Cardiovasc. Surg.-
2001.- Vol. 122.- P. 234-241.
28. Wilkinson J.L., Cochrane A.D., Karl T.R. Congenital heart nomenclature and data-
base project: Corrected (discordant) transposition of the great arteries (and related
malformations) // Ann. Thorac. Surg. - 2000.- Vol. 69.- P. S236-S248.
213
Глава 13. ПОРОКИ РАЗВИТИЯ АОРТЫ
13.1. Стеноз аорты
Данная патология характеризуется обструкцией выхода из систем-
ного желудочка на клапанном, надклапанном или подклапанном уров-
не (рис. 13-1).
Рис. 13-1. Основные варианты стеноза аорты: А - клапанный стеноз;
Б - надклапанный стеноз; В - подклапанный дискретный стеноз; Г - идиопатический
гипертрофический субаортальный стеноз.
Частота. Частота порока в зависимости от критериев изолирован-
ности составляет 0,04-0,48/1000 новорожденных, 2-8% среди всех ВПС
и 2,5% среди критических ВПС.
Анатомия. Наиболее распространенным вариантом порока явля-
ется клапанный стеноз (70%), который комбинируется из различных
вариантов сращения комиссур, дисплазии створок, гипоплазии клапан-
ного кольца. В большинстве случаев клапан имеет две створки и две
сращенные комиссуры. Возможен стеноз, представленный фактически
мембраной с эксцентрично расположенным отверстием и одной комис-
сурой (одностворчатый клапан). Подобные морфологические характе-
ристики присущи критическому стенозу новорожденных. У них порок
может сопровождаться также умеренной гипоплазией левого желудоч-
ка; выраженная гипоплазия переводит порок в другую категорию - син-
дром гипоплазии левого сердца.
Трехстворчатый аортальный клапан чаще стенозирован за счет
утолщения и желатинообразного изменения створок, а также сраще-
ния комиссур. Значительную обструкцию такие изменения создают поз-
же, по мере дальнейшего утолщения и кальцификации створок.
214
Тяжелый аортальный стеноз нередко сопровождается развитием
фиброэластоза эндокарда, особенно у новорожденных. Возникновение
данного осложнения связано с повышенным конечным диастолическим
давлением в левом желудочке в сочетании с выраженной гипертрофи-
ей миокарда, что приводит к нарушению кровообращения в концевых
отделах коронарных сосудов и ишемии в субэндокардиальном слое.
Подклапанный стеноз (24%) может быть дискретным или диф-
фузным. Первый из них обычно представлен фиброзной или фиброз-
но-мышечной мембраной, второй - туннелеобразным мышечным су-
жением, которое начинается на уровне клапанов и распространяется
на 1-3 см в левый желудочек. Около 50% больных с дискретным суб-
аортальным стенозом имеют регургитацию на аортальном клапане.
Недостаточность клапанов может быть связана с повреждением ство-
рок струей крови, ударяющей в них со стороны желудочка, или утол-
щением и деформацией, связанной с разрастанием фиброзной ткани
в сторону клапана. Сопутствующие пороки сердца встречаются у 50%
больных с данной патологией. Наиболее частые - коарктация аорты,
двухстворчатый аортальный клапан, ДМЖП, аномалии митрального
клапана. Сочетание с надклапанным митральным кольцом, парашю-
тообразным митральным клапаном и коарктацией аорты образует ком-
плекс Shone.
Идиопатический гипертрофический субаортальный стеноз по на-
рушениям гемодинамики похож на предыдущую группу (динамическая
подаортальная обструкция, создаваемая утолщенной стенкой желудоч-
ка и передним движением митрального клапана), однако представляет
разновидность кардиомиопатий.
Надклапанный аортальный стеноз (6%) - редкий тип порока, ко-
торый может быть представлен в виде песочных часов, фиброзной мем-
браны или диффузного сужения восходящей аорты. В последнем вари-
анте могут быть изменены и брахиоцефальные сосуды. Данный порок
часто сочетается с синдромом Вильямса. Особенностью патологии яв-
ляется вовлечение коронарных артерий, которые расширены и извиты
из-за повышенного в них давления. Интима сосудов склонна к проли-
ферации, в них легко возникают атеросклеротические изменения.
Гемодинамика. Аортальный стеноз затрудняет выброс крови в
аорту, особенно в ответ на физическую нагрузку. В результате возни-
кает компенсаторная гипертрофия левого желудочка; его усиленная
работа создает градиент систолического давления на клапане, позво-
ляющий сохранить достаточный сердечный выброс. При декомпен-
сации желудочка развивается сердечная недостаточность, ригидность
сердечного выброса.
215
У новорожденных с тяжелой обструкцией выводного тракта и не-
достаточно гипертрофированным левым желудочком синдром низкого
сердечного выброса может реализоваться в первые дни после рожде-
ния (критический аортальный стеноз). При этом градиент давления на
клапане может быть небольшим, что создает иллюзию небольшого сте-
ноза. При резком снижении артериального давления в подобных си-
туациях кровь в системное кровообращение может попадать из легоч-
ной артерии через ОАП. Так как венозная кровь поступает и в нисхо-
дящую, и в восходящую аорту, возникает центральный цианоз, симу-
лирующий «синий» порок сердца [1] (рис. 13-2).
Рис. 13-2. Схема кровотока при критическом аортальном стенозе и
дуктус-зависимом кровообращении.
При выраженном и длительно существующем стенозе наряду с ги-
пертрофией миокарда возникает дефицит коронарной перфузии, ише-
мия миокарда, формируется эндомиокардиальный фиброэластоз. При
распространении ишемии на папиллярные мышцы может развиться не-
достаточность митрального клапана.
Турбулентный поток через измененный аортальный клапан при-
водит к его фиброзу и дальнейшему прогрессированию левожелудоч-
ковой обструкции. С другой стороны, из-за деформации клапана мо-
жет возникать аортальная недостаточность, которая значительно уве-
личивает объемную перегрузку левого желудочка и способствует раз-
витию застойной сердечной недостаточности.
Аортальный стеноз может быть условно разделен на три сте-
пени [2].
216
1. Небольшой стеноз - нормальный второй тон, нормальное на-
полнение пульса, градиент систолического давления (ГСД) менее
40 мм рт. ст., градиент среднего давления (ГСрД) менее 20 мм рт. ст.
2. Умеренный стеноз - второй тон расщеплен, наполнение пульса
снижено, ГСД до 75 мм рт. ст., ГСрД - до 50 мм рт. ст.
3. Выраженный стеноз - второй тон представлен лишь легочным
компонентом, наполнение пульса снижено, ГСД более 75 мм рт. ст.,
ГСрД более 50 мм рт. ст.
Следует отметить, что данные градиенты могут значительно ме-
няться в условиях физической нагрузки. Кроме того, к снижению гра-
диента давления может приводить падение сердечного выброса из-за
дисфункции миокарда.
Естественное течение. Гемодинамическое значение порока про-
является уже в процессе беременности. Прогрессирующая обструкция
левого желудочка приводит к его дисфункции и дилатации, низкому
антеградному кровотоку. Это сопровождается увеличением правого же-
лудочка. Около 30% обследованных плодов с аортальным стенозом име-
ют водянку, 7% погибают внутриутробно [3,4]. Среди детей с порока-
ми, выявленными в постнатальном периоде, смертность в течение пер-
вого месяца составляет 5%, большинство этих детей имеют критиче-
ский аортальный стеноз и гипоплазию левого желудочка. Еще 10 лет
назад выживаемость в данной группе к концу 1 года не превышала
78% [5]. При современной терапии простагландинами, баллонной ди-
латации клапана и хирургии до 6 месяцев доживают около 91%, до 1
года - 90%, до 15 лет - 88,4% больных [6].
Клиническая симптоматика. Клинические признаки клапанно-
го стеноза аорты впервые могут проявиться в любом возрасте. У ново-
рожденных с критическим клапанным стенозом аорты некоторое вре-
мя сохраняется относительно стабильное состояние из-за обеспечения
дистального кровотока через открытый артериальный проток. При та-
ком дуктус-зависимом кровообращении и низком антеградном крово-
токе в аорте возможно развитие цианоза из-за большой примеси ве-
нозной крови. После закрытия ОАП картина резко ухудшается, возни-
кают признаки низкого сердечного выброса: тахикардия и тахипноэ,
пульс на периферических артериях очень низкий или не определяется,
выражена бледность кожных покровов. Заболевание может протекать
под маской сепсиса, так как шум стеноза из-за низкого сердечного вы-
броса практически отсутствует. Прогноз, в том числе послеопераци-
онный, значительно ухудшается у больных с фракцией выброса лево-
го желудочка менее 36±7% [7, 8].
217
При небольшом аортальном стенозе порок может протекать бес-
симптомно и проявляться только систолическим шумом. Надклапан-
ный стеноз аорты можно заподозрить по специфическому «лицу эль-
фа» и задержке умственного развития, часто сочетающихся с данной
патологией (синдром Вильямса).
При умеренном стенозе возникает симптоматика в виде повышен-
ной утомляемости, приступов сердцебиения, снижения толерантности
к физической нагрузке. При резком стенозе могут добавляться такие
симптомы, как обморочные состояния или боли в грудной клетке ише-
мического типа. В редких случаях порок впервые манифестирует вне-
запной сердечной смертью, возникающей при физической нагрузке.
Вероятной причиной этого является остро возникающий дефицит ко-
ронарного кровотока, приводящий к фатальной аритмии. Сердечная
недостаточность в явном виде долго не развивается из-за хороших ком-
пенсаторных способностей левого желудочка. Однако если она разви-
лась, состояние больных и прогноз жизни резко ухудшаются, леталь-
ный исход возможен в пределах 2-3 лет.
Аускультативная картина аортального стеноза достаточно харак-
терна. Первый тон громкий, сразу за ним следует грубый систоличе-
ский шум с максимумом во втором-третьем межреберье справа. Осо-
бенностью шума является хорошее проведение на сосуды шеи. При
подклапанном стенозе шум смещен влево, в третье-четвертое межре-
берье. При надклапанном стенозе он более мягкий, проводится пре-
имущественно на правые шейные сосуды. Небольшой протодиастоли-
ческий шум появляется при развитии сопутствующей недостаточно-
сти аортального клапана.
Второй тон сердца в некоторой степени отражает степень стеноза.
По мере усиления порока он расщепляется, а затем остается представ-
лен лишь легочным компонентом.
Систолическое артериальное давление и пульсовое давление сни-
жаются по мере прогрессирования стеноза. В соответствии с этим
уменьшается и наполнение пульса. При надклапанном стенозе может
быть асимметрия давления между правой и левой руками из-за пре-
имущественного тока крови в брахиоцефальный ствол.
Следует отметить, что особенностью аортального порока и кли-
нической картины заболевания является их прогрессирующий с тече-
нием времени характер.
Электрокардиография. При легких и умеренных стенозах ЭКГ
обычно нормальная. При тяжелом стенозе аорты электрокардиограм-
ма в 80% случаев выявляет гипертрофию левого желудочка. Однако
218
нет корреляции между абсолютным вольтажом зубца R в левых груд-
ных отведениях и тяжестью левожелудочковой обструкции. Дополни-
тельно могут быть признаки перегрузки левого желудочка по типу strain:
депрессия сегмента ST более 2 мм в левых отведениях и инверсия зуб-
ца Т. Примерно у 10% больных выявляется блокада левой передней
ножки пучка Гиса.
При мониторировании ЭКГ часто выявляют комплексные желу-
дочковые аритмии.
Рентгенография грудной клетки. Легочный рисунок в большин-
стве случаев нормальный. Усиление по венозному руслу возникает как
проявление застойной сердечной недостаточности. Сердечная тень
обычно расширена незначительно, имеет характерную конфигурацию
- хорошо выражена талия сердца, верхушка закруглена и приподнята
над диафрагмой («аортальная» конфигурация) (рис. 13-3).
Возможно расширение восходящей аорты. Увеличение тени серд-
ца в сочетании с венозным застоем в легких характерно для новорож-
денных с критическим аортальным стенозом.
В старшем детском возрасте кардиомегалия возникает у больных
с выраженной сердечной недостаточностью или фиброэластозом эн-
докарда. Однако она может быть и проявлением сопутствующих поро-
ков сердца, в первую очередь - аортальной регургитации.
Рис. 13-3. Рентгенография при аортальном стенозе. Хорошо видна
«аортальная» конфигурация тени сердца, несмотря на тимомегалию.
219
Эхокардиография. Ультразвуковое исследование в последние го-
ды стало ведущим в диагностике различных форм аортального стено-
за. При сканировании сердца обращают внимание на диаметр клапан-
ного кольца аорты, количество створок клапана, их раскрытие, диа-
метр (и площадь) эффективного отверстия (рис. 13-4).
Рис. 13-4. Эхокардиограмма при клапанном аортальном стенозе,
парастернальная позиция по короткой оси. Визуализируются две уплотненные
створки клапана; комиссуры расположены на уровне 12 и 6 часов.
Характерным симптомом является дугообразное выбухание ство-
рок в просвет аорты с турбулентным потоком крови через клапан
(рис. 13-5).
Изучение выводного отдела левого желудочка позволяет выявить
фиброзную или фиброзно-мышечную обструкцию при подклапанном
стенозе (рис. 13-6).
При надклапанной форме стеноза наиболее часто удается обнару-
жить обструкцию на уровне верхней границы синусов Вальсальвы.
Допплерография дает представление об уровне максимальной об-
струкции и приблизительную оценку тяжести стеноза. Однако следует
помнить, что градиент давления в значительной мере зависит от вели-
чины сердечного выброса и может значительно изменяться при сер-
дечной недостаточности или физической нагрузке. В некоторых слу-
чаях для выявления истинной тяжести порока необходимо выполнить
стресс-тест.
Дополнительно проводят оценку гипертрофии левого желудочка,
его систолических и диастолических параметров (рис. 13-7).
220
Рис. 13-5. Эхокардиограмма при клапанном аортальном стенозе.
А - парастернальная позиция по длинной оси: выявляется асимметричность и резкое
ограничение открытия с «куполообразным» выбуханием створок аортального
клапана в систолу, утолщенность и усиление эхосигнала от створок (признак
фиброза); Б - допплерография в постоянно-волновом режиме из супрастернальной
позиции по длинной оси: регистрируется высокоскоростной поток над клапаном с
выраженным систолическим градиентом давления (140 мм рт. ст.).
Рис. 13-6. Эхокардиограмма из парастернальной позиции по
длинной оси при подклапанном аортальном стенозе. В выводном тракте
левого желудочка визуализируется фиброзный тяж; выявляется умеренная
гипертрофия левого желудочка.
При аортальном стенозе ранним признаком развивающейся сер-
дечной недостаточности может быть диастолическая дисфункция же-
лудочка. Анализу подлежат также вторичные изменения, такие как аор-
тальная регургитация, постстснотичсская дилатация аорты, митраль-
221
ная недостаточность. Сопутствующую аортальную недостаточность
оценивают по глубине проникновения потока регургитации в левый
желудочек (при картировании с помощью импульсно-волновой или цве-
товой допплерографии), отношению диаметра проксимальной части
потока к диаметру выводного тракта левого желудочка, расчетному вре-
мени полуспада давления потока аортальной регургитации и наличию
обратного кровотока в грудной и брюшной аорте.
Рис. 13-7. Эхокардиограмма из верхушечной четырехкамерной
позиции при аортальном стенозе. Выявляется выраженная гипертрофия
миокарда левого желудочка и межжелудочковой перегородки с умеренным
увеличением полости левого желудочка.
Различают три степени аортальной недостаточности.
Незначительная аортальная регургитация', струя под створками
клапана, отношение ширины струи к диаметру выводного тракта ЛЖ
менее 30%, время полуспада градиента давления более 600 мс, отсут-
ствие реверсивного диастолического кровотока в области дуги аорты.
Умеренная регургитация', струя регургитации проникает в левый же-
лудочек до уровня створок митрального клапана, ширина ее составля-
ет более 30% диаметра выводного тракта, время полуспада градиента
давления - менее 600 мс, в области дуги аорты регистрируется диасто-
лический ретроградный кровоток. Выраженная регургитация', струя
регургитации проникает в левый желудочек до концов папиллярных
мышц или в зону верхушки, регистрируется реверсивный кровоток в
брюшной аорте, имеет место умеренная или выраженная дилатация
левого желудочка [9].
222
При аортальном стенозе могут обнаруживаться сопутствующие вро-
жденные пороки сердца, имеющие гемодинамическое значение (коарк-
тация аорты, ДМЖП).
Катетеризация сердца и ангиокардиография. Данное исследо-
вание показано в основном при изучении сопутствующей патологии
или в сочетании с баллонной вальвулопластикой клапанного стеноза.
При синдроме Вильямса дополнительно выполняют контрастирование
правых отделов сердца для исключения периферических легочных сте-
нозов.
Лечение. При критическом аортальном стенозе у новорожденных
основой терапии является снижение метаболических потребностей ор-
ганизма (создание температуры комфорта, ограничение физической ак-
тивности ребенка, проведение искусственной вентиляции легких). В
ряде случаев необходима инотропная поддержка (допамин 6-8 мкг/кг/
мин) и мочегонная терапия. При дуктус-зависимом кровообращении
проводят инфузию простагландинов группы Е до стабилизации состоя-
ния больного, при котором появится возможность выполнить баллон-
ную дилатацию клапанного стеноза. Последняя предпочтительнее опе-
ративного вмешательства, особенно у больных с фиброэластозом эн-
докарда и низкой фракцией выброса (менее 36±7%). У пациентов с
неадекватной функцией гипоплазированного левого желудочка, узким
аортальным или митральным кольцом более уместной может оказать-
ся операция Норвуда.
В более старшем возрасте необходимо ограничение тяжелой фи-
зической нагрузки, занятий спортом, так как велика опасность внезап-
ной смерти. Показанием к операции является градиент систолическо-
го давления, превышающий 75 мм рт. ст. Однако при наличии болей,
обмороков, ишемических изменений на ЭКГ, плохой толерантности к
нагрузке, коррекция стеноза показана и при градиенте давления менее
50 мм рт.ст. При лечении прибегают как к баллонным процедурам, так
и к операциям на открытом сердце. Последние предпочтительнее в слу-
чаях с моно- или двустворчатым клапаном и при сопутствующей ре-
гургитации на клапане. Однако следует помнить, что любые вмеша-
тельства при клапанном стенозе являются по сути паллиативными из-
за сохраняющихся диспластических изменений клапана, гипоплазии
кольца, аномалий числа створок, прогрессирующей со временем аор-
тальной недостаточности. В связи с этим нет отчетливого преимуще-
ства у той или иной процедуры. Необходимо быть готовым к повтор-
ным вмешательствам вплоть до протезирования клапана у 50-70% боль-
ных в пределах 3-14 лет [10].
223
Баллонные процедуры при подклапанном или надклапанном сте-
нозе малоэффективны. При устранении дискретного подклапанного сте-
ноза наиболее результативны ранние операции, которые предотвраща-
ют развитие аортальной регургитации и снижают частоту рестеноза.
Это особенно справедливо для случаев с относительно низким гради-
ентом давления - до 40 мм рт. ст. [11]. Для коррекции диффузного под-
клапанного стеноза расширяют выводной отдел левого желудочка и
клапанное кольцо (операция Kono) или дополняют ее операцией Ross
(замена аортального клапана легочным аутоклапаном и имплантация
биологического протеза в легочную позицию).
У пациентов с надклапанным стенозом операция показана уже при
достижении градиента давления 50 мм рт. ст., так как велика опасность
поражения коронарных артерий, расположенных в «камере» высокого
давления. Локальный стеноз устраняется с хорошим эффектом путем
вшивания в аорту специально сформированной заплаты. Более серьез-
ную проблему представляет тубулярное сужение аорты на большом про-
тяжении, требующее обширного протезирования или обходного шун-
тирования (верхушка левого желудочка-аорта).
13.2. Коарктация аорты
Коарктация аорты - врожденное сегментарное сужение, которое
может локализоваться на любом участке аорты. Такие морфологиче-
ские изменения описаны для восходящего отдела, нисходящей груд-
ной или брюшной аорты, а также отмечены случаи множественной ло-
кализации. Однако в подавляющем большинстве случаев (89-98%) ко-
арктация располагается на участке от левой подключичной артерии до
ОАП (так называемый «перешеек аорты») или сразу ниже ОАП. У груд-
ных детей встречается почти исключительно эта локализация коаркта-
ции. В то же время, в отличие от взрослых, сужение может выявляться
на большем протяжении и достигать значительной степени, вплоть до
атрезии или перерыва дуги аорты, которые имеются у 1,5% больных.
Частота. Частота коарктации аорты составляет 0,23-0,33/1000 но-
ворожденных, среди всех ВПС - около 6%, среди критических ВПС -
до 10%. В период новорожденное™ коарктация аорты уступает по час-
тоте только ДМЖП и транспозиции магистральных артерий сердца.
Это объясняется ранним возникновением гемодинамических проблем
при данном пороке. Во взрослой популяции порок представлен в ос-
новном случаями, не выявленными ранее.
Анатомия. У плода и новорожденного в возрасте 5-10 недель об-
ласть перешейка аорты и в норме бывает сужена, так как в период внут-
224
риутробного развития пропускает в нисходящую аорту не более трети
всего кровотока, а две трети попадают туда через ОАП из легочной
артерии.
Так как в норме ОАП закрывается вскоре после рождения, весь
поток крови в нисходящую аорту начинает поступать через перешеек,
и он постепенно расширяется до нормального диаметра. При форми-
ровании коарктации в данной области сохраняется сужение различной
протяженности и формы, наиболее часто - в виде локальной перетяж-
ки, выше и ниже которой аорта имеет обычный диаметр. Внутри аор-
ты в таких случаях находят диафрагму с небольшим отверстием или
серповидную связку. Иногда просвет аорты полностью облитерирован.
Другим анатомическим вариантом является тубулярное сужение пере-
шейка аорты (менее 50% от диаметра нисходящей аорты), протяжен-
ностью 1,5-2,5 см. Артериальный проток в таких случаях, как прави-
ло, сохраняет свою проходимость. Ранее локальный и протяженный
типы коарктации называли «взрослым» и «инфантильным» соответст-
венно. Однако в результате накопления большого клинического и па-
толого-анатомического материала эти термины были оставлены, так
как выяснилось, что «взрослый» тип встречается у умерших новорож-
денных, а «инфантильный» тип нередко обнаруживается у взрослых.
Кроме того, возможна комбинация тубулярной гипоплазии перешейка
с резким локальным сужением аорты.
Причины развития коарктации аорты, как и вообще ВПС, остают-
ся во многом неясными. Нарушения формирования нормальной аорты
связывают с внешними влияниями, врожденной предрасположенно-
стью к дегенерации тканей и генерализованной сосудистой патологии,
гемодинамическими расстройствами во внутриутробном периоде. В
настоящее время основными патогенетическими звеньями в возник-
новении коарктации аорты считают наличие аномальной ткани арте-
риального протока (дуктальной ткани) в стенке аорты и патологиче-
ское перераспределение кровотока в магистральных сосудах сердца в
период эмбриогенеза, приводящее к выраженному снижению потока
крови через перешеек.
Характерной особенностью коарктации аорты в грудном возрасте
является значительная частота сопутствующих ВПС. Так, если у взрос-
лых подобное сочетание встречается в 18% случаев, то у детей - в 70%,
причем чем меньше возраст, тем выше вероятность дополнительных
пороков сердца. Чаще всего выявляют ОАП (68%), ДМЖП (53%), по-
роки аортального (14%) и митрального (8%) клапанов. Цианотические
пороки сочетаются с коарктацией значительно реже, чем пороки блед-
225
ного типа. Сопутствующую гипоплазию дуги аорты (между брахиоце-
фальным стволом и левой подключичной артерией) большей или мень-
шей степени находят примерно у 65% пациентов, подвергающихся хи-
рургическому лечению.
Гемодинамика. Гемодинамические сдвиги при коарктации аорты
определяются препятствием кровотоку в аорте. Основным следствием
этого является высокое давление в левом желудочке и верхней полови-
не туловища. В последующем артериальная гипертензия поддержива-
ется с помощью измененной реактивности стенки сосудов, располо-
женных проксимальней коарктации, а также гуморальными механиз-
мами (система ренин-ангиотензин-альдостерона и др.) [12]. В ниж-
ней половине тела перфузионное давление резко снижено, и крово-
снабжение зависит либо от проходимости ОАП, через который посту-
пает кровь из легочной артерии (дуктус-зависимое кровообращение),
либо от наличия коллатералей. К главным сосудам, участвующим в раз-
витии коллатеральной сети, относятся подключичные артерии с их вет-
вями, внутренние грудные артерии, межреберные артерии, сосуды
лопатки, позвоночные артерии. При коарктации, расположенной пре-
дуктально, кровоток в нисходящую аорту может долгое время осущест-
вляться через ОАП, и стимулы для развития коллатералей отсутствуют.
При аномальном отхождении левой или правой подключичных ар-
терий ниже места резкой коарктации возможно развитие в них ретро-
градного кровотока из бассейна мозговых сосудов в нисходящую аор-
ту с клиническими проявлениями церебральной недостаточности (син-
дром обкрадывания).
В период внутриутробного развития основную нагрузку несет пра-
вый желудочек, в значительной мере осуществляющий системное кро-
вообращение. После рождения ребенка эта функция полностью пере-
ходит к левому желудочку, который при коарктации аорты должен бы-
стро гипертрофироваться. Если нарастание массы миокарда не сопро-
вождается достаточным увеличением его кровоснабжения, это ведет к
кислородному голоданию мышцы сердца, развитию зон ишемии, мел-
коочаговых некрозов, фиброэластоза. Фракция выброса желудочка сни-
жается как вследствие механического препятствия, так и последую-
щей миокардиальной недостаточности; это сопровождается падением
сердечного выброса.
Изменения легочного кровотока обычно связаны с наличием ОАП
и других ВПС. Кровоток через ОАП может быть направлен как в сто-
рону нисходящей аорты (у новорожденных с предуктальной коаркта-
цией), так и в сторону легочной артерии (у старших детей). В первом
226
случае он поддерживает кровообращение в бассейне нисходящей аор-
ты, во втором приводит к гиперволемии малого круга кровообраще-
ния. Сопутствующий ДМЖП сопровождается быстрым развитием вы-
сокой легочной гипертензии, так как через него на легочные сосуды
передается высокое давление из левого желудочка.
При изолированной коарктации в связи с повышением левопред-
сердного давления возможен застой в малом круге кровообращения и
шунтирование крови в правое предсердие через открытое овальное ок-
но. Сброс слева направо через сопутствующий ДМЖП в течение неко-
торого времени «разгружает» левый желудочек, позволяя адаптировать-
ся к нагрузке давлением, но быстро приводит к дополнительной объем-
ной нагрузке. При пороках со сбросом крови справа налево обращают
на себя внимание симптомы артериальной гипоксемии.
Кроме того, при естественном течении заболевания могут развиться
вторичный фиброэластоз левого желудочка, морфологические измене-
ния коронарных артерий, расстройства мозгового кровообращения или
кровоизлияния в мозг, аневризма аорты, что также утяжеляет прогноз
и ухудшает результаты отложенного хирургического лечения.
Классификация. По мере развития кардиохирургии грудного воз-
раста менялись взгляды на систематизацию заболевания. Опыт пока-
зал, что наличие или отсутствие ОАП не оказывает существенного влия-
ния на хирургическую технику или тактику лечения больных, поэтому
данный порок не требует специального обособления. Аномальное рас-
положение коарктации или аберрантные ветви дуги аорты встречают-
ся у детей достаточно редко и при необходимости могут быть указаны
как дополнительная патология аорты. В отличие от этого, дефект меж-
желудочковой перегородки, встречающийся примерно у половины де-
тей первых месяцев жизни, существенно влияет на течение порока,
результаты операции и требует гибкой тактики, что делает необходи-
мым выделение его в особую группу.
Мы считаем, что для практической работы удобна следующая клас-
сификация коарктации аорты у грудных детей:
1-я группа - «простая коарктация» аорты (изолированная или в
сочетании с ОАП);
2-я группа - коарктация аорты в сочетании с ДМЖП;
3-я группа - коарктация аорты в сочетании с другими пороками
сердца, оказывающими влияние на состояние больных (А - бледного
типа, Б - синего типа).
По морфологическим критериям целесообразно выделение локаль-
ной коарктации, коарктации с тубулярным сужением перешейка аорты
227
и коарктации с гипоплазией дуги аорты. В описательных целях ис-
пользуются термины «предуктальная», «юкстадуктальная», «постдук-
тальная» коарктация.
Любая из групп может быть дополнена характеристикой степени
нарушения кровообращения, а если исследуется функция сердца - то
и характеристикой его сократительной способности.
Естественное течение. Во внутриутробном периоде коарктация
аорты не оказывает влияния на развитие плода. Даже при полном пе-
рерыве аорты кровоснабжение нижней половины туловища успешно
осуществляется через ОАП. После рождения ОАП может поддержи-
вать кровоток с помощью двух механизмов: 1) путем сохранения фе-
тального типа кровоснабжения нисходящей аорты; 2) в качестве «об-
ходного канала» зоны коарктации (рис. 13-8).
Рис. 13-8. Роль ОАП в кровоснабжении нисходящей аорты. А - при
сохранении фетального типа кровообращения и гипоплазии перешейка аорты
имеется адекватное кровоснабжение нисходящей аорты через артериальный проток;
Б - при юкстадуктальной коарктации открытый артериальный проток обеспечивает
кровоток в нисходящей аорте в качестве обходного канала; В - при констрикции
протока кровоток в нисходящей аорте резко снижается.
Закрытие ОАП у таких больных приводит к ухудшению течения
порока, и даже при медикаментозном лечении сопровождается высо-
кой летальностью. Изолированная коарктация приводит к смерти 41-
46% пациентов в течение первого года жизни, при ее сочетании с дру-
гими ВПС умирают 70-90% детей [13, 14]. Основные причины смерти
- сердечная и почечная недостаточность. В некоторых случаях катаст-
рофическая сердечная недостаточность может развиться неожиданно
быстро, например, после респираторного заболевания. В целом, чем
раньше проявляется заболевание, тем тяжелее оно протекает и небла-
гоприятнее его последствия.
228
Среди дополнительных факторов риска особое значение имеют
внесердечные аномалии развития, встречающиеся у 26% детей (тре-
тья часть из них не поддается лечению), а также масса тела при рожде-
нии менее 2 кг. Эти факторы повышают смертность почти в два раза.
Клиническая симптоматика. Проявления коарктации аорты у
грудных детей и у более взрослых больных существенно различаются.
Если порок впервые выявляется в возрасте старше одного года, это
обычно свидетельствует о его относительно малой выраженности. Де-
ти внешне выглядят вполне здоровыми, хорошо развитыми, признаки
сердечной недостаточности имеются лишь у 5% больных. Изменения
аорты часто обнаруживают случайно при обследовании по другим при-
чинам, чаще всего - в связи с артериальной гипертензией.
В отличие от этого резкая коарктация аорты проявляется уже в пер-
вые месяцы жизни как общими, так и специфическими симптомами.
Для детей этого возраста характерно повышенное беспокойство, от-
сутствие аппетита, плохая прибавка в весе; у 2/3 имеется гипотрофия
II—III степени, обычно сочетающаяся с анемией (рис. 13-9).
Рис. 13-9. Внешний вид грудного ребенка с коарктацией аорты.
229
Нередко детей долго лечат по поводу пневмонии, и только тщатель-
ное обследование позволяет выявить порок. Диагностика затрудняет-
ся тем, что нет характерной аускультативной картины, на которую обыч-
но опираются врачи при диагностике пороков сердца. Чаще всего име-
ется лишь небольшой систолический шум слева от грудины, проводя-
щийся в межлопаточную область. Более выраженная шумовая картина
возникает при сочетании с ОАП или ДМЖП, но и она может быть «сма-
зана» в случаях высокой легочной гипертензии.
Специфическими симптомами коарктации аорты у грудных детей
являются сердечная недостаточность, артериальная гипертензии на
верхних конечностях и градиент систолического давления между пра-
вой рукой и ногой.
Нормальным считается давление, не превышающее 90-х центи-
лей соответственно возрасту и полу. Измерение давления на обеих ру-
ках позволяет исключить отхождение одной из подключичных арте-
рий ниже области коарктации и гипоплазию дуги аорты. В случае та-
ких аномалий давление на соответствующей руке на 10-30 мм рт. ст.
ниже, чем на противоположной.
Сравнительно невысокая артериальная гипертензия (при выра-
женной коарктации) может встретиться у больных с сопутствующим
клапанным стенозом аорты, большим ДМЖП или тяжелой сердечной
недостаточностью. Однако по мере лечения последней и увеличения
сердечного выброса артериальное давление может возрастать.
Как уже отмечалось, у новорожденных физиологическая узость
перешейка аорты создает градиент давления между руками и ногами,
который примерно у 16% детей превышает 20 мм рт. ст. и может дохо-
дить до 30 мм рт. ст. [15, 16]. Однако, как правило, он быстро снижает-
ся в течение нескольких дней. При истинной коарктации градиент дав-
ления обычно, наоборот, нарастает, достигая 50-170 мм рт.ст.
Другой характерный признак порока в этом возрасте - быстрое
развитие застойной сердечной недостаточности, проявляющейся пре-
жде всего тахикардией и одышкой. Основным фактором, предъявляю-
щим повышенные требования к сердцу, служит механическое препят-
ствие кровотоку в аорте. Степень нарушения кровообращения зависит
от степени обструкции аорты, наличия коллатералей, быстроты разви-
тия компенсаторной гипертрофии сердца. При «симптоматичной» ко-
арктации аорты сердечная недостаточность развивается у 100% боль-
ных в первые три месяца жизни и у 70% на первом году жизни. Если
не проводится терапевтическое лечение, возникает задержка жидко-
сти, увеличение печени, периферические отеки; в легких выслушива-
ются влажные мелкопузырчатые хрипы.
230
Снижение насосной функции левого желудочка в связи с развити-
ем вторичного фиброэластоза (у 15-20% больных) резко утяжеляет со-
стояние [17]. У таких детей наблюдается выраженная кардиомегалия
за счет миогенной дилатации. Тоны сердца приглушены, нередко вы-
слушивается шум митральной недостаточности. В этих случаях сер-
дечная недостаточность быстро прогрессирует, несмотря на интенсив-
ную терапию.
Особое внимание необходимо уделять функции ОАП у новорож-
денных с предуктальной коарктацией аорты. Закрытие протока у та-
ких детей приводит к острой гипоперфузии нижней половины тулови-
ща, молниеносному развитию тяжелой недостаточности кровообраще-
ния, нарушению функции почек и быстрой гибели. Неблагоприятным
прогностическим признаком является уровень мочевины в крови у этих
пациентов более 10 ммоль/л.
Электрокардиография. Электрокардиограмма у грудных детей с
коарктацией аорты, в отличие от детей старшего возраста, характери-
зуется признаками преобладающей нагрузки на правые отделы серд-
ца, что особенно выражено в первые три месяца жизни. Лишь у трети
из них электрическая ось сердца имеет вертикальное или нормальное
положение, у остальных отклонена вправо. Гипертрофия преимущест-
венно правого желудочка или комбинированная встречаются пример-
но в равной степени. При достижении 6-12 мес симптомы перегрузки
левых отделов сердца становятся преобладающими. Более чем у поло-
вины больных первого года жизни с сердечной недостаточностью ре-
гистрируют изменения, характерные для хронической ишемии миокар-
да в виде деформации конечной части желудочкового комплекса
(рис. 13-10).
Сочетание коарктации аорты с другими ВПС проявляется усилени-
ем гипертрофии левых или правых отделов сердца в зависимости от ха-
рактера порока и степени легочной гипертензии. Относительно часто
выявляются перегрузки левого (45%) или правого (39%) предсердий.
В целом, ЭКГ играет вспомогательную диагностическую роль, по-
зволяя заподозрить порок и уточнить степень перегрузки тех или иных
отделов сердца.
Рентгенография грудной клетки. Рентгенологическая картина
при коарктации аорты у грудных детей обычно представлена явления-
ми умеренного венозного застоя в легких и увеличением размеров серд-
ца. Сердце имеет в основном «аортальную» конфигурацию, но может
быть и овоидной формы. Возможно отклонение кпереди контрастиро-
ванного пищевода на уровне среднегрудного отдела позвоночника во
втором косом положении. Причиной этого служит постстенотическое
расширение аорты [18].
231
Рис. 13-10. ЭКГ больного с коарктацией аорты. Регистрируются
изменения сегмента ST в стандартных и левых грудных отведениях.
При сопутствующих ВПС со сбросом крови слева направо выяв-
ляются признаки не только венозного застоя в легких, но и гиперволе-
мии, а в последующем и гипертензии. Корни легких расширены, дуга
легочной артерии выбухает. Статистически достоверно возрастают ли-
нейные размеры и объем сердца, особенно у больных с резко снижен-
ной сократительной способностью миокарда. Нарастание сердечной
недостаточности сопровождается и усилением признаков венозного за-
стоя в легких.
Следует отметить, что на первом году жизни никогда не встреча-
ются узуры ребер, которые являются одним из главных диагностиче-
ских признаков в старшем возрасте.
Эхокардиография. При проведении данного исследования необ-
ходимо ответить на следующие вопросы: 1) имеется ли локальная ко-
арктация или тубулярное сужение перешейка аорты? 2) какова степень
выраженности коарктации? 3) от какой области аорты отходят подклю-
чичные артерии? 4) есть ли дополнительные ВПС, в том числе гипо-
плазия дуги аорты? 5) насколько нарушена насосная функция сердца?
Для сканирования аорты наиболее часто используется супрастер-
нальная позиция. В норме при двухмерном изображении аорта выгля-
дит на экране эхокардиографа как дугообразное образование без ка-
ких-либо сужений, с симметричной пульсацией по всей длине. На уча-
стке коарктации аорты визуализируется сужение просвета с активной
пульсацией выше этого места (рис. 13-11).
232
Рис. 13-11. Эхокардиограмма в супрастернальной позиции по
длинной оси. Выявляется локальное сужение аорты в области перешейка, а также
гипоплазия перешейка аорты; визуализируется расширение восходящего отдела
грудной аорты, левой общей сонной артерии, а также нисходящей грудной аорты
ниже места коарктации.
Косвенными признаками, подтверждающими коарктацию, могут
быть постстенотическое расширение аорты, гипертрофия и дилатация
желудочков. Достаточно хорошей визуализации аорты можно достичь
у 92-100% больных. Точность диагностики увеличивается по мере на-
копления опыта и дополнительного использования допплер-методики,
с помощью которой регистрируется турбулентный кровоток в месте
сужения аорты и сниженный кровоток в брюшном отделе аорты.
Особенно важно выявление гипоплазии дуги аорты, что влияет на
объем хирургического вмешательства. Опорным моментом является
сравнение диаметров дуги аорты и нисходящей аорты. Гипоплазию дуги
можно заподозрить при отношении этих диаметров менее 0,7. Другим
вариантом является сравнение диаметра дуги аорты с диаметром вос-
ходящей аорты (до отхождения безымянного ствола). В норме их отно-
шение должно быть более 0,5.
Катетеризация сердца и ангиокардиография. Данное исследо-
вание у грудных детей применяют в случаях, когда не ясен характер
сопутствующих ВПС или есть подозрение на перерыв дуги аорты (рис.
13-12). Так как пункция бедренной артерии при коарктации аорты опас-
на возникновением ее тромбоза (травма сосуда плюс низкое давление
в нем), используют другие доступы. Возможно проведение катетера
через бедренную вену в правое предсердие и далее транссептальным
233
доступом в левое предсердие и левый желудочек. Для аортографии ис-
пользуют также сосуды подмышечной области. При этом катетер пред-
почтительнее проводить через подлопаточные артерии, что позволяет
избежать возможного тромбоза подключичной артерии [19].
Рис. 13-12. Ангиокардиография при локальной коарктации аорты
(А) и тубулярной гипоплазии перешейка аорты (Б).
При левой вентрикулографии могут быть выявлены также сим-
птомы поражения мышцы сердца - выраженная дилатация левого же-
лудочка, длительное стояние контраста в его полости с небольшими
колебаниями в периоды систолы и диастолы.
Лечение. При симптоматичной коарктации аорты у грудных де-
тей единственным эффективным средством помощи является опера-
ция. Однако не всегда ее можно выполнить немедленно после уста-
новления диагноза. В этих случаях необходима терапия, которая помо-
гает предотвратить ухудшение состояния ребенка и подготовить более
благоприятный фон для оперативного вмешательства.
Терапия включает следующие основные компоненты:
1) снижение потребностей организма в кислороде путем создания
комфортных температурных условий, ограничения физической актив-
ности; 2) использование простагландинов группы Е; 3) назначение ди-
гоксина, при низком сердечном выбросе - допамина; уменьшение за-
стойных явлений в МКК и БКК вполне компенсируют тот небольшой,
хотя и нежелательный прирост систолического артериального давле-
ния, который может наступить в результате действия инотропных пре-
234
паратов; 4) применение диуретиков в случае застойной сердечной не-
достаточности; 5) коррекция метаболического ацидоза с помощью гид-
рокарбоната натрия, 6) проведение искусственной вентиляции легких
для уменьшения потребностей в сердечном выбросе; 7) проведение бал-
лонной дилатации аорты.
Использование простагландинов группы Е показано при дуктус-
зависимом кровообращении у новорожденных с предуктальной коарк-
тацией аорты. В результате лечения наряду с увеличением потока кро-
ви через ОАП вероятна релаксация дуктальной ткани, имеющейся в
стенке аорты, что улучшает ее проходимость. Анализ литературных
сообщений показывает, что широкое использование простагландинов
у новорожденных с коарктацией аорты существенно улучшило пока-
затели выживаемости в этой возрастной группе. Если ранее погибал
каждый третий ребенок, то в настоящее время лишь в единичных слу-
чаях не удается стабилизировать состояние больных и затем выпол-
нить операцию.
В качестве неотложной помощи возможна также дилатация аор-
ты с помощью специального баллона, который вводится через пери-
ферические сосуды. Однако техническая сторона вмешательства дос-
таточно сложна. Для адекватного расширения аорты необходимо ис-
пользовать баллон большего диаметра, чем суженное место. Фиксиро-
ванное расширение достигается только при повреждении интимы и
среднего слоя сосуда. Это может повлечь за собой тромбоз аорты, а в
отдаленные сроки - развитие ее аневризмы. Кроме того, часто возни-
кает рекоарктация - уже через несколько дней или недель после
вмешательства, а операция в таких случаях осложняется наличием раз-
мозженных тканей в стенке аорты. Не случайно широкое применение
баллонной дилатации у грудных детей не рекомендуется. Гораздо ча-
ще ее используют после операции для устранения развивающегося рес-
теноза аорты [20].
Основным показанием к операции у грудных детей является нали-
чие коарктации аорты, вызывающей недостаточность кровообращения.
Принимают во внимание также наличие артериальной гипертензии,
гипотрофии, сопутствующих ВПС. Проявления коарктации в первые
дни и месяцы жизни свидетельствуют о значительной тяжести заболе-
вания, и хирургическое вмешательство часто выполняют в неотлож-
ном порядке. При этом плохая насосная функция левого желудочка не
должна быть противопоказанием к операции, так как это в большинстве
случаев связано с механическим препятствием в аорте, и после коррек-
ции порока нормальный объем выброса быстро восстанавливается [21].
235
Несмотря на обилие предложенных методов устранения коаркта-
ции аорты, в настоящее время у детей предпочтение отдают двум ос-
новным - резекции коарктации с анастомозом конец-в-конец и истмо-
пластике аорты левой подключичной артерией. Однако при последней
операции возможно развитие ряда специфических осложнений (нару-
шение магистрального кровотока в левой руке, синдром обкрадыва-
ния головного мозга). Исследование внутричерепных сосудов с помо-
щью транскраниального дуплексного сканирования позволило нам
впервые достоверно установить феномен обкрадывания у таких боль-
ных даже в случаях перевязки позвоночной артерии у ее устья [22]
(рис. 13-13 на цветной вкладке). Данный феномен может быть связан с
развитием анастомозов между дистальным отделом левой позвоноч-
ной артерии, артериями щитовидной железы и задними шейными со-
судами и перетоком крови в сосуды левой руки.
Таким образом, возникающие осложнения заставляют пересмот-
реть показания к истмопластике аорты левой подключичной артерией,
которая может быть рекомендована только в редких, анатомически и
технически сложных случаях.
При анастомозе конец-в-конец риск развития рекоарктации аорты
быстро снижается с совершенствованием техники операции. В настоя-
щее время частота ее колеблется от 0,5 до 10% при наблюдениях до 10
лет [20]. В связи с этим данная операция становится доминирующей.
Хирургическая тактика при сопутствующих ВПС варьирует в за-
висимости от опыта клиники. Возможна поэтапная коррекция (снача-
ла коарктации аорты, затем других ВПС), одномоментная коррекция,
выполнение сопутствующих паллиативных операций. Однако во всех
случаях наличие дополнительных пороков является фактором, повы-
шающим послеоперационную смертность и ухудшающим отдаленные
результаты.
13.3. Перерыв дуги аорты
Перерыв дуги аорты (атрезия дуги аорты, атипичная коарктация)
представляет собой отсутствие сообщения между восходящей и нис-
ходящей аортой.
Частота. Частота порока составляет 0,02/1000 новорожденных,
0,4% среди всех ВПС и около 1% среди критических ВПС.
Анатомия. Дуга аорты подразделяется на три сегмента, имеющих
различное эмбриональное происхождение (рис. 13-14).
Проксимальная дуга простирается от брахиоцефального ствола до
левой общей сонной артерии и происходит из аортального мешка; дис-
236
тальная дуга - от левой общей сонной артерии до левой подключич-
ной артерии и формируется из четвертой эмбриональной дуги; пере-
шеек аорты - от левой подключичной артерии до юкстадуктального
участка нисходящей аорты и возникает при слиянии шестой эмбрио-
нальной дуги (проток) с четвертой эмбриональной дугой и левой дор-
зальной аортой. Такое сложное строение обусловливает возможность
перерыва дуги аорты в различных местах с различной частотой. Как
известно, в период эмбриогенеза нормальное развитие магистральных
сосудов связано с определенной величиной потока крови в них из же-
лудочковых камер. При сниженном по каким-либо причинам выбросе
из левого желудочка в аорту или повышенном потоке крови в легочную
артерию (из-за аномального формирования конотрункуса) структуры эм-
брионального сердца, из которых развивается дуга аорты, остаются в
зачаточном состоянии и могут полностью атрезироваться. Особенно бла-
гоприятные условия для возникновения патологии складываются при
сочетании ДМЖП с обструкцией выхода из левого желудочка.
Левая общая
сонная артерия
Рис. 13-14. Сегменты дуги аорты.
Удобную классификацию порока предложили Celoria G. и Patton
R. [23]. При типе А (30-41%) перерыв дуги расположен дистальней
левой подключичной артерии, при типе В (55-69%) - между левой об-
237
щей сонной и левой подключичной артериями, при типе С (4%) - меж-
ду брахиоцефальным стволом и левой сонной артерией (рис. 13-15).
Рис. 13-15. Типы перерыва дуги аорты по Секта G. и Patton R.
(штриховкой указана дуктальная ткань).
При типе А нередко сохраняется фиброзный тяж между концами
аорты («атрезия аорты»). При типе В правая подключичная артерия
может отходить от нисходящей аорты ниже перерыва.
Изолированный перерыв дуги аорты встречается чрезвычайно ред-
ко, в литературе описано не более 25 случаев. Для выживания пациен-
тов с такой патологией необходимо раннее развитие мощных коллате-
ралей. При участии в их формировании подключичной артерии, отхо-
дящей ниже перерыва, может возникнуть синдром обкрадывания моз-
гового кровотока [24]. Это связано с тем, что давление в артериях ви-
лизиева круга выше, чем в нисходящей аорте, и кровь по позвоночной
и подключичной артерии течет в ретроградном направлении.
Более часто (98%) порок сочетается с открытым артериальным про-
током, необходимым для кровоснабжения органов в бассейне нисхо-
дящей аорты. Другой аномалией, необходимой для сообщения между
собой кругов кровообращения, является ДМЖП (частота более 90%).
При его отсутствии необходимо искать дефект аортолегочной перего-
родки [25]. Менее часто встречаются единственный желудочек (11%),
общий артериальный ствол (10%), аномалия Тауссиг-Бинга (9%). В
редких случаях нисходящая аорта располагается справа от пищевода и
кровоснабжается через правый артериальный проток [26].
Обструкция выводного тракта левого желудочка (20%) может быть
обусловлена мышечным сужением на уровне конусной перегородки,
двухстворчатым аортальным клапаном, гипоплазией клапанного кольца.
Частой сопутствующей патологией является делеция 22ql 1 хро-
мосомы (DiGeorge syndrome).
238
Гемодинамика. Кровоток в восходящей аорте обеспечивается ле-
вым желудочком. Правый желудочек изгоняет кровь в легочный ствол,
откуда одна ее часть направляется в легочные артерии, а другая через
ОАП - в нисходящую аорту. Нарушения гемодинамики при наиболее
частом варианте порока (комбинация перерыва дуги аорты с ОАП и
ДМЖП) в раннем неонатальном периоде могут не возникать. Однако
при закрытии протока возникает синдром гипоперфузии нижней поло-
вины туловища, метаболический ацидоз, олигоурия. Метаболические
нарушения приводят к повреждению тканей головного мозга, миокар-
да, других органов. Прогрессирующее ухудшение сократительной функ-
ции миокарда, снижение сердечного выброса заканчиваются смертью
больного.
В редких случаях длительного функционирования открытого ар-
териального протока сохраняется удовлетворительная гемодинамика
во всех отделах туловища. Однако существует динамическая конку-
ренция между системным и легочным кровотоком: увеличение послед-
него приводит к снижению периферического кровоснабжения. С дру-
гой стороны, постоянный высокий легочный кровоток (из-за сброса
крови через септальные дефекты) приводит к явлениям застойной сер-
дечной недостаточности.
Естественное течение. Во внутриутробном периоде порок не ока-
зывает влияния на кровообращение плода, так как имеется хорошо
функционирующий ОАП. В постнатальном периоде судьба больных
также определяется проходимостью протока, который склонен к ран-
нему закрытию. Без соответствующего лечения в течение первого ме-
сяца жизни погибают более 60% детей. До 6 мес доживают не более
26%. У всех выживших имеются устойчивые источники кровоснабже-
ния нисходящей аорты.
Клиническая симптоматика. Так как порок является типичной
дуктус-зависимой патологией, первые симптомы возникают с началом
закрытия ОАП, обычно в раннем неонатальном периоде. Состояние
выглядевшего нормальным ребенка начинает быстро ухудшаться. Раз-
вивается синдром низкого сердечного выброса - плохое наполнение
пульса, тахикардия, одышка, похолодание конечностей, олигоурия.
Больной становится беспокойным, а затем заторможенным. В крови
определяется декомпенсированный метаболический ацидоз. Ишеми-
ческие повреждения печени приводят к повышению концентрации в
крови трансаминаз и лактатдегодрогеназы, поражение почек - к по-
вышению содержания креатинина, кишечника - к некротизирующему
энтероколиту.
239
При более благоприятном течении порока симптомы менее выра-
жены. Можно отметить легкий цианоз, который у 10% больных имеет
дифференцированный характер (более выражен на ногах), затрудне-
ния кормления, отставание в физическом развитии. В зависимости от
анатомического варианта порока имеется различное наполнение пуль-
са на конечностях. При типе А пульс на руках выше, чем на ногах. При
типе В дополнительно отмечается снижение пульса на левой руке, а
при аномальном отхождении правой подключичной артерии - на всех
конечностях. Полное исчезновение пульса на ногах свидетельствует о
закрытии ОАП и служит плохим прогностическим признаком.
Аускультативная картина отражает наличие сопутствующих поро-
ков сердца - ДМЖП и ОАП. Обычно имеется систолический шум во
втором-третьем межреберье слева. При развитии гиперволемии мало-
го круга кровообращения или выраженной обструкции выхода из ле-
вого желудочка развиваются симптомы сердечной недостаточности (та-
хикардия, одышка, гепатомегалия). Прогностически неблагоприятны
нарастающий цианоз и исчезновение шума над сердцем.
Электрокардиография. У новорожденных сохраняется отклоне-
ние электрической оси сердца вправо. При длительном существова-
нии порока развивается левожелудочковая или бивентрикулярная ги-
пертрофия.
Рентгенография грудной клетки. У новорожденных рентгено-
логическая картина может быть не изменена. Тень сердца умеренно
расширена, сосудистый пучок часто узкий из-за отсутствия тимуса (при
синдроме DiGeorge). По мере снижения ОЛС легочный рисунок уси-
ливается по артериальному руслу; при развитии сердечной недоста-
точности появляются симптомы венозного застоя и отека легких.
Эхокардиография. В большинстве случаев эхокардиография по-
зволяет поставить полноценный диагноз, необходимый для планиро-
вания лечения (рис. 13-16 на цветной вкладке).
В дополнение к локализации места перерыва необходимо оценить
диастаз между сегментами аорты, степень обструкции левого желу-
дочка, диаметр аортального клапана и восходящей аорты. Большое зна-
чение имеет выявление сопутствующих ВПС.
Дефект межжелудочковой перегородки обычно нерестриктивный,
сброс крови через него может быть слева направо или двухсторонним.
Через ОАП кровь течет из легочной артерии в нисходящую аорту.
Катетеризация сердца и ангиокардиография. До недавнего вре-
мени данное исследование было ведущим в диагностике порока. Од-
нако по мере развития ультразвукового исследования оно отходит на
второй план из-за опасности утяжеления состояния больных.
240
Катетеризация выявляет равное давление в обоих желудочках, что
не характерно для банальной коарктации аорты. Наиболее информа-
тивна ангиокардиография, позволяющая выявить как тип перерыва дуги
аорты, так и сопутствующие ВПС (рис. 13-17).
Рис. 13-17. Ангиокардиография при перерыве дуги аорты. А - после
вентрикулографии контрастируется восходящая аорта с брахиоцефальными ветвями;
отсутствует ее продолжение в нисходящую аорту; Б - при контрастировании легочной
артерии через ОАП заполняется нисходящая аорта.
Лечение. Основным методом лечения новорожденных с переры-
вом дуги аорты является инфузия простагландинов группы Е для под-
держания проходимости ОАП. Одновременно следует поддерживать
адекватный внутрисосудистый объем крови и корригировать анемию.
Для поддержания сердечного выброса используют инотропные
препараты, наиболее часто - допамин (4-6 мкг/кг/мин). Данный пре-
парат оказывает дополнительное положительное действие на почеч-
ную функцию. Однако следует избегать высоких доз, вызывающих
увеличение периферического сопротивления и смещение объема кро-
ви в легкие.
В некоторых случаях приходится прибегать к искусственной вен-
тиляции легких, которую проводят в режиме, исключающем гипер-
вентиляцию, и без добавления кислорода. Эти меры необходимы для
предотвращения закрытия ОАП или усиления легочного кровотока.
Не следует стремиться к повышению системного SO2 более 75-85%.
Необходимы также постоянный контроль и коррекция метаболиче-
ского ацидоза.
У больных с синдромом DiGeorge необходим постоянный контроль
уровня кальция; переливание им цитратной крови может быть опасным.
241
Хирургическое вмешательство выполняют после стабилизации со-
стояния больного. Операцией выбора является создание прямого ана-
стомоза между сегментами аорты. Возможна и интерпозиция синтети-
ческого протеза. При большом шунтировании крови через ДМЖП опе-
рацию на аорте дополняют сужением легочной артерии; радикальную
коррекцию выполняют через несколько месяцев. В клиниках с боль-
шим хирургическим опытом осуществляют одномоментное устране-
ние перерыва дуги аорты и сопутствующих ВПС.
13.4. Аорто-желудочковый туннель
Данная аномалия представляет собой сообщение между аортой и
желудочком в обход аортального клапана.
Частота. Порок чрезвычайно редок, истинная его частота неиз-
вестна. При патолого-анатомических исследованиях сердец с ВПС дан-
ную аномалию обнаруживают в 0,1% случаев [27]. В литературе опи-
сано немногим более 60 операций коррекции порока. Наиболее типич-
ное сообщение - между аортой и левым желудочком, сообщение с пра-
вым желудочком встречается значительно реже (соотношение 12:1).
Описаны два случая сообщения с правым предсердием [28]. Следует
отметить, что некоторые авторы к истинному туннелю относят только
случаи соединения с левым желудочком, а все остальные - к внутриут-
робным разрывам аневризмы синуса Вальсальвы.
Анатомия. При аорто-левожелудочковом туннеле входное отвер-
стие туннеля расположено чаще всего в правом синусе Вальсальвы над
устьем коронарной артерии (40%). Оно может быть расположено так-
же ниже коронарной артерии (25%) или на уровне артерии (16% случа-
ев) [29]. Значительно реже канал берет начало из левого синуса Валь-
сальвы. Далее туннель направляется кнаружи от аортального клапана
и вниз, проходит через фиброжировую прослойку между инфундибу-
лумом и аортальными синусами, межжелудочковую перегородку, фор-
мирующую выводной отдел левого желудочка, и впадает в левый же-
лудочек. При прохождении через инфундибулярную перегородку тун-
нель может смещать ее кпереди, вызывая подлегочный стеноз.
На основании обзора литературы Hovaguimian et al. в 1988г. пред-
ложили выделить четыре типа порока [29] (рис. 13-18):
- тип I - простой туннель, не затрагивающий аортальный клапан;
- тип II - туннель с большой аневризмой аортальной стенки, начи-
нающейся овальным отверстием, с деформацией или без деформации
аортального клапана;
242
- тип III - внутрисердечная аневризма септального участка тунне-
ля с обструкцией или без обструкции выводного отдела правого желу-
дочка;
- тип IV - комбинация типов II и III.
В некоторых случаях коронарная артерия может брать начало не-
посредственно от стенки туннеля. Возможно сочетание порока с ОАП,
ДМЖП. При впадении туннеля в правый желудочек в половине случа-
ев имеется также клапанный стеноз легочной артерии.
Рис. 13-18. Классификация аорто-левожелудочкового туннеля по
Hovaguimian et. al. ЛП - левое предсердие, ЛЖ - левый желудочек, ПЖ - правый
желудочек.
Гемодинамика. Туннель не создает препятствий току крови во все
фазы сердечного цикла. В связи с этим у пациентов имеется выражен-
ная регургитация крови в левый желудочек, приводящая к его объем-
ной перегрузке. У данных больных быстро развиваются кардиомега-
лия и сердечная недостаточность. Дилатация желудочка может при-
вести к вторичной центральной регургитации на аортальном клапане.
Характерно также расширение восходящей аорты.
243
В случае сочетания аорто-правожелудочкового туннеля с легочным
стенозом, последний предотвращает объемную перегрузку желудочка
и его дисфункцию в течение некоторого периода времени, позволяя
отложить оперативное вмешательство.
Так как порок создает нагрузку на сердце уже во внутриутробном
периоде, выраженная сердечная недостаточность может возникнуть
вскоре после рождения ребенка.
Естественное течение. Внутриутробное течение порока не изу-
чено. В постнатальном периоде прогноз зависит от объема регургита-
ции крови, однако обычно требуется ранняя операция для спасения
ребенка. Как правило, у этих больных быстро прогрессирует сердеч-
ная недостаточность, которая приводит к смерти в первые месяцы жиз-
ни. До взрослого возраста пациенты доживают в единичных случаях.
Клиническая симптоматика. Симптомы порока возникают вско-
ре после рождения ребенка и проявляются характерными признака-
ми объемной перегрузки сердца: тахикардией, одышкой, увеличени-
ем печени. Сердечная недостаточность быстро прогрессирует, плохо
поддается терапии и может привести к смерти в течение первых ме-
сяцев жизни.
Выслушиваются систолический и диастолический шумы слева
от грудины и на верхушке. Пульс высокий, диастолическое артери-
альное давление снижено. В целом картина напоминает недостаточ-
ность аортального клапана, однако в отличие от нее тоны сердца луч-
ше сохранены.
Электрокардиография. Изменения ЭКГ неспецифичны. У груд-
ных детей электрическая ось сердца быстро смещается влево, появля-
ются симптомы гипертрофии и перегрузки левого желудочка.
Рентгенография грудной клетки. Рентгенограмма выявляет кар-
диомегалию, связанную с дилатацией левого желудочка, и расшире-
ние сосудистого пучка, как в переднезадней, так и в боковой проекци-
ях. При сердечной недостаточности определяются признаки венозно-
го застоя в малом круге кровообращения.
Эхокардиография. Данное исследование в последнее время ста-
ло ведущим в диагностике порока. При сканировании обращает на се-
бя внимание дилатация левого желудочка с концентрической гипер-
трофией. В парастернальной проекции длинной оси можно обнаружить
туннель, берущий начало в области аортального синуса, проходящий
между аортальным клапаном и выводным отделом межжелудочковой
перегородки и соединяющийся с полостью левого желудочка (рис. 13-19
на цветной вкладке). В проекции короткой оси определяется связь
244
туннеля с правым синусом Вальсальвы и коронарной артерией. Строе-
ние и функция аортального клапана, как правило, нормальные. Одна-
ко может отмечаться регургитация, связанная с дилатацией кольца или
деформацией клапана.
Необходимо также оценить наличие обструкции выводного трак-
та правого желудочка.
Катетеризация сердца и АКГ. Данное исследование в последние
годы практически не используется в связи с возможностями эхокар-
диографической диагностики.
Лечение. Основные мероприятия должны быть направлены на сни-
жение метаболических потребностей организма (температурный ком-
форт, ограничение физической активности ребенка), снижение ОЦК
(диуретики) и периферического сопротивления (ингибиторы АПФ).
Возможно также использование дигоксина. Однако медикаментозная
терапия малоэффективна и может быть применена только для стаби-
лизации больного перед операцией. Единственным средством лечения
является оперативная коррекция порока.
Во время операции закрывают аномальную коммуникацию на ее
аортальном конце или на обоих концах. Последний вариант предпоч-
тительнее, так как предотвращает дальнейшую дилатацию туннеля при
нагнетании в него крови левым желудочком [30]. Во время операции
особое внимание уделяют коронарной артерии и аортальному клапану
для исключения их повреждения. Ранние операции приводят к быст-
рому восстановлению функции левого желудочка; проблемы, связан-
ные с аортальным клапаном, отсутствуют. При поздних операциях, как
правило, имеется деформация аортального клапана, и в последующем
требуется его пластика или протезирование.
13.5. Врожденная аневризма синуса Вальсальвы
Врожденная аневризма синуса Вальсальвы представляет собой ме-
шотчатое выпячивание стенки аортального синуса и нередко сопрово-
ждается прорывом в рядом расположенные полости сердца.
Частота. Истинная частота аномалии неизвестна, так как она не-
редко протекает бессимптомно. В патолого-анатомических сериях ука-
зывают на 0,09%, в хирургических сериях колебания составляют от
0,14 до 3,5% [31].
Анатомия. Возникновение порока связано с дефицитом нормаль-
ной эластической ткани. В результате нарушается соединение средне-
го слоя аортальной стенки с фиброзным кольцом аортального клапана.
Аневризма формируется над уровнем клапанного кольца и наиболее
245
часто располагается в правом синусе Вальсальвы (65-85%). Реже она
возникает в некоронарном (10-30%) или левом синусе (менее 5%). При
множественных дилатациях говорят уже об аневризме корня аорты,
что больше присуще синдрому Марфана.
О врожденном характере аномалии свидетельствует частое соче-
тание с другими пороками сердца: ДМЖП (30-60%), аортальной не-
достаточностью (20-30%), двустворчатым аортальным клапаном (10%),
легочным стенозом, коарктацией аорты.
Аневризма может выглядеть как незначительное расширение си-
нуса или достигать гигантской шарообразной формы, однако в боль-
шинстве случаев она представляет собой пальцеобразное выпячива-
ние размером до 1-2 см, проникающее в смежные отделы сердца. Раз-
рыв аневризмы возникает обычно на ее верхушке.
Гемодинамика. Неразорвавшаяся аневризма синуса Вальсальвы,
как правило, протекает бессимптомно и является случайной находкой
при кардиологическом обследовании. Однако возможны и осложне-
ния. В частности, аневризма может сдавливать коронарную артерию
или вызывать ее изгиб с развитием ишемии миокарда. Описаны нару-
шения ритма из-за сдавления проводящих путей (фибрилляция пред-
сердий, желудочковая тахикардия, атриовентрикулярный блок), об-
струкция выводного отдела правого желудочка, периферические арте-
риальные эмболии [32].
Разрыв аневризмы возникает преимущественно в возрасте от 15 до
30 лет, однако подобный случай наблюдали и у четырехлетнего ребенка
[33]. Провоцировать разрыв могут травма грудной клетки, значительное
физическое усилие, бактериальный эндокардит. В результате возникает
сброс крови в какую-либо камеру сердца. Наиболее часто это правый
желудочек или правое предсердие. Значительно реже развивается сооб-
щение с левым желудочком, левым предсердием, легочной артерией или
полой веной. При сбросе в камеры с низким давлением кровь в них по-
ступает постоянно, так как и в систолу, и в диастолу давление в аорте
выше. При наиболее частом варианте прорыва в правые отделы помимо
их собственной перегрузки возникает выраженная гиперволемия мало-
го круга кровообращения, объемная перегрузка левых отделов сердца и
застойная сердечная недостаточность. Прорыв в полость перикарда, как
правило, заканчивается тампонадой сердца.
Естественное течение. Данные о естественном течении порока от-
сутствуют. Однако известно, что после разрыва аневризмы острые гемо-
динамические расстройства могут привести к быстрой гибели больных.
246
Клиническая симптоматика. Как уже указывалось выше, нера-
зорвавшаяся аневризма синуса Вальсальвы в большинстве случаев про-
текает бессимптомно. Появление болей в грудной клетке, нарушений
ритма, обмороков является следствием сдавления тех или иных струк-
тур сердца (коронарная артерия, проводящие пути) и основанием для
обследования пациента. В таких наблюдениях эхокардиографическое
исследование позволяет обнаружить необычную структуру, пенетри-
рующую в какие-либо камеры сердца.
Разрыв аневризмы сопровождается возникновением болей в об-
ласти сердца, одышкой, сердцебиениями. Это связано, с одной сторо-
ны, с острой легочной гиперволемией, а с другой - с падением коро-
нарного кровотока и сердечного выброса из-за оттока крови из аорты в
правые отделы. Одновременно появляется систолодиастолический ма-
шинообразный шум на основании сердца, слева или справа от груди-
ны. Артериальное диастолическое давление снижается, пульсовое -
повышается. У пациентов быстро развиваются симптомы застойной
сердечной недостаточности - одышка, тахикардия, гепатомегалия.
Электрокардиография. Изменения электрокардиограммы неспе-
цифичны. Обычно они отражают перегрузку соответствующих отде-
лов сердца или возникшие нарушения ритма и проводимости.
Рентгенография грудной клетки. Рентгенограмма при разрыве
аневризмы синуса Вальсальвы отражает возросший легочный крово-
ток (артериальная гиперволемия) и кардиомегалию за счет тех отделов
сердца, которые подверглись объемной перегрузке.
Эхокардиография. В настоящее время данное исследование иг-
рает ведущую роль в диагностике порока. Помимо косвенных призна-
ков патологии (увеличение полостей сердца) можно выявить структур-
ное образование, связанное с аортальным синусом и проникающее в
какую-либо из камер сердца (рис. 13-20).
При наличии разрыва аневризмы в соответствующей камере реги-
стрируется постоянный мозаичный кровоток. Дополнительное внима-
ние должно быть уделено последствиям разрыва - изменениям коро-
нарного кровотока, обструкции выхода из правого желудочка аневриз-
матическим мешком.
Необходимо также исключить сопутствующие пороки сердца:
ДМЖП, двухстворчатый аортальный клапан, недостаточность аорталь-
ного клапана, коарктацию аорты.
Катетеризация сердца и ангиокардиография. При катетериза-
ции сердца выявляют умеренную легочную гипертензию и артериали-
247
зацию крови на уровне камеры, в которую произошел разрыв. Аорто-
графия позволяет визуализировать аневризматическое образование и
определить, с каким отделом сердца оно сообщается.
Рис. 13-20. Эхокардиография при разрыве аневризмы синуса
Вальсальвы (указана стрелкой) в правый желудочек.
Лечение. Терапевтическое лечение эффективно только при неболь-
шом объеме сброса через перфорированную аневризму и включает тра-
диционный дигоксин и мочегонные препараты.
В большинстве случаев гемодинамические расстройства, приво-
дящие к сердечной недостаточности, возможно устранить только с по-
мощью хирургического вмешательства. Операция заключается в закры-
тии отверстия в стенке аорты или обоих отверстий аневризмы. Особое
внимание должно быть уделено состоянию аортального клапана и при-
лежащей коронарной артерии и предотвращению их компрометации.
При соответствующих показаниях выполняют пластику или протези-
рование клапана и восстановление проходимости коронарной артерии
[34, 35].
13.6. Сосудистые кольца и слинг легочной артерии
Сосудистое кольцо - врожденная аномалия, при которой сосуди-
стые структуры окружают и сдавливают трахею и пищевод.
248
Частота. Истинная частота патологии неизвестна. Пренатально она
выявляется у 0,01% обследованных [36]. В то же время, частота опера-
ций по поводу сосудистого кольца в популяции составляет 0,0013%.
Таким образом, до 90% патологии может протекать бессимптомно. Сре-
ди пациентов с ВПС, попадающих в кардиохирургические клиники,
сосудистое кольцо встречается менее чем у 1% .
Анатомия. Формирование порока происходит на раннем этапе эм-
брионального развития. При нормальном физиологическом процессе
каждая из шести эмбриональных дуг превращается в функционирую-
щий сосуд или происходит ее регресс. Патологическое развитие дуги
происходит при отсутствии необходимых изменений эмбриональных
структур.
Сосудистые кольца могут быть полными или неполными. К наи-
более частым полным кольцам относятся сосудистые образования в
виде двойной дуги аорты (с гипоплазированной левой дугой) и правой
дуги аорты с левой артериальной связкой. Данные пороки составляют
70-85% всех сосудистых колец (рис. 13-21).
1
2 3
4
6
Рис. 13-21. Схема основных вариантов сосудистых колец. 1 - норма;
2 - двойная дуга аорты; 3 - правая дуга аорты с левой артериальной связкой;
4 - аномальная безымянная артерия; 5 - аномальная правая подключичная артерия;
6 - перекидывающаяся легочная артерия.
249
Ряд других сосудистых аномалий не формируют полного кольца,
однако также приводят к сдавлению расположенных рядом структур.
Наиболее часто встречаются аномально отходящая (смещенная влево)
безымянная артерия (10%) и легочный слинг (sling - «перекидываю-
щаяся» легочная артерия). Последняя патология характеризуется отхо-
ждением от правой легочной артерии левой ветви, которая перекиды-
вается через правый бронх и направляется к левому легкому между
трахеей и пищеводом. Примерно у 50% этих больных имеется врож-
денная аномалия самой трахеи в виде отсутствия мембранозного уча-
стка в трахеальных хрящах. В результате хрящи составляют полное
кольцо, что усугубляет стеноз трахеи.
Еще одна разновидность порока - аномальное отхождение правой
подключичной артерии от нисходящей аорты (20% случаев). Артерия
проходит позади пищевода и вызывает его незначительное сдавление.
Оно более выражено при дополнительном образовании дивертикула
аорты в месте отхождения подключичной артерии.
Данные пять вариантов наиболее часто проявляются клинически
и требуют хирургического лечения.
Гемодинамика. При всех рассматриваемых аномалиях имеется од-
на общая особенность - компрессия дыхательных путей и/или пище-
вода. Это связано с тем, что давление в магистральных артериях вы-
ше, чем давление в просвете трахеи или пищевода. Кроме того, у детей
первого года жизни имеются особенности дыхательных путей, пред-
располагающие к возникновению гиповентиляции легких: слабое раз-
витие хрящевой, мышечной и эластической ткани, маленький диаметр
бронхов, плохо развитая коллатеральная вентиляция альвеол (поры
Kohn и каналы Lambert), большое количество слизистых желез.
При умеренном нарушении проходимости бронхов возникает ло-
барная эмфизема, а при значительном сужении - ателектазы долей лег-
ких. В местах пережатия дыхательных путей могут развиваться трахе-
обронхиальная маляция и стойкие стенозы. Компрессия пищевода со-
провождается нарушениями глотания и прохождения пищи.
Нарушения проходимости дыхательных путей и пищевода могут
быть изолированными или сочетаться друг с другом.
С аномалиями дуги аорты могут комбинироваться другие врож-
денные пороки сердца (до 25% наблюдений). Правая дуга аорты встре-
чается у трети больных с тетрадой Фалло. Аномалии дуги также не
являются редкостью при двойном отхождении сосудов от правого же-
лудочка, общем артериальном стволе, транспозиции магистральных ар-
терий, атрезии трехстворчатого клапана. В таких случаях присутству-
ют соответствующие нарушения внутрисердечной гемодинамики.
250
Естественное течение. Естественное течение не изучено.
Клиническая симптоматика. У большинства пациентов (до 50%)
с сосудистыми кольцами заболевание манифестирует в младенчестве
или в раннем детском возрасте. При раннем проявлении порока преоб-
ладают признаки обструкции дыхательных путей [37]. Возможны за-
труднения при кормлении. Дисфагия и другие симптомы сдавления пи-
щевода обычно доминируют у старших детей. Некоторые пациенты
остаются бессимптомными, и диагноз устанавливается случайно при
медосмотре [38].
Чем уже кольцо, тем сильнее дискомфорт и раньше появляются
симптомы заболевания. У этих пациентов, даже при наличии сопутст-
вующих ВПС, преобладает клиника обструкции дыхательных путей.
Как правило, отмечаются стридор, цианоз, респираторный дистресс-
синдром, асфиксия и/или характерный частый кашель. Могут наблю-
даться симптомы астмы, пневмонии. В некоторых случаях признаки
компрессии дыхательных путей усиливаются при кормлении. У мла-
денцев с выраженной обструкцией наблюдается втяжение межребер-
ных промежутков при дыхании. У некоторых из них отмечается выну-
жденное положение, при котором голова запрокинута назад для умень-
шения компрессии и облегчения дыхания.
Патологические шумы в сердце выявляют лишь при сопутствую-
щих ВПС.
Электрокардиография. При изолированной патологии измене-
ния ЭКГ отсутствуют. Наличие сопутствующих ВПС проявляется со-
ответствующими им изменениями.
Рентгенография грудной клетки. Поскольку симптомы часто свя-
заны с нарушением дыхания, рентгенография грудной клетки является
высокоинформативным методом исследования. В частности, иденти-
фикация правой дуги аорты на рентгенограмме грудной клетки у ре-
бенка с нарушением дыхания, респираторным дистресс-синдромом или
дисфагией должна насторожить врача в отношении наличия сосуди-
стого кольца. К другим специфическим рентгенографическим призна-
кам относят сдавление трахеи, повышенную воздушность и/или ате-
лектаз долей легких. Последние признаки особенно характерны для
аномального отхождения левой легочной артерии.
Рентгенография пищевода с барием во многих случаях является
решающей в диагностике (рис. 13-22) [37]. Ход пищевода исследуют в
переднезадней и боковой проекции. Двойная дуга аорты приводит к
билатеральной и задней компрессии пищевода. Правое углубление круп-
нее и расположено немного выше, чем левое. Сзади компрессия обыч-
но довольно широкая и проходит в нисходящем направлении справа
251
налево. У пациентов с ретроэзофагеальной правой подключичной ар-
терией имеется только задний дефект пищевода в нисходящем направ-
лении справа налево, не столь широкий, как при двойной дуге аорты.
При аномальной левой легочной артерии определяется характерный де-
фект передней стенки пищевода на уровне бифуркации трахеи. Задняя
компрессия отсутствует. В случаях аномально расположенной безымян-
ной артерии с трахеальной компрессией рентгенограмма пищевода не
изменена.
Рис. 13-22. Схема нарушений контрастирования пищевода при
различных видах сосудистого кольца. А - двойная дуга аорты; Б - правая
аортальная дуга с левым артериальным протоком; В - аберрантная правая
подключичная артерия; Г - слинг левой легочной артерии. 1 - передне-задняя
проекция, 2 - латеральная проекция (спина пациента справа).
Эхокардиография. Тщательное исследование дуги аорты и ее вет-
вей из супрастернального доступа позволяет выявить сосудистые ано-
малии. Однако семиотика заболевания окончательно не разработана.
Кроме того, использование цветной допплерографии невозможно при
исследовании таких структур, как артериальная связка или атрезиро-
ванная дуга (т.е. не имеющих кровотока). Данное исследование более
эффективно для обнаружения сопутствующих пороков сердца.
Катетеризация сердца и ангиокардиография. В настоящее вре-
мя считается, что в большинстве случаев метод мало добавляет к ин-
формации, полученной при контрастной рентгенографии пищевода.
Прочие исследования. При диагностике сосудистого кольца вы-
сокоинформативными методами являются компьютерная и магнитно-
резонансная томография, позволяющие установить положение сосу-
дистых структур, трахеи, бронхов и пищевода и их пространственные
взаимоотношения. Эффективность исследования повышается при ис-
пользовании внутрисосудистого контрастирования.
Бронхоскопия может быть показана при длительном существова-
нии обструкции дыхательных путей, когда есть опасность трахеоброн-
хомаляции, а также при подозрении на врожденный стеноз трахеи. При
252
сосудистом кольце выявляется щелевидное сужение бронха или тра-
хеи пульсирующим образованием. Тубус бронхоскопа свободно раз-
двигает сужение, однако оно вновь возникает после удаления тубуса.
В случае аномально расположенной безымянной артерии пульсация
наблюдается только на передней стенке трахеи.
Лечение. Детей необходимо кормить жидкой и мягкой пищей. Важ-
ным компонентом терапии является профилактика и лечение легочной
инфекции.
Единственная радикальная форма лечения сосудистых колец - хи-
рургическая коррекция. У пациентов без симптомов (но с установлен-
ным диагнозом) операция не показана. У детей со стридором, асфик-
сией или другими признаками респираторного дистресс-синдрома она
должна быть выполнена как можно быстрее после установления диаг-
ноза.
Целью операции является пересечение образования, вызывающе-
го компрессию, и восстановление нарушенной проходимости аорты и
ее ветвей. При слинге легочной артерии операцию выполняют в усло-
виях искусственного кровообращения. При этом аномальную артерию
отсекают, перемещают кпереди и реимплантируют в легочный ствол.
В редких случаях приходится прибегать к дополнительной пла-
стике пищевода. Если сохраняются симптомы обструкции дыхатель-
ных путей, может потребоваться резекция размягченной части трахеи
или бронха или более сложная операция трахеопластики.
Литература
1. Gupta A., Mogos С., Schmer V, Gudavalli М. One day old infant with acyanotic
congenital heart disease: critical aortic stenosis //J. Pcrinat. Med.- 1999.- Vol. 27.-
P. 292-294.
2. Nguyen K.H. Congenital heart surgery database and nomenclature project: aortic
valve disease // Ann. Thorac. Surg. - 2000.- Vol. 69.- P. S118-S131.
3. Robertson M.A., Byrne P.J., Penkoske PA. Perinatal management of critical aortic
valve stenosis diagnosed by fetal cchocardigraphy // Br. Heart J.- 1989.- Vol. 61.-
P. 365-367.
4. Sharland G.K., Chita S.K., Fagg N.L.K. et al. Left ventricular dysfunction in the
fetus: relation to aortic valve anomalies and endocardial fibroelastosis // Br. Heart
J.- 1991.- Vol. 66.- P. 419-424.
5. Hawkins J.A., Munich L.L., Tani L. Y. et al. Late results nd reintervention after aortic
valvotomy for critical aortic stenosis in neonates and infants // Ann. Thorac. Surg.-
1998.-Vol. 65.- P. 1758-1763.
6. Samanek M., Voriskova M. Congenital Heart disease among 815.569 children born
between 1980 and 1990 and their 15-ycar survival: A prospective Bohemia survival
study // Pediatr. Cardiol.- 1999.-V.20.- P. 411-417.
253
7. Gundry S.R., Berendt D.M. Prognostic factors in valvotomy for critical aortic steno-
sis in infancy // J. Thorac. Cardiovasc. Surg.- 1986.- Vol. 92.- P. 747-754.
8. Pelech A.N., Dyck J.D., Trusler G.A. et al. Critical aortic stenosis. Survival and
management // J. Thorac. cardiovasc. aurg.- 1987.- Vol. 94.- P. 510-517.
9. Reich O., Tax P, Razek V. et al. Long term results of percutaneous balloon val-
voplasty of congenital aortic stenosis: Independent predictors of outcome // Heart. -
2004. - Vol. 90. - P. 70-76.
10. Thomson J.D.R. Management of valvar aortic stenosis in children // Heart.- 2004.-
Vol. 90.- P. 5-6.
11. Kitchiner D. Subaortic stenosis: still more questions than answers // Heart.- 1999.-
Vol. 82.- P. 647-648.
12. Celermajer D.S., Greaves K. Survivors of coarctation repair: fixed but not cured //
Heart.- 2002.-Vol. 88.-P. 113-114.
13. Fyler D.C. Report of New England Regional Infant Cardiac Programm // Pediat-
rics.-1980.-Vol. 65.-№2.-Part 2.- Suppl.
14. Hessleini P.S., Gutgesell H.P., McNamara D.G. Prognosis of symptomatic coarcta-
tion of the aorta in infancy // Am. J. Cardiol.- 1983.- Vol. 51.- P. 299-303.
15. De Swiet M., Petj J., Shinebourne E.A. Difference between upper and lower limb
blood pressure in normal neonates using Doppler technique // Arch. Dis. Childh.-
1974.-Vol. 49.-P. 734-735.
16. Crossland D.S., Furness J.C., Abu-Harb M. et al. Variability of four limb blood
pressure in normal neonates // Arch. Dis. Child. Fetal Neonatal Ed.- 2004.- Vol. 89.-
P. F325-F327.
17. Алекси-Месхишвили В.В. Хирургическое лечение врожденных пороков сердца
у детей первого года жизни.— Дисс...докт. мед. наук - М., 1978.
18. Ролонзко Р.Р., Яковлева Н.А., Шарыкин А.С. Рентгеносемиотика коарктации
аорты у детей первого года жизни // Вести, рентген, радиол.- 1987.- №4.-
С. 69-74.
19. Гарибян В.А. Диагностика врожденных пороков сердца у новорожденных и
детей первого года жизни.— Дисс...докт. мед. наук.- М., 1984.
20. Gibbs J.I. Treatment options for coarctation of the aorta // Heart.- 2000.- Vol. 84.-
P. 11-13.
21. Шарыкин A.C., Ильин В.И.,.Рогова ТВ, Ильина О.Н. Результаты хирургиче-
ского лечения коарктации аорты у грудных детей с резким снижением насос-
ной функции левого желудочка // Грудная и серд.-сос. хир.- 1992.- № 9-10.-
С. 9-11.
22. Шарыкин.А.С., Агаджанова Л.П. Синдром обкрадывания головного мозга по-
сле устранения коарктации аорты у детей раннего возраста // Грудная и серд.-
сос. хир.- 2000.- №4.- С. 9-14.
23. Celoria G.C., Patton R.B. // Am. Heart J.- 1959.- v. 58.- p.407-413.
24. Garcia O.L., Hernandez F.A., Tamer D. et al. Congenital bilateral subclavian steal.
Ductus-dependent symptoms in interrupted aortic arch associated with ventricular
septal defect // Am. J. Cardiol.- 1979.- Vol. 44.- P. 101-104.
25. Castaneda A. R., Jonas R.A., Mayer J.E., Hanley F.L. Cardiac surgery of the neonate
and infant. - W.B.Saunders Comp., Philadelphia, 1994.
26. Pierpont M.E.M., Zollikqfer C.L., Moller J.H, Edwards J.E. Interruption of the
aortic arch with right descending aorta // Ped. Cardiol.- 1982.- Vol. 2.- P. 153-159.
254
27. Okoroma E.O., Perry L.W., Scott L.P. Ill, McClenathan J.E. Aortico-left ventriculai
tunnel: clinical profile, diagnostic features, and surgical considerations // J. Thorac
Cardiovasc. Surg.- 1976.- Vol. 71.- P. 238-244.
28. Kalangos A., Beghetti M., Vala D. et al. Aorticorhigt atrial tunnel // Ann. Thorac
Surg.- 2000.- Vol. 69.- P. 635-637.
29. Hovaguimian H., Cobanoglu A., Starr A. Aortico-left ventricular tunnel: A clinical
review and new surgical classification // Ann. Thorac. Surg. - 1988.- Vol. 45.-
P. 106-112.
30. Hucin B., Horvath P, Skovranek J. et al. Correction of aortico-left ventricular tun-
nel during the first day of life // Ann. Thorac. Surg.- 19889.- Vol. 47.- P. 254-256.
31. Ring S.W. Congenital heart surgery nomenclature and database project: Aortic
aneurism, sinus of Valsalva aneuvrism, and aortic dissection // Ann. Thorac. Surg.-
2000.- Vol. 69.- P. S147-S163.
32. Pepper C., Munsch C., Sivananthan U.M., Pye M. Unruptured aneurysm of the lefi
sinus of Valsalva extending into the left ventricular outflow tract: presentation anc
imaging // Heart.- 1998.- Vol. 80.- P. 190-193.
33. Vural K.M., Sener E., Tasdemir O., Bayazit K. Approach to sinus of Valsalva aneu-
rysms: A review of 53 cases // Eur. J. Cardiothorac. Surg.- 2001.- Vol. 20.- P. 71 -76
34. Takach T.J., Reul G.J., Duncan M. et al. Sinus of Valsalva aneurism or fistula: man-
agement and outcome // Ann. Thorac. Surg.- 1999.- Vol. 68.- P. 1573-1577.
35. Murashita T, Kubota T, Kamikubo Y. et al. Long-term results of aortic valve regur-
gitation after repair of ruptured sinus of Valsalva aneurism // Ann. Thorac. Surg.-
2002.- Vol. 73.- P. 1466-1471.
36. Bronshtein M., Lorber A., Berant M. et al. Sonographic diagnosis of fetal vasculai
rings in early pregnancy // Am. J. Cardiol.- 1998.- Vol. 81.- P. 101-103.
37. Roesler M., de Leval M., Chrispin A., Stark J. Surgical management of vascular ring
// Ann. Surg.- 1983.- Vol. 197.- P. 139-146.
38. Kron I.L., Mappin G., Nolan S.P. et al. Symptomatic double aortic arch causing
tracheal andesophageal compression in the adult // Ann. Thorac. Surg.- 1987.-
VoL 43.- P. 105-106.
255
Глава 14. ВРОЖДЕННЫЕ АНОМАЛИИ
МИТРАЛЬНОГО КЛАПАНА
Митральный клапан состоит из фиброзного кольца, двух створок,
сухожильных хорд и двух папиллярных мышц (рис. 14-1). Большая пе-
редняя створка (аортальная) прикрепляется в пределах 150° окружно-
сти кольца и имеет трапециевидную форму. Ее фиброзное основание
продолжается в аортальный клапан. Задняя створка (муральная) при-
крепляется в пределах 210° окружности кольца, однако более узкая и
имеет фестончатый край. Под комиссурами, разделяющими створки,
находятся две папиллярные мышцы, переходящие в миокард левого
желудочка. Сухожильные хорды от папиллярных мышц прикрепляют-
ся к обеим створкам, так что каждая из них соединяется с хордами от
обеих мышц. Нормальный митральный клапан может иметь мелкие
вариации в формировании отдельных структур, однако основное пред-
назначение клапана - свободно пропускать кровь в полость левого же-
лудочка и предотвращать ее возврат в полость левого предсердия при
этом не нарушается.
Врожденные аномалии митрального клапана представляют собой
отклонения в анатомическом строении клапана, приводящие к расстрой-
ствам функции клапана. В соответствии с анатомической локализаци-
ей выделяют надклапанную, клапанную, подклапанную и смешанную
форму порока [1].
14.1. Врожденные недостаточность и стеноз
митрального клапана
Учитывая тот факт, что врожденные поражения митрального кла-
пана редко носят изолированный характер, мы сочли возможным из-
ложить их описание в одном разделе.
Митральная недостаточность характеризуется преимуществен-
ным нарушением запирательной функции митрального клапана во вре-
мя систолы левого желудочка, что сопровождается регургитацией кро-
ви в левое предсердие.
Митральный стеноз характеризуется обструкцией кровотоку из
левого предсердия в левый желудочек во время диастолы.
Частота. Истинная частота патологии неизвестна, так как у 35-70%
больных она сочетается с другими аномалиями сердца. В кардиохи-
рургических клиниках порок представлен менее чем в 1% случаев всех
ВПС.
256
Анатомия. Различные анатомические варианты порока представ-
лены в исчерпывающей классификации Carpentier А. [2]. В зависимо-
сти от подвижности створок он выделяет три группы аномалий.
Тип I. Нормальная подвижность створок
1. Дилатация клапанного кольца
2. Расщепление створок (или трехстворчатый клапан)
3. Дефект в створке
Тип II. Пролапс створок
1. Удлинение хорд
2. Удлинение папиллярных мышц
3. Отсутствие хорд
Тип III. Ограничение подвижности створок
А.Нормальные папиллярные мышцы
1. Сращения у комиссур
2. Укорочение хорд
3. Изменения клапана по типу аномалии Эбштейна
Б. Аномалии папиллярных мышц
1. Парашютообразный клапан
2. Гамакообразный клапан
3. Агенезия, гипоплазия папиллярных мышц
При парашютообразном клапане все хорды прикрепляются к един-
ственной папиллярной мышце, расположенной в нижней трети левого
желудочка. Как правило, это дополняется облитерацией межхордаль-
ного пространства, создающей выраженную обструкцию кровотоку, а
ограничение подвижности створок приводит к регургитации (рис. 14-1).
Рис. 14-1. Схема нормального митрального клапана (А) и
парашютообразного клапана (Б). Объяснения в тексте.
257
Гамакообразный клапан характеризуется смещением папиллярных
мышц вверх и кзади под муральную створку. Вследствие этого хорды,
идущие к передней створке, пересекают митральное отверстие, созда-
вая частичную обструкцию, а также нарушая подвижность створок.
При этом недостаточность клапана может быть вызвана укорочением
хорд, сопутствующей гипоплазией передней створки, ее расщеплени-
ем и дилатацией кольца.
Недостаточность митрального клапана может быть следствием от-
клонений в развитии любых компонентов клапана. В результате воз-
никает дефицит ткани створок по отношению к площади отверстия, их
пролабирование в полость предсердия, неполное смыкание из-за огра-
ничения движения. Во многих случаях эти факторы сочетаются (на-
пример, дилатация фиброзного кольца и удлинение хорд).
Митральный стеноз наиболее выражен при парашютообразном
клапане и гипоплазии кольца. Отдельную патологию представляет над-
клапанный стеноз в виде соединительнотканного валика, расположен-
ного непосредственно над передней створкой и продолжающегося к
задней створке. При этом возможна различная степень обструкции, за-
висящая от диаметра отверстия. В отличие от трехпредсердного серд-
ца мембрана расположена ниже ушка левого предсердия и устьев ле-
гочных вен. В большинстве случаев сам митральный клапан также из-
менен и является стенотичным или гипопластичным.
Гемодинамика. Основным следствием некомпетентности мит-
рального клапана является обратный ток части крови из левого желу-
дочка в левое предсердие во время систолы. Левое предсердие пере-
гружается, увеличивается в объеме. Во время диастолы увеличенный
объем крови из левого предсердия вновь поступает в левый желудо-
чек. Последний дилатируется и гипертрофируется. Давление в левом
предсердии при данном пороке быстро повышается, при наличии от-
крытого овального окна возникает сброс слева направо. За счет воз-
растания работы желудочка и увеличения ударного объема обеспечи-
вается сравнительно адекватный выброс крови в аорту. Однако воз-
можности увеличить сердечный выброс при выполнении нагрузки ста-
новятся ограниченными.
При нарастании митральной регургитации и/или развитии мио-
кардиальной недостаточности объемная нагрузка на левый желудочек
не сопровождается адекватным его опорожнением. Возрастает конеч-
ное диастолическое давление в желудочке, соответственно повышает-
ся давление в левом предсердии и легочных венах. Постепенно увели-
чивается застой в малом круге кровообращения, развивается легочная
гипертензия. В дальнейшем повышается нагрузка на правое сердце,
возникают застойные изменения и в большом круге кровообращения.
258
Возникающее расширение левого предсердия, клапанного кольца
и подтягивание вследствие этого задней створки клапана усугубляет
митральную недостаточность и обусловливает прогрессирующий ее ха-
рактер.
При митральном стенозе нагрузка долго падает на левое пред-
сердие. Давление в нем повышается, стенка гипертрофируется. Эти ме-
ханизмы усиливают поступление крови в левый желудочек, однако по-
степенно происходит ретроградное повышение давления в легочных
венах и капиллярах. В результате рефлекторного спазма легочных ар-
териол (рефлекс Китаева) возрастает давление в легочной артерии, а
затем развиваются и морфологические изменения в стенках легочных
сосудов. Таким образом, легочная гипертензия при митральном стено-
зе сначала формируется в посткапиллярном (венозном) пространстве,
а затем в прекапиллярном (артериальном) русле.
Естественное течение. Естественное течение изолированного вро-
жденного митрального порока не изучено. Однако, учитывая сообще-
ния о том, что в 11-22% всех хирургических случаев операцию необ-
ходимо выполнять уже на первом году жизни [3-5], можно предполо-
жить неблагоприятный прогноз.
Клиническая симптоматика. Митральная недостаточность при
незначительной деформации створок может проявляться лишь систо-
лическим шумом на верхушке сердца, проводящимся в левую подмы-
шечную область. Значительная регургитация быстро приводит к раз-
витию сердечной недостаточности, признаков легочной гипертензии.
Дети подвержены респираторным инфекциям, отстают в физическом
развитии. К систолическому шуму может добавиться акцент второго
тона на легочной артерии. Сердечная недостаточность носит бивен-
трикулярный характер.
При митральном стенозе ведущим признаком является одышка,
усиливающаяся при нагрузке [6]. Цианоз появляется только при легоч-
ной гипертензии, имеет красноватый оттенок. Сердечная недостаточ-
ность комбинируется из симптомов перегрузки правых отделов и низ-
кого выброса левого желудочка. Может возникать приступообразное
ухудшение состояния, с трудом поддающееся терапии. При аускульта-
ции на верхушке определяется мезодиастолический шум с пресисто-
лическим усилением. Возможен систолический шум сопутствующей
митральной недостаточности. Второй тон на легочной артерии усилен.
Следует отметить, что сопутствующие врожденные пороки серд-
ца, часто встречающиеся при поражении митрального клапана, могут
значительно изменять аускультативную картину.
259
Электрокардиография. Митральная недостаточность. С пер-
вых месяцев жизни электрическая ось сердца смещается в сторону нор-
мального положения. Возникают признаки перегрузки преимуществен-
но левого желудочка и левого предсердия. При длительном существо-
вании порока развивается перегрузка правого желудочка, возможно мер-
цание и трепетание предсердий.
Митральный стеноз. Электрическая ось сердца сохраняется от-
клоненной вправо в течение длительного времени. Имеются признаки
перегрузки обоих предсердий. При длительном существовании поро-
ка возможно возникновение мерцательной аритмии.
Рентгенография грудной клетки. Изменения рентгенограммы за-
висят от степени нарушения гемодинамики. В большинстве случаев
выявляется венозный застой в легких. При значительной митральной
недостаточности сердце быстро увеличивается в размерах за счет ле-
вого желудочка и левого предсердия. При митральном стенозе кардио-
мегалия обычно отсутствует. Однако при длительном существовании
порока тень сердца увеличивается за счет левого предсердия и правого
желудочка.
Эхокардиография. Данное исследование является ведущим в ди-
агностике аномалий митрального клапана. Косвенными признаками по-
рока служат дилатация левого предсердия и левого желудочка. При ана-
лизе архитектуры митрального аппарата обращают внимание на рас-
ширение или сужение фиброзного кольца, увеличение площади ство-
рок и их пролабирование, расщепление передней створки, утолщение
и малую подвижность створок (особенно задней), аномальное крепле-
ние хорд и расположение папиллярных мышц. При парашютообраз-
ном клапане выявляется одна папиллярная мышца, от которой отходят
хорды к обеим створкам.
Возможны три основных варианта митральной некомпетентности,
соответствующих классификации Carpentier.
1. Движение створок нормальное. Имеется регургитация, связан-
ная с деформацией кольца или дефектами в створке (чаще передней).
2. Движение створок увеличено, они пролабируют в полость лево-
го предсердия (свободный край створок переходит за плоскость фиб-
розного кольца). Может отсутствовать одна из папиллярных мышц.
3. Движение створок ограничено в связи со сращением комиссур,
утолщением или укорочением подклапанного аппарата.
Характеристика степени митральной регургитации может быть да-
на на основании визуализации потока с помощью цветной допплеро-
графии (рис. 14-2 на цветной вкладке). Степень митральной регурги-
260
тации можно оценить по глубине проникновения струи регургитации
с помощью импульсно-волновой допплерографии и по площади струи
регургитации при цветном картировании кровотока. При этом незна-
чительной степени (1+) митральной регургитации соответствует по-
ток под створками клапана; от незначительной до умеренной степени
(2+) - поток, не достигающий середины предсердия; умеренной степе-
ни (3+) - глубже середины предсердия; выраженной степени (4+) - по-
ток, распространяющийся на все левое предсердие до устьев верхних
легочных вен.
Более точное измерение степени митральной регургитации связа-
но с определением ударного выброса левого желудочка и истинного
антеградного выброса в аорту. Разница между ними, рассчитанная как
процент от общего выброса, дает фракцию регургитации.
При митральном стенозе внимание обычно привлекает ограниче-
ние подвижности створок и их деформация (рис. 14-3).
Рис. 14-3. Эхокардиограмма из парастернальной позиции по
длинной оси при митральном пороке (слева - систола, справа -
диастола): усиление эхосигнала от краев створок и хордального аппарата
митрального клапана с признаками фиброза, ограничение открытия створок в
диастолу в виде куполообразного движения; расширение левого предсердия на фоне
относительно небольшого левого желудочка.
Обструкцию кровотока можно обнаружить с помощью цветного
допплеровского картирования (рис. 14-4 на цветной вкладке), а изме-
ряя градиент систолического и среднего давления между левым пред-
сердием и левым желудочком в диастолу - определить степень мит-
рального стеноза.
261
При исследовании необходимо также оценить степень легочной
гипертензии и наличие сопутствующих ВПС.
Катетеризация сердца и ангиокардиография. В настоящее вре-
мя данное исследование используется только для уточнения характера
легочной гипертензии и диагностики сложных сопутствующих ВПС.
Лечение. При развитии сердечной недостаточности прибегают к
стандартной терапии (дигоксин, мочегонные препараты, ингибиторы
синтеза АПФ). Оперативное вмешательство по возможности отклады-
вают, пока дети не достигнут более старшего возраста, так как пласти-
ческие операции на тонких структурах у грудных детей затруднены, а
для размещения протеза адекватного размера требуются достаточно
большие полости сердца. Большинство операций производят в возрас-
те 4-6 лет.
Основным видом операций у детей является пластическая рекон-
струкция митрального клапана. Арсенал вмешательств разнообразен.
При преимущественной недостаточности клапана выполняют сужение
фиброзного кольца, ушивают расщепленную створку или вшивают за-
плату из перикарда в дефект створки. Возможны мобилизация, удли-
нение хорд и папиллярных мышц или, наоборот, их укорочение. У де-
тей старше двух лет при деформации клапанного кольца подшивают
также искусственное кольцо Carpentier-Edwards [7]. При митральном
стенозе выполняют резекцию надклапанной мембраны или аномаль-
ных мышц, комиссуротомию, мобилизуют хордальный аппарат.
Из-за грубых изменений клапанного аппарата у 5% больных при-
ходится осуществлять протезирование клапана.
В последние годы делаются попытки баллонной дилатации мит-
рального стеноза, однако объем вмешательств у детей еще невелик, а
сопутствующая митральная недостаточность приводит к быстрому
ухудшению результата [8].
14.2. Пролапс митрального клапана
Пролапс митрального клапана (ПМК) представляет собой прогиб
одной или обеих створок в полость левого предсердия во время систо-
лы. В настоящем разделе мы рассматриваем только врожденный вари-
ант патологии.
Частота. Вопрос о распространенности пролапса митрального кла-
пана все еще остается спорным. В ранних исследованиях пациентов,
по тем или иным причинам обратившихся к врачу, частота выявления
порока была высока - до 22%. При проведении амбулаторных иссле-
262
дований в неселективных группах и переходе с одномерной эхокар-
диографии на двухмерную процент аномалии оказался значительно ни-
же - до 2,4% [9]. Считается, что у детей и в некоторых этнических груп-
пах встречаемость порока выше, чем в остальной популяции, однако
методические основы исследований существенно различаются [6, 10].
Анатомия. Пролапс митрального клапана является феноменом,
происхождение которого до конца не ясно. На одном конце спектра
находятся больные с избыточными размерами створок вследствие мик-
соматозной пролиферации и удлинения хордального аппарата (болезнь
Barlow); фиброзное кольцо обычно дилатировано. На другом конце
спектра - пациенты со створками, прогибающимися в левое предсер-
дие, однако без явных морфологических изменений.
Большинство исследователей считают, что пролапс митрального
клапана представляет собой группу дегенеративных поражений, раз-
личающихся по степени выраженности и клинической значимости [11-
13]. Основные изменения затрагивают губчатый слой створки, в кото-
ром накапливаются кислые мукополисахариды. Нарушения эластиче-
ского каркаса створок больше характерны для взрослых больных.
Другие исследователи склонны считать ПМК приобретенной па-
тологией, следствием диспропорций, возникающих по каким-либо при-
чинам между размерами митрального клапана и левого желудочка, и в
их пространственном положении. Характерно, что ПМК не выявляет-
ся у новорожденных [14]. Однако его обнаруживают в последующем,
при интесивном росте скелета и внутренних органов ребенка. Raggi Р.
et al. [15] выявили у больных с ПМК уменьшение переднезаднего раз-
мера грудной клетки, что расширяет площадь контакта сердца с перед-
ней грудной стенкой и приводит к деформации внутрисердечных струк-
тур. Аналогичный механизм имеется у больных с pectus excavatum, у
которых уменьшены размеры переднего средостения. Отмечена связь
ПМК со сниженным объемом левого желудочка у больных с анорекси-
ей (и исчезновение ПМК после набора веса) [16] или при изменении
объема циркулирующей крови [17]. Роль геометрии левого желудочка
подтверждается и значительными изменениями аускультативной кар-
тины при перемене положения тела пациентов. Обилие вегетососуди-
стых нарушений при ПМК также свидетельствует в пользу функцио-
нальных расстройств работы клапана [18]. Таким образом, врожден-
ный характер патологии выражается лишь в предрасположенности к
диспропорциональному росту сердца и окружающих его структур. Мор-
фологические изменения створок и подклапанного аппарата по этой
гипотезе являются вторичными.
263
Для практического здравоохранения важно выявление патологии,
оказывающей влияние на состояние и жизнь пациентов. Как показал
опыт клиник, располагающих большим количеством наблюдений, риск
развития серьезных осложнений возникает только при морфологиче-
ских изменениях створок клапана.
Гемодинамика. Наличие ПМК без существенной регургитации не
сопровождается нарушениями гемодинамики, но может служить мар-
кером синдрома соединительнотканной дисплазии. У этих пациентов
дополнительно могут быть симптомы вегетативной дисфункции, дис-
пластические изменения соединительной ткани других органов, сте-
нок сосудов (особенно венозных) с соответствующими перифериче-
скими расстройствами кровообращения.
Основным гемодинамическим следствием собственно ПМК мо-
жет быть хроническая регургитация различной степени на митраль-
ном клапане, а также разрыв истонченных хорд, приводящий к острой
регургитации. Результатом этого является перегрузка левого предсер-
дия, его расширение, возникновение фибрилляции предсердий. Фор-
мирующаяся дисфункция левого желудочка сопровождается снижени-
ем антеградного выброса, а затем и общей фракции выброса (в аорту и
в левое предсердие). Выраженная регургитация развивается у 7% боль-
ных с классическим ПМК. При отсутствии морфологических измене-
ний створок она никогда не достигает значительной степени [12].
В редких случаях на створках клапана формируются тромбы. Од-
нако, в целом, риск эмболий и мозговых осложнений при ПМК не вы-
ше, чем у больных без этой патологии [19]. Другое следствие недоста-
точности клапана - развитие застойных явлений в легких и легочной
гипертензии.
Естественное течение. Течение порока изучено в основном у
взрослых пациентов [20]. Основные осложнения, которые развивают-
ся при ПМК, включают митральную недостаточность, требующую хи-
рургической коррекции, сердечную недостаточность, фибрилляцию
предсердий, мозговые или периферические эмболии, инфекционный
эндокардит. При минимальной регургитации и изменении створок риск
смерти соответствует среднему в популяции, состояние больных мо-
жет ухудшаться лишь в 6,2% случаев.
Более серьезными факторами риска являются митральная регур-
гитация умеренной или выраженной степени, и низкая фракция вы-
броса левого желудочка (менее 50%). У этих больных смертность в
течение 10 лет в среднем достигает 45±9%, а плохое состояние наблю-
дается еще в 18,5% случаев.
264
Клиническая симптоматика. У трети больных ПМК протекает
бессимптомно [6]. Клинические проявления патологии возникают в
основном при наличии митральной регургитации.
При осмотре обращают на себя внимание признаки диспласти-
ческого физического развития - нарушения осанки, плоская грудная
клетка, слабое развитие мускулатуры, повышенная подвижность в
мелких суставах, X- и О-образные ноги, плокостопие, миопия и т.д.
Аускультативная картина достаточно специфична. Над сердцем,
максимально на верхушке, выслушиваются систолические щелчки
(клики), которые связывают с резким натяжением хорд митрального
клапана. Другой характерный симптом - позднесистолический шум,
свидетельствующий о митральной недостаточности. Щелчки и шумы
могут сочетаться, усиливаться при переходе из горизонтального в
вертикальное положение или после нагрузки.
У больных с ПМК может возникнуть разрыв хорд, сопровождаю-
щийся выраженной митральной недостаточностью. В этих случаях со-
стояние ухудшается внезапно, быстро развивается сердечная недоста-
точность. Над сердцем появляется грубый, ранее не регистрировавший-
ся шум. В подобных наблюдениях следует исключить латентно проте-
кающий ревматизм или инфекционный эндокардит.
Электрокардиография. Изменения ЭКГ при пролапсе митраль-
ного клапана полиморфны. У большинства имеется вертикальное
положение электрической оси сердца, у 30% - неполная блокада
правой ножки пучка Гиса. Имеется склонность к синусовой тахи-
кардии и нарушениям процесса реполяризации левого желудочка
(низкая амплитуда, инверсия зубца 7), суправентрикулярным экст-
расистолам. Выраженность и частота этих нарушений возрастает в
ортостазе.
У части детей обнаруживают удлинение интервала Q-T, что ско-
рее может быть самостоятельным сопутствующим заболеванием.
Рентгенография грудной клетки. В большинстве случаев изме-
нения отсутствуют. При значительной митральной недостаточности вы-
является венозный застой в легких, сердце увеличивается в размерах
за счет левого желудочка и левого предсердия.
Эхокардиография. В ранних исследованиях пролапс митрального
клапана определялся на основании одномерной эхокардиографии. Од-
нако этот метод сопровождался значительным процентом ошибок, пре-
имущественно в сторону завышения частоты патологии. В настоящее
время основным исследованием стала двухмерная эхокардиография (рис.
14-5), и сформировались следующие критерии двух основных форм
265
пролапса у взрослых. Классическим пролапсом митрального клапана
считается смещение во время систолы митральной створки более чем
на 2 мм выше фиброзного кольца при утолщении створки не менее 5
мм (определяется в диастолу). Неклассический пролапс при том же сме-
щении характеризуется незначительным утолщением створок (менее 5
мм) или его отсутствием.
Рис. 14-5. Эхокардиограмма из парастернальной позиции по
длинной оси при пролапсе митрального клапана. Створки митрального
клапана прогибаются в полость левого предсердия до 4-5 мм, пересекая плоскость
фиброзного кольца.
Смещение менее чем на 2 мм не имеет клинических и прогности-
ческих последствий, поэтому не рассматривается как пролапс. Анало-
гичные критерии могут быть использованы у детей.
Оценку состояния митрального клапана проводят преимущественно
в проекции длинной оси, так как в проекции четырех камер сердца
возможна гипердиагностика ПМК. Это связано с особенностями
конфигурации митрального фиброзного кольца. Дополнительно анали-
зируют степень митральной регургитации, дилатации левого предсер-
дия и левого желудочка, признаки легочной гипертензии, наличие раз-
рыва хорд и сопутствующей патологии сердца.
Использование дозированной физической нагрузки позволяет вы-
явить митральную регургитацию у трети больных, не имеющих ее в покое.
266
Катетеризация сердца и ангиокардиография. В настоящее вре-
мя данное исследование утратило свое значение при изучении функции
митрального клапана.
Лечение. В большинстве случаев дети с ПМК не нуждаются в ле-
чении, их физическая активность не ограничивается. При выраженной
вегетососудистой симптоматике проводится соответствующая терапия.
У больных с хронической умеренной митральной недостаточно-
стью показано назначение ингибиторов синтеза АПФ [21], а в случаях
дентальных или других микрохирургических вмешательств - антибио-
тикопрофилактика бактериального эндокардита.
При развитии застойной сердечной недостаточности к терапии до-
бавляют мочегонные препараты, дигоксин.
Хирургическое лечение показано при сердечной недостаточности,
плохо поддающейся терапии, быстром прогрессировании легочной ги-
пертензии, задержке физического развития. Операцией выбора явля-
ется пластическая реконструкция клапана. Пролапс передней створки
сопровождается несколько более высокой частотой остаточной регур-
гитации и повторных операций по сравнению с пролапсом, обуслов-
ленным задней створкой [22].
Литература
1. Mitruka S.N., Lamberti J. J. Congenital heart surgery nomenclature and database
project: Mitral valve disease //Ann. Thorac. Surg.- 2000.- Vol. 69.- P. SI 32-146.
2. Carpentier A. Congenital malformations of the mitral vakve. // Stark J., de Leval
M., editors. Surgery for congenital heart defects. - London: Grune&Stratton, 1983.
_ p. 467-482.
3. Uva M.S., Galetti L., Lacour Gayet F. et al. Surgery for congenital mitral valve
disease in the first year of life // J. Thorac. Cardiovasc. Surg.- 1995.- Vol. 109.-
P. 164-176.
4. Yoshimura N., Yamaguchi M., Oshima Y. et al. Surgery for mitral valve disease in
the pediatric age group // J. Thorac. Cardiovasc. Surg.- 1999.- Vol. 118.- P. 99-106.
5. Stellin G., Padalino M., Mi lanes i O. et al. Repair of congenital mitral valve dyspla-
sia in infants and children: Is it always possible? // Eur. J. Cardiothorac. Surg.-
2000.- Vol. 18.- P. 74-82.
6. Белоконь H.A., Подзолков В.П. Врожденные пороки сердца.- М.: «Медицина»,
1991.
7. Chauvaud S., Fuzellier JU.F., Houel R et al. Reconstructive surgery in congenital
mitral valve insufficiency (Carpentier’s techniques): long-term results // J. Thorac.
Cardiovasc. Surg.- 1998.- Vol. 115.- P. 84-93.
8. Zhang H.P., Yen G.S.H., Allen J. PL et al. Comparison of late results of balloon val-
votomy in mitral stenosis with versus without mitral regurgitation // Amm. J. Car-
diol.- 1998.-Vol. 81.- P. 51-55.
267
9. Freed L.A., Levy D., Levine R.A. et al. Prevalence and clinical outcome of mitral-
valve prolapse // N. Engl. J. Med.- 1999.- Vol. 341.- P. 1-7.
10. Warth D.C., King M.E., Tesoriero V.L. et al. Prevalence of mitral valve prolapse in
normal children // J. Am. Coll. Cardiol.- 1985.- Vol. 5.- P. 1173-1177.
11. Nishimura R.A., McGoon M.D. Perspectives on mitral-valve prolapse // N. Engl.
J. Med.-1999.- Vol. 341,- P. 48-50.
12. Pellerin D., Brecker S., Veyrat C. Degenerative mitral valve disease with emphasis
on mitral valve prolapse // Heart.- 2002.- Vol. 88(Suppl. IV).- P. S20-S28.
13. Зелщовский Э.В. Соединительнотканные дисплазии сердца. - Санкт-Петербург:
«Политекс», 2000.
14. Nascimento R., Freitas A., Teixeira F. et al. Is mitral valve prolapse a congenital or
acquired disease? // Am. J. Cardiol.- 1997.- Vol. 79.- P. 226-227.
15. Raggi P, Callister T.Q., Lippolis N.J., Russo D.J. Is mitral valve prolapse due to
cardiac entrapment in the chest cavity? // Chest.- 2000.- Vol. 117.- P. 636-642.
16. Meyers D.G., Starke H., Pearson PH. et al. Mitral valve prolapse in anorexia ner-
vosa //Ann. Intern. Med.- 1986.- Vol. 105.- P. 384-386.
17. Iga R., Hori K., Takahashi S. Transient mitral regurgitation due to mitral valve
prolapse accompanied by systolic anterior motion of the mitral valve // Chest.- 1990.-
Vol. 98.- P. 1017-1019.
18. Белозеров Ю.М., Страхова О.С., Болбиков В.В. Пролапс митрального клапана.
// Клиническая кардиология / Под ред. Ю.М. Белозерова, И.В. Леонтьевой. -
М.: Медпрактика-М, 2004.- С. 202-215.
19. Gilon D., Виопаппо F.S., Joffe М.М. et al. Lack of evidence of an associacion be-
tween mitral-valve prolapse and stroke in young patients // N. Engl. J. Med.- 1999.-
Vol. 341.- P. 8-13.
20. Avierinos J.-F., Gersh B.J., Melton L.J. et al. Natural history of asymptomatic mitral
valve prolapse in the community // Circulation.- 2002.- Vol. 106.- P. 1355.
21. Mori Y., Nakazawa M., Tomimatsu H., Momma K. Long-term effect of angiotensin-
converting ensime inhibitor in volume overloaded heart during growth: a controlled
pilot study // J. Am. Coll. Cardiol.- 2000.- V.36.- P. 270-275.
22. Mohty D., Orszulak T.A., SchaffH. V. et al. Very long-term survival and durability of
mitral valve repair for mitral valve prolapse. // Circulation.- 2001.- Vol. 104
(Suppl. I).- P. 1-7.
268
Глава 15. АНОМАЛИЯ ЭБШТЕЙНА
Аномалия Эбштейна - врожденная патология трикуспидального
клапана, характеризующаяся смещением преимущественно септаль-
ной и задней створок клапана в полость правого желудочка, что приво-
дит к образованию над ними так называемой атриализованной части
правого желудочка.
Частота. Частота аномалии Эбштейна составляет 0,03/1000 но-
ворожденных, 0,04% среди всех ВПС и 0,4% среди критических ВПС.
Большинство случаев аномалии Эбштейна - спорадические, но ино-
гда можно наблюдать и семейные случаи.
Анатомия. Анатомия порока характеризуется различными комби-
нациями следующих морфологических нарушений: 1) распластанность
и сращение трикуспидальных створок с прилегающим миокардом;
2) смещение к верхушке функционального трикуспидального кольца;
3) дилатация зоны истинного трикуспидального кольца и атриализи-
рованной части правого желудочка, с истонченностью его стенки в раз-
личной степени; 4) избыточное увеличение, ограничение подвижно-
сти передней створки трикуспидального клапана. В результате смеще-
ния створок полость правого желудочка оказывается разделенной на
две части. В качестве правого желудочка функционирует лишь нижняя
часть, расположенная под клапаном и состоящая из трабекулярного и
выводного отделов (рис. 15-1).
6
Рис. 15-1. Аномалия Эбштейна (схема порока). 1 - правое предсердие;
2 - атриализованная часть правого желудочка; 3 - уменьшенный правый желудочек;
4 - легочная артерия; 5 - уровень нормального трикуспидального кольца; 6 - уровень
функционального трикуспидального кольца.
269
У 90% больных с аномалией Эбштейна выявляется дефект меж-
предсердной перегородки или открытое овальное окно. Более редко
наблюдаются такие пороки, как стеноз легочной артерии или ее атре-
зия, ОАП, двухстворчатый аортальный клапан. Около 14% больных
имеют патологические проводящие пути, приводящие к синдрому WPW
[1]. Частота выявления множественных дополнительных проводящих
путей у больных с аномалией Эбштейна гораздо выше, чем в целом
среди пациентов с пароксизмальной суправентрикулярной тахикардией.
При длительном существовании порока в миокарде обнаружива-
ют значительные изменения - гипертрофию, атрофию, склероз. В по-
следующем страдает и функция левого желудочка. Причины этого не-
ясны, предполагают, что «виноваты» хронический цианоз, явления
апоптоза и постоянная дилатация правого желудочка, смещающая меж-
желудочковую перегородку влево [2].
Гемодинамика. Гемодинамические нарушения при данном поро-
ке определяются степенью смещения створок, возникающей трехствор-
чатой регургитацией и затруднениями легочного кровотока. В случае
умеренного смещения створок и умеренной регургитации нарушения
кровообращения минимальны, симптоматика может отсутствовать в
течение многих лет. Однако если смещение или регургитация на кла-
пане значительные, развивается дилатация правого предсердия и пра-
вого желудочка, а также аритмии. Возникают шунтирование крови спра-
ва налево через дефект межпредсердной перегородки или открытое
овальное окно и симптоматика артериальной гипоксемии. В последую-
щем это опасно также возникновением парадоксальных эмболий.
Легочный кровоток может быть снижен из-за функциональной ги-
поплазии правого желудочка или стенозирования выводного отдела за
счет передней трикуспидальной створки. В случаях функциональной
или анатомической легочной атрезии возникает дуктус-зависимое со-
стояние.
Переполнение правых отделов приводит к выбуханию межжелу-
дочковой перегородки влево, что ограничивает наполнение левого же-
лудочка. Возможно развитие застойной сердечной недостаточности,
вторичной по отношению к снижению функции правого желудочка.
Пароксизмальная суправентрикулярная тахикардия наблюдается у
25-50% больных, до 14% из них имеют синдром WPW.
Естественное течение. Порок может существенно нарушать ге-
модинамику плода при наличии трикуспидальной недостаточности. Это
приводит к развитию сердечной недостаточности, водянке плода и его
гибели. В постнатальном периоде прогноз определяется степенью
270
деформации и дисфункции трикуспидального клапана, а также степе-
нью гипоплазии правого желудочка. Все пациенты с грубой патологи-
ей погибают в течение первого месяца жизни (около 25% больных).
До 6 мес доживают 68%, до 5 лет - 64%, в последующем кривая выжи-
ваемости стабилизируется. У неоперированных больных причинами
смерти становятся постепенно прогрессирующая сердечная недоста-
точность и нарушения ритма.
Клиническая симптоматика. Клиническая картина, как прави-
ло, варьирует в зависимости от степени нарушений гемодинамики. В
большинстве случаев порок проявляется в первые месяцы жизни, од-
нако примерно в 20% случаев его впервые обнаруживают во второй
декаде жизни.
Ведущий симптом - цианоз, который у 60% больных возникает с
рождения. Его выраженность прямо связана с величиной давления в
правом предсердии и объемом сброса через межпредсердное сообще-
ние. Артериальная гипоксемия углубляется в случаях сопутствующего
легочного стеноза. У младенцев возможны также трудности при корм-
лении, одышка.
В последующем усиливаются признаки сердечной недостаточно-
сти, снижается толерантность к физической нагрузке, возрастает час-
тота аритмий. У пациентов старшего возраста может наблюдаться вы-
бухание яремных вен. Формируется сердечный горб, обусловленный
большими размерами правого предсердия и атриализованной части пра-
вого желудочка.
Аускультативные изменения скудные, связаны со степенью три-
куспидальной недостаточности и степенью обструкции выводного трак-
та правого желудочка у конкретного больного. В классических случа-
ях выслушивается ритм галопа или четырехтактный ритм, возникаю-
щий из-за «растянутого» первого и второго тонов сердца, а также из-за
наличия третьего или четвертого тонов.
Трикуспидальная регургитация сопровождается мягким голосисто-
лическим или коротким систолическим шумом, который наиболее вы-
ражен в нижней части грудины у левого ее края. Также могут выслу-
шиваться диастолический шум сопутствующего трикуспидального сте-
ноза или шум систолического выброса через обструктивный вывод-
ной тракт правого желудочка.
Сердечная недостаточность сопровождает обструкцию кровотока
через правые отделы сердца (при небольшом межпредсердном сооб-
щении) или выраженную трикуспидальную недостаточность и носит
преимущественно правожелудочковый характер (тахикардия, гепато-
мегалия, пульсация шейных вен).
271
Электрокардиография. ЭКГ вариабельна. Обычно имеется от-
клонение электрической оси сердца вправо. В правых грудных отведе-
ниях регистрируется низкоамплитудный деформированный комплекс
QRS. Картина неполной или полной блокады правой ножки пучка Гиса
иногда имеет форму «пилы». Зубец Рц у1 увеличен по амплитуде и про-
должительности. Возможен синдром WPW.
При проведении холтеровского мониторирования можно выявить
периоды трепетания предсердий, суправентрикулярной пароксизмаль-
ной тахикардии.
Рентгенография грудной клетки. Легочный рисунок часто не из-
менен, у больных с цианозом он снижен. Сердце имеет шаровидную
форму, правый атриовазальный угол смещен вверх за счет резко дила-
тированного правого предсердия. Степень кардиомегалии тесно связа-
на с выраженностью трикуспидальной регургитации. В тяжелых слу-
чаях кардиоторакальный индекс может приближаться к единице.
Эхокардиография. При исследовании в проекции 4-х камер об-
ращает на себя внимание смещение септальной створки в полость пра-
вого желудочка. Имеется дистанция между смещенным клапаном и три-
куспидальным кольцом, соответствующая атриализированной части
правого желудочка (рис. 15-2 на цветной вкладке).
Так как и в норме трикуспидальный клапан смещен к верхушке,
необходимо вычислять индекс его смещения. Он рассчитывается как
отношение расстояния между местами прикрепления атриовентрику-
лярных клапанов к площади поверхности тела. Величина индекса бо-
лее 8 мм/м2 указывает на аномалию Эбштейна.
Косвенно о тяжести порока можно судить по отношению суммар-
ной площади правого предсердия и атриализированной части правого
желудочка к суммарной площади функционирующего правого желу-
дочка, левого предсердия и левого желудочка [3]. Измерения проводят
в проекции четырех камер в конце диастолы. Выделяют четыре степе-
ни изменений. При первой, наиболее легкой степени это отношение
<0,5, при второй равно 0,5-0,99, при третьей равно 1-1,49, при четвер-
той >1,5.
Открытое овальное окно или ДМПП выявляют в 85% случаев,
сброс через них осуществляется чаще справа налево. С помощью доп-
плер-ЭХОКГ выявляют величину трикуспидальной недостаточности,
нарушения легочной гемодинамики, наличие сопутствующих анома-
лий. Избыточная передняя створка трикуспидального клапана может
быть причиной функциональной обструкции выводного тракта право-
го желудочка.
272
Катетеризация сердца. Катетеризация сердца может быть прове-
дена для оценки состояния легочного русла и электрофизиологическо-
го исследования. Последнее показано у больных, имеющих аритмии, в
частности, суправентрикулярную пароксизмальную тахикардию. Час-
то аритмогенный очаг выявляется в области, прилежащей к кольцу трех-
створчатого клапана.
Лечение. Больные с умеренной или незначительной трикуспидаль-
ной регургитацией нуждаются в постоянном наблюдении кардиолога,
с периодическим контролем электрокардиограммы, рентгенографиче-
ской картины и насыщения крови кислородом. У больных с отсутстви-
ем каких-либо клинических проявлений порока должна проводиться
лишь профилактика антибиотиками инфекционного эндокардита в слу-
чае дентальных или микрохирургических процедур. При появлении
симптомов застойной сердечной недостаточности рекомендуется при-
ем дигоксина и мочегонных препаратов.
В случаях сопутствующей суправентрикулярной пароксизмальной
тахикардии необходима терапия антиаритмическими препаратами. Це-
лесообразно также электрофизиологическое исследование, выполняе-
мое как с диагностической, так и с лечебной целью. Эффективность
аблации у больных с изолированными правожелудочковыми дополни-
тельными проводящими путями достигает 95%, при множественных
путях - лишь 75%.
Показания к хирургическому лечению определяются сердечной не-
достаточностью, артериальной гипоксемией и нарушениями ритма,
рефрактерными к медикаментозной терапии. Вид оперативного вме-
шательства зависит от возможности выполнить двухжелудочковую кор-
рекцию. В связи с этим существуют различные подходы к лечению де-
тей первых месяцев жизни и более старших пациентов.
В неонатальном периоде хирургическое вмешательство обычно
требуется при выраженной правожелудочковой дисплазии, нарушени-
ях антеградного кровотока в легочное русло, резкой дилатации правых
отделов с компрессией левого желудочка. В подобных случаях ориен-
тируются на одножелудочковую коррекцию. Для предоперационной ста-
билизации больных используют инфузию простагландинов группы Е,
инотропные препараты и корригируют метаболический ацидоз. Пер-
воначально выполняют операцию Starnes: закрывают трехстворчатый
клапан заплатой из аутоперикарда (создание физиологической атрезии
трехстворчатого клапана), увеличивают межпредсердное сообщение и
накладывают системно-легочный анастомоз. При легочной регургита-
ции процедуру дополняют изоляцией легочной артерии от правого
273
желудочка. Цель операции - разгрузить правые отделы, уменьшить об-
струкцию левого желудочка выбухающей межжелудочковой перегород-
кой, обеспечить адекватную оксигенацию крови [4]. В последующем
выполняют операцию Фонтена.
Двухжелудочковую коррекцию осуществляют при адекватной
функции правого желудочка, как правило, в более старшем возрасте.
Операцией выбора является восстановление компетентности трикус-
пидального клапана и закрытие межпредсердного сообщения. Пред-
почтение отдается пластическим операциям (сужение трикуспидаль-
ного кольца и перевод клапана в моностворчатый с использованием
передней или задней створки, пликация атриализованной части право-
го желудочка) [5]. У больных с выраженной дисплазией створок (20-
30% случаев) может возникнуть необходимость протезирования трех-
створчатого клапана; обычно используют биологические клапаны.
Литература
1. Dearani J.A., Danielson G.K. Congenital heart surgery nomenclature and database
project: Ebsteins anomaly and tricuspid valve disease // Ann. Thorac. Surg.- 2000.-
Vol. 69.- P. S106-S117.
2. Yetman A.T., Freedom R.M., NcCrindle B.W. Outcome in cyanotic neonates with
Ebstein’s anomaly // Am. J. Cardiol.- 1998.- Vol. 81.- P. 749-754.
3. Celermajer D.S., Bull C., Till J.A. et al. Ebstein’s anomaly: presentation and out-
come from fetus to adult // J. Am. Coll. Cardiol.- 1994.- V.23.- P. 170-176.
4. Van Son J.A.M., Falk V, Black M.D. et al. Conversion of complex neonatal Eb-
stein’s anomaly into functional tricuspid or pulmonary atresia // Europ. J. Cardio-
Thorac. Surg.- 1998.- Vol. 13.- P. 280-285.
5. Hetzer R., Nagdyman N., Ewert P. et al. A modified repair technique for tricuspid
incompetence in Ebstein’s anomaly //J. Thorac. Cardiovasc. Surg.- 1998.- Vol. 115.-
P. 857-868.
274
Глава 16. ЕДИНСТВЕННЫЙ ЖЕЛУДОЧЕК И
АТРЕЗИЯ ТРИКУСПИДАЛЬНОГО
КЛАПАНА
Существует большой спектр врожденных пороков сердца, при ко-
торых нет двух нормально развитых желудочков. В этих случаях ис-
пользуют термины «общий желудочек», «трехкамерное сердце с един-
ственным желудочком», «одножелудочковое сердце» и т.п., однако наи-
более удачным и распространенным является термин «единственный
желудочек». Характерной особенностью патологии является наруше-
ние соединения предсердий с желудочками: в отличие от нормального
сердца, когда полость каждого из предсердий сообщается со своим же-
лудочком, при единственном желудочке полости предсердий соединя-
ются лишь с одним, хорошо развитым и доминирующим желудочком.
Частота. Частота единственного желудочка по критериям Ja-
cobs M.L. и Mayer J.E. [1] в популяции составляет около 0,13/1000 но-
ворожденных, среди всех ВПС - 2,5%, среди «критических» ВПС -
5,5%. Наиболее частый вариант (до 70% случаев) - двуприточный ле-
вый желудочек с транспозицией магистральных артерий (аорта отхо-
дит от выпускника) (рис. 16-1).
Рис. 16-1. Схема единственного желудочка с транспозицией
магистральных артерий (стрелкой указано бульбовентрикулярное окно).
Анатомия. До последнего времени продолжаются дебаты о том,
какую патологию включать в синдром единственного желудочка. Со-
275
гласно классическому определению Van Praagh в единственный желу-
дочек впадают трикуспидальный и митральный клапаны или общий
атриовентрикулярный клапан. Таким образом, по этому определению
из спектра патологии исключаются атрезии атриовентрикулярных кла-
панов. Другие авторы допускают, что трикуспидальная атрезия также
может представлять единственный желудочек [2]. В 2000 г. Jacobs M.L.
и Mayer J.E. [1], основываясь на клинических потребностях, предло-
жили относить к единственному желудочку следующие аномалии: серд-
ца с двуприточным левым или правым желудочком, сердца с отсутст-
вием одного из атриовентрикулярных клапанов (митральная или три-
куспидальная атрезия), сердца с общим атриовентрикулярным клапа-
ном и одним хорошо развитым желудочком (несбалансированный об-
щий атриовентрикулярный канал), единственный желудочек с синдро-
мом гетеротаксии, а также другие редкие варианты одножелудочково-
го сердца, не входящие в данные категории. Однако синдром гипопла-
зии левого сердца, атрезия легочной артерии с интактной межжелу-
дочковой перегородкой, сердца с «верхом сидящим» атриовентрику-
лярным клапаном классифицируются ими как самостоятельные пато-
логии. Нам кажется, что для детских кардиологов, ориентирующихся
преимущественно на клинические проявления порока, данная систе-
матизация является удобной, так как во многом опирается на основ-
ную черту патологии - гемодинамику, присущую сердцу с одним же-
лудочком. Характеризуется она тем, что кровообращение в малом и
большом кругах осуществляется параллельно, а не последовательно,
как при нормальном сердце.
Более подробный анализ морфологии сердца и многочисленные
классификации единственного желудочка и трикуспидальной атрезии
можно найти в работах патологоанатомов и хирургов [2-4].
В соответствии с анатомией желудочкового сегмента сердца при
двуприточном желудочке идентифицируют следующие нозологии: дву-
приточный левый желудочек (более 63% случаев), двуприточный пра-
вый желудочек (около 20%), двуприточный единственный (недетерми-
нированный) желудочек (около 17% случаев). Хорошо развитый (един-
ственный) желудочек характеризуется наличием приточного отдела,
трабекулярной зоны, отточного отдела, а также подклапанного хордаль-
но-мышечного аппарата. Второй желудочек, при классическом вари-
анте патологии, существует в виде рудиментарной или гипопластич-
ной камеры, представляющей собой «выпускник» для одного из маги-
стральных сосудов; нередко его рассматривают как часть выводного
тракта единственного желудочка. С полостью желудочка выпускник
276
соединяется посредством отверстия, которое обозначают как «бульбо-
вентрикулярное окно». В редких случаях выпускник полностью отсут-
ствует; при этом оба сосуда отходят от единственного желудочка. При
трикуспидальной атрезии правый желудочек выражен более отчетли-
во; отверстие между желудочками нередко обозначают как ДМЖП.
Единственный желудочек может сопровождаться также аномалия-
ми положения сердца и внутренних органов (« 14% больных).
При развернутой характеристике каждого конкретного случая опи-
сывают также выход магистральных сосудов из желудочка (наличие
выпускника - с рестриктивным или нерестриктивным бульбовентри-
кулярным окном и отхождением от него аорты или легочной артерии;
двойное отхождение сосудов от желудочка), положение сосудов (транс-
позиция, мальпозиция - до 75% случаев), атрезию, стеноз или гипо-
плазию легочной артерии (50%), субаортальный стеноз. Аномалии впа-
дения системных или легочных вен не столь важны, так как притекаю-
щая к сердцу кровь в конечном итоге попадает все в тот же единствен-
ный желудочек. Существенным фактором является лишь обструкция
легочных вен, приводящая к застою в малом круге кровообращения и
снижению оксигенации крови. В случае атрезии атриовентрикулярно-
го клапана большое значение приобретает диаметр межпредсердного
сообщения, через которое опорожняется соответствующее предсердие.
Гемодинамика. Особенности гемодинамических нарушений при
единственном желудочке определяются смешиванием потоков оксиге-
нированной крови из легочных вен (среднее SO2 - 95-100%) и неокси-
генированной крови из системных вен (среднее SO2~ 55-60%) в одной
камере. При равном легочном (£>р) и системном (£>v) кровотоке резуль-
тирующая оксигенация (SO2) составляет 75-80%. При возрастании ле-
гочного кровотока возрастает и системное насыщение; соотношение
Q^QS более 3,0 дает SO? = 90%. В свою очередь, объем кровотока через
легкие и большой круг кровообращения определяется (при отсутствии
анатомических сужений) относительной резистентностью соответст-
вующих сосудов. Так, в первые часы после рождения, когда быстро
падает сопротивление легочных сосудов, системная оксигенация мо-
жет достигать 80%. Таким образом, при данной патологии уровень на-
сыщения системной крови кислородом может быть простым марке-
ром соотношения легочного и системного кровотоков.
При постоянно высоком легочном кровотоке быстро возникает объ-
емная перегрузка единственного желудочка, обеспечивающего как сис-
темное, так и легочное кровообращение. В результате развивается за-
стойная сердечная недостаточность, желудочек теряет способность аде-
277
кватно изгонять кровь против высокого системного сопротивления, и
все большая часть выброса рециркулирует через легочные сосуды. Дли-
тельное существование усиленного легочного кровотока приводит к
изменениям в легочных сосудах вплоть до склеротических и повыше-
нию ОЛС.
В случае препятствия легочному кровотоку (анатомического или
вследствие высокого ОЛС) гемодинамические нарушения развивают-
ся по иному сценарию. Падение ^у^ниже 1,0 сопровождается значи-
тельным снижением SO2, однако сердечная недостаточность менее вы-
ражена. Следует отметить, что препятствие потоку крови в легкие мо-
жет существовать как на уровне легочной артерии, так и на уровне буль-
бовентрикулярного окна.
У больных с трикуспидальной атрезией смешение артериальной и
венозной крови происходит уже на уровне левого предсердия, куда че-
рез межпредсердное сообщение поступает вся кровь из системных вен.
В этом случае степень застойных явлений в большом круге кровообра-
щения во многом определяется диаметром межпредсердного отверстия.
Для случаев с отхождением аорты от выпускника характерно на-
растание со временем обструкции на уровне бульбовентрикулярного
отверстия, затрудняющей системный кровоток. Наличие у пациентов с
единственным желудочком субаортального стеноза, гипоплазии дуги
аорты или коарктации может сопровождаться недостаточной перфузи-
ей периферических тканей вплоть до шока. В крайне редких случаях
одновременно имеются препятствия на пути легочного и системного
кровотоков. Как правило, такие дети нежизнеспособны.
В поддержании адекватной гемодинамики как малого, так и боль-
шого кругов кровообращения важную роль может играть открытый ар-
териальный проток (дуктус-зависимые состояния).
Естественное течение. Единственный желудочек практически не
нарушает развитие плода, обеспечивая нормальный системный крово-
ток. Сердечная недостаточность развивается только в случаях регур-
гитации на атриовентрикулярных клапанах. После рождения прогноз
при данной патологии неблагоприятен, первый год жизни переживают
лишь 46% детей с трикуспидальной атрезией и 39% с двуприточным
желудочком; до 15 лет доживают в среднем 35% больных. Течение по-
рока во многом зависит от степени легочной гиперволемии: наличие
легочного стеноза улучшает прогноз, легочная гипертензия - ухудша-
ет. Однако во всех случаях средняя продолжительность жизни боль-
ных с единственным желудочком невелика. «Хирургически модифи-
цированный» прогноз также остается серьезным. Так, в группе с три-
278
куспидальной атрезией летальность на первом году жизни составляет
не менее 20% [5] . Частыми причинами смерти являются сердечная
недостаточность на фоне прогрессирующей гипоксемии, нарушения
ритма, пневмонии [6].
Клиническая симптоматика. Больные с единственным желудоч-
ком обращают на себя внимание вскоре после рождения из-за наличия
умеренного цианоза. Однако он может быстро уменьшиться вследст-
вие естественного снижения резистентности легочных сосудов и уси-
ления легочного кровотока. Более выраженный и стойкий цианоз со-
провождает случаи со стенозом легочной артерии. Длительная (1-2 го-
да) артериальная гипоксемия приводит к развитию симптомов «часо-
вых стекол» и «барабанных палочек».
При наличии усиленного легочного кровотока развивается клини-
ческая картина, соответствующая большому внутрисердечному сбро-
су слева направо: одышка, тахикардия, застойные хрипы в легких, уве-
личение печени, повторные пневмонии.
Аускультативная картина определяется, в первую очередь, степе-
нью обструкции бульбовентрикулярного отверстия и легочным стено-
зом (систолический шум во втором-третьем межреберье). Систоличе-
ский шум на верхушке соответствует недостаточности атриовентрику-
лярного клапана. При высоком кровотоке через этот клапан можно вы-
слушать также мезодиастолический шум вдоль левого края грудины и
на верхушке. Следует помнить, что единственный желудочек часто со-
четается с аномалиями положения сердца, которые меняют локализа-
цию шумов.
Электрокардиография. Электрокардиограмма характеризуется
выраженным полиморфизмом в связи с большим количеством анато-
мо-гемодинамических вариантов. Наиболее часто отмечают отклоне-
ние электрической оси сердца вправо, высокий вольтаж в грудных от-
ведениях, за исключением Vj , преобладание зубцов S над зубцами R
или равнозначные комплексы RS. Отклонение электрической оси сердца
влево характерно для трикуспидальной атрезии. Часто отмечают нару-
шения ритма и проводимости различного характера. Примерно у 12%
пациентов развивается полная атриовентрикулярная блокада.
Рентгенография грудной клетки. Рентгенологическое исследо-
вание используется для оценки степени кардиомегалии и состояния
легочного кровотока [7]. Определение гипо- или гиперволемии малого
круга кровообращения важно для составления плана терапии.
Эхокардиография. Данное исследование позволяет поставить пол-
ноценный диагноз. Обычно выявляют впадение обоих атриовентрику-
279
лярных клапанов в единственный желудочек; полость второго желу-
дочка значительно уменьшена или полностью отсутствует (рис. 16-2).
Рис. 16-2. Эхокардиограмма в верхушечной позиции при
единственном желудочке сердца. Визуализируется единственный желудочек,
в который открываются оба атриовентрикулярных клапана.
Для хирургического лечения существенны следующие параметры,
которые необходимо также оценить:
1. Морфологическое строение желудочковой камеры (левого или
правого типа).
2. Локализация рудиментарной камеры. Над желудочковой поло-
стью (обычно слева и спереди) лоцируют дополнительную камеру вы-
пускника, не содержащую атриовентрикулярного клапана.
3. Размер и степень рестриктивности бульбовентрикулярного ок-
на. Обструкция присутствует, если градиент давления на отверстии бо-
лее 10 мм рт.ст. Диаметр необструктивного отверстия равен или боль-
ше диаметра аортального клапана.
4. Положение магистральных сосудов, их размеры, наличие кла-
панных стенозов.
5. Анатомия и позиция атриовентрикулярных клапанов.
6. Размер межпредсердного сообщения и ОАП, направление сбро-
са через них.
7. Наличие сопутствующих пороков (коарктация аорты, перерыв
дуги аорты).
Катетеризация сердца и ангиокардиография. При отсутствии
легочного стеноза обнаруживают равное давление в аорте, легочной
артерии и камере желудочка. Однако, как правило, проведение катете-
ра в легочную артерию затруднено. В желудочке и аорте степень окси-
генации одинаково снижена. В случаях трикуспидальной атрезии ок-
280
сигенация снижена и в левом предсердии. Характерно умеренное по-
вышение оксигенации крови в полости желудочка по сравнению с по-
лостью правого предсердия. Наиболее важно в диагностическом отно-
шении определение давления в легочных сосудах, наличие градиентов
давления на уровне бульбовентрикулярного окна и на полулунных кла-
панах, а также выявление периферических стенозов легочных артерий.
При введении контрастного вещества в правое предсердие видно
его поступление в левое предсердие и единственный желудочек, а в
последующем в магистральные сосуды сердца. Для уточнения величи-
ны ДМЖП, наличия стенозов магистральных сосудов (в том числе пе-
риферических легочных и коарктации аорты) контраст вводят в полость
желудочка. Иногда для уточнения характера патологии бывает необхо-
димо контрастирование непосредственно выпускника. Отсутствие его
сообщения с предсердиями дает возможность отличить выпускник от
второго желудочка.
Лечение. Для физиологии единственного желудочка характерны
избыточный или сниженный легочный кровоток. Поэтому терапевти-
ческие мероприятия направлены на регулировку резистентности ле-
гочных или системных сосудов. У новорожденных наиболее важным
звеном терапии является использование простагландинов группы Е, в
основном для поддержания проходимости ОАП. Для регуляции балан-
са легочного и системного кровотоков применяют также искусствен-
ную вентиляцию легких с изменяемой концентрацией кислорода и дав-
ления в дыхательных путях. При лечении сердечной недостаточности
используют дигоксин, диуретики, ингибиторы синтеза АПФ. Необхо-
димо также корригировать кислотно-щелочной баланс, функцию по-
чек и печени.
У пациентов с трикуспидальной атрезией и рестриктивным меж-
предсердным сообщением в качестве неотложной помощи можно вы-
полнить процедуру Рашкинда.
При длительном выживании больных с единственным желудоч-
ком возникает опасность бактериального эндокардита, в связи с чем
показана профилактика антибиотиками.
Показания к оперативному лечению определяются в основном уров-
нем легочного кровотока. При его относительной недостаточности на-
кладывают шунт (наиболее часто - модифицированный протезом ана-
стомоз Блелока-Тауссиг) между аортой и легочной артерией. Так как
протез диаметром 3,5-4,0 мм имеет достаточно большое сопротивление,
он создает дозированный кровоток в легкие. Однако при снижении ОЛС
кровоток все же может стать чрезмерным. В этом случае действия врача
281
должны быть направлены на уменьшение периферического и повыше-
ние легочного сопротивления. При недостаточной функции анастомоза
действия противоположны и направлены на снижение ОЛС.
У больных с резко увеличенным легочным кровотоком показана
операция суживания легочной артерии, которая способствует умень-
шению сердечной недостаточности и защищает сосуды малого круга
от развития неблагоприятных изменений. Данную процедуру можно
выполнять только при необструктивном бульбовентрикулярном окне.
В противном случае лучше прибегнуть к операции Damus-Kaye-Stansel.
Гемодинамическую коррекцию порока выполняют с помощью опе-
рации Фонтена в ее различных модификациях. Основные задачи опе-
рации - восстановить последовательное кровообращение, улучшить
системную оксигенацию крови и снизить объемную нагрузку на желу-
дочек. Для успеха операции необходимо соблюдение ряда критериев:
1) синусовый ритм; 2) среднее давление в легочной артерии не выше
15 мм рт. ст.; 3) ОЛС менее 2 ед.; 4) нормальная функция желудочка с
фракцией выброса не менее 0,6; 5) нормальная функция атриовентри-
кулярного клапана; 6) благоприятная анатомия легочных артерий.
Операции по созданию межжелудочковой перегородки («септация»
желудочка) крайне редки и сопровождаются высокой летальностью.
Чаще прибегают к трансплантации сердца.
Литература
1. Jacobs M.L., Mayer J.E. Congenital heart surgery nomenclature and database pro-
ject: Single ventricle // Ann. Thorac. Surg.- 2000.- Vol.69.- Suppl.- P. 197-204.
2. Anderson R.H., Becker A.E., Macartney F.J. et al. Is “Tricuspid atresia” a univen-
tricular heart? // Pediatr. Cardiology.- 1979.- Vol. 1.- P. 51-56.
3. Fesslova V., Hunter S., Stark J., Taylor J.F.N. The long-term clinical outcome of
patients with tricuspid atresia. I. «Natural history» //J. Cardiovasc. Surg.- 1989.-
Vol.30.- P. 262-272.
4. Махачев О.А. Двуприточный желудочек сердца (левый, правый и единствен-
ный): новый подход к систематике, диагностика вариантов порока и результа-
ты корригирующих операций - Дисс...докт.мед.наук. - М., 2003.
5. Fesslova V., Hunter S., Stark J., Taylor J.F.N. The long-term clinical outcome of
patients with tricuspid atresia. II. Influence of surgical procedures //J. Cardiovasc.
Surg.- 1991.- Vol. 32.- P. 225-232.
6. Сердечно-сосудистая хирургия: руководство / Под ред. В.И., Бураковского,
Л.А. Бокерия.- М.: Медицина, 1989.
7. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца.- М.: Медицина,
1990.
282
Глава 17. СИНДРОМ ГИПОПЛАЗИИ ЛЕВОГО
СЕРДЦА
Термин «синдром гипоплазии левого сердца» (СГЛС) использует-
ся для обозначения гетерогенной группы пороков, характеризующих-
ся недоразвитием комплекса левое сердце - аорта, что создает обструк-
цию кровотоку. В результате левое сердце не в состоянии поддержи-
вать на должном уровне системное кровообращение.
Частота. Частота СГЛС составляет 0,12-0,21/1000 новорожден-
ных, 3,4-7,5% среди всех ВПС и 16,0% среди критических ВПС [1].
Анатомия. При данном синдроме в различных комбинациях мо-
гут быть представлены атрезия, стеноз или гипоплазия аортального
и/или митрального клапана, а также гипоплазия или почти полное от-
сутствие левого желудочка, гипоплазия восходящей аорты и дуги аор-
ты. В подавляющем большинстве случаев ДМЖП отсутствует, так как
значительный поток крови через него способствует хорошему разви-
тию левого желудочка, и порок не попадает в рамки данной нозологи-
ческой единицы. Межпредсердная перегородка обычно утолщена, от-
крытое овальное окно небольшое. У трети больных имеется сопутст-
вующая выраженная коарктация аорты, а у 80% - умеренное сужение
аорты за счет мембраны в зоне ОАП [2]. Правый желудочек и легоч-
ные артерии дилатированы. Легочный ствол как бы переходит в широ-
кий ОАП, который продолжается в нисходящую аорту.
В данный синдром не включают патологии сердца, сопровождаю-
щиеся изолированным уменьшением левого желудочка (тотальный ано-
мальный дренаж легочных вен, несбалансированная форма атриовен-
трикулярного канала, единственный желудочек и т.д.).
Наиболее тяжелая форма СГЛС связана с атрезией аорты, часто
сочетающейся с гипоплазией или атрезией митрального клапана и прак-
тически отсутствующей полостью левого желудочка [3]. На другом,
более благоприятном конце спектра находятся пациенты с критическим
аортальным стенозом, сопровождающимся умеренной гипоплазией ле-
вого желудочка.
Гемодинамика. В основе гемодинамических изменений при СГЛС
лежит обструкция кровотоку через левые отделы сердца. В связи с этим
артериальная кровь из левого предсердия поступает через открытое
овальное окно в правое предсердие, правый желудочек, легочную ар-
терию и через ОАП в нисходящую аорту. При этом небольшой объем
крови направляется ретроградно в гипоплазированную восходящую
аорту и коронарные сосуды.
283
Таким образом, для поддержания системного кровообращения при
данной патологии необходимо, чтобы овальное окно и ОАП были дос-
таточных размеров. При выраженном СГЛС (атрезия аорты, митраль-
ный стеноз) системное кровообращение полностью зависит от право-
го желудочка, который функционирует как общий для большого и ма-
лого кругов кровообращения, перекачивая смешанную кровь. При уме-
ренно выраженной гипоплазии левых отделов системное кровообра-
щение лишь частично зависит от правого желудочка, который изгоня-
ет кровь в нисходящую аорту. В восходящую аорту, дугу аорты и ее
ветви кровь поступает из левого желудочка.
Последствиями возникших нарушений гемодинамики являются
умеренная артериальная гипоксемия в сочетании с выраженной ише-
мией внутренних органов, головного мозга, сердца. Синдром гипопла-
зии левого сердца сопровождается также высокой легочной гипертен-
зией, предпосылки которой возникают уже внутриутробно (обструк-
ция оттоку из легочных вен). Быстро развиваются гипертрофия, дила-
тация и декомпенсация правого желудочка, обеспечивающего как ле-
гочное, так и системное кровообращение.
Естественное течение. Несмотря на то что патология характери-
зуется серьезными изменениями структур сердца, в силу особенностей
внутриутробного кровообращения это обычно не приводит к значи-
тельным нарушениям развития плода. Как правило, недостаточная
функция левого желудочка компенсируется работой правого желудоч-
ка и адекватным системным кровоснабжением через ОАП. Критиче-
ская недостаточность кровообращения развивается вскоре после рож-
дения, что приводит к быстрой гибели ребенка. Смертность на 1-й не-
деле жизни составляет 71%, к 6 мес - почти 100%. Результаты хирур-
гических вмешательств также неутешительны, летальность составля-
ет 20-40%, продолжительность последующей жизни невелика. В свя-
зи с этим выявление СГЛС у плода позволяет ставить вопрос о преры-
вании беременности. К сожалению, внутриутробная диагностика вы-
являет лишь от 18 до 40% плодов с СГЛС [4-7]. Дополнительное ис-
пользование функциональных показателей (обратный кровоток через
открытое овальное окно, изменение характера кровотока в легочных
венах), возможно, повысит выявляемость порока [8]. Беременность пре-
рывают в 11-60% случаев; еще в 12-24% наблюдений родители отка-
зываются от какой-либо операции после рождения ребенка.
Клиническая симптоматика. Первые проявления порока возни-
кают вскоре после рождения и напоминают респираторный дистресс-
синдром, поражение ЦНС или септический шок [3]. Кожные покровы
284
имеют серый оттенок, конечности холодные; состояние детей харак-
теризуется адинамией, выраженной одышкой с втяжением уступчи-
вых мест грудины и влажными хрипами в легких. Цианоз выражен
умеренно, в некоторых случаях можно обнаружить дифференциро-
ванный цианоз - более явный на ногах из-за сброса венозной крови
через ОАП в нисходящую аорту. Синдром низкого сердечного выброса
может быстро усиливаться, что сопровождается нарушениями функ-
ции почек, декомпенсированным метаболическим ацидозом и при-
водит к смерти больных.
При относительно благоприятном течении порока можно выявить
приглушение тонов сердца, небольшой неспецифический систоличе-
ский шум. Характерными симптомами являются ослабление пульса и
снижение артериального давления на всех конечностях, а также про-
грессирующая сердечная недостаточность как право-, так левожелу-
дочкового характера.
Электрокардиография. Электрическая ось сердца отклонена
вправо, имеются признаки гипертрофии обоих предсердий (больше пра-
вого) и правого желудочка. Вольтаж комплексов QRS снижен.
Рентгенография грудной клетки. Для СГЛС наиболее характер-
ным симптомом является венозный застой в малом круге кровообра-
щения, вплоть до интерстициального отека легких. Обычно это отра-
жает резкую обструкцию на уровне митрального клапана или малый
диаметр овального окна. Несмотря на небольшую полость левого же-
лудочка, имеется кардиомегалия (за счет дилатации правых отделов) с
шарообразной конфигурацией сердечной тени.
Эхокардиография. В проекции четырех камер и проекции длин-
ной оси обнаруживают гипоплазированные левый желудочек и левое
предсердие при резко расширенных правых камерах сердца (рис. 17-1).
Дальнейший анализ позволяет оценить остальные компоненты синдро-
ма: атрезию или гипоплазию митрального клапана, устья и восходя-
щей части аорты; коарктацию аорты, межпредсердное сообщение, ОАП.
Цветная допплер-эхокардиография полезна при определении направ-
ления кровотока в различных отделах сердца и сосудов (рис. 17-2 на
цветной вкладке).
Необходимо также оценить сократительную функцию правого же-
лудочка, компетентность трикуспидального и легочного клапанов, так
как их плохое состояние может служить противопоказанием для опе-
ративного вмешательства.
Катетеризация сердца и ангиокардиография. Инвазивные ис-
следования в последнее время применяются крайне редко из-за высо-
285
кого риска при данном пороке. При зондировании правых отделов ка-
тетер легко удается провести из легочного ствола в нисходящую аорту;
выявляется одинаковое насыщение крови кислородом в правом желу-
дочке, легочной артерии и аорте. Давление в правом желудочке и ле-
гочной артерии значительно превышает давление в плечевой артерии.
Контрастное исследование выявляет резкую дилатацию правого желу-
дочка, ствола и легочных артерий с последующим заполнением через
ОАП нисходящей аорты. Восходящая аорта заполняется контрастом
ретроградно после визуализации брахиоцефальных сосудов. Если мит-
ральный клапан проходим, возможно контрастирование резко умень-
шенной полости левого желудочка (рис. 17-3).
Рис. 17-1. Эхокардиограмма из субкостальной позиции по длинной
оси при синдроме гипоплазии левого сердца. Выявляются резкое уменьшение
в размерах левого желудочка (LV), гипоплазия митрального клапана и восходящей
аорты (Ао), расширение правого желудочка и левого предсердия.
Лечение. Основные принципы лечения при СГЛС заключаются в
снижении метаболических потребностей организма (создание темпе-
ратуры комфорта, ограничение физической активности ребенка), кор-
рекции метаболических нарушений. В значительном числе случаев при-
бегают к искусственной вентиляции легких с регуляцией баланса ле-
гочного и системного кровотоков путем изменения концентрации ки-
слорода и СО2 во вдыхаемой смеси, а также использования повышен-
ного давления в дыхательных путях. Показаны также инотропная под-
держка, введение бикарбоната натрия, диуретиков и седативных пре-
паратов. Раннее применение простагландинов группы Е позволяет улуч-
шить периферическое кровообращение и метаболические показатели
286
[9, 10]. В случаях рестриктивного межпредсердного сообщения (диа-
метр менее 4 мм, скорость кровотока более 2 м/сек) прибегают к за-
крытой атриосептостомии [11]. Без хирургического вмешательства срок
жизни ограничен несколькими месяцами, однако и результаты вмеша-
тельств неутешительны, поэтому даже в развитых странах ограничи-
ваются симптоматическим лечением или «пассивной эвтаназией» [10].
Рис. 17-3. Ангиокардиография при синдроме гипоплазии левого серд-
ца. Выявляются резко гипоплазированныс левый желудочек и восходящая аорта.
Если решено прибегнуть к операции, ее желательно выполнить в
первые 30 дней жизни. Существуют три основных хирургических под-
хода: 1) многоэтапная реконструкция, базирующаяся на принципах кор-
рекции единственного желудочка; 2) трансплантация сердца; 3) двух-
желудочковая коррекция. В большинстве случаев единственно возмож-
ной реконструкцией в период новорожденности является операция Нор-
вуда с передачей правому желудочку функции системного желудочка и
обеспечением дозированного легочного кровотока через аортолегоч-
ный шунт. В последующем выполняется операция типа операции Фон-
тена. Двухжелудочковая коррекция возможна в редких случаях (изоли-
рованный критический аортальный стеноз с умеренной гипоплазией
левого желудочка).
287
Литература
1. Samanek М., Voriskova М. Infants with critical heart disease in territory with cen-
tralized care // Internat. J. Cardiol.- 1987.- Vol. 16.- P. 75-91.
2. Sade R.M., CrawfordFA., Fyfe D.A. Symposium on hypoplastic left heart syndrome
//J. Thorac. Cardiovasc. Surg.- 1986.- Vol. 91.- P. 937-939.
3. Белоконь H.A., Подзолков В.П. Врожденные пороки сердца.- М.: Медицина,
1990.
4. Allan L.D., Apfel H.D., Printz B.F. Outcome aftert prenatal diagnosis of the hy-
poplastic left heart syndrome // Heart.- 1998.- Vol. 79.- P. 371-374.
5. Andrews R., Tulloh R., Sharland G. et al. Outcome of staged reconstructive surgery
for hypoplastic left heart syndrome following antenatal diagnosis // Arch. Dis. Child.-
2001.-Vol. 85.- P. 474-477.
6. Kumar R.K., Newhurger J.W, Gauvreau K. et al. Comparison of outcome when
hypoplastic left heart syndrome and transposition of the great arteries are diagnosed
prenatally versus when diagnosis of these two conditions is made only postnatally //
Am. J. Cardiol.- 1999.- Vol. 83.- P. 1649-1653.
7. Brackley J.K., Kilby M.D., Wright J.G. et al. Outcome after prenatal diagnosis of
hypoplastic left-heart syndrome: A case series 7/ Lancet.- 2000.- Vol. 356.-
P. 1143-1147.
8. Better D.J., Apfel H.D., Zidere V, Allan L.D. Pattern of pulmonary venous blood
flow in the hypoplastic left heart syndrome in the fetus // Heart.- 1999.- Vol. 81.-
P. 646-649.
9. Hastreiter A.R., van der Horst R.L., Sepehri B. et al. Prostaglandin El infusion in
newborns with hypoplastic left ventricle and aortic atresia // Ped. Cardiol. 1982.-
Vol. 2.- P. 95-98.
10. Hoshino K., Ogawa K., Hishitani T. et al. Hypoplastic left heart syndrome: duration
of survival without surgical intervention//Am. Heart J.- 1999.-Vol. 137.-P. 535-542.
11. Kuhn M.A., Larsen R.L., Mulla N.F. et al. Outcome of infants with hypoplastic left
heart syndrome who undergo atrial septostomy before heart transplantation //
Am. J. Cardiol.- 2000.- Vol. 85.- P. 124-127.
288
Глава 18. АНОМАЛИИ КОРОНАРНЫХ АРТЕРИИ
Врожденные аномалии коронарных артерий представляют собой
широкий спектр анатомических отклонений. Некоторые из них могут
незначительно нарушать гемодинамику (единая коронарная артерия,
аномалии положения устьев в пределах синусов Вальсальвы, добавоч-
ные коронарные ветви и т.п.), другие представляют серьезную угрозу
здоровью детей (отхождение коронарных артерий от легочной арте-
рии, аберрантное отхождение левой коронарной артерии, коронарные
фистулы).
Малозначимые аномалии находят примерно у 0,17% асимптома-
тичных детей [1]. Тяжелые аномалии выявляют более часто в связи с
возникающей клинической симптоматикой. В настоящей главе мы рас-
смотрим группу патологий, имеющих гемодинамическое значение.
18.1. Аномальное отхождение коронарной артерии
от легочной артерии
Аномальное отхождение коронарной артерии от легочной артерии
- редкая, однако обычно тяжело протекающая врожденная патология
сердца, при которой ствол или ветви коронарной артерии берут начало
от системы легочной артерии.
Частота. Отхождение левой коронарной артерии от легочной со-
ставляет 0,025-0,05/1000 новорожденных, 0,22% среди всех ВПС и
0,4-0,7% среди критических ВПС. Аномалии правой или добавочной
коронарной артерии встречаются значительно реже. Так, с 1981 г. мы
нашли в доступной литературе описание лишь 35 случаев отхождения
правой коронарной артерии от легочной артерии [2-6].
Так как в клинической практике наибольшее значение имеет отхо-
ждение левой коронарной артерии от легочной артерии, мы приводим
описание патофизиологических изменений, возникающих именно при
этой аномалии.
Анатомия. Левая коронарная артерия обычно начинается от лево-
го, реже - от правого синуса легочной артерии, дальнейший ее ход и
ветвление такие же, как в норме. Правая коронарная артерия при этом
расположена нормально. В случае выраженных межкоронарных ана-
стомозов она расширена и извита. Состояние миокарда отражает сте-
пень нарушения коронарного кровоснабжения. Как правило, имеется
фиброэластоз эндокарда, гипертрофия и склерозирование папилляр-
ных мышц, нередки субэндокардиальные или трансмуральные инфарк-
289
ты миокарда. Примерно в половине случаев имеется аневризма в об-
ласти переднебоковой стенки и верхушки. Сердце резко увеличено, пре-
имущественно за счет дилатации левого желудочка.
Гемодинамика. Особенности кровообращения при данной пато-
логии зависят от соотношения давлений в аорте и легочной артерии
(рис. 18-1).
Рис. 18-1. Схема коронарного кровообращения: А - в норме,
Б-Г - при отхождении левой коронарной артерии от левой легочной артерии (Б - во
внутриутробном периоде; В - у новорожденных; Г - у грудных детей). Черной стрел-
кой обозначена венозная кровь, белой стрелкой - артериальная кровь; Ао - аорта,
ЛА - легочная артерия, ПКА - правая коронарная артерия, ЛКА - левая коронарная
артерия.
У плода давление в этих сосудах одинаковое, что обеспечивает
нормальное направление кровотока в коронарных артериях (рис. 18-1,
Б). При этом в аномально отходящую левую коронарную артерию по-
ступает достаточно оксигенированная кровь из легочной артерии. В
связи с этим ишемии миокарда не возникает. Сразу после рождения
высокое давление в легочных сосудах некоторое время обеспечивает
антеградный кровоток в коронарное русло, однако теперь туда посту-
пает венозная кровь, в связи с чем возникает гипоксия миокарда
290
(рис. 18-1, В). По мере снижения резистентности легочных сосудов дав-
ление в легочной артерии и антеградный кровоток в левой коронарной
артерии также снижаются. В последующем поток крови меняет направ-
ление и возникает шунтирование из коронарного русла в легочную ар-
терию, что приводит к синдрому обкрадывания («coronary steal») с низ-
ким перфузионным давлением в коронарных сосудах (рис. 18-1, Г). В
этот период кровоснабжение миокарда в бассейне левой коронарной
артерии осуществляется из расширенной правой коронарной артерии
через межкоронарные анастомозы (коллатерали). При их слабом раз-
витии (так называемый «инфантильный тип» кровообращения - у 85%
больных) рано возникают выраженная ишемия миокарда, дисфункция
и дилатация левого желудочка, митральная недостаточность [7]. При
хорошем развитии коллатералей («взрослый тип кровообращения» -
10-15% случаев) функция желудочка страдает в меньшей степени.
Гемодинамика несколько изменяется при наличии сопутствующих
ВПС, сопровождающихся высокой легочной гипертензией, например,
дефекта межжелудочковой перегородки. В этих случаях высокое дав-
ление в легочной артерий может поддерживать в аномальной коронар-
ной артерии антеградный кровоток, а примесь артериальной крови -
достаточно высокую оксигенацию. В связи с этим диагностика затруд-
нена и патология коронарных артерий обнаруживается случайно при
обследовании по поводу ВПС или посмертно [2].
Естественное течение. Во внутриутробном периоде данная пато-
логия не приводит к нарушениям питания миокарда. В обе коронар-
ные артерии кровь поступает под равным давлением и примерно с оди-
наковой оксигенацией. После рождения течение заболевания зависит
от того, какие отделы сердца попадают в условия недостаточного кро-
воснабжения. Отхождение левой коронарной артерии от легочной, или
синдром Bland-White-Garland, в большинстве случаев приводит к ран-
ней ишемии и инфаркту миокарда и заканчивается смертью 90% детей
в пределах первого года жизни. При хорошем развитии коллатералей
возможно длительное выживание пациентов, несмотря на наличие суб-
клинической ишемии миокарда. Так, описан случай первичной диаг-
ностики данной патологии у женщины 72 лет [8]. Нередко единствен-
ными проявлениями порока могут быть лишь нарушения ритма [9].
Однако, как правило, 80-90% этих пациентов умирают внезапно в воз-
расте около 35 лет.
Отхождение правой коронарной артерии от легочной сопровож-
дается нарушениями коронарной перфузии преимущественно правого
желудочка и протекает более благоприятно, так как редко приводит к
серьезным повреждениям миокарда.
291
Клиническая симптоматика. Несмотря на редкость порока, не-
обходима высокая настороженность в отношении аномального отхож-
дения левой коронарной артерии от легочной артерии при обследова-
нии больных с тотальной миокардиальной дисфункцией. Заболевание
обычно проявляется в возрасте до 3 мес. Первые признаки - общее
недомогание, вялость, бледность кожных покровов, потливость. Воз-
можны приступы резкого беспокойства с одышкой, криком, усилени-
ем бледности, потливости [10]. Эти состояния могут провоцироваться
кормлением, другими физическими усилиями и рассматриваются как
эквиваленты стенокардии у взрослых.
Тоны сердца обычно сохранены. Возможен систолический шум
митральной недостаточности, связанной как с дилатацией левого же-
лудочка, так и с дисфункцией папиллярных мышц. При развитии сер-
дечной недостаточности она быстро становится рефрактерной к меди-
каментозной терапии.
При обследовании ребенка чаще всего подозревают дилатацион-
ную кардиомиопатию из-за сочетания застойной сердечной недоста-
точности с кардиомегалией, ишемическими изменениями на ЭКГ и шу-
мом митральной недостаточности.
Электрокардиография. Данное исследование имеет большое ди-
агностическое значение. Из изменений общего порядка можно отме-
тить отклонение электрической оси сердца влево, блокаду левой нож-
ки пучка Гиса, признаки гипертрофии миокарда левого желудочка с
субэндокардиальной ишемией (смещение сегмента ST ниже изолинии,
отрицательные зубцы 7). Характерным симптомом порока являются
глубокий (>3 мм) и расширенный (> 30 мс) зубец Q в отведениях I,
aVL, V . Диагностически значимо также сочетание глубокого зубца Q
с инвертированным зубцом Т в отведении aVL. При свежем инфаркте
миокарда эти изменения нередко сочетаются с подъемом сегмента ST
выше изолинии и уменьшением амплитуды зубца R. О ранее перене-
сенном инфаркте миокарда свидетельствует «провал» амплитуды зуб-
ца R в отведениях V и V , (комплекс типа r5, QS, Qr) [10].
Рентгенография грудной клетки. На рентгенограмме грудной
клетки определяется резкое расширение тени сердца и явления застоя
в малом круге кровообращения. Картина похожа на таковую при дила-
тационной кардиомиопатии.
Эхокардиография. При исследовании сердца обращают на себя
внимание дилатация полости левого желудочка с признаками глобаль-
ной гипокинезии, аномальными сегментарными движениями стенки,
повышенная эхогенность папиллярных мышц.
292
При изучении корня аорты выявляется нормально отходящая пра-
вая коронарная артерия и отсутствие левой коронарной артерии
(рис. 18-2, А на цветной вкладке). В пользу исследуемой патологии сви-
детельствует расширение правой коронарной артерии. Диагноз высо-
ковероятен при отношении ее диаметра к диаметру аортального коль-
ца более 0,14 (средняя величина составляет 0,20±0,06) [И]. Однако
этот симптом может отсутствовать у маленьких детей с небольшими
межкоронарными анастомозами. Хорошо развитые коллатерали про-
являются также картиной множественного высокоскоростного коро-
нарного кровотока в межжелудочковой перегородке.
Диагноз считается подтвержденным при установлении соедине-
ния левой коронарной артерии с легочной артерией и наличия обрат-
ного кровотока из нее в легочный ствол (рис. 18-2, Б на цветной
вкладке).
Частой сопутствующей патологией является митральная регурги-
тация, которая может быть связана как с дисфункцией папиллярных
мышц, так и с дилатацией клапанного кольца.
В процессе исследования необходимо оценить степень поражения
миокарда, так как это определяет лечебную тактику; при наличии мас-
сивного инфаркта или большой аневризмы желудочка реваскуляриза-
ция миокарда может не принести успеха.
Для определения резервов миокарда возможно дополнительное
проведение стресс-эхокардиографии или изотопного исследования.
Катетеризация сердца и ангиокардиография. В настоящее вре-
мя данное исследование предпринимают лишь для исключения дру-
гих коронарных аномалий или пороков сердца. В большинстве случа-
ев для диагностики достаточно квалифицированно выполненной эхо-
кардиографии.
Лечение. Специфического медикаментозного лечения не сущест-
вует. Необходимо ограничение физической активности ребенка, ино-
тропная поддержка сердца (допамин 4-6 мкг/кг/мин). Противопоказа-
ны препараты, снижающие ОЛС, а также оксигенотерапия.
Оперативное лечение показано в максимально ранние сроки. В за-
висимости от анатомического расположения сосудов и возможностей
учреждения прибегают к различным методикам. Операцией выбора яв-
ляется прямая реимплантация левой коронарной артерии в аорту, в ре-
зультате чего восстанавливается система двух коронарных артерий. Не-
сколько менее эффективны шунтирование артерии с помощью внутри-
грудных артерий или операция Takeuchi (соединение аорты и левой
коронарной артерии с помощью туннеля внутри легочного ствола). Про-
293
стая перевязка устья левой коронарной артерии, направленная на ли-
квидацию обкрадывания коронарного бассейна и повышения в нем
перфузионного давления, сопровождается неудовлетворительным ре-
зультатом.
Сопутствующая патология, которую также необходимо бывает кор-
ригировать, - это аневризма левого желудочка и митральная недоста-
точность. Многие авторы считают, что в случае выраженной митраль-
ной регургитации необходимо прибегнуть к реконструкции митраль-
ного клапана. Однако, как показали Huddleston С.В. et al. [12], плохая
послеоперационная функция клапана обычно связана со стенозирова-
нием реимплантированной коронарной артерии. В значительном же ко-
личестве случаев состояние митрального клапана улучшается после
восстановления адекватного коронарного кровообращения, поэтому во-
прос о вмешательстве на нем остается спорным.
18.2. Коронарные фистулы
При данной патологии коронарная артерия нормально отходит от
аорты, а затем в виде фистулы (свища) сообщается с камерами сердца
или крупными сосудами.
Частота. Средняя частота в популяции составляет около
0,02/1000 новорожденных. В хирургических сериях, связанных с па-
тологией сердца, данные аномалии встречаются в среднем у 0,2% боль-
ных [13, 14]. У 20^40% пациентов имеются сопутствующие ВПС-тет-
рада Фалло, ДМПП, ОАП, ДМЖП; в этих случаях на первое место
выходит симптоматика основного, «большого» порока. В данной главе
рассматривается изолированная патология коронарных артерий.
Анатомия. Коронарно-сердечные фистулы могут располагаться в
любой части артерии, но чаще наблюдаются в ее дистальных отделах.
Артерия от устья до места фистулы значительно расширена, извита.
Стенка ее истончена, нередко выглядит как сосудистая аневризма. По-
сле проксимально расположенной фистулы коронарная артерия может
продолжаться в виде обычного сосуда. Сообщение с камерами сердца
представлено чаще всего в виде единичного отверстия (70-90% случа-
ев), однако может быть и множественным. Его анатомические вариан-
ты включают прямое соустье, коммуникацию с помощью одиночного
аберрантного сосуда или через сплетение извитых артерий (плекси-
формный дренаж) [15]. Предполагается, что внутрисердечные фисту-
лы представляют собой сохранившиеся межтрабекулярные промежут-
ки и синусоиды [16].
294
Более чем в половине случаев фистула исходит из правой коро-
нарной артерии, в трети случаев - из левой коронарной артерии, в ос-
тальных - из обеих или единственной коронарной артерии.
Описаны сообщения коронарных артерий практически со всеми
возможными полостями сердца и крупных сосудов. Наиболее частым
местом впадения является правый желудочек (45%), затем - правое
предсердие (28%), легочная артерия, левые камеры сердца. В единич-
ных случаях возникает сообщение с коронарным синусом, полой или
легочной венами.
Вторичные изменения сердца широко варьируют. Возможно уме-
ренное увеличение сердца и расширение восходящей аорты.
Гемодинамика. Нарушения гемодинамики имеют два аспекта:
1) сброс крови в сердечные камеры приводит к их объемной перегруз-
ке; 2) из-за возникающего синдрома обкрадывания коронарного русла
ухудшается питание миокарда в зоне патологически измененной арте-
рии. Объем шунта через фистулу может достигать 60% от минутного
объема кровотока, но в большинстве случаев не превышает 40%. На
эту величину влияют сопротивление стенок коронарной артерии, диа-
метр фистулы, разница давления в коронарной артерии и камере. Сброс
в левый желудочек происходит преимущественно в диастолу, в осталь-
ные полости - в систолу и диастолу. Шунт в правые камеры сердца
сопровождается объемной перегрузкой правых и левых отделов (из-за
высокого возврата крови из легких), сброс в левые камеры - перегруз-
кой только этих отделов. Несмотря на гиперволемию малого круга кро-
вообращения, высокая легочная гипертензия представляет чрезвычай-
ную редкость.
Большой объем сброса по фистуле может значительно уменьшить
кровоток и перфузионное давление в дистальных отделах пораженной
артерии по типу коронарного стил-синдрома. Следствием этого явля-
ется ишемия миокарда, которая проявляется преимущественно в усло-
виях физической нагрузки. Интересно, что нет достоверной связи ме-
жду объемом шунтирования крови и клиническим симптомокомплек-
сом. В ряде случаев даже при документированном стил-синдроме при-
знаки ишемии миокарда отсутствуют. Как правило, это относится к
пациентам первых 10-20 лет жизни. Возможно, что миокард в зоне
гипоперфузии у них снабжается ретроградно из смежных коронарных
артерий.
Естественное течение. Характер внутриутробного течения дан-
ной аномалии неизвестен. После рождения в большинстве случаев по-
рок протекает благоприятно, пациенты доживают до зрелого возраста.
295
Описаны редкие случаи спонтанного закрытия фистул [10]. Однако воз-
можно и развитие осложнений, угрожающих жизни больных, - разры-
ва аневризматически расширенной коронарной артерии, сердечной не-
достаточности, бактериального эндокардита, преждевременного разви-
тия атеросклероза. Редким наблюдением является дисфункция синус-
ного узла при фистуле в бассейне конусной ветви правой коронарной
артерии [16].
Клиническая симптоматика. В большинстве случаев порок про-
текает бессимптомно. При больших фистулах уже в период новорож-
денное™ возникает одышка при нагрузке, тахикардия. В последую-
щем отмечается снижение толерантности к физической нагрузке, сла-
бость. Ангинозные боли или их эквиваленты не характерны, чаще по-
являются к ЗСМЮ годам и скорее связаны с атеросклеротическим пора-
жением коронарных сосудов.
Над областью сердца выслушивается продолжительный систоли-
ческий шум, убывающий ко II тону, и диастолический шум, нарастаю-
щий к I тону [10]. Шумы обычно локализуются в третьем-четвертом
межреберье слева от грудины, однако могут быть и справа от нее, и на
верхушке. При фистуле в левый желудочек диастолический компонент
преобладает. Симптомы застойной сердечной недостаточности редки.
Возможно развитие нарушений ритма сердца.
Электрокардиография. Изменения ЭКГ неспецифичны и могут
полностью отсутствовать. При большом сбросе отмечают признаки ги-
пертрофии соответствующих отделов сердца. Симптомы ишемии мио-
карда выявляют не более чем у 3% больных, обычно старшего возрас-
та. Гемодинамическую значимость фистулы более четко можно выявить
при исследовании с дозированной физической нагрузкой.
Рентгенография грудной клетки. При рентгенологическом ис-
следовании выявляют незначительное увеличение размеров сердца за
счет камер, в которые происходит сброс, а также умеренное усиление
легочного рисунка.
Эхокардиография. Ультразвуковая диагностика данной аномалии
возможна, однако семиотика заболевания разработана недостаточно.
Нередко обнаруживают локальное расширение коронарной артерии
проксимальнее фистулы с повышением скорости кровотока в этом уча-
стке. Если объем сброса через дефект сосуда приводит к существенно-
му дефициту коронарного кровотока в дистальном участке, то возмож-
но выявить зону локального нарушения сокращения миокарда, обыч-
но достаточно четко отделенную от миокарда с сохранным коронар-
ным кровотоком. При локализации фистулы на уровне предсердий, ле-
296
точной артерии или коронарного синуса единственным признаком мо-
жет явиться выявление локального кровотока сброса в полость серд-
ца, преимущественно в диастолу (рис. 18-3 на цветной вкладке).
Катетеризация сердца и ангиокардиография. При катетериза-
ции сердца отмечают повышение оксигенации крови в камере, куда
открывается фистула, а также увеличение кровотока в малом круге кро-
вообращения. Ведущими исследованиями являются ретроградная аор-
тография или селективная коронарография, с помощью которых выяв-
ляют извитую, расширенную коронарную артерию, сообщающуюся с
какой-либо камерой сердца. Важным моментом является определение
уровня расположения фистулы.
Лечение. Специфическое медикаментозное лечение отсутствует;
при развитии сердечной недостаточности используют симптоматиче-
скую терапию. Показания к операции до конца не разработаны. К хи-
рургическому лечению обычно прибегают в случаях развития ослож-
нений (аневризматическое расширение коронарной артерии, сердеч-
ная или коронарная недостаточность). Небольшие фистулы, вероятно,
не требуют коррекции. Однако в связи с прогрессом кардиохирургии в
последние годы и низким риском операции, показания к закрытию ко-
ронарно-желудочковых фистул могут расширяться.
Устранение фистулы достигается либо путем прошивания и пере-
вязки ее «ножки», либо ушиванием отверстия из просвета расширен-
ной коронарной артерии. Во время операции особое внимание уделя-
ют сохранению адекватного кровотока в бассейне пораженной коро-
нарной артерии.
В последнее время при постановке диагноза коронарной фистулы и
планировании лечения значительное место отводится интервенционно-
му вмешательству, а именно спиральной эмболизации фистулы [17].
18.3. Аберрантная левая коронарная артерия
Коронарные артерии, аномально отходящие от аорты, составляют
треть всех коронарных патологий. Однако в большинстве случаев они
протекают доброкачественно. Проблему представляют варианты, при
которых обе коронарные артерии берут начало в одном синусе Валь-
сальвы. Наибольшее значение имеет отхождение левой коронарной ар-
терии от правого синуса Вальсальвы.
Частота. В связи с редкостью аномалии ее частота не определена.
Анатомия. Левая коронарная артерия отходит от правого коро-
нарного синуса вместе с правой коронарной артерией, иногда общим
297
стволом. Далее она направляется влево и кзади, проходит между аор-
той и легочным стволом и делится на огибающую и переднюю нисхо-
дящую артерии.
Гемодинамика. Так как коронарная артерия отходит под ост-
рым углом, устье ее имеет щелевидный вид (рис. 18-4). В условиях
нагрузки, когда артерия расширяется, может произойти почти пол-
ное перекрытие устья и развиться ишемия миокарда. Кроме того, рас-
ширение корня аорты и легочного ствола при возрастании сердечно-
го выброса может привести к сдавлению коронарной артерии и вне-
запной смерти пациента.
Естественное течение. Внутриутробное и послеродовое тече-
ние порока не изучены. Из числа известных пациентов около 20%
умерли внезапно.
Клиническая симптоматика. Проявления порока характеризуют-
ся внезапной потерей сознания и даже смертью во время выполнения
физической нагрузки. Подобные наблюдения относятся как к подрост-
кам, так и более старшим пациентам. В редких случаях имеются пред-
шествующие ангинозные боли или аритмии. Проявления порока у груд-
ных детей являются казуистикой. В большинстве наблюдений анома-
лию обнаруживают случайно при обследовании по другому поводу.
Рис. 18-4. Состояние аберрантной левой коронарной артерии в
покое (А) и при физической нагрузке (Б). До - аорта, ЛА - легочная артерия,
ПКА - правая коронарная артерия, ЛКА - левая коронарная артерия.
Электрокардиография. На ЭКГ можно обнаружить признаки пе-
ренесенной ишемии миокарда, однако чаще изменения отсутствуют.
Выявлению скрытой ишемии помогает проведение исследования с до-
зированной физической нагрузкой.
298
Рентгенография грудной клетки. В большинстве случаев изме-
нения отсутствуют. При развитии обширного инфаркта миокарда по-
являются признаки левожелудочковой недостаточности - расширение
тени сердца, венозный застой в малом круге кровообращения.
Эхокардиография. При отсутствии левой коронарной артерии в
области левого синуса Вальсальвы необходимо исключить ее отхож-
дение от других синусов, а также проследить пространственное поло-
жение относительно магистральных сосудов.
Катетеризация сердца и ангиокардиография. Наиболее важным
исследованием является контрастирование восходящей аорты или се-
лективная коронарография, которые позволяют определить место отхо-
ждения коронарных артерий, их расположение и формирование ветвей.
Лечение. Медикаментозная терапия неизвестна. Выявление данной
аномалии является показанием для хирургического лечения. Операцией
выбора является реимплантация левой коронарной артерии в стенку аор-
ты таким образом, чтобы исключить ее перегиб или сдавление.
Литература
1. Davis J.A., Cecchin Е, Jones Т.К., Portman М.А. Major coronary artery anomalies
in pediatric population: Incidence and clinical importance//JACC.-2001.-Vol. 37.-
P. 593-597.
2. Бураковский В.И., Шарыкин А.С., Гарибян В.А. Аномальное отхождение пра-
вой коронарной артерии от легочной артерии в сочетании с дефектом межже-
лудочковой перегородки // Грудная хир.- 1981.- №2.- С.5-10.
3. CoeJ. Y, Radley-Smith, Yacouh М. Clinical and hemodynamic significance of anoma-
lous origin of the right coronary artery from the pulmonary artery // Thorac. Cardio-
vasc. Surg.- 1982.- Vol. 30.- P. 84-87.
4. Rotzsch C, Kabus M., Hausler H.-J. A rare congenital coronary anomaly: Anoma-
lous origin of the right coronary artery from the pulmonary artery // Heart.- V. 88.-
P. 141.
5. Михайлова E.B., Любомудров В.Г, Болсуновский В.А., Цытко А.Л. Коррекция
аномального отхождения коронарных артерий - хирургические варианты //
Бюлл. НЦССХ им. А.Н. Бакулева РАМН,- 2002.- Т.З.- № 11.- С. 31.
6. Michielon G., Di Carlo D., Brancaccio G. et al. Anomalous coronary artery origin
from the pulmonary artery: Correlation between surgical timing and left ventricular
function recovery // Ann. Thorac.Surg.- 2003.- Vol. 76.- P. 581-588.
7. Agustsson M.H., Gasul B.M., Fell H. et al. Anomalous origin of the left coronary
artery from the pulmonary artery diagnosis and treatment of infantile and adult types
//JAMA.- 1962.-Vol. 180.- P. 15-21.
8. Fierens C, Budts W., DenefB., Van de WerfF. A 72 year old woman with ALCAPA
// Heart.- 2000.- Vol. 83.-P. e2.
9. Frapier J.-M., Leclercq E, Bodino M., Chaptai P.-А. Malignant ventricular arrhyth-
mias revealing anomalous origin of the left coronary artery from the pulmonary
artery in two adults // Eur. J. Cardiothorac. Surg.- 1999.- Vol. 15.- P. 539-541.
299
10. Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца.- М., «Медицина»,
1991.
11. Chang R.-K.R., Allada У. Electrocardiographic and echocardiographic features that
distinguish anomalous origin of the left coronary artery from pulmonary artery from
idiopathic dilated cardiomyopathy // Pediatr. Cardiol.- 2001.- Vol. 22.- P. 3-10.
12. Huddleston C.B., Balzer D.T., Mendeloff E.N. Repair of anomalous left main coro-
nary artery arising from the pulmonary artery in infants: Long-term impact on the
mitral valve // Ann. Thorac. Surg.- 2001.- Vol. 71.- P. 1985-1989.
13. Demirkilic U., Ozal E., Bingol H. et al. Surgical treatment of coronary artery fistu-
las: 15 years’ experience // Asian Cardiovasc. Thorac. Ann.- 2004.- Vol. 12.-
P. 133-138.
14. Сердечно-сосудистая хирургия: руководство / Под ред. В.П. Бураковского,
Л.А. Бокерия.-М.: Медицина, 1989.
15. Петросян Ю.С., Абдуллаев Ф.З., Лепихова И.И., Обловацкая О.Г Ангиографи-
ческая семиотика и патофизиология врожденных фистул коронарных артерий //
Грудная хир.- 1989.- № 6.- С. 23-31.
16. Бухарин В.А., Плотникова Л.Р, Джафаров Д.Х. Фистулы коронарных артерий
с левым желудочком // Грудная хир.- 1983.- № 3.- С. 11-16.
17. Алекян Б.Г., Подзолков В.П., Карденас К.Э. Эмболизационная терапия некото-
рых врожденных пороков сердца и сосудов // Эндоваскулярная и минимально
инвазивная хирургия сердца и сосудов у детей / Под ред. Л.А. Бокерия, Б.Г. Але-
кяна, В.П. Подзолкова.- М.: Изд-во НЦССХ им. А.Н.Бакулева РАМН, 1999.-
С. 189-216.
300
Глава 19. ОПУХОЛИ СЕРДЦА
19.1. Общие положения
Частота
Опухоли представляют собой редкие врожденные пороки разви-
тия сердца. Их частота в первых крупных сериях наблюдений состав-
ляла лишь 0,027-0,05% среди новорожденных [1, 2]. Это связано с
тем, что опухоли у детей относительно нечасто приобретают гемоди-
намическое значение и проявляются клинически, подвержены спон-
танной регрессии, и соответственно редко встречаются в материалах
аутопсий. Однако по мере внедрения в практику эхокардиографии,
компьютерной томографии, магнитно-резонансной томографии вы-
являемость первичных опухолей среди детей и подростков за период
с 1980 по 1994 г. увеличилась с 0,06 до 0,32% [3]. Нарастание объе-
мов скрининговых исследований, несомненно, приведет к дальней-
шему увеличению частоты этой патологии.
С развитием ранней, в том числе внутриутробной, диагностики
появилась возможность более реально оценивать место опухолей
среди врожденных патологий сердца, в том числе в целом в популя-
ции. В настоящее время удельный вес пренатальных диагнозов со-
ставляет 21-27%. А в постнатальном периоде большинство опухо-
лей (72-77%) диагностируют в возрасте до 1 года [4, 5], что также
говорит в пользу их врожденного характера.
Анатомия
В соответствии с хирургической номенклатурой [6] опухоли серд-
ца могут быть первичными, т.е. исходящими из тканей сердца, и вто-
ричными, исходящими из других органов. В последнем случае возмож-
но непосредственное прорастание сердца опухолью (чаще всего из под-
диафрагмального пространства по нижней полой вене) или метастази-
рование гематогенным или лимфогенным путем. Подразделение пер-
вичных опухолей на доброкачественные или злокачественные в мо-
мент диагностики или операции бывает крайне затруднено, поэтому
предложено избегать такой оценки при создании хирургических баз
данных. Известно, по меньшей мере, 14 различных наименований пер-
вичных опухолей сердца, однако у маленьких детей встречаются дале-
ко не все из них. Около 85% всех новообразований составляют рабдо-
миома, фиброма и тератома. Очень редко обнаруживают миксомы, ко-
торые доминируют у взрослых пациентов, а также злокачественные
301
новообразования (в среднем 8%). Еще реже встречаются гемангиома,
опухоль клеток Пуркинье, мезотелиома атриовентрикулярного узла, ли-
пома. Их частота колеблется от 1 до 4% (табл. 19-1).
Таблица 19-1
Частота первичных опухолей сердца у детей
Показатели Число наблюдений, абс. (%)
Takach Т. et al., 1996' Sallee D. et al., 19992 Becker A.E., 20001 Freedom R.M. et al., 20004 Stiller B. et al., 2001s Всего
Общее число наблюдении 40 22 76 (55)6 56 267 220
Доброкачественные опухоли 37(92) 21 (95) 63 (83) 56 (100) 26 (100) 203 (92)
- в том числе:
рабдомиома 11 29 (27) 44 29 113(63/
фиброма 1 18 (13) 6 9 34 (18,9/
миксома 1 6(2) - 7 (3,9/
гемангиома 1 4(3) - 2 7 (3,9/
тератома 2 1 (1) 1 2 6(3,3/
опухоль клеток Пуркинье - 4(4) - - 4 (2,2/
мезотелиома АВ-узла 1 2(1) - 3(1,7/
липома 1 (0) 1 2(1,1/
Multicystic hamartoma - - 1 1 (0,5/
Неклассифицированные 4 - 3 7 (3,9/
Злокачественные опухоли 3 (7,5) 1 (4,5) 13(17) - - 17(8)
Средняя частота в год 1,14 1,22 4,47 3,11 2,6 2,3
Средняя частота за период 1,2 3,4
Примечание. 1 35 лет наблюдений;2 18 лет наблюдений;3 17 лет наблюдений;
4 18 лет наблюдений;5 10 лет наблюдений;6 в скобках количество больных младше
1 года;7 количество пациентов отличается от количества опухолей;8 среди четырех
предпоследних колонок.
Классификация
Основные сведения об опухолях исходят из кардиохирургических
клиник, в связи с чем современные классификации носят в основном
прикладной анатомо-хирургический характер.
Мы считаем возможным при описании данной патологии придер-
живаться последовательности, приведенной на рис. 19-1.
Диагностика
Клинические симптомы обычно симулируют врожденный порок
сердца, несколько варьируют от опухоли к опухоли и описаны ниже.
Традиционные методы исследования - аускультация, ЭКГ, рентгено-
графия грудной клетки - помогают заподозрить поражение сердца, од-
нако не являются достаточно информативными для установления ди-
агноза. Изменения на ЭКГ присутствуют не всегда, неспецифичны и
используются обычно для выявления нарушений ритма или проводи-
мости. При рентгенографии можно обнаружить изменение размеров
или конфигурации сердца и средостения; в некоторых случаях - каль-
цификаты в проекции сердца.
Ведущим методом в диагностике опухолей сердца является эхо-
кардиография (рис. 19-2, 19-3).
302
Рис. 19-1. Схема описания опухолей сердца у детей.
Рис. 19-2. Эхокардиограммы в верхушечной четырехкамерной
позиции при рабдомиоме левого желудочка. А (фрагмент) - в верхушечном
отделе левого желудочка лоцируется обширное дополнительное пристеночное
образование повышенной эхоплотности, неоднородное по эхострукгуре; Б - в области
межжелудочковой перегородки и верхушки задней папиллярной мышцы лоцируются
два дополнительных образования повышенной эхоплотности.
Это относится как к пренатальному, так и к постнатальному пе-
риодам. В соответствии с принятым описанием (рис. 19-1) определя-
ют локализацию образования, его подвижность в разные фазы работы
сердца, степень обструкции кровотоку, вторичную недостаточность кла-
панов, вовлечение коронарных артерий, нарушение диастолической или
систолической функции желудочков. В отдельных случаях полезно вы-
303
полнение магнитно-резонансной томографии, позволяющей разграни-
чить опухоль и нормальный миокард, определить связь с другими сер-
дечными структурами, магистральными сосудами или органами сре-
достения. Кроме того, характеристики тканей, получаемые с помощью
данной методики, дают возможность определить тип опухоли (рабдо-
миома, фиброма, липома, гемангиома) [7]. Катетеризация сердца ма-
лоинформативна и представляет определенную опасность, так как мо-
жет вызвать фатальную аритмию. Поэтому ее выполняют только в слу-
чаях, необходимых для электрофизиологического исследования, био-
псии или коронарографии (когда подозревают компрометацию коронар-
ной артерии) [8, 14].
Рис. 19-3. Эхокардиограмма в верхушечной четырехкамерной
позиции при миксоме левого предсердия. В полости предсердия выявляется
дополнительное объемное образование умеренной эхоплотности, крепящееся к
межпредсердной перегородке, подвижное.
19.2. Характеристика отдельных опухолей
Рабдомиома
Рабдомиома представляет собой наиболее частую (60-70%) доб-
рокачественную опухоль сердца и обычно выглядит как плотный се-
рый узел, отличающийся от окружающего миокарда и не имеющий кап-
сулы. Некоторые авторы считают ее не истинным новообразованием, а
гамартомой [9]. У 50-90% детей узлы множественные. При гистологи-
ческом исследовании обнаруживают «разбухшие» миоциты с больши-
ми вакуолями и обилием гликогена. Характерны также большие поли-
гональные клетки с центрально расположенным ядром и расходящи-
мися к клеточной мембране «паутинками». Локализуется опухоль ча-
304
ще всего в межжелудочковой перегородке, выводном тракте левого же-
лудочка и свободных стенках желудочков. Однако есть сообщения о
предсердной и эпикардиальной локализациях [10, 11], а также прояв-
лении в виде диффузного утолщения миокарда у плода [12]. Опухоль
не подвержена некротизации, кальцифицируется редко.
Рабдомиома может входить в синдром туберозного склероза, быть
спорадической или сочетаться с другими ВПС.
Синдромалъная формарабдомиомы. Наиболее частый вариант опу-
холи, являющейся одним из компонентов туберозного склероза. По раз-
ным сведениям, последнее заболевание выявляют в 30-90% случаев.
Однако истинная частота туберозного склероза у пациентов с рабдо-
миомой остается неизвестной, так как многие из них умирают без точ-
ного диагноза. Туберозный склероз представляет собой аутосомно-до-
минантное поражение, характеризующееся высокой частотой мутаций
и многочисленными опухолевыми образованиями, расцениваемыми как
гамартомы. Заболевание проявляется интракраниальными узлами, ли-
цевым ангиофиброматозом, подногтевыми фибромами, линейными
эпидермальными пигментациями, почечными ангиомиолипомами и т.д.
У 30-50% пациентов имеется рабдомиома сердца, которую нередко вы-
являют случайно при обследовании по поводу основного заболевания.
В 90% случаев опухоль носит множественный характер. Некоторые
авторы даже предлагают считать множественную рабдомиому у плода
маркером туберозного склероза.
Спорадическая рабдомиома обычно проявляется солитарными уз-
лами. Так как миксома является чрезвычайной редкостью у грудного
ребенка, при обнаружении массивного образования в полости сердца
в первую очередь должна быть заподозрена рабдомиома. Это важно в
отношении лечебной тактики, так как если нет компрометации гемо-
динамики, операция не показана и можно ограничиться наблюдением
за динамикой развития опухоли. При локализации образования в пра-
вых отделах сердца необходимо также провести дифференциальную
диагностику с тромботическими массами. Последние могут возник-
нуть у детей, перенесших выраженную неонатальную гипоксию. При
этом возникает подъем давления в правом желудочке, трикуспидальная
недостаточность, турбулентность крови, повреждение эндокарда в зоне
трикуспидального клапана и тромбообразование. В пользу последнего
процесса могут свидетельствовать также нарушения коагулограммы.
Сочетание с врожденными пороками сердца. В данной комбина-
ции важны время и место возникновения опухоли. Так, в раннем пе-
риоде беременности (до 2 мес) опухоль, расположенная в стратегиче-
305
ски важной зоне, может влиять на развитие соответствующих отделов
сердца (межжелудочковая перегородка, выводные отделы желудочков,
клапаны сердца) и перераспределение потоков крови. В этом случае
она является как бы «причиной» ВПС. Возникновение опухоли после
8 недель беременности, когда формирование структур сердца уже за-
вершено, редко сочетается с врожденным пороком сердца [13]. Описа-
ны комбинации рабдомиомы с ДМЖП, тетрадой Фалло, стенозами вы-
водных трактов правого или левого желудочков, гипоплазией левого
сердца, транспозицией магистральных артерий, клапанной патологи-
ей, аномалией Эбштейна, коарктацией аорты и поражением проводя-
щей системы сердца. В подобных ситуациях клиническая симптома-
тика определяется преимущественно ВПС, а не опухолью. Кроме того,
рабдомиома может уменьшаться в размерах и даже полностью исчез-
нуть, после чего уменьшаются и симптомы обструкции или аритмии,
связанные с ней, а симптомы ВПС сохраняются.
Клиническая симптоматика. В период внутриутробной жизни воз-
можно развитие сердечной недостаточности вследствие аритмии или
обструкции полостей сердца, с последующей водянкой плода и смер-
тью. Однако точная частота осложненного или благоприятного тече-
ния неизвестна. После рождения симптоматика определяется разме-
ром опухоли, ее множественностью, степенью выбухания в полости
сердца и сосудов, обструкцией клапанов. В большинстве случаев раб-
домиома протекает практически бессимптомно и регрессирует с воз-
растом. У детей первого года жизни клинические проявления могут
симулировать врожденный порок сердца - различной интенсивности
и локализации шумы в сердце, застойная сердечная недостаточность,
кардиомегалия, аритмия, внезапная смерть. При локализации опухоли
в области атриовентрикулярного кольца характерен синдром преэкс-
цитации. Известен феномен исчезновения аритмии по мере уменьше-
ния опухоли.
Мнение по поводу прогноза при рабдомиоме менялось с развити-
ем неонатальной кардиологии. В восьмидесятые годы считали, что до
80% больных погибнет в грудном возрасте [14]. Однако оказалось, что
это справедливо только для симптоматичных новообразований, т.е. за-
ведомо требующих хирургического вмешательства. С появлением ран-
ней ультразвуковой диагностики и возможности проследить судьбу
большего количества опухолей стало ясно, что около 73% из них не
вызывают каких-либо серьезных нарушений гемодинамики и в боль-
шинстве своем («50%) подвергаются спонтанной регрессии [10, 15].
Наиболее высока вероятность полного исчезновения при небольших
306
размерах рабдомиомы. Средний возраст, до которого происходит про-
цесс апоптоза, составляет 7,3±3,0 года. Механизм этого явления оста-
ется неясным, хотя высказываются предположения о его гормональ-
ной зависимости. Известно, например, что рабдомиома растет особен-
но быстро в период от 22 до 32 недель беременности, затем рост значи-
тельно замедляется. Кроме того, отмечены факты роста опухоли у паци-
ентов, которым назначали кортикотропин для лечения инфантильных
спазмов.
В отличие от рабдомиомы сердца, регрессия туберозных узлов в
головном мозге не описана. Однако именно поражения головного моз-
га и почек определяют обычно прогноз заболевания. Средняя продол-
жительность жизни при туберозном склерозе составляет около 25 лет.
Оперативное вмешательство показано только у больных, имею-
щих симптомы обструкции притока или оттока в желудочках, которые
вызывают сердечную недостаточность, артериальную гипоксемию или
упорные нарушения ритма. Учитывая доброкачественную природу раб-
домиомы и тенденцию к ее регрессии, возможно не полное удаление
опухоли, а частичная резекция, направленная на восстановление нор-
мальной гемодинамики в полостях сердца.
Фиброма
Фиброма - вторая по частоте опухоль у детей (19% случаев). Ино-
гда фигурирует под названием «фиброматоз сердца». Представляет доб-
рокачественное солитарное образование фибробластного происхожде-
ния, плотное, беловатое, с четкими краями (макроскопически); однако
при микроскопии определяются диффузная или «пальцеобразная» ин-
фильтрация в нормальный миокард. Состоит из соединительной тка-
ни, в центральной части - из практически бесклеточного коллагена и
эластина, к периферии - имеет более явную «клеточность», нередко с
митотической активностью. Количество клеток уменьшается с возрас-
том. Локализуется чаще в свободной стенке левого желудочка или меж-
желудочковой перегородке, реже - в правом желудочке или предсер-
диях. Возможны центральный некроз, кальцификация и кистозная де-
генерация.
Клиническая симптоматика зависит от положения и размеров опу-
холи. Средний возраст диагностики 13 лет (от 1 дня до 56 лет), более
1/3 приходится на первый год жизни. Симптомы неспецифические, как
и при других опухолях, - шум, кардиомегалия, сердечная недостаточ-
ность, цианоз, боли в сердце, внезапная смерть. Наиболее характерно
возникновение аритмий (чаще - желудочковой тахикардии). Фиброма,
распространяясь по стенке желудочка, может приводить к обструкции
307
притока через атриовентрикулярные клапаны или оттока в магистраль-
ные сосуды. У новорожденных это может проявляться симптомами циа-
нотического ВПС, так как возникает право-левый сброс на уровне
овального окна. С другой стороны, опухоль может достигать весьма
больших размеров до появления первых клинических проявлений; опи-
саны и случаи значительного роста без существенных нарушений ге-
модинамики [16]. Истинная частота бессимптомного течения неизвест-
на по понятным причинам. Хотя фиброма растет в пределах миокарда,
в некоторых случаях она может сдавливать проксимальный сегмент
коронарной артерии, что дает соответствующую клиническую симпто-
матику и препятствует полному удалению новообразования. Опухоль
может входить в состав синдрома Gorlin (nevoid basal cell carcinoma),
однако частота данного сочетания составляет не более 4% [17].
Оперативное вмешательство, как правило, неизбежно, так как в
отличие от рабдомиомы, надеяться на спонтанный регресс фибромы
не приходится. Операцию выполняют при возникновении признаков
обструкции кровотоку, чтобы восстановить нормальную гемодинами-
ку в полостях сердца. Учитывая диффузное внедрение опухоли в здо-
ровый миокард, не всегда возможна ее полная экстирпация, особенно
при локализации в области МЖП. Однако в связи с доброкачествен-
ной природой фибромы и ее медленным ростом, частичная резекция
вместо полного удаления опухоли также дает неплохие отдаленные ре-
зультаты. В случаях массивной опухоли, обтурирующей правый желу-
дочек, возможно выполнение операции бинаправленного кавопульмо-
нального шунтирования. При аналогичной обструкции левого желу-
дочка показана трансплантация сердца [3].
Прочие опухоли сердца
Другие опухоли сердца встречаются у детей значительно реже. В
связи с этим их эпидемиология, прогноз и результаты лечения изучены
слабо. Мы приводим лишь основные характеристики некоторых из них.
Тератома (-3,3%). Традиционно располагается в перикарде, со-
держит ткани, чужеродные месту, откуда исходит. Обычно кистозной
природы, состоит из множественных эмбриональных тканевых дери-
ватов (чаще - эктодермальных), кальцификатов. Может иметь злокаче-
ственное течение с агрессивной локальной инвазией. В этом случае
обычно распространяется в средостение, имеет явные гистологические
признаки злокачественности.
Гемангиома (-3,9%) - опухоль, состоящая из сосудистых образо-
ваний, микроскопически представленных капиллярными и каверноз-
308
ними структурами. Локализуется в желудочках или предсердиях, пре-
имущественно эпикардиально, что может приводить к гемоперикарду.
При интрамуральном варианте дает симптомы сердечной недостаточ-
ности, атриовентрикулярного блока или клапанной обструкции. Чаще
встречается локальное поражение сердца, однако возможен и ангио-
матоз, захватывающий значительные зоны сердечной мышцы. Как пра-
вило, имеет небольшой потенциал роста; описаны и случаи спонтан-
ной инволюции [18].
Мезотелиома атриовентрикулярного узла (опухоль клеток
Пуркинье) (3,9%) - маленькая поликистозная опухоль, классически
локализующаяся в области АВ-узла и распространяющаяся из межпред-
сердной перегородки вдоль ножки пучка Гиса. Типичные проявления
- нарушения проводимости и ритма.
Миксома (3,9%) - опухоль, исходящая из примитивных мезенхи-
мальных клеток. Хорошо дифференцируется; прикрепляется широким
основанием или ножкой к эндокарду и распространяется в полости серд-
ца. В 75% случаев исходит из области овальной ямки, располагаясь в
левом предсердии. В большинстве остальных случаев находится в пра-
вом предсердии. Описаны редкие варианты локализации опухоли в же-
лудочке, на клапанах или хордах. Множественные миксомы встреча-
ются при миксомном синдроме. Имеет желатиноподобную консистен-
цию, небольшие кисты. Вероятно тромбообразование на ее поверхно-
сти. В связи с этим, помимо общих для опухолей симптомов, возмож-
ны материальные периферические эмболии. У 5% пациентов заболе-
вание носит семейный характер. Аутосомно-доминантное заболевание
(генетически гетерогенное) - Carney complex - включает множествен-
ные миксомы сердца и опухоли других локализаций (фиброаденома
груди, миксомы кожи), эндокринную дисфункцию (пигментное узло-
вое адренокортикальное заболевание), кожные заболевания (множест-
венный лентигеноз - веснушчатость, голубые пигментные пятна). Для
данного синдрома характерны рецидивирующие миксомы в различных
зонах и летальность около 50%.
Липома (1,1%) - опухоль, состоящая из жировой ткани, заклю-
ченной в капсулу. Может локализоваться в любом отделе сердца. Кро-
ме того, выделяют липоматозную гипертрофию межпредсердной пе-
регородки (не инкапсулированную). Оба варианта могут сопровождать-
ся нарушениями ритма или обструкцией камер сердца.
309
Литература
1. Fyler D.C. Report of New England Regional Infant Cardiac Programm // Pediat-
rics.-1980.-Vol. 65.-№2.-Part 2.- Suppl.
2. Nadas A. S., Ellison R.C. Cardiac tumors in infancy//Am. J. Cardiol.- 1968.- Vol. 21.-
P. 363-366.
3. Freedom R.M., Lee K.-J., MacDonald C, Taylor G. Selected aspects of cardiac
tumors in infancy and childhood // Pediatr. Cardiol.- 2000.- Vol. 21.- P. 299-316.
4. Saillee D., Spector M.L., van Heeckeren D. W., Patel C.R. Primary pediatric cardiac
tumors: A 17 year experience // Cardiol Young.- 1999.- Vol. 9.- P. 155-162.
5. Becker A.E. Primary heart tumors in the pediatric age group: A review of salient
pathologic features relevant for clinicians // Pediatr. Cardiol.- 2000.- Vol. 21.-
P. 317-323.
6. Mehta S.M., Myers J.L. Congenital heart surgery nomencklature and database pro-
ject: Cardiac tumors // Ann. Thor. Surg.- 2000.- Vol. 69.- P. S358-368.
7. Kiaffas M.G., Powell A.J., Geva T. MRI evaluation of cardiac tumor characteristics
in infants and children // J. Amer. Coll. Cardiol.- 2002,- Vol. 39.- № 5.- Suppl. A.-
P. 411A.
8. Beghetti M., Gow R.M., Haney I. et al. Pediatric primary benign cardiac tumors: A
15-year review//Am. Heart J.- 1977.-Vol. 134.-P. 1107-1114.
9. MacAlister H.A.Jr, Fenoglio J.J.Jr. Tumors of the cardiovascular system // Atlas of
tumor pathology. 2nd ser. Fascicle 15. Armed Forces Institute of pathology. - Wash-
ington, 1978.
10. Holley D.G., Martin G.R., Brenner J.L et al. Diagnosis and management of fetal
cardiac tumors: A multicenter experience and review of published reports // J. Am.
Coll. Cardiol.- 1995.- Vol. 26.- P. 516-520.
11. Eirich C, Longo S, Palmgren M. et al. Unusual sonographic appearance of a large
fetal cardiac rhabdomyoma // J. Ultrasound Med.- 2002.- Vol. 21.- P. 681-685.
12. Coates T.L., McGahan J.P. Fetal cardiac rhabdomyomas presenting as diffuse myo-
cardial thickening // J. Ultrasound Med.- 1994.- Vol. 13.- P. 813-816.
13. Jiang Z. Y., Pircova A., Sekarski N. et al. Transposition of the great arteries, pulmo-
nary atresia, and multiple ventricular septal defects associated with multiple cardiac
rhabdomyomas in case of tuberous sclerosis // Pediatr. Cardiol.- 2000.- Vol. 21.-
P. 165-169.
14. Сото A., de Simone G., Catena G., Marcelletti C. Cardiac rhabdomyoma: surgical
treatment in the neonate // J. Thorac. Cardiovasc. Surg.- 1984.- Vol. 87.- P. 725-731.
15. Smythe J.F., Dyck J.D., Smallhorn J.F., Freedom R.M. Natural history of cardiac
rhabdomyoma in infancy and childhood // Am. J. Cardiol.- 1990.- Vol. 66.-
P. г 1247-1249.
16. Tahernia A.S., Ricker J. T, Ott D.A. Intracardiac fibroma in an asymptomatic infant
// Clin. Card.- 1990.- Vol. 13.- P. 506-512.
17. Burke A.P, Rosado-de-Christenson M., Templeton P.A. et al. Cardiac fibroma: Clini-
copathologic correlates and surgical treatment // J. Thorac. Cardiovasc. Surg.- 194.-
Vol. 108.- P. 862-870.
18. Palmer T.E., Tresch D.D., Bonchek L.I. Spontaneous resolution of a large, cavern-
ous hemangioma of the heart // Am. J. Cardiol.- 1986.- Vol. 58.- P. 184-185.
310
Глава 20. ИНТЕРВЕНЦИОННЫЕ ПРОЦЕДУРЫ
ПРИ ВРОЖДЕННЫХ ПОРОКАХ СЕРДЦА
И СОСУДОВ
20.1. Общие положения
Большинство врожденных пороков сердца имеют комбинацию от-
верстий между камерами сердца, сужение жизненно важных сосудов
или клапанов. Хирургические вмешательства, при которых данные де-
фекты исправляют под контролем зрения, в опытных руках сопровож-
даются риском около 5,1-7,0%, а при сравнительно простых пороках -
в среднем 4,0% [1, 2]. Однако сами по себе торакотомия, длительная
искусственная вентиляция легких, искусственное кровообращение мо-
гут приводить к определенным осложнениям. В связи с этим достаточ-
но заманчиво было бы исправлять патологию сердца и сосудов, не при-
бегая к «большим» операциям. Примером наиболее простой методики
такого рода является использование катетера с раздувающимся балло-
ном на конце, который проводят через периферические сосуды к месту
патологического сужения. Корни интервенционной кардиологии ухо-
дят в 50-60-е годы, когда впервые в клинической практике были вы-
полнены без торакотомии легочная вальвулопластика и атриосептосто-
мия [3, 4]. Однако прогресс в этой области долго сдерживался невоз-
можностью экспериментальных исследований. Как известно, создание
аналогов врожденных пороков сердца (например, клапанного стеноза
или септального дефекта) у животных - достаточно трудная задача. И
если физиологическая модель порока еще достижима, создать анало-
гичный анатомический субстрат практически невозможно. Более дос-
тупной оказалась модель суженного крупного сосуда. Так удалось по-
лучить данные о «поведении» аорты и легочной артерии в ответ на их
растяжение баллоном [5, 6]. В результате стало ясно, что успешная ди-
латация неатеросклеротического поражения возможна только при ус-
ловии разрыва внутреннего и среднего слоев сосуда баллоном доста-
точно большого диаметра. В данной зоне возникает кровоизлияние, а
к концу 2-го месяца у животных формируется периадвентициальная
рубцовая ткань; соответственно, в течение этого срока велика опас-
ность формирования аневризмы сосуда. Полученные данные сформи-
ровали представления о должном диаметре применяемых баллонов [7],
давлении в них и показаниях к процедурам.
Последующие технические разработки были направлены на со-
вершенствование баллонов и создание стентов, имплантируемых в про-
свет сосудов [8, 9], которые сохраняют сосуд в растянутом состоянии
311
после удаления баллона. Такие конструкции способны эндотелизиро-
ваться, что снижает опасность тромбообразования. Однако в малых
сосудах избыточная пролиферация интимы может привести к умень-
шению просвета и необходимости повторной дилатации. В последние
годы разрабатывают стенты, которые рассасываются с течением вре-
мени или дозированно выделяют лекарственные препараты (например,
гепарин). Интерес представляют также конструкции, содержащие ис-
кусственный биоклапан для чрессосудистого введения в просвет кон-
дуита (в легочной позиции) [10].
Другое направление относится к разработке устройств, предназна-
ченных для закрытия патологических сообщений между сосудами или
камерами сердца. В этой области разработаны специальные кониче-
ские спирали (Gianturco) и септальные окклюдеры (Amplatzer, Sideris).
Таким образом, целью интервенционных процедур является лече-
ние сердечных и сосудистых дефектов с помощью специальных кате-
теров и/или приспособлений, которые доставляются с помощью кате-
теров. Основные вмешательства включают дилатацию стенозирован-
ных клапанов или сосудов, создание межпредсердного сообщения, а
также окклюзии аномальных сообщений. Спектр этих процедур мень-
ше, чем традиционных хирургических вмешательств, но эффективность
при определенных пороках вполне сопоставима.
Преимущества катетерных процедур очевидны: они не требуют
глубокой анестезии и торакотомии, менее травматичны и болезненны,
дешевле, имеют более короткий послеоперационный период. Однако
и они могут вызывать определенные специфические осложнения - эм-
болии, перфорации сердца или сосудов, тромбоз. Кроме того, интер-
венционные процедуры требуют большего времени, чем диагностиче-
ская катетеризация сердца, в связи с чем увеличивается доза облуче-
ния. А, как указывают Modan В. с соавт. [11], даже обычная катетери-
зация повышает риск раковых заболеваний. Так, среди 674 детей, вклю-
ченных в их исследование, средняя частота злокачественной патоло-
гии была в 2,3 раза выше ожидаемой, а меланом и лимфом - в 5-6 раз.
Возможно, что данную опасность можно уменьшить с помощью более
широкого использования чреспищеводной или трансторакальной эхо-
кардиографии, уменьшающей время радиационного контроля за про-
цедурой [12, 13].
В настоящее время некоторые вмешательства, требующие относи-
тельно простых катетеров и легко выполнимые (процедура Рашкинда,
баллонная вальвулопластика легочного стеноза), стали фактически ру-
тинными в большинстве кардиоцентров. На другом конце спектра на-
312
ходится процедуры, для которых используют сложные конструкции и
выполняемые хорошо обученными операторами только в специализи-
рованных лабораториях.
Эндоваскулярные вмешательства применяются как самостоятель-
ный метод лечения, а также в качестве вспомогательного пособия при
подготовке больных к сложным многоэтапным операциям или непо-
средственно во время операции. Кроме того, к ним прибегают после
операций для закрытия дозированных фенестраций или ликвидации
остаточных сбросов и стенозов.
20.2. Частные процедуры
Закрытая септостомия и дилатация
межпредсердного сообщения
Создание широкого межпредсердного сообщения применяется наи-
более часто при транспозиции магистральных артерий и направлено
на улучшение смешивания оксигенированной и неоксигенированной
крови. Другая задача возникает при атрезии легочной артерии с ин-
тактной межжелудочковой перегородкой или трикуспидальной атре-
зии. У этих больных межпредсердное сообщение увеличивают с це-
лью декомпрессии правого предсердия и беспрепятственного перето-
ка крови в левое предсердие. Следует отметить, что попытки анало-
гичной декомпрессии левого предсердия (при митральной атрезии)
опасны резким возрастанием легочного кровотока, ухудшением состоя-
ния и даже смертью больного.
Относительно немногочисленной группой являются пациенты по-
сле операции Фонтена (имеющие хронически повышенное системное
венозное давление) или больные с необратимой высокой легочной ги-
пертензией. В этих случаях создание дозированного межпредсердного
сообщения приводит к разгрузке правого предсердия и повышению
сердечного выброса, однако сохраняется артериальная гипоксемия.
Существуют три основные методики: 1) разрыв межпредсердной
перегородки с помощью тракций раздутым баллоном (процедура Раш-
кинда [4, 12]); 2) ножевая атриосептостомия (процедура Парка [14]);
3) дилатация отверстия баллоном высокого давления [15, 16]. Послед-
ние два способа применяют при высокой ригидности межпредсердной
перегородки (обычно у пациентов старше 1 месяца). У больных с ин-
тактной межпредсердной перегородкой предварительно создают отвер-
стие специальной иглой или с помощью других технологий (радиочас-
тотная или лазерная перфорация перегородки).
313
Риск вмешательства колеблется в зависимости от анатомии поро-
ка и используемой методики. При рутинных процедурах он не превы-
шает нескольких долей процента.
Баллонная вальвулопластика
Клапанный и инфундибулярный легочный стеноз
Баллонная вальвулопластика клапанного легочного стеноза в по-
следние годы стала основным способом лечения этого порока
(рис. 20-1).
Рис. 20-1. Баллонная дилатация легочного стеноза. Катетер проведен
через бедренную вену в легочную артерию. Видна перетяжка раздутого баллона в
проекции стенозированного легочного клапана.
Данная процедура особенно показана новорожденным с критиче-
ским стенозом, у которых традиционное оперативное вмешательство
сопряжено с высоким риском. Проведение баллонирования позволяет
существенно улучшить состояние больных, уменьшить трикуспидаль-
ную регургитацию, шунтирование крови справа налево на уровне пред-
сердий и артериальную гипоксемию. Известны успешные процедуры
у недоношенных детей с массой тела 800-1022 г [17, 18]. Однако и
осложнения возникают преимущественно в этой возрастной группе
(травма и перфорация миокарда, тромбоз вен, неадекватная дилата-
ция) [19, 20]. В более старшем возрасте показаниями к интервенцион-
314
ной процедуре являются гипертрофия правого желудочка и пиковая ско-
рость кровотока на клапане более 4 м/с. Одним из основных условий
успеха является правильный выбор диаметра баллона, который дол-
жен составлять не менее 120-140% от диаметра клапана [19, 21]. Хо-
рошим результатом можно считать достижение систолического гради-
ента давления между правым желудочком и легочной артерией менее
30 мм рт. ст. при минимальной регургитации. Однако следует заме-
тить, что регургитация, возникающая при разрыве легочного клапана,
как правило, небольшая и хорошо переносится. Важным преимущест-
вом баллонной процедуры является легкость повторного ее выполне-
ния - в случаях неудовлетворительного непосредственного результата
или нарастания стеноза в отдаленные сроки.
Противопоказанием к транслюминальной процедуре служит вы-
раженная дисплазия клапана с узким кольцом (например, при синдро-
ме Нунана). В этом случае необходима операция - пластическое рас-
ширение выхода из правого желудочка.
В то же время наличие инфундибулярного стеноза не является пря-
мым противопоказанием - транслюминальная баллонная процедура мо-
жет быть успешной и у некоторых детей с тетрадой Фалло [22, 23]. В
частности, данное вмешательство может быть оправданным у пациен-
тов, которым операция не показана из-за выраженной гипоплазии ле-
гочного артериального дерева. Лучших результатов можно ожидать,
если инфундибулярный стеноз имеет форму песочных часов, худший
- при тубулярной его форме. Механизм улучшения не совсем ясен; мож-
но предполагать, что возникают надрывы миокарда с последующим
рубцеванием. Эффективность процедуры выше, если она выполняется
в более раннем возрасте, а в последующем дополняется приемом
p-адреноблокаторов, релаксирующих миокард правого желудочка. В
качестве альтернативы хирургическому лечению рассматриваются так-
же возможности имплантации стентов в выводной отдел правого же-
лудочка, однако опыт таких вмешательств еще невелик [24].
Легочная атрезия
При тетраде Фалло с легочной атрезией методом выбора является
операция. Попытки создать сообщение между правым желудочком и
легочной артерией эндоваскулярным доступом опасны перфорацией
резко суженного выводного тракта. Более благоприятна ситуация при
атрезии легочной артерии с интактной межжелудочковой перегород-
кой I типа. В этом случае возможна перфорация клапана одним из су-
ществующих методов (иглой, лазерным или радиочастотным воздей-
ствием) с последующей баллонной дилатацией [25, 26]. При одновре-
315
менном поддержании проходимости артериального протока с помощью
простагландинов можно добиться удовлетворительного легочного кро-
вотока и избежать оперативного вмешательства. Однако подобные про-
цедуры редки, требуют хорошего оснащения и высокой квалификации
персонала.
Клапанный аортальный стеноз
Баллонная вальвулопластика клапанного аортального стеноза в на-
стоящее время изучается в качестве альтернативы хирургическому вме-
шательству (рис. 20-2).
Рис. 20-2. Баллонная дилатация аортального стеноза. Катетер проведен
через бедренную артерию в левый желудочек. Видна перетяжка на раздутом баллоне
в проекции стенозированного аортального клапана.
К сожалению, не существует рандомизированных серий исследо-
ваний, пригодных для качественного сравнительного анализа.
Предполагается, что обе методики вполне сопоставимы как по непо-
средственному снижению градиента давления, так и госпитальной или
отдаленной летальности. К 14 годам выживают 89% пациентов и 50%
из них не требуются хирургические вмешательства [27]. Обычно кате-
тер проводят ретроградно через бедренную артерию и аортальный кла-
пан. Однако известны доступы и через плечевую или сонную артерии.
У старших пациентов проблемой может быть изгнание баллона в аорту
во время сокращений сердца. В связи с этим используют специальные
316
спиральные катетеры, фиксирующиеся в выводном отделе желудочка
или введение аденозина, вызывающего кратковременную остановку
сердца на время раздувания баллона [7]. Рекомендуется использовать
баллон несколько меньшего диаметра, чем диаметр клапанного кольца,
так как в противном случае неизбежно возникает недостаточность кла-
пана.
Баллонная вальвулопластика в первую очередь показана у ново-
рожденных с дуктус-зависимым кровообращением вследствие крити-
ческого аортального стеноза. У старших детей показаниями служат гра-
диент систолического давления более 70 мм рт. ст., левожелудочковая
гипертрофия с нарушениями реполяризации на ЭКГ и плохая реакция
артериального давления на нагрузку. Так как у детей, в отличие от взрос-
лых, аортальный клапан редко кальцифицирован, он легче поддается
воздействию баллоном. Известны попытки дилатации подклапанного
или надклапанного аортального стеноза, однако малоэффективные.
Основные осложнения, которые сопровождают транслюминаль-
ную баллонную пластику аортального стеноза, - это повреждение ма-
гистральных артерий, возникновение аортальной недостаточности, пер-
форация сердца, эмболии. У маленьких детей особенно высок риск
окклюзионного поражения бедренных артерий (до 57%), а также час-
тота реинтервенций (75% vs. 20% среди пациентов младше и старше
3 мес) [28].
И эндоваскулярная процедура, и операция чреваты неполной эф-
фективностью и возникновением аортальной регургитации, в связи с
чем их необходимо рассматривать как паллиативные и быть готовым к
повторным вмешательствам.
Врожденные стенозы атриовентрикулярных клапанов
Врожденный митральный стеноз - редкая патология, проявляю-
щаяся различными анатомическими вариантами: утолщением створок
и их срастанием, укорочением и сращением хорд, надклапанной мем-
браной или парашютообразным подклапанным аппаратом. Баллонная
дилатация стеноза эффективна у -50% больных, преимущественно при
сращении комиссур и нормальном диаметре отверстия. К сожалению,
симптомы рестеноза могут появиться в течение нескольких месяцев
[29]. При успешном выполнении процедуры отмечают снижение диа-
столического градиента давления на клапане, уменьшение сердечной
недостаточности, давления в легочных сосудах. В некоторых наблюде-
ниях возникает небольшая митральная регургитация, однако повышен-
ная объемная нагрузка на левое предсердие и левый желудочек даже
благоприятна, так как ведет к увеличению полостей сердца и облегча-
ет последующее протезирование клапана.
317
Дилатация трикуспидального клапана относится к казуистическим
процедурам. Castaneda A. et al. [43] сообщили о трех больных с атре-
зией легочной артерии и интактной межжелудочковой перегородкой,
которым выполнили баллонную дилатацию трикуспидального клапа-
на. Вмешательство было эффективным в двух случаях.
Баллонная ангиопластика
Коарктация и рекоарктация аорты
Баллонную дилатацию аорты выполняют как при нативной коарк-
тации, так и для устранения рекоарктации в послеоперационном пе-
риоде (рис. 20-3). Эффективность процедуры в значительной мере свя-
зана с возрастом больных и степенью гипоплазии дуги аорты. У ново-
рожденных дилатация легче выполнима, однако последующая конст-
рикция дуктальной ткани, распространяющейся на стенку аорты, обу-
словливает высокий уровень ранних рестенозов - до 40-50% [30, 31].
Выполнение операции в этих случаях осложняется наличием размоз-
женных тканей в стенке аорты, а в качестве дополнительной пробле-
мы часто встречается окклюзионное поражение бедренной артерии,
через которую проводился катетер (из-за низкого артериального дав-
ления в травмированном сосуде).
Рис. 20-3. Баллонная дилатация коарктации аорты. А - аортография до
выполнения процедуры; Б - после процедуры. Наряду с улучшением проходимости
аорты, отмечаются деформации и неровности контуров сосуда.
Малая эффективность процедуры также может быть связана с ту-
булярной гипоплазией аорты, плохо поддающейся дилатации. Учиты-
318
вая низкую летальность при хирургическом устранении коарктации аор-
ты в современных условиях, следует считать первичную операцию все
же методом выбора при лечении маленьких детей.
В старшем возрасте и локальной форме коарктации результаты бал-
лонной дилатации более обнадеживающие. Однако возможно разви-
тие аневризм (до 20% в некоторых сериях) [7]. Это связано с разрывом
интимы и медиального слоя аорты во время дилатации. В связи с этим
большое значение приобретает правильный подбор диаметра балло-
на, который обычно не должен превышать диаметра аорты на уровне
диафрагмы [32]. Следует помнить также, что частичное устранение ко-
арктации аорты - неприемлемый вариант, так как это сопровождается
регрессом коллатералей и риском повреждения спинного мозга при по-
следующей операции.
Более широко применяется транслюминальная баллонная дилата-
ция у пациентов с рекоарктацией аорты. В этих случаях аорта окруже-
на фиброзной тканью, и риск формирования аневризмы снижается. Про-
тивопоказанием для процедуры может служить использование синте-
тического материала (заплаты) в стенке сосуда, так как растяжение аор-
ты в этом месте может привести к ее разрыву и смерти больного.
Отдельного внимания заслуживает применение стентов при ко-
арктации аорты. Их использование снижает риск развития аневриз-
мы аорты, однако возможны другие осложнения - миграция стента,
разрастание интимы в его просвете, кровотечение [33, 34]. Это дик-
тует необходимость тщательного наблюдения за пациентами с потен-
циальными повторными вмешательствами - хирургическими или
транслюминальными.
Стенозы ствола и ветвей легочной артерии
Данная патология наиболее часто сопровождает тетраду Фалло и
может встречаться как до, так и после операции. В последнем случае
это связано с рестрикцией заплаты или разрастанием вокруг нее руб-
цовой ткани. Ветви легочной артерии обладают высокой эластично-
стью, поэтому простая дилатация их сужений малоэффективна. Боль-
шинство исследователей прибегают к имплантации стентов. Стенози-
рующая пролиферация интимы в их просвете встречается сравнитель-
но редко, связана с чрезмерным раскрытием стента или расположени-
ем его оси под значительным углом к оси сосуда и легко поддается
повторной дилатации [7, 34].
Периферические легочные стенозы представляют все еще не ре-
шенную проблему. Их дилатация более трудна технически, а следстви-
319
ем может быть локальная гиперемия легочной доли и ее отек. К на-
стоящему времени нет рандомизированных данных, свидетельствую-
щих об улучшении выживаемости таких больных или значительном
облегчении их состояния в течение длительного времени.
В связи с широким распространением в последние годы анатоми-
ческой коррекции транспозиции магистральных артерий в поле зре-
ния кардиологов появились случаи послеоперационных стенозов ле-
гочного ствола. Баллонная дилатация или имплантация стента в этой
зоне обычно бывает затруднена близостью полулунного клапана или
бифуркации ствола. Таким образом, более рациональным остается опе-
ративное вмешательство.
Стенозы кондуитов
Кондуиты между правым желудочком и легочным стволом под-
вергаются стенозированию, независимо от их происхождения. Извест-
ны успешные попытки дилатации таких кондуитов и имплантации в
их просвет стентов, в том числе клапанно-содержащих [10, 35, 36]. Од-
нако необходимо накопление большого количества наблюдений для
окончательных выводов об эффективности и безопасности подобных
вмешательств.
Артериальный проток, коллатерали,
межартериальные анастомозы
Относительно малоизученной проблемой является поддержание
проходимости сосудов, соединяющих большой и малый круги крово-
обращения. Попытки дилатации артериального протока и импланта-
ции в него стента предпринимались для пролонгированного поддер-
жания легочного или системного кровообращения [37, 38]. Однако при
дуктус-зависимом легочном кровотоке проток обычно тонкий и изви-
той, что значительно затрудняет его стентирование, и наложение меж-
артериального анастомоза оказывается предпочтительнее. А имплан-
тация стента у больных с синдромом гипоплазии левого сердца, к со-
жалению, не предотвращает прогрессирования сердечной недостаточ-
ности, и поэтому более оправданной выглядит операция Норвуда. Та-
ким образом, вмешательства на артериальном протоке выглядят мало-
целесообразными.
Более эффективна баллонная дилатация хирургически созданного
классического анастомоза Блелока-Тауссиг [39]. В данном случае оп-
равданно и использование стента. В то же время анастомоз, выполнен-
ный с помощью протеза, малопригоден для интервенционной проце-
дуры. В этом случае возможно расширение только проксимального или
дистального концов протеза, суженных в процессе операции. Тромби-
320
рованный протез можно реканализировать проводником, фибринолити-
ческой терапией и баллонной дилатацией. Однако существует опасность
легочной тромбоэмболии или отрыва протеза во время процедуры.
При некоторых сложных ВПС с атрезией легочной артерии крово-
обращение в легких поддерживается за счет коллатеральных сосудов,
которые со временем подвергаются стенозированию. Так как в боль-
шинстве случаев имеется диффузное сужение сосуда, а не локальное,
эффективность дилатации обычно невысока. Нередко стенка этих кол-
латералей настолько утолщается, что не поддается воздействию даже
баллона высокого давления. Использование стентов у данных пациен-
тов приносит некоторое улучшение, однако продолжительность эффек-
та неизвестна [40].
Окклюзионные процедуры
Открытый артериальный проток
Хирургическое закрытие артериального протока у недоношенных
и грудных детей остается доминирующей процедурой. Однако у более
старших пациентов все чаще используется транскатетерная эмболиза-
ция протока (рис. 20-4) [39].
Рис. 20-4. Аортография до (А) и после (Б) эмболизации открытого
артериального протока. После процедуры сброс контрастированной крови в
легочную артерию не определяется.
При небольших протоках, до 3 мм в диаметре, применяют специ-
альные спиральные эмболы (Gianturco), при более крупных - зонтико-
образные (Rashkind) или грибообразные (Amplatzer) окклюдеры. Дос-
тавить окклюзирующее устройство в проток удается в 96-100% случа-
ев. В раннем послеоперационном периоде примерно у 30% пациентов
321
можно выявить резидуальный шунт через проток, как правило, без
аускультативной симптоматики. Такой шунт исчезает в пределах 3 ме-
сяцев, по мере продолжающегося тромбирования просвета протока.
Однако в некоторых случаях необходима повторная эмболизация из-за
персистирующего сброса, особенно сопровождающегося гемолизОхМ
[41]. Среди других осложнений основным является миграция спирали.
В этих случаях требуется ее извлечение с помощью специальной ло-
вушки.
Коронарные фистулы и коллатеральные сосуды
Врожденные коронарно-сердечные фистулы представляют собой
сообщение между коронарной артерией и одной из камер сердца. В
большинстве наблюдений в процесс вовлечены правая коронарная ар-
терия и правые отделы сердца. При больших фистулах возникает объ-
емная перегрузка сердца, а также недостаточное поступление крови в
дистальные отделы коронарного бассейна. В настоящее время счита-
ется, что при постановке диагноза коронарной фистулы и планирова-
нии лечения спиральная эмболизация должна рассматриваться как ме-
тод выбора [41]. Оптимальный результат может быть получен при рез-
ко расширенных коронарном устье и коронарной артерии, стенозе фис-
тулы, дистальном расположении дренажного отверстия. Для полной
окклюзии используют имплантацию нескольких спиралей. Среди воз-
можных осложнений встречаются миграция спирали, перфорация ис-
тонченной стенки сосуда.
Аномальные сосуды, отходящие от грудной аорты к легким, обыч-
но сопровождают цианотические пороки сердца со сниженным легоч-
ным кровотоком. В ряде случаев они могут создавать проблемы в до- и
послеоперационном периоде, а также непосредственно во время опе-
рации, увеличивая венозный возврат в левые отделы сердца, конкури-
руя с эффективными источниками кровотока в легких, снижая систем-
ную перфузию и осложняя операцию. У больных с затрудненным ле-
гочным кровотоком (например, после операции Фонтена) или с лево-
желудочковой недостаточностью даже небольшие коллатеральные ар-
терии могут вызывать ощутимые расстройства гемодинамики. Нали-
чие подобных проблем является показанием для катетерной эмболиза-
ции аортолегочных коллатералей. Наиболее пригодными сегментами
для процедуры являются прямые участки сосуда с дистальными стено-
зами, препятствующими миграции спирали в легкое. Не подлежат за-
крытию: 1) большие коллатерали, закрытие которых приведет к сни-
жению насыщения крови кислородом ниже 70%; 2) коллатерали, кото-
322
рые являются единственным источником кровоснабжения крупных сег-
ментов легких; 3) коллатерали, которые доступны интраоперационно
и будут использованы для унифокализации легочных сосудов [41, 42].
Наиболее частыми проблемами после процедуры являются сме-
щение спирали или местные реакции в виде ателектаза, или плевраль-
ного выпота.
Внутрилегочные артериовенозные сообщения - редкая патология,
встречающаяся при синдроме Rendu-Osler-Weber или после анасто-
моза Гленна. Эмболизацию аномальных сосудов выполняют по стан-
дартной методике.
Дефект межпредсердной перегородки
Попытки транскатетерного закрытия ДМПП выполняли еще в кон-
це 70-х годов. С тех пор разработано несколько устройств, применяв-
шихся с различной степенью успеха. Основными требованиями к сис-
теме являются легкость имплантации, возможность репозиции или уда-
ления устройства при неточном расположении, маленький размер дос-
тавляющей системы. В настоящее время одной из наиболее распро-
страненных и удачных является система «Amplatzer Septal Occluder»
(США), состоящая из двух дисков, соединенных между собой объем-
ной (стентоподобной) перемычкой толщиной 4 мм; диаметр ее соот-
ветствует закрываемому дефекту. Диск со стороны левого предсердия
имеет несколько больший размер и превышает диаметр перемычки на
12-14 мм, а правый - на 8-10 мм. Конструкция изготовлена из нити-
ноловых (никель и титан) нитей и заполнена дакроновой тканью для
усиления процесса тромбообразования [43, 44].
Показаниями для процедуры служит наличие шунта слева напра-
во с отношением кровотоков Qp:Qs > 1,5:1,0 или наличие парадоксаль-
ных эмболий через дефект (функционирующее овальное окно). Для
закрытия пригодны вторичные дефекты межпредсердной перегородки
или созданные хирургическим путем фенестрации (как при операции
Фонтена) диаметром до 40 мм, имеющие расстояние 4 мм и более от
краев дефекта до ближайших структур (устье легочной вены, коронар-
ный синус, атриовентрикулярные клапаны). Возможно также закры-
тие перфорированной аневризмы межпредсердной перегородки [45].
Во время катетеризации сердца, выполняемой под общей анесте-
зией, исключают аномальный дренаж легочных вен. Затем с помощью
специальных баллонов точно измеряют диаметр ДМПП и подходящий
окклюдер в сложенном состоянии проводят в полость левого предсер-
дия, где раскрывают «левый» диск. После прижатия окклюдера к меж-
323
предсердной перегородке раскрывают перемычку и «правый» диск.
Контроль за процедурой осуществляют с помощью транспищеводной
эхокардиографии и флюороскопии (рис. 20-5 на цветной вкладке).
Дефект окончательно закрывается в процессе тромбирования и эн-
дотелизации конструкции в пределах двух месяцев. Для равномерного
процесса тромбообразования назначают ингибиторы агрегации тромбо-
цитов - аспирин (на 6 мес) и клопидогрель на (1,5-3 мес). Возможны
осложнения процедуры в виде миграции конструкции (<1%), преходя-
щей аритмии, тромбоэмболии. У 3-7% пациентов не удается импланти-
ровать устройство по техническим причинам.
Дефект межжелудочковой перегородки
Для транс катетерного закрытия дефектов межжелудочковой пере-
городки используются конструкции, аналогичные окклюдерам ДМПП.
Вероятно, наиболее удачной является система Amplatzer [10]. Основ-
ным показанием для процедуры является наличие множественных мы-
шечных дефектов, когда операция технически трудна. Пригодны так-
же дефекты, открывающиеся в приточную часть правого желудочка.
Процедура противопоказана при подартериальных дефектах или де-
фектах, сочетающихся с аортальной недостаточностью [13].
Коррекция перимембранозных ДМЖП затруднена их близостью к
трикуспидальному и аортальному клапанам. Однако в последние годы
разработана специальная эксцентрическая конструкция, позволяющая
не травмировать аортальный клапан [46]. Это достигается тем, что ле-
вожелудочковый диск не имеет верхнего края, будучи смещен в сторо-
ну верхушки на 5 мм. Правожелудочковый диск всего на 4 мм шире
перемычки, толщина которой, в свою очередь, уменьшена до 1,5 мм.
Процедуру проводят под общей анестезией с транспищеводной
эхокардиографией и флюороскопическим контролем. Для доставки
устройства в зону дефекта используют доступ через яремную вену
или комбинированный трансвенозный и трансартериальный доступ.
Особое внимание уделяют тому, чтобы при раскрытии окклюдера не
повредить подклапанные структуры митрального и трикуспидально-
го клапанов, а также створки аортального клапана. Закрытие ДМЖП
- более сложная и трудоемкая процедура, чем окклюзия ДМПП. Опыт
подобных вмешательств невелик, однако первые результаты обнаде-
живающие.
Аналогичную технику используют для закрытия резидуальных
шунтов после операции, а также постинфарктных ДМЖП. Описан так-
же случай закрытия реканализированного дефекта аортолегочной пе-
регородки [39].
324
Как видно из приведенных данных, практически любые виды вро-
жденной патологии сердца и сосудов могут подвергаться транскате-
терной терапии. В некоторых случаях она носит паллиативный харак-
тер, однако в других приводит к полному излечению. Интервенцион-
ные вмешательства получают все большее распространение и смеща-
ются в сторону более раннего возраста. Например, в Соединенном Ко-
ролевстве за 1988 г. было выполнено лишь 337, а за 2000 г. - уже 1828
педиатрических процедур, в том числе 472 в период новорожденности
и первого года жизни. При этом летальность не превышала 0,6-2,0% в
зависимости от возраста [2, 47]. За тот же период времени (2000 г.)
операции проведены у 3666 детей (летальность 2,3%-6,9%). Таким об-
разом, интервенционные процедуры составили 33,3% всех вмеша-
тельств. Несомненно, что они уже стали важной частью кардиологи-
ческой помощи детям с врожденными пороками сердца.
Литература
1. Monro J.L., Alexiou С., Salmon А.Р., Keeton B.R. Reoperations and survival after
primary repair of congenital heart defects in children // J. Thorac. Cardiovasc. Surg.-
2003.- Vol. 126.- P. 511-520.
2. Gibbs J.L., Monro J.L., Cunningham D., Rickards A. Survival after surgery or thera-
peutic catheterization for congenital heart disease in children in United Kingdom:
Analysis of central cardiac audit database for 2000-1 // BMJ, doi: 10.1136/
bmj.38027.613403.F6 (24 February 2004).
3. Rubio-Alvarez V., Limon R.L., SoniJ. Valvulotomias intracardiacas por medio de un
cateter// Arch. Inst. Cardiol. Mexico.- 1953.- Vol. 23.- P. 183.
4. Rashkind W.J., Miller PEW. Creation of an atrial septal defect without thoracotomy:
A palliative approach to complete transposition of the great arteries // J AM A.-1966.-
Vol. 196.-P. 991-992 .
5. Lock J. E., Niemi B.A., Burke B.A. et al. Transcutaneous angioplasty of experimental
aortic coarctation // Circulation.- 1982.- 1982.- Vol. 66.- P. 1280.
6. Lock J.E., Niemi B.A., Einzig S. et al. Transvenous angioplasty of experimental
branch pulmonary artery stenosis in newborn lambs // Circulation.- 1981.- Vol. 64.-
P. 886.
7. Gibbs J. Interventional catheterization. Opening up I: The ventricular outflow tracts
and great arteries // Heart.- 2000.- Vol. 83.- P. 111-115.
8. Beekman R.H., Moller D. W., Lupipnetti F.M. et al. Balloon expandable stent repair
of experimental coarctation in dogs//Circulation.- 1991.-Vol. 84 (suppl. II).-P. 513.
9. Mullins C.E., О ’Laughlin M.P., Vick G. W.lll et al. Implantation of balloon expand-
able intravascular grafts by cateterization in pulmonary arteries and systemic veins //
Circulation.- 1988.- Vol. 77.- P. 188.
10. Walsh K.P. Interventional paediatric cardiology// BMJ.- 2003.- Vol. 327.- P. 385-388.
11. Modan B., Keinan L., Blumstein T, Sadetzki S. Cancer following cardiac catheteri-
zation in childhood // Int. J. Epidemiology.- 2000.- Vol. 29.- P. 424-428.
325
12. Шарыкин А. С., Иваницкий А.В., Андерсон А.Г. и др. Сравнительная характери-
стика закрытой атриосептостомии под ультразвуковым контролем и классиче-
ской процедуры Рашкинда при транспозиции магистральных артерий // Груд-
ная и серд.-сос. хир.- 2002.- №6.- С. 13-17.
13. Rigby M.L. Transoesophageal echocardiography during interventional cardiac cathe-
terization in congenital heart disease // Heart.- 2001.- Vol. 86 (Suppl II).- P. 1123-1129.
14. ParkS.C., Neches W.H., Mullins C.E. et al. Blade atrial septostomy: collaborative
study // Circulation.- 1982.- Vol. 66.- P. 258-266.
15. Thanopoulos B.D., Georgakopoulos D., Tsaousis G.S., Simeunovic S. Percutaneous
balloon dilatation of atrial septum: immediate and midterm results // Heart.- 1996.-
Vol. 76.- P. 502-506.
16. Алекян Б.Г, Гарибян В.А., Шарыкин А.С. и др. Транслюминальная баллонная
дилатация межпредсердной перегородки у новорожденных и грудных детей с
транспозицией магистральных сосудов, находящихся в критическом состоя-
нии // 4-я ежегод. сессия НЦССХ им. А.Н. Бакулева с Всеросс. конф, молодых
ученых.- М., 2000.- С. 96.
17. Hoyer М.Н. Balloon valvuloplasty for critical pulmonary valve stenosis in a prema-
ture infant // Pediatr. Cardiol.- 2001.- Vol. 22.- P. 519-522.
18. Hofbeck M., Singer H., Buheitel G., Ries M. Balloon valvuloplasty of critical pul-
monary valve stenosis in a premature neonate // Pediatr. Cardiol.- 1999.- Vol. 20.-
P. 147-149.
19. Ladusans E.J., Quereshi S.A., Parsons J. M. etal. Balloon dilatation of critical stenosis
of pulmonary valve in neonates // Br. Heart J.- 1990.- Vol. 63.- P. 362-367.
20. Ugurlu B., Oto Ц., bnal N., Akcoral A. Pseudoaneurysm of the right ventricular
outflow tract complicating balloon dilatation for tetralogy of Fallot // Pediatr. Car-
diol.- 2001.- Vol. 22.- P. 523-524.
21. Алекян Б.Г., Шарыкин А.С., Гарибян В.А. и др. Ближайшие и отдаленные ре-
зультаты эндоваскулярного лечения стеноза легочной артерии у новорожден-
ных и грудных детей // Грудная и серд.-сос. хир.- 1998.- №2.- С. 16-19.
22. Sluysmans Т, Neven В., Rubay J. et al. Early balloon dilatation of the pulmonary
valve in infants with tetralogy of Fallot: risks and benefits // Circulation.- 1995.-
Vol. 91.- P. 1506-1511.
23. Алекян Б.Г, Подзолков В.П., Зуфаров M.M. и соавт. Ближайшие и отдаленные
результаты эндоваскулярного лечения больных с комбинированным стенозом
легочной артерии // Грудная и серд.-сос. хир.- 1998.- № 1.- С. 59-64.
24. Gibbs J.L., Uzun О., Blackburn М.Е. et al. Right ventricular outflow stent implan-
tation: an alternative to palliative surgical relief of infundibular pulmonary stenosis
// Heart.- 1997.- Vol. 77.- P. 176-179.
25. Gibbs J. L., Blackburn M.E., Uzun O. etal. Laser valvotomy with balloon valvoplasty
for pulmonary atresia with intact ventricular septum: Five years’ experience // Heart.-
1997.-Vol. 77.- P. 225-228.
26. Алекян Б.Г, Гарибян В.А., Шарыкин А.С. и др. Успешная баллонная вальвуло-
пластика клапана легочной артерии у ребенка в возрасте 55 дней с «гемодина-
мической атрезией» легочной артерии и интактной межжелудочковой перего-
родкой // Грудная и серд.-сос. хир.- 1998,- №6,- С. 68-71.
27. Reich О., Тах Р, Marek J. et al. Long term results of percutaneous balloon val-
voplasty of congenital aortic stenosis: independent predictors of outcome // Heart.-
2004.- Vol. 90.- P. 70-76.
326
28. Balmer C., Beghetti M., Fasnacht M. et al. Balloon aortic valvoplasty in paediatric
patients: Progressive aortic regurgitation is common // Heart.- 2004.- Vol. 90.-
P. 77-81.
29. Spevak P.J., Ball J.L., Ben-Shachar G. et al. Balloon angioplasty for non rheumatic
mitral stenosis in children // Am. J. Cardiol.- 1990.- Vol. 66.- P. 472.
30. Park Y., Lucaaas V.W., Sklansky M.S. et al. Balloon angioplasty of native aortic
coarctation in infants 3 months ofage and younger//Am. Heart J.- 1997.-Vol. 134.-
P. 917-923.
31. Patel H. T, Madani A., Paris Y.M. et al. Balloon angioplasty of native coarctation of
the aorta in infants and neonates: is it worth the hassle? // Pediatr. Cardiol.- 2001.-
Vol. 22.- P. 53-57.
32. Данилов Е.Ю., Харпунов В.Ф., Шумилина M.B. и др. Баллонная ангиопластика
и стентирование при лечении больных с коарктацией и рекоарктацией аорты //
Бюлл. НЦССХ им. А.Н. Бакулева РАМН.- 2002.-№ 11.- С. 201.
33. Magee A. G., Brzezinska-Rajszys G., Qureshi S.A. et al. Stent implantation for aortic
coarctation and recoarctation // Heart.- 1999.- Vol. 82.- 600-606.
34. Duke C., Rosenthal E., Qureshi S.A. The efficacy and safety of stent redilatation in
congenital heart disease // Heart.- 2003.- Vol. 89.- P. 905-912.
35. Powell A.J., Lock J.E., Keane J.F. et al. Prolongation of RV-PA conduit life by
percutaneous stent implantation: intermediate term results H Circulation.- 1995.-
Vol. 92.- P. 3282-3288.
36. Hatai, Nykanen D.G., Williams W.G. et al. Endovascular stents in children under
1 year of age: acute impact and late results// Brit. Heart J.- 1995.- Vol. 74.-
P. 689-695.
37. Walsh K.P., Sreeram N., Franks R. et al. Balloon dilatation of the arterial duct in
congenital heart disease // Lancet.- 1992.- Vol. 339.- P. 331-332.
38. Gibbs J.L., Wren C, Watterson K.G. et al. Stenting of the arterial duct combined
with banding of the pulmonary arteries and atrial septectomy or septostomy: A new
approach to palliation for the hypoplastic left heart syndrome // Brit. Heart J.- 1993.-
Vol. 69.- P. 551-555.
39. Эндоваскулярная и минимально инвазивная хирургия сердца и сосудов у детей
/ Под ред. Л.А. Бокерия, Б.Г. Алекяна, В.П. Подзолкова.- М.: Изд-во НЦССХ
им. А.Н. Бакулева РАМН, 1999.
40. Redington A.N., Somerville J. Stenting of aortopulmonary collaterals in complex
pulmonary atresia // Circulation.- 1996.- Vol. 94.- P. 2479-2484.
41. Uzun O., Veldtman G.R., Dickinson D.F. et al. Haemolysis following implantation
of duct occlusion coils // Heart.- 1999.- Vol. 81.- P. 160-161.
42. Castaneda A. R., Jonas R.A., Mayer J. E., Hanley F.L. Cardiac surgery of the neonate
and infant. - W.B.Saunders Comp., Philadelphia, 1994.
43. Chan K.C., Godman M.J., Walsh K. et al. Transcatheter closure of atrial septal de-
fect and interatrial communications with a new self expanding nitinol double disc
device (Amplatzer septal occluder): Multicentrc UK experience // Heart.- 1999.-
VoL 82.- P. 300-306.
44. Fischer G., StiehJ., UebingA. et al. Experience with transcathetcr closure of secun-
dum atrial septal defects using the Amplatzer septal occluder: a single center study
in 236 consecutive patients // Heart.- 2003.- Vol. 89.- P. 199-204.
327
45. Ewert P., Berger F., Vogel M. et al. Morphology of perforated atrial septal aneurysm
suitable for closure by transcatheter device placement // Heart.- 2000.- Vol. 84.-
P. 327-331.
46. Thanopoulos B.D., Tsaousis G.S., Karanasios E. et al. Transcatheter closure of pe-
rimembranous ventricular septal defects with the Amplatzer asymmetric ventricular
septal defect occluder: Preliminary experience in children // Heart.- 2003.- Vol. 89.-
P. 918-922.
47. Hubner P.J.B. Cardiac interventional procedures in the United Kingdom dur-
ing 1988 // Br. Heart J.- 1990.- Vol. 64.- P. 36-37.
328
Глава 21. СОЧЕТАНИЕ ВРОЖДЕННЫХ ПОРОКОВ
СЕРДЦА С НАСЛЕДСТВЕННЫМИ
ЗАБОЛЕВАНИЯМИ
Врожденные пороки сердца могут быть представлены в изолиро-
ванной форме или являться составной частью комплекса множествен-
ных пороков развития (ВПР). В последних случаях возможно взаим-
ное влияние каждого из компонентов синдрома на состояние организ-
ма и тактику лечения.
21.1. Беременность и периоды опасности
Внутриутробное развитие зародыша проходит предэмбриональный
(первые 14-15 дней после оплодотворения), эмбриональный (первые
6-8 недель) и фетальный периоды.
На первой стадии (ее еще называют стадией бластогенеза) проис-
ходит дифференцировка клеток, формирование зародышевых листков
и внезародышевых органов. На это время приходится первый крити-
ческий период развития, для которого характерна повышенная чувст-
вительность к действию повреждающих факторов и ответная реакция
по принципу «все или ничего». Зародыш или погибает, или продолжа-
ет развиваться без формирования пороков. Частота гибели в первые 15
дней беременности исключительно высока и достигает 50% от числа
всех оплодотворенных яиц.
В течение эмбрионального периода происходит дальнейшая диф-
ференцировка клеток и тканей (гистогенез), закладка и формирование
органов. На это время, на 3-6 неделю беременности, приходится вто-
рой критический период - время максимальной ранимости зародыша.
Повреждения, которые называются эмбриопатиями, приводят к гибе-
ли эмбриона или врожденным порокам развития. Спонтанными абор-
тами в этот период заканчиваются более 10% зарегистрированных бе-
ременностей. Вклад генетических факторов в происхождение эмбрио-
патий составляет 60-64% [1].
После 6-8 недель беременности зародыш называют плодом. На
ранних стадиях плодного периода продолжают формироваться внут-
ренние органы, в частности, окончательно закрывается отверстие в меж-
желудочковой перегородке сердца, заканчивает формироваться лицо,
исчезают жаберные дуги, хвост, и плод принимает облик человека. К
10 неделе основное формирование органов заканчивается, и с этого
периода идет «дозревание тканей». Патологические проявления плод-
329
ного периода называют фетопатиями. В это время формируются вто-
ричные пороки, тканевые дисплазии, гипоплазии органов или плода в
целом. Возможно повреждение нормально развивавшихся органов в
связи с воспалительными изменениями. Вклад наследственных факто-
ров в патологию плодного периода значительно меньше, чем в патоло-
гию эмбрионального периода. Хромосомный дисбаланс у абортусов
плодного периода составляет всего 11-12%.
21.2. Причины нарушения развития плода
Причинами нарушения внутриутробного развития с формирова-
нием врожденных пороков в 14-17% случаев являются мутации еди-
ничных генов, в 9-10% случаев - хромосомные и геномные мутации
(хромосомные болезни), в 40-65% случаев - комплексное воздействие
наследственных и средовых факторов (мультифакториальная группа
ВПР), и 2-5% врожденных пороков определяются тератогенными фак-
торами [2].
Тератогенные факторы
К тератогенным факторам относят любую вредность, воздействие
которой на зародыш индуцирует ВПР. Тератогенный эффект у челове-
ка оказывают эндокринные заболевания (сахарный диабет), физиче-
ские факторы (ионизирующее облучение в дозе более 5 сГр за период
органогенеза), некоторые медикаменты (талидомид, диазепам, проти-
восудорожные средства, антигистаминные препараты), этиловый ал-
коголь, вирусы (краснухи, энтеровирусы, пикорновирусы группы Кок-
саки), протозойные инфекции (токсоплазмоз) [3, 4]. Тератогенный эф-
фект с развитием пороков сердца могут оказывать гипервитаминоз А и
дефицит цинка. Поражение сердца может возникнуть не только в ре-
зультате трансплацентарной передачи острого вирусного заболевания
во время беременности, но и от матери с персистентной вирусной ин-
фекцией. Тератогенный эффект зависит не столько от природы дейст-
вующего фактора, сколько от возраста зародыша и его генетической
предрасположенности.
Мутации единичных генов
23 хромосомы сперматозоида (гаплоидный набор), соединяясь с
23 хромосомами яйцеклетки, образуют зиготу с 23 парами хромосом
(диплоидный набор хромосом). Основу каждой хромосомы составля-
ет линейный полимер ДНК, участок которого, кодирующий синтез ка-
кой-либо макромолекулы, называется геном. Место локализации оп-
330
ределенного гена в определенной хромосоме называется генным локу-
сом. Для каждого гена, таким образом, существует аналог с той же ло-
кализацией во второй, гомологичной хромосоме данной пары. Такие
пары генов, кодирующие один и тот же признак, называют аллельны-
ми. Аллельные гены аналогичны, но не абсолютно одинаковы. Вари-
ант гена, который оказывает отрицательное влияние на организм, счи-
тается мутацией. Если мутантный ген один, то больной гетерозиготен
по отношению к данному гену, если оба аллельных гена мутантны -
гомозиготен. Если в гетерозиготном состоянии ген не проявляется, то
его называют рецессивным, а если проявляется - доминантным. Каж-
дый единичный мутантный ген проявляется по одному из четырех ти-
пов менделевского наследования: аутосомно-доминантному, аутосом-
но-рецессивному, Х-сцепленному доминантному и Х-сцепленному ре-
цессивному.
Термин «мультифакториальный тип наследования» отражает про-
цесс, при котором патология обусловлена действием одного или более
патологических генов и факторов окружающей среды. Число генов,
определяющих подобные состояния, неизвестно. Некоторые исследо-
ватели предполагают, что они относятся к «малым генам», каждый из
которых не злокачественен, но обладает кумулятивными свойствами.
На проявление данных генов оказывают влияние множество негенети-
ческих факторов, в основном условия внутриутробного развития пло-
да. Прежде чем порок развития отнести к заболеванию с мультифакто-
риальным типом наследования, необходимо исключить другие типы
наследования и собрать данные о большом количестве больных и их
семьях.
Моногенные синдромы идентифицируют при помощи многочис-
ленных монографий и каталогов, самый знаменитый из которых - «Мен-
делевский тип наследования у человека», впервые изданный
V. McKusik в 1966 г. и постоянно переиздаваемый.
Хромосомные синдромы
В основе хромосомных синдромов лежат хромосомные (видимые
в световой микроскоп) мутации и микроделеционные синдромы (син-
дромы «протяженного гена» - contiguous gene syndrome). Совокупность
количественных и качественных признаков хромосомного набора
называют кариотипом. Для избежания путаницы номенклатура описа-
ния кариотипа стандартизирована. Во-первых, записывают общее чис-
ло хромосом, во-вторых, набор половых хромосом, после чего следует
описание аберраций (повреждений). Хромосома состоит из двух плеч
331
и центромеры. Короткое плечо хромосомы обозначают буквой «р», а
длинное - «q». Любое увеличение хромосомного материала обознача-
ют знаком «+», а потерю - соответственно знаком «-». Хромосомы
делятся на метацентрические (равноплечие), субметацентрические (р
< q) и акроцентрические (р < q в несколько десятков раз).
Патология хромосом делится на 2 группы: количественные и струк-
турные перестройки.
Количественные перестройки', полиплоидия (увеличение количе-
ства всех хромосом, кратное гаплоидному набору, например, 46, 69,
92); сшеуплоидия (изменение в отдельно взятой паре хромосом, напри-
мер, трисомия, т.е. три гомологичные хромосомы вместо двух к моно-
сомия, т.е. отсутствие одной из гомологичных хромосом); полисомия
(изменение количества половых хромосом у гомо - или гетерогаметно-
го пола или изменение соотношения половых хромосом у гетерога-
метного пола, например: 47,XXX; 48,XYYY; 47,ХХУ и т.д).
Структурные перестройки меняют структуру отдельно взятой
хромосомы. В эту группу входят:
- транслокация^) - обмен сегментами между двумя негомологич-
ными хромосомами, известен как реципрокная, или сбалансированная,
транслокация. Лица с реципрокными транслокациями обычно фено-
типически нормальны, так как имеют полный набор генов;
- делеция (del) - безвозмездная утрата хромосомой части генети-
ческого материала. Например, 46,XY,del(5p) - утрата короткого плеча 5
хромосомы;
- дупликация (dup) - удвоение сегмента на одной из хромосом;
- инверсия (inv) - поворот участка хромосомы на 180 градусов;
- кольцевые хромосомы (г) - образуются, если оба конца хромосо-
мы отрываются, а концы центральных фрагментов соединяются, обра-
зуя хромосому с делецией как короткого, так и длинного плеча;
- изохромосома, или идентичноплечая (i) - образуется, если при
митозе образуются хромосомы, состоящие только из двух коротких или
двух длинных плеч.
К микроделеционным синдромам, выявление которых стало воз-
можным лишь с открытием молекулярно-генетических методов диаг-
ностики, относятся такие широко распространенные среди пациентов
с ВПС патологии, как синдромы группы CATCH 22, Вильямса, Смит-
Магенис, Прадера-Вилли, Миллера-Дикера.
332
21.3. Диагностика наследственных заболеваний
Лабораторные методы
Цитогенетическое исследование позволяет визуально распознать
дефект хромосомы. Для исследований обычно используют культуру
клеток лимфоцитов крови. При необходимости возможно получение
культур клеток амниотической жидкости. Выделенные хромосомы ок-
рашивают и исследуют в световом микроскопе.
Молекулярно-генетическая диагностика. В основе метода лежит
технология использования гибридизации нуклеиновых кислот in situ и
компьютерных систем для анализа хромосом. Применяется для точ-
ной диагностики нарушений на хромосомном уровне, в том числе мик-
роделеционных повреждений.
Флюоресцентная гибридизация in situ (FISH - Fluorescence in situ
hybridization) заключается в применении специально подготовленных
флюоресцирующих ДНК-проб для выявления генетических дефектов
при использовании флюоресцентной микроскопии. Для успешной ди-
агностики хромосомных синдромов необходимо располагать большой
коллекцией ДНК-зондов даже для выявления наиболее распространен-
ных хромосомных аберраций. Данные методы используются в настоя-
щее время на заключительном этапе анализа.
Клиническая диагностика
В клинической практике при первичном осмотре ребенка с ВПС
обязательна оценка малых аномалий развития. Практическая значи-
мость этих признаков заключается в диагностике трех аномалий и бо-
лее. Каждый новорожденный с ВПС и тремя малыми аномалиями раз-
вития имеет высокую вероятность (до 90%) диагностики синдромаль-
ной формы патологии. Синдром - этиологически определенное забо-
левание с плейотропным (множественным) эффектом.
Более 70% аномалий располагаются в области головы, шеи и кис-
тей рук. Для облегчения работы педиатров и кардиологов в поликли-
ническом отделении или в стационаре возможно использование диф-
ференциально-диагностических таблиц (табл. 21-1) [5].
21.4. Особенности пациентов с синдромальными
формами врожденных пороков сердца
Сопутствующая патология может иметь различное влияние на со-
стояние ребенка, нередко определяя прогноз более существенно, чем сам
ВПС. В ряде случаев необходимо корригировать специфические пато-
333
логические состояния параллельно лечению порока сердца. Для опре-
деления тяжести сопутствующей патологии нами предложена рабочая
классификация состояний, имеющих значение для ведения больного с
ВПС на до- и послеоперационном этапе [6]:
1) синдромы, практически не влияющие на естественное течение
ВПС;
2) синдромы, влияющие на анатомию и функцию сердечно-сосу-
дистой системы;
3) синдромы, влияющие на функцию других систем и органов;
4) потенциально летальные синдромы.
В табл. 21-2 приведены синдромы, наиболее часто встречающие-
ся в кардиологической клинике.
Конечно, представленная таблица не исчерпывает многообразия
синдромов, которые должны учитываться при лечении ВПС. Кроме то-
го, следует иметь в виду, что одна и та же наследственная патология
может проявляться различными нарушениями функций организма и
входить в различные группы. В этом случае следует ориентироваться
на наиболее прогностически значимую составляющую синдрома.
После установления генетического диагноза и определения потен-
циальной опасности синдрома, необходимо составить план обследо-
вания пациента для выявления характерных сопутствующих пороков
развития и разработать меры для предотвращения реализации возмож-
ных патологических состояний. Например, у пациентов с синдрома-
ми, приводящими к нарушениям гомеостаза, необходим мониторинг
указанных выше показателей при обследовании и подготовке к опера-
ции, а также во время послеоперационного выхаживания. При веде-
нии таких пациентов необходимо проводить профилактику возможных
нарушений (например, вводить препараты кальция в суточной дозе в
раннем послеоперационном периоде пациентам с синдромами группы
CATCH 22) до наступления необратимых последствий.
При определении показаний к операции на сердце у пациентов
четвертой группы необходимо коллегиальное решение генетиков, кли-
нических специалистов, кардиологов и родителей. Необходимо учи-
тывать, что множественные поражения других органов и систем обыч-
но приводят к смерти на первом году жизни и целесообразность кор-
рекции ВПС может быть сомнительной.
Одним из наиболее частых и важных синдромов, встречающихся
в кардиологической клинике, является CATCH 22. Мы считаем необ-
ходимым осветить его более подробно.
334
Таблица 21-1
Основные микроаномалии развития при синдромах,
ассоциированных с врожденными пороками сердца
Микроаномалии развития Возможные синдромы
Пропорционально низкий рост Корнелии де Ланге, фациокардиомелическая дисплазия летальная, Нунан, панцитопения Фанкони, Рубинштейна-Тейби, Смита-Лемли-Опитца, Вильямса, велокардиофациальный (Schprintzen), «кошачьего крика», Шершевского-Тернера, CHARGE, TAR, VATER
Макросомия Беквита-Видемана
Микроцефалия ДиДжорджа, Рубинштейна-Тейби, велокардиофациальный, фетальный алкогольный синдром, Смита-Лемли-Опитца, Беквита-Видемана, Эдвардса, Патау
Сниженное умственное развитие ДиДжорджа, Рубинштейна-Тейби, велокардиофациальный, фетальный алкогольный синдром, Смита-Лемли-Опитца, Беквита-Видемана, Эдвардса, Патау, CHARGE. Нунан, Дауна, «кошачьего крика», панцитопения Фанкони
Гипотония мышечная Велокардиофациальный, Нунан, Смита-Лемли-Опитца, Дауна
Гирсутизм Нунан, Рубинштейна-Тейби
Асимметрия лица Гольденхара, CHARGE
Дисплазия ушей Гольденхара, VATER
Деформированные низкие уши CATCH 22, Нунан, Гольденхара, фациокардиомелическая дисплазия, Дауна, Рубинштейна-Тейби, Корнелии де Ланге, Патау, Эдвардса, «кошачьего крика», Шсрешсвского-Тернера, CHARGE, Смита-Лемли- Опитца
Маленький нос с вывернутыми наружу ноздрями Вильямса, Корпепии де Ланге, Дауна, Смита-Лемли-Опитца
Широкая спинка носа Рубинштейна-Тейби, CATCH 22
Рот большой Гольденхара
Рот маленький Рубинштейна-Тейби, фациокардиомелическая дисплазия
Расщелина неба Гольденхара, CATCH 22, CHARGE, фетальный алкогольный синдром, Смита-Лемли-Опитца, VATER, Беквита-Видемана. Эдвардса, Патау
Гемангиома лица TAR, Нунан
Пороки радужки CATCH 22, Рубинштейна-Тейби, CHARGE, Марфана, Нунан, Гольденхара
Арахнодактилия Марфана
Брахидактилия Холт-Орама, Дауна
Отсутствие пальцев, олигодактилия Холт-Орама, фетальный алкогольный синдром, Смита Лсмли-Опитца
Полидактилия фетальный алкогольный синдром, VATER, панцитопения Фанкони, Смита- Лсмли-Опитца, Холта-Орама, Беквита-Видемана
Синдактилия Холт-Орама, CHARGE, TAR, VATER, Эдвардса
Гипо/аплазия лучевой кости Гольденхара, CHARGE, TAR, VATER, панцитопения Фанкони, Холт- Орама
Гипо/аплазия локтевой кости TAR, Холт-Орама
Интсркуррентные заболевания CATCH 22, панцитопения Фанкони, Смита-Лемли-Опитца
335
Таблица 21-2
Рабочая классификация синдромальной патологии,
сопутствующей врожденным порокам сердца
Тяжесть синдрома Зона влияния Название синдрома Возможные проблемы
1. Синдромы, практиче- ски не влияющие на ес- тественное течение ВПС - Семейная форма тетра- ды Фалло и аортально- го стеноза -
2. Синдромы, сопровож- дающиеся специфиче- скими нарушениями морфологии и функции сердсч но-сосудистой системы Функция миокарда Синдром врожденной краснухи, Нунан, Бек- вита-Видемана, диабе- тической фетопатии Дилатация или гипер- трофия миокарда
Артериальное давление Вильямса, Адамса Артериальная гипер- тензия, тахикардия
Состояние системных сосудов Марфана, Гольденхара, Беквита-Видемана, Тернера Расслаивающая анев- ризма аорты, аневриз- мы сосудов мозга, ано- малии вен
Состояние легочных сосудов Алажиля Периферические легоч- ные стенозы
Дауна Ускоренное развитие легочной гипертензии
Состояние проводящей системы сердца Холт-Орама, Ciuffo Атриовентрикулярная блокада(особенно при стрессе или наркозе)
3. Синдромы, сопровож- дающиеся изменениями морфологии и функции других органов и сис- тем Пороки развития ЦНС Беквита-Видемана, Элерса-Данлоса Припадки, аномалии ЭЭГ
Пороки развития почек Гольденхара, Ивемар- ка, Смита-Лемли- Опитца, CHARGE, CATCH 22, Вильямса, Нунан Пороки мочевыводя- щей системы, поликис- тоз и гидронефроз, опу- холи
Поражение иммунной системы CATCH 22, панцитопе- нии Фанкони, Смита- Лемли-Опитца, Рубин- штейна-Тейби А/гипоплазия тимуса, иммуннодефицит
Поражение системы го- меостаза Вильямса Гиперкальциемия
группа CATCH 22, Элерса-Данлоса Гипокальциемия
Ди Джорджа, диабети- ческой фетопатии Гипогликемия, анемия
Синдром врожденной краснухи, Нунан, пан- цитопении Фанкони Нарушения коагуляция крови, гемолиз, анемия
Аномалии трахеи и глотки Ди Джорджа, феталь- ный алкогольный син- дром Нарушения проходимо- сти трахеи и глотки
4. Потенциально леталь- ные синдромы - Эдвардса, Патау, Элли- са-Ван Кревельда, гид- ролетальный, фацио- кардиомелическая дис- плазия Смерть пациента
336
Группа синдромов CATCH 22
CATCH 22 является аббревиатурой латинских названий основных
симптомов заболевания: Cardiac defects, Abnormal facies, Thymic hy-
poplasia, Cleft palate, Hypocalcemia, deletion of chromosome 22. В эту
группу в 1993 г. были объединены известные ранее генетические син-
дромы (DiGeorge, велокардиофациальный (синдром Schprintzen), ко-
нотрункальных и лицевых аномалий) и «несиндромальные» случаи вро-
жденных пороков сердца, этиологическим фактором которых является
del22. В настоящее время они рассматриваются как формы одного за-
болевания. Данная патология является одной из самых частых хромо-
сомных анеусомий у человека (1 на 4000 живорожденных) и связана с
микроделецией района ql 1.2 хромосомы 22 (del22). В большинстве слу-
чаев del22 возникает в результате новой мутации, однако описаны и
семейные случаи с частотой от 6 до 28% [7]. Отмечается как межсе-
мейная, так и внутрисемейная вариабельность проявлений CATCH 22.
Пороки сердца. del22 является главной причиной возникновения
пороков конотрункуса, который формируется на 21-29 день гестации,
и дуги аорты. Так, при общем артериальном стволе аномалию хромо-
сомы находят в 30-40% случаев, а при редких его типах (III тип, или
общий артериальный ствол в сочетании со стенозом легочной арте-
рии) - практически в 100%. От 6 до 20% случаев тетрады Фалло -
результат del22, а при тетраде Фалло с атрезией легочной артерии час-
тота del22 составляет 55%. Перерыв дуги аорты вызывается del22 в
30-70% случаев (тип А в 30%, а тип В-в 70-80%). При ДМЖП деле-
ния выявляется в 15% случаев, при агенезии клапана легочной арте-
рии в 8-10%, при транспозиции магистральных артерий - в 13%.
Для CATCH 22 характерны правая дуга аорты (у 50% больных, в
то время как у детей с неуточненной этиологией ВПС эта аномалия
встречается в 16-18% случаев), большие аортолегочные коллатерали,
аберрантная подключичная артерия. Такие находки при обследовании
в кардиологической клинике, особенно у детей с пороками конотрун-
куса и аорты, требуют исключения у пациента de!22. Кроме того, у де-
тей с CATCH 22 возможны крайне редкие аномалии сосудов, о кото-
рых важно помнить при планировании хирургической коррекции ВПС:
аномальное отхождение одной из легочных артерий от аорты, отхож-
дение общей сонной артерии от легочной артерии. В целом, ВПС име-
ются более чем у 75% больных с CATCH 22.
Лицевые аномалии (гипертелоризм, короткие глазные щели, теле-
кант, монголоидный разрез глаз, маленький открытый рот, плоская пе-
реносица, выступающие низкие уши с плохо сформированным завит-
ком) встречаются практически у всех пациентов с CATCH 22.
337
Гипоплазия тимуса. Интараоперационно тимус не находят у 60%
пациентов, и в целом, пациенты с CATCH 22 должны при рождении
рассматриваться как потенциально иммунодефицитные. Это имеет
большое значение для кардиохирургической клиники, поскольку ран-
няя смертность при операциях на сердце у детей с CATCH 22 в 60-
75% случаев - результат сепсиса [8]. В то же время лишь около 20%
пациентов с CATCH 22 имеют клинические и лабораторные признаки
отклонений в иммунитете, основные из которых - уменьшенное число
CD4 + клеток (меньше чем 400/мкл) и снижение реакции на фитоге-
магглютинин. Как правило, общее количество лимфоцитов не измене-
но. Примечательно то, что функция Т-клеток обычно не улучшается и
не ухудшается спонтанно.
Для восстановления иммунитета при синдроме DiGeorge прибега-
ют к различным методам. Эффективна HLA-идентичная транспланта-
ция костного мозга или тимуса. Используется также введение синтети-
ческого гормона тимуса thymopoietin (ТР5). Описаны попытки имму-
ноукрепляющей терапии интерлейкинами (IL-2).
Небно-глоточной недостаточностью страдают от 50 до 95% па-
циентов. Открытая или субмукозная расщелина неба встречается у 14%
пациентов. Это резко повышает риск аспирационных осложнений или
апноэ в результате особенностей строения носа или чаще - гипотонии
небно-глоточной области с формированием преграды дыхательных пу-
тей [9]. Проблемы вскармливания таких младенцев в результате нару-
шений моторики через глоточно-пищеводный отдел ошибочно припи-
сывают болезни сердца. Для диагностики истинных причин рекомен-
дуется рентгеновское исследование с глотком бария. Нарушения строе-
ния ротоглотки могут привести к проблемам, связанным с интубацией
и искусственной вентиляцией легких. Иногда необходима коррекция
небно-глоточной недостаточности, в частности, пластика сфинктера
глотки в самом раннем возрасте.
Гипопаратиреоз и гипокальциемия являются наиболее важными
среди патологий гомеостаза, которые сопровождают CATCH 22. Часто
они являются транзиторными проблемами периода новорожденности,
но проявляются и в более позднем возрасте. Выраженная гипокаль-
циемия регистрируется у 51-62% пациентов [10, 11] и может быть
первым проявлением синдрома у детей, поскольку лицевые аномалии
не всегда выражены, особенно в первые месяцы жизни. У таких паци-
ентов возможно развитие гипокальциемического криза в период ак-
тивного роста в юности, во время беременности, во время хирургиче-
ских вмешательств или стресса.
338
Как правило, у детей с CATCH 22 и нормальным уровнем кальция
в крови уменьшен секреторный запас гормона паращитовидной желе-
зы при нормальной базальной секреции гормона. Этот феномен при-
водит к осложнениям во время коррекции ВПС; после искусственного
кровообращения уровень паратгормона остается низким, что приво-
дит к тяжелой гипокальциемии.
В качестве терапии и профилактики гипокальциемии в периопе-
рационном периоде используют глюконат кальция и препараты вита-
мина Д (alfacalcidol, calcitriol).
Прочие заболевания. Умственное развитие пациентов с CATCH 22
в 32% случаев оценивается как нормальное. В 50% случаев имеется
легкая степень, а в 18% - среднетяжелая и тяжелая степень психомо-
торного отставания. Уровень интеллекта не коррелирует с наличием
ВПС.
Пороки развития почек и мочевыводящих путей наблюдаются у
30% больных с CATCH 22.
Необходимо знать и о такой часто встречающейся аномалии (до
77%) у детей с CATCH 22, как короткая трахея в результате сокраще-
ния числа трахеальных колец до 15 и меньше. В связи с этим обяза-
тельна оценка уровня бифуркации по рентгенограмме перед интубаци-
ей трахеи. Примечательно, что с возрастом трахея растет за счет уве-
личения в размере трахеальных колец хряща, межкольцевых мембран
и увеличения числа колец.
Таким образом, необходимо тщательно обследовать детей с ко-
нотрункальными ВПС для обнаружения других, возможно скрытых,
клинических признаков CATCH 22. Как только эти отклонения найде-
ны, необходима лабораторная диагностика с использованием различ-
ных молекулярно-генетических и молекулярно-цитогенетических ме-
тодов. При подтверждении диагноза CATCH 22 необходимо сразу же
информировать родителей и принять срочные меры для предотвраще-
ния возможных осложнений.
Подводя итоги, можно сказать, что при выявлении какого-либо син-
дромального заболевания необходимо искать и врожденный порок серд-
ца. С другой стороны, состояние детей с синдромальной патологией
определяется не только тяжестью поражения сердца. Различные на-
следственные заболевания могут существенно осложнять развитие ре-
бенка, приводить к дисфункции других органов и систем, затруднять
терапевтическое и хирургическое лечение порока сердца. Знания этио-
логии и патогенеза развивающихся специфических осложнений, их про-
филактика, своевременная диагностика и лечение могут улучшить про-
гноз у этих пациентов.
339
Литература
1. Болезни новорожденного, врожденные нарушения обмена веществ // Педиат-
рия. Рук-во. Книга 2 / Под ред. Р.Е. Бергмана, В.К. Вогана. - М.: Медицина,
1991.
2. Белозеров Ю.М., Страхова О.С. Врожденные пороки сердца у детей (генети-
ческие и средовые факторы возникновения). - М., 2002.
3. Болезни плода, новорожденного и ребенка. Нозология, диагностика, патоло-
гическая анатомия. Справ, пособие / Под ред. Е.Д. Черствого, ГИ. Кравцо-
вой.- Минск: «Вышейшая школа», 1991.
4. Бочков Н.П., Лазюк Г.И. Генетика ВПС // Наследственная патология человека /
Под ред. Ю.Е. Вельтищева, Н.П. Бочкова. - М., 1992.- Том 1.- С. 39-40.
5. Левченко Е.Г. Врожденные пороки сердца у детей - синдромальные формы и
ассоциированные аномалии: диагностика и проблемы послеоперационного ве-
дения. - Дисс...канд. мед. наук. - М., 2003.
6. Шарыкин А.С., Левченко Е.Г. Классификация наследственных заболеваний в
детской кардиологической клинике // Бюлл. НЦССХ им. А.Н. Бакулева РАМН.-
2001.-№3.- С. 149.
7. Leatherbury L., Kirby ML. Cardiac development and perinatal care of infants with
neural crest-associated conotruncal defects// Semin Perinatal.- 1996.- Vol. 129.-
P. 473-81.
8. Hatchwell E; Long F; Wilde J et al. Molecular confirmation of germ line mosaicism
for a submicroscopic deletion of chromosome 22qll. // Am J Med Genet.- 1998.-
Vol. 82.- P. 103-106.
9. McDonald-McGinn DM, Driscoll DA, Emanuel BS et al. Detection of a 22ql 1.2
deletion in cardiac patients suggests a risk for velopharyngeal incompetence. // Pedi-
atrics.- 1997.- Vol. 99. - № 5. -P. e9.
10. Hypocalcemia and chromosome 22ql 1 microdeletion//Genet Couns 1999.-Vol. 1 О.-
P. 389-394.
11. Cuneo B.F., Langman C.B., llbawi M.N. Latent hypoparathyroidism in children with
conotruncal cardiac defects. // Circulation.- 1996.- Vol. 93, P. 1702-1708.
340
Глава 22. ОСОБЕННОСТИ НАБЛЮДЕНИЯ ЗА
БОЛЬНЫМИ, ОПЕРИРОВАННЫМИ ПО
ПОВОДУ ВРОЖДЕННЫХ ПОРОКОВ
СЕРДЦА
Основной объем работы по контролю за состоянием пациентов по-
сле операций на сердце ложится на кардиологов, работающих в систе-
ме практического здравоохранения. Поэтому мы считаем важным оп-
ределить для них основные опорные пункты в этой области. Сущест-
вует два основных аспекта наблюдения: 1) за состоянием сердца; 2) за
общим состоянием пациента. Однако для каждого вида операций су-
ществуют свои особенности, на которые следует обращать внимание.
В настоящей главе мы суммировали наиболее часто встречающиеся
виды вмешательств и проблемы, с которыми можно столкнуться в про-
цессе наблюдения за пациентами.
Межартериальный анастомоз
Межартериальный анастомоз (накладывается между аортой и ле-
гочной артерией или их ветвями) предназначен для увеличения легоч-
ного кровотока и создается в основном при цианотических ВПС, сопро-
вождающихся его уменьшением (тетрада Фалло, ВПС с атрезией легоч-
ной артерии, транспозиция магистральных артерий с легочным стено-
зом). Функционирующий анастомоз дает мягкий, дующий систолодиа-
столический шум, похожий на шум ОАП, на стороне его наложения (слева
или справа от грудины). Однако при высоком ОЛС шум может быть ог-
раничен только систолическим компонентом.
При рентгенографии грудной клетки должен определяться отчет-
ливый легочно-сосудистый рисунок, соответствующий нормоволемии
в малом круге кровообращения. Насыщение крови кислородом после
операции увеличивается и остается стабильным при динамическом кон-
троле.
Основные проблемы - гипофункция или гиперфункция анастомоза.
При гипофункции шум слабый, непостоянный. Нарастает цианоз,
общее состояние пациента ухудшается. В динамике отмечается сниже-
ние SO2 и интенсивности легочного сосудистого рисунка; при резкой
гипоксемии возможно развитие метаболического ацидоза. В первые
часы после операции это осложнение может быть связано с неправиль-
ным выбором диаметра вшиваемого протеза или техническими погреш-
ностями. В последующем наиболее частая причина гипофункции -
тромбоз анастомоза, обычно спровоцированный неадекватным огра-
341
ничением объема потребляемой жидкости или назначением диуретиков
и повышением гематокрита. Проявляется обычно острым началом; зна-
чительное ухудшение состояния больного наступает уже в течение не-
скольких часов. При угрозе данного осложнения возможно проведение
антикоагулянтной терапии гепарином (100 ед. в/в капельно), введение
повышенного объема жидкости (до 120% от суточной потребности). Ес-
ли симптомы гипофункции сохраняются в течение 3-4 часов, нарастает
метаболический ацидоз и имеются данные за сформировавшийся тромб,
показана неотложная операция. Возможно также развитие относитель-
ной гипофункции анастомоза в связи с ростом ребенка. В этом случае,
как правило, признаки гипоксемии нарастают постепенно.
При гиперфункции анастомоза характер шума может не меняться;
иногда он «чрезмерно» громкий, резкий. Состояние пациента опреде-
ляется степенью легочной гиперволемии - развиваются сердечная не-
достаточность, отек легких (проявляющийся клинически и на рентге-
нограммах), последующее снижение SO2. Терапия включает ограниче-
ние жидкости, мочегонные, инотропные препараты, в тяжелых случа-
ях - искусственную вентиляцию легких без добавления кислорода и с
повышенным давлением в дыхательных путях (от +7 до +10 см вод. ст.
в конце выдоха). При отсутствии эффекта показана операция, направ-
ленная на уменьшение диаметра анастомоза.
Решение о времени радикальной коррекции порока, имеющегося
у больного с анастомозом, принимают в зависимости от основного ди-
агноза, состояния легочного сосудистого русла и т.д. Как правило, та-
кие вмешательства выполняют через 3-6 мес после создания анасто-
моза. Однако показания к операции должны быть рассмотрены быст-
рее в случаях, когда недостаточный уровень содержания кислорода в
системной крови ограничивает физическую активность пациента, его
развитие, вызывает дисфункцию жизненно важных органов.
Если радикальная операция откладывается, периодичность наблю-
дения составляет 3-6 мес. Основные методы исследования: аускуль-
тация, рентгенография грудной клетки, контроль сатурации крови и
кислотно-щелочного состояния.
Операция суживания легочной артерии
Данную операцию выполняют обычно с помощью лигатуры, на-
кладываемой вокруг легочного ствола. В редких случаях используют
раздельное наложение лигатур на правую и левую легочные артерии.
Цель процедуры - ограничить легочный кровоток при патологиях, при
которых его избыток приводит к развитию сердечной недостаточно-
сти и высокой легочной гипертензии (множественные ДМЖП, единст-
венный желудочек, полная форма атриовентрикулярного канала, двой-
342
ное отхождение сосудов от правого желудочка). При транспозиции ма-
гистральных артерий данная операция может применяться в качестве
«тренировки» левого желудочка для последующей анатомической кор-
рекции порока.
Чрезмерное сужение легочной артерии нередко приводит к разви-
тию сердечной недостаточности и даже к смерти больного, что наблю-
дается обычно в раннем послеоперационном периоде. В отдаленные
сроки после операции при значительном росте ребенка возможно на-
растание относительного стеноза в области лигатуры. В этом случае
высокое сопротивление выбросу правого желудочка сопровождается
повышением давления в желудочке, возникновением сброса крови че-
рез ДМЖП справа налево и нарастающим цианозом. Однако не следу-
ет считать это признаком необратимой легочной гипертензии и неопе-
рабельным состоянием больного. В таких случаях необходимо оценить,
прежде всего, сопротивление на манжете легочного ствола.
Недостаточное сужение легочной артерии сопровождается сохра-
нением избыточного легочного кровотока, высокого давления в систе-
ме легочной артерии и прогрессированием легочной гипертензии. За-
дача кардиолога - своевременно выявить повышенный легочный кро-
воток и давление в системе легочной артерии и рекомендовать хирур-
гическое лечение. Возникновение цианоза у таких больных свидетель-
ствует о развитии сброса крови справа налево, связанного с высокой,
часто необратимой степенью легочной гипертензии.
В целом, не следует чрезмерно длительно наблюдать пациентов с
суженной легочной артерией. Радикальную операцию, если она показа-
на, необходимо рекомендовать уже через 3-4 мес. Стабильное состоя-
ние больного, уменьшение признаков сердечной недостаточности по
сравнению с дооперационным периодом не являются признаками «из-
лечения» от порока. Кроме того, длительное существование манжеты на
легочной артерии приводит к развитию фиброзных изменений в сосуди-
стой стенке. При повторной, корригирующей операции потребуется не
просто снятие манжеты, а пластика легочного ствола, что, конечно, ус-
ложнит операцию. Длительное существование манжеты на легочном
стволе целесообразно лишь у больных, которым предстоит операция Фон-
тена (при отсутствии у них выраженной гипоксемии).
При эхокардиографическом контроле необходимо обращать вни-
мание на положение манжеты на легочном стволе. Она должна распо-
лагаться примерно на его середине. Смещение в сторону бифуркации
или легочного клапана может приводить к их деформации и фиброзу.
В этом случае следует рекомендовать более раннюю операцию, до раз-
вития необратимых склеротических изменений указанных структур.
343
Если радикальная операция откладывается, периодичность наблю-
дения 3-4 мес. Основные методы исследования: эхокардиография, кон-
троль сатурации крови, рентгенография грудной клетки.
Коррекция легочного стеноза
Интервенционные процедуры при легочном клапанном стенозе в
последнее время практически полностью вытеснили традиционное опе-
ративное вмешательство. Однако выполнение баллонной дилатации
производится не под зрительным контролем, поэтому вероятны такие
проблемы, как остаточное неполное раскрытие створок клапана или
возникновение его недостаточности. Сохранение высокого градиента
давления на клапане может быть связано с грубой исходной деформа-
цией клапана, неадекватным проведением процедуры; нередки также
случаи его нарастания в отдаленные сроки. Повторное баллонное или
«открытое» вмешательство показано при градиенте систолического дав-
ления более 60 мм рт. ст. Другой проблемой является возникновение
регургитации на легочном клапане. В этом случае необходимо оцени-
вать реакцию правого желудочка на объемную перегрузку (дилатация,
гипертрофия) в динамике и своевременно ставить показания к опера-
ции. Неблагоприятным признаком является увеличивающаяся трикус-
пидальная недостаточность.
После транслюминальных процедур возможны тромбозы сосудов,
через которые проводились катетеры. Чаще всего опасности подверга-
ются бедренные или подвздошные вены. В связи с этим необходимо
контролировать их проходимость с помощью ультразвуковой доппле-
рографии и проводить соответствующее лечение антиагрегантами.
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: эхокардиография, рентгенография грудной клетки, контроль
сатурации крови. Необходима профилактика бактериального эндокар-
дита при дентальных или микрохирургических процедурах.
Коррекция аортального стеноза
Устранение критического аортального стеноза наряду с традици-
онной операцией также возможно путем баллонной дилатации. После
процедуры оценивают состояние аортального клапана и левого желу-
дочка. Следует помнить, что стеноз или недостаточность аортального
клапана при прочих равных условиях более существенно сказываются
на насосной функции сердца и состоянии больного, чем аналогичные
изменения легочного клапана. При исходно плохой сократительной
функции левого желудочка высока вероятность прогрессирования сер-
дечной недостаточности и возникновения регургитации на митраль-
ном клапане.
344
Как правило, после операции показано ограничение физической
нагрузки, занятий спортом.
При нарастании изолированного стеноза возможна повторная бал-
лонная дилатация клапана. Деформация и дисплазия створок с гради-
ентом давления более 50 мм рт. ст. или прогрессирующей регургита-
цией являются показаниями к корригирующей операции вплоть до за-
мены клапана протезом. При наличии дисфункции клапана интервал
между наблюдениями должен быть не более полугода.
При данной патологии дополнительно анализируют степень нару-
шения коронарного кровообращения и наличие фиброэластоза эндокарда
как признаки сохраняющейся или нарастающей нагрузки на сердце.
После транслюминальных процедур возможны тромбозы сосудов,
через которые проводились катетеры (чаще всего это бедренные или
подвздошные артерии). В связи с этим необходимо контролировать их
проходимость с помощью ультразвуковой допплерографии и проводить
антиагрегантную терапию.
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: ЭКГ, эхокардиография, исследование с дозированной физиче-
ской нагрузкой. Необходима профилактика бактериального эндокарди-
та при дентальных или микрохирургических процедурах.
Устранение коарктация аорты
При контрольном исследовании в первую очередь оценивают про-
ходимость аорты. Неблагоприятный результат можно заподозрить при
повышенном артериальном давлении на правой руке. В таком случае
необходимо измерить градиент систолического давления между пра-
вой рукой и правой ногой (с помощью метода Короткова, а не ЭХОКГ!).
Градиент давления более 25-30 мм рт.ст. считают патологическим. Даль-
нейшая диагностика направлена на выяснение уровня возникновения
градиента - на дуге аорты (между правой и левой руками) или дис-
тальнее, в области операции. Измеряя артериальное давление, необхо-
димо помнить, что при реконструкции аорты могла быть использована
левая подключичная артерия и в левой руке отсутствует магистраль-
ный кровоток. В случае умеренной локальной рекоарктации (градиент
систолического давления до 30 мм рт. ст.) допустима баллонная дила-
тация суженного участка или стентирование; при значительной обструк-
ции показана повторная операция.
При использовании во время операции синтетической заплаты вы-
сока вероятность развитии аневризмы аорты в отдаленные сроки. Та-
ким пациентам в диагностических целях необходимо раз в год выпол-
нять рентгенографию грудной клетки, а раз в 5 лет - магнитно-резо-
нансную томографию.
345
Артериальная гипертензия возможна и при отсутствии сужения
аорты, что чаще наблюдается при поздних вмешательствах. Так, из-
вестно, что после операций у взрослых более чем в 50% случаев со-
храняется резидуальная артериальная гипертензия, подлежащая тера-
пии, в то время как у 90% детей происходит нормализация давления
[1]. Необходимо стремиться к медикаментозной коррекции давления,
так как у этих больных повышена вероятность стенозирования коро-
нарных артерий и развития ишемической болезни сердца, а также по-
ражения сосудов головного мозга [2]. Опенке подлежит и степень ги-
пертрофии левого желудочка.
Следует также обратить внимание на наличие ВПС, которые час-
то сопровождают коарктацию аорты: ДМЖП, ДМПП, митральный по-
рок. Нередко состояние пациента и функция сердца зависят от степени
выраженности этих пороков, а не от нарушения проходимости аорты.
Отдельной проблемой является двухстворчатый аортальный клапан,
который встречается примерно у 30% пациентов с коарктацией аорты и
обычно проявляется тривиальным систолическим шумом. Однако с те-
чением времени изменения клапана могут нарастать, развивается аор-
тальный стеноз и возникает необходимость в его коррекции.
Осложнение, которое может развиться в отдаленные сроки после
операции с использованием левой подключичной артерии - синдром
обкрадывания головного мозга (см. раздел «Коарктация аорты»). При
выявлении соответствующих симптомов необходимо провести дуплекс-
ное сканирование сосудов и консультацию с хирургами, занимающи-
мися нарушениями кровообращения головного мозга.
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: контроль артериального давления на правой руке и ноге, эхо-
кардиография, ЭКГ. Необходима профилактика бактериального эндокар-
дита при дентальных или микрохирургических процедурах.
Коррекция дефекта межпредсердной перегородки
Основные проблемы, подлежащие оценке, - наличие резидуаль-
ного внутрисердечного шунта и нарушений ритма сердца. Косвенны-
ми признаками сохраняющегося значительного сброса крови являют-
ся дилатация правых отделов сердца и повышенная васкуляризация
легких на рентгенограмме. При отсутствии их положительной дина-
мики в течение 2-3 мес после операции необходимо ставить вопрос о
повторном вмешательстве.
После закрытия ДМПП с помощью интервенционных методов при
эхокардиографическом исследовании выявляют плотные структуры в
области МПП (рис. 22-1). Следует проводить дифференциальную ди-
346
агностику между нормальным изображением конструкции окклюзи-
рующего устройства и возможным наличием тромбов или вегетаций
в этой зоне.
Рис. 22-1. Эхокардиограмма в верхушечной четырехкамерной
позиции после коррекции дефекта межпредсердной перегородки с
ПОМОЩЬЮ ОККЛЮДера. Выявляется дополнительное линейное образование в
проекции межпредсердной перегородки со стороны обоих предсердий - окклюдер;
сохраняется незначительное расширение правого предсердия; правый желудочек
нормальных размеров.
Нарушения ритма - характерное осложнение при ДМПП. Чаще
возникает при первичном дефекте и дефекте типа sinus venosus; веро-
ятность нарушений синусового ритма нарастает с возрастом (особен-
но после 30 лет). При развитии трепетания или фибрилляции предсер-
дий помимо антиаритмической терапии показана антикоагулянтная те-
рапия.
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: аускультация, эхокардиография, ЭКГ (при нарушениях ритма),
рентгенография грудной клетки. Профилактика инфекционного эндо-
кардита рекомендуется только в случаях сопутствующего расщепле-
ния или пролапса митрального клапана.
347
Коррекция дефекта межжелудочковой перегородки
Основная проблема, подлежащая оценке, - наличие резидуально-
го сброса, который может колебаться в значительных пределах. Если
при этом после операции отсутствует положительная динамика, или
даже, наоборот, нарастают размеры полостей сердца, симптомы сер-
дечной недостаточности, и возникают нарушения ритма (фибрилля-
ции предсердий), необходимо ставить вопрос о повторном хирургиче-
ском лечении. Отдельную проблему представляют пациенты с множе-
ственными ДМЖП. Во время операции нередко закрывают только боль-
шие дефекты, а мелкие мышечные оставляют без коррекции. Послед-
ние в дальнейшем могут закрыться спонтанно, проявляться только шу-
мом или стать гемодинамически значимыми, в связи с чем необходимо
систематическое наблюдение за пациентами.
В случаях с высокой легочной гипертензией (исходной или про-
грессировавшей после операции) сброс через реканализированный де-
фект может сократиться или даже стать обратным. Это сопровождает-
ся уменьшением шума и нередко расценивается как спонтанное закры-
тие фистулы. При этом, однако, остаются увеличенными правые отде-
лы сердца, на ЭКГ имеется отклонение электрической оси сердца впра-
во. На рентгенограммах грудной клетки видны расширенные прокси-
мальные отделы легочных артерий с конусообразным сужением к пе-
риферии, легочные поля - с обедненным рисунком. В правом желудоч-
ке определяется высокое давление (при отсутствии легочного стено-
за!).
Необходимо также обращать внимание на сопутствующую пато-
логию, которая может играть роль в отдаленные послеоперационные
сроки, - пролабирование створок аортального клапана (обычно при
отточном ДМЖП) с развитием аортальной недостаточности, а также
обструкцию выводного отдела правого желудочка. При их нарастании
может возникнуть необходимость в дополнительном хирургическом
вмешательстве.
Периодичность наблюдения - 6-12 мес. Основные методы иссле-
дования: аускультация, эхокардиография, ЭКГ (при нарушениях ритма),
рентгенография грудной клетки.
Коррекция полной формы атриовентрикулярного канала
Коррекция данной патологии редко сопровождается полным ис-
чезновением шумов. Это связано с трудностями в формировании иде-
ального митрального или трикуспидального клапанов и подклапанно-
го аппарата. Наличие их стеноза или недостаточности сопровождается
соответствующими клиническими проявлениями, перегрузками серд-
348
ца и дилатацией камер. Отсутствие положительной динамики состоя-
ния сердца в течение 6 мес после операции должно насторожить в отно-
шении адекватности функционирования клапанов. Около 15% больных
с дисфункцией митрального клапана требуются повторные операции.
Вторая проблема - сброс на уровне ДМЖП или ДМПП. Если он
приводит к дилатации сердца и усилению легочного сосудистого ри-
сунка, также требуется повторная операция. Третья проблема - нару-
шения ритма и атриовентрикулярной проводимости. Если они сопро-
вождаются недостаточностью кровообращения, а медикаментозная те-
рапия неэффективна, необходимо ставить вопрос об интервенционном
электрофизиологическом обследовании или постоянной электрокардио-
стимуляции.
Периодичность наблюдения - 6-12 мес. Основные методы иссле-
дования: аускультация, эхокардиография, ЭКГ (при нарушениях рит-
ма), рентгенография грудной клетки. Необходима профилактика бак-
териального эндокардита при дентальных или микрохирургических
процедурах.
Гемодинамическая коррекция транспозиции
магистральных артерий (предсердное переключение,
операции Мастарда или Сеннинга)
Основные проблемы, сопровождающие данные операции, связа-
ны с тем, что роль системного продолжает выполнять правый желудо-
чек. Так как филогенетически он не предназначен для работы в усло-
виях высокого давления, функция его постепенно ухудшается. Это про-
является в снижении сердечного выброса, развитии нарушений ритма
и трикуспидальной недостаточности. Данные нарушения сопровож-
даются симптомами сердечной недостаточности и кардиомегалией. К
сожалению, медикаментозная терапия не предотвращает прогрессирую-
щего ухудшения насосной функции сердца и носит в основном сим-
птоматический характер.
Редким, но серьезным осложнением являются стенозы коллекто-
ров (легочных или системных вен), которые могут потребовать повтор-
ной операции. Клинически они проявляются застойными явлениями в
малом или большом кругах кровообращения. В большинстве случаев
диагноз ставят на основании эхокардиографического исследования, но
нередко требуется катетеризация сердца с последующей баллонной ди-
латацией суженных участков.
Периодичность наблюдения - 6-12 мес. Основные методы иссле-
дования: эхокардиография, ЭКГ (при нарушениях ритма), рентгеногра-
фия грудной клетки, контроль сатурации крови.
349
Анатомическая коррекция транспозиции магистральных
артерий (артериальное переключение, операция Jatene)
В отличие от предсердного переключения, после данной опера-
ции желудочки несут нагрузку, соответствующую их анатомическому
строению, и дисфункция миокардиального или клапанного генеза воз-
никает редко. Основными проблемами данной операции являются сте-
нозы в области корней неоаорты и легочной артерии, устьев коро-
нарных артерий, а также нарушения ритма. Проявления стенозов ма-
гистральных артерий в большинстве случаев ограничиваются шума-
ми, но возможны и прогрессирующие перегрузки соответствующих же-
лудочков. Коронарные поражения в отдаленные сроки редки, протека-
ют с клинической картиной ишемической болезни сердца и могут по-
требовать оперативного вмешательства.
При недостаточности неоаортального клапана может потребовать-
ся его протезирование.
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: аускультация, эхокардиография, ЭКГ (при нарушениях ритма
или коронарных нарушениях).
Радикальная коррекция тетрады Фалло
Идеальной целью коррекции тетрады Фалло является достижение
нормального давления в правом желудочке при сохранении компетент-
ности легочного клапана. Как показывает мировой и отечественный
опыт, в послеоперационном периоде именно выраженная недостаточ-
ность легочного клапана является основной причиной правожелудоч-
ковой недостаточности, снижения фракции выброса и толерантности
к физической нагрузке, возникновения аритмий и внезапной сердеч-
ной смерти [3, 4]. В свою очередь, степень легочной регургитации за-
висит от диаметра легочного кольца, созданного во время операции, -
превышение двух стандартных отклонений от нормальной величины
сопровождается плохим прогнозом. Тревожным симптомом, указываю-
щим на необходимость повторного вмешательства на легочном клапа-
не, является прогрессирующая дилатация правого желудочка. Так как
точная оценка размеров и функции правого желудочка с помощью эхо-
кардиографии затруднена, рекомендуется использовать МРТ или ра-
дионуклидное исследование.
Важным показателем является величина систолического давления
в правом желудочке, которая зависит при данном пороке не столько от
сброса через ДМЖП, сколько от препятствия в выводном отделе пра-
вого желудочка. В случаях, когда давление превышает 2/3 системного,
необходима повторная операция.
350
Величина резидуального сброса на межжелудочковой заплате оце-
нивается по принципам, указанным для изолированного ДМЖП.
Желудочковая аритмия после коррекции тетрады Фалло с помо-
щью холтеровского мониторирования выявляется у 40-50% пациен-
тов, и у 1-2% из них может привести к внезапной сердечной смерти.
Аритмия более вероятна при выполнении операции в старшем возрас-
те, при систолической или диастолической дисфункции желудочков, в
том числе связанной с легочной регургитацией, удлинении QRS более
180 мс [1, 4]. Как правило, ее возникновение связано с дополнитель-
ными путями проведения, возникающими в оперированном сердце по-
сле пластики выводного отдела правого желудочка, наложения запла-
ты на межжелудочковую перегородку, травмы конусной перегородки.
У 20-30% пациентов обнаруживают также дисфункцию синусного узла
и предсердную тахикардию. При выявлении анатомического субстра-
та аритмий показаны интервенционные или хирургические процеду-
ры, направленные на его устранение.
Среди других остаточных проблем необходимо указать также на
открытое овальное окно и аномалии коронарных артерий.
Периодичность наблюдения -6-12 мес. Основные методы исследо-
вания: эхокардиография, ЭКГ (при нарушениях ритма), МРТ, контроль са-
турации крови. При общехирургических или дентальных вмешательст-
вах показана антибиотикопрофилактика бактериального эндокардита.
Операции типа операции Фонтена
Спектр операций данного типа довольно обширен - от относи-
тельно «простого» кавопульмонального анастомоза до полного обхода
правого предсердия и правого желудочка. В результате операции един-
ственный полноценный желудочек нагнетает кровь в сосуды большо-
го круга кровообращения. В малый круг кровь течет из полых вен прак-
тически без поддержки сердцем. В связи с этим давление в полых ве-
нах и в правом предсердии должно быть достаточно высоким, обычно
составляя не менее 10-15 см рт. ст. Пациенты с подобной физиологией
кровообращения весьма чувствительны к изменениям внутригрудного
давления и резистентности легочных сосудов. Так, даже глубокий вдох
приводит к повышению легочного кровотока, а проба Вальсальвы - к
его снижению. Изменение общего легочного сопротивления, напри-
мер при пневмонии, может спровоцировать развитие выраженной сер-
дечной недостаточности.
Пациенты данной группы, как правило, плохо переносят физиче-
скую нагрузку, так как не могут быстро и адекватно увеличивать сер-
дечный выброс. В связи с этим существует опасность легкого развития
351
отеков, гидроторакса, асцита. В то же время терапия этих осложнений
диуретиками должна быть минимальной во избежание дальнейшего
падения сердечного выброса. Возможны также белково-дефицитные
энтеропатии или бронхопатии, прогноз при которых неблагоприятен:
до 50% больных погибают в течение 5 лет.
Данный тип операций сопровождается высокой частотой предсерд-
ных аритмий, которые существенно нарушают сердечный выброс. При
наличии застойных явлений и развитии аритмии примерно у 6% боль-
ных существует опасность внезапной смерти.
Артериальная гипоксемия может развиваться при реканализации
внутрисердечных сообщений, формировании внутрилегочных артерио-
венозных шунтов. Нередко это сочетается с увеличением размеров серд-
ца и сердечной недостаточностью. Если имеются явные анатомические
причины данных осложнений, необходимо их хирургическое исправ-
ление. Пациенты с прогрессирующей сердечной недостаточностью яв-
ляются кандидатами на трансплантацию сердца.
Периодичность наблюдения определяется степенью нарушений ге-
модинамики (3-12 мес). Основные методы исследования: эхокардиогра-
фия, ЭКГ (при нарушениях ритма), контроль сатурации и биохимиче-
ского состава крови. Необходима профилактика бактериального эндо-
кардита при дентальных или микрохирургических процедурах.
Пациенты - носители кондуита
Цель имплантации кондуита - замещение гипоплазированного или
отсутствующего сосуда. Наиболее часто создается сообщение между
правым желудочком и легочной артерией. Кондуит формируют из ау-
тотканей или синтетических материалов; экзогенные биопротезы мо-
гут быть человеческого (гомографт) или животного (ксенографт) про-
исхождения. Кроме того, кондуит может быть бесклапанным или кла-
панно-содержащим.
Основные проблемы, возникающие у пациентов - носителей кон-
дуитов, связаны с образованием тромбов, подверженностью инфекции,
кальцификацией стенок протеза, разрушением клапана или формиро-
ванием его стеноза, а также отторжением биологических тканей [5, 6].
Все это приводит к повышению давления в правом желудочке, право-
желудочковой недостаточности, уменьшению легочного кровотока.
Показания к повторным операциям у симптоматичных больных
определяются градиентом систолического давления более 40-50 мм рт.
ст. и необходимостью замены разрушающегося биопротеза. При от-
сутствии выраженной симптоматики к замене кондуита прибегают
в случаях подъема давления в венозном желудочке до близкого к сис-
темному уровню, прогрессирующих аритмий или недостаточности
352
атриовентрикулярного клапана [7]. Примерно через каждые 2-3 года
требуется замена кондуита на больший размер из-за роста ребенка.
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: эхокардиография, ЭКГ (при нарушениях ритма), МРТ или кате-
теризация сердца и ангиокардиография.
Коррекция аномалии Эбштейна
Основные проблемы после коррекции аномалии Эбштейна свя-
заны с дисфункцией трикуспидального клапана и возникновением на-
рушений ритма. Если была выполнена операция одножелудочковой
коррекции, могут развиваться осложнения, аналогичные описанным
в разделе «операция типа операции Фонтена».
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: аускультация, эхокардиография, ЭКГ (при нарушениях ритма).
Необходимы профилактика бактериального эндокардита, ограничение
физической нагрузки.
Коррекция корригированной транспозиции
магистральных артерий
Необходимо контролировать нарушения атриовентрикулярной про-
водимости и ритма, степень регургитации на трикуспидальном (сис-
темном) клапане. Примерно у 15% пациентов возникает необходимость
в протезировании клапана.
При дисфункции клапана и системного желудочка ограничивает-
ся физическая нагрузка. При имплантированном водителе ритма необ-
ходим контроль за его работой.
У больных после операции «double switch» возможны проблемы,
аналогичные таковым при коррекции простой транспозиции магист-
ральных артерий (см. выше).
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: аускультация, эхокардиография, ЭКГ (при нарушениях ритма).
Необходима профилактика бактериального эндокардита при денталь-
ных или микрохирургических процедурах.
Устранение сосудистого кольца
У больных, оперированных в связи с выраженной обструкцией ды-
хательных путей, остаточные явления их стеноза могут сохраняться в
течение недель или месяцев. Причиной являются процессы трахеома-
ляции. В некоторых случаях приходится прибегать к специальному хи-
рургическому вмешательству на трахее и бронхах.
Периодичность наблюдения -6-12 мес при сохранении стеноза ды-
хательных путей. Основные методы исследования: аускультация, из-
мерение артериального давления, эхокардиография (при наличии сопут-
ствующих ВПС), МРТ.
353
Коррекция тотального аномального дренажа легочных вен
Основные проблемы после коррекции аномального дренажа свя-
заны с прогрессирующим стенозом устьев легочных вен и развитием
высокой легочной гипертензии. Примерно у 10% пациентов требуется
повторная операция по устранению этих сужений, большинство из них
имеют инфракардиальную форму дренажа. Более редко встречаются
сужение верхней полой вены или коллектора легочных вен, а также
аритмии (наиболее часто - суправентрикулярная тахикардия).
Периодичность наблюдения -6-12 мес. Основные методы иссле-
дования: эхокардиография, ЭКГ (при нарушениях ритма), катетериза-
ция сердца и ангиокардиография с баллонной дилатацией стенозов (при
наличии осложнений).
Литература
I. Brickner М.Е., Hillis L.D., Lange R.A. Congenital Heart Disease in adults //
N. Engl. J. Med.- 2000.-Vol. 342.- P. 256-263.
2. Celermajer D.S., Greaves K. Survivors of coarctation repair: Fixed but not cured //
Heart.- 2002.- Vol. 88.- P. ИЗ-П4.
3. Туманян М.Р. Оценка качества жизни пациентов в отдаленном периоде наблю-
дения после радикальной коррекции тетрады Фалло, выполненной в раннем
возрасте. - Дисс...докт. мед. наук.- М., 2001.
4. Helbing WA., Roest А.А., Niezen R.A. et al. ECG predictors of ventricular arrhyth-
mias and biventricular size and wall mass in tetralogy of Fallot with pulmonary
regurgitation // Heart.- 2002.- Vol. 88.- P. 515-520.
5. Юрлов И.А., Костава B.T., Ковалев Д.В. и др. Факторы риска дисфункции про-
тезов легочного ствола у больных со сложными ВПС // Бюлл. НЦССХ
им. А.Н. Бакулева РАМН.- 2001.- № 3.- С. 17.
6. Ковалев Д.В. Реконструкция путей ооттока правого желудочка с помощью ксе-
ноперикардтального кондуита с бескаркасным трехстворчатым клапаном при
коррекции ВПС. - Дисс...канд. мед. наук. - М., 2003.
7. Dearani J.A., Danielson G.K., Puga F.J. et al. Late follow-up of 1095 patients un-
dergoing operation for complex congenital heart disease utilizing pulmonary ventri-
cle to pulmonary artery conduits // Ann. Thorac. Surg.- 2003.- Vol. 75.- P. 399-411.
354
Глава 23. ПРОБЛЕМЫ ДЛИТЕЛЬНОГО
ВЫЖИВАНИЯ ПАЦИЕНТОВ С
ВРОЖДЕННЫМИ ПОРОКАМИ СЕРДЦА
Успехи детской кардиологии и кардиохирургии приводят к тому,
что увеличивается срок жизни больных, имеющих или имевших врож-
денные пороки сердца (ВПС). Таким образом, формируется популя-
ция взрослых пациентов, у которых существуют проблемы, связанные
с данными аномалиями. Впервые этот вопрос был поднят еще в 1973 г.
J.K. Perloff [1], а в начале 90-х годов признан важным уже многими
врачами [2]. «Взрослая» кардиологическая служба занимается в основ-
ном ишемической болезнью сердца, гипертонической болезнью, при-
обретенными пороками сердца. В то же время, ВПС имеют свою спе-
цифику нарушений гемодинамики, социальной адаптации пациентов,
особенности медикаментозного или хирургического лечения. Многие
развитые страны обеспокоены ростом числа подобных пациентов, так
как не существует стройной системы помощи для них. Несмотря на то
что точные потребности неизвестны, предполагается, что к началу два-
дцать первого века в США имелось около 500 000 взрослых - «носите-
лей» ВПС и ежегодно добавлялось еще по 20 000. В северных регио-
нах Англии, при средней рождаемости 35-38 тыс. в год и средней час-
тоте ВПС среди новорожденных 0,6%, ежегодный прирост числа та-
ких пациентов составляет 2500 [3]. За десять последних лет в этой стра-
не количество клиник, занимающихся проблемами взрослых с ВПС,
увеличилось в 4 раза, в Канаде - в 2,7 раза [4]. Смещается и пик смерт-
ности от ВПС. Если в 50-е годы в большинстве развитых стран он при-
ходился на грудной период, то в 80-е - на возраст старше 20 лет[3].
Отсутствие точной статистики в РФ не позволяет оценить масштабы
этой проблемы, однако путем экстраполяции можно предположить по-
явление не менее 10 000 подобных пациентов ежегодно [5, 6].
23.1. Основные группы пациентов с ВПС
Чем же определяется структура сердечной патологии в старшем
возрастном периоде? Такие пороки, как синдром гипоплазии левого
сердца, трикуспидальная атрезия, единственный желудочек, атрезия
легочной артерии (особенно с интактной межжелудочковой перегород-
кой), полная форма атриовентрикулярного канала, транспозиция маги-
стральных артерий, общий артериальный ствол, резкая коарктация аор-
ты, в силу своей тяжести проявляются в основном в грудном возрасте
и сопровождаются высокой естественной смертностью. Достижение
355
старшего возраста возможно только в странах с хорошо развитой кар-
диохирургией; некорригированные пороки встречаются у взрослых в
единичных случаях. Другие нозологические единицы (ДМПП, ОАП,
ДМЖП, аортальный и легочный стенозы, умеренная коарктация аор-
ты, частичная форма атриовентрикулярного канала) впервые могут
встретиться на приеме у врача в любом возрасте - и в дошкольном, и в
раннем школьном. У части этих детей операция необходима, у других,
с умеренными расстройствами гемодинамики, требуется диспансерное
наблюдение. Прогноз жизни определяется «естественной» смертно-
стью, известной для большинства пороков [4], а также риском опера-
ции. В результате вмешательства можно получить полностью корриги-
рованное сердце или лишь хирургически модифицированное, в кото-
ром сохраняются те или иные отклонения от нормы. Таким образом,
суммарное количество пациентов, которые достигнут возраста 18 лет,
складывается из больных, перенесших хирургическое вмешательство,
а также больных, выживших без операции. Среди последних встреча-
ются пациенты с пороками, при которых возможно и последующее дли-
тельное выживание без хирургической интервенции (из них наиболее
частые - двухстворчатый аортальный клапан, умеренная коарктация
аорты или легочный стеноз, небольшие ДМПП и ОАП, аномалия Эб-
штейна, врожденная полная атриовентрикулярная блокада с частым же-
лудочковым ритмом, корригированная транспозиция магистральных ар-
терий) [7]. В таких случаях нередко на первый план выходят уже не
сами пороки, а сопутствующие проблемы: бактериальный эндокардит,
тромбоэмболии, нарушения ритма и т.п.
Как правило, значительная часть взрослых с ВПС подлежит лишь
диспансерному наблюдению, однако другим требуются терапевтиче-
ское лечение, а также хирургические или интервенционные процеду-
ры. Среди взрослых с некорригированными пороками основные объе-
мы вмешательств связаны с патологией аортального клапана и корня
аорты (аортальный стеноз или недостаточность, аортолевожелудочко-
вое сообщение, разрыв аневризмы синуса Вальсальвы - около 15% вме-
шательств), а также с коарктацией аорты (13%). Значительную группу
в последнее время образовали пациенты с ДМПП и открытым оваль-
ным окном, подвергающиеся интервенционным процедурам по закры-
тию этого дефекта (43%). Другие виды операций, выполняемых при
ВПС, представлены во взрослой популяции в меньшей степени [8].
Среди оперированных пациентов наблюдение и лечение требуется
обычно при наличии остаточных проблем, или неблагоприятных по-
следствий операций, изложенных ниже.
356
23.2. Остаточные проблемы после коррекции ВПС
Врач, предлагающий операцию, должен представлять, что далеко
не во всех случаях она приведет к полному излечению пациента. Дос-
таточно часто сохраняются остаточные проблемы, связанные с приро-
дой ВПС, которые не зависят от схемы или техники выполнения опе-
рации. К основным из них относятся электрофизиологические, кла-
панные, желудочковые, сосудистые, а также внесердечные нарушения.
Электрофизиологические расстройства
Существуют две основные категории электрофизиологических рас-
стройств: 1) врожденные нарушения ритма или проводимости, связан-
ные с анатомическим отклонениями, присущими конкретным ВПС;
2) дисфункции, являющиеся следствием гипоксии или гемодинамиче-
ских нагрузок. Последние могут проходить после коррекции порока.
Наиболее частыми и безопасными являются выраженные откло-
нения электрической оси сердца (чаще влево), встречающиеся при ат-
риовентрикулярной коммуникации, двойном отхождении сосудов от
правого желудочка, единственном желудочке (левожелудочкового ти-
па), корригированной транспозиции магистральных артерий, анома-
лии Эбштейна. В случаях, когда во время операции разрушают суб-
страт электрофизиологических нарушений (как, например, правые до-
полнительные пути при аномалии Эбштейна), положение электриче-
ской оси сердца может измениться.
Нарушения атриовентрикулярной проводимости различной сте-
пени характерны для корригированной транспозиции магистральных
артерий, а также вторичного ДМПП, особенно его так называемой се-
мейной формы.
Аномалии формирования синусового импульса обычно сопрово-
ждают ДМПП типа sinus venosus или левый изомеризм, при котором
отсутствует морфологически правое предсердие и нет анатомического
субстрата для нормального синусного узла.
У пациентов с объемной перегрузкой предсердий вследствие внут-
рисердечного шунтирования крови или недостаточности атриовентри-
кулярных клапанов часто развивается тахиаритмия в виде наджелу-
дочковой тахикардии, фибрилляции или трепетания предсердий. В не-
которых случаях возможна нормализация ритма после корригирующей
операции.
Дисфункция клапанов
В эту группу входят аномалии формирования клапанов, не позво-
ляющие восстановить их адекватную запирающую функцию, а также
357
предрасполагающие к последующим гемодинамическим расстрой-
ствам. Типичными примерами являются общий атриовентрикулярный
канал и двухстворчатый аортальный клапан. Трудно также надеяться
на длительный устойчивый эффект после устранения клапанного аор-
тального стеноза.
Дисфункция желудочков
Данная группа включает изменения массы и структуры миокарда,
а также изменения конфигурации камер сердца и функциональных ха-
рактеристик желудочков. Эти нарушения могут быть врожденными или
формироваться в период существования порока, сохраняться после опе-
рации и определять ее результат. Так, например, в ряду: трикуспидаль-
ная атрезия, двуприточный левый желудочек, двуприточный правый
желудочек - функция системного желудочка прогрессивно ухудшает-
ся. В соответствии с этим, после операции Фонтена при этих пороках
степень сердечной недостаточности будет различной. Аналогичные ре-
зидуальные проблемы отмечаются у больных после гемодинамической
коррекции транспозиции магистральных артерий, когда правый желу-
дочек, обладающий относительно низкой насосной функцией и фрак-
цией выброса, остается работать в позиции системного желудочка.
Увеличение массы желудочков при ВПС может происходить дву-
мя основными способами. В незрелом миокарде (первые несколько ме-
сяцев жизни) обычно возникает повышенная гиперплазия (реплика-
ция) миоцитов наряду с продолжающейся их дифференцировкой. В зре-
лом миокарде гипертрофия миокарда характеризуется увеличением уже
существующих миоцитов. После операции, устраняющей перегрузку
желудочка, процесс уменьшения массы миокарда будет зависеть от ис-
ходного типа гипертрофии, степени жировой дистрофии и фиброза. В
связи с этим при одной и той же патологии можно ожидать различного
функционального результата в зависимости от возраста, в котором вы-
полнена операция.
Сосудистые поражения
Врожденные пороки сердца нередко сочетаются с дополнитель-
ными аномалиями магистральных сосудов, сосудов головного мозга,
коронарных артерий. В частности, коарктация аорты нередко сочета-
ется с аневризмой в виллизиевом круге; аортальный стеноз, тетрада
Фалло, коарктация аорты - с отклонениями в формировании коронар-
ных артерий. В ряде случаев врожденные изменения в среднем слое
сосудистой стенки, затрагивающие гладкомышечные, эластичные и
358
коллагеновые волокна, могут приводить к образованию аневризм и раз-
рывам аорты или легочной артерии (идиопатическая дилатация легоч-
ной артерии, синдром Марфана).
Серьезную проблему представляет гипертензия в системе малого
(синдром Эйзенменгера) или большого кругов кровообращения. Пер-
вая, как известно, развивается при длительном существовании боль-
шого сброса крови слева направо, вторая характерна для поздних опе-
раций по поводу коарктации аорты.
Прочие заболевания
Наиболее частыми патологиями, сочетающимися с ВПС, являют-
ся поражения центральной нервной системы, скелета, почек, иммун-
ной системы. Нередко все они входят в какой-либо генетический син-
дром (Дауна, Вильямса, Тернера, Холт-Орама и т.п.) [9]. В этих случа-
ях необходимо информировать пациентов заранее о прогнозе сопутст-
вующих заболеваний, так как нередко существует необоснованное мне-
ние, что «все пройдет после устранения порока сердца».
Не следует забывать, что пациенты с ВПС так же, как и другие
люди, подвержены недугам, обычно встречающимся в популяции, -
диабету, ишемической болезни сердца, эссенциальной артериальной
гипертензии. Гемодинамические расстройства, присущие ВПС, могут
провоцировать раннее возникновение этих и других заболеваний. Из-
вестно, например, что длительный цианоз способствует нарушениям
обмена, приводящим к холециститу [10].
23.3- Последствия операций
К данной группе относятся проблемы, тесно связанные с выпол-
ненной операцией, и избежать которых при настоящем уровне знаний
не представляется возможным. Сюда же тесно примыкают осложне-
ния - состояния, неожиданно возникающие во время или после опера-
ции вследствие погрешностей в работе медперсонала, отсутствия дос-
таточной информации о состоянии организма или несовершенства тех-
ники. Однако данная группа является достаточно динамичной, по ме-
ре совершенствования научных и практических знаний многие ослож-
нения уходят в прошлое. Наглядным подтверждением этого является,
например, снижение в несколько раз частоты послеоперационной ат-
риовентрикулярой блокады после коррекции неосложненных форм
ДМЖП.
359
Электрофизиологические расстройства
Наиболее частыми послеоперационными расстройствами являются
нарушения ритма, обычно связанные с рассечением стенки предсер-
дия, повреждением синусного узла или его артерии. В результате мо-
гут возникать синусовая брадикардия, предсердная тахиаритмия (тре-
петание, фибрилляция предсердий). Подобные нарушения отмечают
при операциях типа Фонтена, Мастарда или Сеннинга и даже после
устранения банального вторичного ДМПП. Коррекция первичного
ДМПП или ДМЖП может сопровождаться нарушениями атриовентри-
кулярной проводимости, так как проводятся манипуляции в зоне ат-
риовентрикулярного узла и ножек пучка Гиса. Полный атриовентрику-
лярный блок наиболее часто возникает при закрытии ДМЖП у боль-
ных с корригированной транспозицией магистральных артерий, при
которой имеется аномальный ход проводящих путей.
В случаях вентрикулотомии часто наблюдается замедление внут-
рижелудочковой проводимости (QRS >180 мс), что опасно в аспекте
внезапной смерти вследствие желудочковой тахиаритмии [10].
Дисфункция клапанов
Недостаточность полулунных клапанов наиболее часто можно ожи-
дать после коррекции тетрады Фалло или баллонной дилатации аор-
тального клапана. Нарушения функции атриовентрикулярных клапа-
нов редко связаны непосредственно с операцией, скорее с их исходной
патологией. Так, дефекты хирургического формирования митрального
и трикуспидального клапанов при полной форме атриовентрикуляр-
ного канала часто определяются отклонениями в подклапанном аппа-
рате, приводящими к затруднениям потока крови в желудочек или к
регургитации.
Дисфункция желудочков
Послеоперационные расстройства работы желудочков могут быть
связаны непосредственно с хирургическими манипуляциями, повреж-
дающими миокард (разрезы, замещение участка миокарда заплатой),
или быть имманентными для определенных операций (правый желу-
дочек в роли системного при гемодинамической коррекции транспо-
зиции магистральных артерий или при операции Фонтена). Наиболее
частыми следствиями являются нарушения ритма и развитие сердеч-
ной недостаточности.
360
Экзогенные материалы
При большинстве операций имплантируются заплаты, кондуиты,
клапаны, являющиеся по отношению к сердцу чужеродными материа-
лами. Наиболее приемлемыми являются аутоткани (перикард, сосуды,
клапаны), так как наряду с хорошими механическими свойствами они
являются нетромбогенными, неантигенными и резистентными к ин-
фекции. Однако их использование ограничено по понятным причинам.
Экзогенные биопротезы могут быть человеческого (гомографты) или
животного (ксенографты) происхождения. Большую группу составля-
ют синтетические материалы. Среди них наибольшей популярностью
пользуются изделия из Gore-Tex, обладающие высокой механической
прочностью и биохимической инертностью, в связи с чем они широко
используются в качестве заплат, сосудистых протезов или кондуитов.
Конструкции механических искусственных клапанов сердца дос-
таточно многочисленны, так как создание идеального протеза остает-
ся пока недостижимой целью. Основные проблемы относятся к разра-
ботке оптимального соотношения размеров и гемодинамических ха-
рактеристик клапана, а также его тромборезистентности.
Присутствие того или иного материала в организме пациента мо-
жет определять особенности наблюдения за ним и необходимость со-
ответствующего лечения, в частности, профилактику инфекции или
проведение антикоагулянтной терапии. Повторные оперативные вме-
шательства наиболее часто связаны с обструктивными поражениями
или отрывом сосудистых или клапанных протезов.
Прочие проблемы
Среди послеоперационных проблем, не связанных непосредствен-
но с сердцем, наиболее важное место занимают неврологические: су-
дорожные припадки, моторные нарушения, задержка психомоторного
развития. В большинстве случаев они являются следствием проведе-
ния искусственного кровообращения во время операции, артериаль-
ной гипотонии, микроэмболий в сосуды головного мозга. По мере со-
вершенствования технического обеспечения операции процент данных
нарушений снижается. Дальнейший прогресс может быть связан с ши-
рокой заменой ряда операций на интервенционные процедуры.
После операции Фонтена неблагоприятным фактором являются за-
стойные явления в большом круге кровообращения, замедление крово-
тока в сосудах головного мозга, с чем связывают более низкие познава-
тельные способности пациентов в сравнении с обычной популяцией [11].
Кроме того, частой проблемой являются белковые энтеропатии.
361
23.4. Организация специальных центров для
оказания помощи взрослым с врожденными
пороками сердца
В соответствии с тяжестью проблем, с которым пациенты достига-
ют взрослого возраста, формируются три естественных группы: 1) па-
циенты со сложными патологиями, требующими пожизненного наблю-
дения высококвалифицированными специалистами (экспертами) (20-
25%); 2) пациенты с патологиями, при которых потребность в эксперт-
ной оценке и лечении может возникать периодически (35-40%); 3) па-
циенты с простыми или практически полностью корригированными па-
тологиями, которые не требуют экспертного наблюдения (40%) [3].
Оценка состояния пациентов, коррекция проводимого лечения, вы-
явление новых осложнений требуют периодического контакта с высо-
коквалифицированным врачом-кардиологом, прошедшим специализи-
рованное обучение. Курс обучения включает сведения по лечению ВПС
в период детства и у взрослых, диагностические процедуры (ЭХОКГ -
трансторакальная и транспищеводная, магнитно-резонансная томогра-
фия, катетеризация сердца), послеоперационное ведение. С другой сто-
роны, врач обязан также ориентироваться в общей медицине, разби-
раться в вопросах взрослой кардиологии, включая ИБС и связанные с
этим исследования. Кроме того, он должен владеть техникой интер-
венционных вмешательств - коронарной ангиопластикой и стентиро-
ванием, а также баллонными процедурами, применяющимися при ВПС.
Врачи, специализирующиеся в области электрофизиологии, обязаны
разбираться в аритмиях, возникающих как при врожденных, так и при-
обретенных заболеваниях сердца, использовании электрокардиостиму-
ляторов и имплантируемых дефибрилляторов, технологиях аблации.
Как считают зарубежные исследователи, подготовка врача-эксперта,
ориентирующегося во всех указанных вопросах, занимает 5-6 лет [3,
12, 13].
Исходя из перечисленных проблем можно сделать вывод, что цен-
тры, где оказывается помощь подобным пациентам, должны базироваться
в учреждениях взрослой медицины, имеющих специалистов различно-
го профиля (в том числе неврологов, эндокринологов, общих хирургов,
гинекологов, генетиков). Наиболее важными и специализированными
подразделениями центра являются диагностическое и электрофизиоло-
гическое. В таком учреждении, помимо кардиологов, получивших спе-
циальное дополнительное образование, должны работать кардиохирур-
ги и анестезиологи, имеющие опыт детских и взрослых операций. Кро-
ме того, необходим тесный контакт с трансплантологами.
362
Как показывает первый опыт зарубежных исследователей, госпи-
тализация требуется незначительному числу больных - около 15%.
Главные причины госпитализации - общие терапевтические или хи-
рургические проблемы (инфекция, эндокардит, беременность, «несер-
дечные» операции). Непосредственно к кардиологическим действиям
относятся лечение нарушений ритма, интервенционные или диагно-
стические катетеризационные процедуры, реже - кардиохирургические
вмешательства. В случаях, требующих лечения сердечной недостаточ-
ности в условиях стационара, обычно речь идет о последующей транс-
плантации сердца. Учитывая, что потребность в госпитализации для
лечения или операций относительно невелика, она может быть удов-
летворена за счет специализированных региональных центров, объе-
диняющих большие территории на основании соответствующих ста-
тистических расчетов.
В Российской Федерации число больных, которым была проведе-
на хирургическая коррекция ВПС, увеличивается ежегодно на 7-12%
[6]. Можно ожидать, что в связи с улучшением послеоперационной вы-
живаемости и более качественной реабилитацией число этих пациен-
тов будет и дальше неуклонно расти. Изменения возрастной структу-
ры ВПС приводят к формированию взрослой популяция, в которой па-
раллельно существуют пациенты с неоперированными ВПС, полно-
стью корригированными пороками и хирургически модифицирован-
ной патологией. Охват этих людей полноценной кардиологической и
хирургической помощью - непростая задача, все больше привлекаю-
щая внимание врачей во многих странах мира, и решение ее может
привести к созданию нового раздела кардиологии.
Литература
1. PerloffJ.K. Pediatric congenital cardiac becomes a postoperative adult: The chang-
ing population of congenital heart disease//Circulation.- 1973.-Vol. 47.-P. 606-619.
2. Congenital heart disease after childhood: an expanding patient population: 22IHl Be-
thesda Conference. Maryland, Oktober 18-19. 1990//J.Am. Coll. Cardiol.- 1991.-
Vol. 18.- P. 311-342.
3. Grown-up congenital heart (GUCH) disease: Current needs and provision of service
for adolescents and adults with congenital heart disease in UK // Heart.- 2002.-
Vol. 88 (Suppl 1).- P. il-il4.
4. Wren С., О ‘Sullivan J. J. Survival with congenital heart disease and need for follow
up in adult life // Heart. - 2001.- Vol. 85.- P. 438-443.
5. Школьникова M.A., Абдулатипова И.В., Осокина ГГ Болезни сердечно-сосу-
дистой системы у детей в Российской Федерации // Врожденные и приобре-
тенные пороки сердца / Под ред. В.И. Макарова.- Архангельск, 2003.- С. 3-9.
363
6. Бокерия Л.А., Гудкова РГ Сердечно-сосудистая хирургия - 2001. Болезни и
врожденные аномалии системы кровообращения.-М.: Изд-во НЦССХ
им. А.Н. Бакулева РАМН, 2002.
7. Мартюшов С.И. Врожденные пороки сердца у взрослых // Врожденные и при-
обретенные пороки сердца / Под ред. В.И. Макарова. - Архангельск, 2003.-
С. 163-181.
8. Подзолков В.П., Плотникова Л.Г, Амиркулов Б.Д. ВПС у больных старше 30 лет:
структура, результаты хирургического лечения // Бюлл. НЦССХ им. А.Н. Баку-
лева РАМН.- 2000.- № 2.- С. 14.
9. Левченко Е.Г Врожденные пороки сердца у детей - синдромальные формы и
ассоциированные аномалии: диагностика и проблемы послеоперационного ве-
дения. - Дисс...канд. мед. наук.- М., 2003.
10. PerloffJ.K., Warnes С.A. Challenges posed by adults with repaired congenital heart
disease // Circulation.- 2001.- Vol. 103.- P. 2637-2643.
11. Wernovsky G., Stiles K.M., Gravreau K. et al. Cognitive development after the Fonten
operation // Circulation.- 2000.- Vol. 102.- P. 883-889.
12. Webb G.D. Challenges in the care of adult patients with congenital heart defects //
Heart.- 2003.- Vol. 89.- P. 465-469.
13. Qureshi S.A., Hobbins S.M., Naqvi N. A career in paeditric cardiology // BMJ.-
2003.- Vol. 327.- P. s3-s4.
364
Приложение 1.
Основные нормативы сердечно-сосудистой
системы у детей
Таблица 1
Частота пульса у детей [ 1 ]
Возраст | 1 1 II 1 111 1 IV I V 1 VI
До 2 нед 60 95 105 140 180 200
До 1 мес 50 90 НО 150 170 190
До 1 года 40 80 100 140 160 190
До 2 лет 40 70 85 130 150 190
До 4 лет 40 70 80 128 150 190
До 6 лет 40 65 75 125 140 190
До 8 лет 40 65 70 НО 140 190
До 10 лет 35 60 66 100 140 190
До 12 лет 35 60 65 95 130 190
До 14 лет 35 55 60 95 130 190
До 16 лет 35 52 60 90 130* 190
старше 17 лет 35 45 60 88 130 190
Примечание. Диапазон от I до II - выраженная синусовая брадикардия, от II до
III - синусовая брадикардия, от III до IV - синусовый ритм, от IV до V - синусовая
тахикардия, свыше V - выраженная синусовая тахикардия.
Таблица 2
Критерии брадикардии у детей [2]
Стандартная ЭКГ покоя Холтеровское мониторирование ЭКГ
Возраст, лет Минимальная ЧСС, | уд/мин Возраст Минимальная ЧСС, | уд/мин
0-1 <100 0-1 мес. <70
1-3 <100 1 мес-1 год <65
3-9 <60 7-11 лет <45
9-16 <50 12-16 лет <40
Таблица 3
Ориентировочные показатели артериального давления грудных детей
в зависимости от возраста и антропометрических параметров
Возраст Масса тела, кг Поверхность тела, м‘ Систолическое артериальное давление, мм рт. ст. Диастолическое артериальное давление, мм рт. ст.
новорожденный 3,0 0,23 65±8 41±6
1 мес 3,5 0,25 92±8 59±7
3 мес 5,0 0,31 90±7 58±8
6 мес 6,0 0,38 89±9 58±1О
1 год 8,0 0,47 98±4 54±4
365
Таблица 4
Значения 90 и 95 перцентилей систолического и диастолического
артериального давления у мальчиков в возрасте от 1 до 17 лет
в зависимости от перцентильного распределения их роста [3]
Систолическое АД, мм рт. ст. Диастолическое АД, мм рт. с г.
Возраст. Перцентили перцентили роста * перцентили роста *
годы АД 5-й 10-й 25-й 50-й 75-й 90-й 95-й 5-й 10-й 25-й 50-й 75-й 90-й 95-й
। 90-й 94 95 97 98 100 102 102 50 51 52 53 54 54 55
95-й 98 99 101 102 104 106 106 55 55 56 57 58 59 59
90-й 98 99 100 102 104 105 106 55 55 56 57 58 59 59
2 95-й 101 102 104 106 108 109 110 59 59 60 61 62 63 63
90-й 100 101 103 105 107 108 109 59 59 60 61 62 63 63
95-й 104 105 107 109 111 112 ИЗ 63 63 64 65 66 67 67
90-й 102 103 105 107 109 110 111 62 62 63 64 65 66 66
95-й 106 107 109 111 1 13 114 115 66 67 67 68 69 70 71
90-й 104 105 106 108 110 112 112 65 65 66 67 68 69 69
5 95-й 108 109 110 112 114 115 116 69 70 70 71 72 73 74
А 90-й 105 106 108 110 111 ИЗ 114 67 68 69 70 70 71 72
О 95-й 109 110 112 114 1 15 117 117 72 72 73 74 75 76 76
7 90-й 106 107 109 111 ИЗ 114 115 69 70 71 72 72 73 74
95-й 110 111 ИЗ 115 116 118 119 74 74 75 76 77 78 78
я 90-й 107 108 110 112 114 115 116 71 71 72 73 74 75 75
о 95-й 111 112 114 116 118 119 120 75 76 76 77 78 79 80
о 90-й 10 110 112 ИЗ 115 117 117 72 73 73 74 75 76 77
7 95-й 113 114 116 117 119 121 121 76 77 78 79 80 80 81
90-й НО 1 12 ИЗ 115 117 118 119 73 74 74 75 76 77 78
95-й 114 115 117 119 121 122 123 77 78 79 80 80 81 82
11 90-й 112 ИЗ 115 117 119 120 121 74 74 75 76 77 78 78
95-й 116 117 119 121 123 124 125 78 79 79 80 81 82 83
1 7 90-й 115 116 117 119 121 123 123 75 75 76 77 78 78 79
1 Z 95-й 119 120 121 123 125 126 127 79 79 80 81 82 83 83
1 7 90-й 117 118 120 122 124 125 126 75 76 76 77 78 79 80
1 J 95-й 121 122 124 126 128 129 130 79 80 81 82 83 83 84
14 90-й 120 121 123 125 126 128 128 76 76 77 78 79 80 80
95-й 124 125 127 128 130 132 132 80 81 81 82 83 84 85
1 с 90-й 123 124 125 127 129 131 131 77 77 78 79 80 81 81
1 J 95-й 127 128 129 131 133 134 135 81 82 83 83 84 85 86
1 А 90-й 125 126 128 130 132 133 134 79 79 80 81 82 82 83
J О 95-й 129 130 132 134 136 137 138 83 83 84 85 86 87 87
1 7 90-й 128 129 131 133 134 136 136 81 81 82 83 84 85 85
1 / 95-й 132 133 135 136 138 140 140 85 85 86 87 88 89 89
Примечание. * Перцентиль роста определяется по стандартным таблицам.
366
Таблица 5
Значения 90 и 95 перцентилей систолического и диастолического
артериального давления у девочек в возрасте от 2 до 17 лет
в зависимости от перцентильного распределения их роста [3]
Возраст, годы Перцентили АД Систолическое АД, мм рт. ст. Диастолическое АД, мм рт. ст.
перцентили зоста * перцентили роста *
5-й 10-й 25-й 50-й 75-й 90-й 95-й 5-й 10-й 25-й 50-й 75-й 90-й 95-й
। 90-й 97 98 99 100 102 103 104 53 53 53 54 55 56 56
95-й 101 102 103 104 105 107 107 57 57 57 58 59 60 60
0 90-й 99 99 100 102 103 104 105 57 57 58 58 59 60 61
95-й 102 103 104 105 107 108 109 61 61 62 62 63 64 65
7 90-й 100 100 102 103 104 105 106 61 61 61 62 63 63 64
95-й 104 104 105 107 108 109 110 65 65 65 66 67 67 68
90-й 101 102 103 104 106 107 108 63 63 64 65 65 66 67
4 95-й 105 106 107 108 109 111 111 67 67 68 69 69 70 71
с 90-й 102 103 104 106 107 108 109 65 66 66 67 68 68 69
J 95-й 107 107 108 110 111 112 1 13 _69_ 70 70 71 72 72 73
90-й 104 105 106 107 109 110 111 67 67 68 69 69 70 71
95-й 108 109 110 111 1 12 114 114 71 71 72 73 73 74 75
90-й 106 107 107 109 110 112 112 69 69 69 70 71 72 72
95-й 110 110 112 113 1 14 115 116 73 73 73 74 75 76 76
90-й 108 109 НО 111 112 113 114 70 70 71 71 72 73 74
8 95-й 112 112 113 115 116 117 1 18 74 74 75 75 76 77 78
Q 90-й НО НО 112 ИЗ 114 115 1 16 71 72 72 73 74 74 75
V 95-й 114 114 115 117 118 119 120 73 76 76 77 78 78 79
1 Л 90-й 112 112 114 115 116 117 1 18 73 73 73 74 75 76 76
1 и 95-й 1 16 116 117 119 120 121 122 77 77 77 78 79 80 80
1 1 90-й 114 114 116 117 1 18 119 120 74 74 75 75 76 77 77
1 1 95-й 118 118 119 121 122 123 124 78 78 79 79 80 81 81
1 7 90-й 116 116 118 119 120 121 122 75 75 76 76 77 78 78
J Z 95-й 120 120 121 123 124 125 126 79 79 80 80 81 82 82
1 д 90-й 118 118 119 121 122 123 124 76 76 77 78 78 79 80
1 3 95-й 121 122 123 125 126 127 128 80 80 81 82 82 83 84
1 Л 90-й 119 120 121 122 124 125 126 77 77 78 79 79 80 81
1Ч 95-й 123 124 125 126 128 129 130 81 81 82 83 83 84 85
90-й 121 121 122 124 125 126 127 78 78 79 79 80 81 82
15 95-й 124 125 126 128 129 130 131 82 82 83 83 84 85 86
1 А 90-й 122 122 123 125 126 127 128 79 79 79 80 81 82 82
1 о 95-й 125 126 127 128 130 131 132 83 83 83 84 85 86 86
1 7 90-й 122 123 124 125 126 128 128 79 79 79 80 81 82 82
1 / 95-й 126 126 127 129 130 131 132 83 83 83 84 85 86 86
Примечание. * Перцентиль роста определяется по стандартным таблицам.
Нормальное артериальное давление - средние уровни
систолического и диастолического давления при трех обследованиях,
не превышающие значения 89-го перцентиля для данного возраста, пола
и роста.
Высокое нормальное артериальное давление - средние уровни
систолического и/или диастолического давления на трех визитах,
равные или превышающие значения 90-го перцентиля, но меньшие
значений 95-го перцентиля для данного возраста, пола и роста.
Артериальная гипертензия - средние уровни систолического и/или
диастолического давления на трех визитах, равные или превышающие
значения 95-го перцентиля для данного возраста, пола и роста.
367
Таблица 6
Основные нормативные показатели стандартной ЭКГ покоя у детей [2'
Параметр ЭКГ Возраст
1-4 нед 1-2 мес 3-5 мес 6-11.MCC 1-2 1. 3-4 г. 5-7 л. 8-11 л. 12-15 л.
Ось QRS. мин.- макс. <а (+) 65-161 31-113 7-104 6-99 7-101 6-104 11-143 9-114 15-110
PR мин-макс, с 0,07-0,14 0,07-0,13 0,07-0,15 0,07-0,16 0,08-0,15 0,09-0,16 0,09-0,16 0,09-0,17 0,09-0,18
QRS,c 0,05 0,05 0,05 0,05 0,06 0,06 0,06 0,06 0,06
R Vi мин.-макс., мм 3-21 3-18 3-20 1,5-20 2,5-17 1-18 0,5-14 0-12 1-14
5 Vi мин.-макс., мм 0-11 0-12 0-17 0,5-18 0,5-1 0,2-21 0,3-24 0,3-25 0,3-25
R V6, мин.- макс.. мм 2,5-16,5 5-21,5 6,5-22,5 6-22,5 6-22,5 8-24,5 8,5-26,5 9-25,5 9-25,5
5 V6 мий.-макс., мм 0-10 0-6,5 0-10 0-7 0-6,5 0-5 0—4 0-4 0-4
Q ш макс., мм 6 7,5 6,5 8,5 6 5 4 3 3
Q V6 макс., мм 3 3 3 3 3 3,5 4,5 3 3
Таблица 7
Основные нормативные морфометрические показатели у детей,
определенные с помощью ЭХОКГ
(минимальное - максимальное значения) [4]
Масса гела, KI Пол кдцлж КСД ЛЖ ДАо длп дпж ТЗС ЛЖд ТМЖПд ТСС ПЖд
2.0-2,5 М 13-20 8-13 7-12 9-15 2-13 2-4 2-6 1-3
Д 12-19 8-12 7-10 8-14 2-12 2-4 2-5 1-3
2,6-3,0 м 14-21 9-14 8-12 9-16 2-13 2-4 2-6 1-3
д 13-20 8-13 7-11 9-15 2-12 2-4 2-5 1-3
3,1-3,5 м 15-22 9-15 8-13 10-17 2-14 2-4 2-6 1-3
Д 14-21 9-15 7-12 9-16 2-13 2-4 2-5 1-3
3,6-4,0 м 16-24 10-16 9-13 10-17 2-14 2-5 2-6 1-3
д 15-22 9-15 8-12 10-17 2-13 2-4 2-5 1-3
4,1-4,5 м 17-25 10-17 9-14 11-18 2-14 3-5 2-6 1-3
Д 16-24 9-16 9-13 10-17 2-13 2-4 2-5 1-3
4,6-5,0 м 17-26 11-17 9-14 11-19 2-14 3-5 2-6 1-3
д 16-25 10-16 9-13 11-18 2-13 2-4 2-5 1-3
5,1-6,0 М 18-26 11-18 10-15 12-19 2-14 3-5 2-6 1-3
д 17-25 10-17 9-14 12-19 2-14 2-5 2-6 1-3
6,1-7,0 м 19-28 12-19 10-16 12-20 3-14 3-5 2-6 1-3
д 18-26 11-18 10-15 12-19 2-14 3-5 2-6 1-3
м 20-29 12-20 11-16 13-21 3-14 3-6 2-6 1-3
7,1-8,0 д 19-28 12-18 10-16 12-20 2-14 3-5 2-6 1-3
8,1-9,0 м 21-31 13-21 11-17 13-22 3-14 3-6 2-6 1-3
д 20-30 12-20 10-17 13-21 3-14 3-6 2-6 1-3
9,1-10,0 м 22-32 13-22 12-18 14-23 3-14 3-6 2-6 1-4
д 21-31 13-21 11-17 13-22 3-14 3-6 2-6 1-3
10,1-15,0 м 24-34 14-22 12-18 14-24 4-14 3-6 3-6 1-4
д 23-33 13-21 11-17 13-22 3-14 3-6 3-6 1-3
м 26-37 16-26 14-21 16-27 5-15 4-7 3-6 2-4
15.1-20.0 д 25-37 15-25 12-19 15-25 4-14 3-6 3-6 1-3
20,1-25,0 м 30-39 17-28 15-23 17-29 5-15 4-7 4-6 2-4
д 29-38 16-26 13-19 16-27 5-14 4-7 4-7 1-3
368
Таблица 7 (продолжение)
Основные нормативные морфометрические показатели у детей,
определенные с помощью ЭХОКГ
(минимальное - максимальное значения) [4]
Масса тела, кг Пол КДДЛЖ КСД ЛЖ ДАо длп дпж T3C ЛЖд ТМЖПд ТСС ПЖд
25,1-30.0 М 32-41 19-30 16-24 19-30 6-15 4-7 4-7 2-4
д 31-39 18-28 14-20 17-29 5-14 4-7 4-7 1-3
30,1-35,0 м 34-44 20-32 17-26 20-31 7-16 4-8 5-8 2-4
д 33-42 19-29 14-22 18-30 6-14 4-7 5-7 1-3
35,1-40,0 м 36-47 21-33 18-27 20-31 8-16 5-8 5-8 2-4
д 34-44 20-31 15-25 19-30 7-14 5-8 5-8 1-3
40,1-45,0 м 38-50 22-35 19-28 20-31 8-16 5-8 5-9 2-4
д 35-46 21-32 16-26 20-30 7-14 5-8 5-8 2-4
45,1-50,0 м 39-51 22-35 19-29 21-32 9-16 5-9 5-9 2-4
д 36-47 21-31 16-28 20-30 8-15 5-8 5-9 2-4
50,1-55,0 м 40-51 23-35 20-30 21-32 9-17 5-9 5-9 2-4
д 39-48 22-33 17-29 20-31 8-15 5-9 5-9 2-4
м 41-52 24-36 21-31 22-33 10-17 6-9 5-10 2-4
55.1-60,0 д 38-49 23-34 19-30 21-32 8-15 5-9 5-9 2-4
60,1-65,0 м 41-53 25-37 21-32 23-33 10-18 6-10 6-10 2-4
д 39-51 25-35 20-31 22-32 9-17 6-10 5-10 2-4
Примечание. КДД ЛЖ - конечный диастолический диаметр ЛЖ;
КСД ЛЖ - конечно-систолический диаметр ЛЖ; Д Ао - диаметр корня аорты;
Д ЛП - диаметр левого предсердия; Д ПЖ - диаметр правого желудочка;
ТЗСЛЖд - толщина задней стенки ЛЖ в диастолу; ТМЖПд - толщина
межжелудочковой перегородки в диастолу; ТСС ПЖд - толщина свободной стенки
ПЖ в диастолу; измерения в парастернальной позиции по длинной оси.
Таблица 8
Формулы для расчета нормальных диаметров сосудов, определяемых
на основании эхокардиографии [5]
Место измерения Сосуд Формула расчета
Супрастернальная позиция по длинной оси Дуга аорты -0,0356 + 1,343 • BSA12
Супрастернальная позиция по короткой оси Дуга аорты 0,00465 + 1,739 • BSA12
Парастернальная позиция по коровой оси Легочный ствол 0,0946+ 1.544 • BSA12
Парастернальная позиция по короткой оси Правая легочная артерия -0,00372 + 1,160 • BSA12
Примечание. BSA - поверхность тела в м2.
369
Таблица 9
Средние диаметры клапанов сердца в норме (мм)
(Rowlatt U. et al.; в модификации Pacifico А., 1983)
Поверхность тела, м2 Митральный клапан Трикуспидальный клапан Аортальный клапан Легочный клапан
0,25 11.2 13,4 7,4 8,4
0,30 12,6 14,9 8,4 9,3
0,35 13.6 16,2 8,9 10,1
0,40 14,4 17,3 9,5 10,7
0,45 15,2 18,2 10,1 11,3
0,50 15.8 19,2 10,7 11,9
0,60 16,9 20,7 11,5 12,8
0,70 17,9 21,9 12.3 13,5
0,80 18,8 23,0 13.0 14,2
0.90 19,7 24,0 13,4 14,8
1.0 20,2 24,9 14,0 15,3
1.2 21,4 26,2 14,8 16,2
1.4 22,3 27,7 15,5 17,0
1,6 23,1 28,9 16,1 17,6
1,8 23,8 29,1 16,5 18,2
2.0 24,2 30, 17,2 18,0
Примечание. Стандартные отклонения для митрального клапана при BSA
<0,3 м2 равны ±1,9 мм, при BSA >О,Зм2 равны ±2,0 мм. Сигмальные отклонения для
трикуспидального клапана при BSА < 1,0 м2 равны ± 1,7 мм, при BSА > 1,0 м2 равны
±1,5 мм.
Таблица 10
Максимальные скорости кровотока, зарегистрированные в режиме
допплер-эхокардиографии у здоровых детей [6]
Локализация потока | Скорость, м/с
Митральный клапан 1,0 (0,8-1,3)
Трикуспидальный клапан 0,6 (0,5-1,1)
Легочный ствол 0,9 (0,7-1,1)
Левый желудочек 1,0 (0.7-1,2)
Нисходящая грудная aop ia 1,5 (1,2-1,8)
Таблица 11
Значения скорости систолы левого предсердия (VA), соотношения
кровотока раннего наполнения левого желудочка и потока
предсердной систолы (VE/VA) и фракция левого предсердия у
здоровых детей в зависимости от частоты ритма сердца [7]
ЧСС, уд/мин | Скорость VА, м/с | VE/VA | Фракция ЛП, %
40-59 0,34±0,09 3,2±0,8 15.2±5,7
60-69 0,44±0,08 2,4±0,5 18.6±4,8
70-79 0,48±0,05 2,1 ±0,2 21,2±2,3
80-89 0,53±0,06 1,7±0,5 26,7±6,9
90-99 0,67±0,15 1,6±0,3 28,9±5,7
100-109 0,72±0,12 1,5±0,2 28,6±5,5
110-119 0,80±0,12 1,3±О,3 33,3+5,5
120-129 0,86±0,13 1,2±0,2 32,4±5,6
130-139 0,84±0,07 1,2±0.1 34,3±6,4
370
Таблица 12
Расчетное среднее давление в легочной артерии по Kitabatake А.
(мм рт. ст.) [8]
ВУ/ВИ | Среднее ДЛА | ВУ/ВИ | Среднее ДЛА
0,20 69 0,33 30
0,21 64 0,34 28
0,22 60 0,35 26
0,23 57 0,36 24
0,24 53 0,37 23
0,25 50 0,38 21
0,26 47 0,39 20
0,27 44 0,40 19
0,28 41 0,41 17
0,29 38 0,42 16
0,30 36 0,43 15
0,31 34 0,44 J4
0,32 31 0,45 13
Примечание. ДЛА - давление в легочной артерии; ВУ - время ускорения; ВИ -
время изгнания.
Литература
1. Вельтищев Ю.Е., Ветров В.П. Объективные показатели нормального разви-
тия и состояния здорового ребенка (нормативы детского возраста) // Росс, вести,
перинатол. и педиатрии. - Приложение. - М, 2002. - 96 с.
2. Макаров Л.М. ЭКГ в педиатрии. - М: Медпрактика-М, 2002. - 276 с.
3. Update on the 1987 Task Force Report on the high blood pressure in children and
adolescents. National High Blood Pressure Education Program Working Group on
Hypertension Control in Children and Adolescents // Pediatrics - 1996 - Vol. 98.-
№4, Part I.-P. 649-658.
4. Бечозеров Ю.М., Потылико Г.Н., Болбиков В.В., Гнусаев С.Ф. Ультразвуковая
семиотика и диагностика в кардиологии детского возраста. - М, 1995. - 176 с.
5. Snider A.R., Enderlein М.А., Teitel D.F., Jusre R.P. Two-dimensional echocardio-
graphic determination of aortic and pulmonary artery sizes from infancy to adult-
hood in normal subjects // Am. J. Cardiol.- 1984.- Vol. 53.- P. 218-224.
6. Алехин M.H., Седов В.П. Допплер-эхокардиография. - М, 1997. - 80 с.
7. Верченко Е.Г. Факторы риска и гемодинамические механизмы развития арит-
могенной кардиомиопатии.-Дисс...канд.мед.наук. - М., 2003.
8. Клиническое руководство по ультразвуковой диагностике. Том V. / Под
ред. В.В. Митькова, В.А. Сандрикова. - М: ВИДАР. - 1998. - 360 с.
371
Приложение 2
Схемы основных операций, применяемых при
лечении врожденных пороков сердца
В процессе наблюдения за пациентами с ВПС перед врачом-кар-
диологом рано или поздно встает вопрос о необходимости выполнения
хирургического вмешательства. С другой стороны, нередко на приеме
оказывается больной, знающий только название выполненной ему опе-
рации. Некоторые из вмешательств зачастую существенно модифици-
руют структуру сердца, имеют характерную аускультативную картину,
эхокардиографическое изображение. Таким образом, представления об
основных кардиохирургических процедурах являются неотъемлемой ча-
стью кардиологического образования. В настоящем приложении пред-
ставлены схемы наиболее широко применяемых операций, за исключе-
нием самых простых (перевязка ОАП, пластика ДМПП или ДМЖП).
1. Межартериальный анастомоз
Анастомоз предназначен для увеличения легочного кровотока и
создается в основном при цианотических ВПС со сниженным крово-
током. Может быть наложен: между восходящей аортой и правой ле-
гочной артерией (анастомоз Кули-Эдвардса) - 1; между нисходящей
аортой и левой легочной артерией (анастомоз Поттса) - 2; с помощью
правой подключичной артерии, вшиваемой в легочную артерию (клас-
сический анастомоз Блелока-Тауссиг) - 3; с помощью протеза между
372
подключичной артерией и легочной артерией (модифицированный ана-
стомоз Блелока-Тауссиг) - 4; с помощью протеза между восходящей
аортой и легочным стволом (центральный анастомоз) - 5.
2. Коррекция коарктации аорты
А
В
Анастомоз конец в конец. Основная операция при коарктации аор-
ты, которая заключается в резекции измененного участка аорты (А) с
последующим сшиванием сегментов аорты (Б, В).
Истмопластика аорты левой подключичной артерией. Перевя-
зывают дистальный участок левой подключичной артерии с ее ветвя-
ми, обязательно - левую позвоночную артерию (А). Затем рассекают
аорту и культю подключичной артерии продольно (Б). Лоскут подклю-
чичной артерии вшивают в зону рассечения аорты (В).
373
Модифицированная истмопластика аорты левой подключичной ар-
терией. Перевязывают дистальный участок левой подключичной арте-
рии с ее ветвями, обязательно - левую позвоночную артерию. Резециру-
ют аорту в пределах здоровых тканей (А). Гипоплазированный перешеек
аорты и левую подключичную аорту рассекают продольно. Формируют
заднюю стенку аорты, сшивая концы сегментов аорты (Б). Формируют
переднюю стенку с использованием лоскута левой подключичной арте-
рии (В). Преимущество операции перед традиционной истмопластикой
заключается в полном удалении патологической дуктальной ткани.
3. Суживание легочной артерии
Операцию выполняют с двумя различными целями: 1) для умень-
шения легочного кровотока; 2) для повышения нагрузки на желудочек
с целью его тренировки (например, перед операцией артериального пе-
реключения у больных с транспозицией магистральных артерий).
В первом случае создают дозированное сужение, которое рассчиты-
вают по формуле «Торонто 1»: L = 21 + Р или «Торонто 2»: L = 24 + Р (у
больных, которым не планируется радикальная коррекция порока в бли-
жайшие месяцы),
где L - длина манжеты, мм, Р - вес больного, кг.
374
Во втором случае суживают легочную артерию по формуле «То-
ронто 1» или пока давление в «легочном» желудочке не достигнет 70%
от системного давления.
4. Радикальная коррекция тетрады Фалло
Радикальная коррекция тетрады Фалло включает закрытие ДМЖП
и устранение легочного стеноза. Последнее заключается в иссечении
инфундибулярного стеноза, пластике легочного клапана, расширении
выводного отдела правого желудочка заплатой. При трансаннулярной
пластике заплата переходит с желудочка на легочный ствол. В таких
случаях нередко используют заплату с моностворкой для уменьшения
легочной регургитации.
5. Коррекция атриовентрикулярного канала
А Б
При частичной форме порока закрывают заплатой первичный
ДМПП и ушивают расщепление передней створки митрального кла-
пана (А); при полной форме атриовентрикулярного канала операция
включает закрытие заплатой ДМЖП, закрытие заплатой ДМПП (та-
ким образом, чтобы разделить общий клапан на митральный и трикус-
пидальный компоненты) и ушивание расщепления в створке митраль-
ного клапана (Б).
375
6. Операция Фонтена
Операцию выполняют для коррекции ВПС, при которых у боль-
ных имеется лишь один полноценный желудочек (единственный же-
лудочек, трикуспидальная атрезия, атриовентрикулярный канал с не-
сбалансированными желудочками и т.п.). После данной операции един-
ственный полноценный желудочек нагнетает кровь в аорту, а кровь в
легочные сосуды из системных вен поступает самотеком. В качестве
первого этапа может быть выполнен кавопульмональный двунаправ-
ленный анастомоз (операция Гленна) (А). В окончательном варианте
операция Фонтена представлена либо в классическом исполнении с
внутрипредсердным туннелем (без его перфорации или с перфораци-
ей, разгружающей малый круг кровообращения) (Б), либо с экстракар-
диальным туннелем (В).
7. Гемодинамическая коррекция транспозиции
магистральных артерий (предсердное переключение, atrial
лв switch)
Операцию выполняют на уровне предсердий. При операции Мас-
тарда используется специально выкроенная заплата из аутоперикарда
или синтетического материала, при операции Сеннинга - собственные
ткани предсердий.
376
Иссекается межпредсердная перегородка. Заплата подшивается та-
ким образом, чтобы кровь из полых вен направлялась в митральный
клапан и далее в легочную артерию, а кровь из легочных вен поверх
заплаты - в трикуспидальный клапан и далее в аорту. Системным же-
лудочком остается морфологически правый желудочек. Примечание. ВПВ
- верхняя полая вена, НПВ - нижняя полая вена, ТК - трикуспидальный клапан,
МК - митральный клапан, ЛВ - легочные вены. Белая стрелка - артериальная кровь,
черная стрелка - венозная кровь.
8. Анатомическая коррекция транспозиции
магистральных артерий (артериальное переключение,
arterial switch, операция Jatene)
Операцию выполняют на уровне магистральных сосудов, кото-
рые меняют местами. Одновременно перемещают коронарные арте-
рии. Роль системного желудочка выполняет морфологически левый
желудочек.
В ходе операции пересекают аорту и легочный ствол, иссекают
устья коронарных артерий с участками стенки аорты (А). Затем коро-
нарные артерии имплантируют в корень бывшего легочного ствола и
подшивают к нему дистальную аорту (Б, В). С помощью заплат вос-
станавливают целостность коронарных синусов в бывшей аорте и со-
единяют С ней бифуркацию легочного ствола (Г). Примечание. Сосуд со
штриховкой - легочная артерия.
377
9. Коррекция аномалии Эбштейна
Для создания компетентного атриовентрикулярного клапана ис-
пользуют наиболее мобильную створку клапана (обычно переднюю,
но можно и заднюю). Одновременно с этим уменьшают (плицируют)
полость агриализированного желудочка, или эту часть перемещают под
клапан, инкорпорируя ее в «истинный» правый желудочек.
10. Коррекция тотального аномального дренажа легочных
А Б В Г
Основная цель операции - создать сообщение между легочными
венами и левым предсердием. При супракардиальном (А) и инфракар-
диальном (Г) дренаже это достигается наложением прямого анастомо-
за между коллектором легочных вен и задней стенкой левого предсер-
дия. При интракардиальных вариантах дренажа (Б, В) специальным
образом вшивается заплата, разграничивающая левое предсердие с ле-
гочными венами от правого предсердия с системными венами.
378
11. Операция Растелли
Основная патология, при которой применяют данную операцию,
- транспозиция магистральных артерий в сочетании с ДМЖП и легоч-
ным стенозом. Во время операции пересекают легочный ствол и уши-
вают проксимальный его конец. Вшивают внутрижелудочковую запла-
ту таким образом, чтобы с аортой сообщался только системный желу-
дочек. Между венозным желудочком и дистальным концом легочного
ствола вшивают клапанно-содержащий кондуит.
12. Коррекция общего артериального ствола
Доступом через правый желудочек закрывают ДМЖП таким об-
разом, чтобы с аортой (стволом) сообщался только левый желудочек.
В соответствии с этим трункальный клапан остается в системном же-
лудочке. Отсекают легочную артерию и закрывают дефект в стволе
(обычно с помощью заплаты). Между венозным желудочком (вентри-
кулотомным разрезом) и легочной артерией вшивают клапанно-содер-
жащий кондуит.
379
13. Операция Damus-Kaye-Stansel
Операцию Damus-Kaye-Stansel наиболее часто выполняют при
единственном желудочке с субаортальным стенозом. Легочную арте-
рию пересекают у бифуркации. В восходящей аорте рядом с легочной
артерией создают отверстие, которое соединяют с проксимальным сег-
ментом легочной артерии с помощью «капюшонообразного» трубча-
того протеза. Таким образом, кровь изгоняется в системное кровооб-
ращение через легочный и аортальный клапаны. Дистальное отверстие
в легочной артерии ушивают. Накладывают межартериальный шунт
для дозированного кровоснабжения легких.
14. Операция унифокализации легочных артерий
Операция включает несколько этапов.
Первый этап (показана двухсторонняя унифокализация): А - мно-
жественные коллатеральные сосуды отсекают от аорты и собирают вме-
сте; Б - создается источник легочного кровоснабжения с помощью меж-
артериального дозированного анастомоза. Второй этап: В - вновь соз-
данные легочные артерии соединяются с венозным желудочком с по-
мощью кондуита.
380
Используется при изолированной патологии аортального клапа-
на. Иссекают легочный клапан вместе с полоской правого желудочка и
участком легочного ствола (А). Стенозированный аортальный клапан
удаляют вместе с частью аорты, оставляя коронарные артерии с обод-
ком аортальной стенки (Б). Легочный аллографт (собственный клапан)
пришивают к аортальному кольцу и восходящей аорте. Коронарные
артерии имплантируют в аллографт. В легочную позицию импланти-
руют биологический клапан (В).
381
Издательство БИНОМ
готовит к выпуску:
Селия Окли, Кэрол А. Уорнес
БОЛЕЗНИ СЕРДЦА У БЕРЕМЕННЫХ
Пер. с англ.
Практическое руководство для врачей, наблюдающих за состоянием
женщин с заболеваниями сердца или с возможными
кардиологическими проблемами во время беременности и родов.
Оно будет полезно терапевтам и кардиологам стационаров,
акушерам, врачам общей практики и специалистам, медицинским
сестрам, непосредственно ухаживающим за пациентками, и
анестезиологам, отвечающим за безопасность родов, а также
генетикам, которые консультируют супружеские пары с болезнями
сердца в персональном или семейном анамнезе.
Объем 368 стр.
Срок выхода - IV квартал 2009 года
Издательство БИНОМ
готовит к выпуску:
М. Гэбриэл Хан
ФАРМАКОТЕРАПИЯ В КАРДИОЛОГИИ
Пер. с англ.
Перевод седьмого издания известного руководства по
фармакологическому и терапевтическому применению
лекарственных препаратов при лечении заболеваний сердца и
артериальной гипертензии. В книге представлена практическая
информация по свойствам, дозам, побочным эффектам, недостаткам
и преимуществам всех доступных в продаже кардиологических
препаратов.
Для кардиологов, врачей общей практики.
Объем около 600 стр.
Срок выхода - IV квартал 2009 года
Научное издание
Шарыкин Александр Сергеевич
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА
Руководство для педиатров, кардиологов, неонатологов
Второе издание
Художник - Груздкова О.С.
Оформление обложки - Шарыкина О.А., Мясникова С.О.
Компьютерная верстка - Станюкович А.А.
ISBN 978-5-9518-0368-9
Подписано в печать 15.07.2009. Формат 60x90 1/16
Бумага офсетная.Тираж 2000 экз. Заказ 8701
ООО Издательство БИНОМ
103473, Москва, ул. Краснопролетарская, 16
E-mail: info@binom-press.ru
При участии ООО «Эмпреза»
Отпечатано с готовых файлов заказчика в ОАО «ИПК
«Ульяновский Дом печати». 432980, г. Ульяновск, ул. Гончарова, 14
Рис. 6-3. Эхокардиограмма из парастернальной позиции по короткой
оси при большом открытом артериальном протоке. Цветное допплеровское
картирование выявляет распространенный турбулентный кровоток из области
бифуркации легочной артерии, достигающий середины легочного ствола; отмечается
значительное расширение легочного ствола по сравнению с аортой.
Рис. 7-3. Эхокардиограмма из высокой парастернальной позиции
по короткой оси при дефекте аортолегочной перегородки.
А - непосредственно над аортальным клапаном визуализируется отсутствие стенки
аорты, граничащей с проксимальным отделом легочного ствола; Б - цветное
допплеровское картирование выявляет турбулентный кровоток сброса в области
дефекта стенки, направленный из аорты в легочную артерию.
Рис. 8-4. Цветное допплеровское картирование из субкостальной
четырехкамерной позиции при вторичном дефекте межпредсердной
перегородки. А - артериовенозный кровоток; Б - веноартериальный кровоток
сброса через дефект.
Рис. 8-8. Эхокардиограмма при тотальном аномальном дренаже
легочных вен. А -субкостальный доступ, четырехкамерная позиция: позади сердца
визуализируется дополнительный сосуд - венозный коллектор; Б - цветное
допплеровское картирование из нестандартной позиции субкостального доступа
выявляет дополнительный турбулентный кровоток в зоне дренажа венозного
коллектора в правое предсердие.
Рис. 9-5. Эхокардиограмма из верхушечной четырехкамерной
позиции при перимембранозном субтрикуспидальном дефекте
межжелудочковой перегородки, осложненном высокой легочной
гипертензией. Визуализируется расширенный и гипертрофированный правый
желудочек; при цветном допплеровском картировании кровотока определяется
веноартериальный сброс с дефекта.
Рис. 9-6. Эхокардиограмма из верхушечной четырехкамерной
позиции при небольших множественных мышечных дефектах
межжелудочковой перегородки. Цветное допплеровское картирование выявляет
несколько локальных турбулентных потоков в межжелудочковой перегородке.
Рис. 13-13. Дуплексное сканирование левой позвоночной артерии
после истмопластики коарктации аорты. В правой позвоночной артерии (А)
и базальной артерии (Б) регистрируется нормальный антеградный кровоток
(направленный на рисунке книзу); в левой позвоночной артерии (В) - ретроградный
кровоток (направленный на рисунке кверху); Г - при компрессионной пробе
отмечается усиление патологического кровотока в левой позвоночной артерии.
Рис. 13-16. Эхокардиограммы из супрастернальной позиции по
длинной оси при перерыве дуги аорты. А - лоцируется расширение
восходящего отдела и дуги аорты, а также ветвей дуги аорты; отсутствует
продолжение аорты в области перешейка; Б - широкий открытый артериальный
проток дренируется в дистальный отрезок нисходящей грудной аорты.
Рис. 13-19. Эхокардиограммы из парастернальной позиции по
длинной оси при аорто-левожелудочковом туннеле. А - лоцируется
аномальное сообщение от восходящей аорты до выводного тракта левого желудочка
в виде аневризмы стенки аорты; туннель расположен кнаружи от фиброзного кольца;
Б-цветное допплеровское картирование выявляет ретроградный кровоток в туннеле
в диастолу и умеренную регургитацию крови из аорты в левый желудочек; видно
отклонение базального отдела межжелудочковой перегородки кпереди.
Рис. 14-2. Цветное допплеровское картирование потока митральной
регургитации второй степени в двухкамерной верхушечной позиции.
Рис. 14-4. Эхокардиограмма в верхушечной позиции при
митральном стенозе. Цветное допплеровское картирование в диастолу выявляет
турбулентный кровоток наполнения левого желудочка.
Рис. 15-2. Эхокардиограммы при аномалии Эбштейна.
А - верхушечная четырехкамерная позиция: выявляется смещение септальной
створки трикуспидального клапана к верхушке сердца; расширение правого
предсердия; Б - верхушечная позиция по длинной оси правого желудочка: при
цветном допплеровском картировании регистрируется турбулентный кровоток
выраженной регургитации на трикуспидальном клапане.
Рис. 17-2. Эхокардиограмма из супрастернального доступа по
длинной оси при синдроме гипоплазии левого сердца. Выявляются резкое
сужение восходящей аорты и дуги аорты; цветное допплеровское картирование
позволяет визуализировать ретроградное направление кровотока в дуге аорты (А) и
восходящей аорте (Б).
Рис. 18-2. Эхокардиограммы в парастернальной позиции по
короткой оси при аномальном отхождении левой коронарной артерии
от легочного ствола. А - визуализируется значительно расширенная правая
коронарная артерия; устье левой коронарной артерии в типичном месте не
определяется; Б - цветное допплеровское картирование позволяет выявить над
клапаном легочной артерии турбулентный кровоток в диастолу - сброс крови из
левой коронарной артерии в легочную артерию.
Рис. 18-3. Цветное допплеровское картирование в парастернальной
позиции по короткой оси при коронарно-легочной фистуле. В систолу в
легочном стволе регистрируется ламинарный кровоток; в диастолу выявляется
локальный («точечный») кровоток на уровне синуса легочной артерии,
противолежащего аорте.
Рис. 20-5. Транспищеводная эхокардиография. Установка Amplatzer-
окклюдера у больного с дефектом межпредсердной перегородки; определяется
небольшой резидуальный сброс крови в правое предсердие.
Александр Сергеевич Шарыкин -
доктор медицинских наук, профессор, в течение
многих лет работал в Научном центре сердечно-
сосудистой хирургии им. А. Н. Бакулева РАМН,
руководил отделением неонатальной интенсивной
кардиологии. Ведет консультативный приём в ФГУ
«Московский НИИ педиатрии и детской хирургии
Росмедтехнологий», в Детском консультативно-
диагностическом центре и на кафедре социальной
педиатрии ФГУ «Национальный медико-хирургический
центр им. Н. И. Пирогова Росздрава».
Область интересов - диагностика, терапия
и хирургическое лечение врожденных пороков сердца
у детей, начиная с периода новорожденности;
интервенционные процедуры и функциональные
исследования при патологии сердца.