Автор: Сулимов В.А. Маколкин В.И.
Теги: патология сердечно-сосудистой системы сердечно-сосудистые заболевания внутренние болезни медицина кардиология
ISBN: 5-225-04621-5
Год: 2001
Текст
Чреспищеподная
электрическая
стимуляция сердца
УДК 616.12-085.844
ББК 54.101
476Чреспищеводная электрическая стимуляция сердца/Под476 ред. В.А. Сулимова, В.И. Маколкина. — М.: Медицина,
2001. - 208 с.: ил. ISBN 5-225-04621-5В монографии обобщен 17-летний опыт применения чреспище-
водной электрической стимуляции сердца в кардиологической кли¬
нике. Показаны широкие возможности этого неинвазивного метода в
диагностике и лечении сердечно-сосудистых заболеваний. Представ¬
лены технические характеристики кардиостимуляторов и электродов,
используемых для проведения чреспищеводной электрической сти¬
муляции сердца (ЧПЭСС). Изложены основные электрофизиологи-
ческие критерии диагностики наиболее часто встречающихся надже-
лудочковых пароксизмальных тахикардий. Рассмотрено значение
ЧПЭСС в диагностике ИБС и подборе медикаментозной антианги-
нальной терапии.Для кардиологов, терапевтов, специалистов по функциональной
диагностике, электрофизиологов.ББК 54.101Transesophageal cardiac pacing. Eds V.A. Sulimov, V.I. Ma-
kolkin. — Moscow: Meditsina Publishers, 2001. — 208 p.: ill.
ISBN 5-225-04621-5The monograph summarizes the experience accumulated over 17 years
in using transesophageal cardiac pacing (TECP) in cardiological care. It
shows the great capacities of this noninvasive technique in the diagnosis and
treatment of various cardiovascular diseases. The technical data of cardiac
pacemakers and electrodes used for TECP are presented. Basic electro-
physiological criteria for diagnosing most common supraventricular parox¬
ysmal tachycardias are outlined. The value of TECP in diagnosing coronary
heart disease and choosing antianginal drug therapy is considered.Readership: cardiologists, internists, functional diagnostic physicians,
electrophysiologists.ISBN 5-225-04621-5 © Коллектив авторов, 2001Все права авторов защищены. Ни одна часть этого издания не может быть
занесена в память компьютера либо воспроизведена любым способом без
предварительного письменного разрешения издателя.
КОЛЛЕКТИВ АВТОРОВДубровский
Игорь АлександровичКанорский
Сергей ГригорьевичМаколкинВладимир ИвановичНовиковаНина АлександровнаПетрийВладимир ВикторовичПоповСергей ВалентиновичСулимоеВиталий Андреевичдоктор технических наук, профессор
кафедры электроники Московского
инженерно-физического института.доктор медицинских наук, профессор
кафедры госпитальной терапии Ку¬
банской государственной медицинс¬
кой академии.доктор медицинских наук, член-кор-
респондент Российской академии ме¬
дицинских наук, профессор, заведую¬
щий кафедрой внутренних болезней
№ 1 лечебного факультета Московс¬
кой медицинской академии им.
И.М. Сеченова.кандидат медицинских наук, врач от¬
деления интенсивной терапии и реа¬
нимации факультетской терапевтиче¬
ской клиники Московской медицин¬
ской академии им. И.М. Сеченова.кандидат медицинских наук, старший
научный сотрудник кафедры внутрен¬
них болезней № 1 лечебного факуль¬
тета Московской медицинской акаде¬
мии им. И.М. Сеченова.доктор медицинских наук, профессор,
руководитель отделения нарушений
ритма сердца научно-исследовательс¬
кого института кардиологии Томского
научного центра Сибирского отделе¬
ния Российской академии медицинс¬
ких наук.доктор медицинских наук, профессор
кафедры внутренних болезней № 1
лечебного факультета Московской
медицинской академии им. И.М. Се¬
ченова, заведующий отделением ин¬
тенсивной терапии и реанимации фа¬
культетской терапевтической
клиники Московской медицинской
академии им. И.М. Сеченова.3
ОГЛАВЛЕНИЕВведение 8Глава 1. Технические аспекты чреспищеводной электрической
стимуляции сердца. — И.Л.Дубровский 111.1. Основные характеристики чреспищеводных кардиостимуля¬
торов 111.2. Автоматизированные комплексы для чреспищеводной диаг¬
ностики 201.3. Основные характеристики пищеводных электродов 231.4. Особенности стимуляции желудочков 27Глава 2. Методика проведения чреспищеводной электрической
стимуляции сердца. — Н.А. Новикова 312.1. Общие правила 312.2. Техника введения и установки пищеводного электрода 312.3. Определение порога стимуляции 34Глава 3. Применение чреспищеводной электрической стимуляции
сердца для диагностики ишемической болезни сердца и подбора
медикаментозной антиангинальной терапии. — В.В. Петрий 363.1. Протокол проведения ЧПЭСС для диагностики ишемической
болезни сердца . 363.2. «Ускоренный» одноступенчатый тест чреспищеводной элект¬
рической стимуляции сердца 443.3. Сопоставление результатов теста ЧПЭС сердца с другими
нагрузочными и медикаментозными пробами в диагностике
ИБС 463.4. Комбинированное применение теста ЧПЭС сердца с ультра¬
звуковыми методиками (стресс-эхокардиография, стресс-доп-
плерэхокардиография) 513.5. Комбинированное применение теста чреспищеводной элект¬
рической стимуляции сердца с радиоизотопными методиками 573.6. Возможности теста ЧПЭС сердца для оценки эффективности
антиангинальных препаратов и индивидуального подбора ме¬
дикаментозной терапии у больных с ИБС 60Глава 4. Применение ЧПЭС сердца для купирования наджелудоч-
ковых тахикардий и трепетания предсердий. — Н.А. Новикова 684.1. Методика купирования наджелудочковых тахикардий и трепе¬
тания предсердий 684.2. Определение механизма тахикардии 704
Глава 5. Чреспищеводное электрофизиологическое исследование
у больных с синдромом слабости синусового узла. — Н.А. Новикова 74Глава 6. Чреспищеводное электрофизиологическое исследование
в дифференциальной диагностике пароксизмальных тахикардий
с широким комплексом QRS. — Н.А. Новикова 78Глава 7. ЧПЭС сердца у больных с наджелудочковыми пароксиз¬
мальными тахикардиями. — В.А. Сулимое 837.1. Современные представления об основных механизмах нару¬
шений ритма сердца , 837.2. ЧП ЭФИ у больных с различными формами наджелудочковых
пароксизмальных тахикардий 887.2.1. Протокол проведения чреспищеводного электрофизио-
логического исследования у больных с наджелудочковы¬
ми пароксизмальными тахикардиями 897.2.2. ЧП ЭФИ в диагностике пароксизмальной синусовой
тахикардии (синоатриальной реципрокной пароксиз¬
мальной тахикардии) 987.2.3. ЧП ЭФИ в диагностике предсердной пароксизмальной
тахикардии (без участия синоатриального или атриовен¬
трикулярного соединения) 997.2.4. ЧП ЭФИ в диагностике трепетания предсердий 997.2.5. ЧП ЭФИ в диагностике мерцания (фибрилляции) пред¬
сердий 1007.2.6. ЧП ЭФИ в диагностике атриовентрикулярной узловой
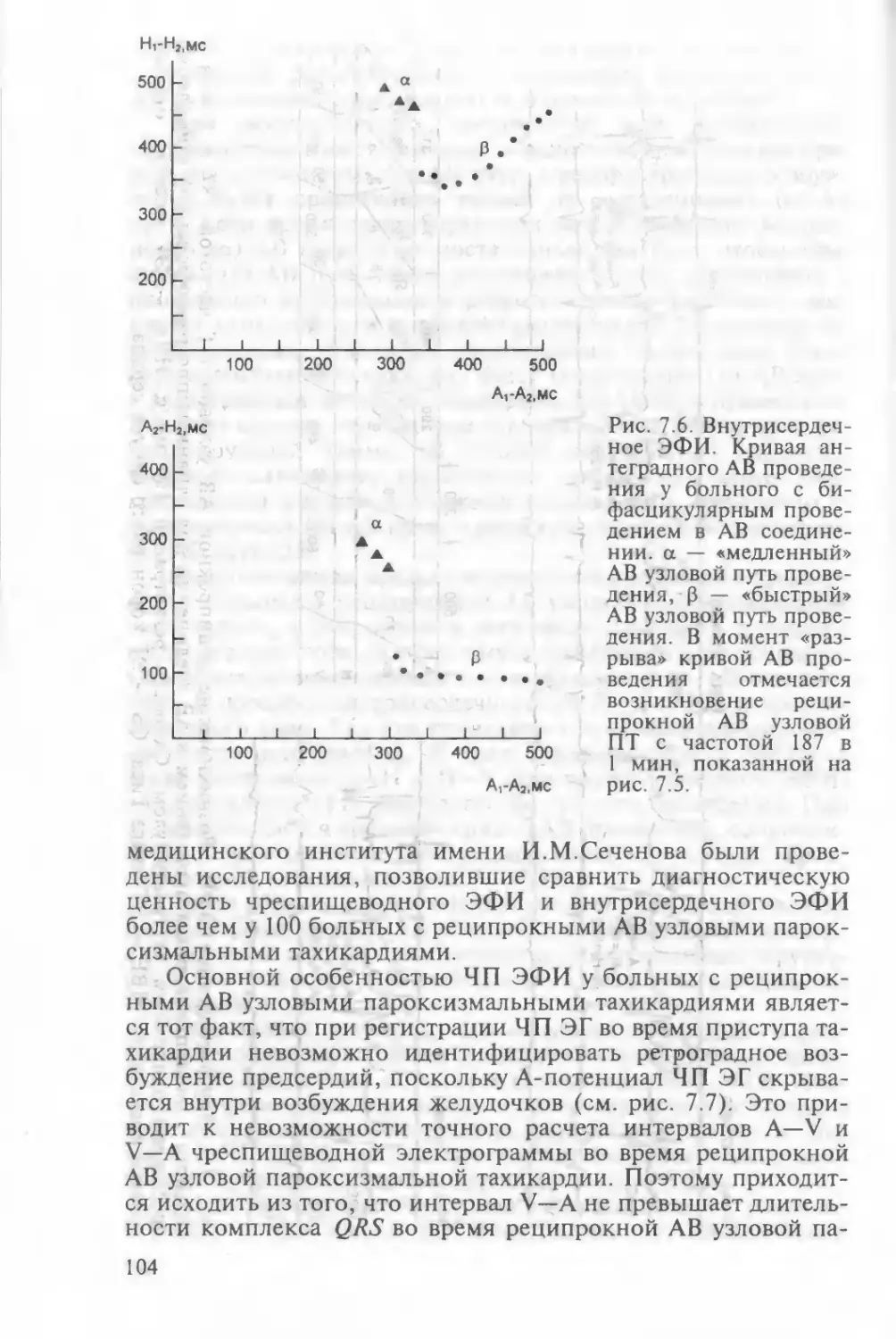
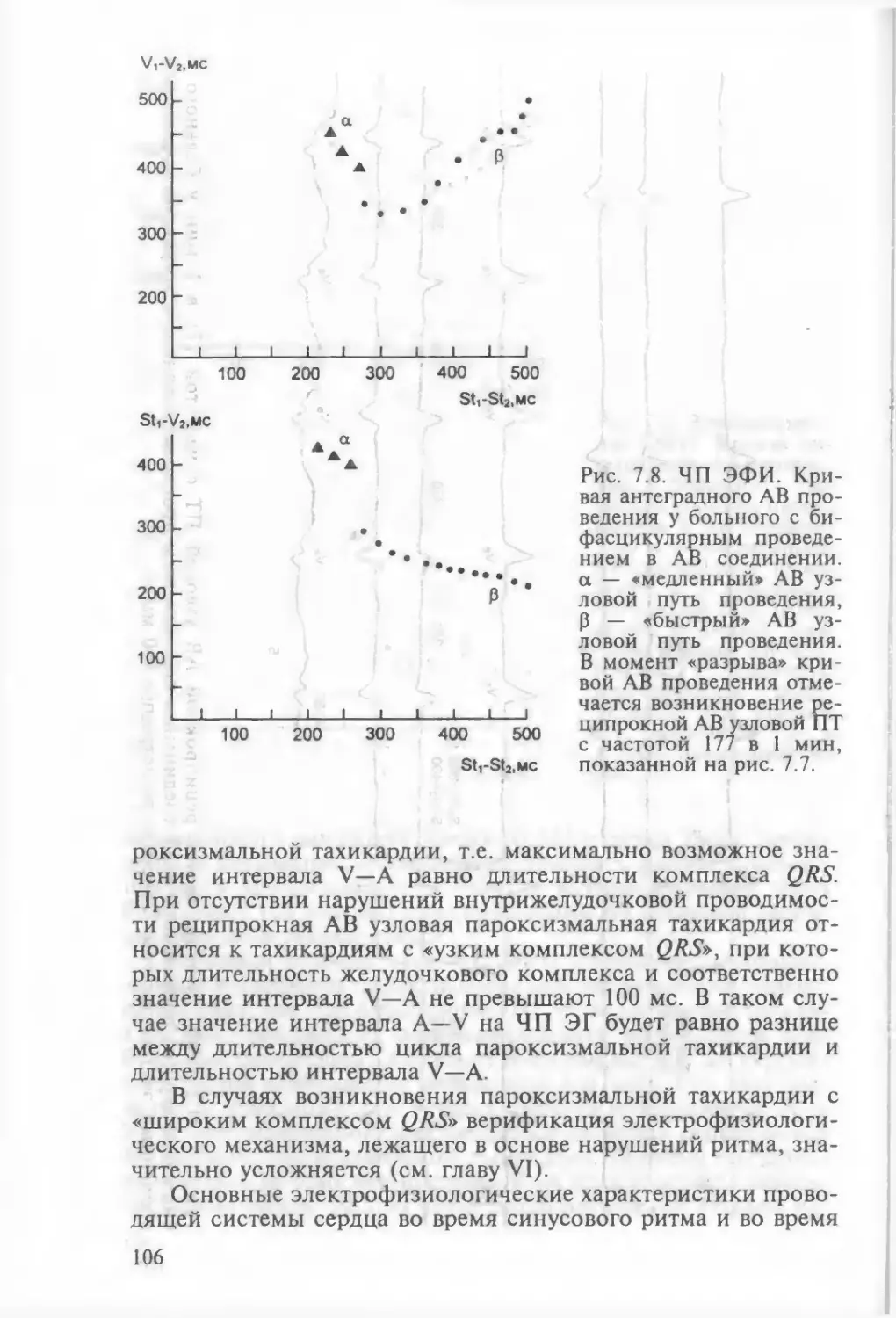
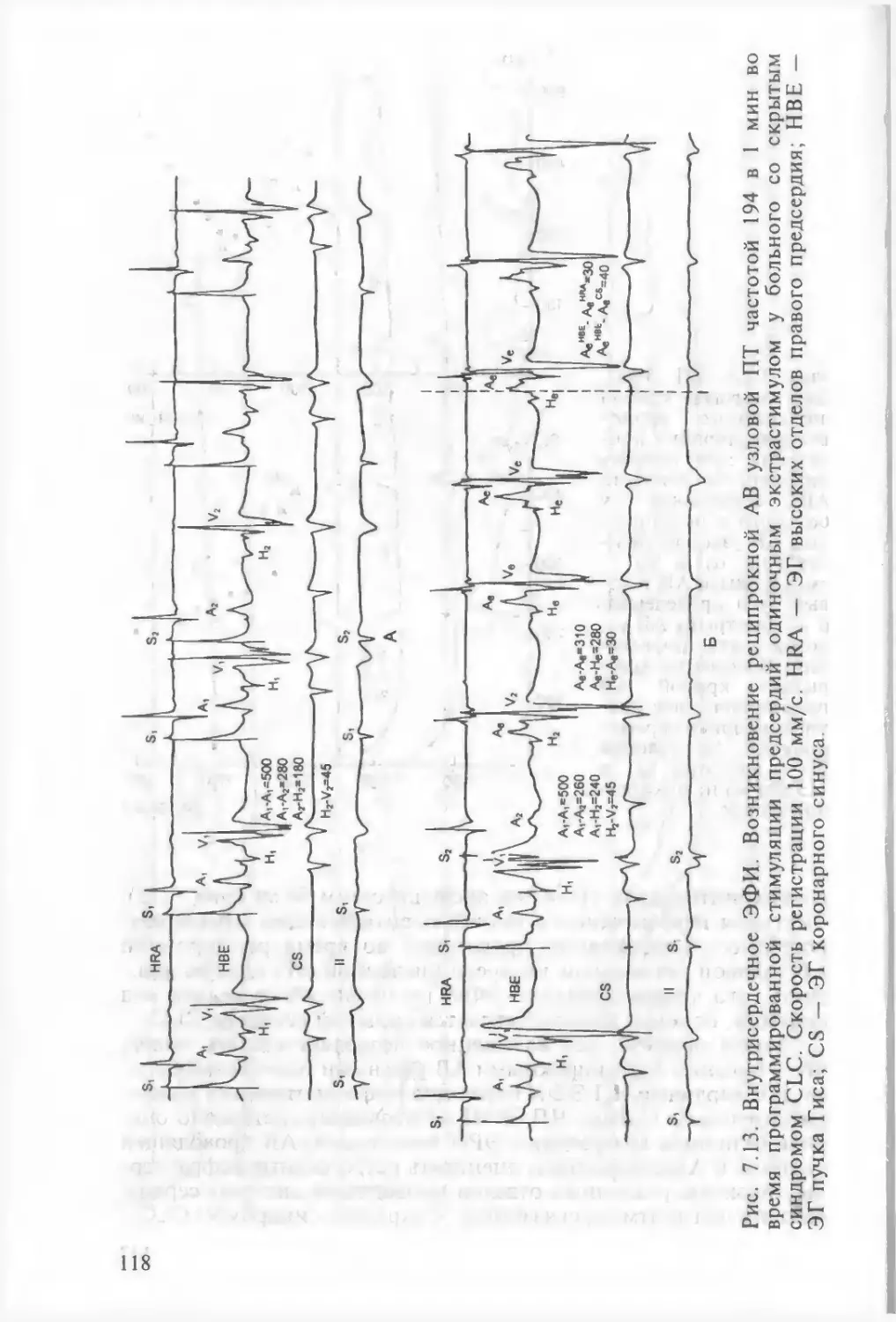
реципрокной пароксизмальной тахикардии 1017.2.7. ЧП ЭФИ в диагностике атриовентрикулярной реципро¬
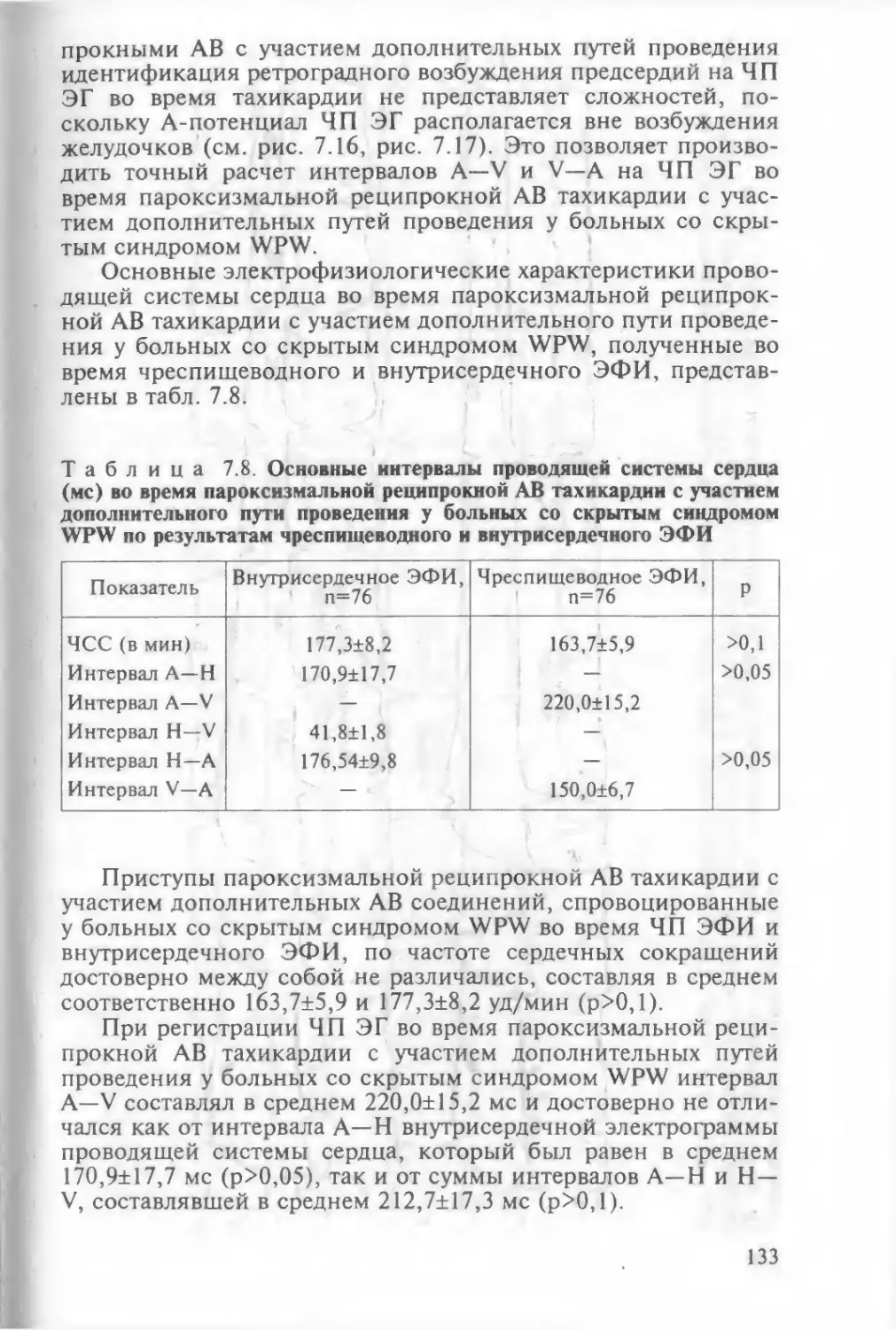
кной пароксизмальной тахикардии с участием дополни¬
тельного пути проведения 1197.2.7.1. ЧП ЭФИ в диагностике атриовентрикулярной
реципрокной пароксизмальной тахикардии у
больных с явным синдромом WPW 1207.2.7.2. ЧП ЭФИ в диагностике атриовентрикулярной
реципрокной пароксизмальной тахикардии у
больных со скрытым синдромом WPW 130Глава 8. ЧПЭС сердца как метод подбора медикаментозной
антиаритмической терапии с целью профилактики рецидивов
нарушений ритма у больных с пароксизмальными наджелудочко¬
выми тахикардиями. — В.А. Сулимое 1448.1. Патофизиологический подход к медикаментозной антиарит¬
мической терапии у больных с наджелудочковыми пароксиз¬
мальными тахикардиями с позиций «Сицилианского гамбита» 1448.2. Серийное тестирование эффективности антиаритмических
препаратов в условиях ЧП ЭФИ 1508.3. Эффективность медикаментозной профилактики рецидивов
пароксизмальной реципрокной АВ тахикардии с участиемДПП 1568.4. Эффективность медикаментозной профилактики рецидивов
реципрокной АВ узловой пароксизмальной тахикардии 1595
Глава 9. ЧПЭС сердца у больных с пароксизмальной формой фиб¬
рилляции предсердий. — С. Г. Канорский, С.В. Попов, В.А. Сулимое 1649.1. Современные представления о фибрилляции предсердий. ... 1649.2. Стандартный протокол проведения чреспищеводного элект-
рофизиологического исследования у больных с пароксизмаль¬
ной формой фибрилляции предсердий 1669.3. Протокол проведения ЧП ЭФИ у больных с пароксизмальной
формой фибрилляции предсердий, основанный на оценке
состояния вегетативной нервной системы 1709.4. Медикаментозная профилактика рецидивов фибрилляции
предсердий у больных с пароксизмальной формой мерцатель¬
ной аритмии с помощью серийного тестирования антиарит-
мических препаратов в условиях ЧП ЭФИ 177Глава 10. ЧП ЭФИ у больных с желудочковыми пароксизмальны¬
ми тахикардиями. — В.А. Сулимое 20210.1. Методика проведения электрической стимуляции желудоч¬
ков сердца из желудка 20310.2. Электрическая стимуляция сердца из желудка для индукции
желудочковых пароксизмальных тахикардий и оценки функ¬
ционального состояния миокарда желудочков 203
СПИСОК СОКРАЩЕНИЙАВ — атриовентрикулярное (AV)АД — артериальное давлениеАРМ — автоматизированное рабочее место кардиологаВВФСУ — время восстановления функции синусового узлаВСАП — время синоатриального проведенияВСЭФИ — внутрисердечное электрофизиологическое исследованиеВЭМ — велоэргометрияДП — двойное произведениеДПП — дополнительный путь проведенияИБС — ишемическая болезнь сердцаКВВФСУ — корригированное время восстановления функциисинусового узлаПТ — пароксизмальная тахикардияПС — порог стенокардииССУ — слабость синусового узлаФП — фибрилляции предсердийФРП — функциональный рефрактерный периодЧСС — частота сердечных сокращенийЧП ЭГ — чреспищеводная электрограммаЧПЭС — чреспищеводная электрическая стимуляцияЧП ЭФИ — чреспищеводное электрофизиологическое исследованиеЭГ — электрограммаЭКГ — электрокардиограммаЭРП — эффективный рефрактерный периодЭхоКГ — эхокардиографияWPW — синдром Вольфа—Паркинсона—Уайта
ВВЕДЕНИЕВпервые в эксперименте Zoll и соавт. показали воз¬
можность электрической стимуляции желудочков сердца
через пищевод. В 1957 г. Shafirofif и Linder сообщили об
успешно проведенном исследовании у добровольцев.В дальнейшем появились сообщения об использо¬
вании ЧПЭС желудочков сердца в комплексе реанима¬
ционных мероприятий, а также у больных с полной
АВ-блокадой. Первое упоминание о применении
ЧПЭС в клинической практике относится к 1969 г.
(больной с полной АВ-блокадой). Однако болезнен¬
ность процедуры ЧПЭС, особенно при стимуляции
желудочков, и успешное освоение временной трансве¬
нозной стимуляции сердца ограничили в те годы при¬
менение метода лишь ургентной терапией.Дальнейшие исследования показали возможность
существенного снижения дискомфорта ЧПЭС и по¬
служили мощным стимулом для внедрения в клиниче¬
скую практику диагностической ЧПЭС. Уже в 1983 г.
публикуется первое руководство по диагностической
ЧПЭС на русском языке. Затем после многочисленных
исследований появилась возможность стимуляции не
только желудочков, но и предсердий, после чего метод
нашел применение для купирования наджелудочковых
пароксизмальных тахикардий и трепетания предсер¬
дий.В настоящее время ЧПЭС широко используется
для выявления ишемической болезни сердца (ИБС),
исследования функции автоматизма синусового узла,
определения параметров синоатриальной и атриовент¬
рикулярной проводимости, диагностики дополнитель¬
ных проводящих путей, подбора медикаментозной
антиаритмической терапии у больных с наджелудочко¬
выми пароксизмальными тахикардиями и пароксизма¬
ми фибрилляции предсердий.Общепризнанными достоинствами ЧПЭС являют¬
ся неинвазивность процедуры и простота введения
стимулирующего электрода, отсутствие необходимости
в рентгеноскопическом контроле и стерильности, воз-
можность проведения нагрузочного теста у пациентов
с высокой артериальной гипертонией (из-за относи¬
тельного постоянства АД в процессе ЧПЭС), у лиц с
заболеваниями опорно-двигательного аппарата, сосу¬
дов нижних конечностей (варикозное расширение вен,
тромбофлебит), органов дыхания, нервной системы, у
детренированных, лежачих больных.ЧПЭС — высокочувствительный и информативный
метод, хорошо коррелирующий как с нагрузочными
тестами, так и с внутрисердечным электрофизиологи-
ческим исследованием. Воспроизводимость результа¬
тов и возможность многократного повторения проце¬
дуры позволяют осуществлять подбор эффективной
медикаментозной терапии. Отсутствие осложнений,
техническая простота аппаратуры и относительно низ¬
кая стоимость процедуры делают ЧПЭС во многих си¬
туациях методом выбора.С 1981 г. только в журнале «Кардиология» опубли¬
ковано свыше 100 статей, в которых ЧПЭС либо явля¬
ется предметом обсуждения, либо о ней упоминается
как об одном из рутинных методов диагностики. Се¬
годня описания процедуры приводятся как в журналь¬
ных лекциях, так и в монографиях. Тем не менее сис¬
тематическое практическое руководство для врачей по
ЧПЭС отсутствует.В факультетской терапевтической клинике ММА
им. И.М.Сеченова диагностическая ЧПЭС изучается и
применяется с 1983 г. Проведено свыше 5 тыс. проце¬
дур более чем у 1500 больных с различными сердечно¬
сосудистыми заболеваниями или подозрением на них.
Выявлены основные факторы дискомфорта, определе¬
ны возможности и ограничения различных протоколов
ЧПЭС-диагностики применительно к тем или иным
нозологическим формам заболеваний сердечно-сосу¬
дистой системы, исследована диагностическая цен¬
ность по отношению к внутрисердечному ЭФИ и дру¬
гим нагрузочным тестам. Апробировано 13 моделей ап¬
паратов, включая автоматизированное рабочее место
кардиолога для проведения ЧПЭС на базе персональ¬
ной ЭВМ, и несколько типов электродов.Полученные результаты побудили выполнявший
эти исследования коллектив систематизировать свой,
отечественный, и мировой опыт проведения ЧПЭС в
виде книги и тем самым восполнить указанный выше
пробел.9
Мы надеемся, что содержание отдельных глав
книги будет полезно хотя бы в качестве справочного
материала врачам, уже применяющим ЧПЭС. Но в
первую очередь книга, как единое целое, предназначе¬
на для тех, кто этот полезный метод собирается осваи¬
вать. Именно с учетом их интересов построено содер¬
жание книги от выбора технических средств для ус¬
пешного проведения самой процедуры ЧПЭС до при¬
менения результатов диагностической ЧПЭС в лечеб¬
ном процессе.
Глава 1ТЕХНИЧЕСКИЕ АСПЕКТЫ
ЧРЕСПИЩЕВОДНОЙ ЭЛЕКТРИЧЕСКОЙ
СТИМУЛЯЦИИ СЕРДЦАДостоинства диагностической ЧПЭС, кратко указанные во
введении и подробно излагаемые в главах этой книги, в пол¬
ной мере могут быть реализованы при адекватном техничес¬
ком обеспечении: чреспищеводный электрокардиостимулятор
(в дальнейшем для краткости «аппарат»), пищеводные
электроды и кардиограф или иной прибор для наблюдения и
распечатки фрагментов ЭКГ. В данной главе обсуждаются во¬
просы грамотного выбора аппарата и электродов.1.1. Основные характеристики чреспищеводных
кардиостимуляторовМодели аппаратов. Как можно судить по публикациям в
отечественных журналах, для проведения ЧПЭС в клиниках
используется несколько моделей отечественных и зарубежных
чреспищеводных кардиостимуляторов, модификации эндо-
кардиальных кардиостимуляторов и трансторакальные стиму¬
ляторы. Основные характеристики аппаратов приведены в
табл. 1.1.Анализ публикаций, содержащих ссылки на конкретные
модели аппаратов, а также анализ технических характеристик
самих аппаратов позволяет утверждать, что не все из применя¬
емых моделей обеспечивают необходимую эффективность
процедуры ЧПЭС. Чтобы правильно выбрать аппарат, врачу
нет необходимости знать, как он устроен. Но какие именно
характеристики аппарата влияют на качество процесса диа¬
гностики и как именно они влияют, знать необходимо.Основными факторами, которые следует учитывать при
выборе модели аппарата для ЧПЭС, являются параметры и
форма стимулирующего импульса, алгоритмы стимуляции,
способы и погрешность задания временных параметров, иска¬
жения ЭКГ и некоторые эксплуатационные характеристики.Параметры стимулирующих импульсов и дискомфорт.
В большинстве публикаций в качестве основных явных или
скрытых недостатков метода ЧПЭС отмечаются дискомфорт¬
ные и болевые ощущения в пищеводе, которые ограничивают
проведение процедуры (ее длительность, число пациентов).
В то же время изменение параметров стимулирующих импуль¬
сов позволяет при прочих равных условиях (навыки введения11
Таблица 1.1. Характеристики диагностических чреспищеводныхМодельФирмаАмплитудаДлитель¬
ность, мсЧастота,имп/минЧЭЭКС-2Вектор—МС,
Екатеринбург10-80 В
(2-16 мА)2-10,
шаг 2 мс50-800,
шаг 10;ЭЗОТЕСТ-ДМСПередовые техно¬
логии, Москва5-50 В
(2-25 мА)10(1)60-1200,
шаг 10, 40, 400ЭКС-П-02СГАУ,Самара5-50 В4-12,плавно40-1000,плавноЭКСП-2Электрофизика,С.-Петербург10—40 мА5-20,плавно60-1000,плавноБИОТОК-
ЭКСД 01 лБИОТОК,Томск1—50 мА,
шаг 1 мА1-10,
шаг 1 мс1-999,
шаг 1STEP-1Bioelettronica,Италия2—42 мА5, 7, 10,
12, 15, 2050-1200,
шаг 1 мсCORD-ELECTRO-4CORD-ELECTRO,Литва5—50 мА
(0,5—5 мА)5-25
(0,5-2,5)40-800,плавноSP-5OBREAM,Польша1—50 мА5, 1030-1500,плавноПримечание. Модели аппаратов расположены в алфавитном поряд-
Опущены малопригодные для проведения ЧПЭС модели ЭКСН-1,
замененная аппаратом «ЭЗОТЕСТ-ДМС». В колонке «Амплитуда» в
(эндо) при наличии в аппарате отдельного выхода или переключателя ре-
БИОТОК-ЭКСД 01 Л). В колонке «Задержка» указано число базовых им-
ции. В колонке «Питание» аббревиатурой ЗУ обозначено зарядное уст-
ем указано время непрерывной работы.и локализация пищеводного электрода, его качество) сущест¬
венно ослабить дискомфортность ЧПЭС.Основной электрофизиологической характеристикой воз¬
будимости миокарда является, как известно, пороговая кри¬
вая, иначе — зависимость амплитуды от длительности импуль¬
са (рис. 1.1). Стимуляция сердца через пищеводный электрод,
как и через эндокардиальный, осуществляется прямоугольны¬
ми импульсами (рис. 1.2, а). Основными параметрами импуль¬
са являются амплитуда V, длительность t„ и спад вершины им¬
пульса 6. При чреспищеводной стимуляции амплитуда и дли¬
тельность импульса в 10—20 раз больше, чем при эндокарди-
альной стимуляции. В то же время в отличие от эндокарда, ли¬
шенного нервных окончаний, пищевод весьма чувствителен к
электрическому току, а стенки пищевода в ответ на электри¬
ческую стимуляцию отвечают спастическим сокращением.
Эти факторы в совокупности и определяют дискомфортность
процедуры ЧПЭС.Дискомфорт является субъективным ощущением пациен¬
та, поэтому его прямую оценку получали методом сравнения12
кардиостимуляторовЗадержка, мс;
число имп.ПитаниеПотреб¬лениеМасса,кгГабариты,мм50-800,
шаг 10; 10+1Сеть 220 В60 Вт10350x250x500180-560,
шаг 20, 8+2Встроенные
аккумулятор и ЗУ25 мА,
24 ч1,3225x215x80НетБатарея 9 В,
6x373400 мА,
6 ч1,5202x140x3060—720, плав¬
но; 9+2Сеть 220 В,
батарея 9 В150 мА3,5110x165x3001-999,
шаг 1; 8+3Батарея 9 В,
6x373250 мА,
10 ч6320x300x10050-999,
шаг 1; 8+3Встроенные
аккумулятор и ЗУ12 чНетданных360x270x25010-990,
шаг 10; 8+2Батарея 9 В,
2x337JIНе указано2,2310x150x15040-999,
шаг 1; 8+3Встроенныйаккумулятор20 ч5410x240x105ке городов России и зарубежных стран — производителей аппаратов.
ЭКСК-02, ЭКСК-04, устаревшая модель ЭКСП-Д и модель «СТИКАР»,
скобках указан диапазон амплитуд для эндокардиальной стимуляции
жима; регулировка амплитуды у всех моделей — плавная (кроме модели
пульсов + число задержанных импульсов при программируемой стимуля-
ройство. В колонке «Потребление» для аппаратов с автономным питани-ощущений каждым пациентом при изменении параметров им¬
пульсов без прерывания процесса стимуляции (метод парных
измерений). Все измерения выполнялись в процессе диагнос¬
тической стимуляции. Перед началом процедуры пациентов
информировали о типичных ощущениях в пищеводе и о воз¬
можности немедленного прекращения процедуры в случае
плохой переносимости. Для стимуляции применяли специаль¬
но разработанные аппараты моделей «СТИКАР» с регулируе¬
мыми в широких пределах параметрами импульсов. Электро¬
безопасность аппаратов обеспечивалась автономным (батарей¬
ным) питанием, позволявшим также устранять сетевую помеху
для кардиографа или монитора и исключать паразитное расте¬
кание тока стимуляции.Степень дискомфорта в наибольшей степени зависит от
длительности импульса t„. По нашим данным [4], его увеличе¬
ние от 1 до 10 мс приводит к снижению порога стимуляции
предсердий в среднем от 28 до 16 В и сопровождается столь
явным снижением дискомфортных и болевых ощущений, ко¬
торые не требуют количественных оценок (см. рис. 1.1). Эти13*
1 мс10 мсРис. 1.1. Зависимость порога стимуляции (а) и ощущения диском¬
форта (б) от длительности импульса.Рис. 1.2. Форма и параметры стимулирующего импульса напряжения
V и протекающего через контакты тока I. Объяснение в тексте.результаты согласуются с данными других работ, от ранних [9,
10] до новейших [8]. При дальнейшем увеличении длительнос¬
ти импульса или изменении других его параметров изменение
дискомфорта не столь заметно и требует более аккуратных
оценок.Для сравнения дискомфортных ощущений при изменении
какого-либо фактора ЧПЭС использовали качественные оцен¬
ки «хуже»—«также»—«лучше», причем вопросы задавались па¬
циентам именно в указанной последовательности. Результаты
субъективных оценок пациентов подвергались сравнению по144
непараметрическому критерию Диксона (тест знаков Диксо¬
на): «хуже» — минус, «также» — ноль, «лучше» — плюс [1].Прежде всего мы оценили то минимальное изменение амп¬
литуды импульса AV, которое пациенты различают по измене¬
нию дискомфорта. В серии измерений порога стимуляции
предсердий при длительности импульса tH= 10 мс получено
следующее распределение оценок у 19 пациентов. Увеличение
пороговой амплитуды напряжения на AV=1 В воспринимали
как «хуже» 53 % пациентов, «также» 47 %, «лучше» 0 %; увели¬
чение пороговой амплитуды на AV=2 В соответственно 90, 10
и 0 %. В обоих случаях различие статистически значимо с ве¬
роятностью р>0,99. Следовательно, критерием изменения дис¬
комфортных ощущений можно считать изменение пороговой
амплитуды на AV=1 В.Исследована целесообразность дальнейшего увеличения
' длительности импульса до tH=40 мс у 28 пациентов. Уменьше¬
ние порога стимуляции на AV=1 В наблюдалось у 54 % паци¬
ентов, причем некоторые из них не отмечали уменьшение, а
часть даже испытывали повышение дискомфорта. Уменьше¬
ние порога стимуляции на AV=2 В наблюдалось у 46 % паци¬
ентов. Все они отмечали уменьшение дискомфорта. Как
видно, 4-кратное увеличение длительности импульса незначи¬
тельно уменьшает порог стимуляции и не всегда приводит к
уменьшению дискомфорта. Однако, как будет показано ниже,
при увеличении длительности импульса значительно возраста¬
ют искажения ЭКГ; кроме этого, сокращается срок работы ап¬
паратов с автономным питанием.Таким образом, длительность импульса tH=10 мс можно
считать оптимальной для ЧПЭС по совокупности показателей
«дискомфорт—искажения ЭКГ—экономичность аппарата».
Поэтому приводимые ниже результаты получены для tM= 10 мс.Исследовано влияние на дискомфорт формы импульса
(см. рис. 1.2, а). В серии измерений после определения порога
стимуляции предсердий и без прерывания процесса стимуля¬
ции дискретно увеличивали спад вершины импульса 6, кото¬
рый исходно составлял 5=10 %. Получено следующее распре¬
деление оценок у 19 пациентов. Увеличение спада до 5=20 %
воспринимали как «хуже» 16 % пациентов, «также» 37 %,
«лучше» 47 %. Увеличение спада до 5=40 % — соответственно10, 10 и 80 %. В обоих случаях в среднем уменьшение диском¬
форта статистически значимо с вероятностью р>0,99. Умень¬
шение дискомфорта при увеличении спада 5 можно объяснить
избыточностью прямоугольного импульса по порогу стимуля¬
ции, что применительно к прямой стимуляции сердца являет¬
ся давно установленным фактом [14].В применяемых нами чреспищеводных стимуляторах серии
«СТИЮ\Р» амплитуда импульсов задается величиной напря¬
жения в вольтах. Это означает, что при изменении сопротив-15
ления нагрузки RH в оговоренных пределах установленное на
шкале аппарата значение амплитуды импульсов напряжения V
остается постоянным с заданным допуском. Иначе говоря, у
двух пациентов с одинаковыми значениями амплитуд порого¬
вых напряжений Vn значения амплитуд импульсов тока I, про¬
текающего через контакты пищеводного электрода, могут раз¬
личаться в зависимости от значения RH в несколько раз (см.
ниже размах сопротивления RH).В некоторых моделях чреспищеводных стимуляторов (см.
табл. 1.1) амплитуда импульсов задается величиной тока в
миллиамперах. Это означает, что при изменении сопротивле¬
ния RH в оговоренных пределах установленное на шкале аппа¬
рата значение амплитуды импульсов тока I остается постоян¬
ным с заданным допуском. Иначе говоря, у двух пациентов с
одинаковыми значениями амплитуд пороговых токов 1п значе¬
ния амплитуд импульсов напряжения V, приложенного между
контактами электрода, могут различаться в несколько раз.Сравнивать дискомфортные ощущения при стимуляции
импульсами напряжения V или тока I от аппаратов разных
фирм по организационным причинам крайне трудно. Поэтому
мы использовали один из аппаратов серии «СТИКАР», кото¬
рый обеспечивал стимуляцию импульсами напряжения или
тока с примерно одинаковыми спадами их вершин. Переход от
импульсов напряжения на импульсы тока осуществлялся без
прерывания процесса стимуляции, что обеспечило условия
для парных измерений. По результатам измерений у 11 паци¬
ентов порогов по напряжению Vn и току 1п достоверных разли¬
чий в оценке дискомфорта не установлено.В публикациях зарубежных авторов сводные значения поро¬
гов стимуляции нередко указываются в величинах тока [13]. Для
сопоставления порогов по напряжению Vn и току 1п необходимо
знать значение эквивалентного сопротивления пищевода, кото¬
рое одновременно является и сопротивлением нагрузки RH для
стимулятора. Строго говоря, сопротивление пищевода между
электродом и слизистой пищевода моделируется импедансом,
имеющим явно выраженный емкостной характер. Вследствие
этого при стимуляции импульсами напряжение V (см. рис. 1.2,а)
на фронте импульса тока I (рис. 1.2,6) наблюдается короткий и
значительный выброс, а в течение импульса — заметный спад
его вершины. Поэтому для определенности амплитуда тока I из¬
мерялась методом выборки длительностью 0,5 мс через интервал
tB=l мс от переднего фронта импульса на уровне порогового
напряжения Vn при спаде его вершины 6=10 % и ритме
100 имп/мин. Измерения выполнялись попутно с исследовани¬
ем качества пищеводных электродов (раздел 1.3). Эквивалент¬
ное сопротивление R„ рассчитывали по формулеRhIkOm] = Уп[В]/1[мА].16
При статистической обработке использовался непарамет¬
рический U-критерий Уилкоксона.По результатам измерений в 3 группах у 47 пациентов по¬
лучено среднее значение эквивалентного сопротивления
RH=0,87 кОм, размах сопротивления 0,35—1,58 кОм. Важно
отметить, что хотя в этих измерениях использовались различ¬
ные электроды (материал катетера и контактов, расстояние
между контактами), средние значения RH для различных групп
не сильно отличались одно от другого. Поэтому с практичес¬
кой точки зрения и для простоты запоминания можно при¬
нять среднее значение RH * 71 кОм. А так какV[B) = Rh[kOm] х І[мА],то при сопоставительных оценках можно приближенно счи¬
тать, что пороги стимуляции в вольтах Vn и в миллиампермет¬
рах 1п численно равны между собой (при одинаковой длитель¬
ности импульса tH и спаде 5). Добавим, что сопротивление RH
уменьшается при увеличении частоты и амплитуды стимули¬
рующих импульсов [4]. Первое сопровождается возрастанием
тока в режимах частой и сверхчастой стимуляции предсердия,
второе — более резким возрастанием тока при стимуляции же¬
лудочка.При крутом фронте импульса напряжения амплитуда вы¬
броса тока превышает амплитуду I в начале пологого спада
(см. рис. 1.2, б) в среднем в 1,6 раза с размахом 1,1—2,1 (11 изме¬
рений). При сглаживании переднего фронта: импульса напряже¬
ния (рис. 1.2, в) амплитуда выброса тока заметно уменьшает¬
ся, порог стимуляции по напряжению Vn почти не возрастает,
но дискомфорт, по оценкам пациентов, несколько уменьшает¬
ся. Поэтому в аппаратах серии «СТИКАР», а затем «ЭЗОТЕСТ»
(см. табл. 1.1) фронт импульса напряжения сглажен.Оценивая дискомфорт в целом, можно утверждать, что неза¬
висимо от достижения порога стимуляции все пациенты почти
не ощущали стимулирующих импульсов до амплитуды Vn=10 В,
ощущали легкий дискомфорт в диапазоне Vn= 10—15 В и испы¬
тывали заметный, хотя и переносимый, дискомфорт при
Vn=15—20 В и выше (чувство жжения за грудиной, боли, сокра¬
щение диафрагмальных мышц), что согласуется с наблюдения¬
ми других авторов [8, 9, 10]. Добавим, что оценку дискомфорта
на здоровых добровольцах [7, 12] или при анестезии [11] мы счи¬
таем методически некорректной.Таким образом, для уменьшения дискомфорта при прове¬
дении диагностической ЧПЭС мы рекомендуем выбирать ап¬
парат, который обеспечивает:— длительность импульса около 10 мс; ее дополнительная
регулировка излишне усложняет аппарат;2— 127917
— амплитуду импульса при стимуляции предсердий не
менее 30 В (или 30 мА), причем регулировка амплитуды
должна быть либо достаточно плавной, либо дискрет¬
ность регулировки не должна превышать 1 В (или 1 мА);— спад вершины импульса в пределах 20—40 %.Алгоритмы стимуляции и временные параметры. При прове¬
дении диагностической ЧПЭС результаты измерений времен¬
ных параметров ЭКГ, полученные врачами при использовании
разных кардиостимуляторов (см. табл. 1.1) и кардиографов,
должны удовлетворять критерию сопоставимости. А это воз¬
можно лишь в том случае, если способы задания временных
параметров стимуляторов удовлетворяют определенным мет¬
рологическим требованиям.Общепринятыми диагностическими алгоритмами являют¬
ся нагрузочный тест, тест для определения функций синусово¬
го узла, частая, сверхчастая и программируемая стимуляция.Нагрузочный тест чаще всего выполняется в диапазоне от
60 до 160—180 имп/мин с шагом 10 имп/мин. Поэтому стиму¬
лятор должен обеспечивать задание именно ритма стимуля¬
ции, причем обязательно дискретно с указанным или близким
шагом. Иначе говоря, для проведения нагрузочных тестов
аппараты с плавным заданием ритма непригодны, с шагом1 имп/мин неудобны, а с дискретным заданием периода сти¬
муляции крайне неудобны.Очевидно также, что абсолютная погрешность аппарата в
любой точке шкалы не должна превышать половины шага, т.е.
5 имп/мин. В противном случае две соседние точки шкалы,
например 100 и 110 имп/мин, не будут различаться между
собой. Более точные расчеты показывают, что погрешность
задания ритма в указанном диапазоне при скорости записи
ЭКГ 100 мм/с не должна превышать 1 % [3]. У аппаратов с
плавной регулировкой ритма погрешность его задания всегда
существенно больше.Эти же требования относятся и к тесту для определения
функций синусового узла.Требования к режимам частой и особенно сверхчастой сти¬
муляции гораздо менее жесткие, так как само значение ритма
при этих алгоритмах особой информации для врача не содер¬
жит. Поэтому диапазон ритмов от 300 до 1200 имп/мин может
задаваться в аппарате как плавно, так и дискретно. Но дис¬
кретное задание ритма с малым шагом остается неудобным, а
периода стимуляции — крайне неудобным.Программируемую стимуляцию обычно осуществляют на
базовом ритме 100 имп/мин с одним (или более) задержанным
импульсом (см. табл. 1.1). Физиологический диапазон задер¬
жек при ЧПЭС составляет 160—600 мс, а достаточный для до¬
стоверной диагностики шаг задержки составляет 20 мс. По¬18
грешность задания задержки при скорости записи ЭКГ
100 мм/с не должна превышать 1 % [3].Часто в аппаратах с режимом программируемой стимуля¬
ции задержка импульса устанавливается с шагом 1 мс с помо¬
щью многопозиционного переключателя. Такая дискретность
является явно избыточной, а способ установки не очень удоб¬
ным, особенно при переходе в любом направлении через каж¬
дые 100 мс.Таким образом, для проведения диагностической ЧПЭС с
необходимой достоверностью мы рекомендуем выбирать аппа¬
рат, который обеспечивает:— в диапазоне ритмов 60—300 имп/мин регулировку с
шагом не менее 10 имп/мин;— в диапазоне ритмов 300—1200 имп/мин регулировку с
шагом не менее 100 имп/мин или плавно;— в диапазоне независимых задержек импульсов 160—
600 мс регулировку с шагом 10—20 мс;— погрешность задания ритма и задержек во всех точках
шкалы не более 1 %.Дополнительные эксплуатационные характеристики. В про¬
цессе ЧПЭС, применяемой для диагностических целей, врачу
приходится постоянно анализировать записи ЭКГ на ленте
или изображение ЭКГ на мониторе. Из-за большой амплиту¬
ды и длительности стимулирующих импульсов артефакты сти¬
мулов могут сильно искажать и затруднять расшифровку или
чтение записи ЭКГ, движущегося изображения на мониторе и
особенно на этапе освоения врачом диагностической ЧПЭС.В некоторых пределах эти искажения определяются моде¬
лью аппарата. Возможная степень уменьшения искажений
ЭКГ иллюстрируется фрагментами на рис. 1.3 одного и того
же пациента без изменения положения и типа пищеводного
электрода и параметров стимулирующих импульсов. Уменьше¬
ние искажений ЭКГ повышает точность измерения парамет¬
ров ЭКГ.Наконец, при выборе модели аппарата полезно учитывать
следующие его характеристики: простоту управления, незави¬
симый выбор режимов и параметров стимуляции, наглядную
индикацию режимов стимуляции, наличие автономного пита¬
ния, тип источника питания (батарея или аккумулятор), время
работы без смены или перезаряда источника питания, автома¬
тическую индикацию разряда источника питания, резервное
время для завершения процесса диагностики после срабатыва¬
ния индикатора разряда источника питания, наличие встроен¬
ного блока заряда аккумулятора от сети (при питании от акку¬
мулятора), защиту аккумулятора от перезаряда, защиту от ко¬
роткого замыкания в пищеводном электроде, наконец, габа¬
риты и массу аппарата.2*19
Рис. 1.3. Уменьшение искажений ЭКГ схемотехническим методом.
Амплитуда стимулирующих импульсов 18 В, начало импульсов поме¬
чено стрелками в отведении V3. Калибровка по вертикали 1 мВ, по
горизонтали 20 мс. V3, V4, V5, Уб — отведения ЭКГ.1.2. Автоматизированные комплексы
для чреспищеводной диагностикиИзвестные достоинства диагностической ЧПЭС способст¬
вовали распространению этого метода из специализированных
кардиологических отделений в поликлинические отделения
функциональной диагностики, медсанчасти и амбулаторные
кабинеты [6]. Естественно, сама организация приема пациен¬
тов в таких лечебных подразделениях сопровождается значи¬
тельным возрастанием потока обследуемых лиц. Как следст¬
вие резко увеличивается нагрузка на врачебный персонал,
износ традиционно применяемого кардиографа, расход диа¬
граммной ленты, временные затраты на создание и ведение
архива.Например, для выполнения полного, без пропуска ступе¬
ней, нагрузочного теста на ИБС с записью фрагментов ЭКГ в
конце каждой ступени на рекомендуемой скорости 50 мм/с
необходимо на каждого пациента израсходовать около 5 м
диаграммной ленты и осуществить 10—12 включений/выклю¬
чений лентопротяжного механизма кардиографа. Диагностика20
нарушений ритма и проводимости сердца, выполняемая при
скорости записи 100 мм/с, требует большего числа записей
фрагментов ЭКГ, особенно при включении 2-го задержанного
импульса, и сопровождается существенно большим расходом
ленты и износом кардиографа. При последующем анализе 60—
90 % записей ЭКГ уничтожаются как не содержащие необхо¬
димой для заключительного диагноза информации.В результате общепризнанные достоинства методики
ЧПЭС пришли в противоречие с современными требованиями
к технологичности диагностического процесса. Естественным
разрешением этого противоречия является автоматизация на
базе персональной ЭВМ, т.е. создание автоматизированного
рабочего места (АРМ) кардиолога для проведения ЧПЭС.При диагностической ЧПЭС выделяют следующие этапы:1) установка пищеводного электрода,2) определение порога стимуляции,3) подача на электрод стимулирующих импульсов по опре¬
деленному алгоритму,4) оценка, отбор и анализ информативных фрагментов ЭКГ,5) формирование твердой копии из отобранных фрагмен¬
тов ЭКГ.На первом этапе локализация электрода осуществляется по
форме снимаемого с него зубца Р (глава II), при этом процесс
его регистрации существенно затрудняется наличием мощной
помехи в виде дыхательной модуляции кардиосигнала; ампли¬
туда помехи в 10—100 раз больше полезного сигнала и превы¬
шает динамический диапазон серийных мониторов и кардио¬
графов. Это вынуждает регистрировать зубец Р на задержке
дыхания, увеличивает продолжительность и снижает точность
локализации электрода. Чтобы быстро и достоверно анализи¬
ровать пищеводную ЭКГ и форму зубца Р, АРМ должен на 2—
3 порядка ослаблять низкочастотную дыхательную помеху без
заметного искажения самой ЭКГ, полезно дополнительно по¬
давлять и сетевую наводку.На втором этапе определяется порог стимуляции Vn. Как
уже отмечалось, одним из недостатков метода ЧПЭС являет¬
ся дискомфорт, который в большей или меньшей степени ог¬
раничивает продолжительность следующего этапа диагности¬
ки. Значение Vn в немалой степени зависит от точности ло¬
кализации пищеводного электрода на первом этапе. Поэтому
по результатам измерения пороговой амплитуды часто произ¬
водится коррекция положения электрода и повторное изме¬
рение Vn. Следовательно, АРМ должен, во-первых, обеспечи¬
вать наглядное отображение, запоминание и сравнение поро¬
гов стимуляции Vn в процессе одной процедуры ЧПЭС, а
также накопление статистики по значениям Vn у разных па¬
циентов. Во-вторых, для оценки влияющих на дискомфорт
факторов необходимо обеспечить возможность отображения21
одновременно двух статистик с указанием достоверности их
различий.На третьем этапе стимулирующие импульсы подаются на
пищеводный электрод по одному из алгоритмов, которые для
простоты можно разделить на 2 группы. К 1-й группе относят¬
ся отработанные и рекомендованные к клиническому приме¬
нению алгоритмы, условно называемые рутинными. Ко 2-й
группе относятся новые алгоритмы, диагностическая ценность
которых сама является предметом исследований и которые ус¬
ловно именуются экспериментальными.Число рутинных алгоритмов не превышает сегодня четы¬
рех—пяти. Эти алгоритмы могут быть реализованы как в руч¬
ном, так и в автоматическом режимах. Ручной режим диагнос¬
тики вынуждает врача постоянно манипулировать хотя бы
двумя органами управления (например, «частота» и
«вкл/выкл») и контролировать длительность каждого шага, что
отвлекает внимание от оперативного анализа ЭКГ, повышает
утомляемость и увеличивает продолжительность диагности¬
ческой процедуры. Автоматический режим диагностики устра¬
няет эти недостатки, но требует от врача осуществлять предус¬
тановку некоторых временных параметров перед каждым алго¬
ритмом и поддерживать навыки управления АРМ на уровне
автоматизма.Указанные противоречия ручного и автоматического режи¬
мов диагностики нарастают при увеличении числа и сложнос¬
ти рутинных алгоритмов, и этап отработки эксперименталь¬
ных алгоритмов становится дороже. Следовательно, интер¬
фейс пользователя АРМ, с одной стороны, должен быть «дру¬
жественным» врачу при выполнении рутинных алгоритмов, а с
другой стороны, позволять врачу разрабатывать и отрабаты¬
вать экспериментальные алгоритмы с сохранением простоты
управления АРМ в процессе диагностики.Четвертый этап (анализ и отбор информативных фрагмен¬
тов ЭКГ) выполняется по существу одновременно с предыду¬
щим. Именно при включенной стимуляции необходимо сфор¬
мировать на экране монитора движущееся негаснущее изобра¬
жение нескольких отведений ЭКГ с изменением масштаба
изображения, соответствующего стандартным скоростям за¬
писи ЭКГ до 100 мм/с, но без ускорения движения. Также
должна быть обеспечена возможность непрерывного запоми¬
нания предшествующей «записи» длительностью в несколько
секунд и просмотра этой записи. При выключении стимуля¬
ции необходимо обеспечить остановку изображения и разме¬
щение на экране 2—3 циклов ЭКГ. Именно этот фрагмент
подвергается качественному и, если необходимо, количествен¬
ному анализу. Следовательно, АРМ должен предоставлять
удобные средства измерения на экране амплитудных и вре¬
менных параметров ЭКГ.22
Если по результатам анализа врач принимает решение о
неинформативности данного фрагмента, последний удаляется
из памяти. Если же фрагмент достаточно информативен, то он
должен автоматически нумероваться и переноситься на маг¬
нитный носитель, оставаясь доступным для просмотра на
любом следующем этапе диагностического процесса. При
этом АРМ должен обеспечивать возможность просмотра и ре¬
дактирования сделанных записей ЭКГ на экране и после за¬
вершения процедуры диагностики (т.е. в отсутствие пациен¬
та), а также поддерживать базы данных пациентов и врачей.На последнем этапе АРМ позволяет создавать на обычных
принтерах твердые копии результатов диагностики: отобран¬
ные фрагменты ЭКГ, протоколы стимуляции, заключения и
т.п.Некоторые из указанных в табл. 1.1 моделей стимуляторов
допускают управление от персональных ЭВМ, оснащенных
необходимым пакетом программ. Однако намного более уни¬
версальны и удобны в работе самостоятельные АРМ. По дан¬
ным многих публикаций, изложенным выше, требованиям в
достаточно полной мере удовлетворяют отечественные ком¬
плексы «Polysystem-ЕР/L» («Медитек», Москва), «СТАРМ»
(МИФИ — Интерпрогс, Москва), «БИОТОК-250КС» («БИО¬
ТОК», Томск), «ЭЛКАРТ-ЧПС» («Электропульс», Томск).Добавим, что АРМ могут использоваться как обычные кар¬
диографы высокого класса для безбумажной записи, обработ¬
ки и хранения ЭКГ с возможностью распечатки нужных фраг¬
ментов.1.3. Основные характеристики пищеводных
электродовДаже идеальный аппарат не позволит выполнить качест¬
венно диагностическую ЧПЭС без хорошего пищеводного
электрода и навыка его установки. Понятие «хороший
электрод» оценивается по совокупности показателей: простота
конструкции, механические и электрические характеристики,
устойчивость к стерилизации и т.п. Для врача наиболее на¬
глядной и, что весьма важно, количественной оценкой качест¬
ва пищеводного электрода, равно как и навыка его установки,
является средний порог стимуляции, полученный для данного
электрода при проведении ЧПЭС в представительной выборке
пациентов.Действительно, выше было показано, что пациенты разли¬
чают изменение пороговой амплитуды Vn на AV=1 В по изме¬
нению дискомфортных ощущений. Следовательно, любые из¬
менения характеристик электрода и(или) методов его установ¬
ки, которые сопровождаются уменьшением средней порого¬23
вой амплитуды Vn хотя бы на AV=1 В, могут рассматриваться
как улучшение качества электрода и(или) совершенствование
навыка его установки.Сравнение электродов или методов их установки по эти¬
ческим и организационным причинам производили в различ¬
ных группах пациентов. Поскольку закон распределения по¬
рогов стимуляции Vn априори известен не был, при статисти¬
ческой обработке результатов измерений использовался не¬
параметрический U-критерий Уилкоксона. Результаты иссле¬
дований влияния основных факторов представлены в табл. 1.2.Таблица 1.2. Конструкция, методика и навык установки пищевод
ного электродаПара¬метрыКонструкцияМетодикаНавыкПЭДСП-2МИФИврач Аврач Бсерия 1серия 2серия 3N39222215191615Vn, в21,417,217,214,216,615,114,2Р>0,995>0,99>0,99Примечание. АиБ — условное обозначение врачей, выполнявших
соответствующие измерения, N — число пациентов в независимой груп¬
пе, р — доверительная вероятность.Прежде всего мы сравнили электрод ПЭДСП-2 (СКВ
МЭТ, Украина) с изменяемым расстоянием между контактами
и электрод МИФИ собственной конструкции с фиксирован¬
ным расстоянием между контактами (40 мм). Эти измерения
выполнены одним врачом А, по одной методике установки
электрода, одним аппаратом. Полученные значения порогов
стимуляции Vn представлены в колонках «Конструкция», раз¬
личаются в среднем на AV=4,2 Вив комментариях не нужда¬
ются. Поэтому все дальнейшие измерения выполнялись
электродами МИФИ.Методика локализации электрода по форме и полярности
зубца Р также существенно влияет на порог стимуляции (ко¬
лонки «Методика»). Эти измерения выполнены разными вра¬
чами, но однотипными электродами и аппаратами. Сама мето¬
дика, по которой получены пороги врачом Б и все приводи¬
мые ниже, подробно излагается в главе 2.Врачебный опыт, выраженный в количестве процедур
ЧПЭС, если только на каждой процедуре врач уделяет долж¬
ное внимание установке пищеводного электрода, дает весьма
заметные результаты, которые иллюстрируются данными в ко¬
лонках «Навык». Эти измерения выполнены врачом Б, одно¬24
типными электродами и аппаратом и по одной методике, ко¬
торая, однако, постоянно совершенствовалась. Именно если
после первичной установки электрода порог стимуляции Vn
превышал 20 В и/или пациент испытывал чрезмерный дис¬
комфорт, врач корректировал положения электрода, что обыч¬
но позволяло снизить порог стимуляции.В процессе отбора материала катетера для пищеводного
электрода мы столкнулись с фактом расхождения экспертных
оценок врачей относительно желательной гибкости электрода.
Одни предпочитали работать с более мягким электродом, дру¬
гие — с более жестким, что отразилось и на порогах стимуля¬
ции Vn, которые достоверно уменьшались на AV>2 В, когда
врач использовал предпочтительный для него по гибкости
электрод [1].В описанных измерениях необходимость протоколировать
значение Vn диктовалась целями исследований. Но так как
порог стимуляции диагностической информации в себе не со¬
держит, при рутинных процедурах диагностики врач, полага¬
ясь на уже выработанный навык установки электрода, значе¬
ния Vn обычно не протоколирует. В результате привычка ми¬
нимизировать порог стимуляции у каждого больного может
быть утрачена, и тогда даже опытный врач перестает замечать
возрастание пороговой амплитуды Vn. Влияние этого субъек¬
тивного фактора отражено в табл. 1.3.Таблица 1.3. Протоколирование порогаНавыкВрач БВрач ВПротоколДаНетДаN151121vn, В14,219,015,5Размах, В8-1215-2611-26Во второй колонке табл. 1.3 воспроизведены результаты
измерений врача Б в серии 3 из табл. 1.2, т.е. врача с хорошим
навыком установки электрода. В третьей колонке представле¬
ны выполненные тем же врачом результаты более поздних из¬
мерений, в которых задача минимизации порога Vn не стави¬
лась и сам порог протоколировался не врачом, а помощником.
Как видно, отсутствие самоконтроля сопровождалось весьма
заметным ростом порога стимуляции Vn и размахом пороговых
значений VMHH—VMaKC.В последней колонке представлены результаты измерения
порога Vn врачом В, который имел значительно меньший опыт25
установки электрода, но продолжал сам протоколировать зна¬
чения Vn. Сравнение двух последних колонок явно не в пользу
более опытного врача Б (в обоих случаях различия средних
значений Vn по отношению к третьей колонке статистически
значимы с вероятностью р>0,995). Именно поэтому комплекс
«СТАРМ» (см. раздел 1.2) отображает на экране значения Vn у
данного пациента, в группе пациентов у данного врача и луч¬
шую статистику из группы врачей [2].При проведении нагрузочных тестов с прерыванием стиму¬
ляции мы неоднократно отмечали уменьшение порога стиму¬
ляции Vn при последующем включении стимуляции. Эти на¬
блюдения побудили нас целенаправленно исследовать эффект
снижения порога. Измерения выполнялись после установки
электрода по принятой методике (см. раздел 2.2) без коррек¬
ции положения электрода по минимальному значению Vn в
такой последовательности: 1) измерение порога стимуляции
Vn, 2) уменьшение амплитуды импульсов до значения V=10 В
без изменения частоты стимуляции, 3) продолжение стимуля¬
ции в этом режиме в течение 30 с, 4) повторение шагов 1—3
без изменения положения электрода. Эти измерения выполне¬
ны одним врачом Г, однотипными электродами и аппаратом.Таблица 1.4. Повторные измерения порогаN262025Измерение 119,517,720,1Измерение 217,316,018,1Измерение 3Нет15,217,2Р(2—1)>0,99>0,99>0,99Р(3—2)Нет>0,99Н.д.Примечание. р(2— 1) и р(3—2) — доверительные
вероятности соответственно измерения 2 по отноше¬
нию к 1 и измерения 3 по отношению к 2; Н.д. — раз¬
личие недостоверно.•Результаты измерений представлены в табл. 1.4. Амплитуда
импульсов V=10 В выбрана по критерию отсутствия диском¬
форта у большинства больных [1]. В первой, постановочной
серии измерений (N=26) порог Уп определялся дважды, во
второй серии (N=20) для повышения надежности измерения
выполнялись 4 раза, в третьей (N=25) — 5 раз.Как видно, при двукратном повторении процедуры значе¬
ние Vn достоверно уменьшается на ДУ = 2 В. Однако повторе¬
ние процедуры более 2 раз не приводит к достоверному сни¬
жению порога стимуляции. Этот прием можно использовать26
при проведении ЧПЭС у детей и больных с повышенной чув¬
ствительностью к дискомфорту. Различия по значению Vn в
трех сериях объясняются использованием различных по гиб¬
кости электродов.Подводя итог, приведем обобщенную информацию по
оценке факторов дискомфорта, связанных с качеством
электродов, методиками их установки и выработке врачебных
навыков. Всего было выполнено 19 независимых серий изме¬
рений порога стимуляции Vn с протоколируемыми результата¬
ми. Объем минимальной выборки N=5, объем максимальной
выборки N=136, объем планируемой выборки N>20. Всего
выполнено 486 измерений (число непротоколированных по
порогу процедур ЧПЭС превышает 5 тыс.). При стимуляции
предсердий минимальный порог составил 5 В, максималь¬
ный — 34 В. Из 486 пациентов порог стимуляции не более 10 В
фиксирован у 10 пациентов (2,1 %), а не более 15 В — у 99 па¬
циентов (20,4 %).Таким образом, для уменьшения дискомфорта при прове¬
дении диагностической ЧПЭС мы рекомендуем:— использовать электрод с гибкостью, привычной для
врача;— методически четко выполнять установку электрода в пи¬
щеводе, при необходимости производить коррекцию его
локализации;— протоколировать для самоконтроля порог стимуляции;— для уменьшения дискомфорта при навязывании ритма
не повышать амплитуду импульса излишне быстро, а по
достижении порога не увеличивать ее более чем на 1 В.1.4. Особенности стимуляции желудочковРассмотренные выше методы снижения дискомфорта по¬
зволяют в целом успешно проводить диагностическую стиму¬
ляцию предсердий. Однако стимуляция желудочков из пище¬
вода требует даже при tM= 10 мс амплитуды 30—50 В и сопро¬
вождается выраженными болезненными ощущениями, сокра¬
щением мышц диафрагмы и грудной клетки [4]. Эти побочные
эффекты не имеют особого значения при дополнительном
обезболивании [11], при проведении операций [13] и по необ¬
ходимости терпимы при неотложной терапии, но весьма огра¬
ничивают ЧПЭС как диагностическую процедуру.Принципиальным решением этой проблемы является сти¬
муляция из желудка, выполняемая с помощью специального
пищеводного электрода, который устанавливается в фундаль-
ном отделе желудка под рентгеноскопическим и электрокар¬
диографическим контролем. В этом случае порог стимуляции27
значительно снижается, а дискомфорт практически отсутству¬
ет. По нашим данным, в группе из 23 пациентов среднее зна¬
чение порога стимуляции желудочка составило Vn=18,3 В с
размахом 10,5—27 В (более подробное описание методики
приведено в главе 10).Изложенные выше результаты получены в процессе много¬
летних исследований технических аспектов ЧПЭС, выполнен¬
ных совместно сотрудниками кафедры электроники Москов¬
ского инженерно-физического института и клиникой факуль¬
тетской терапии имени В.Н.Виноградова Московской меди¬
цинской академии имени И.М.Сеченова. Результаты исследо¬
ваний использованы при разработке экспериментальных аппа¬
ратов для ЧПЭС серии «СТИКАР», последний из которых вы¬
пускается как серийный под названием «ЭЗОТЕСТ-ДМС»
(см. табл. 1.1).Список литературы1. Дубровский И.Л., Петрий В. В., Кузьменков Д. В., Ма кол кин В. И.
Технические аспекты снижения дискомфорта процедуры чреспище¬
водной электростимуляции сердца//Кардиология. — 1994. — N° 4. —
С. 127-131.2. Дубровский И.А., Станкевич В.И., Кузьменков Д.В., Сулимое В.А.
Автоматизация процедуры диагностической чреспищеводной элек¬
тростимуляции сердца//Вестн. аритмологии. — 1995. — № 4. —
С. 67.3. Дубровский И.А., Сулимое В.А. Обоснование дискретности за¬
держки и частоты при диагностической кардиостимуляции//Кардио-
логия. - 1984. - № 12. - С. 73-79.4. Дубровский И.А., Сулимое В.А., Папакин Г.М., Горбатов А.А.
Чреспищеводная электрокардиостимуляция: дискомфорт и парамет¬
ры импульсов//Кардиология. — 1989. — N° 5. — С. 91—93.5. Кузьменков Д.В., Сулимое В.А., Богатырев И.В., Кузьмин H.JI.
и др. Новый неинвазивный способ электрической стимуляции серд-
ца//Кардиология. — 1990. — № 3. — С. 91—92.6. Кушаковский И.С., Узилевская Р.А., Шулутко Г.В., Кузьмин А.П.,
Реброва Г.А. Опыт работы городского противоаритмического цент-
ра//Вестн. аритмологии. — 1993. — № 1. — С. 78—82.7. Andersen H.R., Pless P. Trans-Esophageal Pacing//PACE.— 1983.—
Vol. 6, N 7-8. - P. 674-679.8. Bagliani G., Meniconi I. Raggi F. Left origin of the atrial esophageal
signal as recorded in the pacing site//PACE. — 1998. — Vol. 21, N 1. —
P. 18-24.9. Benson D. W., Dunnigan A., Sterba R. Atrial pacing from the esopha¬
gus in the diagnostics and management of tachycardia and palpitations//.!,
of Pediatrics. - 1983. - Vol. 102, N 4. - P. 40-46.10. Gallagher J.J., Smith W.M., Kerr C.R., Kasell J. et al. Esophageal
pacing: a diagnostic and therapeutic tool//Circulation. — 1982. — Vol. 65,
N 2. - P. 336-341.28
11. Pattison C.Z., Atlee J.L., Mathews E.L., Buljubasic N., Entress J.J.
Atrial pacing thresholds measured in anesthetized patients with the use of
an esophageal stethoscope modified for pacing//Anesthesiology.— 1991.—
Vol. 74, N 5. - P. 854-859.12. Res J.C., Van Woersem R.J., Dekker E., Dunning A.J. Transeso¬
phageal atrial pacing — stimulation and discomfort thresholds: the role of
electrode configuration and pulse width//PACE.— 1991.— Vol. 14, N 9.—
P. 1359-1366.13. Santini М., Ansalone G., Cacciatore G., Turitto G. Transesophageal
pacing//PACE. - 1990. - Vol. 13, N 10. - P. 1298-1323.14. Thalen H.J.Th., Van Der Berg J.W., Van Der Heide J.N.H. et al.
The artificial cardiac pacemaker//Assen: Charles C. Thomas etc., 1969. —
359 p.
hHООО «ДМС ПЕРЕДОВЫЕ ТЕХНОЛОГИИ»Производит и реализует диагностические медицинские системы
Тел./факс: (095) 249-15-57, 746-80-22 http//www.dms-at.ruРекомендовано Министерством здравоохранения РФ
к применению в медицинской практикеЧреспищеводный и эндокардиальный
диагностический кардиостимуляторЭЗОТЕСТНазначение• Выявление скрытой коронарной недостаточности (ИБС)• Оценка резерва миокарда• Определение функционального состояния синусового узла• Определение характера синоатриального и атриовентрикулярного
проведений •• Исследование функционального состояния различных отделов
проводящей системы сердца• Индуцирование и купирование наджелудочковых нарушений ритма
с целью уточнения их электрофизиологических механизмов• Подбор эффективной антиангинальной и антиаритмической терапииВозможности аппарата• Два режима стимуляции: постоянной и программируемой (с одним
или двумя задержанными импульсами)• Два выхода: для чреспищеводной и эндокардиальной стимуляции• Работа от встроенного аккумулятора с возможностью его заряда
от сети• Время непрерывной работы после заряда аккумулятора —
не менее 20 часов• Автоматическая индикация разряда аккумулятора• Время работы кардиостимулятора после индикации разряда
аккумулятора — не менее 1 часа• Автоматическое отключение блока стимуляции в режиме заряда• Простота управления, наглядная индикация режимов
и параметров стимуляции
Глава 2МЕТОДИКА ПРОВЕДЕНИЯ
ЧРЕСПИЩЕВОДНОИ ЭЛЕКТРИЧЕСКОЙ
СТИМУЛЯЦИИ СЕРДЦА
2.1. Общие правилаЧПЭС — простой и безопасный метод диагностики при ус¬
ловии строгого соблюдения методических рекомендаций.
Описываемые большинством авторов методики чреспищевод¬
ной стимуляции предсердий отличаются друг от друга лишь
незначительно [1, 13].Перед проведением процедуры врач должен ознакомить
пациента с характером и возможными осложнениями исследо¬
вания. Непосредственно перед исследованием должны быть
проведены врачебный осмотр и регистрация стандартной ЭКГ
(натощак или не ранее чем через 2—2,5 ч после еды).Для проведения ЧПЭС необходимы электрод, электрокар¬
диостимулятор, электрокардиограф (желательно многоканаль¬
ный с осциллоскопом). Процедура должна осуществляться под
непрерывным кардиомониторным контролем в помещении,
оснащенном дефибриллятором и необходимым набором меди¬
каментозных средств для оказания неотложной помощи и
проведения реанимационных мероприятий [1, 3].В настоящее время в арсенале врача-кардиолога имеются
десятки электродов и кардиостимуляторов различных кон¬
струкций и модификаций отечественного и зарубежного про¬
изводства. Строгой стерилизации пищеводных электродов не
требуется, однако необходима тщательная обработка в соот¬
ветствии с инструкцией по их эксплуатации.2.2. Техника введения и установки
пищеводного электродаОдним из важных условий успешного проведения ЧПЭС яв¬
ляется применение премедикации перед исследованием. Обыч¬
но всем больным за 20—30 мин до начала процедуры вводится
внутримышечно 2 мл 0,5 % раствора седуксена или реланиума.До начала исследования производится анестезия слизистой
оболочки носоглотки — орошение раствором любого местного
анестетика (чаще всего используется 0,5 % раствор новокаина
или 2 % раствор лидокаина), что позволяет уменьшить дис¬
комфорт при установке электрода. Процедура проводится в
положении больного лежа на спине (без подушки). Через 1 —2 мин после анестезии электрод медленно вводится через нос31
Рис. 2.1. Расположение электрода в пищеводе и чреспищеводная
электрограмма.в просвет пищевода, при этом больному предлагают делать
мелкие глотательные движения. При введении электрода через
нос рвотный рефлекс выражен обычно меньше. Однако при
искривлении носовой перегородки, узких носовых ходах, по¬
явлении болезненности он может быть проведен через рот.Первичная установка электрода осуществляется на глаз:
дистальный полюс его погружается в пищевод на 40±4 см (рис.
2.1) [6]. Затем окончательная установка электрода осуществля¬
ется по чреспищеводной электрограмме. Для этого к дисталь¬
ному полюсу пищеводного электрода с помощью зажима под¬
ключается грудной электрод кардиографа (чаще всего VI) или
монитора, и в этом отведении регистрируется чреспищеводная
электрограмма. Под визуальным контролем (на экране мони¬
тора или по записи ЭКГ) электрод устанавливается в позиции,
обеспечивающей максимальную положительную амплитуду
зубца Р, что обычно соответствует нижней части левого пред¬
сердия (рис. 2.2) [2—5, 9, 10, 12].Другим возможным вариантом установки электрода явля¬
ется следующий: производится запись пищеводной электро¬
граммы последовательно с проксимального и дистального по¬
люсов пищеводного электрода, и он устанавливается в пози¬
ции, когда с обоих полюсов записана наиболее сходная
электрограмма с максимальной амплитудой зубца Р (рис 2.3).Глубина введения электрода от ноздрей до дистального по¬
люса равна обычно 36—45 см. Чтобы исключить смещение
электрода в ходе исследования, он фиксируется к носу или32
Рис. 2.2. Рентгенограмма грудной клетки (левая боковая проекция).
Расположение электрода в пищеводе на уровне нижней части левого
предсердия.коже лица полоской лейкопластыря или (если устанавливается
через рот) больной сжимает его губами.К процедуре окончательной установки электрода необхо¬
димо отнестись очень внимательно, поскольку от этого зави¬
сит порог стимуляции и соответственно дискомфорт при про¬
ведении исследования.V,V,АРис. 2.3. Чреспищеводная электрограмма, записанная с проксималь
ного (А) и дистального (Б) полюсов электрода. Vi — отведения ЭКГ.3 — 127933
А БРис. 2.4. Устойчиво «навязанный» искусственный ритм с частотой
160 имп/мин во время теста ЧПЭС. А — начало ЧПЭС предсердий,
Б — окончание ЧПЭС предсердий.2.3. Определение порога стимуляцииПосле установки электрод подключают к электрокардио¬
стимулятору: проксимальный контакт к отрицательной клем¬
ме аппарата, а дистальный — к положительной (иногда дис¬
тальный вывод окрашен в красный цвет, как и положитель¬
ная клемма стимулятора, а проксимальный — в черный или
синий).Перед включением необходимо убедиться в том, что ручка
регулирования амплитуды стоит на минимальном значении.
Длительность импульса в аппарате уже заранее установлена и
чаще всего равна 10 мс. По ЭКГ измеряется частота сердечных
сокращений, и на стимуляторе устанавливается частота, на
10 имп/мин превышающая собственный ритм больного. Пос¬
ле включения импульсов при постоянном ЭКГ-контроле по¬
степенно увеличивается амплитуда импульсов до тех пор, пока
не удается добиться стабильного «навязывания» искусствен¬
ного ритма [1, 3, 7, 8, 10—13]. При правильной установке
электрода порог стимуляции предсердий обычно не превыша¬
ет 15—18 В. При этом чем меньше порог стимуляции, тем
меньше неприятных ощущений испытывает пациент.При устойчиво «навязанном» искусственном ритме за каж¬
дым стимулирующим импульсом (артефакт на ЭКГ) появляет¬
ся комплекс QRS (рис. 2.4). Ритм может «навязываться» нере¬
гулярно или не «навязываться» вовсе в зависимости от не¬
скольких условий. Основным из них является хорошая уста¬
новка электрода в пищеводе по отношению к левому предсер¬
дию и его надежный контакт со слизистой. Иногда наилучшее
положение электрода может соответствовать не максимальной34
положительной амплитуде зубца Р пищеводной электрограм¬
мы, а максимальной суммарной амплитуде зубца Р.Если порог стимуляции предсердий превышает 25 В или не
происходит стойкого «навязывания» искусственного ритма,
следует изменить положение электрода в пищеводе или поме¬
нять полярность полюсов электрода, можно также попытаться
увеличить длительность импульсов.После установки электрода и «навязывания» искусствен¬
ного ритма можно приступить к диагностическим и лечебным
процедурам. Программа ЧПЭС зависит от задач исследовате¬
ля. Основные протоколы стимуляции описаны в соответству¬
ющих разделах книги.Список литературы1. Аронов Д.М., Лупанов В. П. Функциональные пробы в кардио¬
логии. Лекция V. Проба с чреспищеводной электрической стимуля¬
цией предсердий//Кардиология. — 1996. — № 4. — С. 95—98.2. Бредикис Ю.Ю., Римша Э.Д., Киркутис А.А. и др. Амбулатор¬
ная электрофизиологическая диагностика нарушений сердечного
ритма//Кардиология. — 1987. — № 4. — С. 12.3. Голицын С.П., Малахов М.И., Соколов С.Ф. и др. Чреспище¬
водная электростимуляция в диагностике и лечении нарушений
ритма сердца (часть 1)//Кардиология. — 1990. — № 11. — С. 31.4. Римша Э.Д. Методика диагностической чреспищеводной
электростимуляции сердца. — В кн.: Диагностическая и лечебная
стимуляция сердца. — Каунас, 1983. — С. 77—101.5. Сметнев А.С., Гросу А.А., Соколов С.Ф. и др. Чреспищеводная
электрическая стимуляция сердца в диагностике пароксизмальных
наджелудочковых тахикардий//Кардиология.— 1983.—№ 11,— С. 13.6. Andersen H.R., Pless P. Trans-Esophageal Pacing//PACE.—
1983.- Vol. 6. - P. 674.7. Burack B., Furman S. Transesophageal cardiac pacing//Amer.J.
Cardiol. - 1969. - Vol. 23. - P. 469.8. Dittrich P., Lauten A. Transesophagale Elektrostimulation des
Herzens Deutsch. — Ges. Wesen, 1979. — Vol. 27. — P. 2018—2020.9. Gallagher J.J., Smith IV.М., Kassel J. et al. Use of the esophageal
lead in the diagnosis of mechanisms of reciprocating supraventricular ta-
chicardia//PACE. - 1979. - Vol. 2. - P. 32.10. Gallagher J.J., Smith W.M., Kerr C.R. et al. Esophageal pacing: A
diagnoctic and therapeutic tool//Circulation. — 1982. — Vol. 65, N 2. —
P. 336-341.11. Lubell D.L. Cardiac pacing from the esophagus//Amer.J. Car¬
diol. - 1971. - Vol. 27. - P. 641-644.12. Nishimura М., Katoh Т., Nanai S. et al. Optimal mode of transeso¬
phageal Pacing//Amer.J.Cardiol.— 1986.— Vol. 57, N 10.— P. 791—796.13. Roth F., Salzjnann C., Gurtner H.P. Elektrische Stimulation des
Herzens ueber eine Oesophaguselektrode//Schweiz. Med. Wschr. —
1969. - Vol. 99. - P. 1661.3*
Глава ЗПРИМЕНЕНИЕ ЧРЕСПИЩЕВОДНОЙ
ЭЛЕКТРИЧЕСКОЙ СТИМУЛЯЦИИ СЕРДЦА
ДЛЯ ДИАГНОСТИКИ ИШЕМИЧЕСКОЙ
БОЛЕЗНИ СЕРДЦА И ПОДБОРА
МЕДИКАМЕНТОЗНОЙ АНТИАНГИНАЛЬНОЙ
ТЕРАПИИ3.1. Протокол проведения ЧПЭССдля диагностики ишемической болезни сердцаХорошо известны трудности, часто возникающие при уста¬
новлении диагноза ишемической болезни сердца (ИБС). Это
особенно актуально при стертой клинической картине заболе¬
вания, атипичном болевом синдроме, нормальной ЭКГ, сня¬
той в покое [1,7, 28].Известные способы диагностики ИБС (электрокардиогра¬
фическая регистрация состояния гипоксии миокарда, вызван¬
ного физической нагрузкой, велоэргометрия, тредмил-тест)
[7, 19] не всегда выполнимы. В связи с этим разработана на¬
грузочная проба, повышающая потребность миокарда в кисло¬
роде, но не требующая физической нагрузки, — проба с элект¬
рической стимуляцией предсердий, первоначально предло¬
женная как инвазивный метод, поскольку предусматривала
введение электрода в полость сердца для стимуляции правого
предсердия [39].Тест эндокардиальной предсердной стимуляции — высоко¬
информативный и многоцелевой метод. Однако необходи¬
мость катетеризации сердца и возможность осложнений, огра¬
ничения при повторных исследованиях, большая трудоем¬
кость и дорогостоящее оборудование не позволили широко
применять данную методику в клинической практике [7, 19,
28].Методика чреспищеводного теста предсердной стимуля¬
ции разрабатывалась практически параллельно. Широкому
внедрению в диагностическую практику препятствовали явле¬
ния, сопровождающие процесс стимуляции, — болевые ощу¬
щения по ходу пищевода, сокращение мышц диафрагмы и
грудной клетки. Поэтому ЧПЭС долгое время выполнялась
лишь в условиях реанимации для лечения неотложных состоя¬
ний нарушений сердечной деятельности. Совершенствование
конструкции пищеводных электродов и кардиостимуляторов
позволило ограничить зону стимуляции (без вовлечения тора-
ко-абдоминальных мышц), снизить порог стимуляции и улуч¬
шить переносимость процедуры больными.36
А.С.Сметнев и соавт. [20], проводя ЧПЭС больным с па¬
роксизмальными наджелудочковыми тахикардиями, выявили
депрессию сегмента ST на ЭКГ, сопровождающуюся развити¬
ем приступа стенокардии. Дальнейшие разработки подтверди¬
ли возможность применения теста ЧПЭС для диагностики
ИБС, выявления скрытой коронарной недостаточности, уточ¬
нили показания и противопоказания к проведению нагрузоч¬
ного теста [10, 29].При пробе с ЧПЭС повышается потребность миокарда в
кислороде за счет увеличения частоты сердечных сокращений
(ЧСС) без существенного изменения артериального давления
(АД) [2]. Обследуемый находится в состоянии покоя, не при¬
нимая активного участия в процедуре, т.е. «нагружается серд¬
це без нагрузки больного» [27] — это дает возможность ис¬
пользовать ЧПЭС в тех случаях, когда проведение проб с до¬
зированной физической нагрузкой противопоказано или их не
удается довести до диагностических критериев из-за детрени¬
рованности пациента или наличия у него сопутствующей па¬
тологии (выраженная дыхательная недостаточность, недоста¬
точность кровообращения, артериальная гипертония, пере¬
межающаяся хромота, дефекты опорно-двигательного аппара¬
та и т.д.).Премедикация обычно проводится за 20—30 мин до начала
процедуры; вводится внутримышечно 2 мл 0,5 % раствора се¬
дуксена или реланиума. Существует мнение, что введение се¬
дативных препаратов может исказить восприятие характера и
интенсивности болевых ощущений, затруднить оценку резуль¬
татов пробы. По нашим наблюдениям, премедикация является
условием успешного проведения теста, позволяет с минималь¬
ными неприятными ощущениями вводить электрод в пище¬
вод, несколько уменьшает явления дискомфорта во время сти¬
муляции.Методика введения и установки чреспищеводного
электрода для проведения ЧПЭС с целью диагностики ИБС и
подбора медикаментозной антиангинальной терапии не отли¬
чается от стандартной и изложена в главе 2.Исходно регистрируется ЭКГ в 12 стандартных отведени¬
ях (грудные отведения V,—V6, или II, avF, V2, V5 как наибо¬
лее информативные, что определяется возможностями
электрокардиографа); скорость записи — 50 мм/с. Проведе¬
ние нагрузочного теста ЧПЭС начинают с частоты, превы¬
шающей на 10—20 имп/мин собственный ритм. В дальней¬
шем каждую минуту, не прекращая стимуляции, дискретно
увеличивают частоту ритма на 10—20 имп/мин; после каждой
минуты нагрузки, в момент ее прекращения и в восстанови¬
тельном периоде на 1—5-й минутах регистрируется ЭКГ.
Контроль за ритмом сердца осуществляется непрерывно по
экрану осциллоскопа.37
v. jlLlLxLa^LJWUITРис. 3.1. Оценка изменений ЭКГ по время теста ЧПЭС предсердий.
Отчетливо видна горизонтальная депрессия сегмента ST до 2 мм
в последнем «навязанном» и в трех последующих синусовых ком¬
плексах.Тест ЧПЭС прекращается при достижении субмаксималь-
ной для возраста пациента частоты сердечных сокращений, а
также при появлении клинических или электрокардиографи¬
ческих признаков ишемии миокарда. При отсутствии типич¬
ного для пациента ангинозного приступа и динамики конеч¬
ной части желудочкового комплекса ЭКГ продолжительность
ЧПЭС на последней ступени нагрузки должна быть увеличена
до 2 мин.По критериям ВОЗ (1971), субмаксимальная ЧСС состав¬
ляет для людей в возрасте 20—29 лет 170 уд/мин, 30—39 лет —
160 уд/мин, 40—49 лет — 150 уд/мин, 50—59 лет — 140 уд/мин,
60 лет и старше — 130 уд/мин. В практической работе наибо¬
лее удобными формулами для расчета ЧСС максимальной и
ЧСС субмаксимальной являются: ЧССмакс = 220 — возраст;
ЧССсубмакс = 200 — возраст пациента.Тест ЧПЭС считается положительным при появлении
горизонтальной или косонисходящей депрессии сегмента
ST > 1 мм длительностью не менее 0,08 с от точки j в первом
и последующих 3—5 синусовых комплексах постстимуляци-
онного периода (рис. 3.1).Во время теста ЧПЭС при увеличении частоты стимуля¬
ции отмечается замедление атриовентрикулярной проводи¬
мости (рис. 3.2) — удлиняется интервал «артефакт стимула —
Q». У 36—40 % пациентов возникает атриовентрикулярная
блокада II степени с периодами Самойлова—Венкебаха. На¬
рушения проводимости отмечаются при частоте стимуляции
от 100 до 170 имп/мин (в среднем при 130—140 имп/мин).
В этих случаях вводится внутривенно 1 мг сульфата атропи¬
на, что у большинства пациентов позволяет довести тест до38
тллпшвvs A——_A——vsX__1j——j\ і—Li—Лі—Al.
v.jl4_l~Lj Ljl Ui—ні MlБ ГРис. 3.2. Замедление АВ проводимости во время теста ЧПЭС. А — ис¬
ходная ЭКГ, синусовый ритм 80 уд/мин (интервал Р—Q = 0,15 с). Б —
ЧПЭС предсердий 110 имп/мин (St—Q = 0,23 с). В — ЧПЭС предсер¬
дий 130 имп/мин (St—Q = 0,28 с). Г — ЧПЭС предсердий 140 имп/мин:
появление АВ-блокады II степени с периодами Самойлова—Венке-
баха.1ШРис. 3.3. Улучшение АВ проводимости после внутривенного введения
атропина во время теста ЧПЭС. А — АВ-блокада II степени с перио¬
дами Самойлова—Венкебаха при ЧПЭС предсердий 130 имп/мин.
Б — ЧПЭС предсердий 160 имп/мин после внутривенного введения
1 мг атропина, исчезновение АВ-блокады II степени.диагностических критериев. После введения атропина про¬
должительность интервала «артефакт стимула — Q» уменьша¬
ется (рис. 3.3).При высокой частоте стимуляции артефакт стимула насла¬
ивается на конечную часть желудочкового комплекса, что за-39
fWWlРис. 3.4. Изменения ЭКГ после прекращения теста ЧПЭС предсер¬
дий. А — ЭКГ в покое. Б — во время ЧПЭС 150 имп/мин оценка из¬
менений конечной части комплекса QRS затруднена. В последнем
«навязанном» и в двух последующих синусовых комплексах отчетливо
видна депрессия сегмента 5— Т до 2 мм.трудняет интерпретацию изменений ЭКГ. В этих случаях
оценка изменений ST— Г при ЧПЭС проводится после выклю¬
чения кардиостимулятора, так как «ишемические» изменения
ЭКГ или отсутствие изменений хорошо видимы в последнем
«навязанном» комплексе и нескольких последующих синусо¬
вых комплексах (рис. 3.4).По литературным данным, полностью завершить тест
ЧПЭС удается у 92—96 % пациентов. В 3—7 % случаев тест
не доводится до диагностических критериев из-за возникно¬
вения АВ-блокады II степени, не исчезающей и после внут¬
ривенного введения 1 мг раствора сульфата атропина и реже
(в 1—2 % случаев) из-за болевых ощущений, связанных со
стимуляцией, интенсивность которых не позволяет закончить
исследование.У всех остальных пациентов интенсивность болевых ощу¬
щений во время процедуры бывает незначительной (легкое
жжение, покалывание, пощипывание, подергивание по ходу
пищевода, в ряде случаев с иррадиацией в эпигастрий, спину).
Болевые ощущения практически мгновенно проходят при от¬
ключении импульсов кардиостимулятора. Этот признак может
иметь дифференциально-диагностическое значение при выяв¬
лении возникшего в ходе нагрузочной пробы приступа стено¬
кардии, который так мгновенно не купируется. Дискомфорт¬
ные ощущения обычно не препятствуют проведению ЧПЭС,
но у части пациентов могут маскировать ангинозный приступ,
что не позволяет наверняка дифференцировать свои ощуще¬
ния.40
Обычно ангинозный приступ, индуцированный ЧПЭС, по
характеру боли, ее локализации и иррадиации похож на свой¬
ственные данному пациенту приступы стенокардии. Поэтому
перед проведением теста врачу необходимо подробно расспро¬
сить больного о характере ощущений при приступе стенокар¬
дии.у 80—84 % больных, страдающих ишемической болезнью
сердца, тест ЧПЭС оказывается положительным — отмечается
депрессия сегмента ST на 1 мм и более. У 40—44 % «ишеми¬
ческие» изменения ЭКГ сочетаются с появлением приступа
стенокардии; у остальных депрессия сегмента ST не сопро¬
вождается приступом стенокардии или больные затрудняются
его выделить. При появлении болей, похожих на ангинозные,
но не сочетающихся с «ишемическими» изменениями ЭКГ,
результаты нагрузочного теста ЧПЭС следует трактовать как
сомнительные; в таких случаях целесообразно проводить до¬
обследование.Обычно сомнительные и ложноположительные тесты
ЧПЭС отмечаются у пациентов, у которых «ишемические» из¬
менения ЭКГ не сочетаются с приступом стенокардии, а воз¬
никающая депрессия сегмента ST не превышает 1,5 мм и по¬
является лишь при частоте искусственной тахикардии в сред¬
нем 150—160 имп/мин. Если считать критерием положитель¬
ного теста горизонтальную или косонисходящую депрессию
сегмента ST на 2 мм и более, то количество «ложноположи¬
тельных» результатов, естественно, уменьшится, но это суще¬
ственно отразится на чувствительности теста, так как у части
больных с достоверно доказанной ИБС в ходе исследования
депрессия сегмента ST возникает при 1 мм < ST < 2 мм.Таким образом, доведение теста до максимальной для воз¬
раста больного ЧСС приводит к некоторому повышению чув¬
ствительности, но значительному снижению специфичности.
Поэтому наиболее оптимальным критерием прекращения
теста ЧПЭС следует считать достижение субмаксимальной для
возраста больного ЧСС.У больных с клинически типичной стенокардией тест
ЧПЭС оказывается положительным чаще, чем у пациентов с
ИБС с атипичным болевым синдромом (90—95 % против 75—
80 %). При болях по типу кардиалгии ишемическая болезнь
выявляется лишь в 30—40 % случаев.Суммируя результаты многочисленных исследований по¬
следних лет, проводимых для выявления диагностической
Ценности изменений ЭКГ при ЧПЭС в зависимости от сте¬
пени поражения коронарного русла по данным коронароан-
гиографии, можно утверждать: чувствительность теста ЧПЭС
84а^агностике ишемической болезни сердца составляет 80—
специфичность — 75—80 %, предсказующая ценность
°ложительного результата — около 90 %, предсказующая41
ценность отрицательного результата — около 70 % [2, 10, 12,
29, 41].Очень важно отметить, что «порог стенокардии» (мини¬
мальная частота стимуляции, при которой отмечено появле¬
ние «ишемической» динамики ЭКГ) в ходе теста ЧПЭС среди
больных с достоверно доказанной ИБС значительно меньше,
чем диагностическая частота стимуляции у пациентов без ко¬
ронарной патологии. Так, по нашим данным, «порог стено¬
кардии» больных с ИБС составляет в среднем 130—140 ударов
в 1 мин, у пациентов без ИБС диагностическая частота ритма
колеблется в пределах 160 ударов в 1 мин.Уровень АД во время ЧПЭС на максимальной частоте как
у больных с ИБС, так и у пациентов без коронарной патоло¬
гии лишь незначительно превышает исходные цифры и досто¬
верно не отличается в каждой из групп: систолическое АД
обычно не повышается более чем на 10—15 мм рт.ст.При исследовании диагностических возможностей ЧПЭС
выявляется обратная корреляционная зависимость результа¬
тов теста и тяжести клинических проявлений стенокардии у
обследуемых больных. Этот вывод хорошо иллюстрируется
следующими данными: «порог стенокардии» у больных со сте¬
нокардией II функционального класса составляет в среднем
140 ударов в 1 мин, III — 125 ударов в 1 мин, IV — 110 ударов
в 1 мин. Таким образом, по величине «порога стенокардии»
можно с большой долей вероятности судить о тяжести клини¬
ческих проявлений стенокардии.ЧПЭС является селективным нагрузочным тестом для
миокарда и абсолютно безопасна для больных. Практически
ни в одном из исследований в литературе не описаны случаи
осложнений при его проведении. Весьма важной особеннос¬
тью теста является его управляемость. При отключении кар¬
диостимулятора очень быстро (обычно в течение 20—60 с) ис¬
чезают приступ стенокардии и ЭКГ-проявления ишемии мио¬
карда, индуцированные в ходе нагрузки, что позволяет ис¬
пользовать этот метод для диагностики ИБС у больных с по¬
дозрением на нестабильную стенокардию. Лишь в единичных
случаях (преимущественно при стенокардии IV функциональ¬
ного класса) может возникнуть необходимость купирования
приступа стенокардии.К побочным действиям относится дискомфорт по ходу пи¬
щевода, возникающий практически у всех пациентов во время
стимуляции, что связано, очевидно, с сокращением стенок
пищевода синхронно с импульсами кардиостимулятора и (что
менее вероятно) с прямым воздействием электрического тока
на слизистую пищевода (орошение местными анестетиками —
растворами лидокаина, пиромикаина, тримекаина мест кон¬
такта полюсов электрода со стенкой пищевода ощущений дис¬
комфорта не уменьшает).42
Прямого электрического или электрохимического воздей¬
ствия на слизистую оболочку пищевода стимуляция не оказы¬
вает, повреждений пищевода не вызывает. В одном из наших
исследований 20 больным на следующий день после ЧПЭС в
плановом порядке для обследования органов желудочно-ки¬
шечного тракта проведена эзофагогастродуоденоскопия, при
которой повреждений слизистой оболочки пищевода, види¬
мых на глаз, выявлено не было.Суммируя сказанное, можно сформулировать показания к
применению нагрузочного теста ЧПЭС:— невозможность проведения проб с дозированной физи¬
ческой нагрузкой в связи с наличием сопутствующих за¬
болеваний или противопоказаний к проведению этой
пробы, включая нестабильную стенокардию;— неинформативность проб с физической нагрузкой
вследствие того, что она не доведена до диагностичес¬
ких критериев по ЭКГ или до субмаксимальной ЧСС
(из-за детренированности больного, высокого АД и вы¬
раженной гипертензивной реакции при нагрузке, а так¬
же при заболеваниях и дефектах опорно-двигательного
аппарата, препятствующих выполнению проб с нагруз¬
кой;— застойная сердечная и дыхательная недостаточность, не
позволяющая применить пробу с дозированной физи¬
ческой нагрузкой.Противопоказаний к применению теста ЧПЭС немного:
проба абсолютно противопоказана при наличии органических
забований пищевода — эзофагитах, стриктурах, дивертикулах,
опухолях.Проведение ЧПЭС с целью диагностики ИБС невозможно
при постоянной форме мерцательной аритмии, нецелесооб¬
разно у больных с атриовентрикулярной блокадой II—III сте¬
пени, так как при этом отсутствует возможность навязывания
искусственного ритма с необходимой ЧСС, а также у больных
с исходными изменениями ЭКГ вследствие блокады левой
ножки пучка Гиса, выраженной гипертрофии миокарда, син¬
дрома Вольфа—Паркинсона—Уайта, так как при этих состоя¬
ниях невозможно правильно интерпретировать изменения ко¬
нечной части желудочкового комплекса.Таким образом, простота выполнения теста ЧПЭС, воз¬
можность доведения его до диагностических критериев неза¬
висимо от возраста, пола, массы тела больного, сопутствую¬
щих заболеваний, влияния экстракардиальных факторов в
сочетании с высокой информативностью делает этот тест не¬
заменимым в выявлении скрытой коронарной недостаточ¬
ности у больных с подозрением на коронарный атеросклероз
и ИБС.43
3.2. «Ускоренный» одноступенчатый тест
чреспищеводной электрической стимуляции
сердцаПри проведении нагрузочной пробы по ступенчато возрас¬
тающей методике у сердца появляется возможность использо¬
вать свои приспособительные, адаптационные механизмы: ди-
латация коронарных артерий и коллатеральное кровообраще¬
ние улучшают кровообращение в ишемизированном миокарде
в ходе нагрузочного теста на каждой его ступени. Действи¬
тельно, можно допустить, что незначительное несоответствие
потребности и доставки кислорода, возникающее при уве¬
личении частоты сердечных сокращений на 10—20 ударов в1 мин, еще не приводит к развитию приступа стенокардии и
появлению «ишемических» изменений на ЭКГ, но сам факт
возникшей ишемии — мощный фактор дилатации коронарных
артерий и включения коллатерального кровообращения. По¬
требность и доставка приходят в соответствие, и в ряде случа¬
ев маскируется имеющаяся ишемическая болезнь сердца,
ее подтверждение при проведении нагрузочной пробы отсут¬
ствует.В факультетской терапевтической клинике имени В.Н.Ви¬
ноградова Московской медицинской академии имени
И.М.Сеченова была предпринята попытка изучить диагности¬
ческие возможности «ускоренного» одноступенчатого теста
ЧПЭС, отличающегося от многоступенчатого тем, что стиму¬
ляцию начинают сразу с частоты, равной субмаксимальной
для возраста больного ЧСС и продолжают ее до 1 мин под не¬
прерывным ЭКГ-контролем по осциллоскопу электрокардио¬
графа. Подобный эффект мгновенного учащения пульса про¬
сто невозможен при проведении обычных нагрузочных проб
(велоэргометрии, тредмила). При «ускоренном» тесте ЧПЭС,
по нашему мнению, воздействие вышеописанных приспосо¬
бительных и адаптационных механизмов коронарного резерва
в значительной степени исключается.Для большей достоверности результатов «ускоренный» тест
считали положительным при появлении горизонтальной или
косонисходящей депрессии сегмента ST > 2 мм длительностью
более 0,08 с от точки j.По данной методике нами было обследовано 116 больных
(всем до этого проводился обычный ступенчатый тест, а «ус¬
коренный» тест проводился не ранее чем через 30—45 мин
после предыдущего). У 70 из 75 больных (93 %) с доказанной
ИБС «ускоренный» тест был положительным, у 31 из 41 (76 %)
без коронарной патологии — отрицательным. Таким образом,
чувствительность «ускоренного» теста оказалась равной 93 %,
специфичность — 76 %, предсказующая ценность положитель¬
ного результата — 88 %, отрицательного результата — 86 %,44
ІПЛПЯГ..ЩЦ—МЧ-V5 jUt^^ ■ "
v. UmJlMt І VsvekkUJjL '-Lr—вРис. 3.5. Изменения ЭКГ при проведении ступенчато возрастающего
и «ускоренного» тестов ЧПЭС предсердий. А — ЭКГ в покое; Б —
ступенчато возрастающий тест ЧПЭС предсердий 130 имп/мин; В —
«ускоренный» тест ЧПЭС предсердий 130 имп/мин.что значительно превышает аналогичные результаты обычного
ступенчато возрастающего теста.Методика «ускоренного» одноступенчатого теста ЧПЭС
позволяет существенно сократить время проведения нагрузоч¬
ной пробы до 1 мин вместо 7—9 мин при ступенчато возраста¬
ющем тесте, что весьма важно с учетом тех дискомфортных, а
иногда и болезненных ощущений, которые возникают во
время стимуляции и довольно часто препятствуют проведению
длительных исследований. Методика «ускоренного» теста
также несколько увеличивает диагностическую ценность дан¬
ной нагрузочной пробы, динамика ЭКГ становится более на¬
глядной (рис. 3.5), что позволяет рекомендовать ее к примене¬
нию как в сочетании со ступенчатым тестом (для подтвержде¬
ния результата пробы), так и в виде самостоятельной пробы
при обследовании больных с ИБС или при неясном диагнозе.Согласующиеся данные опубликованы в работе А.П.Голи¬
кова и соавт. [8], наблюдавших феномен регресса ишемии
миокарда в процессе ступенчато возрастающего теста ЧПЭС.
Дополнив свое исследование «внезапной» пробой — эквива¬
лент «ускоренного» одноступенчатого теста ЧПЭС, они доби¬
лись предотвращения ложноотрицательных результатов пробы
у пациентов с критическим стенозом коронарных артерий, но45
хорошо функционирующим коллатеральным кровообращени¬
ем (выявленными при коронароангиографии), а также у паци¬
ентов с начальными проявлениями коронарного атеросклеро¬
за, у которых возникающая ишемия миокарда нивелируется
коронародилатацией в ответ на нагрузку. Клиническим под¬
тверждением регресса ишемии миокарда при нагрузке являет¬
ся феномен «прохождения через боль» (приступ стенокардии
напряжения проходит самостоятельно при продолжении на¬
грузки, а дальнейшая непрерывная нагрузка хорошо перено¬
сится больными). Авторы считают, что подобная методика
может оказаться ценной при определении прогноза и лечеб¬
ной тактики у больных с ИБС, решении вопроса о риске про¬
ведения коронарной ангиопластики.3.3. Сопоставление результатов теста
ЧПЭС сердца с другими нагрузочными
и медикаментозными пробами в диагностике ИБССравнительные результаты теста ЧПЭС и проб с дозиро¬
ванной физической нагрузкой (велоэргометрия, тредмил-тест)
с данными селективной коронароангиографии для диагности¬
ки ИБС в отечественной и зарубежной литературе освещены
достаточно подробно [2, 16, 28, 38]. Основные выводы в боль¬
шинстве работ совпадают. Мы также считаем возможным ос¬
ветить этот вопрос на примере собственных исследований.В факультетской терапевтической клинике имени В.Н.Ви¬
ноградова Московской медицинской академии имени
И.М.Сеченова за период 1984—1996 гг. у 188 пациентов (122 с
достоверно доказанной ИБС и 66 без коронарной патологии)
проведены обе нагрузочные пробы. Результаты (ЧПЭС и
ВЭМ) представлены в табл. 3.1, из которой видно, что соот¬
ветствующие показатели (чувствительность, специфичность,
предсказующая ценность положительного и отрицательного
результата) при обеих пробах существенно не различаются.Таблица 3.1. Сопоставление результатов ЧПЭСС и велоэргометри-
ческой пробыжПоказательЧПЭС, %ВЭМ проба, %Чувствительность84•76Специфичность7888Предсказующая ценность
положительного результата9091Предсказующая ценность
отрицательного результата677046
I I чпэсс УУ////Л вэмРис. 3.6. Пороговые величины ЧСС и АД при тесте ЧПЭСС и ВЭМ.
Светлый столбик — ЧПЭСС, заштрихованный — ВЭМ.Совпадение положительных и отрицательных результатов
исследований отмечено у 174 больных (92 %), расхождение ре¬
зультатов исследований — у 14 (8 больных с ИБС и 6 — без
ИБС).В табл. 3.2 приведены данные изменений АД, ЧСС и ДП у
больных с ИБС и без нее в ходе ЧПЭС и ВЭМ пробы.Во время теста ЧПЭС ни в одном случае значительного по¬
вышения АД не наблюдалось, у 23 % больных на максимуме
нагрузки АД не изменялось, а у 11 % пациентов даже несколь¬
ко снижалось. В среднем же прирост систолического АД со¬
ставил около 11 мм рт.ст. Во время ВЭМ пробы отмечалось
значительное повышение АД: у 12 больных пришлось прекра¬
тить пробу из-за чрезмерного подъема АД, в среднем же сис¬
толическое АД увеличивалось на 50 мм рт.ст. и более.«Порог стенокардии» при тесте ЧПЭС оказался выше, чем
при пробе с физической нагрузкой: 131±8 ударов в 1 мин про¬
тив 116±6 ударов в 1 мин.Подобная динамика АД и ЧСС при ЧПЭС объясняется
кардиоселективностью данного теста.При ЧПЭС после отключения кардиостимулятора сразу
восстанавливается спонтанный синусовый ритм с практичес¬
ки прежней исходной частотой сердечных сокращений. АД
возвращается к исходному уровню в ближайшие 20—60 с. При
пробе с физической нагрузкой на ВЭМ восстановление ритма
сердца с исходной частотой и нормализация АД отмечаются
на 3—25-й минутах (в среднем около 7 мин). Показатели двой¬
ного произведения (ДП) в группе больных с ИБС на максиму¬
ме нагрузки существенно не отличались как при тесте ЧПЭС,
так и при ВЭМ пробе (см. табл. 3.2). Как видно, тенденция из-47
Таблица 3.2. Сопоставление гемодинамических показателей приТест ЧПЭСГруппаЧСС в 1 минсистолическое АД,
мм рт.ст.ДП, усл.ед.исх.макс.исх.макс.исх.макс.1-я2-я73±677±6131±8
158±14128±11
131±13137±14143±1598±9101±11182±23226±28Примечание. 1-я группа — больные с ИБС; 2-я группа — больныеменений АД, ЧСС и ДП при тесте ЧПЭС и ВЭМ пробе в рав¬
ной степени касается больных с ИБС и пациентов без коро¬
нарной патологии. Графическое изображение пороговых вели¬
чин ЧСС и систолического АД в ходе ЧПЭС и ВЭМ представ¬
лено на рис. 3.6.Приступ стенокардии, индуцированный предсердной сти¬
муляцией, быстро проходил в течение первой минуты после
отключения кардиостимулятора. Лишь нескольким больным
для купирования затянувшегося приступа стенокардии при¬
шлось принять нитроглицерин (однократно). Приступ стено¬
кардии, вызванный ВЭМ пробой, проходил значительно мед¬
леннее, был интенсивнее, для его купирования прием нитро¬
глицерина требовался большему числу больных, иногда по¬
вторно.«Ишемические» изменения ЭКГ, возникшие во время
теста ЧПЭС, также проходили быстрее, чем при ВЭМ пробе (в
среднем 4,5 с против 93 с).Особую диагностическую ценность тест ЧПЭС приобре¬
тает в тех случаях, когда невозможно провести пробы с физи¬
ческой нагрузкой из-за исходно повышенных цифр АД, де¬
фектов костно-мышечной системы, патологии органов дыха¬
ния, сосудов нижних конечностей, выраженных проявлений
сердечной недостаточности или просто физической детрени¬
рованности. Из 42 больных (22 %), которым не удалось до¬
вести до диагностических критериев ВЭМ пробу из-за выра¬
женной общей слабости, одышки, повышенного АД и т.д., 37
больным тест ЧПЭС был выполнен полностью, что позволи¬
ло провести дифференциальную диагностику при неясном
кардиалгическом синдроме и выработать правильную тактику
лечения.Необходимо отметить, что в отличие от ВЭМ пробы каче¬
ство ЭКГ в ходе теста ЧПЭС много лучше (четкая запись без
артефактов) из-за отсутствия помех, связанных с работой ске¬
летной мускулатуры и движением тела.48#
тесте ЧПЭС и велоэргометрической пробеВЭМ пробаЧСС в1 минсистолическое АД,
мм рт.ст.ДП, усл.ед.исх.макс.исх.макс.исх.макс.68±6116±6123±12172±2184±8196±2571±5149±12129±13181±2592±8273±31без ИБС. ДП — показатель двойного произведения.В настоящее время для диагностики ИБС с успехом при¬
меняется и ряд фармакологических тестов, применяемых в
случаях неинформативности проб с дозированной физической
нагрузкой или невозможностью довести их по объективным
или субъективным причинам до диагностических критериев.
Наиболее информативной и представляющей практический
интерес является проба с дипиридамолом [2, 5, 16] в связи с
медикаментозным индуцированием преходящей контролируе¬
мой ишемии миокарда, при которой возникает так называе¬
мый феномен «межкоронарного обкрадывания». Обычно пре¬
парат вводится внутривенно в дозе 0,56 мг/кг в течение 4 мин;
при необходимости с промежутком в 4 мин могут быть допол¬
нительно введены 0,28 мг/кг препарата в течение 2 мин. При
этом наблюдается умеренная тахикардия (обычно ЧСС увели¬
чивается не более чем на 30 % от исходного уровня), систоли¬
ческое и диастолическое АД практически не меняются, отме¬
чается умеренно выраженный положительный инотропный
эффект. В случае возникновения приступа стенокардии или
«ишемических» изменений ЭКГ, вызванных дипиридамолом,
вводится внутривенно эуфиллин (антагонист аденозина), бло¬
кирующий рецепторы, через которые осуществляется артерио-
лодилатирующий эффект дипиридамола.Исследование с дипиридамолом по информативности не
уступает пробам с дозированной физической нагрузкой и
тесту ЧПЭС. Большинство авторов отмечают ее высокую спе¬
цифичность и предсказующую ценность положительного ре¬
зультата, однако невысокая чувствительность приводит к до¬
статочно большому числу ложноотрицательных данных [2, 16].На наш взгляд, представляет интерес комбинированная
(дипиридамол + ЧПЭС) электрокардиографическая проба
[13]. Особенность исследования заключается в том, что снача¬
ла проводится обычный тест ЧПЭС, затем пациенту внутри¬
венно вводится дипиридамол в дозе 0,84 мг/кг в течение 6 мин
и повторно проводится тест ЧПЭС. Комбинированную пробу4— 127949
авторам [13] удалось довести до диагностических критериев
всем пациентам, при этом отмечена более высокая информа¬
тивность (чувствительность и специфичность), чем при ис¬
пользовании каждого из этих тестов в отдельности в связи с
тем, что при комбинированном нагрузочном тесте потреб¬
ность миокарда в кислороде еще больше усугубляется «межко-
ронарным обкрадыванием», увеличивая тем самым вероят¬
ность появления признаков ишемии миокарда на ЭКГ. Есте¬
ственно, рекомендовать применение комбинированного теста
следует при диагностике начальных проявлений ИБС с мини¬
мальными признаками коронарного атеросклероза.В работе И.А.Пакулина [18] проведен сравнительный ана¬
лиз информативности ЧПЭС, дипиридамоловой пробы и тес¬
тов с дозированной физической нагрузкой (велоэргометр и
тредмил). Сопоставление результатов функциональных проб
нередко выявляло противоречивые данные: при сравнении ме¬
тодов частота попарного несовпадения результатов составляла
40—48 %. Из этого был сделан вывод, что ориентация на
какой-либо один из тестов может быть ошибочной. Логично
было предположить, что при использовании комплекса функ¬
циональных нагрузочных электрокардиографических тестов
вероятность ошибки уменьшится. В работе рассчитаны пока¬
затели чувствительности, специфичности и прогностичности
результатов как для каждого функционального теста, так и для
их сочетания; при этом учитывались варианты полного и не¬
полного совпадения результатов в комплексе. Лучшие диа¬
гностические возможности выявлены у ЧПЭС. Дипиридамо-
ловая проба, обладая хорошей специфичностью, имеет срав¬
нительно невысокую чувствительность. Классические нагру¬
зочные пробы несколько уступили по всем характеристикам
ЧПЭС и дипиридамоловой пробе, при этом информативность
тредмил-теста оказалась несколько выше, чем ВЭМ пробы.Совершенно очевидно, что в случае получения отрицатель¬
ного результата одного теста обследование должно быть до¬
полнено и быть комплексным: при использовании 2 из 4 изу¬
ченных тестов лучшие статистические характеристики были
получены при сочетании тредмил-теста или дипиридамоловой
пробы с ЧПЭС; при использовании трех методов оптимально
сочетание тредмил-теста, дипиридамоловой пробы и ЧПЭС.
Проведение всех четырех функциональных проб при совпаде¬
нии результатов позволяет достигнуть 100 % достоверности
диагноза.Таким образом, в клинической практике при проведении
дифференциально-диагностического поиска в случае неясного
кардиалгического синдрома необходимо комплексное обсле¬
дование с применением оптимального количества методик
функциональных электрокардиографических тестов, что обес¬
печивает высокую достоверность диагноза.50
3.4. Комбинированное применение теста
ЧПЭС сердца с ультразвуковыми методиками
(стресс -эхокардиография,
стресс-допплер-эхокардиография)Известно, что увеличение нагрузки у больных с ИБС вна¬
чале приводит к неоднородности кровотока в миокарде и раз¬
витию региональной дисфункции миокарда желудочка. Затем
наступают выраженный дефект перфузии и нарушение общей
насосной функции левого желудочка, и только после этого ре¬
гистрируются «ишемические» изменения ЭКГ и клиническое
проявление ишемии — приступ стенокардии. Таким образом,
ЭКГ при нагрузке регистрирует один из конечных этапов
ишемии миокарда, что в том числе и определяет невысокую
степень информативности функциональных электрокардио¬
графических тестов. По данным R.D.Rifkin и соавт. [38], поло¬
жительный результат пробы указывает на возможность пора¬
жения коронарных артерий у 98 % больных с типичной стено¬
кардией, 88 % больных с атипичными болями в грудной клет¬
ке, 44 % больных с другими болевыми ощущениями и только у
33 % больных, не предъявляющих никаких жалоб.Как уже говорилось выше, региональные нарушения со¬
кращения и особенно расслабления стенки левого желудочка
при ИБС возникают значительно раньше, чем электрокардио¬
графические и клинические признаки ишемии миокарда. По¬
этому методики, позволяющие регистрировать эти региональ¬
ные нарушения сократимости в “сочетании с записью ЭКГ в
ходе нагрузочного теста, должны существенно повышать чув¬
ствительность и специфичность нагрузочных проб, что осо¬
бенно важно при гипертрофии миокарда, блокаде левой
ножки пучка Гиса, когда интерпретация ЭКГ существенно за¬
труднена. Принцип диагностики основан на выявлении зон с
нарушенным характером движения стенки желудочка на высо¬
те нагрузки. Так, если в норме в ответ на нагрузку отмечается
равномерное увеличение амплитуды движения всех стенок
сердца, то при ИБС снижение регионального субэндокарди-
ального кровотока приводит к метаболическим и, как следст¬
вие, механическим аномалиям — снижению амплитуды систо¬
лического движения эндокардиальной поверхности стенки ле¬
вого желудочка (гипокинезия), отсутствию систолического
движения стенки (акинезия).Ряд исследователей показали возможность повышения
диагностической ценности проб с физической нагрузкой в вы¬
явлении ИБС при параллельном использовании ультразвуко¬
вого метода — эхокардиографии, позволяющей регистриро¬
вать ухудшение показателей центральной гемодинамики и со¬
кратительной функции миокарда [3, 4, 24, 26, 30, 32, 37].4*51
ЭхоКГ выявляет зоны дискинезии после перенесенного
инфаркта миокарда или во время приступа стенокардии, одна¬
ко для диагностики преходящих нарушений движения стенок
сердца, возникающих при нагрузочных пробах, требуются
дальнейшие исследования.Первое сообщение о применении эхокардиографии в соче¬
тании с физической нагрузкой с целью диагностики ИБС по¬
явилось в 1979 г. [41]. Однако прошло более 10 лет, прежде
чем новый метод получил признание многих врачей-кардио-
логов и нашел широкое практическое применение.Многие исследователи пытались комбинировать ЭхоКГ с
некоторыми формами динамических физических нагрузок.S.J.Mason и соавт. [35], M.H.Grawford и соавт. [31] использо¬
вали ВЭМ в положении лежа в сочетании с ЭхоКГ в М-режи-
ме и смогли получить адекватное изображение во время физи¬
ческой нагрузки только у 45 % из их пациентов. Такой малый
процент качественных исследований авторы связывали с по¬
мехами, возникающими при движении грудной клетки и ги¬
первентиляции во время физической нагрузки.Двухмерная ЭхоКГ обеспечивает улучшение визуальной
оценки возникающих региональных нарушений движения
стенки левого желудочка. L.S.Wann и соавт. [41], используя
ВЭМ и двухмерную ЭхоКГ, получили хорошее изображение у
71 % больных; Y.Sugishita и соавт. [40] сообщили, что полно¬
ценная регистрация ЭхоКГ с удовлетворительным изображе¬
нием на высоте физической нагрузки возможна лишь у 58—
83 % лиц в покое.P.D.Chapman и соавт. [30] добились адекватных нагрузоч¬
ных эхокардиограмм у всех больных, исходное изображение у
которых было приемлемым, используя в качестве нагрузочно¬
го теста ЧПЭС. Такое сочетание оказалось высокоинформа¬
тивным в выявлении ИБС (чувствительность 87 %). Детально
эта методика разработана в исследованиях S.Iliceto и соавт.
[32].Во время ЧПЭС в учащающем режиме изучение локальной
сократимости левого желудочка проводится из апикального
или парастернального доступа с записью всего хода исследова¬
ния на видеопленку.Существует несколько способов оценки локальных нару¬
шений сократимости левого желудочка. Самый простой —
описательный — основан на субъективной оценке уменьше¬
ния утолщения участка миокарда и амплитуды движения эн¬
докарда. При этом каждый участок с нарушенной сократимос¬
тью описывается в зависимости от степени ее выраженности
(гипо-, дис- и акинетичный). Количественный метод анализа
нарушений локальной сократимости достаточно сложен. При
полуавтоматическом анализе в компьютер вводятся конечное
диастолическое и конечное систолическое изображение серд¬52
ца, затем оператор вручную определяет эндо- и эпикардиаль-
ную поверхности левого желудочка. При помощи специаль¬
ных алгоритмов компьютер рассчитывает сократимость раз¬
личных сегментов миокарда. В настоящее время продолжается
работа над совершенствованием алгоритмов расчета локаль¬
ной сократимости левого желудочка, которые бы учитывали
сложное движение сердца в пространстве. Существуют и пол¬
ностью автоматизированные системы определения эндо- и пе¬
рикардиальной поверхности левого желудочка и оценки ло¬
кальной сократимости. Armstrong и соав. [25] впервые приме¬
нили систему, которая позволила вводить в компьютер данные
видеозаписи и выводить на монитор непрерывно движущееся
изображение одного сердечного цикла (по выбору исследова¬
теля). При этом одновременно можно наблюдать за сокраще¬
нием левого желудочка до и после нагрузки в двух проекциях.
Это позволяет детально оценить сократимость и сравнить из¬
менения локальной сократимости в покое и при нагрузке.Нагрузочная ЭхоКГ считается положительной в случае по¬
явления новых преходящих или увеличения (по площади аси¬
нергии и/или периметру) имевшихся в состоянии покоя нару¬
шений локальной сократимости миокарда левого желудочка.
Некоторые исследователи предлагают включать в программу
оценки результатов стресс-ЭхоКГ параметры, характеризую¬
щие глобальную систолическую и диастолическую функцию
левого желудочка. В качестве функциональных индексов при
этом используются фракция изгнания, конечный систоличес¬
кий и диастолический объемы, конечное систолическое на¬
пряжение, ударный объем, параметры наполнения левого же¬
лудочка. Диагностическая и прогностическая ценность отме¬
ченных критериев оценивается неоднозначно. В основном же
все-таки отмечается, что динамическая оценка систолической
и/или диастолической функции при проведении стресс-
ЭхоКГ дает важную дополнительную информацию, отражаю¬
щую функциональное состояние сердца.По чувствительности и специфичности стресс-ЭхоКГ не ус¬
тупает нагрузочной сцинтиграфии миокарда с 20|Т1. В большом
количестве работ проведено сопоставление этих методик, и все
авторы указывают на значительное совпадение результатов. При
примерно одинаковой их аккуратности и сопоставимости усло¬
вий нагрузочная сцинтиграфия миокарда с 20'Т1 несколько более
чувствительна, а стресс-ЭхоКГ более специфична [5].С помощью стресс-ЭхоКГ можно не только установить и
подтвердить диагноз ИБС, но и оценить тяжесть поражения
коронарного русла. Установлена прямая зависимость между
тяжестью поражения сосудов сердца и размерами зоны ише¬
мии на ЭхоКГ во время нагрузки. При этом признаком много¬
сосудистого поражения является снижение глобальной сокра¬
тимости левого желудочка на фоне нагрузки. В ряде исследо¬53
ваний с помощью стресс-ЭхоКГ удается довольно точно пред¬
сказывать и локализацию стенозов (особенно при поражениях
передней межжелудочковой артерии).Стресс-ЭхоКГ с успехом используется для оценки прогно¬
за после перенесенного инфаркта миокарда. Критериями по¬
ложительной пробы (т.е. наличия участков ишемии миокарда
вне зоны инфаркта) в этом случае служат появление новых
зон нарушений локальной сократимости вне зоны рубца во
время нагрузки и снижение фракции выброса, ухудшение ин¬
декса локальной сократимости. Положительный результат
стресс-ЭхоКГ имеет большую ценность, чем даже данные ко¬
ронароангиографии и ВЭМ при предсказании развития коро¬
нарных эпизодов. Стресс-ЭхоКГ может с успехом применять¬
ся для оценки качества реваскуляризации после операции аор¬
токоронарного шунтирования и выявления резидуального сте¬
ноза после проведения системного тромболизиса по поводу
острого инфаркта миокарда.H.Lambertz и соавт. [34] впервые применили ЧПЭС в соче¬
тании с чреспищеводной эхокардиографией. Высококачест¬
венное ультразвуковое изображение сердца, которое можно
получить из чреспищеводного доступа, позволяет повысить
чувствительность стресс-ЭхоКГ до 85—100 %.Как уже говорилось, к наиболее ранним и чувствительным
маркерам ишемии миокарда относится нарушение диастоли¬
ческой функции левого желудочка, изучение которой возмож¬
но с помощью допплерэхокардиографии в сочетании с нагру¬
зочной ЧПЭС (стресс-допплерЭхоКГ). Оценка диастоличес¬
кой функции левого желудочка проводится в режиме импульс¬
ной допплерЭхоКГ из апикального доступа. Контрольный
объем располагается в полости левого желудочка на уровне
кончиков створок митрального клапана, амплитуда раннего
диастолического пика при этом максимальна, а косинус угла
между направлением трансмитрального кровотока и ультра¬
звуковым импульсом близок к 1. Исследование диастоличес¬
кой функции левого желудочка проводится в покое и немед¬
ленно после прекращения каждой ступени стимуляции. Ре¬
зультаты стресс-допплерЭхоКГ должны быть записаны на ви¬
деопленку для последующего компьютерного анализа и расче¬
та параметров: максимальные скорости раннего диастоличес¬
кого пика и систолы предсердия — Ml и М2, площади под
кривыми раннего диастолического наполнения и систолы
предсердия — Е и А, отношения МІ/М2 и Е/А, время замедле¬
ния раннего диастолического наполнения — dT. Для расчетов
выбирают 3—5 первых постстимуляционных комплексов, ко¬
торые обводятся по внешним контурам допплеровского спект¬
ра и рассчитывают средние показатели. По данным многочис¬
ленных исследований, наиболее достоверным критерием ише¬
мической реакции является уменьшение отношения М1/М254
на 20 % и более после стимуляции по сравнению с исходным.
Диагностическая ценность параметров стресс-допплерЭхоКГ
не уступает нагрузочной эхокардиографии, но при этом не
возникает трудностей с трактовкой нарушений локальной со¬
кратимости, выполненной даже с помощью компьютера. К не¬
достаткам использования допплерэхокардиографических
параметров диастолической функции левого желудочка в ка¬
честве критерия ишемической реакции, рассчитанной по
трансмитральному потоку, следует отнести невозможность
использования при исходной тахикардии более 90 ударов в
1 мин, так как выраженная митральная регургитация способна
изменить характер трансмитрального кровотока.Представляют интерес сообщения о возможности оценки
показателей центральной гемодинамики и сократительной
способности миокарда методом импульсной допплеркардио-
графии по потоку крови в восходящем отделе аорты [24]. Ис¬
пользуя супрастернальный доступ — ультразвуковое «окно», в
меньшей степени зависящее от конституции пациента, выра¬
женности эмфиземы и деформации грудной клетки, можно
определить ударный объем левого желудочка, максимальную
скорость потока крови в аорте Vmax и время изгнания ЕТ и
рассчитать отношение Vlliax/ET, которое характеризует сокра¬
тимость миокарда. В работе Л.Ю.Чургановой [24] установлена
высокая степень корреляции между эхокардиографическим
показателем, отражающим сократимость и являющимся наи¬
более чувствительным параметром для выявления ранней
стадии сердечной недостаточности Vcf, и допплеркардиогра-
фическим показателем Vmax/ET. Показана высокая степень
воспроизводимости результатов при использовании допплер-
ЭхоКГ, даже в сравнении с данными ЭхоКГ.Ультразвуковой датчик устанавливают в яремную ямку,
получают изображение восходящего отдела аорты и под кон¬
тролем кривой скорости потока располагают стробируемый
объем параллельно потоку, после чего фиксируют кривую ско¬
рости потока и рассчитывают отношение Vmax/ET. В конце
каждой ступени нагрузки фиксируется кривая допплерЭхоКГ.
Снижение отношения Vmax/ET на 5 % и более от максимально
достигнутого уровня считается признаком ухудшения сократи¬
тельной функции миокарда левого желудочка, а результаты
стресс-допплерЭхоКГ — положительными.В факультетской терапевтической клинике имени В.Н.Ви¬
ноградова ММА имени И.М. Сеченова тест ЧПЭС совместно
с регистрацией импульсной допплеркардиографии (Л.Ю.Чур-
ганова) выполнен более чем у 150 больных. Убедительно дока¬
зана высокая диагностическая ценность данной методики в
выявлении ИБС. В качестве иллюстрации приводим диаграм¬
мы динамики показателя Vmax/ET у части пациентов с ИБС и
без коронарной патологии (рис. 3.7, 3.8).55
Vn^ET, см/с2
35030050Рис. 3.7. ИзменениеVmax/ET ВО время ТЄС-та ЧПЭС предсердий у
і і і і і і і больных ИБС. Стрел-100 110 120 130 140 150 160 ками указан моментвыявления депрессии
Частота стимуляции, имп/мин сегмента ST на ЭКГ.Следует подчеркнуть, что в отличие от сочетанного приме¬
нения нагрузочной пробы и двухмерной эхокардиографии,
при которой для выявления зон сегментарной асинергии при¬
ходится использовать несколько ультразвуковых «окон», что
не позволяет проводить мониторное наблюдение за сократи¬
тельной функцией миокарда в процессе теста, а для расчета
результатов необходимо программное обеспечение, нагрузоч¬
ная допплеркардиография использует одно ультразвуковое
«окно» (апикальный доступ при регистрации трансмитрально¬
го потока и супрастернальный доступ при регистрации транс¬
аортального потока). Это дает возможность мониторировать
сократительную функцию миокарда левого желудочка в тече¬
ние всего нагрузочного теста; прост и расчет показателей
М1/М2, Vmax/ET.Таким образом, сочетанное применение нагрузочной
пробы — теста ЧПЭС и ультразвукового метода — импульсной
допплеркардиографии позволяет, помимо обнаружения пря¬
мых электрокардиографических признаков преходящей ише¬
мии миокарда, выявлять и косвенные ее проявления (даже не-56
Vmax/ET, СМ/С2Рис. 3.8. Изменение
Vmax/ET ВО время ТЄС-
та ЧПЭС предсердий
у больных без ИБС.100 110 120 130 140 150 160
Частота стимуляции, имп/минсколько более ранние), оценить сократительную функцию
миокарда, а также проводить мониторный контроль показате¬
лей сократимости миокарда левого желудочка в процессе на¬
грузки, что значительно повышает диагностическую ценность
ЧПЭС в плане выявления ИБС и практическую значимость в
оценке функционального состояния миокарда при ИБС.3.5. Комбинированное применение теста
чреспищеводной электрической стимуляции
сердца с радиоизотопными методикамиОдним из важных направлений в диагностике ИБС в на¬
стоящее время является оценка региональных дефектов пер¬
фузии левого желудочка как проявление основного патогене-57
тического механизма заболевания — ишемии миокарда [5].
Бесспорным лидером в этом направлении являются радио¬
нуклидные методы диагностики.Статические изображения, достаточно информативные
при обследовании пациентов с постинфарктным кардиоскле¬
розом, мало пригодны для диагностики ИБС, поэтому стан¬
дартный протокол включает нагрузочную пробу, самой аде¬
кватной из которых может быть тест ЧПЭС, с синхронной ре¬
гистрацией ЭКГ и сцинтиграфии. Наиболее часто использует¬
ся изотоп 201Т1: препарат вводится внутривенно при достиже¬
нии максимальной ступени нагрузки, после чего тест продол¬
жается еще 1—2 мин. Затем проводится исследование на
гамма-камере для оценки равномерности или, что более
важно, неравномерности поступления изотопа в различные
регионы сердца. Через 2—4 ч после введения препарата в тех
же проекциях проводят повторную сцинтиграфию миокарда
для оценки характера вымывания индикатора. В настоящее
время планарную сцинтиграфию, дающую суммарное изобра¬
жение сердца, т.е. наложение друг на друга различных бассей¬
нов коронарных артерий, заменяет однофотонная эмиссион¬
ная компьютерная томография, позволяющая получать томо¬
граммы левого желудочка в различных плоскостях и на разных
уровнях. Большинство исследователей указывают на высокую
чувствительность нагрузочной сцинтиграфии с 201Т1 — от 85 до
93 %. Следует отметить, что чувствительность этого метода
возрастает с тяжестью поражения коронарных сосудов и явля¬
ется максимальной при многососудистом поражении. Выявле¬
ние дефектов перфузии при однососудистом поражении во
многом зависит от локализации стеноза. Например, пораже¬
ние левой огибающей коронарной артерии практически не оп¬
ределяется на планарных изображениях и может быть обнару¬
жено только при однофотонной томографии. К сожалению, с
помощью нагрузочных радионуклидных методов нельзя досто¬
верно выявить топику поражения коронарных артерий. Одна¬
ко метод может помочь в определении прогноза заболевания.
Как правило, у больных с множественными обратимыми де¬
фектами перфузии в различных бассейнах коронарных арте¬
рий, а также расширением левого желудочка сразу после на¬
грузки существует высокий риск развития острых коронарных
осложнений. Несколько иначе обстоит дело со специфичнос¬
тью метода: если при многососудистом поражении она дос¬
тигает 85—92 %, то в случаях менее выраженного поражения
колеблется в пределах 60—70 %, причем достаточно часто дает
ложноположительные результаты. Суть этих проблем до конца
не ясна. Скорее всего в этих случаях речь может идти о вли¬
янии нарушений микроциркуляции на получаемые изобра¬
жения.58
Нагрузочная сцинтиграфия миокарда, выполняемая в ди¬
намике медикаментозного лечения ишемической болезни
сердца, является объективным тестом для оценки влияния
антиангинальной терапии на перфузию сердечной мышцы.
Наиболее чувствительный сцинтиграфический показатель эф¬
фекта лечения — уменьшение размеров преходящих дефектов
перфузии.К сожалению, широкому применению метода сцинтигра¬
фии миокарда с 2,0Т1 в практике российского здравоохранения
препятствуют недостаточные объемы его отечественного про¬
изводства, высокая стоимость одного исследования, а также
достаточно большая лучевая нагрузка. В лабораторных и кли¬
нических испытаниях В.И.Чернова и соавт. [23] показана
принципиальная возможность использования более дешевого
изотопа 199Т1, с помощью которого авторы также получили вы¬
сококачественные сцинтиграфические изображения миокарда.
Кроме того, короткий период полураспада |99П, равный 7,4 ч,
позволяет значительно уменьшить лучевую нагрузку на обсле¬
дуемого.В заключении к предыдущим разделам этой главы следует
отметить, что при типичной клинической картине заболева¬
ния и наличии специфических изменений ЭКГ при нагрузоч¬
ной пробе диагноз ИБС не вызывает сомнений и нет необхо¬
димости в дополнительных инструментальных исследованиях.
При сомнительных результатах необходимо применение на¬
грузочной или фармакологической пробы с использованием
ультразвуковых методик или сцинтиграфии миокарда. Какая
из этих двух методик предпочтительнее, зависит от оснащен¬
ности клиники, ее традиций и опыта исследователей, так как
чувствительность и специфичность этих проб в настоящее
время практически сравнялись [5, 22, 23].Подводя итог сказанному, необходимо еще раз подчерк¬
нуть, что наличие выраженных изменений при неинвазивных
функциональных пробах или сомнительные результаты этих
проб при типичной клинической картине заболевания, моло¬
дой возраст пациентов, безуспешность лекарственной тера¬
пии, неудовлетворенность пациента качеством жизни служат
показанием к проведению коронарографии, так как в настоя¬
щее время только этот метод позволяет поставить точный то¬
пический диагноз, выявить наличие, количество и степень
стенозов коронарных артерий и тем самым помогает опре¬
делить прогноз и тактику хирургического или терапевтичес¬
кого лечения пациента. Диагноз ИБС должен устанавливать¬
ся с учетом всего комплекса клинико-инструментальных
данных, так как в повседневной практике нередко встреча¬
ются пациенты, имеющие типичные признаки ИБС при
практически неизмененных сосудах по данным коронаро¬
графии.59
3.6. Возможности теста ЧПЭС сердца
для оценки эффективности антиангинальных
препаратов и индивидуального подбора
медикаментозной терапии у больных с ИБСПроведение длительной антиангинальной терапии пред¬
ставляет сложную практическую задачу, включающую пробле¬
му индивидуального выбора наиболее эффективного препара¬
та или их комбинации, определение схем приема и контроля
за эффективностью лечения. Подбор медикаментозной анти¬
ангинальной терапии у больных с ИБС обычно осуществляет¬
ся эмпирическим методом «проб и ошибок», на что уходит
много времени. Такой метод подбора антиангинальной тера¬
пии приводит к нерациональному использованию коечного
фонда стационаров, неоправданному приему большого коли¬
чества лекарств. Оценка эффективности лечения не должна
ограничиваться выводами типа «действует», «не действует»,
«лучше», «хуже», т.е. качественными показателями. Необходи¬
ма объективная количественная информация о том, насколько
один препарат лучше или хуже другого, какова зависимость
доза — эффект для изучаемого лекарственного препарата.В настоящее время индивидуальный подбор наиболее эф¬
фективного антиангинального препарата осуществляется в ос¬
новном с помощью парных ВЭМ проб [6, 7, 22, 28]. Этот
метод позволяет количественно охарактеризовать эффектив¬
ность того или иного антиангинального препарата, определить
оптимальную схему его приема. В качестве основных критери¬
ев переносимости физических нагрузок используются показа¬
тели суммарной длительности нагрузки, объем работы, выпол¬
ненной до достижения порогового уровня нагрузки, а прирост
этих показателей при проведении повторных ВЭМ проб выра¬
жает количественный эффект лечения. Парные ВЭМ пробы
стали широко использоваться в хирургической практике для
объективной оценки результатов оперативного лечения коро¬
нарной недостаточности, в отделениях реабилитации для
оценки эффективности лечения больных, перенесших острый
инфаркт миокарда.В последние годы ВЭМ стала активно использоваться и
как самостоятельный лечебный фактор (эффект тренировки) у
больных с ИБС как при стабильных формах, так и при остром
инфаркте миокарда. Регулярные физические упражнения ока¬
зывают на больных тренирующее воздействие, проявляющееся
в улучшении переносимости и повышении толерантности к
физическим нагрузкам. Поэтому естественный прирост «поро¬
га стенокардии» при применении повторных ВЭМ проб может
приводить к ошибочным заключениям об антиангинальной
эффективности препаратов при подборе терапии. Вследствие60
этого для большей достоверности объективной оценки лече¬
ния больные проходят сначала период адаптации к физичес¬
ким нагрузкам (повторение несколько раз ВЭМ пробы), а
затем в период медленной тренировки, когда толерантность к
нагрузке развивается незначительно, начинают подбор инди¬
видуальной терапии. Однако до сих пор не выработано единых
четких методических рекомендаций и критериев подбора ан¬
тиангинальной терапии у больных с ИБС с помощью парных
ВЭМ тестов. Для этого в настоящее время проводятся боль¬
шие кооперативные исследования в масштабах специализиро¬
ванных кардиологических центров.Тест ЧПЭС как метод объективной оценки недостаточнос¬
ти коронарного кровообращения в последнее время также
начал активно применяться для оценки эффективности анти¬
ангинальной терапии у больных с ИБС [12, 15].В факультетской терапевтической клинике имени В.Н.Ви¬
ноградова ММА имени И.М.Сеченова за период с 1986 по
1995 г. подбор антиангинальной терапии с помощью ЧПЭС
осуществлен более чем у 100 пациентов со стенокардией II—IV функционального класса.Остановимся на некоторых методических принципах дан¬
ного протокола.При использовании нагрузочной пробы для оценки эф¬
фективности проводимых лечебных или реабилитационных
мероприятий важными принципами являются повторяемость
и воспроизводимость результатов при равнозначности и сопо¬
ставимости условий проведения пробы. У 25 наблюдавшихся
нами больных (18 с ИБС и 7 с НЦД) тест ЧПЭС проводился
дважды с интервалом 3—10 дней. У 17 больных с ИБС (94 %)
«ишемические» изменения ЭКГ появились при той же частоте
стимуляции. Лишь у 1 пациента «порог стенокардии» стал
выше на 1 ступень нагрузки. У всех больных нейроциркуля-
торной дистонией результаты теста ЧПЭС повторялись. Таким
образом, результаты теста ЧПЭС устойчивы у каждого больно¬
го и воспроизводимы в динамике.За 24—48 ч до начала подбора терапии больным необходи¬
мо отменять все антиангинальные препараты (если это воз¬
можно). Антигипертензивную и другую симптоматическую те¬
рапию целесообразно продолжать в полном объеме, для купи¬
рования приступов стенокардии можно принимать нитрогли¬
церин.До начала лечения на «чистом» фоне выполняется диа¬
гностический ступенчато возрастающий тест ЧПЭС. Ступень
нагрузки при проведении диагностического теста ЧПЭС
должна быть равна 10 имп/мин. Тест доводится до «порога
стенокардии» — минимальной частоты сердечных сокраще¬
ний, при которой отмечается появление электрокардиографи¬
ческих признаков ишемии миокарда. У каждого больного61
Препарат 1Препарат 2Препарат 3 Комбинация препаратовРис. 3.9. Алгоритм подбора антиангинальной терапии.должны учитываться общая длительность стимуляции в секун¬
дах, глубина возникшей депрессии сегмента ST в мм, длитель¬
ность восстановления ЭКГ в секундах.Далее исследуется эффективность препаратов, выбранных
для лечения больного. Из тестирования можно исключать
препараты, ранее принимавшиеся и не оказавшие клиничес¬
кого эффекта, а также заведомо противопоказанные пациенту.
На фоне монотерапии проводится контрольный тест ЧПЭС,
после чего осуществляется смена препарата. Контрольные
тесты ЧПЭСС необходимо проводить на фоне курсового лече¬
ния через 1—3 ч после очередного приема препарата, в осталь¬
ном соблюдая условия проведения диагностического теста
(время суток и др.). Схема подбора антиангинальной терапии
представлена на рис. 3.9.Больным, у которых при проведении диагностического
теста ЧПЭС отмечалось появление АВ-блокады II степени с
периодами Самойлова—Венкебаха, необходимо заранее в ка¬
честве премедикации ввести подкожно 1 мг атропина сульфа¬
та, чтобы не прерывать контрольное исследование. Атропин
необходимо предварительно вводить и тем больным, которые
получали бета-блокаторы, изоптин. Все остальные пациенты
получают препарат по мере необходимости, если появляются
признаки ухудшения проводимости, препятствующие дости¬
жению субмаксимальной для возраста больных ЧСС.Контрольный тест ЧПЭС проводится по тем же ступеням,
что и диагностический тест, и доводится до нового «порога
стенокардии». Нагрузочную пробу желательно заканчивать
при возникновении депрессии сегмента STтакой же глубины,
что и в первом тесте, либо по достижении субмаксимальной
частоты сердечных сокращений. При анализе результатов ис¬
следования необходимо учитывать суммарную длительность
стимуляции при проведении контрольного теста, глубину воз¬
никшей депрессии сегмента ST, длительность периода восста¬
новления ЭКГ, прирост «порога стенокардии».Оценка эффективности терапии проводится по приросту
Д-«порога стенокардии» ПС: ДПС = [(ПС на фоне терапии —
ПС исходный)/ПС исходный] х 100 %.62
При ДПС>41 % мы расценивали эффект препарата как
отличный, при 21 % < ДПС < 40 % — как хороший, при 11 % <
дПС < 20 % — как удовлетворительный, при ДПС < 10 % —
как неудовлетворительный или отсутствие эффекта. В течение
12—15 дней удается оценить эффективность 3—4 препаратов,
а в отдельных случаях и комбинации из 2 препаратов.При сравнении антиангинального действия двух препара¬
тов различие ПС более чем на 10 % являлось критерием выбо¬
ра наиболее эффективного препарата.При приеме отдельных препаратов целесообразно учиты¬
вать и общее самочувствие больных, отмечать количество воз¬
никавших за сутки приступов стенокардии напряжения и
покоя, количество дополнительно принятых таблеток нитро¬
глицерина на фоне обычных для больного физических нагру¬
зок в условиях больничного режима.Критерии клинической оценки эффективности препара¬
тов:— отличное действие препарата — приступы стенокардии
прекращались вообще;— хорошее — количество приступов стенокардии и потреб¬
ляемого нитроглицерина уменьшалось более чем на
50 %;— удовлетворительное — при уменьшении на 21—50 %;
неудовлетворительное — при уменьшении менее чем на
20 %.«В одном из исследований, выполненных в факультетской
терапевтической клинике у 66 пациентов, оценивалась эффек¬
тивность препаратов из 3 основных групп антиангинальных
средств: пролонгированный нитропрепарат изокет в дозе 80—
120 мг/сут, (3-блокатор обзидан в дозе 80—120 мг/сут, антаго¬
нист кальциевых каналов финоптин в дозе 240—320 мг/сут.
У 22 % больных оказались эффективными (хорошее или удов¬
летворительное действие) все 3 препарата, 49 % больных 2
препарата: в 50 % случаев — изокет и финоптин, в 33 % — изо¬
кет и обзидан, в 14 % — финоптин и обзидан. У 29 % больных
оказался эффективным только один препарат: в 45 % случа¬
ев — изокет, в 30 % — финоптин, в 25 % — обзидан.Примерно в 90 % случаев увеличение «порога стенокар¬
дии», длительности стимуляции сочеталось с положительным
клиническим эффектом: уменьшалось количество приступов
стенокардии, дополнительно принятого нитроглицерина.
Практически для всех исследуемых больных удалось подо¬
брать эффективный антиангинальный препарат или комбина¬
цию препаратов. При этом на фоне приема наиболее эффек¬
тивного препарата ПС повысился у больных II функциональ¬
ного класса в среднем на 15±3 ударов в 1 мин, III функцио¬
нального класса на 25±4 ударов в 1 мин, IV функционального63
класса на 25±4 ударов в 1 мин, возросла длительность стимуля¬
ции в среднем на 132±21 с, среднесуточная частота приступов
стенокардии напряжения снизилась с 4,9±0,8 до 1,9±0,5, сте¬
нокардии покоя — с 2,2±0,3 до 0,8±0,1, потребность в нитро¬
глицерине составила в среднем 1,7±0,5 по сравнению с исход¬
ной — 4±1 таблетки в сутки.Только 2 больным, страдающим стенокардией напряжения
и покоя IV функционального класса, не удалось подобрать
антиангинальный препарат или комбинацию препаратов, су¬
щественно улучшивших бы их состояние и увеличивших
«порог стенокардии» более чем на 10 %. Оба пациента были
направлены на коронароангиографию для уточнения степени
тяжести поражения коронарных артерий и возможного хирур¬
гического лечения.Таким образом, применение теста ЧПЭС позволяет отно¬
сительно быстро, основываясь на объективных критериях,
оценить эффективность антиангинального препарата и подо¬
брать индивидуальную медикаментозную терапию больным со
стенокардией. Использование данной методики нагрузочной
пробы позволяет оценивать эффективность медикаментозной
терапии у больных, которым не удается провести подбор ле¬
карств с помощью парных велоэргометрических проб. Тести¬
рование антиангинальных препаратов существенно улучшает
качество подобранной лекарственной терапии, значительно
сокращает длительность пребывания больного в стационаре.
Ни в одном случае повторного применения теста ЧПЭС не от¬
мечено осложнений после процедуры.В задачи исследования не входило определение длитель¬
ности действия каждого из антиангинальных препаратов у
конкретного больного и соответственно этому определения
кратности приема препарата. Однако, учитывая неинвазивный
характер данной нагрузочной пробы, абсолютную безопас¬
ность ее, относительно хорошую переносимость процедуры
больными, можно рекомендовать и такое фармакодинамичес-
кое исследование путем неоднократного повторения теста в
течение дня.Следует указать и на возможность проведения острого ле¬
карственного тестирования с помощью ЧПЭС, когда повтор¬
ные тесты проводятся сразу после внутривенного введения
или перорального приема быстродействующего препарата и в
течение 2—4 ч оценивается эффективность нескольких анти¬
ангинальных препаратов у одного больного с ИБС [8, 11, 15,
21].Учитывая селективность нагрузочной пробы, ее управляе¬
мость, ЧПЭС можно рекомендовать для исследования боль¬
ных, перенесших острый инфаркт миокарда, для определения
эффективности реабилитационных мероприятий, у больных
после проведения операции аортокоронарного шунтирования,64
чрескожной транслюминальной коронарной ангиопластики
для получения объективной информации об эффективности
хирургического лечения [17].Таким образом, учитывая неинвазивный характер и про¬
стоту выполнения теста ЧПЭС, отсутствие осложнений, уп¬
равляемость диагностической пробой и отсутствие последей¬
ствия от нагрузки, а также учитывая, что ЧПЭС не является
трудоемкой процедурой и не требует дорогостоящего оборудо¬
вания, следует рекомендовать применение теста в дифферен¬
циально-диагностической практике, для оценки эффектив¬
ности проводимой терапии и результатов хирургического ле¬
чения не только в специализированных кардиологических
клиниках, но и в стационарах общетерапевтического профиля,
поликлиниках, т.е. широко внедрять данный метод в практи¬
ческое здравоохранение.Список литературы1. Аллилуев И.Г., Маколкин В.И., Аббакумов С.А. Боли в области
сердца. — М.': Медицина, 1985. — 200 с.2. Аронов Д.М., Лупанов В.П. Функциональные пробы в кардио-
логии//Кардиология. — 1996. — № 4. — С. 95—98.3. Бакинский С.Е. Применение стресс-допплерэхокардиогра-
фии для диагностики ИБС: Автореф. дис. ... канд.мед.наук. — М.,
1991.- 20 с.4. Бащинский С.Е. Стресс-эхокардиография: новые возможнос¬
ти диагностики ИБС//Кардиология. — 1992. — № 9—10. — С. 64—69.5. Беленков ЮН. Неинвазивные методы диагностики ишеми¬
ческой болезни сердца//Кардиология. — 1996. — № 1. — С. 4—11.6. Гасилин B.C., Сидоренко Б.А. Стенокардия. — М.: Медицина,
1987. - 255 с.7. Гасилин B.C., Сидоренко Б.А., Лазарев И.А., Смирнов М.Ю.
Чреспищеводная электростимуляция предсердий с постоянной час¬
тотой в оценке тяжести состояния больных со стенокардией и анти¬
ангинального эффекта эринита//Кардиология. — 1990. — № 12. —
С. 27-30.8. Голиков А.П., Овчинников В.Л., Белозеров Г.Е. Варианты тече¬
ния стресс-теста со стимуляцией предсердий в сопоставлении с
ангиографической картиной коронарных артерий//Кардиология. —
1996. - № 12. - С. 18-21.9. Козлов С.Г. Применение чреспищеводной электрической сти¬
муляции левого предсердия в диагностике ишемической болезни
сердца: Автореф. дис. ... канд.мед.наук. — М., 1986. — 20 с.10. Лутай М.И., Ломаковский А.Н., Строганова Н.П. Зависимость
антиангинального эффекта коринфара от состояния диастолической
функции сердца у больных ишемической болезнью сердца//Кардио-
логия. - 1992. - № 11-12. - С. 65-67.11. Лякишев А.А., Козлов С.Г., Миронова И.Ю. Применение чрес¬
пищеводной электрической стимуляции сердца для диагностики5— 1279 65і
Глава 4ПРИМЕНЕНИЕ ЧПЭС СЕРДЦА
ДЛЯ КУПИРОВАНИЯ НАДЖЕЛУДОЧКОВЫХ
ТАХИКАРДИЙ И ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ4.1. Методика купирования наджелудочковых
тахикардий и трепетания предсердийО возможности применения частой стимуляции левого
предсердия через пищевод в целях прекращения различных
наджелудочковых нарушений ритма впервые сообщили
J. Montoyo и соавт. в 1973 г. Им удалось восстановить синусо¬
вый ритм у 5 из 8 больных с наджелудочковой реципрокной
пароксизмальной тахикардией [10]. В настоящее время дока¬
зано, что все наджелудочковые тахикардии, имеющие в основе
механизм reentry (кроме мерцательной аритмии), могут быть
купированы чреспищеводной стимуляцией предсердий [2, 3,
4, 5, 6, 7, 8, 11, 12, 13, 14].Для купирования пароксизмов тахикардии может быть ис¬
пользована программированная стимуляция предсердий на
фоне ритма тахикардии. Однако более простым методом являет¬
ся частая (до 240 имп/мин) и сверхчастая (240—1200 имп/мин)
стимуляция предсердий. После введения электрода устанавли¬
вается частота стимуляции на 10—20 имп/мин, превышающая
собственный ритм тахикардии, а амплитуда импульсов устанав¬
ливается около 20 В, и в течение 5—10 с проводится стимуляция
предсердий, после «захвата» ритма ее прекращают. Если «захва¬
та» не произошло и пароксизм не купирован, устанавливается
большая частота и процедура повторяется.Для купирования трепетания предсердий используется
обычно сверхчастая стимуляция. Электрод устанавливается в
пищеводе на уровне, где регистрируются наиболее четкие и
наибольшей амплитуды волны трепетания. Стимуляция начи¬
нается с частоты, на 10—20 имп/мин превышающей частоту
волн трепетания предсердий, а затем процедура проводится в
течение 5—10 с на каждой частоте (от 240 до 1200 имп/мин) до
купирования трепетания (обычно I тип — «классическое» тре¬
петание — купировать удается).Напомним, что для трепетания I типа характерна частота
240—340 в 1 мин, а для трепетания II типа — 340—430 в 1 мин
(по Waldo) [15, 16], при этом формы могут переходить друг в
друга, они не отличаются существенно друг от друга морфоло¬
гией или полярностью волн. Причины различной эффектив¬
ности сверхчастой стимуляции предсердий для купирования
трепетания I и II типов окончательно не выяснены. Возмож-68
Рис. 4.1. Купирование пароксизма «классического» трепетания пред¬
сердий методом частой стимуляции предсердий (300 имп/мин). По
окончании ЧПЭС сразу восстановился синусовый ритм 63 уд/мин.но, что для трепетания II типа характерен короткий период
рефрактерности в сочетании с медленным прохождением воз¬
буждения по предсердиям, т.е. короткий возбудимый проме¬
жуток (или он отсутствует вовсе, как при мерцании предсер¬
дий), что делает невозможным «проникновение» стимула в
цепь reentry при стимуляции предсердий. Но также нельзя со¬
вершенно исключить возможность того, что трепетание II
типа обусловлено не механизмом reentry, а ускоренным авто¬
матизмом, который не может быть подавлен электрической
стимуляцией предсердий. При этом достоверно известно, что
в основе трепетания I типа лежит механизм reentry с достаточ¬
но большим возбудимым промежутком, что делает возможным
купирование приступов аритмии с помощью стимуляции
предсердий [11].Известна нередко используемая методика, при которой
стимуляция начинается с частоты 240 имп/мин, затем частота
стимуляции в течение 5 с непрерывно увеличивается до 800—
1200 имп/мин, а затем так же непрерывно в течение 5 с умень¬
шается до 150—160 имп/мин. У 39—52 % пациентов сразу
после стимуляции восстанавливается синусовый ритм (рис.4.1). Часто (42—53 % больных) после окончания стимуляции
трепетание переходит в мерцание предсердий с меньшей час¬
тотой желудочковых сокращений (рис. 4.2). Если оно самосто¬
ятельно не прекращается в течение 15—20 мин, для его устра¬
нения применяют обычные медикаментозные средства. При
этом отмечено, что при частоте волн трепетания от 220 до 28069
JL k. L II—I—*-aVR'—^—Y—уг^ггтгтттт 1 XЛ-aVLj—4r mnri rntraVF—ь-J-JL—J■Л-4-Л-Рис. 4.2. Купирование пароксизма трепетания предсердий методом
частой стимуляции предсердий (400 имп/мин). Синусовый ритм 70 в1 мин восстановился после короткого периода фибрилляции предсер¬
дий.в 1 мин синусовый ритм чаще восстанавливается сразу, а при
частоте волн трепетания 300—360 чаще трепетание трансфор¬
мируется в мерцание предсердий. Лишь у 7—18 % больных
этот метод оказывается неэффективным [1, 3, 6, 10, 12, 14].Преимущества данного метода очевидны: можно немед¬
ленно оценить его эффективность; кроме того, из-за отсутст¬
вия противопоказаний он может быть успешно применен даже
в тех случаях, когда проведение электроимпульсной терапии
связано с определенным риском (насыщение сердечными гли-
козидами, нежелательность наркоза) [6].4.2. Определение механизма тахикардииОсобое достоинство метода ЧПЭС заключается в том, что
он позволяет оценить механизм развития тахикардии [9, 11],
т.е. в зависимости от реакции аритмии на учащающую и/или
программированную стимуляцию сердца отличить аритмии,
обусловленные нарушениями автоматизма, от нарушений рит¬
ма, вызванных другими электрофизиологическими механиз¬
мами.В отличие от reentry и некоторых форм триггерной актив¬
ности (поздние постдеполяризации) аритмии, связанные как с
ускоренным нормальным автоматизмом, так и с патологичес¬
ким автоматизмом, не могут быть ни вызваны, ни купированы
с помощью электрической стимуляции сердца. При этом арит¬
мии, вызванные ускоренным нормальным автоматизмом,
могут быть лишь временно подавлены с помощью overdrive
отмечается кратковременное восстановление синусового ритма с по¬
следующим возобновлением предсердной тахикардии и возрастанием
частоты эктопического ритма до 166 в 1 мин. Предполагаемый элект-
рофизиологический механизм тахикардии — патологический автома¬
тизм.pacing (рис. 4.3). После короткой паузы по окончании стиму¬
ляции обычно наблюдается постепенное возрастание частоты
эктопического ритма до тех пор, пока она не достигнет своего
исходного значения. В то же время аритмии, вызванные пато¬
логическим автоматизмом, обычно не могут быть подавлены с
помощью overdrive pacing. В этом случае подавление аритмии
возможно лишь при условии, что период стимуляции был дли¬
тельным, а частота стимуляции высокой. Более того, кратко¬
временное воздействие overdrive pacing на аритмии, обуслов¬
ленные патологическим автоматизмом, может привести к вре¬
менному увеличению частоты эктопического ритма.Аритмии, вызванные ранними постдеполяризациями, не
могут быть прекращены с помощью учащающей и/или про¬
граммированной стимуляции сердца. В то же время аритмии,
вызванные поздними постдеполяризациями, так же как и
reentry, могут быть купированы с помощью электрической
стимуляции сердца. Прекратить аритмии, связанные с поздни¬
ми постдеполяризациями, чаще удается с помощью overdrive
pacing, чем с помощью программированных экстрастимулов.71
r-Vi-т-ЧПЭГРис. 4.4. Купирование реципрокной предсердной тахикардии с часто
той 172 в 1 мин с помощью частой стимуляции предсердий. Электро
физиологический механизм аритмии — reentry.Частая стимуляция либо сразу купирует тахикардию, либо
сначала тахикардия возрастает, затем постепенно уменьшает¬
ся, и пароксизм купируется.Все аритмии, в основе которых лежит механизм reentry
(кроме фибрилляции предсердий), могут быть купированы с
помощью электрической стимуляции сердца (рис. 4.4). Одна¬
ко если тахикардия не купируется (с помощью программиро¬
ванной и/или учащающей стимуляции предсердий), это не по¬
зволяет полностью исключить механизм reentry, так как необ¬
ходимыми условиями купирования тахикардии являются
«проникновение» стимула в цепь reentry и развитие блокады
циркуляции волны возбуждения, что требует достаточной
длины цепи (так, при reentry с коротким возбудимым проме¬
жутком или с его отсутствием электрическая стимуляция не
купирует тахикардию). Определение механизма тахикардии по
концепции Сицилианского гамбита является одним из осно¬
вополагающих факторов для выбора правильной тактики ме¬
дикаментозной терапии.Список литературы1, Ватутин Н.Т., Дядык А.И., Багрий А.Э. и др. Эффективность
лечения трепетания предсердий чреспищеводной электростимуля¬
цией левого предсердия//Кардиология. — 1992. — № 2. — С. 64.
2. Голицын С.П., Малахов В.И., Соколов С.Ф. и др. Чреспищевод¬
ная элекгрокардиостимуляция в диагностике и лечении нарушений
ритма сердца (часть И)//Кардиология. — 1990. — № 12. — С. 105.3. Грудцын Г.В., Торопин М.В. Лечение трепетания предсердий
методом частой чреспищеводной электростимуляции предсердий//
Кардиология. — 1995. — № 3. — С. 40.4. Жданов А.М. Лечение суправентрикулярных тахикардий ме¬
тодом электрической стимуляции сердца: Автореф. дис. ... канд. мед.
наук. — М., 1985. — 20 с.5. Лукошявичюте А. Й., Гедримене Д.А. Случай успешного много¬
кратного применения частой стимуляции левого предсердия через
пищевод для прекращения суправентрикулярной пароксизмальной
тахйкардии//Кардиология. — 1982. — № 9. — С. 109.6. Лукошявичюте А.Й., Гедримене Д.А. Эффективность частой
электростимуляции левого предсердия через пищевод для прекраще¬
ния правильного трепетания//Кардиология. — 1984. — № 12. —
С. 18-22.7. Рычков А.Ю. Опыт лечения пароксизмальных наджелудочко¬
вых тахикардий с применением чреспищеводного электрофизиоло-
гического исследования//Кардиология. — 1995. — № 12. — С. 18—20.8. Фурланелло Ф., Гванерио М., Вергара Г. и др. Чреспищеводная
электростимуляция предсердий как электрофизиологический метод
лечения суправентрикулярных тахикардий//Кардиология. — 1990. —
№ 11. - С. 52.9. Antiarrhythmic Therapy: A Pathophysiologic Approach. — NY:
Futura Publ. Com. Inc., 1994. — P. 41—85.10. Montoyo J. V., Angel J., Valle V. et al. Cardioversion of Tachy¬
cardias by transesophageal atrial pacing//Amer. J. Cardiol. — 1973. — Vol.
32, N 85. - P. 25.11. Rostock K.-J. Herzrhythmusstoerungen in Theorie und Praxis.
Berlin: Akad. Verl, 1993. - N 73-74. - P. 327.12. Sterz H., Pager H., Koler H. Transoesophageale rasche Stimulation
des linken Vorhofes zur Elektrotherapie ektoper tachykarder Vorhofrhyth-
musstoerungen//Z.Kardiol. — 1978. — N 67. — P. 365—381.13. Stroedter D., Schwarz F. Diagnostische und therapeutische Moeg-
lichkeiten bei transesophagealer Vorhofstimulation//Herz-Kreisl. —
1980. - N 12. - P. 163-169.14. Volkmann H., Paliege R. et al. Transoesophageale Elektrostimula-
tion zur Initiirung und Terminierung von Tachikarden Rhythmusstoerun-
gen//Dt. Gesundh. Wesen. — 1982. — N 37. — P. 1888—1892.15. Waldo Al. Some observations concerning atrial flutter in man//
Pace. - 1983. - N 6. - P. 1181-1189.16. Waldo Al., Henthorn R., Plumb V: Relevance of electrograms and
transient entrainment for antitachycardia devices//Pace.— 1984.— N 7.—
P. 588-600. ‘
Глава 5ЧРЕСПИЩЕВОДНОЕ ЭЛЕКТРО¬
ФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
У БОЛЬНЫХ С СИНДРОМОМ СЛАБОСТИ
СИНУСОВОГО УЗЛАОсновными электрофизиологическими показателями, ха¬
рактеризующими автоматическую активность синусового узла,
считаются время восстановления функции синусового узла
(ВВФСУ) и корригированное время восстановления функции
синусового узла (КВВФСУ) [2, 4, 5, 8, 13]. Методики опреде¬
ления ВВФСУ и КВВФСУ с помощью эндокардиальной сти¬
муляции являются инвазивными и трудоемкими. Доказано,
что продолжительность ВВФСУ и КВВФСУ, определенных
при внутрисердечном и чреспищеводном электрофизиологи-
ческом исследовании (ЧП ЭФИ), существенно не различается
[1, 3, 7, 8]. В связи с этим применение теста ЧПЭС предсер¬
дий для диагностики синдрома слабости синусового узла нахо¬
дит широкое применение. ЧП ЭФИ сердца показано боль¬
ным, у которых при обычной ЭКГ или при холтеровском мо-
ниторировании ЭКГ не удалось точно установить наличие
дисфункции синусового узла.Исследование проводится после отмены препаратов, влия¬
ющих на функцию синусового узла и проводящей системы
сердца [4]. Срок отмены препаратов должен определяться пе¬
риодом полувыведения каждого лекарства (обычно срок отме¬
ны равен пяти периодам полувыведения). При проведении
теста необходимо регистрировать стандартные отведения ЭКГ
на скорости 100 мм/с.После установки пищеводного электрода и стабилизации
ритма вновь регистрируется ЭКГ и определяется средняя про¬
должительность сердечного цикла. Она рассчитывается как
среднее арифметическое 10—15 последовательных циклов си¬
нусового ритма. Затем начинается стимуляция предсердий с
частотой, на 5—10 имп/мин превышающей собственный ритм
больного. Через одну минуту стимуляцию прекращают и опре¬
деляют в миллиметрах интервал между последним стимулом и
первым возбуждением предсердий синусового происхождения.
Эта величина соответствует ВВФСУ в миллисекундах (рис.5.1). Через 1—2 мин стимуляцию повторяют с частотой, на
10 имп/мин превышающей предыдущую. Таким образом, про¬
водится электрическая стимуляция предсердий со ступенеоб¬
разно возрастающей частотой в течение минуты на каждой сту¬
пени до достижения точки Венкебаха — частоты электрической
стимуляции, при которой появляется АВ-блокада II степени.74
Рис. 5.1. Определение времени восстановления функции синусового
узла с помощью ЧП ЭФИ.На каждой ступени стимуляции рассчитывается ВВФСУ.
Максимальное значение ВВФСУ, полученное при любой часто¬
те стимуляции, в норме не превышает 1500—1600 мс [4, 11, 14].
Более информативным показателем многие считают продолжи¬
тельность КВВФСУ, рассчитываемое также на каждой частоте
стимуляции как разность между продолжительностью ВВФСУ и
спонтанного сердечного цикла (в достимуляционном периоде)
(см. рис. 5.1). Учитывается также максимальное значение, полу¬
ченное при любой частоте стимуляции. В норме КВВФСУ не
должно превышать 525—600 мс [4, 8, 10, 11, 12, 14].Как правило, у больных с синдромом слабости синусового
узла отмечается увеличение ВВФСУ и КВВФСУ: увеличенная
постстимуляционная пауза заканчивается восстановлением
автоматизма синусового узла (86 % больных). При выраженном
повреждении функции автоматизма, когда постстимуляционная
пауза очень велика, она может заканчиваться гетеротопными
ритмами или замещающими сокращениями (рис. 5.2). Если речь
идет о возбуждениях из АВ-соединения или из желудочков без
ретроградного возбуждения предсердий, ВВФСУ определяется
точно до первого возбуждения предсердий синусового проис¬
хождения (у 7,5 % пациентов его величина превышает 5—10 с).
Если речь идет о замещающем ритме с ретроградным возбужде¬
нием предсердий (6,5 % больных), ВВФСУ может быть определе¬
но лишь как «больше чем». В этих случаях точные высказыванияо состоянии функции автоматизма синусового узла невозможны
[14]. Кроме этого, по данным некоторых авторов [5], примерно у
50 % больных даже с выраженной дисфункцией синусового узла
значения ВВФСУ и КВВФСУ остаются в пределах нормы.75
При отклонении показателей функции синусового узла от
нормы или при сомнительных результатах возможно повторе¬
ние исследования в условиях вегетативной блокады сердца
(через 5 мин после внутривенного струйного введения раство¬
ра атропина сульфата в дозе 0,02 мг/кг и обзидана в дозе 0,1
мг/кг) для исключения изменений, обусловленных избыточ¬
ным тонусом вегетативной нервной системы [4, 5, 10].Приблизительно У 65 % больных с синдромом слабости си¬
нусового узла отмечаются также сопутствующие нарушения
синоатриального провеДения, Для определения суммарного
времени которого (ВСАП) при тесте ЧПЭС используется ме¬
тодика Narula: больному 5—10 раз проводится электрическая
стимуляция предсердий в течение 3—5 с с частотой, мини¬
мально превышаюшей собственный ритм, но обеспечивающей
стабильность «захвата» сердечного ритма. Каждый раз опреде¬
ляют разность величин постстимуляционной паузы S—Р1 и
первого спонтанного сердечного цикла PI—Р2 синусового
происхождения. СреДнее арифметическое полученных данных
характеризует ВСАП и в норме не превышает 300 мс [13, 14].
Определение ВСАП позволяет выявить причины ложноотри¬
цательных результатов у больных с синдромом ССУ при опре¬
делении ВВФсу. При замедлении синоатриального проведе¬
ния во время частой стимуляции предсердий не все импульсы
проходят к синусовому узлу, не происходит угнетения функ¬
ции автоматизма синусового узла и ВВФСУ остается в преде¬
лах нормы [8] Однако вычисление этого показателя при тесте
ЧПЭС не имеет большого диагностического значения, так как
значения ВС/\п, полученные при прямом и косвенном мето¬
дах измерения, у больных с синдромом ССУ различаются [8, 9].Достоинствами метода определения ВВФСУ и КВВФСУ
являются хорошая воспроизводимость и высокая специфич¬
ность (96—100 %)■ Однако данные о чувствительности метода
противоречивы [1,7, 8, 11]. Использование фармакологичес¬
кой вегетативной блокады сердца во время теста повышает
диагностическую ценность метода. Для подтверждения диа¬76
гноза синдрома ССУ тем не менее необходимо сочетание кли¬
нических симптомов со значительными изменениями
электрофизиологических показателей [5]. Если же значение
ВВФСУ и КВВФСУ лишь немного превышает норму, это
может являться формальным подтверждением дисфункции си¬
нусового узла, но не позволяет сделать более определенные
выводы и тем более решить вопрос о необходимости имплан¬
тации искусственного водителя ритма.Список литературы1. Актуальные вопросы электрокардиостимуляции//Тезисы до¬
кладов Всесоюзной конференции. — Томск, 1983. — С. 56.2. Аритмии сердца. Механизмы, диагностика, лечение/Под ред.B.Д.Мандела. — Т. 1. — М.: Медицина, 1996.3. Бредикис Ю.Ю., Римша Э.Д., Дрогайцев А.Д. и др. Чреспище¬
водная предсердная электростимуляция при исследовании функции
синусового узла//Кардиология. — 1981. — № 12. — С. 72—78.4. Голицын С.П., Малахов М.И., Соколов С.Ф. и др. Чреспище¬
водная электростимуляция в диагностике и лечении нарушений
ритма сердца (часть 1).//Кардиология. — 1990. — № 11. — С. 31.5. Сметнев Ф.С., Шевченко Н.М., Гросу А.А. Дисфункция и син¬
дром слабости синусового узла//Кардиология.— 1988,— № 2,— С. 5.6. Чирейкин Л.В., Шубик Ю.В., Егоров Д. Ф. Неинвазивные мето¬
ды обследования больных с нарушениями функции синусового узла
аномалиями проводящей системы сердца. — В кн.: Новые перспек¬
тивы в электрокардиостимуляции/Под ред. Ж.Мюжика, Д.Егорова,C.Барольда. — СПб., 1995. — С. 613—665.7. Шульман В.А., Матюшин Г.В., Кусаев В.В. Методы диагности¬
ки синдрома слабости синусового узла. — В кн.: Шульман В.А., Его¬
ров Д.Ф., Матюшин Г.В., Выгодский А.Б. Синдром слабости синусо¬
вого узла. — СПб. — Красноярск, 1995. — С. 63—106.8. Шульман В.А. Функциональные тесты в диагностике синдрома
слабости синусового узла//Кардиология.— 1984.— № 12.— С. 109—113.9. Gomes J.A.C., Kang P.S., Tl-Sherif N. The sinus node electrogram
in patients with and without sick sinus syndrome. Techniques and correla¬
tion between directly measured and indirectly estimated sinoatrial conduc¬
tion time//Circulation. — 1982. — N 66. — P. 864—873.10. Jordan J., Jamaguchi J., Mandel W.J. Studies of sinus node dis¬
function in the sick sinus syndrome//Circulation.— 1978.— N 57.— P. 217.11. Mandel W, Hayakawa H., Allen H.N. et al. Assessment of sinus
node function in patients with sick sinus node syndrome/Circulation. —
1972. - N 41. - P. 761-769.12. Mandel W., Hayakawa H., Danzig R., Marcus H.S. Evaluation of
sinoatrial node function in man by overdrive supression//Circulation. —
1971. - N 44. - P. 59-66.13. Narula O.S., Sanut P., Javier R.P. Significance of the sinus node
recovery time//Circulation. — 1972. — N 45. — P. 140.14. Rostock K.-J. Herzrhythmusstoerungen in Theorie und Praxis. —
Berlin: Akad. Verl., 1993. — P. 97—114.77
Глава 6ЧРЕСПИЩЕВОДНОЕ
ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ В ДИФФЕРЕНЦИАЛЬНОЙ
ДИАГНОСТИКЕ ПАРОКСИЗМАЛЬНЫХ
ТАХИКАРДИЙ С ШИРОКИМ КОМПЛЕКСОМ
QRSПри развитии пароксизма тахикардии с широкими ком¬
плексами QRS, протекающего без выраженных гемодинами-
ческих расстройств, целесообразна регистрация пищеводной
электрограммы, позволяющей провести дифференциальную
диагностику между желудочковой тахикардией, антидромной
тахикардией при синдроме WPW, суправентрикулярной тахи¬
кардией с функциональной блокадой ножки пучка Гиса, а
также оценить возможность купирования тахикардии с помо¬
щью ЧПЭС предсердий.Дифференциальная диагностика осуществляется по лока¬
лизации зубца Р и его положению относительно комплекса
QRS:— при желудочковой тахикардии в отличие
от суправентрикулярной тахикардии с широкими ком¬
плексами в 50 % случаев наблюдается АВ-диссоциация,
а также наличие «захватов» и сливных комплексов; АВ-
блокада 2:1 говорит в пользу суправентрикулярной тахи¬
кардии с аберрантным проведением, хотя наблюдается и
в 20 % случаев желудочковой тахикардии;— при синоатриальной реципрокной та¬
хикардии зубец Р предшествует комплексу QRS и
по форме практически не отличается от синусовых зуб¬
цов Р\— при предсердной реципрокной тахи¬
кардии зубец Р предшествует комплексу QRS и отли¬
чается по конфигурации от синусового;— при атриовентрикулярной узловой та¬
хикардии зубец Р накладывается на комплекс QRS
и не дифференцируется;— при антидромной тахикардии при WPW
зубец Р регистрируется после желудочкового комплекса
с интервалом R—P, превышающим 100 мс.Необходимо заметить, что основные электрофизиологи-
ческие критерии диагностики суправентрикулярных тахикар¬
дий при чреспищеводном исследовании не отличаются от кри¬
териев внутрисердечного ЭФИ [1,3, 4].78
v.Рис. 6.1. ЭКГ больного Н. Объяснение в тексте.Все реципрокные наджелудочковые тахикардии могут быть
купированы с помощью программированной или учащающей
стимуляции предсердий.Приведем несколько наблюдений.Б-й Н., 64 лет, 5-е сутки острого трансмурального переднесеп-
тального инфаркта миокарда. Жалобы на сердцебиение, давящие
боли в области сердца. ЧСС — 157 в 1 мин. АД — 90/60 мм рт.ст. На
ЭКГ (рис. 6.1) регистрируется тахикардия с широкими комплексами
(RR=380 мс).На ЧП ЭГ (рис. 6.2) отчетливо видна атриовентрикулярная дис¬
социация, характерная для желудочковой тахикардии. Пароксизм ку¬
пирован внутривенным введением 100 мг лидокаина.Б-й 3., 56 лет, 14-е сутки после операции аортокоронарного шун¬
тирования. Жалобы на одышку, внезапно развившееся ритмичное
сердцебиение. ЧСС — 125 в 1 мин. АД — 120/70 мм рт.ст. На ЭКГ
(рис. 6.3) тахикардия с широкими комплексами (RR=480 мс).На ЧП ЭГ (рис. 6.4) зубцы Р расположены перед комплексом
QRS. PR= 150 мс. Пароксизм тахикардии не удалось купировать мето-Рис. 6.2. ЧП ЭГ больного Н. Объяснение в тексте.
дом чреспищеводной стимуляции. Предположительный диагноз —
пароксизм эктопической предсердной тахикардии с функциональной
блокадой левой ножки пучка Гиса.Б-й К., 45 лет, в течение многих лет страдает пароксизмальной
формой мерцательной аритмии. 2 ч назад возник приступ ритмично¬
го сердцебиения, сопровождавшийся головокружением. ЧСС — 115 в1 мин. АД — 90/60 мм рт.ст.На ЭКГ (рис. 6.5) регистрируется тахикардия с широкими ком¬
плексами (RR=520 мс).На ЧП ЭГ (рис. 6.6) — трепетание предсердий 2:1 (частота пред¬
сердных сокращений 230 в 1 мин) с функциональной блокадой левой
ножки пучка Гиса. Пароксизм купирован сверхчастой стимуляцией
предсердий (280 имп/мин).80
Рис. 6.5. ЭКГ больного 3. Объяснение в тексте.Рис. 6.6. ЧП ЭКГ больного 3. Объяснение в тексте6—127981
Список литературы1. Голицын С.П., Малахов В.И., Соколов С.Ф. и др. Чреспищевод¬
ная электрокардиостимуляция в диагностике и лечении нарушений
ритма сердца (часть Н)//Кардиология. — 1990. — № 12. — С. 105.2. Рынков А.Ю., Кузьмина Е.Н., Кляшев С.М. Широкие комплексы
QRS при чреспищеводной электростимуляции//Кардиология. —
1996. - № 12. - С. 70.3. Сулимое В.А. Пароксизмальные тахикардии (клиническая
электрофизиология, системная гемодинамика, субстратный энерге¬
тический метаболизм миокарда): Автореф. дис. ... д-ра мед.наук. —
М., 1990. - С. 18.4. Rostock K.-J. Herzrhythmusstoerungen in Theorie und Praxis. —
Berlin.: Akad. Verl., 1993. — P. 73—74.
Глава 7ЧПЭС СЕРДЦА У БОЛЬНЫХ
С НАДЖЕЛУДОЧКОВЫМИ
ПАРОКСИЗМАЛЬНЫМИ
ТАХИКАРДИЯМИ7.1. Современные представления об основных
механизмах нарушений ритма сердцаС электрофизиологических позиций все нарушения ритма
сердца могут быть разделены на 2 большие группы: аритмии,
вызванные нарушениями формирования импульса, и аритмии,
вызванные нарушениями проведения импульса. Возможно
также сочетание этих механизмов.Современная классификация электрофизиологических механизмов на¬
рушений ритма сердцаНАРУШЕНИЯ ФУНКЦИИ АВТОМАТИЗМА— ускоренный нормальный автоматизм— патологический автоматизмТРИГГЕРНАЯ АКТИВНОСТЬ— ранние постдеполяризации— поздние постдеполяризацииНАРУШЕНИЯ ПРОВЕДЕНИЯ ИМПУЛЬСА
REENTRYReentry в анатомически обусловленных структурах:— reentry с большим возбудимым промежутком в структурах
с Na-каналами— reentry с большим возбудимым промежутком в структурах
с Са-каналами— reentry с коротким возбудимым промежутком
Reentry в функционально обусловленных структурах:— reentry без возбудимого промежутка («ведущий цикл»,
«спиральная волна»)— reentry, обусловленное анизотропией миокардаОТРАЖЕНИЕОДНОВРЕМЕННОЕ НАРУШЕНИЕ ФОРМИРОВАНИЯ
И ПРОВЕДЕНИЯ ИМПУЛЬСАПАРАСИСТОЛИЯ6*83
I. Аритмии, вызванные нарушениями формирования им¬
пульса.Под термином «формирование импульса» понимают про¬
цесс спонтанной деполяризации клеточной мембраны, в ре¬
зультате которого электрический импульс может возникать
как в одиночной клетке, так и в группе рядом расположенных
клеток и, возникнув там, распространяется по всему сердцу.
Два основных механизма приводят к развитию аритмий в
связи с нарушением формирования импульса — это наруше¬
ния автоматизма и триггерная активность.1. Нарушения автоматизма.Нормальный автоматизм является неотъемлемым свойст¬
вом нормальных клеток основного водителя ритма сердца —
синусового узла. В норме он также свойствен некоторым вто¬
ричным (латентным) водителям ритма сердца (устье коронар¬
ного синуса, атриовентрикулярный узел, система Гиса—Пур-
кинье и др.).Известны два вида нарушения автоматизма.А. Ускоренный нормальный автоматизм может относиться
как к синусовому узлу, так и ко вторичным водителям ритма,
обычно находящимся в подавленном состоянии благодаря фе¬
номену overdrive suppression со стороны синусового узла. Ос¬
новными причинами возникновения нарушений ритма сердца
при нем являются следующие.1. Воздействие симпатической стимуляции, в том числе и
на вторичные (латентные) водители ритма.2. Снижение частоты импульсов, генерируемых синусовым
узлом, ниже частоты собственного ритма вторичных (латент¬
ных) водителей ритма. При этом прекращается подавление
вторичных водителей ритма синусовым узлом по механизму
overdrive suppression и вторичный водитель ритма, обладаю¬
щий наибольшей частотой, становится основным водителем
ритма сердца [54].3. Любое воздействие (воспаление, фиброзирование), спо¬
собное за счет разъединения клеток миокарда уменьшить сте¬
пень электротонического подавления латентных пейсмекер-
ных клеток непейсмекерными клетками, приведет к актива¬
ции латентных водителей и к превращению их в основной во¬
дитель ритма сердца.4. Увеличение частоты возникновения импульсов во вто¬
ричных (латентных) водителях ритма под влиянием катехола¬
минов, снижения концентрации ионов К во внеклеточном
пространстве, острого растяжения миокарда и т.д.Б. Патологический автоматизмПод патологическим автоматизмом понимают возникнове¬
ние спонтанной диастолической деполяризации в клетках ми¬
окарда предсердий, желудочков и системы Гиса — Пуркинье,
которым в норме это не свойственно. Основным условием84
возникновения и отличительным признаком патологического
автоматизма является существенное снижение трансмембран¬
ного потенциала покоя ниже нормального значения для каж¬
дого типа клеток (от —70 до —30); причиной этого могут быть
различные поражения миокарда.В обычных условиях клетки с низким потенциалом покоя
не проявляют свой патологический автоматизм, поскольку
более частый синусовый ритм подавляет их активность по ме¬
ханизму overdrive suppression. Однако при замедлении синусо¬
вого ритма либо при возрастании частоты деполяризаций кле¬
ток с низким потенциалом покоя под влиянием, например,
симпатической стимуляции патологический автоматизм
может себя проявлять в виде нарушений ритма сердца.2. Триггерная активностьПод триггерной активностью понимают возникновение
импульсов, вызванных осцилляциями в клеточной мембране,
которые появляются после фазы быстрой деполяризации и
носят название постдеполяризаций. Триггерная активность
может быть обусловлена ранними и поздними постдеполяри¬
зациями.Ранние постдеполяризации — осцилляции в
клеточной мембране, возникающие во время процесса репо¬
ляризации либо во время 2-й фазы (плато), либо во время 3-й
фазы (медленная реполяризация) трансмембранного потен¬
циала (см. рис. 8.2).Поздние постдеполяризации — осцилляции
в клеточной мембране, возникающие после завершения про¬
цесса реполяризации (см. рис. 8.2).А. Триггерная активность, обусловленная ранними постде¬
поляризациями.Ранние постдеполяризации и связанная с ними триггерная
активность могут возникать под влиянием любых причин,
приводящих к замедлению процесса реполяризации и удлине¬
нию потенциала действия. Чаще всего этот процесс обуслов¬
лен действием антиаритмических препаратов, обладающих
способностью удлинять потенциал действия и процесс репо¬
ляризации. К ним относятся хинидин [19], d-соталол, в мень¬
шей мере d/1-соталол [29], амиодарон, прокаинамид [18] и др.
Однако, помимо антиаритмических препаратов, любой пато¬
логический процесс в миокарде, приводящий к удлинению
процесса реполяризации, может способствовать возникнове¬
нию ранних постдеполяризаций и связанной с ними триггер¬
ной активности. При этом нужно отметить, что в волокнах
Пуркинье ранние постдеполяризации возникают легче, чем в
клетках миокарда предсердий и желудочков.Б. Триггерная активность, обусловленная поздними по¬
стдеполяризациями.85
Поздние деполяризации и связанная с ними триггерная ак¬
тивность могут возникать в клетках миокарда предсердий, же¬
лудочков и проводящей системы сердца под влиянием различ¬
ных причин, приводящих к чрезмерному увеличению кон¬
центрации ионов Са в миоплазме и саркоплазматическом ре-
тикулуме, при так называемой перегрузке ионами кальция.
Необходимо подчеркнуть, что возникновению аритмий при
этом может способствовать укорочение сердечного цикла
(учащение ритма сердца), а также воздействие катехоламинов
[34] и сердечных гликозидов [41].Важно отметить, что первый комплекс аритмии, обуслов¬
ленной поздними постдеполяризациями и вызванной метода¬
ми электрической стимуляции сердца, обычно регистрируется
в сердечном цикле поздно [42]. Помимо этого, нередко на¬
блюдается прямая зависимость между частотой электрической
стимуляции или интервалами сцепления программированного
экстрастимула, вызвавшего аритмию, и интервалом сцепления
первого цикла индуцированной аритмии с последним элект¬
рическим импульсом [31].Прекратить аритмии, связанные с поздними постдеполя¬
ризациями, удается с помощью overdrive pacing чаше, чем с
помощью программированных экстрастимулов [42].II. Аритмии, вызванные нарушениями проведения им¬
пульса.Вторая большая группа нарушений ритма сердца — арит¬
мии, вызванные нарушениями проведения возбуждения и не
зависящие от формирования импульса в тканях сердца. Они
обусловлены механизмом циркуляции возбуждения в замкну¬
той цепи (reentry) и носят название реципрокных аритмий.Замкнутая цепь, по которой идет возбуждение, может со¬
стоять из анатомических структур, имеющих обычно цент¬
ральное препятствие, которое не позволяет циркулирующему
возбуждению самопроизвольно прекратиться. Размер и лока¬
лизация этих замкнутых цепей проведения импульса обычно
являются постоянными.Кроме того, существуют и функционально обусловленные
замкнутые цепи проведения возбуждения, само существова¬
ние которых, форма и размер зависят от электрофизиологи¬
ческих свойств тканей сердца. Центральный невозбудимый
участок функциональной обусловленной цепи, вокруг кото¬
рого происходит циркуляция импульса, обычно является ре¬
зультатом изменения рефрактерности тканей внутри цепи,
а не истинным анатомическим препятствием. Размер и ло¬
кализация этих замкнутых путей проведения импульса мо¬
гут быть как постоянными, так и непрерывно изменяющи¬
мися.Для возникновения reentry необходимы 3 обязательных ус¬
ловия:86
— существование двух анатомически или функционально
различных путей проведения импульса, имеющих
общую начальную и конечную точки,— наличие односторонней блокады проведения импульса в
одном из двух путей,— замедление скорости проведения импульса по замкну¬
той цепи проведения.Для правильной диагностики механизма аритмии и выбора
адекватной медикаментозной антиаритмической терапии
большое значение имеет установление электрофизиологичес¬
ких характеристик цепи reentry.Reentry в анатомически обусловленных структурах.Существует несколько типичных видов замкнутых цепей
проведения в анатомически обусловленных структурах.1. У больных с синдромом WPW цепь reentry наджелудочко¬
вых тахикардий состоит из предсердий, АВ проводящей системы
(АВ соединение и пучок Гиса), желудочков и дополнительного
соединения между желудочками и предсердиями [26].2. У больных с реципрокными АВ узловыми тахикардиями
цепь reentry расположена в атриовентрикулярном соединении
и состоит из быстрого и медленного АВ пути проведения [20].3. У части больных с трепетанием предсердий цепь reentry
представлена круговыми мышечными волокнами вокруг есте¬
ственного препятствия, которым является отверстие трех¬
створчатого клапана [25].4. У больных с некоторыми видами желудочковых тахикар¬
дий цепь reentry включает в себя ножки пучка Гиса, имеющие
общее проксимальное соединение в виде пучка Гиса, и общее
дистальное соединение в виде миокарда желудочков [35].В условиях замедления скорости проведения импульса и
укорочения периода рефрактерности тканей длина цепи reen¬
try может быть небольшой (всего 10—20 мм).Важной отличительной чертой reentry в анатомических
структурах является наличие частично либо полностью возбу¬
димых тканей (так называемого возбудимого промежутка)
между головой и хвостом циркулирующей волны возбуждения.
Поэтому импульсы, возникающие вне цепи reentry, могут про¬
никать в нее через этот промежуток и оказывать влияние на
реципрокную аритмию (иногда прекращать ее). Выделяют
reentry с большим или коротким возбудимым промежутком.Reentry в функционально обусловленных структурах.Reentry в функциональных структурах обусловлено цирку¬
ляцией возбуждения в замкнутых цепях, которые возникают в
результате изменений электрофизиологических свойств тка¬
ней сердца, а не являются анатомически очерченными струк¬
турами, их отличительная особенность — отсутствие возбуди¬
мого промежутка в замкнутой цепи циркуляции импульса.87ІІ
Известно несколько видов reentry в функциональных
структурах.Reentry типа «ведущего цикла», характерное для мерца¬
тельной аритмии, при котором возбуждение циркулирует во¬
круг центрального участка, находящегося в состоянии рефрак-
терности благодаря постоянной бомбардировке его импульса¬
ми со всех сторон замкнутой цепи. Замкнутая цепь возбужде¬
ния характеризуется распространением возбуждения в частич¬
но рефрактерных тканях, что приводит к исчезновению возбу¬
димого промежутка (длина цепи наименьшего «ведущего
цикла» может составлять 6—8 мм, размеры, форма и локализа¬
ция reentry этого цикла могут меняться).2. Reentry, обусловленное анизотропией миокарда (анизо¬
тропное reentry), связано с различной скоростью распростра¬
нения импульса вдоль (0,5 м/с) и поперек (0,05 м/с) мышеч¬
ных волокон миокарда [22]. Анизотропное reentry может спо¬
собствовать возникновению желудочковых аритмий в подо-
строй фазе инфаркта миокарда [22].Основным дифференциально-диагностическим призна¬
ком, позволяющим установить, что электрофизиологическим
механизмом нарушений ритма является reentry, служит реак¬
ция на электрическую стимуляцию сердца. В отличие от арит¬
мий, вызванных нарушениями формирования импульса (за
исключением триггерной активности, связанной с поздними
постдеполяризациями), аритмии, обусловленные механизмом
reentry, могут быть индуцированы и прекращены с помощью
программированной и/или учащающей стимуляции сердца.Определение электрофизиологического механизма надже¬
лудочковых тахикардий имеет не только академическое значе¬
ние для установления правильного диагноза, но во многом не¬
посредственно определяет выбор тактики ее лечения (анти-
аритмические препараты, радиочастотная абляция, хирурги¬
ческое вмешательство на проводящих путях, имплантация
кардиостимулятора).7.2. ЧП ЭФИ у больных с различными формами
наджелудочковых пароксизмальных тахикардийПод ЧП ЭФИ понимают совокупность методов электри¬
ческой стимуляции сердца через пищевод, которые вместе с
регистрацией чреспищеводной электрограммы во время нару¬
шений ритма сердца позволяют оценить функциональное со¬
стояние различных отделов проводящей системы сердца и по¬
лучить определенную информацию о возможных механизмах
возникновения аритмии.Одной из наиболее распространенных методик ЧПЭС
предсердий является их учащающая стимуляция, с помощью88
которой можно выявить дисфункцию синусового узла, опре¬
делить характер АВ проведения, функциональное состояние
АВ соединения и дополнительных АВ соединений (пучков
Кента), обладающих антеградным проведением.Продемонстрированная в начале 80-х годов возможность
выполнения программированной ЧПЭС предсердий [4, 55] су¬
щественно расширила ее диагностические границы, позволив
дифференцировать эктопический и reentry механизм возник¬
новения пароксизмальных тахикардий и определять рефрак¬
терные периоды различных отделов проводящей системы
сердца и дополнительных АВ путей проведения в антеградном
направлении. f іОІНаиболее важными в диагностике электрофизиологичес¬
ких механизмов наджелудочковых пароксизмальных тахикар¬
дий являются два момента. Во-первых, момент запуска арит¬
мии с помощью чреспищеводной программированной стиму¬
ляции предсердий; во-вторых, регистрация чреспищеводной
электрограммы (ЧП ЭГ) с измерением интервала V—А во
время приступа. Если возбуждение предсердий на ЧП ЭГ во
время приступа наджелудочковой пароксизмальной тахикар¬
дии регистрируется после окончания возбуждения желудочков
с интервалом V—А, равным 100 мс и более, то это свидетель¬
ствует в пользу того, что аритмия является АВ реципрокной
тахикардией с участием дополнительного пути проведения.
В случаях, когда возбуждение предсердий на ЧП ЭГ не иден¬
тифицируется и сливается с желудочковым комплексом, счи¬
тается, что имеет место реципрокная АВ узловая тахикардия.Способность ЧП ЭФИ провоцировать свойственные боль¬
ным приступы пароксизмальной тахикардии дала возмож¬
ность осуществлять индивидуальный подбор медикаментоз¬
ной антиаритмической терапии для профилактики рецидивов
аритмии методом серийного тестирования антиаритмических
препаратов на фоне перорального приема.7.2.1. Протокол проведения чреспищеводного
электрофизиологического исследования у больных
с наджелудочковыми пароксизмальными тахикардиямиЧП ЭФИ у больных с наджелудочковыми пароксизмаль¬
ными тахикардиями преследует следующие цели:— изучить характер антеградного АВ проведения;— выявить и ориентировочно локализовать дополнитель¬
ные АВ соединения (пучки Кента), функционирующие в
антеградном направлении;— изучить функциональное состояние различных отделов
антеградной проводящей системы сердца;89
— установить электрофизиологический механизм наджелу-
дочковой пароксизмальной тахикардии;— определить режим электрической стимуляции, позво¬
ляющей провоцировать и купировать приступ наджелу-
дочковой тахикардии с целью последующего тестирова¬
ния эффективности антиаритмических препаратов в ус¬
ловиях ЧП ЭФИ.В программу ЧП ЭФИ у больных с наджелудочковыми па¬
роксизмальными тахикардиями входят следующие этапы.1. Регистрация чреспищеводной электрограммы (ЧП ЭГ)
во время синусового ритма.2. Выполнение нагрузочных предсердных электростимуля-
ционных тестов.3. Провокация приступа наджелудочковой пароксизмаль¬
ной тахикардии.4. Регистрация ЧП ЭГ во время приступа наджелудочковой
пароксизмальной тахикардии. Во время приступа наджелудоч¬
ковой ПТ на ЧП ЭГ, помимо частоты тахикардии и длитель¬
ности комплекса QRS, измеряются значения интервалов А—V
и V—А, отражающих скорость проведения возбуждения соот¬
ветственно в антеградном и ретроградном звене цепи тахикар¬
дии.5. Подбор параметров электрической стимуляции предсер¬
дий, позволяющих купировать приступ наджелудочковой па¬
роксизмальной тахикардии.Нагрузочные электростимуляционные тесты включают в
себя;— проведение электрической стимуляции предсердий с
возрастающей частотой,— проведение программированной стимуляции предсер¬
дий одиночными и парными экстрастимулами на фоне
базового электростимуляционного ритма.Электрическую учащающую стимуляцию предсердий начи¬
нают с частоты, превышающей спонтанный синусовый ритм
на 10 имп/мин. Она выполняется прерывистым методом, при
котором частота стимуляции повышается на 20 имп/мин на
каждом этапе до достижения периодики Самойлова— Венкеба-
ха либо до возникновения приступа наджелудочковой парок¬
сизмальной тахикардии. Длительность стимуляции предсер¬
дий на каждом этапе составляет 30 с. Важно подчеркнуть, что
частота электрической стимуляции предсердий не должна пре¬
вышать 220 имп/мин ввиду опасности развития тахисистолии
желудочков сердца при наличии АВ проведения 1:1.Программированная стимуляция предсердий на фоне базо¬
вой электростимуляции может выполняться в нескольких мо¬
дификациях.90
StrSt, St,-St2 StrV2 V,-V2
600 420 200 420I V,.1st,1st,St, |st,St2600 400 200 420600 380 210600 260600 360 220 380600 340 230 360600 320 240 350600 300 270 360L/n600 280 300 380іisA-^ 1— -A.Рис. 7.1. Программированная ЧПЭС одиночным экстрастимулом
Stj—Stj — интервал базовой стимуляции предсердий. Stj —St2 — ин¬
тервал сцепления программированного экстрастимула (St2>.Программированная стимуляция предсердий одиночным
экстрастимулом (рис. 7.1). В этом режиме работы кардиости¬
мулятор осуществляет одновременно две функции. Он выпол¬
няет базовую электрическую стимуляцию (St,) предсердий с
базовой частотой (интервал St,—St,) и через каждые 8 кардио¬
циклов наносит одиночный программированный экстрасти¬
мул (St2) с интервалом сцепления (St,—St2), укорачивающийся
каждый раз на 20 мс до достижения эффективного рефрактер¬
ного периода предсердий (ЭРП). Первоначальный интервал
сцепления программированного тестирующего экстрастимула91
St2 устанавливается на 20 мс меньше, чем длительность базо¬
вого кардиоцикла St,—St,.При оценке значений антеградных рефрактерных перио¬
дов различных отделов проводящей системы сердца и мио¬
карда предсердий с помощью программированной стимуля¬
ции предсердий одиночным экстрастимулом целесообразно
использовать стандартную частоту базовой стимуляции пред¬
сердий, равную 100 имп/мин. При этом режиме програм¬
мированной стимуляции предсердий с целью провокации
приступа ПТ в процессе одного ЧП ЭФИ должны использо¬
ваться различные базовые частоты стимуляции предсердий
(100 имп/мин, 120 имп/мин, 140 имп/мин и т.д.) в возрас¬
тающей последовательности.Программированная стимуляция предсердий парным экстра¬
стимулом (рис. 7.2). Этот режим используется для повышения
агрессивности электростимуляционного воздействия с целью
провокации приступа тахикардии в тех случаях, когда это не
удается сделать с помощью программированной стимуляции
одиночным экстрастимулом.Методика отличается от предыдущей тем, что в программу
работы кардиостимулятора вводится второй программирован¬
ный экстрастимул (St3), интервал сцепления которого (St2—
St3) отсчитывается от первого программированного экстрасти¬
мула (St2), при этом первый программированный экстрасти¬
мул (St2) устанавливается таким образом, чтобы интервал
сцепления St,—St2 превышал по длительности значение ЭРП
предсердий на 20—40 мс и вызывал преждевременное возбуж¬
дение предсердий. Второй программированный экстрастимул
St3 первоначально устанавливается с интервалом сцепления
St2—St3 таким образом, чтобы сумма интервалов сцепления
(St,—St2) + (St2—St3) была меньше, чем интервал базового кар¬
диоцикла St,—St, на 20 мс. Во время этого варианта програм¬
мированной стимуляции интервал сцепления первого про¬
граммированного экстрастимула St,—St2 остается постоян¬
ным, в то время как интервал сцепления второго экстрастиму¬
ла St2—St3 укорачивается на 20 мс через каждые 8 базовых кар¬
диоциклов до достижения ЭРП предсердий.Использование этих электростимуляционных тестов по¬
зволяет индуцировать приступ аритмии у 92—95 % больных с
наджелудочковой пароксизмальной тахикардией [6].Попытки провокации приступа ПТ начинают с помощью
электрической стимуляции предсердий с возрастающей часто¬
той. Если это удается, необходимо тщательно анализировать
момент непосредственного возникновения аритмии, обращая
внимание на наличие атипичной периодики Самойлова—Вен-
кебаха. В тех случаях, когда электрическая стимуляция пред¬
сердий с возрастающей частотой не провоцирует приступ ПТ,
целесообразно переходить к программированной стимуляции92
600 280 440600 280 420Jl~S^ »^v——sy^i.s|—^ X-'4 -X-600 280 400600 280 380 іL~———-Xл|.600 280 360600 280 340J—^^—>Л-600 280іРис. 7.2. Программированная ЧПЭС одиночным экстрастимулом
St і—St і — интервал базовой стимуляции предсердий. St і—St2 — ин¬
тервал сцепления первого программированного экстрастимула (St2)
St2—St3 — интервал сцепления второго программированного экстра¬
стимула (St3).предсердий одиночным экстрастимулом, а при ее неэффек¬
тивности — парным экстрастимулом.У больных с пароксизмальной формой фибрилляции и тре¬
петания предсердий учащающая и программированная стимуля¬
ция предсердий одиночным либо парным экстрастимулом редко
провоцирует приступ аритмии. Поэтому в этой группе больных
нередко прибегают к частой стимуляции предсердий с помощью
залпа асинхронных импульсов с дискретно возрастающей часто¬
той: 200—300—400—500—600—800—1200 имп/мин. Длитель¬
ность залпа в диапазоне частот 200—600 имп/мин обычно не
превышает 2 мин, а при более высоких частотах длительность93
залпа ограничивается 30 с из-за выраженных болевых ощуще¬
ний.При невозможности индуцирования пароксизма фибрил¬
ляции или трепетания предсердий залпом асинхронных им¬
пульсов проводят частую стимуляцию предсердий с помощью
залпа программированных стимулов с теми же параметрами
частоты импульсов и длительности залпа.Особое внимание необходимо обращать на регистрацию
момента возникновения приступа ПТ под влиянием програм¬
мированной стимуляции предсердий, поскольку анализ имен¬
но этого момента является чрезвычайно существенным в диа¬
гностике электрофизиологического механизма аритмии.В тех случаях, когда ПТ могла быть повторно вызвана оди¬
ночным либо парным программированным предсердным
экстрастимулом, такая тахикардия должна расцениваться как
реципрокная, в основе которой лежит электрофизиологичес-
кий механизм reentry. В тех случаях, когда этого сделать не
удается, а у больных имеются достоверные свидетельства воз¬
никавших ранее эпизодов ПТ, наиболее вероятно, что
электрофизиологическим механизмом этих аритмий являются
нарушения функции автоматизма.Чрезвычайно важна регистрация ЧП ЭГ во время приступа
наджелудочковой ПТ. Во время приступа наджелудочковой ПТ
на ЧП ЭГ, помимо частоты тахикардии и длительности ком¬
плекса QRS, измеряются интервалы А—V и V—А. Они отражают
скорость проведения возбуждения соответственно в антеград¬
ном и ретроградном звене цепи тахикардии, что имеет чрезвы¬
чайно важное значение для правильного определения электро¬
физиологического механизма наджелудочковой тахикардии.Купирование приступа спровоцированной наджелудочко¬
вой тахикардии или трепетания предсердий осуществляется
обычно с помощью частой стимуляции предсердий. Индуци¬
рованный приступ фибрилляции предсердий купируют внут¬
ривенным введением антиаритмических препаратов.Оценка характера антеградного атриовентрикулярного
проведения основывается на анализе интервала А—V ЧП ЭГ
во время синусового ритма и его изменениях при проведении
нагрузочных электростимуляционных тестов.Основными задачами оценки характера антеградного атрио¬
вентрикулярного проведения являются выявление различных
аномалий проводящей системы сердца и установление их вида
(пучки Кента, дискретное проведение в АВ соединении и др.).Для наглядной оценки характера антеградного АВ проведе¬
ния целесообразно строить графическую зависимость измене¬
ний длительности интервалов St2—V2 и V,—V2 от длительности
интервала St,—St2 во время программированной стимуляции
предсердий одиночным экстрастимулом, которая носит назва¬
ние «кривой АВ проведения».94
ЗД-ЗД.мс700
650
600
550
500
о 450
:> 400
> 350зоо 250 200 1501 1 1 1 I I 1 і I I I I I I I I I I ■ і і200 220 240 260 280 300 320 340 360 380 400 420 440 460 480 500 520 540 560 580 600Sti-St2.MCРис. 7.3. Кривые нормального антеградного атриовентрикулярного
проведения.При нормальном антеградном АВ проведении эта кривая
имеет плавный характер, как показано на рис. 7.3.При существовании дискретного характера АВ проведения,
свойственного ряду аномалий проводящей системы сердца, на
кривой АВ проведения выявляются ее «разрывы» или «скач¬
ки». Под «разрывом кривой АВ проведения», отражающей
дискретный его характер, понимают скачкообразное возраста¬
ние интервала St2—V2 и(или) V,—V2 на 40 мс и более в ответ на
укорочение интервала сцепления тестирующего экстрастимула
на 20 мс (рис. 7.4).Функциональное состояние различных отделов проводя¬
щей системы сердца в антеградном направлении оценивается
по величинам их функционального (ФРП) и эффективного
(ЭРП) рефрактерных периодов, определяемых с помощью ме¬
тода программированной стимуляции предсердий одиночным
экстрастимулом на фоне их базовой стимуляции с частотой
100 имп/мин.440-430-420410400■420* 460
440*7-480500▲520560540±-580-41040095
Sti-St2,MC- 700650600550500о 450
5£ 400
> 350
300
250
.200150 I I I I I I і I I I I I l I I I I I I l200 220 240 260 280 300 320 340 360 380 400 420 440 460 480 500 520 540 560 580 600Stt-Sts.MCРис. 7.4. «Разрыв» кривой антеградного атриовентрикулярного прове¬
дения при бифасцикулярном строении АВ соединения у больного с
реципрокной АВ узловой ПТ. а — «медленный» АВ узловой путь про¬
ведения, р — «быстрый» АВ узловой путь проведения.« mrn /- Ыл«| / *» 1 і - V 4 V I V " w\К сожалению, на современном этапе развития ЧП ЭФИ
одним из его методических недостатков является невозмож¬
ность точной идентификации начала возбуждения предсердий
во время их программированной чреспищеводной стимуля¬
ции, что связано с выраженной перегрузкой каналов электро¬
кардиографа электрическими стимулами. Поэтому мы предла¬
гаем следующую методику количественной оценки антеград-
ных рефрактерных периодов различных отделов проводящей
системы сердца и миокарда предсердий, прекрасно понимая
все ее ограничения.Под ФРП предсердий понимали самый короткий интервал
St,—St2, который сопровождался 2 последовательными воз¬
буждениями желудочков.Под ЭРП предсердий понимали наибольший интервал St,—
St2, не сопровождавшийся деполяризацией V2. При такой оценкеа* Г320 320 а збо
Ь „ А 340 380400420+ 460440 А- 480500ж * 560
А 540
520' 580—30096
он совпадал с ЭРП АВ проводящей системы и ЭРП АВ соедине¬
ния (см. ниже), поскольку уровень блокады проведения экстра-
стимуляционного возбуждения оставался неизвестным.Под ФРП АВ проводящей системы понимали наиболее ко¬
роткий интервал V,—V2 при любом значении интервалов St,—
St2.Под ЭРП АВ проводящей системы понимали наибольший
интервал St,—St2, не сопровождавшийся деполяризацией V2.Значение ФРП АВ соединения с помощью программиро¬
ванной ЧПЭС предсердий четко определить не представляется
возможным, поскольку эта методика не позволяет регистриро¬
вать Н-потенциал (возбуждение пучка Гиса). Однако величина
ФРП АВ соединения может быть приблизительно приравнена
к величине ФРП АВ проводящей системы, т.е. соответствовать
наименьшему интервалу V,—V2 при любом значении интерва¬
лов St,—St2 при условии, что оба последовательных возбужде¬
ния проводились по обычным АВ путям.Под ЭРП АВ соединения понимали наибольший интервал
St,—St2, не сопровождавшийся деполяризацией V2, при усло¬
вии, что базовое электростимуляционное возбуждение прове¬
лось по обычным АВ путям. При такой оценке значение ЭРП
АВ соединения совпадало со значениями ЭРП предсердий и
ЭРП АВ проводящей системы.Под ФРП «быстрого» АВ узлового пути понимали наибо¬
лее короткий интервал V,—V2 в диапазоне интервалов St,—St2
до возникновения «разрыва» кривой АВ проведения при усло¬
вии, что оба последовательных возбуждения провелись по
обычным АВ путям. При такой оценке значение ФРП «бы¬
строго» АВ узлового пути совпадало со значениями ФРП АВ
соединения и ФРП АВ проводящей системы.Под ЭРП «быстрого» АВ узлового пути понимали наиболь¬
ший интервал St,—St2, при котором возникал «разрыв» кривой
АВ проведения, при условии, что оба последовательных воз¬
буждения провелись по обычным АВ путям.Под ФРП «медленного» АВ узлового пути понимали на¬
именьший интервал V,—V2 в диапазоне интервалов St,—St2
после возникновения «разрыва» кривой АВ проведения при
условии, что оба последовательных возбуждения провелись по
обычным АВ путям.Под ЭРП «медленного» АВ узлового пути понимали наи¬
больший интервал St,—St2 после возникновения «разрыва»
кривой АВ проведения, не сопровождавшийся деполяриза¬
цией V2, при условии, что оба последовательных возбуждения
провелись по обычным АВ путям.Под ФРП дополнительного АВ соединения (пучок Кента)
понимали наименьший интервал V,—V2 при любом значении
интервалов St,—St2 при условии, что оба последовательных
возбуждения провелись по пучку Кента.7—127997
Под ЭРП дополнительного АВ соединения (пучок Кента)
понимали наибольший интервал St,—St2, вызвавший исчезно¬
вение на ЭКГ признаков синдрома преждевременного возбуж¬
дения желудочков либо не сопровождавшийся деполяриза¬
цией V2, при условии, что базовое электростимуляционное
возбуждение провелось по пучку Кента.К сожалению, анализировать характер ретроградного АВ
проведения и оценить основные ретроградные рефрактерные
периоды проводящей системы сердца с помощью современно¬
го ЧП ЭФИ не представляется возможным, так как нельзя
идентифицировать ретроградное возбуждение предсердий на
чреспищеводной ЭГ и поверхностной ЭКГ при проведении
чреспищеводной электрической стимуляции желудочков серд¬
ца (предсердное возбуждение накладывается на комплекс QRS
и скрывается в нем).7.2.2. ЧП ЭФИ в диагностике
пароксизмальной синусовой тахикардии
(синоатриальной реципрокной пароксизмальной
тахикардии)Синоатриальная реципрокная пароксизмальная тахикар¬
дия — достаточно редкая форма наджелудочковых пароксиз¬
мальных тахикардий, при которой циркуляция возбуждения
происходит в пределах синоатриального соединения [13]. Ей
свойственны относительно низкая частота ритма (от 80 до
150 уд/мин) и неустойчивый характер аритмии (обычно 10—20
последовательных возбуждений, редко в течение нескольких
минут). По форме предсердных комплексов на ЭКГ она неот¬
личима от синусовой тахикардии, чрезвычайно чувствительна
к вагусным пробам (массаж каротидного синуса, задержка ды¬
хания).Специфических электрофизиологических критериев диа¬
гностики синоатриальной реципрокной пароксизмальной та¬
хикардии с помощью ЧП ЭФИ не существует. С высокой сте¬
пенью вероятности такой электрофизиологический механизм
наджелудочковой тахикардии может быть установлен только с
помощью внутрисердечного ЭФИ.Как любая реципрокная тахикардия, в основе которой
лежит механизм reentry в анатомически обусловленных струк¬
турах, она может быть вызвана, а также прекращена одиноч¬
ным предсердным экстрастимулом. Чрезвычайно важно, что
при этом отсутствуют электрофизиологические критерии диа¬
гностики, характерные для АВ узловых реципрокных парок¬
сизмальных тахикардий, АВ реципрокных тахикардий с учас¬
тием дополнительного пути проведения или предсердных па¬
роксизмальных тахикардий.98
Таким образом, диагноз синоатриальной реципрокной па¬
роксизмальной тахикардии с помощью ЧП ЭФИ может быть
поставлен только методом исключения.7.2.3. ЧП ЭФИ в диагностике
предсердной пароксизмальной тахикардии
(без участия синоатриального
или атриовентрикулярного соединения)Это также достаточно редкий вид аритмии, чаще всего на¬
блюдающийся у детей или молодых людей либо при интокси¬
кации сердечными гликозидами. При ней отмечается доста¬
точно высокая частота ритма (150—200 уд/мин), а также ус¬
тойчивый характер аритмии и относительно небольшая чувст¬
вительность к вагусным пробам. Форма предсердных ком¬
плексов отличается от синусовых.Электрофизиологическим механизмом предсердной парок¬
сизмальной тахикардии может быть как триггерная актив¬
ность, связанная с поздними постдеполяризациями, так и
reentry. Инициация приступов с помощью программирован¬
ной стимуляции предсердий наблюдается достаточно редко
[44].Специфических электрофизиологических критериев диа¬
гностики предсердной пароксизмальной тахикардии с помо¬
щью ЧП ЭФИ не существует. Важно, что при этом отсутству¬
ют электрофизиологические критерии, характерные для АВ
узловых реципрокных пароксизмальных тахикардий, АВ реци¬
прокных тахикардий с участием дополнительного пути прове¬
дения. С высокой степенью вероятности диагноз также может
быть установлен только с помощью внутрисердечного ЭФИ.Таким образом, диагноз предсердной пароксизмальной та¬
хикардии, так же как и синоатриальной реципрокной парок¬
сизмальной тахикардии, с помощью ЧП ЭФИ может быть по¬
ставлен в основном методом исключения.7.2.4. ЧП ЭФИ в диагностике трепетания предсердийПод трепетанием предсердий понимают регулярный пред¬
сердный ритм с частотой более 200 уд/мин. При этом необхо¬
димо учитывать относительную условность этого определения,
поскольку нет четкой электрофизиологической границы
между трепетанием предсердий и предсердной тахикардией,
особенно при пограничных значениях частот предсердного
ритма.С электрофизиологических позиций в основе трепетания
предсердий лежит механизм reentry. При этом каждому из двух7*99
известных типов трепетания предсердий соответствует свой
вариант циркуляции волны возбуждения в предсердиях.Трепетание предсердий I типа («классическое») характери¬
зуется частотой предсердного ритма в пределах от 240 до 340
ударов в минуту [51]. Оно представляет собой одиночную цепь
reentry в анатомически обусловленных предсердных структу¬
рах с Ыа-каналами и длинным «возбудимым промежутком».
Поэтому трепетание предсердий I типа может быть как вызва¬
но, так и прекращено одиночным (парным) программирован¬
ным предсердным экстрастимулом либо частой стимуляцией
предсердий залпом импульсов.Трепетание предсердий II типа характеризуется частотой
предсердного ритма от 340 до 430 уд/мин. Оно также представ¬
ляет собой внутрипредсердную циркуляцию возбуждения в
одиночной цепи reentry в предсердных структурах с Na-кана-
лами. Однако в отличие от трепетания предсердий I типа тре¬
петание II типа представляет собой reentry в функционально
обусловленных структурах без «возбудимого промежутка»
либо reentry в анатомически обусловленных структурах с ко¬
ротким «возбудимым промежутком». Из-за этих электрофизи¬
ологических особенностей трепетание предсердий II типа не
может быть прекращено ни нанесением программированных
экстрастимулов (одиночных и парных) на предсердия, ни час¬
той стимуляцией предсердий залпом импульсов.Диагноз трепетания предсердий обычно не труден, если
хотя бы один пароксизм был зарегистрирован на ЭКГ. Поэто¬
му роль ЧП ЭФИ в диагностике этой аритмии сводится к ре¬
шению следующих задач:— верификация возникновения пароксизмов трепетания
предсердий путем его индуцирования у пациентов с не¬
документированными приступами сердцебиения;— дифференциальная диагностика трепетания предсердий
с другими вариантами пароксизмальных тахикардий с
широкими комплексами QRS (см. главу VI);— подбор антиаритмической терапии с помощью серийно¬
го тестирования антиаритмических препаратов в услови¬
ях ЧП ЭФИ (см. главы VII и IX).7.2.5. ЧП ЭФИ в диагностике мерцания (фибрилляции)
предсердийВ основе фибрилляции предсердий лежит механизм reentry
в функционально обусловленных структурах без «возбудимого
промежутка». Reentry при мерцательной аритмии носит харак¬
тер «ведущего цикла», «спиральной волны» либо связано с
анизотропией миокарда предсердий. В случае «анизотропно¬100
го» reentry возможно существование «возбудимого» промежут¬
ка в цепи циркулирующего возбуждения.При фибрилляции предсердий цепь reentry непрерывно из¬
меняет свои размеры, конфигурацию и локализацию (random
reentry). Важно отметить, что при мерцании предсердий могут
одновременно существовать многочисленные непрерывно из¬
меняющиеся цепи reentry типа «ведущего цикла» [36, 49].Диагноз мерцательной аритмии обычно не представляет
существенных трудностей, если на ЭКГ бывает зарегистриро¬
ван хотя бы один пароксизм, и роль ЧП ЭФИ для диагностики
фибрилляций предсердий, так же как и при их трепетании,
сводится к решению сходных задач (см. выше).7.2.6. ЧП ЭФИ в диагностике атриовентрикулярной
узловой реципрокной пароксизмальной тахикардииВ отличие от описанных выше видов тахикардий (парок¬
сизмальных наджелудочковых) значение ЧП ЭФИ в диагнос¬
тике АВ узловой реципрокной пароксизмальной тахикардии
трудно переоценить. Не будет преувеличением сказать, что это
один из основных, наиболее информативных и достоверных
методов диагностики этой аритмии.Морфологическим субстратом АВ узловой реципрокной
пароксизмальной тахикардии является врожденная аномалия
проводящей системы сердца, которая носит название двойно¬
го проведения в АВ соединении [20]. В основе этой аномалии
лежит дискретное проведение в АВ соединении или продоль¬
ная диссоциация АВ соединения на два функционально раз¬
личных АВ узловых проводящих пути. Однако до настоящего
времени окончательно не выяснено, имеет ли это разделение
анатомическую основу [14] или же представляет собой чисто
электрофизиологический феномен [15].Вне зависимости от этого под двойным проведением в АВ
соединении подразумевают наличие в нем двух проводящих
путей, отличающихся друг от друга своими электрофизиологи-
ческими свойствами. Один из них, обладающий большей ско¬
ростью проведения возбуждения и большим ЭРП, называется
«быстрым», или (р)-АВ путем. Другой, проводящий возбужде¬
ние медленнее, но обладающий коротким ЭРП, называют
«медленным», или (а)-АВ путем [20, 52]. К настоящему време¬
ни накоплено достаточно сведений, показывающих, что а- и
р-АВ пути имеют проксимальную (в верхней части АВ узла) и
дистальную (в нижней части АВ узла) точки соединения — так
называемый начальный и конечный общий путь [32].В обычных условиях синусовый импульс, достигая АВ со¬
единения, начинает распространяться как по «быстрому», так
и по «медленному» АВ пути. Возбуждение, распространяю¬101
щееся по «быстрому» АВ пути, первым достигает пучка Гиса, в
то время как распространение возбуждения по «медленному»
АВ пути осуществляется скрытно (concealed conduction).При возникновении предсердной или желудочковой
экстрасистолы может возникнуть односторонняя блокада про¬
ведения в «быстром» (Р)-АВ пути и распространение возбуж¬
дения будет происходить только по «медленному» (а)-АВ
пути. Если время распространения возбуждения по «медлен¬
ному» (а)-АВ пути будет достаточным для того, чтобы «бы¬
стрый» (р)-АВ путь успел восстановить свою способность к
проведению возбуждения в ретроградном направлении, зам¬
кнется цепь reentry и возникнет реципрокная АВ узловая па¬
роксизмальная тахикардия. Антеградным звеном цепи такой
пароксизмальной тахикардии будет «медленный» (а)-АВ путь,
а ретроградным звеном — «быстрый» (Р)-АВ путь проведения.
В редких случаях, обычно при так называемой непрерывно ре¬
цидивирующей форме АВ узловой реципрокной пароксиз¬
мальной тахикардии, циркуляция возбуждения может осу¬
ществляться в противоположном направлении: антеградно —
по «быстрому» (Р)-АВ пути, а ретроградно — по «медленному»
(а)-АВ пути [53].При проведении программированной стимуляции предсер¬
дий у больных с реципрокной АВ узловой пароксизмальной
тахикардией, с укорочением интервала сцепления тестирую¬
щего предсердного экстрастимула наблюдается постепенное
удлинение времени проведения возбуждения по АВ соедине¬
нию. В процессе внутрисердечного ЭФИ (рис. 7.5) и чреспи-
щеводного (рис. 7.6) это проявляется прогрессирующим воз¬
растанием интервала А—V (для чреспищеводного ЭФИ), а
также интервалов А—Н и Н—V (для внутрисердечного ЭФИ)
до достижения ЭРП «быстрого» (р)-АВ пути проведения. При
этом наблюдается «разрыв» кривой АВ проведения, сопровож¬
дающийся возникновением реципрокной АВ узловой парок¬
сизмальной тахикардии (рис. 7.7, 7.8).Таким образом, электрофизиологической основой возник¬
новения реципрокной АВ узловой пароксизмальной тахикар¬
дии является reentry в анатомически обусловленных структу¬
рах с Са-каналами (АВ соединение) и длинным возбудимым
промежутком.Не вызывает сомнений, что «золотым стандартом» в диа¬
гностике электрофизиологических механизмов пароксизмаль¬
ных тахикардий было и остается внутрисердечное ЭФИ. Поэ¬
тому информативность любых других клинических методов
изучения механизмов пароксизмальных тахикардий, в том
числе и ЧП ЭФИ, должна оцениваться по отношению к дан¬
ным, полученным во время внутрисердечного ЭФИ.В первой половине 80-х годов в факультетской терапевти¬
ческой клинике имени В.Н.Виноградова 1-го Московского102
103
500400300200a a*AJ I I I I L100 200 300 400 500A,-A2imcA2-H2imc Рис. 7.6. Внутрисердеч-ное ЭФИ. Кривая ан-
4001- теградного АВ проведе¬ния у больного с би-
фасцикулярным прове¬
дением в АВ соедине-300200100 -a▲а нии. a — «медленный»А АВ узловой путь прове¬дения, (3 — «быстрый»
АВ узловой путь прове¬
дения. В момент «раз-
• Р рыва» кривой АВ про-••••• • •. ведения отмечаетсявозникновение реци¬
прокной АВ узловой
ПТ с частотой 187 в
1 мин, показанной наі і і100 200 300 400 500А,-А2,мс рис. 7.5.медицинского института имени И.М.Сеченова были прове¬
дены исследования, позволившие сравнить диагностическую
ценность чреспищеводного ЭФИ и внутрисердечного ЭФИ
более чем у 100 больных с реципрокными АВ узловыми парок¬
сизмальными тахикардиями.Основной особенностью ЧП ЭФИ у больных с реципрок¬
ными АВ узловыми пароксизмальными тахикардиями являет¬
ся тот факт, что при регистрации ЧП ЭГ во время приступа та¬
хикардии невозможно идентифицировать ретроградное воз¬
буждение предсердий, поскольку A-потенциал ЧП ЭГ скрыва¬
ется внутри возбуждения желудочков (см. рис. 7.7). Это при¬
водит к невозможности точного расчета интервалов А—V и
V—А чреспищеводной электрограммы во время реципрокной
АВ узловой пароксизмальной тахикардии. Поэтому приходит¬
ся исходить из того, что интервал V—А не превышает длитель¬
ности комплекса QRS во время реципрокной АВ узловой па-104
V,-V2imc
500400
300
200aAI I I I I I I I I I100 200 300 400 500Sti-Sb,MCSti-V2,McL400 h A Рис. 7.8. ЧП ЭФИ. Кри¬вая антеградного АВ про-
30Q I ведения у больного с би-* . фасцикулярным проведе-•• ,.в нием в АВ соединении. •* а — «медленный» АВ уз-200 Г 0 ловой путь проведения,Р — «быстрый» АВ уз¬
ловой путь проведения.
1001" В момент «разрыва» кри¬вой АВ проведения отме¬
чается возникновение ре-100 200 300 400 500 иипрокной АВ узловой ПТс частотой 177 в 1 мин,St,-St2lMc показанной на рис. 7.7.роксизмальной тахикардии, т.е. максимально возможное зна¬
чение интервала V—А равно длительности комплекса QRS.
При отсутствии нарушений внутрижелудочковой проводимос¬
ти реципрокная АВ узловая пароксизмальная тахикардия от¬
носится к тахикардиям с «узким комплексом QRS», при кото¬
рых длительность желудочкового комплекса и соответственно
значение интервала V—А не превышают 100 мс. В таком слу¬
чае значение интервала А—V на ЧП ЭГ будет равно разнице
между длительностью цикла пароксизмальной тахикардии и
длительностью интервала V—А.В случаях возникновения пароксизмальной тахикардии с
«широким комплексом QRS» верификация электрофизиологи-
ческого механизма, лежащего в основе нарушений ритма, зна¬
чительно усложняется (см. главу VI).Основные электрофизиологические характеристики прово¬
дящей системы сердца во время синусового ритма и во время106
реципрокной АВ узловой пароксизмальной тахикардии, полу¬
ченные во время ЧП ЭФИ и внутрисердечной ЭФИ, представ¬
лены в табл. 7.1 и 7.2 (учтены указанные ранее ограничения
ЧП ЭФИ).Таблица 7.1. Основные интервалы проводящей системы сердца
(мс) во время синусового ритма у больных с реципрокными АВ узловы¬
ми тахикардиями по результатам чреспищеводного и внутрисердечного
ЭФИПоказательВнутрисердечное
ЭФИ, п=112Чреспищеводное
ЭФИ, п=112РЧСС (в 1 мин)88,0±6,186,6±3,8>0,1Интервал Р—А23,8±2,5 Интервал А—Н86,3±4,4 Интервал Н—V41,3±3,5•Сумма интервалов151,3±5,3 >0,1(Р—А)+(А—Н)+(Н—V)Интервал А—V158,9±3,7Таблица 7.2. Основные интервалы проводящей системы сердца
(мс) во время реципрокной АВ узловой пароксизмальной тахикардии по
результатам чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное ЭФИ,
п=112Чреспищеводное ЭФИ,
п=112РЧСС (в 1 мин)177,7±7,7183,8±5,8>0,1Интервал А—Н294,2±13,8 >0,05Интервал А—V259,8±11,7Интервал Н—V55,4±3,5 Интервал Н—А54,2±6,0 >0,1Интервал V—А71,1±2,1При регистрации ЧП ЭГ во время синусового ритма (см.
табл. 7.1), частота которого во время ЧП и ВС ЭФИ достовер¬
но не различалась, интервал А—V был равен в среднем
158,9±3,7 мс и достоверно превышал интервал А—Н, равный в
среднем 86,3±4,4 мс (р<0,001). В то же время сумма интерва¬
лов (Р—А)+(А— Н)+(Н—V) внутрисердечной электрограммы
проводящей системы сердца (в среднем 151,3±5,3 мс) досто¬
верно не отличалась от значения интервала А—V чреспище¬
водной электрограммы (р>0,1).Приступы реципрокной АВ узловой пароксизмальной та¬
хикардии, спровоцированные у больных во время ЧП ЭФИ и107
ВС ЭФИ (см. табл. 7.3), по частоте сердечных сокращений до¬
стоверно (р>0,1) между собой не различались (183,8±5,8 и
177,7±7,7 ударов в 1 мин).При регистрации ЧП ЭГ во время реципрокной АВ узло¬
вой пароксизмальной тахикардии интервал А—V (259,8±11,7
мс) достоверно (р>0,05) не отличался от интервала А—Н внут¬
рисердечной электрограммы проводящей системы сердца
(294,2±13,8 мс).С учетом указанных выше ограничений значение интерва¬
ла V—А чреспищеводной электрограммы во время реципрок¬
ной АВ узловой пароксизмальной тахикардии колебалось в
пределах 55— 90 мс (в среднем 71,1±2,1 мс). Она не отличалась
достоверно (р>0,05) от значения интервала Н—А внутрисер¬
дечной электрограммы проводящей системы сердца (в сред¬
нем 54,2±6,0 мс).Основные антеградные рефрактерные периоды различных
отделов проводящей системы сердца у больных с реципрокны-
ми АВ узловыми пароксизмальными тахикардиями, по дан¬
ным чреспищеводного и внутрисердечного ЭФИ, представле¬
ны в табл. 7.3.Таблица 7.3. Основные антеградные рефрактерные периоды раз¬
личных отделов проводящей системы сердца (мс) у больных с реци-
прокными АВ узловыми пароксизмальными тахикардиями по результа¬
там чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечноеЭФИЧреспищеводноеЭФИРФРП предсердий250,8±7,6283,8±10,2>0,05ЭРП предсердий218,3±9,0261,3±10,3<0,02ФРП АВ проводящей системы390,8±15,8394,8±8,6>0,1ЭРП АВ проводящей системы223,3±8,5261,3±10,3<0,05ФРП АВ соединения388,3±16,0394,8±8,6>0,1ЭРП АВ соединения233,3±8,3261,3±10,3<0,05ФРП p-пути АВ соединения388,3±16,0• 394,8±8,6>0,1ЭРП p-пути АВ соединения309,2±12,9318,3±9,1>0,1ФРП a-пути АВ соединения435,0±15,3451,3±14,8>0,1ЭРП а-пути АВ соединения258,3±13,9277,0± 11,4>0,1Сравнительный анализ полученных результатов показыва¬
ет, что большинство антеградных функциональных и эффек¬
тивных рефрактерных периодов различных отделов проводя¬
щей системы сердца у больных с реципрокными АВ узловыми
пароксизмальными тахикардиями, определенных с помощью
внутрисердечного и чреспищеводного ЭФИ, достоверно меж¬108
ду собой не различаются. Исключениями являются ЭРП пред¬
сердий, ЭРП атриовентрикулярной проводящей системы и
ЭРП атриовентрикулярного соединения. Это связано с тем,
что из-за технических и методических ограничений ЧП ЭФИ
все указанные значения оказываются равными ЭРП предсер¬
дий. В свою очередь при определении ЭРП предсердий во
время ЧП ЭФИ может возникать погрешность, поскольку
метод не позволяет точно идентифицировать возбуждение
предсердий во время их программированной стимуляции из-за
перегрузки каналов электрокардиографа электрическими сти¬
мулами. Поэтому критерием достижения ЭРП предсердий
считается отсутствие желудочкового возбуждения в ответ на
предсердный экстрастимул. При этом необходимо отдавать
себе отчет в том, что такой подход не позволяет точно устано¬
вить, где именно возникла блокада проведения: на уровне ми¬
окарда предсердий или на уровне АВ соединения.На основании данных анализа литературы и собственных
исследований, выполненных в факультетской терапевтичес¬
кой клинике ММА имени И.М.Сеченова, включивших в себя
сравнительный анализ внутрисердечных и чреспищеводных
исследований более чем у 100 больных с реципрокными АВ
узловыми пароксизмальными тахикардиями, нами были пред¬
ложены следующие основные электрофизиологические крите¬
рии диагностики (ЧП ЭФИ) этой формы наджелудочковой па¬
роксизмальной тахикардии.1. Отсутствие электрофизиологических признаков сущест¬
вования и функционирования дополнительных АВ соедине¬
ний (пучков Кента) в антеградном направлении при проведе¬
нии нагрузочных электростимуляционных тестов из предсер¬
дий (см. глава VII, раздел 7.2.7.1).2. Возможность провоцирования приступа наджелудочко¬
вой пароксизмальной тахикардии с помощью стимуляции
предсердий с возрастающей частотой.3. Возможность провоцирования приступа наджелудочко¬
вой пароксизмальной тахикардии с помощью программиро¬
ванной стимуляции предсердий одиночным либо парным
экстрастимулом (см. рис. 7.7).4. Возникновение приступа наджелудочковой пароксиз¬
мальной тахикардии требует обязательного критического уд¬
линения времени проведения возбуждения по АВ соедине¬
нию, что проявляется атипичной периодикой Самойлова—
Венкебаха при выполнении стимуляции предсердий с возрас¬
тающей частотой либо «разрывом» кривой АВ проведения при
выполнении программированной стимуляции предсердий (см.
рис. 7.7, 7.8).5. Во время приступа наджелудочковой пароксизмальной
тахикардии ретроградное возбуждение предсердий не иденти¬
фицируется, сливаясь с желудочковым комплексом. Это по¬109
зволяет считать, что интервал V—А во время наджелудочковой
тахикардии не превышает 100 мс (см. рис. 7.7).Предлагаемые нами критерии, используемые во время ЧП
ЭФИ, очень близки к критериям, применяемым во время
внутрисердечного ЭФИ. В то же время имеются и некоторые
отличия, связанные в первую очередь с различиями в техни¬
ческих возможностях обоих методов. Сравнительная оценка
электрофизиологических критериев диагностики реципрок¬
ной АВ узловой пароксизмальной тахикардии с помощью
внутрисердечного и чреспищеводного ЭФИ приводится ниже.Электрофизиологические критерии диагностики реципрокной АВ узло¬
вой пароксизмальной тахикардииВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИОтсутствие электрофизиологичес¬
ких признаков функционирования
дополнительных АВ соединений
(пучков Кента) как в антеградном,
так и в ретроградном направлениях
при проведении нагрузочных элек¬
тростимул я ционных тестов из
предсердий и желудочковВозможность провоцирования
приступа наджелудочковой парок¬
сизмальной тахикардии с помощью
стимуляции предсердий с возрас¬
тающей частотойПровоцирование и купирование
приступа наджелудочковой парок¬
сизмальной тахикардии с помощью
программированной стимуляции
предсердий и/или желудочков оди¬
ночным либо парным экстрастиму¬
ломВозникновение приступа наджелу¬
дочковой пароксизмальной тахи¬
кардии требует обязательного кри¬
тического удлинения времени про¬
ведения возбуждения по АВ соеди¬
нению, что проявляется либо ати¬
пичной периодикой Самойлова—
Венкебаха при выполнении стиму¬
ляции предсердий с возрастающей
частотой, либо «разрывом» кривой
АВ проведения при выполнении
программированной стимуляции
предсердийОтсутствие электрофизио¬
логических признаков
функционирования допол¬
нительных АВ соединений
(пучков Кента) в антеград¬
ном направлении при про¬
ведении нагрузочных эле-
ктростимуляционных тес¬
тов из предсердийКритерий тот жеПровоцирование приступа
наджелудочковой парок¬
сизмальной тахикардии с
помощью программиро¬
ванной стимуляции пред¬
сердий одиночным либо
парным экстрастимуломКритерий тот же110
ВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИВо время приступа наджелудочко¬
вой пароксизмальной тахикардии
ретроградное возбуждение предсер¬
дий регистрируется внутри желу¬
дочкового комплекса с интервалом
Н—А в пределах от 50 до 100 мс
•Возможность существования над¬
желудочковой пароксизмальной та¬
хикардии при наличии АВ блокады
2:1Во время наджелудочковой парок¬
сизмальной тахикардии, а также
при проведении программирован¬
ной и учащающей стимуляции же¬
лудочков наблюдается ретроград¬
ная симметричная последователь¬
ность возбуждения предсердий сни¬
зу вверх с первоначальной актива¬
цией нижних отделов правого пред¬
сердия и последующим (через 20—
60 мс) почти одновременным воз¬
буждением левого предсердия и вы¬
соких отделов правого предсердияДекрементный характер ретроград¬
ного проведения в АВ соединении,
проявляющийся в прогрессирую¬
щем возрастании интервала V2—Аг
и интервала Нг—Аг при проведе¬
нии программированной и уча¬
щающей стимуляции желудочковВо время приступа надже¬
лудочковой пароксизмаль¬
ной тахикардии ретроград¬
ное возбуждение предсер¬
дий не идентифицируется,
сливаясь с желудочковым
комплексом. Это позволя¬
ет считать, что интервал
V—А во время наджелудоч¬
ковой тахикардии не пре¬
вышает 100 мсКритерий тот жеОценить с помощью ЧП
ЭФИ технически невоз¬
можноОценить с помощью ЧП
ЭФИ технически невоз¬
можноКлинические внутрисердечные электрофизиологические ис-
ледования, выполненные в факультетской терапевтической кли¬
нике ММА имени И.М.Сеченова, позволили идентифицировать
ряд более тонких электрофизиологических механизмов, лежащих в
основе реципрокных АВ узловых пароксизмальных тахикардий.В результате этих исследований была сформулирована кон¬
цепция полифасцикулярного строения АВ соединения как
одного из вариантов врожденных аномалий проводящей систе¬
мы сердца у больных с реципрокными АВ узловыми пароксиз¬
мальными тахикардиями. Было показано, что при этой патоло¬
гии более чем у 40 % больных с реципрокными АВ узловыми па¬
роксизмальными тахикардиями АВ соединение может иметь не111
toooK>VOA1nAa*330Aj-H2=140Hrv7=eo“CSmid
V—^-v^Аі-Аг=310
Аг-Нг-210
H2-V,*50-CSmidН,-Н2=4в0Рис. 7.9. Внутрисердечное ЭФИ. Возникновение двух вариантов реципрокной АВ узловой тахикардии с
частотой 167 в 1 мин (В) и частотой 150 в 1 мин (С) под влиянием программированной стимуляции
предсердий одиночным экстрастимулом у больного с трифасцикулярным проведением в АВ соединении.
Скорость регистрации 100 мм/с. HRA — ЭГ высоких отделов правого предсердия. НВЕ — ЭГ пучка Гиса.
CS — ЭГ коронарного синуса сердца.
A2-H2imc
500400А 0С2300А <*1200р Рис. 7.10. Внутрисер-• • • • дечное ЭФИ. Два_і | «разрыва» кривой ан-500«1100 200 зоо 400 500 теградного атриовент-рикулярного проведе-
А,-А2,мс ния при трифасцику-Hi.H мс лярном строении АВ• соединения у больно-
“2 , * го с реципрокной АВузловой тахикардии,
ai и аг — «медлен¬
ные» АВ узловые пу-400 К • ТИ ПрОВЄДЄНИЯ, Р —«быстрый» АВ узло¬
вой путь проведения.3001_ В моменты «разры¬вов» кривой АВ про¬
ведения отмечается
возникновение двух
вариантов реципрок¬
ной АВ узловой ПТ с
частотой 167 в 1 мини частотой 150 в1 мин, показанной на200J I I100 200 300 400 500А,-А2>мс рис. 7.9.двухпучковое строение (общепризнанная концепция двойного
проведения в АВ соединении), а имеет полифасцикулярное
строение и состоит из одного «быстрого» и нескольких «медлен¬
ных» АВ узловых путей проведения [10]. У 65 % больных, по
данным внутрисердечного ЭФИ, наблюдалось бифасцикуляр-
ное проведение в АВ соединении, соответствующее термину
«двойное проведение в АВ соединении». Детальный анализ ха¬
рактера и кривых АВ проведения у этих больных показал суще¬
ствование одного «разрыва» кривой АВ проведения, сопровож¬
давшегося возникновением первого варианта реципрокной АВ
узловой пароксизмальной тахикардии (см. рис. 7.5, 7.6).В то же время у 35 % больных с реципрокной АВ узловой
пароксизмальной тахикардией, по данным внутрисердечного
ЭФИ, наблюдалось трифасцикулярное проведение в АВ со¬
единении, состоявшее из одного «быстрого» и двух «медлен-114
ных» АВ путей проведения. Детальный анализ характера и
кривых АВ проведения у этой категории больных показал су¬
ществование двух «разрывов» кривой АВ проведения, каждый
из которых сопровождался возникновением реципрокных АВ
узловых тахикардий, различавшихся по своим электрофизио-
логическим характеристикам (рис. 7.9, 7.10).Аналогично результатам внутрисердечного ЭФИ во время
ЧП ЭФИ было показано, что у ряда больных с реципрокными
АВ узловыми пароксизмальными тахикардиями, обусловленны¬
ми дискретным проведением в АВ соединении, последнее может
иметь не только двухпучковое, но и полифасцикулярное стро¬
ение, включая в себя «быстрый» ((3) и несколько «медленных»
(а) АВ путей проведения. По данным ЧП ЭФИ, полифасцику¬
лярное строение АВ соединения выявлено у 35 % больных с ре¬
ципрокной АВ узловой пароксизмальной тахикардией, что близ¬
ко к результатам внутрисердечного ЭФИ (рис. 7.11, 7.12).Необходимо также отметить имевшее место у 2 больных с
реципрокными АВ узловыми пароксизмальными тахикардия¬
ми несовпадение оценки характера антеградного проведения в
АВ соединении по данным внутрисердечного и ЧП ЭФИ. По
данным ЧП ЭФИ, у них имело место бифасцикулярное прове¬
дение в АВ соединении, а по данным внутрисердечного
ЭФИ — трифасцикулярное.В отличие от внутрисердечного ЭФИ ЧП ЭФИ ни разу не
позволило выявить существование квадрифасцикулярного
проведения в АВ соединении.Другим важным результатом этих исследований явилось
осознание того факта, что электрофизиологический механизм
возникновения аритмии у больных с реципрокной АВ узловой
пароксизмальной тахикардией неоднороден.Проведенными нами исследованиями установлено, что
одной из причин возникновения реципрокных АВ узловых па¬
роксизмальных тахикардий является такая врожденная анома¬
лия проводящей системы сердца, как скрытые дополнитель¬
ные атрионодальные соединения (скрытый синдром Clerc—
Levy—Cristesco). В этой группе больных антеградным звеном
цепи тахикардии служили АВ узловые структуры, а ретроград¬
ным звеном являлись дополнительные аномальные соедине¬
ния между предсердиями и АВ узлом, функционировавшие
только в ретроградном направлении. Скрытый синдром CLC
был выявлен у 12 % больных с реципрокными АВ узловыми
пароксизмальными тахикардиями.Наконец, были разработаны и электрофизиологические
критерии диагностики реципрокных АВ узловых пароксиз¬
мальных тахикардий, обусловленных скрытым синдромом
CLC [11]. Одним из основных критериев является возникно¬
вение ретроградного возбуждения предсердий либо до, либо
одновременно с началом возбуждения желудочков с очень ко-8*115
116Рис. 7.11. ЧП ЭФИ. Возникновение двух вариантов реципрокной АВ узловой тахикардии частотой 122 в
1 мин (А, Б) и частотой 113 в 1 мин (В) под влиянием программированной стимуляции предсердий
одиночным экстрастимулом у больного с трифасцикулярным проведением в АВ соединении. Скорость
регистрации 100 мм/с.
Рис. 7.12. ЧП ЭФИ.
Два «разрыва» кривой
антеградного атрио¬
вентрикулярного про¬
ведения при трифас-
цикулярном строении
АВ соединения у
больного с реципрок¬
ной АВ узловой тахи¬
кардией. ai и аг —
«медленные» АВ узло¬
вые пути проведения,
Р — «быстрый» АВ уз¬
ловой путь проведе¬
ния. В моменты «раз¬
рывов» кривой АВ
проведения возника¬
ют два варианта реци¬
прокной АВ узловой
ПТ с частотой 122 и
113 в 1 мин, показан¬
ной на рис. 7.11.V,-V2,mcSti-Sfe.McStrV2.MCSt,-St2lMCротким интервалом Н—А, не превышающим 50 мс (рис. 7.13).
Учитывая невозможность точной идентификации начала рет¬
роградного возбуждения предсердий во время реципрокной
АВ узловой тахикардии на чреспищеводной ЭГ, следует при¬
знать, что чреспищеводное ЭФИ не позволяет выделить вид
аритмии, основой которой является скрытый синдром CLC.Таким образом, все изложенное позволяет сделать вывод,
что у больных с реципрокными АВ узловыми пароксизмальны¬
ми тахикардиями ЧП ЭФИ близко по информативности к внут-
рисердечному. Однако ЧП ЭФИ не позволяет достоверно оце¬
нить величины антеградных ЭРП предсердий, АВ проводящей
системы и АВ соединения, оценивать ретроградные рефрактер¬
ные периоды различных отделов проводящей системы сердца,
выявить вид аритмии, связанный со скрытым синдромом CLC.117
SI£ 2 ЇЇ
lg-хоwаз O S
W О^ о-о 5’S * о.
о £ с:1-50.2 он*о UЯ °т *й
н § «Е- Р CQ>> о
« ЗЕ ч
О S UЯ Р зО О нс: я оО 5CQ * *< п 8
«г2
о 2X IL* тто oL;о. х і
с К I
5 Ч .я о <0 ОСа« Xа> £ .5 §■<v о 5Й й 5 J2 з gX 0.0 >,* со X5 ~ s? S s uS §52
“ Sg Ь
p-ж
r ^ ha1 1 £ IЛ Й fc 2оо0 * л *
х о нг1 Ї OUSi°mп Сй ^•-Ч ^ /-Ча « §DO*о a.Uc/3S £ г \н SUї iSn З“ u *
. О sum 2- о ce
- с S *05 CX
. s ЄЗ c
° о їгSasbOh CQ О (D
7.2.7. ЧП ЭФИ в диагностике атриовентрикулярнойреципрокной пароксизмальной тахикардии с участиемдополнительного пути проведенияРеципрокная пароксизмальная АВ тахикардия с участием
дополнительного пути проведения обусловлена врожденной
аномалией проводящей системы сердца, морфологическим суб¬
стратом которой являются дополнительные (аномальные) пути
проведения между предсердиями и желудочками, существую¬
щие помимо обычного АВ соединения. Значение ЧП ЭФИ в
диагностике этого вида тахикардий чрезвычайно велико.У большинства людей дополнительные проводящие пути
исчезают в процессе онтогенеза либо становятся неактивны¬
ми. Однако у 8—10 % здоровых людей они могут сохраняться
(особенно по периметру фиброзного кольца трехстворчатого
клапана [14]) и обнаруживаются при клинических электрофи¬
зиологических исследованиях [16].Один из вариантов аномальных путей проведения носит
название дополнительного АВ соединения и является морфо¬
логической, а также электрофизиологической основой син¬
дрома WPW. Этот аномальный путь представляет собой мы¬
шечный мостик, содержащий клетки специализированной
проводящей системы и соединяющий между собой предсердия
и желудочки в стороне от обычного АВ соединения. Такие до¬
полнительные АВ соединения получили название пучков
Кента, хотя с академической точки зрения это неверно, по¬
скольку Кент описал дополнительное соединение между
участком специализированной ткани атриовентрикулярного
кольца и миокардом желудочка [33]. Истинное дополнитель¬
ное АВ соединение впервые описал Ohnell в 1944 г. [40]. В по¬
следующем существование дополнительных АВ соединений у
больных с синдромом WPW было доказано многочисленными
исследованиями, а также результатами катетерной абляции и
хирургического лечения наджелудочковых пароксизмальных
тахикардий.В настоящее время выделяют несколько вариантов синдро¬
ма WPW.1. Манифестирующий, или явный синдром WPW (ЭКГ
признаки присутствуют постоянно).2. Интермиттирующий синдром WPW (ЭКГ признаки при¬
сутствуют на ЭКГ не постоянно).3. Латентный синдром WPW (ЭКГ признаки выявляются
только с помощью нагрузочных электростимуляционных тес¬
тов) [39].4. Скрытый синдром WPW (проведение возбуждения по
дополнительному АВ соединению осуществляется только в
ретроградном направлении — от желудочков к предсердиям и
отсутствует в антеградном направлении) [9, 24, 38].119
7.2.7.1. ЧП ЭФИ в диагностике атриовентрикулярной
реципрокной пароксизмальной тахикардии у больных
с явным синдромом WPWПри явном синдроме WPW во время синусового ритма воз¬
буждение желудочков представляет собой «сливное возбужде¬
ние» (fusion beat), поскольку осуществляется одновременно по
двум анатомически и функционально различным проводящим
путям: по обычному АВ пути проведения и по дополнительно¬
му АВ соединению. На внутрисердечной электрограмме про¬
водящей системы сердца это проявляется в виде укорочения
интервала Н—V (менее 35 мс) при нормальном значении ин¬
тервала А—Н. При этом локализация Н-потенциала на внут¬
рисердечной электрограмме проводящей системы сердца зави¬
сит от соотношения скорости проведения возбуждения по
нормальному и дополнительному АВ пути.Пусковым механизмом возникновения реципрокной АВ
тахикардии у больных с явным синдромом WPW чаще всего
бывает предсердная или желудочковая экстрасистола. Возник¬
новение тахикардии связано с различием электрофизиологи¬
ческих свойств обычных и дополнительных путей проведения.Обычные АВ проводящие пути обладают способностью к
декрементному проведению (т.е. с возрастанием частоты
электрической стимуляции сердца либо с уменьшением за¬
держки экстрастимулов возникает замедление скорости рас¬
пространения возбуждения), которое осуществляется в клет¬
ках АВ соединения. В отличие от этого дополнительные пути
проведения, обходя АВ соединение и соединяя напрямую
предсердия и желудочки, лишены способности к декремент¬
ному проведению возбуждения как в антеградном, так и в рет¬
роградном направлениях [46]. Далее, обычно в антеградном
направлении значение ЭРП дополнительных АВ соединений
превышает значение ЭРП обычных АВ путей проведения, а в
ретроградном направлении — наоборот [49].При проведении электростимуляционных тестов из пред¬
сердий при явном синдроме WPW с возрастанием частоты их
стимуляции или с уменьшением задержки предсердного
экстрастимула возрастает степень задержки проведения воз¬
буждения в обычных АВ путях при отсутствии этой задержки в
пучке Кента. Это приводит к возрастанию степени преждевре¬
менности возбуждения желудочков, что отражается на ЭКГ в
виде нарастающего расширения комплекса QRS.При проведении ЧП ЭФИ максимальная степень прежде¬
временности возбуждения желудочков позволяет проводить
только ориентировочную оценку месторасположения пучка
Кента, не уточняя локализацию, поскольку нет возможности
осуществить эндокардиальное картирование последователь¬
ности ретроградного возбуждения предсердий во время при-120
Рис. 7.14. ЧП ЭФИ (А и Б) и внутрисердечное ЭФИ (Ви Г). Возник¬
новение реципрокной ортодромной АВ тахикардии частотой 140 в1 мин (Б и Г) во время программированной стимуляции предсердий
одиночным экстрастимулом у одного и того же больного с манифес¬
тирующим синдромом WPW типа А. Скорость регистрации 100 мм/с.
HRA — ЭГ высоких отделов правого предсердия; НВЕ — ЭГ пучка
Гиса; CS — ЭГ коронарного синуса сердца.ступа реципрокной пароксизмальной АВ тахикардии (или во
время нагрузочных электростимуляционных тестов из желу¬
дочков сердца).Прогрессирующее возрастание степени преждевременнос¬
ти возбуждения желудочков при ЧП ЭФИ сопровождается
прогрессирующим укорочением интервала St2—V (рис. 7.14).
Во время внутрисердечного ЭФИ при этом наблюдаются про¬
грессирующее укорочение интервала Н—V и удлинение интер¬
вала А—Н со смещением Н-потенциала в сторону комплекса
QRS с последующим его исчезновением в желудочковом воз¬
буждении (см. рис. 7.14).
Такая ситуация продолжается до тех пор, пока не будет до¬
стигнут ЭРП дополнительного АВ пути проведения и возбуж¬
дение не начнет распространяться на желудочки только по
обычным АВ путям. Достижение предсердной экстрасистолой
ЭРП пучка Кента сопровождается исчезновением всех ЭКГ
признаков синдрома WPW, скачкообразным возрастанием ин¬
тервала А2—V2 (при внутрисердечном ЭФИ), St2—V2 (при ЧП
ЭФИ) и возникновением приступа реципрокной АВ тахикар¬
дии с узким комплексом QRS (см. рис. 7.14). Такой тип реци¬
прокной АВ тахикардии с участием дополнительного пути
проведения у больных с синдромом WPW, когда антеградным
звеном цепи тахикардии служат обычные АВ пути проведения,
а ретроградным звеном — пучок Кента, носит название орто-
дромной.Аналогичная электрофизиологическая ситуация склады¬
вается у больных с явным синдромом WPW при возникно¬
вении желудочковой экстрасистолы, блокирующейся в
обычных путях проведения, и когда ретроградное возбужде¬
ние предсердий начинает осуществляться только по пучку
Кента.В более редких случаях у больных с явным синдромом
WPW может возникать другой вариант реципрокной АВ тахи¬
кардии с участием дополнительного пути проведения, кото¬
рый носит название антидромной. При этом на ЭКГ регистри¬
руется пароксизмальная тахикардия с широким комплексом
QRS. Антеградным звеном такой тахикардии служит пучок
Кента, а ретроградным — обычные АВ пути проведения. Воз¬
никновение антидромного варианта реципрокной АВ тахикар¬
дии у больных с явным синдромом WPW чаще всего связано с
наличием множественных дополнительных АВ соединений
или с тем, что антеградный ЭРП обычных АВ путей проведе¬
ния превышает антеградный ЭРП пучка Кента, или с тем, что
ретроградный ЭРП обычных АВ путей проведения короче рет¬
роградного ЭРП пучка Кента.Таким образом, электрофизиологическим механизмом воз¬
никновения реципрокной АВ пароксизмальной тахикардии с
участием аномального пути проведения у больных с явным
синдромом WPW является reentry в анатомически обусловлен¬
ных структурах преимущественно с Na-каналами (предсердия,
желудочки, пучок Кента) и длинным возбудимым промежут¬
ком.В первой половине 80-х годов в факультетской терапевти¬
ческой клинике ММА имени И.М.Сеченова были проведены
исследования, позволившие сравнить диагностическую цен¬
ность чреспищеводного и внутрисердечного ЭФИ более чем у
50 больных с реципрокными АВ пароксизмальными тахикар¬
диями с участием дополнительных путей проведения на фоне
явного синдрома WPW.122
Основные электрофизиологические характеристики прово¬
дящей системы сердца во время синусового ритма у больных с
явным синдромом WPW, полученные во время чреспищевод¬
ного и внутрисердечного ЭФИ, представлены в табл. 7.4.Таблица 7.4. Основные интервалы проводящей системы сердца
(мс) во время синусового ритма при явном синдроме WPW по результа¬
там чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное
ЭФИ, п=58Чреспищеводное
ЭФИ, п=58PЧСС (в мин)84,6±4,481,2±4,2>0,1Интервал Р—А19,0±1,8 Интервал А—Н104,5±9,2 Интервал Н—V15,6±2,9 Сумма интервалов
(Р—А)+(А—Н)+(Н—V)136,5±7,6 >0,1Интервал А—V 116,5±6,3При регистрации ЧП ЭГ у больных с явным синдромом
WPW на фоне синусового ритма, частота которого во время
ЧП и внутрисердечного ЭФИ достоверно не различалась, зна¬
чение интервала А—V составляло в среднем 116,5±6,6 мс и до¬
стоверно не отличалось как от значения интервала А—Н внут¬
рисердечной электрограммы проводящей системы сердца,
равного в среднем 104,5±9,2 мс (р >0,1), так и от суммы значе¬
ний величин интервалов Р—А, А—Н и Н—V, составлявшей в
среднем 136,5±7,6 мс (р > 0,05).В отличие от больных с реципрокными АВ узловыми па¬
роксизмальными тахикардиями у больных с явным синдромом
WPW и пароксизмальными реципрокными АВ тахикардиями с
участием дополнительных путей проведения идентификация
ретроградного возбуждения предсердий на ЧП ЭГ не пред¬
ставляет сложностей, поскольку A-потенциал ЧП ЭГ распола¬
гается вне возбуждения желудочков (см. рис. 7.14, рис. 7.15).
Это позволяет производить точный расчет интервалов А—V и
V—А на ЧП ЭГ во время пароксизмальной реципрокной АВ
тахикардии с участием дополнительных путей проведения при
явном синдроме WPW.Основные электрофизиологические характеристики прово¬
дящей системы сердца во время пароксизмальной реципрок¬
ной АВ тахикардии с участием дополнительного пути проведе¬
ния у больных с явным синдромом WPW, полученные во
время чреспищеводного и внутрисердечного ЭФИ, представ¬
лены в табл. 7.5.123
n (8-А) MORYMNTOBqTOxe мынноныдо йыдяээдэчп rnjjrr^mnto RBHHBaoqNMMBqioqn .ИФЄ ПН .£ІЛ .on4
MOMoqEHND о йонапод у (8) hnm I a VOS nototdef NNRqBXNXfiT 8A NOHXoqriNuaq NOHMoqaoTqo эынэаоюшнеоа
8A fioaNqx «fiaiaqeeq» эынэаонхынео8 .нынэныдэоо 8A a M3NH3bsaoqn MIdнqRRYXNЦoвфNд n 8 впыт W4W
HNUBqTONisq dTooqoxD .ТП MSNTNaeeq ROTSBjUKoaoqnoo (3) втнэЯ вхнуп ПЧЄ rnh3XNTDor элэоп RNHaRsaoqn.э\мм 00100 Г= cA- oV 0ЄГэА 1ЄПМ<~лr\J
Таблица 7.5. Основные интервалы проводящей системы сердца
(мс) во время ортодромией пароксизмальной реципрокной АВ тахикар¬
дии с участием дополнительного пути проведения при явном синдроме
WPW по результатам чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное ЭФИ
п=58Чреспищеводное ЭФИ
п=58РЧСС (в мин)180,5±6,6187,3±5,5>0,1Интервал А—Н154,5±19,5 >0,1Интервал А—V 163,5±13,3Интервал Н—V36,0±5,8 Интервал Н—А184,5±17,2 >0,1Интервал V—А 155,0±10,9Приступы пароксизмальной реципрокной АВ тахикардии с
участием дополнительных АВ соединений, спровоцированные
у больных с явным синдромом WPW во время ЧП ЭФИ и
внутрисердечного ЭФИ, по частоте сердечных сокращений
достоверно между собой не различались, составляя в среднем
соответственно 187,3±5,5 и 180,5±6,6 уд/мин (р>0,1).При регистрации ЧП ЭГ во время пароксизмальной реци¬
прокной АВ тахикардии с участием дополнительных путей
проведения у больных с явным синдромом WPW интервал А—
V составлял в среднем 163,5±13,3 мс и достоверно не отличал¬
ся от величины интервала А—Н внутрисердечной электро¬
граммы проводящей системы сердца, который был равен в
среднем 154,5±19,5 мс (р>0,1).Значение интервала V—А ЧП ЭГ во время пароксизмаль¬
ной реципрокной АВ тахикардии с участием дополнительных
путей проведения у больных с явным синдромом WPW коле¬
балось от 100 до 230 мс, составляя в среднем 155,0±10,9 мс.
Она не отличалась достоверно от значения интервала Н—А
внутрисердечной электрограммы проводящей системы сердца,
колебавшейся в пределах 100—275 мс и составлявшей в сред¬
нем 184,5±17,2 мс (р>0,1).С учетом ограничений, присущих ЧП ЭФИ, основные ан¬
теградные рефрактерные периоды различных отделов прово¬
дящей системы сердца у больных с пароксизмальными реци¬
прокными АВ тахикардиями с участием дополнительных пу¬
тей проведения у больных при явном синдроме WPW по ре¬
зультатам чреспищеводного и внутрисердечного ЭФИ пред¬
ставлены в табл. 7.6.Сравнительный анализ полученных данных показывает,
что значения антеградных ФРП и ЭРП различных отделов
проводящей системы сердца у больных с явным синдромом
WPW,определенные с помощью ЧП и внутрисердечного ЭФИ,126
Таблица 7.6. Основные антеградные рефрактерные периоды раз¬
личных отделов проводящей системы сердца (мс) у больных с парок¬
сизмальными реципрокными АВ тахикардиями на фоне явного синдро¬
ма WPW по результатам чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное
ЭФИ, п=58Чреспищеводное
ЭФИ. п=58PФРП предсердий272,0±12,8278,0±9,6>0,05ЭРП предсердий226,0±11,1248,0±7,9>0,1ФРП АВ проводящей системы339,0±12,6332,0±12,8>0,1ЭРП АВ проводящей системы235,0±10,9248,0±7,9>0,1ФРП АВ соединения373,0±12,4403,1±7,0>0,05ЭРП АВ соединения235,0±11,9247,5±8,2<0,05ФРП пучка Кента341,0±12,2334,0+12,7>0,1ЭРП пучка Кента298,0±11,4296,0±7,3>0,1достоверно не различаются. Это касается и значения антеград¬
ного ЭРП пучка Кента, что особенно важно для определения
показаний к хирургическому лечению либо деструкции допол¬
нительных АВ соединений у больных с явным синдромом
WPW.На основании анализа литературы и собственных данных,
включающих сравнительный анализ внутрисердечных и чрес¬
пищеводных исследований более чем 50 больных, нами пред¬
ложены следующие основные электрофизиологические крите¬
рии диагностики (ЧП ЭФИ) этой формы наджелудочковой па¬
роксизмальной тахикардии.1. Наличие электрофизиологических признаков существо¬
вания и функционирования дополнительных АВ соединений
(пучков Кента) в антеградном направлении при проведении
нагрузочных электростимуляционных тестов из предсердий
(см. рис. 7.14, рис. 7.15).2. Возможность провоцирования приступа наджелудочко¬
вой пароксизмальной тахикардии с помощью программиро¬
ванной стимуляции предсердий одиночными или парными
экстрастимулами (см. рис. 7.14, 7.15).3. Возникновение приступа ортодромной реципрокной АВ
тахикардии с участием дополнительного пути проведения при
программированной стимуляции предсердий у больных с
явным синдромом WPW требует критического замедления
проведения в АВ соединении с одновременным развитием ан-
теградной блокады проведения возбуждения по пучку Кента,
что сопровождается исчезновением электрофизиологических
признаков синдрома WPW и возникновением «разрыва» кри¬
вой АВ проведения (см. рис. 7.14, 7.15).127
4. Во время пароксизмальной реципрокной АВ тахикардии
с участием дополнительного пути проведения ретроградное
возбуждение предсердий на ЧП ЭГ регистрируется после воз¬
буждения желудочков с интервалом V—А, равным 100 мс и
более (см. рис. 7.14, 7.15).Предлагаемые нами электрофизиологические критерии
диагностики пароксизмальной реципрокной АВ тахикардии с
участием дополнительного пути проведения у больных с
явным синдромом WPW, используемые во время чреспище¬
водного ЭФИ, очень близки к критериям, применяемым во
время внутрисердечного ЭФИ. В то же время имеются и неко¬
торые различия, связанные в первую очередь с техническими
возможностями обоих методов.Сравнительная оценка электрофизиологических критериев
диагностики пароксизмальной реципрокной АВ тахикардии с
участием дополнительного пути проведения у больных с
явным синдромом WPW с помощью внутрисердечного и чрес¬
пищеводного ЭФИ представлена ниже.Электрофизиологические критерии диагностики пароксизмальной ре¬
ципрокной АВ тахикардии с участием дополнительного пути проведе¬
ния у больных с явным синдромом WPWВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИНаличие электрофизиологических
признаков существования и функ¬
ционирования дополнительных АВ
соединений (пучков Кента) как в
антеградном, так и в ретроградном
направлениях при проведении на¬
грузочных электростимуляционных
тестов из предсердий и желудочковВозможность провоцирования и
купирования приступа наджелу¬
дочковой тахикардии с помощью
программированной стимуляции
предсердий и/или желудочков оди¬
ночным либо парным экстрастиму¬
ломИндукция приступа наджелудочко¬
вой тахикардии (ортодромный ва¬
риант) при проведении программи¬
рованной стимуляции предсердий у
больных с явным синдромом WPW
требует критического замедления
проведения по АВ соединению и
одновременного развития анте-Наличие электрофизиоло¬
гических признаков функ¬
ционирования дополни¬
тельных АВ соединений
(пучков Кента) в антеград¬
ном направлении при про¬
ведении нагрузочных элек¬
тростимуляционных тестов
из предсердийВозможность провоциро¬
вания приступа наджелу¬
дочковой тахикардии с по¬
мощью программирован¬
ной стимуляции предсер¬
дий одиночным либо пар¬
ным экстрастимуломКритерий тот же128
ВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИградной блокады проведения воз¬
буждения по пучку Кента. Это со¬
провождается исчезновением
электрофизиологических призна¬
ков синдрома WPW и возникнове¬
нием «разрыва» кривой антеград¬
ного АВ проведенияВо время приступа наджелудочко¬
вой пароксизмальной тахикардии
ретроградное возбуждение предсер¬
дий регистрируется после желудоч¬
кового комплекса с интервалом
Н—А, равным или превышающим
100 мсНевозможность существования
наджелудочковой пароксизмальной
тахикардии при наличии АВ блока¬
ды 2:1Замедление частоты пароксизмаль¬
ной тахикардии при возникнове¬
нии блокады ножки пучка ГисаАсимметричная ретроградная по¬
следовательность возбуждения
предсердий снизу вверх во время
наджелудочковой пароксизмальной
тахикардии, а также при проведе¬
нии программированной и уча¬
щающей стимуляции желудочков
(за исключением больных с сеп-
тальной локализацией пучка Кен¬
та) в зависимости от места распо¬
ложения дополнительного АВ со¬
единенияВозможность ретроградного воз¬
буждения предсердий во время па¬
роксизмальной тахикардии желу¬
дочковым экстрастимулом, нане¬
сенным в период рефрактерности
пучка ГисаОтсутствие декрементного характе¬
ра ретроградного ВА проведения,
что проявляется стабильной вели¬
чиной интервала V2—Аг при прове¬
дении программированной и уча¬
щающей стимуляции желудочковВо время приступа нзДЖе"лудочковой пароксизмаль-ной тахикардии ретроград¬
ное возбуждение преДсеР"
дий регистрируется после
возбуждения желудочков с
интервалом V—А, равным
или превышающим 100 мсКритерий тот же
Критерий тот жеОценить С ПОМОЩЬЮ ЧПЭФИ технически нев°3-
можно%Оценить С ПОМОЩЬЮ ЧП
ЭФИ технически невоз¬
можноОценить С ПОМОЩЬЮ ЧП
ЭФИ технически нев°3-
можно9—1279129
В процессе внутрисердечных электрофизиологических ис¬
следований нами выявлено, что более чем 40 % больных с
явным синдромом WPW имеют множественные аномалии
проводящей системы сердца. Наиболее часто среди них встре¬
чаются сочетания манифестирующих пучков Кента с поли-
фасцикулярным строением АВ соединения [12]. Осознание
возможности существования множественных аномалий прово¬
дящей системы сердца у больных с наджелудочковыми парок¬
сизмальными тахикардиями, в том числе на фоне явного син¬
дрома WPW, может иметь важное значение при выполнении
их радиочастотной абляции или хирургического устранения.К сожалению, ЧП ЭФИ, выполненное у этих же больных,
позволило выявить существование множественных аномалий
проводящей системы сердца только у 1 пациента (см. рис. 7.15).Таким образом, ЧП ЭФИ у больных с пароксизмальными
реципрокными АВ тахикардиями при дополнительных путях
проведения на фоне явного синдрома WPW близко по инфор¬
мативности к внутрисердечному ЭФИ.Недостатками ЧП ЭФИ у больных с пароксизмальными
реципрокными АВ тахикардиями с участием дополнительных
путей проведения на фоне явного синдрома WPW являются
невозможность оценки характера ретроградного ВА проведе¬
ния, значений ретроградных рефрактерных периодов различ¬
ных отделов проводящей системы сердца, точной топической
диагностики дополнительных АВ соединений, а также невоз¬
можность выявления существования множественных анома¬
лий проводящей системы сердца.7.2 7.2. ЧП ЭФИ в диагностике атриовентрикулярной
реципрокной пароксизмальной тахикардии у больных
со скрытым синдромом WPWСуществование дополнительных АВ путей проведения воз¬
можно без каких-либо проявлений синдрома WPW на ЭКГ и
на внутрисердечной электрограмме проводящей системы
сердца (скрытый синдром WPW).При скрытом синдроме WPW дополнительные АВ соеди¬
нения функционируют только в ретроградном направлении
[9,24, 38]. Предполагают, что в процессе онтогенеза либо ран¬
него постнатального периода дополнительные АВ соединения
теряют способность проводить возбуждение в антеградном на¬
правлении, сохраняя способность проводить его ретроградно
[50]. Частота скрытого синдрома WPW у больных с наджелу¬
дочковыми реципрокными пароксизмальными тахикардиями
достигает 20—30 % [43, 50].При программированной стимуляции предсердий у боль¬
ных со скрытым синдромом WPW (в отличие от больных с130
явным синдромом WPW и реципрокными АВ узловыми па¬
роксизмальными тахикардиями) кривая антеградного АВ про¬
ведения сходна с таковой у здоровых людей. С укорочением
интервала сцепления тестирующего предсердного экстрасти¬
мула наблюдается постепенное удлинение времени проведе¬
ния возбуждения по АВ соединению до достижения его эф¬
фективного рефрактерного периода. В процессе чреспищевод¬
ного и внутрисердечного ЭФИ это проявляется прогрессирую¬
щим возрастанием интервала А—V (для чреспищеводного
ЭФИ), а также интервалов А—Н и Н—V (для внутрисердечно¬
го ЭФИ). Однако при достижении критического замедления
проведения в АВ соединении без возникновения «разрыва»
кривой АВ проведения развивается приступ реципрокной АВ
пароксизмальной тахикардии (рис. 7.16).Нами были проведены исследования, позволившие срав¬
нить диагностическую ценность чреспищеводного и внутри¬
сердечного ЭФИ более чем у 70 больных с реципрокными АВ
пароксизмальными тахикардиями с участием дополнительных
путей проведения на фоне скрытого синдрома WPW.Основные электрофизиологические характеристики прово¬
дящей системы сердца во время синусового ритма у больных
при скрытом WPW, полученные во время чреспищеводного и
внутрисердечного ЭФИ, представлены в табл. 7.7.Таблица 7.7. Основные интервалы проводящей системы сердца
(мс) во время синусового ритма у больных со скрытым синдромом WPW
по результатам чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное
ЭФИ, п=76Чреспищеводное
ЭФИ, п=76РЧСС (в мин)75,3±5,181,6±4,3>0,1Интервал Р—А17,3±1,9 Интервал А—Н85,3±3,7 Интервал Н—V38,6+2,1 Сумма интервалов
(Р—А)+(А—Н)+(Н—V)141,8±4,0 >0,1Интервал А—V 158,0±4,9При регистрации ЧП ЭГ у больных со скрытым синдромом
WPW во время синусового ритма, частота которого во время
ЧП и ВС ЭФИ достоверно не различалась, значение интервала
А—V составляло в среднем 158,0±4,9 мс и достоверно превы¬
шало значение интервала А—Н, равное в среднем 85,3±3,7 мс
(р<0,001). В то же время сумма интервалов (Р—А)+(А—
Н)+(Н—V) внутрисердечной электрограммы проводящей сис-9*131
Рис. 7.16. ЧП ЭФИ (А и Б) и внутрисердечное ЭФИ (В и Г). Возник¬
новение реципрокной АВ тахикардии частотой 150 в 1 мин (Б и Г) во
время программированной стимуляции предсердий одиночным
экстрастимулом у одного и того же больного со скрытым синдромом
WPW. Скорость регистрации 100 мм/с. HRA — ЭГ высоких отделов
правого предсердия; НВЕ — ЭГ пучка Гиса; CS — ЭГ коронарного
синуса сердца.темы сердца (в среднем 141,8±4,0 мс) достоверно не отлича¬
лась от значения интервала А—V чреспищеводной электро¬
граммы (р>0,1)-Так же как и у больных с явным синдромом WPW, у боль¬
ных со скрытым синдромом WPW и пароксизмальными реци-132
прокными АВ с участием дополнительных путей проведения
идентификация ретроградного возбуждения предсердий на ЧП
ЭГ во время тахикардии не представляет сложностей, по¬
скольку A-потенциал ЧП ЭГ располагается вне возбуждения
желудочков (см. рис. 7.16, рис. 7.17). Это позволяет произво¬
дить точный расчет интервалов А—V и V—А на ЧП ЭГ во
время пароксизмальной реципрокной АВ тахикардии с учас¬
тием дополнительных путей проведения у больных со скры¬
тым синдромом WPW.Основные электрофизиологические характеристики прово¬
дящей системы сердца во время пароксизмальной реципрок¬
ной АВ тахикардии с участием дополнительного пути проведе¬
ния у больных со скрытым синдромом WPW, полученные во
время чреспищеводного и внутрисердечного ЭФИ, представ¬
лены в табл. 7.8.Таблица 7.8. Основные интервалы проводящей системы сердца
(мс) во время пароксизмальной реципрокной АВ тахикардии с участием
дополнительного пути проведения у больных со скрытым синдромом
WPW по результатам чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное ЭФИ,
п=76Чреспищеводное ЭФИ,
п=76PЧСС (в мин)177,3±8,2163,7±5,9>0,1Интервал А—Н170,9±17,7 >0,05Интервал А—V 220,0±15,2Интервал Н—V41,8±1,8 Интервал Н—А176,54±9,8 >0,05Интервал V—А 150,0±6,7Приступы пароксизмальной реципрокной АВ тахикардии с
участием дополнительных АВ соединений, спровоцированные
у больных со скрытым синдромом WPW во время ЧП ЭФИ и
внутрисердечного ЭФИ, по частоте сердечных сокращений
достоверно между собой не различались, составляя в среднем
соответственно 163,7±5,9 и 177,3±8,2 уд/мин (р>0,1).При регистрации ЧП ЭГ во время пароксизмальной реци¬
прокной АВ тахикардии с участием дополнительных путей
проведения у больных со скрытым синдромом WPW интервал
А—V составлял в среднем 220,0±15,2 мс и достоверно не отли¬
чался как от интервала А—Н внутрисердечной электрограммы
проводящей системы сердца, который был равен в среднем
170,9±17,7 мс (р>0,05), так и от суммы интервалов А—Н и Н—
V, составлявшей в среднем 212,7±17,3 мс (р>0,1).133
чпэгРис. 7.17. ЧП ЭФИ. Программированная стимуляция предсердий одиночным экстрастимулом (А—Г) и
возникновение двух вариантов реципрокной АВ тахикардии частотой 171 в 1 мин (Б) и частотой 158 в 1 мин
— (В и Г) у больного со скрытым синдромом WPW и бифасцикулярным проведением в АВ соединении.
& Скорость регистрации 100 мм/с.
Значение интервала V—А чреспищеводной электрограммы
во время пароксизмальной реципрокной АВ тахикардии с
участием дополнительных путей проведения у больных со
скрытым синдромом WPW колебалось от 100 до 230 мс, со¬
ставляя в среднем 150,0±6,7 мс. Оно не отличалось достоверно
от значения интервала Н—А внутрисердечной электрограммы
проводящей системы сердца, колебавшегося в пределах 110—
220 мс, составляя в среднем 176,4±9,8 мс (р>0,05).Основные антеградные рефрактерные периоды различных
отделов проводящей системы сердца у больных с пароксиз¬
мальными реципрокными АВ тахикардиями с участием допол¬
нительных путей проведения у больных со скрытым синдро¬
мом WPW по результатам чреспищеводного и внутрисердечно¬
го ЭФИ представлены в табл. 7.9.Таблица 7.9. Основные антеградные рефрактерные периоды раз¬
личных отделов проводящей системы сердца (мс) у больных с парок¬
сизмальными реципрокными АВ тахикардиями на фоне скрытого син¬
дрома WPW по результатам чреспищеводного и внутрисердечного ЭФИПоказательВнутрисердечное
ЭФИ, п=76Чреспищеводное
ЭФИ, п=76РФРП предсердийЭРП предсердийФРП АВ проводящей системыЭРП АВ проводящей системыФРП АВ соединенияЭРП АВ соединения274,5±12,3240,0±12,3398,2±16,1260,0±15,4394,5±16,0260,0±15,4289,5±8,9262,3±7,9388,9±9,1262,3±7,9388,9±9,1262,3±7,9>0,1>0,1>0,1>0,1>0,1Сравнительный анализ полученных данных показывает,
что значения антеградных ФРП и ЭРП различных отделов
проводящей системы сердца у больных со скрытым синдро¬
мом WPW, определенным с помощью ЧП и внутрисердечного
ЭФИ, достоверно не различаются.На основании анализа литературы и собственных исследо¬
ваний, включивших в себя сравнительный анализ внутрисер-
дечных и чреспищеводных исследований более чем у 70 боль¬
ных, нами предложены следующие основные электрофизиоло¬
гические критерии диагностики этой формы наджелудочковой
пароксизмальной тахикардии с помощью ЧП ЭФИ:1. Отсутствие электрофизиологических признаков сущест¬
вования и функционирования дополнительных АВ соеди¬
нений (пучков Кента) в антеградном направлении при прове¬
дении нагрузочных электростимуляционных тестов из пред¬
сердий.136
2. Возможность провоцирования приступа наджелудочко¬
вой пароксизмальной тахикардии с помощью программиро¬
ванной стимуляции предсердий одиночными или парными
экстрастимулами (см. рис. 7.16, 7.17).3. Возникновение приступа наджелудочковой пароксиз¬
мальной тахикардии требует критического замедления време¬
ни проведения возбуждения по АВ соединению без возникно¬
вения «разрыва» кривой антеградного АВ проведения (см. рис.
7.16, 7.17).4. Во время приступа пароксизмальной наджелудочковой
тахикардии ретроградное возбуждение предсердий на ЧП ЭГ
регистрируется после желудочкового комплекса с интервалом
V—А, равным или превышающим 100 мс (см. рис. 7.16, 7.17).Предлагаемые нами электрофизиологические критерии диа¬
гностики пароксизмальной реципрокной АВ тахикардии с учас¬
тием дополнительного пути проведения у больных со скрытым
синдромом WPW, используемые во время чреспищеводного
ЭФИ, очень близки к критериям, применяемым во время внут¬
рисердечного ЭФИ. В то же время имеются и некоторые разли¬
чия, связанные в первую очередь с различиями в технических
возможностях обоих методов. Сравнительная оценка электро¬
физиологических критериев диагностики пароксизмальной ре¬
ципрокной АВ тахикардии с участием дополнительного пути
проведения у больных со скрытым синдромом WPW с помощью
внутрисердечного и чреспищеводного ЭФИ представлена ниже.Электрофизиологические критерии диагностики пароксизмальной ре¬
ципрокной АВ тахикардии с участием дополнительного пути проведе¬
ния у больных со скрытым синдромом WPWВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИОтсутствие электрофизиологичес¬
ких признаков существования и
функционирования дополнитель¬
ных АВ соединений (пучков Кента)
в антеградном направлении, но
присутствие их в ретроградном на¬
правлении при проведении нагру¬
зочных электростимуляционных
тестов из предсердий и из желудоч¬
ковОтсутствие электрофизио¬
логических признаков
функционирования допол¬
нительных АВ соединений
(пучков Кента) в антеград¬
ном направлении при про¬
ведении нагрузочных элек¬
тростимуляционных тестов
из предсердийВозможность провоцирования и
купирования приступа наджелу¬
дочковой пароксизмальной тахи¬
кардии с помощью программиро¬
ванной стимуляции предсердий
и/или желудочков одиночным либо
парным экстрастимуломВозможность провоциро¬
вания приступа наджелу¬
дочковой пароксизмальной
тахикардии с помощью
программированной сти¬
муляции предсердий оди¬
ночным либо парным
экстрастимулом137
ВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИОтсутствие электрофизиологичес¬
ких признаков существования и
функционирования дополнитель¬
ных АВ соединений (пучков Кента)
в антеградном направлении, но
присутствие их в ретроградном на¬
правлении при проведении нагру¬
зочных электростимуляционных
тестов из предсердий и из желудоч¬
ковОтсутствие электрофизио¬
логических признаков
функционирования допол¬
нительных АВ соединений
(пучков Кента) в антеград¬
ном направлении при про¬
ведении нагрузочных элек¬
тростимуляционных тестов
из предсердийИндукция приступа наджелудочко¬
вой тахикардии при проведении
программированной стимуляции
предсердий требует критического
замедления проведения по АВ со¬
единению без возникновения «раз¬
рыва» кривой антеградного АВ
проведенияКритерий тот жеВо время приступа наджелудочко¬
вой тахикардии ретроградное воз¬
буждение предсердий регистриру¬
ется после желудочкового ком¬
плекса с интервалом Н—А, равным
или превышающим 100 мсВо время приступа надже¬
лудочковой тахикардии
ретроградное возбуждение
предсердий регистрируется
после возбуждения желу¬
дочков с интервалом V—А,
равным или превышаю¬
щим 100 мсНевозможность существования
наджелудочковой пароксизмальной
тахикардии при наличии АВ бло¬
кады 2:1Критерий тот жеЗамедление частоты пароксизмаль¬
ной тахикардии при возникнове¬
нии блокады ножки пучка ГисаКритерий тот жеАсимметричная ретроградная по¬
следовательность возбуждения
предсердий снизу вверх во время
наджелудочковой пароксизмальной
тахикардии, а также при проведе¬
нии программированной и уча¬
щающей стимуляции желудочков
(за исключением больных с сеп-
тальной локализацией пучка Кен¬
та) в зависимости от места распо¬
ложения дополнительного АВ со¬
единенияОценить с помощью ЧП
ЭФИ технически невоз¬
можноВозможность ретроградного воз¬
буждения предсердий во время па¬
роксизмальной тахикардии желу¬
дочковым экстрастимулом, нане¬
сенным в период рефрактерности
пучка ГисаОценить с помощью ЧП
ЭФИ технически невоз¬
можно138
ВНУТРИСЕРДЕЧНОЕ ЭФИЧРЕСПИЩЕВОДНОЕ ЭФИОтсутствие электрофизиологичес¬
ких признаков существования и
функционирования дополнитель¬
ных АВ соединений (пучков Кента)
в антеградном направлении, но
присутствие их в ретроградном на¬
правлении при проведении нагру¬
зочных электростимуляционных
тестов из предсердий и из желудоч¬
ковОтсутствие электрофизио¬
логических признаков
функционирования допол¬
нительных АВ соединений
(пучков Кента) в антеград¬
ном направлении при про¬
ведении нагрузочных элек¬
тростимуляционных тестов
из предсердийОтсутствие декрементного характе¬
ра ретроградного ВА проведения,
что проявляется стабильной вели¬
чиной интервала V2—Аг при прове¬
дении программированной и уча¬
щающей стимуляции желудочковОценить с помощью ЧП
ЭФИ технически невоз¬
можноДетальный анализ результатов внутрисердечных электро¬
физиологических исследований, выполненных в факультет¬
ской терапевтической клинике ММА имени И.М.Сеченова
более чем у 70 больных с пароксизмальными реципрокными
АВ тахикардиями с участием дополнительных путей проведе¬
ния на фоне скрытого синдрома WPW, показал, что у 40 % из
них имеются множественные аномалии проводящей системы
сердца в виде сочетания дополнительных АВ соединений и
полифасцикулярного строения АВ соединения [12]. ЧП ЭФИ,
выполнненое у этих пациентов, подтвердило, что около 40 %
больных со скрытым синдромом WPW имеют множественные
аномалии проводящей системы сердца. Наиболее часто из них
встречается сочетание скрытого пучка Кента с полифасцику-
лярным строением АВ соединения (см. рис. 7.17).Таким образом, ЧП ЭФИ у больных с указанной патоло¬
гией очень близко по информативности к внутрисердечному
ЭФИ.Недостатки ЧП ЭФИ, проводимых у больных на фоне
скрытого синдрома WPW, аналогичны таковым при явном
синдроме WPW.Список литературы1. Бредикис Ю.Ю., Римша Э.Д., Дрогайцев А.Д. и др. Чреспище¬
водная предсердная электростимуляция при исследовании функции
синусового узла//Кардиология. — 1981. — № 12. — С. 12—П.2. Бредикис Ю.Ю., Римша Э.Д., Киркутис А.А. Неинвазивный
способ определения опасной для жизни формы синдрома Вольфа —139
Паркинсона — Уайта (WPW) и обоснование метода хирургического
лечения//Тер. арх. — 1982. — № 12. — С. 59—64.3. Гросу А.А. Клиническое значение электрической стимуляции
сердца в подборе и оценке эффективности антиаритмической тера¬
пии у больных с пароксизмами наджелудочковой тахикардии: Авто¬
реф. дис. ... канд. мед. наук. — М., 1984. — 21 с.4. Жданов А.М. Лечение суправентрикулярных тахикардий ме¬
тодом электрической стимуляции сердца: Автореф. дис. ... канд. мед.
наук. — М., 1985. — 20 с.5. Киркутис А.А. Топическая диагностика дополнительных
атриовентрикулярных проводящих соединений сердца: Автореф. дис.
... канд. мед. наук. — Каунас, 1983. — 20 с.6. Кузьменков Д.В. Электрофизиологические механизмы надже¬
лудочковых пароксизмальных тахикардий у больных с дополнитель¬
ными путями проведения и дискретным проведением в атриовентри¬
кулярном соединении: Автореф. дис. ... канд. мед. наук. — М.,
1994. - 18 с.7. Лукошевичуте А. И., Гедремене Д.А. Случай успешного много¬
кратного применения частой стимуляции левого предсердия через
пищевод для прекращения суправентрикулярной пароксизмальной
тахикардии//Кардиология. — 1982. — № 9. — С. 109—111.8. Сметнев А.С., Гросу А.А., Соколов С.Ф. и др. Чреспищеводная
электрическая стимуляция сердца в диагностике пароксизмальных
наджелудочковых тахикардий//Кардиология. — 1983. — № 11. —
С. 13-18.9. Сулимое В.А., Богатырев И.В., Павлов В.В. и др. Скрытый
синдром Вольфа—Паркинсона—Уайта как электрофизиологическая
и морфологическая основа наджелудочковых тахикардий//Кардиоло-
гия. — 1986. — № 4. — С. 26—34.10. Сулимое В.А., Богатырев И.В., Преображенский В.Ю. и др.
Концепция полифасцикулярного строения атриовентрикулярного
соединения у больных с реципрокными пароксизмальными узловы¬
ми тахикардиями//Кардиология. — 1986. — № 6. — С. 22—28.11. Сулимое В.А. Скрытый синдром Клерка — Леви — Кристеско
как электрофизиологическая основа пароксизмальных реципрокных
атриовентрикулярных узловых тахикардий//Кардиология. — 1988. —
№ 10. - С. 60-68.12. Сулимое В.А. Пароксизмальные тахикардии (клиническая
электрофизиология, системная гемодинамика, субстратный энерге¬
тический метаболизм миокарда): Автореф. дис. ... д-ра мед. наук. —
Москва, 1990. — 20 с.13. Allissie М.А., Bonk F.I.M. Reentry within the sinoatrial node as
demonstrated by multiple microelectrode recordings in the isolated rabbit
heart. — In: Bonk F.I.M. (ed). The Sinus Node: Structure, Function and
Clinical Relevance. — The Hague: Nijhoff, 1978. — P. 409.14. Anderson R.H., Becker A.E. Gross morfology and microscopy of
the conduction system. — In: Cardiac Arrhythmias. Their mechanisms, di¬
agnosis and management/Ed. W.J.Mandel. Philadelphia and Toronto:
J.B. Lippincott Company, 1980. — P. 12—54.15. Bharaty S. Congenital abnormalities of the conduction system in
two patients with recurrent tachyarrhythmias//Circulation. — 1979. — Vol.
59. - P. 593-606.140
16. Bisset J.K., de Soyza N., Kane J.J. et al. Atrioventricular conduc¬
tion patterns in patients with paroxysmal supraventricular tachycardias//
Amer. Herat J. - 1976. - Vol. 91. - P. 287-291.17. Burack B., Furman S. Transesophageal cardiac paciing//Amer. J.
Cardiol. - 1969. - Vol. 23. - P. 469-472.18. Dangman K.H., Hoffman B.F. In vivo and in vitro antiarrhythmic
arrhythmigenic effects of N-acetyl procainamide//J. Pharmacol, exp.
Ther. - 1981. - Vol. 217. - P. 851-862.19. Davidenko J.M., Cohen L., Goodrow R., Antzelevich C. Quinidine-
induced action potential prolongation, early afterdepolarizationa, and
triggered activity in canine Purkinje fibers. Effects of stimulation rate,
potassium, and magnesium//Circulation. — 1989. — N 79. — P. 674—
686.20. Denes P., Wu D., Dhingra R.C. et al. Demonstration of dual AB
nodal pathways in patients with paroxysmal supraventricular tachycardia//
Circulation. — 1973. — Vol. 48. — P. 549—555.21. Denes P., Wyndham C.R.C., Wu D. et al. «Supernormal conduc¬
tion» of the premature impuls utilizing the fast pathway in a patient with
dual atrioventricular nodal pathways//Circulation. — 1975. — Vol. 51. —
P. 811-814.22. Dillon S., Allessie M.A., Ursell P.C., Wit A.L. Influence of anisot¬
ropic tissue structure on rentrant circuits in the subepicardial border zone
of subacute canine infarcts//Circulat. Res. — 1988. — Vol. 63. — P. 182—
206.23. Dittrich P., Lauten A. Transesophageale Elektrostimulation des
Herzens//Dtsch. Ges. Wesen. — 1972. — Vol. 27. — P. 2018—2020.24. Farshidi A., Josephson M.E., Horowitz L.N. Electrophysiologic
characteristics of concealed bypass tracts. Clinical and electrocardiographic
correlates//Amer. J. Cardiol. — 1978. — Vol. 41. — P. 1052—1059.25. Frame L.H., Page R.L., Boyden P.A., Fenoglio J.J.Jr., Hoffman B.F.
Circus movement in the canine atrium around the tricuspid ring during ex¬
perimental atrial flutter and during reentry in vivo//Circulation.— 1987.—
Vol. 76. - P. 1155-1175.26. Gallagher J.J., Pritchett E.L.C., Sealy W.C., Kassel J., Wallace
A.G. The preexcitation syndromes//Progr. cardiovasc. Dis. — 1978. — Vol.
64. - P. 176-189.27. Gallagher J.J., Smith W.M., Kerr M. et al. Esophageal pacing: a di¬
agnostic and therapeutic toul//Circulation. — 1982. — Vol. 65. — P. 336—
341.28. Hartley J.M. Transesophageal cardiac pacing//Anaesthesia. —
1982. - Vol. 37. - P. 192-194.29. Hiromasa S., Coto H., Li Z.Y., Maldonado C., Kupersmith J. Dex-
trorotary isomer of sotalol: Electrophysiologic effects and interaction with
verapamil//Amer. Heart J. — 1988. — Vol. 116. — P. 1552—1557.30. Hoffman B.F., Dangman K.H. Are arrhythmias caused by automat¬
ic impulse generation? — In: Paes de Carvalho A., Hoffman B.F., Lieber-
man M. (eds) Nornal and Abnormal Conduction in the Heart. — Mount
Kisco, NY: Futura Publishing Co, 1982. — P. 429—448.31. Johnson N.J., Rosen V.R. The distinction between triggered activity
and other cardiac arrhythmias. — In: Brugada P., Wellens H.J.J. (eds) Car¬
diac Arrhythmias: Where to Go from Here. — Mount Kisco, NY: Futura
Publishing Co, 1987. - P. 129-145.141
32. Josephson M.E., Kastor J.A. Paroxysmal supraventricular tachy¬
cardia. Is the atrium a necessary link?//Circulation. — 1976. — Vol. 54. —
P. 430-435.33. Kent A.P.S. The right lateral auroculo — ventricular junction of
the heart//J. Physiol. - 1914. - Vol. 48. - P. 23-27.34. Lazzara R., Marchi S. Electrophysiologic mechanisms for the gen¬
eration of arrhythmias with adrenergic stimulation. — In: Brachmann J.,
Schomig A. (eds) Adrenergic System and Ventricular Arrhythmias in Myo¬
cardial Infarction. — Berlin: Springer — Verlag, 1989. — P. 231—238.35. Lyons C.J., Burgess M.J. Demonstration of reentry within the ca¬
nine specialized conduction system//Amer. Heart J. — 1979. — Vol. 98. —
P. 595-603.36. Мое G.K. On the multiple wavelet hypothesis of atrial fibrillation//
Arch. Intern. Pharm. Ther. — 1962. — Vol. 140. — P. 183—188.37. Montoyo J., Angel J., Valle V et al. Cardioversion of tachycardias
by transesophageal atrial pacing//Amer. J. Cardiol. — 1973. — Vol. 32. —
P. 85-90.38. Narula O.S. Retrograde preexitation. Comparison of antegrade
and retrograde conduction intervals in man//Circulation. — 1974. — Vol.50. - P. 1129-1141.39. Narula O.S. Electrophysiologic evaluation of accessory conduction
pathways. — In: His bundle Electrocardiography and Clinical Electro¬
physiology/Ed. O.S.Narula. — Philadelphia: Davis Compahy, 1975. —
P. 313-342.40. Ohnell R.F. Pre-exitation: a cardiac abnormality//Acta med.
scand. - 1944. - Vol. 152. - P. 38-49.41. Rosen M.R., Gelband H., Merker C., Hoffman B.F. Mechanisms of
digitalis toxicity. Effects of ouabain on phase four of canine Purkinje fiber
transmembrane potentials//Circulation. — 1973. — Vol. 47. — P. 681 —
689.42. Rosen M.R., Reder R.F. Does triggered activity have a role in the
genesis of cardiac arrhythmias?//Ann. intern. Med. — 1981. — Vol. 94. —
P. 794-801.43. Rowland E., Curry P. V.L., Callowhill E. et al. Recognition and im¬
plications of concealed pre-excitation//Brit. Heart J.— 1977,— Vol. 39.—
P. 932-933.44. Scheinman M.M., Basu D., Hollenberg M. Electrophysiologic stud¬
ies in patients with persistent atrial tachycardia//Circulation. — 1974. —
Vol. 50. - P. 266.45. Shafiroff B.G.P., Linder J.Effects of external electrical pacemaker
stimuli on the human heart//J. thorac. Surg. — 1957. — Vol. 33. —
P. 544-550.46. Shetf L., Neufeld H.N. The Pre-excitation Syndrome: Facts and
Theories. — New York: York Medical Books, 1978. — P. 141 — 161.47. Sterz H., Pager H., Koller H. Transesophageale rasche stimulation
des linken Vorhofes zur Elektrotherapie ektoper, tachykarder verhofrhyth-
musstorungen//Z. Kardiol. — 1978. — Vol. 67. — P. 136—138.48. Strodter D., Schwarz P■ Transesophageale Elektrostimulation zyr
Initierung und Terminierung von tachykarden Rhythmusstorungen//Herz.
Kreesh. - 1980. - Vol. 12. - P. 163-169.49. Sung R.J., Castellanos A., Mallon S.M. et al. Mode of initiation of
reciprocating tachycardia during programmed ventricular stimulation in142
the Wolff — Parkinson — White syndrome, with reference to variuos pat¬
terns of ventricular-atrial conduction//Amer. J. Cardiol. — 1977. — Vol.40. - P. 24-35.50. Sung R.J., Gelband H., Castellanos A. et al. Clinical and electro¬
physiologic observations in patients with concealed accessory atrioven¬
tricular bypass tracts//Amer. J. Cardiol. — 1977. — Vol. 40. — P. 839—
853.51. Wells J.L., Maclean W.A.H., James T.N., Waldo A.L. Charac¬
terization of atrial flurre. Studies in man after open heart surgery using
fixed atrial electrodes//Circulation. — 1979. — Vol. 60. — P. 665—673.52. Wu D., Denes P., Wyndham C.R.C. et al. Demonstration of dual
atrioventricular nodal pathways utilizing a ventricular extrastimulus in pa¬
tients with atrioventricular nodal reentrant paroxysmal supraventricular
tachycardia//Circulation. — 1975. — Vol. 52. — P. 789—798.53. Wu D., Denes P., Amat-y-Leon F. et al. An unusual variety of
atrioventricular nodal reentry due to retrograde dual atrioventricular nodal
pathways//Circulation. — 1977. — Vol. 56. — P. 50—59.54. Vassale M. The relationship among cardiac pacemakers. Overdrive
suppression//Circulat. Res. — 1977. — Vol. 41. — P. 269—277.55. Volkmann N., Paliege R., Sonnen-Schein R. Horshfrequente atrial
Stimulation uber eine Osophaguselektrode sur Elektrotherapie tachykarder
Vorhofarrhythmien//Dtsch. Gesundh.-Wes. — 1978. — Vol. 33. —
P. 1559-1564.56. Zoll P. Resuscitation of the heart in ventricular standstill by exter¬
nal electrical stimulation//New Engl. J. Med. — 1952. — Vol. 247. —
P. 768-772.
Глава 8ЧПЭС СЕРДЦА КАК МЕТОД
ПОДБОРА МЕДИКАМЕНТОЗНОЙ
АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
С ЦЕЛЬЮ ПРОФИЛАКТИКИ РЕЦИДИВОВ
НАРУШЕНИЙ РИТМА У БОЛЬНЫХ
С ПАРОКСИЗМАЛЬНЫМИ
НАДЖЕЛУДОЧКОВЫМИ ТАХИКАРДИЯМИ8.1. Патофизиологический подход
к медикаментозной антиаритмической
терапии у больных с наджелудочковыми
пароксизмальными тахикардиями с позиций
«Сицилианского гамбита»«Сицилианский гамбит» предусматривает патофизиологи¬
ческий подход как к вопросам диагностики, так и к медика¬
ментозной терапии нарушений ритма сердца [22].Согласно современным представлениям, основанным на
концепции «Сицилианского гамбита», процесс подбора меди¬
каментозной антиаритмической терапии включает в себя сле¬
дующие основные этапы (рис. 8.1).1. Установление электрофизиологического механизма на¬
рушения ритма сердца.2. Выявление критических компонентов аритмии. Под
критическими компонентами понимают совокупность всех
функциональных (электрофизиологических) и морфологичес¬
ких (анатомических) условий, необходимых для возникнове¬
ния или поддержания нарушения ритма сердца.3. Установление уязвимого параметра аритмии. При каж¬
дом аритмогенном механизме существует один или несколько
электрофизиологических параметров, изменения которых до¬
статочны для купирования или предотвращения аритмии. Уяз¬
вимый параметр — это легче всего модифицируемый с наи¬
меньшими побочными эффектами по сравнению с другими
электрофизиологический параметр аритмии.4. Определение молекулярных клеточных мишеней воздей¬
ствия на уровне клеточной мембраны. Под молекулярными
клеточными мишенями воздействия понимаются трансмем¬
бранные каналы и трансмембранные ионные токи, рецепторы
и ионные насосы.В последнее десятилетие были идентифицированы много¬
численные молекулярные структуры клеточных мембран,
обеспечивающие сложные процессы взаимодействия транс-144
ПатофизиологическийЭмпирическийЭлектрофизиологоческий
диагноз аритмии* Известные или предполагаемые
механизмы*4Критические компоненты
♦Уязвимые параметрыиМолекулярные мишени воздействияЭлектрокардиографический
диагноз аритмииРис. 8.1. Алгоритм выбора медикаментозной антиаритмической тера¬
пии, основанный на концепции «Сицилианского гамбита».Вмешательства♦Клинические результатыВмешательства♦Клинические результатымембранных ионных токов и в конечном итоге ответственные
за электрофизиологические характеристики тканей сердца.Ионные каналы представляют собой гликопротеины, про¬
низывающие двуслойную клеточную мембрану и при опреде¬
ленных условиях образующие поры, через которые различные
ионы могут быстро перемещаться через мембрану клетки, об¬
разуя ионные токи. Обычно каналы селективны по отноше¬
нию к тому либо другому конкретному иону (например, на¬
триевые, калиевые, кальциевые каналы).Насосы и транспортные системы представляют собой про¬
теины мембран, ускоряющие обмен ионов или других субстра¬
тов между внутри- и внеклеточным пространством с использо¬
ванием энергии. К ним относятся два аденозин-трифосфатза-
висимых насоса: Na/K-Hacoc и Са-насос, а также Na/Ca-
контртранспортная система, Na/H и С1/НСОэ обменная сис¬
тема и Na/K/Cl-контртранспортная система.Вегетативная нервная система является важным фактором,
определяющим ритм сердца, а- и (3-адренергические рецепто¬
ры, мускариновые и пуринергические рецепторы через свя¬
занные с ними посредством G-протеинов эффекторные систе¬
мы могут влиять на различные ионные каналы и насосы и
таким образом участвовать в формировании и проведении воз¬
буждения.В зависимости от вида каналов в клеточной мембране все
ткани сердца разделяются на структуры с Na-каналами (мио¬
кард предсердий и желудочков, проводящая система Гиса —
Пуркинье, аномальные пути проведения) и на структуры с10—1279145
Клетки предсердий и желудочковINaКлетки синоатриального узлаО или маленький«К,IKItoIICa-LICa-TINa/CaIK(ACh)I pumpРис. 8.2. Ионные токи и каналы, участвующие в образовании потен¬
циалов покоя и действия. Слева — потенциал действия миоцитов
предсердий и желудочков сердца. Справа — потенциал действия кле¬
ток синоатриального узла. О — фаза деполяризации; 1 — фаза бы¬
строй реполяризации; 2 — фаза плато; 3 — фаза медленной реполяри¬
зации; 4 — фаза спонтанной диастолической деполяризации. Знак во¬
проса (?) обозначает, что до настоящего времени экспериментальных
данных о наличии либо отсутствии этих каналов в мембранах синоат¬
риальных клеток не получено.Са-каналами (синоатриальное и атриовентрикулярное соеди¬
нение).Нормальный трансмембранный потенциал действия (рис.
8.2) в структурах с Na-каналами имеет высокий (— 90 мВ)
мембранный потенциал покоя, состоит из фазы быстрой депо¬
ляризации (нулевая фаза потенциала действия) и 3 фаз репо¬
ляризации (1 — быстрая ре поляризация, 2 — плато и 3 — мед¬
ленная реполяризация). Потенциал покоя клеток поддержива¬
ется в основном калиевым током IK,, направленным из клет¬
ки и обусловленным трансмембранным градиентом ионов К
[14]. В волокнах Пуркинье внутриклеточная концентрация
ионов К в 30 раз выше, чем внеклеточная, составляющая
около 4 ммоль/л. В меньшей степени потенциал покоя под¬
держивается током INa/Ca, создаваемым Na/Ca-контртранс¬
портной системой [21].146
Фаза быстрой деполяризации (нулевая фаза потенциала
действия) обусловлена направленным внутрь натриевым
током INa, связанным с быстрым вхождением внутрь клетки
ионов Na по натриевым каналам.Все три фазы реполяризации связаны в основном как с на¬
правленными внутрь кальциевыми токами I Ca-L и I Са-Т
[18], обусловленными вхождением внутрь клетки ионов Са по
кальциевым каналам (в основном во время фазы плато и мед¬
ленной реполяризации), так и с калиевыми токами I К, Ito
[20], направленными из клетки и связанными с выходом
ионов К по калиевым каналам (в основном во время фазы
медленной и быстрой реполяризации). Помимо этого, во
время процесса реполяризации продолжается процесс поступ¬
ления ионов Na внутрь клетки по натриевым каналам, но ско¬
рость его резко падает.Структуры с преобладанием Са-каналов и выраженной спо¬
собностью к автоматизму (синоатриальное и атриовентрикуляр¬
ное соединение) обладают менее высоким мембранным потен¬
циалом покоя (между —60 и —70 мВ). В них фаза деполяризации
(нулевая фаза потенциала действия) существенно замедлена, а
также регистрируется фаза медленной деполяризации (4-я фаза
потенциала действия), лежащая в основе возникновения спон¬
танной автоматической активности (см. рис. 8.2).В клетках, мембраны которых не содержат Na-каналов,
фаза деполяризации связана исключительно с направленными
внутрь кальциевыми токами I Ca-L и I Са-Т [15, 18], обуслов¬
ленными вхождением внутрь клетки ионов Са по кальциевым
каналам. Процесс реполяризации связан в основном с калие¬
вым током I К [20], направленным из клетки и обусловлен¬
ным выходом ионов К по калиевым каналам и в меньшей сте¬
пени с направленным внутрь током I Na/Ca, создаваемым
Na/Са-контртранспортной системой [21].Согласно концепции «Сицилианского гамбита», для выбо¬
ра правильной антиаритмической терапии сначала необходи¬
мо установить электрофизиологический механизм нарушения
ритма сердца. ЧП ЭФИ позволяет это сделать с достаточно
высокой степенью вероятности.Как у больных с реципрокными АВ узловыми пароксиз¬
мальными тахикардиями, так и у больных с пароксизмальны¬
ми реципрокными АВ тахикардиями с участием ДПП электро-
физиологическим механизмом, ответственным за возникнове¬
ние аритмий, является нарушение проведения возбуждения в
виде reentry в анатомически обусловленных структурах с боль¬
шим «возбудимым промежутком». Исходя из электрофизиоло-
гического механизма, критическими компонентами этого вида
аритмий являются скорость проведения импульса по различ¬
ным звеньям цепи reentry (проводимость), а также значение
эффективного рефрактерного периода различных участков це¬10*147
пи reentry (возбудимость). Помимо этого, к критическим ком¬
понентам реципрокных аритмий можно отнести и пусковые
факторы reentry — экстрасистолию и длину сердечного цикла.Основной задачей фармакологического вмешательства яв¬
ляется создание полной блокады проведения импульса в
одном из звеньев цепи reentry, что во многом зависит от
электрофизиологических свойств самой цепи reentry: является
ли она анатомически или функционально обусловленной, со¬
держат ли структуры, ее составляющие, Na- или Са-каналы,
какова причина замедления проведения импульса в цепи, име¬
ется ли в цепи reentry «возбудимый промежуток», и если име¬
ется, то какова его длительность (большой или короткий).Поскольку и у больных с реципрокными АВ узловыми па¬
роксизмальными тахикардиями, и у больных с пароксизмаль¬
ными реципрокными АВ тахикардиями при дополнительном
пути проведения цепь reentry обусловлена анатомическими
структурами и имеет большой «возбудимый промежуток», то
уязвимым параметром этих аритмий является замедление ско¬
рости проведения импульса (проводимость).Главной молекулярной мишенью воздействия при парок¬
сизмальных реципрокных АВ тахикардиях с участием допол¬
нительного пути проведения, обусловленных reentry в анато¬
мических структурах с преобладанием Na-каналов и большим
«возбудимым промежутком», является направленный внутрь
натриевый ток I Na.В то же время, поскольку часть цепи reentry при пароксиз¬
мальных реципрокных АВ тахикардиях с участием ДПП форми¬
руется АВ соединением, где преобладают структуры с Са-кана-
лами, дополнительной молекулярной мишенью воздействия
может являться и направленный внутрь кальциевый ток I Ca-L.Наконец, нельзя сбрасывать со счетов и возможность ис¬
пользования в качестве уязвимого параметра пароксизмаль¬
ных реципрокных АВ тахикардий с участием ДПП эффектив¬
ного рефрактерного периода тканей (возбудимость), вовлечен¬
ных в цепь reentry.Особое значение такой подход приобретает в тех случаях,
когда пароксизмальная реципрокная АВ тахикардия с участи¬
ем ДПП имеет очень короткий «возбудимый промежуток»
либо не имеет его вообще. Чаще всего это характерно для па¬
роксизмальных реципрокных АВ тахикардий с очень высокой
частотой сердечных сокращений, превышающей 200 ударов в1 мин. В таких случаях основной молекулярной мишенью воз¬
действия становится направленный из клетки калиевый ток I
К, а также направленный внутрь натриевый ток I Na.Патофизиологический подход к медикаментозному лече¬
нию пароксизмальных реципрокных АВ тахикардий с участи¬
ем дополнительного пути проведения, предлагаемый «Сици-
лианским гамбитом», отражен в следующих выводах.148
Патофизиологический подход к медикаментозному лечению пароксиз¬
мальных наджелудочковых тахикардий, обусловленных reentry с боль¬
шим «возбудимым промежутком» в анатомических структурах с Na-ка¬
наламиМеханизм аритмииКритические компоненты
Уязвимый параметр
Цель воздействияКлеточная мишень
ПрепаратыReentry с большим возбудимым про¬
межутком в анатомических структу¬
рах с Na-каналамиСкорость проведения возбужденияПроводимостьЗамедлить скорость проведения воз¬
буждения в анатомических структу¬
рах цепи reentry с Na-каналамиБлокировать ток I NaБлокаторы Na-каналовПатофизиологический подход к медикаментозному лечению наджелу¬
дочковых пароксизмальных тахикардий, обусловленных reentry в ана¬
томических структурах с коротким «возбудимым промежутком»Механизм аритмииКритические компонентыУязвимый параметр
Цель воздействияКлеточная мишень
ПрепаратыReentry в анатомических структурах с
коротким возбудимым промежутком
Reentry в функционально обуслов¬
ленных структурахДлительность эффективного рефрак¬
терного периодаЭффективный рефрактерный периодУдлинить эффективный рефрактер¬
ный периодБлокировать ток IKБлокаторы К-каналов, блокаторы
Na-каналовПатофизиологический подход к медикаментозному лечению пароксиз¬
мальных наджелудочковых тахикардий,обусловленных reentry с боль¬
шим «возбудимым промежутком» в анатомических структурах с Са-ка-
наламиМеханизм аритмииКритические компоненты
Уязвимый параметр
Цель воздействияКлеточная мишень
ПрепаратыReentry с большим возбудимым про¬
межутком в анатомических структу¬
рах с Са-каналамиСкорость проведения возбужденияПроводимостьЗамедлить скорость проведения воз¬
буждения в анатомических структу¬
рах цепи reentry с Са-каналамиБлокировать ток I Ca-LБлокаторы Са-каналов, р-блокаторы149
Основной молекулярной мишенью воздействия при реци¬
прокных АВ узловых пароксизмальных тахикардиях, обуслов¬
ленных reentry в анатомических структурах с преобладанием
Са-каналов и большим «возбудимым промежутком», является
направленный внутрь кальциевый ток I Ca-L.Поэтому основными антиаритмическими препаратами, ис¬
пользующимися для лечения этого вида аритмий, служат анта¬
гонисты Са-каналов, непосредственно блокирующие кальцие¬
вый ток I Ca-L, либо p-блокаторы, осуществляющие эту бло¬
каду опосредованно через адренергические рецепторы. Анта¬
гонисты Са-каналов и p-блокаторы замедляют скорость про¬
ведения антеградного возбуждения по медленному (а)-АВ уз¬
ловому пути и увеличивают его ЭРП.В то же время необходимо учитывать, что ретроградным
звеном цепи реципрокной АВ узловой пароксизмальной тахи¬
кардии обычно является быстрый (р) АВ узловой путь, состоя¬
щий преимущественно из структур с Na-каналами. В связи с
этим дополнительной молекулярной мишенью воздействия
при реципрокных АВ узловых пароксизмальных тахикардиях
может считаться направленный внутрь натриевый ток I Na.
Поэтому блокаторы Na-каналов, активно влияющие на
электрофизиологические характеристики быстрого (Р)-АВ уз¬
лового пути, также могут с успехом применяться для лечения
этого вида наджелудочковых пароксизмальных тахикардий.Патофизиологический подход к медикаментозному лече¬
нию реципрокных АВ узловых пароксизмальных тахикардий,
предлагаемый «Сицилианским гамбитом», представлен выше.8.2. Серийное тестирование эффективности
антиаритмических препаратов в условиях
ЧП ЭФИМетодом выбора при лечении больных с реципрокной АВ
узловой пароксизмальной тахикардией и пароксизмальной ре¬
ципрокной АВ тахикардией с участием ДПП является радио¬
частотная катетерная абляция медленного либо быстрого АВ
узлового пути проведения, а также пучка Кента или хирурги¬
ческое вмешательство на этих проводящих путях сердца. Опе¬
рации позволяют полностью избавить больных от нарушений
ритма сердца и избежать длительного постоянного приема
антиаритмических препаратов, большинство из которых имеет
серьезные побочные эффекты.Тем не менее следует признать, что и сейчас значительная
часть больных, страдающих наджелудочковыми пароксизмаль¬
ными тахикардиями, требует проведения регулярной медика¬
ментозной профилактики нарушений ритма сердца.150
Наиболее широко применяющаяся в настоящее время
классификация антиаритмических препаратов, предложенная
Vaughan Williams в 1970 г. [25], подразделяет их на 4 основных
класса.Классификация антиаритмических препаратовКЛАСС I: Блокаторы Na-каналовIAIB1CQuinidineLidocaineEncainideProcainamideMexiletineFlecainaideDisopyramideTocainideEthmozinPropafenon• подавляют бы¬• подавляют быструю• сильно подавляютструю фазу де¬фазу деполяризации вбыструю фазу де¬поляризацииизмененных тканяхполяризации• замедляют ск мало влияют на деп сильно замедляютрость проведе¬ляризацию в нор¬скорость проведе¬ния возбуждениямальных тканяхния возбуждения• удлиняют реп укорачивают реполя¬• мало влияют наляризациюризациюреполяризациюКЛАСС IIКЛАСС IIIКЛАСС IVР- БлокаторыБлокаторыБлокаторыК-каналовСа-каналовPropranololAmiodaroneVerapamilMetoprololdl-SotalolDiltiazemAtenololDofetilide• удлиняют реполяри¬
зациюВ основе этой классификации лежат данные о влиянии
антиаритмических препаратов на различные фазы потенциала
действия и на скорость проведения возбуждения в изолиро¬
ванных миоцитах, полученные с помощью микроэлектродной
техники.В то же время многочисленные электрофизиологические
исследования действия антиаритмических препаратов на кле¬
точном уровне, выполненные к концу 80-х годов, показали,
что, пожалуй, не существует ни одного антиаритмического
препарата, имеющего лишь одну-единственную точку прило¬
жения своего действия на уровне клеточной мембраны. Так,
например, антиаритмические препараты, влияющие преиму¬
щественно на Na-каналы (хинидин, дизопирамид, флекаинид,151
пропафенон), одновременно могут модифицировать как К-,
так и Са-каналы; амиодарон, помимо преимущественного
влияния на К-каналы, одновременно модифицирует и Na- и
Са-каналы, а также обладает а- и (3-блокирующим действием
и т.д.Современные представления о сложном и многосторон¬
нем действии антиаритмических препаратов представлены в
табл. 8.1.Проблема медикаментозной профилактики рецидивов над¬
желудочковых пароксизмальных тахикардий представляется
на сегодня достаточно сложной, так как требует постоянного
приема антиаритмических препаратов, при этом необходимо
оценивать соотношение выгоды и риска при назначении того
или иного препарата: многие из них являются далеко не без¬
опасными для больных с пароксизмами наджелудочковой та¬
хикардии, развивающейся на фоне органического поражения
сердца.О наличии серьезных проаритмических эффектов у пре¬
паратов I и III классов свидетельствуют результаты исследова¬
ний CAST I [7], CAST II [8], SWORD, результаты метаанализа
применения хинидина для профилактики рецидивов фибрил¬
ляции предсердий после восстановления синусового ритма [9], а
также некоторые нерандомизированные исследования [13].Вопрос о необходимости постоянной антиаритмической
терапии у каждого пациента, страдающего пароксизмальной
наджелудочковой тахикардией, требует индивидуального ре¬
шения. При этом нужно учитывать частоту рецидивирования
приступов аритмии, тяжесть гемодинамических расстройств
во время приступа, вероятность развития проаритмических и
других побочных эффектов и т.д.Принимая решение о целесообразности медикаментозной
профилактики пароксизмов наджелудочковой пароксизмаль¬
ной тахикардии, врач сталкивается с еще более сложной про¬
блемой — выбором индивидуально для каждого больного эф¬
фективного антиаритмического препарата.До середины 80-х годов подбор препарата осуществлялся
методом «проб и ошибок», часто растягиваясь на многие меся¬
цы, а нередко и годы, приводя к существенным социально-
экономическим потерям. С внедрением в клиническую прак¬
тику метода ЧП ЭФИ, позволяющего провоцировать присту¬
пы наджелудочковой тахикардии, свойственные больным в
повседневной жизни, появилась возможность оценивать ин¬
дивидуальную эффективность различных антиаритмических
препаратов при их постоянном приеме — серийное тестирова¬
ние эффективности антиаритмических препаратов в условиях
ЧП ЭФИ [2].Вначале выполняется на «чистом фоне», т.е. без приема
антиаритмических препаратов, контрольное исследование.152
Таблица 8.1. Действие антиаритмических препаратовВлияние на ЭКГК1О)*«-«-«-*■«-«-QRS«-«■«■«•*■«■«■і4-«■«-*■«-«-«-*■Клинический эффектвнесер-дечные©©•О•©©ООООООООсинусо¬
вый ритм*функ¬
ция ЛЖtФt*Ф*С-ФНасосыNa/KАТФазаРецепторыCLМ2ООСО.©■•а©■Ионные каналы и токи<+-<мм#О©©©О©••cdи••©cd••••••оОО•оОПрепаратЛидокаинМексилетинТокаинидМорицизинПрокаинамидДизопирамидХинидинПропафенонФлекаинидЭнкаинидБепридилВерапамилДилтиаземБретилиумСоталол
Продолжение табл. 8.1Влияние на ЭКГКО)«-QRS1«-«-4-«-«■н&■©>внесер-дечные••ОО©О•tS*о<иVSXX5синусо¬
вый ритм*«•■*функ¬
ция ЛЖt«У»tС4-«-НасосыNa/KАТФаза•Рецепторыси□М2•□Ol©••0©Ионные каналы и токи«4-І•и•©свиО«яZоОПрепаратАмиодаронАлинидинНадололПропранололАтропинАденозинДигоксинUё5? *2ан о.н
D О ^ 5О- С5 о о
ю««•=:ОО оі о X о А1 Э ss S лСОС ЯcdС £CQ154
Спустя 48 ч после отмены всех антиаритмических препаратов
(за исключением амиодарона и сердечных гликозидов, период
отмены которых составляет 10—14 сут) оценивается возмож¬
ность провокации наджелудочковой пароксизмальной тахи¬
кардии с помощью ЧПЭС предсердий. Если эта попытка уда¬
ется,то на основании изложенных ранее критериев (см. гл.
VII) устанавливается конкретная электрофизиологическая
форма тахикардии и больные могут быть включены в програм¬
му серийного тестирования антиаритмических препаратов в
условиях ЧП ЭФИ. Индуцированный приступ наджелудочко¬
вой тахикардии обычно легко купируется с помощью чреспи-
щеводной стимуляции предсердий (см. гл. IV).Повторную попытку провокации пароксизмальной тахи¬
кардии с помощью установленного ранее режима ЧПЭС пред¬
сердий предпринимают не ранее чем на 3—5-й день от начала
приема антиаритмического препарата в средних терапевтичес¬
ких дозах; для амиодарона этот срок равен 10—14 дням. Выбор
последовательности назначения антиаритмических препаратов
зависит от анамнестических данных об эффективности прово¬
дившейся ранее антиаритмической терапии, а также от элект-
рофизиологических механизмов пароксизмальной тахикардии.Если препарат предотвращает возможность провоцирования
устойчивого (длительностью более 30 с) приступа пароксизмаль¬
ной наджелудочковой тахикардии либо индуцируются лишь от¬
дельные эхо-возбуждения, считается, что тестируемый препарат
у данного пациента является индивидуально эффективным и
обеспечивает профилактическое антиаритмическое действие.В тех случаях, когда тестируемый препарат не предупреж¬
дает возможность провоцирования наджелудочковой парок¬
сизмальной тахикардии с помощью ЧП ЭФИ, назначается
следующий антиаритмический препарат. Интервал между ис¬
следованиями должен быть не меньше чем 5 периодов полу-
выведения предшествующего тестируемого антиаритмическо¬
го препарата. В связи с этим с практической точки зрения тес¬
тировать антиаритмическую эффективность амиодарона целе¬
сообразно в последнюю очередь. Процедура тестирования по¬
вторяется до тех пор, пока не выявляется индивидуально эф¬
фективный антиаритмический препарат либо не исчерпыва¬
ются возможности медикаментозной антиаритмической те¬
рапии. Минимально достаточным считается определение 1 —2 антиаритмических препаратов, применение которых предуп¬
реждает провоцирование наджелудочковой пароксизмальной
тахикардии с помощью ЧП ЭФИ и не сопровождается серьез¬
ными побочными, в том числе проаритмическими, эффектами.В настоящее время не вызывают сомнения высокая ин¬
формативность и предсказующая ценность метода серийного
тестирования антиаритмических препаратов с помощью ЧП
ЭФИ у больных, страдающих пароксизмальными наджелудоч-155
ковыми тахикардиями. Эффективность длительной медика¬
ментозной профилактики приступов с помощью этого метода
достигает 66—92 % [12, 17]. К сожалению, критерии эффек¬
тивности медикаментозной профилактики рецидивов этого
вида тахикардии достаточно разноречивы. Не вызывает сомне¬
ний, что отсутствие спонтанных приступов наджелудочковой
тахикардии является свидетельством хорошего результата. Од¬
нако нередко под эффективностью антиаритмического пре¬
парата понимают и существенное (более чем на 75 % или
50 %) снижение частоты спонтанных приступов аритмии.Кроме того, клиницистам хорошо известен феномен сни¬
жения или полного исчезновения с течением времени перво¬
начальной антиаритмической эффективности препарата, даже
при условии регулярного приема в адекватной дозе. Причина
«ускользания антиаритмической эффективности» до настоя¬
щего времени полностью не ясна. Вероятно, длительность ан¬
тиаритмической эффективности, помимо собственно фарма¬
кокинетических и фармакодинамических особенностей пре¬
паратов, во многом зависит от изменений, происходящих с те¬
чением времени в структурах сердца, участвующих в формиро¬
вании цепи reentry, от баланса симпатических и парасимпати¬
ческих влияний на эти структуры, от нерегулярности приема
больными антиаритмических препаратов и от многого другого.Таким образом, даже сама оценка эффективности профи¬
лактики рецидивов наджелудочковой пароксизмальной тахи¬
кардии с помощью антиаритмических препаратов связана с
определенными трудностями.8.3. Эффективность медикаментозной
профилактики рецидивов пароксизмальной
реципрокной АВ тахикардии с участием ДППДля медикаментозной профилактики пароксизмов реци¬
прокной АВ тахикардии с участием дополнительного пути про¬
ведения могут использоваться все 4 класса антиаритмических
препаратов, однако эффективность их далеко не одинакова.К сожалению, следует отметить, что серьезных многоцент¬
ровых плацебо контролируемых исследований, посвященных
этому вопросу, не проводилось.Результаты анализа литературы, посвященной этому во¬
просу, представлены на рис. 8.3.Многочисленные клинические исследования показали, что
антиаритмические препараты I класса (блокаторы Na-кана-
лов) позволяют добиться эффекта в 40—90 % случаев [4, 10,
19, 23], препараты III класса (блокаторы К-каналов) — в 60—
70 % [5, 19, 24].156
70656760605040ЗО2010504333оI—2ОО5ооIXо*с;з2гао.сооо>оXSГСсасI КЛАСС40оI—2ОчгсмSоX8.сасII КЛАССт28<м3оZ0Q.1
Xосмсо8КЛАСС43осо2(О"с.X2сос:аш47т2О?Осо2гасаmIV КЛАССРис. 8.3. Медикаментозная профилактика атриовентрикулярной ре
ципрокной тахикардии с участием ДПП.Однако, учитывая возможные побочные эффекты анти¬
аритмических препаратов I и III классов, в том числе их про-
аритмическое действие, не стоит отказываться от использова¬
ния p-блокаторов и блокаторов Са-каналов, являющихся без¬
опасными на первых этапах подбора профилактической анти¬
аритмической терапии, несмотря на то что эффективность их
существенно ниже и колеблется, по данным разных авторов,
от 40 до 60 % [11, 19, 23].Анализ результатов подбора индивидуально эффективной
профилактической антиаритмической терапии более чем у 130
больных с реципрокными пароксизмальными АВ тахикардия¬
ми с участием дополнительного пути проведения (на фоне как
явного, так и скрытого синдрома WPW), выполненной нами в
клинике факультетской терапии ММА имени И.М.Сеченова с
помощью метода серийного тестирования эффективности
антиаритмических препаратов в условиях ЧП ЭФИ, представ¬
лен на рис. 8.4.Метод серийного тестирования антиаритмических препара¬
тов позволил подобрать индивидуально эффективную медика¬
ментозную антиаритмическую терапию у 84,8 % больных. При
оценке как групповой, так и индивидуальной профилактичес¬
кой эффективности лучшими оказались антиаритмические пре¬
параты I класса (хинидин, ритмилен, этмозин, аллапинин),
а среди них — ритмилен, при назначении которого в дозе 600—157
6050 -40ЗО201056N=13040ооО)Iоосо203Q.Sс°Sа34оооГГ)с;«j2в<О24со6XXо2ю £ОчГО00оX03Q.иL.201ClOJ52О?осмSгасСОа.®m12I КЛАССII КЛАССтIII КЛАССIV КЛАССРис. 8.4. Профилактическая эффективность антиаритмических пре¬
паратов различных классов по данным серийного тестирования в ус¬
ловиях ЧП ЭФИ у больных с реципрокными пароксизмальными АВ
тахикардиями с участием ДПП.900 мг в сутки был достигнут эффект в 40 % случаев. Примене¬
ние указанных препаратов не позволило индуцировать приступ
наджелудочковой пароксизмальной тахикардии у 56 % больных.Следующими наиболее эффективными являются анти-
аритмические препараты III класса. При применении амиода¬
рона в дозе 400—800 мг в сутки положительный результат до¬
стигнут у 34 % больных.Антиаритмические препараты II класса менее эффектив¬
ны: пропранолол в дозе 80—240 мг в сутки предупреждает ре¬
цидивы тахикардии лишь у 24 % больных.Еще менее эффективны антиаритмические препараты IV
класса: положительный результат отмечен лишь у 12 % боль¬
ных при приеме верапамила в дозе 120—480 мг в сутки.Таким образом, метод серийного тестирования антиарит¬
мических препаратов в условиях ЧП ЭФИ является высокоэф¬
фективным способом подбора индивидуальной профилакти¬
ческой терапии у больных с реципрокной АВ тахикардией с158
участием дополнительного пути проведения. Он позволил по¬
добрать индивидуально эффективную профилактическую те¬
рапию у 84,8 % этой категории больных.В то же время оценка индивидуальной профилактической
эффективности каждого из исследовавшихся нами антиарит¬
мических препаратов различных классов у больных с парок¬
сизмальной реципрокной АВ тахикардией с участием допол¬
нительного пути проведения показала, что при использовании
метода серийного тестирования в условиях ЧП ЭФИ профи¬
лактическая эффективность антиаритмических препаратов су¬
щественно ниже, чем при их эмпирическом применении. Ве¬
роятно, это связано с тем, что метод серийного тестирования
эффективности антиаритмических препаратов в условиях ЧП
ЭФИ позволяет исключить ложноположительные результаты
их профилактического применения, неизбежные при эмпири¬
ческом назначении.8.4. Эффективность медикаментозной
профилактики рецидивов реципрокной
АВ узловой пароксизмальной тахикардииДля медикаментозной профилактики пароксизмов этого
вида могут использоваться все 4 класса антиаритмических
препаратов.К сожалению, при этом виде тахикардий исследований по
оценке сравнительной эффективности профилактики рециди¬
вов аритмии с помощью антиаритмических препаратов раз¬
личных классов, выполненных по одному более или менее
стандартному протоколу, не проводилось.Анализ литературы, посвященной вопросу сравнительной
эффективности профилактики рецидивов реципрокной АВ уз¬
ловой пароксизмальной тахикардии с помощью антиаритми¬
ческих препаратов различных классов, назначавшихся эмпи¬
рическим путем без использования метода их серийного тес¬
тирования, представлен на рис. 8.5.С патофизиологических позиций «Сицилианского гамби¬
та» наиболее эффективными антиаритмическими препаратами
в плане профилактики рецидивов реципрокной АВ узловой
пароксизмальной тахикардии должны быть блокаторы Са-ка-
налов и р-блокаторы.Однако многочисленные клинические исследования показа¬
ли, что эффективность профилактики приступов реципрокной
АВ узловой тахикардии различными классами антиаритмичес¬
ких препаратов при их эмпирическом назначении мало различа¬
ется между собой и колеблется в пределах от 50 до 70 % случаев.Блокаторы Са-каналов при реципрокной АВ узловой парок¬
сизмальной тахикардии позволяют добиться хорошего профи-159
70605057635056606569555040ЗО2010оооо>6оюCtS2гоClSсосооооО)6ючгX0Z1госаоосмd>оос;ос.оZ2.сооосмI§§§аЗооосм5о8.го5X2<оосмсо6(О§оКЛАССII КЛАССТ2(0сгоCL22ГОсаоСООоGO*'*оСО2госгоQ.£КЛАССIV КЛАСС1Рис. 8.5. Медикаментозная профилактика реципрокной атриовентри¬
кулярной узловой пароксизмальной тахикардии.лактического эффекта в 60—70 % случаев [3, 16], антиаритмиче-
ские препараты II класса (пропранолол, атенолол) — в 50—60 %
случаев [1, 11], антиаритмические препараты I класса (дизопи¬
рамид, пропафенон) — у 57—63 % больных [4, 19]; препараты III
класса (амиодарон, d/І соталол) — в 60—65 % случаев [6, 19].Анализ результатов подбора индивидуально эффективной
профилактической антиаритмической терапии более чем у 110
больных с реципрокными АВ узловыми пароксизмальными
тахикардиями, выполненной в факультетской терапевтичес¬
кой клинике ММА имени И.М.Сеченова с помощью метода
серийного тестирования эффективности антиаритмических
препаратов в условиях ЧП ЭФИ, представлен на рис. 8.6.
Эффективность метода, примененного у этой, кате гори и боль¬
ных, — 96,4 %, что достоверно выше, чем у больных с парок¬
сизмальной реципрокной АВ тахикардией с участием ДПП
(р<0,05). Наиболее эффективными оказались антиаритмичес¬
кие препараты I класса (70 % больных).Второе место принадлежало антиаритмическим препара¬
там II класса (p-блокаторам). Использование пропранолола в
дозе 80—240 мг в сутки не позволяло индуцировать приступ
реципрокной АВ узловой пароксизмальной тахикардии у 50 %
больных.Существенно ниже была профилактическая эффективность
антиаритмических препаратов III класса: применение амиода-160
7070605040ЗО2010N=11225соXszXсгос;оосо«О§соО2нО2002О§1оо<опS2HJClSс8О2§со4 I15 |1050ооч*200с;ос<иQ.с:а25о8°?ОО(О03SX2<оо00’Т§са:ZЯ)с(0аОш15ТI КЛАССтII КЛАССКЛАССIV КЛАССРис. 8.6. Профилактическая эффективность антиаритмических пре
паратов различных классов по данным серийного тестирования в ус
ловиях ЧП ЭФИ у больных с реципрокными узловыми АВ пароксиз
мальными тахикардиями.рона в дозе 600—800 мг в сутки позволило добиться профилак¬
тики рецидивов тахикардии лишь у 25 % больных.Неожиданным оказался результат профилактического при¬
менения у больных с реципрокной АВ узловой пароксизмаль¬
ной тахикардией антиаритмических препаратов IV класса.
Лишь у 15 % больных верапамил в дозе 120—480 мг в сутки по¬
зволил предупредить индукцию реципрокной АВ узловой па¬
роксизмальной тахикардии во время ЧП ЭФИ.Что касается индивидуальной эффективно¬
сти профилактики реципрокной АВ узловой пароксизмаль¬
ной тахикардии, первое место, несомненно, принадлежит
p-блокаторам: эффективность пропранолола в суточной дозе
8—240 мг в сутки равна 50 %.Индивидуальная профилактическая активность таких анти¬
аритмических препаратов I класса, как аймалин, ритмилен, эт-
мозин, аллапинин, была существенно ниже: при назначении ал-11 — 1279161
лапинина (наиболее выраженный результат) в дозе 100—150 мг в
сутки индуцировать приступ пароксизмальной тахикардии не
удалось у 25 % больных; при применении этмозина в дозе 600—
800 мг в сутки — у 20 %. Профилактическая активность других
препаратов I класса (аймалин, ритмилен) была более низкой.Таким образом, необходимо отметить, что метод серийно¬
го тестирования антиаритмических препаратов в условиях ЧП
ЭФИ является высокоэффективным способом подбора инди¬
видуальной профилактической терапии у больных с реципрок¬
ной АВ узловой пароксизмальной тахикардией. Он позволит
подобрать индивидуально эффективную профилактическую
терапию более чем у 95 % этой категории больных.В то же время оценка индивидуальной профилактической
эффективности каждого из исследовавшихся нами антиарит¬
мических препаратов различных классов у больных с реци¬
прокной АВ узловой пароксизмальной тахикардией показала,
что, как и у больных с реципрокной АВ тахикардией с участи¬
ем дополнительного пути проведения, при использовании ме¬
тода серийного тестирования в условиях ЧП ЭФИ профилак¬
тическая эффективность различных антиаритмических пре¬
паратов существенно ниже, чем при их эмпирическом приме¬
нении. Во многом это, вероятно, связано с тем, что метод се¬
рийного тестирования эффективности антиаритмических пре¬
паратов в условиях ЧП ЭФИ позволяет исключить ложнопо¬
ложительные результаты их профилактического применения,
неизбежные при эмпирическом назначении.Список литературы1. Мазур Н.А. Пароксизмальные тахикардии.— М.: Медицина, 1984.2. Сметнев А.С., Гросу А.А., Соколов С.Ф. и др. Способ оценки
антиаритмической терапии у больных с пароксизмами наджелудоч¬
ковой тахикардии//Кардиология. — 1984. — № 5. — С. 25—30.3. Соколов С.Ф, Голицын С.П. Наджелудочковые тахикардии: ме¬
ханизмы, диагностика и лечение//Кардиология. — 1982. — Т.22,
№ 11. - С. 112-116.4. Яковлева Н.В. Сравнительная эффективность и возможности
длительного применения пропафенона у больных с пароксизмальны¬
ми нарушениями ритма сердца: Автореф. дис. ... канд. мед. наук. —
М., 1997. - 20 с.5. Albeni P., Shantha N., Pirani R. et al. Effects of amiodarone on su¬
praventricular tachycardia involving bypass tracts//Amer. J. Cardiol. —
1984. - Vol. 53. - P. 93-98.6. Camm A.J., Paul V. Sotalol for paroxysmal supraventricular tachy-
cardias//Amer. J. Cardiol. — 1990. — Vol. 65. — P. 67A—73A.7. The Cardiac Arrhythmia Supression Trial (CAST) Investigators. Ef¬
fect of encainide and flecainide on mortality in a randomized trial of ar¬
rhythmia suppression after myocardial infarction//New. Engl. J. Med. —1989. - Vol. 321. - P. 406-412.162
8. The Cardiac Arrhythmia Supression Trial II (CAST) Investigators.
Effect of antiarrhythmic agent moricizine on survival after myocardial in-
farction//New Engl. J. Med. — 1992. — Vol. 327. — P. 227—233.9. Coplen S.E., Antman E.M., Berlin J.A. et al. Efficacy and safety of
quinidine therapy for maintenance of sinus rhythm after cardioversion.
A meta-analysis of randomized control trails//Circulation. — 1990. — Vol.
82. - P. 1106-1116.10. Cosin-Aguilar J., Hernediz-Martinez A. The clinical usefulness of
the antiarrhythmic drug quinidine//Europ. Heart. J. — 1987. — Vol. 8,
suppl. A. — P. 1—9.11. Coumel P., Lockerq J.F., Escoubet B. Beta-blockers: use for ar-
rhythmias//Europ. Heart J. — 1987. — Vol. 8, suppl. A. — P. 41—52.12. Denes P., Wu D., WyndhamC.R. et al. Chronic electrophysiologic
study of paroxysmal ventricular tachycardia//Chest.— 1980.— Vol. 77.13. Flaker G.C., Blackshear J.L., McBride R. et al. Antiarrhythmic
drug therapy and cardiac mortality in atrial fibrillation//.!. Amer. Coll.
Cardiol. - 1992. - Vol. 20. - P. 527-532.14. Giles W.R., Imaizumi Y. Comparison ofpotassium currents in rab¬
bit atrial and ventricular cells//J. Physiol (Lond).— 1988.— Vol. 405.15. Hagiwara N., Irisawa Y, Kasanuki H., Hosoda S. Background cur¬
rent in sino-atrial node cells of rabbit heart//J. Physiol. (Lond). — 1992. —
Vol. 448. - P. 53-72.16. Keefe D.L., Miura, Somberg J.S. Supraventricular tachyarrhyth¬
mias: their evaluation and therapy//Amer. Heart J. — 1986. — Vol. 111.17. Mason J.W., Winkle R.A. Electrode catheter arrhythmia induc¬
tion in selection and assessement of antiarrhythmic drug therapy for recur¬
rent ventricular tachycardia//Circulation.— 1978.— Vol. 58.— P. 971—985.18. Pelzer D., Pelzer S., MacDonald T.F. Properties and regulation of
calcium channels in muscle cells//Rev. Physiol. Biochem Pharmacol. —1990. - Vol. 114. - P. 107-207.19. Rostock K-J. Herzrhythmusstorungen in Theorie und Praxis 1993,
Akademie Verlag. — P. 616.20. Sanguinetti M.C., Jurkiewicz N.K. Two components of cardiac de¬
layed rectifier К current. Differential sensitivity to block by Class III an¬
tiarrhythmic agents//J. gen. Physiol. — 1990. — Vol. 96. — P. 195—215.21. Sheu S-S., Lederer W.J. Lidocaine’s negative inotropic and an-
tiarhhythmic actions. Dependence on shortening of action potential dura¬
tion and reduction of intracellular sodium activity//Circ. Res. — 1985. —
Vol. 57. - P. 578-590.22. The Task Force of the Working Group on Arrhythmias of the
European Society of Cardiology: The Sicilian Gambit. A new approach to
the classification of antiarrhythmic drugs based on their actions on arrhyth-
mogenic mechanisms//Circulation. — 1991. — Vol. 84. — P. 1831 — 1851.23. Wellens H.J.J., Bar T. W, Dassen W.R.M. et al. Effects of drugs in
the Wolff — Parkinson — White syndrome//Amer. J. Cardiol. — 1980. —
Vol. 40. - P. 655-669.24. Wellens H.J.J., Brugada P., Abdollach H. Effects of amiodarone in
paroxysmal supraventricular tachycardia with and without Wolff — Parkin¬
son — White syndrome//Amer. Heart J.— 1983.— Vol. 106,— P. 876—881.25. Vaughan Williams E.M. Classification of antiarrhythmic drugs. —
In: Sandoe E., Flenstedt-Jensen E., Olesen K.H. (Eds). Symposium on
cardiac arrhythmias. — Sodertalje, Astra, 1970. — P. 449—471.11*
Глава 9ЧПЭС СЕРДЦА У БОЛЬНЫХ
С ПАРОКСИЗМАЛЬНОЙ ФОРМОЙ
ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ9.1. Современные представления о фибрилляции
предсердийФибрилляция предсердий (ФП), или мерцание предсердий
(мерцательная аритмия — МА), — это хаотическое возбужде¬
ние участков миокарда предсердий с высокой частотой и не¬
прерывно изменяющейся последовательностью, сопровож¬
дающееся аритмичным возбуждением желудочков сердца и
прекращением насосной функции предсердий.В основе электрофизиологического механизма ФП лежит
механизм reentry в функционально обусловленных структурах
без «возбудимого промежутка». Reentry при ФП имеет харак¬
тер «ведущего цикла», «спиральной волны» либо связано с
анизотропией миокарда предсердий. В последнем случае воз¬
можно существование «возбудимого» промежутка в цепи цир¬
кулирующего возбуждения [40].При ФП одновременно могут существовать многочислен¬
ные непрерывно изменяющиеся цепи reentry типа «ведущего
цикла» [32], которые непрерывно изменяют свои размеры,
конфигурацию и локализацию (random reentry).Относительно недавно выявлено, что у некоторых пациен¬
тов ФП может быть обусловлена нарушением функции авто¬
матизма в виде триггерной активности [27].Продолжительные эпизоды ФП могут приводить к разви¬
тию так называемого «электрического ремоделирования мио¬
карда», выражающегося в устойчивом укорочении рефрактер¬
ных периодов миокарда предсердий [19], в возрастании дис¬
персии рефрактерности различных его участков [34] и в увели¬
чении дезорганизации процессов распространения возбужде¬
ния по миокарду предсердий. Укорочение рефрактерных пе¬
риодов после эпизодов фибрилляции предсердий может быть
связано как с непосредственной перегрузкой миоцитов иона¬
ми Са и уменьшением ионного тока Са—L [21], так и с опос¬
редованным — из-за перегрузки миоцитов ионами Na с после¬
дующим увеличением внутриклеточной концентрации ионов
Са через Na/Ca-обменный механизм.Не вызывает сомнений, что укорочение рефрактерных пе¬
риодов миокарда предсердий является не единственной при¬
чиной трансформации пароксизмальной формы ФП в посто¬
янную. Чрезмерная нагрузка на миоциты предсердий во время164
эпизодов их фибрилляции через экспрессию генов и актива¬
цию нейрогуморальних механизмов (в основном кардиальный
ангиотензин II) может запускать механизм «структурного ре¬
моделирования», приводящий к дилатации, гипертрофии,
структурной дезорганизации миофибрилл и фиброзированию
миокарда предсердий, что также может поддерживать сущест¬
вование мерцательной аритмии.ФП — чрезвычайно часто встречающаяся аритмия сердца,
которой страдают многие миллионы людей во всем мире. Ее
распространенность во всей популяции составляет 0,4—5 %
среди лиц старше 65 лет. По обобщенным данным других по¬
пуляционных исследований, проведенных в США и Велико¬
британии, ФП встречается чаще: в 5—5,4 % случаев в возрасте
от 50 до 60 лет, 16,2 % — 61—70 лет, 14—20,7 % — 71—80 лет,
13—24,3 % — 81—85 лет и 12,6—22 % — старше 85 лет [30].
В результате постарения населения ФП становится основной
причиной обращений за медицинской помощью и госпитали¬
зации по поводу нарушения ритма сердца [35], огромным и
все увеличивающимся бременем для систем здравоохранения
в развитых странах.В настоящее время в зависимости от длительности сущест¬
вования ФП выделяют две ее основные формы пароксизмаль¬
ную (ФП длится менее 7 сут) и постоянную (более 7 сут).В последние годы стали выделять несколько вариантов па¬
роксизмальной формы ФП — собственно пароксизмальную и
устойчивую.1. Пароксизмальная форма ФП. Особенности этого вида
мерцательной аритмии — относительно короткая продолжи¬
тельность приступа (от нескольких минут до 48 ч) и способность
к самопроизвольному прекращению. Стратегическая цель меди¬
каментозного лечения этого варианта ФП — предупреждение
возникновения пароксизмов. При купировании этого варианта
ФП специальной антикоагулянтной подготовки не требуется.2. Устойчивая форма ФП. Продолжительность приступа
более 48 ч, самопроизвольного прекращения у подавляющего
большинства больных не наблюдается. Но в то же время суще¬
ствует возможность ее купирования с помощью медикамен¬
тозной либо электрической кардиоверсии. Цель лечения —
восстановление синусового ритма с последующей медикамен¬
тозной профилактикой рецидивов аритмии. У этих больных
решение о целесообразности восстановления синусового
ритма принимается, исходя из анамнестических данных и ре¬
зультатов инструментального обследования. В большинстве
случаев пациенту целесообразно попытаться предоставить воз¬
можность восстановить синусовый ритм. Однако перед этим
необходима 3-недельная антикоагулянтная подготовка.3. Постоянная форма ФП. Ее либо не удается купировать
вообще (включая электрическую кардиоверсию), либо восста¬165
новленный синусовый ритм сохраняется только несколько
часов. В этих ситуациях стратегической целью лечения являет¬
ся контроль частоты ритма желудочков сердца.9.2. Стандартный протокол проведения
чреспищеводного электрофизиологического
исследования у больных с пароксизмальной
формой фибрилляции предсердийДиагноз мерцательной аритмии обычно не труден, если
хотя бы один пароксизм регистрируется на ЭКГ.Поэтому роль ЧП ЭФИ в диагностике ФП сводится к сле¬
дующему:— верификация возникновения пароксизмов ФП путем
индуцирования их у пациентов с приступами сердцебие¬
ния, не подтвержденными ЭКГ,— дифференциальная диагностика ФП с другими вариан¬
тами пароксизмальных тахикардий с широкими ком¬
плексами QRS (см. главу VI),— подбор антиаритмической терапии с помощью серийно¬
го тестирования антиаритмических препаратов в услови¬
ях ЧП ЭФИ.ЧП ЭФИ у больных с пароксизмальной формой ФП вклю¬
чает:— регистрацию ЧП ЭГ во время синусового ритма (см.
главу II);— выполнение предсердных электростимуляционных тестов;— провокацию приступа ФП;— регистрацию ЧП ЭГ во время индуцированной аритмии
для дифференциальной диагностики ФП с другими ва¬
риантами пароксизмальных тахикардий с широкими
комплексами QRS.Несмотря на кажущуюся простоту вопроса, многие мето¬
дические аспекты протокола проведения ЧП ЭФИ у больных с
пароксизмальной формой ФП до сих пор остаются достаточно
сложной и до конца не решенной проблемой: не определены
чувствительность и специфичность каждого из методов индук¬
ции ФП, не проводилась сравнительная оценка чувствитель¬
ности и специфичности различных методов индукции ФП
между собой по единому протоколу; неизвестна прогностичес¬
кая ценность каждого из методов индукции ФП относительно
эффективности длительной профилактической антиаритми¬
ческой терапии.Если у больных с пароксизмальными наджелудочковыми
тахикардиями применение стандартного протокола исследова-166
fния (см. главу VII), включающего использование электричес¬
кой стимуляции предсердий с возрастающей частотой и про¬
граммированную стимуляцию предсердий одиночным и пар¬
ным экстрастимулами на фоне их базовой электростимуляции
(рис. 9.1, 9.2), позволяет индуцировать приступ аритмии в 92—
95 % случаев, то у больных с ФП, подтвержденными ЭКГ, это
удается сделать только в 11,4—18 % случаев [5]. Одной из при¬
чин такой низкой эффективности является эффект OLBI [9],
при котором во время чреспищеводной электрической стиму¬
ляции возбуждения левого и правого предсердия возникают
одновременно и пароксизм ФП не индуцируется. В ряде слу¬
чаев простое изменение положения биполярного электрода в
пищеводе (либо изменение кривизны электрода) приводит к
изменению последовательности возбуждения предсердий
(сначала левое, затем правое) и позволяет индуцировать при¬
ступ ФП без повышения «агрессивности» стимуляции.Для увеличения чувствительности нагрузочных электро-
стимуляционных тестов, применяющихся во время ЧП ЭФИ
для индукции пароксизмов ФП, могут быть использованы раз¬
личные модификации электрической стимуляции предсердий,
приводящие к повышению «агрессивности» протокола иссле¬
дования.Рис. 9.1. Индуцирование пароксизма ФП одиночным программиро¬
ванным предсердным экстрастимулом во время ЧП ЭФИ.ЧП ЭГ167
ЧП-ЭГРис. 9.2. Индуцирование пароксизма ФП парным программирован
ным предсердным экстрастимулом во время ЧП ЭФИ.Если приступ ФП не удается индуцировать с помощью
стандартного протокола ЧП ЭФИ, то следующим этапом яв¬
ляется применение метода частой стимуляции предсердий зал¬
пом асинхронных импульсов (рис. 9.3), при котором частую
стимуляцию левого предсердия в диапазоне частот от 300 до
800 имп/мин проводят по ступенчатой методике с увеличе¬
нием на каждой ступени частоты наносимых импульсов на
100 имп/мин (длительность стимуляции на каждой ступени от
2 до 5 с).При невозможности индукции пароксизма ФП залпом
асинхронных импульсов применяется метод частой стимуля¬
ции предсердий залпом программируемых импульсов (рис.
9.4), которые «бомбардируют» каждый предсердный цикл на
фоне базового электростимуляционного ритма. Базовые час¬
тоты стимуляции предсердий (100, 120, 140 имп/мин и т.д.)
используются в возрастающей последовательности. В зависи¬
мости от их частоты количество программируемых импульсов
в каждом «залпе» может колебаться от 2 до 5. Первый импульс
в «залпе» устанавливается с задержкой 400 мс, а каждый из
последующих — на 10—20 мс меньше. Шаг каждого из них
может уменьшаться на 10—20 мс до момента индуцирования168
Рис. 9.3. Индуцирование пароксизма ФП залпом асинхронных пред¬
сердных стимулов во время ЧП ЭФИ.ФП. При использовании этого режима в процессе одного ЧП
ЭФИ должны использоваться различные базовые частоты сти¬
муляции предсердий.В случаях неэффективности перечисленных методов ис¬
пользуется частая стимуляция предсердий с плавным возрас¬
танием частоты импульсов от 300 до 800 имп/мин, осущест¬
вляемая за 15 с.Однако, даже используя «высокоагрессивные» способы
ЧПЭС предсердий, индуцировать устойчивый приступ фиб¬
рилляции предсердий (длящийся более 30 с) удается у 47—
85 % больных [2, 5].169
Кроме собственных электрофизиологических характеристик
миокарда предсердий (укорочение рефрактерных периодов, воз¬
растание дисперсии рефрактерности различных участков мио¬
карда предсердий, увеличение дезорганизации процессов рас¬
пространения возбуждения по миокарду предсердий), важней¬
шими условиями, предрасполагающими к возникновению ФП,
являются вагусные и адренергические влияния [15, 16, 17, 25].ЧП ЭГРис. 9.4. Индуцирование пароксизма ФП залпом программированных
предсердных экстрастимулов во время ЧП ЭФИ.Помимо увеличения «агрессивности» электрической сти¬
муляции предсердий, для повышения чувствительности ЧП
ЭФИ у больных с пароксизмальной формой ФП могут ис¬
пользоваться рефлекторные и фармакологические пробы.9.3. Протокол проведения ЧП ЭФИ у больных
с пароксизмальной формой фибрилляции
предсердий, основанный на оценке состояния
вегетативной нервной системы170
Известно, что активация вагусных влияний на сердце бла¬
гоприятствует возникновению кругов reentry в предсердиях
путем укорочения потенциала действия и рефрактерного пе¬
риода, а также замедления проводимости в них [12, 16, 17]. В
многочисленных экспериментальных исследованиях модели¬
рование мерцательной аритмии осуществлялось с помощью
воздействия на предсердия ацетилхолина в различных кон¬
центрациях и электростимуляции блуждающих нервов [10, 11,
37], т.е. усиления парасимпатических влияний на предсердия.
При этом было установлено, что в создаваемых условиях даже
одной экстрасистолы может оказаться достаточно для индуци¬
рования ФП.L.Liu и S.Nattel [31] в экспериментах на собаках показали,
что вагусное возбуждение больше способствует инициации и
поддержанию ФП, чем симпатическое. Несмотря на сравни¬
мое укорочение эффективного рефрактерного периода пред¬
сердий, активация парасимпатической нервной системы уве¬
личивает еще и дисперсию рефрактерности, что также способ¬
ствует возникновению ФП. Описаны случаи возникновения
ФП и у человека, связанные со стимуляцией блуждающего
нерва во время массажа каротидного синуса [33].С другой стороны, активация симпатической нервной сис¬
темы с помощью p-адреностимуляторов также способна про¬
воцировать ФП [42]. Увеличение концентрации катехолами¬
нов приводит к усилению эктопической активности, что в ус¬
ловиях укорочения рефрактерности предсердий способствует
возникновению фибрилляции [26]. B.Brembilla-Perrot [13] со¬
общил о повышении индуцируемости ФП при программируе¬
мой и учащающей ЧПЭС предсердий на фоне внутривенной
капельной инфузии изопротеренола.Учитывая изложенное, можно предположить, что наиболее
аритмогенной для фибрилляции предсердий может оказаться
ситуация с одновременным усилением симпатических и пара¬
симпатических влияний на сердце [8].Мы предположили, что создание такой ситуации с помо¬
щью рефлекторных и фармакологических воздействий может
обеспечить воспроизведение ФП у значительно большего
числа больных, в том числе из тех 80—90 % пациентов, у кото¬
рых стандартный протокол ЧП ЭФИ не позволял индуциро¬
вать приступ аритмии. Таким образом можно значительно по¬
высить чувствительность стандартного протокола ЧП ЭФИ
без увеличения его «агрессивности». Основанный на этих
принципах расширенный протокол ЧПЭС у пациентов с ФП
был разработан и использован нами впервые [4].Первоначально у каждого больного с пароксизмальной
формой ФП оценивается соотношение симпатических и пара¬
симпатических влияний на сердце и выявляется, по возмож¬
ности, доминирование одного из них. Для этого нами был ис¬171
пользован метод вариационной пульсометрии [1, 3] в сочета¬
нии со стандартным протоколом ЧП ЭФИ.Следует подчеркнуть, что подобное разделение оказалось
непростым. В то время как у практически здоровых лиц ос¬
новные показатели вариационной пульсометрии, как правило,
находятся в пределах нормы или незначительно и однонаправ¬
ленно изменяются в соответствии с преобладанием вагусных
или симпатических влияний на ритм сердца, у лиц с ФП эти
показатели часто изменялись разнонаправленно. Это застави¬
ло нас для упрощения задачи взять за основу сочетания таких
ключевых показателей вариационной пульсометрии, как амп¬
литуда моды, индекс напряжения и коэффициент вариации.Нормотония:— амплитуда моды — от 30 до 50 %,— индекс напряжения — от 60 до 100 ед.,— коэффициент вариации — от 5 до 7 %.Ваготония:— амплитуда моды — менее 30 %,— индекс напряжения — менее 60 ед.,— коэффициент вариации — более 7 %.Симпатикотония:— амплитуда моды — более 50 %,— индекс напряжения — более 100 ед.,— коэффициент вариации — менее 5 %.При анализе результатов стандартного протокола ЧП ЭФИ
оценивали следующие показатели.Нормотония:— корригированное время восстановления функции сину¬
сового узла — от 250 до 400 мс,— величина эффективного рефрактерного периода атрио¬
вентрикулярного соединения — от 280 до 330 мс,— значение точки Венкебаха — от 150 до 180 имп/мин.Ваготония:— корригированное время восстановления функции сину¬
сового узла — более 400 мс,— значение эффективного рефрактерного периода атрио¬
вентрикулярного соединения — более 330 мс,— точка Венкебаха — менее 150 имп/мин.Симпатикотония:— корригированное время восстановления функции сину¬
сового узла — менее 250 мс,— значение эффективного рефрактерного периода атрио¬
вентрикулярного соединения — менее 280 мс,— точка Венкебаха — более 180 имп/мин.172
Среди обследованных нами 240 больных с документиро¬
ванными спонтанными пароксизмами ФП перечисленные
критерии позволили констатировать преобладание симпати¬
ческих влияний на сердце (1-я группа) у 154 человек (64,2 %),
доминирующее влияние парасимпатических влияний (2-я
группа) было выявлено у 86 человек (35,8 %).Несмотря на известные ограничения описанного способа
разделения лиц с пароксизмами ФП в зависимости от тонуса
автономной нервной системы, ключевые показатели вариаци¬
онной пульсометрии и чреспищеводной электростимуляции
предсердий в сложившихся группах достоверно (р<0,05) раз¬
личались (табл. 9.1).Таблица 9.1. Основные параметры вариационной пульсометрии и
ЧП ЭФИ у больных с пароксизмальной формой мерцательной аритмии
на фоне преобладания симпатических (1-я группа) и вагусных (2-я
группа) влияний на сердцеМетодика исследования
и показательГруппа обследованных1-я, п=1542-я, п=86Вариационная пульсометрия
АМо, %ТІ, ед.V, %ЧПЭС левого предсердия
КВВФСУ, мс
ЭРП ABC, мс
ТВ, имп/мин68,3±3,5357,6±28,12,8±0,2243,8±16,3
272,1±8,5
184,6±6,237,9±2,0*74,6±4,4*4,2±0,4*348,7±25,1*321,4±9,9*171,3±5,8*Примечание. АМо — амплитуда моды; ТІ — индекс напряжения;
V — коэффициент вариации; КВВФСУ — корригированное время вос¬
становления функции синусового узла; ЭРП ABC — эффективный реф¬
рактерный период атриовентрикулярного соединения; ТВ — точка Вен-
кебаха; * р<0,05 при сравнении показателей 1-й и 2-й групп.У больных с симатикотонией устойчивые пароксизмы мер¬
цательной аритмии в рамках стандартного протокола ЧП
ЭФИ с использованием одиночных и парных программиро¬
ванных предсердных экстрастимулов были индуцированы у 48
человек (33,1 % случаев).При невозможности индуцирования пароксизма фибрил¬
ляции предсердий у этих больных ЧП ЭФИ повторялось на
фоне активации парасимпатической системы с помощью
пробы Вальсальвы. Такой подход с искусственным усилени¬
ем вагусных влияний на сердце позволял дополнительно ин¬173
дуцировать устойчивый приступ фибрилляции предсердий
одиночными и парными преждевременными стимулами у
4,5 % больных с исходным повышением симпатического то¬
нуса.При неэффективности программированной стимуляции
предсердий одиночными и парными экстрастимулами мы
переходили к использованию «агрессивных» методов ЧПЭС
предсердий, применение которых позволило нам индуциро¬
вать пароксизм фибрилляции предсердий еще у 46,7 % боль¬
ных.В случаях неэффективности «агрессивных» методов ЧПЭС
предсердий они повторялись на фоне проведения пробы Валь-
сальвы, что приводило к возникновению устойчивого парок¬
сизма фибрилляции предсердий у всех ранее резистентных
больных.Чрезвычайно интересно отметить, что у больных с преоб¬
ладанием парасимпатических влияний на сердце программи¬
рованная ЧПЭС предсердий одиночными и парными экстра¬
стимулами при частоте базового ритма от 100 до 140 имп/мин
не индуцировала устойчивую фибрилляцию предсердий ни у
одного больного.Повторение данного протокола на фоне пробы Вальсаль-
вы, дополнительно усиливавшей ваготонию, также не приво¬
дило к развитию мерцательной аритмии.При невозможности индуцирования пароксизма ФП у
больных с парасимпатикотонией в рамках стандартного про¬
токола ЧП ЭФИ с использованием одиночных и парных про¬
граммированных предсердных экстрастимулов ЧП ЭФИ по¬
вторялось на фоне активации симпатических влияний на
сердце с помощью внутривенной инфузии изопротеренола
с минимальной скоростью 1 мкг/кг/мин. ЧП ЭФИ выпол¬
нялось в первые минуты внутривенной инфузии изопроте¬
ренола.Такой подход с искусственным усилением симпатических
влияний на сердце позволил индуцировать устойчивый при¬
ступ ФП одиночными и парными преждевременными стиму¬
лами у 38,4 % больных с исходным повышением парасимпати¬
ческого тонуса.В случаях неэффективности программированной стимуля¬
ции предсердий одиночным и парным экстрастимулом приме¬
нялись «агрессивные» методы ЧПЭС. Они позволили индуци¬
ровать устойчивый пароксизм ФП еще у 46,5 % больных с до¬
минированием парасимпатических влияний на сердце.Вместе с тем даже «агрессивные» способы электростимуля¬
ции не индуцировали устойчивое пароксизмальное мерцание
предсердий 15,1 % больных этой группы. У них была повторно
выполнена «агрессивная» ЧПЭС предсердий на фоне вну¬
тривенной капельной инфузии изопротеренола со скоростью174
1 мкг/кг/мин, что позволяло провоцировать ФП во всех слу¬
чаях.Несмотря на осторожное и кратковременное проведение
инфузии изопротеренола, нам не удалось избежать побочных
эффектов, характерных для этого (3-адреномиметика. У 31,4 %
больных на фоне введения препарата отмечалось сердцебие¬
ние, у 10,5 % наблюдалась преходящая желудочковая экстра-
систолия, у 10,5 % возникало чувство нехватки воздуха, в
9,3 % случаев инфузия сопровождалась ощущением тревоги,
страха, тремора, слабости и тошноты. У 4,7 % пациентов с
ишемической болезнью сердца возник приступ стенокардии,
который купировался самопроизвольно (без применения
нитроглицерина) после прекращения введения изопротерено¬
ла. Резких изменений артериального давления (З-адреномиме-
тик не вызывал. Как правило, наблюдалась лишь тенденция к
повышению систолического артериального давления на фоне
стабильного или немного (на 5—10 мм рт.ст.) снижавшегося
диастолического давления.Итоговые результаты моделирования устойчивой ФП у лиц
с частыми ее спонтанными пароксизмами при проведении ЧП
ЭФИ сердца, в том числе на фоне искусственной активации
вегетативных влияний, приведены в табл. 9.2.Таблица 9.2. Результаты индуцирования устойчивых пароксизмов
ФП во время ЧП ЭФИСпособэлектростимуляцииГруппа обследованных1-я, п== 1542-я, п:=86УП ФП, п%УП ФП, п%Программированная5133,100Программированная +5837,700проба ВальсальвыПрограммированная + 3338,4введение изопротеренола«Агрессивная»7246,74046,5«Агрессивная» +2415,6 проба Вальсальвы«Агрессивная» + 1315,1введение изопротеренолаПримечание. УП ФП — устойчивая пароксизмальная ФП; — ис¬
следование не проводилось.Таким образом, нам удалось показать, что у больных с па¬
роксизмальной формой ФП одновременное усиление симпа¬175
тических и парасимпатических влияний на сердце создает оп¬
тимальные условия для индуцирования пароксизма во время
ЧП ЭФИ и может позволить оценивать протективное, а также
прогнозировать противорецидивное действие антиаритмичес¬
ких препаратов у всех пациентов. При искусственной актива¬
ции вегетативных влияний на сердце у 37,7 % больных с пре¬
обладанием симпатических и 38,4 % пациентов с усилением
вагусных влияний на сердце для индуцирования устойчивого
пароксизма мерцательной аритмии достаточно программиро¬
ванной ЧПЭС предсердий, причем в это число не входят11,4 % от общего количества больных, у которых мерцатель¬
ная аритмия провоцируется такой же электростимуляцией в
обычных условиях.Важным результатом проведенного исследования являет¬
ся доказательство повышения частоты возникновения фиб¬
рилляции предсердий при их программированной электро¬
стимуляции в период одновременного усиления вагусных и
адренергических влияний на сердце. При таком способе про¬
воцирования фибрилляции предсердий создается ситуация,
подобная той, в которой у больных возникают спонтанные
пароксизмы этой аритмии. Кратковременный характер одно¬
временной активизации вегетативных влияний на сердце
предопределял и меньшую устойчивость фибрилляции пред¬
сердий, индуцированной программированной электростиму¬
ляцией, что полностью согласуется с экспериментальными
данными [20].Полученные нами результаты позволяют говорить о моде¬
ли в известной степени управляемой фибрилляции предсер¬
дий у человека, позволяющей тестировать антиаритмические
препараты, быстро выбирая наиболее эффективный из них
для длительной противорецидивной терапии.Напротив, при использовании для индуцирования при¬
ступа мерцательной аритмии «агрессивной» электростимуля¬
ции предсердий не только не создается ситуация, встречаю¬
щаяся в реальной жизни пациентов, но и возникают гораздо
более устойчивые пароксизмы [20]. Поэтому преимущества¬
ми примененного нами способа являются не только возмож¬
ность индуцирования устойчивой фибрилляции предсердий у
всех больных с частыми ее спонтанными пароксизмами, но и
меньшая «травматизация» больного, а также меньшие про¬
блемы для медицинского персонала при купировании арит¬
мии.Воспроизводившиеся во время ЧП ЭФИ устойчивые па¬
роксизмы фибрилляции предсердий, как правило, купиро¬
вались спонтанно или легко устранялись внутривенным вве¬
дением пропафенона (2 мг/кг за 10 мин) или прокаинамида
(12 мг/кг не менее чем за 20 мин).176
9.4. Медикаментозная профилактика
рецидивов фибрилляции предсердий у больных
с пароксизмальной формой мерцательной
аритмии с помощью серийного тестирования
антиаритмических препаратов в условиях ЧП ЭФИДо середины 80-х годов подбор эффективного антиаритми-
ческого препарата у каждого больного с пароксизмальной
формой мерцательной аритмии осуществлялся методом «проб
и ошибок», часто растягиваясь на длительное время. С внедре¬
нием в клиническую практику метода ЧП ЭФИ, позволяюще¬
го провоцировать приступы ФП, свойственные больным в по¬
вседневной жизни, появилась возможность оценивать инди¬
видуальную эффективность различных постоянно принимае¬
мых антиаритмических препаратов (серийное тестирование
эффективности антиаритмических препаратов в условиях ЧП
ЭФИ).Первый этап метода — контрольное исследование, кото¬
рое, как описано ранее, выполняется на «чистом фоне», т.е.
без приема антиаритмических препаратов, которые отменяют¬
ся за 48 ч до начала исследования (за исключением амиодаро¬
на и сердечных гликозидов, период отмены которых равен
10—14 сут). Затем с помощью методов ЧПЭС оценивается воз¬
можность провокации приступа ФП. Если попытка удается,
включается программа серийного тестирования антиаритми¬
ческих препаратов в условиях ЧП ЭФИ.Нередко индуцированный приступ мерцательной аритмии
прекращается спонтанно, однако часто его приходится купи¬
ровать внутривенным введением того или иного антиаритми-
ческого препарата, и лишь в редких случаях возникает необхо¬
димость прибегать к кардиоверсии.Повторную попытку провокации приступа мерцательной,
так же как и пароксизмальной, аритмии с помощью установ¬
ленного ранее режима ЧПЭС предсердий предпринимают не
ранее чем на 3—5-й день от начала приема антиаритмического
препарата в средних терапевтических дозах (для амиодарона —
10—14 дней) с учетом анамнестических данных об эффектив¬
ности проводившейся ранее антиаритмической терапии.Далее, как и при пароксизмальной аритмии, если препарат
предотвращает провоцирование устойчивого приступа (более
30 с) либо индуцируются лишь отдельные эхо-возбужден ИЯ,
можно с большой долей вероятности считать, что он обеспе¬
чивает профилактическое антиаритмическое действие и явля¬
ется индивидуально эффективным.Если этого не происходит, назначается следующий анти¬
аритмический препарат. Интервал между исследованиями
должен быть не меньше 5 периодов полу выведен ия предшест¬12—1279177
вующего препарата. В связи с этим тестировать антиаритми-
ческую эффективность амиодарона целесообразно в послед¬
нюю очередь. Процедура повторяется до тех пор, пока не вы¬
являются 1—2 индивидуально эффективных антиаритмичес¬
ких препарата либо не исчерпываются возможности медика¬
ментозной антиаритмической терапии.К сожалению, критерии эффективности долгосрочной ме¬
дикаментозной профилактики рецидивов фибрилляции пред¬
сердий достаточно разнородны. Полное отсутствие спонтан¬
ных приступов мерцательной аритмии при условии хорошей
переносимости, несомненно, является свидетельством хоро¬
шей эффективности антиаритмического препарата.Удовлетворительным эффектом долговременной профи¬
лактической антиаритмической терапии ФП можно считать:— значительное урежение пароксизмов мерцательной
аритмии, когда их частота не превышает одного присту¬
па в 2—3 мес;— существенное уменьшение продолжительности присту¬
пов, обусловленное их спонтанным прекращением;— более легкую переносимость приступа в связи с мень¬
шей частотой сердечных сокращений во время приступа.При неудовлетворительном эффекте долговременной про¬
филактической медикаментозной терапии ФП не наблюдается
существенных изменений в частоте или тяжести пароксизмов,
возможно появление побочных эффектов препаратов либо
признаков их проаритмического действия.К сожалению, приходится констатировать, что в настоя¬
щее время оценка эффективности подбора противорецидив-
ной терапии пароксизмальной формы ФП с помощью методи¬
ки серийного тестирования антиаритмических препаратов в
условиях ЧП ЭФИ недостаточно разработана.В течение ряда лет происходят дискуссии о том, насколько
индуцированный пароксизм ФП соответствует спонтанно воз¬
никшему, а следовательно, насколько адекватна проводимая
профилактическая антиаритмическая терапия, назначаемая на
основании результатов метода [23, 24]. Этот вопрос особенно
актуален для «агрессивных» режимов ЧПЭС предсердий, когда
могут индуцироваться приступы фибрилляции предсердий,
неидентичные спонтанным [7]. Следовательно, и профилакти¬
ческая антиаритмическая терапия у больных с пароксизмаль¬
ной формой ФП, назначаемая, исходя из результатов «агрес¬
сивных» методов индукции аритмии, может оказаться неаде¬
кватной.Некоторые авторы предлагают считать критериями протек-
тивного действия антиаритмических препаратов при использо¬
вании «агрессивных» режимов ЧПЭС предсердий при пароксиз¬
мальной форме ФП невозможность воспроизведения устойчи¬178
вой (более 30 с) мерцательной аритмии и увеличение частотного
порога индуцирования аритмии в 2 раза. Вряд ли можно при¬
знать такое использование «агрессивных» режимов стимуляции
правомочным [5, 6, 7]. Вероятно, именно с этим связана одна из
причин несоответствия результатов тестирования антиаритми¬
ческих препаратов в условиях ЧП ЭФИ и эффективности дли¬
тельного приема с целью предупреждения ФП [7].Учитывая приведенные выше сведения об электрофизио-
логических механизмах мерцательной аритмии, можно пред¬
положить, что критическими компонентами и уязвимым пара¬
метром ФП являются продолжительность рефрактерного пе¬
риода предсердий и скорость проведения возбуждения, а мо¬
лекулярными мишенями воздействия служат ионные токи IK
и INa. Логично предположить, что в лечении этого вида арит¬
мии наиболее эффективными должны быть антиаритмические
препараты, либо замедляющие скорость внутрипредсердного
проведения, либо увеличивающие рефрактерность миокарда
предсердий, либо сочетающие эти влияния.Не вызывает сомнений, что наиболее эффективными и
широко используемыми антиаритмическими препаратами,
предупреждающими рецидивирование ФП, являются анти¬
аритмические препараты 1C, IA и III классов: блокаторы Na-
каналов (хинидин, прокаинамид, дизопирамид, пропафенон,
этацизин, флекаинид) и блокаторы К-каналов (амиодарон, d/1
соталол, дофетилид, ибутилид). Однако, учитывая их возмож¬
ное проаритмическое действие, нельзя полностью отказывать¬
ся от использования p-блокаторов в начале подбора эффек¬
тивной профилактической антиаритмической терапии. Не¬
смотря на то, что p-блокаторы могут оказывать профилакти¬
ческое антиаритмическое действие лишь у незначительного
числа больных с ФП, попытка их применения оправдана из-за
их безопасности.Прежде чем обсуждать профилактическую эффективность
различных антиаритмических препаратов, необходимо обра¬
тить внимание на тот факт, что у 25 % больных синусовый
ритм после кардиоверсии сохраняется в течение 6—12 мес
(рис. 9.5) на фоне приема плацебо [18].Другой важный момент медикаментозной профилактики
рецидивов ФП, который, к сожалению, не имеет какого-либо
удовлетворительного объяснения, заключается в том, что с те¬
чением времени активность первоначально эффективного
антиаритмического препарата существенно снижается и врач
вновь оказывается перед проблемой поиска нового эффектив¬
ного антиаритмического средства.С патофизиологических позиций «Сицилианского гамби¬
та» наиболее эффективными антиаритмическими препарата¬
ми, предупреждающими рецидивы, должны быть блокаторы
Na-каналов (препараты I класса).12*179
8070 -657875606050545050 5048404430201025їїсао.оОПлацебососмИ:О)gс8(ОэЕSа:юI8О)соосSсмсоIIс3ODф"О>»§соIIсОсмаоIIсфсо00¥сффДизопирамид
300-450 мг/сХинидин600-1200 мг/ссм8>т—ЛФ1ОосмIIс3О)ф?пз€ОспФлекаинид200-300 мг/сямс76*£о>соIIСго"SПропафенон
450-900 мг/сРис. 9.5. Профилактика дэецидивов ФП антиаритмичсскими препара¬
тами 1 класса в течение 6—12 мес.Анализ литературы, посвященной вопросу сравнительной
эффективности профилактики рецидивов мерцательной арит¬
мии с помощью антиаритмических препаратов I класса, на¬
значавшихся эмпирическим путем без использования метода
серийного тестирования, представлен на рис. 9.5.Наибольшая эффективность в профилактике рецидивов
ФП наблюдается при применении пропафенона (1C класс) в
суточной дозе 450—900 мг (эффективность, по данным разных
авторов, равна 67—91 %) [29, 39].Несколько уступает пропафенону другой представитель 1C
класса — флекаинид (эффективность в суточной дозе 200—
300 мг равна 60—65 %) [14, 38].Надежность профилактики рецидивов ФП антиаритмичес-
кими препаратами IA класса ниже и колеблется в пределах180
90 г858070605040ЗО2010_ 79?зСП"ОоО7879юCD14ССО00О)£2оIIссоо>я■Л-*0)о(ОIIсоS^ тЯфЪсл35552?о?ээ378&со"О)О)Ефсс8ТГсоО)о>яфсяЕIво01ЯфсоО251 ГДофетилид
500-1000мкг/сАмиодарон
200-400 мг/сd/1 Соталол
160-960 мг/сПлацебоРис. 9.6. Профилактика рецидивов ФП антиаритмическими препара
тами III класса в течение 6—12 мес.50 %, при этом эффективность хинидина (600—1200 мг в сут¬
ки) и дизопирамида (300—450 мг в сутки) приблизительно
одинакова и колеблется в пределах 44—54 % [18, 28].С патофизиологических позиций «Сицилианского гамби¬
та» не менее эффективными, чем блокаторы Na-каналов, яв¬
ляются антиаритмические препараты III класса, блокирующие
К-каналы.Анализ литературы, посвященной вопросу сравнительной
эффективности профилактики рецидивов мерцательной арит¬
мии с помощью антиаритмических препаратов III класса, на¬
значавшихся эмпирическим путем без использования метода
серийного тестирования, представлен на рис. 9.6.Однако необходимо отметить, что антиаритмические пре¬
параты, блокирующие К-каналы и удлиняющие процесс репо¬
ляризации, имеют один существенный недостаток: их элек-
трофизиологические свойства наиболее сильно выражены при
невысоких частотах ритма сердца, а при относительно частом181
ритме их способность удлинять реполяризацию существенно
ослабевает.Первое место в профилактике рецидивов ФП среди пре¬
паратов III класса занимает амиодарон (эффективность в су¬
точной дозе 200—400 мг приближается к 80 %) [22, 41]. D/1 со¬
талол в дозе от 160 до 960 мг в сутки предупреждает возникно¬
вение рецидивов ФП примерно у 50—55 % больных [28, 36];
близок к нему по эффективности (60 % успеха) и новый анти-
аритмический препарат III класса — дофетилид.Эффективность коротких курсов антиаритмических препара¬
тов различных классов для профилактики рецидивов фибрилля¬
ции предсердий на фоне активации вегетативных влияний на
сердце у больных с пароксизмальной формой мерцательной арит¬
мии. С целью выбора индивидуально эффективной длительной
медикаментозной профилактики пароксизмов ФП нами с по¬
мощью метода серийного тестирования в условиях ЧП ЭФИ
(3000 процедур) было проведено плацебо контролируемое ис¬
следование 7 наиболее широко используемых в Российской
Федерации антиаритмических препаратов различных классов
(хинидин, этацизин, аллапинин, пропафенон, пропранолол, со¬
талол и амиодарон) у 471 больного с пароксизмальной формой
мерцательной аритмии на фоне различных заболеваний сердца
(ИБС, гипертоническая болезнь, ревматические пороки, кар-
диомиопатии), а также при отсутствии какого-либо органи¬
ческого поражения сердца. Суточная доза хинидина составля¬
ла 400—800 мг, этацизина — 100—150 мг, аллапинина — 75—
100 мг/с, пропафенона — 450—900 мг, пропранолола — 80—
120 мг, соталола — 160—320 мг, амиодарона — 600—800 мг.Во время исследования протективного действия антиарит¬
мических препаратов при коротком курсовом приеме у 31 па¬
циента с пароксизмальной формой ФП, воспроизводившейся
при программированной электростимуляции предсердий без
применения искусственной активации автономных влияний
на сердце (группа больных с выраженной электрической не¬
стабильностью миокарда предсердий), наблюдалась высокая
антиаритмическая эффективность всех тестировавшихся ле¬
карственных средств (рис. 9.7).Программированная ЧПЭС предсердий в режиме, вызы¬
вавшем устойчивый пароксизм ФП на «чистом фоне», т.е. в
период отмены антиаритмических препаратов, не позволяла
индуцировать мерцательную аритмию при приеме хинидина и
амиодарона у 30 (96,8 %) из 31, этацизина, аллапинина и про¬
пафенона — у 29 (96,7 %) из 30, соталола — у 28 (93,3 %) из 30,
пропранолола — у 17 (63 %) из 27 больных. В редких случаях
мерцательная аритмия спонтанно купировалась в сроки до
5 мин, и лишь пароксизмы, возникавшие на фоне приема про¬
пранолола, отличались достаточно высокой устойчивостью.
Прием плацебо ни в одном случае не препятствовал повторно-182
100908070605040302010г 96.896.796,796,796.8N=3163,093.3хsXx1s§соіРис. 9.7. Эффективность антиаритмических препаратов различных
классов при коротком курсовом приеме в группе больных с выражен¬
ной электрической нестабильностью миокарда.му индуцированию устойчивого приступа мерцательной арит¬
мии с помощью программированной ЧПЭС предсердий.Учитывая такой необычно высокий протективный эффект
всех тестированных антиаритмических препаратов, не соот¬
ветствующий реальным возможностям медикаментозной про¬
филактики пароксизмальной формы ФП, а также предполагая
важную роль вегетативных влияний в развитии приступов
мерцательной аритмии в реальной жизни, попытку индуциро¬
вания ФП с помощью программированной стимуляции повто¬
ряли на фоне активации автономных влияний на сердце. Для
этого у лиц с преобладанием симпатикотонии использовали
пробу Вальсальвы, а у пациентов с парасимпатикотонией —
внутривенное капельное введение изопротеренола. В этой си¬
туации антиаритмическая эффективность короткого курса
антиаритмических препаратов существенно снижалась. Так,
амиодарон оказался эффективным у 23 (76,7 %) из 30, хини-
дин, этацизин и аллапинин — у 21 (70 %) из 30, пропафенон —
у 19 (63,3 %) из 30, соталол — у 18 (60 %) из 30, а пропрано-
лол — у 8 (47,1 %) из 17 больных (рис. 9.8).Таким образом, многообещающие результаты оценки про-
тективного эффекта различных антиаритмических препаратов,
получаемых при применении «неагрессивного» протокола
ЧПЭС предсердий без учета вегетативных влияний на сердце,
дают неадекватно оптимистичный прогноз их противореци-183
80706076,6707070N=3063,360504047.1ЗО2010хsXsёXXnXI§іs.сaСоРис. 9.8. Эффективность антиаритмических препаратов различных
классов при коротком курсовом приеме на фоне активации автоном¬
ных влияний на сердце в группе больных с выраженной электричес¬
кой нестабильностью миокарда.дивного действия. Это подтверждается заметным снижением
эффективности антиаритмических препаратов при активации
вегетативных влияний на сердце, при этом она соответствует
ожидаемому профилактическому действию при длительном
лечении.В группе больных с преобладанием симпатических влия¬
ний на сердце, у которых в обычных условиях программиро¬
ванная стимуляция предсердий была не способна индуциро¬
вать ФП и пароксизм мерцательной аритмии с помощью этого
метода электрической стимуляции предсердий возможно было
вызвать лишь на фоне пробы Вальсальвы, эффективность
антиаритмических препаратов, тестированных во время ко¬
роткого курсового приема, представлена на рис. 9.9.При программированной стимуляции предсердий одиноч¬
ным либо парным экстрастимулом пароксизм мерцательной
аритмии не удалось индуцировать при приеме этацизина в 52
(89,7 %) из 58, аллапинина — в 50 (87,7 %) из 57, хинидина —
в 48 (85,7 %) из 56, амиодарона — в 39 (67,2 %) из 58, пропа-
фенона — в 33 (58,9 %) из 56, соталола — в 31 (54,4 %) из 57,
пропранолола в 16 (31,4 %) из 51 случая, а использование пла¬
цебо не давало антиаритмического эффекта ни у одного из 26
больных.184
I КЛАСС II КЛАСС III КЛАССI I Программированная стимуляция предсердий одиночным и парным экстрастимулом
Х//А "Агрессивная” стимуляция предсердийРис. 9.9. Эффективность антиаритмических препаратов различных
классов при коротком курсовом приеме у больных с преобладанием
симпатических влияний на сердце на фоне пробы Вальсальвы.В то же время при проведении более «агрессивной» стиму¬
ляции предсердий эффективность всех тестированных анти¬
аритмических препаратов была значительно ниже (см. рис.
9.9). На фоне приема амиодарона синусовый ритм сохранялся
лишь у 5 (12,8 %) из 39 больных, на фоне приема хинидина —
у 5 (10,4 %) из 48 больных; этацизин показал себя эффектив¬
ным у 5 (9,6 %) из 52, аллапинин — у 4 (8 %) из 50, пропрано-
лол — у 1 (6,3 %) из 16, пропафенон — у 2 (6,1 %) из 33 и сота-
лол — лишь у 1 (3,2 %) из 31 больного. Столь слабый профи¬
лактический эффект тестировавшихся препаратов, разумеется,
был связан не с низкой их антиаритмической активностью, а,
по-видимому, с неадекватно сильным дестабилизирующим
воздействием на предсердия при применении «агрессивных»
режимов электростимуляции.Эффективность антиаритмических препаратов, тестиро¬
ванных во время короткого курсового приема, в группе боль¬
ных с преобладанием парасимпатических влияний на сердце,
на фоне внутривенного введения изопротеренола представле-185
90
80
70
60
50
40
30 h-
20
10
О_ 78.18aгz78,87.7ахsс«о81,87.4ELГОIN=3371,934,58.7іасас87.910.3zа34,5Огос;с:I КЛАСС II КЛАСС III КЛАССО Программированная стимуляция предсердий одиночным и парным экстрастимулом
£22 "Агрессивная" стимуляция предсердийРис. 9.10. Эффективность антиаритмических препаратов различных
классов при коротком курсовом приеме у больных с преобладанием
парасимпатических влияний на сердце на фоне внутривенного введе¬
ния изопротеренола.на на рис. 9.10 (условия те же, что в группе больных с преоб¬
ладанием симпатических влияний на сердце).Используя программированную стимуляцию предсердий
одиночным либо парным экстрастимулом, мерцательную
аритмию не удалось индуцировать у 29 (87,9 %) из 33 пациен¬
тов, получавших амиодарон, у 27 (81,8 %) из 33 — этацизин, у
26 (78,8 %) из 33 — аллапинин, у 25 (78,1 %) из 32 — хинидин,
у 23 (71,9 %) из 32 — пропафенон, у 18 (56,3 %) из 32 — сота¬
лол и у 10 (34,5 %) из 29 — пропранолол, тогда как на фоне
плацебо устойчивые пароксизмы аритмии развивались у всех
24 больных.При проведении более «агрессивной» стимуляции пред¬
сердий у этих больных эффективность всех тестированных
антиаритмических препаратов была значительно ниже (см.
рис. 9.10). На фоне приема амиодарона синусовый ритм со¬
хранялся лишь у 3 (10,3 %) из 29 больных, на фоне приема
хинидина — у 2 (8,0 %) из 25, этацизин был эффективен у 2
(7,4 %) из 27, аллапинин — у 2 (7,7 %) из 26, пропафенон —
у 2 (8,7 %) из 23, пропранолол и соталол были неэффективны
вообще.186
1084N=687,96.56,74.8 4,83.36.3Рис. 9.11. Эффективность антиаритмических препаратов различных
классов при коротком курсовом приеме у больных, индуцирование
ФП у которых было возможно только с помощью «агрессивных» ме¬
тодов ЧПЭС предсердий.Таким образом, как указано выше, для оценки антиаритми¬
ческого эффекта различных препаратов с помощью метода их
серийного тестирования следует ограничиваться использовани¬
ем только «неагрессивных» режимов стимуляции предсердий.
Применение же «агрессивных» методов стимуляции предсердий
нецелесообразно, поскольку они индуцируют фибрилляцию
предсердий, несмотря на прием антиаритмических препаратов.У 63 пациентов с пароксизмальной формой ФП, воспроиз¬
водившейся на «чистом» фоне только при помощи «агрессив¬
ных» методов ЧПЭС предсердий, тестировавшиеся антиарит¬
мические препараты при коротком курсовом приеме не проде¬
монстрировали какого-либо достаточно выраженного анти¬
аритмического эффекта. Эффективность амиодарона состави¬
ла 7,9 % (у 5 из 63 больных), эффективность пропафенона —
6,7 % (у 4 из 60), эффективность хинидина — 6,5 % (у 4 из 62),
эффективность соталола — 6,3 % (у 4 из 63), этацизина и алла-
пинина — 4,8 % (у 3 из 63), пропранолола — 3,3 % (у 2 из 60)
при отсутствии протективного эффекта плацебо ни у одного
из обследованных (рис. 9.11).Оценивая способность указанных антиаритмических пре¬
паратов предотвращать индуцирование мерцательной аритмии187
при использовании «агрессивных» режимов ЧПЭС, мы пола¬
гаем, что этот метод дает менее точный прогноз противореци-
дивного эффекта длительной терапии по сравнению с про¬
граммированной стимуляцией. В связи с тем что «агрессив¬
ные» режимы ЧПЭС предсердий вызывают мерцательную
аритмию на фоне антиаритмической терапии у абсолютного
большинства пациентов, неадекватность этого режима тести¬
рования лекарственных препаратов очевидна.Подтверждением могут служить результаты наших иссле¬
дований, в которых мы провели анализ зависимости долговре¬
менного эффекта антиаритмического лечения, подобранного
методом серийного тестирования антиаритмических препара¬
тов, от режима индукции приступа ФП у 205 больных с часто
рецидивирующими пароксизмами мерцательной аритмии
(табл. 9.3).Таблица 9.3. Зависимость долговременного эффекта антиарнтми-
ческой терапии от степени «агрессивности» режима электрокардиости¬
муляции, индуцирующего пароксизм ФПГруппабольныхРежим индуцирования
пароксизма фибрилляции
предсердийЧислобольных,пЭффективностьлеченияР3—6 мес6—24 месп%п%1-яОдиночный экстрастимул
на фоне базовой частоты,
100 имп/мин3736963286Н.д.2-яОдиночный экстрастимул
на фоне увеличения базо¬
вой частоты3937943488Н.д.3-яЗалп программированных
экстрастимулов на фоне ба¬
зовой частоты 100 имп/мин413892,526630,054-яЗалп программированных
экстрастимулов на фоне
увеличения базовой частоты43388920470,055-яЗалп асинхронных стимулов
частотой 300—400 имп/мин454088,518410,01Итого...2051527413164Примечание. Н.д. — не достоверно.Анализ результатов исследований показал, что чем «агрес¬
сивнее» были режимы чреспищеводной стимуляции предсер¬
дий, которые требовались для индукции фибрилляции пред¬
сердий во время первоначального (базового) ЧП ЭФИ, тем188
хуже были результаты отдаленной профилактической терапии,
подобранной во время серийного тестирования антиаритми¬
ческих препаратов. Если фибрилляция предсердий первона¬
чально индуцировалась учащающей или программированной
стимуляцией предсердий одиночным либо парным экстрасти¬
мулом, то надежность длительного профилактического приема
антиаритмического препарата, показавшего себя эффектив¬
ным в процессе серийного тестирования, достигала 86—88 %.
Если же для первоначальной индукции приступа фибрилля¬
ции предсердий было необходимо использовать «высокоагрес¬
сивные» методы электрической стимуляции предсердий, то
надежность длительного профилактического приема анти¬
аритмического препарата, показавшего свою эффективность
в процессе серийного тестирования, снижалась до 47—64 %
(р <0,05).Анализ результатов серийного тестирования антиаритми¬
ческих препаратов различных классов показал, что у 108
(22,9 %) из 471 обследованного пациента явно преобладала
протективная активность какого-либо одного антиаритмичес¬
кого препарата, тогда как в 363 (77,1 %) случаях выявлялась
примерно равная эффективность двух или более лекарствен¬
ных средств. Это предоставляло возможность подбора наибо¬
лее приемлемого препарата для лечения каждого конкретного
больного с учетом противопоказаний, прогнозируемых побоч¬
ных эффектов и его стоимости.Эффективность длительной медикаментозной профилактики
рецидивов фибрилляции предсердий у больных с пароксизмаль¬
ной формой мерцательной аритмии. Анализ суммарной эффек¬
тивности длительной (от 6 мес до 6 лет) медикаментозной
профилактики рецидивов пароксизмов ФП (полное прекраще¬
ние приступов), индивидуально подобранной с помощью ме¬
тода серийного тестирования антиаритмических препаратов
различных классов у 295 больных (рис. 9.12), показал, что при
коротком курсовом приеме наибольшей суммарной антиарит¬
мической активностью в условиях серийного тестирования
препаратов с помощью ЧП ЭФИ обладают препараты 1C, IA и
III классов. Среди препаратов I класса наиболее эффективны
этацизин (81,2 % больных), аллапинин (78,9 %) и хинидин
(78,4 %); активность пропафенона несколько ниже (64,7 %).
Самым активным антиаритмическим препаратом III класса,
несомненно, является амиодарон, эффективность которого
(77,3 %) мало чем отличается от эффективности препаратов I
класса. Меньшая активность отмечена у соталола (49,6 %). Не¬
высока антиаритмическая эффективность и у представителя II
класса пропранолола (38,5 %).Таким образом, отмечено явное преимущество амиодарона
во время короткого и длительного курсового приема (73,3 %).
Длительная антиаритмическая активность другого представи-189
1 КЛАСС II КЛАСС III КЛАССI I Короткий курсовой прием Е2 Длительная профилактикаРис. 9.12. Сравнительная эффективность антиаритмических препара¬
тов различных классов при коротком курсовом приеме и при дли¬
тельной профилактике рецидивов ФП, подобранной методом серий¬
ного тестирования у больных с пароксизмальной формой ФП.теля препаратов III класса — соталола была существенно ниже
(45 %). Антиаритмические препараты I класса по длительной
антиаритмической эффективности отчетливо уступают амио-
дарону. Отсутствие рецидивов ФП наблюдалось у больных,
получавших этацизин (69,9 %), хинидин (62,8 %), аллапинин
(60,9 %), пропафенон (55,7 %).Важно отметить, что длительная профилактическая эффек¬
тивность всех изучавшихся антиаритмических препаратов была
ниже, чем антиаритмическая эффективность каждого из них во
время короткого курсового приема в процессе серийного тести¬
рования в условиях ЧП ЭФИ. Следует вновь подчеркнуть, что
феномен «ускользания эффективности антиаритмической тера¬
пии», когда с течением времени активность первоначально эф¬
фективного антиаритмического препарата существенно снижа¬
ется и врач вновь оказывается перед проблемой поиска нового
препарата, к сожалению, на сегодня не имеет какого-либо удов¬
летворительного объяснения. Возможно, что здесь, помимо осо¬
бенностей фармакокинетики и фармакодинамики антиаритми¬
ческих препаратов, необходимо учитывать регулярность приема190
пациентом назначенного препарата, а также естественное тече¬
ние основного заболевания и его осложнений, приведшего к
развитию ФП (эпизоды ишемии и некроза миокарда при ише¬
мической болезни сердца, прогрессирование процесса ремоде¬
лирования желудочков сердца и предсердий при их выраженном
структурном поражении и т.д.).Эффективность длительной медикаментозной профилактики
рецидивов фибрилляции предсердий в зависимости от этиологии
мерцательной аритмии. Оценка сравнительной эффективности
длительной профилактики рецидивов ФП антиаритмическими
препаратами различных классов связана со значительными
трудностями. Профилактическая эффективность может зави¬
сеть не только от различий в собственно антиаритмической
активности препаратов, но и от причин развития ФП (ишеми¬
ческая болезнь сердца, ревматические пороки, гипертоничес¬
кая болезнь, кардиомиопатии и т.д.). Естественно, что такие
заболевания, как тиреотоксикоз, активные воспалительные
поражения миокарда (ревматизм, миокардиты), должны выво¬
диться за рамки анализа.В настоящее время не вызывает сомнений, что эффектив¬
ность длительной профилактики рецидивов пароксизмальной
формы мерцательной аритмии зависит не только от собствен¬
ной противоаритмической активности антиаритмических пре¬
паратов, но и от многих других причин. К ним относятся на¬
личие и степень органического поражения клапанного аппа¬
рата, наличие и тяжесть структурного поражения миокарда,
наличие и тяжесть дисфункции левого желудочка.Одним из важнейших факторов является размер левого
предсердия. Если величина левого предсердия превышает 5 см,
то шансы на стойкое сохранение синусового ритма вне зави¬
симости от того, какой из антиаритмических препаратов ис¬
пользуется в качестве профилактической терапии, невелики.
Однако остается неясным, зависит ли эффективность профи¬
лактики рецидивов ФП от характера и тяжести заболевания,
приведшего к увеличению размеров левого предсердия, или
основным структурным фактором, влияющим на эффектив¬
ность длительной профилактики рецидивов мерцательной
аритмии, является только степень увеличения левого предсер¬
дия, а наличие и тяжесть органического поражения миокарда,
дисфункции левого желудочка имеют значение лишь для
оценки прогноза безопасности назначения того или иного
антиаритмического препарата (проаритмический эффект).На этот счет не существует единого мнения. На основании
данных, приведенных Gold и соавт. [22], представленных на
рис. 9.13, складывается впечатление, что профилактическая
антиаритмическая эффективность амиодарона, применяемого
в дозе 200—400 мг в сутки, не зависит от этиологии заболева¬
ния, на фоне которого возникают пароксизмы ФП.191
Амиодарон 200-400 мг/сут10080604020737791N*68н Ишемическая Ревматичес-
болезнь сердца кие порокисердца78711 "Г"Г ипертони- Идиопатичес-ческая кая мерцатель -болезнь пая аритмияТ83СиндромслабостисинусовогоузлаДругиеРис. 9.13. Зависит ли эффективность профилактики рецидивов ФП с
помощью амиодарона от ее этиологии?В то же время проведенный нами анализ эффективности
длительной профилактической терапии двумя наиболее актив¬
ными антиаритмическими препаратами I класса (этацизин в
дозе 100—150 мг в сутки и пропафенон в дозе 450—900 мг в
сутки) у 220 больных с пароксизмальной формой мерцатель¬
ной аритмии в зависимости от ее этиологии показал, что такая
зависимость существует (рис. 9.14).Наибольшая суммарная профилактическая эффективность
антиаритмических препаратов I класса была отмечена у боль¬
ных с идиопатической формой пароксизмальной ФП (85 %) и
у больных с гипертонической болезнью (77 %). Значительно
хуже были суммарные результаты длительной профилактики
рецидивов ФП у больных с ревматическими пороками сердца
(57 %) и ишемической болезнью сердца (44 %).Этацизин продемонстрировал примерно равную профи¬
лактическую эффективность во всех группах больных вне за¬
висимости от этиологии мерцательной аритмии (42—52 %), за
исключением больных с ишемической болезнью сердца, где
эффективность была крайне низкой (12 %).В то же время профилактическая эффективность пропа-
фенона оказалась самой незначительной у больных с ревма¬
тическими пороками сердца (15 %), тогда как у больных с
другой этиологией ФП она была примерно одинаковой (32—
37 %).Эффективность длительной медикаментозной профилактики
рецидивов фибрилляции предсердий в зависимости от типа до¬
минирования вегетативных влияний на сердце. Нами проведена
также оценка профилактической эффективности антиаритми-192
908070605040ЗО2010N=220854477571 ГИшемическая болезнь Ревматические
сердца (п=74) пороки сердца (п=53)Гипертоническая
болезнь (п=60)Идиопатическая
мерцательная
аритмия (п=33)I I Суммарная эффективностьЕ2 Этацизин ЕЗ ПролафенонРис. 9.14. Эффективность длительной профилактики рецидивов ФП
антиаритмическими препаратами I класса в зависимости от ее этио¬
логии.ческих препаратов различных классов в зависимости от типа
доминирования вегетативных влияний на сердце.Мы располагаем результатами длительного (не менее 2 лет)
наблюдения за 242 больными с ФП, непрерывно получавшими
противорецидивную терапию антиаритмическими препарата¬
ми, подобранными индивидуально по результатам серийного
тестирования препаратов при коротком курсовом приеме и с
учетом типа доминирования симпатической или парасимпати¬
ческой системы на сердце.При «вагусной форме» пароксизмальной ФП эффектив¬
ность этацизина (50—150 мг/сут), аллапинина (25—50 мг/сут)
и хинидина (400—600 мг/сут) достигала 85,3, 84,4 и 67,7 % со¬
ответственно (рис. 9.15) и была достоверно (р < 0,05) выше,
чем у антиаритмических препаратов II и III классов (пропра-
нолол, амиодарон и соталол).При «адренергической форме» пароксизмальной мерца¬
тельной аритмии пропранолол оказывал противорецидивное
действие только при манифестировавшей симпатикотонии.
Уже через 1 мес эффективность пропранолола снижалась па¬
раллельно ослаблению гиперсимпатикотонии. Лучший профи¬
лактический эффект у данной группы пациентов отмечен при
приеме амиодарона в дозе 1000—1400 мг в неделю (рис. 9.16).
Аритмии в течение 2 лет лечения не наблюдались у 85,7 %13—1279193
Рис. 9.15. Сравнительная эффективность длительной профилактики
рецидивов ФП антиаритмическими препаратами различных классов у
больных с «вагусным типом* вегетативных влияний на сердце.90ч80-7060-50-40-30-20-100- 55.64852,285,7756058,3XXZXсIXXпXX3.Рис. 9.16. Сравнительная эффективность длительной профилактики
рецидивов ФП антиаритмическими препаратами различных классов у
больных с «адренергическим типом* вегетативных влияний на сердце.194
I I Прекращение рецидивов мерцательной аритмииУ/Х Уменьшение частоты и (или) продолжительности пароксизмов
мерцательной аритмии > чем на 75 %Рис. 9.17. Сравнительная эффективность длительной профилактики
рецидивов ФП антиаритмическими препаратами различных классов у
больных со «смешанным типом» вегетативных влияний на сердце.больных, тогда как пропафенон и соталол существенно усту¬
пали ему (60 и 58,3 % соответственно).Вторичная профилактика рецидивов ФП у лиц со «сме¬
шанным типом» вегетативных влияний на сердце является
наиболее трудной (рис. 9.17). Даже амиодарон обеспечивал
прекращение рецидивов мерцательной аритмии лишь у 56,3 %
больных, а у 62,5 % больных его прием позволял добиться
уменьшения частоты и продолжительности пароксизмов мер¬
цательной аритмии более чем на 75 %. Нами были отмечены
сравнительно невысокие результаты профилактики рецидивов
ФП у лиц со смешанным типом вегетативных влияний на
сердце и другими антиаритмическими препаратами. Этацизин
полностью подавлял рецидивирование ФП у 45,5 % больных, а
у 68,2 % больных с его помощью удавалось достичь значитель¬
ного (на 75 %) снижения частоты и продолжительности эпизо¬
дов мерцательной аритмии. Аллапинин позволил добиться
этих результатов у 37,5 и у 50 % больных соответственно, про¬
пафенон — у 35,3 и 64,7 %, а соталол — у 31,8 и 63,6 %.13*195
I I Эффективность У7Л Побочные эффектыР5Я Кардиальные побочные эффекты Щ] Проаритмические эффектыРис. 9.18. Соотношение эффективности и безопасности антиаритми¬
ческих препаратов I и III классов у больных с ФП.Соотношение эффективности и безопасности длительной
медикаментозной профилактики рецидивов фибрилляции пред¬
сердий антиаритмическими препаратами различных классов у
больных с пароксизмальной формой мерцательной аритмииПри проведении долговременной антиаритмической тера¬
пии у больных с ФП чрезвычайно важна оценка эффективнос¬
ти и безопасности наиболее активных антиаритмических пре¬
паратов I и III классов. Их частота, по данным литературы,
приведена на рис. 9.18.Проаритмическое действие антиаритмических препаратов
во многом зависит от степени структурных изменений мио¬
карда. Существует достаточно большое количество факторов,
влияющих на эффективность и безопасность применения
антиаритмических препаратов I и III классов у больных с ФП.196
К факторам, снижающим безопасность применения антиарит¬
мических препаратов, могут быть отнесены структурные пора¬
жения миокарда (постинфарктный кардиосклероз, аневризма
левого желудочка, гипертрофия миокарда левого желудочка),
дисфункции левого желудочка, нарушения функции синусо¬
вого узла, нарушения проводимости, электролитные расстрой¬
ства, удлинение интервала Q—T.К сожалению, приходится признать, что ЧП ЭФИ не по¬
зволяет надежно выявлять проаритмические эффекты анти¬
аритмических препаратов, применяемых для профилактики
рецидивов ФП. Для этого необходимо использовать другие ис¬
следования, в частности холтеровское мониторирование ЭКГ.К проаритмическим эффектам мы относили учащение и
удлинение приступов ФП, снижение купирующего действия
ранее эффективного антиаритмического препарата. Сюда же
• относили появление других, ранее не регистрировавшихся на¬
рушений ритма сердца либо учащение имевшихся ранее над-
желудочковых и желудочковых аритмий, включая желудочко¬
вую экстрасистолию высоких градаций, эпизоды неустойчи¬
вой и устойчивой желудочковой тахикардии, в том числе и
типа torsades de pointes.Частота возникновения проаритмических эффектов на
фоне длительного приема антиаритмических препаратов раз¬
личных классов, использовавшихся нами для профилактики
пароксизмов мерцательной аритмии, приведена на рис. 9.19.
По нашим данным, наиболее часто проаритмические эффекты
отмечались при использовании этацизина (32 %) и хинидина
(27 %).Таким образом, к сожалению, медикаментозная антиарит¬
мическая терапия ФП не может быть признана достаточно эф¬
фективной.Перспективы ее совершенствования могут быть связаны с
несколькими направлениями дальнейших исследований.Во-первых, в будущих исследованиях необходимо диффе¬
ренцированно оценивать эффективность антиаритмической
терапии ФП и трепетания предсердий, поскольку электрофи-
зиологические механизмы этих аритмий различны.Во-вторых, целесообразно дифференцированно оценивать
эффективность медикаментозной антиаритмической терапии
в зависимости от варианта и длительности существования
ФП.В-третьих, в планируемых исследованиях нужно учитывать
характер и тяжесть структурных поражений сердца у больных
с ФП.Таким образом, лечение мерцательной аритмии остается и,
вероятно, еще долго будет оставаться серьезной проблемой.
Решение ее, по-видимому, лежит в комплексном использова¬
нии:197
Рис. 9.19. Частота возникновения проаритмических эффектов анти¬
аритмических препаратов I класса, использовавшихся для профилак¬
тики рецидивов ФП.— возможностей медикаментозной терапии, в том числе
вновь создаваемых на основе молекулярных биотехно¬
логий антиаритмических препаратов, целенаправленно
ориентированных на взаимодействие с конкретными
молекулярными мишенями на уровне клеточной мем¬
браны;— возможностей электрической стимуляции сердца (моно-
и бифокальная электрическая стимуляция предсердий);— возможностей имплантируемых предсердных кардиовер-
теров-дефибрилляторов;— возможностей метода радиочастотной катетерной абля¬
ции;— возможностей хирургической коррекции ФП (операции
«лабиринт» и «коридор»).'Список литературы1. Баевский P.M., Кириллов О.И., Клецкин С.З. Математический
анализ изменений сердечного ритма при стрессе. — М.: Наука,
1984. - 221 с.2. Гросу А.А., Шевченко Н.М., Жосан С.И. и др. Клиническое зна¬
чение мерцания-трепетания предсердий, индуцируемого электричес¬198
кой стимуляцией сердца через пищевод//Тер. арх. — 1989. — № 4. —
С. 75-78.3. Жемаитите Д.И., Телькснис JI. Анализ сердечного ритма. —
Вильнюс: Мокслас, 1982. — 130 с.4. Канорский С.Г., Скибицкий В.В., Кудряшов Е.А. Новые воз¬
можности оценки профилактической эффективности антиаритми¬
ческих препаратов у больных с пароксизмальной фибрилляцией
предсердий//Кардиология. — 1997. — № 3. — С. 42—46.5. Канорский С.Г. Пароксизмальная фибрилляция предсердий
(патогенетическое обоснование и оптимизация медикаментозного
лечения): Автореф. дис. ... д-ра мед. наук. — Краснодар, 1998.6. Попов С.В. Электрические методы диагностики, контроля ле¬
карственной терапии и лечения пароксизмальных тахикардий и тахи¬
аритмий: Автореф. дис. ... д-ра мед. наук. — Томск, 1996. — 95 с.7. Савенкова Г.М., Попов С.В., Антонченко И.В. и др. Лечение
пароксизмальной формы фибрилляции предсердий антиаритмичес¬
кими препаратами I класса, подобранными на основании данных
чреспищеводной электростимуляции//Вестн. аритмол. — 1995. —
№ 5. - С. 10-14.8. Федоров Б.М. Стресс и система кровообращения. — М.: Ме¬
дицина, 1990. — С. 320.9. Хасанов И.Ш., Шальдах М. Синхронная атриовентрикулярная
стимуляция сердца с применением единого двухкамерного электро-
да//Вестн. аритмол. — 1998. — № 7. — С. 12—20.10. Шарифов О.Ф., Розенштраух Л.В., Зайцев А.В. и др. Изучение
хронотопографии возбуждения на начальной стадии холинергичес-
кого мерцания предсердий в интактном сердце собаки//Кардиоло-
гия. - 1997. - № 4. - С. 43-71.11. Шусслер Р.Б., Хенд Д.Е., Бромберг В.И. и др. Функция пейсме-
кера, синоатриальное проведение и аритмии в изолированном пра¬
вом предсердии собаки при действии низких концентраций ацетил-
холина//Кардиология. — 1996. — № 6. — С. 58—71.12. Bayes de Luna A., Bayes-Genis A., Guindo J. et al. Mecanismes fa-
vorisant et declenchant la fibrillation auriculaire//Arch. Mai. Coeur.
Vaiss. - 1994. - Vol. 87, N 1. - P. 19-25.13. Brembilla-Perrot B. Value of oesophageal pacing in evaluation of
atrial arrhythmias//Europ. Heart J. — 1994. — Vol. 15, N 8. — P. 1085—
1088.14. Clementy J., Dulhoste M.N., Laiter C. et al. Flecainide acetate in
the prevention of paroxysmal atrial fibrillation: a nine-month follo-up of
more than 500 patients//Amer. J. Cardiol.— 1992.— N 70.— С. 44A—49A.15. Coumel P. Neural aspects of paroxysmal atrial fibrillation. Atrial
fibrillation: mechanisms and management/Eds R.H.Falk, P.J.Podrid. —
New York: Raven Press, 1992. — P. 109—126.16. Coumel P. Paroxysmal atrial fibrillation: disorder of autonomic
tone?//Eur. Heart J. — 1994. — Vol. 15, Suppl.A. — P. 9—16.17. Coumel P. Autonomic influences in atrial tachyarrhythmias//
J. Cardiovasc. Electrophysiol. — 1996. — Vol. 7, N 10. — P. 999—1007.18. Coplen S.E., Antman E.M., Berlin J.A. et al. Efficacy and safety of
quinidine therapy for maintenance of sinus rhythm after cardioversion: a
meta-analysis of randomized control trials//Circulation. — 1990. — Vol.
82. - P. 1106-1116.199
Глава 10ЧП ЭФИ У БОЛЬНЫХ С ЖЕЛУДОЧКОВЫМИПАРОКСИЗМАЛЬНЫМИТАХИКАРДИЯМИВ настоящее время не вызывает сомнений ценность внут¬
рисердечного электрофизиологического исследования у боль¬
ных с пароксизмальными желудочковыми тахикардиями. В то
же время исследователей, занимавшихся проблемами ЧПЭС,
не оставляла мысль попытаться применить этот неинвазивный
метод при желудочковых пароксизмальных тахикардиях. Ис¬
торически ЧПЭС берет свое начало с экспериментальных
работ P.Zoll [4], показавшего возможность электрической сти¬
муляции желудочков сердца через пищевод. В последующем
B.G.P.ShafirofF и F.Linder [3] в 1957 г. подтвердили эту возмож¬
ность, сообщив об успешной электрической стимуляции же¬
лудочков сердца через пищевод у 26 добровольцев. В дальней¬
шем появились сообщения об использовании метода в ком¬
плексе реанимационных мероприятий у больных с полной АВ
блокадой [1, 2].Однако использовать электрическую стимуляцию желудоч¬
ков сердца через пищевод у больных с рецидивирующими ус¬
тойчивыми желудочковыми тахикардиями, находящихся в со¬
знании, оказалось намного сложнее.Учитывая тот факт, что электрофизиологическим механиз¬
мом подавляющего большинства рецидивирующих устойчи¬
вых желудочковых тахикардий является reentry в анатомичес¬
ки обусловленных структурах с большим «возбудимым про¬
межутком», для успешной индукции и прекращения приступа
желудочковой тахикардии необходимо осуществлять электри¬
ческую стимуляцию желудочков сердца точно так же, как и
при внутрисердечном исследовании.Основной причиной, ограничивающей использование тра¬
диционной методики ЧПЭС для проведения электрической
стимуляции желудочков сердца у больных, находящихся в со¬
знании, является выраженный, часто непереносимый диском¬
форт во время процедуры, возникающий из-за сильных боле¬
вых ощущений, а также в связи с сокращениями мышц диа¬
фрагмы и грудной клетки. Он обусловлен в первую очередь
тем, что для стимуляции желудочков сердца через пищевод не¬
обходимо использовать электрические импульсы с амплитудой
30—50 В, а иногда 90 В (известно, что больные хорошо пере¬
носят чреспищеводную стимуляцию в диапазоне амплитуд от
10 до 20 В).202
10.1. Методика проведения электрической
стимуляции желудочков сердца из желудкаДля снижения амплитуды импульсов, использующихся для
проведения неинвазивной стимуляции желудочков сердца, мы
разработали новую оригинальную методику, позволяющую су¬
щественно снизить дискомфорт процедуры*. Суть методики
заключается в том, что стимулирующий электрод локализуется
внутри желудка. При этом специально разработанный нами
(совместно с МИФИ) для этих целей трехполюсный стимули¬
рующий электрод устанавливается в области свода желудка,
который анатомически прилегает к куполу диафрагмы и ниж¬
ней поверхности сердца, формируемой желудочками сердца
(рис. 10.1).Техника установки стимулирующего электрода в пищеводе
описана в главе II. После введения в пищевод электрод про¬
двигается в полость желудка, где под рентгеноскопическим
контролем из него формируется петля таким образом, чтобы
стимулирующие полюса электрода находились в своде желудка
и максимально прилегали к нижнему краю рентгеноскопичес¬
кой тени сердца (см. рис. 10.1). Для достижения оптимальной
локализации коррекция положения стимулирующего электро¬
да осуществляется под контролем внутрижелудочной электро¬
граммы с ориентацией на максимальную амплитуду комплекса
QRS. С накоплением опыта надобность в рентгеноскопичес¬
ком контроле резко уменьшается.10.2. Электрическая стимуляция сердца
из желудка для индукции желудочковых
пароксизмальных тахикардий и оценки
функционального состояния миокарда
желудочковДля проверки нашей гипотезы о том, что внутрижелудоч-
ковое расположение электрода с локализацией контактных
колец в своде желудка дает возможность осуществлять элект¬
рическую стимуляцию желудочков сердца, используя неболь¬
шие значения амплитуды стимулирующих импульсов, у 21
больного было проведено сравнение порогов при стимуляции
желудочков сердца по традиционной методике с локализацией
стимулирующего электрода в пищеводе и по нашей ориги¬
нальной методике. Результаты этого сравнения приведены в
табл. 10.1.* Авторское свидетельство № 1697730.
Рис. 10.1. Рентгенограмма, показывающая расположение электрода в
своде желудка при осуществлении электрической стимуляции желу¬
дочков сердца.Таблица 10.1. Эффективный рефрактерный период желудочков
сердца и пороговые значения импульсов, необходимые для осуществле¬
ния стимуляции желудочков сердца при расположении электрода в пи¬
щеводе и желудке (п=21)Порог электрической стимуляции
желудочков сердца, ВЭффективный рефрактерный
период желудочков сердца, мссвод желудкапищеводсвод желудкавнутрисердечнаялокализация21,6±3,937,4±3,5229,5±5,3236,7±5,5р<0,05р<0,05204
Полученные нами данные показали, что при использова¬
нии традиционной методики с расположением электрода в пи¬
щеводе средний порог электрической стимуляции желудочков
сердца был высоким, составляя в среднем 37,5±3,5 В, а стиму¬
ляция плохо переносилась больными. В то же время предло¬
женная нами методика электрической стимуляции желудочков
сердца из желудка позволила снизить средний порог стимуля¬
ции до 21,6±3,9 В (р<0,05), что переносилось больными так
же, как ЧПЭС предсердий.Низкие пороги стимуляции желудочков сердца при исполь¬
зовании предложенной нами методики могут быть объяснены
анатомо-топографическим взаиморасположением сердца и фун¬
дального отдела желудка, а также его иннервацией. Нижняя
(диафрагмальная) поверхность сердца, образованная в основ¬
ном левым желудочком, частично правым желудочком и неболь¬
шим участком правого предсердия, прилежит к сухожильному
центру диафрагмы. Последний, имея низкое электрическое со¬
противление, в отличие от нижней трети пищевода лишен воз¬
можности сокращаться. Кроме того, в этой области отсутствуют
крупные нервные сплетения с развитыми рефлекторными свя¬
зями. Все эти факторы позволяют использовать для стимуляции
желудочков сердца из желудка относительно низкие амплитуды
электрических импульсов и избежать возникновения выражен¬
ных болевых ощущений во время процедуры.При исследовании возможностей предложенного нами ме¬
тода для оценки функционального состояния миокарда желу¬
дочка у 21 больного было проведено сравнение величин ЭРП
желудочков, полученных при проведении внутрисердечного
ЭФИ и во время программированной электрической стимуля¬
ции желудочков сердца из желудка (см. табл. 10.1).Результаты исследований показали отсутствие достоверных
различий в величинах ЭРП желудочков сердца при применении
этих двух методов. По результатам внутрисердечного ЭФИ сред¬
няя величина ЭРП желудочков составила 229,5±5,3 мс, в то
время как при использовании программированной стимуляции
желудочков по предлагаемому нами методу — 236,7±5,5 мс.Программированная электрическая стимуляция желудоч¬
ков сердца из желудка одиночным и парным экстрастимулом,
выполняемая по стандартному протоколу (см. главу II), позво¬
ляет в некоторых случаях при рецидивирующих устойчивых
желудочковых пароксизмальных тахикардиях индуцировать
приступ аритмии (рис. 10.2). Однако необходимо отметить,
что эффективность программированной электрической стиму¬
ляции желудочков сердца из желудка относительно индукции
пароксизмальной желудочковой тахикардии существенно
ниже, чем при внутрисердечном ЭФИ. Лишь у 7 из 21 больно¬
го (30 %) с устойчивой пароксизмальной желудочковой тахи¬
кардией, индуцированной во время внутрисердечного ЭФИ,205
Рис. 10.2. Электрическая стимуляция желудочков сердца из свода же¬
лудка: А — индукция желудочковой тахикардии частотой 150 в 1 мин
под влиянием программированной стимуляции желудочков сердца из
желудка парным экстрастимулом; Б — внутрисердечные ЭГ из право¬
го предсердия (HRA), от пучка Гиса (НВЕ) и из коронарного синуса
(CS), зарегистрированная во время индуцированной желудочковой
тахикарии; В — купирование желудочковой тахикардии частой сти¬
муляцией желудочков сердца (160 имп/мин) из желудка.206
программированная стимуляция желудочков сердца из желуд¬
ка позволила воспроизвести эту аритмию.Тем не менее, если программированная электрическая сти¬
муляция желудочков сердца из желудка индуцирует пароксизм
желудочковой тахикардии, предлагаемая нами методика может
быть использована при подборе эффективной медикаментоз¬
ной терапии с помощью серийного тестирования антиаритми¬
ческих препаратов у этой категории больных.Необходимо также отметить, что у всех 7 больных, у кото¬
рых устойчивую пароксизмальную желудочковую тахикардию
удавалось индуцировать с помощью программированной
электрической стимуляции желудочков сердца из желудка,
аритмия могла быть купирована частой стимуляцией желудоч¬
ков сердца, выполняемой из желудка (см. рис. 10.2).Таким образом, предложенная нами оригинальная методи¬
ка неинвазивной электрической стимуляции желудочков серд¬
ца при локализации стимулирующего электрода в своде же¬
лудка позволяет существенно уменьшить дискомфорт проце¬
дуры, значительно снизить амплитуду импульсов и повысить
ее переносимость. Она позволяет получать достоверную ин¬
формацию о функциональном состоянии миокарда желудоч¬
ков сердца (ЭРП), а у ряда больных с рецидивирующими па¬
роксизмами устойчивой желудочковой тахикардии дает воз¬
можность индуцировать и купировать приступы желудочковой
тахикардии. Это создает предпосылки для использования
этого неинвазивного метода при подборе медикаментозной
антиаритмической терапии больным с рецидивирующими ре¬
ципрокными желудочковыми тахикардиями с помощью се¬
рийного тестирования антиаритмических препаратов.Список литературы1. Вигаск В., Furman S. Transesophageal cardiac paciing//Amer. J.
Cardiol. - 1969. - Vol. 23. - P. 469-472.2. Hartley J. M. Transesophageal cardiac pacing//Anaesthesia. —
1982. - Vol. 37. - P. 192-194.3. Shafiroff B.G.P., Linder J. Effects of external electrical pacemaker sti¬
muli on the human heart//J. thoracic Surg.— 1957,— Vol. 33.— P. 544—550.4. Zoll P. Resuscitation of the heart in ventricular standstill by external
electrical stimulation//New Engl. J. Med.— 1952.— Vol. 247,— P. 768—772.БлагодарностьАвторы выражают искреннюю благодарность за помощь в
работе всем сотрудникам отделения интенсивной терапии и
реанимации факультетской терапевтической клиники ММА
имени И.М.Сеченова, врачам Г.М.Папакину, Д.В.Кузьменко¬
ву, а также сотрудникам лаборатории медицинской электро¬
ники кафедры электроники МИФИ.