Автор: Ковальчук Л.В. Ганковская Л.В. Мешкова Р.Я.
Теги: этиология учение о причинах болезней общая патология медицина иммунология
ISBN: 978-5-9704-2241-0
Год: 2012
Текст
Л.В. Ковальчук
Л.В. Ганковская
Р.Я. Мешкова
КЛИНИЧЕСКАЯ
ИММУНОЛОГИЯ
И АЛЛЕРГОЛОГИЯ
С ОСНОВАМИ ОБЩЕЙ
ИММУНОЛОГИИ
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
Данное пособие является ознакомительным
I Коммерческое использование данного файла запрещено I
Еще больше полезного и уникального
материала ищите в нашем сообществе
ВраЧитаЬЬа (самообразование врача)
Л.В. Ковальчук, Л.В. Ганковская, Р.Я. Мешкова
КЛИНИЧЕСКАЯ
ИММУНОЛОГИЯ
И АЛЛЕРГОЛОГИЯ
С ОСНОВАМИ ОБЩЕЙ
ИММУНОЛОГИИ
УЧЕБНИК
Министерство образования и науки РФ
Рекомендовано ГОУ ВПО «Московская медицинская академия
имени И.М. Сеченова» в качестве учебника для студентов учреждений
высшего профессионального образования, обучающихся
по специальностям 060101.65 «Лечебное дело»,
060103.65 «Педиатрия» по дисциплине «Общая и клиническая
иммунология», по специальностям 060112.65 «Медицинская
биохимия», 060113.65 «Медицинская биофизика»,
060114.65 «Медицинская кибернетика» по дисциплине
«Иммунология»
Регистрационный номер рецензии 68 от 19 марта 2010 года
ФГУ «Федеральный институт развития образования»
УДК 616-022.8-097(075.8)
ББК 52.5я73-1
К56
Данное издание подготовлено в рамках программы развития
Национального исследовательского университета
ГОУ ВПО «Российский государственный медицинский университет»,
Приоритетное направление развития № 2 «Персонализированная медицина»
Ковальчук, Л. В.
К56 Клиническая иммунология и аллергология с основами общей иммуно-
логии : учебник / Л. В. Ковальчук, Л. В. Ганковская, Р. Я. Мешкова. — М.:
ГЭОТАР-Медиа, 2012. — 640 с.: ил.
ISBN 978-5-9704-2241-0
В основу учебника положен многолетний опыт преподавания современной
общей и клинической иммунологии на кафедре иммунологии Российского государ-
ственного медицинского университета и на кафедре клинической иммунологии и
аллергологии Смоленской медицинской академии.
Методология изложения материала построена на современных представлениях
о том, что предмет клинической иммунологии — иммунная система организма, ее
структурные и функциональные особенности в норме и при патологии.
В связи с этим основное внимание уделяется изложению ключевых вопросов
общей иммунологии, дающих знания об иммунной системе человека и ее врож-
денном и приобретенном компонентах, а также наиболее важных тем клинической
иммунологии, включая иммунопатологию, оценку иммунного статуса человека,
генетически опосредованные и приобретенные иммунодефициты, аллергические
заболевания, иммунотерапию и иммунопрофилактику.
Учебник предназначен студентам медицинских вузов, клиническим ординато-
рам, аспирантам, аллергологам-иммунологам.
УДК 616-022.8-097(075.8)
ББК 52.5я73-1
Права на данное издание принадлежат ООО Издательская группа «ГЭОТАР-Медиа».
Воспроизведение и распространение в каком бы то ни было виде гасти или целого
издания не могут быть осуществлены без письменного разрешения ООО Издательская
группа «ГЭОТАР-Медиа».
ISBN 978-5-9704-2241-0
© Коллектив авторов, 2012
© ООО Издательская группа «ГЭОТАР-Медиа», 2012
© ООО Издательская группа «ГЭОТАР-Медиа»,
оформление, 2012
ОГЛАВЛЕНИЕ
Предисловие....................................................8
Сокращения и условные обозначения..............................12
ЧАСТЬ 1. ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ
КЛИНИЧЕСКОЙ МЕДИЦИНЫ...........................................14
Глава 1. Основные понятия......................................16
1.1. Иммунная система..........................................16
1.2. Врожденный и адаптивный иммунитет.........................19
1.3. Структуры, распознаваемые иммунной системой, — антигены...24
Глава 2. Клинически значимые характеристики клеток, органов и тканей
иммунной системы...............................................30
2.1. Клетки иммунной системы...................................30
2.1.1. Гемопоэтическая стволовая клетка......................31
2.1.2. Лимфоциты.............................................34
2.1.3. Основные клеточные элементы системы врожденного
иммунитета...................................................41
2.2. Структурно-функциональная организация иммунной системы....51
2.2.1. Органы и ткани иммунной системы.......................54
2.2.1.1. Тимус..............................................54
2.2.1.2. Периферические органы и ткани иммунной системы.....58
2.2.1.З. Лимфоидная ткань, ассоциированная со слизистыми
оболочками..................................................63
Глава 3. Рецепторные и медиаторные взаимодействия в иммунной
системе........................................................68
3.1. Основные рецепторы системы врожденного иммунитета.........68
3.1.1. Рецепторы комплемента.................................69
3.1.2. Fc-рецепторы для иммуноглобулинов.....................70
3.1.3. Паттернраспознающие рецепторы врожденного иммунитета..74
З.1.З.1. Toll-подобные рецепторы (TLR)......................75
З.1.З.2. NOD-подобные рецепторы (NLR).......................84
3.2. Антигенраспознающая функция Т- и В-лимфоцитов.............85
3.2.1. Особенности дифференцировки Т-лимфоцитов человека
и распознавание антигенов....................................86
3.2.1.1. Антигенраспознающий рецептор Т-клеток..............86
З.2.1.2. Дифференцировка Т-лимфоцитов.......................89
3.2.1.3. Презентация антигена Т-лимфоцитам. Роль молекул главного
комплекса гистосовместимости................................98
3.2.2. Особенности дифференцировки В-лимфоцитов человека
и распознавание антигенов...................................106
З.2.2.1. В-клеточный рецептор..............................106
3.2.2.2. Этапы дифференцировки В-лимфоцитов................107
4
ОГЛАВЛЕНИЕ
3.3. Система цитокинов..........................................114
3.3.1. Цитокины: свойства, рецепторы, клетки-продуценты.......114
3.3.2. Цитокины и воспаление..................................125
Глава 4. Эффекторные механизмы адаптивного
и врожденного иммунитета................................/.......132
4.1. Антитела — эффекторные молекулы гуморального иммунитета....132
4.2. Т-клеточная цитотоксичность................................142
4.3. Гиперчувствительность замедленного типа....................145
4.4. Гуморальные эффекторные механизмы врожденного иммунитета...148
4.4.1. Система комплемента....................................148
4.4.2. Белки острой фазы......................................160
4.4.3. Противомикробные пептиды...............................160
4.5. Эффекторные клетки врожденного иммунитета..................165
4.5.1. Макрофаги и нейтрофилы.................................165
4.5.2. NK-клетки..............................................175
4.5.3. NKT-лимфоциты..........................................178
Глава 5. Регуляторные Т-лимфоциты...............................181
Обобщение к главам 3-5. Развитие иммунного ответа
на генетически чужеродные субстанции............................185
Глава 6. Апоптоз и его роль в иммунной системе..................189
6.1. Механизмы развития апоптоза................................191
6.2. Регуляция апоптоза.........................................195
6.3. Роль апоптоза в иммунных процессах.........................196
Глава 7. Основы иммуногенетики в клинической иммунологии.
Система лейкоцитарных антигенов человека........................198
7.1. Особенности HLA-системы....................................201
7.1.1. Полиморфизм генов главного комплекса гистосовместимости
и заболевания.................................................201
7.1.1.1. Некоторые гаплотипы главного комплекса
гистосовместимости являются протективными...................201
Глава 8. Иммунные механизмы повреждения тканей: введение
в иммунопатологию............................................. 206
ЧАСТЬ 2. КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ
И АЛЛЕРГОЛОГИИ..................................................216
Глава 9. Оценка иммунной системы человека.......................218
9.1. Основные понятия...........................................218
9.2. Подходы к оценке иммунного статуса: тесты I и II уровня....220
9.3. Патогенетический принцип оценки функций иммунной системы...224
9.4. Аналитический принцип оценки отдельных иммунных подсистем..230
Глава 10. Возрастные особенности иммунной системы ребенка.......237
10.1. Роль грудного молока в адаптации иммунной системы ребенка.240
10.1.1. Уровни цитокинов в сыворотке крови при оценке периода
адаптации новорожденного......................................241
ОГЛАВЛЕНИЕ
5
Глава 11. Иммунодефицитные заболевания..........................247
11.1. Основные понятия..........................................247
11.2. Первичные (генетически обусловленные) иммунодефициты......247
11.2.1. Группа 1. Комбинированные Т- и В-клеточные
иммунодефициты.................................................259
11.2.1.1. Х-сцепленная тяжелая комбинированная иммунная
недостаточность..............................................265
11.2.1.2. Тяжелая комбинированная иммунная недостаточность
с дефицитом аденозиндезаминазы..............................266
11.2.1.3. Тяжелая комбинированная иммунная недостаточность
с дефицитом пуриннуклеозидфосфорилазы.......................267
11.2.1.4. Синдром Оменна....................................268
11.2.1.5. Тяжелая комбинированная иммунная недостаточность,
обусловленная дефицитом JAK3.................................268
11.2.1.6. Дефицит молекул главного комплекса гистосовместимости
класса! 269
11.2.1.7. Дефицит молекул главного комплекса гистосовместимости
класса II...................................................269
11.2.2. Группа 2. Преимущественные дефициты антител...........271
11.2.2.1. Агаммаглобулинемия с отсутствием В-клеток.
Х-сцепленная агаммаглобулинемия с дефицитом В-клеток........274
11.2.2.2. Гипогаммаглобулинемия с нормальным или сниженным
количеством В-клеток. Общая вариабельная иммунная
недостаточность.............................................278
11.2.2.3. Первичные В-клеточные дефекты. Синдромы, связанные
с блоком переключения класса иммуноглобулинов...............283
11.2.2.4. Селективный дефицит IgA...........................288
11.2.2.5. Другие первичные иммунодефициты, связанные
с дефицитом изотипов или легких цепей иммуноглобулинов.......291
11.2.2.6. Дефицит специфических антител с нормальной
концентрацией иммуноглобулинов...............................293
11.2.2.7. Транзиторная гипогаммаглобулинемия детей
раннего возраста............................................294
11.2.3. Группа 3. Синдромы иммунодефицитов с хорошо
охарактеризованными клиническими признаками...................296
11.2.3.1. Атаксия-телеангиэктазия (синдром Луи-Бар).........300
11.2.3.2. Синдром Неймеген..................................303
11.2.3.3. Синдром Вискотта-Олдрича..........................304
11.2.3.4. Синдром Ди Джорджи................................306
11.2.3.5. Rinep-IgE-синдром.................................307
11.2.3.6. Хронический кожно-слизистый кандидоз..............310
11.2.4. Группа 4. Генетические нарушения регуляции иммунитета.311
11.2.4.1. Семейный гемофагоцитарный лимфогистиоцитоз........314
6
ОГЛАВЛЕНИЕ
11.2.4.2. Иммунодефициты с гипопигментацией.................316
11.2.4.3. Синдром Чедиака-Хигаси............................318
11.2.4.4. Х-сцепленный лимфопролиферативный синдром.........318
11.2.4.5. Аутоиммунный лимфопролиферативный синдром.........320
11.2.4.6. Х-сцепленные иммунодисрегуляция, полиэндокринопатия,
энтеропатия (синдром IPEX)...................................322
11.2.5. Группа 5. Врожденные дефекты фагоцитов.................323
11.2.5.1. Тяжелые врожденные нейтропении....................325
11.2.5.2. Циклическая нейтропения...........................326
11.2.5.3. Дефициты адгезии лейкоцитов.......................327
11.2.5.4. Хроническая гранулематозная болезнь...............329
11.2.5.5. Дефицит глюкозо-6-фосфатдегидрогеназы нейтрофилов.330
11.2.5.6. Дефицит миелопероксидазы..........................331
11.2.6. Группа 6. Дефекты врожденного иммунитета: рецепторов
и сигнальных компонентов......................................332
11.2.7. Группа 7. Аутовоспалительные нарушения................335
11.2.8. Группа 8. Дефициты комплемента........................337
11.2.8.1. Наследственный ангионевротический отек............338
11.3. Основные клинические симптомы и тесты лабораторной
диагностики первичных иммунодефицитов...........................340
11.4. Общие принципы лечения больных с первичными
иммунодефицитами.............................................. 342
11.5. Приобретенные (вторичные) иммунодефициты..................345
11.6. Синдром приобретенного иммунодефицита.....................350
11.6.1. Иммунопатогенез ВИЧ-1-инфекции........................353
11.6.2. Клиническая картина ВИЧ-инфекции......................358
11.6.3. Классификация ВИЧ-инфекции............................360
11.6.4. ВИЧ-инфекция у детей..................................363
11.6.5. Диагностика ВИЧ-инфекции..............................367
11.6.6. Лечение ВИЧ-инфекции..................................371
11.6.7. Химиопрофилактика и специфическое лечение вторичных
заболеваний...................................................376
11.6.8. Патогенетическая терапия, направленная на коррекцию
иммунной недостаточности......................................377
11.6.9. Профилактика заражения вирусом иммунодефицита человека.378
11.6.10. Проблема создания вакцины против вируса иммунодефицита
человека......................................................381
Глава 12. Аллергические заболевания.............................383
12.1. Аллергены.................................................384
12.2. Аллергодиагностика........................................397
12.2.1. Аллергодиагностика in vitro...........................407
12.3. Аллергический ринит.......................................417
12.4. Атопический дерматит......................................433
ОГЛАВЛЕНИЕ
7
12.5. Бронхиальная астма.......................................449
12.5.1. Бронхиальная астма у детей...........................456
12.6. Пищевая аллергия.........................................459
12.7. Лекарственная аллергия...................................470
12.7.1. Клинические проявления отдельных форм лекарственной
аллергии.....................................................484
12.8. Инсектная аллергия.......................................498
12.9. Латексная аллергия.......................................509
12.10. Аллергический контактный дерматит.......................512
12.11. Крапивница..............................................517
12.12. Принципы терапии аллергических заболеваний. Основные
направления в лечении аллергии.................................533
12.12.1. Фармакотерапия аллергических заболеваний............534
12.12.2. Аллергенспецифическая иммунотерапия.................542
12.12.2.1. Подкожная аллергенспецифическая иммунотерапия...544
12.12.2.2. Неинъекционная (локальная) аллергенспецифическая
иммунотерапия..............................................547
12.12.3. Современные достижения в лечении аллергии.........551
12.13. Профилактика аллергии...................................552
Глава 13. Ургентные формы в клинической иммунологии и аллергологии.558
13.1. Анафилаксия..............................................558
13.2. Идиопатическая анафилаксия...............................562
13.3. Анафилактический шок.....................................570
13.4. Астматический статус.....................................572
13.5. Острая крапивница, обострение хронической крапивницы.....573
13.6. Острые буллезные дерматозы...............................573
13.7. Синдром Стивенса-Джонсона................................576
13.8. Синдром Лайелла (токсический эпидермальный некролиз).....577
13.9. Острые токсико-аллергические реакции.....................578
13.10. Сывороточная болезнь....................................583
Глава 14. Основы иммунотерапии.................................588
14.1. Классификация иммунотропных препаратов...................589
14.2. Принципы применения иммунотропных средств................594
14.3. Характеристика отдельных иммунотропных средств...........595
14.4. Моноклональные антитела в клинической практике...........610
Глава 15. Иммунопрофилактика...................................616
Литературы.....................................................630
Предметный указатель...........................................632
ПРЕДИСЛОВИЕ
Иммунология проникает во все области медицины и становится одной
из ведущих клинических дисциплин. Современная иммунология осмыс-
лена всем мировым сообществом. Врачи на практике всё чаще имеют дело
с больными, у которых скомпрометирована иммунная система. В реестр
клинической иммунологии входят не только традиционные иммунодефи-
циты, аутоиммунная патология, но и заболевания, число которых посто-
янно растет, включая синдром приобретенного иммунодефицита (СПИД),
аллергопатологию [бронхиальная астма (БА), аллергический ринит (АР),
атопический дерматит и др.], хронические воспалительные заболевания,
рак и многие другие. Только больные с аллергией составляют до 20-30%
населения при тенденции к возрастанию. В клиническую практику актив-
но внедряются новые иммунодиагностические технологии, новые методы
иммунотерапии, иммунонанобиотехнологии, иммунопрофилактики.
В России, как и во многих ведущих странах мира, клиническая имму-
нология с аллергологией сформировалась как самостоятельная врачебная
дисциплина. Интерес к ней и расширение ее преподавания наблюдаются во
всех странах.
Несмотря на это, знания студентов в области клинической иммунологии
всё еще отстают от требований практической медицины. Это прежде всего
объясняется неполными и нередко разрозненными сведениями об основах
иммунологии, иммунопатогенезе различных заболеваний, о методах имму-
нодиагностики и иммунотерапии, получаемыми студентами медицинских
вузов. Ясно, что, если врачи не знают основ клинической иммунологии и
аллергологии, значительно ограничиваются возможности оказания полно-
ценной медицинской помощи.
Опыт практической медицины показывает, что все будущие врачи долж-
ны быть подготовлены по базисным основам клинической иммунологии
на додипломном уровне. Во многих случаях именно врачи общей практики
вынуждены оказывать помощь больным с аллергией и иммунопатологией,
в том числе в ургентных ситуациях.
Современный врач лечебной практики и педиатр должны уметь ориен-
тироваться в наиболее актуальных проблемах клинической иммунологии и
аллергологии, включая вопросы иммунодефицита, атопии, аутоиммунной
патологии, вакцинопрофилактики, трансфузиологии, иммунокоррекции и
многих других. Экологические проблемы в первую очередь отражаются на
иммунной системе, способствуют росту аллергических заболеваний.
Последипломный уровень предусматривает специальную подготовку
врачей через систему клинической ординатуры, аспирантуры по своей про-
ПРЕДИСЛОВИЕ
9
грамме, тем более что в соответствии с приказом Министерства здравоохра-
нения Российской Федерации от 16.02.1995 об утверждении новой врачеб-
ной специальности — «аллерголог-иммунолог» аллергология-иммунология
стала полноценной врачебной специальностью. Статус ее как основной
специальности подтвержден в приказе Министерства здравоохранения
Российской Федерации от 27.08.1999 № 337.
В России уже много лет существует налаженная система преподавания
иммунологии с аллергологией в медицинских вузах. Число таких кафедр
постоянно растет. Велика заинтересованность иностранных студентов-
медиков в получении современных знаний по аллергологии и иммуно-
логии. Создание кафедр способствовало развитию службы клинической
иммунологии и аллергологии в регионах. Многие заведующие кафедра-
ми являются главными специалистами аллергологами-иммунологами
в республиках и областях России.
Система преподавания дисциплины в России соответствует требовани-
ям международных и отечественных организаций, занимающихся пробле-
мами иммунологии и аллергологии (Всемирная организация здравоохра-
нения, Международный союз иммунологических обществ, Европейский
союз иммунологических обществ, Российское научное общество имму-
нологов, Российская ассоциация врачей-аллергологов и клинических
иммунологов и др.).
Многолетний опыт преподавания основ фундаментальной и клиниче-
ской иммунологии оказал существенное влияние на повышение уровня
знаний студентов медицинских вузов в других областях теоретической и
практической медицины (хирургия, терапия, педиатрия, акушерство и др.),
на понимание ими основ нормальной и патологической физиологии и био-
химии, а также многих других проблем, объединенных понятием «клиниче-
ская иммунология». Знание этой дисциплины студентами крайне важно для
таких общемедицинских проблем, как оценка и расшифровка иммунного
статуса человека, выявление первичных и приобретенных иммунодефици-
тов, аллергических заболеваний, иммунотропного действия лекарственных
средств, иммунотерапии и т.д. Известно, что правильный выбор совре-
менных методов иммунодиагностики позволяет более чем в 70% случаев
помочь в ранней постановке клинического диагноза. Зарекомендовал себя
принцип преподавания иммунологии в два этапа в рамках единой само-
стоятельной кафедры: «общая иммунология» и «клиническая иммунология
с аллергологией».
Кафедры иммунологии и аллергологии активно включились в форми-
рование современной иммунологической службы в тех регионах, где они
были созданы. Особого внимания заслуживает опыт кафедр медицинских
вузов Смоленска, Твери, Курска, Орла, Томска, Новосибирска, Челябинска,
Казани, Иванова и других городов по совершенствованию этой службы.
10
ПРЕДИСЛОВИЕ
Под эгидой кафедр организованы областные иммунологические центры,
позволившие в 2-3 раза улучшить качество специализированной медицин-
ской помощи, особенно в области профилактики.
Под руководством кафедральных коллективов в ряде регионов реали-
зуются целевые программы практического здравоохранения по совер-
шенствованию ранней диагностики первичных иммунодефицитов (ПИД)
(Челябинск), вакцинопрофилактики больных с иммунодефицитом
(Смоленск), по иммунокоррекции приобретенных иммунодефицитов при
бесплодии (Орел), по иммунологии репродукции (Иваново), созданию и
внедрению новых клеточных технологий (Новосибирск) и многие дру-
гие.
В основу данного учебника положен многолетний опыт преподавания
современной общей и клинической иммунологии на кафедре иммуноло-
гии (с 1971 г.) Российского государственного медицинского университета
(ранее 2-й Московский медицинский институт им. Н.И. Пирогова) и на
кафедре клинической иммунологии и аллергологии (с 1988 г.) Смоленской
медицинской академии.
Методология изложения материала построена на современных представ-
лениях о том, что предмет клинической иммунологии — иммунная систе-
ма организма, ее структурные и функциональные особенности в норме и
при патологии. Одной из реалий иммунологии на стыке XX и XXI вв. стало
учение о врожденном и приобретенном иммунитете, открывающее пути
к совершенно новому взгляду на природу функционирования иммунной
системы в норме и при патологии.
В связи с этим основное внимание уделяется изложению ключевых
вопросов общей иммунологии, дающих знания об иммунной системе
человека и ее врожденном и приобретенном компонентах, а также наи-
более важных тем клинической иммунологии, включая иммунопатологию,
оценку иммунного статуса человека, генетически опосредованные и приоб-
ретенные иммунодефициты, аллергические заболевания, иммунотерапию и
иммунопрофилактику. Мы специально не остановились на аутоиммунных и
лимфопролиферативных заболеваниях, которые пока в достаточном объе-
ме преподаются на кафедрах разного профиля (ревматология, дерматоло-
гия, гематология и др.), хотя разные аспекты данных патологий, особенно
способы их иммунотерапии, с каждым годом всё больше рассматриваются с
иммунологических позиций.
Мы постарались руководствоваться высказыванием создателя основ
современной клинической иммунологии и организатора преподавания
иммунологии в медицинских вузах академика Р.В. Петрова: «Клиническая
иммунология — это всегда комплексный и в то же время очень инди-
видуализированный подход к пациенту».
ПРЕДИСЛОВИЕ 11
Пользуясь случаем, выражаем признательность сотрудникам кафедр
иммунологии Российского государственного медицинского университета,
Смоленской медицинской академии и других медицинских вузов за боль-
шой вклад в развитие и совершенствование преподавания этой дисципли-
ны.
Любые замечания и предложения по совершенствованию данного учеб-
ника будут с благодарностью приняты авторами и учтены при переиздании
книги.
Авторы
СОКРАЩЕНИЯ И УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
* — торговое название лекарственного средства
*> — лекарственное средство не зарегистрировано в России
® — лекарственное средство в России аннулировано (исключено из офици-
ального Реестра лекарственных средств)
АДА — аденозиндезаминаза
АДС — комбинированная вакцина против дифтерии и столбняка
АКД — аллергический контактный дерматит
АКДС — комбинированная вакцина против дифтерии, коклюша и столб-
няка
АПК — антигенпрезентирующая клетка
АР — аллергический ринит
АС — анатоксин столбнячный
АтД — атопический дерматит
БА — бронхиальная астма
БЦЖ — бацилла Кальметта-Герена
ВИЧ — вирус иммунодефицита человека
ГЗТ — гиперчувствительность замедленного типа
Г-КСФ — гранулоцитарный колониестимулирующий фактор
ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий
фактор
дАТФ — дезоксиаденозинтрифосфат
ДК — дендритная клетка
ДНК — дезоксирибонуклеиновая кислота
ИЛ — интерлейкин
ИФА — иммуноферментный анализ
ИФН — интерферон
ЛА — лекарственная аллергия
ЛПС — липополисахарид
М-КСФ — макрофагальный колониестимулирующий фактор
МНН — международное непатентованное название
МЭЭ — многоформная экссудативная эритема
НПВС — нестероидные противовоспалительные средства
ОВИН — общая вариабельная иммунная недостаточность
ОТАР — острые токсико-аллергические реакции
ОФВХ — объем форсированного выдоха за 1 с
ПИД — первичный иммунодефицит
ПЦР — полимеразная цепная реакция
РНК — рибонуклеиновая кислота
СОКРАЩЕНИЯ И УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
13
СПИД — синдром приобретенного иммунодефицита
ТКИД — тяжелый комбинированный иммунодефицит
ТФР — трансформирующий фактор роста
ФДК — фолликулярная дендритная клетка
ФИО — фактор некроза опухоли
ХГБ — хроническая гранулематозная болезнь
ЦМВ — цитомегаловирус
ЦНС — центральная нервная система
ЦТЛ — цитотоксические Т-лимфоциты
AID — индуцированная активацией цитидиндезаминаза (Activation-Induced
cytidine Deaminase)
BCR — В-клеточный рецептор (В-cell receptor)
СРВ — С-реактивный белок
HLA — лейкоцитарный антиген человека (Human Leukocyte Antigen)
MBL — лектин, связывающий маннозу (Mannose-Binding Lectin)
NADPH — никотинамидадениндинуклеотид фосфат
NK-клетки — естественные киллеры (от англ. Natural Killer)
NKT-клетки — естественные киллерные Т-лимфоциты
NLR — Мос1-подобный(е) рецептор(ы) (NOD-Like Receptors)
РАМР — патогенассоциированный молекулярный паттерн (Pathogen-
Associated Molecular Pattern)
PNU — единица белкового азота
PRR — паттернраспознающие рецепторы (от англ. Pattern Recognition
Receptor)
TCR — Т-клеточный рецептор (T-cell receptor)
TLR — ТоИ-подобный(е) рецептор(ы) (Toll-Like Receptors)
ЧАСТЬ 1
Основы общей иммунологии
в практике клинической
медицины
Цель настоящего раздела — знакомство с общими закономерностями
организации и функционирования иммунной системы. Структура глав
позволяет последовательно ознакомиться с основными процессами,
происходящими в иммунной системе (начиная с молекул, узнаваемых
клетками иммунной системы, и распознающих рецепторов), включая
основные формы иммунного ответа ~ врожденный и адаптивный.
Рассмотрены эффекторные механизмы элиминации антигена, структура
и функции главного комплекса гистосовместимости, роль иммунной
системы в повреждении тканей.
Глава 1. Основные понятия.............................16
Глава 2. Клинически значимые характеристики клеток,
органов и тканей иммунной системы.....................30
Глава 3. Рецепторные и медиаторные взаимодействия
в иммунной системе....................................68
Глава 4. Эффекторные механизмы адаптивного и врожденного
иммунитета...........................................132
Глава 5. Регуляторные Т-лимфоциты....................181
Глава 6. Апоптоз и его роль в иммунной системе.......189
Глава 7. Основы иммуногенетики в клинической иммунологии.
Система лейкоцитарных антигенов человека..............198
Глава 8. Иммунные механизмы повреждения тканей:
введение в иммунопатологию...........................206
Глава 1
Основные понятия
Иммунология — наиболее перспективная и быстро развивающаяся
медико-биологическая дисциплина. Особенность современного этапа
иммунологии — изучение молекулярных механизмов иммунных процессов
и широкое внедрение достижений иммунологии в медицину. Это нашло
отражение и в современном определении иммунологии, предметом изуче-
ния которой служит иммунная система, ее структура и функции в норме и
при патологии.
1.1. ИММУННАЯ СИСТЕМА
Для защиты организма от биологической агрессии инфекционных аген-
тов, а также измененных (в том числе генетически) клеток собственного
организма на определенном этапе эволюции возникла специализированная
иммунная система.
Иммунная система представляет собой совокупность специализи-
рованных органов, тканей и клеток, способных выполнять функцию
иммунитета и другие жизненно важные функции, такие, как регу-
ляция и координация межсистемных связей. По крайней мере три
системы: нервная, эндокринная и иммунная — составляют основу
жизнедеятельности организма. Иммунологическая индивидуаль-
ность обеспечивает сохранение каждой особи в пределах вида.
На первых этапах становления иммунологии во времена И.И. Мечникова
и Л. Пастера (начало XX в.) под иммунитетом понимали невосприимчивость
организма к инфекционным заболеваниям. Однако основополагающие
исследования ученых в середине XX в. позволили по-новому взглянуть на
эту проблему. Согласно концепции об иммунологическом надзоре, выдви-
нутой в 50-е годы прошлого столетия известным австралийским ученым,
нобелевским лауреатом Ф. Бернетом, главная функция иммунной системы
ОСНОВНЫЕ ПОНЯТИЯ 17
стала рассматриваться с позиции распознавания «своего» и «чужого» (име-
ется в виду генетически чужеродное). Идея эта необычайно расширила
границы иммунологии и доминирует в настоящее время.
Функция иммунной системы (а более конкретно — иммунитет) выходит
далеко за рамки защиты от инфекционных заболеваний. Противораковый,
трансплантационный иммунитет, иммунные взаимоотношения мать-плод,
ликвидация пострадиационных последствий, неблагоприятных воздей-
ствий экологических факторов, иммунопрофилактика инфекционных и
неинфекционных заболеваний и многие другие процессы реализуются
иммунной системой.
Под иммунитетом, по определению академика Р.В. Петрова, понимают
«Способ защиты организма от живых тел и веществ, несущих при-
знаки генетически чужеродной информации (включая микроорга-
низмы, чужеродные клетки, ткани или генетически изменившиеся
собственные клетки, в том числе опухолевые)».
Исходя из этого уникальность физиологической роли иммунной систе-
мы заключается в контроле генетического постоянства внутренней среды
организма в период онтогенетического развития. Всё генетически чужерод-
ное для конкретного организма элиминируется с участием его иммунной
системы.
Иммунная система высокоспециализирована и обладает целым ком-
плексом уникальных свойств, многие из которых не дублируются в других
системах организма.
Следующие феномены определяют основные свойства иммунной
системы:
• высокая специфичность проявляется высокоспецифичным и
селективным связыванием антител с конкретным антигеном, инду-
цировавшим их образование. Лимфоциты с помощью антигенспеци-
фических рецепторов распознают антигенные молекулы, различаю-
щиеся 1-2 аминокислотными остатками, и удаляют их из организма.
Упрощенная формула иммунной специфичности: «один антиген —
одно антитело — один клон лимфоцитов»;
• высокая степень чувствительности — иммунокомпетентные клетки
осуществляют распознавание антигена на уровне отдельных молекул.
Взаимодействие «антиген-антитело» — одна из наиболее высокочув-
ствительных биологических реакций. Тесты, основанные на использо-
вании антител и/или антигенов (иммуноферментные, радиоиммунные
и др.), позволяют идентифицировать пикограммовые и близкие к ним
количества анализируемого вещества;
• иммунологическая индивидуальность — для каждого организма
характерен свой, контролируемый генетически тип иммунного отве-
та. Основной постулат иммуногенетики — «конкретность иммунного
ответа»;
ГЛАВА 1
18 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
• клональный принцип организации иммунокомпетентных клеток,
проявляющийся в способности всех клеток в пределах отдельного
клона отвечать только на одну антигенную детерминанту. Согласно
клонально-селекционной теории Ф. Бернета, в иммунной системе
формируются клоны лимфоцитов, способные распознать огромное
количество (109-10п) вариантов антигенных молекул, составляющих
так называемый антигенный репертуар;
• иммунологическая память — способность иммунной системы (кле-
ток памяти) отвечать ускоренно и усиленно на повторное введение
антигена. Это свойство иммунной системы составляет основу анамне-
стического ответа на повторный контакт с антигеном (например, при
инфекции или вакцинации);
• иммунная толерантность — специфическая неотвечаемость на анти-
гены, в том числе на антигены собственного организма (аутоантиге-
ны). Нарушение этого свойства приводит к срыву толерантности и
формированию аутоиммунной патологии;
• высокая способность иммунной системы к регенерации — свой-
ство иммунной системы к поддержанию гомеостаза лимфоцитов за
счет пополнения пула «наивных» клеток и контроля популяции клеток
памяти. Нарушение гомеостаза лимфоцитов (лимфопения) лежит в
основе многих заболеваний, в первую очередь иммунодефицитных;
• способность клеток иммунной системы к рециркуляции — пере-
мещение клеток через кровеносную и лимфатическую систему обес-
печивает единство и целостность иммунной системы. Лимфоциты,
моноциты, нейтрофилы и другие клетки способны мигрировать через
эндотелий кровеносных и лимфатических сосудов в центральные и
периферические органы и ткани иммунной системы, а также в различ-
ные ткани в норме и при патологии (чаще воспаление). В циркуляции
могут находиться практически все клеточные элементы иммунной
системы, в том числе гемопоэтические стволовые клетки;
• «двойное распознавание» антигена Т-лимфоцитами — уникаль-
ная способность Т-лимфоцита распознавать чужеродные антигенные
пептиды в ассоциации с собственными молекулами главного комплек-
са гистосовместимости (у человека с HLA). Подобный механизм высо-
коспециализирован и отсутствует в других системах организма;
• неразборчивость иммунной системы. Иммунные механизмы не
всегда работают во благо: в ряде случаев они могут оказывать имму-
ноагрессивное действие в собственном организме, вызывая тяжелую
патологию: аллергические, аутоиммунные, иммунокомплексные забо-
левания и др.;
• регуляторное действие на другие системы организма. Иммунная
система через прямые межклеточные контакты и опосредованно через
ОСНОВНЫЕ ПОНЯТИЯ
19
огромное количество медиаторных молекул (цитокины, хемокины,
гормоны тимуса, пептиды и др.) оказывает регуляторное воздействие
практически на все системы организма. Нарушение регуляторных
механизмов лежит в основе многих заболеваний человека, часто с
поражением органов и тканей, формально не включаемых в иммунную
систему (например, поражение суставов, печени, кожи, ЦНС и др.). От
того, насколько полноценно функционирует иммунная система, зави-
сят многие процессы нормальной жизнедеятельности организма. Эта
функция может быть непосредственно не связана с иммунитетом, но в
процессе иммунного ответа выработка иммуноцитокинов значительно
усиливается, и их действие распространяется на реализацию регуля-
торных воздействий как внутри, так и за пределами иммунной систе-
мы. Современная иммунология большое внимание уделяет изучению
роли цитокинов в межсистемных регуляторных процессах.
Таким образом, наряду с нервной и эндокринной иммунная система слу-
жит одной из интегрирующих систем регуляции, действующих на уровне
целого организма.
1.2. ВРОЖДЕННЫЙ И АДАПТИВНЫЙ ИММУНИТЕТ
Одним из наиболее важных обобщений в иммунологии конца XX и
начала XXI в. стало создание научно обоснованного учения о врожденном
(от англ, innate immunity), или естественном, природном, и адаптивном
(от англ, adaptive immunity), или приспособительном, приобретенном
(от англ, acquired immunity), иммунитете. В иммунологической практике
чаще используют термины «врожденный» и «адаптивный» иммунитет,
врожденные и адаптивные компоненты иммунной системы, врожденный
и адаптивный иммунный ответ. Оба варианта иммунитета реализуются
через клеточные и гуморальные факторы. Ушли в прошлое такие термины,
как «неспецифический иммунитет», «неспецифическая иммунологическая
реактивность» и им подобные.
Врожденный и приобретенный иммунитет представляет собой
две взаимодействующие части одной системы, обеспечивающей раз-
витие иммунного ответа на генетически чужеродные субстанции.
Врожденный иммунитет — наследственно закрепленная система защиты
многоклеточных организмов от любых патогенных и непатогенных микро-
организмов, а также эндогенных продуктов тканевой деструкции.
Как самая ранняя форма иммунной защиты организма, врожденный
иммунитет сформировался на начальных этапах эволюции многокле-
точных организмов, до появления способности к перегруппировке генов
иммуноглобулинов и TCR, а также возможности узнавания «своего» и
полноценной иммунной памяти. Доказательством этому служит наличие
ГЛАВА 1
ЧАСТЬ 1
20 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
разнообразных генов врожденной защиты у беспозвоночных животных и
растений. Известно, что у беспозвоночных (например, у членистоногих)
существуют клеточные элементы, обладающие фагоцитарной функцией, и
гуморальные факторы типа противомикробных пептидов, лектинов и др.,
успешно распознающих и поражающих патогенные микроорганизмы. Все
эти компоненты консервативны, наследуются и не подвергаются генетиче-
ской модификации в течение жизни.
Охарактеризованы основные отличительные признаки системы врож-
денного иммунитета.
• Врожденный иммунитет обеспечивает распознавание и элиминацию
патогенов в первые несколько минут или часов после их проникнове-
ния в организм, когда механизмы адаптивного иммунитета еще отсут-
ствуют.
• Функция системы врожденного иммунитета осуществляется через раз-
нообразные клеточные элементы (макрофаги, ДК, нейтрофилы, туч-
ные клетки, эозинофилы, базофилы, NK-клетки, NKT-клетки, некото-
рые негемопоэтические клетки) и гуморальные факторы (естественные
антитела, цитокины, комплемент, белки острой фазы, катионные
противомикробные пептиды, лизоцим и др.) (см. табл. 1-1).
Клетки врожденной иммунной системы:
• не образуют клонов. Отсутствие клональности в организации врожден-
ной иммунной системы — одно из ее основных отличий от адаптивной
иммунной системы. В этом смысле каждая клетка врожденного имму-
нитета действует индивидуально, тогда как при адаптивном иммунном
ответе все клетки в пределах клона (сообщества) подчинены единой
генетически детерминированной программе;
• не подвергаются негативной и позитивной селекции;
• участвуют в реакциях фагоцитоза, цитолиза, в том числе бактериолиза,
нейтрализации, выработки цитокинов и др.
Распознавание патогенов клетками врожденного иммунитета реализу-
ется через многочисленные рецепторные структуры, такие, как рецепторы-
мусорщики (scavenger-рецепторы), маннозные рецепторы, рецепторы ком-
племента (CR1, CR3, CR4), лектиновые рецепторы и др. Особую группу
рецепторов врожденного иммунитета составляют так называемые паттерн-
распознающие рецепторы (англ. Pattern-Recognition Receptor — PRR).
Они распознают консервативные, общие для многих типов микроор-
ганизмов структуры, так называемые патогенассоциированные молеку-
лярные паттерны (англ. Pathogen-Associated Molecular Patterns — РАМР).
В настоящее время интенсивно изучают структуру и функции рецепторов
врожденного иммунитета, таких, как Toll-подобные рецепторы (TLR),
NOD-1, NOD-2, RIG и др. Рецепторы врожденной иммунной системы эво-
люционно законсервированы.
ОСНОВНЫЕ ПОНЯТИЯ
21
Toll-рецепторы впервые обнаружены у дрозофил. Toll-подобные (TLR)
рецепторы у млекопитающих имеют сходную с ними структуру и функцию.
Рецепторы этого семейства широко представлены на различных клетках
иммунной системы (моноциты, ДК, лейкоциты и др.), а также на многих
клетках организма (фибробласты, эндотелий, эпителий, кардиомиоциты и
др.). Система TLR более подробно рассмотрена ниже.
Факторы врожденного иммунитета не изменяются в процессе
жизни организма, контролируются генами зародышевой линии и насле-
дуются.
Активация врожденного иммунитета не формирует продолжи-
тельной иммунной памяти, но служит обязательным условием раз-
вития адаптивного иммунного ответа.
Все перечисленные функции крайне важны для защиты от патогенных
микроорганизмов, но недостаточны для жизнедеятельности высокооргани-
зованных многоклеточных организмов, таких, как позвоночные. Именно у
них в процессе эволюции возникли новые иммунные компоненты и сфор-
мировалась иммунная система, главной функцией которой стал контроль
над генетическим постоянством внутренней среды многоклеточного орга-
низма. Перед иммунной системой возникла задача распознать и запомнить
«свое». Всё, что антигенно «свое», должно сохраниться, а всё, что антигенно
«чужое», подлежит удалению из организма. В условиях многомиллионно-
го разнообразия чужеродных антигенных структур невозможно обойтись
небольшим набором генов, передаваемых по наследству (так называемых
зародышевых генов — англ, germ line),
В связи с новыми задачами формируется приобретенная (адаптивная)
иммунная система с появлением целого ряда новых структур и свойств:
• тимус;
• клеточные компоненты: антигенраспознающие Т- и В-лимфоциты,
антигенпрезентирующие, регуляторные, цитотоксические и другие
клетки; молекулы: антитела;
• система генов главного комплекса гистосовместимости (у человека
HLA — от англ. Human Leukocyte Antigens)*
• механизм соматической перегруппировки генов TCR и иммуногло-
булинов (антител) из первоначально небольшого числа зародышевых
генов.
В результате этого механизма под влиянием регуляторов генной пере-
группировки (RAG1 и RAG2) из первоначального небольшого набора генов
зародышевой линии, передаваемых по наследству, в процессе соматической
рекомбинации генных сегментов V, D, J и С, кодирующих молекулы антител
или TCR, создается огромное разнообразие распознающих элементов, кото-
рые охватывают все существующие в природе антигены. После рождения
иммунная система человека потенциально способна к узнаванию любого
антигена и может дифференцировать антигены, различающиеся одним
ГЛАВА 1
22 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
или несколькими аминокислотными остатками. На уровне тимуса и кост-
ного мозга происходит элиминация или блокада (селекция) Т- и В-клеток,
потенциально способных реагировать с аутологичными антигенами.
Ключевую роль в реакциях адаптивного иммунитета выполня-
ют субпопуляции Т- и В-лимфоцитов, узнающие антигены с помощью
антигенраспознающих рецепторов (TCR и BCR соответственно).
Т-лимфоциты способны распознавать антиген, только если он представ-
лен антигенпрезентирующими клетками собственного организма с участи-
ем молекул главного комплекса гистосовместимости I или II класса. Такими
уникальными свойствами в организме обладают только Т-лимфоциты, и в
этом смысле они являются истинными иммунокомпетентными клетками
(иммуноцитами, по терминологии основателя клонально-селективной тео-
рии иммунитета Ф. Бернета).
В процессе развития центральных органов иммунной системы в них
изначально формируются клеточные элементы с рецепторами к любому
антигену, который, поступая в организм, активирует специфичный к нему
клон лимфоцитов. Например, до инфекции частота специфических клеток
(Т- и В-лимфоцитов) крайне низкая для протективного ответа и составля-
ет примерно 1:10 000-1:100 000 клеток. Однако в течение 1-2 нед после
распознавания антигена клетки интенсивно пролиферируют, и их число
возрастает примерно в 1000 раз. После созревания они образуют клоны,
клетки которых защищают хозяина, вырабатывая антитела, активируя
макрофаги, убивая инфицированные клетки и выполняя другие функции.
После завершения иммунного ответа антигенспецифические Т- и В-клетки
сохраняются как «клетки памяти».
Таким образом,
• молекулы и рецепторы системы адаптивного иммунитета закладыва-
ются на ранних этапах онтогенеза из небольшого набора зародышевых
генов;
• эта система имеет огромное число антигенраспознающих вариантов
(репертуар), достаточное для узнавания своих и чужеродных анти-
генов в течение жизни. Иными словами, она формируется в течение
жизни индивида под действием различных антигенов;
• основная особенность приобретенного или адаптированного иммуни-
тета заключается в том, что соматически перегруппировавшиеся гены
иммуноглобулинов и TCR не наследуются. Потомство получает от
родителей набор только зародышевых генов и затем формирует свой
спектр элементов приобретенного иммунитета. Эмбрион, получивший
зародышевые гены, начинает «строить» свою иммунную систему.
Естественно, что в организме млекопитающих врожденный и адаптив-
ный иммунитет, осуществляющие разные задачи, функционируют коор-
динированно. Активация врожденного иммунитета, как правило, служит
обязательным условием инициации адаптивного иммунного ответа.
ОСНОВНЫЕ ПОНЯТИЯ
23
В историческом аспекте клиническая иммунология имеет дело с заболе-
ваниями, вызванными нарушениями приобретенного иммунитета (иммуно-
дефициты, аутоиммунная патология, аллергопатология, лимфопролифера-
тивные заболевания и др.). Однако в последнее время активно выявляются
и изучаются заболевания с преимущественными дефектами компонентов
врожденного иммунитета, включая патологию рецепторов врожденного
иммунитета, комплемента, цитокинов и их рецепторов, системы нормаль-
ных киллеров и многие другие. Чаще всего такие заболевания проявляются
в форме воспаления различного уровня — от системного до локального.
Тем не менее в настоящее время целесообразно оба типа иммунного реа-
гирования рассматривать в комплексе, делая акценты на наиболее важных
сторонах каждого из них. В связи с этим по мере изложения материала мы
приводим не только индивидуальные особенности врожденного и приобре-
тенного иммунитета, но и общие закономерности их функционирования.
В табл. 1-1 приведены основные компоненты и свойства систем врожден-
ного и адаптивного иммунитета.
ГЛАВА 1
Таблица 1-1. Компоненты и функции врожденного и приобретенного иммунитета
Компоненты и функции Врожденный иммунитет Приобретенный иммунитет
Клетки-эффекторы Моноциты/макрофаги, ден- дритные клетки, гранулоциты, NK-клетки, NKT-лимфоциты, эози- нофилы, тучные клетки Т- и В-лимфоциты, их многочис- ленные субпопуляции (Т-хелперы, Т-регуляторы, Т-киллеры и др.)
Гуморальные факторы Комплемент, естественные антите- ла, катионные противомикробные пептиды, провоспалительные цитокины, интерфероны типа 1, белки острой фазы, белки тепло- вого шока, лектины и др. Антитела различных изотипов и подтипов: IgM, IgG (lgG1, lgG2, lgG3, lgG4), IgA (lgAr lgA2), IgE, IgD; цито- кины (ИЛ-2, ИЛ-4, ИФН-у и др.)
Основные функции Распознавание патогенов, прямое противомикробное действие, под- держание микробиоценоза, разви- тие воспаления, индукция приоб- ретенного иммунитета и др. Двойное распознавание антигена в комплексе с молекулами главного комплекса гистосовместимости (для Т-лимфоцитов), развитие иммунно- го ответа клеточного или гумораль- ного типа, иммунная память и др.
Компоненты врожденного и приобретенного иммунитета тесно связаны
по многим параметрам:
• дендритные клетки (ДК), макрофаги и другие клетки врожденного
иммунитета презентируют антиген Т- и В-лимфоцитам;
• ДК через различные сочетания TLR и секретируемые цитокины опре-
деляют направление развития иммунного ответа по клеточному или
гуморальному пути;
24 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
• компоненты комплемента крайне важны для развития и функциониро-
вания В-лимфоцитов;
• цитокины, вырабатываемые Т-клетками, макрофагами, тучными клет-
ками, оказывают взаиморегулирующее действие;
• естественные киллеры (NK-клетки) уничтожают в организме клетки,
лишившиеся молекул главного комплекса гистосовместимости класса I
(«утраченное свое»).
Таким образом, физиологическое значение иммунной системы состоит
в обеспечении иммунологической индивидуальности организма в течение
его жизни за счет иммунного распознавания с участием компонентов врож-
денного и приобретенного иммунитета. Иммунная система тесно взаимо-
действует с другими системами организма, оказывая регуляторное влияние
на многие жизненно важные функции организма.
Следует заметить, что в клинической практике разработка методов
оценки наиболее важных компонентов врожденной иммунной системы,
диагностики их роли в иммунопатогенезе заболеваний человека, методов
их иммунотерапии находится на начальном этапе.
1.3. СТРУКТУРЫ, РАСПОЗНАВАЕМЫЕ ИММУННОЙ
СИСТЕМОЙ,-АНТИГЕНЫ
Учение об антигене — один из ключевых разделов общей иммунологии.
В данной главе мы рассмотрим некоторые свойства веществ как антигенов,
имеющие значение в первую очередь для решения проблем клинической
иммунологии.
Основная функция иммунной системы связана с распознаванием («ска-
нирование») огромного количества белковых и других структур, посту-
пающих в организм. Естественно, что среди них преобладают структуры,
связанные с патогенными и непатогенными микроорганизмами. Однако
широк спектр белковых и других молекул, происходящих от представите-
лей других или того же вида. Все эти вещества, чужеродные по отношению
к конкретному индивиду, объединены таким понятием, как «антиген».
Антигенами называют вещества, несущие признаки генетически
чужеродной информации, которые при попадании в организм спо-
собны вызывать иммунный ответ, направленный на их удаление.
Чтобы выступать в качестве антигена, вещество должно обладать такими
признаками, как чужеродность, антигенность, иммуногенность, специфич-
ность.
Чужеродность — основополагающее свойство антигена по отношению
к организму, в который антиген попадает. В связи с этим выделяют сле-
дующие антигены по отношению к организму: аутологичные (собственный,
ОСНОВНЫЕ ПОНЯТИЯ
25
аутоантиген), сингенные (изологичный, как правило, среди генетически
однородных линий животных), аллогенные (гомологичный, среди предста-
вителей одного вида), ксеногенные (гетерологичный, среди представителей
разных видов).
Антигенность молекулы определяется ее способностью вызывать
иммунный ответ в конкретном организме. Иммуногенность — это способ-
ность антигена сформировать иммунитет (иммунологическую память). Эти
определения сложно разграничить, однако антигенность подразумевает
способность молекул быть распознанными рецепторами иммунокомпетент-
ных клеток индивидуально, т.е. это свойство определяет специфичность
иммунного ответа. Большинство антигенов (преимущественно белковой
природы) способно вызывать формирование иммунологической памяти.
Это важно в отношении антигенов микроорганизмов, обусловливающих
невосприимчивость к инфекции, — насколько иммуногенна та или иная
вакцина? Иммуногенность антигена можно усилить за счет более эффек-
тивной его переработки и презентации иммунокомпетентным клеткам,
присоединения иммуностимулирующих компонентов и т.д. Высока зави-
симость иммуногенности от генотипических особенностей организма, от
размера молекулы, ее конформации, разнообразия эпитопов.
Еще одно свойство антигена — толерогенность. Это способность анти-
гена вызывать развитие неотвечаемости (анергии) или иммунной толерант-
ности. Как правило, толерогены — вещества с низкой молекулярной массой,
не образующие агрегатов, не презентируемые АПК.
Специфичность — одна из наиболее важных характеристик анти-
гена, отличающая его от других антигенов. Специфичность определяют
структурные особенности антигена, в частности структура антигенной
детерминанты, или эпитопа. Практически в любой молекуле антигена есть
несколько антигенных детерминант, или эпитопов, определяющих ее
специфичность. Иммунная система через TCR или антитело распознает не
весь антиген, а часть молекулы, определяемую как доминантный эпитоп.
Поиск эпитопов, распознаваемых иммунной системой, — крайне важная
задача вакцинологии. Выявление эпитопов аутоантигенов открывает пути
к более эффективной диагностике аутоиммунных патологий и созданию
новых подходов к их лечению.
Эпитоп — участок молекулы антигена из нескольких аминокислотных
остатков, специфически взаимодействующий с антигенсвязывающим цен-
тром (паратоп) антигенраспознающих рецепторов Т- или В-лимфоцитов,
а также с вариабельным регионом (активный центр) антител. Существуют
линейные и конформационные эпитопы. Линейные эпитопы образованы
последовательностью аминокислотных остатков, конформационные эпи-
топы — отдаленными остатками белковой молекулы антигена, сближающи-
мися при образовании третичной структуры (рис. 1-1).
ГЛАВА 1
26 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
(145) 146-151
СООН
Рис. 1-1. Схематичное изображение миоглобина спермы кита. Детерминанты, распозна-
ваемые В-лимфоцитами (В-клеточные эпитопы), расположены на внешней поверхности
молекулы антигена (окрашены синим). Цифры обозначают порядковый номер аминокис-
лотных остатков в полипептиде.
Антигены многообразны по химической природе, но в наибольшей сте-
пени в качестве антигенов выступают белки и гликопротеины с молекуляр-
ной массой больше 10 кДа. Отдельные аминокислоты не являются антиге-
нами, но полипептиды размером 8-10 аминокислотных остатков — это уже
антигены. В зависимости от конкретных условий антигенными свойствами
обладают полисахариды, фосфолипиды и некоторые другие молекулы.
Особое место среди антигенов занимают вещества, назывемые гаптена-
ми. Это низкомолекулярные химические соединения, например динитро-
хлорбензол, некоторые лекарственные средства (антибиотики р-лактамы,
сульфаниламиды и др.). Гаптены, в отличие от антигенов, выработку
антител непосредственно не индуцируют, но реагируют с антителами, обра-
зующимися в ответ на иммунизацию гаптеном, связанным с иммуногенным
(белковым) носителем. Реагирование иммунной системы на гаптены — рас-
пространенная ситуация, хотя в ряде случаев они служат причиной разви-
тия аллергических реакций немедленного или замедленного типа.
В зависимости от способности вовлекать в иммунный ответ Т-лимфо-
циты выделяют тимусзависимые и тимуснезависимые антигены.
Большинство природных антигенов принадлежит к группе тимусзави-
симых. Это значит, что полноценное развитие иммунного ответа на такие
антигены развивается только при подключении Т-лимфоцитов, т.е. проис-
ходит в результате взаимодействия Т- и В-лимфоцитов.
Тимуснезависимые антигены (ТН-антигены) активируют непосред-
ственно В-клетки без помощи Т-клеток. В зависимости от способа акти-
вации В-лимфоцитов выделяют две группы ТН-антигенов: антигены 1-го
ОСНОВНЫЕ ПОНЯТИЯ
27
типа (THl-антигены) и антигены 2-го типа (ТН2-антигены). ТН1-антигены
вызывают поликлональную активацию В-лимфоцитов. Примером таких
антигенов может служить липополисахарид (ЛПС) клеточной стенки
грамотрицательных бактерий. ТН2-антигены представлены крупными
полисахаридными молекулами с повторяющимися антигенными детерми-
нантами (например, фиколл, декстран, флагелин бактерий); они вызывают
перекрестное сшивание антигенраспознающих рецепторов В-лимфоцитов
и активацию этих клеток, однако при этом требуется цитокиновая помощь.
В результате этих взаимодействий В-лимфоциты дифференцируются в
плазматические клетки, синтезирующие IgM и IgG2, не формируют дли-
тельной иммунной памяти. ТН-антигены активируют преимущественно
Bl-клетки, локализованные в основном в полостях тела (брюшной и плев-
ральной) и lamina propria.
Аутоантигенами называют антигены собственного организма, на кото-
рые в норме иммунного ответа не развивается. В процессе развития орга-
низма формируется иммунная толерантность к собственным антигенам.
Некоторые аутоантигены в норме не контактируют с иммунокомпетент-
ными клетками и находятся в так называемых забарьерных (иммунопри-
вилегированных) тканях (например, ткани глаза, яичек, головного мозга,
волосяных фолликулов и др.). Срыв толерантности к аутоантигенам или
нарушение «забарьерности» приводит к развитию аутоиммунной патоло-
гии.
Аллерген — антиген, вызывающий образование IgE и развитие аллер-
гической иммунной реакции. Обычно аллергены — безвредные белки, но
у определенной категории людей они вызывают тяжелейшие атопические
заболевания. До сих пор нет четкого определения вещества как аллерге-
на. Существует мнение, что аллергены могут обладать ферментативной
(протеазной) активностью, имеют сложную пространственную структуру,
характерные особенности гликозилирования молекулы и др. Во всяком слу-
чае главное свойство аллергенов — способность активировать ТЬ2-лимфо-
циты и направлять дифференцировку В-лимфоцитов в IgE-продуцирующие
клетки. Разнообразие аллергенов рассматривается в разделах, касающихся
аллергопатологии.
Особое место в клинической иммунологии отводят веществам, обознача-
емым как суперантигены. Как правило, это продукты жизнедеятельности
микроорганизмов, с помощью которых реализуется их способность укло-
няться от иммунной защиты. Взаимодействуя с V-доменом 0-цепи TCR,
суперантигены осуществляют поликлональную активацию Т-клеток, и на
этом фоне «теряется» антигенспецифическая активность Т-лимфоцитов.
Кроме того, известно, что избыточная активация лимфоцитов (феномен,
индуцированный активацией клеточной смерти) приводит к апоптозу и в
конечном счете к иммунодефициту. Большинство суперантигенов имеет
ГЛАВА 1
ЧАСТЬ 1
28 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
бактериальную и вирусную природу. К ним относят энтеротоксины стафи-
лококков, компоненты вирусов (вирусы Эпштейна-Барр, бешенства, вирус
иммунодефицита человека), микобактерий и др. С суперантигенами связы-
вают запуск аутоиммунной патологии.
Иммунная система подвержена воздействию молекул, обозначаемых
как митогены, вызывающих поликлональную активацию иммунокомпе-
тентных клеток. Их действие осуществляется через поверхностные струк-
туры Т- и В-лимфоцитов, и поэтому эти молекулы обозначаются как
Т-митогены (фитогемагглютинин, конканавалин А и др.) и В-митогены
(полисахариды, ЛПС, митоген лаконоса и др.).
В реакциях врожденного иммунитета распознаются совершенно
другие структуры, а именно общие для многих типов микроорганиз-
мов (РАМР). Характеристика таких структур приведена в разделе 3.1.
Для усиления иммунного ответа часто используют адъюванты (от
латинского <<adiuvare> — помогать) — вещества, неспецифически повы-
шающие иммуногенность антигена. Эффекты адъювантов обусловлены по
крайней мере двумя механизмами: созданием депо антигена и активацией
антигенпрезентирующих клеток, приводящей к выработке цитокинов,
которые регулируют направление дифферецировки Т-хелперов.
Неорганические соли (гидроксид алюминия, фосфат кальция) создают
депо антигена в малых гранулах. Эти адъюванты широко применяются в
вакцинах, содержащих дифтерийный и столбнячный анатоксин для индук-
ции антител.
Классическим является адъювант Фрейнда. В состав полного адъюванта
входит суспензия убитых микобактерий в ланолиновом или вазелиновом
масле. Неполный адъювант не содержит микобактерий.
Открытие TLR объяснило действие многих бактериальных продуктов, в
том числе и адъюванта Фрейнда на активацию ДК, макрофагов и индукцию
синтеза ими цитокинов. Новое поколение адъювантов основано на при-
менении очищенных бактериальных компонентов, включая синтетические
агонисты TLR (CpG-мотивы, монофосфорил-липид А). Связывание раз-
личных TLR ДК может регулировать иммунный ответ в направлении Thl
или Th2. Сами цитокины, связанные с антигеном, действуют как эффек-
тивные адъюванты. Использование цитокинов в качестве адъювантов
целесообразно у людей с иммунодефицитами, у которых обычные вакцины
неэффективны. Применение определенного набора цитокинов позволит
вызвать иммунный ответ Thl- (при действии ИЛ-12, ИЛ-18, ИФН-у) и Th2-
типа (выработка антител) — при действии ИЛ-4.
Вопросы для самоконтроля
• Сформулируйте представление об иммунной системе организма, ее
функциях, основных свойствах.
• Дайте определение иммунитета.
ОСНОВНЫЕ ПОНЯТИЯ 29
Дайте сравнение врожденного и адаптивного иммунитета.
Охарактеризуйте клеточные и гуморальные компоненты врожденного
и адаптивного иммунитета.
Какие функции реализуются системой врожденного и адаптивного
иммунитета?
Приведите примеры взаимодействия врожденного и адаптивного
иммунитета.
Назовите основные различия в распознающих рецепторах систем
врожденного и адаптивного иммунитета.
Дайте определение антигена, охарактеризуйте его основные свойства.
В чем различия между антигеном, суперантигеном и аллергеном?
Приведите примеры адъювантов и объясните механизм их действия.
Охарактеризуйте структуры, распознаваемые клетками систем врож-
денного и адаптивного иммунитета.
ГЛАВА 1
Глава 2
Клинически значимые
характеристики клеток, органов
и тканей иммунной системы
2.1. КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы гетерогенны как по поверхностным
маркерам, так и по функциям. Многие клеточные элементы сходны
по морфологическим признакам, но различить их можно только по
маркерам клеточной мембраны.
Маркеры — поверхностные молекулы, в первую очередь белко-
вой природы, характеризующие стадию дифференцировки клетки
и ее принадлежность к определенной популяции или субпопуля-
ции. Под фенотипом клетки понимают совокупность всех поверх-
ностных маркеров и рецепторов.
В настоящее время создана единая номенклатура поверхност-
ных антигенов (маркеров) клеток иммунной системы, выявляемых
с помощью моноклональных антител. Систематическое проведе-
ние международных рабочих совещаний специалистов по типиро-
ванию клеток иммунной системы дало возможность сопоставить
специфичность моноклональных антител, полученных исследо-
вателями в разных странах, в отношении конкретных маркеров.
Достаточно подробно охарактеризованные общепринятые марке-
ры стали обозначаться символом CD (сокращение от англ. Cluster
of Differentiation). К 2009 г. описано 339 молекул CD, и число их
продолжает увеличиваться. Для идентификации поверхностных
маркеров клеток в крови, других биологических жидкостях, тка-
нях, в культурах in vitro применяются моноклональные антитела,
конъюгированные с флюорохромами (например, флюоресцеином
и фикоэретрином), и анализируются методом проточной цито-
флюорометрии (см. гл. 9).
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 31
2.1.1. Гемопоэтическая стволовая клетка
Особое место в иммунной системе отводят гемопоэтической стволовой
клетке, дающей начало подавляющему большинству клеточных элементов
иммунной системы. Впервые вопрос о полипотентности стволовой гемопо-
этической клетки поставил выдающийся русский гистолог А.А. Максимов.
В 20-х годах XX в. он заявил, что стволовая клетка подобна костномозгово-
му малому лимфоциту, обладает способностью к самоподдержанию и из нее
развиваются все клетки крови (эритроциты, моноциты, тромбоциты, лим-
фоциты). Гемопоэтические стволовые клетки постоянно в незначительном
количестве перемещаются по кровотоку. В настоящее время разработаны
методы получения фракций, обогащенных стволовыми клетками, не только
из костного мозга, но и из периферической, а также из пуповинной крови,
где уровень их такой же, как в костном мозге.
Известны основные морфологические и фенотипические характеристи-
ки стволовых клеток. Это клетки диаметром 8-10 мкм с узким ободком
цитоплазмы и гомогенным круглым ядром. При электронной микроскопии
в этих клетках не выявляются аппарат Гольджи, эндоплазматический рети-
кулум и лизосомы, но имеется много свободных рибосом и малые митохон-
дрии. Известно, что стволовые клетки кроветворных тканей мобильны.
Первые веские доказательства способности кроветворных стволовых
клеток к миграции получены благодаря результатам экспериментальных
исследований на мышах. В 60-х годах прошлого столетия было установле-
но, что в костном мозге и периферической крови содержатся клетки, обла-
дающие функцией стволовых и способные образовывать кроветворные
колонии в селезенке облученных радиацией животных. Наличие в крови
циркулирующих клеток, обладающих функцией стволовых, свидетельству-
ет о способности кроветворных предшественников выходить в кровяное
русло и мигрировать по организму.
В конце эмбрионального периода и в первые дни после рождения содер-
жание циркулирующих стволовых клеток в крови в десятки раз выше, чем
во взрослом организме. Во внутриутробном периоде главный очаг крове-
творения — печень. Раньше печень эмбриона использовали как источник
гемопоэтических стволовых клеток для трансплантации. Костный мозг как
кроветворная ткань формируется в конце эмбрионального периода жизни.
Переключение кроветворения с эмбриональной печени на костный мозг,
по-видимому, осуществляется посредством переселения стволовых клеток с
током крови. В дальнейшем, во взрослом состоянии, костный мозг человека
сам поставляет стволовые клетки на периферию.
Определены ключевые поверхностные маркеры, характерные для ство-
ловых гемопоэтических клеток человека: CD34, CD133, CD38, Thy-1
(CD90), C-kit (CD117) и др. Ключевым и практически значимым марке-
ГЛАВА 2
ЧАСТЬ 1
32 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ром таких клеток человека является CD34 — высокогликолизированный
трансмембранный белок типа 1 семейства сиаломуцинов с адгезивными
свойствами. Лигандом CD34 служит L-селектин (CD62L). Приблизительно
1-3% ядросодержащих клеток костного мозга и 0,5% мононуклеарных кле-
ток периферической крови экспрессируют молекулы CD34.
В последние годы большое внимание уделяют гемопоэтическим ство-
ловым клеткам пуповинной крови, используемым для трансплантации.
Первая трансплантация стволовых клеток пуповинной крови была про-
ведена в 1989 г. при анемии Фанкони. По фенотипическим признакам
(CD34++ CD38- Thyl+ Lin- HLA-DR+) они отличаются от стволовых клеток
костного мозга.
На сегодняшний день охарактеризовано несколько этапов развития
гемопоэтической клетки.
• Полипотентная стволовая кроветворная клетка (англ, stem cell).
Малодифференцированная клетка, способная к самоподдержанию,
пролиферации и дифференцировке в родоначальные стволовые клетки
для миело- и лимфопоэза.
• Родоначальная стволовая кроветворная клетка (англ, progenitor
cell) ограничена в самоподдержании, но она интенсивно пролифери-
рует, имеет ограниченное число делений и коммитирована к диффе-
ренцировке по крайней мере в двух направлениях (лимфоидном и
миелоидном).
• Клетка-предшественник (англ, precursor cell) — коммитирована к
дифференцировке только в один тип клеток (лимфоциты, гранулоци-
ты, моноциты и др.).
На всех этапах дифференцировки стволовой и последующих клеток
ключевая роль отводится стромальным элементам костного мозга,
факторам роста и цитокинам. В частности, дифференцировку ство-
ловой клетки в лимфоидный ряд определяет ИЛ-7 и его рецептор.
Для дифференцировки в миелоидный ряд важен эритропоэтин и
гранулоцитарно-макрофагальный колониестимулирующий фактор
(ГМ-КСФ). Многие цитокины регулируют дифференцировку стволо-
вых клеток. Система JAK-STAT факторов (JAK — Janus kinases; STAT —
Signal transducer and activator of transcription) обеспечивает передачу
цитокиновых сигналов. При дефектах этой системы развиваются
нарушения гемопоэза (лейкоз и тяжелый комбинированный иммуно-
дефицит — ТКИД) (см. гл. 10).
• Зрелые клетки (Т- и В-лимфоциты, моноциты и др.).
На рис. 2-1 представлены ключевые и практически важные этапы раз-
вития гемопоэтической стволовой клетки человека.
Таким образом, гемопоэтическая стволовая клетка, как малодифферен-
цированный клеточный элемент, способна к самоподдержанию, полипо-
тентности, пролиферации, дифференцировке, колониеобразованию (in vitro
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 33
ГСК
Самопод-
держание
NK
Treg
предшественник
Миелоидная ДК Миелоидная
rfs* родоначальная
RCV*—" у/ клетка
Макрофаг Моноцит
Лимфоидная
родоначальная
клетка
Нейтрофил ГМ-
предшественник
Эозинофил Предшественник
эозинофилов
В-клеточный В-клетка
предшественник
ГЛАВА 2
Базофил Предшественник
базофилов
Тромбоцит Мегакариоцит
Эритроцит Предшественник
Плазмоцитоидная
ДК
эритроцитов
Рис. 2-1. Схема гемопоэза человека (объяснение в тексте).
и in vivo), репопуляции гемо- и иммунопоэза после радиационного облуче-
ния или тяжелой химиотерапии. Способность к самоподдержанию опреде-
ляется тем, что одна из возникших дочерних клеток дифференцируется, а
другие остаются недифференцированными, локализуются, как полагают, в
особых клеточных «нишах» и служат источником образования последую-
щих поколений клеток. Такое асимметричное деление позволяет говорить о
«бессмертности» стволовых клеток.
ЧАСТЬ 1
34 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Помимо гемопоэтических стволовых клеток, в костном мозге имеются
мезенхимальные (стромальные) стволовые клетки (МСК), представ-
ляющие собой популяцию полипотентных клеток в костномозговом микро-
окружении, способных к дифференцировке в остеогенные, хондрогенные,
адипогенные, миогенные и другие линии клеток. МСК были описаны в 60-х
годах XX столетия отечественным ученым А.Я. Фриденштейном.
МСК отличаются от гемопоэтических стволовых клеток как по функ-
ции, так и по маркерам. Эти клетки экспрессируют высокий уровень CD90,
CD29, CD44, CD105 и умеренный уровень CD166, CD106 маркеров. МСК
пуповинной крови экспрессируют CD29, CD44, CD95, CD105, HLA класса I.
Большие надежды возлагаются на использование МСК для лечения многих
заболеваний человека с нарушением функции кератиноцитов, кардиомио-
цитов, синовиальных, нервных и других клеток.
Стволовые гемопоэтические стволовые клетки находят всё большее
применение в клинической трансплантологии. Лечение многих иммуно-
опосредованных заболеваний (первичные иммунодефициты, лимфо-
пролиферативные заболевания, системные аутоиммунные заболевания
и др.) основывается на трансплантации гемопоэтических стволовых
клеток. Эффективность таких методов лечения варьирует, но прогресс
несомненен.
2.1.2. Лимфоциты
Лимфоцит — основной клеточный элемент иммунной системы,
обеспечивающий развитие реакций иммунитета. Лимфоциты — неод-
нородная популяция клеток, участвующих в реакциях адаптивного (Т- и
В-лимфоциты и их многочисленные субпопуляции) и врожденного (NK-,
NKT-клетки, Bl-лимфоциты и др.) иммунитета.
В организме взрослого человека содержится около 1012 лимфоцитов, при
этом их общая масса составляет около 1,5 кг. Лимфоциты рециркулируют в
крови и лимфе, накапливаются в различных лимфоидных органах, в меж-
тканевых пространствах, обладают уникальной способностью проникать
через высокий эндотелий венул, не нарушая их целостности. Проведенные
расчеты показывают, что в крови находится около 2,2% лимфоцитов
от общего их числа, а основная масса распределена в тканях и лимфе
(табл. 2-1).
В периферической крови взрослого человека при общем количестве лей-
коцитов 4500-9500/мкл абсолютное содержание лимфоцитов составляет
800-1860/мкл, а относительный показатель 18-38%. Уровень лимфоцитов
в крови подвержен значительному влиянию целого ряда экзогенных и
эндогенных факторов, в частности возраста. У новорожденных количество
лимфоцитов может составлять около 10% от уровня взрослого человека.
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 35
ГЛАВА 2
Быстрое нарастание их количества почти до уровня взрослых происходит
к 15-16 годам.
Таблица 2-1. Содержание лимфоцитов в различных органах человека [Ganusov V.t
De Boer R., 2007\
Ткань Абсолютное количество (х109) Процент от общего количества
Кровь 10 2,2
Лимфатические узлы 190 41,2
Селезенка 70 15,2
Пейеровы бляшки 20 4,3
Тимус 50 10,8
Костный мозг 50 10,8
Lamina propria кишечника 30 6,5
Lamina propria легких 30 6,5
Другие ткани 10 2,2
Общее число 460 100
Морфологически лимфоциты представляют собой клетки с крупным
ядром, занимающим практически всю (малые лимфоциты) или большую
(средние и большие лимфоциты) часть цитоплазмы, и отличаются значи-
тельным разнообразием (гетерогенность) как по морфологическим, так и
по функциональным признакам (рис. 2-2).
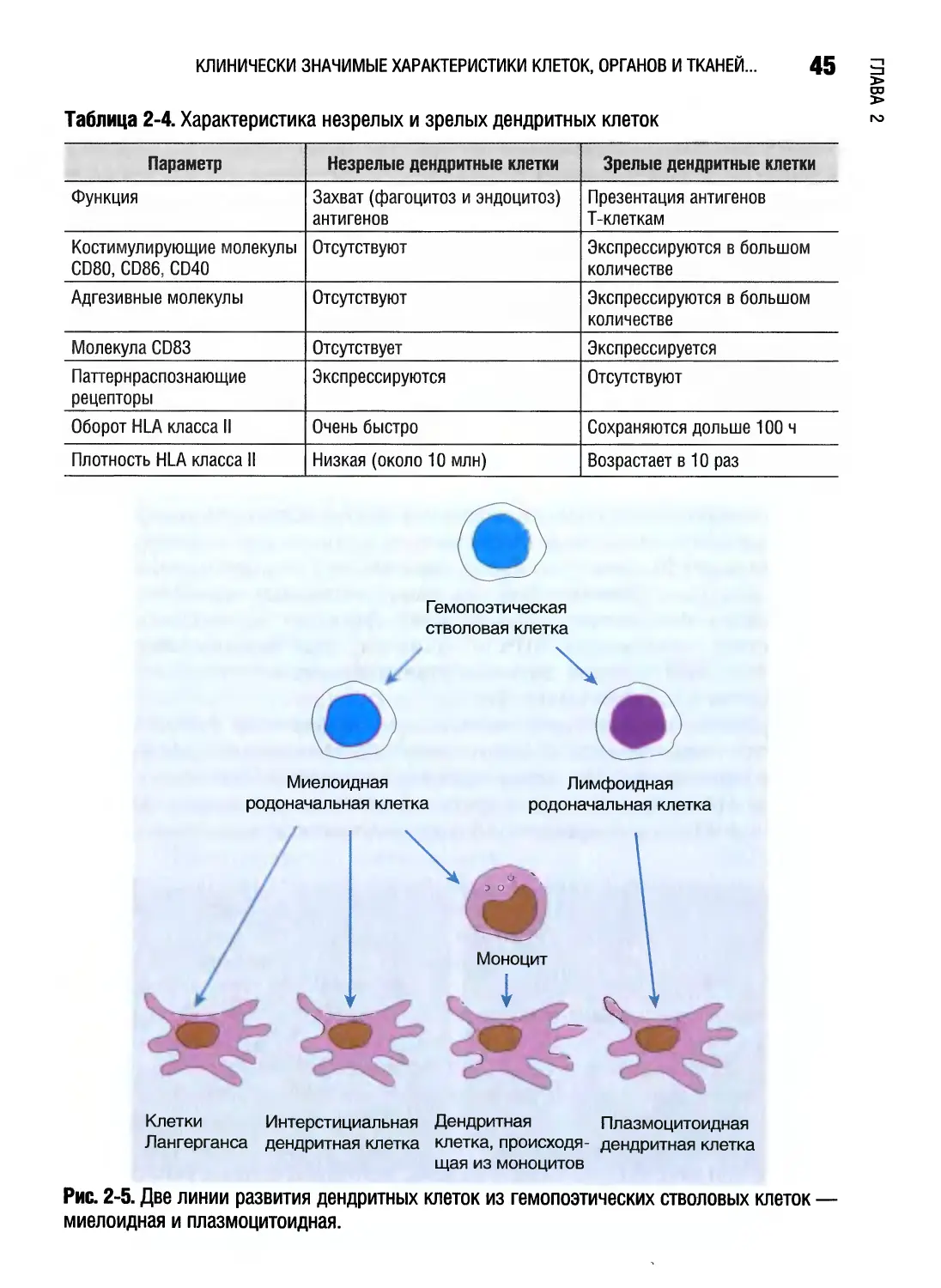
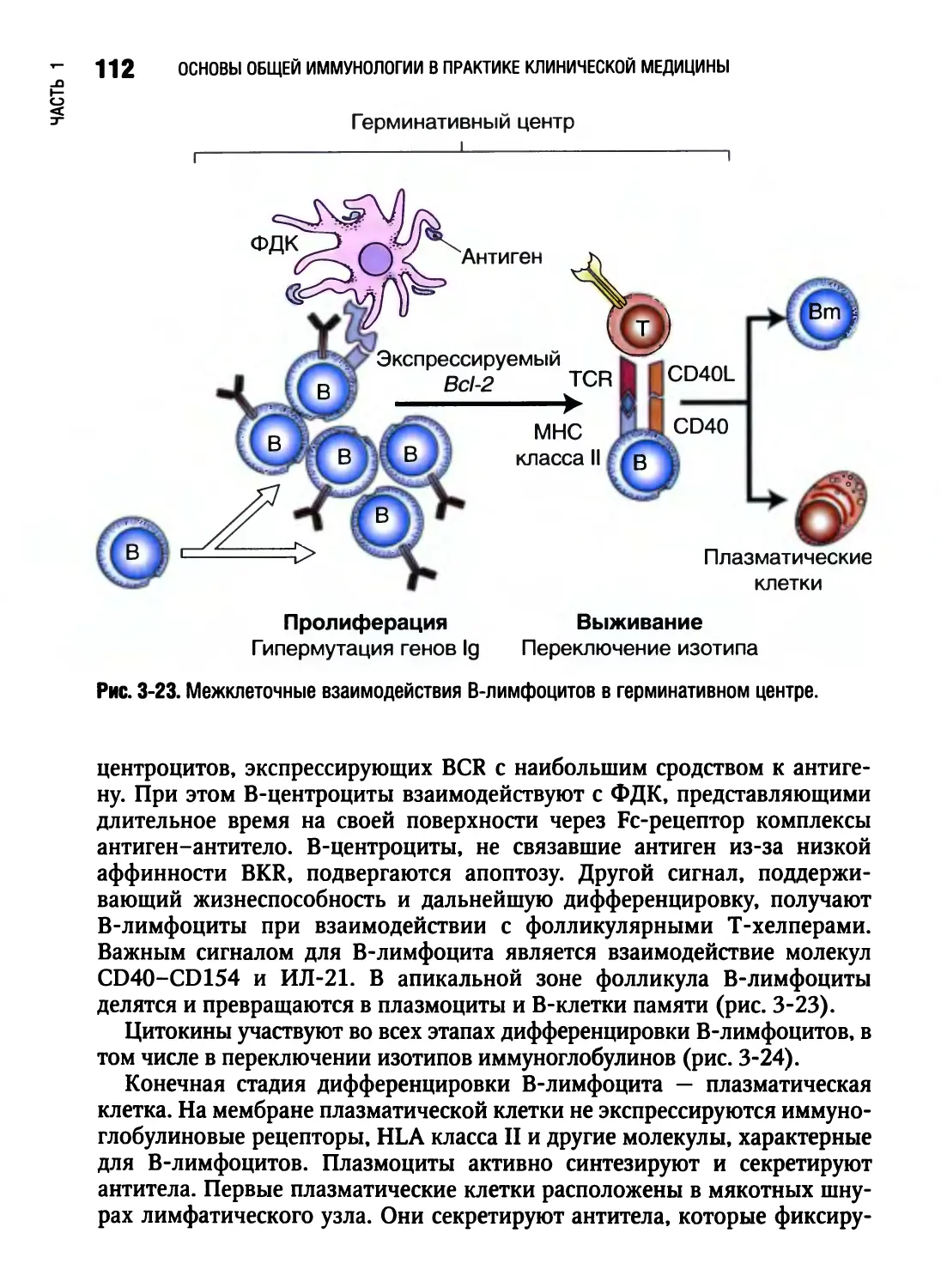
Отличительная особенность Т- и В-лимфоцитов состоит в том, что они
являются истинными иммунокомпетентными клетками. Основные мар-
керы Т- и В-лимфоцитов представлены в табл. 2-2.
Рис. 2-2. Морфология лимфоцитов: А — лимфоцит периферической крови, световая
микроскопия; В — электронная микрофотография малого лимфоцита; С — электрон-
ная микрофотография большого лимфоцита (лимфобласта) (Fawcett D.W. Textbook of
Histology, 12th, 1994).
36 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Таблица 2-2. Основные маркеры Т- и В-лимфоцитов
Маркеры Т-лимфоциты В-лимфоциты
Рецептор для антигена Т-клеточный рецептор (ар или у8) р-Клеточный рецептор
CD2 Адгезивная молекула (LFA-2). Е-розеткообразующий рецептор Нет
CD3 Входит в состав ар и у8 Т-клеточного рецептора. Содержит 4 субъединицы (у, 5, е, е) и гемодимер £-цепей (CD247) и участвует в передаче сигнала. СОЗ-комплекс — типичный маркер Т-клетки Нет
CD4 Маркер Т-хелперов, рецептор для моле- кул HLA класса II и вируса иммунодефи- цита человека Нет
CD8 Маркер цитотоксических Т-лимфоцитов, рецептор для молекул HLA класса I Нет
CD19 Нет Часть В-клеточного рецепторного комп- лекса. Типичный маркер В-клеток
CD20 Нет Участвует в передаче активирующего сигна- ла с участием В-клеточного рецептора. Типичный маркер В-клеточных опухолей
CD21 Нет Часть В-клеточного рецепторного комплек- са, рецептор комплемента (CR2), вируса Эпштейна-Барр
CD23 Нет FceRII, низкоаффинный рецептор для IgE
CD25 Рецептор a-цепи ИЛ-2. Характерен для Treg. Также активационный маркер Т-клеток Рецептор a-цепи ИЛ-2
CD28 Ключевая костимулирующая молекула для активации и пролиферации Т-клеток (рецептор костимулирующих молекул CD80/86) Нет
CD32 Нет Fc-yRlI, низкоаффинный рецептор для IgG
CD40 Нет Рецептор для костимулирующей молекулы CD40L (CD154), появляющейся на Т-клетке при кооперации с В-клеткой
CD79a Нет lga-субъединица В-клеточного рецептор- ного комплекса
CD79b Нет lgp-субъединица В-клеточного рецепторного комплекса
CD80/86 Нет Рецептор для костимулирующей молекулы CD28
CD95 Fas-рецептор для FasL (CD178), передает сигнал апоптоза Fas-рецептор для FasL (CD178), передает сигнал апоптоза
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 37
Только Т- и В-лимфоциты способны:
• распознавать антиген с помощью клонально экспрессированных анти-
генспецифических TCR и BCR;
® развивать антигенспецифические иммунные реакции, направленные
на элиминацию антигена;
• создавать клоны себе подобных клеток после стимуляции антигеном;
® формировать иммунную память;
• развивать иммунную толерантность.
Другие клетки иммунной системы не способны реализовать полный
набор свойств иммунокомпетентных клеток, хотя им бывают присущи
отдельные из вышеперечисленных характеристик.
Клональный принцип организации популяций Т- и В-лимфоцитов озна-
чает, что каждая клетка экспрессирует уникальный по специфичности анти-
генраспознающий рецептор. В процессе пролиферации она формирует клон
лимфоцитов, способных распознать именно этот единственный антиген.
Вся популяция лимфоцитов в целом способна распознать всю совокуп-
ность антигенных эпитопов. При дифференцировке лимфоцитов форми-
руется полный набор рецепторов, так называемый антигенраспознающий
репертуар. Потенциально опасные для организма клоны аутореактивных
лимфоцитов в процессе селекции удаляются из иммунной системы или
становятся анергичными (см. гл. 3).
В-лимфоциты отвечают за гуморальный адаптивный иммунный
ответ, направленный преимущественно на поражение внеклеточных инфек-
ционных агентов. При связывании специфического антигена В-лимфоциты
при кооперативном взаимодействии с Т-лимфоцитами-хелперами про-
лиферируют, дифференцируются в плазматические клетки, секретирую-
щие антитела, и клетки памяти. Антиген вызывает селекцию клонов
В-лимфоцитов, экспрессирующих специфичные к нему BCR (рис. 2-3).
Различают В1- и В2-субпопуляции В-лимфоцитов, участвующие в реак-
циях врожденного и адаптивного иммунитета.
В1-лимфоциты (CD5+). Возникают в эмбриогенезе, локализуются
преимущественно в брюшной и плевральной полости и lamina propria,
распознают тимуснезависимые антигены и секретируют в основном IgM;
не формируют клеток памяти. В отличие от «обычных» В-лимфоцитов
Bl-клетки способны к самоподдержанию и играют важную роль в защите от
патогенных микроорганизмов. Известны 2 субпопуляции В-1-лимфоцитов:
В-la (СП5+)иВ-1Ь (CD5 ).
В2-лимфоциты (CD5) проходят дифференцировку в эмбриональном
периоде в печени, затем в костном мозге, а антигензависимый этап диф-
ференцировки — в фолликулах периферических лимфоидных органов.
В2-лимфоциты характеризуются широким разнообразием BCR, распозна-
ют Т-зависимые антигены, продуцируют иммуноглобулины разных клас-
сов, формируют иммунологическую память.
ГЛАВА 2
38 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Продукция антител клоном 2
Рис. 2-3. Развитие гуморального иммунного ответа (описание в тексте).
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 39
Т-лимфоциты занимают особое место в иммунной системе и служат
главной популяцией в развитии клеточно-опосредованного иммун-
ного ответа. Развитие Т-лимфоцитов зависит от тимуса, хотя выделяют
также зоны внетимического развития таких клеток. Среди CD4+ и CD8+
Т-лимфоцитов выделяют следующие основные субпопуляции:
• Т-клетки-хелперы (ThO, Thl, Th2, Thl7, Tfh);
• регуляторные Т-клетки клетки (Treg, Tri, Th3);
• цитотоксические Т-клетки (ЦТЛ).
CD4+ Т-хелперы — функциональная субпопуляция Т-клеток, которые
продуцируют различные цитокины и участвуют в распознавании анти-
генного пептида в комплексе с HLA класса II, на антигенпрезентирующей
клетке, в генерации цитотоксических Т-лимфоцитов, в межклеточной
кооперации с В-клетками, направляя их дифференцировку по пути плазма-
тических клеток, синтезирующих антитела, а также в некоторых вариантах
цитотоксичности.
Цитотоксические CD8+ Т-лимфоциты (ЦТЛ) — клетки-киллеры,
способные поражать инфицированные вирусом клетки-мишени, опухоле-
вые клетки, клетки трансплантата. ЦТЛ распознают антигенные пептиды в
комплексе с молекулами HLA класса I.
Регуляторные CD4+ CD25+ FoxP3+ Т-лимфоциты (Treg) под-
разделяются на природные (естественные), развивающиеся в тиму-
се, и индуцированные на периферии из CD4+ ThO-клеток. Основная
функция Treg-клеток — подавление (супрессия) активированных CD4+ и
CD8+ Т-лимфоцитов, а также других клеток. Более подробный анализ Treg
дан в главе 5.
Т-клетки памяти (англ, memory cells) — долгоживущие лимфоци-
ты, примированные антигеном, но не достигшие стадии терминальной
дифференцировки в клетки-эффекторы. Т-клетки памяти экспрессируют
молекулы CD45RO (изоформа тирозинфосфатазы) и много молекул CD44,
способствующих их активной рециркуляции. При повторном контакте с тем
же антигеном они отвечают намного быстрее и активнее, чем наивные лим-
фоциты. Клетки памяти отличаются от наивных большим сроком жизни,
выраженной рециркуляцией и способностью к самоподдержанию. Более
подробная характеристика различных субпопуляций лимфоцитов пред-
ставлена в главах 3-5.
В табл. 2-3 представлено содержание CD4+ и CD8+ Т-лимфоцитов в крови
и различных тканях и органах человека. В лимфатических узлах содержит-
ся основное количество Т-лимфоцитов (41,2%). Среди них CD4+ Т-клетки
составляют 46,9%, CD8+ Т-лимфоциты — 35,0%. В селезенке содержится
15,2% лимфоцитов от общего количества в организме. На долю Т-хелперов
приходится 6,9%, на долю ЦТЛ — 19,4%.
ГЛАВА 2
ЧАСТЬ 1
Таблица 2-3. Распределение CD4+ и CD8+ Т-лимфоцитов у человека [Ganusov I/., De Boer R., 2OO7\ §
Локализация Общее количество CD4* Т-клеток (хЮ9) Процент С04+Т-клеток от обще- го числа СО4+-клеток в организме Общее количество СО8+ Т-клеток (хЮ9) Процент СО8+Т-клеток от общего числа СО8+-клеток в орга- низме
Кровь 5 2,5 2,5 2,3
Лимфатические узлы 95 46,9 38 35,0
Селезенка 14 6,9 21 19,4
Пейеровы бляшки 6 3,0 2 1,8
Тимус 37,5 18,5 12,5 11,5
Костный мозг 10 4,9 15 13,8
Lamina propria кишечника 15 7,4 7,5 6,4
Lamina propria легких 15 7,4 7,5 6,4
Другие ткани 5 2,5 2,5 2,3
Общее число 202,5 100 108,5 100
ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИН
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 41
2.1.3. Основные клеточные элементы системы
врожденного иммунитета
NK-клетки (англ. Natural Killer) — натуральные или естественные
клетки-убийцы. Морфологически характеризуются как большие грану-
лярные лимфоциты (см. рис. 2-8, Г). NK-клетки распознают и убивают
некоторые опухолевые, инфицированные вирусом, трансплантированные
и другие клетки без развития типичной иммунной реакции. NK-клетки
реализуют первую линию противоопухолевой и противовирусной защи-
ты. Распознающие рецепторы NK-клеток отличаются от таковых Т- и
В-лимфоцитов. Основная мишень распознавания — аутологичные молеку-
лы HLA класса I, а именно их наличие или отсутствие на клетке. NK-клетки
относятся к системе врожденного иммунитета. Они более подробно охарак-
теризованы в разделе 4.5.
NКТ-«неклассическая» субпопуляция Т-лимфоцитов, сочетающая
признаки Т-лимфоцитов и NK. Эти клетки экспрессируют на поверх-
ности молекулы NK-клеток (CD56, CD161, KIR) и антигенраспознающие
рецепторы-ТСИ-СОЗ. Являясь клетками врожденного иммунитета, NKT
выполняют цитотоксическую функцию, регуляторную функцию, активно
секретируют ИНФ-у в ответ на поступление в организм патогенов. Более
подробно эти клетки описаны в разделе 4.5.3.
у8Т-«неклассические» лимфоциты рассматривают как клетки
врожденного иммунитета. Эти клетки имеют фенотип CD3+, CD8aa+,
CD4+/_, CD2", CD5~, CD28”, y8TCR и сочетают функции регуляторных и
эффекторных клеток. Как и aPT-лимфоциты, они развиваются из регу-
ляторных Т-клеточных предшественников (рис. 3-9), но отличаются от
арТ-лимфоцитов по структурным и функциональным характеристикам.
у8Т-клетки составляют около 5% Т-лимфоцитов периферической крови,
однако значительно больше таких клеток в коже, слизистых оболочках
пищеварительного, дыхательного и репродуктивного тракта. Более подроб-
но эта субпопуляция Т-лимфоцитов охарактеризована в разделе 4.5.
Система фагоцитарных клеток. Включает большой набор клеток
с основной способностью к фагоцитозу (макро- и микрофаги, по терми-
нологии И.И. Мечникова). Развиваются из гемопоэтических стволовых
клеток костного мозга. Фагоциты — наиболее важный компонент системы
врожденного иммунитета. С помощью разнообразных рецепторов, так
называемых рецепторов врожденного иммунитета, фагоциты взаимодей-
ствуют с патогенами, а также с поврежденными соматическими клетками,
фагоцитируют и уничтожают их. Фагоциты лишены рецепторов, подобных
TCR и BCR.
Мононуклеарные фагоциты — долгоживущие клетки (продолжи-
тельность жизни составляет месяцы и годы), представлены резидентными
ГЛАВА 2
42 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Рис. 2-4. Морфология мононуклеарных фагоцитов: а — моноцит периферической
крови человека, световая микроскопия; б — моноцит периферической крови человека,
электронная микрофотография; в — электронная микрофотография активированного
тканевого макрофага с фагосомами (Fawcett D.W. Textbook of Histology, 12th, 1994).
макрофагами, обитающими в тканях, и циркулирующими моноцитами,
мобилизуемыми в очаг воспаления. Моноциты — крупные клетки (диаметр
10-18 мкм) с подковообразным ядром, мембраной с многочисленными
псевдоподиями, выраженным комплексом Гольджи. В цитоплазме содер-
жатся азурофильные гранулы, многочисленные лизосомы, включающие
пероксидазу, кислые гидролазы — ферменты, участвующие в киллинге
фагоцитированных патогенов (рис. 2-4). Среди многочисленных рецепто-
ров макрофагов и моноцитов выделяют рецепторы-мусорщики (scavenger-
рецепторы), маннозные рецепторы, Toll-подобные рецепторы, которые
связывают РАМР микроорганизмов и поврежденных клеток, активируя
механизмы врожденного иммунитета. Рецепторы к компонентам ком-
племента и Fc-рецепторы к Fc-фрагменту иммуноглобулинов участвуют в
фагоцитозе опсонизированных микроорганизмов. Важную роль во взаи-
модействии макрофагов и моноцитов с другими клетками и компонентами
межклеточного матрикса играют адгезивные молекулы (интегрины). На
поверхности мононуклеарных фагоцитов экспрессируются рецепторы для
цитокинов [ИЛ-2, фактора некроза опухоли (ФНО), ИЛ-1, макрофагально-
го колониестимулирующего фактора (М-КСФ), ИФН-у, хемокинов и др.],
регулирующих их функцию, а также корецепторные молекулы CD80/CD86
и молекулы гистосовместимости HLA классов I и II, участвующие во взаи-
модействии с Т-лимфоцитами. Для моноцитов и макрофагов характерна
чрезмерная подвижность. Эти клетки легко активируются под действием
разных стимулов. При этом изменяется метаболизм фагоцитов: развива-
ется кислородный взрыв, начинается секреция цитокинов, простагланди-
нов и других биологически активных молекул, обеспечивающих развитие
эффекторных механизмов, которые направлены на разрушение патогенов
и опухолевых клеток.
Более подробно рецепторы и роль макрофагов в адаптивном и врожден-
ном иммунитете рассмотрены в соответствующих разделах.
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 43
Нейтрофилы составляют 60-75% общего количества лейкоцитов и
95% общего количества гранулоцитов, циркулирующих в периферической
крови человека. Нейтрофилы мигрируют из костного мозга в циркуля-
цию, где пребывают 8-10 ч, в затем мигрируют в ткани и погибают по
механизму апоптоза через 2-3 сут. Морфологически они представляют
собой небольшие клетки (диаметр 10-12 мкм) с сегментированным ядром.
Структура ядра зависит от степени зрелости нейтрофила. Цитоплазма
включает множество гранул (см. рис. 2-8, В). В первичных азурофильных
гранулах содержатся кислые гидролазы, нейтральная протеиназа — катеп-
син G, катионные противомикробные пептиды (дефенсины, кателицидины,
сепроцидины), миелопероксидаза, эластаза и другие ферменты. Вторичные
гранулы содержат ферменты, проявляющие активность при щелочных и
нейтральных значениях pH: щелочную фосфатазу, лактоферрин, лизоцим.
При слиянии с фагосомами они способны разрушить и лизировать различ-
ные микроорганизмы.
Нейтрофилы обладают самой высокой подвижностью и способностью
отвечать на хемотаксические и активационные факторы. Они первыми
мигрируют в очаг воспаления и выполняют свои функции: фагоцитируют
патогены, оказывают бактерицидное действие, вырабатывают цитокины и
другие молекулы, регулирующие активность клеток.
На поверхности нейтрофилов экспрессируются разнообразные TLR для
патогенов, Fcy-рецепторы (CD32, CD16), рецепторы компонентов компле-
мента (CR1, CR2, CR4), рецепторы для анафилактогенов СЗа, С5а, рецепто-
ры для цитокинов, ИЛ-8 и а-хемокинов, что обеспечивает их накопление
в очаге воспаления. Нейтрофилы экспрессируют адгезивные молекулы:
Р^интегрины (LFA-1), CD13 (аминопептидаза N), CD14 и др.
Антигенпрезентирующие клетки (АПК). Морфологически и функ-
ционально гетерогенная популяция клеток, способных захватывать внекле-
точные антигены, перерабатывать их в кислых условиях эндосом и лизосом
до антигенных фрагментов (пептидов) и в ассоциации с молекулами HLA
класса II представлять Т-лимфоцитам для запуска адаптивного иммунного
ответа.
Основная роль в этих процессах отводится так называемым профессио-
нальным АПК, среди которых выделяют ДК, макрофаги и В-лимфоциты.
Дендритные клетки («часовые» иммунной системы) наиболее эффек-
тивны как АПК. В этом качестве они активнее макрофагов в 100 раз и
активнее В-клеток в 1000 раз. Это обусловлено тем, что ДК:
« экспрессируют высокий уровень молекул HLA класса II;
• обладают значительной стимулирующей активностью в отношении
Т-хелперов, экспрессируя высокий уровень костимулирующих моле-
кул CD80/86, CD40, хемокиновых рецепторов, цитокинов и других
факторов.
ГЛАВА 2
44 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
ДК, в свою очередь, тоже гетерогенная популяция клеток иммунной
системы, происходящих из миелоидных и лимфоидных предшественников,
основные функции которых:
• поглощение антигенного материала путем фагоцитоза, пиноцитоза,
эндоцитоза, через Fcy-рецепторы и другие структуры;
• переработка этого материала до антигенных пептидов, формирование
комплекса с молекулами HLA класса II (процессинг антигена) и пере-
мещение его на клеточную мембрану;
• переход из незрелых в зрелые клетки с потерей ряда старых и приоб-
ретением новых функций;
• миграция в дренирующие лимфатические узлы;
• представление комплекса антигенного пептида с HLA класса II
Т-хелперам.
Функция ДК определяются степенью из зрелости. Незрелые ДК при-
сутствуют в тканях, основная их функция — фагоцитоз антигенов. После
захвата и переработки антигена клетки созревают, утрачивают способ-
ность к фагоцитозу и приобретают способность презентировать антиген
Т-хелперам, которая успешно реализуется в микроокружении лимфати-
ческих узлов (табл. 2-4). Незрелые ДК могут вызывать состояние неот-
вечаемости Т-лимфоцитов, индуцируя их анергию, апоптоз или активируя
регуляторные Т-клетки. Зрелые ДК, наоборот, активируют Т-клетки и спо-
собствуют их выживанию.
Считают, что после миграции в лимфоидную ткань одна зрелая
ДК, нагруженная антигеном, может вступать в контакт в течение 1 ч с
5000 Т-лимфоцитов (см. рис. 2-6). При таких контактах специфические
Т-клетки могут найти ДК, презентирующие специфический антиген (см.
рис. 2-6).
В зависимости от происхождения выделяют миелоидные (CDllc+) и
плазмоцитоидные (CDllc~CD123+) ДК, имеющие общих предшественни-
ков с марофагами и лимфоцитами, соответственно, и обладающие различ-
ными фукциональными свойствами. Популяции различаются по экспрес-
сии TLR, но способны стимулировать наивные Т-лимфоциты. ДК широко
представлены в организме. Миелоидные ДК находятся в дерме, эпидерме,
дыхательных путях, кишечнике, тимусе, селезенке, печени, лимфоидной
ткани. Плазмоцитоидные ДК локализуются в лимфоидных органах, печени,
легких, коже.
В своем развитии миелоидные ДК разделяются по крайней мере на 3 кле-
точные линии: клетки Лангерганса, интерстициальные ДК, находящиеся
преимущественно в различных тканях, и ДК, происходящие из моноцитов
(рис. 2-5).
Клетки Лангерганса описаны Паулем Лангергансом в 1868 г. Исходно
клетки Лангерганса как незрелые ДК локализуются выше базального
слоя эпителиальных клеток в коже, во всех вариантах слоистого эпите-
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 45
ГЛАВА 2
Таблица 2-4. Характеристика незрелых и зрелых дендритных клеток
Параметр Незрелые дендритные клетки Зрелые дендритные клетки
Функция Захват (фагоцитоз и эндоцитоз) антигенов Презентация антигенов Т-клеткам
Костимулирующие молекулы CD80, CD86, CD40 Отсутствуют Экспрессируются в большом количестве
Адгезивные молекулы Отсутствуют Экспрессируются в большом количестве
Молекула CD83 Отсутствует Экспрессируется
Паттернраспознающие рецепторы Экспрессируются Отсутствуют
Оборот HLA класса II Очень быстро Сохраняются дольше 100 ч
Плотность HLA класса II Низкая (около 10 млн) Возрастает в 10 раз
Гемопоэтическая
стволовая клетка
Миелоидная
родоначальная клетка
Лимфоидная
родоначальная клетка
Клетки Интерстициальная Дендритная Плазмоцитоидная
Лангерганса дендритная клетка клетка, происходя- дендритная клетка
щая из моноцитов
Рис. 2-5. Две линии развития дендритных клеток из гемопоэтических стволовых клеток —
миелоидная и плазмоцитоидная.
ЧАСТЬ 1
46 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
лия полости рта, носа, пищевода, легких, влагалища и толстой кишки,
т.е. в покровных тканях. Клетки Лангерганса происходят из CD34+ CLA+-
предшественников и специфически экспрессируют ряд молекул (белок адге-
зии Е-кадгедрин, CDla, интегрин CDllc, CD13, CD14, CD33, лектиновый
лангерин CD207 и эндоцитарный рецептор, индуцирующий образование
гранул Вербека, важных для захвата антигенного материала). После захвата
и переработки антигена клетки Лангерганса транспортируют антигенные
пептиды в региональные лимфатические узлы через афферентные лимфа-
тические сосуды и участвуют в дифференцировке Т-лимфоцитов-хелперов
из нативных ThO-предшественников.
Клетки Лангерганса участвуют в одном из путей быстрого ВИЧ-
инфицирования. Эти клетки экспрессируют рецепторные структуры для
вируса иммунодефицита человека (ВИЧ): CD4, рецепторы хемокинов
(СХС4, CCR5). Локализуясь в слизистой оболочке женского репродуктив-
ного тракта, эти клетки Лангерганса способны проникать в просвет влага-
лища, захватывать антигенный материал и быстро доставлять его в близле-
жащие лимфатические узлы. После захвата антигена или инфицирования
ВИЧ уже через 30 мин клетки Лангерганса мигрируют в дренирующие лим-
фатические узлы. Максимальную миграцию наблюдают через 24 ч. Таким
образом, клетки Лангерганса выполняют функцию «троянского коня»,
способствуя диссеминации ВИЧ по организму. Подобными свойствами в
отношении ВИЧ, а также других внутриклеточных патогенов, например
микобактерий, обладают макрофаги.
ДК, происходящие из моноцитов, обычно получают из фракции моно-
цитарных клеток in vitro. Для этих целей СП14+-моноциты, выделенные
из периферической крови, стимулируются в течение 6-7 сут in vitro в при-
сутствии ГМ-КСФ и ИЛ-4 или других комбинаций цитокинов (М-КСФ,
ГМ-КСФ и ФНО-а). Созревание ДК оценивают по экспрессии на их поверх-
ности CD83.
Индуцированные in vitro ДК находят всё большее распространение в
качестве вакцин при многих заболеваниях, в первую очередь при раке.
Приготовление такой вакцины состоит из нескольких этапов: выделение
моноцитов из крови конкретного больного, стимуляция их цитокинами
in vitro для дифференцировки в ДК, добавление в культуру иммуногенно-
го пептида, происходящего из опухоли больного (клеточный лизат или
стандартный антиген), продолжение культивирования до созревания ДК и,
наконец, возвращение зрелых ДК в организм больного. Лечебный эффект
такой вакцины связывают с активацией клонов ЦТЛ, активность которых
обычно снижена у больных раком. Возможно, это происходит за счет пода-
вления регуляторных Т-лимфоцитов. Обнадеживающий лечебный эффект
получен при раке предстательной железы, некоторых формах рака почки и
в некоторых других случаях.
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 47
Плазмоцитоидные ДК развиваются из СП34+-гемопоэтических предше-
ственников, по морфологии подобны плазматическим клеткам, локализу-
ются в Т-клеточных зонах лимфоидной ткани, миндалинах, тимусе и др. У
них отсутствуют маркеры миелоидных клеток. Для таких клеток характерен
фенотип CDllc- CD14" CD123++ BDCA2+ (CD303+) HLA-DR+ TLR7+ TLR9+.
Плазмоцитоидные ДК экспрессируют рецептор ИЛ-3 (CD123) и созревают
в присутствии ИЛ-3. Предшественники плазмоцитоидных ДК составляют
около 0,5% мононуклеарных клеток периферической крови.
Плазмоцитоидные ДК вырабатывают большое количество ИФН-а в
ответ на стимуляцию и оказывают существенное влияние на врожден-
ный иммунитет против патогенов. Считают, что циркулирующий в крови
ИФН-а — продукт плазмоцитоидных ДК.
Различия между профессиональными АПК. ДК после экспрессии
антигенного пептида на мембране активируются, созревают и мигрируют
в лимфоидные органы. Тканевые макрофаги тоже захватывают антиген
путем фагоцитоза, пиноцитоза, активируются, но в лимфоидные ткани не
перемещаются (хотя могут там находиться изначально). В-лимфоциты,
как АПК, захватывают антиген через BCR, т.е. тот антиген, против которо-
го они экспрессируют антигенраспознающий рецептор, и затем передают
антигенной пептид Т-хелперам. Их можно назвать антигенспецифическими
профессиональными АПК.
Особую роль в иммунной системе занимают фолликулярные ДК (ФДК)
мезенхимального происхождения, презентирующие антиген В-лимфоцитам
в лимфоидных фолликулах вторичных лимфоидных органов без участия
молекул HLA. Эти клетки захватывают, хранят и презентируют антиген в
нативном состоянии без расщепления на пептиды (в таком виде он может
быть распознан только В-лимфоцитами). При повторном поступлении
антигена в организм, когда он связывается с ранее наработанными анти-
телами, ФДК стимулируют клетки памяти.
ГЛАВА 2
Рис. 2-6. Дендритная клетка (А) и ее взаимодействие с лимфоцитом (Б) (сканирующая
микроскопия). ДК — дендритная клетка; Лф — лимфоцит.
48
ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Только профессиональные АПК (ДК, макрофаги и В-лимфоциты) спо-
собны презентировать антиген в комплексе с HLA класса II и поставлять
костимулирующие сигналы, необходимые для активации, пролиферации и
дифференцировки Т-лимфоцитов.
Помимо профессиональных АПК, многие негемопоэтические клетки
(эпителиальные, эндотелиальные, фибробласты и др.) способны захва-
тывать, перерабатывать и презентировать антигенные пептиды Т-лимфо-
цитам. Есть ряд необходимых условий: в частности, подобные клетки
должны быть активированы (например, ИФН-у) и экспрессировать HLA-
молекулы класса II (HLA-DR). Непрофессиональные АПК, как правило,
остаются в ткани, не мигрируют в лимфатические узлы. Естественно, их
функция в качестве АПК не велика. Функцию АПК могут выполнять также
тучные клетки.
Эозинофилы составляют 2-5% лейкоцитов периферической крови здо-
ровых людей, обычно имеют двухсегментное ядро и большое количество
цитоплазматических гранул, содержащих главный основной белок, токсич-
ный для гельминтов, катионный белок, нейротоксин и другие биологически
активные медиаторы (см. рис. 2-8, А). Освобождаемые при дегрануляции
биологически активные вещества способны поражать крупных внеклеточ-
ных паразитов (например, шистосом), не подвергшихся фагоцитозу.
Эозинофилы — главные клетки, инфильтрирующие ткани при аллерги-
ческом воспалении. Они способны к фагоцитозу, активируют нейтрофилы,
тромбоциты и другие клетки.
Базофилы и тучные клетки
В последние годы уделяют большое внимание роли базофилов и тучных
клеток в иммунной системе, так как они вносят существенный вклад в защи-
ту от паразитарных и бактериальных инфекций. Им отводят роль главных
эффекторных клеток в IgE-опосредованных патологических процессах при
аллергопатологии. В периферической крови базофилы составляют меньше
0,2% лейкоцитов (см. рис. 2-8, Б). Тучные клетки отсутствуют в кровотоке
и локализуются в коже, слизистых оболочках, вокруг мелких кровеносных
сосудов. Много тучных клеток в ткани сердца. Оба типа клеток содержат
большое количество цитоплазматических гранул. Выделяемые из гранул
медиаторы (гистамин, серотонин и др.) вызывают спазм гладкой муску-
латуры и усиливают аллергическое воспаление. Ультраструктура тучных
клеток представлена на рис. 2-7.
Не исключают участия тучных клеток в патогенезе воспалительных
процессов при рассеянном склерозе, сердечно-сосудистых заболеваниях,
артритах, колите и других патологиях.
При аллергопатологии тучные клетки активируются через высоко-
аффинный рецептор IgE типа I (FceRI), экспрессируемый только на базо-
филах и тучных клетках. Этот рецептор связывает аллергенспецифиче-
ский IgE через Fc-фрагмент. Таким образом, происходит сенсибилизация
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 49
ГЛАВА 2
Рис. 2-7. Тучная клетка с электронно-плотными гранулами (а). Экзоцитоз содержимого
гранул (б). Трансмиссионная электронная микроскопия (из учебника Д. Мейла и др.,
2007).
клеток для ответа на последующее воздействие аллергена (см. рис. 3-2).
Агрегация FceRI на тучных клетках мультивалентным аллергеном приводит
к дегрануляции, выработке метаболитов арахидоновой кислоты и секре-
ции цитокинов, которые в комплексе запускают воспалительный процесс
(см. рис. 4-7).
В результате активации тучной клетки или базофила немедленно (секун-
ды, минуты) освобождаются преформированные секреторные гранулы,
синтезируются de novo провоспалительные липидные медиаторы и цито-
кины (несколько часов), изменяется цитоскелет клетки. Освобождаемые
преформированные гранулы и липидные медиаторы запускают реакцию
немедленной гиперчувствительности. Вырабатываемые цитокины и хемо-
кины в дальнейшем усиливают этот процесс, а также привлекают и акти-
вируют другие клетки, в частности эозинофилы, в очаг аллергического
воспаления. Появляются данные о важной роли тучных клеток в ответе
на патогены, в том числе с участием TLR. Тучные клетки экспрессируют
широкий спектр таких рецепторов: TLR1, TLR2, TLR3, TLR4, TLR6, TLR9.
Избыточное воздействие паттернов микроорганизмов может привести к
запуску аллергопатологии.
Тромбоциты не только принимают участие в свертывании крови, но
также активируются и вырабатывают медиаторы воспаления. Тромбоциты
представляют собой кровяные пластинки и образуются в костном мозге
из мегакариоцитов. В крови человека в среднем содержится 1011 тромбо-
50 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Рис. 2-8. Морфология клеток иммунной системы: А — малый лимфоцит; Б — зрелый
эозинофил, В базофил; Г — моноцит; Д — нейтрофил; Е — большой гранулярный
лимфоцит.
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 51
цитов, и около 30% из них находится в селезенке. На поверхности тром-
боцитов представлен большой спектр иммунологически важных молекул:
HLA класса I, CD32 (FcyRII для IgG в составе иммунного комплекса), CD41
(интегриновый рецептор для фибриногена, фибронектина и других фак-
торов свертывания), рецептор комплемента (ClqR) и др. Тромбоциты под
влиянием иммунных комплексов, фактора активации тромбоцитов (ФАТ),
продуцируемого макрофагами, нейтрофилами и базофилами, активируют-
ся и вырабатывают медиаторы воспаления и цитокины.
Негемопоэтические клетки (ретикулярные клетки, клетки эпителия,
эндотелия, фибробласты, стромальные элементы) могут принимать участие
в разнообразных иммунных и воспалительных реакциях.
2.2. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
ИММУННОЙ СИСТЕМЫ
В иммунной системе различают центральные и периферические органы
и ткани (рис. 2-10). К центральным органам иммунной системы относятся
костный мозг и тимус.
В центральных органах происходит антигеннезависимая дифференци-
ровка лимфоцитов (иммунопоэз) из стволовых клеток, их селекция в отно-
шении аутореактивности и созревание. Т-лимфоциты развиваются в тимусе,
а В-клетки — в печени плода и после рождения в костном мозге. В тимусе и
в костном мозге происходит очень важный процесс формирования реперту-
ара специфических антигенраспознающих рецепторов Т- и В-лимфоцитов
соответственно. Помимо этого, костный мозг как кроветворный орган
содержит самоподдерживающуюся популяцию полипотентных гемопоэ-
тических стволовых клеток, дающих начало всем росткам кроветворных
клеток. У птиц есть специализированный орган, где дифференцируются
В-клетки — бурса Фабриция. Важную роль в созревании В-клеток, особен-
но направленных на синтез IgA, выполняют пейеровы бляшки.
К периферическим органам иммунной системы относятся лимфа-
тические узлы, селезенка и лимфоидная ткань, связанная со слизи-
стыми оболочками и кожей, объединенные системой рециркуляции. В
этих органах происходят антигензависимые этапы дифференцировки
лимфоцитов (иммуногенез) и развивается иммунный ответ. Этапы имму-
ногенеза (иммунного ответа) представлены на рис. 2-9.
На территории периферических лимфоидных органов наивные лимфо-
циты распознают антиген и активируются. Обязательный процесс в адап-
тивном иммунном ответе — пролиферация клонов антигенраспознающих
лимфоцитов и их дальнейшая дифференцировка в клетки-эффекторы
(ЦТЛ, Т-хелперы, плазматические клетки, продуцирующие антитела, и т.д.).
ГЛАВА 2
52 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Рис. 2-9. Основные этапы адаптивного иммунного ответа.
Действие эффекторных клеток и молекул направлено на элиминацию анти-
гена из организма. В процессе иммунного ответа формируются клетки памя-
ти. В определенных условиях активация может привести к апоптозу клеток
(феномен апоптоза, индуцированного активацией). Все этапы иммунного
ответа контролируются рядом механизмов. Тип иммунного ответа, его
функциональные характеристики зависят от природы антигена, его дозы,
способа введения, природы антигенпрезентирующих клеток, секретируе-
мых этими клетками цитокинов, от особой популяции клеток-регуляторов,
а также от наличия апоптоза. Большое значение имеет нейроэндокринная
регуляция иммунного ответа и его генетический контроль.
Особое место в иммунной системе занимает лимфоидная ткань, связан-
ная со слизистыми оболочками и кожей. В структуре покровных тканей
обильно представлены клетки иммунной системы, нередко с особыми свой-
ствами, например внутриэпителиальные лимфоциты в эпителии тонкого
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 53
кишечника. Считают, что среди 100 клеток эпителия может находиться до
20-30 таких лимфоцитов. Часто иммунные реакции в слизистых оболоч-
ках обозначают как «мукозальный иммунитет», основная задача которого
связана с иммунной защитой от патогенных микроорганизмов. Однако в
слизистых тканях, в частности, кишечника может происходить и внетими-
ческая дифференцировка Т-лимфоцитов.
Нередко к органам иммунной системы относят легкие, печень и др.
Действительно, в этих органах весьма высок уровень клеточных элементов
иммунной системы (ДК, макрофагов, NK-клеток, Т- и В-лимфоцитов и др.)
и они существенно влияют на иммунные процессы в организме, но в этих
органах, как правило, отсутствуют условия микроокружения, обеспечиваю-
щие иммунопоэз и иммуногенез в объеме, характерном для центральных и
периферических органов. Тем не менее в печени наиболее высок уровень
макрофагов (клетки Купфера), выстилающих венозные синусы. Существует
мнение, что печень служит «кладбищем» Т-лимфоцитов. Интенсивные
иммунные реакции происходят во многих органах при их аутоиммунном
поражении.
Во всех органах и тканях организма содержатся тканевые макрофаги и
ДК, а также лимфоциты, в частности Т-клетки, преимущественно в стадии
клеток памяти (за исключением забарьерных тканей). При локальном
запросе (инфицирование, деструкция, провоспалительные стимулы) очень
быстро привлекаются нейтрофилы и другие клетки иммунной системы.
Кровь и лимфа составляют циркуляторное звено иммунной системы.
По кровотоку происходит рециркуляция лимфоцитов и миграция клеток из
кроветворных в периферические органы. В лимфу лимфоциты проникают
из лимфатических узлов и лимфоидной ткани слизистых оболочек, а из
лимфы клетки поступают в кровоток. Таким образом, несмотря на анатоми-
ческую разобщенность, отдельные компоненты иммунной системы связаны
в единую систему посредством крово- и лимфотока, где происходит посто-
янный процесс миграции и рециркуляции клеток.
Итак, можно сказать, что основной принцип организации иммунной
системы органно-циркуляторный. Это означает, что клетки иммунной
системы постоянно рециркулируют между органами иммунной системы и
нелимфоидными тканями. Такая организация оптимальна для реализации
функции иммунологического надзора.
Рассматриваемые органы и ткани по принадлежности следует отнести в
первую очередь к адаптивной иммунной системе. Нет возможности выде-
лить в качестве самостоятельной ткань или орган врожденной иммунной
системы, хотя известно, что огромное число макрофагов сконцентрировано
в венозных синусах печени, альвеолах легких и других тканях.
ГЛАВА 2
54 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
1. Центральные
органы
иммунной
системы
Источник полипотентных
гемопоэтических
стволовых клеток
Антигеннезависимая
дифференцировка
Т-лимфоцитов -
иммунопоэз
2 Перифериче-
ские органы
иммунной
системы
Лимфатичес- кие узлы Селезенка Лимфоидная ткань, ассоции- рованная с барьерами (слизистые оболочки, кожа)
Антигензависи-
мая дифферен-
цировка Т- и В-
лимфоцитов -
иммуногенез
Кровь
Лимфа
3. Циркуляторный
компонент
иммунной
системы
Рециркуляция
лифоцитов
и миграция клеток
Рис. 2-10. Структурно-функциональная организация иммунной системы.
2.2.1. Органы и ткани иммунной системы
2.2.1.1. ТИМУС
Тимус — центральный орган иммунной системы, расположенный в
переднем верхнем средостении за грудиной. Основные функции тимуса:
• развитие Т-лимфоцитов (тимоцитов) из мигрировавших в орган тими-
ческих предшественников;
• образование генов TCR из небольшого набора зародышевых генов
путем их перегруппировки;
• «обучение» Т-клеток через этапы положительной и отрицательной
селекции;
• контроль аутоиммунитета;
• синтез тимических гормонов;
• созревание CD4+ и CD8+ Т-лимфоцитов и миграция их на периферию в
форме наивных клеток, способных к распознаванию антигена.
В результате уникального феномена случайной перегруппировки (реан-
жировки) генов TCR в тимусе в процессе онтогенеза создается репертуар
Т-клеток с предопределенной способностью реагировать с любым суще-
ствующим в природе антигеном. После встречи с родственным антигеном
такие клетки формируют клоны антигенреактивных Т-лимфоцитов.
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 55
Благодаря работам австралийских иммунологов Д. Миллера и Ф. Бер-
нета в середине XX в. была доказана центральная роль тимуса в иммун-
ной системе. Удаление тимуса у новорожденных мышей приводит через
1-2 мес к тяжелым иммунным нарушениям (атрофия лимфоидной ткани,
снижение иммунных реакций, особенно клеточного типа) и поражению
различных органов, что проявляется в снижении массы тела, диарее,
дерматите, выпадении шерсти и других признаках так называемого син-
дрома истощения (wsftng-синдром). Тимэктомия во взрослом состоянии
не приводит к подобным дефектам, так как заселившие периферические
органы иммунной системы Т-лимфоциты могут компенсировать иммун-
ные нарушения.
Удаление тимуса при операции на сердце у детей не вызывает ранних
иммунных нарушений, однако в будущем отсутствие тимуса сказывается на
формировании иммунного ответа, например, при вакцинации, инфекцион-
ных заболеваниях и т.д. Пример центральной роли тимуса в становлении
Т-клеточного звена иммунной системы человека — синдром Ди Джорджи,
характеризующийся врожденным недоразвитием тимуса, что приводит к
резкому снижению популяции Т-лимфоцитов. Дети с таким синдромом
проявляют повышенную чувствительность к вирусным, бактериальным и
грибковым инфекциям (см. раздел 11.2.3).
В некоторых случаях у детей при рентгенографии находят увеличенный
тимус и делают заключение о так называемой тимомегалии. Однако диагноз
не является общепринятым. Возможно, речь идет об активации иммунной
системы, в том числе на уровне тимуса, что характерно для многих инфек-
ционных заболеваний детского возраста, в частности, у часто болеющих
детей. Природа гиперактивации иммунной системы анализируется далее.
Тимус как лимфоэпителиальный орган состоит из двух больших долей,
каждая из которых содержит множество долек, разделенных соедини-
тельнотканными перегородками. Дольки — структурные единицы тимуса.
Внутри дольки различают две зоны:
® наружную корковую, плотно заполненную незрелыми пролиферирую-
щими лимфоцитами (около 85-90% тимоцитов содержится в корковой
зоне);
• центральную медуллярную зону, где находятся более зрелые клетки
(рис. 2-11).
Эпителий тимуса, ДК костномозгового происхождения, макрофаги, дру-
гие клеточные элементы микроокружения и синтезируемые ими цитокины
определяют дифференцировку Т-лимфоцитов. Эпителий корковой зоны
формируется из 3-го глоточного кармана эктодермального происхождения,
а эпителий мозговой зоны — из 3-й жаберной дуги эктодермального про-
исхождения.
В тимусных дольках различают по происхождению и функции как мини-
мум три типа эпителиальных клеток.
ГЛАВА 2
56 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Эпителиальная Тимоцит
клетка коры
Капсула
ДК
Макрофаг
Эпителиальная
клетка
медуллярной
зоны
Трабекула
Медуллярный слой
Тельца
Гассаля
Рис. 2-11. Схематичное изображение
структуры тимуса (а), морфологиче-
ское строение дольки тимуса (6). На
гистологическом срезе: С — наруж-
ная корковая зона; М — внутренняя
или медуллярная зона; Н — окра-
шенные тельца Гассаля (из учебника
Д. Мейла и др., 2007).
а
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 57
• Эпителиальные клетки, «няньки» наружного коркового слоя, содержат
лимфоциты в цитоплазматических карманах и стимулируют пролифе-
рацию клеток-предшественников, продуцируя ИЛ-7.
• Эпителиальные клетки коры экспрессируют адгезивные молеку-
лы и молекулы HLA класса I и отвечают за позитивную селекцию
Т-лимфоцитов.
• Медуллярные эпителиальные клетки экспрессируют разнообразные
органоспецифичные аутоантигены, участвуя, таким образом, в нега-
тивной селекции, а именно в выбраковке аутоагрессивных клонов
Т-лимфоцитов.
Помимо этого, секреторные эпителиальные клетки вырабатывают гор-
моны (тимозин, тимопоэтин и др.), цитокины типа ИЛ-1, ИЛ-7, ФНО-а,
колониестимулирующие и другие медиаторные факторы.
ДК находятся на границе между корковой и медуллярной зоной, а макро-
фаги — во всех зонах тимуса. В медуллярной зоне тимуса обнаруживают
интердигитальные ДК, формирующие клеточную сеть, в которой находятся
другие клеточные элементы. Макрофаги активно вырабатывают цитокины
и фагоцитируют тимоциты, не прошедшие полноценной дифференциров-
ки. Известно, что до 95% тимоцитов подвергается апоптозу и поглощается
макрофагами.
В медуллярной зоне тимуса обнаруживают тельца Гассаля — наслаиваю-
щиеся дегенерирующие эпителиальные клетки.
Морфогенез тимуса изменяется в зависимости от возраста. Орган закла-
дывается на первом месяце развития эмбриона человека, затем происходит
его заселение предшественниками Т-лимфоцитов из эмбриональной пече-
ни и костного мозга. Важно, что первоначально формируется строма тимуса
из клеток микроокружения, в условиях которого из предшественников
развиваются тимоциты, получая сигналы при прямом межклеточном кон-
такте и через продуцируемые цитокины. К моменту рождения тимус мор-
фологически и функционально полностью сформирован. Абсолютная масса
тимуса увеличивается до периода половой зрелости, а затем снижается.
Лимфоидная ткань к 17 годам составляет 50% массы органа, к 60 годам —
около 10%, т.е. происходит возрастная инволюция тимуса. Можно сказать,
что в течение жизни тимус постепенно «расходуется», создавая в организме
длительно существующий пул периферических Т-лимфоцитов, который
позволяет перенести утрату центрального органа без существенных измене-
ний функций иммунной системы. Это подтверждает минимальный эффект
тимэктомии у взрослых по сравнению с выраженным Т-клеточным имму-
нодефицитом в результате неонатальной тимэктомии у мышей.
Знание особенностей структурных и функциональных характеристик
тимуса крайне важно для понимания различных вариантов развития имму-
нопатологии от иммунодефицита до аутоиммунной агрессии. Так, при зло-
качественной миастении и некоторых других аутоиммунных заболеваниях
ЧАСТЬ 1
58 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
в тимусе появляются структуры, напоминающие зародышевые центры в
лимфатических узлах. По терминологии Ф. Бернета, в тимусе могут форми-
роваться запрещенные клоны аутореактивных клеток. Удаление тимуса при
подобных заболеваниях нередко приводит к положительному лечебному
эффекту.
2.2.1.2. ПЕРИФЕРИЧЕСКИЕ ОРГАНЫ И ТКАНИ ИММУННОЙ СИСТЕМЫ
Наивные лимфоциты мигрируют из центральных в периферические
органы и ткани, где при участии антигена происходят сложные взаимодей-
ствия между клетками иммунной системы. В эти взаимодействия вовле-
каются стромальные элементы. В результате развивается полноценный
иммунный ответ. Лимфатические узлы, селезенка и неинкапсулированная
лимфоидная ткань, связанная с барьерными тканями, составляют основные
зоны, где происходит иммуногенез.
Лимфатические узлы широко распространены в организме, дренируют
различные участки тела, участвуют в иммунном ответе на антигены, посту-
пающие через лимфу, и развивают клеточно-опосредованный и гумораль-
ный адаптивный иммунный ответ.
Лимфатические узлы располагаются по ходу лимфатических сосудов в
местах их разветвления, по ходу кровеносных сосудов. Преимущественное
скопление лимфатических узлов наблюдают в области шеи, затылка, сре-
достения, бронхов, брыжейки, в подключичной, подмышечной и паховой
области. В эмбриогенезе лимфатические узлы возникают в конце 2-го и
начале 3-го месяца развития. Вначале формируется строма лимфатиче-
ского узла, которая затем заполняется мигрирующими лимфоцитами и
другими клетками иммунной системы. В норме диаметр лимфатического
узла составляет от 0,2 до 10-20 мм. Резкое увеличение размера лимфати-
ческих узлов наблюдают при многих патологических системных и местных
процессах (инфекционные заболевания, воспаление, в том числе гнойное,
малигнизация и др.). Гиперплазия, так же как и гипоплазия, лимфатические
узлы — один из ключевых клинических симптомов иммунопатологии.
Постоянные элементы стромы и поступающие через афферентную лимфу
и артериальную кровь клетки иммунной системы, а также вновь форми-
рующиеся клетки (например, плазматические) составляют структурно-
функциональную основу лимфатического узла, уровень организации кото-
рой варьирует в зависимости от стадии, направленности (клеточный или
гуморальный ответ), продолжительности иммунного ответа.
Типичный лимфатический узел покрыт коллагеновой капсулой с ради-
ально отходящими трабекулами, окружающими небольшие дольки, в
пределах которых расположены характерные для лимфатических узлов
клеточные образования. В зависимости от функциональных свойств в
каждой дольке выделяют как минимум три зоны: В-клеточную (корковую
зону, или кортекс), Т-клеточную (паракортикальную зону, или паракор-
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 59
текс) и центральную медуллярную зону, состоящую из клеточных тяжей,
которые содержат макрофаги и многочисленные плазматические клетки
(рис. 2-12).
В пределах лимфатического узла кровоток и лимфоток имеют свои
особенности. Лимфа по. афферентным сосудам, пронизывающим капсулу,
поступает в субкапсулярный краевой синус, затем в промежуточные синусы,
проходящие через всю толщу лимфатического узла, и собирается в эффе-
рентном (выносящем) лимфатическом сосуде, несущем лимфу в грудной
проток и наконец в верхнюю полую вену. Каждый лимфатический узел в
области ворот имеет собственные артерию и вену. Там же проходит эффе-
рентный лимфатический сосуд.
Клеточные элементы иммунной системы и вырабатываемые ими рас-
творимые медиаторы поступают в лимфатические узлы и покидают их по
запрограммированным путям. Эти процессы регулируются многочислен-
ными факторами, включая молекулы адгезии и хоминга, хемокины, цито-
кины и др. Через афферентную лимфу в лимфатические узлы мигрируют
зрелые ДК (в основном клетки Лангерганса), нагруженные антигеном.
ГЛАВА 2
Аффе-
рентные Подкапсульный Соединительно-
Ток лимфы сосуды Клапан краевой синус тканная капсула
Вторичный
фолликул
с мантией
из малых
В-лимфоцитов
и центром
размножения
Наружная
корковая
(В-клеточная)
область
Паракортика-
льная
(Т-клеточная)
область
Ворота Вена Артерия
лимфоузла лимфоузла лимфоузла
Рис. 2-12. Строение лимфатического узла: М.Т. — медуллярные трабекулы; М.С. —
медуллярные синусы.
60 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Взаимодействие их с наивными Т-хелперами определяет дифференциров-
ку последних в Thl- или ТЬ2-клетки и направленность иммунного ответа
по клеточному или гуморальному типу. Взаимодействие Т-хелперов с
В-клетками направляет дифференцировку В-лимфоцитов в плазматические
клетки.
Зональную локализацию Т- и В-клеток определяет особенность клеточ-
ного состава стромы и вырабатываемых медиаторов. Т-лимфоциты распо-
ложены преимущественно в паракортикальной зоне. В кортексе находятся
В-лимфоциты, организованные в первичные и в основном во вторичные
фолликулы с зародышевым центром (рис. 2-13). Медуллярная зона содер-
жит основной пул плазматических клеток, а также Т- и В-лимфоциты, обра-
зующие тяжи лимфоидных клеток.
Лимфоциты мигрируют в лимфатические узлы из кровотока через спе-
циализированные высокоэндотелиальные посткапиллярные венулы (HEV)
в паракортикальной зоне. Среди лимфоцитов, поступающих в лимфатиче-
ские узлы, преобладают наивные Т- и В-клетки, дифференцирующиеся в
эффекторные Т-хелперы, ЦТЛ, регуляторные Т-клетки и в антителопро-
дуценты соответственно. Функционально зрелые Т-лимфоциты покидают
лимфатические узлы через эфферентные лимфатические сосуды.
Лимфоциты (до 99%) составляют основу клеточного пула лимфы.
Рециркуляция лимфоцитов происходит постоянно. В течение часа рецир-
кулируют около 1-2% пула лимфоцитов. Это позволяет большому числу
лимфоцитов контактировать с соответствующими антигенами в перифе-
рических лимфоидных органах. Антигенспецифические лимфоциты задер-
живаются в лимфатических узлах, где сконцентрированы все клеточные
элементы, необходимые для запуска иммунного ответа. Именно поэтому
для усиления иммунного ответа антиген иногда вводят непосредственно в
лимфатический узел. Например, для получения кроличьей антисыворот-
ки против какого-либо низкоиммуногенного антигена препарат вместе с
адъювантом вводят непосредственно в подколенный лимфатический узел.
На рис. 2-13 представлены зародышевые центры корковой зоны лимфа-
тического узла, окруженные мантией.
Лимфатические узлы имеют особое значение для функционирования
В-лимфоцитов и развития адаптивного гуморального иммунного ответа.
В лимфатических узлах наивные зрелые В-клетки выполняют следующие
функции:
• захват и переработку антигена с участием особых ФДК;
• взаимодействие с родственными Т-хелперами;
• активацию, пролиферацию и дифференцировку в антителопродуценты
(плазматические клетки);
• соматическую гипермутацию V-генов BCR, приводящую к формирова-
нию дополнительного репертуара и повышению аффинитета антител;
• переключение изотипов иммуноглобулинов с IgM на другие классы.
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 61
Рис. 2-13. Вторичный лимфоид-
ный фолликул содержит герми-
нативный (зародышевый) центр,
окруженный мантией [Bloom W.,
1975]: gc—герминативный центр;
m — мантия.
ГЛАВА 2
Все эти процессы сопровождаются изменениями в структуре лимфатиче-
ского узла. Первичный фолликул состоит из неделящихся В-клеток. В про-
цессе развития иммунного ответа В-клетки, распознав антиген, начинают
активно пролиферировать и формируют зародышевый (герминативный)
центр, окруженный мантией (рис. 2-13). В герминативных центрах выде-
ляют темную и светлую зоны. В темной зоне В-клетки, называющиеся
центробластами, активно пролиферируют и подвергаются соматической
гипермутации. В результате формируется пул В-лимфоцитов с высоким
аффинитетом к антигену. В светлой зоне В-лимфоциты, называемые цен-
троцитами, взаимодействуют с антигеном, представленным на поверхности
высокоспециализированных ФДК. Эти клетки не принадлежат к популяции
классических ДК и не происходят из гемопоэтических предшественников.
Они фиксируют антиген, чаще в форме иммунного комплеска, и передают
его «родственным» В-лимфоцитам без участия молекул HLA класса II.
В последние годы открыта новая субпопуляция Т-хелперов, назван-
ных фолликулярными Т-хелперами (Tfh); определен их фенотип
(GD4+CXCR5+ICOS+STAT3+). Эти клетки в зародышевых центрах обеспе-
чивают дифференцировку В-лимфоцитов в продуценты высокоаффинных
ЧАСТЬ 1
62 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
антител, вырабатывают ИЛ-21 и участвуют в образовании зародышевых
центров.
Клетки, экспрессирующие высокоаффинный антигенраспознаю-
щий рецептор, взаимодействуют с Tfh-клетками и дифференцируются в
В-клетки памяти или предшественники плазматических клеток, которые
затем мигрируют в медуллярную зону. В-лимфоциты с низкоаффинным
рецептором подвергаются апоптозу.
В паракортикальной зоне лимфатических узлов содержатся интердиги-
тальные ДК, мигрировавшие из кожи (клетки Лангерганса) или из слизи-
стых оболочек, которые транспортируют переработанный антиген и пред-
ставляют его Т-лимфоцитам.
Таким образом, с иммунологической точки зрения лимфатические узлы
характеризуются как периферические органы иммунной системы, состоя-
щие из стромальных элементов (микроокружение), в которых мигрирую-
щие клетки иммунной системы выполняют важнейшие иммунные функции:
созревание эффекторных Т-хелперов, ЦТЛ, регуляторных и других клеток,
а также плазматических клеток, вырабатывающих специфические антите-
ла, и формирование Т- и В-клеток памяти.
Клетки селезенки отвечают на антигены, поступающие через кровоток,
и осуществляют преимущественно адаптивный гуморальный иммунный
ответ (антителообразование). Удаление селезенки, чаще в связи с ее трав-
мой, не приводит в первое время к существенным изменениям в иммунных
процессах, но в отдаленные сроки у таких пациентов проявляются суще-
ственные иммунные нарушения.
Формирование гуморального ответа на антигены, содержащиеся в крови,
связано главным образом с селезенкой. Она расположена в левом верхнем
квадрате брюшной полости и покрыта капсулой, от которой в паренхиму
отходят трабекулы, несущие сосуды. Размеры селезенки у взрослого чело-
века составляют приблизительно 10x15 см. Масса селезенки составляет
200-250 г. В эмбриогенезе селезенку выявляют после 2-го месяца разви-
тия, и вначале она представлена стромой, которую затем заселяют клетки
иммунной системы. В селезенке плода происходит гемопоэз, который пре-
кращается после рождения. У грызунов после рождения гемопоэтическая
функция селезенки сохраняется.
Рассматривая селезенку как периферический орган иммунной системы,
следует иметь в виду, что она состоит из красной и белой пульпы с совер-
шенно разными иммуноопосредованными свойствами.
Белая пульпа селезенки представлена лимфоидной тканью, связанной с
артериолами селезенки, обозначаемой как периартериальные лимфоидные
муфты с Т- и В-клеточными зонами.
Т-клетки окружают центральную артериолу и формируют тимусзависи-
мую зону селезенки. В-клеточные фолликулы расположены ближе к краю
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 63
Т-клеточная зона
(периартериальная
«муфта»)
В-клеточная зона
(вторичный
фолликул)
Рис. 2-14. Морфология селезенки. Схематичное строение (из учебника Abbas А., 2003).
ГЛАВА 2
муфты и образуют скопления первичных или вторичных фолликулов с
зародышевыми центрами и клетками памяти (рис. 2-14).
Красная пульпа состоит из венозных синусов и клеточных тяжей. В сину-
сах наряду с форменными элементами крови расположены губчатые ско-
пления ткани, в которой имеются макрофаги, Т-лимфоциты, покидающие
селезенку через венозные синусы, и плазматические клетки — конечная ста-
дия дифференцировки В-лимфоцитов, вышедших из зародышевых центров
белой пульпы. В селезенке создаются оптимальные условия для развития
адаптивного гуморального иммунного ответа (антителогенез).
Особую роль в реализации иммунных функций селезенки играет так
называемая маргинальная зона, окружающая белую пульпу и содержащая
уникальные оседлые клетки (В-лимфоциты, ДК, макрофаги).
Помимо выполнения иммунных функций, селезенка депонирует тромбо-
циты, эритроциты и гранулоциты. В красной пульпе разрушаются старые
тромбоциты и эритроциты, которые затем фагоцитируются макрофагами.
2.2.1.3. ЛИМФОИДНАЯ ТКАНЬ, АССОЦИИРОВАННАЯ СО СЛИЗИСТЫМИ
ОБОЛОЧКАМИ
Первую линию защиты слизистых оболочек (дыхательные пути, пище-
варительный, урогенитальный тракт и т.д.) от патогенов обеспечивает
неинкапсулированная лимфоидная ткань, включающая групповые лимфа-
тические фолликулы (пейеровы бляшки, миндалины, аппендикс и др.) и
диффузно расположенные клетки иммунной системы в эпителии слизистой
оболочки (внутриэпителиальные Т-лимфоциты), в собственной пластинке
(laminapropria), а также в подслизистом слое.
ЧАСТЬ 1
64 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Слизистые оболочки — биологический барьер, через который в
организм проникают различные патогены, комменсалы (симбион-
ты), аллергены, антигены пищи и т.д.
Поверхность слизистых оболочек занимает огромную площадь —
около 400 м2.
Слизистые оболочки, являясь биологическим барьером, принимают
участие в:
• развитии защитных реакций врожденного иммунитета на патогены;
• инициации реакций адаптивного иммунитета;
• формировании толерантности к непатогенным микроорганизмам
(комменсалам) и пищевым антигенам;
• развитии патологических процессов (аллергия, хроническое воспале-
ние и др.).
Глоточные, нёбные и язычные миндалины образуют кольцо Вальдейера.
Локализация миндалин на границе дыхательного и пищеварительного
тракта обеспечивает контакт с большим количеством антигенов. На меди-
альной поверхности миндалин есть отверстия-крипты (10-20), прони-
зывающие миндалины и открывающиеся на их поверхности лакунами. В
криптах происходит постоянный контакт иммунокомпетентных клеток с
антигенами, поступающими через лакуны. Лимфоциты миндалин (в основ-
ном В-лимфоциты, несущие мембранный IgA) расположены в фолликулах,
устроенных так же, как и в других лимфоидных органах.
Миндалины доступны для забора биологического материала (мазки-
отпечатки, смывы, соскобы, биопсийный материал) для исследования
состояния врожденного иммунитета на уровне слизистой оболочки, для
идентификации патогенов.
Строение групповых лимфатических фолликулов можно рассмотреть на
примере пейеровой бляшки, представленной на рис. 2-15.
Среди клеток эпителия, покрывающего пейеровы бляшки и другие
лимфоидные скопления, имеются так называемые М-клетки, не принад-
лежащие непосредственно к клеткам иммунной системы. Они захваты-
вают, но не перерабатывают антиген, транспорт его в субэпителиальную
лимфоидную ткань слизистой оболочки. Обычно М-клетки сконцентри-
рованы в области купола пейеровой бляшки. В области купола содержится
много В-лимфоцитов и антигенпрезентирующих клеток. Под куполом рас-
положены лимфоидные фолликулы (В-зона) и находящаяся между ними
Т-зависимая зона. В-лимфоциты составляют 90% клеток фолликула, среди
них 20% представлены В-клетками, несущими IgA на клеточной мембране.
После взаимодействия с антигеном лимфоциты из Т- и В-зависимых зон
мигрируют в брыжеечные лимфатические узлы, а затем в эффекторные
зоны слизистых оболочек (ворсинки кишечника) и в итоге попадают в
lamina propria и в поверхностный эпителий (см. рис. 2-15). Такая специфи-
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 65
ГЛАВА 2
Ворсинка
Рис. 2-15. Схема строения пейеровой бляшки (объяснения в тексте).
ческая рециркуляция лимфоцитов в пределах слизистой ткани обусловлена
экспрессией клетками рецепторов хоминга.
Диффузная лимфоидная ткань представлена:
• В-лимфоцитами (потомками Bl-клеток брюшной полости) и плазма-
тическими клетками, секретирующими преимущественно IgA;
• внутриэпителиальными лимфоцитами, преимущественно
Т-клетками. Среди них больше 70% составляют CD8+ арТ-лимфоциты
и 15% — убТ-лимфоциты.
В слизистых оболочках пищеварительного, урогенитального, дыхатель-
ного тракта в определенных иммунных процессах участвуют клетки не
только иммунной системы, но и эпителиальные и другие клетки, экспресси-
рующие иммунологически значимые молекулы врожденного и адаптивного
иммунитета.
Важную роль отводят ДК, которые связывают антигены, попадающие на
слизистые оболочки, в частности, через рецепторы врожденного иммуните-
та (TLR). Созревание этих клеток происходит после миграции в лимфатиче-
ские узлы, где они экспрессируют костимулирующие молекулы, молекулы
HLA класса II и презентируют переработанные антигены родственным наи-
вным Т-лимфоцитам. В лимфатическом узле развивается иммунный ответ,
формируются эффекторные клетки (Thl, Th2, ТЬ17-клетки), которые
мигрируют в слизистые оболочки.
66 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Микрофлора кишечника
Рис. 2-16. Основные межклеточные взаимодействия в лимфоидной ткани слизистой обо-
лочки кишечника (по J. Cho, 2008).
При проникновении патогенов через эпителиальные клетки слизи-
стой оболочки возрастает образование провоспалительных цитокинов и
хемокинов Thl-клетками и развивается воспаление. ТЫ7-клетки также
играют важную роль в развитии хронических воспалительных процессов и
аутоиммунной патологии в слизистых оболочках (например, при болезни
Крона).
MALT (англ. Mucosa Associated Lymphoid Tissue) — лимфоидная ткань, свя-
занная со слизистыми оболочками. Отличается от других периферических
лимфоидных органов тем, что рециркуляция лимфоцитов может проис-
ходить в пределах этой системы. Лимфоциты, примированные антигеном в
пейеровых бляшках, мигрируют в регионарные лимфатические узлы, затем
в грудной проток и вновь возвращаются в lamina propria, где осуществляется
эффекторная стадия иммунного ответа (синтез антител, выработка цито-
кинов).
КЛИНИЧЕСКИ ЗНАЧИМЫЕ ХАРАКТЕРИСТИКИ КЛЕТОК, ОРГАНОВ И ТКАНЕЙ... 67
Взаимодействие между лимфоидными органами и тканями обеспечива-
ется рециркулирующими лимфоцитами, поступающими из крови в лимфа-
тические узлы, селезенку, другие лимфоидные ткани и возвращающимися
в кровоток по основным лимфатическим путям через грудной лимфатиче-
ский проток.
Вопросы для самоконтроля
• Перечислите и охарактеризуйте основные клеточные элементы иммун-
ной системы.
• Какие стадии развития гемопоэтических стволовых клеток вы знаете?
Назовите основные свойства гемопоэтических стволовых клеток.
• Какие клетки являются иммунокомпетентными? Назовите их, пере-
числите основные свойства.
• Перечислите основные популяции и субпопуляции лимфоцитов, дайте
их краткую характеристику, опишите их распределение в организме.
• Перечислите основные клеточные элементы врожденного иммунитета,
укажите их основные функции.
• Как организована иммунная система? Ответ поясните.
• Дайте определение иммунопоэза и иммуногенеза. В каких органах
иммунной системы они реализуются?
• Опишите особенности строения тимуса.
• Перечислите основные функции периферических лимфоидных орга-
нов.
• Приведите строение лимфатического узла и опишите процессы, проис-
ходящие в его различных зонах.
• Охарактеризуйте особенности лимфоидной ткани слизистых оболо-
чек.
• Перечислите основные функции лимфоидной ткани слизистых обо-
лочек.
ГЛАВА 2
Глава 3
Рецепторные и медиаторные
взаимодействия в иммунной
системе
3.1. ОСНОВНЫЕ РЕЦЕПТОРЫ СИСТЕМЫ
ВРОЖДЕННОГО ИММУНИТЕТА
Врожденный иммунитет — самая ранняя форма иммунной
защиты организма от экзогенных (патогенные микроорганизмы)
и эндогенных (продукты клеточного распада, так называемые
иммунные сигналы опасности) паттернов (англ, pattern — обра-
зец). Рецепторы, распознающие такие структуры, обозначают-
ся как «паттернраспознающие рецепторы» (ПРР) (англ. Pattern
Recognition Receptor, PRR). В активации врожденного иммунитета
можно условно выделить три фазы:
• первая фаза распознавания — распознавание чужеродных
структур микроорганизмов комбинацией поверхностных
рецепторов (сенсоров) врожденного иммунитета;
• вторая фаза — передача сигнала через систему адаптерных
молекул;
• третья фаза — выработка эффекторных молекул (цитокинов,
хемокинов, противомикробных пептидов, костимулирующих
молекул), направленных на элиминацию патогена и/или под-
ключение механизмов адаптивного иммунного ответа.
Стратегия распознавания микроорганизмов клетками врож-
денного иммунитета основана на распознавании консерватив-
ных структур микроорганизмов, общих для разных патогенов и,
как правило, отсутствующих у млекопитающих, — так называе-
мых патогенассоциированных молекулярных паттернов (от англ.
Pathogen Associated Molecular Pattern; PAMP). Образующиеся при
повреждении клеток организма, так называемые сигналы опасно-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 69
сти (белки теплового шока, модифицированный коллаген, липиды низкой
плотности и др.), распознаваемые системой врожденного иммунитета,
обозначаются как молекулярные паттерны, связанные с опасностью (англ.
Danger Associated Molecular Pattern; DAMP).
Выделяют два способа распознавания патогена клетками системы врож-
денного иммунитета — опосредованное или прямое.
При опосредованном распознавании сначала происходит опсониза-
ция микроорганизмов антителами с участием комплемента (опсонины) в
биологических средах организма. А фагоциты связывают микроорганизмы
не напрямую, а опосредованно через рецепторы к иммуноглобулинам и
компонентам комплемента.
Растворимые рецепторы: рецептор для Clq-комплемента, ЛПС-
связывающий протеин, маннозосвязывающий лектин, С-реактивный белок
(СРВ) — распознают микроорганизмы в биологических средах, а затем
взаимодействуют с родственными рецепторами на клетках врожденного
иммунитета.
Прямое распознавание патогена осуществляется через мембран-
ные рецепторы, представленные на клетках врожденного иммунитета. К
ним относятся рецепторы-«мусорщики» (англ, scavenger), маннозные
рецепторы, рецепторы комплемента (CR1 CR3 CR4), рецепторы для
Fc-фрагмента иммуноглобулина, лектиновые рецепторы и многие
другие.
Рецепторы-«мусорщики» (CD163) участвуют в поглощении апопто-
тировавших клеток, модифицированных липопротеинов, полианионных
лигандов (ЛПС, липотейхоевая кислота), а также отдельных бактерий типа
нейссерий. Неэффективное удаление апоптотировавших клеток из организ-
ма может способствовать развитию аутоиммунного заболевания, например
системной красной волчанки (СКВ).
Среди лектиновых рецепторов наиболее изучен маннозный рецептор,
реагирующий с маннозилированными углеводами и связанными с ними
гликоконъюгатами. Микроорганизмы, которые экспрессируют структуры,
богатые маннозой, распознаются при помощи этого рецептора. Эндогенные
лиганды маннозного рецептора — миелопероксидаза, лизосомальные
гидролазы и др.
3.1.1. Рецепторы комплемента
(Англ, complement receptor, CR.) Четыре типа рецепторов комплемента
(CR1, CR2, CR3, CR4) реагируют с СЗ-компонентом и его фрагментами.
• CR1(CD35) экспрессирован на поверхности лейкоцитов и эритроци-
тов, связывает СЗЬ и С4Ь и содержащие их иммунные комплексы.
ГЛАВА 3
ЧАСТЬ 1
70 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
• CR2 (CD21) присутствует в основном на В-клетках и ФДК. Крайне
важен для распознавания В-клетками специфичного антигена в составе
иммунного комплекса, презентируемого ФДК в периферических орга-
нах иммунной системы.
• CR3 (CDllb/CD18) и CR4 (CDllc/CD18) — интегрины, экспрессируе-
мые большинством лейкоцитов. Участвуют в формировании адгезив-
ных свойств этих клеток, связывают iC3b, имеют сродство к бактериаль-
ным продуктам (ЛПС, липофосфогликаны Leishmania, поверхностные
структуры дрожжевых грибов родов Candida и Histoplasma), способ-
ствуют устранению апоптотировавших клеток.
• C3aR и CSaR (CD88) экспрессированы на нейтрофилах, макрофагах,
базофилах, тучных клетках. Участвуют в активации фагоцитов СЗа и
С5а, что сопровождается выработкой провоспалительных цитокинов,
усилением их адгезивных свойств и хемотаксиса (С5а). СЗа и С5а иног-
да называют анафилатоксинами. Через родственные рецепторы они
стимулируют базофилы и тучные клетки к освобождению биологиче-
ски активных медиаторов (гистамина и др.) и запускают аллергиче-
скую реакцию без участия IgE и аллергена.
3.1.2. Fc-рецепторы для иммуноглобулинов
Профессиональные антигенпрезентирующие клетки (ДК, макрофаги)
захватывают экзогенный антиген более эффективно через специализи-
рованные рецепторы, взаимодействующие с различным аффинитетом с
Fc-фрагментом молекулы антитела. Антигены в структуре иммунного ком-
плекса захватываются и презентируются ДК более эффективно, чем рас-
творимые антигены, что может быть связано с действием стимулирующих
сигналов, запускаемых при активации клетки через Fc-рецептор.
Идентифицированы Fc-рецепторы для Fc-фрагмента тяжелой у-, е- или
a-цепи (IgG, IgE или IgA), обозначаемые как FcyR, FceR, FcaR соответствен-
но. В зависимости от класса Fc-рецептор состоит из внеклеточных а-, р- и
у-цепей (рис. 3-1). Fc-фрагмент иммуноглобулина соединяется с уникаль-
ной a-цепью, которая имеет 2-3 домена, подобных иммуноглобулиновым.
Другие цепи, как правило, необходимы для трансдукции сигнала. В струк-
туру Fc-рецептора входят цитоплазматические, так называемые иммуноре-
цепторные, основанные на тирозине активирующие мотивы ГГАМ (англ.
Immunoreceptor Tyrosine based Activation Motif), которые имеют уникальный
набор аминокислот. Через эти мотивы поступает стимулирующий сигнал
при активации эффекторного ответа фагоцитов в реакциях фагоцитоза,
антителозависимой клеточной цитотоксичности (АЗКЦ), секреции раство-
римых медиаторов, презентации антигена. Некоторые рецепторы, напри-
мер FcyRIIb, содержат ингибирующие мотивы ГПМ (англ. Immunoreceptor
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 71
Рис. 3-1. Схематичное изображение строения Fc-рецепторов человека (из учебника
Abbas А., 2003).
ГЛАВА 3
Tyrosine based Hnhibition Motif), сигналы, через которые блокируют актива-
цию, угнетают функции клеток, особенно В-лимфоцитов.
Известны три подтипа Fc-рецепторов для IgG: FcyRI (CD64), FcyRII
(CD32) и FCyRIII (CD 16), экспрессируемые на нейтрофилах, моноцитах и
обеспечивающие связь между врожденным и адаптивным иммунитетом.
FcyRI (CD64) — высокоаффинный рецептор для IgG. Постоянно экс-
прессирован только на клетках миелоидного происхождения, включая
моноциты, макрофаги, гранулоциты. Под влиянием цитокинов (ИФН-у,
Г-КСФ) уровень экспрессии FcyRI на моноцитах возрастает, и он появляет-
ся на нейтрофилах.
FcyRII (CD32) представлен более широко, чем CD64, и находится на
поверхности практически всех гемопоэтических клеток. Уровень экспрес-
сии этих рецепторов под влиянием цитокинов не изменяется. Выделяют две
изоформы рецептора — FcyRIIA и FcyRIIB, обладающие разными функция-
ми. FcyRIIA содержит ПАМ, a FcyRIIB — ITIM. С активацией FcyRIIA свя-
зывают поступление в клетки иммунных комплексов и запуск иммунного
ответа.
FcyRIII (CD16) экспрессирован в большом количестве на нейтрофилах
и с меньшей плотностью — на моноцитах. Характерен для NK-клеток.
Экспрессируется как внутренний белок (FcylHA) или белок, связанный с
гликосфинголипидом (FcylUB).
FcyRI способен связывать мономерный IgG, тогда как два других вариан-
та рецепторов преимущественно связывают IgG в составе иммунного ком-
72 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
плекса. Сбалансированные сигналы через активирующие и подавляющие
Fcy-рецепторы регулируют активность различных эффекторных клеток
иммунной системы. В интактных тканях отношение активирующих и пода-
вляющих сигналов снижено и возрастает при воспалительном процессе.
Иммунные комплексы связываются одновременно с активационными
и ингибиторными рецепторами. Ответ клеток зависит от преобладания
экспрессии рецепторов того или иного типа. Fcy-рецепторы под влиянием
иммунных комплексов способны регулировать порог активации и ее дли-
тельность. Рецептор FcyRIIb экспрессируется В-лимфоцитами. Этот рецеп-
тор участвует в сохранении толерантности и ограничении образования
иммунных комплексов, усиливая апоптоз низкоаффинных аутореактивных
В-клеток в зародышевых центрах, а также ограничивает накопление ауто-
реактивных плазматических клеток.
Полиморфизм FcyRIIa влияет на связывание IgG2, специфичного к инкап-
сулированным бактериям. Аллель Н рецептора связывает IgG2 активнее
аллеля R. Изоформу FcyRIIIa в качестве трансмембранного белка экспрес-
сируют некоторые моноциты. Рецептор FcyRIIIb выявляют на нейтрофилах
и эозинофилах. Этот рецептор заякорен на внутренней структуре мембраны
через гликозилфосфатидилинозитол. Под влиянием ИФН-у и Г-КСФ сни-
жается экспрессия рецепторов FcyRIIIb на нейтрофилах (преимущественно
за счет их сбрасывания). Fc-фрагмент IgG взаимодействует не только с
рецептором, но и со стафилококковым белком А.
FcaRI (CD89) — рецептор для IgA типа I. Экспрессирован на моноцитах,
тканевых макрофагах, эозинофилах. Иммунные комплексы, содержащие
IgA-антитела, активируют моноциты и запускают образование этими клет-
ками ФНО-a и ИЛ-ip. Нейтрофилы при распознавании таких комплексов
начинают активнее продуцировать супероксид. CD89 участвует в запуске
фагоцитоза, дегрануляции, дыхательного взрыва, а также реализации бак-
терицидное™ и других свойств клеток.
Среди Fc-рецепторов особую роль отводят FcRn-рецепторам.
Неонатальный Fc-рецептор для IgG — Fc-связывающая молекула, струк-
турно и функционально отличающаяся от FcyR. FcRn относят к белкам
семейства HLA класса I. Этот рецептор состоит из тяжелой цепи, связанной
с Р2-микроглобулином, и связывает два главных лиганда: IgG и сыворо-
точный альбумин. Главная функция FcRn заключается в защите IgG и
сывороточного альбумина от катаболизма (переводит их в безопасные
зоны) после интернализации клеткой. Биологическая роль такого механиз-
ма — обеспечить транспорт IgG через эпителиальный и эндотелиальный
барьеры, вовлеченные в трансмиссию IgG от матери к плоду. FcRn широко
экспрессируются у взрослых людей клетками эпителия, эндотелия, парен-
химы почек, макрофагами кишечника, ДК моноцитарного происхождения,
но не Т- и В-клетками. Считают, что клетки, несущие FcRn, способны сохра-
нять интернализированные IgG-молекулы (например, материнского про-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 73
исхождения) в нативной форме. В организме ребенка IgG-антитела матери
могут сохраняться до 8-9-месячного возраста. Возможно, подобный меха-
низм позволяет сохранять определенный пул внутривенных иммуноглобу-
линов, применяемых с лечебной целью при многих заболеваниях.
Два типа Fc-рецепторов взаимодействуют с Fc-фрагментом IgE: это FceRI
и FceR2.
FceRI — высокоаффинный рецептор. Экспрессируется только тучными
клетками и базофилами. Тетрамерный рецепторный комплекс состоит
из одной a-цепи (связывает 3-й и 4-й константные домены молекулы
IgE), одной p-цепи (четырежды пронизывает мембрану и усиливает сиг-
нал) и двух дисульфидно связанных гомологичных у-цепей (отвечают
за проведение сигнала внутрь клетки с участием двух ITAM) (рис. 3-2).
Аллергенспецифические IgE-антитела взаимодействуют с FceRI и сенсиби-
лизируют клетки для последующего воздействия аллергена. Агрегация FceRI
на тучных клетках мультивалентным аллергеном приводит к дегрануляции,
выработке метаболитов арахидоновой кислоты и секреции цитокинов,
которые в комплексе запускают воспалительный процесс (см. рис. 4-8).
Одна из особенностей функциональной активности тучных клеток и
базофилов — постоянное наличие на их поверхности аллергенспецифи-
ческих IgE, фиксированных через FceRI. В результате активации аллерге-
ГЛАВА 3
Рис. 3-2. Схематичное изображение строения высокоаффинного рецептора FceRI и низ-
коаффинного рецептора FceRII (описание в тексте).
74 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ном немедленно освобождаются преформированные секреторные гранулы
(дегрануляция; в течение нескольких минут), синтезируются de novo про-
воспалительные липидные медиаторы и цитокины (в течение нескольких
часов), изменяется цитоскелет тучных клеток. Высвобождаемые префор-
мированные гранулы и липидные медиаторы запускают реакцию немед-
ленной гиперчувствительности. Вырабатываемые цитокины и хемокины
в дальнейшем усиливают этот процесс, а также привлекают и активируют
другие клетки (в частности, эозинофилы) в очаг аллергического воспале-
ния. Экспрессию FccRI на клетках регулируют цитокины.
FceR2 (CD23) — низкоаффинный рецептор лектинового типа.
Экспрессируют лимфоциты и лейкоциты. У человека существуют две
изоформы рецептора: CD23a представлена на В-лимфоцитах, CD23b экс-
прессируется многими клетками. При взаимодействии с IgE происходит
индукция образования ИЛ-4. FccR2 играет важную роль в дифференциров-
ке В-лимфоцитов.
Регион CD23 в зоне соединения с клеточной мембраной легко деградиру-
ет с образованием растворимой формы молекулы CD23, содержание кото-
рой в сыворотке крови может возрастать при некоторых иммунопатологиях
(см. рис. 3-2).
3.1.3. Папернраспознающие рецепторы врожденного
иммунитета
Особую роль в реакциях врожденного иммунитета играют паттернрас-
познающие рецепторы (PRR, особенно Toll-подобные рецепторы — TLR),
распознающие компоненты микроорганизмов и эндогенные сигналы опас-
ности, которые возникают в организме. В результате действия высокоэф-
фективных механизмов врожденная иммунная система определяет потен-
циальные патогены, распознавая ЛПС, пептидогликаны, липопептиды,
флагеллин и многие другие консервативные и неизменяющиеся структур-
ные молекулы. В этом отношении врожденную иммунную систему рассма-
тривают как первую линию защиты против патогенных микроорганизмов
у млекопитающих. Одна из целей врожденного иммунитета сводится к
раннему установлению различий между патогенами и непатогенами, что
особенно важно в пограничных тканях (слизистые оболочки пищевари-
тельного тракта и дыхательных путей, кожа и т.д.). Приобретенная (адап-
тивная) иммунная система сформировалась для узнавания более сложных
изменяющихся молекулярных структур (белков). В процессе реализации
функций клеток врожденной иммунной системы (ДК, макрофаги, нейтро-
филы, тучные клетки, эозинофилы и др.) происходит изменение их поверх-
ностных структур, активация захвата антигена, запуск сигнальных путей и
изменение эффекторных механизмов. Это важно для контроля иммунного
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 75
гомеостаза, реализации эффекторных реакций врожденной иммунной
защиты и индукции приобретенного иммунитета.
Среди сигнальных рецепторов Toll- (TLR) и NOD-подобные рецепторы
(NLR) с эволюционной точки зрения — одни из наиболее древних семейств,
играющих центральную роль в инициации врожденной иммунной защиты
против патогенов. Так, Toll-рецепторы впервые выявлены у дрозофил, а
NLR — у растений, но их ключевые свойства сохранились и у позвоноч-
ных.
3.1.3.1. TOLL-ПОДОБНЫЕ РЕЦЕПТОРЫ (TLR)
TLR млекопитающих входят в семейство трансмембранных рецепторов,
кодируемых генами зародышевой линии. Эти рецепторы взаимодействуют
с патогенассоциированными молекулярными паттернами (образы пато-
генности; РАМР), экспрессируемыми патогенными микроорганизмами.
РАМР — консервативные структуры микроорганизмов, общие для разных
патогенов: компоненты бактериальной стенки (например, ЛПС, пептидо-
гликан, флагеллин), бактериальная ДНК, вирусная двухцепочечная РНК
и др. Паттерны обычно экспрессируются на поверхности патогенов, но не
на клетках организма; они инвариантны в пределах одного класса микро-
организмов.
Строение Toll-подобных рецепторов
TLR — трансмембранные гликопротеины с внеклеточным фрагмен-
том, представленным повторяющимися последовательностями с высоким
содержанием лейцина. Эти рецепторы состоят из двух доменов. Внешний
домен содержит варьирующее число богатых лейцином повторяющихся
мотивов (LRR), которые обеспечивают прямое взаимодействие рецептора с
компонентами микроорганизмов или их продуктами. Третичная структура
этого домена определяет специфичность связывания TLR с определенны-
ми РАМР. Внутренний домен TLR сходен с цитоплазматическим доменом
рецептора ИЛ-1, в связи с этим его называют TIR-доменом (англ. Toll/
interleukin-1 receptor domain). Этот домен участвует в трансдукции сигнала
от активированного TLR внутрь клетки (рис. 3-3).
Toll-рецепторы, вовлекаемые в иммуностимуляцию, впервые выявлены в
90-х годах XX в. у дрозофил как белки, участвующие в установлении дорсо-
вентральной поляризации тела и защите против инфекции грибами.
В настоящее время у млекопитающих идентифицированы 13 предста-
вителей семейства Toll-подобных рецепторов (TLR1, TLR2, TLR3, TLR4,
TLR5, TLR6, TLR7, TLR8, TLR9 выявляют у мышей и у человека; TLR10 —
только у человека; TLR11 — только у мышей; TLR12, TLR13 — пока только
у мышей).
Во многом структура всех TLR сходна. Различия могут быть связаны с
набором лейцинов в LRR. Отдельные TLR распознают ограниченное число
ГЛАВА 3
76 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
ИЛ-IR
TLR
Рис. 3-3. Строение Toll-подобных рецепторов. Сходство цитоплазматических доменов Toll-
подобных рецепторов и рецептора интерлейкина-1.
лигандов, тогда как всё семейство TLR может узнавать широкий спектр
РАМР бактерий, вирусов, грибов и паразитов. В табл. 3-1 представлены TLR
и их лиганды.
TLR экспрессируются на поверхности и внутри клетки. TLR1, TLR2, TLR4,
TLR5, TLR6, TLR11 представлены на клеточной мембране и распознают
в основном бактериальные компоненты. Рецепторы другой подгруппы
семейства Toll-подобных рецепторов (TLR3, TLR7, TLR8, TLR9) специфич-
ны к нуклеиновым кислотам бактериального и вирусного происхождения
(см. рис. 3-5). В частности, TLR3 распознает двухцепочечную РНК; TLR7 и
TLR8 активируются одноцепочечными РНК. TLR7 и TLR8 участвуют в рас-
познавании мотивов, обогащенных гуанином и урацилом. Взаимодействие
TLR7 с одноцепочечной РНК вируса гриппа или ВИЧ приводит к усилению
синтеза ИФН-а и провоспалительных цитокинов.
TLR9 взаимодействует с ДНК вирусов и бактерий [неметилирована, содер-
жит повторы CpG (цитозин-фосфо-гуанин)]. CpG-олигодезоксинуклеотид
обладает иммуностимулирующим действием и нередко используется в
качестве адъюванта. Интересно, что TLR3, TLR7, TLR8, TLR9 локализуются
во внутриклеточных мембранных компартментах (эндосомы), что изоли-
рует эти рецепторы от возможного контакта с эндогенными нуклеиновы-
ми кислотами (рис. 3-4). Естественные лиганды TLR10 человека пока не
определены.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 77
ГЛАВА 3
Таблица 3-1. Toll-подобные рецепторы человека и их лиганды
Toll-подобные рецепторы Лиганды Toll-подобных рецепторов
TLR1 Триациллипопептиды бактерий и микобактерий, растворимые факторы Neisseria meningitidis, Borrelia burgdorferi
TLR2 Липопротеины и липопептиды (различные патогены), пептидогликан (грам- положительные бактерии), липотейхоевые кислоты (грамположительные бактерии), липоарабиноманнан (микобактерии), гликолипиды (Treponema maltophilum), порины (Neisseria), зимозан (грибы), липополисахарид (Leptospira interrogans, Porphyromonas gingivalis, Chlamydia trachomatis), вирусные белки (вирус простого герпеса, цитомегаловирус), белок тепло- вого шока HSP70 (эндогенный), ди- и триациллипопептиды (синтетические) и др.
TLR3 Двухцепочечная РНК вирусов, поли 1:С (синтетический)
TLR4 Липополисахарид (грамотрицательные бактерии), домен А фибронектина (эндогенный), фибриноген (эндогенный), олигосахариды гиалуроновой кислоты (эндогенные), полисахаридные фрагменты гепарансульфата (эндогенные), 0-дефенсин, таксой (растительного происхождения): белки теплового шока: Hsp60 (Chlamydia pneumoniae), Hsp70 (эндогенные): липид А (синтетический) и др.
TLR5 Бактериальный флагеллин
TLR6 Диациллипопептиды микоплазм, липотейхоевая кислота грамположитель- ных бактерий, зимозан грибов и др.
TLR7 Имидазольные хинолины: imiquimod, resiquimod (синтетический): одно- цепочечная РНК (вирусы гриппа, иммунодефицита человека, везикулярного стоматита) и др.
TLR8 Имидазольный хинолин Imiquimod (синтетический), одноцепочечная РНК вирусов
TLR9 CpG-содержащая ДНК бактерий и вирусов, синтетические аналоги
TLR10 Специфичность не известна
На основании структурной гомологии и специфичности по отношению
к белкам, нуклеиновым рецепторам и липопротеинам выделяют три под-
семейства TLR (рис. 3-5).
Первым из TLR у млекопитающих был охарактеризован TLR4, специ-
фичный к ЛПС грамотрицательных бактерий. Чрезмерная экспрессия
конститутивно активного TLR4 моноцитами приводит к избыточному
образованию провоспалительных цитокинов и костимулирующих моле-
кул. Распознавание ЛПС TLR4 усиливают дополнительные молекулы.
Растворимый ЛПС в межклеточном пространстве соединяется с ЛПС-
связывающим белком (ЛСБ), принадлежащим к семейству белков острой
фазы воспаления. Комплекс ЛПС-ЛСБ гораздо эффективнее взаимодей-
ствует с TLR4 и с входящей в его состав молекулой CD14. Адаптерная
молекула MD2, присоединяясь к внеклеточной части TLR4, обеспечивает
78 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
TLR1/2
Рис. 3-4. Экспрессия Toll-подобных рецепторов [Кода К., Mor G., 2008, с модификациями].
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 79
стабильность комплекса и передачу сигнала. Таким образом, формируется
высокоаффинный рецепторный комплекс, способный взаимодействовать с
Л ПС и проводить активационный сигнал в клетку (см. рис. 3-6).
Из всех выявленных TLR наиболее широким спектром специфично-
сти обладает TLR2 (см. табл. 3-1). Рецептор реагирует с липопротеинами
грамположительных и грамотрицательных бактерий, микобактерий, пеп-
тидогликаном и липотейхоевой кислотой грамположительных бактерий,
грибковым зимозаном.
TLR2 распознает некоторые микробные продукты после образования
гетеродимеров с TLR1 или TLR6. Комплекс TLR2/TLR1 распознает бак-
териальные триацилированные липопротеины, а комплекс TLR2/TLR6 —
диацилированные липопротеины микоплазм. При активации клетки через
TLR2 развивается воспалительный ответ патологической или протективной
направленности. TLR2 играет роль и в раннем образовании медиаторов вос-
паления, и в развитии хронической воспалительной патологии. Известно,
что мыши с дефицитом TLR2 высоковосприимчивы к инфекции, вызы-
ваемой Staphylococcus aureus, однако они не отвечают на пептидогликан или
липопротеины.
Следует отметить, что TLR распознают не только структуры бактериаль-
ных клеток и вирионов, но и эндогенные молекулы, вырабатываемые при
повреждениях тканей и травмах. Клетки, несущие TLR4, могут активировать-
ся фибронектином, который имеет дополнительный домен А. Белки тепло-
вого шока 70 и 60 (Hsp70 и Hsp60) вызывают повышенную выработку про-
воспалительных цитокинов при действии на TLR4 и TLR2. Внесосудистый
фибриноген индуцирует выработку хемокинов макрофагами через TLR4.
Лизосомальные гидролазы, тиреоглобулин, тиреотропный гормон, миелопе-
роксидаза, фибриноген, липопротеины высокой плотности, модифицирован-
ные липопротеины низкой плотности, а также апоптотические тельца тоже
могут выступать в качестве лигандов TLR. Биологический смысл активации
механизмов врожденного иммунитета эндогенными молекулами заключает-
ся в адекватном реагировании иммунной системы на сигналы опасности —
DAMP (англ. Danger Associated Molecular Patterns). Подобный механизм обе-
спечивает своевременное выведение из организма модифицированных эндо-
генных молекул и поддержание антигенного постоянства.
Пшерактивация TLRs эндогенными лигандами может быть одним из
основных механизмов в развитии патологического повреждения тканей
при инфаркте миокарда, атеросклерозе, остром панкреатите, мозговом
инсульте, патологии беременности и других острых и хронических заболе-
ваниях. Мощный системный или местный «цитокиновый шторм» нередко
развивается с участием системы рецепторов врожденного иммунитета.
В последнее время отмечают, что сепсис, системное воспаление и другие
состояния во многом являются следствием гиперактивации иммунной
системы (в первую очередь врожденной).
ГЛАВА 3
ЧАСТЬ 1
80 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Система распознавания патогенов с помощью механизмов врожденного
иммунитета более древняя, но не менее эффективная, чем система рас-
познавания антигенспецифическими рецепторами Т- и В-лимфоцитов.
Передача сигналов с Toll-подобных рецепторов
TLR различаются по своей специфичности, однако все эти рецепторы
передают сигналы по одинаковому пути. Взаимодействие рецептора с
соответствующим лигандом вызывает конформационные изменения в
TIR-домене, взаимодействующим с адапторным сигнальным белком мие-
лоидным фактором дифференцировки 88 (MyD88). MyD88 существует в
виде гомодимера и содержит два элемента: TIR-домен (взаимодействует с
TIR-доменом TLR) и домен смерти DD (англ. Death Domain), связывающий
следующий элемент сигнального каскада. При распознавании TLR своего
лиганда MyD88 соединяется с внутриклеточным фрагментом рецептора
(TIR-TIR-взаимодействие). После этого MyD88 через DD-домен связывает
и активирует DD-содержащую серин-треониновую киназу IL-lR-связанную
киназу (IRAK). Затем IRAK диссоциирует из рецепторного комплекса и
связывается с TRAF-6. Дальнейшее вовлечение NF-кВ и МАР-киназного
сигнального пути происходит через активацию киназного каскада, вклю-
чающего киназы ТАК-1 и IKK (рис. 3-6).
Таким образом, TLR инициируют передачу сигнала, связывая вну-
триклеточным участком TLR (TIR) адапторные белки: MyD88 (общий
для всех TLR), TIRAP [Toll-Interleukin 1 Receptor (TIR) domain containing
Adaptor Protein] (для TLR2 и TLR4) и TICAM (TIR-содержащая адаптер-
ная молекула-1 для TLR3, TLR4). Последующее фосфорилирование и
активация приводят к транслокации в ядро фактора транскрипции NF-kB,
активирующего гены, ответственные за выработку провоспалительных
цитокинов, хемокинов, катионных противомикробных пептидов и кости-
мулирующих молекул.
Помимо MyD88, существуют другие TIR-содержащие адапторные белки
без домена смерти, TIRAP, Mai.
В активацию через TLR3 и TLR4 может быть вовлечена еще одна адап-
торная молекула TRIF (англ. TIR-domain-containing adaptor-including IFNfi),
напрямую связывающаяся через свой N-конец с TRAF-6 и впоследствии
активирующая NF-кВ (см. рис. 3-4, рис. 3-6). Этот ядерный фактор,
попадая в клеточное ядро, инициирует транскрипцию генов провоспали-
тельных цитокинов ИЛ-6, ФНО-а, ИЛ-8, ИЛ-18, хемокинов, NO-синтазы
и других медиаторов, регулирующих воспаление. Также происходит акти-
вация цитокинов, стимулирующих дифференцировку Thl-клеток: ИЛ-12,
ИЛ-23, ИЛ-27, ответственных за развитие адаптивного иммунного ответа
Thl-типа.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 81
ГЛАВА 3
VWVWWWW
WWW\A/VVVVV\AAA/^
Рис. 3-6. МуО88-зависимый и МуО88-независимый пути передачи сигнала от Toll-
подобного рецептора 4 (TLR4). Активация NF-кВ, вызываемая Toll-подобным рецепто-
ром 4, может происходить по классическому МуО88-зависимому сигнальному пути или
по МуО88-независимому пути через связывание TRIF [DeFranco A.L., 2007].
Более того, TLR4 и TLR3 в ответ на ЛПС и двухцепочечную РНК (dsRNA),
соответственно, могут стимулировать образование интерферонов I типа
(ИФН-а и ИФН-р) и запускать экспрессию генов, индуцируемых интерфе-
ронами. Этот процесс — результат активации TRIF через ТВК-1. TRIF обла-
дает способностью стимулировать факторы транскрипции - регуляторные
факторы интерферонов (IRF-3, IRF-7) (см. рис. 3-6).
Сходные пути передачи сигналов через TLR реализуются при актива-
ции клеток с участием сигналов иммунной опасности (DAMP — Danger
Associated Molecular Pattern).
ЧАСТЬ 1
82 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Экспрессия Toll-подобных рецепторов
Очевидно, что TLR широко экспрессируются клетками иммунной систе-
мы (особенно врожденной), в частности, вовлекаемыми в воспалитель-
ный ответ: макрофагами, нейтрофилами, моноцитами, ДК (табл. 3-2).
Распознавание пептидогликана TLR2 на тучных клетках вызывает их
дегрануляцию, что усиливает воспалительные изменения в тканях и может
запускать аллергический процесс без участия IgE и аллергена.
Таблица 3-2. Экспрессия Toll-подобных рецепторов некоторыми гемопоэтическими
и другими клетками
Рецептор Клетки, экспрессирующие Toll-подобные рецепторы Регуляция экспрессии
TLR1 Большинство клеток иммунной системы Регуляция под действием фитогемагглю- тинина в Т-клетках
TLR2 Моноциты, клетки слизистых оболочек, дендритные клетки, полиморфно- ядерные лейкоциты, тучные клетки Экспрессию индуцирует липополисаха- рид
TLR3 Дендритные клетки. NK-клетки Экспрессия усиливается при дифферен- цировке клеток
TLR4 Макрофаги; клетки роговицы, слизистых оболочек; дендритные, эндотелиальные клетки Усиление экспрессии при действии про- воспалительных цитокинов и патогенов бактерий, ослабление экспрессии при действии противовоспалительных цито- кинов
TLR5 Моноциты, незрелые дендритные клетки NK-клетки, Т-лимфоциты, эпителиальные клетки Экспрессия незначительно изменяется под действием цитокинов или липопо- лисахарида
TLR6 В-клетки (высокая экспрессия), моноци- ты, NK-клетки Цитокинами и липополисахаридом экс- прессия не индуцируется провоспали- тельными цитокинами
TLR7 В-клетки, предшественники плазмоцито- идных дендритных клеток Экспрессию индуцирует ИЛ-6
TLR8 Моноциты NK-клетки, Т-клетки Экспрессию индуцируют ИФН-у и липо- полисахарид
TLR9 Предшественники плазмоцитоидных ден- дритных клеток, В-клетки, макрофаги, полиморфно-ядерные лейкоциты, клетки микроглии и роговицы Экспрессию индуцируют ИФН-у и липо- полисахарид
TLR1O В-клетки. предшественники плазмоцито- идных дендритных клеток Экспрессия незначительно изменяется под действием цитокинов и липополи- сахарида
Различные TLR экспрессируются на ДК, играющих важную роль в
индукции врожденного иммунитета и его координации с адаптивным
иммунитетом.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 83
Накапливается всё больше доказательств, что TLR, но не другие типы
PRR, широко представлены практически на всех ядросодержащих клетках
организма, в частности на клетках слизистых оболочек, через которые в
организм проникает множество чужеродных агентов (патогены, комменса-
лы, аллергены и др.) (см. табл. 3-2). Следует обратить внимание на то, что
PRR могут участовать в запуске как локального, так и системного воспали-
тельного процесса при распознавании РАМР или DAMP.
Интенсивно накапливающиеся результаты из клинической практики
убедительно свидетельствуют о ключевой роли TLR в патогенезе многих, в
первую очередь иммунопатологических заболеваний.
Появляются данные о важной роли тучных клеток в ответе на патогены.
Тучные клетки экспрессируют широкий спектр TLR: TLR1, TLR2, TLR3,
TLR4, TLR6, TLR9 (см. табл. 3-2). Избыточное воздействие паттернов
микроорганизмов может привести в запуску аллергопатологии.
Мутации гена, кодирующего TLR4, у человека увеличивают риск разви-
тия инфекционных заболеваний, вызываемых грамотрицательными бакте-
риями. Выявлены две мутации гена, кодирующего TLR4 (Asp/Gly299, Thr/
Пе399), с которыми связывают недостаточный ответ на Л ПС. У носителей
этих мутаций также повышается риск развития септического шока.
Известны случаи генетических дефектов на уровне сигнальных молекул
TLR. У детей с генетическим дефектом киназы IRAK4 с раннего возраста
увеличивается частота гнойных бактериальных инфекций, вызванных
Streptococcus pneumoniae и Staphylococcus aureus. При этом защита против
вирусных, грибковых и паразитарных инфекций может сохраняться. В то
же время паттерны бактерий и вирусов, как мощные активаторы врожден-
ного иммунного ответа, рассматриваются в качестве иммуномодуляторов.
Кроме того, появляются сообщения об их применении в качестве адъюван-
тов, включаемых в состав вакцинных препаратов для усиления их иммуно-
генности. Это показано, в частности, для агониста TLR9 — CpG и агониста
TLR4 — аналога липида А. Так, CpG, конъюгированный с антигеном вируса
гепатита С, значительно повышает иммуногенность вакцины против вируса
гепатита С.
Не исключено, что в определенных ситуациях, воздействуя на врожден-
ные компоненты иммунной системы, в частности на TLR, можно добиться
положительного лечебного эффекта, если механизмы приобретенного
иммунного ответа еще не сформировались (неонатальный период), не
полноценны (первичные и вторичные иммунодефициты) или претерпели
возрастные изменения (старческий период). Однако следует учитывать,
что избыточная активация этих компонентов может также привести к раз-
витию иммунопатологии. Так, гиперэкспрессия TLR2 и TLR4 в плаценте и
слизистой оболочке цервикального канала у беременных с урогенитальной
инфекцией часто является причиной, приводящей к прерыванию беремен-
ности, тяжелым гестозам, внутриутробному инфицированию.
ГЛАВА 3
84 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
3.1.3.2. NOD-ПОДОБНЫЕ РЕЦЕПТОРЫ (NLR)
Гетерогенное семейство эндогенных NOD-подобных рецепторов
также относят к сигнальным паттернраспознающим рецепторам (NOD —
англ. Nucleotide-binding Oligomerization Domain). Они экспрессируются
в цитоплазме клеток и распознают РАМР внутриклеточных патогенов.
Недавно обнаружено, что рецепторы, принадлежащие к семейству NLR
(NOD-like receptor), могут распознавать вещества, которые образуются при
повреждении клеток организма (АТФ, кристаллы мочевой кислоты и др.), и
вызывать развитие воспалительного процесса в основном за счет образова-
ния ИЛ-ip, ИЛ-18 и других провоспалительных цитокинов. Данное семей-
ство включает как минимум 23 типа рецепторов, характерной структурой
которых является NOD-домен.
Наиболее изучены NOD-1, N0D-2 — внутриклеточные рецепторы, экс-
прессируемые в ДК, макрофагах, эпителиальных клетках слизистых оболо-
чек и др. Особенно много NLR в клетках Панета, где активация их приводит
к выработке дефенсинов.
NLR содержат, как правило, три домена: на С-конце — распознающий
участок с повторами, богатыми лейцином; на N- конце — пирин или каспазо-
ассоциированные домены (CARD). Одним из доменов является NOD-домен.
Внутриклеточные патогены распознаются димером N0D-1, активирующим
киназу RISK, что приводит к транскрипции NF-кВ-зависимых генов цито-
кинов (рис. 3-7). Кроме этого, активация N0D-1 и NOD-2 приводит к акти-
вации транскрипционного фактора АР-1.
Провоспа-
лительные
цитокины
и хемокины
Рис. 3-7. Передача сигнала с рецеп-
тора NOD-1.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 85
Клинические синдромы, которые связаны с мутацией генов, кодирую-
щих NLR, рассмотрены в главе 11. Мутацию гена, кодирущего NOD-2 (рас-
познает мурамилдипептиды грамотрицательных и грамположительных
бактерий), выявляют у людей с болезнью Крона.
Результат взаимодействия лигандов с рецепторами врожденного имму-
нитета и проведения сигналов — активация эффекторных функций клеток
как врожденного, так и адаптивного иммунитета, экспрессирующих такие
рецепторы. Эффекторные механизмы иммунного ответа изложены более
подробно в главе 4.
3.2. АНТИГЕНРАСПОЗНАЮЩАЯ ФУНКЦИЯ
Т- И В-ЛИМФОЦИТОВ
Система приобретенного (адаптивного) иммунитета сформировалась
эволюционно в наиболее совершенной форме у позвоночных благодаря
уникальному процессу реаранжировки генов иммуноглобулинов и TCR,
обусловленному факторами RAG1 и RAG2 — регуляторами генной пере-
группировки. Из первоначального небольшого набора зародышевых генов,
передаваемых по наследству, в процессе соматической перегруппировки
генных сегментов V, D, J и С, кодирующих фрагменты цепей антител или
TCR, формируется огромное разнообразие распознающих элементов, кото-
рые охватывают все существующие в природе антигены. После рождения
иммунная система человека потенциально способна к узнаванию любых
антигенов, даже различающихся одним или несколькими аминокислотны-
ми остатками.
Каждый Т- и В-лимфоцит, прошедший обучение в тимусе и костном мозге,
соответственно несет на поверхности антигенраспознающие рецепторы с
уникальной специфичностью. При встрече на периферии со «своим» антиге-
ном такой лимфоцит формирует клон себе подобных клеток. На пике иммун-
ного ответа число клеток в клоне с идентичными антигенраспознающими
рецепторами может достигать нескольких миллионов. После окончания
иммунного ответа клональная экспансия резко снижается, но, как прави-
ло, сохраняются клетки памяти, которые при вторичном иммунном ответе
повторяют этот процесс, с более высокой интенсивностью и эффективно-
стью. Таким образом, антигенраспознающие рецепторы Т- и В-лимфоцитов
клональны и их иногда обозначают как клоноспецифические.
Высочайшая степень специфичности может иметь исключения. В таких
случаях появляются полиспецифичные антитела и TCR. Например, есте-
ственные IgM-антитела, вырабатываемые Bl-клетками, могут реагировать
с несколькими антигенами. Отклонения специфичности TCR могут быть
зарегистрированы среди Т-лимфоцитов.
ГЛАВА 3
ЧАСТЬ 1
86 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
3.2.1. Особенности дифференцировки Т-лимфоцитов
человека и распознавание антигенов
В подавляющем большинстве случаев Т-лимфоцит способен распознать
только одну антигенную детерминанту. Функционально зрелая Т-клетка
экспрессирует на поверхности около 3xlO5TCR одной специфичности.
Т-лимфоциты распознают антигены особым образом, отличным от
такового В-лимфоцитов. Они не способны реагировать на растворимый
нативный антиген. Антиген для них должен быть представлен (презенти-
рован) ДК, макрофагами или В-клетками в форме антигенного пептида
(так называемого Т-клеточного эпитопа), обязательно встроенного за
счет нековалентных связей в аутологичную молекулу HLA класса I или И.
Феномен «двойного распознавания» описали Р. Цинкернагель (США) и
П. Дохерти (Австралия) в 1970-х годах, получившие в 1996 г. Нобелевскую
премию за открытие роли молекул главного комплекса гистосовместимо-
сти в презентации антигена. Таким образом, TCR распознает 2 компонен-
та: «чужой» антигенный пептид в комплексе со «своей» HLA-молекулой.
Именно собственные HLA-молекулы служат основой для обучения и селек-
ции Т-клеток в отношении «своего». Механизм двойного распознавания
уникален и очень точно характеризует основную функцию иммунной систе-
мы в распознавании «чужого» через «свое». К сожалению, многие заболе-
вания иммунной системы, и в первую очередь аутоиммунные, обусловлены
неспособностью отличить «свое» от «чужого».
3.2.1.1. АНТМГЕНРАСПОЗНАЮЩИЙ РЕЦЕПТОР Т-КЛЕТОК
Строение TCR подробно изучено за последние 15 лет. Существуют два
варианта TCR, различающихся составом цепей, которые непосредственно
взаимодействуют с антигенными пептидами, — содержащих гетеродимеры
ар- или у8-цепей.
Более 95% Т-лимфоцитов экспрессируют на своей поверхности apTCR.
Они расположены преимущественно в тимусе, периферических органах
иммунной системы и крови. Именно с ними связаны все главные функции
Т-лимфоцитов как иммунокомпетентных клеток адаптивного иммунитета.
Изучение особенностей развития и функционирования арТ-лимфоцитов
крайне важно для понимания механизмов развития подавляющего числа
иммуноопосредованных заболеваний человека.
TCR — сложная многокомпонентная структура из двух распознающих
антиген цепей (аир), соединенных дисульфидной связью, и нековалентно
связанных сигнальных субъединиц СВЗ-комплекса, способных передавать
активационный сигнал в клетку. В целом TCR обозначают как «Т-клеточный
рецепторный комплекс» (рис. 3-8).
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 87
Внеклеточные
домены
Плазматическая
мембрана
Цитоплазма
Рис. 3-8. Схематичное изображение строения Т-клеточного рецептора.
ГЛАВА 3
По структуре а- и 0-цепи принадлежат к суперсемейству иммуноглобу-
линов и имеют доменное строение. Ведущую роль в распознавании антиге-
на играют 0-цепи (аналогично тяжелой цепи молекулы иммуноглобулина).
В каждой цепи выделяют вариабельный (V), константный (С), трансмем-
бранный и короткий цитоплазматический домены. В антигенраспознающем
V-домене TCR есть три гипервариабельных региона, определяющих ком-
плементарность связывания с эпитопом антигена (CDR1, CDR2 и CDR3).
Эти участки входят в состав активного центра рецептора. Вариабельность
аминокислот в пределах этих регионов обеспечивает высокоспецифичное
взаимодействие a0TCR с антигенной детерминантой в комплексе с молеку-
лой HLA класса I или II.
Трансмембранные участки обеих цепей содержат положительно заря-
женные аминокислотные остатки, которые взаимодействуют с отрицатель-
но заряженными субъединицами CD3 (см. рис. 3-8).
Короткие цитоплазматические участки а- и 0-цепей не способны прово-
дить внутрь клетки активационные сигналы. Гетеродимеры а0 соединены
с комплексом инвариантных (идентичных у всех Т-лимфоцитов) полипеп-
тидных цепей, обозначаемым CD3. Основная функция CD3 — трансдукция
сигнала после взаимодействия TCR с антигеном. Корецептор CD3 состоит
из двух гетеродимеров (уе, 8е). Гомодимер ££ расположен в цитоплазме, и
88 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Неперестроенные гены гаметной конфигурации (зародышевой линии)
а-цепи
LVa1 LVan LVs1 LVsn Ds1Ds2 Ja1Js2 Cs LVs5 Js1Js2 Jan Ca
IH—lip—И ЧИ D-DyD-- М-з
Перестроенные гены LVa1 LVa2 LVaJaJan Ca
а-цепи 5 IB !....MH M-3’
Гены зародышевой линии p-цепи
Рис. 3-9. Схема реаранжировки генов Т-клеточного рецептора (из учебника Голдсби Р.
и др. «Иммунология», 2003). Фигурные скобки между рядами генов, отражающими гены
в зародышевом и перестроенном виде, обозначают сближение ранее разобщенных гене-
тических сегментов.
в настоящее время обозначается как самостоятельная молекула- CD247.
Цитоплазматические участки полипептидных цепей содержат в сумме
10 ITAM (см. рис. 3-8). После распознавания антигена происходит фос-
форилирование тирозинов в ITAM и вовлечение протеинтирозинкиназ
(P561ck, P59fyn, ZAP-70 и др.), участвующих в дальнейшей передаче
активационного сигнала. В результате активируются гены, регулирующие
основные эффекторные функции Т-лимфоцитов.
Идентифицированы многочисленные генные дефекты компонентов
TCR комплекса и сигнальных молекул. С этими нарушениями связаны
Т-клеточные и комбинированные первичные иммунодефициты.
Структуру TCR контролирует группа генов, кодирующих а-, р-, у-, 8-цепи
(рис. 3-9). У человека гены а- и 8-цепей картированы на хромосоме 14,
гены р- и у-цепей — на хромосоме 7. Гены вариабельного региона (V)
представлены отдельными сегментами, сгруппированными в кластеры:
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 89
для 0-цепи — V (вариабельный), D (разнообразия),} (связывающий); для
а-цепи — V и J.
Гены TCR закодированы в геноме как зародышевые (germ line) гены в
ограниченном количестве. У всех клеток организма, за исключением зре-
лых лимфоцитов, эти гены существуют в виде раздельных сегментов. В
процессе дифференцировки Т-лимфоцитов происходит перегруппировка и
слияние генов, приводящая к формированию зрелого V-гена 0-цепи, содер-
жащего зародышевый V-сегмент и случайно выбранные D- и J-сегменты
(рис. 3-9). Этот процесс происходит при участии специальных ферментов
экзонуклеаз, кодируемых генами RAG1 и RAG2, и фермента терминальной
дезоксирибонуклеотидилтрансферазы (TdT), обеспечивающей добавление
олигонуклеотидов в местах рекомбинации.
При этом из серии зародышевых V-генов в перестройку вовлекается
случайным образом только один ген, что в основном и определяет специ-
фичность рецептора данной клетки. Известны дополнительные механиз-
мы формирования разнообразия рецепторов. Среди них — комбинации
V-генов с различными сегментами}- и D-, Р- и N-вставки, вариабельность
}-сегмента и др.
Обычно перестройка генов TCR происходит на одной хромосоме. Если
она прошла успешно, то на другой хромосоме этот процесс блокируется
за счет прекращения экспрессии генов RAG1 и RAG2, Это обеспечивает
аллельное исключение, т.е. невозможность синтеза разных молекул TCR в
одной клетке. В случае непродуктивной перестройки генов на одной хромо-
соме реаранжировка генов происходит на другой хромосоме.
Среди генетически обусловленных дефектов развития Т-клеток мутации
RAG1- и КАС2-генов вызывают развитие наиболее тяжелой комбинирован-
ной иммунной недостаточности. Блокада этих ферментов обусловливает
практически полное отсутствие у больных Т- и В-лимфоцитов и развитие
инфекционных заболеваний, быстро приводящих к летальному исходу.
Т- и В-клетки, дифференцирующиеся с использованием небольшого набора
зародышевых генов TCR и иммуноглобулинов, способны обеспечить нор-
мальное функционирование адаптивного иммунитета.
На рис. 3-9 представлен пример перестройки (реаранжировки) генных
сегментов TCR, приводящей к образованию функционального гена, коди-
рующего а- и 0-цепи рецептора.
В процессе реаранжировки (перестройки) генов происходит вырезание
генетического материала, расположенного между соединяемыми сегмен-
тами.
3.2.1.2. ДИФФЕРЕНЦИРОВКА Т-ЛИИФОЦИТОВ
В тимусе обеспечены оптимальные условия для развития всех субпопуля-
ций Т-лимфоцитов из костномозговых предшественников до зрелых форм
с полноценными TCR. Ключевая роль в микроокружении Т-лимфоцитов
ГЛАВА 3
90 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
в тимусе отводится эпителиальным клеткам. Именно они и обеспечи-
вают необходимые условия для дифференцировки Т-лимфоцитов (раз-
дел 2.2.1.1.) Существующие в организме очаги внетимического развития
Т-клеток (например, в кишечнике) не обеспечивают подобного эффекта
в полной мере. Следует учитывать, что основная Т-образующая функция
тимуса осуществляется внутриутробно и в первые годы постнатального раз-
вития. С возрастом в подвергающемся инволюции тимусе интенсивность
этой функции существенно снижается, хотя некоторые очаги тимопоэза
сохраняются до поздней старости. С возрастом уменьшается пул наив-
ных Т-лимфоцитов, покидающих тимус. В это время иммунная система
«использует» сформировавшиеся в организме Т-клетки памяти. Одна из
ключевых проблем адаптивной иммунной системы в пожилом возрасте —
способность адекватно отвечать на новые антигены, с которыми организм
ранее не встречался (например, «новые» инфекционные заболевания про-
текают более тяжело, чем в молодом возрасте, и чаще приводят к осложне-
ниям и летальному исходу).
Определены основные этапы развития Т-лимфоцитов в тимусе
(Т-клеточный иммунопоэз) в соответствии с генетически обусловленной
программой и в отсутствие антигенной стимуляции:
• формирование клоноспецифичных антигенраспознающих рецепторов,
способных распознавать антигенные пептиды в комплексе с аутологич-
ными молекулами HLA;
• выбраковка Т-клеток, специфичных к аутоантигенам;
• экспрессия корецепторных молекул CD4 или CD8 с формированием
субпопуляций Т-хелперов и ЦТЛ, а также естественных (природных)
регуляторных Т-клеток (Treg).
Дифференцировка в тимусе сопровождается сменой поверхностных
маркеров Т-лимфоцитов. На рис. 3-12 представлена схема основных этапов
дифференцировки Т-клеток. Она включает следующие стадии:
• миграцию предшественников Т-клеток из костного мозга;
• перегруппировку генов TCR и формирование полноценного рецеп-
тора;
• положительную и отрицательную селекцию Т-клеток;
• формирование зрелых субпопуляций CD4+ и CD8+ Т-лимфоцитов;
• эмиграцию зрелых Т-клеток из тимуса.
Ранние лимфоидные предшественники (CD34, CD38, CD45RA, CD117,
CD7, CD44), образующиеся в печени плода и позже в костном мозге, посту-
пают в паренхиму тимуса путем диапедеза через посткапиллярные венулы с
высоким эндотелием, расположенные в кортико-медуллярном соединении,
и перемещаются в наружные слои коры, а потом вновь мигрируют в зону
кортикомедуллярного соединения. При миграции клеток происходит их
дифференцировка.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 91
Основные маркеры дифференцировки Т-лимфоцитов в тимусе — харак-
терные корецепторные молекулы: CD4 для Т-хелперов и CD8 для ЦТЛ, а
также рецепторный комплекс TCR-CD3. Выделяют три наиболее общие
стадии развития Т-лимфоцитов: двойные негативные (ДН), двойные
позитивные (ДП) и одинарные позитивные клетки (ОП) (рис. 3-10).
ГЛАВА 3
МФ
В-кл
ДК
TCR-CD3
CD44
TCR-CD3
CD8+
Медулла
Кортико-
медуллярное
соединение
TCR-CD3
Общий лимфоидный
предшественник
CD25*
CD44*
NK
ДН4
NKT
CD8+
CD4+
TCR-CD3
CD44-
CD25
у6Т-кл
Внутренний
слой коры
Наружный
слой коры
Субкапсу-
лярная
зона
Рис. 3-10. Стадии дифференцировки двойных негативных лимфоцитов.
ЧАСТЬ 1
92 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
В развитии двойных негативных (ДН) лимфоцитов выделяют 4 стадии,
отличающиеся по экспрессии CD44 (рецептора, ответственного за мигра-
цию клеток в тимус) и молекулы CD25 (a-цепи ИЛ-2Р) (табл. 3-3, см. рис.
3-10).
На стадии ДН1 происходит активная пролиферация клеток под действи-
ем фактора стволовых клеток.
Коммитированность развития в направлении Т-клеток определяет фак-
тор транскрипции Notchl (см. рис. 3-10). При блокаде Notchl нарушается
дифференцировка Т-клеток и могут появляться очаги эктопического созре-
вания В-лимфоцитов. Дисрегуляция Notch связана с наследственными
генетическими дефектами и раком. В частности, мутации Notchl найде-
ны в большинстве Т-клеток при остром лимфобластном лейкозе у детей.
Лиганды рецептора Notchl (CD339, TAG-1) имеются на стромальных клет-
ках костного мозга и эпителиальных клетках тимуса.
Как было сказано ранее, предшественники содержат гены TCR в непере-
строенной зародышевой конфигурации (зародышевые гены). При переходе
тимоцитов со стадии ДН2 на стадию ДНЗ запускается перестройка генов
TCR тимоцитов. Первым перестраивается сегмент У0-цепи. Затем синтези-
руемая 0-цепь связывается с инвариантной пре-а-цепью и молекулой CD3,
образуя пре-TCR (рис. 3-11). Под действием ИЛ-7 запускается пролифера-
ция этих клеток, происходит так назваемая 0-селекция.
На стадии ДНЗ клетка делает выбор между а0- и у8-путями дифферен-
цировки. В эмбриональном тимусе развиваются преимущественно у8Т-
лимфоциты, которые быстро эмигрируют в периферические лимфоидные
органы. В тимусе взрослого организма у8Т-клетки составляют около 1%, а
а0Т-клетки (99%) продолжают дальнейшую дифференцировку.
На стадии ДН4 происходит одновременная экспрессия корецепторных
молекул CD4 и CD8 на поверхности клетки. Это обеспечивает переход
0-цепь
Рис. 3-11. Структура пре-Т-клеточного рецептора
Таблица 3-3. Основные стадии дифференцировки Т-лимфоцитов в тимусе
Зона тимуса Стадия дифференцировки Поверхностные маркеры клеток Процессы
Кортикомедуллярное соединение Ранний лимфоидный пред- шественник CD34*, CD38*, CD45RA*, CD7-, CD117 Миграция в тимус в зоне кортикомедуллярно- го соединения
Внутренний слой коры ДН1 (двойная негативная Т-клетка) CD44*. CD25, ИЛ7П\ CD34*, CD4, CD8 Пролиферация под действием фактора ство- ловых клеток
Наружный слой коры ДН2 (проТ) CD44\ CD25*. CD4, CD8 Пролиферация под действием ИЛ-7. Коммитированность Т-клеточной линии раз- вития
Наружный слой коры. Субкапсулярная зона ДНЗ (преТ) CD44. CD25*. CD4, CD8 Перестройка генов р-цепи. Экспрессия npeTCR. Выбор дифференцировки между apTCR и y8TCR
Субкапсулярная зона ДН4 CD44, CD25, CD4, CD8 Активация пролиферации
Кортикомедуллярное соединение ДП (двойная позитивная Т-клетка) CD4\ CD8*, TCR CD3*, CD69*, CD5\ CD27\ CD28- Перестройка V-гена а-цепи. Экспрессия TCR в комплексе с CD3. Экспрессия корецепторных молекул CD4, CD8. Положительная селекция. Отрицательная селекция
Медуллярная зона ОП (одинарная позитивная Т-клетка) CD4* или CD8+, CD62L*, CCR7*, рецептор SIP-1 Формирование субпопуляций CD4* или CD8*. Эмиграция в периферические лимфоидные органы
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ
С V9VLTJ
94 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
тимоцитов на стадию двойных позитивных (ДП) клеток. На этой стадии
происходит перестройка V-гена ос-цепи и сборка TCR, который затем экс-
прессируется на мембране в комплексе с молекулой CD3 и ^-цепями.
Двойные позитивные клетки имеют фенотип CD4+ CD8+ CD44 CD25
CD3+apTCR+. На этой стадии происходит положительная селекция тимо-
цитов во внутренней зоне коркового слоя тимуса с участием эпителиальных
клеток, экспрессирующих молекулы HLA класса I или II, но не экспресси-
рующие костимулирующие молекулы. Выживают и продолжают диффе-
ренцировку Т-лимфоциты с антигенраспознающими рецепторами средней
аффинности по отношению к аутологичным молекулам HLA. Экспрессия
TCR очень высокой или очень низкой аффинности к собственным HLA-
молекулам приводит к гибели Т-клеток путем апоптоза. Таких клеток
довольно много, и поэтому в тимусе один из самых высоких показателей
апоптоза в организме: погибает более 95% тимоцитов. Апоптотические
клетки не приносят вреда структурам тимуса, так как эффективно фаго-
цитируются местными макрофагами. В процессе положительной селек-
ции для дальнейшего развития отбираются Т-лимфоциты, способные
взаимодействовать со средней степенью аффинности с аутологичными
HLA-молекулами. Клетки, успешно прошедшие положительную селекцию,
имеют следующий фенотип: TCR-CD3+, CD69+ (молекула активации),
CD5+, CD27+ и CD28+ (костимулирующая молекула).
На этой стадии около 90% ДП-лимфоцитов погибают.
ДП клетки, прошедшие положительную селекцию, мигрируют в кортико-
медуллярную и медуллярную зону, где подвергаются отрицательной
селекции, суть которой заключается в элиминации аутоагрессивных кло-
нов Т-лимфоцитов. Взаимодействие тимоцитов с интердигитальными ДК,
макрофагами, медуллярными эпителиальными клетками, экспрессирую-
щими HLA-молекулы со встроенным аутологичным антигеном, вызывает
элиминацию аутоагрессивных Т-лимфоцитов. Доказано, что в тимусе экс-
прессируется большинство аутоантигенов (но не все). Клетки, не прошед-
шие отрицательную селекцию, подвергаются апоптозу и фагоцитируются
макрофагами. В результате отрицательной селекции погибает половина
клеток, прошедших положительную селекцию. Однако некоторые клоны
Т-лимфоцитов избегают отрицательной селекции и мигрируют в перифе-
рические лимфоидные органы. Состояние анергии, участие регуляторных
клеток и других механизмов препятствуют развитию аутоагрессии.
В медуллярной зоне тимуса параллельно с селекцией тимоцитов проис-
ходит формирование одинарных позитивных клеток (ОП): CD4+ или
CD8+.
В результате взаимодействия с ДК в медуллярной зоне тимуса двой-
ные позитивные клетки дифференцируются в CD3+ CD4+ a|JTCR+ или
CD3+ CD8+ aPTCR+ Т-лимфоциты. Т-клетки, имеющие сродство к молекулам
HLA класса I, экспрессируют СЭ8-корецептор и подвергаются дифференци-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 95
ровке в ЦТЛ, иногда обозначаемые как предшественники ЦТЛ, поскольку
эти Т-лимфоциты приобретают свойства эффекторных клеток на пери-
ферии после контакта с антигеном и клетками-помощниками. Подобные
изменения претерпевают также клетки, имеющие сродство к HLA класса
II и экспрессирующие корецептор CD4. В последние годы показано, что
экспрессия в клетках дифференцировочных факторов GATA-3 и Th-ROK
определяет дифференцировку по пути Th (CD4), а экспрессия Тох и Runx-3-
по пути CD8. После внутритимической дифференцировки CD4+ Т-клеток
на периферии формируется субпопуляция наивных ThO-клеток с более
разнообразными потенциальными возможностями дальнейшего развития,
чем у CD8+ Т-клеток. После эмиграции из тимуса и взаимодействия с АПК
наивные ThO-клетки, в зависимости от индуцирующих факторов (антиген,
природа АПК, цитокины), формируют пулы таких эффекторных клеток,
как ТЫ-, Th2-, ТЫ7-лимфоциты, индуцированные Т-регуляторные клетки
(Th3, Тг1) и др. (рис. 3-28). Развитие природных регуляторных Т-клеток в
тимусе имеет свои особенности и рассматривается в главе 5.
Таким образом, на разных этапах внутритимического развития тимоци-
ты проходят жесткий контроль на соответствие оптимальным требованиям
иммунокомпетентных клеток. Клеточные элементы коркового и медулляр-
ного слоев тимуса (эпителий стромы, ДК и др.), молекулярные структуры
(в первую очередь HLA классов I и II), а также растворимые медиаторы
(тимические гормоны, цитокины и др.) регулируют процессы селекции
тимоцитов. Полноценная структура, аффинитет, способность реагировать
с аутоантигенами и чужеродными антигенами определяют эффективность
селекции тимоцитов.
Дифференцированные Т-лимфоциты экспрессируют молекулы адге-
зии: L-селектин (CD62L) хемокиновый рецептор CCR7 и рецептор для
сфингозин-1-фосфата, определяющие эмиграцию клеток на периферию,
где происходит антиген-зависимый этап дифференцировки (иммуногенез).
В тимусе происходит формирование так называемых неклассических
субпопуляций Т-лимфоцитов NKT, у8Т (рис. 3.10). Свойства этих клеток
описаны в разделе 4.5.3.
Значение молекул HLA для развития Т-лимфоцитов можно продемон-
стрировать на примере иммунодефицитного синдрома «голых» лимфо-
цитов, когда нарушена экспрессия молекул HLA на поверхности клеток
организма. У больных нарушена дифференцировка CD8+ Т-клеток при
отсутствии молекул HLA класса I или CD4+ Т-клеток при отсутствии HLA
класса II (см. гл. 10).
В табл. 3-4 представлены некоторые молекулы, определяющие развитие
лимфоцитов. Мутации генов этих молекул и нарушение экспрессии соот-
ветствующих белков приводят к развитию различных форм иммунодефи-
цитов (см. гл. 10).
ГЛАВА 3
96 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Поверхностные маркеры
Костный
мозг
C-Kit CD25
Кровь
Перестройка
генов TCR
Тимус
Экспрес-
сия RAG-
генов
Кровь
Пери-
фериче-
ские
лимфо-
идные
органы
Рис. 3-12. Основные
ния см. в тексте).
стволовая клетка.
Лимфоидная
Миграция
CD44
Предшественник
Т-лимфоцитов
Vp-Dp-jp
CD8
Двойная
негативная
Т-клетка
Vp-Dp-JR
- и (
Va-Jp
Двойная
негативная CD3
Т-клетка
Двойная
позитивная
Т-клетка
CD4+
^Одинарные
позитивы
Миграция
CD8
CD4*
этапы дифференцировки Т-лимфоцитов
в
TCR-p
цепь
Pre-Ta
TCR-a
цепь
тимусе
CD4
и
CD8+
CD4
или
CD8
(поясне-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 97
ГЛАВА 3
Таблица 3-4. Некоторые молекулярно-генетические дефекты, приводящие к нарушению
дифференцировки и функций лимфоцитов [Кондратенко И.В., Бологов А.А., 2005].
Молекулы, повреждаемые в результате генетических дефектов Функции повреждаемых молекул
RAG1, RAG2 Активация рекомбинации генов иммуноглобулинов и Т-клеточ- ного рецептора, создание двунитевых разрывов ДНК
ARTEMIS V(D)J реаранжировка, репарация двунитевых разрывов ДНК
у-Цепь рецептора ИЛ-2 у-Цепь, общая для рецепторов ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15, важна для созревания и дифференцировки Т-лимфоцитов
JAK3 Киназа связана с у-цепью ИЛ-2, ИЛ-4, ИЛ-7, активация транс- крипционного фактора STAT (активация, пролиферация Т-лимфоцитов)
Рецептор ИЛ-7 Созревание и дифференцировка лимфоцитов
CD45 С045-тирозинфосфатаза участвует в проведении сигнала с TCR
Аденозиндезаминаза (АДА) Ферменты пуринового обмена, при мутации гена накапливаются АМТ, ГМФ, оказывающие токсическое влияние на лимфоциты
Пуриннуклеотидфосфорилаза (ПНФ) При отсутствии ПНФ накапливается дезоксигуанозинтрифос- фат, токсичный для Т-клеток
ZAP-70 ZAP-70 участвует в передаче сигнала с TCR при активации Т-лимфоцитов
CD25 а-Цепь рецептора ИЛ-2 участвует в активации лимфоцитов
CD3y у-Цепь СОЗ участвует в проведении активационного сигнала cTCR
CD3e
ТАР ТАР-1-, ТАР-2-транспортные белки, взаимодействующие с HLA класса I
CD40 Взаимодействие CD40-CD40L необходимо для переключения классов иммуноглобулинов с IgM
CD40L
Btk Брутоновская тирозинкиназа важна для развития В-клеток
Делеция гена тяжелых цепей иммуноглобулинов Необходимы для дифференцировки В-лимфоцитов
Индуцированная активацией цитидиндезаминаза (AID) Необходима для реализации соматической гипермутации генов иммуноглобулинов и переключения классов lg
NBS1 Nibrin и ATM необходимы для репарации двунитевых разрывов ДНК
ATM
WAS WAS — белок синдрома Вископа-Олдрича участвует в полиме- ризации актина и формировании цитоскелета лимфоцитов и тромбоцитов
ЧАСТЬ 1
98 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
3.2.1.3. ПРЕЗЕНТАЦИЯ АНТИГЕНА Т-ЛИМФОЦИТАМ. РОЛЬ МОЛЕКУЛ
ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ
Для понимания процессов презентации антигена и его распознавания
Т-лимфоцитами рассмотрим основные представления о главном ком-
плексе гистосовместимости (МНС) и его продуктах. Структура и функции
главного комплекса гистосовместимости человека представлены в главе 7.
Первоначально молекулы, кодируемые Н-2 системой мыши и HLA-системой
человека, рассматривались как антигенные структуры, ответственные за
тканевую несовместимость, и были охарактеризованы как антигены глав-
ного комплекса гистосовместимости (МНС; англ. Major Histocompatibility
Complex) или трансплантационные антигены. Системы Н-2 мыши и HLA
человека организованы сходным образом.
Позже выяснилось, что система МНС выполняет в организме важней-
шую функцию, связанную с презентацией чужеродных и собственных
антигенов иммунокомпетентным клеткам. Выделяют два основных класса
молекул главного комплекса гистосовместимости человека: HLA класса I и
HLA класса II (рис. 3-13). По структуре молекулы HLA — типичные глико-
протеины. Они локализуются на клеточной поверхности и обладают выра-
женным генетическим полиморфизмом. Их синтез контролируют гены
кластера HLA, которые подробно рассмотрены в главе 7.
Рис. 3-13. Строение молекул главного комплекса гистосовместимости I и II класса
[Chapel Н., 2006].
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 99
Молекулы HLA класса I состоят из двух полипептидных цепей: тяже-
лой а-цепи (45 кДа) и нековалентно связанной с ней легкой цепи, называе-
мой Р2-микроглобулином (12 кДа). Ген, кодирующий a-цепь, расположен в
комплексе HLA, а Р2-микроглобулин — на хромосоме 12. а-Цепь содержит
три внеклеточные (а1-, а2-, аЗ-), трансмембранный и цитоплазматический
домены (см. рис. 3-13). Индивидуальные различия в молекуле HLA класса
I обусловлены множественными аллельными вариантами a-цепи, тогда как
структура Р2-микроглобулина всегда постоянна. Методом рентгенокристал-
лографии установлено, что встраивание чужеродных коротких антиген-
ных пептидов (9-13 аминокислотных остатков) происходит между al- и
а2-доменами, образующими антигенсвязывающую бороздку, замкнутую с
обоих концов (см. рис. 3-10).
Строение молекулы HLA класса II отличается от строения молекулы
HLA класса I. В ее состав входят две цепи (а- и р-), различающиеся по
структуре и кодируемые разными генами HLA класса II. Наружные доме-
ны al и pi образуют антигенсвязывающую бороздку, открытую с обоих
концов, что позволяет связывать более длинные антигенные пептиды
(12-25 аминокислотных остатков). Специфичность взаимодействия TCR с
комплексом «пептид-HLA» определяет структура эпитопа антигена и ком-
плементарного для него гистотопа, расположенного в бороздке молекулы
HLA.
Молекулы HLA класса I находятся на поверхности всех ядросодержащих
клеток организма, тогда как молекулы HLA класса II экспрессируют глав-
ным образом АПК (ДК, макрофаги, В-клетки и др.) и некоторые негемопоэ-
тические клетки (эпителиальные клетки, эндотелий сосудов и др.). ИФН-у
стимулирует экспрессию молекул HLA класса II на клетках щитовидной
железы, эпителия, эндотелия и на других клетках, что играет важную роль
в патогенезе воспалительных и аутоиммунных заболеваний.
На некоторых клетках (например, на Т-лимфоцитах) молекулы HLA
класса II появляются только в ответ на активацию. Клетки трофобласта
человека лишены молекул HLA-A и HLA-В, однако экспрессируют дру-
гие молекулы HLA класса I (HLA-G, HLA-Е), ингибирующие активность
NK-клеток.
В представлении антигена Т-клеткам выделяют следующие этапы:
• ферментативную переработку экзогенных и эндогенных анитигенов до
коротких антигенных пептидов;
• синтез молекул HLA в эндоплазматическом ретикулуме клетки;
• образование комплекса «антигенный пептид-молекула HLA» (встра-
ивание антигенного пептида в бороздку синтезированной HLA-
молекулы);
• транспорт образовавшегося комплекса на клеточную мембрану;
• презентация антигенного пептида Т-лимфоцитам.
ГЛАВА 3
100 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Многоэтапный процесс сборки комплекса «пептид-HLA» происходит
в особых цитоплазматических зонах клетки и называется процессингом
антигена. Механизмы и пути презентации эндогенных и экзогенных анти-
генов различны и схематично представлены на рис. 3-14 и рис. 3-15.
Процессы переработки и презентации антигенных пептидов в комплексе
с молекулами HLA различаются в зависимости от происхождения и приро-
ды антигенов: эндогенных (вирусы, внутриклеточные бактерии, опухоли, в
том числе аутоантигены, и др.) и экзогенных (микроорганизмы, токсины,
аллергены, разнообразные белки и др.).
Эндогенные антигены после ферментативной деградации в протеасо-
ме транспортируются в эндоплазматический ретикулум с участием пере-
носчиков ТАР-1 и ТАР-2, где образуют комплекс с молекулой HLA класса
I, синтезируемой в ретикулуме. Затем комплекс с помощью транспортной
системы аппарата Гольджи транспортируется на клеточную поверхность
АПК и презентируется CD8+ Т-лимфоцитам (рис. 3-14).
Экзогенные пептиды презентируются в комплексе с молекулами HLA
класса II. В эндоплазматическом ретикулуме синтезируются молекулы HLA
класса И, которые вначале стабилизируются с помощью шаперона калнек-
сина, а затем с помощью инвариантной цепи. Фрагмент этой цепи CLIP
встраивается в бороздку молекулы HLA класса И. Везикулы, содержащие
такие молекулы HLA (без антигенного пептида), сливаются с ранними
эндосомами или первичными лизосомами, которые содержат экзогенные
Рис. 3-14. Презентация эндогенных антигенов в комплексе с молекулами главного ком-
плекса гистосовместимости.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 101
белки. Эти белки вытесняют CLIP из молекулы HLA класса II. В кислой
среде при действии протеаз участки белков, не встроенные в бороздку,
отщепляются. Затем в составе везикул комплексы «HLA-11-антигенный
пептид» транспортируются на клеточную мембрану и презентируются
CD4+ Т-лимфоцитам (рис. 3-15).
Эффективность взаимодействия Т-клеток с АПК увеличивается при-
мерно в 100 раз за счет связывания корецепторов CD8 и CD4 с молекулами
HLA класса I и II соответственно. Молекула CD4, состоящая из четырех
иммуноглобулиновых доменов, взаимодействует с 02-доменом молекулы
HLA класса II (рис. 3-16).
Молекула CD8 состоит из гетерогенных а- и 0-цепей и взаимодействует
с аЗ-доменом молекулы HLA класса I (см. рис. 3-16). Молекулы CD4 и
CD8 стабилизируют взаимодействие АПК и Т-лимфоцита и участвуют в
передаче сигнала в клетку. Цитоплазматическая часть CD4 и CD8 связана с
тирозинкиназой Lek, запускающей активационный сигнал с TCR.
ГЛАВА 3
Рис. 3-15. Презентация экзогенных антигенов в комплексе с молекулами главного ком-
плекса гистосовместимости.
102 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Дендритная клетка
CD8 Т-клетка CD4 Т-клетка
Рис. 3-16. Взаимодействие корецепторов CD4 и CD8 с молекулами главного комплекса
гистосовместимости.
В процессе презентации антигена Т-лимфоцитам задействованы межкле-
точные контактные взаимодействия, участвующие в образовании молеку-
лярного иммунологического синапса, в пределах которого происходит
обмен сигналами для оптимизации начального этапа иммунной реакции.
Известно несколько типов межклеточных взаимодействий (рис. 3-17).
Важно, что полноценный набор межклеточных кооперативных взаимодей-
ствий реализуется только после формирования комплекса «HLA-пептид-
TCR». Наиболее существенны следующие варианты взаимодействий:
• адгезивные взаимодействия [CD2/CD58, LFA-l(CDlla/CD18)/ICAM-
1(CD54)], обеспечивающие тесный и стабильный контакт между АПК и
Т-лимфоцитом. Эти контакты не участвуют в костимуляции, но повыша-
ют эффективность других сигналов взаимодействующих клеток;
• корецепторные взаимодействия (CD28/CTLA-4 и CD80/86).
Т-лимфоцит получает сигнал от АПК, опосредованный молекулами
CD80 и CD86, которые взаимодействуют с молекулой CD28, посто-
янно экспрессируемой на Т-хелперах. Сигнал запускает активацию
Т-клетки. При максимальной активации Т-клетка начинает экспрес-
сировать молекулу CTLA-4 (CD152), оказывающую ингибирующую
функцию. При отсутствии костимулирующих сигналов развивается
анергия Т-лимфоцитов;
• взаимодействие CD40/CD40L играет важную роль в кооперации
В-лимфоцитов и Т-хелперов. Молекула CD40 постоянно экспрессиро-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 103
Клеточная мембрана
ГЛАВА 3
Клеточная мембрана
АПК
Молекулы HLA
i I или II класса
(LFA-3) CD58 Ь
(В7.1)СР8О~~>Г7
(В7.2) СР86~~> 2—^ > CD28
СР40 £ £ CP40L
или CD8_____
H)CD11a/CD18
Т-лимфоцит
Рис. 3-17. Молекулы, участвующие во взаимодействии Т-лимфоцита и антигенпрезенти-
рующей клетки (иммунологический синапс).
вана на поверхности В-клетки, тогда как ее лиганд (CD40L) появляется
на Т-клетках только в процессе межклеточного взаимодействия. В этом
случае сигнал, передаваемый В-лимфоциту через молекулу CD40, обес-
печивает переключение классов иммуноглобулинов, индуцирует про-
лиферацию и дифференцировку В-лимфоцитов в плазматические клет-
ки, синтезирующие IgG. В отсутствие взаимодействия CD40/CD40L
В-лимфоциты дифференцируются только в плазматические клетки,
продуцирующие IgM. Один из тяжелых ПИД (ranep-IgM-синдром),
связанный с мутацией гена CD40L, характеризуется высоким уровнем
циркулирующего IgM при отсутствии или глубоком дефиците имму-
ноглобулинов других классов. Сигналы от CD40/CD40L важны для
формирования В-клеток памяти и защиты клеток от апоптоза. Нужно
отметить, что реализация сигналов от CD40/CD40L важна для коопе-
рации Т-клеток не только с В-лимфоцитами, но и с другими типами
АПК. При взаимодействии АПК с Т-лимфоцитом возрастает экспрес-
сия CD80 на АПК и индуцируется секреция ими цитокинов, что в итоге
также способствует активации Т-лимфоцитов;
• медиаторные (цитокиновые) сигналы между взаимодействую-
щими клетками играют важную регуляторную роль и рассмотрены в
главе 4.
Таким образом, при распознавании антигена между Т-лимфоцитом и
АПК образуется зона высокоупорядоченного взаимодействия молекул —
иммунологический синапс. Распознавание TCR комплекса «пептид-HLA» и
взаимодействие костимулирующих молекул индуцирует передачу сигнала.
104 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Вначале происходит активация тирозинкиназы семейства Src-Lck, свя-
занной с цитоплазматическими участками CD4 и CD8. Lek фосфорилирует
£-цепи комплекса CD3-TCR. Затем происходит присоединение и активация
тирозинкиназы ZAP-70 (^-associated protein-70). Активированная ZAP-70
катализирует активацию фосфолипазы С (PLCy), транспортируемой из
цитоплазмы в мембрану и расщепляющей фосфатидилинозитол-4,5-
бифосфат (Р1Р2) до диацилглицерола (DAG) и инозитолтрифосфата (1Р3).
DAG активирует протеинкиназу С, которая в свою очередь активирует
транскрипционный фактор NF-кВ. На рис. 3-18 представлена схема актива-
ции Т-лимфоцитов, состоящая в передаче сигналов от взаимодействующих
рецепторных молекул.
Молекула 1Р3 вызывает выход внутриклеточного Са2+ из депо в цитозоль
и активацию кальцийсвязывающих белков: кальмодулина и кальциневри-
на, активирующего NF-АТ (Nuclear Factor of Activated T-cells). В проведении
активационного сигнала участвуют малые G-белки, центральным из кото-
рых является RAS, взаимодействующий с гуанозинтрифосфатом (ГТФ). В
активированном состоянии RAS индуцирует каскад MAP-киназ (Mitogen-
Activated Protein kinase). Эти киназы в ядре активируют транскрипцию генов
c-Fox и c-Jun. Продукты их димеризуются и выступают в роли фактора
транскрипции АР-1, который, взаимодействуя с NF-АТ, индуцирует транс-
крипцию генов ИЛ-2 и рецептора ИЛ-2. ИЛ-2, взаимодействуя с рецепто-
ром, вызывает пролиферацию клона Т-лимфоцитов.
Презентацию антигена в иммунной системе осуществляют не толь-
ко классические молекулы главного комплекса гистосовместимости.
Презентация чужеродных и собственных липидных и гликолипидных
антигенов происходит с участием неклассических антигенсвязывающих
гликопротеинов CD1, для которых характерно отсутствие выраженной
полиморфное™ и независимость от TAP-белков. Молекула CD1 состоит из
тяжелой цепи (45-65 кДа) суперсемейства иммуноглобулинов, связанной
нековалентно с 02-микроглобулином. Специфические участки, ответствен-
ные за взаимодействие с лигандом, располагаются преимущественно на
V-домене. Семейство CD1 кодируется пятью неполиморфными генами на
хромосоме Iq22-q23. Изоформы CDla, CDlb, CDlc, CDld локализуются
на поверхности гемопоэтических и негемопоэтических клеток (тимоциты,
В-лимфоциты, миелоидные ДК, эпителий кишечника и др.). Молекулы
CD1 презентируют для распознавания специализированным субпопуля-
циям Т-лимфоцитов человека (арт-лимфоциты, уЗТ-клетки, NKT-клетки)
гликолипидные и липидные антигены (липиды микобактерий, главный
компонент стенки микобактерий: липоарабиноманнан, глицерофосфоли-
пиды, сфинголипиды, синтетические гидрофобные пептиды и др.). Многие
из этих липидных структур играют роль в патогенезе рака и аутоиммунных
заболеваний, при клеточной гибели и т.д. CD1 играет важную роль в раз-
витии Т-лимфоцитов.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 105
ГЛАВА 3
CD45 CD4
Рис. 3-18. Активация Т-клеток, трансдукция сигнала от Т-клеточного рецептора (из учеб-
ника Мейла Д. и др., 2007).
ЧАСТЬ 1
106 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
3.2.2. Особенности дифференцировки В-лимфоцитов
человека и распознавание антигенов
В-лимфоциты, как иммунокомпетентные клетки, с помощью BCR с высо-
кой эффективностью распознают чужеродные антигены и после взаимодей-
ствия с Т-хелперами дифференцируются в плазматические клетки, синтези-
рующие антитела, которые совпадают по специфичности с BCR. Гены BCR и
антител организованы сходно с генами TCR, однако существуют различия в
формировании их репертуара.
З.2.2.1. В-КЛЕТОЧНЫЙ РЕЦЕПТОР
В-лимфоциты, в отличие от Т-лимфоцитов, распознают антигены в
нативной форме с помощью клоноспецифичного антигенраспознающе-
го рецептора иммуноглобулиновой природы. Антигены, распознаваемые
В-клетками, презентируются высокоспециализированными ФДК, фикси-
рующими антиген чаще в форме иммунного комплекса. Важная роль в этом
процессе отводится рецепторам комплемента, через которые иммунный
комплекс фиксируется на соответствующих структурах ФДК. Молекулы
HLA в презентации антигена В-лимфоцитам не участвуют.
BCR-комплекс отличается от TCR-комплекса по структуре и числу
формирующих его субъединиц. Рецептор образован мономерной формой
иммуноглобулинов с коротким цитоплазматическим концом и корецептор-
ными молекулами, участвующими в трансдукции сигнала: Iga (CD79a) и
IgP (CD79b). Цитоплазматические концы Iga и IgfJ содержат мотивы ITAM
(рис. 3-19). Перекрестное связывание поверхностных BCR (антигеном или
антителами против иммуноглобулинов) приводит к активации киназ (Fyn,
Lyn, Btk и др.), участвующих в проведении активационного сигнала. Киназа
Lek соединяется с мотивами ITAM Iga и IgP и передает активационный
сигнал в ядро.
Активация В-лимфоцитов усиливается при участии дополнительных
корецепторных молекул, входящих в BCR-комплекс: CD21 (рецептор ком-
племента 2-го типа), CD19 и CD81. Антиген может дополнительно взаимо-
действовать с CD21 через фрагмент комплемента C3d, что, в свою очередь,
приводит к фосфорилированию цитоплазматической части CD19, Iga и IgP
и активации В-лимфоцита (рис. 3-20).
Этапы активации В-лимфоцитов аналогичны этапам, происходящим в
Т-лимфоците, различны лишь киназы семейства Src: у В-лимфоцитов они
представлены Fyn, а также Lyn и Blk. Проведение активационных сигналов
в В-лимфоците — необходимый процесс для пролиферации и дифферен-
цировки В-клеток. Об этом свидетельствует тот факт, что генетический
дефект в тирозинкиназе Btk (англ. Bruton tyrosine kinase) приводит к тяже-
лому иммунодефицитному синдрому (Х-сцепленная агаммаглобулинемия
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 107
ГЛАВА 3
Дисульфидная связь -
Рис. 3-19. Структура В-клеточного рецептора.
Брутона) практически с полным отсутствием у больного В-лимфоцитов и
иммуноглобулинов (см. раздел 11.2.2).
3.2.2.2. ЭТАПЫ ДИФФЕРЕНЦИРОВКИ В-ЛИМФОЦИТОВ
Дифференцировка В-лимфоцитов происходит в два этапа:
• антигеннезависимый (осуществляется в костном мозге):
• антигензависимый (происходит в В-зонах периферических лимфоид-
ных органов).
108 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Рис. 3-20. В-клеточный рецепторный комплекс.
В эмбриогенезе человека первые В-лимфоциты появляются в печени и
затем в костном мозге. После рождения В-клеточный иммунопоэз проис-
ходит в основном в костном мозге, где В2-лимфоциты проходят несколько
последовательных стадий: лимфоидная клетка-предшественник -> ранняя
про-В-клетка -> поздняя про-В-клетка -> большая пре-В-клетка -> малая
пре-В-клетка -> незрелая В-клетка -> зрелая В-клетка.
Подсчитано, что в итоге 1012 В-лимфоцитов и происходящих из них
плазматических клеток у человека синтезируют около 1020 молекул имму-
ноглобулинов (антител) в свободной и мембанной форме и большинство из
них находится в сыворотке.
В становлении В-клеток в костном мозге главную роль играет форми-
рование полноценного BCR. В процессе развития, дифференцировки и
функционирования судьба В-клетки определяется количеством и каче-
ством сигналов, получаемых через BCR. Так же, как в тимусе, в отношении
Т-лимфоцитов в костном мозге после стадии общего лимфоидного пред-
шественника запускается процесс перегруппировки генов иммуноглобу-
линов.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 109
Стадии дифферен- Процессы'''— Стволовая клетка Про-В-клетка Пре-В-клетка Незре- лая В- клетка Зрелая В клетка Активирован ная В-клетка В-клетка памяти Плазма- тическая клетка
ранняя ПОЗДНЯЯ большая малая
Перестройка генов тяжелых цепей DJ V-DJ VDJ
Перестройка генов легких цепей V-JVJ
RAG-1,2/ТсГГ
Суррогатная легкая цепь
Иммуноглобулин ц-цепь 1дм 1дМ |дм igD |дм IgG/lgA/lgE Секреторные 19
lg«. Ig|i
CD34
c-kit
CD43
CD45R
В220
МНС класс II -
CD19
CD20
CD40
Рис. 3-21. Дифференцировка В-лимфоцитов.
ГЛАВА 3
Легкие и тяжелые цепи иммуноглобулинов кодируются генами, рас-
положенными на разных хромосомах (см. рис. 3-23). Гены, кодирующие
тяжелую цепь, находятся на хромосоме 14 и включают большую группу
V-генов (с V-, D- и J-сегментами) и С-гены (кодируют константые домены
молекулы иммуноглобулина). Гены, кодирующие легкую цепь к, картиро-
ваны на хромосоме 2, гены легкой цепи I картированы на хромосоме 22.
Перестройка генов иммуноглобулинов происходит аналогично перестройке
генов TCR (рис. 3-22).
В стадии ранней про-В-клетки экспрессируются гены, активирующие
рекомбинацию (RAG1 и RAG2), и происходит перегруппировка генов тяже-
лых цепей BCR. Эта стадия характеризуется синтезом ц-цепей и их перво-
начальным появлением в цитоплазме клетки (цитоплазматическая ц-цепь),
а затем на ее мембране (мембранная ц-цепь) в форме пре-В-клеточного
рецептора, состоящего из полноценной ц-цепи и суррогатной легкой цепи,
лишенной V-региона. Суррогатная цепь состоит из двух полипепитдов, обо-
значаемых как А5 (CD179b) и V-пре-В (CD179a). Подобного рода npe-TCR
формируется при развитии Т-лимфоцитов.
У человека выявлена мутация гена CD179b, приводящая к нарушению
развития В-клеток и развитию синдрома агаммаглобулинемии. При отсут-
ствии Х5-цепи нарушается дифференцировка про-В-клеток до стадии пре-
В-лимфоцитов. По мере созревания В-клеток экспрессия генов CD 179а и
CD179b заканчивается.
110 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Рис. 3-22. Внефолликулярный и фолликулярный путь дифференцировки В-лимфоцитов:
СВ — центробласт; СС — центроцит; ФДК — фолликулярная дендритная клетка;
АПК — антигенпрезентирующая клетка; Tfh — фолликулярные Т-хелперы (Linterman М.,
Vinuesa С., 2010).
Важную роль в развитии и функционировании BCR играют субъедини-
цы Iga (CD79a) и IgP (CD79b). Обе субъединицы появляются на поверх-
ности клетки до экспрессии тяжелой p-цепи. Iga и IgP, помимо внекле-
точного и трансмембранного домена, имеют цитоплазматический домен с
консервативным мотивом ITAM. Эти субъединицы связаны между собой
дисульфидной связью (между цистеинами, расположенными во внекле-
точных доменах) в гетеродимеры. Два таких гетеродимера осуществляют
трансдукцию сигнала.
Известны иммунодефициты, в патогенезе которых важную роль играет
дефект генов, кодирующих данные субъединицы. Нулевая мутация Iga
приводит к полной блокаде дифференцировки В-лимфоцитов со стадии
про-В-клеток до стадии пре-В-лимфоцитов. Важно, что последователь-
ность экспрессии и сборки BCR определяет различные стадии развития
В-клеток. В отсутствие экспрессии пре-BCR невозможен переход про-В-
клеток в пре-В-клетки. Такие клетки подвергаются апоптозу. Появление
пре-В-рецептора на мембране клетки сопровождается инактивацией генов
RAG и интенсивной клеточной пролиферацией.
При переходе про-В-клеток в пре-В-клетки Iga-IgP-гетеродимер уча-
ствует в запуске аллельного исключения, клонального расширения и пере-
группировки генов легкой цепи. В стадии пре-В-клетки вновь экспресси-
руются гены RAG1 и RAG2, что необходимо для перестройки генов легкой
цепи и окончательного формирования BCR.
После перестройки генов легкой цепи на В-клетке экспрессируется
полноценный BCR, содержащий легкую (к- или Х-) цепь, ц-цепь и Iga-Igp-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 111
гетеродимер. Эту стадию развития называют незрелым В-лимфоцитом.
IgM+ В-клетки наиболее чувствительны к развитию толерантности.
В последней стадии развития В-лимфоцита появляется дополнительная
экспрессия IgD. Перед экспрессией IgD происходит выбраковка ауто-
агрессивных клонов В-лимфоцитов, взаимодействующих с высоким
аффиннитетом с аутоантигенами. Этот механизм называется делецией
аутоагрессивных клонов. Зрелые В-лимфоциты с полноценным анти-
генраспознающим BCR покидают костный мозг и мигрируют в перифери-
ческие органы иммунной системы, где распознают родственный антиген и
вступают в стадию В-клеточного иммуногенеза, заканчивающегося син-
тезом антител. Как таковые В-лимфоциты (подавляющее большинство) не
вырабатывают антител, но они служат предшественниками плазматических
клеток, выполняющих эту функцию.
Кроме BCR, в процессе дифференцировки В-клетки экспрессируются
другие молекулы, необходимые для полноценного распознавания антигена
и взаимодействия с другими клетками (см. рис. 3-22).
Дальнейшая дифференцировка В-лимфоцитов зависит от того, мигри-
руют ли клетки в герминативные центры или в перифоликулярное про-
странство лимфатического узла. В-лимфоциты, не экспрессирующие
хемокиновый рецептор CXCR5, остаются в перифоликулярном простран-
стве, потом перемещаются в мякотные шнуры и дифференцируются в
короткоживущие плазматические клетки, синтезирующие IgM. Их взаи-
модействие с Т-лимфоцитами минимальное (рис. 3-23). CXR5+ В-клетки,
получив сигнал от Т-лимфоцитов в перифоликулярном пространстве,
мигрируют затем в темную базальную зону герминативного центра, где
они трансформируются в центробласты и активно делятся. Одновременно
с делением происходит переключение изотипов тяжелых цепей имму-
ноглобулинов. Важную роль в этом процессе играют костимулирующие
молекулы CD40 и ICOS.
В пролиферирующих центробластах происходит дополнительный про-
цесс формирования разнообразия антител в результате сомати-
ческой гипермутации в уже перестроенных V-генах иммуногобу-
линов. Суть соматической гипермутации заключается в возникновении
точечных мутаций в V-областях генов иммуноглобулинов. В гипермута-
ции участвует ферментиндуцированная активацией цитидиндезаминаза
(AID; англ, activation — inducedcytidinedeaminase), заменяющая основание
цитидин на урацил в молекуле ДНК. Этот фермент экспрессируется при
взаимодействии CD40-CD40L. При дефиците AID нарушено переключе-
ние класса иммуноглобулинов, что сопровождается развитием тяжелого
иммунодефицита (подраздел 11.2.2.3).
Затем центробласты мигрируют в светлую зону герминативного центра,
где перестают делиться и превращаются в центроциты. Происходит отбор
ГЛАВА 3
112 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Герминативный центр
Пролиферация Выживание
Гипермутация генов lg Переключение изотипа
Рис. 3-23. Межклеточные взаимодействия В-лимфоцитов в герминативном центре.
центроцитов, экспрессирующих BCR с наибольшим сродством к антиге-
ну. При этом В-центроциты взаимодействуют с ФДК, представляющими
длительное время на своей поверхности через Fc-рецептор комплексы
антиген-антитело. В-центроциты, не связавшие антиген из-за низкой
аффинности BKR, подвергаются апоптозу. Другой сигнал, поддержи-
вающий жизнеспособность и дальнейшую дифференцировку, получают
В-лимфоциты при взаимодействии с фолликулярными Т-хелперами.
Важным сигналом для В-лимфоцита является взаимодействие молекул
CD40-CD154 и ИЛ-21. В апикальной зоне фолликула В-лимфоциты
делятся и превращаются в плазмоциты и В-клетки памяти (рис. 3-23).
Цитокины участвуют во всех этапах дифференцировки В-лимфоцитов, в
том числе в переключении изотипов иммуноглобулинов (рис. 3-24).
Конечная стадия дифференцировки В-лимфоцита — плазматическая
клетка. На мембране плазматической клетки не экспрессируются иммуно-
глобулиновые рецепторы, HLA класса II и другие молекулы, характерные
для В-лимфоцитов. Плазмоциты активно синтезируют и секретируют
антитела. Первые плазматические клетки расположены в мякотных шну-
рах лимфатического узла. Они секретируют антитела, которые фиксиру-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 113
ГЛАВА 3
Цитокины,
регулирующие
пролиферацию:
ИЛ-2, ИЛ-4, ИЛ-5
Плазматические клетки
ИФН-у
lgG2a
lgG3
Пролиферирующие
В-лимфоциты
ИЛ-2,
ИЛ-4,
ИЛ-5
Активированный
В-лимфоцит
ИЛ-4
Цитокины, регулирующие
дифференцировку: ИЛ-2,
ИЛ-4, ИЛ-5, ИФН-у, ТФР-0
igE
igGi
ИЛ-2,
ИЛ-4,
ИЛ-5
ТФР-В
lgG2b
Рис. 3-24. Цитокины участвуют в процессах пролиферации, дифференцировки В-лим-
фоцитов и переключении классов иммуноглобулинов (из учебника Goldsby R.A., 2003).
ются на Fc-рецепторах фолликулярных ДК. По мере развития иммунного
ответа плазматические клетки мигрируют из лимфатических узлов в
lamina propria, костный мозг и др. Помимо дифференцировки в плазма-
тические клетки, В-лимфоциты формируют пул долгоживущих В-клеток
памяти.
Важнейшее событие в поддержании гомеостаза В-лимфоцитов — нега-
тивная и позитивная селекция, приводящая к элиминации аутореак-
тивных В-клеток в костном мозге. Уклонение В-клеток от негативной
селекции связывают с формированием аутоиммунной патологии. При
распознавании аутоантигена на периферии предполагается осуществление
по крайней мере трех различных механизмов индукции толерантности:
редактирование рецептора, клональная или периферическая делеция и
анергия.
ЧАСТЬ 1
114 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
3.3. СИСТЕМА ЦИТОКИНОВ
Цитокины в настоящее время рассматриваются как белково-пептидные
молекулы, продуцируемые различными клетками организма и участвую-
щие в межклеточных и межсистемных взаимодействиях. Цитокины — уни-
версальные регуляторы жизненного цикла клеток, контролирующие про-
цессы их дифференцировки, пролиферации, функциональной активности
и апоптоза. Термином «иммуноцитокины» обозначают класс растворимых
пептидных медиаторов иммунной системы, необходимых для ее развития,
функционирования и взаимодействия с другими системами организма
[Ковальчук Л.В. и др., 1999].
Являясь регуляторными молекулами, цитокины играют важную роль
в осуществлении реакций врожденного и адаптивного иммунитета, обес-
печивают их взаимосвязь, а также контролируют гемопоэз, воспаление,
заживление ран, образование новых кровеносных сосудов (ангиогенез) и
многие другие процессы.
3.3.1. Цитокины: свойства, рецепторы, клетки-продуценты
В настоящее время существует несколько различных классификаций
цитокинов, основанных на их строении, функциональной активности, про-
исхождении, типе цитокиновых рецепторов. Традиционно исходя из био-
логических эффектов принято выделять несколько групп цитокинов.
• Интерлейкины (ИЛ-1-ИЛ-34) — секреторные регуляторные белки
иммунной системы, обеспечивающие внутрисистемные медиаторные
взаимодействия и связь иммунной системы с другими системами орга-
низма. Среди интерлейкинов на основе функциональной активности
выделяют провосполительные цитокины, ростовые факторы лимфо-
цитов, регуляторные цитокины.
• Интерфероны — противовирусные агенты с выраженным иммуноре-
гуляторным действием [интерфероны типа I — а, р, 8, к, G5, т; интерфе-
роны типа II — у и группа интерфероноподобных цитокинов, ИЛ-28А
(ИФН-Х2), ИЛ-28В (ИФН-ХЗ) и ИЛ-29 (ИФН-ХЗ)].
• Факторы некроза опухоли — цитокины с цитотоксическим и регуля-
торным действием: ФНО-а и лимфотоксины (ЛТ).
• Факторы роста гемопоэтических клеток — фактор роста стволо-
вых клеток (c-Kit-лиганд, ИЛ-3, ИЛ-7, ИЛ-11, эритропоэтин, тромбо-
поэтин, ГМ-КСФ, Г-КСФ, М-КСФ).
• Хемокины [СС, СХС (ИЛ-8), СХЗС, С] — регуляторы хемотаксиса
различных типов клеток.
• Факторы роста — регуляторы роста, дифференцировки и функ-
циональной активности клеток различной тканевой принадлежности
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 115
(фактор роста фибробластов, фактор роста эндотелиальных клеток,
фактор роста эпидермиса) и трансформирующий фактор роста (ТФР).
Цитокины различаются по строению, биологической активности и другим
свойствам. Однако наряду с различиями цитокины обладают общими свой-
ствами, характерными для данного класса биорегуляторных молекул.
• Цитокины — это, как правило, гликозилированные полипептиды сред-
ней молекулярной массы (меньше 30 кДа).
• Цитокины вырабатываются клетками иммунной системы и некото-
рыми другими клетками в ответ на активирующий стимул (патогены,
антигены, цитокины и др.) и участвуют в реакциях врожденного и
адаптивного иммунитета, регулируя их силу и продолжительность.
Некоторые цитокины синтезируются конститутивно.
• Секреция цитокинов — непродолжительный процесс. Цитокины не
существуют в преформированном виде, а их синтез индуцибельный и
начинается всегда с транскрипции генов. Клетки вырабатывают цито-
кины в низкой концентрации (пикограммы).
• В большинстве случаев цитокины действуют кратковременно и на
клетки-мишени, находящиеся в непосредственной близости от проду-
цента. Основное место их активности — межклеточный синапс.
• Избыточность системы цитокинов проявляется в том, что каждый
тип клеток способен продуцировать несколько цитокинов и каждый
цитокин может секретироваться различными клетками.
• Помимо этого, для всех цитокинов характерна плейотропность или
полифункциональность действия. Так, проявление признаков воспале-
ния обусловлено действием ИЛ-1, ФНО-а, ИЛ-6, ИЛ-8. Дублирование
функций обеспечивает надежность работы системы цитокинов.
• Действие цитокинов на клетки-мишени опосредуется высокоспеци-
фичными высокоаффинными мембранными рецепторами, представ-
ляющими собой трансмембранные гликопротеины, которые состоят,
как правило, более чем из одной субъединицы. Внеклеточная часть
рецепторов отвечает за связывание цитокина. Существуют рецепторы,
устраняющие избыток цитокинов в патологическом очаге. Это так
называемые рецепторы-ловушки. Растворимые рецепторы являются
ферментативно отщепленным внеклеточным доменом мембранного
рецептора. Растворимые рецепторы способны нейтрализовать цитоки-
ны, а также участвовать в их транспорте в очаг воспаления и выведе-
нии их из организма.
Цитокины работают по принципу сети. Они могут действовать согла-
сованно. Многие функции, приписываемые первоначально одному цитоки-
ну, как оказалось, обусловлены согласованным действием нескольких цито-
кинов (синергизм действия). Примеры синергического взаимодействия
цитокинов — стимуляция воспалительных реакций ИЛ-1, ИЛ-6 и ФНО-а, а
также синтез IgE под действием ИЛ-4, ИЛ-5 и ИЛ-13.
ГЛАВА 3
116 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Одни цитокины способны индуцировать синтез других цитокинов
(каскад). Каскадность действия цитокинов необходима для развития
воспалительных и иммунных реакций. Способность одних цитокинов
усиливать или ослаблять образование других служит основой для важных
механизмов позитивной и негативной регуляции.
Действие цитокинов может быть антагонистическим: ИФН-у тормо-
зит выработку IgE В-лимфоцитами, при увеличении концентрации ФНО-а
происходит образование ИЛ-6, который может угнетать образование этого
медиатора воспаления.
Цитокиновая регуляция функций клеток-мишеней осуществляется по
аутокринному, паракринному или эндокринному механизму. Некоторые
цитокины (например, ИЛ-1, ИЛ-6, ФНО-а) могут обладать тремя механиз-
мами действия (рис. 3-25).
Ответ клеток на цитокины зависит от нескольких факторов: от типа кле-
ток и их исходной функциональной активности, локальной концентрации
цитокина, наличия других медиаторных молекул.
Таким образом, клетки-продуценты, цитокины и специфические для них
рецепторы на клетках-мишенях формируют единую медиаторную сеть.
Именно набор регуляторных пептидов, а не индивидуальные цитокины,
Аутокринный механизм регуляции
Паракринный механизм регуляции
Клетка-мишень
Эндокринный механизм регуляции
Клетка-мишень
Рис. 3-25. Типы цитокиновой регуляции клеток-мишеней.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 117
СИСТЕМА ЦИТОКИНОВ
ГЛАВА 3
Антагонисты рецепторов.
3. КЛЕТКА-МИШЕНЬ
1. КЛЕТКА-ПРОДУЦЕНТ
Индукторы
Растворимые рецепторы.
Антагонисты цитокинов
2. РАСТВОРИМЫЕ
ЦИТОКИНЫ
Пролиферация,
Цитокин цитотоксичность,
секреция
биологически
активных молекул
Рис. 3-26. Система цитокинов.
определяют окончательный ответ клетки. В настоящее время цитокины
рассматривают как универсальную систему регуляции на уровне целостного
организма, обеспечивающую развитие иммунных реакций.
В последние годы сложилось представление о системе цитокинов, объ-
единяющей:
• клетки-продуценты;
• растворимые цитокины и их антагонисты;
• клетки-мишени, экспрессирующие рецепторы цитокинов (рис. 3-26).
Такое представление о системе цитокинов особенно важно для клиниче-
ской практики.
Нарушения различных компонентов системы цитокинов приводят к раз-
витию многочисленных патологических процессов. В связи с этим выявле-
ние дефектов в данной системе важно для правильной постановки диагноза
и назначения адекватного лечения.
Вначале следует рассмотреть основные компоненты системы цитоки-
нов.
Клетки-продуценты цитокинов
I . Основную группу клеток-продуцентов цитокинов в адаптивном
иммунном ответе составляют Т-хелперы. Покоящиеся клетки не секрета-
118 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
руют цитокины. При распознавании антигена происходит взаимодействие
корецепторных молекул CD28 и CD80/86 (см. рис. 3-18). Т-лимфоциты
активируются, и индуцируется транскрипция генов цитокинов, трансляция
и секреция гликозилированных пептидов в межклеточное пространство.
Регулярно появляются сообщения о новых субпопуляциях Т-клеток,
происходящих из наивных ThO-лимфоцитов. На начало 2009 г. описаны
следующие субпопуляции CD4+ Т-лимфоцитов, происходящие из ThO-
клеток: Thl, Th2, Thl7, Tfh, Th9 (продуценты ИЛ-9), а также индуцирован-
ные регуляторные Т-клетки (iTreg) — Tri и Th3.
Исследования в течение почти 20 лет убедительно доказали, что после
развития в тимусе наивные CD4+ Т-клетки дифференцируются на перифе-
рии в эффекторные Thl- и ТЬ2-клетки. Дифференцированные Thl-клетки
вырабатывают ИФН-у, ИЛ-2, ИЛ-3, ФНО-а, -0, ГМ-КСФ, усиливающие
клеточно-опосредованный иммунный ответ с преимущественной цитоток-
сической направленностью (в частности, против внутриклеточных патоге-
нов и опухолей). Thl и секретируемые ими цитокины также участвуют в
развитии аутоиммунных процессов клеточного типа. Дифференцированные
ТЬ2-клетки вырабатывают типичные для них цитокины (ИЛ-4, -5, -6, -9,
-10, -13, -21, -23, -3, ГМ-КСФ), усиливающие гуморальный иммунный
ответ и участвующие в аллергических реакциях, противогельминтном отве-
те, гуморальных аутоиммунных процессах. Цитокины ТЫ и Th2 негативно
регулируют активность Th, их продуцирующих. ИЛ-4 и ИЛ-10 подавляют
функцию Thl. ИФН-у угнетает биологические эффекты, вызываемые ИЛ-4,
и его образование ТЬ2-клетками.
Выбор пути дифференцировки между Thl и Th2 определяется природой
антигена, типом ДК в тканях, действием ИЛ-12 или ИЛ-4, регулирующих
белки STAT4 и STAT6 соответственно. Под влиянием бактериальных,
вирусных агентов и сигналов опасности активируются TLR, индуцирующие
синтез ИЛ-12 ДК, что в дальнейшем активирует STAT4 и транскрипцион-
ный фактор T-bet, который запускает Thl-ответ лимфоцитов (рис. 3-27).
В ряде случаев (при СПИДе, туберкулезе, малярии, вирусных инфекциях,
при действии ингибиторов: ИЛ-10, простагландина Е2 глюкокортикоидов,
витамина D3) нарушается образование ИЛ-12. ТЬ2-клетки дифференци-
руются главным образом при действии ИЛ-4, который может синтезиро-
ваться тучными клетками и базофилами в ответ на проникновение аллер-
генов. Сам ИЛ-4 является аутокринным фактором роста ТЬ2-лимфоцитов.
Дифференцировка ТЬ2-клеток находится под контролем STAT6 и транс-
крипционного фактора GATA-3.
Недавно обнаружена отдельная линия эффекторных Т-хелперов, селек-
тивно вырабатывающих ИЛ-17. Они участвуют в регуляции воспаления
и аутоиммунных реакций. Клетки получили название ТЫ7-лимфоцитов.
Развитие ТЫ7 СП4+-клеток из наивных предшественников направляет
ИЛ-10 и ИЛ-23; на дифференцировку ТЫ7 у человека ТФР-0 непосред-
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 119
ИЛ-17
ГЛАВА 3
[H.G. Kingston, 2008, с изменениями]
Рис. 3-27. Различные субпопуляции Т-хелперов, продуцирующие цитокины.
ственно не влияет [Annunziato F. и др., 2008]. ИЛ-17 содержится вместе с
ИЛ-22 в ТЫ7-клетках. Для ТЫ7-клеток характерна экспрессия фактора
транскрипции RORyt (см. рис. 3-27). Развитие ТЬ17-клеток отличается от
дифференцировки Т-регуляторных клеток.
CD4+ Tfh-клетки (T-follicular helper) выполняют хелперную функцию
в отношении В-клеток и служат одной из наиболее многочисленных и
важных субпопуляций эффекторных Т-клеток во вторичных лимфоид-
120 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
ных тканях. Основные отличительные признаки Tfh-клеток — экспрессия
рецептора хемокинов CXCR5 (лиганд CXCL13) и молекул ICOS, мигра-
ция и локализация в В-клеточных фолликулах, осуществление помощи
В-клеткам. Tfh-лимфоциты вырабатывают «хелперный» цитокин ИЛ-21,
стимулирующий развитие В-клеток в антителопродуценты (плазмоциты).
Таким образом, многочисленные субпопуляции CD4+ Т-клеток крайне
важны в запуске и поддержании иммунного ответа. Нарушение функции
тех или иных субпопуляций Т-хелперов лежит в основе практически всех
патологий иммунной системы, включая иммунодефициты, аутоиммунные
и аллергические заболевания, ВИЧ-инфекцию и др.
Кроме того, Т-лимфоциты в тимусе могут дифференцироваться в есте-
ственные регуляторные Т-клетки (Treg), экспрессирующие поверхностные
маркеры CD4+, CD25+ и транскрипционный фактор FOXP3. Эти клетки
способны подавлять иммунный ответ, опосредуемый ТЫ- и ТЬ2-клетками
путем прямого межклеточного контакта и синтеза ТФР-0 и ИЛ-10.
ЦТЛ (CD8+), В-лимфоциты, естественные киллеры — слабые продуцен-
ты цитокинов.
I I. Во врожденном иммунитете основными продуцентами цитоки-
нов служат клетки миелоидного ряда. С помощью PRR они распознают
молекулярные структуры различных патогенов (РАМР), такие, как ЛПС
грамотрицательных бактерий, липотейхоевые кислоты, пептидогликаны
грамположительных бактерий, флагеллин, богатая неметилированными
CpG-повторами ДНК и др. В результате такого распознавания запускается
внутриклеточный сигнальный каскад, приводящий к экспрессии генов двух
основных групп цитокинов — провоспалительных и интерферонов типа I
(см. рис. 3-4). Главным образом, эти цитокины (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12,
ФНО-а, ГМ-КСФ, ИФН, хемокины и др.) индуцируют развитие воспаления
и участвуют в защите организма от бактериальных и вирусных инфекций.
I II. Клетки, не относящиеся к иммунной системе. Клетки соеди-
нительной ткани, эпителия, эндотелия спонтанно (без антигенной стиму-
ляции) конститутивно секретируют аутокринные факторы роста (фактор
роста фибробластов, эпителиальный фактор роста, ТФР-р и др.) и цитоки-
ны, поддерживающие пролиферацию гемопоэтических клеток.
Цитокины и их антагонисты
Избыточная экспрессия цитокинов небезопасна для организма и может
привести к развитию чрезмерной воспалительной реакции, острофазного
ответа. В регуляцию выработки провоспалительных цитокинов вовлечены
различные ингибиторы. Так, для ИЛ-1 описан ряд молекул, неспецифиче-
ски связывающих цитокин и препятствующих проявлению его биологиче-
ского действия (а2-макроглобулин, компонент комплемента СЗ, уромоду-
лин). Специфическими ингибиторами ИЛ-1 могут выступать растворимые
рецепторы-ловушки, антитела и рецепторный антагонист ИЛ-1 (ИЛ-1РА).
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 121
При развитии воспаления происходит усиление экспрессии гена, кодирую-
щего ИЛ-1РА. Однако и в норме этот антагонист присутствует в циркуля-
ции в высокой концентрации (до 1 нг/мл и больше), блокируя действие
эндогенного ИЛ-1.
Клетки-мишени
Действие цитокинов на клетки-мишени опосредовано через специфиче-
ские рецепторы, связывающие цитокины с очень высокой аффинностью,
причем отдельные цитокины могут использовать общие субъединицы
рецепторов. Каждый цитокин взаимодействует со своим специфическим
рецептором.
Рецепторы цитокинов — трансмембранные белки, их можно разделить
на 5 основных типов. Наиболее распространен первый тип рецепторов, так
называемый гемопоэтиновый. Гемопоэтиновые рецепторы имеют два вне-
клеточных домена, один из которых содержит общую последовательность
аминокислотных остатков, который состоит из двух повторов триптофана
и серина, разделенных любой аминокислотой (WSXWS-мотив). Второй тип
рецепторов может иметь два внеклеточных домена с большим количеством
консервативных цистеинов. Это рецепторы семейства ИЛ-10 и интерфе-
ронов. Оба рецептора относятся ко второму типу. Третий тип представлен
рецепторами цитокинов, относящихся к группе фактора некроза опухоли.
Четвертый тип рецепторов цитокинов относится к суперсемейству имму-
ноглобулиновых рецепторов, имеющих внеклеточные домены, сходные по
строению с доменами молекул иммуноглобулинов (например, ИЛ-1 рецеп-
тор). Наконец, пятый тип рецепторов, связывающих молекулы семейства
хемокинов, представлен трансмембранными белками, семикратно про-
низывающими клеточную мембрану (рис. 3-28). Рецепторы цитокинов
могут существовать в растворимой форме, сохраняя способность связывать
лиганды. На рис. 3-28 представлены некоторые рецепторы для цитокинов.
Связывание цитокина с рецептором вызывает его димеризацию, что при-
водит к фосфорилированию и активации Jak-киназы, которая способствует
фосфорелированию и последующей димеризации STAT-киназы. STAT-
киназа связывается с промоторным участком генов цитокинов и индуциру-
ет их экспрессию.
Цитокины могут влиять на пролиферацию, дифференцировку, функ-
циональную активность и апоптоз клеток-мишеней [Кетлинский С.А.,
Симбирцев А.С., 2008]. Существует несколько вариантов проявления био-
логической активности цитокинов в клетках-мишенях в зависимости от уча-
стия различных внутриклеточных систем в передаче сигнала от рецептора. В
проведении сигнала к апоптозу участвует специфический домен рецепторов
группы фактора некроза опухоли — так называемый домен смерти {death
domain) (см. рис. 3-30; подробно этот процесс описан в разделах 4.2 и 6).
ГЛАВА 3
ЧАСТЬ 1
Фактор роста
ИЛ-1 рецептор ТФР-р рецептор Рецептор Рецепторы Рецепторы Рецепторы
фактора роста гемопоэтина семейства ФИО хемокинов
Рис. 3-28. Рецепторы цитокинов (из учебника A.L. DeFranco, 2007).
122 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 123
Дифференцировочные сигналы передаются с участием внутриклеточных
белков семейства STAT (сигнальные трансдукторы и активаторы транс-
крипции; рис. 3-29). В передаче сигнала от хемокиновых рецепторов уча-
ствуют G-белки (ГТФ-связывающие сигнальные белки), что приводит к
усилению миграции и адгезии клеток.
Обобщенное действие цитокинов, секретируемых ТЫ- и ТЬ2-лимфо-
цитами, на различные клетки-мишени представлено на рис. 3-32 и 3-33.
Многочисленные эффекты Thl-клеток опосредуются плейотропным дей-
ствием ИФН-у. ИФН-у усиливает фагоцитоз, микробицидную активность
макрофагов, выработку ими провоспалительных цитокинов, усиливает
процессинг и презентацию антигенов макрофагами и ДК. ИФН-у индуци-
рует активацию NK-клеток, созревание ЦТЛ и опсонизацию внеклеточных
патогенов с помощью IgG, синтез которых усиливается при действии этого
цитокина на В-лимфоциты (см. рис. 3-31).
Одно из основных биологических свойств ИЛ-4 и ИЛ-13, секретируемых
Th2, — их способность стимулировать пролиферацию активированных
антигеном В-лимфоцитов. Механизм действия ИЛ-4 связан с переклю-
чением синтеза изотипов иммуноглобулинов с IgM на IgE и IgG4. Этот
цитокин служит фактором роста для базофилов, тучных клеток и эозино-
филов. ИЛ-4 и ИЛ-13 участвуют в иммунопатогенезе многих аллергических
ГЛАВА 3
ЦИТОКИН
Экспрес-
сия гена
Ядро
//
Рис. 3-29. Jak-STAT-сигнальный путь проведения сигнала с гемопоэтиновых рецепторов
цитокинов.
124 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Здоровая
клетка
ФНО-а
Инфицированная
клетка
Активация
МАР-киназ
Активация апоптоза
через каскад каспаз
Рис. 3-30. Передача сигнала с рецептора фактора некроза опухоли.
заболеваний человека. ИЛ-5 — главный цитокин, отвечающий за развитие
эозинофилии. ИЛ-4, ИЛ-5 и в основном ИЛ-13 играют заметную роль в
патогенезе астмы. Избыточное образование ИЛ-4 и ИЛ-13 может вызвать
серьезные патологические изменения в тканях при паразитарных инфекци-
ях (шистосомозе и др.).
ИЛ-4 и ИЛ-13 вызывают альтернативную активацию макрофагов, инду-
цируя экспрессию маннозного рецептора, дектина, хемокинов CCL17,
CCL18 и CCL22.
Другой цтокин ИЛ-9, секретируемый ТЬ2-лимфоцитами человека, дей-
ствует на кроветворные клетки-предшественники, преактивированные Т- и
В-лимфоциты. У мышей действие этого цитокина связано с пролиферацией
и дифференцировкой тучных клеток (см. рис. 3-33).
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 125
Активация
ГЛАВА 3
3.3.2. Цитокины и воспаление
В зависимости от воздействия на воспалительный процесс цитоки-
ны подразделяются на две группы — провоспалительные (ИЛ-1, ИЛ-6,
ИЛ-8, ФНО-а, ИЛ-12) и противовоспалительные (ИЛ-4, ИЛ-10, ТФР-р).
Основные типы клеток, участвующих в развитии местной воспали-
тельной реакции, — нейтрофилы, моноциты, макрофаги, а также клетки
эндотелия и фибробласты. Первыми на внедрение инфекционного агента
реагируют ДК и макрофаги.
Защита на местном уровне происходит за счет формирования типичной
воспалительной реакции с ее классическими проявлениями: развитием
126 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Th2
ИЛ-4/ИЛ-13
Альтернативная
активация макро-
фагов, выробатка
IgE плазматичес-
кими клетками,
активация эпите-
лиальных
и гладкомышеч-
ных клеток
ИЛ-5 ИЛ-З/ИЛ-9
Привлечение
и активация
эозинофилов,
выроботка IgA
плазмоцитами
Привлечение
и активация
тучных клеток
и базофилов
Базофил
Эозинофил
В-клетка
В-клетка
Тучная клетка
Эпителий
Гладкомышечная клетка
Рис. 3-32. Действие цитокинов, секретируемых Т112-клетками.
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 127
отека, покраснением, появлением болевого синдрома. Воспаление раз-
вивается в ответ на повреждение и проникновение в ткани патогенов при
участии провоспалительных цитокинов, синтезируемых в очаге воспаления
главным образом макрофагами, активированными компонентами клеточ-
ной стенки патогенов, а также в ответ на повреждение тканей. Цитокины
активируют эндотелий, что приводит к повышению проницаемости, уси-
лению экспрессии адгезивных молекул и прокоагулянтной активности.
При этом происходит выброс низкомолекулярных медиаторов воспаления
(гистаминов, простагландинов и др.), ответственных за развитие воспа-
лительной реакции в полной мере. Хемокины усиливают направленную
миграцию лейкоцитов в очаг воспаления и вместе с другими цитокинами
увеличивают их функциональную активность, направленную на элимина-
цию патогена: фагоцитоз и образование кислородных радикалов.
Одновременно провоспалительные цитокины активируют метаболизм
соединительной ткани, стимулируют пролиферацию фибробластов и кле-
ток эпителия, что чрезвычайно важно для заживления повреждений и
восстановления целостности ткани. Таким образом, на местном уровне
цитокины отвечают за все последовательные этапы развития адекватного
ответа на внедрение патогена, его локализацию и удаление, а затем — за
восстановление поврежденной структуры тканей.
«Узнавание» патогена макрофагами и нейтрофилами происходит при
участии TLR. Это один из возможных вариантов индукции воспалительно-
го процесса. В первые 24 ч в очаге воспаления преобладают нейтрофилы,
затем доминируют моноциты и макрофаги.
Под влиянием ИЛ-1 возрастает концентрация продуктов метаболизма
фосфолипидов (простагландины, тромбоксан и тромбоцитактивирующий
фактор) в клетках воспалительного экссудата. Это вызывает расширение
стенок кровеносных сосудов (вазодилатацию). В костном мозге возрастает
число гранулоцитов, рециркулирующих в зону воспаления. Нейтрофилы
из циркуляции поступают в очаг воспаления. С повышением локального
уровня ИЛ-1 усиливаются процессы дегрануляции.
Активированные макрофаги наряду с ИЛ-1 и ИЛ-8 вырабатывают также
ИЛ-6, ИЛ-12 и ФНО-а.
ФНО-а — важный провоспалительный цитокин. Под действием этого
фактора:
• увеличивается количество молекул агдезии на эндотелиальных клет-
ках сосудов, что способствует привлечению лейкоцитов в очаг вос-
паления;
• происходит активация клеток, участвующих в воспалительной реак-
ции;
• увеличивается количество молекул главного комплекса гистосовмести-
мости на поверхности инфицированных клеток, что способствует их
разрушению цитотоксическими клетками.
ГЛАВА 3
128 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
При контакте с микроорганизмами цитокины могут выделять и другие
клетки: NK-клетки и Т-лимфоциты — ИФН-у, базофилы — ИЛ-4.
При несостоятельности местной иммунной защиты развивается систем-
ная воспалительная реакция. При этом усиливается синтез цитокинов; они
попадают в циркуляцию и оказывают свое действие на системном уровне.
Начинается следующий этап воспаления — системная воспалительная
реакция или острофазовый ответ на системном уровне. В этом случае про-
воспалительные цитокины влияют почти на все органы и системы орга-
низма, вовлеченные в регуляцию гомеостаза. Действие провоспалительных
цитокинов на ЦНС снижает аппетит и изменяет поведенческие реакции,
которые становятся направлены на решение только одной задачи — на
борьбу с внедрившимся патогеном. Одно из первых проявлений системной
воспалительной реакции, связанное с действием цитокинов на терморе-
гуляторный центр гипоталамуса, заключается в повышении температуры
тела. Повышение температуры — одна из эффективных защитных реакций
организма, поскольку при повышенной температуре уменьшается способ-
ность ряда бактерий к размножению и, напротив, усиливается пролифера-
ция лимфоцитов.
В печени под влиянием цитокинов усиливается синтез белков острой
фазы и компонентов системы комплемента, необходимых для борьбы с
патогеном, однако одновременно ослабевает интенсивность синтеза аль-
бумина. Другой пример избирательного действия цитокинов — изменение
ионного состава плазмы крови при развитии системной воспалительной
реакции. При этом снижается уровень ионов железа, что угнетает пролифе-
рацию бактериальных клеток. С другой стороны, для нормальной работы
иммунной системы нужно увеличение уровня цинка (в частности, это необ-
ходимо для образования биологически активного сывороточного фактора
тимуса — одного из основных тимических гормонов, обеспечивающих
дифференцировку лимфоцитов).
Влияние цитокинов на кроветворную систему связано с существенной
активизацией гемопоэза. Увеличение количества лейкоцитов и их функцио-
нальной активности оправдано при элиминации патогена и восполнении
потерь нейтрофилов в очаге гнойного воспаления. Действие цитокинов на
систему свертывания крови направлено на усиление свертываемости, необ-
ходимое для остановки кровотечения и прямого блокирования патогена. В
иммунной системе цитокины осуществляют взаимосвязь между реакциями
врожденного и адаптивного иммунитета, координируя их активность при
уничтожении патогенов. Таким образом, на уровне организма цитокины
осуществляют связь между иммунной, нервной, эндокринной, кроветвор-
ной и другими системами и вовлекают их в формирование единой защит-
ной реакции и ее регуляцию.
Цитокины — система, формирующая и регулирующая весь комплекс
защитных реакций организма при внедрении патогенов. Гйперпродукция
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 129
цитокинов служит причиной развития ряда патологических состояний,
в частности септического шока. Появление цитокинов в кровотоке сразу
обусловливает увеличение синтеза глюкокортикоидов, причем ИЛ-1 и дру-
гие провоспалительные цитокины не только вызывают усиление синтеза
рилизинг-факторов, но и стимулируют образование гормонов клетками
коры надпочечников. Стероидные гормоны известны как одни из наиболее
сильных иммуносупрессоров. Они блокируют синтез цитокинов и не позво-
ляют их уровню превысить предельных значений. Это служит эффективным
механизмом отрицательной обратной связи для контроля гиперпродукции
цитокинов. Тем не менее в ряде случаев уровни цитокинов в крови превы-
шают физиологические концентрации. Цитокины в низких концентрациях
нужны для правильного формирования местного воспаления, более высо-
кие дозы вызывают развитие системной воспалительной реакции. Эффекты
провоспалительных цитокинов представлены на рис. 3-33.
ГЛАВА 3
Каскад провоспалительных цитокинов
ЛПС микро-
организмов
ИЛ-6, ИЛ-8
Низкие концентрации Средние концентрации Высокие концентрации
Локальное вопаление Системные эффекты Септический шок
Расширение сосудов, отек, гиперемия. Увеличение экспрессии молекул адгезии на эндотелии. Миграция нейтрофилов и моноцитов из крови в ткани. Активация фагоцитоза. Генерация активных форм кислорода и NO-радикалов макрофагами. Усиление синтеза простагландинов и других цитокинов. Активация Т- и В-лимфоцитов, NK-клеток Повышение температуры тела. Индукция синтеза гепатоцитами белков острой фазы. Повышение уровня глюкокортикоидов. Резорбция костной и хрящевой ткани. Изменение ионного состава плазмы крови (Fe2+|,Zn2+|,Cu2+f). Лейкоцитоз. Индукция прокоагулян- тной активности Тромбоз сосудов, гипогликемичес- кий шок
Рис. 3-33. Эффекты провоспалительных цитокинов в зависимости от их концентрации
[Ковальчук Л.В. и др., 2001].
130 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Следует отметить, что агрессивный воспалительный ответ организма-
хозяина при некоторых инфекционных заболеваниях представляет даже
бдлыпую проблему, чем сама инфекция. Так, у пациентов с молниенос-
ной грамотрицательной бактериальной инфекцией развивается тяжелое
клиническое состояние — сепсис, приводящий к септическому шоку с
полиорганной недостаточностью и высокой смертностью. В связи с этим
в лечении подобных заболеваний применяют препараты, направленные
на подавление действия цитокинов. Эти препараты могут угнетать синтез
или секрецию цитокинов, связываться с секретируемым цитокином, с его
рецептором на клетке-мишени или блокировать передачу сигнала с цито-
кинового рецептора.
В клинической практике используют: 1) рекомбинантные препараты
рецепторного антагониста ИЛ-1 (препарат арил); 2) рекомбинантные рас-
творимые рецепторы ФНО-RII (этанерцепт); 3) гуманизированные моно-
клональные антитела к ФНО-а (ремикейд, инфликсимаб).
На кефедре иммунологии ГОУ ВПО «РГМУ» разработана новая техно-
логия, получившая название персонифицированной иммунотерапии, осно-
ванная на локальном применении комплекса аутологичных цитокинов,
выделяемых из лейкоцитов пациента. Этот метод позволяет избежать раз-
вития побочных реакций и обладает высокой эффективностью в лечении
широкого спектра заболеваний, сопровождающихся воспалением, наруше-
нием репарации и развитием вторичного иммунодефицита.
Вопросы для самоконтроля
• В чем заключаются принципиальные различия стратегии распознава-
ния патогенов системой врожденного и адаптивного иммунитета?
• Охарактеризуйте основные рецепторы системы врожденного иммуни-
тета.
• Опишите строение антигенраспознающих рецепторов Т- и
В-лимфоцитов. Что общего в структуре этих рецепторов? Назовите
основные различия.
• Опишите строение TLR, их экспрессию на клетках иммунной системы.
• В чем состоят различия в экспрессии и проведении сигналов с TLR, рас-
познающих вирусные и бактериальные антигены?
• Какое клиническое значение имеет изучение системы TLR? Перечислите
возможные уровни дефектов в системе TLR.
• Каковы основные особенности распознавания антигенов Т- и
В-лимфоцитами?
• Опишите особенности презентации и распознавания бактериальных и
вирусных антигенов.
• Что такое иммунологический синапс?
РЕЦЕПТОРНЫЕ И МЕДИАТОРНЫЕ ВЗАИМОДЕЙСТВИЯ В ИММУННОЙ СИСТЕМЕ 131
Каковы основные этапы антигеннезависимой дифференцировки
Т-лимфоцитов в тимусе?
Опишите основные стадии дифференцировки В-лимфоцитов.
Дайте определение цитокинов. Охарактеризуйте их основные свой-
ства.
Сформулируйте представление о системе цитокинов. Укажите значе-
ние цитокинов для клинической иммунологии.
Охарактеризуйте основные клетки, продуцирующие цитокины.
Какую роль играют цитокины в воспалении?
Объясните роль цитокинов в патогенезе заболеваний. Цитокинзави-
симая патология.
ГЛАВА 3
Глава 4
Эффекторные механизмы
адаптивного и врожденного
иммунитета
В эффекторной стадии иммунного ответа происходит элиминация пато-
гена с помощью клеток-эффекторов или эффекторных молекул. Выделяют
два типа эффекторных механизмов адаптивного иммунного ответа: антите-
лозависимые и зависимые от Т-лимфоцитов (будут рассмотрены далее).
4.1. АНТИТЕЛА - ЭФФЕКТОРНЫЕ МОЛЕКУЛЫ
ГУМОРАЛЬНОГО ИММУНИТЕТА
Основные эффекторные молекулы адаптивного гуморального иммунно-
го ответа — молекулы иммуноглобулинов.
Структура и функция основных классов иммуноглобулинов
Структура иммуноглобулинов стала известна благодаря работам
Р. Портера и Г. Эдельмана. Р. Портер обработал препарат IgG кролика
ферментом папаином. В результате были получены три фрагмента, два из
которых имели одинаковую молекулярную массу (45 кДа) и связывали
антиген. Они были названы Fab (англ. Fragment antigen-binding). Третий
фрагмент (55 кДа) с постоянной структурой обладал способностью легко
кристаллизоваться и был назван Fc (англ. Fragment cristallizable). При дей-
ствии пепсина молекула иммуноглобулина расщепляется в другом месте с
образованием двух фрагментов: Fc-фрагмента и фрагмента (Fab)2, способ-
ного связывать две молекулы антигена.
Г. Эдельман, обработав молекулы антител меркаптоэтанолом, восста-
навливающим дисульфидные связи, вызвал диссоциацию этих молекул
на отдельные белковые цепи. На основании этих работ была предложена
принципиальная схема строения иммуноглобулинов (рис. 4-1).
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 133
Рис. 4-1. Схема структуры молекулы иммуноглобулина (IgG).
ГЛАВА 4
У человека выделяют пять классов иммуноглобулинов: IgM, IgG, IgA, IgD
и IgE. Иммуноглобулины разных классов имеют сходный план строения.
Структура иммуноглобулинов представлена на рис. 4-1.
Молекула иммуноглобулина состоит из четырех полипептидных цепей:
двух тяжелых (Н — heavy) цепей с молекулярной массой 100-120 кДа и
двух легких (L — light) цепей с молекулярной массой 50-60 кДа. Эти цепи
объединены в молекулу за счет ковалентных межцепочечных дисуль-
фидных связей (-S-S-). Каждая цепь включает вариабельные (Vlh Vh —
variable) домены, определяющие специфичность молекулы иммуноглобу-
лина и константные (С — constant) домены. L-цепь имеет один констант-
ный участок (СЕ-домен). Н-цепь содержит три константных домена: Сн1,
Сн2, Сн3. Между СН1 и Сн2 расположена шарнирная область, состоящая из
гомологичных участков, которые включают примерно 110 остатков ами-
нокислот. Углеводные компоненты присоединяются в большей степени к
доменам Сн2 и обеспечивают ряд биологических свойств молекул имму-
ноглобулинов (присоединение к Fc-рецепторам, к лектинам). Основные
элементы домена — два антипараллельных р-складчатых слоя, соеди-
ненных одной или несколькими дисульфидными связями. Эта структура
иммуноглобулинового домена появилась на ранних этапах эволюции и
стала структурным элементом различных рецепторов, объединенных в
суперсемейство иммуноглобулинов (TCR, молекулы МНС, молекулы адге-
зии, Fc-рецепторы и др.).
ЧАСТЬ 1
134 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
При рассмотрении молекулы иммуноглобулина в качестве антигена
можно выделить следующие антигенные детерминанты:
• изотипы — детерминанты, определяющие структурные особенности
константных областей тяжелых цепей (изотип определяется типом
тяжелых цепей). Изотипы одинаковы у всех особей данного вида;
• аллотипы — индивидуальные аллельные варианты иммуноглобули-
нов в пределах одного изотипа, обусловленные вариабельностью кон-
стантных доменов или каркасных участков V-доменов;
• идиотипы — антигенные детерминанты, локализованные в вариа-
бельных доменах, определяющие специфичность молекулы антитела.
Антигенсвязывающий центр располагается в N-концевых доменах обеих
цепей иммуноглобулинов. Он образован VL- и V -доменами и обладает
индивидуальной специфичностью. Внутри вариаоельных доменов выде-
ляют гипервариабельные области CDR (англ. Complementary Determining
Regions): CDR1, CDR2, CDR3. Именно эти последовательности комплемен-
тарно взаимодействуют с антигеном. Иммуноглобулины связывают различ-
ные антигены: пептиды, полисахариды, стероидные молекулы и нативные
антигены, не прошедшие предварительной обработки. У молекулы моно-
мерного иммуноглобулина есть два активных центра, связывающих анти-
гены.
Силу связывания одного эпитопа с одним активным центром имму-
ноглобулина называют аффинностью. Между антигеном и антителом
образуются многочисленные нековалентные связи: водородные, гидро-
фобные, электростатические взаимодействия, ван-дер-валльсовы силы.
Суммарную силу взаимодействия цельной молекулы антитела со всеми
антигенными эпитопами называют авидностью. Консервативные участ-
ки (так называемые каркасные) V-области молекулы иммуноглобулина
могут связывать ионы металлов, суперантигены, обладать ферментатив-
ной активностью.
Иммуноглобулины существуют в организме:
• в растворимой форме в крови и других биологических жидкостях;
• в составе иммунных комплексов (антиген-антитело);
• в структуре BCR;
• на поверхности клеток (макрофагов, нейтрофилов и др.), фиксирован-
ных на Fc-рецепторах.
Основные характеристики иммуноглобулинов разных классов представ-
лены в табл. 4-1.
IgM. Молекула IgM имеет большую молекулярную массу 970 кДа и поэ-
тому плохо проникает в ткани. IgM состоит из пяти мономеров, объединен-
ных в единую пентамерную молекулу дисульфидными связями и J-цепью
(рис. 4-2). В состав ц-цепи входят четыре С-домена.
Помимо пентамера, IgM существует также в мономерной форме на мем-
бране В-лимфоцитов в составе BCR (см. рис. 3-20).
Таблица 4-1. Основные характеристики иммуноглобулинов разных классов человека
Параметр Тип иммуноглобулина
igM igGl !gG2 igG3 lgG4 |дА1 1дА2 slgA 1дО ЮЕ
Тяжелая цепь ц Y1 ?з у4 cd а2 а1/а2 8 Е
Средняя концен- трация в сыворот- ке (г/л) 0.5-2,0 5,0-12.0 2,0-6.0 0.5-1.0 0.1-1.0 0.5-3.0 0-0.2 0.05 0,03 (0-5) хЮ 5
Молекулярная масса (кДа) 970 146 146 170 146 160 160 385 184 188
Период полужизни (сут) 10 21 20 7 21 6 6 ? 3 2
Основная функция Нейтрализа- ция, опсони- зация Опсони- зация Опсони- зация Опсони- зация Опсони- зация Нейтрализа- ция пато- генов на слизистых оболочках Нейтрализа- ция на слизистых оболочках Нейтрализа- ция на слизистых оболочках Рецептор на мем- бране лимфо- цита Запуск реакций гиперчув- ствительно- сти немед- ленного типа
Активация компле- мента ++++ + + +++ + - - - - -
Проникновение через плацентар- ный барьер - ++ +/- ++ + - - - - -
Связывание с Fc-рецепторами различных клеток Л м, Н, Тр, л,э Тр, Л М, Н, Тр, Л, Э Н, Тр, Л М, Н М, Н М, Н - Б, Э,Л,Т
Способность ней- трализовать виру- сы и бактерии + + + + + + + + - -
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА
Л — лимфоцит; М — моноцит; Н — нейтрофил; Тр — тромбоцит; Э — эозинофил; Б — базофил; Т — тучная клетка; + — слабо;
++ — умеренно; +++ — хорошо; ++++ — очень хорошо.
Р V9VUJ
136 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Рис. 4-2. Структура иммуноглобулинов разных классов.
В процессе иммунного ответа первыми вырабатываются IgM-антитела
(см. рис. 4-5). IgM, связавшись с антигеном, претерпевает конформацион-
ные изменения, после чего приобретает наибольшую способность связы-
вать и активировать белки системы комплемента. Основная физиологиче-
ская функция IgM — нейтрализация патогенов (преимущественно вирусов)
в кровяном русле.
IgG. Иммуноглобулины этого изотипа составляют большинство антител
при вторичном иммунном ответе. IgG свободно проникает в ткани, а также
является единственным иммуноглобулином, проходящим через плацентар-
ный барьер. Транспорт через плаценту не является пассивным и происходит
с участием неонатального Fc-рецептора (FcRn) для IgG. Характеристика
FcRn представлена в разделе 3.1. Главная функция FcRn заключается в
защищите IgG от катаболизма после его интернализации. Такой меха-
низм обеспечивает транспорт IgG через эпителиальный и эндотелиальные
барьеры, участвующие в передаче IgG от матери к плоду. Выделяют четыре
подкласса IgG: IgGl, IgG2, IgG3, IgG4; различия в их свойствах представ-
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 137
лены в табл. 4-1. IgGl и IgG3 активируют комплемент, фагоциты и клетки-
киллеры. IgG2 и IgG4 участвуют в прямой нейтрализации патогенов.
IgA. Выделяют два подкласса IgA. IgAl циркулирует в крови и спо-
собствует нейтрализации патогенов, попавших в кровоток. Однако IgAl
чувствителен к действию бактериальных протеаз, поэтому играет незначи-
тельную роль в нейтрализации возбудителей. IgA2 локализуется в секретах
слизистых оболочек и участвует в нейтрализации патогенов, проникающих
в организм этим путем. Димеры IgA секретируются плазматическими
клетками неинкапсулированной лимфоидной ткани слизистых оболочек,
например, в Lamina propria кишечника. Затем они связываются с полиимму-
ноглобулиновым рецептором на базолатеральной поверхности эпителиаль-
ных клеток и путем эндоцитоза поглощаются этими клетками. В специаль-
ной везикуле этот комплекс транспортируется через клетку и выделяется в
составе слизи. Секреторный компонент защищает молекулу IgA от действия
протеолитических ферментов (рис. 4-3).
IgA участвует в формировании первой линии защиты слизистых обо-
лочек. Он не активирует комплемент, не обладает бактерицидной актив-
ГЛАВА 4
Структура секреторного IgA
Рис. 4-3. Траспорт молекул IgA через эпителиальные клетки.
ЧАСТЬ 1
138 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ностью, но играет важную роль в нейтрализации бактериальных токсинов.
IgA содержится в молозиве и обеспечивает иммунную защиту новорожден-
ных на уровне слизистых оболочек.
IgD — трансмембранный рецептор В-лимфоцитов, функции его не
известны.
IgE связываются с базофилами, тучными клетками через FceRl и вызы-
вают сенсибилизацию клеток слизистых оболочек, что приводит к разви-
тию аллергических реакций.
IgG плода и новорожденных поступает к ним от матери и исчезает из
сыворотки крови ребенка к 6-8 мес. В это время иммунная система ребенка
начинает синтезировать IgM и IgA. В возрасте 1 года уровень собственных
IgM в крови ребенка практически достигает уровня взрослого человека,
IgG - 75%, IgA - 25% (рис. 4-4).
Рис. 4-4. Изменение с возрастом содержания сывороточных иммуноглобулинов у челове-
ка (по данным Hobbs J.R., 1969).
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 139
На рис. 4-5 представлена динамика выработки иммуноглобулинов раз-
ных класов при первичном и повторном введении антигена. При первич-
ном иммунном ответе основная масса антител представлена IgM. При
повторном попадании антигена в организм количество IgM не изменяется,
преобладающим классом иммуноглобулинов становится IgG. Аффинность
антител при этом значительно возрастает, они появляются быстрее и дости-
гают высоких концентраций, сохраняются в течение более длительного
времени.
Механизмы защиты от патогенов, опосредуемые антителами, могут осу-
ществляться за счет различных функций этих молекул.
• Антигенспецифическая функция антител. В результате связыва-
ния патогена с активным центром антитела происходит нейтрализа-
ция патогенов и затрудняется их проникновение в клетки организма.
Это относится в первую очередь к IgM, участвующим в связывании и
нейтрализации токсинов возбудителей дифтерии и столбняка, а также
многих вирусов. После нейтрализации патогены утрачивают способ-
ность связываться с клетками-мишенями, выводятся из кровотока и
разрушаются макрофагами. Димеры IgA связываются с антигенами в
просвете органов и препятствуют проникновению патогенов в эпите-
лий слизистых оболочек.
ГЛАВА 4
Время после иммунизации
Рис. 4-5. Динамика выработки иммуноглобулинов при первичной и вторичной иммуни-
зации.
140 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
• Антитела могут также опсонизировать бактерии и различные клетки-
мишени, делая их более доступными для фагоцитоза или антителоза-
висимой клеточной цитотоксичности.
• Эффекторные функции антител опосредуются Fc-частью молекулы,
взаимодействующей с Fc-рецепторами клеток врожденного иммуни-
тета или с комплементом (рис. 4-6). Среди них выделяют следующие
функции.
<> Активация комплемента по классическому типу и комплемент-
опосредованный лизис клеток-мишеней (рис. 4-6, а).
v IgM, IgG3, IgGl в комплексе с антигеном взаимодействуют с ком-
понентами комплемента СЗЬ и С4Ь, связанными с эритроцитами.
Таким образом, эритроциты приносят иммунные комплексы в
печень и селезенку, где они фагоцитируются и разрушаются макро-
фагами.
< Связывание комплекса «антиген-антитело» макрофагами и нейтро-
филами, экспрессирующими Fcy-рецепторы с последующей актива-
цией фагоцитоза и разрушением комплекса (см. рис. 4-6).
о Антителозависимая клеточная цитотоксичность (АЗКЦ).
NK-клетки, эозинофилы, нейтрофилы и другие клетки экспресси-
руют FcyR III типа (CD16). Эти рецепторы участвуют в связывании
эффекторных клеток через молекулы IgG с инфицированными
клетками-мишенями. NK-клетки запускают перфорингранзимовый
механизм цитотоксичности и убивают клетку-мишень, индуцируя в
ней апоптоз (рис. 4-6, с).
о Активация клеток при взаимодействии антител с Fc-рецепторами
мембраны (рис. 4-6, д).
<> IgE-опосредованная реакция гиперчувствительности. Связывание
комплекса антигена (аллергена) с IgE-антителом через высоко-
аффинные рецепторы FceRI тучными клетками и базофилами ини-
циирует дегрануляцию этих клеток и высвобождение вазоактивных
медиаторов (гистамин, лейкотриены D4, простагландины) (рис. 4-7).
Это приводит к развитию сосудистых реакций: расширению сосудов,
повышению их проницаемости, способствует возникновению отека
и задержке антигена в очаге, препятствует его проникновению в
кровь. Кроме того, происходит интенсивное сокращение гладкой
мускулатуры, спазм бронхов и пищеварительного тракта.
о Связывание IgE эозинофилами через низкоаффинный FceRII инду-
цирует образование в эозинофилах белковых токсинов, убивающих
гельминтов, развивая IgE-опосредовацную антителозависимую кле-
точную цитотоксичность.
О Помимо этого, антитела способны в некоторых случаях расщеплять
антиген, т.е. обладают ферментативной активностью пептидаз
и ДНКаз. Известно, что аутоантитела у больных с недостаточной
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 141
Антитела действуют как молекулы-посредники для эффекторных
реакций иммунитета
ГЛАВА 4
1 Иммунный
комплекс
2 Иммунный 3 Клетка-мишень/ 4
комплекс/патоген патоген
Антиген
Активация
комлемента
по классическому
пути
Опсонизация
фагоцитоз
Распознавание
антитело-
зависимая
клеточная
цитотоксичность
Сенсибилизация
клеточная активация
Рис. 4-6. Эффекторные функции антител.
Аллерген
Рис. 4-7. Дегрануляция тучных клеток.
ЧАСТЬ 1
142 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
функцией щитовидной железы способны расщеплять тиреоглобу-
лин, что играет важную роль в патогенезе данного заболевания.
<> Некоторые антитела связывают жизненно необходимые ионы,
вызывая их дефицит в организме.
С помощью Fc-рецепторов эффекторные молекулы гуморального имму-
нитета — антитела — вовлекают клетки врожденного иммунитета (макро-
фаги, нейтрофилы, NK-клетки, эозинофилы, тучные клетки) в деструкцию
антигена и его элиминацию из организма. В этом заключаются эффектор-
ные функции антител.
4.2. Т-КЛЕТОЧНАЯ ЦИТОТОКСИЧНОСТЬ
Важный эффекторный механизм адаптивного иммунного ответа — кле-
точная цитотоксичность, опосредованная ЦТЛ.
ЦТЛ защищают организм от внутриклеточных патогенов: вирусов, неко-
торых бактерий, паразитов, а также от опухолевых клеток. Наивные ЦТЛ
мигрируют из тимуса в Т-зависимые зоны периферических лимфоидных
органов через высокий эндотелий посткапиллярных венул. При этом проис-
ходит взаимодействие молекул адгезии (интегрина LFA-1 на Т-лимфоцитах
и ICAM-1 — на клетках эндотелия). В коре происходит взаимодействие
Т-лимфоцитов с АПК. В межклеточный контакт вступают вначале молеку-
лы адгезии: CD2-CD58 и LFA-1-ICAM. Как только Т-лимфоцит встречает
свой антиген, увеличивается аффинность связывания адгезивных молекул и
происходит взаимодействие TCR с комплексом антигенный пептид-HLA-I
с участием корецептора CD8. Для дальнейшей дифференцировки ЦТЛ
должен получить второй костимулирующий сигнал от АПК. Этот сигнал
возникает при взаимодействии молекул АПК (CD80/86) с CD28 ЦТЛ. При
этом происходит индукция синтеза и секреции ИЛ-2 и одновременно экс-
прессия рецептора ИЛ-2 на наивном Т-лимфоците. Клон ЦТЛ пролифери-
рует и дифференцируется в зрелые эффекторные клетки. В ряде случаев при
развитии цитотоксического ответа на вирусы и трансплантаты необходимо
наличие CD4+Т-клеток, синтезирующих дополнительно ИЛ-2 (рис. 4-8).
Таким образом, для развития цитотоксического действия требуется:
• во-первых, развитие предварительных процессов распознавания, про-
лиферации и дифференцировки специфического для данного антигена
клона ЦТЛ;
• во-вторых, взаимодействие зрелых ЦТЛ с клетками-мишенями.
Дифференцированные ЦТЛ с помощью TCR распознают специфиче-
ский антиген, представленный на клетках-мишенях в комплексе с МНС-1.
Большинство ЦТЛ экспрессируют маркер CD8+, лишь немногие из этих
клеток несут маркер CD4+ и распознают антиген в комплексе с молекулами
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 143
ГЛАВА 4
I/IJ1-2R
Рис. 4-8. Антигензависимая дифференцировка цитотоксических Т-лимфоцитов (ЦТЛ).
HLA класса II. Взаимодействие ЦТЛ с клетками-мишенями проиллюстри-
ровано на рис. 4-9.
Ряд патогенов, например вирусы герпеса, снижают экспрессию молекул
HLA класса I на поверхности инфицированной клетки, тем самым снижая
презентацию вирусных пептидов на клеточной мембране. Таким способом
вирус уклоняется от иммунологического надзора.
Механизмы цитотоксической активности Т-клеток, опосредован-
ные Fas и фактором некроза опухоли
Рецепторы клеток-мишеней, акцептирующие цитотоксический сигнал от
ЦТЛ: молекула Fas (CD95) и рецепторы фактора некроза опухоли принад-
лежат к семейству рецепторов фактора некроза опухоли.
ЦТЛ экспрессируют Fas-лиганд (FasL), распознающий Fas на клетках-
мишенях. ФНО-а, секретируемый ЦТЛ, взаимодействует с рецептором фак-
тора некроза опухоли на клетке-мишени. В результате перекрестного связы-
вания формируются тримеры Fas и тримеры ФНО-а-рецептор ФНО типа I.
Их цитоплазматические домены смерти (DD) связываются с адаптерным
белком FADD, активирующим каспазу-8 или -10. Рецептор фактора некро-
за опухоли взаимодействует с TRADD. Далее каспаза-8 активирует другие
144 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
эффекторные каспазы (3, 6, 7) и индуцирует апоптоз клетки-мишени
(рис. 4-10). Подробнее механизмы апоптоза описаны далее в главе.
Перфории-граизимовый механизм
Дифференцированные ЦТЛ содержат цитоплазматические гранулы, в
состав которых входит белок перфорин, и ферменты — сериновые протеа-
зы, так называемые гранзимы. При распознавании клетки-мишени гранулы
направляются к месту клеточного контакта (иммунологического синап-
са) и высвобождают перфорин — белок, образующий поры в мембране.
Гранзимы через образуемые перфорином поры поступают в клетку-мишень
и, индуцируя каспазы, запускают апоптоз (подробно этот процесс описан в
главе 6). ЦТЛ при этом остаются неповрежденными, поскольку они облада-
ют резистентностью к собственному перфорину. Такая невосприимчивость
формируется за счет молекулы катепсина В, локализованного на мембране
ЦТЛ, и белка cFLIP, ингибирующего каспазу-8.
Обнаружен ряд врожденных заболеваний, обусловленных дефек-
том ЦТЛ. Мутация гена перфорина приводит к развитию семейного
гемофагоцитарного лимфогистиоцитоза, при котором органы инфильтро-
ваны макрофагами, фагоцитировавшими ЦТЛ и не способными разрушить
инфицированные вирусом клетки.
Нарушение экспрессии FasL вызывает развитие аутоиммунного лимфо-
пролиферативного синдрома 2-го типа, при котором наблюдают избыточ-
ную пролиферацию лимфоцитов.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 145
ГЛАВА 4
TNFR-1
Рис. 4-10. Механизмы цитотоксической активности Т-лимфоцитов, опосредованные Fas
и фактором некроза опухоли ос.
4.3. ГИПЕРЧУВСТВИТЕЛЬНОСТЬ ЗАМЕДЛЕННОГО ТИПА
Пшерчувствительность замедленного типа (ГЗТ) относят к клеточно-
опосредованным эффекторным механизмам адаптивного иммунитета. Эта
реакция развивается в ответ на повторное введение антигена и проявляется
локальной воспалительной реакцией, в основе которой лежит активация
Thl-клеток и макрофагов.
Выделяют три вида реакции ГЗТ: гиперчувствительность туберкулино-
вого типа, контактная чувствительность (достигают максимума через 72 ч),
гранулематозная ГЗТ (развивается через 21-28 сут).
ЧАСТЬ 1
146 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
В развитии ГЗТ можно выделить две фазы: сенсибилизирующую и
эффекторную.
В первой (сенсибилизирующей, или индуктивной) фазе антиген (или
гаптен, связанный с белком) поглощается клетками Лангерганса, которые
затем мигрируют в Т-зависимые зоны регионарного лимфатического узла.
Эти клетки представляют процессированный антиген CD4+ Т-лимфоцитам
(ThO). В результате клеточного иммунного ответа появляются эффектор-
ные клетки ТЫ и CD4+ Т-клетки памяти.
Дифференцировку Thl-лимфоцитов обеспечивают ИЛ-12, ИФН-у.
ИЛ-12 продуцируют ДК, макрофаги, а ИФН-у — ЦТЛ и NK-клетки
(рис. 4-11).
В эффекторной фазе Thl-клетки активируют макрофаги двумя спосо-
бами:
• через контактное взаимодействие молекул CD40L на Thl-лимфоците и
CD40 на макрофаге;
• через цитокиновое взаимодействие с ИФН-у.
Thl-клетки индуцируют активацию макрофага, проявляющуюся в:
• усилении экспрессии Fc-рецепторов, связывающих комплекс «анти-
ген-антитело»;
• активации НАДФН-оксидазной системы ферментов, генерирующей
активные формы кислорода;
• индукции активности NO-синтазы, вызывающей образование оксида
азота, участвующего во внутриклеточной цитотоксичности;
• стимуляции синтеза липидных медиаторов воспаления: лейкотриенов,
простагландинов;
• усилении экспрессии молекул МНС-П и костимулирующих молекул
CD80, что активирует антигенпрезентирующую функцию макрофагов.
Также увеличивается экспрессия молекул адгезии ICAM-1 и LFA-3;
• индукции синтеза провоспалительных цитокинов, в первую очередь
ФНО-а и ИЛ-1, затем факторов роста (ТФР-р) и факторов, стимули-
рующих ангиогенез. Такая реакция Манту на туберкулин развивается
через 48-72 ч, характеризуется уплотнением тканей, эритемой, нали-
чием инфильтратов мононуклеарных фагоцитов и лимфоцитов.
Контактная (кожная) гиперчувствительность проявляется локально в
зоне контакта с антигеном. Возникает часто в ответ на сенсибилизацию
химическими веществами (динитрохлорбензол, пикрилхлорид, хроматы,
парафенилендиамин, соли никеля и др.). Процесс сенсибилизации про-
должается 10-12 сут. Клетки Лангерганса микропиноцитозом поглощают
гаптенмодифицированные белки. Затем появляются Т-клетки памяти и
регуляторные Т-клетки. Повторная аппликация антигена вызывает обра-
зование провоспалительных цитокинов клетками Лангерганса, а также
выработку ИЛ-1а и хемокинов кератиноцитами. В результате местного
образования цитокинов и хемокинов на клетках эндотелия экспрессиру-
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 147
ГЛАВА 4
Th-опосредованные клетки:
в основном Thl-клетки,
иногда СО8+-клетки
(Ь) Эффекторная фаза
ФНО-
Th1 секретируют:
Цитокины ИФН-у, ТФР-р, ИЛ-2,
ИЛ-3, ГМ-КСФ,
хемокины ИЛ-8, МИФ
I МНС класса II
t ФНО-рецепторы
t кислородные радикалы
t оксид азота
Рис. 4-11. Схема развития гиперчувствительности.
ются молекулы адгезии и происходит миграция мононуклеарных клеток
в дерму и эпидермис. Thl-клетки получают стимул от клеток Лангерганса,
пролиферируют и секретируют цитокины. Таким образом поддерживается
воспалительная реакция. CD8* Т-лимфоциты оказывают прямое цитоток-
сическое действие на клетки эпидермиса и вырабатывают ИФН-у.
ЧАСТЬ 1
148 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
При хронических инфекционных заболеваниях, вызванных внутри-
клеточными патогенами, не разрушенными в макрофагах (М. tuberculosis,
L. donovani и др.), сенсибилизированные лимфоциты постоянно секрети-
руют цитокины. В результате накапливаются активированные макрофаги,
дифференцирующиеся в эпителиоидные и гигантские клетки Лангерганса.
Вместе с пролиферирующими лимфоцитами и фибробластами эти макро-
фаги образуют хроническую гранулему, ограничивающую очаг персисти-
рующей инфекции. Формирование гранулем происходит и при отсутствии
инфекции, например при ГЗТ, вызванной цирконием, бериллием, силиката-
ми, рядом корпускулярных антигенов, не разрушающихся в макрофагах, а
также при саркоидозе. В таких гранулемах отсутствуют лимфоциты.
4.4. ГУМОРАЛЬНЫЕ ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ
ВРОЖДЕННОГО ИММУНИТЕТА
С помощью механизмов врожденного иммунитета осуществляется эли-
минация патогенов в первые минуты и часы после их проникновения
в организм, когда механизмы адаптивного иммунитета (глава 4.3) еще
не сформировались. К гуморальным компонентам системы врожденно-
го иммунитета относят белки системы комплемента, белки острой фазы
(С-реактивный белок, маннозосвязывающий лектин, белки сурфактанта
и др.), провоспалительные цитокины, интерфероны 1-го типа, противоми-
кробные пептиды.
4.4.1. Система комплемента
Система комплемента — одна из важных составляющих естественного
(врожденного) иммунитета. Компоненты комплемента и их рецепторы
вовлечены во многие процессы, связанные с нормальным развитием и
функционированием иммунной системы: в противобактериальную защи-
ту, фагоцитоз, запуск и осуществление иммунного ответа, активацию и
повреждение клеток, выведение иммунных комплексов, контроль воспа-
ления, хемотаксис лейкоцитов, участие в качестве эффекторных молекул в
аутоиммунных процессах и реакциях гиперчувствительности.
Комплемент — система термолабильных сывороточных белков с каскад-
ным ферментативным действием. Система включает непосредственно белки
комплемента, их расщепленные фрагменты, рецепторы на мембране многих
клеток, а также белки, регулирующие активность отдельных компонентов.
Комплемент содержится в сыворотке крови, биологических секретах,
тканевой жидкости. Его концентрация в сыворотке составляет около
0,05 мг/мл.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 149
Для обозначения всех белков комплемента: ингибиторов, регуляторов
и рецепторов — введена единая классификация. Компоненты обозначают
буквой «С» (от англ. Complement) и цифрой. Девять основных белков ком-
племента обозначены (расположены в порядке активации) как С1, С4, С2,
СЗ, С5, С6, С7, С8 и С9. Расщепленные пептидные фрагменты С4, С2, СЗ, С5
обозначают, добавляя букву «а» или «Ь». Инактивированные компоненты
имеют префикс «i» (iC3b). Объединенные фрагменты формируют активные
ферменты, при обозначении которых иногда используют черту над назва-
нием фактора. Факторы, усиливающие действие комплемента, — Р, В и Р
(пропердин). Рецепторы комплемента — CR1, CR2 и т.д.
Клетки, продуцирующие компоненты комплемента
Более 90% комплемента сыворотки крови образуется в печени. Белки
комплемента синтезируют многие клетки организма, включая макрофаги,
моноциты, эпителий кишечника, почечных канальцев, клетки эндотелия,
кератинобласты, фибробласты и др. Полный биосинтез комплемента, его
рецепторов и регуляторов происходит в ЦНС (астроциты, микроглия и др.).
Активированные макрофаги вырабатывают многие компоненты компле-
мента (Clq, С4, С2 и др.), особенно в зоне воспаления. Провоспалительные
цитокины (ИЛ-1, ИЛ-6, ИФН-у) регулируют синтез многих белков компле-
мента.
Компоненты комплемента не транспортируются от матери к плоду через
плаценту. К концу беременности содержание комплемента в сыворотке
плода составляет 50-70% от материнского уровня. В возрасте 3 мес у боль-
шинства детей содержание комплемента соответствует уровню взрослого
организма.
Активация комплемента
Белки комплемента в норме содержится в кровотоке в неактивном
состоянии. Взаимодействие их с микроорганизмами, клетками организма,
иммунными комплексами приводит к развитию каскада активации и сборке
мембраноатакующего комплекса. За счет своих ферментативных свойств
компоненты комплемента расщепляют в определенной последователь-
ности последующие компоненты. Продукты одной реакции формируют
активный фермент для следующего этапа. Каскад активации запускается
первоначальным небольшим стимулом. Ряд этапов активации зависит от
ионов Са2+ или Mg2+. Каждый предшественник при активации расщепляет-
ся на два или более фрагментов, из которых основной обозначают буквой
«Ь»; минорный, как правило, — буквой «а». Основной фрагмент имеет
два функционально активных участка. Один из фрагментов соединяется с
рецептором на клеточной мембране или с другими структурами, а второй
обладает активностью фермента, расщепляя следующий компонент ком-
племента. Минорный фрагмент («а») существует в растворимой форме и
ГЛАВА 4
ЧАСТЬ 1
150 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
обычно обладает хемотаксической активностью (медиатор воспаления).
Исключение составляет компонент комплемента С2, у которого основной
компонент обозначают как С2а, а минорный — как С2Ь. Основные характе-
ристики белков комплемента приведены в табл. 4-2.
Выделяют по крайней мере три пути активации комплемента:
• классический;
• альтернативный;
• лектиновый.
Классический путь — активация системы комплемента антителами,
связанными с антигеном (иммунными комплексами), агрегированными
IgG или IgM. В каскад последовательно вовлекаются компоненты в следую-
щем порядке: С1 (гексамер Clq и димеры С1г и Cis), С4, С2.
Таблица 4-2. Основные характеристики компонентов комплемента и их ингибиторов
Компонент Мол. масса, «Д Число цепей Концентрация в сыворотке, мкг/мл Фрагменты
C1q 460 18 (6А, 6В. 6С) 70-250 -
С1г 83 1 50-100 -
C1s 83 1 50-80 -
С4 210 3(а,Р,у) 450-550 С4а, C4b, iC4b, С4с, C4d
С2 117 1 25 С2а, С2Ь
СЗ 190 2 (а. Р) 1000-1300 СЗа, СЗЬ, iC3b, СЗс, C3dg, C3d, C3dk, СЗе, C3f
в 100 1 200-230 Ba. Bb
D 24 1 2-10 -
Р 220 4 25-30 -
С5 180 2 70-75 C5a, C5b
С6 150 1 60 -
С7 140 1 50-60 -
С8 150 3(а, Р, у) 60-80 -
С9 80 1 50-60 -
C1-inh 106 1 180-200 -
С4 Ьр 550 7 250 -
I 100 2 30-50 -
Н 155 1 400-500 -
Процесс начинается со связывания Са2+-зависимого компонента Clq
с молекулой иммуноглобулина через специальный участок шарнирной
области (в IgM — домены СНЗ, IgG — домены СН2). Clq может также свя-
зываться с поверхностью патогенов без участия антител (например, взаи-
модействуя с СРВ, присоединенным к фосфорилхолину клеточной стенки
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 151
бактерий). Взаимодействие с IgM более эффективно. Молекула Clq при-
надлежит к семейству коллективов и представляет собой полимер из шести
идентичных субъединиц, каждая из которых состоит из трех полипептид-
ных цепей. Участки связывания с Fc-областью молекулы иммуноглобулина
находятся в глобулярных головках Clq. Каталитические пары профер-
ментов С1г и Cis расположены внутри кольца, образованного головками
субъединиц Clq (рис. 4-12). Во взаимодействии участвуют две молекулы
IgG или пентамерная молекула IgM. Участок связывания Clq претерпевает
конформационные изменения и активируется при взаимодействии анти-
тела с антигеном.
Антитела классов IgA, IgD, IgE, а также подкласса IgG4 не связывают Clq
и не активируют каскад комплемента. В сыворотке Clq находится в ком-
плексе с субъединицами С1г и Cis. В результате ферментативной актива-
ции после прикрепления к комплексу «антиген-антитело» С1 приобретает
активность сериновой протеиназы. Под влиянием Clq активируются С1г и
Cis. Все три субкомпонента после соединения генерируют Cl-эстеразу, слу-
жащую мишенью для специфического эстеразного ингибитора Cl (Cl-inh).
ГЛАВА 4
Clq
Рис. 4-12. Структура С1-компонента комплемента.
ЧАСТЬ 1
152 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Cis за счет протеолитических свойств запускает следующий компонент —
С4, продуцируемый макрофагами.
Под влиянием Cis a-цепь С4 расщепляется на С4а и С4Ь. Более крупный
фрагмент С4Ь связывается с мембраной клетки, атакованной антителами,
и участвует в расщеплении С2-компонента на основной С2а и минорный
С2Ь.
С4Ь и С2а объединяются в активный фермент С4В2а, прикрепляясь к
комплексу «антиген-антитело» и/или к мембране (если антиген связан
с клеткой). Образуется СЗ-конвертаза, расщепляющая СЗ на СЗа- и СЗЬ-
фрагменты (рис. 4-13). Некоторые вирусы, например ВИЧ, способны непо-
средственно активировать комплемент по классическому пути в отсутствие
антител.
Альтернативный путь активации комплемента запускается при
спонтанном расщеплении СЗ или под влиянием СЗ-конвертаз, а также
ряда сывороточных либо микробных протеаз. С филогенетической точки
зрения это более древний путь активации комплемента. Кроме некоторых
бактерий по альтернативному пути каскад комплемента запускают ЛПС,
эндотоксин грамотрицательных бактерий, зимозан (компонент клеточных
стенок некоторых грибов), агрегированные IgA, IgG, IgE и IgM, а также
фактор яда кобры. В активации комплемента по альтернативному пути не
участвуют ионы кальция и компоненты Cl, С4 и С2.
Каскад начинается с СЗ, который подвергается спонтанному гидроли-
зу с разрушением тиоэфирной связи и появлением участка связывания с
фактором В. Помощь в каскаде оказывают усиливающие факторы В, D и Р
(пропердин). Фактор В структурно и функционально сходен с С2. Он соеди-
няется с фрагментом СЗЬ и образует СЗЬВ. Фактор D расщепляет СЗЬВ для
формирования СЗ-конвертазы (СЗЬВЬ). Она подобна СЗ-конвертазе клас-
сического пути активации С4В2а (см. рис. 4-13).
Пропердин — белок из четырех идентичных нековалентно связанных
субъединиц. Его действие направлено на стабилизацию конвертазы СЗЬВЬ,
расщепляющей СЗ на СЗа и СЗЬ. Взаимодействие СЗЬ с факторами В и D
приводит к возрастанию уровня фрагмента СЗЬ, регулируемого инактива-
торами СЗ — факторами I и Н.
Лектиновый путь активирует систему комплемента через лектин,
связывающий маннозу. Без участия антител способностью к активации
комплемента обладают липиды и углеводы (наприМер, манноза, полиса-
хариды). Активация начинается со взаимодействия лектина с маннозной
группой на поверхности многих бактерий. Лектин, связывающий маннозу
(англ. Mannose-Binding Lectin), — тетрамер, обозначается как MBL. После
того как домены лектина С-типа в молекуле MBL соединяются с манно-
зой или N-ацетилглюкозаминовыми структурами на поверхности многих
патогенных микроорганизмов, происходит активация сериновых протеаз
MASP (MBL-Assosiated Serine Protease), Коллагеноподобные регионы MBL
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 153
Классический путь
Лектин,
связывающий
маннозу (MBL)
Пектиновый
путь
ГЛАВА 4
С1 связывается
с комплексом АГ -АТ
С4О
С2О
MASP связывает
MBL и генерирует
активированный
С1-подобный
комплекс
Активиро- СJ D
ванный С1 J
Конвертаза С5
Q СЗЬ
Спонтанно
©СЗ
Рис. 4-13. Пути активации комплемента.
вовлекаются в связывание с MASP2 и MASP1 (рис. 4-14). Образовавшийся
комплекс MBL-MASP участвует в активации компонентов классическо-
го каскада, а также ассоциирует с ингибиторами сериновых протеаз.
Функционально MASP1 и MASP2 подобны активированным компонентам
С1г и Cis соответственно и способны расщеплять С4 и С2, генерируя ком-
плекс С4В2а, обладающий активностью СЗ-конвертазы (см. рис. 4-13).
154 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Лектин, связывающий маннозу
Рис. 4-14. Структура маннозосвязывающего белка (MBL).
Центральный этап каскада комплемента. Все три типа активации
приводят к расщеплению СЗ-конвертазой (два типа конвертаз: С4В2а и
СЗЬВЬ) главного эффекторного компонента комплемента СЗ на мелкий
фрагмент СЗа и крупный фрагмент СЗЬ. Часть молекул СЗЬ (опсонины)
присоединяется к рецепторам мембраны макрофагов и нейтрофилов и
опосредует фагоцитарный процесс. Молекулы СЗЬ взаимодействуют с
фрагментами С4Ь и С2а и образуют С5-конвертазу. Под влиянием инакти-
ваторов возможно расщепление СЗЬ на СЗс (свободный фрагмент) и C3d
(связан с мембраной клетки). СЗЬ вместе с СЗ-конвертазой расщепляет С5
на С5а и С5Ь.
Фрагмент С5Ь начинает сборку мембраноатакующего, или литического,
комплекса: С5Ь, С6, С7, С8, С9 (рис. 4-15). Липофильный комплекс С5Ь,6,7
встраивается в гидрофобную плазматическую мембрану. Присоединение
С8 стабилизирует взаимодействие с клеточной мембраной, и комплекс
С5Ь,6,7,8 вызывает образование трансмембранных ионных каналов, кото-
рые могут привести к лизису атакуемой клетки. Однако финальный этап
состоит в полимеризации в мембране клетки-мишени компонентов С9
(перфориноподобные молекулы) с участием С5Ь,6,7,8-комплекса. В резуль-
тате формируются трансмембранные каналы, что приводит к нарушению
осмотического давления в клетке и к ее лизису. Внутренний диаметр пор
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 155
С5Ь
ГЛАВА 4
С567 С5Ь678
Мембраноатакующий комплекс
Рис. 4-15. Сборка мембраноатакующего (литического) комплекса.
составляет около 10 нм. Рассчитано, что мембраноатакующий комплекс
содержит по одной молекуле С5Ь, С6, С7, С8 и 10 или больше молекул С9.
Образуемые в результате активации комплемента мелкие фрагменты
играют важную роль в развитии воспаления. С2а обладает кининоподоб-
ной активностью, индуцирует сокращение гладкой мускулатуры, увели-
чивает проницаемость сосудов, участвует в развитии локальных болевых
ощущений.
СЗа, С4а и С5а получили название анафилатоксинов, поскольку они
вызывают дегрануляцию тучных клеток и активируют в них метаболизм
арахидоновой кислоты. В результате происходит локальное увеличение
образования гистамина и тромбоксана А2. Наибольшей анафилактогенной
активностью обладает СЗа. На тучных клетках выявлены рецепторы для
СЗа: C3aRl и C3aR2.
ЧАСТЬ 1
156 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
С5а усиливает хемотаксис нейтрофилов, макрофагов, ДК, Т-лимфоцитов.
Активированные Т-клетки экспрессируют рецепторы к С5а. Это играет
важную роль в развитии реакции ГЗТ, привлекая сенсибилизирован-
ные Т-лимфоциты. Основные этапы каскада комплемента представлены
на рис. 4-13.
Альтернативный и лектиновый пути в основном вовлечены во врожден-
ный иммунитет. А классический путь активации, инициированный анти-
телами, связан с адаптивным иммунитетом.
Регуляция активации комплемента
Клетки человека защищены от действия комплемента мембранными
белками, подавляющими отдельные стадии каскада активации. Регуляторы
ограничивают действие комплемента на собственные клетки, блокируют
его литический потенциал, а также неконтролируемое действие на многие
биохимические процессы.
DAF (CD55; англ. Decay-Accelerating Factor — фактор, ускоряющий рас-
пад) экспрессируется на эритроцитах, тромбоцитах, лейкоцитах, клетках
эпителия, эндотелия и других, защищает клетки от повреждающего дей-
ствия аутологичного комплемента. DAF препятствует сборке и усиливает
катаболизм СЗ- и С5-конвертаз.
МСР (CD46; Membrane Cofactor Protein — мембранный кофакторный
белок). Белок связывает СЗЬ, С4Ь на лейкоцитах, тромбоцитах, клетках
эпителия и эндотелия. МСР обладает кофакторной активностью в протео-
лизе СЗЬ/С4Ь, опосредованном фактором I.
р18 (CD59) — гомологичный ограничивающий фактор. Белок широко
распространен на клетках. Связывает аутологичные С8, С9 и ограничивает
образование мембраноатакующего комплекса (конечная литическая стадия
активации комплемента).
CR1 (CD35) ограничивает ранние стадии активации комплемента, пре-
пятствует образованию СЗ-конвертаз классического и альтернативного
путей активации.
Кроме того, известны растворимые регуляторы комплемента. В класси-
ческом пути эстеразный ингибитор Cl-inh необратимо связывается с Cis,
что приводит к ослаблению активации С4.
В альтернативном каскаде нестабильны СЗЬ (пропердин повышает ста-
бильность СЗЬ), СЗ-конвертаза. Регуляторную роль выполняют факторы I
и Н, белок S, Cl-inh.
Cl-inh — высокогликозилированный одноцепочечный полипептид
семейства молекул, обозначаемых как серпины (ингибиторы серинпро-
теиназы). Дисфункция серпинов проявляется главным образом тромбо-
зом, эмфиземой, циррозом, отеками и другими нарушениями. С1-эстераза
является мишенью для Cl-inh. Соединяясь с С1г и Cis, подавляет образо-
вание комплекса С1 и ингибирует запуск классического каскада активации.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 157
Дефицит Cl-inh наследуется по аутосомно-доминантному типу и приводит
к развитию наследственного ангионевротического отека.
С4-Ьр связывает С4Ь и ускоряет распад конвертазы, служит кофактором
для расщепления С4Ь.
Фактор Н соединяется с фрагментом СЗЬ, стрептококковым поверх-
ностным белком (Мб); ускоряет распад конвертазы, служит кофактором
при расщеплении СЗЬ. Важная особенность фактора Н — способность свя-
зывать ВИЧ.
Белок S (витронектин) препятствует взаимодействию комплекса С5Ь,6,7
с клеточной мембраной.
Кластрин обладает многофункциональными свойствами, среди них пода-
вление комплемента, связывание липидов, агрегация клеток. Этот белок
играет важную роль в восстановлении целостности ткани, в том числе в уда-
лении некротизированных клеток и их остатков, предупреждении воспале-
ния. Показано участие кластрина в регуляции клеточного ответа на стресс.
Мембранные рецепторы комплемента (CR1, CR2 и др.) могут при-
сутствовать в растворимой форме и оказывать регуляторное действие на
иммунные процессы.
Способы защиты микроорганизмов от действия комплемента
Особые взаимоотношения устанавливаются между некоторыми микро-
организмами и компонентами системы комплемента.
Патогены в процессе эволюции приобрели свойство использовать систе-
му комплемента для уклонения от иммунной защиты. Вирус Эпштейна-
Барр использует для проникновения в В-клетки СК2-рецепторы. В резуль-
тате инфицирования развиваются некоторые опухоли (В-клеточные
лимфомы, лимфома Беркитта и др.) или происходит поликлональная
активация В-клеток. Вирус кори для этих целей использует МСР (CD46).
Микобактерии фиксируют на поверхности белок С2а, расщепляющий СЗ с
образованием СЗЬ, что позволяет микобактериям инфицировать макрофаги
через рецепторы СЗ. Белок М Streptococcus pyogenes (стрептококк группы А),
вызывающий многочисленные пиогенные поражения кожи человека, опо-
средует прилипание патогенов к кератиноцитам через МСР.
ВИЧ, покрытый фрагментами комплемента, может эффективно взаимо-
действовать с различными клетками, несущими рецептор комплемента. ДК
могут связывать ВИЧ при помощи подобного механизма и, взаимодействуя
с лимфоцитами, передавать его CD4+ Т-клеткам.
Основные биологические свойства комплемента
Компоненты комплемента участвуют в защитных реакциях.
• Комплементопосредованный лизис бактерий, клеток — один из основ-
ных механизмов противомикробной защиты.
ГЛАВА 4
ЧАСТЬ 1
158 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
• Компоненты комплемента участвуют в опсонизации клеток-мишеней,
делая их доступными для клеток-эффекторов (макрофаги, нейтрофи-
лы), экспрессирующих рецепторы комплемента. Так, компонент СЗЬ
опсонизирует клетки микроорганизмов, а затем взаимодействует с
рецепторами для компонентов комплемента на фагоцитах, что активи-
рует фагоцитоз.
• При активации комплемента образуются небольшие (легкие) СЗа-,
С4а- и С5а-фрагменты, вызывающие высвобождение гистамина, лей-
котриена В4, ФНО-а из тучных клеток и базофилов. В нейтрофилах
усиливается образование кислородных радикалов. С5а служит мощ-
ным хемотаксическим агентом для нейтрофилов. СЗа и С5а повышают
проницаемость сосудов, усиливают сокращение гладкой мускулатуры,
что характерно для аллергических реакций. Именно поэтому СЗа и С5а
называются анафилатоксинами.
• Переработка и выведение иммунных комплексов с участием компле-
мента. Так, СЗЬ может опсонизировать иммунные комплексы и вызы-
вать их дезагрегацию, а также связывать эти комплексы с эритроцита-
ми, переносящими их в селезенку и печень, где они фагоцитируются
макрофагами.
• Компоненты комплемента усиливают активацию В-лимфоцитов и их
выживаемость в зародышевых центрах. CD21 и C3d, взаимодействуя с
CR2, усиливает адгезию между В-лимфоцитами и ФДК.
Заболевания с нарушениями в системе комплемента
Дефекты системы комплемента проявляются повышением чувствитель-
ности к бактериальным инфекциям, частыми воспалительными процесса-
ми, иммунокомплексной патологией и др. Недостаточность функции ком-
племента обусловливает повышенную чувствительность к определенным
патогенам. При дефиците комплемента возрастает активность пиогенных
микроорганизмов (Staphylococcus и Streptococcus), Их разрушение в орга-
низме происходит главным образом в фагоцитах в результате внутри-
клеточного киллинга. Этот процесс нарушается при дефиците антител,
комплемента или при дисфункции фагоцитов. Наиболее существенна недо-
статочность ранних компонентов классического пути активации.
Резкое повышение чувствительности к Neisseria проявляется при дефи-
ците преимущественно компонентов, формирующих мембраноатакующий
комплекс, а также компонентов альтернативного каскада. Внеклеточный
цитолизис нейссерий с участием комплемента, возможно, один из наиболее
важных механизмов их элиминации.
Снижение содержания компонентов комплемента в сыворотке выявля-
ют при многих заболеваниях. Дефицит комплемента может быть связан с
его повышенным потреблением, распадом, усиленным синтезом ингиби-
торов или генетически-опосредованным снижением синтеза компонен-
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 159
тов, а также с действием аутоантител и другими факторами. Повышение
уровня компонентов комплемента может отражать их сверхобразование,
дефицит ингибиторов и другие состояния. Белок Clq, подобный колла-
гену, перекрестно реагирует с различными типами коллагенов и может
участвовать в патогенезе хронического воспаления, например, при ревма-
тоидном артрите.
В ЦНС система комплемента функционирует полноценно, особенно при
стимуляции провоспалительными цитокинами. Астроциты экспрессируют
не только компоненты комплемента, но и их рецепторы. Локальная актива-
ция компонентов комплемента происходит при воспалительных и дегене-
ративных заболеваниях ЦНС (рассеянный склероз, болезнь Альцгеймера,
ишемия, травма мозга и др.). При рассеянном склерозе комплемент активи-
руется непосредственно на олигодендроцитах, а при болезни Альцгеймера
локальная активация комплемента запускается 0-амилоидом, вызывая
повреждение соседних нейронов. Возможно, с участием фрагментов ком-
племента происходит инфицирование клеток мозга такими вирусами, как
ВИЧ, вирус Эпштейна-Барр, вирус кори и др. Предупреждение иммуноком-
плексной патологии — одна из важнейших функций системы комплемента.
В отношении связи комплемента с иммунными комплексами имеется пара-
доксальная ситуация: с одной стороны, комплемент участвует в развитии
иммунокомплексного воспаления, а с другой — у больных с генетическим
дефектом ранних компонентов классического пути появляется аутоиммун-
ная иммунокомплексная патология.
Излишняя активация комплемента иммунными комплексами может
привести к повреждению тканей. Белки СЗа и С5а стимулируют накопление
нейтрофилов в очаге воспаления. Высвобождение гистамина под влиянием
С5а усиливает воспаление, повышает проницаемость сосудов. Острая акти-
вация каскада комплемента происходит при сепсисе, вызванном грамотри-
цательными бактериями. Хроническая активация возможна при иммунном
ответе на антиген, выведение которого из организма затруднено (например,
поражение сосудов сердца при бактериальном эндокардите, гепатите С и
др.), а также при иммунокомплексной патологии. Активация комплемента
в определенных условиях приводит к системному васкулиту и иммуноком-
плексному гломерулонефриту. Регуляторы активации комплемента (RCA)
вовлечены в патогенез ряда заболеваний человека: CR1 — иммуноком-
плексных патологий (СКВ и др.), CR2 — инфекционного мононуклеоза,
рака (лимфомы Беркитта, носоглоточного рака), МСР — коревой инфек-
ции, подострого склерозирующего панэнцефалита, гнойного дерматита.
Молекулы CR2 (CD21) в растворимой форме в норме содержатся в сыво-
ротке человека, и их уровень возрастает при хроническом В-клеточном
лимфолейкозе. При нарушении кровообращения (ишемия, инфаркт) выяв-
ляют увеличение содержания комплекса, атакующего мембрану. В экспе-
ГЛАВА 4
ЧАСТЬ 1
160 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
риментальных условиях растворимый белок CR1 (CD35) снижает степень
повреждения мышцы сердца.
Наследственные дефициты комплемента описаны в разделе 11.2.8.
4.4.2. Белки острой фазы ________________
Белки острой фазы — другое семейство гуморальных факторов врожден-
ного иммунитета. СРБ, маннозосвязывающий лектин, белки сурфактанта
SP-A и SP-D, фибриноген синтезируются в печени при действии провос-
палительных цитокинов (ИЛ-1, ИЛ-6).
С-реактивный белок (СРБ) относят к семейству пентаксинов (имеют
пентамерную структуру). При воспалительном ответе концентрация его в
сыворотке возрастает в сотни и тысячи раз и достигает 1 г/л. СРБ связыва-
ется с фосфорилхолином, входящим в состав клеточной стенки бактерий,
грибов. В результате такого взаимодействия происходит активация ком-
понента комплемента Clq и СЗ-конвертазы, что приводит к опсонизации
бактерий и дальнейшему их фагоцитозу. Таким образом, СРБ опсонизирует
патогены и поврежденные клетки организма для последующего их удале-
ния фагоцитами без развития воспаления.
Маннозосвязывающий лектин (MBL) подобен компоненту компле-
мента Clq (см. рис. 4-12). Он принадлежит к семейству коллектинов, свя-
зывающих остатки маннозы на поверхности патогенов (грибы, вирусы, бак-
терии), опсонизируя их для последующего фагоцитоза моноцитами. Также
MBL индуцирует активацию комплемента по лектиновому пути.
Белки сурфактанта SP-A и SP-D (Surfactant Protein) являются чле-
нами семейства коллектинов, секретируемых эпителиальными клетками
бронхиол (SP-A), эпителием дыхательных путей (преимущественно SP-D).
Многие грамотрицательные и грамположительные бактерии, респиратор-
ные вирусы, грибы и микобактерии служат мишенями для белков суфак-
танта. Связывая патогены, попадающие в организм с вдыхаемым воздухом,
сурфактантные белки активируют их фагоцитоз, участвуя, таким образом,
в формировании первой линии защиты организма.
Белки острой фазы имеют важное диагностическое значение для оценки
течения воспалительного процесса и эффективности проводимого лечения.
Количественное определение СРБ используют, чтобы определить прогноз
течения инфаркта миокарда, диагностики сепсиса, воспалительных про-
цессов.
4.4.3. Противомикробные пептиды
Противомикробные пептиды составляют обширную группу катионных
белков, способных поражать многие вирусы, бактерии, грибы и простейшие.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 161
Осуществляя «instant immunity* (мгновенный иммунитет), противоми-
кробные пептиды служат, с одной стороны, естественными эндогенными
антибиотиками, а с другой — сигнальными молекулами, вовлеченными в
процессы активации клеток иммунной системы и репарации тканей.
У млекопитающих наиболее подробно охарактеризованы два семейства
противомикробных пептидов — дефенсины и кателицидины.
Дефенсины получили свое название от англ, defence — защита. Название
отражает способность этих белков обеспечивать защиту организма
от патогенных и условно-патогенных микроорганизмов.
Особенность первичной структуры дефенсинов — наличие шести остат-
ков цистеина, участвующих в образовании трех внутримолекулярных
дисульфидных мостиков. Это стабилизирует вторичную структуру пептид-
ной молекулы и делает ее устойчивой к действию протеиназ.
В зависимости от расположения дисульфидных связей выделяют три
группы дефенсинов: а-, р- и 0-дефенсины (рис. 4-16).
У человека известно 6 а-дефенсинов: 4 из них, обозначаемых как HNP1,
HNP2, HNP3 и HNP4, — человеческие нейтрофильные пептиды, присут-
ствуют в гранулах нейтрофилов, а а-дефенсины HD-5 и HD-6 (HD — Human
Defensin) экспрессированы в эпителиальных клетках пищеварительного и
репродуктивного тракта человека.
ГЛАВА 4
1-6, 2-4, 3-5
а-Дефенсины
— СС —
1-5, 2-4, 3-6
Рис. 4-16. Расположение дисульфидных связей в молекулах дефенсинов.
ЧАСТЬ 1
162 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
р-Дефенсины синтезируются эпителиальными клетками слизистых обо-
лочек респираторного, урогенитального и пищеварительного тракта, где
отсутствуют гранулы, сберегающие пептиды.
Столь выраженная экспрессия противомикробных пептидов эпители-
альными клетками слизистых оболочек объясняется, по-видимому, необ-
ходимостью их защиты от постоянного действия факторов окружающей
среды, микрофлоры и патогенных микроорганизмов.
Другое семейство катионных противомикробных пептидов — кателици-
дины — обнаруживают только у млекопитающих. Они состоят из консер-
вативного N-концевого сигнального пептида и вариабельного С-концевого
противомикробного домена. В центре молекулы расположен консерватив-
ный кателин (ингибитор катепсина L) (рис. 4-17).
Функции С-терминальных доменов кателицидинов:
• оказывают антибактериальный эффект:
• связывают и нейтрализуют ЛПС;
• активируют хемотаксис Т-клеток и фагоцитоз;
• стимулируют экспрессию HLA-DR на ДК;
• вызывают дегрануляцию тучных клеток.
Выделяют около 30 разновидностей кателицидинов, характерных для
каждого класса млекопитающих, однако у людей обнаружен только LL-37/
hCapl8. вырабатываемый нейтрофилами.
Между противомикробными пептидами и цитокинами существуют осо-
бые взаимодействия. Они способны индуцировать синтез друг друга.
Действие противомикробных пептидов на клетки иммунной системы
часто опосредуют хемокиновые рецепторы. Противомикробные пептиды
по принципу обратной связи активируют посттранскрипционный синтез
ИЛ-1, ФНО-а, простагландинов и других медиаторов воспаления макрофа-
гами. ФНО-а, продуцируемый стимулированными макрофагами, индуци-
рует выработку противомикробных пептидов кератиноцитами. Экспрессию
противомикробных пептидов подавляют ТЬ2-клетки.
Таким образом, а-дефенсины — важные медиаторы системных иммун-
ных реакций, а р-дефенсины более важны для процессов, протекающих в
слизистых оболочках.
29-30 а.о. 99-114 а.о. 12-100 а.о.
Сигнальный пептид Кателин Антимикробный домен
Рис. 4-17. Структура кателицидина.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 163
Механизм действия противомикробных пептидов
Катионные пептиды участвуют в противомикробной защите двумя путями:
• оказывая прямое противомикробное действие;
• опосредованно, индуцируя механизмы врожденного и адаптивного
иммунного ответа.
Способность дефенсинов уничтожать микроорганизмы, стимулировать
фагоцитоз, подвижность и накопление нейтрофилов, регулировать акти-
вацию системы комплемента усиливает активность факторов врожденного
иммунитета.
Прямое противомикробное действие катионных пептидов заслуживает
отдельного внимания. Противомикробные пептиды по праву называют-
ся естественными эндогенными антибиотиками. Они взаимодействуют с
мембраной бактериальной клетки за счет собственного положительного
заряда. Действие пептидов высокоселективно, мишень противомикробных
пептидов — отрицательно заряженные компоненты мембран клеток микро-
организмов (рис. 4-18).
Соматические клетки эукариот противомикробными пептидами не
повреждаются. Это обусловлено тем, что существуют различия между мем-
бранами клеток эукариот и прокариот.
ГЛАВА 4
а
Рис. 4-18. Механизм образования
поры в мембране бактериальной
клетки при действии противоми-
кробных пептидов (б). Пора — вид
сверху (а).
164 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Мембраны соматических клеток млекопитающих и грибов, в отличие
от клеток прокариот, содержат заряженные нейтрально стеролы (холе-
стерол, эргостерол). Клеточные мембраны многих бактерий лишены
стеролов и содержат в основном фосфатидилглицерол, кардиолипин и
фосфатидилсерин, заряженные отрицательно. Это обеспечивает их взаи-
модействие с катионными противомикробными пептидами (рис. 4-19).
Внедрение и прохождение катионных пептидов через мембрану сопро-
вождается нарушением ее структурной целостности и образованием пор,
что обусловливает нарушение осмотического барьера клеток-мишеней,
выход из них жизненно важных компонентов (ионов калия, аминокислот,
коферментов, нуклеотидов и др.). Происходящая при этом дезорганиза-
ция встроенных в мембрану мультиферментных комплексов приводит к
подавлению дыхания, окислительного фосфорилирования, репликации,
транскрипции и синтеза белков.
Нарушение образования катионных противомикробных пептидов
с повышением или снижением их экспрессии выявляют при многих заболе-
ваниях человека, в патогенезе которых воспаление играет важную роль.
К ним относят раневые процессы различной природы и течения, ожоги,
псориаз, атопический дерматит, язвенный колит, болезнь Крона, воспале-
ние ободочной кишки, дизентерию, муковисцидоз, обструктивный брон-
хит, БА и патологию репродуктивной системы бактериального и вирусного
генеза.
Внутренний слой
Холестерол
Фосфолипиды
Рис. 4-19. Взаимодействие противомикробных пептидов с мембранами соматической
и бактериальной клеток.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 165
4.5. ЭФФЕКТОРНЫЕ КЛЕТКИ ВРОЖДЕННОГО
ИММУНИТЕТА
В реализации эффекторных механизмов врожденного иммунитета уча-
ствуют различные клетки миелоидного ряда: фагоциты, NK-клетки, NKT-
лимфоциты, эозинофилы, базофилы, тучные клетки, ДК. Эти клетки отли-
чаются от иммунокомпетентных целым рядом особенностей, подробно
описанных в главе 2.
Основные отличия следующие:
• клетки врожденного иммунитета активируются при распознавании
специальными рецепторами (PRR) не индивидуальных молекул, а их
групп — РАМР;
• клетки врожденного иммунитета всегда готовы к осуществлению
эффекторных функций. Для этого им не требуется пролиферации,
дифференцировки и межклеточных взаимодействий, характерных дя
клеток адаптивного иммунитета;
• отсутствие иммунологической памяти;
• клетки врожденного иммунитета содержат в цитоплазме широкий
спектр эффекторных молекул. Действие этих молекул осуществляется
внутриклеточно при фагоцитозе и вне клетки при экзоцитозе.
4.5.1. Макрофаги и нейтрофилы
Фагоциты — основная группа клеток системы врожденного иммуни-
тета. Они имеют миелоидное происхождение и обладают способностью
к фагоцитозу (см. раздел 2.1.3). По морфологии и функции их разделяют
на мононуклеарные клетки (моноциты/макрофаги) и нейтрофилы, что
соответствует предложенному И.И. Мечниковым разделению на макро- и
микрофаги. Роль фагоцитов в иммунном ответе крайне многообразна. Они
выполняют ряд ключевых функций во врожденном и в адаптивном имму-
нитете. Активация фагоцитов происходит через многие поверхностные
рецепторы. Ведущую роль в активации фагоцитов играют PRR врожден-
ного иммунитета (например, TLR, NOD-рецепторы, маннозные рецепто-
ры, рецепторы-«мусорщики», рецепторы комплемента и многие другие).
Ответная реакция развивается быстро, не требует пролиферации и диффе-
ренцировки клеток.
Активация обычно происходит в два этапа: прайминг и собственно
активация. Суть прайминга заключается в том, что предварительная обра-
ботка клеток небольшим количеством стимулятора (1-й сигнал), действие
которого не вызывает прямой активации, сопровождается усилением отве-
ГЛАВА 4
ЧАСТЬ 1
166 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
та фагоцитов на второй сигнал. В результате активированные фагоциты
выполняют следующие функции:
• хемотаксис;
• фагоцитоз;
• образование активных форм кислорода;
• синтез оксида азота;
• синтез и секреция цитокинов и других биологически активных медиа-
торных молекул (метаболиты арахидоновой кислоты, компоненты
комплемента, факторы свертывания крови, белки матрикса, ферменты,
противомикробные пептиды, гормоны и др.);
• бактерицидную активность;
• процессиг и презентацию антигена (профессиональные АПК — ДК,
мононуклеарные фагоциты).
Основные типы клеток, участвующих в развитии воспаления — универ-
сальной защитной реакции организма на повреждение, — нейтрофилы,
моноциты, макрофаги, а также клетки эндотелия и фибробласты. Первыми
в очаг воспаления мигрируют нейтрофилы (в первые часы, сутки), затем
макрофаги (в течение нескольких дней) и самыми последними — лимфо-
циты. При остром воспалении преобладают нейтрофилы и активирован-
ные Т-хелперы, при хроническом воспалении больше макрофагов, ЦТЛ и
В-лимфоцитов. Такая периодичность миграции лейкоцитов в очаг воспале-
ния обусловлена хемокинами и молекулами адгезии.
Хемокины — группа низкомолекулярных цитокинов молекулярной
массой 8-10 кДа, индуцирующих процесс миграции лейкоцитов из крови.
В настоящее время идентифицировано больше 40 различных хемокинов.
По химической структуре, а именно в зависимости от положения остат-
ков цистеина в молекуле, выделяют четыре основные группы хемокинов
(табл. 4-3).
Избирательное вовлечение различных популяций лейкоцитов в форми-
рование очагов воспаления обеспечивается экспрессией различных рецеп-
торов хемокинов. Thl-клетки и моноциты экспрессируют хемокиновый
рецептор CCR5, что обеспечивает ответ на хемокин CCL3. ТЬ2-клетки,
эозинофилы и базофилы экспрессируют CCR3, необходимый для ответа
на CCL11. Следует отметить, что обе группы клеток экспрессируют рецеп-
торы CCR1 и CCR2, чем обусловлен ответ на CCL2, CCL7, CCL8 и CCL13.
Известно, что на нейтрофилах экспрессируются CXCR1 и CXCR2 — рецеп-
торы ИЛ-8, CXCL1 и CXCL2.
Вызванное воспалением проникновение нейтрофилов из сосудов в ткани
обеспечивается рядом адгезивных взаимодействий между лейкоцитами и
клетками эндотелия, а также действием хемокинов. В табл. 4-4 представ-
лены некоторые клинически значимые молекулы адгезии и их лиганды.
Выделяют две группы молекул адгезии: селектины и интегрины.
Таблица 4-3. Характеристика некоторых хемокинов
Семейство хемокинов Представители семейства Рецепторы
С у-хемокины Лимфотактин XCR
СС Р-хемокины Эотоксин CCR3
RANTES CCR1, CCR3, CCR5
М1Р-1а CCR1.CCR3, CCR5
М1Р-1р CCR1.CCR3, CCR5
СХС а-хемокины ИЛ-8 CXCR1, CXCR2
SDF-1a/p CXCR4
IP-10 CXCR3
GROot CXCR2
GROp CXCR2
GROy CXCR2
p-TG CXCR2
СХХХС 8-хемокины Фракталкин CX3CR1
Клетки-мишени Биологические эффекты
В основном Т-лимфоциты Дифференцировка миграция лим- фоцитов
Т-клетки, моноциты, эозино- филы Воспаление в тканях
Т-лимфоциты (Th2), дендритные клетки, NK-клетки, моноциты, эозинофилы, базофилы Воспаление в тканях, дегрануляция базофилов, активация Т-клеток
Th1-лимфоциты, дендритные клетки, NK-клетки, моноциты, базофилы Активация клеток, продуцирующих ИФН-у, конкурирует с ВИЧ-1 за свя- зывание с рецептором
Активированные Т-клетки, дендритные клетки, NK-клетки моноциты Конкурирует с ВИЧ-1 за связывание с рецептором
Нейтрофилы, Т-клетки Ангиогенез, активация нейтрофилов
Т-клетки, СО34*-клетки — пред- шественники В-лимфоцитов (костный мозг) Хоминг лимфоцитов, развитие В-клеток
Моноциты, NK-клетки, Th1- лимфоциты Подавление ангиогенеза, активация клеток, продуцирующих ИФН-у
Нейтрофилы Активация нейтрофилов
Т-клетки Пролиферация фибробластов
Фибробласты Ангиогенез
Нейтрофилы Активация нейтрофилов, ангиогенез, резорбция тромба
Моноциты, Т-клетки Воспалительные процессы в мозге, адгезия лейкоцитов к эндотелию
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 167
P V9VUJ
168 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Таблица 4-4. Некоторые клинически значимые адгезивные молекулы
Молекула адгезии Лиганд Клинические последствия взаимодействия Последствия дефекта экспрессии
Семейство ^-интегринов
VLA-4* (CD49d/ CD29), экспресси- рованы на лимфо- цитах и моноцитах VCAM-1**, экс- прессирован на эндотелии Адгезия лимфоци- тов и моноцитов на эндотелии Нарушение миграции лимфоцитов и моноцитов в ткани
Семейство $2-интегринов
CD18/CD11, экс- прессированы на всех типах лей- коцитов ICAM-1***, на эндотелии Адгезия всех типов лейкоци- тов к эндотелию сосудов Тяжелый иммунодефицит, прояв- ляющийся нейтропенией, возврат- ными инфекциями бактериальной и грибковой природы, уменьшени- ем способности нейтрофилов к хемотаксису в ткани
Семейство селектинов
Е-селектин (CD62E), экспрес- сирован на активи- рованных клетках эндотелия CD15, экспрес- сирован на нейтрофилах и эозинофилах Начальные этапы адгезии и роллин- га лейкоцитов на эндотелии Дефект экспрессии CD15 проявля- ется аналогично дефекту экспрес- сии CD18
L-селектин (CD62L) CD34, Gly САМ, экспрессирован в высокоэндоте- лиальных венулах Участвует в адге- зии и роллинге лейкоцитов в лим- фатических узлах Снижение роллинга и хоминга лейкоцитов
*VLA — очень поздний активационный антиген; **VCAM — молекула адгезии на эндоте-
лиальных клетках; ***1САМ — межклеточная молекула адгезии.
Различают Е-селектины (на клетках эндотелия), L-селектины (на лей-
коцитах) и Р-селектины (на тромбоцитах). Селектины связываются с
углеводными остатками на поверхности лейкоцитов и клеток эндотелия и
участвуют в миграции клеток в очаг воспаления.
Интегрины — основные молекулы межклеточной адгезии. Это гетероди-
меры, состоящие из а- и [3-субъединиц, соединенных нековалентными свя-
зями. Интегрины пронизывают клеточную мембрану и через адаптерные
молекулы талин и винкулин связываются с цитоскелетом. В зависимости от
типа p-цепи, входящей в состав молекулы, выделяют три семейства инте-
гринов.
Pj-Интегрины обеспечивают связывание клеток с внеклеточным матрик-
сом. Р2-Интегрины участвуют в адгезии лейкоцитов к клеткам эндотелия.
Р3-Интегрины обусловливают взаимодействие тромбоцитов и нейтро-
филов. Дефицит р2-интегрина LFA-1 (CD18/CD11) приводит к развитию
врожденного дефекта фагоцитов — синдрома дефицита адгезии лейкоцитов
(LAD-синдром), сопровождающегося тяжело протекающими инфекцион-
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 169
ними заболеваниями бактериальной и грибковой природы, уменьшением
миграции фагоцитов в ткани (см. раздел 11.2.5).
Вызванный воспалением процесс проникновения лейкоцитов в ткани
из сосудистого русла обеспечивается рядом адгезивных взаимодействий и
включает несколько этапов (рис. 4-20):
• роллинг (перекатывание);
• адгезию;
• проникновение в ткани.
Рассмотрим этапы проникновения лейкоцитов в ткани на примере ней-
трофилов. Первый этап — роллинг (качение) нейтрофилов по поверхности
клеток эндотелия — происходит при участии селектинов. В норме клетки
эндотелия сосудов не несут молекул адгезии. При активации в очаге вос-
паления клетки начинают экспрессировать Е-селектины и рецепторы для
селектинов. Скорость нейтрофилов в кровотоке замедляется за счет взаи-
модействия Е-селектина и углеводной детерминанты Lewis-X, связаннйой с
СБ15-молекулой нейтрофила.
L-селектины нейтрофилов взаимодействуют с сиаломуцином (CD34),
расположенным на эндотелии. Активированные эндотелиальные клетки
секретируют ИЛ-8, индуцирующий смену селектинов на поверхности ней-
трофилов и стимулирующий экспрессию р2-интегринов. Активация клеток
эндотелия происходит при развитии местной воспалительной реакции под
действием локально образующихся провоспалительных цитокинов ИЛ-ip
и ФНО-а.
Второй этап — адгезия — образование прочных связей между лейкоци-
тами и эндотелиальными клетками, осуществляемое за счет интегрино-
вых взаимодействий. Лигандами Р2-интегринов служат молекулы группы
ICAM.
Третий этап — миграция нейтрофилов между клетками эндотелия (транс-
эндотелиальная миграция) осуществляется под действием хемокинов.
Последующая миграция нейтрофилов в ткани основана на хемотакси-
се. Хемоаттрактанты для нейтрофилов существуют в очаге воспаления.
ГЛАВА 4
Просвет кровеносного сосуда
Кровоток—* * ""''Д
Все типы
лейкоцитов
L-селектин----
CD34/GlyCAM-1
Нейтрофилы Лимфоциты
к Моноциты
CD15 CD49d/CD29
| - Е-селектин VCAM-1 —
Все типы
лейкоцитов
CD18/CD11
ICAM-1
Селектинзависимая
стадия
Интегринзависимая
стадия
Проникновение
в ткани
Цитокин(хемокин)зависимая
стадия
Стадия 1
Стадия 2
Стадия 3
Рис. 4-20. Стадии проникновения лейкоцитов в ткани.
170 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
К ним относятся фактор активации тромбоцитов (ФАТ), лейкотриен В4,
компоненты комплемента (С5а), N-формил-метионил-пептиды бакте-
рий, ИЛ-8. Провоспалительные цитокины повышают уровень экспрессии
р2-интегринов, ICAM-1, ИЛ-8.
В зоне воспаления фагоциты начинают распознавать опсонизированные
патогены. В качестве опсонинов выступают чаще всего инактивированные
компоненты комплемента iC3b и молекулы IgG. В распознавании опсо-
низированных патогенов участвуют рецепторы комплемента: CR1, CR3 (у
макрофагов важную роль играет CR4) и FcyR (CD64, CD32, CD16). Эти
взаимодействия индуцируют процесс поглощения.
Нейтрофилы и макрофаги обладают мощным потенциалом для уничто-
жения патогенов. Выделяют кислородзависимые и кислороднезависимые
механизмы бактерицидности фагоцитов.
Резидентные макрофаги удаляют апоптозные клетки и эндогенные моле-
кулы организма, модифицированные вследствие патологического процесса
(так называемые эндогенные лиганды: например, модифицированный кол-
лаген, белки теплового шока, липиды низкой плотности и др.), с помощью
рецепторов-мусорщиков. В данном случае активации макрофагов и разви-
Инфекция
CD11b/CD18
ИЛ-1Р<~*
ИЛ-6 «..
ФИО <...
Toll-подобные рецепторы
CD14 (рецептор
к липополисахариду)
CD11C/CD18
Макрофаг
Рецептор, распознающий
остатки маннозы
L.> ИЛ-8
(фактор хемотаксиса
нейтрофилов)
..► ИЛ-12
(активирует NK-клетки, способствует
дифференцировке ThO в Th1)
•> Другие медиаторы:
простагландины,
радикалы кислорода,
оксид азота
Рис. 4-21. Активация макрофага при распознавании патогена.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 171
тия механизмов цитотоксичности не происходит. Поглощение чужеродных
клеток и патогенов приводит к активации макрофагов.
Функциональная активность макрофагов регулируется цитокинами.
Цитокины, продуцируемые ТЫ- и ТЬ2-клетками, индуцируют в макрофаге
разные реакции. ИФН-у стимулирует выработку активных форм кислорода,
провоспалительных цитокинов, экспрессию МНС-П.
ИЛ-4 и ИЛ-13 угнетают эти функции макрофага, но способствуют обра-
зованию гигантских клеток в гранулемах, выработке факторов роста, сти-
мулируя тем самым заживление повреждений ткани. Эти цитокины вызы-
вают альтернативную активацию макрофагов (см. рис. 3-32, рис. 3-33).
Исключительно важную роль в активации фагоцитов и в реализации
их кислородзависимой бактерицидной функции играют активные формы
кислорода и оксида азота, образуемые в процессе кислородного или дыха-
тельного взрыва.
В основе дыхательного взрыва лежит усиление потребления глюкозы и
ее расщепление с участием NADPH по механизму гексозомонофосфатного
шунта, что сопровождается накоплением NADPH. Взаимодействие NADPH
с молекулой кислорода при участии NADPH-оксидазы приводит к обра-
зованию супероксид аниона (О2 ), из которого с участием ионов водорода
образуются потенциально токсичные для бактерий гидроксильные ради-
калы (ОН), перекись водорода (Н2О2) и синглетный кислород. Этот про-
цесс начинается спонтанно после образования фагосомы перед слиянием
с лизосомой. Наиболее выражен бактерицидный эффект в фаголизосомах.
Образование Н2О2 происходит спонтанно и при участии супероксиддисму-
тазы. Фермент миелопероксидаза обеспечивает образование гипохлорида
из Н2О2 с участием ионов галогенов. Оксид азота (NO) образуется в резуль-
тате расщепления аргинина до цитруллина и катализируется NO-синтазой
(рис. 4-22).
Оксид азота (NO) участвует во многих физиологических и патологиче-
ских процессах как на клеточном, так и на организменном уровне, оказывая
защитное, регуляторное и повреждающее действия.
Регуляторное действие NO проявляется в поддержании тонуса и прони-
цаемости сосудов, подавлении адгезии тромбоцитов, в модуляции клеточ-
ной адгезии, нейротрансмиссии и бронходилатации, а также в регуляции
некоторых функций почек и иммунной системы.
Под защитным действием оксида азота подразумевают его антиокисли-
тельные свойства, т.е. защиту от агентов окислительного стресса (перекись
водорода, алкильные гидроперекиси, супероксидный анион-радикал и др.),
снижение адгезии лейкоцитов и антитоксический эффект, в частности, про-
тив ФНО-а.
Повреждающее действие оксида азота оказывается через подавление
функций ферментов, индукцию процессов перекисного окисления липидов
172 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
iNOS
NADPH
оксидаза
О2
NADPH
L-аргинин
О2
NADPH
Рис. 4-22. Схема образования бактерицидных веществ фагоцитами (активных форм кис-
лорода и оксида азота).
и повреждения ДНК клетки, повышение чувствительности клетки к дей-
ствию радиации, алкилирующих агентов и токсичных металлов, а также
через истощение антиокислительных возможностей клетки. Непрямое
цитотоксическое действие оксида азота осуществляется за счет изменения
цитокинового равновесия и опосредованной ИЛ-12 активации NK-клеток
и ЦТЛ. Сам по себе оксид азота не является мощным цитотоксическим
агентом, но он может усиливать чувствительность клеток к действию дру-
гих цитотоксических веществ. Наиболее выраженной антибактериальной
активностью обладают соединения, образовавшиеся при взаимодействии
активных форм кислорода и оксида азота. В результате взаимодействия
NO с активными формами кислорода и некоторыми другими соедине-
ниями образуются цитотоксические вещества, включая пероксинитрит
(0N00 ), S-нитрозотиолы (RSNO), диоксид азота (N02), динитроген три-
оксид (N2O3), динитроген тетраоксид (N2O4) и железодинитрозильные
комплексы (DNIC).
Эффекты оксида азота принято разделять на основные и опосредо-
ванные. Основные эффекты включают реакции, в которых он непосред-
ственно взаимодействует со специфическими биологическими моле-
кулами (например, с гуанилатциклазой, цитохромом Р450 и др.).
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 173
Опосредованные эффекты действия оксида азота связаны с реактивными
формами азота, образующимися при взаимодействии NO с кислородом
или с супероксидным анион-радикалом.
Основные и побочные эффекты реакций с непосредственным участием
оксида азота определяются его локальной концентрацией. Основные эффек-
ты вероятны при низких концентрациях оксида азота (меньше 1 мкМ), тогда
как побочные эффекты, включая образование радикалов, становятся воз-
можными при более высоких его концентрациях (больше 1 мкМ).
Оксид азота in vivo образуется с участием NO-синтазы (NOS), суще-
ствующей у млекопитающих в трех изоформах: nNOS — нейтральной
(1-й тип); iNOS — индуцибельной (2-й тип); eNOS-синтаза — эндотелиаль-
ной (3-й тип).
В макрофагах функционирует iNOS, экспрессию которой стимулируют
некоторые цитокины и продукты микроорганизмов, часто действующие в
синергизме. NO-синтазы типов 1 и 3 называются также cNOS — избира-
тельными (существуют в клетках и могут быть активированы притоком
кальция, который в последующем связывается с кальмодулином). В при-
сутствии iNOS оксид азота вырабатывается в больших количествах и часто
оказывает побочные эффекты, такие, как перекисное окисление липидов и
гидроксилирование, образование нитрозаминов и нитротирозина.
На рис. 4-23 представлены некоторые типы рецепторов, участвующих в
фагоцитозе и апоптозе.
ГЛАВА 4
Рис. 4-23. Некоторые типы рецепторов фагоцитов, участвующие в фагоцитозе и апоптозе.
174 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Активация TLR при действии различных патогенов на макрофаги и дру-
гие клетки врожденного иммунитета обусловливает экспрессию множества
генов хемокинов и провоспалительных цитокинов, в частности ИЛ-1, ИЛ-2,
ИЛ-6, ИЛ-8, ИЛ-12, ФНО-а, ГМ-КСФ, ИФН-у. Помимо цитокинов, усили-
вается экспрессия молекул адгезии, противомикробных пептидов, белков
острой фазы воспаления, NO-синтазы, циклооксигеназы. Это приводит к
развитию воспалительной реакции. В табл. 4-5 представлены основные
молекулы, секретируемые макрофагами.
Таблица 4-5. Секреторные продукты макрофагов
Классы секретируе- мых молекул Молекулы Функция
Цитокины ИЛ-1, ИЛ-6, ИЛ-8, ФНО-а Развитие локального и системного воспаления
ТФР-р Модуляция воспаления, репарация
ИФН-а, ИФН-р, ГМ-КСФ, М-КСФ, ИЛ-12, ИЛ-18 и др. Противовирусное действие, регуляция гемопоэза, межклеточных и межси- стемных взаимодействий
CCL2, CCL3, CCL4, CCL5, CXCL8 Хемокины
Метаболиты арахи- доновой кислоты (эйкозаноиды) Простагландин Е2, лейкотриены В и С, тромбоксан А Регуляция воспаления, иммунных реакций и других процессов
Активные формы кислорода и азота О2-, Н202, ОН, NO и др Бактерицидное, цитотоксическое дей- ствие, участие в воспалении
Ферменты Кислые гидролазы, нейтральные протеиназы Бактерицидное действие
Лизоцим Лизис грамположительных бактерий, фибринолиз
Урокиназа (активатор плазминоге- на), коллагеназа, эластаза Расщепление белков матрикса
Липаза Липидный обмен
Компоненты ком- племента С1-С9, СЗа, СЗЬ, С5а, пропердин; факторы В, D, I Эффекторные реакции иммунитета, бактериолиз, цитолиз
Факторы свертыва- ния крови Факторы V, VII, IX, X Свертывание крови
Белки матрикса, интегрины Фибронектин, протеогликаны: гепарин и хондроитин-сульфаты Образование межклеточного матрик- са, межклеточные взаимодействия
Транспортные белки Трансферрин, а2-макроглобулин, транскобаламин II Транспорт и метаболизм белков
Гормоны и регуля- торные пептиды Соматотропный гормон, адре- нокортикотропный гормон, p-эндорфины и др. Регуляция активации и функциониро- вания клеток, регуляция воспаления
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 175
Активированные макрофаги, наряду с ИЛ-1 и ИЛ-8, вырабатывают
ИЛ-6, ИЛ-12 и ФНО-а.
ФНО-а — важный провоспалительный цитокин. Под действием
ФНО-а:
• увеличивается количество молекул агдезии на эндотелиальных клет-
ках сосудов, что способствует прикреплению лейкоцитов к эндотелию
в очаге воспаления;
• активируются клетки, участвующие в воспалительной реакции;
• возрастает количество молекул главного комплекса гистосовместимо-
сти на поверхности инфицированных клеток, что способствует их раз-
рушению цитотоксическими клетками.
ИЛ-6 и ИЛ-1 действуют как медиаторы ответа острой фазы, участвуя в
уничтожении патогена.
4.5.2. NK-клетки
NK-клетки, или естестественные киллеры, — эффекторные клетки врож-
денной иммунной системы, осуществляющие прямую цитотоксическую
функцию без предварительной активации.
NK-клетки экспрессируют многие поверхностные распознающие
рецепторы и имеют следующий фенотип: CD3- CD16+ CD56+ CD94+,
но не экспрессируют TCR. Выделяют две субпопуляции NK-клеток.
Примерно 90% циркулирующих в крови NK-лимфоцитов имеют низкую
плотность CD56 (CD56dim) и высокую — CD16 (CD16bright). В перифериче-
ских лимфоидных органах уровень экспрессии CD56 высокий (CD56bright)»
а уровень CD16 — низкий (CD16dim). С участием молекулы CD16 (тип
FcRIII) NK-клетки осуществляют антителозависимую цитотоксичность,
разрушают опсонизированные антителами клетки-мишени по перфофин-
гранзимовому механизму (см. раздел 4-2, рис. 4-6). Клетки с фенотипом
CD56bright CD16dim экспрессируют хемокиновые рецепторы CCR5 и CCR7,
L-селектин, что позволяет им мигрировать в лимфатические узлы и секре-
тировать различные цитокины ИФН-у, ФНО-0 ГМ-КСФ, ИЛ-10. Основная
роль этих клеток в иммунной системе сводится к обнаружению и уничтоже-
нию опухолевых и инфицированных вирусами клеток.
В периферической крови человека NK-клетки составляют 10-12% от
общего числа лимфоцитов. Активация NK-клеток регулируется соотноше-
нием рецепторов, поставляющих подавляющие и активирующие сигналы.
Известны три типа рецепторов NK-клеток, реагирующих с молекулами
HLA класса I:
• KIR-рецепторы NK-лимфоцитов обозначаются как киллерные имму-
ноглобулиноподобные рецепторы;
• лектиноподобные рецепторы;
ГЛАВА 4
176 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
• иммуноглобулиноподобные лейкоцитарные транскрипты (ILT-2) —
содержат 2 или 4 иммуноглобулиноподобных домена и взаимодейству-
ют с широким спектром молекул HLA (рис. 4-24).
KIR состоит из двух или трех внеклеточных иммуноглобулиновых
доменов. Ингибирующие рецепторы содержат внутриклеточные ITIM
(см. рис. 4-24). В мембранном участке активирующих KIR расположен
заряженный аминокислотный остаток и отсутствуют ITIM. Лигандами для
этих рецепторов служат молекулы HLA-C.
Лектинподобные рецепторы содержат молекулу лектина CD94, соеди-
ненную с молекулой NKG2A (содержит ITIM) или NKG2C (передает акти-
вационный сигнал).
Ингибирующие рецепторы распознают молекулы HLA-I, что вызывает
подавление цитотоксической активности и угнетает выработку цитокинов
NK-клетками (рис. 4-25). Отсутствие или низкий уровень экспрессии соб-
ственных HLA на клетках-мишенях способствует активации NK-клеток.
Рецепторы
CD94 —
NKG2A.B
ILT-2
KIR 3DL
HLA-E
HLA-G
(аЗ-домен)
UL18
HLA-C,
-Bw4, -А
Лиганды
Ингибирующие рецепторы
HLA-C
HLA-E
MICA, MICB,
ULBP
мембрана NK а ПАМ <=> YxxM с=> ITIM
Рис. 4-24. Рецепторы NK-клеток.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 177
Рис. 4-25. Функциональная активность NK-клеток.
ГЛАВА 4
Активирующие рецепторы принадлежат к семействам иммуноглобу-
линоподобных или лектинподобных молекул, которые запускают каскад
сигнальных молекул, сходных с Т-клеточными, через молекулу DAP12,
родственную £-цепи комплекса TCR. При избытке сигналов через акти-
вирующие рецепторы они могут перекрывать ингибирующие сигналы. В
последние годы показана экспрессия HLA-G молекул на клетках трофобла-
ста. Они защищают плаценту от действия NK-клеток. Одним из рецепторов,
распознающих эту молекулу является ILT.
Не менее важна регуляторная функция NK-клеток как продуцентов
ИФН-у и других медиаторов межклеточных взаимодействий. Кроме того,
при вирусной инфекции NK-лимфоциты не только вовлекаются в удаление
инфицированных клеток, но и участвуют в элиминации активированных
эффекторных клеток, предупреждая деструкцию тканей. NK-клетки спо-
собны взаимодействовать с ДК, что способствует активации естественных
киллеров, в частности, при противовирусном иммунном ответе.
Нарушение баланса между ингибирующими рецепторами NKG2A и акти-
вирующими рецепторами NKG2D может быть важно для патогенеза многих
инфекционных, опухолевых и других заболеваний.
Дефицит перфориновой дегрануляции NK-клеток приводит к развитию
тяжелого синдрома семейного гемофагоцитарного лимфогистиоцитоза,
выявляемого приблизительно в одном из 50 000 случаев. Для этой пато-
ЧАСТЬ 1
178 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
логии характерно нарушение цитотоксичности NK- и Т-лимфоцитов, обу-
словливающие развитие системного воспаления, увеличение содержания
CD8+ Т-клеток, макрофагальную инфильтрацию и формирование повы-
шенного уровня провоспалительных цитокинов. Семейный гемофагоци-
тарный лимфогистиоцитоз типа 3 связан с мутацией MUNC13-4.
4.5.3. NKT-лимфоциты
NKT-клетки (англ. Natural Killer T-cell) рассматривают как высококон-
сервативную неклассическую субпопуляцию Т-лимфоцитов, зависимую от
CDld — неклассической антигенпрезентирующей молекулы главного ком-
плекса гистосовместимости класса I. Цитотоксичность NKT-клеток, так же
как NK-клеток, опосредуется через рецепторы, кодируемые множественны-
ми зародышевыми генами. NKT-лимфоциты относятся к уникальной попу-
ляции Т-клеток, которые экспрессируют одновременно TCR и лектиновые
рецепторы С-типа, характерные для NK-клеток.
NKT-клетки распознают гликолипидные антигены. Считают, что NKT-
лимфоциты развиваются в тимусе из гемопоэтических предшественников
и в процессе формирования их а- и 0-цепей происходит инвариантная
перегруппировка генов TCR (Va24-Jal8 у человека и Va24-Ja у мыши).
Важную роль в их развитии играют стромальные клетки тимуса.
Лиганд Val4+ NKT клеток человека — гликосфинголипид
a-галактозилцерамид (aGalCer), презентируемый молекулами CDld, кото-
рые подобны МНС-I. Связывание TCR приводит к быстрой выработке про-
воспалительных цитокинов, влияющих на другие иммунные клетки, в том
числе на NK-, Т- и В-лимфоциты, ДК. Выявление NKT-клеток возможно с
использованием тетрамеров, которые сконструированы из молекул CDld и
aGalCer, выделенного из морских губок. Рецептор NKT-клеток распознает
гликосфинголипиды грамотрицательных бактерий Sphyngomonas, не содер-
жащих ЛПС.
NKT-клетки обнаруживаются в различных органах, включая тимус, селе-
зенку, печень, костный мозг; их мало в лимфатических узлах и слизистой
оболочке кишечника (единичные). NKT-клетки могут мигрировать в зону
воспаления. Содержание NK-, NKT- и Т-клеток памяти повышено в печени,
где их рассматривают как внутрипеченочные лимфоциты. У мышей больше
30% лимфоцитов в печени составляют NKT-клетки. В других тканях они
составляют 0,1-1,0% от отбщего числа лимфоцитов. У человека NKT-
клеток меньше, чем у мышей, и уровень их варьирует от индивида к инди-
виду. Так, в тимусе они составляют приблизительно 0,001% тимоцитов, а в
печени — около 1% лимфоцитов.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ АДАПТИВНОГО И ВРОЖДЕННОГО ИММУНИТЕТА 179
Таким образом, помимо эффекторной, NKT-лимфоциты выполняют
важную иммунорегуляторную функцию во врожденном и адаптивном
иммунном ответе.
уЗТ-лимфоциты являются полноправными участниками реакций
врожденного иммунитета
В зависимости от тканевого распределения и условий микроокружения
уЗТ-клетки выполняют различные функции. У человека выявлены две
главные субпопуляции циркулирующих уЗТ-клеток. TCR одной из них
представлен У82-цепью, связанной преимущественно с Уу9-цепью. Эти
клетки составляют больше 70% циркулирующих уЗТ-лимфоцитов. Другие
уЗТ-клетки экспрессируют У81-цепь в ассоциации с у-цепью, отличающейся
от Vy9. В периферической крови эти клетки составляют 30%, но преоб-
ладают в слизистых оболочках. Vy982+ Т-клетки распознают различные
низкомолекулярные непептидные антигены микроорганизмов (бактерии,
простейшие, вирусы), белки теплового шока и другие антигены без участия
молекул HLA. Эти клетки отвечают на антигенный стимул поликлонально,
пролиферируют, вырабатывают большое количество Thl-цитокинов, осо-
бенно ИФН-у, и дифференцируются в эффекторные ЦТЛ. Возможно, у8Т-
клетки участвуют в патогенезе аллергического воспаления.
V82+ Т-клетки выполняют широкий спектр эффекторных функций врож-
денного иммунитета за счет быстрой выработки хемокинов и цитоки-
нов, лизиса клеток мишеней, активации ДК. Эти Т-лимфоциты оказыва-
ют помощь В-клеткам, способствуя осуществлению реакций адаптивного
иммунитета. V82+ Т-клетки способны формировать yST-клетки памяти.
Не исключается способность yST-клеток презентировать антигены арТ-
лимфоцитам.
В ранний период после рождения, когда механизмы распознавания арТ-
клетками еще несовершенны, yST-лимфоциты выполняют важные иммуно-
регуляторые функции при вирусных инфекциях.
Вопросы для самоконтроля
• Каковы основные эффекторные молекулы гуморального иммунного
ответа?
• Охарактеризуйте структуру и функции иммуноглобулинов разных
классов.
• В чем заключаются различия первичного и вторичного иммунного
ответа гуморального типа?
• Перечислите специфические и эффекторные функции молекул имму-
ноглобулинов.
• Укажите основные условия и механизмы развития Т-клеточной цито-
токсичности.
• Перечислите заболевания, обусловленные дефектами ЦТЛ.
ГЛАВА 4
ЧАСТЬ 1
180 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
• Каков механизм развития ГЗТ? Опишите роль этой реакции в иммуно-
патологии.
• Охарактеризуйте основные субпопуляции регуляторных Т-клеток, их
роль в иммунном ответе и патологии.
• Перечислите основные молекулы макрофагов, участвующие в воспа-
лении.
• Дайте характеристику NK- и NKT-клеткам, опишите их роль в пато-
логии.
• Противомикробные пептиды: классификация, механизм действия. При
каких патологиях выявляют нарушение образования противомикроб-
ных пептидов?
Глава 5
Регуляторные Т-лимфоциты
В центре внимания фундаментальной и клинической иммуноло-
гии в настоящее время находится важнейшая субпопуляция регу-
ляторных CD4+ Т-клеток (Treg), осуществляющих супрессорные
функции. Ранее такие свойства приписывали CD8+ Т-лимфоцитам.
Однако в последние годы пересмотрено представление о ведущей
роли CD8+ Т-клеток в механизмах иммуносупрессии.
Основная функция регуляторных Т-клеток направлена на кон-
троль иммунного ответа, толерантности и преимущественно на
подавление избыточных иммунных процессов.
Известны по крайней мере два варианта регуляторных Т-клеток:
естественные (природные — natural), спонтанно развивающиеся
в тимусе клетки (Treg), и адаптивные, формирующиеся на пери-
ферии (индуцированные) (ТЬЗ- и Trl-клетки). Все эти клетки
происходят из CD4+ Т-лимфоцитов. В табл. 5-1 представлена
характеристика регуляторных CD4+ Т-клеток.
Особое место среди регуляторных Т-клеток занимают естествен-
ные CD25+ CD4+ Foxp3+ Т-лимфоциты. Развитие Treg происходит
в тимусе на стадии двойных позитивных клеток или на стадии
СО4+-лимфоцитов. Во время положительной селекции предше-
ственники Treg взаимодействуют с эпителиальными клетками тиму-
са и экспрессируют высокоаффинный рецептор для ИЛ-2 (CD25).
При взаимодействии с ИЛ-2 в клетках индуцируется экспрессия
гена фактора транскрипции Foxp3 (скурфина), и клетки становятся
устойчивыми к апоптозу. На мембране клеток появляются моле-
кулы, обеспечивающие их супрессорные свойства и миграцию в
зоны воспаления (индуцированный глюкокортикоидами рецептор
фактора некроза опухоли (GITR), CTLA-4 (негативный регулятор
активации Т-клеток), LAG-3 (CD223), связанную с CD4 молекулу
ЧАСТЬ 1
182 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
(связывается с МНС-И и вовлекается в функцию подавления), а также
адгезивные молекулы: аЕр7-интегрин (CD103), CD62L и хемокиновые
рецепторы (CCR4, CCR5, CCR8). Зрелые Treg, способные вырабатывать
супрессорные цитокины ИЛ-10 и ТФР-р, мигрируют на периферию. В
периферической крови среди CD4+ Т-клеток природные регуляторные
Т-лимфоциты составляют 5-10%. Основная функция этих клеток -
супрессия аутоагрессивных клонов Т-лимфоцитов и поддержание
толерантности к антигенам плода при беременности. Снижение коли-
чества и функциональной активности естественных Treg приводит к раз-
витию аутоиммунных процессов и невынашиванию плода.
Ген Foxp3 идентифицирован как дефектный Х-сцепленный рецессивный
мутантый ген «у покрытых перхотью» мышей. Самцы таких мышей, несу-
щие мутацию, погибают в течение 1 мес после рождения, при этом выявляют
чрезмерную активацию CD4+ Т-клеток и повышенную выработку провос-
палительных цитокинов. Впоследствии мутация гена Foxp3 была обнару-
жена у человека — она приводила к тяжелым заболеваниями с летальным
исходом: Х-сцепленному рецессивному синдрому иммунной дисрегуляции,
полиэндокринопатии и энтеропатии (IPEX) и Х-сцепленному синдрому
аутоиммунитета и аллергической дисрегуляции (XLAAD). Среди конкрет-
ных клинических форм преобладают сахарный диабет типа 1, тиреоидит,
воспалительные заболевания кишечника, аллергический дерматит, аллер-
гия к пищевым продуктам, нарушение гемопоэза, тяжелые инфекционные
заболевания.
Адаптивные (индуцибельные) регуляторные Т-клетки образуются
на периферии из зрелых Т-лимфоцитов после антигенной стимуляции (см.
табл. 5-1). Основная функция адаптивных Т-регуляторных клеток -
контроль иммунного ответа, подавление его избыточности. В ходе
адаптивного иммунного ответа возможно превращение (конверсия) Th
в Treg, экспрессирующие Foxp3. Этот процесс происходит при участии
толерогенных дендритных клеток, антигена и цитокинов ТФР-р, ИЛ-2.
Уровень CD25 на поверхности адаптивных регуляторных Т-клеток варьи-
рует.
Trl-клетки, продуцирующие ИЛ-10, развиваются из наивных
CD4+ Т-лимфоцитов в ответ на активацию через TCR и CD28 при участии
ИЛ-10 и ИФН-а. Незрелые и обработанные ИЛ-10 или ИФН-а ДК также
способны индуцировать дифференцировку наивных CD4+ Т-клеток в Trl-
лимфоциты. Эффективность дифференцировки этих клеток возрастает
за счет индуцибельного костимулятора (ICOS) с участием ICOS-лиганда.
Иммуносупрессивные агенты (дексаметазон и витамин D3) усиливают
образование Trl-клеток.
Супрессорная функция Treg реализуется при стимуляции через TCR. При
поликлональной или антигенспецифической стимуляции регуляторные
Т-клетки подавляют пролиферацию и выработку цитокинов эффектор-
РЕГУЛЯТОРНЫЕ Т-ЛИМФОЦИТЫ 183
ними CD4+ и CD8+ Т-клетками, супрессируя транскрипцию гена, коди-
рующего ИЛ-2, а также угнетают пролиферацию и выработку антител
В-лимфоцитами. Супрессорный эффект антигенспецифичен и индуцирует-
ся специфическим пептидом в низкой концентрации.
Механизм супрессии Т-эффекторов зависит не только от цитокинов, но
и от прямого межклеточного контакта. В частности, мембранный ТФР-р в
активной форме может участвовать в осуществлении супрессорного эффек-
та регуляторных Т-клеток.
Считают, что Trl-клетки играют ключевую роль в периферической толе-
рантности на пищевые антигены и антигены комменсалов. При участии
Trl-лимфоцитов ограничивается повреждение тканей в процессе воспали-
тельного ответа на патогены (в том числе внутриклеточные, индуцирующие
ответ преимущественно Thl-клеток) или на некоторые внеклеточные пара-
зиты, индуцирующие главным образом ответ ТЬ2-клеток.
ТЬЗ-клетки представляют субпопуляцию Th, секретирующих пре-
имущественно ТФР-р. Эта субпопуляция Т-клеток регуляторов супрес-
сирует преимущественно функцию Thl и соответственнно развитие Thl-
воспалительного ответа.
ГЛАВА 5
Таблица 5-1. Характеристика регуляторных CD4* Т-клеток
Характеристика Естественные регуляторные CD4* CD25* Т-клетки (Treg) TH - и ТИЗ-клетки
Место образования Тимус Периферические лимфоидные органы
Экспрессия Foxp3 Постоянная Непостоянная
Другие экспрессируемые поверхностные молекулы CD25hl°h, CD45RB'0*, CTLA-4, СОЗЯСЛ, LAG-3 (CD223), глюкокортикоид- индуцированный рецептор ФНО, аЕр7-интегрин (CD103), хемокино- вые рецепторы (CCR4, CCR5, CCR8) Экспрессия CD25 непостоянна, CD45ROhiflh
Зависимость эффекта от межклеточных взаимо- действий Зависит Не зависит
Зависимость от ИЛ-2 ИЛ-2 необходим для развития супрессии Супрессия не зависит от ИЛ-2
Активация специфиче- ским антигеном Не требуется Требуется
Секретируемые цитокины ИЛ-10, ТФР-р ИЛ-10, ТФР-р
b'fh — высокая экспрессия;,ow — низкая экспрессия.
Естественные регуляторные клетки имеются также среди CD8* Т-клеток.
Так, СВ8+СВ122+-клетки рассматриваются как регуляторные Т-лимфоциты,
эффективно подавляющие пролиферацию и образование ИФН-у CD4* и
CD8* Т-клетками. Супрессорное действие осуществляется через взаимодей-
184 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
ствие обычных молекул МНС-I и apTCR. Непосредственно супрессорный
эффект проявляется через действие ИЛ-10. Описаны и другие субпопуля-
ции Т-клеток с регуляторной функцией: CD8+ CD28" Т-клетки, двойные
негативные CD3+ CD4- CD8- Т-клетки. Клетки врожденного иммунитета
(NK, NKT и уЗТ-клетки) также обладают супрессорными свойствами.
Таким образом, регуляторные Т-клетки играют важную роль не только в
развитии и поддержании нормального иммунного ответа, но и в развитии
аутоиммунитета, противоопухолевого иммунитета, аутотолерантности, при
трансплантации и инфекционной патологии. У человека мутация гена Foxp3
приводит к тяжелому аутоиммунному и аллергическому заболеванию с
тотальной иммунной дисрегуляцией.
Управление функцией регуляторных Т-лимфоцитов — одна из первей-
ших задач клинической иммунологии и иммунотерапии. Например, при
злокачественных новообразованиях возрастает активность регуляторных
Т-клеток, подавляющая противоопухолевый иммунитет против конкретной
формы рака — тогда необходимо подавлять активность этих клеток (имму-
носупрессия). Такая же ситуация возможна при инфекционной патологии,
при вакцинации. Однако в других случаях, например, при аутоиммунной
патологии (СКВ, ревматоидный артрит и др.), в условиях активного оттор-
жения трансплантата, активность регуляторных Т-клеток уменьшается, и в
этом случае необходимо усилить это звено иммунного процесса (иммуно-
стимуляция).
Таким образом, в клинической иммунологии интенсивно разрабатывают
подходы к диагностике функций регуляторных Т-клеток человека, а также
к предупреждению и лечению иммуноопосредованных заболеваний с избы-
точной или недостаточной функцией регуляторных Т-лимфоцитов.
Обобщение к главам 3-5
Развитие иммунного ответа
на генетически чужеродные
субстанции
Врожденный и приобретенный иммунитет представляет собой две взаи-
модействующие части одной системы, обеспечивающей развитие иммунно-
го ответа на генетически чужеродные субстанции. Врожденный иммунитет,
являясь самой ранней формой иммунной защиты организма, сформировал-
ся на начальных этапах эволюции многоклеточных организмов, до появ-
ления способности узнавания «своего» и полноценной иммунной памяти.
Механизмы врожденного иммунитета крайне важны для защиты от пато-
генных микроорганизмов и продуктов тканевой деструкции, но недо-
статочны для обеспечения жизнедеятельности высокоорганизованных
многоклеточных организмов, таких, как позвоночные. Главной функцией
иммунной системы многоклеточных является контроль над генетическим
постоянством внутренней среды многоклеточного организма. Способность
распознать «свое», удалить антигенное «чужое» и сформировать иммунную
память — вот основные признаки адаптивного иммунитета.
Иммунный ответ развивается на генетически черодные субстанции,
проникающие во внутреннюю среду организма и возникающие в процессе
жизни. В развитии иммунного ответа можно выделить индуктивную и
эффекторную стадии.
В индуктивную стадию иммунного ответа патогены или иные чуже-
родные агенты, попавшие в организм через различные барьерные ткани
(кожу, слизистые оболочки), встречаются с факторами врожденного имму-
нитета как гуморальными (белки системы комплемента, противомикроб-
ные пептиды), так и клеточными (фагоцитарными клетками, NK, NKT,
у8 Т-лимфоцитами и др.). Первым иммунологически значимым событием
является распознавание патогенов с помощью паттерн-распознающих
рецепторов (TLRs, NOD, RIG и др.) эпителиальных клеток и клеток
врожденного иммунитета. Это распознавание индуцирует выработку про-
воспалительных цитокинов, хемокинов. Происходит привлечение в зону
Ив да*
ЧАСТЬ 1
186 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
проникновения патогенов нейтрофилов, макрофагов, дендритных клеток,
лимфоцитов. Активируется фагоцитоз и выработка цитокинов. Иммунные
процессы в этом случае развиваюся локально в коже и на слизистых.
В дальнейшем патогены с помощью дендритных клеток транспортиру-
ются в региональные лимфатические узлы и презентируются наивным
Т-лимфоцитам. Происходит активация антиген-специфических клонов
Т- и/или В-лимфоцитов, их пролиферация и дифференцировка в клетки
эффекторы. Таким образом формируется адаптивный иммунный ответ.
Подробно процессы, происходящие в индуктивную фазу, описаны в главах
3 и 4.
В эффекторную стадию иммунного ответа происходит элиминация
патогенов, которая осуществляется в основном при участии механизмов
врожденного иммунитета, усиленными за счет компонентов адаптивно-
го иммунитета. Так, фагоцитоз макрофагов активируется при действии
ИФН-у, вырабатываемого ТЫ. Антитела опсонизируют патогены и акти-
вируют Fc-опосредованный фагоцитоз, также активируют комплемент-
опосредованный лизис патогенов. Цитотоксические Т-лимфоциты уда-
лаяют клетки, содержащие внутриклеточные патогены. Все эффекторные
механизмы, опосредуемые антителами и Т-лимфоцитами, описаны ранее в
разделе 4.4. Для своевременного завершения иммунного ответа включают-
ся иммунорегуляторные механизмы (гл. 5).
Различные механизмы иммунного ответа развиваются в зависимости
от природы патогена, путей его проникновения в организм, локализации
в клетке или вне клетки, природы дендритных клеток, презентирующих
антиген, спектра цитокинов и ряда других факторов. Большинство бакте-
рий и крупных паразитов не проникают в клетки и могут быть нейтрализо-
ваны антителами и факторами врожденного иммунитета Многие патогены
(некоторые простейшие и бактерии) размножаются внутри клетки (мико-
бактерии, лейшмании и др.), могут быть уничтожены с помощью цитоки-
нов, секретируемых ТЫ, и бактерицидных факторов фагоцитов. Основной
механизм элиминации вирусов, встроенных в ДНК клетки-хозяина, — уни-
чтожение инфицированных клеток цитотоксическими Т-лимфоцитами и
естественными киллерами.
На примере герпетической инфекции рассмотрим особенности и этапы
развития противовирусного иммунного ответа (см. рисунок). Цикл репро-
дукции вируса в клетке хорошо изучен и включает стадию проникновения
вируса в клетку. Вирус герпеса простого проникает в клетку, используя
различные рецепторы для проникновения. Оболочка вируса сливается с
мембраной клетки, и вирусная ДНК, проникая через ядерную мембрану,
встраивается в ДНК хозяина. Начинается стадия синтеза вирусных белков
и репликации вирусной ДНК. Затем происходит сборка капсида в ядре и
выход вируса из клетки.
Ян*
РАЗВИТИЕ ИММУННОГО ОТВЕТА НА ГЕНЕТИЧЕСКИ ЧУЖЕРОДНЫЕ СУБСТАНЦИИ 187
Рис. Развитие иммунного ответа на вирус
ОБОБЩЕНИЕ К ГЛАВАМ 3-5
Механизмы врожденного иммунитета представляют первую линию
защиты от проникновения патогенов. Вначале вирус подвергается атаке
таких белков врожденного иммунитета, как комплемент, противомикроб-
ные пептиды, природные IgM. На эпителиальных клетках слизистых
и клетках врожденного иммунитета (макрофагах, дендритных клетках,
нейтрофилах и др.) экспрессируются различные паттерн-распознающие
рецепторы (TLR 1-9). Эти рецепторы распознают общие молекулярные
последовательности — паттерны. Так, TLR2 распознает гликопротеины обо-
лочки вируса герпеса простого, TLR9 распознает неметиллировааные CpG-
мотивы вирусной ДНК. В результате взамодействия с рецепторами проис-
ходит активация сигнальных путей через ядерный фактор транскрипции
NF-kB и увеличивается экспрессия генов провоспалительных цитокинов и
интерферонов 1-го типа, блокирующих репликацию вируса в клетке и обла-
дающих протективным действием по отношению к неинфицированным
клеткам. Плазмацитоидные дендритные клетки являются главными проду-
центами интерферонов 1-го типа, активирующих NK- и NKT-лимфоциты.
Активация NK-клеток наблюдается в течение двух суток вирусной инфек-
ции. Развиается локальная воспалительная реакция. Миелоидные дендрит-
ные клетки, пришедшие в очаг инфиицрования, фагоцитируют разрушен-
ные вирус-инфицированные клетки, и вирусные пептиды встраиваются в
188 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
молекулы HLA классов I и II, затем эти клетки созревают и мигрируют в
региональный лимфатический узел, где происходит презентация вирусных
пептидов специфическим клонам ThO и CD84 Т-лимфоцитов (см. рисунок).
С этого момента включаются механизмы адаптивного иммунного ответа.
Происходит активация, пролиферация и дифференцировка специфических
клонов наивных Thl- и ТЬ2-лимфоцитов. ТЫ вырабатывают цитокины
ИЛ-2 и ИФН-у, которые активируют NK, макрофаги и цитоксические
Т-лимфоциты. Th2 секретируют ИЛ-4, -5, -6 и вызывают развитие гумо-
рального иммунного ответа.
В элиминации вирус-инфицированных клеток участвуют цитотоксиче-
ские Т-лимфоциты, естественные киллеры, активированные макрофаги.
Антитела, вырабатываемые плазматическими клетками, связывают и ней-
трализуют внеклеточные вирусные частицы, участвуют в развитии антитело-
зависимой клеточной цитотоксичности, комплемент-опосредованного
лизиса инфицированных клеток и Fc-опосредованного фагоцитоза
(см. рис. 4-6 в гл. 4). В результате иммунного ответа формируются специ-
фичные клетки памяти. Однако в процессе эволюции вирусы выработали
механизмы уклонения от иммунного надзора. Антигенная вариабельность
и переход в латентное состояние — наиболее эффективные механизмы.
Помимо этого, вирусы блокируют систему интерферонов, экспрессию
вирусных пептидов в комлексе с HLA молекулами на поверхности клет-
ки, синтезируют аналоги цитокинов и их рецепторов, блокируют апоптоз
вирус-инфицированных клеток.
В последние годы внимание ученых-иммунологов обращено на разра-
ботку инновационных технологий, направленных на регуляцию системы
врожденного иммунитета. Это применение агонистов и антагонистов Toll-
подобных рецепторов, растворимых рецепторов врожденного иммунитета.
Глава 6
Апоптоз и его роль
в иммунной системе
По классификации, предложенной в 2005 г. Комитетом по
номенклатуре клеточной гибели NCCD (Nomenclature Committee on
Cell Death) и основанной на морфологических проявлениях, выде-
ляют различные формы клеточной гибели: апоптоз, аутофагию,
некроз, митотическую катастрофу, ороговение и др.
Важно отличать две самые распространенные из них — некроз
и апоптоз.
Некроз развивается под действием на клетку внешних повреж-
дающих агентов или неадекватных условий среды, таких, как
гипоосмия, крайние значения pH, гипертермия, механические
воздействия, формирование пор в мембране с участием факторов
комплемента, действие других агентов, повреждающих мембрану.
Термин «апоптоз» (в переводе с греч. — «опадание листьев»)
введен в 1972 г. Дж. Керр (J. Kerr) и соавт., которые исследовали
личинок круглых червей нематод и наблюдали в определенной
стадии развития одновременную гибель одного и того же числа
клеток. Возникла мысль о запрограммированной клеточной гибе-
ли. В пролиферирующих тканях млекопитающих тоже происходит
запрограммированная гибель клеток. Так, апоптозу подвергают-
ся стадиеспецифичные ткани в эмбриогенезе, пролиферирующие
клетки в отсутствие факторов роста, Т- и В-лимфоциты в процессе
селекции, короткоживущие клетки крови. Апоптоз может быть
индуцирован активацией лимфоцитов.
Таким образом, под апоптозом понимают форму гибели клетки
в ответ на действие физиологических сигналов или в результате
включения генетической программы. Морфологические изменения
190 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
при апоптозе: округление клеток, сокращение псевдоподий, уменьшение
клеточных объемов (пикнозис), конденсация хроматина, фрагментизация
ядра (кариорексис), модификация клеточных органелл (рис. 6-1).
Ключевые отличия апоптоза от некроза заключается в том, что процесс
апоптоза начинается с дезорганизации хроматина и, как следствие, фраг-
ментации ядра, затем клетка распадается на апоптотические тельца, в даль-
нейшем фагоцитируемые. Таким образом, в случае апоптоза гибель клетки
не приводит к воспалению и практически не влияет на окружающие клетки.
Обычно апоптотировавшие клетки фагоцитируются макрофагами и други-
ми клетками. При некрозе ключевой момент — увеличение проницаемости
мембраны и ее разрыв. Это приводит к скоплению вокруг гибнущих клеток
их активных внутриклеточных компонентов (включая энзимы), закисле-
нию среды и развитию воспаления.
В нормальной физиологии клетки роль апоптоза столь же велика, как
и роль митоза. Апоптоз необходим при элиминации из организма кле-
ток, пораженных различными патогенами; старых клеток, прекращающих
выполнять свои функции; клеток гормонально-зависимых тканей при сни-
жении концентрации гормонов.
Гибель лимфоцитов при апоптозе — важный механизм регуляции
в иммунной системе и средство поддержания иммунного гомеостаза
в организме.
Рис. 6-1. Морфологические проявления апоптоза (а) и некроза (б).
АПОПТОЗ И ЕГО РОЛЬ В ИММУННОЙ СИСТЕМЕ 191
6.1. МЕХАНИЗМЫ РАЗВИТИЯ АПОПТОЗА
В развитии апоптоза можно выделить три стадии: индукторную,
эффекторную и стадию деградации.
• В стадии индукции апоптоза происходит рецепция сигнала и началь-
ные этапы его передачи.
• В эффекторной стадии активируются каспазы. Этот процесс вызывает
необратимые изменения в клетке.
• В стадии деградации реализуются механизмы гибели клетки.
Условно механизмы индукции апоптоза можно разделить на две группы:
• рецепторные (при действии внешних факторов на специализирован-
ные мембранные рецепторы);
• митохондриальные (при активации внутриклеточных сигналов)
(см. рис. 4-12).
Стадия I (индукция). Наиболее детально изучен рецепторный меха-
низм индукции апоптоза при действии внешних факторов. Рецепторы,
запускающие апоптоз, принадлежат к суперсемейству рецепторов фактора
некроза опухоли и обозначаются как рецепторы смерти (Death Receptor —
DR). Характерная особенность этих рецепторов — наличие внутриклеточ-
ного домена, называемого доменом «смерти» (англ. Death Domain — DD),
активация этого домена индуцирует внутриклеточные сигналы, приводя-
щие к апоптозу. Описано 6 DR; среди них рецептор Fas (Аро-1 или CD95),
ФНО-Р1 (р55 или CD120a) и другие рецепторы (TRAIL-R1/DR4, TRAIL-
R2/DR5, Apo-2/TRICK2/KILLER, LT0R, CAR1 и DR6). Самые известные
лиганды рецепторов смерти — Fas-лиганд (FasL или CD95L) и ФНО-а. Они
представляют собой мембранные белки, экспрессируемые теми же клетка-
ми, на которых находятся рецепторы, или клетками ближайшего окру-
жения. Таким образом, апоптоз может индуцироваться по аутокринному
или паракринному механизму. В последние годы показано, что не только
рецепторы суперсемейства фактора некроза опухоли могут запускать про-
цесс апоптоза — этой способностью обладают и TLR. Цитоплазматический
домен TLR2 через каскад адапторных белков (MyD88 и FADD) активирует
протеолитический каскад каспаз, что приводит к апоптозу клеток. Этот
механизм показан для клеток плаценты. Активация TLR4 индуцирует
синтез провоспалительного цитокина ФНО-а, который, связываясь со
своим рецептором, запускает апоптоз. В макрофагах, инфицированных
М. tuberculosis, тоже инициируется TLR-опосредованный апоптоз.
Внутренний путь активации апоптоза в основном связан с процесса-
ми, происходящими в митохондриях, и инициация апоптоза происходит с
помощью внутриклеточных сигналов. К таким сигналам относят недоста-
ток факторов роста, гормонов и цитокинов. Уменьшение количества этих
факторов приводит к несостоятельности механизма супрессии апоптоза, и
ГЛАВА 6
192 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
клетка запускает программу клеточной гибели. Радиация, гипоксия, гипо-
термия, вирусная инвазия и свободные радикалы непосредственно запуска-
ют внутренние механизмы апоптоза.
Все эти факторы приводят к изменениям на внутренней мембране мито-
хондрий. Результат этих изменений — открытие пор в мембране митохон-
дрий, потеря митохондриями мембранного потенциала и высвобождение из
межмембранного пространства в цитозоль проапоптотических факторов.
Можно выделить две группы факторов, высвобождаемых из межмем-
бранного пространства митохондрий. Первую группу представляют белки,
имеющие проапоптотическое действие и запускающие каспазозависимый
путь апоптоза. К этой группе относят цитохром С, фактор Smac/DIABLO
и сериновую протеазу HtrA2/Omi. Высвобожденный цитохром С связыва-
ется с фактором APAF-1, что приводит к кластеризации и, как следствие, к
активации каспазы-9. Комплекс цитохрома С с белком APAF-1 и каспазой-9
называют апоптосомой (рис. 6-2).
Сигналы к апоптозу
Fas-лиганд
(повреждения, стресс)
Рис. 6-2. Механизмы развития апоптоза.
АПОПТОЗ И ЕГО РОЛЬ В ИММУННОЙ СИСТЕМЕ 193
Проапоптотическая функция Smac/DIABLO и HtrA2/Omi сводится к
блокированию ингибиторов апоптоза — белков семейства IAP.
Вторую группу белков составляют AIF (англ. Apoptosis Inducing Factor),
эдонуклеаза G и CAD (англ. Caspase Activated DNAse). Эти белки высво-
бождаются из митохондрий в поздних стадиях, когда клетка уже на пути
к гибели. Белок AIF и эндонуклеза G, проникая через ядерную мембрану,
индуцируют разрезание ДНК на фрагменты размером 180-200 пар нуклео-
тидов и конденсацию периферических участков хроматина. Такая ранняя
конденсация в ядре получила название конденсации первого уровня. Белок
CAD расщепляется каспазой-3, проникает в ядро и вызывает выраженную
конденсацию хроматина. Эти более поздние и более ярко выраженные
изменения в ядре называют конденсацией второго уровня.
Стадия II (эффекторная). Оба пути активации апоптоза запускают
каскад основных ферментов апоптоза — каспаз, принадлежащих к группе
цистеиновых протеаз. На данный момент у человека описано 11 каспаз:
7 каспаз вовлечено в апоптоз, 3 — в активацию провоспалительных цито-
кинов и одна участвует в дифференцировке кератиноцитов.
В процессе апоптоза различные каспазы выполняют разные функции. В
зависимости от того, на каком этапе эти белки вступают в каскад апоптоза,
выделяют инициаторные и эффекторные каспазы (рис. 6-3). К инициатор-
ным относят каспазы 8,9,10 к эффекторным - каспазы 3,7.
ГЛАВА 6
Рис. 6-3. Схема активации каскада каспаз.
194 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Механизм запуска неактивной каспазы можно рассмотреть на примере
каспазы-8. В настоящее время предложен механизм созревания каспазы,
представленный на рис. 6-2. При распознавании рецептором, запускающим
апоптоз, своего лиганда внутриклеточный домен рецептора взаимодейству-
ет с адапторным белком FADD. Комплекс, образуемый при данном взаимо-
действии, получил название DISC (Death-Inducing Signalling Complex). Одна
из молекул прокаспазы-8 связывается с комплексом DISC, что приводит к
изменению конформации прокаспазы и ее взаимодействию с другой моле-
кулой неактивной каспазы-8. Только димеризованная молекула каспазы-8
активируется и расщепляет прокаспазу-3. В отличие от инициаторных каса-
паз, механизмом активации которых служит димеризация, для активации
эффекторной каспазы-3 необходимо ее протеолитическое расщепление.
В активации каспазы-3 могут участвовать и другие инициаторные каспа-
зы — 9 и 10.
Стадия III (деградации). Каспаза-3 специфически активирует эндону-
клеазу CAD. В пролиферирующих клетках эта эндонуклеаза сопряжена с ее
ингибитором — ICAD (англ. Inhibitor of Caspase Activated DNAse). В апопто-
тических клетках активная каспаза-3 разрезает ингибитор фермента, что
высвобождает эндонуклеазу CAD. Активность фермента приводит к дегра-
дации хромосомальной ДНК, вызывая конденсацию хроматина.
Активация эндонуклеаз не единственная функция каспазы-3.
Ферментативная активность каспазы приводит к реорганизации цитоске-
лета и преобразованию клетки в апоптотические тельца.
Все вышеописанные пути апоптоза обусловливают определенные, харак-
терные для всех механизмов биохимические изменения. Каспазы обладают
протеолитической активностью и способны расщеплять белки по остаткам
аспарагиновой кислоты. Вследствие этой функции каспаз в клетке возни-
кает одно из проявлений апоптоза — массивное разрушение белка. Другой
признак апоптоза — активное перекрестное связывание пептидов. Это про-
исходит из-за экспрессии и активации тканевой трансглутаминазы.
Деградацию ДНК осуществляют Са2+- и Mg^-зависимые эндонуклеа-
зы. В результате вся ДНК клетки распадается на фрагменты размером в
180-200 пар нуклеотидов. Важное биохимическое явление в процессе
апоптоза — появление на поверхности апоптотической клетки маркеров,
необходимых для ее фагоцитоза. Достигается это за счет перемещения
молекул фосфатидилсерина на внешнюю поверхность клеточной мембра-
ны. Фосфатидилсерин — один из основных лигандов для распознавания
клетки-мишени фагоцитами. Однако не только фосфатидилсерин презен-
тируется на поверхности клеточной мембраны. Также в течение апоптоза
на поверхности клетки появляются такие белки, как аннексии V и калре-
тикулин. Аннексии V — белок, связывающий фосфатидилсерин. Его часто
АПОПТОЗ И ЕГО РОЛЬ В ИММУННОЙ СИСТЕМЕ 195
используют как маркер апоптоза. Часто на мембране апоптотирующей
клетки экспрессируется и адгезивный гликопротеин — тромбоспондин-1.
Последний этап апоптоза — захват апоптотических клеток фагоцитами.
Маркеры этой фазы — изменение структуры фосфолипидов и представле-
ние на поверхности мембраны фосфатидилсерина.
Клетки, подвергшиеся апоптозу, быстро фагоцитируются макрофага-
ми. Рецепторы, участвующие в распознавании апоптотировавших клеток,
включают рецепторы-«мусорщики», рецепторы витронектина, CD14 и др.
При этом фагоциты секретируют противовоспалительные цитокины —ТФР
и др. Неэффективное удаление апоптотировавших клеток способствует раз-
витию аутоиммунных заболеваний, например СКВ.
Т-лимфоциты могут проявлять цитотоксичность с помощью механизма,
связанного с секрецией перфоринов и гранзимов. Этот путь используется
для поражения опухолевых и поврежденных вирусом клеток. Перфорины
формируют трансмембранные поры, через которые в последующем в
цитоплазму клетки-мишени проникают гранулы. Основные компоненты
этих гранул — сериновые протеазы гранзим А и гранзим В. Ц)анзим В рас-
щипляет белки по аспартатным остаткам, активирует каспазу-10 и может
разрушать фактор ICAD. Некоторые исследования показали, что гранзим В
может запускать и митохондриальный путь апоптоза за счет специфическо-
го разрезания фактора Bid и индукции высвобождения цитохрома с. Также
гранзим В может напрямую активировать каспазу-3.
6.2. РЕГУЛЯЦИЯ АПОПТОЗА
Основные два молекулярных механизма апоптоза имеют свои пути регу-
ляции. Митохондриальный путь апоптоза регулируется с помощью белков
семейства Вс1-2. Представители этого семейства влияют на проницаемость
митохондриальной мембраны и могут оказывать проапоптотическое и
антиапоптотическое действие. В настоящее время известно 25 генов, коди-
рующих белки семейства Вс1-2.
Антиапоптотическим действием обладают Вс1-2 (В-cell lymphoma
protein 2), Bcl-X (BCL2 like 1), Bcl-XL (BCL2 related protein, long isoform), Bcl-
XS (BCL2 related protein, short isoform), Bel-W (BCL2 like 2 protein), BAG (BCL2
associated athanogene).
Протективный эффект Bcl-XL и Bcl-2 заключается в их влиянии
на активацию каспаз.
Считают, что основной механизм регуляции апоптоза с помощью белков
семейства Вс1-2 заключается в контроле высвобождения цитохрома с из
митохондрий за счет изменения проницаемости мембраны.
Достаточно изучено действие белка Bad: в нефосфорилированной форме
он проникает в митохондрии и приводит к высвобождению цитохрома с.
ГЛАВА 6
196 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Белок Bad может также образовывать димеры с белками Bcl-XL или Вс1-2,
нейтрализуя их защитный эффект и приводя к запуску апоптоза в клетке.
Открыт новый класс ингибиторов апоптоза IAP (Inhibitor of Apoptosis
Protein). В него входят такие белки, как XIAP (X-linked IAP), c-IAPl, C-IAP2
и ML-IAP. Выделяют 2 пути ингибирования каспаз в клетке с помощью
IAP. По первому механизму каспазы элиминируются из клетки по убик-
витиновому механизму с помощью протеасом. Второй механизм состоит в
блокировании ферментной активности каспаз ингибиторами. Основная же
функция белка XIAP у человека — угнетение ферментативной активности
каспаз.
Проапоптотическое влияние оказывают Bcl-10 (В-cell lymphomaprotein
10), Вах (BCL2 associated Xprotein), Bak (BCL2 antagonist killer 1), Bid (BH3
interacting domain death agonist), Bad (BCL2 antagonist of cell death), Bim (BCL2
interacting protein BIM), Bik (BCL2 interacting killef) и Blk (Bik-like killer
protein).
Регуляция рецепторного механизма апоптоза осуществляется преимуще-
ственно путем контроля функций основных белков апоптоза — каспаз.
Выделяют проапоптотические и антиапоптотические факторы, уча-
ствующие в регуляции апоптоза. К проапоптатическим факторам относят
цитохром с, APF-1, р53, Smac/DIABLO, HtrA2/Omi, APAF-1, AIF, Bcl-10,
Bax, Bak, Bid, Bad, Bim, Bik; к антиапоптотическим — Bcl-2, Bcl-X, Bcl-XL,
Bcl-XS, Bcl-W, BAG, IAPs, FLIP.
6.3. РОЛЬ АПОПТОЗА В ИММУННЫХ ПРОЦЕССАХ
Апоптоз — крайне важный механизм иммунной регуляции. Развитие
клеток иммунной системы происходит при постоянном участии апоптоза.
Подробно изучена роль апоптоза в различных стадиях дифференцировки
лимфоцитов. В стадии про-Т- и про-В-лимфоцитов при отсутствии ИЛ-7
происходит избыточная гибель клеток. Апоптоз служит основным меха-
низмом выбраковки клеток с дефектами перестройки генов антигенраспоз-
нающих рецепторов (TCR, BCR). Свыше 97% лимфоцитов погибает при
апоптозе в тимусе в результате селекции: при положительной селекции
погибают лимфоциты, не распознающие аутологичных молекул HLA со
средней степенью аффинности; при отрицательной селекции с помощью
апоптоза происходит выбраковка аутоагрессивных клонов. При дифферен-
цировке субпопуляций Т-хелперов и ЦТЛ апоптозу подвергаются клетки в
случае несоответствия их костимулирующих молекул (CD4 и CD8).
Клетки, выполнившие свою функцию в иммунном ответе, подвергаются
апоптозу. Большинство активированных клеток погибает при апопто-
зе в результате элиминации антигена. При отсутствии антигена клетки
не получают сигналов, необходимых для их выживания. В этом случае
АПОПТОЗ И ЕГО РОЛЬ В ИММУННОЙ СИСТЕМЕ 197
митохондрии клетки высвобождают цитохром с, который в комплексе
с APAF-1 (Apoptosis Protein Activating Factor — активирующий апоп-
тоз фактор 1) вызывает активацию каспаз. При длительной антигенной
стимуляции клетки подвергаются апоптозу по механизму индуцирован-
ной активацией клеточной гибели. Этот механизм обусловлен тем, что в
нем участвует семейство рецепторов фактора некроза опухоли. Наиболее
важный из них — рецептор Fas, при связывании со своим лигандом FasL
вызывает активацию каскада каспаз и в итоге — гибель клетки. FasL может
экспрессироваться на поверхности различных клеток, однако существуют
данные, что Т-лимфоциты могут сами секретировать растворимый FasL и
тем самым запускать собственную гибель при длительной стимуляции.
Нарушения регуляции гибели клетки — важный компонент многих забо-
леваний: опухолевых, лимфопролиферативного синдрома, СПИДа, ишемии
и нейродегенеративных заболеваний (болезнь Паркинсона, Альцгеймера,
Хантингтона). При одних заболеваниях функция апоптоза снижена, при
других, наоборот, выражена чрезмерная гибель клеток путем апоптоза.
Подавление апоптоза играет центральную роль в развитии и прогрессиро-
вании раковых образований. Существует множество молекулярных меха-
низмов, с помощью которых в опухолевых клетках происходит подавление
апоптоза. Клетки могут приобрести устойчивость к апоптозу путем усилен-
ной экспрессии антиапоптотических факторов или в результате мутаций в
генах проапоптотических молекул. Так, в опухолевых клетках снижена экс-
прессия рецептора Fas либо изменена его конформация, что делает невоз-
можным взаимодействие с лигандом. Важную роль в канцерогенезе играет
и белок р53 — фактор транскрипции. Он регулирует клеточный цикл и
активирует белки, участвующие в репарации ДНК. Однако, если поврежде-
ния ДНК восстановить невозможно, белок р53 запускает процесс апоптоза.
Мутации гена р53 резко ослабляют процесс элиминирования опухолевых
клеток. В процессе канцерогенеза могут участвовать и другие механизмы
подавления апоптоза. Еще одно заболевание, при котором резко снижен
уровень апоптоза, — аутоиммунный лимфопролиферативный синдром.
При этом заболевании не происходит апоптоза аутоагрессивных Т-клеток,
что приводит к развитию разнообразных аутоиммунных процессов, таких,
как тромбоцитопения, гемолитическая анемия и аутоиммунная нейтропе-
ния.
ГЛАВА 6
Глава 7
Основы иммуногенетики
в клинической иммунологии.
Система лейкоцитарных антигенов
человека
Иммуногенетика — одно из важных направлений современ-
ной иммунологии, изучающее генетический контроль иммунного
ответа. Основная генетическая структура, ответственная за этот
контроль, — главный комплекс гистосовместимости — МНС (англ.
Major Histocompatibility Complex).
Американский генетик Ж. Снелл вместе с П. Горером иден-
тифицировал у мышей локус, наиболее важный для отторжения
чужеродной ткани, и обозначил его как Н-2 (hystocompatibility —
тканевая совместимость).
Ж. Доссе, французский врач и исследователь, в 1950-х годах
обнаружил в крови реципиента после гемотрансфузии изоантитела
против лейкоцитов человека и в 1954 г. обозначил первый антиген
как Мас по имени больного (теперь HLA-B2). По мере исследова-
ний показана аналогия между главным комплексом гистосовмести-
мости мыши и человека.
Первые продукты генов главного комплекса гистосовместимо-
сти человека были названы HLA (Human Leukocyte Antigenes).
Система HLA обеспечивает регуляцию иммунного ответа, осу-
ществляя важнейшие функции:
• презентацию антигена Т-лимфоцитам;
• селекцию и обучение Т- и В-лимфоцитов в отношении «свое-
го» и «не своего»;
• взаимодействие клеток иммунной системы организма;
• распознавание «своего» и «не своего», в том числе изменен-
ных «своих» клеток;
• участие в реакциях «хозяин против трансплантата» и «транс-
плантат против хозяина»;
ОСНОВЫ ИММУНОГЕНЕТИКИ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ... 199
• запуск, реализацию и генетический контроль иммунного ответа;
• формирование иммунной толерантности, в том числе в период бере-
менности, к полуаллогенному плоду;
• обеспечение выживания человека как вида в условиях экзогенной и
эндогенной агрессии.
Всё многообразие указанных функций обеспечивается строением глав-
ного комплекса гистосовместимости, в первую очередь генетическим и
популяционным разнообразием или полиморфизмом данной генетической
системы и ее продуктов — антигенов HLA.
Рассмотрим строение главного комплекса гистосовместимости человека
более подробно. Система HLA — одна из сложных и наиболее изученных
генетических систем в геноме человека.
На рис. 7-1 представлена современная карта строения комплекса HLA
человека, расположенного в 6-й хромосоме.
HLA включает три класса генов:
• гены класса I (HLA-A, HLA-B, HLA-С) наиболее удалены от центро-
меры, отличаются очень высоким полиморфизмом и кодируют синтез
молекул HLA класса I. В дополнение к классическим локусам HLA-A,
HLA-B, HLA-С к первому классу относят «неклассические» гены
HLA-E, HLA-F, HLA-G, HLA-H (см. рис. 7-1). Они менее полиморфны.
Молекулы генов HLA-Е презентируют лидерные пептиды собственных
классических молекул МНС-I и распознаются с помощью рецептора
CD94/NKG2, ингибирующего активность NK-клеток. Клетки, лишен-
ные молекул HLA-I (инфицированные вирусом, опухолевые), не экс-
прессируют HLA-Е, и NK-клетки получают сигнал, подавляющий их
активность. HLA-G экспрессируют только клетки трофобласта; он
подавляет действие NK-клеток;
• гены класса II (HLA-DP, HLA-DQ, HLA-DR) контролируют синтез
молекул HLA класса II. К этой же группе генов относят LMP и ТАР,
кодирующие белки, которые ответственны за процессирование эндо-
генных антигенов;
• гены класса III кодируют молекулы врожденного иммунитета (компо-
ненты комплемента С2, С4, ФНО, лимфотоксин, фактор В, вовлекае-
мый в альтернативный путь активации комплемента, белки теплового
шока и др.).
Ранее, со времени открытия этой системы Ж. Доссе, основным объек-
том изучения служили белки HLA, выявляемые с помощью антител или
клеточных реакций. С внедрением в исследование системы HLA методов
молекулярной биологии и генетики: полимеразной цепной реакции (ПЦР),
прямого сиквенса генов — стало возможным изучение самих генов, их
полиморфизма.
ГЛАВА 7
200 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Область генов класса II
DPB1 DMA LMP7 DQB2 DQB1 DRB1 DRA
DPA2 DPA1 ЬмВ ТАР1/ТАР2/DQA2 IdQA1 I DRB2
DPB2 у |dOA| ^LMP2/jc^JBy ^DQB3| I | | DRB3^9
DDDDDDDQDQDQODQ 0 0 DDEI DO
I—।—।—।—।—।—।—।—H
300 400 500 600 700 800 900 1000
Область генов класса III
Область генов класса I
Рис. 7-1. Современная карта генов главного комплекса гистосовместимости человека
[Хаитов Р.М. и др., 2008].
ОСНОВЫ ИММУНОГЕНЕТИКИ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ... 201
7.1. ОСОБЕННОСТИ HLA-СИСТЕМЫ
• Это полигенная система. Полная нуклеотидная последовательность
генов HLA была расшифрована в конце прошлого столетия, она вклю-
чает 224 локуса.
• Гены HLA характеризуются высоким полиморфизмом. В отли-
чие от вариабельности генов TCR и BCR, основанной на реком-
бинации генов, полиморфизм генов HLA определяется существо-
ванием множественных аллелей (альтернативные варианты генов).
Наибольшим полиморфизмом обладают гены HLA классов I и II. Так,
известно более 450 аллельных вариантов локуса HLA-A, более 780 —
HLA-В, более 238 — HLA-С. Гены неклассических молекул характе-
ризуются низким уровнем полиморфизма. HLA-Е имеет 9 аллелей,
HLA-F — 20 аллелей, HLA-G — 23 аллеля. Среди генов, кодирующих
структуру HLA класса И, наиболее вариабельны локусы HLA-DR
(440 аллельных вариантов) и HLA-DPB1 (124 аллельных варианта).
Как известно, микроорганизмы обладают способностью к изменчиво-
сти и представляют опасность для существования человека как вида.
Таким образом, благодаря полиморфизму HLA обеспечивается выжи-
вание человека в инфекционном окружении.
• Гены HLA наследуются кодоминантно, т.е. у потомков экспрессиру-
ются одновременно гены, полученные от обоих родителей.
7.1.1. Полиморфизм генов главного комплекса
гистосовместимости и заболевания
С изучением HLA-системы стала возможной разработка новых клеточ-
ных технологий, таких, как пересадка клеток костного мозга от доброволь-
цев онкогематологическим больным, лицам после техногенных аварий.
Показано, что генетический контроль иммунного ответа связан с систе-
мой HLA. Именно сцепленностью генов иммунного ответа (1г-генов) с HLA
можно объяснить ассоциации различных иммунопатологий с определен-
ными гаплотипами HLA.
7.1.1.1. НЕКОТОРЫЕ ГАПЛОТИПЫ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИ ЯВЛЯЮТСЯ ПРОТЕКТИВНЫМИ
Предпочтительная презентация на определенных аллельных продуктах
HLA пептидных фрагментов некоторых патогенов может быть предпосыл-
кой устойчивости к данному заболеванию. Аллель HLA-DRB1*13O2 ассоции-
рован с повышенной элиминацией вируса гепатита В, аллель HLA-A*02 - со
сниженным риском возникновения инфекции, вызванной Т-лимфотропным
вирусом 1 человека (HTLV-1). В организме таких людей обнаружено повы-
шенное содержание ЦТЛ, специфичных к данному вирусу.
ГЛАВА 7
ЧАСТЬ 1
202 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Более защищенными от инфекции ВИЧ-1 были люди с наибольшей
гетерозиготностью по HLA-локусам класса 1, не экспрессирующие алле-
лей HLA-B*35 и HLA-Cw*04. Прогрессирование ВИЧ-инфекции и пере-
ход ее в СПИД связаны с полиморфизмом гена 5 рецептора хемокина
CCR5, обеспечивающего проникновение в макрофаг штаммов ВИЧ-1.
Мутации, инактивирующие этот рецептор, обнаружены у европейцев и
практически не встречаются у африканцев и азиатов. Лица, гомозиготные
по CCR5, устойчивы к ВИЧ-инфекции.
Предрасположенность к аутоиммунным заболеваниям тоже связана с
определенными гаплотипами HLA. Некоторые из примеров такой ассо-
циации генов HLA и болезнями представлены в табл. 7-1.
Таблица 7-1. Ассоциация генов главного комплекса гистосовместимости с различными
заболеваниями
Заболевание Аллель HLA Относительный риск развития заболевания
Антигены HLA класса 1 (HLA-B27)
Анкилозирующий спондилит B27 87,4
Болезнь Рейтера B27 37,0
Постсальмонеллезный артрит B27 29,7
Увеит B27 14,6
Амилоидоз при ревматоидном артрите B27 8,2
Другие антигены HLA класса 1
Подострый тиреоидит B35 13,7
Обыкновенная пузырчатка Cw6 13,3
Злокачественная миастения B8 4,4
Антигены HLA класса II
Болезнь Хашимото DR11 3,2
Первичная микседема DR17 5,7
Базедова болезнь DR17 3,7
Инсулинзависимый диабет DQ8 14,0
DQ2/8 20,0
DQ6 0,2
Болезнь Аддисона DR17 6,3
Синдром Гудпасчера DR2 13,1
Ревматоидный артрит DR4 5,8
Ювенильный ревматоидный артрит DR8 8,1
Синдром Шегрена DR17 9,7
Рассеянный склероз DR2, DQ6 12,0
Герпетиформный дерматит Dr17 56,4
ОСНОВЫ ИММУНОГЕНЕТИКИ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ... 203
Относительный риск, определяемый как отношение частоты развития
заболевания при наличии данного аллеля и при его отсутствии, показывает
связь заболевания с определенными аллелями HLA. Если относительный
риск равен 1, то частота аллелей одинакова в группе больных и контроль-
ной группе и исследуемый аллель не влияет на развитие заболевания.
Аллель обладает протективным действием, если относительный риск мень-
ше 1. Чем больше кратность соотношения частот, тем большую роль играет
исследуемый аллель в развитии данного заболевания. Высокая степень
ассоциации аллеля HLA с заболеванием предполагает участие иммунных
механизмов в его патогенезе.
Большинство аутоиммунных заболеваний связано с генами HLA класса
II. Инсулинзависимый сахарный диабет связан с аллелями DQ8 и DQ2.
Наибольшую предрасположенность наблюдают у гетерозигот DQ8/DQ2.
Некоторые варианты аллеля, например DQ6, обеспечивают протективный
эффект. Ген DR4 является фактором риска развития ревматоидного артрита
у европеоидов; ген DR2 оказывает защитный эффект.
Показана самая высокая степень ассоциации гена HLA-B27 с анкилози-
рующим спондилитом (болезнь Бехтерева). Этот ген у больных выявляют
в 95% случаев. Увеличена частота встречаемости этого гена при следующих
заболеваниях: при болезни Рейтера, псориазе, увеите и др. Причины таких
ассоциаций остаются неясными.
Следует сказать, что наследственная предрасположенность к определен-
ным заболеваниям связана не только с генами HLA. Восприимчивость к
инфекциям кодируется также генами, регулирующими активность макро-
фагов — основных клеток врожденного иммунитета.
В последние годы начаты исследования, которые изучают роль полимор-
физма генов распознающих рецепторов врожденного иммунитета и эффек-
торных молекул (цитокины, хемокины и их рецепторы) в развитии инфек-
ционных заболеваний, аутоиммунной патологии (см. гл. 3). Появились
данные о том, что полиморфизм генов TLR связан с инфекционными,
аллергическими, аутоиммунными заболеваниями. В табл. 7-2 показана
связь определенных заболеваний с полиморфизмом генов TLR. Известно,
что полиморфизм (SNP — single nucleotide polymorphisms) гена TLR2: Arg/
Gln753 и T597C ассоциирован с заболеваниями, вызванными ЦМВ, виру-
сом простого герпеса-2, Candida albicans, М. tuberculosis и другими патогена-
ми. Полиморфизм гена TLR9,1174A/G, 1635A/G и 2848G/A связан с СКВ,
развитием инфекции ВИЧ-1 и другими заболеваниями.
Изучение таких ассоциаций позволит вскрыть механизмы патогенеза
этих заболеваний и разработать новые иммунологически обоснованные
подходы к их лечению.
ГЛАВА 7
204 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ЧАСТЬ 1
Таблица 7-2. Ассоциация некоторых заболеваний с полиморфизмом генов Toll-подобных
рецепторов
Ген Полиморфизм Заболевание
TLR1 T1805G Проказа (M. leprae)
Илеит
G239 C (Arg80Thr) Инвазивный аспергиллез
743а G (Asn248 Ser)
TLR2 Arg753Gln Урогенитальные инфекционные заболевания
Инфицирование цитомегаловирусом
Т597С Развитие инфекционного заболевания, вызванного М. tuberculosis
R753Q Атопический дерматит
A-15607G Генитальный герпес
TLR3 A829C Назофарингеальная карцинома
C2593T Сахарный диабет 1-го типа
C2642A
TLR4 Asp299Gly, Thr399lle Пневмония, вызванная Streptococcus pneumoniae септический шок
Сепсис (Candida albicans)
Спондилоартрит
TLR5 Arg392Stop Болезнь Крона
Системная красная волчанка
TLR6 Ser249Pro Инвазивный аспергиллез
Воспалительные заболевания кишечника
Бронхиальная астма, атопический дерматит
TLR7 T120G Воспалительные процессы у больных с инфекцией, вызванной вирусом гепатита С
TLR8 A1G (rs3764880) ВИЧ-инфекция
TLR9 T-1237C Рассеянный склероз
Атопическая экзема
Воспалительные заболевания кишечника
G2848A Системная красная волчанка
TLR10 A2322G Рак простаты
G1031A, A2322G Бронхиальная астма
ОСНОВЫ ИММУНОГЕНЕТИКИ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ... 205
Вопросы для самоконтроля
• Что такое главный комплекс гистосовместимости?
• Перечислите основные функции главного комплекса гистосовмести-
мости.
• Назовите основные локусы HLA и молекулы, контролируемые этими
локусами.
• Опишите строение молекул главного комплекса гистосовместимости
класса I. Какую функцию в иммунном ответе они выполняют?
• Опишите строение молекул главного комплекса гистосовместимости
класса II, их экспрессию на клетках и основную функцию в иммунном
распознавании.
• Перечислите особенности системы HLA.
• Приведите доказательства связи системы HLA с заболеваниями.
• Полиморфизм каких генов врожденного иммунитета связан с иммуно-
патологией? Приведите примеры.
ГЛАВА 7
Глава 8
Иммунные механизмы
повреждения тканей: введение
в иммунопатологию
Реакции иммунной системы, направленные на элиминацию
антигена, в ряде случаев бывают чрезмерно выраженными и при-
водят к повреждению тканей. Реакции, при которых удаление
антигена из организма или какие-либо иные иммунные про-
цессы, протекающие с избыточной активацией, сопровождаются
повреждением органов и тканей, называются реакциями гипер-
чувствительности. Поскольку в такие процессы могут вовлекаться
все факторы иммунной системы, то для них правомерен термин
«иммунопатологические», а область иммунологии, изучающую их,
называют иммунопатологией. Как правило, все иммунопатоло-
гические процессы сопровождаются воспалением.
Впервые английские ученые Г. Джелл и Р. Кумбс в 1963 г. пред-
ложили классификацию реакций, отвечающих за развитие клини-
ческой гиперреактивности и заболеваний, которые подразделили
на четыре типа. Следует подчеркнуть, что в патогенез некоторых
заболеваний может вовлекаться несколько иммунопатологических
механизмов. В настоящее время известен значительно более широ-
кий спектр иммунных повреждений тканей, но основу их состав-
ляют предложенные ранее четыре типа патологических состояний.
В табл. 8-1 представлены основные типы иммуноопосредованных
реакций, механизм их развития, а также приведены некоторые
клинические примеры.
Таблица 8-1. Типы повреждения тканей (реакции гиперчувствительности) [Chapel Н. et al.. 2006. с модификациями]
Тип Механизм Лечение и профилактика Клинические примеры
Немедленный тип (тип I) Аллерген \ Fc-рецептор X для IgE / Аллерген--jT специфический .• Kje «Ъч чуг?' •• Дегрануляция *•’* Тип! Синтез IgE Предотвращение контакта с аллер- геном Анафилаксия
Дегрануляция тучных клеток Стабилизация мембран тучных клеток Атопические заболевания
Медиаторы: гистамин, лейко- триены; медиаторы, содержа- щиеся в гранулах и др. Применение блокаторов ^-рецепторов гистамина, антаго- нисты лейкотриеновых рецепторов, глюкокортикоиды и др. Аллергенспецифическая иммуно- терапия
ИММУННЫЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ: ВВЕДЕНИЕ В ИММУНОПАТОЛОГИЮ 207
9 V8VLLI
Тип Механизм
Цитотоксический (тип II) оно ^1?\ Г\ иоИ А \ / Цитотоксическая Ж Fc рецептор клетка ^^Поверхностный антиген 'Клетка / у мишень / / / Активация ' комплемента h \ r Иммунный комплвкс Тип II lgG-ZlgM-аутоантитела. Антирезусные антитела (резус- конфликт: до 15% людей европейской популяции резус- отрицательны). Комплементзависимый лизис (пояснения в тексте)
Активация нейтрофилов
Опсонизация
Стимуляция метаболизма
Блокирующие антитела
ЧАСТЬ 1
Продолжение табл. 8-1
Лечение и профилактика Клинические примеры
Иммуносупрессивная терапия, плаз- маферез и др. Холодовая аутоиммунная гемолитическая анемия, злокачественная миастения, гемолитическая болезнь новорожденных
Иммуносупрессивная терапия, внутривенное введение иммуногло- булинов и др. Синдром Гудпасчера, тепло- вая аутоиммунная гемолити- ческая анемия
Аутоиммунная тромбоцитопе- ническая пурпура
Нормализация метаболизма Базедова болезнь
Восполнение недостающих фак- торов Пернициозная анемия, мик- седема, некоторые случаи невынашивания беремен- ности и др.
ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИН!
Продолжение табл. 8-1
Тип Механизм Лечение и профилактика Клинические примеры
Иммунокомплексный (тип III) Иммунные.% комплексы'ЛА Активация . комплементаЛ Высокая концентрация иммун- ных комплексов вследствие длительной персистенции анти- гена и синтеза антител, приво- дящая к активации комплемен- та и развитию воспаления Удаление антигена или предотвра- щение контакта с ним Сывороточная болезнь, экзо- генный аллергический аль- веолит, лепроматозная лепра
- Противовоспалительные препараты Системная красная волчанка
- Иммуносупрессивная терапия: применение цитостатических лекар- ственных средств Кожный васкулит
Нейтрофил ( ] 1 Плазмаферез для удаления избытка медиаторов Некоторые формы гломеру- лонефрита
Тип III
ИММУННЫЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ: ВВЕДЕНИЕ В ИММУНОПАТОЛОГИЮ 209
9 V9VUJ
ЧАСТЬ 1
Окончание табл. 8-1
Тип Механизм Лечение и профилактика Клинические примеры
Замедленный (тип IV) 0 Антиген Сенсибилизированный Th 1 ) \J ) Цитокины § Активированный макрофаг Тип IV Синтез цитокинов Th1-клетками Подавление синтеза цитокинов: при- менение циклоспорина и др. Реакция отторжения транс- плантата, болезнь «транс- плантат против хозяина»
- Противовоспалительная терапия: применение глюкокортикоидов и др. -
Активация макрофагов Подавление активации макрофагов: применение глюкокортикоидов и др. Туберкулез, туберкулоидная лепра
Предотвращение контакта с аллер- геном Контактный дерматит
ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИН
ИММУННЫЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ: ВВЕДЕНИЕ В ИММУНОПАТОЛОГИЮ 211
В других случаях иммуноопосредованное повреждение тканей может
быть связано с повышенной выработкой провоспалительных цитокинов
(ФНО-а, ИЛ-ip, ИЛ-6, ИЛ-8, ИЛ-17 и многих других), гиперактивацией
иммунной системы, приводящей к апоптозу клеток-мишеней и последую-
щему иммунодефициту, с цитотоксическим действием киллерных клеток
иммунной системы (Т-, NK-, NKT-лимфоциты, макрофаги, нейтрофилы и
др.) и т.д.
В основе реакции гиперчувствительности немедленного типа (IgE-
опосредованной) лежит взаимодействие между аллергеном (антигеном) и
молекулами IgE, которые связаны с FceRI, экспрессируемым тучными клет-
ками и базофилами. Перекрестное связывание IgE с аллергеном на поверх-
ности тучных клеток индуцирует их дегрануляцию, что служит ключевым
моментом в инициации острой аллергической реакции. Из гранул тучных
клеток высвобождаются биологически активные вещества (медиаторы),
подразделяемые по крайней мере на первичные и вторичные (рис. 8-1).
ГЛАВА 8
Предсуществукмцие медиаторы
Рецептор для IgE
== Антигенспецифичный
igE
Растворимые (выделяющиеся немедленно)
Гистамин.
Хемокины и др.
Присутствующие в гранулах
Протеазы.
Пероксидаза.
Протеогликаны.
Другие факторы
воспаления и анафилаксии
Вновь синтезируемые медиаторы
Простагландины ПГО2
Лейкотриены ЛТС4
ЛТО4
ЛТЕ4
Цитокины
медленно
- реагирующая
“ субстанция
анафилаксии
Рис. 8-1. Медиаторы, высвобождаемые при дегрануляции тучных клеток (I тип повреж-
дения тканей).
212 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
Первичные медиаторы освобождаются на ранних этапах дегрануляции.
Среди них выделяют:
• гистамин и серотонин — повышают проницаемость стенок кровенос-
ных сосудов и вызывают сокращение гладких мышц;
• эозинофильный и нейтрофильный хемотаксические факторы, действу-
ющие на хемотаксис эозинофилов и нейтрофилов соответственно;
• протеазы — усиливают секрецию слизи в бронхах, участвуют в разру-
шении базальных мембран кровеносных сосудов, образуют продукты
расщепления комплемента;
• протеогликаны (гепарин, хондроитин сульфат), ферменты (катеп-
син G, карбоксипептидаза).
Вторичные медиаторы представлены вновь синтезированными фактора-
ми, вовлекаемыми в реакции в более отдаленный период (часы):
• фактор, активирующий тромбоциты, вызывает агрегацию тромбоци-
тов и их дегрануляцию, а также сокращение гладких мышц бронхов;
• липидные метаболиты арахидоновой кислоты:
О лейкотриены (С4, D4, Е4) — медленно реагирующие вещества ана-
филаксии — расширяют кровеносные сосуды, сокращают гладкие
мышцы в легких, агрегируют тромбоциты;
простагландины (Е2, D2 и др.) — расширение кровеносных сосудов,
сокращение гладких мышц в легких, агрегация тромбоцитов;
О брадикинин повышает сокращение гладких мышц и вызывает рас-
ширение кровеносных сосудов.
Нередко в третью группу аллергических медиаторов выделяют цитокины
разнонаправленного действия:
• ФНО-а и ИЛ-ip участвуют в развитии системной анафилаксии, повы-
шенной экспрессии клеточно-адгезивных молекул на клетках эндоте-
лия венул;
• ИЛ-4, ИЛ-13 и другие определяют направление развития ThO-
лимфоцитов в направлении ТЬ2-клеток;
• ГМ-КСФ, ИЛ-5, ИЛ-3 поддерживают дифференцировку эозинофилов.
Именно ТЬ2-клетки и секретируемые ими цитокины играют важную
роль в индукции IgE-ответа. Спустя 12 ч после развития острой аллер-
гической реакции формируется ее поздняя фаза, которая характеризу-
ется образованием клеточных инфильтратов, содержащих моноциты,
эозинофилы и CD4+ Т-лимфоциты. Активированные клетки выраба-
тывают цитокины ТЬ2-типа и поддерживают воспаление в месте лока-
лизации аллергена.
Тучные клетки слизистых оболочек и соединительной ткани различа-
ются по спектру секретируемых ими медиаторов. Активацию тучных
клеток вызывает ряд факторов:
• комплексы аллергена с IgE-антителами, фиксированными через FceRI-
рецепторы на поверхности тучных клеток и базофилов. В этих случаях
ИММУННЫЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ: ВВЕДЕНИЕ В ИММУНОПАТОЛОГИЮ 213
говорят об истинной атопической или анафилактической иммунной
реакции. В других случаях процессы дегрануляции не связаны с атопи-
ческими реакциями;
• анафилатоксины (компоненты комплемента СЗа, С5а) взаимодейству-
ют с рецепторами комплемента;
• медиаторы активированных нейтрофилов;
• лиганды TLR1, TLR2, TLR4, TLR5, TLR9, экспрессируемых тучными
клетками и базофилами;
• различные лекарственные средства, продукты питания и многие дру-
гие, вызывающие дегрануляцию и синтез липидных медиаторов туч-
ными клетками и базофилами.
Реакция немедленной гиперчувствительности развивается очень быстро
(секунды, минуты). Внутрикожно введенный сенсибилизированному боль-
ному аллерген вызывает клинические проявления (гиперемия, отек) через
5-10 мин. Известны факторы генетической предрасположенности к раз-
витию атопической реакции. Подробно различные формы атопических
аллергических заболеваний описаны в главе 12.
В основе реакций гиперчувствительности типа II, обусловленной
антителозависимой цитотоксичностью, лежит эффект взаимодействия
между антителом и антигеном на клеточных мембранах. Антитела классов
IgM и IgG против аутоантигенов или чужеродных антигенов, взаимодей-
ствуя с соответствующими антигенами, активируют комплемент и в конеч-
ном счете повреждают клеточную мембрану, что приводит к нарушению
тканевого гомеостаза. Кроме того, клетки-мишени, покрытые антителами,
запускают механизмы антителозависимой клеточно-опосредованной цито-
токсичности, которая осуществляется клетками, экспрессирующими FcRyill
(фагоциты, NK-клетки и др.), по перфорингранзимовому пути.
Классический пример — трансфузионные реакции, приводящие к лизису
эритроцитов при переливании несовместимой крови, а также при резус-
конфликте.
Повреждение тканей при аутоиммунной патологии происходит с участи-
ем аутоантител и сенсибилизированных Т-лимфоцитов, инфильтрирующих
ткань-мишень (например, островки Лангерганса в поджелудочной железе,
печень при аутоиммунном гепатите, кожа и т.д.). Аутоиммунная гемолити-
ческая анемия, обусловленная аутоантителами, связана с непосредственной
деструкцией эритроцитов. Антитела к тромбоцитам важны в патогенезе
аутоиммунной тромбоцитопении. При синдроме Тудпасчера определяются
антитела к антигенам базальной мембраны почечных клубочков и альвеол
легких. Антитела связывают комплемент, активация которого вызывает
тяжелые поражения базальной мембраны. Появление антител к рецепто-
рам ацетилхолина лежит в основе патогенеза злокачественной миастении,
приводящей к мышечной слабости. При некоторых аутоиммунных заболе-
ваниях, например при рассеянном склерозе, патогенным действием облада-
ГЛАВА 8
214 ОСНОВЫ ОБЩЕЙ ИММУНОЛОГИИ В ПРАКТИКЕ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
ют как аутоантитела (например, к антигенам олигодендроцитов, основному
белку миелина и др.), так и CD4+ Т-клетки (непосредственно инфильтриру-
ют нервную ткань и участвуют в деструкции миелиновой оболочки нерва).
Лекарственные препараты могут взаимодействовать с форменными эле-
ментами крови и индуцировать образование антител, цитотоксичных для
клеток, которые несут этот гаптен. Гемолитическая анемия возникает при
длительном применении фенацетина, агранулоцитоз может быть вызван
применением аминопирина или хинидина.
Гиперчувствительность типа III в основном связана с длительным
воздействием избыточного количества антигена на организм, что часто
приводит к образованию иммунных комплексов, включающих чаще IgG-
и IgM-антитела. При избытке антигена, низкой активности антител и
дефиците компонентов комплемента комплексы преципитируют и обра-
зуют крупномолекулярные структуры. Отложение иммунных комплек-
сов в тканях активирует систему комплемента по классическому пути с
образованием анафилатоксинов (СЗа, С5а). Активированные макрофаги
и нейтрофилы участвуют в запуске локального воспалительного процесса
с усилением хемотаксиса нейтрофилов. Из-за больших размеров иммун-
ных комплексов нарушается процесс их фагоцитирования. Выделяемые
активированными клетками иммунной системы лизосомальные ферменты
участвуют в повреждении окружающих тканей. В патогенезе повреждения
тканей ключевую роль играют фиксированные иммунные комплексы, тогда
как патогенность циркулирующих иммунных комплексов относительна и
необязательно их повышенный уровень в сыворотке крови свидетельствует
о наличии иммунопатологии.
Многообразны проявления иммунокомплексной патологии. Клас-
сический пример иммунокомплексной патологии — феномен Артюса,
который воспроизводили с помощью многократных подкожных инъекций
сыворотки лошади кроликам. Патогенез феномена Артюса заключается в
развитии гиперергического воспаления, вплоть до развития некроза в месте
введения антигена в сенсибилизированный организм. Причина некроза
связана с тем, что в месте введения антигена образуются иммунные ком-
плексы, вызывающие активацию комплемента и хемотаксис нейтрофилов.
Время развития феномена 6-24 ч.
Сывороточная болезнь развивается через 6-10 сут после повторного
введения гетерологичной сыворотки. За это время синтезируются IgG-
антитела и образуются иммунные комплексы, которые часто откладывают-
ся на эндотелии сосудов, в суставах, в почках, вызывая развитие васкулита,
артрита, нефрита соответственно. СКВ, гломерулонефрит и экзогенные
аллергические альвеолиты — другие клинические примеры реакций гипер-
чувствительности III типа.
ИММУННЫЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ: ВВЕДЕНИЕ В ИММУНОПАТОЛОГИЮ 215
Клеточно-опосредованная гиперчувствительность замедленного
типа IV (ГЗТ). Главное условие развития этой реакции — предварительная
сенсибилизация антигеном. Реакция развивается через несколько часов,
суток. Т-лимфоциты — основной тип клеток, инициирующих гиперчув-
ствительность. После взаимодействия с антигеном они дифференциру-
ются в Thl-клетки. При повторном введении антигена ТЫ-лимфоциты
мигрируют в зону поступления антигена и синтезируют цитокины, акти-
вирующие макрофаги и другие клетки, что приводит к развитию воспа-
ления. Морфологическую основу реакций гиперчувствительности типа IV
составляет клеточная инфильтрация тканей макрофагами, лимфоцитами,
эозинофилами. Хронизация воспаления при некоторых инфекционных
заболеваниях (лепра, туберкулез) обусловливает образование гранулем.
Классические примеры ГЗТ — туберкулиновая реакция (реакция Манту),
контактный дерматит. Нередко пробы с использованием туберкулина и
других антигенов, с которыми естественно контактировал человек, исполь-
зуются для оценки состояния клеточно-опосредованного иммунитета у
пациентов, находящихся на иммуносупрессивном лечении, получающих
химиотерапию, перенесших трансплантацию и т.д. Подробно механизм ГЗТ
описан в разделе 4-3.
В последние годы открыты новые механизмы повреждения тканей,
связанные с острыми и хроническими воспалительными заболеваниями.
В частности, установлена противоположная роль липидных метаболитов
(эйкозаноиды) в патогенезе запуска («Go») и разрешения («Stop») воспале-
ния при различных заболеваниях (табл. 8-2).
ГЛАВА 8
Таблица 8-2. Роль эйкозаноидов в исходе воспаления [Serhan. 2007]
Симптом Сигналы
«Go» «Stop-
Вазоконстрикция PGF2a, ТхА2, LTC4 LTD4, LTE4
Хемотаксис лейкоцитов LTB4, HETEs LXA4, LXB4
Проницаемость сосудов LTC4, LTD4 LXA4
Боль (гипералгезия) PGE2, PGI2, LTB4 LXA4
Локальная и системная температура PGE2, PGI2 LXA4
Вазодилатация (эритема) PGI2, PGE1.PGE2, PGD2 LXA4
Отек (припухлость) PGE2, LTB4 LXB4, LTB4
Понимать механизмы иммуноопосредованного повреждения тканей при
различных патологиях важно, чтобы проводить патогенетически обосно-
ванное лечение и профилактику патологических состояний, развивающих-
ся по представленным иммунным механизмам повреждения тканей.
ЧАСТЬ 2
Клинические аспекты
иммунологии и аллергологии
Глава 9. Оценка иммунной системы человека............218
Глава 10. Возрастные особенности иммунной
системы ребенка.....................................237
Глава 11. Иммунодефицитные заболевания..............247
Глава 12. Аллергические заболевания.................383
Глава 13. Ургентные формы в клинической иммунологии
и аллергологии......................................558
Глава 14. Основы иммунотерапии......................588
Глава 15. Иммунопрофилактика........................616
Глава 9
Оценка иммунной системы
человека
9.1. ОСНОВНЫЕ ПОНЯТИЯ
Одна из первоочередных задач клинической иммунологии —
полная оценка функционирования иммунной системы в норме
и при заболеваниях человека. Сложность этой проблемы обу-
словлена многокомпонентной организацией иммунной системы,
разнообразием ее характерных структур на клеточном и молеку-
лярном уровне, зависимостью от регуляторных сигналов со сто-
роны нервной, эндокринной, кровеносной и многих других систем
организма.
В этом отношении заслуживает внимания образное сравнение
реакции иммунной системы с парусами яхты, высказанное ака-
демиком Р.В. Петровым: «Наша иммунная система очень гибкая,
нехватку одних клеток могут компенсировать другие. Мне пред-
ставляется удачной аналогия с яхтой. Какое положение парусов
на яхте следует считать правильным? Нет такого. Всё зависит от
направления и силы ветра. Так же и с иммунитетом. Разумеется,
измерить “площадь парусов и длину мачт” можно. Для оценки
иммунной системы нужна очень оснащенная клиника. Пациента
необходимо понаблюдать, поставить ряд функциональных тестов.
Надо увидеть систему в действии».
Тем не менее необходимость оценивать иммунную систему —
современная реальность. Естественно, нет единого теста для оцен-
ки иммунной системы в целом. Новый взгляд на оценку иммунной
системы сформировался с начала 70-х годов XX века, когда стало
ясным, что в этой системе существуют клеточное и гуморальное
звенья. Основы такого представления об иммунной системе чело-
века были заложены в учении о ПИД с выявлением конкретных
дефектов («поломок») в иммунной системе. Стали появляться
тесты для оценки как количественных, так и качественных харак-
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 219
теристик иммуногенеза и иммунопоэза на клеточном, молекулярном и
позже на генном уровне.
На кафедре иммунологии 2-го Московского ордена Ленина государ-
ственного медицинского института им. Н.И. Пирогова (ныне Российский
государственный медицинский университет) на основании собственных
исследований по проблеме ПИД в начале 1980-х годов был сформулиро-
ван двухэтапный принцип оценки иммунной системы человека. В 1984 г.
двухэтапный принцип, получивший всеобщее одобрение среди иммуно-
логов и клиницистов, принят в методических рекомендациях Минздрава
СССР «Оценка иммунного статуса человека» (Р.В. Петров, Ю.М. Лопухин,
А.Н. Чередеев, Л.В. Ковальчук, К.А. Лебедев). До сих пор подобный подход
к оценке иммунной системы широко применяют в клинической иммуно-
логии. Его основные положения заложены в так называемой иммунограм-
ме (карта первичного обследования иммунного статуса), отражающей в
основном показатели тестов первого уровня, но нередко, в зависимости от
оснащенности лаборатории, и второго уровня.
Практика клинической иммунологии при постановке иммунологическо-
го диагноза ориентируется на сбор анамнеза, клиническое обследование
больного и лабораторное исследование материалов. Обследование начи-
нают со сбора иммунологического анамнеза по специально разработанным
анкетам, включающим элементы опроса и сбора сведений, по медицинским
картам и т.п. Врачи общего профиля и специалисты в различных областях
медицины при сборе анамнеза и проведении клинического обследования
больного обязательно оценивают ключевые иммунологические проявле-
ния. Такой подход позволяет своевременно выявить признаки иммунопа-
тологии, особенно в детской практике.
Огромное значение в клинической иммунологии придают лабораторным
исследованиям, и в первую очередь оценке такого состояния, как иммун-
ный статус.
Иммунный статус — комплекс количественных и функциональных пока-
зателей, отражающих конкретное состояние иммунной системы, опреде-
ляемое с помощью стандартных общепринятых доступных тестов, которые
позволяют получить ориентировочные сведения об общих параметрах
иммунной системы. Наряду с другими сведениями данные о состоянии здо-
ровья индивида могут служить одним из показателей качества жизни.
Несколько по-иному трактуют понятие «иммунодиагностика».
Иммунодиагностика — проведение лабораторного и клинического иссле-
дований, которые помогают выявить конкретные нарушения в иммунной
системе, позволяющие:
• диагностировать конкретное заболевание;
• определить иммунопатогенез выявленного заболевания;
• разработать алгоритм индивидуальной иммунокоррекции и прокон-
тролировать ее эффективность;
• провести мониторинг состояния иммунной системы.
ГЛАВА 9
220 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Тесты для оценки иммунного статуса могут служить целям иммунодиаг-
ностики. Общие характеристики тестов оценки иммунного статуса даны в
табл. 9-1.
Таблица 9-1. Тесты оценки иммунного статуса
Уровень I Уровень II
Ориентировочные Аналитические
Доступны Трудоемкие
Результат (несколько суток) Результат (сутки, недели)
Не требует дефицитных реактивов Часто требует дорогих реактивов
Информативны Высокая информативность
Возможен перевод в гематологические и био- химические лаборатории Доступны для специализированных лаборато- рий
9.2. ПОДХОДЫ К ОЦЕНКЕ ИММУННОГО СТАТУСА:
ТЕСТЫ IИII УРОВНЯ
Суть двухуровневого принципа сводится к следующему. На первом этапе
выявляют более общие («грубые») дефекты клеточного и гуморального
звена адаптивного (субпопуляции лимфоцитов, изотипы иммуноглобули-
нов и др.) и врожденного иммунитета (активность фагоцитов и компонен-
тов комплемента). Для этого используют простые, но довольно точные (так
называемые ориентирующие) тесты.
В настоящее время минимальный набор таких тестов включает опреде-
ление:
• относительного и абсолютного числа лейкоцитов и лимфоцитов в
периферической крови (общепринятый анализ крови);
• относительного и абсолютного количества Т- и В-лимфоцитов,
NK-клеток с использованием моноклональных антител против CD3-,
CD19- и СВ16-/СВ56-маркеров соответственно;
• субпопуляций Т-лимфоцитов: Т-хелперов (CD3+ CD4+) и ЦТЛ
(CD3+CD8+) и их соотношения (CD4/CD8);
• концентрации сывороточных иммуноглобулинов основных классов
(IgM, IgG, IgA);
• фагоцитарной активности лейкоцитов, выработки активных форм
кислорода;
• активности комплемента;
• возможен анализ других показателей (например, цитокинов).
Если выявлены отклонения показателей в ориентирующих тестах или
при специальных показаниях, рекомендуется более тщательно анализи-
ровать иммунный статус. На втором этапе использование аналитических
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 221
тестов позволяет выявить более тонкие и конкретные дефекты в иммунной
системе. Комплекс тестов второго уровня может существенно варьировать
в зависимости от поставленных врачом задач. Количество и качество их
постоянно растут, хотя требования к ним остаются прежними: стандар-
тизация, воспроизводимость, информативность, высокая квалификация
персонала лаборатории, и, что очень важно, каждый тест должен отражать
тот или иной конкретный показатель или процесс в иммунной системе.
Расширение уровня оценки иммунной системы до третьего и так далее
нецелесообразно. Достаточно того, что на сегодняшний день генные мето-
ды оценки иммунной системы получают всё большее распространение
(например, варианты ПЦР и др.).
На втором этапе в зависимости от конкретных задач определяют:
• количество субпопуляций Т-лимфоцитов: ТЫ -, Th2-, ТЫ7-лимфоциты,
естественные (Treg) и индуцированные (Tri, Th3) регуляторные
Т-клетки, NKT-лимфоциты, у8Т-клетки и др.;
• фенотипические характеристики клеток иммунной системы на разных
этапах иммуногенеза и иммунопоэза (очень важно, например, в онко-
иммунологии для определения природы и стадии развития малигнизи-
рованных лимфоцитов);
• экспрессию активационных маркеров: CD25, CD69, CD71, HLA-DR и др.;
• пролиферативный ответ Т- и В-лимфоцитов на митогены, антигены,
аллогенные клетки;
• активационный апоптоз в культуре лимфоцитов in vitro;
• количество и функцию ТЫ-, ТЬ2-лимфоцитов и регуляторных Т-клеток
по внутриклеточному содержанию и выработке типичных цитокинов
(ИФН-у, ИЛ-4, ТФР-р соответственно);
• активность киллерных лимфоцитов (ЦТЛ, NK-клеток и др.) с определе-
нием гранзимов/перфорина и осуществлением апоптоза через Fas/FasL;
• классы и подклассы сывороточных, секреторных и других иммуногло-
булинов (IgM, IgGl, IgG2, IgG3, IgG4, IgAl, IgA2, IgE); антитела разной
специфичности, в том числе аутоантитела, иммунные комплексы, пато-
логические иммуноглобулины;
• синтез иммуноглобулинов в культуре В-лимфоцитов in vitro;
• наиболее типичные цитокины в сыворотке крови и различных био-
логических жидкостях;
• различные этапы фагоцитоза и рецепторного аппарата фагоцитов;
• подавление миграции моноцитов in vitro в присутствии митогена или
специфичного для Т-лимфоцитов антигена;
• функцию рецепторов врожденного иммунитета (TLR и др.);
• содержание различных компонентов комплемента;
• результаты (при отсутствии противопоказаний) кожных тестов ГЗТ на
туберкулин, антигены грибов, аллергены;
• другие показатели.
ГЛАВА 9
ЧАСТЬ 2
222 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Следует отметить, что создание новых технологий (проточной цито-
метрии, иммуноблоттинга, ПЦР, микрочипов и др.) позволяет проводить
оценку иммунной системы более стандартными и автоматизированными
методами.
Для исследования иммунной системы используют различные биологи-
ческие материалы:
• цельную периферическую кровь (как правило, венозная);
• сыворотку крови — жидкую фракцию крови, освобожденную от фибри-
ногена;
• плазму крови — жидкую фракцию крови, содержащую фибриноген и,
следовательно, способную к образованию сгустков фибрина;
• клеточные элементы крови;
• спинномозговую жидкость;
• синовиальную жидкость;
• бронхоальвеолярную жидкость;
• выделения слизистых секретов половых органов (из канала шейки
матки, влагалища, семенная жидкость);
• выделения из носа (смывы или адсорбция на пористые материалы);
• мочу;
• слезную жидкость, зубодесневую жидкость и пр.;
• супернатант с культивируемых in vitro клеток;
• гомогенаты тканей (биопсия или post mortem);
• цитоплазматические и ядерные компоненты клеток.
Получение и хранение биологических жидкостей — крайне важный этап
подготовки их к исследованию. Нарушение правил может существенно
изменить конечный результат.
В табл. 9-2 представлено содержание основных субпопуляций лимфоци-
тов в периферической крови у людей различных возрастных групп в норме,
оцененное методом проточной цитометрии с определением показателей
первого уровня.
Таблица 9-2. Содержание субпопуляций лимфоцитов в перферической крови человека в
разных возрастных группах
Субпопуляции лимфоцитов 1-6 лет 7-17 лет 18-70 лет
CD3* Т-клетки
Относительные количества, % 64 (62-69) 70 (66-76) 72 (67-76)
Абсолютные количества 2,5 (1,8-3,0) 1,8 (1,4-2,0) 1,4 (1,1-1,7)
CD4* Т-клетки
Относительные количества, % 37 (30-40) 37 (30-40) 42 (38-46)
Абсолютные количества 1,6 (1,0-1,8) 0,8 (0,7-1,1) 0,8 (0,7-1,1)
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 223
ГЛАВА 9
Окончание табл. 9-2
Субпопуляции лимфоцитов 1-6 лет 7-17 лет 18-70 лет
CD8* Т-клетки
Относительные количества, % 29 (25-32) 30 (27-35) 35 (31-40)
Абсолютные количества 0,9 (0,8-1,5) 0,8 (0,6-0,9) 0,7 (0,5-0,9)
CD19* В-клетки
Относительные количества, % 24 (21-28) 16(12-22) 13(11-16)
Абсолютные количества 0,9 (0,7-1,3) 0,4 (0,3-0,5) 0,3 (0,2-0,4)
CD3 CD16-CD56* NK-клетки
Относительные количества, % 11 (8-15) 12(9-16) 14(10-19)
Абсолютные количества 0,4 (0,2-0,6) 0,3 (0,2-0,3) 0,3 (0,2-0,4)
В табл^-3 представлены концентрации IgM, IgG и IgA в зависимости от
возраста.
Таблица 9-3. Концентрации IgM, IgG и IgA в сыворотке здоровых людей
Возраст Концентрация иммуноглобулинов в сыворотке крови, г/л
IgM IgG igA
10-12 мес 0,4-1,5 3-11 0,16-0,85
1 год 0,4-1,7 3,5-12 0,14-1
2 года 0,5-1,7 4,25-11 0,14-1,25
3 года 0,5-2,0 4,5-11 0,2-1,5
4-5 лет 0,4-2,0 4,5-12,5 0,25-1,5
6-8 лет 0,5-2,0 6,3-13 0,3-2
9-10 лет 0,5-2,5 6-16 0,45-2,5
Взрослые 0,55-3,5 6,5-13,5 0,7-3,15
В сыворотке крови взрослого человека в норме выявляют иммуноглобу-
лины в следующих концентрациях: IgGl — 9 г/л, IgG2 — 3 г/л, IgG3 — 1 г/л,
IgG4 - 0,5 г/л, IgAl - 3 г/л, IgA2 - 0,5 г/л, IgE - 0,00005 г/л.
Поскольку IgE в норме в крови содержится в очень низких концентраци-
ях, чтобы уменьшить вероятность ошибок, по международной договорен-
ности значения IgE выражаются в международных единицах — МЕ/мл или
кМЕ/л (IU/ml, kIU/1). 1 МЕ=2,43 нг IgE.
Следует иметь в виду, что показатели иммунного статуса могут суще-
ственно варьировать в зависимости от многих факторов даже в норме
(например, в зависимости от биологических циклов, гормональных и экзо-
генных воздействий). Именно поэтому понятие «нормальный иммунный
ЧАСТЬ 2
224 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
статус» довольно условно. Таким образом, определение параметров иммун-
ной системы при различных патологических состояниях дает возможность
подразделить последние на три главные группы:
• без существенных изменений иммунного статуса;
• с недостаточностью иммунной системы (иммунодефициты);
• с повышенной активацией иммунокомпетентных клеток (аутоиммун-
ные заболевания, аллергия, воспаление).
Абсолютные показатели параметров иммунного статуса более информа-
тивны, чем относительные (процентные).
9.3. ПАТОГЕНЕТИЧЕСКИЙ ПРИНЦИП ОЦЕНКИ ФУНКЦИЙ
ИММУННОЙ СИСТЕМЫ
При анализе принципов оценки иммунной системы следует остано-
виться на патогенетическом подходе, сформулированном в 1990 г.
Л.В. Ковальчуком и А.Н. Чередеевым. Патогенетический (углубленный)
подход основан на лабораторной оценке ключевых этапов иммунного
ответа, позволяющей установить уровень патогенетического дефекта в
иммунной системе. Оценивают стадии развития иммунного процесса,
включая распознавание, активацию, пролиферацию, дифференци-
ровку, эффекторные механизмы, формирование иммунной памяти,
регуляцию и апоптоз на всех этапах иммунного ответа.
Для оценки патогенетических механизмов иммунного процесса пред-
ложены разнообразные тесты, число которых постоянно растет. Один из
постулатов этой концепции — при блоке предыдущего этапа последую-
щий несостоятелен, и нужно искать подходы для снятия этого блока.
Для оценки процессов распознавания предложены следующие тесты:
• смешанная культура лимфоцитов (СКЛ);
• взаимодействие лимфоцитов с макрофагами, предварительно обрабо-
танными антигеном в системе in vitro;
• определение экспрессии молекул МНС класса II (презентация анти-
гена);
• оценка образования цитокинов (ИФН-у, ИЛ-4 и др.) Т-клетками при
распознавании специфического антигена;
• выявление специфических CD4+ и/или CD8+ Т-лимфоцитов с исполь-
зованием комплексов рекомбинантных молекул, обозначенных как
тетрамеры (тетрамер МНС образуется при биотинилировании моле-
кулы МНС и связывании их с четырехвалентной молекулой авидина),
каждый из которых состоит из молекулы МНС класса I или II, нагру-
женной антигенным пептидом, и метки. В основе этого метода лежит
прямое окрашивание антигенспецифических Т-клеток.
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 225
Для оценки активации лимфоцитов определяют:
• экспрессию лимфоцитами и другими клетками иммунной системы
маркеров активации: CD25, CD69, CD71, HLA-DR и др.;
• внутриклеточные сигнальные молекулы лимфоцитов, в том числе вну-
триклеточную концентрацию ионов Са2+, экспрессию генов тирозин-
киназ, протеинкиназу С, ядерные факторы транскрипции; активность
НАДФН-оксидазы в нейтрофилах и моноцитах;
• уровень провоспалительных цитокинов (ФНО-а, ИЛ-1р, ИЛ-6, ИЛ-8 и
др.) в сыворотке и биологических жидкостях;
• выработку провоспалительных цитокинов с участием рецепторов
врожденного иммунитета (TLR и др.).
Если активация лимфоцитов блокируется до вступления в пролифера-
цию, то клетки подвергаются апоптозу и погибают. Такая массовая гибель
активированных лимфоцитов лежит в основе феномена «апоптоза, инду-
цированного активацией». На этом основании была сформулирована кон-
цепция апоптогенных иммунодефицитов [Ковальчук Л.В., Чередеев А.Н.,
1998].
С другой стороны, проблема усиленной активации иммунной системы
становится одной из важнейших в патогенезе многих заболеваний чело-
века, включая ВИЧ-инфекцию, многие воспалительные процессы и другие
патологии. Оказалось, что следствие приобретенной гиперактивации
иммунной системы — иммунодефицит.
Для исследования пролиферативной активности иммунокомпетентных
клеток используют тесты на определение:
• пролиферативной активности лимфоцитов в ответ на митогены: фито-
гемагглютинин, конканалин А, ЛПС и др.;
• пролиферативного ответа лимфоцитов на специфические антигены и
аллергены.
По пролиферативному ответу лимфоцитов на стимуляцию фитогемаг-
глютинином и конканалином А судят о функции Т-клеток; по ответу на
стимуляцию ЛПС — о функции В-лимфоцитов, а на стимуляцию митогеном
лаконоса — о взаимодействии между Т- и В-клетками.
Для оценки эффекторных функций иммунокомпетентных клеток исполь-
зуют тесты на:
• клеточную цитотоксичность (Т-киллеры, NK-клетки и др.);
• образование иммуноглобулинов в культуре В-лимфоцитов in vitro;
• образование клетками иммунной системы иммуноцитокинов и ответ
на них in vitro.
Цитотоксические тесты проводят, чтобы оценить способность Т-килле-
ров, NK-клеток, макрофагов убивать соответствующие клетки-мишени
in vitro. Определение синтеза иммуноглобулинов в культуре антитело-
образующих клеток in vitro, а также в сыворотке — главные методы оценки
функциональной активности В-лимфоцитов.
ГЛАВА 9
226 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
В настоящее время важное значение придают оценке иммунорегулятор-
ного звена. Хотя до сих пор методы оценки числа и функций регуляторных
Т-клеток трудоемки, некоторые из них находят применение в практике
клинической иммунологии. Более доступны методы определения:
• соотношения числа CD4+ и CD8+ Т-лимфоцитов;
• соотношения про- и противовоспалительных цитокинов в сыворотке и
различных биологических жидкостях;
• количества регуляторных Т-клеток фенотипа CD4+ CD25MHOro FoxP3+
и их функциональных свойств при совместном культивировании с
клетками-мишенями in vitro.
Соотношения числа CD4+ и CD8+ Т-лимфоцитов в периферической
крови называют иммунорегуляторным индексом. В норме иммунорегуля-
торный индекс составляет 1,6-2,2. В зависимости от природы иммунопа-
тологии значения этого показателя могут изменяться в сторону снижения
(характерно для приобретенных форм иммунодефицитов, в частности
для прогрессирующей ВИЧ-инфекции) или повышения (например, при
аутоиммунных и других иммунопатологиях). Возможные варианты соот-
ношения иммунорегуляторных клеток были изображены авторами в виде
«иммунологического компаса» [Ковальчук Л.В., Чередеев А.Н., 1989]
(рис. 9-1). Принцип «иммунологического компаса» был воспроизведен в
.jQXD 0 Ф ©
а б в г д
е ж з к л
Рис. 9-1. Возможные варианты взаимоотношения иммунорегуляторных Т-клеток («имму-
нологический компас», «иммунологические часы»). Отмечены их нормальные абсо-
лютные значения, составляющие в среднем 1200/мкл для CD4* Т-клеток и 600/мкл для
CD8* Т-клеток; соотношение этих субпопуляций в среднем равно 2:1.
а — норма; б — аллергия, аутоиммунитет; в — иммунодефициты, синдром приобре-
тенного иммунодефицита; г — опухоли; д — аутоиммунитет, аллергия; е — синдром
приобретенного иммунодефицита, иммунодефициты; ж — опухоли, иммунодефициты;
з — аутоиммунитет и интоксикация, стресс, эндокринопатии; к — начальный период
ВИЧ-инфекции и других острых вирусных инфекционных заболеваний; л — лимфопро-
лиферация.
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 227
США [Ueno Н. et al., 2007], но в основу его заложено соотношение между
конкретной парой цитокина и его антагониста (например, ИФН-у и ИЛ-4,
ФНО-а и ИФН-а и др.) (рис. 9-2). Наиболее показательно соотношение
между ИФН-у и ИЛ-4. При аллергопатологии обычно возрастает уровень
ИЛ-4 (продуценты — ТЬ2-клетки), а при многих воспалительных заболева-
ниях — ИФН-у (продуценты — Thl-клетки). Изменившееся под влиянием
самых разнообразных факторов направление стрелки «иммунологического
компаса» может служить важным показателем вмешательства в иммуно-
регуляторные механизмы. Приводим пример, как изменяются показатели
«иммунологического компаса» при анализе соотношения между провос-
палительным (ИЛ-8) и противовоспалительным (ИЛ-10) цитокинами в
семенной жидкости больных хроническим бактериальным простатитом до
и после лечения иммунотропным препартом суперлимфом* (рис. 9-3).
Другие
воспалительные
заболевания
ГЛАВА 9
Системная красная
волчанка, дерматомиозит,
синдром Шегрена
ИФН-а
Ювенильный
ревматоидный
артрит, подагра
ФНО-а
Ревматоидный артрит
Воспалительные заболевания
кишечника
Рис. 9-2. Иммунологический компас определяет тип заболевания (Ueno Н. et al. // Immunol
Rev. — 2007. — Vol. 219. — P. 118-142).
228 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
250±102
пг/мл
2±0,8
пг/мл
Хронический бактериальный
простатит (до лечения)
ХБП после лечения
(суперлимф)
Рис. 9-3. Иммунологический компас (цитокины в семенной плазме) (Ковальчук Л .В. и др. И
ЖМЭИ. — 2007. — № 5. — С. 57).
НОРМА
714±55
пг/мл
В перспективе планируют оценивать соотношения между различными
субпопуляциями CD4+ Т-клеток (Thl, Th2, Thl7, Treg и др.) и соотношения
цитокинов, определяющих их развитие.
Клеточно-цитокиновая сеть с ее саморегулирующимися механизмами
создает основу для оптимального функционирования иммунной системы.
В нормальных условиях изменения в этой сети могут легко компенсиро-
ваться за счет положительных или отрицательных взаимосвязей. Однако
стойкие (патологические) сдвиги в регуляторной сети, выходящие за рамки
самоконтроля, приводят к тяжелым заболеваниям иммунной системы. На
декомпенсацию регуляторной сети могут влиять многочисленные факторы
эндогенной (генетические, метаболические, гормональные и др.) и экзо-
генной природы (патогенные микроорганизмы, физические и химические
воздействия, токсины и др.). Поиск лекарственных средств для направ-
ленной коррекции конкретных клеточных и молекулярных дефектов в
иммунорегуляции — одна из важнейших задач клинической иммунологии.
В настоящее время разрабатываются методы генетической коррекции
иммунопатологии.
Регуляторные функции клеток врожденного иммунитета (моноцитов/
макрофагов, нейтрофилов и др.) оцениваются в тестах на образование
цитокинов, презентацию антигена (ДК) и др.
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 229
Заслуживает внимания так называемый этиологический принцип
оценки иммунной системы, заключающийся в подборе определенных мето-
дов исследования, которые позволяют получить максимум информации о
данной патологии исходя из этиологического фактора иммунопатологии.
Например, при вирусной инфекции постановка всех тестов второго уровня
необязательна. Значимую информацию дают:
• оценка системы интерферонов, включая выявление экспрессии генов
интерферонов типа I и ИФН-у, и определение их уровня в сыворотке,
исследование способности мононуклеарных клеток продуцировать
интерфероны (как спонтанной, так и обусловленной действием индук-
торов интерферона);
• исследование цитотоксических клеток (NK-клеток, ЦТЛ и др.), вклю-
чая определение их количества и функциональной активности;
• определение цитокинов, играющих важную роль в противовирусной
защите (ФНО-а, ИФН-у, ИЛ-12 и др.).
В настоящее время всё большее значение в иммунодиагностике приоб-
ретают молекулярно-биологические и генетические методы исследования.
Среди них набольшее распространение в практике клинической иммуноло-
гии получают несколько групп методов.
• Фенотипирование клеток иммунной системы — определение
поверхностных маркеров, характеризующих те или иные клетки
иммунной системы. Как правило, такими маркерами служат молекулы
CD, к которым созданы наборы моноклональных антител. В основе
метода лежит взаимодействие моноклональных антител, меченных
флюоресцентными красителями, с поверхностными антигенами кле-
ток и последующий анализ образцов на проточном цитофлюориметре.
Возможно применение одного антитела, меченного флюорохромом,
или нескольких различающихся по специфичности моноклональных
антител, меченных разными флюорохромами. Определяют процент
клеток, несущих на своей поверхности искомый антиген, и среднюю
интенсивность свечения, характеризующую выраженность экспрес-
сии исследуемого антигена. Современные проточные многоцветовые
цитофлюориметры позволяют определить одновременно на поверхно-
сти клетки больше 10 разных маркеров. Для проведения исследований
можно использовать как цельную кровь, так и предварительно выде-
ленные из нее клетки.
• Методы иммуноанализа, основанные на определении, или детек-
ции, тех или иных молекул, против которых получены специфичные
антитела. Иммуноферментный анализ (ИФА), радиоиммунный анализ,
иммунофлюоресцентный анализ — наиболее высокочувствительные и
широко применяемые в настоящее время виды иммуноанализа.
• Методы молекулярной генетики и молекулярной биологии
(ПЦР; иммуноблоттинг, микрочипы и др.).
ГЛАВА 9
ЧАСТЬ 2
230 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Различные варианты метода ПЦР нашли широкое применение в клини-
ческой иммунологии при:
• выявлении в клинических образцах микроорганизмов (вирусов, бакте-
рий, простейших, грибов и др.);
• обнаружении генетически-опосредованных иммунопатологий;
• типировании генов HLA при трансплантации органов и тканей, оценке
связи с заболеваниями;
• определении экспрессии генов и полиморфизмов иммунологически важ-
ных молекул (цитокины и их рецепторы, сигнальные молекулы и др.).
9.4. АНАЛИТИЧЕСКИЙ ПРИНЦИП ОЦЕНКИ ОТДЕЛЬНЫХ
ИММУННЫХ ПОДСИСТЕМ
Оценка иммунной системы — довольно сложная задача клинической
иммунологии. Она имеет свои особенности и определенные методологиче-
ские подходы. Помимо оценки иммунной системы по двухуровневому и
патогенетическому принципу, сформировался третий принцип, который
мы обозначаем как аналитический, основанный на комплексной оцен-
ке различных иммунных подсистем, например цитокиновой, рецепторов
врожденного иммунитета (TLR, NLR), комплемента и т.д.
Один из таких подходов состоит в комплексной оценке системы
цитокинов — важнейшей для организма системы медиаторов межклеточ-
ных взаимодействий. Следует отметить, что в клинической медицине выяв-
ляют существенный рост заболеваний, обусловленных избыточной или
недостаточной активностью цитокинов. Чтобы установить роль цитокинов
в иммунопатогенезе различных заболеваний, только определения содер-
жания цитокина в биологических жидкостях недостаточно. Цитокиновая
система — крайне сложный компонент иммунной системы, включающий:
• клетки-продуценты цитокинов;
• гены и сигнальные пути, связанные с выработкой цитокинов;
• растворимые или мембранные формы цитокинов и их антагонисты;
• клетки-мишени цитокинов;
• рецепторы цитокинов, экспрессируемые клетками-мишенями;
• сигнальные пути, запускаемые через цитокиновые рецепторы, и экс-
прессия генов, связанных с их реализацией;
• группа растворимых рецепторов цитокинов.
Все эти этапы крайне важны для функционирования цитокиновой систе-
мы. Известны заболевания, в иммунопатогенезе которых может наблю-
даться нарушение любого из названных механизмов.
В качестве примера можно рассмотреть участие некоторых цитокинов в
иммунопатогенезе туберкулеза. CD4+ и CD8+ Т-лимфоциты вырабатывают
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 231
ИФН-у, участвующий в активации макрофагов и других клеток при инфи-
цировании микобактериями. Однако туберкулезная инфекция протекает
крайне тяжело у больных, имеющих мутантный рецептор ИФН-у. При этом
уровень ИФН-у в циркуляции у больных с тяжелой формой туберкулеза
может быть нормальным или повышенным, однако нарушена его рецеп-
ция (вследствие дефекта рецептора). Известно, что ФНО-а необходим для
защиты против микобактерий и принимает активное участие в образовании
гранулем. В последние годы для лечения некоторых аутоиммунных заболе-
ваний, например ревматоидного артрита, стали использовать лекарствен-
ные средства на основе моноклональных антител против ФНО-а. При рев-
матоидном артрите уровень ФНО-а существенно превышает нормальные
показатели, но под влиянием специфических антител он снижается вплоть
до нормальных значений. У большинства больных наступает ремиссия
заболевания. Однако в некоторых случаях с высокой частотой происходит
реактивация латентной формы туберкулезной инфекции. Подобного рода
примеров довольно много при самых разных заболеваниях.
Возникает крайне важная проблема клинической иммунологии: как и на
каком уровне следует оценивать разные этапы, связанные с выработкой и
рецепцией цитокинов?
Комплексный анализ системы цитокинов включает несколько последо-
вательных этапов.
• Анализ на уровне клеток-продуцентов (мононуклеарные клетки,
лимфоциты, лейкоциты, макрофаги, ДК и др.)
о Генный уровень
- Исследование генов, которые ответственны за синтез цитокинов и
их полиморфизмов, методами, основанными на ПЦР.
- Идентификация адаптерных и других молекул, которые проводят
сигнал, запускающий транскрипцию цитокиновых генов (ПЦР,
иммуноблоттинг и др.).
О Клеточный уровень
- Выявление и определение количества клеток (Thl, Th2, регуля-
торные Т-лимфоциты и др.), содержащих цитокины (методом
внутриклеточного окрашивания цитокинов).
- Подсчет количества клеток, секретирующих анализируемые цито-
кины (методом ELISPOT).
• Анализ растворимых цитокинов и их антагонистов в биологиче-
ских средах организма
Количественное определение цитокинов с помощью ИФА.
Тестирование биологической активности цитокинов на различных
моделях (клеточные линии, клетки-мишени и др.).
Иммуногистохимическое окрашивание цитокинов в тканях.
О Определение соотношения оппозитных цитокинов (например, про-
и противовоспалительных), а также цитокинов и их антагонистов.
ГЛАВА 9
ЧАСТЬ 2
232 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Определение действия цитокинов на клетки-мишени
<> Выявление экспрессии рецепторов цитокинов и их генов (проточная
цитофлюориметрия, ПЦР).
О Анализ молекул, участвующих в передаче сигнала с рецепторов
цитокинов в клетках-мишенях (ПЦР, иммуноблоттинг).
о Анализ фенотипа и функциональной активности клеток-мишеней
после действия на них конкретного цитокина (проточная цито-
флюорометрия, методы биологического тестирования).
В клинической практике с научными и диагностическими целями исполь-
зуют самые разнообразные методы (в зависимости от оснащенности имму-
нологической лаборатории):
• методы генотипирования;
• молекулярно-биологические методы;
• методы количественного определения растворимых цитокинов с помо-
щью иммуноанализа;
• тестирование биологической активности цитокинов;
• выявление внутриклеточных цитокинов;
• метод ELISPOT, который позволяет определить единичные клетки,
продуцирующие цитокины;
• иммунофлюоресценцию.
Генно-молекулярные методы позволяют исследовать экспрессию
генов цитокинов, их рецепторов, сигнальных молекул, а также изучать
полиморфизм этих генов. Имеется связь между вариантами аллелей генов
молекул цитокинов и предрасположенностью к ряду заболеваний. Изучение
аллельных вариантов генов цитокинов может дать информацию о генетиче-
ски запрограммированной продукции того или иного цитокина. Наиболее
чувствительным методом считают ПЦР в реальном времени (ПЦР-РВ).
Метод гибридизации in situ позволяет уточнить тканевую и клеточную
локализацию генов цитокинов.
В настоящее время выявлен полиморфизм многих генов цитокинов и их
рецепторов у человека. Так, среди группы провоспалительных цитокинов
наиболее изучен полиморфизм генов семейства ФНО-а. Для гена ФНО-а
описано несколько замен единичных нуклеотидов (англ, single nucleotide
polymorphism — SNP), вызывающих количественные изменения функцио-
нирования гена. Известны замены нуклеотидов в положениях -308 (G->A)
и -238 (G->A) в зоне промоторных участков. В связи с наличием поли-
морфного аллеля (-308) эффективность транскрипции гена и образова-
ния ФНО-а возрастает в 3-5 раз, что при определенных условиях может
способствовать более выраженному развитию системной воспалительной
реакции. Полиморфное состояние гена не является патологией, но в неко-
торых ситуациях полиморфизм гена, наряду с другими факторами, может
быть связан с чувствительностью или устойчивостью к иммунопатологии.
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 233
Количественное определение цитокинов в биологических жид-
костях и в надосадочной жидкости культуры мононуклеарных кле-
ток периферической крови методом иммуноферментного анализа
(ИФА). Поскольку цитокины служат локальными медиаторами, более
целесообразно измерять их уровни в соответствующих тканях после экс-
тракции тканевых белков или в естественных жидкостях (например, в
слезе, смывах из полостей, моче, амниотической и спинномозговой жид-
кости и т.д.). Уровни цитокинов в сыворотке или других биологических
жидкостях отражают текущее состояние иммунной системы, т.е. синтез
цитокинов клетками организма in vivo.
Определение уровней образования цитокинов мононуклеарными клетка-
ми периферической крови показывает функциональное состояние клеток.
Спонтанная выработка цитокинов этими клетками в культуре in vitro свиде-
тельствует, что последние уже были активированы in vivo. Индуцированный
различными стимуляторами, митогенами, антигенами синтез цитокинов
отражает потенциальную, резервную способность клеток отвечать на анти-
генный стимул, в частности, при действии лекарственных препаратов.
Низкое индуцированное образование цитокинов может служить одним из
признаков иммунодефицитного состояния. Цитокины не являются анти-
генспецифичными факторами, поэтому специфическая диагностика инфек-
ционных, аутоиммунных и аллергических заболеваний с помощью опреде-
ления уровня тех или иных цитокинов невозможна. Однако следует иметь
в виду, что стимуляции in vitro лимфоцитов специфическим антигеном
или аллергеном сопровождается выработкой цитокинов, чаще ИФН-у
(продуценты — Thl-клетки, ЦТЛ) или ИЛ-4 (продуценты — ТЬ2-клетки).
Таким способом можно определить клоны лимфоцитов, сенсибилизирован-
ные конкретным антигеном или аллергеном.
Оценка уровней цитокинов позволяет получить данные о тяжести вос-
палительного процесса, его переходе на системный уровень и прогнозе, а
также о функциональной активности клеток иммунной системы и соотно-
шении ТЬ1/ТЬ2-клеток, что очень важно при дифференциальной диагно-
стике ряда инфекционных и иммунопатологических процессов.
В биологических средах можно определить количественное содержание
цитокинов с помощью целого ряда методов иммуноанализа, используя
моноклональные и реже поликлональные антитела. ИФА позволяет опреде-
лить точные концентрации цитокинов в самых разнообразных биологиче-
ских жидкостях организма. При этом нужно иметь в виду, что для определе-
ния истинной концентрации цитокина в анализируемом образце необходима
его стандартизация, например, в отношении уровня общего белка.
Иммуноферментное определение цитокинов имеет ряд преимуществ
перед другими методами, а именно: обладает высокой чувствительностью,
специфичностью, независимостью от наличия антагонистов, поддается точ-
ному автоматизированному учету и стандартизации. Однако и этот метод
ГЛАВА 9
ЧАСТЬ 2
234 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
имеет свои ограничения. ИФА не характеризует биологическую активность
цитокина и может давать ложные результаты за счет перекрестно реагирую-
щих антигенных детерминант анализируемых образцов.
Биологическое тестирование проводят на основе знания об основных
свойствах цитокинов, их действии на определенные клетки-мишени, экс-
прессирующие рецепторы цитокинов. Изучение биологических эффектов
цитокинов позволило выявить по крайней мере 4 разновидности тестов для
цитокинов:
• по индукции пролиферации клеток-мишеней;
• по цитотоксическому эффекту;
• по индукции дифференцировки, например, костномозговых предше-
ственников;
• по противовирусному действию.
Для оценки биологических свойств цитокинов используют стандарт-
ные клеточные линии, лимфоидные и опухолевые клетки лабораторных
животных, различные клеточные элементы (лимфоциты, моноциты и др.)
человека.
Биологическую активность ИЛ-ip определяют в тесте пролиферации
мышиных тимоцитов, стимулированных митогеном in vitro; ИЛ-2 — по
способности стимулировать пролиферативную активность лимфобластных
клеток. По цитотоксическому действию на мышиные фибробласты (L929)
исследуют ФНО-а и лимфотоксины. Колониестимулирующие факторы
оценивают по их способности поддерживать рост костномозговых пред-
шественников in vitro в виде колоний в агаре. Противовирусную активность
интерферонов оценивают по угнетению цитопатического действия вирусов
в культуре диплоидных фибробластов человека и опухолевой линии фибро-
бластов мышей L-929.
Существует набор клеточных линий, рост которых зависит от наличия
конкретных цитокинов. По способности индуцировать пролиферацию
чувствительных клеток-мишеней проводят биотестирование ИЛ-1, ИЛ-2,
ИЛ-4, ИЛ-6, ИЛ-7, ИЛ-15 и др. Однако данные методы тестирования цито-
кинов отличаются недостаточной чувствительностью и информативностью.
Кроме того, молекулы ингибиторов и антагонистов могут маскировать
биологическую активность цитокинов. Некоторые цитокины проявляют
общую биологическую активность. Тем не менее эти методы приемлемы
для определения специфической активности рекомбинантных цитокинов.
Приведем несколько примеров нарушений, выявленных в системе цито-
кинов, с использованием комплексного подхода и современных методов
диагностики.
• Нарушение выработки цитокина может обусловливаться мутацией
кодирующего его гена. Так, мутация гена ИЛ-2 в 5'-регуляторном
регионе или мутация ядерного фактора NF-АТ обусловливает наслед-
ственный дефицит выработки ИЛ-2 и развитие ПИД.
ОЦЕНКА ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА 235
• На уровне рецепторов цитокинов выявлен дефект гена, кодирующего
синтез у-цепи, общей для рецепторов ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-13
и ИЛ-15. В результате дефекта в клетках-мишенях заблокирован про-
цесс проведения сигнала активации даже при наличии в организме
неизмененных молекул цитокинов. Генный дефект синтеза общей
у-цепи затрагивает несколько цитокинзависимых систем, влияет на
дифференцировку Т-клеток и приводит к развитию одной из форм
тяжелого комбинированного иммунодефицита (ТКИД). Описан ТКИД
человека, связанный с мутацией гена JAK-3 — молекулы, передающий
сигнал активации после взаимодействия ИЛ-2 с рецептором ИЛ-2.
• Известно, что нарушение баланса выработки цитокинов ТЫ-, Th2-,
ТЫ7- и регуляторными Т-клетками приводит к развитию различных
заболеваний.
• Так, уменьшение в периферической крови относительного количества
Thl-клеток, экспрессирующих ИФН-у, выявляют у больных туберку-
лезом, рассеянным склерозом и другими заболеваниями.
• Увеличение уровня ТЬ2-клеток при уменьшении количества Thl-
клеток может стать причиной участившихся инфекционных осложне-
ний после оперативного вмешательства. У больных атопической БА
содержание продуцентов ИФН-у не изменяется, однако повышается
процентный уровень Т-клеток, вырабатывающих ИЛ-4. При атопи-
ческом дерматите и БА у детей уменьшается количество Т-клеток,
экспрессирующих ФНО-а. У ВИЧ-инфицированных больных умень-
шается количество клеток, экспрессирующих ИФН-у и ИЛ-2, а также
увеличивается количество продуцентов ИЛ-4 и ИЛ-10. Повышенная
выработка ИЛ-17 характерна для хронических воспалительных про-
цессов и аутоиммунных заболеваний, таких, как аутоиммунный увеит,
ревматоидный артрит и др.
Подобный аналитический подход дает возможность выявить дефект на
разных уровнях функционирования не только цитокинов, но и системы рецеп-
торов врожденного иммунитета (например, TLR), антителогенеза и т.д.
Вопросы для самоконтроля
• Что такое иммунный статус?
• Сформулируйте основные подходы к оценке иммунной системы чело-
века.
• В чем состоит двухэтапный принцип оценки иммунного статуса?
Перечислите тесты уровней I и II.
• Какие биологические материалы используются для оценки состояния
иммунной системы человека?
• Перечислите основные методы оценки процессов распознавания, акти-
вации, пролиферации, дифференцировки, регуляции иммунного отве-
та. Обоснуйте патогенетический подход.
ГЛАВА 9
ЧАСТЬ 2
236 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Опишите возможности применения методов молекулярной генетики и
молекулярной биологии при обследовании иммунной системы.
• В чем состоит аналитический подход к оценке системы цитокинов,
системы TLR?
• Как, используя современные методы иммуноанализа и молекулярной
биологии, оценить систему цитокинов и выявить дефект на уровне
клеток-продуцентов, цитокинов, клеток-мишеней?
Глава 10
Возрастные особенности
иммунной системы ребенка
Для иммунной системы новорожденного характерны количественные
и функциональные особенности, не позволяющие оптимально реа-
гировать в первую очередь на многочисленные патогенные микро-
организмы. По данным Всемирной организации здравоохранения
(2005 г.), ежегодно от инфекционных заболеваний в мире умирают
около 2 000 000 детей и большинство из них до 6-месячного воз-
раста. Чаще других заболеваемость и смертность в неонатальный и
ранний детский периоды вызывают грамположительные бактерии
(стрептококки группы В, Streptococcus pneumoniae), грамотрица-
тельные бактерии {Escherichia coli, Bordetella pertussis), вирус про-
стого герпеса, респираторно-синцитиальный вирус, ротавирусы и
многие другие.
В норме здоровый доношенный новорожденный имеет особое,
отличное от взрослого, состояние иммунной системы — биологи-
чески целесообразное, но характеризуемое как физиологическое
иммунодефицитное состояние. В процессе родов и в первые
часы после рождения ребенок контактирует с огромным количе-
ством ранее не знакомых ему экзогенных антигенов вирусной, бак-
териальной и грибковой природы. Адаптация иммунной системы
к антигенной нагрузке окружающей среды — один из важнейших
физиологических факторов, обеспечивающих нормальное раз-
витие ребенка. От того, как пройдет период иммунологической
адаптации, во многом будет зависеть качество жизни растущего
ребенка.
Иммунная система новорожденного испытывает также влияние
большого количества других факторов внешней среды, существен-
но влияющих на ее функцию. Это приводит к развитию своеобраз-
ной динамики показателей периферической крови, объяснение
ЧАСТЬ 2
238 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
которой может быть только многофакторным. Например, существенно изме-
няется лейкоцитарная формула крови. У новорожденных соотношение числа
нейтрофилов и лимфоцитов примерно такое же, как и у взрослых, или же,
как и у беременных, несколько преобладают нейтрофилы. Однако в первые
дни жизни количество нейтрофилов быстро снижается, а лимфоцитов воз-
растает. К 4-5-м суткам жизни процентное соотношение нейтрофилов и
лимфоцитов устанавливается в среднем на уровне 45%. Это так называемый
первый физиологический перекрест лейкоцитов. По данным различ-
ных авторов, его наблюдают с 3-х по 7-е сутки жизни. Большой индивиду-
альный разброс показателей «перекреста» объясняется различными гено- и
фенотипическими особенностями новорожденного: особенностями генотипа
родителей, течения антенатального периода, характером родов, условиями
окружающей среды и степенью патогенного окружения. К моменту рожде-
ния у ребенка сформированы механизмы адаптации к новой среде обитания.
Один из них — повышенное содержание лейкоцитов (в 3-4 раза выше, чем
у взрослого), что, учитывая массовую гибель нейтрофилов в реакциях фаго-
цитоза в первые часы и дни жизни, обеспечивает защиту кожи и слизистых
оболочек.
В этот период жизни происходит контакт с большим количеством анти-
генов, что дает мощный импульс сформированному антенатально лимфоид-
ному комплексу включиться в реакции адаптивного иммунного ответа резким
повышением выработки лимфоцитов. Среди циркулирующих лимфоцитов
пуповинной и периферической крови преобладают так называемые наивные
Т-клетки, экспрессирующие маркер CD45RA, после миграции из тимуса еще
не контактировавшие с антигеном. Постепенно с возрастом ребенка возрастает
уровень CD45RO Т-лимфоцитов — клеток памяти.
Затем процентное содержание лимфоцитов продолжает повышаться, а
процентное содержание нейтрофилов снижаться, благодаря чему постепенно
формируется картина обратного соотношения уровней нейтрофилов и лим-
фоцитов. С 10 месяца до 2,5 лет у детей выявляют максимальный физиоло-
гический лимфоцитоз (65%). В течение этого времени ребенок сталкивается
со специфическим антигенным воздействием (профилактические прививки,
вирусы, бактерии и др.). Происходит количественное увеличение лимфоид-
ной ткани (аденоиды, миндалины, лимфатические узлы), в результате чего
иммунная система организма постепенно приобретает типичные для нее
характеристики. У большинства детей к концу 2-го года жизни на некоторые
инфекции развивается вторичный иммунный ответ. Постепенно происходит
снижение процентного содержания лимфоцитов, при этом гиперплазия лим-
фоидной ткани еще нарастает. К 4-5 году жизни наступает повторное равно-
весие между лимфоцитами и нейтрофилами периферической крови. Это так
называемый второй физиологический перекрест лейкоцитов. Время
установления второго перекреста имеет индивидуальные различия и коле-
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ИММУННОЙ СИСТЕМЫ РЕБЕНКА 239
блется от 4 до 7 лет, что зависит от фенотипических особенностей ребенка,
функционального состояния основных органов и систем и других условий
созревания организма (материально-бытовое обеспечение, индивидуальное
и коллективное воспитание, экология и др.). Детей в возрасте 6-7 лет с немо-
тивированным лимфоцитозом принято относить к «поздно стартующим», то
есть к детям с задержкой иммунного созревания.
В последующем происходит постепенная инволюция лимфоидной ткани
с совершенствованием ее функции. В результате процент лимфоцитов начи-
нает снижаться, в то время как процент нейтрофилов нарастает, достигая
нормы взрослого.
Таким образом, в норме у ребенка наступает 2 перекреста в лейкоцитар-
ной формуле крови: на 5-е сутки и на 5-6-м году жизни. Однако в послед-
нее время отмечают изменения скорости созревания иммунной системы,
поэтому чаще выявляют «поздно стартующих» детей, у которых 2-й пере-
крест происходит на 7-8-м году жизни (на рис. 10-1 обозначено более
жирной линией). Однако в настоящее время неясно, какое значение имеют
соотношения между нейтрофилами и лимфоцитами в формировании имму-
нопатологии и насколько они важны для оптимального формирования
поствакцинального иммунитета?
ГЛАВА 10
Количество клеток
Возраст
Рис. 10-1. Физиологические перекресты лейкоцитарной формулы периферической крови
у детей.
ЧАСТЬ 2
240 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
10.1. РОЛЬ ГРУДНОГО МОЛОКА В АДАПТАЦИИ
ИММУННОЙ СИСТЕМЫ РЕБЕНКА
Грудное молоко — важнейший компонент адаптации иммунной системы
новорожденного к новым условиям существования. В день ребенок с груд-
ным молоком получает около 108 клеток иммунной системы, большинство из
которых представлены макрофагами, молозивными тельцами (макрофаги,
содержащие частицы жира) и нейтрофилами, а к лимфоцитам (в основном
Т-клетки) принадлежат 5-27% клеток. В 1 мл молозива содержится около
5 000 000 лейкоцитов, а зрелого молока — 100 000 лейкоцитов. Молозиво
и зрелое молоко различаются также и по составу лейкоцитов: молозиво
содержит 40-50% макрофагов, 40-50% нейтрофилов и 5-10% лимфоцитов;
в зрелом молоке доля макрофагов возрастает до 85%. Сравнение клеточного
состава грудного молока и периферической крови показывает, что в грудном
молоке меньше лимфоцитов и гораздо больше макрофагов, чем в аналогич-
ном объеме периферической крови.
Таблица 10-1. Сравнительная характеристика процентного содержания клеток иммунной
системы грудного молока и периферической крови
Клетки Содержание клеток, %
Грудное молоко Периферическая кровь
С03< 25,6 68,6
СОФ 13,6 42,9
CD8* 12,2 25,9
Макрофаги (CD14*) 64,2 2,1
В-лимфоциты (CD19) 10,2 12,6
Кроме клеток, молоко содержит гуморальные факторы иммунной
системы: IgA, цитокины и хемокины (ИЛ-10, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-18,
ФНО-а, ИФН-у, Г-КСФ, М-КСФ, МСР-1, VEGF и др.), лактоферрин,
ос-лактальбумин, казеин и др. В грудном молоке поддерживается высокий
уровень остеопонтина — многофункционального белка, вырабатываемого
макрофагами, Т-лимфоцитами и клетками эпителия. Этот белок индуци-
рует клеточный иммунный ответ и хемотаксис клеток воспаления, пода-
вляет выработку оксида азота, является ключевой молекулой в индукции
Th 1-клеток.
Материнские лимфоциты переносят ребенку иммунитет и вырабатыва-
ют цитокины. Относительно нейтральный pH желудочного содержимого и
буферные свойства молока обеспечивают функционирование клеток иммун-
ной системы в желудке ребенка. Однако молоко может быть и источником
заражения. Так, макрофаги и CD4* Т-клетки матери через молоко Moiyr
переносить ребенку инфекционных возбудителей.
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ИММУННОЙ СИСТЕМЫ РЕБЕНКА 241
10.1.1. Уровни цитокинов в сыворотке крови при оценке
периода адаптации новорожденного
Динамика изменений уровня некоторых цитокинов в сыворотке крови
может отражать нарушения, возникающие в течение периода адаптации
новорожденного ребенка. Осложненное течение раннего периода пост-
натальной адаптации (5-9-е сутки) приводит к снижению содержания в
сыворотке крови ИЛ-ip и ФНО-а. В норме уровень ИЛ-8 у новорожденных
очень низкий. Однако резкое увеличение содержания ИЛ-8 происходит при
внутриутробной инфекции и у недоношенных детей (>150 пг/мл у инфици-
рованных и >50 пг/мл у недоношенных). У детей от матерей, страдающих
атопией, выявляют повышенный уровень ИЛ-4 в пуповинной крови.
Состояние иммунной системы плода в период внутриутробного развития
и ее взаимодействие с иммунной системой матери во многом определяет
становление иммунокомпетентности ребенка в первые годы его жизни.
• В течение эмбриогенеза иммунная система матери проявляет толерант-
ность к антигенам плода. Клетки трофобласта лишены классических
антигенов МНС. В норме реакции отторжения плода отсутствуют.
• Плацента и плод синтезируют супрессорные факторы. На клетках
плаценты, выполняющих барьерную функцию, задерживаются анти-
тела к антигенам HLA. От матери к плоду передаются только IgG, а
от плода — клетки трофобласта, поддерживающие иммуносупрессию.
Реакции отторжения плода подавляются.
• У беременной усилена функция ТЬ2-клеток. Вирусные инфекции,
инфекции TORCH-комплекса (токсоплазмоз, краснуха, цитомегало-
вирусная и герпетическая инфекции) приводят к усилению функции
Thl-лимфоцитов, что может сопровождаться отторжением плода, пре-
рыванием беременности.
• Ткань тимуса обнаруживается в возрасте 5 недель. Т-лимфоциты появ-
ляются в тимусе в возрасте 12 недель. Реакции клеточного иммунного
ответа проявляются в слабой форме.
• На 16-й неделе дифференцируются Т-хелперы и регуляторные Т-клетки.
Супрессорную функцию выполняют не только CD4+ CD25+ Treg, но и
незрелые Т-лимфоциты и другие клетки. Это подавляет отторжение
плода.
• Цитотоксическая функция Т-лимфоцитов значительно снижена. С этим
может быть связана высокая чувствительность к протозойным и вирусным
инфекциям, таким как краснуха, герпес, вирусный гепатит, токсоплаз-
моз и др.
• Фагоцитоз нарастает с 20-недельного возраста, причем преимущественно
его поглотительная способность, а последующие фазы остаются несо-
вершенны.
ГЛАВА 10
242 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
• Активный синтез компонентов системы комплемента фетальной пече-
нью выявляют на ранней стадии онтогенеза (с 8 недели С2 и С4). Один
из механизмов врожденной иммунной системы.
• Активный трансплацентарный транспорт материнских IgG к плоду начи-
нается со 2-й половины беременности. Низкий показатель IgG в пупо-
винной крови подтверждает недоношенность плода (более быстрый
катаболизм IgG).
• При сохранности трансплацентарного барьера к моменту рождения
IgM в пуповинной крови выявить не удается. Наличие IgM (>0,2 г/л)
в пуповинной крови свидетельствует о перенесенной внутриутробной
инфекции.
• К моменту рождения иммуносупрессорные факторы организма ослабе-
вают. В частности, исчезает один из наиболее активных факторов супрес-
сии — а-фетопротеин. Изменения в иммунной системе в последние дни
беременности и в период родов сходны с проявлениями воспалительной
реакции: увеличение уровня провоспалительных цитокинов (ФНО-а,
ИЛ-ip), простагландинов и других медиаторов. Подобные механизмы
могут отвечать за невынашивание беременности инфекционного генеза с
участием рецепторов врожденного иммунитета (TLR и др.).
Становление иммунной системы ребенка проходит через ряд стадий,
условно подразделяемых как минимум на 5 критических периодов. Знание
особенностей иммунной системы в эти периоды развития ребенка край-
не важны как для проведения эпидемиологических и профилактических
мероприятий (в первую очередь для вакцинации), так и для контроля каче-
ства его жизни. Установление связи критических периодов формирования
иммунной системы с наиболее тяжелыми заболеваниями детского возраста
(иммунодефициты, аллергопатология, аутоиммунные заболевания, лимфо-
пролиферативные заболевания) — одна из ключевых задач современной
педиатрии и детской иммунологии. Еще предстоит выяснить, для какого из
этих периодов наиболее характерны те или иные заболевания иммунной
системы. Ниже приведены основные клинически значимые возрастные
изменения в иммунной системе ребенка.
I критический период — период новорожденное™. Характерны сле-
дующие особенности:
• низкая устойчивость к условно-патогенной, пиогенной, грамотрица-
тельной микрофлоре;
• склонность к образованию гнойно-воспалительных процессов, воз-
никновению септических состояний;
• высокая чувствительность к вирусным инфекциям;
• до 0,5% новорожденных имеют признаки врожденной вирусной
инфекции.
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ИММУННОЙ СИСТЕМЫ РЕБЕНКА 243
Основные возрастные особенности иммунной системы в период
новорожденное™
• Среди факторов врожденного иммунитета высокоэффективен лизоцим
как один из основных механизмов местной защиты.
• Содержание пропердина активно нарастает в течение 1-й недели жизни.
Система пропердина активируется значительной антигенной нагрузкой
в первые дни жизни.
• Барьеры кожи и слизистых оболочек недостаточно совершенны и часто
проницаемы для патогенных микроорганизмов. Кроме того, уровень
катионных противомикробных пептидов на уровне покровных тканей
нормального уровня не достигает.
• Активация комплемента по классическому и альтернативному путям
ослаблена, дефицит С5-компонента. Низкая опсонизирущая активность
крови (слабость антибактериальной защиты), склонность к избыточно-
му накоплению продуктов воспаления.
• Незавершенность фагоцитоза. Большие антигенные нагрузки приводят
к интоксикации организма ребенка экзо- или эндотоксинами. Высокая
частота пневмонии с осложненным течением.
• Ограниченная секреция цитокинов, в том числе интерферонов, и их быстрая
истощаемость. Слабая противовирусная защита. Склонность к ранней
генерализации вирусного и бактериального инфекционного процессов
(Pneumococcus, Klebsiella, Haemophilus influenzae, Staphylococcus и др.).
• Сохраняется супрессорная функция регуляторных Т-лимфоцитов и дру-
гих клеток, что, возможно, играет роль в предупреждении аутоагрессии.
• Снижено содержание NK-клеток. Ослаблена противоопухолевая и
противовирусная защита.
• В-лимфоциты отличаются низкой чувствительностью к интерлейкинам,
вырабатываемым Т-клетками, и недостаточно эффективной способно-
стью к антителообразованию.
• Эффективно функционируют IgG-антитела, полученные от мате-
ри. Собственные IgG продуцируются в недостаточном количестве.
Материнские IgG защищают новорожденных и детей первых месяцев
жизни от дифтерийного токсина, вирусов полиомиелита, кори, красну-
хи, возбудителей бактериальных инфекций (стрептококка, менинго-
кокка, частично от столбняка). Не исключен перенос от матери IgG с
аутоиммунной активностью, способных вызывать некоторые аутоим-
мунные процессы.
• Слабое образование субклассов IgG2, IgG4, IgA, IgM антител.
Предрасположенность к вирусным и бактериальным инфекциям.
Слабость антитоксического иммунитета.
• Снижен синтез секреторного и сывороточного IgA. Слабая защищен-
ность слизистых оболочек дыхательной системы и пищеварительного
тракта.
ГЛАВА 10
ЧАСТЬ 2
244 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Снижена пролиферативная активность Т-лимфоцитов в ответ на дей-
ствие митогенов. Ограниченна секреция цитокинов. Слабая противо-
вирусная защита.
• Биологический смысл супрессорной направленности иммунных
реакций состоит в подавлении развития аутоиммунной патологии.
Предупреждение тяжелой иммунокомплексной патологии при контак-
те с огромным числом антигенов.
• Относительно высокий уровень IgE. Возможно, важно для начала фор-
мирования аллергопатологии.
II критический период — возраст 3-6 месяцев. В этот период наиболее
выражено транзиторное снижение уровня иммуноглобулинов в сыворотке
крови. Иммунный ответ носит в основном первичный характер без сохра-
нения иммунной памяти. Вакцинация приводит к формированию надежной
иммунной памяти, и только ревакцинация формирует вторичный иммун-
ный ответ.
Основные возрастные особенности иммунной системы во второй
критический период
• Сохраняется супрессорная направленность иммунных реакций при
лимфоцитозе. Подавляются реакции аутоагрессии при разнообразных
антигенных нагрузках.
• Существенно снижен уровень IgG (за счет катаболизма антител, полу-
ченных от матери).
• С 3-месячного возраста повышается синтез секреторного IgA, но недо-
статочность мукозального иммунитета сохраняется до 4 лет. Высокая
чувствительность к респираторным вирусным инфекциям. Начинаются
рецидивирующие острые респираторные вирусные инфекции, бронхи-
ты, пневмонии.
• В этот период выявляют наиболее низкие уровни сывороточных
иммуноглобулинов всех классов. Физиологическая гипоиммуногло-
булинемия.
• Низкая способность к синтезу интерферона. Частые острые респира-
торные вирусные инфекции.
• На большинство антигенов развивается первичный иммунный ответ
с синтезом IgM без формирования стойкой иммунной памяти. Корь и
коклюш протекают атипично, не оставляя стойкого иммунитета. Вирус
гепатита В редко вызывает желтушную форму, чаще служит причиной
акродерматита — синдрома Джанотти.
• Фагоцитоз остается незавершенным. Нарушено развитие полноценно-
го иммунного ответа.
Основные особенности иммунитета ребенка на 1-м году жизни
• Супрессорная направленность иммунных реакций. Биологический
смысл заключается в предупреждении развития тяжелой иммуноком-
плексной патологии.
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ИММУННОЙ СИСТЕМЫ РЕБЕНКА 245
• Низкая способность к синтезу интерферона. Частые острые респира-
торные вирусные инфекции.
• Низкий уровень IgG и IgA. Слабый иммунный ответ на инкапсулиро-
ванные бактерии.
III критический период — 2-3-й годы жизни. Значительное расши-
рение контактов ребенка определяет повышение частоты инфекционных
заболеваний, что приводит к декомпенсации незрелых иммунных механиз-
мов и манифестации аномалий иммунитета.
Основные возрастные особенности иммунной системы в 3-й кри-
тический период
• Сохраняется первичный характер иммунного ответа. Ребенок плохо
адаптируется к детским коллективам.
• Сохраняется дефицит IgG2 и IgG4. Сохраняется чувствительность к
вирусным инфекциям, Haemophilus influenzae. Созревает гуморальный
иммунитет.
• Повышается чувствительность В-лимфоцитов к интерлейкинам, акти-
вируется хелперная функция Т-клеток. Повышается антигенная нагруз-
ка, появляются фенотипические проявления аномалий иммунитета.
• Незрелость иммунных процессов в слизистых оболочках. Дети чувстви-
тельны к вирусным инфекциям, частые заболевания ЛОР-органов.
IV критический период — 4-6-й годы жизни. Завершается период
становления адаптивного иммунитета. Характерна склонность заболеваний
верхних дыхательных путей к хроническому или рецидивирующему тече-
нию в связи с недостаточностью мукозального иммунитета у некоторых
детей.
Основные возрастные особенности иммунной системы в 4-й кри-
тический период
• Происходит 2-й перекрест процентного содержания в крови лимфоци-
тов и нейтрофилов. Иммунный ответ усовершенствуется.
• Формируется выраженный вторичный иммунный ответ на большин-
ство антигенов. Возрастает надежность вакцинации и эффективность
преодоления инфекции.
• Повышается иммунорегуляторный индекс. Уменьшается супрессорная
направленность иммунных реакций.
• Абсолютное число В-лимфоцитов снижается, а уровень IgM прибли-
жается к норме взрослого. Повышается эффективность иммунного
ответа.
• Секреторный IgA значительно ниже уровня, характерного для взрос-
лого человека. Сохраняется недостаточность мукозального иммуните-
та. Характерно учащение рецидивирующих заболеваний носоглотки.
• Физиологическое повышение уровня IgE. Возрастает частота иммуно-
патологических заболеваний.
ГЛАВА 10
ЧАСТЬ 2
246 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
V критический период — 12-13 лет. В этот период начинают активно
функционировать половые железы, поэтому появляются половые различия
в иммунном статусе. Однако иммунология пубертатного периода требует
углубленного изучения, поскольку в этот период окончательно формиру-
ются многие иммунопатологии.
Основные возрастные особенности иммунной системы в 5-й кри-
тический период
• Уменьшается масса лимфоидных образований. Окончательно устраня-
ются признаки лимфатизма.
• У мальчиков происходит стимуляция секреции половых гормо-
нов (андрогенов), способных ингибировать клеточный иммунитет.
Возрастает чувствительность к микобактериям туберкулеза и другим
патогенам, от которых защищает преимущественно Т-клеточное звено
иммунной системы, однако облегчается течение аллергических и ауто-
иммунных заболеваний.
• У девочек неустановившиеся взаимоотношения эстрогенов и прогесте-
рона приводят к снижению супрессорной функции Т-клеточного звена.
Утяжеляется течение аллергических и аутоиммунных заболеваний.
Многие особенности развития и течения заболеваний иммунной систе-
мы у детей представлены в соответствующих главах.
Глава 11
Иммунодефицитные заболевания
11.1. ОСНОВНЫЕ ПОНЯТИЯ
Как сообщалось ранее, иммунопатология — область иммуноло-
гии, изучающая патологические процессы (иммунопатогенез) и
заболевания иммунной системы. В настоящее время выделяют ряд
состояний и заболеваний, обусловленных нарушениями иммунной
системы:
• заболевания, обусловленные ослаблением функций иммунной
системы, — иммунодефициты (первичные и приобретенные,
или вторичные);
• заболевания, обусловленные избыточным реагированием
иммунной системы, — аутоиммунные, аллергические;
• инфекционные заболевания иммунной системы, при кото-
рых возбудители избирательно поражают лимфоциты (ВИЧ-
инфекция, инфекционный мононуклеоз и др.);
• лимфопролиферативные заболевания — опухоли иммунной
системы: различные формы лейкоза, лимфогранулематоз,
лимфома, лимфосаркома и др.;
• болезни иммунных комплексов;
• трансплантационная болезнь;
• иммунопатология репродуктивной системы;
• другие.
11.2. ПЕРВИЧНЫЕ (ГЕНЕТИЧЕСКИ
ОБУСЛОВЛЕННЫЕ) ИММУНОДЕФИЦИТЫ
Первичные иммунодефициты (ПИД) — гетерогенная группа
наследственных расстройств, причиной которых являются мута-
ции специфических генов с дефектами в одном или нескольких
ЧАСТЬ 2
248 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
компонентах иммунной системы. Реализация генетического дефекта при-
водит к появлению широкого спектра заболеваний. В подавляющем боль-
шинстве случаев эти заболевания — результат повышенной чувствитель-
ности пациентов к инфекциям, предрасположенности к аутоиммунным и
онкологическим заболеваниям, а также аллергии. К настоящему времени
описано около 150 различных вариантов ПИД. Однако распространенность
ПИД в общей популяции точно не известна, хотя специалисты по изучению
генетически обусловленных заболеваний считают, что они встречаются с
такой же частотой, как и другие подобные патологии человека. Следует
отметить, что ПИД это не такие редкие заболевания, как было принято
считать ранее.
Распространенность первичных иммунодефицитов
Впервые о заболеваниях, связанных с генетическими дефектами иммун-
ной системы, стало известно лишь в середине XX в. В 1952 г. английский
военный педиатр О. Брутон описал историю болезни мальчика в возрасте
14 лет, у которого в сыворотке отсутствовала у-глобулиновая фракция бел-
ков и развились тяжелые воспалительные заболевания, в первую очередь
пневмония. Позже синдром назвали Х-сцепленной агаммаглобулинемией
Брутона и нашли белок (Btk), мутация которого связана с этим заболева-
нием. Длительное время мальчик получал сыворотку и плазму, чтобы вос-
полнить недостаток иммуноглобулинов.
Особую роль в понимании проблемы иммунодефицитов сыграл аме-
риканский педиатр Р. Гуд (1922-2003), одним из первых на примере
генетических иммунных дефектов у детей доказавший двухкомпонентное
зависимое от тимуса и от костного мозга строение иммунной системы
человека. Р. Гуд описал тяжелую форму иммунодефицита (синдром Гуда).
Под его руководством в 1968 г. была проведена первая успешная транс-
плантация костного мозга при тяжелой форме иммунодефицита и разра-
ботана методология ведения таких больных в условиях стерильного бокса.
Широко известны его высказывания: «Иммунодефициты — наши учителя»,
«Иммунодефициты продолжают нас учить». Фактически благодаря таким
ученым, как Р. Гуд, зародилась современная клиническая иммунология с ее
основным акцентом на иммунную систему.
В настоящее время известно около 150 клинических форм генетически
опосредованной иммунной недостаточности, и примерно в 130 из них
открыты генные дефекты. За истекшие десятилетия накоплены клинические
данные, что потребовало их систематизации и создания регистров больных.
В большинстве стран Европы, в том числе и в России, созданы нацио-
нальные регистры больных ПИД: в 1980-е годы - в Англии, с 1989 г. -
в России, с 1997 г. — в Испании и т.д. Общеевропейский регистр больных
ПИД создан в 1994 г. (штаб-квартира в Швеции). К 2008 г. в него включены
6614 пациентов из 23 стран Европы.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 249
Врожденные дефекты
фагоцитов, 11,2%
Другие хорошо
охарактеризованные
иммунодефициты, 18,3%
Дефициты
комплемента, 2,5%
Аутовоспалительные
нарушения, 0,4%
Дефекты врожденного
иммунитета: рецепторов
и сигнальных
компонентов, 0,4%
Генетические
нарушения иммунной
регуляции, 2,7%
Комбинированные
Т- и В-клеточные
иммунодефициты, 8,4%
Преимущественный
дефицит антител,
56,1%
ГЛАВА 11
Рис. 11-1. Частота встречаемости первичных иммунодефицитных заболеваний.
В России на начало 2009 г. зарегистрировано 604 пациента (по данным
отделения иммунопатологии детей ФГБУ ГНЦ «Институт иммунологии»
ФМБА РФ). Регистры больных во всех странах постоянно пополняются.
Следует отметить, что по частоте встречаемости отдельных нозологических
форм «лидируют» селективный дефицит IgA (1:300-1:700); ОВИН (1:7000-
1:200 000); Х-сцепленная агаммаглобулинемия (1:50 000-1 000 000); ХГБ
(1:50 000-1:250 000) (рис. 11-1). Данные о распространенности ПИД очень
широко варьируют в разных регионах, в том числе и в России, что связано
в основном с трудностями внедрения достижений фундаментальной имму-
нологии в клиническую практику.
Классификация первичных иммунодефицитов
Классификация ПИД отражает этапы развития современной клиниче-
ской иммунологии. Накопление новых данных о генетических дефектах
иммунной системы требует регулярно пересматривать классификации
этих нарушений. Ниже приведен краткий анализ классификаций ПИД,
основанных на выявляемых в разные годы изменениях в иммунной систе-
ме. В составлении классификаций приняли участие эксперты Всемирной
организации здравоохранения и других организаций иммунологического
профиля:
• 1968 г. — поражение клеточного и гуморального иммунитета, различ-
ные варианты агаммаглобулинемии и гипогаммаглобулинемии;
250 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
• 1972 г. — грубые дефекты стволовых клеток, Т- и В-лимфоцитов
(15 форм). В 1969 г. английский иммунолог И. Ройт (автор несколь-
ких вариантов учебника по иммунологии) ввел символы Т- и
В-лимфоциты;
• 1974 г. — отечественная классификация, предложенная Р.В. Петровым
и Ю.М. Лопухиным — организаторами первой в стране клиники ПИД в
Москве, где впервые в мире была проведена трансплантация комплек-
са «тимус-грудина, содержащая костный мозг» для лечения больных
атаксией-телеангиэктазией. Особенность данной классификации в
том, что впервые выдвинута идея подразделения больных ПИД на
группы в зависимости от блока того или иного этапа развития иммун-
ной системы (блоки развития клеток). На рис. 11-2 представлены
этапы становления иммунной системы, известные в 1974 г., и их блоки.
Отдельные или комбинированные генетические блоки позволили опи-
сать по крайней мере 12 вариантов ПИД. Следует отметить, что данный
принцип подразделения ПИД лег в основу классификации, предложен-
ной позже членами экспертной комиссии Всемирной организации
здравоохранения, членом которой был академик РАН Р.В. Петров;
• 1977 г. — дефекты отдельных этапов иммуногенеза, Т- и В-клеток,
фагоцитоза, комплемента, функциональных расстройств, клеточных
нарушений;
• 1997 г., 1999 г. и далее — молекулярные и генные дефекты;
В-клетки
Рис. 11-2. Схема последовательности этапов развития Т- и В-систем иммунитета.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 251
• 2007 г. — расширение спектра заболеваний с включением новых групп:
дефекты врожденного иммунитета, аутовоспалительные заболевания
и др. Основу изложенного ниже материала составляют новые данные,
обобщенные по результатам последней классификации.
Разработка классификаций ПИД продолжается и постоянно попол-
няется научной группой Всемирной организации здравоохранения по
иммунодефицитам (International Union of Immunological Societies Primary
Immunodeficiency Disease Classification Committee).
Согласно современной классификации, принятой в 2007 г., все описан-
ные на сегодняшний день генетически опосредованные иммунодефициты
разделены на восемь групп, в каждой из которых, в свою очередь, выделяют
подгруппы:
• группа 1 — комбинированные Т- и В-клеточные иммунодефициты;
• группа 2 — преимущественный дефицит антител;
• группа 3 — синдромы иммунодефицитов с хорошо охарактеризован-
ными клиническими признаками;
• группа 4 — генетические нарушения иммунной регуляции;
• группа 5 — врожденные дефекты фагоцитов (числа, функций и/или
того и другого);
• группа 6 — дефекты врожденного иммунитета;
• группа 7 — аутовоспалительные заболевания;
• группа 8 — дефициты комплемента.
Перед тем как перейти к изучению отдельных форм ПИД, необходимо
ознакомиться с некоторыми проблемами, характеризующими их в целом.
Основные клинические характеристики ПИД
• Манифестация иммунодефицита, как правило, с раннего возраста.
• Рецидивирующие инфекционные поражения ЛОР-органов и органов
дыхания.
• Рецидивирующие пиогенные инфекционные заболевания.
• Оппортунистические инфекционные заболевания с необычно тяжелым
течением.
• Рецидивирование инфекционных заболеваний, вызванных одним и
тем же типом патогена.
• Аутоиммунные или хронические воспалительные заболевания и/или
лимфопролиферация.
• Характерны комбинации клинических особенностей для определен-
ных синдромов.
• Ангиоотеки.
Согласно международным рекомендациям для врачей первичного звена
здравоохранения, выделяют 9-10 признаков, настораживающих в отноше-
нии ПИД (по сути, это признаки «иммунной недостаточности») и являю-
щихся диагностически значимыми:
• частый отит (6-8 раз в год и чаще);
• синусит (4-6 раз в год);
ГЛАВА 11
ЧАСТЬ 2
252 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• пневмония (2 раза в год и чаще);
• абсцессы кожи и внутренних органов, особенно повторные;
• антибиотикотерапия для купирования инфекции с применением анти-
биотиков внутримышечно или per os в течение 2 мес и более, а также с
использованием внутривенных антибиотиков;
• не менее двух перенесенных инфекций, таких, как менингит, остеомие-
лит, сепсис;
• отставание ребенка в росте и по массе в сравнении с возрастной нор-
мой;
• персистирующая молочница или грибковые поражения кожи в возра-
сте старше 1 года;
• указание на наличие в семье больных ПИД, ранние смерти детей от
тяжелых инфекций.
Анализ анамнеза по указанным признакам дает основание заподозрить
ПИД при условии выявления у больных хотя бы одного из этих показа-
телей. В таких случаях необходимо углубленное обследование иммунной
системы на наличие признаков генетических нарушений.
Наиболее частые проявления ПИД — рецидивирующие инфекции или
инфекции, вызванные оппортунистическими микроорганизмами (табл.
11-1). При этом природа возбудителя может зависеть от уровня поражения
иммунной системы по клеточно-опосредованному, гуморальному, фагоци-
тарному, комплементзависимому или комбинированному типу. Дефицит
гуморального иммунитета часто связан с рецидивирующими инфекцион-
ными заболеваниями дыхательной системы. Среди пациентов с хрониче-
скими синуситами в 10% случаев выявляют ОВИН и в 7% — IgA-дефицит.
Иммунодефицит обнаруживают у 10% детей с повторными пневмониями.
У взрослых больных с бронхоэктазами иммунодефицит выявлен у 8%
пациентов. Рецидивирующие кожные абсцессы часто служат признаком
врожденных иммунных нарушений, в частности ninep-IgE-синдрома и хро-
нической гранулематозной болезни (ХГБ), при этом характерно длитель-
ное сохранение абсцессов либо персистенция редко встречающихся микро-
организмов, их вызывающих. Обращает на себя внимание ассоциация
иммунодефицитов с определенными инфекциями. Так, менингококковая
инфекция часто связана с дефектами комплемента либо в редких случаях
с дефектами антител. У 18% пациентов с менингококковыми менингитами
обнаружены дефекты комплемента, причем у этих пациентов менингит
вызывают менингококки нетипичных серогрупп (X, Y, W135). Реже встре-
чаются больные, инфицированные менингококками серогрупп А и С (соот-
ветственно 45% и 3%).
Такие микроорганизмы, как Streptococcus pneumoniae, сравнительно редко
выступают этиологически значимыми возбудителями у больных с иммуно-
дефицитами.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 253
ГЛАВА 11
Таблица 11-1. Возбудители инфекционных заболеваний, связанных с иммунодефицита-
ми [Rezaei N. et al., 2008]
Возбудители инфекционных заболеваний Связанные иммунодефициты Комментарий
Микоплазмы (Mycoplasma), уреаплазмы (Ureaplasma) Дефицит антител Часто вызывают остеомиелиты или артриты
Neisseria meningitidis Дефицит комплемента У пациентов часты рецидиви- рующие менингиты
Burkholderia cepacia Хроническая гранулематозная болезнь Наиболее частая причина смер- ти больного
Pseudomonas aeruginosa Нейтропения -
Сальмонеллы (Salmonella sp.) Хроническая гранулематозная болезнь Обычно инвазивные инфекции вызываются сальмонеллами с низкой патогенностью
Serratia marcescens Хроническая гранулематозная болезнь Вызывает поражение исклю- чительно мочевыделительной системы
Staphylococcus aureus Хроническая гранулематозная болезнь, гипер-1дЕ-синдром Чаще проявляется в виде вис- церальных инфекций
Стрептококки (Streptoccocus) Дефицит IRAK4, дефицит NEMO, дефицит комплемента, дефицит антител Дефицит IRAK4 связан со стрептококковым сепсисом
Атипичные микобактерии Нарушения активации макро- фагов, хроническая гранулема- тозная болезнь Исключительно в виде изо- лированной цервикальной аденопатии
Цитомегаловирус (Cytomegalovirus — CMV/ Вирус Эпштеина-Барр (Epstein-Barr Virus — EBV) Х-связанные лимфопроли- феративные заболевания, Т-клеточный дефицит -
Вирус простого гепреса (Herpes Simplex Virus — HSV) UNC-93B и дефицит TLR3 (дефицит STAT-1, каспазы-8, NEMO) Герпетический энцефалит как изолированное заболевание при дефиците TLR3; при других дефектах обычно связан с дру- гими инфекциями
Вирус гриппа (Influenza) Дефициты TLR3 Обнаруживают у У3 пациентов с гриппозным энцефалитом
Varicella zoster Большинство Т- и NK-клеточных дефицитов Заболевания могут иметь реци- дивирующий характер
Вирус папилломы (Papilloma virus) Г ипогаммаглобулинемии -
Aspergillus Хроническая гранулематозная болезнь -
254 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Окончание табл 11-1
Возбудители инфекционных заболеваний Связанные иммунодефициты Комментарий
Candida Хроническая гранулематозная болезнь, аутоиммунная поли- эндокринопатия с кандидозом и эктодермальной дисплазией —
Histoplasmosis Дефицит макрофагов Диссеминация. инвазивная форма
Низкопатогенные грибы Хроническая гранулематозная болезнь -
Cryptosporidia Дефицит антител Холангиты
Giardia Дефицит антител -
Pneumocystis jiroveci Т-клеточный дефицит, дефи- цит NEMO -
Toxoplasmosis Т-клеточный дефицит, дефи- цит смены классов иммуногло- булинов -
Для иммунодефицитов характерны не только инфекционные осложне-
ния, но и поражения различных систем органов (табл. 11-2).
Малигиизация
У всех больных с иммунодефицитами, затрагивающими Т- и NK-клетки,
выявляют повышенную частоту онкопатологий. Установлена связь малиг-
низации с аутоиммунным лимфопролиферативным синдромом, ОВИН,
дефицитом смены классов иммуноглобулинов, Х-сцепленным лимфопро-
лиферативным синдромом и всеми синдромами, связанными с дефектами
репарации ДНК. Малигиизация — нечастое проявление иммунодефици-
та, однако описаны и изолированные случаи в родословных больных с
Х-сцепленным лимфопролиферативным синдромом. Указания в семей-
ном анамнезе на онкопатологию характерны для больных с атаксией-
телеангиэктазией, синдромом Неймеген.
Аутоиммунные проявления
У больных с ПИД зачастую выявляют различные аутоиммунные нару-
шения, либо связанные с другими проявлениями иммунодефицита, либо
носящие определяющий характер (табл. 11-3,11-4).
Таблица 11-2. Особенности проявлений симптомов первичных иммунодефицитов [Кондратенко И.В., Бологов А.А., Пащенко О.Е.,
Ковальчук Л.В., 2008]
Характеристика Комбинированные иммунодефициты Преимущественно В-клеточные дефекты Фагоцитарные дефекты Дефекты комплемента
Возраст развития инфекционных заболеваний Раннее начало — обычно 1-3-й месяцы жизни Начало заболеваний вслед за уменьшением содержа- ния материнских антител — обычно 5-7-й месяцы жизни Раннее начало В любом возрасте
Спектр патогенов Бактерии: Streptococci, Staphylococci, Haemophilus, Campylobacter, Mycobacteria. Вирусы: цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса, энтеровирусы. Грибы и паразиты: Candida, Cryptosporidia. Оппортунистические инфекции, вызванные Pneumocystis jiroveci Бактерии: Streptococci, Staphylococci, Haemophilus, Campylobacter. Вирусы: энтеровирусы Паразиты: Giardia lamblia Бактерии: Staphylococci, Pseudomonas, Serratia, Klebsiella, Salmonella. Грибы и паразиты: Candida, Nocardia, Aspergillus Бактерии: Neisseria, Escherichia coli
Патология органов и систем Отставание в физическом развитии, поражение лег- ких, диарея, кандидоз кожи и слизистых оболочек Повторные инфекционные заболевания респиратор- ного и пищеварительного тракта, энтеровирусный энцефалит Гнойные инфекционные заболевания кожи, гнойный лимфаденит, периодонтит, язвенный стоматит, абсцес- сы, остеомиелит Менингит, повторные инфекционные заболева- ния респираторного тракта
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 255
Lt V9VLLI
256 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 11-3. Аутоиммунные нарушения, обычно связанные с иммунодефицитом
[Rezaei N. et al., 2008]
Аутоиммунное заболевание Иммунодефициты
Идиопатическая тромбоцитопеническая пурпура IgA-дефицит, общая вариабельная иммунная недостаточность, хроническая гранулематозная болезнь, синдром Ди Джорджи, синдром Вискотта-Олдрича
Аутоиммунная гемолитическая анемия IgA-дефицит, общая вариабельная иммунная недостаточность, хроническая гранулематозная болезнь, синдром Ди Джорджи, дефицит HLA-II, дефицит пуриннуклеозидфосфорилазы. син- дром Вискотта-Олдрича
Системная красная волчанка Дефицит комплемента, хроническая гранулематозная болезнь IgA-дефицит
Ювенильный артрит IgA-дефицит, синдром Ди Джорджи синдром Вискотта- Олдрича, Х-сцепленная агаммаглобулинемия
Склерозирующие холангиты Дефицит перегруппировки классов иммуноглобулинов
Васкулиты Синдром Вискотта-Олдрича, Х-сцепленные лимфопролифера- тивные заболевания
Таблица 11-4. Иммунодефициты, при которых аутоиммунные нарушения являются
определяющими [Rezaei N. et al., 2008]
Иммунодефицит Аутоиммунные проявления Комментарии
Аутоиммунный лимфопроли- феративный синдром Аутоиммунная гемолитическая анемия, идиопатическая тром- боцитопеническая пурпура, аутоиммунная нейтропения, первичный билиарный цирроз У пациентов с дефицитом каспазы-8 развивается герпети- ческая инфекция. С возрастом увеличивается риск возникно- вения лимфом
Аутоиммунная полиэндокрино- патия с кандидозом и эктодер- мальной дисплазией Гипопаратироидизм, гипо- адренализм, сахарный диабет, гипотиреоидизм, витилиго, аутоиммунный гепатит Манифестация аутоиммунных нарушений обычно начинается в первой декаде жизни и уси- ливается с возрастом
Х-сцепленная иммунная дисре- гуляция, полиэндокринопатия, энтеропатия Аутоиммунная энтеропатия, сахарный диабет, гемолитиче- ская анемия, гипотиреоидизм, экзема Инфекционные заболевания протекают тяжело. Может развиваться гипогаммаглобу- линемия
Другие проявления первичных иммунодефицитов
ПИД не часто выявляют путем внешнего осмотра больного, тем не менее
у некоторых пациентов бывают дисморфические и другие особенности. Так,
отсутствие миндалин и аденоидов типично для пациентов с Х-сцепленной
агаммаглобулинемией или Т-клеточными дефицитами, при которых в лим-
фатических узлах формирования герминативных центров не происходит.
Симптомы дисморфизма характерны для синдрома Ди Джорджи; микроце-
фалия — для синдромов Неймеген, Ди Джорджи, дефиците ядерного белка
Cemunnos и др.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 257
Целый ряд иммунодефицитных состояний сопровождается развитием
нарушений скелета. Так, метафизарная дисплазия характерна для дефицита
аденозиндезаминазы, синдрома Швахмана-Даймонда. Кожные проявления
в виде пигментации выявляются при синдромах Чедиака-Хигаси (Chediak-
Higashi), Грисцелли, Германски-Пудлака; отсутствие волос характерно
для тяжелого комбинированного иммунодефицита. У больных атаксией-
телеангиэктазией (синдром Луи-Бар) развиваются мозжечковая атаксия,
дефекты капилляров.
Помимо инфекционных заболеваний, у больных с ПИД часто встречают-
ся неинфекционные проявления (табл. 11-5).
Таблица 11-5. Неинфекционные проявления первичных иммунодефицитов
[Кондратенко И.В., Бологов А.А., Пащенко О.Е., Ковальчук Л.В., 2008]
ГЛАВА 11
Проявления Иммунодефицит
Гипоплазия лимфоидной ткани Агаммаглобулинемия, тяжелая комбинированная иммун- ная недостаточность, общая вариабельная иммунная недостаточность, синдром Неймеген*
Гиперплазия лимфоидной ткани Аутоиммунный лимфопролиферативный синдром, гипер- lgM-синдром, общая вариабельная иммунная недостаточ- ность, синдром Неймеген*
Лейкопения, лимфопения Тяжелая комбинированная иммунная недостаточность
Нейтропения Агаммаглобулинемия, общая вариабельная иммунная недостаточность, гипер-1дМ-синдром, синдром Неймеген, аутоиммунный лимфопролиферативный синдром, син- дром Вискотта-Олдрича*
Тромбоцитопения Синдром Вискотта-Олдрича, общая вариабельная иммун- ная недостаточность, синдром Неймеген, аутоиммунный лимфопролиферативный синдром
Гемолитическая анемия Общая вариабельная иммунная недостаточность, гипер- lgM-синдром, синдром Неймеген аутоиммунный лимфо- пролиферативный синдром
Артрит Агаммаглобулинемия, общая вариабельная иммунная недостаточность, гипер-1дМ-синдром, синдром Неймеген, аутоиммунный лимфопролиферативный синдром, син- дром Вискотта-Олдрича
Гломерулонефрит, миозит, скле- родерма, аутоиммунный гепатит, неспецифический язвенный колит, болезнь Крона Агаммаглобулинемия, общая вариабельная иммунная недостаточность, гипер-1дМ-синдром, синдром Неймеген, аутоиммунный лимфопролиферативный синдром, син- дром Вискотта-Олдрича
Выявляют у отдельных больных.
ЧАСТЬ 2
258 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Общая клиническая характеристика первичных иммунодефицитов
с преимущественным поражением Т-лимфоцитов
• Появление симптомов в грудном возрасте (4-5 мес).
• Повторные инфекционные заболевания, вызываемые вирусами, гриба-
ми, микобактериями.
• Инфекционные заболевания, вызываемые оппортунистическими
микроорганизмами (например, Pneumocystis jiroveci).
• Фатальные инфекционные заболевания, развившиеся в результате вак-
цинации живыми вирусными вакцинами или после введения БЦЖ.
• Болезнь «трансплантат против хозяина» в результате трансфузии про-
дуктов крови, содержащих лимфоциты, или внутриутробного попада-
ния лимфоцитов матери.
• Увеличение риска малигнизации.
Общая клиническая характеристика первичных иммунодефицитов
с преимущественным поражением В-лимфоцитов
• Появление симптомов в возрасте 7-9 мес, после исчезновения мате-
ринских антител.
• Повторные инфекционные заболевания, вызванные инкапсулирован-
ными бактериями.
• Хронические очаги инфекции (синуситы, отиты, пневмонии, бронхо-
эктазы), гнойные лимфадениты, абсцессы.
• Менингиты, септицемия, остеомиелиты, возникшие в результате гема-
тогенного распространения патогена.
• Редкая заболеваемость грибковыми и вирусными инфекциями (за
исключением энтеровирусов).
• Выживаемость до зрелого возраста при проведении адекватного лече-
ния.
• Гйпоплазия периферических лимфатических узлов и назофарингеаль-
ной лимфоидной ткани (характерно для Х-сцепленной агаммаглобу-
линемии Брутона).
• Лимфоидная гиперплазия (гепатоспленомегалия при ОВИН).
• Повышенная частота аллергических и аутоиммунных заболеваний.
Ниже приведена клинико-иммунологическая характеристика отдельных
форм ПИД в соответствии с международной классификацией 2007 г.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 259
11.2.1. Группа 1. Комбинированные Т- и В-клеточные
иммунодефициты (табл. 11-6)
К настоящему времени расшифрованы молекулярно-генетические дефек-
ты большинства заболеваний, относящихся к первой группе. Гены, коди-
рующие ТКИД (тяжелый комбинированный иммунодефицит), связанный с
Х-хромосомой (Х-ТКИД), картированы в положении Xql3 (60% случаев).
Выявлены 93 патогенные мутации, распределенные по всему кодирующему
региону и часто обнаруживаемые в местах сплайсинга. В большинстве слу-
чаев это точечные мутации, нарушающие цитокиновую регуляцию процес-
сов развития и взаимодействия лимфоцитов. К числу подобных нарушений
относятся мутации генов, кодирующих общую у-цепь рецепторов ИЛ-2,
ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15, ИЛ-21. Молекулярный фактор патогенеза,
связанного с Х-хромосомой ТКИД, — нарушение взаимодействия ИЛ-7 и
его рецептора за счет дефектности у-цепи рецептора. Известно, что ИЛ-7,
секретируемый стромальными клетками костного мозга и тимуса, слу-
жит ростовым фактором для Т- и В-лимфоцитов. Обнаружено несколько
мутантных генов, находящихся в аутосомах и отвечающих за некоторые
формы ТКИД: недостаточность АДА, недостаточность/ялю-киназы (Jak3),
дефицит a-цепи рецептора ИЛ-7 (IL-7Ra); мутации генов, которые коди-
руют белки, активирующие рекомбинацию (RAG-1 и/или RAG-2), Artemis,
CD45, полипептидные цепи 8, е и у СОЗ-комплекса, а также гена протеинти-
розинкиназы ZAP-70, связанной с ^-димером комплекса TCR.
В результате генетических дефектов нарушаются процессы дифференци-
ровки и созревания Т- и В-лимфоцитов, что приводит к подавлению боль-
шинства иммунных процессов. В зависимости от формы заболевания у боль-
ных выявляют уменьшение количества CD4+ и/или CD8+ Т-лимфоцитов и
уровня циркулирующих иммуноглобулинов. В других случаях содержание
Т-лимфоцитов очень низкое, но В-лимфоциты выявляются в большом
количестве, концентрация иммуноглобулинов в сыворотке крови может
сохраняться на уровне среднестатистической возрастной нормы или даже
превышать ее. У некоторых больных количество Т-лимфоцитов нормаль-
ное, однако это могут быть незрелые лимфоциты или даже клетки, подоб-
ные тимоцитам. В этом случае содержание иммуноглобулинов обычно
снижено. Описаны случаи, при которых количество Т- и В-лимфоцитов
нормальное, но функционально они не активны — не отвечают пролифе-
рацией на стимуляцию фитогемагглютинином и конканавалином А, не
реагируют на аллогенные клетки в смешанной культуре лимфоцитов. К
таким иммунодефицитам относят разновидности синдрома Оменна, дефи-
цит ДНК-лигазы IV и др. Наконец, встречаются больные с функционально
неактивным тимусом, дефектным в отношении выработки гормона тимо-
поэтина. В предыдущей классификации ПИД от 1999 г. были выделены пре-
ЧАСТЬ 2
Таблица 11-6. Комбинированные Т- и В- клеточные иммунодефициты [Deist F. Le et al., 2008]
Заболевание Подтип Г енетический дефект Ассоциированные особенности
T-BJKI/IH Дефицит общей у-цепи у-Цепи рецептора ИЛ-2 Снижение уровня сывороточных иммуноглобули- нов всех изотипов; резкое снижение содержания Т- и NK-клеток; нормальное или увеличенное число В-клеток
Дефицит JAK3 JAKS-киназы общего лейко- цитарного антигена —
Дефицит CD45 Мутации LCA (Leukocyte Common Antigen) или тиро- зинфосфатазы CD45 Снижение уровня сывороточных иммуноглобулинов всех изотипов; резкое снижение числа Т-клеток, нор- мальное число В-клеток, нормальное или сниженное число NK-клеток
Дефицит a-цепи рецептора ИЛ-7 Рецептора ИЛ-7 Снижение уровня сывороточных иммуноглобулинов всех изотипов; резкое снижение числа Т-клеток, нор- мальное число В- и NK-клеток
СОЗу-дефицит СОЗЗ-дефицит СОЗе-дефицит CD3G CD3D СОЗЕ -
т-в-ткин Дефицит RAG1 RAG1 (от англ. Recombination Activation Gene 1) Снижение уровня сывороточных иммуноглобулинов всех изотипов; резкое снижение содержания Т- и В-клеток, нормальное число NK-клеток
Дефицит RAG2 RAG2 То же
Дефицит нуклеазы Artemis DCLREIC Снижение содержания Т- и В-клеток
Дефицит аденозиндезаминазы ADA Снижение уровня сывороточных иммуноглобулинов всех изотипов; резкое снижение содержания Т-, В- и NK-клеток
Ретикулярная дисгенезия Нарушение созревания иммунных клеток из стволо- вой клетки Снижение уровней сывороточных иммуноглобулинов всех изотипов; резкое снижение содержания Т-, В- и NK-клеток; гранулоцитопения, тромбоцитопения
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Заболевание Подтип Генетический дефект
Синдром Оменна RAG1/2 Artemis Рецептор ИЛ-7
Дефицит ДНК- лигазы IV - LIG4
Дефицит ядерного белка Cernunnos; XLF-дефицит - NHEJ1 (кодирует ядерный белок, связанный с репара- цией ДНК)
Дефицит пуриннуклео- зидфосфорилазы PNP
Нарушение взаимо- действия CD40-CD40L Дефицит С040-лиганда TNFS5B
Дефицит CD40 TNFRSF5
Дефицит HLA клас- са II Дефицит СИТА СИТА (класса II транс- активатор от анг. Class II TransActivator)
Дефицит RFX5 Дефицит RFXAP Дефицит RFXANK RFX5 RFXAP RFXANK
Дефицит HLA класса 1 Дефицит ТАР1 Дефицит ТАР2 TAP1 TAP2
Дефицит CD8 Дефект С08а-цепи ZAP-70-дефицит CD8A ZAP-70
Продолжение табл. 11-6
Ассоциированные особенности
Снижение уровня сывороточных иммуноглобулинов
всех изотипов, за исключением IgE; снижение содер-
жания Т-клеток; нормальное или сниженное число
В-клеток; нормальное число NK-клеток; эозинофилия;
лимфопролиферация_____________________________
Снижение уровня сывороточных иммуноглобулинов
всех изотипов: снижение содержания Т- и В- клеток:
микроцефалия; чувствительность к радиации_____
Снижение уровня иммуноглобулинов всех изотипов;
снижение содержания Т- и В-клеток; микроцефалия;
чувствительность к радиации, нарушение роста__
Нормальный или сниженный уровень иммуноглобу-
линов всех изотипов; снижение общего количества
лимфоцитов и Т-клеток; неврологические нарушения.
аутоиммунные проявления_______________________
Снижение уровня IgG и IgA в сыворотке крови; увели-
чение или нормальный уровень IgM______________
То же_________________________________________
Нормальный или сниженный уровень сывороточных
иммуноглобулинов всех изотипов; снижение числа
CD4* Т-клеток_________________________________
То же
Снижение числа CD8 Т-клеток
Отсутствие CD8* Т-клеток
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 261
LL V9VUJ
Заболевание Подтип Генетический дефект
Дефицит CD4 Дефицит р561ск LCK-киназа
Идиопатическая СО4-лимфоцитопения Неизвестно
CRAC-дефицит - CRACM1
Дефицит белка WHN (Winged-Helix Nude) - WHN
Дефицит СО25-молекул - IL2RA (a-цепь рецептора ИЛ-2)
Дефицит STAT5B - STAT5B
ЧАСТЬ 2
Окончание табл. 11-6 g
--------------------------------------------- ьэ
Ассоциированные особенности
Снижение числа CD4* Т-клеток
То же
Дефекты TCR-опосредованной активации; аутоиммун-
ные нарушения, миопатия_________________________
Снижение уровня иммуноглобулинов всех изоти-
пов; резкое снижение Т-клеток; нормальное число
В-клеток; алопеция; нарушения тимического эпителия
Нормальное или сниженное число Т-клеток; снижение
числа CD4* Т-клеток; аутоиммунитет: лимфопроли-
ферация
Снижение содержания Т-клеток; гормоннезависимая
карликовость; дисморфизм
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИ
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 263
имущественно Т-клеточные дефекты. Однако возможность существования
таких изолированных дефектов в настоящее время подвергается сомнению,
так как любое нарушение функции Т-лимфоцитов затрагивает активность
В-лимфоцитов, а следовательно, является комбинированным. Тем не менее,
при подозрении на изолированный дефицит CD4+ Т-лимфоцитов необхо-
димо выявить и другие критерии:
• уменьшение числа CD4+ Т-клеток в крови меньше 300 кл/мкл;
• отсутствие ВИЧ-инфекции;
• исключение цитостатической терапии;
• наличие индикаторных инфекционных заболеваний, вызванных виру-
сами, грибами, простейшими.
Первый случай изолированного дефицита CD4+ Т-лимфоцитов был
описан в 1992 г. у больного криптококковым менингитом и оральным кан-
дидозом при отсутствии ВИЧ-инфекции и сохранении нормального уровня
В-лимфоцитов и иммуноглобулинов.
Клинические проявления основных комбинированных Т- и В-клеточных
иммунодефицитов
Комбинированные иммунодефициты, за исключением связанной
с Х-хромосомой ТКИД, наследуются преимущественно по аутосомно-
рецессивному типу, в результате чего заболевают лица и мужского, и жен-
ского пола (причем мальчики составляют до 75%).
Как правило, клинические симптомы ПИД проявляются в первые неде-
ли жизни в виде некорригируемой диареи, бактериальных и грибковых
поражений кожи и слизистых оболочек, прогрессирующего поражения
респираторного тракта, пневмоцистной пневмонии, вирусных инфекций,
гипоплазии лимфоидной ткани. Возбудители принадлежат к разным так-
сономическим группам: грибам (Candida), бактериям, вирусам. Пневмонию
часто вызывает Pneumocystis jiroveci, диарею — ротавирусы, Campilobacter,
Giardia lamblia. Нередко развивается вирусный гепатит, в некоторых случа-
ях — осложнение в виде БЦЖита после вакцинации БЦЖ в роддоме. Дети
отстают в физическом и психомоторном развитии. Однако в ряде случаев
при наличии ТКИД все вышеперечисленные симптомы у младенцев раз-
виваются не сразу и в течение первых 2-6 мес жизни они могут расти и
развиваться сравнительно нормально.
Таким образом, основные клинические критерии, позволяющие заподо-
зрить комбинированный ПИД:
• наличие тяжелых, часто летальных инфекций, начиная с периода
новорожденное™; у больных развиваются затяжные формы диареи,
пневмонии, сепсис;
• характерно инфицирование маловирулентными микроорганизмами,
такими, как грибы рода Candida, пневмоцисты, ЦМВ;
ГЛАВА 11
ЧАСТЬ 2
264 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• появление с рождения кожной сыпи в виде эритродермии, обусловлен-
ной материнскими лимфоцитами, которые поступили к плоду во время
беременности;
• отставание ребенка в росте и массе.
В большинстве случаев заболевание заканчивается летальным исходом
в раннем возрасте ввиду развития генерализованных оппортунистических
инфекций (возбудители — пневмоцисты, вирус герпеса, ЦМВ, кандиды,
аденовирусы, вирус Эпштейна-Барр, а также при генерализации БЦЖита
и др.).
Лабораторные критерии комбинированных ПИД — нарушения реак-
ций клеточного и гуморального иммунитета с 6-7-месячного возраста,
проявляющися в форме лимфопении (менее 4000 кл/мкл), снижения
уровня IgG, IgM, IgA в сыворотке крови, в отсутствии специфических
антител даже после вакцинации, а также в снижении либо отсутствии ’T-
и/или В-лимфоцитов в зависимости от формы иммунодефицита (Т- В+,
Т+ Вит.д.).
Для гистологических изменений характерны резкое снижение массы
тимуса (меньше 1 г), отсутствие тимоцитов, плохо дифференцированная
кортикальная зона тимуса. Граница между кортикальной и медуллярной
зонами смазана, а иногда вовсе отсутствует, тельца Гассаля не развиты.
Периферические лимфоидные органы гипоплазированы либо отсутствуют.
Лимфатические узлы, селезенка, миндалины, пейеровы бляшки зачастую
находятся в стадии обратного развития, а лимфоциты в них выявить не
удается. В лимфатических узлах отсутствуют герминативные центры.
Основные принципы лечения больных с комбинированными первичными
иммунодефицитами
• Трансплантация гаплоидентичного костного мозга или костного мозга,
взятого от полностью совместимого по HLA донора, причем перед
трансплантацией из донорского костного мозга удаляют Т-лимфоциты,
во избежание реакции «трансплантат против хозяина».
• Заместительная терапия внутривенными иммуноглобулинами, интен-
сивное антибактериальное, противогрибковое и противовирусное
лечение (проводятся детям с ТКИД, страдающим инфекционными
заболеваниями, в период поиска донора и подготовки к пересадке
костного мозга). В последние годы получены крайне обнадеживающие
результаты пересадки костного мозга: в 50-60% случаев происходит
существенное или полное восстановление функций иммунной системы.
При невозможности пересадки костного мозга, несмотря на интен-
сивное консервативное лечение, летальный исход наступает в первые
1-3 года жизни.
Прогноз в данной группе заболеваний неблагоприятный. Дети чаще
всего погибают от септических состояний. Пересадка костного мозга в пер-
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 265
вые 3-5 мес жизни может быть высокоэффективной. В настоящее время во
всём мире насчитывают более 400 пациентов с ТКИД, у которых трансплан-
тация костного мозга оказалась эффективной.
Ниже приведена клиническая характеристика некоторых комбиниро-
ванных иммунодефицитов.
11.2.1.1. Х-СЦЕПЛЕННАЯ ТЯЖЕЛАЯ КОМБИНИРОВАННАЯ ИММУННАЯ
НЕДОСТАТОЧНОСТЬ
Данную форму иммунодефицита выявляют с частотой 1:100 000 ново-
рожденных. Болеют только мальчики. Клинические проявления заболе-
вания возникают у детей начиная с 3-6 мес. Как правило, у детей недо-
статочная масса тела; они страдают частыми вирусно-бактериальными
инфекциями, в том числе вызванными ЦМВ, респираторно-синцитиальным
вирусом, вирусом Эпштейна-Барр, вирусом герпеса и др. Характерны пнев-
мония, сепсис, хроническая диарея, менингит. Если в кровоток ребенка
во внутриутробном периоде поступают лимфоциты матери, развивается
болезнь «трансплантат против хозяина», клинически проявляющаяся не
только снижением массы тела, диареей, но и появляющимися на коже
ребенка высыпаниями пятнисто-папулезного и эритематозного характера.
После вакцинации БЦЖ в роддоме у ребенка зачастую развивается поствак-
цинальное осложнение — БЦЖит.
Диагностика Х-сцепленной ТКИН включает:
• генетическое исследование ДНК на наличие мутаций в Xql3.1;
• определение экспрессии общей у-цепи на лимфоцитах с помощью
моноклональных анти-у-антител;
• пренатальную диагностику путем исследования ворсин хориона или
клеток амниотической жидкости на наличие данной мутации либо
исследование крови плода, начиная с 17-й недели развития, и выявле-
ние лимфопении за счет снижения количества Т-клеток и их ответа на
митоген.
Приведенные диагностические тесты крайне дорогостоящие и ограни-
чены для широкого применения, но только они позволяют окончательно
диагностировать форму ПИД и сформировать решение о трансплантации
донорского костного мозга.
При обследовании пациентов с Х-сцепленной ТКИН Т-лимфоциты и
NK-клетки обнаружить обычно не удается или же их содержание мало, а
содержание В-лимфоцитов повышено. При этом наблюдают выраженную
недостаточность функций Т- и В-клеток. Подавление синтеза иммуно-
глобулинов сохраняется даже после восстановления нормального уровня
Т-лимфоцитов после пересадки костного мозга. С помощью рестрикцион-
ного анализа удалось показать, что ген, при мутации которого возникает
данное заболевание, картирован в участке Xql3. Этот ген кодирует структу-
ру общей у-цепи. У 2/3 пациентов выявляют аномальную у-цепь рецепторов
ГЛАВА 11
ЧАСТЬ 2
266 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
цитокинов, а в оставшихся случаях у-цепь вообще отсутствует, что приводит
к нарушению передачи сигнала через рецепторы целой группы цитокинов.
Эти данные позволяют понять, почему в результате мутации единственного
гена могут страдать функции нескольких типов клеток.
11.2.1.2. ТЯЖЕЛАЯ К6МБИНИР6ВАННАЯ ИММУННАЯ НЕДОСТАТОЧНОСТЬ
С ДЕФИЦИТОМ АДЕНОЗИНДЕЗАМИНАЗЫ
Первичный аутосомно-рецессивный комбинированный иммунодефицит
развивается в результате дефекта гена важнейшего для клеток иммунной
системы фермента — аденозиндезаминазы (АДА).
Данная группа фенотипически похожих генетических дефектов включает
точечные мутации и делеции в пределах гена, кодирующего АДА. Этот ген
расположен на длинном плече хромосомы 20, в локусе ql2-13.1. В отсут-
ствие АДА токсичные метаболиты пуринового обмена (дАТФ) и метилиро-
вания (S-аденозил-гомоцистеин) накапливаются внутри клетки и тормозят
пролиферацию. В результате нарушается функция Т- и В-лимфоцитов.
Накопление дАТФ происходит также в эритроцитах. В плазме повышается
концентрация аденозина и дезоксиаденозина.
Клиническая картина зависит от возраста, в котором произошла
манифестация заболевания (ранняя и поздняя манифестация). Для ранней
манифестации характерно появление к 2-3-месячному возрасту повторных
респираторных инфекций, диареи, отставание в развитии, а также нали-
чие множественных дефектов костей (хондродисплазия), затрагивающих
костно-хрящевые соединения, апофизы подвздошных костей и тела позвон-
ков. Рентгенологически эти изменения визуализируются как феномен
«кость в кости». При позднем начале заболевания в возрасте от 2 до 15 лет у
детей развиваются повторные пневмонии, вызванные 5. pneumoniae, сепсис,
заболевания аутоиммунной природы (сахарный диабет, тиреоидит, гемоли-
тическая анемия, идиопатическая тромбоцитопения). У взрослых больных
часто рецидивирует герпетическая инфекция.
Диагностика:
• определение содержания АДА в эритроцитах, лимфоцитах, фибробла-
стах;
• обнаружение дАТФ и дезоксиаденозина в моче;
• генетическое обследование на наличие мутации гена, кодирующего
АДА;
• пренатальная диагностика ворсин хориона, амниотических клеток и
клеток крови плода на наличие мутаций гена, кодирующего АДА.
При лечении данного заболевания применяют следующие подходы:
• трансплантацию костного мозга от HLA-совместимого донора;
• ферментозамещающую терапию 3 раза в неделю в виде подкожных
инъекций препарата АДА крупного рогатого скота, конъюгированного
с полиэтиленгликолем (препарат ADAGEN*’);
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 267
• генную терапию. Дефицит АДА — первое заболевание, при котором
успешно применена генная терапия в начале 1980-х годов.
11.2.1.3. ТЯЖЕЛАЯ КОМБИНИРОВАННАЯ ИММУННАЯ НЕДОСТАТОЧНОСТЬ
С ДЕФИЦИТОМ ПУРИННУКЛЕОЗИДФОСФОРИЛАЗЫ
Аутосомно-рецессивное заболевание, которое развивается в результа-
те дефекта гена, кодирующего фермент пуриннуклеозидфосфорилазу и
находящегося на хромосоме 14 (локус При отсутствии пуринну-
клеозидфосфорилазы токсичные метаболиты, в данном случае дезокси-
гуанозинтрифосфатаза (дГТФ), накапливаются внутри клетки и нарушают
пролиферацию лимфоцитов. Т-лимфоциты особенно чувствительны к
накоплению дГТФ. Они поражаются в большей степени, чем В-лимфоциты.
В сыворотке крови накапливаются инозин, гуанозин, которые выделяются
с мочой.
Содержание сывороточных иммуноглобулинов чаще в пределах нормы
или несколько повышено. У больных с недостаточностью пуриннуклео-
зидфосфорилазы, как и при дефиците АДА, выявляют выраженную лим-
фопению (до 500 клеток в 1 мкл). Активность Т-лимфоцитов снижена,
но поддерживается на минимальном уровне и с течением времени может
меняться.
Клинические проявления заболевания могут развиваться и в первый
год жизни, и в более позднем возрасте. Характерны рецидивирующие
вирусно-бактериальные инфекции, поражающие органы дыхания, ЛОР-
органы, мочевыделительную систему.
У 2/3 пациентов выявляют неврологическую симптоматику в виде спа-
стических нарушений: диплегию, тетрапарез, атаксию, тремор, гипер- или
гипотонию, а также задержку умственного развития. В некоторых случа-
ях обнаруживают аутоиммунные расстройства, в частности аутоиммун-
ную гемолитическую анемию, идиопатическую тромбоцитопению, СКВ.
Возможно появление лимфомы.
Диагностика:
• исследование активности фермента в лизате эритроцитов (спектрофо-
тометрия, радиохимический анализ);
• определение содержания мочевой кислоты в сыворотке крови (сни-
жено);
• определение содержания инозина и гуанозина в сыворотке крови;
• определение содержания инозина, гуанозина, дезоксиинозина и дезок-
сигуанозина в моче;
• пренатальная диагностика путем исследования активности пуринну-
клеозидфосфорилазы и наличия мутации его гена в ворсинках хориона
и амниотических клетках.
ГЛАВА 11
ЧАСТЬ 2
268 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
11.2.1.4. СИНДРОМ ОМЕННА
Первоначально описан Г. Оменном (Gilbert S. Отепп) в 1965 г. как
семейный ретикулоэндотелиоз с эозинофилией. Причина развития син-
дрома Оменна — мутации в генах RAG1 и RAG2. В 60% случаев мутирует
ген RAG1, в 40% — RAG2. Эти гены, картированные на хромосоме 11р13,
участвуют в процессах соматической перестройки генов TCR и BCR. При
отсутствии RAG1/RAG2 не происходит У(П)}-рекомбинации и не форми-
руется разнообразие TCR и BCR, а также антител. Следовательно, при мута-
циях генов RAG1 и RAG2 нарушается экспрессия антигенных рецепторов
вследствие торможения рекомбинации генов.
Полные мутации этих генов могут означать тотальный блок развития Т- и
В-клеток и вызывать ТКИД с отсутствием зрелых форм Т- и В-лимфоцитов
(Т- В -ТКИД). Пре-Т- и пре-В-клетки не выживают при дифференцировке,
если не получают сигнал от пре-BCR и пре-TCR соответственно. Тяжелая
цепь молекулы IgM и p-цепь TCR - необходимые составляющие этих
рецепторов. Таким образом, предшественник лимфоцита не получает сиг-
нал и погибает. Эти факты и объясняют отсутствие лимфоцитов у пациен-
тов с недостаточностью RAG1 и RAG2.
Синдром Оменна, в отличие от ТКИД с полным дефицитом RAG,
характеризуется частичным их дефицитом и частично сохраненной V(D)
J-рекомбинацией.
Клинически синдром Оменна проявляется вскоре после рождения и
характеризуется развитием генерализованной эритродермии и десквама-
ции кожных покровов; диареей, гепатоспленомегалией, лимфаденопатией,
лихорадкой.
У пациентов с сочетанным дефектом RAG выявляют очень низкое содер-
жание CD19+ В-клеток. Уровень сывороточных IgA, IgM, IgG значительно
снижен, образование антител in vivo нарушено. У больных с синдромом
Оменна выявляют лейкоцитоз, гиперэозинофилию и повышенный уровень
IgE. В лимфатических узлах отсутствуют фолликулы с центрами размно-
жения. Тимус гипоплазирован. Прогноз неблагоприятный. При лечении
рекомендуют трансплантацию костного мозга.
11.2.1.5. ТЯЖЕЛАЯ КОМБИНИРОВАННАЯ ИММУННАЯ НЕДОСТАТОЧНОСТЬ,
ОБУСЛОВЛЕННАЯ ДЕФИЦИТОМ JAK3
}АКЗ-киназа — единственная сигнальная молекула, взаимодействующая
с у-цепью, и поэтому считают, что дефект гена именно этой киназы служит
причиной развития аутосомно-рецессивного варианта ТКИД, молекулярная
основа которого до сих пор остается неизвестной. Больные восприимчивы
к инфекционным заболеваниям и подвержены болезни «трансплантат про-
тив хозяина», которую могут вызвать аллогенные Т-лимфоциты. В иммун-
ном статусе уровень В-лимфоцитов повышен, а содержание Т-лимфоцитов
и NK-клеток резко снижено.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 269
Популяцию NK-клеток у детей с данным заболеванием не удается под-
держивать на достаточном уровне даже после успешной трансплантации
стволовых клеток гаплоидентичного костного мозга. Более того, зачастую
не восстанавливаются и функции В-лимфоцитов, хотя их содержание может
превышать норму. Эти иммунные сдвиги, очевидно, обусловлены наличием
аномального рецептора для цитокинов на поверхности В-клеток.
11.2.1.6. ДЕФИЦИТ МОЛЕКУЛ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИ КЛАССА I
Изолированное нарушение экспрессии HLA класса I выявляют редко.
Уровень растворимых антигенов HLA класса I и Р2-микроглобулина в
сыворотке больных в пределах нормы, однако на поверхности клеток
такие антигены отсутствуют. При этом возникает дефицит CD8+, но не
CD4+ Т-лимфоцитов. Развитие патологии обусловлено дефектом двух генов
HLA класса I, кодирующих структуру транспортных белков ТАР-1 и ТАР-2.
Функция TAP-белков заключается в переносе антигенов белковой природы
из цитоплазмы в цистерны аппарата Гольджи, где происходит соединение
a-цепи молекулы HLA класса I и р2-микроглобулина и загрузка антигенно-
го пептида в бороздку, формируемую al- и а2-доменами. Образовавшийся
комплекс перемещается на поверхность клетки; в том случае, если белковый
антиген отсутствует, окончательная сборка этого комплекса не завершается,
и молекула HLA класса I деградирует в цитоплазме.
Клинически этот вид иммунодефицита протекает менее тяжело, чем
другие формы ТКИД, а его проявления манифестируют довольно поздно.
Характерно развитие васкулитов.
11.2.1.7. ДЕФИЦИТ МОЛЕКУЛ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИ КЛАССА II
Нарушение экспрессии антигенов HLA класса II (синдром «голых»
лимфоцитов) — ПИД с полным отсутствием экспрессии всех молекул HLA
класса II (HLA-DP, HLA-DQ, HLA-DR).
Синдром «голых» лимфоцитов наследуется по аутосомно-рецессивному
типу, и, следовательно, заболеванию подвержены как девочки, так и маль-
чики. Распространенность этого иммунодефицита неизвестна. Заболевание
нередко выявляют случайно в процессе дифференциальной диагностики
причин хронических инфекций, особенно вирусной этиологии.
При этом заболевании первичный дефект связан с повреждением регу-
ляторных факторов. Нарушение экспрессии антигенов HLA класса II может
быть вызвано четырьмя молекулярными дефектами. Один из них обу-
словлен мутацией гена, картированного на хромосоме lq и кодирующего
белок RFX5 — субъединицу белкового комплекса RFX, который связывает
Х-участок промотора HLA класса II. Другой дефект — мутация гена, локали-
зованного на хромосоме 13q, кодирующего RFX-связанный белок (RFXAP),
ГЛАВА 11
ЧАСТЬ 2
270 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
который также входит состав комплекса RFX. Наиболее частая причина
дефицита молекул HLA класса И, обнаруженная позже всех, — мутация гена
RFXANK, который кодирует третью субъединицу RFX. Существует еще один
дефект — мутация гена трансактиватора HLA класса II — СИТА (англ. Class
II TransActivator) — картированного на хромосоме 16р13. Он относится к
коактиваторам, контролирующим формирование клеточной специфично-
сти и индуцибельность экспрессии молекул HLA класса II. Все эти дефекты
вызывают нарушение координации экспрессии молекул HLA класса II на
поверхности В-лимфоцитов и макрофагов. У некоторых больных одновре-
менно нарушается экспрессия HLA класса I.
Клинические проявления возникают у детей начиная с первых 6 мес
жизни. У ребенка выявляют задержку роста и развития на фоне частых
вирусных инфекций, таких, как герпетическая, аденовирусная и ЦМВ.
Нередки грибковые инфекционные заболевания. У больных детей, как
правило, выявляют синдром мальабсорбции; характерно также развитие
интерстициальной пневмонии. Следует отметить, что вакцинация БЦЖ, а
также другими живыми вакцинами опасна для больных детей, поскольку
может возникнуть осложнение в виде генерализации инфекции.
В иммунограмме общее содержание лимфоцитов в перифе-
рической крови может варьировать в пределах среднестатистической
нормы. Диагностически значимый признак — уменьшение количества
CD4+ Т-лимфоцитов. При определении экспрессии молекул HLA класса II
на активированных Т-лимфоцитах, а также на В-лимфоцитах и антигенпре-
зентирующих клетках выявляют либо резкое снижение этого показателя,
либо их полное отсутствие. Это позволяет с большой долей вероятности
диагностировать синдром «голых» лимфоцитов.
Т-лимфоциты не способны к активации in vitro в реакции бласттрансфор-
мации на митогены, а также в смешанной культуре лимфоцитов. Количество
В-лимфоцитов сохраняется в пределах нормы, однако содержание иммуно-
глобулинов в плазме снижено, а стимуляция бактериальными и особенно
вирусными антигенами не сопровождается выработкой специфических
антител.
При гистологическом исследовании тимуса выявляют уменьшение
объема субпопуляции тимоцитов с фенотипом CD4+ CDS-клеток. Из этих
лимфоцитов лишь 73 способна экспрессировать СБЗ-антиген, но и на этих
клетках уровень экспрессии данного комплекса ниже, чем на тимоцитах
здоровых лиц. В отсутствие молекул HLA в тимусе происходит только
частичное созревание CD4+CD8_ Т-клеток. Содержание CD4 CD8+тимоци-
тов, напротив, существенно повышено. В периферической крови выявляют
те же соотношения. Большинство CD4+ CD8' Т-клеток экспрессируют мар-
кер CD45RA. Таким образом, в отсутствие антигенов HLA класса II полно-
ценного созревания Т-хелперов не происходит.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 271
Лечение больных симптоматическое. Прогноз заболевания в тяжелых
случаях неблагоприятен. Дети погибают от септических инфекций в тече-
ние первых лет жизни. Возможны стертые малосимптомные формы. В этих
случаях адекватная симптоматическая терапия позволяет добиться суще-
ственного клинического эффекта.
11.2.2. Группа 2. Преимущественные дефициты антител
(табл. 11-7)
Дефицит антителообразования — наиболее частая форма ПИД. Снижение
антителообразования может быть обусловлено:
• нарушением количества и дифференцировки В-клеток;
• нарушением ответа В-клеток на сигналы Т-лимфоцитов.
Основные положения:
• дефициты антител — наиболее частые формы ПИД, обычно контроли-
руемые заместительной терапией иммуноглобулинами;
• некоторые формы дефицита антител могут быть вторичными по отно-
шению к Т-клеточному дефициту, что ухудшает прогноз и изменяет
подходы к терапии;
• при поздней диагностике и отсутствии адекватного лечения, первич-
ные дефекты антител могут привести к серьезным заболеваниям и
ранней смерти пациента;
• клинический анализ — наиболее важная часть диагностики первичных
дефицитов антител;
• выявление молекулярного дефекта — важная составная часть диа-
гностики первичных дефицитов антител, включая пренатальную диа-
гностику.
У пациентов с гипогаммаглобулинемией имеют место рецидивирующие
бактериальные инфекции преимущественно респираторного и пищевари-
тельного тракта. Возбудители инфекционных заболеваний — в основном
пиогенные бактерии (например, Haemophilus influenza, Moraxella catarrhalis,
Streptococcus pneumoniae, Staphylococcus aureus, Pseudomonas auregmosae). В
отличие от пациентов с Т-клеточным дефицитом, имеющих повышенную
чувствительность к оппортунистическим инфекциям, пациенты с дефици-
том антител обычно не страдают от грибковых и вирусных инфекций (за
исключением пациентов с Х-сцепленной агаммаглобулинемией, чувстви-
тельных к энтеровирусам с развитием энтеровирусного энцефаломиелита).
Манифестация иммунодефицита имеет место у детей, начиная, как пра-
вило, с 6-месячного возраста, когда снижается уровень пассивно получен-
ных от матери IgG. Большинство пациентов с дефицитами антител могут
вести нормальный образ жизни при условии постоянной заместительной
ГЛАВА 11
ЧАСТЬ 2
Таблица 11-7. Преимущественные дефициты антител [AghamohammadiA. eta!., 2008]
Заболевание Подтипы Генетические дефекты Иммунологические фенотипы
Агаммаглобулинемия с отсут- ствием В-клеток Х-сцепленная агаммаглобу- линемия Btk Снижение уровня всех изотипов иммуноглобулинов в сыворотке; нормальное количество пре-В-клеток; резкое снижение содержания или отсутствие зрелых В-лимфоцитов
Аутосомно-рецессивная агаммаглобулинемия IGHM IGLL1 CD79A CD79B BLNK
Другие формы агаммаглобу- линемии LRRC8
Гипогаммаглобулинемия с нормальным или уменьшенным количеством В-клеток Общая вариабельная иммун- ная недостаточность Неизвестен Снижение уровня IgG и IgA в сыворотке; нормальное или уменьшенное количество В-клеток
Дефицит ICOS ICOS
Дефицит ТАС1 ТАС1
Дефицит CD19 CD19
Другие формы гипогамма- глобулинемии Неизвестен
lgCSR-дефицит (нарушение переключения классов иммуно- глобулинов) Дефицит, индуцированный активацией цитидиндезами- назы (AID) AID Снижение уровня сывороточных IgA и IgG; увеличение или нормальный уровень IgM; нормальное или увеличенное количество В-клеток
UNG-дефицит UNG
Другие формы CSR- селективных дефицитов Неизвестен
Селективный дефицит IgA - Неизвестен Снижение или отсутствие IgA в сыворотке крови
272 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Окончание табл. 11-7
Заболевание Подтипы Генетические дефекты Иммунологические фенотипы
Дефицит других изотипов иммуноглобулинов или легких цепей Изолированный дефицит субклассов IgG Неизвестен Снижение уровня одного или нескольких субклассов IgG
Дефицит IgA и субклассов IgG Неизвестен Снижение уровня одного или более субклассов IgG и уров- ня сывороточного IgA
Делеция тяжелой цепи имму- ноглобулина Хромосомная делеция 14q.32 Снижение уровня одного или более субклассов IgG и/или IgA и IgE
Дефицит легких к-цепей IGKC Все иммуноглобулины имеют легкие Х-цепи
Дефицит специфических анти- тел при нормальном уровне иммуноглобулинов Неизвестен Нормальный уровень иммуноглобулинов; нормальное количество В-клеток; отсутствие гуморального ответа на специфический антиген
Транзиторная гипогаммаглобу- линемия младенцев — Неизвестен Снижение уровня сывороточных IgG и IgA; нормальное количество В-клеток
Примечание. Расшифровка некоторых сокращений дана в тексте по мере изложения материала.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 273
LL V8VUJ
ЧАСТЬ 2
274 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
иммуноглобулинотерапии и профилактики антибиотиками. В ряде случаев
требуется дополнительная трансплантация гемопоэтических стволовых
клеток.
11.2.2.1. АГАММАГЛОБУЛИНЕМИЯ С ОТСУТСТВИЕМ В-КЛЕТОК.
Х-СЦЕПЛЕННАЯ АГАММАГЛОБУЛИНЕМИЯ С ДЕФИЦИТОМ В-КЛЕТОК
Это наследственная гипогаммаглобулинемия. Выделяют Х-сцепленный
вариант (85% случаев) и аутосомно-рецессивную форму (15%). В основе
заболевания лежит нарушение процессов дифференцировки и созрева-
ния В-лимфоцитов. Впервые заболевание описано в 1952 г. О. Брутоном
(О. Bruton), Оно встречается с частотой 1-5:1 000 000 новорожденных.
Развитие В-клеток происходит в костном мозге и зависит от последова-
тельной экспрессии продуктов специфических генов. В костном мозге про-
исходит превращение про-В-клеток в пре-В-клетки и зрелые В-лимфоциты,
покидающие костный мозг и выходящие на периферию.
Х-сцепленную форму заболевания вызывает мутация гена ВТК на
Х-хромосоме, кодирующего специфичную для В-лимфоцитов протеинки-
назу (названную в честь Брутона брутоновской тирозинкиназой — Btk)
(рис. 11-3). Ген ВТК экспрессируется во всех гемопоэтических клетках,
за исключением плазматических и Т-лимфоцитов. В результате мута-
ции задерживается созревание В-клеток на уровне пре-В-лимфоцитов.
Выраженность иммунодефицита может варьировать от полного отсутствия
иммуноглобулинов в крови до их сниженной концентрации и уменьшения
количества зрелых В-лимфоцитов.
Прогностически неблагоприятным является полный блок созревания
В-лимфоцитов. Характерный признак этого дефекта — отсутствие кле-
ток, экспрессирующих иммуноглобулиновые рецепторы. В других случаях
выявляют мембранные IgM и IgD, при этом количество В-лимфоцитов
в периферической крови может достигать границ среднестатистической
нормы. Однако вследствие блока на этапе дифференцировки плазмоциты
не образуются, в результате чего содержание циркулирующих иммуно-
глобулинов снижено или они не определяются. В костном мозге есть пре-
В-клетки, но в периферической крови В-лимфоциты отсутствуют. При
аутосомно-рецессивной форме заболевания возникают мутации разных
генов (расположены на хромосомах 10, 14, 22, 17), кодирующих тяжелые
ц-цепи, сигнальные молекулы и адапторный белок BLNK.
Клинические проявления Х-сцепленной агаммаглобулинемии воз-
никают только у мальчиков начиная со второго полугодия жизни. Первые
6 мес дети растут и развиваются нормально и прививаются без осложнений.
Первые клинические симптомы возникают в 7-11 мес в виде бактери-
альных инфекционных заболеваний. У 50% больных детей выявляются
кишечные инфекции и в дальнейшем сохраняется неустойчивый стул, при-
соединяются бактериальные инфекции респираторного тракта (пневмония,
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 275
Пре-В-клеточный рецептор
МАР-киназы
Рис. 11-3. Диаграмма, суммирующая взаимодействие нескольких молекул, отсутствие
которых связано с агаммаглобулинемией. Пре-В-клетки экспрессируют пре-BCR (рецеп-
торный комплекс формируется за счет тяжелой ц-цепи, гетеродимера Iga-lgp, V-npe-B
и 15), который инициирует через киназы (в частности, Btk) сигнал, необходимый для
дифференцировки В-клеток. Мутации генов Btk (ВТК), тяжелой ц-цепи (IGHM), Iga
(CD79A), Igp (CD79B), 15 (IGLL1) и В-клеточного связывающего белка (BLNK) описаны
у пациентов с агаммаглобулинемией. V-npe-B — вариабельный домен пре-В-рецептора.
Btk — брутоновская тирозинкиназа. BLNK — В-клеточный связывающий белок (от англ.
В-cell linker protein). Адаптерный белок, который передает сигнал с В-клеточного рецеп-
тора на несколько внутриклеточных путей, в том числе MAP-киназный. В итоге активи-
руются ключевые транскрипционные факторы (NF-кВ, NFAT, АР-1), которые включают
программу пролиферации и дифференцировки В-лимфоцитов. НАМ — внутриклеточные
участки (домены) молекул Iga и Igp. Lyn — тирозинкиназа. PLCy2 — фосфолипаза
Су2. Syk — фермент серин-треониновая тирозинфосфатаза катализирует дефосфо-
рилирование транскрипционного фактора NF-АТ и фосфорилирует один из ключевых
адаптерных белков В-клеток — BLNK. РКС — протеинкиназа С. МАР-киназы (от англ.
Mitogen Activated Protein): активация протеинкиназы С приводит к активации других фер-
ментов так называемого MAP-каскада (ERK-1, ERK-2). В результате происходит активация
транскрипционного фактора АР-1, который способствует активации генов, кодирующих
выработку ИЛ-2.
ЧАСТЬ 2
276 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
обструктивный бронхит), острый пиелонефрит, пиодермия, гнойный конъ-
юнктивит, а также сочетания указанных заболеваний. К 2-3 годам бакте-
риальные инфекции принимают затяжной, рецидивирующий характер (на
1 больного приходится от 3 до 8 очагов хронической бактериальной инфек-
ции). У 87% больных развиваются хронические заболевания дыхательных
путей (хронический бронхит, хроническая пневмония). Почти половина
больных детей к этому возрасту переносит деструктивную пневмонию.
В 75% случаев пневмония осложняется экссудативным гнойным плевритом
и поражением ЛОР-органов в виде гнойных гайморитов, отитов. На коже
возникают фурункулы, абсцессы, флегмоны. Выявляют также гнойные
конъюнктивиты, септический эндокардит, парапроктит, пиелонефрит и др.
При отсутствии своевременной диагностики стойкие бактериальные очаги
хронической инфекции формируются уже к 2-3 годам. Характерно воз-
никновение тяжелых пиогенных инфекций: синуситов, отитов, бронхитов,
пневмоний, пиодермий, септических артритов (бактериальных или хла-
мидиозных), септицемий, менингитов, энцефалитов. Возбудителями сино-
пульмональных инфекций чаще всего становятся Haemophilus influenzae,
Streptococcus pneumoniae, Staphylococcus aureus. Диарею вызывают кишечные
бактерии или Giardia lamblia. Клеточный иммунный ответ у больных не
страдает, поэтому вирусные и грибковые инфекции, туберкулез выявляют-
ся не чаще, чем в остальной популяции. Исключение составляют вирусные
гепатиты, инфекции нейротропными вирусами ECHO 19, вызывающи-
ми персистирующий менингоэнцефалит. Хронический менингоэнцефалит
может быть ассоциирован с дерматомиозитом или существовать отдельно
от него. Усугубляют тяжесть течения воспалительного процесса энтерови-
русы и Ureaplasma urealyticum. У больных детей при иммунизации живой
полиомиелитной вакциной, как правило, наблюдают продолжительное
выделение вакцинного вируса полиомиелита, причем с восстановленной
и нарастающей вирулентностью. С возрастом у таких детей выявляют
отставание в росте; пальцы имеют форму барабанных палочек, изменяется
форма грудной клетки и появляются симптомы, характерные для заболе-
ваний нижних дыхательных путей, отмечается гипоплазия лимфатических
узлов и миндалин. Несмотря на то что рецидивирующие бактериальные
инфекции респираторного и/или пищеварительного тракта — основные
проявления этого заболевания, описаны случаи, когда иммунодефицит
носил бессимптомный характер не только у детей, но даже у подростков и
взрослых. В типичных случаях у пациентов развиваются рецидивирующие
средние отиты, синуситы, бронхиты, пневмонии и инфекционные пораже-
ния кишечника.
Хронические синуситы выявляют более чем у 30% больных.
Рецидивирующие бронхиты и пневмонии могут развиваться даже на фоне
проводимой заместительной терапии иммуноглобулинами и зачастую
приводят к развитию бронхоэктазов. Это происходит ввиду того, что вво-
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 277
димые IgG с трудом достигают слизистых оболочек и не могут обеспечить
эффективную защиту от инфекционных поражений, осуществляя при этом
защиту от системных инфекций (сепсис, менингит, менингоэнцефалит).
Кишечные инфекции часто возникают у больных Х-сцепленной агамма-
глобулинемией. Например, Giardia lamblia вызывают хроническую диарею
и мальабсорбцию, Campylobacter jejuni также может быть выделен у боль-
ных с диареей, персистирующей многие недели. Mycoplasma служит частой
причиной развития инфекционных заболеваний респираторного и уро-
генитального тракта. Кроме того, в 5-8% случаев микоплазмы вызывают
рецидивирующие конъюнктивиты.
С 1990-х годов у больных стали выявлять гепатит С, связанный с кон-
таминированием препаратов иммуноглобулинов. Больные с Х-сцепленной
агаммаглобулинемией более устойчивы к вирусу гепатита С, чем пациенты
с ОВИН; у 73 из них гепатит С носит бессимптомный характер. У 20%
больных с Х-сцепленной агаммаглобулинемией развиваются артриты, воз-
будителями которых могут быть пиогенные бактерии, хотя в большинстве
случаев причина их остается невыясненной. Симптомы артритов купиру-
ются при проведении заместительной терапии иммуноглобулинами в соче-
тании с антибактериальным лечением. У 10-25% больных с Х-сцепленной
агаммаглобулинемией выявляют нейтропению. К редким проявлениям
заболевания относят гломерулонефрит, алопецию, амилоидоз.
Следует отметить, что для больных с агаммаглобулинемией аллерги-
ческие заболевания не характерны. Признаки аутоиммунных наруше-
ний выявляются редко. Злокачественные новообразования у пациентов с
Х-сцепленной агаммаглобулинемией возникают в 4,2% случаев.
Диагностика:
• уменьшение содержания IgG в сыворотке крови (меньше 2 г/л);
• уровень сывороточных IgA, IgM резко снижен, вплоть до полного
отсутствия (меньше 0,02 г/л);
• резко снижены или отсутствуют естественные антитела к широко рас-
пространенным антигенам (один из доступных тестов при подозрении
на гуморальный иммунодефицит);
• содержание CD19* В-клеток в периферической крови меньше 1-2%;
• показатели Т-клеточного иммунного ответа остаются в пределах
нормы;
• пролиферативная активность мононуклеаров периферической крови
на аллогенную и митогенную стимуляцию сохраняется.
В пунктате костного мозга у больных количество пре-В-клеток нормаль-
ное или даже повышенное, но В-клетки в последующих стадиях развития
отсутствуют или количество их весьма незначительно. При гистологи-
ческом исследовании лимфоидной ткани выявляют отсутствие гермина-
тивных центров в фолликулах лимфатических узлов и селезенки, а также
плазматических клеток.
ГЛАВА 11
ЧАСТЬ 2
278 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
В лечении больных с агаммаглобулинемией применяют пожизненную
заместительную терапию антителосодержащими препаратами — имму-
ноглобулином нормальным человеческим для внутривенного введения
(ВВИГ). В случае недоступности этих препаратов для лечения можно
использовать нативную донорскую плазму.
Заместительную терапию детям с впервые выявленным диагнозом агам-
маглобулинемии либо не получавшим ранее адекватной заместительной
терапии, а также после всех серьезных инфекционных эпизодов следует
проводить в режиме насыщения (иммуноглобулины внутривенно 2 раза в
неделю по 15-20 мл/кг в месячной дозе до 120 мл/кг). При достижении
уровней IgG не ниже 4-6 г/л и при подавлении активности инфекционного
процесса можно переходить на режим поддерживающей профилактической
иммунотерапии внутривенными иммуноглобулинами — 1 раз в месяц по
15-20 мл/кг.
Практически все случаи бактериальных инфекционных осложнений при
агаммаглобулинемии требуют антибактериальной терапии, как правило,
парентеральной. Антибактериальное лечение применяют одновременно с
заместительной терапией. Сроки антибактериальной терапии в 2-3 раза
превосходят продолжительность стандартной антибиотикотерапии вос-
палительных поражений соответствующих органов у других пациентов.
Возможность генетической терапии обсуждается.
11.2.2.2. ГИПОГАММАГЛОБУЛИНЕМИЯ С НОРМАЛЬНЫМ ИЛИ СНИЖЕННЫМ
КОЛИЧЕСТВОМ В-КЛЕТОК. ОБЩАЯ ВАРИАБЕЛЬНАЯ ИММУННАЯ
НЕДОСТАТОЧНОСТЬ
Впервые диагноз «общей вариабельной иммунной недостаточности»
(ОВИН) был сформулирован в 1953 г., но до настоящего времени молеку-
лярный дефект заболевания не известен.
Диагноз ОВИН устанавливают, если у пациента снижены уровни имму-
ноглобулинов как минимум двух изотипов (сывороточные IgA, IgG, и/или
IgM) в два раза и более по сравнению со стандартными при исключении
других генетических дефектов антител. Хотя большинство случаев ОВИН
носит спорадический характер, в 10-20% отмечают семейные случаи, при
этом у 80% пациентов выявляют аутосомно-доминантное наследование.
Недавние исследования предполагают, что гены, ответственные за ОВИН,
располагаются на хромосоме 6. Попытки идентифицировать эти гены при-
вели в последние годы к открытию новых монотонных дефектов, включая
ICOS-дефицит, СВ19-дефицит.
ICOS (англ. Inducible COStimulator) принадлежит к семейству иммуно-
глобулиноподобных костимуляторных поверхностных молекул CD28, экс-
прессируемых только активированными Т-клетками. \гСО5 взаимодейству-
ет с ICOS-лигандом (ICOSL), экспрессируемым на поверхности В-клеток,
обеспечивая Т-/В-клеточное взаимодействие. Связывание ICOSL и ICOS
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 279
обусловливает индукцию синтеза Т-клетками ИЛ-10, что в итоге позволя-
ет В-лимфоцитам осуществить переключение классов иммуноглобулинов
(англ. Class Switch Recombination — IgCSR) и терминальную дифференци-
ровку в клетки памяти и плазматические клетки. Более того, взаимодей-
ствие ICOS-ICOSL — важный сигнал для развития и функционирования
высокоспециализированных субпопуляций CXCR5+ Т-хелперов. Снижение
экспрессии ICOS приводит к исчезновению этой субпопуляции клеток и,
соответственно, к нарушению терминальной В-клеточной дифференциров-
ки и развитию гипогаммаглобулинемии.
Недавно описаны мутации гена, кодирующего белок CD 19, который
формирует комплекс с CD21, CD81, CD225 на мембране зрелых В-клеток.
Вместе с BCR этот комплекс влияет на антигензависимую активацию
В-клеток. В-клеточная дифференцировка напрямую зависит от сигнала,
поступающего через BCR. Корецепторы, связанные с BCR, могут модули-
ровать трансдуцирующий сигнал позитивно или негативно. Мутации гена,
кодирующего CD19, вызывают снижение гуморального иммунного ответа
на антигенную стимуляцию.
В 2005 г. выявлены мутации гена TNFRSF13B, регулирующего трансмем-
бранную активацию гена ТАС1, находящегося на хромосоме 17 и принадле-
жащего к суперсемейству рецепторов ФНО. У пациентов с мутациями ТАС1
выявляют гипогаммаглобулинемию и нарушение гуморального ответа на
иммунизацию, снижение содержания В-клеток памяти в периферической
крови. Клинические проявления включают рецидивирующие инфекции, ауто-
иммунные заболевания, лимфопролиферацию, спленомегалию, малигниза-
цию.
При синдроме ОВИН выявляют дефекты поздней стадии В-клеточной
дифференцировки, но природа их остается неизвестной. Уменьшение коли-
чества CD27+ В-клеток памяти в периферической крови служит критерием
для выделения разных подгрупп ОВИН. Расстройства соматического гипер-
мутагенеза, резко уменьшающие образование высокоаффинных антител, -
другой признак нарушения терминальной В-клеточной дифференцировки
у больных с ОВИН. Нарушения соматической гипермутации выявляют у
77% пациентов с ОВИН, страдающих частыми тяжелыми инфекционными
заболеваниями респираторного тракта.
Помимо нарушений со стороны В-клеток, у больных с ОВИН выявля-
ют различные дефекты функций Т-клеток. У 25-30% пациентов с ОВИН
увеличивается количество CD8* Т-клеток и снижается соотношение CD4+/
CD8+ Т-клеток. У таких пациентов часто развивается спленомегалия и
аутоиммунные заболевания. Относительно тимопоэза при данном заболе-
вании в настоящее время имеются противоречивые данные. Так, согласно
одним авторам, примерно у 70% пациентов с ОВИН снижено содержание
CD4+ Т-клеток, что предполагает снижение тимопоэза, тогда как дру-
гие исследователи продемонстрировали существенное увеличение уровня
ГЛАВА 11
ЧАСТЬ 2
280 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
TRECs (англ. T-cell Receptor Excision Circles) — маркеров усиления тимопоэ-
за. Подобные циклические образования содержатся в цитоплазме наивных
Т-клеток, недавно покинувших тимус. Авторы предполагают, что эти раз-
личия объясняются гетерогенным характером популяции пациентов.
У больных с ОВИН выявлены нарушения образования ИЛ-7, причем в
сторону не только снижения, но и повышения; усиление экспрессии рецеп-
торов ИЛ-12 и ИЛ-18. Эти изменения способствуют Thl-поляризации
иммунного ответа у пациентов с ОВИН.
Комплекс генов, ответственных за функции NK-клеток, находится на
коротком плече хромосомы 12. Абсолютное число NK-клеток в перифе-
рической крови большинства пациентов снижено. Возможно, этот локус
является главным не-НЬА-зависимым локусом для ОВИН.
У некоторых больных с ОВИН выявляют также нарушения функциони-
рования дендритных клеток и экспрессии TLR.
Клиническая картина общей вариабельной
иммунной недостаточности
К основным клиническим проявлениям ОВИН относят рецидивирующие
инфекции, аутоиммунные заболевания, лимфомы, разные формы рака.
Первая симптоматика может проявляться в различном возрасте, начиная
от детского и до пожилого. Возрастные пики манифестации отмечаются
между 1-5 и 18-25 годами. В отличие от больных агаммаглобулинемией, у
больных с ОВИН миндалины и лимфатические узлы остаются нормальных
размеров или увеличены; примерно у 25% пациентов развивается сплено-
мегалия.
Почти все пациенты с ОВИН имеют в анамнезе острые, хронические или
рецидивирующие инфекции (особенно пневмонии, синуситы и отиты). К
моменту выявления ОВИН у 90% пациентов манифестируют хронические
синуситы и у 70% — рецидивирующие средние отиты; 75-85% пациентов к
этому времени неоднократно перенесли пневмонию.
У 37,5-73% больных с ОВИН развиваются бронхоэктазы. Этих больных
относят к подгруппе ОВИН, со снижением числа В-клеток памяти и уровня
антипневмококковых IgM-антител (в ответ на вакцинацию). У таких боль-
ных повышен риск развития рецидивирующих бактериальных пневмоний и
бронхоэктазов. В их лечении следует использовать более активную тактику.
Бронхиальную астму выявляют у 9-15% пациентов с ОВИН.
Неказеозные гранулематозные инфильтраты в легких выявляют у
5,4-22% пациентов. Эти изменения трудноотличимы от саркоидоза.
Помимо этого, их обнаруживают в лимфоидных органах и тканях. У паци-
ентов с ОВИН могут развиваться также лимфоидные интерстициальные
пневмонии, выявляемые при сканировании. Наличие гранулец в легких
и лимфоидных интерстициальных пневмоний связывают с утйжелением
прогноза и повышением вероятности развития лимфопролиферативных
заболеваний.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 281
Заболевания ЖКТ, гепатобилиарной системы. Для пациентов с
ОВИН характерна высокая частота распространения воспалительных и
инфекционных кишечных заболеваний. Диарея водянистого характера воз-
никает периодически у 20% больных, причем 10% из них имеют тяжелые
формы энтеропатии типа мальабсорбции с потерей массы тела.
Патология пищеварительного тракта у этих пациентов включает нодуляр-
ную лимфоидную гиперплазию, воспаление толстого кишечника (язвенные
колиты, язвенные проктиты или болезнь Крона), лямблиоз. Helicobacter
pylori — важный патоген, вызывающий хронический активный гастрит с
вовлечением антрума и тела желудка. Около 10% пациентов с ОВИН имеют
серьезные нарушения функции печени, вирусные гепатиты В и С, первич-
ный биллиарный цирроз.
Аутоиммунные заболевания. Примерно 20-25% больных с ОВИН
имеет одно или более аутоиммунных заболеваний (например, аутоиммун-
ную гемолитическую анемию, тромбоцитопению, ревматоидный артрит).
Механизм развития аутоиммунных нарушений не известен. Большинство
пациентов с ОВИН и идиопатической тромбоцитопенической пурпурой
или аутоиммунной гемолитической анемией положительно отвечают на
лечение высокими дозами внутривенных иммуноглобулинов в сочетании с
коротким курсом глюкокортикоидов.
Онкопатология. У пациентов с ОВИН повышена частота малигниза-
ции, особенно развитие лимфом. В возрасте от 30 до 50 лет малигнизация
имеет место у 11-13% пациентов. В большинстве случаев вовлекаются
пищеварительный тракт и лимфоидная ткань. У этих пациентов частота
развития всех форм рака увеличивается в 1,8-5 раз, причем чаще всего это
рак желудка и лимфомы. Доброкачественные новообразования включают
нодулярную лимфоидную гиперплазию, спленомегалию и генерализован-
ную лимфаденопатию.
Диагностика общей вариабельной иммунной недостаточности
Лабораторные показатели, наиболее важные для постановки диагноза
ОВИН:
• низкая концентрация сывороточных IgG (в 2 раза ниже нормального
уровня для соответствующего возраста). У большинства пациентов
низкий уровень IgA, и примерно у 50% больных снижен уровень IgM;
• уменьшение количества или отсутствие специфических антител после
иммунизации белковыми (дифтерийный, столбнячный анатоксины)
или полисахаридными антигенами (пневмококковая вакцина). После
первого года жизни 70% детей способны синтезировать антитела к
АВО-антигенам групп крови (изогемагглютинины). Для пациентов с
ОВИН характерно нарушение образования специфических антител, а
именно изогемагглютининов и/или слабый ответ на одну или несколь-
ко вакцин;
ГЛАВА 11
ЧАСТЬ 2
282 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• количество В-клеток в периферической крови может быть нормаль-
ным или сниженным. У 13% пациентов количество В-клеток в перифе-
рической крови ниже 3%;
• у половины пациентов с ОВИН уменьшено количество Т-клеток и
нарушен пролиферативный ответ лимфоцитов на митогены и анти-
гены;
• наличие гипогаммаглобулинемии при отсутствии диагностически зна-
чимого иммунологического и генетического маркера ОВИН вызывает
необходимость исключить все хорошо диагностируемые причины
гипогаммаглобулинемии. У мальчиков с ОВИН должны быть исключе-
ны такие ПИД, как Х-сцепленная агаммаглобулинемия, Х-сцепленный
лимфопролиферативный синдром, Х-сцепленный дефицит переключе-
ния классов иммуноглобулинов. Разные формы агаммаглобулинемии
проявляются обычно вскоре после рождения, тогда как ОВИН чаще
манифестирует после двух лет.
В иммунограмме выявляют:
• значительное снижение уровней сывороточных IgG (до 3,5-4,0 г/л) и
IgA; в меньшей степени — IgM;
• содержание В-лимфоцитов (CD19+) в норме, но у 10% больных сни-
жено;
• суммарная концентрация иммуноглобулинов в сыворотке крови ниже
3,0 г/л.
Иммунологические показатели могут меняться в течение жизни боль-
ного, постепенно ухудшаясь. Наряду с дефицитом иммуноглобулинов у
пациентов с ОВИН выявляют существенные нарушения клеточного иммун-
ного ответа в виде изменений в субпопуляционном составе лимфоцитов:
уменьшение количества CD4+ и повышение содержания CD8+ Т-клеток,
повышение содержания активированных Т-лимфоцитов.
Лечение
В основе лечения больных ОВИН лежит заместительная терапия имму-
ноглобулинами. С этой целью требуется введение иммуноглобулинов по
400-600 мг/кг каждые 3-4 нед. Показано, что доза 600 мг/кг каждые
4 нед поддерживает уровень IgG в сыворотке выше 5,0 г/л. Пациентам
со структурными нарушениями в легких необходим уровень IgG до 7,0-
8,0 г/л. Высокие дозы иммуноглобулинов бывают необходимы пациентам
с тяжелыми хроническими синопульмональными инфекциями для предот-
вращения развития бронхоэктазов.
Нежелательные реакции на введение иммуноглобулинов включают
боли в спине, тошноту, рвоту, субфебрилитет, озноб, миалгии, слабость.
Эти реакции развиваются в пределах 30 мин после введения и обычно
исчезают в течение нескольких часов. Уменьшение скорости введения
или прекращение инфузии на несколько минут помогают предотвратить
появление указанных симптомов. Эти реакции можно свести к минимуму
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 283
и путем премедикации с использованием противовоспалительных пре-
паратов, включая глюкокортикоиды. Помимо заместительной терапии,
используют длительное антибактериальное лечение, однако данных кон-
тролируемых исследований, посвященных сравнительной эффективности
различных антибиотиков у пациентов с иммунодефицитами, нет. В ряде
исследований для профилактики бактериальных инфекций у детей исполь-
зовали амоксициллин по 20 мг/кг в сутки, бисептол* [ко-тримоксазол
(сульфаметоксазол + триметоприм)] по 3-5 мг/кг в сутки, азитромицин по
10 мг/кг еженедельно.
Прогноз у пациентов с ОВИН зависит от частоты инфекций, структурных
нарушений в легких, возникновения аутоиммунных заболеваний и успеш-
ности профилактики инфекций. Пациенты должны научиться выявлять
ранние симптомы инфекции и понимать необходимость своего активного
лечения.
11.2.2.3. ПЕРВИЧНЫЕ В-КЛЕТОЧНЫЕ ДЕФЕКТЫ. СИНДРОМЫ, СВЯЗАННЫЕ
С БЛОКОМ ПЕРЕКЛЮЧЕНИЯ КЛАССА ИММУНОГЛОБУЛИНОВ
Дефицит переключения классов иммуноглобулинов — IgCSR (от англ.
Immunoglobulin Class Switch Recombination deficiencies). В данную гетеро-
генную группу заболеваний включены выявленные в последнее время
генетические дефекты переключения класса иммуноглобулинов в про-
цессе развития иммунного ответа с IgM-антител на IgG, IgA и IgE. К этой
группе относят гипер-^М-синдром, первоначально выявленный только
у мальчиков, однако затем подобные дефекты были диагностированы и у
девочек. Блок развития В-клеток после взаимодействия с антигеном (см.
ранее В-клеточный иммуногенез) пока выявляют редко, однако суще-
ствует общая тенденция к увеличению числа выявляемых случаев ПИД
(в основном за счет совершенствования диагностической базы). Число
таких больных будет увеличиваться, и в первую очередь среди детского
контингента.
Дефицит переключения классов иммуноглобулинов — нарушение физио-
логических механизмов переключения изотипов иммуноглобулинов, ранее
обозначавшееся термином «гипер-^М-синдром». Это редкая форма ПИД с
нарушением образования антител. Впервые заболевание описано в 1961 г. С
момента появления первых сообщений об этом заболевании и до последне-
го времени в мировой литературе описано немногим более 200 случаев.
Агаммаглобулинемия с гиперпродуцией IgM — ПИД, для которого
характерно снижение концентрации IgG в сыворотке менее 2,0 г/л, IgA —
меньше 0,05 г/л при нормальном или повышенном содержании IgM (боль-
ше 3,0 г/л) и который клинически проявляется повторными бактериаль-
ными и оппортунистическими инфекциями, лимфоидной гиперплазией и
аутоиммунными нарушениями. В целом это гетерогенная группа заболе-
ваний, в которой выделяют не меньше пяти форм, различающихся и по
ГЛАВА 11
ЧАСТЬ 2
284 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
характеру наследования, и по клиническим проявлениям. В 70% случаев
это Х-сцепленная форма заболевания.
Кроме того, выделяют комбинированные и преимущественно гумораль-
ные иммунодефициты. К комбинированным формам rHnep-IgM-синдрома
относят Х-сцепленную недостаточность CD40L и аутосомную недостаточ-
ность CD40. К гуморальным формам относят аутосомные синдромы, в
основе которых лежит дефект гена цитидиндезаминазы (AID), недостаточ-
ность урацил-Ы-гликозидазы и селективную недостаточность рекомбина-
ции переключения классов иммуноглобулинов.
Дефекты этого типа являются селективными врожденными В-клеточны-
ми дефектами, причина которых заключается в мутациях генов AID, UNG
(англ. Uracyl-DNA Glycosylase) и др.
Механизмы развития. Репертуар антител, содержащий иммуноглобу-
лины различных изотипов с высоким аффинитетом к антигенам, состав-
ляет основной компонент гуморального иммунного ответа. Формирование
репертуара антител происходит в первичных и вторичных лимфоидных
органах. В первичных лимфоидных органах, в В-клетках происходит первая
ДНК-рекомбинация. В этой стадии происходят V(D)J- и VJ-рекомбинации,
независимые от антигена и Т-лимфоцитов. В результате на поверхности
В-клеток экспрессируются поверхностные иммуноглобулины (IgM, IgD).
IgM+ В-клетки образуются в костном мозге и мигрируют во вторичные
лимфоидные органы, в которых они встречают антигены, связывающиеся с
их рецепторами. Во вторичных лимфоидных органах зрелые В-лимфоциты
могут стимулироваться ко вторичной модификации ДНК. В течение этого
специфического процесса в В-клетках могут происходить два различных
антигензависимых процесса, в том числе переключение изотипов иммуно-
глобулинов и соматический гипермутагенез.
Мутации в генах, кодирующих CD40L и CD40, служат причиной дефек-
тов в СО40-активационном пути, что приводит к различным дефици-
там переключения изотипов иммуноглобулинов (классифицируемых как
комбинированные Т- и В-клеточные иммунодефициты). Мутации в гене,
кодирующем IKKy, — причина дефектов СО40-пути активации, которые
приводят к ангидротической эктодермальной дисплазии с иммунодефици-
том. Мутации в генах, кодирующих AID и UNG, вызывают разрывы ДНК и
приводят к дефицитам переключения изотипов иммуноглобулинов за счет
врожденных дефектов В-клеток (рис. 11-4).
Выделяют как минимум два фенотипа дефицитов переключения изоти-
пов иммуноглобулинов:
• дефицит переключения изотипов иммуноглобулинов типа 1 обуслов-
лен мутацией гена AID, Переключение изотипов иммуноглобулинов
и соматическая гипермутация происходят в зрелых В-клетках, и для
обоих процессов нужен специфичный для В-клеток фермент AID, экс-
прессируемый только в активированных В-лимфоцитах. AID — белок
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 285
переключения
классов
иммуноглобулинов
ГЛАВА 11
Рис. 11-4. Молекулярные дефекты, приводящие к дефициту переключения классов имму-
ноглобулинов. CD40L — С040-лиганд, клеточная сигнальная молекула. Нарушение экс-
прессии CD40L приводит к невозможности переключения синтеза IgM на другие классы
lg. AID — AID-ген на хромосоме 12р13 кодирует белок, который содержит 198 аминокис-
лот массой 24 кДа, экспрессируемый только в активированных В-клетках. Дефект AID-
гена вызывает недостаточность индуцированной активации цитидиндезаминазы, которая
инициирует процессы рекомбинации переключения классов lg, превращая цитозин в
урацил. Это приводит к отсутствию или очень низкому уровню IgG, IgA, IgE в сочетании
с нормальным или повышенным содержанием сывороточного IgM. UNG — UNG-ген
кодирует урацил-И-гликозилазу. Мутации UNG-гена приводят к селективной недоста-
точности рекомбинации переключения классов lg. UNG-гены требуются для генерации
высокоаффинных антител. IKKy — гетеродимер, который состоит из двух молекул IKK-a
и IKK-p, скрепленных молекулой IKK-y или NEMO (от англ. NF-кВ essential modulator).
Комплекс активируется многими киназами. NF-кВ — транскрипционный ядерный фак-
тор кВ. Регулятор гена легкой к-цепи. NF-кВ семейства цитоплазматических белков,
которые находятся в цитоплазме в неактивном состоянии в комплексе с ингибиторами
1кВ. При стимуляции переходит в свободное состояние, перемещаясь в ядро клетки, где
проявляет активность, связываясь с премоторными участками многих генов. ATM — ген
ATM (Ataxia-Teleangiectasia Mutated), расположенный в районе 11 g22.3-g23.1-хромосомы.
Н2АХ — фосфоформа гистона А2АХ. Активация сигнальных киназ ATM и ATR приводит
к накоплению Н2АХ в участке повреждения ДНК и остановке клеточного цикла. NHEJ —
ген, кодирующий синтез белкового канала клетки, через который происходит «прокачка»
ионов натрия и водорода. MSH2, MSH6 — гены, которые кодируют белки, участвующие
в исправлении ошибок репликации ДНК и в конверсии генов. MSH2 формирует гетеро-
димер с MSH3, который участвует только в коррекции вставок/выпадений нуклеотидов.
Гетеродимер MSH2 с MSH6 участвует, кроме того, в создании некомплементарных пар
оснований. Соматические гипермутации: множество мутаций на небольшом по про-
тяженности участке генома (1500-2000 нуклеотидов) в районе перестроенного V-(D)-
J-сегмента. Этот процесс осуществляется в герминативном центре фолликула. Клетки,
прошедшие соматическую гипермутацию, характеризуются экспрессией IgG/lgA и CD27.
ЧАСТЬ 2
286 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
(цитидиндезаминаза), инициирующий переключение изотипов имму-
ноглобулинов и соматическую гипермутацию путем конвертации цито-
зина в урацил в S- или V-регионах соответственно. При дефиците AID
выявляют отсутствие или очень низкий уровень IgG, IgA и IgE, при
нормальном или повышенном содержании IgM. У больных гумораль-
ный ответ ограничен IgM-изотипом без изменения аффинитета после
повторной иммунизации. В-клетки не способны переключать изоти-
пы иммуноглобулинов под действием СЭ40-агонистов и цитокинов.
Дефицит AID часто наследуется аутосомно-рецессивным путем;
• дефицит переключения изотипов иммуноглобулинов типа 2 обуслов-
лен мутацией в гене UNG и характеризуется дефицитом урацил-ДНК-
гликозилазы (UNG). Мутации в гене, кодирующем UNG, приводят к
нарушениям переключения изотипов иммуноглобулинов в В-клетках
после их активации СО40-агонистами и цитокинами. UNG-дефицит
наследуется аутосомно-рецессивным путем. Другие селективные дефи-
циты переключения изотипов иммуноглобулинов, встречающиеся
более чем у половины пациентов с этой патологией, также обуслов-
лены врожденными дефектами В-клеток, но молекулярная основа их
пока не известна.
Клинические проявления rHnep-IgM-синдрома характеризуются
повторными инфекциями, аутоиммунными расстройствами, частыми онко-
логическими заболеваниями и гематологическими нарушениями. Первые
клинические проявления у большинства больных возникают в младенче-
ском и раннем детском возрасте. На первом месте стоят поражения респи-
раторного тракта в виде синуситов, бронхитов и пневмонии. Поскольку при
этой форме иммунодефицита существенно нарушается элиминация вну-
триклеточных патогенов, тяжелые поражения легких в виде интерстици-
альной пневмонии чаще вызывают Pneumocystis carini (12%), а поражения
пищеварительного тракта — криптоспоридии. Криптоспоридиоз — одна из
причин развития язвенного поражения пищеварительного тракта и скле-
розирующего холангита. Пациенты высокочувствительны к энтеровирус-
ным энцефалитам. Может развиться гиперплазия лимфатических узлов и
миндалин, нередко выявляют гепатоспленомегалию. Возможно появление
аутоиммунных нарушений в виде артрита и гломерулонефрита (протекают
тяжело и способны ухудшить прогноз заболевания), гемолитической ане-
мии, нейтропении, тромбоцитопении, гепатита.
Дефицит цитидиндезаминазы (AID). У пациентов развиваются тяже-
лые рецидивирующие инфекции респираторного и пищеварительного
тракта. Рецидивирующие инфекции приводят к развитию хронических
синуситов и бронхоэктазов. Поражения пищеварительного тракта лям-
блиями могут быть причиной хронической диареи. Инфекционные заболе-
вания ЦНС вызывают Haemophilus influenzae и Herpes Simplex, Пациенты не
чувствительны к оппортунистическим инфекциям, например Pneumocystis
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 287
jiroveci. У 69% пациентов развивается лимфоидная гиперплазия, обуслов-
ленная антигенной стимуляцией и пролиферацией В-клеток в отсутствии
эффективного синтеза антител. В 75% случаев лимфоидная гиперплазия
уменьшается в результате лечения внутривенными иммуноглобулина-
ми. Аутоиммунные нарушения возникают у 21% пациентов и включа-
ют аутоиммунные гепатиты, гемолитическую анемию, тромбоцитопению,
болезнь Крона, увеиты, хронический активный гепатит, сахарный диабет
1-го типа. У пациентов выявляют аутоантитела IgM-изотипа. В отличие
от дефицитов переключения изотипов иммуноглобулинов, обусловленных
дефектами CD40L, у пациентов с мутацией в гене AID заболевание развива-
ется в более позднем возрасте и протекает менее тяжело.
Дефицит урацил-ДНК-гликозилазы (UNG). Клинические прояв-
ления сходны с таковыми у больных с дефицитом AID и характеризуют-
ся рецидивирующими синопульмональными инфекциями и лимфоидной
гиперплазией. Пациенты имеют очень низкий уровень сывороточных IgG и
IgA, повышенный уровень сывороточного IgM и сниженный гуморальный
IgG-ответ на антигены вакцин. Содержание Т- и В-лимфоцитов у таких
больных остается в норме.
Диагностика
• Наиболее важный лабораторный критерий при диагностике дефицита
переключения изотипов иммуноглобулинов — низкая концентрация
сывороточных IgG, IgA, IgE и нормальный или повышенный уровень
сывороточного IgM. В иммунограмме выявляют стойкое снижение в
сыворотке крови уровня IgG (ниже 2,0 г/л) и IgA (ниже 0,05 г/л) при
нормальной или повышенной концентрации IgM (может достигать
10,0 г/л и больше). Количество В-лимфоцитов в норме.
• Выявляют снижение экспрессии молекул CD40L Т-хелперами.
• У больных с Х-сцепленным дефицитом переключения изотипов имму-
ноглобулинов выявляют гипоплазию лимфоидной ткани, тогда как
более чем для половины пациентов с дефицитом AID характерны лимф-
аденопатия и гипертрофия миндалин.
• Диагноз подтверждают генетическими методами, выявляя мутации в
генах, кодирующих AID и UNG.
Лечение. В основе лечения лежит заместительная терапия иммуно-
глобулинами, эффективно уменьшающая частоту и ослабляющая тяжесть
инфекционных заболеваний, а также устраняющая лимфоидную гипер-
плазию. Применяют пожизненную заместительную терапию антителосо-
держащими препаратами (иммуноглобулины для внутривенного введения,
плазма). При проявлениях бактериальных инфекций и их осложнениях
обязательна антибактериальная терапия, как правило, парентеральная.
У больных с дефицитом CD40L эффективна трансплантация стволовых
гемопоэтических клеток от HLA-идентичного донора. Симптоматическую
терапию проводят по показаниям.
ГЛАВА 11
ЧАСТЬ 2
288 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
11.2.2.4. СЕЛЕКТИВНЫЙ ДЕФИЦИТ IgA
Этот ПИД диагностируют у пациентов старше 4 лет, у которых уровень
сывороточного IgA меньше 0,07 г/л при нормальном уровне сывороточных
IgG и IgM. Частичный дефицит IgA выявляют, если уровень IgA снижен
более чем в 2 раза по сравнению с возрастной нормой.
В 1961 г. IgA-дефицит был впервые описан у пациентов с атаксией-
телеангиэктазией. Его выявляют с одинаковой частотой у мальчиков и дево-
чек. В зависимости от различных этнических групп частота селективного
дефицита IgA в популяции варьирует от 1:142 до 1:15 000 человек. Дефект
возникает в результате того, что нарушается переключение изотипов на
IgA или созревание IgA-продуцентов. Истинная природа дефекта пока не
известна, однако имеются убедительные доказательства его детерминиро-
ванности на уровне HLA-системы. Так же, как и при ОВИН, у больных с
селективным дефицитом IgA чаще всего выявляют HLA-гаплотипы Al, В8
и DR3. Ген константного фрагмента тяжелой цепи IgA расположен на хро-
мосоме 6, но у больных структурных делеций в этом регионе не выявлено.
Считают, что в патогенезе селективного дефицита IgA большую роль
играет ТФР-р, служащий основным фактором в индукции синтеза IgA
В-лимфоцитами. Кроме того, в развитии дефицита играет роль снижение
экспрессии CD40 на В-лимфоцитах, что нарушает возможность коопе-
рирования последних с Т-хелперами и антигенпрезентирующими клет-
ками (АПК) при инициации синтеза IgA. Показано, что при дефиците
IgA имеет место нарушение процессов терминальной дифференцировки
В-лимфоцитов, синтезирующих IgA, но не способных его секретировать.
Клиническая картина
Почти у 2/3 пациентов с селективным IgA-дефицитом заболевание проте-
кает бессимптомно в течение всей жизни. Наличие сопутствующих иммун-
ных дефектов у пациентов с дефицитом IgA может способствовать воз-
никновению рецидивирующих инфекций. Эти сопутствующие иммунные
дефекты включают дефицит субклассов IgG, дефекты образования специ-
фических антител против белков и полисахаридных антигенов вакцин,
дефекты маннозосвязывающего лектина. У пациентов с манифестацией
симптомов возникают рецидивирующие вирусные инфекции. Инвазивные
инфекции, такие, как септицемия и менингиты, не характерны. У пациентов
с селективным дефицитом IgA повышен риск возникновения аутоиммунных
заболеваний и малигнизации. Заболевание у больных протекает нетяжело,
что может быть обусловлено компенсаторным увеличением секреции IgM.
Клинические проявления данной формы ПИД манифестируют в основном
в раннем детском возрасте. В дальнейшем происходит нормализация уров-
ня IgA. Следует отметить, что аллергические и аутоиммунные заболевания
у таких больных протекают «классически».
Наиболее частые клинические проявления — рецидивирующие и хрони-
ческие заболевания дыхательных путей и ЛОР-органов (отиты, синуситы,
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 289
бронхиты, пневмонии), причем в большей степени выражена чувствитель-
ность больных к вирусным, а не к бактериальным инфекционным заболева-
ниям. Инфекции органов дыхания редко переходят в хронические формы.
Характерная особенность этого вида иммунодефицита — наличие заболе-
ваний пищеварительного тракта (например, целиакии, неспецифического
язвенного колита, болезни Крона, гипертрофического гастрита, дисбакте-
риоза). При недостаточном содержании секреторного IgA создаются пред-
посылки к развитию аллергических и аутоиммунных заболеваний.
В зависимости от преобладания той или иной симптоматики выделяют
следующие варианты селективной недостаточности IgA:
• атопический;
• с поражением дыхательных путей;
• с поражением пищеварительного тракта;
• аутоиммунный;
• бессимптомный (случайная лабораторная находка).
Синопульмональные инфекции. Рецидивирующие синопульмональ-
ные инфекции — наиболее частый симптом, связанный с селективным
IgA-дефицитом. Инфекции вызывают экстрацеллюлярные инкапсулиро-
ванные бактерии, например Haemophilus influenzae, Streptococcus pneumoniae.
Рецидивирующие средние отиты и синопульмональные инфекции выявля-
ются чаще у пациентов, имеющих одновременно низкий уровень IgG (осо-
бенно IgG2 у детей).
У пациентов с сочетанным IgA-дефицитом и дефицитом субклассов IgG
нарушен гуморальный ответ на белковые и полисахаридные антигены, что
является фактором риска развития хронической легочной патологии и
бронхоэктазов. У 5,3-14% больных с бронхоэктазами выявляют селектив-
ный дефицит IgA.
Заболевания пищеварительного тракта. У пациентов с селективным
IgA-дефицитом повышен риск развития некоторых заболеваний, в том
числе лямблиоза, нодулярной лимфоидной гиперплазии, целиакии, коли-
тов. У 50% пациентов выявляют преципитирующие антитела к антигенам
коровьего молока, и у большинства пациентов циркулирующие иммунные
комплексы в сыворотке появляются спустя 15-60 мин после употребления
молока.
Аутоиммунные нарушения. Отсутствие IgA обусловливает проник-
новение перекрестно реагирующих антигенов в циркуляцию и инициацию
аутоиммунных реакций, включая идиопатическую тромбоцитопеническую
пурпуру, аутоиммунную гемолитическую анемию, ревматоидный артрит,
СКВ, тиреоидит, витилиго. У пациентов часто выявляют аутоантитела к
тиреоглобулину, эритроцитам, тиреоидным микросомальным антигенам,
базальной мембране, клеткам гладкой мускулатуры, панкреатическим
клеткам, нуклеарным протеинам, кардиолипину, коллагену, адреналовым
клеткам.
ГЛАВА 11
ЧАСТЬ 2
290 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Важно отметить, что в определенной подгруппе больных с селективным
дефицитом IgA вырабатываются анти-^А-антитела, способные индуциро-
вать трансфузионные реакции, причем эти антитела могут существовать
и у бессимптомных пациентов. В связи с этим таким пациентам введение
препаратов крови (на основе иммуноглобулинов, а также плазмы) противо-
показано до проведения тестирования на наличие сывороточных анти-IgA-
аутоантител. При неконтролируемом введении иммуноглобулиновых пре-
паратов, содержащих IgA, возможно образование иммунных комплексов и
развитие иммунокомплексной патологии.
Аллергия. У пациентов с селективным дефицитом IgA выявлена связь с
аллергическими заболеваниями, такими, как бронхиальная астма, аллерги-
ческий ринит, крапивница, атопический дерматит и пищевая аллергия.
Малигнизация. У пациентов с селективным дефицитом IgA в более стар-
шем возрасте может быть повышен риск развития желудочно-кишечной и
лимфоидной малигнизации.
Диагностика
• Диагностический критерий — снижение у пациентов старше 4 лет
уровня сывороточного IgA меньше 0,07 г/л при нормальном содержа-
нии IgG и IgM и исключении других причин гипогаммаглобулинемии.
Диагностически значимы:
❖ изолированное снижение уровня IgA в сыворотке (меньше 0,05 г/л)
при нормальном уровне других изотипов иммуноглобулинов у детей
старше 1 года, отсутствие IgAl и IgA2. Уровень IgM и IgG в норме.
Однако у некоторых больных выявляют дефицит IgG2;
Ф если уровень IgA находится в пределах от 0,05 г/л до 0,2 г/л, то диа-
гностируют частичную недостаточность IgA;
О нормальное количество Т-лимфоцитов и их субклассов;
Ф обычно нормальное количество В-лимфоцитов (CD19+, CD20+);
< нормальное количество NK-клеток (CD16+CD56+).
• У пациентов с дефицитом IgA, особенно при отсутствии секреторного
IgA, необходимо исследовать уровень субклассов IgA. У некоторых
пациентов селективная недостаточность IgA может прогрессировать с
развитием в дальнейшем ОВИН. Необходим длительный регулярный
мониторинг содержания иммуноглобулинов (в том числе у бессимп-
томных пациентов).
• Определение аутоантител (антинуклеарных, антитиреоидных и др.).
• При пищевой непереносимости или мальабсорбции необходимо аллер-
готестирование и определение антител к молоку и антиглутеновых
IgG-антител.
Лечение
Пациентам с бессимптомным селективным дефицитом IgA постоянное
лечение не требуется. Пациентам с проявлениями инфекционных заболе-
ваний назначают с профилактической целью антибиотики. Интенсивное
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 291
антибактериальное лечение проводят у всех больных во время возникнове-
ния инфекционного заболевания. Пациентам не противопоказана рутинная
иммунизация. Заместительная иммуноглобулиновая терапия противопо-
казана, когда у больного выявляют аутоантитела против IgA. Следует учи-
тывать тот факт, что избирательный дефицит IgA относится к некорриги-
руемым первичным иммунным дефектам. Лечебные мероприятия сводятся
к симптоматической терапии инфекционных, аллергических и аутоиммун-
ных заболеваний. Иммунотропные препараты назначают главным образом
в связи с проявлением повышенной инфекционной заболеваемости.
Прогноз. У пациентов с селективным IgA-дефицитом прогноз зависит от
наличия сопутствующего дефекта специфических антител, аллергии или ауто-
иммунных заболеваний. Нередко бессимптомное течение заболевания может
нарушаться в связи с действием внешних поражающих факторов, например, в
стрессовой ситуации, при иммуносупрессии, химиотерапии и т.д.
11.2.2.5. ДРУГИЕ ПЕРВИЧНЫЕ ИММУНОДЕФИЦИТЫ, СВЯЗАННЫЕ
С ДЕФИЦИТОМ ИЗОТИПОВ ИЛИ ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНОВ
К этой группе заболеваний относят изолированный дефицит субклас-
сов IgG, дефицит IgA с IgG-субклассами, делеции тяжелых цепей иммуно-
глобулинов, дефицит легких к-цепей.
Дефицит субклассов IgG впервые описан в 1970 г. как дефицит одного
или более субклассов IgG при нормальном уровне общего IgG. У боль-
шинства пациентов уровень IgM в норме. У некоторых больных возможна
ассоциация со сниженным уровнем IgA. Клиническая значимость дефицита
субклассов IgG у пациентов с рецидивирующими инфекционными заболе-
ваниями не ясна.
У человека выявляют четыре субкласса IgG: IgGl, IgG2, IgG3 и IgG4.
IgGl составляет 66% от общего уровня IgG, IgG2 — 24%, IgG3 — 7%, IgG4 —
3%. Первыми в онтогенезе появляются IgGl и IgG3. Иммуноглобулины
этих подклассов являются активаторами классического пути активации
комплемента и направлены против белковых антигенов. IgG2 представлены
антителами преимущественно к полисахаридным антигенам инкапсули-
рованных бактерий. Содержание IgG2 у детей достигает уровня взрослых
только к 5-10 годам жизни. Через плаценту проходят все подклассы IgG,
кроме IgG2.
Патогенез дефицитов субклассов IgG до конца не ясен. Большинство
из них возникает благодаря нарушениям экспрессии у-генов. Частота
встречаемости дефицитов субклассов IgG варьирует: IgG4 — 40%, IgG2 —
28%, IgG3 — 17%, IgGl — 14%. Изолированный дефицит IgGl встреча-
ется крайне редко. Дефицит субклассов IgG может быть связан с дефици-
том IgA и другими ПИД (например, атаксией-телеангиэктазией, синдро-
мом Вискотта-Олдрича), а также с приобретенными иммунодефицитами
(например, ВИЧ-инфекцией).
ГЛАВА 11
ЧАСТЬ 2
292 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Клиническая картина
Наиболее часто у пациентов с низким уровнем одного или более субклас-
сов IgG развиваются рецидивирующие инфекционные заболевания органов
дыхания и ЛОР-органов (например, отиты, синуситы, бронхиты, вызван-
ные инкапсулированными бактериями). Серьезные системные инфекции
(сепсис, пневмония, менингиты) не характерны. ПИД с дефицитом субклас-
сов IgG чаще проявляются с 6-месячного возраста.
При данной патологии возможно отложение иммунных комплексов в
стенках сосудов, что клинически проявляется поражением капиллярной
сети в виде телеангиэктазий, возникающих прежде всего на верхнем веке.
В поздних стадиях сосудистая сеть на верхнем веке пальпируется в виде
нитевидных тяжей.
Дефицит IgG2 может быть изолированным или сочетаться с другими
нарушениями иммунной системы. Характерный признак дефицита IgG2 —
снижение резистентности больных к возбудителям бактериальных инфек-
ций, поражающих преимущественно дыхательные пути и ЛОР-органы
(пневмококкам, Haemophilus influenzae, Pseudomonas aeruginosa). Клинически
иммунодефицит проявляется хронической пневмонией, гнойными отита-
ми. Пневмонии и бронхиты нередко осложняются развитием бронхоэк-
татической болезни. Сочетанный дефицит IgG2 и IgG3 имеет высокую
степень ассоциации с ювенильным сахарным диабетом, идиопатической
тромбоцитопенической пурпурой, СКВ и атопической патологией.
Для селективного дефицита IgGl характерна высокая частота респира-
торных инфекционных заболеваний, наличие атопии, а также врожденные
кардиопатии и аутоиммунные процессы. У некоторых пациентов развива-
ются частые вирусные инфекционные заболевания.
Диагностика
• У пациентов с рецидивирующими респираторными инфекциями и
нормальным уровнем общего IgG необходимо исследовать уровень
субклассов IgG.
• При выявлении дефицита субклассов IgG определяют гуморальный
ответ на вакцины.
• Содержание IgG в сыворотке крови снижено более чем в два раза по
сравнению с нормой для данного возраста. Для детей наиболее харак-
терно снижение уровня IgG2, особенно в сочетании со слабым ответом
на полисахаридные антигены, для взрослых — снижение уровня IgG3.
• Ввиду волнообразных колебаний концентрации иммуноглобулинов
при иммунокомплексной патологии однократное исследование может
выявить как дефицит IgG или пангипоиммуноглобулинемию, так и
нормальное или повышенное содержание IgG. Именно поэтому, оце-
нивая концентрацию иммуноглобулинов, необходимо учитывать фазу
течения заболевания и активность его клинических проявлений, а
также повторно определять подклассы иммуноглобулинов.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 293
Лечение
Пациенты с бессимптомным течением не нуждаются в постоянном
лечении. При возникновении респираторных инфекционных заболеваний
необходимо раннее применение антибиотиков. Дефицит субклассов IgG
не служит показанием к заместительной терапии иммуноглобулинами. У
некоторых детей дефицит субклассов IgG может восстанавливаться спон-
танно, особенно при частичном отсутствии субкласса. Однако у пациентов
с клиническими проявлениями возможно прогрессирование заболевания
вплоть до развития ОВИН. Пациентам необходимо ежегодно проводить
мониторирование субклассов IgG.
11.2.2.6. ДЕФИЦИТ СПЕЦИФИЧЕСКИХ АНТИТЕЛ С НОРМАЛЬНОЙ
КОНЦЕНТРАЦИЕЙ ИММУНОГЛОБУЛИНОВ
Для дефицитов специфических антител (SAD; англ. Specific Antibody
Deficiency) характерны нормальная концентрация иммуноглобулинов и
субклассов IgG и нарушенный гуморальный IgG-ответ на большинство
полисахаридных антигенов, а также повышенный риск развития рецидиви-
рующих бактериальных инфекционных заболеваний у детей старше 2 лет.
Считают, что дефицит специфических антител — наиболее характерный
иммунодефицит детей, страдающих повышенной чувствительностью к
инфекционным заболеваниям.
Механизмы развития
До настоящего времени природа синдрома неизвестна. Тем не менее
есть некоторые доказательства генных нарушений и связи их с Gm- и
Km-аллотипами IgG. Некоторые исследователи предполагают наличие
дефекта в В-клеточном репертуаре или нарушений в маргинальной зоне
фолликулов селезенки, где происходит взаимодействие дендритных клеток
с В-лимфоцитами. Наличие ассоциации между аллергическими заболева-
ниями и синдромом дефицита специфических антител предполагает, что
эти нарушения отражают наличие иммунной дисрегуляции с нарушениями
ответа на полисахаридные антигены.
Клинические проявления
Больные обычно страдают рецидивирующими бактериальными инфек-
циями органов дыхания и ЛОР-органов (например, синуситами, отитами,
бронхитами). Менее характерны такие заболевания, как пневмония, сепсис
или менингит. У пациентов развивается хотя бы одно аллергическое забо-
левание (чаще всего — аллергический ринит). Обычно пациенты нормаль-
но растут и развиваются.
Диагностика
Характерен слабый ответ на полисахаридные антигены (например, пнев-
мококка) на фоне нормального уровня сывороточных иммуноглобулинов
и субклассов IgG. Иммунный ответ на дифтерийный и столбнячный анти-
ген нормальный. Иммунный ответ на отдельные серотипы пневмококков
ГЛАВА 11
ЧАСТЬ 2
294 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
оценивают по концентрации поствакцинальных антител (ответ считают
адекватным при их концентрации 1,3 г/л и выше или при 4-кратном воз-
растании титра антител). У пациентов, иммунизированных поливалентной
пневмококковой конъюгированной вакциной, важно измерять гумораль-
ный ответ против как минимум 6 серотипов, содержащихся в этой вакци-
не. Интерпретация ответов на иммунизацию полисахаридами зависит от
ряда факторов: у детей до 2 лет иммунный ответ не оценивают; пациенты
в возрасте 2-5 лет отвечают на 50% или больше типов пневмококковых
антигенов; дети старше 5 лет отвечают на 70% серотипов пневмококков.
Детям младшего школьного возраста рекомендуют повторить исследование
специфических антител с интервалом в один год, так как показатели могут
спонтанно восстановиться до нормы. У взрослых необходимо проводить
наблюдение в динамике, так как возможно прогрессирование заболевания
и развитие ОВИН.
Лечение
Пациентам с синдромом селективного дефицита антител необходимо
проводить курс профилактической антибиотикотерапии каждые 6 мес. В
случае персистирования инфекции необходима заместительная терапия
иммуноглобулинами.
11.2.2.7. ТРАНЗИТОРНАЯ ГИПОГАММАГЛОБУЛИНЕМИЯ ДЕТЕЙ РАННЕГО
ВОЗРАСТА
Заболевание впервые было описано в 1956 г. Оно характеризуется гипо-
гаммаглобулинемией вследствие нарушения образования IgG у детей ран-
него возраста и диагностируется после исчезновения материнских транс-
плацентарных IgG. Транзиторная гипогаммаглобулинемия сохраняется у
детей с 6 мес до 2-3 лет. Уровень IgG при этом снижен в два раза по сравне-
нию с возрастной нормой при нормальных или сниженных показателях IgA
и IgM. У детей в возрасте 4-7 мес возникает физиологическая гипогамма-
глобулинемия, когда уровень материнских IgG снижается, а скорость син-
теза собственных иммуноглобулинов еще недостаточна и достигает нормы
только к 2-3 годам. Ранее для характеристики этого состояния использо-
вали термин «медленный иммунологический старт». Следует отметить, что
транзиторную гипогаммаглобулинемию чаще выявляют у детей, в семьях
которых были случаи иммунодефицитов. Возникает этот вид иммунодефи-
цита у мальчиков и девочек с одинаковой частотой.
Механизмы развития
Генетическая основа транзиторной гипогаммаглобулинемии до сих пор
неизвестна. Предполагают, что имеет место дефицит Т-хелперов или нару-
шение баланса цитокинов.
Клинические проявления
У некоторых младенцев с транзиторной гипогаммаглобулинемией симп-
томы не проявляются. Они нормально отвечают на антигены вакцин и спу-
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 295
стя несколько лет «перерастают» гипогаммаглобулинемию. У других детей
выявляют рецидивирующие бактериальные инфекционные заболевания
начиная с первого месяца жизни. В среднем у 50% таких детей диагноз
устанавливают к 6-12 мес жизни. Основные клинические проявления —
бактериальные инфекции верхних дыхательных путей (например, средний
отит, синуситы). Пневмония, менингит, сепсис развиваются редко. У неко-
торых детей выявляют рецидивирующую диарею, тяжелые формы ветря-
ной оспы, длительно сохраняющийся оральный кандидоз. У большинства
детей развиваются аллергические заболевания, включая бронхиальную
астму, атопический дерматит, пищевую аллергию. Лимфатические узлы и
миндалины у таких детей гипоплазированы. В целом дети нормально растут
и развиваются.
Диагностика
• Уровень сывороточных IgA и IgG обычно снижен. Уровень IgG ниже
2,0 г/л выявляют у 50% пациентов.
• Уровень IgM чаще в норме или повышен.
• Содержание циркулирующих В-лимфоцитов в норме.
• В периферической крови выявляют нейтропению и реже тромбоцито-
пению.
• Образование специфических антител обычно сохранно, и пациенты
способны синтезировать специфические антитела против антигенов
АВО-групп крови (изогемагглютинины) и некоторых белков (дифте-
рийный и столбнячный анатоксин), но на респираторные вирусы ответ
может быть снижен.
В основном окончательный диагноз можно поставить лишь ретроспек-
тивно. Поскольку окончательная постановка диагноза иммунодефицита
возможна только к 2-3 годам, за такими детьми необходимо постоянно
наблюдать в динамике, чтобы дифференцировать диагноз транзиторной
гипогаммаглобулинемии от других иммунодефицитов, включая ОВИН.
По достижении ребенком возраста 5 лет станет окончательно ясно, что
ранее у него была транзиторная гипогаммаглобулинемия. У большин-
ства детей симптомы транзиторной гипогаммаглобулинемии исчезают к
2-3 годам.
Повторно определять уровни иммуноглобулинов необходимо с интерва-
лом 6-12 мес, пока не восстановятся нормальные показатели.
Лечение
Транзиторная гипогаммаглобулинемия детей раннего возраста — это
отклонения, восстанавливающиеся в период между 18-м и 36-м месяцем
жизни. Заболевание, протекающее бессимптомно, лечения не требует.
При симптоматической форме применяют общеукрепляющую и анти-
микробную терапию в соответствии с чувствительностью возбудителя.
Если у пациентов возникают рецидивирующие бактериальные инфекции,
то в качестве превентивной терапии необходимо применять антибиотики,
ГЛАВА 11
ЧАСТЬ 2
296 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
особенно в сезон, когда учащаются респираторные инфекционные заболе-
вания. Пациентам, у которых респираторные инфекции возникают часто и
протекают тяжело или рефрактерно, помимо антибиотикотерапии, назна-
чают внутривенные иммуноглобулины по 400-500 мг/кг каждые 3-4 нед
в течение сезона. Заместительную терапию нужно начинать спустя 3-6 мес
после того, как начнут клинически проявляться нарушения гуморального
иммунного ответа. Показано, что короткий курс заместительный терапии
иммуноглобулинами не подавляет образование специфических антител.
У большинства детей иммунитет восстанавливается на 2-м году жизни.
Поскольку транзиторная гипогаммаглобулинемия заканчивается чаще
самопроизвольным выздоровлением, патогенетической иммунокоррекции
не требуется. Лечение инфекционных заболеваний проводят по стандартам
соответствующих нозологий. В целом прогноз транзиторной гипогаммагло-
булинемии благоприятен.
11.2.3. Группа 3. Синдромы иммунодефицитов с хорошо
охарактеризованными клиническими признаками
(табл. 11-8)
В данную группу четко очерченных синдромов иммунодефицитов входят
заболевания, имеющие типичную симптоматику, позволяющую диагности-
ровать эти иммунодефициты в первую очередь по клинической картине.
Основные положения
• Механизмы репарации ДНК играют ключевую роль в созревании
иммунной системы. В отсутствие геномной стабильности не только
нарушено созревание лимфоцитов и изменяются их функции, но и воз-
никают нарушения других систем.
• Причина синдрома Ди Джорджи — хромосомная делеция 22qll. У
пациентов не развиваются тимус, паратиреоидные железы. Клеточный
иммунодефицит сопровождается врожденными аномалиями и гипо-
кальциемией.
• Синдром Вискотта-Олдрича (WAS) — Х-сцепленное нарушение, обу-
словленное дефектом цитоскелета. У пациентов выявляют персистиру-
ющую тромбоцитопению, развиваются экзема, клеточный и гумораль-
ный иммунодефицит и аутоиммунные реакции; для этой патологии
характерно наличие тромбоцитов небольшого размера.
• Dinep-IgE-синдром обусловлен нарушениями цитокинов и проявляет-
ся рецидивирующими кожными абсцессами, пневмонией и повыше-
нием уровня IgE в сыворотке. Отмечают и другие дефекты, например
деформацию скелета.
Таблица 11-8. Синдромы иммунодефицитов с ясно очерченными клиническими признаками [Yeganeh М. et al., 2008]
Заболевание Т-лимфоциты В-лим- фоциты Иммуноглобулины Связанные особенности Наследование Дефекты генов
1. Синдром Вискотта-Олдрича Прогрессирую- щее снижение В норме i IgM, часто i IgA и IgE, снижение синтеза антител к полисахаридам Тромбоцитопения, экзема, лимфома, ауто- иммунные заболевания, IgA-нефропатия, бакте- риальные и вирусные инфекционные забо- левания Х-сцепленное Мутации в WASP, дефекты в гемопоэтиче- ских стволовых клетках
2. Дефекты репара- ции ДНК (отличные от группы 1): а) Атаксия- телеангиэктазия Прогрессирую- щее снижение В норме Часто 1 IgA, IgE, i lgG-субклассов, TlgM-мономеров, вариабельное снижение уровней специфических антител Атаксия, телеангиэкта- зия, ?а-фетопротеина, лимфоретикулярные и другие малигнизации повышение чувстви- тельности к радиации, хромосомная неста- бильность Аутосомно- рецессивное Мутации в ATM, нару- шения в клеточном цикле и удвоении ДНК: нарушение контроля клеточного цикла в критических точках; 11q22.33
б) Нарушения, подобные атаксии- телеангиэктазии Прогрессирую- щее снижение В норме Часто i IgA, i IgE, i lgG-субклассов. T IgM-мономеров Средней тяжести атак- сия. повышение радио- чувствительности Аутосомно- рецессивное Гипоморфные мутации в MRE11: нарушения в клеточном цикле и удвоении ДНК
с) Синдром Неймеген Прогрессирую- щее снижение В норме Гипогаммаглобу- линемия; дефицит специфического гуморального ответа; повышение уровня IgM Микроцефалия, измене- ние лицевого скелета по типу «птичьего лица», высокая чувствитель- ность к бактериальным вирусным, оппортуни- стическим инфекциям Аутосомно- рецессивное Повреждения в гене NBS1', ген кодирует белок нибрин, при- нимающий участие в репарации ДНК; 8q21
3. Тимические дефекты: а) Синдром Ди Джорджи (полный) Снижение или отсутствие CD3* Т-клеток (меньше 50 в мкл) В норме В норме или i Наличие подтвержден- ной атимии. гипокаль- циемии и дефектов со стороны сердца De novo или АД Мутации в гене транс- крибирующего фактора ТВХ1; синдром делеции 22q11.2
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 297
1Л V9VUJ
Заболевание Т-лимфоциты В-лим- фоциты Иммуноглобулины
б) Синдром Ди Джорджи (частич- ный) Снижение числа CD3* Т-клеток меньше 500 в мкл в течение первых 3 лет жизни В норме В норме или X
4. Иммунокостная дисплазия; хряще- волосяная гипо- плазия i или в норме В норме
5. Гипер-lgE- синдром В норме В норме ? IgE (обычно выше 2000 МЕ/мл)
6. Хронический кожно-слизистый кандидоз В норме В норме В норме
ЧАСТЬ 2
Продолжение табл. 11-8
Связанные особенности Наследование Дефекты генов
Гипопаротироидизм, правая позиция сердца, дефекты лица, гипо- кальциемия гипоплазия тимуса
Карликовость АР Нарушения в гене RMRP\ поврежден РНК-компонент мито- хондриальной РНК- процессирующей эндо- рибонуклеазы; 9р13
Повторные кожные абсцессы и пневмонии (S aureus), пневмато- целе, экзема, кандидоз ногтей, изменения лица, задержка роста зубов, повышенное растяже- ние связок АД, АР, спора- дически, de novo Хромосома 4, мутации STAT3
Хронический кожно- слизистый кандидоз, усиление гиперчувстви- тельности к Candida, аутоиммунитет АД, АР, спора- дически При АР форме воз- никают мутации в гене 21q22.3 При АД форме возни- кают мутации в 15-сМ регионе хромосомы 2р
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Окончание табл. 11-8
Заболевание Т-лимфоциты В-лим- фоциты Иммуноглобулины Связанные особенности Наследование Дефекты генов
7. Синдром Хойераал- Хрейдарсона Прогрессирую- щее снижение Прогрес- сирую- щее сни- жение Вариабельно Задержка роста плода, поражение костного мозга, микроцефалия, неврологические нару- шения, панцитопения, уменьшение количества и ослабление функций NK-клеток Х-сцепленное Мутации в Dyskerin
АД — аутосомно-доминантный: АР — аутосомно-рецессивный.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ
1Л V9VUJ
ЧАСТЬ 2
300 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Для иммунокостной дисплазии характерна связь иммунодефицита с
нарушениями скелета. Имеются различные дефекты гуморального и
клеточного иммунитета.
• Хронический кожно-слизистый кандидоз — повышенная чувствитель-
ность к грибковой инфекции врожденного аутосомно-доминантного или
рецессивного типа. Возбудитель — преимущественно Candida albicans.
• Синдром Нетертона (Nethertori) характеризуется инвагинальным три-
хорексисом, атопическим дерматитом и экземой, высоким уровнем
IgE, ангиоотеком и иммунодефицитом.
• Синдром Хойераал-Хрейдарсона (Hoyeraal-Hreidarssori), описанный
соответственно авторами в 1970 и 1988 гг., характеризуется гипоплазией
мозжечка, психомоторной задержкой развития, микроцефалией, нару-
шением роста и прогрессивной панцитопенией, нарушениями костного
мозга. Ряд авторов рассматривает данный синдром как тяжелый вари-
ант врожденного дискератоза. Синдром врожденного дискератоза —
редкий генодерматоз с мультисистемными нарушениями, причиной
которого является врожденный дефект теломеразного комплекса. Для
него характерно поражение кожи (пойкилодерма), дистрофия ногтей,
лейкоплакия языка и слизистой оболочки полости рта. Кроме того, у
пациентов резко повышен риск развития апластической анемии, миело-
дисплазии и малигнизации. Синдром врожденного дискератоза впервые
описан в 1906 г. Цинссером (Zinsser), затем в 1926 г. Энгменом (Engman)
и в 1930 г. Коулом (Cole) и назван по имени этих авторов.
11.2.3.1. АТАКСИЯ-ТЕЛЕАНГИЭКТАЗИЯ (СИНДРОМ ЛУИ-БАР)
ПИД с прогрессивной церебральной нейродегенерацией. Заболевание
было открыто в 1941 г. французским невропатологом Д. Луи-Бар, описав-
шей историю болезни девочки в возрасте 9 лет с прогрессирующей мозжеч-
ковой атаксией, умственной отсталостью и кожно-глазными телеангиэкта-
зиями. Заболевание полиорганное и характеризуется, помимо мозжечковой
атаксии, телеангиэктазиями, повторными бронхолегочными инфекциями,
повышенной чувствительностью к радиации. В 1995 г. был картирован ген,
расположенный на длинном плече хромосомы 11. Продукт этого гена —
белок ATM, вовлекаемый в контроль клеточного роста, распознавание
клеткой поврежденной ДНК и ее репарацию или блокирование клеточно-
го цикла в таких клетках. Заболевание выявляют с одинаковой частотой
у мальчиков и девочек (1:500 000-1:1 000 000). У большинства больных
увеличено количество циркулирующих Т-клеток с преобладанием незре-
лых Т-лимфоцитов. Помимо этого, у пациентов часто выявляют феномен
слияния теломер в Т-лимфоцитах, являющийся причиной хромосомной
нестабильности клеток и, как следствие, превращения их в опухолевые.
Нарушение репарации ДНК у больных атаксией-телеангиэктазией снижает
устойчивость клеток к радиации и повышает риск малигнизации.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 301
Клинические проявления
Манифестирует в раннем детском возрасте, однако диагностируется
это заболевание чаще всего в возрасте 5-7 лет. В первые месяцы жизни у
больных детей обнаруживают признаки иммунной недостаточности в виде
склонности к респираторным инфекциям и поражению органов дыхания,
синуситам, отитам и т.д. При атаксии-телеангиэктазии выявляют также
поражения ЦНС, лимфоидной и эндокринной систем, кожи, органов пище-
варения. Выделяют следующие основные клинические симптомы:
• прогрессирующую мозжечковую атаксию, возникающую чаще в воз-
расте 1-2 лет. У больных детей выявляют неустойчивую походку,
неловкие и неуверенные движения, частые спотыкания и падения.
При выполнении пальце-носовой и пяточно-коленной пробы наблю-
дают интенционное дрожание. Мозжечковая атаксия сопровождается
гипотонией мышц, а в далеко зашедших стадиях — атрофией мышц
конечностей; глазодвигательная атаксия возникает рано и проявляется
в нарушении способности писать и читать;
• телеангиэктазии мелких сосудов, расположенных в конъюнктивах глаз-
ных яблок, на веках, ушных раковинах, скулах, крыльях носа, в межло-
паточной области и т.д. При гистологическом исследовании телеангиэк-
тазии можно обнаружить на мягкой мозговой оболочке и мозжечке;
• повторные инфекционные заболевания дыхательных путей, синуситы.
Заболевания принимают хронический характер и сопровождаются
бронхоэктазами, дыхательной недостаточностью.
Почти у 50% детей с атаксией-телеангиэктазией выявляют отклонения
в ЦНС: заторможенность, нарушения когнитивных функций, особенно
внимания и памяти, умственное отставание. У детей развиваются речевые
расстройства: речь невнятная, замедленная, с элементами скандирования.
Поражение подкорковых ядер проявляется в виде гиперкинезов, навязчи-
вого гримасничанья. При внешнем осмотре следует обратить внимание на
позу больного ребенка: голова и плечи опущены, руки немного согнуты в
локтевых суставах и ротированы наружу. Дети малоподвижны, с бедной
мимикой, вплоть до амимии. У больных развиваются нарушения функций
черепных нервов, а именно: глазодвигательного, отводящего, зрительного,
тройничного, лицевого, языкоглоточного.
Кожа у больных сухая, тонкая, шероховатая на ощупь, легкоранимая. В
углах губ постоянно сохраняются трещины, чему способствует повышенная
саливация. Часто возникает экзема. Характерно наличие на коже лица и
туловища пятен цвета «кофе с молоком». Наряду с этим выявляют призна-
ки нарушений пигментного обмена в виде участков депигментации на коже
и ранней седины. На лице, шее и ладонях возможно появление фолликуляр-
ного кератоза, что придает детям вид «старичков». Ногти имеют слоистое
строение и повышенную ломкость. Практически у всех больных выявляют
дефекты десен и зубов, серый цвет эмали, множественный кариес.
ГЛАВА 11
ЧАСТЬ 2
302 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Иммунные проявления при атаксии-телеангиэктазии. Иммунные
изменения при атаксии-телеангиэктазии крайне варьируют и характе-
ризуются гетерогенностью. Т-лимфопения сопровождается нарушением
функциональных свойств клеток в реакциях бласттрансформации на
антигены и митогены. У большинства больных существенно снижены
уровни сывороточных IgA, тогда как содержание иммуноглобулинов дру-
гих классов может быть в пределах нормы. Выявляют гипоплазию тиму-
са, лимфатических узлов, селезенки. Выработка специфических антител
дефектна. Более чем у половины детей имеются умеренные изменения
в иммунной системе или вовсе отсутствует иммунодефицит, хотя под
влиянием многочисленных факторов у них могут развиваться проявления
иммунной недостаточности.
Гипоплазия, а в некоторых случаях аплазия тимуса послужили осно-
ванием для применения нового оригинального способа лечения больных
атаксией-телеангиэктазией, основанного на трансплантации тимуса в
комплексе с грудиной и разработанного отечественным хирургом —
профессором Ю.И. Морозовым. В 1970-х годах на базе отделения ПИД
55-й клинической больницы Москвы и кафедры иммунологии 2-го
Московского медицинского института им. Н.И. Пирогова под руковод-
ством академиков Ю.М. Лопухина и Р.В. Петрова впервые были проведе-
ны операции по трансплантации неонатального комплекса тимус-грудина
детям с синдромом Луи-Бар. После операции у большинства больных
повышалась функциональная активность тимусзависимых лимфоцитов,
однако часто трансплантат отторгался. В одном случае был выявлен кле-
точный химеризм.
У детей с синдромом атаксии-телеангиэктазии постепенно развиваются
изменения в иммунной системе, характерные для старческого возраста.
Отечественные ученые сформулировали концепцию преждевременного
старения иммунной системы, в основу которой положены наблюдения за
иммунными процессами у больных атаксией-телеангиэктазией [Петров Р.В.,
Ковальчук Л.В., 1982].
Уникальная особенность иммунной системы больных атаксией-
телеангиэктазией состоит в том, что в сыворотке у них выявляют
а-фетопротеин, характерный для эмбрионального периода развития чело-
века и для больных первичным раком печени. Известно, что а-фетопротеин
обладает мощными иммуносупрессивными свойствами, возможно, за счет
активации регуляторных Т-клеток.
Лечение
Для лечения атаксии-телеангиэктазии применяют заместительную тера-
пию иммуноглобулинами, гормонами тимуса, а также по показаниям
используют антибиотики широкого спектра действия, противогрибковые
препараты, иммунотропные лекарственные средства.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 303
Рис. 11-5. Врожденный иммунодефицит. Атаксия-телеангиэктазия. Собственные наблю-
дения (пациентке 16 лет).
ГЛАВА 11
Прогноз
Прогноз для жизни относительно неблагоприятный. В среднем пациенты
доживают до 14-20 лет. Основные причины смерти — опухоли, в основном
лимфоидного происхождения: лимфома, лимфогранулематоз, а также лей-
коз, ретикулосаркома. У больных выявляют высокую предрасположенность
к развитию злокачественных новообразований. Помимо злокачественных
новообразований, причинами смерти могут быть тяжелые инфекционные
заболевания с полиорганной недостаточностью.
11.2.3.2. СИНДРОМ НЕЙМЕГЕН
Синдром описан в 1981 г. С. Вимаесом (С. Weemaes etdl.) и назван в честь
города в Нидерландах, где был обнаружен первый больной. В настоящее
время синдром Неймеген отнесен к группе хорошо распознаваемых ПИД, а
более конкретно — к подгруппе заболеваний с нарушением репараций ДНК.
Установлены дефекты гена NBS1, который кодирует синтез белка нибрина
(хромосома 8q.21)9 участвующего в репарации двухцепочечных разрывов
ДНК и регуляции клеточного цикла. Хромосомная нестабильность включа-
ет специфические транслокации, часто выявляемые между локусами генов
иммуноглобулинов и TCR на хромосомах 7 и 14. Подобные транслокации
характерны для больных атаксией-телеангиэктазией и пациентов с синдро-
мом, подобным атаксии-телеангиэктазии.
Больные высокорадиочувствительны, у них высок риск малигнизации,
выявляется иммунодефицит (гипогаммаглобулинемия, дефицит синтеза
специфических антител и повышенный уровень IgM) и нарушение роста.
У пациентов клинически выражены микроцефалия, изменение лицевого
скелета по типу «птичьего лица», для них характерна высокая чувствитель-
ность к бактериальным, вирусным, оппортунистическим инфекциям. У
некоторых больных на коже имеются пятна типа «кофе с молоком».
ЧАСТЬ 2
304 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
При лечении больных используют внутривенные иммуноглобулины
(ВВИГ), противомикробные, противовирусные и противогрибковые пре-
параты.
11.2.3.3. СИНДРОМ ВИСКОТТА-ОЛДРИЧА
В своей классической форме синдром Вискотта-Олдрича (англ. Wiskott-
Aldrich Syndrome — WAS) — ПИД, характеризующийся склонностью к кро-
вотечениям (по причине уменьшения количества тромбоцитов), экземой
и повышенной чувствительностью к инфекционным заболеваниям. Кроме
того, у больных повышен риск малигнизации (включая возникновение
лимфомы и лейкоза) и развития аутоиммунных заболеваний. Синдром
выявляют с частотой 1:250 000; болеют только мальчики.
Синдром описан в 1937 г. немецким педиатром А. Вискоттом (впервые
сообщил о трех больных братьях) и в 1954 г. педиатром из США Р. Олдричем
(доказал наследование по Х-сцепленному рецессивному пути).
Причина развития синдрома — мутации в структуре гена, отвечающего
за выработку белка синдрома Вискотта-Олдрича (англ. Wiskott-Aldrich
Syndrome Protein — WASP). Ген WASP расположен на коротком плече
Х-хромосомы (Хр 11.22). Выявление причинного гена дает возможность
идентифицировать его внутриутробно в клетках, полученных путем амнио-
центеза, или в ворсинках хориона.
Мутации в гене WASP разнообразны (больше 200 мутаций в виде замен,
вставок, делеций) и до конца не изучены. У больных выявляют нарушения
передачи сигналов, миграции и организации иммунных взаимодействий
клеток. В Т-лимфоцитах, дендритных клетках и фагоцитах выявляют
повреждения цитоскелета. В последние годы обнаружено, что белок син-
дрома Вискотта-Олдрича играет важную роль в активирующей и супрес-
сорной функции регуляторных CD4+ CD25+Т-клеток, нарушение функцио-
нальной активности которых может привести к развитию аутоиммунных
заболеваний у пациентов. Отмечают усиленное разрушение тромбоцитов в
селезенке. В периферической крови больных при электронной микроско-
пии выявляют так называемые лысые лимфоциты; кроме того, диагности-
руют врожденный дефект тромбоцитов и тромбоцитопению.
Клинические проявления
Начинаются с первых месяцев жизни и характеризуются триадой симп-
томов:
• геморрагическими проявлениями вследствие тромбоцитопении: кро-
вотечениями из пупочной ранки, кефалогематомой, меленой, пете-
хиями, экхимозами, макро- и микрогематурией. Эти проявления
возникают первыми и являются диагностически значимыми. В более
старшем возрасте возникают носовые и/или кишечные кровотечения
и развивается постгеморрагическая анемия;
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 305
• дерматитом, возникающим практически одновременно с геморра-
гическими проявлениями и манифестирующим в виде атопического
дерматита разной степени тяжести — от локализованной до распро-
страненной формы;
• инфекционными заболеваниями: бактериальными (стафилококки,
пневмококки, стрептококки, синегнойная палочка, Escherichia colt),
вирусными (вирусы герпеса, ротавирусы), грибковыми (кандиды,
аспергиллы). У больных детей развиваются тяжелые пневмонии,
отиты, синуситы, менингиты, сепсис.
У 40% больных выявляют аутоиммунные заболевания (васкулиты,
артриты, гломерулонефрит, гемолитическую анемию и др.). С возрастом,
особенно у детей старше 8 лет, значительно возрастает риск развития
онкопатологии. У больных с классическим синдромом Вискотта-Олдрича
в 13% случаев выявляют лимфому, ассоциированную в основном с вирусом
Эпштейна-Барр.
Следует отметить, что клиническая симптоматика существенно варьиру-
ет. Так, у некоторых больных могут развиваться все три классических прояв-
ления: тромбоцитопения и кровотечения, иммунодефицит и инфекционные
заболевания, экзема, а у других только тромбоцитопения. Аутоиммунные
нарушения при синдроме Вискотта-Олдрича включают гемолитическую
анемию, васкулиты, пурпуру Шенлейна-Геноха, полиартрит, гломеруло-
нефрит и колиты. Отмечаются и другие, реже встречающиеся аутоиммун-
ные заболевания, такие, как нейтропения, дерматомиозит, увеиты и реци-
дивирующие ангиоотеки. Малигнизация обычно происходит у подростков
или взрослых пациентов с классическим синдромом Вискотта-Олдрича. В
основном это В-клеточные лимфомы.
Заболевание имеет разные фенотипы и широкий спектр клинических
проявлений. Следует проводить дифференциальную диагностику синдрома
Вискотта-Олдрича у каждого мальчика с кровотечениями, связанными с
врожденной или рано возникшей тромбоцитопенией и малыми размерами
тромбоцитов. Наличие экземы подтверждает диагноз (табл. 11-9).
Лечение
В настоящее время получены обнадеживающие результаты при транс-
плантации аллогенного костного мозга или стволовых клеток, что продле-
вало жизнь и улучшало качество жизни пациентов. Почти у 70% больных,
получающих гемопоэтические стволовые клетки, выживаемость составляет
больше 5 лет. В лечении используют также спленэктомию, внутривенное
введение иммуноглобулинов, антибиотикотерапию.
Прогноз для жизни неблагоприятный. Причинами смерти могут быть
тяжелые инфекционные заболевания, несовместимые с жизнью кровотече-
ния, малигнизация.
ГЛАВА 11
306 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 11-9. Клинические фенотипы, связанные с мутациями гена WASP [Yeganeh М
et al., 2008]
Фенотип Синдром Вискотта-Олдрича Х-сцепленная тромбоцитопения Интермиттирующая Х-сцепленная тромбоцитопения Х-сцепленная нейтропения
Тромбоцитопения Да Да Да Нет
Малый размер тромбоцитов Да Да Да Нет
Экзема Да Возможна Нет Нет
Иммунодефицит Да Возможен Нет Нет
Инфекционные заболевания Да Возможны Нет Типичны
Аутоиммунные заболевания и/или малигиизация Часто Возможны Нет Нет
Врожденная нейтро- пения Нет Нет Нет Да
Экспрессия WASP- белка Нет Есть но снижена В норме В норме
11.2.3.4. СИНДРОМ ДИ ДЖОРДЖИ
Заболевание впервые описал американский педиатр и эндокринолог
Анджело Мария Ди Джорджи в 1965 г. как врожденное отсутствие тимуса
и паращитовидных желез. Для синдрома Ди Джорджи (DiGeorge) характер-
на триада клинических симптомов: многочисленные врожденные дефекты,
иммунодефицит и гипокальциемия. Заболевание выявляют с частотой 1:4000-
1:6000 в равной пропорции у мальчиков и девочек. В результате мутации
стволовые клетки не дифференцируются в Т-лимфоциты. Иными словами, это
изолированный Т-клеточный иммунодефицит. Способность к синтезу антител
у больных сохранена, но на более низком уровне. К настоящему времени уста-
новлено, что генетический дефект связан с хромосомой 22. Наиболее общая
причина синдрома — гемизиготная делеция хромосомы 22qlL2, выявляемая
приблизительно у 90% больных с синдромом Ди Джорджи.
Самый ранний симптом заболевания — судорожный синдром, воз-
никающий в первые дни после рождения вследствие гипокальциемии.
Судороги могут послужить причиной ранней смерти ребенка. Характерны
тяжело протекающие бактериальные инфекционные заболевания, напри-
мер некротическая пневмония, пиелонефрит, колит, сепсис. Данный имму-
нодефицит можно диагностировать при рождении ребенка, если выявляют
совокупность следующих симптомов:
• судорожного синдрома (дисфункция паращитовидных желез);
• врожденного порока сердца и магистральных сосудов (тетрада Фалло,
декстрапозиция аорты);
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 307
• аномалий лица (антимонголоидный разрез глаз, гипоплазия нижней
челюсти, низкое расположение и заостренность ушных раковин);
• гипоплазии или аплазии тимуса, отсутствия тени тимуса при рентгено-
графии грудной клетки;
• множественных пороков развития;
• неонатальную гипокальциемию.
Известны частичный и полный синдром Ди Джорджи (табл. 11-10).
ГЛАВА 11
Таблица 11-10. Диагностические критерии частичного и полного синдрома Ди Джорджи
Тип синдрома Диагностическая категория Описание
Частичный синдром Ди Джорджи Характерно В течение первых 3 лет жизни содержание CD3* Т-клеток в крови ниже 500/мм3; пороки сердца и/или гипокальциемия. Возможно, связан с делецией 22q11.2
Вероятно В течение первых 3 лет жизни содержание CD3* Т-клеток в крови ниже 1500/мм3; делеция хромо- сомы 22q 11.2
Вполне возможно В течение первых 3 лет жизни содержание CD3* Т-клеток в крови ниже 1500/мм3, связано с поро- ком сердца, гипокальциемией или дисморфизмом лица и нёба
Полный синдром Ди Джорджи Характерно Снижение/отсутствие CD3* Т-клеток в крови (меньше 50/мм3), диагностированное отсутствие тимуса, гипо- кальциемия, пороки сердца
При гистологическом исследовании лимфоидных органов выявляют
аплазию либо гипоплазию тимуса, опустошение Т-зависимых зон в селезен-
ке и лимфатических узлах.
Лечение
Выбирают в зависимости от степени тяжести синдрома:
• трансплантацию фетального тимуса;
• лечение инфекционной патологии;
• посиндромное лечение.
Прогноз для жизни чаще неблагоприятный. Если ребенок доживает до
5-летнего возраста, то может произойти купирование иммунологических
нарушений.
11.2.3.5. ГИПЕР-1дЕ-СИНДР0М
Dmep-IgE-синдром относят к редким ПИД, которые характеризуются
классической триадой:
• рецидивирующими абсцессами кожи;
• пневмонией с формированием пневматоцеле;
• повышением уровня IgE в сыворотке крови выше 2000 МЕ/мл.
ЧАСТЬ 2
308 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Впервые rnnep-IgE-синдром описали в 1966 г. американский педиатр
С. Девис и соавт. у двух девушек с рыжими волосами, хроническим дермати-
том, рецидивирующими стафилококковыми абсцессами и пневмонией. Авто-
ры назвали заболевание в честь многострадального терпеливого библейско-
го Иова (англ. Job), чье тело сатана покрыл гнойниками. В литературе гипер-
IgE-синдром также называют синдромом Джоба (другой перевод —«терпели-
вый человек»). В типичных случаях rHnep-IgE-синдром наследуется либо как
аутосомно-доминантное, либо как спорадическое заболевание. При рецессив-
ном наследовании клинические проявления синдрома отличаются.
Молекулярные дефекты rHnep-IgE-синдрома до конца не ясны.
Предполагают роль гомозиготных делеций в гене TYK2, кодирующем
тирозинкиназу-2 человека (Тук-2). Тук-2 — нерецепторная тирозинкина-
за, принадлежащая к семейству Janus-киназ (Jak). Дефицит Тук-2 служит
причиной дефектов сигнального пути цитокинов, включая интерфероны
типа I, ИЛ-6, ИЛ-10, ИЛ-12, ИЛ-23, а также нарушение ответа Thl-клеток
и повышение чувствительности пациентов к заболеваниям, вызываемым
вирусами, грибами и микобактериями. Роль Тук-2 показана при аутосомно-
рецессивной форме гипер-^Е-синдрома. У пациентов с доминантным
наследованием и спорадическими формами доказана роль мутаций в гене
STAT3, приводящих к дисморфогенезу и мультисистемным нарушениям.
Клинические проявления
ninep-IgE-синдром — мультисистемное заболевание, проявляющееся с
раннего возраста. От типа наследования зависят особенности клинических
проявлений. Основной отличительный признак — повышенное содер-
жание IgE в сыворотке крови, которое может достигать 40 000 МЕ/мл.
Клинические проявления характеризуются рецидивирующими гнойными
инфекциями мягких тканей и внутренних органов. С раннего детства воз-
никают глубокие повторные гнойные инфекционные поражения кожи и
подкожной клетчатки, протекающие как «холодные» абсцессы, т.е. без
явных признаков воспаления. У 50% больных развиваются гнойные лим-
фадениты, гнойные отиты; наиболее опасно развитие острой пневмонии,
поскольку это может привести к повреждению легких и возникновению
пневмоторакса. На рентгенограмме выявляют «легочные буллы» или
пневматоцеле, зачастую множественные. Возможно появление абсцессов
печени, как при хронической гранулематозной болезни (ХГБ). При бак-
териологическом исследовании чаще всего высевают стафилококки, реже
стрептококки, пневмококки и грибы Candida albicans.
Заболевание может манифестировать начиная с первых недель жизни.
Оно проявляется экземой кожи с поражением лица, разгибательных поверх-
ностей конечностей и напоминает атопический дерматит. К 3-летнему воз-
расту проявления ослабевают, но могут сохраняться сухость и шелушение
кожи. При осмотре больных выявляют грубые диспластические изменения
лица в виде седловидной переносицы, увеличения размеров нижней челю-
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 309
сти, выступающих скул, «картофелеобразного» носа. Пациенты склонны к
спонтанным переломам трубчатых костей.
Клинические и лабораторные проявления гипер-1§Е-синдрома у
пациентов с аутосомно-доминантным/спорадическим типом насле-
дования
• Кожа: экзема, сыпь у новорожденных, «холодные» абсцессы, кожно-
слизистый кандидоз.
• Легкие: рецидивирующая пневмония, пневматоцеле.
• Изменения лица: «грубое» лицо, глубоко посажанные глаза, выступаю-
щий подбородок, широкий нос.
• Зубы: нарушение роста зубов.
• Опорно-двигательный аппарат: повышенное растяжение связок, пато-
логические переломы, сколиоз.
Лабораторные данные: наиболее характерны повышение уровня сыво-
роточного IgE, эозинофилия.
Возбудителями инфекционных заболеваний чаще выступают стафилококки.
Наследование гипер-IgE синдрома по аутосомно-рецессивному типу
обусловливает появление клинических симптомов, отличающихся от при-
веденных классических проявлений (табл. 11-11).
В иммунограмме выявляют гипериммуноглобулинемию Е выше
2000 МЕ/мл. Исследование необходимо повторять неоднократно, так как
в некоторых пробах содержание IgE может быть меньше 1000 МЕ/мл.
Поскольку для данного заболевания характерна эозинофилия, следует
неоднократно определять уровень эозинофилов в периферической крови.
Кожные пробы с аллергенами обычно положительны.
Таблица 11-11. Сравнение клинических проявлений гипер-1дЕ-синдрома с разным типом
наследования (доминантным, рецессивным)
ГЛАВА 11
Клинические проявления Аутосомно-доминантный гипер-1дЕ-синдром Аутосомно-рецессивный гипер-1дЕ-синдром
Экзема Да Да
Кожные абсцессы (рецидивирующие) Да Да
Повторные пневмонии Да Да
Пневматоцеле Да Нет
Неврологические симптомы Нет Да
Васкулиты Нет Да
Вирусные инфекции Нет Да
Деформация скелета Да Нет
Повышенное растяжение связок Да Нет
Задержка первичных зубов Да Нет
ЧАСТЬ 2
310 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Лечение
Этиотропная терапия не разработана. Лечение носит симптоматический
характер. Необходима пожизненная профилактическая антибиотикоте-
рапия. Прогноз для жизни сравнительно благоприятный, пациенты могут
доживать до 18-20 лет.
11.2.3.6. ХРОНИЧЕСКИЙ КОЖНО-СЛИЗИСТЫЙ КАНДИДОЗ
До настоящего времени характер генетического дефекта не установлен. У
пациентов выявляют весьма частые поражения кожи и слизистых оболочек
Candida albicans, В 50% случаев обнаруживают сочетание с аутоиммунной
полиэндокринопатией в виде патологии паращитовидных, щитовидной,
половых желез, гипофиза.
Заболевание клинически проявляется с первых месяцев жизни в виде
упорного кандидоза слизистой оболочки ротовой полости, рецидивирую-
щего на протяжении всей жизни больного. Одновременно возникает гриб-
ковый дерматит, сохраняющийся у детей в среднем до 3-летнего возраста.
У больных детей часто развивается онихомикоз, возникающий в возра-
сте 1-2 лет, при этом ногтевые пластины деформируются, появляется их
поперечная исчерченность. Важная особенность заболевания — отсутствие
глубоких микозов внутренних органов. В то же время характерно при-
соединение бактериальной инфекции и возникновение пневмоний, отитов,
гайморитов, остеомиелита.
В возрасте 4-10 лет у больных детей могут возникать тяжелые эндо-
кринные нарушения, затрагивающие паращитовидные железы. Развивается
гипопаратиреоз, клинически проявляющийся внезапными мышечными
болями и тетаническими судорогами. При этом выявляют снижение уровня
кальция в сыворотке крови, замедление свертывания крови. У некоторых
детей с возрастом развивается диффузный остеопороз. Помимо нарушений
со стороны паращитовидных желез, может развиваться надпочечниковая
недостаточность.
При пальпации часто обнаруживают гиперплазию лимфатических узлов
в шейной и подчелюстной группах, сохраняющуюся на протяжении всей
жизни. Лицо ребенка изменено за счет седловидной переносицы; харак-
терно истончение волос. В поведении детей обращает на себя внимание
заторможенность, а также отставание в психическом и интеллектуальном
развитии.
Лечение
Применяют современные антифунгицидные средства в течение длитель-
ного времени, а также внутривенные иммуноглобулины для профилактики
инфекционных осложнений.
Прогноз для жизни сравнительно благоприятный. Причинами смерти
могут быть хронический гепатит (25% случаев), а также сепсис и тяжелые
инфекционные заболевания.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 311
Рис. 11-6. Хронический кожно-слизистый
кандидоз. (Собственные наблюдения. Фото
сделано с согласия родителей. Ребенку 3 г.
8 мес. Наблюдается с 4-месячного воз-
раста.)
Рис. 11-7. Хронический кожно-слизистый
кандидоз. (Собственные наблюдения.
Ребенку 3 г. 8 мес.)
ГЛАВА 11
11.2.4. Группа 4. Генетические нарушения регуляции
иммунитета
Одна из основных задач иммунной системы — защита от патогенов.
Антимикробный иммунный ответ — высокодинамичный процесс, в кото-
рый вовлекаются клетки иммунной системы, растворимые медиаторы,
антимикробные факторы и др. Нарушения регуляции иммунного ответа
могут вызвать различные клинические проявления, включая лимфопро-
лиферацию, фебрильный воспалительный ответ и аутоиммунные реакции.
В большинстве случаев триггерами этих процессов служат инфекции.
Молекулярные и клеточные механизмы, отвечающие за нарушение регуля-
ции иммунитета, варьируют при разных формах ПИД. Иммунодефициты,
связанные с иммунной дисрегуляцией, включают дефицит антител,
Т-клеточный дефицит, дефект фагоцитов и комплемента. Однако выявлены
ЧАСТЬ 2
312 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
некоторые синдромы иммунодефицитов, при которых иммунная дисрегу-
ляция играет основную роль:
• семейный гемофагоцитарный синдром;
• иммунодефициты с гипопигментацией;
• Х-сцепленный лимфопролиферативный синдром;
• аутоиммунный лимфопролиферативный синдром;
• синдром APECED (аутоиммунная полиэндокринопатия с кандидозом и
эктодермальной дистрофией);
• синдром ТРЕХ (Х-сцепленные иммунодисрегуляция, полиэндокрино-
патия, энтеропатия).
Основные положения
• При многих ПИД выявляют повышенную чувствительность к инфек-
ционным заболеваниям и иммунную дисрегуляцию.
• При некоторых ПИД, вызываемых иммунной дисрегуляцией, отсут-
ствует повышенная чувствительность к инфекциям.
• Патофизиологическая особенность семейного гемофагоцитарного
лимфогистиоцитоза (ГФЛГ) — нарушение клеточной цитотоксично-
сти. Клиническая картина возникает в результате избыточной актива-
ции иммунной системы, а не вследствие неконтролируемой инфекции.
• Синдром Чедиака-Хигаси, синдром Грисцелли II типа, синдром
Германски-Пудлака, дефицит р14 — аутосомно-рецессивные заболева-
ния с гипопигментацией кожи и роговицы и различными симптомами
иммунодефицитов.
• Х-сцепленный лимфопролиферативный синдром имеет 3 основных
клинических проявления: фульминантный инфекционный монону-
клеоз, дисгаммаглобулинемию и лимфому. Триггером данного заболе-
вания обычно служит вирус Эпштейна-Барр. До инфицирования им
симптомы могут не проявляться.
• Аутоиммунный лимфопролиферативный синдром (АЛПС) — доброка-
чественное лимфопролиферативное заболевание, причиной которого
служит дефект апоптоза периферических лимфоцитов. Основные кли-
нические проявления — лимфопролиферация и аутоиммунные заболе-
вания, особенно аутоиммунная цитопения.
• Типичные проявления аутоиммунной полиэндокринопатии с кан-
дидозом и эктодермальной дистрофией (APECED; англ. Autoimmune
Polyendocrinopathy with Candidiasis and Ectodermal Dystrophy) — хрониче-
ский или рецидивирующий кожно-слизистый кандидоз, гипопарати-
реоидизм и адренокортикальные нарушения. Патогенетическая основа
APECED — нарушение развития иммунной толерантности в тимусе в
результате мутации гена, кодирующего белок AIRE (англ. Autoimmune
Regulator),
• Синдром иммунодисрегуляции, полиэндокринопатии, энтеропатии,
Х-сцепленный (IPEX; англ. Immune disregulation, Polyendocrinopathy,
Таблица 11-12. Генетические нарушения регуляции иммунитета [Speckmann С. et al., 2008]
Заболевание Т-лимфоциты В-лимфоциты Иммуноглобулины Ассоциированные особенности Наследование Дефект гена
Иммунодефициты с гипопигментацией
Синдром Чедиака-Хигаси В норме В норме В норме Частичный альбинизм снижение активности NK-клеток и цитотоксиче- ских Т-лимфоцитов АР Дефект гена LYST. нарушение лизосо- мального трафика; 1q42-q43
Синдром Грисцелли, II тип В норме В норме В норме 1 CD8* Т-клеток, X NK-клеток - Дефект гена RAB27A
Синдром Германски- Пудлака В норме - - - АР -
Х-сцепленный лимфопролиферативный синдром
Х-сцепленный лим- фопролифератив- ный синдром CD4 J. CD8 Т Уменьшение CD27* В-клеток памяти IgE 1 IgA относительное повышение IgM относительное повашение. Гипогаммаглобули- немия Фульминантный инфек- ционный мононуклеоз, лимфомы, панцитопения, кровотечения, васкулит Х-сцепленное Дефект в гене SH2D1A и белке SAP: Xq25
Аутоиммунный лимфопролиферативный синдром (АЛПО)
АЛ ПС, тип la (дефи- цит CD95) TCD4, CD8 В норме Гипергаммаглобу- линемия Т ИЛ-10 ТИЛ-4 ТИЛ-5 Т ИФН-у ТИЛ-2 АД, АР Дефект гена Fas-рецептора (TNFRSF6); дефект медиатора апоптоза CD95; 10q23-q24.1
АЛПС, тип lb (дефи- цит CD95L) То же То же То же То же АД, АР Дефект гена Fas- лиганда, дефект гена TNFRSF6: 1q23
АЛПС, тип На (де- фицит каспазы-10) То же То же То же То же АД Дефект гена CASP10, 2q33-q34
АЛПС, тип НЬ (де- фицит каспазы-8) То же То же То же То же АД Дефект гена CASP8
АД — аутосомно-доминантный; АР — аутосомно-рецессивный.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 313
Ц V8VUJ
ЧАСТЬ 2
314 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Enteropathy X-linked) вызывается мутацией гена FOXP3, играющего
центральную роль в дифференцировке и функционировании регуля-
торных CD4+CD25+Т-лимфоцитов. Синдром IPEX обычно манифести-
рует у мальчиков в течение первого года жизни в виде тяжелой диареи,
экземы с сахарным диабетом и/или других эндокринопатий.
11.2.4.1. СЕМЕЙНЫЙ ГЕМОФАГОЦИТАРНЫЙ ЛИМФ0ГИСТИ0ЦИТ03
Семейный гемофагоцитарный лимфогистиоцитоз (FHL; англ. Familial
Hemophagocytic Lymphohistiocytosis) — группа генетически детерминирован-
ных заболеваний с аутосомно-рецессивным типом наследования, причиной
развития которых служит неконтролируемая пролиферация активирован-
ных лимфоцитов и гистиоцитов, секретирующих в большом количестве
провоспалительные цитокины. Симптомы этого заболевания впервые опи-
саны в 1952 г. и включают длительную лихорадку, гепатоспленомегалию,
панцитопению, неврологические симптомы.
В настоящее время описаны четыре формы заболевания, для трех из
которых определены «виновные» гены, ответственные за синтез белков,
которые участвуют в опосредуемой CD8+ Т- и NK-клетками цитотоксич-
ности. Эти гены кодируют перфорин, Munc 13-4 и Syntaxin 11 и экспрес-
сируются в NK-клетках и ЦТЛ. Известно, что перфорин — белок, встраи-
вающийся в липидный бислой мембраны клетки-мишени и запускающий
ее гибель, в частности, через активацию апоптоза. Цитотоксичность, зави-
сящая от перфорина, играет важную роль в поддержании Т-клеточного
гомеостаза. Эти механизмы используются и NK-клетками, что приводит к
контролю репликации патогенов в инфицированных тканях, но при этом и
к элиминации АПК. В результате подобных процессов снижается уровень
антигенной стимуляции Т-клеток, вследствие чего большинство эффектор-
ных Т-лимфоцитов погибает. Также страдает пул Т-клеток памяти, опо-
средующих повторный ответ на антиген. Пролонгированная стимуляция от
АПК и нарушения контроля за патогенами приводят к неконтролируемой
экспансии и персистенции активированных ЦТЛ (рис. 11-8).
Неконтролируемая секреция цитокинов активированными ЦТЛ и
NK-клетками приводит к избыточному воспалению, характеризующемуся
гемофагоцитарным лимфогистиоцитозом. В эксперименте показано, что
при дефиците перфорина основной цитокин, вовлекаемый в патологию, —
ИФН-у. Он оказывает токсическое действие на гемопоэтические клетки,
что приводит к цитопении. Цитокин также служит основным активатором
макрофагов и инфильтрации тканей макрофагами. При этом ИФН-у уве-
личивает их фагоцитарную активность — ключевую особенность данной
патологии.
Клинические проявления
Заболевание у 85% пациентов манифестирует на первом году жизни,
причем у 70% в возрасте до 6 мес. У большинства пациентов болезнь начи-
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 315
ГЛАВА 11
ЦТЛ или NK-клетки
Рис. 11-8. Патогенез дефекта цитотоксических процессов [Speckmann С. et al., 2008].
Перфорин (FHL от англ. Familial hemophagocytic lymphohistiocytosis) — семейный гемо-
фагоцитарный лимфогистиоцитоз. Известны четыре формы заболевания FHL 1-4, из
них в трех случаях идентифицированы гены. FHL-2 вызывается мутацией в гене, коди-
рующем перфорин. Мипс 13-4 (FHL3) — ген MUNC 13-4 экспрессируется в NK-клетках
и ЦТЛ, мутация в котором вызывает FHL 3-го типа. Дефицит р14 — р14-адаптерная
молекула, которая, возможно, играет основную роль в контроле эндосомального ком-
партмента. Дефицит р14 ведет к снижению цитотоксической активности ЦТЛ, нарушению
В-клеточной дифференцировки, хронической нейтропении. LYST (CHS) — ген LYST (от
англ. Lysosomal Trafficking Regulator), кодирующий белок CHS (от англ. Chediak-Higashi
Syndrome). Дефект гена ведет к формированию увеличенных в размерах гранул секре-
торных лизосом. Секреторные лизосомы — это клеточные органеллы, вовлекаемые в
перемещение и экзоцитоз внутриклеточных белков. STX11 — ген-синтаксин 11. RAB27A
(GS II) — ген RAB27A, кодирующий белок, который необходим для движения гранул
секреторных лизосом из микротрубочек центра к клеточной мембране. Мутации в гене
являются причиной синдрома Грисцелли 2-го типа. АРЗ₽1 (HPS II) — ген АРЗВ1, коди-
рующий |3-субъединицу АР-3 эндосомального адаптерного белка. Мутации в гене АРЗВ1
вызывают синдром Германски-Пудлака. МТОС (от англ. Microtubule organizing center) —
микротубулярный центр. Гранулы движутся вдоль микротрубочек из центра к клеточной
мембране.
ЧАСТЬ 2
316 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
нается с высокой лихорадки, не отвечающей на антибиотикотерапию, часто
в сочетании с бледностью кожных покровов, рвотой, потерей массы тела.
Гепатоспленомегалию и лимфаденопатию выявляют у 30% пациентов. У
некоторых больных возникают отеки, пурпура, кровотечения и неспеци-
фическая кожная сыпь. Неврологическая симптоматика, которая может
появиться в любой период заболевания, проявляется раздражительностью,
выбуханием родничка, гипер- или гипотонией, вплоть до комы.
Диагностика
Диагностические критерии включают восемь основных признаков, при-
чем для подтверждения диагноза необходимо обнаружить у больного не
менее пяти из перечисленных критериев:
• лихорадку;
• спленомегалию;
• цитопению (содержание нейтрофилов в крови меньше 1000/мкл,
тромбоцитов — меньше 100 000/мкл);
• гипертриглицеридемию и/или гипофибриногенемию;
• гемофагоцитоз в костном мозге, селезенке, лимфатических узлах;
• снижение активности NK-клеток;
• содержание ферритина в сыворотке крови больше 500 нг/мл;
• содержание растворимых молекул CD25 больше 2400 U/мкл.
Генетический анализ помогает установить диагноз.
Лечение
При лечении используют фармакотерапию (антитимоцитарный гло-
булин, циклоспорин А, дексаметазон), трансплантацию стволовых гемо-
поэтических клеток. Для купирования симптомов заболевания применяют
антимикробные препараты.
Прогноз
Пациенты обычно погибают в течение 1-го года жизни.
11.2.4.2. ИММУНОДЕФИЦИТЫ С ГИПОПИГМЕНТАЦИЕЙ
Секреторные лизосомы — клеточные органеллы, вовлекаемые в транс-
порт и эндоцитоз внутриклеточных белков. Они играют важную роль в
клетках разных типов, включая меланоциты, нервные клетки, тромбоциты,
гранулоциты, тучные клетки, NK- и Т-лимфоциты. Генетические дефекты
белков, вовлекаемых в лизосомальный транспорт, широко варьируют, обу-
словливая развитие заболеваний с поражением разных органов и систем.
У больных выявляют дерматологические, гематологические, иммунные
нарушения, а также нарушения гемостаза.
Сравнительная характеристика отдельных форм иммунодефици-
тов с гипопигментацией
В целом, клинические проявления генетических нарушений иммунной
регуляции крайне вариабельны. Выраженность альбинизма варьирует
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 317
от уменьшения пигментации кожи и волос до тяжелой гипопигментации
кожи и глаз с одновременными симптомами фотофобии и нистагмом.
Отмечают также кровотечения, неврологические нарушения, прогресси-
рующую задержку умственного развития, периферические нейропатии.
Пациенты чувствительны к пиогенным инфекционным заболеваниям. У
пациентов с синдромом Грисцелли II более выражена гипопигментация,
часто выявляют серый цвет волос, «светящуюся» кожу. Дефекты тромбо-
цитов не характерны.
У пациентов с синдромом Германски-Пудлака также гипопигменти-
рована кожа и склера; кроме того, у них наблюдается тенденция к кровоте-
чениям, дисморфизм лица, задержка развития, фиброз легких, нейтропения
и повышенная частота бактериальных инфекций. У больных с дефицитом
р14, помимо гипопигментации кожи и радужки, отмечают невысокий рост
и рецидивирующие бронхолегочные инфекционные заболевания.
Диагностика. У пациентов с гипопигментацией необходимо заподо-
зрить дефекты лизосомального транспорта. Наличие дисморфизма, кро-
вотечения, задержки развития также характерны для иммунодефицита.
Световая микроскопия выявляет, что в волосах больных нарушено распре-
деление гранул меланина. Длительные кровотечения характерны для боль-
ных с синдромами Чедиака-Хигаси и Германски-Пудлака (табл. 11-13).
Для данных синдромов характерно пониженное содержание NK-клеток и
ЦТЛ либо их полное отсутствие.
Таблица 11-13. Дифференциальная диагностика иммунодефицитов с синдромом гипо-
пигментации кожи и глаз
ГЛАВА 11
Проявление Синдром Грисцелли Синдром Чедиака-Хигаси Синдром Германски-Пудлака II Р14-дефицит
Гипопигментация кожи и глаз 4- +
Иммунодефицит + + + +
Задержка умственного развития - + ± -
Нейтропения - - +
Кровотечения - + -
Лечение
Перспективное направление в лечении генетических нарушений иммун-
ной регуляции — пересадка стволовых клеток. Симптоматическая терапия
включает применение антибактериальных препаратов, гемостатических
методов и средств, а также использование цитокина Г-КСФ при появлении
эпизодов нейтропении.
ЧАСТЬ 2
318 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
11.2.4.3. СИНДРОМ ЧЕДИАКА-ХИГАСИ
Французский врач М. Чедиак в 1952 г. и японский врач О. Хигаси в
1954 г. независимо друг от друга обнаружили генетический дефект, который
назван в их честь. В основе синдрома Чедиака-Хигаси лежит мутация гена
LYST (англ. LYSosomal Traffiking regulator), кодирующего белок синдрома
Чедиака-Хигаси. Этот белок играет ключевую роль в формировании вну-
триклеточных везикул. В клетках больных возникают различные аномалии
лизосомальных белков, включая HLA класса II, CTLA-4, гранзимы и перфо-
рин. Кроме того, с дефектом гена LYST связано формирование увеличенных
в размерах гранул с нарушенными функциями, что влияет на хемотаксис и
киллинг клеток-мишеней. При этом страдает цитотоксическая активность
NK-лимфоцитов и ЦТЛ.
Основные клинические симптомы — частичный (гипопигментация) или
полный альбинизм кожи, волос, глаз. Кожа у таких пациентов чувствитель-
на к солнечному свету. Выявляют светобоязнь, уменьшение слезоотделения,
обесцвечивание радужки, инъецирование сосудов. Больные чувствительны
к вирусным, грибковым, бактериальным инфекционным заболеваниям.
Характерно появление лимфопролиферативных заболеваний в раннем воз-
расте. При обследовании выявляют спленомегалию, возникшую в результа-
те ускоренного разрушения лейкоцитов.
Иммунодиагностика
Определение дефектов фагоцитоза; возможно, NK-клеток и цитотокси-
ческой активности лимфоцитов. Кроме того, обнаруживают гранулоцито-
пению, наличие гигантских азурофильных гранул в лейкоцитах, дающих
положительную реакцию на пероксидазу. Выявление лейкоцитов с подоб-
ными гранулами важно для диагностики синдрома Чедиака-Хигаси.
Лечение
Симптоматическое.
Прогноз
Прогноз для жизни неблагоприятный. Продолжительность жизни боль-
ных детей не превышает 7 лет. Причины гибели — рано возникающие опу-
холи, тяжелые бактериальные инфекции.
11.2.4.4. Х-СЦЕПЛЕННЫЙ ЛИМФОПРОЛИФЕРАТИВНЫЙ СИНДРОМ
Х-сцепленный лимфопролиферативный синдром (Х-ЛПС) — генети-
ческое нарушение иммунной регуляции. Синдром впервые был выявлен в
1969 г. и описан в 1975 г. Д. Пуртильо (D. Purtilo). В литературе его часто
обозначают как синдром Пуртильо или как болезнь Дункан (Dunkan's
disease) по фамилии семьи, в которой он впервые был обнаружен. Выявляют
с частотой 1:1 000 000 у мальчиков в возрасте от 5 мес до 5 лет. В основе
заболевания лежит дефект гена SH2D1A, расположенного на длинном
плече Х-хромосомы (локус Xq25). Мутация, которая возникает в этом
гене, кодирующем синтез белка SAP, в конечном счете приводит к тому,
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 319
что нарушается передача активационного сигнала от В-лимфоцитов, инфи-
цированных вирусом Эпштейна-Барр, к Т-лимфоцитам и NK-клеткам.
В итоге происходит индуцированная вирусом поликлональная активация
В-лимфоцитов и развивается лимфопролиферация. Выделяют два гене-
тических варианта заболевания — Х-сцепленный лимфопролифератив-
ный синдром-1 и Х-сцепленный лимфопролиферативный синдром-2. При
типе 1 выявлена мутация гена SAP, кодирующего белок, который модулиру-
ет передачу внутриклеточного сигнала с рецепторов семейства SLAM (англ.
Signaling Lymphocytic Activation Molecule) в пулах Т-лимфоцитов, NK- и
NKT-клеток. Взаимодействие белков SAP с рецепторами SLAM-семейства
влияет на активацию и взаимодействие Т-, В- и NK-клеток. В этих случаях
нарушается образование цитокинов, цитотоксичность и синтез/секреция
антител. Нарушение цитотоксичности сопровождается пролиферацией
В-лимфоцитов, индуцированной вирусом Эпштейна-Барр, длительной
антигенной презентацией и, соответственно, гиперактивацией ЦТЛ и макро-
фагов. До настоящего времени не ясно, почему триггером Х-сцепленного
лимфопролиферативного синдрома служит именно вирус Эпштейна-Барр.
Х-сцепленный лимфопролиферативный синдром-2 обусловлен мутацией
гена, кодирующего Х-сцепленный ингибитор апоптоза (XIAP). Патогенез
дефицита не ясен. Показано, что лимфоциты пациентов с этим типом син-
дрома отличаются повышенной чувствительностью к апоптозу.
Клинические проявления
Симптомы заболевания на первом году жизни обычно не проявляются.
В типичных случаях манифестация Х-сцепленного лимфопролиферативно-
го синдрома начинается под влиянием инфицирования вирусом Эпштейна-
Барр. Фульминантный инфекционный мононуклеоз выявляют у 50-60%
пациентов, и чаще всего он возникает между 2-м и 3-м годами жизни, но
может манифестировать и в более позднем возрасте. Первые проявления
мононуклеоза такие же, как у пациентов без иммунодефицита (лихорад-
ка, фарингиты, лимфаденопатия и гепатоспленомегалия), но выражены в
более тяжелой форме. В дальнейшем заболевание прогрессирует и развива-
ются тяжелые формы гепатитов, гипоплазии костного мозга с симптомами
тромбоцитопении и анемии, заболевания ЦНС. У каждого третьего паци-
ента с Х-сцепленным лимфопролиферативным синдромом развиваются
лимфомы в возрасте около 5 лет (чаще В-клеточные). В ряде случаев воз-
никают некрозы в печени, что служит прогностически неблагоприятным
фактором. Прогрессирующая поликлональная активация В-лимфоцитов
может вызывать изменения в костном мозге — вытеснение других видов
клеток и развитие цитопении.
В настоящее время выделяют несколько вариантов клинического тече-
ния Х-ЛПС:
• неконтролируемое течение инфекционного мононуклеоза;
• развитие гемоцитопений в виде апластической анемии, агранулоцито-
за, тромбоцитопении, аплазии кроветворения;
ЧАСТЬ 2
320 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• развитие лимфом (неходжкинских или ходжкинских);
• развитие «приобретенной» агаммаглобулинемии или гипоиммуногло-
булинемии с преобладанием IgM.
Диагностика
Основная клиническая особенность — тяжелое течение инфекцион-
ного мононуклеоза, причем после первых 2 нед заболевания у пациентов
развивается прогрессирующая панцитопения и одновременно массивная
инфильтрация лимфоцитами костного мозга, гемофагоцитоз.
Лабораторные исследования: обнаружение вируса Эпштейна-Барр и
антител против его антигенов; гипогаммаглобулинемия с относительным
увеличением уровня IgM и IgA; неспецифическое изменение содержания
лимфоцитов различных фенотипов (повышение уровня CD8+ Т-клеток и
уменьшение — CD27+ В-клеток памяти, нарушение функций NK-клеток).
Для уточнения диагноза необходимо выявить мутации гена SH2DIA.
Однако примерно у 40% больных с Х-сцепленным лимфопролифератив-
ным синдромом таких мутаций нет.
Лечение
Всем пациентам проводят заместительную терапию иммуноглобулина-
ми, назначают противовирусные препараты. Эффективной считают пере-
садку стволовых клеток.
Прогноз
Неблагоприятный: 70% пациентов умирают до 10-летнего возраста, а
при фульминантном инфекционном мононуклеозе в сочетании с некро-
зом печени и аплазией костного мозга летальность достигает 96%. У
20-25% выживших больных с выраженной недостаточностью гуморально-
го иммунитета развиваются лимфомы.
11.2.4.5. АУТОИММУННЫЙ ЛИМФОПРОЛИФЕРАТИВНЫЙ СИНДРОМ
Аутоиммунный лимфопролиферативный синдром — генетически гетеро-
генный синдром, наследуемый по аутосомно-доминантному и аутосомно-
рецессивному типам, но он может быть связан с соматическими мутациями.
Впервые описан в 1967 г. как аутоиммунный лимфопролиферативный
синдром, с 1976 г. отнесен к ПИД. Активное изучение этого синдрома идет
с конца XX в., когда стало понятным, что в его основе лежат механизмы
нарушения апоптоза лимфоцитов [дефект экспрессии мембранных рецеп-
торов Fas (CD95) и Fas-лиганда (FasL; CD 178), определяющих способность
клеток к генетически запрограммированной гибели].
Механизмы развития
В основе аутоиммунного лимфопролиферативного синдрома лежит
мутация генов, вовлекаемых в развитие апоптоза.
CD95 экспрессируется на активированных Т- и В-клетках. Нарушения
процессов апоптоза обусловливают накопление этих клеток и хроническую
гиперплазию лимфоидной ткани. Особенно эти процессы выражены в лим-
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 321
фатических узлах, печени и селезенке. Следует отметить, что большинство
пораженных лимфоцитов — CD4- CD8" арт-клетки. Предполагают, что
ранее это были зрелые активированные ЦТЛ. Затем они утратили способ-
ность экспрессировать корецептор CD8, но стали поликлональными, приоб-
рели экспрессию CDllb, CD45RA, CD57, HLA-DR и начали продуцировать
большое количество ИЛ-10. Эти клетки отвечают за развитие аутоимму-
нитета. В настоящее время с учетом генетических изменений выделяют
несколько вариантов аутоиммунного лимфопролиферативного синдро-
ма, при которых выявляют мутации генов, кодирующих CD95, CD178,
каспазы-8 и -10. Однако общепризнанной классификации пока нет.
Клинические проявления
Симптоматика заболевания вариабельна. Диагноз в основном устанав-
ливают в первые 2-5 лет жизни (вплоть до 15-летнего возраста). Основные
проявления — лимфопролиферация в виде хронической лимфаденопатии и
спленомегалии в сочетании с аутоиммунными нарушениями в виде той или
иной формы аутоиммунной цитопении (анемия, тромбоцитопения, нейтро-
пения). Иногда аутоиммунная цитопения возникает до лимфопролиферации.
Помимо гематологических нарушений, у больных выявляют аутоиммунный
гепатит, увеит, тиреоидит, экзему, гломерулонефрит. Примерно у 10% боль-
ных развивается лимфома, преимущественно В-клеточной природы.
Можно выделить несколько групп клинических признаков аутоиммун-
ного лимфопролиферативного синдрома:
• хроническую незлокачественную лимфопролиферацию. Проявляется с
раннего детства, иногда с 1-го года жизни. Сохраняется дольше 6 мес.
Возникает персистирующее увеличение периферических лимфати-
ческих узлов трех и больше групп. Лимфатические узлы плотные, не
спаяны с подлежащими тканями. Типична гепатоспленомегалия;
• аутоиммунные проявления: гемолитическая анемия, тромбоцитопе-
ния, нейтропения, а также гломерулонефрит, увеит, гепатит, артрит,
васкулит, тиреоидит и др.;
• риск развития злокачественных новообразований разной локализации.
Вследствие дефекта апоптоза, опосредованного через Fas-рецептор,
снижается контроль пролиферации и повышается выживаемость кле-
ток с опухолевой трансформацией (так как ген Fas принадлежит к
опухолевым супрессорам). У больных развиваются Т- и В-лимфомы,
лимфогранулематоз, рак молочной железы, кишечника, легких и др.;
• возможны крапивницы, васкулиты, задержка физического развития.
Диагностика
К основным клиническим диагностическим критериям относят лимфа-
денопатию (незлокачественную) и/или спленомегалию в течение послед-
них 6 мес.
Лабораторные критерии:
• нарушения СВ95-опосредованного апоптоза лимфоцитов in vitro;
• появление в циркуляции больше 1% CD4’CD8" Т-клеток;
ГЛАВА 11
ЧАСТЬ 2
322 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• выявляемые при генетических исследованиях мутации в генах, коди-
рующих CD95, CD178, каспазы-8 и -10. Кроме того, у пациентов с
аутоиммунным лимфопролиферативным синдромом могут выявлять-
ся и другие маркеры заболевания, носящие вспомогательный характер:
маркеры активации Т-клеток (экспрессия HLA-DR, высокий уровень
растворимых молекул CD25), повышение количества CD5+ В-клеток,
гипергаммаглобулинемия, повышение уровня ИЛ-10.
При гистологических исследованиях выявляют фолликулярную
гиперплазию в лимфатических узлах и лимфоидную гиперплазию в белой
пульпе селезенки.
Лечение
В основном носит патогенетический характер (иммуносупрессивная
терапия, глюкокортикоиды, спленэктомия, пересадка стволовых клеток,
введение внутривенных иммуноглобулинов).
Прогноз
Прогноз для жизни неблагоприятен. Пациенты умирают в основном от
сепсиса, развивающегося на фоне спленэктомии, кровотечений и лимфом.
11.2.4.6. Х-СЦЕПЛЕННЫЕ ИММУНОДИСРЕГУЛЯЦИЯ,
ПОЛИЭНДОКРИНОПАТИЯ, ЭНТЕРОПАТИЯ (СИНДРОМ IPEX)
Заболевание впервые описано в 1982 г. К настоящему времени уста-
новлена этиологическая роль дефекта гена FOXP3, экспрессируемого в
основном лимфоидными клетками и тканями (CD4+ Treg). Нарушения
иммунной регуляции, возникающие в результате мутации гена, приводят к
неконтролируемой активации незрелых клеток в тимусе, нарушению спо-
собности иммунной системы подавлять иммунную активацию, опосредуе-
мую через TCR. У пациентов с РОХРЗ-мутацией отмечается так называемая
TCR-гиперотвечаемость на антигены, при этом одновременно снижается
чувствительность клеток к костимулирующим сигналам, что приводит к
спонтанной клеточной пролиферации, дефекту апоптоза и аутоиммунным
нарушениям.
Клинические проявления
Заболевание является Х-сцепленным, проявляется только у мальчиков.
У больного ребенка развивается манифестация заболевания с младенческо-
го возраста. К основным клиническим симптомам относятся гастроинтести-
нальный в виде хронической диареи, инсулинзависимого диабета, начиная
с первого года жизни ребенка; гипо- или гипертиреоидизм; поражение кожи
в виде эритродермии, эксфолиативного дерматита, экземы или дерматита,
подобного псориазу. У пациентов повышена чувствительность к тяжелым
инфекционным заболеваниям, таким, как сепсис, менингит, остеомиелит,
пневмония. Характерны аутоиммунная анемия, тромбоцитопения, нейтро-
пения.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 323
Диагностика
У детей с IPEX-синдромом на фоне хронической диареи при биопсии
тонкого кишечника выявляют лимфоцитарную инфильтрацию подслизи-
стого и слизистого слоев, атрофию ворсинок, язвенные изменения. При
этом у детей обнаруживаются антитела к глиадину. Безглютеиновая диета
не приводит к улучшению состояния и прекращению диареи.
У всех больных присутствуют аутоантитела к инсулину, микросомам,
тироглобулину, эритроцитам, тромбоцитам и др. Часто повышено содер-
жание общего IgE. Методом проточной цитометрии выявляют снижение
числа Treg-клеток (CD4+ CD25+FOXP3+). В анализе крови отмечается ане-
мия, тромбоцитопения, нейтропения, эозинофилия. В основе диагностики
лежит генетический анализ и выявление дефекта гена FOXP3.
Лечение
Для лечения больных с IPEX-синдромом применяется иммуносупрес-
сивная терапия с использованием циклоспорина А, азатиоприна, монокло-
нальных антител (инфликсимаб), стероидов, причем эти средства использу-
ются как в виде монотерапии, так и в комбинации. Посиндромная терапия
включает также трансфузию эритроцитов или тромбоцитов, различные
антимикробные препараты. Лечение кожных проявлений требует примене-
ния топических стероидов, циклоспорина А. Однако применяемые методы
лечения позволяют достигать лишь частичного контроля над заболевани-
ем. Генная терапия не разработана.
Прогноз
Прогноз для жизни благоприятный.
11.2.5. Группа 5. Врожденные дефекты фагоцитов
(табл. 11-14)
ГЛАВА 11
Среди различных врожденных форм иммунной недостаточности рас-
пространены дефекты числа и функций фагоцитов, в частности нарушение
подвижности, хемотаксиса, адгезии, эндоцитоза, киллинга, деградации
фагоцитированных частиц, секреции цитокинов и др. На сегодняшний день
выделяют больше 20 вариантов нозологических форм врожденных дефек-
тов фагоцитоза, включая:
• врожденную Х-сцепленную нейтропению (дефект гена WASP, локус
Xqll.22);
• циклическую нейтропению и наследственный агранулоцитоз (дефект
гена ELA2, локус 19р.13.3);
• дефекты лейкоцитов (дефекты генов ITGB2, RAC2);
• хроническую гранулематозную болезнь (ХГБ) (дефект гена CYBB,
локус Хр21.1; дефект цитохромоксидазы фагоцитов).
324 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 11-14. Врожденные дефекты фагоцитов
Заболевание Дефектные гены Наследование Ассоциированная патология
Тяжелая врожденная ней- тропения (SCN; англ. Severe Congenital Neutropenia) ELA2 АД Миелодисплазия
GFI1 АД В-Я-лимфопения
НАХ1 АР Увеличение уровня иммуногло- булинов
GCSFR АД Г-КСФ-рефрактерная нейтропения
WASP Х-сцепленное Моноцитопения
Циклическая нейтропения ELA2 АД Колебания образования всех типов клеток крови
Дефект лейкоцитарной адгезии (LAD) ITGB2 АР Задержка отпадения пупочного канатика, омфалит, кожные язвы, лейкоцитоз
FUCT1 АР Периодонтит, задержка умствен- ного развития
CalDAG-GEFI АР Задержка отпадения пупочного канатика, кожные язвы, крово- течения
RAC-2-дефицит RAC-2 АД Плохое заживление ран, лейко- цитоз
Дефицит р-актина ACTS АД Задержка умственного развития, фоточувствительность
Хроническая гранулематоз- ная болезнь CYBB Х-сцепленное Иммунная дисрегуляция (вос- палительные заболевания кишеч- ника, стриктуры урогенитального тракта, хореоретиниты); синдром McLeod; дискоидная волчанка и оральные язвы (у женщин- носительниц гена)
CYBA АР Болезни иммунной дисрегуляции
NCF1 NCF2 АР Встречаются реже других форм
Дефицит нейтрофильный G-6PD G-6PD Х-сцепленное Гемолитическая анемия
Дефицит миелопероксидазы MPO АР Отсутствие клинических симпто- мов, кандидозы
Дефицит специфических гранул СЕВРЕ АР Двудольное ядро нейтрофилов
Синдром Швахмана-Даймонда SBDS АР Хондродисплазия, панкреатит, агрессивный периодонтит
Локализованный ювениль- ный периодонтит FRP1 АР Упорные периодонтиты
Синдром Папийона-Лефевра CTSC АР Периодонтиты, ладонно- подошвенный гиперкератоз
АД — аутосомно-доминантный; АР — аутосомно-рецессивный.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 325
Основные положения
• Тяжелая врожденная нейтропения — синдром, возникающий в резуль-
тате разнообразных генных дефектов. Есть пациенты с невыясненным
генным дефектом.
• Основная часть алгоритма обследования пациентов с нейтропенией —
подсчет клеток крови и формулы крови дважды в неделю в течение 6 нед.
• У пациентов с плохо заживающими ранами без нагноения возможно
нарушение адгезии лейкоцитов, а также дефицит RAC-2 и др.
• У пациентов с дефектами фагоцитов необходимо обследовать полость
рта и зубы.
• Позднюю манифестацию ХГБ выявляют чаще, чем было принято счи-
тать ранее.
Достижения последних лет в области молекулярной биологии позволили
лучше понимать природу дефектов фагоцитов. Через 50 лет после того, как
Костман описал синдром, названный его именем, были обнаружены генные
мутации этого и других дефектов.
11.2.5.1. ТЯЖЕЛЫЕ ВРОЖДЕННЫЕ НЕЙТРОПЕНИИ
Редко встречающиеся ПИД [(1—2): 1 000 000]. Характеризуются ранни-
ми проявлениями бактериальных инфекций и персистирующей тяжелой
нейтропенией. В 1956 г. это заболевание описал Р. Костман (R. Kostmanri)
в шведской семье, у членов которой возникали тяжелые бактериальные
инфекции на фоне нейтропении, характеризующейся тем, что в стадии
перехода промиелоцитов в миелоциты нарушается созревание нейтрофи-
лов.
Механизм развития
Полного понимания патогенеза и характера генетических дефектов пока
нет. Показано, что это мультигенные нарушения с различными формами
наследования.
Клинические проявления
Рецидивирующие бактериальные инфекционные заболевания — главные
проявления иммунодефицита. Обычно манифестация клинических симпто-
мов начинается в возрасте около 1 года. К наиболее частым проявлениям
относят неглубокие абсцессы, язвы в полости рта, инфекционные пораже-
ния кожи, омфалит, пневмонию, средние отиты. Характерно поочередное
возникновение абсцессов различной локализации, кожно-слизистых про-
явлений, респираторных инфекционных заболеваний и диареи. Частые
афтозные стоматиты и гингивиты приводят к повреждению зубов у детей.
Недавно появились сообщения о неврологических нарушениях в виде
задержки развития и эпилепсии у некоторых больных с мутацией гена
НАХ1. У 20% больных выявляют спленомегалию. Возможно появление
миелодиспластического синдрома и острого миелоидного лейкоза.
ГЛАВА 11
ЧАСТЬ 2
326 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Диагностика
Диагностически важным является наличие нейтропении, связанной с
ранними проявлениями тяжелых и рецидивирующих инфекционных забо-
леваний, включая поверхностные абсцессы и язвы полости рта, гингивиты.
Диагностический критерий тяжелой нейтропении — содержание нейтро-
филов меньше 500/мм3 и одновременное повышение чувствительности к
рецидивирующим бактериальным инфекциям начиная с раннего возраста.
У младенцев нужно исключить иммунную нейтропению путем выявления
антинейтрофильных антител. Такие антитела, опосредующие нейтропении
у новорожденных, образуются не в результате аутоиммунных нарушений,
а обычно имеют материнское происхождение. Подобная нейтропения
у ребенка исчезает в течение первых месяцев жизни. При исследовании
костного мозга пациентов с тяжелой нейтропенией выявляют нарушенное
созревание нейтрофилов из предшественников в ранней стадии (диффе-
ренцировка промиелоцитов в миелоциты). Клеточность обычно нормаль-
ная или слегка снижена, тогда как количество эозинофилов и моноцитов
увеличено. Молекулярные исследования проводятся, чтобы подтвердить
диагноз.
Лечение
Трансплантацию костного мозга проводят только пациентам до
20-летнего возраста. Рекомбинантный Г-КСФ рекомендуют всем пациен-
там, которым не требуется трансплантация костного мозга. Использование
этого фактора значительно улучшает прогноз и качество жизни пациентов.
Более 90% пациентов положительно отвечают на это лечение увеличением
числа нейтрофилов и соответственно уменьшением числа инфекционных
заболеваний (следовательно, и дней госпитализации). Однако у пациен-
тов с мутацией гена, кодирующего рецептор Г-КСФ (G-CSFR), которые не
отвечают на лечение Г-КСФ и у которых продолжаются тяжелые бактери-
альные инфекции, развивается миелодисплазия. В этом случае необходима
пересадка стволовых клеток.
11.2.5.2. ЦИКЛИЧЕСКАЯ НЕЙТРОПЕНИЯ
Заболевание относят к редким формам ПИД с частотой 1:1 000 000. Оно
характеризуется нейтропенией, возникающей каждые 3 нед и сохраняю-
щейся в течение 3-6 сут. Впервые заболевание описано в 1910 г. доктором
Чарльзом Лилем у младенцев с рецидивирующими эпизодами лихорадки,
инфекционным поражением кожи, стоматитами и нейтропенией. У паци-
ентов уровень нейтрофилов колеблется от нормального содержания до
полного отсутствия с периодичностью 21 сут. При полном исчезновении
нейтрофилов резко повышается риск развития инфекционных заболева-
ний. В целом, заболевание имеет благоприятное течение. Для лечения при-
меняют Г-КСФ.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 327
11.2.5.3. ДЕФИЦИТЫ АДГЕЗИИ ЛЕЙКОЦИТОВ
Дефицит адгезии лейкоцитов (LAD; англ. Leukocyte Adhesion Deficiency) —
ПИД, выявляемый с частотой 1:1 000 000 и характеризующийся кожными
язвами, плохо заживающими ранами и рецидивирующими бактериальны-
ми инфекциями. Впервые заболевание описано в 1970-х годах. В настоя-
щее время выделены три генетические формы синдрома дефицита адгезии
лейкоцитов.
У пациентов выявляют аномалии рецепторов необратимой адгезии
CD11/CD18 (интегрины). Так, если на клетке экспрессируется меньше 1%
адгезивных молекул, то у больных развиваются угрожающие жизни инфек-
ционные процессы.
Если экспрессируется до 10% от нормального уровня этих рецепторов,
у детей возможно развитие септицемии, гингивита, периодонтита, некро-
тических поражений кожи, кишечных или перианальных свищей. После
перенесенного фурункулеза остаются шрамы, обусловленные выраженным
дефицитом инфильтрации раны фагоцитами.
Механизм развития
В норме при воспалении происходит накопление лейкоцитов в зоне
поражения благодаря трансмиграции этих клеток из крови через эндоте-
лиальный барьер. Основная проблема дефицита лейкоцитарной адгезии
состоит в том, что лейкоциты не могут покинуть кровеносные сосуды и
мигрировать в зону воспаления (рис. 11-9).
Клинические проявления
Возникают с рождения и характеризуются задержкой отделения пупоч-
ного канатика и развитием омфалита, рецидивирующими затяжными
бактериальными инфекционными поражениями кожи, периодонтитом.
Особенно характерно то, что не формируется гной и плохо заживляются
раны. Наиболее частые возбудители — S. aureus или грамотрицательные
бактерии. При отсутствии адекватного лечения больше 75% пациентов
умирают до 2-летнего возраста.
Диагностика
Сочетание ранних бактериальных инфекций, особенно омфалита, с отсут-
ствием гноя и резко выраженной нейтрофилией (до 50 000-100 000/мкл
при инфицировании патогеном или в пределах 15 000/мкл в отсутствие
инфекции) — диагностический признак для варианта LAD-1. Диагноз под-
тверждают, анализируя экспрессию молекул CD18, CD15a на нейтрофилах.
При лабораторном исследовании в крови выявляют массивный нейтро-
фильный лейкоцитоз до 15 000-75 000 и даже до 100 000 клеток в 1 мкл,
что объясняется неспособностью этих клеток выйти из сосудистого русла
на периферию. Клиническая характеристика синдромов приведена в табли-
це 11-15.
ГЛАВА 11
328 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Воспаление разрешается
и нейтрофилы подвергаются
апоптозу
Фагоцитоз, дегрануляция
и продукция оксидантов
Нейтрофилы созревают
в костном мозге
инфекции
Диапедез
Селектин- Интегрин-
опосредованное опосредованная
продвижение адгезия
Рис. 11-9. Жизненный цикл нейтрофилов, включая фазы миграции в зоны инфекцион-
ного поражения или воспаления. Нейтрофилы развиваются в костном мозге и выходят
в циркуляцию. В зоне воспаления в посткапиллярных венулах адгезия лейкоцитов опо-
средуется селектинами и интегринами. Далее происходит хемотаксическая миграция
нейтрофилов между эндотелиальными клетками базальной мембраны. Затем эти клетки
мигрируют в ткани, зону воспаления, где происходит фагоцитоз бактерий или других
патогенов. В течение нескольких часов или дней нейтрофилы подвергаются апоптозу, а
процесс воспаления купируется [Wintergerst U. et al., 2008].
Таблица 11-15. Клиническая характеристика и лечение синдромов дефицита лейкоцитар-
ной адгезии (LAD-1, LAD-2 и LAD-3)
Тип Характеристика Дефектные молекулы Терапевтические особенности
LAD-1 Задержка отделения пупоч- ного канатика, омфалит, кожные язвы, лейкоцитоз Общая P-цепь интегринов, отсутствие CD18 При острой инфекции назначают антибиотики, трансфузию нейтрофилов
LAD-2 Периодонтит, задержка умственного развития, короткое туловище, лейко- цитоз, группа крови Hh Дефект ГДФ, отсутствие CD15a Антибиотики применяют профилактически, назнача- ют котримоксазол; гигиена полости рта
LAD-3 Сходна с LAD-1, кровоте- чения Нормальная экспрессия CD18, нарушение сродства к лиганду VLA-4 и LFA-1 Сходны с LAD-1
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 329
Лечение
При всех трех генетических типах синдрома дефицита адгезии лимфо-
цитов нужно применять антибиотики. Кроме того, при тяжелых инфек-
ционных заболеваниях используют Г-КСФ, а также стволовые клетки.
В будущем возможна генная терапия, методы которой разрабатываются.
11.2.5.4. ХРОНИЧЕСКАЯ ГРАНУЛЕМАТОЗНАЯ БОЛЕЗНЬ
ХГБ — ПИД, при котором фагоциты не способны генерировать активные
формы кислорода и нарушается «кислородный взрыв», необходимый для
уничтожения бактерий и грибов.
Известно, что цитохром Ь558 в мембране фагоцитов представлен в
форме гетеродимера двух цепей (массой 91 и 22 кДа). При активации
фагоцитов компоненты NADPH-оксидазы в цитоплазме подвергаются
фосфорилированию, мигрируют на поверхность мембраны и связывают
цитохром Ь558. Развитие ХГБ обусловлено дефектами этих молекул.
Х-сцепленная форма заболевания развивается вследствие дефекта цепи
массой 91 кДа. В ряде случаев ХГБ связана с определенной делецией в
коротком плече Х-хромосомы в регионе Хр21. При наследовании ХГБ
по аутосомно-рецессивному типу выявляют дефект цепи массой 22 кДа,
ген которой расположен на хромосоме 16, или нарушение одного из двух
компонентов NADPH-оксидазы — p67phox или p47phox. Наследование
в 70-85% Х-сцепленное (болеют мальчики), в остальных случаях —
аутосомно-рецессивное.
В стимулированных фагоцитах больных выделенный супероксид состав-
ляет 3-38% от нормы. Нейтрофилы больных способны к нормальному
хемотаксису, поглотительная и секреторная активность их сохранена;
основное нарушение при данном дефекте заключается в неспособности
фагоцитов к киллингу. ХГБ называют «болезнью парадоксов», поскольку
наиболее вирулентные возбудители, такие, как пневмококки, Haemophilus
influenzae, обычно не вызывают заболеваний у пациентов с данной пато-
логией. Эти патогены являются каталазонегативными и погибают внутри
фагоцитов в результате некислородного киллинга. В то же время менее
вирулентные каталазопозитивные возбудители, для уничтожения которых
требуется «кислородный взрыв» внутри фагоцитов, для этой категории
больных наиболее опасны.
Клинические проявления
Могут возникать у детей в раннем возрасте (1-1,5 года). Иногда у под-
ростков развиваются гнойные поражения кожи (фурункулы, карбункулы,
абсцессы с медленным прогрессированием). Заболевание, как правило,
проявляется в виде рецидивирующих инфекционных заболеваний, пора-
жающих органы дыхания, кожу, лимфатические узлы, печень, почки и
др. Характерно возникновение лимфаденита, БЦЖита. Помимо этого,
ГЛАВА 11
ЧАСТЬ 2
330 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
у 80-100% больных выявляют абсцессы печени, легких, параректальные
абсцессы. Имеет место гепатоспленомегалия. Отличительная особенность
ХГБ — формирование в любых органах гранулем, содержащих гигантские
многоядерные клетки.
У 70-80% детей может развиваться пневмония в «инкапсулированной»
форме, осложняемой абсцедированием или эмпиемой плевры. Зачастую
встречается аспергиллез органов дыхания. Инфекционные заболевания
пищеварительного тракта протекают тяжело, и у 25% детей сальмонеллез
может привести к летальному исходу.
При ХГБ у 15-30% больных развивается остеомиелит мелких костей
пальцев рук и ног и остеоартрит, вызванный стафилококком или аспергил-
лами. Нередко гранулематозный процесс приводит к утолщению костей,
придавая им вид «вздутых». Гнойный лимфаденит с преимущественным
поражением шейных и подмышечных лимфатических узлов выявляют в
75-100% случаев ХГБ.
Диагностика
Для иммунодиагностики ХГБ используют тесты, помогающие выявить
нарушения фагоцитоза, в частности, с нитросиним тетразолием. В имму-
нограмме выявляют снижение высвобождения супероксида из стимулиро-
ванных фагоцитов до 3-30% от нормы. Помимо фагоцитарных нарушений,
у большинства больных выявляют повышенный уровень сывороточных
иммуноглобулинов (IgA, IgM, IgG).
Лечение
• Пожизненная антибактериальная терапия, в ряде случаев в план лече-
ния дополнительно включают препараты на основе ИФН-у.
• Применение антимикотических препаратов.
• Генная терапия — введение в стволовые клетки костного мозга гена
gp91phox, поврежденного мутацией при ХГБ.
Прогноз
Прогноз для жизни сравнительно благоприятный, особенно когда забо-
левание развилось после 1 года. Пациенты в среднем доживают до 30 лет и
больше. Описаны случаи беременности и родов у пациенток с ХГБ.
11.2.5.5 . ДЕФИЦИТ ГЛЮК030-6-Ф0СФАТДЕГИДР0ГЕНАЗЫ
НЕЙТРОФИЛОВ
Дефицит глюкозо-6-фосфатдегидрогеназы нейтрофилов (Г-6-ФДГ-
дефицит) — наиболее частая форма энзимопатии, обычно служащая при-
чиной несфероцитарной анемии. В 1972 г. М. Купер (М. Cooper) и соавт.
описали заболевание, характеризовавшееся тяжелыми бактериальными
инфекциями и отсутствием глюкозо-6-фосфатдегидрогеназы в лейкоцитах.
Такие лейкоциты оказались неспособными разрушать поглощенные бакте-
рии.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 331
Механизм развития
Заболевание возникает в результате мутации гена, кодирующего глюкозо-
6-фосфатдегидрогеназу на хромосоме Xq28.
Клинические проявления
При тяжелых формах заболевания развиваются абсцессы в разных орга-
нах, тяжелые пневмонии и признаки гемолитической анемии.
Диагностика
Симптомы гемолитической анемии в комбинации с «патологическим»
тестом с нитросиним тетразолием предполагают наличие данной патоло-
гии. Активность глюкозо-6-фосфатдегидрогеназы в эритроцитах и лейко-
цитах определяют флюоресцентным методом.
Лечение
Применяют симптоматическое лечение.
11.2.5.6 . ДЕФИЦИТ МИЕЛОПЕРОКСИДАЗЫ
Дефицит миелопероксидазы — наиболее частый дефект фагоцитов,
выявляемый с частотой 1:4000. Вследствие этого дефицита нарушается
образование фагоцитами гипохлорной кислоты. Впервые описан у больных
с диссеминированным кандидозом, у которых в нейтрофилах и моноцитах
не была выявлена активность лизосомальных ферментов, при этом актив-
ность других гранулосвязанных ферментов оставалась в норме.
Механизмы развития
Миелопероксидаза находится в азурофильных гранулах и катализирует
превращение перекиси водорода (Н2О2) в гипохлорную кислоту (НОС1).
Ген расположен на хромосоме 17q23. Дефицит миелопероксидазы — врож-
денное аутосомно-рецессивное заболевание. Описаны вторичные формы
дефицита миелопероксидазы при тяжелых инфекционных заболеваниях,
сахарном диабете, миелоидной лейкемии, миелодиспластическом синдро-
ме, ходжкинской лимфоме.
Клинические проявления
Больше чем у 95% пациентов с дефицитом миелопероксидазы симптомы
заболевания не проявляются, несмотря на дефекты киллинга нейтрофилов.
При наличии симптоматики выявляют рецидивирующую кандидозную
инфекцию и иногда сахарный диабет. Тяжелые инфекционные поражения
костей, менингиты и сепсис развиваются редко. Антитела, специфичные к
миелопероксидазе, выявляют при некоторых формах васкулитов.
Диагностика
Для подтверждения диагноза определяют дефицит фермента в клетках.
Лечение
Специфического лечения нет. Проводят симптоматическую терапию
противогрибковыми препаратами.
ГЛАВА 11
332 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
11.2.6. Группа 6. Дефекты врожденного иммунитета:
рецепторов и сигнальных компонентов
Основные положения
• Врожденный иммунитет — первая линия защиты от патогенов, обеспе-
чивающая быструю и эффективную защиту за счет преформированных
факторов.
• Toll-подобные рецепторы (TLR) распознают специфические молеку-
лярные области (паттерны) патогенов (бактерий, вирусов, грибов и
др.) (рис. 11-10).
Рис. 11-10. НИЗ-опосредованный врожденный иммунный ответ [Parvaneh N. et al., 2008].
MyD88 — миелоидный фактор дифференцировки 88. Является адаптерным сигнальным
белком. Взаимодействует с TIR-доменами TLR1, TLR2, TLR4, TLR6, TLR7, TLR8, TLR9.
IRAC4 — киназа, ассоциированная с рецептором ИЛ-1. IRF-3, IRF-7 — интерферон, регу-
лирующий факторы 3 и 7. UNC-93B — белок эндоплазматического ретикулума. Играет
ключевую роль в реализации нормального иммунного ответа к вирусам. Связывается с
TLR3, TLR7, TLR8, TLR9.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 333
• Известны ПИД с нарушениями в TLR-сигнальной системе, вызван-
ными дефектами киназы IRAK4, трансмембранного белка эндоплаз-
матического ретикулума UNC-93B (важен для проведения сигналов с
участием TLR3, TLR7, TLR8 и TLR9, вовлеченных в ответ на вирусную
инфекцию), и дефицит TLR3. Эти дефекты обусловливают повы-
шенную чувствительность пациентов к инфекциям (пневмококковой
при дефиците IRAK4 и герпетической при дефицитах UNC93 и TLR3)
(табл. 11-16).
• Ангидротическая эктодермальная дисплазия с иммунодефицитом обу-
словлена дефектами ядерного фактора NF-кВ. При этом также повреж-
дается TLR-сигнальная система.
• Тяжелое течение инфекционного заболевания на фоне слабого воспали-
тельного ответа и отсутствия лихорадки характерно для дефектов TLR.
• Мутации гена хемокинового рецептора CXCR4 вызывают ПИД, сопро-
вождающийся гипогаммаглобулинемией, инфекционными заболева-
ниями, симптомами поражения кожи.
• В последние годы выделяют различные группы генетически обуслов-
ленных дефектов врожденной иммунной системы, например дефекты
TLR-сигнальной системы без эктодермальной дисплазии или с экто-
дермальной дисплазией и изменением чувствительности к микобакте-
риальным заболеваниям, а также другие формы.
Таблица 11-16. Сравнительная характеристика дефектов сигнальной системы Toll-
подобных рецепторов
ГЛАВА 11
Фенотип Ген Локус Наследо- вание Инфекционные заболевания
бактери- альные вирус- ные микобакте- риальные
Без эктодермальной дисплазии IRAK4 12q12 АР 4- - -
UNC-93B 11q13 АР - + (герпес) -
TLR3 4q35 АД - + (герпес) -
С эктодермальной дисплазией NEMO Xq28 Х-связанное + ± +
IKBA 14q13 АД + + +
АД — аутосомно-доминантный; АР — аутосомно-рецессивный.
Клинические проявления
У пациентов первой подгруппы (ШАК4-дефицит) развиваются бакте-
риальные инфекции, вызванные Streptococcus pneumoniae и Staphylococcus
aureus, иногда выделяют Neisseria meningitidis и Shigella sonnei. Проявления
ЧАСТЬ 2
334 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
инфекционных заболеваний выявляют с грудного и раннего детского воз-
раста; часто в виде менингита, артрита, септицемии. Следует отметить, что
лихорадка и другие симптомы воспаления, как правило, слабо выражены
или отсутствуют. Пациенты резистентны к другим инфекционным забо-
леваниям, включая вызываемые микобактериями, вирусами и грибами.
Больше 50% пациентов погибают от инфекции.
Диагностика. Клинически 1ИАК4-дефицит необходимо заподозрить
у больных с тяжелыми инфекционными заболеваниями, протекающи-
ми без лихорадки, при выделении из крови или церебральной жидкости
S. pneumoniae. Одновременно при лабораторном исследовании показатели
воспаления, такие, как СРБ, остаются в норме.
При лечении больных первой группы рекомендуют применять анти-
бактериальную терапию; у больных с нарушенным иммунным ответом на
полисахаридные антигены — заместительную терапию иммуноглобулина-
ми; больным с симптомами герпетической инфекции назначают препараты
ИФН-а и ацикловир.
Больные второй группы с Х-сцепленной эктодермальной дисплазией
(NEMO-дефицит) характеризуются нарушением развития эктодермаль-
ных структур, что проявляется патологией ногтей, гипотрихозом, гипо-
гидрозом, гиподонтией и повреждением зубов. У пациентов выявляют
тяжелые бактериальные инфекционные заболевания респираторного
и пищеварительного трактов, кожи и др. Возникновение септицемии и
менингита возможно начиная с грудного возраста. Характерно выделение
слабопатогенных микобактерий {Mycobacterium kansasii, Mycobacterium
avium, Mycobacterium bovis), К другим возбудителям заболеваниий у паци-
ентов относят S. pneumoniae, S. aureus, Н, influenzae, вирусы (ЦМВ, вирусы
простого герпеса, аденовирусы, папиломавирусы). В отличие от боль-
ных первой группы при мутациях гена NEMO возникают аутоиммунные
нарушения в виде гемолитической анемии, артритов, поражения толстой
кишки.
Диагностика. NEMO-дефицит следует подозревать при наличии симп-
томов эктодермальной дисплазии у больных с тяжелыми инфекционными
заболеваниями, протекающими на фоне нормальной температуры тела
и отсутствия маркеров воспаления. Кроме того, у пациентов развивается
гипогаммаглобулинемия, возникают нарушения NK-клеток.
Лечение. Применяют внутривенные иммуноглобулины, антибиотики
для лечения атипичных микобактериальных инфекций. Другие виды лече-
ния, в частности пересадка стволовых клеток от гаплоидентичного доно-
ра, дают неоднозначные результаты. Вакцинация БЦЖ этим пациентам
противопоказана.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 335
11.2.7. Группа 7. Аутовоспалительные нарушения
Основные положения
• «Аутовоспалительные нарушения» — это недавно введенное обо-
значение, охватывающее группу заболеваний, характеризующихся
рецидивирующим генерализованным воспалением в отсутствие явных
инфекционных или аутоиммунных причин.
• Дисрегуляция врожденной иммунной системы служит причиной вос-
паления из-за нарушений в первую очередь в системе NOD-подобных
рецепторов (NLR).
• Основное последствие большинства этих нарушений — повышенный
риск развития амилоидоза.
• Термин «аутовоспалительные нарушения» первоначально использо-
вался только для обозначения синдрома врожденной периодической
лихорадки. В последние несколько лет в число аутовоспалительных
нарушений включается все больше полигенных/мультисистемных
заболеваний.
• В настоящее время аутовоспалительные заболевания рассматриваются
как последствия дисрегуляции преимущественно врожденного, а не
адаптивного иммунитета. Впервые аутовоспалительные заболевания
были описаны в последние два десятилетия, а открытие генов происхо-
дило начиная с конца 1990-х годов. В настоящее время идет активное
накопление сведений об иммунопатогенезе синдромов, однако многие
вопросы еще остаются малоизученными.
Для всех аутовоспалительных заболеваний характерны периодические
приступы, сопровождающиеся недомоганием, лихорадкой, артритами/
артралгиями, абдоминальными болями и кожной сыпью. Заболевание
начинается чаще в детском или подростковом возрасте. Лабораторные при-
знаки воспаления возникают во время атаки заболевания или в субклини-
ческой стадии.
Перечень аутовоспалительных синдромов постоянно пополняется. Чаще
других упоминают несколько заболеваний (табл. 11-17).
• Семейная средиземноморская лихорадка (FMF; англ. Familial
Mediterranean Fever).
• Синдром гипериммуноглобулинемии D и периодической лихорадки
(HIDS; англ. Hyperlmmunoglobulinemia D and periodic fever Syndrome).
• Периодический синдром, связанный с рецептором фактора некроза
опухоли (TRAPS; англ. TNF Receptor-Associated Periodic Syndrome).
• Семейный холодовой аутовоспалительный синдром (FCAS;
англ. Familial Cold Autoinflammatory Syndrome).
• Пиогенный артрит, гангренозная пиодермия и акне-синдром (PAPA;
англ. Pyogenic Arthritis, Pyoderma gangrenosum and Acne syndrome).
ГЛАВА 11
ЧАСТЬ 2
Таблица 11-17 Краткая характеристика некоторых наследственных периодических лихорадок [Berg S.t Fasth А., 2008]
Особенность Семейная средиземноморская лихорадка Синдром гипериммуноглобу- лимении D Периодический синдром, связанный с рецептором к фактору некроза опухоли Семейный холодовой аутовоспа- лительный синдром Синдром Макла-Уэльса Хронический младенческий мультисистемный воспалительный синдром
Наследование АР АР АД АД АД АД
Этнические особен- ности Средиземноморье В основном Нидерланды, Франция Европа Северная Америка Европа Не выявлены
Хромосомы 16р13 12q24 12р13 1q44 1q44 1q44
Гены MEVF MVK TNFRSF1A CIASI/NALP3 CIASI/NALP3 CIASI/NALP3
Поврежденный белок Пирин Мевалонаткиназа 55 кДа рецептор фактора некроза опухоли Криопирин Криопирин Криопирин
Длительность атаки 12-72ч 3-7 сут Более 7 сут 12-24ч 24-72 ч Длительно
Кожные сыпи Подобная рожистой на ногах Пятнисто- папулезная Мигрирующая сыпь Подобная кра- пивнице Подобная крапив- нице Подобная крапив- нице
Лимфаденопа- тия и гепатосплено- мегалия Спленомегалия Шейная лимфоаде- нопатия Спленомегалия Нет изменений Не характерно Характерно
Органы дыхания Плевриты - Плевриты - - -
Абдоминальные симптомы Перитониты Боли, рвота, диарея Перитониты Тошнота Боли Не характерны
Суставы, связки В основном моно- артриты Артриты, артралгии Артриты, артралгии Артралгия Артриты, артрал- гии Артропатия
Возраст начала В 90% случаев до 20 лет До года Вариабельно; при- близительно 3 года До 6 мес В детстве Новорожденные
Клинические при- знаки - Триггеры — вакци- нация и стресс Периорбиталь- ный отек, миалгия, конъюнктивиты Триггер — холод Снижение слуха, конъюнктивиты Асептический менингит; ухудше- ние слуха
Амилоидоз В 25-40% Не характерен В 10-20% Не характерен В 25% Характерен
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
АД - аутосомно-доминантный: АР - аутосомно-рецессивный.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 337
• Периодические синдромы, связанные с криопирином (CAPS;
англ. Cryopyrin-Associated Periodic Syndromes), включают три различных
заболевания, наследуемых по аутосомно-доминантному типу:
❖ хронический младенческий неврологический, кожный и суставной
синдром (CINCA; англ. Chronic Infantile Neurologic Cutaneous and
Articular syndrome), также известный как неонатальная мульти-
системная воспалительная болезнь (NOMID; англ. Neonatal-Onset
Multisystem Inflammatory Disease);
<> семейный холодовой аутовоспалительный синдром (FCAS), также
известный как семейная холодовая крапивница (FCU; англ. Familial
Cold Urticaria);
О синдром Макла-Уэльса (MWS; Muckle-Wells Syndrome),
11.2.8. Группа 8. Дефициты комплемента
ГЛАВА 11
Основные положения
• Комплемент участвует в распознавании, опсонизации, киллинге и
элиминации микроорганизмов, иммунных комплексов и разрушенных
клеток организма.
• Выделяют три основных пути активации комплемента: классический
(Cl-зависимый); лектиновый (зависимый от MBL); альтернативый
(фактор В, D и пропердинзависимый).
• Дефицит MBL — наиболее частая форма недостаточности компле-
мента.
• Дефицит комплемента относится к редким формам ПИД. Клинически
проявляется рецидивирующими пиогенными инфекциями и/или ауто-
иммунными заболеваниями.
Система комплемента насчитывает более 30 белков, большинство из
которых продуцируется гепатоцитами и циркулирует в неактивных формах.
Некоторые протеины, такие, как Clq, С7 и фактор D, в основном синтези-
руются вне печени (макрофагами, клетками почек). Активация системы
комплемента происходит по классическому (С1-С9), лектиновому или аль-
тернативному пути. Активированные факторы комплемента обладают важ-
ными биологическими функциями, такими, как распознавание, процессинг,
презентация чужеродных молекул, регуляция приобретенного иммунитета,
элиминация иммунных комплексов. Они участвуют в апоптозе, опсони-
зации и усилении фагоцитоза (СЗЬ), усилении реакций нейтрализации
вирусов антителами (Cl, С4), опосредовании высвобождения гистамина
тучными клетками (анафилатоксины СЗа, С4а, С5а), в хемоаттрактантном
действии (СЗа, С5а), активации В-лимфоцитов при взаимодействии их с
дендритными клетками (C3d).
ЧАСТЬ 2
338 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Дефекты компонентов комплемента выявляют у 0,03% общей популя-
ции, за исключением дефицита MBL, который определяют у 3%. Первичные
дефициты комплемента в основном связаны с увеличением чувствительно-
сти к инвазивным инфекциям и с аутоиммунными патологиями. Дефицит
Cl-ингибитора — основного регулятора классического и лектинового пути
активации комплемента — приводит к развитию ангиоотека. У пациентов с
дефицитом разных компонентов комплемента и со снижением активации
СЗ часто возникают рецидивирующие пиогенные инфекции, вызванные
инкапсулированными бактериями (S. pneumoniae, Н. influenza, тип Ь), так
как опсонизация и фагоцитоз служат основными механизмами защиты от
этих патогенов. Для дефицита терминальных компонентов комплемента
(С5-9) характерны рецидивирующие системные инфекции, вызванные
нейссериями, так как элиминация этих бактерий зависит от С5-С9 опосре-
дованного лизиса (табл. 11-18).
11.2.8.1. НАСЛЕДСТВЕННЫЙ АНГИОНЕВРОТИЧЕСКИЙ ОТЕК
Cl-ингибитор контролирует начальную фазу активации комплемента
по классическому пути, прикрепляясь ковалентно к активированным
С1г- и Cls-компонентам, что приводит к диссоциации связи С1 с субстра-
том. Дефект Cl-ингибитора вызывает развитие наследственного ангио-
невротического отека (НАО). Наследование по аутосомно-доминантному
типу.
Клинически заболевание проявляется отеками подкожного и подслизи-
стого слоя, невоспалительными, сопровождающимися дилатацией капил-
ляров и венул, увеличением промежутков между эндотелиальнымим клет-
ками. Отеки могут возникать на лице, конечностях, гениталиях, а также в
респираторном и пищеварительном тракте и носят локальный характер.
Как правило, отеки развиваются внезапно, нарастают в течение 1-2 сут,
затем постепенно разрешаются. При отеках верхних дыхательных путей
могут возникнуть угрожающие жизни состояния, когда появляется чувство
напряжения в горле, отек языка, слизистой оболочки глотки, затруднение
глотания; при отеке гортани — инспираторная одышка. Возникновение
отеков пищеварительного тракта сопровождается ноющими болями, в ряде
случаев — острыми абдоминальными болями.
Диагностика. Для диагностики используют традиционный СН50-метод,
основанный на гемолизе эритроцитов барана, метод ИФА, иммунохимиче-
ские тесты, генетические методы.
Манифестация генного дефекта возможна начиная с детского возраста.
Триггерными факторами клинических атак наследственного ангионевро-
тического отека могут быть экстракция зубов, тонзиллэктомия, травмы,
действие холода, влияние сдавливающей одежды (джинсы, плавки и т.п.),
операции, а также другие воздействия.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 339
ГЛАВА 11
Таблица 11-18. Характеристика первичных дефицитов комплемента [Mahmoudi М. et al.,
2008]
Компоненты комплемента Дефицитный фактор Гены Тип наследования Ассоциированные патологии
Классический путь C1q С1г Cis C1Q C1R C1S АР АР АР Системная красная волчанка, рев- матоидные и инфекционные забо- левания
С4 С4А С4В АР АР Системная красная волчанка, рев- матоидные и инфекционные забо- левания
С2 С2 АР Системная красная волчанка, васку- литы, полимиозиты, инфекционные заболевания
Лектиновый путь MBL MBL2 АР Пиогенные инфекции
MASP2 MASP2 АР Пиогенные инфекции, системная красная волчанка
Альтернативный путь Фактор D CFD АР Инфекция нейссериальная
Пропердин PFC Х-сцепленное Инфекция нейссериальная
СЗ СЗ СЗ АР Рецидивирующие пиогенные инфек- ции, гломерулонефриты
Мембрано- атакующий комплекс С5 С5 АР Нейссерии, системная красная вол- чанка
С6 С6 АР Нейссерии. системная красная вол- чанка
С7 С7 АР Нейссерии, системная красная вол- чанка, васкулиты
С8а С8а АР Нейссерии, системная красная вол- чанка
С8Ь С8$ АР Нейссерии, системная красная вол- чанка
С9 С9 АР Нейссерии, системная красная вол- чанка
Регуляторные протеины С1-ингибитор C11NH АД Наследственный ангиоотек
Фактор I CFI АР Рецидивирующие пиогенные инфек- ции
Фактор Н CFH АР Гемолитико-уремический синдром, мембранопролиферативный гломе- рулонефрит
CD46 CD46 (МСР) АР Гемолитико-уремический синдром, гломерулонефриты
CD59 CD59 АР Гемолизирующие пиогенные инфек- ции
CD18 ITGB2 АР Некротические проявления, омфали- ты, дефицит лейкоцитарной адгезии тип I
АД — аутосомно-доминантный; АР — аутосомно-рецессивный.
ЧАСТЬ 2
340 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
В настоящее время разработаны эффективные методы лечения и про-
филактики наследственного ангионевротического отека. Прежде
всего это препараты, повышающие уровень Cl-ингибитора. С этой целью
используют андрогены (даназол, станазол р). При отсутствии препаратов
рекомендуют антифибринолитические агенты (е-аминокапроновая кис-
лота). Во время атаки, а также перед планируемыми операциями можно
использовать свежезамороженную плазму. Существуют лекарственные
средства на основе рекомбинантного Cl-ингибитора. Следует отметить,
что блокаторы Hj-рецепторов гистамина и глюкокортикоиды у больных с
наследственным ангионевротическим отеком неэффективны.
При лечении различных форм дефицита комплемента применяют симп-
томатическую терапию, при лечении инфекционных заболеваний — анти-
бактериальную терапию и вакцинацию пневмококковой и менингококко-
вой вакцинами. Очищенный MBL используют для заместительной терапии
соответствующего дефицита.
11.3. ОСНОВНЫЕ КЛИНИЧЕСКИЕ СИМПТОМЫ
И ТЕСТЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ
Успешную диагностику врожденных нарушений иммунной системы
можно провести на основании оценки разнообразных клинических симпто-
мов ПИД и выделения ряда особенностей и проявлений, характерных для
многих ПИД. Выявление и анализ этих симптомов в сочетании с общекли-
ническими лабораторными исследованиями позволяют врачу с большой
долей вероятности заподозрить у пациента наличие врожденного дефекта
иммунной системы. В практической деятельности целесообразно исполь-
зовать следующие рекомендации, основанные на клинико-лабораторных
показателях [Кондратенко И.В. и др., 2008] (табл. 11-19).
Тесты оценки Т-клеточного звена
Скрининговые тесты:
• абсолютное число лимфоцитов, Т-лимфоцитов (CD3), субпопуляций
Т-лимфоцитов (CD4, CD8);
• ультразвуковое исследование или рентгенография тимуса у младенцев;
• кожные тесты ГЗТ.
Подтверждающие тесты:
• лимфопролиферативный ответ на митогены, антигены и аллогенные
клетки;
• образование цитокинов: Thl-типа (ИФН-у, ФНО-а, ИЛ-2); ТЬ2-типа
(ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13);
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 341
ГЛАВА 11
Таблица 11-19. Основные клинические симптомы и лабораторные показатели, характер-
ные для первичных иммунодефицитов
Клинические симптомы Лабораторные показатели
Рецидивирующие, плохо поддающиеся традиционной терапии инфекционные заболевания респираторного и пищеварительного тракта Оппортунистические инфекции (пневмоцистные пнев- монии) Упорный кандидоз слизистых оболочек и кожи, особен- но у детей старше 1 года Упорная диарея, мальабсорбция Повторные бактериальные инфекционные поражения кожи, подкожной клетчатки, лимфатических узлов и внутренних органов (деструктивные пневмонии, абсцес- сы печени) Отставание в развитии у младенцев на фоне необычных инфекций и диареи Лимфаденопатия в сочетании с гепатоспленомегалией (при исключении злокачественных новообразований и специфических инфекционных заболеваний) Артриты, дерматомиозит, склеродермия Гипоплазия лимфоидной ткани Лейкопения, лимфопения, нейтропе- ния, гемолитическая анемия, тромбо- цитопения [лимфаденопатия в соче- тании с гепатоспленомегалией (при исключении злокачественных новооб- разований и специфических инфекци- онных заболеваний)], снижение уровня иммуноглобулинов
• функциональный ответ Т-клеток на цитокины;
• выявление активационных молекул на мембране Т-лимфоцитов (CD25,
HLA-DR);
• молекулярный анализ специфических дефектов развития Т-клеток;
• выявление молекул адгезии (интегрина CDlla/CD18).
Тесты оценки В-клеточного звена
Скрининговые тесты:
• определение содержания В-лимфоцитов (CD19+ CD20+) в перифери-
ческой крови;
• определение концентрации сывороточных иммуноглобулинов IgA,
IgM. IgE. IgG;
• определение субклассов IgG (IgGl, IgG2, IgG3, IgG4);
• выявление специфических антител:
О изогемагглютининов (IgM к антигенам групп крови А и В);
❖ IgGl-антитела к анатоксинам столбняка и дифтерии;
О ^С2-антитела к пневмококковым и менингококковым полисаха-
ридным вакцинальным антигенам;
❖ IgGl, IgG3 к антигенам респираторных вирусных вакцин;
❖ к другим вакцинам против гепатита В, кори, паротита, краснухи.
ЧАСТЬ 2
342 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Подтверждающие тесты:
• тест на образование В-клетками иммуноглобулинов in vitro;
• регуляция синтеза иммуноглобулинов;
• взаимодействие CD40L с CD40;
• молекулярный анализ генетических нарушений.
Тесты оценки фагоцитарного звена
Скрининговые тесты:
• определение абсолютного числа нейтрофилов и моноцитов;
• показатели фагоцитоза;
• генерация активных форм кислорода (НСТ-тест).
Подтверждающие тесты:
• оценка хемотаксиса фагоцитов;
• определение экспрессии молекул адгезии на поверхностной мембране
нейтрофилов (CDlla, CDllb, CDllc, CD18);
• определение завершенности фагоцитоза.
11.4. ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ БОЛЬНЫХ
С ПЕРВИЧНЫМИ ИММУНОДЕФИЦИТАМИ
Основные положения
• Лечение ПИД должно быть направлено на восстановление иммунного
дефекта и предотвращение осложнений.
• Неотъемлемой частью терапии должно быть ее раннее начало.
• Профилактика инфекций — это очень важная составная часть ком-
плексной терапии всех форм ПИД. Эта цель может быть достигнута
путем снижения воздействия инфекционных патогенов, активной
тактикой назначения антимикробных препаратов, заместительной
терапией иммуноглобулинами.
• У младенцев с ТКИН трансплантация гематопоэтических стволовых
клеток является терапией выбора и ведет в большинстве случаев к
положительным результатам.
• Заместительная терапия иммуноглобулинами лежит в основе лечения
пациентов с преимущественным дефицитом антител.
• Аутоиммунные нарушения не являются редкими у больных ПИД. Их
лечение нередко отличается от того, что применяют у иммунокомпе-
тентных пациентов.
• Антибактериальная и антигрибковая профилактика обязательно
используется при лечении дефектов фагоцитоза. Кроме того, G-CSF
используется в терапии некоторых пациентов с тяжелой врожденной
нейтропенией.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 343
• Трансплантация гематопоэтических стволовых клеток имеет важное
значение в лечении комбинированных иммунодефицитов, а также
дефектов фагоцитов и иммунной дисрегуляции.
Достижения современной медицины позволяют в ряде случаев про-
водить успешное лечение ПИД в соответствии с основными принципами
[Кондратенко И.В., Ковальчук Л.В. и др., 2008]:
• заместительную терапию;
• лечение и профилактику бактериальных, грибковых, вирусных, мико-
бактериальных инфекций; лечение аутоиммунных осложнений, злока-
чественных новообразований;
• специальные методы терапии (например, спленэктомия при синдроме
Вискотта-Олдрича);
• трансплантацию костного мозга и стволовых клеток;
• генную терапию.
Важны постоянные мероприятия по контролю за состоянием здоровья
больных ПИД, основанные на базисных принципах.
• Поддерживающая терапия и раннее выявление инфекций (антибакте-
риальная, противогрибковая, муколитическая и др.).
• Для раннего выявления бронхоэктазов оценивают функцию дыхания
у больных с легочной патологией и проводят компьютерную томогра-
фию не реже одного раза в 6 мес.
• Микробиологическое исследование флоры респираторного тракта.
• Поскольку диарея — частый симптом у больных с дефицитом антител,
исследование копрограммы, идентификацию возбудителя (G. lamblia,
Campylobacter, Yersinia) проводят не реже одного раза в 6 мес.
• Биохимический анализ крови для скрининга гепатитов и функции
печени проводят на регулярной основе.
• Подсчет форменных элементов крови, особенно у пациентов с ОВИН,
склонных к развитию аутоиммунных цитопений, следует проводить не
реже одного раза в 6 мес.
• Иммунологический контроль по показаниям.
Один из наиболее распространенных методов лечения больных ПИД —
заместительная терапия. Для заместительной терапии при ПИД в насто-
ящее время используют следующие препараты:
• иммуноглобулины для внутривенного введения;
• ростовые факторы (ленограстим и филграстим);
• препараты интерферона гамма (ИФН-у)*;
ГЛАВА 11
* Используют при лечении редко встречающихся форм иммунодефицитов, вызванных
генетически детерминированным нарушением продукции ИФН-у и в качестве вспомо-
гательного средства при лечении тяжелых инфекционных осложнений у пациентов с
хронической гранулематозной болезнью.
ЧАСТЬ 2
344 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• препараты на основе ИЛ-2*;
• аденозиндезаминазу**.
Поскольку при большинстве форм ПИД нарушено образование специфи-
ческих антител, основной препарат, используемый для заместительной
терапии, — иммуноглобулины для внутривенного введения, служащие
обязательным компонентом лечения при следующих формах иммунодефи-
цитов:
• Х-сцепленной и аутосомно-рецессивной форме агаммаглобулинемии с
дефектом В-клеток;
• ОВИН;
• Х-сцепленном и аутосомно-рецессивном гипер-^М-синдроме;
• синдроме хромосомных поломок Неймеген;
• синдроме Вискотта-Олдрича;
• атаксии-телеангиэктазии при наличии признаков нарушения антите-
лопродукции;
• тяжелых комбинированных иммунодефицитах.
Схемы введения и дозы внутривенных иммуноглобулинов рассчи-
тываются следующим образом: в начале лечения проводят «терапию
насыщения» — 1,2-1,5 г/кг массы тела в месяц (4-5 введений внутривен-
ного иммуноглобулина каждые 5-7 сут). Цель «терапии насыщения» —
достижение нормальной возрастной концентрации сывороточного IgG.
Поддерживающую терапию иммуноглобулином проводят пожизненно,
независимо от состояния пациента. Стандартная доза иммуноглобулинов
для поддерживающей терапии — 0,4 г/кг один раз в 3-4 нед. Цель лечения —
поддержание претрансфузионного уровня сывороточного IgG не ниже 5,0 г/л.
В результате проводимого лечения у пациентов улучшаются показатели
функции легких, уменьшается потребность в антибиотиках и, как следствие,
сокращается число пропущенных дней учебы или работы. Нежелательные
явления при проведении терапии связаны с нарушением функции почек за
счет повышенного осмотического давления в проксимальных канальцах.
Необходимо проводить мониторирование функции почек.
Вопросы для самоконтроля
• Назовите основные группы первичных иммунодефицитов (ПИД) в
соответствии с международной классификацией последнего пересмо-
тра 2007 г.
• Перечислите основные клинико-иммунологические критерии преиму-
щественного дефицита антител.
* Применяют как дополнительный препарат у пациентов с ОВИН.
** Используют для поддерживающей терапии пациентов с генетически детерминирован-
ным дефектом АДА.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 345
• В чем состоит основное отличие первичных иммунодефицитов от вто-
ричных?
• Перечислите основные формы иммунодефицитов с гипопигментацией
и их клинико-иммунологические особенности.
• Каковы основные клинические проявления аутоиммунного лимфо-
пролиферативного синдрома и механизмы развития данного иммуно-
дефицита?
• В чем различие тяжелой врожденной нейтропении и циклической
нейтропении?
• Каковы механизмы дефицитов адгезии лейкоцитов?
• Назовите основные иммунологические и клинические проявления
ХГБ.
• Какие фенотипические проявления дефектов врожденного иммунитета
вам известны, в чем их особенности?
• Какие заболевания относятся к группе аутовоспалительных генети-
ческих нарушений и в чем заключаются механизмы развития этих
заболеваний?
• Какие инфекции чаще всего ассоциированы с первичными дефицитами
комплемента?
• Назовите основные скрининговые и углубленные лабораторные тесты,
используемые для диагностики ПИД.
• Перечислите основные принципы терапии первичных иммунодефи-
цитов.
• Что такое заместительная терапия ПИД, какие препараты для этого
применяются?
• Перечислите показания к назначению ВВИГ.
11.5. ПРИОБРЕТЕННЫЕ (ВТОРИЧНЫЕ)
ИММУНОДЕФИЦИТЫ
Приобретенные (вторичные) иммунодефициты (ВИД) — не нозоло-
гическая форма, а патогенетическая характеристика нарушений иммунной
системы. Воздействие различных факторов может привести к структурным
и/или функциональным нарушениям иммунной системы, выражающимся
в недостаточности эффекторных механизмов Т-клеточного, В-клеточного
и/или фагоцитарного звеньев, а также функций врожденного иммунитета.
При этом важную роль играют многочисленные факторы (генетические,
возрастные, окружающей среды, условий жизни и др.) предрасположен-
ности к иммунодефициту. Единственное, что могло бы ограничить более
широкое практическое использование термина «приобретенный», это сход-
ство с понятием «синдром приобретенного иммунодефицита».
ГЛАВА 11
ЧАСТЬ 2
346 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Обычно приобретенные формы иммунодефицитов развиваются под вли-
янием разнообразных повреждающих факторов, воздействующих на фоне
ранее сохранной иммунной системы. Среди таких факторов преобладают:
• инфекционные (типичная ВИЧ-инфекция, туберкулез и др.);
• алиментарные (белково-энергетическая неполноценность питания,
дефицит витаминов, микроэлементов: цинка, селена и др.);
• лекарственные (цитостатики, иммунодепрессанты, антибиотики);
• физические (воздействие радиации и других факторов);
• химические (иммунотропные токсичные вещества, яды, производ-
ственные факторы);
• метаболические (чаще на фоне тяжелых системных заболеваний, при
раке);
• стресс, травмы и др.
Важно, что выявление и успешная отмена повреждающего фактора, если
это возможно, позволяют скорректировать иммунные нарушения. Врачи
разных специальностей должны предполагать возможную роль иммунных
нарушений в патогенезе многочисленных заболеваний человека и исполь-
зовать современные методы их диагностики.
В последние годы накапливается всё больше новых данных о развитии
иммунодефицита на фоне феномена гиперактивации иммунной системы, в
частности, под влиянием инфекционных агентов. Например, важный про-
гностический фактор перехода ВИЧ-инфекции в СПИД — повышенная акти-
вация Т-лимфоцитов и компонентов врожденного иммунитета и избыточная
выработка провоспалительных цитокинов (ФНО-а, ИЛ-lp, ИЛ-6 и др.).
Среди других новых механизмов иммуносупрессии рассматривают
повышенную активацию регуляторных Т-клеток с активной выработкой
противовоспалительных цитокинов (ТФР-р, ИЛ-10). Излишне активиро-
ванные регуляторные Т-клетки подавляют функцию других субпопуляций
Т-лимфоцитов (при прямом контакте и опосредованно через цитокины),
что обусловливает развитие иммунодефицита, например, при злокачествен-
ных опухолях, некоторых формах инфекционных заболеваний.
Однако на сегодняшний день нет единой общепризнанной классифика-
ции вторичных иммунодефицитов. Более того, авторы расходятся во мне-
нии относительно этиологии таких нарушений.
В отечественной литературе выделяют следующие формы вторичных
иммунодефицитов [Хаитов Р.М., Пинегин Б.В., 1999]:
• индуцированную;
• спонтанную;
• приобретенную (СПИД).
Индуцированная форма вторичного иммунодефицита возникает в
результате конкретных воздействий (причин), а именно: рентгеновско-
го излучения, цитостатической терапии, применения глюкокортикоидов,
травм, хирургических вмешательств и др. К ним относят также нарушение
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 347
иммунитета, развивающееся вторично по отношению к основному заболе-
ванию (сахарному диабету, заболеваниям печени, почек, злокачественным
новообразованиям).
Спонтанная форма вторичного иммунодефицита характеризуется
отсутствием явной причины (хотя, без сомнения, она имеется), вызы-
вающей нарушение в иммунной системе. Клинически проявляется в виде
хронических, часто рецидивирующих инфекционно-воспалительных про-
цессов в органах дыхания, придаточных пазухах носа, урогенитальном и
пищеварительном тракте, глазах, коже, мягких тканях. Возбудители таких
патологий — оппортунистические (условно-патогенные) микроорганизмы.
Клинические проявления вторичных иммунодефицитов — хронические,
часто рецидивирующие, вялотекущие, трудно поддающиеся лечению тра-
диционными средствами воспалительные процессы любой локализации.
Основные признаки вторичных иммунодефицитов
• Отсутствие генетического дефекта развития иммунной системы.
• Возникновение иммунодефицита на фоне ранее нормально функцио-
нировавшей иммунной системы, в результате перенесенного заболе-
вания, воздействия неблагоприятных физических, биологических,
психических факторов.
• Устойчивое сохранение возникшей иммуномодуляции после того, как
устранена причина ее возникновения.
• Сочетание нескольких клинических проявлений вторичных иммуно-
дефицитов (очаги хронической инфекции).
• Наличие в иммунограмме изменений непостоянного характера, затра-
гивающих различные звенья иммунной системы.
• Возможность клинико-иммунологического эффекта при адекватной
иммунотерапии.
Иммунологический анамнез
Для активного выявления больных важное значение имеет анализ
данных анамнеза. Анализируя анамнез больного, следует отыскать при-
чину иммунодефицита и составить предварительное заключение о наличии
дефекта в том или ином звене иммунной системы.
Зачастую больные с приобретенным иммунодефицитом, проявляю-
щимся в виде инфекционного синдрома, могут довольно четко определить
сроки его возникновения. В этих случаях они указывают, что нарушения в
состоянии здоровья возникли у них после стресса, тяжелого заболевания,
радиационного облучения, инфекции и т.д.
Причинами развития иммунодефицита могут быть также професси-
ональные вредности: воздействие химикатов, канцерогенных веществ,
облучение, контакт с гербицидами, излучением сверхвысоких частот, а
также злоупотребление алкоголем, курение табака, применение наркоти-
ков. Выявить причину иммунодефицита очень важно: если она продолжает
ГЛАВА 11
ЧАСТЬ 2
348 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
действовать, то рассчитывать на успех проводимой иммунотерапии не
приходится. Следует предпринять всё возможное для устранения этой при-
чины, по крайней мере уменьшить степень воздействия неблагоприятного
фактора. Если в качестве причины иммунодефицита выступает тяжелая
соматическая патология, то иммунотерапию нужно проводить одновремен-
но с лечением основного заболевания.
Тщательный анализ анамнеза (семейного, профессионального, перенесен-
ных заболеваний) позволяет сделать предварительное заключение о пора-
жении Т-клеточного, гуморального звена иммунной системы либо врож-
денного иммунитета. Анализируя семейный анамнез, следует выяснить, нет
ли у родственников иммунопатологии, злокачественных новообразований,
аутоиммунных и аллергических заболеваний, хронических воспалительных
заболеваний с частыми обострениями и не поддающихся традиционной
терапии, врожденных уродств, малой продолжительности жизни ближайших
родственников, не обусловленной случайными причинами.
Наиболее важный момент — анализ списка перенесенных больным заболе-
ваний. В этом смысле важно опираться на знание «болезней-масок» иммуно-
дефицита. Указания в анамнезе на вирусные инфекции, грибковые поражения,
наличие аутоиммунной патологии и онкозаболеваний позволяют предпола-
гать возможные нарушения в Т-клеточном звене иммунной системы. В то же
время если больной сообщает о ряде перенесенных бактериальных инфекций
(сепсис, остеомиелит, бактериальные пневмонии, ангина, аднексит и др.), то,
скорее всего, можно предположить нарушения в гуморальном звене имму-
нитета. В тех случаях, когда у больного имеются данные о перенесенных им
«болезнях-масках» Т-клеточного и гуморального иммунитета, предполагают
комбинированный тип поражения иммунной системы.
Довольно трудно, скорее невозможно, клинически дифференцировать
«болезни-маски» гуморальной недостаточности и нарушений фагоцитоза.
В любом случае у больных на первый план выходят заболевания бактери-
альной природы.
Поскольку приобретенный иммунодефицит — это прежде всего клини-
ческое состояние, сопровождающееся транзиторными изменениями пока-
зателей иммунограммы, следует выделить наиболее значимые заболевания,
которые могут быть обусловлены иммунными нарушениями.
• Генерализованные инфекции: сепсис, гнойные менингиты и т.п.
• Хронический бронхит с частыми рецидивами в сочетании с заболе-
ваниями ЛОР-органов (гнойные синуситы, отиты), резистентные к
стандартной терапии.
• Повторные пневмонии, плевропневмонии.
• Бронхоэктатическая болезнь.
• Хронические бактериальные инфекционные поражения кожи и под-
кожной клетчатки (фурункулы, абсцессы, пиодермии, флегмоны, пара-
проктиты).
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 349
• Хронические грибковые поражения кожи и слизистых оболочек, гене-
рализованный кандидоз.
• Паразитарные заболевания.
• Рецидивирующий афтозный стоматит в сочетании с повышенной забо-
леваемостью острыми респираторными вирусными инфекциями.
• Рецидивирующая герпес-вирусная инфекция.
• Хроническая диарея неясной этиологии.
• Лимфаденопатия, повторные лимфадениты.
• Длительный субфебрилитет, лихорадка неясного генеза.
Следующий этап активного выявления иммунодефицита — клиническое
обследование больного. Поскольку приобретенный иммунодефицит не
нозологическая форма, то специфических симптомов он, как правило, не
имеет. Тем не менее при осмотре больного следует провести оценку лим-
фатических узлов, миндалин, селезенки, тимуса. Выявление гиперплазии
лимфоидных органов или, наоборот, их гипоплазия может свидетельство-
вать об иммунопатологии.
Важно исследовать состояние кожных покровов и слизистых оболочек,
так как при многих иммунопатологических состояниях имеются признаки
их поражения (атопический дерматит, СКВ, герпес, абсцессы, фурункулы
и т.д.). Объективный осмотр больного должен проводиться посистемно,
тщательно, чтобы выявить признаки поражения не только иммунной систе-
мы, но и других органов и систем.
При подозрении на приобретенный иммунодефицит необходимо про-
вести тщательное лабораторное исследование, позволяющее выявить лей-
копению, лимфопению, моноцитопению, моноцитоз, эозинофилию, сниже-
ние общего уровня комплемента, гипогаммаглобулинемию, протеинурию.
Применение инструментальных методов позволяет диагностировать умень-
шение или отсутствие тени тимуса на рентгенограмме, спленомегалию.
Иммунологические тесты для проведения исследований выбирает врач
аллерголог-иммунолог с учетом предполагаемых дефектов в иммунной
системе. При необходимости назначают иммунологический мониторинг.
Клинико-иммунологическое заключение выдает врач аллерголог-
иммунолог на основании совокупности перечисленных выше клиниче-
ских и иммунологических данных. При выявлении вторичной иммунной
недостаточности следует указать ее причину (если удается выяснить).
Обязательный компонент заключения — рекомендации относительно лече-
ния больного.
Следует иметь в виду, что иммунодефицитные состояния могут иметь
физиологическую природу. Так называемые физиологические иммуноде-
фициты характерны для:
• детей раннего возраста, у которых иммунная система находится в ста-
дии формирования или замедленно реализуется феномен «иммунной
адаптации ребенка»;
ГЛАВА 11
ЧАСТЬ 2
350 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• беременных женщин, у которых происходит подавление адаптивной
иммунной системы преимущественно за счет регуляторных Т-клеток,
необходимых для предотвращения иммунной активации против анти-
генов плода отцовского происхождения. При этом сохраняется функ-
ция врожденной иммунной системы, но ее избыточная активация
инфекционными агентами может привести к преждевременным родам
в результате активности провоспалительных цитокинов;
• людей старческого возраста, когда происходит ослабление иммунных
функций, особенно тех, которые отвечают за первичный ответ на поступа-
ющие в организм антигены, главным образом инфекционной природы.
Еще раз следует напомнить, что в последнее время накапливается всё
больше данных, свидетельствующих о том, что приобретенной форме имму-
нодефицита, как правило, предшествует избыточная активация иммунной
системы, особенно компонентов Т-клеточного звена и врожденного имму-
нитета. С другой стороны, прямое поражение тех или иных компонентов
иммунной системы (цитостатиками, физической иммуносупрессией и др.)
и дефицит необходимых для ее оптимального функционирования аген-
тов (микроэлементы, белково-энергетические продукты и т.д.) приводят
к дефициту эффекторных механизмов иммунного реагирования. Важная
задача — научиться своевременно идентифицировать природу поражаю-
щих факторов, чтобы провести направленную иммунокоррекцию.
Вопросы для самоконтроля
• Каковы основные причины возникновения ВИД?
• Перечислите клинические и иммунологические признаки ВИД.
• Каковы особенности иммунологического анамнеза?
• Какие формы ВИД выделяют в настоящее время и какова характери-
стика этих форм?
• Перечислите основные методы диагностики ВИД.
• Охарактеризуйте основные принципы терапии больных с признаками
ВИД.
• Какие заболевания и состояния могут быть обусловлены приобретен-
ными нарушениями со стороны иммунной системы?
11.6. СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА*
Вирус иммунодефицита человека принадлежит к семейству РНК-со-
держащих ретровирусов (особенность — наличие фермента обратной транс-
криптазы), к подсемейству так называемых медленных лентивирусов.
* Раздел подготовлен при участии доцента кафедры иммунологии и аллергологии
СГМА канд. мед. наук Е.В. Слабкой и зав. отделением Центра по профилактике СПИДа
Л.И. Беспаловой.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 351
Известны два варианта вируса иммунодефицита человека: ВИЧ-1 и
ВИЧ-2. В геноме этих вирусов имеются различия. ВИЧ-1 содержит ген vpu,
а ВИЧ-2 — ген vpx. Генетический аппарат двух типов вирусов схож между
собой по последовательности нуклеотидов на 50%. Белки оболочки ВИЧ-2
имеют меньшие размеры, чем у ВИЧ-1, в результате чего в тест-системах
на ВИЧ-1 могут не определяться ВИЧ-2. ВИЧ-1 имеет несколько подтипов
от А до К. Более 90% людей, инфицируемых ВИЧ-1, проживают преиму-
щественно в США, Европе и Центральной Африке, а ВИЧ-2 эндемичен для
Западной Африки и менее патогенен. В России преимущественно распро-
странен ВИЧ-1.
Основной белок нуклеокапсида ВИЧ — р24. В нуклеокапсиде заключены
две одноцепочечные молекулы РНК, связанные с ними белки р7 и р9, ком-
плекс ферментов (обратная транскриптаза, интеграза, РНК-полимераза,
протеиназа). В зрелых вирионах содержится также белок Vpr. В состав
оболочки вируса входят гликопротеины gpl60 (160 кДа), состоящие из над-
мембранной части gpl20 и внутримембранной — gp41. Гликопротеин gpl20
способен связываться с молекулами CD4 и играет ключевую роль в проник-
новении вируса в клетку-мишень. Значительное количество молекул gpl20
отрывается от вирусных частиц и попадает в кровь и ткани. Этот процесс
называется шеддингом (от англ, «утечка») антигена и играет существенную
роль в патогенезе ВИЧ-инфекции. ВИЧ-2 имеет мембранные гликопро-
теины gpl40 (gpl05 кДа и gp36 кДа). Геном ВИЧ может существовать в
двух вариантах: в виде геномной РНК и в виде ДНК, синтезированной на
геномной РНК, как на матрице, и интегрированной в какую-либо хромосо-
му клетки-хозяина. Вторую форму называют провирусом. В структуре ВИЧ
выделяют три группы генов:
• env, кодирующие антигены оболочки вируса;
• gag, кодирующие антигены сердцевины;
• pol —гены ферментов.
Кроме того, ВИЧ-1 имеет восемь регуляторных генов, а у ВИЧ-2 их
девять. Вероятно, с этим связана большая способность ВИЧ-2 инфици-
ровать клетки, не имеющие рецептора CD4. Как и все ретровирусы, ВИЧ
обладает сильной изменчивостью и существует в качестве множества квази-
видов. Частота генетических ошибок при репликации ВИЧ составляет 1 на
10 000 актов, а геном вируса содержит 10 000 нуклеотидов. Следовательно,
ни один дочерний вирион не воспроизводит родительский в точности.
Считают, что по мере прогрессирования инфекции происходит эволюция
вируса от менее вирулентного к более вирулентному варианту.
Пути передачи вируса
Источник — ВИЧ-инфицированные люди в любой период течения
инфекционного процесса. Вирус обнаруживают во всех биологических
жидкостях зараженного человека, но в разных титрах: максимальная кон-
ГЛАВА 11
ЧАСТЬ 2
352 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
центрация в крови, сперме, вагинальном отделяемом, грудном молоке. В то
же время в слюне и слезной жидкости могут находиться лишь единичные
экземпляры вируса. Инфицированный человек наиболее заразен при нали-
чии виремии, т.е. через короткое время после заражения (соответствует
стадии «серонегативного окна»), а также в период наиболее тяжелых про-
явлений иммунодефицита.
Пути заражения ВИЧ:
• парентеральный;
• половой;
• вертикальный — новорожденного от матери.
В группу риска парентерального заражения входят внутривенные нар-
команы; медицинские работники, контактирующие с продуктами крови
и жидкостями организма; пациенты, получающие трансфузии крови и ее
продуктов.
Риск заражения половым путем тем выше, чем больше сексуальных
партнеров. При половом контакте происходит механическое «втирание»
зараженных секретов, что обеспечивает передачу вируса здоровому парт-
неру. Урологические и гинекологические воспалительные заболевания,
травмы слизистых оболочек увеличивают вероятность проникновения
возбудителя в организм. При парентеральной передаче наиболее опасно
переливание инфицированной крови и ее компонентов, плазмы. По суще-
ствующим оценкам, вероятность инфицирования реципиента превышает
90% и является самой высокой. В России вся донорская кровь тестируется
на наличие антител к ВИЧ, однако и в нашей стране зарегистрированы
случаи заражения реципиентов, так как донорская кровь может быть
взята в период «серонегативного окна». Другие способы парентерального
заражения — трансплантация органов, искусственное оплодотворение,
передача возбудителя через инфицированные медицинские инструменты,
а также при инъекционном введении наркотиков. Если наркотики вводятся
нескольким лицам одним общим шприцем и нестерилизованной иглой,
частота заражения составляет 67:10 000 инъекций. Этот путь распростра-
нения ВИЧ-инфекции — один из основных в США и Западной Европе, а с
1996 г. он стал основным и в России. Вертикальный путь инфицирования
происходит по одному из трех вариантов:
• антенатальному (трансплацентарный) — вероятность инфицирования
15-25%;
• интранатальному (в родах) — вероятность инфицирования 60-85%;
• постнатальному (в результате грудного вскармливания), вызывает
инфицирование ребенка в 12-25% случаев.
Вероятность рождения инфицированного ребенка от ВИЧ-
инфицированной матери составляет в европейских странах 25-30%, в
Африке — 50-60%. При повторных беременностях риск возрастает в
2-3 раза. Следует отметить, что вероятность заражения зависит от давности
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 353
заболевания, стадии инфекционного процесса и степени иммуносупрессии
у матери.
В сравнении с начальным периодом эпидемии ВИЧ-инфекции в настоя-
щее время отмечается перераспределение основных путей передачи ВИЧ.
Если 10 лет назад ВИЧ-инфекция поражала преимущественно внутривен-
ных наркоманов и мужчин, имеющих гомосексуальные половые контакты,
то теперь всё бдлыпую долю занимают случаи заражения ВИЧ при гетеро-
сексуальных половых отношениях.
ВИЧ не передается бытовым путем (при пожатии рук, через общую
посуду и столовые приборы, при пользовании ванной и туалетом, которы-
ми пользуются ВИЧ-инфицированные), через кровососущих насекомых,
воздушно-капельным путем при кашле и чиханье.
Таким образом, на передачу ВИЧ-инфекции влияют следующие факто-
ры: титр вируса, стадия заболевания, наличие местных травм, особенности
эпителиальных рецепторов, интенсивность экспозиции вируса.
Прогноз
У взрослых обычно проходит длительный период между инфицировани-
ем ВИЧ и развитием развернутой картины СПИДа. У детей этот интервал
обычно короче. Исторически известно, что длительность прогрессирования
инфекции вплоть до СПИДа у нелеченых взрослых в среднем составляет
около 10 лет. Примерно у 10% взрослых, инфицированных ВИЧ-1, заболе-
вание принимает характер быстро прогрессирующего с развитием СПИДа в
течение 2-3 лет после инфицирования. У 50% взрослых, инфицированных
ВИЧ-1, сохраняется стабильный уровень CD4+ Т-клеток, и клинические
проявления прогрессирования заболевания отсутствуют многие годы.
11.6.1. Иммунопатогенез ВИЧ-1-инфекции
Основные мишени ВИЧ-1 — CD4+ Т-клетки человека, количество кото-
рых в результате заболевания прогрессивно снижается. Поверхностный
гликопротеин вируса gpl20 напрямую связывается с молекулами CD4.
После связывания оболочка ВИЧ-1, содержащая гликопротеины gpl20 и
gp41, изменяется и происходит взаимодействие между gp41 и плазмати-
ческой мембраной клетки хозяина, в результате чего внутренние вирусные
компоненты проникают в цитоплазму клетки.
Для инфицирования клеток-мишеней ВИЧ-1 необходимы корецепторы
в дополнение к CD4. Тип хемокинового рецептора определяет природу
инфицирования клеток разными вариантами ВИЧ-1. В качестве корецеп-
тора для ВИЧ-1 (имеет тропизм к макрофагам) выступает хемокиновый
рецептор CCR5 (И5-вирусы), имеющий семь трансмембранных сегментов и
одновременно служащий рецептором хемокинов RANTES (англ. Regulated
on Activation, Normal T-cell Expressed and Secreted) и макрофагальных вое-
ГЛАВА 11
ЧАСТЬ 2
354 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
палительных белков (MIP-la, MIP-10). Рецептор CCR5 экспрессируется
преимущественно мононуклеарными фагоцитами. Показано, что мутации
гена рецептора CCR5 защищают клетки хозяина от инфицирования ВИЧ-1.
Гомозиготы по CCR5 высокоустойчивы к заражению ВИЧ-1.
Слиянию ВИЧ-1 с клеткой способствует также хемокиновый рецептор
CXCR4 (Х4-вирусы), экспрессируемый преимущественно наивными Т-,
В-клетками и моноцитами. Антитела к этому рецептору блокируют клеточ-
ное слияние и инфицирование нормальных СП4+-клеток человека. Лиганд
для CXCR4 — а-хемокин SDF-la (англ. Stromal cell-Derived Factor-1) пода-
вляет проникновение ВИЧ-1 в клетки.
Вначале ВИЧ-1 инфицирует макрофаги и ДК, связывая вирус через
поверхностные молекулы CD4 и CCR5. RS-вирусы не участвуют в образо-
вании синцития. Позже происходит инфицирование CD4+ Т-клеток путем
связывания поверхностных молекул CD4 и CXCR4, в большей мере экс-
прессируемых на этих лимфоцитах, чем рецепторы CCR5. Эти Х4-штаммы
ВИЧ-1 участвуют в образовании межклеточного синцития. Описаны штам-
мы ВИЧ-1 (R5X4) с двойным тропизмом. В поздней стадии инфицирования
отмечается переключение фенотипа вируса с R5 на Х4 у 50% больных.
В качестве потенциальных мишеней ВИЧ, помимо CD4+ Т-лимфоцитов,
макрофагов и дендритных клеток, могут выступать и другие клетки, напри-
мер астроциты, микроглиальные, клетки трофобласта, клетки почечного
эпителия и др. Однако не все клетки, чувствительные к ВИЧ-1, экспрес-
сируют на своей поверхности CD4 или хемокиновые рецепторы, что дает
основание предполагать наличие и других рецепторов ВИЧ-1.
CD4* Т-клетки
Иммунодефицит, вызванный ВИЧ-1, обусловлен в первую очередь
уменьшением количества и ослаблением функций CD4+ Т-лимфоцитов.
Механизмы разрушения CD4+ Т-клеток интенсивно изучаются, и на сегод-
няшний день выделяют несколько вариантов этого процесса:
• разрушение инфицированных клеток происходит вследствие внутри-
клеточной репликации вируса и выделения его из клетки;
• клетки погибают в результате формирования синцития. ВИЧ-1, инду-
цирующие синцитий (Х4), вызывают тяжелый, быстро прогресси-
рующий иммунодефицит. Гликопротеин вируса gpl20 выступает в
роли лиганда молекулы CD4. Связывание его с CD4+ Т-лимфоцитами
вызывает гибель клеток внутри синцития;
• другой механизм истощения пула CD4+ Т-клеток состоит в нару-
шении дифференцировки лимфоцитов. Так, на аутопсии ВИЧ-1-
инфицированных плодов и взрослых больных выявлены нарушения
в тимусе, которые могут влиять на развитие Т-клеток у пациентов.
Кроме того, обнаруживают изменения в костном мозге больных, вклю-
чая фиброз;
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 355
• обсуждаются и другие механизмы разрушения или нарушения функ-
ций CD4+ Т-клеток, такие, как роль ВИЧ-1 в качестве суперантигена,
апоптоз клеток-мишеней, цитотоксическое действие CD8+ Т-клеток,
направленное против CD4+ Т-лимфоцитов, которые экспрессируют
антигены ВИЧ-1.
В-клетки
У пациентов, инфицированных ВИЧ-1, происходит аномальная акти-
вация В-лимфоцитов. У многих больных развивается гипергаммаглобу-
линемия и увеличивается образование IgG и IgA, в большинстве случаев
специфичных к ВИЧ-1. Однако у многих пациентов, инфицированных
ВИЧ-1, усиленно образуются специфические антитела и к другим анти-
генам. Одновременно in vitro выявляют снижение пролиферации В-клеток
в ответ на стимуляцию антигеном или митогеном. Существуют разные тео-
рии, объясняющие данные факты:
• дисфункция В-клеток у пациентов возникает в результате того, что
уменьшается количество CD4+ Т-хелперов, что влияет на регуляцию
образования антител и нарушает кооперацию между Т- и В-клетками;
• некоторые вирусы могут отвечать за активацию В-лимфоцитов у
пациентов, инфицированных ВИЧ-1. ЦМВ и вирус Эпштейна-Барр —
поликлональные В-клеточные активаторы, которые могут вовлекаться
в этот процесс. Кроме того, известно, что ВИЧ-1 оказывает прямое
поликлональное активационное действие на В-клетки.
Цитокины
У пациентов, инфицированных ВИЧ-1, нарушается синтез цитокинов,
что связано с манифестацией и прогрессированием заболевания.
Так, у пациентов со СПИДом и СПИД-связанными оппортунистиче-
скими инфекциями уменьшается содержание ИФН-у. Снижается уровень
ИЛ-2, секретируемого Т-лимфоцитами и регулирующего пролиферацию
и дифференцировку Т- и В-лимфоцитов, а также уменьшается содержание
других цитокинов (ИЛ-12, ИЛ-13, ИЛ-16 и др.). Мононуклеарные фаго-
циты пациентов, инфицированных ВИЧ-1, образуют повышенное количе-
ство ФНО-а, что способствует прогрессированию заболевания. С другой
стороны, показано, что ФНО-а снижает репликацию ВИЧ-1, подавляя
экспрессию рецепторов CCR5. Другие цитокины (ИЛ-1р, ИЛ-6, ГМ-КСФ)
способны регулировать и повышать экспрессию ВИЧ-инфицированными
моноцитами и Т-клетками.
ИЛ-10, подавляющий рост макрофагов и секрецию цитокинов Т-клетка-
ми, способен угнетать репликацию ВИЧ-1 в макрофагах. Образование
ИЛ-12 уменьшается у ВИЧ-инфицированных пациентов.
ГЛАВА 11
ЧАСТЬ 2
356 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Вирусная нагрузка
Содержание ВИЧ в периферической крови, или вирусная нагрузка, —
важный показатель, позволяющий определять эффективность противо-
вирусного лечения и прогноз. Виремию определяют, обнаруживая РНК
ВИЧ-1 в плазме методом ПЦР. Показана корреляция между концентрацией
ВИЧ-1 в плазме и прогрессированием заболевания.
Процесс инфицирования клетки ВИЧ можно разделить на несколько стадий.
• Рецепция вируса (связывание вириона с поверхностью клетки) проис-
ходит посредством взаимодействия gpl20 с молекулой CD4 на многих
клетках, в том числе на лимфоцитах, макрофагах, клетках нервной
системы (нейроны, микроглиальные клетки); также через взаимо-
действие комплекса «ВИЧ-противовирусные антитела» с рецептором
для Fc-фрагмента иммуноглобулинов (т.е. антитела способствуют
инфицированию клеток); а также через рецепцию комплекса «ВИЧ-
интерферон у» большинством цитотоксических клеток. Геном ВИЧ
может проникать в клетки-мишени в виде псевдовирусов, т.е. под обо-
лочкой другого вируса, например вируса герпеса.
• Проникновение ВИЧ внутрь клетки посредством слияния мембран
вируса и клетки-мишени.
• Высвобождение геномной РНК вируса, синтез ДНК на матрице РНК с
участием обратной транскриптазы.
• Интеграция ДНК провируса с помощью интегразы в геном клетки-
хозяина. На этом этапе трансляции генов вируса не происходит
(латентная стадия инфекции).
• Транскрипция с ДНК провируса и формирование новых вирионов.
Установлено, что в ранней стадии ВИЧ-инфекции преобладают штаммы
вируса с низкой репродуктивной активностью, получившие название «мед-
ленных». По мере развития иммунодефицита увеличивается доля штаммов
ВИЧ с высокой активностью репликации («быстрые»).
Факторы, способствующие активации ВИЧ
• Факторы, приводящие к развитию иммунной недостаточности (стрес-
сы, травмы, ультрафиолетовое облучение, радиация, алкоголизм и
наркомания, беременность и др.).
• Вероятность развития ранней активной ВИЧ-инфекции больше у
иммунологически компрометированного человека (аутоиммунная
патология, врожденный иммунодефицит и др.).
• Гйпертермия способствует репликации ВИЧ (в отличие от других
вирусов).
• Антигены и митогены индуцируют пролиферацию лимфоцитов и, как
следствие, приводят к развитию репродуктивной ВИЧ-инфекции.
• Генетическая предрасположенность. При этом доминирующую роль
играют антигены главного комплекса гистосовместимости. Особенно
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 357
чувствительны лица с генотипами HLA-DR5 и HLA-B35. Система
антигенов определяет частоту заражения и особенности течения
ВИЧ-инфекции среди представителей различных национальностей.
Популяций людей, генетически устойчивых к ВИЧ-инфекции, нет.
ВИЧ обладает не только иммунотропным, но и нейротропным действи-
ем. Помимо этого, вирус поражает другие органы и системы:
• оказывает прямое деструктивное действие на СО4+-клетки
(Т-лимфоциты, макрофаги, ДК), В-лимфоциты и др.;
• растворимые вирусные белки обладают гуморальным иммуносупрес-
сивным действием;
• ВИЧ индуцирует дисфункцию иммунной системы, а именно нарушает
распознавание антигенов и последующие стадии иммунного ответа и
индуцирует апоптоз клеток.
Прямое цитопатогенное действие вируса на инфицированные клет-
ки обусловливает их гибель. Сохранившие жизнеспособность клетки,
инфицированные ВИЧ, несут на своей мембране молекулы gpl20, связы-
вающиеся с молекулами CD4 здоровых клеток и вовлекающие их в обра-
зование межклеточного синцития. В этом конгломерате клетки теряют
жизнеспособность. Образование синцития характерно только для ВИЧ-1,
но не для ВИЧ-2. Кроме того, 50% всех молекул gpl20 существует в раство-
римой форме и оказывает выраженное иммуносупрессивное действие на
СО4+-клетки, так как связь gpl20-CD4 служит отрицательным сигналом.
Блокада молекул CD4 нарушает взаимодействие Т-хелперов с антигена-
ми HLA на поверхности антигенпрезентирующих клеток. Антигены ВИЧ
вызывают поликлональную активацию клеток гуморального звена иммун-
ной системы. У ВИЧ-инфицированных пациентов прогрессивно уменьша-
ется образование цитокинов Thl-клетками и увеличивается секреция цито-
кинов Th2-лимфоцитами (ИЛ-4, ИЛ-10). Это приводит к гиперпродукции
низкоаффинных антител (IgA и IgM), в результате чего сильно изменчивый
вирус сам ускользает от гуморальной защиты и нарушает защиту против
других патогенов.
Вследствие того что оболочка вируса формируется из мембран клеток
хозяина, на ней представлены аутоантигены инфицированного челове-
ка, в том числе антигены HLA классов I и И. В результате наступает срыв
естественной толерантности и может сформироваться аутоиммунное пора-
жение здоровых клеток. Таким образом, создается ситуация «иммунного
паралича».
Один из важнейших этапов прогрессирования ВИЧ-инфекции — пере-
ход из стадии инфицирования в стадию СПИДа. В последние годы активно
рассматривают новую гипотезу о роли хронической иммунной активации и
воспаления в патогенезе ВИЧ-инфекции и СПИДа.
Экспериментальные исследования убедительно показали, что африкан-
ские обезьяны: зеленая мартышка и дымчатый мангабей — естественные
ГЛАВА 11
ЧАСТЬ 2
358 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
носители вируса иммунодефицита обезьян. Они устойчивы к этим виру-
сам. У них не происходит делеция CD4+ Т-клеток в лимфоидной ткани
кишечника, отсутствуют иммунная активация, микробная транслокация и
перерастание в СПИД. Азиатские макаки-резус не являются естественными
носителями вируса иммунодефицита обезьян, и у них быстро развиваются
высокая иммунная активация, дефицит CD4+ Т-клеток и иммунодефицит
после инфицирования данным вирусом. Эти данные свидетельствуют о
важной роли гиперактивации иммунной системы в формировании имму-
нодефицита.
На современном этапе выделяют по крайней мере три главные особен-
ности ВИЧ-инфекции.
• Массивная делеция CD4+ Т-клеток, в первую очередь в структурах
кишечника, приводит к интенсивной транслокации микроорганизмов
и их продуктов (ЛПС, флагеллина, CpG ДНК, других лигандов TLR) во
внутреннюю среду организма. Активирующее действие микроорганиз-
мов приводит к интенсивной выработке провоспалительных цитоки-
нов (ФНО-а, ИЛ-1р, ИЛ-6 и др.).
• На этом фоне развивается так называемый феномен хронической
иммунной активации (ВИЧ-парадокс) в результате не только прямого
действия вируса на Т-клетки, но и опосредованного через рецепто-
ры врожденного иммунитета. Считают, что параметры хронической
иммунной активации более информативны для выявления прогресси-
рования инфекции, чем уровень вирусной мРНК в плазме крови.
• Происходит истощение регенеративной способности иммунной систе-
мы, в частности, за счет апоптоза, укорочения теломер Т-клеток.
Выявляют сходство с иммунной системой людей преклонного возра-
ста. Делают попытки связать развитие деменции со степенью иммун-
ной активации.
11.6.2. Клиническая картина ВИЧ-инфекции
Клиническая картина ВИЧ-инфекции крайне разнообразна. Заболевание
может длительно протекать бессимптомно.
Острая ВИЧ-инфекция развивается не у всех инфицированных и чаще
диагностируется ретроспективно. Инкубационный период от момента
заражения до стадии первичных проявлений составляет в среднем 2 нед,
однако у некоторых больных он увеличивается до 3 мес. Острая первич-
ная инфекция проявляется в виде гриппоподобного или мононуклеозо-
подобного синдрома, который самостоятельно купируется через 2-3 нед.
Наиболее часто в этот период возникают следующие симптомы: лихорадка
различной степени выраженности, головные боли, генерализованная лим-
фаденопатия, артралгия или миалгия, воспалительные процессы в глотке и
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 359
гортани, кандидоз слизистой оболочки полости рта, различные высыпания
(папулезные, эритематозные, петехиальные, уртикарные) на лице, тулови-
ще, конечностях (включая ладони и подошвы), гепато- и спленомегалия,
диарея, конъюнктивит, моноартрит, иногда полирадикулоневрит, серозный
менингит. Эти проявления совпадают по времени с наличием виремии у
пациента. В этот период специфические антитела выявить не удается или
они присутствуют в очень низких титрах. Существует мнение, что манифе-
стация ранней острой ВИЧ-инфекции служит прогностическим признаком
быстрого прогрессирования заболевания.
Вслед за острой лихорадочной фазой наступает бессимптомная фаза,
т.е. длительный период, для которого характерно отсутствие каких-либо
клинических проявлений и постепенное развитие иммунодефицита.
Бессимптомная фаза при ВИЧ-инфекции, как и при других медленных
инфекционных заболеваниях, может продолжаться неопределенно долгое
время. В среднем эта фаза длится до 5-10 лет. В это время вирус персисти-
рует в клетках иммунной системы, где происходит его репликация.
Следующая стадия - персистирующая генерализованная лимфа-
денопатия. Это стадия неустойчивого равновесия между инфекционным
процессом и сдерживающим его развитие противовирусным иммунитетом.
В основном увеличиваются шейные, над- и подключичные, подмышечные,
кубитальные лимфатические узлы. Согласно рекомендациям экспертов
ВОЗ, диагностическим следует считать увеличение 2-3 лимфатических
узлов (больше 1 см в диаметре) разной локализации, длящееся дольше
1,5 мес. Увеличение паховых лимфатических узлов следует рассматривать
как малоинформативный признак. Лимфатические узлы при пальпации
могут быть болезненными, со временем они уплотняются, кожа над ними
не изменена. При биопсии лимфатического узла обычно выявляют добро-
качественную фолликулярную гиперплазию, в более поздних стадиях —
инволюцию фолликулов. Персистирующая генерализованная лимфаде-
нопатия может сопровождаться лихорадкой, симптомами интоксикации,
увеличением селезенки. В этой стадии у ряда больных возникают психо-
патические и неврологические расстройства, соответствующие подострой
энцефало- и полинейропатии. Появляются чувство тревоги, снижение вни-
мания, нарушения сна, головные боли.
По мере углубления иммуносупрессии ухудшается общее состояние
больного, присоединяются вторичные заболевания: оппортунистические
инфекции, вызываемые условно-патогенными возбудителями, и злока-
чественные новообразования (саркома Капоши, В-клеточная лимфома и
др.). Эту фазу характеризуют как СПИД-связанный симптомокомплекс.
Больные предъявляют жалобы на слабость, быструю утомляемость, про-
грессивное похудание (больше 10%), снижение работоспособности, пот-
ливость, плохой аппетит, нарушения стула, субфебрилитет, частые интер-
куррентные заболевания. Происходит неуклонное снижение интеллекта и
ЧАСТЬ 2
360 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
памяти, вплоть до развития ВИЧ-деменции. Вторичные заболевания носят
вначале преимущественно поверхностный характер, изменения локализу-
ются на коже и слизистых оболочках (волосистая лейкоплакия языка, кан-
дидоз полости рта, герпетические элементы, пиодермии, фурункулез и др.).
Согласно классификации В.И. Покровского (см. ниже), эту стадию делят на
три последовательные подстадии (А, Б, В), отражающие прогрессирование
иммуносупрессии и развитие генерализованных вторичных заболеваний. В
этот период температура тела повышается до 38-39 °C, возникает обильное
потоотделение, особенно в ночное время, и резкая слабость, исчезает аппе-
тит, появляется стойкое увеличение лимфатических узлов, частый водя-
нистый стул, прогрессивно снижается масса тела (на 10-15 кг и больше).
Прогрессируют оппортунистические инфекции, часто развивается пнев-
моцистная пневмония. У значительной части больных (40%) развивается
саркома Капоши, лимфома головного мозга.
11.6.3. Классификация ВИЧ-инфекции
Предложено несколько классификаций ВИЧ-инфекции. В России
используют клиническую классификацию, разработанную академиком
В.И. Покровским в 2001 г.
• Стадия инкубации.
• Стадия первичных проявлений. Варианты течения:
А. Бессимптомное течение.
Б. Острая ВИЧ-инфекция без вторичных заболеваний.
В. Острая ВИЧ-инфекция со вторичными заболеваниями.
• Латентная стадия.
• Стадия вторичных заболеваний.
А. Потеря массы тела меньше 10%; грибковые, вирусные, бактериаль-
ные поражения кожи и слизистых оболочек; опоясывающий лишай;
повторные фарингиты, синуситы.
- Прогрессирование (на фоне отсутствия противоретровирусной
терапии, на фоне противоретровирусной терапии).
- Ремиссия (спонтанная, после ранее проводившейся противоре-
тровирусной терапии, на фоне противоретровирусной терапии).
Б. Потеря массы тела больше 10%; необъяснимая диарея или лихо-
радка, длящаяся дольше 1 мес; волосистая лейкоплакия; туберкулез
легких; повторные или стойкие вирусные, бактериальные, гриб-
ковые, протозойные поражения внутренних органов; повторный
или диссеминированный опоясывающий лишай; локализованная
саркома Капоши.
- Прогрессирование (на фоне отсутствия противоретровирусной
терапии, на фоне противоретровирусной терапии).
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 361
- Ремиссия (спонтанная, после ранее проводившейся противоре-
тровирусной терапии, на фоне противоретровирусной терапии).
В. Кахексия; генерализованные бактериальные, вирусные, прото-
зойные и паразитарные заболевания; пневмоцистная пневмония;
кандидоз пищевода, бронхов, легких; внелегочный туберкулез и
атипичные микобактериозы; диссеминированная саркома Капоши;
поражения центральной нервной системы различной этиологии.
- Прогрессирование (на фоне отсутствия противоретровирусной
терапии, на фоне противоретровирусной терапии).
- Ремиссия (спонтанная, после ранее проводившейся противоре-
тровирусной терапии, на фоне противоретровирусной терапии).
• Терминальная стадия.
Наряду с анализом клинической картины, объективный критерий оцен-
ки степени иммуносупрессии — абсолютное количество CD4+ Т-клеток.
Всеобщее признание, в том числе и в России, получила комплексная
клинико-иммунологическая классификация ВИЧ-инфекции, разрабо-
танная Центром по контролю и профилактике заболеваний США [Centerfor
Disease Control and Prevention’, MMWR 41 (RR-17):1-19,1992].
Клиническая категория А соответствует стадии первичных проявлений
ВИЧ-инфекции. Категория С — стадии вторичных заболеваний и разви-
тия СПИДа. Клиническая категория В выделена как промежуточная.
Категория А
Острая (первичная) ВИЧ-инфекция — синдром, проявляющийся лихо-
радкой, утомляемостью, слабостью, головной болью и похуданием, иногда
появлением миалгии, фарингита. Возникает персистирующая генерализа-
ция лимфаденопатии. Симптомы обычно развиваются спустя 2-4 нед после
инфицирования.
Клинические диагностические критерии — одно или несколько из при-
веденных ниже состояний:
• острая лихорадочная фаза или заражение ВИЧ в анамнезе;
• бессимптомная фаза ВИЧ-инфекции;
• персистирующая генерализованная лимфаденопатия.
Категория В
Это симптомы ВИЧ-инфекции у подростков и взрослых, сопровождаю-
щиеся следующими проявлениями:
• кандидозом, в том числе орофарингеальным;
• персистирующими, частыми, не поддающимися адекватному лечению
кандидозом и вульвовагинитом;
• среднетяжелой или тяжелой цервикальной дисплазией; раком шейки
матки in situ;
• лихорадкой выше 38,5 °C или диареей в течение 1 мес и дольше;
• волосатой лейкоплакией языка;
ГЛАВА 11
ЧАСТЬ 2
362 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• двумя эпизодами (или больше) заболеваний, вызываемых Herpes zoster
или поражением различных лимфатических узлов;
• идиопатической тромбоцитопенической пурпурой;
• листериозом;
• аднекситом, особенно в сочетании с абсцессами малого таза;
• периферической нейропатией.
Категория С
Клинические диагностические критерии:
• кандидоз пищевода, бронхов, трахеи и легких;
• рак шейки матки;
• диссеминированный и внелегочный кокцидиоидоз;
• внелегочный криптококкоз;
• хронический (дольше 1 мес) криптоспоридиоз;
• ЦМВ-инфекция (кроме поражений печени, селезенки и лимфатиче-
ских узлов), цитомегаловирусный ретинит (с потерей зрения);
• энцефалопатия, обусловленная ВИЧ;
• инфекция, вызванная вирусом простого герпеса (хронические язвы, не
заживающие дольше 1 мес, бронхит, пневмония и эзофагит);
• хронический изоспориоз длительностью больше 1 мес;
• саркома Капоши;
• лимфома Беркитта, В-клеточная лимфома, первичная лимфома ЦНС;
• диссеминированная и внелегочная инфекция, вызванная Mycobacterium
avium intracellulare',
• легочный и внелегочный туберкулез;
• диссеминированные и внелегочные инфекционные заболевания,
вызванные другими микобактериями;
• пневмоцистная пневмония;
• рецидивирующая пневмония; прогрессирующая мультифокальная лей-
коэнцефалопатия;
• рецидивирующий сепсис, вызванный Salmonella spp,\
• токсоплазмоз с поражением головного мозга;
• кахексия.
Больного, отнесенного к категории В или С, впоследствии нельзя отне-
сти к более легкой категории. В последние годы для оценки иммуноло-
гического статуса ВИЧ-инфицированных больных наряду с количеством
CD4+ Т-лимфоцитов определяют количество содержащихся в крови вирио-
нов или вирусную нагрузку.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 363
ГЛАВА 11
Таблица 11-20. Классификация ВИЧ-инфекции у взрослых и подростков (CDCJ992)
Содержание CD4* * Т-клеток Клинические категории
А острая (первичная) инфекция. Протекает бессимптомно или в виде ПГЛ В симптомы ни А ни С с синдром приобретенного иммунодефицита
> 500/мкл А1 В1 С1
200-499/мкл А2 В2 С2
< 200/мкл АЗ вз СЗ
Клинические категории Cl, С2, СЗ, а также АЗ и ВЗ относят к больным СПИДом; ПГЛ —
персистирующая генерализованная лимфаденопатия.
11.6.4. ВИЧ-инфекция у детей (табл. 11-21)
Клиническая картина у детей во многом зависит от стадии онтогенеза, на
которой происходит заражение внутриутробно или от возраста ребенка при
постнатальном заражении.
У детей выделяют два основных пути заражения ВИЧ:
• антенатальное заражение в эмбриональном периоде (трансплацен-
тарно);
• перинатальное заражение (с 28-й недели внутриутробной жизни, в
родах), постнатальное при вскармливании грудным молоком или
парентеральное.
Следствие трансплацентарного заражения плода — преждевременные
роды и недоношенность, а также развитие эмбриопатий. На это могут
указывать признаки внутриутробной гипотрофии плода, микроцефалия,
черепно-лицевой дисморфизм (гипертейлоризм, широкий выступающий
лоб, западающая спинка носа, выраженный желобок верхней губы), голу-
бые склеры, избыточный волосяной покров. У внутриутробно инфици-
рованных детей значительно чаще, чем в основной популяции, выявляют
врожденные пороки сердца и крупных сосудов, отсутствие почки, полисин-
дактилия, брадидактилия, обширные невусы, крипторхизм и др. К пере-
численным признакам эмбриопатии при ВИЧ-инфекции новорожденных
относят также рецидивирующую диарею, прогредиентные неврологические
симптомы в виде патологических рефлексов, парезов, моторных нару-
шений. В то же время при вертикальном трансплацентарном заражении
острый гриппо/мононуклеозоподобный синдром не развивается и крайне
редко возникает саркома Капоши.
При заражении плода в позднем пренатальном периоде или заражении
родившегося ребенка течение ВИЧ-инфекции во многом аналогично тече-
364 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 11-21. Классификация ВИЧ-инфекции у детей моложе 13 лет (CDC, 1994)
Иммуносупрессия Содержание CD4* Т-клеток в 1 мкл крови Клинические категории
Д01 года 1-5 лет 6-12 лет Н А В С
Отсутствует >1500 >1000 >500 Н1 А1 В1 С1
Умеренная 750-1499 500-999 200-499 Н2 А2 В2 С2
Тяжелая <750 <500 <200 НЗ АЗ ВЗ СЗ
Диагноз «синдром приобретенного иммунодефицита» устанавливают детям, имеющим по
совокупности симптомов клинические категории Cl. С2. СЗ, НЗ, АЗ, ВЗ, а также детям, у
которых диагностирована лимфоцитарная интерстициальная пневмония.
нию заболевания у взрослых. Однако незрелость иммунной системы у детей
способствует быстрой активации ВИЧ и более ранней клинической мани-
фестации. Быстрее наступает глубокая иммуносупрессия со значительным
снижением содержания CD4+ Т-клеток. В более ранние сроки возникает
недостаточность не только клеточного, но и гуморального иммунного отве-
та, истощается процесс антителообразования. Это определяет частоту реци-
дивирующих бактериальных инфекций. К наиболее частым возбудителям
относят стафилококки, пневмококки, гемофильную палочку, сальмонеллы.
У детей возникают гнойные отиты, менингиты, абсцедирующая пневмония
и другие тяжелые нагноительные процессы. Часто выявляют пневмоцист-
ную пневмонию, из вирусных инфекций — ЦМВ, герпетическую, паротит-
ную, инфекцию вирусом Эпштейна-Барр; из микозов — кандидоз. Большей
выраженности достигают изменения, связанные с прямым действием ВИЧ.
Это относится, прежде всего, к поражениям центральной нервной системы.
По мнению многих авторов, прогрессирующие неврологические нарушения
у детей по сравнению со взрослыми возникают чаще (у 50-80%).
К основным клиническим проявлениям ВИЧ-инфекции у детей отно-
сят персистирующую генерализованную лимфаденопатию, гепато- и спле-
номегалию, лихорадку, экзему, паротит, отит, синусит, анемию, задержку
умственного и физического развития, мышечную слабость, персистирую-
щую диарею, лимфоцитарную интерстициальную пневмонию, токсоплаз-
моз головного мозга (у детей старше 1 года), герпетические поражения
кожи и слизистых оболочек. В 1994 г. CDC была предложена классифика-
ция ВИЧ-инфекции у детей моложе 13 лет.
Категория Н соответствует бессимптомному течению ВИЧ-инфекции у
детей (моложе 15 мес), заразившихся перинатально.
Категория А — слабо выраженные симптомы первичных проявлений:
лимфаденопатия (лимфатические узлы крупнее 0,5 см больше чем в двух
областях), гепатомегалия, спленомегалия, дерматит, паротит, рецидиви-
рующие респираторные инфекции, синусит.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 365
Категория В (ни А ни С). Для нее характерны умеренно выраженные
симптомы:
• анемия, тромбоцито- и нейтропения (дольше 30 сут);
• бактериальная пневмония, менингит, сепсис (один эпизод);
• орофарингеальный кандидоз, персистирующий дольше 2 мес у детей
старше 6 мес;
• кардиомиопатия;
• инфекция ЦМВ у детей старше 1 мес;
• рецидивирующая или хроническая диарея;
• гепатит;
• рецидивирующий (более двух эпизодов в год) герпетический стоматит;
• герпетический бронхит, пневмония, эзофагит с началом не раньше 1 мес;
• опоясывающий герпес (больше одного эпизода);
• лейколимфосаркома;
• нефропатия;
• лихорадка, персистирующая дольше 1 мес;
• диссеминированная ветряная оспа;
• токсоплазмоз у ребенка старше 1 мес;
• лимфоцитарная интерстициальная пневмония или гиперплазия при-
корневых лимфатических узлов.
Категория С включает состояния, определяющие диагноз СПИДа:
• серьезные бактериальные инфекции, множественные или рецидиви-
рующие, не меньше двух раз за 2-летний период в виде септицемии,
пневмонии, менингита, остеомиелита, абсцессов различных органов
и полостей (за исключением отита, поверхностных кожно-слизистых
абсцессов);
• кандидозный эзофагит или легочный кандидоз;
• диссеминированный кокцидиоидоз;
• внелегочный криптококкоз;
• криптоспоридиоз и изоспоридиоз с диареей дольше 1 мес;
• ЦМВ-болезнь у ребенка старше 1 мес, исключая изолированные пора-
жения печени, легких или лимфатических узлов;
• энцефалопатия (прогрессирующие симптомы дольше двух месяцев при
отсутствии других заболеваний, кроме ВИЧ, а именно: приобретенная
микроцефалия, атрофия мозга у ребенка старше 2 лет, нарушение
интеллекта, парезы, патологические рефлексы, атаксия или нарушения
походки);
• герпес-вирусная инфекция с кожно-слизистыми язвами, персисти-
рующая дольше месяца, или бронхит, пневмония, эзофагит у ребенка
старше 1 мес;
• диссеминированный гистоплазмоз;
• саркома Капоши;
ГЛАВА 11
ЧАСТЬ 2
366 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• первичная лимфома головного мозга, лимфома Беркитта, В-клеточная
лимфома;
• диссеминированный или внелегочный туберкулез;
• диссеминированный атипичный микобактериоз с поражением нес-
кольких органов;
• пневмоцистная пневмония;
• прогрессирующая лейкоэнцефалопатия;
• сальмонеллезная рецидивирующия септицемия;
• токсоплазмоз головного мозга у ребенка старше 1 мес;
• синдром истощения при отсутствии заболеваний, сходных с ВИЧ-
инфекцией (стойкая потеря массы тела больше 10% от должного,
хроническая диарея в течение 30 сут, зарегистрированная интермит-
тирующая или постоянная лихорадка дольше 30 сут). При отсутствии
клинических проявлений у детей наличие выраженного иммунодефи-
цита или лимфоцитарной интерстициальной пневмонии позволяет
диагностировать СПИД.
Диагностика ВИЧ-инфекции у новорожденных (табл. 11-22) пред-
ставляет собой особую сложность. Это связано с тем, что трансплацентарно
ребенку могут передаться антитела к ВИЧ, однако передачи вируса при
этом может и не произойти. Таким образом, если у новорожденного обна-
ружены антитела к ВИЧ, это необязательно означает, что он инфицирован.
У 70-75% детей этой группы материнские анти-ВИЧ-антитела исчеза-
ют (или снижается их концентрация) примерно после 15-18-месячного
возраста, при этом лабораторных или клинических проявлений ВИЧ-
инфекции не наблюдается. Ребенку, рожденному ВИЧ-инфицированной
матерью, полное клиническое и лабораторное обследование необходимо
провести сразу после родов и далее в динамике.
У новорожденных, для того чтобы отличить материнские антитела от
обусловленных инфицированием ребенка, проводят определение в сыво-
ротке крови специфичных IgA- и IgM-антител, которые не проходят через
плаценту. Однако отсутствие этих антител не позволяет сделать оконча-
тельных выводов об инфицированности новорожденного. Окончательный
диагноз ВИЧ-инфекции у ребенка, родившегося от инфицированной мате-
ри, устанавливают только при выявлении анти-ВИЧ-антител после 18 мес.
Поскольку у части детей появление собственных антител к возбудителю
может задерживаться, серологические тесты повторяют каждые 3-6 мес.
Для ранней диагностики ВИЧ-инфекции у младенцев можно исполь-
зовать тесты на обнаружение антигенемии (выявление р24 в сыворотке
крови) и полимеразную цепную реакцию (ПЦР). Следствием высокой
чувствительности ПЦР является сравнительно высокая частота ложно-
положительных результатов. Высокоинформативный метод — выделение
ВИЧ-культуры in vitro.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 367
ГЛАВА 11
Таблица 11-22. Диагностические тесты для выявления ВИЧ-инфекции у новорожденных
и детей первого года жизни [Рахманова А.Г., 1997]
Тесты Их оценка
ВИЧ-культура Специфичный высокоинформативный тест
Определение анти-ВИЧ IgG-антител Положительный результат в первые 9 мес (иммунофермент- ный анализ, иммуноблот) может быть связан с выявлением материнских антител
Выявление р24-антигена Специфичность около 65%
Определение анти-ВИЧ IgM-антител Специфичность около 65%
Полимеразная цепная реакция Высокоспецифична и чувствительна после 2 мес жизни
Определение анти-ВИЧ IgA-антител Высокочувствительный тест, но не в первые 2-3 мес жизни
Поликлональная гиперглобули- немия С первых месяцев жизни, не специфична
Лейкопения, тромбоцитопения С первых месяцев жизни, не специфична
Уменьшение количества CD4+ Т-клеток и отношения CD47CD8T Т-лимфоцитов С первых месяцев жизни, не специфична
При отсутствии клинических признаков ВИЧ-инфекцию можно исклю-
чить у детей, имеющих два или более отрицательных теста определения
ВИЧ-культуры или ПЦР в возрасте 1 мес и 4 мес либо два или более отри-
цательных результата определения анти-ВИЧ-антител в возрасте старше
6 мес (при условии, что гипогаммаглобулинемия на момент определения
антител у ребенка отсутствует).
11.6.5. Диагностика ВИЧ-инфекции
Диагностика ВИЧ-инфекции требует комплексного подхода и должна
включать определение совокупности эпидемиологических, клинических и
лабораторных критериев.
Клинические критерии:
• указание на недавно перенесенное острое заболевание с гриппо- или
мононуклеозоподобным синдромом;
• лихорадка длительностью больше 1 мес;
• увеличение лимфатических узлов двух и более групп дольше 1 мес;
• необъяснимое снижение массы тела больше чем на 10%;
• затяжные и рецидивирующие или не поддающиеся обычному лечению
пневмонии;
• затяжные и рецидивирующие гнойно-бактериальные, паразитарные
заболевания, сепсис;
ЧАСТЬ 2
368 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• подострый энцефалит с развитием слабоумия у ранее здоровых лиц;
• ворсистая лейкоплакия языка;
• рецидивирующие пиодермии;
• хронические воспалительные заболевания половой системы у женщин
неясной этиологии;
• признаки ряда заболеваний (саркома Капоши, лимфома мозга,
Т-клеточный лейкоз, легочный и внелегочный туберкулез, гепатит В,
гепатит С, HBs-носительство, анемии разного генеза, кандидоз пищевода,
глубокие микозы, заболевания, передающиеся половым путем, и др.).
Эпидемиологические критерии:
• наркоманы;
• би- и гомосексуалы, лица, ведущие беспорядочную половую жизнь;
• реципиенты, получающие повторные переливания крови и ее компо-
нентов;
• некоторые профессиональные группы населения, участвующие в обсле-
довании на ВИЧ или работающие с контаминированным материалом;
• дети, рожденные от ВИЧ-инфицированных матерей;
• доноры крови, плазмы, спермы и других биологических жидкостей и
тканей (перед каждым получением материала);
• беременные при постановке на учет.
Согласно существующему законодательству, тестирование на ВИЧ-
инфекцию проводят строго добровольно и оно требует обязательного
письменного согласия с проведением дотестового и послетестового кон-
сультирования обследуемого. Обязательному медицинскому освидетель-
ствованию на наличие ВИЧ-инфекции подлежат следующие группы лиц:
• доноры крови, спермы и других биологических жидкостей, тканей и
органов;
• медицинский персонал центров по профилактике СПИДа и лаборато-
рий по диагностике ВИЧ-инфекции;
• иностранные граждане, прибывшие на срок больше 3 мес.
Для постановки диагноза необходимо лабораторное определение специ-
фических маркеров ВИЧ, среди которых выделяют обязательные и допол-
нительные.
Специфические лабораторные маркеры ВИЧ-инфекции
• Обязательные — определение анти-ВИЧ-антител.
О Выявление методом иммуноферментного анализа антител к gpl20,
gp41, gpl20/160 и др. Твердофазный ИФА — наиболее распро-
страненный метод лабораторного обнаружения анти-ВИЧ-антител,
чувствительность и специфичность которого достигают 99%.
Ложноположительные результаты могут быть обусловлены наличи-
ем у обследуемого пациента аутоиммунной патологии, беременно-
стью и рядом других причин.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 369
<>- Определение методом иммуноблота антител к двум и более анти-
генам ВИЧ. Иммуноблоттинг — качественный метод, позволяющий
выявить антитела одновременно к ряду антигенов ВИЧ.
• Дополнительные — определение антигенов ВИЧ.
о Определение ВИЧ в лимфоцитах методом ПЦР.
<> Определение р24-антигена методом ИФА.
•Ф* Выделение ВИЧ в культуре in vitro.
Неспецифические лабораторные маркеры
• Уменьшение количества CD4+ Т-клеток.
• Снижение иммунорегуляторного индекса (соотношение CD4+/
CD8+ Т-клеток) меньше 1.
• Гипергаммаглобулинемия.
• Увеличение уровня циркулирующих иммунных комплексов.
• Лейкопения, лимфопения, тромбоцитопения, анемия.
Антитела к ВИЧ появляются у 90-95% инфицированных в течение 3 мес
после заражения, у 5-9% — через 6 мес после заражения и у 0,5-1% — в
более поздние сроки. Наиболее ранний срок обнаружения антител — 2 нед
после заражения, однако он встречается крайне редко.
Антигенные маркеры ВИЧ выявляются в крови значительно раньше.
Так, начиная со 2-й по 8-ю неделю после заражения выявляют белок р24.
При получении положительных результатов в тест-системах данного типа
нужно провести обследование на антитела к ВИЧ. Одновременное опреде-
ление анти-ВИЧ-антител и антигенов значительно сокращает период
«серонегативного окна».
В России принято 3-этапное выявление антител к ВИЧ. Отрицательный
этап скрининговой ИФА-диагностики считают окончательным. Поло-
жительный результат ИФА требует двойной проверки с использованием
тест-систем другой серии. Дважды отрицательный результат считается
окончательным. При повторном положительном результате ИФА необ-
ходимо исследование методом иммуноблота на целлюлозной мембране.
Обнаружение антител к двум или трем антигенам вируса (основные анти-
гены gp41, gpl20 и их предшественник gpl60) служит основанием для того,
чтобы лабораторно подтвердить диагноз ВИЧ-инфекции. Определение в
иммуноблоте антител к какому-либо одному белку вируса расценивают как
сомнительный результат, что делает необходимым динамический контроль
через 3 и 6 мес.
К методам специфической диагностики ВИЧ-инфекции относят также
ПЦР. Выявление в 1 мл крови меньше 500 копий вирусной РНК свидетель-
ствует о существенном ограничении инфекционного процесса, от 500 до
99 000 — об умеренной его интенсивности, а выявление 100 000 и больше
копий в 1 мл — об активном процессе репликации возбудителя.
ГЛАВА 11
ЧАСТЬ 2
370 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ПЦР имеет большое значение, когда тесты на антитела к ВИЧ и
антигены дают отрицательный результат, иными словами, в латентный
период заболевания. ПЦР можно использовать, например, для установ-
ления диагноза у детей, рожденных от ВИЧ-инфицированных матерей.
Материнские антитела циркулируют в крови ребенка до 15-18 мес, а ПЦР
позволяет обнаружить ВИЧ уже на 1-м месяце жизни. Кроме того, ПЦР
можно использовать, чтобы количественно оценить активность инфек-
ционного процесса по числу вирусных копий РНК (уровень вирусной
нагрузки). В разные периоды инфекционного процесса уровни анти-ВИЧ-
антител и вирусной нагрузки значительно меняются. Лабораторные мето-
ды определения специфических маркеров ВИЧ используются не только
для постановки диагноза, но и для оценки активности процесса, прогно-
зирования течения заболевания, определения объема и эффективности
противовирусной терапии.
Достоверный лабораторный признак ВИЧ-инфекции — выделение и
идентификация культуры ВИЧ. Однако этот метод требует длительного
времени, специального оборудования, высокой квалификации исполни-
телей и проводится в специализированных лабораториях в сложных для
диагностики случаях.
Для оценки степени иммунной недостаточности у больных ВИЧ-ин-
фекцией важно контролировать показатели иммунного статуса.
Первостепенное значение имеет определение количества CD4+ Т-лим-
фоцитов, так как именно они являются основными клетками-мишенями для
вируса и именно их повреждение определяет глубину иммуносупрессии.
Для ВИЧ-инфекции характерны следующие изменения в иммунограм-
ме (табл. 11-23):
• снижение соотношения CD4+/CD8+ Т-клеток меньше 1;
• гипергаммаглобулинемия (повышение концентрации IgA, IgM, IgG)
или гипогаммаглобулинемия в терминальной стадии;
• увеличение концентрации циркулирующих иммунных комплексов;
• снижение продукции цитокинов;
• ослабление ответа лимфоцитов на антигены и митогены.
Однако эти изменения неспецифичны для ВИЧ-инфекции и могут воз-
никать и при других заболеваниях.
Для ВИЧ-инфекции характерны также изменения ряда других лабо-
раторных показателей: анемия, лимфо- и лейкопения, тромбоцитопения,
повышение уровня Р2-микроглобулина и СРБ, повышение активности
трансаминаз в сыворотке.
В заключение следует подчеркнуть, что для окончательной постановки
диагноза необходимо комплексное клиническое и лабораторное обследо-
вания.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 371
ГЛАВА 11
Таблица 11-23. Иммунологические показатели при ВИЧ-инфекции
Стадия процесса Иммунологические показатели
Заражение Появление антител к р24, др120 и др41; повышение количе- ства CD8* * Т-клеток; обнаружение антигена р24
Латентный период Наличие антител к р24, др120, др41; гипергаммаглобулинемия; ослабление ответа на антигены
Персистирующая генерализован- ная лимфаденопатия Наличие антител к др120 и др41; ослабление функций макро- фагов и моноцитов, NK-клеток; снижение соотношения CD47 CD8* Т-клеток ниже 1
СПИД-связанный комплекс Снижение концентрации антител к др120, др41; значительное уменьшение количества CD4+ Т-клеток
Синдром приобретенного имму- нодефицита (СПИД) Снижение концентрации антител к р24; появление антигена р24; резкое уменьшение количества CD4+ Т-клеток (меньше 200/мкл); гипогаммаглобулинемия
11.6.6. Лечение ВИЧ-инфекции
Современное лечение ВИЧ-инфекции имеет несколько основных направ-
лений.
• Специфическая антиретровирусная терапия.
• Химиопрофилактика и специфическое лечение вторичных заболева-
ний.
• Патогенетическое лечение, направленное на коррекцию иммунной
недостаточности.
Специфическая антиретровирусная терапия
Основные цели терапии: снижение смертности больных, снижение
частоты случаев СПИД-связанных заболеваний, восстановление иммуните-
та, достижение максимального подавления репликации вируса. Требования
при выборе антиретровирусной терапии: эффективность, удобство приема
и краткосрочная переносимость, долгосрочная переносимость и сопут-
ствующие заболевания, возможность перевода в дальнейшем на другие
препараты.
К основным препаратам этой группы относят ингибиторы обратной
транскриптазы. Первый опыт применения зидовудина в качестве моно-
терапии показал быстрое развитие вирусной резистентности к этому пре-
парату. В дальнейшем было выявлено быстрое развитие устойчивости
ВИЧ, когда использовались моновалентные схемы терапии. В настоящее
время используют комбинированную терапию. Обоснован новый подход к
лечению ВИЧ-инфекции, названный высокоактивной антиретровирусной
терапией (ВААРТ), которая включает три лекарственных средства и более.
Это дает возможность полностью подавить репликацию ВИЧ и уменьшить
количество копий его РНК в крови у абсолютного большинства пациентов
ЧАСТЬ 2
372 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
до неопределяемого уровня, замедлить развитие устойчивости ВИЧ к пре-
паратам. При этом базовым лекарственным средством остается зидовудин.
Однако приблизительно у половины пациентов наблюдают «возврат
вируса», что в значительной степени связано со сложностью соблюдения
режима приема нескольких лекарственных средств и формированием
лекарственной устойчивости ВИЧ.
Чтобы преодолеть эту проблему, разработаны новые, более удобные
для приема комбинированные формы препаратов: комбивир* (зидову-
дин + ламивудин), калетра* (лопинавир + ритонавир), тризивир* (абака-
вир + ламивудин + зидовудин) и др. Перед назначением высокоактивной
антиретровирусной терапии обязательно проводят психосоциальное кон-
сультирование.
Кроме того, пациент должен иметь хорошую мотивацию, быть достаточ-
но информированным и психологически подготовленным к проведению
длительной комбинированной терапии.
При развитии устойчивости ВИЧ возникает необходимость заменить
лекарственный препарат или всю схему лечения. Для выбора оптимальной
схемы показано лабораторное тестирование на резистентность ВИЧ к анти-
ретровирусным препаратам с использованием генотипических и фенотипи-
ческих методов. Эти методы не позволяют определить меру устойчивости,
а лишь свидетельствуют о возможном ее наличии.
На сегодняшний день антиретровирусную терапию начинают при содер-
жании в крови СП4+-клеток менее 350/мкл, при наличии клинических
симптомов, свидетельствующих об иммунодефиците и уровне вирусной
нагрузки, превышающий 100 000 копий/мл. Дополнительным критерием
служит уменьшение количества лимфоцитов в периферической крови ниже
1000-1200/мкл.
Основной критерий оценки эффективности антиретровирусной тера-
пии — уменьшение вирусной нагрузки до неопределяемого уровня; допол-
нительные — увеличение количества CD4+ Т-лимфоцитов, а также положи-
тельная клиническая динамика.
Успешный результат научных разработок последних лет — расширение
арсенала химиопрепаратов для лечения ВИЧ-инфекции. На современном
этапе в качестве антиретровирусных препаратов используют следующие
группы лекарственных средств:
• нуклеозидные ингибиторы обратной транскриптазы;
• ингибиторы обратной транскриптазы ненуклеозидной природы;
• ингибиторы протеазы ВИЧ;
• ингибиторы фузии (слияния);
• ингибиторы рецептора CCR5;
• ингибиторы созревания;
• ингибиторы интегразы.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 373
Нуклеозидные ингибиторы обратной транскриптазы
Препараты этой группы действуют как антиметаболиты. Механизм
их действия основан на блокировании транскрипции РНК ВИЧ в про-
вирусную ДНК, которая осуществляется с помощью фермента обрат-
ной транскриптазы. В процесс транскрипции вовлекаются аналогичные
(модифицированные) нуклеозиды, обратная транскриптаза «стопорится»
на антиметаболите, и полимеризация нуклеотидов в цепь ДНК останав-
ливается.
Аналоги тимидина
Азидотимидин* (зидовудин, ретровир*); аналоги азидотимидина отече-
ственного производства — тимазид* (зидовудин, зидо-ейч), фосфазид
(никавир*, таблетки по 0,2 г). Форма выпуска: капсулы по 100 мг и таблетки
по 300 мг. Азидотимидин* назначают внутрь. Суточная доза для больных с
массой тела 60 кг и выше составляет 600 мг. В виде сиропа азидотимидин*
используют в педиатрической практике в дозе 10 мг/кг. Препарат рекомен-
дуют в виде внутривенных капельных инфузий для профилактики верти-
кальной передачи ВИЧ во время родов.
Ставудин (зерит*). Предпочтительно использовать у пациентов с анеми-
ей. Форма выпуска: таблетки и капсулы по 15, 20, 30 и 40 мг.
Аналоги цитидина
Ламивудин (эпивир*). Выпускают в таблетках по 150 мг и в виде сиропа
для детей (10 мг/мл) применяют 2 раза в день. Особенность препарата —
быстрое развитие резистентности к нему.
Аналоги аденина
Диданозин (видекс*). Капсулы 125,200,250,400 мг, жевательные таблет-
ки по 100 мг. Суточная доза у больных с массой больше 60 кг — 400 мг 1 раз
в сутки; массой меньше 60 кг — 250 мг 1 раз в сутки. Не применяют в соче-
тании со ставудином ввиду усиления нейротоксичности.
Аналоги гуанина
Абакавир (зиаген*) обладает избирательным противовирусным действи-
ем по отношению к ВИЧ-1 и ВИЧ-2, включая штаммы ВИЧ-1, резистент-
ные к зидовудину, ламивудину, диданозину, невирапину. Препарат обладает
аддитивным действием в комбинации с диданозином, ламивудином и ставу-
дином. Абакавир проникает через гематоэнцефалический барьер и снижает
уровень вирусной РНК в спинномозговой жидкости, что может иметь зна-
чение для предотвращения неврологических осложнений ВИЧ-инфекции.
Выпускают препарат в таблетках по 300 мг и в виде раствора для приема
внутрь по 240 мл (100 мг в 5 мл). К абакавиру в 4-9% случаев может раз-
виться реакция гиперчувствительности в первые 6 нед от начала лечения,
обусловленная генетической предрасположенностью (HLA В570Г), кото-
рую можно выявить с помощью генетического тестирования.
ГЛАВА 11
374 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Ингибиторы обратной транскриптазы ненуклеозидной природы
Механизм их действия, в отличие от нуклеозидных ингибиторов, заключа-
ется в прямом блокировании фермента без встраивания в провирусную ДНК.
Невирапин (вирамун*). У препарата отмечаются нежелательные явления
в виде аллергических реакциий и гепатита. В связи с возможностью разви-
тия угрожающего жизни поражения печени препарат назначают женщинам
с уровнем CD4+ клеток больше 250/мл, а мужчинам — 250 клеток в мл и
меньше. Форма выпуска: таблетки по 200 мг, суспензия по 200 мл во флако-
не. Суточная доза составляет 400 мг в один прием.
Эфавиренз (стокрин*). Активен в отношении ВИЧ-1. Стокрин* — препа-
рат, относящийся к I линии в лечении ВИЧ-инфекции. В России стокрин*
входит в схему лечения более, чем у половины больных. Форма выпуска:
капсулы по 50,100, 200 и 600 мг.
Этравирин (интеленс*). Форма выпуска — таблетки по 100 мг. Назначают
по 2 таблетки 2 раза в сутки во время еды.
Ингибиторы протеазы
Протеаза ВИЧ участвует в формировании зрелого вириона. Ингибиторы
протеазы делают процесс репликации незавершенным.
Саквинавир (инвираза*®) — один из первых протеазных ингибиторов.
Форма выпуска: таблетки по 500 мг. Суточная доза составляет 2 г (по 1 г
2 раза в сутки во время еды). Назначают одновременно с ритонавиром.
Ритонавир (норвир*) — наиболее активный ингибитор протеазы.
Используют в качестве бустера для атазанавира, дарунавира и других
лекарственных средств как препарат, улучшающий их фармакодинамику.
Форма выпуска: таблетки и капсулы по 100 мг. Принимают по 100 мг 2 раза
в сутки во время или после еды.
Индинавир (криксиван*) хорошо сочетается со всеми нуклеозидными
ингибиторами обратной транскриптазы. Форма выпуска: капсулы по 200 и
400 мг. Принимают по 800 мг 3 раза в сутки натощак или через 1-2 ч после
еды.
Нелфинавир (телзир*). Используют у детей первых 5 лет жизни и бере-
менных.
Ампренавир (агенераза*). Форма выпуска — капсулы по 50, 150 мг и
раствор для приема внутрь 15 мг/мл. Суточная доза не должна превышать
1,2 г/сут. Взрослым назначают по 1,2 г 2 раза в сутки.
Атазанавир (реатаз*) можно принимать один раз в сутки, что принципи-
ально отличает его от других ингибиторов протеазы. Выпускают в капсулах
по 150 и 200 мг. Практически лишен недостатков протеазных ингибиторов
и в отличие от них не оказывает негативного действия на липидный обмен.
Используют вместе с бустером ритонавиром. В дозе 400 мг применяют без
бустера.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 375
Дарунавир (презиста*) — препарат И линии. Используют у резистентных
к другим ингибиторам протеазы больных. Форма выпуска в таблетках по
300 мг. Суточная доза равна 1,2 г по 2 таблетке (300 мг) 2 раза в сутки во
время еды вместе с бустером ритонавиром.
Лопинавир + ритонавир (калетра*) — основной препарат, разрешенный
для применения у беременных и женщин, планирующих беременность.
Форма выпуска — таблетки, суточная доза — по 2 таблетки 2 раза в сутки.
При первом назначении лечения разрешено применять 1 раз в сутки
4 таблетки.
Фосампренавир (телзир*). Форма выпуска — таблетки по 700 мг. Прием
не зависит от приема пищи. Суточная доза 1,4-2,8 г на фоне приема рито-
навира.
Ингибиторы фузии (слияния)
Механизм действия препаратов этой группы связан с нарушением «под-
тягивания» вирусной частицы к лимфоциту.
Единственный представитель этой группы, разрешенный к клиническо-
му применению, — энфувиртид (фузеон*). Энфувиртид — препарат И линии
для больных, которые не имеют возможности использовать формы для
приема внутрь при кандидозе пищевода, нейроинфекции и т.д. Выпускают
в растворимой форме для подкожного введения. Доза — по 0,9 г 2 раза в
сутки; возможны местные реакции, не являющиеся показанием для отмены
препарата.
За рубежом зарегистрирован еще один препарат — маравирок^.
Ингибиторы интегразы
Ралтегравир (исентресс*). Форма выпуска — таблетки по 400 мг.
Принимают 2 раза в сутки по 1 таблетке. Независимо от приема пищи.
Антагонисты CCR5
За рубежом зарегистрирован антагонист — маравирок^. Препарат отно-
сят к потенциально эффективной терапии в будущем. В России не зареги-
стрирован.
Ингибиторы созревания
Бевиримат*’ — препарат в России не зарегистрирован.
В настоящее время, основываясь на достаточно длительном опыте при-
менения антиретровирусных препаратов и данных катамнеза, предпочти-
тельным считают индивидуализацию назначения этих препаратов. Это обу-
словлено в первую очередь повышенным риском развития сопутствующих
заболеваний и увеличением возраста пациентов с ВИЧ-инфекцией.
Российские критерии антиретровирусной терапии (2009)
Клинические — терапия показана независимо от числа CD4+ Т-лимфоци-
тов и уровня РНК ВИЧ. Это стадия вторичных заболеваний 4Б в фазе про-
ГЛАВА 11
ЧАСТЬ 2
376 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
грассирования и стадия 4В. Кроме того, стадия первичных проявлений при
наличии вторичных заболеваний — 2В.
При отсутствии клинических проявлений вторичных заболеваний или
при минимальных проявлениях учитывают показатели лабораторных
исследований. Количество CD4+ Т-лимфоцитов меньше 200 клеток в мкл,
сохраняющихся в течение 3 мес на стадии первичных проявлений 2А;
меньше 350 клеток в мкл на стадии первичных проявлений 2Б; субклини-
ческой стадии — стадии 3 и стадии вторичных заболеваний — 4А, 4Б в фазе
ремиссии.
Уровень РНК ВИЧ больше 100 000 копий при количестве
CD4+ Т-лимфоцитов 351-500/мкл на стадии 3 и стадии вторичных заболе-
ваний 4А, 4Б в фазе ремиссии.
11.6.7. Химиопрофилактика и специфическое лечение
вторичных заболеваний
Помимо специфической терапии ВИЧ-инфекции, актуальна проблема
лечения сопутствующих оппортунистических инфекций и злокачественных
новообразований. В связи с развитием иммунодефицита они выступают на
передний план и играют главную роль в исходе основного заболевания. До
90% летальных исходов прямо или косвенно обусловлено оппортунистиче-
скими инфекциями и вторичными заболеваниями.
Для профилактики пневмоцистной пневмонии (при содержании
CD4+ Т-клеток меньше 200 в 1 мкл) и ее лечения используют бисептол*,
септрин*®, а при их непереносимости — дапсон, пентамидин®. Можно
также использовать комбинации дапсона с триметопримом, примахина с
клиндамицином. При грибковых поражениях используют амфотерицин В,
кетоконазол, флуконазол.
Людям с положительной реакцией Манту (для ВИЧ-инфицированных —
больше 5 мм) проводят химиопрофилактику туберкулеза изониазидом. В
развернутых стадиях туберкулеза используют сочетания стрептомицина,
рифампицина, изониазида, этамбутола. Если содержание СП4+-клеток
меньше 100/мкл, для профилактики атипичного туберкулеза назначают
рифампицин.
При токсоплазмозе применяют пириметамин в комбинации с сульфа-
диазином или клиндамицином.
При ЦМВ-инфекции используют ганцикловир и фоскарнет натрия.
Для лечения инфекций, вызванных вирусом простого герпеса,
используют ацикловир, а при устойчивости к нему — фоскарнет.
Бактериальные инфекции требуют проведения комплексной антибио-
тикотерапии, рассчитанной на широкий круг условно-патогенных и пато-
генных микроорганизмов, включая анаэробы. В настоящее время крайне
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 377
актуальна проблема туберкулеза при ВИЧ-инфекции, требующая своих
методов лечения.
При ВИЧ-связанных онкологических поражениях кожи, мозга и вис-
церальных органов проводят противоопухолевую терапию. Перечень важ-
нейших проявлений СПИДа включает саркому Капоши, неходжкинскую
лимфому, первичную лимфому мозга и карциному цервикального канала
шейки матки. Для их лечения применяют химиотерапию (винкристин, блео-
мицин, циклофосфамид и другие препараты в комбинации или в качестве
монотерапии), рентгенотерапию, иммунотропные препараты (интерферон,
колониестимулирующие факторы), а также хирургическое лечение при
цервикальной карциноме.
11.6.8. Патогенетическая терапия, направленная
на коррекцию иммунной недостаточности
Это направление в лечении ВИЧ-инфекции пока находится в стадии
научных разработок. Препараты, усиливающие пролиферативную актив-
ность клеток иммунной системы, в настоящее время не используются,
поскольку они неизбежно усиливают репликацию ВИЧ (например, пре-
параты тимуса и стимуляторы лейкопоэза). Однако эффективны иммуно-
тропные средства, преимущественно заместительного действия, в первую
очередь препараты интерферона.
Препараты интерферона, наряду с антиретровирусными лекарственны-
ми средствами, используются в качестве основных противовирусных препа-
татов для лечения герпетической инфекции у ВИЧ-инфицированных. Они
обладают универсально широким спектром противовирусной активности и
не вызывают развития резистентности у возбудителей.
Наиболее часто при ВИЧ-инфекции используются препараты рекомби-
нантного а2-интерферона [реаферон* (интерферон альфа-2Ь), реальдирон*
(интерферон альфа-2Ь), роферон* (интерферон альфа-2а), интрон-А*®
и др.)], природного человеческого p-интерферона (ферон*®, фрон** и др.).
Для коррекции гематологических осложнений этиотропной антиретрови-
русной терапии, в частности, при анемии используют эритропоэтин* (эпоэ-
тин бета), при лейкопении — филграстим (гранулоцитарный колониести-
мулирующий фактор) и сарграмостим*’ (гранулоцитарно-макрофагальный
колониестимулирующий фактор).
В комплексное лечение оппортунистических инфекций бактериальной
природы включают заместительную терапию иммуноглобулинами. Более
эффективны препараты для внутривенного введения: сандоглобулин*®,
интраглобин*, октагам*, цитотект* (иммуноглобулин человека антицито-
мегаловирусный), иммуноглобулин человека нормальный и др.
ГЛАВА 11
378
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
11.6.9. Профилактика заражения вирусом
иммунодефицита человека
Предотвращение передачи вируса иммунодефицита человека
половым путем
Поскольку даже одного полового контакта с инфицированным партне-
ром иногда бывает достаточно для передачи вируса, рекомендуется соблю-
дать следующие правила профилактики:
• необходимо сократить число сексуальных партнеров;
• нужно интересоваться прошлыми половыми контактами сексуальных
партнеров и их отношением к наркотикам;
• следует интересоваться состоянием здоровья партнеров (ранее полу-
ченные гемотрансфузии и т.д.);
• нужно использовать презервативы, значительно уменьшающие риск
передачи ВИЧ.
Чтобы уменьшить риск полового заражения, рекомендуется применять
антиретровирусные препараты только в экстренных случаях (например,
при разрыве презерватива), так как эффективность химиопрофилактики
полового заражения не доказана. Можно использовать следующую схему:
не позднее чем через 72 ч после возможного заражения начать прием ази-
дотимидина перорально по 0,2 г 3 раза в сутки в течение 4 нед.
Предотвращение передачи вируса при инъекциях наркотиков
Профилактика этого пути передачи складывается из борьбы с наркома-
нией как таковой и с работой в среде наркозависимых. В некоторых странах
лицам, употребляющим наркотики внутривенно, рекомендуют отказаться
от наркотических средств и пройти курс лечения, а при некурабельной
зависимости — использовать непарентеральные пути введения препаратов
(вдыхание, курение, прием внутрь), не пользоваться одним шприцем и
иглой с другими лицами, раствор наркотика перед введением кипятить в
индивидуальной посуде. Необходимо объяснять также опасность заразить
другого половым путем, советовать заниматься только защищенным сексом
и использовать презервативы.
Профилактика парентеральной передачи вируса иммунодефици-
та человека в медицинских учреждениях
Чтобы предотвратить передачу ВИЧ от доноров в стадии «серонегатив-
ного окна» и отсутствия специфических антител, введены более строгие
критерии их отбора (исключают наркоманов, гомосексуалистов), а также
введено отсроченное переливание крови после повторной проверки донора
(предусмотрено хранение плазмы с запретом ее использования на протя-
жении 180 сут).
Чтобы исключить передачу ВИЧ через медицинские инструменты, необ-
ходимо соблюдать правила дезинфекции медицинских инструментов или
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 379
использовать одноразовые инструменты. Дезинфекции подлежат пред-
меты, постоянно соприкасающиеся с кожей, например стетоскопы, кото-
рые следует очищать с помощью мыльного раствора или раствора этано-
ла. Медицинские инструменты, используемые для инвазивных процедур
(скальпели, иглы, ларингоскопы, гибкие эндоскопы, влагалищные зеркала,
стоматологические боры и т.д.), необходимо стерилизовать либо применять
методы высокоинтенсивной химической дезинфекции после каждого кон-
такта с больным. Химическую дезинфекцию как самостоятельный метод
применяют для обработки инструментов только в крайнем случае. При
этом необходимо предварительно удалять загрязнения, так как дезинфици-
рующие растворы не могут проникать в некоторые органические вещества.
Чаще всего для высокоинтенсивной дезинфекции применяют замачивание
продолжительностью не менее 30 мин в 2% растворе глутаральдегида или
в 6% растворе перекиси водорода. Стерилизация сухим горячим воздухом
подходит для обработки инструментов, которые могут выдерживать тем-
пературу 170 °C в течение 2 ч. Дезинфекцию кипячением в течение 20 мин
следует применять только в том случае, если невозможно осуществить сте-
рилизацию паром или горячим воздухом.
Для обеззараживания объектов окружающей среды используют раствор
этанола и хлорсодержащие соединения (гипохлорит натрия, гипохлорит
кальция, хлорамин). Места, запачканные кровью, сначала протирают
впитывающим материалом (который потом замачивают на 10 мин в дезин-
фицирующем растворе), затем проводят химическую дезинфекцию поверх-
ности.
Рекомендации по предупреждению заражения вирусом иммуноде-
фицита человека медицинского персонала на рабочем месте
Не исключен риск заражения ВИЧ врачей и медицинских сестер, кото-
рые выполняют инвазивные процедуры, связанные с нарушением целост-
ности кожных покровов. Во время работы медперсонал иногда получа-
ет микротравмы (уколы контаминированными иглами, порезы и т.д.).
Быстрое развитие эпидемии ВИЧ-инфекции повышает вероятность того,
что медработник будет оказывать помощь ВИЧ-инфицированному пациен-
ту, не зная об этом.
Медработники, контактирующие с потенциально или заведомо инфи-
цированными пациентами или материалом от них, должны пользоваться
защитной одеждой, перчатками, при необходимости — защитными очками,
экранами, производить забор крови, используя вакутайнер.
В случае повреждения (укол, порез) нужно принять срочные меры. При
повреждении кожи — обработать кожу 70% этанолом, выдавить кровь,
промыть место повреждения проточной водой с мылом, повторно обрабо-
тать его 70% этанолом и смазать рану 5% спиртовым раствором йода.
При попадании заразного материала в ротовую полость — прополоскать
рот 70% этанолом; в глаза — промыть водой, а затем закапать раствор
ЧАСТЬ 2
380 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
альбуцида. При необходимости — в носовые ходы закапывают 1% раствор
протаргола* (серебра протеинат).
Кроме того, в аварийном случае необходимо не позже чем через 72 ч
начать посттравматическую профилактику антиретровирусными препа-
ратами и продолжать ее в течение 4 нед. В настоящее время используют
либо комбинацию трех антиретровирусных препаратов, либо монотерапию
зидовудином перорально по 0,2 г каждые 3 ч (8 раз в сутки) в течение 4 нед,
фосфазидом — по 0,4 г 2 раза в сутки. После курса посттравматической
профилактики проводят ежеквартальное тестирование на антитела к ВИЧ
в течение 1 года.
Предотвращение вертикальной передачи вируса иммунодефици-
та человека
Для профилактики вертикального пути инфицирования необходимо:
• двукратно обследовать беременных на наличие ВИЧ;
• назначить антиретровирусные препараты ВИЧ-инфицированным
беременным на период беременности и родов;
• назначить антиретровирусные препараты новорожденному;
• запретить естественное вскармливание ВИЧ-инфицированным мате-
рям;
• отдать предпочтение естественному способу родоразрешения.
ВИЧ-инфицированная женщина имеет право самостоятельно принять
решение о сохранении беременности либо ее прерывании.
При сохранении беременности ВИЧ-инфицированным женщинам необ-
ходимо проводить химиопрофилактику перинатальной передачи ВИЧ во
время беременности и родов, что уменьшает вероятность инфицирования
ребенка до 1-2%. При этом пациентке предлагают подписать информиро-
ванное согласие на проведение химиопрофилактики.
Поскольку органогенез происходит до 10-12-й недели внутриутробно-
го развития, рекомендуют начать прием антиретровирусных препаратов
не раньше 14-й недели беременности, а наиболее целесообразным счи-
тают проведение химиопрофилактики после 28-й недели беременности.
Показание к ранней химиопрофилактике — острая стадия ВИЧ-инфекции.
Во время беременности можно использовать следующие препараты:
зидовудин, фосфазид, ламивудин, невирапин, санквинавир + ритонавира,
калетру*.
Чтобы уменьшить риск передачи ВИЧ от матери к ребенку во время
родов, разработана схема химиопрофилактики с использованием азидо-
тимидина и/или невирапина: новорожденному, начиная с 8-го часа после
рождения, показан ретровир* (зидовудин) в сиропе до 6-й недели жизни
или суспензии невирапина один раз в сутки в течение трех суток с интерва-
лом 24 ч. Если введение антиретровирусных препаратов не было начато в
первые 3 сут после рождения, начинать их прием на более поздних сроках
нецелесообразно.
ИММУНОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ 381
Во время родов нежелателен длительный безводный период (> 4 ч), так
как риск инфицирования при этом повышается в 2 раза. При живом плоде
не рекомендуют родовозбуждение, перинео(эпизио)томию, наложение
акушерских щипцов, вакуум-экстракцию и т.д. Эти процедуры повы-
шают риск инфицирования плода и их применение возможно лишь по
жизненным показаниям. Плановое кесарево сечение можно использовать
как самостоятельный метод профилактики при родах. Однако решение о
способе родоразрешения принимают индивидуально с учетом акушерских
показаний.
11.6.10. Проблема создания вакцины против вируса
иммунодефицита человека
Во многих странах мира проводятся интенсивные исследования в этом
направлении. Несмотря на это, до настоящего времени эффективная вакци-
на против ВИЧ не создана. Сложности обусловлены сильнейшей изменчи-
востью вируса и его способностью внедряться в геном клетки-хозяина.
Проведенные к настоящему времени научные исследования позволили
определить антигены ВИЧ, которые наиболее перспективны для разработ-
ки вакцины. При создании вакцины получают рекомбинантные иммуноген-
ные структуры, тестируют различные адъюванты и разрабатывают схемы
иммунизации. К настоящему времени созданы следующие кандидатные
вакцины против ВИЧ:
• субъединичные вакцины на основе белков и гликопротеинов gpl20
и gpl60, полученные путем культивирования вируса в различных
системах (клетки дрожжей, насекомых и млекопитающих); например
вакцина AIDSVAX, содержащая gpl20;
• вакцины на основе вирусных векторов, в качестве которых используют
вирус оспы канареек, рекомбинантный аденовирус, модифицирован-
ный вирус осповакцины и др. Преимущество этих вакцин — индукция
ответа СП8+-ЦТЛ;
• ДНК-вакцины, не имеющие клеточного субстрата;
• вакцины на основе ДК перспективны в качестве лечебных, так как они
позволяют стабилизировать вирусную нагрузку без дополнительного
использования антиретровирусных препаратов;
• рекомбинантные вакцины на адъювантах. Примером такой вакцины
может служить отечественная вакцина ВИЧРЕПОЛ (консервативные
антигены ВИЧ-1, конъюгированные с иммуностимулятором полиок-
сидонием);
• ремун — инактивированная вакцина из цельного вируса, лишенного
gpl20, — предложена для иммунотерапии ВИЧ-инфицированных
больных.
ГЛАВА 11
ЧАСТЬ 2
382 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Как считают эксперты Всемирной организации здравоохранения, быстрое
решение вопроса о создании эффективной вакцины затруднительно ввиду
патогенетических и эпидемиологических особенностей ВИЧ.
Вопросы для самоконтроля
• Приведите современную классификацию ПИД. Отразите роль отече-
ственных ученых.
• Охарактеризуйте наиболее распространенные инфекционно-
воспалительные заболевания, связанные с ПИД.
• Назовите заболевания неинфекционной природы у больных ПИД.
• Охарактеризуйте основные клинические проявления у больных ПИД с
преимущественным поражением Т-лимфоцитов.
• Охарактеризуйте основные клинические проявления у больных ПИД с
преимущественным поражением В-лимфоцитов.
• Охарактеризуйте основные клинические проявления у больных ПИД с
комбинированным поражением Т- и В-лимфоцитов.
• Охарактеризуйте основные клинические проявления у больных ПИД
с нарушениями врожденного иммунитета (фагоцитов, комплемента,
цитокинов, TLR).
• Перечислите синдромы ПИД с хорошо охарактеризованными клини-
ческими признаками.
• Охарактеризуйте основные клинические и лабораторные подходы к
диагностике ПИД.
• Опишите основные современные принципы лечения больных ПИД.
• Дайте определение приобретенным (вторичным) иммунодефицитам и
охарактеризуйте основные их формы.
• Охарактеризуйте иммунопатогенез ВИЧ-инфекции/СПИД.
• Принципы иммунодиагностики и иммунокоррекции при ВИЧ-
инфекции/СПИД.
• Современные подходы к созданию вакцин против ВИЧ.
Глава 12
Аллергические заболевания
Аллергические заболевания — одна из главных проблем здо-
ровья в развитых индустриальных странах. В разных странах до
20-30% населения болеют аллергическими заболеваниями. Только
бронхиальной астмой (БА) и атопическим дерматитом страда-
ют 10-15% детей во всём мире. Пищевую аллергию выявляют у
4-5% людей в популяции.
Во всём мире обращают пристальное внимание на рост числа
аллергических заболеваний. Иногда им придают «эпидемический»
статус. Наибольшие усилия направляют на исследование дет-
ской аллергии, БА, анафилаксии и лекарственной аллергии (ЛА).
Выявляют рост числа пациентов, страдающих аллергией к пище-
вым продуктам, у которых развился эозинофильный эзофагит и
эозинофильный колит. Становятся все более распространенными
такие заболевания, как аллергия к арахису и другим орехам, коро-
вьему молоку, рыбе и другим пищевым аллергенам.
При этом выявляют неожиданные перекрестные аллергические
реакции. Например, обнаружен новый аллерген а-галактозид,
содержащийся в лекарственном средстве цетуксимабе (препарат
на основе моноклональных антител против лигандсвязывающего
домена рецептора эпидермального фактора роста, используемый
при лечении больных раком) и в мясных продуктах.
В последние годы наблюдается значительный прогресс в изуче-
нии механизмов развития аллергопатологии. Благодаря достиже-
ниям в области клеточной, молекулярной и генетической иммуно-
логии и аллергологии раскрыт иммунопатогенез многих аллергиче-
ских болезней, в частности атопической природы. Их определяют
как болезни иммунной системы, возникающие в результате IgE-
опосредованной гиперчувствительности к аллергену. Одним из
наиболее эффективных методов лечения аллергии стала АСИТ.
Основную эффекторную роль в аллергической реакции отводят
тучным клеткам и базофилам, высвобождающим медиаторы с
384 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
повреждающим действием на органы и ткани-мишени. Большое внимание
уделяют изучению роли рецепторов врожденного иммунитета в патогене-
зе аллергопатологии. Множество факторов, влияющих на формирование
аллергии, охарактеризованы далее.
Помимо этого, выделяют псевдоаллергические заболевания (астма физи-
ческой нагрузки, холодовая астма, «аспириновая астма», идиопатическая
крапивница и многие другие), когда аллерген отсутствует или выявить его
не удается.
Первичный контакт с аллергеном обусловливает развитие иммунного
ответа и сенсибилизацию, тогда как последующие воздействия аллергена в
очень низких концентрациях приводят к развитию заболевания, в первую
очередь атопической природы.
Несколько терминов, имеющих отношение к аллергопатологии.
• Австрийский детский врач К. Пирке (Clemens Freiherr von Pirquet, 1874-
1929) предложил в 1906 г. термин «аллергия» (греч. alios — другой +
ergon — действие).
• Американский исследователь А. Кока (Arthur Fernandes Coca; 1875-
1959) в 1922 г. ввел термин «атопия» (греч. a topia — нечто необыч-
ное, странное, чужеродная болезнь). А. Кока ввел также термин «ато-
пические антитела» (теперь IgE-антитела), был первым в получении и
классификации аллергенов.
• Французский физиолог Ш. Рише (Charles Robert Richet, 1850-1935)
открыл вместе с П. Портье (Paul Jules Portier, 1866-1968) иммунную
анафилактическую реакцию (греч. апа — усиление + hylaxis — защита)
на чужеродный белок. В 1913 г. Ш. Рише присуждена Нобелевская
премия «за исследование анафилаксии».
12.1. АЛЛЕРГЕНЫ
Аллергенами называют антигены и гаптены, способные вызывать
аллергическую реакцию. Термин «аллергены» используют для обозначения
молекул, которые вызывают образование IgE у генетически предрасполо-
женных индивидуумов. Термин «аллерген» — аналог термина «антиген»,
обозначающего молекулы, которые вызывают синтез иммуноглобулинов
или клеточный иммунный ответ. Большинство аллергенов — белки с моле-
кулярной массой 10-70 кДа.
Аллергенность — особое свойство антигена (аллергена), результатом
распознавания которого служит индукция IgE-ответа. Несмотря на то что
проблема «аллергенности антигена» крайне важна для понимания возник-
новения аллергии, до сих пор нет надежных методов, позволяющих пред-
сказать аллергенность того или иного белка и таким образом идентифи-
цировать его как аллерген. Для этого важно учитывать многие параметры:
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 385
структуру и функции аллергена, факторы носителей аллергена, внешней
среды и восприимчивости человека.
На сегодняшний день нельзя считать до конца понятными механиз-
мы, благодаря которым молекулы действуют именно как аллергены.
Аллергенные молекулы имеют свои структурные особенности и, вероятно,
особенности превращения в организме при их переработке либо взаимо-
действии с эндогенными молекулами.
Аллергены являются Т-клеточными антигенами. Т-клеточные эпито-
пы — короткие пептидные фрагменты, в пределах 12-13 аминокислотных
остатков, тогда как В-клеточные эпитопы — специфические последователь-
ности аминокислотных остатков, определяющие трехмерную конфигура-
цию молекулы. Перекрестная антигенная активность обусловлена струк-
турной гомологией молекул аллергенов разного происхождения.
Факторы аллергенности
• Структурные (пространственные) характеристики аллергенов, степень
N-гликозилирования.
• Генетическая предрасположенность определенных лиц к формирова-
нию IgE-ответа.
• Особенности переработки поступающего в организм (и на поверх-
ностные ткани — слизистые оболочки, кожу) материала, обладающего
аллергенными свойствами.
• Способ процессирования антигена (аллергена) в антигенпрезентирую-
щих клетках, что может повлиять на характер последующего ответа и
синтез IgE.
• Биохимическая (ферментативная) активность аллергенного материа-
ла. Эта активность может, с одной стороны, повышать аллергенный
потенциал всей молекулы, влияя на характер ее превращения по пути
проникновения через поверхностные барьерные ткани или на про-
цессирование молекулы в аллергенпрезентирующих клетках, а с дру-
гой — приводить к образованию новых молекул, которые затем могут
вовлекаться в индукцию IgE-ответа.
Номенклатура аллергенов
Впервые номенклатура аллергенов была опубликована под эгидой
Всемирной организации здравоохранения в 1986 г. В 1994 г. подкомитетом
по номенклатуре аллергенов Международного союза иммунологических
обществ (IUIS) была предложена унифицированная номенклатура, осно-
ванная на таксономическом названии рода и вида источника аллергенов.
В соответствии с данной номенклатурой сокращенное название аллергена
выглядит следующим образом: первые три буквы латинского названия
рода, первая буква вида, арабская цифра. Например, Dermatophagoides
farinae обозначают как Der f 1, изоформы аллергенов и их варианты —
ГЛАВА 12
ЧАСТЬ 2
386 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
дополнительными цифрами. Пример обозначения аллергенов: амброзии —
Amb а 1, Amb а 2 и т.д., березы — Bet v 1, Bet v 2 ... Bet v 7; кошки — Fel d 1,
Fel d 2, Fel d 3; собаки — Can f 1 и др.
Классификация аллергенов
Перечень известных в настоящее время аллергенов чрезвычайно раз-
нообразен. Существующие классификации не являются исчерпывающими,
поэтому одновременно используют разные классификации, в зависимости
от принципов группирования аллергенов.
• По происхождению: аллергены пыльцы растений, грибов, насекомых,
животных, лекарственные, пищевые и др.
• По способам поступления в организм: аэроаллергены (пыльцевые,
грибковые, инсектные, клещевые, антигены пыли, эпидермальные),
пищевые, контактные.
• По встречаемости в разных условиях: бытовые, профессиональные.
Такое деление аллергенов лишь несколько упорядочивает их рассмотре-
ние, однако следует помнить, что один и тот же аллерген можно отнести
к нескольким группам. Например, аллерген пыльцы березы — это в то же
время и аэроаллерген, латекс — одновременно и профессиональный, и
бытовой аллерген, а также аэроаллерген и контактный аллерген.
В 1994 г. в список аллергенов вошло 104 наименования, а уже в 2005 г. их
количество достигло 489, из них 86 аллергенов грибов.
Пыльцевые аллергены
Это аллергены растительного происхождения. Сенсибилизирующим
действием обладает пыльца ветроопыляемых растений: культурных зла-
ков и луговых трав, деревьев, сорных трав и садовых цветов, фруктовых
деревьев и ряда культивируемых растений. В последние годы появляются
сообщения о том, что аллергенными свойствами может обладать пыльца
домашних растений. Например, в некоторых странах в домашних усло-
виях выращивают фиговое дерево. Отмечают перекрестную реактивность
между пыльцой фигового дерева и его плодами (инжир). Аллергенными
свойствами обладают также плоды, листья и даже стебли растений. У вер-
тоопыляемых растений цветки мелкие без запаха, пыльца легкая и гладкая.
У растений, опыляемых насекомыми, цветки яркие, с приятным запахом,
пыльца крупная и клейкая.
Пыльца — совокупность пыльцевых зерен (мужские гаметофиты).
Каждое пыльцевое зерно имеет внутренний (интима) и внешний (экзима)
слой. У разных видов пыльцы экзима различна за счет углублений и утол-
щений, выростов, пиков, зубчиков. Наибольшее значение имеют борозды:
их число и характер расположения — наследственный видовой признак.
Аллергенные свойства связаны с экзимой пыльцы, а также с ее рибосо-
мальными и митохондриальными компонентами. В химической структуре
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 387
аллергенов пыльцы выделяют соединения белков с углеводами, фермента-
ми, пигментами и даже с гормонами пыльцы.
Аллергенность пыльцы обусловлена белками, входящими в ее состав.
Выделяют несколько групп пыльцевых аллергенов: это аллергены пыльцы
• злаковых трав: тимофеевки, ежи сборной, лисохвоста, пырея, овсяни-
цы и др.;
• культурных злаков: овса, пшеницы, ячменя, ржи, кукурузы;
• культурных растений: сахарной свеклы, клевера, щавеля, подсолнеч-
ника и т.д.;
• деревьев: дуба, клена, ольхи, орешника, березы, тополя, осины, сосны,
ели, липы и т.д.;
• сорняков: одуванчика, амброзии, подорожника, крапивы, полыни,
лебеды и т.д.;
• фруктовых деревьев: яблони, вишни, груши и т.д.; аллергены пыльцы
садовых цветов: маргариток, роз, тюльпанов, нарциссов, лилий и т.д.
Однако пыльца не всех видов растений вызывает аллергические заболе-
вания. Она должна обладать следующими свойствами:
• принадлежать к ветроопыляемым растениям;
• продуцироваться в большом количестве, способном вызвать сенсиби-
лизацию организма;
• быть легкой и летучей;
• иметь круглую форму и размеры 25-35 мкм;
• принадлежать к широко распространенным в зоне проживания боль-
ного растениям;
• обладать выраженными аллергенными свойствами.
Степень выраженности аллергенных свойств пыльцы зависит от:
• метеорологических условий (максимальная концентрация пыльцы в
воздухе — с 4 до 8 ч утра в сухой солнечный день);
• возраста пыльцы (свежая пыльца обладет максимальной активно-
стью).
Пыльца содержит «фактор проницаемости», необходимый при опы-
лении; однако он также играет важную роль при проникновении пыльцы
сквозь эпителий слизистых оболочек дыхательных путей больного. Для
каждого географического региона характерен свой «график пыления». В
средней полосе выделяют три пика пыления растений:
• весенний (середина апреля — конец мая) — пыление деревьев (береза,
ольха, дуб, ясень);
• летний (начало июня — конец июля) — пыление злаков (рожь, тимо-
феевка, ежа, лисохвост);
• летне-осенний (конец июля — начало октября) — пыление сорных
трав (полынь, лебеда).
ГЛАВА 12
ЧАСТЬ 2
388 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
В связи с разностью климатических условий в Европе выделяют три
периода поллинации растений, отличающихся от российских:
• ранняя зима (декабрь — март) — пыление деревьев;
• поздний весенне-летний (апрель — июль) включает в себя и период
цветения с марта по май. Это время пыления садовых цветов и злаков.
• летне-осенний (август — октябрь) — пыление злаков и второй период
цветения деревьев.
Во многих странах мира оборудованы специализированные лаборатории
для сбора и анализа пыльцы растений, находящейся в воздухе. В Москве
такая лаборатория расположена в здании МГУ на Воробьевых горах.
Данные о концентрации пыльцы растений в воздухе публикуются регу-
лярно, и чувствительные больные могут с ними ознакомиться. Пыльцевой
мониторинг — необходимая составная часть оказания помощи больным с
сенсибилизацией к пыльце растений.
Пищевые аллергены
Ими могут быть любые продукты питания или вещества, образующие-
ся при их переваривании, кулинарной обработке, длительном хранении.
Некоторые авторы выделяют две группы пищевых аллергенов:
• облигатные аллергены 1-й группы: кофе, какао, шоколад, цитрусовые,
клубника, земляника, куриные яйца, мясо курицы, мед, рыба, икра,
крабы, раки;
• облигатные аллергены 2-й группы: молоко, морковь, свекла, томаты,
гречневая крупа и т.д.
Считают, что наиболее выраженной аллергенной активностью обладают
продукты белкового происхождения (гликопротеиды с молекулярной мас-
сой 18-40 кДа). Жиры, углеводы, микроэлементы реже вызывают симпто-
мы пищевой аллергии.
С практической точки зрения многие отечественные авторы выделяют три
группы пищевых аллергенов по степени их аллергизирующей активности:
• высокая — коровье молоко, рыба, яйцо, цитрусовые, орехи, мед, грибы,
куриное мясо, клубника, малина, земляника, ананасы, дыня, хурма,
гранаты, черная смородина, ежевика, шоколад, кофе, какао, горчица,
томаты, морковь, свекла, сельдерей, пшеница, рожь, виноград;
• средняя — персики, абрикосы, красная смородина, клюква, рис, куку-
руза, гречиха, перец зеленый, картофель, горох, свинина, индейка,
кролик;
• слабая — кабачки, патиссоны, репа, тыква (светлых тонов), кисло-
сладкие яблоки, бананы, миндаль, белая смородина, крыжовник,
чернослив, слива, арбуз, салат, конина, баранина.
По данным многих авторов, у детей первых лет жизни наиболее часто при-
чиной развития желудочно-кишечных и кожных проявлений аллергии ста-
новится употребление коровьего молока, сои, яиц, рыбы, мяса курицы и т.д.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 389
Коровье молоко. Известно, что белков в коровьем молоке содержится
в четыре раза больше, чем в грудном молоке женщин (соответственно 3,3%
и 0,7%). Всего в состав коровьего молока входит больше 20 разных белков,
способных вызывать гуморальный ответ у человека. Наиболее важные
антигенные фракции — а-лактоальбумин, р-лактоглобулин, казеин, липо-
протеины.
Яйцо кур. Антигенность белка в 50 раз выше в сравнении с желтком.
Аллергические реакции могут возникать при употреблении яиц разных
птиц, но чаще возникает аллергия на антигены куриного яйца.
Рыба и продукты из рыбы. К наиболее распространенным и сильным
аллергенам относят белки рыб. Большинство антигенных компонентов
белков рыбы не разрушается при кулинарной обработке. Среди антигенов
рыб наибольшей сенсибилизирующей активностью обладают протеины
паральбумина саркоплазмы, особенно М-паральбумин. М-паральбумин
при термической обработке образует летучие фракции, способные попадать
в организм ингаляционным путем.
Семейство злаковых. Содержание белка в зерновых колеблется в
широких пределах -5,3-12 г на 100 г продукта. Больше всего белка содер-
жится в гречневой и овсяной, меньше — в ржаной крупе. В связи с этим наи-
более часто аллергию вызывают овес, пшеница, рис, ячмень, реже — рожь.
Семейство бобовых. Бобовые содержат около 30 антигенов. Основные
представители — бобы, горох, гуар (входит в состав жевательной резинки),
земляной орех (орехи, ореховое масло), соя (детское питание, мука, соевый
сыр).
Семейство пасленовых. Представители — картофель, баклажан, перец,
томат и др. Картофель теряет аллергенность при термической обработке.
Семейство розоцветных. К ним относят землянику, клубнику, малину,
абрикос, вишню, айву.
Цитрусовые: апельсины, лимоны, мандарины. Считают, что вареные
ягоды и фрукты не вызывают аллергии.
Перекрестно реагирующие пищевые аллергены
Выделяют три группы перекрестно реагирующих пищевых аллергенов
(по наличию или отсутствию клинических симптомов).
• Перекрестно реагирующие аллергены, вызывающие отчетливые кли-
нические симптомы.
0 Аллергия на один вид рыбы дает основания утверждать, что воз-
можна перекрестная реакция на многие другие виды рыб.
О Аллергия на креветки часто сочетается с выявлением перекрестной
реактивности по отношению к крабам, омарам, устрицам. Более того,
у таких пациентов могут развиваться аллергические реакции в ответ
на укусы насекомых и на клещей домашней пыли. Такой широкий
спектр перекрестной реактивности возможен за счет тропомиозина,
обнаруживаемого у клещей и в морепродуктах. Поскольку у клещей
ГЛАВА 12
ЧАСТЬ 2
390 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
это не основной аллерген, то при наличии у ребенка основной сенси-
билизации к клещам домашней пыли он может употреблять в пищу
креветки. Наоборот, при основной сенсибилизации ребенка к тропо-
миозину креветок очень велика вероятность развития перекрестной
респираторной аллергии к клещам домашней пыли.
> Хорошо известно сочетание пищевой аллергии на яблоко и пыльцу
березы. Этот феномен называют «березово-фруктовым синдро-
мом». Наличие сенсибилизации к аллергенам березы (поллиноз)
дает основание исключить из питания в период поллинации ряд
фруктов и овощей. Помимо яблок, к таким продуктам относят абри-
косы, бананы, морковь, сельдерей, вишню, фенхель, лесной орех,
киви, грушу, картофель, малину, клубнику, грецкий орех.
О Другой частый синдром — «птица-яйцо». Этот синдром проявляет-
ся пищевой аллергией на яйцо кур и респираторной аллергией при
вдыхании аллергенов птиц (перо подушки).
• Перекрестно реагирующие аллергены, не всегда вызывающие клини-
ческие симптомы.
О Сочетание перекрестной аллергии на пыльцу трав (поллиноз) и пище-
вой аллергии на фрукты, овощи и злаки, такие, как миндаль, абрико-
сы, вишня, киви, дыня, персики, слива, томаты, арбуз, пшеница.
<> Аллергены фруктов, содержащих цистеин (киви, ананас, папайя) и
аллергены домашней пыли.
о Синдром «латекс-фрукты». Из латекса производят игрушки для
детей, надувные шары, хирургические перчатки, презервативы и
другие изделия. Латекс служит причиной широкого распростране-
ния аллергических реакций на фрукты и овощи.
• Перекрестно реагирующие аллергены, не вызывающие клинических
проявлений. В этих случаях только in vitro можно выявить IgE-антитела
к аллергенам, имеющим общие детерминанты.
Кроме того, при аллергии на коровье молоко возможны перекрестные
реакции на телятину, говядину, шерсть коровы. По данным литературы,
у больных с пищевой аллергией к яйцу могут развиться аллергические
реакции при введении некоторых вакцин (против клещевого энцефалита,
желтой лихорадки, гриппа и др.), содержащих примеси тканей куриного
эмбриона или различных частей плодного яйца. При аллергии к конине
возможно развитие тяжелых аллергических реакций на введение лошади-
ной противодифтерийной и других сывороток, используемых с лечебными
и профилактическими целями.
В последние годы особую актуальность приобретает проблема аллер-
генности трансгенных пищевых продуктов. Возрастающее число пищевых
трансгенных зерновых культур обусловливает необходимость оценивать
аллергенность продуктов, прежде чем ввести их в пищевую цепочку чело-
века.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 391
Бытовые аллергены
Это аллергены домашней пыли, пера подушки, библиотечной пыли.
Аллергены домашней пыли весьма разнообразны по своему составу. В них
входят вещества животного, растительного происхождения, продукты жиз-
недеятельности грибов, насекомых, бактерий. Основная составная часть
домашней пыли — клещи рода Dermatophagoides, особенно активно размно-
жающиеся в октябре и марте-апреле.
Аллергенная активность домашней пыли обусловлена многокомпонент-
ным ее составом: это обрывки тканых волокон, эпителий и волосы чело-
века, шерсть и слюна комнатных животных, частицы тел и экскременты
насекомых, споры грибов, бактерий. По химическому составу аллергены
домашней пыли — смесь кислых полисахаридов (85-88%) и полипептидов
(12-15%). Основной аллергенный компонент домашней пыли - клещи
(живые, мертвые, их линные шкурки, экскременты). В настоящее время
описано шесть основных семейств клещей домашней пыли.
Таблица 12-1. Клещи домашней пыли
ГЛАВА 12
Семейство Роды и виды
Acaridae Acarus siro, Aleuroglyphus ovatus. Tyrophagus putrescentiae, Suidasia medanensis/ponifica
Echimyopodidae Blomia tropicalis, Austroglycyphagus malaysiensis/geniculata
Glicyphagidae Glycyphagus domesticus, Lepidoglyphus destructor
Pyroglyphidae Dermatophagoides pteronyssinus, Dermatophagoides farinae, Dermatophagoides vicroceras, Euroglyphus maynei, Sturnophagoides brasiliensis, Malayoglyphus intermedius
Cheyletidae Cheyletus sp.
Tarsonemidae Tarsonemus sp.
Среди клещей домашней пыли основную массу составляют клещи семей-
ства Pyroglyphidae (Dermatophogoides pteronyssinus, Dermatophogoides farinae).
Это микроскопические клещи размером 0,1-0,3 мм. Основное место их раз-
множения и обитания — постель. Клещей выявляют в основном в матрасах,
перьевых подушках, коврах, мягкой мебели, одежде и т.д. Питательный
материал для них — чешуйки слущенного эпидермиса человека и животных,
отсюда название этого рода — Dermatophagoides («питающийся кожей»).
Численность пироглифидных клещей в домашней пыли непостоянна и
ЧАСТЬ 2
392 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
существенно изменяется в течение года. Как правило, отмечают один или
два периода подъема численности клещей. Так, например, в пыли квартир
в Москве зарегистрированы 2 периода нарастания их численности: летом-
ранней осенью и зимой, когда численность клещей может достигать 10 700
в 1 г пыли.
Помимо пироглифидных клещей, в помещениях обитают клещи амбарно-
зернового комплекса: Acares siro — мучной клещ, tyrophagus putrescentiae —
зерновой клещ, Glycyphagus domesticatecae и др. Среда обитания этих кле-
щей — влажные дома, помещения для животных. Пищей для них служат
злаки, мука, грибы. Предрасполагающие факторы к сенсибилизации аллер-
генами клещей амбарно-зернового комплекса — профессия, высокая влаж-
ность в квартире, наличие подстилки из некоторых материалов (соломы)
для домашних животных.
К потенциально аллергенным клещам относят также D. microceras,
Euroglyphus maynei, 'tyrophagus putrescentiae, Austroglycyphagus malaysiensis,
Stumophagoides brasiliesis. Однако степень чувствительности и уровень IgE-
антител, специфичных к их аллергенам, не высоки.
Попадают клещи в разные помещения преимущественно антропохор-
ным путем, т.е. при помощи человека: с мебелью, на верхней и нижней
одежде, мягких игрушках и т.д. Самка клеща откладывает 20-40 яиц; про-
должительность ее жизни 2-5 мес. Жизненный цикл включает 5 фаз: яйцо,
личинку, протонимфу, тритонимфу и половозрелых особей (самка, самец).
Иногда при неблагоприятных условиях протонимфа может не линять в
тритонимфу, а переходить в фазу покоящейся протонимфы (не питается и
имеет сниженный метаболизм). В таком состоянии она может находиться
довольно долго и продолжить свой цикл развития при наступлении благо-
приятных условий. Сроки развития разных видов пироглифид варьируют
от 20 до 53 сут. Наиболее благоприятные условия для развития клещей —
температура 25±2 °C, относительная влажность 70-80% и влажность суб-
страта 10-14%.
При сенсибилизации к аллергенам клещей домашней пыли возможны
перекрестные реакции на аллергены морепродуктов (рыбы, креветок), а
также аллергены тропических плодов (киви, папайя, ананасы).
Эпидермальные аллергены
Они могут входить в состав домашней пыли или иметь самостоятельное
значение в развитии клинической картины аллергических заболеваний.
К ним относят перхоть человека, лошади, свиньи; шерсть собаки, кошки,
кролика, морской свинки, мыши, овцы, козы и т.д.
Инсектные аллергены
Это аллергены насекомых, входящие в состав их слюны, яда и тела.
Аллергическая реакция возникает при укусах, вызванных перепончатокры-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 393
лыми, двукрылыми и клопами; при контакте с выделениями и частями тел
насекомых либо при вдыхании этих частиц.
Насекомые, вызывающие аллергические реакции
Класс Insecta (насекомые), отряды:
• Orthoptera (кузнечики, саранча);
• Trihoptera (ручейники);
• Blattoptera (тараканы, сверчки);
• Hemiptera (клопы);
• Echemenoptera (поденки, майские жуки, веснянки);
• Homoptera (тли, цикады, белокрылки);
• Coleoptera (жуки);
• Lepidoptera (бабочки, мотыльки, моль);
• Diptera (мухи, комары, мотыли);
• Heminoptera (пчелы, муравьи).
По способу попадания аллергена в организм выделяют несколько путей
сенсибилизации.
• Парентеральный
о С ядом при ужалениях.
•О Со слюной (секретом слюнных желез) при укусах насекомых.
• Ингаляционный. При попадании чешуек тел и метаболитов инсект-
ного происхождения в составе домашней пыли. Известна ингаляцион-
ная форма аллергии к хитиновому покрову тараканов и перепончато-
крылых.
• Контактный. При непосредственном контакте с насекомыми, в част-
ности с представителями отрядов Blattoptera (тараканы), Lepidoptera
(бабочки), Trichoptera (ручейники) и др.
Все виды насекомых по способу попадания их аллергенов в организм
человека условно можно разделить на две большие группы:
• жалящие — представители отрядов Hymenoptera (пчелы, осы, муравьи
и др.);
• нежалящие — представители отрядов Lepidoptera (бабочки), Dyctioptera
(тараканы), Diptera (комары, мухи), Ortoptera (кузнечики, сверчки),
Ephemenoptera (майская муха), Coleoptera (жуки), Siphonoptera (блохи),
Trihoptera и др. Среди нежалящих насекомых тоже можно условно
выделить группы:
О некусающие {Chironomide — мотыль и др.);
о кусающие {Cockroah — тараканы и др.);
о кровососущие {Mosquitoes —комары, москиты и др.).
Грибковые аллергены
В мире известно огромное количество видов грибов, способных сенси-
билизировать организм человека. Однако стандартные аллергены изго-
тавливаются только из 100 видов грибов [Фрадкин В.А., 1990]. К источ-
ГЛАВА 12
ЧАСТЬ 2
394 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
никам грибковых аллергенов относят Altemaria altemata (10 аллергенов),
Aspergillus fumigata (19 аллергенов), Aspergillus niger (4 аллергена), Candida
albicans (2 аллергена), Cladosporium herbarum (9 аллергенов), а также грибы
родов Penicillium и Malasseria. В изучении респираторной аллергии этио-
логически значимую роль играет не менее 80 родов грибов. Аллергенная
активность обнаружена более чем у 300 видов плесневых и дрожжеподоб-
ных грибов. Аллергенные свойства грибов определяются их компонента-
ми: белком цитоплазмы и кислыми гликопротеинами клеточной стенки.
Сенсибилизирующими свойствами обладают органы размножения грибов:
споры и конидии, а также молекулы, входящие в состав этих органов
(экзоферменты, вкусовые вещества, продукты метаболизма, ферруканин и
др.). Роль основного аллергена выполняют споры грибов, находящиеся в
атмосфере, входящие в состав домашней пыли, вегетирующие на коже и в
кишечнике в качестве сапрофитов.
Наиболее часто состояние гиперчувствительности у человека вызы-
вают плесневые грибы: фикомицеты (Mucor, Rhizopus и др.), аскоми-
цеты (Aspergillus, Pennicillium), дейтеромицеты (Altemaria, Cladosporium,
Fusarium),
Cladosporium spp, по численности превосходят все классы грибов. Их
споры широко распространены повсюду, имеют сухую дисперсию; пик
спорообразования наблюдается в июле-сентябре. Наиболее детально
исследованы два представителя этого вида — Cladosporium cladosporoides,
Cladosporium herbatum.
Altemaria spp. В сухие дни поздним летом и осенью в 1 м воздуха обитает
от 500 до 1000 спор A. altemata (A. tenuis) и A. tenuissima. Особенно их много
в областях, где в изобилии произрастают злаковые. Споры и обрывки
мицелия A. tenuis обнаруживаются в воздухе лесной зоны. Они составляют
20-80% всех грибных спор в зависимости от времени года. Они весьма
часто могут встречаться и в воздухе закрытых помещений, их обнаружи-
вают на оконных рамах, в комнатах с плохой вентиляцией, где образуется
водный конденсат. Черная пятнистость томатов может быть обусловлена
альтернарией.
Rhisopus nigricans. Этот род часто связывают с мусором. Его находят на
кухнях, на незакрытом компосте. Споры его распространены повсеместно,
они весьма жизнеспособны, имеют сухую дисперсию.
Helmintosporium spp. Н. solani и Н. velutinum наносят большой ущерб карто-
фелю. Уровень реактивности кожи в ответ на экстракты Н. solani у больных
аллергией, проживающих в США, сравним с аллергизирующей активно-
стью Altemaria altemata.
Aspergillus spp. (в большинстве — сапрофиты). Их основная среда оби-
тания — сгнившие органические массы, влажные помещения, болотистые
местности, самая верхняя часть перегноя (где и происходит развитие гри-
бов). Количество колоний Aspergillus в помещениях превышает их число
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 395
на открытом воздухе. Аспергиллы выделены из различных текстильных
материалов: хлопка, пеньки, жгута. В цикле развития гриба есть стадия
спорообразования, и именно в этой стадии грибы проникают в респиратор-
ный тракт. Наиболее активно споры размножаются весной и осенью, имеют
сухую дисперсию.
Penicillium spp. Доминирование разновидностей пенициллов зависит от
конкретного места и обстановки. Они имеют сухую дисперсию спор, кото-
рые, как правило, обнаруживаются круглогодично.
Oomycetes spp. Различные виды пушистой плесени — в большинстве слу-
чаев облигатные паразиты. В регионах, где происходит инфицирование
трав и широколистных зерновых культур (особенно винограда и лука),
споры появляются в воздухе в сухую ветреную погоду. Частота воздействия
на людей не установлена, зарегистрированы отдельные случаи профессио-
нальной аллергии на Phitophthora infestans.
Дрожжи. Это гетерогенная группа грибов. Некоторые типы (Saccharomy-
ces cerevicae, пекарские дрожжи) формируют аскоспоры, другие (Cryptococ-
cus) размножаются почкованием и редко делением. Такое разнообразие
предполагает антигенную неоднородность дрожжей и различия в реактив-
ности кожи. Дрожжевые клетки обнаруживаются главным образом ночью
во время влажной погоды. Многие из них устойчивы к кислоте и повы-
шенному давлению, что позволяет им колонизировать бытовую технику,
промышленное оборудование, резервуары увлажнителей воздуха, конди-
ционеры и т.п. Пищевые дрожжи, прежде всего S. cereviciae, в редких слу-
чаях могут быть аллергеном для лиц, имеющих с ними профессиональный
контакт. Наиболее распространенны Candida albicans и Candida crusei. Их
обнаруживают на растениях, в почве, они входят в состав пищевых молоч-
ных продуктов с высоким содержанием сахара: в творожную массу, сырки,
мороженое. Нередко ими обсеменены фрукты, особенно яблоки, груши,
инжир, персики, сливы.
Единой классификации грибов нет. По сезонному характеру спорообра-
зования можно выделить две группы грибов:
• сезонные виды плесени с пиком спорообразования в июле-сентябре
(Cladosporium)\ в мае-сентябре (Altemaria)\
• круглогодичные (без четкой сезонности) Penicillium, Aspergillus и др.
В клинической практике врачи аллергологи-иммунологи часто приме-
няют более упрощенную классификацию, в которой все грибы подразделя-
ются на внедомашние и внутридомашние. В большинстве своем Altemaria и
Cladosporium — плесневые грибы, растущие на открытом воздухе; Aspergillus
и Penicillium растут в основном в помещении.
При аллергии к плесневым грибам возможны перекрестные реакции с
другими группами аллергенов. Перекрестные реакции возникают с пище-
выми аллергенами: пекарскими дрожжами, грибами, а также с продуктами,
ГЛАВА 12
ЧАСТЬ 2
396 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
приготовленными в процессах брожения (сыры, копченые рыба и мясо,
квашеная капуста, кефир и кисломолочные продукты), ферментированны-
ми напитками (вино, шампанское, пиво, квас), свежевыпеченным хлебом,
булочками. Кроме того, возможны перекрестные аллергические реакции с
лекарственными средствами — антибиотиками пенициллинового и цефало-
споринового ряда, витаминами группы В.
Аллергены гельминтов
Гельминты — облигатные паразиты человека и животных. Наиболее
аллергенными свойствами среди представителей этой группы обладают эхи-
нококки, трихинелла спиральная, аскариды и возбудители описторхоза —
кошачья или сибирская двуустка. В последнее время широко обсуждается
вопрос об аллергенной активности возбудителей токсокароза и лямблиоза.
Известно, что различные гельминты при паразитировании в организме
хозяина выделяют вещества, обладающие сенсибилизирующими свой-
ствами. У лиц, пораженных гельминтами (в первую очередь аскаридами),
уровень IgE в крови, как правило, во много раз выше, чем у здоровых
людей. Выраженность и характер аллергических реакций в разных стадиях
развития паразита различны. Было обнаружено, что основной антигенной
активностью обладают личинки и юные формы паразитов, а не взрослые
особи, хотя активность последних также очевидна. Кроме того, при эхи-
нококкозе и трихинеллезе может развиться сенсибилизация к продуктам
жизнедеятельности гельминтов. Значительные количества эндогенных
антигенов воздействуют на организм и при гибели паразитов в результа-
те дегельминтизации. В настоящее время гельминтам отводится роль не
столько носителей аллергенных свойств, сколько ингибиторов аллергиче-
ских процессов. Известно, что ряд факторов ТЬ2-клеток (например, ИЛ-13)
подавляют активность гельминтов.
Бактериальные аллергены
Выделяют бактериальные аллергены, связанные с Neisseria perflava,
Bacillus subtilis (алкалаза), Bacillus licheniformis (эспераза), Clostridium
histolyticum (коллагеназа) и др.
Лекарственные аллергены
К ним относятся химические, ферментные препараты и продукты гриб-
кового синтеза. Лекарственные препараты — в основном гаптены, которые
становятся истинными аллергенами только при конъюгации с белком-
носителем.
Промышленные аллергены
Промышленные аллергены выступают химическими и биологическими
загрязнителями среды. Среди химических веществ аллергенами являются
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 397
металлы и их соли, пестициды, синтетические полимеры. Они вызывают
профессиональные аллергические заболевания.
Вопросы для самоконтроля
• Дайте определение аллергенам.
• Что такое аллергенность и каковы факторы аллергенности?
• На каком основании построена номенклатура аллергенов?
• Каковы критерии классификации аллергенов?
• Назовите известные вам пыльцевые аллергены и их свойства.
• Укажите основные периоды поллинации растений в России.
• Какие пищевые продукты обладают наиболее выраженной аллерген-
ной активностью и чем это обусловлено?
• Назовите основные семейства клещей домашней пыли. К какому
семейству относятся клещи рода Dermatophagoides и каковы места их
обитания?
• Назовите аллергены плесневых грибов, наиболее часто вызывающих
состояния гиперчувствительности у человека. Охарактеризуйте их.
• Опишите эндогенные и экзогенные антигены гельминтов.
ГЛАВА 12
12.2. АЛЛЕРГО ДИАГНОСТИКА
К настоящему времени идентифицированы многочисленные медиаторы
аллергического воспаления такие, как ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-13,
опосредующие усиление синтеза IgE, гиперреактивность бронхов, избыточ-
ную продукцию слизи, а также способствующие вовлечению в хроническое
аллергическое воспаление эозинофилов и тучных клеток.
Другие медиаторы воспаления — хемокины — участвуют в процессах
активации и привлечения лейкоцитов. К ним относят эотаксины, RANTES,
моноцитарные хемоаттрактантные белки (МСР-2, МСР-3), TARC и др.
У больных с аллергией цитокиновый профиль Т-клеток преимуще-
ственно ТЬ2-типа. ИЛ-4 и ИЛ-13 стимулируют образование IgE; ИЛ-5 и
ИЛ-9 вовлечены в созревание эозинофилов; ИЛ-4 и ИЛ-9 способствуют
развитию тучных клеток; ИЛ-9 и ИЛ-13 участвуют в формировании гипер-
реактивности дыхательных путей; ИЛ-4, ИЛ-9 и ИЛ-13 способствуют
гиперпродукции слизи.
Для выявления различных типов аллергических реакций, лежащих в
основе целого ряда заболеваний, существуют специальные методы диагно-
стики как in vivo, так и in vitro (табл. 12-2).
398 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-2. Аллергодиагностика in vivo и in vitro
Тип аллергической реакции Заболевание Диагностика
in vivo in vitro
IgE- опосредован- ный (гиперчувстви- тельность немед- ленного типа) Аллергический ринит, аллергический конъюн- ктивит, бронхиальная астма, атопический дерматит, анафилак- тический шок, аллер- гическая крапивница, инсектная аллергия, пищевая аллергия, лекарственная аллергия Кожное тестирование: скарификационные тесты, prick-тесты (тесты уколом). Провокационные тесты: назальный, конъюнктивальный ингаляционный, подъязычный Определение уровня общего и аллерген- специфического IgE в сыворотке крови; иммуноферментный, радиоизотопный, хеми- люминесцентный анали- зы и др: базофильные тесты
Гиперчувствитель- ность замедленно- го типа Аллергический контакт- ный дерматит, лекар- ственная аллергия, инфекционные забо- левания (туберкулез, кандидоз, токсоплазмоз и т.д.) Аппликационные кож- ные тесты Реакция бласттранс- формации лимфоцитов в ответ на аллергены и антигены
Цель аллергодиагностики — выявление заболеваний или состояний, обу-
словленных аллергенспецифической гиперчувствительностью. В подавля-
ющем большинстве аллергических заболеваний это IgE-опосредованные
нозологические формы, такие, как аллергический ринит (АР), аллергиче-
ский конъюнктивит, бронхиальная астма, инсектная, пищевая, лекарствен-
ная и другие виды аллергии, анафилактический шок (АШ).
Для выявления IgE-опосредованной аллергии и установления спектра
причинно-значимых аллергенов применяют определенный алгоритм диа-
гностических мероприятий, включающий:
• сбор аллергологического анамнеза;
• постановку кожных проб (прик-тесты, скарификационные, внутри-
кожные);
• постановку аллергенспецифических провокационных проб;
• in vitro лабораторные исследования для выявления аллергенспецифи-
ческого IgE либо специфической чувствительности клеток-мишеней
аллергии к определенным аллергенам.
Аллергологический анамнез
Аллергологический анамнез отличается от других видов анамнеза тем,
что не только позволяет определить нозологическую форму заболевания,
но и одновременно помогает установить возможный механизм развития
заболевания и вид аллергена, к которому у пациента повышена чувстви-
тельность. Весьма велика роль правильно собранного аллергологического
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 399
анамнеза, позволяющего определить тактику дальнейших исследований
in vivo и/или in vitro, характер и объем лечения. При сборе анамнеза следует
учитывать, что клинические проявления псевдоаллергических реакций
сходны с таковыми у больных с «истинной» аллергией, тогда как тактика
их лечения и профилактика имеют значительные различия.
Сбор аллергоанамнеза можно условно разделить на несколько этапов:
• установление основных сведений о наследственной предрасположен-
ности пациента к аллергии (аллергические заболевания у отца, матери,
ближайших родственников);
• определение «шагов атопии», иными словами, выявление аллергиче-
ских заболеваний, возникших у пациента ранее;
• установление (по возможности) вида аллергена, причинно-значимого
для настоящего аллергического заболевания. В этой части анамнеза
следует подробно выяснить все возможные нюансы с учетом вида
аллергии — лекарственной, пищевой, пыльцевой, инсектной, бытовой,
латексной, контактной и др. В перечень основных вопросов следует
включить:
< > реакции на различные лекарства (какие, когда),
< > реакции на введение вакцин, сывороток,
< > реакции на пищевые продукты,
< > сезонность заболевания, ухудшение состояния на улице в солнеч-
ную, ветреную либо сырую влажную погоду,
О появление симптоматики или ухудшение состояния в пыльных
помещениях, при уборке, в поле, днем (ночью), при контакте с
животными и Т.Д.,
4 характер жилищно-бытовых условий пациента и, соответственно,
возможное влияние аллергенов окружающей среды: сырость и нали-
чие плесени в помещениях, ковры, мягкая мебель, спальные принад-
лежности, книги, животные, аквариумные рыбы, птицы, цветы;
• наличие профессиональных вредностей;
• выяснение всех возможных триггеров и факторов риска возникно-
вения либо обострения настоящего заболевания или состояния. При
определении роли триггеров необходимо установить:
о влияние физических факторов (охлаждение, перегревание, стресс,
давление, вибрация и т.д.) на возникновение или обострение забо-
левания, например, крапивницы,
<> роль физических нагрузок, в том числе физических упражнений,
эмоциональных факторов, стресса,
О роль инфекционных заболеваний,
о связь заболевания с беременностью, родами,
О наличие клинического эффекта после применения противоаллер-
гических средств и/или элиминации аллергена либо триггерного
фактора.
ГЛАВА 12
ЧАСТЬ 2
400 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
При сборе аллергоанамнеза у детей раннего возраста необходимо
дополнительно оценить следующие факторы:
• характер течения антенатального периода с целью определить возмож-
ную внутриутробную сенсибилизацию;
• наличие внутриутробной гипоксии, которая может способствовать
ранней сенсибилизации плода;
• характер вскармливания ребенка и диету кормящей матери;
• сроки введения докормов и прикормов, а также их объем и кратность.
Анализируя анамнез, важно уточнить возраст ребенка на момент возник-
новения тех или иных аллергических заболеваний. Это может предполо-
жительно указать на этиологически значимый фактор IgE-опосредованной
аллергии, а именно: у детей до 2-летнего возраста преобладает пищевая
аллергия, затем присоединяется бытовая и к 5-7 годам — пыльцевая. У
подростков и взрослых большую роль играют аэроаллергены, а также
аллергены лекарственные, инсектные, вызывающие IgE-опосредованные
заболевания; кроме того, у них чаще развиваются другие типы аллергиче-
ских реакций, в частности IV тип гиперчувствительности.
Таким образом, на первом этапе диагностики можно не только устано-
вить нозологическую форму, но и предположить возможную этиологию и
патогенез аллергического заболевания, иными словами, разделить боль-
ных, зачастую имеющих одинаковую клиническую симптоматику (напри-
мер, крапивницу, астму, атопический дерматит), на «атопиков» (с наслед-
ственно обусловленной IgE-опосредованной гиперчувствительностью) и
«неатопиков», у которых заболевания патогенетически развиваются как
аллергические, но обусловленные другими типами гиперчувствитель-
ности, либо как болезни, в основе которых лежат псевдоаллергические
механизмы.
Кожное тестирование
Этот метод исследования — один из основных в диагностике IgE-
опосредованной аллергии немедленного типа в силу высокой специфич-
ности и информативности. С помощью кожного тестирования выявляют
сенсибилизацию к различным аллергенам, стандартизированным и раз-
решенным к применению в лечебно-диагностических целях. К ним относят
пыльцевые, пищевые, бытовые (клещи домашней пыли), эпидермальные,
инсектные, грибковые аллергены.
Постановку кожных тестов следует проводить в специализированных
аллергологических кабинетах, оборудованных в соответствии с норматив-
ными требованиями (приказ Минздравсоцразвития России от 01.12.2005
№ 753). Отбор необходимых аллергенов, а также учет результатов проб
осуществляет врач аллерголог-иммунолог. Кабинет должен быть оснащен
средствами по оказанию экстренной помощи при развитии анафилак-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 401
сии. Следует отметить, что в один день можно исследовать в среднем до
10-15 аллергенов, причем относящихся к одной группе. Максимально
допустимое количество исследуемых аллергенов у взрослых — 18-20.
Тестирование проводят на коже предплечья, однако у детей до года и в
особых случаях (например, при поражении кожи рук) в старшем возрасте и
даже у взрослых — на коже спины.
Противопоказания к постановке кожных аллергопроб:
• острые инфекционные заболевания;
• обострение хронических заболеваний;
• тяжелые формы БА (ОФ!^ <70%);
• декомпенсированные заболевания печени, почек, кровеносной систе-
мы, болезни крови, эндокринной системы и др.;
• туберкулез, сифилис, бруцеллез;
• аутоиммунные заболевания в стадии обострения (СКВ, ревматоидный
артрит, склеродермия, дерматомиозит и др.);
• первичные (врожденные) иммунодефициты;
• анафилактический шок в анамнезе;
• злокачественные новообразования;
• психические заболевания;
• беременность и лактация;
• СПИД.
Методика постановки отдельных видов аллергологических
проб in vivo
Скарификационные кожные пробы
С их помощью выявляют причинно-значимый аллерген и степень сен-
сибилизации к нему. Пробы проводят со всеми неинфекционными аллерге-
нами. Одновременно в зависимости от возраста можно поставить не более
10-15 проб, причем при высокой сенсибилизации количество аллергенов
одного наименования желательно ограничить.
Техника постановки: кожу сгибательной поверхности предплечья
обрабатывают 70% этанолом, затем наносят отдельными шприцами по
капле гистамина 0,01%, аллергенов и тест контрольной жидкости на рассто-
янии 4-5 см друг от друга. Отдельными скарификаторами проводят через
каждую каплю по 2 параллельные царапины длиной 4-5 мм на расстоянии
2 мм. Детям до пяти лет можно проводить по одной царапине.
Царапины проводят поверхностно, нарушая только целостность эпи-
дермиса, не травмируя кровеносных сосудов. Через 10 мин осторожно
промокают каждую каплю отдельным ватным тампоном, еще через 10 мин
оценивают пробы.
Обязательное условие при оценке проб — отрицательный результат с
тест-контрольной жидкостью и положительный с гистамином.
ГЛАВА 12
ЧАСТЬ 2
402 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
При оценке скарификационного кожного тестирования (табл. 12-3) сле-
дует учитывать возможность появления ложноположительной реакции:
• на тест-контрольную жидкость при повышенной чувствительности
кожных покровов к механическому воздействию, а также в случае воз-
никновения реакции на компоненты, входящие в тест-контрольную
жидкость (например, фенол);
• на аллергены при нарушении техники постановки кожного тестиро-
вания (слишком глубокое введение аллергена) и/или повышенной
индивидуальной чувствительности кожных покровов к механическому
воздействию.
Таблица 12-3. Оценка скарификационной пробы
Результат реакции Условные обозначения Местная реакция кожи
Отрицательный - Соответствует контролю
Сомнительный + Гиперемия без волдыря
Слабоположительный + Волдырь размером до 2-3 мм, гиперемия
Положительный средней степени ++ Волдырь размером до 5 мм, гиперемия
Резко положительный +++ Волдырь до 5-10 мм, гиперемия, псевдо- подии
Очень резко положительный ++++ Волдырь размером больше 10 мм, псевдо- подии, гиперемия
Рис. 12-1. Положительные кожные пробы с бытовыми аллергенами.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 403
Возможны ложноотрицательные реакции:
• на гистамин при снижении индивидуальной чувствительности к гиста-
мину или при проведении кожного тестирования в период лечения
антигистаминными или гормональными препаратами;
• на аллергены при отсутствии полного серийного набора аллерге-
нов одного типа (например, домашней пыли); неправильном хра-
нении аллергенов; нарушении техники введения аллергенов (очень
поверхностно); проведении кожного тестирования на фоне обострения
аллергического или тяжелого соматического заболевания; при приеме
лекарственных средств (антигистаминных препаратов, мембраноста-
билизаторов, гормонов, бронхолитиков).
Тест уколом (PnJfe-тест)
Этот тест проводят специальными прикерами, которые позволяют
регулировать глубину укола и исключают раздавливание капли при уколе.
Оценку проводят так же, как и скарификационных проб.
Аппликационные пробы
Используются для диагностики аллергии замедленного типа, в частно-
сти профессиональной аллергии, аллергических контактных дерматитов
и др. С этой целью применяют тест-системы промышленного производ-
ства в виде пластин с нанесенными на них аллергенами. Пластины при-
клеивают в межлопаточной области и оставляют на 48 ч. Учет реакции
проводят через 30 мин после удаления пластин и повторно через 1-2 сут.
Интерпретацию результатов производят, сравнивая данные в контроль-
ной зоне и в зонах с аллергенами. Характер реакции может варьировать от
сомнительного (однородная эритема) до положительного (инфильтрация,
эритема, папулы, везикулы), вплоть до резко положительного с образова-
нием булл на месте контакта с аллергеном. Проявление положительной
реакции на месте контакта с аллергеном обычно исчезает через 1-2 нед.
Противопоказана постановка этого теста беременным и кормящим гру-
дью женщинам.
Провокационные тесты
Провокационные тесты — методы диагностики, основанные на реакци-
ях, которые возникают при контакте шокового органа с аллергеном. Их
используют, если данные анамнеза расходятся с результатами кожного
тестирования. Противопоказания те же, что и при кожном тестировании.
В зависимости от вида аллергена и способа его введения в организм раз-
личают назальный, конъюнктивальный, ингаляционный, сублингвальный,
оральный тесты.
• Назальный тест проводят с бытовыми, эпидермальными, пыльцевы-
ми аллергенами с целью диагностировать аллергический ринит. Для
этого в один носовой ход закапывают одну каплю тест-контрольной
жидкости, в другой носовой ход — последовательно по одной капле
ГЛАВА 12
404 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Рис. 12-2. Аппликационная проба. Пластины с аллергенами находились на теле пациентки
48 ч.
Рис. 12-3. Учет результата аппликационной пробы спустя 48 ч путем наложения контроль-
ной измерительной пластины строго на место ранее находившейся тест-пластины.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 405
разведения аллергена: 1:100,1:10 и затем цельный аллерген. Интервал
между закапываниями аллергенов должен составлять не меньше
30 мин. Тест считают положительным, если появляются симптомы
ринита.
Конъюнктивальный тест используют для диагностики аллерги-
ческого конъюнктивита. С этой целью в конъюнктивальный мешок
глаза закапывают тест-контрольную жидкость. В другой последо-
вательно закапывают по 1 капле аллергена в разведении от 1:2048,
1:1024,1:512 до 1:2. Интервал между нанесениями должен составлять
не меньше 30 мин. Концентрацию аллергена увеличивают только в
том случае, если отсутствует реакция на предыдущее разведение дозы.
Тест считают положительным, когда появляются симптомы конъюн-
ктивита.
Сублингвальный тест используют для диагностики пищевой и
лекарственной аллергии. При пищевой аллергии применяют нату-
ральные продукты в разведении 1:10, при лекарственной — '/*-
х/4 разовой дозы лекарственного препарата в таблетированном либо
растворенном виде. Аллерген наносят на слизистую подъязычной
области. Тест считают положительным, если спустя 10-20 мин воз-
никает местная реакция на слизистой оболочке полости рта или
системная реакция в виде учащения пульса, высыпаний на коже,
чиханья, кашля. После тестирования больной должен находиться под
наблюдением врача в течение суток. За этот период врач проводит
мониторинг состояния пациента. При наличии в анамнезе пациента
тяжелых реакций, предположительно связанных с исследуемым пре-
паратом или пищевым продуктом, лучше использовать лабораторные
методы исследования.
Ингаляционный тест применяют для диагностики БА и проводят
только в условиях стационара. Показатели ОФВХ должны быть не
меньше 70% от должных величин. Ингалируемые аллергены исполь-
зуются в двукратных разведениях, начиная с 1:1024, затем 1:512,
1:256 и так далее до 1:16. Аллергены вводят с помощью струйного
дозатора. Через каждые 10 мин после очередной ингаляции опреде-
ляют ОФВГ Если показатель снижается больше чем на 20%, тест счи-
тают положительным. После проведения теста пациент должен оста-
ваться под наблюдением врача не менее 24 ч. В течение одних суток
можно провести ингаляционный тест только с одним аллергеном.
Основные показания к проведению ингаляционного тестирования —
выявление этиологически значимых аллергенов, оценка эффектив-
ности медикаментозного лечения, определение профессиональной
пригодности пациента (выявление латентного бронхоспазма). Тест
с бытовыми, эпидермальными, пыльцевыми аллергенами проводят
ГЛАВА 12
ЧАСТЬ 2
406 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
с 4-5-летнего возраста при отрицательном результате назального
теста или же несовпадении данных анамнеза с результатами кожного
тестирования.
• Оральный тест применяют для диагностики пищевой аллергии. В
качестве аллергенов используют натуральные продукты. За 2-3 сут
до проведения теста из рациона пациента исключают исследуемый
продукт. Затем снова вводят этот продукт в рацион, оценивая общее
состояние и состояние шоковых органов (кожи, слизистых, органов
дыхания и пищеварения). Пробу считают положительной, если в
течение 1 ч после приема пищевого продукта проявляются реакции со
стороны шоковых органов.
• Внутрикожный тест с аутологичной сывороткой крови.
Применяется при диагностике аутоиммунной крапивницы.
Особенностью является выполнение пробы в период обострения забо-
левания. Внутрикожно вводят 50 мкл аутологичной сыворотки; в кон-
троле — те же объемы гистамина и физиологического раствора NaCl.
Оценку производят спустя 30 мин.
• Провокационные тесты для диагностики холодовой крапивницы. С
этой целью обычно используют холодовую пробу с аппликацией куби-
ка льда на предплечье на 10-15 мин. Результат считается положитель-
ным при появлении волдыря в зоне воздействия холода.
Рис. 12-4. Положительный внутрикожный тест с аутосывороткой.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 407
Рис. 12-5. Положительная холодовая проба с кубиком льда.
ГЛАВА 12
12.2.1. Аллергодиагностика in vitro
Клиническое значение IgE
В 1966 г. японские ученые, работавшие в Соединенных Штатах Америки,
Кимишиге и Теруко Ишизака (Kimishige и Teruko Ishizakd) обнаружили
«реагиновые» антитела, соответствующие иммуноглобулинам, но отли-
чающиеся от IgG, IgM, IgA, IgD, и назвали их IgE. Параллельно в Швеции
С. Йохансон (S.G. Jahansson) и Н. Беннич (Н. Bennich) обнаружили IgE у
больных миеломной болезнью. Ранее в 1921 г. в Германии бактериолог
О. Прауснитц (О. Prausnitz) и гинеколог Г. Кюстнер (Н. Kustner) разработали
метод выявления реагинов в крови больных атопией, заключающийся во
внутрикожном введении здоровому человеку сыворотки больного атопией
с последующим введением в это же место исследуемого аллергена. Затем
оценивали местную кожную реакцию. В настоящее время реакцию не при-
меняют.
В норме IgE в минимальной концентрации находится в крови и других
жидкостях организма. Большинство IgE-продуцирующих плазматических
клеток содержится в лимфоидной ткани, связанной с пищеварительным и
респираторным трактом (в миндалинах и аденоидах).
Внутриутробно плод способен продуцировать IgE не раньше 11-й неде-
ли гестации. После рождения концентрация сывороточных IgE низкая
и достигает максимума между 10-м и 15-м годом жизни. Сывороточная
~ 408 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
-О
концентрация IgE весьма вариабельна и изменяется в зависимости от цело-
го ряда обстоятельств: от наличия или отсутствия атопии, пола, возраста,
расы, сезона, обострения заболевания и других факторов. Из-за низкой
концентрации уровень IgE в сыворотке обозначают в международных
единицах: (ME — англ. IU — International Units; 1 МЕ/мл = 2,4 нг/мл). У
немногих здоровых детей и взрослых концентрация IgE может достигать
1000 МЕ/мл.
Повышение концентрации IgE в сыворотке крови выявляют у боль-
шинства больных с атопическими заболеваниями. Однако есть целый ряд
состояний, при которых тоже отмечают необычно высокий уровень IgE:
бронхолегочные микозы, грибковые синуситы, ВИЧ-инфекция, лимфомы,
гипер-^Е-синдром, синдром Незелофа, паразитозы, туберкулез.
IgE в пуповинной крови
У большинства новорожденных во внутриутробном периоде стимуляции
образования IgE не происходит. Материнские IgE в норме не проходят
через плаценту. Измерять сывороточный IgE в концентрации ниже 1 МЕ/мл
технически трудно, тем не менее такие исследования проводились и было
показано, что концентрация IgE в пуповинной крови колеблется в пределах
0,1-0,5 МЕ/мл. Установлено, что на концентрацию общего IgE в пуповин-
ной крови влияет ряд факторов.
• Факторы, связанные с повышением уровня IgE в пуповинной крови:
О атопия у матери;
О атопия у ближайших родственников;
& повышение уровня IgE у матери;
О мужской пол плода;
О принадлежность к негроидной или испанской расе;
Ф введение прогестерона;
о паразитоз у матери (аскаридоз);
О курение матери (обсуждается).
• Факторы, связанные со снижением уровня IgE в пуповинной крови:
о носительство матерью HBs-антигена;
употребление алкоголя матерью.
• Факторы, не влияющие на уровень IgE в пуповинной крови:
о оральные контрацептивы, используемые в пренатальном периоде;
< применение бронхолитиков;
О диета беременной;
О курение матери (обсуждается);
< гестационный возраст от 34 до 42 нед;
❖ характер родов (самопроизвольные, вакуум-экстракция и др.);
О использование матерью глюкокортикоидов.
Многочисленные сравнительные исследования, изучавшие риск раз-
вития аллергических заболеваний у детей с повышенным уровнем IgE
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 4Q9
в пуповинной крови или наследственным анамнезом, свидетельствуют
о неоднозначности результатов: так, семейный анамнез в ряде случаев
является более чувствительным прогностическим тестом развития аллер-
гических заболеваний у детей, тогда как с уровнем IgE больше коррелирует
специфичность аллергического ответа.
Неаллергические заболевания, связанные с повышенным или
пониженным уровнем общего сывороточного иммуноглобулина Е
Повышение уровня общего IgE:
• паразитарные заболевания (аскаридоз, парагонимоз, фасциолез,
шистосомоз, трихинеллез, стронгилоидоз, эхинококкоз, малярия);
• инфекционные заболевания (аспергиллез, системный кандидоз, лепра,
инфекционный мононуклеоз, ЦМВ-инфекция, ВИЧ-1/СПИД, коклюш,
туберкулез);
• кожные заболевания (буллезный пемфигоид, хронический акродерма-
тит, стрептококковая эритема, другие дерматозы);
• другие заболевания (нефротический синдром, лекарственно-инду-
цированный интерстициальный нефрит, заболевания печени за
исключением гепатита С, болезнь Кавасаки, первичный легочный
гемосидероз, синдром Гййена-Барре, ожоги, ревматоидный артрит,
трансплантация костного мозга, курение, анемия Фанкони, алкого-
лизм);
• неопластические заболевания (болезнь Ходжкина, IgE-миелома, кар-
цинома бронхов);
• иммунодефициты: синдром Вискотта-Олдрича, гипер-^Е-синдром,
аномалия Ди Джорджи, селективный IgA-дефицит.
Снижение уровня IgE (семейный IgE-дефицит, повторные синопуль-
мональные инфекции, первичный билиарный цирроз, инфицирование
Т-лимфотропным вирусом типа 1).
Аллергенспецифические 1дЕ-аититела
Уровень аллергенспецифических IgE-антител определяют (по аналогии с
общим IgE) в единицах, обозначающих соотношение массы и объема: нг/мл,
МЕ/мл. Основной метод выявления специфических IgE in vitro — ИФА. В то
же время классическое аллерготестирование in vivo тоже является методом
выявления аллергенспецифических IgE-антител в организме пациента.
Сравнительная характеристика иммуноферментного анализа и
кожных тестов при определении аллергенспецифических IgE
ИФА:
• не вызывает развития аллергической реакции;
• результаты не зависят от приема лекарственных средств;
• результаты не зависят от состояния кожи;
• предпочитается большинством пациентов;
• возможен документированный контроль.
ГЛАВА 12
ЧАСТЬ 2
410 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Кожные тесты:
• имеют более выраженную чувствительность;
• широкий выбор аллергенов;
• немедленное получение результатов;
• на один тест затрачивается меньше времени и реагентов.
Концентрация специфических IgE in vitro варьирует в зависимости от
степени и длительности экспозиции недавних аллергенов и перекрестно
реагирующих аллергенов, иммунотерапии. С другой стороны, у больных
атопическим дерматитом высокий уровень общего IgE может обусловить
ложноположительные результаты. У больных с поллинозом отмечают
сезонные колебания уровня аллергенспецифического IgE с максимальным
подъемом спустя 4 нед после сезона пыления причинно-значимых рас-
тений, причем сезонные колебания показателей могут перемещаться от
отрицательных до положительных. Возможно выявление специфических
IgE-антител у лиц без клинических симптомов манифестации аллергии.
Результаты выявления аллергенспецифических IgE-антител in vitro обыч-
но коррелируют с результатами тестирования in vivo, например с кожными
тестами. Однако ложноотрицательные результаты исследования in vitro
получают в 5-40% случаев, что может зависеть от чистоты аллергенов. У
таких пациентов, особенно при высокой чувствительности к инсектным
аллергенам, лекарственным средствам, латексу и пище необходимо выяв-
лять причинно-значимые аллергены в кожных тестах, поскольку возмож-
ные реакции на них могут быть жизнеугрожающими. В случае отрицатель-
ных тестов in vitro пациенту необходимо провести кожное тестирование,
прежде чем давать заключение о наличии или отсутствии у него сенсиби-
лизации. На основании многочисленных исследований, изучавших степень
ассоциации положительных тестов, которое выявляли аллергенспецифиче-
ские IgE in vivo или in vitro, с клиническими проявлениями аллергических
заболеваний, было сделано заключение, что положительные результаты
тестов нельзя использовать в качестве единственных для диагностики
аллергических заболеваний. Кроме того, даже при наличии аллергических
симптомов и положительных тестов необходимо дополнительно выяснить
анамнез (в том числе наследственный) и провести клинические обследова-
ние, чтобы окончательно установить диагноз.
В настоящее время широко применяются лабораторные методы диа-
гностики аллергических заболеваний, которые позволяют выявлять аллер-
генспецифические IgE-антитела. В совокупности с данными аллергоанам-
неза и кожного тестирования результаты лабораторных исследований
позволяют с большей точностью диагностировать этиологические факторы
аллергического заболевания. Кроме того, возможность использования
лабораторной диагностики позволяет проводить исследования, когда кож-
ное тестирование неприменимо, например:
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 411
• в период обострения аллергического заболевания и у пациентов с
высокой степенью сенсибилизации;
• при поливалентной сенсибилизации, когда нет возможности провести
тестирование in vivo сразу со всеми предполагаемыми аллергенами, а
сроки обследования ограничены;
• при измененной реактивности кожи и получении ложноположитель-
ного или ложноотрицательного результата при тестировании in vivo.
Кроме того, лабораторную диагностику используют, обследуя одно-
временно с большим количеством аллергенов различных групп (пищевые,
бытовые, грибковые, лекарственные и т.д.). Этот вид диагностики безопа-
сен для больного и не вызывает дополнительной сенсибилизации.
В последние десятилетия шла активная разработка методов диагностики
аллергических заболеваний IgE-опосредованного типа in vitro. Основная
цель этих исследований — количественное или полуколичественное выяв-
ление аллергенспецифических IgE и тем самым установление этиологи-
ческих факторов аллергии. Однако следует отметить, что положительные
результаты тестов не равнозначны диагнозу «аллергия», поскольку они
свидетельствуют лишь о наличии в организме молекул с определенной
иммунологической функцией. Примеры современных методов определения
аллергенспецифических IgE представлены ниже (табл. 12-4).
Таблица 12-4. Некоторые методы определения аллергенспецифических IgE в сыворотке
крови [Гущин И.С., 2008]
ГЛАВА 12
Название метода Особенности системы Количественный или полуколичественный анализ
RAST (Radioallergosorbent Test) Твердофазная радиоаллергосор- бентная система Количественный
Phadiatop Группа аллергенов связана с инкапсулированной целлюлозой. Сочетание ферментной и флюорес- центной метки Полуколичественный
CAP FEIA (Capsulated Hydrophilic Carrier Polymer — Fluorescent Enzyme Immunoassay) Твердофазный иммунофлюорес- центный метод Количественный
Immuno-САР (Universal Capsulated Hydrophilic Carrier Polymer) Твердофазный (аллерген инкап- сулирован на целлюлозе) иммуно- флюоресцентный метод Количественный
Allergen Иммуноферментный метод с жид- кими биотинированными аллерге- нами Количественный
MAST-CLA (Multiall-ergosorbent Chemiluminescent Assay) Аллергосорбентный хемилюминес- центный метод Количественный
412 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Окончание табл. 12-4
Название метода Особенности системы Количественный или полуколичественный анализ
FAST (Fluoroallergosorbent Test) Аллерген связан с полистеролом. Двойная метка — ферментная и флюоресцентная Количественный
Immulite 2000 (Immulite — Chemiluminescent Enzyme Immunometric System) Жидкие аллергены. Двойная метка — ферментная и флюорес- центная Количественный
CLA (Chemical diagnostic — Chemiluminescent Assay) Иммунохемилюминесцентный метод Количественный
Hytec (HY-TEC-RAST) Иммуноферментная система Количественный
LMD (Lumiward Immunoassay System) Иммунохемилюминесцентный метод -
Magic lite (Magic lite SO Allergy System) Двойная метка — ферментная и хемилюминесцентная Количественный
TRF (Time-Resolved Fluorometric Immunoassay) Микрометод. Аллерген связан с полистеролом. Использование меченных флюоресцеином нано- сфер, несущих Fab-фрагменты анти-1дЕ-антител Количественный
Магнитофоретический имму- нометод Основан на изменении после инкубации с сывороткой больного магнитофоретической подвижности микрошариков, несущих аллерген. На 2-м этапе — взаимодействие с магнитными наночастицами, конъюгированными с анти-lgE- антителами Количественный
Помимо тестов, выявляющих аллергенспецифические IgE, в медицин-
скую практику внедрены современные лабораторные методы выявления
медиаторов, секретируемых активированными клетками. В частности,
CAST (Cellular Antigen Stimulation Test) — тест антигенной стимуляции кле-
ток in vitro. Метод основан на определении сульфидолейкотриенов (LTC4,
LTD4, LTE4), секретируемых примированными ИЛ-3 базофилами под
действием аллергенов in vitro. При контакте аллергена с IgE на базофилах
и тучных клетках происходит каскад ферментных реакций, приводящих
к синтезу и секреции медиаторов аллергических реакций, в том числе и
лейкотриенов. Поскольку лейкотриены синтезируются и в случае псевдо-
аллергии, т.е. без участия IgE, то CAST называют также провокационным
тестом in vitro. С его помощью можно определить наличие IgE-зависимой
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 413
ГЛАВА 12
аллергии и псевдоаллергии, выявить причинно-значимые аллергены и
наличие аутоанти-^Е-антител и антител к рецептору IgE.
Таким образом, современные возможности аллергодиагностики позво-
ляют врачу выявить наличие у пациентов аллергии, начиная с рождения, а
также не только в период ремиссии, но и в период обострения заболевания.
Клиническое значение эозинофилии
Эозинофилы — это клетки костномозгового происхождения. Эозинофи-
лия развивается под действием специфических стимулов, усиливающих
эозинофилопоэз.
Факторы роста эозинофилов — ГМ-КСФ, ИЛ-3, ИЛ-5 (усиливает эози-
нофилопоэз).
У пациентов с эозинофилией разной этиологии выявляют разнообраз-
ные морфологические и функциональные изменения эозинофилов перифе-
рической крови: вакуолизацию цитоплазмы, изменение числа и размеров
гранул; усиление метаболической активности и антителозависимой цито-
токсичности.
Поскольку ИЛ-5 — это цитокин, продуцируемый ТЬ2-лимфоцитами (так
же как и другими клетками, включая эозинофилы), то часто эозинофилию
рассматривают в контексте ТЬ2-ответа при аллергических заболеваниях и
иммунном ответе на гельминты. В этих случаях тоже происходит увеличе-
ние уровня IgE. Но эозинофилия может возникать и тогда, когда содержа-
ние IgE в крови не повышается.
Заболевания и состояния, связанные с эозинофилией
• Аллергические заболевания:
О атопические и другие аллергические заболевания;
О лекарственно-индуцированная эозинофилия.
• Инфекционные заболевания:
о паразитарные (в основном гельминтозы);
О вызываемые грибами;
О другие (редко).
• Гематологические и неопластические нарушения:
4 гиперэозинофильный синдром;
< лейкозы;
лимфомы (у 15% пациентов с ходжскинской лимфомой и у 5% с
неходжскинскими лимфомами);
о рак;
О мастоцитоз.
• Соматическая органная патология:
О заболевания кожи и подкожной клетчатки (эпизодические ангио-
отеки, эозинофильный целлюлит);
ЧАСТЬ 2
414 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
<> эозинофильная пневмония;
v эозинофильный гастроэнтерит;
<> эозинофильный менингит;
v синдром Черджа-Стросса;
>> лекарственно-индуцированный интерстициальный нефрит;
</ эозинофильный цистит.
• Иммунопатология:
<> ПИД: синдром Оменна, ninep-IgE-синдром;
<> реакция отторжения трансплантата.
• Эндокринные нарушения:
о гипоадренализм.
• Другие виды патологии:
<> наследственные;
О идиопатический гиперэозинофильный синдром.
Следует отметить, что эозинофилы — это преимущественно тканеассоци-
ированные лейкоциты (респираторный, пищеварительный, урогениталь-
ный тракты, слизистая оболочка носа), где количество этих клеток в тысячи
раз превышает их количество в крови. При некоторых патологических
ситуациях преобладает тканевая эозинофилия, тогда как в периферической
крови количество этих лейкоцитов минимально либо они отсутствуют
совсем (эозинофильные гранулемы легких). Эозинофилия крови варьиру-
ет в течение суток в соответствии с уровнем глюкокортикоидов: пиковый
уровень эозинофилов выявляют поздно ночью, минимальный уровень —
утром. Обследование пациентов с эозинофилией требует проведения целого
комплекса мероприятий, включающих не только иммунологические, но и
другие лабораторные и инструментальные методы обследования.
Атопические заболевания. У больных с АР эозинофилия в крови
служит менее чувствительным показателем, чем назальная эозинофилия —
патогномоничный симптомом заболевания. Диагностическим является уро-
вень назальных эозинофилов у детей более 4%, у взрослых — 10-25%. Эти
показатели возрастают при сезонном рините в период пыления причинно-
значимых растений и снижаются при лечении топическими глюкокорти-
коидами.
Назальная эозинофилия может возникать и при других ринитах:
• неаллергическом рините с эозинофильным синдромом. У таких паци-
ентов имеется склонность к полипозу носа, аллергоанамнез не отяго-
щен, кожные тесты отрицательные, нормальный уровень IgE в сыво-
ротке, нет аспириновой чувствительности;
• полипозе носа может иметь место эозинофилия в назальном секрете, в
некоторых случаях отмечают триаду симптомов, включая БА и аспи-
риновую непереносимость на фоне полипоза;
• хронических синуситах. Эозинофилия часто возникает при этом забо-
левании у детей, особенно страдающих БА. У взрослых имеется
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 415
корреляция с эозинофилией крови, усиливающейся с утяжелением
синдрома.
Аллергические грибковые синуситы тоже сопровождаются назальной
эозинофилией. Эозинофилия в периферической крови часто возникает
у больных аллергической БА. Увеличение числа эозинофилов в мокроте
выявляют как при аллергической, так и при неаллергической астме, причем
это служит дифференциальным признаком с хронической обструктивной
болезнью легких. Эозинофилия в мокроте может возникать у некоторых
пациентов с бронхитом, интерстициальным фиброзом легких и синдромом
Черджа-Стросса.
Лекарственные средства и эозинофилия. Применение различных
препаратов, пищевых добавок, гомеопатических средств может вызывать
эозинофилию. Установить связь эозинофилии с лекарственным средством
можно при проведении плацебо-контроля. В некоторых случаях повышает-
ся уровень эозинофилов в тканях. Механизмы эозинофилии в большинстве
случаев остаются неясными. Если реакция на лекарственное средство не
сопровождается системными поражениями, то эозинофилия сама по себе не
служит основанием для его отмены. Однако лекарственно-индуцированная
эозинофилия вызывает необходимость тщательного обследования различ-
ных органов, таких, как легкие, сердце, почки. При выявлении дисфункции
этих органов необходимо отменить препарат.
Лекарственно-индуцируемая эозинофилия и органы дыхания
Эозинофилию органов дыхания могут вызвать различные препараты.
Клинические проявления весьма разнообразны (табл. 12-5). Нарушения
протекают в виде острой или хронической эозинофильной пневмонии, при
которой в большинстве случаев бывает повышен уровень эозинофилов в
крови. При отсутствии эозинофилии в крови для подтверждения диагноза
необходимо обнаружить эозинофилы в мокроте и бронхоальвеолярном
лаваже. Симптомы заболевания могут возникать внезапно или постепенно
после нескольких лет использования препарата и проявляться в виде дис-
пное, кашля, лихорадки, снижения массы тела, уртикарных или пятнисто-
папулезных высыпаний на коже. При объективном исследовании у боль-
ных выявляют нарушение дыхания (удушье), разнокалиберные хрипы в
легких, дистанционные хрипы. При лабораторном обследовании отмечают
повышение скорости оседания эритроцитов; уровень IgE вариабелен. На
рентгенограмме грудной клетки выявляют периферические субплевраль-
ные инфильтраты, интерстициальные инфильтраты.
Лечение состоит в отмене лекарственного средства, вызвавшего эозино-
фильное поражение. Симптомы в течение нескольких недель постепенно
купируются. Глюкокортикоиды купируют проявления в течение несколь-
ких суток. При возобновлении приема лекарственного средства легочная
симптоматика возвращается в течение 48 ч, причем инфильтраты возника-
ют в прежних местах.
ГЛАВА 12
416 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-5. Лекарственно-индуцированные эозинофильные реакции
Заболевание, состояние Причинно-значимые лекарственные средства
Эозинофильные инфильтраты в легких Нестероидные противовоспалительные лекарственные сред- ства
Эозинофильный интерстициаль- ный нефрит Полусинтетические пенициллины, сульфаниламиды цефало- спорины, каптоприл, нестероидные противовоспалительные лекарственные средства, циметидин, аллопуринол
Некротический эозинофильный миокардит Ранитидин
Эозинофильный миокардит ИЛ-2 (цитокинотерапия)
Гепатиты с эозинофилией Полусинтетические пенициллины, тетрациклины, ранитидин, фенитоин
Васкулиты Аллопуринол
Гастроэнтероколиты Нестероидные противовоспалительные лекарственные сред- ства
Синдром эозинофилии-миалгии L-триптофан
Астма, назальные полипы Ацетилсалициловая кислота
Бессимптомная эозинофилия Ампициллин, пенициллины, цефалоспорины, препараты цитокинов (ИЛ-2)
К лекарственным средствам, наиболее часто вызывающим легочные
симптомы, относят:
• антимикробные (ампициллин, цефотаксим, ципрофлоксацин, дапсон,
метронидазол, нитрафураны, пенициллины, сульфаниламиды, тетра-
циклины);
• НПВС;
• антиаллергические: беклометазона дипропионат* ингаляционный
(беклометазон), кромоглин* ингаляционный (кромоглициевая кис-
лота);
• гипогликемические (хлорпропамид, толазамид®);
• препараты золота;
• антинеопластические (блеомицин, метотрексат);
• препараты для лечения органов пищеварения (циметидин, ранитидин,
сульфасалазин);
• наркотические вещества (кокаин и др.);
• антидепрессанты, антиэпилептические и другие препараты (карбама-
зепин, флуоксетин, фенитоин и др.);
• гомеопатические;
• другие (йодоконтрастные, никель, назальные капли, дым сигарет).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 417
Вопросы для самоконтроля
• Назовите основные методы диагностики in vivo заболеваний, в основе
которых лежит IgE-опосредованный механизм развития.
• Перечислите методы определения аллергенспецифического IgE в сыво-
ротке крови.
• Какие методы выявления гиперчувствительности замедленного типа
in vivo вам известны? При каких заболеваниях они используются?
• Каковы особенности аллергологического анамнеза? Охарактеризуйте
аллергоанамнез у детей раннего возраста?
• Перечислите показания и противопоказания для кожного аллерготе-
стирования?
• При каких условиях возможно получение ложноположительного или
ложноотрицательного результатов кожного тестирования?
• Каковы особенности постановки и учета результатов аппликационной
пробы? Показания к ее проведению.
• При каких заболеваниях назначают провокационные тесты? Опишите
постановку назального теста.
• Назовите факторы, влияющие на концентрацию общего IgE в пуповин-
ной крови.
• Перечислите неаллергические заболевания, связанные с повышенным
уровнем сывороточного IgE.
• Какова роль ИФА-диагностики в выявлении гиперчувствительности у
пациентов?
• Назовите заболевания и состояния, связанные с эозинофилией.
ГЛАВА 12
12.3. АЛЛЕРГИЧЕСКИЙ РИНИТ
Аллергический ринит — одно из наиболее распространенных аллергиче-
ских заболеваний. Первые упоминания об АР относятся к 131-210 гг. н.э.,
когда для обозначения выделений из носа врач Гален использовал термин
«катар» (от catarrhal — стекаю). Уже в те времена врачи различали «нерв-
ный насморк» и «насморк от запаха роз».
В 1565 г. Ботталлус (Bottallus) утверждал, что знает людей, у которых
запах некоторых цветов вызывает зуд в носу, приступообразное чиханье,
головную боль.
Только в 1660 г. анатом Шнейдер (Schneider) открыл, что ситовидная
пластинка непроницаема для содержимого полости черепа, а следователь-
но, выделения из носа — это всецело продукт деятельности слизистой носа.
В1761 г. Моргагни (Morgagni) описал 16 случаев, при которых у больных то
и дело из носа выделялась жидкость, «прозрачная, как вода из источника».
ЧАСТЬ 2
418 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
В 1819 г. Босток (Bostok) описал историю своего заболевания с приступо-
образным чиханьем и насморком, отличавшимися сезонностью. Он считал
причиной заболевания летнюю жару. В 1824 г. Клоке (Cloquet) впервые
предложил использовать термин «ринорея» (rhinorhea) для обозначения
выделений из носа.
В России в 1859 г. доктор П. Фебус описал людей с «сезонным катаром»,
а в 1873 г. английский врач Д. Блэкли (Blakley) выделил сезонную форму
ринореи под названием «сенной насморк». Поскольку чаще всего забо-
левание связывали с сезонным действием пыльцы растений, то его стали
обозначать как «поллиноз». В 1889 г. доктор Л. Силич сделал первое сооб-
щение о поллинозе в России. В последние годы этот термин стал меньше
использоваться в научной литературе и в клинической практике. В настоя-
щее время «аллергический, или атопический ринит» выделен в отдельную
нозологическую форму аллергических заболеваний (табл. 12-6).
Таблица 12-6. Классификация ринитов [Adkinson N. et al., 2003]
Виды ринитов Тип/причина
Аллергические Интермиттирующие, персистирующие
Инфекционные Вирусные, бактериальные, вызванные другими инфек- ционными агентами
Профессиональные Интермиттирующие, персистирующие
Лекарственно-индуцированные Аспирин, топические деконгестанты, другие препараты
Гормональные Беременность, пубертатный период
Возникшие в результате других причин (неаллергические, неинфекционные) NARES (nonallergic rhinitic eosinophilic syndrome), ирри- танты, пища, эмоциональные факторы
Определение
АР — хроническое аллергическое заболевание, характеризующееся IgE-
опосредованным воспалением слизистых оболочек носовой полости и
наличием хотя бы двух из следующих симптомов: заложенностью (обструк-
ция) носа, выделениями из носа (ринорея), чиханьем, зудом в носу, кото-
рые проходят самостоятельно или в результате лечения.
Распространенность
АР — одно из наиболее часто встречающихся аллергических заболе-
ваний. По результатам эпидемиологических исследований, проведенных
в разных странах, распространенность АР (по данным обращаемости)
колеблется от 4 до 32%. Так, в начале XXI в. в Англии этот показатель
составил 24%, в Германии — 13-19,6%, в Норвегии — 20,6%; в США —
10-30%. В России такие исследования проводились лишь в некоторых
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 419
регионах. Установлено, что истинная распространенность АР значительно
выше, чем по данным официальной статистики, и значительно колеблется
в разных регионах и возрастных группах. В среднем в России распро-
страненность АР колеблется в пределах 12,7-24%; у детей в возрасте
6-7 лет — 0,8-14,95%, 13-14 лет — 1,4-39,7%. Считают, что АР у детей
до двух лет выявляют редко, однако этот вопрос остается малоизученным.
В Европе распространенность симптомов АР у детей от 3 до 5 лет состав-
ляет 6,1-26,1%.
В целом следует отметить, что распространенность АР во всём мире воз-
растает, причем в западных странах она выше, чем во всех других регионах
мира. Заболевание может возникать в любом возрасте, но пик заболеваемо-
сти приходится на детский и молодой возраст.
У мальчиков частота АР выше, чем у девочек; в подростковом возрасте
этот показатель оказывается сходным у мальчиков и девочек. На долю АР
приходится около 50% случаев от числа всех хронических ринитов.
Этиология
Выделяют несколько групп причинно-значимых аллергенов.
• Пыльцевые аллергены. Следует учитывать наличие в России трех
пиков пыления растений, во время которых обостряются симптомы АР
у чувствительных пациентов:
4 весенний (апрель-май), когда происходит пыление деревьев (бере-
за, ольха, орешник, дуб, сосна и др.);
О первая половина лета (июнь-июль) — поллинация злаковых трав
(овес, тимофеевка, рожь, лисохвост, ежа и др.);
О конец лета-начало осени (август-сентябрь) — поллинация сорных
трав (полынь, лебеда, подорожник, амброзия).
• Бытовые аллергены:
О клещи домашней пыли (Dermatophagoidespteronyssinus, D. farinae)',
О эпидермальные аллергены (кошки, собаки, лошади, попугаи, мор-
ские свинки, овцы и т.д.);
аллергены библиотечной пыли;
О аллергены тараканов.
• Плесневые грибы. Споры грибов относятся к круглогодичным аллер-
генам, однако содержание их в окружающем воздухе зависит от време-
ни года, а именно: снижается в зимнее время и увеличивается весной
и осенью.
• Инсектные аллергены.
• Аллергены латекса.
• Профессиональные аллергены: мука, медикаменты, пух, перо,
животные, латекс и т.п. Группа риска — работники хлебозаводов, зоо-
техники, фармацевты, медицинские сестры, лаборанты и др.
ГЛАВА 12
ЧАСТЬ 2
420 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Патогенез
Слизистая оболочка носа — зона, постоянно подвергающаяся воздей-
ствию разнообразных инородных частиц. Благодаря действию мукоцили-
арной системы слизистой оболочки удаление частиц из полости носа про-
исходит в течение 15-20 мин.
В последние годы показана возможность локального синтеза IgE
В-клетками в пределах слизистой носа. Назальные тучные клетки и базо-
филы способны генерировать ИЛ-4 и ИЛ-13 и у пациентов с АР экс-
прессируют CD40L. В присутствии ИЛ-4 они способны запускать синтез
IgE В-клетками. Тучные клетки происходят из гемопоэтических предше-
ственников, мигрирующих и созревающих в периферических тканях. Эти
клетки — компонент слизистой оболочки носа в норме. Для нормального
развития и выживания тучных клеток необходимо взаимодействие между
рецептором тирозин-киназы (c-kit), экспрессируемым на поверхности
тучных клеток и прекурсоров тучных клеток, с c-kit-лигандом — SCF {Stem
Cell Factor — фактор стволовых клеток). SCF продуцируют костномозго-
вые стромальные клетки, фибробласты, эндотелиальные клетки и клетки
Сертоли. Клетками-мишенями SCF являются стволовые кроветворные
клетки, ранние коммитированные предшественники различных клеток
крови и тучные клетки. Для тучных клеток SCF является основным факто-
ром роста и хемотаксическим агентом.
Цитоплазма тучных клеток содержит гранулы с преформированными
медиаторами, такими, как амины (гистамин), протеазы (триптаза и химаза),
цитокинами (ИЛ-4, ИЛ-5, ИЛ-8, ИЛ-13, ФНО-а), протеогликан (гепарин).
У человека выделяют две субпопуляции тучных клеток по типу экс-
прессируемых нейтральных протеаз: клетки одной субпопуляции содержат
только триптазу, а клетки другой — также химазу, катепсин G, карбокси-
пептидазу. Цитокиновый профиль этих двух субпопуляций различается по
уровню ИЛ-4 (хотя этот цитокин имеется в обеих субпопуляциях); кроме
того, ИЛ-5 и ИЛ-6 почти полностью отсутствуют в тучных клетках, содер-
жащих только триптазу. При АР происходит их активация, в результате
которой повышается уровень триптазы и простагландина D2 в назальном
лаваже. У больных с аллергическим ринитом ИЛ-5 и ФНО-а вызывают
активацию эозинофилов, тогда как ИЛ-4 и ИЛ-13 усиливают эффект
ФНО-а, способствуя экспрессии VCAM-1 (от англ. Vascular Cell Adhesion
Molecule) клетками сосудистого эндотелия, благодаря чему в зону аллерги-
ческого воспаления рекрутируются эозинофилы, базофилы и лимфоциты
(посредством взаимодействия с лигандом VLA-4). При АР, как сезонном,
так и круглогодичном, в слизистой оболочке носа повышается содержание
CD4+ Т-лимфоцитов, причем у больных с круглогодичным ринитом также
увеличено и число CD4+ Т-клеток памяти. Одновременно на Т-клетках воз-
растает экспрессия активационного маркера CD25 и увеличивается число
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 421
ТЬ2-клеток с соответствующим повышением синтеза ИЛ-4, ИЛ-5, ИЛ-13.
Одновременно у больных сокращается число ТЫ -лимфоцитов, а также
замедляется образование ИЛ-12. Накопление ТЬ2-лимфоцитов можно объ-
яснить воздействием хемокинов TARC (англ. Thymus and Activation Regulated
Chemokine), генерируемых эпителиальными клетками. Усиление экспрессии
TARC эпителиальными клетками показано у больных АР. Эти исследова-
ния свидетельствуют о том, что взаимодействие эпителиальных и тучных
клеток и их цитокинов играет важную роль при локальной активации
специфических ТЬ2-лимфоцитов в патогенезе АР.
Главная роль в патогенезе АР отводится IgE-опосредованным аллер-
гическим реакциям. Аллерген, впервые попадающий в носовую полость с
вдыхаемым воздухом, захватывается антигенпрезентирующими клетками
и после фрагментации презентируется в виде пептидов Т-клеткам (Th2). В
результате такого взаимодействия ТЬ2-лимфоциты активируются и про-
дуцируют ряд характерных для них цитокинов (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10,
ИЛ-13). Одновременно ТЬ2-клетки экспрессируют молекулы CD40L, кото-
рые, в свою очередь, связываются с CD40 на В-лимфоцитах, что служит сиг-
налом для В-клеток к индукции синтеза IgE. В итоге аллергенспецифиче-
ские IgE-антитела фиксируются на тучных клетках и базофилах слизистой
оболочки носа через FceRI.
В результате первичного контакта аллергена с клетками иммунной систе-
мы формируется состояние, именуемое как сенсибилизация, при котором
клинические проявления у пациентов обычно отсутствуют.
При повторном попадании аллергена происходит его связывание с IgE-
антителами, что служит механизмом запуска активации тучных клеток и
базофилов и последующей их дегрануляции. В окружающие ткани выде-
ляются медиаторы: гистамин, метаболиты арахидоновой кислоты (про-
стагландин D2, сульфидопептидные лейкотриены С4, D4 и Е4), фактор
активации тромбоцитов, кинины (брадикинин).
В результате выброса медиаторов в течение нескольких минут после
контакта с аллергеном развиваются патофизиологические процессы ранней
фазы аллергической реакции. Происходит повышение сосудистой проница-
емости, отек слизистой оболочки, активация нейрорецепторов парасимпа-
тической нервной системы. Это вызывает вазодилатацию и гиперсекрецию
слизистых желез. В результате межклеточного взаимодействия выделяются
хемотаксические медиаторы (ИЛ-5, ИЛ-8, ИЛ-13, RANTES, СС-хемокины),
играющие важную роль в привлечении воспалительных клеток в слизистую
оболочку полости носа. Клинически указанные изменения проявляются в
виде ринореи, чиханья, зуда, заложенности носа, подтекания слизи по зад-
ней стенке носоглотки.
У 50-92% больных АР развивается и поздняя фаза аллергической реак-
ции немедленного типа, а именно: симптомы, возникшие в период раннего
ответа, могут появляться вновь спустя 4-8, а иногда 12 ч после контакта с
ГЛАВА 12
ЧАСТЬ 2
422 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
аллергеном и сохраняются до 24 ч без дополнительного контакта с ним. Эта
фаза называется также отсроченной.
В развитии поздней фазы аллергической реакции 1-го типа основную
роль играют эозинофилы и базофилы, продуцирующие провоспалитель-
ные цитокины, ТЬ2-лимфоциты, ИЛ-5, моноцитарный хемотаксический
белок-1 (МСР-1), молекулы клеточно-сосудистой адгезии — sVCAM-1
и лейкотриен LTC4. Указанные хемокины и цитокины высвобождаются
резидентными клетками слизистой оболочки носа и вызывают хемотаксис
базофилов и эозинофилов. Последние активируются и выделяют допол-
нительные медиаторы, в том числе гистамин, лейкотриены и цитокины
(ИЛ-3, ИЛ-5, ИЛ-6, ИЛ-8, ГМ-КСФ), способствуя тем самым персистенции
возникшего аллергического воспаления.
Однажды развившееся воспаление в слизистой оболочке носа сохраня-
ется в течение нескольких недель после воздействия аллергена. При пер-
систирующем АР, когда происходит длительное воздействие низких кон-
центраций аллергена, развивается хроническое аллергическое воспаление в
слизистой оболочке носа.
При АР попадание аллергенов на слизистую оболочку уже через минуту
вызывает симптомы заболевания в виде чиханья, зуда в полости носа, рино-
реи. Активность ресничек мерцательного эпителия снижена. Важную роль
в развитии симптомов АР играет назальная гиперреактивность, развитию
которой способствует ухудшение экологической обстановки; ухудшение
качества воздуха в жилых помещениях, офисах, учебных заведениях и про-
изводственных помещениях, кондиционированный воздух. Формированию
назальной гиперреактивности также способствуют вирусные инфекции.
Назальная гиперреактивность — отличительный признак АР. Она может
развиваться в результате повышения чувствительности слизистой оболочки
носа к ирритантам и неспецифическим стимулам (например, к изменению
температуры, сильным запахам). Индукция назальной гиперреактивности
может приводить к появлению персистирующих симптомов назальной
блокады и секреции слизи в течение некоторого времени после удаления
этиологического агента. Для диагностики используют тесты с метахолином,
гистамином; причем усиление назальной гиперреактивности выявляют
преимущественно у пациентов с АР. Наличие назальной гиперреактивно-
сти у пациентов с ринитами проявляется усилением назальных симптомов
(ринорея, заложенность носа, чиханье, зуд при появлении во вдыхаемом
воздухе табачного дыма, сильных запахов парфюма, выхлопных газов
машин, поллютантов, загрязнителей воздуха). Наличие назальной гиперре-
активности ограничивает качество жизни пациентов с ринитом.
Классификация
Согласно Международной классификации болезней 10-го пересмотра
(МКБ-10), выделяют сезонный и круглогодичный АР.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 423
Рис. 12-6. Классификации аллергического ринита: А—классификация согласно МКБ-10;
Б — классификация ARIA.
ГЛАВА 12
Помимо этого, существуют другие классификации, представленные в
согласительных документах Европейской академии аллергологии и кли-
нической иммунологии (2000), а также разработанные группой экспертов
Всемирной организации здравоохранения в рамках программы ARIA (The
Allergic Rhinitis and its Impact on Astma, 1999), дополненные в 2008 г.
В России в настоящее время используют обе классификации, что в какой-
то мере позволяет оценивать заболевание с учетом разных факторов: сезон-
ности, выраженности симптомов, длительности их сохранения у больного,
частоты возникновения симптомов, этиологических факторов.
ЧАСТЬ 2
424 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
В приведенных выше классификациях АР выделены факторы, важные
для диагностики данного заболевания в отличие от ринитов, вызываемых
неаллергическими причинами. Акцент на сезонность АР позволяет оценить
спектр причинно-значимых аллергенов, элиминационные мероприятия и
планировать проведение специфического аллерголечения.
С другой стороны, разделение на интермиттирующий и персистирую-
щий ринит нацелено на определение фармакологической тактики ведения
больного, но в меньшей степени характеризует возможные этиологические
причины.
Клиническая картина
Основные клинические проявления АР:
• зуд в полости носа;
• ринорея (обильные водянистые выделения из носа);
• чиханье, чаще многократное, приступообразное;
• заложенность носа.
Сезонный АР характеризуется повторяемостью симптомов в один и
тот же период года, что связано с наличием в воздухе пыльцы причинно-
значимых деревьев, трав, сорняков, а также спор плесневых грибов.
Сезонный АР чаще возникает внезапно, остро, с появления зуда в носу,
многократного чиханья, слизистых прозрачных выделений из носа, затруд-
нения носового дыхания. Характерно сочетание сезонного АР с сезонным
аллергическим конъюнктивитом, что выявляют у 50-90% пациентов. У
некоторых больных ринит сочетается со средним серозным отитом, евста-
хиитом, фарингитом. Из-за раздражающего действия назального секрета у
детей кожа над верхней губой зачастую мацерируется.
У пациентов со среднетяжелым и тяжелым течением сезонного АР к
основным симптомам заболевания могут присоединяться симптомы инток-
сикации в виде головной боли, недомогания, расстройства сна и др. У неко-
торых больных ослабевает обоняние.
Наличие общих антигенов у пыльцы растения с его листьями, стеблями,
плодами, а также другими родственными растениями вызывает развитие
перекрестных реакций между пыльцевыми и пищевыми аллергенами. Этот
факт следует обязательно учитывать, назначая диету пациентам с сезонным
АР. Например, при наличии аллергии к пыльце деревьев (в особенности
березы) возможна перекрестная пищевая аллергия к яблокам, грушам,
сливам, абрикосам, персикам, вишне, черешне, орехам, моркови, киви,
петрушке, сельдерею.
При наличии сенсибилизации к аллергенам злаковых трав выявляют
непереносимость пищевых злаков: овса, пшеницы, ячменя и др. При
аллергии на сорные травы у пациентов может развиться непереносимость
семян подсолнечника, а также продуктов их переработки (подсолнеч-
ное масло, халва, майонез), тыквенных (дыня, арбуз, огурцы, кабачки),
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 425
пасленовых (томаты, баклажаны), крестоцветных (капуста, редька, гор-
чица), лебедовых (свекла, шпинат) и напитков, в состав которых входит
полынь.
В том случае, когда сезонный АР возникает в ответ на контакт с аллер-
генами спор плесневых грибов, необходимо учитывать возможность пере-
крестной пищевой непереносимости продуктов грибкового происхожде-
ния, а именно: сыров, кисломолочных продуктов, квашеной капусты, пива,
кваса, сухих вин и др. Важно отметить, что пациенты с сезонным АР могут
обладать повышенной чувствительностью к лекарственным средствам из
группы фитотерапевтических, а при аллергии к грибкам — к пенициллинам
и витаминам группы В.
Круглогодичный АР характеризуется наличием постоянной клиниче-
ской симптоматики в течение года, отсутствием сезонных обострений.
У больных с круглогодичным АР проявляются все основные симптомы
АР. Поскольку больные круглогодичным АР могут быть сенсибилизиро-
ваны и к бытовым, и к пыльцевым аллергенам, обострения заболевания
и его утяжеление могут носить отчасти сезонный характер. Кроме того,
ингаляционные аллергены внутри жилища могут накапливаться в высокой
концентрации в период активного размножения клещей и/или грибов, что,
в свою очередь, может сопровождаться сезонными (периодическими) обо-
стрениями заболевания.
Основные клинические симптомы круглогодичного АР:
• ринорея (менее обильная, чем при сезонном АР);
• заложенность носа;
• зуд в полости носа и/или носоглотки;
• чиханье (чаще по утрам).
Указанные выше симптомы нарастают по частоте и выраженности по
мере длительности заболевания, оказывая существенное влияние на каче-
ство жизни пациента. Зачастую у пациентов с круглогодичным АР одновре-
менно выявляют нарушения слуха и обоняния. Возможно подтекание слизи
по задней поверхности носоглотки.
У детей при внешнем осмотре обращает на себя внимание полуоткрытый
рот, «аллергическое сияние», т.е. круги под глазами или потемнение нижних
век из-за хронической назальной обструкции и дополнительная складка на
нижнем веке (линия Дени), «аллергический салют» — потирание кончика носа
ладонью снизу вверх, поперечная складка между кончиком и спинкой носа.
Симптомы круглогодичного АР беспокоят пациента практически посто-
янно, снижая его физическую, эмоциональную, профессиональную, соци-
альную активность. У больных ухудшается качество сна.
Дети, страдающие круглогодичным АР, часто жалуются на повышенную
утомляемость, головную боль. У них происходит нарушение когнитивных
функций (памяти, внимания и т.д.), страдает ночной сон, усиливается сон-
ливость днем, раздражительность, появляется склонность к депрессиям.
ГЛАВА 12
ЧАСТЬ 2
426 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Симптомы поражения слизистой оболочки носа при круглогодичном АР
носят, как правило, двусторонний характер. У 30-50% больных с круглого-
дичным АР развивается БА.
Диагностика
В настоящее время алгоритм диагностики АР следующий:
• сбор аллергоанамнеза и общеклинического анамнеза;
• аллергологическое обследование in vivo, in vitro;
• цитологическое исследование слизистой оболочки полости носа (эози-
нофилия);
• консультация ЛОР-врача (риноскопия, риноманометрия и др.).
Дифференциальная диагностика
АР составляют до 50% всех ринитов у пациентов. При проведении
дифференциальной диагностики необходимо уже на этапе сбора анамнеза
выявить у больного наличие атопии (шаги атопии у пациента, наличие
аллергии у родственников), а также оценить характер причинно-значимых
аллергенов.
Прежде всего врачу необходимо выделить группу больных с аллергией
из числа тех, кто страдает нарушениями носового дыхания. Трудности в
проведении дифференциальной диагностики требуют несколько подробнее
остановиться на причинах и классификации неаллергических ринитов.
Классификация неаллергичских ринитов
• Идиопатические неаллергические риниты.
О Неаллергический эозинофильный ринит.
<> Сезонный неаллергический (вазомоторный) ринит.
о Холинергические синдромы (например, водянистые выделения из
носа во время еды или под влиянием холодного воздуха).
• Риниты инфекционной этиологии.
• Риниты эндокринной природы:
v при беременности;
О при гипотиреозе.
• Риниты, вызванные лекарственными препаратами:
О средствами, уменьшающими отечность слизистой оболочки носа
(медикаментозный ринит);
о гипотензивными препаратами;
•О пероральными контрацептивами;
& ацетилсалициловой кислотой и другими НПВС у лиц с повышенной
чувствительностью к ацетилсалициловой кислоте;
<> кокаином при наркомании.
• Риниты при гранулематозах:
О саркоидозе;
О гранулематозе Вегенера;
<> срединной гранулеме лица.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 427
• Анатомическая или механическая обструкция носовых ходов:
о искривление носовой перегородки;
О полипоз носа;
гипертрофия носовых раковин;
< > опухоли;
< > аденоиды;
атрезия хоан.
• Риниты иной природы:
< > нарушение подвижности ресничек мерцательного эпителия;
- атрофический ринит;
О назальная ликворея.
Перечень заболеваний и состояний, сопровождающихся симптомами
хронического ринита, позволяет оценить важность ранней диагностики и
дифференциации заболевания. В 2006 г. в России сотрудниками Института
иммунологии ФМБА предложено разделять неаллергические риниты на
три большие группы:
• инфекционные;
• структурные;
• другие.
В свою очередь, инфекционные риниты подразделяются на острые (вирус-
ные, бактериальные) и хронические (бактериальные, бактериальные с нео-
бычной микрофлорой — анаэробной, туберкулезной, лепрозной; грибковой,
сформированной аспергиллами, актиномицетами, кандидами и др.).
Среди структурных ринитов предложено выделять полипоз носа, гипер-
трофию носовых раковин, аденоидные разрастания, инородные тела, атре-
зию хоан, неопластические процессы.
Риниты, относящиеся к группе «другие»: идиопатический вазомоторный,
индуцированный лекарственными средствами (0-блокаторами, оральными
контрацептивами, гормонами, ингибиторами ангиотензинпревращающе-
го фермента, НПВС, резерпином, деконгестантами), возникающие при
различных заболеваниях (муковисцидозе, иммунодефицитах — гипогам-
маглобулинемии; системных заболеваниях — СКВ, синдроме Шегрена,
гранулематозе Вегенера, саркоидозе), гормональные (ринит беременных,
старческий).
Аллергический грибковый риносинусит связан с Aspergillus, Rhizopus,
Altemaria, Curvularia, Bipolaris specifera. Для инициирования заболевания
требуется экспозиция к этим грибам. Аллергический грибковый риноси-
нусит первоначально развивается в молодом возрасте у пациентов с ато-
пией, причем одновременно возрастает риск развития назальных полипов.
При обследовании выявляют положительные кожные тесты на грибковые
аллергены и повышение уровня общего IgE и аллергенспецифических
IgE-антител в сыворотке. В слизистой оболочке пазух носа обнаруживают
ГЛАВА 12
ЧАСТЬ 2
428 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
характерное эозинофильное воспаление с заполнением синусов слизистым
секретом (вязким, эозинофильным, с грибковыми частичками и кристал-
лами Шарко-Лейдена). Большое количество производных эозинофилов и
нейтрофилов (главный основной белок, нейтрофильная эластаза и др.) в
слизи свидетельствует об активации этих клеток при данном заболевании.
Аллергический грибковый риносинусит более чем у 50% пациентов
протекает как одностороннее поражение пазух носа. Часто у больных со
временем развивается БА.
Острые и хронические рииосииуситы
Синуситы — воспалительные заболевания, встречающиеся с частотой
10-30% в Европе и примерно 15% в Америке.
Симптомы острого синусита включают заложенность носа, назальные
выделения, в том числе гнойные, стекание отделяемого по задней стенке
глотки, боли в области лица, головные боли, чувство давления в голове,
нарушение обоняния (гипосмия), кашель, лихорадку, а также «отражен-
ные» зубные боли и боли в глазах. При острой бактериальной инфекции
преобладают боли в области лица и при пальпации, головные боли имеют
разную локализацию в зависимости от поражения синуса. При рентгеноло-
гическом исследовании выявляют частичное или полное затемнение одного
и более синусов. При хронических синуситах симптомы подобны таковым
при остром процессе, но могут отличаться от них (например, проявлением
лишь одного симптома).
Симптомы, характерные для хронического риносинусита.
• Основные:
❖ боль в области лица и при надавливании;
< > гиперемия лица;
• О- назальная обструкция/блокада;
О гнойное назальное отделяемое;
О стекание отделяемого по задней стенке глотки;
гипосмия, аносмия.
• Дополнительные:
<> головная боль;
О лихорадка;
о слабость;
Ф неприятный запах изо рта;
зубные боли;
О боли в глазах и при надавливании.
Наиболее общими из всех перечисленных симптомов при хронических
риносинуситах являются головная боль, боли в области лица, назальная
обструкция и выделения из носа.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 429
Аллергический ринит у детей
АР может начаться в раннем возрасте. Считается, что пик заболеваемо-
сти у детей приходится на возраст 3-4 года, а наиболее часто АР начинается
в возрасте 2-3 лет. У 70% детей заболевание начинается в возрасте до 6 лет,
причем вплоть до подросткового возраста мальчики болеют чаще девочек,
а затем показатели заболеваемости сравниваются.
У детей в грудном возрасте причинами АР выступают прежде всего
пищевые аллергены (коровье молоко, молочные смеси, яйцо кур); начиная
с раннего дошкольного возраста — ингаляционные аллергены. У 54% детей
выявляют отягощенный аллергологический анамнез.
Провоцирующие факторы в детском возрасте — особенности анатомо-
физиологического строения носа, повышенная проницаемость слизи-
стой оболочки и сосудистой стенки, кавернозная ткань носовых раковин.
Различные условия внешней среды (в частности, курение табака в присут-
ствии ребенка, контакт с домашними животными, птицами, рыбами и др.)
могут оказывать провоцирующее действие на развитие АР. В 12% случаев
у детей АР может развиться после перенесенной острой респираторной
вирусной инфекции.
Клинические проявления АР, в зависимости от возраста ребенка, имеют
свои особенности. Так, у грудных детей основными симптомами могут быть
затруднение носового дыхания вследствие отека слизистой оболочки носа,
нарушения сосания, срыгивания. У детей в раннем возрасте при АР, помимо
чиханья и ринореи, могут возникнуть симптомы кашля, подъем темпера-
туры, увеличение регионарных лимфатических узлов. С 3-4 лет ребенок в
состоянии предъявить жалобы на зуд в носу, чиханье, ринорею, затрудне-
ние носового дыхания.
При осмотре детей с АР следует обращать внимание на их внешний вид.
Часто у ребенка полуоткрыт рот, приподнята верхняя губа, «готическое»
строение верхнего нёба, неправильный прикус, сухие губы, распухший кон-
чик носа, одутловатое лицо, круги под глазами.
Зачастую у ребенка появляется гнусавость вследствие отечности мягкого
нёба и язычка. Риноскопическая картина у детей в период обострения АР не
отличается от таковой у взрослых и представлена отеком слизистой носо-
вых раковин (в основном нижних); цвет которой беловатый, реже синюш-
ный. Выделения носят серозно-слизистый характер.
ГЛАВА 12
Рис. 12-7. Аллергический ринит у
ребенка 6 лет. Аденоидные вегета-
ции. Аллергический конъюнктивит —
дополнительная складка на ниж-
нем веке (линия Дени-Моргана).
Сенсибилизация к бытовым, пыльце-
вым и пищевым аллергенам.
ЧАСТЬ 2
430 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Лечение
Основные принципы этиопатогенетической терапии АР:
• устранение (элиминация) причинно-значимых аллергенов и прово-
цирующих факторов либо при невозможности полной элиминации
уменьшение контакта с ними;
• АСИТ;
• фармакотерапия;
• Большую вспомогательную роль играют образовательные программы
для пациентов.
Элиминационные мероприятия при сезонном АР
• В период цветения растений, к которым у пациентов отмечается повы-
шенная чувствительность, следует уменьшать время пребывания на
улице в солнечные дни либо рано утром, т.е. в периоды наибольшей
концентрации пыльцы в воздухе.
• Не рекомендуется выезжать в загородную зону в течение всего сезона
поллинации.
• Следует использовать в доме на окнах занавески.
• Нужно закрывать окна в машинах.
• Следует планировать переезд на сезон поллинации в другую климати-
ческую зону.
• После возвращения с улицы домой обязательно нужно умываться или
принимать душ.
• При перекрестной пищевой аллергии следует исключить из рациона
продукты, имеющие общие антигенные детерминанты с пыльцевыми
аллергенами.
Элиминационные мероприятия при круглогодичном АР
• Регулярная уборка помещений.
• Отказ от содержания домашних животных, птиц, рыб и т.д.
• Удаление плесени в жилых и нежилых помещениях, в которых пре-
бывает пациент.
• Исключение из продуктов питания причинно-значимых продуктов,
способных вызвать перекрестные реакции.
• Противопоказано применение лекарственных средств пенициллино-
вого ряда при грибковой аллергии, а также НПВС, сульфаниламидов
и др.
Аллергенспецифическая иммунотерапия (АСИТ)
Наиболее эффективным, патогенетически обоснованным методом лече-
ния АР является АСИТ (см. главу «Лечение аллергических заболеваний»).
Фармакотерапия
Рациональная фармакотерапия позволяет не только облегчить состоя-
ние больного, но и предотвратить утяжеление течения АР и развитие
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 431
Диагностика аллергического ринита
Интермиттирующие Персистирующие
симптомы симптомы
Исключите астму,
особенно у пациентов
со среднетяжелым/тяжелым
и/или
персистирующим ринитом
ГЛАВА 12
Легкий
I
Перечислены
в произвольном
порядке
Пероральный
антигистаминный
препарат, или
Интраназальный
антигистаминный
препарат, и/или
Деконгестант, или
Антагонист лейко-
триеновых
рецепторов*
Среднетяжелый/ Легкий
тяжелый
Перечислены
в произвольном порядке
Пероральный антигистаминный
препарат, или
Интраназальный антигиста-
минный препарат, и/или
Деконгестант, или
Интраназальный
кортикостероид, или
Антагонист лейкотриеновых
рецепторов* (или кромон)
При персистирующем
рините обследуйте
пациента через
2-4 нед
—I—
Если нет улучшения,
перейдите на одну
ступень вверх.
При улучшении
продолжайте
лечение в течение
месяца
*В особенности у больных с бронхиальной астмой.
Среднетяжелый/
тяжелый
I
Перечислены в произвольном порядке
Интраназальный кортикостероид
Антигистаминный препарат
или антагонист лейкотриеновых
При зуде/чихании При обструкции
добавьте добавьте
антигистаминный деконгестант или
препарат пероральный
кортикостероид
(коротким курсом)
| Нет эффекта |
(Консультация
________________
Необходимо исключить контакт с аллергенами и раздражающими агентами
При наличии конъюнктивита добавьте в схему лечения:
- пероральный антигистаминный препарат, или
- антигистаминный препарат в виде глазных капель, или
- кромон в виде глазных капель (или физиологический раствор)
Рассмотрите возможность назначения специфической иммунотерапии
Рис. 12-8. Алгоритм диагностики и лечения аллергического ринита.
сопутствующих заболеваний и осложнений. На основании принципов дока-
зательной медицины предлагаются подходы к лечению АР, представленные
в табл. 12-7 (в рамках программы ARIA, 2007).
432 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-7. Доказательная эффективность лечения ринита
Способ лечения Аллергический ринит
сезонный круглогодичный
взрослые дети взрослые дети
Пероральные блокаторы Н^рецепторов гистамина А А А А
Интраназальные блокаторы Н(-рецепторов гистамина А А А А
Интраназальные глюкокортикоиды А А А А
Интраназальные кромоны А А (старше 12 лет) А А
Антагонисты лейкотриеновых рецепторов А А А ?
Подкожная АСИТ А А А А
Сублингвальная/назальная АСИТ А А А В
Элиминация аллергена д д А* В*
А — рекомендация основана на результатах рандомизированных контролируемых кли-
нических испытаний; В — хотя бы одно нерандомизированное клиническое испытание;
Д — рекомендация основана на клиническом опыте экспертов.
* Неэффективно в популяции в целом.
Вопросы для самоконтроля
• Назовите современную классификацию ринитов (ARIA, 2008).
• Какова распространенность АР в различных странах мира, в том числе
в России?
• Перечислите основные группы причинно-значимых аллергенов при
АР.
• Какие иммунологические реакции лежат в основе патогенеза АР?
Какова роль цитокинов в реализации ранней и поздней фаз аллергиче-
ской реакции I типа?
• Каковы критерии интермиттирующего и персистирующего АР?
• Каковы основные клинические проявления АР? Опишите особенности
сезонного аллергического ринита.
• Назовите основные признаки круглогодичного аллергического ринита.
• С какими формами неаллергических ринитов следует дифференциро-
вать АР?
• Охарактеризуйте основные клинические особенности АР у детей.
• Перечислите элиминационные мероприятия при сезонных и кругло-
годичных АР.
• Какие методы терапии АР имеют степень доказательности А?
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 433
12.4. АТОПИЧЕСКИЙ ДЕРМАТИТ
Атопический дерматит (АтД) — одно из самых распространенных аллер-
гических заболеваний, поражающих прежде всего детей. Манифестирует с
грудного возраста и сохраняется в ряде случаев в течение всей жизни паци-
ента. Впервые в 1892 г. Безниер (Besnier) описал группу больных с пруриго,
у которых одновременно имелась наследственная предрасположенность
к астме и сенной лихорадке. В 1930 г. Л. Хилл, М. Зальцбергер (I. Hill и
М. Sulzberger) предложили термин «атопический дерматит» для описания
экземы у младенцев и детей, а также хронических лихеноидных нарушений
и ксероза, характерных для взрослых.
По данным эпидемиологических исследований, распространенность
АтД сильно варьирует в разных странах и даже внутри одной страны в
зависимости от региона. Так, распространенность АтД в Европе составляет
15-20%, в Австралии — до 31%, в Азии — 5%. В России — до 32% детей в
возрасте 2-3 лет имеют симптомы АтД. Начиная с 70-х годов XX в. проис-
ходит неуклонный рост заболеваемости АтД и частоты ранних проявлений
первых симптомов заболевания у детей (начиная с возраста 1-2 мес).
До настоящего времени о патогенезе и этиологии данного заболевания
единого мнения нет. Неоднократно происходила смена терминологии. У
некоторых больных (10-40%) установлена неаллергическая природа дер-
матита.
В 2002 г. был создан Российский национальный согласительный доку-
мент по атопическому дерматиту (под общей редакцией Р.М. Хаитова,
А.А. Кубановой), позволивший глубже понять основные признаки заболе-
вания.
Определение
АтД — аллергическое заболевание кожи, возникающее, как правило, в
раннем детском возрасте у лиц с наследственной предрасположенностью к
атопическим заболеваниям, имеющее хроническое рецидивирующее тече-
ние, характерные возрастные особенности, локализацию и морфологию
очагов воспаления. Заболевание проявляется кожным зудом и обусловлено
гиперчувствительностью к аллергенам и неспецифическим раздражителям.
АтД служит одним из первых проявлений «аллергического марша» у
ребенка и одновременно существенным фактором риска развития у него в
будущем АР и БА.
В патогенезе АтД ведущую роль играют иммунные механизмы. Установ-
лено, что ДК кожи (клетки Лангерганса) презентируют антиген Т-хелперам,
активация которых происходит по ТЬ2-типу. Активированные Th2-лимфо-
циты продуцируют цитокины, особенно ИЛ-4. В коже больных АтД обнару-
живают значительно больше клеток Лангерганса, чем у здоровых.
ГЛАВА 12
ЧАСТЬ 2
434 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
При повторном поступлении аллергена происходит дегрануляция туч-
ных клеток и выделение медиаторов воспаления, запускающих раннюю
фазу аллергической реакции, клинически проявляющуюся зудом кожных
покровов, гиперемией, отеком. В дальнейшем под действием ИЛ-5, ИЛ-6,
ИЛ-8 происходит усиление миграции эозинофилов и макрофагов в очаг
воспаления и хронизация аллергического воспаления кожи.
Эпителиальные клетки продуцируют подобный ИЛ-7 цитокин — TSLP
(Thymic Stromal Lymphopoietiri), способный существенно активировать мие-
лоидные ДК человека и индуцировать опосредованный ТЬ2-клетками вос-
палительный ответ, характеризующийся высоким уровнем образования
ФНО-а и низкой продукцией ИЛ-10.
Обнаружено, что TSLP экспрессируется в большом количестве кератино-
цитами кожи больных АтД и связан с активацией ДК in situ. Показано, что
у человека TSLP может потенциально активировать CDllc+ ДК и индуци-
ровать образование хемокинов-аттрактантов ТЬ2-клетками: TARC (англ.
Thymus and Activation-Regulated Chemokine\ известный также как CCL17) и
MDC (англ. Macrophage Derived Chemokine, или CCL22). Активированные
ДК примируют наивные ThO-лимфоциты к образованию цитокинов ИЛ-4,
ИЛ-5, ИЛ-13, ФНО-а, тогда как синтез/секреция ИЛ-10 и ИФН-у снижают-
ся. Экспрессия TSLP связана с миграцией и активацией клеток Лангерганса
in situ. Воспалительный ответ ТЬ2-клеток, инициированный TSLP, реализу-
ется через экспрессию молекул OX40L.
В настоящее время описано больше 20 факторов, ответственных за
формирование АтД. Предрасположенность к атопии связывают преиму-
щественно с генами, находящимися на хромосомах Iq23-q25, 13ql4.1,
Ilql2-ql3, 6р21.2-р12, 5q33.2, 5q32. Формированию аллергического
воспаления в коже способствуют цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10,
ИЛ-13, ИЛ-18, ТФР-01, ФНО-а), а также хемокины (CCL11, или эотак-
син, и др.).
Кожа больных АтД отличается особой сухостью, что может приводить к
нарушению ее барьерной функции. Предрасполагающий фактор — дефект
гена, кодирующего белок филаггрин (ттл. filaggrin). Больные с мутацией
гена, кодирующего филаггрин, предрасположены к формированию АтД и
вульгарной формы ихтиоза с ослаблением барьерных функций кожи.
Таким образом, одна из ключевых особенностей иммунологических
нарушений в коже — взаимодействие эпителиальных, дендритных и лим-
фоидных клеток с выделением медиаторов аллергического воспаления в
очагах поражения.
Иммунорегуляторные нарушения при АтД.
• Усиление синтеза IgE.
• Увеличение уровня специфических IgE-антител к различным аллерге-
нам, включая пищевые и аэроаллергены.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 435
• Увеличение уровня IgE-антител, специфичных к микроорганизмам и
энтеротоксинам.
• Усиление экспрессии CD23 на В-лимфоцитах и моноцитах.
• Усиление выделения гистамина базофилами.
• Снижение числа и функциональной активности CD8+ Т-лимфоцитов.
• Увеличение секреции ИЛ-4, ИЛ-5, ИЛ-13 ТЬ2-лимфоцитами.
• Снижение секреции ИФН-у ТЫ-лимфоцитами.
• Увеличение уровня ИЛ-10, простагландина Е2 и циклической адено-
зинмонофосфатфосфодиэстеразы моноцитов.
Нарушения, выявляемые у пациентов с АтД, затрагивают все основные
звенья иммунной системы. В-клетки синтезируют в больших количествах
IgE, в то же время у мононуклеарных клеток периферической крови
синтез ИФН-у нарушен, что коррелирует с повышенным уровнем IgE.
Образование ИФН-у подавляется также простагландином Е2 и ИЛ-10,
секретируемыми в повышенном количестве моноцитами пациентов с АтД.
В настоящее время считают, что центральное место в каскаде иммуноре-
гуляторных нарушений при АтД занимает активация ТЬ2-лимфоцитов и
моноцитов.
Одновременно с иммунными механизмами в патогенезе АтД важную
роль играют нарушения функций центральной и вегетативной нервной
системы. Выявляют патологическую сухость кожных покровов, нарушения
водно-липидного баланса и барьерной функции кожи.
Генетика
Предполагают наличие локуса, ответственного за атопию на хромосоме
llql3, но связь АтД с этим локусом пока не доказана. Однако обнаружена
возможная связь АтД и БА с генами на хромосоме llql2-13, ответствен-
ными за синтез 0-цепи высокоаффинного рецептора IgE. Изучают роль
генов хромосомы 5q31-33, поскольку именно здесь расположено семейство
генов цитокинов: ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-13 и ГМ-КСФ, экспрессируемых
ТЬ2-лимфоцитами. В последнее время показано, что чувствительность к
АтД может быть связана с хромосомами 3q21, lq21, 17q25 и 20р. Такие
исследования особенно важны, поскольку эти локусы связаны с псориазом
и, возможно, гены, локализующиеся в них, ответственны за процессы вос-
паления в коже и за иммунную дисрегуляцию.
Следует отметить, что многие механизмы повреждения кожи при АтД
остаются недостаточно изученными. Выделяют ряд факторов риска раз-
вития АтД. Наиболее значимы из них:
• наследственная предрасположенность к аллергии, выявляемая у
75-82% пациентов с АтД и проявляющаяся повышением образования
IgE, нарушением синтеза ИЛ-4, генетически запрограммированным
Т112-типом иммунного ответа;
ГЛАВА 12
ЧАСТЬ 2
436 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• наследственно обусловленное избыточное накопление в коже клеток
Лангерганса, нарушение синтеза липидов и, как следствие, дефицит
церамидов и врожденная повышенная сухость кожи;
• важна роль аллергенов при АтД. Наиболее значимыми в раннем воз-
расте являются пищевые аллергены (белки коровьего молока, кури-
ного яйца, рыбы, злаковых, сои); у детей школьного возраста роль
пищевых аллергенов уменьшается, и возрастает роль ингаляционных,
бытовых, эпидермальных, пыльцевых аллергенов;
• сенсибилизация к бактериальным аллергенам. Выявляют в 20% случаев.
Она обусловлена появлением очагов хронического инфицирования кожи.
Доказана роль суперантигенов стафилококков и грибов в хронизации
аллергического воспаления кожи. Высокая антигенная нагрузка на плод,
связанная с патологическим течением беременности и родов, нарушение
диеты женщины во время беременности и в период лактации.
• ранний перевод ребенка на искусственное вскармливание;
• патология пищеварительного тракта ребенка (дисбиоз кишечника),
паразитарные инфекции, наличие очагов хронической инфекции;
• экология среды обитания, характерной для современного стиля
жизни.
Иммуногистохимические исследования кожи показали, что при
остром и хроническом АтД выявляют в основном CD3+ CD4+ CD45RO+
Т-лимфоциты памяти. Эти клетки экспрессируют также молекулы CD25
и HLA-DR. Кроме того, почти все Т-лимфоциты, инфильтрирующие зоны
поражения, экспрессируют высокий уровень CLA — лиганда для адгезив-
ной молекулы сосудов Е-селектина. Эндотелиальные клетки сосудов в зоне
поражения экспрессируют высокий уровень Е-селектина. Тучные клетки,
моноциты, клетки Лангерганса, кератиноциты служат источниками ИЛ-1 и
ФНО-а, индуцирующих экспрессию Е-селектина.
Мишенью Е-селектина являются CLA+ Т-лимфоциты в зоне кожного
воспаления. Более того, в процесс миграции Т-лимфоцитов в зону воспа-
ления вовлекается взаимодействие между молекулами VCAM-1 и VLA-4.
Клетки Лангерганса в эпидермисе и дерме пациентов с АтД экспрессируют
молекулы CD16, CD36, HLA-DR и способны активировать CD4+ Т-клетки.
Клиническая картина
АтД манифестирует в раннем детском возрасте и к 5 годам развивается
у 90% пациентов. У детей младше 2 мес заболевание начинается крайне
редко, возможно, ввиду незрелости иммунного ответа в этом возрасте.
Прогнозировать дальнейшее течение АтД трудно, и данные разных авто-
ров противоречивы. В основном больше чем у 50% детей, у которых АтД
манифестирует в первые 2 года жизни, сохраняются симптомы заболевания
и во взрослом состоянии. Диагностика АтД основана на определении ряда
симптомов: основных и дополнительных.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 437
Основные симптомы АтД
• Зуд.
• Поражение лица и разгибательных поверхностей конечностей у детей.
• Лихенификация в сгибательных участках конечностей.
• Хронический рецидивирующий дерматит.
• Другие атопические заболевания в анамнезе у пациента.
• Отягощенный семейный анамнез.
Дополнительные симптомы АтД.
• Ксероз.
• Инфекционные поражения кожи.
• Дерматиты конечностей.
• Ихтиоз.
• Гйперисчерченность ладоней.
• Себорейная экзема.
• Экзема соска у женщины.
• Белый дермографизм.
В дополнение к этим симптомам в исследовательских целях вычисляют
различные индексы: SCORAD (SCORing Atopic Dermatitis) или EASI (Eczema
Area and Severity Index). Принципиальными для диагностики являются симп-
томы зуда, рецидивирующее течение, типичная морфология и локализация
кожного поражения, анамнез атопического заболевания.
• Острый АтД характеризуется интенсивным зудом, эритематозными
папулами, экскориациями, появлением везикул и серозного экссудата.
• Подострый АтД характеризуется эритемой, экскориациями, папулами.
• Для хронического АтД характерно утолщение кожи с лихенификаци-
ей и фиброзными папулами. У пациентов с хроническим АтД возмож-
ны все три типа кожных поражений.
У грудных детей первоначально вовлекается лицо, волосистая часть
головы, разгибательные поверхности конечностей. Паховая зона обычно
не затронута. Поражение в паховой зоне может быть вторичным за счет
инфицирования Candida. У детей раннего возраста с АтД, наоборот, обычно
поражается межъягодичная область.
Все пациенты с АтД имеют повышенную чувствительность кожи к
инфекциям, таким, как герпес, моллюск, папилломавирусы. Суперинфекция
может быть причиной обострения АтД. У таких больных чаще выявляют
Trichophyton rubrum. При преимущественном поражении головы и шеи обна-
руживают ассоциацию с инфекцией Pityrosporum ovale. Многочисленные
исследования показали роль Staphylococcus aureus при АтД и высокую сте-
пень колонизации кожи этими возбудителями.
У 80-85% больных АтД выявляют сенсибилизацию к пищевым и инга-
ляционным аллергенам, что предполагает важную роль аллергенов в ини-
циации этого заболевания.
ГЛАВА 12
438 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Рис. 12-9. Атопический дерматит, распространенная форма у ребенка 4 мес.
Рис. 12-10. Атопический дерматит, ограниченно-локализованная форма. Пищевая аллер-
гия. Ребенок 8 мес.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 439
Рис. 12-11. Атопический
дерматит. Гипопигментация
в подколенных сгибах.
Ребенок 15 лет.
ГЛАВА 12
Рис. 12-12. Атопический
дерматит, локализованная
форма. Поражение лица
и шеи. Пациентка 29 лет.
440 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Рис. 12-13. Атопический
дерматит Лихенификация
в области локтевого сгиба.
4г
Рис. 12-14. Атопический
дерматит. Гиперисчерчен-
ность ладоней.
Классификация
Классификация АтД основана на параметрах, отражающих возрастные
аспекты, распространенность процесса и степень его тяжести. В соответ-
ствии с этим выделяют три возрастных периода, различающихся клиниче-
скими проявлениями (табл. 12-8).
Во всех возрастных периодах у больных АтД возникает зуд разной степе-
ни интенсивности, вплоть до скальпирующего.
По распространенности кожного процесса различают:
• ограниченно-локализованный АтД — поражение затрагивает локте-
вые и/или подколенные складки, кисти рук, кожу шеи и/или лица.
Площадь поражения составляет до 10% кожных покровов;
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 441
ГЛАВА 12
Таблица 12-8. Возрастная характеристика и локализация очагов поражения при атопи-
ческом дерматите (по данным Национального консенсуса по атопическому дерматиту,
М., 2005)
Возрастной период Клинические проявления
Первый возрастной период (от рождения до 2 лет) Преобладание экссудативной формы атопического дерматита, воспаление носит острый или подострый характер, возникает гиперемия, отечность, мокнутие, корки. Локализация: лицо, наружная поверхность голеней, сгибательная и разгибательная поверхности конечностей. К концу этого периода очаги локализу- ются преимущественно в областях локтевых сгибов и подколен- ных ямок, а также в области запястий и шеи
Второй возрастной период (2 года —12 лет) Процесс носит характер хронического воспаления: эритема, папу- лы, шелушение, утолщение кожи (инфильтрация), усиление кож- ного рисунка (лихенизация). множественные экскориации (рас- чесы), трещины. На местах разрешения воспаления возникают участки гипо- или гиперпигментации У некоторых детей в этом периоде формируется дополнительная складка нижнего века (симптом Дени-Моргана). Локализация: локтевые и подколенные складки, задняя поверхность шеи. сгибательные поверхности голеностопных и лучезапястных суставов, заушные области
Третий возрастной период (старше 13 лет и взрослые) Преобладают явления инфильтрации с лихенификацией, эритема с синюшным оттенком; папулы сливаются в очаги сплошной папулезной инфильтрации, характерна избирательность высыпа- ний в области верхней половины туловища, лица, шеи, верхних конечностей
• распространенный АтД — характерны частичные поражения кожи
груди, спины; помимо локтевых и подколенных складок, в про-
цесс вовлекаются другие участки конечностей (плечи, предплечья,
голени, бедра). Площадь поражения составляет 10-50% кожного
покрова;
• диффузный АтД — в патологический процесс вовлекается больше
50% кожного покрова.
По степени тяжести выделяют следующие формы АтД:
• легкую - ограниченное поражение кожи с редкими обострениями
1-2 раза в год;
• среднетяжелую — распространенный характер поражения и наличие
3-4 обострений в год;
• тяжелую — диффузные поражения кожи наряду с непрерывно-
рецидивирующим течением.
ЧАСТЬ 2
442 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Диагностика
В основе диагностики АтД лежит комплексное клинико-аллергологи-
ческое обследование, включающее:
• сбор аллергоанамнеза;
• постановку кожных аллергопроб (по показаниям — провокационные
пробы);
• лабораторную диагностику (уровень общего IgE, аллергенспецифиче-
ских IgE-антител), иммунологические исследования.
Дифференциальная диагностика
АтД развивается в любом возрасте и характеризуется истинным поли-
морфизмом сыпи. В типичных случаях заболевание имеет характерную
клиническую картину и четкие критерии для постановки диагноза. Однако
симптомы и морфологические признаки поражения кожи, свойственные
АтД, в виде эритемы, папулезных или папуловезикулезных элементов,
сухости, шелушения, трещин, экскориаций, инфильтрации и лихенифи-
кации кожи могут встречаться при других кожных заболеваниях, а также
бывают проявлениями целого ряда метаболических, неопластических и
иммунодефицитных состояний. В соответствии с этим следует дифферен-
цировать АтД от ряда заболеваний.
• Врожденные заболевания:
о синдромом HereproHa(Nethertori).
• Хронические дерматозы:
о себорейный дерматит;
контактный (аллергический или ирритантный) дерматит;
<> нумулярная экзема;
4 Lichen simplex (простой лишай).
• Инфекционные заболевания и инвазии:
чесотка;
ВИЧ-связанные дерматиты.
• Малигнизация:
<> кожная Т-клеточная лимфома (синдром Сезари).
• Иммунодефициты:
<> синдром Вискотта-Олдрича;
О ТКИД;
v ninep-IgE-синдром.
• Метаболические расстройства:
<> дефицит цинка;
< дефицит пиридоксина (витамин В6) и ниацина (никотиновая кисло-
та, витамин РР);
дефицит карбоксилазы, фенилкетонурия.
• Пролиферативные нарушения:
болезнь Леттерера-Сиве.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 443
Синдром Вискотта-Олдрича — ПИД, выявляемый у детей с первого
месяца жизни и характеризующийся триадой симптомов: дерматитом, кли-
нически сходным с атопическим, тромбоцитопенией, рецидивирующими
инфекциями пищеварительного и респираторного тракта.
Синдром гипериммуноглобулинемии Е (синдром Джоба) — симпто-
мокомплекс, относящийся к первичным иммунодефицитам, характеризую-
щийся высоким уровнем общего IgE в сыворотке крови (больше 2000 МЕ/
мл), атопическим дерматитом и рецидивирующими инфекционными про-
цессами. Характерно возникновение подкожных абсцессов, гнойных оти-
тов, пневмоний, кандидоза кожи и слизистых оболочек. Развивается в
раннем детском возрасте с появления на коже высыпаний в виде гиперемии,
инфильтрации, склонных к слиянию папул, которые локализуются в обла-
сти лица (при интактном носогубном треугольнике), на разгибательных
поверхностях конечностей, ягодицах, туловище. У детей старшего возраста
возникает лихенификация на шее, сгибательных поверхностях конечно-
стей, в области суставов.
Кандидоз гладкой кожи чаще начинается с поражения крупных скла-
док (интертригинозный кандидоз), где формируются эритематозно-
отечные очаги с везикулами, пустулами, эрозиями и мокнутием. При рас-
пространении воспаления с крупных складок на прилегающие участки
возникает кандидоз гладкой кожи. Преобладание эритематозно-отечных
очагов с эрозивными участками и мокнутием характерно для эритематоз-
ной формы. Наличие преобладающего количества везикул, пузырей, пустул
на фоне отечно-эритематозной кожи свойственно везикулезной разновид-
ности кандидоза.
Чесотка — контагиозное заболевание кожи из группы дерматозооно-
зов, вызываемое чесоточным клещом (Sarcoptes scabies). В ряде случаев
больные с чесоткой длительно получают лечение по поводу «атопического
дерматита». Основные клинические симптомы чесотки — зуд, усиливаю-
щийся в вечернее время, наличие чесоточных ходов, полиморфизм высы-
паний. Локализация сыпи у детей — сгибательные поверхности верхних и
нижних конечностей, особенно межпальцевые складки кистей, внутрен-
няя поверхность бедер, ягодицы, туловище, особенно в области пояса,
живота и по переднему краю подкрыльцовых впадин, а у мальчиков —
кожа мошонки и полового члена. Кроме того, у детей чесоточные эле-
менты могут располагаться на коже ладоней, подошв, лица и волосистой
части головы.
Аллергический контактный дерматит возникает спустя 24-48 ч
после воздействия различных аллергенов (химических, лекарственных,
косметических и т.п.) и проявляется в виде выраженного отека, эритемы,
папулезных и/или везикулезных, буллезных и уртикарных элементов на
местах контакта. В очагах поражения возникает зуд, жжение, чувство жара.
ГЛАВА 12
ЧАСТЬ 2
444 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
У некоторых больных клинические проявления могут выходить за пределы
зон воздействия аллергенов.
Себорейный дерматит локализуется преимущественно на участках
кожи, богатых сальными железами, а именно: в области волосистой части
головы, ушных раковин, грудины, между лопатками, в носогубных склад-
ках. Очаги поражения имеют четкие границы и представляют собой бляш-
ки, покрытые жирными желтоватыми чешуйками. При себорейном дерма-
тите наследственная предрасположенность к атопии и связь с действием
аллергенов отсутствуют.
Микробная экзема. Клинически характеризуется образованием эри-
тематозных очагов величиной 1-3 см с четко очерченными границами
и фестончатыми краями. На их отечно-гиперемированной поверхности
отмечается мокнутие, наслоение серозно-гнойных корок. Очаги пораже-
ния расположены, как правило, на передней поверхности голени, тыльной
поверхности стоп, в области пупка. В отдельных случаях процесс может
принимать распространенный характер. Зуд умеренный, возможно ощуще-
ние жжения и болезненности в местах высыпаний. В анамнезе выявляют
предшествующие гнойные процессы и травмы.
Лечение
В настоящее время концепция лечения АтД предполагает учитывать роль
различных факторов в развитии заболевания (аллергенов, инфекционных
агентов, ирритантов, факторов окружающей среды, эмоциональных стрес-
сов) и оценивать их важность с первых этапов лечения. Исходя из этого
лечение включает ряд мероприятий.
• Общие мероприятия
Идентификация и элиминация факторов, обостряющих заболевание
(ирритантов, аллергенов), контроль окружающей среды.
о Решение индивидуальных психосоциальных вопросов; качество
жизни пациентов.
❖ Образовательная программа, обучение родителей, реабилитация,
профилактика.
О Фармакотерапия системная и местная.
• Местные мероприятия
О Гйдратация кожи.
<> Применение топических глюкокортикоидов (низкой и средней
активности).
О Использование топических ингибиторов кальциневрина (особенно
на область лица).
о Антиинфекционная терапия.
<> Противозудное лечение.
Если заболевание носит тяжелый характер и все вышеуказанные меро-
приятия не приносят улучшения, то необходимо скорректировать лечение,
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 445
в том числе применяя глюкокортикоиды системно, используя иммуномо-
дуляторы и т.д.
Пациенты с АтД имеют низкий порог чувствительности к ирритантам,
в связи с чем распознавание и удаление ирритантов — важный фактор
успешного лечения заболевания. К ирритантам относят детергенты, мыла,
химические вещества, поллютанты, абразивные материалы. Температура и
влажность окружающей среды существенно влияют на течение АтД.
Для очистки кожи рекомендуется использовать не мыло, а средства с
нейтральным pH. Новую одежду рекомендуется перед надеванием высти-
рывать; чтобы уменьшить содержание формальдегида и других химических
веществ, желательно использовать одежду из хлопка.
Фармакотерапия атопического дерматита
В течение последних десятилетий развивалась довольно динамично, и в
настоящее время в перечень основных препаратов, используемых при обо-
стрении заболевания, а также в период относительной ремиссии, входят
блокаторы ^-рецепторов гистамина, мембраностабилизаторы, глюкокор-
тикоиды и другие препараты.
Блокаторы ^-рецепторов гистамина снижают выраженность симпто-
мов, обусловленных выделением гистамина (гиперемия, отек, зуд). У пациен-
тов, страдающих АтД, во время обострения выражен симптом зуда. В связи с
этим кратковременно можно использовать блокаторы ^-рецепторов гиста-
мина 1-го поколения: супрастин* (хлоропирамин), тавегил* (клемастин).
В качестве препаратов базисной терапии блокаторами ^-рецепторов гиста-
мина рекомендуют препараты 2-го поколения, выбор которых обусловлен,
прежде всего, возрастом ребенка. В любом возрасте следует применять дет-
ские формы лекарственных средств (капли, сиропы). Поскольку блокаторы
^-рецепторов гистамина тормозят развитие как ранней, так и поздней фазы
аллергического воспаления, длительность их применения не ограничивается
только фазой обострения АтД; прием продолжают до стабилизации клиниче-
ского процесса. В ряде случаев пациентам с АтД назначают комбинацию бло-
каторов ^-рецепторов гистамина 1-го и 2-го поколения. Однако научных
данных, подтверждающих эффективность такого лечения, недостаточно.
В последние годы нашли клиническое подтверждение работы по увеличе-
нию терапевтических доз блокаторов Н^рецепторов гистамина 2-го поко-
ления: кестина* (эбастин) — таблетки по 10 и 20 мг; в исследованиях авто-
ры увеличивают дозу эриуса* (дезлоратадин) с 5 до 20 мг. Показано, что с
увеличением дозы усиливается клинический эффект, что не сопровождается
расширением спектра побочных действий. По-видимому, в перспективе у
больных АтД блокаторы ^-рецепторов гистамина будут использоваться в
различных терапевтических дозах и комбинациях.
Мембраностабилизаторы. Это препараты, обладающие свойствами
блокаторов Hj-рецепторов и одновременно являющиеся мембранотроп-
ными, т.е. способными тормозить выход медиаторов аллергического вое-
ГЛАВА 12
ЧАСТЬ 2
446 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
паления из тучных клеток. В лечении больных для профилактики обо-
стрения АтД используют препараты кромоглициевой кислоты (налкром*)
и кетотифен как в комплексе с другими лекарственными средствами, так и
в виде монотерапии. Детям налкром* назначают с 1 года по 100 мг 3 раза в
сутки до еды, с 4 лет — по 4 раза в день, а с 7 лет — по 200 мг 4 раза в сутки
в течение 1-2 мес. Кетотифен применяют с 6 мес по 0,5 мг 2 раза в сутки, а
с 3 лет — по 1 мг 2 раза в день в течение 3 мес-1 года.
Глюкокортикоиды. Системные глюкокортикоиды применяются при
тяжелых формах АтД только в крайне редких случаях, поскольку существует
большой выбор современных глюкокортикоидов для местного применения.
Антиинфекционная терапия
Системная антибактериальная терапия бывает необходима при лечении
АтД, осложненного вторичной инфекцией S. aureus. Применяют полу-
синтетические пенициллины, цефалоспорины, макролиды, топические
антистафилококковые антибиотики [бактробан* (мупироцин)]. Больным
рекомендуют ежедневно принимать душ/ванну, используя антимикробное
мыло с триклозаном. Если у пациентов развивается герпетическая экзема,
то в лечение включают ацикловир. При выявлении инфекции Pityrosporum
ovale необходимо назначать топические или системные противогрибковые
лекарственные средства.
Противозудные средства
Даже частичное уменьшение зуда существенно улучшает качество жизни
пациентов с АтД. Показано, что причиной зуда являются медиаторы (не
только гистамин): нейропептиды, провоспалительные цитокины.
Системные блокаторы ^-рецепторов гистамина и анксиолитики могут
уменьшить зуд благодаря их транквилизирующему и седативному эффек-
ту. Трициклические антидепрессанты (doxepin) способны связывать и
Н2-рецепторы, и в небольшой дозе их можно применять на ночь. В тяжелых
случаях назначают локальные анестетики.
Иммуномодулирующая терапия
• Интерфероны. ИФН-у угнетает синтез IgE и подавляет функцио-
нальную активность ТЬ2-лимфоцитов. Применение рекомбинантного
ИФН-у человека может уменьшить тяжесть АтД.
• Ингибиторы кальциневрина. К этой группе препаратов относят
циклоспорин А, такролимус, пимекролимус. Активация кальциневри-
на необходима для инициации транскрипции генов цитокинов.
Другие методы лечения (находятся в стадии изучения либо не носят
общепризнанного характера).
• АСИТ с аллергенами Ь. Pteronyssinus.
• Внутривенные иммуноглобулины.
• Фитотерапия.
• Эссенциальные жирные кислоты.
• Ингибиторы фосфодиэстеразы.
• Антагонисты лейкотриеновых рецепторов.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 447
При тяжелых формах АтД применяют также иммунодепрессанты (цик-
лоспорин А). В случае возникновения осложнений АтД и присоединения
бактериальной или грибковой инфекции назначают системную либо наруж-
ную антибактериальную или антифунгицидную терапию. В ряде случаев
больным проводят санацию очагов инфекции. В последние годы интенсив-
но изучается эффективность применения интерферонов, внутривенного
иммуноглобулина, гистаглобулина, трициклических антидепрессантов и
других лекарственных средств для лечения АтД. Современные научные
результаты позволяют расширить наши представления о механизмах АтД и
использовать индивидуальный подход к лечению данной патологии.
Наружное лечение атопического дерматита
Применяемая наружная терапия — патогенетический метод лечения,
позволяющий решить следующие задачи:
«> уменьшение либо устранение зуда, жжения и т.д.;
• купирование кожных проявлений аллергии в острой (зуд, отек, гипере-
мия) и хронической (лихенификация, зуд) фазе заболевания;
• профилактика и лечение вторичной инфекции;
о уменьшение и/или устранение сухости кожи;
• защита кожного покрова от неблагоприятных влияний внешней
среды.
Для проведения рационального наружного лечения следует соблюдать
правила его назначения, зависящие от остроты воспаления. При остром
воспалении с мокнутием назначают лекарственные средства в виде при-
мочек, аэрозолей, влажно-высыхающих повязок; при подостром воспале-
нии — кремы, пасты, присыпки; при хроническом — мази; при выраженной
инфильтрации и лихенификации в очагах поражения — кремы и мази с
кератолитическими средствами; в стадии регресса кожного процесса —
кремы и мази с витаминами.
К средствам местной терапии относят:
• традиционные: нафталан, ихтиол* (ихтаммол), цинка оксид, солко-
серил*, актовегин*, дерматол* (висмута субгаллат), АСД-Ш-фракция
и др.;
• топические глюкокортикоиды. Использовать их следует для лечения,
а не для профилактики АтД. Наносят на поверхность кожи, не пре-
вышающую 20% площади тела. Длительность лечения зависит от
эффективности и не должна превышать 3-4 нед, предпочтительны
прерывистые курсы.
В России наиболее часто используют глюкокортикоиды, перечисленные
в табл. 12-9.
В последние годы для лечения АтД предложен принципиально новый
класс препаратов, относящихся к НПВС (блокатор кальциневрина пиме-
кролимус, торговое название элидел*, 1% крем).
ГЛАВА 12
448 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-9. Классификация потенциальной активности местных глюкокортикоидов
Международное название Торговое название
Слабые (класс 1)
Гидрокортизон Гидрокортизоновая мазь*, локоид, латикорт
Преднизолон Преднизолоновая мазь
Средние (класс 2)
Предникарбат Дерматол*
Триамцинолон Фторокорт*
Флуметазон*' Лоринден*
Сильные (класс 3)
Мометазон Элоком*
Бетаметазон Белодерм*, целестодерм*
Флуоцинолона ацетонид Синафлана мазь, линимент, флуцинар*
Метилпреднизолона ацепонат Адвантан*
Флутиказон Кутивейт*
Очень сильные (класс 4)
Клобетазол Дермовейт*
Пимекролимус действует на кальциневринзависимые сигнальные вну-
триклеточные пути, осуществляя прямой контроль генов, ответственных
за экспрессию цитокинов, активированными Т-лимфоцитами, а именно:
ИЛ-1, ИЛ-5, ИЛ-10, ИЛ-13. Он снижает высвобождение из тучных клеток
медиаторов воспаления: гистамина, триптазы, ФНО-а. В отличие от глюко-
кортикоидов пимекролимус не действует на синтез коллагена и не вызывает
атрофии кожи. Препарат можно наносить на любые участки кожи, в том
числе на лицо и шею.
Следующий после купирования острого воспаления этап лечения АтД -
гидратация и питание кожи. С этой целью используют увлажняющие, смяг-
чающие и питательные средства.
В лечении осложненных форм АтД используют системные антибиотики,
противогрибковые препараты, противовирусные средства. Помимо этого,
в качестве наружной терапии применяют комбинированные препараты
(глюкокортикоиды в сочетании с антибиотиками и противогрибковыми
средствами).
Поскольку при АтД очаги поражения кожи сопровождаются интенсив-
ным бактериальным инфицированием, в частности, S. aureus, были прове-
дены исследования, показавшие глубокий локальный дефицит катионных
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 449
противомикробных пептидов (в частности, дефенсинов). В связи с этим
стали рассматриваться средства топической терапии, содержащие такие
пептиды. Пока спектр их ограничен. Например, препарат суперлимф* в
своем составе кроме цитокинов содержит комплекс катионных противо-
микробных пептидов (природные антибиотики) с активностью против
стафилококка, стрептококка, вируса герпеса, микобактерий.
Вопросы для самоконтроля
• Дайте определение АтД.
• Каковы иммунологические нарушения, выявляемые у больных АтД?
• Перечислите наиболее важные факторы риска развития АтД.
• Какова роль клеток Лангерганса в развитии АтД?
• Назовите основные и дополнительные симптомы АтД.
• Опишите возрастные особенности клинических проявлений АтД у
детей и взрослых.
• С какими заболеваниями следует дифференцировать АтД?
• Перечислите методы и средства, используемые для местной терапии АтД.
• Назовите основные группы препаратов, используемых в лечении АтД.
Приведите примеры.
• Какие группы топических кортикостероидов используют при лечении
АтД?
ГЛАВА 12
12.5. БРОНХИАЛЬНАЯ АСТМА
Бронхиальная астма (БА) — хроническое воспалительное заболева-
ние органов дыхания, характеризующееся гиперреактивностью бронхов,
частично или полностью обратимой (спонтанно или вследствие лечения)
бронхиальной обструкцией, возникающей вследствие бронхоспазма, а
также гиперсекрецией слизи и отеком слизистой оболочки бронхов. БА
клинически проявляется свистящими хрипами в легких, кашлем, одышкой
и признаками удушья.
Распространенность
За последние несколько десятилетий во всём мире происходит рост числа
больных БА. К 2006 г. это число составляло больше 300 млн человек. В
разных странах распространенность БА в популяции варьирует от 1 до 18%.
В России этот показатель составляет 5,6-7,3% в популяции, а у детей —
5,6-12,1%. Увеличивается число больных БА в сочетании с другими аллер-
гическими заболеваниями, в частности АР.
ЧАСТЬ 2
450 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Классификация
До настоящего времени единой классификации не разработано.
Существуют варианты классификации в соответствии с Международной
номенклатурой. С 2006 г. в большинстве стран используют классифика-
цию на основе рекомендаций Глобальной инициативы по борьбе с БА
[GINA, 2006].
• Аллергическая:
о атопическая (обусловлена развитием IgE-зависимых реакций);
<> неатопическая (в результате He-IgE-зависимых реакций; в том числе
инфекционно-аллергическая).
• Неаллергическая (характерно отсутствие аллергических реакций в
патогенезе БА (в том числе аспириновая БА).
• Смешанная (в патогенезе участвует несколько механизмов).
По степени тяжести выделяют несколько типов БА.
• Легкая интермиттирующая БА — симптомы заболевания возникают
реже одного раза в неделю, ночные симптомы — не чаще двух раз
в месяц. ОФВХ или пиковая скорость выдоха больше 80% от нормы
(вариабельность показателей меньше 20%).
• Легкая персистирующая БА — симптомы возникают чаще одного
раза в неделю, влияют на физическую активность и сон. Ночные сим-
птомы возникают чаще двух раз в месяц. ОФВХ и пиковая скорость
выдоха составляют 80% от нормы (вариабельность показателей
20-30%).
• Среднетяжелая персистирующая БА — симптомы ежедневные, обо-
стрения влияют на физическую активность и сон. Ночные приступы
возникают чаще одного раза в неделю. Пациенты вынуждены при-
нимать агонисты р2-адренорецепторов короткого действия ежеднев-
но. ОФВХ и пиковая скорость выдоха составляют 60-80% от нормы
(вариабельность показателей больше 30%).
• Тяжелая персистирующая БА — симптомы астмы возникают еже-
дневно как днем, так и в ночное время. Физическая активность огра-
ничена. ОФВХ и пиковая скорость выдоха меньше 60% от должных
величин.
По фазе течения БА выделяют:
• обострение (больные с любой степенью тяжести БА могут иметь лег-
кое, среднетяжелое и тяжелое обострение);
• ремиссию.
По степени контроля выделяют [GINA, 2006] (табл. 12-10):
• контролируемую БА;
• частично контролируемую БА;
• неконтролируемую БА.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 451
ГЛАВА 12
Таблица 12-10. Характеристика различных форм бронхиальной астмы [GINA, 2006]
Характеристика Контролируемая бронхиальная астма Частично контролируемая бронхиальная астма Неконтролируемая бронхиальная астма
Дневные симптомы Отсутствуют или воз- никает меньше двух эпизодов в неделю Больше двух эпизодов в неделю Наличие трех и более признаков неконтроли- руемой бронхиальной астмы в течение любой недели
Ограничение активности Отсутствует Имеет место
Ночные симптомы или пробуждение Отсутствуют Имеются
Потребность в препаратах скорой помощи Отсутствует или мень- ше двух эпизодов в неделю Больше двух эпизодов в неделю
Функция внешнего дыхания (ОФВ,; ПСВ) В норме Меньше 80% от долж- ных значений
Обострения Отсутствуют Одно или больше в год Любые обостре- ния служат поводом к пересмотру тактики лечения Одно в течение любой недели. Ежедневные обострения в течение недели — критерий неконтролируемой бронхиальной астмы
ОФВХ — объем форсированного выдоха за 1 с; ПСВ — пиковая скорость выдоха.
Этиология
В развитии БА играют роль многочисленные факторы как эндогенного,
так и экзогенного происхождения. К основным эндогенным факторам, спо-
собствующим развитию БА, относят:
• генетическую предрасположенность;
• наличие атопии;
• гиперреактивность бронхов.
К экзогенным факторам относят:
• аллергены различного происхождения, в том числе домашней пыли,
клещей домашней пыли (D. pteronyssinus, D.farinae, D. microceras и др.);
библиотечной пыли; пыльцы растений; эпидермальные аллергены
(шерсть, перо, перхоть, выделения животных); инсектные аллергены;
аллергены плесневых и дрожжевых грибов (Altemaria, Cladosporium,
Penicillium, Aspergillus, Candida и др.); профессиональные и промышлен-
ные, реже — пищевые и лекарственные аллергены;
• инфекционные заболевания;
• поллютанты (NO2, SO^;
• раздражающие факторы (табачный дым и др.);
• физические нагрузки;
• прием аспирина и «аспириновая триада» — природа заболевания до
конца не изучена; предполагают, что происходит подавление фермента
452 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
циклооксигеназы, нарушение метаболизма арахидоновой кислоты и
усиление образования лейкотриенов, вызывающих бронхообструктив-
ный синдром. Аспириновая астма сопровождается полипозом носа и
непереносимостью других НПВС.
Патогенез
В патогенезе аллергической БА основную роль играют реакции гипер-
чувствительности 1-го типа по Джеллу и Кумбсу, развивающиеся при
контакте аллергена со слизистыми оболочками бронхов. В осуществлении
этих реакций принимают участие активированные аллергенспецифиче-
ские CD4+ Т-лимфоциты, продуцирующие цитокины ИЛ-4, ИЛ-5, ИЛ-9,
ИЛ-13, ИЛ-16, которые участвуют в переключении синтеза иммуноглобу-
линов В-лимфоцитами, индуцируя секрецию IgE. Аллергенспецифические
IgE-антитела связываются с высокоаффинными рецепторами (FceRI) на
тучных клетках и базофилах и с низкоаффинными рецепторами (FceRII)
на эозинофилах и макрофагах. При повторном поступлении аллергенов
в организм происходит их связывание с молекулами IgE, расположенны-
ми на мембранах тучных клеток, что обусловливает дегрануляцию этих
клеток.
Выделяют раннюю и позднюю фазы аллергической реакции. Ранняя
фаза развивается через 10-20 мин после контакта с аллергеном под дей-
ствием медиаторов: гистамина, простагландина D2, лейкотриенов (В4,
С4, D4, Е4), хемотаксических факторов зинофилов и нейтрофилов. В
результате у больных возникают бронхоспазм, отек слизистой оболочек,
усиление секреции слизи. По прошествии 6-8 ч развивается поздняя
фаза аллергической реакции или аллергическое воспаление. В этом про-
цессе участвуют различные клетки и больше 100 медиаторов, в частности
макрофаги, Th2- и Thl-лимфоциты, эозинофилы, эпителиальные клетки
дыхательных путей. Выделен «ген астмы» ADAM33, который входит в
семейство генов, кодирующих подгруппу цинкзависимых металлопро-
теиназ (metzinciri), и связан с гиперреактивностью бронхов. Его относят
к подсемейству генов, ассоциированных с расщеплением молекул кле-
точной адгезии, передаче клеточных сигналов и слущивании различных
рецепторов (в частности, рецептора ФНО-а). Все эти изменения приводят
к развитию субэпителиального фиброза, гипертрофии гладких мышц и
других нарушений. Нарушения в гене ADAM33 связаны с астматическим
фенотипом.
Помимо воспаления, характер которого сходен у пациентов при всех
формах БА, происходят структурные изменения бронхиального дерева
или так называемое ремоделирование дыхательных путей. Это прояв-
ляется увеличением массы мышц, гиперплазией бокаловидных клеток
слизистой оболочки, гипертрофией слизистых желез и увеличением коли-
чества слизи и воспалительного экссудата, утолщением стенок бронхов с
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 453
уменьшением просвета, усилением отложения коллагена и фибронектина.
Факторы роста и цитокины вызывают пролиферацию гладкомышечных
клеток бронхов.
Клинические проявления
Основные симптомы БА: приступ удушья, свистящее дыхание, кашель с
отхождением слизистой мокроты, одышка экспираторного характера. На
этом фоне у больных при аускультации выслушивают свистящие хрипы,
а при исследовании функции внешнего дыхания выявляют нарушения по
обструктивному типу, которые уменьшаются после использования сим-
патомиметиков. Приступ БА может внезапно развиться после контакта с
причинно-значимым аллергеном либо после воздействия раздражающих
факторов (запах, холод и др.), вызывающих гиперреактивность бронхов.
Отечественные авторы выделяют различные варианты БА, различаю-
щиеся этиологией и особенностями клинического течения (табл. 12-11).
• Атопическая БА. К этой форме относят пыльцевую и бытовую БА.
• Инфекционно-аллергическая БА (имеет ряд клинических особенно-
стей и отличается от атопической БА).
Таблица 12-11. Клинические особенности разных форм бронхиальной астмы [Хаитов Р.М.,
2006]
ГЛАВА 12
Признаки Атопическая бронхиальная астма Инфекционно-аллергическая бронхиальная астма
Возраст начала заболевания Чаще до 30 лет Чаще 31-40 лет
Аллергическая наследствен- ность в семье В 49% случаев В 39% случаев
Клиническая картина при- ступов Острое начало, быстрое разви- тие, более легкое течение Возникают постепенно, носят пролонгированный характер, среднетяжелое и тяжелое течение
Тяжесть течения заболевания Чаще легкое и среднетяжелое Только у 15% легкое течение
Осложнения после 5 лет тече- ния заболевания (эмфизема, пневмосклероз) У 34,6% У 68,4%
Ремиссия на ранних этапах, инфекции У 92,3% У 40,8%
Синдром элиминации Характерен Не характерен
Патология придаточных пазух Часто аллергический ринит Часто полипоз носа, риноси- нуситы
Рентгенография Часто без патологии Усиление легочного рисунка, эмфизема, пневмосклероз
Уровень эозинофилов в крови и мокроте Умеренная эозинофилия Чаще в норме
ЧАСТЬ 2
454 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Вирусиндуцированная БА (в развитии этой формы БА участвуют виру-
сы гриппа, парагриппа, респираторно-синцитиальные, аденовирусы,
риновирусы). Показано, что индукция ИЛ-11 вирусами приводит к
активации воспаления, развитию отека и гиперреактивности бронхов;
нарушается баланс ТЫ-/ТЬ2-иммунного ответа.
• БА физического усилия. Приступ возникает через 2-5 мин после окон-
чания нагрузки и сохраняется в среднем 15-20 мин. В основе лежит
более высокая чувствительность бронхов у больных с БА к ацетилхо-
лину. Раздражение эффекторных окончаний блуждающего нерва при-
водит к развитию бронхоспазма.
Диагностика
Алгоритм диагностики БА включает проведение ряда мероприятий:
• анализ клинико-анамнестических данных;
• лабораторные исследования (общеклинические, анализ мокроты);
• аллергологическое обследование (кожные тесты, уровень общего и
специфического IgE; провокационные тесты);
• применение инструментальных методов: исследование функции внеш-
него дыхания; рентгенографии органов грудной клетки; бронхоскопии
(по показаниям).
Лечение
Лечение БА носит комплексный характер и включает:
• базисную терапию (фармакотерапия);
• профилактику обострений (элиминационные мероприятия, контроль
окружающей среды, меры реабилитации и др.);
• АСИТ (по показаниям);
• обучение пациентов.
Базисную фармакотерапию назначают в соответствии с международными
рекомендациями [GINA, 2006, 2008]. Выбор объема лекарственной терапии
БА зависит от степени контроля заболевания на предыдущем этапе, а всё лече-
ние построено по этапному принципу. Выделяют пять «шагов» в лечении БА.
• Шаг 1:
О базисной терапии не требуется (Р2-агонисты короткого действия по
необходимости).
• Шаг 2 (один из предложенных вариантов):
О ингаляционные глюкокортикоиды в низких дозах (табл. 12-12);
О антилейкотриеновые препараты.
• Шаг 3 (один из предложенных вариантов):
О ингаляционные глюкокортикоиды + Р2-агонисты пролонгированно-
го действия;
О ингаляционные глюкокортикоиды в средних или высоких дозах;
> ингаляционные глюкокортикоиды в низких дозах + антилейкотрие-
новые препараты.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 455
ГЛАВА 12
Таблица 12-12. Эквивалентные дозы ингаляционных глюкокортикоидов
Препарат Суточная доза, мкг
низкая средняя высокая
Беклометазона дипропионат* (беклометазон) 250-500 >500-1000 >1000-2000
Будесонид 200^400 >400-800 >800-1600
Флутиказон 100-250 >250-500 >500-1000
Циклесонид 80-160 >160-320 >320-1280
Мометазон 200-400 >400-800 >800-1200
• Шаг 4 (добавить одно или более):
<> ингаляционные глюкокортикоиды в средних или высоких
дозах + Р2-агонисты пролонгированного действия;
о антилейкотриеновые препараты;
v теофиллин (пролонгированный).
• Шаг 5 (добавить одно или более):
о глюкокортикоиды per os\
<> анти-IgE [ксолар* (омализумаб)].
Принципы назначения пошаговой терапии:
• после достижения стойкого контроля над заболеванием объем лечения
может быть уменьшен на один «шаг». На решение вопроса о переходе
от «шага» 2 к «шагу» 3 и от «шага» 3 к «шагу» 4 нужно 3-4 мес; от
«шага» 4 к «шагу» 5 — до 6 мес;
• при достижении неполного контроля объем лечения либо остается на
прежнем уровне либо увеличивается;
• если контроль над БА не достигнут, следует перейти на один шаг в сто-
рону увеличения объема лечения.
АСИТ обычно проводят пациентам в возрасте от 5 до 50 лет при атопиче-
ской БА. Продолжительность курса составляет не меньше 3 мес. Наиболее
эффективна АСИТ с аллергенами клещей домашней пыли. Всё большее
применение находят назальный и сублингвальный способы введения
аллергенов. В России зарегистрировано несколько видов аллергенов для
проведения сублингвальной АСИТ (пыльца деревьев, грибы, клещи домаш-
ней пыли).
Для успешного лечения БА важна доставка лекарственного препарата
(аэрозоль заданной дисперсности) к очагу воспаления в бронхах. С этой
целью применяют специальные устройства, называемые небулайзерами,
или ингаляторы, создающие аэрозоль с частицами заданного размера.
Мелкодисперсный аэрозоль за счет малых размеров частиц удается доста-
вить в мелкие бронхи, которые преимущественно и подвергаются обструк-
ции. В России наиболее распространены ультразвуковые и компрессорные
небулайзеры. Ультразвуковые небулайзеры компактны, малошумны, порта-
тивны, но более дорогостоящие и не дают возможности вводить масляные
ЧАСТЬ 2
456 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
растворы и суспензии. Компрессорные небулайзеры требуют стационарно-
го электрического питания, шумные за счет компрессора, но дают возмож-
ность применения масляных растворов и суспензий.
12.5.1. Бронхиальная астма у детей
В конце XX — начале XXI века в мире происходит рост заболеваемости
БА у детей, причем «молодеет» возраст манифестации заболевания. У
детей БА часто сочетается с атопическим дерматитом и АР. В этиологии БА
играют роль различные аллергены, в том числе бытовые, эпидермальные,
пищевые, пыльцевые. Зачастую приступы БА провоцируются вирусной
инфекцией.
В основе классификации БА у детей лежат те же принципы, что и у
взрослых. Отечественные ученые разработали соответствующие критерии
с учетом международных рекомендаций (И.И. Балаболкин, Н.А. Геппе,
В.А. Ревякина и др., 2006-2008). Чтобы выбрать объем лечения, необходи-
мо адекватно оценить степень тяжести заболевания (табл. 12-13).
Степень тяжести БА определяют до начала базисного лечения. Следует
различать тяжесть самого заболевания и тяжесть обострения (приступа)
БА. Тяжесть обострения БА оценивают по следующим параметрам: частоте
дыхания, участию вспомогательной мускулатуры в акте дыхания, интен-
сивности свистящего дыхания, вздутию грудной клетки, данным аускульта-
ции, принятию вынужденного положения, изменению поведения, степени
ограничения физической активности, объему проведенного лечения (табл.
12-14).
Лечение детей с бронхиальной астмой
Лечение детей младше 2 лет — наиболее трудная задача. Начинают лече-
ние с применения кромонов или ингаляционных глюкокортикоидов, дозы
которых подбирают индивидуально. Установив контроль над болезнью,
дозы ингаляционных глюкокортикоидов снижают до минимальных, а кон-
троль за БА поддерживают либо минимальными дозами этих лекарствен-
ных средств, либо кромонами.
Детям старше 2 лет в качестве препаратов первой линии базисной тера-
пии следует назначать кромоны, антагонисты лейкотриеновых рецепторов
или ингаляционные глюкокортикоиды.
Особое значение в решении проблем БА отводят «Астма-школе» для
родителей и их детей. В основу «Астма-школы» заложен ряд концептуаль-
ных положений.
• Здоровье пациента можно восстановить, только обеспечив здоровый
образ жизни, и психологическая реабилитация должна предшество-
вать физической.
Таблица 12-13. Классификация бронхиальной астмы у детей по степени тяжести
Критерии Легкая Средней степени Тяжелая
интермиттирующая персистирующая
Возникновение дневных симптомов Реже одного раза в неделю Реже одного раза в неделю Чаще одного раза в неделю Ежедневно или несколько раз в неделю
Ночные симптомы Отсутствуют Отсутствуют или редкие Регулярные Регулярные, несколько раз в день. Нарушен сон
Переносимость физической нагрузки Хорошая Есть ограничения Ограничена Значительно снижена
Объем форсированного выдоха за 1 с, пиковая ско- рость выдоха (от нормы) 80% и больше 80% и больше 60-80% Меньше 60%
Вариабельность пиковой скорости выдоха Не больше 20% Не больше 20% 20-30% Больше 30%
Период ремиссии Симптомы отсутствуют; функция внешнего дыхания в норме Симптомы отсутствуют; функция внешнего дыхания в норме Неполная ремиссия Неполная ремиссия
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 457
31 V9VLLI
ЧАСТЬ 2
Таблица 12-14. Критерии, по которым оценивают тяжесть приступа бронхиальной астмы у детей
Признаки Степень тяжести приступа
легкая среднетяжелая тяжелая крайне тяжелая (астматический статус)
Физическая активность Сохранена Ограничена Вынужденное положение во время приступа Отсутствует
Разговорная речь Сохранена Ограничена; речь состоит из отдельных фраз Затруднена Отсутствует
Сознание Иногда возбужденное Возбужденное Возбуждение, испуг «дыхательная паника» Спутанное, кома
Частота дыхания Дыхание учащенное Экспираторная одышка Резко выражена экспира- торная одышка Тахипноэ или брадипноэ
Участие вспомогательной мускулатуры Нерезко выражено Выражено Резко выражено Парадоксальное торакоаб- доминальное дыхание
«Свистящее дыхание» В конце выдоха Выражено Резко выражено «Немое легкое», отсутствие дыхательных шумов
Частота сердечных сокра- щений Тахикардия Тахикардия Выраженная тахикардия Брадикардия
Объем форсированного выдоха за 1 с, пиковая ско- рость выдоха (от нормы) Больше 80% 60-80% Меньше 60% -
РаО2 В норме Выше 60 мм рт.ст. Ниже 60 мм рт.ст. -
РаСО2 Ниже 45 мм рт.ст. Ниже 45 мм рт.ст. Выше 45 мм рт.ст. -
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 459
• Нужно, чтобы пациент имел возможность оценить тяжесть своего
состояния, адекватность лечения (детям старшего возраста и подрост-
кам). Необходимо научить ребенка самостоятельно распознавать при-
ближающееся ухудшение в течении бронхиальной астмы и предотвра-
щать его. Семье отводят главную роль в реабилитации больного БА.
Четкое соблюдение этих рекомендаций позволяет уменьшить частоту
обострений БА у детей приблизительно в три раза.
Вопросы для самоконтроля
• Дайте определение БА.
• Какова распространенность БА у взрослых и детей?
• Перечислите основные факторы риска развития БА.
• Назовите группы причинно-значимых аллергенов при БА.
• В чем заключаются отличия аллергической БА от неаллергической?
• Опишите особенности инфекционно-аллергической БА.
• Перечислите критерии тяжести БА.
• Каковы критерии тяжести приступа БА у детей?
• Назовите основные принципы лечения БА.
• Что такое «пошаговое» лечение БА?
• Какими критериями определяется объем базового лечения БА?
12.6. ПИЩЕВАЯ АЛЛЕРГИЯ
Пищевую аллергию относят к одному из видов побочных реакций на
пищу, в основе которых лежат иммунологические механизмы. Побочная
реакция на пищу — совокупность любых клинических симптомов, воз-
никающих в связи с употреблением пищевых продуктов. Виды побочных
реакций на пищу:
• токсические;
• нетоксические:
О иммунологические (пищевая аллергия);
о неиммунологические (псевдоаллергия).
Пищевая аллергия может возникать начиная с периода новорожден-
ное™. В развитых странах распространенность пищевой аллергии у детей
первого года жизни составляет 6-8%, снижаясь к подростковому возрасту
до 2-4%.
Классификация
Существует несколько вариантов классификации пищевой аллергии.
По механизмам развития:
• IgE-зависимая пищевая аллергия;
• IgE-независимая пищевая аллергия (Т-клеточно-опосредованная,
IgG-/IgM-обусловленная).
ГЛАВА 12
ЧАСТЬ 2
460 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
По типу сенсибилизации:
• 1-й тип — возникает вследствие пероральной сенсибилизации пище-
выми аллергенами, устойчивыми к воздействию секретов пищевари-
тельного тракта (характерен для детей);
• 2-й тип — возникает вследствие сенсибилизации к аэроаллергенам.
Чаще выявляют у взрослых с аллергией к пыльце растений при упо-
треблении продуктов растительного происхождения (так называемый
пыльцево-пищевой синдром).
По течению:
• транзиторная пищевая аллергия (пищевая аллергия раннего возраста;
исчезает в более старшем возрасте);
• персистирующая пищевая аллергия, сохраняется в течение всей
жизни.
Один из факторов, способствующих снижению толерантности к пище-
вым антигенам у детей, — наследственная предрасположенность к аллер-
гии. В антенатальном периоде у таких детей с 22-й недели гестации может
формироваться ТЬ2-тип иммунного реагирования на антигены. Начиная
с периода новорожденности до 2-летнего возраста для ребенка характер-
ны функциональная незрелость пищеварительного тракта, транзиторный
дефицит секреторного IgA, уменьшение активности пищеварительных
ферментов, что также способствует снижению толерантности к пищевым
антигенам. В более старшем возрасте усиливается роль инвазий, дисбиоза,
кишечных инфекций.
Следует отметить, что на долю He-IgE-опосредованных механизмов
пищевой аллергии у детей на первом году жизни приходится до 40% всех
реакций. Развитие IgE-опосредованных аллергических реакций на пище-
вые аллергены связано с изменением соотношения Thl/Th2 в сторону
преобладания ТЬ2-лимфоцитов, синтеза этими клетками ИЛ-4, ИЛ-13 и
последующей гиперпродукции антигенспецифических IgE.
Пищевые антигены из пищеварительного тракта попадают в циркули-
рующее русло. Однако эти интактные протеины (перевариваемые антиге-
ны) в норме не вызывают развития клинических симптомов заболевания,
поскольку к ним развивается толерантность. В слизистых оболочках пище-
вые антигены слабо иммуногенны.
Оральная толерантность — специфическая иммунологическая неотвеча-
емость на антигены, индуцированная их предварительным употреблением
в пищу. Неотвечаемость Т-клеток на перевариваемые пищевые протеины
может быть вызвана:
• разрушением Т-клеток;
• Т-клеточной анергией;
• индукцией регуляторных Т-клеток.
Все эти механизмы оральной толерантности находят подтверждение.
Так, клональное разрушение антигенспецифических Т-клеток путем апоп-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 461
тоза показано в эксперименте, но это не главный механизм. Основной
механизм — Т-клеточная анергия, характеризующаяся снижением про-
лиферации Т-клеток в ответ на презентацию антигена АПК, поскольку в
пищеварительном тракте могут отсутствовать костимулирующие факторы
для реализации иммунного ответа.
Наконец, индукция регуляторных Т-клеток может вызвать подавление
ответа на пищевые антигены через образование ингибирующих цитокинов,
таких, как ТФР-р, ИЛ-4, ИЛ-10. Индуцированные регуляторные Т-клетки
(Th3 и Tri) — потенциальные источники ТФР-р. Они образуются в лимфо-
идной ткани слизистых оболочек в ответ на минимальные дозы антигена
и вызывают толерантность в органах пищеварения, подавляя активацию
окружающих их лимфоцитов.
Механизмы развития
Нарушение оральной толерантности происходит у лиц с гиперчувстви-
тельностью к пищевым аллергенам. При этом могут вовлекаться разные
механизмы гиперчувствительности.
Роль IgE-опосредованных реакций (I тип)
Аллергенспецифические IgE-антитела связываются с высокоаффинными
рецепторами FceRI на тучных клетках и базофилах и с низкоаффинными
рецепторами FceRII (CD23) на макрофагах, моноцитах, лимфоцитах, эози-
нофилах и тромбоцитах.
Когда пищевые аллергены проникают в слизистые оболочки и связы-
ваются с IgE-антителами на тучных клетках или базофилах, эти клетки
выделяют медиаторы, вызывающие симптомы немедленной гиперчувстви-
тельности: вазодилатацию, спазм гладкой мускулатуры, секрецию слизи. В
течение первых 4-8 ч нейтрофилы и эозинофилы инфильтрируют место
реакции и активируются, выделяя другие медиаторы (эозинофильный
катионный протеин, пероксидазу, фактор, активирующий тромбоциты и
др.). В течение последующих 24-48 ч развивается поздняя стадия аллерги-
ческого воспаления. С каждым последующим попаданием пищевого аллер-
гена мононуклеарные клетки секретируют гистамин-рилизинг-фактор,
который в свою очередь усиливает выработку гистамина базофилами и
тучными клетками.
Роль реакций клеточно-опосредованной гиперчувствительности
(IV тип)
В некоторых случаях симптомы развиваются через несколько часов
после употребления в пищу причинно-значимых аллергенов, при этом
обнаруживают усиление пролиферации специфических лимфоцитов.
Клеточно-опосредованная гиперчувствительность возникает при таких
аллергических заболеваниях, как аллергический эозинофильный эзофагит
и гастроэнтерит, целиакия.
ГЛАВА 12
ЧАСТЬ 2
462 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Наличие в сыворотке крови аллергенспецифических IgE-антител —
свидетельство сенсибилизации ребенка. Однако это нельзя рассматривать
как безусловный диагностический критерий пищевой аллергии. Довольно
часто у пациентов выявляют латентную сенсибилизацию при отсутствии у
них клинических проявлений пищевой аллергии.
При пищевой аллергии I типа, т.е. при пероральной сенсибилизации,
пищевые аллергены отличаются устойчивостью к воздействию на них
пищеварительных соков и ферментов. В зависимости от степени аллергизи-
рующей активности выделяют три группы пищевых продуктов:
• пищевые продукты с высокой аллергизирующей активностью: коро-
вье молоко, рыба, яйца, цитрусовые, орехи, мед, грибы, мясо кур,
клубника, малина, земляника, ананасы, дыня, хурма, гранаты, черная
смородина, ежевика, шоколад, кофе, какао, горчица, томаты, морковь,
свекла, сельдерей, пшеница, рожь, виноград;
• пищевые продукты со средней аллергизирующей активностью: перси-
ки, абрикосы, красная смородина, клюква, рис, кукуруза, гречка, перец
зеленый, картофель, горох, свинина, мясо индейки, кролика;
• пищевые продукты со слабой аллергизирующей активностью: кабачки,
патиссоны, репа, тыква (светлая), кисло-сладкие яблоки, бананы, мин-
даль, белая смородина, крыжовник, чернослив, арбуз, салат, баранина.
Аллергические реакции у чувствительных лиц могут быть вызваны
дрожжеподобными грибами, содержащимися в таких продуктах, как кефир,
сдоба, квас, йогурт, квашеная капуста, пивные дрожжи.
В развитии псевдоаллергических реакций, клинически напоминающих
аллергию I типа, важную роль играют:
• продукты-гистаминолибераторы: шоколад, томаты, яйца, шпинат,
клубника, моллюски, соя, рыба, куры, ананас, специи;
• продукты, содержащие гистамин и другие биогенные амины: орехи,
томаты, яйца, шпинат, клубника, бананы, шоколад, моллюски, рыба
(сельдь, тунец, треска), сыр, ревень, перец, квашеная капуста, вино;
• продукты, содержащие пуриновые основания и другие азотсодержащие
экстрактивные вещества: бульоны, жареные и тушеные мясо и рыба,
мозг, почки, печень, шпинат, спаржа, брюссельская капуста, зеленый
горох, фасоль, чечевица, кофе, какао, чай черный.
При пищевой аллергии II типа, так называемом пыльцевопищевом
синдроме, аллергенспецифичные IgE направлены против общих перекрест-
но реагирующих структур, сходных у пыльцы растений и растительной
пищи. Структурное сходство таких аллергенов проявляется на уровне пер-
вичных или третичных структур белка разного происхождения (пыльца,
растительные продукты, латекс и др.). Пищевые растительные аллергены,
вызывающие пищевую аллергию II типа, более чувствительны к действию
температуры и пищеварительных ферментов. Именно поэтому при попа-
дании в пищеварительный тракт они не вызывают сенсибилизации. Такие
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 463
пищевые аллергены провоцируют аллергические реакции лишь у ранее
сенсибилизированных пыльцой пациентов (табл. 12-15).
Таблица 12-15. Перекрестные реакции с пищевыми продуктами
ГЛАВА 12
Аллергены, вызывающие сенсибилизацию Возможные перекрестные реакции с пищевыми продуктами
Пыльца деревьев Орехи, яблоки, груши, черешня, вишня, слива, персики, березовый сок, лесные и грецкие орехи, морковь, сельдерей, картофель
Пыльца дикорастущих злаков Культурные злаки, мед, продукты пчеловодства, щавель
Пыльца сложноцветных Подсолнечное масло, семечки, халва, арбуз, дыня, артишоки, эстрагон, мед
Пыльца полыни Цитрусовые, цикорий, подсолнечное масло, семечки, халва, мед
Пыльца лебеды Свекла, шпинат, мед
Пыльца амброзии Подсолнечное масло, халва, дыня, бананы, мед
Пух, перо Мясо и яйца кур
Шерсть кошки Мясо кролика
Шерсть овцы Баранина, овечий жир
Дафнии Рыба и морепродукты
Грибковые аллергены Кефир, плесневые сорта сыров, изделия из дрожжевого теста, квас, вино, пиво
Инсектные аллергены Мед, продукты пчеловодства
У больных поллинозом клинические проявления перекрестных реакций
при пыльцевопищевом синдроме могут возникнуть при следующих ассо-
циациях:
• березово-полынно-сельдерейно-специевый синдром;
• пыльца злаковых трав и сельдерей, морковь;
• пыльца деревьев и фундук;
• пыльца полыни и персик;
• пыльца березы и яблоки, персик, абрикос;
• пыльца оливкового дерева, полыни, а также яблоки, абрикосы, череш-
ня, сливы, персик, груша, виноград, киви, пшеница, фундук, каштан,
грецкий орех.
Следует отметить, что при непереносимости аспирина возможны перекрест-
ные реакции с продуктами, содержащими салицилаты: персиками, абрикоса-
ми, сливами, клубникой, малиной, вишней, виноградом, картофелем.
ЧАСТЬ 2
464 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Клинические проявления
Клинические проявления пищевой аллергии весьма разнообразны
и затрагивают различные органы и системы. В зависимости от основного
механизма развития время возникновения симптомов пищевой аллергии
может существенно колебаться: от нескольких минут или часов после кон-
такта с пищевыми аллергенами при IgE-зависимых реакциях до 2-3 сут при
клеточно-опосредованных реакциях.
Клинические проявления реакций гиперчувствительности при
пищевой аллергии
• IgE-опосредованные:
О кожные — крапивница, ангиоотеки, кореподобная сыпь, эритема и
др.;
о желудочно-кишечные — оральный аллергический синдром, гастро-
интестинальный синдром;
респираторные — острый риноконъюнктивит, бронхоспазм, шумное
дыхание;
О генерализованные — анафилаксия.
• Смешанные — IgE- и клеточно-опосредованные:
О кожные — атопический дерматит;
о желудочно-кишечные — аллергический эозинофильный эзофагит,
аллергический эозинофильный гастроэнтерит;
0 респираторные — БА.
• Клеточно-опосредованные:
<> кожные — контактный дерматит, герпетиформный дерматит;
О желудочно-кишечные — энтероколиты и проктоколиты, индуциро-
ванные пищевыми протеинами; целиакия;
•<> респираторные — легочный гемосидероз, индуцированный пищевы-
ми аллергенами (синдром Гейнера).
• Неклассифицированные:
Ф анемия, индуцированная коровьим молоком; артриты; мигрень.
Клинические особенности пищевой аллергии в зависимости от
возраста больных [Балаболкин И.И., 2008]
• У новорожденных первые симптомы пищевой аллергии в виде кож-
ной сыпи и нарушений органов пищеварения могут возникнуть сразу
после рождения при назначении смеси на основе коровьего молока.
• У грудных детей проявления пищевой аллергии бывают в виде
кишечной колики, гастроинтестинального синдрома, редко в виде
крапивницы и ангиоотеков. В тяжелых случаях аллергия к белкам
коровьего молока может проявиться синдромом мальабсорбции в
виде снижения аппетита, стеатореи, гипотрофии, увеличения размеров
живота, задержки развития. Иногда при аллергии к белкам коровьего
молока поражается пищеварительный тракт на всём его протяжении:
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 465
эозинофильный гастроэнтерит, проктит, колит, сопровождающиеся
появлением прожилок крови в кале, повторной рвотой. При осмотре
ребенка до года следует обращать внимание на наличие перианального
дерматита и зуда, усиливающихся после кормления, что может быть
признаком пищевой аллергии.
• У детей первых 2-3 лет жизни, начиная с грудного возраста,
наиболее частое проявление пищевой аллергии — атопический
дерматит. Пищевая аллергия может провоцировать приступы БА и
симптомы АР.
• У детей дошкольного и младшего школьного возраста в случаях
нераспознанной пищевой аллергии и повторного поступления аллер-
генов с пищей гиперчувствительность клинически может проявляться
периодически возникающей рвотой, болями в животе, диареей. У
некоторых детей возникает оральный аллергический синдром в виде
быстро возникающего зуда и умеренно выраженного отека губ, иногда
слизистой полости рта и задней стенки глотки. В этом возрасте чаще
пищевая аллергия проявляется в виде крапивницы и ангиоотеков,
обострения атопического дерматита. Выявляют эпизоды пищевой
аллергии II типа, обусловленной пыльцевопищевым синдромом при
наличии сенсибилизации к пыльцевым аллергенам. К редким проявле-
ниям относят анафилактические реакции (чаще развиваются в ответ на
прием рыбы, арахиса, яиц, ракообразных).
• У подростков пищевая аллергия проявляется чаще всего в виде
орального аллергического синдрома, аллергического эозинофиль-
ного эзофагита и гастроэнтерита; нередко в этом возрасте пищевая
аллергия манифестирует в виде крапивницы и ангиоотеков. Пищевая
аллергия может обусловливать обострение атопического дерматита и
БА. Однако следует заметить, что с возрастом проявления пищевой
аллергии у детей и подростков становятся менее выраженными либо
исчезают. Более длительно сохраняется IgE-опосредованная пищевая
аллергия на такие продукты, как рыба, орехи, яйца.
• У взрослых пищевая аллергия может клинически проявляться всеми
известными симптомами, затрагивающими кожу, систему органов
дыхания, пищеварительный тракт, нервную систему и др.
Необходимо дифференцировать истинную (иммунологическую) пище-
вую аллергию от неиммунологической (ложная пищевая аллергия, или
псевдоаллергия).
В основе псевдоаллергии лежит несколько основных механизмов.
• Гйстаминовый, когда в биологических жидкостях увеличивается кон-
центрация гистамина не только за счет избыточного его поступления в
организм, но и за счет избыточного синтеза гистамина. Гистамин ока-
зывает свое действие через H2- и Н2-рецепторы, что сопровождается
ГЛАВА 12
466 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
развитием вегетативных и сосудистых реакций: гиперемии, крапивни-
цы, бронхоспазма, головной боли и т.д.
• Нарушение активации системы комплемента и, как следствие, избы-
точное образование анафилатоксинов. Это приводит к высвобождению
медиаторов из тучных клеток, базофилов, лейкоцитов и т.п. Наиболее
частые клинические проявления — анафилактоидные реакции.
• Нарушение метаболизма ненасыщенных жирных кислот, и в первую
очередь арахидоновой кислоты, синтезируемой из фосфоглицери-
дов клеточных мембран нейтрофилов, макрофагов, тучных клеток и
тромбоцитов, происходящее под действием эндотоксинов, некоторых
лекарственных средств и других веществ.
Помимо того что псевдоаллергические реакции на пищу могут клини-
чески напоминать симптомы истинной пищевой аллергии, существует ряд
заболеваний и состояний, при которых возникают симптомы, напоминаю-
щие проявления пищевой аллергии (табл. 12-16).
Таблица 12-16. Побочные реакции на пищевые продукты, клинически напоминающие
пищевую аллергию
Состояние Симптомы Механизмы
Непереносимость сахаров (лактозы, фруктозы, сахарозы, тригалозы) Вздутие живота, боли в животе, диарея (зависимая от дозы) Дефицит дисахаридаз
Недостаточность панкреати- ческих ферментов (трипсина, химотрипсина, липазы — син- дром Шелдона-Рея; энтерокина- зы — синдром Швахмана) Мальабсорбция, диарея Дефицит ферментов поджелу- дочной железы
Функциональные расстройства верхних отделов пищеваритель- ного тракта Отрыжка, рвота, изжога, вздутие живота, диспепсия Нарушение эвакуации пищи из желудка и транзита по двенад- цатиперстной кишке
Воспалительные заболевания кишечника Боль, лихорадка, диарея, кровь в кале Хронический воспалительный процесс слизистой оболочки пищеварительного тракта
Синдром раздраженного кишеч- ника с диареей Мальдигестия. диарея Относительная недостаточность ферментов
Патология печени, желчного пузыря и нарушение обмена желчных кислот Мальабсорбция Нарушение процесса эмуль- гирования жиров, нарушение реабсорбции первичных желч- ных кислот
Аллергия к примесям в пищевых продуктах Крапивница, кожный зуд, ангиоотек, кашель, рвота IgE-опосредованные реакции к антигенам клещей и плесневым грибам; а также загрязнение муки насекомыми, морепродук- тов паразитами
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 467
ГЛАВА 12
Окончание табл. 12-16
Состояние Симптомы Механизмы
Пищевое отравление Боль, лихорадка, тошнота, рвота, диарея Бактериальные токсины в пище
Отравление скумбриевыми рыбами Ангиоотек, крапивница, боль в животе Гистидин в испорченной рыбе метаболизируется в гистамин
Кофеин Тремор, судороги, диарея Фармакологический эффект кофеина у восприимчивых субъектов
Паническое расстройство Субъективные реакции, обморок от запаха или вида продукта Психологический
Нервная анорексия Реакция на многие пищевые продукты, похудание Психологический
Диагностика
При диагностике пищевой аллергии используют общепринятые методы
выявления гиперчувствительности:
• аллергоанамнез;
• оценку клинических симптомов и ведение пищевого дневника;
• кожные аллергопробы;
• провокационные пробы;
• двойной слепой плацебо-контролируемый провокационно-пищевой
тест;
• определение аллергенспецифических IgE в сыворотке крови.
При сборе аллергоанамнеза необходимо уточнить связь между воз-
никновением симптомов пищевой аллергии и употреблением продукта,
его количеством, между временем, прошедшим с момента употребления
продукта, и возникновением симптомов, продолжительностью сохранения
симптомов.
При сборе анамнеза у детей первого года жизни необходимо учитывать
вероятность поступления пищевых аллергенов с грудным молоком, а также
при сосании сосок, смоченных жидкой пищей. У детей может развиться сен-
сибилизация до первого употребления продукта, а также часто развиваются
He-IgE-опосредованные и псевдоаллергические реакции на пищу.
Кожные пробы (прик-тест, скарификационные). Кожное тестирование
является наиболее чувствительным методом диагностики пищевой аллер-
гии. Противопоказаниями к проведению кожного тестирования служат ука-
зания на анафилаксию в анамнезе, прием блокаторов ^-адренорецепторов,
обострение аллергического заболевания, обширное поражение кожного
покрова, затрудняющее техническое выполнение теста. Перед тестировани-
ем за 2-3 сут следует отменить прием блокаторов Н^рецепторов гистамина,
468 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
за 24 ч — блокаторов Н2-рецепторов, за 14 сут — мембраностабилизаторов,
за 7 сут — антидепрессантов. Данные о влиянии глюкокортикоидов на
результаты тестирования противоречивы. При оценке результатов прик-
теста минимально позитивной считают реакцию в виде волдыря диаметром
2-5 мм.
При оценке кожных проб следует учитывать возможность ложноотрица-
тельных результатов вследствие приема блокаторов ^-рецепторов гиста-
мина, местных и системных глюкокортикоидов, мембраностабилизаторов,
бронхолитиков.
Лечение
В настоящее время лечение пищевой аллергии проводят в соответствии
со следующими принципами:
• элиминация причинно-значимых пищевых аллергенов и диетотерапия;
• фармакотерапия: неотложная, превентивная.
В отношении АСИТ следует отметить, что ранее предпринимавшиеся
попытки лечения с помощью принимаемых внутрь разведений коровьего
молока не привели к желаемым клиническим результатам.
Диетотерапия
В основе немедикаментозного лечения пищевой аллергии лежит эли-
минационная диета при истинной аллергии и гипоаллергенная диета при
псевдоаллергии. Установление этиологической роли конкретного продук-
та является решающим для назначения элиминационной диеты. Следует
исключить из питания одновременно все виды пищевых продуктов, которые
могут содержать даже незначительное количество аллергена. Например,
при аллергии на коровье молоко следует исключить из питания сливочное
масло, творог, каши на молоке, говядину и т.п.
Важная проблема — пищевая аллергия у детей раннего возраста, у кото-
рых в подавляющем большинстве случаев основным аллергеном является
белок коровьего молока. Аллергию к коровьему молоку среди детей груд-
ного возраста выявляют у 0,5-1,5% из тех, кто находится на естественном
вскармливании, и у 2-7% — на искусственном. Если детей слишком рано
переводят на искусственное вскармливание, с 2-3 мес дают им молочные
каши, если мать во время беременности и лактации злоупотребляет моло-
ком и молочными продуктами, пищевая аллергия манифестирует у ребенка
чаще. Если ребенок находится на естественном вскармливании, необхо-
димо назначить гипоаллергенную диету матери, ограничив либо полно-
стью исключив молочные продукты на период кормления грудью. Детям,
находящимся на смешанном или искусственном вскармливании, следует
заменить смеси на основе цельного коровьего молока гидролизованными
смесями. Доказано, что чем выше степень гидролиза молочного белка, тем
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 469
меньше риск развития аллергических реакций. По степени гидролиза выде-
ляют три вида смесей:
• лечебные (глубокий гидролиз белка);
• лечебно-профилактические (частичный гидролиз);
• профилактические (частичный гидролиз).
К лечебным смесям относят «Альфаре», «Нутрилак Пептиди СЦТ»,
«Нутрилак Пепти ТСЦ», «Нутрамиген», «Прегестимил», «Туттели Пеп-
тиди», «Фрисопеп», «Фрисопеп АС».
К лечебно-профилактическим смесям — «Нутрилак ГА», «ХиПП ГА 1 и
2», «Хумана ГА 1 и 2», «Дамил Пепти».
К профилактическим смесям — «НАН ГА 1 и 2», «Нутрилон гипоаллер-
генный 1 и 2».
Выбирая лечебную смесь, необходимо учитывать также другие прояв-
ления со стороны пищеварительного тракта, поскольку у детей с непере-
носимостью коровьего молока одновременно может возникать и лак-
тозная недостаточность. Так, при отсутствии симптоматики со стороны
пищеварительного тракта можно использовать смеси, содержащие лак-
тозу («Фрисопеп», «Туттели Пептиди»); при наличии лактозной недо-
статочности — «Нутрамиген», «Фрисопеп АС»; при сочетанной лактозной
недостаточности и нарушении усвоения жиров и появления стеатореи —
«Прегестимил», «Нутрилон Пепти ТСЦ», «Альфаре», «Нутрилак Пептиди
СЦТ».
При псевдоаллергии временно исключают из питания гистаминолибе-
раторы, проводят лечение основной патологии (пищеварительного тракта,
эндокринной патологии и др.), и в дальнейшем пациент возвращается к
обычной диете.
Особое место в пищевой аллергии занимают аллергические реакции
на всевозможные пищевые добавки, проявляющиеся в форме дермати-
та, крапивницы, ангиоотека, бронхоспазма, анафилактических и других
осложнений. Ряд пищевых добавок обладает аллергенными свойствами. К
ним относятся консерванты с антибактериальным (бензоат натрия), анти-
оксидантным (бутилгидроксианизол), антибродильным (метабисульфит,
сульфит калия, диоксид серы), красящим (тартразин, кармин), подслащи-
вающим (аспартам, сахарин), ферментным (папаин), нутриентным (белко-
вые гидролизаты), наполняющим (крахмал), эмульгирующим (лецитин),
формообразующим (желатин), усиливающим вкус (глутамат натрия) и
другими свойствами. Иногда возникают трудности в дифференциальной
диагностике аллергии на пищевой продукт и аллергии на различные добав-
ки (в том числе консерванты).
Фармакотерапия пищевой аллергии
Медикаментозное лечение носит симптоматический характер и направ-
лено на устранение развившейся реакции. Препараты первой линии —
блокаторы ^-рецепторов гистамина, выбор которых зависит от возраста
ГЛАВА 12
ЧАСТЬ 2
470 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
пациента, сопутствующей патологии, выраженности симптомов пищевой
аллергии и т.д. При необходимости можно использовать глюкокортикои-
ды, стабилизаторы мембран тучных клеток.
Вопросы для самоконтроля
• Что такое побочная реакция на пищу? Виды побочных реакций на
пищу.
• Классификация пищевой аллергии.
• Каковы иммунологические механизмы развития пищевой аллергии?
• Что такое оральная толерантность?
• Чем отличаются продукты, вызывающие пищевую аллергию I типа при
пероральной сенсибилизации?
• Каковы особенности пищевой аллергии II типа?
• Приведите примеры перекрестных реакций с пищевыми продуктами.
• Назовите клинические проявления IgE-опосредованных реакций при
пищевой аллергии.
• Каковы клинические особенности пищевой аллергии у новорожден-
ных и грудных детей?
• Каковы механизмы псевдоаллергии? Приведите примеры.
• Перечислите основные методы диагностики пищевой аллергии.
• Какова роль диетотерапии в лечении пищевой аллергии? Что такое
лечебные смеси? Приведите примеры.
• Перечислите основные средства фармакотерапии пищевой аллергии.
12.7. ЛЕКАРСТВЕННАЯ АЛЛЕРГИЯ
Лекарственная аллергия (ЛА) — повышенная чувствительность к лекар-
ственным средствам, обусловленная иммунными механизмами как гумо-
рального (IgE, IgM, IgG), так и клеточного типа. Псевдоаллергические
реакции клинически напоминают истинную аллергию на лекарственные
средства, при этом выявляют четкую связь с приемом препаратов, однако
развитие таких реакций происходит без участия иммунных механизмов.
Распространенность
ЛА встречается как у взрослых, так и у детей и составляет, по дан-
ным разных авторов, от 1 до 30% от всех видов аллергических реакций.
С наибольшей частотой выявляют гиперчувствительность к антибиоти-
кам пенициллинового ряда, НПВС, сульфаниламидам. Участились случаи
непереносимости местных анестетиков, йод- и бромсодержащих препа-
ратов, витаминов, ферментов и других лекарственных средств, влияющих
на метаболизм. Изредка возникают аллергические реакции на вакцины и
сыворотки.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 471
ЛА является составной частью целого спектра побочных реакций,
которые могут возникнуть при использовании лекарственных средств
(Лопатин А.С., 1992).
• Фармакологическое побочное действие.
• Токсические побочные действия, обусловленные передозировкой пре-
паратов, токсическими реакциями при нарушениях экскреторных
функций организма, накоплением лекарственных средств и их метабо-
литов, усилением всасывания препаратов, местно-раздражающим дей-
ствием, а также реакциями, возникающими вследствие неправильно
выбранного пути введения лекарственного средства.
• Побочные действия, обусловленные нарушениями в иммунной систе-
ме: аллергические реакции немедленного, замедленного типа, аутоим-
мунные, иммунокомплексные реакции и т.п.
• Псевдоаллергические реакции на лекарственные средства.
• Канцерогенное действие лекарственных средств.
• Тератогенное действие лекарственных средств.
• Мутагенное действие лекарственных средств.
• Лекарственная зависимость: токсикомания, синдром отмены, психоло-
гическая зависимость.
• Лекарственное действие на экологию микроорганизмов: дисбактериоз,
кандидамикоз, резистентность.
• Лекарственное действие на основные обменные процессы в организме.
• Побочные реакции и осложнения, вызванные взаимодействием лекар-
ственных средств в организме, химико-фармакологическая несовме-
стимость.
• Побочные реакции и осложнения смешанного генеза.
• Побочные действия препаратов, обусловленные факторами внешней
среды: пищевым режимом, климатом, экологией и т.п.
Отличия истинных аллергических реакций на лекарственные
средства от других нежелательных побочных реакций
В отличие от перечисленных побочных эффектов лекарственных средств
истинная ЛА имеет ряд особенностей:
• аллергические реакции на лекарственные средства клинически отлича-
ются от фармакологического действия самих препаратов;
• аллергические реакции могут возникнуть в результате приема лекар-
ственного средства в минимальной дозе;
• характерно наличие периода сенсибилизации (3-7 сут при гиперчув-
ствительности немедленного типа и от 2-3 нед до 2-3 мес при ГЗТ),
исключение составляет «скрытая сенсибилизация»;
• истинная ЛА проявляется при повторном использовании лекарствен-
ного средства;
• реакции могут воспроизводиться при введении препаратов различных
групп, имеющих общие химические и аллергенные свойства;
ГЛАВА 12
ЧАСТЬ 2
472 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• клиническая картина ЛА проявляется в виде классических симптомов
аллергического заболевания (крапивница, ангиоотек, бронхоспазм и
др., вплоть до развития АШ);
• характерна нарастающая тяжесть аллергических реакций при повтор-
ных введениях того же лекарственного средства.
Классификация лекарственной аллергии
В соответствии с современной классификацией, предложенной экспер-
тами Европейской академии аллергологии и клинической иммунологии
(2004), выделяют лекарственную гиперчувствительность.
Классификация лекарственной гиперчувствительности
• ЛА.
О IgE-опосредованная.
He-IgE-опосредованная.
• Неаллергическая лекарственная гиперчувствительность.
Помимо предложенной выше классификации лекарственной гипер-
чувствительности, сохраняет свое значение и другая классификация ЛА,
согласно которой выделяют:
о истинную ЛА (иммунологически опосредованная);
О псевдоаллергическую ЛА.
По механизмам развития истинная ЛА может быть:
• IgE-зависимой (1-й тип);
• цитотоксической;
• иммунокомплексной;
• клеточно-опосредованной.
Факторы риска развития ЛА
• Природа лекарственного средства (высокоаллергенными являются макро-
молекулярные вещества: инсулин, гетерологичные сыворотки и др.).
• Способ введения лекарственного средства: внутривенное введение
реже обусловливает сенсибилизацию, но чаще вызывает аллергические
реакции у ранее сенсибилизированных лиц.
• Схема назначения лекарственных средств: прерывистые курсы лечения
с короткими интервалами чаще вызывают ЛА.
• Использование депо-препаратов (инсулин, бициллин).
• Назначение высоких доз лекарственных средств.
• Полипрагмазия.
• Возраст: дети меньше подвержены развитию сенсибилизации к лекарствен-
ным средствам, но аллергические реакции у них протекают тяжелее.
• Пол: чаще ЛА возникает у женщин.
• Атопическая наследственность.
• Генетические факторы: выделяют некоторые генетические маркеры
ЛА (антигены HLA-DR4 и HLA-B13) или устойчивости к ней (анти-
гены HLA-DQW1 и HLA-B12).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 473
• Наличие лекарственной и других видов аллергии в анамнезе (пере-
крестные аллергические реакции).
• Сопутствующие заболевания: аллергия на латекс у больных со Spina
bifida, на НПВС при БА, на пенициллин при грибковых заболеваниях
кожи; повышена частота ЛА у больных муковисцидозом и пациентов с
иммунодефицитами различной этиологии (врожденные иммунодефи-
циты и ВИЧ-инфекция).
Важно идентифицировать кофакторы, влияющие на течение реакций
гиперчувствительности к лекарственным средствам, такие, как:
• вирусные инфекции;
• лечение глюкокортикоидами, блокаторами Hj-рецепторов гистамина,
иммуносупрессивными препаратами;
• конкурирующая пищевая непереносимость;
• активация сопутствующих заболеваний;
• метаболизм лекарственных средств и их взаимодействие.
Во многих случаях идентифицировать лекарственные средства, вызвав-
шие реакции, невозможно, так как причиной может быть не само лекар-
ственное средство, а гаптены, метаболиты, консерванты и др.
В клинической практике следует учитывать возможность перекрестных
аллергических реакций на препараты, обладающие сходными антиген-
ными свойствами. Это особенно важно при множественной лекарственной
непереносимости (табл. 12-17).
Таблица 12-17. Перекрестно-реагирующие лекарственные средства (Пыцкий В.И. и др.,
1984, с дополнениями)
ГЛАВА 12
Общие детерминанты Лекарственные препараты, имеющие общие детерминанты
Кольцо Р-лактама Пенициллины (природные и полусинтетические). Дюрантные пенициллины: бициллин, экстенциллин®*, ретарпен* (бензати- на бензилпенициллин). Карбапенемы (исключение — азтреонама монобактамр). Тиенамицины (имипенем входит в состав тиенама*). Цефалоспорины: кефзол®*, клафоран* (цефотаксим), роцефин* (цефтри- аксон) и др Пеницилламин
Бензолсульфидная группа Сульфаниламиды и препараты, их содержащие: бактрим* (ко-тримоксазол), бисептол*, ингалипт*. мази: левосин*, сунореф* и др. Сахароснижающие: манинил* (глибенкламид), глюренорм* (гликвидон), букарбан®* и др. Диуретики, содержащие сульфамидную группу: фуросемид, кристепин* (дигидроэрготоксин + клопамид + резерпин), тенорик* (атенолол + хлорта- лидон), теноретик* (атенолол + хлорталидон) и др. Тиазидные диуретики: гипотиазид* (гидрохлоротиазид), бутизидр, комби- нированные препараты — триампур, энап-Н*, трирезид® и др. Ингибиторы карбоангидразы (диакарб*)
474 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Окончание табл. 12-17
Общие детерминанты Лекарственные препараты, имеющие общие детерминанты
Парааминобензойная кислота Анестезин*, новокаин*, дикаин*, тетракаин и препараты, их содержащие (алмагель Ар, белластезин*, меновазин*, солуган®, сульфокамфокаин* и др.). Сульфаниламиды и препараты, их содержащие (см. выше)
Фенотиазиновая группа Нейролептики (терален®, сонапакс*, аминазин* и др.). Антигистаминные препараты (дипразин*, пипольфен*). Антидепрессанты (фторацизин*). Антиаритмические средства (этмозин*. этацизин*). Коронарорасширяющие (нонахлазин*, хлорацизин®) Противорвотные (торекан*). Метиленовый синий
Ацетилсалициловая кислота Препараты ацетилсалициловой кислоты (ацетилсалициловая кислота, ано- пирин и т.д.) и ее содержащие (аскофен*, цитрамон* и др.). Тартразин входит в состав но-шпы* (дротаверин), тавегила*, кеторола* и других препаратов в оболочке желтого цвета
Барбитураты Снотворные лекарственные средства (реладорм*, циклобарбитал® и др.). Средства для наркоза (гексенал*, тиопентал натрия). Противосудорожные (фенобарбитал) и препараты, содержащие фенобар- битал: теофедрин*, антастман®, беллатаминал*, валокордин*, корвалол*, пенталгин* и др.
Парааминофенол Фенацетин® (входит в состав антастманар, аскофена*, седалгинар, теофе- дрина*). Парацетамол (входит в состав аскофена*, колдрекса*, панадола*, солпа- деина*, цитрамона* и др.)
Йод Неорганические йодиды (калия и натрия йодид, раствор Люголя, раствор йода спиртовой). Йодсодержащие рентгеноконтрастные средства. Средства, применяемые при заболеваниях щитовидной железы (антистру- мин*, тиреоидин, L-тироксин* и др.). Антисептические средства (йодоформ*, йодинол*. йодонат*)
Витамин В Эссенциале, кокарбоксилаза, эскузан и др.
Патогенез
Тип иммунной реакции на лекарственные средства при истинной ЛА
определяют следующие факторы: физико-химические свойства аллергена,
путь его введения, особенности иммунного реагирования (гуморальный,
клеточный иммунный ответ), возможный переход одного типа реагирова-
ния в другой или развитие одновременно нескольких типов гиперчувстви-
тельности.
Лекарственные средства могут быть полноценными антигенами (гор-
моны, сыворотки, вакцины) или гаптенами. В качестве гаптенов могут
выступать неизмененные лекарственные средства (эритромицин), примеси
и продукты распада препаратов (ангидрид салициловой кислоты в ацетил-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 475
ГЛАВА 12
салициловой кислоте), продукты биотрансформации препаратов in vivo, в
результате чего образуются метаболиты, способные связываться с белками
плазмы и вызывать сенсибилизацию.
Большинство лекарственных средств в организме подвергается био-
трансформации (метаболические превращения), в результате которой
образуются соединения, способные связываться с белками организма и
индуцировать гиперпродукцию IgE либо активировать Т-лимфоциты ГЗТ.
Клинические проявления гиперчувствительности различных типов пред-
ставлены в табл. 12-18.
Таблица 12-18. Клинические проявления гиперчувствительности различных типов
(Адо А.Д.. 1986)
Тип реакции Иммунный механизм Основные клинические проявления
IgE-зависимый Немедленные генерализованные реакции, опосредованные IgE Анафилактический шок, крапив- ница. ангиоотек. бронхиальная астма, аллергический ринит
Цитотоксический Реакции, опосредованные IgG и IgM, как правило, с участием комплемента Иммунные цитопении (лейкопе- ния, тромбоцитопения, гемоли- тическая анемия), агранулоцитоз, волчаночноподобный синдром
Иммунокомплексный Реакции, обусловленные цирку- лирующими иммунными ком- плексами Сывороточная болезнь, васкулит, феномен Артюса, гломерулонеф- рит, лекарственная лихорадка, волчаночноподобный синдром
Клеточно-опосредованный Реакции, обусловленные сенсибилизированными Т-лимфоцитами и цитокинами Аллергический контактный дерматит, экзантемы и другие неуртикарные кожные реакции, воспалительные поражения неко- торых органов, фиксированная эритема, узловатая эритема
Существуют две концепции лекарственного распознавания: гаптен-/про-
гаптеновая и Р-1-концепции (англ, pharmacological interection with immune
receptors). Многие годы превалирует гаптеновая концепция, согласно
которой происходит ковалентное связывание лекарственных средств с
молекулами-носителями, что приводит к стимуляции иммунной системы
указанным путем. В модели прогаптена главную роль отводят продуктам
метаболизма препаратов. Однако в этой гипотезе остается много вопросов:
в частности, какова антигенность препаратов с неизвестным метаболизмом
или положительные кожные тесты с лекарственными средствами, метабо-
лизирующимися в печени? Согласно концепции Р-1, лекарственные сред-
ства напрямую стимулируют клоны специфических Т-клеток, связываясь
с их TCR. Особенность таких взаимодействий препаратов с иммунными
ЧАСТЬ 2
476 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
клетками состоит в лабильности связывания, вовлечении АПК. Таким
образом, антигенность лекарственных средств может быть результатом или
их химических особенностей в случае гаптен-пептидных взаимодействий,
или структурных особенностей при прямом взаимодействии препарата с
рецепторами Т-клеток.
Гаптеновая теория может объяснить некоторые типы аллергических
реакций на лекарственные препараты. Р-1-концепция иммунного взаимо-
действия с рецепторами в основном подходит для объяснения пятнисто-
папулезных высыпаний.
Эти данные служат основой для субклассификации реакций IV типа
в соответствии с вовлечением различных эффекторных клеток: моно-
цитов, Т-лимфоцитов, эозинофилов и нейтрофилов. Концепция Р-1 объ-
ясняет гетерогенность клинических проявлений, развитие аллергии без
предварительной сенсибилизации. Такое жизнеугрожающее заболевание,
как токсический эпидермальный некролиз, характеризуется кожными
проявлениями, вовлечением слизистых тканей, лихорадкой, слабостью.
Определение тяжелых кожных реакций базируется на типе и характере
кожных нарушений.
В отличие от истинной ЛА в основе псевдоаллергических реакций
лежит высвобождение гистамина из тучных клеток и базофилов, обуслов-
ленное следующими механизмами:
• прямым неспецифическим высвобождением гистамина (возможно,
при введении плазмозаменителей, рентгеноконтрастных веществ, ане-
стетиков, миорелаксантов, витаминов группы В, йод- и бромсодержа-
щих препаратов и др.);
• нарушением метаболизма арахидоновой кислоты (при введении НПВС);
• нарушением механизмов инактивации гистамина и повышением содер-
жания его в тканях при заболеваниях печени и почек;
• неспецифической активацией комплемента по классическому и аль-
тернативному пути. Накопление СЗа, С5а, С4а и других компонентов
может привести к дегрануляции тучных клеток (например, в очагах
хронической инфекции). Действие лекарственных средств в этом слу-
чае не является решающим.
С клинической точки зрения важно выделить лекарственные средства,
наиболее часто вызывающие истинную аллергию, и средства, чаще других
становящиеся причиной неаллергической гиперчувствительности. Следует
учесть, что на один и тот же препарат у разных пациентов могут развивать-
ся как истинные, так и псевдоаллергические реакции.
Лекарственные средства, наиболее часто вызывающие аллергиче-
ские и псевдоаллергические реакции
• Анафилаксию чаще вызывают р-лактамные антибиотики, аллер-
генные экстракты, гетерогенные сыворотки, НПВС, анестетики, инсу-
лин, вакцины, стрептокиназа, химопапаин, аспарагиназа, латекс.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 477
• Анафилактоидные реакции часто индуцируются рентгеноконтраст-
ными веществами, ацетилсалициловой кислотой, НПВС, средствами для
наркоза (новокаин, лидокаин), миорелаксантами, протамина сульфатом
(антикоагулянт), ципрофлоксацином, ванкомицином, хлортетрацикли-
ном, алкалоидами (атропин, папаверин и др.), кровезаменителями
(полиглюкин* и др.), но-шпой, полимиксином, опиатами (кодеин, фен-
танил и др.), витаминами (Вр В2, В6, В12), тетрациклинами.
Факторы, способствующие развитию псевдоаллергии:
• полипрагмазия;
• наличие хронических воспалительных заболеваний органов пищева-
рения;
• множественные очаги инфекций (гайморит, бронхит, пневмония);
• обменные нарушения (сахарный диабет);
• нейропсихические изменения;
• использование препарата в дозе, не соответствующей массе тела;
• введение несовместимых лекарственных средств одновременно.
Для проведения адекватного лечения важно дифференцировать истин-
ную и псевдоаллегию (табл. 12-19).
Таблица 12-19. Дифференциальная диагностика истинной лекарственной аллергии и
псевдоаллергии
ГЛАВА 12
Критерии Истинная лекарственная аллергия Псевдоаллергия
Аллергические заболевания у родителей Как правило, имеются Как правило, отсутствуют
Аллергические заболевания в анамнезе у больного Имеются (характерны) призна- ки атопии и шаги аллергии Отсутствуют
Период сенсибилизации Установлен период сенсибили- зации или «скрытая» сенсиби- лизация (продукты с антибио- тиками и т.п.) Такого периода нет. Может возникнуть при первом введе- нии лекарственного средства
Число препаратов, вызываю- щих реакцию Не имеет значения Чаще «на многие препараты»
Особенности клинических про- явлений По любому из четырех типов гиперчувствительности Похожи на IgE-зависимые (крапивница, ангиоотеки, брон- хоспазм и т.п.)
Продолжительность клиниче- ских проявлений Зависит от типа реакции (от нескольких минут до недель) Кратковременно
Воспроизводимость Реакции повторяются при каж- дом последующем введении с утяжелением Как правило, нет
478 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Окончание табл. 12-19
ЧАСТЬ 2
Критерии Истинная лекарственная аллергия Псевдоаллергия
Зависимость от способа введе- ния лекарства Не зависит Не зависит
Зависимость от дозы пре- парата Возникают даже в ответ на минимальное количество лекарственного средства В ответ на минимальные дозы препарата могут не возникать
Уровень IgE Повышен в 40-60% случаев В норме
Лечебно-профилактические мероприятия Пожизненное прекращение контакта с причинными пре- паратами и перекрестно реа- гирующими лекарственными и пищевыми аллергенами Лечение основного заболе- вания. Снижение дозы или отмена препарата
Перекрестные реакции Могут возникать в ответ на разные препараты, имеющие общие химические и аллерген- ные свойства Не характерны
Клиническая картина
Аллергические реакции на препараты могут быть системными (АШ,
синдром Лайелла, синдром Стивенса-Джонсона, сывороточная болезнь,
лекарственный волчаночный синдром, системный васкулит и др.) и с преи-
мущественным поражением отдельных органов.
Общее состояние больных может варьировать от удовлетворительного
до крайне тяжелого (АШ). Прогнозировать тяжесть реакции, которая
может возникнуть у больного с ЛА, практически невозможно. Необходимо
учитывать тот факт, что при каждом последующем применении причинно-
значимого препарата степень выраженности клинических проявлений ЛА
возрастает. В некоторых случаях при ЛА может возникнуть лихорадка,
которая сохраняется длительно и является симптомом сывороточной
болезни. Лихорадка характерна также для лекарственного аллергическо-
го васкулита, системных токсико-аллергических синдромов и др. Кроме
того, у больных с сывороточной болезнью зачастую возникает лимфаде-
нопатия.
Клинические проявления ЛА вариабельны и могут затрагивать прак-
тически все органы и системы и различаться у больных только преиму-
щественным поражением той или иной системы: кожи, органов дыхания,
кровообращения, пищеварительного тракта и гепатобилиарной, моче-
выделительной, нервной системы, органов кроветворения. Кроме того,
выделяют ряд системных аллергических реакций, относящихся к ургентной
патологии (табл. 12-20).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 479
ГЛАВА 12
Таблица 12-20. Клинические проявления лекарственной аллергии (Лусс Л.В., 1994;
Ситкевич А.Е., 1997)
Органы и системы Клинические проявления (предполагаемые механизмы) Причинно-значимые лекарственные средства
Кожа Аллергические реакции 1-4 типа
Крапивница, ангиоотеки (1 тип, 3 тип?) Пенициллины, сульфаниламиды, ацетилсалициловая кислота и другие нестероидные противовоспалитель- ные средства, инсулин
Пустулезные сыпи (пустулы на фоне эритемы) (3 тип) Блокаторы кальциевых каналов, антибиотики пецициллинового ряда, цефалоспорины, макролиды; сульфаниламиды, соли брома, йода, хлора
Аллергический васкулит (3 тип) Антибиотики, сульфаниламиды, бар- битураты, блокаторы ^-рецепторов гистамина; препараты золота; гете- рологичные антисыворотки
Экзантемы (3 и 4 типы) пятнисто- папулезные Любые препараты, но особенно антибиотики, сульфаниламиды, бар- битураты
Экзантемы пурпурозные (не исче- зающие при надавливании лиловые или красноватые пятна различной величины) Гидрохлоротиазид, мепробамат, антикоагулянты
Феномен Артюса (инфильтраты, абсцессы, гиперемия вокруг места инъекции, возникающие на 7-9 сут или через 1-2 мес с момента нача- ла лечения) (3 тип) Инсулин, антибиотики пенициллино- вого ряда, стрептомицин и др.
Фотоаллергические сыпи (распро- страненная экзантема на участках, подверженных солнечному облуче- нию) (4 тип) Чаще вызывают лекарственные сред- ства местного действия: галогени- зированные фенольные соединения (добавляемые в мыла), аромати- ческие вещества (мускат, мускус. 6-метил кумарин), нестероидные противовоспалительные средства, препараты серы, фенотиазины
Аллергический контактный дерма- тит (4 тип) Блокаторы ^-рецепторов гистамина (производные этилендиамина), ами- ногликозиды, местные анестетики, витамины, соли никеля, противоту- беркулезные средства
480 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Продолжение табл. 12-20
Органы и системы Клинические проявления (предполагаемые механизмы) Причинно-значимые лекарственные средства
Синдром Стивенса-Джонсона Пенициллины, сульфаниламиды, нестероидные противовоспалитель- ные средства, противосудорожные средства; реже — вакцины и пре- параты крови
Синдром Лайелла (2 тип? 4 тип?) Пенициллины, сульфаниламиды, нестероидные противовоспалитель- ные средства, противосудорожные средства
Неаллергические реакции и реакции с неуточненными механизмами
Зкзантемы Составляют 75% случаев лекарствен- ных сыпей. Препараты из любых групп
Многоформная экссудативная эритема Пенициллины, сульфаниламиды, нестероидные противовоспалитель- ные средства, барбитураты; редко — вакцины, препараты крови
Фиксированная эритема и другие фиксированные токсидермии Антибиотики (чаще тетрациклино- вого ряда), нестероидные противо- воспалительные средства, сульфа- ниламиды. барбитураты; препараты, содержащие висмут
Узловатая эритема (возникает на 1-2-й неделе приема лекарствен- ных средств) Сульфаниламиды, препараты йода, бромиды, прокаин, оральные контра- цептивы
Эритродермия (гиперемия,отек, инфильтрация, шелушение, охва- тывающие до 50% поверхности тела) Антибиотики пенициллинового ряда, сульфаниламиды; препараты золота, мышьяка, ртути; барбитураты, пира- золоны, прокаин
Лихеноидные высыпания (полиго- нальные папулы, сливающиеся в шелушащиеся пятна. Часто сопро- вождаются зудом. Напоминают красный плоский лишай, экзему, псориаз. Очаги красно-коричневого цвета. Оставляют гиперпигмента- цию Препараты, содержащие золото, про- тивомалярийные, сахароснижаюшие; тиазиды, хлорпромазин, каптоприл блокаторы p-адренорецепторов
Эритема 9-го дня (лихорадка 9-го дня, реакция Милиана) Антибиотики пенициллинового ряда метронидазол, сульфаниламиды
Угреподобные высыпания (воз- никают внезапно, отсутствуют комедоны) Глюкокортикоиды, препараты йода, бромиды
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 481
Продолжение табл. 12-20
ГЛАВА 12
Органы и системы Клинические проявления (предполагаемые механизмы) Причинно-значимые лекарственные средства
Фототоксические сыпи (абсорбция ультрафиолетовых лучей и выделе- ние энергии, повреждающей клет- ки). Сыпь в виде солнечного ожога, иногда с пузырями Нестероидные противовоспалитель- ные средства, хинолины, антибиоти- ки тетрациклинового ряда, фенотиа- зины, амиодарон
Синдром неаллергической гипер- чувствительности (возникает через 2-6 нед после начала приема лекарственных средств. Сыпь в виде папул, пустул, булл в сочета- нии с лихорадкой, болями в суста- вах, лимфаденопатией, в 50% слу- чаев — гепатитом, эозинофилией и атипичными монуклеарами в крови) Противоэпилептические лекарствен- ные средства (фенитоин, карбама- зепин, фенобарбитал), сульфани- ламиды
Органы дыхания Аллергический ринит (риноконъ- юнктивит) Антибиотики (чаще пенициллинново- го ряда), пиразолоны
Бронхоспазм (вплоть до астматиче- ского статуса) Антибиотики (чаще пенициллино- вого ряда) ферментные препараты (трипсин, гиалуронидаза), местные анестетики (чаще прокаин), нейро- лептики (хлорпромазин, галопери- дол), пиразолоны
Ринит, бронхоспазм Ацетилсалициловая кислота, пиразо- лоны; таблетки, покрытые красите- лем (тартразином)
Экзогенный аллергический аль- веолит Антибиотики(пенициллинового ряда), сульфаниламиды, кромо- глициевая кислота, нестероидные противовоспалительные средства, лекарственные средства белкового происхождения
Эозинофильные летучие инфиль- траты легких (синдром Леффлера) Антибиотики пенициллинового ряда, ацетилсалициловая кислота, суль- фаниламиды, нитрофураны, гекс- эстрол,тестостерон
Острый пневмонит Соли золота, производные нитро- фуранов
Отек легких Опиоиды, салицилаты
Органы кровообра- щения Аллергический миокардит (отлича- ется быстрой положительной обрат- ной динамикой и выздоровлением после отмены причинно-значимого лекарственного аллергена) Пенициллины, сульфаниламиды, метилдопа
482 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Продолжение табл. 12-20
Органы и системы Клинические проявления (предполагаемые механизмы) Причинно-значимые лекарственные средства
Пищеварительный тракт Аллергический гастроэнтероколит (рвота, возникающая от нескольких минут до 6 ч после приема лекар- ственных средств, часто упорная; коликообразные боли в животе интенсивного характера; диарея, стул со стекловидной слизью; в кале — эозинофилы, метеоризм) Пиразолоны, сульфасалазин, парацетамол, нейролептики фено- тиазинового ряда (хлорпромазин), препараты солей золота, вальпроаты [вальпроевая кислота (депакин*) и др.]
Печень Острый гепатит Изониазид, метилдопа, галотан
Хронический активный гепатит Метилдопа, нитрофурантоин
Холестатическая желтуха (особен- ности: клинические проявления и изменения лабораторных показате- лей — аланинаминотрансферазы, аспартатаминотрансферазы, тимо- ловой пробы и других; исчезают после отмены причинно-значимых препаратов) Фенотиазины
Органы мочевыдели- тельной системы Острый интерстициальный нефрит Нестероидные противовоспалитель- ные средства, антибиотики пеницил- линового ряда и др.
Нефротический синдром (прогноз благоприятен при отмене пре- паратов) Препараты золота, триметадион
Анальгетическая нефропатия Нестероидные противовоспалитель- ные средства
Нервная система Аллергический энцефаломиелит Вакцины живые вирусные
Аллергическая миастения Пеницилламин
Вегетативные нарушения (головная боль, гиперемия кожи лица, сла- бость, головокружение и др.) При истинных и псевдоаллергиче- ских реакциях на различные лекар- ственные средства
Органы кроветво- рения Гемолитическая анемия Антибиотики пенициллинового ряда, тетрациклины, макролиды, метил- допа
Тромбоцитопении, нейтропении, агранулоцитоз, изолированная эозинофилия Антибиотики пенициллинового ряда, тетрациклины, макролиды, хинидин, нестероидные противовос- палительные средства (ибупрофен, фенацетин®), местные анестетики, изониазид, препараты золота, гепа- рин, антидепрессанты и др.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 483
Окончание табл. 12-20
ГЛАВА 12
Органы и системы Клинические проявления (предполагаемые механизмы) Причинно-значимые лекарственные средства
Системные аллер- гические и имму- нопатологические реакции Анафилактический шок: анафилак- сия (IgE-зависимая) P-Лактамные антибиотики, аллер- генные экстракты, гетерогенные сыворотки, вакцины, инсулин, стреп- токиназа, аспарагиназа
Анафилактоидные реакции (не IgE- зависимые) Рентгеноконтрастные вещества, ацетилсалициловая кислота, несте- роидные противовоспалительные средства, дестраны, средства для наркоза (реакции на некоторые могут быть обусловлены IgE). ципро- флоксацин, некоторые антибиотики (ванкомицин)
Системный лекарственный васку- лит Сульфаниламиды, антибиотики пени- циллинового ряда, цефалоспорины, аллопуринол, препараты йода
Сывороточная болезнь Гетерологичные сыворотки, анти- биотики пенициллинового ряда, сульфаниламиды, цитостатики, нестероидные противовоспалитель- ные средства, вакцины, препараты йода и брома
Лекарственно-индуцированный волчаночный синдром Прокаинамид, гидралазин, пени- цилламин, изониазид, интерферон альфа, метилдопа, хлорпромазин
Синдром Стивенса-Джонсона Антибиотики пенициллинового ряда, сульфаниламиды, нестероидные противовоспалительные средства, противосудорожные препараты; реже — вакцины и препараты крови
Синдром Лайелла Антибиотики пенициллиновой груп- пы, ненаркотические анальгетики, сульфаниламиды (чаще пролонгиро- ванных форм)
Проявления со стороны различных органов и систем (органов дыха- ния, кровообращения, пищевари- тельной и гепатобилиарной систем, мочевыделительной системы, нервной системы, органов крове- творения) Препараты разных фармакологиче- ских групп
ЧАСТЬ 2
484 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
12.7.1. Клинические проявления отдельных форм
лекарственной аллергии
Клинические проявления ЛА в виде крапивницы, ангиоотеков, АКД
описаны в соответствующих главах. Ниже даны клинические особенности
других локализованных и системных форм ЛА.
Фиксированная эритема
При повторных контактах с причинно-значимым лекарственным сред-
ством или с веществом со сходной антигенной структурой высыпания
повторяются каждый раз на одном и том же месте. В типичных случаях
высыпания представлены эритематозно-отечными элементами округлой
или овальной формы, размером от 2 см до 25-30 см с четкими границами.
В дальнейшем элементы уплотняются и приобретают пурпурно-красную
окраску. Иногда высыпания бывают в виде экзематозных, уртикарных,
везикулобуллезных, геморрагических или узелковых элементов. Возможен
слабый зуд, жжение или болезненность в месте поражения, но чаще всего
субъективные ощущения отсутствуют. После отмены препарата в течение
2-3 нед происходит инволюция сыпи, которая оставляет после себя шелу-
шение и стойкую пигментацию. После повторных высыпаний пигмента-
ция становится интенсивнее и приобретает коричнево-черный оттенок.
Поражение слизистых оболочек полости рта и половых органов возникает
редко.
Рис. 12-15. Лекарственная аллергия на амоксициллин. Фиксированная эритема у ребенка.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 485
Узловатая эритема
Узловатая эритема характеризуется появлением болезненных подкож-
ных узелков красного цвета, напоминающих гематомы и расположенных
симметрично на передней поверхности голеней, на бедрах, иногда в обла-
сти лба и шеи. Узлы могут быть размером с лесной орех, кожа над ними
ярко-красная, а через 5-7 сут становится синюшно-розовой. Узловатая
эритема может сопровождаться субфебрилитетом, недомоганием, миалгией
и артралгией. Элементы могут сохраняться от нескольких дней до 4-6 нед
после отмены препарата с исходом в шелушение и пигментацию. Возможны
симптомы интоксикации с повышением температуры тела, появлением
боли в суставах, мышцах.
Кроме ЛА, причиной развития узловатой эритемы могут быть стрепто-
кокковая инфекция, туберкулез, лепра, глубокие микозы, болезнь коша-
чьих царапин, саркоидоз, язвенный колит и другие заболевания.
Многоформная экссудативная эритема
Многоформная экссудативная эритема (МЭЭ) обычно возникает
остро, с появления лихорадки, головной боли, артралгии, боли в горле.
Одновременно у больного появляется полиморфная сыпь в виде эрите-
матозных, пятнисто-папулезных высыпаний разной формы и размеров.
Характерен рост элементов по периферии и появление в центре элементов
везикул и небольших пузырей. В результате сыпь приобретает вид «мише-
ни» (симптом мишени), появляется так называемый симптом «кокарды»,
ГЛАВА 12
Рис. 12-16. Лекарственная аллергия. Узловатая эритема. Больная 34 лет.
486 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Рис. 12-17. Многоформная экссудативная эритема. Пациент 16 лет.
т.е. возвышающийся по периферии край элемента. Сыпь часто распола-
гается симметрично, в первую очередь на лице и конечностях, включая
ладони и подошвы, иногда в области слизистых оболочек. МЭЭ, как пра-
вило, сопровождается симптомами интоксикации. Новые высыпания могут
появляться на протяжении 3-10 сут и более.
Синдром Стивенса-Джонсона (Stevens, Johnson, 1922)
Более тяжелая форма токсико-аллергического поражения кожи при
ЛА — синдром Стивенса-Джонсона, который может возникнуть как само-
стоятельное заболевание либо как развитие и утяжеление МЭЭ у некоторых
больных. Заболевание начинается внезапно с резкого подъема температу-
ры, боли в суставах, головной боли, озноба. Поражение кожи может быть
ранним или возникать на 4-6-е сутки после начала лихорадки. Кожные
проявления характеризуются буллезными высыпаниями с одновременным
поражением слизистых оболочек рта, глаз, мочеполовой системы (стома-
тит, уретрит, вульвовагинит, ринит, конъюнктивит), в тяжелых случаях
вплоть до изъязвления роговицы. Характерно появление множественных
везикулезных и буллезных высыпаний, отличительные признаки кото-
рых - пузыри различной величины с напряженным покровом и группо-
вым расположением на кистях, стопах, в межпальцевых промежутках. В
типичных случаях поражение может затрагивать от 10 до 40% поверхности
кожи. Симптом Никольского (отслойка эпидермиса при надавливании на
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 487
визуально не измененную кожу) отрицателен. По сравнению с синдромом
Лайелла прогноз сравнительно благоприятный.
Синдром Лайелла (Lyell, 1956)
Синдром Лайелла, или токсический эпидермальный некролиз, — это
острая, тяжелая, угрожающая жизни аллергическая реакция, характери-
зующаяся буллезным поражением кожи и слизистых оболочек, эпидер-
мальным некролизом и отслойкой кожи. Внешне пациенты напомина-
ют ожоговых больных, а поражения кожного покрова могут достигать
80-90%. Высыпания чаще начинаются с лица, быстро распространяясь на
грудь, спину и конечности. Образующиеся крупные пузыри имеют дряблую
поверхность, легко вскрываются и отслаиваются. На кистях и стопах эпи-
дермис отслаивается в виде «перчаток» и «носков». Характерно слияние
элементов и образование огромных булл. На местах вскрытия пузырей
после отторжения кожи остаются обширные, резко болезненные, кровото-
чащие поверхности, напоминающие ожоги III степени. В этих участках про-
исходит пропотевание жидкости. Неотторгнувшийся эпидермис выглядит
как гофрированная бумага.
Характерен положительный симптом Никольского и симптом Асбо-
Хансена (при надавливании на пузырь его размеры увеличиваются в связи
с отслойкой эпидермиса по периферии волдыря). Поражения слизистых
оболочек возникают одновременно с кожными проявлениями и носят
эрозивно-язвенный характер.
Осложнения при синдроме Лайелла аналогичны наблюдаемым при
обширных термических ожогах: быстро развивается гиповолемия, сгуще-
ние крови, гипопротеинемия, нарастает сердечно-сосудистая недостаточ-
ность, возможно появление симптомов менингоэнцефалита, гемипареза,
тонических судорог. Присоединяется вторичная инфекция. Острейшее
течение связано с быстрым развитием тяжелой патологии почек, печени,
легких, сердца, абсцессов мозга. Летальность достигает 30-50%.
Синдромы Лайелла, Стивенса-Джонсона и МЭЭ объединены термином
острые токсико-аллергические реакции (ОТАР). Этот симптомоком-
плекс, развивающийся на фоне приема препарата в терапевтической дозе,
основан на иммунных и неиммунных механизмах развития и протекает в
виде тяжелых токсидермий и буллезных дерматитов. Для ОТАР характер-
но острое начало, выраженная интоксикация, быстрое прогрессирование
поражения кожи и слизистых оболочек, поражение внутренних органов
различной степени выраженности. Синдром Лайелла — самая тяжелая
форма буллезного поражения кожи. Перед его развитием, как правило,
проявляются стадии МЭЭ и/или синдрома Стивенса-Джонсона, симптомы
которых длятся от нескольких часов до нескольких дней. Именно поэтому
большинство авторов считают, что эти синдромы являются стадиями одно-
го процесса различной степени тяжести.
ГЛАВА 12
ЧАСТЬ 2
488 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Эритродермия
Для эритродермии характерно острое начало с появления зуда, гипере-
мии и отечности в складках кожи, затем на лице, волосистой части головы,
туловище. Кожа имеет темно-красный цвет, инфильтрирована, отечна,
утолщена, с трудом берется в складку. Элементы сыпи могут трансформи-
роваться в пузыри, эрозии, происходит чешуйчатое шелушение. Вследствие
обширной гиперемии увеличивается теплоотдача, возрастают скрытые
потери воды, может развиться сердечная недостаточность. Обильное шелу-
шение обусловливает потерю большого количества рогового слоя, снижение
уровня альбумина и развитие отеков. Эритродермия может сопровождаться
субфебрилитетом, увеличением лимфатических узлов, похуданием, выпа-
дением волос, деформацией и ломкостью ногтей. Течение вялое, затяжное.
Лекарственная экзантема
Экзантема — частое проявление ЛА. Высыпания трудно отличить от
экзантем при вирусных инфекционных заболеваниях — эритематозные,
пятнисто-папулезные или кореподобные. Сыпь сначала появляется на туло-
вище или в местах, подверженных давлению. Их появлению предшествует
зуд кожных покровов, но сами высыпания, как правило, не зудят. Иногда
присоединяются лихорадка, артралгия, лимфаденопатия, эозинофилия.
Сывороточноподобный синдром
Сывороточноподобный синдром развивается на фоне приема небел-
ковых препаратов, но по клиническим проявлениям напоминает сыворо-
точную болезнь. Для хронических форм сывороточноподобного синдрома
характерна трансформация в лекарственный коллагеноз и появление симп-
томов атипичной СКВ. При амбулаторном обследовании можно выявить
LE-клетки (Lupus Erythematosus cells — клетки красной волчанки) и различ-
ные аутоантитела.
Аллергический васкулит
Аллергический васкулит в легких случаях проявляется кожными высы-
паниями, чаще эритематозными, макулопапулезными и в виде пурпуры,
реже высыпания имеют характер уртикарных. Возможно образование
пузырей с геморрагическим содержимым, на месте которых образуются
корки. Типична локализация в области голеней, вокруг суставов. При
системных васкулитах появляется лихорадка, головная боль, слабость,
миалгии, припухлость и боли в суставах, одышка. Иногда возникают симп-
томы поражения почек (гематурия, протеинурия) и кишечника (боли в
животе, кровянистый стул). По сравнению с васкулитами нелекарственного
происхождения чаще выявляют эозинофилию.
Лекарственная лихорадка
Лекарственная лихорадка может быть единственным проявлением ЛА,
что затрудняет ее диагностику у больных с инфекционными заболева-
ниями. О лекарственном происхождении лихорадки следует думать, если
высокая температура тела (обычно выше 39 °C) не соответстствует срав-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 489
Рис. 12-18. Лекарственная аллергия на амоксициллин. Аллергический васкулит. Пациент
19 лет.
ГЛАВА 12
нительно хорошему общему состоянию больного при положительной
динамике основного заболевания, по поводу которого пациент получал
данный лекарственный препарат. При этом повышение температуры нельзя
объяснить ни обострением основного заболевания, ни наслоением острой
респираторной вирусной инфекции. Признак аллергической лихорад-
ки — относительная брадикардия («диссонанс» между частотой пульса и
температурой). Лабораторные исследования обычно выявляют лейкоцитоз
со сдвигом влево, повышенные значения скорости оседания эритроци-
тов, имитирующие инфекционный процесс. Может возникать небольшая
эозинофилия в периферической крови, изменения функциональных проб
печени. После отмены препарата температура тела обычно нормализуется
в течение 48-72 ч. В некоторых случаях лекарственная лихорадка сопрово-
ждается сыпью, что облегчает ее диагностику. Следует помнить, что реак-
ция может приобрести системный характер, угрожающий жизни больного.
Волчаночноподобный синдром
В результате взаимодействия с лекарственным средством нуклеиновые
кислоты могут приобрести иммуногенные свойства с последующим обра-
зованием антинуклеарных антител. У пациентов возникают эритематозные
пятна на щеках в форме бабочки, а также петехии в области бедер и голеней,
слабость, субфебрильная температура, артриты, полисерозиты. У некото-
рых больных возникает кожный зуд, боли в мышцах и мышечная слабость,
лихорадка до фебрильных цифр. Возможно появление кожных высыпаний
на лице в виде стойкой эритемы пурпурно-лилового цвета, отеков, особен-
но в параорбитальной области. Отеки могут возникать также в области шеи,
ЧАСТЬ 2
490 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
кистей и других участков тела. Кожа сухая, с шелушением. Иногда на спине,
ягодицах, плечах появляются единичные крупно-папулезные высыпания.
Возникают лимфаденопатия, гепато- и спленомегалия. Поражение почек
не характерно. Клинические проявления купируются через 1-2 нед после
отмены препарата. В некоторых случаях симптомы могут сохраняться
длительно, на протяжении нескольких месяцев. При лабораторных иссле-
дованиях отмечается появление LE-клеток и антинуклеарных антител,
повышение скорости оседания эритроцитов.
Бронхоспазм
Одно из проявлений ЛА — бронхоспазм, возникающий при ингаляциях
ферментных препаратов и профессиональном контакте с трипсином, пан-
креатином, питуитрином. Частой причиной обострений БА служат НПВС.
Описаны случаи развития бронхоспазма при лечении р-адреноблокаторами
(в том числе в виде глазных капель и пероральных форм) у лиц, не страдаю-
щих БА. Кроме того, применение p-адреноблокаторов не только повышает
риск развития генерализованных аллергических реакций на другие лекар-
ственные средства, но и осложняет их лечение.
Эозинофильные летучие инфильтраты легких
Возникновение легочных инфильтратов, сопровождающихся эозино-
филией периферической крови, ассоциируется с использованием многих
лекарственных средств (сульфаниламидов, НПВС, пенициллинов, нитро-
фуранов и др.). Основные проявления — непродуктивный кашель, одышка,
головная боль, недомогание, лихорадка; часто возникает заложенность
носа, ринорея, пятнисто-папулезная сыпь. При рентгенологическом иссле-
довании органов грудной клетки обнаруживают мигрирующие фокальные
инфильтраты.
На фоне постоянного контакта с лекарственным аллергеном у фармацев-
тов, медицинских сестер и других специалистов может развиваться хрони-
ческая форма аллергического альвеолита, проявляющаяся пневмосклеро-
зом, фиброзом, поликистозом, бронхоэктазами и др.
Экзогенный аллергический альвеолит
Данное заболевание возникает, когда лекарственные аллергены попадают
в организм ингаляционным или эндобронхиальным путем. В качестве аллер-
генов могут выступать рентгеноконтрастные вещества, ферменты (трипсин,
химотрипсин), интал, антибиотики и др. Заболевание может протекать остро,
подостро и хронически. При острой форме во время контакта с аллергеном у
пациента появляется сухой кашель, одышка, озноб, повышается температура
тела. При аускультации выявляют картину «бронхопневмонии». После пре-
кращения контакта с аллергеном обратное развитие симптомов и нормали-
зация состояния без лечения происходят в течение 1-2 сут. При подострой
форме начало заболевания постепенное; выявляют субфебрилитет, кашель,
рассеянные сухие и влажные хрипы по всему объему легких. На фоне посто-
янного контакта с лекарственным аллергеном развивается хроническая
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 491
форма заболевания, которая прогрессирует и в дальнейшем проявляется
пневмосклерозом, фиброзом, бронхоэктазами и др.
Лекарственный аллергический миокардит
Заболевание может развиться при применении антибиотиков (в первую
очередь пенициллинового ряда), сульфаниламидов, витаминов группы В,
новокаина и др. Характерно повышение температуры тела, слабость,
одышка, боли в области сердца, аритмия, тахикардия. Со стороны сердца
при осмотре выявляют расширение границ сердца влево, приглушенность
тонов, возможно появление систолического шума над верхушкой сердца.
Нередко регистрируют изменения на электрокардиограмме (двухфазный
или отрицательный зубец Т, смещение сегмента ST, нарушения прово-
димости); выявляют незначительное повышение активности ферментов
миокарда в сыворотке крови. Как изолированная форма ЛА миокардит воз-
никает редко. Диагностику облегчает одновременное наличие других про-
явлений аллергической реакции на лекарственные средства (кожные высы-
пания, эозинофилия, ангиоотеки, васкулиты и др.). В большинстве случаев
выздоровление наступает в течение 3-4 нед после отмены препарата. При
персистирующем течении или при тяжелых проявлениях аллергического
миокардита показана интенсивная терапия с использованием глюкокорти-
коидов и иммунодепрессантов.
Лекарственный аллергический гепатит
При ЛА выявляют в 10% случаев. Выделяют цитолитический (повыше-
ние трансаминаз), холестатический (повышение температуры тела, желту-
ха, кожный зуд) и смешанный варианты гепатитов.
Для аллергических поражений печени наиболее характерен холестаз,
которому часто предшествуют крапивница, артралгии, эозинофилия.
Паренхиматозные поражения печени лекарственного происхождения чаще
имеют токсический генез.
Лекарственный аллергический интерстициальный нефрит
Необходимо заподозрить, когда признаки острой почечной недостаточ-
ности в сочетании с лихорадкой, кожной сыпью, артралгией, эозинофи-
лией, невыраженной протеинурией, микрогематурией и эозинофилурией,
развиваются спустя 2 нед после назначения препарата.
Гематологические синдромы
В их развитии играют роль цитотоксический и иммунокомплексный
механизмы гиперчувствительности. Наиболее характерны цитопении раз-
личной степени выраженности, вплоть до гемолитической анемии, тром-
боцитопенической пурпуры и агранулоцитоза. Агранулоцитоз редко слу-
жит проявлением ЛА, но возможен при приеме жаропонижающих и
противоревматических препаратов. Клиническая картина агранулоцитоза
характеризуется внезапностью начала, ознобом, слабостью, недомоганием,
позже появляется некротическая ангина, различные высыпания на кожных
покровах, увеличиваются лимфатические узлы, селезенка. В костном мозге
ГЛАВА 12
ЧАСТЬ 2
492 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
в начале заболевания отмечается гиперплазия, затем гипоплазия и апла-
зия. В периферической крови выявляется лейкопения, гранулоцитопения,
повышенная скорость оседания эритроцитов.
Гемолитическая анемия клинически проявляется симптомами внутри-
сосудистого гемолиза: высокой температурой, рвотой, болями в животе,
гематурией, гепатомегалией. В анализе крови появляется нормохромная
анемия, ретикулоцитоз.
Основной признак тромбоцитопении — геморрагические высыпания,
чаще всего на нижних конечностях, а также на слизистых пищеварительно-
го тракта и оболочках головного мозга.
Следует помнить, что в редких случаях единственным проявлением ЛА
может быть эозинофилия.
Неврологические проявления
К редким формам ЛА относят поражения, затрагивающие нервную
систему, а именно поствакцинальные энцефалиты и энцефаломиелиты.
При введении анатоксинов (АДС), препаратов золота, сульфаниламидов,
колхицина, нитрофурантоина возможно появление периферической поли-
нейропатии и невритов.
Анафилактический шок
Анафилактический шок (АШ) — генерализованная аллергическая реак-
ция, в результате которой нарушается деятельность жизненно важных
органов и систем. Он характеризуется быстро развивающимся снижением
тонуса сосудов, повышением их проницаемости, уменьшением объема
циркулирующей крови, сгущением крови, развитием бронхоспазма и спаз-
ма гладкой мускулатуры внутренних органов. АШ чаще всего развивается
через 3-30 мин после введения лекарственных средств. Следует отметить,
что при внутривенном введении аллергена АШ может иметь молниеносное
течение («на кончике иглы»), тогда как после перорального, ректального,
наружного применения препарата АШ может развиться спустя 1-3 ч.
Наиболее часто АШ развивается в ответ на 0-лактамные антибиотики,
прежде всего пенициллины, и местные анестетики; реже — на стрептоми-
цин, тетрациклин, сульфаниламиды, пиразолоновые препараты, витамины
группы В, ферменты.
Диагностика
Диагностика ЛА основывается на данных аллергоанамнеза, клинических
проявлениях, а также на результатах специфического тестирования in vivo
и in vitro. Необходимо отметить, что достоверность и воспроизводимость
имеющихся на сегодняшний день методов исследования довольно низкая,
что связано с многообразием механизмов аллергии на лекарстенные сред-
ства, с изменением аллергенных свойств препаратов и превращением их в
организме в метаболиты; в ряде случаев это бывает обусловлено опасно-
стью развития анафилаксии при постановке тестов in vivo.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 493
Кожные пробы
Их используют при подозрении на IgE-зависимую ЛА либо реакции
ГЗТ. Следует отметить, что постановка кожных тестов для больных с
IgE-зависимой аллергией несет в себе риск возможного развития АШ.
Отрицательный результат теста свидетельствует лишь об отсутствии IgE-
опосредованной ЛА, но не исключает другие типы гиперчувствительности к
лекарственному препарату. Постановку кожных проб осуществляют, исполь-
зуя только стандартизированные лекарственные аллергены, а не сами лекар-
ственные препараты, поскольку аллергию часто вызывают не препараты, а
их метаболиты. В настоящее время разработаны стандартизированные диа-
гностические тесты с бензилпенициллоил-полилизином и малыми детерми-
нантами пенициллина, с миорелаксантами, инсулином, глюкокортикоидами,
туберкулостатическими и антиконвульсивными препаратами.
Рекомендуют последовательную постановку капельной, скарификацион-
ной и внутрикожной проб с использованием положительного (0,01% рас-
твор гистамина) и отрицательного (растворитель для лекарственного пре-
парата) контроля. Скарификационную пробу проводят при отрицательной
капельной, а внутрикожную — при отрицательной скарификационной
пробе.
Для выявления реакций ГЗТ используют аппликационные кожные
пробы (patch-тест). Положительный результат теста имеет диагностическое
значение только при корреляции с данными анамнеза.
Провокационные пробы
Диагноз гиперчувствительности к какому-либо препарату можно под-
твердить провокационной пробой, которую проводят только в период
ремиссии.
• Наиболее широко используют подъязычную пробу. Ее проводят,
начиная с У8 таблетки или с 2-3 каплель испытуемого препарата.
Пробу считают положительной, если через 15-45 мин возникнет мест-
ная реакция в виде гиперемии и отека или общая реакция в виде учаще-
ния пульса более чем на 10 ударов в минуту и снижения артериального
давления больше чем на 15-20 мм рт.ст.
• Пероральный провокационный тест с ацетилсалициловой кислотой
или НПВС проводят у больных БА. Постановка теста возможна только
в межприступный период. Результат теста считают положительным,
если объем форсированного выдоха снижается на 15% и ниже.
• Тест торможения естественной эмиграции лейкоцитов проводят,
подсчитывая лейкоциты в изотоническом растворе натрия хлорида в
камере Горяева через 15 и 30 мин после последовательного полоскания
полости рта изотоническим раствором натрия хлорида и раствором
испытуемого препарата. Тест оценивают как положительный, когда
количество лейкоцитов в промывной жидкости уменьшается на 30% и
более.
ГЛАВА 12
ЧАСТЬ 2
494 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Провокационные и кожные тесты противопоказаны при наличии в анам-
незе тяжелых проявлений ЛА: синдрома Стивенса-Джонсона, синдрома
Лайелла, МЭЭ, АШ.
Лабораторные тесты
При ЛА лабораторные тесты имеют вспомогательное значение. В настоя-
щее время наиболее широко применяют следующие патогенетически обо-
снованные методы:
• радиоиммунный метод определения специфических IgE, IgG, IgM;
• метод ИФА для оценки IgE- и IgG-антител к пенициллину, инсулину,
некоторым НПВС, анестетикам, сульфаниламидам. Наборов для опре-
деления антител к малым детерминантам пенициллина не существует;
• тесты определения сенсибилизации Т-клеток (реакция торможения
миграции лейкоцитов и реакция бласттрансформации лимфоцитов к
лекарственным аллергенам) в основном для диагностики аллергиче-
ских реакций типа IV;
• определение гистамина и триптазы в плазме крови, а также выявление
компонентов комплемента, цитокинов, метаболитов арахидоновой
кислоты в период клинических проявлений ЛА.
Отбор соответствующих диагностических тестов осуществляют на основе
предполагаемого патогенеза ЛА, базирующегося на морфологии и хроноло-
гии реакции. Например, прик-тесты могут быть полезны в идентификации
препаратов, вызывающих немедленные реакции, тогда как pafc/z-тесты,
внутрикожные, тест бласттрансформации лимфоцитов in vitro имеют значе-
ние при выявлении реакции ГЗТ.
Радиоиммунный аллергосорбентный тест используют для выявления
специфических IgE-антител в сыворотке пациента с немедленной ЛА.
Тест базофильной активации, основанный на определении с помо-
щью проточной цитофлуорометрии активационных маркеров (CD63),
которые экспрессируются на базофилах пациентов, чувствительных к
препарату. Этот метод позволяет исследовать гиперчувствительность к
таким лекарственным средствам, как р-лактамы, мышечные релаксанты,
НПВС и др.
Следует помнить, что отрицательный результат любого лабораторного
теста не исключает ЛА на данный препарат, тем более что часто в роли
аллергена выступает не сам препарат, а его метаболиты. С другой стороны,
положительный тест не служит неоспоримым доказательством аллергии к
препарату.
Кожные, а тем более провокационные пробы с лекарственными сред-
ствами сопряжены с высоким риском развития системных реакций и редко
бывают оправданы. Необходимость их проведения обоснована, лишь когда
лекарственное средство должно применяться по жизненным показаниям
(например, инсулин при сахарном диабете).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 495
У пациентов, находящихся в рефрактерном периоде после перенесенных
реакций на лекарственные средства, кожные тесты могут быть ложнополо-
жительными. Проведение тестов in vitro ограничено числом препаратов, для
которых созданы диагностические тест-системы.
В целом диагностику ЛА в каждом конкретном случае основывают на
детальной оценке клинических симптомов, скорости их возникновения, а
также на результатах различных дополнительных методов исследования,
включая кожные тесты, определение специфических IgE, тестов ГЗТ и др.
Лечение
В лечении ЛА используют основные принципы терапии аллергических
заболеваний: элиминацию, фармакотерапию и в редких случаях специфи-
ческую иммунотерапию.
Элиминационные мероприятия
• Прекращение дальнейшего поступления лекарственного средства,
вызвавшего аллергическую реакцию, а также перекрестно реагирую-
щих препаратов. При развитии тяжелых форм ЛА на фоне применения
нескольких препаратов отменяют их все, за исключением жизненно
необходимых.
• При ЛА, возникшей в ответ на подкожное введение аллергенов, вакцин
и других препаратов, необходимо наложить жгут на конечность выше
места введения или обколоть это место 0,01% раствором эпинефрина
по 0,2-0,3 мл. При внутримышечном введении аллергена обкалыва-
ние нерационально, поскольку симпатомиметики расширяют сосуды
мышц.
• Применение энтеросорбентов: активированного угля или полифепана*
(лигнин гидролизный). Использование энтеросорбентов обосновано
при любых способах введения лекарственных средств, вызвавших
аллергическую реакцию, и при любом механизме этой реакции (как
атопический, так и псевдоаллергический тип с выделением гистамина),
поскольку пищеварительный тракт участвует в элиминации избытка
этого медиатора.
• При развитии реакции на препараты, принимаемые внутрь, необходи-
мо промывание желудка, очищение кишечника.
• Назначение гипоаллергенной диеты с исключением перекрестно реа-
гирующих пищевых продуктов (например, при реакции на ацетилса-
лициловую кислоту и НПВС необходимо исключить из питания про-
дукты, содержащие салицилаты: клюквенный морс, малину, консервы
и др.) и гистаминолибераторов (острых, копченых продуктов, консер-
вантов и т.д.).
Фармакотерапия
В перечень основных препаратов для лечения ЛА входят антигистамин-
ные препараты, глюкокортикоиды. В зависимости от тяжести клинических
ГЛАВА 12
ЧАСТЬ 2
496 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
проявлений пациентам можно назначить эпинефрин, дезинтоксикацион-
ную терапию, экстракорпоральные методы лечения.
• При аллергических реакциях с участием гистамина назначают блока-
торы ^-рецепторов гистамина 1-го или 2-го поколения. В более тяже-
лых случаях начинают лечение с парентерального введения препаратов
1-го поколения, за исключением пипольфена* (прометазин), который
противопоказан при анафилаксии, так как способен усиливать гипо-
тензию. Препараты 1-го поколения применяют кратковременно из-за
возможности развития тахифилаксии. Препараты 2-го поколения
(лоратадин, дезлоратадин, цетиризин, левоцетиризин, эбастин, фексо-
фенадин) принимают внутрь длительно.
• При тяжелых системных реакциях препаратом первой линии является
эпинефрин, вводимый в зависимости от ситуации подкожно, внутри-
мышечно или внутривенно (при шоке). При злокачественной гипотен-
зии возможно повторное введение 0,1% раствора эпинефрина через
каждые 10-15 мин до стабилизации артериального давления.
• При системных тяжелых поражениях кожи, внутренних органов, гема-
тологических нарушениях, васкулитах рекомендуют глюкокортикоиды
внутрь или парентерально в дозе от 1-2 (например, при крапивнице)
до 5-10 мг/кг в сутки (при ОТАР). Однако при назначении высоких доз
необходимо помнить о риске присоединения бактериальных осложне-
ний, поэтому дозу глюкокортикоидов необходимо максимально сни-
зить к 7-10-м суткам лечения.
• Для дезинтоксикации при лечении острых аллергических реакций
на лекарственные средства применяют инфузионно вводимый изо-
тонический раствор натрия хлорида и плазмозамещающие растворы
(полиглюкин*, реополиглюкин*). Объем инфузионной терапии зави-
сит от тяжести аллергической реакции, и возраста пациента и может
составлять от 200 мл/сут до 3-5 л/сут.
• При лечении ОТАР (МЭЭ, синдром Лайелла, синдром Стивенса-
Джонсона) наряду с глюкокортикоидами необходимо назначить анти-
бактериальные препараты, иммуноглобулины для внутривенного вве-
дения.
• При реакциях на йод- и бромсодержащие препараты, цианиды, мышьяк
эффективно внутривенное введение натрия тиосульфата (взрослым по
5-50 мл 30% раствора, детям по 5-10 мл 10% раствора).
• Проводят посиндромное лечение основных проявлений ЛА (противо-
судорожные, сердечные и другие препараты по показаниям).
Аллергенспецифическая иммунотерапия
Применяют при ЛА крайне редко — только в случаях, когда дальней-
шее применение препарата жизненно важно: например, если необходимо
назначить пенициллин больным бактериальным эндокардитом, нейроси-
филисом, беременным с сифилисом; инсулин при сахарном диабете; гете-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 497
рогенные сыворотки для экстренной профилактики или лечения тяжелых
инфекционных заболеваний (столбняк, бешенство и др.).
АСИТ может проводить только врач, имеющий специальную подготовку
и навыки оказания помощи при АШ. Лечение заключается в постепенном
введении повышаемых доз лекарственного средства. Возрастающие дозы
инсулина вводят начиная с 0,00001 ЕД подкожно три раза в сутки. При раз-
витии системных реакций во время АСИТ рекомендуют повторно вводить
препарат в дозе, не вызвавшей реакцию, или изменить схему АСИТ.
Профилактика
Первичная профилактика состоит в рациональном назначении лекар-
ственных средств и включает следующие мероприятия:
• исключение полипрагмазии;
• отказ от назначения пенициллина пациентам с грибковыми заболева-
ниями;
• отказ от назначения антибиотиков с профилактической целью;
• тщательное изучение аллергоанамнеза при назначении любого лече-
ния;
• своевременная вакцинация против инфекционных заболеваний.
Вторичная профилактика предполагает предупреждение ЛА у пациен-
тов, страдающих аллергией, и заключается в:
• обязательной регистрации ЛА в медицинской документации с указани-
ем непереносимости лекарственных препаратов;
• назначении лекарственных средств, не обладающих перекрестными
антигенными свойствами с ранее выявленным лекарственным аллер-
геном;
• ограничении парентерального, особенно внутривенного введения
лекарственных средств;
• ограничении применения пролонгированных препаратов (бициллин
и др.).
Вопросы для самоконтроля
• Что такое ЛА?
• Какова распространенность ЛА у взрослых и детей? Какие препараты
наиболее часто вызывают ЛА?
• Какие побочные эффекты на лекарственные средства могут развиться
как у взрослых, так и у детей?
• В чем отличие истинных аллергических реакций на лекарственные
средства от других побочных реакций?
• Назовите классификацию лекарственной гиперчувствительности и
лекарственной аллергии.
• Какие механизмы развития истинной лекарственной аллергии вам
известны?
ГЛАВА 12
ЧАСТЬ 2
498 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Перечислите факторы риска развития ЛА.
• Приведите примеры перекрестных аллергических реакций на лекар-
ственные препараты.
• Каковы механизмы развития псевдоаллергических реакций на лекар-
ственное средство?
• Назовите факторы, способствующие развитию псевдоалергии на лекар-
ственное средство.
• Каковы дифференциально-диагностические критерии истинной ЛА и
псевдоаллергии?
• Опишите клинические проявления ЛА, затрагивающие органы дыха-
ния, кожи и системы крови.
• Охарактеризуйте клинические проявления фиксированной эритемы у
больных с ЛА.
• Перечислите основные методы диагностики ЛА in vivo и in vitro.
• Назовите основные принципы лечения ЛА.
• В чем состоит первичная и вторичная профилактика ЛА?
12.8. ИНСЕКТНАЯ АЛЛЕРГИЯ
Инсектная аллергия — совокупность аллергических реакций, возникаю-
щих в результате контакта с аллергенами насекомых. Слово «инсектная»
произошло от названия класса Insecta (насекомые). Источником аллергенов
могут быть не только взрослые особи, но и их личинки, куколки и мета-
болиты. Жалящие насекомые принадлежат к отряду Hymenoptera (жалят
только самки).
Эпидемиология
Инсектная аллергия развивается в любом возрасте. Системные аллер-
гические реакции у взрослых выявляют в 3% случаев, а у детей — в 1%.
Частоту обширных локальных реакций не учитывают, но она составляет не
меньше 10% у детей и взрослых.
Число фатальных реакций на укусы ежегодно достигает в США 40 слу-
чаев, в Европе — 16-38 случаев, хотя часть случаев может остаться
нераспознанной. Большинство фатальных реакций на укусы возникает у
взрослых старше 45 лет либо у маленьких детей. При этом в 50% таких слу-
чаев в анамнезе больных отмечались возникавшие ранее реакции на укусы.
Высокая частота сенсибилизации к инсектным аллергенам характерна для
пациентов с сенсибилизацией к ингаляционным аллергенам. У пациентов
с аллергическими заболеваниями наиболее часто выявляют аллергию к
насекомым, обитающим в жилище человека и входящим в состав домашней
пыли (тараканам, домашним мушкам, оконным муравьям и др.).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 499
Аллергию к яду перепончатокрылых насекомых (пчел, ос, шершней, шме-
лей) выявляют у 0,1-0,4% населения нашей страны, а в отдельных странах
этот тип составляет до 4% всех аллергических реакций. Наибольшее число
больных составляют лица молодого возраста (до 20 лет). Следует отметить,
что приблизительно каждый четвертый пациент с повышенной чувстви-
тельностью к яду ос и каждый шестой — к яду пчел имеют аллергию к яду
других насекомых. Аллергические реакции на слюну кровососущих (кома-
ров, мокриц, мошек, москитов, слепней и др.) возникают у 17-20% лиц с
атопическими заболеваниями.
Укусы представителей отрядов бабочек, жуков, ручейников, молей чаще
вызывают профессиональную аллергию. В частности, профессиональная
аллергия к ручейникам выявлена у 61% работников ГЭС.
Механизмы развития
Инсектная аллергия на ужаление перепончатокрылыми в 95-98% слу-
чаев протекает по IgE-зависимому типу. Аллергический ответ на аллергены
нежалящих насекомых формируется по механизмам гиперчувствительно-
сти I-IV типов.
Реже на ужаление насекомых формируется аллергический ответ имму-
нокомплексного типа. Аллергены насекомых могут спровоцировать
развитие аллергических, токсических и ложноаллергических реакций.
Ложноаллергические реакции опосредованы неспецифическим гистамин-
высвобождающим действием отдельных компонентов яда; кроме того, воз-
можно токсическое действие яда насекомого.
Классификация
• В зависимости от способа попадания аллергенов в организм пациента
выделяют инсектную аллергию, вызванную:
О ядом перепончатокрылых (при ужалениях);
Ф слюной кровососущих насекомых (при укусах);
Ф фрагментами тел и продуктами жизнедеятельности насекомых при
их вдыхании;
Ф фрагментами тел и продуктами жизнедеятельности насекомых при
непосредственном соприкосновении с кожей.
• Существуют классификации инсектной аллергии по другим признакам.
о По механизму развития — реакции гиперчувствительности немед-
ленного и замедленного типа.
Ф> По вовлечению шоковых органов — местные и системные аллер-
гические реакции. Шоковыми органами при инсектной аллергии
могут быть кожа, система органов дыхания, кровеносная систе-
ма, пищеварительный тракт, ЦНС, мочевыделительная система и
опорно-двигательный аппарат.
Ф По тяжести течения заболевания выделяют четыре степени тяжести
от легкой до крайне тяжелой.
ГЛАВА 12
ЧАСТЬ 2
500 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Клиническая картина
Укусы насекомых вызывают локальные или системные реакции, разви-
вающиеся немедленно или по замедленному типу. Локальная реакция огра-
ничена зоной вокруг укуса. Отсроченные реакции отражают позднюю фазу
IgE-зависимой реакции, которая развивается через 12-24 ч после укуса и
может достигать 20 см в диаметре. Часто такие реакции сопровождаются
лимфангиитами и регрессируют в течение 5-10 сут. Локальные реакции
не носят угрожающего жизни характера, за исключением потенциальной
угрозы отека гортани при укусе в шею или голову.
Системные реакции проявляются симптомами и синдромами, охватываю-
щими несколько систем, отдаленных от места укуса. Почти все системные
реакции являются IgE-зависимыми. Комбинация кожных (генерализованная
крапивница, ангиоотеки, поражения кожи, зуд), респираторных (чувство
сдавления в груди, дисфагия, стридор, дисфония, шумное дыхание, диспное),
сосудистых (гипотензия, головокружение, потеря сознания) симптомов
может возникать у больных с системными реакциями. Реже появляются симп-
томы поражения органов пищеварения: колики, диарея, тошнота, рвота.
Как проявление анафилаксии на укусы насекомых возможны спазм коро-
нарных сосудов, тахиаритмия или брадикардия. Диагностика острой сердеч-
ной недостаточности бывает затруднена, если гипотензия или кардиальные
симптомы возникли как единственное аллергическое проявление на укус.
Изучение частоты встречаемости тех или иных системных проявлений
показало, что приблизительно у 16% взрослых пациентов развиваются только
кожные симптомы, у 24% — жизнеугрожающие реакции (из них у 15% с поте-
рей сознания, а 44% имеют разнообразную симптоматику). У детей частота
изолированных кожных проявлений достигает 60%. Описана необычная
реакция в виде холодовой крапивницы, возникшей через 1-2 нед после укуса
и персистирующей месяцами. Механизм такой реакции не известен. У боль-
ных при отсутствии симптомов немедленной аллергической реакции на укусы
обнаруживают специфические IgE-антитела к антигенам насекомых.
Причиной системных реакций может быть токсическое действие вазо-
активных веществ, поступающих в организм при ужалении. Такие реакции
отличаются от острых системных аллергических реакций и проявляются
нарушениями функций почек, острым некрозом скелетных мышц, гемо-
лизом, респираторным дистресс-синдромом взрослых, синдромом дис-
семинированного внутрисосудистого свертывания. После множественных
укусов может развиться эпилептический приступ. К необычным реакциям
с замедленным и неизвестным механизмом развития относят энцефалиты,
периферические и центральные нейропатии, гломерулонефрит, миокарди-
ты, синдром Гййена-Барре.
Таким образом, аллергические реакции при контакте с насекомыми
могут быть местными и системными, причем клинические проявления этих
реакций зависят от вида причинно-значимого аллергена, пути его посту-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 501
пленил в шоковый орган, типа аллергической реакции и степени выражен-
ности сенсибилизации больного.
В месте ужаления перепончатокрылыми, как правило, в течение первых
4-10 ч возникают отек диаметром больше 10 см, гиперемия, интенсивный
зуд; реже — везикулезные и буллезные высыпания. Отек сохраняется не
меньше 24 ч. При ужалении в периорбитальную область отек имеет бесфор-
менный вид и закрывает один или оба глаза. Возможен отек региональных
лимфатических узлов, лимфангиит. Симптомы сохраняются до 8-12 сут.
Наиболее опасно ужаление в язык и шею, поскольку это может привести к
асфиксии. У некоторых больных в месте ужаления формируется геморраги-
ческий некроз (феномен Артюса).
Местные аллергические реакции на укусы кровососущих насекомых
(комаров, москитов, слепней, блох, мошек, клопов и др.) чаще всего про-
являются отеком, гиперемией, папулезной или уртикарной сыпью и интен-
сивным зудом в месте укусов. Реже при их укусах развиваются неадекватные
реакции в виде гигантской инфильтрации, сохраняющейся до двух месяцев.
При укусах постельных клопов местные аллергические реакции могут раз-
виваться стремительно (от 1-2 до 40 мин после укуса), отсроченно (через
4-6 ч) и даже через 6-12 ч. В последнем случае инсектная аллергия на
укусы клопов приобретает рецидивирующее течение. В частности, в местах
укусов в течение двух месяцев периодически появляются папулы, везикулы
или буллы, сопровождающиеся интенсивным зудом. Местные реакции на
укусы «целующего клопа» (Triatoma protractd) проявляются папулами с
темной точкой в центре, которые со временем превращаются в везикулы
размером 2-3 см. В месте укусов мошек может развиться эритема, напоми-
нающая рожистое воспаление, везикулезно-буллезная или некротическая
сыпь с исходом в рубцевание.
Системные аллергические реакции на ужаления и укусы насекомых
характеризуются внезапностью появления клинических симптомов и тяже-
стью их течения. Клинические симптомы, характерные для различных
степеней тяжести системных аллергических реакций на ужаление перепон-
чатокрылыми представлены в табл. 12-21.
Системные аллергические реакции на укусы насекомых чаще проявля-
ются генерализованными высыпаниями, ангиоотеком, реже — лихорадкой,
лимфаденитом и даже анафилаксией. В литературе описаны случаи АШ
после укуса постельного и «целующего» клопов.
При ужалении системные реакции возникают у 0,8-5% населения и
составляют 77% случаев инсектной аллергии на яд перепончатокрылых^
Они, как правило, проявляются локализованной или генерализованной
крапивницей, отеком Квинке в стороне от места ужаления, тошнотой, рво-
той, металлическим привкусом во рту, схваткообразными болями в животе,
диареей. Редкие клинические проявления системных аллергических реак-
ций на ужаление насекомыми представлены в табл. 12-22.
ГЛАВА 12
502 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-21. Клинические проявления инсектной аллергии
Степень тяжести системных реакций Клинические симптомы
1 (слабые) Генерализованная крапивница, зуд, недомогание
II (выраженные) Любой из вышеперечисленных симптомов в сочетании с двумя или более из нижеперечисленных: ангионевротический отек, сдавление в груди, тош- нота, рвота, диарея, боль в животе, головокружение
III (тяжелые) Любой из вышеперечисленных и два или более из нижеперечисленных симптомов: диспноэ, хрипы, стридор, дисфагия, спутанность сознания, чувство опасности
IV (крайне тяжелые) Любой из вышеперечисленных симптомов, а также падение артериального давления, коллапс, потеря сознания, недержание мочи и/или кала, цианоз
Таблица 12-22. Необычные системные реакции на яд перепончатокрылых насекомых
(по U.R. Muller)
Тип реакции Клинические проявления
Синдром сывороточной болезни Лихорадка, артралгии, лимфаденопатии, экзантема
Генерализованный васкулит Васкулит
Поражение почек Гломерулонефрит, нефротический синдром
Болезни крови Тромбоцитопения, гемолитическая анемия, синдром диссеми- нированного внутрисосудистого свертывания
Поражение нервной системы Периферические невриты, полирадикулоневриты, эписиндром, обратимые и необратимые поражения нервной ткани
Кардиальные симптомы Аритмия, боли за грудиной, инфаркт миокарда
Одно из самых тяжелых системных проявлений инсектной аллергии —
АШ. Летальность при этом составляет 64-84%. Исследования показали,
что, если через несколько секунд или минут после ужаления насекомым
возникают реакции, затрагивающие дыхательные пути, можно прогнози-
ровать развитие анафилаксии. АШ на ужаление насекомыми клинически
проявляется удушьем, снижением артериального давления, недержанием
мочи, кала, цианозом кожных покровов, коллапсом, потерей сознания.
О степени тяжести системных реакций можно судить по скорости их
появления и нарастания. В частности, тяжелые системные реакции раз-
виваются, как правило, в течение 1-2 мин после ужаления, легкие — через
несколько часов. Тяжесть системных аллергических реакций на ужаление
и укусы насекомыми возрастает у лиц, получающих НПВС (повышено
образование лейкотриенов) и p-адреноблокаторы (угроза тяжелого брон-
хоспазма).
Ингаляционный путь поступления инсектных аллергенов вызывает
развитие аллергических заболеваний органов дыхания, контактный — раз-
витие аллергического контактного дерматита, экземы, контактной крапив-
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 503
ницы. В частности, аллергены тараканов являются причиной обострения
аллергической БА, круглогодичного ринита, контактного аллергического
дерматита, крапивницы и т.д. Клинические проявления инсектной аллергии
к аллергенам тараканов схожи с симптомами, вызываемыми аллергена-
ми саранчи за счет перекрестного реагирования. Аллергены из тела пчел
вызывают развитие профессиональной аллергии у пчеловодов (риноконъ-
юнктивальный синдром, бронхоспазм). Аллергены жуков, гусениц тутового
шелкопряда обусловливают возникновение профессиональной аллергии у
работников складов, зернохранилищ, ткацкого производства.
Папулезная крапивница («острое пруриго») как реакция на укусы
антроподов при инсектной аллергии. Этот вид крапивницы чаще выявляют
у детей в возрасте 1,5-7 лет. Новорожденные и грудные дети редко страдают
этим заболеванием, а пик заболеваемости приходится на предпубертатный
период. Это заболевание особенно характерно для стран Востока и Африки.
Чаще папулезная крапивница возникает летом. В патогенезе основную роль
играют иммунологически опосредованные реакции замедленного типа на
слюну кусающих насекомых, в основном блох, собак и кошек. Блохи живут
в коврах, поэтому следы их укусов можно обнаружить на нижних конечно-
стях; однако если животные лежат на кроватях и креслах, то укусы бывают
и на туловище. Реже папулезная крапивница вызвана укусами москитов,
вшей, клопов, клещей птиц или кузнечиков. Клинически папулезная кра-
пивница проявляется сильно зудящими папулами, возникающими в тече-
ние нескольких часов после укусов. В редких случаях поражается лицо. У
высокосенсибилизированных индивидуумов папулезная крапивница может
проявляться огромными буллами или везикулами на конечностях. По виду
папулезная крапивница очень отличается от так называемой обычной кра-
пивницы. Папулы имеют диаметр 5-10 мм, возникают в основном ночью; в
центре папулы можно обнаружить след укуса. Часто зуд выражен настоль-
ко, что возникают экскориации в местах высыпаний и присоединяется вто-
ричная инфекция (р-гемолитические стрептококки группы А, золотистые
стафилококки). Инфицирование кожи стрептококками может обусловить
риск развития гломерулонефрита. Экскориации и вторичное инфици-
рование становится причиной гиперпигментации и шрамов на коже. По
течению папулезная крапивница может иметь персистирующий характер и
сохраняться в течение недель и месяцев. Диагноз папулезной крапивницы
устанавливают на основании клинической картины, и прежде всего появ-
ления зудящих групповых или расположенных линейно папул вокруг края
одежды. Кожные тесты с гомогенизированными артроподами могут вос-
произвести уртикарные папулы через 4-24 ч. В крайне редких случаях при
гистологических исследованиях обнаруживают спонгиотические везикулы
в эпидермисе и воспалительную инфильтрацию лимфоцитами и эозинофи-
лами в дерме, в основном вокруг сосудов.
ГЛАВА 12
504 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Рис. 12-19. Папулезная крапивница (укусы блох). Ребенок 6 лет.
Дифференцировать папулезную крапивницу следует от пигментной кра-
пивницы, чесотки, ветряной оспы, контагиозного моллюска, АКД, зудящих
экскориаций при ВИЧ-инфекции.
Диагностика
Анамнез
При диагностике инсектной аллергии прежде всего обращают внимание
на указание в анамнезе на укусы насекомыми и последующее развитие реак-
ций. При сборе анамнеза необходимо выяснить:
• взаимосвязь возникновения симптомов с укусами, ужалениями, вды-
ханием инсектных аллергенов или другими контактами с насекомыми
и/или продуктами их жизнедеятельности:
• количество ужалений или укусов и их локализацию;
• время, прошедшее от контакта с насекомым до появления первых кли-
нических симптомов;
• характер клинических проявлений и степень их выраженности;
• объем оказанной первой помощи и ее эффективность;
• наличие в анамнезе больного инсектной и других видов аллергии.
Кожные тесты
Для выявления аллергии к яду жалящих насекомых применяют внутри-
кожные пробы с использованием коммерческих препаратов яда насекомых
в концентрации 0,001-1,0 мг/мл. Накожные тесты можно использовать
изначально у пациентов с очень тяжелыми клиническими реакциями (кон-
центрация аллергена — 0,01 мг/мл). Положительные результаты кожных
тестов выявляют у подавляющего большинства пациентов с убедительным
анамнезом. В то же время через несколько суток или недель после укуса у
некоторых пациентов кожные тесты остаются отрицательными, отражая так
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 505
называемый рефрактерный период или период «анергии». У таких пациен-
тов кожные тесты следует повторить через 4-6 нед. Ложноотрицательные
кожные тесты у пациентов с положительным анамнезом могут возникнуть
также в следующих случаях:
• при низкой чувствительности пациентов, имевших реакции на укусы в
отдаленное время;
• в случае анафилаксии He-IgE-опосредованного типа;
• при системных реакциях на укусы у больных с субклинической формой
мастоцитоза.
Возможно развитие ложноположительных реакций, связанных с нали-
чием минимальных концентраций неаллергических ингредиентов (не выше
1 мг/мл) в коммерческих препаратах.
Чувствительность кожных тестов можно повысить, используя реком-
бинантные аллергены. Почти все пациенты с инсектной аллергией имеют
перекрестную чувствительность к ядам других видов жалящих насекомых.
Следует отметить, что степень кожной чувствительности не коррелирует
с выраженностью клинических реакций на укусы. Часто у пациентов с
сильной локальной реакцией на укусы незначителен риск развития ана-
филаксии, и, наоборот, у пациентов с системными реакциями имеют место
слабовыраженные кожные тесты.
Тесты in vitro
Выявление аллергенспецифичных IgE-антител — высокоинформатив-
ный метод, коррелирующий с результатами кожного тестирования. Однако
у 20% людей с положительными кожными тестами специфичные IgE-
антитела выявить не удается, с другой стороны, у 10% лиц с наличием
IgE-антител кожные тесты остаются отрицательными. Клинически важное
значение имеет определение IgE-антител при отрицательных кожных
тестах, так как это может указывать на риск развития системных реакций
на укусы.
Специфическое аллергологическое обследование (рлс^-тесты, вну-
трикожные и аппликационные пробы) должен проводить только врач
аллерголог-иммунолог в специализированном медицинском учреждении. У
больных с аллергией на жалящих насекомых выбор аллергена для проведе-
ния кожных проб зависит от пути его поступления в организм. При парен-
теральном пути поступления используют аллергены яда насекомых, при
ингаляционном — фрагментов их тел. В России для диагностики аллергии
на укусы нежалящих насекомых разрешен только аллерген комаров вида
Aedes aegypti. Кожные пробы проводят не раньше чем через 2-3 нед после
купирования системной реакции. Оценивают результат кожных проб через
20 мин, 6, 24 и 48 ч. При наличии выраженных системных реакций (АШ)
на укус или ужаление насекомых проводят диагностику in vitro, используя
иммуноферментный твердофазный тест. На сегодняшний день в России
методы диагностики in vitro позволяют выявлять инсектную аллергию к
ГЛАВА 12
ЧАСТЬ 2
506 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
аллергенам комаров, тараканов, мошек, шершней, пчел, ос. Прогнозируя
степень тяжести системных реакций на ужаление насекомых, можно
использовать определение уровня триптазы в сыворотке крови больных.
Инсектную аллергию на ужаление насекомых необходимо дифферен-
цировать от токсической и ложноаллергической реакции. Системная
токсическая реакция возникает при ужалении одновременно большим
количеством насекомых. При ужалении несколькими десятками насекомых
развиваются нейровегетативные симптомы (головокружение, тошнота,
рвота, понос, сердцебиение, тревога). После одновременного ужаления
несколькими сотнями насекомых может развиться гемолиз эритроцитов,
острый некроз скелетных мышц, острая почечная недостаточность и, как
следствие, летальный исход.
Системная ложноаллергическая реакция наиболее характерна для лиц с
мастоцитозом, поскольку у них имеется большое скопление тучных клеток
в коже и внутренних органах, а это способствует развитию выраженной
гистаминолиберации.
Диагностика местных проявлений аллергических и токсических реакций
обычно вызывает затруднения из-за схожести симптомов. Местная токси-
ческая реакция на укусы насекомых часто возникает у пациентов с аутоим-
мунными и онкологическими заболеваниями. Решающие критерии диа-
гностики — результаты специфического аллергологического обследования.
Местную аллергическую реакцию на укусы насекомых порой приходится
дифференцировать от инфекционных заболеваний, в частности от рожисто-
го воспаления, для которого, в отличие от инсектной аллергии, характерно
повышение температуры и увеличение регионарных лимфатических узлов.
Лечение
Принципы лечения инсектной аллергии обусловлены этиопатогенезом
и периодом заболевания, а также клиническими проявлениями и степенью
тяжести инсектной аллергии.
Лечение острых реакций
При лечении сильных локальных реакций, особенно с вовлечением голо-
вы и шеи, используют короткие курсы глюкокортикоидов (начальная доза
40-60 мг преднизолона, снижаемая в течение 5 сут). Наилучших результа-
тов достигают, если начинают вводить эти препараты в первые часы после
укуса. Если обширные локальные реакции возникли через 24-48 ч после
укусов, назначают суточную дозу глюкокортикоидов 30-40 мг, снижаю-
щуюся в течение 4 сут. Системные реакции требуют активных терапевтиче-
ских действий и мониторирования состояния: внутримышечные инъекции
(раннее либо немедленно после укуса введение) эпинефрина по 0,3-0,5 мл
0,1% раствора взрослым и по 0,01 мг/кг детям. Пациенты, получающие
p-адреноблокаторы, могут быть резистентными к эпинефрину. В таких
случаях первоначально следует вводить глюкагон. В некоторых случаях
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 507
развитие анафилаксии возможно через 6-24 ч после укуса, что требует
наблюдения за пациентом.
Лечение системных IgE-опосредованных реакций на ужаление перепон-
чатокрылыми включает элиминацию аллергена, АСИТ и фармакотерапию.
Элиминация аллергена. Чтобы предупредить поступление яда в кровь,
необходимо немедленно:
• удалить жало скользящими движениями ногтя, ножа или других твер-
дых предметов;
• положить на место ужаления холодный предмет;
• наложить жгут выше места ужаления.
Фармакотерапия. Острые системные проявления инсектной аллергии
служат показанием к немедленной госпитализации пациента в стационар.
Лечение местных проявлений инсектной аллергии (отек в месте ужа-
ления, гиперемия, зуд) включает применение блокаторов Hj-рецепторов
гистамина, мазей, содержащих глюкокортикоиды. В случае присоединения
регионарного лимфаденита или ужаления в область шеи, головы глюкокор-
тикоиды вводят системно. Буллезные высыпания вскрывают и обрабатыва-
ют раствором калия перманганата.
Аллергенспецифическая иммунотерапия
Метод выбора при лечении системных проявлений инсектной аллергии
на ужаления и укусы насекомых — АСИТ. Это патогенетический метод
лечения, клиническая эффективность которого при введении аллергенов
яда ос составляет 90%, яда пчел — 75-89%.
Абсолютным показанием к проведению АСИТ с инсектными аллерге-
нами является наличие в анамнезе у пациента:
• хотя бы одного эпизода тяжелой системной реакции (в том числе АШ)
на ужаления и/или укусы насекомыми;
• IgE-опосредованной инсектной аллергии (высокий уровень аллерген-
специфичных IgE-антител в сыворотке крови и/или положительные
результаты кожных тестов с причинно-значимыми аллергенами).
К относительным показаниям относят наличие доказанной IgE-
опосредованной инсектной аллергии у больных:
• с системными реакциями любой степени тяжести при условии высоко-
го риска повторных ужалений и/или укусов насекомых;
• с тяжелыми системными реакциями и значительной вероятностью
повторных ужалений и/или укусов насекомых (даже если пациент
младше 5 лет);
• со страхом перед насекомыми, приводящим к невротизации;
• с системными реакциями любой степени тяжести на яд пчел, если про-
фессия пациентов связана с пчеловодством;
• пожилого возраста с системными реакциями любой степени тяжести
на инсектные аллергены, имеющих сопутствующие заболевания крове-
носной системы, получающих НПВС или р-адреноблокаторы.
ГЛАВА 12
ЧАСТЬ 2
508 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Противопоказания к проведению АСИТ те же, что и к аллерговакци-
нации другими аллергенами. Аллерголечение не проводят больным с мест-
ными клиническими проявлениями инсектной аллергии и необычными
реакциями на яд насекомых.
Особенности проведения АСИТ:
• все аллергены ядов перепончатокрылых, за исключением ос, вводятся
раздельно;
• на первых этапах лечения аллерговакцины вводят с периодичностью
один раз в 14 сут;
• поддерживающую дозу аллерговакцин вводят один раз в 6-12 мес;
• рекомендуемая доза белка яда, достигаемая в процессе АСИТ, —
100 мг/мл, что соответствует дозе яда при ужалении одновременно
двумя пчелами или 2-3 осами;
• у пчеловодов достигаемая суммарная доза белка яда — 200 мг/мл;
• курс лечения составляет 5-10 лет.
АСИТ считают эффективной, если после провокационного ужаления
насекомого отсутствуют системные проявления инсектной аллергии, сни-
жается кожная чувствительность к аллергену (по результатам кожных
проб), снижается уровень специфических IgE-антител в сыворотке крови
или они не определяются совсем.
Профилактика
Для профилактики укусов и ужалений насекомых больным с инсектной
аллергией рекомендуют соблюдать следующие правила:
• не появляться на пасеках, в местах торговли фруктами, цветами;
• не использовать пахнущую косметику;
• не носить одежду ярких и темных расцветок;
• использовать химические средства защиты от насекомых;
• носить одежду, максимально закрывающую тело;
• применять противомоскитные сетки;
• ограничить пребывание вблизи водоемов, болот, в лесу, поле;
• соблюдать гигиену тела и жилища.
Больные обязаны иметь при себе:
• набор лекарственных средств для оказания неотложной помощи;
• паспорт аллергологического больного с указанием возможных кли-
нических симптомов при ужалении насекомыми и мер неотложного
лечения.
Умение оказать первую самопомощь при развитии местных и системных
реакций уменьшает риск летальных исходов при развитии АШ.
Вопросы для самоконтроля
• Что такое инсектная аллергия?
• Каковы источники инсектных аллергенов?
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 509
• Распространенность инсектной аллергии у пациентов разных возра-
стов.
• Какие принципы лежат в основе классификации инсектной аллергии?
• Опишите клинические проявления инсектной аллергии в зависимости
от способа поступления инсектных аллергенов в организм.
• Какие местные аллергические реакции могут возникать в ответ на
укусы кровососущих насекомых?
• Охарактеризуйте системные аллергические реакции на ужаления и
укусы насекомыми в зависимости от степени тяжести.
• Какие необычные системные реакции на яд перепончатокрылых насе-
комых вам известны?
• Перечислите основные методы диагностики инсектной аллергии in vivo
и in vitro.
• Назовите методы неотложной терапии при инсектной аллергии.
• Какова эффективность АСИТ у больных с инсекиной аллергией?
• Назовите меры профилактики инсектной аллергии.
ГЛАВА 12
12.9. ЛАТЕКСНАЯ АЛЛЕРГИЯ
Латекс — природный каучук, получаемый путем обработки раститель-
ного сырья (сока) деревьев Hevea brasiliensis. В условиях промышленного
производства около 90% сырья получают путем кислотной коагуляции
при pH 4,5-4,8. Следует различать продукты из натурального латекса и
синтетические изделия. Синтетические резиновые изделия не представля-
ют опасности для пациентов с повышенной чувствительностью к латексу.
Основные аллергены латекса — белки, которые могут контактировать с
кожей при надевании перчаток или попадать через дыхательные пути.
Следует иметь в виду, что на некоторых предприятиях, выпускающих
хирургические перчатки, используют казеин и реакция на такие изделия
может развиться у лиц с аллергией на молоко. Многие латексные белки
выступают в роли аллергенов; они выделены и очищены из природного
продукта или созданы как рекомбинантные аллергены (Hev b 1, Hev b 5,
Hev b 7 и др.). У медицинских работников чаще всего выявляют сенсибили-
зацию к Hev b 5 и Hev b 6.
Большинство исследователей отмечают перекрестные реакции у больных
с аллергией к латексу на различные фрукты и овощи («латексно-фрукто-
вый синдром»), такие, как бананы, киви, авокадо, папайя, картофель,
томаты. Так, Hev b 5 имеет гомологию с белками киви, Hev b 7 — с белками
картофеля, Hev b 6 — с авокадо и бананом. В ряде случаев в одонтологии
используют материалы, содержащие натуральные трансполиизопрены,
экстрагированные из некоторых видов деревьев. В редких случаях у паци-
ЧАСТЬ 2
510 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ентов с латексной аллергией возникают симптомы гиперчувствительности
к таким материалам.
Эпидемиология
Сведения о том, насколько распространена сенсибилизация к латексу в
общей популяции, ограничены. Так, у детей с атопией в 3% случаев выяв-
ляют положительные кожные тесты к латексу. Специфические IgE-антитела
обнаружены у 6,5% взрослых добровольцев, причем мужчины были сенси-
билизированы в два раза чаще, чем женщины. Этот показатель не связан
с возрастом или расой. У медицинских работников (особенно у атопиков)
распространена сенсибилизации к латексу (5-17%). Сравнивать результаты
разных исследований затруднительно, поскольку не всегда четко разделены
понятия сенсибилизация к латексу (позитивные кожные тесты с латек-
сом или повышение уровня латекс-специфических IgE-антител при отсут-
ствии клинических симптомов) и латексная аллергия (доказательства
латексной сенсибилизации плюс соответствующий анамнез и клинические
проявления, а также положительный тест элиминации латекса).
В конце 1980-х годов были выявлены аллергические реакции у детей и
подростков с незаращением дужек позвонков (spina bifida). Позже выяс-
нилось, что более 70% таких больных страдают латексной аллергией, что,
возможно, связано с интенсивным и постоянным воздействием резиновых
изделий из латекса.
Клиническая картина
При контакте с латексом возможны различные клинические проявле-
ния.
• Ирритантный контактный дерматит. Возникает сухость, раздраже-
ние кожи, особенно на кистях рук. Эти реакции не являются иммуно-
логическими.
• Аллергический контактный дерматит (АКД). Вызывается в боль-
шинстве случаев резиновыми изделиями (перчатки, обувь, спортивное
оборудование, медицинские приборы и аппараты). Симптомы появ-
ляются через 1-2 сут после контакта с этими продуктами. Дерматит
развивается вследствие клеточно-опосредованной реакции ГЗТ к низ-
комолекулярным и антиоксидантсодержащим компонентам резины. К
ним относят производные группы карбамата, бензотиазолов, тиурама
и др. Диагностика АКД основана на клинической картине, морфологии
кожных проявлений, специфическом patch-vecrt с химическими ком-
понентами резины.
• Контактная крапивница — наиболее частое и рано манифести-
рующее клиническое проявление аллергии на латекс. У медицинских
работников в 60-80% случаев контактная крапивница возникает на
руках. По механизму развития это IgE-опосредованная реакция на
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 511
белки латекса. Симптомы возникают через 10-15 мин после надевания
перчаток и включают покраснение кожи, зуд, уртикарии в зоне кон-
такта с перчатками. Симптомы иногда ошибочно расцениваются как
возникшие на мыло и другие моющие средства. У медицинских работ-
ников контактная крапивница может предшествовать развитию АКД.
• Аллергический ринит и бронхиальная астма. Контакт с мелкими
частицами латекса, находящимися в порошке перчаток, может вызвать
симптомы ринита и БА у чувствительных к латексу пациентов. Эти
реакции описаны не только у медицинских работников, но и у рабо-
чих на предприятиях, изготовляющих резиновые изделия из латекса.
У большинства сенсибилизированных к латексу пациентов выявляют
другие атопические заболевания, например сезонный АР или БА с сен-
сибилизацией к клещам домашней пыли или эпидермальным аллерге-
нам. Однако у некоторых пациентов респираторная аллергия на латекс
может быть изолированным феноменом. Индуцированная латексом
профессиональная БА служит основанием для прекращения работы на
данном производстве.
• Анафилаксия. У пациентов с сенсибилизацией к латексу симптомы
анафилаксии могут развиться внезапно: при контакте с резиновыми
катетерами, презервативами, во время внутриабдоминальных опера-
ций, родов, стоматологических вмешательств. Триггером анафилаксии
могут служить надувные резиновые игрушки, теннисные ракетки с
резиновыми покрытиями. Фатальная латексная анафилаксия может
быть индуцирована также ректальными резиновыми надувными или
уретральными катетерами.
Диагностика
Кожное тестирование. Кожные тесты с натуральным латексом прово-
дятся только в странах, где есть коммерческие диагностические препараты.
Использовать нестандартизированные экстракты конечных производств
резины в этих целях запрещено.
Определение латекс-специфических IgE-антител in vitro.
Определение специфических IgE-антител проводят методом ИФА. Однако
лишь у 50-90% лиц с положительными кожными тестами выявляют
латекс-специфические IgE-антитела. Предполагают, что качество диагно-
стики повысится при использовании рекомбинантных белков латекса.
Лечение
Элиминация антигенов латекса. Пациенты, чувствительные к латексу, в
том числе медицинские работники, должны и дома, и на работе использовать
предметы, не содержащие латексную резину. Такие продукты общедоступны:
например, это не содержащие латекса перчатки или презервативы. Пациент
должен предупредить стоматолога о наличии у него аллергии на латекс.
ГЛАВА 12
ЧАСТЬ 2
512 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Перекрестно реагирующие фрукты (бананы, киви, авокадо, папайя) и овощи
(картофель, томаты) следует исключить из диеты либо резко ограничить их
употребление. Реже возникают перекрестные реакции на такие фрукты, как
груша, манго, яблоко, вишня; а также овощи: сельдерей, шпинат.
Элиминация аэроаллергенов латекса. Уровень латексных аэроал-
лергенов наиболее высок в больницах, где используют перчатки и другие
изделия из латекса, причем в зависимости от назначения помещений этот
уровень может резко колебаться. Так, в операционных концентрация аэро-
аллергенов составляет 96-208 нг/м3, в кабинете ортодонта — до 100 нг/м3,
в центре забора донорской крови — в среднем 38 нг/м3, в гематологической
лаборатории — 14 нг/м3, в палате для аллергобольных — 1,8 нг/м3, в отде-
лении трансплантации костного мозга — 0,6 нг/м3.
Актуально создание палат и клиник, свободных от латекса и безопасных
для чувствительных к нему пациентов («Latex-Safe»), В план предопераци-
онной подготовки пациентов с сенсибилизацией к латексу некоторые авто-
ры рекомендуют с профилактической целью включать глюкокортикоиды
или одновременное введение блокаторов и Н2-рецепторов гистамина.
АСИТ при латексной аллергии проводят, используя стандартизирован-
ные препараты латекса. Это эффективный и сравнительно безопасный
метод иммунотерапии IgE-зависимых форм заболевания. АСИТ проводят
парентеральным или сублингвальным методом. Показано, что выражен-
ность назальных, конъюнктивальных и кожных симптомов уменьшается,
тогда как проявления БА не всегда сглаживаются. У некоторых больных в
ответ на инъекции латексных аллергенов возникают системные реакции.
В зависимости от тяжести латексной аллергии лечение проводят так
же, как при других формах аллергии. При АШ используют общепринятые
методы лечения.
Аллергия к латексу у медицинских работников — важная причина про-
фессиональной аллергии. Меры, предпринимаемые в последнее время,
позволили снизить латексную нагрузку на рабочем месте; образовательная
программа и соблюдение диеты позволяют минимизировать риск клини-
ческих проявлений у чувствительных пациентов. Пациентам, страдающим
латексной аллергией, рекомендуют носить браслеты, оповещающие меди-
цинский персонал о сенсибилизации к латексу.
12.10. АЛЛЕРГИЧЕСКИЙ КОНТАКТНЫЙ ДЕРМАТИТ
В 1895 г. Ядассон (Jadasohn) описал первый случай контактного дерма-
тита, обусловленного ртутью. Вскоре после этого были выделены два вида
контактных дерматитов:
• возникающий в результате действия химического ирританта;
• развивающийся при контактной сенсибилизации.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 513
Соответственно их стали обозначать как ирритантный (простой) кон-
тактный дерматит и аллергический контактный дерматит (АКД).
В основе АКД лежат иммунологические механизмы ГЗТ. Реакция кон-
тактной гиперчувствительности состоит из двух фаз: сенсибилизации и
проявления. Когда жирорастворимое низкомолекулярное (гаптен) хими-
ческое вещество впервые проникает в кожу и ковалентно связывается с
белками-носителями организма хозяина, формируется комплекс гаптен-
носитель или иммуноген (антиген). Антиген захватывается ДК (клетки
Лангерганса) в месте проникновения через эпидермис. Затем происходит
обработка антигена и связывание отдельных пептидов с молекулами
МНС-П. Образовавшийся комплекс транспортируется на поверхность кле-
ток Лангерганса. Одновременно эти клетки усиливают экспрессию молекул
клеточной адгезии (САМ — англ, cellular adhesion molecule), что важно для
индукции их перемещения в зону реагирования. Антигенпрезентирующие
клетки Лангерганса мигрируют из кожи через эфферентные лимфатиче-
ские сосуды в региональные лимфатические узлы. В течение 24 ч после
аппликации гаптена клетки Лангерганса презентируют его наивным
CD4+ Т-лимфоцитам; в паракортикальной зоне лимфатического узла про-
исходит клональная пролиферация специфических Т-лимфоцитов, затем
Т-клетки-эффекторы и Т-клетки памяти выходят в циркуляцию. Эта фаза
называется сенсибилизацией.
Фаза проявления развивается при повторном попадании в организм того
же гаптена, вновь образующего комплекс гаптен-носитель. При этом клет-
ки Лангерганса презентируют антиген в эпидермисе, дерме и регионарных
лимфатических узлах специфическим Т-эффекторам и Т-клеткам памяти,
которые активируются и подвергаются бласттрансформации и клональ-
ной пролиферации. Активированные и резидентные клетки продуцируют
спектр цитокинов, преимущественно Thl-типа, запускающих воспалитель-
ный процесс в зоне контакта с аллергеном. Воспалительная реакция разви-
вается в течение 48 ч после повторного контакта с аллергеном.
Накожная аппликация гаптена активирует in vivo клетки Лангерганса
и кератиноциты. Активированные кератиноциты продуцируют ИЛ-1а,
ИЛ-1₽, ИЛ-3, ИЛ-6-ИЛ-8, ИЛ-12, Г-КСФ, М-КСФ, ГМ-КСФ и др.
Образование цитокинов кератиноцитами — один из ключевых факторов
местной реакции. Среди субпопуляций CD4+ Т-клеток в зоне воспаления
преобладают Thl-лимфоциты с высокой способностью к выработке цито-
кинов (ИФН-у, ФНО-а, ИЛ-2 и др.). В воспалительный процесс активно
вовлекаются моноцитарно-макрофагальные клетки, добавляющие провос-
палительные цитокины в общий пул медиаторов воспаления. Формируется
своеобразный локальный цитокиновый штурм, приводящий к манифеста-
ции типичных кожных проявлений. В этих условиях происходит торможе-
ние активности регуляторных Т-клеток — продуцентов противовоспали-
тельных цитокинов (ИЛ-10, ТФР-Р).
ГЛАВА 12
ЧАСТЬ 2
514 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Простой контактный дерматит возникает при непосредственном кон-
такте с химическими веществами. В его патогенезе отсутствуют признаки
аллергического характера.
Клиническая картина
АКД возникает в ответ на местное воздействие аллергенов, содержа-
щихся в различных химических соединениях (лекарственные средства, кос-
метика, латекс, металлы и их соли, некоторые растения — дуб, первоцвет
и т.д.). АКД составляет около 20% всех случаев контактных дерматитов.
Простой контактный дерматит возникает значительно чаще, особенно у
женщин, занимающихся уборкой помещений и использующих различные
чистящие средства, мыла, детергенты.
Предрасполагающий фактор контактного дерматита — нарушение кож-
ного барьера, причем ирритантный дерматит может возникнуть и у боль-
ных с атопическим дерматитом, у которых снижена барьерная функция
кожи. Предрасполагающие факторы АКД:
• генетические факторы;
• возраст — заболевание не характерно для грудных детей и детей моло-
же 8 лет;
• наличие других хронических дерматозов (например, псориаза, ихтио-
за), что может нарушать барьерную функцию кожи и облегчать
абсорбцию аллергенов.
Клинические симптомы АКД возникают через 6-96 ч после повтор-
ного контакта с аллергеном. Если возникает аллергия на изделия, которые
человек носит постоянно (часы, браслеты, крючки и т.д.), симптомати-
ка дерматита развивается через 10-14 сут после первичного контакта с
причинно-значимым аллергеном.
Клинически на месте контакта возникают гиперемия, отек, высыпания
в виде везикул, наполненных жидкостью (от мелких до крупных). Иногда
пузырьки сливаются, лопаются, образуя обширные мокнущие участки. В
тяжелых случаях поражение кожи выходит за пределы участка непосред-
ственного контакта с аллергеном, так как сенсибилизированные лимфоци-
ты мигрируют в другие зоны.
Тяжесть АКД зависит от концентрации воздействующего на кожу веще-
ства, от площади контакта с аллергеном, характера воздействия (мази,
повязки, компрессы и т.д.), а также от предварительного состояния кожи в
зоне воздействия (ранее поврежденная или здоровая кожа).
Следует отметить, что клинические проявления АКД и ирритантного
контактного дерматита схожи. В острой фазе АКД возникают эритема, отек,
везикулы в зоне воздействия этиологического агента. В этой фазе может
быть выражен интенсивный зуд. В течение нескольких дней везикулы лопа-
ются, происходит экссудация, отслоение эпидермиса, появляются корочки.
При хроническом течении процесса отслоение выражено, в зоне поражения
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 515
Рис. 12-20. Аллергический контактный дерматит (местное применение 5% крема кето-
нал). Пациентка 54 лет.
ГЛАВА 12
Рис. 12-21. Аллергический контактный дерматит (на месте компресса с настоем трав).
Пациентка 39 лет.
ЧАСТЬ 2
516 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
кожа обычно утолщена; возможно появление глубоких трещин, особенно
на ладонях или подошвах; нарушается пигментация. Почти в 50% случаев
АКД в процесс вовлекаются руки, так как контакт с экзогенными аллергена-
ми чаще происходит в этой зоне, особенно в тех местах, где кожа истончена,
что способствует абсорбции аллергена.
АКД с поражением рук развивается под влиянием многочисленных
сенсибилизирующих агентов, включая никель и другие металлы, хромат,
этилендиамин, фенилдиамин, латекс, пищевые аллергены, мыла, детерген-
ты и многие другие. Другие, часто поражаемые при АКД зоны — лицо и
шея. Наиболее распространенные этиологические агенты при этом — раз-
нообразные косметические средства, содержащие консерванты, красители
и другие компоненты.
Диагностика
Диагностический алгоритм АКД включает:
• оценку клинической симптоматики;
• наличие периода сенсибилизации;
• отягощенный аллергоанамнез больного;
• методы диагностики in vivo. Для диагностики АКД in vivo используют
тест-системы, рассчитанные на выявление реакции ГЗТ. Данное иссле-
дование противопоказано во время острой фазы заболевания. При
проведении аппликационного теста (pafcA-теста) возможны ложнопо-
ложительные и ложноотрицательные результаты.
А) Ложноположительный ответ возникает, если кожа больного сверх-
чувствительна, или это реакция на лейкопластырь, которым при-
клеивали тест-полоску.
Б) Ложноотрицательный результат возможен при:
- технических нарушениях,
- очень позднем учете результатов,
- использовании теста, не соответствующего анамнезу больного,
- использовании очень низких концентраций аллергена в тест-
системе.
Дифференциальная диагностика
Аллергический контактный дерматит дифференцируют с простым (ирри-
тантным) контактным дерматитом, атопическим дерматитом, нумулярной
экземой, микозами кожи, кожной формой Т-клеточной лимфомы, парапсо-
риазом, СКВ, розацеа.
Клинически дифференцировать проявления АКД и простого ирри-
тантного дерматита довольно сложно. Аллергические реакции вызы-
вают более сильный зуд, длятся дольше и в типичных случаях выходят
за пределы зоны контакта с аллергеном. При ирритантном контактном
дерматите у больных чаще возникает чувство жжения на месте контакта,
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 517
реакция четко ограничена зоной воспаления и быстро исчезает после уда-
ления ирританта.
Данные анамнеза, указывающие на связь симптомов дерматита с мест-
ным использованием причинно-значимого аллергена, позволяют диффе-
ренцировать АКД с другими формами поражений кожи.
Лечение
• Элиминация причинно-значимого аллергена.
• Применение топических глюкокортикоидов на места поражения (в
зависимости от характера клинических проявлений — лосьоны, мази,
кремы).
• При тяжелых формах заболевания, сопровождающихся системными
кожными проявлениями, — парентеральное введение глюкокортикои-
дов.
• В случаях присоединения вторичной инфекции усиление местной
терапии за счет подключения комбинированных препаратов глюко-
кортикоидов в сочетании с антибиотиками или противогрибковыми
средствами.
• При возникновении у больного кожного зуда следует дополнительно к
местной терапии назначить антигистаминные препараты.
12.11. КРАПИВНИЦА
Крапивницу относят к заболеваниям, известным со времен Гйппократа
(IV в. до н.э.). В 1769 г. впервые Куллен (Cullen) предложил термин «urtica»
(лат. — волдырь).
Определение
Крапивница — этиологически гетерогенное заболевание или синдром,
основным проявлением которого является волдырь.
Поскольку крапивница — полиэтиологическое заболевание, возникают
определенные трудности при ее классификации. До настоящего времени
единой общепризнанной классификации не существует, однако разработа-
ны международные рекомендации, и на их основе в 2007 г. была создана
российская классификация, в основе которой лежит этиологический прин-
цип (Российский национальный согласительный документ «Крапивница и
ангиоотек: рекомендации для практических врачей») (табл. 12-23).
Крапивницу по течению разделяют на острую (до 6 нед) и хроническую
(дольше 6 нед). По степени тяжести разделять крапивницы не принято,
однако с научно-практической точки зрения целесообразно оценивать
тяжесть течения этого заболевания, для чего рекомендуют использовать
балльную систему (табл. 12-24).
ГЛАВА 12
518 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-23. Классификация крапивницы
Группа Подгруппа Пояснение
Иммунологическая крапивница Аллергическая крапив- ница IgE-зависимые реакции гиперчувствительности
Аутоиммунная крапив- ница Аутоантитела к FceRI или к IgE
Уртикарный васкулит Иммунные комплексы
Комплемент-зависимая крапивница Дефицит С1-ингибитора
Физическая крапивница (воспроизводится под действием физических стимулов — механи- ческих, температурных и др.) Механическая Дермографическая кра- пивница Кратковременное механи- ческое воздействие
Замедленная крапивница от давления Длительное местное воз- действие давления
Вибрационная крапив- ница Воздействие вибрации
Температурная Тепловая контактная кра- пивница Воздействие тепла
Холодовая крапивница Воздействие холода
Солнечная крапивница Ультрафиолетовое облучение
Под действием иных факторов Анафилаксия/крапивница, вызванная физическим усилием Физическое напряжение
Особые формы крапивницы Аквагенная крапивница Контакт с водой
Контактная крапивница Контакт с ирритантами и т.д.
Холинергическая кра- пивница Физические упражнения, стресс, перегревание ит.д.
Адренергическая кра- пивница Физические нагрузки, стресс и т.д.
Крапивница, вызванная не-1дЕ-опосредованной дегрануляцией тучных клеток Прямое активирующее действие агентов на тучные клетки, напри- мер, опиатов, пищевых добавок
Медикаментозная кра- пивница с механизмами развития, отличными от описанных выше Прием нестероидных противовоспалительных препаратов, ингибиторов ангиотензинпревращаю- щего фермента и др.
Идиопатическая крапивница - Причинный фактор не установлен
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 519
ГЛАВА 12
Таблица 12-24. Оценка степени тяжести крапивницы в баллах
Балл Волдыри Зуд
0 Отсутствуют Отсутствует
1 <20 волдырей за 24 ч Легкий
2 20-50 волдырей за 24 ч Умеренный
3 >50 волдырей за 24 ч или немногочислен- ные гигантские уртикарии Выраженный
Сумма баллов Степень тяжести крапивницы
0-2 Легкая
3-4 Средней тяжести
5-6 Тяжелая
Хроническую крапивницу у взрослых выявляют чаще, чем у детей, при-
чем у женщин в 2 раза чаще. Хроническую крапивницу можно разделить
на идиопатическую и крапивницу с идентифицированной причиной забо-
левания. В большинстве случаев физические и особые формы крапивницы
носят хронический характер.
Патогенез
Механизмы развития крапивницы различны, но центральным звеном
патофизиологического процесса при любых видах этого заболевания явля-
ется активация и дегрануляция тучных клеток с выделением медиаторов,
причем эти процессы могут быть индуцированы иммунологическими
механизмами либо проходить без их участия (при неаллергических кра-
пивницах).
Под действием гистамина, простагландина D2, лейкотриенов (D4, С4,
Е4), брадикинина, триптазы, фактора активации тромбоцитов, нейропепти-
дов в коже происходит вазодилатация, повышается проницаемость сосудов,
активируются сенсорные нервные окончания и, как результат, у пациента
возникают гиперемия, волдырь, кожный зуд.
Аллергическая крапивница чаще развивается по IgE-опосредованному
типу у пациентов с пищевой, лекарственной, инсектной аллергией. Редко
выявляют крапивницу при гемотрансфузиях (цитотоксический тип) либо
при сывороточной болезни (иммунокомплексный тип).
Неаллергические виды крапивницы возникают довольно часто и обуслов-
лены различными механизмами, в том числе «гистаминовым», избыточным
выделением ацетилхолина, нарушением метаболизма арахидоновой кисло-
ты, накоплением брадикинина, активацией системы комплемента и т.д.
При «гистаминовом» механизме у больных повышается концентрация
гистамина при снижении скорости его инактивации:
• за счет дегрануляции тучных клеток и базофилов в результате прямого
воздействия на них лекарственных средств, при сдавливании, воздей-
ствии холода и т.п.;
520
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• вследствие уменьшения активности диаминоксидазы, участвующей
в разрушении гистамина в организме (при заболеваниях печени, под
действием лекарственных средств типа ацетилцистеина, амброксола,
верапамила, клавулановой кислоты и др.);
• при поступлении избыточного количества гистамина с пищей (рыба,
сыр, копчености, вино, пиво, шоколад, орехи, томаты, шпинат, авока-
до, баклажаны);
• при увеличении синтеза гистамина у больных с дисбактериозом.
Избыточное выделение ацетилхолина происходит у больных при физи-
ческих и эмоциональных нагрузках, под действием высоких температур,
воды. Нарушение метаболизма арахидоновой кислоты и, как следствие,
образование избыточного количества лейкотриенов С4, D4, Е4 обусловле-
но чаще всего приемом НПВС. Накопление брадикинина происходит при
приеме ингибиторов ангиотензинпревращающего фермента, при этом у
больных возникают изолированные ангиоотеки.
Помимо этого, крапивница неаллергического генеза может возникать у
больных с непереносимостью салицилатов (помидоры, огурцы, картофель,
перец, яблоки, виноград, абрикосы, персики, сливы, цитрусовые, черно-
слив, земляника; безалкогольные напитки, консервы, сыр, маргарин, гор-
чица) и тартразина (сосиски, колбаса, масло, сыр, ветчина, кондитерские
изделия, безалкогольные напитки).
В качестве триггерных факторов при крапивнице выделяют инфекцион-
ные заболевания: вирусные (вирусы гепатитов А, В и С; вирус Эпштейна-
Барр, ЦМВ и др.), бактериальные (Helicobacterpylori, Escherichia coli, стреп-
тококки, микоплазмы и др.), грибковые, гельминтозы, лямблиоз.
У больных с крапивницей выявляют очаги инфекции ЛОР-органов
(синусит, отит, тонзиллит), пищеварительного тракта (хронический холе-
цистит, гастрит), урогенитального тракта (пиелонефрит, аднексит, проста-
тит). Нередко выявляют дисбактериоз кишечника.
Клиническая картина
Основной симптом крапивницы — волдырь, представляющий собой
отек сосочкового слоя кожи и возникающий вследствие повышенной про-
ницаемости и вазодилатации сосудов кожи с ускорением тока крови в них.
Волдыри могут быть разных размеров и формы; возникают на любом участке
кожи и сохраняются на одном и том же месте не дольше 24 ч; сопровождают-
ся гиперемией и кожным зудом; исчезают при надавливании или растяжении
кожи. После разрешения не оставляют пигментации. Крупные волдыри пре-
вращаются в кольцевидные элементы с просветлением в центре.
Более чем у 50% больных крапивница сопровождается ангиооте-
ком глубоких слоев кожи, подкожной клетчатки, подслизистого слоя.
Преимущественная локализация ангиоотеков — участки тела с рыхлой
подкожной соединительной тканью, склонные к накоплению тканевой
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 521
Рис. 12-22. Лекарственная аллергия на амоксициллин. Острая крапивница. Пациентка
19 лет.
ГЛАВА 12
Рис. 12-23. Лекарственная аллергия на амоксиклав. Острая крапивница. Ребенок 1 г.
4 мес.
522 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
жидкости: губы, щеки, веки, кисти, стопы, гениталии, ушные раковины.
Цвет кожи над отеком не изменяется, при надавливании следов не остается,
сопровождается в некоторых случаях чувством распирания или болезнен-
ности, отек чаще асимметричен, иногда сопровождается незначительным
зудом. Ангиоотеки разрешаются в течение 2-3 сут.
При хронических крапивницах высыпания могут иметь суточный
ритм и усиливаться в вечернее и ночное время в связи с суточными колеба-
ниями секреции гистамина. Высыпания могут различаться по виду в зави-
симости от этиологического фактора.
Хроническая идиопатическая крапивница
К этой категории относят крапивницу, причина которой остается невы-
ясненной.
При дермографической крапивнице возникают зуд и уртикарные эле-
менты сыпи по ходу расчесов: воспроизводится при штриховом раздраже-
нии кожи тупым предметом.
Клинически выделяют несколько форм дермографической крапивницы:
красный, белый, фолликулярный дермографизм, дермографическая холо-
довая крапивница. Кроме того, дермографическую крапивницу разделяют
по формам:
• первичная:
о «аллергическая» (например, на шерсть овцы и т.п.);
< идиопатическая;
Рис. 12-24. Дермографическая крапивница, идиопатическая. Пациент 23 лет.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 523
• вторичная на фоне заболеваний (например, мастоцитоза, сывороточ-
ной болезни и др.).
Дермографическая крапивница может возникать на любом участке тела,
реже на лице.
Холодовая крапивница
Первое упоминание о холодовой крапивнице относится к концу XIX в.
Описание шокоподобного состояния у пациента после купания в холодной
воде было сделано в 1936 г. В последующие годы изучались особенности
течения и механизмов развития холодовой крапивницы, а также подходы к
лечению этого заболевания. Были выявлены формы с наследственной пере-
дачей и приобретенные варианты холодовой крапивницы.
В настоящее время холодовую крапивницу относят к физическим кра-
пивницам наряду с дермографизмом, солнечной крапивницей, крапивни-
цей от давления. Этот тип крапивницы рассматривают как гетерогенную
группу заболеваний, возникающих либо на фоне другой патологии, либо
без видимой причины (идиопатическая форма), либо как врожденную
форму с аутосомно-доминантным типом наследования.
По данным разных авторов, частота встречаемости холодовой крапив-
ницы варьирует от 3,0-5,0% в структуре всех физических крапивниц до
5,2-33,8% у лиц, проживающих в условиях холодного климата. Однако это
не исключает возможности возникновения заболевания у пациентов в тро-
пических регионах. Холодовая крапивница возникает как у взрослых, так и
у детей всех возрастных групп. Первые клинические проявления врожден-
ной семейной холодовой крапивницы возникают у детей, возраст которых
меньше 6 мес. Приобретенные формы заболевания манифестируют в моло-
дом и зрелом возрасте, причем идиопатическая холодовая крапивница воз-
никает преимущественно в возрасте 18-30 лет (в среднем в 22 года), тогда
как вторичные формы этого заболевания, протекающие на фоне других
патологий, чаще Встречаются в возрасте 40-49 лет и старше. Мужчины и
женщины страдают холодовой крапивницей одинаково часто.
Эпизоды крапивницы, возникающей при воздействии холода, могут
повторяться у пациентов в различные промежутки времени на протяжении
всей жизни. По данным разных авторов, продолжительность симптомов
холодовой крапивницы варьирует от нескольких недель до нескольких
десятков лет. В некоторых случаях приобретенная холодовая крапивница у
взрослых спонтанно разрешается через 5-9 лет, а у детей — через 3-4 года
после возникновения. Однако возможность развития анафилактоидного
шока после купания в водоемах у таких пациентов сохраняется в течение
всей жизни. В ряде случаев холодовая крапивница сочетается с другими
формами физических крапивниц.
Крапивница может возникать при внешнем холодовом воздействии
(вода, снег, холодный ветер, холодные предметы и т.д.) или при употре-
ГЛАВА 12
ЧАСТЬ 2
524 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
блении внутрь холодных продуктов (мороженое, напитки, вода и т.д.),
а также при внутривенном введении растворов температурой ниже 6 °C.
Крапивница и/или ангиоотек может возникнуть через несколько минут
после воздействия триггерных факторов. Авторы отводят основную роль
холодной воде как более значимому фактору по сравнению с холодным воз-
духом или контактом с холодными предметами.
В типичных случаях холодовая крапивница клинически характеризуется
появлением гиперемии, зуда, отека и волдыря (волдырей) на коже в месте
воздействия низких температур. Как правило, симптомы крапивницы, воз-
никшие на холоде, сохраняются еще в течение 20-30 мин после согревания
больного и затем бесследно исчезают. Крапивница может быть ограниче-
на зоной воздействия низких температур или носить генерализованный
характер с риском развития системных проявлений в виде поражения ЦНС
(головная боль, головокружение), кровеносной системы (тахикардия, гипо-
тония), органов дыхания (одышка, бронхоспазм), пищеварительного тракта
(тошнота, рвота, боли в животе) и др. Появление системных нарушений —
прогностически неблагоприятный признак. Примерно у 73 больных под
воздействием холода появляются симптомы ангиоотека, который может
возникнуть на участках контакта с холодом. Например, при употреблении
холодной пищи возникает отек языка и губ; отек глотки вывляют нечасто.
Отеки гортани или слизистой оболочки кишечника относятся к категории
редких проявлений заболевания. Следует отметить, что у больных могут
возникать отеки кистей рук в теплых местах при контакте с холодными
предметами. Общее охлаждение, возможное при купании пациентов в бас-
сейне или открытом водоеме, может стать причиной массивного выброса
медиаторов, вследствие чего у больных возникает гипотензия вплоть до
потери сознания и шока. Риск анафилаксии при купании довольно высок:
она развивается почти у 50% пациентов. Угрожающие жизни симптомы
могут появиться по прошествии несколько минут пребывания в воде.
Классификация холодовой крапивницы
• Приобретенная холодовая крапивница.
О Первичная или идиопатическая холодовая крапивница.
< Вторичная холодовая крапивница.
О Атипичная холодовая крапивница.
- Криохолинергическая крапивница.
- Криозависимый дермографизм.
- Холодовая рефлекторная крапивница.
- Системная холодовая крапивница.
- Локализованная холодовая крапивница.
- Холодовая эритема.
• Врожденная холодовая крапивница.
- Семейная холодовая крапивница.
- Замедленная холодовая крапивница.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 525
По тяжести и распространенности симптомов выделяют три типа холо-
довой крапивницы:
• тип 1 — локализованная крапивница и/или ангиоотек (в 30% случаев
холодовой крапивницы);
• тип 2 — генерализованная крапивница и/или ангиоотек без гипотен-
зии или респираторных симптомов (32% случаев);
• тип 3 — крапивница генерализованного характера, одновременное
появление тяжелых системных реакций с одним или несколькими
эпизодами респираторных дисстрессов или гипотензией (слабость,
дезориентация или шок).
В 90-95% случаев приобретенную холодовую крапивницу рассматрива-
ют как идиопатическую.
Вторичную холодовую крапивницу диагностируют при наличии в
сыворотке крови криоглобулинов, криоагглютининов, криофибриногена.
Она возникает на фоне различных заболеваний, в частности инфекционных
(вирусные гепатиты В и/или С, мононуклеоз, корь, ВИЧ-инфекция, вто-
ричный сифилис, болезнь Лайма, микоплазмоз, стрептококковые инфек-
ции, краснуха), неоплазий (лимфомы, множественные миеломы, макрогло-
булинемия Вальденстрема и др.), коллагенозов, болезни Рейно, васкулитов,
дефицита компонентов комплемента.
К атипичным формам холодовой крапивницы относят системную,
криохолинергическую крапивницу, криозависимый дерматографизм, лока-
лизованную, холодовую рефлекторную и холодовую эритему.
Криохолинергическая крапивница характеризуется появлением
уртикарных высыпаний при физической нагрузке и физической актив-
ности на холоде. В то же время у этих больных физические упражнения в
теплых помещениях и в теплое время года крапивницей не сопровожда-
ются. Уртикарии отличаются мелкими размерами (1-3 мм в диаметре) и
напоминают холинергическую крапивницу. Кожные тесты с кубиком льда,
метахолиновая и ацетилхолиновая пробы отрицательны.
Криозависимый дермографизм характеризуется возникновением урти-
карий вследствие травмирования кожи на холоде. Тест с кубиком льда у таких
больных отрицателен, системное охлаждение крапивницу не вызывает.
Холодовая рефлекторная крапивница характеризуется появлением
уртикарий за пределами зоны охлаждения, т.е. на периферии воздействия
холода. При этом уртикарии мелкие, такие же, как при холинергической
крапивнице. Рефлекторная холодовая крапивница может быть и генера-
лизованной, и локализованной. Особенность холодового теста у таких
больных — возникновение сыпи вокруг охлажденного участка кожи и
отсутствие ее в месте контакта с холодом.
Системная холодовая крапивница характеризуется генерализован-
ными уртикарными высыпаниями по всему телу как на открытых, так и на
закрытых участках кожи. Стандартные тесты с кубиком льда и погружением
ГЛАВА 12
ЧАСТЬ 2
526 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
в воду кистей рук у этих пациентов отрицательны. Для диагностики систем-
ной холодовой крапивницы используют тест с общим охлаждением. С этой
целью пациента помещают на некоторое время в холодное помещение при
температуре 10-12 °C и наблюдают за его состоянием и появлением симп-
томов крапивницы. При проведении подобного исследования существует
риск развития системных реакций.
Локализованная холодовая крапивница возникает в основном на
лице и шее. Кроме того, она может возникнуть на участках тела, ранее под-
вергавшихся каким-либо воздействиям, например на местах внутрикожно-
го введения аллергенов, укусов насекомых, обморожений.
Холодовая эритема возникает в месте воздействия низких температур
и сопровождается не только эритематозными поражениями кожи, но и
болезненностью в месте контакта с холодом. Проба с кубиком льда у этих
больных положительна.
Врожденная форма холодовой крапивницы, ранее известная как
семейная холодовая крапивница, была впервые описана в 1940 г. В настоя-
щее время это заболевание получило название «семейный холодовой ауто-
воспалительный синдром» (FCAS — англ. Familian Cold Autoinflammatory
Syndrome).
Заболевание наследуется по аутосомно-доминантному типу, встречает-
ся с частотой 1:1 000 000. Большинство случаев заболевания отмечено в
Северной Америке и Европе.
Первые клинические проявления заболевания в виде сыпи, представля-
ющей собой папулы и бляшки красного цвета, появляются в течение 1-2 ч
после охлаждения. Этот интервал может удлиняться до 8 ч. Помимо сыпи,
у детей повышается температура тела до субфебрильных значений и спустя
4-6 ч после возникновения сыпи присоединяются артралгии в коленных,
локтевых и лучезапястных суставах. У некоторых пациентов появляют-
ся миалгии, конъюнктивит, потливость, головная боль, жажда и рвота.
Каждый эпизод крапивницы обычно длится не меньше 12-24 ч. Развитие
жизнеугрожающих состояний для обострений не характерно. В то же время
частые рецидивы вызывают необходимость решить вопрос о проживании в
других климатических условиях.
Крапивница от давления
Возникает в результате статического давления. Выделяют две формы
заболевания: немедленную и отсроченную.
Немедленная возникает в течение нескольких минут после физического
воздействия, а отсроченная — через 3-8 ч после прекращения давления, в
том числе статического (рюкзак, тяжелые предметы и т.п.). На месте давле-
ния возникает болезненный отек, гиперемия, волдырь. Преимущественная
локализация крапивницы от давления — плечи, ладони, стопы, ягодицы.
В некоторых случаях у пациентов могут возникнуть лихорадка, слабость,
головная боль. Сохраняется крапивница чаще всего до 24 ч.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 527
Солнечная крапивница
Возникает в первые минуты после инсоляции на открытых участках
кожи и характеризуется появлением зуда, гиперемии, отека. Крапивница
может возникнуть в любом возрасте, а тяжесть ее определяется площадью
поражения кожи. Описаны случаи генерализованной крапивницы, сопро-
вождающейся системными анафилактоидными проявлениями в виде гипо-
тензии, бронхоспазма, потери сознания.
Возможно развитие фиксированной световой крапивницы, возникаю-
щей на одном и том же месте при общей инсоляции.
Крапивница может возникнуть под действием лекарственных средств
с фотосенсибилизирующей активностью (тетрациклины, фторхинолоны,
сульфаниламиды и т.д.). Выделяют две формы заболевания — идиопатиче-
скую и вторичную (при СКВ, порфирии).
Холинергическая крапивница
Возникает под действием различных факторов, стимулирующих постган-
глионарные симпатические нервы. К таким факторам относят физические
нагрузки, эмоциональный стресс, потоотделение, горячий душ. Ранее этот
вид крапивницы относили к тепловым. Наиболее часто возникает в возра-
сте 10-30 лет и может сохраняться в течение нескольких лет.
ГЛАВА 12
Рис. 12-25. Холинергическая крапивница, возникает после физической нагрузки, само-
стоятельно купируется спустя 30—40 мин. Пациент 17 лет.
ЧАСТЬ 2
528 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Клинические проявления отличают ее от других видов крапивницы тем,
что волдыри бледно-розового цвета, небольших размеров (от 1-2 мм до
5 мм), окружены зоной гиперемии до 2-4 см и сопровождаются резким
зудом. Иногда возникают сливные уртикарии. Сохраняется крапивница в
течение 20-50 мин после прекращения действия провоцирующего факто-
ра. Нередко одновременно развивается ангиоотек. Высыпания чаще носят
генерализованный характер. В редких случаях при холинергической кра-
пивнице выявляют системные проявления в виде бронхоспазма, головной
боли, обмороков. Усиление симптомов могут спровоцировать пищевые
продукты со специями, сладости.
Аутоиммунная крапивница
У 30-40% взрослых пациентов с хронической крапивницей заболева-
ние носит аутоиммунный характер. Исследования, проведенные в Европе,
показали, что распространенность аутоиммунных крапивниц среди детей
тоже может достигать 30%. Аутоантитела к эпитопам а-цепи рецептора IgE
(анти FceRIA) либо к IgE выявляют у 47% пациентов. Взаимодействие этих
антител с IgE или рецепторами к IgE обусловливает выделение гистамина и
зависит от комплемента.
Помимо этого, показано, что у взрослых пациентов, имеющих аутоанти-
тела к FceRIA, выражена связь с симптомами аутоиммунного тиреоидита,
однако патофизиологические механизмы этой взаимосвязи пока недоста-
точно ясны.
У 12-14% взрослых с хронической крапивницей уровень циркулирую-
щих антитиреоидных антител значительно выше, чем в общей популяции
(5-6%). Большинство из таких пациентов женщины, и у многих возникает
крапивница и ангиоотек. У некоторых пациентов обнаруживают тиреоидит
Хашимото, часто на фоне эутиреоидного состояния. У детей описаны раз-
личные аутоиммунные заболевания (аутоиммунный тиреоидит, юношеский
ревматоидный артрит, целиакия, инсулинзависимый сахарный диабет).
Клинические проявления хронической крапивницы у пациентов с нали-
чием аутоантител и без них схожи, но при аутоиммунной крапивнице
заболевание имеет тенденцию к утяжелению. В анамнезе у больных следует
выяснить наличие тиреоидита либо указания на аутоиммунную патологию
в семье.
Рутинные обследования включают определение уровня общего IgE, анти-
тиреоидных аутоантител, постановку теста с аутосывороткой in vivo, in vitro —
высвобождение гистамина из базофилов под действием гистаминвысво-
бождающих аутоантител (анти FceRIA). Помимо этого, диагноз аутоиммун-
ной крапивницы можно поставить после исключения других возможных
причин либо триггерных факторов (физические стимулы, лекарственные
средства, инфекционные заболевания или пищевые факторы).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 529
Ангиоотек
У пациентов с крапивницей почти в 50% случаев развивается ангиоотек,
тогда как изолированный ангиоотек выявляют у 10% больных. Ангиоотек
может быть обусловлен гиперчувствительностью к лекарственным сред-
ствам, пищевым продуктам, укусам и ужалениям насекомых.
Ангиоотеки могут локализоваться в области губ, языка, шеи, лица, глот-
ки, гортани, кистей, стоп; поражение может затрагивать слизистые оболоч-
ки. Цвет кожи над ангиоотеком не изменен либо имеет розовый оттенок;
зуд бывает редко, чаще беспокоят чувство напряжения, распирания или
даже боли. Сохраняются отеки до 24-48 ч. В отличие от крапивницы, при
которой поражается сосочковый слой, ангиоотек затрагивает ретикуляр-
ный слой дермы. В месте отека повышается проницаемость подслизистых и
подкожных капилляров и венул.
Помимо ангиоотеков, обусловленных гиперчувствительностью, суще-
ствуют неаллергические ангиоотеки (табл. 12-25). В этом случае у больных
выражены наследственно обусловленные абсолютный или относительный
дефициты Cl-ингибитора (соответственно наследственный ангионевроти-
ческий отек типов 1 и 2) либо при ангиоотеке типа 3 уровень и функция
Cl-ингибитора не изменены. При наследственном ангионевротическом
отеке (НАО) клинические проявления отека отличаются более плотной
консистенцией, безболезненные, без зуда и часто локализуются на одном и
том же месте. Развиваются отеки медленно (в течение 12-36 ч) и исчезают
постепенно (за 2-5 сут). Лечение блокаторами Н^рецепторов гистамина и
глюкокортикоидами малоэффективно. Для купирования отеков применя-
ют свежезамороженную плазму, содержащую С1-ингибитор, 5% раствор
е-аминокапроновой кислоты. Для профилактики отеков используют андро-
гены (даназол, сганазолр, метилтестостерон).
ГЛАВА 12
Рис. 12-26. Аллергический ангиоотек век. Пациентка 39 лет.
530 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-25. Дифференциальная диагностика наследственного ангионевротического
отека и аллергического ангиоотека (Российский согласительный документ: крапивница
и ангиоотек. М., 2007)
Признаки НАО Аллергический ангиоотек
Начало заболевания С детских лет В разном возрасте
Наследственность Наличие наследственного ангиоотека у родственников Наличие аллергических заболе- ваний в семье
Провоцирующие факторы Микротравмы, давление, стресс, инфекционные заболе- вания, лекарственные средства Контакт с аллергенами
Динамика развития Постепенные начало (12-36 ч) и регрессия (в течение 2-5 сут) Быстрое появление и исчез- новение
Локализация Чаще на одном и том же месте (конечности, туловище, поло- вые органы, гортань и др.) На разных местах
Сочетание с крапивницей Не характерно Характерно (80-85% случаев)
Отек гортани Более характерен (50% слу- чаев) Менее характерен
Абдоминальные синдромы Характерны в 70-80% случаев Не характерны
Отягощенный аллергологиче- ский анамнез Не характерен Характерен
Лечение антигистаминными препаратами и глюкокорти- коидами Малоэффективно Эффективно
Уровни общего и аллергенспе- цифического IgE Нормальные Повышены
Концентрации С1 -ингибитора, С2- и С4-компонентов компле- мента Чаще снижены Нормальные
Эозинофилия крови Нет Есть
Диагностика крапивницы
Основной элемент крапивницы — волдырь, возникающий как проявле-
ние местного отека сосочкового слоя дермы. Для него характерны:
• в большинстве случаев кожный зуд, иногда — жжение;
• ограниченный отеком кожи, варьирующий по размеру и форме;
• гиперемия;
• полное разрешение в период до 24 ч (от нескольких минут до несколь-
ких часов);
• возникновение на любом участке кожи.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 531
Чтобы выяснить причину возникновения крапивницы, характер тече-
ния, а также выявить триггерные факторы, необходимо собрать анамнез и
оценить:
• наличие зуда; типичных уртикариев, длительность их сохранения на
одном месте, бесследное их исчезновение при надавливании или растя-
жении кожи; связь с приемом лекарственных средств, пищевых продук-
тов, биологически активных добавок; наличие ужалений, инфекцион-
ных заболеваний и т.д., а также отсутствие пигментации. Необходимо
оценить эффективность блокаторов Hj-рецепторов гистамина;
• при аллергической крапивнице — наличие отягощенного аллергоанам-
неза, в том числе других аллергических заболеваний, и роль различных
аллергенов.
Лабораторная диагностика
Включает значительное количество исследований, необходимых для
выявления этиологического фактора.
Помимо общеклинических исследований, проводят определение антител
к тиреоглобулину и тиреоидной пероксидазе, ревмопробы, паразитологи-
ческое и вирусологическое исследования (на вирусы гепатита В и С, ВИЧ),
пробу на Н. pylori, выявляют хронические очаги инфекции.
Инструментальные исследования включают УЗИ пищеварительного трак-
та, щитовидной железы, по показаниям — рентгенографию пазух носа и т.п.
Для диагностики аллергической крапивницы в период ремиссии необхо-
димо провести кожные тесты с аллергенами, кожный тест с аутосывороткой,
выявить аллергенспецифические IgE-антитела in vitro. Для диагностики
уртикарного васкулита осуществляют биопсию кожи из очага поражения.
В целом объем исследований может быть расширен или сокращен в зави-
симости от степени расшифровки этиологии заболевания и эффективности
проводимого лечения.
Лечение
Лечение крапивницы состоит в назначении элиминационной либо гипо-
аллергенной диеты и фармакотерапии.
• Назначают диету, исключающую причинно-значимые аллергены и
гистаминолибераторы.
• Рекомендуют соблюдать оптимальный температурный режим окружа-
ющей среды, ограничивать физические нагрузки, исключать стрессы
и т.п.
• При медикаментозном лечении острой крапивницы препаратами
выбора являются блокаторы Н^рецепторов гистамина. В зависимости
от тяжести проявлений крапивницы и/или при одновременном воз-
никновении симптомов ангиоотеков наряду с препаратами 2-го поко-
ления используют инъекционные формы блокаторов Hj-рецепторов
гистамина 1-го поколения.
ГЛАВА 12
ЧАСТЬ 2
532 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• При недостаточности клинического эффекта антигистаминных препа-
ратов назначают глюкокортикоиды коротким курсом.
• При развитии жизнеугрожающих состояний вводят эпинефрин.
При хронической крапивнице необходимо проводить этиотропное и
патогенетическое лечение. Блокаторы ^-рецепторов гистамина 2-го поко-
ления — препараты первой линии, причем длительность использования
этих средств может варьировать в различных пределах — от нескольких
недель до месяцев. В ряде случаев дозу препаратов увеличивают. Следует
отметить, что при лечении хронической крапивницы, особенно при идио-
патической форме, а также при недостаточной эффективности блокаторов
^-рецепторов можно использовать препараты других фармакологических
групп: блокаторы Н2-рецепторов гистамина, глюкокортикоиды, антилейко-
триеновые препараты, циклоспорин А, метотрексат, трициклические анти-
депрессанты (доксепин®), внутривенные иммуноглобулины и др.
При холодовой крапивнице рекомендуются мероприятия по индукции
толерантности к холоду — постепенное обливание водой, начиная с темпе-
ратуры 36-38 °C и снижая ее на 0,5 °C каждые 3-4 сут.
При холинергической крапивнице можно использовать дозированные
физические нагрузки, чтобы удлинить рефрактерный период, а также
использовать холинолитики (беллатаминал*), препараты обратного захва-
та серотонина (пароксетин и др.). По показаниям необходимо провести
санацию хронических очагов инфекции, а также лечение других хрониче-
ских заболеваний. Важная роль отводится дегельминтезации, особенно у
детей.
Вопросы для самоконтроля
• Дайте определение крапивницы.
• Назовите классификацию крапивницы согласно Российскому нацио-
нальному согласительному документу (2007).
• Перечислите основные механизмы крапивницы.
• Каковы особенности аллергических крапивниц?
• Опишите основной элемент крапивницы.
• Охарактеризуйте особенности хронической крапивницы.
• Перечислите основные проявления холодовой крапивницы. Что такое
вторичная холодовая крапивница?
• Какие формы холодовой крапивницы относятся к атипичным?
• Назовите основные симптомы и отличия дермографической и холи-
нергической крапивниц.
• Что такое аутоиммунная крапивница? Механизмы развития и особен-
ности клинической картины.
• Назовите основные симптомы крапивницы.
• Какова этиология и частота встречаемости ангиоотека у больных с
крапивницей?
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 533
• Опишите клинические проявления ангиоотеков.
• Каковы дифференциально-диагностические признаки аллергического
ангиоотека и НАО?
• Перечислите основные методы лабораторной диагностики крапив-
ницы.
® Перечислите принципы терапии крапивницы и ангиоотеков.
12.12. ПРИНЦИПЫ ТЕРАПИИ АЛЛЕРГИЧЕСКИХ
ЗАБОЛЕВАНИЙ. ОСНОВНЫЕ НАПРАВЛЕНИЯ
ВЛЕЧЕНИИ АЛЛЕРГИИ
Во всём мире лечению больных аллергией уделяют самое пристальное
внимание. Стремительно растет перечень новых лекарственных средств,
включая агонисты TLR (в частности, TLR4 TLR9 — для переключения
иммунного ответа с Th2- на Thl-тип), ингибиторы цитокинов (ИЛ-4,
ИЛ-13, ФНО-а и др.), антитела против CTLA-4 и др. Внедряются новые
методы иммунотерапии на основе пищевых аллергенов и сублингвальной
АСИТ (арахис, киви, лесной орех, яйца курицы, коровье молоко), имеются
попытки создания толерантности к лекарственным средствам (ритуксимаб*7
и др.). Основные принципы лечения аллергических заболеваний включают
проведение целого комплекса мер:
• элиминацию причинно-значимых аллергенов;
• фармакотерапию;
• АСИТ;
• обучение пациентов.
Элиминацию аллергенов следует рассматривать как первую линию в
лечении (и в острый период, и в период реконвалесценции, а в некоторых
случаях — пожизненно). Даже если выраженного эффекта от проводимых
мероприятий не наблюдается, элиминация аллергенов может уменьшить
объем лечебных мероприятий. Особенности элиминационных мероприя-
тий зависят от характера сенсибилизации пациента и носят строго индиви-
дуальный характер.
Фармакотерапия — второй шаг, обеспечивающий сохранение длитель-
ной ремиссии либо выздоровление.
АСИТ необходимо подключать начиная с самой ранней стадии, что дает
возможность предотвратить прогрессирование аллергического заболева-
ния. АСИТ — единственный этиопатогенетический метод лечения, позво-
ляющий воздействовать на причину заболевания при сенсибилизации к
бытовым, пыльцевым, инсектным и другим аллергенам.
При использовании соответствующих аллергенов и корректных способах
их введения (подкожный, сублингвальный, per os и т.д.) АСИТ может суще-
ГЛАВА 12
ЧАСТЬ 2
534 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ственно снизить тяжесть аллергического заболевания, объем применения
лекарственных средств и улучшить качество жизни пациентов с аллергией.
В целом оптимальная стратегия лечения пациентов с аллергией вклю-
чает:
• контроль симптомов с использованием оптимальных методов фарма-
котерапии;
• этиопатогенетическое лечение, включающее элиминацию причинно-
значимых аллергенов, и по показаниям — АСИТ;
• снижение объема фармакотерапии (в результате АСИТ) при сохране-
нии адекватного контроля за заболеванием;
• обучение пациентов на всех этапах лечения.
12.12.1. Фармакотерапия аллергических заболеваний
В основе фармакотерапии аллергических заболеваний лежат препараты,
воздействующие на центральные звенья патогенетического процесса. К
ним относят блокаторы рецепторов гистамина, глюкокортикоиды, мем-
браностабилизаторы, антилейкотриеновые препараты и препараты нового
поколения — антирецепторные, антицитокиновые и др.
Антигистаминные препараты
История создания антигистаминных препаратов насчитывает около
100 лет. Тйстамин впервые был выделен и синтезирован в 1907 г., а рецепто-
ры к гистамину (Нх) были открыты в 1937 г. Через несколько десятилетий, в
1972 г., были открыты Н2-рецепторы, в 1983 г. — Н3-рецепторы и в 2000 г. —
Н4-рецепторы на клетках организма человека. В течение всего этого време-
ни проводится активный поиск лекарственных средств, способных блоки-
ровать данные рецепторы. Дважды за этот период присуждали Нобелевские
премии за работы в области создания блокаторов и Н2-рецепторов
гистамина [1957 г. — Д. Бовет (D. Bovef), 1988 г. - Д. Блэк (J. Black)]. Первое
поколение антигистаминных препаратов [дифенгидрамин (димедрол*),
хлоропирамин (супрастин*), клемастин (тавегил*)], активное создание
которых шло с 1942 по 1979 г., отличается, помимо антигистаминного дей-
ствия, антихолинергическим и седативным эффектами. Эти свойства огра-
ничивают длительность приема препаратов, а также расширяют перечень
противопоказаний. Новое поколение блокаторов Н^рецепторов гистамина
в основном не оказывает указанных выше побочных эффектов, что значи-
тельно расширило возможности их терапевтического применения.
Чтобы решить вопрос о выборе блокаторов Н^рецепторов гистамина,
необходимо учитывать их основные свойства, а именно характер связи пре-
парата с Н^рецепторами на клетках, а также избирательность этого взаи-
модействия. По указанным параметрам препараты 1-го и 2-го поколения
различаются (табл. 12-26).
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 535
ГЛАВА 12
Таблица 12-26. Блокаторы ^-рецепторов гистамина
Свойство Блокаторы ^-рецепторов гистамина 1-го поколения Блокаторы Н’-рецепторов гистамина 2-го поколения
Связь с ^-рецепторами Конкурентная, быстрообратимая Не конкурентная, лигандрецеп- торный комплекс диссоциирует медленно
Избирательность связи с Нгрецепторами Низкая (возможна связь с холинорецепторами и «-адренорецепторами) Высокая, избирательная
Критерии выбора антигистаминного препарата:
• нозологическая форма заболевания (АР, конъюнктивит, поллиноз,
атопический дерматит, крапивница, ангиоотек, инсектная, пищевая,
лекарственная аллергия, БА и др.);
• возраст пациента;
• клиническая эффективность (индивидуальная эффективность);
• безопасность (минимум побочных эффектов);
• качество жизни;
• удобство применения.
Свойства блокаторов Hj-рецепторов 1-го поколения
• Образуют конкурентную обратимую связь с Hj-рецепторами на тучных
клетках, базофилах и других клетках.
• Обладают антихолинергическим эффектом, клинически проявляю-
щимся сухостью во рту и носоглотке, уменьшением секреции слюнных
и бронхиальных желез, повышением вязкости секрета, обострением
БА, учащением сердечных сокращений, снижением тонуса кишечника
и мочевыводящих путей, нарушением зрения.
• Вызывают ОС] -блокирующий эффект, в связи с чем может снижаться
артериальное давление.
• Оказывают системный хинидиноподобный эффект — удлинение реф-
рактерной фазы и развитие желудочковой тахикардии.
• Действуют на ЦНС, проникая через гематоэнцефалический барьер и
блокируя центральные Hj-рецепторы, серотониновые рецепторы и
центральные М-холинорецепторы, оказывая, таким образом, выра-
женный седативный эффект. Характеристика отдельных препаратов
дана в табл. 12-27.
Блокаторы Н^рецепторов гистамина 1-го поколения различаются по про-
должительности действия и имеют возрастные ограничения (табл. 12-28).
536 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-27. Характеристика отдельных блокаторов ^-рецепторов гистамина 1-го
поколения
Препарат Параметры действия
взаимодействие с другими лекарственными средствами побочные эффекты
Хлоропирамин (супрастин*) Умеренное усиление действия сно- творных лекарственных средств и нейролептиков Сухость во рту, повышение уровня трансаминаз раздражение слизистой оболочки желудка и двенадцатиперст- ной кишки
Мебгидролин (диазолин*) Усиливает действие средств, угнетаю- щих ЦНС Сухость во рту. раздражение слизи- стой оболочки желудка и двенадцати- перстной кишки
Дифенгидрамин (димедрол*) Усиление действия снотворных, нейролептиков, противосудорожных лекарственных средств Возбуждение, снижение артериаль- ного давления, сухость во рту, запор, бронхоспазм, затруднение мочеиспус- кания
Прометазин (пипольфен*) Усиление действия наркотических, снотворных, местно-анестезирующих средств Кратковременное снижение артери- ального давления, повышение уровня трансаминаз, фотосенсибилизирую- щий эффект
Клемастин (тавегил*) Усиление действия снотворных, инги- биторов моноаминоксидазы, алкоголя Сухость во рту, запор, бронхоспазм, затруднение мочеиспускания
Квифенадин*', хифенадин (фенкарол*) Повышение содержания гистамина в тканях, антиаритмический эффект Сухость во рту, иногда тошнота
Таблица 12-28. Блокаторы ^-рецепторов гистамина: возрастные ограничения
Препараты Параметры действия
возрастные ограничения продолжительность действия кратность приема в сутки седативный эффект М-холинерги- ческий эффект
Хлоропирамин (супрастин*) С 1 мес 4-6 ч 2-3 раза + +
Мебгидролин (диазолин*) С 2 мес 4-8 ч 1-3 раза - +
Прометазин (пипольфен*) С 2 мес 8-12 ч 2-3 раза +++ +
Ципрогептадин (перитол*) С 6 мес 4-6 ч 3-4 раза - ±
Клемастин (тавегил*) С 1 года 8-12 ч 2 раза ± +
Квифенадинр, хифенадин (фенкарол*) С 2 лет 4-6 ч 3-4 раза - -
АЛЛЕРГИЧЕСКИЕ ЗАБОЛААНИЯ 537
Свойства блокаторов Hj-рецепторов гистамина 2-го поколения (табл.
12-29,12-30):
• обладают высокой специфичностью и избирательным сродством к
Hj-рецепторам, что обусловливает их однократный прием в сутки;
” не блокируют рецепторы других типов;
* обладают слабой способностью проникать через гематоэнцефаличе-
ский барьер, что определяет:
отсутствие седативного действия:
отсутствие повышенного аппетита и увеличения массы тела;
< отсутствие тахифилаксии дает возможность длительно принимать пре-
парат без его замены.
Таблица 12-29. Характеристика отдельных блокаторов l^-рецепторов гистамина 2-го
поколения
ГЛАВА 12
Препараты Параметры действия
взаимодействие с другими лекарственными средствами побочные эффекты
Дезлоратадин (эриус*) Не выявлено Сухость во рту (крайне редко)
Лоратадин (кларитин*) Эритромицин повышает концен- трацию препарата Головная боль, нервозность, сухость во рту (редко)
Цетиризин (зиртек*) Не выявлено Сухость во рту (иногда)
Эбастин (кестин*) Эритромицин, кенолог' Сухость во рту (редко), боли в животе(редко)
Фексофенадин (телфаст*) Эритромицин повышает концен- трацию препарата Редко головная боль, слабость
Таблица 12-30. Блокаторы ^-рецепторов гистамина 2-го поколения: возрастные огра-
ничения
Препараты Параметры действия
продолжительность действия кратность приема в день седативный эффект холинергиче- ский эффект
Дезлоратадин (эриус*) 27 ч 1 раз Нет Нет
Лоратадин (кларитин*) 12-24 4 1 раз Нет Нет
Цетиризин (зиртек*) 7-9 ч 1-2 раза Может быть Нет
Эбастин (кестин*) 48 ч 1 раз Нет Нет
Фексофенадин (телфаст*) 12-24ч 1 раз Редко Нет
Большой выбор блокаторов Hj-рецепторов гистамина вызывает необхо-
димость учитывать не только механизмы действия этих средств, но и воз-
растные ограничения к их применению (табл. 12-31).
538 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-31. Возрастные критерии назначения блокаторов ^-рецепторов гистамина
Возраст Блокаторы ^-рецепторов гистамина 1-го поколения Блокаторы ^-рецепторов гистамина 2-го поколения
С 1 мес Хлоропирамин (супрастин*) -
С 2 мес Диметиден (фенистил*) Мебгидролин (диазолин*) Дифенгидрамин (димедрол*) Прометазин (пипольфен*) —
С 6 мес Ципрогептадин (перитол*) Цетиризин (зиртек)
С 12 мес Клемастин (тавегил*) Дезлоратадин (эриус*)
С 2 лет Хифенадин (фенкарол*) Лоратадин (кларитин*) Левоцетиризин (ксизал*)
С 6 лет - Эбастин (кестин*) Фексофенадин (телфаст*)
Помимо возрастных ограничений, в детской практике следует обращать
внимание на характер лекарственной формы препарата и отдавать предпо-
чтение сиропам и каплям (табл. 12-32).
Таблица 12-32. Детские формы блокаторов ^-рецепторов гистамина 2-го поколения
Международное непатентованное название Торговое название Лекарственные формы
Дезлоратадин Эриус* Сироп
Лоратадин Кларитин* Лоратадин Сироп
Фексофенадин Телфаст* Таблетки
Цетиризин Зиртек* Зодак* Парлазин Капли Сироп,капли Капли
Эбастин Кестин* Сироп
Левоцетиризин Ксизал* Капли
Блокаторы Hj-рецепторов гистамина составляют основу фармакотера-
пии аллергических заболеваний. Назначение их патогенетически обосно-
вано как в остром периоде, так и при хронических проявлениях аллергии.
Современные блокаторы Hj-рецепторов гистамина 2-го поколения дают
возможность длительно сохранять на высоком уровне качество жизни
пациентов с респираторными, кожными и другими проявлениями аллер-
гии.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 539
Глюкокортикоиды (ГКС)
ГКС широко используются для лечения различных аллергических забо-
леваний и бронхиальной астмы. Известно, что при введении в организм
ГКС проникают внутрь клеток и связываются с соответствующими ГКС-
рецепторами, находящимися в цитоплазме в неактивном состоянии, после
чего происходит связывание активированного рецептора с определенными
участками ДНК в ядре клетки, а это в свою очередь способствует увели-
чению синтеза мРНК. Воздействие ГКС на глубинные процессы в клетке
приводит к разнообразным механизмам действия, часть из которых играет
ключевую роль в лечении аллергии:
• противовоспалительный эффект, обусловленный усилением транс-
крипции противовоспалительных генов;
• прямое ингибирующее действие на высвобождение медиаторов из
эозинофилов;
• уменьшение продукции ИЛ-5, ГМ-КСФ и, как следствие, снижение
образования эозинофилов в костном мозге;
• подавление активности ТЬ2-лимфоцитов и их способности продуциро-
вать ИЛ-4 и ИЛ-5;
• подавление продукции цитокинов альвеолярными макрофагами
(ИЛ-10), эпителиальными клетками (ИЛ-8, ГМ-КСФ);
• уменьшение количества антигенпредставляющих дендритных клеток в
слизистой носа и бронхов;
• снижение экспрессии молекул адгезии ICAM-1, и наоборот, усиление
экспрессии 02-адренорецепторов гладкомышечных клеток дыхатель-
ных путей;
• подавление секреции слизистых желез за счет уменьшения синтеза
медиаторов воспаления.
Помимо перечисленных выше эффектов, ГКС оказывают выраженное
иммунодепрессивное действие. Механизмы, лежащие в основе данного
эффекта, следующие (цит. по Л.И. Дятчиной, 2010): уменьшение количе-
ства лимфоцитов в периферической крови (лимфопения) за счет перехода
циркулирующих лимфоцитов (главным образом, Т-клеток) в лимфоидную
ткань; возможно и накопления их в костном мозге; усиление апоптоза
незрелых или активированных Т- и В-лимфоцитов; подавление пролифера-
ции Т-клеток; снижение функции Т-хелперов, ЦТЛ; угнетение активности
системы комплемента; торможение образования фиксированных иммун-
ных комплексов; снижение уровня иммуноглобулинов (высокие дозы глю-
кокортикоидов); угнетение реакции ГЗТ (IV тип), в частности туберкулино-
вой пробы; нарушение кооперации между Т- и В-лимфоцитами; нарушение
синтеза иммуноглобулинов и антител, в том числе и аутоантител; уменьше-
ние количества моноцитов в сосудистом русле.
В результате воздействия ГКС подавляется выраженность аллергическо-
го воспаления.
ГЛАВА 12
ЧАСТЬ 2
540 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Классификация ГКС [Дятчина Л.И., 2010]
В зависимости от продолжительности угнетения АКТГ после разовой
дозы ГКС делятся на:
• короткодействующие — угнетают активность АКТГ до 24-36 ч;
• средней продолжительности — 48 ч;
® длительно действующие — более 48 ч.
I . ЕСТЕСТВЕННЫЕ — кортизол, кортизон (гидрокортизон), кортизон
ацетат — угнетают активность АКТГ до 24-36 ч.
I I. ПОЛУСИНТЕТИЧЕСКИЕ.
К препаратам короткого действия относят преднизолон, преднизон,
метилпреднизолон (урбазон*, метипред*).
К препаратам средней продолжительности действия относится триамци-
нолон (полькортолон*).
К препаратам длительного действия относятся бетаметазон, дексамета-
зон.
Эталоном среди ГКС считается преднизолон, и по отношению к
нему оценивается эффективность других препаратов этой группы.
Среднетерапевтические дозы ГКС в расчете на преднизолон составляют
0,5-1,0 мг/кг массы тела. Назначая ГКС, следует соблюдать принцип экви-
валентных доз с целью получения одинакового противовоспалительного
эффекта. Эквивалентные дозы: преднизолона — 5 мг, триамцинолона —
4 мг, метилпреднизолона — 4 мг, дексаметазона — 0,5 мг, бетаметазона —
0,75 мг, гидрокортизона — 25 мг. При этом расчет дозы для больного всегда
идет на преднизолон. При переводе больных с парентерального введения
ГКС на прием внутрь необходимо уменьшить суточную дозу в 5-6 раз, при
жизнеугрожающих состояниях следует назначать сразу большие дозы ГКС.
Системные ГКС применяются в ургентной аллергологии при лечении
больных с токсико-аллергическими заболеваниями, ангиоотеками, ана-
филактическим шоком, крапивницами для купирования обострений БА в
случае недостаточной эффективности ИГКС и т.п. Кортикостероиды при-
водят к клинически значимому улучшению состояния спустя 4 ч после их
введения.
Ингаляционные ГКС (ИГКС)
ИГКС отличаются от системных ГКС целым рядом фармакологических
свойств: липофильностью, быстротой инактивации, коротким периодом полу-
выведения из плазмы крови, местным действием [Княжеская Н.П., 2008].
Благодаря липофильности ИГКС накапливаются в дыхательных путях,
замедляется их высвобождение из тканей и увеличивается их сродство к
ГКС-рецептору. Высоколипофильные ИГКС быстрее и лучше захватыва-
ются из просвета бронхов и длительно задерживаются в тканях дыхатель-
ных путей. Все ИГКС имеют быстрый системный клиренс, сравнимый
с величиной печеночного кровотока. Это один из факторов, снижающих
системное действие ИГКС.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 541
Характеристика наиболее гасто используемых препаратов
[Княжеская Н.П., 2008]
К ИГКС относятся беклометазона дипропионат, будесонид, флютиказона
пропионат, флунизолид, триамцинолона ацетонид, мометазона фуроат. Они
выпускаются в виде дозированных аэрозолей, порошковых ингаляторов, а
также в виде растворов для ингаляции через небулайзер (будесонид).
Беклометазона дипропионат. Применяется в клинической практике
более 20 лет и остается одним из самых эффективных и часто используемых
препаратов. Разрешено применение препарата у беременных. Выпускается в
виде дозированного аэрозольного ингалятора (Бекотид 50 мкг, Беклофорте
250 мкг, Альдецин 50 мкг, Беклокорт 50 и 250 мкг, Бекломет 50 и 250 мкг/
доза), дозированного ингалятора, активируемого вдохом (Беклазон Легкое
Дыхание 100 и 250 мкг/доза), порошкового ингалятора (Бекодиск 100 и
250 мкг/доза, ингалятор Дискхалер; мультидозовый ингалятор Изихейлер,
Бекломет 200 мкг/доза). Для ингаляторов Бекотид и Беклофорте произво-
дятся специальные спейсеры «Волюматик» (клапанный спейсер большого
объема для взрослых) и «Бэбихалер» (2-клапанный спейсер малого объема
с силиконовой лицевой маской для детей раннего возраста).
Будесонид. Современный высокоактивный препарат. Используется в виде
дозированного аэрозольного ингалятора (Будесонид-мите 50 мкг/доза;
Будесонид-форте 200 мкг/доза), порошкового ингалятора (Пульмикорт
1Урбухалер 200 мкг/доза; Бенакорт Циклохалер 200 мкг/доза) и суспензии
для небулайзера (Пульмикорт 0,5 и 0,25 мг/доза). Пульмикорт Турбухал ер —
единственная лекарственная форма ИГКС, не содержащая носителя. Для
дозированных ингаляторов Будесонид-мите Будесонид-форте производит-
ся спейсер. Будесонид является составной частью комбинированного пре-
парата симбикорт (средство по рецепту). Пульмикорт также рекомендован
к применению у беременных: установлено, что его применение не вызывает
увеличения числа аномалий плода.
Флютиказона пропионат. Самый высокоактивный препарат на сегодняш-
ний день. Обладает минимальной пероральной биодоступностью (<1%).
Представлен в виде дозированного аэрозольного ингалятора (Фликсотид
50, 125 и 250 мкг/доза) и порошкового ингалятора (Фликсотид Дискха-
лер — ротадиски 50, 100, 250 и 500 мкг/доза; Фликсотид Мультидиск
250 мкг/доза). Для аэрозольных ингаляторов производятся специальные
спейсеры — «Волюматик» (клапанный спейсер большого объема для взрос-
лых) и «Бэбихалер» (2-клапанный спейсер малого объема с силиконовой
лицевой маской для детей раннего возраста). Флютиказон является состав-
ной частью комбинированного препарата Серетид Мультидиск.
Флунизолид. Препарат с низкой глюкокортикоидной активностью. На
отечественном рынке представлен торговой маркой Ингакорт (дозирован-
ный ингалятор 250 мкг/доза со спейсером).
ГЛАВА 12
ЧАСТЬ 2
542 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Триамцинолона ацетонид. Препарат с низкой гормональной активно-
стью. Дозированный ингалятор 100 мкг/доза. Торговая марка Азмакорт, на
российском рынке не представлен.
Мометазона фуроат. Препарат с высокой глюкокортикоидной активно-
стью. На российском рынке представлен только в виде назального спрея
Назонекс.
Комбинированные препараты, содержащие ингаляционный ГКС и
р2-агонист длительного действия. На сегодняшний день 02-агонисты дли-
тельного действия представлены двумя препаратами: формотерола фумара-
том и сальметерола ксинафоатом. В современных руководствах по терапии
БА рекомендовано добавление 02-агонистов длительного действия при
недостаточном контроле БА мототерапией ИГКС.
Главным преимуществом комбинированной терапии является повыше-
ние эффективности лечения при использовании более низких доз ИГКС.
Серетид Мультидиск. Составными компонентами являются сальметеро-
ла ксинафоат и флютиказона пропионат (в различных дозировках: 50/100,
50/250, 50/500 мкг сальметерола/флютиказона в 1 дозе). Мультидиск
относится к ингаляционным устройствам малого сопротивления, что позво-
ляет использовать его и у пациентов со сниженной скоростью вдоха.
Симбикорт Турбухалер. Составными компонентами являются будесонид
и формотерола фумарат (160/4,5 мкг в 1 дозе). Симбикорт может использо-
ваться как для базисной терапии (для контроля воспалительного процесса),
так и для немедленного облегчения симптомов астмы.
12.12.2. Аллергенспецифическая иммунотерапия
Этиопатогенетический метод лечения атопических заболеваний — аллер-
генспецифическая иммунотерапия (АСИТ). Этот метод известен и исполь-
зуется в медицине больше 100 лет.
С позиций доказательной медицины в 2006 г. EAACI (Европейская
академия аллергологии и клинической иммунологии) были предложены
стандарты АСИТ, регламентирующие ее проведение с целью добиться мак-
симального эффекта и свести к минимуму риск анафилаксии.
Определение. АСИТ — введение аллергенов в постепенно возрастаю-
щей концентрации пациенту, страдающему IgE-опосредованной аллергией,
с целью устранить симптомы заболеваний, возникающие при контакте с
этим причинно-значимым аллергеном. АСИТ индуцирует клиническую и
иммунологическую толерантность, имеет длительный эффект и предотвра-
щает прогрессирование аллергического заболевания. АСИТ также улучшает
качество жизни пациента с аллергией. Определение базируется на доказа-
тельствах I категории.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 543
Исторические названия АСИТ: десенсибилизация, гипосенсибилиза-
ция — в настоящее время не применяются, тогда как термин «аллерговак-
цинация» упоминают в некоторых научных работах.
Для проведения АСИТ используют различные виды аллергенов, являю-
щиеся протеинами или гликопротеинами, способными связываться с IgE. В
практике используют диагностические и/или лечебные «аллергенные про-
дукты» — биологические продукты, содержащие аллергены или компонен-
ты аллергенов и применяемые у человека для диагностики, профилактики
и лечения аллергических заболеваний.
При производстве аллергенных продуктов используют методы их стан-
дартизации in vivo на репрезентативной выборке, сравнивая результаты
кожного тестирования аллергенных продуктов и гистамина (10 мг/мл).
Следует отметить, что данный метод не позволяет добиваться полной
идентичности аллергенных продуктов, получаемых на разных предприяти-
ях, так как чувствительность отобранных популяций пациентов может
различаться. Кроме того, существуют различные аллергенные продукты,
различающиеся по составу, эффективности, безопасности. К ним относят:
• натуральные аллергенные продукты, не содержащие адъювантов
и не подвергавшиеся химической модификации. Этот тип продуктов
представлен в основном натуральными лиофилизированными экс-
трактами ингаляционных и инсектных аллергенов для подкожной или
сублингвальной иммунотерапии;
• физически модифицированные продукты. Для их создания исполь-
зуют различные вещества, адсорбирующие натуральные аллергены.
В качестве адсорбентов применяют гидроокись алюминия, фосфат
кальция, тирозин. Цель создания таких препаратов — депонирование
аллергенов в месте введения;
• химически модифицированные продукты — натуральные экстрак-
ты, которые подвергают химической модификации, чтобы уменьшить
их аллергенность, и/или синтетические высокомолекулярные веще-
ства. Модифицируют аллергены с помощью формальдегида, глута-
ральдегида; затем их адсорбируют на различных носителях;
• рекомбинантные аллергенные продукты. В последние годы,
используя методы современной молекулярной биотехнологии, полу-
чают рекомбинантные аллергены для диагностики аллергических
заболеваний.
По способу введения аллергенов выделяют несколько видов АСИТ:
• подкожную;
• локальную:
< сублингвальную;
О оральную;
назальную;
бронхиальную.
ГЛАВА 12
ЧАСТЬ 2
544 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
12.12.2.1. ПОДКОЖНАЯ АЛЛЕРГЕНСПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ
Этот вид АСИТ используют у больных с сенсибилизацией к ингаляци-
онным и инсектным аллергенам. Проверенная временем эффективность
и безопасность данного метода лечения подтверждена контролируемыми
исследованиями последних лет. АСИТ не показана для лечения пищевой
аллергии и атопического дерматита.
Ингаляционные аллергены
Клинические проявления атопической сенсибилизации к ингаляционным
аллергенам включают риниты, конъюнктивиты и астму. Эффективность
лечения заключается в снижении симптомов и/или уменьшении объема
используемых лекарственных средств. С 1980 по 2005 г. было проведено
75 двойных слепых плацебо-контролируемых исследований, из которых
15 продемонстрировали клиническую эффективность лечения у детей.
Категории доказательств: 1а — для астмы, 1b — для ринитов с использова-
нием аллергенов деревьев, трав, клещей домашней пыли D. pteronyssinnus,
грибов родов Altemaria, Cladosporium. АСИТ вызывает длительный эффект
(категория 1b).
Инсектная аллергия
Доказана эффективность АСИТ при аллергии на укусы пчел, муравьев,
шершней. Эффективность АСИТ доказана (категория 1b), но она зависит
от вида насекомых. Наиболее эффективна АСИТ при аллергии на укусы
шершней и муравьев (по сравнению с укусами пчел). Во всех случаях умень-
шается тяжесть симптомов, возникающих при повторных укусах.
Показания и противопоказания
Подкожную АСИТ можно проводить начиная с 5-летнего возраста.
В более раннем возрасте ингаляционные аллергены играют менее важную
этиологическую роль, и, кроме того, дети раннего возраста не способны
идентифицировать проявления побочных реакций в виде симптомов ана-
филаксии. Так же редко АСИТ проводят пациентам старше 60 лет, однако
это связано в первую очередь с наличием сопутствующей патологии и дру-
гих хронических заболеваний.
Показания при ингаляционной аллергии
Отбор пациентов для АСИТ осуществляют в соответствии со следующи-
ми критериями:
• пациенты с АР, конъюнктивитами, БА;
• пациенты с симптомами, возникающими преимущественно при кон-
такте с аллергенами;
• пациенты, чувствительные к одному или нескольким аллергенам;
• пациенты с пыльцевой сенсибилизацией и длительным сезоном или с сим-
птомами, возникающими в течение нескольких периодов поллинации;
• пациенты с ринитами и симптомами со стороны нижних отделов дыха-
тельных путей, возникающих в сезон поллинации;
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 545
• пациенты, у которых блокаторы ^-рецепторов гистамина и топические
глюкокортикоиды вызывают недостаточный контроль симптомов;
• пациенты, не желающие применять длительную фармакотерапию;
• пациенты, у которых фармакотерапия индуцирует нежелательные
побочные эффекты.
Кроме того, при назначении АСИТ необходимо взвесить и ясно опреде-
лить следующие факторы:
• заболевание и его тяжесть;
• аллергены и важность сенсибилизации;
• необходимость и эффект симптоматической терапии;
• оценить и сравнить риск самого аллергического заболевания и лечения;
• психологические факторы;
• отношение пациента к заболеванию и лечению.
Показания при инсектной аллергии
АСИТ показана взрослым и детям, у которых выражены тяжелые
системные аллергические реакции, включая респираторные и/или кардио-
васкулярные симптомы и выявленную путем кожного тестирования и/или
определения специфического IgE сенсибилизацию к инсектным аллерге-
нам. В отличие от АСИТ с ингаляционными аллергенами при инсектной
аллергии АСИТ часто проводят в пожилом возрасте. В этих случаях следует
тщательно взвешивать риск АСИТ и клинических проявлений аллергии.
При системных, не угрожающих жизни реакциях (крапивница, эритема,
зуд) на выбор АСИТ в качестве метода лечения могут влиять другие фак-
торы, включающие профессиональную необходимость либо хобби, когда
риск анафилаксии увеличивается. При сильных местных реакциях либо
при возникновении необычных реакций на укусы, например при HelgE-
опосредованных реакциях гиперчувствительности (васкулиты, нефрозы
или тромбицитопении), проводить АСИТ не рекомендуют.
Противопоказания
Противопоказания к подкожной АСИТ ингаляционными и инсектными
аллергенами.
• Абсолютные противопоказания:
серьезные иммунологические заболевания, тяжелые заболевания
кровеносной системы, рак, хронические инфекции;
О тяжелая БА со сниженной функцией легких (ОФ!^ <70%);
О лечение 0-адреноблокаторами (включая топические);
< психические расстройства и отсутствие комплаенса.
• Относительные противопоказания:
О беременность (однако отсутствуют публикации, подтверждающие
риск тератогенного эффекта), но возможны анафилактические реак-
ции и вызванные этим повреждения плода;
О тяжелый атопический дерматит.
ГЛАВА 12
ЧАСТЬ 2
546 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Реакции на аллергеиспецифическую иммунотерапию
Реакции на АСИТ могут быть локальными и системными. Чаще реакции
возникают в начальный период лечения; может возрастать риск системных
реакций в период поллинации причинно-значимых растений. У пациентов
с БА, получающих АСИТ с экстрактами клещей домашней пыли, эпизоды
астмы как системной реакции могут возникнуть при начальных показателях
OOBj <80%. Возникновение локальных реакций не является предвестником
развития системных проявлений и не требует коррекции дозы аллергенов.
С целью уменьшить риск системных реакций при АСИТ рекомендуют
проводить премедикацию, используя оральные глюкокортикоиды, кетоти-
фен, теофиллин, блокаторы Hj-рецепторов, а также комбинации блокато-
ров Hj- и Н2-рецепторов гистамина.
Оценка результатов аллергеиспецифической иммунотерапии
В результате проведения АСИТ у больных не расширяется спектр новых
видов сенсибилизации. Так, через 4 года после начала АСИТ сенсибилиза-
ция к новым аллергенам возникает в три раза реже по сравнению с контро-
лем. АСИТ предотвращает прогрессирование ринита, а также значительно
уменьшает риск возникновения БА. После 3 лет проведения АСИТ брон-
хиальная астма развивается в два раза реже, чем в контрольной группе.
Благодаря АСИТ снижается бронхиальная гиперреактивность.
Практические аспекты
• АСИТ должен проводить врач аллерголог-иммунолог и специально
обученный медицинский персонал. Детей до 15 лет на АСИТ должны
сопровождать родители.
• Для проведения АСИТ используют лечебные стандартизированные
аллергены. В настоящее время отсутствует единая система стандарти-
зации аллергенов, производимых в разных странах. В России диагно-
стические и лечебные аллергены стандартизуют по содержанию в них
единиц белкового азота (PNU), а аллергенную активность оценивают
качественно при проведении кожного тестирования на чувствительных
пациентах. В европейских странах аллергены стандартизуют в биоло-
гических единицах (BU), рассчитанных по величине кожной реакции
у чувствительных пациентов; в США — в аллергенных единицах (AU),
определяемых по кожной реакции чувствительного пациента при вну-
трикожном тестировании.
Виды лечебных аллергенов, применяемых в России:
• водно-солевые экстракты;
• аллергоиды, т.е. аллергены, модифицированные формальдегидом или
глутаровым альдегидом;
• пролонгированные аллергены, сорбированные на гидрооксиде алю-
миния;
• аллергены для приема внутрь.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 547
12.12.2.2. НЕИНЪЕКЦИОННАЯ (ЛОКАЛЬНАЯ) АЛЛЕРГЕНСПЕЦИФИЧЕСКАЯ
ИММУНОТЕРАПИЯ
Впервые неинъекционные методы введения аллергенов были использо-
ваны в XX в. Так, в 1951 г. Герксгеймер (Herxheimer) впервые предложил
интраназально вводить аллергены. В нашей стране метод интраназальной
АСИТ впервые был разработан и применен Т.А. Ушаковой и А.Д. Адо в
1973 г.
В настоящее время выделяют несколько видов неинъекционной АСИТ:
бронхиальную, оральную, назальную и сублингвальную.
Оказалось, что бронхиальное введение аллергенов зачастую сопрово-
ждается риском развития бронхоспазма и неблагоприятным соотношением
риск/польза. Практически этот вид АСИТ не применяют.
Оральная аллергеиспецифическая иммунотерапия
Ряд клинических исследований показал клиническую эффективность, в
других случаях эффект не превышал эффекта плацебо. Более того, побочные
эффекты, включая боли в животе, рвоту, диарею, возникавшие у ряда паци-
ентов, позволили экспертам заключить, что оральный путь введения аллер-
генов не может считаться эффективной альтернативой подкожной АСИТ.
Назальная аллергеиспецифическая иммунотерапия
Доказана клиническая эффективность данного метода АСИТ при АР
(уровень доказательности 1b).
Сублингвальная аллергеиспецифическая иммунотерапия
Наибольший интерес в последние годы вызвал этот метод АСИТ, широко
используемый во многих странах мира. Категория доказательности клини-
ческой эффективности для ринитов — 1а и для БА — 1b.
При изучении эффективности и безопасности данного метода лече-
ния показано, что при ринитах уменьшается выраженность симптомов и
объем медикаментозного лечения. Особенно эффективным (категория 1а)
оказалось лечение аллергенами березы, оливы, травами, Der. Farinae,
Der. Pteronyssinus. Отмечена также меньшая частота системных побочных
эффектов и жизнеугрожающих осложнений по сравнению с подкожной
АСИТ. В то же время описаны локальные побочные эффекты (включают
зуд, отек губ и языка). Особенно характерно возникновение этих симпто-
мов при увеличении дозы аллергенов. Однако такие побочные эффекты не
требуют медикаментозного лечения или снижения дозы и часто исчезают
при продолжении лечения. В редких случаях возможны дозо- и аллергенза-
висимые системные реакции, такие, как крапивница или приступ БА.
В целом эксперты заключают, что больные (как взрослые, так и дети)
хорошо переносят сублингвальную АСИТ. Однако пациентов нужно про-
информировать о возможности локальных или системных реакций.
ГЛАВА 12
ЧАСТЬ 2
548 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
При изучении длительности эффекта лечения в исследованиях у детей-
астматиков, сенсибилизированных к антигенам клещей домашней пыли,
получавших сублингвальную АСИТ в течение 4-5 лет, показано, что в
последующие 10 лет у них достоверно уменьшилось число обострений БА,
а если она и развивалась, то объем медикаментозного лечения был меньше
по сравнению с группой контроля.
Показания к проведению неинъекционной аллергенспецифиче-
ской иммунотерапии
Иммунотерапию проводят только для лечения IgE-опосредованных
заболеваний, используя стандартизированные аллергенные продукты с
доказанной клинической эффективностью и безопасностью.
• Назальная иммунотерапия остается альтернативой подкожной АСИТ
для взрослых пациентов с АР при пыльцевой сенсибилизации.
• Сублингвальная (с проглатыванием аллергена) АСИТ показана:
о пациентам с аллергическими риноконъюнктивитами и БА;
<> пациентам с сенсибилизацией к аллергенам пыльцы березы, трав,
оливы, а также к клещам домашней пыли, грибам;
& пациентам с недостаточным контролем симптомов антиаллергиче-
скими лекарственными средствами;
<> пациентам с системными реакциями на подкожную АСИТ;
<> пациентам, отказывающимся от инъекционной АСИТ.
Противопоказания
Все противопоказания к сублингвальной и подкожной АСИТ одинако-
вы.
Превентивный эффект сублингвальной аллергенспецифической
иммунотерапии
Показано, что 3-летний курс лечения АР достоверно предупреждает воз-
никновение БА и расширение спектра сенсибилизации (категория доказа-
тельности 1b).
Практические аспекты
• Аллергенные продукты нужно транспортировать, хранить и использо-
вать в соответствии с инструкциями производителя.
• Лечебные аллергены бывают в жидком или таблетированном виде.
• Аллергены следует подержать под языком 2-3 мин и затем прогло-
тить.
• После использования капель или таблеток необходимо вымыть руки,
чтобы аллерген не попал в глаза или нос и не вызвал симптомов.
Схемы лечения и модификация доз
Для рутинной терапии рекомендуется придерживаться следующих пра-
вил:
• изменять дозу необходимо при появлении системных побочных
эффектов;
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 549
• сублингвальную АСИТ необходимо отсрочить:
- при наличии орофарингеальной инфекции;
в случае дентальных операций;
при острых гастроэнтеритах;
- при обострении БА;
❖ при снижении показателей пикфлуометрии <80% от персонального
наилучшего уровня;
0 при одновременном введении вирусных вакцин.
Классичееская схема сублингвальной аллергенспецифической
иммунотерапии
Основной курс лечения аллергеном проводят в течение 5 мес (табл. 12-33).
Аллергены в более низких концентрациях (1-100 PNU/мл) используют,
как правило, три раза в неделю (например, в понедельник, среду и пятницу
или во вторник, четверг, субботу). При использовании повышенных кон-
центраций (до 1000-10 000 PNU/мл) интервалы между дозами увеличива-
ют и принимают их два раза или один раз в неделю.
Поддерживающая иммунотерапия
В течение 3-5 лет после основного курса лечения необходимо прини-
мать по 10 капель аллергена с концентрацией 10 000 PNU/мл один раз в
неделю.
ГЛАВА 12
Таблица 12-33. Проведение основного курса аллергенспецифической иммунотерапии в
течение 5 мес
Концентрация Количество капель в сутки
1 PNU/мл День 1 3 5 8 10 - - - - - - -
Количество капель 2 4 7 12 18 -
10 PNU/мл День 1 3 5 8 10 -
Количество капель 2 4 7 12 18 -
100 PNU/мл День 1 4 8 12 16 20 24 28 - - - -
Количество капель 2 3 4 5 7 10 14 19 - - - -
1000 PNU/мл День 1 4 8 12 16 20 24 28 32 36 40 44
Количество капель 2 3 4 5 6 7 8 10 12 14 17 20
10 000 PNU/мл День 1 8 16 24 32 40 47 54 - - - -
Количество капель 2 3 4 5 6 7 8 10 - - - -
550 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 12-34. Ускоренная сублингвальная АСИТ (единая схема для всех концентраций —
1-10 000 PNU/мл)
Концентрация Дни последовательно Дозирование с увеличением на одну каплю в сутки
1 PNU/мл 1-10 От 1 капли в 1-е сутки до 10 капель на 10-е сутки
10 PNU/мл 11-20 От 1 капли на 11-е сутки до 10 капель на 20-е сутки
100 PNU/мл 21-30 От 1 капли на 21-е сутки до 10 капель на 30-е сутки
1000 PNU/мл 31-40 От 1 капли на 31-е сутки до 10 капель на 40-е сутки
10 000 PNU/мл 41-50 От 1 капли на 41-е сутки до 10 капель на 50-е сутки
Основной курс лечения проводят в течение 50 дней.
В течение 3-5 лет после основного курса лечения необходимо принимать 10 капель
аллергена концентрацией 10 000 PNU/мл один, два или три раза в неделю.
Профилактика и лечение нежелательных реакций
• Локальные реакции включают зуд слизистой оболочки полости рта,
отек под языком, гастроинтестинальные симптомы. Эти симптомы
обычно являются легкими, исчезают спонтанно и не нуждаются в
лечении.
• Системные реакции требуют лечения, как и при подкожной АСИТ.
Прекращение сублингвальной иммунотерапии
• Курс сублингвальной иммунотерапии можно считать успешным и
законченным, если после 3-5 лет проведения АСИТ у пациентов симп-
томы заболевания исчезают либо в течение двух последующих лет
проявляются минимально.
• Если отсутствует клинический ответ на лечение после двух последова-
тельных лет терапии.
• Если появляются другие противопоказания к иммунотерапии.
• Если персистируют и нарастают локальные побочные эффекты.
• Если возникают повторные системные реакции.
Педиатрические аспекты
Сублингвальная (с проглатыванием) АСИТ особенно показана детям
ввиду ее большей безопасности и возможности лечения на дому. Однако
еще требуется дополнительное исследование, чтобы установить оптималь-
ные дозы для детей, выяснить особенности хранения аллергенов дома,
лечения во время каникул, при возникновении гастроэнтеритов и т.п.
Хороший профиль безопасности и неинъекционное введение аллергенов
повышают возможности использования этого метода у детей младше 5 лет.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 551
12.12.3. Современные достижения в лечении аллергии
Расшифровка иммунологических механизмов аллергии позволила в
последние годы создать препараты целенаправленного действия, влияющие
на ключевые факторы аллергического воспаления. В качестве мишеней
выступают рецепторы, цитокины, IgE. Подобные препараты-антагонисты
позволяют прерывать процесс острого иммунного ответа на аллерген,
иными словами, изменять иммунопатогенез аллергических заболеваний.
В клинической практике эти препараты относят к категории препаратов
будущего (табл. 12-35).
ГЛАВА 12
Таблица 12-35. Современные препараты в аллергологии
Точки приложения действия современных препаратов Современные препараты в аллергологии Заболевания
FceRI Анти-ГсеБ1-моноклональные антитела Аллергический ринит, бронхиальная астма
igE Анти-1дЕ-моноклональные антитела; омализу- маб (ксолар*) Аллергический ринит бронхиальная астма
ИЛ-4 Рецептор ИЛ-4 (Nuvance - растворимые рецепторы ИЛ-4) Бронхиальная астма
ИЛ-5 Меполизумабр (моноклональные антитела к ИЛ-5) Бронхиальная астма
Интегрин Антагонисты интегрина VLA4; антагонисты интегрина R411 и др. Бронхиальная астма
Лейкотриены Ингибиторы лейкотриенов: зафирлукаст, мон- телукаст (аколат*. сингулар*) Бронхиальная астма
Нейрокинин Антагонисты нейрокинина Бронхиальная астма
Вопросы для самоконтроля
• Перечислите основные принципы лечения аллергических заболева-
ний.
• Назовите блокаторы ^-рецепторов гистамина 1-го и 2-го поколения.
• Перечислите критерии выбора блокатора ^-рецепторов гистамина.
• Приведите сравнительную характеристику блокаторов Нх-рецепторов
гистамина 1-го и 2-го поколения.
• Каковы возрастные ограничения назначения блокаторов Hj-рецеп-
торов гистамина?
• Что такое АСИТ?
• Какие аллергенные продукты используют при проведении АСИТ?
• Перечислите основные виды локальной АСИТ.
• Назовите показания и противопоказания к проведению подкожной
АСИТ.
ЧАСТЬ 2
552 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Как проводят оценку результатов АСИТ?
• Какие виды лечебных аллергенов применяют в России для проведения
подкожной АСИТ?
• Какие виды аллергенов используют для проведения локальной АСИТ?
• Каковы показания и противопоказания для сублингвальной АСИТ?
12.13. ПРОФИЛАКТИКА АЛЛЕРГИИ
В западном мире за последние 40 лет распространенность аллергии и БА
увеличилась в 2-3 раза и приняла эпидемический характер. Однако эпиде-
миологические исследования показывают большие различия в распростра-
нении БА и аллергии в различных странах.
В современных рекомендациях по профилактике аллергии сделан акцент
на первичную профилактику аллергенспецифической IgE-опосредованной
сенсибилизации, являющейся основой атопической аллергии и БА.
Первичная профилактика. Целью является предупреждение возник-
новения аллергического заболевания. Профилактику нужно применять,
когда можно добиться следующих результатов:
• эти меры должны быть успешными у большинства людей в популя-
ции;
• они должны быть известны как минимум 50% пациентам;
• они не должны быть дорогостоящими.
Эти меры в детской практике необходимо начинать еще до рождения
ребенка.
Вторичная профилактика. Целью является ранняя диагностика и
адекватное лечение возникшего аллергического заболевания, способные
повлиять в дальнейшем на возникновение других форм аллергии, в том
числе БА, АР и других в более позднем возрасте.
Третичная профилактика — профилактика повторных обострений
аллергического заболевания, чему способствует адекватное и своевремен-
ное лечение возникших обострений.
Факторы, влняющне на развнтне аллергии
Генетические
В настоящее время генетические маркеры IgE-сенсибилизации не извест-
ны. Имеются потенциальные кандидаты генов, вовлекаемых в патогенез
аллергии. В силу этих причин ни для врачей, ни для пациентов нет реко-
мендаций, основанных на результатах генетических исследований, но такие
рекомендации могут быть разработаны в будущем.
Известно, что:
• атопическая конституция — фактор риска для развития IgE-
сенсибилизации;
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 553
• у людей, в семьях которых есть больные атопией, повышен риск раз-
вития аллергических заболеваний, таких, как аллергическая астма,
аллергический риноконъюнктивит, атопическая экзема;
• риск развития аллергического заболевания определенного органа-
мишени (ЛОР-органы, органы дыхания, кожа и др.) возникает в соот-
ветствии с семейной историей этого заболевания;
• доля генетических факторов в развитии IgE-сенсибилизации и семей-
ного анамнеза IgE-опосредованных заболеваний составляет 70-80%.
В будущем идентификация вариантов генетической предрасположенно-
сти к аллергическим заболеваниям может способствовать ранней иденти-
фикации специфической чувствительности младенцев и предупреждать IgE-
сенсибилизацию благодаря удалению контакта с аллергеном. Генетический
скрининг в раннем возрасте можно использовать для профилактики аллер-
гических заболеваний. Выявление в будущем факторов окружающей среды,
служащих триггерами аллергических заболеваний, позволит модифициро-
вать эти факторы. Понимание генетических вариантов ответа на лечение и
возможная идентификация генов расширят терапевтические возможности.
Факторы окружающей среды
На настоящий момент считают общепризнанным, что факторы окру-
жающей среды могут инициировать и аггравировать аллергические забо-
левания и БА:
• курение беременной затрудняет развитие легких у плода и увеличивает
риск возникновения кашля у младенцев;
• пассивное курение является причиной развития кашля у младенцев и
осложняет течение БА. Все дети должны быть ограждены от табачного
дыма;
• устранение контакта с аллергеном может только частично предупре-
дить IgE-сенсибилизацию. Устранение аллергенов — трудновыполни-
мая задача;
• на первом году жизни детей, у которых высок риск развития аллергии
(при наличии аллергических заболеваний у родителей-атопиков),
полезно предотвратить контакт с домашними животными и клещами
домашней пыли;
• некоторые респираторные инфекционные заболевания в раннем воз-
расте (например, коклюш и респираторно-синцитиальный бронхио-
лит), так же как и некоторые формы гастроэнтерита, могут ускорить
развитие аллергических заболеваний, в том числе БА;
• наряду с относительным урежением инфекционных заболеваний
(желудочно-кишечных и респираторных), особенно в раннем возрасте,
может усиливаться развитие аллергических заболеваний (возможно
отражение «гигиенической концепции аллергии»).
ГЛАВА 12
ЧАСТЬ 2
554 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
В будущем потребуются исследования, изучающие роль факторов окру-
жающей среды в распространенности аллергии, эффективность сбаланси-
рованной диеты беременной и кормящей женщины, эффективность эли-
минации аллергенов в первичной и вторичной профилактике и лечении
аллергических заболеваний (третичная профилактика), защитную роль
контакта с аллергеном в первый год жизни ребенка, роль поллютантов (озон,
оксид азота и др.) в развитии аллергических заболеваний и их аггравации.
Ранние иммунологические влияния
В настоящее время известны факторы, в той или иной мере способные
объяснить иммунопатологические процессы, происходящие у детей с
риском развития аллергии.
• Аллергенспецифичное программирование Т-хелперов начинается в ран-
нем возрасте и продолжается в последующем. Это программирование
напрямую управляется пищевыми и ингаляционными аллергенами.
• Ранний контакт с высококонцентрированными пищевыми и ингаляцион-
ными аллергенами обычно приводит к развитию высокодозовой толерант-
ности, которая, в свою очередь, защищает ребенка от IgE-сенсибилизации.
Постнатальное развитие аллергенспецифического ответа изменяется под
действием Thl-лимфоцитов, которые реагируют в ответ на микробные
антигены, отсутствующие в микроокружении плода.
• Ранняя экспозиция низкого уровня ингаляционных аллергенов в
отсутствие влияния микробных факторов может послужить триггером
низкодозовой толерантности, что вызывает ослабление иммунного
ответа Thl-типа и поляризацию в сторону ТЬ2-ответа. В связи с этим
может увеличиваться риск развития IgE-сенсибилизации.
В будущем следует изучить ряд вопросов, пока не нашедших объяснения.
Наиболее важные из них:
• безопасная стратегия «интервенции» аллергенов у младенцев с высо-
ким риском развития аллергии;
• роль факторов питания в развитии иммунной и дыхательной системы
у младенцев;
• возможность индукции постнатальной высокодозовой толерантно-
сти к ингаляционным аллергенам путем использования высоких доз
аллергенов;
• подавление функций ТЬ2-клеток в ранней стадии развития аллергии с
помощью новых антагонистов (против IgE, ИЛ-4, ИЛ-12 и др.) в виде
монотерапии или в комбинации с АСИТ;
• изучение механизмов взаимодействия между респираторной аллерги-
ей и респираторной инфекцией у младенцев в дальнейшей реализации
БА, а также роли антивирусной терапии респираторно-синцитиальной
инфекции в предупреждении БА у детей раннего возраста.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 555
Превентивные меры в развитии аллергических заболеваний
Первичная профилактика
• Исключение курения или вдыхания табачного дыма, особенно в тече-
ние беременности и в раннем детстве (степень доказательности В).
Курение должно быть исключено также и на рабочих местах.
• Устранение сырости в домах (степень доказательности С) и снижение
содержания поллютантов в воздухе помещений.
• Исключительное грудное кормление ребенка до 4-6 мес (степень дока-
зательности В). Специальных диет для кормящей матери не требуется
(степень доказательности А).
• Снижение экспозиции к ингаляционным аллергенам у детей раннего
возраста с высоким риском развития аллергии (аллергены клещей
домашней пыли, тараканов, домашних животных — степень доказа-
тельности В).
• Элиминация сенсибилизирующих и высокоирритантных агентов в
профессиональной окружающей среде (степень доказательности С).
Вторичная профилактика
• Лечение атопического дерматита/экземы у младенцев и детей, что спо-
собствует предупреждению развития респираторной аллергии (степень
доказательности D).
• Лечение заболеваний верхних дыхательных путей для снижения риска
развития БА (степень доказательности D).
• Уменьшение численности в доме клещей домашней пыли, домашних
животных или тараканов способствует профилактике аллергических
заболеваний у детей раннего возраста.
• Уход из профессии, если профессиональные факторы вызывают раз-
витие симптомов профессиональных аллергических заболеваний.
Третичная профилактика
• У младенцев с аллергией на коровье молоко необходимо исключить
из питания протеины коровьего молока. В этом случае рекомендуют
использовать гипоаллергенные продукты.
• Пациенты с БА, риноконъюнктивитом или атопическим дермати-
том, имеющие аллергию к антигенам внутри помещений (аллергенам
клещей домашней пыли, тараканов, домашних животных), с целью
улучшения контроля за симптомами заболевания и профилактики
обострений должны элиминировать эти аллергены или снизить экспо-
зицию к ним.
• Цель фармакотерапии — подавление аллергического воспаления (сте-
пень доказательности А).
• Исключение приема ацетилсалициловой кислоты и других НПВС у
чувствительных к ним пациентов.
ГЛАВА 12
ЧАСТЬ 2
556 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Информация для пациентов по практическим мерам снижения
содержания аллергенов в окружающей среде
Снижение численности клещей домашней пыли
• Основные требования:
О регулярная (каждые 1-2 нед) стирка постельных принадлежностей
при температуре 55-60 °C (при такой температуре клещи погибают);
о стирка подушек в горячей воде (55-60 °C). Использование специ-
альных защитных материалов для наволочек, матрацев, одеял;
проветривание помещений для снижения загрязненности воздуха;
снижение влажности до 50% и исключение условий для повышения
влажности.
• Дополнительные требования:
О использование качественных вакуумных очистителей воздуха;
О влажная уборка помещений;
о замена ковровых покрытий линолеумом или деревянными полами
(могут быть легко очищены);
О удаление занавесок, штор, лишней мягкой мебели в спальне;
Ъ удаление мягких игрушек из спальни; их стирка при 55-60 °C или
замораживание в холодильнике для уничтожения клещей домашней
пыли;
О исключение пребывания животных в спальне;
& выдерживание матрацев, подушек, ковров и т.п. на солнце не меньше
3 ч, поскольку клещи домашней пыли чувствительны к действию
солнечного света.
Удаление аллергенов тараканов
• Эрадикация тараканов с помощью соответствующих инсектицидов.
• Устранение трещин в полах и вдоль плинтусов.
• Удаление остатков пищи.
• Контроль влажности.
• Мытье полов с детергентами для удаления аллергенов.
• Регулярная чистка постели, штор, одежды, поскольку они могут быть
контаминированы.
Удаление пыльцы растений
• Обеспечение механических барьеров для контакта с пыльцой, а именно:
о следует закрывать окна во время пика пыления (вечером пыльцы в
воздухе меньше);
О нужно использовать солнцезащитные очки для предупреждения
попадания пыльцы в глаза;
О следует использовать маску для носа и рта во время пика пыления;
О- пациенты с аллергией на пыльцу растений не должны косить траву;
О по возможности нужно использовать кондиционирование воздуха.
АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ 557
Удаление аллергенов животных (снижение концентрации аллергенов
животных внутри помещений)
• Если возможно, найти другой дом для животного и не приносить в дом
новых животных.
• Не допускать животных в спальню и, если возможно, держать их вне
дома.
• Нужно проводить регулярную чистку матрацев, ковров и других вещей
с помощью вакуумных пылесосов.
• Следует менять одежду перед выходом в школу/на работу, если вы
перед этим контактировали со своим животным (лошадью, кошкой,
собакой).
Удаление аллергенов плесени (внутри помещений)
• Поддержание влажности в помещениях в пределах 50%.
• Вентиляция, кондиционирование воздуха.
• Использование специальных антифунгицидных средств для удаления
плесени в ванной комнате и на других поверхностях.
• Замена ковров на твердые покрытия, замена обоев на покраску стен.
• Вне помещений: не стричь траву поздним летом, когда споры плесени
находятся в гниющих растениях.
Вопросы для самоконтроля
• Какие меры относят к первичной, вторичной и третичной профилакти-
ке аллергических заболеваний?
• Назовите факторы, влияющие на развитие аллергии.
• Перечислите факторы окружающей среды, способствующие возникно-
вению аллергических заболеваний.
• Какова роль иммунологических механизмов в формировании аллер-
гии у детей раннего возраста?
• Какие меры контроля окружающей среды необходимо соблюдать для
профилактики обострений аллергических заболеваний?
ГЛАВА 12
Глава 13
Ургентные формы в клинической
иммунологии и аллергологии
В клинической практике всё чаще выявляют тяжелые и очень
тяжелые формы заболеваний у пациентов с аллергией, причем эти
ургентные формы могут быть вызваны разными аллергенами либо
носить псевдоаллергический характер.
К ургентным формам аллергических и иммуноопосредованных
заболеваний в настоящее время относят:
• анафилактический шок (АШ);
• ангиоотек;
• генерализованную крапивницу;
• астматический статус;
• острые токсико-аллергические реакции на лекарственные сред-
ства (ОТАР): многоформная экссудативная эритема (МЭЭ),
синдром Стивенса-Джонсона, синдром Лайелла;
• сывороточную болезнь.
13.1. АНАФИЛАКСИЯ
Термин «анафилаксия» был введен в 1902 г. Портье и Рише (Portier
и Richef). Под анафилаксией понимают системную немедленную
реакцию гиперчувствительности, причиной которой является IgE-
опосредованное выделение медиаторов из тучных клеток и базофи-
лов в ответ на поступление аллергенов. Крайнее проявление анафи-
лаксии — АШ, при котором происходит резкое падение артериаль-
ного давления. Анафилаксию выявляют с частотой 1:10 000 человек,
причем с летальным исходом — 1:1 000 000 человек.
В отличие от анафилаксии анафилактоидная реакция —
He-IgE-опосредованная реакция, имеющая сходные с анафилак-
сией клинические проявления и способная возникнуть при при-
менении радиоконтрастных агентов, ацетилсалициловой кислоты,
опиоидов и др.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 559
Анафилактический шок как крайнее проявление анафилаксии вклю-
чает кардиоваскулярный коллапс, а также кожные, респираторные или
гастроинтестинальные симптомы.
По тяжести течения выделяют 4 степени анафилаксии, из которых 3-я и
4-я степени относят к тяжелым. Анафилаксия 3-й степени тяжести включа-
ет различные симптомы: кардиоваскулярный коллапс, аритмию, тяжелый
бронхоспазм. При 4-й степени все вышеуказанные симптомы нараста-
ют вплоть до остановки сердечной деятельности (клиническая смерть).
Летальную анафилаксию диагностируют как 5-ю степень тяжести.
Основные этиологические факторы анафилаксии: пища, лекарственные
средства, латекс, укусы насекомыми, парентеральное введение препаратов
(например, 0-лактамных антибиотиков). Известны случаи анафилаксии на
гетерогенные антисыворотки, гормоны (инсулин, адренокортикотропный гор-
мон, вазопрессин). Синдром бронхоспазма — наиболее частое проявление ана-
филаксии на орехи. По данным эпидемиологических исследований, в 15% слу-
чаев анафилаксию вызывают пищевые аллергены, в 62% - лекарственные,
в 11% — инсектные. В патогенезе анафилаксии и анафилактоидных реакций
принимают участие различные медиаторы тучных клеток и базофилов.
Таблица 13-1. Клинико-патофизиологическая роль медиаторов тучных клеток
ГЛАВА 13
Медиаторы тучных клеток и базофилов Патофизиологическое действие медиаторов Клинические проявления
Гистамин, продукты метабо- лизма арахидоновой кислоты (лейкотриены, тромбоксан, простагландины, фактор, акти- вирующий тромбоциты) Спазм гладкой мускулатуры, секреция слизи, вазодилатация, увеличение проницаемости сосудов, активация болевых рецепторов, склеивание тром- боцитов, активация и хемотак- сис эозинофилов Шумное дыхание, крапивница и ангиоотеки, покраснение кожи, зуд, диарея и абдоми- нальные боли, гипотензия, ринорея, бронхорея
Нейтральные протеазы: трип- таза, химаза, карбоксипептида- за, катепсин G Разделение компонентов ком- племента, хемоаттрактанты для эозинофилов и нейтрофи- лов. дальнейшая активация и дегрануляция тучных клеток, расщепление нейропептидов, превращение ангиотензина I в ангиотензин II Возможно улучшение симп- томов при воздействии на превращение ангиотензина I в ангиотензин II путем инактива- ции нейропептидов
Протеогликаны: гепарин, хон- дроэтинсульфат Антикоагуляция, подавление комплемента, связывание фос- фолипазы А2, активация кини- нового пути; хемоаттрактанты для эозинофилов, ингибиторы функций цитокинов Могут препятствовать внутри- сосудистому свертыванию, активации комплемента; могут рекрутировать кинины, что увеличивает тяжесть реакции
Хемоаттрактанты: хемокины. факторы хемотаксиса эозино- филов Удерживают клетки в зоне поражения Могут частично отвечать за возврат симптомов в поздней фазе реакции или расширении и затяжной характер реакции
ЧАСТЬ 2
560 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Помимо дегрануляции тучных клеток и базофилов с выбросом медиато-
ров, значительную роль в патогенезе анафилаксии играют другие системы:
кининовая, система комплемента, система свертывания крови.
Классификация анафилаксии, анафилактоидных реакций и вызы-
вающих их причин
Анафилаксия (IgE-опосредованная реакция).
• Лекарственные средства.
• Пища.
• Укусы и ужаления.
Анафилактоидные реакции (псевдоаллергия).
• Прямое дегранулирующее действие на тучные клетки и базофилы.
<> Лекарственные средства.
о Физические факторы — холод, солнце.
Физические упражнения.
& Идиопатические.
• Нарушение метаболизма арахидоновой кислоты.
<> Аспирин.
О НПВС.
• Образование иммунных комплексов.
о При введении гамма-глобулина.
<> Возможно при введении декстрана и альбумина.
• Цитотоксическое действие.
• Трансфузионная реакция на клеточные компоненты.
• Полимедиаторная активация.
Альтернативный путь активации комплемента.
<> Радиоконтрастные вещества.
Факторы, влияющие на выраженность и тяжесть анафилаксии и анафи-
лактоидных реакций.
• Возраст пациентов. Эти состояния у взрослых возникают чаще, чем
у детей, при воздействии одних и тех же агентов. При этом наиболее
частый индуцирующий фактор — радиоконтрастные вещества, компо-
ненты плазмы, анестетики.
• Социально-экономический статус пациентов. Оказалось, что
риск развития анафилаксии повышен у лиц с высоким социально-
экономическим статусом.
• Пол. У женщин чаще возникают реакции на латекс, аспирин, мышеч-
ные релаксанты; у мужчин — на укусы насекомыми.
• Путь введения. При приеме лекарственных средств внутрь реакции
возникают реже и протекают менее тяжело.
• Атопия — фактор риска развития анафилаксии на пищевые аллер-
гены, латекс, анафилаксии физического усилия, идиопатической, на
радиоконтрастные вещества.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 561
Клиническая картина
Клинические проявления анафилаксии разнообразны и затрагивают раз-
личные органы и системы. Частота встречаемости различных симптомов
варьирует.
Частота встречаемости симптомов анафилаксии.
Кожные симптомы (>90%):
О крапивница и ангиоотеки 85-90%;
4 гиперемия 45-55%;
О зуд без сыпи 2-5%.
• Респираторные симптомы (46-60%):
о шумное дыхание, диспноэ 45-50%;
< ангиоотек верхних дыхательных путей 50-60%;
-О риниты 15-20%.
• Головокружение, синкопальные состояния, гипотензия (30-35%).
• Абдоминальные (25-30%):
о тошнота, рвота, диарея, колики.
• Другие:
о головная боль 5-8%;
загрудинная боль 4-6%;
О эпилептический приступ 1-2%.
Симптомы анафилаксии обычно возникают в первые 5-30 мин после
инъекционного введения аллергена. Если антиген поступает внутрь, этот
период удлиняется до часа и дольше. Все симптомы обычно возникают в
пределах первых двух часов от начала реакции, но могут задерживаться до
нескольких часов. У некоторых больных симптомы анафилаксии возника-
ют немедленно после еды, что прогностически неблагоприятно. Показано,
что время возникновения симптомов и их тяжесть взаимосвязаны: более
быстрое развитие симптомов соответствует более тяжелому течению ана-
филаксии.
Выделяют особый вариант течения анафилаксии — так называемую
бифазную анафилаксию — когда симптомы уменьшаются, а затем вновь
усиливаются спустя несколько часов. Эта атака может быть пролонгиро-
ванной и сохраняться в течение нескольких суток. Повторно возникшие
симптомы разнообразны и чередуются с асимптоматическими периодами,
длящимися несколько часов. Бифазную анафилаксию выявляют чаще,
если первоначальное введение эпинефрина было задержано. Также важно
отметить, что при повторных эпизодах бифазной анафилаксии необходимо
вновь вводить эпинефрин, поскольку глюкокортикоиды не могут супресси-
ровать данную реакцию в полном объеме. Каждый эпизод бифазной реак-
ции может оказаться более тяжелым, чем начальный.
ГЛАВА 13
ЧАСТЬ 2
562 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
13.2. ИДИОПАТИЧЕСКАЯ АНАФИЛАКСИЯ
В тех случаях, когда этиологический фактор не может быть установлен,
анафилактическую реакцию обозначают как идиопатическую.
О первых случаях идиопатической анафилаксии было сообщено в 1978 г.
[Бэкал (Bacal), Паттерсон (Patterson), Зейсс (Zeiss)], в этой работе из 21 слу-
чая анафилаксии в 11 причинный фактор установлен не был. Дальнейшие
исследования в разных странах показали, что почти в 2/3 случаев возникает
идиопатическая анафилаксия. В 1996 г. был описан первый фатальный слу-
чай. Показано, что для детей характерна сходная ситуация.
Классификация
По частоте манифестаций:
• с частыми эпизодами (больше 6 эпизодов в год или 2 и больше эпизо-
дов в течение двух месяцев);
• с редкими эпизодами.
По форме:
• А — с ангиоотеком;
• Г — генерализованная.
Варианты:
• глюкокортикоидзависимая (контролируется преднизолоном, но с каж-
дым последующим эпизодом дозу приходится увеличивать);
• злокачественная (для контроля эпизодов требуются высокие дозы
преднизолона);
• другие.
При форме А у пациентов возникают крапивница или ангиоотеки с
поражением верхних дыхательных путей (например, отек гортани, глотки,
языка без других симптомов системной анафилаксии).
При форме Г развиваются крапивница или ангиоотек с бронхоспазмом,
гипотензией, синкопальными или гастроинтестинальными симптомами. У
некоторых пациентов возникает гормонозависимая анафилаксия.
Клиническая картина
Клиническая симптоматика у пациентов, страдающих идиопатической
анафилаксией, отличается от других форм анафилаксии и может включать
ангиоотеки, крапивницу, удушье, прилив крови к лицу, внезапное покрас-
нение шеи и лица, тахикардию, тахипноэ, потерю сознания, рвоту, диа-
рею, гипотензию, стридор, охриплость голоса или дисфагию. Также могут
возникать диспное, зуд, чувство слабости, тошнота, абдоминальные боли.
Крапивница обычно генерализованная с резким зудом, эритемой, уртика-
риями. Ангиоотек, сопровождающий крапивницу, обычно располагается на
лице, веках, губах, половых органах или конечностях. Отек языка и гортани
может привести к жизнеугрожающим состояниям.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 563
Симптоматика со стороны сердца при анафилаксии варьирует и может
быть тяжелой. Тахикардия обычно возникает как компенсаторный меха-
низм при снижении давления в сосудах. Кардиоваскулярный коллапс может
развиваться изолированно без других клинических симптомов поражения
кожи или респираторного тракта.
Скорость появления жизнеугрожающих симптомов варьирует у разных
пациентов. У одних симптомы возникают внезапно и быстро прогрессиру-
ют — от появления первых симптомов до жизнеугрожающей гипотензии,
отека гортани и/или бронхоспазма проходит меньше 10 мин. У других
пациентов между первыми симптомами и развитием жизнеугрожающей
анафилаксии проходит несколько часов. Во время первого эпизода идио-
патической анафилаксии пациент не понимает, что с ним происходит и что
при этом делать, но в дальнейшем, при повторении эпизодов, пациенты
хорошо распознают продромальные симптомы и необходимость экстрен-
ного лечения. Обычно, когда симптомы нарастают медленно, риск жиз-
неугрожающих реакций меньше, чем в случаях быстрого прогрессирования
симптоматики.
Патогенез
До настоящего времени патогенез идиопатической анафилаксии полно-
стью неясен. Существовало несколько теорий, пытавшихся объяснить
развитие заболевания, но все они не получили экспериментального под-
тверждения. В частности, показано, что у больных с идиопатической ана-
филаксией число тучных клеток и базофилов, а также их дегрануляция
не отличаются от таковых у здоровых лиц. Не было установлено у них и
повышения уровня анти-^Е-антител. В последние годы было обнаружено,
что у больных во время эпизодов обострения заболевания (по сравнению с
этими же пациентами в ремиссию) происходит активация мононуклеарных
фагоцитов периферической крови и, соответственно, повышение уровня
активационных маркеров HLA-DR и CD25 на Т-лимфоцитах и CD23 на
В-клетках.
Дифференциальная диагностика
Диагностику идиопатической анафилаксии проводят на основании
исключения других потенциальных причин, способных вызывать анафи-
лаксию.
• Известные причины немедленных генерализованных реакций.
❖ IgE-опосредованные:
- на пищу;
- на лекарственные средства: пенициллины, цефалоспорины;
- на пищевые добавки.
О Анафилаксия физического усилия.
О Пищевая аллергия в сочетании с анафилаксией физического усилия.
ГЛАВА 13
ЧАСТЬ 2
564 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Реакции, индуцированные лекарственными препаратами:
- НПВС, том числе ацетилсалициловой кислотой;
- ингибиторами ангиотензинпревращающего фермента;
- опиатами.
О Реакции, опосредованные радиоконтрастными веществами.
• Наследственный ангиоотек.
О Классическая форма.
- Отсутствие С1-ингибитора.
- Дисфункция С1-ингибитора.
О Приобретенная форма.
- В-клеточные лимфопролиферативные нарушения.
- Аутоантитела к С1-ингибитору.
• Системный мастоцитоз.
• Астма, маскируемая как анафилаксия.
• Недифференцированная соматоформная идиопатическая анафилаксия.
• Смешанная (разнообразная) анафилаксия.
О Панические атаки.
о Богатая гистамином пища, индуцирующая приливы крови к голове
и шее, покраснение лица и шеи.
О Феохромоцитома.
Пища — частая причина анафилаксии. В популяции вероятность раз-
вития таких реакций составляет 1-2%, причем у детей она выше, чем у
взрослых. Основные пищевые аллергены — моллюски, рыба, орехи, моло-
ко, яйца, соя, пшеница. На эти продукты приходится до 90% всех случаев
пищевой анафилаксии. Анафилактические реакции на пищу обычно возни-
кают в течение первых 5-30 мин после еды. Первые симптомы часто прояв-
ляются в виде генерализованного зуда, крапивницы, абдоминальных болей
тошноты, рвоты, диареи. Однако у некоторых пациентов такие симптомы,
как генерализованная крапивница и абдоминальные боли, могут не появ-
ляться в первые 1-2 ч после приема пищи. С повышением чувствительности
к пище анафилактические симптомы усиливаются, включая бронхоспазм,
отек гортани, гипотензию, нарушение сознания, кардиопульмональный
шок. Пища вызывает анафилаксию как IgE-опосредованную реакцию и
может быть диагностирована путем кожного тестирования с соответствую-
щими пищевыми экстрактами.
Физические упражнения индуцируют анафилаксию в результате акти-
вации тучных клеток, обычно происходящей при энергичных упражнени-
ях. Симптомы включают тошноту, рвоту, абдоминальные боли, диарею,
крапивницу, ангиоотеки, отеки гортани, бронхоспазм, респираторный ди-
стресс, шок и потерю сознания. Выделяют 3 типа анафилаксии физического
усилия:
• 1-й тип — упражнения в сочетании с приемом пищи (сельдерея, яблок,
пшеницы, орехов, мяса кур);
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 565
• 2-й тип — прием пищи перед упражнениями;
• 3-й тип — независимо от приема пищи.
У 2/3 пациентов выявляют наследственную отягощенность по атопии
и у 50% пациентов — атопию в анамнезе. У некоторых пациентов могут
развиваться оба типа анафилаксии — идиопатическая и индуцированная
упражнениями.
Лекарственные средства — другая важная причина анафилактиче-
ских реакций. Препараты, такие как р-лактамные антибиотики, могут
вызвать IgE-опосредованный ответ, который обычно возникает в течение
от нескольких минут до часов с момента введения. Ацетилсалициловая кис-
лота и другие НПВС могут вызвать анафилактоидные реакции благодаря
не IgE-опосредованным механизмам, причем тяжелые реакции возникают
в пределах одного часа. Следует отметить, что до возникновения ангио-
отека в ответ на прием ингибиторов ангиотензинпревращающего фермента
пациенты могли использовать указанные препараты в течение нескольких
недель, месяцев и даже лет. Обычно такие отеки развиваются медленно, в
противоположность ангиоотекам, индуцируемым лекарственными сред-
ствами других классов.
Другое заболевание, напоминающее анафилаксию, — наследственный
ангиоотек (НАО) — врожденное аутосомно-доминантное заболевание с
вариабельной пенетрантностью. Оно характеризуется повторными эпи-
зодами ангиоотеков, обычно вовлекающих губы, язык верхние отделы
дыхательных путей. Пищеварительный тракт также может быть вовлечен
в процесс с проявлениями в виде абдоминальных болей, тошноты, диареи.
Эпизодам обычно предшествуют локализованные травмы, например стома-
тологические манипуляции. Отеки обычно без зуда и медленно нарастают.
Это заболевание может быть дифференцировано от анафилаксии путем
лабораторной диагностики и при отсутствии других симптомов анафилак-
сии. При лабораторном исследовании обнаруживают снижение уровня С4,
СН50 и Cl-ингибитора. Выделяют еще 2 формы приобретенного дефицита
Cl-ингибитора. Один — в сочетании с аутоиммунными заболеваниями,
другой — с лимфопролиферативной малигнизацией.
При системном мастоцитозе могут возникать симптомы, напоми-
нающие идиопатическую анафилаксию, поскольку в этот процесс тоже
вовлекаются тучные клетки. Симптомы включают зуд, приливы крови к
голове и шее, покраснение лица и шеи, абдоминальные боли, крапивницу,
гипотензию.
Дифференциальная диагностика анафилаксии и анафилактоидных
реакций
• Анафилактоидные реакции: на экзогенные агенты; физические факто-
ры (упражнения, тепло, холод, солнце), идиопатические.
ГЛАВА 13
ЧАСТЬ 2
566 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Вазодепрессорные реакции: синдром внезапного покраснения лица
и шеи (flush-syndrome), карциноидные опухоли, постменопаузальный
синдром; реакции, вызванные алкоголем, и др.
• «Ресторанные синдромы» в ответ на пищевые добавки, глутамат
натрия, сульфиты, а также индуцированные скумбрией и др.
• Другие формы шока: геморрагический, кардиогенный, эндотоксиче-
ский.
• Повышение эндогенного образования гистамина: системный мастоци-
тоз, пигментная крапивница, базофильная лейкемия, острая промие-
лоцитарная лейкемия, эхинококковые кисты.
• Несоматические заболевания: панические атаки, стридор, синдром
дисфункции голосовых связок, истерические приступы, недифферен-
цированная соматоформная анафилаксия.
• Разные: наследственный ангиоотек, «прогестероновая» анафилаксия,
уртикарный васкулит, феохромоцитома, гипер-^Е-синдром, крапив-
ница, неврологические реакции (эпилепсия), псевдоанафилаксия, син-
дром «красного человека» (ванкомицин).
Большинство состояний, напоминающих анафилаксию, — вазодепрес-
сорные реакции, механизм которых до конца неясен. Предполагают, что
происходит активация сенсорных рецепторов, отвечающих за давление на
стенки сосудов и пародоксальное увеличение ответа вагуса. В результате
возникают симптомы вазодилатации, брадикардии, гипотензии и голово-
кружение. Эти реакции часто развиваются в результате эмоциональных
травм. Симптомы брадикардии отличают эти состояния от анафилаксии.
Кроме того, при вазодепрессорных реакциях не возникают кожные про-
явления, такие как крапивница, ангиоотек или уйюй-синдром (внезапный
прилив крови к лицу, румянец).
Феномен внезапного покраснения лица и шеи (//гюй-синдром) может
возникать при разных состояниях, например при действии никотина, кате-
холаминов, ингибиторов ангиотензинпревращающего фермента, ниацина.
Этот синдром может быть связан с карциноидом, опухолью поджелудочной
железы, медуллярной карциномой щитовидной железы, гипогликемией,
розацеей, феохромоцитомой, приемом алкоголя, постменопаузальными
«приливами», эпилепсией, паническими атаками, системным мастоци-
тозом. Выделяют влажную и сухую формы уйюй-синдрома. При влажной
форме одновременно с поражением появляется пот. Эта форма вовлекает
симпатические холинергические нервы, иннервирующие потовые железы в
коже. Этот тип выявляют у женщин в постменопаузальный период, а также
при употреблении в пищу специй, содержащих капсаицин.
Прямая вазодилатация без стимуляции потовых желез — сухой flush-
синдром — может возникать у больных с карциноидными опухолями,
секретирующими гистамин, калликреин, нейрорецепторы и простагланди-
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 567
ны, серотонин. Эти состояния возможны при опухолях поджелудочной и
щитовидной желез.
Симптомы, напоминающие анафилаксию, могут возникать при употре-
блении в пищу продуктов, содержащих консерванты, красители, пищевые
добавки. Так, глутамат натрия может вызвать покраснение лица, паре-
стезии, слабость, боли в грудной клетке, головную боль, тошноту, рвоту,
потерю сознания. Гйстамин в большом количестве содержится в рыбе
скумбриевых пород.
Во всех случаях, напоминающих анафилаксию, необходимо проводить
тщательные клинические и лабораторные обследования больных.
Лабораторные исследования
Лабораторные исследования в ряде случаев помогают дифференцировать
анафилаксию от других схожих с ней состояний. Для анафилаксии харак-
терно наличие в сыворотке крови гистамина и триптазы. Триптаза в тучных
клетках человека существует в двух формах: а- и p-триптаза. При этом
p-триптаза выделяется только в периоды дегрануляции тучных клеток.
Этот тест позволяет различать системную анафилаксию и мастоцитоз. У
пациентов с анафилаксией в плазме крови и моче выявляют гистамин (или
метаболиты гистамина), а в сыворотке крови — p-триптазу. Уровень гиста-
мина в плазме повышается в первые 5-10 мин и сохраняется повышенным
30-60 мин, а в моче сохраняется повышенным еще более длительный период.
Уровень сывороточной триптазы достигает максимума через 60-90 мин
после появления симптомов анафилаксии и может сохраняться до 5 ч.
Оптимальное время для измерения уровня гистамина в плазме крови — от
10 мин до 1 ч с момента начала анафилактической реакции; а определения
триптазы в сыворотке крови — между 1-ми 2-м часами. В ряде случаев
можно обнаружить только один из этих медиаторов. Так, при карциноме,
феохромоцитоме с развернутой клинической картиной можно выявить
повышение уровня серотонина в крови и 5-гидроксилиндолуксусную кис-
лоту, катехоламины в моче.
Лечение анафилаксии
Лечение должно быть разделено на этапы, предусматривающие немед-
ленные действия, которые следует предпринять сразу после появления
симптомов, и последующие, включающие отбор лекарственных средств в
зависимости от состояния больного. Правильность проведения начальной
терапии может предотвратить фатальный исход.
Поэтапное лечение анафилаксии
• Немедленные действия.
О Оценка состояния.
О Контроль дыхательных путей.
О Фиксация больного (если требуется).
О Быстрая оценка уровня сознания больного.
ГЛАВА 13
ЧАСТЬ 2
568 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Лечение.
О Введение эпинефрина (адреналин).
о Ингаляции кислорода.
О Наложение жгута на конечность для последующего внутривенного
введения препаратов.
• В зависимости от состояния больного на догоспитальном этапе:
<> начинают внутривенное введение препаратов;
О глюкокортикоиды (внутривенно);
О вазопрессоры (внутривенно);
<> блокаторы Hj- и Н2-рецепторов гистамина (внутривенно);
о применяют аминофиллин;
О вводят глюкагон;
О применяют атропин;
о проводят мониторинг электрокардиограммы;
о осуществляют транспортировку пациента в реанимационное отде-
ление больницы.
• Госпитальная стадия.
-О Продолжают антишоковые мероприятия.
<> Проводят лечение осложнений.
Проведение адекватного лечения больных с анафилаксией — трудная
задача.
Лекарственные средства, используемые для лечения анафилаксии и ана-
филактоидных реакций.
• Эпинефрин (адреналин). Начальное средство, требуемые для всех эпи-
зодов; должно быть введено немедленно! Взрослым — 0,1% раствор
по 0,3-0,5 мл внутримышечно. Детям — 0,1% раствор по 0,01 мг/кг
или 0,1-0,3 мл внутримышечно. Можно повторять каждые 10-15 мин.
Если нет ответа на внутримышечное введение и пациент в шоке с симп-
томами кардиоваскулярного коллапса, то препарат вводят внутривен-
но 0,1 мл (0,1 мг) в разведении 1:1000 в 10 мл изотонического раствора
натрия хлорида.
• Блокаторы Hj-рецепторов гистамина — дифенгидрамин. Взрослым —
по 25-50 мг внутримышечно или внутривенно. Детям — 12,5-25 мг
внутрь, внутримышечно, внутривенно. Путь введения зависит от тяже-
сти течения.
• Глюкокортикоиды — гидрокортизон. Взрослым — 0,1-1 г внутривенно
или внутримышечно. Детям — 10-100 мг внутривенно. Можно приме-
нять и другие препараты, например метилпреднизолон, преднизолон
по 30-60 мг.
• Препараты для снятия бронхоспазма. Аэрозольные р-агонисты (аль-
бутерол®, метапротерелонр) — препараты выбора. Дозы как при астме
(0,25-0,5 мг в 1,5-2 мл изотонического раствора натрия хлорида каж-
дые 4 ч). Применяют при бронхоспазме, не отвечающем на эпинефрин.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 569
Аминофиллин — дозы как при астме; редко используют для восстанов-
ления бронхоспазма.
• Восполнение объема циркуляции. Кристаллоиды (изотоничекий рас-
твор натрия хлорида, раствор Рингера). Взрослым — по 1000-2000 мл
быстро. Детям — 30 мл/кг в первый час. Скорость введения титруется
по артериальному давлению; необходимо мониторирование показа-
телей объема крови. Пациентам, принимающим p-блокаторы, может
потребоваться введение большого количества препаратов.
• Вазопрессоры. Допамин — 400 мг в 500 мл; 5% раствор декстрозы вну-
тривенно, скорость 2-20 мг/кг в минуту. Допамин — препарат выбора;
скорость перфузии титруют по данным артериального давления; тре-
буется интенсивное наблюдение за больным.
• Лекарственные средства, применяемые у пациентов, принимающих
p-адреноблокаторы. Атропина сульфат. Глюкагон. Ипратропиум.
Взрослым — 0,3-0,5 мг внутривенно; можно повторять каждые 10 мин
до максимума 2 мг/кг. Начальная доза 1-5 мг внутривенно со скоро-
стью 5-15 мг/мин, титруют по артериальному давлению. Глюкагон,
возможно, как препарат выбора; с атропином его используют для
лечения брадикардии. Может использоваться как альтернатива или в
добавление к p-адренергическим средствам при шумном дыхании.
Пациентам проводят динамическое наблюдение и мониторирование
органов и систем.
Особенности лечения идиопатической анафилаксии
• Обучение пациентов: при первых симптомах идиопатической анафи-
лаксии пациент должен ввести себе в/м 0,3 мл 0,1% эпинефрина, 60 мг
преднизолона, блокаторы Hj-рецепторов гистамина (например, супра-
стин4) и обратиться за медицинской помощью.
• Стартовая доза преднизолона — 40-60 мг/сут в течение 1 нед или до
полного исчезновения симптомов. Может потребоваться увеличение
дозы, длительность терапии может увеличиться до 1-6 нед.
• Назначение блокаторов Hj-рецепторов гистамина.
• Применение симпатомиметиков.
• В случае гормонорезистентных форм могут быть подключены стаби-
лизаторы тучных клеток (кетотифен).
• С целью снижения дозы глюкокортикоидов для достижения ремиссии
можно подключить антилейкотриеновые препараты — монтелукаст
(сингуляр).
Пациенты с идиопатической анафилаксией должны всегда иметь при
себе паспорт больного с указанными диагнозом, методами оказания первой
помощи и лечения.
ГЛАВА 13
ЧАСТЬ 2
570 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
13.3. АНАФИЛАКТИЧЕСКИЙ ШОК
Анафилактический шок (АШ) — самая тяжелая из всех ургентных форм
аллергии. Причиной его могут быть укусы перепончатокрылыми насеко-
мыми, лекарственные средства, продукты питания и др.
АШ — жизнеугрожающее остро развивающееся состояние, сопрово-
ждающееся нарушением гемодинамики и приводящее к недостаточности
кровообращения и гипоксии во всех жизненно важных органах. По меха-
низму развития АШ может быть:
• результатом гиперчувствительности IgE-зависимого типа, при которой
возникновение клинических симптомов не зависит от дозы и способа
введения аллергена;
• АШ по типу анафилактоидной реакции, т.е. неиммунный. Без периода
сенсибилизации; может возникнуть в ответ на первое введение препа-
рата и зависит от его дозы.
Как в первом, так и во втором случае, независимо от начальных меха-
низмов развития, происходит выброс большого количества биологически
активных веществ из тучных клеток и базофилов, что определяет схожие
клинические проявления и обусловливает проведение похожих терапевти-
ческих мероприятий. Следует отметить, однако, что анафилактоидный шок
может протекать несколько легче и быстрее купироваться по сравнению с
анафилактическим.
В зависимости от ведущего клинического синдрома выделяют несколько
вариантов АШ:
• типичный;
• гемодинамический вариант;
• асфиктический;
• абдоминальный;
• церебральный.
У взрослых описан «кардиогенный» вариант, напоминающий острый
инфаркт миокарда с признаками острой коронарной недостаточности.
Выделяют различные типы течения АШ:
• острое злокачественное;
• острое доброкачественное;
• затяжное;
• рецидивирующее;
• абортивное.
Некоторые авторы выделяют 4 степени тяжести АШ: от легкой до крайне
тяжелой.
• Особого внимания заслуживают анафилактические и анафилакто-
идные реакции, появляющиеся в пред- и послеоперационном перио-
де. Выявление и оценку таких реакций осложняет одновременное
использование множества лекарственных средств и бессознательное
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 571
состояние больного. Во время наркоза можно выявить только призна-
ки сердечно-сосудистой недостаточности и обструкции дыхательных
путей. До 70% таких реакций связано с использованием миорелак-
сантов, около 12% возникают при контакте с резиновыми изделиями
(латекс). Анафилактогенной активностью обладают внутривенные
средства для вводного наркоза, препараты опия, плазмозаменители,
протамина сульфат (используют при подключении аппаратов искус-
ственного кровообращения). Следует отметить, что практически все
лекарственные средства, включая глюкокортикоиды, кромоглициевую
кислоту и другие препараты, могут вызвать немедленные генерализо-
ванные анафилактические реакции.
Типичная форма АШ, как правило, развивается очень быстро (через
несколько минут после введения лекарственного средства). Первыми симп-
томами могут быть чувство жара, тошнота, гиперемия кожных покровов,
быстро сменяющаяся резкой бледностью. Это состояние часто сопрово-
ждается возбуждением; возможны судороги, боли в области сердца. При
осмотре выявляют слабый пульс, глухие тоны сердца, снижение артери-
ального давления (в тяжелых случаях определить его не удается); дыхание
поверхностное, частое, с дистанционными хрипами. Иногда возникает
клиническая картина отека легких.
При гемодинамической форме АШ на первый план выступают изменения
кровеносной системы. Появляются боли в сердце, резкое снижение артериаль-
ного давления, слабость пульса или его исчезновение, аритмии, глухость тонов
сердца. Другие клинические симптомы выражены незначительно.
В клинической картине асфиктической формы АШ преобладают симп-
томы острой дыхательной недостаточности, которая обусловлена бронхо-
спазмом, отеком слизистой оболочки воздухоносных путей. Тяжесть состо-
яния больного при этой форме шока определяется степенью выраженности
симптомов дыхательной недостаточности.
Церебральная форма АШ характеризуется преобладанием изменений
вегетативной и центральной нервной системы. При этом возникает пси-
хомоторное возбуждение, чувство страха, нарушение сознания, судороги,
эпилептиформные припадки, развиваются симптомы отека мозга.
Абдоминальная форма проявляется картиной «острого» живота — рез-
кими болями в животе, симптомами раздражения брюшины.
Принципы лечения анафилактического шока
• Прекращение поступления лекарственного средства в организм.
• Купирование острых нарушений функций кровообращения, дыхания
иЦНС.
• Компенсация возникшей адренокортикальной недостаточности.
• Нейтрализация и подавление выработки биологически активных
веществ (гистамина, брадикинина, анафилатоксинов и др.), а также
замедление реакций образования комплексов антиген-антитело.
ГЛАВА 13
ЧАСТЬ 2
572 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Поддержание жизненно важных функций организма, реанимационные
мероприятия.
• Введение прессорных аминов (0,2 мл 0,1% эпинефрина с интервалом
10-15 мин внутримышечно, но не подкожно, поскольку при АШ про-
исходит спазм периферических сосудов).
• Ведение глюкокортикоидов внутримышечно или внутривенно (пред-
низолона 90-120 мг, дексаметазона 8-12 мг; далее глюкокортикоиды
вместе с инфузионной терапией не менее 3 мг/кг в сутки по преднизо-
лону, поскольку в этой дозе глюкокортикоиды проявляют негеномную
активность, но учитывается тяжесть АШ и сопутствующей патологии).
• Восполнение объема циркулирующей крови (полиглюкин*, реополи-
глюкин*, изотонический раствор партия хлорида).
• Антигистаминные препараты следует применять лишь при артериальном
давлении >90 мм рт.ст., за исключением прометазина (пипольфен4).
Посиндромная терапия по показаниям [эуфиллин* (аминофиллин),
противосудорожные средства и др.]. Все больные, перенесшие лекарствен-
ный АШ, должны находиться под наблюдением врача не меньше 2-3 нед,
учитывая возможное абортивное течение и развитие осложнений кровенос-
ной и мочевыделительной систем. Обязательно проведение общего анализа
крови, мочи, электрокардиографии.
Отличительные особенности анафилактического шока
от анафилактоидных реакций
• Возникновения симптомов АШ связано с конкретным аллергеном.
• Возможно появление кожных высыпаний в виде крапивницы, эритемы
и/или ангиоотека; развитие бронхоспазма перед или одновременно с
гемодинамическими нарушениями.
• АШ протекает более тяжело и длительно, чем анафилактоидный шок.
13.4. АСТМАТИЧЕСКИЙ СТАТУС
Астматический статус, по определению А.Г. Чучалина (1997), необычный
по тяжести приступ удушья, резистентный к обычной для больного терапии
бронходилататорами. Причины астматического статуса:
• воздействие массивных доз аллергенов;
• бронхолегочная инфекция;
• ошибки в лечении, а именно: быстрая отмена ингаляционных
глюкокортикоидов, бесконтрольное использование симпатомиметиков
и др.;
• стрессы;
• большая физическая нагрузка.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 573
По механизму развития астматического статуса выделяют
анафилактическую и метаболическую формы. По степени нарушения
дыхательных функций выделяют 3 степени тяжести:
• 1-я — относительная компенсация,
• 2-я — стадия декомпенсации, «немого легкого»;
• 3-я — стадия гипоксической гиперкапнической комы.
В лечении больных применяют системные глюкокортикоиды,
внутривенное введение бронхолитиков, дезагрегационную терапию,
адекватную гидратационную терапию, искусственную вентиляцию легких,
симптоматическое лечение. Летальность при астматическом статусе
достигает 17%.
ГЛАВА 13
13.5. ОСТРАЯ КРАПИВНИЦА, ОБОСТРЕНИЕ ХРОНИЧЕСКОЙ
КРАПИВНИЦЫ
Выраженность клинической симптоматики крапивницы, независимо от
вызвавших ее причин, обусловливает в ряде случаев ургентный характер
течения этого заболевания. К таким признакам относят распространен-
ный характер поражения кожных покровов; наличие обширных,
сливающихся, иногда гигантских, уртикарных элементов с резко
выраженным зудом; нарушение общего состояния больного и появление
симптомов интоксикации; цианотичный оттенок элементов сыпи. Сочетание
крапивницы и ангиоотека возникает почти в 50% случаев, что усиливает
ургентность этого состояния.
В зависимости от локализации ангиоотека выделяют наиболее опасные —
ангиоотеки лица и шеи, требующие немедленного оказания медицинской
помощи.
13.6. ОСТРЫЕ БУЛЛЕЗНЫЕ ДЕРМАТОЗЫ
Миогоформная экссудативная эритема (МЗЗ)
Острое полиэтиологическое заболевание, относимое к ургентным
формам патологии. На сегодняшний день выделяют 2 формы заболевания:
идиопатическую и симптоматическую.
При идиопатической форме, которую некоторые авторы относят к
инфекционной, заболевание возникает как проявление инфекции (вирусом
герпеса, стрептококками). Симптоматическая форма МЭЭ возникает
вследствие аллергии на прием некоторых лекарственных средств, в
ЧАСТЬ 2
574 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
частности антибиотиков либо НПВС, а также в результате обострения
хронических инфекций (тонзиллит), вследствие интоксикаций, ожогов,
переохлаждений и т.д.
В последние годы обнаружена связь МЭЭ с имеющимися у больных
аутоиммунными, системными кожными или гематологическими
заболеваниями. Как правило, идиопатическая форма заболевания
возникает весной и осенью; чаще у взрослых, иногда у детей старшего
возраста и подростков. Для симптоматической (токсико-аллергической
формы) сезонность не характерна. Поражению кожи может предшествовать
короткий продромальный период с симптомами интоксикации, повышением
температуры тела, ознобом, головной болью, болью в суставах. Эти
симптомы могут сохраняться и в период высыпаний. Высыпания возникают
внезапно, локализуются симметрично на тыльной поверхности кистей и
стоп, разгибательных поверхностях предплечий, голеней; реже — на лице,
шее, туловище, ладонях и подошвах. Элементы сыпи полиморфны, но чаще
округлые красные или синюшно-красные четко очерченные пятна и папулы;
центральная часть элементов несколько западает. В центре отдельных
папул возникают пузыри с серозным или геморрагическим содержимым.
При вскрытии пузырей образуются эрозии и корочки. Папулы постепенно
разрастаются к периферии, в результате формируется венчик, а папулы
приобретают вид концентрических фигур (симптом «совиного глаза» или
«кокардообразные» высыпания). Иногда они сливаются друг с другом и
образуются фестончатые бляшки. При засыхании пузырей образуются
корочки. Симптом Никольского отрицательный. Одновременно с кожными
проявлениями у больных может развиваться поражение слизистых оболочек
полости рта, глаз, носа, половых органов. Иногда поражение слизистых
оболочек носит изолированный характер. Характерно поражение красной
каймы губ и слизистой оболочки полости рта с образованием крупных
быстро вскрывающихся пузырей, после вскрытия которых обнажаются
чрезвычайно болезненные эрозии, покрывающиеся серовато-коричневатым
налетом и толстыми коричневыми кровянистыми корками. Кожные
высыпания сопровождаются очень незначительным зудом; чаще больные
жалуются на жжение и болезненность, особенно на пораженных слизистых
оболочках.
Острый период заболевания длится обычно 10-12 сут; содержимое
пузырей подсыхает с образованием корок, пятна бледнеют, возможно
появление легкого шелушения. Выздоровление наступает через 3-4 нед.
Однако у некоторых больных МЭЭ принимает тяжелый характер и, по сути,
переходит в другую стадию — синдром Стивенса-Джонсона.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 575
Рис. 13-1. Многоформная экссудативная эритема, единичные элементы сыпи на тыле
кистей рук. Пациент 24 лет.
ГЛАВА 13
Рис. 13-2. Многоформная экссудативная эритема, поражение красной каймы губ. Тот же
пациент.
576 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Рис. 13-3. Многоформная экссудативная эритема, поражение глаз. Тот же пациент.
13.7. СИНДРОМ СТИВЕНСА-ДЖОНСОНА
Развитие синдрома Стивенса-Джонсона как острой токсико-
аллергической реакции (ОТАР) вызывают, прежде всего, лекарственные
средства в терапевтических дозах (антибиотики, НПВС, сульфаниламиды,
витамины, противосудорожные препараты, вакцины, наркотики).
При отсутствии указаний на связь синдрома Стивенса-Джонсона с
лекарственными препаратами необходимо исключить инфекционно-
аллергический генез заболевания (вирусы герпеса, гриппа, гепатита, ВИЧ,
микоплазмы, р-гемолитический стрептококк группы А, микобактерии, а
также возбудители грибковых и протозойных заболеваний). Описана связь
синдрома Стивенса-Джонсона с онкогематологическими, аутоиммунными
заболеваниями, а также идиопатическая форма.
Клинические проявления этого синдрома можно рассматривать
как продолжение МЭЭ, либо заболевание изначально начинается как
самостоятельное — остро, с повышения температуры тела до 38-39,5 °C
и выше (может сохраняться длительно) и возникновения пятнистых,
пятнисто-папулезных и папулезных высыпаний на верхних и нижних
конечностях, стопах, кистях рук, лице, половых органах, туловище.
Высыпания чаще симметричные. Одновременно происходит поражение
слизистых оболочек, в том числе внутренних органов. Элементы сыпи
принимают вид концентрических фигур, пузыри наполнены серозным или
геморрагическим содержимым, быстро вскрываются, обнажая сплошные
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 577
эрозивные поверхности. Выявляют жжение и боль в местах поражения.
Поражение слизистых может привести к развитию стеноза пищевода,
стриктуры уретры у мужчин, кровотечениям из мочевого пузыря,
вульвовагинитам у женщин.
Поражение глаз в виде блефароконъюнктивита и иридоциклита может
в итоге привести к потере зрения (до 3-10% больных). Полиорганные
поражения, возникающие при синдроме Стивенса-Джонсона,
затрагивающие кровеносную, дыхательную, мочевыделительную
и центральную нервную системы, в конечном итоге не только
отражают тяжесть процесса, но и обусловливают прогноз заболевания.
Неблагоприятные прогностические факторы: возраст больных старше
40 лет, быстропрогрессирующее течение заболевания с первоначальной
зоной поражения кожного покрова больше 10%, тахикардия выше
120 ударов в минуту. Летальность достигает 3-15%.
13.8. СИНДРОМ ЛАЙЕЛЛА (ТОКСИЧЕСКИЙ
ЭПИДЕРМАЛЬНЫЙ НЕКРОЛИЗ)
Это наиболее тяжелая форма токсико-аллергической реакции на лекар-
ственные препараты. Заболевание начинается внезапно через несколько
часов после приема препарата с появления лихорадки, озноба, тахикардии,
головной боли, слабости, иногда рвоты. На коже (особенно в складках, у
естественных отверстий), на слизистых оболочках рта, половых органах,
конъюнктиве глаз возникают покраснение и пузыри с серозным или гемор-
рагическим содержимым. Пузыри дряблые, вялые, сморщенные. На месте
вскрытия пузырей обнажается эрозивная поверхность. Внешний вид напо-
минает ожоговых больных. При прикосновении эпидермис сморщивается
и сползает (симптом «сползания эпидермиса»), причем сползание эпидер-
миса выявляют не только в зоне поражения, но и на видимо здоровой
коже. Эрозивные поверхности обильно выделяют экссудат, что приводит
к быстрому обезвоживанию организма. В условиях присоединения вто-
ричной инфекции появляются симптомы поражения внутренних органов,
главным образом почек, легких, сердца.
При благоприятном исходе заболевания процесс начинает стихать с
6-10 суток, однако критическим может быть не только ранний период, но
и конец первой недели заболевания. Смертность при синдроме Лайелла
может достигать 30-70%.
В отечественной и зарубежной литературе реакции на лекарственные
средства, проявляющие МЭЭ, синдромом Стивенса-Джонсона и синдромом
Лайелла в последнее время принято рассматривать как стадии одного и того
же процесса, отличающиеся разной степенью распространенности, глубиной
поражения кожи и слизистых оболочек (Латышева Т.В. и др., 2007).
ГЛАВА 13
ЧАСТЬ 2
578 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
13.9. ОСТРЫЕ ТОКСИКО-АЛЛЕРГИЧЕСКИЕ РЕАКЦИИ
В клинической практике зачастую возникают ситуации, когда у больного
с тяжелым распространенным поражением кожи и слизистых оболочек,
интоксикацией четко поставить диагноз не представляется возможным.
Отечественные авторы предложили клинический термин «острые
токсико-аллергические реакции» (ОТАР) — симптомокомплекс, разви-
вающийся на фоне приема лекарственного препарата в терапевтической
дозе. Имеет в основе иммунные и неиммунные механизмы развития и
клиническую картину кожного поражения разной степени выраженности
(Латышева Т.В. и др., 2007). Для ОТАР характерно острое начало, выражен-
ная интоксикация, поражение кожи и слизистых оболочек прогрессирую-
щего характера, поражение внутренних органов.
Лечение острых токсико-аллергических реакций
• Отмена причинно-значимого препарата. Диета неспецифическая гипо-
аллергенная, а при 3-4-й степени тяжести — употребление протертой
пищи или парентеральное питание.
• Применение системной глюкокортикоидной терапии в высоких дозах
(200-1500 мг/сут по преднизолону). Тем не менее препараты подби-
рают индивидуально. В связи с возможностью развития септических
осложнений и перфораций тканей при 3-4-й степени тяжести ОТАР
гормонотерапия должна быть минимально необходимой. Пик септи-
ческих осложнений приходится на 12-14-е сутки заболевания, и дозы
глюкокортикоидов к этому периоду необходимо снизить до минималь-
но возможных или полностью их отменить.
• Всем больным ОТАР показана интенсивная инфузионная терапия,
направленная на дезинтоксикацию и выведение причинно-значимого
аллергена. Суточный объем вводимых растворов при 3-4-й степени
тяжести заболевания — до 6-8 л под контролем центральной гемоди-
намики, диуреза и кислотно-щелочного состояния. У детей — до 30-50
мл/кг массы в сутки.
• Заместительная терапия препаратами крови (альбумин, нативная
плазма) или иммуноглобулином (сандоглобулин®, пентаглобин4, окта-
гам* и др.) показана при 3-4-й степени тяжести ОТАР.
• На 7-10-е сутки заболевания возможно развитие агранулоцитоза,
однако встречаются больные, у которых изменения кроветворения
выявляют с первых дней заболевания. В этом случае необходима
заместительная терапия свежей донорской кровью или лейкоцитарной
массой.
• При 3-4-й степени тяжести ОТАР, особенно у детей, с первых дней
заболевания показана антибактериальная терапия широкого спектра
действия с учетом данных анамнеза пациента, а в дальнейшем — с уче-
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 579
Рис. 13-4. Острая токсико-аллергическая реакция. Пациентка 72 лет.
ГЛАВА 13
Рис. 13-5. Острая токсико-аллергическая реакция. Лекарственная аллергия. Ребенку 1 г.
2 мес.
ЧАСТЬ 2
Таблица 13-2. Клиническая характеристика острых токсико-аллергических реакций на лекарственные средства (Латышева Т.В., оо
Мясникова Т.Н., 2007) °
Клинические проявления Степени тяжести
легкая I средняя II тяжелая III крайне тяжелая IV
Лихорадка, °C 37,5-38 38-39 39 >39; возможна злокачественная гипертензия
Поражение кожи Генерализованная эритема папулезно-эритематозные высыпания Генерализованная много- формная эритема, везику- лы, единичные буллы Генерализованная многоформ- ная эритема с преобладанием везикулезно-буллезного пора- жения с серозным содержимым, эпидермальный некролиз до 10% Множественные сливные буллы с серозно-геморрагическим содержимым, эпидермаль- ный некролиз >10%, симптом Никольского положительный
Поражение слизистых оболочек Не отмечено Поверхностные эрозии сли- зистых оболочек <30% Эрозивные поражения всех слизистых оболочек >30%. Возможны желудочно-кишечные кровотечения и кровотечения из мочевого пузыря Язвенно-некротические пораже- ния слизистых оболочек >30%. Возможны желудочно-кишечные кровотечения и кровотечения из мочевого пузыря
Поражения печени и под- желудочной железы Не отмечены Выявляют кратковременное повышение активности трансаминаз Значительное изменение показа- телей трансаминаз, уровня белка, билирубина, С-реактивного белка, холестерина и др. Значительное изменение всех показателей
Поражение мочевыдели- тельной системы Не отмечено Протеинурия, гематурия (кратковременно) Протеинурия, гематурия, цилин- друрия. лейкоцитурия и другие проявления, развитие почечной недостаточности Развитие почечной недостаточ- ности
Поражение кровеносной системы Не отмечено Не отмечено Нарушения гемодинамики не выражены Выраженные нарушения гемоди- намики вплоть до развития шока
Поражение центральной нервной системы Не отмечено Не отмечено Проявления интоксикационного поражения центральной нервной системы
Общий анализ крови Лейкоцитоз до 10x109 клеток в литре крови, лим- фоциты в норме Лейкоцитоз до 15x109 кле- ток в литре крови, сдвиг в сторону палочкоядерных форм, токсическая зерни- стость, лимфоциты в норме Лейкоцитоз или лейкопения, сдвиг до юных форм, токсическая зер- нистость, лимфопения, анемия и др.
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Таблица 13-3. Дифференциальная диагностика буллезных дерматозов (Верткин А.Л., Дадыкина А.В., 2006)
Показатель Многоформная экссудативная эритема Синдром Стивенса-Джонсона Синдром Лайелла
Начало Проявления острых респира- торных вирусных инфекций Как правило, продромальный гриппоподобный период Может начаться внезапно
Время появления поражения Обычно через 1-2 нед после начала лихорадочного периода Через 4-6 сут после начала лихорадки Высыпания более определенно связаны с приемом лекарственных средств; сыпь появляется через 24-48 ч
Поражение кожи и слизистых оболочек Папулезные высыпания с пузырьком в центре в виде «мишени». Эпидермального некролиза и эксфолиации кожи нет Высыпания полиморфные, красные, с темно-фиолетовым центром; со склонностью к слиянию и изолирован- ные; появляются пузыри; эпидермальный некролиз <10% поверхности; симптом Никольского отрицательный Сыпь сначала эритематозно-папулезного характера, затем в виде крупных с дряблой, морщинистой поверх- ностью и тонкими стенками пузырей; легко вскрывают- ся, обнажая поверхность, напоминающую ожог кипят- ком (симптом «обваренной кожи»). Эпидермальный некролиз и эксфолиация кожи >30%. Симптом Никольского резко положительный. Поражение затра- гивает слизистые оболочки глаз, полости рта, половых органов, внутренних органов
Типичная локали- зация Симметричные высыпания на конечностях и лице; редко — на туловище Генерализованные высы- пания на лице и туловище. Преимущественное поражение конечностей, особенно тыла стоп и кистей Специфичность локализации отсутствует, чаще высыпа- ния возникают в области лица, груди, спины и спуска- ются ниже
Поражение слизи- стых оболочек Может не быть. Если имеет- ся, то вызывает поверхност- ные эрозии Выступает на первый план поражение слизистых обо- лочек полости рта и половых органов. Эрозии обширные, могут предшествовать высы- паниям на коже Возможны тяжелые язвенно-некротические поражения слизистых оболочек с развитием стриктур
Поражение других органов и систем Стоматит, кератоконъюнкти- вит. передний увеит Различные поражения вну- тренних органов (почек моче- выводящих путей, глаз, пище- вода, сердца) и центральной нервной системы Тубулярный некроз и острая почечная недостаточность, эрозии слизистых оболочек трахеи, бронхов, пищева- рительного тракта; интоксикация центральной нервной системы, судороги
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 581
ei vavuj
Показатель Многоформная экссудативная эритема Синдром Стивенса-Джонсона
Прогноз Выздоровление через 2-4 нед Смертельный исход в 3-15% случаев, нередко при развитии менингоэнцефалита и мио- кардита. Регресс клинических симптомов через 2-3 нед
Лечение Отмена лекарственных средств, симптоматическая терапия. В тяжелых случа- ях — назначение глюкокор- тикоидов (спорно) Отмена лекарственных средств, переливание жидко- стей, применение глюкокорти- коидов (спорно), профилакти- ка инфекций
ЧАСТЬ 2
Окончание табл. 13-3 g
----------------------------------------------- ho
Синдром Лайелла
Смертельный исход в 30% случаев, чаще в ранний пери-
од в результате гиповолемии и сепсиса
Ведение как ожоговых больных
КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ и аллергологии 583
том чувствительности микрофлоры кожи и слизистых оболочек. При
необходимости проводят противогрибковое лечение.
• Плазмаферез, гемосорбцию, гемодиализ можно использовать строго
по показаниям и при стабильной гемодинамике. При этом необходима
адекватная заместительная терапия плазмой или иммуноглобулинами.
• Симптоматическая терапия: антигистаминные препараты, антикоагу-
лянты, дезагреганты, диуретические препараты, ингибиторы протеаз,
сердечные гликозиды и т.д.
• Индивидуальный уход за больным в специально созданных стериль-
ных условиях открытым способом. При наличии экссудативного ком-
понента кожу необходимо подсушивать и дезинфицировать раствора-
ми, не применяя мазевых основ. Обработку слизистых оболочек глаз
нужно проводить 6 раз в сутки (трижды массаж с гидрокортизоновой
мазью и колларголом, трижды закапывание дексаметазоновых глаз-
ных капель). Обработка полости рта реополиглюкином\ перекисью
водорода, дезинфицирующими растворами после каждого приема
пищи, а при начале эпителизации — маслом шиповника и облепихи.
Обработку слизистых оболочек мочеполовой системы проводят дезин-
фицирующими растворами, солкосериловой и гидрокортизоновой
мазями 3-4 раза в сутки.
• Все больные в дальнейшем требуют тщательного обследования и дис-
пансерного наблюдения.
13.10. СЫВОРОТОЧНАЯ БОЛЕЗНЬ
Сывороточная болезнь возникает в результате отложения циркулирую-
щих иммунных комплексов на стенках кровеносных сосудов и в тканях, что
вызывает повышение сосудистой проницаемости и развитие воспалитель-
ных процессов, в том числе гломерулонефритов, артритов.
Болезнь является осложнением сывороточной терапии, когда пациенты
получают массивные дозы антител (например, при введении противодиф-
терийной или противостолбнячной сыворотки). Как правило, лечебные
антитоксические сыворотки гетерогенны (лошадиные) и у некоторых
пациентов продуцируются антитела к белкам животного происхождения.
Приблизительно через неделю после введения сыворотки образуются
антитела, поступающие в кровь, связывающие антиген и формирующие
иммунные комплексы. Поскольку реакция протекает в условиях избытка
антигена, образуются иммунные комплексы небольших размеров. Эти
комплексы довольно медленно удаляются системой мононуклеарных фаго-
цитов и длительно персистируют в циркуляции. По мере повышения титра
антител формируются более крупные комплексы, откладывающиеся в
тканях, и затем быстро разрушаемые. Небольшие комплексы активируют
ГЛАВА 13
ЧАСТЬ 2
584 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
комплемент менее эффективно, чем крупные, поскольку компонент С1
для активации должен связываться с Fc-фрагментами нескольких молекул
антител. Вслед за образованием комплексов происходит резкое снижение
гемолитической активности системы комплемента.
По мере развития реакции и сдвига ее в сторону избытка антител может
происходить увеличение размеров комплексов, что приводит к их более
эффективному выведению. Иммунные комплексы после активации компле-
мента опсонизируются СЗЬ и удаляются из организма (особенно клетками
печени и селезенки). Элиминация опосредована рецепторами СЗЬ (CR1).
CR1 экспрессируется на эритроцитах, причем каждый эритроцит содержит до
700 рецепторов. Эритроциты связывают иммунные комплексы, удаляют их из
плазмы и транспортируют в печень и селезенку, где они поглощаются фикси-
рованными тканевыми макрофагами. Такие процессы происходят в норме.
У больных с сывороточной болезнью могут происходить нарушения
на любом этапе. Этому способствуют повышение проницаемости сосудов,
дефицит компонентов комплемента, дефекты фагоцитов, характер самих
комплексов и т.д. Клинические признаки сывороточной болезни обусловле-
ны отложением комплексов антиген-антитело-СЗ на базальной мембране
мелких сосудов кожи, почечных клубочков и других участков тела.
Перечень препаратов, вызывающих при определенных обстоятельствах
сывороточную болезнь у пациентов, включает:
• гетерологические белковые препараты — антитоксические сыворотки,
вводимые для профилактики и лечения инфекционных заболеваний
(например, против столбняка, дифтерии, газовой гангрены, ботулизма);
• гомологичные белковые препараты, изготавливаемые из крови чело-
века (цельная плазма, иммуноглобулин, альбумин, антилимфотиче-
ская сыворотка), цельная кровь;
• лекарственные средства, содержащие белки животного происхождения
(инсулин, адренокортикотропный гормон);
• вакцины и анатоксины;
• яды змей, насекомых.
Один из факторов, способствующих развитию сывороточной болезни, —
количество применяемого препарата. В частности, при введении 100 мл
лошадиной сыворотки сывороточная болезнь развивается в 90% случаев, а
при введении 10 мл — только в 10% случаев. Важную роль в возникновении
сывороточной болезни играет степень очистки применяемого препарата.
Клинические симптомы сывороточной болезни появляются через
1-3 нед после первичного введения сыворотки. В этом случае в основе
патогенеза лежит образование иммунных комплексов, а шоковыми органа-
ми являются сосуды. При повторном введении сыворотки реакция протека-
ет значительно тяжелее; чаще развивается типичный АШ. Инкубационный
период при этом длится от нескольких секунд до суток.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 585
Клиническая картина сывороточной болезни довольно многообразна.
Первые симптомы заболевания появляются на месте введения сыворотки
в виде уплотнения, побледнения кожи; реже — гиперемии. Это сигнал к
прекращению дальнейшего введения препарата в связи с возможным раз-
витием сывороточной болезни.
Иногда заболевание начинается с полиморфной сыпи, возникающей
сначала в месте введения сыворотки, затем распространяющейся по всему
телу. Сыпь может быть скарлатино- и кореподобной, в виде крапивницы,
иногда с геморрагическим синдромом; сопровождается резким зудом и
сохраняется от нескольких часов до нескольких недель. Появление сыпи
сопровождается увеличением лимфатических узлов (иногда этот симптом
предшествует появлению сыпи). Сперва поражаются регионарные, затем
в процесс вовлекаются все остальные лимфатические узлы. Они становят-
ся мягкими, подвижными. Повышенная температура держится долго: от
нескольких суток до недель, носит интермиттирующий характер. На пике
высыпания появляются отеки ушных раковин, половых органов, которые
быстро проходят.
Очень часто в поражение вовлекаются крупные и мелкие суставы.
Характерна их болезненность, гиперемия кожи над ними, небольшая отеч-
ность, ограничение подвижности. Всё это напоминает поражение суставов
при ревматизме.
При сывороточной болезни могут возникать изменения во внутренних
органах. Со стороны кровеносной системы возможны тахикардия или бра-
дикардия, снижение артериального давления, миокардиты, перикардиты,
васкулиты; со стороны органов дыхания — бронхоспазм; со стороны ЦНС —
полиневриты, энцефаломиелиты.
При анализе периферической крови на ранних этапах заболевания выяв-
ляют лейкоцитоз, сменяющийся лейкопенией, лимфоцитозом, эозинофи-
лией, тромбоцитопенией.
Тяжесть состояния зависит от выраженности клинических проявлений.
Выделяют легкую, среднетяжелую и тяжелую формы.
• При легкой форме наблюдают скудность всех симптомов (сыпь воз-
никает только в месте введения сыворотки, увеличиваются только
регионарные лимфоузлы, температура тела выше 38 °C не поднимает-
ся, реакции со стороны внутренних органов нет).
• При среднетяжелой форме сыпь обильная, сливная, с геморрагическим
компонентом, резким зудом, сохраняется до одного месяца. Увеличены
все группы лимфатических узлов, температура тела повышается до
40 °C. Выявляют реакцию со стороны внутренних органов.
• При тяжелой форме характерна клиническая картина АШ.
Некоторые авторы, в зависимости от длительности и течения заболева-
ния, выделяют острую форму сывороточной болезни (от нескольких дней
ГЛАВА 13
ЧАСТЬ 2
586 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
до месяца) и хроническую, сопровождающуюся периодическими обостре-
ниями.
Лечение сывороточной болезни
Лечение сывороточной болезни зависит от степени ее тяжести. При лег-
ком течении заболевания лечение чаще амбулаторное (введение антигиста-
минных препаратов, глюкокортикоидов в низких дозах коротким курсом),
при среднетяжелой и тяжелой формах лечение проводят стационарно.
Больным рекомендуют постельный режим до снятия симптомов инток-
сикации; глюкокортикоиды 2-4 мг/кг по преднизолону внутривенно до
улучшения состояния; трасилол* внутривенно капельно; аминокапроновую
кислоту (под контролем свертывающей системы крови); гепарин для связы-
вания циркулирующих иммунных комплексов; блокаторы Н^рецепторов
гистамина.
Вопросы для самоконтроля
• Какие аллергические заболевания могут быть отнесены к ургентным?
• Что такое анафилаксия и анафилактоидные реакции?
• Назовите медиаторы тучных клеток и базофилов, вовлеченные в раз-
витие анафилаксии.
• Какова классификация анафилаксии и анафилактоидных реакций?
• Перечислите факторы, влияющие на тяжесть анафилаксии.
• Опишите клинические проявления анафилаксии.
• Что такое идиопатическая анафилаксия?
• Какова классификация идиопатической анафилаксии?
• Дифференциальная диагностика анафилаксии, в том числе идиопати-
ческой.
• Каковы особенности лечения идиопатической анафилаксии?
• Принципы лечения анафилаксии и анафилактоидных реакций.
• Что такое анафилактический шок?
• Какие виды анафилактического шока вам известны?
• Опишите типичную форму анафилактического шока.
• Перечислите основные принципы лечения анафилактического шока.
• Каковы клинические проявления и механизмы развития астматиче-
ского статуса?
• Какие заболевания относят к категории острых токсико-аллергических
реакций?
• Опишите механизмы и клинические проявления многоформной экс-
судативной эритемы.
• Каковы причины развития и особенности клинических проявлений
синдрома Стивенса-Джонсона?
• Перечислите дифференциально-диагностические признаки синдрома
Лайелла.
УРГЕНТНЫЕ ФОРМЫ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ 587
Приведите клиническую характеристику острых токсико-аллергичес-
ких реакций по степеням тяжести.
Каковы основные принципы лечения острых токсико-аллергических
реакций?
Что является причиной развития сывороточной болезни и каковы
механизмы ее развития?
Опишите клинические проявления сывороточной болезни.
Каковы критерии тяжести сывороточной болезни?
ГЛАВА 13
Глава 14
Основы иммунотерапии
Иммунотерапия — способ лечения и предупреждения заболе-
ваний человека лекарственными и другими средствами, направ-
ленными на усиление, подавление или замещение функций
иммунной системы.
В соответствии с рекомендациями WHO/IUIS/IAACI (Всемирной
организации здравоохранения, международных иммунологичес-
ких обществ) выделяют специальные формы лечения и профилак-
тики в клинической иммунологии.
• Иммуностимуляция (иммунокоррекция, иммуномодуляция).
• Иммуносупрессия.
• Заместительная терапия.
• АСИТ.
• Вакцинация, иммунизация.
На сегодняшний день больным с иммунными нарушениями
показаны разные виды иммунотерапии в зависимости от нозологи-
ческой формы заболевания, стадии процесса, возраста и т.д.
Показания к иммунотерапии:
• первичные и приобретенные (вторичные) иммунодефициты;
• аллергопатология;
• аутоиммунные заболевания;
• онкологические заболевания (в том числе лимфопролифера-
тивные);
• инфекционные заболевания;
• состояния после аллотрансплантации (в том числе при реак-
ции «трансплантат против хозяина»);
• заболевания, сопровождающиеся нарушением регенерации;
• другие.
Основные принципы иммунотерапии:
• выявление нарушенного звена в иммунной системе (по клини-
ческим и лабораторным показателям);
• применение соответствующих иммунотропных средств;
• проведение клинического и иммунологического контроля
эффективности лечения;
ОСНОВЫ ИММУНОТЕРАПИИ 589
• оценка отдаленных результатов лечения;
• регистрация и анализ побочных эффектов иммунотропных средств.
Средства, используемые для проведения иммунотерапии, иными слова-
ми, иммунотропные лекарственные средства, — препараты, лечебный
эффект которых связан с их преимущественным или селективным действи-
ем на иммунную систему человека. По механизму воздействия на иммун-
ную систему выделяют несколько групп иммунотропных лекарственных
средств (Хаитов Р.М., Пинегин Б.В., 2005).
• Иммуномодуляторы — лекарственные средства, восстанавливаю-
щие функции иммунной системы. Их действие зависит от исходного
состояния иммунной системы пациента, а именно, они нормализуют
пониженные и повышенные иммунные показатели.
• Иммуностимуляторы преимущественно усиливают иммунный от-
вет, доводя пониженные показатели до нормы; активируют иммун-
ные реакции или отдельные их звенья, как поврежденные, так и непо-
врежденные.
• Иммунодепрессанты — лекарственные средства, подавляющие
иммунный ответ. Применяют при аутоиммунных и опухолевых забо-
леваниях, при трансплантации.
В настоящее время общепризнанной классификации иммунотропных
лекарственных средств не существует, что, вероятно, связано с широким
спектром действия этих препаратов и трудностями в выборе основного кри-
терия их эффективности. В связи с этим ниже будут приведены основные из
существующих классификаций (Ковальчук Л.В. и др., 2008).
14.1. КЛАССИФИКАЦИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ
• Иммуномодуляторы.
о Эндогенные:
- пептиды тимуса (тимозин, тималин*, тактивин*, тимоптин*, тимо-
ген* и др.);
- пептиды костного мозга (миелопид*);
- цитокины: ИЛ-2 (ронколейкин*), ИФН-ар [реаферон* (интер-
ферон альфа-2Ь), виферон*, роферон* (интерферон альфа-2а)
и др.], ИЛ-1 (бетаферон*), колониестимулирующий фактор (лей-
костим*), естественный комплекс цитокинов (суперлимф*) и др.;
- иммуноглобулины внутривенные (пентаглобин*, имбиоглобинр,
октагам*, сандоглобулин*® и др.).
О Экзогенные:
- препараты на основе бактерий, вирусов, грибов, растений и т.п.
(бронхомунал, рибомунил*, бестим*, имудон* и др.).
ГЛАВА 14
ЧАСТЬ 2
590 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
<> Синтетические (аналоги эндогенных иммуномодуляторов, иммуно-
модуляторы направленного синтеза, известные препараты со свой-
ствами иммуномодуляторов): полиоксидоний* (N-оксидированное
производное полиэтиленпиперазина), ликопид* (глюкозаминил-
мурамилдипептид — ГМДП), иммунофанр (гексопептид: Arg-a-
Asp-Lys-Val-iyr-Arg), натрия нуклеинат (производное дрожжевой
РНК), синтетические пептиды, полученные на основе миелопептида
(фракции МП-1, МП-2, МП-3, МП-4, МП-5, МП-6 и др.).
о Другие: агонисты TLR и других рецепторов врожденного имму-
нитета, интерфероногены (пирогенал*, продигиозан*, полудан* и
др.), витамины (С, А, Д), адаптогены, препараты, содержащие цинк,
селен, и многие другие микроэлементы.
• Иммуносупрессоры.
О Антиметаболиты (торможение синтеза РНК и ДНК вследствие
включения в обмен нуклеотидов) — азатиоприн*, метотрексат,
6-меркаптоэтанол.
Алкилирующие соединения (присоединение алкилирующих групп к
ДНК, нарушение репликации) — циклофосфамид, циклофосфан*.
v Алкалоиды (блок митоза, нарушение цитоскелета опухолевых кле-
ток) — винбластин, винкристин.
О Антибиотики (связываются с ДНК, образуя стойкий комплекс,
вызывают фрагментацию ДНК) — блеомицин, дактиномицин.
О Глюкокортикоиды (вызывают множественные эффекты) — предни-
золон, дексаметазон и др.
<> Циклоспорины:
- обратимо блокирующие кальцийзависимый белок кальцийнев-
рин — циклоспорин А, сандиммун неорал*;
- обратимо блокирующие кальцийзависимый белок циклофил-
лин — такролимус (элидел*);
- рапамицинр.
❖ Антитела и их конструкты (химерные антитела, антитело + токсин,
гуманизированные антитела и др.) — анти-СПЗ, анти-CDS, анти-
CD40 и др. Антитимоцитарная сыворотка и др. Антитела к ФНО-а,
растворимые рецепторы ФНО-а.
Новые подходы к иммунотерапии: генотерапия, трансплантация,
цитокинотерапия
Генотерапия как новый подход в иммунотерапии
Генная терапия — перспективное направление в лечении иммунодефи-
цитов. С помощью специального вектора можно ввести нормальный ген
пациенту или перенести нормальный ген в предварительно изолированные
от пациента стволовые клетки, а затем провести аутологичную трансплан-
тацию этих клеток (таким образом удается добиться приживления клеток
основы иммунотерапии 591
с восстановленной иммунологической функцией). Например, у больных
ТКИД с дефицитом аденозиндезаминазы (АДА) присутствует мутация гена
АДА в положении 304 (замена лейцина на аргинин), что приводит к инак-
тивации фермента. В дефектный по репликации ретровирус встраивают
нормальный ген АДА и переносят в клетки костного мозга больного ТКИД,
начинающие продуцировать нормальный фермент. Отмечен положитель-
ный лечебный эффект от трансфекции нормального гена АДА. Генная тера-
пия разработана для некоторых форм ТКИД. Перспективно применение
генной терапии и при других иммунодефицитных синдромах.
Трансплантация костного мозга, обогащенного фракцией стволо-
вых клеток (из периферической или пуповинной крови). Применяют при
ТКИД, в онкогематологии, при апластической анемии, лучевой болезни,
отдельных формах аутоиммунной патологии и др. Донорами чаще стано-
вятся родственники. Тщательный подбор донора и реципиента осущест-
вляют по типированию HLA и в последнее время по минорным антигенам
гистосовместимости (mHAg). Клетки костного мозга вводят внутривенно.
До операции пересадки проводят элиминацию Т-клеток у реципиента, а
после пересадки для профилактики отторжения или реакции «трансплан-
тат против хозяина» назначают иммуносупрессивную терапию (например,
циклоспоринами).
Цитокинотерапия. В лечении могут использовать монопрепараты
цитокинов (ИЛ-2, ИЛ-3, ИЛ-8, ИЛ-12, КСФ, интерфероны, ТФР-р и др.)
для системного применения; топической цитокинотерапии (суперлимф*);
антагонисты цитокинов (антагонист рецептора ИЛ-1, растворимые рецеп-
торы ФНО-а и др.); антитела против цитокинов или их рецепторов (анти-
CD25, анти-ИЛ-1, анти-ФНО-а).
Вакцины лечебные и профилактические
• Классические (с адъювантами или без них).
О Микроорганизмы: убитые и живые, ослабленные.
о Фрагменты микроорганизмов, синтетические пептидные эпитопы.
Рекомбинантные формы.
• Форсифицированные вакцины.
о Природные или синтетические аналоги в комбинации с иммуномо-
дуляторами, например вакцина гриппол, состоящая из антигенов
вируса гриппа и полиоксидония; комплекс антигена с цитокинами.
• ДНК-вакцины. Получение и перенос гена в экспрессионную систему,
продуцирующую антиген.
• Вакцины на основе дендритных клеток (ДК): получение фракций ДК
путем культивирования in vitro моноцитов периферической крови
нагрузка их антигеном (чаще связанным с опухолью), введение нагру-
женных антигеном ДК аутологичному больному.
ГЛАВА 14
ЧАСТЬ 2
592 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Классификация иммуиомодуляторов (Хаитов Р.М., Пииегии Б.В., 2005)
• По происхождению.
>> Микробные.
- Естественные (рибомунил*, бронхомуналр, иммудон*, ИРС-19®).
- Синтетические (ликопид*).
<> Тимические.
- Естественные (тактивин, тимоптин, тимостимулин®).
- Синтетические (тимоген*, имунофан*).
<> Костномозговые.
- Естественные (миелопид*).
- Синтетические (серамилр).
<> Цитокины.
- Естественные (суперлимф*).
- Рекомбинантные (ронколейкин, беталейкин, лейкомакс®, нейпо-
ген*).
< Нуклеиновые кислоты.
- Естественные (натрия нуклеинат, деринат*).
- Синтетические (полудан*).
< Растительные (иммунал*).
Химически чистые.
- Низкомолекулярные (галавит*, гепон*, глутоксим*, диуцифонр,
аллоферон*).
- Высокомолекулярные (полиоксидоний*).
• Интерфероны и индукторы интерферона.
о Интерфероны.
- Естественные (интерферон лейкоцитарный из донорской крови
человека).
- Рекомбинантные а-2в (реальдирон*, интрон*, бетаферон*, вифе-
рон*), а-2а (роферон-А*).
<> Индукторы интерферонов (амиксин*, арбидол*, циклоферон*, полу-
дан*, неовир*, курантил; полифенолы растительного происхожде-
ния — мегасинр, кагоцел*, рагосинр, газолидонр).
В связи с успехами в области биотехнологии и клеточных технологий
авторы предлагают и другие варианты классификаций, созданные на осно-
ве указанного выше принципа деления препаратов по их происхождению с
добавлением вновь разработанных лекарственных средств.
Главные мишени действия иммуномодуляторов
Фармакологическое действие иммуиомодуляторов
• Микробного происхождения. Мишень — фагоциты. Под действием
иммуиомодуляторов происходит усиление фагоцитоза и внутрикле-
точного киллинга поглощенных бактерий, усиление образования про-
воспалительных цитокинов, участвующих в инициации клеточного и
ОСНОВЫ ИММУНОТЕРАПИИ 593
гуморального иммунитета, и, как результат, — усиление синтеза анти-
тел и активация антигенспецифических Т-хелперов и Т-киллеров.
• Тимического происхождения. Мишень — Т-лимфоциты. Стимуля-
ция дифференцировки и пролиферации предшественников Т-клеток
в зрелые Т-лимфоциты, нормализация иммунорегуляторного индекса
CD4/CD8, усиление образования цитокинов. Опосредованно проис-
ходит повышение функциональной активности клеток врожденного
иммунитета (нейтрофилов, моноцитов/макрофагов, NK-клеток).
• Костномозгового происхождения. Мишень — В-лимфоциты.
Усиление митотической активности клеток костного мозга и диффе-
ренцировка их в зрелые В-лимфоциты.
• Цитокины. Оказывают многогранный эффект на клетки, участвую-
щие в воспалении, регенерации, иммунном ответе (врожденном и при-
обретенном).
• Химически чистые. Воздействуют на все звенья иммунной системы.
Основные механизмы действия иммунотропных средств:
• стимулирование дифференцировки иммунных клеток за счет влияния
на систему гемопоэза (колониестимулирующие факторы);
• взаимодействие иммунотропных средств с рецепторами иммунных
клеток;
• стимулирование или угнетение секреции цитокинов;
• формирование специфического противоинфекционного иммунитета:
активного (вакцины), пассивного (сыворотки, иммуноглобулины);
• заместительная терапия (препараты тимуса);
• сочетанное иммунокорригирующее действие и прямое воздействие на
антиген (противовирусное действие).
Опыт использования иммунотропных препаратов в медицинской прак-
тике насчитывает несколько десятков лет. За этот период шло накопление
информации о клинико-иммунологической эффективности, показаниях
и противопоказаниях к их назначению, возможности монотерапии либо
сочетания в комплексе с другими лекарственными средствами и т.д. До
настоящего времени не сформулированы общепризнанные рекомендации
по использованию ряда иммунотропных средств. Более того, активно про-
должаются дискуссии по критериям, согласно которым препарат можно
считать иммунотропным. В связи с этим при назначении препаратов, воз-
действующих на иммунную систему человека, необходимо руководство-
ваться принципами применения иммунотропных средств.
ГЛАВА 14
ЧАСТЬ 2
594 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
14.2. ПРИНЦИПЫ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ
СРЕДСТВ
В настоящее время в медицинской практике широко используют имму-
нотропные препараты. В связи с этим возникает необходимость разра-
ботки основных принципов их применения. В наиболее полной мере эти
принципы представлены в работах отечественных авторов (Хаитов Р.М.,
Пинегин Б.В., 2005).
I. Иммунопрофилактика
• Специфическая — вакцинация детей и взрослых в соответствии с
Национальными календарями прививок (вакцины против гепатита А,
гепатита В, коклюша, дифтерии, столбняка, кори, паротита, краснухи,
гемофильной инфекции, менингококковой и пневмококковой инфек-
ции, бешенства, клещевого энцефалита, брюшного тифа, ветряной
оспы, папилломавирусной инфекции и др.).
• Неспецифическая — интерфероны, индукторы интерферонов, адапто-
гены, антиоксиданты, витамины.
II. Системная иммунотерапия
• Пассивная (например, применение иммуноглобулинов с заместитель-
ной целью).
• Активная — большинство иммунотропных препаратов активно влияют
на разные звенья иммунной системы.
III. Местная иммунотерапия — локальное применение иммунотроп-
ных средств (интерфероны, деринат* интраназально, на язвы, суперлимф*
местно и др.).
IV. Аллергенспецифическая иммунотерапия (АСИТ) — используют
при лечении аллергических заболеваний.
V. Применение иммуномодуляторов у больных с недостаточной
противоинфекционной защитой (иммунодефициты):
• в комплексной терапии одновременно с антибиотиками, противогриб-
ковыми, противопротозойными или противовирусными средствами;
• в виде монотерапии при проведении иммунореабилитационных меро-
приятий, в частности, при неполном выздоровлении после перенесен-
ного острого инфекционного заболевания;
• раннее назначение в комплексной терапии (желательно с первого дня
применения химиотерапевтических этиотропных средств);
• иммуномодуляторы, действующие на фагоцитарное звено иммунитета.
Можно назначать больным как с выявленными, так и не выявленными
нарушениями иммунного статуса, т.е. на основании клинической кар-
тины;
• при применении иммуномодуляторов целесообразно проводить имму-
нологический мониторинг;
основы иммунотерапии 595
• у практически здорового человека снижение иммунных показателей
не является обязательным основанием для назначения иммуномоду-
лирующей терапии.
Соблюдение указанных принципов назначения иммунотропных препа-
ратов позволяет добиться стабилизации хронических процессов, замедле-
ния их прогрессирования, улучшения качества жизни пациентов. Следует
отметить, что иммунотерапия наиболее эффективна в комплексе лечебно-
профилактических мероприятий, а не как монотерапия. При вторичной
иммунной недостаточности наиболее важно установление причины иммун-
ных нарушений и обязательное проведение этиотропного лечения с после-
дующим либо одновременным использованием иммунотропных средств. В
клинической практике важно, что иммунотропные препараты в большин-
стве случаев хорошо сочетаются с другими лекарственными средствами
(антибиотиками и др.). Контроль эффективности иммунотерапии проводят
на основании клинических данных, результатов катамнестического наблю-
дения. Что касается исследования иммунного статуса, то нужно помнить,
что нормализация иммунных показателей может по времени не совпадать с
клиническим улучшением. В связи с этим необходимо проведение монито-
ринга иммунных показателей.
14.3. ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ИММУНОТРОПНЫХ
СРЕДСТВ
Иммуноглобулины для внутримышечного введения донорские
Показания:
• пассивная иммунизация при контакте с больными гепатитом А, ветря-
ной оспой, коклюшем, менингококковой инфекцией, корью, краснухой;
• гипоиммуноглобулинемия (IgGi);
• идиопатическая тромбоцитопеническая пурпура;
• хронический лимфолейкоз.
Схемы и дозы: детям и взрослым с целью профилактики гепатита А
назначают 0,02 мл/кг, краснухи — 0,55 мл/кг, кори — 0,25 мл/кг, ветряной
оспы — 0,6-1,2 мл/кг однократно.
При дефиците IgG первоначальная доза насыщения составляет 1,3 мл/кг
до достижения нормального уровня IgG. Затем поддерживающая доза —
0,2-0,6 мл/кг каждые 3-4 нед.
Внутривенное введение таких препаратов запрещено. Форма выпу-
ска — ампулы по 1,5 мл.
Иммуноглобулины для внутривенного введения (ВВИГ)
В настоящее время выделяют несколько поколений внутривенных имму-
ноглобулинов (Онищенко Г.Г., Алешкина В.А., 2002).
ГЛАВА 14
ЧАСТЬ 2
596 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• I поколение (расщепленные ферментами): молекулы иммуногло-
булинов химически или ферментативно повреждены, не имеют функ-
ционального Fc-фрагмента. Иммуноглобулин человека нормальный
(ИмБио, Россия), иммуновенин* (Иммунопрепарат, Россия).
• II поколение (химически модифицированные): сохранена функ-
ция Fc-фрагмента, но не в полном объеме; низкая степень очистки —
интраглобин*, пентаглобин*.
• III поколение («мягкое фракционирование»): функция Fc-фраг-
мента полностью сохранена; высокоочищенные — эндобулин*®.
• IV поколение (обработка при кислом значении pH): функция
Fc-фрагмента полностью сохранена; высокоочищенные, в виде готово-
го раствора для инфузии; четыре метода инактивации вирусов — окта-
гам*, гамиммун Н*, интратект*.
Для практических целей целесообразно использование классификации
иммуноглобулинов для внутривенного введения, основанной на составе
препаратов:
• стандартные (поливалентные) иммуноглобулины; содержат антитела
класса IgG различной специфичности;
• препараты, содержащие антитела класса IgG, обогащенные антителами
классов IgM и IgA;
• гипериммунные препараты, содержащие значительно более высокие
концентрации специфических антител класса IgG против определен-
ных возбудителей.
Таблица 14-1. Иммуноглобулины для внутривенного введения, зарегистрированные и
разрешенные к применению в России (2006)
Торговое название препарата. Международное
Фирма-изготовитель непатентованное название
Стандартные (поливалентные) иммуноглобулины для внутривенного введения
Интраглобин Ф (Biotest Pharma Gmbh, Германия); интратект* (Biotest Pharma Gmbh. Германия); иммуноглобулин нормальный человека для внутривенного введе- ния (Имбио, Россия); гамимун Н (Malegris Biotherapeutics inc, США); И.Г. Вена Н.И.В (Kedrion S.p.A, Италия); хумаглобин (leva, Венгрия); октагам* (Oktapharma AG, Австрия); иммуновенин (Микроген НПО ФГУП Иммунопрепарат, Россия); габриглобин (АПФ, Россия); эндобулин*® (BaxterAG, Австрия) Иммуноглобулин человече- ский нормальный
Иммуноглобулины для внутривенного введения, обогащенные антителами IgM, IgA
Пентаглобин* (Biotest Pharma Gmbh, Германия) Иммуноглобулин чело- века нормальный (IgG + IgM + lgA+)
основы иммунотерапии 597
ГЛАВА 14
Окончание табл. 14-1
Торговое название препарата. Фирма-изготовитель Международное непатентованное название
Специфические (гипериммунные) иммуноглобулины для внутривенного введения
Неоцитотект (Biotest Pharma Gmbh, Германия) Иммуноглобулин человека против цитомегаловируса (содержит в 2 раза больше антител к цитомегаловирусу, чем цитотект*)
Неогепатект (Biotest Pharma Gmbh, Германия) Иммуноглобулин человека против гепатита В
Механизмы иммуномодулирующего действия иммуноглобулинов для
внутривенного введения очень разнообразны и по времени разделяются на
быстрые и отдаленные.
Быстрые эффекты:
• нейтрализация антигена;
• нейтрализация циркулирующих антител по механизму идиотип-
антиидиотипического взаимодействия;
• блокада Fc-рецепторов на макрофагах;
• блокада классического пути активации комплемента (ингибирование
компонентов комплемента С1, СЗ, С4);
• элиминация циркулирующих иммунных комплексов, диссоциация их
отложений в тканях;
• модуляция образования провоспалительных цитокинов.
Отдаленные эффекты:
• подавление синтеза алло- и аутоантител (по механизму обратной
связи);
• изменение ТЫ/ТЬ2-баланса в сторону Thl-клеток.
Обязательные требования, предъявляемые к иммуноглобулинам для
внутривенного введения, — вирусная безопасность и эффективность.
Показания к назначению иммуноглобулинов для внутривенного
введения:
• первичные и вторичные иммунодефициты;
• иммунная тромбоцитопеническая пурпура;
• тяжелые инфекционные заболевания;
• профилактика инфекций после трансплантации органов;
• синдром Гийена-Барре (восходящий полирадикулоневрит);
• демиелинизирующие заболевания и др.
Схемы и дозы
При лечении больных с иммунодефицитами доза препарата составляет
0,1-0,4 г/кг 1 раз в 3-4 нед, длительно, иногда пожизненно; при тяжелых
инфекциях может понадобиться назначение более высокой дозы препарата
ЧАСТЬ 2
598 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
(до 0,5-1,0 г/кг в неделю) до достижения клинического эффекта; при тром-
боцитопенической пурпуре — 0,4-1,0 г/кг в сутки в течение 2-5 сут, затем
0,4-1,0 г/кг 1 раз в 3-6 нед.
Препараты иммуноглобулинов, зарегистрированные в России
• Иммуноглобулин (IgG). Порошок для инфузионного раствора во
флаконах по 500 мг, 1, 3, 6 г.
• Интраглобин (IgG). Раствор 50 мг/мл в ампулах по 10,20 мл; во фла-
конах по 50,100 мл.
• Октагам* — 5% раствор во флаконах по 50,100, 200 мл.
• Пентаглобин* — раствор 50 мг/мл в ампулах 10, 20 мл; флаконах по
20, 100 мл. Пентаглобин* — первый и единственный поливалентный
иммуноглобулин человека, обогащенный IgM в виде 5% раствора.
Отличается от обычных иммуноглобулинов для внутривенного вве-
дения наличием IgM, повышенной активностью в отношении эндо- и
экзотоксинов, способствует нейтрализации бактерий и токсинов путем
усиления фагоцитоза. Рекомендуют применять при сепсисе и септиче-
ском шоке.
• Сандоглобин, порошок во флаконах по 1, 3, 6 г.
• Цитотект — первый иммуноглобулин, содержащий повышенный
уровень антител к ЦМВ, в 10 раз превышающий их уровень в нор-
мальном иммуноглобулине; 10% раствор для внутривенного введения.
Применяют при ЦМВ-инфекции у новорожденных и пациентов других
возрастных групп, для профилактики ЦМВ-инфекции при лечении
цитостатиками и после трансплантации почек, костного мозга, печени.
При ЦМВ-инфекции у новорожденных назначение цитотекта — един-
ственная этиотропная терапия.
• Гепатект — первый иммуноглобулин человека против гепатита В;
10% раствор для внутривенного введения. Используют для экстрен-
ной профилактики гепатита В после контакта с инфицированным
материалом (кровь, слизь и т.п.); а также у новорожденных от HBsAg-
положительных матерей в первые 12 ч жизни в дозе 0,5 мл внутримы-
шечно однократно. Для лечения острого и хронического гепатитов не
применяют.
• Тимоглобин (порошок, 25 мг); АЛГ-Фрезениус (раствор) — имму-
ноглобулин антилимфоцитарный — иммунодепрессант, препятствую-
щий отторжению трансплантата и используемый для профилактики
отторжений и реакции «трансплантат против хозяина»; а также при
апластической анемии. Назначают взрослым — 0,06 мл/кг (3-5 мл)
2 раза через 30 сут.
• Иммуноглобулиновый комплекс (КИП) — препарат для энтераль-
ного применения, сухой порошок. Активирует иммунокомпетентные
клетки слизистой пищеварительного тракта, усиливает фагоцитоз,
ОСНОВЫ ИММУНОТЕРАПИИ 599
синтез комплемента, секрецию противовоспалительных цитокинов.
Применяют в лечении детей с кишечной инфекцией и дисбактерио-
зами, с 1-го месяца до 14 лет per os по одной дозе 1-2 раза в день в
течение 5 сут.
• Иммуноглобулин антирабический специфический — пассивная
иммунизация после укуса бешеными животными. Назначают детям и
взрослым по 20 МЕ/кг внутримышечно однократно с одновременным
введением антирабической вакцины.
• Иммуноглобулин человека против клещевого энцефалита (про-
изводство России, Австрии) — экстренная профилактика и лечение
клещевого энцефалита после укуса клещом. Назначают внутримышеч-
ное введение не позднее четырех суток после укуса в дозе 0,1 мл/кг в
первые 24 ч, 0,2 мл/кг через 48-96 ч.
• Иммуноглобулин антистафилококковый человека применяют
для лечения стафилококковых инфекций органов дыхания, носоглот-
ки, кожи, почек и т.д. Назначают 5 МЕ/кг массы (не меньше 100 ME)
от 1 до 5 введений внутримышечно.
• Иммуноглобулин противостолбнячный человека — профилактика
столбняка у невакцинированных пациентов при глубоких загрязнен-
ных ранах. С целью профилактики детям до 7 лет назначают по 4 ЕД/кг;
детям старше 7 лет и взрослым — по 250 ЕД. При лечении столбняка
суммарная доза для детей — 500-3000 ЕД, взрослых — 3000-6000 ЕД.
• Иммуноглобулин антиротавирусный человека, донорский —
лечение ротавирусной инфекции у детей до 3 лет. Назначают per os по
1,5-3,0 мл 2 раза в сутки до еды в течение 4-5 сут.
• Иммуноглобулин против вируса Varicella zoster (ветряная оспа)
назначают новорожденным при высоком риске их заражения от мате-
рей, больных ветряной оспой; контактировавшим с больным ветряной
оспой беременным; онкобольным, пациентам с врожденными имму-
нодефицитами, получающим цитостатическую терапию. Назначают
детям и взрослым — не позже 96 ч после контакта в дозе 125 ЕД/10 кг
(минимальная доза — 125 ЕД, максимальная — 625 ЕД) внутримышеч-
но. При необходимости повторную дозу вводят через 3 нед.
• Антирезусный RhO (D) — IgG для предупреждения резус-конфликта
у резус-отрицательных женщин; вводят внутривенно.
Сыворотки лечебные
• Антирабическая. Вводят однократно в кратчайшие сроки после укуса
бешенным животным в дозе 40 ЕД/кг, причем х/2 дозы препарата
используют для обкалывания места укуса, а оставшуюся часть вводят
внутримышечно.
• Против яда змей.
• Противоботулиническая.
ГЛАВА 14
600 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 14-2. Алгоритм выбора препаратов внутривенных иммуноглобулинов в педиа-
трии
Клинические показания Группа внутривенных иммуноглобулинов Торговые названия
Врожденные и приобретенные иммуноде- фициты. Иммуноопосредованные заболе- вания (идиопатическая тромбоцитопени- ческая пурпура, болезнь Кавасаки и др.) Внутривенные иммуноглобу- лины, содержащие антитела класса IgG Интраглобин Интратект* Гамимун Н* Эндобулин* Иммуноглобулин человека нормальный для в/в введения и др.
Сепсис и тяжелые бактериальные инфек- ции у новорожденных и детей раннего возраста. Профилактика инфекционных заболеваний у больных с иммунодефи- цитными состояниями и высоким риском развития гнойно-септических заболева- ний Внутривенные иммуноглобу- лины, содержащие антитела класса IgG, IgM Пентаглобин*
Острая цитомегаловирусная инфекция у недоношенных, новорожденных и грудных детей. Профилактика и лечение цитомегаловирусной инфекции у детей с первичными и вторичными иммуноде- фицитами Специфические внутри- венные иммуноглобулины, содержащие антитела класса IgG к цитомегаловирусу Неоцитотект* Цитотект*
Новорожденные от матерей-носителей вируса гепатита В (пассивная иммуни- зация) Специфические внутри- венные иммуноглобулины, содержащие антитела класса IgG против вируса гепатита В Неогепатект* Гепатект*
• Противогангренозная.
• Против яда гадюки, паука (черной вдовы).
• Противодифтерийная.
Иммуиомодуляторы экзогенного происхождения
• Натрия дезоксирибонуклеат (деринат*) влияет на клеточный и гумо-
ральный иммунный ответ; стимулирует гемопоэз; усиливает репара-
тивные процессы; активирует противовирусный, грибковый и бакте-
риальный иммунитет.
Бактериальные и растительные препараты с иммуномодулирую-
щими свойствами
• Бронхомунал (лиофилизат бактерий) — капсулы по 3,5,7 мг. Повыша-
ет гуморальный и клеточный иммунный ответ, фагоцитоз, активность
NK-клеток, усиливает синтез ИФН-а и ИФН-у, ИЛ-2, ФНО-а; повы-
шает уровень IgA, IgM, IgG в сыворотке крови. Показания: вторичные
иммунодефициты, проявляющиеся рецидивирующими бактериальны-
ОСНОВЫ ИММУНОТЕРАПИИ 601
ми инфекциями. Рекомендуют с 12 лет 3 курса по 10 сут с интервалом
20 сут.
• ИРС-19® (смесь лизатов бактерий) вызывает активацию фагоцито-
за, увеличение синтеза специфических антител (секреторный IgA).
Рекомендуют с 3 мес, интраназально.
• Имудон* (смесь лизатов бактерий) повышает уровень лизоцима, IgA в
слюне. Рекомендуют для лечения тонзиллита, пародонтоза, гингивита,
глоссита с 3 лет и у взрослых. Выпускают в таблетках для рассасыва-
ния. Курс лечения 10-20 сут в дозе от 6 до 8 таблеток в сутки; курс
лечения можно повторить через 3-4 мес.
• Рибомунил* состоит из рибосомальных фракций бактерий; повы-
шает гуморальный и клеточный иммунный ответ, число макрофагов,
Т-лимфоцитов, NK-клеток, синтез ИФН-а и ИФН-у, ИЛ-2, ФНО-а
и уровень IgA, IgM, IgG. Рекомендуют для лечения рецидивирую-
щих бактериальных инфекций бронхолегочного аппарата. Препарат
назначают 1 раз в сутки по 3 таблетки (1 порошок) утром до еды 4 дня
в неделю в течение 4 нед подряд. Поддерживающий курс проводят
последовательно 4 дня в месяц в течение 3-5 мес.
Растительные иммуномодуляторы
• Эхинацея* (эхинацеи узколистной экстракт) содержит полисахариды и
комплекс флавоноидов; повышает активность макрофагов, гранулоци-
тов, В-лимфоцитов, а также индукцию синтеза ИФН-а.
• Иммунал* (эхинацеи пурпурной травы сок) — сок эхинацеи пурпур-
ной; применяют с 4 лет.
• Алпизарин* (тетрагидроксиглюкопиранозилксантен) — трава копееч-
ника альпийского; повышает синтез ИФН-у и усиливает противовирус-
ный иммунитет. Выпускают в таблетках по 0,1 г и 5% мазь.
• Госсиполр (из семян хлопка) усиливает противовирусный иммуни-
тет при герпесе. Выпускается в виде 3% линимента, глазных капель;
используют 4-6 раз в сутки в течение 10-15 сут.
• Препараты солодки голой: глицирам* (аммония глицирризинат) —
таблетки, флакарбин* — гранулы, ликвиритон* (солодки корня фла-
воноидный препарат) — таблетки. Усиливают фагоцитарную актив-
ность, оказывают противовоспалительное и отхаркивающее действие.
Показаны при инфекционно-воспалительных заболеваниях дыхатель-
ных путей, желудка, двенадцатиперстной кишки.
• Тонзилгон* (комплекс лекарственных растений) повышает фагоцитар-
ную активность макрофагов и гранулоцитов. Показан для профилак-
тики осложнений острой респираторной вирусной инфекции и забо-
леваний органов дыхания детям и взрослым по 2 драже или 25 капель
5-6 раз в сутки.
ГЛАВА 14
ЧАСТЬ 2
602 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Хелепин* (десмодиума канадского травы экстракт) показан при острых
респираторных вирусных инфекциях, герпесе, ветряной оспе и других
вирусных инфекциях. Выпускают в таблетках, 1 и 5% мазях.
• Геримакс* (женьшень, витамины, микроэлементы). Показан лицам
старше 15 лет.
• Гинсана® (экстракт женьшеня в капсулах). Показан лицам старше
12 лет.
• Иммунорм* (эхинацеи пурпурной травы сок). Применяют с 12 лет.
Бактериофаги
• Против кишечных инфекций (дизентерийный, сальмонеллезный,
брюшнотифозный, полиспецифический — интести).
• Раневые (орошения, аппликации и т.п.) — стафилококковые.
• Прочие: пиобактериофаг (стафилококк, стрептококк, синегнойная
палочка, протей, Е. coll), клебсиеллезный, колипротейный, псевдомо-
нас, холерный бактериофаг.
Пробиотики (эубиотики)
• Бифидумбактерин* (бифидобактерии бифидум), применяют с 6 мес
для профилактики и лечения дисбактериоза у взрослых и детей.
Торговые названия: бифидумбактерин* сухой (таблетки, капсулы, суп-
позитории), бифидумбактерин форте*, пробифор*, бифиформ*; бифи-
лиз* (бифидобактерии бифидум + лизоцим). Назначают с рождения
по 2,5 дозы 3 раза в сутки; старше 3 мес — по 5 доз 2-3 раза в сутки в
течение 20-24 сут.
• Препараты, содержащие лактобактерии: ацилакт* (лактобактерии аци-
дофильные), лактобактерии*, аципол* (лактобактерии ацидофиль-
ные + грибки кефирные), линекс*, гастрофарм*.
• Препараты, содержащие Е. coir, колибактерин* (кишечные палочки)
назначают с 6 мес, бификол* (бифидобактерии бифидум + кишечные
палочки).
• Препараты, содержащие споробактерии (непатогенные Bacillus)-, бак-
тиспорин* (бациллюс субтилис), биоспорин* (с 1 года), бактисубтил*
(с 3 лет).
Иммуномодуляторы эндогенного происхождения
Выделяют несколько групп иммуномодуляторов эндогенного проис-
хождения: иммунорегуляторные пептиды, цитокины, интерфероны, индук-
торы интерферонов, препараты мембранных пептидов, монокины, синтези-
рованные препараты.
Иммунорегуляторные пептиды
• Тактивин* (тимуса экстракт) — Т-иммуномиметик; 0,01% раствор
1,0 мл для подкожного введения в дозе 1,0 мл 1 раз в сутки на ночь;
курс 5-14 сут.
ОСНОВЫ ИММУНОТЕРАПИИ 603
• Тимактид* (тимуса экстракт) — Т-иммуномиметик; таблетки по 0,25 мг.
Рекомендуют принимать 1 раз в сутки вечером до еды под язык. Курс
лечения состоит из 5-7 таблеток, принимаемых с интервалом 4 сут.
Повторить курс лечения можно через 1-2 мес.
• Тималин* (тимуса экстракт) — Т-иммуномиметик; усиливает фагоци-
тоз, стимулирует процессы регенерации. Выпускается в виде порошка
во флаконах. Рекомендуют по 1-2 мл внутримышечно. Курс лечения —
5-20 сут.
• Тимоптин* — Т-иммуномиметик. Выпускают во флаконах по 0,1 мг.
Рекомендуют применять по 0,5-1,0 мл подкожно. Курс лечения
5-10 сут.
• Тимоген* (альфа-глутамил-триптофан) повышает активность Т-клеток.
Применяют интраназально 0,01% раствор по 3-5 капель 2-3 раза в
сутки; внутримышечно — 50-100 мкг. Курс лечения 3-10 сут.
• Миелопид* — Т- и В-иммуномиметик; восстанавливает показатели
Т- и В-звеньев иммунной системы, стимулирует противоопухолевый
иммунитет и эритропоэз. Рекомендуют вводить подкожно по 3-6 мг
1 раз в сутки или через день. Курс лечения 3-5 сут. Из миелопида*
выделен и синтезирован ряд пептидов, обозначаемых как МП-1 и
другие, обладающие разнонаправленным действием, в том числе про-
тивоопухолевым.
Цитокины
• ИЛ-10 (беталейкин*; порошок 0,05,0,5 и 1,0 мкг; вводят подкожно или
внутривенно). Иммуностимулятор, усиливающий лейкопоэз у больных
с лейкопенией в результате воздействия излучения или применения
цитостатиков; радиопротектор. Показания: иммунодефициты, гнойно-
септические и деструктивные процессы, хронические септические
состояния. Применяют подкожно или внутривенно в дозе 15-20 нг/кг
при лейкопении и 5-8 нг/кг при тяжелых формах иммунодефицитов.
Курс лечения 5 сут.
• ИЛ-2.
О ИЛ-2 человека рекомбинантный*. Показан для проведения заме-
стительной терапии у больных с иммунодефицитами, сепсисом,
раком почки. Применяют внутривенно капельно 1 раз в сутки в дозе
0,25-2,0 мг. Курс лечения 2-3 введения с интервалом 3 сут.
<> Рекомбинантный иммуномодулятор, аналог ИЛ-2 (ронколей-
кин*). Индуцирует рост, дифференцировку и пролиферацию Т- и
В-лимфоцитов, моноцитов, макрофагов и других клеток с рецепто-
рами к ИЛ-2. Повышает активность NK-клеток и ЦТЛ, активирует
противоопухолевый иммунитет. Вводят внутривенно капельно по
схеме от 1-3 до 10 введений у больных с тяжелыми инфекционными
заболеваниями, сепсисом, онкопатологией. Препарат противопока-
зан при беременности и аллергии к дрожжам.
ГЛАВА 14
ЧАСТЬ 2
604 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Суперлимф* (комплекс природных цитокинов и катионных про-
тивомикробных пептидов). В состав суперлимфа входит сбаланси-
рованный комплекс природных полипептидов: ИЛ-1, ИЛ-2, ИЛ-6,
ФНО-а, ТФР-р, фактор, подавляющий миграцию макрофагов, и др.
Они активируют клетки фагоцитарного ряда, фибробласты и усили-
вают взаимодействие между этими клеточными элементами. Кроме
того, препарат обладает прямым противомикробным действием (ста-
филококки, стрептококки, вирус простого герпеса, микобактерии и
др.). Молекулярный механизм действия препарата заключается в уве-
личении концентрации внутриклеточных ионов кальция, модуляции
кислородного метаболизма фагоцитарных клеток с последующей их
активацией. Противовоспалительное действие суперлимфа сочетается
с прямым противомикробным действием (естественные антибиоти-
ки), активацией регенерации раневых поверхностей, аналгезирующим
эффектом. Использование препарата основано на принципе локальной
цитокинотерапии (в форме аппликации раствора, свечей) для созда-
ния максимальной концентрации полипептидов в зоне воспаления,
повреждения, деструкции и т.п.
Интерфероны
Препараты природных интерферонов.
• ИФН-а (интерферон моноцитарный человеческий сухой) применяют
для профилактики и лечения гриппа и острых респираторных вирус-
ных инфекций. Вводят интраназально по 5 капель 2-5 раз в сутки в
течение первых 2-3 сут от начала заболевания.
• ИФН-а (интерферон человеческий лейкоцитарный для инъекций).
Применяют для лечения острых респираторных вирусных инфекций,
рассеянного склероза, гемобластозов, онкопатологии. Препарат вводят
внутривенно, внутримышечно, внутрикостно.
• ИФН-а (интерферон человеческий лейкоцитарный в свечах). Приме-
няют для лечения вирусных гепатитов, хламидийной и микоплазмен-
ной инфекций. Выпускают суппозитории ректальные и вагинальные.
• ИФН-а (локферон). Применяют в виде глазных капель у больных с
герпесом, аденовирусной инфекцией. Рекомендуют применять глазные
капли в острой стадии заболевания до 8 раз в сутки, затем — 4-6 раз.
Курс лечения — до 2-4 недель.
• ИФН-а-2b (гриппферон). Применяют интраназально через 3-4 ч при
гриппе и острых респираторных вирусных инфекциях. Курс лечения
3-5 сут.
Препараты рекомбинантных интерферонов.
• Рекомбинантный ИФН-а-2Ь (офтальмоферон*). Применяют в
виде глазных капель у больных с вирусными поражениями глаз.
Рекомендуют по 1-2 капли 6-8 раз в сутки. Курс лечения 10-14 сут.
ОСНОВЫ ИММУНОТЕРАПИИ 605
• Комплексный иммуноглобулиновый препарат для энтерального при-
менения и рекомбинантный ИФН-а (кипферон*). Применяют в виде
вагинальных суппозиториев при урогенитальных инфекциях.
• ИФН-а-2а (реаферон*). Применяют у больных с острыми и хрони-
ческими гепатитами В, С, D; онкопатологией, рассеянным склерозом,
кератитами. Рекомендуют внутримышечное введение и инстилляции
при кератитах 3-4 раза в сутки в течение 2 нед.
• ИФН-а-2а (роферон А*). Применяют у больных с острыми и хрониче-
скими гепатитами В и/или С; лейкозами, Т-клеточными лимфомами,
саркомой Капоши при ВИЧ-инфекции, онкопатологией. Препарат
вводят внутримышечно или подкожно.
• Рекомбинантный ИФН-а-2а (инфагель*). Применяют в виде мази у
больных с герпесом.
• ИФН-а-2Ь (интрон А*). Применяют у больных с хроническими гепа-
титами В, С, D; ВИЧ-инфекцией, онкопатологией, лейкозом, миелом-
ной болезнью, саркомой Капоши, раком почки и мочевого пузыря,
меланомой. Рекомендуют вводить подкожно или внутримышечно.
Курс лечения — до 18 мес.
• ИФН-а-2Ь (реальдирон*). Применяют у больных с хроническими
гепатитами В, С или D; кератитами, онкопатологией; рассеянным
склерозом. Рекомендуют в виде внутримышечных инъекций 2 раза в
неделю. Курс лечения — до 6 мес.
• ИФН-а-2Ь (виферон*). Применяют в комплексной терапии вирусно-
бактериальных инфекций у новорожденных, детей и взрослых; а
также при вирусных гепатитах, герпесе, урогенитальной инфекции.
Выпускается в виде суппозиториев по 150 тыс., 500 тыс., 1 млн, 3 млн
ME, а также в виде мази для наружного применения.
• Интерферон альфа-пЗр. Применяется у больных остроконечными
кондиломами, не поддающимися другому лечению. Рекомендуют при-
менять в дозе 250 000 ME (0,05 мл) в основание кондиломы 2 раза в
неделю в течение 8 нед; повторный курс проводят через 3 мес.
• Интерферон бета-1а* (ребиф*, авонекс*). Назначают для лечения
больных с рассеянным склерозом. Рекомендуют применять в дозе
30 мкг внутримышечно 1 раз в неделю; длительно.
• Интерферон бета-lb* (бетаферон*). Применяют у больных рассе-
янным склерозом в дозе 8 млн ЕД подкожно через день в течение
многих лет.
• Интерферон гамма-lb*. Повышает бактерицидность макрофагов.
Применяют у больных хронической гранулематозной болезнью (ХГБ),
что вызывает уменьшение тяжести инфекций. Рекомендуют взрослым
в дозе 50 мкг/м2 3 раза в неделю. Детям — 1,5 мкг/кг 3 раза в неделю.
ГЛАВА 14
ЧАСТЬ 2
606 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Индукторы интерферонов.
• Рибонуклеат натрия43 (ридостин*). Стимулирует эндогенный интерфе-
роногенез. Применяют для лечения больных с герпетической, хлами-
дийной инфекциями урогенитального тракта. Рекомендуют использо-
вать в дозе 8 мг 1 раз в 3 сут подкожно или внутримышечно троекратно;
при хламидийной инфекции урогенитального тракта — по 8 мг 1 раз
через 2 дня, четырежды. Курс повторить через 2-3 мес.
• Амиксин* (тилорон) (таблетки по 60 мг и 125 мг № 10). Повышает
синтез ИФН-а, ИФН-у, ИФН-0, стимулирует антителообразование,
усиливает выход стволовых клеток, восстанавливает соотношение
СП4/СП8-клеток. Применяют один раз в день у больных с гепатита-
ми А, В и С, рассеянным склерозом, гриппом, герпесом, хламидийной
инфекцией. Противопоказан беременным и детям до 7 лет.
• Оксодигидроакридинилацетат натрия (Неовир*) (таблетки по 0,125 г;
ампулы по 125 и 250 мг/мл, 2 мл). Синтетический интерфероно-
миметик, усиливает синтез ИФН-а, активирует стволовые клетки
и NK-лимфоциты, нормализует содержание Т-хелперов. Препарат
показан у больных герпесом, ЦМВ, ВИЧ-инфекцией, гепатитами В, С,
энцефалитами вирусной природы, рассеянным склерозом, кандидозом,
урогенитальными инфекциями (хламидии, уреаплазмы, микоплазмы).
Рекомендуют принимать внутрь по 6 таблеток одномоментно одно-
кратно либо вводить внутримышечно по 250 мг один раз в день — 5-7
инъекций с интервалом 48 ч.
• Аллокин-альфа* (Аллоферон*). Показан при рецидивирующем гени-
тальном герпесе в период обострения. Рекомендуют 3 инъекции под-
кожно, проводимые через день в дозах 10; 1,0; 0,1 мг.
• Мегосин* (мазь 3% из хлопчатника). Рекомендуют для местного при-
менения при герпесе кожи 3 раза в сутки в течение 4-6 сут.
• Циклоферон* (меглюмина акридонацетат) (таблетки 0,15 г; раствор
12,5% 2,0 мл, порошок 250 мг, линимент 5%). Синтетический интер-
ферономиметик. Назначают больным с ВИЧ-инфекцией, ЦМВ, гепа-
титами А, В, С и D, вторичными иммунодефицитами, ревматоидным
артритом, онкопатологией, генитальным герпесом (линимент) и др.
• Полудан* (глазные капли). Синтетический интерферономиметик.
Показан при вирусных заболеваниях глаз.
Препараты мембранных пептидов
• Аффинолейкин* (порошок; подкожное введение). Иммунокорректор
цитокинового типа. Показан больным офтальмогерпесом с 4-летнего
возраста.
Монокины
• Молграмостим (неостим*). ГМ-КСФ. Стимулирует рост гранулоци-
тов, моноцитов, Т-лимфоцитов; не влияет на количество и функции
В-клеток. Показан при злокачественных нейтропениях, возникших
ОСНОВЫ ИММУНОТЕРАПИИ 607
вследствие супрессивной терапии, химиотерапии, а также при мие-
лодиспластических синдромах для повышения числа лейкоцитов.
Рекомендуют принимать по 3 мг/кг 1 раз в сутки подкожно или вну-
тривенно до нормализации числа лейкоцитов.
• Ленограстим (граноцит 34*). Г-КСФ человека рекомбинантный.
Усиливает рост клеток костного мозга, повышает число лейкоци-
тов в периферической крови, уменьшает токсичность химиотерапии.
Рекомендуют для внутримышечного или подкожного введения 1 раз в
сутки в течение 3-7 сут.
• Филграстим (нейпоген*). Гемопоэтический фактор роста. Усиливает
созревание нейтрофилов в костном мозге и выход их в кровь. Показан
при нейтропениях у больных со злокачественными новообразования-
ми на фоне цитостатической терапии. Рекомендуют внутривенное или
подкожное введение 1 раз в сутки по 5 мг/кг.
Химически чистые и синтезированные иммуномодуляторы
• Полиоксидоний* (азоксимера бромид) синтетический поли-
мер (N-оксидированное производное полиэтиленпиперазина).
Иммунокорректор с широким спектром действия. Напрямую воз-
действует на фагоциты, Т- и В-лимфоциты, NK-клетки, усиливает
синтез антител, обладает детоксикационным действием; не проявляет
антигенных и мутагенных свойств. Показан больным с аллерги-
ей (осложненные формы атопического дерматита), острыми и хро-
ническими вирусно-бактериальными инфекциями, с аутоиммунной
патологией, ревматоидным артритом. Рекомендуют внутримышечное,
внутривенное, ректальное и интравагинальное применение ежедневно,
через день или 1-2 раза в неделю по 3-12 мг/сут. Длительность — от
6-10 сут до 2-3 мес.
• Глутоксим* (глутамил-цистеинил-глицин динатрия) (ампулы с 0,5, 1,
3% раствором по 1 и 2 мл) — синтетическое производное глутатиона;
новый класс лекарственных средств — тиопоэтинов, влияющих на
внутриклеточные процессы тиолового обмена. Препарат усиливает
пролиферацию и апоптоз клеток; регулирует синтез цитокинов ИЛ-10,
ИЛ-6, ИФН-а, ИФН-у, ФНО, ГМ-КСФ, эритропоэтины, переход пре-
Т-лимфоцитов в CD3+ CD4+; усиливает фагоцитоз, стимулирует лимфо-
поэз и эритропоэз. Показан больным со вторичными иммунодефицита-
ми, атопическим дерматитом, гепатитом В, гепатитом С, туберкулезом,
герпесом, хроническими инфекционными заболеваниями мочеполо-
вой системы. Рекомендуют внутривенное, внутримышечное или под-
кожное введение в дозе от 10 до 60 мг 1 раз в сутки в течение 10 сут.
• Гепон* — синтетический пептид, усиливающий образование
ИФН-а, ИФН-у, ИФН-0. Активирует макрофаги, повышает число
ГЛАВА 14
ЧАСТЬ 2
608 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
CD4+ Т-лимфоцитов и NK-клеток. Оказывает противовирусное дей-
ствие, ослабляя репликацию вирусов. Показан больным герпесом,
вирусными гепатитами, острыми респираторными заболеваниями,
вирусными стоматитами, кандидозом. Рекомендуют использовать в
виде орошения слизистых, примочек, интраназально и per os.
• Иммуномакс* — кислый пептидогликан. Повышает активность
NK-клеток и макрофагов. Показан больным с папилломавирусной
инфекцией (кондиломы, бородавки, дисплазии), герпесом и уро-
генитальными инфекциями (хламидии, микоплазмы, уреаплазмы).
Рекомендуют применять с 12-летнего возраста по 100-200 ЕД вну-
тримышечно 1 раз в сутки 6 дней (дни лечения: 1-й, 2-й, 3-й, 8-й, 9-й,
10-й).
• Имунорикс* (пидотимод) — иммуномодулятор, активирующий син-
тез антител, фагоцитарную активность макрофагов и активность
NK-клеток. Показан больным с частыми вирусно-бактериальными
инфекционными заболеваниями, а также при хронических рецидиви-
рующих инфекциях. Рекомендуют детям с 3-летнего возраста и взрос-
лым в виде раствора для приема внутрь во флаконах по 7 мл (400 мг
пидотимода) 1-2 раза в сутки от 2 до 6-8 недель.
• Другие препараты: инозин пранобекс (изопринозин*), калия оротат*
(оротовая кислота), левамизол, метилурацил* (диоксометилтетраги-
дропиримидин), пентоксил*, арбидол*.
Аналоги иммуиомодуляторов эндогенного происхождения
• Ликопид* (глюкозаминил мурамилдипептид) (таблетки 1, 10 мг).
Производные мурамилпептидов. Первоначально был выделен из кле-
точной стенки бактерий L. bulgaricus и затем синтезирован в чистой
форме. Вакциноподобный иммуномодулятор. Повышает активность
фагоцитов, Т- и В-лимфоцитов, усиливает синтез антител и цитокинов.
Показан при вирусных, грибковых, бактериальных инфекционных
заболеваниях у взрослых и детей, а также при аутоиммунных забо-
леваниях. Рекомендуют применять, начиная с 1 года, 1 раз в сутки в
течение 10 сут.
• Натрия нуклеинат. Препарат обладает иммуностимулирующей актив-
ностью. Показан больным с хроническими бактериальными инфек-
циями, иммунодефицитами. Рекомендуют применять по 0,25 г 3 раза
в сутки перорально в течение 2-3 мес либо 2 или 5% раствор по 5 мл
внутримышечно в течение 2 нед.
• Имунофан* (0,05 мг/мл). Действующее начало — аргинил-альфа-
аспартил-лизил-валил-тирозил-аргинин. Олигопептидный иммуно-
модулятор. Показан больным со вторичными иммунодефицитами,
онкопатологией, оппортунистическими инфекциями, при иммунопа-
тологиях. Применяют подкожно и внутримышечно.
ОСНОВЫ ИММУНОТЕРАПИИ 609
Иммуномодуляторы из разных фармакологических
и парафармакологических групп
Антиоксиданты и антигипоксанты
• Актовегин* (из сыворотки телячьей крови).
• Ламисплат4* (микроэлементы, витамины, аминокислоты).
• Лимонтар* (лимонная кислота + янтарная кислота).
• Димефосфон* (диметилоксобутилфосфонилдиметилат). Применяют
per os, внутривенно, наружно.
• Милдронат* (мельдоний).
Адаптогены, ноотропы
• Косвенное иммуномодулирующее действие оказывают такие препара-
ты, как глицин, пирацетам, фенибут* (аминофенилмасляная кислота),
пантогам* (гопантеновая кислота), экстракт элеутерококка* (элеутеро-
кокка колючего корневища и корни).
Витамины и витаминосодержащие вещества
Водорастворимые: витамин С (аскорбиновая кислота) повышает содер-
жание Т- и В-лимфоцитов, IgG, усиливает фагоцитоз; витамин Bj (тиамин);
витамин В2 (рибофлавин); витамин РР (никотиновая кислота); витамин В3
(никотинамид); витамин В6 (пиридоксин) усиливает фагоцитоз; витамин В5
(кальция пантотенат) усиливает фагоцитоз; витамин В9 (фолиевая кислота);
витамин В12 (цианокобаламин) восстанавливает число Т- и В-лимфоцитов,
повышает концентрацию IgG в сыворотке крови.
Жирорастворимые: витамин А — повышает активность макрофагов,
повышает число CD8+ Т-лимфоцитов и синтез ИЛ-2; витамин D (колекаль-
циферол); витамин Е (а-токоферол), витамин К (фитоменадион).
Комбинированные препараты витаминов: компливит*, супрадин*,
алфавит* и др.
В детской практике применяют целый ряд иммунотропных препаратов,
относимых к иммуномодуляторам. У детей использование лекарственных
средств предпочтительно в специальных формах, чаще не инъекционных.
Кроме того, для любого препарата существуют возрастные ограничения,
которые необходимо учитывать. Ниже представлен перечень некоторых
иммуномодуляторов, используемых в педиатрии (табл. 14-3).
ГЛАВА 14
Таблица 14-3. Иммунотропные препараты в педиатрии (Маркова Т.П., 2008)
Препарат (торговое название) Лекарственная форма Режим назначения
Имудон* Таблетки для рассасывания С 2-3 лет
ИРС-19® Спрей интраназальный С 6 мес
Бронхомунал*’ Капсулы С 6 мес
Бронховаксом*’ Капсулы С 6 мес
Рибомунил* Таблетки, порошок С 6 мес
610 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Окончание табл. 14-3
ЧАСТЬ 2
Препарат (торговое название) Лекарственная форма Режим назначения
Ликопид* Таблетки С периода новорожденное™
Иммунал* Капли внутрь С 1 года
Виферон* Свечи ректальные С периода новорожденное™
Амиксин* Таблетки С 7 лет
Циклоферон* Таблетки, раствор для инъекций С 4 лет С 7 лет
Полиоксидоний* Свечи ректальные, таблетки С 6 мес С 1 года
Имунофан* Свечи ректальные С 6 мес
Тимоген* Спрей назальный, раствор для инъекций С 1 года С 6 мес
Деринат* Раствор для местного приме- нения, раствор для инъекций С периода новорожденное™
Изопринозин* Таблетки С 1 года
14.4. МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Важное достижение медицины последних лет — разработка и клиниче-
ское использование биологических препаратов, созданных на основе моно-
клональных антител.
Первые моноклональные антитела использовали в основном с диа-
гностической целью. Именно с помощью моноклональных антител к
поверхностным молекулам определяют субпопуляционный состав лимфо-
цитов, проводят иммуногистохимические исследования для диагностики
онкологических и аутоиммунных заболеваний при работе с материалами
биопсии.
С помощью цитолитических моноклональных антител проводят сорти-
ровку клеток для выделения нужной популяции (например, выделение
стволовых кроветворных клеток для трансплантаций). Возможно создание
моноклональных антител к антигенам вирусов, бактерий и других патоге-
нов для лечения инфекционных заболеваний.
Области применения моноклональных антител:
• с диагностической целью: определение экспрессии различных моле-
кул;
• блокада рецепторов;
• инактивация и лизис клеток (лечение онкологических и аутоиммун-
ных заболеваний).
ОСНОВЫ ИММУНОТЕРАПИИ 611
Сначала были созданы гетероиммунные антитела (мышиные античело-
веческие, овечьи антимышиные и т.д.). Их используют в основном для диа-
гностических целей и селекции клеток. При введении в организм человека
они вызывают выработку антител.
Препараты для клинического использования были созданы для обеспе-
чения высокоспецифичного, высокоаффинного сродства моноклональных
антител с антигеном в сочетании с минимизацией побочных эффектов,
в частности выработки пациентом антител к чужеродному белку. Чтобы
уменьшить степень иммунологической несовместимости, применяют мето-
ды генной инженерии, позволяющие конструировать химерные или гума-
низированные антитела, сочетающие элементы структуры антител мыши и
человека. Таким образом, были разработаны химерные моноклональные
антитела. При создании химерных антител молекула антитела человека
сохраняет все элементы тяжелых и легких цепей, за исключением вариа-
бельных N-концевых отрезков, которые замещают соответствующими
отрезками моноклонального антитела мыши. Таким образом, антитело
человека становится носителем антигенсвязывающего фрагмента мыши-
ного иммуноглобулина. Эти препараты на 75% состоят из белка человека и
на 25% — из белка мыши. Такая структура обеспечивает высокое сродство
к антигену и уменьшает (хотя и не исключает) возможность образования
против них антител организмом хозяина, что может вызвать серьезные
побочные реакции, вплоть до развития анафилаксии. Пример химерного
антитела — препарат ремикейд* (инфликсимаб).
Следующим шагом стало создание гуманизированных моноклональных
антител, на 80-95% состоящих из белка человека и только на 5-10% — из
белка мыши. Мышиного происхождения в этих молекулах — только гипер-
вариабельные участки, формирующие антигенсвязывающий центр.
Наконец, были созданы генно-инженерные, полностью гуманизирован-
ные моноклональные антитела, молекулы которых полностью состоят из
белка человека.
Таблица 14-4. Моноклональные антитела, используемые в клинической практике
ГЛАВА 14
Препарат/ торговое название Структура моноклональных антител Состав препарата
Антицитокиновые препараты
Инфликсимаб (ремикейд*) Химерные Моноклональные антитела к ФНО-а
Адали му маб (хумира*) Антитела человека Моноклональные антитела к ФНО-а
Энтанерцепт(энербел*) Антитела человека Моноклональные антитела к рецеп- тору ФНО-а
Анакинра (кинерет*) Антитела человека Моноклональные антитела к рецеп- тору ИЛ-1
Рилонацепт Антитела человека Моноклональные антитела к рецеп- тору ИЛ-1
612 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Окончание табл. 14-4
ЧАСТЬ 2
Препарат/ торговое название Структура моноклональных антител Состав препарата
Тосилизумаб (актемра*) Гуманизированные Моноклональные антитела к ИЛ-6
Фонтолисумаб Гуманизированные Моноклональные антитела к ИФН-у
AMG 714 Антитела человека Моноклональные антитела к ИЛ-15
Антитела к поверхностным молекулам иммунокомпетентных клеток
Ритуксимаб (мабтера*) Химерные Моноклональные антитела к CD20
Иритузумаб (зевалин*) Гуманизированные Моноклональные антитела к CD20, конъюгированные с У 90
Алемтузумаб (Campath 1Н) Гуманизированные Моноклональные антитела к CD52
Мурономаб Гуманизированные Моноклональные антитела к СОЗ
Линтузумаб Гуманизированные Моноклональные антитела к CD33
Епратузумаб Гуманизированные Моноклональные антитела к CD22
Аполизумаб Гуманизированные Моноклональные антитела к HLA-DR
B-F5 Гуманизированные Моноклональные антитела к CD4
Антитела, влияющие на взаимодействие иммунокомпетентных клеток
Абатацепт Антитела человека Внеклеточный домен молекулы CTLA4, соединенный с Fc-фрагментом lgG1
Алефасепт Антитела человека Соединение LFA-3 с Fc-фрагментом lgG1
Натализумаб Гуманизированные Моноклональные антитела к инте- грину ос4
Моноклональные антитела к рецепторам опухолевых клеток и моноклональные антитела,
_________________________подавляющие неоангиогенез
Трастузумаб (герцетин*) Гуманизированные Гуманизированные моноклональные антитела против HER2neuR
Цетуксимаб Химерные Моноклональные антитела к рецеп- тору эпидермального фактора роста
Витаксин Гуманизированные Моноклональные антитела к инте- грину эндотелиальных клеток
Бевацизумаб (авастин*) Гуманизированные Моноклональные антитела против фактора роста эндотелия сосудов
Антитела к вирусным антигенам
Павализумаб Гуманизированные Моноклональные антитела к респираторно-синцитиальному вирусу
Антитела к IgE
Омализумаб (ксолар) Гуманизированные Моноклональные антитела к цирку- лирующему IgE
ОСНОВЫ ИММУНОТЕРАПИИ 613
ГЛАВА 14
Таблица 14-5. Применение моноклональных антител при аутоиммунных заболеваниях
Препарат/ торговое название Область применения
Инфликсимаб (ремикейд*) Ревматоидный артрит, анкилозирующий спондилоартрит, юве- нильный ревматоидный артрит, псориаз и псориатический артрит, болезнь Крона. Аутовоспалительный синдром TNFR (TRAPS). Системные васкулиты
Адалимумаб (хумира*) Энтанерцепт (энербел*) Ревматоидный артрит, анкилозирующий спондилоартрит, юве- нильный ревматоидный артрит, псориаз и псориатический артрит, болезнь Крона
Анакинра (кинерет*) Рилонацепт Ревматоидный артрит, анкилозирующий спондилоартрит, юве- нильный ревматоидный артрит, псориаз и псориатический артрит, болезнь Крона. Аутовоспалительные синдромы, обусловленные повышенным образованием ИЛ-1 (синдром Макла-Веллса и др.)
Тосилизумаб (актемра*) Ревматоидный артрит, ювенильный ревматоидный артрит, болезнь Кастельмана
Фонтолисумаб Ревматоидный артрит, ювенильный ревматоидный артрит, псори- аз, болезнь Крона
AMG 714 Ревматоидный артрит
Ритуксимаб (мабтера*) Ревматоидный артрит, ювенильный ревматоидный артрит, систем- ная красная волчанка, системные васкулиты, кожный васкулит, синдром Шегрена, аутоиммунные гемоцитопении (гемолитическая анемия, синдром Фишера-Эванса, в том числе после трансплан- тации костного мозга), некоторые случаи рефрактерного течения реакции «трансплантат против хозяина»
Алемтузумаб (Campath 1Н) Резистентные к лечению формы аутоиммунных заболеваний. Т0-деплеция и профилактика реакции «трансплантат против хозяина» после трансплантации костного мозга. Профилактика и лечение отторжения трансплантата при трансплантации почки Рассеянный склероз
Мурономаб Профилактика и лечение отторжения трансплантата при транс- плантации почки и сердца. Фульминантный воспалительный миокардит
Епратузумаб Системная красная волчанка, резистентные системные васкулиты, синдром Шегрена
B-F5 Ревматоидный артрит, системная склеродермия, профилактика отторжения трансплантата почки
Абатацепт Ревматоидный артрит, ювенильный ревматоидный артрит, транс- плантология
Алефасепт Ревматоидный артрит, ювенильный ревматоидный артрит, псори- аз, псориатический артрит
Натализумаб Ревматоидный артрит, рассеянный склероз, прогрессирующая лей- коэнцефалопатия, болезнь Крона
614 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Таблица 14-6. Моноклональные антитела, эффективные для лечения онкологических
заболеваний
Препарат/ торговое название Область применения
Ритуксимаб (мабтера) Острый и хронический В-клеточные лимфобластные лейко- зы, волосато-клеточный лейкоз, неходжкинские В-лимфомы, нодулярно-лимфоцитарные (преимущественно ходжкинские) лимфомы (NLPHL), лимфомы Беркитта; лимфомы, связанные с вирусом Эпштейна-Барр, после трансплантации костного мозга
Алемтузумаб (Campath 1Н) Т-клеточный пролимфоцитарный лейкоз хронический лимфолей- коз
Линтузумаб Миелоидный лейкоз
Епратузумаб Неходжкинские В-лимфомы, крупноклеточные В-лимфомы, фол- ликулярные лимфомы
Аполизумаб В-клеточные лимфомы и лейкозы, неходжкинские В-лимфомы
Трастузумаб (герцетин) Рак молочной железы, рак поджелудочной железы, рак мочевого пузыря, рак легкого, остеогенная саркома, рак слюнной железы
Цетуксимаб Плоскоклеточный рак головы и шеи, метастазы рака толстой кишки
Витаксин Лейомиосаркома
Бевацизумаб (авастин) Рак молочной железы, рак почки
Побочные реакции при применении моноклональных антител
Большинство препаратов на основе моноклональных антител пациенты
переносят хорошо. При использовании химерных возможна выработка
антител к ним и развитие анафилактических реакций. Препараты, пода-
вляющие функции и уменьшающие количество различных субпопуляций
иммунокомпетентных клеток, могут вызвать снижение противоинфек-
ционной резистентности и/или обострение хронических инфекций. Для
предотвращения этих осложнений необходимо тщательное наблюдение за
пациентами, получающими лечение препаратами на основе моноклональ-
ных антител, и своевременное назначение адекватной сопроводительной
терапии. Те же меры предосторожности необходимо предпринимать для
уменьшения риска и тяжести течения токсических реакций, описанных при
применении моноклональных антител для лечения онкологических забо-
леваний (например, препаратов, подавляющих ангиогенез). При лечении
антителами против ФНО-а возможна активация скрытого туберкулеза.
Перспективное направление в создании новых препаратов на основе
моноклональных антител — каталитические антитела абзимы. Это молеку-
лы, обладающие свойствами антител (могут связываться с определенными
эпитопами) и биологических катализаторов различных химических реак-
ций (энзимов).
ОСНОВЫ ИММУНОТЕРАПИИ 615
Области применения абзимов
• Диагностика аутоиммунных заболеваний (анти-ДНК аутоантитела с
каталитической активностью).
• Лечение аутоиммунных заболеваний (создание ДНК-абзимов для
использования в качестве фармакоконструкций при сайт-направленной
абзимотерапии системных форм аутоиммунной патологии).
• Лечение инфекционных заболеваний (создание абзимов, направлен-
ных на специфический катализ инфекционных агентов).
Вопросы для самоконтроля
• Что такое иммунотерапия?
• Какие виды воздействия на иммунную систему применяют в современ-
ной медицине?
• Каковы показания к иммунотерапии?
• Каковы основные принципы иммунотерапии?
• Перечислите группы иммунотропных лекарственных средств в соот-
ветствии с механизмом воздействия их на иммунную систему.
• Перечислите основные группы иммуномодуляторов в соответствии с
классификацией Р.М. Хаитова, Б.В. Пинегина 2005 г.
• Охарактеризуйте основные механизмы действия иммуномодуляторов.
• Перечислите препараты, относящиеся к группе иммуносупрессоров.
• Перечислите основные принципы применения иммунотропных
средств.
• Назовите основные поколения иммуноглобулинов для внутривенного
введения и опишите особенности каждого из них. Приведите приме-
ры.
• В чем особенности выбора препаратов внутривенных иммуноглобули-
нов в педиатрии?
• Приведите примеры иммуномодуляторов экзогенного и эндогенного
происхождения?
• Назовите известные вам препараты цитокинов, интерферонов, индук-
торов интерферонов, используемые в лечебной практике.
• При каких заболеваниях рекомендуют применение препаратов мем-
бранных пептидов, монокинов, а также синтезированных иммуномо-
дуляторов?
• Каковы возрастные ограничения применения отдельных видов имму-
нотропных препаратов в педиатрии?
• Охарактеризуйте механизмы действия и области применения моно-
клональных антител в клинической практике.
• Какие моноклональные антитела используют в аллергологической
практике?
ГЛАВА 14
Глава 15
Иммунопрофилактика
Предупреждение инфекционных заболеваний путем иммуни-
зации — одно из выдающихся достижений в истории медицины.
Использование вакцин для профилактики заболеваний берет свое
начало с конца XVIII в. Впервые американский адвокат К. Мате
(С. Mather) в 1721 г. после возвращения из Африки сообщил о
методе защиты от оспы коренного населения с помощью втирания
заразного материала в кожу. В то время медицинская обществен-
ность не оценила этот метод как принципиально новый в про-
филактике заболеваний. Спустя несколько десятилетий в 1796 г.
Э. Дженнер (английский врач) использовал подобный метод для
защиты от натуральной оспы, а с 1880 г., когда Л. Пастер открыл
метод аттенуации микроорганизмов, началась эпоха вакцинации.
Идея вакцинации была впервые апробирована с вирусами нату-
ральной оспы и бешенства. Э. Дженнер в Англии произвел успеш-
ную вариоляцию натуральной оспы ребенку. Л. Пастер во Франции
осуществил успешную вакцинацию против бешенства, используя
аттенуированные путем пассажа на животных вирусы. С этого
времени в вакцинологии произошли крупные изменения и обще-
ство вступило в эру вакцинопрофилактики. Становление массовой
иммунизации населения Земли прошло в своем развитии 3 этапа.
• Первый этап (1890-1950 гг.). В этот период с появлением
технологии культивирования бактерий стало возможным со-
здание бактериальных вакцин и анатоксинов (против туберку-
леза, дифтерии, коклюша, столбняка).
• Второй этап (1950-1970 гг.). В эти годы благодаря появлению
технологии культивирования вирусов в культуре ткани были
разработаны противовирусные вакцины. В 1949 г. за работы
по культивированию вирусов Д. Эндерс (J. Enders), Т. Веллер
(Г. Weller), Ф. Роббинс (F. Robbins) получили Нобелевскую
премию, и в этот же год была создана убитая вакцина про-
тив полиомиелита. В последующие годы почти одновременно
появились и начали успешно применяться живые цельнови-
ИММУНОПРОФИЛАКТИКА 617
рионные вакцины против полиомиелита, кори, паротита, краснухи,
ветряной оспы, желтой лихорадки.
• Третий этап (начался в 1970 г. и продолжается до настоящего време-
ни). Этот период характеризуется успехами молекулярной биологии
и разработкой новых технологий создания вакцин принципиально
нового поколения. К ним относят рекомбинантные вакцины про-
тив гепатита В, синтетические — на основе носителя полиоксидония
(против гриппа), субъединичные, расщепленные сплит-вакцины про-
тив гриппа, конъюгированные полисахаридные против гемофиль-
ной инфекции, полисахаридные против пневмо- и менингококковой
инфекций, рекомбинантные векторные против ЦМВ, ДНК-вакцины.
На всех этапах известную роль сыграли российские ученые, например
Н.Ф. Гамалея, проводивший работу по вакцинации против бешен-
ства. В открытие новых вирусов внесли свой вклад Д.И. Ивановский,
Л.А. Зильбер, работами по вирусному гепатиту известен С.П. Боткин.
Современные научные исследования под руководством академиков
Р.В. Петрова и Р.М. Хаитова позволили создать новые принципы кон-
струирования вакцин на основе синтетических носителей.
Массовая иммунизация началась с середины XX в. и позволила сохра-
нить миллионы жизней во всем мире. В России, как и в других странах,
вакцинацию проводят в соответствии с Национальным календарем, и она
является важной государственной задачей. Эффективность программ вак-
цинопрофилактики подтверждается проведением эпидемиологического
надзора за вакцинуправляемыми инфекциями.
Таблица 15-1. Эффективность национальных программ противовирусной вакцинации в
России
ГЛАВА 15
Инфекция Начало вакцинации Результаты Планы
Натуральная оспа 1919 г. Ликвидация к 1936 г. С 1980 г. прививки отмене- ны во всем мире
Полиомиелит 1940-1950 гг живая полио- миелитная вакцина (с 1963 г. тривалентная), инактиви- рованная полиомиелитная вакцина Ликвидация к 2002 г. (известны случаи возврата полиомие- лита) Предупреждение вакцино- связанного полиомиелита (введение инактивированной полиомиелитной вакцины)
Бешенство 1885 г. Единичные случаи -
Корь 1963 г. В 2005 г. —416 слу- чаев—0,29:100 000 Ликвидация к 2010 г.
Паротит Середина 1950-х годов 2,1 случая на 100 000 Единичные случаи
Краснуха 1971 г. Заболеваемость варьирует Профилактика врожденной краснухи
Гепатит В С 1981 г. плазменные вак- цины. С 1986 г. — рекомби- нантные вакцины Заболеваемость варьирует Снижение заболеваемости
618 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Как видно из представленных данных, к настоящему времени в стране
ликвидированы такие заболевания, как оспа и полиомиелит; заболевае-
мость корью и паротитом снижена до единичных случаев. На этом фоне на
первый план выходят такие инфекционные заболевания, как грипп, гепа-
тит, ветряная оспа, гемофильная инфекция, ротавирусная и другие инфек-
ции, снижение заболеваемости которыми можно достичь путем вакцино-
профилактики. Следует отметить, что в России зарегистрированы вакцины
против онкогенных папилломавирусов (церварикс*, гардасил*).
Цель иммунопрофилактики — создание коллективного и индивиду-
ального иммунитета против инфекций, управляемых с помощью вакцин.
Таблица 15-2. Национальный календарь профилактических прививок (2002)
Возраст Наименование прививки
Новорожденные (в первые 24 ч жизни) Первая вакцинация против гепатита В
Новорожденные (3-7 сут) Вакцинация против туберкулеза (БЦЖ-М или БЦЖ)
1 мес Вторая вакцинация против гепатита В (дети из групп риска)
2 мес Третья вакцинация против гепатита В (дети из групп риска)
3 мес Вторая вакцинация против гепатита В Первая вакцинация против дифтерии, коклюша, столбня- ка, полиомиелита
4-5 мес Вторая вакцинация против дифтерии, коклюша, столбня- ка, полиомиелита
6 мес Третья вакцинация против вирусного гепатита В, против дифтерии, коклюша, столбняка, полиомиелита
12 мес Четвертая вакцинация против гепатита В (дети из групп риска), вакцинация против кори, краснухи, паротита
18 мес Первая ревакцинация против дифтерии, коклюша, столб- няка, полиомиелита
20 мес Вторая ревакцинация против полиомиелита
6 лет Ревакцинация против кори, краснухи, паротита
6-7 лет Вторая ревакцинация против дифтерии, столбняка
7 лет Ревакцинация против туберкулеза (БЦЖ)
14 лет Третья ревакцинация против дифтерии, столбняка, ревак- цинация против туберкулеза (БЦЖ), третья ревакцинация против полиомиелита
Взрослые (от 18 лет) Ревакцинация против дифтерии, столбняка — каждые 10 лет от момента последней ревакцинации
Дети от 1 года до 17 лет, взрослые от 18 до 55 лет, не привитые ранее Вакцинация против вирусного гепатита В
ИММУНОПРОФИЛАКТИКА 619
Возраст
Дети от 1 года до 17 лет, не болев-
шие, не привитые, однократно при-
витые против краснухи.
Девушки от 18 до 25 лет, не болев-
шие, не привитые ранее__________
Дети, посещающие дошкольные
учреждения; учащиеся 1-11 классов;
студенты высших профессиональ-
ных и средних профессиональных
учебных заведений; взрослые, рабо-
тающие по отдельным профессиям
и должностям (работники медицин-
ских и образовательных учреждений,
транспорта, коммунальной сферы
и др.).
Взрослые старше 60 лет__________
Подростки и взрослые в возрасте до
35 лет, не болевшие, не привитые
и не имеющие сведений о профи-
лактических прививках против кори;
контактные лица из очагов заболева-
ния, не болевшие, не привитые и не
имеющие сведений о профилактиче-
ских прививках против кори — без
ограничения по возрасту
Окончание табл. 15-2
ГЛАВА 15
Наименование прививки
Иммунизация против краснухи
Вакцинация против гриппа
Иммунизация против кори
Национальный календарь профилактических прививок предусматрива-
ет обязательную вакцинацию против десяти инфекционных заболеваний,
начиная с периода новорожденное™. В календарь входит вакцинация
против туберкулеза, гепатита В, кори, паротита, краснухи, полиомиелита,
коклюша, дифтерии, столбняка и (с 2006 г.) против гриппа. С учетом крат-
ности вакцинаций детям до 12 мес проводятся 19 введений антигенов; к
6 годам — 28 введений антигенов вакцин. Помимо календарных вакцин
против целого ряда инфекционных заболеваний, предусматривают вакци-
нацию по эпидемиологическим показаниям: гепатит А, клещевой энцефа-
лит, бешенство, ветряная оспа, желтая лихорадка и др. Следует отметить,
что Национальный календарь в каждой стране имеет свои особенности, но в
мире используют примерно одинаковый набор вакцин. Изменения россий-
ского календаря происходят регулярно в соответствии с необходимостью
влияния на инфекционную заболеваемость населения. Планируют введе-
ние в Национальный календарь вакцинации прививок против ветряной
оспы, пневмококковой, ротавирусной и гемофильной инфекций.
ЧАСТЬ 2
620 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Виды вакцин, свойства вакцин
В настоящее время все вакцины делят на 2 большие группы: живые и
убитые. В свою очередь, в каждой из этих групп выделяют вирусные и бак-
териальные вакцины. К живым вирусным вакцинам относят вакцины про-
тив полиомиелита, кори, паротита, краснухи, гриппа, клещевого энцефали-
та, ветряной оспы и других; к живым бактериальным — против туберкулеза
(БЦЖ). Группа убитых вирусных вакцин представлена целым спектром
современных препаратов, получаемых с использованием достижений био-
технологии. К ним относятся цельновирионные вакцины (против гриппа,
полиомиелита), рекомбинантные (против гепатита В), расщепленные или
сплит-вакцины (против гриппа), субъединичные (против гриппа), синте-
тические (гриппол), виросомальные (против гриппа, папилломавирусные)
вакцины. К убитым бактериальным вакцинам относятся цельноклеточные
(коклюш), конъюгированные (гемофильная инфекция), а также анатокси-
ны (дифтерийный, столбнячный).
Характеризуя свойства вакцин, следует отметить, что эпидемиологиче-
ская эффективность живых и убитых вакцин сравнима. В то же время есть
ряд отличий между этими видами вакцин, влияющих на иммунологическую
характеристику, стойкость и длительность иммунитета.
Свойства живых вирусных вакцин
Преимущества:
• требуются низкие дозы антигенов, так как происходит репликация
вакцинных вирусов в организме;
• для получения протективного иммунитета может быть достаточно вве-
дения одной дозы вакцины;
• поствакцинальный иммунитет длительный и стойкий;
• индуцируют гуморальный, клеточный, мукозальный иммунитет;
• не содержат адъювантов;
• реже вызывают аллергические реакции.
Потенциальные проблемы живых вакцин:
• возможность реверсии вирулентных свойств (вакциноассоциирован-
ные заболевания);
• противопоказаны иммунокомпрометированным лицам;
• трудности создания вакцин с использованием потенциально онкоген-
ных вирусов (вирус Эпштейна-Барр) или особо агрессивных (ВИЧ).
Проблемы безопасности живых вакцин:
• возможна низкая аттенуация вирусов;
• возможны мутации, приводящие к реверсии вирулентности;
• нестабильность вакцинных препаратов и их термолабильность;
• в состав входят белки среды культивирования, антибиотики, стабили-
заторы, консерванты;
• возможна контаминация бактериями в культуре клеток.
ИММУНОПРОФИЛАКТИКА 621
Свойства инактивированных вирусных вакцин
Преимущества:
• не вызывают вакциноассоциированных заболеваний;
• индуцируют гуморальный (клеточный?) иммунитет;
• иммунитет менее напряженный, чем вызываемый живыми вакцинами.
Потенциальные проблемы инактивированных вакцин:
• недостаточная инактивация вируса;
• разрушение при замораживании;
• наличие в составе адъювантов (алюминия и др.), стабилизаторов
(желатина, сорбитола);
• необходима бустерная вакцинация;
• повышен риск развития аллергических реакций.
Виды противовирусных вакцин
• Цельновирионные (грипп, корь, краснуха, паротит, гепатит А, полио-
миелит).
• Сплит-вакцины или расщепленные (грипп).
• Субъединичные (грипп).
• Рекомбинантные (гепатит В, папилломавирус).
• Синтетические (грипп).
Таблица 15-3. Цельновирионные противовирусные вакцины
ГЛАВА 15
Заболевание Отечественные вакцины Зарубежные вакцины, зарегистрированные в России
Гепатит А Геп-А-ин-Вак* Геп-А-ин-Вак-Поле Вакта* Хаврикс* Аваксим*
Полиомиелит Живая полиомиелитная вакцина Инактивированная полиомиелитная вакцина-имовакс-полио
Корь Живая коревая вакцина M-M-RII* Приорик*с Вакцина против кори, паротита, крас- нухи живая аттенуированная*
Паротит Живая паротитная вакцина Паротит-корь M-M-R-II* Приорик*с Вакцина против кори, паротита, крас- нухи живая аттенуированная*
Краснуха Живая, инактивированная Рудивакс® Эрвивакс*
Грипп Живая интраназальная Убитые вакцины: Инфлексал* Инфлювак* Ваксигрип* Агриппал* Бегривак* Флюарикс*
ЧАСТЬ 2
622 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Нежелательные явления, поствакцинальные реакции и осложнения
В редких случаях у привитых лиц могут возникнуть нежелательные явле-
ния, рассматриваемые как клинически неадекватный ответ на вакцинацию.
В исследованиях, проведенных в США, за 10 лет с 1991 г. по 2001 г. было
введено 1,9 млрд доз вакцин и зарегистрирован 2281 случай поствакци-
нальных осложнений, что составило 0,00012%. Вакциноассоциированный
полиомиелит выявляют с частотой 1:750 000 при первом введении живой
полиомиелитной вакцины. Из приведенных примеров ясно, что современ-
ные вакцины — безопасные биологические препараты, однако даже редкие
нежелательные явления вызывают необходимость изучения причин их воз-
никновения и возможностей предупреждения.
Причины поствакцинальных реакций и осложнений:
• реактогенность вакцины;
• индивидуальные особенности вакцинируемого;
• программные ошибки (нарушение техники вакцинации, стерильности
вакцины, ошибочное введение других препаратов и др.).
При возникновении поствакцинальных реакций у нескольких лиц, вак-
цинированных одной и той же серией вакцины, предполагают связь этих
реакций с реактогенностью вакцины и дальнейшее ее использование при-
останавливают до формулировки окончательного решения, принимаемого
контролирующим органом.
Индивидуальные особенности вакцинируемого, влияющие на воз-
можность развития нежелательных явлений:
• наличие у ребенка с аллергией фоновой патологии, которая может
обостряться в поствакцинальном периоде (атопический дерматит, БА,
пищевая аллергия, ЛА и др.);
• сенсибилизация компонентами используемой вакцины;
• врожденные или приобретенные иммунодефициты, способствующие
возникновению вакциноассоциированных заболеваний при введении
живых вакцин;
• генетическая предрасположенность ребенка к патологии (аллергиче-
ские, аутоиммунные заболевания, болезни ЦНС), которая может реа-
лизоваться под действием вакцинации как триггерного фактора;
• индивидуальная гиперреактивность вакцинируемого как непредска-
зуемая причина осложнений.
Программные ошибки при вакцинации относят к категории предска-
зуемых, и они включают не только нарушение техники вакцинации, холо-
довой цепи, но и несоблюдение противопоказаний к вакцинации.
Противопоказания к вакцинации
• Истинные — настоящие противопоказания, перечисленные
в инструкции к вакцинам и руководящих документах (приказы и
международные рекомендации).
ИММУНОПРОФИЛАКТИКА 623
• Ложные — противопоказания, которые таковыми не являются.
• Абсолютные — противопоказания, имеющие абсолютную силу. При
наличии такого рода противопоказаний данную прививку не проводят
ни при каких условиях.
• Относительные — истинные противопоказания, окончательное
решение по которым принимает врач на основании других факторов
(близости эпидемии, степени вероятности контакта с источником
инфекции, вероятности того, что пациент сможет получить прививку в
следующий раз, и т.п.).
• Временные — противопоказание есть в данный момент, однако
по прошествии времени оно может быть снято. Например, острые
респираторные вирусные инфекции, во время которых проводить
вакцинацию не рекомендуют, однако после выздоровления прививки
не противопоказаны.
• Постоянные — противопоказания, которые с течением времени сняты
не будут. Например, ПИД, вызванный глубоким дефектом иммунной
системы.
• Общие — противопоказания, общие для всех прививок. На практике
к общим противопоказаниям относят наличие остро текущего
инфекционного заболевания, сопровождающегося повышением
температуры; обострение хронического заболевания или острое
заболевание.
• Частные — противопоказания, относящиеся только к данной
прививке или конкретной вакцине, но не ко всем остальным.
Например, беременность является противопоказанием к проведению
прививок живыми вакцинами (краснуха, желтая лихорадка), но не
инактивированными (грипп, гепатит В).
ГЛАВА 15
Таблица 15-4. Противопоказания к вакцинации отдельными вакцинами
Россия Всемирная организация здравоохранения
БЦЖ
Недоношенность (до 2000 г) Келлоидный рубец на месте первого введения БЦЖ. Возраст меньше 18 мес. Рожденные от ВИЧ-инфицированных матерей Недоношенность (до 2000 г). Келлоидный рубец на месте первого введения БЦЖ. Возраст меньше 18 мес. Рожденные от ВИЧ-инфицированных матерей
Оральная полиомиелитная вакцина (ОПВ)
Врожденные первичные иммунодефициты ВИЧ-инфекция. При наличии ВИЧ-инфекции у матери детей не вакцинируют до 18 мес. Злокачественные опухоли. Длительное применение высоких доз глюкокор- тикоидов, цитостатических препаратов ВИЧ-инфекция у пациента или контакт с ВИЧ- инфицированным дома. Иммунодефициты: врожденные, приобретен- ные. Беременность
624 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
ЧАСТЬ 2
Окончание табл. 15-4
Россия I Всемирная организация здравоохранения
Инактивированная полиомиелитная вакцина (ИПВ)
Анафилактические реакции на неомицин или стрептомицин. Беременность (осторожно!) Анафилактические реакции на неомицин или стрептомицин. Беременность (осторожно!)
Вакцина адсорбированная коклюшно-дифтерийно-столбнячная (АКДС)
Сильные реакции или поствакцинальные ослож- нения на предыдущую дозу вакцины. Прогрессирование заболеваний центральной нервной системы. Афебрильные судороги Симптомы энцефалопатии в пределах 7 сут после вакцинации. Крик (визг) ребенка в течение 3 ч в первые 2 сут после введения первой дозы вакцины Коллапс в течение 2 сут
Адсорбированный дифтерийно-столбнячный анатоксин (АДС АДС-М)
Постоянных противопоказаний нет. При наличии сильных реакций повторную дозу вводят на фоне применения преднизолона по 1-1,5 мг на кг массы тела Симптомы энцефалопатии в пределах 7 сут после вакцинации. Крик (визг) ребенка в течение 3 ч в первые 2 сут после введения первой дозы вакцины Коллапс в течение 2 сут
Вакцина против гепатита В
Аллергия на грибковые аллергены Рассеянный склероз Аллергия к дрожжам. Рассеянный склероз Гепатит В в латентной или прогрессирующей стадии. Беременность (вакцинация возможна только по жизненным показаниям)
Вакцины против кори, паротита, краснухи
Аллергия на аминогликозиды. Аллергия на яйца. Беременность. Иммунодефициты врожденные: при опухолях, при длительной иммуносупрессии. При введении иммуноглобулина, плазмы, крови за 3 мес до вакцинации и через 2 нед после нее Аллергия на аминогликозиды. Аллергия на яйца. Беременность Иммунодефициты врожденные: при опухолях, при длительной иммуносупрессии. При введении иммуноглобулина, плазмы, крови за 3 мес до вакцинации и через 2 нед после нее
По механизму развития поствакцинальные реакции и осложнения могут
быть различными.
Локальные неаллергические (не IgE) реакции на вакцины разделяют
на легкие (гиперемия и припухлость в месте введения), средней тяжести
(дополнительно возникают боль, эритема, отек в месте введения диаметром
5-10 см) и тяжелые, при которых к вышеперечисленной симптоматике при-
соединяется отек конечности, а также стерильные абсцессы в месте введе-
ния препарата. В основном эти реакции возникают на адъювант гидроокись
алюминия, входящий в состав АКДС (комбинированная вакцина против
дифтерии, коклюша и столбняка), АДС (комбинированная вакцина против
дифтерии и столбняка), АС (анатоксин столбнячный). Описан отек конеч-
ИММУНОПРОФИЛАКТИКА 625
Нежелательные явления
Неаллергические Аллергические
локальные системные локальные системные
♦
- жизнеугрожающие;
- нежизнеугрожающие
ГЛАВА 15
Рис. 15-1.
ности на четвертую дозу дифтерийного анатоксина. Возникают локальные
реакции через несколько часов после введения вакцины. Все вышеперечис-
ленные реакции относят к категории прививочных.
В последние годы появился принципиально новый взгляд на возможное
развитие осложнений при использовании вакцин, содержащих в качестве
адъюванта квасцы (гидроокись алюминия). Один из рецепторов врожден-
ного иммунитета NOD-подобный рецептор типа РЗ (NLRP3), взаимодей-
ствуя с квасцами, вовлекается в образование инфламмасомного комплекса,
конечный этап действия которого — выработка клетками, в частности анти-
генпрезентирующими, большого количества ИЛ-1, важного для активации
Т-хелперов. Однако избыток образования ИЛ-1 может оказывать побоч-
ный эффект при вакцинации.
Прививочные реакции — естественный ответ организма привитых лиц
на введение вакцины. Одной из причин этих реакций может быть образо-
вание провоспалительных цитокинов в ответ на антиген. Косвенно при-
вивочные реакции свидетельствуют об активации факторов врожденного
иммунитета.
Прививочные реакции по распространенности.
• Местные: болезненность, гиперемия, отек, инфильтрат, катаральные
явления (при аэрозольной вакцинации), патология пищеварительного
тракта (при пероральной вакцинации).
• Общие: лихорадка, недомогание, головная боль, расстройства сна,
боли в суставах, боли в животе, тошнота, рвота.
Прививочные реакции по выраженности:
• Слабые. Диаметр инфильтрата до 2,5 см; температурная реакция
37,1-37,5 °C.
• Средние. Диаметр инфильтрата до 8 см; температурная реакция
37,6-38,5 °C.
ЧАСТЬ 2
626 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
• Сильные. Диаметр инфильтрата 8-10 см; температурная реакция
38,6-40,5 °C.
Наличие у привитых пациентов поствакцинальных реакций не является
поводом для прекращения вакцинации той же или любой другой вакциной.
Системные неаллергические реакции на вакцины возникают доста-
точно часто и не служат показанием для прекращения вакцинации. К таким
реакциям относят появление лихорадки, головную боль, снижение аппети-
та, недомогание, появление артралгий, миалгий. Эти симптомы могут воз-
никать через несколько часов после вакцинации.
У подростков и взрослых довольно часто развиваются вазовагальные
реакции в виде брадикардии, слабости, бледности кожных покровов, голо-
вокружения, синкопальных состояний. Такие реакции могут возникнуть
на введение любых вакцин в течение первых 10-15 мин после инъекции.
Кроме того, при введении живых вирусных вакцин (корь, паротит, крас-
нуха, грипп, ветряная оспа) возможно появление симптомов естественной
инфекции в ослабленном виде. Для обозначения течения таких инфекций
в последние годы применяют термин «заболевание прорыва» (например,
«ветрянка прорыва»).
Аллергические неугрожающие жизни реакции: крапивница (чаще на
АКД С), геморрагии, петехии (АКД С), местная реакция Артюса (АС, АД С).
К аллергическим жизнеугрожающим реакциям относят анафилаксию
на повторное введение вакцины. Это редкое поствакцинальное осложнение
выявляют с частотой 2:100 000 доз АКДС, 1:600 000 доз вакцины против
гепатита В, 1,6:1 000 000 доз АС. Анафилаксия — абсолютное противопо-
казание для последующего введения вакцин.
Ряд вакцин вызывает характерные именно для них нежелательные явления:
• ОПВ: вакцинассоциированный полиомиелит (ВАП), паралитический
полиомиелит, синдром Пшена-Барре, анафилактические реакции;
• ЖПВ: асептический менингит, синдром Пшена-Барре;
• ЖКВ: тромбоцитопения, асептический менингит, синдром Пшена-
Барре, склерозирующий панэнцефалит;
• вакцина против гепатита В: артралгия, миалгия;
• вакцина против краснухи: тромбоцитопения, артралгия, артриты;
• любые вакцины: вазовагальные неаллергические реакции (чаще у
подростков), лихорадка, болезненность в месте введения, гиперемия в
месте введения, крапивница, отек Квинке.
К редким поствакцинальным осложнениям относят:
• синдром Пшена-Барре, который может возникнуть при введении
АКДС, оральной полиомиелитной вакцины, Акт-ХИБ* (вакцина для
профилактики инфекций, вызываемых Haemophilus influenzae), инфлю-
вак* [вакцина для профилактики гриппа (инактивированная)]. Этот
синдром проявляется острым восходящим вялым параличом;
ИММУНОПРОФИЛАКТИКА 627
• гипотензивно-гипореспонсивный синдром — транзиторная острая
сердечно-сосудистая недостаточность (снижение артериального давления,
снижение мышечного тонуса, бледность, нарушение или потеря сознания);
• тромбоцитопеническую пурпуру, возникающую при введении коревой
вакцины и M-M-R-II* (вакцина для профилактики кори, краснухи и
паротита);
• артриты после введения краснушной вакцины, протекающие как тран-
зиторные (до 10 сут) неревматоидные, поражающие один или несколь-
ко суставов и возникающие через 5-30 сут с момента вакцинации.
В соответствии с законом Российской Федерации о вакцинопрофилак-
тике все поствакцинальные осложнения подлежат регистрации, при этом
необходимо расследование причин и определение характера ущерба здоро-
вью привитого пациента.
Поствакцинальные осложнения (приказ Минздрава России № 229,
2002 г.):
• анафилактический шок;
• генерализованные аллергические реакции;
• энцефалит;
• вакциноассоциированный полиомиелит;
• поражения ЦНС с остаточными изменениями, приводящими к инва-
лидности;
• генерализованная инфекция после введения БЦЖ;
• хронический артрит, вызванный вакцинацией против краснухи.
Профилактика нежелательных явлений
Для проведения успешной вакцинации врачу необходимо соблюдать ряд
требований, включающих обязательный осмотр пациента до вакцинации,
сбор анамнеза с учетом возможной гиперчувствительности на компонен-
ты вакцин, контроль за правильным выполнением процедуры вакцина-
ции средним медицинским персоналом, наблюдение в поствакцинальном
периоде не меньше 20-30 мин, а также соблюдение «холодовой цепи» при
транспортировке вакцин.
В вакцинологии выделяют несколько видов профилактики.
• Первичная — соблюдение противопоказаний к вакцинации в соот-
ветствии с инструкциями к вакцинам и национальным календарем.
Предварительный скрининг (анамнез, осмотр).
• Вторичная — прогнозирование реакции в связи с видом сенсибили-
зации ребенка и составом вакцин (подбор вакцин). Фармакотерапия
основного заболевания в до- и поствакцинальном периоде.
• Третичная — профилактика и лечение обострений хронических
заболеваний, в том числе аллергических, в поствакцинальный период.
Альтернативные подходы: пассивная иммунопрофилактика (иммуно-
глобулинами).
ГЛАВА 15
ЧАСТЬ 2
628 КЛИНИЧЕСКИЕ АСПЕКТЫ ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ
Первичная профилактика
Перед вакцинацией необходимо провести сбор анамнеза. Следует оце-
нить предыдущие реакции на вакцины; выяснить наличие в анамнезе у
пациента и его родственников аллергии, характер сопутствующей патоло-
гии, очагов инфекции и т.д. Это может оказать отрицательное влияние на
течение поствакцинального периода. Основные вопросы анамнеза:
• наличие пищевой аллергии (яйца кур, желатин, дрожжи), ЛА (амино-
гликозиды), грибковой аллергии;
• анафилаксия или анафилактоидные реакции в анамнезе, в том числе
на вакцины;
• лечение глюкокортикоидами (за исключением ингаляционных глюко-
кортикоидов при БА);
• введение иммуноглобулинов или переливание крови за последние
3 мес перед вакцинацией;
• наличие заболеваний, резко снижающих иммунитет (лейкоз, ВИЧ-
инфекция, онкопатология);
• химиотерапия, радиотерапия;
• наличие в семье лиц с иммунодепрессией;
• ревакцинация противопоказана при анафилаксии в анамнезе.
Вторичная профилактика поствакцинальных осложнений заключа-
ется в тщательном отборе вакцин с учетом возможной сенсибилизации у
пациента. Например, при анафилаксии на белок куриного яйца противопо-
казано применение вакцин против гриппа как отечественных, так и зару-
бежных, полученных путем культивирования вируса в курином эмбрионе;
при аллергии к дрожжевым грибкам исключено применение вакцин против
гепатита В, поскольку в технологии их получения имеется этап культивиро-
вания вирусов в дрожжевых клетках.
Третичная профилактика складывается из мероприятий, направ-
ленных на предупреждение обострений аллергии и других заболеваний, и
проведения своевременного адекватного лечения. В то же время у паци-
ентов с аллергией обострение заболевания может по времени совпадать с
вакцинацией. В связи с этим при анализе возможных причин обострений
аллергических заболеваний в ранний поствакцинальный период следует
учитывать ряд факторов:
• воздействие аллергенов (окружающей среды и пищевых);
• характер кормления ребенка;
• нарушение диеты в поствакцинальном периоде;
• состав воздуха в доме (домашняя и библиотечная пыль), сырость;
• наличие животных в доме;
• использование постельных принадлежностей из пуха, пера, шерсти,
мохера, кокосовой стружки и др.;
• воздействие поллютантов (оксид азота, озон) и загрязнение окружаю-
щей среды;
ИММУНОПРОФИЛАКТИКА 629
• активное и пассивное курение;
• наслоение инфекций, способных усиливать развитие аллергических
заболеваний и БА (инфекция респираторно-синцитиальным вирусом,
коклюш, гастроинтестинальные инфекции). Пациентам с хрониче-
ской патологией вакцинацию следует проводить в период стойкой
ремиссии. Специальной подготовки к вакцинации не проводят, но для
стабилизации хронических заболеваний в предвакцинальном периоде
можно осуществлять лечение в соответствии с нозологией. Лечение
обострений хронических заболеваний и аллергии, совпавших по вре-
мени с вакцинацией, проводят в соответствии со стандартами для дан-
ной патологии.
Вопросы для самоконтроля
• Какова история иммунопрофилактики инфекционных заболеваний?
• Назовите три этапа становления массовой иммунизации населения.
• Приведите примеры эффективности национальных программ вакци-
нации в России и мире.
• Какова цель иммунопрофилактики?
• Какие заболевания относят к вакциноуправляемым?
• Какие вакцины используют у детей первого года жизни в России?
• В чем особенности живых вирусных вакцин?
• Каковы свойства инактивированных вирусных вакцин? Перечислите
возможные нежелательные явления, поствакцинальные реакции и
осложнения.
• Каковы возможные причины поствакцинальных реакций и осложне-
ний?
• Назовите истинные и ложные противопоказания к вакцинации.
• Что такое временный медицинский отвод к вакцинации?
• Что такое прививочные реакции? Охарактеризуйте их.
• Какие заболевания и состояния расценивают как поствакцинальные
осложнения?
• В чем состоит профилактика нежелательных реакций на вакцинацию?
ГЛАВА 15
ЛИТЕРАТУРА
Аллергология и иммунология. Национальное руководство / Под ред.
Р.М. Хаитова, Н.И. Ильиной. — М.: ГЭОТАР-Медиа, 2009. — 659 с.
Иммунология и аллергология. Цветной атлас / Под ред. А.А. Воробьева,
А.С. Быкова, А.В. Караулова. — М.: Практическая медицина, 2006. — 287 с.
Иммунология. Практикум / Под ред. Л.В. Ковальчука, Г.А. Игнатьевой,
Л.В. Ганковской. — М.: ГЭОТАР-Медиа, 2010. — 176 с.
Иммунопрофилактика / Под ред. В.К. Таточенко, Н.А. Озерецковского. — М.,
2007. - 175 с.
Казмирчук В.Е., Ковальчук Л.В., Мальцев Д.В. Клиническая иммунология и
аллергология. — Киев: Феникс, 2009. — 522 с.
Кетлинский С.А., Симбирцев А.С. Цитокины. — СПб.: Фолиант, 2008. —
552 с.
Клиническая иммунология / Под ред. А.В. Караулова. — М.: Мед. информа-
ционное агентство, 1999.
Ковальчук Л.В. Антигенные маркеры иммунной системы человека CD
(Cluster Differentiation) система. — М.: РГМУ, 2005.
Кокряков В.Н. Очерки о врожденном иммунитете. — СПб.: Наука, 2006. —
261 с.
Кондратенко И.В., Бологов А.А. Первичные иммунодефициты. — М.:
Медпрактика-М, 2005. — 230 с.
Лечение аллергических болезней у детей / Под общ. ред. И.И. Балаболкина. —
М.: МИА, 2008. - 348 с.
Макаров О.В., Ковальчук Л.В., Ганковская Л.В. и др. Невынашивание бере-
менности. Инфекция. Врожденный иммунитет. — М.: ГЭОТАР-Медиа, 2007. —
175 с.
Мейл Д., Бростофф Дж., Рот Д.Б., Ройт А. Иммунология. — 7-е изд. — М.:
Логосфера, 2007. — 556 с.
Мешкова Р.Я. Иммунопрофилактика. — Смоленск: Русич, 1999. — 252 с.
Михайленко А.А., Коненков В.И., Базанов Г.А., Покровский В.И. Руководство
по клинической иммунологии, аллергологии, иммуногенетике и иммунофарма-
кологии (для врачей общей практики), том 1. — М., 2005. — 511 с.
Рабсон А., Ройт А., Делвз П. Основы медицинской иммунологии. — М.: Мир,
2006. - 320 с.
Сибиряк С.В., Черешнев В.А., Симбирцев А.С., Сибиряк Д.С., Гаврилова Т.В.
Цитокиновая регуляция биотрансформации ксенобиотиков и эндогенных сое-
динений. — Екатеринбург: Уро РАН, 2006. — 161 с.
Теплова С.Н., Пищальников А.Ю. Первичные иммунодефицитные состоя-
ния. — Екатеринбург, 2005. — 229 с.
ЛИТЕРАТУРА 631
Хаитов Р.М., Игнатьева Г.А., Сидорович И.Г. Иммунология. Норма и патоло-
гия. — М.: Медицина, 2010. — 750 с.
Хаитов Р.М. Иммунология. Учебник для вузов с компакт-диском. —М.:
ГЭОТАР-Медиа, 2006. - 311 с.
Хаитов Р.М. Иммунология: Учебник. — 2-е изд. — М.: ГЭОТАР-Медиа, 2011. —
528 с.
Хаитов Р.М., Ярилин А.А., Пинегин Б.В. Иммунология. Атлас. — М.: ГЭОТАР-
Медиа, 2011. — 624 с.
Царегородцев А.Д., Таболин В.А. Руководство по фармакотерапии в педиа-
трии и детской хирургии. Фармакотерапия аллергических заболеваний и пер-
вичных иммунодефицитов у детей / Под ред. А.Н. Пампуры. — М.: Медпрактика,
2006. - 227 с.
Чапель Э., Хейни М., Мисбах С., Сновден Н. Основы клинической иммуноло-
гии. — 5-е изд. — М.: ГЭОТАР-Медиа, 2008. — 416 с.
Черешнев В.А. Иммунитет человека и общества. — НИКО УРО РАН, 2004. —
316 с.
Ярилин А.А. Иммунология. — М.: ГЭОТАР-Медиа, 2010. — 748 с.
предметный указатель
Абдоминальный анафилактический шок 571
Абзимы 614
Авидность 134
Агаммаглобулинемия Х-сцепленная
Брутона 106,248,274
Агранулоцитоз 491
Аденозиндезаминаза 266
Адъювант 28
Активация комплемента 149
Алкалаза 396
Аллельное исключение ПО
Аллерген 27,384
- пролонгированный 546
Аллергенность 384
Аллергическая бронхиальная астма 450
Аллергический ринит 424
Аллергическое сияние 425
Аллергия 384
- инсектная 498
- лекарственная 470
- лечение 533
- пищевая 459
- профилактика 552
Аллергоанамнез 467
Аллергоид 546
Аллогенный антиген 25
Альвеолит аллергический экзогенный 490
Аминопептидаза 43
Анафилаксия 511,558
- бифазная 561
- гастроинтестинальная 464
- идиопатическая 562
- системная 464
Анафилатоксин 70
Ангионевротический отек 529
Анемия
- гемолитическая 492
— аутоиммунная 213
- Фанкони 32,409
Анергия 25
Аннексии 194
Антагонизм цитокинов 116
Антенатальное заражение ВИЧ 352
Антиапоптотический фактор 195
Антиген 24
- аллогенный 25
- аутологичный 24
- главного комплекса гистосовместимос-
ти 98
- изологичный 25
- ксеногенный 25
- сингенный 25
- тимусзависимый 26
- тимуснезависимый 26
- трансплантационный 98
-экзогенный 100
- эндогенный 100
Антигенная детерминанта 25
Антигенность 25
Антитело
-гуманизированное 611
- функция 139
Антителогенез 63
Антителозависимая клеточная
цитотоксичность 140
Аплазия тимуса 307
Апоптоз 189
- перфорин-гранзимовый 144
- регуляция 195
Апоптосома 192
Артрит пиогенный 335
Астма бронхиальная 449,511
Асфиксический анафилактический шок 571
Атаксия-телеангиэктазия 300
Атопический дерматит 433
Атопическое заболевание 414
Атопия 384
Аутоантиген 25,27
Аутовоспалительное нарушение 335
Аутологичный антиген 24
Аутопсия 354
Аутофагия 189
Аффинность 134
Базофил 48
Бактериофаг 602
Белок
- синдрома Вискотта-Олдрича 304
- WASP 304
- А 72
Биологический материал 222
Бляшка
- пейерова 51
- фестончатая 574
Болезнь
- Альцгеймера 197
- Бехтерева 203
- гранулематозная хроническая 329
- Дункан 318
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 633
-Кавасаки 409
- Крона 66,85,164,281,287,289
-Лайма 525
- неонатальная мультисистемная
воспалительная 337
-Паркинсона 197
-Рейно 525
-Рейтера 203
-сывороточная 214,583
-Хантингтона 197
-Ходжкина 409
Брадикинин 421
Бронхоспазм 490
Бронхоэктаз 301
Бурса Фабриция 51
Вакцина 620
Вакцинации противопоказания 622
Вакцинопрофилактика 616
Васкулит аллергический 488
Взрыв дыхательный 171
Винкулин 168
Вирус
- иммунодефицита человека 350
- Эпштейна-Барр 28
Вирусная нагрузка 356,370
ВИЧ-инфекция
- вирусная нагрузка 356
-заражение 351
- классификация 360
-лечение 371
-патогенез 353
-стадии 358
-удетей 363
ВИЧ-парадокс 358
Внутривенные иммуноглобулины 595
Волосистая лейкоплакия 360
Волчанка системная красная 69
Волчаночноподобный синдром 489
Воспаление 206
-системное 128
Врожденный иммунитет 19
Высокоактивная антиретровирусная
терапия 371
Гангренозная пиодермия 335
Гаптен 26
Гемодинамический анафилактический
шок 571
Гепатит аллергический лекарственный 491
Герминативный центр 61
Гетерологичный антиген 25
ninep-IgE-синдром 307
Интерактивность иммунной системы 346
Гйпермутация соматическая 111
Гйперчувствительность 206
- замедленного типа 145
- контактная 146
-лекарственная 472
Гйпогаммаглобулинемия 278
- транзиторная 294
Гйпопигментация 318
Гйпоплазия тимуса 307
Гйпосмия 428
Гйстамин 140,421,448
Гйстамин-рилизинг-фактор 461
Гистотоп 99
Глазодвигательная атаксия 301
Гранзим 144
Гранула Бербека 46
Гранулема 330
Гранулематоз Вегенера 426
Гуманизированное антитело 611
Двойное распознавание 18,86
Дектин 124
Делеция аутоагрессивных клонов
В-клеток 111
Дерматит
- атопический 433,464
- контактный 464
— аллергический 443,510
— ирритантный 510
- перианальный 465
- себорейный 444
Дермографизм криозависимый 525
Детерминанта антигенная 25
Дефенсин 43,449
Дефицит
- адгезии лейкоцитов 327
- аденозиндезаминазы 266
- глюкозо-6-фосфатдегидрогеназы 330
- миелопероксидазы 331
- переключения классов иммуноглобу-
линов 283
- пуриннуклеотидфосфорилазы 267
- специфических антител 293
- субклассов IgG 291
- урацил-ДНК-гликозилазы 287
- цитидиндезаминазы 286
- С1-ингибитора 338
- IgA 288
- IRAK4 333
- JAK3 268
- NEMO 334
- р14 317
Диапедез 90
634 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Дисплазия эктодермальная
ангидротическая 333
Дистресс-синдром 500
Домен смерти 121
Доминантный эпитоп 25
Дыхательный взрыв 171
Естественный киллер 41,175
Заболевание атопическое 414
Зародышевый центр 61
Избыточность системы цитокинов 115
Изологичный антиген 25
Иммунитет 17
- адаптивный 21
- врожденный 19,68
Иммунная память 18
Иммунная толерантность 18
Иммуноанализ 229
Иммуногенез 51
-В-клеточный 111
Иммуногенетика 198
Иммуногенность 25
Иммуноглобулин
- изотип 134
- фрагменты 132
Иммунограмма 370
Иммунодепрессанты 589
Иммунодефицит
- первичный 247
- - лечение 342
- с гипопигментацией 316
Иммунодиагностика 219
Иммунокоррекция 588
Иммунологическая индивидуальность 16
Иммунологический синапс 102
Иммуномодулятор 589
Иммунопатогенез 247
Иммунопатология 206,247
Иммунопоэз
- В-клеточный 108
-Т-клеточный 90
Иммунопрофилактика 594,616
Иммуностимулятор 589
Иммуносупрессия 588
Иммунотерапия 588,594
- аллергенспецифическая 542
Иммуноцитокин 114
Инвариантная цепь 100
Индекс иммунорегуляторный 226
Индивидуальность иммунологическая 16
Индуцированная активацией
цитидиндезаминаза 111
Инспираторная одышка 338
Интегрин 168
Интерстициальная дендритная клетка 44
Интранатальное заражение ВИЧ 352
Инфекция синопульмональная 289
Инфильтрат легких эозинофильный 490
Исключение аллельное 110
Казеин 389
Календарь прививок 618
Калнексин 100
Калретикулин 194
Кандидоз
- гладкой кожи 443
- кожно-слизистый хронический 310
Капсаицин 566
Кариорексис 190
Карцинома цервикальная 377
Каскад
- комплемента 148
- цитокинов 116
Каспаза 143,192
Кателицидин 43
Катепсин G 43
Кислота арахидоновая 466
Классический путь активации
комплемента 150
Клетка
- антигенпрезентирующая 43
- гемопоэтическая стволовая 31
- дендритная 43
- иммунокомпетентная 35
- Купфера 53
- Лангерганса 44,146,433,513
- мезенхимальная стволовая 34
- Панета 84
- плазматическая 112
- пре-В 110
- предшественник 32
- про-В 109
- ретикулярная 51
- стромальная стволовая 34
- Т-регуляторная 181
- тучная 48
- Т-цитотоксическая 142
- эндотелия 51
- эпителия 51
- В 37
- М 64
- NK 41,175
- NKT 41,178
- Т 39
Клональная экспансия 85
Клональность 18
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 635
Коллагеназа 396
Коллапс кардиоваскулярный 559,563
Кольцо Вальдейера 64
Кома гипоксическая гиперкапническая 573
Комплемент 148
Конденсация хроматина апоптотическая
193
Конканавалин А 28
Кортекс лимфатического узла 58
Костный мозг 51
Крапивница 517
- аутоиммунная 528
- контактная 510
- острая 573
- папулезная 503
- солнечная 527
- холодовая 523
— семейная 337
- хроническая 522
Криопирин 337
Кристаллы Шарко-Лейдена 428
Кровь 53
Ксеногенный антиген 25
Лаконоса митоген 28
Лактоальбумин 389
Лактоферрин 43
Лейкотриен 140
Лизоцим 43,243
Лимфа 53
Лимфатический узел 51,58
Лимфоаденопатия генерализованная
персистирующая 359
Лимфогистиоцитоз
- гемофагоцитарный 144
— семейный 314
Лимфома
- Беркитта 362
- неходжкинская 377
- Ходжкина 331
Лимфоцит
- Т-регуляторный 181
- В 37
- NK 175
- NKT 41,178
- Т 39
Линия Дени 425
ЛипидА 28,309
Липоарабиноманнан 104
Лихорадка
-лекарственная 488
- средиземноморская семейная 335
Макроглобулинемия Вальденстрема 525
Макрофаг 41,165
- бактерицидный эффект 171
Малигиизация 254
Маркер клеточный 30
Мастоцитоз системный 565
Материал биологический 222
Медиатор воспаления 212
Медуллярная зона лимфатического узла 59
Мезенхимальная стволовая клетка 34
Метод
- генно-молекулярный 232
- иммуноанализа 229
- иммунодиагностики 232
- тестирование биологическое 234
- фенотипирование клеток иммунной
системы 229
- СН50 338
Миграция трансэндотелиальная 169
Миелоидная дендритная клетка 44
Микроглобулин Ь2 99
Миндалина 64
Миокардит аллергический лекарственный
491
Митоген 28
Многоформная экссудативная эритема 485
Мозг костный 51
Мозжечковая атаксия 301
Моноцит 41
Нагрузка вирусная 356,370
Натуральный киллер 41
Национальный календарь
профилактических прививок 618
Неаллергическая бронхиальная астма 450
Недостаточность
- аденозиндезаминазы 259
- иммунная общая вариабельная 278
- иммунная тяжелая комбинированная 265
-лактозная 469
- урацил-Ы-гликозилазы 284
- CD-40 284
- Janus-киназы 259
Нейтрализация патогенов 139
Нейтропения
- врожденная 325
- циклическая 326
Нейтрофил 43,165
Некроз 189
Некролиз эпидермальный токсический
487,577
Неразборчивость иммунной системы 18
Нефрит интерстициальный аллергический
491
636 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Нибрин 303
Область шарнирная 133
Оболочка слизистая 64
Обратная транскриптаза 373
Одышка инспираторная 338
Окно серонегативное 352
Оксид азота 171
Опсонизация 140
Орган иммунной системы 51
Островок Лангерганса 213
Отек
- ангионевротический наследственный
338,565
- Квинке 501
Память иммунная 18
Папаин 132
Паракортекс лимфатического узла 58
Паральбумин 389
Паратоп 25
Патогенетический подход оценки
иммунной системы 224
Паттерн 68
Пейерова бляшка 51
Пепсин 132
Период развития иммунной системы
критический 242
Пероксинитрит 172
Перфорин 144
Печень эмбриона 31
Пикнозис 190
Пиогенный артрит 335
Пиодермия гангренозная 335
Плазма крови 222
Плазмоцит 112
Плазмоцитоидная дендритная клетка 44
Пластинка собственная (Lamina propria) 63
Плейотропность цитокинов 115
Пневмония пневмоцистная 376
Побочный эффект лекарственного
средства 471
Полимеразная цепная реакция 369
Полипоз носа 427
Полипотентная стволовая
гемопоэтическая клетка 32
Положительная селекция Т-клеток 94
Постнатальное заражение ВИЧ 352
Прайминг 165
Проапоптотический фактор 196
Проба
-аппликационная 403
-кожная 467
- - при лекарственной аллергии 493
- подъязычная 493
- провокационная при лекарственной
аллергии 493
- скарификационная 401
Пробиотик 602
Провирус 351
Пропердин 149,243
Простагландин 140
Процессинг антигена 100
Пруриго острое 503
Псевдоаллергия пищевая 465
Пуриннуклеотидфосфорилаза 267
Пурпура Шенлейна-Геноха 305
Распознавание
-двойное 18,86
- клетками врожденного иммунитета 69
Реакция
- анафилактическая 384,570
- анафилактоидная 466,558,570
- Артюса 626
- бласттрансформации лимфоцитов 270,
494
- вазодепрессорная 566
- ложноположительная 402
- Манту 146,215,376
- на пищу 459
- полимеразная цепная 369
- прививочная 625
- псевдоаллергическая 476
- токсико-аллергическая острая 487
-токсическая 506
- торможения миграции лейкоцитов 494
- туберкулиновая 215
Регуляторный Т-лимфоцит 181
Рецептор
- антигенраспознающий 85
- врожденного иммунитета 20
-клоноспецифический 85
-комплемента 69
-лектиновый 69
-ловушка 115
- маннозный 69
- мусорщик 69
- паттернраспознающий 74
- пре-В-клеточный 109
- Fc-фрагмента 70
- NOD-подобный 84
- Toll-подобный 75
Рециркуляция 18
Ринит
-аллергический 417,418,511
— круглогодичный 425
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 637
- - сезонный 424
- вазомоторный 426
- инфекционный 427
- структурный 427
Ринорея 418
Риносинусит 427
Родоначальная стволовая гемопоэтическая
клетка 32
Роллинг 169
Саркома Капоши 359,377
Селезенка 51,62
Селектин 168
Селекция Т-клеток 94
Сенсибилизация 421
- к латексу 510
- пероральная 462
Сепроцидин 43
Сепсис 130
Септический шок 129
Серонегативное окно 352
Сеть цитокиновая 115
Сиаломуцин 169
Симптом
- Асбо-Хансена 487
- мишени 485
- Никольского 486,574
- сползания эпидермиса 577
Синапс иммунологический 102
Сингенный антиген 25
Синдром
-акне 335
- аллергический оральный 464
- ассоциированный с криопирином 337
- аутовоспалительный холодовой
семейный 335,526
- березово-фруктовый 390
- бронхообструктивный 452
- бронхоспазма 559
- Вискотта-Олдрича 304,409,443
- внезапного покраснения лица и шеи 566
- волчаночноподобный 489
- врожденного дискератоза 300
- гастроинтестинальный 464
- Германски-Пудлака 257,312,317
- Гййена-Барре 500,597,626
- гипериммуноглобулинемии
- - D 335
- -Е 443
- гиперпродукции
- - IgE 307
- - IgM 283
- гиперэозинофильный 413
- - идиопатический 414
- голых лимфоцитов 269
- гриппоподобный 358
- Грисцелли 257,312,317
- Гуда 248
- 1удпасчера 213
- дефицита адгезии лейкоцитов 168
-Джанотти 244
-Джоба 443
-Джонсона 486,576
- Ди Джорджи 55,256,306,409
- диссеминированного внутрисосудистого
свертывания 500
- истощения 55
-Лайелла 487,577
- латексно-фруктовый 509
- латекс-фрукты 390
- лимфопролиферативный
- - Х-сцепленный 312,318
- - аутоиммунный 197,312,320
-Луи-Бар 257,300
- Макла-Уэльса 337
- мальабсорбции 464
- миелодиспластический 331
- мононуклеозоподобный 358
- Неймеген 254,256,303
- Нетертона 442
- Олдрича 304,443
- Оменна 268,414
- приобретенного иммунодефицита 350
- птица-яйцо 390
-Пудлака 312,317
- Пуртильо 318
- пыльцево-пищевой 460,462
- раздраженного кишечника с диареей 467
- разрывов Неймеген 303
- Рея 467
- Стивенса-Джонсона 486,576
-судорожный 306
- сывороточноподобный 488
- Уэльса 337
- Хигаси 257,312,318
- Чедиака-Хигаси 257,312,318
- Черджа-Строс 414
- Швахмана 467
- Шегрена 427
- Шелдона-Рея 467
- APECED 312
- IPEX 312
- Х-сцепленной агаммаглобулинемии
Брутона 106
Синергизм цитокинов 115
638 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Синопульмональная инфекция 289
Синцитий 354
Система
- иммунная 16
- комплемента 148
- фагоцитарных клеток 41
-цитокинов 114
- HLA 201
- JAK-STAT 32
Сияние аллергическое 425
Слизистая оболочка 64
Смерть клиническая 559
Смесь молочная 469
Смешанная бронхиальная астма 450
Собственная пластинка (Lamina propria) 63
Соматическая гипермутация 111
Состояние иммунодефицитное
физиологическое 237
Спазм периферических сосудов 572
Специфичность 17,25
Статус астматический 572
Стромальная стволовая 34
Сумка Фабриция 51
Суперантиген 27
Супероксиддисмутаза 171
Суперсемейство иммуноглобулинов 133
Суррогатная легкая цепь 109
Сыворотка
- крови 222
- лечебная 599
Сывороточноподобный синдром 488
Талин 168
Телеангиэктаз 301
Тельце
- Гассаля 57,264
- молозивное 240
Тест
- базофильной активации 494
- ингаляционный 405
- кожный 400
- конъюнктивальный 405
- назальный 403
- оральный 406
- ориентирующий 220
- оценки
— В-клеточного звена 341
— Т-клеточного звена 340
— фагоцитарного звена 342
- провокационно-пищевой 467
- провокационный 403
- пролиферации тимоцитов,
стимулированных митогеном 234
- радиоиммунный аллергосорбентный 494
- с гистамином 422
- скарификационный 401
- с метахолином 422
- с тетразолием нитросиним 331
- сублингвальный 405
- торможения естественной эмиграции
лейкоцитов 493
- уколом 403
Тестирование биологическое 234
Тетрада Фалло 306
Тимомегалия 55
Тимус 51,54
- гипоплазия 307
Тимусзависимый антиген 26
Тимуснезависимый антиген 26
Тиреоидит Хашимото 528
Токсический эпидермальный некролиз 577
Токсоплазмоз 376
Толерантность
- иммунная 18
- оральная 460
Толерогенность 25
Транзиторная гипогаммаглобулинемия 294
Транскриптаза обратная 373
Триптаза 448,567
Тромбопоэтин 114
Тромбоспондин 195
Тромбоцит 49
Тромбоцитопения 492
Тяжелая комбинированная иммунная
недостаточность 265
Узел лимфатический 58
Узловатая эритема 485
Уромодулин 120
Уртикария 528
Фабрициева сумка 51
Фагоцит 165
Фактор
- антиапоптотический 195
- проапоптотический 196
- роста
— фибробластов 115
- - эндотелиальных клеток 115
- - эпидермиса 115
- тимуса сывороточный 128
- усиливающий образование гистамина 461
Феномен
- апоптоза, индуцированного активацией 52
-Артюса 214,501
- двойного распознавания 86
- кость в кости 266
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 639
Фенотипирование клеток иммунной
системы 229
Ферруканин 394
Фетальная печень 31
Фибробласт 51
Физиологический перекрест лейкоцитов
238
Фиксированная эритема 484
Филаггрин 434
Фитогемагглютинин 28
Фолликулярная дендритная клетка 47
Фосфатаза щелочная 43
Хемокин 166
Центр зародышевый 61
Центробласт 61
Центроцит 61
Цепь
- инвариантная 100
- суррогатная легкая 109
Церебральный анафилактический шок 571
Цитидиндезаминаза 111
Цитокин 114
- антагонист 120
- провоспалительный 125
- продуцент 117
Цитокиновая сеть 115
Цитотоксичность
- клеточная антителозависимая 140
-Т-клеточная 142
Цитохром 192,329
Чесотка 443
Чужеродность 24
Шарнирная область 133
Шеддинг 351
Шок
- анафилактический 492,559,570
- септический 129
Эйкозаноид 215
Экзантема лекарственная 488
Экзема
- атопическая 553
- герпетическая 446
- микробная 444
- нумулярная 442
- себорейная 437
Экзогенный антиген 100
Экспансия клональная 85
Элиминация аллергенов 533
Эндогенный антиген 100
Энцефалит поствакцинальный 492
Энцефаломиелит 492
Эозинофил 48
Эпитоп 25,99
Эритема 403
- многоформная экссудативная 485,573
-узловатая 485
- фиксированная 484
- холодовая 526
Эритродермия 488
Эритропоэтин 114
Эспераза 396
Эубиотик 602
Эффект побочный лекарственного
средства 471
ПРИГЛАШЕНИЕ К СОТРУДНИЧЕСТВУ
Издательская группа «ГЭОТАР-Медиа» приглашает к сотрудничеству
авторов и редакторов медицинской литературы,
литературы по ветеринарии и агротехнике.
ИЗДАТЕЛЬСТВО СПЕЦИАЛИЗИРУЕТСЯ НА ВЫПУСКЕ
учебной литературы для вузов и колледжей, атласов,
руководств для врачей, переводных изданий
По вопросам издания рукописей обращайтесь в отдел по работе с авторами.
Тел: (495) 921-39-07.
Угебное издание
Ковальчук Леонид Васильевич
Ганковская Людмила Викторовна
Мешкова Раиса Яковлевна
КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ И АЛЛЕРГОЛОГИЯ
С ОСНОВАМИ ОБЩЕЙ ИММУНОЛОГИИ
Подписано в печать 16.03.2012. Формат 60х90716.
Бумага офсетная. Печать офсетная. Объем 40 п.л.
Тираж 1500 экз. Заказ № 473
ООО Издательская группа «ГЭОТАР-Медиа».
115035, Москва, ул. Садовническая, д. 9, стр. 4,
тел./факс: (495) 921-39-07,
e-mail: info@geotar.ru, http://www.geotar.ru
Отпечатано в ООО «Чебоксарская типография №1».
428019, г. Чебоксары, пр. И. Яковлева, 15.
и
Ковальчук Леонид Васильевич
Доктор медицинских наук, профес-
сор, академик РАЕН, заведующий
кафедрой иммунологии Российско-
го государственного медицинского
университета, заслуженный деятель
науки РФ, известный специалист в
области фундаментальной и клини-
ческой иммунологии, автор более
350 научных работ, 3 учебников по иммунологии.
4 монографий, 10 патентов. Подготовил 15 докторов
наук и более 40 кандидатов наук по актуальным про-
блемам современной иммунологии.
Янковская Людмила Викторовна
Доктор медицинских наук, профес-
сор кафедры иммунологии Россий-
ского государственного медицин-
ского университета. Сфера научных
интересов — молекулярная имму-
нология, иммунология репродукции,
персонализированная иммунотера-
пия. Автор 2 монографий, 7 посо-
бий и руководств для студентов, более 300 научных
публикация 17 патентов. Руководитель 2 докторских
диссертаций и свыше 30 кандидатских диссертаций
по современным проблемам фундаментальной и кли-
нической иммунологии.
Мешкова Раиса Яковлевна
Доктор медицинских наук, профес-
сор, заведующая кафедрой клини-
ческой иммунологии и аллерголо-
гии Смоленской государственной
медицинской академии. Главный
внештатный аллерголог-иммунолог
Департамента Смоленской области
по здравоохранению. Руководитель
областного центра аллергологии-иммунологии. За-
служенный врач РФ. Член Российской ассоциации ал-
лергологов и клинических иммунологов. Европейской
ассоциации аллергологов и клинических иммунологов
(EAACI). Член редакционного совета «Российского
аллергологического журнала», журнала «Аллерго-
логия и иммунология в педиатрии». Член проблем-
ной комиссии по аллергологии и иммунологии при
Главном внештатном аллергологе-иммунологе МЗиСР
РФ, заместитель председателя учебно-методической
Основные понятия
Клинически значимые
характеристики клеток
органов и тканей
иммунной системы
Рецепторные
и медиаторные
взаимодействия
в иммунной системе
Эффекторные механизмы
врожденного
и адаптивного иммунитета
Регуляторные
Т-яимфоциты
Апоптоз и его рояь
в иммунной системе
Основы иммуногенетики
в клинической
иммунологии. Система
лейкоцитарных антигенов
человека
Иммунные механизмы
повреждения тканей:
введение
в иммунопатологию
Оценка иммунной
системы человека
Иммунодефицитные
забояевания
Аллергические
заболевания
Ургентные формы
в клинической
иммунологии
и аллергологии
Основы иммунотерапии
Иммунопрофилактика
комиссии по преподаванию иммунологии и аллерго-
логии при МЗиСР РФ. Автор более 120 научных работ:
руководитель 7 кандидатских диссертаций.
www.geotar.ru
www.medknigaservis.ru
Иммунология